パパイヤモザイクウイルスに基づく免疫原性の親和性で複合体化された抗原系及びその使用
パパイヤモザイクウイルス(PapMV)又はPapMVのコートタンパク質由来のウイルス様粒子(VLP)に、複数の親和性部分を介して複合体化される1以上の抗原を含む、親和性で複合体化された抗原系(ACAS)が提供される。親和性部分は、対象とする抗原(単数もしくは複数)に特異的に結合できる分子又は化合物であり、これは、例えば、化学的もしくは遺伝子工学的手段により、PapMV又はPapMV VLPのコートタンパク質に取り付けられ得る。ACASは、必要に応じて、1以上の追加抗原をさらに含み得、これは、ACASにより含まれる複合体化された抗原(単数もしくは複数)と同一又は異なっていてもよい。また、ACASを含むワクチンを含めた免疫原性組成物も提供される。免疫原性組成物は、動物における体液性及び/又は細胞性応答が必要とされる、種々の疾病及び疾患の、予防を含めた治療において有用である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、免疫原性組成物の分野、特にパパイヤモザイクウイルスに基づく免疫原性組成物に関する。
【背景技術】
【0002】
免疫は、感染症の予防及び治療のための有効な方法を提供し、前世紀の公衆衛生における最も大きな利益のひとつをもたらした。早期の免疫戦略は、免疫原として生きた、弱毒化された又は不活化された病原体を用いた。しかしながら、社会的関心が、より明確で、より安全なワクチンのための探索を助長した。本探索は、個々の抗原が単離されるか又は組換え技術によって発現させられ、かつ免疫原として接種される、研究の新しい方向性を促進した。しかしながら、そのようなワクチンは、単離されたタンパク質が典型的には防御免疫応答を起こすために十分な免疫原性ではないために、抗原に対する十分な免疫応答を起こすためにアジュバントの添加をしばしば必要とする。完全フロイントアジュバント等のいくつかの強いアジュバントが知られているが、多くが望ましくない副作用を有した(Lerner, R. A.,ら、Proc. Natl. Acad. Sci. USA 78:3403- 3407 (1981); Bhatnagar, P. K.,らProc. Natl. Acad. Sci. USA 79:4400-4404 (1982); Neurath, A. R.,ら、J. Gen. Virol. 65: 1009-1014 (1984);及びMuller, G. M.,ら、Proc. Natl. Acad. Sci. USA 79:569-573 (1982))。
【0003】
免疫原としての合成ペプチドの使用もまた、より安全かつより有効なワクチンを調製する目的で精力的に研究されてきた(Lerner, R. A., Green, N., Alexander, H., Liu, F. -T., Sutcliffe, J. G.,及びShinnick, T. M. Proc. Natl. Acad. Sci. USA 78:3403-3407 (1981); Bhatnagar, P. K., Papas, E., Blum, H. E., Milich, D. R., Nitecki, D. Karels, M. J.,及びVyas, G. N. Proc. Natl. Acad. Sci. USA 79:4400-4404 (1982); Neurath, A. R., Kent, S. B. H.,及びStrick, N. J. Gen. Virol. 65:1009-1014 (1984))。しかしながら、合成ペプチドワクチンの開発もまた、望ましいアジュバント及び担体の探索が妨げになっている。
【0004】
最近になって、免疫系による自己と異物との識別の原理に関する研究により、組織化の程度及びウイルスの表面における抗原の反復が、抗原が異物として認識されるための非常に強いシグナルであることが明らかになってきた(Bachmann & Zinkernagel, Immunol. Today 17:553 558 (1996))。ウイルス構造の本特性は、ウイルス構造の免疫原性及び複製不可能なワクチンという改良された安全特性を組み合わせた、ウイルス様粒子(VLP)に基づく有望な新規ワクチンの設計に用いられた。
【0005】
動物ウイルスに基づく2つのVLPワクチンである、B型肝炎ウイルス(HBV)及びヒトパピローマウイルス(HPV)は、ヒトにおいて効果的に機能することが示されている(Faganら、1987, J. Med. Virol, 21:49-56; Harper ら、2004, Lancet, 364: 1757-1765) 。例えば、ヒトパピローマウイルス(HPV)主要カプシドタンパク質L1でできているVLPは、女性における子宮頸癌の進行に対して、100%の防御を提供することが示されている(Ault, K.A., 2006, Obstet. Gynecol. Surv. 61:S26-S31; Harperら、2004, Lancet 364: 1757-1765, 国際特許出願PCT/US0l/18701(WO02/04007)もまた参照)。バクテリオファージQB(Maurer ら、2005, Eur. J. Immunol. 35:2031-2040)、ウイルスコアタンパク質でできたB型肝炎ウイルスVLP(Mihailova ら、 2006, Vaccine 24:4369-4377; Pumpens ら、2002, Intervirology 45:24-32)及びパルボウイルスVLP(Antonis ら、 2006, Vaccine 24:5481-5490; Ogasawara ら、 2006, In Vivo 20:319-324)等のプラットフォームもまた、エピトープを輸送する能力、並びに強い抗体応答を誘導する能力を示している。同様に、米国特許第6627202号は、エピトープ送達系としての使用のために、HBVカプシド結合性ペプチドにより架橋された抗原を含むHBVコアタンパク質を記載しており、抗原としては、種々のウイルス及び細菌を標的にしているか又はそれらに由来する抗原が含まれる。
【0006】
エピトープ提示系としての植物ウイルス由来のVLPの使用が記載されている。植物ウイルスは、免疫原性が高く、かつ複雑な、反復性の結晶の構成を有する、タンパク質から主に構成される。さらに、植物ウイルスは、動物免疫系から系統発生学的に離れており、このことが植物ウイルスをワクチン開発へのふさわしい候補者としている。例えば、ササゲモザイクウイルス(CPMV)、セイバンモロコシモザイクウイルス(JGMV)、タバコモザイクウイルス(TMV)、及びアルファルファモザイクウイルス(AIMV)は、対象とするエピトープの提示のために改変がなされた(Canizares, M. C. ら、2005, Immunol. Cell. Biol. 83:263-270; Brennan ら、2001, Molec. Biol. 17:15-26; Saini and Vrati, 2003, J. Virol. 77:3487- 3494)。国際特許出願PCT/GB97/01065(WO97/39134)号は、コートタンパク質及び非ウイルスタンパク質を含むキメラのウイルス様粒子を記載し、これらは、例えば、ペプチドエピトープの提示のために用いられ得る。国際特許出願PCT/USOl/07355(WO01/66778)号は、植物ウイルスコートタンパク質、特に、N末端におけるリンカーを介して、病原微生物のエピトープを含み得る対象とするポリペプチドと融合されたタバコモザイクウイルスコートタンパク質を記載している。国際特許出願PCT/USOl/20272(WO02/00169)号は、外来ペプチド、特にニューカッスル病ウイルス又はヒト免疫不全ウイルス(HIV)のエピトープと融合された、ジャガイモYウイルスコートタンパク質又は切断されたインゲン黄斑モザイクウイルスコートタンパク質のいずれかを含むワクチンを記載している。また、米国特許第6042832号は、免疫応答を引き起こすために、アルファルファモザイクウイルス又はイラルウイルスカプシドタンパク質と共に動物へ、病原体エピトープ等のポリペプチドの融合体を投与する方法を記載している。
【0007】
最近になって、パパイヤモザイクウイルス(PapMV)のコートタンパク質由来のVLP及び免疫賦活剤としてのこれらの使用が記載されている(国際特許出願PCT/CA03/00985(WO2004/004761)号)。E.コリ内でのPapMVコートタンパク質の発現は、反復性及び結晶性の様式で組織化された数百のCPサブユニットからなるVLPの自己集合をもたらす(Tremblayら、 2006, FEBS J 273: 14)。PapMV CP欠失コンストラクトの発現及び精製の研究は、CPサブユニットの自己集合(又は多量体化)が、機能に重要であることをさらに示唆している(Lecoursら、2006, Protein Expression and Purification, 47:273-280)。gp100又はインフルエンザウイルスM1タンパク質のいずれか由来のエピトープを含むPapMV VLPについては、特定のヒトT細胞の増殖をもたらすエピトープのMHCクラスI交差提示を誘導する能力が示されている(Leclerc, D.ら、J. Virol, 2007, 81(3): 1319-26; Epub. ahead of print November 22, 2006)。さらに、C型肝炎ウイルスE2エンベロープタンパク質由来のエピトープを含むPapMV VLPは、PapMV VLP及びE2ペプチドに対するマウスにおける体液性応答を誘導することが示された(Denisら, 2007, Virology, 363(1): 59-68)。
【0008】
HIV、HCV、EBV又はインフルエンザウイルス由来の種々の抗原決定基を担持するジャガイモXウイルス(PVX)由来のVLPが記載されている(欧州特許出願第1167530号)。HIVエピトープを担持するPVX VLPの、体液性及び細胞性経路を介してのマウスにおける抗体産生を誘導する能力もまた、記載されている。本効果を高めるために、追加のアジュバントが、PVX VLPと併せて用いられた。
【0009】
B型肝炎コアタンパク質又はパルボウイルスVLPは、これらが遺伝情報を持ったない場合でさえもCTL応答を誘導すると報告されており(Ruedlら、 2002, Eur. J. Immunol. 32; 818-825; Martinezら、 2003, Virology, 305; 428-435)、これらが入り込んだ細胞内で活発に複製することができない。リンパ性脈絡髄膜炎(lymophocytic choriomeningitis)ウイルス(LCMV)又は鶏卵アルブミン由来のエピトープを担持する該VLPの、インビボでの樹状細胞による交差提示もまた記載されている(Ruedlら、2002, 前掲; Moron,ら、 2003, J. Immunol. 171 :2242-2250)。LCMV由来のエピトープを担持するB型肝炎コアタンパク質VLPのCTL応答を刺激する能力もまた記載されている。しかしながら、本VLPは、単独で投与された場合、CTL応答を誘導することができず、また、ウイルスチャレンジからの有効な防御を仲介することができなかった。VLPが抗CD−40抗体又はCpGオリゴヌクレオチドと併せて用いられる場合のみ、有効なCTL応答が誘導された(Storniら、2002, J. Immunol. 168:2880-2886)。先の報告は、LCMV由来のペプチドを担持するブタパルボウイルス様粒子(PPMV)が、致死のLCMVチャレンジに対してマウスを防御できたことを示唆した(Sedlikら、2000, J. Virol. 74:5769-5775)。
【0010】
親和性ペプチドと融合されたパパイヤモザイクウイルスVLPは、真菌性疾患の検出においてモノクローナル抗体の代替品として提案されている(Morinら、 2007, J. Biotechnology, 128: 423-434 [epub ahead of print October 26, 2006])。高い結合活性でネコブカビ(Plasmodiophara brassicae)胞子に結合することができるVLPが開発され、1つのコンストラクトの胞子への結合は、ポリクローナル抗体のそれに相当するレベルであることが実証された。
【0011】
本背景情報は、出願人により本願発明に関連し得ると考えられている公知の情報を公表する目的で提供される。前述の情報のいずれかが本願発明に対する先行技術を構成することを認めることは必ずしも意図されておらず、また、そのように解釈されるべきではない。
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明の目的はパパイヤモザイクウイルスに基づく親和性で複合体化された抗原系免疫原性の親和性で複合体化された抗原系免疫原性の親和性で複合体化された抗原系及びその使用を提供することである。本発明の一態様にしたがって、1以上の抗原及びパパイヤモザイクウイルス(PapMV)又はPapMVコートタンパク質由来のウイルス様粒子(VLP)を含む親和性で複合体化された抗原系が提供され、該PapMV又はVLPが、PapMVのコートタンパク質もしくはVLPに取り付けられた複数の親和性部分を含み、該親和性部分が前述の1以上の抗原に結合することができ、該系が動物における免疫応答を誘導することができる、抗原系が提供される。
【0013】
本発明の別の態様にしたがって、本発明の親和性で複合体化された抗原系及び薬学的に許容される担体を含む免疫原性組成物が提供される。
【0014】
本発明の別の態様にしたがって、有効量の本発明の親和性で複合体化された抗原系を動物に投与することを含む、該動物における免疫応答を誘導する方法が提供される。
【0015】
本発明の別の態様にしたがって、動物における疾病又は疾患を予防又は治療する方法であって、該方法が有効量の本発明の抗原提示系を該動物に投与することを含む、方法が提供される。
【0016】
本発明の別の態様にしたがって、それを必要とする動物における免疫応答を誘導するための有効量の本発明の親和性で複合体化された抗原系の使用が提供される。
【0017】
本発明の別の態様にしたがって、それを必要とする動物における疾病又は疾患を予防又は治療するための有効量の本発明の親和性で複合体化された抗原系の使用が提供される。
【0018】
本発明の別の態様にしたがって、医薬の製造におけるパパイヤモザイクウイルス(PapMV)又はPapMVコートタンパク質由来のウイルス様粒子(VLP)の使用であって、該PapMV又はVLPが該PapMVもしくはVLPのコートタンパク質に取り付けられた複数の親和性部分を含む、使用が提供される。
【0019】
本発明の別の態様にしたがって、医薬の製造における本発明の親和性で複合体化された抗原系の使用が提供される。
【0020】
本発明の別の態様にしたがって、1以上の抗原を、パパイヤモザイクウイルス(PapMV)又はPapMVコートタンパク質由来のウイルス様粒子(VLP)と混合することを含む、免疫原性組成物を調製する方法がであって、該PapMV又はVLPが該PapMVもしくはVLPのコートタンパク質に取り付けられた複数の親和性部分を含み、該親和性部分が前述の1以上の抗原に結合できる、方法が提供される。
【0021】
本発明の別の態様にしたがって、1以上の抗原をパパイヤモザイクウイルス(PapMV)又はPapMVコートタンパク質由来のウイルス様粒子(VLP)と混合することを含む方法により調製される免疫原性組成物であって、該PapMV又はVLPが該PapMVもしくはVLPのコートタンパク質に取り付けられた複数の親和性部分を含み、該親和性部分が前述の1以上の抗原に結合できる、組成物が提供される。
【0022】
本発明の別の態様にしたがって、HCVコアタンパク質に結合できる親和性ペプチドと融合されたパパイヤモザイクウイルス(PapMV)コートタンパク質を含む、融合タンパク質が提供される。
【0023】
本発明の別の態様にしたがって、HCVコアタンパク質に結合できる親和性ペプチドに融合されたパパイヤモザイクウイルス(PapMV)コートタンパク質を含む融合タンパク質をコードする、単離されたポリヌクレオチドが提供される。
【0024】
本発明の別の態様にしたがって、HCVコアタンパク質に結合できる親和性ペプチドに融合されたパパイヤモザイクウイルス(PapMV)コートタンパク質を含む融合タンパク質、又はHCVコアタンパク質に結合できる親和性ペプチドに融合されたパパイヤモザイクウイルス(PapMV)コートタンパク質を含む融合タンパク質をコードするポリヌクレオチドの、ウイルス様粒子を調製するための使用が提供される。
【0025】
図面の簡単な説明
本発明のこれら及び他の特徴は、添付の図面を参照する以下の詳細な説明においてより明確にされるだろう。
【図面の簡単な説明】
【0026】
【図1】図1は、(A)パパイヤモザイクウイルス外殻(又はカプシド)タンパク質のアミノ酸配列(GenBank Accession No. NP_044334.1;配列番号:1)、(B)パパイヤモザイクコートタンパク質をコードするヌクレオチド配列(GenBank Accession No. NC_001748 (ヌクレオチド5889-6536);配列番号:2)及び(C)変異体PapMVコートタンパク質CPΔN5のアミノ酸配列(配列番号:3)を示す。
【図2】図2は、抗原単独、抗原に加えてPapMV、フロイント完全アジュバント(FCA)又はE.コリO111:B4由来のLPSで免疫0日目に免疫したBALB/cマウス(3匹/群)における、モデル抗原(A)鶏卵リゾチーム(HEL)及び(B)オボアルブミン(OVA)に対する抗体応答を強化するPapMVの能力を示す。2つの実験に由来する代表的結果を示す。免疫した動物から採取した血清の抗体は、モデル抗原(HEL又はOVA)での、(C)IgG1、(D)IgG2a及び(E)IgG2bについてELISAによりイソタイプを判別した。
【図3】図3は、(A)親和性ペプチドのPapMVコートタンパク質のC−末端におけるOmpC又はOmpF(それぞれコンストラクトPapMV OmpC及びPapMV OmpF)との融合を含む組換えコンストラクトの略図;(B)精製タンパク質PapMV、PapMV OmpC、PapMV OmpF、OmpC及びOmpFのプロファイルを示すSDS−PAGE、[第1レーン:分子量マーカー、第2レーン;PapMV VLP、第3レーン;PapMV OmpC VLP、第4レーン;PapMV OmpF VLP、第5レーン;精製OmpC、第6レーン;精製OmpF]、並びに(C)組換えPapMV OmpC及びPapMV OmpF VLPの高速ペレットの電子顕微鏡写真を示す。
【図4】図4は、それらのそれぞれの抗原に対するPapMV VLPの高い親和力の結合を示す。(A)は、OmpC抗原に対する高結合活性PapMV OmpC VLP結合を示すELISAを示す。(B)は、OmpF抗原に対する高結合活性PapMV OmpF VLP結合を示すELISAを示す。
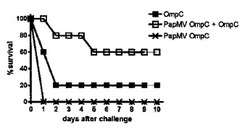
【図5】図5は、マウスおけるS.チフィ(S.typhi)でのチャレンジに対する保護アッセイの結果を示す。(A)は、OmpC単独で免疫したマウス及びOmpC+PapMV OmpC VLPを含む製剤で免疫したマウスにおける、100LD50のS.チフィに対する防御能を表し;(B)は、OmpF単独で免疫したマウス及びOmpF+PapMV OmpF VLPを含む製剤で免疫したマウスにおける、100LD50のS.チフィに対する防御能を表し;(C)は、OmpC単独で免疫したマウス及びOmpC+PapMV OmpC VLPを含む製剤で免疫したマウスにおける、500LD50のS.チフィに対する防御能を表し、並びに(D)は、OmpF単独で免疫したマウス及びOmpF+PapMV OmpF VLPを含む製剤で免疫したマウスにおける、500LD50のS.チフィに対する防御能を表す。
【図6】図6は、OmpCに対する抗体応答の評価を示しており;イソタイプIgG1、IgG2a、IgG2b及びIgG3のOmpCに対するIgG応答をOmpC又はOmpC+PapMV OmpC VLPを含むワクチンで免疫したマウスの間で測定した。
【図7】図7は、OmpC及びPapMV OmpCのマウスに対する同時免疫に続くS.チフィのチャレンジが、OmpC又はPapMV OmpC単独による免疫と比較した場合、S.チフィ感染(生存%によって示している)に対するマウスの長期に渡る活発な防御を助けることを示している。
【図8】図8は、PapMVウイルスがOmpCポーリンの防御能を上昇させたことを示している;100(黒記号)又は500致死量50(LD50)(白記号)のS.チフィで行ったチャレンジの結果を、チャレンジ後10日間記録した生存率と共に示す。
【図9】図9は、Salmonella enterica 亜種enterica serovar Typhi Ty2(GenBank Accession No. P0A264)由来のOmpC前駆体タンパク質のアミノ酸配列(配列番号:4)を示す;
【図10】図10は、Salmonella enterica亜種 enterica serovar Typhi CTl 8(GenBank Accession No. CAD05399)由来のOmpF前駆体タンパク質のアミノ酸配列(配列番号:5)を示す。
【図11】図11は、(A)OmpCに結合するための親和性ペプチドを含むPapMVコートタンパク質[配列番号:6]、及び(B)OmpFに結合するための親和性ペプチドを含むPapMVコートタンパク質[配列番号:7]のアミノ酸配列を示す。クローン化された配列と野生型配列との間の差異は、太字及び下線で特筆する;親和性ペプチド配列を下線で、並びにヒスチジンタグを斜字体で示す。
【図12】図12は、(A)E.コリから精製したPapMV VLPの電子顕微鏡写真;(B)親和性ペプチドSTASYTR[配列番号:8](PapMVCP−STASYTR)を含むPapMV VLPの電子顕微鏡写真;(C)PapMVCP−STASYTRのHCVコアタンパク質(1−170)NLP(1μg/ml)への結合を示すELISAを示す。灰色のバーはPapMVCP−STASYTRで得られたシグナルを表し;点のバーはPapMV VLP単独で得られたバックグラウンドシグナルを表し;並びに(D)1μg/mlの遊離HCVコアタンパク質(1−170)をELISAプレートにロードするために使用した以外はCと同様である。全てのELISAは、PapMVコートタンパク質に対するポリクローナルウサギ抗体及びアルカリホスファターゼに結合したヤギ抗ウサギ抗体により明らかにされた。
【図13】図13は、HCVコアタンパク質及びPapMV VLPに対するマウスにおける免疫応答を示している:(A)はHCVコアタンパク質(1−82)NLP(「コア」)、親和性ペプチドSTASYTR[配列番号:8]を含むPapMV VLP(「PapSTA」)、及びHCVコアタンパク質(1−82)NLPと併用したPapSTA(「PapSTA+コア」)に対する抗体価(全IgG)を表す。並びに(B)PapSTA、HCVコアタンパク質(1−82)NLP、又はHCVコアタンパク質(1−82)NLPと併用したPapSTAで免疫した後、HCVポリタンパク質のアミノ酸1−382を発現する組換えワクチンウイルスでチャレンジしたマウスの両方の卵巣から回収された組換えワクチンウイルスの抗体価を表す。
【図14】図14は、(A)HCVコアタンパク質断片(PapMVCP−STASYTR;配列番号:48)に結合するための親和性ペプチドを含むPapMVコートタンパク質のヌクレオチド配列、及び(B)PapMVCP−STASYTRコンストラクト(配列番号:42)のアミノ酸配列を表す。開始コドンを太字斜字体で、終止コドンを太字及び下線で、並びにヒスチジンタグを斜字体で示す。
【発明を実施するための形態】
【0027】
パパイヤモザイクウイルス(PapMV)又はPapMVのコートタンパク質由来のウイルス様粒子(VLP)に対して複数の親和性部分を介して複合体化された1以上の抗原を含む、親和性で複合体化された抗原系(ACAS)が提供される。「由来」は、野生型コートタンパク質の配列と実質的に同一であるアミノ酸配列を有するコートタンパク質を含むVLPを意味する。親和性部分は、対象とする抗原に特異的に結合できる分子又は化合物であり、これらは、例えば化学的もしくは遺伝子工学的手段によりPapMVもしくはPapMV VLPのコートタンパク質に取り付けられて、親和性PapMV(「aPapMV」)もしくは親和性VLP(「aVLP」)を形成することができる。1つの実施形態では、本発明にしたがうaPapMV及びaVLPは、高分子等の大きな抗原に複合体化するために特に有用である。
【0028】
抗原は、本発明のACASにおいてaPapMV又はaVLPに「複合体化され」ているとして、本明細書内に記載されているが、ACASにおける抗原(単数もしくは複数)及びaPapMV/aVLPは、局所的な環境に応じて時々又は常に、非複合体化の状態で提示されてもよいと考えられる。同様に、ACASに存在する全ての抗原が、同種のaPapMV/aVLPに複合体化され得るわけではないと考えられる。例えば、当業者によって理解されるように、非常に高いあるいは低いpHもしくは塩濃度、又は高希釈のACASといった条件は、抗原(単数もしくは複数)の同種のaPapMV/aVLPへの結合に影響を及ぼし得るであろう。
【0029】
本発明のACASは、必要に応じて、1以上のさらなる孤立した抗原(すなわちAIA)をさらに含み得る。本発明の文脈では、AIAは、aPapMV/aVLPにより含まれる親和性部分が結合できる抗原(単数又は複数)以外の抗原である。
【0030】
本発明の一態様にしたがって、ACASは免疫原性であり、かつ動物に投与された場合に免疫応答を誘導することができる。免疫応答は、体液性応答、細胞性応答または両方であってもよい。したがって、本発明は、ACASを構成する免疫原性組成物(ワクチンを含む)を提供する。免疫原性組成物は、動物における体液性及び/又は細胞性応答を必要とする種々の疾病及び疾患の、治療(予防を含む)において有用である。本発明の1つの実施形態において、ACASは、動物の体液性免疫応答の関与を必要とする疾病又は疾患の予防を含む治療において特に有用である。
【0031】
定義
別に定義しない限り、本明細書内で用いられる全ての技術的及び科学的用語は、本発明が属する分野の当業者によって一般に理解されるものと同様の意味を有する。
【0032】
本明細書内で用いられる用語「約(about)」は、所与の値からおよそ+/−10%の変動を言う。はっきりと言及していようがなかろうが、そのような変動は常に本明細書内で与えられた任意の所与の値にも含まれると理解すべきである。
【0033】
本明細書内で用いられる用語「アジュバント(adjuvant)」は、動物における免疫応答を増強、刺激、作動、促進及び/又は調節する、剤を言う。
【0034】
本明細書内で用いられる用語「免疫原性(immunogenic)」は、物質の、動物における検出可能な免疫応答を誘導する能力を言う。
【0035】
本明細書内で同じ意味で用いられる用語「免疫刺激(immune stimulation)」及び「免疫賦活(immunostimulation)」は、動物病原体もしくは疾病とは無関係であるPapMVもしくはPapMV VLP等の分子が、免疫系を刺激すること及び/又は感染もしくは疾病に対して応答する免疫系の能力を改善することにより、病原体による感染又は疾病に対する防御を提供する能力を言う。免疫賦活は、予防的効果、治療的効果、又はそれらの組み合わせを有してもよい。
【0036】
本明細書内で用いられる用語「免疫応答(immune response)」は、物質(例えば、化合物、分子、材料等)の投与に対する応答における動物の免疫系の反応性の変化を言い、並びにこれは、抗体産生、細胞性免疫の誘導、補体活性化、免疫寛容の発達もしくはそれらの組み合わせを伴い得る。
【0037】
本明細書内で用いられる用語「免疫(vaccination)」は、免疫防御応答を起こす目的のために対象へのワクチンの投与を言う。免疫は、予防効果、治療効果、又はそれらの組み合わせを有していてもよい。免疫は、治療される対象対象に応じて種々の方法を用いて行うことができ、これらに限定されないが、腹腔内投与(i.p.)、静脈内投与(i.v.)又は筋肉内投与(i.m.)等の非経口投与;経口投与;経鼻投与;皮内投与;経皮投与及び液浸等が挙げられる。
【0038】
本明細書内で用いられる用語「ワクチン(vaccine)」は、免疫防御応答を引き起こすことができる組成物を言う。
【0039】
本明細書内で用いられる用語「疾病又は疾患惹起薬剤」は、宿主における疾病又は疾患を惹起し得る剤を言う。限定されない例としては、癌、感染症、アレルギー反応、自己免疫疾患を引き起こす剤、又は薬物、ホルモン、又は毒素に対する免疫応答を誘導し得る剤が挙げられる。感染症としては、例えば細菌、ウイルス、原生生物、菌類及び寄生虫といった種等の病原体によって引き起こされるものが挙げられる。
【0040】
本明細書内で用いられる用語「病原体(pathogen)」は、宿主における疾病又は疾患を引き起こし得る生物を言い、これらに限定されないが、細菌、ウイルス、原生生物、菌類及び寄生虫が挙げられる。
【0041】
本明細書内で用いられる用語「天然に存在する(Naturally-occurring)」は、物に対して適用する場合、その物が自然界において発見され得ることを言う。例えば、生物(ウイルスを含む)、又は自然界のソースから単離され得る生物中に存在するポリペプチドもしくはポリヌクレオチド配列であって、かつ人によって研究室内で意図的に改変されていないものは天然に存在するものである。
【0042】
本明細書内で用いられる用語「ポリペプチド(polypeptide)」又は「ペプチド(peptide)」は、ペプチド結合によってつながった少なくとも4つのアミノ酸がある分子を意味することを意図している。
【0043】
本明細書内で用いられる表現「ウイルス核酸(viral nucleic acid)」は、ウイルスのゲノム(もしくはその大部分)、又は該ゲノムに対する塩基配列において相補的な核酸分子であり得る。ウイルスRNAに対して相補的なDNA分子もまた、ウイルスDNAに対する塩基配列において相補的であるRNA分子と同様、ウイルス核酸と見なされる。
【0044】
本明細書内で用いられる用語「ウイルス様粒子」(VLP)は、ウイルス粒子と似た外観を有する自己集合性粒子を言う。VLPは、ウイルス核酸を含んでも、含んでいなくてもよい。VLPは、通常、複製することができない。
【0045】
本明細書内で用いられる用語「偽ウイルス(pseudovirus)」は、プラスミド形態の核酸を含むDNA又はRNA等の核酸配列を含むVLPを言う。偽ウイルスは、通常、複製することができない。
【0046】
本明細書内で用いられる用語「免疫原(immunogen)」及び「抗原(antigen)」は、単独又はアジュバントとの併用により対象における免疫応答を誘導することができる、分子(単数、複数)、分子の一部(単数もしくは複数)、又は分子の組み合わせ、並びにそれらを含めて全細胞及び組織までを言う。免疫原/抗原は、単一のエピトープを含んでもよく、又は複数のエピトープを含んでもよい。したがって、該用語は、ウイルス、ペプチド、炭水化物、タンパク質、核酸並びに、細菌及び寄生虫を含めた種々の微生物の全体又は一部を包含する。ハプテンもまた、本明細書内で用いられる用語「免疫原」及び「抗原」により包含されると考えられる。
【0047】
本明細書内で用いられる用語「刺激(prime)」及びその文法的変化は、抗原による追加免疫を投与する前に、動物における抗原に対する免疫応答を刺激及び/又は作動することを意味する。
【0048】
本明細書内で用いられる用語「治療する(treat)」、「治療される(treated)」又は「治療すること(treating)」は、疾病又は病原体に関して用いる場合、疾病もしくは病原体による感染に対する対象の耐性を増加させる(即ち、対象が病気にかかるもしくは病原体により感染する可能性を低下させる)治療、並びに対象が病気にかかったもしくは疾病もしくは感染と戦う(例えば、疾病もしくは感染を低減、除去、寛解もしくは安定させる)ための感染後の治療を言う。
【0049】
本明細書内で用いられる用語「対象(subject)」又は「患者(patient)」は、治療を必要とする動物を言う。
【0050】
本明細書内で用いられる用語「動物(animal)」は、ヒト及び非ヒト動物の両方を言い、これらに限定されないが、哺乳動物、鳥類、及び魚類が挙げられ、並びに、例えば、ウシ、ブタ、ウマ、ヤギ、ヒツジ又は他の有蹄動物、イヌ、ネコ、ニワトリ、アヒル、ヒトでない霊長類、モルモット、ウサギ、フェレット、ラット、ハムスター及びマウス等の家畜(domestic)、家畜(farm)、動物園の動物、実験動物及び野生動物を包含する。
【0051】
核酸又はアミノ酸配列に関して本明細書内で用いられる用語「実質的に同一」は、、例えば以下に記載する方法を用いて必要に応じてアラインした場合、、核酸又はアミノ酸配列が、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%の配列同一性を、規定された第2の核酸又はアミノ酸配列(すなわち「参照配列」)と共有することを示す。「実質的な同一性」は、完全長配列、機能的ドメイン、コーディング配列及び/又は調節配列、プロモーター、及びゲノム配列等、種々の型及び長さの配列を参照するために用いられ得る。2つのアミノ酸又は核酸配列の間の同一性のパーセントは、当業者の技術の範囲内の種々の方法で決定され得、例えば、Smith Waterman Alignment (Smith, T. F. and M. S. Waterman (1981) JMol Biol 147: 195- 7); GeneMatcher PlusTM内に組み込まれた"BestFit" (Smith 及びWaterman, Advances in Applied Mathematics, 482-489 (1981))、Schwarz及びDayhof (1979) Atlas of Protein Sequence and Structure, Dayhof, M. O.,編 pp 353-358; BLAST program (Basic Local Alignment Search Tool (Altschul, S. F., W. Gish,ら(1990) J Mol Biol 215: 403-10等、公的に入手可能なコンピュータソフトウェア、並びにBLAST-2、BLAST-P、BLAST-N、BLAST-X、WU-BLAST-2、ALIGN、ALIGN-2、CLUSTAL、及びMegalign (DNASTAR)ソフトウェアを含むそれらの変形を用いて決定され得るさらに、当業者は、比較している配列に渡って最大のアライメントを達成するために必要なアルゴリズムを含む、アライメントを評価するのための適切なパラメータを決定し得る。一般に、アミノ酸配列に対して、比較配列の長さは少なくとも10アミノ酸であるだろう。当業者は、実際の長さが、比較される配列の全体の長さに依存するであろうこと、並びにそれらが少なくとも20、少なくとも30、少なくとも40、少なくとも50、少なくとも60、少なくとも70、少なくとも80、少なくとも90、少なくとも100、少なくとも110、少なくとも120、少なくとも130、少なくとも140、少なくとも150、もしくは少なくとも200のアミノ酸であってもよく、又はアミノ酸配列の全長であってもよいと理解するだろう。核酸に関して、比較配列の長さは、通常、少なくとも25ヌクレオチドであるだろうが、少なくとも50、少なくとも100、少なくとも125、少なくとも150、少なくとも200、少なくとも250、少なくとも300、少なくとも350、少なくとも400、少なくとも450、少なくとも500、少なくとも550、もしくは少なくとも600ヌクレオチドであってもよく、又は核酸配列の全長であってもよい。
【0052】
用語「一致している(corresponding to)」又は「一致する(corresponds to)」は、核酸配列が参照核酸配列の全て又は一部と同一であることを示す。対照的に、用語「相補的(complementary to)」は、核酸配列が参照核酸配列の相補鎖の全て又は一部と同一であることを示すために本明細書内で用いられる。説明のために、核酸配列“TATAC”は、参照配列“TATAC”と一致し、参照配列“GTATA”に相補的である。
【0053】
親和性で複合体化された抗原系(ACAS)
本発明の親和性で複合体化された抗原系(ACAS)は、対象とする抗原に結合できる複数の親和性部分を含むように改変されたPapMV又はVLP(それぞれ親和性PapMV(aPapMV)又は親和性VLP(aVLP)を言う)を含み、それと共に、親和性部分を介してaPapMV又はaVLPに複合体化された1以上の対象とする抗原を含む。ACASは必要に応じて、上述の通り、1以上の追加の孤立した抗原(すなわちAIA)を含んでもよい。
【0054】
親和性パパイヤモザイクウイルス(aPapMV)及び親和性PapMV VLP(aVLP)
本発明のACASに含めるために好適なaPapMVは、そのコートタンパク質が、複数の親和性部分を含むように例えば化学的に改変されたPapMVである。aPapMVを調製するために用いられるPapMVは、野生型PapMV又はそれらの天然に存在する変異体であり得る。
【0055】
ACASに含めるために好適なPapMV aVLPは、多量体化及び自己集合してVLPを形成し得る組換えPapMVコートタンパク質から形成される。集合した場合、各VLPはコートタンパク質サブユニットの長いらせん配列を含む。野生型ウイルスは1200を超えるコートタンパク質サブユニットを含み、約500nmの長さである。しかしながら、野生型ウイルスよりもより短いか又はより長いかのいずれかであるPapMV VLPはなお効果的であり得る。本発明の1つの実施形態において、VLPは少なくとも40のコートタンパク質サブユニットを含む。別の実施形態において、VLPは約40から約1600の間のコートタンパク質サブユニットを含む。代替的な実施形態において、VLPは少なくとも40nmの長さである。別の実施形態において、VLPは約40nmから約600nmの間の長さである。
【0056】
集合した場合の最終的なaVLPが同一のコートタンパク質サブユニットを含むように、aVLPは、同一のアミノ酸配列を有する複数の組換えコートタンパク質から調製され得、又は、集合した場合の最終的なaVLPがコートタンパク質サブユニットにおけるばらつきを含むように、aVLPは、異なるアミノ酸配列を有する複数の組換えコートタンパク質から調製され得る。
【0057】
aVLPを形成するために用いられるコートタンパク質は、全体のPapMVコートタンパク質もしくはそれらの部分であり得、又はそれはPapMVコートタンパク質の遺伝子工学的に改変された形(例えば、1以上のアミノ酸欠失、挿入、置換等を含む形)であり得る(但しコートタンパク質がVLP内に多量体化及び集合する能力を保つという条件で)。野生型PapMV外殻(又はカプシド)タンパク質のアミノ酸配列は、当該技術分野で公知であり(Sit ら 1989, J. Gen. Virol, 70:2325-2331、及び GenBank Accession No. NP_044334.1参照)、配列番号:1として本明細書では与えられている(図1A参照)。PapMVコートタンパク質のヌクレオチド配列もまた当該技術分野で公知であり(Sit,ら、 前掲.,及び GenBank Accession No. NC_001748 (ヌクレオチド5889-6536参照))、配列番号:2として本明細書では与えられている(図1B参照)。
【0058】
上述の通り、VLPにより含まれる組換えPapMVコートタンパク質のアミノ酸配列は、親の配列に対して正確に一致している必要はなく、即ちそれは改変されたか又は「変異体配列」であってもよい。例えば組換えタンパク質は、その部位における残基が親の(参照)配列と一致しないように、1以上のアミノ酸残基の置換、挿入又は欠失により変異されてもよい。しかしながら、当業者は、そのような変異は、大規模なものではなく、組換えコートタンパク質がVLP内に多量体化及び集合する能力に劇的に影響を与えることがないであろうと理解するだろう。PapMVコートタンパク質の変異型が多量体内に集合してVLPを形成する能力は、本明細書で与える実施例に示した例示的な方法のような、例えば標準的な方法の後の電子顕微鏡検査により評価され得る。
【0059】
したがって、VLP内に多量体化及び集合する能力を保った野生型タンパク質の断片(即ち、「機能性」断片)である組換えコートタンパク質もまた、本発明により意図される。例えば、断片は、タンパク質のN末端、C末端、もしくは内部、またはそれらの組み合わせからの、1以上のアミノ酸の欠質を含んでもよい。一般に、機能性断片は、少なくとも100アミノ酸の長さである。本発明の1つの実施形態において、機能性断片は、少なくとも150アミノ酸、少なくとも160アミノ酸、少なくとも170アミノ酸、少なくとも180アミノ酸、及び少なくとも190アミノ酸の長さである。タンパク質のN末端において起こった欠失は、該タンパク質が多量体化する能力を保つために一般に25未満のアミノ酸の削除であるべきである。
【0060】
本発明にしたがって、組換えコートタンパク質が変異体配列を含む場合、変異体配列は参照配列と、少なくとも約70%同一である。1つの実施形態において、変異体配列は参照配列と、少なくとも約75%同一である。他の実施形態において、変異体配列は参照配列と、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、及び少なくとも約97%同一である。特定の実施形態において、参照アミノ酸配列は配列番号:1である。
【0061】
本発明の1つの実施形態において、aVLPは、PapMVコートタンパク質の遺伝子工学的に改変された(即ち変異体)版を含む。別の実施形態において、PapMVコートタンパク質は、タンパク質のN末端もしくはC末端からアミノ酸を削除するように、及び/又は1以上のアミノ酸の置換を含めるように、遺伝子工学的に改変されている。さらなる実施形態において、PapMVコートタンパク質は、タンパク質のN末端又はC末端から約1から約10の間のアミノ酸を削除するように、遺伝子工学的に改変されている。
【0062】
特定の実施形態において、PapMVコートタンパク質は、タンパク質のN末端の近位(即ち、配列番号:1の1及び6の位置)に存在して翻訳を開始させ得る2つのメチオニンコドンのうちの1つを除去するように、遺伝子工学的に改変されている。翻訳開始コドンのうちの1つの除去は、タンパク質の均質集団の産生を可能にする。選択されたメチオニンコドンは、例えば、該コドンを作るヌクレオチドの1つ以上を置換して、該コドンがメチオニンを除くアミノ酸をコードするか、又はナンセンスコドンとなるようにすることによって除去され得る。代替的には、全てもしくは一部のコドン、又は選ばれたコドンを含むタンパク質をコードする核酸の5’領域が、削除され得る。本発明の特定の実施形態において、PapMVコートタンパク質は、タンパク質のN末端から1から5の間のアミノ酸を削除するように、遺伝子工学的に改変されている。さらなる実施形態において、遺伝子工学的に改変されたPapMVコートタンパク質は、配列番号3と実質的に同一であるアミノ酸配列を有する。
【0063】
組換えコートタンパク質が、1以上のアミノ酸置換を包含する変異体配列を含む場合、これらは「保存的(conservative)」置換又は「非保存的(non-conservative)」置換であり得る。保存的置換は、類似した側鎖の特性を有する別の残基による1つのアミノ酸残基の置換を伴う。当該技術分野で公知のように、20の天然に存在するアミノ酸は、それらの側鎖の物理化学的特性にしたがって分類され得る。好適な分類としては、アラニン、バリン、ロイシン、イソロイシン、プロリン、メチオニン、フェニルアラニン及びトリプトファン(疎水性側鎖);グリシン、セリン、スレオニン、システイン、チロシン、アスパラギン、及びグルタミン(極性、非荷電側鎖);アスパラギン酸及びグルタミン酸(酸性側鎖)及びリジン、アルギニン及びヒスチジン(塩基性側鎖)が挙げられる。アミノ酸の別の分類は、フェニルアラニン、トリプトファン及びチロシン(芳香族側鎖)である。保存的置換は、同一グループからの別のアミノ酸によるアミノ酸の置換を伴う。非保存的置換は、異なる側鎖の特性を有する別の残基による1つのアミノ酸残基の置換を伴い、例えば、中性残基又は塩基性残基による酸性残基の置換、酸性残基又は塩基性残基による中性残基の置換、疎水性残基による疎水性残基の置換等である。
【0064】
本発明の1つの実施形態において、変異体配列は1以上の非保存的置換を含む。異なる特性を有する別のアミノ酸による1つのアミノ酸の置換は、コートタンパク質の特性を改善し得る。例えば、本明細書に記載されるように、コートタンパク質の残基128の変異は、VLP内への該タンパク質の集合を改善する。したがって、本発明の1つの実施形態において、コートタンパク質は、コートタンパク質の残基128における変異を含み、この位置のグルタミン酸残基が中性残基により置換される。さらなる実施形態において、128位のグルタミン酸残基はアラニン残基により置換される。
【0065】
同様に、組換えコートタンパク質をコードする核酸配列は親の参照配列との正確な一致を必要とせず、遺伝コードの縮退により及び/又はそれが上述の変異体アミノ酸配列をコードするように、変動してもよい。したがって、本発明の1つの実施形態において、組換えコートタンパク質をコードする核酸配列は、参照配列と、少なくもと約70%同一である。別の実施形態において、組換えコートタンパク質をコードする核酸配列は、参照配列と、少なくとも約75%同一である。他の実施形態において、組換えコートタンパク質をコードする核酸配列は、参照配列と、少なくとも約80%、少なくとも約85%又は少なくとも約90%同一である。特定の実施形態において、参照核酸配列は配列番号:2である。
【0066】
より詳細に下記に記載する通り、aVLPにより含まれるコートタンパク質もまた、ACASにより含まれる1以上の抗原との複合体化のための1以上の親和性部分を含むように、例えば化学的又は遺伝子工学的に改変されている。一つの実施形態において、aVLPは、1以上の親和性部分又は親和性ペプチドに対して遺伝子工学的に融合されたコートタンパク質を含む。
【0067】
親和性部分
本発明のACASを使用するために選ばれた親和性部分は、対象とする抗原に望ましくは特異的に結合でき、並びに、例えば化学的もしくは遺伝子工学的手段により、PapMVコートタンパク質に望ましくは取り付けられることができる。種々の親和性部分が当該技術分野で公知であり、対象とする標的抗原に結合するのに好適な親和性部分は、当業者により容易に選ばれ得る。
【0068】
好適な親和性部分の例としては、これらに限定されないが、抗体及び抗体断片(Fab断片、Fab’断片、Fab’−SH、断片(Fab'-SH, fragments)、F(ab’)2断片、Fv断片、ダイアボディ(diabodies)、及び単鎖Fv(scFv)分子等)、(ビオチン標識抗原に結合する)ストレプトアビジン、天然リガンド(もしくはリガンドの結合ドメイン)、ペプチド又はタンパク質断片(レセプタータンパク質断片等)が挙げられ、これらは、抗原に特異的に結合する。本発明の抗原への特異性を有する合成親和性部分もまた、本明細書では意図されている。
【0069】
リガンドの例としては、これらに限定されないが、タンパク質、改変タンパク質(例えば、糖タンパク質)、炭水化物、プロテオグリカン、脂質、ムチン分子、及び当該技術分野で公知の他の類似分子が挙げられる。
【0070】
所与の抗原に結合することができる種々の親和性部分は当該技術分野で公知であり、多数の抗体、抗体断片、レセプター及びレセプター断片、並びにリガンドが市販されている(例えば、特にInvitrogen Corp., Carlsbad, CA; Santa Cruz Biotechnology, Santa Cruz, CA; ABR-Affinity Bioreagents, Golden, CO, 及び Abeam Inc., Cambridge, MA)。さらに、所与の標的分子に特異的な抗体及び抗体断片を産生する方法は、当該技術分野で公知である(例えば、Current Protocols in Immunology, Coligan ら編、J. Wiley & Sons, New York, NY参照)。
【0071】
リガンドに関して、タンパク質−リガンド相互作用(Protein-Ligand INTeractions)(ProLINT)のためのウェブベースの公共にアクセス可能なデータベースは、結合データ、タンパク質に関する配列及び構造情報、リガンドに関する構造情報、並びにタンパク質−リガンド相互作用に関する実験の詳細を含む。リガンドとそれらの標的タンパク質との間の相互作用についての知識は、QSAR解析(Kitajima ら、2002. Genomic Information, 13:498-499)を用いて特徴付けられ得、並びに当該技術分野で公知の技術を用いた新規リガンドの設計に用いられ得る。
【0072】
親和性部分として用いるのに好適なペプチド又は抗体(抗体断片を含む)はまた、ファージ又は酵母提示技術等の、当業者に公知の技術により選ばれ得る。ペプチド又は抗体は、天然に存在する、組換え、合成、又はこれらの組み合わせであり得る。例えば、ペプチドは天然に存在するタンパク質又はポリペプチドの断片であり得る。本明細書内で用いられる用語ペプチドはまた、ペプチドアナログ、ペプチド誘導体及びペプチド模倣化合物を包含する。そのような化合物は当該技術分野で周知であり、並びに、例えば、より高い化学的安定性、タンパク質分解に対する上昇した耐性、強化された薬理学特性(半減期、吸収、効力及び有効性等)及び/又は低下した抗原性を含む天然に存在するペプチドを越える利点を有してもよい。
【0073】
本発明の1つの実施形態において、親和性部分はペプチドである。好適なペプチドは、約3アミノ酸の長さから約50アミノ酸の長さの範囲であり得る。本発明の1つの実施形態によれば、ACASにおける使用に好適な親和性ペプチドは、少なくとも5アミノ酸の長さである。本発明の別の実施形態にしたがって、ACASにおける使用に好適な親和性ペプチドは、少なくとも7アミノ酸の長さである。本発明の別の実施形態にしたがって、ACASにおける使用に好適な親和性ペプチドは、約5から約50の間のアミノ酸の長さである。本発明の別の実施形態にしたがって、ACASにおける使用に好適な親和性ペプチドは、約7から約50の間のアミノ酸の長さである。本発明の他の実施形態にしたがって、ACASにおける使用に好適な親和性ペプチドは、約5から約45の間のアミノ酸の長さ、約5から約40の間のアミノ酸の長さ、約5から約35の間のアミノ酸の長さ並びに約5から約30の間のアミノ酸の長さである。本発明の特定の実施形態にしたがって、ACASにおける使用に好適な親和性ペプチドは、3、4、5、6、7、8、9、10、11、12、13、14又は15アミノ酸の長さである。当業者によって理解されるように、ペプチドがPapMVコートタンパク質と遺伝子工学的に融合される場合、選ばれたペプチドの長さは、コートタンパク質がVLP内に自己集合する能力を妨げるべきではない。
【0074】
親和性部分がペプチドを含むPapMV又はVLPにより含まれる場合、親和性部分は単一のペプチドであり得、又はペプチドのタンデムな又は多重の配列を含み得る。
【0075】
大きな抗原の結合を促進するために、親和性部分とコートタンパク質との間に所望によりスペーサーを含めてもよい。好適なスペーサーは、グリシン等の中性アミノ酸の短い伸長を含む。例えば、約3から約10の間の中性アミノ酸の伸長である。1つの実施形態において、約3から約10の間のアミノ酸の伸長は、PapMVコートタンパク質と親和性部分との間に挿入される。
【0076】
上述の通り、ファージ提示は、標準的な技術(例えばCurrent Protocols in Immunology, Coliganら編、 J. Wiley & Sons, New York, NY参照)及び/又は市販のファージ提示キット(例えばNew England Biolabsから入手可能なPh.D.シリーズのキット、及びNovagenから入手可能なT7-Select(登録商標)kit)を用いて対象とする抗原性タンパク質に結合する特異的ペプチドを選ぶために用いられ得る。ファージ提示によるペプチドの選択の例もまた、下記の実施例3及び7で与えられる。
【0077】
ファージ提示により同定された所与の抗原に結合する代表的なペプチドを表1に示す。当業者は、これらのペプチドは例にすぎず、対象とする抗原に対する親和性を有する他のペプチドが当業者に公知の技術を用いて容易に同定され得ることを理解するだろう。例えば、少なくとも4つの連続したアミノ酸を含む、表1に説明した配列の切断バージョンもまた、意図される。本発明の1つの実施形態にしたがって、配列番号:9、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14に示す配列の全て又は一部を含む1以上の親和性ペプチドを含むPapMV又はVLPを含む、ACASが提供される。別の実施形態において、配列番号:8、配列番号:15、配列番号:16、配列番号:17、配列番号:18、配列番号:19又は配列番号:20に示す配列の全て又は一部を含む1以上の親和性ペプチドを含むPapMV又はVLPを含む、ACASを提供する。
【0078】
【表1】

【0079】
抗原
本発明の親和性で複合体化された抗原系(ACAS)は、親和性部分を介してaPapMV又はaVLPに複合体化された1以上の抗原を含む。ACASはまた、必要に応じて、1以上のAIAを含んでもよく、これは複合体化された抗原(単数もしくは複数)と同一又は異なっていてもよい。
【0080】
種々の疾病又は疾患に関連する多様多種の抗原は当該技術分野で公知である。本発明のACASに含めるのに適切な抗原は、例えば、目的とする疾病もしくは疾患及び/又は投与される動物等、組成物の所望の最終使用に基づいて、当業者により容易に選ばれ得る。
【0081】
例えば、抗原は、癌、感染症、アレルギー反応、もしくは自己免疫疾患等、動物における疾病もしくは疾患を引き起こし得る剤由来であり得、又は薬物、ホルモンもしくは毒素に関連する疾病もしくは疾患に対する免疫応答を誘導するための使用に好適な抗原であり得る。抗原は、例えば、細菌、ウイルス、原生生物、菌類、寄生虫等、当該技術分野で公知の病原体、又はプリオン等の感染粒子由来であってもよく、又は腫瘍関連抗原、自己抗原もしくはアレルゲンであってもよい。
【0082】
ACAS内に組み込むための抗原(単数又は複数)は、様々な大きさであってよく、並びに、例えば、ペプチド、タンパク質、核酸、多糖類、小分子、もしくは病原体全体もしくはその一部(例えば、生きた、不活化された又は弱毒化された病原体の形)まで含む、それらの組み合わせであってもよい。1つの実施形態において、ACAS内に組み込まれる抗原(単数もしくは複数)は、例えばタンパク質(糖タンパク質、リポタンパク質等を含む)、タンパク質の大きな断片(例えば、約20アミノ酸以上の長さ)、多糖類、多糖類断片、核酸、核酸断片、病原体全体もしくは病原体の一部等の巨大分子である。別の実施形態において、ACAS内に組み込まれる抗原(単数もしくは複数)は、タンパク質又はペプチドの短い断片である(例えば、約4から約20の間のアミノ酸の長さ)。
【0083】
ACASが1つより多くの抗原を含む場合、ACASに組み込むために選ばれた抗原は同一であり得、又はそれらは異なり得、並びに単独のソースもしくは複数のソース由来であってもよい。抗原は、特異的免疫応答を誘発することができる単独のエピトープをそれぞれ有し得、又は各抗原は1つより多くのエピトープを含んでもよい。
【0084】
抗原は、T細胞、B細胞、NK細胞、マクロファージにおける表面構造、クラスIもしくはクラスII APC関連細胞表面構造、又はそれらの組み合わせにより認識されるエピトープを含んでもよい。1つの実施形態において、本発明は、ACASが弱い免疫原性抗原に対してとりわけ有用であることを意図する。
【0085】
公知の抗原に加えて、本発明のACASに組み込むための抗原もまた、当業者公知の方法により対象とする病原体又は他のソースから選ばれてもよく、並びに当該技術分野で公知の標準的な免疫学的技術を用いて動物における免疫応答を誘導するこれらの能力について選別されてもよい。例えば、抗原性タンパク質内のエピトープを予測する方法はNussinov R and Wolfson H J, Comb Chem High Throughput Screen (1999) 2(5):261に記載され;並びにCTLエピトープを予測する方法はRothbardら、EMBO J. (1988) 7:93-100及びde Groot M S ら、Vaccine (2001) 19(31):4385-95に記載されている。他の方法は、Rammensee H-G.ら、Immunogenetics (1995) 41 :178-228及びSchirle Mら、Eur J Immunol (2000) 30(18):2216-2225に記載されている。
【0086】
例えば、有用なウイルス抗原としては、アデノウイルス科(Adenoviradae);アレナウイルス科(例えば、イッピイウイルス及びラッサウイルス);ビルナウイルス科;ブニヤウイルス科;カルシウイルス科;コロナウイルス科;フィロウイルス科;フラビウイルス科(例えば、黄熱病ウイルス、デング熱ウイルス及びC型肝炎ウイルス);ヘパドナウイルス科(Hepadnaviradae)(例えば、B型肝炎ウイルス);ヘルペスウイルス科(Herpesviradae)(例えば、ヒト単純ヘルペスウイルス1型);オルトミクソウイルス科(例えば、インフルエンザウイルスA型、B型及びC型);パラミクソウイルス科(例えば、ムンプスウイルス、麻疹ウイルス及び呼吸器合胞体ウイルス);ピコルナウイルス科(例えば、ポリオウイルス及びA型肝炎ウイルス);ポックスウイルス科;レオウイルス科;レトロウイルス科(Retroviradae)(例えば、BLV−HTLVレトロウイルス、HIV−1型、HIV−2型、ウシ免疫不全ウイルス及びネコ免疫不全ウイルス);ラブドウイルス(Rhabodoviridae)(例えば、狂犬病ウイルス)、並びにトガウイルス科(例えば、風疹ウイルス)のメンバー由来のものが挙げられる。1つの実施形態において、組成物は、種々の肝炎ウイルス、ヒト免疫不全ウイルス(HIV)、種々のインフルエンザウイルス、ウエストナイルウイルス、呼吸器合胞体ウイルス、インフルエンザウイルス、狂犬病ウイルス、ヒトパピローマウイルス(HPV)、エプスタインバーウイルス(EBV)、ポリオーマウイルス、又はSARSコロナウイルス等の、主要なウイルス病原体由来の1以上の抗原を含む。
【0087】
A型肝炎ウイルス(HAV)、B型肝炎ウイルス(HBV)、C型肝炎ウイルス(HCV)、デルタ肝炎ウイルス(HDV)、E型肝炎ウイルス(HEV)及びG型肝炎ウイルスを含む、肝炎ウイルス由来のウイルス抗原は、当該技術分野で公知である。抗原は、例えば、HCVコアタンパク質、E1タンパク質、E2タンパク質、NS3及び他のタンパク質(NS2、NS4a、NS4b、NS5a及びNS5b)由来、HBV HbsAg抗原又はHBVコア抗原由来、並びにHDVデルタ−抗原由来であり得る(例えば、米国特許第5378814号参照)。例えば、米国特許第6596476号;第6592871号;第6183949号;第6235284号;第6780967号;第5981286号;第5910404号;第6613530号;第6709828号;第6667387号;第6007982号;第6165730号;第6649735号及び第6576417号は、HCVコアタンパク質に基づく種々の抗原を記載する。1つの実施形態において、HCVコアタンパク質の抗原性部分が、本発明のACASに含められる。例えば、好適な抗原性部分としては、HCVコアタンパク質の最初の(N末端)82アミノ酸及びHCVコアタンパク質の最初の(N末端)170アミノ酸が挙げられる。
【0088】
ヘルペスウイルス科由来の公知の抗原の限定されない例としては、HSV−1型及びHSV−2型糖タンパク質gB、gD及びgH等の単純ヘルペスウイルス(HSV)1型及び2型由来のものが挙げられる。
【0089】
HIV抗原の限定されない例としては、gp120由来の抗原、gp160及びgp41等の種々のエンベロープタンパク質由来の抗原、p24gag及びp55gag等のgag抗原、並びにHIVのpol、env、tat、vifrev、nefvpr、vpu及びLTR領域由来のタンパク質が挙げられる。HIVの種々の遺伝子工学的サブタイプのメンバーを含む、多数のHIV−1型及びHIV−2型分離株由来のgp120の配列は公知である(例えば、Myers ら、 Los Alamos Database, Los Alamos National Laboratory, Los Alamos, N. Mex. (1992);及びModrowら、J. Virol. (1987) 61 :570 578参照)。
【0090】
他のウイルス抗原の限定されない例としては、水痘帯状ヘルペスウイルス(VZV)、エプスタイン・バー・ウイルス(EBV)並びにCMV gB及びgHを含むサイトメガロウイルス(CMV)由来のもの;並びにHHV6及びHHV7等の他のヒトヘルペスウイルス由来の抗原が挙げられる(例えば、Cheeら(1990) Cytomegaloviruses(J. K. McDougall,編., Springer- Verlag, pp. 125 169; McGeoch ら(1988; J. Gen. Virol. 69:1531 1574; U.S. Pat. No. 5,171,568; Baer ら(1984) Nature 310:207 211; 及びDavisonら (1986) J. Gen. Virol. 67: 1759 1816参照)。
【0091】
抗原はまた、インフルエンザウイルス由来、例えば、ヘマグルチニン(HA)、ノイラミニダーゼ(NA)、ヌクレオプロテイン(NP)M1及びM2タンパク質由来であり得る。これらタンパク質の配列は当該技術分野で公知であり、並びにNational Center for Biotechnology Information(NCBI)により維持されるGenBankデータベースから容易にアクセスできる。HA、NP及びマトリックスタンパク質の好適な抗原性断片としては、これらに限定されないが、ヘマグルチニンエピトープ:HA91−108、HA307−319及びHA306−324(Rothbard, Cell, 1988, 52:515-523)、HA458−467(J. Immunol. 1997, 159(10):4753-61)、HA213−227、HA241−255、HA529−543及びHA533−547(Gao, W. al., J. Virol, 2006, 80:1959-1964); ヌクレオプロテインエピトープ: NP206-229(Brett, 1991, J. Immunol. 147:984-991)、NP335−350及びNP380−393(Dyer and Middleton, 1993, Histocompatibility testing, a practical approach中(編集: Rickwood, D. and Hames, B. D.)IRL Press, Oxford, p. 292; Gulukota and DeLisi, 1996, Genetic Analysis: Biomolecular Engineering, 13:81)、NP305−313(DiBrino, 1993, PNAS 90:1508-12);NP384−394(Kvist, 1991, Nature 348:446-448);NP89−101(Cerundolo, 1991, Proc. R. Soc. Lon. 244: 169-7);NP91−99(Silver et al,1993, Nature 360: 367-369);NP380−388(Suhrbier, 1993, J. Immunology 79:171- 173);NP44−52及びNP265−273(DiBrino, 1993,(前掲));及びNP365−380(Townsend, 1986, Cell 44:959-968);マトリックスタンパク質(M1)エピトープ:M1 2−22、M1 2−12、M1 3−11、M1 3−12、M1 41−51、M1 50−59、M1 51−59、M1 134−142、M1 145−155、M1 164− 172、M1 164−173(全て Nijman, 1993, Eur. J. Immunol. 23: 1215-1219に記載); M1 17−31、M1 55−73、M1 57−68(Carreno, 1992, MoI Immunol 29:1131-1140);M1 27−35、M1 232−240(DiBrino, 1993, (前掲))、M1 59−68及びM1 60−68(Eur. J. Immunol.1994, 24(3): 777-80);及びM1 128−135(Eur. J. Immunol. 1996, 26(2): 335-39)のうち1つ以上を含む断片が挙げられる。
【0092】
他の関連する抗原性領域及びインフルエンザウイルスタンパク質のエピトープもまた、公知である。例えば、M2eペプチド(M2の細胞外ドメイン)を含むインフルエンザイオンチャネルタンパク質(M2)の断片である。このペプチドの配列はインフルエンザの様々な菌株に渡って高度に保存されている。M2eペプチド配列の例は、配列番号:21として表2に示す。この配列の変異株が同定されており、そのような変異形のいくつかの例もまた、表2に示す。
【0093】
【表2】

【0094】
M2e配列全体又はM2e配列の一部が用いられてもよく、例えば、アミノ酸2から10により定義された領域を含む断片、又は保存されたエピトープEVETPIRN[配列番号:26](M2e配列のアミノ酸6−13)等の変異形に渡って保存されている部分配列である。6−13エピトープは、GenBankにおいて入手可能なヒトインフルエンザA型株の84%で不変であることが明らかになっている。同定もされている、この配列の変異形としては、EVETLTRN[配列番号:27](9.6%)、EVETPIRS[配列番号:28](2.3%)、EVETPTRN[配列番号:29](1.1%)、EVETPTKN[配列番号:30](1.1%)並びにEVDTLTRN[配列番号:31]、EVETPIRK[配列番号:32]及びEVETLTKN[配列番号:33](各0.6%)が挙げられる(Zou, P., et al., 2005, Int Immunopharmacology, 5:631-635; Liu et al. 2005, Microbes and Infection, 7:171-177)。
【0095】
他の有用な抗原としては、不活性化ポリオウイルス(Jiang ら、J. Biol. Stand., (1986) 14: 103-9)、A型肝炎ウイルスの弱毒化株(Bradleyら、J. Med. Virol, (1984) 14:373-86)、弱毒化麻疹ウイルス(James ら、N. Engl. J. Med., (1995) 332:1262-6)等の生ウイルス、弱毒化ウイルス及び不活性化ウイルス並びに百日咳ウイルスのエピトープ(例えば、ACEL-IMUNETMacellular DTP, Wyeth- Lederle Vaccines and Pediatrics)が挙げられる。
【0096】
抗原はまた、当業者に公知である、クル病、クロイツフェルト−ヤコブ病(CJD)、スクレイピー、伝染性ミンク脳症、及び慢性消耗性疾患の原因物質等の特殊なウイルスもしくはウイルス様剤由来、又は狂牛病に関連するプリオン等のタンパク質性感染粒子由来であり得る。
【0097】
有用な細菌性抗原としては、例えば、リポ多糖類等の細菌表面の抗原性成分、莢膜抗原(タンパク質性(proteinacious)もしくは天然の多糖類)、又は鞭毛構成成分を含み、並びにこれらは、ジフテリア、百日咳、破傷風、結核、細菌性もしくは真菌肺炎、コレラ、チフス、ペスト、細菌性赤痢もしくはサルモネラ症、レジオネラ症(Legionaire's Disease)、ライム症、ハンセン病、マラリア、鉤虫症、オンコセルカ症、住血吸虫症、トリパノソーマ症(Trypamasomialsis)、リーシュマニア症(Lesmaniasis)、ジアルジア、アメーバ症、フィラリア症、ボレリア、及び旋毛虫症等の疾病に関与する公知の原因物質から得てもまたそれ由来であってもよい。
【0098】
腸内細菌科のグラム陰性菌由来の抗原の例としては、これらに限定されないが、S.チフィVi(莢膜多糖類)抗原、E.コリK及びCFA(莢膜成分)抗原並びにE.コリ繊毛アドへシン抗原(K88及びK99)が挙げられる。抗原性タンパク質の例としては、ポーリンとしても知られる外膜タンパク質(Omp)(Secundino ら、2006, Immunology 117:59);S.チフィ鉄制御外膜タンパク質等の関連ポーリン(IROMP, Sood ら、2005, Mol Cell Biochem 273:69-78)、及び、限定されないがS.チフィHSP40を含む熱ショックタンパク質(HSP)が挙げられる(Sagi ら、2006, Vaccine 24:7135-7141)。抗原性ポーリンの限定されない例としては、OmpC及びOmpFが挙げられ、これらは、多数のサルモネラ属及びエシェリキア属種中に見られる。OmpC及びOmpFのオルソログはまた、他の腸内細菌科に見られ、並びにこれらは本発明の目的のための好適な抗原性タンパク質である。さらに、腸内細菌科のポーリンタンパク質中に見られる配列の保存領域に基づいて、Omp1B(Shigella flexneri)、OmpC2(Yersinia pestis)、OmpD(S. enterica)、OmpK36(Klebsiella pneumonie)、OmpN(E. coli)及びOmpS(S. enterica)が好適であり得る(Diaz-Quinonezら, 2004, Infect. and Immunity 72:3059-3062)。
【0099】
種々の腸内細菌由来の抗原性タンパク質の配列は、当該技術分野で公知であり、並びにNational Center for Biotechnology Information(NCBI)により維持されるGenBankデータベースから容易にアクセス可能である。例えば、GenBank Accession No.P0A264(図9[配列番号:4]にも示す)及びGenBank Accession No.NP_804453:OmpC(S. enterica 亜種enterica serovar Typhi Ty2);GenBank Accession No.CAD05399 (図10[配列番号:5]にも示す):OmpF前駆体タンパク質 (S. enterica亜種enterica serovar Typhi CT 18);GenBank Accession No.16761195:OmpC(S. enterica serovar Typhimurium);GenBank Accession No.47797:OmpC(S. enterica serovar Typhi);GenBank Accession No.8953564:OmpC(S. enterica serovar Minnesota);GenBank Accession No.19743624:OmpC(S. enterica serovar Dublin);GenBank Accession No.19743622:OmpC(S. enterica serovar Gallinarum);GenBank Accession No.26248604:OmpC(E. coli);GenBank Accession No.24113600:Omp1B (Shigella flexneri);GenBank Accession No.16764875:OmpC2(Yersinia pestis);GenBank Accession No.16764916:OmpD(S. enterica Serovar Typhimurium);GenBank Accession No.151149831:OmpK36(Klebsiella pneumonie);GenBank Accession No.3273514:OmpN(E. coli)、並びにGenBank Accession No.16760442:OmpS(S. enterica serovar Typhi)である。
【0100】
種々の腫瘍関連抗原が当該技術分野で公知である。代表的な例としては、これらに限定されないが、Her2(乳癌);GD2(神経芽細胞腫);EGF−R(悪性神経膠芽腫);CEA(甲状腺髄様癌);CD52(白血病);ヒトメラノーマタンパク質gp100;ヒトメラノーマタンパクmelan−A/MART−1;NA17−A ntタンパク質;P53タンパク質;MAGE1、MAGE2、MAGE3(HLA−A1ペプチド)及びMAGE4を含む種々のMAGE(メラノーマ関連抗原E);種々のチロシナーゼ(HLA−A2ペプチド);変異ras;p97メラノーマ抗原;進行癌に関連するRasペプチド及びp53ペプチド;子宮頸癌に関連するHPV16/18及びE6/E7抗原;乳癌に関連するMUCl−KLH抗原;結腸直腸癌に関連するCEA(癌胎児性抗原),肺癌に関連するDKK−1(Dickkopf-1タンパク質)及び前立腺癌に関連するPSA抗原が挙げられる。
【0101】
有用なアレルゲンとしては、これらに限定されないが、花粉、動物のフケ、草、カビ、埃、抗生物質、刺咬昆虫毒に由来するアレルゲン、並びに様々な環境、薬物及び食物アレルゲンが挙げられる。ありふれた樹木のアレルゲンとしては、ハコヤナギ、ポプラ(popular)、セイヨウトネリコ、カバノキ、カエデ、オーク、ニレ、ヒッコリー、及びペカンの木由来の花粉が挙げられる。ありふれた植物アレルゲンとしては、ライムギ、ブタクサ、イギリスオオバコ、ソレル−ドック(sorrel-dock)及びアカザ由来のものが挙げられ、並びに植物接触アレルゲンとしては、ウルシ、ツタウルシ及びイラクサ由来のものが挙げられる。ありふれた草アレルゲンとしては、チモシー、ジョンソン、バミューダ、フェスク及びブルーグラスアレルゲンが挙げられる。ありふれたアレルゲンはまた、アルテルナリア属、フサリウム属、ホルモデンドラム属、アスペルギルス属、ミクロポリスポラ属、ケカビ属及び好熱性放線菌類等のカビ又は真菌から入手できる。ペニシリン、スルホンアミド及びテトラサイクリンはありふれた抗生物質アレルゲンである。表皮性アレルゲンは、ハウスダストもしくは有機塵(典型的には真菌起源)から、イエダニ(ヤケヒョウヒダニ(dermatphagoides pterosinyssis))等の昆虫から、もしくは羽毛、並びにネコ及びイヌのフケ等の動物ソースから入手できる。ありふれた食物アレルゲンとしては、牛乳及びチーズ(乳製品(diary))、卵、コムギ、ナッツ(例えば、ピーナッツ)、海産物(例えば、甲殻類)、エンドウマメ、マメ及びグルテンアレルゲンが挙げられる。ありふれた薬物アレルゲンとしては、局所麻酔薬及びサリチル酸アレルゲンが挙げられ、並びにありふれた昆虫アレルゲンとしては、ミツバチ、スズメバチ(hornet)、カリバチ(wasp)及びアリ毒、並びにゴキブリ腎杯アレルゲン(cockroach calyx allergens)が挙げられる。
【0102】
特に十分に特徴づけられたアレルゲンとしては、これらに限定されないが、イエダニアレルゲンDer pI及びDer pII(Chua,ら、J. Exp. Med., 167:175 182, 1988;及び Chua, ら、Int. Arch. Allergy Appl. Immunol, (1990) 91 : 124-129参照)、Der pIIアレルゲンのT細胞エピトープペプチド(Joost van Neerven,ら、 J. Immunol, (1993) 151 :2326-2335参照)、高度に大量の抗原E(Amb aI)ブタクサ花粉アレルゲン(Rafnar, ら、J. Biol. Chem., (1991) 266:1229-1236参照)、ホスホリパーゼA2(ハチ毒)アレルゲン及びその中のT細胞エピトープ( Dhillon, ら、 J. Allergy Clin. Immunol, (1992) 42参照)、シラカバ花粉(Betvl)(Breiteneder,ら、EMBO, (1989) 8:1935-1938参照)、Fel dI主要イエネコアレルゲン(Rogers,ら、 MoI Immunol, (1993) 30:559-568参照)、樹木花粉(Elsayedら、Scand. J. Clin. Lab. Invest. Suppl, (1991) 204:17-31参照)並びに複数エピトープの組換え草アレルゲンrKBG8.3(CaoらImmunology (1997) 90:46-51)が挙げられる。これら及び他の好適なアレルゲンは市販されており並びに/又は公知の技術にしたがって容易に調製され得る。
【0103】
自己抗原に関連する病気に関する抗原もまた、当業者に公知である。そのような抗原の代表的な例としては、これらに限定されないが、リンホトキシン、リンホトキシン受容体、核内因子kBリガンドの受容体活性化因子(RANKL)、血管内皮増殖因子(VEGF)、血管内皮増殖因子受容体(VEGF−R)、インターロイキン5、インターロイキン17、インターロイキン13、CCL21、CXCL12、SDF−1、MCP−1、エンドグリン、レジスチン、GHRH、LHRH、TRH、MIF、エオタキシン、ブラジキニン、BLC、腫瘍壊死因子アルファ及びアミロイドベータペプチド、並びに免疫応答を誘発するために用いられ得る各断片が挙げられる。
【0104】
有用な毒素は、一般的に有毒植物、動物及び微生物の天然物、又はこれらの化合物の断片である。そのような化合物としては、例えば、アフラトキシン、シガテラ毒素、百日咳毒素及びテトロドトキシンが挙げられる。
【0105】
レクリエーションドラッグ中毒に関して有用な抗原は、当該技術分野で公知であり、例えば、コデイン、フェンタニル、ヘロイン、モルヒネ及びアヘン等のオピオイド及びモルヒネ誘導体;アンフェタミン、コカイン、MDMA(メチレンジオキシメタンフェタミン(methylenedioxymethamphetamine))、メタンフェタミン、メチルフェニデート及びニコチン等の刺激物質;LSD、メスカリン及びシロシビン等の幻覚剤;ハシッシュ及びマリファナ等の大麻類、他の中毒性薬物又は化合物、並びにそのような化合物の誘導体、副生物、変異形及び複合体が挙げられる。
【0106】
本発明の1つの実施形態において、ACASに含まれる抗原(単数又は複数)は、タンパク質抗原である。タンパク質抗原は、全長タンパク質、実質的に全長のタンパク質(例えば、約25あるいはそれ未満のアミノ酸のN末端及び/もしくはC末端欠失を含むタンパク質)、タンパク質の抗原性断片、又はそれらの組み合わせであり得る。全長タンパク質は、それが利用できる場合、該タンパク質の前駆形態又は該タンパク質の成熟(プロセシングされた)形態であり得る。タンパク質は、例えば糖タンパク質又はリポタンパク質といった、翻訳後修飾されたものであってもよい。抗原性断片は、1又は複数のエピトープを含み得、したがって、数個のアミノ酸(例えば、少なくとも4個のアミノ酸)のペプチドから数百のアミノ酸の長さのポリペプチドまで、大きさに幅があってもよい。本発明の1つの実施形態において、ACASに組み込むために好適な抗原性断片は、少なくとも20アミノ酸の長さである。別の実施形態において、ACASに組み込むために好適な抗原性断片は、約20アミノ酸から約500アミノ酸の間の長さである。別の実施形態において、ACASに組み込むために好適な抗原性断片は、約20アミノ酸から約450アミノ酸の間の長さである。他の実施形態において、ACASにおける封入体に好適な抗原性断片は、約20アミノ酸から約400アミノ酸の間の長さ、約20アミノ酸から約350アミノ酸の間の長さ、約20アミノ酸から約300アミノ酸の間の長さ、約20アミノ酸から約250アミノ酸の間の長さ、約20アミノ酸から約200アミノ酸の間の長さ、及び約20アミノ酸から約150アミノ酸の間の長さである。別の実施形態において、ACASに含まれるタンパク質抗原は、全長又は実質的に全長のタンパク質である。
【0107】
ACASの作製
aPapMV及びaVLP
PapMVは当該技術分野で公知であり、例えば、ATCC No.PV-204TMとして、アメリカン・タイプ・カルチャー・コレクション(ATCC)から入手できる。ウイルスは、維持され得、並びに標準プロトコル(例えば、Erickson, J. W. & Bancroft, J. B., 1978, Virology 90:36-46参照)にしたがって、パパイヤ(Carica papaya)及びキンギョソウ(Antirrhinum majus)等の宿主植物で維持され得、かつ該宿主植物から精製(purified form)され得る。選ばれた親和性部分は、例えばリジン、アルギニン、アスパラギン酸、グルタミン酸及び/又はシステイン残基を介して、ウイルスの表面上に配置された反応基を通じてaPapMVを形成するためにPapMVのコートタンパク質に取り付けられ得る。
【0108】
一般に、親和性部分はPapMVのコートタンパク質に化学的に取り付けられる。「化学的に取り付けられる」とは、例えば、共有又は非共有(イオン性結合、疎水性結合、水素結合等)結合により、親和性部分がコートタンパク質に化学的に架橋されていることを意味する。親和性部分及び/又はコートタンパク質は、当該技術分野で公知のように、そのような架橋を促進するために改変されてもよく、それは例えば、例えば、C末端もしくはN末端又は内部の位置での、該タンパク質及び/又は抗原に対する官能基又は化学的部分の付加によるものである。例示的な改変としては、S−アセチルメルカプトコハク酸無水物(SAMSA)もしくはS−アセチルチオアセテート(SATA)等の官能基の付加、又は1以上のシステイン残基の付加が挙げられる。他の架橋剤は当該技術分野で公知であり、かつその多くが市販されている(例えば、Pierce Chemical Co.及びSigma-Aldrichからのカタログ参照)。例としては、これらに限定されないが、1,6−ジアミノヘキサン、1,3−ジアミノプロパン及び1,3−ジアミノエタン等のジアミン;グルタルアルデヒド等のジアルデヒド;エチレングリコール−bis(コハク酸N-ヒドロキシコハク酸イミドエステル)、ジコハク酸イミドグルタル酸エステル、ジコハク酸イミドスベリン酸エステル、N−(g−マレイミドブチリルオキシ)スルホスクシンイミドエステル及びエチレングリコール−bis(スクシンイミジルスクシネート)等のコハク酸イミドエステル;ヘキサメチレンジイソシアネート等のジイソシアネート;1,4ブタンジイルジグリシジルエーテル等のビスオキシラン;ジサリチル酸スクシニル(succinyidisalicylate)等のジカルボン酸;3−マレイミドプロピオン酸N−ヒドロキシスクシンイミドエステル等が挙げられる。上述の架橋剤の多くは、VLPから親和性部分を遠ざけるスペーサーを組み込んでいる。他のスペーサーの使用もまた、本発明により意図されている。種々のスペーサーが当該技術分野で公知であり、該スペーサーとしては、これらに限定されないが、6−アミノヘキサン酸;1,3−ジアミノプロパン;1,3−ジアミノエタン;及び1から5のアミノ酸のポリグリシン配列等の短いアミノ酸配列が挙げられる。
【0109】
コートタンパク質への1以上の親和性部分の共有結合を促進するために、PapMVの表面に露出され、かつ、親和性部分の化学結合のための適切な部位を提供するように、短いペプチド又はアミノ酸リンカーが、まずコートタンパク質に結合され得る。例えば、システイン残基、又は、共有結合(例えば酸性及び塩基性残基)を形成することができるか、もしくは共有結合を形成するように容易に改変され得るその他のアミノ酸残基を含む短いペプチドが当該技術分野で公知である。アミノ酸リンカー又はペプチドは、例えば、1から約20アミノ酸の間の長さであり得る。1つの実施形態において、コートタンパク質は、上述したような好適な架橋剤を用いることにより、1つ以上のリジン残基(これが共有結合され得る)を例えばシステイン残基と共に有する短いペプチドと、該部分において融合される。特定の実施形態において、コートタンパク質は、グリシン及びリジン残基の短いペプチド配列と融合される。別の実施形態において、ペプチドは配列:GGKGGを含む。
【0110】
本発明のaVLPを調製するために用いられ得る組換えコートタンパク質は、野生型タンパク質の配列が与えられた、当業者によって標準的な遺伝子工学技術により、容易に調製され得る。タンパク質を遺伝子操作する方法は、野生型PapMVコートタンパク質の配列(配列番号:1及び2参照)と同様に、当該技術分野で周知である(例えば、Ausubel ら. (1994 & 更新版) Current Protocols in Molecular Biology, John Wiley & Sons, New York参照)。
【0111】
野生型タンパク質をコードする核酸配列の単離及びクローニングは、標準的な技術を用いて達成され得る(例えば、Ausubelら、(前掲)参照)。例えば、核酸配列は、標準的な技術によりRNAを抽出し、次いで、該RNAテンプレートから(例えばRT−PCRによって)cDNAを合成することによりPapMVから直接得ることができる。PapMVは、モザイク病の症状を示す感染した植物の葉から、標準的な技術により精製され得る(例えば、本明細書に与える実施例1参照)。
【0112】
コートタンパク質をコードする核酸配列は、次いで、直接又は1以上のサブクローニング工程の後に、好適な発現ベクター内に挿入される。当業者は、用いられる正確なベクターは、本発明にとって重要ではないことを理解するだろう。好適なベクターの例としては、これらに限定されないが、プラスミド、ファージミド、コスミド、バクテリオファージ、バキュロウイルス、レトロウイルス又はDNAウイルスが挙げられる。以下により詳細に記載するように、コートタンパク質は次いで、発現及び精製され得る。
【0113】
あるいは、コートタンパク質をコードする核酸配列は、当該技術分野で公知の標準的なインビトロでの部位特異的突然変異誘発技術により、上述したような1以上の突然変異を導入するためにさらに改変され。得る突然変異は、コーディング配列を形成する1以上の適切なヌクレオチドの欠失、挿入、置換、逆位又はそれらの組み合わせにより導入され得る。これは、例えば、1以上のヌクレオチドのミスマッチ、挿入もしくは欠失を組み込んだプライマーを設計するためのPCRに基づく技術により、達成され得る。突然変異の存在は、例えば制限解析又はDNA配列決定といった数多くの標準的な技術により確認され得る。
【0114】
上述の通り、親和性部分がペプチド、タンパク質又はタンパク質断片である場合、コートタンパク質もまた、親和性部分をコートタンパク質に対して遺伝子工学的に融合させるために改変され得る。aVLPの表面上における親和性部分の提示を可能にし、それにより、親和性部分に結合した抗原の免疫認識を増強するために、親和性部分は、好ましくは、aVLPの外表面に配置されたコートタンパク質の領域に対して融合される。したがって、親和性部分は、例えば、コートタンパク質のアミノ(N)又はカルボキシ(C)末端において取り付けられ得、又はaVLPの外表面に配置されたコートタンパク質の内部ループに対して取り付けられ得る。本発明の1つの実施形態において、親和性部分は、PapMVコートタンパク質のC末端又はその近位において遺伝子工学的に融合される。
【0115】
融合タンパク質を作製する方法は、当業者に周知である。融合タンパク質をコードするDNA配列は、上述の通りの好適な発現ベクター内に挿入され得る。
【0116】
当業者は、コートタンパク質をコードするDNAは、コードされたタンパク質の活性に影響を及ぼすことなく種々の手段で改変され得ると理解するだろう。例えば、DNA配列における変動は、タンパク質を発現させるのに用いられる宿主細胞におけるコドン選択用に最適化するために用いられてもよく、又は発現を促進する他の配列変化を包含していてもよい。
【0117】
当業者は、発現ベクターは、コートタンパク質又は融合タンパク質をコードするDNA配列の効率的な転写のために必要とされる、転写要素等の調節要素をさらに含んでもよいと理解するだろう。ベクター内に組み込まれ得る、調節要素の例としては、これらに限定されないが、プロモーター、エンハンサー、ターミネーター、及びポリアデニル化シグナルが挙げられる。したがって、本発明は、遺伝子組換えされたコートタンパク質をコードする核酸配列に作動可能に連結された調節要素を含むベクターを提供する。当業者は、好適な調節要素の選択は、遺伝子組換えされたコートタンパク質の発現のために選ばれた宿主細胞に依存し、またそのような調節要素は、細菌、真菌、ウイルス、哺乳動物もしくは昆虫の遺伝子を含む、種々のソース由来であり得ることを理解するだろう。
【0118】
本発明の文脈では、発現ベクターは、発現されたタンパク質の精製を促進する異種核酸配列をさらに包含してもよい。該異種核酸配列の例としては、これらに限定されないが、金属親和性タグ、ヒスチジンタグ、アビジン/ストレプトアジビンをコードする配列、グルタチオン−S−トランスフェラーゼ(GST)をコードする配列及びビオチンをコードする配列等の親和性タグが挙げられる。該核酸の発現に対応するアミノ酸は、当該技術分野で公知の方法にしたがって、用いる前に発現されたコートタンパク質から除去され得る。代替的に、異種核酸配列の発現に対応するアミノ酸は、それらがその後のVLP内への集合を妨げない場合、コートタンパク質上で保たれてもよい。
【0119】
本発明の1つの実施形態において、コートタンパク質はヒスチジンタグを付したタンパク質として発現される。ヒスチジンタグは、コートタンパク質のカルボキシ末端又はアミノ末端に位置し得る。
【0120】
発現ベクターは、当該技術分野で公知の様々な方法の1つによって好適な宿主細胞又は組織内に導入され得る。そのような方法は、概してはAusubelら(前掲)に記載されているのを見出すことができ、例えば、組換えウイルスベクターを用いた、安定的な又は一過性のトランスフェクション、リポフェクション、エレクトロポレーション、及び感染が挙げられる。当業者は、コートタンパク質の発現に適切な宿主細胞の選択は、選ばれたベクターに依存するであろうことを理解するだろう。宿主細胞の例としては、これらに限定されないが、細菌、酵母、昆虫、植物及び哺乳動物の細胞が挙げられる。用いられる正確な宿主細胞は本発明にとって重要ではない。コートタンパク質は、原核生物宿主(例、E.コリ、A.サルモニシダもしくはB.スブチリス)又は真核生物宿主(例、酵母類もしくはピキア;哺乳動物細胞、例、COS、NIH、3T3、CHO、BHK、293もしくはHeLa細胞;又は昆虫細胞)において産生され得る。1つの実施形態において、コートタンパク質は原核生物細胞において産生され得る。
【0121】
組換えコートタンパク質は、VLP内に多量体化及び集合することができる。一般に、集合はコートタンパク質を発現する宿主細胞において起こる。VLPは、本明細書に与える実施例の項に記載されるような、標準的な技術により宿主細胞から単離され得る。VLPは、混入した宿主細胞タンパク質もしくはLPS等の他の化合物を除去するために、クロマトグラフィー等の標準的な技術によりさらに精製され得る。本発明の1つの実施形態において、VLPはLPSを除去するために精製される。必要に応じて、コートタンパク質は、タンパク質の同定を確かめるために、インタクトなタンパク質もしくはそのタンパク質分解断片のいずれかを用いて標準的なペプチド配列決定技術により配列決定され得る。
【0122】
親和性ペプチド、タンパク質もしくはドメインに取り付けられた組換えコートタンパク質及びコートタンパク質は、標準的な技術によって、VLP内に多量体化及び自己集合する能力について解析され得る。例えば、電子顕微鏡により精製タンパク質を視覚化することによる(例えば、実施例7参照)。VLPの形成はまた、超遠心分離法により測定されてもよく、並びに円偏光二色性(CD)分光分析は、組換えもしくは修飾タンパク質の二次構造をWTウイルスと比較するために用いられてもよい(例えば、実施例7参照)。
【0123】
VLPの安定性は、必要に応じて、当該技術分野で公知の技術、例えば、SDS−PAGE及びプロテイナーゼK分解解析により測定され得る。本発明の1つの実施形態にしたがって、本発明のPapMV VLPは上昇した温度において安定であり、室温で容易に保管され得る。
【0124】
本発明の1つの実施形態において、コートタンパク質は、宿主細胞において集合してウイルスもしくは偽ウイルスを提供し、並びに核酸及び融合タンパク質を含む感染性ウイルス粒子を作り出すために用いられ得る。これは、感染性ウイルスもしくは偽ウイルス粒子による隣接する細胞の感染並びにそこでの融合タンパク質の発現を可能にし得る。本実施形態において、ウイルスもしくは偽ウイルスを複製するために用いられる宿主細胞は、ウイルスの複製を可能にするであろう、植物細胞、昆虫細胞、哺乳動物細胞もしくは細菌細胞であり得る。本発明の1つの実施形態において、該細胞は、E.コリ等の細菌性細胞である。細胞は、ウイルス様粒子が由来するウイルスのための天然宿主細胞であり得るが、これが必要なわけではない。宿主細胞は、粒子形態(すなわち、核酸及びタンパク質を含む集合した桿状)のウイルスもしくは偽ウイルスで、最初に感染させ得るか、あるいは最初の感染に用いられるウイルス核酸が複製して、融合タンパク質を有するウイルス粒子全体の産生を引き起こすことができる限り、核酸状態(すなわち、ウイルスRNAなどのRNA;cDNAもしくはcDNAから作製された流出転写物)で最初に感染され得る。
【0125】
親和性部分が、VLPへの集合の後、コートタンパク質に化学的に取り付けられ得る場合、親和性部分は、PapMVに関して上述したとおり、種々の化学的方法によって結合され得る。
【0126】
aPapMV又はaVLPへの抗原の複合体化
抗原は、該抗原をaPapMV又はaVLPに接させることにより、aPapMV又はaVLPに複合体化され得る。複合体化は、例えば、水素結合、イオン結合、疎水性相互作用もしくはファンデルワールス相互作用といった少なくとも1つの非共有化学結合によって起こり得る。親和性部分への抗原の共有結合もまた、意図される。
【0127】
複合体化は、例えば、撹拌の有無に関わらず溶液中で抗原とaPapMV又はaVLPとを単純に混合することにより、達成され得る。上述の通り、当該技術分野で公知のように、適切な化学剤を該混合液に加えて、aPapMVもしくはaVLPと抗原との間の共有結合の形成を誘導し、それによりaPapMVもしくはaVLPと抗原との間の取り付けの強さを改善することができる。複合体化されたの後、あらゆる複合体化されなかった抗原及び/又はaPapMVもしくはaVLP及び/又は架橋剤(単数もしくは複数)は、標準的な技術、例えば、複合体化されなかったパートナーからより大きなタンパク質を単離する、クロマトグラフィーゲルろ過技術を用いて、必要に応じて除去され得る。超遠心分離法もまた、aPapMV/aVLP及び複合体化された複合体から抗原を分離するために用いられ得る。
【0128】
抗原:aPapMV/aVLPの最適比は、当業者により容易に決定され得る。例えば、重量:重量ベース(basis)で、約10:1から1:10の間の抗原:aPapMV/aVLPの比が、有用であり得る。1つの実施形態において、重量:重量ベースで約9:1から1:9の間の抗原:aPapMV/aVLPの比が、ACASを形成するために用いられる。別の実施形態において、重量:重量ベースで約8:1から1:8の間の抗原:aPapMV/aVLPの比が、ACASを形成するために用いられる。他の実施形態において、重量:重量ベースで約7:1から1:7、約6:1から1:6、約5:1から1:5の間の抗原:aPapMV/aVLPの比が、ACASを形成するために用いられる。
【0129】
aPapMVもしくはaVLPがその標的抗原に結合する能力は、例えば、フローサイトメトリー(例えば、Morin ら、 2007, J. Biotechnology, 128: 423-434参照)、電子顕微鏡、超遠心分離法を用いたプルダウンアッセイ又はELISA型アッセイ(本明細書に与えた実施例参照)といった標準的技術により、測定され得る。
【0130】
有効性の評価
上述の通り、本発明のACASは、動物において免疫応答を誘導することができる。免疫応答は、体液性応答、細胞性応答もしくは体液性及び細胞性応答の組み合わせであり得る。本発明のACASが動物において免疫応答を誘導する能力は、以下及び実施例中に記載するように、当業者公知の方法により試験され得る。例えば、ACASは好適な動物モデルに対して、例えば皮下注射によりもしくは鼻腔内に投与され得、並びに例えばELISAにより、抗体の進展が評価された。
【0131】
細胞性免疫応答もまた、当該技術分野で公知の標準的な技術により評価され得る。例えば、細胞性免疫応答は、インビトロ及びインビボにおいて、樹状細胞により、aPapMV又はaVLPに複合体化した抗原の、特異的Tリンパ球に対するプロセシング及び交差提示を評価することにより測定され得る。細胞性免疫(Tリンパ球)の誘導を評価するための他の有用な技法としては、例えば、サイトカインの誘導をモニターするためのELISA(例えば、Leclerc, D., et al., J. Virol, 2007, 81(3):1319-26)により、T細胞増殖及びIFN−γ分泌放出をモニタリングすることが挙げられる。
【0132】
本発明のACASのワクチンとしての有効性を評価するために、チャレンジ研究が行われ得る。そのような研究は、標準的な方法による、本発明のACASでの実験動物(マウス等)の群の接種を伴う。非接種動物及び/又は市販のワクチンで接種された動物を含む対照群、あるいは他の陽性対照を並行して用意する。免疫後の適切な期間の後、動物を適切な病原体、アレルゲンなどを用いてチャレンジする。次いで、接種前及び後並びにチャレンジ後の動物から採取した血液サンプルを、抗体応答について解析する。抗体応答のための好適な試験としては、これらに限定されないが、ウエスタンブロット解析及び酵素結合免疫測定法(ELISA)が挙げられる。動物はまた、抗原を含有する物質もしくは生物に関する条件の進展についてモニターされ得る。
【0133】
同様に、腫瘍関連抗原を含むACASは、実験動物の接種、及び、例えば皮下的に、動物内に癌細胞を移植することによるその後のチャレンジ、並びに該動物内での腫瘍の成長のモニタリングによって、その予防効果について試験され得る。代替的に、腫瘍関連抗原を含むACASの治療的効果は、癌細胞の移植及び腫瘍の確立の後、実験動物にACASを投与し、その後で腫瘍の増殖及び/もしくは転移をモニタリングすることにより、試験され得る。
【0134】
免疫原性組成物
本発明は、1以上の本発明のACASを1以上の非中毒性の薬学的に許容できる担体、希釈剤及び/又は賦形剤と共に含む、免疫原性組成物を提供する。そのような組成物は、例えば、疾病もしくは疾患の予防及び/又は治療のためのワクチンもしくは免疫賦活剤として用いられるのに好適である。必要に応じて、他の活性成分、アジュバント及び/もしくは免疫賦活剤を、該組成物に含めてもよい。したがって、本発明の1つの実施形態において、免疫原性組成物は、1以上のPapMV、VLP、aPapMVもしくはaVLPと共に、1以上のACASを含んでもよい。
【0135】
免疫原性組成物は、種々のルートにより投与するために処方され得る。例えば、組成物は、経口、局所、直腸もしくは非経口投与又は吸入もしくは噴霧による投与のために処方され得る。本明細書内で用いられる用語、非経口的には、皮下接種、静脈内、筋肉内、くも膜下腔内、胸骨内投与又は点滴手法が含まれる。本発明の1つの実施形態において、組成物は、局所、直腸もしくは非経口投与又は吸入もしくは噴霧による投与のために処方され得る。別の実施形態において、組成物は非経口投与のために製剤化される。
【0136】
免疫原性組成物は、好ましくは、有効量の1以上の本発明のACASを含む。本明細書内で用いられる用語「有効量」は、動物において検出可能な免疫応答を産み出すために必要とされるACASの量を言う。所与の兆候に対するACASの有効量は、例えば、細胞培養アッセイ、又は動物モデル、通常、げっ歯類、ウサギ、イヌ、ブタもしくは霊長類のいずれかにおいて最初に推定され得る。動物モデルはまた、適切な濃度範囲及び投与ルートを決定するためにも用いられ得る。そのような情報は、次いで、ヒトを含む治療される動物における投与のための有効投与量及びルートを決定するために用いられ得る。本発明の1つの実施形態において、単位用量は、約10μgから約10mgの間のコートタンパク質を含む。別の実施形態において、単位用量は、約10μgから約5mgの間のコートタンパク質を含む。さらなる実施形態において、単位用量は、約40μgから約2mgの間のコートタンパク質を含む。1以上の用量が、動物を免疫するために用いられてもよく、また1以上の用量が、同日又は数日もしくは数週間に渡って投与されてもよい。
【0137】
上述の通り、本発明のACASは、複数の抗原を含んでもよく、並びにしたがって、単一のACASが多価ワクチン製剤を提供し得る。多価ワクチンはまた、疾病又は疾患惹起薬剤の群の様々な異なるメンバーの間で保存されている、抗原を含むACASの使用を通じて提供され得る。各ACASが異なる抗原を含んでいる、複数のACASを含む多価ワクチン組成物もまた、意図されている。多価ワクチンは、例えば、1より多くの細菌、ウイルス、菌類、原生生物、寄生虫、癌、自己免疫疾患もしくはアレルゲンに対する防御を提供するため、又はこれらの疾病もしくは疾患惹起薬剤の組み合わせに対する防御を提供するために、有用である多価ワクチン製剤処方としては、より高い価数を有するワクチンに加えて、二価及び三価製剤が挙げられる。本発明の1つの実施形態は、多価ワクチンを提供する。本発明の別の実施形態は、複数の疾病又は疾患惹起薬剤に渡って保存された抗原を含む多価ワクチンを提供する。さらなる実施形態は、各ACASが異なる抗原を含んでいる、複数の(即ち2以上の)ACASを含む多価ワクチンを提供する。
【0138】
各ACASが異なる抗原を含んでいる、複数の(即ち2以上の)ACASを含むワクチン製剤処方はまた、該製剤中のエピトープがより多いことによる改善された防御を提供し得る。したがって、本発明の1つの実施形態は、各ACASが異なる抗原を含んでいる、2以上のACASを含むワクチン製剤を提供する。別の実施形態において、各ACASが同一の疾病又は疾患惹起薬剤由来の異なる抗原を含んでいる、少なくとも2つのACASを含むワクチン製剤を提供する。別の実施形態において、各ACASが疾病又は疾患惹起薬剤の異なる部分を含んでいる、少なくとも2つのACASを含むワクチン処方を提供する。
【0139】
経口使用のための組成物は、例えば、錠剤、トローチ剤、ロゼンジ、水性もしくは油性の懸濁液、分散性粉末もしくは顆粒剤、エマルションの硬もしくは軟カプセル剤、又はシロップもしくはエリキシル剤として製剤化され得る。そのような組成物は、医薬組成物の製造のために当業者に公知の標準的な方法にしたがって調製され得、並びに、薬剤的に的確で、かつ口当たりのよい調製を提供するために、甘味剤、香料剤(flavouring agents)、着色剤(colouring agent)及び保存剤からなる群より選ばれる1以上の剤を含有してもよい。錠剤は、例えば、炭酸カルシウム、炭酸ナトリウム、ラクトース、リン酸カルシウムもしくはリン酸ナトリウム等の不活性希釈剤;コーンスターチもしくはアルギン酸等の造粒剤及び崩壊剤;デンプン、ゼラチンもしくはアカシア等の結合剤、並びにステアリン酸マグネシウム、ステアリン酸もしくはタルク等の平滑剤を含む、好適な非中毒性の、薬学的に許容される賦形剤との混合物中にACASを含む。錠剤はコーティングされていなくてもよく、又は、消化管内での崩壊及び吸収を遅らせるために公知の技術によりコーティング被膜されていてもよく、その結果、より長い期間に渡る持続性作用を提供する。例えば、モノステアリン酸グリセリン(glyceryl monosterate)又はジステアリン酸グリセリル等の時間遅延物質が用いられ得る。
【0140】
経口使用のための組成物もまた、ACASが、例えば、炭酸カルシウム、リン酸カルシウムもしくはカオリンといった、不活性固形希釈剤と混合された、硬ゼラチンカプセルとしてあるいは、活性成分が、水又はピーナッツ油、流動パラフィンもしくはオリーブ油等の油媒体と混合された、軟ゼラチンカプセルとして提供され得る。
【0141】
水性懸濁液として製剤化された組成物は、例えばカルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシプロピルメチルセルロース(hydropropylmethylcellulose)、アルギン酸ナトリウム、ポリビニルピロリドン、ヒドロキシプロピル−β−シクロデキストリン、トラガントゴム及びアカシア等の懸濁剤;天然に存在するホスファチ(例、レシチン)、又はアルキレンオキシドと脂肪酸との縮合物(例、ポリオキシエチレンステアリンエテアラート)、又はエチレンオキシドと長鎖脂肪族アルコールとの縮合物(例、ヘプタ−デカエチレンオキシセタノール)、又は、エチレンオキシドと脂肪酸及びヘキシトール由来の部分エステルとの縮合物(例、ポリオキシエチレンソルビトールモノオレエート)、又は、エチレンオキシドと脂肪酸及び無水ヘキシトール由来の部分エステルとの縮合物(例、ポリエチレンソルビタンモノオレエート)、等の分散剤又は湿潤剤、1以上の好適な賦形剤との混合物中にACASを含有する。水性懸濁液もまた、1以上の保存料(例、エチルもしくは、n−プロピル p−ヒドロキシ−ベンゾエート)、1以上の着色剤(colouring agents)、1以上の香料剤(flavouring agents)もしくはスクロース又はサッカリン等の1以上の甘味剤を含有してもよい。
【0142】
組成物は、植物油(例、ラッカセイ油、オリーブ油、ゴマ油もしくはココナッツ油)中、又は流動パラフィン等の鉱油中のACASを懸濁することにより油性懸濁液として製剤化され得る。油性懸濁液は、増粘剤(例、蜜ろう、固形パラフィンもしくはセチルアルコール)を含有してもよい。口当たりのより経口剤を提供するために上に説明したような甘味剤、及び/又は香料剤(flavouring agents)を添加してもよい。これらの組成物は、アスコルビン酸等の酸化防止剤の添加により保存され得る。
【0143】
免疫原性組成物は、後に、水の添加により水性懸濁液を調製するために用いられ得る、分散性粉末もしくは顆粒剤として製剤化され得る。そのような分散性粉末もしくは顆粒剤は、1以上の分散剤もしくは湿潤剤、懸濁剤及び/又は保存料との混合物中のACASを提供する。好適な分散剤もしくは湿潤剤及び懸濁剤は、既に上述したものにより例示される。追加の賦形剤(例、甘味剤、香料剤及び着色剤)もまた、これら組成物に含まれ得る。
【0144】
本発明の免疫原性組成物はまた、オイルインウォーターエマルションとして製剤化され得る。油相は、植物油(例、オリーブ油もしくはラッカセイ油)、もしくは鉱油(例、流動パラフィン)であり得、もしくはこれらの油の混合物であってもよい。これらの組成物に組み込むために好適な乳化剤としては、天然に存在するガム(例、アカシアゴムもしくはトラガントゴム);天然に存在するリン脂質(例、ダイズ、レクチン);又は脂肪酸及びヘキシトール、無水物に由来するエステルもしくは部分エステル(例、ソルビタンモノオレエート)、並びに該部分エステルのエチレンオキシドとの縮合物(例、ポリオキシエチレンソルビタンモノオレエート)が挙げられる。エマルションもまた、必要に応じて、甘味剤及び香味料を含有し得る。
【0145】
組成物は、ACASを1以上の甘味剤(例、グリセロール、プロピレングリコール、ソルビトールもしくはスクロース)とあわせることにより、シロップもしくはエリキシル剤として製剤化され得る。そのような製剤としては、必要に応じて、1以上の粘滑薬、保存料、香料剤及び/又は着色剤を含有し得る。
【0146】
免疫原性組成物は、当該技術分野で公知の方法にしたがって、及び、上述したような好適な1以上の分散剤もしくは湿潤剤及び/又は懸濁剤を用いることにより、無菌注射用の水性もしくは油性懸濁液として製剤化され得る。無菌注射用製剤は、非中毒性で非経口的に許容される希釈液もしくは溶媒に中の無菌注射用溶液もしくは懸濁液、例えば1,3−ブタンジオール溶液であり得る。使用され得る許容されるビヒクル及び溶媒としては、これらに限定されないが、水、リンガー溶液、乳酸リンガー溶液及び等張塩化ナトリウム溶液が挙げられる。他の例としては、溶媒もしくは懸濁媒体剤として従来より使用される、無菌の固定油、及び例えば、合成のモノもしくはジグリセリドを含む、様々な無菌性固定油が挙げられる。オレイン酸等の脂肪酸もまた、注射剤の調製に用いられ得る。
【0147】
必要に応じて、本発明の組成物は、抗菌剤、酸化防止剤、キレート剤、及び不活性ガス等の保存料及び/又は炭水化物(例、ソルビトール、マンニトール、デンプン、スクロース、グルコース、もしくはデキストラン)等の安定剤、タンパク質(例、アルブミンもしくはカゼイン)又はタンパク質含有剤(例、ウシ血清もしくはスキムミルク)を好適なバッファ(例、リン酸バッファ)と共に含有してもよい。組成物の様々な成分のpH及び正確な濃度は、周知のパラメータにしたがって調整されてもよい。
【0148】
さらに、アジュバント活性を有する1以上の化合物が、必要に応じてワクチン組成物に添加されてもよい。好適なアジュバントとしては例えば、(水酸化アルミニウム、リン酸アルミニウムもしくは酸化アルミニウム;オイルエマルション(例、バイオールF(登録商標)のエマルションもしくはマルコール52(登録商標)のエマルション);サポニン、又はビタミンE可溶化物(solubilisate)が挙げられる。これらの免疫活性化作用に起因して、PapMVもしくはPapMV VLP(aPapMV及びaVLPを含む)はまた、必要に応じて、アジュバントとして免疫原性組成物に添加され得る。オプソニン化ワクチン組成物もまた、本発明により包含され得る(例、前もってワクチンで免疫された動物もしくはヒトから単離された抗体を含む、ワクチン組成物)。前もってワクチンで免疫された動物もしくはヒトから単離された抗体に基づく組換え抗体もまた、ワクチン組成物をオプソニン化するために用いられ得る。
【0149】
本発明のACASを含む組成物と市販のワクチンとの組み合わせもまた、本発明に包含される。
【0150】
他の医薬組成物及び医薬組成物を調製する方法は、当該技術分野で公知であり、例えば、”Remington:The Science and Practice of Pharmacy" (かつての"Remingtons Pharmaceutical Sciences"); Gennaro, A., Lippincott, Williams & Wilkins, Philadelphia, PA (2000)に記載されている。
【0151】
ACASの使用
本発明は、ACASの多くの適用及び使用並びにそれを含む免疫原性組成物を提供する。本発明の1つの実施形態は、例えばアジュバント、免疫賦活物質、免疫賦活剤もしくはワクチンとして投与されたときに、動物において免疫応答を誘導するためのACASの使用を提供する。免疫応答は、体液性応答、細胞性応答、又はその両方であってもよい。本発明の1つの実施形態において、ACASは、動物における体液性応答を誘導することができる。別の実施形態において、ACASは、動物における細胞性応答を誘導することができる。さらなる実施形態において、ACASは、動物において細胞傷害性Tリンパ球(CTL)応答を誘導することができる。別の実施形態において、ACASは、動物において体液性及び細胞性応答の両方を誘導することができる。
【0152】
本発明はまた、aPapMVもしくはaVLPに複合体化された抗原(単数もしくは複数)に結合できる抗体を選択するためのACASの使用を提供する。本発明は、アジュバント、免疫増強剤、免疫賦活剤、ワクチン及び/又は医薬組成物等の、診断及び薬剤の調製のための組成物の使用をさらに提供する。
【0153】
したがって、本発明のACASは、免疫応答の誘導を必要とする動物における疾病もしくは疾患の予防を含めた治療における使用に好適である。疾病又は疾患の性質に応じて、治療は、体液性免疫応答、細胞性免疫応答もしくはその両方の誘導を必要とし得る。例えば、特定の感染は、単に動物における体液性応答の誘導により効果的に予防され得、一方、他の疾病に対する完全な防御は、体液性及び細胞性応答の両方の誘導を必要とするかもしれない。例としては、体液性応答を誘導するワクチンは、腸チフス、狂犬病、ポリオ、コレラ、髄膜炎(ナイセリア・メニンギティディス(Neisseria meningitides)に起因する)、B型肝炎、ヒトメタニューモウイルス(metapheumovirus)及びインフルエンザのいくつかの種に対して効果的であり得る。他の疾病又は疾患に対する防御は、細胞性応答も誘導された場合に、最も効果的である(例、C型肝炎、マラリア、森林型熱帯リーシュマニア感染、HIV及びヒト結核菌感染)。
【0154】
したがって、本発明は、疾病もしくは疾患の予防を含めた治療のための単剤としてのACASの使用、並びに、より複雑な免疫応答を必要とする疾病/疾患のための、併用ワクチンの成分もしくは治療としてのACASの使用を提供する。そのような併用としては、例えば、追加ワクチン、アジュバント及び/又は抗原を挙げることができる。この文脈では、ACASは、治療されている動物における免疫応答を強めるための免疫賦活剤もしくはアジュバントとして作用し得る。ACASもまた、二次ワクチンの投与前の免疫系を刺激するために用いられ得る。したがって、この文脈でのACASの投与は、二次ワクチン、アジュバントもしくは抗原の投与の前、後もしくは同時に起こり得る。
【0155】
本発明のACASは、ヒト並びに家畜(domestic)及び家畜(farm animals)を含む、非ヒト動物における使用に好適である。組成物についての投与方針は、任意の他の一般に認められた免疫計画と異なる必要はない。例えば、上述の通り、効果的な免疫応答を誘発するのに十分な量のACASの単回投与を、用いてもよく、あるいは、ACASの初回投与に続き抗原単独もしくはACASで追加免疫する、他の方針が用いられ得る。同様に、ACASもしくは抗原のいずれかによる追加免疫を時々起こして、初回投与後に抗体価が許容されるレベルを下回る場合にうまくいくようにしてもよい。ACASの投与の正確な方法は、例えばACASの構成成分、治療され得る動物及び治療の望ましい最終的な効果に依存するだろう。投与の適切な方法は、当業者により容易に決定され得る。
【0156】
該方針が、ACAS及び追加抗原(単数もしくは複数)の投与を含む場合、免疫応答が求められる対象の必要性に応じてACAS構成成分は、抗原(単数もしくは複数)と同時に投与され得、又は抗原(単数もしくは複数)の投与の前もしくは後に投与され得る。
【0157】
本発明の1つの実施形態は、従来のワクチンとの複合体化における本発明のACASの使用を提供する。本実施形態によれば、ACASは従来のワクチンと同時に投与されてもよく(例、2つの組成物をあわせることによる)、又は従来のワクチンの投与の前もしくは後に投与され得る。
【0158】
本発明のACASは、予防的に用いられ得(例、ウイルス、細菌もしくは他の感染粒子による感染、又は腫瘍の進行を予防するため)、又は、感染、自己免疫もしくはアレルギー反応、薬物添加もしくは癌に関連する疾病もしくは疾患の影響を寛解させるために治療的に用いられてもよい。本発明の1つの実施形態において、ACASは、動物における疾病もしくは疾患を予防するために予防的に用いられる。ACASが投与される動物は、ヒト又は、ウシ、ブタ、ウマ、ヤギ、ヒツジ、イヌ、ネコ、ニワトリ、アヒル、シチメンチョウ、非ヒト霊長類、モルモット、ウサギ、フェレット、ラット、ハムスター、マウス、魚類もしくは鳥類等の非ヒト動物であってもよい。
【0159】
上述の通り、本発明のACASは、例えば、病気を治療するための活性化を必要とする経路、及び組成物に似含めるため又は組成物と使用するために選ばれた抗原に応じて、種々の疾病もしくは疾患の予防もしくは治療において用いられ得る。限定されない例としては、インフルエンザ(種々のインフルエンザウイルス由来の抗原を用いて)、腸チフス(S.チフィ由来の抗原を用いて)、HCV感染(HCV抗原を用いて)、HBV感染(HBV抗原を用いて)、HAV感染(HAV抗原を用いて)、デルタ肝炎(HDV抗原を用いて)、E型肝炎ウイルス(HEV抗原を用いて)、G型肝炎ウイルス(HGV抗原を用いて)、単純ヘルペスウイルス(HSV抗原を用いて)、水痘帯状疱疹ウイルス(VZV抗原を用いて)、エプスタイン・バー・ウイルス(EBV抗原を用いて)、サイトメガロウイルス(CMV抗原を用いて)、他のヒトヘルペスウイルス(例えば、HHV6もしくはHHV7抗原を用いて)、HIV感染(HIV抗原を用いて)、ポリオ(ポリオウイルス抗原を用いて)、ジフテリア(ジフテリア毒素由来の抗原を用いて)、アレルギー反応(種々のアレルゲンを用いて)及び癌(種々の腫瘍関連抗原を用いて)が挙げられる。他の使用としては、例えば炎症性疾患(例えば、関節炎)の予防もしくは治療並びに、鳥インフルエンザウイルス、ヒト呼吸器合胞体ウイルス、デングウイルス、麻疹ウイルス、ヒトパピローマウイルス、仮性狂犬病ウイルス、ブタロタウイルス、ブタパルボウイルス、ニューカッスル病ウイルス、口蹄疫ウイルス、ブタコレラウイルス、アフリカブタ熱ウイルス、ウシ感染性鼻気管炎ウイルス、感染性喉頭気管炎ウイルス、ラクロスウイルス、新生仔ウシの下痢ウイルス、ウシ呼吸器合胞体ウイルス、ウシウイルス性下痢ウイルス、マイコプラズマ・ハイオニューモニエ、連鎖球菌性細菌、淋菌性細菌、腸内細菌及び寄生虫による感染(例えば、リーシュマニアもしくはマラリア)が挙げられる。
【0160】
本発明もまた、「自己」遺伝子産物に起因するかもしくはこれにより悪化する疾病もしくは疾患を予防及び/又は弱毒化する抗体を産生するためのACASの使用を提供する。そのような疾病もしくは症状の例としては、移植片対宿主病、IgE介在アレルギー反応、アナフィラキシー、成人呼吸促迫症候群、クローン病、アレルギー性喘息、急性リンパ性白血病(ALL)、糖尿病、非ホジキンリンパ腫(NHL)、グレーブス病、全身性エリテマトーデス(SLE)、炎症性自己免疫疾患、重症筋無力症、免疫増殖性疾患リンパ節症(immunoproliferative disease lymphadenopathy)(IPL)、血管免疫増殖性リンパ節症(AIL)、免疫芽球性リンパ節症(IBL)、関節リウマチ、糖尿病、多発性硬化症、アルツハイマー病、骨粗鬆症、並びに、リウマチ熱、デング熱、ライム病染を含む特定の感染、及び感染性多発性関節炎に関連する自己免疫症状が挙げられる。
【0161】
本発明は、ホルモン、薬物及び毒性化合物等の化合物に対する免疫応答を刺激するACASの使用をさらに提供する。様々な薬物、ホルモン及び毒性化合物に対する免疫応答は、該化合物に曝露された個体における治療として、該化合物への曝露の危険性がある個体を防御するため、又は該化合物に対する中毒を予防もしくは治療するために用いられる。
【0162】
本発明もまた、例えば、ACASに複合体化する抗原に対する抗体をスクリーニングするための、スクリーニング剤としての、ACASの使用を提供する。ACASは、酵素結合免疫測定法(ELISA)又はウエスタンブロット等の従来の免疫学的技術に対して容易に適応し得、したがって診断及び研究の文脈において有用である。
【0163】
キット
本発明は、1以上のACASを含む薬学的キットをさらに提供する。キットの個々の構成要素は、別々の容器中に包装され、医薬品もしくは生物学的製品の製造、使用又は販売を規制する行政機関により定められた形態の表示がそのような容器に関連付けられてもよく、ここで該表示は、製造、使用又は販売の該機関による承認を反映したものである。キットは、必要に応じて、ACASの使用方法もしくは投与計画の概要を述べた指示書もしくは説明書を包含してもよい。
【0164】
キットの1以上の構成要素が溶液として提供される場合(例、水溶液もしくは滅菌水溶液)、容器手段は、それ自体が、そこから溶液が対象に投与され得るか、又はキットのほかの構成要素に適用されて混合され得る、吸入器(inhalant)、シリンジ、ピペット、点眼器又は他のそのような器具であってもよい。
【0165】
キットの構成要素はまた、乾燥又は凍結乾燥形態で提供されてもよく、並びにキットは、凍結乾燥成分の再構成のための好適な溶媒を含有し得る。容器の数もしくは種類に関係なく、本発明のキットもまた、患者に対する組成物の投与を補助するための装置を含んでもよい。そのような装置は、吸入器(inhalant)、シリンジ、ピペット、鉗子、計量スプーン、点眼器もしくは類似の医学的に承認された送達媒体であり得る。
【0166】
抗体検出における使用のための、1以上の本発明のACASを含有するスクリーニングキットも、提供される。キットは、診断キット又は研究目的のために意図されたキットであり得る。キットの個々の構成要素は、別々の容器中に包装され、医薬品もしくは生物学的製品の製造、使用又は販売を規制する行政機関により定められた形態の表示がそのような容器に関連付けられてもよく、ここで該表示は、製造、使用又は販売の該機関による承認を反映したものである。キットは、必要に応じて、ACASの使用方法もしくは投与計画の概要を述べた指示書もしくは説明書を包含してもよい。
【0167】
以下の実施例は、本明細書内に記載した本発明のより良い理解を得るために示している。これらの実施例は、本発明の例示的な実施形態を記載することを意図しており、いかなる意味でも本発明の範囲を限定することは意図していない。
【実施例】
【0168】
実施例1:PapMVのアジュバント効果
PapMVの精製
モザイク病の症状を示す感染したパパイヤの葉から分画遠心法により、PapMVを精製した。感染した葉(100g)を10mM EDTA含有100mL 50mM Tris−HCl中で、市販のブレンダー内で粉砕した。粉砕した葉をチーズクロスに通してろ過し、1%のトリトンX−100をろ液に添加し、ろ液を穏やかに10分間撹拌した。ろ液の4分の1の量に等しい量までクロロホルムを滴下した。溶液をさらに30分間4℃で撹拌し、10000gで20分間遠心分離し、沈殿を除去した。上清を、120分間の高速(100000g)遠心分離に供した。ウイルスペレットを懸濁し、スクロースクッション(30% スクロース)を通した、100000gで3.5時間の別の高速遠心分離に供した。最終ウイルスペレットを、10mLの50mM Tris(pH8.0)に懸濁した。色が持続した場合、クロロホルムで追加の清澄を行った。精製したウイルスを、超遠心分離法により回収した。
【0169】
抗原
LPSフリーOVAグレードVIを、Sigma-Aldrich Chemical Co, St Louis, MOから購入した。ニワトリ卵白リゾチーム(HEL)をResearch Organics Inc. Cleveland, OHから購入した。E.コリO111:B4由来のLPSをSigma-Aldrich, St Louis, MOから購入した。
【0170】
免疫
BALB/cマウス、6−8週齢を、メキシコ国立自治大学(UNAM)、医学部、実験的医薬研究部門の動物施設下で飼育及び維持し、優良実験室規範のガイドラインにしたがって世話をした。アジュバントの効果を調べるために、マウスの群を、2mgのOVAもしくはHEL単独で、又は30mgのPapMV、CFA1:1(v/v)、もしくは5mgのE.コリO111:B4由来のLPS(Sigma-Aldrich)と共に、0日目に腹腔内に免疫した。対照マウスに食塩溶液のみを注射した。図2に示すように、種々の時間において、血液試料を逆眼窩血脈洞から採取した。個々の血清試料を、解析まで−20℃で保管した。3匹のマウスを各実験に用いた。
【0171】
ELISAによる抗体価の測定
高結合96ウェルポリスチレンプレート(Highpbinding 96-well polystyrene plates)(Corning(登録商標), New York, NY)を、0.1M 炭酸塩−重炭酸塩バッファ(pH9.5)中の1mg/mLのPapMV、100mg/mLのHEL、又は150mg/mL OVAでコートした。プレートを1時間37℃で、次いで終夜4℃でインキュベートした。翌朝使用する前に、プレートを0.05% Tween−20含有PBS(pH7.2)(PBS−T)(Sigma-Aldrich)で3回洗浄した。非特異的結合を、PBSで希釈した5%脱脂粉乳(PBS−M)で1時間、37℃でブロックした。洗浄の後、マウス血清をPBS−Mで1:40に希釈し、2倍の段階希釈液をウェルに添加した。プレートを1時間37℃でインキュベートし、次いで、PBS−Tで4回洗浄したペルオキシダーゼ抱合ウサギ抗マウスIgM(最適希釈1:1000)IgG、IgG1、IgG2a、IgG2b抗体(Zymed, San Francisco, CA)又はIgG3(最適希釈1:3000)(Rockland, Gilbertsville, PA)を添加し、プレートを1時間37℃でインキュベートし、PBS−Tで3回洗浄した。30% 過酸化水素を含有する0.1M クエン酸バッファ(pH5.6)中のオルトフェニレンジアミン(0.5mg/mL;Sigma-Aldrich)を、酵素基質として用いた。反応を2.5N H2SO4で停止し、BIOLINX 2.22ソフトウェアを備えた自動ELISAプレートリーダー(Dynex Technologies MRII, Chantilly, VA, USA)を用いて、490nmにおける吸光度を測定した。抗体価は、−log2希釈×4として与えられる。陽性の力価は、陰性対照の平均値よりの3SD高いものとして定義した。
【0172】
結果
アジュバントが低免疫原性ワクチンに対して共投与される場合の、抗体応答への自然免疫応答の転換を観察した。アジュバントは、抗原に対する抗体もしくは細胞性免疫応答を強化又は増強することができる。PapMVが、他の抗原に対する長期に渡る抗体応答を促進し得るアジュバントであるかどうかを判定するために、BALB/cマウスを、OVA又はHELを、単独又は以下のアジュバント:PapMV、CFAもしくはLPSと共にのいずれかで免疫した。OVA又はHELに特異的なIgG抗体価は、ELISAにより、示したタイムポイントにおいて測定した(図2A及びB)。PapMVのアジュバント効果は、免疫した動物におけるOVA及びHELに対する総IgG応答で見られた。PapMVにより誘導されたアジュバント効果は、免疫後30日目のHELに関して見られ、その時、HEL単独により増加した抗体価と比較して、抗体価が8倍になった。抗体価におけるこの差異は、120日目までは維持されたが、400日目までは維持されなかった(図2A)。LPSは、免疫後最初の30日間においてのみアジュバント効果を誘導したが、CFAは、免疫後8日目から実験終了の400日目までが、最も強いアジュバント効果を示した(図2A)。OVAでの免疫について、総IgG抗体価におけるアジュバント効果が、最初の免疫後120日目までにのみ見られ、その後抗体価は時間と共に減少し、400日目にはOVAと比較すると4倍の高さであった(図2B)。OVA及びOVAとアジュバントとの共免疫(PapMVは総IgG応答においてアジュバント効果を示さなかった)により、どのIgGサブクラスが誘導されたかを同定するために、20日目にさらなる解析を行った。PapMV、LPS、及びCFAは、OVA特異的UgG2a及びIgG2b抗体価を誘導し、一方ではOVA単独が、IgG1特異的抗体価のみを誘導した(図2C−E)。OVAが使用されるアジュバントのいずれかと共免疫される場合、IgG1に対するアジュバント効果は見られなかった。これらの結果は、PapMV、LPS、及びCFAが、OVAに対するIgGサブクラス応答においてアジュバント効果を誘導することを示す。さらに、PapMVは、モデル抗原に対する特異的抗体価の長期に渡る増加を誘導する、アジュバント特性を示す。総合すると、これらのデータは、PapMVが、観察された、抗原特異的である長期に渡る抗体応答への先天性応答の転換を介在し得る、固有のアジュバント特性を有することを示唆する。
【0173】
実施例2:S.チフィポーリンタンパク質の精製
以下の精製手順を、OmpC及びOmpFの精製に用いた。精製手順は、Secundino ら(2006), Immunology 117:59に記載されたものに基づく。
【0174】
2つのタンパク質をS.チフィから共精製した。OmpC及びOmpFの個々の精製は、OmpC[STYC 171 (OmpC-)]又はOmpF[STYF302 (OmpF-)]オープンリーディングフレームが中断された、S.チフィノックアウト変異体を用いて達成した。細菌のノックアウト変異型由来の個々のタンパク質の精製の手順は、共精製の場合にしたがった。本手順を以下に概説する。
【0175】
細菌種、S.チフィ9,12,Vi:d(ATCC 9993)を、酵母エキス、マグネシウム及びグルコースを添加した最少培地A中で、37℃、200rpmで成育した。酵母エキス、マグネシウム及びグルコースを添加した、10L 最少培地Aについての処方は:5.0gの無水クエン酸Na(NaC6H5O7:2H2O)、31.0g 一塩基のNaPO4(NaH2PO4)、70.0g 二塩基のNaPO4(Na2HPO4)、10.0g (NH4)2SO4、200mL 酵母抽出溶液5%(300mL中15.0g)である。1.434L 培地を4Lの三角フラスコに分配した。滅菌を121℃、15lbspression/in2、15分で行った。次いで、各フラスコに(o each flask):6.0mLの滅菌MgSO4溶液 25%及び60.0mLのグルコース溶液 12.5%を添加した。フラスコに、終夜培養のS.チフィを接種し、OD540が1.0に達した時に、培養を停止し、7500rpmで15分間、4℃で培養物を遠心分離した。ペレットを100mL 最終Tris−HCl pH7.7(6.0g Tris塩基/L)で懸濁し、バイオマスを90分間、氷上で超音波処理し、次いで7500rpmで、20分間4℃で遠心分離した。各10mLの上清に:2.77mL MgCl2 1M、25ml RNaseA(10000U/mL)、25ml DNaseA(10000U/mL)を添加した。次いで、混合物を37℃及び120rpmで30分間インキュベートした。
【0176】
混合物からのポーリンの抽出は、まず45000rpmで、45分間4℃で混合物を超遠心分離をし、そして、及びペレットを保持することにより行った。次いで、ペレットを10mL Tris−HCl−SDS 2%に懸濁し、続いてホモジナイズした。次に、インキュベーションことを32℃、120rpm、30分間で行い、混合物を40000rpm、30分間、20℃で(fat)超遠心分離し、ペレットを保持した。ペレットを5mL Tris−HCl−SDS 2%に再懸濁し、続いてホモジナイズ及び32℃、120rpm、30分間のインキュベーションことを行った。40000rpm、30分間、20℃での別の超遠心分離ことを行い、ペレットを保持した。ペレットを、20mL Nikaidoバッファ−SDS 1%に再懸濁し、続いてホモジナイズした。[1LのNikaidoバッファとして:6.0g Tris塩基、10.0g SDS、23.4g NaCl、1.9g EDTAを水に溶解し、pHをpH7.7に調整した。次いで、0.5mL β−メルカプトエタノール溶液を添加した。]次いで、混合物を37℃で、120rpm、120分間インキュベートした。最後に、混合物を40000rpm、45分間、20℃で超遠心分離し、ポーリン抽出物を含有する上清を回収した。
【0177】
ポーリンは、高速タンパク質液体クロマトグラフィー(FPLC)を用いて、上清から精製した。精製工程の間、β−メルカプトエタノールを含まない0.5×Nikaidoバッファ(上記参照)を使用した。タンパク質は、流速:10mL/分でSephacryl S-200 (FPLC WATERS 650 E)を用いて分離した。カラムに22mLの上清をロードした。溶出画分を260nm及び280nmでモニターした。精製ポーリンを含有するメインピークを保持し、4℃で保管した。精製ポーリンは、長期間安定であった(1年以上)。
【0178】
結果
図3Bは、上述の手順により精製された、ポーリン、OmpC及びOmpFのSDS−PAGEのプロファイルを示す。
【0179】
実施例3:OmpC又はOmpFに対する親和性ペプチドを含むPapMV VLPの産生及び遺伝子操作
【0180】
親和性ペプチドの選択
Ph.D-7 Phage Display Peptide Library Kit(New England Biolabs, Inc.)を用いて、精製OmpC及びOmpFに対する特異的ペプチドを選んだ。以下のプロトコルは、「パニング(panning)」として知られるin vitro選択方法であり、これは、製造者のプロトコルにしたがって行った。簡潔に述べれば、2×1011ファージをELISAプレートのウェルの底に結合させた10μgの精製OmpC又はOmpFに添加し、ウェルの内容物を室温で1時間、穏やかに混合した。結合しなかったファージを1mlの200mM グリシン−HCl(pH2.2)を用いて、室温で10分間インキュベーションすることにより溶出した。上清を中和するために、並びにファージが死滅するのを防ぐために、150μlのIM Tris−HCl(pH9.1)を添加した。次いで、溶出したファージを増幅し、結合配列に有利なようにプールを濃縮するための、さらなる結合/増幅サイクルを通じて採取した。ウォッシュバッファはパニングの最初のラウンドのために0.1%のTween−20を含有し、続くラウンドのために0.5%に増やした。各パニングラウンドの間に、選ばれたファージをE.コリER2738中で増幅した。サイクルを3回繰り返し、それぞれのポーリンタンパク質についての最も高い親和性を伴うペプチドを選んだ。このようにして同定されたペプチドを図3に示す。
【0181】
【表3】

【0182】
選ばれた親和性ペプチドに融合された、高結合活性PapMV VLPの遺伝子操作、発現、及び精製
【0183】
各ポーリン、OmpC及びOmpFに対して、1つの親和性ペプチドを、上述のパニング過程において同定されたものより選んだ。対応するDNA配列を、PapMVコートタンパク質(CP)のC末端においてクローン化された。PapMV CP CPΔN5(Tremblay, M-H.,ら、 2006, FEBSJ., 273:14-25)を、テンプレートとして用いた。各選ばれたペプチドをコードしている配列を、PCRを用いて導入し、pET−3D発現ベクター(Stratagene, La Jolla, CA)内にクローン化した。つまり、フォワードオリゴヌクレオチド(配列番号:34;表4)及びオリゴヌクレオチドPapOmpC(配列番号:35;表4)を、PapMV CP遺伝子PapMV CP CPΔN5をテンプレートとするPCR反応に用いた。
【0184】
得られたPCR断片は、PapMV CPのC末端に、ペプチドEAKGLIRの融合を持つ。同一のアプローチを用いて、フォワードオリゴヌクレオチド(配列番号:34;表4)及びオリゴヌクレオチドPapMVOmpF(配列番号:36;表4)を、PCRによるPapMV CPのC末端でのペプチドFHENWPSの融合を導入するために用いた。2つのそれぞれのPCR断片を、制限酵素NcoI及びBamHIで消化し、同一の酵素で消化したpET 3−Dベクター内にクローン化した該ペプチドがPapMV CPを伴うフレーム内にあることを確認するために、クローンを配列決定した。
【0185】
【表4】

【0186】
親和性ペプチドを含む遺伝子操作したPapMV CPを、以前に記載されているようにして、E.コリBL21 RILにおいて発現した(Tremblay, M-H.,ら、 2006, FEBS J., 273:14-25; Secundino ら, 2006, Immunology 1 17:59)。簡潔に述べれば、細菌を、フレンチプレスを通して溶解し、Ni2+カラム上にロードし、10mM Tris−HCl 50mM イミダゾール 0.5% トリトンX100 pH8で、次いで、10mM Tris-HCl、50mM イミダゾール、1% Zwittergent pH8で洗浄し、エンドトキシン混入を除去した。ポーリンを、120分間、Beckman 50.2 TIローターにおける高速遠心分離(100000g)供した。VLPペレットを、エンドトキシンフリーPBS(Sigma)に再懸濁した。タンパク質を、0.45μMフィルターを用いて、使用前にろ過した。タンパク質の純度をSAS−PAGEにより測定した。BCA protein Kit(Pierce)を用いてタンパク質の量を評価した該精製タンパク質中のLPSレベルを、製造者の使用説明書にしたがって(Cambrex)リムルス試験により評価し、0.005エンドトキシンユニット(EU)/μgより低いタンパク質であった。
【0187】
2つのPapMVコートタンパク質の配列を図11に示す(配列番号:6−OmpC親和性ペプチドを含むPapMVコートタンパク質、及び配列番号:7−OmpF親和性ペプチドを含むPapMVコートタンパク質)。野生型と比較して、2つのアミノ酸差異がPapMV OmpCのコートタンパク質の配列において観察され(図11における太字及び下線)、これは恐らくPCR反応の間に導入されたようである。
【0188】
ELISA
各実験のために、10μgのそれぞれの標的タンパク質(OmpC又はOmpF)を用いて、ELISAプレートをコートした。それぞれのPapMV VLPsの増加量を、結合アッセイに用いた。それらの標的のためのVLPの親和性を、PapMV CPに対するポリクローナルマウス抗体及びペルオキシダーゼに結合した二次的抗マウス抗体を用いて明らかにした。
【0189】
結果
親和性ペプチドの選択
ファージ提示を用いて、OmpC又はOmpFに結合する特異的なペプチドを選んだ。OmpCに結合した8つのファージ及びOmpFに結合した5つのファージを配列決定した。これらのペプチドの配列及び発生頻度を表3に示す。ペプチドEAKGLIR[配列番号:10]は、最も高い頻度を示し、したがって、OmpCに対する親和性ペプチドとして選ばれた。ペプチドFHENWPS[配列番号:12]は、OmpFスクリーニングにおいて最も頻繁であり、したがって、OmpFに対する親和性ペプチドとして選ばれた。興味深いことに、7つのうち5つのアミノ酸が同定され、並びに親和性ペプチドにおける同一の位置において発見されていることから、OmpFに対する両方の親和性ペプチドは相同である。
【0190】
高結合活性PapMV VLPの合成
ペプチド配列EAKGLIR[配列番号:10]及びFHENWPS[配列番号:12]をPapMVコートタンパク質のC末端において融合された(図3A)。続いて、融合ペプチドを6×Hで標識し、精製過程を促進した(Tremblay, M-H.,ら、2006, FEBS J., 273:14-25)。組換えコンストラクトをE.コリ内で発現し、Ni2+カラム上の親和性クロマトグラフィーにより精製した。タンパク質は、500mM イミダゾールを用いて溶出し、透析し、100000gで超遠心分離して、VLPをペレット化した(図3B)。電子顕微鏡(EM)観察により、PapMV CPのC末端におけるそれぞれのペプチドの添加は、タンパク質がVLP内に自己集合する能力に影響を与えないことが確認された(図3C)。VLPの長さは、201±80nmの範囲のサイズで様々である。201nmの長さのタンパク質は、反復したつくりでペプチドが存在する560コピーのCPを示す。
【0191】
これらのそれぞれの抗原に対する各PapMV VLPの高結合活性を、ELISA型結合アッセイにより示した。両方のVLP(「PapMV OmpC」及び「PapMV OmpF」)について、それらのそれぞれの抗原への結合が明確に示され、かつ、アッセイにおいて用いたVLPの量と共に増加した(図4A及びB)。したがって、1:1の割合(重量/重量)で溶液中で混合した場合、PapMV VLPは、同種の抗原に結合し、複合体を形成するだろうと想定された。
【0192】
実施例5:親和性に複合体化されたPapMV VLP−OmpC及びPapMV VLP−OmpFによる、S.チフィに対する免疫
【0193】
マウス
メスBALB/cマウス、6−8週齢(Harlan, Mexico or Charles River, Canada)を用いて、メキシコ国立自治大学(UNAM)、医学部、実験的医薬研究部門の動物施設下で維持した。
【0194】
チャレンジアッセイ
外部のアジュバント非存在下で、10μg OmpC、10μg OmpC+10μg PapMV OmpC、10μg OmpF、10μg OmpF+10μg PapMV OmpF、10μg PapMV OmpC、10μg PapMV OmpF又は生理食塩水(SSI)で、マウス(10匹/群)を腹腔内(i.p)免疫した(0日目)。15日目に、アジュバントなしで10μg OmpC又は10μg OmpFそ用いて、マウスを腹腔内追加免疫した。PapMV OmpC及びOmpCを、免疫の1から24時間前に混合し、4℃で保管した。
【0195】
25日目又は140日目に、5% 胃ムチン(Sigma)含有500μl TEバッファ(50mM Tris、pH7.2、5mM EDTA)に再懸濁した、100又は500LD50のS.チフィ(ATCC 9993)でマウスを腹腔内チャレンジした。防御は、チャレンジ後10日の生存率として定義した。90000CFUでの1LD50を測定した。
【0196】
免疫
外部のアジュバント非存在下で、10μg OmpC、10μg OmpC+10μg PapMV OmpC、10μg PapMV OmpC又は等張生理食塩水(ISS)で、5匹のマウスの群を腹腔内(i.p)免疫した(0日目)。15日目に、アジュバントなしで、10μg OmpCを用いて、マウスを腹腔内追加免疫した。血液試料を、図5から7に示すような、種々の時間において、頚静脈から採取した。解析まで、個々の血清試料を−20℃で保管した。
【0197】
ELISA
高結合96ウェルポリスチレンプレート(High binding 96-well polystyrene plates)(Nunc)を、0.1M 炭酸塩−重炭酸塩バッファ ph9.5中の10μg/mLのOmpCでコートした。プレートを1時間、37℃で、続いて4℃で終夜、インキュベートした。プレートを蒸留したH2O−0.1% Tween20で4回洗浄した。非特異的結合をブロッキングバッファ(PBS pH7.4−2% BSA(Sigma))で37℃で1時間ブロックした。洗浄後、プールしたマウス血清をブロッキングバッファで1:40に希釈し、2倍段階希釈液をウェルに添加した。プレートを1.5時間、37℃でインキュベートし、続いて4回洗浄した。HRP抱合ヤギ抗マウスIgG1、IgG2a、IgG2b(Jackson Immunochemicals)又はIgG3(Rockland)(1 :10000)を添加し、1時間、37℃でインキュベートし、続いて4回洗浄した。検出系として、TMBペルオキシダーゼ基質(Fitzgerald)を用いた。暗所で10分間、37℃でインキュベーション後、2.5N H2SO4で反応を停止し、自動ELISAプレートリーダーを用いて、450nmにおける吸光度を測定した。抗体価は、−log2希釈×40として与えられる。陽性の力価は、陰性対照の平均値よりの3SD高いものとして定義した。
【0198】
受動免疫及びチャレンジ
外部のアジュバント非存在下で、10μg OmpC、10μg OmpC+10μg PapMV OmpC、10μg PapMV OmpC又は等張生理食塩水(SSI)で、5匹のマウスの群を腹腔内(i.p)免疫した(0日目)。15日目に、アジュバントなしで10μg OmpCを用いて、マウスを腹腔内追加免疫した。23日目に心穿刺を行い、各群由来の血清試料をプールし、−20℃で保管した。ナイーブマウス(5匹/群)に、200μlのプールした補体不活性化免疫血清を腹腔内投与した。転移から3時間後、上述のようにして、ムチンで再懸濁した100LD50のS.チフィでマウスをチャレンジした。防御は、チャレンジ後10日の生存率として定義した。
【0199】
結果
PapMV VLPは、ポーリンの防御能を改善する。
【0200】
精製タンパク質OmpC及びOmpFは、マウスでのS.チフィに対する防御を提供し、OmpC単独では、100LD50に対して60%防御を提供することが以前に示されている(Secundino ら、 2006, Immunology 117:59)。ポーリン、OmpC及びOmpFそれぞれの免疫原性を改善するために、それぞれ、PapMV VLPを含むワクチン製剤を調製した。2つの異なる製剤、PapMV OmpC VLP+OmpC及びPapMV OmpF VLP+OmpFを、100及び500LD50のS.チフィに対してマウスを保護する能力についてマウスにおいて試験し、結果をOmpC又はOmpF単独で免疫したマウスを用い得られるものと比較した。PapMV VLPとそれらのそれぞれのポーリンとの間の割合を、1:1に維持した。
【0201】
OmpCへのPapMV OmpC VLPの添加は、100LD50のS.チフィにチャレンジした状態で、Ompの防御能を70%から100%へ改善した(図5A)。防御効果の改善は、マウスを500LD50でチャレンジした時にさらに大きく、OmpCがPapMV OmpC VLPと結合した時には、30%から90%へ増加した防御が観察された(図5C)。同様に、PapMV OmpF VLPは、100LD50のS.チフィのチャレンジ状態で、OmpFの防御能を60%から90%へ改善した(図5B)が、チャレンジを500LD50のS.チフィで行った場合、わずかな差異のみが見られた(図5D)。この結果は、S.チフィチャレンジに対する防御に関して、OmpCは、OmpFよりもより良い抗原であることを示す。両方の場合において、PapMV VLPは、ポーリンの防御能をかなり改善した。
【0202】
PapMV VLPがOmpCに対する抗体価を改善するかを判定するために、10μg OmpC又は10μg OmpC及び10μg PapMV OmpC VLP含有複合体化ワクチンで免疫したマウスのIgGの力価を測定した。いずれかの処理を伴う、異なるIgGイソタイプIgG1、IgG2a、IgG2b及びIgG3の力価において、有意な差異は見られず(図6)、PapMV VLPで見られた防御の改善は、抗体自体の産生の増加よりむしろ、S.チフィ感染の中和における、CTL応答及び/又は抗体の結合効率における改善に関連するものであり得ることを示している。
【0203】
PapMV VLPでの免疫は、ポーリンに対するメモリー応答を改善する
OmpCと組み合わせてPapMV VLPを含むワクチン製剤のメモリー応答を評価するために、マウスを2週間の間をあけて2回、OmpC単独もしくはPapMV OmpC VLP及びOmpCを含むワクチン製剤のいずれかで免疫し、続いて15日目にOmpC単独で追加免疫した。140日目に、マウスを100LD50のS.チフィにチャレンジした。結果は、PapMV OmpC VLP及びOmpCを含むワクチン製剤による刺激が、免疫したマウスの防御能を有意に改善した(3倍の改善)ことを明らかに示している(図7)。したがって、本実験は、PapMV VLPがS.チフィチャレンジに対するマウスの保護を改善するだけでなく、より良いメモリー応答をも提供することを実証している。
【0204】
実施例5:S.チフィに対するPapMVとOmpCとの組み合わせの防御能
【0205】
PapMVの精製
PapMVを、実施例1に記載のように精製した。
【0206】
保護アッセイ
BALB/cマウス(10群)を、10μgのOmpC又は、30μgのPapMVと共に1時間4℃で予めインキュベートしておいた、10μgのOmpCで0日目に腹腔内免疫した。15日目に、10μgのOmpC単独で追加免疫を行った。対照マウスには、生理食塩水のみを接種した。21日目に、マウスを、5%ムチンに懸濁した100及び500LD50のS.チフィ(STYC302 DompF菌株)(前述の通り)でチャレンジし、以前に記載されたようにしてチャレンジし、生存率をチャレンジ後10日間モニターした。
【0207】
結果
感染した植物から単離したPapMVウイルスの、OmpCにより提供される防御の増加におけるアジュバント能を試験するために、OmpCで免疫したマウスと、PapMV精製ウイルスと混合したOmpCで免疫し、続いてS.チフィにチャレンジしたマウスとを比較した。PapMV精製ウイルスと混合したOmpCを、OmpC単独との比較として用いた場合、100LD50又は500LD50のいずれかのS.チフィでチャレンジ後に、20%から30%高い生存率が見られた(図8)。したがって、PapMV及びS.チフィOmpCポーリンの共投与は、S.チフィチャレンジに対する防御能を増加させることを見ることができる。
【0208】
実施例1から4に概説した実験の結果は、PapMVが、抗原特異的免疫グロブリンの切り換えを誘導することができ、モデル抗原に対する持続性の長期に渡る抗体応答を提供することができ、並びにOmpC又はOmpF単独の防御能を増加させることができるという、固有のアジュバント特性を有することを示唆する。これらのデータは、PapMV及びPapMV VLPが、OmpCポーリンにより誘発される、生得的及び適応的免疫応答の、S.チフィチャレンジに対する防御への転換を増強することを示唆する。
【0209】
実施例6:HCVコアタンパク質の精製
【0210】
E.コリ中でのHCVコアタンパク質のクローニング及び発現
HCVコアタンパク質の最初のN末端82及び170アミノ酸(それぞれHCV−C82及びHCV−C170と表す)を、E.コリ中での翻訳に最も代表的なコドンで最適化し、以下のように、精製のためにC末端においてHis6−タグと融合された。
【0211】
プラスミドpCV−H77c(J. Bukh, NIHの厚意により提供された)を用いてHCVコアコンストラクトを作製した。HCV−C170を、プライマーC170−6h(5'-CATGGGATCCTTACTAATGGTGATGGTGATGGTGACGCGTGGTACTAGTA GGAAGGTTCCCTGTTGCATAGTTCACGCC-3'[配列番号:43])を、プライマーC N9(5'-CATGAACCATGGCGAGCACGAATCCTAAACCTCAAAGAAAAACC-3'[配列番号:44])と共に用いたPCRにより増幅した。PCR産物を、制限酵素NcoI及びBamHIで消化し、pET3d発現ベクター(New England Biolabs)内にクローン化したコアC末端欠失コンストラクトHCV−C82をテンプレートDNAとしてC1−170クローンを用い、かつプライマー82(5'-CATGACTAGTAGGGTACCCGGGCTGAGC-3'[配列番号:45])、C79(5'-ACGTACTAGTGGGCTGAGCCCAGGTCCTGCC-3'[配列番号:46])を、プライマーc9−6h−Pet(5'-CATGACTAGTACCACGCGTCACC-S' [配列番号:47])と共に用いてPCRにより作製し、SpeIによるDNAの消化の後、ライゲーションによりクローンを環状化した。HCVクローンの配列を、DNA配列決定により確認した。E.コリ発現菌株BL21(DE3)RIL(Stratagene)を、C−タンパク質発現pET3dコンストラクトで形質転換し、50mg アンピシリンm121(Difco)を添加した26YT培地[16g バクトペプトン121(Difco)、10g 酵母エキス121(Difco)、5g NaCl121、pH7.0に調整]中で維持した。細菌細胞を37℃で、OD600が0.6になるまで生育し、タンパク質発現を1mM IPTGで誘導した。誘導を2時間、25℃で継続した(Majeau, N.,ら(2004) J. Gen. Virol, 85; 971-981参照)。2時間の誘導後、6000gで15分間の遠心分離により細胞をペレット化した。
【0212】
HCV−C82の精製
採取した細胞を、プロテアーゼインヒビターの1×カクテル(Roche Diagnostics GmbH)を添加した、30mlの氷冷溶解バッファ(50mM リン酸塩、300mM NaCl、pH12.0)で再懸濁し、−80℃で凍結した。次いで、ソニックディスメンブレーター(sonic dismembranator)モデル500(Fisher)を用いて、10秒間の超音波処理及びそれに続く各超音波処理の間の50秒間の冷却の24サイクルにより細胞を溶解した。次いで、溶解物を、27000gで30分間遠心分離した。4℃で撹拌しながら、上清をNi−NTA樹脂(QIAGEN)に添加した。結合の90分後、50mlのウォッシュバッファ1(50mM リン酸塩、300mM NaCl、10mM イミダゾール、pH12.0)でビーズを洗浄し、30分間撹拌した。50mLのウォッシュバッファ2(50mM リン酸塩、500mM NaCl、20mM イミダゾール、pH12.0)でビーズを再度洗浄し、さらに30分間撹拌した。次いで、HCV−C82をアセンブリーバッファ、1.7mM 酢酸Mg、100mM 酢酸K、25mM HEPES、pH7.6、500mM イミダゾールで溶出した。全てのことを4℃で行った。
【0213】
HCV−170の精製
採取した細胞を500μm PMSEを添加した30ml 溶解バッファ(20mM Tris/HCl pH(7.4)、8M 尿素、300mM NaCl、1mM DTT)中に再懸濁し、−80℃で凍結した。次いで、細胞をソニックディスメンブレーター(sonic dismembranator)モデル500(Fisher)を用いて、10秒間の超音波処理及びそれに続く各超音波処理の間の50秒間の冷却の24サイクルにより細胞を溶解した。次いで、溶解物を、27000gで30分間遠心分離した。上清を、撹拌しながら、Ni−NTA樹脂(QIAGEN)に添加した。結合の90分後、50mlのウォッシュバッファ1(20mM Tris/HCl pH(7.4)、4M 尿素、300mM NaCl、10mM イミダゾール、1mM DTT)でビーズを洗浄し、30分間撹拌した。50mLのウォッシュバッファ2(20mM Tris/HCl pH(7.4)、2M 尿素、300mM NaCl、20mM イミダゾール、1mM DTT)でビーズを再度洗浄し、さらに30分間撹拌した。次いで、HCV−C170を溶出バッファ(20mM Tris/HCl pH(7.4)、2M 尿素、500mM NaCl、500mM イミダゾール、1mM DTT)で溶出した。全てのこれらのことを室温で行った。
【0214】
HCV−コアタンパク質の逆相HPLC精製
HP1050シリーズ(Hewlett Packard)HPLCで、UV検出器及びVYDAC C4カラム(250mm×4.6mm、5μm、及び300A)を用いて、逆相HPLCを行った。勾配に用いた溶媒は、水中の0.05% トリフルオロ酢酸(溶媒A)及びアセトニル中の0.05% トリフルオロ酢酸(溶媒B)であった。流速は、溶媒Bで0.8ml/分であり、HCV−C82に関して、35分で10%から50%に、並びにHCV−C170に関して、15分で10%から50%に、20分で60%に増加した。クロマトグラフは、220nm及び280nmにおいて記録し、並びにLC3D用ChemStation(Agilent Technologies)を用いてデータを解析した。採取した画分を、凍結乾燥し、さらなる研究のためにPBS中で再構成した。
【0215】
タンパク質特性解析
SDS−ポリアクリルアミドゲル電気泳動(SDS−PAGE)及びビシンコニン酸(BCA)タンパク質アッセイキット(Pierce)により、タンパク質純度及び含量を見積もった。
【0216】
HCV−C82及びHCV−C170はNLP内に集合する
インビトロでの集合反応を、精製HCV Cタンパク質及びtRNA(Sigma)を用いて行った。16プロテアーゼインヒビターカクテル及び0.5U RAaseインヒビター(Roche)の存在下で、精製タンパク質(50ml アセンブリーバッファ;(1mM 酢酸マグネシウム、100mM 酢酸カリウム、25mM HEPES、pH7.4)中25mg)を、250ng tRNAと混合した。反応物を、37℃で10分間インキュベートし、続いて、氷上で15分インキュベートした(Majeau, N.,ら(2004)J Gen. Virol., 85; 971-981参照)。
【0217】
実施例7:HCVコア親和性ペプチドを含むPapMV VLPの産生及び遺伝子操作
【0218】
ファージ提示
New England Biolabs (Beverly, USA)から提供されたPh.D.−7ファージライブラリーを用いた。本ライブラリーに用いた無作為提示されたヘプタペプチドは、M13ファージのPIIIタンパク質のN末端において融合されている。ライブラリーは、10μlの供給されたファージにおいて起こり得る、各1.28×109の7残基候補の70コピーからなる。HCV−C170をパニング手順のためのタンパク質標的としてに用い、0.1MのNaHCO3(pH8.6)中100μg/mlに希釈し、150μlをマキシソープ96ウェルポリスチレンプレート(Nunc, Roskilde, Denmark)の1つのウェルに吸着させた。4℃で終夜、穏やかな撹拌と共に、加湿された容器内でプレートをインキュベートした。吸着されなかったタンパク質を廃棄し、400μlのブロッキングバッファ(0.1M NaHCO3(pH8.6)+5mg/ml BSA+0.02%(w/v)NaN3)を添加すること、及びプレートを1時間4℃でインキュベートすることにより、ウェルをブロックした。各ウェルをTrisバッファ生理食塩水(TBS):50mM Tris−HCl、0.1%(v/v)Tween−20を添加した150mM NaCl(pH7.5)、で6回洗浄した。10μlのファージライブラリーPh.D.−7(2×1011pfu)をTBST中に1mlに希釈し、100μlを各ウェルに分配した。プレートを1時間、室温で、穏やかな撹拌と共にインキュベートした。TBSTで10回洗浄することにより、結合しなかったファージをウェルから除去した。結合したファージを、TBS中100μg/mlの100μlの標的タンパク質ににより溶出した。本パニング手順を、2つの独立した実験系で計4ラウンド繰り返した。後の各パニングラウンドについて、ファージの投与量は2×1011pfuであった。各選択のストリンジェンシーは、非特異的なファージの結合の頻度を減少させるための最後の3回のパニングのラウンドについて、TBS中の0.5% Tween−20を用いることにより増加させた。
【0219】
ファージ滴定
E.コリER2738の単一コロニーを、10mlのLBに接種し、対数期の中間部(OD600〜0.5)まで振盪培養した。溶出ファージの10倍段階希釈液を、増幅ファージについては108−1011、又は粗パニング溶出液については101−104の範囲で、LB中で調製した。10μlの各希釈液を200μlの対数期の中間部細菌に添加し、室温で5分インキュベートした。感染した細胞を、予め温めた上層アガロース(45℃)含有培養チューブに移し、すばやくボルテックスし、予め温めたLB/IPTG/Xgalプレート上に注いだ。プレートを終夜、37℃でインキュベートし、〜100の溶解プラークを含有するプレートを滴定用に計数した。
【0220】
プラークの増幅
E.コリER2738の終夜培養物を、LB中に1:100で希釈し、10から〜100プラークを有するプレートより選ばれた青色プラークを接種した。接種したチューブを37℃で、浸透しながら、4−5時間インキュベートした。インキュベーション後、培養物を30秒間遠心分離し、上清を新たなチューブに移し、再びスピンした。ピペットを用いて、最高80%の上清を清潔なチューブに移し、増幅したファージを次の過程まで4℃で保管した。
【0221】
ファージ配列決定
DNA抽出のために、製造者の取り扱い説明書にしたがってQIAprep(登録商標)スピンM13キット(Qiagen)を用いた。各実験について最終パニング手順の10クローンは、下記のプライマーを用いてDNA配列決定した:5'TGTATGGGATTTTGTAATACATCA 3'[配列番号:37]。
【0222】
PapMVコートタンパク質のクローニング及びPapMVCP−STASYTRの生成
PapMV CP遺伝子を単離したウイルスRNAから、プライマー5'-AGTCCCATGGCATCCACACCCAACATAGCCTTC-S'[配列番号:38]及び5'-GATCGGATCCTTACTAATGGTGATGGTGATGGTGACGCGTGGTACTAGTTT CGGGGGGTGGAAGGAATTGGATGGTTGG-3'[配列番号:39]:を用いてRT−PCRにより増幅した。増幅断片をNcoI/BamHI断片として、pET3D(New England Biolabs)内にクローン化した。
【0223】
PapMVCP−STASYTRコンストラクト([配列番号:42];図14参照)を作製するために、オリゴ5'CTAGTAGCACCGCGAGCTACACCAGAA-3'[配列番号:40]及び5' CGCGTTCTGGTGTAGCTCGCGGTGCTA-3'[配列番号:41]を共にアニールし、SpeI/MIuIで直線化されたPapMV CPクローン内にライゲーションした。最終PapMVCP−STASYTRコンストラクトの核酸配列を図14Aに示す[配列番号:48]。
【0224】
PapMVCPタンパク質の作製及び精製
E.コリ発現菌株BL21(DE3)RIL(Stratagene)を、PapMVCP−STASYTR含有プラスミドpET−3dで形質転換した。培養物を50μg/ml アンピシリンと共に、OD600が約0.6になるまで37℃で生育し、22℃で終夜、1mM IPTG(イソプロピル−1−チオ−β−D−ガラクトピラノシド)を用いて誘導し、6000gで15分間遠心分離した。ペレットを、氷冷溶解バッファ(50mM NaH2PO4[pH8.0]、300mM NaCl、10mM イミダゾール、40μM PMSF、及び0.1mg/ml リゾチーム)に再懸濁し、750PSIでフレンチプレスに1回通すことにより、細菌を溶解した。溶解物を30分間、13000rpmで2回遠心分離し、細胞残屑を除去した。全精製手順を4℃で行った。上清を、1mlのNi−NTA−アガロースマトリクス(QiagenD40724)と終夜混合した。タンパク質を、ポリプロピレンクロマトグラフィーカラム上の重力フロー(Econo-Pac Colomns, Bio-Rad Laboratories)により精製した。樹脂を、第1のウォッシュバッファ(20mM イミダゾールを添加した溶解バッファ)と共に10ベッドボリュームで1回洗浄し、第2のウォッシュバッファ(50mM イミダゾールを添加した溶解バッファ)で1回洗浄した。調製物からLPS混入物を除去するために、これらを10mM Tris−HCl 50mM イミダゾール 0.5% トリトンX100 pH8で1回洗浄し、10mM Tris−HCl 50mM イミダゾール 1% Zwittergent pH8で1回洗浄した。これらの洗浄ステップ後、第3のウォッシュバッファ(10mM Tris−HCl(pH8.0)及び50mM イミダゾール)での洗浄を行い、全ての微量の界面活性剤を除去した。タンパク質を終夜2.5ベッドボリュームの溶出バッファ(1M イミダゾールを添加した第3のウォッシュバッファ)と共にインキュベートし、10mM Tris−HCl(pH8.0)で終夜透析した。試料中のVLP量を増加させるため、試料を3000×gで90分間、1000kmacrosep(登録商標)遠心分離機(Pall life sciences)で遠心分離し、PBSで終夜透析した。
【0225】
タンパク質特性解析
ワクチン製剤のエンドトキシン含量を、リムルスアメーバ様細胞溶解物アッセイキット(Limulus amoebocyte lysate assay kit)(Cambrex)で見積もった。VLP含量を、Superdex200(10/300)GL分析カラムを用いて、FPLCサイズ排除クロマトグラフィーにより評価した。
【0226】
電子顕微鏡観察
NLP内へのHCVコアタンパク質の集合後、150ngの試料をPBSで希釈し、400メッシュ炭素絶縁被膜格グリッド(400-mesh carbon formvar grids)(Canemco)上に5分間吸着させた。グリッドをTBSで1回洗浄し、ろ過処理した2% 酢酸ウラニル溶液で3分間染色した。グリッドを乾燥し、電子顕微鏡下において、60kVolの加速電圧、100000の倍率で調べた。
【0227】
ELISA
コスター高結合96ウェルプレート(Coster High Binding 96-well plates)(Corning, NY, U.S.A.)を終夜、4℃で、0.1M NaHCO3バッファ pH9.6中で、1μg/mlの濃度まで希釈した100μl/ウェルのHCV−C170NLP又はフリー(即ち、非NLP)HCV−C170でコーティングした。プレートをPBS−0.1% Tween−20−2% BSA(150μl/ウェル)で、1時間37℃でブロックした。1μg/ml又は2.5μg/mlから始まるPapMVCP−STASYTRの2倍段階希釈液を試験した。
プレートを、ペルオキシダーゼ抱合ヤギ抗ウサギIgGとのインキュベート前に、PBST中で1/5000でのPapMVCP タンパク質に対する100μlのポリクローナルウサギ抗体と共にインキュベートした。3回の洗浄後、100μlのTMB−Sで、使用者の説明書にしたがって、IgGの存在を検出した;反応を、100μlの0.18mM H2SO4の添加により停止させ、450nmにおけるODを読んだ。
【0228】
結果
HCVコアタンパク質に結合できる親和性ペプチドを、ファージ提示により選んだ。ペプチドの配列及びこれらの頻度を表5に示す。
【0229】
【表5】

【0230】
ペプチドSTASYTR[配列番号:8]が最も高い頻度で見出され、したがってPapMVコートタンパク質と融合するように選択した。電子顕微鏡(EM)観察により、PapMV CPに対するペプチドの添加は、融合していないPapMV CPと比較して(図12A)、得られた融合タンパク質であるPapMVCP−STASYTRがVLP内へ自己集合する能力に影響を及ぼさなかったことが確認された(図12B)。
【0231】
PapMVCP−STASYTRのHCVコアタンパク質(1−170)NLP及びフリー(非NLP)HCV−C170との結合は、ELISA型結合アッセイにより示された。両方のアッセイについて、抗原への結合が明らかに実証され、アッセイに用いたPapMVCP−STASYTRの量と共に増加した(図12C及びD)。
【0232】
実施例8:親和性に複合体化されたPapMV VLP−HCVコアでのC型肝炎に対する免疫
PapMV−STASYTR/HCV−コアACASの調製
PapMV−STASYTR及びHCV−C82を滅菌PBSバッファ中で、5:1 PapMV−STASYTR:HCV−C82の割合で混合し、次いで、16時間4℃でインキュベートした。最初のインキュベーション後、混合物を90分間25℃(室温)での第2のインキュベーションに提示した。
【0233】
マウス
5匹の4−8週齢C57BL/6マウスに、10μgのHCV−C82NLP又は10μgのC82NLP+50μg PapMVCP−STASYTR又は50μl PapMVCP−STASYTR又はPBSエンドトキシンフリー(Sigma)を皮下的に注射した。
【0234】
一次免疫の後、2週間の間隔で2回の追加免疫投与を与えた。血液試料を異なる時点で取得し、解析まで−20℃で保管した。最後の免疫から3週間後、マウスを、HCVポリタンパク質のアミノ酸1−382を発現する、5×106PFUの組換えワクチンウイルスSc59 6C/Sに腹腔内にチャレンジした(Kozielら、1995 J Clin Invest. 96(5):2311-21)。チャレンジ前に、0.1mlのケタミン(15mg/ml)−キシラジン(1mg/ml)/10g体重で、マウスを麻酔した。チャレンジ後5日目にマウスを屠殺し、卵巣を回収し、ホモジナイズし、CV−I指標細胞のプレートにおける10倍段階希釈液によりウイルス抗体価についてアッセイした。2日間の培養後、培地を除去し、CV−I細胞単層を、1% メチレンブルー(Sigma)で10分間染色し、水で10分間洗浄し、並びに、ワクチンウイルスの滴定のためにウェルごとのプラークの数を計数した。
【0235】
ELISA
コスター高結合96ウェルプレート(Costar High Binding 96-well plates)(Corning, NY, U.S.A.)を、0.1M NaHCO3バッファ pH9.6で1μg/mlの濃度まで希釈した100μl/ウェルのHCV−C170フリータンパク質で4℃で終夜コートした。プレートを、PBS−0.1% Tween−20−2% BSA(150μl/ウェル)で、1時間37℃でブロックした。PBS−0.1% Tween−20で3回洗浄後、血清を、添加された1:100から始まる2倍段階希釈液中で検査し、1時間37℃でインキュベートした。インキュベーション後に、プレートを3回洗浄し、100μlのペルオキシダーゼ抱合ヤギ抗マウスIgG(Jackson Immunoresarch)と共に、PBS/0.1% Tween−20/2% BSA中1/10000の希釈度で、1時間37℃でインキュベートした。3回の洗浄の後、IgGの存在を、使用者の説明書にしたがって、100μlのTMB−Sで検出した;反応を、100μlの0.18mM H2SO4を添加することにより停止し、450nmでのODを読んだ。OD値が、PBSマウス由来の血清の1:100希釈で得られたバックグラウンド値の3倍である場合に決定された抗体終点力価として、結果を表す。
【0236】
統計的方法
データをX=(log y+1)で変換して分散を均一化にし、次いで、Tukeyの多重比較をパラメータデータのためのポストテストとするANOVA試験を用いて解析した。p<0.05は、統計的に有意であると見なした。
【0237】
結果
HCVコア、PapMVCP−STASYTR、又はHCVコア+PapMVCP−STASYTRでの免疫後のマウスにおける総IgG力価を、図13Aに示す。HCVコア+PapMVCP−STASYTRでの免疫は、HCVコア単独又はPapMVCP−STASYTR単独での免疫と比較したIgGにおいて、統計的に有意な(p<0.05)増加を示した。
【0238】
図13Bは、HCVポリタンパク質のアミノ酸1−382を発現する、組換えワクチンウイルスSc59 6C/Sでチャレンジ後の、感染したマウスの両方の卵巣から回収したウイルス価を示す。本実験において、PBS、HCVコア、PapMVCP−STASYTR又はHCVコア+PapMVCP−STASYTRでの免疫後に有意な差異は見られなかったにもかかわらず、総IgG力価からすると、HCVコア+PapMVCP−STASYTR組成物での免疫が、HCVコア単独で達成された免疫応答よりも、優れた免疫応答を生成することができることは明らかである。したがって、組成物の最適化及び/又は、例えば、抗原単独の追加免疫投与の追加による、日常投与の最適化は、ウイルスチャレンジに対する効果的な防御をもたらすであろうと予想される。そのような最適化は、本明細書に与えた教示を考慮すると当業者に用意に理解され得る。例えば、CD8+HCVコア特異的増殖アッセイは、マウスにおける強力なCTL応答を誘発することができる、PapMV-STASYTRとHCVコアタンパク質との最適な割合、並びに最終ワクチン調製の適切投与量を決定するために行われる。1つの実施形態において、HCVコアタンパク質に対して4:1、3:1、2:1及び1:1のPapMV-STASYTRの割合が、ワクチン製剤に組み込むためのACASの調製について意図される。
【0239】
本発明を、特定の具体的な実施形態に関して説明してきたが、本発明の種々の改変は、本発明の精神及び範囲から逸脱することなく、当業者に明らかであるだろう。当業者に明らかであるような、そのような全ての改変が、添付の特許請求の範囲内に含まれることを意図している。
【技術分野】
【0001】
本発明は、免疫原性組成物の分野、特にパパイヤモザイクウイルスに基づく免疫原性組成物に関する。
【背景技術】
【0002】
免疫は、感染症の予防及び治療のための有効な方法を提供し、前世紀の公衆衛生における最も大きな利益のひとつをもたらした。早期の免疫戦略は、免疫原として生きた、弱毒化された又は不活化された病原体を用いた。しかしながら、社会的関心が、より明確で、より安全なワクチンのための探索を助長した。本探索は、個々の抗原が単離されるか又は組換え技術によって発現させられ、かつ免疫原として接種される、研究の新しい方向性を促進した。しかしながら、そのようなワクチンは、単離されたタンパク質が典型的には防御免疫応答を起こすために十分な免疫原性ではないために、抗原に対する十分な免疫応答を起こすためにアジュバントの添加をしばしば必要とする。完全フロイントアジュバント等のいくつかの強いアジュバントが知られているが、多くが望ましくない副作用を有した(Lerner, R. A.,ら、Proc. Natl. Acad. Sci. USA 78:3403- 3407 (1981); Bhatnagar, P. K.,らProc. Natl. Acad. Sci. USA 79:4400-4404 (1982); Neurath, A. R.,ら、J. Gen. Virol. 65: 1009-1014 (1984);及びMuller, G. M.,ら、Proc. Natl. Acad. Sci. USA 79:569-573 (1982))。
【0003】
免疫原としての合成ペプチドの使用もまた、より安全かつより有効なワクチンを調製する目的で精力的に研究されてきた(Lerner, R. A., Green, N., Alexander, H., Liu, F. -T., Sutcliffe, J. G.,及びShinnick, T. M. Proc. Natl. Acad. Sci. USA 78:3403-3407 (1981); Bhatnagar, P. K., Papas, E., Blum, H. E., Milich, D. R., Nitecki, D. Karels, M. J.,及びVyas, G. N. Proc. Natl. Acad. Sci. USA 79:4400-4404 (1982); Neurath, A. R., Kent, S. B. H.,及びStrick, N. J. Gen. Virol. 65:1009-1014 (1984))。しかしながら、合成ペプチドワクチンの開発もまた、望ましいアジュバント及び担体の探索が妨げになっている。
【0004】
最近になって、免疫系による自己と異物との識別の原理に関する研究により、組織化の程度及びウイルスの表面における抗原の反復が、抗原が異物として認識されるための非常に強いシグナルであることが明らかになってきた(Bachmann & Zinkernagel, Immunol. Today 17:553 558 (1996))。ウイルス構造の本特性は、ウイルス構造の免疫原性及び複製不可能なワクチンという改良された安全特性を組み合わせた、ウイルス様粒子(VLP)に基づく有望な新規ワクチンの設計に用いられた。
【0005】
動物ウイルスに基づく2つのVLPワクチンである、B型肝炎ウイルス(HBV)及びヒトパピローマウイルス(HPV)は、ヒトにおいて効果的に機能することが示されている(Faganら、1987, J. Med. Virol, 21:49-56; Harper ら、2004, Lancet, 364: 1757-1765) 。例えば、ヒトパピローマウイルス(HPV)主要カプシドタンパク質L1でできているVLPは、女性における子宮頸癌の進行に対して、100%の防御を提供することが示されている(Ault, K.A., 2006, Obstet. Gynecol. Surv. 61:S26-S31; Harperら、2004, Lancet 364: 1757-1765, 国際特許出願PCT/US0l/18701(WO02/04007)もまた参照)。バクテリオファージQB(Maurer ら、2005, Eur. J. Immunol. 35:2031-2040)、ウイルスコアタンパク質でできたB型肝炎ウイルスVLP(Mihailova ら、 2006, Vaccine 24:4369-4377; Pumpens ら、2002, Intervirology 45:24-32)及びパルボウイルスVLP(Antonis ら、 2006, Vaccine 24:5481-5490; Ogasawara ら、 2006, In Vivo 20:319-324)等のプラットフォームもまた、エピトープを輸送する能力、並びに強い抗体応答を誘導する能力を示している。同様に、米国特許第6627202号は、エピトープ送達系としての使用のために、HBVカプシド結合性ペプチドにより架橋された抗原を含むHBVコアタンパク質を記載しており、抗原としては、種々のウイルス及び細菌を標的にしているか又はそれらに由来する抗原が含まれる。
【0006】
エピトープ提示系としての植物ウイルス由来のVLPの使用が記載されている。植物ウイルスは、免疫原性が高く、かつ複雑な、反復性の結晶の構成を有する、タンパク質から主に構成される。さらに、植物ウイルスは、動物免疫系から系統発生学的に離れており、このことが植物ウイルスをワクチン開発へのふさわしい候補者としている。例えば、ササゲモザイクウイルス(CPMV)、セイバンモロコシモザイクウイルス(JGMV)、タバコモザイクウイルス(TMV)、及びアルファルファモザイクウイルス(AIMV)は、対象とするエピトープの提示のために改変がなされた(Canizares, M. C. ら、2005, Immunol. Cell. Biol. 83:263-270; Brennan ら、2001, Molec. Biol. 17:15-26; Saini and Vrati, 2003, J. Virol. 77:3487- 3494)。国際特許出願PCT/GB97/01065(WO97/39134)号は、コートタンパク質及び非ウイルスタンパク質を含むキメラのウイルス様粒子を記載し、これらは、例えば、ペプチドエピトープの提示のために用いられ得る。国際特許出願PCT/USOl/07355(WO01/66778)号は、植物ウイルスコートタンパク質、特に、N末端におけるリンカーを介して、病原微生物のエピトープを含み得る対象とするポリペプチドと融合されたタバコモザイクウイルスコートタンパク質を記載している。国際特許出願PCT/USOl/20272(WO02/00169)号は、外来ペプチド、特にニューカッスル病ウイルス又はヒト免疫不全ウイルス(HIV)のエピトープと融合された、ジャガイモYウイルスコートタンパク質又は切断されたインゲン黄斑モザイクウイルスコートタンパク質のいずれかを含むワクチンを記載している。また、米国特許第6042832号は、免疫応答を引き起こすために、アルファルファモザイクウイルス又はイラルウイルスカプシドタンパク質と共に動物へ、病原体エピトープ等のポリペプチドの融合体を投与する方法を記載している。
【0007】
最近になって、パパイヤモザイクウイルス(PapMV)のコートタンパク質由来のVLP及び免疫賦活剤としてのこれらの使用が記載されている(国際特許出願PCT/CA03/00985(WO2004/004761)号)。E.コリ内でのPapMVコートタンパク質の発現は、反復性及び結晶性の様式で組織化された数百のCPサブユニットからなるVLPの自己集合をもたらす(Tremblayら、 2006, FEBS J 273: 14)。PapMV CP欠失コンストラクトの発現及び精製の研究は、CPサブユニットの自己集合(又は多量体化)が、機能に重要であることをさらに示唆している(Lecoursら、2006, Protein Expression and Purification, 47:273-280)。gp100又はインフルエンザウイルスM1タンパク質のいずれか由来のエピトープを含むPapMV VLPについては、特定のヒトT細胞の増殖をもたらすエピトープのMHCクラスI交差提示を誘導する能力が示されている(Leclerc, D.ら、J. Virol, 2007, 81(3): 1319-26; Epub. ahead of print November 22, 2006)。さらに、C型肝炎ウイルスE2エンベロープタンパク質由来のエピトープを含むPapMV VLPは、PapMV VLP及びE2ペプチドに対するマウスにおける体液性応答を誘導することが示された(Denisら, 2007, Virology, 363(1): 59-68)。
【0008】
HIV、HCV、EBV又はインフルエンザウイルス由来の種々の抗原決定基を担持するジャガイモXウイルス(PVX)由来のVLPが記載されている(欧州特許出願第1167530号)。HIVエピトープを担持するPVX VLPの、体液性及び細胞性経路を介してのマウスにおける抗体産生を誘導する能力もまた、記載されている。本効果を高めるために、追加のアジュバントが、PVX VLPと併せて用いられた。
【0009】
B型肝炎コアタンパク質又はパルボウイルスVLPは、これらが遺伝情報を持ったない場合でさえもCTL応答を誘導すると報告されており(Ruedlら、 2002, Eur. J. Immunol. 32; 818-825; Martinezら、 2003, Virology, 305; 428-435)、これらが入り込んだ細胞内で活発に複製することができない。リンパ性脈絡髄膜炎(lymophocytic choriomeningitis)ウイルス(LCMV)又は鶏卵アルブミン由来のエピトープを担持する該VLPの、インビボでの樹状細胞による交差提示もまた記載されている(Ruedlら、2002, 前掲; Moron,ら、 2003, J. Immunol. 171 :2242-2250)。LCMV由来のエピトープを担持するB型肝炎コアタンパク質VLPのCTL応答を刺激する能力もまた記載されている。しかしながら、本VLPは、単独で投与された場合、CTL応答を誘導することができず、また、ウイルスチャレンジからの有効な防御を仲介することができなかった。VLPが抗CD−40抗体又はCpGオリゴヌクレオチドと併せて用いられる場合のみ、有効なCTL応答が誘導された(Storniら、2002, J. Immunol. 168:2880-2886)。先の報告は、LCMV由来のペプチドを担持するブタパルボウイルス様粒子(PPMV)が、致死のLCMVチャレンジに対してマウスを防御できたことを示唆した(Sedlikら、2000, J. Virol. 74:5769-5775)。
【0010】
親和性ペプチドと融合されたパパイヤモザイクウイルスVLPは、真菌性疾患の検出においてモノクローナル抗体の代替品として提案されている(Morinら、 2007, J. Biotechnology, 128: 423-434 [epub ahead of print October 26, 2006])。高い結合活性でネコブカビ(Plasmodiophara brassicae)胞子に結合することができるVLPが開発され、1つのコンストラクトの胞子への結合は、ポリクローナル抗体のそれに相当するレベルであることが実証された。
【0011】
本背景情報は、出願人により本願発明に関連し得ると考えられている公知の情報を公表する目的で提供される。前述の情報のいずれかが本願発明に対する先行技術を構成することを認めることは必ずしも意図されておらず、また、そのように解釈されるべきではない。
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明の目的はパパイヤモザイクウイルスに基づく親和性で複合体化された抗原系免疫原性の親和性で複合体化された抗原系免疫原性の親和性で複合体化された抗原系及びその使用を提供することである。本発明の一態様にしたがって、1以上の抗原及びパパイヤモザイクウイルス(PapMV)又はPapMVコートタンパク質由来のウイルス様粒子(VLP)を含む親和性で複合体化された抗原系が提供され、該PapMV又はVLPが、PapMVのコートタンパク質もしくはVLPに取り付けられた複数の親和性部分を含み、該親和性部分が前述の1以上の抗原に結合することができ、該系が動物における免疫応答を誘導することができる、抗原系が提供される。
【0013】
本発明の別の態様にしたがって、本発明の親和性で複合体化された抗原系及び薬学的に許容される担体を含む免疫原性組成物が提供される。
【0014】
本発明の別の態様にしたがって、有効量の本発明の親和性で複合体化された抗原系を動物に投与することを含む、該動物における免疫応答を誘導する方法が提供される。
【0015】
本発明の別の態様にしたがって、動物における疾病又は疾患を予防又は治療する方法であって、該方法が有効量の本発明の抗原提示系を該動物に投与することを含む、方法が提供される。
【0016】
本発明の別の態様にしたがって、それを必要とする動物における免疫応答を誘導するための有効量の本発明の親和性で複合体化された抗原系の使用が提供される。
【0017】
本発明の別の態様にしたがって、それを必要とする動物における疾病又は疾患を予防又は治療するための有効量の本発明の親和性で複合体化された抗原系の使用が提供される。
【0018】
本発明の別の態様にしたがって、医薬の製造におけるパパイヤモザイクウイルス(PapMV)又はPapMVコートタンパク質由来のウイルス様粒子(VLP)の使用であって、該PapMV又はVLPが該PapMVもしくはVLPのコートタンパク質に取り付けられた複数の親和性部分を含む、使用が提供される。
【0019】
本発明の別の態様にしたがって、医薬の製造における本発明の親和性で複合体化された抗原系の使用が提供される。
【0020】
本発明の別の態様にしたがって、1以上の抗原を、パパイヤモザイクウイルス(PapMV)又はPapMVコートタンパク質由来のウイルス様粒子(VLP)と混合することを含む、免疫原性組成物を調製する方法がであって、該PapMV又はVLPが該PapMVもしくはVLPのコートタンパク質に取り付けられた複数の親和性部分を含み、該親和性部分が前述の1以上の抗原に結合できる、方法が提供される。
【0021】
本発明の別の態様にしたがって、1以上の抗原をパパイヤモザイクウイルス(PapMV)又はPapMVコートタンパク質由来のウイルス様粒子(VLP)と混合することを含む方法により調製される免疫原性組成物であって、該PapMV又はVLPが該PapMVもしくはVLPのコートタンパク質に取り付けられた複数の親和性部分を含み、該親和性部分が前述の1以上の抗原に結合できる、組成物が提供される。
【0022】
本発明の別の態様にしたがって、HCVコアタンパク質に結合できる親和性ペプチドと融合されたパパイヤモザイクウイルス(PapMV)コートタンパク質を含む、融合タンパク質が提供される。
【0023】
本発明の別の態様にしたがって、HCVコアタンパク質に結合できる親和性ペプチドに融合されたパパイヤモザイクウイルス(PapMV)コートタンパク質を含む融合タンパク質をコードする、単離されたポリヌクレオチドが提供される。
【0024】
本発明の別の態様にしたがって、HCVコアタンパク質に結合できる親和性ペプチドに融合されたパパイヤモザイクウイルス(PapMV)コートタンパク質を含む融合タンパク質、又はHCVコアタンパク質に結合できる親和性ペプチドに融合されたパパイヤモザイクウイルス(PapMV)コートタンパク質を含む融合タンパク質をコードするポリヌクレオチドの、ウイルス様粒子を調製するための使用が提供される。
【0025】
図面の簡単な説明
本発明のこれら及び他の特徴は、添付の図面を参照する以下の詳細な説明においてより明確にされるだろう。
【図面の簡単な説明】
【0026】
【図1】図1は、(A)パパイヤモザイクウイルス外殻(又はカプシド)タンパク質のアミノ酸配列(GenBank Accession No. NP_044334.1;配列番号:1)、(B)パパイヤモザイクコートタンパク質をコードするヌクレオチド配列(GenBank Accession No. NC_001748 (ヌクレオチド5889-6536);配列番号:2)及び(C)変異体PapMVコートタンパク質CPΔN5のアミノ酸配列(配列番号:3)を示す。
【図2】図2は、抗原単独、抗原に加えてPapMV、フロイント完全アジュバント(FCA)又はE.コリO111:B4由来のLPSで免疫0日目に免疫したBALB/cマウス(3匹/群)における、モデル抗原(A)鶏卵リゾチーム(HEL)及び(B)オボアルブミン(OVA)に対する抗体応答を強化するPapMVの能力を示す。2つの実験に由来する代表的結果を示す。免疫した動物から採取した血清の抗体は、モデル抗原(HEL又はOVA)での、(C)IgG1、(D)IgG2a及び(E)IgG2bについてELISAによりイソタイプを判別した。
【図3】図3は、(A)親和性ペプチドのPapMVコートタンパク質のC−末端におけるOmpC又はOmpF(それぞれコンストラクトPapMV OmpC及びPapMV OmpF)との融合を含む組換えコンストラクトの略図;(B)精製タンパク質PapMV、PapMV OmpC、PapMV OmpF、OmpC及びOmpFのプロファイルを示すSDS−PAGE、[第1レーン:分子量マーカー、第2レーン;PapMV VLP、第3レーン;PapMV OmpC VLP、第4レーン;PapMV OmpF VLP、第5レーン;精製OmpC、第6レーン;精製OmpF]、並びに(C)組換えPapMV OmpC及びPapMV OmpF VLPの高速ペレットの電子顕微鏡写真を示す。
【図4】図4は、それらのそれぞれの抗原に対するPapMV VLPの高い親和力の結合を示す。(A)は、OmpC抗原に対する高結合活性PapMV OmpC VLP結合を示すELISAを示す。(B)は、OmpF抗原に対する高結合活性PapMV OmpF VLP結合を示すELISAを示す。
【図5】図5は、マウスおけるS.チフィ(S.typhi)でのチャレンジに対する保護アッセイの結果を示す。(A)は、OmpC単独で免疫したマウス及びOmpC+PapMV OmpC VLPを含む製剤で免疫したマウスにおける、100LD50のS.チフィに対する防御能を表し;(B)は、OmpF単独で免疫したマウス及びOmpF+PapMV OmpF VLPを含む製剤で免疫したマウスにおける、100LD50のS.チフィに対する防御能を表し;(C)は、OmpC単独で免疫したマウス及びOmpC+PapMV OmpC VLPを含む製剤で免疫したマウスにおける、500LD50のS.チフィに対する防御能を表し、並びに(D)は、OmpF単独で免疫したマウス及びOmpF+PapMV OmpF VLPを含む製剤で免疫したマウスにおける、500LD50のS.チフィに対する防御能を表す。
【図6】図6は、OmpCに対する抗体応答の評価を示しており;イソタイプIgG1、IgG2a、IgG2b及びIgG3のOmpCに対するIgG応答をOmpC又はOmpC+PapMV OmpC VLPを含むワクチンで免疫したマウスの間で測定した。
【図7】図7は、OmpC及びPapMV OmpCのマウスに対する同時免疫に続くS.チフィのチャレンジが、OmpC又はPapMV OmpC単独による免疫と比較した場合、S.チフィ感染(生存%によって示している)に対するマウスの長期に渡る活発な防御を助けることを示している。
【図8】図8は、PapMVウイルスがOmpCポーリンの防御能を上昇させたことを示している;100(黒記号)又は500致死量50(LD50)(白記号)のS.チフィで行ったチャレンジの結果を、チャレンジ後10日間記録した生存率と共に示す。
【図9】図9は、Salmonella enterica 亜種enterica serovar Typhi Ty2(GenBank Accession No. P0A264)由来のOmpC前駆体タンパク質のアミノ酸配列(配列番号:4)を示す;
【図10】図10は、Salmonella enterica亜種 enterica serovar Typhi CTl 8(GenBank Accession No. CAD05399)由来のOmpF前駆体タンパク質のアミノ酸配列(配列番号:5)を示す。
【図11】図11は、(A)OmpCに結合するための親和性ペプチドを含むPapMVコートタンパク質[配列番号:6]、及び(B)OmpFに結合するための親和性ペプチドを含むPapMVコートタンパク質[配列番号:7]のアミノ酸配列を示す。クローン化された配列と野生型配列との間の差異は、太字及び下線で特筆する;親和性ペプチド配列を下線で、並びにヒスチジンタグを斜字体で示す。
【図12】図12は、(A)E.コリから精製したPapMV VLPの電子顕微鏡写真;(B)親和性ペプチドSTASYTR[配列番号:8](PapMVCP−STASYTR)を含むPapMV VLPの電子顕微鏡写真;(C)PapMVCP−STASYTRのHCVコアタンパク質(1−170)NLP(1μg/ml)への結合を示すELISAを示す。灰色のバーはPapMVCP−STASYTRで得られたシグナルを表し;点のバーはPapMV VLP単独で得られたバックグラウンドシグナルを表し;並びに(D)1μg/mlの遊離HCVコアタンパク質(1−170)をELISAプレートにロードするために使用した以外はCと同様である。全てのELISAは、PapMVコートタンパク質に対するポリクローナルウサギ抗体及びアルカリホスファターゼに結合したヤギ抗ウサギ抗体により明らかにされた。
【図13】図13は、HCVコアタンパク質及びPapMV VLPに対するマウスにおける免疫応答を示している:(A)はHCVコアタンパク質(1−82)NLP(「コア」)、親和性ペプチドSTASYTR[配列番号:8]を含むPapMV VLP(「PapSTA」)、及びHCVコアタンパク質(1−82)NLPと併用したPapSTA(「PapSTA+コア」)に対する抗体価(全IgG)を表す。並びに(B)PapSTA、HCVコアタンパク質(1−82)NLP、又はHCVコアタンパク質(1−82)NLPと併用したPapSTAで免疫した後、HCVポリタンパク質のアミノ酸1−382を発現する組換えワクチンウイルスでチャレンジしたマウスの両方の卵巣から回収された組換えワクチンウイルスの抗体価を表す。
【図14】図14は、(A)HCVコアタンパク質断片(PapMVCP−STASYTR;配列番号:48)に結合するための親和性ペプチドを含むPapMVコートタンパク質のヌクレオチド配列、及び(B)PapMVCP−STASYTRコンストラクト(配列番号:42)のアミノ酸配列を表す。開始コドンを太字斜字体で、終止コドンを太字及び下線で、並びにヒスチジンタグを斜字体で示す。
【発明を実施するための形態】
【0027】
パパイヤモザイクウイルス(PapMV)又はPapMVのコートタンパク質由来のウイルス様粒子(VLP)に対して複数の親和性部分を介して複合体化された1以上の抗原を含む、親和性で複合体化された抗原系(ACAS)が提供される。「由来」は、野生型コートタンパク質の配列と実質的に同一であるアミノ酸配列を有するコートタンパク質を含むVLPを意味する。親和性部分は、対象とする抗原に特異的に結合できる分子又は化合物であり、これらは、例えば化学的もしくは遺伝子工学的手段によりPapMVもしくはPapMV VLPのコートタンパク質に取り付けられて、親和性PapMV(「aPapMV」)もしくは親和性VLP(「aVLP」)を形成することができる。1つの実施形態では、本発明にしたがうaPapMV及びaVLPは、高分子等の大きな抗原に複合体化するために特に有用である。
【0028】
抗原は、本発明のACASにおいてaPapMV又はaVLPに「複合体化され」ているとして、本明細書内に記載されているが、ACASにおける抗原(単数もしくは複数)及びaPapMV/aVLPは、局所的な環境に応じて時々又は常に、非複合体化の状態で提示されてもよいと考えられる。同様に、ACASに存在する全ての抗原が、同種のaPapMV/aVLPに複合体化され得るわけではないと考えられる。例えば、当業者によって理解されるように、非常に高いあるいは低いpHもしくは塩濃度、又は高希釈のACASといった条件は、抗原(単数もしくは複数)の同種のaPapMV/aVLPへの結合に影響を及ぼし得るであろう。
【0029】
本発明のACASは、必要に応じて、1以上のさらなる孤立した抗原(すなわちAIA)をさらに含み得る。本発明の文脈では、AIAは、aPapMV/aVLPにより含まれる親和性部分が結合できる抗原(単数又は複数)以外の抗原である。
【0030】
本発明の一態様にしたがって、ACASは免疫原性であり、かつ動物に投与された場合に免疫応答を誘導することができる。免疫応答は、体液性応答、細胞性応答または両方であってもよい。したがって、本発明は、ACASを構成する免疫原性組成物(ワクチンを含む)を提供する。免疫原性組成物は、動物における体液性及び/又は細胞性応答を必要とする種々の疾病及び疾患の、治療(予防を含む)において有用である。本発明の1つの実施形態において、ACASは、動物の体液性免疫応答の関与を必要とする疾病又は疾患の予防を含む治療において特に有用である。
【0031】
定義
別に定義しない限り、本明細書内で用いられる全ての技術的及び科学的用語は、本発明が属する分野の当業者によって一般に理解されるものと同様の意味を有する。
【0032】
本明細書内で用いられる用語「約(about)」は、所与の値からおよそ+/−10%の変動を言う。はっきりと言及していようがなかろうが、そのような変動は常に本明細書内で与えられた任意の所与の値にも含まれると理解すべきである。
【0033】
本明細書内で用いられる用語「アジュバント(adjuvant)」は、動物における免疫応答を増強、刺激、作動、促進及び/又は調節する、剤を言う。
【0034】
本明細書内で用いられる用語「免疫原性(immunogenic)」は、物質の、動物における検出可能な免疫応答を誘導する能力を言う。
【0035】
本明細書内で同じ意味で用いられる用語「免疫刺激(immune stimulation)」及び「免疫賦活(immunostimulation)」は、動物病原体もしくは疾病とは無関係であるPapMVもしくはPapMV VLP等の分子が、免疫系を刺激すること及び/又は感染もしくは疾病に対して応答する免疫系の能力を改善することにより、病原体による感染又は疾病に対する防御を提供する能力を言う。免疫賦活は、予防的効果、治療的効果、又はそれらの組み合わせを有してもよい。
【0036】
本明細書内で用いられる用語「免疫応答(immune response)」は、物質(例えば、化合物、分子、材料等)の投与に対する応答における動物の免疫系の反応性の変化を言い、並びにこれは、抗体産生、細胞性免疫の誘導、補体活性化、免疫寛容の発達もしくはそれらの組み合わせを伴い得る。
【0037】
本明細書内で用いられる用語「免疫(vaccination)」は、免疫防御応答を起こす目的のために対象へのワクチンの投与を言う。免疫は、予防効果、治療効果、又はそれらの組み合わせを有していてもよい。免疫は、治療される対象対象に応じて種々の方法を用いて行うことができ、これらに限定されないが、腹腔内投与(i.p.)、静脈内投与(i.v.)又は筋肉内投与(i.m.)等の非経口投与;経口投与;経鼻投与;皮内投与;経皮投与及び液浸等が挙げられる。
【0038】
本明細書内で用いられる用語「ワクチン(vaccine)」は、免疫防御応答を引き起こすことができる組成物を言う。
【0039】
本明細書内で用いられる用語「疾病又は疾患惹起薬剤」は、宿主における疾病又は疾患を惹起し得る剤を言う。限定されない例としては、癌、感染症、アレルギー反応、自己免疫疾患を引き起こす剤、又は薬物、ホルモン、又は毒素に対する免疫応答を誘導し得る剤が挙げられる。感染症としては、例えば細菌、ウイルス、原生生物、菌類及び寄生虫といった種等の病原体によって引き起こされるものが挙げられる。
【0040】
本明細書内で用いられる用語「病原体(pathogen)」は、宿主における疾病又は疾患を引き起こし得る生物を言い、これらに限定されないが、細菌、ウイルス、原生生物、菌類及び寄生虫が挙げられる。
【0041】
本明細書内で用いられる用語「天然に存在する(Naturally-occurring)」は、物に対して適用する場合、その物が自然界において発見され得ることを言う。例えば、生物(ウイルスを含む)、又は自然界のソースから単離され得る生物中に存在するポリペプチドもしくはポリヌクレオチド配列であって、かつ人によって研究室内で意図的に改変されていないものは天然に存在するものである。
【0042】
本明細書内で用いられる用語「ポリペプチド(polypeptide)」又は「ペプチド(peptide)」は、ペプチド結合によってつながった少なくとも4つのアミノ酸がある分子を意味することを意図している。
【0043】
本明細書内で用いられる表現「ウイルス核酸(viral nucleic acid)」は、ウイルスのゲノム(もしくはその大部分)、又は該ゲノムに対する塩基配列において相補的な核酸分子であり得る。ウイルスRNAに対して相補的なDNA分子もまた、ウイルスDNAに対する塩基配列において相補的であるRNA分子と同様、ウイルス核酸と見なされる。
【0044】
本明細書内で用いられる用語「ウイルス様粒子」(VLP)は、ウイルス粒子と似た外観を有する自己集合性粒子を言う。VLPは、ウイルス核酸を含んでも、含んでいなくてもよい。VLPは、通常、複製することができない。
【0045】
本明細書内で用いられる用語「偽ウイルス(pseudovirus)」は、プラスミド形態の核酸を含むDNA又はRNA等の核酸配列を含むVLPを言う。偽ウイルスは、通常、複製することができない。
【0046】
本明細書内で用いられる用語「免疫原(immunogen)」及び「抗原(antigen)」は、単独又はアジュバントとの併用により対象における免疫応答を誘導することができる、分子(単数、複数)、分子の一部(単数もしくは複数)、又は分子の組み合わせ、並びにそれらを含めて全細胞及び組織までを言う。免疫原/抗原は、単一のエピトープを含んでもよく、又は複数のエピトープを含んでもよい。したがって、該用語は、ウイルス、ペプチド、炭水化物、タンパク質、核酸並びに、細菌及び寄生虫を含めた種々の微生物の全体又は一部を包含する。ハプテンもまた、本明細書内で用いられる用語「免疫原」及び「抗原」により包含されると考えられる。
【0047】
本明細書内で用いられる用語「刺激(prime)」及びその文法的変化は、抗原による追加免疫を投与する前に、動物における抗原に対する免疫応答を刺激及び/又は作動することを意味する。
【0048】
本明細書内で用いられる用語「治療する(treat)」、「治療される(treated)」又は「治療すること(treating)」は、疾病又は病原体に関して用いる場合、疾病もしくは病原体による感染に対する対象の耐性を増加させる(即ち、対象が病気にかかるもしくは病原体により感染する可能性を低下させる)治療、並びに対象が病気にかかったもしくは疾病もしくは感染と戦う(例えば、疾病もしくは感染を低減、除去、寛解もしくは安定させる)ための感染後の治療を言う。
【0049】
本明細書内で用いられる用語「対象(subject)」又は「患者(patient)」は、治療を必要とする動物を言う。
【0050】
本明細書内で用いられる用語「動物(animal)」は、ヒト及び非ヒト動物の両方を言い、これらに限定されないが、哺乳動物、鳥類、及び魚類が挙げられ、並びに、例えば、ウシ、ブタ、ウマ、ヤギ、ヒツジ又は他の有蹄動物、イヌ、ネコ、ニワトリ、アヒル、ヒトでない霊長類、モルモット、ウサギ、フェレット、ラット、ハムスター及びマウス等の家畜(domestic)、家畜(farm)、動物園の動物、実験動物及び野生動物を包含する。
【0051】
核酸又はアミノ酸配列に関して本明細書内で用いられる用語「実質的に同一」は、、例えば以下に記載する方法を用いて必要に応じてアラインした場合、、核酸又はアミノ酸配列が、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%の配列同一性を、規定された第2の核酸又はアミノ酸配列(すなわち「参照配列」)と共有することを示す。「実質的な同一性」は、完全長配列、機能的ドメイン、コーディング配列及び/又は調節配列、プロモーター、及びゲノム配列等、種々の型及び長さの配列を参照するために用いられ得る。2つのアミノ酸又は核酸配列の間の同一性のパーセントは、当業者の技術の範囲内の種々の方法で決定され得、例えば、Smith Waterman Alignment (Smith, T. F. and M. S. Waterman (1981) JMol Biol 147: 195- 7); GeneMatcher PlusTM内に組み込まれた"BestFit" (Smith 及びWaterman, Advances in Applied Mathematics, 482-489 (1981))、Schwarz及びDayhof (1979) Atlas of Protein Sequence and Structure, Dayhof, M. O.,編 pp 353-358; BLAST program (Basic Local Alignment Search Tool (Altschul, S. F., W. Gish,ら(1990) J Mol Biol 215: 403-10等、公的に入手可能なコンピュータソフトウェア、並びにBLAST-2、BLAST-P、BLAST-N、BLAST-X、WU-BLAST-2、ALIGN、ALIGN-2、CLUSTAL、及びMegalign (DNASTAR)ソフトウェアを含むそれらの変形を用いて決定され得るさらに、当業者は、比較している配列に渡って最大のアライメントを達成するために必要なアルゴリズムを含む、アライメントを評価するのための適切なパラメータを決定し得る。一般に、アミノ酸配列に対して、比較配列の長さは少なくとも10アミノ酸であるだろう。当業者は、実際の長さが、比較される配列の全体の長さに依存するであろうこと、並びにそれらが少なくとも20、少なくとも30、少なくとも40、少なくとも50、少なくとも60、少なくとも70、少なくとも80、少なくとも90、少なくとも100、少なくとも110、少なくとも120、少なくとも130、少なくとも140、少なくとも150、もしくは少なくとも200のアミノ酸であってもよく、又はアミノ酸配列の全長であってもよいと理解するだろう。核酸に関して、比較配列の長さは、通常、少なくとも25ヌクレオチドであるだろうが、少なくとも50、少なくとも100、少なくとも125、少なくとも150、少なくとも200、少なくとも250、少なくとも300、少なくとも350、少なくとも400、少なくとも450、少なくとも500、少なくとも550、もしくは少なくとも600ヌクレオチドであってもよく、又は核酸配列の全長であってもよい。
【0052】
用語「一致している(corresponding to)」又は「一致する(corresponds to)」は、核酸配列が参照核酸配列の全て又は一部と同一であることを示す。対照的に、用語「相補的(complementary to)」は、核酸配列が参照核酸配列の相補鎖の全て又は一部と同一であることを示すために本明細書内で用いられる。説明のために、核酸配列“TATAC”は、参照配列“TATAC”と一致し、参照配列“GTATA”に相補的である。
【0053】
親和性で複合体化された抗原系(ACAS)
本発明の親和性で複合体化された抗原系(ACAS)は、対象とする抗原に結合できる複数の親和性部分を含むように改変されたPapMV又はVLP(それぞれ親和性PapMV(aPapMV)又は親和性VLP(aVLP)を言う)を含み、それと共に、親和性部分を介してaPapMV又はaVLPに複合体化された1以上の対象とする抗原を含む。ACASは必要に応じて、上述の通り、1以上の追加の孤立した抗原(すなわちAIA)を含んでもよい。
【0054】
親和性パパイヤモザイクウイルス(aPapMV)及び親和性PapMV VLP(aVLP)
本発明のACASに含めるために好適なaPapMVは、そのコートタンパク質が、複数の親和性部分を含むように例えば化学的に改変されたPapMVである。aPapMVを調製するために用いられるPapMVは、野生型PapMV又はそれらの天然に存在する変異体であり得る。
【0055】
ACASに含めるために好適なPapMV aVLPは、多量体化及び自己集合してVLPを形成し得る組換えPapMVコートタンパク質から形成される。集合した場合、各VLPはコートタンパク質サブユニットの長いらせん配列を含む。野生型ウイルスは1200を超えるコートタンパク質サブユニットを含み、約500nmの長さである。しかしながら、野生型ウイルスよりもより短いか又はより長いかのいずれかであるPapMV VLPはなお効果的であり得る。本発明の1つの実施形態において、VLPは少なくとも40のコートタンパク質サブユニットを含む。別の実施形態において、VLPは約40から約1600の間のコートタンパク質サブユニットを含む。代替的な実施形態において、VLPは少なくとも40nmの長さである。別の実施形態において、VLPは約40nmから約600nmの間の長さである。
【0056】
集合した場合の最終的なaVLPが同一のコートタンパク質サブユニットを含むように、aVLPは、同一のアミノ酸配列を有する複数の組換えコートタンパク質から調製され得、又は、集合した場合の最終的なaVLPがコートタンパク質サブユニットにおけるばらつきを含むように、aVLPは、異なるアミノ酸配列を有する複数の組換えコートタンパク質から調製され得る。
【0057】
aVLPを形成するために用いられるコートタンパク質は、全体のPapMVコートタンパク質もしくはそれらの部分であり得、又はそれはPapMVコートタンパク質の遺伝子工学的に改変された形(例えば、1以上のアミノ酸欠失、挿入、置換等を含む形)であり得る(但しコートタンパク質がVLP内に多量体化及び集合する能力を保つという条件で)。野生型PapMV外殻(又はカプシド)タンパク質のアミノ酸配列は、当該技術分野で公知であり(Sit ら 1989, J. Gen. Virol, 70:2325-2331、及び GenBank Accession No. NP_044334.1参照)、配列番号:1として本明細書では与えられている(図1A参照)。PapMVコートタンパク質のヌクレオチド配列もまた当該技術分野で公知であり(Sit,ら、 前掲.,及び GenBank Accession No. NC_001748 (ヌクレオチド5889-6536参照))、配列番号:2として本明細書では与えられている(図1B参照)。
【0058】
上述の通り、VLPにより含まれる組換えPapMVコートタンパク質のアミノ酸配列は、親の配列に対して正確に一致している必要はなく、即ちそれは改変されたか又は「変異体配列」であってもよい。例えば組換えタンパク質は、その部位における残基が親の(参照)配列と一致しないように、1以上のアミノ酸残基の置換、挿入又は欠失により変異されてもよい。しかしながら、当業者は、そのような変異は、大規模なものではなく、組換えコートタンパク質がVLP内に多量体化及び集合する能力に劇的に影響を与えることがないであろうと理解するだろう。PapMVコートタンパク質の変異型が多量体内に集合してVLPを形成する能力は、本明細書で与える実施例に示した例示的な方法のような、例えば標準的な方法の後の電子顕微鏡検査により評価され得る。
【0059】
したがって、VLP内に多量体化及び集合する能力を保った野生型タンパク質の断片(即ち、「機能性」断片)である組換えコートタンパク質もまた、本発明により意図される。例えば、断片は、タンパク質のN末端、C末端、もしくは内部、またはそれらの組み合わせからの、1以上のアミノ酸の欠質を含んでもよい。一般に、機能性断片は、少なくとも100アミノ酸の長さである。本発明の1つの実施形態において、機能性断片は、少なくとも150アミノ酸、少なくとも160アミノ酸、少なくとも170アミノ酸、少なくとも180アミノ酸、及び少なくとも190アミノ酸の長さである。タンパク質のN末端において起こった欠失は、該タンパク質が多量体化する能力を保つために一般に25未満のアミノ酸の削除であるべきである。
【0060】
本発明にしたがって、組換えコートタンパク質が変異体配列を含む場合、変異体配列は参照配列と、少なくとも約70%同一である。1つの実施形態において、変異体配列は参照配列と、少なくとも約75%同一である。他の実施形態において、変異体配列は参照配列と、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、及び少なくとも約97%同一である。特定の実施形態において、参照アミノ酸配列は配列番号:1である。
【0061】
本発明の1つの実施形態において、aVLPは、PapMVコートタンパク質の遺伝子工学的に改変された(即ち変異体)版を含む。別の実施形態において、PapMVコートタンパク質は、タンパク質のN末端もしくはC末端からアミノ酸を削除するように、及び/又は1以上のアミノ酸の置換を含めるように、遺伝子工学的に改変されている。さらなる実施形態において、PapMVコートタンパク質は、タンパク質のN末端又はC末端から約1から約10の間のアミノ酸を削除するように、遺伝子工学的に改変されている。
【0062】
特定の実施形態において、PapMVコートタンパク質は、タンパク質のN末端の近位(即ち、配列番号:1の1及び6の位置)に存在して翻訳を開始させ得る2つのメチオニンコドンのうちの1つを除去するように、遺伝子工学的に改変されている。翻訳開始コドンのうちの1つの除去は、タンパク質の均質集団の産生を可能にする。選択されたメチオニンコドンは、例えば、該コドンを作るヌクレオチドの1つ以上を置換して、該コドンがメチオニンを除くアミノ酸をコードするか、又はナンセンスコドンとなるようにすることによって除去され得る。代替的には、全てもしくは一部のコドン、又は選ばれたコドンを含むタンパク質をコードする核酸の5’領域が、削除され得る。本発明の特定の実施形態において、PapMVコートタンパク質は、タンパク質のN末端から1から5の間のアミノ酸を削除するように、遺伝子工学的に改変されている。さらなる実施形態において、遺伝子工学的に改変されたPapMVコートタンパク質は、配列番号3と実質的に同一であるアミノ酸配列を有する。
【0063】
組換えコートタンパク質が、1以上のアミノ酸置換を包含する変異体配列を含む場合、これらは「保存的(conservative)」置換又は「非保存的(non-conservative)」置換であり得る。保存的置換は、類似した側鎖の特性を有する別の残基による1つのアミノ酸残基の置換を伴う。当該技術分野で公知のように、20の天然に存在するアミノ酸は、それらの側鎖の物理化学的特性にしたがって分類され得る。好適な分類としては、アラニン、バリン、ロイシン、イソロイシン、プロリン、メチオニン、フェニルアラニン及びトリプトファン(疎水性側鎖);グリシン、セリン、スレオニン、システイン、チロシン、アスパラギン、及びグルタミン(極性、非荷電側鎖);アスパラギン酸及びグルタミン酸(酸性側鎖)及びリジン、アルギニン及びヒスチジン(塩基性側鎖)が挙げられる。アミノ酸の別の分類は、フェニルアラニン、トリプトファン及びチロシン(芳香族側鎖)である。保存的置換は、同一グループからの別のアミノ酸によるアミノ酸の置換を伴う。非保存的置換は、異なる側鎖の特性を有する別の残基による1つのアミノ酸残基の置換を伴い、例えば、中性残基又は塩基性残基による酸性残基の置換、酸性残基又は塩基性残基による中性残基の置換、疎水性残基による疎水性残基の置換等である。
【0064】
本発明の1つの実施形態において、変異体配列は1以上の非保存的置換を含む。異なる特性を有する別のアミノ酸による1つのアミノ酸の置換は、コートタンパク質の特性を改善し得る。例えば、本明細書に記載されるように、コートタンパク質の残基128の変異は、VLP内への該タンパク質の集合を改善する。したがって、本発明の1つの実施形態において、コートタンパク質は、コートタンパク質の残基128における変異を含み、この位置のグルタミン酸残基が中性残基により置換される。さらなる実施形態において、128位のグルタミン酸残基はアラニン残基により置換される。
【0065】
同様に、組換えコートタンパク質をコードする核酸配列は親の参照配列との正確な一致を必要とせず、遺伝コードの縮退により及び/又はそれが上述の変異体アミノ酸配列をコードするように、変動してもよい。したがって、本発明の1つの実施形態において、組換えコートタンパク質をコードする核酸配列は、参照配列と、少なくもと約70%同一である。別の実施形態において、組換えコートタンパク質をコードする核酸配列は、参照配列と、少なくとも約75%同一である。他の実施形態において、組換えコートタンパク質をコードする核酸配列は、参照配列と、少なくとも約80%、少なくとも約85%又は少なくとも約90%同一である。特定の実施形態において、参照核酸配列は配列番号:2である。
【0066】
より詳細に下記に記載する通り、aVLPにより含まれるコートタンパク質もまた、ACASにより含まれる1以上の抗原との複合体化のための1以上の親和性部分を含むように、例えば化学的又は遺伝子工学的に改変されている。一つの実施形態において、aVLPは、1以上の親和性部分又は親和性ペプチドに対して遺伝子工学的に融合されたコートタンパク質を含む。
【0067】
親和性部分
本発明のACASを使用するために選ばれた親和性部分は、対象とする抗原に望ましくは特異的に結合でき、並びに、例えば化学的もしくは遺伝子工学的手段により、PapMVコートタンパク質に望ましくは取り付けられることができる。種々の親和性部分が当該技術分野で公知であり、対象とする標的抗原に結合するのに好適な親和性部分は、当業者により容易に選ばれ得る。
【0068】
好適な親和性部分の例としては、これらに限定されないが、抗体及び抗体断片(Fab断片、Fab’断片、Fab’−SH、断片(Fab'-SH, fragments)、F(ab’)2断片、Fv断片、ダイアボディ(diabodies)、及び単鎖Fv(scFv)分子等)、(ビオチン標識抗原に結合する)ストレプトアビジン、天然リガンド(もしくはリガンドの結合ドメイン)、ペプチド又はタンパク質断片(レセプタータンパク質断片等)が挙げられ、これらは、抗原に特異的に結合する。本発明の抗原への特異性を有する合成親和性部分もまた、本明細書では意図されている。
【0069】
リガンドの例としては、これらに限定されないが、タンパク質、改変タンパク質(例えば、糖タンパク質)、炭水化物、プロテオグリカン、脂質、ムチン分子、及び当該技術分野で公知の他の類似分子が挙げられる。
【0070】
所与の抗原に結合することができる種々の親和性部分は当該技術分野で公知であり、多数の抗体、抗体断片、レセプター及びレセプター断片、並びにリガンドが市販されている(例えば、特にInvitrogen Corp., Carlsbad, CA; Santa Cruz Biotechnology, Santa Cruz, CA; ABR-Affinity Bioreagents, Golden, CO, 及び Abeam Inc., Cambridge, MA)。さらに、所与の標的分子に特異的な抗体及び抗体断片を産生する方法は、当該技術分野で公知である(例えば、Current Protocols in Immunology, Coligan ら編、J. Wiley & Sons, New York, NY参照)。
【0071】
リガンドに関して、タンパク質−リガンド相互作用(Protein-Ligand INTeractions)(ProLINT)のためのウェブベースの公共にアクセス可能なデータベースは、結合データ、タンパク質に関する配列及び構造情報、リガンドに関する構造情報、並びにタンパク質−リガンド相互作用に関する実験の詳細を含む。リガンドとそれらの標的タンパク質との間の相互作用についての知識は、QSAR解析(Kitajima ら、2002. Genomic Information, 13:498-499)を用いて特徴付けられ得、並びに当該技術分野で公知の技術を用いた新規リガンドの設計に用いられ得る。
【0072】
親和性部分として用いるのに好適なペプチド又は抗体(抗体断片を含む)はまた、ファージ又は酵母提示技術等の、当業者に公知の技術により選ばれ得る。ペプチド又は抗体は、天然に存在する、組換え、合成、又はこれらの組み合わせであり得る。例えば、ペプチドは天然に存在するタンパク質又はポリペプチドの断片であり得る。本明細書内で用いられる用語ペプチドはまた、ペプチドアナログ、ペプチド誘導体及びペプチド模倣化合物を包含する。そのような化合物は当該技術分野で周知であり、並びに、例えば、より高い化学的安定性、タンパク質分解に対する上昇した耐性、強化された薬理学特性(半減期、吸収、効力及び有効性等)及び/又は低下した抗原性を含む天然に存在するペプチドを越える利点を有してもよい。
【0073】
本発明の1つの実施形態において、親和性部分はペプチドである。好適なペプチドは、約3アミノ酸の長さから約50アミノ酸の長さの範囲であり得る。本発明の1つの実施形態によれば、ACASにおける使用に好適な親和性ペプチドは、少なくとも5アミノ酸の長さである。本発明の別の実施形態にしたがって、ACASにおける使用に好適な親和性ペプチドは、少なくとも7アミノ酸の長さである。本発明の別の実施形態にしたがって、ACASにおける使用に好適な親和性ペプチドは、約5から約50の間のアミノ酸の長さである。本発明の別の実施形態にしたがって、ACASにおける使用に好適な親和性ペプチドは、約7から約50の間のアミノ酸の長さである。本発明の他の実施形態にしたがって、ACASにおける使用に好適な親和性ペプチドは、約5から約45の間のアミノ酸の長さ、約5から約40の間のアミノ酸の長さ、約5から約35の間のアミノ酸の長さ並びに約5から約30の間のアミノ酸の長さである。本発明の特定の実施形態にしたがって、ACASにおける使用に好適な親和性ペプチドは、3、4、5、6、7、8、9、10、11、12、13、14又は15アミノ酸の長さである。当業者によって理解されるように、ペプチドがPapMVコートタンパク質と遺伝子工学的に融合される場合、選ばれたペプチドの長さは、コートタンパク質がVLP内に自己集合する能力を妨げるべきではない。
【0074】
親和性部分がペプチドを含むPapMV又はVLPにより含まれる場合、親和性部分は単一のペプチドであり得、又はペプチドのタンデムな又は多重の配列を含み得る。
【0075】
大きな抗原の結合を促進するために、親和性部分とコートタンパク質との間に所望によりスペーサーを含めてもよい。好適なスペーサーは、グリシン等の中性アミノ酸の短い伸長を含む。例えば、約3から約10の間の中性アミノ酸の伸長である。1つの実施形態において、約3から約10の間のアミノ酸の伸長は、PapMVコートタンパク質と親和性部分との間に挿入される。
【0076】
上述の通り、ファージ提示は、標準的な技術(例えばCurrent Protocols in Immunology, Coliganら編、 J. Wiley & Sons, New York, NY参照)及び/又は市販のファージ提示キット(例えばNew England Biolabsから入手可能なPh.D.シリーズのキット、及びNovagenから入手可能なT7-Select(登録商標)kit)を用いて対象とする抗原性タンパク質に結合する特異的ペプチドを選ぶために用いられ得る。ファージ提示によるペプチドの選択の例もまた、下記の実施例3及び7で与えられる。
【0077】
ファージ提示により同定された所与の抗原に結合する代表的なペプチドを表1に示す。当業者は、これらのペプチドは例にすぎず、対象とする抗原に対する親和性を有する他のペプチドが当業者に公知の技術を用いて容易に同定され得ることを理解するだろう。例えば、少なくとも4つの連続したアミノ酸を含む、表1に説明した配列の切断バージョンもまた、意図される。本発明の1つの実施形態にしたがって、配列番号:9、配列番号:10、配列番号:11、配列番号:12、配列番号:13、又は配列番号:14に示す配列の全て又は一部を含む1以上の親和性ペプチドを含むPapMV又はVLPを含む、ACASが提供される。別の実施形態において、配列番号:8、配列番号:15、配列番号:16、配列番号:17、配列番号:18、配列番号:19又は配列番号:20に示す配列の全て又は一部を含む1以上の親和性ペプチドを含むPapMV又はVLPを含む、ACASを提供する。
【0078】
【表1】

【0079】
抗原
本発明の親和性で複合体化された抗原系(ACAS)は、親和性部分を介してaPapMV又はaVLPに複合体化された1以上の抗原を含む。ACASはまた、必要に応じて、1以上のAIAを含んでもよく、これは複合体化された抗原(単数もしくは複数)と同一又は異なっていてもよい。
【0080】
種々の疾病又は疾患に関連する多様多種の抗原は当該技術分野で公知である。本発明のACASに含めるのに適切な抗原は、例えば、目的とする疾病もしくは疾患及び/又は投与される動物等、組成物の所望の最終使用に基づいて、当業者により容易に選ばれ得る。
【0081】
例えば、抗原は、癌、感染症、アレルギー反応、もしくは自己免疫疾患等、動物における疾病もしくは疾患を引き起こし得る剤由来であり得、又は薬物、ホルモンもしくは毒素に関連する疾病もしくは疾患に対する免疫応答を誘導するための使用に好適な抗原であり得る。抗原は、例えば、細菌、ウイルス、原生生物、菌類、寄生虫等、当該技術分野で公知の病原体、又はプリオン等の感染粒子由来であってもよく、又は腫瘍関連抗原、自己抗原もしくはアレルゲンであってもよい。
【0082】
ACAS内に組み込むための抗原(単数又は複数)は、様々な大きさであってよく、並びに、例えば、ペプチド、タンパク質、核酸、多糖類、小分子、もしくは病原体全体もしくはその一部(例えば、生きた、不活化された又は弱毒化された病原体の形)まで含む、それらの組み合わせであってもよい。1つの実施形態において、ACAS内に組み込まれる抗原(単数もしくは複数)は、例えばタンパク質(糖タンパク質、リポタンパク質等を含む)、タンパク質の大きな断片(例えば、約20アミノ酸以上の長さ)、多糖類、多糖類断片、核酸、核酸断片、病原体全体もしくは病原体の一部等の巨大分子である。別の実施形態において、ACAS内に組み込まれる抗原(単数もしくは複数)は、タンパク質又はペプチドの短い断片である(例えば、約4から約20の間のアミノ酸の長さ)。
【0083】
ACASが1つより多くの抗原を含む場合、ACASに組み込むために選ばれた抗原は同一であり得、又はそれらは異なり得、並びに単独のソースもしくは複数のソース由来であってもよい。抗原は、特異的免疫応答を誘発することができる単独のエピトープをそれぞれ有し得、又は各抗原は1つより多くのエピトープを含んでもよい。
【0084】
抗原は、T細胞、B細胞、NK細胞、マクロファージにおける表面構造、クラスIもしくはクラスII APC関連細胞表面構造、又はそれらの組み合わせにより認識されるエピトープを含んでもよい。1つの実施形態において、本発明は、ACASが弱い免疫原性抗原に対してとりわけ有用であることを意図する。
【0085】
公知の抗原に加えて、本発明のACASに組み込むための抗原もまた、当業者公知の方法により対象とする病原体又は他のソースから選ばれてもよく、並びに当該技術分野で公知の標準的な免疫学的技術を用いて動物における免疫応答を誘導するこれらの能力について選別されてもよい。例えば、抗原性タンパク質内のエピトープを予測する方法はNussinov R and Wolfson H J, Comb Chem High Throughput Screen (1999) 2(5):261に記載され;並びにCTLエピトープを予測する方法はRothbardら、EMBO J. (1988) 7:93-100及びde Groot M S ら、Vaccine (2001) 19(31):4385-95に記載されている。他の方法は、Rammensee H-G.ら、Immunogenetics (1995) 41 :178-228及びSchirle Mら、Eur J Immunol (2000) 30(18):2216-2225に記載されている。
【0086】
例えば、有用なウイルス抗原としては、アデノウイルス科(Adenoviradae);アレナウイルス科(例えば、イッピイウイルス及びラッサウイルス);ビルナウイルス科;ブニヤウイルス科;カルシウイルス科;コロナウイルス科;フィロウイルス科;フラビウイルス科(例えば、黄熱病ウイルス、デング熱ウイルス及びC型肝炎ウイルス);ヘパドナウイルス科(Hepadnaviradae)(例えば、B型肝炎ウイルス);ヘルペスウイルス科(Herpesviradae)(例えば、ヒト単純ヘルペスウイルス1型);オルトミクソウイルス科(例えば、インフルエンザウイルスA型、B型及びC型);パラミクソウイルス科(例えば、ムンプスウイルス、麻疹ウイルス及び呼吸器合胞体ウイルス);ピコルナウイルス科(例えば、ポリオウイルス及びA型肝炎ウイルス);ポックスウイルス科;レオウイルス科;レトロウイルス科(Retroviradae)(例えば、BLV−HTLVレトロウイルス、HIV−1型、HIV−2型、ウシ免疫不全ウイルス及びネコ免疫不全ウイルス);ラブドウイルス(Rhabodoviridae)(例えば、狂犬病ウイルス)、並びにトガウイルス科(例えば、風疹ウイルス)のメンバー由来のものが挙げられる。1つの実施形態において、組成物は、種々の肝炎ウイルス、ヒト免疫不全ウイルス(HIV)、種々のインフルエンザウイルス、ウエストナイルウイルス、呼吸器合胞体ウイルス、インフルエンザウイルス、狂犬病ウイルス、ヒトパピローマウイルス(HPV)、エプスタインバーウイルス(EBV)、ポリオーマウイルス、又はSARSコロナウイルス等の、主要なウイルス病原体由来の1以上の抗原を含む。
【0087】
A型肝炎ウイルス(HAV)、B型肝炎ウイルス(HBV)、C型肝炎ウイルス(HCV)、デルタ肝炎ウイルス(HDV)、E型肝炎ウイルス(HEV)及びG型肝炎ウイルスを含む、肝炎ウイルス由来のウイルス抗原は、当該技術分野で公知である。抗原は、例えば、HCVコアタンパク質、E1タンパク質、E2タンパク質、NS3及び他のタンパク質(NS2、NS4a、NS4b、NS5a及びNS5b)由来、HBV HbsAg抗原又はHBVコア抗原由来、並びにHDVデルタ−抗原由来であり得る(例えば、米国特許第5378814号参照)。例えば、米国特許第6596476号;第6592871号;第6183949号;第6235284号;第6780967号;第5981286号;第5910404号;第6613530号;第6709828号;第6667387号;第6007982号;第6165730号;第6649735号及び第6576417号は、HCVコアタンパク質に基づく種々の抗原を記載する。1つの実施形態において、HCVコアタンパク質の抗原性部分が、本発明のACASに含められる。例えば、好適な抗原性部分としては、HCVコアタンパク質の最初の(N末端)82アミノ酸及びHCVコアタンパク質の最初の(N末端)170アミノ酸が挙げられる。
【0088】
ヘルペスウイルス科由来の公知の抗原の限定されない例としては、HSV−1型及びHSV−2型糖タンパク質gB、gD及びgH等の単純ヘルペスウイルス(HSV)1型及び2型由来のものが挙げられる。
【0089】
HIV抗原の限定されない例としては、gp120由来の抗原、gp160及びgp41等の種々のエンベロープタンパク質由来の抗原、p24gag及びp55gag等のgag抗原、並びにHIVのpol、env、tat、vifrev、nefvpr、vpu及びLTR領域由来のタンパク質が挙げられる。HIVの種々の遺伝子工学的サブタイプのメンバーを含む、多数のHIV−1型及びHIV−2型分離株由来のgp120の配列は公知である(例えば、Myers ら、 Los Alamos Database, Los Alamos National Laboratory, Los Alamos, N. Mex. (1992);及びModrowら、J. Virol. (1987) 61 :570 578参照)。
【0090】
他のウイルス抗原の限定されない例としては、水痘帯状ヘルペスウイルス(VZV)、エプスタイン・バー・ウイルス(EBV)並びにCMV gB及びgHを含むサイトメガロウイルス(CMV)由来のもの;並びにHHV6及びHHV7等の他のヒトヘルペスウイルス由来の抗原が挙げられる(例えば、Cheeら(1990) Cytomegaloviruses(J. K. McDougall,編., Springer- Verlag, pp. 125 169; McGeoch ら(1988; J. Gen. Virol. 69:1531 1574; U.S. Pat. No. 5,171,568; Baer ら(1984) Nature 310:207 211; 及びDavisonら (1986) J. Gen. Virol. 67: 1759 1816参照)。
【0091】
抗原はまた、インフルエンザウイルス由来、例えば、ヘマグルチニン(HA)、ノイラミニダーゼ(NA)、ヌクレオプロテイン(NP)M1及びM2タンパク質由来であり得る。これらタンパク質の配列は当該技術分野で公知であり、並びにNational Center for Biotechnology Information(NCBI)により維持されるGenBankデータベースから容易にアクセスできる。HA、NP及びマトリックスタンパク質の好適な抗原性断片としては、これらに限定されないが、ヘマグルチニンエピトープ:HA91−108、HA307−319及びHA306−324(Rothbard, Cell, 1988, 52:515-523)、HA458−467(J. Immunol. 1997, 159(10):4753-61)、HA213−227、HA241−255、HA529−543及びHA533−547(Gao, W. al., J. Virol, 2006, 80:1959-1964); ヌクレオプロテインエピトープ: NP206-229(Brett, 1991, J. Immunol. 147:984-991)、NP335−350及びNP380−393(Dyer and Middleton, 1993, Histocompatibility testing, a practical approach中(編集: Rickwood, D. and Hames, B. D.)IRL Press, Oxford, p. 292; Gulukota and DeLisi, 1996, Genetic Analysis: Biomolecular Engineering, 13:81)、NP305−313(DiBrino, 1993, PNAS 90:1508-12);NP384−394(Kvist, 1991, Nature 348:446-448);NP89−101(Cerundolo, 1991, Proc. R. Soc. Lon. 244: 169-7);NP91−99(Silver et al,1993, Nature 360: 367-369);NP380−388(Suhrbier, 1993, J. Immunology 79:171- 173);NP44−52及びNP265−273(DiBrino, 1993,(前掲));及びNP365−380(Townsend, 1986, Cell 44:959-968);マトリックスタンパク質(M1)エピトープ:M1 2−22、M1 2−12、M1 3−11、M1 3−12、M1 41−51、M1 50−59、M1 51−59、M1 134−142、M1 145−155、M1 164− 172、M1 164−173(全て Nijman, 1993, Eur. J. Immunol. 23: 1215-1219に記載); M1 17−31、M1 55−73、M1 57−68(Carreno, 1992, MoI Immunol 29:1131-1140);M1 27−35、M1 232−240(DiBrino, 1993, (前掲))、M1 59−68及びM1 60−68(Eur. J. Immunol.1994, 24(3): 777-80);及びM1 128−135(Eur. J. Immunol. 1996, 26(2): 335-39)のうち1つ以上を含む断片が挙げられる。
【0092】
他の関連する抗原性領域及びインフルエンザウイルスタンパク質のエピトープもまた、公知である。例えば、M2eペプチド(M2の細胞外ドメイン)を含むインフルエンザイオンチャネルタンパク質(M2)の断片である。このペプチドの配列はインフルエンザの様々な菌株に渡って高度に保存されている。M2eペプチド配列の例は、配列番号:21として表2に示す。この配列の変異株が同定されており、そのような変異形のいくつかの例もまた、表2に示す。
【0093】
【表2】

【0094】
M2e配列全体又はM2e配列の一部が用いられてもよく、例えば、アミノ酸2から10により定義された領域を含む断片、又は保存されたエピトープEVETPIRN[配列番号:26](M2e配列のアミノ酸6−13)等の変異形に渡って保存されている部分配列である。6−13エピトープは、GenBankにおいて入手可能なヒトインフルエンザA型株の84%で不変であることが明らかになっている。同定もされている、この配列の変異形としては、EVETLTRN[配列番号:27](9.6%)、EVETPIRS[配列番号:28](2.3%)、EVETPTRN[配列番号:29](1.1%)、EVETPTKN[配列番号:30](1.1%)並びにEVDTLTRN[配列番号:31]、EVETPIRK[配列番号:32]及びEVETLTKN[配列番号:33](各0.6%)が挙げられる(Zou, P., et al., 2005, Int Immunopharmacology, 5:631-635; Liu et al. 2005, Microbes and Infection, 7:171-177)。
【0095】
他の有用な抗原としては、不活性化ポリオウイルス(Jiang ら、J. Biol. Stand., (1986) 14: 103-9)、A型肝炎ウイルスの弱毒化株(Bradleyら、J. Med. Virol, (1984) 14:373-86)、弱毒化麻疹ウイルス(James ら、N. Engl. J. Med., (1995) 332:1262-6)等の生ウイルス、弱毒化ウイルス及び不活性化ウイルス並びに百日咳ウイルスのエピトープ(例えば、ACEL-IMUNETMacellular DTP, Wyeth- Lederle Vaccines and Pediatrics)が挙げられる。
【0096】
抗原はまた、当業者に公知である、クル病、クロイツフェルト−ヤコブ病(CJD)、スクレイピー、伝染性ミンク脳症、及び慢性消耗性疾患の原因物質等の特殊なウイルスもしくはウイルス様剤由来、又は狂牛病に関連するプリオン等のタンパク質性感染粒子由来であり得る。
【0097】
有用な細菌性抗原としては、例えば、リポ多糖類等の細菌表面の抗原性成分、莢膜抗原(タンパク質性(proteinacious)もしくは天然の多糖類)、又は鞭毛構成成分を含み、並びにこれらは、ジフテリア、百日咳、破傷風、結核、細菌性もしくは真菌肺炎、コレラ、チフス、ペスト、細菌性赤痢もしくはサルモネラ症、レジオネラ症(Legionaire's Disease)、ライム症、ハンセン病、マラリア、鉤虫症、オンコセルカ症、住血吸虫症、トリパノソーマ症(Trypamasomialsis)、リーシュマニア症(Lesmaniasis)、ジアルジア、アメーバ症、フィラリア症、ボレリア、及び旋毛虫症等の疾病に関与する公知の原因物質から得てもまたそれ由来であってもよい。
【0098】
腸内細菌科のグラム陰性菌由来の抗原の例としては、これらに限定されないが、S.チフィVi(莢膜多糖類)抗原、E.コリK及びCFA(莢膜成分)抗原並びにE.コリ繊毛アドへシン抗原(K88及びK99)が挙げられる。抗原性タンパク質の例としては、ポーリンとしても知られる外膜タンパク質(Omp)(Secundino ら、2006, Immunology 117:59);S.チフィ鉄制御外膜タンパク質等の関連ポーリン(IROMP, Sood ら、2005, Mol Cell Biochem 273:69-78)、及び、限定されないがS.チフィHSP40を含む熱ショックタンパク質(HSP)が挙げられる(Sagi ら、2006, Vaccine 24:7135-7141)。抗原性ポーリンの限定されない例としては、OmpC及びOmpFが挙げられ、これらは、多数のサルモネラ属及びエシェリキア属種中に見られる。OmpC及びOmpFのオルソログはまた、他の腸内細菌科に見られ、並びにこれらは本発明の目的のための好適な抗原性タンパク質である。さらに、腸内細菌科のポーリンタンパク質中に見られる配列の保存領域に基づいて、Omp1B(Shigella flexneri)、OmpC2(Yersinia pestis)、OmpD(S. enterica)、OmpK36(Klebsiella pneumonie)、OmpN(E. coli)及びOmpS(S. enterica)が好適であり得る(Diaz-Quinonezら, 2004, Infect. and Immunity 72:3059-3062)。
【0099】
種々の腸内細菌由来の抗原性タンパク質の配列は、当該技術分野で公知であり、並びにNational Center for Biotechnology Information(NCBI)により維持されるGenBankデータベースから容易にアクセス可能である。例えば、GenBank Accession No.P0A264(図9[配列番号:4]にも示す)及びGenBank Accession No.NP_804453:OmpC(S. enterica 亜種enterica serovar Typhi Ty2);GenBank Accession No.CAD05399 (図10[配列番号:5]にも示す):OmpF前駆体タンパク質 (S. enterica亜種enterica serovar Typhi CT 18);GenBank Accession No.16761195:OmpC(S. enterica serovar Typhimurium);GenBank Accession No.47797:OmpC(S. enterica serovar Typhi);GenBank Accession No.8953564:OmpC(S. enterica serovar Minnesota);GenBank Accession No.19743624:OmpC(S. enterica serovar Dublin);GenBank Accession No.19743622:OmpC(S. enterica serovar Gallinarum);GenBank Accession No.26248604:OmpC(E. coli);GenBank Accession No.24113600:Omp1B (Shigella flexneri);GenBank Accession No.16764875:OmpC2(Yersinia pestis);GenBank Accession No.16764916:OmpD(S. enterica Serovar Typhimurium);GenBank Accession No.151149831:OmpK36(Klebsiella pneumonie);GenBank Accession No.3273514:OmpN(E. coli)、並びにGenBank Accession No.16760442:OmpS(S. enterica serovar Typhi)である。
【0100】
種々の腫瘍関連抗原が当該技術分野で公知である。代表的な例としては、これらに限定されないが、Her2(乳癌);GD2(神経芽細胞腫);EGF−R(悪性神経膠芽腫);CEA(甲状腺髄様癌);CD52(白血病);ヒトメラノーマタンパク質gp100;ヒトメラノーマタンパクmelan−A/MART−1;NA17−A ntタンパク質;P53タンパク質;MAGE1、MAGE2、MAGE3(HLA−A1ペプチド)及びMAGE4を含む種々のMAGE(メラノーマ関連抗原E);種々のチロシナーゼ(HLA−A2ペプチド);変異ras;p97メラノーマ抗原;進行癌に関連するRasペプチド及びp53ペプチド;子宮頸癌に関連するHPV16/18及びE6/E7抗原;乳癌に関連するMUCl−KLH抗原;結腸直腸癌に関連するCEA(癌胎児性抗原),肺癌に関連するDKK−1(Dickkopf-1タンパク質)及び前立腺癌に関連するPSA抗原が挙げられる。
【0101】
有用なアレルゲンとしては、これらに限定されないが、花粉、動物のフケ、草、カビ、埃、抗生物質、刺咬昆虫毒に由来するアレルゲン、並びに様々な環境、薬物及び食物アレルゲンが挙げられる。ありふれた樹木のアレルゲンとしては、ハコヤナギ、ポプラ(popular)、セイヨウトネリコ、カバノキ、カエデ、オーク、ニレ、ヒッコリー、及びペカンの木由来の花粉が挙げられる。ありふれた植物アレルゲンとしては、ライムギ、ブタクサ、イギリスオオバコ、ソレル−ドック(sorrel-dock)及びアカザ由来のものが挙げられ、並びに植物接触アレルゲンとしては、ウルシ、ツタウルシ及びイラクサ由来のものが挙げられる。ありふれた草アレルゲンとしては、チモシー、ジョンソン、バミューダ、フェスク及びブルーグラスアレルゲンが挙げられる。ありふれたアレルゲンはまた、アルテルナリア属、フサリウム属、ホルモデンドラム属、アスペルギルス属、ミクロポリスポラ属、ケカビ属及び好熱性放線菌類等のカビ又は真菌から入手できる。ペニシリン、スルホンアミド及びテトラサイクリンはありふれた抗生物質アレルゲンである。表皮性アレルゲンは、ハウスダストもしくは有機塵(典型的には真菌起源)から、イエダニ(ヤケヒョウヒダニ(dermatphagoides pterosinyssis))等の昆虫から、もしくは羽毛、並びにネコ及びイヌのフケ等の動物ソースから入手できる。ありふれた食物アレルゲンとしては、牛乳及びチーズ(乳製品(diary))、卵、コムギ、ナッツ(例えば、ピーナッツ)、海産物(例えば、甲殻類)、エンドウマメ、マメ及びグルテンアレルゲンが挙げられる。ありふれた薬物アレルゲンとしては、局所麻酔薬及びサリチル酸アレルゲンが挙げられ、並びにありふれた昆虫アレルゲンとしては、ミツバチ、スズメバチ(hornet)、カリバチ(wasp)及びアリ毒、並びにゴキブリ腎杯アレルゲン(cockroach calyx allergens)が挙げられる。
【0102】
特に十分に特徴づけられたアレルゲンとしては、これらに限定されないが、イエダニアレルゲンDer pI及びDer pII(Chua,ら、J. Exp. Med., 167:175 182, 1988;及び Chua, ら、Int. Arch. Allergy Appl. Immunol, (1990) 91 : 124-129参照)、Der pIIアレルゲンのT細胞エピトープペプチド(Joost van Neerven,ら、 J. Immunol, (1993) 151 :2326-2335参照)、高度に大量の抗原E(Amb aI)ブタクサ花粉アレルゲン(Rafnar, ら、J. Biol. Chem., (1991) 266:1229-1236参照)、ホスホリパーゼA2(ハチ毒)アレルゲン及びその中のT細胞エピトープ( Dhillon, ら、 J. Allergy Clin. Immunol, (1992) 42参照)、シラカバ花粉(Betvl)(Breiteneder,ら、EMBO, (1989) 8:1935-1938参照)、Fel dI主要イエネコアレルゲン(Rogers,ら、 MoI Immunol, (1993) 30:559-568参照)、樹木花粉(Elsayedら、Scand. J. Clin. Lab. Invest. Suppl, (1991) 204:17-31参照)並びに複数エピトープの組換え草アレルゲンrKBG8.3(CaoらImmunology (1997) 90:46-51)が挙げられる。これら及び他の好適なアレルゲンは市販されており並びに/又は公知の技術にしたがって容易に調製され得る。
【0103】
自己抗原に関連する病気に関する抗原もまた、当業者に公知である。そのような抗原の代表的な例としては、これらに限定されないが、リンホトキシン、リンホトキシン受容体、核内因子kBリガンドの受容体活性化因子(RANKL)、血管内皮増殖因子(VEGF)、血管内皮増殖因子受容体(VEGF−R)、インターロイキン5、インターロイキン17、インターロイキン13、CCL21、CXCL12、SDF−1、MCP−1、エンドグリン、レジスチン、GHRH、LHRH、TRH、MIF、エオタキシン、ブラジキニン、BLC、腫瘍壊死因子アルファ及びアミロイドベータペプチド、並びに免疫応答を誘発するために用いられ得る各断片が挙げられる。
【0104】
有用な毒素は、一般的に有毒植物、動物及び微生物の天然物、又はこれらの化合物の断片である。そのような化合物としては、例えば、アフラトキシン、シガテラ毒素、百日咳毒素及びテトロドトキシンが挙げられる。
【0105】
レクリエーションドラッグ中毒に関して有用な抗原は、当該技術分野で公知であり、例えば、コデイン、フェンタニル、ヘロイン、モルヒネ及びアヘン等のオピオイド及びモルヒネ誘導体;アンフェタミン、コカイン、MDMA(メチレンジオキシメタンフェタミン(methylenedioxymethamphetamine))、メタンフェタミン、メチルフェニデート及びニコチン等の刺激物質;LSD、メスカリン及びシロシビン等の幻覚剤;ハシッシュ及びマリファナ等の大麻類、他の中毒性薬物又は化合物、並びにそのような化合物の誘導体、副生物、変異形及び複合体が挙げられる。
【0106】
本発明の1つの実施形態において、ACASに含まれる抗原(単数又は複数)は、タンパク質抗原である。タンパク質抗原は、全長タンパク質、実質的に全長のタンパク質(例えば、約25あるいはそれ未満のアミノ酸のN末端及び/もしくはC末端欠失を含むタンパク質)、タンパク質の抗原性断片、又はそれらの組み合わせであり得る。全長タンパク質は、それが利用できる場合、該タンパク質の前駆形態又は該タンパク質の成熟(プロセシングされた)形態であり得る。タンパク質は、例えば糖タンパク質又はリポタンパク質といった、翻訳後修飾されたものであってもよい。抗原性断片は、1又は複数のエピトープを含み得、したがって、数個のアミノ酸(例えば、少なくとも4個のアミノ酸)のペプチドから数百のアミノ酸の長さのポリペプチドまで、大きさに幅があってもよい。本発明の1つの実施形態において、ACASに組み込むために好適な抗原性断片は、少なくとも20アミノ酸の長さである。別の実施形態において、ACASに組み込むために好適な抗原性断片は、約20アミノ酸から約500アミノ酸の間の長さである。別の実施形態において、ACASに組み込むために好適な抗原性断片は、約20アミノ酸から約450アミノ酸の間の長さである。他の実施形態において、ACASにおける封入体に好適な抗原性断片は、約20アミノ酸から約400アミノ酸の間の長さ、約20アミノ酸から約350アミノ酸の間の長さ、約20アミノ酸から約300アミノ酸の間の長さ、約20アミノ酸から約250アミノ酸の間の長さ、約20アミノ酸から約200アミノ酸の間の長さ、及び約20アミノ酸から約150アミノ酸の間の長さである。別の実施形態において、ACASに含まれるタンパク質抗原は、全長又は実質的に全長のタンパク質である。
【0107】
ACASの作製
aPapMV及びaVLP
PapMVは当該技術分野で公知であり、例えば、ATCC No.PV-204TMとして、アメリカン・タイプ・カルチャー・コレクション(ATCC)から入手できる。ウイルスは、維持され得、並びに標準プロトコル(例えば、Erickson, J. W. & Bancroft, J. B., 1978, Virology 90:36-46参照)にしたがって、パパイヤ(Carica papaya)及びキンギョソウ(Antirrhinum majus)等の宿主植物で維持され得、かつ該宿主植物から精製(purified form)され得る。選ばれた親和性部分は、例えばリジン、アルギニン、アスパラギン酸、グルタミン酸及び/又はシステイン残基を介して、ウイルスの表面上に配置された反応基を通じてaPapMVを形成するためにPapMVのコートタンパク質に取り付けられ得る。
【0108】
一般に、親和性部分はPapMVのコートタンパク質に化学的に取り付けられる。「化学的に取り付けられる」とは、例えば、共有又は非共有(イオン性結合、疎水性結合、水素結合等)結合により、親和性部分がコートタンパク質に化学的に架橋されていることを意味する。親和性部分及び/又はコートタンパク質は、当該技術分野で公知のように、そのような架橋を促進するために改変されてもよく、それは例えば、例えば、C末端もしくはN末端又は内部の位置での、該タンパク質及び/又は抗原に対する官能基又は化学的部分の付加によるものである。例示的な改変としては、S−アセチルメルカプトコハク酸無水物(SAMSA)もしくはS−アセチルチオアセテート(SATA)等の官能基の付加、又は1以上のシステイン残基の付加が挙げられる。他の架橋剤は当該技術分野で公知であり、かつその多くが市販されている(例えば、Pierce Chemical Co.及びSigma-Aldrichからのカタログ参照)。例としては、これらに限定されないが、1,6−ジアミノヘキサン、1,3−ジアミノプロパン及び1,3−ジアミノエタン等のジアミン;グルタルアルデヒド等のジアルデヒド;エチレングリコール−bis(コハク酸N-ヒドロキシコハク酸イミドエステル)、ジコハク酸イミドグルタル酸エステル、ジコハク酸イミドスベリン酸エステル、N−(g−マレイミドブチリルオキシ)スルホスクシンイミドエステル及びエチレングリコール−bis(スクシンイミジルスクシネート)等のコハク酸イミドエステル;ヘキサメチレンジイソシアネート等のジイソシアネート;1,4ブタンジイルジグリシジルエーテル等のビスオキシラン;ジサリチル酸スクシニル(succinyidisalicylate)等のジカルボン酸;3−マレイミドプロピオン酸N−ヒドロキシスクシンイミドエステル等が挙げられる。上述の架橋剤の多くは、VLPから親和性部分を遠ざけるスペーサーを組み込んでいる。他のスペーサーの使用もまた、本発明により意図されている。種々のスペーサーが当該技術分野で公知であり、該スペーサーとしては、これらに限定されないが、6−アミノヘキサン酸;1,3−ジアミノプロパン;1,3−ジアミノエタン;及び1から5のアミノ酸のポリグリシン配列等の短いアミノ酸配列が挙げられる。
【0109】
コートタンパク質への1以上の親和性部分の共有結合を促進するために、PapMVの表面に露出され、かつ、親和性部分の化学結合のための適切な部位を提供するように、短いペプチド又はアミノ酸リンカーが、まずコートタンパク質に結合され得る。例えば、システイン残基、又は、共有結合(例えば酸性及び塩基性残基)を形成することができるか、もしくは共有結合を形成するように容易に改変され得るその他のアミノ酸残基を含む短いペプチドが当該技術分野で公知である。アミノ酸リンカー又はペプチドは、例えば、1から約20アミノ酸の間の長さであり得る。1つの実施形態において、コートタンパク質は、上述したような好適な架橋剤を用いることにより、1つ以上のリジン残基(これが共有結合され得る)を例えばシステイン残基と共に有する短いペプチドと、該部分において融合される。特定の実施形態において、コートタンパク質は、グリシン及びリジン残基の短いペプチド配列と融合される。別の実施形態において、ペプチドは配列:GGKGGを含む。
【0110】
本発明のaVLPを調製するために用いられ得る組換えコートタンパク質は、野生型タンパク質の配列が与えられた、当業者によって標準的な遺伝子工学技術により、容易に調製され得る。タンパク質を遺伝子操作する方法は、野生型PapMVコートタンパク質の配列(配列番号:1及び2参照)と同様に、当該技術分野で周知である(例えば、Ausubel ら. (1994 & 更新版) Current Protocols in Molecular Biology, John Wiley & Sons, New York参照)。
【0111】
野生型タンパク質をコードする核酸配列の単離及びクローニングは、標準的な技術を用いて達成され得る(例えば、Ausubelら、(前掲)参照)。例えば、核酸配列は、標準的な技術によりRNAを抽出し、次いで、該RNAテンプレートから(例えばRT−PCRによって)cDNAを合成することによりPapMVから直接得ることができる。PapMVは、モザイク病の症状を示す感染した植物の葉から、標準的な技術により精製され得る(例えば、本明細書に与える実施例1参照)。
【0112】
コートタンパク質をコードする核酸配列は、次いで、直接又は1以上のサブクローニング工程の後に、好適な発現ベクター内に挿入される。当業者は、用いられる正確なベクターは、本発明にとって重要ではないことを理解するだろう。好適なベクターの例としては、これらに限定されないが、プラスミド、ファージミド、コスミド、バクテリオファージ、バキュロウイルス、レトロウイルス又はDNAウイルスが挙げられる。以下により詳細に記載するように、コートタンパク質は次いで、発現及び精製され得る。
【0113】
あるいは、コートタンパク質をコードする核酸配列は、当該技術分野で公知の標準的なインビトロでの部位特異的突然変異誘発技術により、上述したような1以上の突然変異を導入するためにさらに改変され。得る突然変異は、コーディング配列を形成する1以上の適切なヌクレオチドの欠失、挿入、置換、逆位又はそれらの組み合わせにより導入され得る。これは、例えば、1以上のヌクレオチドのミスマッチ、挿入もしくは欠失を組み込んだプライマーを設計するためのPCRに基づく技術により、達成され得る。突然変異の存在は、例えば制限解析又はDNA配列決定といった数多くの標準的な技術により確認され得る。
【0114】
上述の通り、親和性部分がペプチド、タンパク質又はタンパク質断片である場合、コートタンパク質もまた、親和性部分をコートタンパク質に対して遺伝子工学的に融合させるために改変され得る。aVLPの表面上における親和性部分の提示を可能にし、それにより、親和性部分に結合した抗原の免疫認識を増強するために、親和性部分は、好ましくは、aVLPの外表面に配置されたコートタンパク質の領域に対して融合される。したがって、親和性部分は、例えば、コートタンパク質のアミノ(N)又はカルボキシ(C)末端において取り付けられ得、又はaVLPの外表面に配置されたコートタンパク質の内部ループに対して取り付けられ得る。本発明の1つの実施形態において、親和性部分は、PapMVコートタンパク質のC末端又はその近位において遺伝子工学的に融合される。
【0115】
融合タンパク質を作製する方法は、当業者に周知である。融合タンパク質をコードするDNA配列は、上述の通りの好適な発現ベクター内に挿入され得る。
【0116】
当業者は、コートタンパク質をコードするDNAは、コードされたタンパク質の活性に影響を及ぼすことなく種々の手段で改変され得ると理解するだろう。例えば、DNA配列における変動は、タンパク質を発現させるのに用いられる宿主細胞におけるコドン選択用に最適化するために用いられてもよく、又は発現を促進する他の配列変化を包含していてもよい。
【0117】
当業者は、発現ベクターは、コートタンパク質又は融合タンパク質をコードするDNA配列の効率的な転写のために必要とされる、転写要素等の調節要素をさらに含んでもよいと理解するだろう。ベクター内に組み込まれ得る、調節要素の例としては、これらに限定されないが、プロモーター、エンハンサー、ターミネーター、及びポリアデニル化シグナルが挙げられる。したがって、本発明は、遺伝子組換えされたコートタンパク質をコードする核酸配列に作動可能に連結された調節要素を含むベクターを提供する。当業者は、好適な調節要素の選択は、遺伝子組換えされたコートタンパク質の発現のために選ばれた宿主細胞に依存し、またそのような調節要素は、細菌、真菌、ウイルス、哺乳動物もしくは昆虫の遺伝子を含む、種々のソース由来であり得ることを理解するだろう。
【0118】
本発明の文脈では、発現ベクターは、発現されたタンパク質の精製を促進する異種核酸配列をさらに包含してもよい。該異種核酸配列の例としては、これらに限定されないが、金属親和性タグ、ヒスチジンタグ、アビジン/ストレプトアジビンをコードする配列、グルタチオン−S−トランスフェラーゼ(GST)をコードする配列及びビオチンをコードする配列等の親和性タグが挙げられる。該核酸の発現に対応するアミノ酸は、当該技術分野で公知の方法にしたがって、用いる前に発現されたコートタンパク質から除去され得る。代替的に、異種核酸配列の発現に対応するアミノ酸は、それらがその後のVLP内への集合を妨げない場合、コートタンパク質上で保たれてもよい。
【0119】
本発明の1つの実施形態において、コートタンパク質はヒスチジンタグを付したタンパク質として発現される。ヒスチジンタグは、コートタンパク質のカルボキシ末端又はアミノ末端に位置し得る。
【0120】
発現ベクターは、当該技術分野で公知の様々な方法の1つによって好適な宿主細胞又は組織内に導入され得る。そのような方法は、概してはAusubelら(前掲)に記載されているのを見出すことができ、例えば、組換えウイルスベクターを用いた、安定的な又は一過性のトランスフェクション、リポフェクション、エレクトロポレーション、及び感染が挙げられる。当業者は、コートタンパク質の発現に適切な宿主細胞の選択は、選ばれたベクターに依存するであろうことを理解するだろう。宿主細胞の例としては、これらに限定されないが、細菌、酵母、昆虫、植物及び哺乳動物の細胞が挙げられる。用いられる正確な宿主細胞は本発明にとって重要ではない。コートタンパク質は、原核生物宿主(例、E.コリ、A.サルモニシダもしくはB.スブチリス)又は真核生物宿主(例、酵母類もしくはピキア;哺乳動物細胞、例、COS、NIH、3T3、CHO、BHK、293もしくはHeLa細胞;又は昆虫細胞)において産生され得る。1つの実施形態において、コートタンパク質は原核生物細胞において産生され得る。
【0121】
組換えコートタンパク質は、VLP内に多量体化及び集合することができる。一般に、集合はコートタンパク質を発現する宿主細胞において起こる。VLPは、本明細書に与える実施例の項に記載されるような、標準的な技術により宿主細胞から単離され得る。VLPは、混入した宿主細胞タンパク質もしくはLPS等の他の化合物を除去するために、クロマトグラフィー等の標準的な技術によりさらに精製され得る。本発明の1つの実施形態において、VLPはLPSを除去するために精製される。必要に応じて、コートタンパク質は、タンパク質の同定を確かめるために、インタクトなタンパク質もしくはそのタンパク質分解断片のいずれかを用いて標準的なペプチド配列決定技術により配列決定され得る。
【0122】
親和性ペプチド、タンパク質もしくはドメインに取り付けられた組換えコートタンパク質及びコートタンパク質は、標準的な技術によって、VLP内に多量体化及び自己集合する能力について解析され得る。例えば、電子顕微鏡により精製タンパク質を視覚化することによる(例えば、実施例7参照)。VLPの形成はまた、超遠心分離法により測定されてもよく、並びに円偏光二色性(CD)分光分析は、組換えもしくは修飾タンパク質の二次構造をWTウイルスと比較するために用いられてもよい(例えば、実施例7参照)。
【0123】
VLPの安定性は、必要に応じて、当該技術分野で公知の技術、例えば、SDS−PAGE及びプロテイナーゼK分解解析により測定され得る。本発明の1つの実施形態にしたがって、本発明のPapMV VLPは上昇した温度において安定であり、室温で容易に保管され得る。
【0124】
本発明の1つの実施形態において、コートタンパク質は、宿主細胞において集合してウイルスもしくは偽ウイルスを提供し、並びに核酸及び融合タンパク質を含む感染性ウイルス粒子を作り出すために用いられ得る。これは、感染性ウイルスもしくは偽ウイルス粒子による隣接する細胞の感染並びにそこでの融合タンパク質の発現を可能にし得る。本実施形態において、ウイルスもしくは偽ウイルスを複製するために用いられる宿主細胞は、ウイルスの複製を可能にするであろう、植物細胞、昆虫細胞、哺乳動物細胞もしくは細菌細胞であり得る。本発明の1つの実施形態において、該細胞は、E.コリ等の細菌性細胞である。細胞は、ウイルス様粒子が由来するウイルスのための天然宿主細胞であり得るが、これが必要なわけではない。宿主細胞は、粒子形態(すなわち、核酸及びタンパク質を含む集合した桿状)のウイルスもしくは偽ウイルスで、最初に感染させ得るか、あるいは最初の感染に用いられるウイルス核酸が複製して、融合タンパク質を有するウイルス粒子全体の産生を引き起こすことができる限り、核酸状態(すなわち、ウイルスRNAなどのRNA;cDNAもしくはcDNAから作製された流出転写物)で最初に感染され得る。
【0125】
親和性部分が、VLPへの集合の後、コートタンパク質に化学的に取り付けられ得る場合、親和性部分は、PapMVに関して上述したとおり、種々の化学的方法によって結合され得る。
【0126】
aPapMV又はaVLPへの抗原の複合体化
抗原は、該抗原をaPapMV又はaVLPに接させることにより、aPapMV又はaVLPに複合体化され得る。複合体化は、例えば、水素結合、イオン結合、疎水性相互作用もしくはファンデルワールス相互作用といった少なくとも1つの非共有化学結合によって起こり得る。親和性部分への抗原の共有結合もまた、意図される。
【0127】
複合体化は、例えば、撹拌の有無に関わらず溶液中で抗原とaPapMV又はaVLPとを単純に混合することにより、達成され得る。上述の通り、当該技術分野で公知のように、適切な化学剤を該混合液に加えて、aPapMVもしくはaVLPと抗原との間の共有結合の形成を誘導し、それによりaPapMVもしくはaVLPと抗原との間の取り付けの強さを改善することができる。複合体化されたの後、あらゆる複合体化されなかった抗原及び/又はaPapMVもしくはaVLP及び/又は架橋剤(単数もしくは複数)は、標準的な技術、例えば、複合体化されなかったパートナーからより大きなタンパク質を単離する、クロマトグラフィーゲルろ過技術を用いて、必要に応じて除去され得る。超遠心分離法もまた、aPapMV/aVLP及び複合体化された複合体から抗原を分離するために用いられ得る。
【0128】
抗原:aPapMV/aVLPの最適比は、当業者により容易に決定され得る。例えば、重量:重量ベース(basis)で、約10:1から1:10の間の抗原:aPapMV/aVLPの比が、有用であり得る。1つの実施形態において、重量:重量ベースで約9:1から1:9の間の抗原:aPapMV/aVLPの比が、ACASを形成するために用いられる。別の実施形態において、重量:重量ベースで約8:1から1:8の間の抗原:aPapMV/aVLPの比が、ACASを形成するために用いられる。他の実施形態において、重量:重量ベースで約7:1から1:7、約6:1から1:6、約5:1から1:5の間の抗原:aPapMV/aVLPの比が、ACASを形成するために用いられる。
【0129】
aPapMVもしくはaVLPがその標的抗原に結合する能力は、例えば、フローサイトメトリー(例えば、Morin ら、 2007, J. Biotechnology, 128: 423-434参照)、電子顕微鏡、超遠心分離法を用いたプルダウンアッセイ又はELISA型アッセイ(本明細書に与えた実施例参照)といった標準的技術により、測定され得る。
【0130】
有効性の評価
上述の通り、本発明のACASは、動物において免疫応答を誘導することができる。免疫応答は、体液性応答、細胞性応答もしくは体液性及び細胞性応答の組み合わせであり得る。本発明のACASが動物において免疫応答を誘導する能力は、以下及び実施例中に記載するように、当業者公知の方法により試験され得る。例えば、ACASは好適な動物モデルに対して、例えば皮下注射によりもしくは鼻腔内に投与され得、並びに例えばELISAにより、抗体の進展が評価された。
【0131】
細胞性免疫応答もまた、当該技術分野で公知の標準的な技術により評価され得る。例えば、細胞性免疫応答は、インビトロ及びインビボにおいて、樹状細胞により、aPapMV又はaVLPに複合体化した抗原の、特異的Tリンパ球に対するプロセシング及び交差提示を評価することにより測定され得る。細胞性免疫(Tリンパ球)の誘導を評価するための他の有用な技法としては、例えば、サイトカインの誘導をモニターするためのELISA(例えば、Leclerc, D., et al., J. Virol, 2007, 81(3):1319-26)により、T細胞増殖及びIFN−γ分泌放出をモニタリングすることが挙げられる。
【0132】
本発明のACASのワクチンとしての有効性を評価するために、チャレンジ研究が行われ得る。そのような研究は、標準的な方法による、本発明のACASでの実験動物(マウス等)の群の接種を伴う。非接種動物及び/又は市販のワクチンで接種された動物を含む対照群、あるいは他の陽性対照を並行して用意する。免疫後の適切な期間の後、動物を適切な病原体、アレルゲンなどを用いてチャレンジする。次いで、接種前及び後並びにチャレンジ後の動物から採取した血液サンプルを、抗体応答について解析する。抗体応答のための好適な試験としては、これらに限定されないが、ウエスタンブロット解析及び酵素結合免疫測定法(ELISA)が挙げられる。動物はまた、抗原を含有する物質もしくは生物に関する条件の進展についてモニターされ得る。
【0133】
同様に、腫瘍関連抗原を含むACASは、実験動物の接種、及び、例えば皮下的に、動物内に癌細胞を移植することによるその後のチャレンジ、並びに該動物内での腫瘍の成長のモニタリングによって、その予防効果について試験され得る。代替的に、腫瘍関連抗原を含むACASの治療的効果は、癌細胞の移植及び腫瘍の確立の後、実験動物にACASを投与し、その後で腫瘍の増殖及び/もしくは転移をモニタリングすることにより、試験され得る。
【0134】
免疫原性組成物
本発明は、1以上の本発明のACASを1以上の非中毒性の薬学的に許容できる担体、希釈剤及び/又は賦形剤と共に含む、免疫原性組成物を提供する。そのような組成物は、例えば、疾病もしくは疾患の予防及び/又は治療のためのワクチンもしくは免疫賦活剤として用いられるのに好適である。必要に応じて、他の活性成分、アジュバント及び/もしくは免疫賦活剤を、該組成物に含めてもよい。したがって、本発明の1つの実施形態において、免疫原性組成物は、1以上のPapMV、VLP、aPapMVもしくはaVLPと共に、1以上のACASを含んでもよい。
【0135】
免疫原性組成物は、種々のルートにより投与するために処方され得る。例えば、組成物は、経口、局所、直腸もしくは非経口投与又は吸入もしくは噴霧による投与のために処方され得る。本明細書内で用いられる用語、非経口的には、皮下接種、静脈内、筋肉内、くも膜下腔内、胸骨内投与又は点滴手法が含まれる。本発明の1つの実施形態において、組成物は、局所、直腸もしくは非経口投与又は吸入もしくは噴霧による投与のために処方され得る。別の実施形態において、組成物は非経口投与のために製剤化される。
【0136】
免疫原性組成物は、好ましくは、有効量の1以上の本発明のACASを含む。本明細書内で用いられる用語「有効量」は、動物において検出可能な免疫応答を産み出すために必要とされるACASの量を言う。所与の兆候に対するACASの有効量は、例えば、細胞培養アッセイ、又は動物モデル、通常、げっ歯類、ウサギ、イヌ、ブタもしくは霊長類のいずれかにおいて最初に推定され得る。動物モデルはまた、適切な濃度範囲及び投与ルートを決定するためにも用いられ得る。そのような情報は、次いで、ヒトを含む治療される動物における投与のための有効投与量及びルートを決定するために用いられ得る。本発明の1つの実施形態において、単位用量は、約10μgから約10mgの間のコートタンパク質を含む。別の実施形態において、単位用量は、約10μgから約5mgの間のコートタンパク質を含む。さらなる実施形態において、単位用量は、約40μgから約2mgの間のコートタンパク質を含む。1以上の用量が、動物を免疫するために用いられてもよく、また1以上の用量が、同日又は数日もしくは数週間に渡って投与されてもよい。
【0137】
上述の通り、本発明のACASは、複数の抗原を含んでもよく、並びにしたがって、単一のACASが多価ワクチン製剤を提供し得る。多価ワクチンはまた、疾病又は疾患惹起薬剤の群の様々な異なるメンバーの間で保存されている、抗原を含むACASの使用を通じて提供され得る。各ACASが異なる抗原を含んでいる、複数のACASを含む多価ワクチン組成物もまた、意図されている。多価ワクチンは、例えば、1より多くの細菌、ウイルス、菌類、原生生物、寄生虫、癌、自己免疫疾患もしくはアレルゲンに対する防御を提供するため、又はこれらの疾病もしくは疾患惹起薬剤の組み合わせに対する防御を提供するために、有用である多価ワクチン製剤処方としては、より高い価数を有するワクチンに加えて、二価及び三価製剤が挙げられる。本発明の1つの実施形態は、多価ワクチンを提供する。本発明の別の実施形態は、複数の疾病又は疾患惹起薬剤に渡って保存された抗原を含む多価ワクチンを提供する。さらなる実施形態は、各ACASが異なる抗原を含んでいる、複数の(即ち2以上の)ACASを含む多価ワクチンを提供する。
【0138】
各ACASが異なる抗原を含んでいる、複数の(即ち2以上の)ACASを含むワクチン製剤処方はまた、該製剤中のエピトープがより多いことによる改善された防御を提供し得る。したがって、本発明の1つの実施形態は、各ACASが異なる抗原を含んでいる、2以上のACASを含むワクチン製剤を提供する。別の実施形態において、各ACASが同一の疾病又は疾患惹起薬剤由来の異なる抗原を含んでいる、少なくとも2つのACASを含むワクチン製剤を提供する。別の実施形態において、各ACASが疾病又は疾患惹起薬剤の異なる部分を含んでいる、少なくとも2つのACASを含むワクチン処方を提供する。
【0139】
経口使用のための組成物は、例えば、錠剤、トローチ剤、ロゼンジ、水性もしくは油性の懸濁液、分散性粉末もしくは顆粒剤、エマルションの硬もしくは軟カプセル剤、又はシロップもしくはエリキシル剤として製剤化され得る。そのような組成物は、医薬組成物の製造のために当業者に公知の標準的な方法にしたがって調製され得、並びに、薬剤的に的確で、かつ口当たりのよい調製を提供するために、甘味剤、香料剤(flavouring agents)、着色剤(colouring agent)及び保存剤からなる群より選ばれる1以上の剤を含有してもよい。錠剤は、例えば、炭酸カルシウム、炭酸ナトリウム、ラクトース、リン酸カルシウムもしくはリン酸ナトリウム等の不活性希釈剤;コーンスターチもしくはアルギン酸等の造粒剤及び崩壊剤;デンプン、ゼラチンもしくはアカシア等の結合剤、並びにステアリン酸マグネシウム、ステアリン酸もしくはタルク等の平滑剤を含む、好適な非中毒性の、薬学的に許容される賦形剤との混合物中にACASを含む。錠剤はコーティングされていなくてもよく、又は、消化管内での崩壊及び吸収を遅らせるために公知の技術によりコーティング被膜されていてもよく、その結果、より長い期間に渡る持続性作用を提供する。例えば、モノステアリン酸グリセリン(glyceryl monosterate)又はジステアリン酸グリセリル等の時間遅延物質が用いられ得る。
【0140】
経口使用のための組成物もまた、ACASが、例えば、炭酸カルシウム、リン酸カルシウムもしくはカオリンといった、不活性固形希釈剤と混合された、硬ゼラチンカプセルとしてあるいは、活性成分が、水又はピーナッツ油、流動パラフィンもしくはオリーブ油等の油媒体と混合された、軟ゼラチンカプセルとして提供され得る。
【0141】
水性懸濁液として製剤化された組成物は、例えばカルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシプロピルメチルセルロース(hydropropylmethylcellulose)、アルギン酸ナトリウム、ポリビニルピロリドン、ヒドロキシプロピル−β−シクロデキストリン、トラガントゴム及びアカシア等の懸濁剤;天然に存在するホスファチ(例、レシチン)、又はアルキレンオキシドと脂肪酸との縮合物(例、ポリオキシエチレンステアリンエテアラート)、又はエチレンオキシドと長鎖脂肪族アルコールとの縮合物(例、ヘプタ−デカエチレンオキシセタノール)、又は、エチレンオキシドと脂肪酸及びヘキシトール由来の部分エステルとの縮合物(例、ポリオキシエチレンソルビトールモノオレエート)、又は、エチレンオキシドと脂肪酸及び無水ヘキシトール由来の部分エステルとの縮合物(例、ポリエチレンソルビタンモノオレエート)、等の分散剤又は湿潤剤、1以上の好適な賦形剤との混合物中にACASを含有する。水性懸濁液もまた、1以上の保存料(例、エチルもしくは、n−プロピル p−ヒドロキシ−ベンゾエート)、1以上の着色剤(colouring agents)、1以上の香料剤(flavouring agents)もしくはスクロース又はサッカリン等の1以上の甘味剤を含有してもよい。
【0142】
組成物は、植物油(例、ラッカセイ油、オリーブ油、ゴマ油もしくはココナッツ油)中、又は流動パラフィン等の鉱油中のACASを懸濁することにより油性懸濁液として製剤化され得る。油性懸濁液は、増粘剤(例、蜜ろう、固形パラフィンもしくはセチルアルコール)を含有してもよい。口当たりのより経口剤を提供するために上に説明したような甘味剤、及び/又は香料剤(flavouring agents)を添加してもよい。これらの組成物は、アスコルビン酸等の酸化防止剤の添加により保存され得る。
【0143】
免疫原性組成物は、後に、水の添加により水性懸濁液を調製するために用いられ得る、分散性粉末もしくは顆粒剤として製剤化され得る。そのような分散性粉末もしくは顆粒剤は、1以上の分散剤もしくは湿潤剤、懸濁剤及び/又は保存料との混合物中のACASを提供する。好適な分散剤もしくは湿潤剤及び懸濁剤は、既に上述したものにより例示される。追加の賦形剤(例、甘味剤、香料剤及び着色剤)もまた、これら組成物に含まれ得る。
【0144】
本発明の免疫原性組成物はまた、オイルインウォーターエマルションとして製剤化され得る。油相は、植物油(例、オリーブ油もしくはラッカセイ油)、もしくは鉱油(例、流動パラフィン)であり得、もしくはこれらの油の混合物であってもよい。これらの組成物に組み込むために好適な乳化剤としては、天然に存在するガム(例、アカシアゴムもしくはトラガントゴム);天然に存在するリン脂質(例、ダイズ、レクチン);又は脂肪酸及びヘキシトール、無水物に由来するエステルもしくは部分エステル(例、ソルビタンモノオレエート)、並びに該部分エステルのエチレンオキシドとの縮合物(例、ポリオキシエチレンソルビタンモノオレエート)が挙げられる。エマルションもまた、必要に応じて、甘味剤及び香味料を含有し得る。
【0145】
組成物は、ACASを1以上の甘味剤(例、グリセロール、プロピレングリコール、ソルビトールもしくはスクロース)とあわせることにより、シロップもしくはエリキシル剤として製剤化され得る。そのような製剤としては、必要に応じて、1以上の粘滑薬、保存料、香料剤及び/又は着色剤を含有し得る。
【0146】
免疫原性組成物は、当該技術分野で公知の方法にしたがって、及び、上述したような好適な1以上の分散剤もしくは湿潤剤及び/又は懸濁剤を用いることにより、無菌注射用の水性もしくは油性懸濁液として製剤化され得る。無菌注射用製剤は、非中毒性で非経口的に許容される希釈液もしくは溶媒に中の無菌注射用溶液もしくは懸濁液、例えば1,3−ブタンジオール溶液であり得る。使用され得る許容されるビヒクル及び溶媒としては、これらに限定されないが、水、リンガー溶液、乳酸リンガー溶液及び等張塩化ナトリウム溶液が挙げられる。他の例としては、溶媒もしくは懸濁媒体剤として従来より使用される、無菌の固定油、及び例えば、合成のモノもしくはジグリセリドを含む、様々な無菌性固定油が挙げられる。オレイン酸等の脂肪酸もまた、注射剤の調製に用いられ得る。
【0147】
必要に応じて、本発明の組成物は、抗菌剤、酸化防止剤、キレート剤、及び不活性ガス等の保存料及び/又は炭水化物(例、ソルビトール、マンニトール、デンプン、スクロース、グルコース、もしくはデキストラン)等の安定剤、タンパク質(例、アルブミンもしくはカゼイン)又はタンパク質含有剤(例、ウシ血清もしくはスキムミルク)を好適なバッファ(例、リン酸バッファ)と共に含有してもよい。組成物の様々な成分のpH及び正確な濃度は、周知のパラメータにしたがって調整されてもよい。
【0148】
さらに、アジュバント活性を有する1以上の化合物が、必要に応じてワクチン組成物に添加されてもよい。好適なアジュバントとしては例えば、(水酸化アルミニウム、リン酸アルミニウムもしくは酸化アルミニウム;オイルエマルション(例、バイオールF(登録商標)のエマルションもしくはマルコール52(登録商標)のエマルション);サポニン、又はビタミンE可溶化物(solubilisate)が挙げられる。これらの免疫活性化作用に起因して、PapMVもしくはPapMV VLP(aPapMV及びaVLPを含む)はまた、必要に応じて、アジュバントとして免疫原性組成物に添加され得る。オプソニン化ワクチン組成物もまた、本発明により包含され得る(例、前もってワクチンで免疫された動物もしくはヒトから単離された抗体を含む、ワクチン組成物)。前もってワクチンで免疫された動物もしくはヒトから単離された抗体に基づく組換え抗体もまた、ワクチン組成物をオプソニン化するために用いられ得る。
【0149】
本発明のACASを含む組成物と市販のワクチンとの組み合わせもまた、本発明に包含される。
【0150】
他の医薬組成物及び医薬組成物を調製する方法は、当該技術分野で公知であり、例えば、”Remington:The Science and Practice of Pharmacy" (かつての"Remingtons Pharmaceutical Sciences"); Gennaro, A., Lippincott, Williams & Wilkins, Philadelphia, PA (2000)に記載されている。
【0151】
ACASの使用
本発明は、ACASの多くの適用及び使用並びにそれを含む免疫原性組成物を提供する。本発明の1つの実施形態は、例えばアジュバント、免疫賦活物質、免疫賦活剤もしくはワクチンとして投与されたときに、動物において免疫応答を誘導するためのACASの使用を提供する。免疫応答は、体液性応答、細胞性応答、又はその両方であってもよい。本発明の1つの実施形態において、ACASは、動物における体液性応答を誘導することができる。別の実施形態において、ACASは、動物における細胞性応答を誘導することができる。さらなる実施形態において、ACASは、動物において細胞傷害性Tリンパ球(CTL)応答を誘導することができる。別の実施形態において、ACASは、動物において体液性及び細胞性応答の両方を誘導することができる。
【0152】
本発明はまた、aPapMVもしくはaVLPに複合体化された抗原(単数もしくは複数)に結合できる抗体を選択するためのACASの使用を提供する。本発明は、アジュバント、免疫増強剤、免疫賦活剤、ワクチン及び/又は医薬組成物等の、診断及び薬剤の調製のための組成物の使用をさらに提供する。
【0153】
したがって、本発明のACASは、免疫応答の誘導を必要とする動物における疾病もしくは疾患の予防を含めた治療における使用に好適である。疾病又は疾患の性質に応じて、治療は、体液性免疫応答、細胞性免疫応答もしくはその両方の誘導を必要とし得る。例えば、特定の感染は、単に動物における体液性応答の誘導により効果的に予防され得、一方、他の疾病に対する完全な防御は、体液性及び細胞性応答の両方の誘導を必要とするかもしれない。例としては、体液性応答を誘導するワクチンは、腸チフス、狂犬病、ポリオ、コレラ、髄膜炎(ナイセリア・メニンギティディス(Neisseria meningitides)に起因する)、B型肝炎、ヒトメタニューモウイルス(metapheumovirus)及びインフルエンザのいくつかの種に対して効果的であり得る。他の疾病又は疾患に対する防御は、細胞性応答も誘導された場合に、最も効果的である(例、C型肝炎、マラリア、森林型熱帯リーシュマニア感染、HIV及びヒト結核菌感染)。
【0154】
したがって、本発明は、疾病もしくは疾患の予防を含めた治療のための単剤としてのACASの使用、並びに、より複雑な免疫応答を必要とする疾病/疾患のための、併用ワクチンの成分もしくは治療としてのACASの使用を提供する。そのような併用としては、例えば、追加ワクチン、アジュバント及び/又は抗原を挙げることができる。この文脈では、ACASは、治療されている動物における免疫応答を強めるための免疫賦活剤もしくはアジュバントとして作用し得る。ACASもまた、二次ワクチンの投与前の免疫系を刺激するために用いられ得る。したがって、この文脈でのACASの投与は、二次ワクチン、アジュバントもしくは抗原の投与の前、後もしくは同時に起こり得る。
【0155】
本発明のACASは、ヒト並びに家畜(domestic)及び家畜(farm animals)を含む、非ヒト動物における使用に好適である。組成物についての投与方針は、任意の他の一般に認められた免疫計画と異なる必要はない。例えば、上述の通り、効果的な免疫応答を誘発するのに十分な量のACASの単回投与を、用いてもよく、あるいは、ACASの初回投与に続き抗原単独もしくはACASで追加免疫する、他の方針が用いられ得る。同様に、ACASもしくは抗原のいずれかによる追加免疫を時々起こして、初回投与後に抗体価が許容されるレベルを下回る場合にうまくいくようにしてもよい。ACASの投与の正確な方法は、例えばACASの構成成分、治療され得る動物及び治療の望ましい最終的な効果に依存するだろう。投与の適切な方法は、当業者により容易に決定され得る。
【0156】
該方針が、ACAS及び追加抗原(単数もしくは複数)の投与を含む場合、免疫応答が求められる対象の必要性に応じてACAS構成成分は、抗原(単数もしくは複数)と同時に投与され得、又は抗原(単数もしくは複数)の投与の前もしくは後に投与され得る。
【0157】
本発明の1つの実施形態は、従来のワクチンとの複合体化における本発明のACASの使用を提供する。本実施形態によれば、ACASは従来のワクチンと同時に投与されてもよく(例、2つの組成物をあわせることによる)、又は従来のワクチンの投与の前もしくは後に投与され得る。
【0158】
本発明のACASは、予防的に用いられ得(例、ウイルス、細菌もしくは他の感染粒子による感染、又は腫瘍の進行を予防するため)、又は、感染、自己免疫もしくはアレルギー反応、薬物添加もしくは癌に関連する疾病もしくは疾患の影響を寛解させるために治療的に用いられてもよい。本発明の1つの実施形態において、ACASは、動物における疾病もしくは疾患を予防するために予防的に用いられる。ACASが投与される動物は、ヒト又は、ウシ、ブタ、ウマ、ヤギ、ヒツジ、イヌ、ネコ、ニワトリ、アヒル、シチメンチョウ、非ヒト霊長類、モルモット、ウサギ、フェレット、ラット、ハムスター、マウス、魚類もしくは鳥類等の非ヒト動物であってもよい。
【0159】
上述の通り、本発明のACASは、例えば、病気を治療するための活性化を必要とする経路、及び組成物に似含めるため又は組成物と使用するために選ばれた抗原に応じて、種々の疾病もしくは疾患の予防もしくは治療において用いられ得る。限定されない例としては、インフルエンザ(種々のインフルエンザウイルス由来の抗原を用いて)、腸チフス(S.チフィ由来の抗原を用いて)、HCV感染(HCV抗原を用いて)、HBV感染(HBV抗原を用いて)、HAV感染(HAV抗原を用いて)、デルタ肝炎(HDV抗原を用いて)、E型肝炎ウイルス(HEV抗原を用いて)、G型肝炎ウイルス(HGV抗原を用いて)、単純ヘルペスウイルス(HSV抗原を用いて)、水痘帯状疱疹ウイルス(VZV抗原を用いて)、エプスタイン・バー・ウイルス(EBV抗原を用いて)、サイトメガロウイルス(CMV抗原を用いて)、他のヒトヘルペスウイルス(例えば、HHV6もしくはHHV7抗原を用いて)、HIV感染(HIV抗原を用いて)、ポリオ(ポリオウイルス抗原を用いて)、ジフテリア(ジフテリア毒素由来の抗原を用いて)、アレルギー反応(種々のアレルゲンを用いて)及び癌(種々の腫瘍関連抗原を用いて)が挙げられる。他の使用としては、例えば炎症性疾患(例えば、関節炎)の予防もしくは治療並びに、鳥インフルエンザウイルス、ヒト呼吸器合胞体ウイルス、デングウイルス、麻疹ウイルス、ヒトパピローマウイルス、仮性狂犬病ウイルス、ブタロタウイルス、ブタパルボウイルス、ニューカッスル病ウイルス、口蹄疫ウイルス、ブタコレラウイルス、アフリカブタ熱ウイルス、ウシ感染性鼻気管炎ウイルス、感染性喉頭気管炎ウイルス、ラクロスウイルス、新生仔ウシの下痢ウイルス、ウシ呼吸器合胞体ウイルス、ウシウイルス性下痢ウイルス、マイコプラズマ・ハイオニューモニエ、連鎖球菌性細菌、淋菌性細菌、腸内細菌及び寄生虫による感染(例えば、リーシュマニアもしくはマラリア)が挙げられる。
【0160】
本発明もまた、「自己」遺伝子産物に起因するかもしくはこれにより悪化する疾病もしくは疾患を予防及び/又は弱毒化する抗体を産生するためのACASの使用を提供する。そのような疾病もしくは症状の例としては、移植片対宿主病、IgE介在アレルギー反応、アナフィラキシー、成人呼吸促迫症候群、クローン病、アレルギー性喘息、急性リンパ性白血病(ALL)、糖尿病、非ホジキンリンパ腫(NHL)、グレーブス病、全身性エリテマトーデス(SLE)、炎症性自己免疫疾患、重症筋無力症、免疫増殖性疾患リンパ節症(immunoproliferative disease lymphadenopathy)(IPL)、血管免疫増殖性リンパ節症(AIL)、免疫芽球性リンパ節症(IBL)、関節リウマチ、糖尿病、多発性硬化症、アルツハイマー病、骨粗鬆症、並びに、リウマチ熱、デング熱、ライム病染を含む特定の感染、及び感染性多発性関節炎に関連する自己免疫症状が挙げられる。
【0161】
本発明は、ホルモン、薬物及び毒性化合物等の化合物に対する免疫応答を刺激するACASの使用をさらに提供する。様々な薬物、ホルモン及び毒性化合物に対する免疫応答は、該化合物に曝露された個体における治療として、該化合物への曝露の危険性がある個体を防御するため、又は該化合物に対する中毒を予防もしくは治療するために用いられる。
【0162】
本発明もまた、例えば、ACASに複合体化する抗原に対する抗体をスクリーニングするための、スクリーニング剤としての、ACASの使用を提供する。ACASは、酵素結合免疫測定法(ELISA)又はウエスタンブロット等の従来の免疫学的技術に対して容易に適応し得、したがって診断及び研究の文脈において有用である。
【0163】
キット
本発明は、1以上のACASを含む薬学的キットをさらに提供する。キットの個々の構成要素は、別々の容器中に包装され、医薬品もしくは生物学的製品の製造、使用又は販売を規制する行政機関により定められた形態の表示がそのような容器に関連付けられてもよく、ここで該表示は、製造、使用又は販売の該機関による承認を反映したものである。キットは、必要に応じて、ACASの使用方法もしくは投与計画の概要を述べた指示書もしくは説明書を包含してもよい。
【0164】
キットの1以上の構成要素が溶液として提供される場合(例、水溶液もしくは滅菌水溶液)、容器手段は、それ自体が、そこから溶液が対象に投与され得るか、又はキットのほかの構成要素に適用されて混合され得る、吸入器(inhalant)、シリンジ、ピペット、点眼器又は他のそのような器具であってもよい。
【0165】
キットの構成要素はまた、乾燥又は凍結乾燥形態で提供されてもよく、並びにキットは、凍結乾燥成分の再構成のための好適な溶媒を含有し得る。容器の数もしくは種類に関係なく、本発明のキットもまた、患者に対する組成物の投与を補助するための装置を含んでもよい。そのような装置は、吸入器(inhalant)、シリンジ、ピペット、鉗子、計量スプーン、点眼器もしくは類似の医学的に承認された送達媒体であり得る。
【0166】
抗体検出における使用のための、1以上の本発明のACASを含有するスクリーニングキットも、提供される。キットは、診断キット又は研究目的のために意図されたキットであり得る。キットの個々の構成要素は、別々の容器中に包装され、医薬品もしくは生物学的製品の製造、使用又は販売を規制する行政機関により定められた形態の表示がそのような容器に関連付けられてもよく、ここで該表示は、製造、使用又は販売の該機関による承認を反映したものである。キットは、必要に応じて、ACASの使用方法もしくは投与計画の概要を述べた指示書もしくは説明書を包含してもよい。
【0167】
以下の実施例は、本明細書内に記載した本発明のより良い理解を得るために示している。これらの実施例は、本発明の例示的な実施形態を記載することを意図しており、いかなる意味でも本発明の範囲を限定することは意図していない。
【実施例】
【0168】
実施例1:PapMVのアジュバント効果
PapMVの精製
モザイク病の症状を示す感染したパパイヤの葉から分画遠心法により、PapMVを精製した。感染した葉(100g)を10mM EDTA含有100mL 50mM Tris−HCl中で、市販のブレンダー内で粉砕した。粉砕した葉をチーズクロスに通してろ過し、1%のトリトンX−100をろ液に添加し、ろ液を穏やかに10分間撹拌した。ろ液の4分の1の量に等しい量までクロロホルムを滴下した。溶液をさらに30分間4℃で撹拌し、10000gで20分間遠心分離し、沈殿を除去した。上清を、120分間の高速(100000g)遠心分離に供した。ウイルスペレットを懸濁し、スクロースクッション(30% スクロース)を通した、100000gで3.5時間の別の高速遠心分離に供した。最終ウイルスペレットを、10mLの50mM Tris(pH8.0)に懸濁した。色が持続した場合、クロロホルムで追加の清澄を行った。精製したウイルスを、超遠心分離法により回収した。
【0169】
抗原
LPSフリーOVAグレードVIを、Sigma-Aldrich Chemical Co, St Louis, MOから購入した。ニワトリ卵白リゾチーム(HEL)をResearch Organics Inc. Cleveland, OHから購入した。E.コリO111:B4由来のLPSをSigma-Aldrich, St Louis, MOから購入した。
【0170】
免疫
BALB/cマウス、6−8週齢を、メキシコ国立自治大学(UNAM)、医学部、実験的医薬研究部門の動物施設下で飼育及び維持し、優良実験室規範のガイドラインにしたがって世話をした。アジュバントの効果を調べるために、マウスの群を、2mgのOVAもしくはHEL単独で、又は30mgのPapMV、CFA1:1(v/v)、もしくは5mgのE.コリO111:B4由来のLPS(Sigma-Aldrich)と共に、0日目に腹腔内に免疫した。対照マウスに食塩溶液のみを注射した。図2に示すように、種々の時間において、血液試料を逆眼窩血脈洞から採取した。個々の血清試料を、解析まで−20℃で保管した。3匹のマウスを各実験に用いた。
【0171】
ELISAによる抗体価の測定
高結合96ウェルポリスチレンプレート(Highpbinding 96-well polystyrene plates)(Corning(登録商標), New York, NY)を、0.1M 炭酸塩−重炭酸塩バッファ(pH9.5)中の1mg/mLのPapMV、100mg/mLのHEL、又は150mg/mL OVAでコートした。プレートを1時間37℃で、次いで終夜4℃でインキュベートした。翌朝使用する前に、プレートを0.05% Tween−20含有PBS(pH7.2)(PBS−T)(Sigma-Aldrich)で3回洗浄した。非特異的結合を、PBSで希釈した5%脱脂粉乳(PBS−M)で1時間、37℃でブロックした。洗浄の後、マウス血清をPBS−Mで1:40に希釈し、2倍の段階希釈液をウェルに添加した。プレートを1時間37℃でインキュベートし、次いで、PBS−Tで4回洗浄したペルオキシダーゼ抱合ウサギ抗マウスIgM(最適希釈1:1000)IgG、IgG1、IgG2a、IgG2b抗体(Zymed, San Francisco, CA)又はIgG3(最適希釈1:3000)(Rockland, Gilbertsville, PA)を添加し、プレートを1時間37℃でインキュベートし、PBS−Tで3回洗浄した。30% 過酸化水素を含有する0.1M クエン酸バッファ(pH5.6)中のオルトフェニレンジアミン(0.5mg/mL;Sigma-Aldrich)を、酵素基質として用いた。反応を2.5N H2SO4で停止し、BIOLINX 2.22ソフトウェアを備えた自動ELISAプレートリーダー(Dynex Technologies MRII, Chantilly, VA, USA)を用いて、490nmにおける吸光度を測定した。抗体価は、−log2希釈×4として与えられる。陽性の力価は、陰性対照の平均値よりの3SD高いものとして定義した。
【0172】
結果
アジュバントが低免疫原性ワクチンに対して共投与される場合の、抗体応答への自然免疫応答の転換を観察した。アジュバントは、抗原に対する抗体もしくは細胞性免疫応答を強化又は増強することができる。PapMVが、他の抗原に対する長期に渡る抗体応答を促進し得るアジュバントであるかどうかを判定するために、BALB/cマウスを、OVA又はHELを、単独又は以下のアジュバント:PapMV、CFAもしくはLPSと共にのいずれかで免疫した。OVA又はHELに特異的なIgG抗体価は、ELISAにより、示したタイムポイントにおいて測定した(図2A及びB)。PapMVのアジュバント効果は、免疫した動物におけるOVA及びHELに対する総IgG応答で見られた。PapMVにより誘導されたアジュバント効果は、免疫後30日目のHELに関して見られ、その時、HEL単独により増加した抗体価と比較して、抗体価が8倍になった。抗体価におけるこの差異は、120日目までは維持されたが、400日目までは維持されなかった(図2A)。LPSは、免疫後最初の30日間においてのみアジュバント効果を誘導したが、CFAは、免疫後8日目から実験終了の400日目までが、最も強いアジュバント効果を示した(図2A)。OVAでの免疫について、総IgG抗体価におけるアジュバント効果が、最初の免疫後120日目までにのみ見られ、その後抗体価は時間と共に減少し、400日目にはOVAと比較すると4倍の高さであった(図2B)。OVA及びOVAとアジュバントとの共免疫(PapMVは総IgG応答においてアジュバント効果を示さなかった)により、どのIgGサブクラスが誘導されたかを同定するために、20日目にさらなる解析を行った。PapMV、LPS、及びCFAは、OVA特異的UgG2a及びIgG2b抗体価を誘導し、一方ではOVA単独が、IgG1特異的抗体価のみを誘導した(図2C−E)。OVAが使用されるアジュバントのいずれかと共免疫される場合、IgG1に対するアジュバント効果は見られなかった。これらの結果は、PapMV、LPS、及びCFAが、OVAに対するIgGサブクラス応答においてアジュバント効果を誘導することを示す。さらに、PapMVは、モデル抗原に対する特異的抗体価の長期に渡る増加を誘導する、アジュバント特性を示す。総合すると、これらのデータは、PapMVが、観察された、抗原特異的である長期に渡る抗体応答への先天性応答の転換を介在し得る、固有のアジュバント特性を有することを示唆する。
【0173】
実施例2:S.チフィポーリンタンパク質の精製
以下の精製手順を、OmpC及びOmpFの精製に用いた。精製手順は、Secundino ら(2006), Immunology 117:59に記載されたものに基づく。
【0174】
2つのタンパク質をS.チフィから共精製した。OmpC及びOmpFの個々の精製は、OmpC[STYC 171 (OmpC-)]又はOmpF[STYF302 (OmpF-)]オープンリーディングフレームが中断された、S.チフィノックアウト変異体を用いて達成した。細菌のノックアウト変異型由来の個々のタンパク質の精製の手順は、共精製の場合にしたがった。本手順を以下に概説する。
【0175】
細菌種、S.チフィ9,12,Vi:d(ATCC 9993)を、酵母エキス、マグネシウム及びグルコースを添加した最少培地A中で、37℃、200rpmで成育した。酵母エキス、マグネシウム及びグルコースを添加した、10L 最少培地Aについての処方は:5.0gの無水クエン酸Na(NaC6H5O7:2H2O)、31.0g 一塩基のNaPO4(NaH2PO4)、70.0g 二塩基のNaPO4(Na2HPO4)、10.0g (NH4)2SO4、200mL 酵母抽出溶液5%(300mL中15.0g)である。1.434L 培地を4Lの三角フラスコに分配した。滅菌を121℃、15lbspression/in2、15分で行った。次いで、各フラスコに(o each flask):6.0mLの滅菌MgSO4溶液 25%及び60.0mLのグルコース溶液 12.5%を添加した。フラスコに、終夜培養のS.チフィを接種し、OD540が1.0に達した時に、培養を停止し、7500rpmで15分間、4℃で培養物を遠心分離した。ペレットを100mL 最終Tris−HCl pH7.7(6.0g Tris塩基/L)で懸濁し、バイオマスを90分間、氷上で超音波処理し、次いで7500rpmで、20分間4℃で遠心分離した。各10mLの上清に:2.77mL MgCl2 1M、25ml RNaseA(10000U/mL)、25ml DNaseA(10000U/mL)を添加した。次いで、混合物を37℃及び120rpmで30分間インキュベートした。
【0176】
混合物からのポーリンの抽出は、まず45000rpmで、45分間4℃で混合物を超遠心分離をし、そして、及びペレットを保持することにより行った。次いで、ペレットを10mL Tris−HCl−SDS 2%に懸濁し、続いてホモジナイズした。次に、インキュベーションことを32℃、120rpm、30分間で行い、混合物を40000rpm、30分間、20℃で(fat)超遠心分離し、ペレットを保持した。ペレットを5mL Tris−HCl−SDS 2%に再懸濁し、続いてホモジナイズ及び32℃、120rpm、30分間のインキュベーションことを行った。40000rpm、30分間、20℃での別の超遠心分離ことを行い、ペレットを保持した。ペレットを、20mL Nikaidoバッファ−SDS 1%に再懸濁し、続いてホモジナイズした。[1LのNikaidoバッファとして:6.0g Tris塩基、10.0g SDS、23.4g NaCl、1.9g EDTAを水に溶解し、pHをpH7.7に調整した。次いで、0.5mL β−メルカプトエタノール溶液を添加した。]次いで、混合物を37℃で、120rpm、120分間インキュベートした。最後に、混合物を40000rpm、45分間、20℃で超遠心分離し、ポーリン抽出物を含有する上清を回収した。
【0177】
ポーリンは、高速タンパク質液体クロマトグラフィー(FPLC)を用いて、上清から精製した。精製工程の間、β−メルカプトエタノールを含まない0.5×Nikaidoバッファ(上記参照)を使用した。タンパク質は、流速:10mL/分でSephacryl S-200 (FPLC WATERS 650 E)を用いて分離した。カラムに22mLの上清をロードした。溶出画分を260nm及び280nmでモニターした。精製ポーリンを含有するメインピークを保持し、4℃で保管した。精製ポーリンは、長期間安定であった(1年以上)。
【0178】
結果
図3Bは、上述の手順により精製された、ポーリン、OmpC及びOmpFのSDS−PAGEのプロファイルを示す。
【0179】
実施例3:OmpC又はOmpFに対する親和性ペプチドを含むPapMV VLPの産生及び遺伝子操作
【0180】
親和性ペプチドの選択
Ph.D-7 Phage Display Peptide Library Kit(New England Biolabs, Inc.)を用いて、精製OmpC及びOmpFに対する特異的ペプチドを選んだ。以下のプロトコルは、「パニング(panning)」として知られるin vitro選択方法であり、これは、製造者のプロトコルにしたがって行った。簡潔に述べれば、2×1011ファージをELISAプレートのウェルの底に結合させた10μgの精製OmpC又はOmpFに添加し、ウェルの内容物を室温で1時間、穏やかに混合した。結合しなかったファージを1mlの200mM グリシン−HCl(pH2.2)を用いて、室温で10分間インキュベーションすることにより溶出した。上清を中和するために、並びにファージが死滅するのを防ぐために、150μlのIM Tris−HCl(pH9.1)を添加した。次いで、溶出したファージを増幅し、結合配列に有利なようにプールを濃縮するための、さらなる結合/増幅サイクルを通じて採取した。ウォッシュバッファはパニングの最初のラウンドのために0.1%のTween−20を含有し、続くラウンドのために0.5%に増やした。各パニングラウンドの間に、選ばれたファージをE.コリER2738中で増幅した。サイクルを3回繰り返し、それぞれのポーリンタンパク質についての最も高い親和性を伴うペプチドを選んだ。このようにして同定されたペプチドを図3に示す。
【0181】
【表3】

【0182】
選ばれた親和性ペプチドに融合された、高結合活性PapMV VLPの遺伝子操作、発現、及び精製
【0183】
各ポーリン、OmpC及びOmpFに対して、1つの親和性ペプチドを、上述のパニング過程において同定されたものより選んだ。対応するDNA配列を、PapMVコートタンパク質(CP)のC末端においてクローン化された。PapMV CP CPΔN5(Tremblay, M-H.,ら、 2006, FEBSJ., 273:14-25)を、テンプレートとして用いた。各選ばれたペプチドをコードしている配列を、PCRを用いて導入し、pET−3D発現ベクター(Stratagene, La Jolla, CA)内にクローン化した。つまり、フォワードオリゴヌクレオチド(配列番号:34;表4)及びオリゴヌクレオチドPapOmpC(配列番号:35;表4)を、PapMV CP遺伝子PapMV CP CPΔN5をテンプレートとするPCR反応に用いた。
【0184】
得られたPCR断片は、PapMV CPのC末端に、ペプチドEAKGLIRの融合を持つ。同一のアプローチを用いて、フォワードオリゴヌクレオチド(配列番号:34;表4)及びオリゴヌクレオチドPapMVOmpF(配列番号:36;表4)を、PCRによるPapMV CPのC末端でのペプチドFHENWPSの融合を導入するために用いた。2つのそれぞれのPCR断片を、制限酵素NcoI及びBamHIで消化し、同一の酵素で消化したpET 3−Dベクター内にクローン化した該ペプチドがPapMV CPを伴うフレーム内にあることを確認するために、クローンを配列決定した。
【0185】
【表4】

【0186】
親和性ペプチドを含む遺伝子操作したPapMV CPを、以前に記載されているようにして、E.コリBL21 RILにおいて発現した(Tremblay, M-H.,ら、 2006, FEBS J., 273:14-25; Secundino ら, 2006, Immunology 1 17:59)。簡潔に述べれば、細菌を、フレンチプレスを通して溶解し、Ni2+カラム上にロードし、10mM Tris−HCl 50mM イミダゾール 0.5% トリトンX100 pH8で、次いで、10mM Tris-HCl、50mM イミダゾール、1% Zwittergent pH8で洗浄し、エンドトキシン混入を除去した。ポーリンを、120分間、Beckman 50.2 TIローターにおける高速遠心分離(100000g)供した。VLPペレットを、エンドトキシンフリーPBS(Sigma)に再懸濁した。タンパク質を、0.45μMフィルターを用いて、使用前にろ過した。タンパク質の純度をSAS−PAGEにより測定した。BCA protein Kit(Pierce)を用いてタンパク質の量を評価した該精製タンパク質中のLPSレベルを、製造者の使用説明書にしたがって(Cambrex)リムルス試験により評価し、0.005エンドトキシンユニット(EU)/μgより低いタンパク質であった。
【0187】
2つのPapMVコートタンパク質の配列を図11に示す(配列番号:6−OmpC親和性ペプチドを含むPapMVコートタンパク質、及び配列番号:7−OmpF親和性ペプチドを含むPapMVコートタンパク質)。野生型と比較して、2つのアミノ酸差異がPapMV OmpCのコートタンパク質の配列において観察され(図11における太字及び下線)、これは恐らくPCR反応の間に導入されたようである。
【0188】
ELISA
各実験のために、10μgのそれぞれの標的タンパク質(OmpC又はOmpF)を用いて、ELISAプレートをコートした。それぞれのPapMV VLPsの増加量を、結合アッセイに用いた。それらの標的のためのVLPの親和性を、PapMV CPに対するポリクローナルマウス抗体及びペルオキシダーゼに結合した二次的抗マウス抗体を用いて明らかにした。
【0189】
結果
親和性ペプチドの選択
ファージ提示を用いて、OmpC又はOmpFに結合する特異的なペプチドを選んだ。OmpCに結合した8つのファージ及びOmpFに結合した5つのファージを配列決定した。これらのペプチドの配列及び発生頻度を表3に示す。ペプチドEAKGLIR[配列番号:10]は、最も高い頻度を示し、したがって、OmpCに対する親和性ペプチドとして選ばれた。ペプチドFHENWPS[配列番号:12]は、OmpFスクリーニングにおいて最も頻繁であり、したがって、OmpFに対する親和性ペプチドとして選ばれた。興味深いことに、7つのうち5つのアミノ酸が同定され、並びに親和性ペプチドにおける同一の位置において発見されていることから、OmpFに対する両方の親和性ペプチドは相同である。
【0190】
高結合活性PapMV VLPの合成
ペプチド配列EAKGLIR[配列番号:10]及びFHENWPS[配列番号:12]をPapMVコートタンパク質のC末端において融合された(図3A)。続いて、融合ペプチドを6×Hで標識し、精製過程を促進した(Tremblay, M-H.,ら、2006, FEBS J., 273:14-25)。組換えコンストラクトをE.コリ内で発現し、Ni2+カラム上の親和性クロマトグラフィーにより精製した。タンパク質は、500mM イミダゾールを用いて溶出し、透析し、100000gで超遠心分離して、VLPをペレット化した(図3B)。電子顕微鏡(EM)観察により、PapMV CPのC末端におけるそれぞれのペプチドの添加は、タンパク質がVLP内に自己集合する能力に影響を与えないことが確認された(図3C)。VLPの長さは、201±80nmの範囲のサイズで様々である。201nmの長さのタンパク質は、反復したつくりでペプチドが存在する560コピーのCPを示す。
【0191】
これらのそれぞれの抗原に対する各PapMV VLPの高結合活性を、ELISA型結合アッセイにより示した。両方のVLP(「PapMV OmpC」及び「PapMV OmpF」)について、それらのそれぞれの抗原への結合が明確に示され、かつ、アッセイにおいて用いたVLPの量と共に増加した(図4A及びB)。したがって、1:1の割合(重量/重量)で溶液中で混合した場合、PapMV VLPは、同種の抗原に結合し、複合体を形成するだろうと想定された。
【0192】
実施例5:親和性に複合体化されたPapMV VLP−OmpC及びPapMV VLP−OmpFによる、S.チフィに対する免疫
【0193】
マウス
メスBALB/cマウス、6−8週齢(Harlan, Mexico or Charles River, Canada)を用いて、メキシコ国立自治大学(UNAM)、医学部、実験的医薬研究部門の動物施設下で維持した。
【0194】
チャレンジアッセイ
外部のアジュバント非存在下で、10μg OmpC、10μg OmpC+10μg PapMV OmpC、10μg OmpF、10μg OmpF+10μg PapMV OmpF、10μg PapMV OmpC、10μg PapMV OmpF又は生理食塩水(SSI)で、マウス(10匹/群)を腹腔内(i.p)免疫した(0日目)。15日目に、アジュバントなしで10μg OmpC又は10μg OmpFそ用いて、マウスを腹腔内追加免疫した。PapMV OmpC及びOmpCを、免疫の1から24時間前に混合し、4℃で保管した。
【0195】
25日目又は140日目に、5% 胃ムチン(Sigma)含有500μl TEバッファ(50mM Tris、pH7.2、5mM EDTA)に再懸濁した、100又は500LD50のS.チフィ(ATCC 9993)でマウスを腹腔内チャレンジした。防御は、チャレンジ後10日の生存率として定義した。90000CFUでの1LD50を測定した。
【0196】
免疫
外部のアジュバント非存在下で、10μg OmpC、10μg OmpC+10μg PapMV OmpC、10μg PapMV OmpC又は等張生理食塩水(ISS)で、5匹のマウスの群を腹腔内(i.p)免疫した(0日目)。15日目に、アジュバントなしで、10μg OmpCを用いて、マウスを腹腔内追加免疫した。血液試料を、図5から7に示すような、種々の時間において、頚静脈から採取した。解析まで、個々の血清試料を−20℃で保管した。
【0197】
ELISA
高結合96ウェルポリスチレンプレート(High binding 96-well polystyrene plates)(Nunc)を、0.1M 炭酸塩−重炭酸塩バッファ ph9.5中の10μg/mLのOmpCでコートした。プレートを1時間、37℃で、続いて4℃で終夜、インキュベートした。プレートを蒸留したH2O−0.1% Tween20で4回洗浄した。非特異的結合をブロッキングバッファ(PBS pH7.4−2% BSA(Sigma))で37℃で1時間ブロックした。洗浄後、プールしたマウス血清をブロッキングバッファで1:40に希釈し、2倍段階希釈液をウェルに添加した。プレートを1.5時間、37℃でインキュベートし、続いて4回洗浄した。HRP抱合ヤギ抗マウスIgG1、IgG2a、IgG2b(Jackson Immunochemicals)又はIgG3(Rockland)(1 :10000)を添加し、1時間、37℃でインキュベートし、続いて4回洗浄した。検出系として、TMBペルオキシダーゼ基質(Fitzgerald)を用いた。暗所で10分間、37℃でインキュベーション後、2.5N H2SO4で反応を停止し、自動ELISAプレートリーダーを用いて、450nmにおける吸光度を測定した。抗体価は、−log2希釈×40として与えられる。陽性の力価は、陰性対照の平均値よりの3SD高いものとして定義した。
【0198】
受動免疫及びチャレンジ
外部のアジュバント非存在下で、10μg OmpC、10μg OmpC+10μg PapMV OmpC、10μg PapMV OmpC又は等張生理食塩水(SSI)で、5匹のマウスの群を腹腔内(i.p)免疫した(0日目)。15日目に、アジュバントなしで10μg OmpCを用いて、マウスを腹腔内追加免疫した。23日目に心穿刺を行い、各群由来の血清試料をプールし、−20℃で保管した。ナイーブマウス(5匹/群)に、200μlのプールした補体不活性化免疫血清を腹腔内投与した。転移から3時間後、上述のようにして、ムチンで再懸濁した100LD50のS.チフィでマウスをチャレンジした。防御は、チャレンジ後10日の生存率として定義した。
【0199】
結果
PapMV VLPは、ポーリンの防御能を改善する。
【0200】
精製タンパク質OmpC及びOmpFは、マウスでのS.チフィに対する防御を提供し、OmpC単独では、100LD50に対して60%防御を提供することが以前に示されている(Secundino ら、 2006, Immunology 117:59)。ポーリン、OmpC及びOmpFそれぞれの免疫原性を改善するために、それぞれ、PapMV VLPを含むワクチン製剤を調製した。2つの異なる製剤、PapMV OmpC VLP+OmpC及びPapMV OmpF VLP+OmpFを、100及び500LD50のS.チフィに対してマウスを保護する能力についてマウスにおいて試験し、結果をOmpC又はOmpF単独で免疫したマウスを用い得られるものと比較した。PapMV VLPとそれらのそれぞれのポーリンとの間の割合を、1:1に維持した。
【0201】
OmpCへのPapMV OmpC VLPの添加は、100LD50のS.チフィにチャレンジした状態で、Ompの防御能を70%から100%へ改善した(図5A)。防御効果の改善は、マウスを500LD50でチャレンジした時にさらに大きく、OmpCがPapMV OmpC VLPと結合した時には、30%から90%へ増加した防御が観察された(図5C)。同様に、PapMV OmpF VLPは、100LD50のS.チフィのチャレンジ状態で、OmpFの防御能を60%から90%へ改善した(図5B)が、チャレンジを500LD50のS.チフィで行った場合、わずかな差異のみが見られた(図5D)。この結果は、S.チフィチャレンジに対する防御に関して、OmpCは、OmpFよりもより良い抗原であることを示す。両方の場合において、PapMV VLPは、ポーリンの防御能をかなり改善した。
【0202】
PapMV VLPがOmpCに対する抗体価を改善するかを判定するために、10μg OmpC又は10μg OmpC及び10μg PapMV OmpC VLP含有複合体化ワクチンで免疫したマウスのIgGの力価を測定した。いずれかの処理を伴う、異なるIgGイソタイプIgG1、IgG2a、IgG2b及びIgG3の力価において、有意な差異は見られず(図6)、PapMV VLPで見られた防御の改善は、抗体自体の産生の増加よりむしろ、S.チフィ感染の中和における、CTL応答及び/又は抗体の結合効率における改善に関連するものであり得ることを示している。
【0203】
PapMV VLPでの免疫は、ポーリンに対するメモリー応答を改善する
OmpCと組み合わせてPapMV VLPを含むワクチン製剤のメモリー応答を評価するために、マウスを2週間の間をあけて2回、OmpC単独もしくはPapMV OmpC VLP及びOmpCを含むワクチン製剤のいずれかで免疫し、続いて15日目にOmpC単独で追加免疫した。140日目に、マウスを100LD50のS.チフィにチャレンジした。結果は、PapMV OmpC VLP及びOmpCを含むワクチン製剤による刺激が、免疫したマウスの防御能を有意に改善した(3倍の改善)ことを明らかに示している(図7)。したがって、本実験は、PapMV VLPがS.チフィチャレンジに対するマウスの保護を改善するだけでなく、より良いメモリー応答をも提供することを実証している。
【0204】
実施例5:S.チフィに対するPapMVとOmpCとの組み合わせの防御能
【0205】
PapMVの精製
PapMVを、実施例1に記載のように精製した。
【0206】
保護アッセイ
BALB/cマウス(10群)を、10μgのOmpC又は、30μgのPapMVと共に1時間4℃で予めインキュベートしておいた、10μgのOmpCで0日目に腹腔内免疫した。15日目に、10μgのOmpC単独で追加免疫を行った。対照マウスには、生理食塩水のみを接種した。21日目に、マウスを、5%ムチンに懸濁した100及び500LD50のS.チフィ(STYC302 DompF菌株)(前述の通り)でチャレンジし、以前に記載されたようにしてチャレンジし、生存率をチャレンジ後10日間モニターした。
【0207】
結果
感染した植物から単離したPapMVウイルスの、OmpCにより提供される防御の増加におけるアジュバント能を試験するために、OmpCで免疫したマウスと、PapMV精製ウイルスと混合したOmpCで免疫し、続いてS.チフィにチャレンジしたマウスとを比較した。PapMV精製ウイルスと混合したOmpCを、OmpC単独との比較として用いた場合、100LD50又は500LD50のいずれかのS.チフィでチャレンジ後に、20%から30%高い生存率が見られた(図8)。したがって、PapMV及びS.チフィOmpCポーリンの共投与は、S.チフィチャレンジに対する防御能を増加させることを見ることができる。
【0208】
実施例1から4に概説した実験の結果は、PapMVが、抗原特異的免疫グロブリンの切り換えを誘導することができ、モデル抗原に対する持続性の長期に渡る抗体応答を提供することができ、並びにOmpC又はOmpF単独の防御能を増加させることができるという、固有のアジュバント特性を有することを示唆する。これらのデータは、PapMV及びPapMV VLPが、OmpCポーリンにより誘発される、生得的及び適応的免疫応答の、S.チフィチャレンジに対する防御への転換を増強することを示唆する。
【0209】
実施例6:HCVコアタンパク質の精製
【0210】
E.コリ中でのHCVコアタンパク質のクローニング及び発現
HCVコアタンパク質の最初のN末端82及び170アミノ酸(それぞれHCV−C82及びHCV−C170と表す)を、E.コリ中での翻訳に最も代表的なコドンで最適化し、以下のように、精製のためにC末端においてHis6−タグと融合された。
【0211】
プラスミドpCV−H77c(J. Bukh, NIHの厚意により提供された)を用いてHCVコアコンストラクトを作製した。HCV−C170を、プライマーC170−6h(5'-CATGGGATCCTTACTAATGGTGATGGTGATGGTGACGCGTGGTACTAGTA GGAAGGTTCCCTGTTGCATAGTTCACGCC-3'[配列番号:43])を、プライマーC N9(5'-CATGAACCATGGCGAGCACGAATCCTAAACCTCAAAGAAAAACC-3'[配列番号:44])と共に用いたPCRにより増幅した。PCR産物を、制限酵素NcoI及びBamHIで消化し、pET3d発現ベクター(New England Biolabs)内にクローン化したコアC末端欠失コンストラクトHCV−C82をテンプレートDNAとしてC1−170クローンを用い、かつプライマー82(5'-CATGACTAGTAGGGTACCCGGGCTGAGC-3'[配列番号:45])、C79(5'-ACGTACTAGTGGGCTGAGCCCAGGTCCTGCC-3'[配列番号:46])を、プライマーc9−6h−Pet(5'-CATGACTAGTACCACGCGTCACC-S' [配列番号:47])と共に用いてPCRにより作製し、SpeIによるDNAの消化の後、ライゲーションによりクローンを環状化した。HCVクローンの配列を、DNA配列決定により確認した。E.コリ発現菌株BL21(DE3)RIL(Stratagene)を、C−タンパク質発現pET3dコンストラクトで形質転換し、50mg アンピシリンm121(Difco)を添加した26YT培地[16g バクトペプトン121(Difco)、10g 酵母エキス121(Difco)、5g NaCl121、pH7.0に調整]中で維持した。細菌細胞を37℃で、OD600が0.6になるまで生育し、タンパク質発現を1mM IPTGで誘導した。誘導を2時間、25℃で継続した(Majeau, N.,ら(2004) J. Gen. Virol, 85; 971-981参照)。2時間の誘導後、6000gで15分間の遠心分離により細胞をペレット化した。
【0212】
HCV−C82の精製
採取した細胞を、プロテアーゼインヒビターの1×カクテル(Roche Diagnostics GmbH)を添加した、30mlの氷冷溶解バッファ(50mM リン酸塩、300mM NaCl、pH12.0)で再懸濁し、−80℃で凍結した。次いで、ソニックディスメンブレーター(sonic dismembranator)モデル500(Fisher)を用いて、10秒間の超音波処理及びそれに続く各超音波処理の間の50秒間の冷却の24サイクルにより細胞を溶解した。次いで、溶解物を、27000gで30分間遠心分離した。4℃で撹拌しながら、上清をNi−NTA樹脂(QIAGEN)に添加した。結合の90分後、50mlのウォッシュバッファ1(50mM リン酸塩、300mM NaCl、10mM イミダゾール、pH12.0)でビーズを洗浄し、30分間撹拌した。50mLのウォッシュバッファ2(50mM リン酸塩、500mM NaCl、20mM イミダゾール、pH12.0)でビーズを再度洗浄し、さらに30分間撹拌した。次いで、HCV−C82をアセンブリーバッファ、1.7mM 酢酸Mg、100mM 酢酸K、25mM HEPES、pH7.6、500mM イミダゾールで溶出した。全てのことを4℃で行った。
【0213】
HCV−170の精製
採取した細胞を500μm PMSEを添加した30ml 溶解バッファ(20mM Tris/HCl pH(7.4)、8M 尿素、300mM NaCl、1mM DTT)中に再懸濁し、−80℃で凍結した。次いで、細胞をソニックディスメンブレーター(sonic dismembranator)モデル500(Fisher)を用いて、10秒間の超音波処理及びそれに続く各超音波処理の間の50秒間の冷却の24サイクルにより細胞を溶解した。次いで、溶解物を、27000gで30分間遠心分離した。上清を、撹拌しながら、Ni−NTA樹脂(QIAGEN)に添加した。結合の90分後、50mlのウォッシュバッファ1(20mM Tris/HCl pH(7.4)、4M 尿素、300mM NaCl、10mM イミダゾール、1mM DTT)でビーズを洗浄し、30分間撹拌した。50mLのウォッシュバッファ2(20mM Tris/HCl pH(7.4)、2M 尿素、300mM NaCl、20mM イミダゾール、1mM DTT)でビーズを再度洗浄し、さらに30分間撹拌した。次いで、HCV−C170を溶出バッファ(20mM Tris/HCl pH(7.4)、2M 尿素、500mM NaCl、500mM イミダゾール、1mM DTT)で溶出した。全てのこれらのことを室温で行った。
【0214】
HCV−コアタンパク質の逆相HPLC精製
HP1050シリーズ(Hewlett Packard)HPLCで、UV検出器及びVYDAC C4カラム(250mm×4.6mm、5μm、及び300A)を用いて、逆相HPLCを行った。勾配に用いた溶媒は、水中の0.05% トリフルオロ酢酸(溶媒A)及びアセトニル中の0.05% トリフルオロ酢酸(溶媒B)であった。流速は、溶媒Bで0.8ml/分であり、HCV−C82に関して、35分で10%から50%に、並びにHCV−C170に関して、15分で10%から50%に、20分で60%に増加した。クロマトグラフは、220nm及び280nmにおいて記録し、並びにLC3D用ChemStation(Agilent Technologies)を用いてデータを解析した。採取した画分を、凍結乾燥し、さらなる研究のためにPBS中で再構成した。
【0215】
タンパク質特性解析
SDS−ポリアクリルアミドゲル電気泳動(SDS−PAGE)及びビシンコニン酸(BCA)タンパク質アッセイキット(Pierce)により、タンパク質純度及び含量を見積もった。
【0216】
HCV−C82及びHCV−C170はNLP内に集合する
インビトロでの集合反応を、精製HCV Cタンパク質及びtRNA(Sigma)を用いて行った。16プロテアーゼインヒビターカクテル及び0.5U RAaseインヒビター(Roche)の存在下で、精製タンパク質(50ml アセンブリーバッファ;(1mM 酢酸マグネシウム、100mM 酢酸カリウム、25mM HEPES、pH7.4)中25mg)を、250ng tRNAと混合した。反応物を、37℃で10分間インキュベートし、続いて、氷上で15分インキュベートした(Majeau, N.,ら(2004)J Gen. Virol., 85; 971-981参照)。
【0217】
実施例7:HCVコア親和性ペプチドを含むPapMV VLPの産生及び遺伝子操作
【0218】
ファージ提示
New England Biolabs (Beverly, USA)から提供されたPh.D.−7ファージライブラリーを用いた。本ライブラリーに用いた無作為提示されたヘプタペプチドは、M13ファージのPIIIタンパク質のN末端において融合されている。ライブラリーは、10μlの供給されたファージにおいて起こり得る、各1.28×109の7残基候補の70コピーからなる。HCV−C170をパニング手順のためのタンパク質標的としてに用い、0.1MのNaHCO3(pH8.6)中100μg/mlに希釈し、150μlをマキシソープ96ウェルポリスチレンプレート(Nunc, Roskilde, Denmark)の1つのウェルに吸着させた。4℃で終夜、穏やかな撹拌と共に、加湿された容器内でプレートをインキュベートした。吸着されなかったタンパク質を廃棄し、400μlのブロッキングバッファ(0.1M NaHCO3(pH8.6)+5mg/ml BSA+0.02%(w/v)NaN3)を添加すること、及びプレートを1時間4℃でインキュベートすることにより、ウェルをブロックした。各ウェルをTrisバッファ生理食塩水(TBS):50mM Tris−HCl、0.1%(v/v)Tween−20を添加した150mM NaCl(pH7.5)、で6回洗浄した。10μlのファージライブラリーPh.D.−7(2×1011pfu)をTBST中に1mlに希釈し、100μlを各ウェルに分配した。プレートを1時間、室温で、穏やかな撹拌と共にインキュベートした。TBSTで10回洗浄することにより、結合しなかったファージをウェルから除去した。結合したファージを、TBS中100μg/mlの100μlの標的タンパク質ににより溶出した。本パニング手順を、2つの独立した実験系で計4ラウンド繰り返した。後の各パニングラウンドについて、ファージの投与量は2×1011pfuであった。各選択のストリンジェンシーは、非特異的なファージの結合の頻度を減少させるための最後の3回のパニングのラウンドについて、TBS中の0.5% Tween−20を用いることにより増加させた。
【0219】
ファージ滴定
E.コリER2738の単一コロニーを、10mlのLBに接種し、対数期の中間部(OD600〜0.5)まで振盪培養した。溶出ファージの10倍段階希釈液を、増幅ファージについては108−1011、又は粗パニング溶出液については101−104の範囲で、LB中で調製した。10μlの各希釈液を200μlの対数期の中間部細菌に添加し、室温で5分インキュベートした。感染した細胞を、予め温めた上層アガロース(45℃)含有培養チューブに移し、すばやくボルテックスし、予め温めたLB/IPTG/Xgalプレート上に注いだ。プレートを終夜、37℃でインキュベートし、〜100の溶解プラークを含有するプレートを滴定用に計数した。
【0220】
プラークの増幅
E.コリER2738の終夜培養物を、LB中に1:100で希釈し、10から〜100プラークを有するプレートより選ばれた青色プラークを接種した。接種したチューブを37℃で、浸透しながら、4−5時間インキュベートした。インキュベーション後、培養物を30秒間遠心分離し、上清を新たなチューブに移し、再びスピンした。ピペットを用いて、最高80%の上清を清潔なチューブに移し、増幅したファージを次の過程まで4℃で保管した。
【0221】
ファージ配列決定
DNA抽出のために、製造者の取り扱い説明書にしたがってQIAprep(登録商標)スピンM13キット(Qiagen)を用いた。各実験について最終パニング手順の10クローンは、下記のプライマーを用いてDNA配列決定した:5'TGTATGGGATTTTGTAATACATCA 3'[配列番号:37]。
【0222】
PapMVコートタンパク質のクローニング及びPapMVCP−STASYTRの生成
PapMV CP遺伝子を単離したウイルスRNAから、プライマー5'-AGTCCCATGGCATCCACACCCAACATAGCCTTC-S'[配列番号:38]及び5'-GATCGGATCCTTACTAATGGTGATGGTGATGGTGACGCGTGGTACTAGTTT CGGGGGGTGGAAGGAATTGGATGGTTGG-3'[配列番号:39]:を用いてRT−PCRにより増幅した。増幅断片をNcoI/BamHI断片として、pET3D(New England Biolabs)内にクローン化した。
【0223】
PapMVCP−STASYTRコンストラクト([配列番号:42];図14参照)を作製するために、オリゴ5'CTAGTAGCACCGCGAGCTACACCAGAA-3'[配列番号:40]及び5' CGCGTTCTGGTGTAGCTCGCGGTGCTA-3'[配列番号:41]を共にアニールし、SpeI/MIuIで直線化されたPapMV CPクローン内にライゲーションした。最終PapMVCP−STASYTRコンストラクトの核酸配列を図14Aに示す[配列番号:48]。
【0224】
PapMVCPタンパク質の作製及び精製
E.コリ発現菌株BL21(DE3)RIL(Stratagene)を、PapMVCP−STASYTR含有プラスミドpET−3dで形質転換した。培養物を50μg/ml アンピシリンと共に、OD600が約0.6になるまで37℃で生育し、22℃で終夜、1mM IPTG(イソプロピル−1−チオ−β−D−ガラクトピラノシド)を用いて誘導し、6000gで15分間遠心分離した。ペレットを、氷冷溶解バッファ(50mM NaH2PO4[pH8.0]、300mM NaCl、10mM イミダゾール、40μM PMSF、及び0.1mg/ml リゾチーム)に再懸濁し、750PSIでフレンチプレスに1回通すことにより、細菌を溶解した。溶解物を30分間、13000rpmで2回遠心分離し、細胞残屑を除去した。全精製手順を4℃で行った。上清を、1mlのNi−NTA−アガロースマトリクス(QiagenD40724)と終夜混合した。タンパク質を、ポリプロピレンクロマトグラフィーカラム上の重力フロー(Econo-Pac Colomns, Bio-Rad Laboratories)により精製した。樹脂を、第1のウォッシュバッファ(20mM イミダゾールを添加した溶解バッファ)と共に10ベッドボリュームで1回洗浄し、第2のウォッシュバッファ(50mM イミダゾールを添加した溶解バッファ)で1回洗浄した。調製物からLPS混入物を除去するために、これらを10mM Tris−HCl 50mM イミダゾール 0.5% トリトンX100 pH8で1回洗浄し、10mM Tris−HCl 50mM イミダゾール 1% Zwittergent pH8で1回洗浄した。これらの洗浄ステップ後、第3のウォッシュバッファ(10mM Tris−HCl(pH8.0)及び50mM イミダゾール)での洗浄を行い、全ての微量の界面活性剤を除去した。タンパク質を終夜2.5ベッドボリュームの溶出バッファ(1M イミダゾールを添加した第3のウォッシュバッファ)と共にインキュベートし、10mM Tris−HCl(pH8.0)で終夜透析した。試料中のVLP量を増加させるため、試料を3000×gで90分間、1000kmacrosep(登録商標)遠心分離機(Pall life sciences)で遠心分離し、PBSで終夜透析した。
【0225】
タンパク質特性解析
ワクチン製剤のエンドトキシン含量を、リムルスアメーバ様細胞溶解物アッセイキット(Limulus amoebocyte lysate assay kit)(Cambrex)で見積もった。VLP含量を、Superdex200(10/300)GL分析カラムを用いて、FPLCサイズ排除クロマトグラフィーにより評価した。
【0226】
電子顕微鏡観察
NLP内へのHCVコアタンパク質の集合後、150ngの試料をPBSで希釈し、400メッシュ炭素絶縁被膜格グリッド(400-mesh carbon formvar grids)(Canemco)上に5分間吸着させた。グリッドをTBSで1回洗浄し、ろ過処理した2% 酢酸ウラニル溶液で3分間染色した。グリッドを乾燥し、電子顕微鏡下において、60kVolの加速電圧、100000の倍率で調べた。
【0227】
ELISA
コスター高結合96ウェルプレート(Coster High Binding 96-well plates)(Corning, NY, U.S.A.)を終夜、4℃で、0.1M NaHCO3バッファ pH9.6中で、1μg/mlの濃度まで希釈した100μl/ウェルのHCV−C170NLP又はフリー(即ち、非NLP)HCV−C170でコーティングした。プレートをPBS−0.1% Tween−20−2% BSA(150μl/ウェル)で、1時間37℃でブロックした。1μg/ml又は2.5μg/mlから始まるPapMVCP−STASYTRの2倍段階希釈液を試験した。
プレートを、ペルオキシダーゼ抱合ヤギ抗ウサギIgGとのインキュベート前に、PBST中で1/5000でのPapMVCP タンパク質に対する100μlのポリクローナルウサギ抗体と共にインキュベートした。3回の洗浄後、100μlのTMB−Sで、使用者の説明書にしたがって、IgGの存在を検出した;反応を、100μlの0.18mM H2SO4の添加により停止させ、450nmにおけるODを読んだ。
【0228】
結果
HCVコアタンパク質に結合できる親和性ペプチドを、ファージ提示により選んだ。ペプチドの配列及びこれらの頻度を表5に示す。
【0229】
【表5】

【0230】
ペプチドSTASYTR[配列番号:8]が最も高い頻度で見出され、したがってPapMVコートタンパク質と融合するように選択した。電子顕微鏡(EM)観察により、PapMV CPに対するペプチドの添加は、融合していないPapMV CPと比較して(図12A)、得られた融合タンパク質であるPapMVCP−STASYTRがVLP内へ自己集合する能力に影響を及ぼさなかったことが確認された(図12B)。
【0231】
PapMVCP−STASYTRのHCVコアタンパク質(1−170)NLP及びフリー(非NLP)HCV−C170との結合は、ELISA型結合アッセイにより示された。両方のアッセイについて、抗原への結合が明らかに実証され、アッセイに用いたPapMVCP−STASYTRの量と共に増加した(図12C及びD)。
【0232】
実施例8:親和性に複合体化されたPapMV VLP−HCVコアでのC型肝炎に対する免疫
PapMV−STASYTR/HCV−コアACASの調製
PapMV−STASYTR及びHCV−C82を滅菌PBSバッファ中で、5:1 PapMV−STASYTR:HCV−C82の割合で混合し、次いで、16時間4℃でインキュベートした。最初のインキュベーション後、混合物を90分間25℃(室温)での第2のインキュベーションに提示した。
【0233】
マウス
5匹の4−8週齢C57BL/6マウスに、10μgのHCV−C82NLP又は10μgのC82NLP+50μg PapMVCP−STASYTR又は50μl PapMVCP−STASYTR又はPBSエンドトキシンフリー(Sigma)を皮下的に注射した。
【0234】
一次免疫の後、2週間の間隔で2回の追加免疫投与を与えた。血液試料を異なる時点で取得し、解析まで−20℃で保管した。最後の免疫から3週間後、マウスを、HCVポリタンパク質のアミノ酸1−382を発現する、5×106PFUの組換えワクチンウイルスSc59 6C/Sに腹腔内にチャレンジした(Kozielら、1995 J Clin Invest. 96(5):2311-21)。チャレンジ前に、0.1mlのケタミン(15mg/ml)−キシラジン(1mg/ml)/10g体重で、マウスを麻酔した。チャレンジ後5日目にマウスを屠殺し、卵巣を回収し、ホモジナイズし、CV−I指標細胞のプレートにおける10倍段階希釈液によりウイルス抗体価についてアッセイした。2日間の培養後、培地を除去し、CV−I細胞単層を、1% メチレンブルー(Sigma)で10分間染色し、水で10分間洗浄し、並びに、ワクチンウイルスの滴定のためにウェルごとのプラークの数を計数した。
【0235】
ELISA
コスター高結合96ウェルプレート(Costar High Binding 96-well plates)(Corning, NY, U.S.A.)を、0.1M NaHCO3バッファ pH9.6で1μg/mlの濃度まで希釈した100μl/ウェルのHCV−C170フリータンパク質で4℃で終夜コートした。プレートを、PBS−0.1% Tween−20−2% BSA(150μl/ウェル)で、1時間37℃でブロックした。PBS−0.1% Tween−20で3回洗浄後、血清を、添加された1:100から始まる2倍段階希釈液中で検査し、1時間37℃でインキュベートした。インキュベーション後に、プレートを3回洗浄し、100μlのペルオキシダーゼ抱合ヤギ抗マウスIgG(Jackson Immunoresarch)と共に、PBS/0.1% Tween−20/2% BSA中1/10000の希釈度で、1時間37℃でインキュベートした。3回の洗浄の後、IgGの存在を、使用者の説明書にしたがって、100μlのTMB−Sで検出した;反応を、100μlの0.18mM H2SO4を添加することにより停止し、450nmでのODを読んだ。OD値が、PBSマウス由来の血清の1:100希釈で得られたバックグラウンド値の3倍である場合に決定された抗体終点力価として、結果を表す。
【0236】
統計的方法
データをX=(log y+1)で変換して分散を均一化にし、次いで、Tukeyの多重比較をパラメータデータのためのポストテストとするANOVA試験を用いて解析した。p<0.05は、統計的に有意であると見なした。
【0237】
結果
HCVコア、PapMVCP−STASYTR、又はHCVコア+PapMVCP−STASYTRでの免疫後のマウスにおける総IgG力価を、図13Aに示す。HCVコア+PapMVCP−STASYTRでの免疫は、HCVコア単独又はPapMVCP−STASYTR単独での免疫と比較したIgGにおいて、統計的に有意な(p<0.05)増加を示した。
【0238】
図13Bは、HCVポリタンパク質のアミノ酸1−382を発現する、組換えワクチンウイルスSc59 6C/Sでチャレンジ後の、感染したマウスの両方の卵巣から回収したウイルス価を示す。本実験において、PBS、HCVコア、PapMVCP−STASYTR又はHCVコア+PapMVCP−STASYTRでの免疫後に有意な差異は見られなかったにもかかわらず、総IgG力価からすると、HCVコア+PapMVCP−STASYTR組成物での免疫が、HCVコア単独で達成された免疫応答よりも、優れた免疫応答を生成することができることは明らかである。したがって、組成物の最適化及び/又は、例えば、抗原単独の追加免疫投与の追加による、日常投与の最適化は、ウイルスチャレンジに対する効果的な防御をもたらすであろうと予想される。そのような最適化は、本明細書に与えた教示を考慮すると当業者に用意に理解され得る。例えば、CD8+HCVコア特異的増殖アッセイは、マウスにおける強力なCTL応答を誘発することができる、PapMV-STASYTRとHCVコアタンパク質との最適な割合、並びに最終ワクチン調製の適切投与量を決定するために行われる。1つの実施形態において、HCVコアタンパク質に対して4:1、3:1、2:1及び1:1のPapMV-STASYTRの割合が、ワクチン製剤に組み込むためのACASの調製について意図される。
【0239】
本発明を、特定の具体的な実施形態に関して説明してきたが、本発明の種々の改変は、本発明の精神及び範囲から逸脱することなく、当業者に明らかであるだろう。当業者に明らかであるような、そのような全ての改変が、添付の特許請求の範囲内に含まれることを意図している。
【特許請求の範囲】
【請求項1】
1以上の抗原及びパパイヤモザイクウイルス(PapMV)又はPapMVコートタンパク質由来のウイルス様粒子(VLP)を含む親和性で複合体化された抗原系であって、該PapMV又はVLPがPapMVもしくはVLPのコートタンパク質に取り付けられた複数の親和性部分を含み、該親和性部分が前述の1以上の抗原に結合でき、該系が動物における免疫応答を誘導することができる、抗原系。
【請求項2】
前述の1以上の親和性部分がPapMV又はVLPのコートタンパク質に化学的に取り付けられた、請求項1に記載の親和性で複合体化された抗原系。
【請求項3】
該系がVLPを含み、かつ前述の1以上の親和性部分がVLPのコートタンパク質に対して遺伝子工学的に融合された、請求項1に記載の親和性で複合体化された抗原系。
【請求項4】
前述の1以上の親和性部分がペプチドである、請求項1、2又は3のいずれか1項に記載の親和性で複合体化された抗原系。
【請求項5】
前述の1以上の抗原がそれぞれ、腫瘍関連抗原、自己抗原、アレルゲン、ウイルス抗原、細菌性抗原又は寄生虫抗原である、請求項1、2、3又は4のいずれか1項に記載の親和性で複合体化された抗原系。
【請求項6】
前述の1以上の抗原がそれぞれ、細菌、ウイルス、原生動物、菌類、寄生虫又は感染粒子由来である、請求項1、2、3又は4のいずれか1項に記載の親和性で複合体化された抗原系。
【請求項7】
前述の1以上の抗原がウイルス由来である、請求項1、2、3又は4のいずれか1項に記載の親和性で複合体化された抗原系。
【請求項8】
前述の1以上の抗原が細菌由来である、請求項1、2、3又は4のいずれか1項に記載の親和性で複合体化された抗原系。
【請求項9】
該免疫応答が体液性応答を含む、請求項1、2、3、4、5、6、7又は8のいずれか1項に記載の親和性で複合体化された抗原系。
【請求項10】
該免疫応答が細胞性応答を含む、請求項1、2、3、4、5、6、7又は8のいずれか1項に記載の親和性で複合体化された抗原系。
【請求項11】
該系が1以上の追加抗原をさらに含む、請求項1、2、3、4、5、6、7、8、9又は10のいずれか1項に記載の親和性で複合体化された抗原系。
【請求項12】
請求項1、2、3、4、5、6、7、8、9、10又は11のいずれか1項に記載の親和性で複合体化された抗原系、及び薬学的に許容される担体を含む、免疫原性組成物。
【請求項13】
有効量の請求項1、2、3、4、5、6、7、8、9、10又は11のいずれか1項に記載の親和性で複合体化された抗原系を動物に投与することを含む、該動物における免疫応答を誘導する方法。
【請求項14】
該免疫応答が抗体の産生を含む、請求項13に記載の方法。
【請求項15】
該免疫応答が細胞傷害性Tリンパ球(CTL)応答の誘導を含む、請求項13に記載の方法。
【請求項16】
該系が注射により投与される、請求項13、14又は15のいずれか1項に記載の方法。
【請求項17】
該系が鼻腔内に投与される、請求項13、14又は15のいずれか1項に記載の方法。
【請求項18】
該動物が哺乳動物である、請求項13、14、15、16又は17のいずれか1項に記載の方法。
【請求項19】
該動物がヒトである、請求項13、14、15、16又は17のいずれか1項に記載の方法。
【請求項20】
該動物が非ヒト動物である、請求項13、14、15、16又は17のいずれか1項に記載の方法。
【請求項21】
該方法が追加免疫投与量の前述の1以上の抗原を該動物に投与することをさらに含む、請求項13、14、15、16、17、18、19又は20のいずれか1項に記載の方法。
【請求項22】
有効量の請求項1、2、3、4、5、6、7、8、9、10又は11のいずれか1項に記載の抗原提示系を動物に投与することを含む、該動物における疾病又は疾患を予防又は治療する方法。
【請求項23】
体液性免疫応答の誘導が該疾病もしくは疾患の予防又は治療に効果的である、請求項22に記載の方法。
【請求項24】
該疾病又は疾患が細菌により引き起こされたものである、請求項22又は23に記載の方法。
【請求項25】
該疾病又は疾患がウイルスにより引き起こされたものである、請求項22又は23に記載の方法。
【請求項26】
該系が注射により投与される、請求項22、23、24又は25のいずれか1項に記載の方法。
【請求項27】
該系が鼻腔内に投与される、請求項22、23、24又は25のいずれか1項に記載の方法。
【請求項28】
該動物が哺乳動物である、請求項22、23、24、25、26又は27のいずれか1項に記載の方法。
【請求項29】
該動物がヒトである、請求項22、23、24、25、26又は27のいずれか1項に記載の方法。
【請求項30】
該動物が非ヒト動物である、請求項22、23、24、25、26又は27のいずれか1項に記載の方法。
【請求項31】
該方法が追加免疫投与量の前述の1以上の抗原を該動物に投与することをさらに含む、請求項22、23、24、25、26、27、28、29又は30のいずれか1項に記載の方法。
【請求項32】
それを必要とする動物における免疫応答を誘導するための、有効量の請求項1、2、3、4、5、6、7、8、9、10又は11のいずれか1項に記載の親和性で複合体化された抗原系の使用。
【請求項33】
該免疫応答が抗体の産生を含む、請求項32に記載の使用。
【請求項34】
該免疫応答が細胞傷害性Tリンパ球(CTL)応答の誘導を含む、請求項32に記載の方法。
【請求項35】
該系が注射による投与のために製剤化される、請求項32、33又は34のいずれか1項に記載の使用。
【請求項36】
該系が経鼻投与のために製剤化される、請求項32、33又は34のいずれか1項に記載の使用。
【請求項37】
該動物が哺乳動物である、請求項32、33、34、35又は36のいずれか1項に記載の使用。
【請求項38】
該動物がヒトである、請求項32、33、34、35又は36のいずれか1項に記載の使用。
【請求項39】
該動物が非ヒト動物である、請求項32、33、34、35又は36のいずれか1項に記載の使用。
【請求項40】
該使用が追加免疫投与量の前述の1以上の抗原をさらに含む、請求項32、33、34、35、36、37、38又は39のいずれか1項に記載の使用。
【請求項41】
それを必要とする動物における疾病もしくは疾患の予防又は治療のための、有効量の請求項1、2、3、4、5、6、7、8、9、10又は11のいずれか1項に記載の親和性で複合体化された抗原系の使用。
【請求項42】
体液性免疫応答が該疾病もしくは疾患を予防又は治療するために有効である、請求項41に記載の使用。
【請求項43】
該疾病又は疾患が細菌により引き起こされたものである、請求項41又は42に記載の使用。
【請求項44】
該疾病又は疾患がウイルスにより引き起こされたものである、請求項41又は42に記載の使用。
【請求項45】
該系が注射による投与のために製剤化される、請求項41、42、43又は44のいずれか1項に記載の使用。
【請求項46】
該系が経鼻投与のために製剤化される、請求項41、42、43又は44のいずれか1項に記載の使用。
【請求項47】
該動物が哺乳動物である、請求項41、42、43、44、45又は46のいずれか1項に記載の使用。
【請求項48】
該動物がヒトである、請求項41、42、43、44、45又は46のいずれか1項に記載の使用。
【請求項49】
該動物が非ヒト動物である、請求項41、42、43、44、45又は46のいずれか1項に記載の使用。
【請求項50】
該使用が追加免疫投与量の前述の1以上の抗原をさらに含む、請求項41、42、43、44、45、46、47、48又は49のいずれか1項に記載の使用。
【請求項51】
薬物の製造におけるパパイヤモザイクウイルス(PapMV)又はPapMVコートタンパク質由来のウイルス様粒子(VLP)の使用であって、該PapMV又はVLPが該PapMVもしくはVLPのコートタンパク質に取り付けられた複数の親和性部分を含む、使用。
【請求項52】
前述の複数の親和性部分がPapMV又はVLPのコートタンパク質に化学的に取り付けられた、請求項51に記載の使用。
【請求項53】
前述の複数の親和性部分がVLPのコートタンパク質に対して遺伝子工学的に融合された、請求項51に記載の使用。
【請求項54】
該VLPが前述の複数の親和性部分に対して複合体化された1以上の抗体をさらに含む、請求項51、52又は53のいずれか1項に記載の使用。
【請求項55】
薬物の製造における、請求項1、2、3、4、5、6、7、8、9、10又は11のいずれか1項に記載の親和性で複合体化された抗原系の使用。
【請求項56】
1以上の抗原をパパイヤモザイクウイルス(PapMV)又はPapMVコートタンパク質由来のウイルス様粒子(VLP)と混合することを含む、免疫原性組成物を調製する方法であって、該PapMV又はVLPが該PapMV又はVLPのコートタンパク質に取り付けられた複数の親和性部分を含み、該親和性部分が前述の1以上の抗原に結合できる、方法。
【請求項57】
請求項56に記載の方法により調製された、免疫原性組成物。
【請求項58】
HCVコアタンパク質に結合できる親和性ペプチドに対して融合されたパパイヤモザイクウイルス(PapMV)コートタンパク質を含む融合タンパク質。
【請求項59】
該親和性ペプチドが配列番号8、15、16、17、18、19又は20のいずれか1つに示された配列の少なくとも4つの連続したアミノ酸を含む、請求項58に記載の融合タンパク質。
【請求項60】
請求項58又は59に記載の融合タンパク質をコードする単離されたポリヌクレオチド。
【請求項61】
ウイルス様粒子を調製するための、請求項58もしくは59に記載の融合タンパク質又は請求項60に記載のポリヌクレオチドの使用。
【請求項1】
1以上の抗原及びパパイヤモザイクウイルス(PapMV)又はPapMVコートタンパク質由来のウイルス様粒子(VLP)を含む親和性で複合体化された抗原系であって、該PapMV又はVLPがPapMVもしくはVLPのコートタンパク質に取り付けられた複数の親和性部分を含み、該親和性部分が前述の1以上の抗原に結合でき、該系が動物における免疫応答を誘導することができる、抗原系。
【請求項2】
前述の1以上の親和性部分がPapMV又はVLPのコートタンパク質に化学的に取り付けられた、請求項1に記載の親和性で複合体化された抗原系。
【請求項3】
該系がVLPを含み、かつ前述の1以上の親和性部分がVLPのコートタンパク質に対して遺伝子工学的に融合された、請求項1に記載の親和性で複合体化された抗原系。
【請求項4】
前述の1以上の親和性部分がペプチドである、請求項1、2又は3のいずれか1項に記載の親和性で複合体化された抗原系。
【請求項5】
前述の1以上の抗原がそれぞれ、腫瘍関連抗原、自己抗原、アレルゲン、ウイルス抗原、細菌性抗原又は寄生虫抗原である、請求項1、2、3又は4のいずれか1項に記載の親和性で複合体化された抗原系。
【請求項6】
前述の1以上の抗原がそれぞれ、細菌、ウイルス、原生動物、菌類、寄生虫又は感染粒子由来である、請求項1、2、3又は4のいずれか1項に記載の親和性で複合体化された抗原系。
【請求項7】
前述の1以上の抗原がウイルス由来である、請求項1、2、3又は4のいずれか1項に記載の親和性で複合体化された抗原系。
【請求項8】
前述の1以上の抗原が細菌由来である、請求項1、2、3又は4のいずれか1項に記載の親和性で複合体化された抗原系。
【請求項9】
該免疫応答が体液性応答を含む、請求項1、2、3、4、5、6、7又は8のいずれか1項に記載の親和性で複合体化された抗原系。
【請求項10】
該免疫応答が細胞性応答を含む、請求項1、2、3、4、5、6、7又は8のいずれか1項に記載の親和性で複合体化された抗原系。
【請求項11】
該系が1以上の追加抗原をさらに含む、請求項1、2、3、4、5、6、7、8、9又は10のいずれか1項に記載の親和性で複合体化された抗原系。
【請求項12】
請求項1、2、3、4、5、6、7、8、9、10又は11のいずれか1項に記載の親和性で複合体化された抗原系、及び薬学的に許容される担体を含む、免疫原性組成物。
【請求項13】
有効量の請求項1、2、3、4、5、6、7、8、9、10又は11のいずれか1項に記載の親和性で複合体化された抗原系を動物に投与することを含む、該動物における免疫応答を誘導する方法。
【請求項14】
該免疫応答が抗体の産生を含む、請求項13に記載の方法。
【請求項15】
該免疫応答が細胞傷害性Tリンパ球(CTL)応答の誘導を含む、請求項13に記載の方法。
【請求項16】
該系が注射により投与される、請求項13、14又は15のいずれか1項に記載の方法。
【請求項17】
該系が鼻腔内に投与される、請求項13、14又は15のいずれか1項に記載の方法。
【請求項18】
該動物が哺乳動物である、請求項13、14、15、16又は17のいずれか1項に記載の方法。
【請求項19】
該動物がヒトである、請求項13、14、15、16又は17のいずれか1項に記載の方法。
【請求項20】
該動物が非ヒト動物である、請求項13、14、15、16又は17のいずれか1項に記載の方法。
【請求項21】
該方法が追加免疫投与量の前述の1以上の抗原を該動物に投与することをさらに含む、請求項13、14、15、16、17、18、19又は20のいずれか1項に記載の方法。
【請求項22】
有効量の請求項1、2、3、4、5、6、7、8、9、10又は11のいずれか1項に記載の抗原提示系を動物に投与することを含む、該動物における疾病又は疾患を予防又は治療する方法。
【請求項23】
体液性免疫応答の誘導が該疾病もしくは疾患の予防又は治療に効果的である、請求項22に記載の方法。
【請求項24】
該疾病又は疾患が細菌により引き起こされたものである、請求項22又は23に記載の方法。
【請求項25】
該疾病又は疾患がウイルスにより引き起こされたものである、請求項22又は23に記載の方法。
【請求項26】
該系が注射により投与される、請求項22、23、24又は25のいずれか1項に記載の方法。
【請求項27】
該系が鼻腔内に投与される、請求項22、23、24又は25のいずれか1項に記載の方法。
【請求項28】
該動物が哺乳動物である、請求項22、23、24、25、26又は27のいずれか1項に記載の方法。
【請求項29】
該動物がヒトである、請求項22、23、24、25、26又は27のいずれか1項に記載の方法。
【請求項30】
該動物が非ヒト動物である、請求項22、23、24、25、26又は27のいずれか1項に記載の方法。
【請求項31】
該方法が追加免疫投与量の前述の1以上の抗原を該動物に投与することをさらに含む、請求項22、23、24、25、26、27、28、29又は30のいずれか1項に記載の方法。
【請求項32】
それを必要とする動物における免疫応答を誘導するための、有効量の請求項1、2、3、4、5、6、7、8、9、10又は11のいずれか1項に記載の親和性で複合体化された抗原系の使用。
【請求項33】
該免疫応答が抗体の産生を含む、請求項32に記載の使用。
【請求項34】
該免疫応答が細胞傷害性Tリンパ球(CTL)応答の誘導を含む、請求項32に記載の方法。
【請求項35】
該系が注射による投与のために製剤化される、請求項32、33又は34のいずれか1項に記載の使用。
【請求項36】
該系が経鼻投与のために製剤化される、請求項32、33又は34のいずれか1項に記載の使用。
【請求項37】
該動物が哺乳動物である、請求項32、33、34、35又は36のいずれか1項に記載の使用。
【請求項38】
該動物がヒトである、請求項32、33、34、35又は36のいずれか1項に記載の使用。
【請求項39】
該動物が非ヒト動物である、請求項32、33、34、35又は36のいずれか1項に記載の使用。
【請求項40】
該使用が追加免疫投与量の前述の1以上の抗原をさらに含む、請求項32、33、34、35、36、37、38又は39のいずれか1項に記載の使用。
【請求項41】
それを必要とする動物における疾病もしくは疾患の予防又は治療のための、有効量の請求項1、2、3、4、5、6、7、8、9、10又は11のいずれか1項に記載の親和性で複合体化された抗原系の使用。
【請求項42】
体液性免疫応答が該疾病もしくは疾患を予防又は治療するために有効である、請求項41に記載の使用。
【請求項43】
該疾病又は疾患が細菌により引き起こされたものである、請求項41又は42に記載の使用。
【請求項44】
該疾病又は疾患がウイルスにより引き起こされたものである、請求項41又は42に記載の使用。
【請求項45】
該系が注射による投与のために製剤化される、請求項41、42、43又は44のいずれか1項に記載の使用。
【請求項46】
該系が経鼻投与のために製剤化される、請求項41、42、43又は44のいずれか1項に記載の使用。
【請求項47】
該動物が哺乳動物である、請求項41、42、43、44、45又は46のいずれか1項に記載の使用。
【請求項48】
該動物がヒトである、請求項41、42、43、44、45又は46のいずれか1項に記載の使用。
【請求項49】
該動物が非ヒト動物である、請求項41、42、43、44、45又は46のいずれか1項に記載の使用。
【請求項50】
該使用が追加免疫投与量の前述の1以上の抗原をさらに含む、請求項41、42、43、44、45、46、47、48又は49のいずれか1項に記載の使用。
【請求項51】
薬物の製造におけるパパイヤモザイクウイルス(PapMV)又はPapMVコートタンパク質由来のウイルス様粒子(VLP)の使用であって、該PapMV又はVLPが該PapMVもしくはVLPのコートタンパク質に取り付けられた複数の親和性部分を含む、使用。
【請求項52】
前述の複数の親和性部分がPapMV又はVLPのコートタンパク質に化学的に取り付けられた、請求項51に記載の使用。
【請求項53】
前述の複数の親和性部分がVLPのコートタンパク質に対して遺伝子工学的に融合された、請求項51に記載の使用。
【請求項54】
該VLPが前述の複数の親和性部分に対して複合体化された1以上の抗体をさらに含む、請求項51、52又は53のいずれか1項に記載の使用。
【請求項55】
薬物の製造における、請求項1、2、3、4、5、6、7、8、9、10又は11のいずれか1項に記載の親和性で複合体化された抗原系の使用。
【請求項56】
1以上の抗原をパパイヤモザイクウイルス(PapMV)又はPapMVコートタンパク質由来のウイルス様粒子(VLP)と混合することを含む、免疫原性組成物を調製する方法であって、該PapMV又はVLPが該PapMV又はVLPのコートタンパク質に取り付けられた複数の親和性部分を含み、該親和性部分が前述の1以上の抗原に結合できる、方法。
【請求項57】
請求項56に記載の方法により調製された、免疫原性組成物。
【請求項58】
HCVコアタンパク質に結合できる親和性ペプチドに対して融合されたパパイヤモザイクウイルス(PapMV)コートタンパク質を含む融合タンパク質。
【請求項59】
該親和性ペプチドが配列番号8、15、16、17、18、19又は20のいずれか1つに示された配列の少なくとも4つの連続したアミノ酸を含む、請求項58に記載の融合タンパク質。
【請求項60】
請求項58又は59に記載の融合タンパク質をコードする単離されたポリヌクレオチド。
【請求項61】
ウイルス様粒子を調製するための、請求項58もしくは59に記載の融合タンパク質又は請求項60に記載のポリヌクレオチドの使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公表番号】特表2010−508857(P2010−508857A)
【公表日】平成22年3月25日(2010.3.25)
【国際特許分類】
【出願番号】特願2009−536566(P2009−536566)
【出願日】平成19年10月25日(2007.10.25)
【国際出願番号】PCT/CA2007/001904
【国際公開番号】WO2008/058369
【国際公開日】平成20年5月22日(2008.5.22)
【出願人】(509135795)フォリア バイオテック インコーポレイテッド (2)
【Fターム(参考)】
【公表日】平成22年3月25日(2010.3.25)
【国際特許分類】
【出願日】平成19年10月25日(2007.10.25)
【国際出願番号】PCT/CA2007/001904
【国際公開番号】WO2008/058369
【国際公開日】平成20年5月22日(2008.5.22)
【出願人】(509135795)フォリア バイオテック インコーポレイテッド (2)
【Fターム(参考)】
[ Back to top ]

