ヒストンデアセチラーゼの阻害剤としてのヒドロキサメート
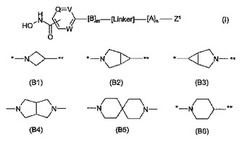
式(I)の化合物、並びにその塩、N-オキシド、水和物及び溶媒和物は、ヒストンデアセチラーゼ阻害剤であり、癌を含む細胞増殖性疾患の治療において有用である:ここで、Q、V及びWは独立して、-N=又は-C=を表し;Bは、(B1)、(B2)、(B3)、(B4)、(B5)及び(B6)から選択される2価の基(式中、*を付した結合手は、-[リンカー1]-を介してQ、V及びWを含有する環に連結し、**を付した結合手は、-[リンカー2]-を介してAに連結する)であり;Aは、任意に置換されていてもよい単環式、2環式若しくは3環式の炭素環式又は複素環式環系であり;-[リンカー1]-及び-[リンカー2]-は独立して、結合手、又は2価のリンカー基を表し;Rは、(a) 式R1R2CHNH-Y-L1-X1-(CH2)z-の基又は(b) 式R-L1-Y1-(CH2)z-の基である。


【発明の詳細な説明】
【技術分野】
【0001】
本発明は、酵素のヒストンデアセチラーゼファミリーのメンバーを阻害する化合物、並びに癌を含む細胞増殖性疾患、ポリグルタミン病、例えばハンチントン病、神経変性疾患、例えばアルツハイマー病、自己免疫疾患、例えばリウマチ性関節炎、及び臓器移植拒絶、糖尿病、血液学的疾患、炎症性疾患、心血管疾患、アテローム性動脈硬化症、及び感染の炎症性続発症の治療におけるそれらの使用に関する。
【背景技術】
【0002】
真核細胞内では、DNAはヒストンと共にパッケージされてクロマチンを形成する。約150塩基対のDNAが、ヒストンのオクタマー(ヒストン2A、2B、3及び4がそれぞれ2つずつ)の周囲に2回巻きついて、クロマチンの基本単位であるヌクレオソームを形成する。クロマチンの規則正しい構造は、関連する遺伝子の転写を可能にするために改変される必要がある。転写調節は、分化、増殖及びアポトーシスの鍵であり、よって厳密に制御される。クロマチン構造の変化(よって転写)の制御は、ヒストン、最も顕著にはN-末端尾部への共有結合的改変により媒介される。アミノ酸の側鎖の共有結合的改変(例えばメチル化、アセチル化、リン酸化及びユビキチン化)は、酵素により媒介される(ヒストンの共有結合的改変及び転写調節におけるそれらの役割についての総説は、Berger SL 2001 Oncogene 20, 3007〜3013に見出される;ヒストンのアセチル化及び転写の総説についてはGrunstein, M 1997 Nature 389, 349〜352; Wolffe AP 1996 Science 272, 371〜372;及びWade PAら 1997 Trends Biochem Sci 22, 128〜132を参照)。
【0003】
ヒストンのアセチル化は、転写活性があるクロマチンの領域に関連するが、アセチル化レベルが低いヌクレオソームは、典型的には、転写がサイレントである。ヒストンのアセチル化の状態は、相対する活性の2つの酵素クラスにより制御される:ヒストンアセチルトランスフェラーゼ(HAT)及びヒストンデアセチラーゼ(HDAC)である。形質転換細胞において、HDACの不適切な発現が、腫瘍サプレッサー遺伝子のサイレンシングをもたらすと考えられている(腫瘍形成におけるHDACの潜在的な役割の総説について、Gray SG及びTeh BT 2001 Curr Mol Med 1, 401〜429を参照)。HDAC酵素の阻害剤は、文献に記載され、動物において癌細胞増殖の阻害、アポトーシスの誘発及び腫瘍成長の阻害をもたらすいくつかの遺伝子の転写再活性化を導くことが示されている(総説として、Kelly WKら 2002 Expert Opin Investig Drugs 11, 1695〜1713を参照)。このような知見は、HDAC阻害剤が、癌(Kramer OHら 2001 Trends Endocrinol 12, 294〜300, Vigushin DM及びCoombes RC 2002 Anticancer Drugs 13, 1〜13)のような増殖性疾患の治療において治療的可能性を有することを示唆する。
【0004】
さらに、異常なHDAC活性又はヒストンアセチル化は、以下の疾患及び障害に関係していることが提案されている:ポリグルタミン病、例えばハンチントン病(Hughes RE 2002 Curr Biol 12, R141〜R143; McCampbell Aら 2001 Proc Soc Natl Acad Sci 98, 15179〜15184; Hockly Eら 2003 Proc Soc Natl Acad Sci 100, 2041〜2046)、その他の神経変性疾患、例えばアルツハイマー病(Hempen B及びBrion JP 1996, J Neuropathol Exp Neurol 55, 964〜972)、自己免疫疾患及び臓器移植拒絶 (Skov Sら 2003 Blood 101, 1430〜1438; Mishra Nら 2003 J Clin Invest 111, 539〜552)、糖尿病(Mosley AL及びOzcan S 2003 J Biol Chem 278, 19660〜19666)、並びに糖尿病合併症、感染(原虫感染を含む(Darkin-Rattray, SJら 1996 Proc Soc Natl Acad Sci 93, 13143〜13147))、及びサラセミアを含む血液学的疾患(Witt Oら 2003 Blood 101, 2001〜2007)。これらの原稿に記載される観察は、HDAC阻害がこれらの疾患及びその他の関連する疾患において治療上の利点を有するはずであることを示唆している。
【0005】
多くの種類のHDAC阻害剤化合物が提案され、このような化合物のいくつかが現在、癌の治療について臨床評価されている。例えば、以下の特許公報がこのような化合物を開示している:
【表1】

【0006】
当該技術において知られるHDAC阻害剤の多くが、式(A):
【化1】

(式中、環Aは、任意置換基Rを有する炭素環式又は複素環式環系であり、[リンカー]は、種々の型のリンカー基である)で表され得る構造的な鋳型を有する。ヒドロキサメート基は、折り畳まれた酵素構造中のポケットの底に位置するHDAC酵素の活性部位にて金属イオンと相互作用する金属結合基として機能する。環又は環系Aは、金属イオンを含有するポケットの中又は入口に位置し、-[リンカー]-基がポケットの奥に伸びて、Aを金属結合ヒドロキサム酸基に連結させる。当該技術において、そして本明細書において時には、環又は環系Aは、時々、阻害剤の「頭基(head group)」と非公式にいうことがある。
【0007】
国際特許出願第PCT/GB2006/001779号は、その構造が一般化された鋳型(A)に適合するHDAC阻害剤の新しいクラスを記載して請求している。この新しいクラスは、式(B)の化合物、並びにその塩、N-オキシド、水和物及び溶媒和物からなる:
【化2】

(式中、
Q、V及びWは独立して、-N=又は-C=を表し;
Bは、(B1)、(B2)、(B3)、(B4)及び(B5)から選択される2価の基である:
【0008】
【化3】

(式中、*の印を付した結合手は、-[リンカー1]-を介してQ、V及びWを含有する環に連結し、**の印を付した結合手は、-[リンカー2]-を介してAに連結し、Aは、単環式、2環式若しくは3環式の炭素環式又は複素環式環系であり、-[リンカー1]-及び-[リンカー2]-は独立して、結合手、又は2価のリンカー基を表す))。
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、HDAC阻害剤分子鋳型(B)及びある構造的に類似の鋳型へのアルファアミノ酸エステル基の導入が、細胞膜を介する作用物質の透過を促進し、そのことにより細胞内カルボキシルエステラーゼ活性がエステルを加水分解して親の酸を放出することが可能になることを見出したことに基づく。荷電されると、酸は、細胞の外に容易には輸送されず、よって、酸はここで蓄積して、活性HDAC阻害剤の細胞内濃度が増加する。このことは、効力及び作用の期間の増加を導く。よって、本発明は、構造(B)及びある関連する構造のアルファアミノ酸コンジュゲートである化合物のクラスを利用可能にする。アルファアミノ酸エステル部分は、細胞内カルボキシルエステラーゼの基質である(本明細書中では、「エステラーゼモチーフ」ともいう)。このようなコンジュゲート、及び対応する脱エステル化された親の酸は、HDACの細胞内阻害により利益を受ける癌のような疾患の治療において医薬的利用性を有する。
【課題を解決するための手段】
【0010】
本発明によると、式(I)の化合物、又はその塩、N-オキシド、水和物若しくは溶媒和物が提供される:
【化4】

【0011】
(式中、
m及びnは独立して0又は1であるが、但しm及びnの少なくとも一方は1である;
Q、V及びWは独立して、-N=又は-C=を表し;
Bは、(B1)、(B2)、(B3)、(B4)、(B5)及び(B6)から選択される2価の基であり:
【化5】

(式中、*を付した結合手は、Q、V及びWを含有する環に連結する)
【0012】
Aは、任意に置換されていてもよい単環式、2環式若しくは3環式の炭素環式又は複素環式環系であり;
-[リンカー]-は、結合手、又は2価のリンカー基を表し;
Z1は、(a) 式R1R2CHNH-Y-L1-X1-(CH2)z-の基、又は(b) 式R-L1-Y1-(CH2)z-の基であり、ここで:
Rは、式(X)又は(Y)の基であり:
【化6】

【0013】
R1は、カルボン酸基(-COOH)、又は1若しくは複数の細胞内エステラーゼ酵素によりカルボン酸基に加水分解され得るエステル基であり;
R6は、水素;又は任意に置換されていてもよいC1〜C6アルキル、C3〜C7シクロアルキル、アリール若しくはヘテロアリール、又は-(C=O)R3、-(C=O)OR3、若しくは-(C=O)NR3 (式中、R3は、水素又は任意に置換されていてもよい(C1〜C6)アルキルである)であり;
R2は、天然又は非天然のアルファアミノ酸の側鎖であり;
Yは、結合手、-C(=O)-、-S(=O)2-、-C(=O)O-、-C(=O)NR3-、-C(=S)-NR3、-C(=NH)-NR3、又は-S(=O)2NR3- (式中、R3は、水素、又は任意に置換されていてもよい C1〜C6アルキルである)であり;
Y1は、結合手、-(C=O)-、-S(O2)-、-C(=O)O-、-OC(=O)-、-(C=O)NR3-、-NR3(C=O)-、-S(O2)NR3-、-NR3S(O2)-、又は-NR3(C=O)NR4- (式中、R3及びR4は独立して、水素又は任意に置換されていてもよい(C1〜C6)アルキルである)であり;
【0014】
L1は、式-(Alk1)m(Q)n(Alk2)p-の2価の基であり、ここで、
m、n及びpは、独立して0又は1であり、
Qは、(i) 任意に置換されていてもよい2価の単環式若しくは2環式で5〜13員環の炭素環式又は複素環式基、又は(ii) pが0である場合、式-Q1-X2- (式中、X2は、-O-、-S-又はNRA- (式中、RAは、水素又は任意に置換されていてもよいC1〜C3アルキルである)であり、Q1は、任意に置換されていてもよい2価の単環式若しくは2環式で5〜13員環の炭素環式又は複素環式基である)の2価の基であり;
Alk1及びAlk2は独立して、任意に置換されていてもよい2価のC3〜C7シクロアルキル基、又は任意に置換されていてもよい直鎖又は分岐鎖のC1〜C6アルキレン、C2〜C6アルケニレン、又はC2〜C6アルキニレン基であって、エーテル(-O-)、チオエーテル(-S-)若しくはアミノ(-NRA-)結合(ここで、RAは、水素又は任意に置換されていてもよいC1〜C3アルキルである)を任意に含有するか又はこれらが末端をなしていてもよいものであり、
X1は、結合手、-C(=O)-;又は-S(=O)2-;-NR4C(=O)-、-C(=O)NR4-、-NR4C(=O)-NR5-、-NR4S(=O)2-、又は-S(=O)2NR4- (式中、R4及びR5は独立して、水素、又は任意に置換されていてもよいC1〜C6アルキルである)であり;
zは、0又は1である)。
【発明を実施するための形態】
【0015】
上記の定義は、高分子量の化合物を潜在的に含むが、医化学のプラクティスの一般的な原理に従うと、本発明が関係する化合物は、600以下の分子量を有することが好ましい。
【0016】
別の広い態様によると、本発明は、上記で定義される式(I)の化合物、又はそのN-オキシド、塩、水和物若しくは溶媒和物の、ヒストンデアセチラーゼの活性を阻害するための組成物の製造における使用を提供する。
本発明が関係する化合物は、エクスビボ又はインビボでのヒストンデアセチラーゼ活性の阻害のために用い得る。
【0017】
本発明のある態様によると、本発明の化合物は、細胞増殖疾患、例えば癌細胞増殖及び自己免疫疾患の治療用の組成物の製造に用い得る。
【0018】
別の態様において、本発明は、上記の種類の疾患に罹患した対象に、上記で定義される式(I)の化合物の有効量を投与することを含む上記の種類の疾患の治療方法を提供する。
【0019】
用語
本明細書で用いる場合、用語「(Ca〜Cb)アルキル」(ここで、a及びbは整数である)は、a〜b個の炭素原子を有する直鎖又は分岐鎖のアルキル基のことである。よって、例えばaが1でありbが6である場合、この用語は、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、イソブチル、sec-ブチル、t-ブチル、n-ペンチル及びn-ヘキシルを含む。
本明細書で用いる場合、用語「二価の(Ca〜Cb)アルキレン基」(ここで、a及びbは整数である)は、a〜b個の炭素原子と2つの不飽和原子価(unsatisfied valences)を有する飽和炭化水素鎖のことをいう。
【0020】
本明細書で用いる場合、用語「(Ca〜Cb)アルケニル」(ここで、a及びbは整数である)は、a〜b個の炭素原子を有し、適用可能である場合にE又はZの立体化学の少なくとも1つの二重結合をする直鎖又は分岐鎖のアルケニル部分のことである。この用語は、例えばビニル、アリル、1-及び2-ブテニル並びに2-メチル-2-プロペニルを含む。
本明細書で用いる場合、用語「二価の(Ca〜Cb)アルケニレン基」は、a〜b個の炭素原子、少なくとも1つの二重結合、及び2つの不飽和原子価を有する炭化水素鎖を意味する。
【0021】
本明細書で用いる場合、用語「Ca〜Cbアルキニル」(ここで、a及びbは整数である)は、a〜b個の炭素原子を有し、さらに1つの三重結合を有する直鎖又は分岐鎖の炭化水素基のことである。この用語は、例えばエチニル、1-プロピニル、1-及び2-ブチニル、2-メチル-2-プロピニル、2-ペンチニル、3-ペンチニル、4-ペンチニル、2-ヘキシニル、3-ヘキシニル、4-ヘキシニル及び5-ヘキシニルを含む。
本明細書で用いる場合、用語「二価の(Ca〜Cb)アルキニレン基」(ここで、a及びbは整数である)は、a〜b個の炭素原子及び少なくとも1つの三重結合を有する二価の炭化水素鎖である。
【0022】
本明細書で用いる場合、用語「炭素環式」は、全て炭素の16個までの環原子を有する単環式、2環式又は3環式の基のことであり、アリール及びシクロアルキルを含む。
本明細書で用いる場合、用語「シクロアルキル」は、3〜8個の炭素原子を有する単環式の飽和炭素環式基のことであり、例えばシクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル及びシクロオクチルを含む。
【0023】
本明細書で用いる場合、限定されていない用語「アリール」は、単環式、二環式又は三環式の炭素環式芳香族基のことであり、共有結合により直接連結された2つの単環式の炭素環式芳香族環を有する基を含む。このような基の例は、フェニル、ビフェニル及びナフチルである。
【0024】
本明細書で用いる場合、限定されていない用語「ヘテロアリール」は、S、N及びOから選択される1又は複数のヘテロ原子を含む単環式、2環式又は3環式の芳香族基のことであり、そのような単環式環を2つ有する基、又はそのような単環式環1つと1つの単環式アリール環とが共有結合により直接連結された基を含む。そのような基の例は、チエニル、ベンズチエニル、フリル、ベンズフリル、ピロリル、イミダゾリル、ベンズイミダゾリル、チアゾリル、ベンズチアゾリル、イソチアゾリル、ベンズイソチアゾリル、ピラゾリル、オキサゾリル、ベンズオキサゾリル、イソキサゾリル、ベンズイソキサゾリル、イソチアゾリル、トリアゾリル、ベンズトリアゾリル、チアジアゾリル、オキサジアゾリル、ピリジニル、ピリダジニル、ピリミジニル、ピラジニル、トリアジニル、インドリル及びインダゾリルである。
【0025】
明細書で用いる場合、限定されていない用語「ヘテロシクリル」又は「複素環式」は、上記で定義される「ヘテロアリール」を含み、その非芳香族の意味は、S、N及びOから選択される1又は複数のヘテロ原子を含む単環式、2環式又は3環式の非芳香族基、及びこのような1又は複数のへテロ原子を含む単環式の非芳香族基からなり、該非芳香族基が別のそのような基又は単環式の炭素環式基に共有結合した基に関する。そのような基の例は、ピロリル、フラニル、チエニル、ピペリジニル、イミダゾリル、オキサゾリル、イソキサゾリル、チアゾリル、チアジアゾリル、ピラゾリル、ピリジニル、ピロリジニル、ピリミジニル、モルホリニル、ピペラジニル、インドリル、モルホリニル、ベンズフラニル、ピラニル、イソキサゾリル、ベンズイミダゾリル、メチレンジオキシフェニル、エチレンジオキシフェニル、マレイミド及びスクシンイミド基である。
【0026】
その用語を用いるときの関係において特にそうでないと言及しない限りは、本明細書においていずれの部分に適用される用語「置換」は、4つまでの適合性の置換基で置換されることを意味し、そのそれぞれは独立して、例えば(C1〜C6)アルキル、(C1〜C6)アルコキシ、ヒドロキシ、ヒドロキシ(C1〜C6)アルキル、メルカプト、メルカプト(C1〜C6)アルキル、(C1〜C6)アルキルチオ、フェニル、ハロ (フルオロ、ブロモ及びクロロを含む)、トリフルオロメチル、トリフルオロメトキシ、ニトロ、ニトリル(-CN)、オキソ、-COOH、-COORA、-CORA、-SO2RA、-CONH2、-SO2NH2、-CONHRA、-SO2NHRA、-CONRARB、-SO2NRARB、-NH2、-NHRA、-NRARB、-OCONH2、-OCONHRA、-OCONRARB、-NHCORA、-NHCOORA、-NRBCOORA、-NHSO2ORA、-NRBSO2OH、-NRBSO2ORA、-NHCONH2、-NRACONH2、-NHCONHRB、-NRACONHRB、-NHCONRARB、又は-NRACONRARB (ここで、RA及びRBは独立して(C1〜C6)アルキル、(C3〜C6)シクロアルキル、フェニル又は5若しくは6個の環原子を有する単環式ヘテロアリールであるか、或いは同じ窒素原子に結合する場合、RA及びRBは環状アミノ基(例えばモルホリノ、ピペリジニル、ピペラジニル又はテトラヒドロピロリル)を形成する)であり得る。「任意の置換基」は、上記の置換基の1つであり得る。
【0027】
本明細書で用いる場合、用語「窒素置換基」は、以下から選択される窒素原子における置換基を意味する:
アミノC1-6アルキル、例えばアミノエチル、C1-3アルキルアミノ C1-6アルキル、C1-3ジアルキルアミノ C1-6アルキル、ヒドロキシ C1-6アルキル、例えばヒドロキシエチル、C1-3アルコキシ C1-6アルキル、例えばメトキシエチル、メルカプト C1-3アルキル、C1-3アルキルメルカプト C1-6アルキル、カルボキサミドC1-6アルキル、例えば-CH2CONH2、アミノスルホニル C1-6アルキル、例えば-CH2SO2NH2、C1-3アルキルアミノスルホニル C1-6アルキル、例えば-CH2SO2NHMe、C1-3ジアルキルアミノスルホニル C1-6アルキル、例えば-CH2SO2NMe2、C1-6アルカノイル、C1-6アルキルスルホニル、アミノスルホニル(-SO2NH2)、C1-6アルキルアミノスルホニル、例えば-SO2NHMe、C1-6ジアルキルアミノスルホニル、例えば-SO2NMe2、任意に置換されていてもよいフェニルアミノスルホニル、カルボキサミド(-CONH2)、C1-6アルキルアミノカルボニル、C1-6ジアルキルアミノカルボニル、モルホリニル C1-6アルキル、イミダゾリル C1-6アルキル、トリアゾリル C1-6アルキル、又は単環式へテロシクロアルキル C1-6アルキル(これらはイミダゾリル、トリアゾリル又はヘテロシクリル環で任意に置換されていてもよい)、例えばピペリジニル C1-6アルキル、ピペラジニル C1-6アルキル、又は4-(C1-6アルキル)ピペラジニル C1-6アルキル。
【0028】
本明細書で用いる場合、用語「塩」は、塩基付加塩、酸付加塩及び第4級塩を含む。酸性である本発明の化合物は、医薬的に許容される塩を含む塩を、例えばアルカリ金属水酸化物、例えば水酸化ナトリウム及びカリウム;アルカリ土類金属水酸化物、例えば水酸化カルシウム、バリウム及びマグネシウムのような塩基と;例えばN-メチル-D-グルカミン、コリントリス(ヒドロキシメチル)アミノメタン、L-アルギニン、L-リジン、N-エチルピペリジン、ジベンジルアミンのような有機塩基と形成できる。塩基性であるこれらの化合物(I)は、医薬的に許容される塩を含む塩を、例えばハロゲン化水素酸、例えば塩化水素酸又は臭化水素酸、硫酸、硝酸又はリン酸などの無機酸と、酢酸、酒石酸、コハク酸、フマル酸、マレイン酸、リンゴ酸、サリチル酸、クエン酸、メタンスルホン酸、p-トルエンスルホン酸、安息香酸、ベンゼンスルホン酸、グルタミン酸、乳酸及びマンデル酸などの有機酸とともに形成できる。
【0029】
不斉炭素原子の存在のために1又は複数の実際の又は潜在的なキラル中心を含む本発明の化合物は、鏡像異性体又は各キラル中心にてR若しくはSの立体化学を有するいくつかのジアステレオ異性体として存在し得る。本発明は、全てのこのような鏡像異性体及びジアステレオマー、並びにその混合物も含む。
【0030】
任意の適合可能な組み合わせで、600未満の分子量を有する化合物が好ましいことを念頭に置く本発明の化合物において、以下のとおりである。
【0031】
ヒドロキサメート基-C(=O)NHOH
本発明の化合物において、ヒドロキサメート基は、折り畳まれた酵素構造のポケットの底に位置するHDAC酵素の活性部位にて金属イオンと相互作用する金属結合基として機能する。
【0032】
Q、V及びWを含有する環
Q、V及びWのそれぞれは、-C=であり得るか、又はQ、V及びWの少なくとも1つは-N=であり得るか、又はQは-C=であり、V及びWはそれぞれ-N=であり得る。現在のところ好ましくは、Qが-C=であり、V及びWがそれぞれ-N=であり、HONHC(=O)-基が、その結果のピリミジン-2-イル基の5位に結合する場合である。
【0033】
環A
環A基は、例えば、任意に置換されていてもよい芳香族炭素環、例えば任意に置換されていてもよいフェニル及びナフチル、又は任意に置換されていてもよい複素芳香族、例えば任意に置換されていてもよいピロリル、フリル、チエニル、イミダゾリル、オキサゾリル、イソキサゾリル、チアゾリル、イソチアゾリル、ピラゾリル、1,2,3-トリアゾリル、1,2,4-トリアゾリル、1,3,4-トリアゾリル、1,2,5-トリアゾリル、1,2,3-オキサジアゾリル、1,2,4-オキサジアゾリル、1,2,5-オキサジアゾリル、1,3,4-オキサジアゾリル、1,3,4-チアジアゾール、ピリジル、ピリミジニル、ピリダジニル、ピラジニル、1,3,5-トリアジニル、1,2,4-トリアジニル、1,2,3-トリアジニル、ベンゾフリル、[2,3-ジヒドロ]ベンゾフリル、イソベンゾフリル、ベンゾチエニル、ベンゾトリアゾリル、イソベンゾチエニル、インドリル、イソインドリル、インダニル、3H-インドリル、ベンズイミダゾリル、インダゾリル、イミダゾ[1,2-a]ピリジル、ベンゾチアゾリル、ベンズオキサゾリル、キノリジニル、キナゾリニル、フタラジニル、キノキサリニル、シンノリニル、ナフチリジニル、ピリド[3,4-b]ピリジル、ピリド[3,2-b]ピリジル、ピリド[4,3-b]ピリジル、キノリル、イソキノリル、テトラゾリル、5,6,7,8-テトラヒドロキノリル、5,6,7,8-テトラヒドロイソキノリル、プリニル、プテリジニル、カルバゾリル、キサンテニル、又はベンゾキノリル基であり得る。
【0034】
環A基は、例えば、任意に置換されていてもよい非芳香族の炭素環及び複素環、例えば任意に置換されていてもよいシクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、2-シクロブテン-1-イル、2-シクロペンテン-1-イル、3-シクロペンテン-1-イル、2,4-シクロペンタジエン-1-イル、3,5-シクロヘキサジエン-1-イル、テトラヒドロフラニル、ピロリン、例えば2-又は3-ピロリニル、ピロリジニル、ジオキソラニル、例えば1,3-ジオキソラニル、イミダゾリニル、例えば2-イミダゾリニル、イミダゾリジニル、ピラゾリニル、例えば2-ピラゾリニル、ピラゾリジニル、ピラニル、例えば2-又は4-ピラニル、ピペリジニル、1,4-ジオキサニル、モルホリニル、1,4-ジチアニル、チオモルホリニル、ピペラジニル、1,3,5-トリチアニル、オキサジニル、例えば2H-1,3-、6H-1,3-、H-1,2-、2H-1,2-若しくは4H1,4-オキサジニル、1,2,5-オキサチアジニル、イソキサジニル、オキサチアジニル、例えば1,2,5若しくは1,2,6-オキサチアジニル、又は1,3,5-オキサジアジニル基でもあり得る。
【0035】
具体的な環A基は、任意に置換されていてもよい以下の環系を含む:
【化7】

【0036】
【化8】

【0037】
【化9】

(式中、R10は、水素、又はC1〜C6アルキルであり、波線が横切る結合手は、-[リンカー]-基に結合し、式(I)の基Rは、任意の利用可能な環原子に結合する)。
【0038】
A中の任意の置換基は、例えば、メチル、エチル、n-プロピル、イソプロピル、フッ素、塩素、臭素若しくはヨウ素原子、又はメチルアミノ、エチルアミノ、ヒドロキシメチル、ヒドロキシエチル、メチルチオール、エチルチオール、メトキシ、エトキシ、n-プロポキシ、2-ヒドロキシエトキシ、3-ヒドロキシプロポキシ、2-アミノエトキシ、3-アミノプロポキシ、2-(メチルアミノ)エトキシ、2-(ジメチルアミノ)エトキシ、3-(ジメチルアミノ)プロポキシ、シクロペンチル、シクロヘキシル、シクロヘキシルアミノ、トリフルオロメチル、トリフルオロメトキシ、アミノ(-NH2)、アミノメチル、アミノエチル、ジメチルアミノ、ジエチルアミノ、エチル(メチル)アミノ、プロピル(メチル)アミノ、2-ヒドロキシエチルアミノ、3-ヒドロキシプロピルアミノ、2-アミノエチルアミノ、3-アミノプロピルアミノ、2-(メチルアミノ)エチルアミノ、2-(エチルアミノ)エチルアミノ、2-(イソプロピルアミノ)エチルアミノ、3-(イソプロピルアミノ)プロピルアミノ、2-(ジメチルアミノ)エチルアミノ、2-(ジエチルアミノ)エチルアミノ、2-(メチルアミノ)エチル(メチル)アミノ、3-(メチルアミノ)プロピル(メチル)アミノ、ニトロ、シアノ、ヒドロキシル、ホルミル、
【0039】
カルボキシル(-CO2H)、-CH2CO2H、-OCH2CO2H、-CO2CH3、-CO2CH2CH3、-CH2CO2CH2CH3、-CH2CO2CH2Ph、t-ブトキシカルボニルメトキシ、アセチル、フェナシル、チオ、チオメチル、チオエチル、スルホニル、メチルスルホニル、メチルアミノスルホニル、エチルアミノスルホニル、ジメチルアミノスルホニル、カルボキサミド、メチルアミノカルボニル、エチルアミノカルボニル、ジメチルアミノカルボニル、ジエチルアミノカルボニル、メチルアミノカルボニルメチル、-NHC(S)NH2、スルホニルアミノ(-NHSO2H)、メチルスルホニルアミノ、ジメチルスルホニルアミノ、アミノスルホニルアミノ(-NHSO2NH2)、メチルアミノスルホニルアミノ、ジメチルアミノスルホニルアミノ、メチルアミノカルボニルアミノ、ジメチルアミノカルボニルアミノ、アセチルアミノ、フェニルカルボニルアミノ、アミノメチルカルボニルアミノ、アセチルアミノメチル、メトキシカルボニルアミノ、t-ブトキシカルボニルアミノ、ピロリジニル、ピペリジニル、ピペラジニル、4-メチルピペラジニル、ホモピペラジニル、モルホリニル、イミダゾリル、1,2,4-トリアゾリル、1.2.3-トリアゾリル、1,3,4-トリアゾリル、1,2,5-トリアゾリル、C1-6直鎖又は分岐鎖のアルキル、
【0040】
アミノC1-6アルキル、例えばアミノエチル、C1-3アルキルアミノ C1-6アルキル、C1-3 ジアルキルアミノ C1-6アルキル、ヒドロキシルC1-6アルキル、例えばヒドロキシエチル、C1-3 アルコキシルC1-6アルキル、例えばメトキシエチル、チオール C1-3アルキルC1-6, C1-3アルキルチオール C1-6アルキル、C1-6アルカノイル、C1-6アルキルスルホニル、アミノスルホニル(-SO2NH2)、C1-6アルキルアミノスルホニル、例えば-SO2NHMe、C1-6ジアルキルアミノスルホニル、例えば-SO2NMe2、任意に置換されていてもよいフェニルアミノスルホニル、カルボキサミド(-CONH2)、カルボキサミド C1-6アルキル、例えばCH2CONH2、C1-6アルキルアミノカルボニル、C1-6ジアルキルアミノカルボニル、アミノスルホニル C1-6アルキル、例えばCH2SO2NH2、C1-3アルキルアミノスルホニル C1-6アルキル、例えばCH2SO2NHMe、C1-3 ジアルキルアミノスルホニル C1-6アルキル、例えばCH2SO2NMe2、C1-6モルホリニル C1-6アルキル、任意に置換されていてもよいイミダゾリル C1-6アルキル、任意に置換されていてもよいトリアゾリル C1-6アルキル、任意に置換されていてもよいヘテロC3-6シクロアルキル C1-6アルキル、例えばピペリジニル C1-6アルキル、ピペラジニル C1-6アルキル、及び4-(C1-6アルキル)ピペラジニル C1-6アルキルであり得る。
【0041】
現在のところ好ましい環Aは、任意に置換されていてもよいフェニル、シクロヘキシル、ナフチル、キノリン-2-イル、及び1,3-ジヒドロ-イソインドール-2-イルを含む。このような好ましい環Aに存在し得る置換基は、ハロゲン、特にフルオロ及びクロロを含む。特に、式(I)中の基-A-は、存在する場合、1,4-フェニレン又は1,4-シクロへキシレンであり得る。
【0042】
[リンカー]基
-[リンカー]-は、2価のB基の、存在する場合に環Aへの連結を提供する。つまり、これは、以下の例から選択できる:
(i) 結合手。これは、通常、環Aが存在しない場合である;
(ii) -O-、-S-、-C(=O)-、-S(=O)2-、-NRC-、-C(=O)NRC-、-S(=O)2NRC-、-NRCC(=O)-、-NRCS(=O)2-、-NRC(CH2)m-、-NRCC(=O)(CH2)m-、-NRCS(=O)2(CH2)m、-NRDC(=O)NRC-、-NRCC(=O)(CH2)mAr-、又は-NRCS(=O)2(CH2)mAr- (ここで、RC及びRDは独立して、水素、C1〜C4アルキル、又は窒素置換基であり、mは、0、1、2、3、4又は5であり、Arは、2価のフェニル基又は2価の単環式若しくは2環式の5〜13員環のヘテロアリール基である);並びに
(iii) 任意に置換されていてもよい直鎖又は分岐鎖のC1〜C6アルキレン、C2〜C6アルケニレン又はC2〜C6アルキニレン基であって、エーテル(-O-)、チオエーテル(-S-)又はアミノ(-NRA-)結合(ここで、RAは、水素、C1〜C3アルキル、又は窒素置換基である)を任意に含むか又はこれらが末端をなしていてもよいもの。
【0043】
-Ar-が-[リンカー]-中に存在する場合、これは、以下から選択される2価の基であり得る:
【化10】

(式中、Xは、O、S又はNHである)。例えば、-[リンカー]-中に存在する場合、-Ar-は、2価のフェニレン、例えば1,4-フェニレン基であり得る。
-[リンカー]-の例は、本明細書の具体的な実施例の化合物に存在するものを含む。
【0044】
Z1基
ケース(a):Z1は、式-(CH2)z-X1-L1-Y-NHCHR1R2の基である。
Z1のケース(a)におけるR1基
エステル基R1は、本発明の化合物において、1又は複数の細胞内カルボキシエステラーゼ酵素によりカルボン酸基に加水分解され得るものでなければならない。本発明の化合物のエステル基を対応する酸に加水分解できる細胞内カルボキシエステラーゼ酵素は、3つの既知のヒト酵素アイソタイプであるhCE-1、hCE-2及びhCE-3を含む。これらは、主要な酵素であると考えられるが、ビフェニルヒドロラーゼ(BPH)のようなその他の酵素も、エステルの加水分解において役割を有し得る。一般的に、カルボキシエステラーゼが遊離のアミノ酸エステルを親の酸に加水分解するならば、これは、上記のようなhCE-2及びhCE-3のN-カルボニル依存性に従って、HDAC阻害剤に共有的にコンジュゲートしている場合、エステルモチーフも加水分解する。よって、本明細書に記載される破砕細胞アッセイ及び/又は単離カルボキシエステラーゼアッセイは、要求される加水分解プロファイルを有するエステルについての直接的で迅速で単純な1次スクリーニングを提供する。このようにして選択されるエステルモチーフは、次いで、選択されたコンジュゲーション化学により阻害剤にコンジュゲートされている場合に、同じカルボキシエステラーゼアッセイで再びアッセイされて、その背景においてもまだカルボキシエステラーゼの基質であることが確認される。
【0045】
細胞内カルボキシエステラーゼ酵素により加水分解され得るという要件に従って、特定のエステル基R1の例は、式-(C=O)OR9
(式中、R9は、R7R8CH-であり、ここで、
(i) R7は、水素又は任意に置換されていてもよい(C1〜C3)アルキル-(Z1)a-[(C1〜C3)アルキル]b-、又は(C2〜C3)アルケニル-(Z1)a-[(C1〜C3)アルキル]b- (式中、a及びbは独立して0又は1であり、Z1は、-O-、-S-、又は-NR10- (式中、R10は、水素又はC1〜C3アルキルである)である)であり、R8は、水素、又は(C1〜C3)アルキル-であるか;
(ii) R7は、水素、又は任意に置換されていてもよいR10R11N-(C1〜C3)アルキル- (式中、R10は、水素、又はC1〜C3アルキルであり、R11は、水素又はC1〜C3アルキルであるか、或いはR10とR11はそれらが結合している窒素と一緒に、任意に置換されていてもよい単環式で5若しくは6環原子の複素環式環、又は2環式で8〜10環原子の複素環式環系を形成する)であり、R8は、水素又は(C1〜C3)アルキル-であるか;或いは
(iii) R7及びR8は、それらが結合している炭素と一緒に、任意に置換されていてもよい単環式で3〜7環原子の炭素環式環、又は2環式で8〜10環原子の炭素環式環系を形成する)
のものを含む。
【0046】
これらのクラスのうち、R9は、例えば、メチル、エチル、n-若しくはイソ-プロピル、n-、sec-若しくはtert-ブチル、シクロヘキシル、アリル、フェニル、ベンジル、2-、3-若しくは4-ピリジルメチル、N-メチルピペリジン-4-イル、テトラヒドロフラン-3-イル、メトキシエチル、インダニル、ノルボルニル、ジメチルアミノエチル、モルホリノエチルであり得る。現在のところ好ましくは、R90がシクロペンチルである場合である。
【0047】
マクロファージは、サイトカイン、特にTNFα及びIL-1の放出により炎症性障害において重要な役割を演じることが知られている(van Roonら Arthritis and Rheumatism, 2003, 1229〜1238)。リウマチ性関節炎において、これらは、関節の炎症及び関節の破壊の維持に主に寄与する。マクロファージは、腫瘍の成長及び発生にも関わる(Naldini及びCarraro, Curr Drug Targets Inflamm Allergy, 2005, 3〜8)。よって、マクロファージ細胞増殖を選択的に標的にする作用物質は、癌及び自己免疫疾患の治療において価値があるだろう。特定の種類の細胞を標的にすることは、副作用の低減を導くと予測される。本発明者らは、阻害剤をマクロファージにターゲティングする方法を見出し、これは、エステラーゼモチーフが阻害剤に連結される様式が、それが加水分解されるかを決定し、よって、それが異なる種類の細胞において蓄積されるか否かを決定するという観察に基づく。具体的には、マクロファージはヒトカルボキシルエステラーゼhCE-1を含有するが、他の種類の細胞は含有しないことが見出された。エステラーゼモチーフR1CH(R2)NH-の窒素が、カルボニル(-C(=O)-)に直接連結されない場合、すなわち、Yが-C(=O)でも-C(=O)O-でも-C(=O)NR3-基でもない場合の一般式(I)において、エステルは、hCE-1のみにより加水分解され、よって、阻害剤はマクロファージ中にのみ蓄積する。
【0048】
Z1のケース(a)におけるアミノ酸側鎖R2
エステル基R1が細胞内カルボキシルエステラーゼ酵素により加水分解され得るという要件に従って、側鎖R2基が何であるかは、重要でない。
アミノ酸側鎖の例は、以下のものを含む:
C1〜C6アルキル、フェニル、2-、3-若しくは4-ヒドロキシフェニル、2-、3-若しくは4-メトキシフェニル、2-、3-若しくは4-ピリジルメチル、ベンジル、フェニルエチル、2-、3-若しくは4-ヒドロキシベンジル、2-、3-若しくは4-ベンジルオキシベンジル、2-、3-若しくは4-C1〜C6アルコキシベンジル、及びベンジルオキシ(C1〜C6アルキル)-基;
天然αアミノ酸の特徴的な基、ここで任意の官能基は保護されていてもよい;
【0049】
-[Alk]nR6基(式中、Alkは、1又は複数の-O-若しくは-S-原子が任意に介在していてもよい(C1〜C6)アルキル又は(C2〜C6)アルケニル基、或いは-N(R7)-基[式中、R7は、水素原子又は(C1〜C6)アルキル基である]であり、nは0又は1であり、R6は、任意に置換されていてもよいシクロアルキル又はシクロアルケニル基である);
フェニル環において、式-OCH2COR8 (式中、R8は、ヒドロキシル、アミノ、(C1〜C6)アルコキシ、フェニル(C1〜C6)アルコキシ、(C1〜C6)アルキルアミノ、ジ((C1〜C6)アルキル)アミノ、フェニル(C1〜C6)アルキルアミノ、アミノ酸若しくは酸ハロゲン化物の残基、そのエステル若しくはアミド誘導体(この残基は、アミド結合により連結され、アミノ酸は、グリシン、α若しくはβアラニン、バリン、ロイシン、イソロイシン、フェニルアラニン、チロシン、トリプトファン、セリン、スレオニン、システイン、メチオニン、アスパラギン、グルタミン、リジン、ヒスチジン、アルギニン、グルタミン酸及びアスパラギン酸から選択される)である)の基により置換されたベンジル基;
【0050】
非置換であるか、又は複素環式環においてハロ、ニトロ、カルボキシ、(C1〜C6)アルコキシ、シアノ、(C1〜C6)アルカノイル、トリフルオロメチル (C1〜C6)アルキル、ヒドロキシ、ホルミル、アミノ、(C1〜C6)アルキルアミノ、ジ-(C1〜C6)アルキルアミノ、メルカプト、(C1〜C6)アルキルチオ、ヒドロキシ(C1〜C6)アルキル、メルカプト(C1〜C6)アルキル又は(C1〜C6)アルキルフェニルメチルで1若しくは2置換された複素環式(C1〜C6)アルキル基;並びに
【0051】
-CRaRbRc基、ここで
Ra、Rb及びRcはそれぞれ独立して、水素、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、フェニル(C1〜C6)アルキル、(C3〜C8)シクロアルキルであるか;又は
Rcは水素であり、Ra及びRbは独立して、フェニル又はヘテロアリール、例えばピリジルであるか;又は
Rcは、水素、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、フェニル(C1〜C6)アルキル、又は(C3〜C8)シクロアルキルであり、Ra及びRbは、それらが結合している炭素原子と一緒に、3〜8員のシクロアルキル又は5-若しくは6-員の複素環式環を形成するか;又は
Ra、Rb及びRcは、それらが結合している炭素原子と一緒に、3環式の環(例えばアダマンチル)を形成するか;又は
【0052】
Ra及びRbはそれぞれ独立して、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、フェニル(C1〜C6)アルキル、又は水素以外の以下のRcについて定義される基であるか、又はRa及びRbは、それらが結合している炭素原子と一緒に、シクロアルキル又は複素環式環を形成し、かつRcは、水素、-OH、-SH、ハロゲン、-CN、-CO2H、(C1〜C4)ペルフルオロアルキル、-CH2OH、-CO2(C1〜C6)アルキル、-O(C1〜C6)アルキル、-O(C2〜C6)アルケニル、-S(C1〜C6)アルキル、-SO(C1〜C6)アルキル、-SO2(C1〜C6)アルキル、-S(C2〜C6)アルケニル、-SO(C2〜C6)アルケニル、-SO2(C2〜C6)アルケニル又は基-Q-W (式中、Qは、結合手、又は-O-、-S-、-SO-若しくは-SO2-を表し、Wは、フェニル、フェニルアルキル、(C3〜C8)シクロアルキル、(C3〜C8)シクロアルキルアルキル、(C4〜C8)シクロアルケニル、(C4〜C8)シクロアルケニルアルキル、ヘテロアリール又はヘテロアリールアルキル基を表し、基Wは、ヒドロキシル、ハロゲン、-CN、-CO2H、-CO2(C1〜C6)アルキル、-CONH2、-CONH(C1〜C6)アルキル、-CONH(C1〜C6アルキル)2、-CHO、-CH2OH、(C1〜C4)ペルフルオロアルキル、-O(C1〜C6)アルキル、-S(C1〜C6)アルキル、-SO(C1〜C6)アルキル、-SO2(C1〜C6)アルキル、-NO2、-NH2、-NH(C1〜C6)アルキル、-N((C1〜C6)アルキル)2、-NHCO(C1〜C6)アルキル、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、(C3〜C8)シクロアルキル、(C4〜C8)シクロアルケニル、フェニル又はベンジルから独立して選択される1若しくは複数の置換基で任意に置換されていてもよい)である。
【0053】
具体的なR2基の例は、水素(グリシンの「側鎖」)、ベンジル、フェニル、シクロヘキシルメチル、シクロヘキシル、ピリジン-3-イルメチル、tert-ブトキシメチル、イソ-ブチル、sec-ブチル、tert-ブチル、1-ベンジルチオ-1-メチルエチル、1-メチルチオ-1-メチルエチル、1-メルカプト-1-メチルエチル、及びフェニルエチルを含む。現在のところ好ましいR2基は、フェニル、ベンジル、及びイソ-ブチル、シクロヘキシル及びt-ブトキシメチルを含む。
【0054】
全身投与される本発明の化合物について、カルボキシルエステラーゼ切断の速度が遅いエステルが好ましい。なぜなら、これらは、前全身代謝(pre-systemic metabolism)により影響されにくいからである。それらの標的組織に無傷で到達する能力は、よって、増加し、エステルは、標的組織の細胞の内部で酸生成物に変換され得る。しかし、エステルが標的組織に直接用いられるか、又は例えば吸入によりそこに指向される局所投与については、全身への曝露を最小限にし、それにより不要な副作用を最小限にするために、エステラーゼ切断の速度が速いエステルがしばしば望ましい。本発明の化合物において、アルファアミノ酸エステルのアルファ炭素に隣接する炭素が1置換である場合、すなわちR2がCH2Rz (Rzは1置換である)である場合、R2が例えばフェニル又はシクロヘキシルである場合のように炭素原子が2-又は3-置換である場合よりも、エステルがより迅速に切断される傾向にある。
【0055】
Z1のケース(a)における基-Y-L1-X1-[CH2]z-
この基(又は結合手)は、アミノ酸エステルモチーフR1CH(R2)NH-を、環A (存在する場合)又は環B (-[リンカー]-基により)に連結させるように選択される具体的な化学方策により生じる。このカップリングについての化学方策は、明らかに、広く変動でき、よって、変動可能なY、L1、X1及びzの多くの組み合わせが可能である。しかし、阻害剤がHDAC酵素にその活性部位にて結合する場合、環B及び/又はAは、酵素の金属イオン含有ポケットの頂部、又はその中に位置して、アミノ酸エステルモチーフをこれらの環に連結することにより、これは、通常、該ポケットから離れる方向に伸長し、そのことにより阻害剤の結合様式との干渉を最小限にするか又は回避する。よって、アミノ酸エステルモチーフと環B及び/又はAとの間の連結化学を形成する可変部の厳密な組み合わせは、全体としての化合物の1次結合様式(primary binding mode)とは無関係である。一方、この連結化学は、金属イオン含有ポケットの頂部で又はそれに隣接して酵素との付加的な結合相互作用を採用して、それにより結合を促進し得る場合がある。
【0056】
上記のアミノ酸エステルモチーフの利点(細胞内への容易な侵入、細胞内でのカルボキシルエステラーゼの加水分解、及び活性カルボン酸加水分解生成物の細胞内での蓄積)は、アミノ酸エステルモチーフと、環B及び/又はAとの間の連結が、細胞内のペプチダーゼ活性の基質でない場合に最もよく達成される(これは、分子からのアミノ酸の切断をもたらす)。もちろん、細胞内ペプチダーゼの安定性は、化合物を破砕細胞内容物とインキュベートし、いずれのそのような切断について分析することにより容易に試験される。
【0057】
上記の一般的な観察を念頭において、基-Y-L1-X1-[CH2]z-を形成する可変部を以下に順に示す。
zは、0又は1であり得、それにより、環A又は環Bに連結されるメチレン基は任意である。
マクロファージ選択性が必要でない場合のYの好ましい具体例は、-(C=O)-、-(C=O)NH-、及び-(C=O)O-を含む。マクロファージ選択性が必要な場合、Yが結合手である場合を含むYについてのその他の選択肢のいずれかが適切である。
【0058】
基L1において、存在する場合にAlk1及びAlk2基の例は、-CH2-、-CH2CH2-、-CH2CH2CH2-、-CH2CH2CH2CH2-、-CH=CH-、-CH=CHCH2-、-CH2CH=CH-、CH2CH=CHCH2- -C≡C-、-C≡CCH2-、CH2C≡C-、及びCH2C≡CCH2を含む。Alk1及びAlk2のさらなる例は、-CH2W-、-CH2CH2W-、-CH2CH2WCH2-、-CH2CH2WCH(CH3)-、-CH2WCH2CH2-、-CH2WCH2CH2WCH2-、及び-WCH2CH2- (式中、Wは-O-、-S-、-NH-、-N(CH3)-、又は-CH2CH2N(CH2CH2OH)CH2-である)を含む。Alk1及びAlk2のさらなる例は、2価のシクロプロピル、シクロペンチル及びシクロヘキシル基を含む。
【0059】
L1において、qが0である場合、この基は、炭化水素鎖(任意に置換されていてもよく、エーテル、チオエーテル又はアミノ結合をおそらく有する)である。現在のところ、L1には任意の置換基が存在しないのが好ましい。p及びrがともに0である場合、L1は、2価の単環式若しくは2環式の5〜13環原子を有する炭素環式又は複素環式基(任意に置換されていてもよい)である。nが1であり、p及びrの少なくとも一方が1である場合、L1は、炭化水素鎖及び単環式若しくは2環式の5〜13環原子を有する炭素環式又は複素環式基(任意に置換されていてもよい)を含む2価の基である。存在する場合、Q1は、例えば2価のフェニル、ナフチル、シクロプロピル、シクロペンチル若しくはシクロヘキシル基、又は単環式若しくは2環式の5〜13員環の複素環式基、例えばピペリジニル、ピペラジニル、インドリル、ピリジル、チエニル、又はピロリル基であり得るが、1,4-フェニレンが現在のところ好ましい。
【0060】
具体的には、本発明のいくつかの実施形態において、qが1であってL1、p及びrは0であり得る。別の実施形態において、pが1であってq及びrは0であり得る。さらなる実施形態において、p、q及びrは全て0であり得る。さらなる実施形態において、pは0であり得、Q1が単環式の複素環式基であってqは1であり得、rは0又は1であり得る。Alk1及びAlk2は、存在する場合、-CH2-、-CH2CH2-、及び-CH2CH2CH2-から選択でき、Q1は1,4-フェニレンであり得る。
【0061】
基-Y-L1-X1-[CH2]z-の具体例は、-C(=O)-及び-C(=O)NH-、並びに-(CH2)v-、-(CH2)vO-、-C(=O)-(CH2)v-、-C(=O)-(CH2)vO-、-C(=O)-NH-(CH2)w-、-C(=O)-NH-(CH2)wO-
【化11】

(式中、vは1、2、3又は4であり、wは1、2又は3、例えば-CH2-、-CH2O-、-C(=O)-CH2-、-C(=O)-CH2O-、-C(=O)-NH-CH2-、及び-C(=O)-NH-CH2O-である)
を含む。
【0062】
ケース(b):Z1が、式-(CH2)z-Y1-L1-Rの基である。
Z1のケース(b)におけるR基
Rは、式(X)又は(Y)の基である。
【化12】

【0063】
式(X)及び(Y)において、R1は、Z1のケース(a)ついて上記で定義され、議論されるようなカルボン酸基、又は1若しくは複数の細胞内カルボキシルエステラーゼ酵素によりカルボン酸基に加水分解され得るエステル基である。
【0064】
Z1のケース(b)における環D
Rが式(Y)の基である場合、Rの例は:
【化13】

(式中、R1は、上記で定義され、議論されるとおりである)
を含む。
【0065】
Z1のケース(b)におけるR6基
R6基は、Rが式(X)の基である場合に本発明の化合物に存在する。
上記のように、モジュレーターが、マクロファージのようにhCE-1が存在する細胞種においてのみ作用することを意図する場合、カルボキシルエステラーゼモチーフのアミノ基は、カルボニル以外の基に直接連結されるべきである。このような場合、R6は、任意に置換されていてもよいC1〜C6アルキル、C3〜C7シクロアルキル、アリール又はヘテロアリール、例えばメチル、エチル、n-若しくはイソプロピル、シクロプロピル、シクロペンチル、シクロヘキシル、フェニル又はピリジルであり得る。マクロファージ特異性が必要でない場合、R6は、水素又は-(C=O)RD (式中、RDは、任意に置換されていてもよい(C1〜C6)アルキル、例えばメチル、エチル、n-若しくはイソプロピル、又はn-、イソ-若しくはsec-ブチル、(C3〜C7)シクロアルキル、例えばシクロプロピル、シクロペンチル、シクロヘキシル、フェニル、ピリジル、チエニル、フェニル(C1〜C6アルキル)-、チエニル(C1〜C6アルキル)-、又はピリジル(C1〜C6アルキル)-、例えばベンジル、4-メトキシフェニルメチルカルボニル、チエニルメチル又はピリジルメチルである)であり得る。
【0066】
R6は、例えば-(C=O)ORD、又は-(C=O)NHRD (式中、RDは、水素又は任意に置換されていてもよい(C1〜C6)アルキル、例えばメチル、エチル、又はn-若しくはイソプロピルである)でもあり得る。
【0067】
全身投与される本発明の化合物について、エステラーゼ切断の速度が遅いエステルが好ましい。なぜなら、これらは、前全身代謝により影響されにくいからである。それらの標的組織に無傷で到達する能力は、よって、増加し、エステルは、標的組織の細胞の内部で酸生成物に変換され得る。しかし、エステルが標的組織に直接用いられるか、又は例えば吸入によりそこに指向される局所投与については、全身への曝露を最小限にし、それにより不要な副作用を最小限にするために、エステラーゼ切断の速度が速いエステルがしばしば望ましい。R基が結合している炭素原子が非置換である場合、すなわちRがメチレン(-CH2)-基に結合する場合、炭素が置換されているか、又はフェニル若しくはシクロヘキシル環のような環系の一部分である場合よりも、エステルはより迅速に切断される傾向がある。
【0068】
Z1のケース(b)における-L1-Y1-[CH2]z-基
Z1のケース(a)と同様に、この基(又は結合手)は、置換基Yにおけるアミノ酸エステルモチーフRを、分子の残りの部分に連結させるように選択される具体的な化学方策から生じる。このカップリングについての化学方策は、明らかに、広く変動でき、変動可能なY1、L1及びzの多くの組み合わせが可能である。しかし、阻害剤が酵素にその活性部位にて結合する場合、アミノ酸エステルモチーフは、通常、酵素から離れる方向に伸長し、そのことにより阻害剤の結合様式との干渉を最小限にするか又は回避する。よって、アミノ酸エステルモチーフと分子の残りの部分との間の連結化学を形成する可変部の厳密な組み合わせは、全体としての化合物の1次結合様式とはしばしば無関係である。
【0069】
上記の一般的な観察を念頭において、基-L1-Y1-[CH2]z-を形成する可変部を以下に順に示す。
zは、0又は1であり得、それにより、分子の残りの部分に連結されるメチレン基は任意である。
Y1は、例えば、-NR3-、-S-、-O-、-C(=O)NR3-、-NR3C(=O)-又は-C(=O)O- (式中、R3は、水素又は任意に置換されていてもよいC1〜C6アルキル、例えば-CH2CH2OHである)であり得る。
【0070】
基L1において、存在する場合、Alk1及びAlk2基の例は、-CH2-、-CH2CH2-、-CH2CH2CH2-、-CH2CH2CH2CH2-、-CH=CH-、-CH=CHCH2-、-CH2CH=CH-、CH2CH=CHCH2-、-C≡C-、-C≡CCH2-、CH2C≡C-、及びCH2C≡CCH2を含む。Alk1及びAlk2のさらなる例は、-CH2W-、-CH2CH2W-、-CH2CH2WCH2-、-CH2CH2WCH(CH3)-、-CH2WCH2CH2-、-CH2WCH2CH2WCH2-、及び-WCH2CH2- (式中、Wは-O-、-S-、-NH-、-N(CH3)-、又は-CH2CH2N(CH2CH2OH)CH2-である)を含む。Alk1及びAlk2のさらなる例は、2価のシクロプロピル、シクロペンチル及びシクロヘキシル基を含む。
【0071】
Alk1及びAlk2は、存在する場合、分岐鎖のアルキル、例えば-CH(CH3)-、-C(CH3)2-、又はいずれの向きでの-CH2CH(CH3)-、-CH2C(CH3)2-でもあり得る。
【0072】
L1において、nが0である場合、この基は、炭化水素鎖(任意に置換されていてもよく、エーテル、チオエーテル又はアミノ結合をおそらく有する)である。現在のところ、L1には任意の置換基が存在しないのが好ましい。m及びpがともに0である場合、L1は、2価の単環式若しくは2環式の5〜13環原子を有する炭素環式又は複素環式基(任意に置換されていてもよい)である。nが1であり、m及びpの少なくとも一方が1である場合、L1は、炭化水素鎖及び単環式若しくは2環式の5〜13環原子を有する炭素環式又は複素環式基(任意に置換されていてもよい)を含む2価の基である。存在する場合、Qは、例えば2価のフェニル、ナフチル、シクロプロピル、シクロペンチル若しくはシクロヘキシル基、又は単環式若しくは2環式の5〜13員環の複素環式基、例えばピペリジニル、ピペラジニル、インドリル、ピリジル、チエニル、又はピロリル基であり得るが、1,4-フェニレンが現在のところ好ましい。
【0073】
具体的には、本発明のいくつかの実施形態において、nが1であってL1、m及びpは0であり得る。別の実施形態において、mが1であってn及びpは0であり得る。さらなる実施形態において、m、n及びpは全て0であり得る。さらなる実施形態において、mは0であり得、Qが単環式の複素環式基であってnは1であり得、pは0又は1であり得る。Alk1及びAlk2は、存在する場合、-CH2-、-CH2CH2-、及び-CH2CH2CH2-から選択でき、Qは1,4-フェニレンであり得る。
【0074】
基-L1-Y1-[CH2]z-の具体例は、-(CH2)3NH-、-CH2C(=O)NH-、-CH2CH2C(=O)NH-、-CH2C(O)O-、-CH2S-、-CH2CH2C(O)O-、-(CH2)4NH-、-CH2CH2S-、-CH2O、-CH2CH2O-、
【化14】

を含む。
【0075】
上記のように、本発明が関係する化合物は、HDAC阻害剤であり、よって、ヒト及びその他の哺乳動物における癌のような細胞増殖性疾患の治療に有用であり得る。
【0076】
いずれの特定の患者についての具体的な用量レベルは、用いられる具体的な化合物の活性、年齢、体重、全身の健康、性別、食餌、投与の時間、投与経路、排出速度、薬物の組み合わせ及び治療を受ける特定の疾患の重篤度を含む種々の因子に依存することが理解されるであろう。最適用量レベル及び投与の頻度は、臨床試験により決定される。
【0077】
本発明が関係する化合物は、それらの薬物動態学的特性に矛盾しないいずれの経路による投与のために製造できる。経口投与可能な組成物は、錠剤、カプセル剤、散剤、顆粒剤、ロゼンジ、液剤又はゲル製剤の形、例えば経口、局所若しくは滅菌非経口の溶液又は懸濁液の形であり得る。
経口投与のための錠剤及びカプセル剤は、単位用量提示形態(unit dose presentation form)であり得、通常の賦形剤、例えば結合剤、例えばシロップ、アカシア、ゼラチン、ソルビトール、トラガカント又はポリビニルピロリドン;充填剤、例えばラクトース、ショ糖、トウモロコシデンプン、リン酸カルシウム、ソルビトール又はグリシン;打錠滑沢剤、例えばステアリン酸マグネシウム、タルク、ポリエチレングリコール、又はシリカ;崩壊剤、例えばバレイショデンプン、或いは許容される湿潤剤、例えばラウリル硫酸ナトリウムを含有し得る。錠剤は、通常の製薬のプラクティスにおいて公知の方法に従って被覆できる。
経口の液体製剤は、例えば水性若しくは油性の懸濁剤、液剤、乳剤、シロップ又はエリキシル剤の形であり得るか、或いは使用前に水又はその他の適切なビヒクルを用いる再構成のための乾燥物質であり得る。このような液体製剤は、通常の添加剤、例えば懸濁剤、例えばソルビトール、シロップ、メチルセルロース、グルコースシロップ、ゼラチン硬化食用油;乳化剤、例えばレシチン、ソルビタンモノオレエート、又はアカシア;非水性ビヒクル(食用油を含み得る)、例えばアーモンド油、ヤシ油、油状エステル、例えばグリセリン、プロピレングリコール又はエチルアルコール;防腐剤、例えばメチル若しくはプロピルp-ヒドロキシベンゾエート又はソルビン酸、並びに所望により通常の矯味矯臭剤又は着色剤を含み得る。
【0078】
吸入による局所的な使用のために、薬剤は、例えば圧力駆動噴射噴霧器又は超音波噴霧器によるか、或いは好ましくは噴射剤駆動計量供給エアロソル又は微粉末の噴射剤フリーの投与、例えば吸入カプセル若しくはその他の「乾燥粉末」送達系によるエアロソル送達用に処方できる。賦形剤、例えば噴射剤(例えば計量供給エアロソルの場合、Frigen)、界面活性剤、乳化剤、安定化剤、防腐剤、矯味矯臭剤及び充填剤(例えば粉末吸入器の場合、ラクトース)が、このような吸入製剤に存在し得る。吸入の目的のために、患者に適する吸入法を用いて、最適粒子サイズのエアロソルを発生させ投与できる多数の装置が利用可能である。アダプタ(スペーサー、エキスパンダー)及び洋ナシ形の容器(例えばNebulator(登録商標)、Volumatic(登録商標))、及び特に粉末吸入器の場合の計量供給エアロソル用の吹きかけるスプレーを発射する自動装置(Autohaler(登録商標))に加えて、多くの技術的解決法が利用可能である(例えば、Diskhaler(登録商標)、Rotadisk(登録商標)、Turbohaler(登録商標)、又は欧州特許出願EP 0 505 321に記載されるような吸入器)。
【0079】
皮膚への局所的な塗布のために、薬剤は、クリーム、ローション又は軟膏剤として製造できる。薬剤に使用し得るクリーム又は軟膏の製剤は、例えば英国薬局方のような製薬の標準的な参考書に記載されるような当該技術において公知の通常の製剤である。
【0080】
眼への局所的な使用のために、薬剤は、適切な滅菌の水性又は非水性のビヒクル中の液剤又は懸濁剤として製造できる。添加剤、例えば緩衝剤、例えばメタ重硫酸ナトリウム又はエデト酸二ナトリウム;殺菌剤及び殺真菌剤を含む防腐剤、例えば酢酸-若しくは硝酸-フェニル第2水銀、塩化ベンザルコニウム又はクロルヘキシジン、及び増粘剤、例えばヒプロメロースも含まれることができる。
【0081】
活性成分は、滅菌媒体中で非経口的に投与することもできる。用いるビヒクル及び濃度に応じて、薬剤は、ビヒクル中に懸濁又は溶解できる。有利には、アジュバント、例えば局所麻酔剤、防腐剤及び緩衝剤をビヒクル中に溶解できる。
【実施例】
【0082】
合成
本発明が関係する化合物(I)の合成のための合成方策は、複数存在するが、全て、合成有機化学者に知られる既知の化学に基づく。つまり、式(I)による化合物は、標準的な文献に記載され、当業者に公知の手順に従って合成できる。典型的な文献の出典は、「Advanced organic chemistry」, 第4版(Wiley), J March、「Comprehensive Organic Transformation」, 第2版(Wiley), R.C. Larock、「Handbook of Heterocyclic Chemistry」, 第2版(Pergamon), A.R. Katritzky、「Synthesis」、「Acc. Chem. Res.」、「Chem. Rev」に見出されるような総説の文献、又は標準的な文献検索により同定される1次的な文献の出典、若しくは「Chemical Abstracts」又は「Beilstein」のような2次的な出典である。以下の実施例の化合物の製造において用いた合成経路は、類似の化合物の製造に適合できる。
【0083】
略号
MeOH = メタノール
EtOH = エタノール
EtOAc = 酢酸エチル
Boc = tert-ブトキシカルボニル
DCM = ジクロロメタン
DMF = ジメチルホルムアミド
DMSO = ジメチルスルホキシド
TFA = トリフルオロ酢酸
THF = テトラヒドロフラン
Na2CO3 = 炭酸ナトリウム
K2CO3 = 炭酸カリウム
HCl = 塩化水素酸
aq = 水溶液
DIPEA = ジイソプロピルエチルアミン
NaH = 水素化ナトリウム
NaOH = 水酸化ナトリウム
NaHCO3 = 炭酸水素ナトリウム
Pd/C = パラジウムカーボン
TBME = tert-ブチルメチルエーテル
【0084】
N2 = 窒素
PyBop = ベンゾトリアゾール-1-イル-オキシ-トリス-ピロリジノ-ホスホニウム ヘキサフルオロホスフェート
Na2SO4 = 硫酸ナトリウム
Et3N = トリエチルアミン
NH3 = アンモニア
TMSCl = トリメチルクロロシラン
NH4Cl = 塩化アンモニウム
LiAlH4 = 水素化リチウムアルミニウム
PyBrOP = ブロモ-トリス-ピロリジノ ホスホニウムヘキサフルオロホスフェート
MgSO4 = 硫酸マグネシウム
nBuLi = n-ブチルリチウム
CO2 = 二酸化炭素
EDCI = N-(3-ジメチルアミノプロピル)-N'-エチルカルボジイミド 塩酸塩
Et2O = ジエチルエーテル
LiOH = 水酸化リチウム
HOBt = 1-ヒドロキシベンゾトリアゾール
【0085】
TLC = 薄層クロマトグラフィー
LCMS = 液体クロマトグラフィー / 質量分析
mL = ミリリットル
g = グラム
mg = ミリグラム
mol = モル
mmol = ミリモル
HPLC = 高性能液体クロマトグラフィー
NMR = 核磁気共鳴
RT = 室温
h = 時間
【0086】
以下の実施例は、本発明の具体的な化合物の製造、及びそれらのHDAC阻害特性を説明する。
アミノ酸エステルの製造(中間体A〜D)
【化15】

【0087】
製造される化合物:
【化16】

【0088】
図1に概説する化合物の合成
経路I (中間体Bについて例示)
工程1 - エステル形成
【化17】

【0089】
(S)-2-tert-ブトキシカルボニルアミノ-3-シクロヘキシル-プロピオン酸(5g, 19.4mmol)のDMF (50mL)中の溶液に、0℃にて、シクロペンタノール(8.8mL, 97.15mmol)、EDCI (4.09g, 21.37mmol)及び最後にDMAP (237mg, 1.94mmol)を加えた。反応混合物をRTまで温め、18時間撹拌した。
DMFを真空除去して、澄明な油を得た。これを水とEtOAcとで分離した。有機相を乾燥させ(MgSO4)、真空濃縮した。粗抽出物をカラムクロマトグラフィーにより精製して(ヘプタン中に25%のEtOAC)、所望の生成物を澄明な油として得た(14.87g, 55%)。1H NMR (300MHz, d6-DMSO) δ: 7.09 (1H, d), 5.08 (1H, t), 3.76 (1H, t), 1.50-1.85 (10H, br m), 1.39 (9H, s), 1.00-1.25 (9H, br m).
【0090】
工程2 - Boc脱保護により、シクロペンチル (2S)-アミノ(シクロヘキシル)アセテート 塩酸塩(中間体B)を得る
【化18】

【0091】
工程1の生成物(14.87g, 45.69mmol)をDCM (100mL)に溶解し、4M HCl/ジオキサン (22.8mL, 91.38mmol)で処理し、反応混合物をRTにて24時間撹拌した。粗混合物を減圧濃縮して、オレンジ色の油を得た。これをEt2Oで粉砕して、白色の沈殿物を得た。これをさらにEt2Oで洗浄して、所望の生成物を白色の粉末として得た(7.78g, 65%)。1H NMR (300MHz, d6-DMSO) δ: 8.45 (3H, br s), 5.22 (1H, t), 3.28 (1H, d), 1.95-1.50 (10H, br m), 1.30-0.90 (9H, br m).
【0092】
経路II
工程1 - エステルを形成して、(1S)-2-(シクロペンチルオキシ)-2-オキソ-1-フェニルエタンアミニウム 4-メチルベンゼンスルホネート(中間体C)を得る
【化19】

【0093】
(S)-フェニルグリシン(5g, 33.1mmol)のシクロヘキサン(150mL)中のスラリーに、シクロペンタノール(29.84mL, 331mmol)及びp-トルエンスルホン酸(6.92g, 36.4mmol)を加えた。反応物をディーンスターク受け器に取り付け、135℃まで加熱して完全に溶解した。12時間後に、反応物をRTまで冷却して、白色の固体の沈殿を導いた。固体をろ過し、EtOAcで洗浄した後に、減圧下で乾燥して、所望の生成物を白色の粉末として得た(11.01g, 85%)。1H NMR (300MHz, d6-DMSO) δ 8.82 (2H, br s), 8.73 (1H, br s), 7.47 (7H, m), 7.11 (2H, d), 5.25 (1H, br s), 5.18 (1H, m), 2.29 (3H, s), 1.87-1.36 (8H, m).
【0094】
経路III
工程1 - エステル形成
【化20】

【0095】
(S)-2-ベンジルオキシカルボニルアミノ-3-tert-ブトキシ-プロピオン酸(25g, 84.65mmol)のDMF (250mL)中の溶液に、0℃にて、シクロペンタノール(15.36mL, 169.3mmol)、EDCI (17.85g, 93.11mmol)及び最後にDMAP (1.03g, 8.46mmol)を加えた。反応混合物をRTまで温め、18時間撹拌した。
DMFを真空除去して、黄色の油を得た。これを水とEtOAcとで分配した。有機相を乾燥させ(MgSO4)、真空濃縮した。粗抽出物をカラムクロマトグラフィーにより精製して(ヘプタン中の25% EtOAC)、所望の生成物を澄明な油として得た。これを、特徴決定せずに次の工程に直接用いた。
【0096】
工程2 - Cbz脱保護して、シクロペンチル O-tert-ブチル-L-セリネート(中間体D)を得る
【化21】

【0097】
工程1の生成物を、EtOAc (150mL)に溶解し、Pd(OH)2 (10 mol%)で処理し、水素雰囲気下で32時間撹拌した。完了の際に、触媒をセライトろ過により除去し、ろ過物を真空濃縮して、所望の生成物を澄明な油として得た(15.96g, 2工程で82%)。1H NMR (300MHz, d6-DMSO) δ: 5.17 (1H, t), 3.45 (1H, m), 3.34 (2H, q), 1.90-1.50 (9H, br m), 1.08 (9H, s).
【0098】
O-(1-イソブトキシエチル)ヒドロキシルアミン(中間体E)の製造
【化22】

【0099】
中間体Eを、WO 01/60785に記載される以下の方法に従って製造した。
1H NMR (300MHz, d6-DMSO) δ: 0.85 (6H, d), 1.15 (3H, d), 1.75 (1H, m), 3.18 (1H, dd), 3.42 (1H, dd), 4.53 (1H, q), 5.82 (2H, s).
【0100】
エチル 2-(メチルスルホニル)ピリミジン-5-カルボキシレート(中間体F)の製造
【化23】

【0101】
工程1 - クロロ還元
【化24】

【0102】
エチル 4-クロロ-2-メチルチオ-5-ピリミジン カルボキシレート(12.5g, 53.88mmol)及びZn粉末(14.1g, 215.52mmol)を併せ、ベンゼン(60mL)及び3M NH4Cl (140mL)を加えた。懸濁物を激しく撹拌し、80℃に30時間加熱した。反応混合物をセライトろ過し、EtOAc (200mL)で洗浄した。ろ過物を約50mLまで真空濃縮し、次いで、H2O (400mL)とEtOAc (400mL)とで分配した。水相をさらにEtOAc (250mL)で抽出した。併せた有機相を乾燥し(MgSO4)、濃色の油まで真空濃縮した。これをカラムクロマトグラフィーにより精製した(純粋なヘプタン、次いで1:1:1 ヘプタン/CH2Cl2/Et2O、最後に2:2:0.5 ヘプタン/CH2Cl2/Et2O)。所望の生成物を、無色の油として得た(13g, 61%)。m/z = 199 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 1.30 (3H, t), 2.60 (3H, s), 4.35 (2H, q), 9.0 (2H, s).
【0103】
工程2 - スルフィドを酸化して、エチル 2-(メチルスルホニル)ピリミジン-5-カルボキシレート(中間体F)を得る
【化25】

【0104】
工程1の生成物(13g, 47.59mmol)の乾燥THF (250mL)中の溶液に、撹拌しながら、mCPBA (47.59g, 275.76mmol)のTHF (150mL)中の溶液を、0℃にてN2の下で30分かけてゆっくりと加えた。反応混合物をRTまで温め、2時間撹拌した。反応混合物を次いで、約100mLまで真空濃縮し、生成物 / 安息香酸混合物を、シリカゲルに予め吸着させた。精製は、カラムクロマトグラフィーにより行った(最初は純粋なヘキサン、次いで1:5:3 CH2Cl2/ヘプタン/Et2O、次いで1:1:1 CH2Cl2/ヘプタン/Et2O)。所望の化合物を、白色の固体として得た(10g, 66%)。m/z = 231 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 1.40 (3H, t), 3.50 (3H, s), 4.40 (2H, q), 9.50 (2H, s).
【0105】
3-アザビシクロ[3.1.0]ヘキシ-6-イルメタノール(中間体G)の製造
【化26】

【0106】
工程1 - ディールスアルダー反応
【化27】

【0107】
N-ベンジルマレイミド(50g, 267.1mmol)をEt2O (600mL)に溶解し、エチルジアゾアセテート(31mL, 293.8mmol)で処理し、RTにて窒素雰囲気下で36時間撹拌した。白色の沈殿物が形成され、これをろ過により単離し、氷冷Et2Oで洗浄し、乾燥して、所望の化合物を白色の固体として得た(72g, 89%)。m/z = 302 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 1.20 (3H, t), 4.15 (2H, q), 4.55 (2H, s), 4.60 (1H, d), 5.00 (1H, d), 7.15-7.35 (5H, m), 9.60 (1H, s).
【0108】
工程2 - 縮合
【化28】

【0109】
工程1の生成物(72g, 239.2mmol)を、融解するまで160℃に加熱し、黄色の油を得た。油をさらに200℃まで加熱すると、発泡が始まった。油を、発泡が治まるまで200℃にて30分間加熱した。得られた琥珀色の油をRTまで冷却し、氷冷Et2Oで粉砕した。得られた沈殿物をろ過し、さらに氷冷Et2Oで洗浄して、生成物をクリーム状の固体として得た(37.2g, 57%)。1H NMR (300MHz, d6-DMSO) δ: 1.20 (3H, t), 2.80 (1H, t), 3.00 (2H, d), 4.15 (2H, q), 4.35 (2H, s), 7.20-7.40 (5H, m).
【0110】
工程3 - 還元
【化29】

【0111】
工程2の生成物(37.2g, 136.3mmol)を、乾燥THF (400mL)に溶解した。この溶液を、0℃にて、LiAlH4 (20.7g, 545.3mmol)の乾燥THF (200mL)中の懸濁物に滴下した。得られた茶色の懸濁物を60℃に、窒素雰囲気下に36時間加熱した。次いで、混合物を0℃に冷却し、飽和NH4Claqを用いて注意深くクエンチした。灰色の固体が形成され、さらにTHFを加えて、穏やかに撹拌した。固体Na2SO4を混合物に加え、これをRTにて30分間撹拌した。混合物を、次いで、セライトろ過して、淡黄色の溶液を得た。これを真空濃縮して、所望の生成物をオレンジ色の油として得た(14.1g, 51%)。m/z = 204 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 2.25 (2H, d), 2.85 (2H, d), 3.20 (2H, t), 3.55 (2H, s), 4.35 (1H, t), 7.20-7.40 (5H, m).
【0112】
工程4 - 窒素脱保護して、3-アザビシクロ[3.1.0]ヘキシ-6-イルメタノール(中間体G)を得る
【化30】

【0113】
工程3の生成物(7.5g, 37.0mmol)を、乾燥MeOH (250mL)にRTにて溶解した。Pd(OH)2 (1.5g)を溶液に加え、反応物を水素バルーンに取り付けた。反応物を2回脱気し、H2でフラッシュした。反応物を6時間撹拌し、バルーンからの新鮮な水素でフラッシュして、さらに64時間撹拌した。反応混合物を、次いで、セライトろ過した。溶媒を真空除去し、残渣を乾燥して、生成物を白色の固体として得た(4.1g, 98%)。m/z = 114 [M+H]+, 1H NMR (300MHz, CDCl3) δ: 0.94 (1H, セプテット, J=3.3Hz), 1.37 (2H, m), 2.89 (2H, d, J=11.4Hz), 3.02 (2H, d, J=11.4Hz), 3.54 (2H, d, J=6.9Hz).
【0114】
実施例1
【化31】

【0115】
製造した化合物
【化32】

【0116】
(1)及び(2)について例示する図2に概説する化合物の合成
工程1 - カップリング
【化33】

【0117】
ピペリジン-4-オン HCl塩(1.16g, 8.5mmol)及びK2CO3 (11.70g, 85.0mmol)の懸濁物を、DMF (50mL)中でRTにて、窒素雰囲気下で10分間撹拌した。中間体F (1.97g, 8.5mmol)を次いで加え、撹拌をさらに10分間継続した。反応物を、次いで、水(150mL)で希釈し、EtOAc (2×200mL)で抽出した。併せた有機相を乾燥し(MgSO4)、溶媒を真空除去して、生成物を黄色の固体として得て、これをさらなる精製を行わずに次の工程に用いた。m/z = 250 [M+H]+.
【0118】
工程2 - エステル加水分解
【化34】

【0119】
工程1の生成物を、1M NaOHaq (30mL)及びTHF (30mL)中で、RTにて4日間撹拌した。反応物を、次いで、pH約3に1M HClaqを用いて酸性にし、これをDCM (2×200mL)で抽出した。併せた有機相を乾燥し(Na2SO4)、溶媒を真空除去して、生成物を黄色の固体として得た(665mg, 2工程で35%). m/z = 222 [M+H]+.
【0120】
工程3 - 還元的アミノ化
【化35】

【0121】
工程2の生成物(100mg, 0.45mmol)を、DCE (10mL)中で中間体A (106mg, 0.45mmol)及びNaBH(OAc)3 (142mg, 0.67mmol)とともに、RTにて窒素雰囲気下に3日間撹拌した。反応物を、次いで、水(50mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機相を乾燥し(Na2SO4)、溶媒を真空除去して、生成物を黄色の固体として得て、これを、さらなる精製を行わずに次の工程に用いた。m/z = 405 [M+H]+.
【0122】
工程4 - 保護されたヒドロキサメートの形成
【化36】

【0123】
工程3の生成物(182mg, 0.45mmol)を、DMF (10mL)中で、EDCI (103mg, 0.54mmol)、HOBt (73mg, 0.54mmol)、Et3N (314μL, 2.25mmol)及び中間体E (310μL, 2.25mmol)とともに16時間、RTにて窒素雰囲気下に撹拌した。反応物を、次いで、水(50mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機相を、次いで、乾燥し(MgSO4)、溶媒を真空除去した。残渣をカラムクロマトグラフィーにより精製して(DCM中の0〜15% MeOH)、生成物を黄色の油として得た(110mg, 47%)。m/z = 520 [M+H]+.
【0124】
工程5 - ヒドロキサメートを脱保護して、シクロペンチル N-[1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]-L-ロイシネート(1)を得る
【化37】

【0125】
工程4の生成物(110mg, 0.21mmol)を、DCM (20mL)中で、TFA (0.5mL)とともに、1時間、RTにて撹拌した。次いで、溶媒を真空除去し、残渣を分取(preparative) HPLCで精製して、生成物を紫色の固体として得た(12mg, 11%)。LCMS純度 99%, m/z = 420 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.91 (6H, m), 1.46-1.84 (13H, m), 2.05 (2H, m), 2.90 (2H, m), 3.42 (2H, m), 4.01 (1H, m), 4.91 (1H, m), 5.27 (1H, m), 8.58 (2H, m).
【0126】
工程6 - エステル加水分解
【化38】

【0127】
工程4の生成物(182mg, 0.45mmol)を、THF (10mL)中で、KOTMS (115mg, 0.9mmol)とともに4日間、RTにて窒素雰囲気下で撹拌した。この時間の後に、溶媒を真空除去し、残渣をさらなる精製を行わずに次の工程に用いた。m/z = 452 [M+H]+.
【0128】
工程7 - ヒドロキサメートを脱保護して、N-[1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]-L-ロイシン(2)を得る
【化39】

【0129】
工程6の生成物(0.45mmol)を、DCM (10mL)中で、TFA (1mL)とともにRTにて30分間撹拌した。溶媒を、次いで、真空除去し、残渣を分取HPLCにより精製して、生成物をピンク色の固体として得た(7mg, 2工程で5%)。LCMS純度 95%, m/z = 352 [M+H]+, NMR溶媒中に不溶。
【0130】
図2に概説する類似物を、(1)及び(2)について記載される手順により製造した。各類似物についてのデータは、以下のとおりである。
(3)
LCMS純度 97%, m/z = 440 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.30-1.61 (9H, m), 1.78-1.90 (4H, m), 2.23 (2H, m), 2.90 (2H, m), 5.00 (1H, m), 5.33 (1H, m), 7.53 (5H, m), 8.69 (2H, s).
(4)
LCMS純度 98%, m/z = 378 [M+H]+, NMR溶媒中に不溶。
【0131】
(5)
LCMS純度 97%, m/z = 446 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.80-1.82 (24H, m), 2.04 (2H, m), 2.94 (2H, m), 4.86 (1H, m), 5.23 (1H, m), 8.58 (2H, s).
(6)
LCMS純度 95%, m/z = 372 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.20 (2H, m), 1.50 (2H, m), 2.15 (2H, m), 2.80 (3H, m), 4.88 (1H, m), 7.37-7.46 (5H, m), 8.56 (2H, s).
(7)
LCMS純度 98%, m/z = 450 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.25 (9H, s), 1.58-1.77 (8H, br m), 1.96 (2H, m), 2.22 (2H, m), 3.02 (2H, m), 3.55 (1H, m), 3.87 (1H, dd, J=10.8, 2.7Hz), 3.99 (1H, dd, J=10.8, 2.7Hz), 4.45 (1H, m), 5.03 (2H, m), 5.35 (1H, m), 8.70 (2H, s).
【0132】
(8)
LCMS純度 98%, m/z = 382 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.25 (9H, s), 1.65 (2H, m), 2.25 (2H, m), 3.01 (2H, t, J=13.2Hz), 3.57 (1H, m), 3.91 (1H, dd, J=10.5, 2.7Hz), 4.00 (1H, dd, J=10.5, 2.7Hz), 4.38 (1H, m), 5.05 (2H, m), 8.70 (2H, s).
(9)
LCMS純度 95%, m/z = 394 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.52-1.98 (11H, m), 2.10 (2H, m), 2.87 (3H, m), 3.44 (1H, m), 3.95 (2H, m), 4.18 (1H, m), 5.25 (1H, m), 8.58 (2H, m).
【0133】
実施例2
【化40】

【0134】
製造した化合物:
【化41】

【0135】
(14)及び(15)について例示する図3に概説する化合物の合成
工程1 - カップリング
【化42】

【0136】
中間体G (0.97g, 8.62mmol)を、DMF (20mL)及びMeCN (20mL)中で、K2CO3 (5.96g, 43.10mmol)とともにRTにて、窒素雰囲気下で10分間撹拌した。次いで、中間体F (2.00g, 8.62mmol)を加え、反応物をさらに20分間撹拌した。反応物を、次いで、水(100mL)で希釈し、EtOAc (2×100mL)で抽出した。併せた有機相を乾燥し(MgSO4)、溶媒を真空除去して、生成物を明黄色の固体として得て、これを、さらなる精製を行わずに次の工程に用いた(1.8g, 78%)。m/z = 264 [M+H]+.
【0137】
工程2 - アルコール酸化
【化43】

【0138】
工程1の生成物(1.80g, 6.84mmol)を、DCM (50mL)中で0℃にて撹拌し、デス-マーチンペルヨージナン(3.50g, 8.22mmol)を加えた。反応物をRTまで温め、4時間撹拌した。次いで、これを飽和NaHCO3(aq)及び飽和Na2S2O4(aq)の1:1混液でクエンチし、得られた混合物を20分間撹拌した。次いで、混合物をDCM (2×100mL)で抽出し、併せた有機抽出物を乾燥し(MgSO4)、溶媒を真空除去した。残渣をカラムクロマトグラフィーにより精製して(DCM中の0〜10% MeOH)、生成物を黄色の油として得た(1.35g, 72%)。m/z = 262 [M+H]+.
【0139】
工程3 - エステル加水分解
【化44】

【0140】
工程2の生成物(1.35g, 5.17mmol)を、1M NaOHaq (20mL)及びTHF (20mL)中で、RTにて3時間撹拌した。反応物を、次いで、pH約3まで1M HClaqを用いて酸性にし、これにより白色の固体が沈殿した。この固体をろ過し、乾燥して保存した。ろ過物を、次いで、DCM (2×100mL)で抽出し、併せた有機相を乾燥し(Na2SO4)、溶媒を真空除去して、淡黄色の固体を得て、これを先に得られた固体と併せた(990mg, 82%)。m/z = 236 [M+H]+.
【0141】
工程4 - 還元的アミノ化
【化45】

【0142】
工程3の生成物(175mg, 0.75mmol)を、DCE (10mL)中で、中間体B (196mg, 0.75mmol)及びNaBH(OAc)3 (222mg, 1.05mmol)とともに、RTにて窒素雰囲気下で16時間撹拌した。反応物を、次いで、H2O (50mL)で希釈し、Et2Oで抽出した。併せた有機相を乾燥し(Na2SO4)、溶媒を真空除去して、所望の生成物を黄色の油として得て、これを、さらなる精製を行わずに次の工程で用いた(171mg, 52%)。m/z = 443 [M+H]+.
【0143】
工程5 - 保護されたヒドロキサメートの形成
【化46】

【0144】
工程4の生成物(171mg, 0.39mmol)を、DMF (10mL)中で、中間体E (539μL, 3.9mmol)、EDCI (90mg, 0.47mmol)、HOBt (63mg, 0.47mmol)及びEt3N (543μL, 3.9mmol)とともに、RTにて窒素雰囲気下で16時間撹拌した。反応物を、次いで、H2O (50mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機相を乾燥し(MgSO4)、溶媒を真空除去した。残渣をカラムクロマトグラフィーにより精製して(DCM中に0〜10% MeOH)、生成物を無色の油として得た(91mg, 42%)。m/z = 558 [M+H]+.
【0145】
工程6 - ヒドロキサメートを脱保護して、シクロペンチル (2S)-シクロヘキシル[([3-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]-3-アザビシクロ[3.1.0]ヘキシ-6-イル]メチル)アミノ]アセテート(14)を得る
【化47】

【0146】
工程5の生成物(91mg, 0.163mmol)を、1:1 MeOH / DCM (4mL)中で、TFA (2mL)とともにRTにて1時間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、所望の生成物を白色の固体として得た(15mg, 20%)。LCMS純度 98%, m/z = 558 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.92-1.38 (6H, m), 1.73-1.95 (16H, m), 3.09 (2H, m), 3.62 (2H, d, J=11.4Hz), 3.91 (1H, d, J=3.6Hz), 4.00 (2H, d, J=11.4Hz), 5.51 (1H, m), 8.67 (2H, s).
【0147】
工程7 - エステル加水分解
【化48】

【0148】
工程5の生成物(161mg, 0.29mmol)を、THF (10mL)中で、KOTMS (74mg, 0.58mmol)とともにRTにて窒素雰囲気下で48時間撹拌した。さらにKOTMS (112mg, 0.87mmol)を加え、反応物を50℃にて48時間撹拌した。次いで、溶媒を真空除去し、残渣を、さらなる精製を行わずに次の工程で用いた。m/z = 490 [M+H]+.
【0149】
工程8 - ヒドロキサメートを脱保護して、(2S)-シクロヘキシル[([3-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]-3-アザビシクロ[3.1.0]ヘキシ-6-イル]メチル)アミノ]酢酸 (15)を得る
【化49】

【0150】
工程7の生成物(0.29mmol)を、DCM (10mL)中で、TFA (1mL)とともにRTにて30分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、生成物を白色の固体として得た(13mg, 12%)。LCMS純度 99%, m/z = 390 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.96 (1H, m), 1.10-1.47 (6H, m), 1.72-1.87 (6H, m), 1.99 (1H, m), 2.99 (1H, m), 3.18 (1H, m), 3.63 (2H, dd, J=11.7, 3.3Hz), 3.85 (1H, d, J=3.3Hz), 3.99 (2H, d, J=11.7Hz), 8.67 (2H, s).
【0151】
図3に概説する類似物は、(14)及び(15)について記載される手順により製造した。各類似物についてのデータを、以下に示す。
(10)
LCMS純度 95%, m/z = 452 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.41-1.64 (6H, m), 1.72-1.93 (5H, m), 2.88 (2H, m), 3.60 (2H, m), 3.97 (2H, d, J=10.5Hz), 5.26 (1H, s), 5.32 (1H, m), 7.51 (5H, m), 8.67 (2H, s).
(11)
LCMS純度 97%, m/z = 384 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.94 (1H, m), 1.83 (2H, m), 3.01 (2H, d, J=7.5Hz), 3.62 (2H, m), 3.96 (2H, d, J=11.7Hz), 5.07 (1H, s), 7.53 (5H, m), 8.67 (2H, s).
【0152】
(12)
LCMS純度 95%, m/z = 462 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.99 (1H, m), 1.24 (9H, s), 3.11 (2H, dd, J=7.5, 2.4Hz), 3.63 (2H, dd, J=12.0, 3.1Hz), 3.91 (2H, ddd, J=24.6, 10.8, 3.3Hz), 4.01 (2H, d, J=11.7Hz), 4.26 (1H, m), 5.35 (1H, m), 8.68 (2H, s).
(13)
LCMS純度 98%, m/z = 394 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.01 (1H, m), 1.25 (9H, s), 1.88 (2H, m), 3.11 (2H, d, J=7.5Hz), 3.64 (2H, dd, J=11.7, 3.9Hz), 3.90 (2H, m), 4.01 (2H, d, J=11.7Hz), 4.14 (1H, m), 8.67 (2H, s).
【0153】
実施例3
【化50】

【0154】
製造した化合物:
【化51】

【0155】
(18)及び(19)について例示する図4に概説する化合物の合成
工程1 - カップリング
【化52】

【0156】
ピペリジン-4イル-メタノール(2.48g, 21.55mmol)を、1:1 DMF/MeCN (20mL)中で、K2CO3 (8.9g, 64.65mmol)とともに、10分間、RTにて窒素雰囲気下で撹拌した。中間体F (5g, 21.55mmol)を、次いで加え、反応物を20分間撹拌した。次いで、これをH2O (100mL)で希釈し、EtOAc (2×100mL)で抽出した。併せた有機相を乾燥し(MgSO4)、溶媒を真空除去して、生成物をオレンジ色の固体として得て、これを、さらなる精製を行わずに次の工程で用いた(5.70g, 99%)。m/z = 266 [M+H]+.
【0157】
工程2 - エステル加水分解
【化53】

【0158】
工程1の生成物(5.70g, 21.51mmol)を、1M NaOHaq (20mL)及びTHF (20mL)中で、RTにて48時間撹拌した。次いで、反応物を、2M HClaqを用いてpH約3まで酸性にし、固体を沈殿させた。これを回収し、真空乾燥して、生成物を白色の固体として得た(4.47g, 89%)。m/z = 238 [M+H]+.
【0159】
工程3 - 保護されたヒドロキサメートの形成
【化54】

【0160】
工程2の生成物(4.47g, 18.86mmol)を、DMF (50mL)中で、中間体E (13.00mL, 94.30mmol)、EDCI (4.33g, 22.60mmol)、HOBt (3.05g, 22.60mmol)及びEt3N (13.10mL, 94.30mmol)とともに、RTにて窒素雰囲気下で48時間撹拌した。反応物を、次いで、H2O (200mL)で希釈し、DCM (2×200mL)で抽出した。併せた有機相を乾燥し (MgSO4)、溶媒を真空除去した。残渣をカラムクロマトグラフィーにより精製して(DCM中に0〜15% MeOH)、生成物を黄色の油として得た(5.12g, 77%)。m/z = 353 [M+H]+.
【0161】
工程4 - アルコール酸化
【化55】

【0162】
(COCl)2 (253μL, 2.90mmol)のDCM (50mL)中の溶液を、窒素雰囲気下で撹拌し、内部温度を-70℃に冷却した。DMSO (363μL, 5.11mmol)を、次いで、温度を-70℃に維持しながらゆっくりと加えた。添加が完了したときに、工程3の生成物(1.00g, 2.84mmol)のDCM (50mL)中の溶液を、内部温度を-70℃に維持しながらゆっくりと加えた。添加が完了したときに、Et3N (1.70mL, 12.21mmol)を、内部温度を-70℃に維持しながらゆっくりと加えた。反応物をRTまで温め、次いで、溶媒を真空除去した。残渣をカラムクロマトグラフィーにより精製して(DCM中に0〜10% MeOH)、生成物を無色の油として得た(890mg, 89%)。m/z = 351 [M+H]+.
【0163】
工程5 - 還元的アミノ化
【化56】

【0164】
工程4の生成物(100mg, 0.28mmol)を、DCE (10mL)中で、中間体B (73mg, 0.28mmol)及びNaBH3CN (35mg, 0.56mmol)とともにRTにて窒素雰囲気下で16時間撹拌した。反応物を、次いで、H2O (50mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機相を乾燥し(MgSO4)、溶媒を真空除去した。残渣をカラムクロマトグラフィーにより精製して(DCM中に0〜10% MeOH)、生成物を無色の油として得た(145mg, 92%)。m/z = 560 [M+H]+.
【0165】
工程6 - ヒドロキサメートを脱保護して、シクロペンチル (2S)-シクロヘキシル[([1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]メチル)アミノ]アセテート(18)を得る
【化57】

【0166】
工程5の生成物(145mg, 0.26mmol)を、DCM (10mL)中で、TFA (0.5mL)とともにRTにて10分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCで精製して、生成物を淡紫色の固体として得た(11mg, 9%)。LCMS純度 >95%, m/z 460 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.02-1.37 (8H, m), 1.73-1.94 (19H, m), 3.02 (3H, m), 3.90 (1H, m), 5.37 (1H, m), 8.67 (2H, s).
【0167】
工程7 - エステル加水分解及びヒドロキサメートを脱保護して、(2S)-シクロヘキシル[([1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]メチル)アミノ]酢酸(19)を得る
【化58】

【0168】
工程5の生成物(78mg, 0.14mmol)を、1M NaOHaq (10mL)及びTHF (10mL)中で4日間、40℃にて撹拌した。この時間の後に、反応物をRTまで冷却し、pH約3まで1M HClaqを用いて酸性にした。この混合物を10分間撹拌し、次いで、蒸発乾燥させた。残渣を分取HPLCにより精製して、生成物を白色の固体として得た(1mg, 2%)。LCMS純度98%, m/z = 392 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.03-1.25 (9H, m), 1.60-1.87 (8H, m), 2.06 (1H, m), 2.85 (4H, m), 3.44 (1H, m), 8.55 (2H, s).
【0169】
図4に概説する類似物は、(18)及び(19)について記載した手順により製造した。各類似物についてのデータを、以下に示す。
(16)
LCMS純度 98%, m/z = 434 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.03 (6H, m), 1.32 (4H, m), 1.71-1.95 (15H, m), 2.90 (1H, m), 3.01 (2H, m), 4.01 (1H, m), 5.37 (1H, m), 8.68 (2H, m).
(17)
LCMS純度 97%, m/z = 366 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.92 (6H, m), 1.19 (3H, m), 1.58 (2H, m), 1.75 (4H, m), 1.98 (1H, m), 2.89 (4H, m), 3.70 (1H, m), 8.55 (2H, s).
【0170】
(20)
LCMS純度 98%, m/z = 454 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.19-1.62 (10H, m), 1.79-1.92 (6H, m), 2.09 (1H, m), 2.84 (1H, m), 2.97 (2H, m), 5.32 (1H, m), 7.54 (5H, m), 8.67 (2H, m)
(21)
LCMS純度 98%, m/z = 386 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.08-1.28 (4H, m), 1.77 (2H, m), 1.98 (1H, m), 2.68-2.87 (4H, m), 4.90 (1H, m), 7.39 (5H, m), 8.54 (2H, s).
【0171】
(22)
LCMS純度 98%, m/z = 464 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.13 (9H, s), 1.56-1.71 (12H, m), 1.82 (3H, m), 2.04 (1H, m), 2.91 (3H, m), 3.81 (2H, m), 4.14 (1H, m), 5.39 (1H, m), 8.55 (2H, m).
(23)
LCMS純度 98%, m/z = 396 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.26 (9H, s), 1.31 (4H, m), 1.94 (2H, m), 2.14 (1H, br s), 3.03 (4H, m), 3.95 (2H, m), 4.16 (1H, m), 8.67 (2H, s).
【0172】
(24)
LCMS純度 98%, m/z = 408 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.22-1.33 (3H, m), 1.53-1.73 (11H, m), 2.02 (1H, m), 2.93 (4H, m), 3.91 (2H, m), 4.02 (1H, m), 5.23 (1H, m), 8.55 (2H, s).
(25)
LCMS純度 95%, m/z = 340 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.28 (2H, m), 1.97 (2H, m), 2.15 (1H, m), 3.07 (4H, m), 4.09 (4H, m), 4.93 (1H, m), 8.67 (2H, m).
(26)
LCMS純度 87%, m/z = 504 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.02-1.48 (7H, br m), 1.67-1.82 (5H, m), 2.01 (1H, m), 2.97 (2H, m), 3.13 (4H, m), 5.19 (2H, m), 7.49 (3H, m), 7.83 (4H, m), 8.59 (2H, s).
【0173】
実施例4
【化59】

【0174】
製造した化合物:
【化60】

【0175】
(27)及び(28)について例示する図5に概説する化合物の合成
工程1 - Boc保護
【化61】

【0176】
4-(アミノメチル)安息香酸(10.00g, 65.36mmol)を、H2O (100mL)及びTHF (100mL)中のBoc2O (28.00g, 130.72mmol)とともに、RTにて撹拌した。飽和NaHCO3(aq)を、pHが約6になるまで加え、反応物を16時間撹拌した。次いで、反応物をpH約3まで1M HClaqを用いて注意深く酸性にし、これにより固体が沈殿した。これをろ過し、乾燥して、生成物を白色の固体として得た(16.1g, 97%)。m/z = 274 [M+Na]+.
【0177】
工程2 - 酸還元
【化62】

【0178】
工程1の生成物(16.1g, 64.14mmol)を、THF (300mL)及びジオキサン(200mL)中で、0℃にて窒素雰囲気下で撹拌した。次いで、LiAlH4を加え、反応物をRTまで温め、16時間撹拌した。次いで、これを0℃に冷却し、飽和NH4Claqでクエンチした。Na2SO4を加え、混合物を30分間撹拌した。次いで、これをセライトろ過し、ろ過物を真空濃縮して、生成物を明黄色の固体として得た(13.1g, 94%)。m/z = 260 [M+Na]+.
【0179】
工程3 - アルコール酸化
【化63】

【0180】
工程2の生成物(5.87g, 24.73mmol)を、DCM (200mL)中で、MnO2 (16.71g, 192.20mmol)とともに、RTにて16時間撹拌した。反応物を、次いで、セライトろ過し、溶媒を真空除去して、生成物を黄色の油として得て、これを、さらなる精製を行わずに次の工程で用いた(4.63g, 80%)。m/z = 258 [M+Na]+.
【0181】
工程4 - 還元的アミノ化
【化64】

【0182】
工程3の生成物(650mg, 2.70mmol)を、DCE (20mL)、中間体A (634mg, 2.70mmol)及びNaBH(OAc)3 (918mg, 4.33mmol)中で、RTにて窒素雰囲気下で3時間撹拌した。この時間の後に、反応物をH2O (50mL)で希釈し、Et2O (2×100mL)で抽出した。併せた有機抽出物を乾燥し(MgSO4)、溶媒を真空除去して、生成物を茶色の油として得て、これを、さらなる精製を行わずに次の工程で用いた(1.1g, 98%)。m/z = 419 [M+H]+.
【0183】
工程5 - Boc脱保護
【化65】

【0184】
工程4の生成物(1.1g, 2.63mmol)を、DCM (5mL)中で、ジオキサン(2mL)中の4M HClとともにRTにて窒素雰囲気下で3時間撹拌した。溶媒を真空除去し、残渣を乾燥して、生成物を茶色の固体として、HCl塩として得た(670mg, 100%)。m/z = 319 [M+H]+.
【0185】
工程6 - 還元的アミノ化
【化66】

【0186】
2-(4-オキソピペリジン-1-イル)ピリミジン-5-カルボン酸(実施例1に記載されるようにして製造 - 100mg, 0.45mmol)を、DCE (10mL)中で、工程5の生成物(159mg, 0.45mmol)及びNaBH(OAc)3 (191mg, 0.9mmol)とともに、RTにて窒素雰囲気下で64時間撹拌した。次いで、反応物をH2O (100mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機相を乾燥し(Na2SO4)、溶媒を真空除去した。残渣を、さらなる精製を行わずに次の工程で用いた。m/z = 524 [M+H]+.
【0187】
工程7 - 保護されたヒドロキサメートの形成
【化67】

【0188】
工程6の生成物(0.45mmol)を、DMF (10mL)中で、中間体E (621μL, 4.50mmol)、EDCI (103mg, 0.54mmol)、HOBt (73mg, 0.54 mmol)及びEt3N (313μL, 2.25mmol)とともに、RTにて窒素雰囲気下で40時間撹拌した。次いで、反応物をH2O (50mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機相を乾燥し(MgSO4)、溶媒を真空除去して、生成物を黄色の油として得て、これを、さらなる精製を行わずに次の工程で用いた。m/z = 639 [M+H]+.
【0189】
工程8 - ヒドロキサメートを脱保護して、シクロペンチル N-[4-[([1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]アミノ)メチル]ベンジル]-L-ロイシネート(27)を得る
【化68】

【0190】
工程7の生成物(0.45mmol)を、DCM (10mL)中で、TFA (1mL)とともにRTにて30分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、生成物をピンク色の固体として得た(15mg, 3工程で6%)。LCMS純度 96%, m/z = 639 [M+H]+. 1H NMR (300MHz, CD3OD) δ: 1.00 (6H, m), 1.61-1.95 (12H, m), 2.28 (2H, m), 3.04 (3H, m), 4.01 (1H, m), 4.29 (4H, m), 5.04 (2H, m), 5.34 (1H, m), 7.60 (4H, m), 8.70 (2H, s).
【0191】
工程9 - エステル加水分解
【化69】

【0192】
工程7の生成物(0.45mmol)を、THF (10mL)中で、KOTMS (115mg, 0.9mmol)とともに96時間、RTにて窒素雰囲気下で撹拌した。次いで、溶媒を真空除去し、残渣を、さらなる精製を行わずに次の工程で用いた。m/z = 571 [M+H]+.
【0193】
工程10 - ヒドロキサメートを脱保護して、N-[4-[([1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]アミノ)メチル]ベンジル]-L-ロイシン(28)を得る。
【化70】

【0194】
工程9の生成物を、DCM (10mL)中で、TFA (1mL)とともにRTにて30分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、生成物を白色の固体として得た(5mg, 3%)。m/z = 471 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 0.9 (6H, d, J=4.8Hz), 1.51 (2H, m), 1.71 (2H, m), 2.19 (2H, m), 3.00 (4H, m), 4.42 (2H, br s), 3.75 (1H, m), 4.22 (4H, m), 4.80 (2H, m), 7.52 (4H, m), 8.71 (2H, s), 8.98 (2H, br s), 11.01 (1H, s).
【0195】
図5に概説する類似物は、(27)及び(28)について記載される手順により製造した。各類似物についてのデータを、以下に示す。
(29)
LCMS純度 99%, m/z = 565 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 0.88 (2H, m), 1.05-1.30 (5H, m), 1.50-1.85 (18H, m), 2.18 (2H, m), 3.00 (2H, m), 2.25 (2H, m), 4.80 (2H, m), 5.17 (2H, m), 7.54 (4H, m), 8.71 (2H, s), 8.93 (2H, m), 9.45 (1H, br s), 11.10 (1H, s).
(30)
LCMS純度 95%, m/z = 497 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.80-1.34 (6H, m), 1.49-1.68 (5H, m), 1.85 (1H, m), 2.17 (2H, m), 2.93 (4H, m), 3.58 (1H, m), 4.20 (4H, m), 4.93 (2H, m), 7.51 (4H, m), 8.59 (2H, m).
【0196】
(31)
LCMS純度 98%, m/z = 569 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.22 (9H, s), 1.51-1.84 (11H, m), 2.18 (2H, m), 2.93 (3H, m), 3.44 (1H, m), 3.79 (2H, qd, J = 7.8, 3.3Hz), 4.24 (4H, m), 4.93 (2H, m), 5.22 (1H, m), 7.52 (4H,, m), 8.59 (2H, s).
(32)
LCMS純度 96%, m/z = 501 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.25 (9H, s), 1.62 (2H, m), 2.29 (2H, m), 3.07 (4H, m), 3.85 (2H, m), 4.35 (4H, m), 5.07 (2H, m), 7.63 (4H, m), 8.71 (2H, m).
【0197】
(33)
LCMS純度 98%, m/z = 559 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.31-1.93 (12H, m), 2.29 (2H, m), 3.04 (3H, m), 3.56 (1H, m), 4.22 (4H, m), 5.17 (2H, m), 5.30 (1H, m), 7.47-7.43 (9H, m), 8.69 (2H, s).
(34)
LCMS純度 95%, m/z = 491 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.63 (2H, m), 2.29 (2H, m), 3.06 (2H, m), 3.29 (2H, m), 3.56 (1H, m), 4.20 (4H, m), 5.07 (1H, m), 7.54 (9H, m), 8.70 (2H, s).
【0198】
実施例5
【化71】

【0199】
製造した化合物:
【化72】

【0200】
工程1 - 還元的アミノ化
【化73】

【0201】
シクロペンチル (2S)-[[4-(アミノメチル)ベンジル]アミノ](フェニル)アセテート(実施例4に記載されるようにして製造 - 100mg, 0.29mmol)を、DCE (10mL)中の2-(6-ホルミル-3-アザビシクロ[3.1.0]ヘキシ-3-イル)-N-(1-イソブトキシエトキシ)ピリミジン-5-カルボキサミド(実施例2に記載されるようにして製造 - 108mg, 0.29mmol)及びNaBH3CN (36mg, 0.58mmol)とともに、RTにて窒素雰囲気下で16時間撹拌した。次いで、反応物をH2O (50mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機抽出物を乾燥し(MgSO4)、溶媒を真空除去した。残渣をカラムクロマトグラフィーにより精製して(DCM中に0〜10% MeOH)、生成物を黄色の油として得た(56mg, 29%)。m/z = 671 [M+H]+.
【0202】
工程2 - ヒドロキサメートを脱保護して、シクロペンチル (2S)-[(4-[[([3-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]-3-アザビシクロ[3.1.0]ヘキシ-6-イル]メチル)アミノ]メチル]ベンジル)アミノ](フェニル)アセテート(35)を得る
【化74】

【0203】
工程1の生成物(56mg, 0.08mmol)を、DCM (10mL)中で、TFA (1mL)とともにRTにて15分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、生成物をピンク色の固体として得た(12mg, 25%)。m/z = 571 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.98 (1H, m), 1.31-1.64 (6H, m), 1.76-1.93(4H, m), 3.09 (2H, d, J=7.5Hz), 3.61 (2H, d, J=10.5Hz), 3.98 (2H, d, J=10.5Hz), 4.15 (2H, m), 4.27 (3H, m), 5.31 (1H, m), 7.57 (9H, m), 8.66 (2H, s).
【0204】
実施例6
【化75】

【0205】
製造した化合物:
【化76】

【0206】
(38)及び(39)について例示する図7に概説する化合物の合成
工程1 - 還元的アミノ化
【化77】

【0207】
シクロペンチル (2S)-[[4-(アミノメチル)ベンジル]アミノ](4-メチルシクロヘキシル)アセテート(実施例4に記載されるようにして製造 - 100mg, 0.29mmol)を、2-(4-ホルミルピペリジン-1-イル)-N-(1-イソブトキシエトキシ)ピリミジン-5-カルボキサミド(実施例3に記載されるようにして製造 - 110mg, 0.29mmol)とともに、DCE (10mL)中で、NaCNBH3 (36mg, 0.58mmol)とともにRTにて窒素雰囲気下で16時間撹拌した。次いで、反応物をH2O (50mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機抽出物を乾燥し(MgSO4)、溶媒を真空除去して、生成物を黄色の油として得て、これを、さらなる精製を行わずに次の工程で用いた。m/z = 701 [M+Na]+.
【0208】
工程2 - ヒドロキサメートを脱保護して、シクロペンチル (2S)-シクロヘキシル[(4-[[([1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]メチル)アミノ]メチル]ベンジル)アミノ]アセテート(38)を得る
【化78】

【0209】
工程1の生成物を、DCM (10mL)中で、TFA (1mL)とともにRTにて30分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、生成物を紫色の固体として得た(14mg, 2工程で8%)。LCMS純度 >95%, m/z = 579 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.01-1.42 (10H, m), 1.74-2.12 (18H, m), 3.01 (2H, m), 3.82 (1H, m), 4.28 (4H, m), 5.31 (1H, m), 7.61 (4H, m), 8.66 (2H, m).
【0210】
工程3 - エステル加水分解
【化79】

【0211】
工程1の生成物(100mg, 0.28mmol)を、THF (10mL)中でKOTMS (180mg, 1.40mmol)とともに50℃にて窒素雰囲気下で撹拌した。反応物をRTまで冷却し、次いで、溶媒を真空除去し、残渣を、さらなる精製を行わずに次の工程で用いた。m/z = 611 [M+H]+.
【0212】
工程4 - ヒドロキサメートを脱保護して、(2S)-シクロヘキシル[(4-[[([1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]メチル)アミノ]メチル]ベンジル)アミノ]酢酸(39)を得る
【化80】

【0213】
工程3の生成物を、DCM (10mL)中で、TFA (1mL)とともにRTにて30分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、生成物をピンク色の固体として得た(19mg, 2工程で13%)。LCMS純度 >95%, m/z = 511 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.16-1.41 (9H, m), 1.69-1.91 (8H, m), 2.12 (1H, m), 2.99 (4H, m), 4.29 (4H, m), 4.92 (1H, m), 7.62 (4H, m), 8.66 (2H, s).
【0214】
図7に概説する類似物は、(38)及び(39)に記載される手順により製造した。各類似物についてのデータを、以下に示す。
(36)
LCMS純度 98%, m/z = 553 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 0.90 (6H, m), 1.12 (2H, m), 1.28 (2H, d, J=6.6Hz), 1.65 (9H, m), 1.72 (3H, m), 2.03 (1H, m), 2.73 (2H, m), 2.96 (2H, t, J=12Hz), 4.20 (4H, m), 4.72 (2H, d, J=13.5Hz), 5.20 (1H, m), 7.54 (4H, m), 8.66 (2H, s), 8.95 (2H, br s), 9.60 (1H, br s), 11.05 (1H, s).
(37)
LCMS純度 97%, m/z = 485 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.87 (6H, m), 1.29 (4H, m), 1.77 (5H, m), 2.00 (1H, m), 2.88 (4H, m), 3.88 (1H, m), 4.18 (4H, m), 7.52 (4H, s), 8.61 (2H, s).
(40)
LCMS純度 99%, m/z = 583 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.24 (9H, s), 1.41 (2H, d, J=6.6Hz), 1.69-1.95 (12H, br m), 2.15 (1H, br s), 3.00 (4H, m), 3.93 (2H, m), 4.20 (1H, m), 4.31 (4H, m), 5.34 (1H, m), 7.63 (4H, m), 8.66 (2H, s).
【0215】
(41)
LCMS純度 99%, m/z = 515 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.25 (9H, s), 1.29 (4H, m), 1.89 (2H, m), 2.12 (1H, br s), 3.01 (4H, m), 3.94 (2H, qd, J=9.0, 3.9Hz), 4.12 (1H, t, J=3.6Hz), 4.33 (4H, app. d, J=18.6Hz), 7.63 (4H, s), 8.66 (2H, s).
(42)
LCMS純度 98%, m/z = 573 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 1.13-1.83 (12H, br m), 2.04 (1H, m), 2.85 (2H, m), 2.96 (2H, t, J=12Hz), 3.99 (2H, m), 4.15 (2H, m), 4.70 (2H, d, J=13.2Hz), 5.16 (2H, m), 7.51 (9H, m), 8.66 (2H, s), 8.97 (2H, br s), 10.13 (1H, br s), 11.05 (1H, s).
(43)
LCMS純度 99%, m/z = 505 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.89 (1H, m), 1.08 (2H, m), 1.77 (3H, m), 2.01 (1H, m), 2.90 (4H, m), 4.08 (4H, m), 4.94 (1H, s), 7.45 (9H, m), 8.55 (2H, s).
【0216】
(44)
LCMS純度 99%, m/z = 528 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.30 (3H, m), 1.67-1.78 (11H, m), 2.12 (1H, m), 3.02 (4H, m), 4.06 (3H, m), 4.33 (4H, app. d, J=18Hz), 5.34 (1H, m), 7.66 (4H, m), 8.66 (2H, s).
(45)
LCMS純度 96%, m/z = 459 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.25 (4H, m), 1.89 (2H, m), 2.15 (1H, m), 2.99 (4H, m), 4.00 (1H, m), 4.09 (2H, m), 4.34 (4H, app. d, J=21.9Hz), 7.64 (4H, m), 8.66 (2H, s).
【0217】
実施例7
【化81】

【0218】
製造した化合物:
【化82】

【0219】
工程1 - 酸還元
【化83】

【0220】
4-(アミノメチル)シクロヘキサンカルボン酸(4.00g, 25.44mmol)を、THF (100mL)中で0℃にて窒素雰囲気下で撹拌した。次いで、LiAlH4 (2.90g, 76.33mmol)を加え、反応物をRTまで温め、3時間撹拌した。次いで、これを0℃まで冷却し、H2Oでクエンチした。次いで、Na2SO4を加え、混合物を10分間撹拌した。次いで、これをセライトろ過し、ろ過物を真空濃縮して、生成物を無色の油として得て、これを放置して固化させて、生成物を白色の固体として得た(3.72g, 100%)。1H NMR (300MHz, d6-DMSO) δ: 0.95 (4H, m), 1.22-1.47 (5H, m), 1.86 (4H, m), 2.55 (2H, d, J=6.6Hz), 4.46 (2H, d, J=6.3Hz).
【0221】
工程2 - Boc保護
【化84】

【0222】
工程1の生成物(3.72g, 26.01mmol)を、H2O (50mL)及びジオキサン(50mL)中のNaOH (1.00g, 26.01mmol)及びジ-tert-ブチル-ジカーボネート(6.24g, 28.61mmol)とともに、RTにて16時間撹拌した。次いで、反応物を真空濃縮した。約50%が蒸発したときに、固体が溶液から析出し、これを回収し、乾燥して、生成物を白色の固体として得た(5.5g, 87%)。m/z = 266 [M+Na]+, 1H NMR (300MHz, CDCl3) δ: 0.82 (4H, m), 1.28 (2H, m), 1.37 (9H, s), 1.70 (4H, m), 2.76 (2H, t, J=6.3Hz), 3.19 (2H, d, J=6.3Hz), 4.32 (1H, br s), 6.75 (1H, m).
【0223】
工程3 - アルコール酸化
【化85】

【0224】
DCM (100mL)及び(COCl)2 (1.58mL, 18.14mmol)の溶液を、窒素雰囲気下で撹拌し、-78℃に冷却した。次いで、温度を-65℃未満に維持しながら、DMSO (2.27mL, 32.02mmol)を加えた。次いで、工程2の生成物(4.5g, 17.79mmol)のDCM (50mL)中の溶液を調製し、温度を-65℃未満に維持しながら、反応混合物にゆっくりと加えた。添加が完了したときに、温度を-65℃未満に維持しながらEt3N (9.99mL, 71.69mmol)をゆっくりと加えた。 添加が完了したときに、反応物をRTまで温め、次いで、溶媒を真空除去した。残渣をカラムクロマトグラフィーにより精製して(DCM中に0〜10% MeOH)、生成物を明黄色の油として得た(5g, >100% - いくらかのEt3Nを含有する)。m/z = 264 [M+Na]+, 1H NMR (300MHz, CDCl3) δ: 1.02 (2H, m), 1.30 (2H, m), 1.45 (9H, s), 1.90 (2H, m), 2.03 (2H, m), 3.01 (2H, t, J=6.3Hz), 4.57 (1H, br s), 9.63 (1H, s).
【0225】
工程4 - 還元的アミノ化
【化86】

【0226】
工程3の生成物(1.00g, 4.14mmol)を、DCE (20mL)中の中間体B (1.08g, 4.14mmol)及びトリアセトキシ水素化ホウ素ナトリウム(1.33g, 6.21mmol)とともに、RTにて16時間撹拌した。次いで、反応物をH2O (100mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機抽出物を乾燥し(MgSO4)、溶媒を真空除去して、生成物を灰色の固体として得て、これを、さらなる精製を行わずに次の工程で用いた(1.74g, 94%)。m/z = 451 [M+H]+.
【0227】
工程5 - Boc脱保護
【化87】

【0228】
工程4の生成物(1.74g, 3.87mmol)を、DCM (10mL)中で、ジオキサン (3mL)中の4M HClとともに、RTにて16時間撹拌した。次いで、溶媒を真空除去し、残渣を真空乾燥して、生成物を白色の固体として得た(1.36g, 98%)。m/z = 351 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 0.90-1.20 (9H, m), 1.50-2.00 (21H, m), 2.65 (4H, m), 3.85 (1H, m), 5.25 (1H, m), 7.83 (2H, m).
【0229】
工程6 - 還元的アミノ化
【化88】

【0230】
工程5の生成物(216mg, 0.56mmol)を、DCE (10mL)中の2-(4-ホルミルピペリジン-1-イル)-N-(1-イソブトキシエトキシ)ピリミジン-5-カルボキサミド(実施例3に記載のようにして製造 - 200mg, 0.57mmol)及びNaBH3CN (70mg, 1.12mmol)とともに、RTにて窒素雰囲気下で48時間撹拌した。次いで、反応物をH2O (100mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機抽出物を乾燥し(MgSO4)、溶媒を真空除去して、生成物を黄色の油として得て、これを、さらなる精製を行わずに次の工程で用いた。
【0231】
工程7 - ヒドロキサメートを脱保護して、シクロペンチル (2S)-シクロヘキシル[[(4-[[([1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]メチル)アミノ]メチル]シクロヘキシル)メチル]アミノ]アセテート(46)を得る
【化89】

【0232】
工程6の生成物(0.28mmol)を、DCM (10mL)中で、TFA (0.5mL)とともにRTにて30分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、生成物をピンク色の固体として得た(15mg, 2工程で9%)。LCMS純度 >95%, m/z = 585 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.96-1.39 (13H, m), 1.72-2.16 (23H, m), 2.81-3.04 (7H, m), 3.84 (2H, d, J=3.9Hz), 5.36 (1H, m), 8.66 (2H, s).
【0233】
工程8 - エステル加水分解
【化90】

【0234】
工程6の生成物(0.28mmol)を、KOTMS (180mg, 1.4mmol)及びTHF (10mL)とともに50℃にて窒素雰囲気下で16時間撹拌した。反応物を、RTまで冷却し、溶媒を真空除去し、残渣を、さらなる精製を行わずに次の工程で用いた。m/z = 617 [M+H]+.
【0235】
工程9 - ヒドロキサメートを脱保護して、(2S)-シクロヘキシル[[(4-[[([1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]メチル)アミノ]メチル]シクロヘキシル)メチル]アミノ]酢酸(47)を得る
【化91】

【0236】
工程8の生成物(0.28mmol)を、DCM (10mL)中で、TFA (1mL)とともにRTにて30分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、生成物を白色の固体として得た(5mg, 2工程で3%)。m/z = 517 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.13-1.44 (11H, m), 1.75-1.94 (15H, m), 2.82-3.09 (8H, m), 3.39 (1H, m), 3.65 (1H, m), 4.94 (1H, m), 8.67 (2H, m).
【0237】
実施例8
【化92】

【0238】
製造した化合物:
【化93】

【0239】
工程1 - カップリング
【化94】

【0240】
エチル 4-フルオロベンゾエート(6.75g, 40.1mmol)及び1,4-ジオキサ-8-アザスピロ[4.5]デカン(2.73g, 19.1mmol)を、K2CO3 (8.5g, 61.5mmol)とともに、MeCN (10mL)中で95℃にて1週間撹拌した。混合物をEtOAc (50mL)に加え、水(3×50mL)で洗浄した。有機物を乾燥し(MgSO4)、ろ過し、真空濃縮した。生成物を、フラッシュクロマトグラフィーにより精製して(DCM中に2%MeOH)、黄色の油を得た(5.58g, 48%)。m/z = 292 [M+H]+.
【0241】
工程2 - エステル加水分解
【化95】

【0242】
工程1の生成物(5.58g, 19.15mmol)を、EtOH (25mL)中に溶解し、50% NaOHaq (25mL)とともに60℃にて3時間撹拌した。混合物をRTに冷却し、2M HClaq (50mL)を加えた。混合物を、次いで、30℃にて3日間撹拌した。生成物を、DCM (4×50mL)で抽出し、乾燥し(MgSO4)、真空濃縮して、EtOHから再結晶させて、白色の固体を得た(1.459g, 26%)。m/z = 294 [M+H]+.
【0243】
工程3 - アセタール脱保護
【化96】

【0244】
工程2の生成物(509mg, 1.735mmol)を、1M HClaq (15ml)中で、RTにて30分間撹拌した。混合物を真空濃縮し、最少量の水を加え、ろ過し、デシケーターで乾燥させた。生成物を、白色の固体として得た(279mg, 73%)。m/z = 220 [M+H]+
【0245】
工程4 - 還元的アミノ化
【化97】

【0246】
工程3の生成物(279mg, 1.27mmol)及び中間体A (303mg, 1.28mmol)を、1,2-ジクロロエタン(10mL)中で、トリアセトキシ水素化ホウ素ナトリウム(405mg, 1.91mmol)とともに、RTにて一晩撹拌した。混合物をDCM (100mL)に加え、水(2×100mL)で洗浄した。併せた水層をDCM (100mL)で再抽出し、併せた有機物を乾燥し(Na2SO4)、ろ過し、真空濃縮して、茶色の油を得た(495mg, 97%)。m/z = 403 [M+H]+.
【0247】
工程5 - 保護されたヒドロキサメートのカップリング
【化98】

【0248】
工程4の生成物(495mg, 1.20mmol)をDMFに溶解し、中間体E (0.84mL, 6.12mmol)、トリエチルアミン(0.84mL, 6.03 mmol)、HOBt (228mg, 1.49mmol)及びEDCI (295mg, 1.54mmol)と、RTにて2日間撹拌した。混合物をDCM (100mL)に加え、水(2×100mL)で洗浄した。併せた水層をDCM (100mL)で再抽出し、次いで、併せた有機物を乾燥し(Na2SO4)、ろ過し、真空濃縮して、黄色の油を得た(638mg, 少量(quant))。m/z = 518 [M+H]+.
【0249】
工程6 - ヒドロキサメートを脱保護して、シクロペンチル N-[1-[4-(ヒドロキシカルバモイル)フェニル]ピペリジン-4-イル]-L-ロイシネート(48)を得る
【化99】

【0250】
工程5の生成物(309mg, 597μmol)を、DCM (5mL)及びTFA (0.5mL)中で、RTにて1時間撹拌した。反応混合物を分取HPLCにより直接精製して、白色の固体を得た(75mg, 30%)。LCMS純度 95%, m/z = 418 [M+H]+. 1H NMR (300MHz, CD3OD) δ: 7.67 (2H, d, J=8.5Hz), 7.02 (2H, d, J=8.5Hz), 5.38 (1H, m), 4.13 (1H, m), 4.04 (2H, d, J=12.4Hz), 2.92 (2H, m), 1.97 (2H, m), 1.88-1.68 (13H, m), 1.04 (6H, dd, J=6.2, 7.8Hz).
【0251】
工程7 - エステル加水分解及びヒドロキサメートを脱保護して、N-[1-[4-(ヒドロキシカルバモイル)フェニル]ピペリジン-4-イル]-L-ロイシン(49)を得る
【化100】

【0252】
工程5の生成物(50mg, 120μmol)を、THF (5mL)及び1M NaOHaq (5mL, 5mmol)中でRTにて3日間撹拌した。混合物をpH約3まで、2M HClaqを用いて酸性にし、20分間撹拌し、次いでこれを真空濃縮し、分取HPLCにより精製して、白色の固体を得た(5mg, 12%)。LCMS純度 90%, m/z = 350 [M+H]+. 1H NMR (300MHz, d6-DMSO) δ: 10.90 (1H, s), 7.63 (2H, d, J=8.8Hz), 6.93 (2H, d, J=9.0Hz), 3.84 (2H, d, J=12.9Hz), 3.24 (1H, t, J=6.9Hz), 2.97-2.76 (3H, m), 1.96-1.74 (3H, m), 1.54-1.32 (4H, m), 0.89 (6H, t, J=6.4Hz).
【0253】
実施例9
【化101】

【0254】
製造した化合物:
【化102】

【0255】
工程1 - カップリング
【化103】

【0256】
エチル 4-フルオロベンゾエート(2.740g, 16.29mmol)及び4-ピペリジンメタノール(1.876g, 16.29mmol)を、DMSO (100mL)中で、K2CO3 (6.765g, 48.95mmol)とともに100℃にて一晩撹拌した。混合物をRTまで冷却し、水(100mL)に加えた。生成物をDCM (2×100mL)で抽出し、乾燥し(Na2SO4)、真空蒸発させて、黄色の油を得た。これを、さらなる精製又は特徴決定を行わずに次の工程で用いた。
【0257】
工程2 - エステル加水分解
【化104】

【0258】
工程1の生成物(16.29mmol)を、2M NaOHaq (40mL, 80mmol)及びTHF (40mL)中で、RTにて2日間撹拌した。反応がほとんど進行しなかったので、50% NaOHaq (10mL)を加え、混合物を55℃にてさらに2日間撹拌した。次いで、混合物をRTに冷却し、得られた沈殿物をろ過して保存した。ろ過物を、pH約3まで2M HClaqを用いて酸性にし、RTにて1時間撹拌した。沈殿物の2回目の回収物を、次いで、ろ過した。両方の回収物を乾燥して、白色の固体を得た(併せて3.052g, 80%)。m/z = 236 [M+H]+.
【0259】
工程3 - 保護されたヒドロキサメートの形成
【化105】

【0260】
工程2の生成物(3.031g, 12.17mmol)を、DMF (100mL)中で、中間体E (8.0mL, 58.27mmol)、トリエチルアミン(8mL, 57.39mmol)、HOBt (2.759g, 18.02mmol)及びEDCI (3.390g, 17.72mmol)とともに、RTにて一晩撹拌した。混合物をDCM (100mL)に加え、水(2×100mL)で洗浄した。併せた水層を、DCM (100mL)で再抽出し、併せた有機物を乾燥し(Na2SO4)、真空濃縮した。粗生成物を、カラムクロマトグラフィーにより精製して(DCM中に1〜10% MeOH)、黄色の油を得た(3.076g, 75%)。m/z = 351 [M+H]+.
【0261】
工程4 - スワーン酸化
【化106】

【0262】
DCM (200mL)を、オキサリルクロリド(0.80mL, 9.17mmol)とともに-72℃で撹拌した。ここに、温度を-72℃に維持しながらDMSO (1.1mL, 15.50mmol)を滴下した。工程3の生成物(3.08g, 8.78mmol)を、DCM (100mL)に溶解し、温度を-72℃に維持しながら混合物に滴下した。次いで、反応物をこの温度にてさらに5分間撹拌した後に、RTまで温めた。次いで、混合物を真空濃縮し、フラッシュクロマトグラフィーにより精製して(DCM中に1〜10% MeOH)、オフホワイトの固体を得た(3.05g, 少量)。m/z = 349 [M+H]+.
【0263】
工程5 - 還元的アミノ化
【化107】

【0264】
工程4の生成物(206mg, 0.591mmol)を、1,2-ジクロロエタン(20mL)中の中間体B (155mg, 0.592mmol)とともに撹拌した。ここに、トリエチルアミン(0.85ml, 6.10mmol)及びシアノ水素化ホウ素ナトリウム(525mg, 8.35mmol)を加え、混合物をRTにて2日間撹拌した。反応物を、水(50mL)を用いてクエンチし、DCM (2×50mL)で抽出した。有機相を乾燥させ(MgSO4)、真空濃縮して、黄色の油を得た(313mg, 95%)。m/z = 558 [M+H]+.
【0265】
工程6 - ヒドロキサメートを脱保護して、シクロペンチル (2S)-シクロヘキシル[([1-[4-(ヒドロキシカルバモイル)フェニル]ピペリジン-4-イル]メチル)アミノ]アセテート(50)を得る
【化108】

【0266】
工程5の生成物(180mg, 323μmol)を、DCM (10mL)及びTFA (0.5mL)中で、RTにて1時間撹拌した。生成物を、分取HPLCにより直接精製して、白色の固体を得た(7.4mg, 5%)。LCMS純度 95%, m/z = 458 [M+H]+. 1H NMR (300MHz, CD3OD) δ: 7.67 (2H, d, J=8.3Hz), 7.02 (2H, d, J=8.3Hz), 5.40 (1H, t, J=5.4Hz), 3.93 (3H, m), 3.07-2.85 (4H, m), 2.05-1.70 (20H, m), 1.47-1.06 (8H, m).
【0267】
工程7 - エステル加水分解
【化109】

【0268】
工程5の生成物(184mg, 330μmol)を、THF (10mL)中で、カリウム トリメチルシラノレート(428mg, 3.34mmol)とともに、50℃にて4日間撹拌した。混合物を真空濃縮し、残渣を次の工程に精製せずに用いた。
【0269】
工程8 - ヒドロキサメートを脱保護して、(2S)-シクロヘキシル[([1-[4-(ヒドロキシカルバモイル)フェニル]ピペリジン-4-イル]メチル)アミノ]酢酸(51)を得る
【化110】

【0270】
工程7の生成物を、DCM (10mL)中で、TFA (0.5mL)とともにRTにて1時間撹拌した。混合物を真空濃縮し、生成物を分取HPLCにより精製して、白色の固体を得た(6.8mg, 5%)。LCMS純度 93%, m/z = 390 [M+H]+. 1H NMR (300MHz, CD3OD) δ: 7.65 (2H, s), 6.99 (2H, s), 3.90 (2H, d, J=12.5Hz), 3.84 (1H, s), 2.89 (4H, m), 2.01-1.65 (10H,m), 1.45-1.05 (8H, m).
【0271】
実施例10
【化111】

【0272】
製造した化合物
【化112】

【0273】
工程1 - 還元的アミノ化
【化113】

【0274】
4-(4-ホルミルピペリジン-1-イル)-N-(1-イソブトキシエトキシ)ベンズアミド(実施例9に記載されるようにして製造 -210mg, 0.603mmol)を、1,2-ジクロロエタン(20mL)中のシクロペンチル (2S)-[[4-(アミノメチル)ベンジル]アミノ](シクロヘキシル)アセテート(実施例4に記載されるようにして製造 - 230mg, 0.604mmol)とともに撹拌した。ここに、トリエチルアミン(0.85mL, 6.10mmol)及びシアノ水素化ホウ素ナトリウム(540mg, 8.59mmol)を加え、混合物をRTにて2日間撹拌した。混合物を水(50mL)に加え、DCM (2×50mL)で抽出した。有機相を乾燥させ(MgSO4)、真空濃縮して、茶色の油を得た(408mg, 92%)。m/z = 677 [M+H]+.
【0275】
工程2 - ヒドロキサメートを脱保護して、シクロペンチル (2S)-シクロヘキシル[(4-[[([1-[4-(ヒドロキシカルバモイル)フェニル]ピペリジン-4-イル]メチル)アミノ]メチル]ベンジル)アミノ]アセテート(52)を得る
【化114】

【0276】
工程1の生成物(226mg, 334μmol)を、DCM (10mL)及びTFA (0.5mL)中で、RTにて1時間撹拌した。生成物を、分取HPLCにより精製して、オフホワイトの固体を得た(33.5mg, 17%)。LCMS純度 95%, m/z = 577 [M+H]+. 1H NMR (300MHz, CD3OD) δ: 7.64 (6H, m), 7.02 (2H, d, J=8.2Hz), 5.31 (1H, t, J=5.3Hz), 4.30 (4H, br s), 3.86 (3H, m), 3.01 (1H, s), 2.92 (2H, t, J=11.1Hz), 2.05-1.68 (20H, m), 1.48-0.95 (8H, m).
【0277】
工程3 - エステル加水分解
【化115】

【0278】
工程1の生成物(218mg, 322μmol)を、THF (10mL)中で、カリウム トリメチルシラノレート(418mg, 3.26mmol)とともに、50℃にて4日間撹拌した。混合物を真空濃縮し、残渣を精製せずに次の工程に用いた。
【0279】
工程4 - ヒドロキサメートを脱保護して、[(2S)-2-シクロヘキシル-2-[(4-[[([1-[4-(ヒドロキシカルバモイル)フェニル]ピペリジン-4-イル]メチル)アミノ]メチル]ベンジル)アミノ]アセチル]オキシ(53)を得る
【化116】

【0280】
工程3の生成物を、DCM (10mL)中で、TFA (0.5mL)とともにRTにて1時間撹拌した。混合物を真空濃縮し、生成物を分取HPLCにより精製して、白色の固体を得た(28.0mg, 17%)。LCMS純度 95%, m/z = 509 [M+H]+. 1H NMR (300MHz, CD3OD) δ: 7.66 (6H, m), 7.02 (2H, d, J=8.6Hz), 4.30 (4H, s), 3.89 (2H, d, J=12.2Hz), 3.76 (1H, d, J=3.2Hz), 3.01 (2H, d, J=6.4Hz), 2.90 (2H, t, J=12.1Hz), 2.03-1.68 (10H, m), 1.46-1.05 (8H, m).
【0281】
実施例11
【化117】

【0282】
製造した化合物:
【化118】

【0283】
工程1 - 還元的アミノ化
【化119】

【0284】
4-(4-ホルミルピペリジン-1-イル)-N-(1-イソブトキシエトキシ)ベンズアミド(実施例9に記載されるようにして製造 -212mg, 0.608mmol)を、1,2-ジクロロエタン (20mL)中のシクロペンチル (2S)-([[4-(アミノメチル)シクロヘキシル]メチル]アミノ)(シクロヘキシル)アセテート (実施例7に記載されるようにして製造 - 236mg, 0.609mmol)とともに撹拌した。ここに、トリエチルアミン(0.85mL, 6.10mmol)及びシアノ水素化ホウ素ナトリウム(555mg, 8.83mmol)を加え、混合物をRTにて2日間撹拌した。混合物を、次いで、水(50mL)に加え、DCM (2×50mL)で抽出した。有機相を乾燥させ(MgSO4)、真空濃縮して、茶色の油を得た(318mg, 77%)。m/z = 683 [M+H]+.
【0285】
工程2 - ヒドロキサメートを脱保護して、シクロペンチル (2S)-シクロヘキシル[[(4-[[([1-[4-(ヒドロキシカルバモイル)フェニル]ピペリジン-4-イル]メチル)アミノ]メチル]シクロヘキシル)メチル]アミノ]アセテート(54)を得る
【化120】

【0286】
工程1の生成物(257mg, 376μmol)を、DCM (10mL)及びTFA (0.5mL)中で、RTにて1時間撹拌した。生成物を、分取HPLCにより精製して、オフホワイトの固体を得た(18.7mg, 9%)。LCMS純度 98%, m/z = 583 [M+H]+. 1H NMR (300MHz, CD3OD) δ: 7.68 (2H, d, J=8.5Hz), 7.04 (2H, d, J=8.6Hz), 5.36 (1H, m), 3.04-2.81 (8H, m), 2.06-1.64 (25H, m), 1.53-0.97 (12H, m).
【0287】
工程3 - エステル加水分解
【化121】

【0288】
工程1の生成物(196mg, 287μmol)を、THF (10mL)中で、カリウム トリメチルシラノレート(399mg, 3.11mmol)とともに50℃にて4日間撹拌した。混合物を真空濃縮し、残渣を精製せずに次の工程に用いた。
【0289】
工程4 - ヒドロキサメートを脱保護して、(2S)-シクロヘキシル[[(4-[[([1-[4-(ヒドロキシカルバモイル)フェニル]ピペリジン-4-イル]メチル)アミノ]メチル]シクロヘキシル)メチル]アミノ]酢酸(55)を得る
【化122】

【0290】
工程3の生成物を、DCM (10mL)中で、TFA (0.5mL)とともにRTにて1時間撹拌した。混合物を真空濃縮し、生成物を分取HPLCにより精製して、オフホワイトの固体を得た(36.7mg, 25%)。LCMS純度 98%, m/z = 515 [M+H]+. 1H NMR (300MHz, CD3OD) δ: 7.68 (2H, d, J=8.7Hz), 7.05 (2H, d, J=8.5Hz), 3.89 (2H, d, J=12.6Hz), 3.79 (1H, d, J=3.6Hz), 3.03-2.82 (8H, m), 2.07-1.65 (16H, m), 1.54-1.04 (12H, m).
【0291】
破砕細胞カルボキシルエステラーゼアッセイ
R1がエステル基である本発明のいずれの与えられた化合物は、細胞内エステラーゼにより加水分解されるという要件を満たすかについて、以下のアッセイにおいて試験することにより決定できる。
【0292】
細胞抽出物の調製
U937又はHCT 116腫瘍細胞(約109)を、4容量のダルベッコのPBS (約1リットル)中で洗浄し、4℃、525 gにて10分間、ペレットにした。これを2回繰り返し、最終の細胞ペレットを、35 mlの冷ホモジナイズバッファー(Trizma 10 mM, NaCl 130 mM, CaCl2 0.5 mM 25℃にてpH 7.0)に再懸濁した。ホモジネートを、窒素キャビテーション(700 psi、4℃にて50分間)により調製した。ホモジネートを氷上に維持し、最終濃度:
ロイペプチン 1μM
アプロチニン 0.1μM
E64 8μM
ペプスタチン 1.5μM
ベスタチン 162μM
キモスタチン 33μM
の阻害剤のカクテルを補った。
細胞ホモジネートを、525 gで10分間の遠心分離により清澄にした後に、得られた上清を、エステラーゼ活性の供給源として用い、必要になるまで-80℃にて貯蔵した。
【0293】
エステル切断の測定
対応するカルボン酸へのエステルの加水分解は、上記のようにして調製した細胞抽出物を用いて測定できる。このために、細胞抽出物(約30μg / 0.5 mlの全アッセイ容量)を、37℃にて、Tris- HCl 25 mM、125 mM NaClバッファー、25℃にてpH 7.5中でインキュベートした。ゼロ時間に、エステル(基質)を、2.5□Mの最終濃度で加え、試料を37℃にて適切な時間(通常、0又は80分)インキュベートした。反応を、3×容量のアセトニトリルの添加により停止した。ゼロ時間の試料のために、アセトニトリルをエステル化合物の前に加えた。12000 gで5分間の遠心分離の後に、試料をエステル及びその対応するカルボン酸について、室温にてLCMS (Sciex API 3000, HP1100バイナリポンプ, CTC PAL)により分析した。クロマトグラフィーは、AceCN (75×2.1mm)カラム、及び水/0.1%ギ酸中の5〜95%アセトニトリルの移動相に基づいた。
【0294】
生物学的活性の測定
ヒストンデアセチラーゼ活性
ヒストンデアセチラーゼ活性を阻害する化合物の能力を、Biomolから商業的に入手可能なHDAC蛍光活性アッセイを用いて測定した。簡単に、イプシロンアミノアセチル化されたリジンであるFluor de LysTM基質を、ヒストンデアセチラーゼ活性の供給源(HeLa核抽出物)と、阻害剤の存否でインキュベートする。基質の脱アセチル化が、基質をFluor de LysTM顕色剤に増感し、これが蛍光体を生じる。つまり、HDAC活性供給源との基質のインキュベーションは、シグナルの増加をもたらし、これは、HDAC阻害剤の存在下で減少する。
【0295】
データは、以下のように、バックグラウンドシグナルを全ての試料から減じて、阻害剤の非存在下で測定された対照のパーセンテージとして表す:
% 活性 = [(Si − B) / (So − B)]×100
(式中、Siは、基質、酵素及び阻害剤の存在下でのシグナルであり、Soは、基質、酵素及び阻害剤が溶解されるビヒクルの存在下でのシグナルであり、Bは、酵素の非存在下で測定されるバックグラウンドシグナルである)。
【0296】
IC50値は、Graphpad Prismソフトウェアを用いて、8つのデータ点の結果を、変化する傾き(化合物のlog濃度に対する%活性)を有するシグモイド型用量応答の等式に当てはめた後に、非線形回帰分析により決定された。
【0297】
HeLa細胞に由来する核粗抽出物からのヒストンデアセチラーゼ活性を、スクリーニングに用いた。4C (Seneffe, Belgium)から購入した調製物を、指数増殖期の間に採集したHeLa細胞から調製した。核抽出物を、J. D. Dignam, Nucl. Acid. Res., 1983, 11, 1475〜1489に記載される方法に従って調製し、液体窒素で急速凍結させ、-80℃にて保存した。最終のバッファー組成は、20 mM Hepes、100 mM KCl、0.2 mM EDTA、0.5 mM DTT、0.2 mM PMSF及び20% (v/v)グリセロールであった。
【0298】
IC50の結果は、以下の3つの範囲の1つに当てはめた:
範囲A:IC50<100nM、
範囲B:IC50 101nMから1000nM、
範囲C:IC50 >1001nM。
【0299】
U937及びHUT細胞阻害アッセイ
対数期増殖している株化癌細胞(U937及びHUT)を採集し、1000〜2000細胞/ウェル(最終容量100μl)で96ウェル組織培養プレートに播種した。24時間の成長の後に、細胞を化合物で処理した。次いで、プレートをさらに72〜96時間再インキュベートした後に、WST-1細胞生存性アッセイを、供給業者(Roche Applied Science)の指示に従って行った。
【0300】
データは、以下のように、阻害剤の非存在下で測定した対照のパーセンテージ阻害として表す:
% 阻害 = 100-[(Si/So)×100]
(式中、Siは、阻害剤の存在下でのシグナルであり、Soは、DMSOの存在下でのシグナルである)。
【0301】
用量応答曲線を、6回の反復を用いる8つの濃度(最高最終濃度10μMから3倍希釈)から作製した。
IC50値は、Graphpad Prismソフトウェアを用いて、結果を、変化する傾き(化合物のlog濃度に対する%活性)を有するシグモイド用量応答の等式に当てはめた後に、非線形回帰分析により決定された。
【0302】
IC50の結果は、以下の3つの範囲の1つに当てはめた:
範囲A:IC50<330nM、
範囲B:IC50 331nMから3300nM、
範囲C:IC50 >3301nM、
n/d:測定せず。
【0303】
HeLa細胞阻害アッセイ
対数期増殖しているHeLa細胞を採集し、1000細胞/ウェル(最終容量200μl)で96ウェル組織培養プレートに播種した。24時間の細胞成長の後に、細胞を化合物で処理した(最終濃度20μM)。次いで、プレートをさらに72時間再インキュベートした後に、スルホローダミンB (SRB)細胞生存性アッセイを、Skehanら, J. Natl. Canc. Inst., 1990, 82, 1107〜1112に記載される方法に従って行った。
【0304】
データは、以下のように、阻害剤の非存在下で測定した対照のパーセンテージ阻害として表した:
% 阻害 = 100-[(Si/So)×100]
(式中、Siは、阻害剤の存在下でのシグナルであり、Soは、DMSOの存在下でのシグナルである)。
【0305】
IC50値は、Graphpad Prismソフトウェアを用いて、8つのデータ点の結果を、変化する傾き(化合物のlog濃度に対する%活性)を有するシグモイド型用量応答の等式に当てはめた後に、非線形回帰分析により決定された。
IC50の結果は、以下の3つの範囲の1つに当てはめた:
範囲A:IC50<330nM、
範囲B:IC50 331nMから3300nM、
範囲C:IC50>3301nM、
n/d:測定せず。
【0306】
【表2−1】

【0307】
【表2−2】

【技術分野】
【0001】
本発明は、酵素のヒストンデアセチラーゼファミリーのメンバーを阻害する化合物、並びに癌を含む細胞増殖性疾患、ポリグルタミン病、例えばハンチントン病、神経変性疾患、例えばアルツハイマー病、自己免疫疾患、例えばリウマチ性関節炎、及び臓器移植拒絶、糖尿病、血液学的疾患、炎症性疾患、心血管疾患、アテローム性動脈硬化症、及び感染の炎症性続発症の治療におけるそれらの使用に関する。
【背景技術】
【0002】
真核細胞内では、DNAはヒストンと共にパッケージされてクロマチンを形成する。約150塩基対のDNAが、ヒストンのオクタマー(ヒストン2A、2B、3及び4がそれぞれ2つずつ)の周囲に2回巻きついて、クロマチンの基本単位であるヌクレオソームを形成する。クロマチンの規則正しい構造は、関連する遺伝子の転写を可能にするために改変される必要がある。転写調節は、分化、増殖及びアポトーシスの鍵であり、よって厳密に制御される。クロマチン構造の変化(よって転写)の制御は、ヒストン、最も顕著にはN-末端尾部への共有結合的改変により媒介される。アミノ酸の側鎖の共有結合的改変(例えばメチル化、アセチル化、リン酸化及びユビキチン化)は、酵素により媒介される(ヒストンの共有結合的改変及び転写調節におけるそれらの役割についての総説は、Berger SL 2001 Oncogene 20, 3007〜3013に見出される;ヒストンのアセチル化及び転写の総説についてはGrunstein, M 1997 Nature 389, 349〜352; Wolffe AP 1996 Science 272, 371〜372;及びWade PAら 1997 Trends Biochem Sci 22, 128〜132を参照)。
【0003】
ヒストンのアセチル化は、転写活性があるクロマチンの領域に関連するが、アセチル化レベルが低いヌクレオソームは、典型的には、転写がサイレントである。ヒストンのアセチル化の状態は、相対する活性の2つの酵素クラスにより制御される:ヒストンアセチルトランスフェラーゼ(HAT)及びヒストンデアセチラーゼ(HDAC)である。形質転換細胞において、HDACの不適切な発現が、腫瘍サプレッサー遺伝子のサイレンシングをもたらすと考えられている(腫瘍形成におけるHDACの潜在的な役割の総説について、Gray SG及びTeh BT 2001 Curr Mol Med 1, 401〜429を参照)。HDAC酵素の阻害剤は、文献に記載され、動物において癌細胞増殖の阻害、アポトーシスの誘発及び腫瘍成長の阻害をもたらすいくつかの遺伝子の転写再活性化を導くことが示されている(総説として、Kelly WKら 2002 Expert Opin Investig Drugs 11, 1695〜1713を参照)。このような知見は、HDAC阻害剤が、癌(Kramer OHら 2001 Trends Endocrinol 12, 294〜300, Vigushin DM及びCoombes RC 2002 Anticancer Drugs 13, 1〜13)のような増殖性疾患の治療において治療的可能性を有することを示唆する。
【0004】
さらに、異常なHDAC活性又はヒストンアセチル化は、以下の疾患及び障害に関係していることが提案されている:ポリグルタミン病、例えばハンチントン病(Hughes RE 2002 Curr Biol 12, R141〜R143; McCampbell Aら 2001 Proc Soc Natl Acad Sci 98, 15179〜15184; Hockly Eら 2003 Proc Soc Natl Acad Sci 100, 2041〜2046)、その他の神経変性疾患、例えばアルツハイマー病(Hempen B及びBrion JP 1996, J Neuropathol Exp Neurol 55, 964〜972)、自己免疫疾患及び臓器移植拒絶 (Skov Sら 2003 Blood 101, 1430〜1438; Mishra Nら 2003 J Clin Invest 111, 539〜552)、糖尿病(Mosley AL及びOzcan S 2003 J Biol Chem 278, 19660〜19666)、並びに糖尿病合併症、感染(原虫感染を含む(Darkin-Rattray, SJら 1996 Proc Soc Natl Acad Sci 93, 13143〜13147))、及びサラセミアを含む血液学的疾患(Witt Oら 2003 Blood 101, 2001〜2007)。これらの原稿に記載される観察は、HDAC阻害がこれらの疾患及びその他の関連する疾患において治療上の利点を有するはずであることを示唆している。
【0005】
多くの種類のHDAC阻害剤化合物が提案され、このような化合物のいくつかが現在、癌の治療について臨床評価されている。例えば、以下の特許公報がこのような化合物を開示している:
【表1】

【0006】
当該技術において知られるHDAC阻害剤の多くが、式(A):
【化1】

(式中、環Aは、任意置換基Rを有する炭素環式又は複素環式環系であり、[リンカー]は、種々の型のリンカー基である)で表され得る構造的な鋳型を有する。ヒドロキサメート基は、折り畳まれた酵素構造中のポケットの底に位置するHDAC酵素の活性部位にて金属イオンと相互作用する金属結合基として機能する。環又は環系Aは、金属イオンを含有するポケットの中又は入口に位置し、-[リンカー]-基がポケットの奥に伸びて、Aを金属結合ヒドロキサム酸基に連結させる。当該技術において、そして本明細書において時には、環又は環系Aは、時々、阻害剤の「頭基(head group)」と非公式にいうことがある。
【0007】
国際特許出願第PCT/GB2006/001779号は、その構造が一般化された鋳型(A)に適合するHDAC阻害剤の新しいクラスを記載して請求している。この新しいクラスは、式(B)の化合物、並びにその塩、N-オキシド、水和物及び溶媒和物からなる:
【化2】

(式中、
Q、V及びWは独立して、-N=又は-C=を表し;
Bは、(B1)、(B2)、(B3)、(B4)及び(B5)から選択される2価の基である:
【0008】
【化3】

(式中、*の印を付した結合手は、-[リンカー1]-を介してQ、V及びWを含有する環に連結し、**の印を付した結合手は、-[リンカー2]-を介してAに連結し、Aは、単環式、2環式若しくは3環式の炭素環式又は複素環式環系であり、-[リンカー1]-及び-[リンカー2]-は独立して、結合手、又は2価のリンカー基を表す))。
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、HDAC阻害剤分子鋳型(B)及びある構造的に類似の鋳型へのアルファアミノ酸エステル基の導入が、細胞膜を介する作用物質の透過を促進し、そのことにより細胞内カルボキシルエステラーゼ活性がエステルを加水分解して親の酸を放出することが可能になることを見出したことに基づく。荷電されると、酸は、細胞の外に容易には輸送されず、よって、酸はここで蓄積して、活性HDAC阻害剤の細胞内濃度が増加する。このことは、効力及び作用の期間の増加を導く。よって、本発明は、構造(B)及びある関連する構造のアルファアミノ酸コンジュゲートである化合物のクラスを利用可能にする。アルファアミノ酸エステル部分は、細胞内カルボキシルエステラーゼの基質である(本明細書中では、「エステラーゼモチーフ」ともいう)。このようなコンジュゲート、及び対応する脱エステル化された親の酸は、HDACの細胞内阻害により利益を受ける癌のような疾患の治療において医薬的利用性を有する。
【課題を解決するための手段】
【0010】
本発明によると、式(I)の化合物、又はその塩、N-オキシド、水和物若しくは溶媒和物が提供される:
【化4】

【0011】
(式中、
m及びnは独立して0又は1であるが、但しm及びnの少なくとも一方は1である;
Q、V及びWは独立して、-N=又は-C=を表し;
Bは、(B1)、(B2)、(B3)、(B4)、(B5)及び(B6)から選択される2価の基であり:
【化5】

(式中、*を付した結合手は、Q、V及びWを含有する環に連結する)
【0012】
Aは、任意に置換されていてもよい単環式、2環式若しくは3環式の炭素環式又は複素環式環系であり;
-[リンカー]-は、結合手、又は2価のリンカー基を表し;
Z1は、(a) 式R1R2CHNH-Y-L1-X1-(CH2)z-の基、又は(b) 式R-L1-Y1-(CH2)z-の基であり、ここで:
Rは、式(X)又は(Y)の基であり:
【化6】

【0013】
R1は、カルボン酸基(-COOH)、又は1若しくは複数の細胞内エステラーゼ酵素によりカルボン酸基に加水分解され得るエステル基であり;
R6は、水素;又は任意に置換されていてもよいC1〜C6アルキル、C3〜C7シクロアルキル、アリール若しくはヘテロアリール、又は-(C=O)R3、-(C=O)OR3、若しくは-(C=O)NR3 (式中、R3は、水素又は任意に置換されていてもよい(C1〜C6)アルキルである)であり;
R2は、天然又は非天然のアルファアミノ酸の側鎖であり;
Yは、結合手、-C(=O)-、-S(=O)2-、-C(=O)O-、-C(=O)NR3-、-C(=S)-NR3、-C(=NH)-NR3、又は-S(=O)2NR3- (式中、R3は、水素、又は任意に置換されていてもよい C1〜C6アルキルである)であり;
Y1は、結合手、-(C=O)-、-S(O2)-、-C(=O)O-、-OC(=O)-、-(C=O)NR3-、-NR3(C=O)-、-S(O2)NR3-、-NR3S(O2)-、又は-NR3(C=O)NR4- (式中、R3及びR4は独立して、水素又は任意に置換されていてもよい(C1〜C6)アルキルである)であり;
【0014】
L1は、式-(Alk1)m(Q)n(Alk2)p-の2価の基であり、ここで、
m、n及びpは、独立して0又は1であり、
Qは、(i) 任意に置換されていてもよい2価の単環式若しくは2環式で5〜13員環の炭素環式又は複素環式基、又は(ii) pが0である場合、式-Q1-X2- (式中、X2は、-O-、-S-又はNRA- (式中、RAは、水素又は任意に置換されていてもよいC1〜C3アルキルである)であり、Q1は、任意に置換されていてもよい2価の単環式若しくは2環式で5〜13員環の炭素環式又は複素環式基である)の2価の基であり;
Alk1及びAlk2は独立して、任意に置換されていてもよい2価のC3〜C7シクロアルキル基、又は任意に置換されていてもよい直鎖又は分岐鎖のC1〜C6アルキレン、C2〜C6アルケニレン、又はC2〜C6アルキニレン基であって、エーテル(-O-)、チオエーテル(-S-)若しくはアミノ(-NRA-)結合(ここで、RAは、水素又は任意に置換されていてもよいC1〜C3アルキルである)を任意に含有するか又はこれらが末端をなしていてもよいものであり、
X1は、結合手、-C(=O)-;又は-S(=O)2-;-NR4C(=O)-、-C(=O)NR4-、-NR4C(=O)-NR5-、-NR4S(=O)2-、又は-S(=O)2NR4- (式中、R4及びR5は独立して、水素、又は任意に置換されていてもよいC1〜C6アルキルである)であり;
zは、0又は1である)。
【発明を実施するための形態】
【0015】
上記の定義は、高分子量の化合物を潜在的に含むが、医化学のプラクティスの一般的な原理に従うと、本発明が関係する化合物は、600以下の分子量を有することが好ましい。
【0016】
別の広い態様によると、本発明は、上記で定義される式(I)の化合物、又はそのN-オキシド、塩、水和物若しくは溶媒和物の、ヒストンデアセチラーゼの活性を阻害するための組成物の製造における使用を提供する。
本発明が関係する化合物は、エクスビボ又はインビボでのヒストンデアセチラーゼ活性の阻害のために用い得る。
【0017】
本発明のある態様によると、本発明の化合物は、細胞増殖疾患、例えば癌細胞増殖及び自己免疫疾患の治療用の組成物の製造に用い得る。
【0018】
別の態様において、本発明は、上記の種類の疾患に罹患した対象に、上記で定義される式(I)の化合物の有効量を投与することを含む上記の種類の疾患の治療方法を提供する。
【0019】
用語
本明細書で用いる場合、用語「(Ca〜Cb)アルキル」(ここで、a及びbは整数である)は、a〜b個の炭素原子を有する直鎖又は分岐鎖のアルキル基のことである。よって、例えばaが1でありbが6である場合、この用語は、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、イソブチル、sec-ブチル、t-ブチル、n-ペンチル及びn-ヘキシルを含む。
本明細書で用いる場合、用語「二価の(Ca〜Cb)アルキレン基」(ここで、a及びbは整数である)は、a〜b個の炭素原子と2つの不飽和原子価(unsatisfied valences)を有する飽和炭化水素鎖のことをいう。
【0020】
本明細書で用いる場合、用語「(Ca〜Cb)アルケニル」(ここで、a及びbは整数である)は、a〜b個の炭素原子を有し、適用可能である場合にE又はZの立体化学の少なくとも1つの二重結合をする直鎖又は分岐鎖のアルケニル部分のことである。この用語は、例えばビニル、アリル、1-及び2-ブテニル並びに2-メチル-2-プロペニルを含む。
本明細書で用いる場合、用語「二価の(Ca〜Cb)アルケニレン基」は、a〜b個の炭素原子、少なくとも1つの二重結合、及び2つの不飽和原子価を有する炭化水素鎖を意味する。
【0021】
本明細書で用いる場合、用語「Ca〜Cbアルキニル」(ここで、a及びbは整数である)は、a〜b個の炭素原子を有し、さらに1つの三重結合を有する直鎖又は分岐鎖の炭化水素基のことである。この用語は、例えばエチニル、1-プロピニル、1-及び2-ブチニル、2-メチル-2-プロピニル、2-ペンチニル、3-ペンチニル、4-ペンチニル、2-ヘキシニル、3-ヘキシニル、4-ヘキシニル及び5-ヘキシニルを含む。
本明細書で用いる場合、用語「二価の(Ca〜Cb)アルキニレン基」(ここで、a及びbは整数である)は、a〜b個の炭素原子及び少なくとも1つの三重結合を有する二価の炭化水素鎖である。
【0022】
本明細書で用いる場合、用語「炭素環式」は、全て炭素の16個までの環原子を有する単環式、2環式又は3環式の基のことであり、アリール及びシクロアルキルを含む。
本明細書で用いる場合、用語「シクロアルキル」は、3〜8個の炭素原子を有する単環式の飽和炭素環式基のことであり、例えばシクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル及びシクロオクチルを含む。
【0023】
本明細書で用いる場合、限定されていない用語「アリール」は、単環式、二環式又は三環式の炭素環式芳香族基のことであり、共有結合により直接連結された2つの単環式の炭素環式芳香族環を有する基を含む。このような基の例は、フェニル、ビフェニル及びナフチルである。
【0024】
本明細書で用いる場合、限定されていない用語「ヘテロアリール」は、S、N及びOから選択される1又は複数のヘテロ原子を含む単環式、2環式又は3環式の芳香族基のことであり、そのような単環式環を2つ有する基、又はそのような単環式環1つと1つの単環式アリール環とが共有結合により直接連結された基を含む。そのような基の例は、チエニル、ベンズチエニル、フリル、ベンズフリル、ピロリル、イミダゾリル、ベンズイミダゾリル、チアゾリル、ベンズチアゾリル、イソチアゾリル、ベンズイソチアゾリル、ピラゾリル、オキサゾリル、ベンズオキサゾリル、イソキサゾリル、ベンズイソキサゾリル、イソチアゾリル、トリアゾリル、ベンズトリアゾリル、チアジアゾリル、オキサジアゾリル、ピリジニル、ピリダジニル、ピリミジニル、ピラジニル、トリアジニル、インドリル及びインダゾリルである。
【0025】
明細書で用いる場合、限定されていない用語「ヘテロシクリル」又は「複素環式」は、上記で定義される「ヘテロアリール」を含み、その非芳香族の意味は、S、N及びOから選択される1又は複数のヘテロ原子を含む単環式、2環式又は3環式の非芳香族基、及びこのような1又は複数のへテロ原子を含む単環式の非芳香族基からなり、該非芳香族基が別のそのような基又は単環式の炭素環式基に共有結合した基に関する。そのような基の例は、ピロリル、フラニル、チエニル、ピペリジニル、イミダゾリル、オキサゾリル、イソキサゾリル、チアゾリル、チアジアゾリル、ピラゾリル、ピリジニル、ピロリジニル、ピリミジニル、モルホリニル、ピペラジニル、インドリル、モルホリニル、ベンズフラニル、ピラニル、イソキサゾリル、ベンズイミダゾリル、メチレンジオキシフェニル、エチレンジオキシフェニル、マレイミド及びスクシンイミド基である。
【0026】
その用語を用いるときの関係において特にそうでないと言及しない限りは、本明細書においていずれの部分に適用される用語「置換」は、4つまでの適合性の置換基で置換されることを意味し、そのそれぞれは独立して、例えば(C1〜C6)アルキル、(C1〜C6)アルコキシ、ヒドロキシ、ヒドロキシ(C1〜C6)アルキル、メルカプト、メルカプト(C1〜C6)アルキル、(C1〜C6)アルキルチオ、フェニル、ハロ (フルオロ、ブロモ及びクロロを含む)、トリフルオロメチル、トリフルオロメトキシ、ニトロ、ニトリル(-CN)、オキソ、-COOH、-COORA、-CORA、-SO2RA、-CONH2、-SO2NH2、-CONHRA、-SO2NHRA、-CONRARB、-SO2NRARB、-NH2、-NHRA、-NRARB、-OCONH2、-OCONHRA、-OCONRARB、-NHCORA、-NHCOORA、-NRBCOORA、-NHSO2ORA、-NRBSO2OH、-NRBSO2ORA、-NHCONH2、-NRACONH2、-NHCONHRB、-NRACONHRB、-NHCONRARB、又は-NRACONRARB (ここで、RA及びRBは独立して(C1〜C6)アルキル、(C3〜C6)シクロアルキル、フェニル又は5若しくは6個の環原子を有する単環式ヘテロアリールであるか、或いは同じ窒素原子に結合する場合、RA及びRBは環状アミノ基(例えばモルホリノ、ピペリジニル、ピペラジニル又はテトラヒドロピロリル)を形成する)であり得る。「任意の置換基」は、上記の置換基の1つであり得る。
【0027】
本明細書で用いる場合、用語「窒素置換基」は、以下から選択される窒素原子における置換基を意味する:
アミノC1-6アルキル、例えばアミノエチル、C1-3アルキルアミノ C1-6アルキル、C1-3ジアルキルアミノ C1-6アルキル、ヒドロキシ C1-6アルキル、例えばヒドロキシエチル、C1-3アルコキシ C1-6アルキル、例えばメトキシエチル、メルカプト C1-3アルキル、C1-3アルキルメルカプト C1-6アルキル、カルボキサミドC1-6アルキル、例えば-CH2CONH2、アミノスルホニル C1-6アルキル、例えば-CH2SO2NH2、C1-3アルキルアミノスルホニル C1-6アルキル、例えば-CH2SO2NHMe、C1-3ジアルキルアミノスルホニル C1-6アルキル、例えば-CH2SO2NMe2、C1-6アルカノイル、C1-6アルキルスルホニル、アミノスルホニル(-SO2NH2)、C1-6アルキルアミノスルホニル、例えば-SO2NHMe、C1-6ジアルキルアミノスルホニル、例えば-SO2NMe2、任意に置換されていてもよいフェニルアミノスルホニル、カルボキサミド(-CONH2)、C1-6アルキルアミノカルボニル、C1-6ジアルキルアミノカルボニル、モルホリニル C1-6アルキル、イミダゾリル C1-6アルキル、トリアゾリル C1-6アルキル、又は単環式へテロシクロアルキル C1-6アルキル(これらはイミダゾリル、トリアゾリル又はヘテロシクリル環で任意に置換されていてもよい)、例えばピペリジニル C1-6アルキル、ピペラジニル C1-6アルキル、又は4-(C1-6アルキル)ピペラジニル C1-6アルキル。
【0028】
本明細書で用いる場合、用語「塩」は、塩基付加塩、酸付加塩及び第4級塩を含む。酸性である本発明の化合物は、医薬的に許容される塩を含む塩を、例えばアルカリ金属水酸化物、例えば水酸化ナトリウム及びカリウム;アルカリ土類金属水酸化物、例えば水酸化カルシウム、バリウム及びマグネシウムのような塩基と;例えばN-メチル-D-グルカミン、コリントリス(ヒドロキシメチル)アミノメタン、L-アルギニン、L-リジン、N-エチルピペリジン、ジベンジルアミンのような有機塩基と形成できる。塩基性であるこれらの化合物(I)は、医薬的に許容される塩を含む塩を、例えばハロゲン化水素酸、例えば塩化水素酸又は臭化水素酸、硫酸、硝酸又はリン酸などの無機酸と、酢酸、酒石酸、コハク酸、フマル酸、マレイン酸、リンゴ酸、サリチル酸、クエン酸、メタンスルホン酸、p-トルエンスルホン酸、安息香酸、ベンゼンスルホン酸、グルタミン酸、乳酸及びマンデル酸などの有機酸とともに形成できる。
【0029】
不斉炭素原子の存在のために1又は複数の実際の又は潜在的なキラル中心を含む本発明の化合物は、鏡像異性体又は各キラル中心にてR若しくはSの立体化学を有するいくつかのジアステレオ異性体として存在し得る。本発明は、全てのこのような鏡像異性体及びジアステレオマー、並びにその混合物も含む。
【0030】
任意の適合可能な組み合わせで、600未満の分子量を有する化合物が好ましいことを念頭に置く本発明の化合物において、以下のとおりである。
【0031】
ヒドロキサメート基-C(=O)NHOH
本発明の化合物において、ヒドロキサメート基は、折り畳まれた酵素構造のポケットの底に位置するHDAC酵素の活性部位にて金属イオンと相互作用する金属結合基として機能する。
【0032】
Q、V及びWを含有する環
Q、V及びWのそれぞれは、-C=であり得るか、又はQ、V及びWの少なくとも1つは-N=であり得るか、又はQは-C=であり、V及びWはそれぞれ-N=であり得る。現在のところ好ましくは、Qが-C=であり、V及びWがそれぞれ-N=であり、HONHC(=O)-基が、その結果のピリミジン-2-イル基の5位に結合する場合である。
【0033】
環A
環A基は、例えば、任意に置換されていてもよい芳香族炭素環、例えば任意に置換されていてもよいフェニル及びナフチル、又は任意に置換されていてもよい複素芳香族、例えば任意に置換されていてもよいピロリル、フリル、チエニル、イミダゾリル、オキサゾリル、イソキサゾリル、チアゾリル、イソチアゾリル、ピラゾリル、1,2,3-トリアゾリル、1,2,4-トリアゾリル、1,3,4-トリアゾリル、1,2,5-トリアゾリル、1,2,3-オキサジアゾリル、1,2,4-オキサジアゾリル、1,2,5-オキサジアゾリル、1,3,4-オキサジアゾリル、1,3,4-チアジアゾール、ピリジル、ピリミジニル、ピリダジニル、ピラジニル、1,3,5-トリアジニル、1,2,4-トリアジニル、1,2,3-トリアジニル、ベンゾフリル、[2,3-ジヒドロ]ベンゾフリル、イソベンゾフリル、ベンゾチエニル、ベンゾトリアゾリル、イソベンゾチエニル、インドリル、イソインドリル、インダニル、3H-インドリル、ベンズイミダゾリル、インダゾリル、イミダゾ[1,2-a]ピリジル、ベンゾチアゾリル、ベンズオキサゾリル、キノリジニル、キナゾリニル、フタラジニル、キノキサリニル、シンノリニル、ナフチリジニル、ピリド[3,4-b]ピリジル、ピリド[3,2-b]ピリジル、ピリド[4,3-b]ピリジル、キノリル、イソキノリル、テトラゾリル、5,6,7,8-テトラヒドロキノリル、5,6,7,8-テトラヒドロイソキノリル、プリニル、プテリジニル、カルバゾリル、キサンテニル、又はベンゾキノリル基であり得る。
【0034】
環A基は、例えば、任意に置換されていてもよい非芳香族の炭素環及び複素環、例えば任意に置換されていてもよいシクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、2-シクロブテン-1-イル、2-シクロペンテン-1-イル、3-シクロペンテン-1-イル、2,4-シクロペンタジエン-1-イル、3,5-シクロヘキサジエン-1-イル、テトラヒドロフラニル、ピロリン、例えば2-又は3-ピロリニル、ピロリジニル、ジオキソラニル、例えば1,3-ジオキソラニル、イミダゾリニル、例えば2-イミダゾリニル、イミダゾリジニル、ピラゾリニル、例えば2-ピラゾリニル、ピラゾリジニル、ピラニル、例えば2-又は4-ピラニル、ピペリジニル、1,4-ジオキサニル、モルホリニル、1,4-ジチアニル、チオモルホリニル、ピペラジニル、1,3,5-トリチアニル、オキサジニル、例えば2H-1,3-、6H-1,3-、H-1,2-、2H-1,2-若しくは4H1,4-オキサジニル、1,2,5-オキサチアジニル、イソキサジニル、オキサチアジニル、例えば1,2,5若しくは1,2,6-オキサチアジニル、又は1,3,5-オキサジアジニル基でもあり得る。
【0035】
具体的な環A基は、任意に置換されていてもよい以下の環系を含む:
【化7】

【0036】
【化8】

【0037】
【化9】

(式中、R10は、水素、又はC1〜C6アルキルであり、波線が横切る結合手は、-[リンカー]-基に結合し、式(I)の基Rは、任意の利用可能な環原子に結合する)。
【0038】
A中の任意の置換基は、例えば、メチル、エチル、n-プロピル、イソプロピル、フッ素、塩素、臭素若しくはヨウ素原子、又はメチルアミノ、エチルアミノ、ヒドロキシメチル、ヒドロキシエチル、メチルチオール、エチルチオール、メトキシ、エトキシ、n-プロポキシ、2-ヒドロキシエトキシ、3-ヒドロキシプロポキシ、2-アミノエトキシ、3-アミノプロポキシ、2-(メチルアミノ)エトキシ、2-(ジメチルアミノ)エトキシ、3-(ジメチルアミノ)プロポキシ、シクロペンチル、シクロヘキシル、シクロヘキシルアミノ、トリフルオロメチル、トリフルオロメトキシ、アミノ(-NH2)、アミノメチル、アミノエチル、ジメチルアミノ、ジエチルアミノ、エチル(メチル)アミノ、プロピル(メチル)アミノ、2-ヒドロキシエチルアミノ、3-ヒドロキシプロピルアミノ、2-アミノエチルアミノ、3-アミノプロピルアミノ、2-(メチルアミノ)エチルアミノ、2-(エチルアミノ)エチルアミノ、2-(イソプロピルアミノ)エチルアミノ、3-(イソプロピルアミノ)プロピルアミノ、2-(ジメチルアミノ)エチルアミノ、2-(ジエチルアミノ)エチルアミノ、2-(メチルアミノ)エチル(メチル)アミノ、3-(メチルアミノ)プロピル(メチル)アミノ、ニトロ、シアノ、ヒドロキシル、ホルミル、
【0039】
カルボキシル(-CO2H)、-CH2CO2H、-OCH2CO2H、-CO2CH3、-CO2CH2CH3、-CH2CO2CH2CH3、-CH2CO2CH2Ph、t-ブトキシカルボニルメトキシ、アセチル、フェナシル、チオ、チオメチル、チオエチル、スルホニル、メチルスルホニル、メチルアミノスルホニル、エチルアミノスルホニル、ジメチルアミノスルホニル、カルボキサミド、メチルアミノカルボニル、エチルアミノカルボニル、ジメチルアミノカルボニル、ジエチルアミノカルボニル、メチルアミノカルボニルメチル、-NHC(S)NH2、スルホニルアミノ(-NHSO2H)、メチルスルホニルアミノ、ジメチルスルホニルアミノ、アミノスルホニルアミノ(-NHSO2NH2)、メチルアミノスルホニルアミノ、ジメチルアミノスルホニルアミノ、メチルアミノカルボニルアミノ、ジメチルアミノカルボニルアミノ、アセチルアミノ、フェニルカルボニルアミノ、アミノメチルカルボニルアミノ、アセチルアミノメチル、メトキシカルボニルアミノ、t-ブトキシカルボニルアミノ、ピロリジニル、ピペリジニル、ピペラジニル、4-メチルピペラジニル、ホモピペラジニル、モルホリニル、イミダゾリル、1,2,4-トリアゾリル、1.2.3-トリアゾリル、1,3,4-トリアゾリル、1,2,5-トリアゾリル、C1-6直鎖又は分岐鎖のアルキル、
【0040】
アミノC1-6アルキル、例えばアミノエチル、C1-3アルキルアミノ C1-6アルキル、C1-3 ジアルキルアミノ C1-6アルキル、ヒドロキシルC1-6アルキル、例えばヒドロキシエチル、C1-3 アルコキシルC1-6アルキル、例えばメトキシエチル、チオール C1-3アルキルC1-6, C1-3アルキルチオール C1-6アルキル、C1-6アルカノイル、C1-6アルキルスルホニル、アミノスルホニル(-SO2NH2)、C1-6アルキルアミノスルホニル、例えば-SO2NHMe、C1-6ジアルキルアミノスルホニル、例えば-SO2NMe2、任意に置換されていてもよいフェニルアミノスルホニル、カルボキサミド(-CONH2)、カルボキサミド C1-6アルキル、例えばCH2CONH2、C1-6アルキルアミノカルボニル、C1-6ジアルキルアミノカルボニル、アミノスルホニル C1-6アルキル、例えばCH2SO2NH2、C1-3アルキルアミノスルホニル C1-6アルキル、例えばCH2SO2NHMe、C1-3 ジアルキルアミノスルホニル C1-6アルキル、例えばCH2SO2NMe2、C1-6モルホリニル C1-6アルキル、任意に置換されていてもよいイミダゾリル C1-6アルキル、任意に置換されていてもよいトリアゾリル C1-6アルキル、任意に置換されていてもよいヘテロC3-6シクロアルキル C1-6アルキル、例えばピペリジニル C1-6アルキル、ピペラジニル C1-6アルキル、及び4-(C1-6アルキル)ピペラジニル C1-6アルキルであり得る。
【0041】
現在のところ好ましい環Aは、任意に置換されていてもよいフェニル、シクロヘキシル、ナフチル、キノリン-2-イル、及び1,3-ジヒドロ-イソインドール-2-イルを含む。このような好ましい環Aに存在し得る置換基は、ハロゲン、特にフルオロ及びクロロを含む。特に、式(I)中の基-A-は、存在する場合、1,4-フェニレン又は1,4-シクロへキシレンであり得る。
【0042】
[リンカー]基
-[リンカー]-は、2価のB基の、存在する場合に環Aへの連結を提供する。つまり、これは、以下の例から選択できる:
(i) 結合手。これは、通常、環Aが存在しない場合である;
(ii) -O-、-S-、-C(=O)-、-S(=O)2-、-NRC-、-C(=O)NRC-、-S(=O)2NRC-、-NRCC(=O)-、-NRCS(=O)2-、-NRC(CH2)m-、-NRCC(=O)(CH2)m-、-NRCS(=O)2(CH2)m、-NRDC(=O)NRC-、-NRCC(=O)(CH2)mAr-、又は-NRCS(=O)2(CH2)mAr- (ここで、RC及びRDは独立して、水素、C1〜C4アルキル、又は窒素置換基であり、mは、0、1、2、3、4又は5であり、Arは、2価のフェニル基又は2価の単環式若しくは2環式の5〜13員環のヘテロアリール基である);並びに
(iii) 任意に置換されていてもよい直鎖又は分岐鎖のC1〜C6アルキレン、C2〜C6アルケニレン又はC2〜C6アルキニレン基であって、エーテル(-O-)、チオエーテル(-S-)又はアミノ(-NRA-)結合(ここで、RAは、水素、C1〜C3アルキル、又は窒素置換基である)を任意に含むか又はこれらが末端をなしていてもよいもの。
【0043】
-Ar-が-[リンカー]-中に存在する場合、これは、以下から選択される2価の基であり得る:
【化10】

(式中、Xは、O、S又はNHである)。例えば、-[リンカー]-中に存在する場合、-Ar-は、2価のフェニレン、例えば1,4-フェニレン基であり得る。
-[リンカー]-の例は、本明細書の具体的な実施例の化合物に存在するものを含む。
【0044】
Z1基
ケース(a):Z1は、式-(CH2)z-X1-L1-Y-NHCHR1R2の基である。
Z1のケース(a)におけるR1基
エステル基R1は、本発明の化合物において、1又は複数の細胞内カルボキシエステラーゼ酵素によりカルボン酸基に加水分解され得るものでなければならない。本発明の化合物のエステル基を対応する酸に加水分解できる細胞内カルボキシエステラーゼ酵素は、3つの既知のヒト酵素アイソタイプであるhCE-1、hCE-2及びhCE-3を含む。これらは、主要な酵素であると考えられるが、ビフェニルヒドロラーゼ(BPH)のようなその他の酵素も、エステルの加水分解において役割を有し得る。一般的に、カルボキシエステラーゼが遊離のアミノ酸エステルを親の酸に加水分解するならば、これは、上記のようなhCE-2及びhCE-3のN-カルボニル依存性に従って、HDAC阻害剤に共有的にコンジュゲートしている場合、エステルモチーフも加水分解する。よって、本明細書に記載される破砕細胞アッセイ及び/又は単離カルボキシエステラーゼアッセイは、要求される加水分解プロファイルを有するエステルについての直接的で迅速で単純な1次スクリーニングを提供する。このようにして選択されるエステルモチーフは、次いで、選択されたコンジュゲーション化学により阻害剤にコンジュゲートされている場合に、同じカルボキシエステラーゼアッセイで再びアッセイされて、その背景においてもまだカルボキシエステラーゼの基質であることが確認される。
【0045】
細胞内カルボキシエステラーゼ酵素により加水分解され得るという要件に従って、特定のエステル基R1の例は、式-(C=O)OR9
(式中、R9は、R7R8CH-であり、ここで、
(i) R7は、水素又は任意に置換されていてもよい(C1〜C3)アルキル-(Z1)a-[(C1〜C3)アルキル]b-、又は(C2〜C3)アルケニル-(Z1)a-[(C1〜C3)アルキル]b- (式中、a及びbは独立して0又は1であり、Z1は、-O-、-S-、又は-NR10- (式中、R10は、水素又はC1〜C3アルキルである)である)であり、R8は、水素、又は(C1〜C3)アルキル-であるか;
(ii) R7は、水素、又は任意に置換されていてもよいR10R11N-(C1〜C3)アルキル- (式中、R10は、水素、又はC1〜C3アルキルであり、R11は、水素又はC1〜C3アルキルであるか、或いはR10とR11はそれらが結合している窒素と一緒に、任意に置換されていてもよい単環式で5若しくは6環原子の複素環式環、又は2環式で8〜10環原子の複素環式環系を形成する)であり、R8は、水素又は(C1〜C3)アルキル-であるか;或いは
(iii) R7及びR8は、それらが結合している炭素と一緒に、任意に置換されていてもよい単環式で3〜7環原子の炭素環式環、又は2環式で8〜10環原子の炭素環式環系を形成する)
のものを含む。
【0046】
これらのクラスのうち、R9は、例えば、メチル、エチル、n-若しくはイソ-プロピル、n-、sec-若しくはtert-ブチル、シクロヘキシル、アリル、フェニル、ベンジル、2-、3-若しくは4-ピリジルメチル、N-メチルピペリジン-4-イル、テトラヒドロフラン-3-イル、メトキシエチル、インダニル、ノルボルニル、ジメチルアミノエチル、モルホリノエチルであり得る。現在のところ好ましくは、R90がシクロペンチルである場合である。
【0047】
マクロファージは、サイトカイン、特にTNFα及びIL-1の放出により炎症性障害において重要な役割を演じることが知られている(van Roonら Arthritis and Rheumatism, 2003, 1229〜1238)。リウマチ性関節炎において、これらは、関節の炎症及び関節の破壊の維持に主に寄与する。マクロファージは、腫瘍の成長及び発生にも関わる(Naldini及びCarraro, Curr Drug Targets Inflamm Allergy, 2005, 3〜8)。よって、マクロファージ細胞増殖を選択的に標的にする作用物質は、癌及び自己免疫疾患の治療において価値があるだろう。特定の種類の細胞を標的にすることは、副作用の低減を導くと予測される。本発明者らは、阻害剤をマクロファージにターゲティングする方法を見出し、これは、エステラーゼモチーフが阻害剤に連結される様式が、それが加水分解されるかを決定し、よって、それが異なる種類の細胞において蓄積されるか否かを決定するという観察に基づく。具体的には、マクロファージはヒトカルボキシルエステラーゼhCE-1を含有するが、他の種類の細胞は含有しないことが見出された。エステラーゼモチーフR1CH(R2)NH-の窒素が、カルボニル(-C(=O)-)に直接連結されない場合、すなわち、Yが-C(=O)でも-C(=O)O-でも-C(=O)NR3-基でもない場合の一般式(I)において、エステルは、hCE-1のみにより加水分解され、よって、阻害剤はマクロファージ中にのみ蓄積する。
【0048】
Z1のケース(a)におけるアミノ酸側鎖R2
エステル基R1が細胞内カルボキシルエステラーゼ酵素により加水分解され得るという要件に従って、側鎖R2基が何であるかは、重要でない。
アミノ酸側鎖の例は、以下のものを含む:
C1〜C6アルキル、フェニル、2-、3-若しくは4-ヒドロキシフェニル、2-、3-若しくは4-メトキシフェニル、2-、3-若しくは4-ピリジルメチル、ベンジル、フェニルエチル、2-、3-若しくは4-ヒドロキシベンジル、2-、3-若しくは4-ベンジルオキシベンジル、2-、3-若しくは4-C1〜C6アルコキシベンジル、及びベンジルオキシ(C1〜C6アルキル)-基;
天然αアミノ酸の特徴的な基、ここで任意の官能基は保護されていてもよい;
【0049】
-[Alk]nR6基(式中、Alkは、1又は複数の-O-若しくは-S-原子が任意に介在していてもよい(C1〜C6)アルキル又は(C2〜C6)アルケニル基、或いは-N(R7)-基[式中、R7は、水素原子又は(C1〜C6)アルキル基である]であり、nは0又は1であり、R6は、任意に置換されていてもよいシクロアルキル又はシクロアルケニル基である);
フェニル環において、式-OCH2COR8 (式中、R8は、ヒドロキシル、アミノ、(C1〜C6)アルコキシ、フェニル(C1〜C6)アルコキシ、(C1〜C6)アルキルアミノ、ジ((C1〜C6)アルキル)アミノ、フェニル(C1〜C6)アルキルアミノ、アミノ酸若しくは酸ハロゲン化物の残基、そのエステル若しくはアミド誘導体(この残基は、アミド結合により連結され、アミノ酸は、グリシン、α若しくはβアラニン、バリン、ロイシン、イソロイシン、フェニルアラニン、チロシン、トリプトファン、セリン、スレオニン、システイン、メチオニン、アスパラギン、グルタミン、リジン、ヒスチジン、アルギニン、グルタミン酸及びアスパラギン酸から選択される)である)の基により置換されたベンジル基;
【0050】
非置換であるか、又は複素環式環においてハロ、ニトロ、カルボキシ、(C1〜C6)アルコキシ、シアノ、(C1〜C6)アルカノイル、トリフルオロメチル (C1〜C6)アルキル、ヒドロキシ、ホルミル、アミノ、(C1〜C6)アルキルアミノ、ジ-(C1〜C6)アルキルアミノ、メルカプト、(C1〜C6)アルキルチオ、ヒドロキシ(C1〜C6)アルキル、メルカプト(C1〜C6)アルキル又は(C1〜C6)アルキルフェニルメチルで1若しくは2置換された複素環式(C1〜C6)アルキル基;並びに
【0051】
-CRaRbRc基、ここで
Ra、Rb及びRcはそれぞれ独立して、水素、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、フェニル(C1〜C6)アルキル、(C3〜C8)シクロアルキルであるか;又は
Rcは水素であり、Ra及びRbは独立して、フェニル又はヘテロアリール、例えばピリジルであるか;又は
Rcは、水素、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、フェニル(C1〜C6)アルキル、又は(C3〜C8)シクロアルキルであり、Ra及びRbは、それらが結合している炭素原子と一緒に、3〜8員のシクロアルキル又は5-若しくは6-員の複素環式環を形成するか;又は
Ra、Rb及びRcは、それらが結合している炭素原子と一緒に、3環式の環(例えばアダマンチル)を形成するか;又は
【0052】
Ra及びRbはそれぞれ独立して、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、フェニル(C1〜C6)アルキル、又は水素以外の以下のRcについて定義される基であるか、又はRa及びRbは、それらが結合している炭素原子と一緒に、シクロアルキル又は複素環式環を形成し、かつRcは、水素、-OH、-SH、ハロゲン、-CN、-CO2H、(C1〜C4)ペルフルオロアルキル、-CH2OH、-CO2(C1〜C6)アルキル、-O(C1〜C6)アルキル、-O(C2〜C6)アルケニル、-S(C1〜C6)アルキル、-SO(C1〜C6)アルキル、-SO2(C1〜C6)アルキル、-S(C2〜C6)アルケニル、-SO(C2〜C6)アルケニル、-SO2(C2〜C6)アルケニル又は基-Q-W (式中、Qは、結合手、又は-O-、-S-、-SO-若しくは-SO2-を表し、Wは、フェニル、フェニルアルキル、(C3〜C8)シクロアルキル、(C3〜C8)シクロアルキルアルキル、(C4〜C8)シクロアルケニル、(C4〜C8)シクロアルケニルアルキル、ヘテロアリール又はヘテロアリールアルキル基を表し、基Wは、ヒドロキシル、ハロゲン、-CN、-CO2H、-CO2(C1〜C6)アルキル、-CONH2、-CONH(C1〜C6)アルキル、-CONH(C1〜C6アルキル)2、-CHO、-CH2OH、(C1〜C4)ペルフルオロアルキル、-O(C1〜C6)アルキル、-S(C1〜C6)アルキル、-SO(C1〜C6)アルキル、-SO2(C1〜C6)アルキル、-NO2、-NH2、-NH(C1〜C6)アルキル、-N((C1〜C6)アルキル)2、-NHCO(C1〜C6)アルキル、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、(C3〜C8)シクロアルキル、(C4〜C8)シクロアルケニル、フェニル又はベンジルから独立して選択される1若しくは複数の置換基で任意に置換されていてもよい)である。
【0053】
具体的なR2基の例は、水素(グリシンの「側鎖」)、ベンジル、フェニル、シクロヘキシルメチル、シクロヘキシル、ピリジン-3-イルメチル、tert-ブトキシメチル、イソ-ブチル、sec-ブチル、tert-ブチル、1-ベンジルチオ-1-メチルエチル、1-メチルチオ-1-メチルエチル、1-メルカプト-1-メチルエチル、及びフェニルエチルを含む。現在のところ好ましいR2基は、フェニル、ベンジル、及びイソ-ブチル、シクロヘキシル及びt-ブトキシメチルを含む。
【0054】
全身投与される本発明の化合物について、カルボキシルエステラーゼ切断の速度が遅いエステルが好ましい。なぜなら、これらは、前全身代謝(pre-systemic metabolism)により影響されにくいからである。それらの標的組織に無傷で到達する能力は、よって、増加し、エステルは、標的組織の細胞の内部で酸生成物に変換され得る。しかし、エステルが標的組織に直接用いられるか、又は例えば吸入によりそこに指向される局所投与については、全身への曝露を最小限にし、それにより不要な副作用を最小限にするために、エステラーゼ切断の速度が速いエステルがしばしば望ましい。本発明の化合物において、アルファアミノ酸エステルのアルファ炭素に隣接する炭素が1置換である場合、すなわちR2がCH2Rz (Rzは1置換である)である場合、R2が例えばフェニル又はシクロヘキシルである場合のように炭素原子が2-又は3-置換である場合よりも、エステルがより迅速に切断される傾向にある。
【0055】
Z1のケース(a)における基-Y-L1-X1-[CH2]z-
この基(又は結合手)は、アミノ酸エステルモチーフR1CH(R2)NH-を、環A (存在する場合)又は環B (-[リンカー]-基により)に連結させるように選択される具体的な化学方策により生じる。このカップリングについての化学方策は、明らかに、広く変動でき、よって、変動可能なY、L1、X1及びzの多くの組み合わせが可能である。しかし、阻害剤がHDAC酵素にその活性部位にて結合する場合、環B及び/又はAは、酵素の金属イオン含有ポケットの頂部、又はその中に位置して、アミノ酸エステルモチーフをこれらの環に連結することにより、これは、通常、該ポケットから離れる方向に伸長し、そのことにより阻害剤の結合様式との干渉を最小限にするか又は回避する。よって、アミノ酸エステルモチーフと環B及び/又はAとの間の連結化学を形成する可変部の厳密な組み合わせは、全体としての化合物の1次結合様式(primary binding mode)とは無関係である。一方、この連結化学は、金属イオン含有ポケットの頂部で又はそれに隣接して酵素との付加的な結合相互作用を採用して、それにより結合を促進し得る場合がある。
【0056】
上記のアミノ酸エステルモチーフの利点(細胞内への容易な侵入、細胞内でのカルボキシルエステラーゼの加水分解、及び活性カルボン酸加水分解生成物の細胞内での蓄積)は、アミノ酸エステルモチーフと、環B及び/又はAとの間の連結が、細胞内のペプチダーゼ活性の基質でない場合に最もよく達成される(これは、分子からのアミノ酸の切断をもたらす)。もちろん、細胞内ペプチダーゼの安定性は、化合物を破砕細胞内容物とインキュベートし、いずれのそのような切断について分析することにより容易に試験される。
【0057】
上記の一般的な観察を念頭において、基-Y-L1-X1-[CH2]z-を形成する可変部を以下に順に示す。
zは、0又は1であり得、それにより、環A又は環Bに連結されるメチレン基は任意である。
マクロファージ選択性が必要でない場合のYの好ましい具体例は、-(C=O)-、-(C=O)NH-、及び-(C=O)O-を含む。マクロファージ選択性が必要な場合、Yが結合手である場合を含むYについてのその他の選択肢のいずれかが適切である。
【0058】
基L1において、存在する場合にAlk1及びAlk2基の例は、-CH2-、-CH2CH2-、-CH2CH2CH2-、-CH2CH2CH2CH2-、-CH=CH-、-CH=CHCH2-、-CH2CH=CH-、CH2CH=CHCH2- -C≡C-、-C≡CCH2-、CH2C≡C-、及びCH2C≡CCH2を含む。Alk1及びAlk2のさらなる例は、-CH2W-、-CH2CH2W-、-CH2CH2WCH2-、-CH2CH2WCH(CH3)-、-CH2WCH2CH2-、-CH2WCH2CH2WCH2-、及び-WCH2CH2- (式中、Wは-O-、-S-、-NH-、-N(CH3)-、又は-CH2CH2N(CH2CH2OH)CH2-である)を含む。Alk1及びAlk2のさらなる例は、2価のシクロプロピル、シクロペンチル及びシクロヘキシル基を含む。
【0059】
L1において、qが0である場合、この基は、炭化水素鎖(任意に置換されていてもよく、エーテル、チオエーテル又はアミノ結合をおそらく有する)である。現在のところ、L1には任意の置換基が存在しないのが好ましい。p及びrがともに0である場合、L1は、2価の単環式若しくは2環式の5〜13環原子を有する炭素環式又は複素環式基(任意に置換されていてもよい)である。nが1であり、p及びrの少なくとも一方が1である場合、L1は、炭化水素鎖及び単環式若しくは2環式の5〜13環原子を有する炭素環式又は複素環式基(任意に置換されていてもよい)を含む2価の基である。存在する場合、Q1は、例えば2価のフェニル、ナフチル、シクロプロピル、シクロペンチル若しくはシクロヘキシル基、又は単環式若しくは2環式の5〜13員環の複素環式基、例えばピペリジニル、ピペラジニル、インドリル、ピリジル、チエニル、又はピロリル基であり得るが、1,4-フェニレンが現在のところ好ましい。
【0060】
具体的には、本発明のいくつかの実施形態において、qが1であってL1、p及びrは0であり得る。別の実施形態において、pが1であってq及びrは0であり得る。さらなる実施形態において、p、q及びrは全て0であり得る。さらなる実施形態において、pは0であり得、Q1が単環式の複素環式基であってqは1であり得、rは0又は1であり得る。Alk1及びAlk2は、存在する場合、-CH2-、-CH2CH2-、及び-CH2CH2CH2-から選択でき、Q1は1,4-フェニレンであり得る。
【0061】
基-Y-L1-X1-[CH2]z-の具体例は、-C(=O)-及び-C(=O)NH-、並びに-(CH2)v-、-(CH2)vO-、-C(=O)-(CH2)v-、-C(=O)-(CH2)vO-、-C(=O)-NH-(CH2)w-、-C(=O)-NH-(CH2)wO-
【化11】

(式中、vは1、2、3又は4であり、wは1、2又は3、例えば-CH2-、-CH2O-、-C(=O)-CH2-、-C(=O)-CH2O-、-C(=O)-NH-CH2-、及び-C(=O)-NH-CH2O-である)
を含む。
【0062】
ケース(b):Z1が、式-(CH2)z-Y1-L1-Rの基である。
Z1のケース(b)におけるR基
Rは、式(X)又は(Y)の基である。
【化12】

【0063】
式(X)及び(Y)において、R1は、Z1のケース(a)ついて上記で定義され、議論されるようなカルボン酸基、又は1若しくは複数の細胞内カルボキシルエステラーゼ酵素によりカルボン酸基に加水分解され得るエステル基である。
【0064】
Z1のケース(b)における環D
Rが式(Y)の基である場合、Rの例は:
【化13】

(式中、R1は、上記で定義され、議論されるとおりである)
を含む。
【0065】
Z1のケース(b)におけるR6基
R6基は、Rが式(X)の基である場合に本発明の化合物に存在する。
上記のように、モジュレーターが、マクロファージのようにhCE-1が存在する細胞種においてのみ作用することを意図する場合、カルボキシルエステラーゼモチーフのアミノ基は、カルボニル以外の基に直接連結されるべきである。このような場合、R6は、任意に置換されていてもよいC1〜C6アルキル、C3〜C7シクロアルキル、アリール又はヘテロアリール、例えばメチル、エチル、n-若しくはイソプロピル、シクロプロピル、シクロペンチル、シクロヘキシル、フェニル又はピリジルであり得る。マクロファージ特異性が必要でない場合、R6は、水素又は-(C=O)RD (式中、RDは、任意に置換されていてもよい(C1〜C6)アルキル、例えばメチル、エチル、n-若しくはイソプロピル、又はn-、イソ-若しくはsec-ブチル、(C3〜C7)シクロアルキル、例えばシクロプロピル、シクロペンチル、シクロヘキシル、フェニル、ピリジル、チエニル、フェニル(C1〜C6アルキル)-、チエニル(C1〜C6アルキル)-、又はピリジル(C1〜C6アルキル)-、例えばベンジル、4-メトキシフェニルメチルカルボニル、チエニルメチル又はピリジルメチルである)であり得る。
【0066】
R6は、例えば-(C=O)ORD、又は-(C=O)NHRD (式中、RDは、水素又は任意に置換されていてもよい(C1〜C6)アルキル、例えばメチル、エチル、又はn-若しくはイソプロピルである)でもあり得る。
【0067】
全身投与される本発明の化合物について、エステラーゼ切断の速度が遅いエステルが好ましい。なぜなら、これらは、前全身代謝により影響されにくいからである。それらの標的組織に無傷で到達する能力は、よって、増加し、エステルは、標的組織の細胞の内部で酸生成物に変換され得る。しかし、エステルが標的組織に直接用いられるか、又は例えば吸入によりそこに指向される局所投与については、全身への曝露を最小限にし、それにより不要な副作用を最小限にするために、エステラーゼ切断の速度が速いエステルがしばしば望ましい。R基が結合している炭素原子が非置換である場合、すなわちRがメチレン(-CH2)-基に結合する場合、炭素が置換されているか、又はフェニル若しくはシクロヘキシル環のような環系の一部分である場合よりも、エステルはより迅速に切断される傾向がある。
【0068】
Z1のケース(b)における-L1-Y1-[CH2]z-基
Z1のケース(a)と同様に、この基(又は結合手)は、置換基Yにおけるアミノ酸エステルモチーフRを、分子の残りの部分に連結させるように選択される具体的な化学方策から生じる。このカップリングについての化学方策は、明らかに、広く変動でき、変動可能なY1、L1及びzの多くの組み合わせが可能である。しかし、阻害剤が酵素にその活性部位にて結合する場合、アミノ酸エステルモチーフは、通常、酵素から離れる方向に伸長し、そのことにより阻害剤の結合様式との干渉を最小限にするか又は回避する。よって、アミノ酸エステルモチーフと分子の残りの部分との間の連結化学を形成する可変部の厳密な組み合わせは、全体としての化合物の1次結合様式とはしばしば無関係である。
【0069】
上記の一般的な観察を念頭において、基-L1-Y1-[CH2]z-を形成する可変部を以下に順に示す。
zは、0又は1であり得、それにより、分子の残りの部分に連結されるメチレン基は任意である。
Y1は、例えば、-NR3-、-S-、-O-、-C(=O)NR3-、-NR3C(=O)-又は-C(=O)O- (式中、R3は、水素又は任意に置換されていてもよいC1〜C6アルキル、例えば-CH2CH2OHである)であり得る。
【0070】
基L1において、存在する場合、Alk1及びAlk2基の例は、-CH2-、-CH2CH2-、-CH2CH2CH2-、-CH2CH2CH2CH2-、-CH=CH-、-CH=CHCH2-、-CH2CH=CH-、CH2CH=CHCH2-、-C≡C-、-C≡CCH2-、CH2C≡C-、及びCH2C≡CCH2を含む。Alk1及びAlk2のさらなる例は、-CH2W-、-CH2CH2W-、-CH2CH2WCH2-、-CH2CH2WCH(CH3)-、-CH2WCH2CH2-、-CH2WCH2CH2WCH2-、及び-WCH2CH2- (式中、Wは-O-、-S-、-NH-、-N(CH3)-、又は-CH2CH2N(CH2CH2OH)CH2-である)を含む。Alk1及びAlk2のさらなる例は、2価のシクロプロピル、シクロペンチル及びシクロヘキシル基を含む。
【0071】
Alk1及びAlk2は、存在する場合、分岐鎖のアルキル、例えば-CH(CH3)-、-C(CH3)2-、又はいずれの向きでの-CH2CH(CH3)-、-CH2C(CH3)2-でもあり得る。
【0072】
L1において、nが0である場合、この基は、炭化水素鎖(任意に置換されていてもよく、エーテル、チオエーテル又はアミノ結合をおそらく有する)である。現在のところ、L1には任意の置換基が存在しないのが好ましい。m及びpがともに0である場合、L1は、2価の単環式若しくは2環式の5〜13環原子を有する炭素環式又は複素環式基(任意に置換されていてもよい)である。nが1であり、m及びpの少なくとも一方が1である場合、L1は、炭化水素鎖及び単環式若しくは2環式の5〜13環原子を有する炭素環式又は複素環式基(任意に置換されていてもよい)を含む2価の基である。存在する場合、Qは、例えば2価のフェニル、ナフチル、シクロプロピル、シクロペンチル若しくはシクロヘキシル基、又は単環式若しくは2環式の5〜13員環の複素環式基、例えばピペリジニル、ピペラジニル、インドリル、ピリジル、チエニル、又はピロリル基であり得るが、1,4-フェニレンが現在のところ好ましい。
【0073】
具体的には、本発明のいくつかの実施形態において、nが1であってL1、m及びpは0であり得る。別の実施形態において、mが1であってn及びpは0であり得る。さらなる実施形態において、m、n及びpは全て0であり得る。さらなる実施形態において、mは0であり得、Qが単環式の複素環式基であってnは1であり得、pは0又は1であり得る。Alk1及びAlk2は、存在する場合、-CH2-、-CH2CH2-、及び-CH2CH2CH2-から選択でき、Qは1,4-フェニレンであり得る。
【0074】
基-L1-Y1-[CH2]z-の具体例は、-(CH2)3NH-、-CH2C(=O)NH-、-CH2CH2C(=O)NH-、-CH2C(O)O-、-CH2S-、-CH2CH2C(O)O-、-(CH2)4NH-、-CH2CH2S-、-CH2O、-CH2CH2O-、
【化14】

を含む。
【0075】
上記のように、本発明が関係する化合物は、HDAC阻害剤であり、よって、ヒト及びその他の哺乳動物における癌のような細胞増殖性疾患の治療に有用であり得る。
【0076】
いずれの特定の患者についての具体的な用量レベルは、用いられる具体的な化合物の活性、年齢、体重、全身の健康、性別、食餌、投与の時間、投与経路、排出速度、薬物の組み合わせ及び治療を受ける特定の疾患の重篤度を含む種々の因子に依存することが理解されるであろう。最適用量レベル及び投与の頻度は、臨床試験により決定される。
【0077】
本発明が関係する化合物は、それらの薬物動態学的特性に矛盾しないいずれの経路による投与のために製造できる。経口投与可能な組成物は、錠剤、カプセル剤、散剤、顆粒剤、ロゼンジ、液剤又はゲル製剤の形、例えば経口、局所若しくは滅菌非経口の溶液又は懸濁液の形であり得る。
経口投与のための錠剤及びカプセル剤は、単位用量提示形態(unit dose presentation form)であり得、通常の賦形剤、例えば結合剤、例えばシロップ、アカシア、ゼラチン、ソルビトール、トラガカント又はポリビニルピロリドン;充填剤、例えばラクトース、ショ糖、トウモロコシデンプン、リン酸カルシウム、ソルビトール又はグリシン;打錠滑沢剤、例えばステアリン酸マグネシウム、タルク、ポリエチレングリコール、又はシリカ;崩壊剤、例えばバレイショデンプン、或いは許容される湿潤剤、例えばラウリル硫酸ナトリウムを含有し得る。錠剤は、通常の製薬のプラクティスにおいて公知の方法に従って被覆できる。
経口の液体製剤は、例えば水性若しくは油性の懸濁剤、液剤、乳剤、シロップ又はエリキシル剤の形であり得るか、或いは使用前に水又はその他の適切なビヒクルを用いる再構成のための乾燥物質であり得る。このような液体製剤は、通常の添加剤、例えば懸濁剤、例えばソルビトール、シロップ、メチルセルロース、グルコースシロップ、ゼラチン硬化食用油;乳化剤、例えばレシチン、ソルビタンモノオレエート、又はアカシア;非水性ビヒクル(食用油を含み得る)、例えばアーモンド油、ヤシ油、油状エステル、例えばグリセリン、プロピレングリコール又はエチルアルコール;防腐剤、例えばメチル若しくはプロピルp-ヒドロキシベンゾエート又はソルビン酸、並びに所望により通常の矯味矯臭剤又は着色剤を含み得る。
【0078】
吸入による局所的な使用のために、薬剤は、例えば圧力駆動噴射噴霧器又は超音波噴霧器によるか、或いは好ましくは噴射剤駆動計量供給エアロソル又は微粉末の噴射剤フリーの投与、例えば吸入カプセル若しくはその他の「乾燥粉末」送達系によるエアロソル送達用に処方できる。賦形剤、例えば噴射剤(例えば計量供給エアロソルの場合、Frigen)、界面活性剤、乳化剤、安定化剤、防腐剤、矯味矯臭剤及び充填剤(例えば粉末吸入器の場合、ラクトース)が、このような吸入製剤に存在し得る。吸入の目的のために、患者に適する吸入法を用いて、最適粒子サイズのエアロソルを発生させ投与できる多数の装置が利用可能である。アダプタ(スペーサー、エキスパンダー)及び洋ナシ形の容器(例えばNebulator(登録商標)、Volumatic(登録商標))、及び特に粉末吸入器の場合の計量供給エアロソル用の吹きかけるスプレーを発射する自動装置(Autohaler(登録商標))に加えて、多くの技術的解決法が利用可能である(例えば、Diskhaler(登録商標)、Rotadisk(登録商標)、Turbohaler(登録商標)、又は欧州特許出願EP 0 505 321に記載されるような吸入器)。
【0079】
皮膚への局所的な塗布のために、薬剤は、クリーム、ローション又は軟膏剤として製造できる。薬剤に使用し得るクリーム又は軟膏の製剤は、例えば英国薬局方のような製薬の標準的な参考書に記載されるような当該技術において公知の通常の製剤である。
【0080】
眼への局所的な使用のために、薬剤は、適切な滅菌の水性又は非水性のビヒクル中の液剤又は懸濁剤として製造できる。添加剤、例えば緩衝剤、例えばメタ重硫酸ナトリウム又はエデト酸二ナトリウム;殺菌剤及び殺真菌剤を含む防腐剤、例えば酢酸-若しくは硝酸-フェニル第2水銀、塩化ベンザルコニウム又はクロルヘキシジン、及び増粘剤、例えばヒプロメロースも含まれることができる。
【0081】
活性成分は、滅菌媒体中で非経口的に投与することもできる。用いるビヒクル及び濃度に応じて、薬剤は、ビヒクル中に懸濁又は溶解できる。有利には、アジュバント、例えば局所麻酔剤、防腐剤及び緩衝剤をビヒクル中に溶解できる。
【実施例】
【0082】
合成
本発明が関係する化合物(I)の合成のための合成方策は、複数存在するが、全て、合成有機化学者に知られる既知の化学に基づく。つまり、式(I)による化合物は、標準的な文献に記載され、当業者に公知の手順に従って合成できる。典型的な文献の出典は、「Advanced organic chemistry」, 第4版(Wiley), J March、「Comprehensive Organic Transformation」, 第2版(Wiley), R.C. Larock、「Handbook of Heterocyclic Chemistry」, 第2版(Pergamon), A.R. Katritzky、「Synthesis」、「Acc. Chem. Res.」、「Chem. Rev」に見出されるような総説の文献、又は標準的な文献検索により同定される1次的な文献の出典、若しくは「Chemical Abstracts」又は「Beilstein」のような2次的な出典である。以下の実施例の化合物の製造において用いた合成経路は、類似の化合物の製造に適合できる。
【0083】
略号
MeOH = メタノール
EtOH = エタノール
EtOAc = 酢酸エチル
Boc = tert-ブトキシカルボニル
DCM = ジクロロメタン
DMF = ジメチルホルムアミド
DMSO = ジメチルスルホキシド
TFA = トリフルオロ酢酸
THF = テトラヒドロフラン
Na2CO3 = 炭酸ナトリウム
K2CO3 = 炭酸カリウム
HCl = 塩化水素酸
aq = 水溶液
DIPEA = ジイソプロピルエチルアミン
NaH = 水素化ナトリウム
NaOH = 水酸化ナトリウム
NaHCO3 = 炭酸水素ナトリウム
Pd/C = パラジウムカーボン
TBME = tert-ブチルメチルエーテル
【0084】
N2 = 窒素
PyBop = ベンゾトリアゾール-1-イル-オキシ-トリス-ピロリジノ-ホスホニウム ヘキサフルオロホスフェート
Na2SO4 = 硫酸ナトリウム
Et3N = トリエチルアミン
NH3 = アンモニア
TMSCl = トリメチルクロロシラン
NH4Cl = 塩化アンモニウム
LiAlH4 = 水素化リチウムアルミニウム
PyBrOP = ブロモ-トリス-ピロリジノ ホスホニウムヘキサフルオロホスフェート
MgSO4 = 硫酸マグネシウム
nBuLi = n-ブチルリチウム
CO2 = 二酸化炭素
EDCI = N-(3-ジメチルアミノプロピル)-N'-エチルカルボジイミド 塩酸塩
Et2O = ジエチルエーテル
LiOH = 水酸化リチウム
HOBt = 1-ヒドロキシベンゾトリアゾール
【0085】
TLC = 薄層クロマトグラフィー
LCMS = 液体クロマトグラフィー / 質量分析
mL = ミリリットル
g = グラム
mg = ミリグラム
mol = モル
mmol = ミリモル
HPLC = 高性能液体クロマトグラフィー
NMR = 核磁気共鳴
RT = 室温
h = 時間
【0086】
以下の実施例は、本発明の具体的な化合物の製造、及びそれらのHDAC阻害特性を説明する。
アミノ酸エステルの製造(中間体A〜D)
【化15】

【0087】
製造される化合物:
【化16】

【0088】
図1に概説する化合物の合成
経路I (中間体Bについて例示)
工程1 - エステル形成
【化17】

【0089】
(S)-2-tert-ブトキシカルボニルアミノ-3-シクロヘキシル-プロピオン酸(5g, 19.4mmol)のDMF (50mL)中の溶液に、0℃にて、シクロペンタノール(8.8mL, 97.15mmol)、EDCI (4.09g, 21.37mmol)及び最後にDMAP (237mg, 1.94mmol)を加えた。反応混合物をRTまで温め、18時間撹拌した。
DMFを真空除去して、澄明な油を得た。これを水とEtOAcとで分離した。有機相を乾燥させ(MgSO4)、真空濃縮した。粗抽出物をカラムクロマトグラフィーにより精製して(ヘプタン中に25%のEtOAC)、所望の生成物を澄明な油として得た(14.87g, 55%)。1H NMR (300MHz, d6-DMSO) δ: 7.09 (1H, d), 5.08 (1H, t), 3.76 (1H, t), 1.50-1.85 (10H, br m), 1.39 (9H, s), 1.00-1.25 (9H, br m).
【0090】
工程2 - Boc脱保護により、シクロペンチル (2S)-アミノ(シクロヘキシル)アセテート 塩酸塩(中間体B)を得る
【化18】

【0091】
工程1の生成物(14.87g, 45.69mmol)をDCM (100mL)に溶解し、4M HCl/ジオキサン (22.8mL, 91.38mmol)で処理し、反応混合物をRTにて24時間撹拌した。粗混合物を減圧濃縮して、オレンジ色の油を得た。これをEt2Oで粉砕して、白色の沈殿物を得た。これをさらにEt2Oで洗浄して、所望の生成物を白色の粉末として得た(7.78g, 65%)。1H NMR (300MHz, d6-DMSO) δ: 8.45 (3H, br s), 5.22 (1H, t), 3.28 (1H, d), 1.95-1.50 (10H, br m), 1.30-0.90 (9H, br m).
【0092】
経路II
工程1 - エステルを形成して、(1S)-2-(シクロペンチルオキシ)-2-オキソ-1-フェニルエタンアミニウム 4-メチルベンゼンスルホネート(中間体C)を得る
【化19】

【0093】
(S)-フェニルグリシン(5g, 33.1mmol)のシクロヘキサン(150mL)中のスラリーに、シクロペンタノール(29.84mL, 331mmol)及びp-トルエンスルホン酸(6.92g, 36.4mmol)を加えた。反応物をディーンスターク受け器に取り付け、135℃まで加熱して完全に溶解した。12時間後に、反応物をRTまで冷却して、白色の固体の沈殿を導いた。固体をろ過し、EtOAcで洗浄した後に、減圧下で乾燥して、所望の生成物を白色の粉末として得た(11.01g, 85%)。1H NMR (300MHz, d6-DMSO) δ 8.82 (2H, br s), 8.73 (1H, br s), 7.47 (7H, m), 7.11 (2H, d), 5.25 (1H, br s), 5.18 (1H, m), 2.29 (3H, s), 1.87-1.36 (8H, m).
【0094】
経路III
工程1 - エステル形成
【化20】

【0095】
(S)-2-ベンジルオキシカルボニルアミノ-3-tert-ブトキシ-プロピオン酸(25g, 84.65mmol)のDMF (250mL)中の溶液に、0℃にて、シクロペンタノール(15.36mL, 169.3mmol)、EDCI (17.85g, 93.11mmol)及び最後にDMAP (1.03g, 8.46mmol)を加えた。反応混合物をRTまで温め、18時間撹拌した。
DMFを真空除去して、黄色の油を得た。これを水とEtOAcとで分配した。有機相を乾燥させ(MgSO4)、真空濃縮した。粗抽出物をカラムクロマトグラフィーにより精製して(ヘプタン中の25% EtOAC)、所望の生成物を澄明な油として得た。これを、特徴決定せずに次の工程に直接用いた。
【0096】
工程2 - Cbz脱保護して、シクロペンチル O-tert-ブチル-L-セリネート(中間体D)を得る
【化21】

【0097】
工程1の生成物を、EtOAc (150mL)に溶解し、Pd(OH)2 (10 mol%)で処理し、水素雰囲気下で32時間撹拌した。完了の際に、触媒をセライトろ過により除去し、ろ過物を真空濃縮して、所望の生成物を澄明な油として得た(15.96g, 2工程で82%)。1H NMR (300MHz, d6-DMSO) δ: 5.17 (1H, t), 3.45 (1H, m), 3.34 (2H, q), 1.90-1.50 (9H, br m), 1.08 (9H, s).
【0098】
O-(1-イソブトキシエチル)ヒドロキシルアミン(中間体E)の製造
【化22】

【0099】
中間体Eを、WO 01/60785に記載される以下の方法に従って製造した。
1H NMR (300MHz, d6-DMSO) δ: 0.85 (6H, d), 1.15 (3H, d), 1.75 (1H, m), 3.18 (1H, dd), 3.42 (1H, dd), 4.53 (1H, q), 5.82 (2H, s).
【0100】
エチル 2-(メチルスルホニル)ピリミジン-5-カルボキシレート(中間体F)の製造
【化23】

【0101】
工程1 - クロロ還元
【化24】

【0102】
エチル 4-クロロ-2-メチルチオ-5-ピリミジン カルボキシレート(12.5g, 53.88mmol)及びZn粉末(14.1g, 215.52mmol)を併せ、ベンゼン(60mL)及び3M NH4Cl (140mL)を加えた。懸濁物を激しく撹拌し、80℃に30時間加熱した。反応混合物をセライトろ過し、EtOAc (200mL)で洗浄した。ろ過物を約50mLまで真空濃縮し、次いで、H2O (400mL)とEtOAc (400mL)とで分配した。水相をさらにEtOAc (250mL)で抽出した。併せた有機相を乾燥し(MgSO4)、濃色の油まで真空濃縮した。これをカラムクロマトグラフィーにより精製した(純粋なヘプタン、次いで1:1:1 ヘプタン/CH2Cl2/Et2O、最後に2:2:0.5 ヘプタン/CH2Cl2/Et2O)。所望の生成物を、無色の油として得た(13g, 61%)。m/z = 199 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 1.30 (3H, t), 2.60 (3H, s), 4.35 (2H, q), 9.0 (2H, s).
【0103】
工程2 - スルフィドを酸化して、エチル 2-(メチルスルホニル)ピリミジン-5-カルボキシレート(中間体F)を得る
【化25】

【0104】
工程1の生成物(13g, 47.59mmol)の乾燥THF (250mL)中の溶液に、撹拌しながら、mCPBA (47.59g, 275.76mmol)のTHF (150mL)中の溶液を、0℃にてN2の下で30分かけてゆっくりと加えた。反応混合物をRTまで温め、2時間撹拌した。反応混合物を次いで、約100mLまで真空濃縮し、生成物 / 安息香酸混合物を、シリカゲルに予め吸着させた。精製は、カラムクロマトグラフィーにより行った(最初は純粋なヘキサン、次いで1:5:3 CH2Cl2/ヘプタン/Et2O、次いで1:1:1 CH2Cl2/ヘプタン/Et2O)。所望の化合物を、白色の固体として得た(10g, 66%)。m/z = 231 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 1.40 (3H, t), 3.50 (3H, s), 4.40 (2H, q), 9.50 (2H, s).
【0105】
3-アザビシクロ[3.1.0]ヘキシ-6-イルメタノール(中間体G)の製造
【化26】

【0106】
工程1 - ディールスアルダー反応
【化27】

【0107】
N-ベンジルマレイミド(50g, 267.1mmol)をEt2O (600mL)に溶解し、エチルジアゾアセテート(31mL, 293.8mmol)で処理し、RTにて窒素雰囲気下で36時間撹拌した。白色の沈殿物が形成され、これをろ過により単離し、氷冷Et2Oで洗浄し、乾燥して、所望の化合物を白色の固体として得た(72g, 89%)。m/z = 302 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 1.20 (3H, t), 4.15 (2H, q), 4.55 (2H, s), 4.60 (1H, d), 5.00 (1H, d), 7.15-7.35 (5H, m), 9.60 (1H, s).
【0108】
工程2 - 縮合
【化28】

【0109】
工程1の生成物(72g, 239.2mmol)を、融解するまで160℃に加熱し、黄色の油を得た。油をさらに200℃まで加熱すると、発泡が始まった。油を、発泡が治まるまで200℃にて30分間加熱した。得られた琥珀色の油をRTまで冷却し、氷冷Et2Oで粉砕した。得られた沈殿物をろ過し、さらに氷冷Et2Oで洗浄して、生成物をクリーム状の固体として得た(37.2g, 57%)。1H NMR (300MHz, d6-DMSO) δ: 1.20 (3H, t), 2.80 (1H, t), 3.00 (2H, d), 4.15 (2H, q), 4.35 (2H, s), 7.20-7.40 (5H, m).
【0110】
工程3 - 還元
【化29】

【0111】
工程2の生成物(37.2g, 136.3mmol)を、乾燥THF (400mL)に溶解した。この溶液を、0℃にて、LiAlH4 (20.7g, 545.3mmol)の乾燥THF (200mL)中の懸濁物に滴下した。得られた茶色の懸濁物を60℃に、窒素雰囲気下に36時間加熱した。次いで、混合物を0℃に冷却し、飽和NH4Claqを用いて注意深くクエンチした。灰色の固体が形成され、さらにTHFを加えて、穏やかに撹拌した。固体Na2SO4を混合物に加え、これをRTにて30分間撹拌した。混合物を、次いで、セライトろ過して、淡黄色の溶液を得た。これを真空濃縮して、所望の生成物をオレンジ色の油として得た(14.1g, 51%)。m/z = 204 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 2.25 (2H, d), 2.85 (2H, d), 3.20 (2H, t), 3.55 (2H, s), 4.35 (1H, t), 7.20-7.40 (5H, m).
【0112】
工程4 - 窒素脱保護して、3-アザビシクロ[3.1.0]ヘキシ-6-イルメタノール(中間体G)を得る
【化30】

【0113】
工程3の生成物(7.5g, 37.0mmol)を、乾燥MeOH (250mL)にRTにて溶解した。Pd(OH)2 (1.5g)を溶液に加え、反応物を水素バルーンに取り付けた。反応物を2回脱気し、H2でフラッシュした。反応物を6時間撹拌し、バルーンからの新鮮な水素でフラッシュして、さらに64時間撹拌した。反応混合物を、次いで、セライトろ過した。溶媒を真空除去し、残渣を乾燥して、生成物を白色の固体として得た(4.1g, 98%)。m/z = 114 [M+H]+, 1H NMR (300MHz, CDCl3) δ: 0.94 (1H, セプテット, J=3.3Hz), 1.37 (2H, m), 2.89 (2H, d, J=11.4Hz), 3.02 (2H, d, J=11.4Hz), 3.54 (2H, d, J=6.9Hz).
【0114】
実施例1
【化31】

【0115】
製造した化合物
【化32】

【0116】
(1)及び(2)について例示する図2に概説する化合物の合成
工程1 - カップリング
【化33】

【0117】
ピペリジン-4-オン HCl塩(1.16g, 8.5mmol)及びK2CO3 (11.70g, 85.0mmol)の懸濁物を、DMF (50mL)中でRTにて、窒素雰囲気下で10分間撹拌した。中間体F (1.97g, 8.5mmol)を次いで加え、撹拌をさらに10分間継続した。反応物を、次いで、水(150mL)で希釈し、EtOAc (2×200mL)で抽出した。併せた有機相を乾燥し(MgSO4)、溶媒を真空除去して、生成物を黄色の固体として得て、これをさらなる精製を行わずに次の工程に用いた。m/z = 250 [M+H]+.
【0118】
工程2 - エステル加水分解
【化34】

【0119】
工程1の生成物を、1M NaOHaq (30mL)及びTHF (30mL)中で、RTにて4日間撹拌した。反応物を、次いで、pH約3に1M HClaqを用いて酸性にし、これをDCM (2×200mL)で抽出した。併せた有機相を乾燥し(Na2SO4)、溶媒を真空除去して、生成物を黄色の固体として得た(665mg, 2工程で35%). m/z = 222 [M+H]+.
【0120】
工程3 - 還元的アミノ化
【化35】

【0121】
工程2の生成物(100mg, 0.45mmol)を、DCE (10mL)中で中間体A (106mg, 0.45mmol)及びNaBH(OAc)3 (142mg, 0.67mmol)とともに、RTにて窒素雰囲気下に3日間撹拌した。反応物を、次いで、水(50mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機相を乾燥し(Na2SO4)、溶媒を真空除去して、生成物を黄色の固体として得て、これを、さらなる精製を行わずに次の工程に用いた。m/z = 405 [M+H]+.
【0122】
工程4 - 保護されたヒドロキサメートの形成
【化36】

【0123】
工程3の生成物(182mg, 0.45mmol)を、DMF (10mL)中で、EDCI (103mg, 0.54mmol)、HOBt (73mg, 0.54mmol)、Et3N (314μL, 2.25mmol)及び中間体E (310μL, 2.25mmol)とともに16時間、RTにて窒素雰囲気下に撹拌した。反応物を、次いで、水(50mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機相を、次いで、乾燥し(MgSO4)、溶媒を真空除去した。残渣をカラムクロマトグラフィーにより精製して(DCM中の0〜15% MeOH)、生成物を黄色の油として得た(110mg, 47%)。m/z = 520 [M+H]+.
【0124】
工程5 - ヒドロキサメートを脱保護して、シクロペンチル N-[1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]-L-ロイシネート(1)を得る
【化37】

【0125】
工程4の生成物(110mg, 0.21mmol)を、DCM (20mL)中で、TFA (0.5mL)とともに、1時間、RTにて撹拌した。次いで、溶媒を真空除去し、残渣を分取(preparative) HPLCで精製して、生成物を紫色の固体として得た(12mg, 11%)。LCMS純度 99%, m/z = 420 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.91 (6H, m), 1.46-1.84 (13H, m), 2.05 (2H, m), 2.90 (2H, m), 3.42 (2H, m), 4.01 (1H, m), 4.91 (1H, m), 5.27 (1H, m), 8.58 (2H, m).
【0126】
工程6 - エステル加水分解
【化38】

【0127】
工程4の生成物(182mg, 0.45mmol)を、THF (10mL)中で、KOTMS (115mg, 0.9mmol)とともに4日間、RTにて窒素雰囲気下で撹拌した。この時間の後に、溶媒を真空除去し、残渣をさらなる精製を行わずに次の工程に用いた。m/z = 452 [M+H]+.
【0128】
工程7 - ヒドロキサメートを脱保護して、N-[1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]-L-ロイシン(2)を得る
【化39】

【0129】
工程6の生成物(0.45mmol)を、DCM (10mL)中で、TFA (1mL)とともにRTにて30分間撹拌した。溶媒を、次いで、真空除去し、残渣を分取HPLCにより精製して、生成物をピンク色の固体として得た(7mg, 2工程で5%)。LCMS純度 95%, m/z = 352 [M+H]+, NMR溶媒中に不溶。
【0130】
図2に概説する類似物を、(1)及び(2)について記載される手順により製造した。各類似物についてのデータは、以下のとおりである。
(3)
LCMS純度 97%, m/z = 440 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.30-1.61 (9H, m), 1.78-1.90 (4H, m), 2.23 (2H, m), 2.90 (2H, m), 5.00 (1H, m), 5.33 (1H, m), 7.53 (5H, m), 8.69 (2H, s).
(4)
LCMS純度 98%, m/z = 378 [M+H]+, NMR溶媒中に不溶。
【0131】
(5)
LCMS純度 97%, m/z = 446 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.80-1.82 (24H, m), 2.04 (2H, m), 2.94 (2H, m), 4.86 (1H, m), 5.23 (1H, m), 8.58 (2H, s).
(6)
LCMS純度 95%, m/z = 372 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.20 (2H, m), 1.50 (2H, m), 2.15 (2H, m), 2.80 (3H, m), 4.88 (1H, m), 7.37-7.46 (5H, m), 8.56 (2H, s).
(7)
LCMS純度 98%, m/z = 450 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.25 (9H, s), 1.58-1.77 (8H, br m), 1.96 (2H, m), 2.22 (2H, m), 3.02 (2H, m), 3.55 (1H, m), 3.87 (1H, dd, J=10.8, 2.7Hz), 3.99 (1H, dd, J=10.8, 2.7Hz), 4.45 (1H, m), 5.03 (2H, m), 5.35 (1H, m), 8.70 (2H, s).
【0132】
(8)
LCMS純度 98%, m/z = 382 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.25 (9H, s), 1.65 (2H, m), 2.25 (2H, m), 3.01 (2H, t, J=13.2Hz), 3.57 (1H, m), 3.91 (1H, dd, J=10.5, 2.7Hz), 4.00 (1H, dd, J=10.5, 2.7Hz), 4.38 (1H, m), 5.05 (2H, m), 8.70 (2H, s).
(9)
LCMS純度 95%, m/z = 394 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.52-1.98 (11H, m), 2.10 (2H, m), 2.87 (3H, m), 3.44 (1H, m), 3.95 (2H, m), 4.18 (1H, m), 5.25 (1H, m), 8.58 (2H, m).
【0133】
実施例2
【化40】

【0134】
製造した化合物:
【化41】

【0135】
(14)及び(15)について例示する図3に概説する化合物の合成
工程1 - カップリング
【化42】

【0136】
中間体G (0.97g, 8.62mmol)を、DMF (20mL)及びMeCN (20mL)中で、K2CO3 (5.96g, 43.10mmol)とともにRTにて、窒素雰囲気下で10分間撹拌した。次いで、中間体F (2.00g, 8.62mmol)を加え、反応物をさらに20分間撹拌した。反応物を、次いで、水(100mL)で希釈し、EtOAc (2×100mL)で抽出した。併せた有機相を乾燥し(MgSO4)、溶媒を真空除去して、生成物を明黄色の固体として得て、これを、さらなる精製を行わずに次の工程に用いた(1.8g, 78%)。m/z = 264 [M+H]+.
【0137】
工程2 - アルコール酸化
【化43】

【0138】
工程1の生成物(1.80g, 6.84mmol)を、DCM (50mL)中で0℃にて撹拌し、デス-マーチンペルヨージナン(3.50g, 8.22mmol)を加えた。反応物をRTまで温め、4時間撹拌した。次いで、これを飽和NaHCO3(aq)及び飽和Na2S2O4(aq)の1:1混液でクエンチし、得られた混合物を20分間撹拌した。次いで、混合物をDCM (2×100mL)で抽出し、併せた有機抽出物を乾燥し(MgSO4)、溶媒を真空除去した。残渣をカラムクロマトグラフィーにより精製して(DCM中の0〜10% MeOH)、生成物を黄色の油として得た(1.35g, 72%)。m/z = 262 [M+H]+.
【0139】
工程3 - エステル加水分解
【化44】

【0140】
工程2の生成物(1.35g, 5.17mmol)を、1M NaOHaq (20mL)及びTHF (20mL)中で、RTにて3時間撹拌した。反応物を、次いで、pH約3まで1M HClaqを用いて酸性にし、これにより白色の固体が沈殿した。この固体をろ過し、乾燥して保存した。ろ過物を、次いで、DCM (2×100mL)で抽出し、併せた有機相を乾燥し(Na2SO4)、溶媒を真空除去して、淡黄色の固体を得て、これを先に得られた固体と併せた(990mg, 82%)。m/z = 236 [M+H]+.
【0141】
工程4 - 還元的アミノ化
【化45】

【0142】
工程3の生成物(175mg, 0.75mmol)を、DCE (10mL)中で、中間体B (196mg, 0.75mmol)及びNaBH(OAc)3 (222mg, 1.05mmol)とともに、RTにて窒素雰囲気下で16時間撹拌した。反応物を、次いで、H2O (50mL)で希釈し、Et2Oで抽出した。併せた有機相を乾燥し(Na2SO4)、溶媒を真空除去して、所望の生成物を黄色の油として得て、これを、さらなる精製を行わずに次の工程で用いた(171mg, 52%)。m/z = 443 [M+H]+.
【0143】
工程5 - 保護されたヒドロキサメートの形成
【化46】

【0144】
工程4の生成物(171mg, 0.39mmol)を、DMF (10mL)中で、中間体E (539μL, 3.9mmol)、EDCI (90mg, 0.47mmol)、HOBt (63mg, 0.47mmol)及びEt3N (543μL, 3.9mmol)とともに、RTにて窒素雰囲気下で16時間撹拌した。反応物を、次いで、H2O (50mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機相を乾燥し(MgSO4)、溶媒を真空除去した。残渣をカラムクロマトグラフィーにより精製して(DCM中に0〜10% MeOH)、生成物を無色の油として得た(91mg, 42%)。m/z = 558 [M+H]+.
【0145】
工程6 - ヒドロキサメートを脱保護して、シクロペンチル (2S)-シクロヘキシル[([3-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]-3-アザビシクロ[3.1.0]ヘキシ-6-イル]メチル)アミノ]アセテート(14)を得る
【化47】

【0146】
工程5の生成物(91mg, 0.163mmol)を、1:1 MeOH / DCM (4mL)中で、TFA (2mL)とともにRTにて1時間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、所望の生成物を白色の固体として得た(15mg, 20%)。LCMS純度 98%, m/z = 558 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.92-1.38 (6H, m), 1.73-1.95 (16H, m), 3.09 (2H, m), 3.62 (2H, d, J=11.4Hz), 3.91 (1H, d, J=3.6Hz), 4.00 (2H, d, J=11.4Hz), 5.51 (1H, m), 8.67 (2H, s).
【0147】
工程7 - エステル加水分解
【化48】

【0148】
工程5の生成物(161mg, 0.29mmol)を、THF (10mL)中で、KOTMS (74mg, 0.58mmol)とともにRTにて窒素雰囲気下で48時間撹拌した。さらにKOTMS (112mg, 0.87mmol)を加え、反応物を50℃にて48時間撹拌した。次いで、溶媒を真空除去し、残渣を、さらなる精製を行わずに次の工程で用いた。m/z = 490 [M+H]+.
【0149】
工程8 - ヒドロキサメートを脱保護して、(2S)-シクロヘキシル[([3-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]-3-アザビシクロ[3.1.0]ヘキシ-6-イル]メチル)アミノ]酢酸 (15)を得る
【化49】

【0150】
工程7の生成物(0.29mmol)を、DCM (10mL)中で、TFA (1mL)とともにRTにて30分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、生成物を白色の固体として得た(13mg, 12%)。LCMS純度 99%, m/z = 390 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.96 (1H, m), 1.10-1.47 (6H, m), 1.72-1.87 (6H, m), 1.99 (1H, m), 2.99 (1H, m), 3.18 (1H, m), 3.63 (2H, dd, J=11.7, 3.3Hz), 3.85 (1H, d, J=3.3Hz), 3.99 (2H, d, J=11.7Hz), 8.67 (2H, s).
【0151】
図3に概説する類似物は、(14)及び(15)について記載される手順により製造した。各類似物についてのデータを、以下に示す。
(10)
LCMS純度 95%, m/z = 452 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.41-1.64 (6H, m), 1.72-1.93 (5H, m), 2.88 (2H, m), 3.60 (2H, m), 3.97 (2H, d, J=10.5Hz), 5.26 (1H, s), 5.32 (1H, m), 7.51 (5H, m), 8.67 (2H, s).
(11)
LCMS純度 97%, m/z = 384 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.94 (1H, m), 1.83 (2H, m), 3.01 (2H, d, J=7.5Hz), 3.62 (2H, m), 3.96 (2H, d, J=11.7Hz), 5.07 (1H, s), 7.53 (5H, m), 8.67 (2H, s).
【0152】
(12)
LCMS純度 95%, m/z = 462 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.99 (1H, m), 1.24 (9H, s), 3.11 (2H, dd, J=7.5, 2.4Hz), 3.63 (2H, dd, J=12.0, 3.1Hz), 3.91 (2H, ddd, J=24.6, 10.8, 3.3Hz), 4.01 (2H, d, J=11.7Hz), 4.26 (1H, m), 5.35 (1H, m), 8.68 (2H, s).
(13)
LCMS純度 98%, m/z = 394 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.01 (1H, m), 1.25 (9H, s), 1.88 (2H, m), 3.11 (2H, d, J=7.5Hz), 3.64 (2H, dd, J=11.7, 3.9Hz), 3.90 (2H, m), 4.01 (2H, d, J=11.7Hz), 4.14 (1H, m), 8.67 (2H, s).
【0153】
実施例3
【化50】

【0154】
製造した化合物:
【化51】

【0155】
(18)及び(19)について例示する図4に概説する化合物の合成
工程1 - カップリング
【化52】

【0156】
ピペリジン-4イル-メタノール(2.48g, 21.55mmol)を、1:1 DMF/MeCN (20mL)中で、K2CO3 (8.9g, 64.65mmol)とともに、10分間、RTにて窒素雰囲気下で撹拌した。中間体F (5g, 21.55mmol)を、次いで加え、反応物を20分間撹拌した。次いで、これをH2O (100mL)で希釈し、EtOAc (2×100mL)で抽出した。併せた有機相を乾燥し(MgSO4)、溶媒を真空除去して、生成物をオレンジ色の固体として得て、これを、さらなる精製を行わずに次の工程で用いた(5.70g, 99%)。m/z = 266 [M+H]+.
【0157】
工程2 - エステル加水分解
【化53】

【0158】
工程1の生成物(5.70g, 21.51mmol)を、1M NaOHaq (20mL)及びTHF (20mL)中で、RTにて48時間撹拌した。次いで、反応物を、2M HClaqを用いてpH約3まで酸性にし、固体を沈殿させた。これを回収し、真空乾燥して、生成物を白色の固体として得た(4.47g, 89%)。m/z = 238 [M+H]+.
【0159】
工程3 - 保護されたヒドロキサメートの形成
【化54】

【0160】
工程2の生成物(4.47g, 18.86mmol)を、DMF (50mL)中で、中間体E (13.00mL, 94.30mmol)、EDCI (4.33g, 22.60mmol)、HOBt (3.05g, 22.60mmol)及びEt3N (13.10mL, 94.30mmol)とともに、RTにて窒素雰囲気下で48時間撹拌した。反応物を、次いで、H2O (200mL)で希釈し、DCM (2×200mL)で抽出した。併せた有機相を乾燥し (MgSO4)、溶媒を真空除去した。残渣をカラムクロマトグラフィーにより精製して(DCM中に0〜15% MeOH)、生成物を黄色の油として得た(5.12g, 77%)。m/z = 353 [M+H]+.
【0161】
工程4 - アルコール酸化
【化55】

【0162】
(COCl)2 (253μL, 2.90mmol)のDCM (50mL)中の溶液を、窒素雰囲気下で撹拌し、内部温度を-70℃に冷却した。DMSO (363μL, 5.11mmol)を、次いで、温度を-70℃に維持しながらゆっくりと加えた。添加が完了したときに、工程3の生成物(1.00g, 2.84mmol)のDCM (50mL)中の溶液を、内部温度を-70℃に維持しながらゆっくりと加えた。添加が完了したときに、Et3N (1.70mL, 12.21mmol)を、内部温度を-70℃に維持しながらゆっくりと加えた。反応物をRTまで温め、次いで、溶媒を真空除去した。残渣をカラムクロマトグラフィーにより精製して(DCM中に0〜10% MeOH)、生成物を無色の油として得た(890mg, 89%)。m/z = 351 [M+H]+.
【0163】
工程5 - 還元的アミノ化
【化56】

【0164】
工程4の生成物(100mg, 0.28mmol)を、DCE (10mL)中で、中間体B (73mg, 0.28mmol)及びNaBH3CN (35mg, 0.56mmol)とともにRTにて窒素雰囲気下で16時間撹拌した。反応物を、次いで、H2O (50mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機相を乾燥し(MgSO4)、溶媒を真空除去した。残渣をカラムクロマトグラフィーにより精製して(DCM中に0〜10% MeOH)、生成物を無色の油として得た(145mg, 92%)。m/z = 560 [M+H]+.
【0165】
工程6 - ヒドロキサメートを脱保護して、シクロペンチル (2S)-シクロヘキシル[([1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]メチル)アミノ]アセテート(18)を得る
【化57】

【0166】
工程5の生成物(145mg, 0.26mmol)を、DCM (10mL)中で、TFA (0.5mL)とともにRTにて10分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCで精製して、生成物を淡紫色の固体として得た(11mg, 9%)。LCMS純度 >95%, m/z 460 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.02-1.37 (8H, m), 1.73-1.94 (19H, m), 3.02 (3H, m), 3.90 (1H, m), 5.37 (1H, m), 8.67 (2H, s).
【0167】
工程7 - エステル加水分解及びヒドロキサメートを脱保護して、(2S)-シクロヘキシル[([1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]メチル)アミノ]酢酸(19)を得る
【化58】

【0168】
工程5の生成物(78mg, 0.14mmol)を、1M NaOHaq (10mL)及びTHF (10mL)中で4日間、40℃にて撹拌した。この時間の後に、反応物をRTまで冷却し、pH約3まで1M HClaqを用いて酸性にした。この混合物を10分間撹拌し、次いで、蒸発乾燥させた。残渣を分取HPLCにより精製して、生成物を白色の固体として得た(1mg, 2%)。LCMS純度98%, m/z = 392 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.03-1.25 (9H, m), 1.60-1.87 (8H, m), 2.06 (1H, m), 2.85 (4H, m), 3.44 (1H, m), 8.55 (2H, s).
【0169】
図4に概説する類似物は、(18)及び(19)について記載した手順により製造した。各類似物についてのデータを、以下に示す。
(16)
LCMS純度 98%, m/z = 434 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.03 (6H, m), 1.32 (4H, m), 1.71-1.95 (15H, m), 2.90 (1H, m), 3.01 (2H, m), 4.01 (1H, m), 5.37 (1H, m), 8.68 (2H, m).
(17)
LCMS純度 97%, m/z = 366 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.92 (6H, m), 1.19 (3H, m), 1.58 (2H, m), 1.75 (4H, m), 1.98 (1H, m), 2.89 (4H, m), 3.70 (1H, m), 8.55 (2H, s).
【0170】
(20)
LCMS純度 98%, m/z = 454 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.19-1.62 (10H, m), 1.79-1.92 (6H, m), 2.09 (1H, m), 2.84 (1H, m), 2.97 (2H, m), 5.32 (1H, m), 7.54 (5H, m), 8.67 (2H, m)
(21)
LCMS純度 98%, m/z = 386 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.08-1.28 (4H, m), 1.77 (2H, m), 1.98 (1H, m), 2.68-2.87 (4H, m), 4.90 (1H, m), 7.39 (5H, m), 8.54 (2H, s).
【0171】
(22)
LCMS純度 98%, m/z = 464 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.13 (9H, s), 1.56-1.71 (12H, m), 1.82 (3H, m), 2.04 (1H, m), 2.91 (3H, m), 3.81 (2H, m), 4.14 (1H, m), 5.39 (1H, m), 8.55 (2H, m).
(23)
LCMS純度 98%, m/z = 396 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.26 (9H, s), 1.31 (4H, m), 1.94 (2H, m), 2.14 (1H, br s), 3.03 (4H, m), 3.95 (2H, m), 4.16 (1H, m), 8.67 (2H, s).
【0172】
(24)
LCMS純度 98%, m/z = 408 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.22-1.33 (3H, m), 1.53-1.73 (11H, m), 2.02 (1H, m), 2.93 (4H, m), 3.91 (2H, m), 4.02 (1H, m), 5.23 (1H, m), 8.55 (2H, s).
(25)
LCMS純度 95%, m/z = 340 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.28 (2H, m), 1.97 (2H, m), 2.15 (1H, m), 3.07 (4H, m), 4.09 (4H, m), 4.93 (1H, m), 8.67 (2H, m).
(26)
LCMS純度 87%, m/z = 504 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.02-1.48 (7H, br m), 1.67-1.82 (5H, m), 2.01 (1H, m), 2.97 (2H, m), 3.13 (4H, m), 5.19 (2H, m), 7.49 (3H, m), 7.83 (4H, m), 8.59 (2H, s).
【0173】
実施例4
【化59】

【0174】
製造した化合物:
【化60】

【0175】
(27)及び(28)について例示する図5に概説する化合物の合成
工程1 - Boc保護
【化61】

【0176】
4-(アミノメチル)安息香酸(10.00g, 65.36mmol)を、H2O (100mL)及びTHF (100mL)中のBoc2O (28.00g, 130.72mmol)とともに、RTにて撹拌した。飽和NaHCO3(aq)を、pHが約6になるまで加え、反応物を16時間撹拌した。次いで、反応物をpH約3まで1M HClaqを用いて注意深く酸性にし、これにより固体が沈殿した。これをろ過し、乾燥して、生成物を白色の固体として得た(16.1g, 97%)。m/z = 274 [M+Na]+.
【0177】
工程2 - 酸還元
【化62】

【0178】
工程1の生成物(16.1g, 64.14mmol)を、THF (300mL)及びジオキサン(200mL)中で、0℃にて窒素雰囲気下で撹拌した。次いで、LiAlH4を加え、反応物をRTまで温め、16時間撹拌した。次いで、これを0℃に冷却し、飽和NH4Claqでクエンチした。Na2SO4を加え、混合物を30分間撹拌した。次いで、これをセライトろ過し、ろ過物を真空濃縮して、生成物を明黄色の固体として得た(13.1g, 94%)。m/z = 260 [M+Na]+.
【0179】
工程3 - アルコール酸化
【化63】

【0180】
工程2の生成物(5.87g, 24.73mmol)を、DCM (200mL)中で、MnO2 (16.71g, 192.20mmol)とともに、RTにて16時間撹拌した。反応物を、次いで、セライトろ過し、溶媒を真空除去して、生成物を黄色の油として得て、これを、さらなる精製を行わずに次の工程で用いた(4.63g, 80%)。m/z = 258 [M+Na]+.
【0181】
工程4 - 還元的アミノ化
【化64】

【0182】
工程3の生成物(650mg, 2.70mmol)を、DCE (20mL)、中間体A (634mg, 2.70mmol)及びNaBH(OAc)3 (918mg, 4.33mmol)中で、RTにて窒素雰囲気下で3時間撹拌した。この時間の後に、反応物をH2O (50mL)で希釈し、Et2O (2×100mL)で抽出した。併せた有機抽出物を乾燥し(MgSO4)、溶媒を真空除去して、生成物を茶色の油として得て、これを、さらなる精製を行わずに次の工程で用いた(1.1g, 98%)。m/z = 419 [M+H]+.
【0183】
工程5 - Boc脱保護
【化65】

【0184】
工程4の生成物(1.1g, 2.63mmol)を、DCM (5mL)中で、ジオキサン(2mL)中の4M HClとともにRTにて窒素雰囲気下で3時間撹拌した。溶媒を真空除去し、残渣を乾燥して、生成物を茶色の固体として、HCl塩として得た(670mg, 100%)。m/z = 319 [M+H]+.
【0185】
工程6 - 還元的アミノ化
【化66】

【0186】
2-(4-オキソピペリジン-1-イル)ピリミジン-5-カルボン酸(実施例1に記載されるようにして製造 - 100mg, 0.45mmol)を、DCE (10mL)中で、工程5の生成物(159mg, 0.45mmol)及びNaBH(OAc)3 (191mg, 0.9mmol)とともに、RTにて窒素雰囲気下で64時間撹拌した。次いで、反応物をH2O (100mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機相を乾燥し(Na2SO4)、溶媒を真空除去した。残渣を、さらなる精製を行わずに次の工程で用いた。m/z = 524 [M+H]+.
【0187】
工程7 - 保護されたヒドロキサメートの形成
【化67】

【0188】
工程6の生成物(0.45mmol)を、DMF (10mL)中で、中間体E (621μL, 4.50mmol)、EDCI (103mg, 0.54mmol)、HOBt (73mg, 0.54 mmol)及びEt3N (313μL, 2.25mmol)とともに、RTにて窒素雰囲気下で40時間撹拌した。次いで、反応物をH2O (50mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機相を乾燥し(MgSO4)、溶媒を真空除去して、生成物を黄色の油として得て、これを、さらなる精製を行わずに次の工程で用いた。m/z = 639 [M+H]+.
【0189】
工程8 - ヒドロキサメートを脱保護して、シクロペンチル N-[4-[([1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]アミノ)メチル]ベンジル]-L-ロイシネート(27)を得る
【化68】

【0190】
工程7の生成物(0.45mmol)を、DCM (10mL)中で、TFA (1mL)とともにRTにて30分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、生成物をピンク色の固体として得た(15mg, 3工程で6%)。LCMS純度 96%, m/z = 639 [M+H]+. 1H NMR (300MHz, CD3OD) δ: 1.00 (6H, m), 1.61-1.95 (12H, m), 2.28 (2H, m), 3.04 (3H, m), 4.01 (1H, m), 4.29 (4H, m), 5.04 (2H, m), 5.34 (1H, m), 7.60 (4H, m), 8.70 (2H, s).
【0191】
工程9 - エステル加水分解
【化69】

【0192】
工程7の生成物(0.45mmol)を、THF (10mL)中で、KOTMS (115mg, 0.9mmol)とともに96時間、RTにて窒素雰囲気下で撹拌した。次いで、溶媒を真空除去し、残渣を、さらなる精製を行わずに次の工程で用いた。m/z = 571 [M+H]+.
【0193】
工程10 - ヒドロキサメートを脱保護して、N-[4-[([1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]アミノ)メチル]ベンジル]-L-ロイシン(28)を得る。
【化70】

【0194】
工程9の生成物を、DCM (10mL)中で、TFA (1mL)とともにRTにて30分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、生成物を白色の固体として得た(5mg, 3%)。m/z = 471 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 0.9 (6H, d, J=4.8Hz), 1.51 (2H, m), 1.71 (2H, m), 2.19 (2H, m), 3.00 (4H, m), 4.42 (2H, br s), 3.75 (1H, m), 4.22 (4H, m), 4.80 (2H, m), 7.52 (4H, m), 8.71 (2H, s), 8.98 (2H, br s), 11.01 (1H, s).
【0195】
図5に概説する類似物は、(27)及び(28)について記載される手順により製造した。各類似物についてのデータを、以下に示す。
(29)
LCMS純度 99%, m/z = 565 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 0.88 (2H, m), 1.05-1.30 (5H, m), 1.50-1.85 (18H, m), 2.18 (2H, m), 3.00 (2H, m), 2.25 (2H, m), 4.80 (2H, m), 5.17 (2H, m), 7.54 (4H, m), 8.71 (2H, s), 8.93 (2H, m), 9.45 (1H, br s), 11.10 (1H, s).
(30)
LCMS純度 95%, m/z = 497 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.80-1.34 (6H, m), 1.49-1.68 (5H, m), 1.85 (1H, m), 2.17 (2H, m), 2.93 (4H, m), 3.58 (1H, m), 4.20 (4H, m), 4.93 (2H, m), 7.51 (4H, m), 8.59 (2H, m).
【0196】
(31)
LCMS純度 98%, m/z = 569 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.22 (9H, s), 1.51-1.84 (11H, m), 2.18 (2H, m), 2.93 (3H, m), 3.44 (1H, m), 3.79 (2H, qd, J = 7.8, 3.3Hz), 4.24 (4H, m), 4.93 (2H, m), 5.22 (1H, m), 7.52 (4H,, m), 8.59 (2H, s).
(32)
LCMS純度 96%, m/z = 501 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.25 (9H, s), 1.62 (2H, m), 2.29 (2H, m), 3.07 (4H, m), 3.85 (2H, m), 4.35 (4H, m), 5.07 (2H, m), 7.63 (4H, m), 8.71 (2H, m).
【0197】
(33)
LCMS純度 98%, m/z = 559 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.31-1.93 (12H, m), 2.29 (2H, m), 3.04 (3H, m), 3.56 (1H, m), 4.22 (4H, m), 5.17 (2H, m), 5.30 (1H, m), 7.47-7.43 (9H, m), 8.69 (2H, s).
(34)
LCMS純度 95%, m/z = 491 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.63 (2H, m), 2.29 (2H, m), 3.06 (2H, m), 3.29 (2H, m), 3.56 (1H, m), 4.20 (4H, m), 5.07 (1H, m), 7.54 (9H, m), 8.70 (2H, s).
【0198】
実施例5
【化71】

【0199】
製造した化合物:
【化72】

【0200】
工程1 - 還元的アミノ化
【化73】

【0201】
シクロペンチル (2S)-[[4-(アミノメチル)ベンジル]アミノ](フェニル)アセテート(実施例4に記載されるようにして製造 - 100mg, 0.29mmol)を、DCE (10mL)中の2-(6-ホルミル-3-アザビシクロ[3.1.0]ヘキシ-3-イル)-N-(1-イソブトキシエトキシ)ピリミジン-5-カルボキサミド(実施例2に記載されるようにして製造 - 108mg, 0.29mmol)及びNaBH3CN (36mg, 0.58mmol)とともに、RTにて窒素雰囲気下で16時間撹拌した。次いで、反応物をH2O (50mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機抽出物を乾燥し(MgSO4)、溶媒を真空除去した。残渣をカラムクロマトグラフィーにより精製して(DCM中に0〜10% MeOH)、生成物を黄色の油として得た(56mg, 29%)。m/z = 671 [M+H]+.
【0202】
工程2 - ヒドロキサメートを脱保護して、シクロペンチル (2S)-[(4-[[([3-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]-3-アザビシクロ[3.1.0]ヘキシ-6-イル]メチル)アミノ]メチル]ベンジル)アミノ](フェニル)アセテート(35)を得る
【化74】

【0203】
工程1の生成物(56mg, 0.08mmol)を、DCM (10mL)中で、TFA (1mL)とともにRTにて15分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、生成物をピンク色の固体として得た(12mg, 25%)。m/z = 571 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.98 (1H, m), 1.31-1.64 (6H, m), 1.76-1.93(4H, m), 3.09 (2H, d, J=7.5Hz), 3.61 (2H, d, J=10.5Hz), 3.98 (2H, d, J=10.5Hz), 4.15 (2H, m), 4.27 (3H, m), 5.31 (1H, m), 7.57 (9H, m), 8.66 (2H, s).
【0204】
実施例6
【化75】

【0205】
製造した化合物:
【化76】

【0206】
(38)及び(39)について例示する図7に概説する化合物の合成
工程1 - 還元的アミノ化
【化77】

【0207】
シクロペンチル (2S)-[[4-(アミノメチル)ベンジル]アミノ](4-メチルシクロヘキシル)アセテート(実施例4に記載されるようにして製造 - 100mg, 0.29mmol)を、2-(4-ホルミルピペリジン-1-イル)-N-(1-イソブトキシエトキシ)ピリミジン-5-カルボキサミド(実施例3に記載されるようにして製造 - 110mg, 0.29mmol)とともに、DCE (10mL)中で、NaCNBH3 (36mg, 0.58mmol)とともにRTにて窒素雰囲気下で16時間撹拌した。次いで、反応物をH2O (50mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機抽出物を乾燥し(MgSO4)、溶媒を真空除去して、生成物を黄色の油として得て、これを、さらなる精製を行わずに次の工程で用いた。m/z = 701 [M+Na]+.
【0208】
工程2 - ヒドロキサメートを脱保護して、シクロペンチル (2S)-シクロヘキシル[(4-[[([1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]メチル)アミノ]メチル]ベンジル)アミノ]アセテート(38)を得る
【化78】

【0209】
工程1の生成物を、DCM (10mL)中で、TFA (1mL)とともにRTにて30分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、生成物を紫色の固体として得た(14mg, 2工程で8%)。LCMS純度 >95%, m/z = 579 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.01-1.42 (10H, m), 1.74-2.12 (18H, m), 3.01 (2H, m), 3.82 (1H, m), 4.28 (4H, m), 5.31 (1H, m), 7.61 (4H, m), 8.66 (2H, m).
【0210】
工程3 - エステル加水分解
【化79】

【0211】
工程1の生成物(100mg, 0.28mmol)を、THF (10mL)中でKOTMS (180mg, 1.40mmol)とともに50℃にて窒素雰囲気下で撹拌した。反応物をRTまで冷却し、次いで、溶媒を真空除去し、残渣を、さらなる精製を行わずに次の工程で用いた。m/z = 611 [M+H]+.
【0212】
工程4 - ヒドロキサメートを脱保護して、(2S)-シクロヘキシル[(4-[[([1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]メチル)アミノ]メチル]ベンジル)アミノ]酢酸(39)を得る
【化80】

【0213】
工程3の生成物を、DCM (10mL)中で、TFA (1mL)とともにRTにて30分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、生成物をピンク色の固体として得た(19mg, 2工程で13%)。LCMS純度 >95%, m/z = 511 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.16-1.41 (9H, m), 1.69-1.91 (8H, m), 2.12 (1H, m), 2.99 (4H, m), 4.29 (4H, m), 4.92 (1H, m), 7.62 (4H, m), 8.66 (2H, s).
【0214】
図7に概説する類似物は、(38)及び(39)に記載される手順により製造した。各類似物についてのデータを、以下に示す。
(36)
LCMS純度 98%, m/z = 553 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 0.90 (6H, m), 1.12 (2H, m), 1.28 (2H, d, J=6.6Hz), 1.65 (9H, m), 1.72 (3H, m), 2.03 (1H, m), 2.73 (2H, m), 2.96 (2H, t, J=12Hz), 4.20 (4H, m), 4.72 (2H, d, J=13.5Hz), 5.20 (1H, m), 7.54 (4H, m), 8.66 (2H, s), 8.95 (2H, br s), 9.60 (1H, br s), 11.05 (1H, s).
(37)
LCMS純度 97%, m/z = 485 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.87 (6H, m), 1.29 (4H, m), 1.77 (5H, m), 2.00 (1H, m), 2.88 (4H, m), 3.88 (1H, m), 4.18 (4H, m), 7.52 (4H, s), 8.61 (2H, s).
(40)
LCMS純度 99%, m/z = 583 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.24 (9H, s), 1.41 (2H, d, J=6.6Hz), 1.69-1.95 (12H, br m), 2.15 (1H, br s), 3.00 (4H, m), 3.93 (2H, m), 4.20 (1H, m), 4.31 (4H, m), 5.34 (1H, m), 7.63 (4H, m), 8.66 (2H, s).
【0215】
(41)
LCMS純度 99%, m/z = 515 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.25 (9H, s), 1.29 (4H, m), 1.89 (2H, m), 2.12 (1H, br s), 3.01 (4H, m), 3.94 (2H, qd, J=9.0, 3.9Hz), 4.12 (1H, t, J=3.6Hz), 4.33 (4H, app. d, J=18.6Hz), 7.63 (4H, s), 8.66 (2H, s).
(42)
LCMS純度 98%, m/z = 573 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 1.13-1.83 (12H, br m), 2.04 (1H, m), 2.85 (2H, m), 2.96 (2H, t, J=12Hz), 3.99 (2H, m), 4.15 (2H, m), 4.70 (2H, d, J=13.2Hz), 5.16 (2H, m), 7.51 (9H, m), 8.66 (2H, s), 8.97 (2H, br s), 10.13 (1H, br s), 11.05 (1H, s).
(43)
LCMS純度 99%, m/z = 505 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.89 (1H, m), 1.08 (2H, m), 1.77 (3H, m), 2.01 (1H, m), 2.90 (4H, m), 4.08 (4H, m), 4.94 (1H, s), 7.45 (9H, m), 8.55 (2H, s).
【0216】
(44)
LCMS純度 99%, m/z = 528 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.30 (3H, m), 1.67-1.78 (11H, m), 2.12 (1H, m), 3.02 (4H, m), 4.06 (3H, m), 4.33 (4H, app. d, J=18Hz), 5.34 (1H, m), 7.66 (4H, m), 8.66 (2H, s).
(45)
LCMS純度 96%, m/z = 459 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.25 (4H, m), 1.89 (2H, m), 2.15 (1H, m), 2.99 (4H, m), 4.00 (1H, m), 4.09 (2H, m), 4.34 (4H, app. d, J=21.9Hz), 7.64 (4H, m), 8.66 (2H, s).
【0217】
実施例7
【化81】

【0218】
製造した化合物:
【化82】

【0219】
工程1 - 酸還元
【化83】

【0220】
4-(アミノメチル)シクロヘキサンカルボン酸(4.00g, 25.44mmol)を、THF (100mL)中で0℃にて窒素雰囲気下で撹拌した。次いで、LiAlH4 (2.90g, 76.33mmol)を加え、反応物をRTまで温め、3時間撹拌した。次いで、これを0℃まで冷却し、H2Oでクエンチした。次いで、Na2SO4を加え、混合物を10分間撹拌した。次いで、これをセライトろ過し、ろ過物を真空濃縮して、生成物を無色の油として得て、これを放置して固化させて、生成物を白色の固体として得た(3.72g, 100%)。1H NMR (300MHz, d6-DMSO) δ: 0.95 (4H, m), 1.22-1.47 (5H, m), 1.86 (4H, m), 2.55 (2H, d, J=6.6Hz), 4.46 (2H, d, J=6.3Hz).
【0221】
工程2 - Boc保護
【化84】

【0222】
工程1の生成物(3.72g, 26.01mmol)を、H2O (50mL)及びジオキサン(50mL)中のNaOH (1.00g, 26.01mmol)及びジ-tert-ブチル-ジカーボネート(6.24g, 28.61mmol)とともに、RTにて16時間撹拌した。次いで、反応物を真空濃縮した。約50%が蒸発したときに、固体が溶液から析出し、これを回収し、乾燥して、生成物を白色の固体として得た(5.5g, 87%)。m/z = 266 [M+Na]+, 1H NMR (300MHz, CDCl3) δ: 0.82 (4H, m), 1.28 (2H, m), 1.37 (9H, s), 1.70 (4H, m), 2.76 (2H, t, J=6.3Hz), 3.19 (2H, d, J=6.3Hz), 4.32 (1H, br s), 6.75 (1H, m).
【0223】
工程3 - アルコール酸化
【化85】

【0224】
DCM (100mL)及び(COCl)2 (1.58mL, 18.14mmol)の溶液を、窒素雰囲気下で撹拌し、-78℃に冷却した。次いで、温度を-65℃未満に維持しながら、DMSO (2.27mL, 32.02mmol)を加えた。次いで、工程2の生成物(4.5g, 17.79mmol)のDCM (50mL)中の溶液を調製し、温度を-65℃未満に維持しながら、反応混合物にゆっくりと加えた。添加が完了したときに、温度を-65℃未満に維持しながらEt3N (9.99mL, 71.69mmol)をゆっくりと加えた。 添加が完了したときに、反応物をRTまで温め、次いで、溶媒を真空除去した。残渣をカラムクロマトグラフィーにより精製して(DCM中に0〜10% MeOH)、生成物を明黄色の油として得た(5g, >100% - いくらかのEt3Nを含有する)。m/z = 264 [M+Na]+, 1H NMR (300MHz, CDCl3) δ: 1.02 (2H, m), 1.30 (2H, m), 1.45 (9H, s), 1.90 (2H, m), 2.03 (2H, m), 3.01 (2H, t, J=6.3Hz), 4.57 (1H, br s), 9.63 (1H, s).
【0225】
工程4 - 還元的アミノ化
【化86】

【0226】
工程3の生成物(1.00g, 4.14mmol)を、DCE (20mL)中の中間体B (1.08g, 4.14mmol)及びトリアセトキシ水素化ホウ素ナトリウム(1.33g, 6.21mmol)とともに、RTにて16時間撹拌した。次いで、反応物をH2O (100mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機抽出物を乾燥し(MgSO4)、溶媒を真空除去して、生成物を灰色の固体として得て、これを、さらなる精製を行わずに次の工程で用いた(1.74g, 94%)。m/z = 451 [M+H]+.
【0227】
工程5 - Boc脱保護
【化87】

【0228】
工程4の生成物(1.74g, 3.87mmol)を、DCM (10mL)中で、ジオキサン (3mL)中の4M HClとともに、RTにて16時間撹拌した。次いで、溶媒を真空除去し、残渣を真空乾燥して、生成物を白色の固体として得た(1.36g, 98%)。m/z = 351 [M+H]+, 1H NMR (300MHz, d6-DMSO) δ: 0.90-1.20 (9H, m), 1.50-2.00 (21H, m), 2.65 (4H, m), 3.85 (1H, m), 5.25 (1H, m), 7.83 (2H, m).
【0229】
工程6 - 還元的アミノ化
【化88】

【0230】
工程5の生成物(216mg, 0.56mmol)を、DCE (10mL)中の2-(4-ホルミルピペリジン-1-イル)-N-(1-イソブトキシエトキシ)ピリミジン-5-カルボキサミド(実施例3に記載のようにして製造 - 200mg, 0.57mmol)及びNaBH3CN (70mg, 1.12mmol)とともに、RTにて窒素雰囲気下で48時間撹拌した。次いで、反応物をH2O (100mL)で希釈し、DCM (2×100mL)で抽出した。併せた有機抽出物を乾燥し(MgSO4)、溶媒を真空除去して、生成物を黄色の油として得て、これを、さらなる精製を行わずに次の工程で用いた。
【0231】
工程7 - ヒドロキサメートを脱保護して、シクロペンチル (2S)-シクロヘキシル[[(4-[[([1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]メチル)アミノ]メチル]シクロヘキシル)メチル]アミノ]アセテート(46)を得る
【化89】

【0232】
工程6の生成物(0.28mmol)を、DCM (10mL)中で、TFA (0.5mL)とともにRTにて30分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、生成物をピンク色の固体として得た(15mg, 2工程で9%)。LCMS純度 >95%, m/z = 585 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 0.96-1.39 (13H, m), 1.72-2.16 (23H, m), 2.81-3.04 (7H, m), 3.84 (2H, d, J=3.9Hz), 5.36 (1H, m), 8.66 (2H, s).
【0233】
工程8 - エステル加水分解
【化90】

【0234】
工程6の生成物(0.28mmol)を、KOTMS (180mg, 1.4mmol)及びTHF (10mL)とともに50℃にて窒素雰囲気下で16時間撹拌した。反応物を、RTまで冷却し、溶媒を真空除去し、残渣を、さらなる精製を行わずに次の工程で用いた。m/z = 617 [M+H]+.
【0235】
工程9 - ヒドロキサメートを脱保護して、(2S)-シクロヘキシル[[(4-[[([1-[5-(ヒドロキシカルバモイル)ピリミジン-2-イル]ピペリジン-4-イル]メチル)アミノ]メチル]シクロヘキシル)メチル]アミノ]酢酸(47)を得る
【化91】

【0236】
工程8の生成物(0.28mmol)を、DCM (10mL)中で、TFA (1mL)とともにRTにて30分間撹拌した。次いで、溶媒を真空除去し、残渣を分取HPLCにより精製して、生成物を白色の固体として得た(5mg, 2工程で3%)。m/z = 517 [M+H]+, 1H NMR (300MHz, CD3OD) δ: 1.13-1.44 (11H, m), 1.75-1.94 (15H, m), 2.82-3.09 (8H, m), 3.39 (1H, m), 3.65 (1H, m), 4.94 (1H, m), 8.67 (2H, m).
【0237】
実施例8
【化92】

【0238】
製造した化合物:
【化93】

【0239】
工程1 - カップリング
【化94】

【0240】
エチル 4-フルオロベンゾエート(6.75g, 40.1mmol)及び1,4-ジオキサ-8-アザスピロ[4.5]デカン(2.73g, 19.1mmol)を、K2CO3 (8.5g, 61.5mmol)とともに、MeCN (10mL)中で95℃にて1週間撹拌した。混合物をEtOAc (50mL)に加え、水(3×50mL)で洗浄した。有機物を乾燥し(MgSO4)、ろ過し、真空濃縮した。生成物を、フラッシュクロマトグラフィーにより精製して(DCM中に2%MeOH)、黄色の油を得た(5.58g, 48%)。m/z = 292 [M+H]+.
【0241】
工程2 - エステル加水分解
【化95】

【0242】
工程1の生成物(5.58g, 19.15mmol)を、EtOH (25mL)中に溶解し、50% NaOHaq (25mL)とともに60℃にて3時間撹拌した。混合物をRTに冷却し、2M HClaq (50mL)を加えた。混合物を、次いで、30℃にて3日間撹拌した。生成物を、DCM (4×50mL)で抽出し、乾燥し(MgSO4)、真空濃縮して、EtOHから再結晶させて、白色の固体を得た(1.459g, 26%)。m/z = 294 [M+H]+.
【0243】
工程3 - アセタール脱保護
【化96】

【0244】
工程2の生成物(509mg, 1.735mmol)を、1M HClaq (15ml)中で、RTにて30分間撹拌した。混合物を真空濃縮し、最少量の水を加え、ろ過し、デシケーターで乾燥させた。生成物を、白色の固体として得た(279mg, 73%)。m/z = 220 [M+H]+
【0245】
工程4 - 還元的アミノ化
【化97】

【0246】
工程3の生成物(279mg, 1.27mmol)及び中間体A (303mg, 1.28mmol)を、1,2-ジクロロエタン(10mL)中で、トリアセトキシ水素化ホウ素ナトリウム(405mg, 1.91mmol)とともに、RTにて一晩撹拌した。混合物をDCM (100mL)に加え、水(2×100mL)で洗浄した。併せた水層をDCM (100mL)で再抽出し、併せた有機物を乾燥し(Na2SO4)、ろ過し、真空濃縮して、茶色の油を得た(495mg, 97%)。m/z = 403 [M+H]+.
【0247】
工程5 - 保護されたヒドロキサメートのカップリング
【化98】

【0248】
工程4の生成物(495mg, 1.20mmol)をDMFに溶解し、中間体E (0.84mL, 6.12mmol)、トリエチルアミン(0.84mL, 6.03 mmol)、HOBt (228mg, 1.49mmol)及びEDCI (295mg, 1.54mmol)と、RTにて2日間撹拌した。混合物をDCM (100mL)に加え、水(2×100mL)で洗浄した。併せた水層をDCM (100mL)で再抽出し、次いで、併せた有機物を乾燥し(Na2SO4)、ろ過し、真空濃縮して、黄色の油を得た(638mg, 少量(quant))。m/z = 518 [M+H]+.
【0249】
工程6 - ヒドロキサメートを脱保護して、シクロペンチル N-[1-[4-(ヒドロキシカルバモイル)フェニル]ピペリジン-4-イル]-L-ロイシネート(48)を得る
【化99】

【0250】
工程5の生成物(309mg, 597μmol)を、DCM (5mL)及びTFA (0.5mL)中で、RTにて1時間撹拌した。反応混合物を分取HPLCにより直接精製して、白色の固体を得た(75mg, 30%)。LCMS純度 95%, m/z = 418 [M+H]+. 1H NMR (300MHz, CD3OD) δ: 7.67 (2H, d, J=8.5Hz), 7.02 (2H, d, J=8.5Hz), 5.38 (1H, m), 4.13 (1H, m), 4.04 (2H, d, J=12.4Hz), 2.92 (2H, m), 1.97 (2H, m), 1.88-1.68 (13H, m), 1.04 (6H, dd, J=6.2, 7.8Hz).
【0251】
工程7 - エステル加水分解及びヒドロキサメートを脱保護して、N-[1-[4-(ヒドロキシカルバモイル)フェニル]ピペリジン-4-イル]-L-ロイシン(49)を得る
【化100】

【0252】
工程5の生成物(50mg, 120μmol)を、THF (5mL)及び1M NaOHaq (5mL, 5mmol)中でRTにて3日間撹拌した。混合物をpH約3まで、2M HClaqを用いて酸性にし、20分間撹拌し、次いでこれを真空濃縮し、分取HPLCにより精製して、白色の固体を得た(5mg, 12%)。LCMS純度 90%, m/z = 350 [M+H]+. 1H NMR (300MHz, d6-DMSO) δ: 10.90 (1H, s), 7.63 (2H, d, J=8.8Hz), 6.93 (2H, d, J=9.0Hz), 3.84 (2H, d, J=12.9Hz), 3.24 (1H, t, J=6.9Hz), 2.97-2.76 (3H, m), 1.96-1.74 (3H, m), 1.54-1.32 (4H, m), 0.89 (6H, t, J=6.4Hz).
【0253】
実施例9
【化101】

【0254】
製造した化合物:
【化102】

【0255】
工程1 - カップリング
【化103】

【0256】
エチル 4-フルオロベンゾエート(2.740g, 16.29mmol)及び4-ピペリジンメタノール(1.876g, 16.29mmol)を、DMSO (100mL)中で、K2CO3 (6.765g, 48.95mmol)とともに100℃にて一晩撹拌した。混合物をRTまで冷却し、水(100mL)に加えた。生成物をDCM (2×100mL)で抽出し、乾燥し(Na2SO4)、真空蒸発させて、黄色の油を得た。これを、さらなる精製又は特徴決定を行わずに次の工程で用いた。
【0257】
工程2 - エステル加水分解
【化104】

【0258】
工程1の生成物(16.29mmol)を、2M NaOHaq (40mL, 80mmol)及びTHF (40mL)中で、RTにて2日間撹拌した。反応がほとんど進行しなかったので、50% NaOHaq (10mL)を加え、混合物を55℃にてさらに2日間撹拌した。次いで、混合物をRTに冷却し、得られた沈殿物をろ過して保存した。ろ過物を、pH約3まで2M HClaqを用いて酸性にし、RTにて1時間撹拌した。沈殿物の2回目の回収物を、次いで、ろ過した。両方の回収物を乾燥して、白色の固体を得た(併せて3.052g, 80%)。m/z = 236 [M+H]+.
【0259】
工程3 - 保護されたヒドロキサメートの形成
【化105】

【0260】
工程2の生成物(3.031g, 12.17mmol)を、DMF (100mL)中で、中間体E (8.0mL, 58.27mmol)、トリエチルアミン(8mL, 57.39mmol)、HOBt (2.759g, 18.02mmol)及びEDCI (3.390g, 17.72mmol)とともに、RTにて一晩撹拌した。混合物をDCM (100mL)に加え、水(2×100mL)で洗浄した。併せた水層を、DCM (100mL)で再抽出し、併せた有機物を乾燥し(Na2SO4)、真空濃縮した。粗生成物を、カラムクロマトグラフィーにより精製して(DCM中に1〜10% MeOH)、黄色の油を得た(3.076g, 75%)。m/z = 351 [M+H]+.
【0261】
工程4 - スワーン酸化
【化106】

【0262】
DCM (200mL)を、オキサリルクロリド(0.80mL, 9.17mmol)とともに-72℃で撹拌した。ここに、温度を-72℃に維持しながらDMSO (1.1mL, 15.50mmol)を滴下した。工程3の生成物(3.08g, 8.78mmol)を、DCM (100mL)に溶解し、温度を-72℃に維持しながら混合物に滴下した。次いで、反応物をこの温度にてさらに5分間撹拌した後に、RTまで温めた。次いで、混合物を真空濃縮し、フラッシュクロマトグラフィーにより精製して(DCM中に1〜10% MeOH)、オフホワイトの固体を得た(3.05g, 少量)。m/z = 349 [M+H]+.
【0263】
工程5 - 還元的アミノ化
【化107】

【0264】
工程4の生成物(206mg, 0.591mmol)を、1,2-ジクロロエタン(20mL)中の中間体B (155mg, 0.592mmol)とともに撹拌した。ここに、トリエチルアミン(0.85ml, 6.10mmol)及びシアノ水素化ホウ素ナトリウム(525mg, 8.35mmol)を加え、混合物をRTにて2日間撹拌した。反応物を、水(50mL)を用いてクエンチし、DCM (2×50mL)で抽出した。有機相を乾燥させ(MgSO4)、真空濃縮して、黄色の油を得た(313mg, 95%)。m/z = 558 [M+H]+.
【0265】
工程6 - ヒドロキサメートを脱保護して、シクロペンチル (2S)-シクロヘキシル[([1-[4-(ヒドロキシカルバモイル)フェニル]ピペリジン-4-イル]メチル)アミノ]アセテート(50)を得る
【化108】

【0266】
工程5の生成物(180mg, 323μmol)を、DCM (10mL)及びTFA (0.5mL)中で、RTにて1時間撹拌した。生成物を、分取HPLCにより直接精製して、白色の固体を得た(7.4mg, 5%)。LCMS純度 95%, m/z = 458 [M+H]+. 1H NMR (300MHz, CD3OD) δ: 7.67 (2H, d, J=8.3Hz), 7.02 (2H, d, J=8.3Hz), 5.40 (1H, t, J=5.4Hz), 3.93 (3H, m), 3.07-2.85 (4H, m), 2.05-1.70 (20H, m), 1.47-1.06 (8H, m).
【0267】
工程7 - エステル加水分解
【化109】

【0268】
工程5の生成物(184mg, 330μmol)を、THF (10mL)中で、カリウム トリメチルシラノレート(428mg, 3.34mmol)とともに、50℃にて4日間撹拌した。混合物を真空濃縮し、残渣を次の工程に精製せずに用いた。
【0269】
工程8 - ヒドロキサメートを脱保護して、(2S)-シクロヘキシル[([1-[4-(ヒドロキシカルバモイル)フェニル]ピペリジン-4-イル]メチル)アミノ]酢酸(51)を得る
【化110】

【0270】
工程7の生成物を、DCM (10mL)中で、TFA (0.5mL)とともにRTにて1時間撹拌した。混合物を真空濃縮し、生成物を分取HPLCにより精製して、白色の固体を得た(6.8mg, 5%)。LCMS純度 93%, m/z = 390 [M+H]+. 1H NMR (300MHz, CD3OD) δ: 7.65 (2H, s), 6.99 (2H, s), 3.90 (2H, d, J=12.5Hz), 3.84 (1H, s), 2.89 (4H, m), 2.01-1.65 (10H,m), 1.45-1.05 (8H, m).
【0271】
実施例10
【化111】

【0272】
製造した化合物
【化112】

【0273】
工程1 - 還元的アミノ化
【化113】

【0274】
4-(4-ホルミルピペリジン-1-イル)-N-(1-イソブトキシエトキシ)ベンズアミド(実施例9に記載されるようにして製造 -210mg, 0.603mmol)を、1,2-ジクロロエタン(20mL)中のシクロペンチル (2S)-[[4-(アミノメチル)ベンジル]アミノ](シクロヘキシル)アセテート(実施例4に記載されるようにして製造 - 230mg, 0.604mmol)とともに撹拌した。ここに、トリエチルアミン(0.85mL, 6.10mmol)及びシアノ水素化ホウ素ナトリウム(540mg, 8.59mmol)を加え、混合物をRTにて2日間撹拌した。混合物を水(50mL)に加え、DCM (2×50mL)で抽出した。有機相を乾燥させ(MgSO4)、真空濃縮して、茶色の油を得た(408mg, 92%)。m/z = 677 [M+H]+.
【0275】
工程2 - ヒドロキサメートを脱保護して、シクロペンチル (2S)-シクロヘキシル[(4-[[([1-[4-(ヒドロキシカルバモイル)フェニル]ピペリジン-4-イル]メチル)アミノ]メチル]ベンジル)アミノ]アセテート(52)を得る
【化114】

【0276】
工程1の生成物(226mg, 334μmol)を、DCM (10mL)及びTFA (0.5mL)中で、RTにて1時間撹拌した。生成物を、分取HPLCにより精製して、オフホワイトの固体を得た(33.5mg, 17%)。LCMS純度 95%, m/z = 577 [M+H]+. 1H NMR (300MHz, CD3OD) δ: 7.64 (6H, m), 7.02 (2H, d, J=8.2Hz), 5.31 (1H, t, J=5.3Hz), 4.30 (4H, br s), 3.86 (3H, m), 3.01 (1H, s), 2.92 (2H, t, J=11.1Hz), 2.05-1.68 (20H, m), 1.48-0.95 (8H, m).
【0277】
工程3 - エステル加水分解
【化115】

【0278】
工程1の生成物(218mg, 322μmol)を、THF (10mL)中で、カリウム トリメチルシラノレート(418mg, 3.26mmol)とともに、50℃にて4日間撹拌した。混合物を真空濃縮し、残渣を精製せずに次の工程に用いた。
【0279】
工程4 - ヒドロキサメートを脱保護して、[(2S)-2-シクロヘキシル-2-[(4-[[([1-[4-(ヒドロキシカルバモイル)フェニル]ピペリジン-4-イル]メチル)アミノ]メチル]ベンジル)アミノ]アセチル]オキシ(53)を得る
【化116】

【0280】
工程3の生成物を、DCM (10mL)中で、TFA (0.5mL)とともにRTにて1時間撹拌した。混合物を真空濃縮し、生成物を分取HPLCにより精製して、白色の固体を得た(28.0mg, 17%)。LCMS純度 95%, m/z = 509 [M+H]+. 1H NMR (300MHz, CD3OD) δ: 7.66 (6H, m), 7.02 (2H, d, J=8.6Hz), 4.30 (4H, s), 3.89 (2H, d, J=12.2Hz), 3.76 (1H, d, J=3.2Hz), 3.01 (2H, d, J=6.4Hz), 2.90 (2H, t, J=12.1Hz), 2.03-1.68 (10H, m), 1.46-1.05 (8H, m).
【0281】
実施例11
【化117】

【0282】
製造した化合物:
【化118】

【0283】
工程1 - 還元的アミノ化
【化119】

【0284】
4-(4-ホルミルピペリジン-1-イル)-N-(1-イソブトキシエトキシ)ベンズアミド(実施例9に記載されるようにして製造 -212mg, 0.608mmol)を、1,2-ジクロロエタン (20mL)中のシクロペンチル (2S)-([[4-(アミノメチル)シクロヘキシル]メチル]アミノ)(シクロヘキシル)アセテート (実施例7に記載されるようにして製造 - 236mg, 0.609mmol)とともに撹拌した。ここに、トリエチルアミン(0.85mL, 6.10mmol)及びシアノ水素化ホウ素ナトリウム(555mg, 8.83mmol)を加え、混合物をRTにて2日間撹拌した。混合物を、次いで、水(50mL)に加え、DCM (2×50mL)で抽出した。有機相を乾燥させ(MgSO4)、真空濃縮して、茶色の油を得た(318mg, 77%)。m/z = 683 [M+H]+.
【0285】
工程2 - ヒドロキサメートを脱保護して、シクロペンチル (2S)-シクロヘキシル[[(4-[[([1-[4-(ヒドロキシカルバモイル)フェニル]ピペリジン-4-イル]メチル)アミノ]メチル]シクロヘキシル)メチル]アミノ]アセテート(54)を得る
【化120】

【0286】
工程1の生成物(257mg, 376μmol)を、DCM (10mL)及びTFA (0.5mL)中で、RTにて1時間撹拌した。生成物を、分取HPLCにより精製して、オフホワイトの固体を得た(18.7mg, 9%)。LCMS純度 98%, m/z = 583 [M+H]+. 1H NMR (300MHz, CD3OD) δ: 7.68 (2H, d, J=8.5Hz), 7.04 (2H, d, J=8.6Hz), 5.36 (1H, m), 3.04-2.81 (8H, m), 2.06-1.64 (25H, m), 1.53-0.97 (12H, m).
【0287】
工程3 - エステル加水分解
【化121】

【0288】
工程1の生成物(196mg, 287μmol)を、THF (10mL)中で、カリウム トリメチルシラノレート(399mg, 3.11mmol)とともに50℃にて4日間撹拌した。混合物を真空濃縮し、残渣を精製せずに次の工程に用いた。
【0289】
工程4 - ヒドロキサメートを脱保護して、(2S)-シクロヘキシル[[(4-[[([1-[4-(ヒドロキシカルバモイル)フェニル]ピペリジン-4-イル]メチル)アミノ]メチル]シクロヘキシル)メチル]アミノ]酢酸(55)を得る
【化122】

【0290】
工程3の生成物を、DCM (10mL)中で、TFA (0.5mL)とともにRTにて1時間撹拌した。混合物を真空濃縮し、生成物を分取HPLCにより精製して、オフホワイトの固体を得た(36.7mg, 25%)。LCMS純度 98%, m/z = 515 [M+H]+. 1H NMR (300MHz, CD3OD) δ: 7.68 (2H, d, J=8.7Hz), 7.05 (2H, d, J=8.5Hz), 3.89 (2H, d, J=12.6Hz), 3.79 (1H, d, J=3.6Hz), 3.03-2.82 (8H, m), 2.07-1.65 (16H, m), 1.54-1.04 (12H, m).
【0291】
破砕細胞カルボキシルエステラーゼアッセイ
R1がエステル基である本発明のいずれの与えられた化合物は、細胞内エステラーゼにより加水分解されるという要件を満たすかについて、以下のアッセイにおいて試験することにより決定できる。
【0292】
細胞抽出物の調製
U937又はHCT 116腫瘍細胞(約109)を、4容量のダルベッコのPBS (約1リットル)中で洗浄し、4℃、525 gにて10分間、ペレットにした。これを2回繰り返し、最終の細胞ペレットを、35 mlの冷ホモジナイズバッファー(Trizma 10 mM, NaCl 130 mM, CaCl2 0.5 mM 25℃にてpH 7.0)に再懸濁した。ホモジネートを、窒素キャビテーション(700 psi、4℃にて50分間)により調製した。ホモジネートを氷上に維持し、最終濃度:
ロイペプチン 1μM
アプロチニン 0.1μM
E64 8μM
ペプスタチン 1.5μM
ベスタチン 162μM
キモスタチン 33μM
の阻害剤のカクテルを補った。
細胞ホモジネートを、525 gで10分間の遠心分離により清澄にした後に、得られた上清を、エステラーゼ活性の供給源として用い、必要になるまで-80℃にて貯蔵した。
【0293】
エステル切断の測定
対応するカルボン酸へのエステルの加水分解は、上記のようにして調製した細胞抽出物を用いて測定できる。このために、細胞抽出物(約30μg / 0.5 mlの全アッセイ容量)を、37℃にて、Tris- HCl 25 mM、125 mM NaClバッファー、25℃にてpH 7.5中でインキュベートした。ゼロ時間に、エステル(基質)を、2.5□Mの最終濃度で加え、試料を37℃にて適切な時間(通常、0又は80分)インキュベートした。反応を、3×容量のアセトニトリルの添加により停止した。ゼロ時間の試料のために、アセトニトリルをエステル化合物の前に加えた。12000 gで5分間の遠心分離の後に、試料をエステル及びその対応するカルボン酸について、室温にてLCMS (Sciex API 3000, HP1100バイナリポンプ, CTC PAL)により分析した。クロマトグラフィーは、AceCN (75×2.1mm)カラム、及び水/0.1%ギ酸中の5〜95%アセトニトリルの移動相に基づいた。
【0294】
生物学的活性の測定
ヒストンデアセチラーゼ活性
ヒストンデアセチラーゼ活性を阻害する化合物の能力を、Biomolから商業的に入手可能なHDAC蛍光活性アッセイを用いて測定した。簡単に、イプシロンアミノアセチル化されたリジンであるFluor de LysTM基質を、ヒストンデアセチラーゼ活性の供給源(HeLa核抽出物)と、阻害剤の存否でインキュベートする。基質の脱アセチル化が、基質をFluor de LysTM顕色剤に増感し、これが蛍光体を生じる。つまり、HDAC活性供給源との基質のインキュベーションは、シグナルの増加をもたらし、これは、HDAC阻害剤の存在下で減少する。
【0295】
データは、以下のように、バックグラウンドシグナルを全ての試料から減じて、阻害剤の非存在下で測定された対照のパーセンテージとして表す:
% 活性 = [(Si − B) / (So − B)]×100
(式中、Siは、基質、酵素及び阻害剤の存在下でのシグナルであり、Soは、基質、酵素及び阻害剤が溶解されるビヒクルの存在下でのシグナルであり、Bは、酵素の非存在下で測定されるバックグラウンドシグナルである)。
【0296】
IC50値は、Graphpad Prismソフトウェアを用いて、8つのデータ点の結果を、変化する傾き(化合物のlog濃度に対する%活性)を有するシグモイド型用量応答の等式に当てはめた後に、非線形回帰分析により決定された。
【0297】
HeLa細胞に由来する核粗抽出物からのヒストンデアセチラーゼ活性を、スクリーニングに用いた。4C (Seneffe, Belgium)から購入した調製物を、指数増殖期の間に採集したHeLa細胞から調製した。核抽出物を、J. D. Dignam, Nucl. Acid. Res., 1983, 11, 1475〜1489に記載される方法に従って調製し、液体窒素で急速凍結させ、-80℃にて保存した。最終のバッファー組成は、20 mM Hepes、100 mM KCl、0.2 mM EDTA、0.5 mM DTT、0.2 mM PMSF及び20% (v/v)グリセロールであった。
【0298】
IC50の結果は、以下の3つの範囲の1つに当てはめた:
範囲A:IC50<100nM、
範囲B:IC50 101nMから1000nM、
範囲C:IC50 >1001nM。
【0299】
U937及びHUT細胞阻害アッセイ
対数期増殖している株化癌細胞(U937及びHUT)を採集し、1000〜2000細胞/ウェル(最終容量100μl)で96ウェル組織培養プレートに播種した。24時間の成長の後に、細胞を化合物で処理した。次いで、プレートをさらに72〜96時間再インキュベートした後に、WST-1細胞生存性アッセイを、供給業者(Roche Applied Science)の指示に従って行った。
【0300】
データは、以下のように、阻害剤の非存在下で測定した対照のパーセンテージ阻害として表す:
% 阻害 = 100-[(Si/So)×100]
(式中、Siは、阻害剤の存在下でのシグナルであり、Soは、DMSOの存在下でのシグナルである)。
【0301】
用量応答曲線を、6回の反復を用いる8つの濃度(最高最終濃度10μMから3倍希釈)から作製した。
IC50値は、Graphpad Prismソフトウェアを用いて、結果を、変化する傾き(化合物のlog濃度に対する%活性)を有するシグモイド用量応答の等式に当てはめた後に、非線形回帰分析により決定された。
【0302】
IC50の結果は、以下の3つの範囲の1つに当てはめた:
範囲A:IC50<330nM、
範囲B:IC50 331nMから3300nM、
範囲C:IC50 >3301nM、
n/d:測定せず。
【0303】
HeLa細胞阻害アッセイ
対数期増殖しているHeLa細胞を採集し、1000細胞/ウェル(最終容量200μl)で96ウェル組織培養プレートに播種した。24時間の細胞成長の後に、細胞を化合物で処理した(最終濃度20μM)。次いで、プレートをさらに72時間再インキュベートした後に、スルホローダミンB (SRB)細胞生存性アッセイを、Skehanら, J. Natl. Canc. Inst., 1990, 82, 1107〜1112に記載される方法に従って行った。
【0304】
データは、以下のように、阻害剤の非存在下で測定した対照のパーセンテージ阻害として表した:
% 阻害 = 100-[(Si/So)×100]
(式中、Siは、阻害剤の存在下でのシグナルであり、Soは、DMSOの存在下でのシグナルである)。
【0305】
IC50値は、Graphpad Prismソフトウェアを用いて、8つのデータ点の結果を、変化する傾き(化合物のlog濃度に対する%活性)を有するシグモイド型用量応答の等式に当てはめた後に、非線形回帰分析により決定された。
IC50の結果は、以下の3つの範囲の1つに当てはめた:
範囲A:IC50<330nM、
範囲B:IC50 331nMから3300nM、
範囲C:IC50>3301nM、
n/d:測定せず。
【0306】
【表2−1】

【0307】
【表2−2】

【特許請求の範囲】
【請求項1】
式(I)の化合物、又はその塩、N-オキシド、水和物若しくは溶媒和物:
【化1】

(式中、
m及びnは独立して0又は1であるが、但しm及びnの少なくとも一方は1である;
Q、V及びWは独立して、-N=又は-C=を表し;
Bは、(B1)、(B2)、(B3)、(B4)、(B5)及び(B6)から選択される2価の基であり:
【化2】

(式中、*を付した結合手は、Q、V及びWを含有する環に連結する);
Aは、任意に置換されていてもよい単環式、2環式若しくは3環式の炭素環式又は複素環式環系であり;
-[リンカー]-は、結合手、又は2価のリンカー基を表し;
Z1は、(a) 式R1R2CHNH-Y-L1-X1-(CH2)z-の基、又は(b) 式R-L1-Y1-(CH2)z-の基であり、ここで:
Rは、式(X)又は(Y)の基であり:
【化3】

R1は、カルボン酸基(-COOH)、又は1若しくは複数の細胞内エステラーゼ酵素によりカルボン酸基に加水分解され得るエステル基であり;
R6は、水素;又は任意に置換されていてもよいC1〜C6アルキル、C3〜C7シクロアルキル、アリール又はヘテロアリール、又は-(C=O)R3、-(C=O)OR3、若しくは-(C=O)NR3 (式中、R3は、水素又は任意に置換されていてもよい(C1〜C6)アルキルである)であり;
R2は、天然又は非天然のアルファアミノ酸の側鎖であり;
Yは、結合手、-C(=O)-、-S(=O)2-、-C(=O)O-、-C(=O)NR3-、-C(=S)-NR3、-C(=NH)-NR3、又は-S(=O)2NR3- (式中、R3は、水素、又は任意に置換されていてもよい C1〜C6アルキルである)であり;
Y1は、結合手、-(C=O)-、-S(O2)-、-C(=O)O-、-OC(=O)-、-(C=O)NR3-、-NR3(C=O)-、-S(O2)NR3-、-NR3S(O2)-、又は-NR3(C=O)NR4- (式中、R3及びR4は独立して、水素又は任意に置換されていてもよい(C1〜C6)アルキルである)であり;
L1は、式-(Alk1)m(Q)n(Alk2)p-の2価の基であり、ここで、
m、n及びpは、独立して0又は1であり、
Qは、(i) 任意に置換されていてもよい2価の単環式若しくは2環式で5〜13員環の炭素環式又は複素環式基、又は(ii) pが0である場合、式-Q1-X2- (式中、X2は、-O-、-S-又はNRA- (式中、RAは、水素又は任意に置換されていてもよいC1〜C3アルキルである)であり、Q1は、任意に置換されていてもよい2価の単環式若しくは2環式で5〜13員環の炭素環式又は複素環式基である)の2価の基であり;
Alk1及びAlk2は独立して、任意に置換されていてもよい2価のC3〜C7シクロアルキル基、又は任意に置換されていてもよい直鎖又は分岐鎖のC1〜C6アルキレン、C2〜C6アルケニレン、又はC2〜C6アルキニレン基であって、エーテル(-O-)、チオエーテル(-S-)若しくはアミノ(-NRA-)結合(ここで、RAは、水素又は任意に置換されていてもよいC1〜C3アルキルである)を任意に含有するか又はこれらが末端をなしていてもよいものであり、
X1は、結合手、-C(=O)-;又は-S(=O)2-;-NR4C(=O)-、-C(=O)NR4-、-NR4C(=O)-NR5-、-NR4S(=O)2-、又は-S(=O)2NR4- (式中、R4及びR5は独立して、水素、又は任意に置換されていてもよいC1〜C6アルキルである)であり;
zは、0又は1である)。
【請求項2】
Qが-C=であり、V及びWがそれぞれ-N=である請求項1〜36のいずれか1項に記載の化合物。
【請求項3】
Aが、任意に置換されていてもよい以下の環系:
【化4】

【化5】

【化6】

(式中、R10は、水素、又はC1〜C6アルキルであり、波線が横切る結合手は、-[リンカー]-基に結合し、Rは、利用可能な環原子に結合する)
の1つである請求項1又は2に記載の化合物。
【請求項4】
環Aが、任意に置換されていてもよいフェニル、シクロヘキシル、ナフチル、キノリン-2-イル、及び1,3-ジヒドロ-イソインドール-2-イルから選択される請求項1又は2に記載の化合物。
【請求項5】
環Aの任意の置換基が、フルオロ及びクロロから選択される請求項4に記載の化合物。
【請求項6】
-[リンカー]-が:
(i) 結合手;
(ii) -O-、-S-、-C(=O)-、-S(=O)2-、-NRC-、-C(=O)NRC-、-S(=O)2NRC-、-NRCC(=O)-、-NRCS(=O)2-、-NRC(CH2)m-、-NRCC(=O)(CH2)m-、-NRCS(=O)2(CH2)m、-NRDC(=O)NRC-、-NRCC(=O)(CH2)mAr-、又は-NRCS(=O)2(CH2)mAr- (ここで、RC及びRDは独立して、水素、C1〜C4アルキル、又は窒素置換基であり、mは、1、2又は3であり、Arは、2価のフェニル基又は2価の単環式若しくは2環式の5〜13員環のヘテロアリール基である);並びに
(iii) 任意に置換されていてもよい直鎖又は分岐鎖のC1〜C6アルキレン、C2〜C6アルケニレン又はC2〜C6アルキニレン基であって、エーテル(-O-)、チオエーテル(-S-)又はアミノ(-NRA-)結合(ここで、RAは、水素、C1〜C3アルキル、又は窒素置換基である)を任意に含むか又はこれらが末端をなしていてもよいもの
から選択される請求項1〜5のいずれか1項に記載の化合物。
【請求項7】
-Ar-が-[リンカー]-中に存在し、以下の:
【化7】

(式中、Xは、O、S又はNHである)
から選択される2価の基である請求項6に記載の化合物。
【請求項8】
-Ar-が-[リンカー]-中に存在し、2価のフェニレン基である請求項6に記載の化合物。
【請求項9】
nが0である場合に-[リンカー]-が結合手である請求項1〜5のいずれか1項に記載の化合物。
【請求項10】
zが0である請求項1〜9のいずれか1項に記載の化合物。
【請求項11】
Yが、-S(=O)2-、-C(=S)-NR3、-C(=NH)-NR3又は-S(=O)2NR3- (式中、R3は、水素又はC1〜C6アルキルである)である請求項1〜10のいずれか1項に記載の化合物。
【請求項12】
Yが結合手である請求項1〜10のいずれか1項に記載の化合物。
【請求項13】
基L1において、Alk1及びAlk2が、存在する場合、-CH2-、-CH2CH2-、-CH2CH2CH2-、並びに2価のシクロプロピル、シクロペンチル及びシクロヘキシル基から選択される請求項1〜12のいずれか1項に記載の化合物。
【請求項14】
基L1において、Q1が、2価のフェニル基、又は単環式若しくは2環式の5〜13員環のヘテロアリール基である請求項1〜13のいずれか1項に記載の化合物。
【請求項15】
Q1が1,4-フェニレンである請求項12に記載の化合物。
【請求項16】
基L1において、p及びrが0である請求項1〜15のいずれか1項に記載の化合物。
【請求項17】
基L1において、q及びrが0であり、pが1である請求項1〜15のいずれか1項に記載の化合物。
【請求項18】
基L1において、p、q及びrが全て0である請求項1〜15のいずれか1項に記載の化合物。
【請求項19】
Z1が、式R1R2CHNH-Y-L1-X1-(CH2)z- (式中、-Y-L1-X1-[CH2]z-の基は、-C(=O)-、-C(=O)NH-、-(CH2)v-、-(CH2)vO-、-C(=O)-(CH2)v-、-C(=O)-(CH2)vO-、-C(=O)-NH-(CH2)w-、-C(=O)-NH-(CH2)wO-
【化8】

(式中、vは1、2、3又は4であり、wは1、2又は3である)
から選択される)
の基である請求項1〜18のいずれか1項に記載の化合物。
【請求項20】
Z1が、式R1R2CHNH-Y-L1-X1-(CH2)z- (式中、基-Y-L1-X1-[CH2]z-は、-CH2-、-CH2O-、
-C(=O)-CH2-、-C(=O)-CH2O-、-C(=O)-NH-CH2-、又は-C(=O)-NH-CH2O-である)の基である請求項1〜18のいずれか1項に記載の化合物。
【請求項21】
R1が、式-(C=O)OR9
(式中、R9は、R7R8CH-であり、ここで、
(i) R7は、水素又は任意に置換されていてもよい(C1〜C3)アルキル-(Z1)a-[(C1〜C3)アルキル]b-、又は(C2〜C3)アルケニル-(Z1)a-[(C1〜C3)アルキル]b- (式中、a及びbは独立して0又は1であり、Z1は、-O-、-S-、又は-NR10- (式中、R10は、水素又はC1〜C3アルキルである)である)であり、R8は、水素、又は(C1〜C3)アルキル-であるか;
(ii) R7は、水素、又は任意に置換されていてもよいR10R11N-(C1〜C3)アルキル- (式中、R10は、水素、又はC1〜C3アルキルであり、R11は、水素又はC1〜C3アルキルであるか、或いはR10とR11はそれらが結合している窒素と一緒に、任意に置換されていてもよい単環式で5若しくは6環原子の複素環式環、又は2環式で8〜10環原子の複素環式環系を形成する)であり、R8は、水素又は(C1〜C3)アルキル-であるか;或いは
(iii) R7及びR8は、それらが結合している炭素と一緒に、任意に置換されていてもよい単環式で3〜7環原子の炭素環式環、又は2環式で8〜10環原子の炭素環式環系を形成する)
のエステル基である請求項1〜20のいずれか1項に記載の化合物。
【請求項22】
R9が、メチル、エチル、n-若しくはイソ-プロピル、n-、sec-若しくはtert-ブチル、シクロヘキシル、アリル、フェニル、ベンジル、2-、3-若しくは4-ピリジルメチル、N-メチルピペリジン-4-イル、テトラヒドロフラン-3-イル、メトキシエチル、インダニル、ノルボルニル、ジメチルアミノエチル、又はモルホリノエチルである請求項21に記載の化合物。
【請求項23】
R9がシクロペンチルである請求項21に記載の化合物。
【請求項24】
Z1が、式R1R2CHNH-Y-L1-X1-(CH2)z-の基であり、R2が、シクロヘキシルメチル、ピリジン-3-イルメチル、sec-ブチル、tert-ブチル、1-ベンジルチオ-1-メチルエチル、1-メチルチオ-1-メチルエチル、1-メルカプト-1-メチルエチル又はフェニルエチルである請求項1〜23のいずれか1項に記載の化合物。
【請求項25】
Z1が、式R1R2CHNH-Y-L1-X1-(CH2)z-の基であり、R2が水素である請求項1〜23のいずれか1項に記載の化合物。
【請求項26】
Z1が、式R1R2CHNH-Y-L1-X1-(CH2)z-の基であり、R2がフェニル、ベンジル、イソ-ブチル、シクロヘキシル又はt-ブトキシメチルである請求項1〜23のいずれか1項に記載の化合物。
【請求項27】
本明細書の具体的な実施例の任意の化合物の構造を有する請求項1に記載の化合物。
【請求項28】
請求項1〜27のいずれか1項に記載の化合物を、医薬的に許容される担体とともに含む医薬組成物。
【請求項29】
HDAC酵素の活性を阻害するための組成物の製造における請求項1〜27のいずれか1項に記載の式(I)の化合物の使用。
【請求項30】
エクスビボ又はインビボでのHDAC1活性の阻害のための請求項29に記載の使用。
【請求項31】
HDAC酵素を、該酵素の活性の阻害に有効量の請求項1〜27のいずれか1項に記載の化合物と接触させることを含む、HDAC酵素の活性を阻害する方法。
【請求項32】
エクスビボ又はインビボでのHDAC1活性の阻害のための請求項31に記載の方法。
【請求項33】
細胞増殖疾患、ポリグルタミン病、神経変性疾患、自己免疫疾患、炎症性疾患、臓器移植拒絶、糖尿病、血液学的疾患及び感染に罹患した対象に、請求項1〜27のいずれか1項に記載の式(I)の化合物の有効量を投与することを含む、前記疾患を治療する方法。
【請求項34】
癌細胞増殖、ハンチントン病、又はアルツハイマー病の治療のための請求項32に記載の方法。
【請求項35】
リウマチ性関節炎の治療のための請求項32に記載の方法。
【請求項1】
式(I)の化合物、又はその塩、N-オキシド、水和物若しくは溶媒和物:
【化1】

(式中、
m及びnは独立して0又は1であるが、但しm及びnの少なくとも一方は1である;
Q、V及びWは独立して、-N=又は-C=を表し;
Bは、(B1)、(B2)、(B3)、(B4)、(B5)及び(B6)から選択される2価の基であり:
【化2】

(式中、*を付した結合手は、Q、V及びWを含有する環に連結する);
Aは、任意に置換されていてもよい単環式、2環式若しくは3環式の炭素環式又は複素環式環系であり;
-[リンカー]-は、結合手、又は2価のリンカー基を表し;
Z1は、(a) 式R1R2CHNH-Y-L1-X1-(CH2)z-の基、又は(b) 式R-L1-Y1-(CH2)z-の基であり、ここで:
Rは、式(X)又は(Y)の基であり:
【化3】

R1は、カルボン酸基(-COOH)、又は1若しくは複数の細胞内エステラーゼ酵素によりカルボン酸基に加水分解され得るエステル基であり;
R6は、水素;又は任意に置換されていてもよいC1〜C6アルキル、C3〜C7シクロアルキル、アリール又はヘテロアリール、又は-(C=O)R3、-(C=O)OR3、若しくは-(C=O)NR3 (式中、R3は、水素又は任意に置換されていてもよい(C1〜C6)アルキルである)であり;
R2は、天然又は非天然のアルファアミノ酸の側鎖であり;
Yは、結合手、-C(=O)-、-S(=O)2-、-C(=O)O-、-C(=O)NR3-、-C(=S)-NR3、-C(=NH)-NR3、又は-S(=O)2NR3- (式中、R3は、水素、又は任意に置換されていてもよい C1〜C6アルキルである)であり;
Y1は、結合手、-(C=O)-、-S(O2)-、-C(=O)O-、-OC(=O)-、-(C=O)NR3-、-NR3(C=O)-、-S(O2)NR3-、-NR3S(O2)-、又は-NR3(C=O)NR4- (式中、R3及びR4は独立して、水素又は任意に置換されていてもよい(C1〜C6)アルキルである)であり;
L1は、式-(Alk1)m(Q)n(Alk2)p-の2価の基であり、ここで、
m、n及びpは、独立して0又は1であり、
Qは、(i) 任意に置換されていてもよい2価の単環式若しくは2環式で5〜13員環の炭素環式又は複素環式基、又は(ii) pが0である場合、式-Q1-X2- (式中、X2は、-O-、-S-又はNRA- (式中、RAは、水素又は任意に置換されていてもよいC1〜C3アルキルである)であり、Q1は、任意に置換されていてもよい2価の単環式若しくは2環式で5〜13員環の炭素環式又は複素環式基である)の2価の基であり;
Alk1及びAlk2は独立して、任意に置換されていてもよい2価のC3〜C7シクロアルキル基、又は任意に置換されていてもよい直鎖又は分岐鎖のC1〜C6アルキレン、C2〜C6アルケニレン、又はC2〜C6アルキニレン基であって、エーテル(-O-)、チオエーテル(-S-)若しくはアミノ(-NRA-)結合(ここで、RAは、水素又は任意に置換されていてもよいC1〜C3アルキルである)を任意に含有するか又はこれらが末端をなしていてもよいものであり、
X1は、結合手、-C(=O)-;又は-S(=O)2-;-NR4C(=O)-、-C(=O)NR4-、-NR4C(=O)-NR5-、-NR4S(=O)2-、又は-S(=O)2NR4- (式中、R4及びR5は独立して、水素、又は任意に置換されていてもよいC1〜C6アルキルである)であり;
zは、0又は1である)。
【請求項2】
Qが-C=であり、V及びWがそれぞれ-N=である請求項1〜36のいずれか1項に記載の化合物。
【請求項3】
Aが、任意に置換されていてもよい以下の環系:
【化4】

【化5】

【化6】

(式中、R10は、水素、又はC1〜C6アルキルであり、波線が横切る結合手は、-[リンカー]-基に結合し、Rは、利用可能な環原子に結合する)
の1つである請求項1又は2に記載の化合物。
【請求項4】
環Aが、任意に置換されていてもよいフェニル、シクロヘキシル、ナフチル、キノリン-2-イル、及び1,3-ジヒドロ-イソインドール-2-イルから選択される請求項1又は2に記載の化合物。
【請求項5】
環Aの任意の置換基が、フルオロ及びクロロから選択される請求項4に記載の化合物。
【請求項6】
-[リンカー]-が:
(i) 結合手;
(ii) -O-、-S-、-C(=O)-、-S(=O)2-、-NRC-、-C(=O)NRC-、-S(=O)2NRC-、-NRCC(=O)-、-NRCS(=O)2-、-NRC(CH2)m-、-NRCC(=O)(CH2)m-、-NRCS(=O)2(CH2)m、-NRDC(=O)NRC-、-NRCC(=O)(CH2)mAr-、又は-NRCS(=O)2(CH2)mAr- (ここで、RC及びRDは独立して、水素、C1〜C4アルキル、又は窒素置換基であり、mは、1、2又は3であり、Arは、2価のフェニル基又は2価の単環式若しくは2環式の5〜13員環のヘテロアリール基である);並びに
(iii) 任意に置換されていてもよい直鎖又は分岐鎖のC1〜C6アルキレン、C2〜C6アルケニレン又はC2〜C6アルキニレン基であって、エーテル(-O-)、チオエーテル(-S-)又はアミノ(-NRA-)結合(ここで、RAは、水素、C1〜C3アルキル、又は窒素置換基である)を任意に含むか又はこれらが末端をなしていてもよいもの
から選択される請求項1〜5のいずれか1項に記載の化合物。
【請求項7】
-Ar-が-[リンカー]-中に存在し、以下の:
【化7】

(式中、Xは、O、S又はNHである)
から選択される2価の基である請求項6に記載の化合物。
【請求項8】
-Ar-が-[リンカー]-中に存在し、2価のフェニレン基である請求項6に記載の化合物。
【請求項9】
nが0である場合に-[リンカー]-が結合手である請求項1〜5のいずれか1項に記載の化合物。
【請求項10】
zが0である請求項1〜9のいずれか1項に記載の化合物。
【請求項11】
Yが、-S(=O)2-、-C(=S)-NR3、-C(=NH)-NR3又は-S(=O)2NR3- (式中、R3は、水素又はC1〜C6アルキルである)である請求項1〜10のいずれか1項に記載の化合物。
【請求項12】
Yが結合手である請求項1〜10のいずれか1項に記載の化合物。
【請求項13】
基L1において、Alk1及びAlk2が、存在する場合、-CH2-、-CH2CH2-、-CH2CH2CH2-、並びに2価のシクロプロピル、シクロペンチル及びシクロヘキシル基から選択される請求項1〜12のいずれか1項に記載の化合物。
【請求項14】
基L1において、Q1が、2価のフェニル基、又は単環式若しくは2環式の5〜13員環のヘテロアリール基である請求項1〜13のいずれか1項に記載の化合物。
【請求項15】
Q1が1,4-フェニレンである請求項12に記載の化合物。
【請求項16】
基L1において、p及びrが0である請求項1〜15のいずれか1項に記載の化合物。
【請求項17】
基L1において、q及びrが0であり、pが1である請求項1〜15のいずれか1項に記載の化合物。
【請求項18】
基L1において、p、q及びrが全て0である請求項1〜15のいずれか1項に記載の化合物。
【請求項19】
Z1が、式R1R2CHNH-Y-L1-X1-(CH2)z- (式中、-Y-L1-X1-[CH2]z-の基は、-C(=O)-、-C(=O)NH-、-(CH2)v-、-(CH2)vO-、-C(=O)-(CH2)v-、-C(=O)-(CH2)vO-、-C(=O)-NH-(CH2)w-、-C(=O)-NH-(CH2)wO-
【化8】

(式中、vは1、2、3又は4であり、wは1、2又は3である)
から選択される)
の基である請求項1〜18のいずれか1項に記載の化合物。
【請求項20】
Z1が、式R1R2CHNH-Y-L1-X1-(CH2)z- (式中、基-Y-L1-X1-[CH2]z-は、-CH2-、-CH2O-、
-C(=O)-CH2-、-C(=O)-CH2O-、-C(=O)-NH-CH2-、又は-C(=O)-NH-CH2O-である)の基である請求項1〜18のいずれか1項に記載の化合物。
【請求項21】
R1が、式-(C=O)OR9
(式中、R9は、R7R8CH-であり、ここで、
(i) R7は、水素又は任意に置換されていてもよい(C1〜C3)アルキル-(Z1)a-[(C1〜C3)アルキル]b-、又は(C2〜C3)アルケニル-(Z1)a-[(C1〜C3)アルキル]b- (式中、a及びbは独立して0又は1であり、Z1は、-O-、-S-、又は-NR10- (式中、R10は、水素又はC1〜C3アルキルである)である)であり、R8は、水素、又は(C1〜C3)アルキル-であるか;
(ii) R7は、水素、又は任意に置換されていてもよいR10R11N-(C1〜C3)アルキル- (式中、R10は、水素、又はC1〜C3アルキルであり、R11は、水素又はC1〜C3アルキルであるか、或いはR10とR11はそれらが結合している窒素と一緒に、任意に置換されていてもよい単環式で5若しくは6環原子の複素環式環、又は2環式で8〜10環原子の複素環式環系を形成する)であり、R8は、水素又は(C1〜C3)アルキル-であるか;或いは
(iii) R7及びR8は、それらが結合している炭素と一緒に、任意に置換されていてもよい単環式で3〜7環原子の炭素環式環、又は2環式で8〜10環原子の炭素環式環系を形成する)
のエステル基である請求項1〜20のいずれか1項に記載の化合物。
【請求項22】
R9が、メチル、エチル、n-若しくはイソ-プロピル、n-、sec-若しくはtert-ブチル、シクロヘキシル、アリル、フェニル、ベンジル、2-、3-若しくは4-ピリジルメチル、N-メチルピペリジン-4-イル、テトラヒドロフラン-3-イル、メトキシエチル、インダニル、ノルボルニル、ジメチルアミノエチル、又はモルホリノエチルである請求項21に記載の化合物。
【請求項23】
R9がシクロペンチルである請求項21に記載の化合物。
【請求項24】
Z1が、式R1R2CHNH-Y-L1-X1-(CH2)z-の基であり、R2が、シクロヘキシルメチル、ピリジン-3-イルメチル、sec-ブチル、tert-ブチル、1-ベンジルチオ-1-メチルエチル、1-メチルチオ-1-メチルエチル、1-メルカプト-1-メチルエチル又はフェニルエチルである請求項1〜23のいずれか1項に記載の化合物。
【請求項25】
Z1が、式R1R2CHNH-Y-L1-X1-(CH2)z-の基であり、R2が水素である請求項1〜23のいずれか1項に記載の化合物。
【請求項26】
Z1が、式R1R2CHNH-Y-L1-X1-(CH2)z-の基であり、R2がフェニル、ベンジル、イソ-ブチル、シクロヘキシル又はt-ブトキシメチルである請求項1〜23のいずれか1項に記載の化合物。
【請求項27】
本明細書の具体的な実施例の任意の化合物の構造を有する請求項1に記載の化合物。
【請求項28】
請求項1〜27のいずれか1項に記載の化合物を、医薬的に許容される担体とともに含む医薬組成物。
【請求項29】
HDAC酵素の活性を阻害するための組成物の製造における請求項1〜27のいずれか1項に記載の式(I)の化合物の使用。
【請求項30】
エクスビボ又はインビボでのHDAC1活性の阻害のための請求項29に記載の使用。
【請求項31】
HDAC酵素を、該酵素の活性の阻害に有効量の請求項1〜27のいずれか1項に記載の化合物と接触させることを含む、HDAC酵素の活性を阻害する方法。
【請求項32】
エクスビボ又はインビボでのHDAC1活性の阻害のための請求項31に記載の方法。
【請求項33】
細胞増殖疾患、ポリグルタミン病、神経変性疾患、自己免疫疾患、炎症性疾患、臓器移植拒絶、糖尿病、血液学的疾患及び感染に罹患した対象に、請求項1〜27のいずれか1項に記載の式(I)の化合物の有効量を投与することを含む、前記疾患を治療する方法。
【請求項34】
癌細胞増殖、ハンチントン病、又はアルツハイマー病の治療のための請求項32に記載の方法。
【請求項35】
リウマチ性関節炎の治療のための請求項32に記載の方法。
【公表番号】特表2010−508255(P2010−508255A)
【公表日】平成22年3月18日(2010.3.18)
【国際特許分類】
【出願番号】特願2009−533924(P2009−533924)
【出願日】平成18年10月30日(2006.10.30)
【国際出願番号】PCT/GB2006/004034
【国際公開番号】WO2008/053131
【国際公開日】平成20年5月8日(2008.5.8)
【出願人】(507288718)クロマ セラピューティクス リミテッド (18)
【氏名又は名称原語表記】CHROMA THERAPEUTICS LTD
【住所又は居所原語表記】93 Milton Park,Abingdon,Oxfordshire OX14 4RY,UNITED KINGDOM
【Fターム(参考)】
【公表日】平成22年3月18日(2010.3.18)
【国際特許分類】
【出願日】平成18年10月30日(2006.10.30)
【国際出願番号】PCT/GB2006/004034
【国際公開番号】WO2008/053131
【国際公開日】平成20年5月8日(2008.5.8)
【出願人】(507288718)クロマ セラピューティクス リミテッド (18)
【氏名又は名称原語表記】CHROMA THERAPEUTICS LTD
【住所又は居所原語表記】93 Milton Park,Abingdon,Oxfordshire OX14 4RY,UNITED KINGDOM
【Fターム(参考)】
[ Back to top ]

