ヒトの健康に関する残差ベースの管理
【課題】改善されたヒトの健康のモニタリングを提供すること。
【解決手段】上記モニタリングを、典型的なバイタルサインおよび他の生物学的パラメータについてのセンサ測定との背景において、パラメータの経験的モデルを使用し、実際の測定値に応じてパラメータの値を推定するように配置されたシステムおよび方法によって提供する。推定値と実際の測定値との差から得られる残差は、初期の健康問題についての堅固な指標に関して分析される。残差分析は、バイタルサインに対する従来の単変数範囲のチェックよりも堅固かつ高感度である。
【解決手段】上記モニタリングを、典型的なバイタルサインおよび他の生物学的パラメータについてのセンサ測定との背景において、パラメータの経験的モデルを使用し、実際の測定値に応じてパラメータの値を推定するように配置されたシステムおよび方法によって提供する。推定値と実際の測定値との差から得られる残差は、初期の健康問題についての堅固な指標に関して分析される。残差分析は、バイタルサインに対する従来の単変数範囲のチェックよりも堅固かつ高感度である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、一般に、ヒトの健康のモニタリング(human health monitoring)の分野に関し、より詳細には、ヒトの健康の指標(human health indicator)に関する残差ベースの評価(residual-based assessment)を提供するために、生物学的パラメータ(biological parameter)の測定値を分析するための多変数モデル(multivariate model)の使用に関する。
【背景技術】
【0002】
ヒトの病状の検出および診断は、個人の健康を維持すること、および患者の回復を助けることにとって、非常に重要である。早期の積極的な検出が非常に望ましいが、このことは、誤警報(false alert)および誤診断についての医療提供のコストとバランスを取る必要がある。明らかになりつつある健康問題(health issue)の正確で実施可能な検出は、例えば、集中治療室(ICU)などのスピードが重視される状況においてであっても、慢性病の人々のホームモニタリング(home monitoring)やアスリートの運動能力のモニタリング(performance monitoring)などの長期的な健康のモニタリングにおいてであっても、非常に医療の注目の的となっている問題である。現在の人口統計学的傾向(demographic trend)は、人々がより長く生きるにつれて、対処すべき慢性的な健康問題の数が増加していることを示す。さらに、以前は高い死亡率を有していた一部の疾病(disease)は、扱いやすい長期的な慢性の病気になっている。その結果として、ますます多くの人々が継続的モニタリング(ongoing monitoring)を必要とし、医療提供システム(healthcare delivery system)に重く負担がかかっている。
【0003】
従来的な医療業務(medical practice)によると、救命救急診療の環境におけるヒトの健康のモニタリングは、典型的に、心電図(ECG)、パルス酸素濃度計、呼吸、および血圧などの様々なリアルタイムセンサ測定(real-time sensor measurements)、ならびに血液、尿、および他の体液についての臨床検査によって実施される。より長期的なモニタリングは、これらの変数、ならびに体重測定、薬物投与測定、および病気についての他の定性的評価(qualitative assessment)を含むことができる。これらの測定値は典型的に、単変数の手法(univariate manner)で、一般に(健康な)集団として知られる所定の正常範囲(normal range)と比較され、病気の兆候または発現中の悪い健康状態が、これらの測定値と標準の範囲(standard range)との対比から診断される。医療訓練を受けた職員による定性的観察と組み合わせて、これは、健康障害の状態および疾病を検出する目的のため、患者および健康な個人のモニタリングの際の医学の分野におけるベースラインの業務(baseline practice)を形成し、医療の提供に対するスタッフ集約的なアプローチ(staff-intensive approach)である。
【0004】
長い間、医療的ケアの目標は、センサおよびコンピュータ技術を使用して、自動化された信頼性ある患者のモニタリングを提供することであった。最近では、デジタル器具の利用性の改善、および医療関係者の専門知識(expertise)を具現化するコンピュータシステムに関する研究によって、バイタルサインおよび臨床検査の結果に基づいて患者のルールベースのモニタリング(rules-based monitoring)を提供するシステムが利用可能になっている。そのようなシステムを病院環境で使用して、例えばICU内の患者をモニタリングする、補助サポートシステム(auxiliary support system)を提供する。エキスパートルールの実行エンジン(expert rules execution engine)を、様々な信号に渡ってしきい値検出のトリガを組み合わせて診断をするように、または人間の医療スタッフの診療を必要とする病気を除外するようにプログラムすることができる。
【0005】
これらのシステムは、限られた成功しか収めていない。エキスパートルールは、人間の集団および患者が呈する様々な状態にわたって、効果的に汎用化できる方法で設計することは困難である。回復中の若い外傷患者にとって正確であり得ることが、高齢の心臓病患者に適用されると誤警報および検出誤りとなり得ることがある。
【0006】
従来技術の別のアプローチでは、ニューラルネットワークなどの、専門家のデータ融合能力とおそらくよく似ている人工知能手法は、より良い自動モニタリングおよび診断を提供するためにヒト患者モニタリング(human patient monitoring)からのデータに適用されている。ニューラルネットワークは、何らかの関連性およびパターンを学習するように標本(example)の集合から訓練される。例えば、疾病の状態(disease state)に関連付けられる患者データの集合と、健康な状態に関連付けられる患者データの別の集合とを使用して、疾病の状態を認識して診断するようにニューラルネットワークを訓練する。典型的に、患者データの集合を、訓練されたニューラルネットワークに入力し、健康か病気かの判定、または特定の病気の診断のいずれかのような分類を出力として得ることが知られている。また当技術分野で知られている代替的なアプローチは、患者データの集合をニューラルネットワークに入力し、スカラ速度値(scalar rating value)、例えば病気の程度または疾病の進行を出力として得るものである。しかし、ニューラルネットワーク出力を入力データおよびトレーニングデータに基づいて生成する手法は、ニューラルコンピューティングの非線形性質(nonlinear nature)のため、観察者にとって不明瞭である。さらに、このような「ブラックボックス」アプローチを、トレーニングデータをはるかにこえて汎用化する方法で設計することは困難である。結果として、これらのアプローチは、成功に広いばらつきがあり、最終的にその信頼性が損なわれる。
【0007】
全てのこれら従来技術のアプローチに関する主要な問題は、生物系(biological system)の動的性質(dynamic nature)である。ヒトは、血圧、血液の化学的性質、酸素化などのような、健康状態の重大な側面を調整するために、身体の条件および要求に応答する複雑な内部制御およびフィードバックシステムを有する生物系を表す。健康状態をモニタリングするために典型的に行われる測定は、活動状態(activity state)、年齢、体重、栄養、および疾病の状態に応じて広く変動しやすい。結果として、適切なトリガレベルを、モニタリングされる変数のしきい値に割り当てることは困難であり、したがってしきい値は、重要かつ即時の健康障害(health problem)しか示すことができないレベルで、人口学的基準で設定される傾向がある。例えば、脈拍数のモニタリング(pulse rate monitoring)を、非常に高いまたは非常に低い(もしくはゼロ)脈拍数のみがアラームをトリガするように設定することができる。変数およびしきい値を多変数のルール(multivariate rules)に組み合わせる、より進んだ従来技術の解決策においてであっても、低い誤警報率を維持しつつ、発現中の真の問題(genuine developing problem)についての実施可能なリードタイム通知(lead time notice)を提供するルールを設計することは非常に困難なままである。同様に、分類のためのニューラルネットワークは、生データ内の変動のため汎用化に関して複雑になっている。言うまでもなく、医学の分野における従来の統計的/人口学的なアプローチは、データの動的変動を許容できず、データを非常に厳しい条件(例えば、血圧の検査に適した標準化された条件)で取得するか、または変動を単純に無視し、それに伴い精度が失われる。
【発明の概要】
【発明が解決しようとする課題】
【0008】
医療上の健康のモニタリングにおけるコンピュータ自動アシスタンス(computer automated assistance)の提供という背景においては、初期の健康障害についての正確かつ実施可能な早期の検出および診断を提供するために、モニタリングされるヒトからのセンサデータおよび検査データを処理して分析するアプローチの改善が、大いに必要である。より具体的には、必要とされることは、ヒトの健康障害についてのより良いコンピュータ自動警戒(computer automated vigilance)を提供して、どの患者が、ヒトの医学的な専門知識(human medical expertise)の注目を必要とするか正確に優先順位を付けるために、既存のセンサ測定を利用するシステムである。改善された自動モニタリング(automated monitoring)は、限られたエキスパートの医療スタッフを活用し、医療提供全体の質および効率を改善するという大きな利点を提供することになる。
【課題を解決するための手段】
【0009】
本発明は、集中治療室または長期的な健康モニタリングなどにおいて、ヒトの健康状態についてのコンピュータ自動モニタリング(computer automated monitoring)に関する新規の方法および装置を提供する。したがって、本発明では、ヒトのバイタルサイン、および他の生物学的パラメータ、または身体の化学的性質(bodily chemistry)の測定値を表すセンサデータをモニタリングして、初期の健康障害についての早期の警告を提供し、どのパラメータが正常な動作(normal behavior)から逸脱しているかについての洞察を医師に提供し、医師の注目の優先順位を提供する。有利には、本発明は、より高感度および低い誤警報率で、健康障害を検出し、健康障害の診断を補助し、所与のレベルの医療スタッフが扱うことができる患者モニタリングの割り当てを増加させる。本発明はまた、より早くより正確な自動化された問題の検出および診断を提供することによって、長期かつリモートでのヒトの健康のモニタリングを非常に容易にする。
【0010】
しきい値またはルールを単一パラメータ(例えば、健康な血圧の範囲)に適用する従来の方法とは対照的に、本発明では、複数の生物学的パラメータを、正常な多変数変動(normal multivariate variation)のモデルを使用して、測定し、分析する。より具体的には、複数の生物学的パラメータについての一連の観察結果(observation)を、パラメータがとるべき推定値を出力するそれらのパラメータの正常な動作についての経験的モデル(empirical model)に入力する。推定値は、パラメータ毎に、実際の測定値と比較されて、差(difference)または残差(residual)を提供する。従来的に行われるように、しきい値、ルール、または統計値を生の測定値に適用するのではなく、健康障害は、モデルによって提供される残差を分析することによって明らかにされる。しきい値、ルール、および統計値を残差に適用して、初期の病状または健康障害が存在するかどうかを判定することができ、早期の検出および治療が可能になる。生データではなく残差データの分析を実施することによって、本発明は重要なことに、測定されたパラメータの正常な生物学的変動(normal biological variation)を調整し、したがって、より低い誤警報率で、真の偏差(genuine deviation)についてより高感度の検出を提供する。
【0011】
本発明の経験的モデルは、健康なヒトの生物学的パラメータの正常な変動を表すデータを使用して生成される。より具体的には、カーネルベースの手法(kernel-based technique)を使用して、健康なヒトからの多変数の標本(multivariate example)に基づいて正常な動的動作(dynamic behavior)のモデルを提供することができる。モデルは、生物学的パラメータの実際の測定値の入力に応答して、実際の測定値の状態に最も近い正常な状態を表す生物学的パラメータの値の推定値を生成する。実際の測定値と推定値との比較により、理想的にはほぼゼロであるべき残差が得られる。分散(variance)またはバイアス(bias)(ドリフト)において残差が通常よりも大きくなる場合、これは、その残差に対応するパラメータの初期の障害を示す。
【0012】
さらに、本発明によると、残差偏差(residual deviation)のパターンおよび傾向を、診断の目的で、特定の知られている発現中の健康障害と関連付けることができる。しきい値を残差に適用して、警報をトリガすることができる。ルールを使用して、根本にあるどの疾病メカニズム(disease mechanism)が働いているのかについての統合ピクチャ(integrated picture)に残差偏差の情報を組み合わせること、または何らかの推察される条件を除外することができる。統計値を残差の時系列に適用して、傾向を識別することができる。
【0013】
本発明の一実施形態によると、健康のモニタリングセンタ(health monitoring center)は、健康状態をモニタリングされている患者の器具から生物学的パラメータデータを受信する。センタは、病院の病棟に設置されることがあり、あるいは、オフサイトに設置されて、異なる場所に位置する複数の病院または診療所にネットワーク接続されることがある。各患者からのパラメータ測定値の集合は、訓練されて生物学的パラメータの正常な変動を学習する1つまたは複数の経験的モデルに入力される。各モデルは、実際の測定値と比較される推定値を生成し、所与の各患者について残差を生成する。残差は、そのセンタ配属の医療職員に対して検査に利用可能である。しかし、自動化されたテストおよび分析を、コンピュータシステム内で残差に実施し、残差は、医療スタッフに提示される警報および診断にマッピングされる。医療スタッフは、分析および警報の結果を利用して、患者の病状に関するマニュアル検査に優先順位を付け、警報および診断によって識別される全ての病状の治療に順序付けをする。医療スタッフは、警報を確認または却下することができ、あるいは、経験的モデルを、指定された或る実際の測定値をモデルに適応させ、組み込ませることができる。
【0014】
別の実施形態では、家庭生活環境においてモニタリングされるべき人に、生物学的パラメータの散発的な測定またはリアルタイム測定のいずれかを行うため、およびそのようなデータを遠隔計算センタ(remote computing center)に伝送するための器具が提供される。初めにデータを使用して、その人の個別モデル(代替方法では汎用モデルも企図される)を生成し、一定の時間の後、該モデルを使用して、その後に送信されたデータを分析することができる。モニタリングデータにより、残差、および対応する警報と診断が得られる。モニタリングデータおよび分析結果は、ウェブサイトでその人の医師に利用可能にされ、該医師はこれらを再検討して、検査に来るようにその人に指示することや治療策を変更するために、さらなる情報に関してその人と連絡を取ることができる。
【0015】
別の実施形態では、一般的に「ミッション(mission)」に関与し、かつその健康状態が該ミッションに関連する人に、生物学的パラメータを測定するためのセンサを装備し、本発明に従ってそのようなデータを分析するためのコンピューティングデバイス(computing device)を取り付ける。さらに、その人は、モデルベースおよび残差ベースの分析から得られる健康状態の指標(health status indication)をリモート位置に伝送するため、コンピューティングデバイスに結合された通信デバイスを有する。ミッション管理は、ミッション決定のために健康状態の情報を使用する。
【0016】
様々な生物学的パラメータは、本発明によるモデル化および分析に適用可能である。ECG、呼吸パラメータ、血液酸素化、およびパルス酸素測定データ、血圧などの、典型的な生物学的パラメータを使用することができる。さらに、これらの測定値から導出される特性、例えば心拍数の変動は、本発明におけるモデル化に対する入力を提供することもできる。
【0017】
本発明を特徴付けるものと考えられる新規の特徴は、特許請求の範囲に記載されている。しかし、本発明自体、ならびに本発明の好ましい形態の使用、さらなる目的、および利点は、実施形態に関する以下の詳細な説明を添付の図面とあわせて参照することによって最も良く理解される。
【図面の簡単な説明】
【0018】
【図1】本発明を実施するための一実施形態にかかる一般的な構成を示す図である。
【図2】本発明の一実施形態にかかるモデルのローカリゼーションのための流れ図である。
【図3】本発明に従って生成される信号、その推定値、および残差信号を有するチャートである。
【発明を実施するための形態】
【0019】
本発明は、一般に、複数の生物学的パラメータについてのモデルベースの分析によって、ヒトの健康状態の自動モニタリングと、健康の悪化または疾患を示す病気の検出とを提供する。したがって、正常な動的変動およびパラメータ間の相互関係をモデル化し、実際の測定値の集合の受信に応答してそれらのパラメータの推定値を生成するモデルが提供される。例として、モデルには、心拍数、心拍数の変動、呼吸速度、酸素測定、血圧、体温などを含めることができる。それらのパラメータの測定値がモデルに入力され、該モデルは、それらの同じパラメータに関する推定値を生成し、該推定値は、実際の測定値の統合ピクチャを前提として、それらのパラメータがとるべき値を表す。推定値は、各実際の測定値との差分を計算されて、各パラメータの残差を提供する。正常な状況下では、残差は、(生データが、時間とともに動的に変動している場合であっても)ほぼゼロであるべきである。健康障害が発現している場合、その影響を受ける1つまたは複数のパラメータの残差は、バイアスとなるか分散が増加する可能性が高い。コンピュータの論理的ルール(logic rule)(単純なしきい値から、複雑なエキスパートルールまで)を残差に適用して、健康障害を示す偏差に関する持続性/信頼性を判定することができる。そこから警報を生成することができ、該警報を、データが測定された人のモニタリングに関与する医療関係者に提供することができる。警報は、偏差についての単純な通知を含むことができ、あるいは、診療を必要とする病気の診断を含むことができる。また、論理的ルールを使用して、疾病の進行についての評価、すなわち、モニタリングされる人の病状に関する持続的な重症度の格付け(continuous severity rating)を生成することもできる。
【0020】
有利には、本発明の残差ベースの手法に基づいたこれらの警報、診断、および評価は、生データに対するしきい値、ルール、および従来技術の他の技法の適用より正確かつ高感度で信頼性がある。ヒトなどの生物系の正常な変動の範囲にわたって推定を行うことが可能なモデルを提供することによって、正常な変動を除去し、偏差(残差)を、計測または導出された特性のパラメータそれぞれの正常な変動の全範囲よりもかなり小さいレベルで識別することができ、そうでなければ、これは大きなスケールの正常な変動では失われてしまう。
【0021】
本発明によるヒトの健康をモニタリングするために使用される1つまたは複数のモデルは、既知の健康状態のモデルであり、より具体的には、ヒトの正常な健康状態のモデルである(しかし、完全には健康でないが、患者の容態を前提として安定であること、例えば術後の安定状態であることが知られている既知の容態をモデル化することが望ましいこともある)。本発明で使用するモデルは、特定の生物学的パラメータの入力に基づいて特定の生物学的パラメータの推定値を出力するように配置される。一実施形態では、推定されるパラメータは、入力パラメータに対応し、モデルは「自動連想的(autoassociative)」である。別の実施形態では、モデルは、モデルへの入力として提供されない1つまたは複数のパラメータに関する推定を行い、この場合、モデルは「推論的(inferential)」である。推論的モデルから推定されるパラメータは、やはりそれらのパラメータからなる実際の測定値と比較される。ただし、実際の測定値は、モデルへの入力には含まれない。
【0022】
本発明にとって適切なモデルは、経験的モデルであるが、これは、パラメータ間の正確な関係が、ヒト生物系内で第一原理モデル(first-principles model)の基礎とするほど十分には理解されていないことが多いからである。さらに、適切な経験的モデルは、数学的カーネル(mathematical kernel)を使用して入力観察値(input observation)とメモリに格納された標本観察値(exemplar observation)とに基づいて問題となっている生物学的パラメータの推定値を生成する、カーネルベースのモデルとすることができる。標本観察値は、カーネルベースの方法のための、健康または安定状態の人において見られる値の正常な組合せを具現化するライブラリを形成する。カーネル演算(kernel operation)自体が、これらの標本観察値を入力観察値に関係付けて、入力値を前提として正常である推定値を生成する。この方法では、経験的データ(すなわち標本観察値)を使用して、相互関係が明確に知られていないパラメータに関する正確な推定モデルを生成することができる。
【0023】
本発明を、1つまたは複数のコンピュータで実行されるコンピュータプログラムで具現化することができる。一実施形態では、スタンドアロンのコンピュータは、1人の人のモニタリング専用のプログラムを、例えばホームコンピュータで実行し、その人に取り付けられた器具および/または埋め込まれた器具から通信プロトコル(例えば、Bluetooth、WLAN)を介して、あるいはその人が定期的に利用する測定ステーションから、センサデータを受信するように配置される。スタンドアロンのコンピュータはさらに、本発明のモデルベース、残差ベースのアプローチでデータを処理して、データをその人にローカルで提示する、および/またはデータをリモートの報告ステーション、例えば医師への電子メールまたは医師が利用可能なウェブページなどにアップロードするように配置される。別の実施形態では、病院のICUの機器が、病棟内のデータステーションに接続され、データステーションは、複数の患者に関するデータを、本発明に従って該データを分析するためにプログラムを実行する1つまたは複数のコンピュータを有する処理センタに転送する。結果として得られる処理されたデータ、警報、および診断などが、医療スタッフによる観察のために、病院および/またはリモートのモニタリングセンタにあるディスプレイ画面に中継される。さらに別の実施形態では、身体に取り付けられた、または埋め込まれたセンサ器具を有する人は、携帯情報端末(PDA)など、小さなコンピューティングプラットフォームも携帯し、このコンピューティングプラットフォームは、データを受信し、本発明のモデルベース、残差ベースのアプローチでデータをローカルで処理して、ローカルで報告され得る結果、および/または医療スタッフによる閲覧のためにリモート位置に伝送され得る結果を生成する。
【0024】
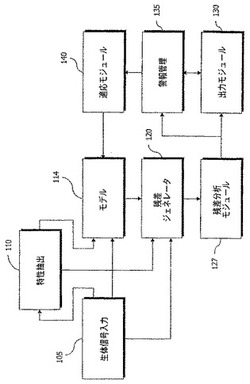
図1に移ると、ブロック図は、生物学的パラメータセンサ、またはセンサデータから導出される「特性(feature)」データストリームを用いて人をモニタリングする、本発明の一実施形態を概略的に示している。生体信号源105は、複数の生物学的パラメータの読取値(readings)をモデルモジュール114に、および任意的に特性抽出モジュール(feature extraction module)110に提供する。特性抽出モジュール110は、例えば、入力源105からのECG信号のデータフィード(data feed)に基づく心拍数データを提供することができる。特性抽出モジュール110によって計算することができる他の特性を、本明細書において以下に述べる。
【0025】
モデル114は、モニタリングされることが望ましい特定の生物学的パラメータの推定値を生成する。自動連想的な実施形態では、生成された推定値は、入力源105からの入力(および/または、そこから特性抽出モジュール110によって生成される特性)に対応する。推論的な実施形態では、モデル114は、入力には存在しないがモデルによって事前に学習された何らかの方法で入力に関係付けられる生物学的パラメータに対応する、1つまたは複数の値を生成することができる。その後、モデル114からの推定値は、推定値と入力源105から提供される測定された実際の値との差から残差を生成する、比較モジュール120に対して利用可能となる。
【0026】
得られる残差は、残差に対する様々なテストのいずれかを実施して健康関連の診断、警報、重症度などを判定する、分析モジュール127に提供される。この分析モジュールは、1つまたは複数の残差値を使用してルールロジックを評価するために、ルールエンジンを実行することができる。ルールは、単純な単変数のしきい値基準(threshold measure)から、多変数および/または時系列の論理まで、様々な一般に使用されるルールのいずれかとすることができる。さらに、例えば単純なしきい値ルールを、ウィンドウの警報カウントルール(windowed alert counting rule)(例えば、y観察値におけるxしきい値警報)に入れるときのように、一部のルールの出力は、他のルールに対する入力とすることができる。さらに、統計的な手法を残差データに対して使用して、それ自身をルールに入力することができる他の基準および信号を導出することがある。適用可能な統計的分析は、これらには限られないが移動ウィンドウの統計値(moving window statistic)(平均、メジアン、標準偏差、最大、最小、歪度、尖度など)、統計的な仮説検定(statistical hypothesis test)、傾向および統計的なプロセス制御(CUSUM、Sチャートなど)を含め、当技術分野で知られている多種多様な手法から選択することができる。
【0027】
残差分析モジュール127は、出力として、論理ルールおよび統計的な検定(statistical test)の適用の結果を提供し、これには、警報、診断結果、および重症度の格付けが含まれる。これらの結果は、これらの結果を表示するための手段(例えば、コンピュータ画面、PDA画面、プリントアウト、またはウェブサーバ)、結果を格納するための手段(例えば、照会機能を有するデータベース、フラットファイル、XMLファイル)、ならびに、リモート位置または他のコンピュータプログラムに結果を通信するための手段(例えば、ソフトウェアインターフェース、XMLデータグラム、電子メールデータパケット、非同期メッセージ、同期メッセージ、FTPファイル、サービス、パイプコマンド(piped command)など)を含むことができる、出力モジュール130に提供される。
【0028】
医療スタッフが、残差分析モジュール127からの結果に注釈を付けて増補して、結果に優先順位を付けて、特定の警報または診断を却下または保留にすることをできるようにし、あるいは結果に対して取られる応答をシステムに登録することができるようにする、警報管理モジュール135も提供することができる。さらに、モデル114、残差ジェネレータ120、および残差分析モジュール127によって異常と分析されたが、医療スタッフは正常と見なす可能性があり、モデル114に組み込む必要がある、入力源105からのデータが存在する可能性がある。したがって、警報管理モジュール135は、データセグメントの識別(identification)を、そのデータをモデル114の学習に組み込むタスクを課される任意的な適応モジュール140に提供することもできる。さらに、適応モジュール140は、任意的に、データおよび/または残差分析結果に対する自己の自動化されたテストを実施し、モデル114を更新することができる。
【0029】
前述したように、本発明による正常またはベースラインダイナミクス(baseline dynamics)の多変数モデルは、参照データから作成される経験的モデルとすることができる。本発明で使用するためのモデルの好ましい形式は、一般的なカーネルベースの推定量の自動連想的または推論的形式である。自動連想的形式は、一般に、
【0030】
【数1】

【0031】
であり、ここで、生物学的パラメータの自動連想的な推定値ベクトルXestは、Ciとカーネル関数Kからの結果との線形結合から生成され、カーネル関数Kは、生物学的パラメータの測定値(または特性)の入力ベクトルXnewを、そのような測定値のL個の学習パターンまたは標本Xiと比較する。多変数の推定値ベクトルXestを提供するために、Ciはベクトルであり、カーネルベース推定量に変化の発生をもたらし、かつ入力Xnewおよび/または標本Xiの一部の関数である可能性のある複数の異なる方法に従ってCiを決定することができる。学習パターンは、モデルが訓練される「データの動作(data behavior)」についてのクラス、例えば正常または健康なヒト、あるいは術後の安定した容態によってもたらされる。本明細書で以下にさらに詳細に説明されるように、標本は、特に年齢、性別、体重、状態など、またはそれらの組合せに基づいて、特定のヒトのタイプに関する正常な状態を表すように選択されることがあり、その結果、例えば高齢の女性患者をモニタリングする目的では、モデルは、例として、その集団から得られる標本に基づく高齢の女性に関する正常な生物学的パラメータのモデルとすることができる。
【0032】
一般的なカーネルベースの推定量の推論的形式は、
【0033】
【数2】

【0034】
であり、ここで、生物学的パラメータ値のベクトルYは、他の生物学的パラメータの入力ベクトルXnewと、それらのパラメータのL個の学習標本(learned exemplar)Xiとのカーネルベースの比較から推定される。各学習標本Xiは、推定されるべきパラメータの別の標本ベクトルYiと関連付けられ、これらは、カーネルKおよびベクトルCi(少なくとも一部はYiの関数である)による重み付けのやり方で組み合わされて、出力Yを予測する。
【0035】
カーネルベースの推定量に共通することは、カーネル関数と、標本を具現化するカーネル結果およびベクトルCiに基づいた標本の線形結合からの結果の生成である。カーネル関数Kは、一般化された内積(inner product)であるが、好ましくは、XnewとXiが同一であるときにその絶対値が最大であるというさらなる特徴を有する。
【0036】
本発明の一実施形態によると、モデルを提供するのに使用することができるカーネルベースの推定量は、Nadaraya−Watsonカーネル回帰形式によって例示されるカーネル回帰(Kernel Regression)である。
【0037】
【数3】

【0038】
推論的形式では、推論される生物学的パラメータの多変数推定値Yestは、パラメータ測定値の入力ベクトルXnewとL個の学習標本Xiとに対するカーネルK演算子を、各Xiとそれぞれ関連付けられる各学習ベクトルYiに従って線形結合してカーネル結果の和によって正規化した結果から生成される。Yiは、Xにおけるパラメータの学習測定値(learned measurement)と関連付けられた(すなわち、同時に測定された)、Yにおけるパラメータに関する学習測定値のL個の集合を表す。例として、Xは、複数の動脈圧読取値を含むことができ、一方、Yは、対応する複数の末梢血圧読取値を表すことができる。
【0039】
カーネル回帰の自動連想的形式では、生物学的パラメータの多変数推定値Xestは、それらのパラメータの学習測定値Xiの正規化された線形結合に、学習観察値(learned observation)Xiと比較した入力ベクトルXnewに関するカーネル演算結果を乗算することによって生成される。
【0040】
本発明の目的のためのカーネル回帰では、上の式1および式2からのCiは、カーネル比較値の和によって正規化された学習標本から構成されることが分かる。推定値ベクトルYestまたはXestは、本発明に従って実際の測定された値(推論的ケースではモデルに入力されないXnewまたはYnew)と差分計算されて残差を提供する、推定されたパラメータの集合を含む。
【0041】
別の実施形態では、相似ベースのモデル(SBM:similarity-based model)を、本発明によるモデルとして使用することができる。Nadaraya−Watsonカーネル回帰は、(場合によっては雑音の多い)学習標本の集合を前提として、平滑化された推定値である推定値を提供するのに対して、SBMは、補間された推定値を提供し、該推定値は、学習標本が入力にもなるとき、すなわち入力ベクトルが学習標本の1つと同一である場合に学習標本に適合する。これは、カーネル回帰アプローチと比べて、これらの信号の雑音が幾分オーバーフィットし(雑音が、モデルが作成された標本に同様に存在した場合)、したがって残差から雑音をいくらか除去するので、生物学的パラメータの偏差を検出するのに有利となり得る。カーネル関数Kを、演算子
【0042】
【数4】

【0043】
と書き換え、学習標本Xiの集合を行列Dとして、行を構成するXiの要素および列を形成するXi観察値と同等に扱うことによって、SBMを、カーネルベース推定量の一形式として理解することができる。
【0044】
【数5】

【0045】
ここで、Dは転置されており、D内の各観察値Xiに対して1つのカーネル値の列ベクトルが得られる。同様に、全ての標本を互いに比較することを、
【0046】
【数6】

【0047】
と表すことができる。
SBMの自動連想的形式は、
【0048】
【数7】

【0049】
に従って推定値ベクトルを生成し、ここで、X(est)は、推定値ベクトルであり、X(in)は、入力観察値(上記にXnewとして示される)であり、Dは、生物学的パラメータの学習標本観察値の集合(または部分集合)を含む学習ベクトル行列(learned vector matrix)である。相似演算(similarity operation)またはカーネルは、記号
【0050】
【数8】

【0051】
によって表され、各オペランドからの任意の2つのベクトルの比較のための相似性スコア(similarity score)をレンダリングするという一般的な性質を有する。したがって、式6に示されるように、最初の項
【0052】
【数9】

【0053】
により、D内の観察値の数に等しいサイズの値の正方行列を得られることになる。式5に示されるように、項
【0054】
【数10】

【0055】
により、D内の各ベクトルに対して1つの相似値(similarity value)のベクトルが得られることになる。この相似演算子(similarity operator)を、以下でさらに詳細に論じる。
【0056】
推定値を、以下の式に従って推定値をデータの原点とは無関係にすることによってさらに改善することができ、ここで、推定値は、相似演算子から作られた「重み(weight)」の和で割ることによって正規化される。
【0057】
【数11】

【0058】
相似ベースモデリングの推論的形式では、推論されるパラメータベクトルYestは、
【0059】
【数12】

【0060】
に従って、学習観察値および入力から推定される。ここで、学習標本の行列Dを、
【0061】
【数13】

【0062】
として理解することができる。重みの和を使用する前述の正規化は、
【0063】
【数14】

【0064】
である。
【0065】
本発明に従って使用することができる上記と類似のさらなる別のカーネルベースモデリング手法は、放射基底関数(radial basis function)の手法である。ニューラル構造(neurological structure)に基づいて、放射基底関数は、ニューラルネットワークの特殊な形式で受容フィールド(receptive field)を利用し、ここで、各基底関数は、入力ベクトルのn次元空間内に受容フィールドを形成し、ニューラルネットワーク内の隠れ層ノード(hidden layer node)によって表される。受容フィールドは、上述のカーネルの形式を有し、受容フィールドの「中心」は、特定の隠れユニット(hidden unit)が表す標本である。存在する標本と同数の隠れユニット受容フィールドが存在する。多変数の入力観察値(multivariate input observation)が、隠れ層と完全に接続された入力層に入る。したがって、各隠れユニットは、完全な多変数の入力観察値を受け取り、入力が受容フィールドの「中心」にマッチするときに最大となる結果を作成し、(上述のSBMと同様に)それらがますます相違するにつれて減少する。受容フィールドノードの隠れ層(hidden layer)の出力は、(式1において上述した)重みciに従って組み合わされる。
【0066】
本発明によるモデル化の上述の方法は全て、前述のカーネルベースのアプローチを利用して、標本のライブラリを利用する。標本(参照観察値または参照ベクトルとも呼ばれる)は、モデル化された生物学的パラメータによって見られるように、モデル化されたシステムの「正常」な動作を表す。任意的に、利用可能な参照データをダウンセレクトして、標本のライブラリとして働くように特徴的な部分集合を提供することができ、この場合、カーネルベースモデルを「訓練」するためのいくつかの手法を採用することができる。好ましい訓練方法によると、少なくとも、全ての利用可能な参照観察値にわたる所与の生物学的パラメータの最高値または最低値を有する観察値がライブラリに含まれる。これを、追加の観察値のランダムな選択、またはデータの散乱(scatter)またはクラスタリング(clustering)を忠実に表すように選ばれた選択で補うことができる。代替的に、参照データがクラスタ化されることがあり、クラスタの代表的な「重心(centroids)」が、新たな人工的に生成された標本として形成され、次いでライブラリを形成する。標本のライブラリを含む観察値を選択するための多種多様な技法が、当技術分野で知られている。
【0067】
上述のように、カーネルを、あり得る様々なカーネルから選択することができ、好ましくは、そのカーネルによって返される全ての値の最大絶対値を有する2つの同一のベクトルを比較するための値(または相似性スコア)を返すように選択する。いくつかの例を本明細書で提供するが、それらは本発明の範囲の限定を意味するものではない。下記は、任意の2つのベクトルXaとXbの比較のために、本発明に従って使用され得るカーネル/相似演算子の例である。
【0068】
【数15】

【0069】
式12〜14では、2つのベクトルのベクトル差または「ノルム(norm)」が使用される。一般に、これは2ノルムであるが、1ノルムまたはpノルムとすることができる。パラメータhは、一般に、しばしばカーネルの「帯域幅(bandwidth)」と呼ばれる定数であり、各標本が有意な結果を返す「フィールド」のサイズに影響を与える。指数λも使用されることがあるが、1に設定することができる。各標本Xiに対して異なるhおよびλを用いることができる。好ましくは、ベクトル差またはノルムを用いるカーネルを使用するとき、例えばセンサデータの集合の最小読取値の値を、全てのセンサ値に加算または全てのセンサ値から減算して、全ての結果をそのセンサの範囲で割ることによって、測定されたデータを最初に0から1の範囲(または他の選択された範囲)に正規化すべきである。代替的に、データは、標準偏差が1(または他の定数)に設定されたゼロ中心の平均データ(zero-centered mean data)に変換することによって正規化することもできる。さらに、本発明によるカーネル/相似演算子を、観察値の要素に関して定義することもでき、すなわち、相似性をベクトルの各次元で判定し、それらの個々の要素の相似性が、全体のベクトル相似性を提供するために何らかの様式で組み合わされる。典型的に、これは、任意の2つのベクトルxとyのカーネル比較に関する要素の相似性を平均化する程度の単純なものとすることができる。
【0070】
【数16】

【0071】
このとき、本発明に従って使用され得る要素の相似演算子には、
【0072】
【数17】

【0073】
が含まれるが、これらには限定されない。帯域幅hは、上記に示されるものなど、要素カーネル(elemental kernels)の場合、観察値ベクトルの第mパラメータの予測範囲についてのある種の基準となるように選択されることがある。これは、例えば、全ての標本にわたるパラメータの最大値と最小値との差を見つけることによって決定することができる。代替的に、これは、例えば、妥当な生理学的予測に基づいて心拍数パラメータの予測範囲を毎秒40から180回に設定することによって、標本または参照ベクトルに存在するデータに関係なく専門知識を使用して設定することができ、したがってhは、心拍数であるモデル内の第mパラメータに関して「140」である。さらに、差分関数を使用するベクトルと要素カーネルとの両方に関して、差を帯域幅で割った値が1よりも大きい場合、その値を1に設定することができ、例えば式13、14、17、および18のカーネル値が0となることに留意されたい。また、カーネルまたは相似演算子は、1、h、λなどの代わりに、様々な定数の加算または乗算によって修正することができることが容易に分かる。三角関数が使用されることもあり、例えば、
【0074】
【数18】

【0075】
である。最も好ましくは、相似演算またはカーネルは、一般に、2つの同一次元ベクトルの比較に関する相似性スコアを提供し、この相似性スコアは、
1.各端部で境界を画されたスカラ範囲内にあり、
2.2つのベクトルが同一である場合には、境界を画された端部の一方の端部の値を有し、
3.スカラ範囲にわたって単調に変化し、
4.2つのベクトルアプローチが同一であるときに増加する絶対値を有する。
【0076】
本発明の重要な代替的な実施形態では、経験的カーネルベースモデルの推論的形式および自動連想的形式を、入力される観察値の質に基づいて「オンザフライ(on-the-fly)」で生成することができ、学習観察値の大きな集合、すなわち参照集合から得られる。このプロセスは、ローカリゼーションと呼ばれる。したがって、本発明の好ましい形式は、カーネルベースモデリングの推論的および自動連想的形式に関する上述の計算を、入力観察値に基づいて、参照観察値のより大きな集合から選択される学習観察値xiの集合またはDを使用して行うことができるものである。カーネルベースモデルは、1回のパスで訓練され、迅速に更新され得るため、この種のローカリゼーションに非常に良く適している。有利には、候補標本の大きな集合を利用し、しかし推定値を生成する目的でそれぞれの新たな入力観察値で部分集合を選択することによって、モデリング計算の速度を短縮することができ、モデルのロバスト性を改善することができ、一方、モデル化されているシステムのダイナミクスを依然として良く特徴付けている。
【0077】
様々な基準を使用して、相似演算子自体の適用を含め、ローカル化されたD行列のメンバーシップを構成することができる。しかし、一般に、プロセスを、図2を参照することで理解することができる。モニタリングプロセスの一部としてのモデルによって推定されるべきである生物学的パラメータまたは導出された特性の集合を含んでいる、入力観察値205は、ローカリゼーションモジュール209に提供され、ローカリゼーションモジュール209は、標本観察値の部分集合を選択してモデルを構築するために、参照ライブラリ212の形式のこれらの標本観察値の大きなストアにアクセスする。ローカリゼーションモジュール209は、入力観察値205に関連するライブラリ212から標本を選択し、これは、ライブラリのサイズよりもはるかに小さい集合とすることができる。例として、参照ライブラリ212は、モデル化されているパラメータによって表される生物系の正常なダイナミクスを特徴付ける100,000個の標本観察値を備えることがあるが、ローカリゼーションモジュール209は、入力観察値205の受信に応答して、数ダースの観察値のみを選択して、ローカルライズされたモデルを構築することがある。次いで、選択された標本観察値は、ローカルライズされたモデル224に提供され、これらの観察値は、(上記でSBMに関連してDとしても示される)カーネルベース推定量のための学習標本Xiの集合を備える。次いで、推定観察値230が、それに応じて上述のように生成される。次の入力観察値205が本発明のモニタリングシステムに提示されるとき、プロセスが繰り返され、新たな入力観察値に基づいて、ライブラリ212から標本の新たな選択、場合によっては異なる部分集合の選択が行われる。
【0078】
本発明の一実施形態によると、入力観察値205を、クラスタリング技法に基づいて、学習観察値の参照ライブラリ212と比較することができる。それに応じて、ライブラリ212内の標本観察値は、ベクトルをクラスタ化するための当技術分野で知られている複数の技法のいずれかを使用してクラスタ化され、ローカリゼーションモジュール209は、入力観察値205がどのクラスタに最も近いかを識別し、そのクラスタのメンバー標本を、ローカルライズされたモデル224に提供されるローカライズされた観察値となるように選択する。適切なクラスタリング方法は、k平均およびファジーc平均クラスタリング、または自己組織化マップのニューラルネットワーク(self-organizing map neural network)を含む。
【0079】
本発明の別の実施形態によると、カーネルを使用して、入力観察値205をライブラリ212内の各標本と比較して、入力観察値と比べた参照観察値のランキングを提供する相似値を得ることができる。次いで、それらの特定の上位部分(top fraction)をローカライズされたD行列に含むことができる。このローカリゼーションの態様のさらなる改良として、全ての参照観察値のランク付けリスト内の観察値は、ライブラリ212内の他の観察値が入力に対してより高い相似性を有する場合であっても、それら観察値の構成要素(component element)の1つが、入力ベクトル内の対応する値を「ブラケット(bracket)」する値を提供する程度まで、ローカライズされたDに含まれる。ランク付けリストのこのサーチダウンは、入力ベクトルの全ての値が、ローカルライズされたDに含まれる参照観察値の1つの値によって、低い側と高い側の両方でブラケットされるまで、または、D内に含むためのベクトルがユーザ選択可能な最大限度に達するまで、または含まれる相似性しきい値を超えるほど、入力に十分に高い相似性を有するさらなる参照観察値が存在しなくなるまで行われる。
【0080】
ローカルライズされたDのメンバーシップを決定する際の他の修正形態は、本発明の範囲内である。例として、上述のクラスタリング選択方法および相似性選択方法の両方では、クラスタ化されるベクトルまたは相似性についてカーネルで比較されるベクトルを備えるのに使用される要素の集合、すなわちパラメータの集合は、モデルおよび推定値を生成するのに使用されるものと同一ではない可能性があるが、代わりに、パラメータの部分集合、または部分的に重なる集合である可能性がある。例えば、心拍数、呼吸量、血圧、体温など、半ダース以上の生物学的パラメータおよび特性の集合で、本発明に従って患者をモニタリングする際、ローカリゼーションを、心拍数および呼吸パラメータのみを利用して行うことができる。
【0081】
図3に移ると、任意のチャート化された、モデル化されている任意の生物学的パラメータを表し得る生信号305と、その推定値310と、チャートの下半分にプロットされた対応する残差315とを参照することで、本発明のアプローチをより良く理解することができる。信号305は、(自動連想的に、または推論的に)モデル化されている複数のパラメータの1つであるが、他の信号は図中に示されていない。生信号は変動を示し、環境、活動、代謝、日周タイミング(diurnal timing)などにより生物学的パラメータが変動することがある生物系の典型である範囲320を有することが分かる。従来のアプローチでは、区間(limits)324は、信号305が、正常または健康とみなされる許容範囲の外に出るときを検出するために提供される。したがって、信号305が区間324の外に出るとき、少し後まで問題が検出されないままの可能性がある。しかし、パラメータ305のモデル生成された推定値310を提供し、それらを差分計算して残差315を生成することによって、別の残差の区間336を使用して、信号305がその正常範囲320にわたって変動するときであっても、信号305が、予測されるものから逸脱しているときを検出することができる。したがって、異常な値の検出を、信号305が依然として十分にその正常範囲320内にあるときであっても、かなり早期の時間340に実現することができる。
【0082】
有利には、本発明によって提供される残差を分析することによって、生データに対する同じ分析の適用に比べて、より良い診断および警報発生が可能である。次に説明の目的で議論される多種多様な統計的、論理的、および数学的手法を使用して、本発明に従ってモニタリングされる各生物学的パラメータに関して残差を分析することができる。
【0083】
使用され得る第1の手法は、パラメータに関する残差にしきい値を適用するものである。従来の医学では、しきい値は典型的に、生データに適用されるが、残差しきい値(residual threshold)は、推定値と実際のデータとの差分計算によって正常な変動が除去されているので、より高い誤警報率をもたらすことなくはるかに厳しい制限が可能である。残差しきい値は、上限、下限、またはその両方とすることができ、警報は、残差がしきい値を超えるときに登録される。しきい値は、専門知識から決定することができ、または特定のパラメータに関する残差データの雑音分布(noise distribution)の関数として設定することができる。例えば、特定の測定デバイスが、非常に雑音の多い生データを提供することがあり、その結果、残差は、対応して高い雑音レベルを有する。この雑音レベルは、残差信号の分布を特徴付けるのに十分な数の観察値に関して観察されることがあり、その際、しきい値は、この明らかになった分布の関数(5×標準偏差など)として設定され、それにより測定デバイスの雑音レベルに対処する。モニタリングされる各患者の各生物学的パラメータは、それ独自の設定されたしきい値レベルを有することがある。
【0084】
しきい値は、ルールシステムまたはエキスパートシステムにおける、ごく単純な形式のルールである。そのようなシステムは、本発明による残差の分析の柔軟性および能力(power)を拡張することができる。例えば、単純なしきい値は、残差が観察値の移動ウィンドウ内で十分な回数だけしきい値を超えたときに、偏差検出アラームをトリガするためのルールにまで拡張されることがある(「y観察値におけるx警報」ルール)。アラームまたは通知を、2つ以上のパラメータにわたる残差に対する条件の組合せに関して構成することもできる。例えば、1つの残差信号がその上限を超え、別の残差信号がその下限を超えるときに、健康容態の可能性の通知を、本発明のモニタリングシステムによって生成することができる。多変数ルールは、残差の観察値の時系列を利用することもできる。ルール自体が、他のルールをトリガするように、または他のルールの結果を拒否するように、互いに連鎖されることがある。生データを取り扱うための多種多様なエキスパートルールシステムが当技術分野で知られており、これらのルール構造を、残差に関するルールに変換することによって本発明に容易に適応させることができる。例えば、以前の生データルール構造は、特定のパラメータが、集団の「平均」値を超えて2より大きい標準偏差であるときに、あり得る健康への脅威を示すことがあるが(従来の分布アプローチ)、新規のルールは、残差が、その残差信号に関してゼロから2より大きい標準偏差(または、何らかの他のしきい値)離れているときに、同じ通知を提供することがある(標準偏差は、その患者から導出された信号から決定されることがあり、あるいは臨床用途でモデルを準備する際にそのパラメータおよびそのモデルを用いて人々をモニタリングした実験から導出されることがある)。パラメータに関する一連の残差値が信号を生成し、その信号は、上述されるように、傾向および仮説検定のための様々な統計的技法を用いて処理することができる。Waldの逐次確率比検定などの統計的仮説検定を使用することができる。
【0085】
様々なパターン認識技法をさらに使用して、残差のパターンを、患者の容態に関する警報、診断結果、または重症度格付けに関連付けることができる。そのような技法の1つは、複数のモニタリングされたパラメータに関する残差の集合を、入力を診断条件と関連付けるように訓練されたニューラルネットワークに提供するものである。
【0086】
本発明のモニタリング目的のためにモデル化され得る生物学的パラメータの選択について、本発明の検出の感度および正確さについての利点は、特に、パラメータを別々にテストする従来の医療業務とは対照的に、生物学的パラメータに対して取られる多変数アプローチによるものである。したがって、本発明のカーネルベース推定量を使用すると、生物学的パラメータの観察値は、各観察値が通常、複数のパラメータそれぞれに対するデータ値(直接センサ読取値であっても、センサデータの何らかの導出された特性であっても)を含むものであるから多変数であり、ほぼ同時の瞬間または周期(period)であることに起因する。例えば、観察値は、ある瞬間の複数のパラメータデータ値のスナップショットを含むことができる。重要なことに、本発明のカーネルベース方法は、スナップショットを定期的に獲得することを必要とせず、スナップショットを不定期な間隔で獲得することができる。
【0087】
したがって、生物学的パラメータに関するデータ値は、直接センサ測定値、例えば時間tの体温とすることができ、または時間tに起因する瞬間心拍数またはウィンドウ平均(window-averaged)の心拍数などの導出される特性とすることができる。観察値を定期的にサンプリングする必要はないので、様々な定期的にサンプルされる信号(ECG、呼吸、酸素測定、圧力、体温など)を、識別される半定期的または不定期的トリガに合わせることが可能である。一実施形態では、観察値が、ECG信号のQRSピークに適合されて生成され、全ての他のサンプリングされる信号は、その時点で、またはRR間隔(あるQRSピークから次のQRSピークまで)にわたって測定される。心拍数は、生来いくらか不規則であることが知られており、したがって、パラメータに関するデータ値を、ECG信号のQRSピーク(または任意の他の識別可能なポイント)に応じて生成することができる。別の実施形態では、観察値は、毎分1回など定期的な間隔で生成され、1分での生の値、1分にわたる信号の統計量、あるいは毎分の測定による累積または平均の移動ウィンドウの値(moving window value)を含むことがある。したがって、モデル化可能な生物学的パラメータは、(a)生の瞬間信号値、(b)何らかの他の信号イベント(QRSピークなど)によって定義されるウィンドウ内の信号からの統計値、(c)1組のそのようなウィンドウにわたる信号からの累積/平均統計値、(d)直前のウィンドウから現在のウィンドウまでの上述した値の1つについての変化の割合、および(e)定期的な時間ウィンドウ(time window)にわたる(例えば、毎分1回)信号からの累積/平均尺度から選択されることがある。
【0088】
例示の目的で、ECG信号のQRSピークのようなキーイングイベント(keying event)を使用して、ヒトの健康をモニタリングするカーネルベースモデルの使用において導出されることがある特性は、以下のものを含む。
瞬間心拍数(Instantaneous Heart Rate)−直前のQRSピークからの時間、または次のQRSピークまでの時間。
「最高」血圧(Blood Pressure “Systolic”)−ECGの現在のQRSピークから次の(または直前の)QRSピークまでのウィンドウ(window)における、連続血圧測定デバイス(カテーテル挿入型または非観血式(non-invasive))からの最高血圧の読取値。
「最低」血圧(Blood Pressure “Diastolic”)−ECGの現在のQRSピークから次の(または直前の)QRSピークまでのウィンドウにおける、連続血圧測定デバイス(カテーテル挿入型または非観血式(non-invasive))からの最低血圧の読取値。
「最高」血圧のラグ(“Systolic” BP Lag)−連続BP(血圧)測定センサからの血圧信号のQRSピークと次の「収縮(systolic)」(すなわち最高(highest))ピークとの間の時間。
「最低」血圧のラグ(“Diastolic” BP Lag)−連続BP(血圧)測定センサからの血圧信号のQRSピークと次の「拡張(diastolic)」(すなわち最低(lowest))ピークとの間の時間。
酸素飽和度ピーク(Oxygen Saturation Peak)(Ebb)−現在のQRSピークと次のQRSピークとの間の酸素飽和度(SpO2)の最高(最低)測定値。
温度(Temperature)−あるQRSピークから次のQRSピークまでのウィンドウにわたる温度センサの平均値、最大値、最小値、またはメジアン値。
【0089】
さらに、以下のパラメータは、呼吸サイクルを、データ収集のためのキーイングイベントとして使用する場合に、使用され得るパラメータの例である。
瞬間呼吸速度(Instantaneous Respiration Rate)−ある完全な呼吸から次の呼吸までの時間。
心拍数(Heart beat count)−ある完全な呼吸中の心拍の数。
酸素化ラグ(Oxygenation lag)−呼吸サイクルのあるポイント、例えば吸入の終了と、例えば酸素濃度計からの血液酸素化信号のピークとの間のタイムラグ。
【0090】
当然、上記のパラメータまたはそれらの生体源信号のメジアン値、平均値、高低差(範囲)などを決定することなど、上記の他の統計的基準を代用することもできる。
【0091】
さらに、例示のために、QRSピークのようなイベントによって定義される1組のウィンドウで導出され得る特性には、以下が含まれる。
ウィンドウでの呼吸速度(Windowed Respiration Rate)−QRSピーク間隔(RR間隔としても知られる)によって定義される直前のm個のウィンドウにわたって測定される呼吸速度。値は、現在のQRSピークイベントに適合させた観察値に起因する。呼吸速度は、瞬間(現在の呼吸の周期)のもの、または平均化したものとすることができる。呼吸速度がm個のウィンドウ全体のスパンより長い場合、その呼吸サイクルの完全な呼吸速度の推定値を、部分的なサイクルから外挿(extrapolation)によって生成することができる。
ウィンドウでの呼吸の深さ(Windowed Respiration Depth)−QRSピーク間隔によって定義される直前のm個のウィンドウにわたって測定される呼気の最大量。値は、現在のQRSピークイベントに適合させた観察値に起因する。
心拍数変動(SDNNタイプ)−QRSピーク間隔によって定義される直前のm個のウィンドウにわたる瞬間心拍数の分散または標準偏差。m個のウィンドウの1つずつが瞬間心拍数を有し、分散または標準偏差は、m個全ての値にわたって計算される。
心拍数変動(RMSSDタイプ)−直前のm個のウィンドウにわたる瞬間心拍数(または、心拍周期)の連続する差の二乗の和の平方根。
【0092】
例として使用され得る他のパラメータを、人工呼吸器など患者に接続される他のデバイスから導出することができる。典型的な換気パラメータ(ventilation parameter)を、本発明による患者モニタリングのためのカーネルベースモデルで使用することができる。これらには、以下のものが含まれる。
1回換気量(または分時換気量)−(瞬間、またはウィンドウ、例えば1分間の平均/累積の)吐き出される空気または吸入される空気の量の基準。
CO2−吐き出される二酸化炭素の量、分圧、または濃度の測定値。
ピーク吸気圧力(Peak Inspiratory Pressure)−吸気サイクル中に人工呼吸器によって適用される最大圧力。
呼気終末陽圧(Positive End Expiratory Pressure)−呼気の終了時のベースライン陽圧。このパラメータは、ローカライズ変数として特に有用である可能性がある。
FIO2−吸入された空気中の酸素濃度、典型的にはパーセンテージ。この変数も、ローカライズ変数として特に有用である可能性がある。
PIF、PEF−空気のピーク吸気流/呼気流。
気道抵抗−陽圧換気に対する肺の抵抗の基準。
【0093】
家庭でのテルヘルス(home telehealth)モニタリング環境において、被験者に、ますます多様なセンサを取り付けることがあり、あるいは、本発明のモデリングで使用することができる定期的な測定を行うように指示することがある。定期的な測定には、以下のものが含まれる。
体重−被験者/患者のスケール測定された体重。
血中グルコースレベル−血液の小滴をサンプリングし、血液のグルコースレベルを測定する器具、または光学測定値から血中のグルコースレベルの判定を行う器具。
活動(Activity)−加速度計(accelerometer)を使用して、患者の運動の量を測定することがある。場合によっては、加速度計を取り付けて、特定の方向(例えば、上下対横)の運動を提供することができる。
周囲温度の差-外気と皮膚または周辺との間の温度の差の基準。
汗−被験者が発汗している度合いの基準。
【0094】
パラメータの上記のリストは、本発明のカーネルベースモデルリングのアプローチで使用可能な、ヒト被験者から得ることができる変数のタイプの例示にすぎないものと意図される。このリストは、限定を意図するものではない。観察値を形成するために本発明において使用される生物学的パラメータは、温度、圧力、活動範囲(例えば、呼吸の量)、速度(呼吸速度、心拍数)、伝導性、電気的活動(例えば、EEG)、化学的測定値、流速(flow rate)、および任意の他の公知のもしくは将来開発されるヒト生物系のメトリクスを含むことができる。好ましくは、モニタリングの目的でモデルに組み合わされるパラメータは、(a)因果関係または併用効果として、(知られているものでも、推察されるものでも)何らかの方法で関係付けられると考えられ、(b)一般に、ほぼ等しい時間内で、身体の変化または身体のフィードバック制御のループに応答し、そして(c)それらの1つまたは複数で偏差が見つかった場合に根本的な原因を示すのに有用である。好ましくは、ヒトの健康をモニタリングするための本発明によるモデルは、心拍数、血液酸素化値、呼吸メトリクス、血圧メトリクス、および温度メトリクスの1つまたは複数を含む。本発明の好ましい実施形態では、ヒトの健康をモニタリングする際に使用するモデルは、3つまたはそれ以上のパラメータ、より好ましくは5つまたはそれ以上のパラメータ(生の信号、または信号から導出された特性)を備える。有利には、本発明のカーネルベースモデリングのアプローチは、多数の変数、すなわち20〜30より多い関連パラメータを用いても効果的である。
【0095】
特定の種類の生体信号に対する何らかの活動の破壊的性質(disruptive nature)が原因で、咳や会話が呼吸信号にどのように影響を及ぼすかなど、本発明の別の態様は、入力観察値のフィルタリングを提供することになる。一般に、ICUにおける患者の回復などの背景においては、観察値は、好ましくは、会話、咳、移動中ではなく、データがよく動作する状態に患者があるとき、特に患者が睡眠または休憩しているときにのみモニタリングされる。データフィルタリングモジュールを提供することができ、このモジュールは、睡眠または休憩状態を自動的に認識し、他のデータをフィルタ除去し、睡眠/休憩状態からのデータのみをモニタリングのために残す。複数の技法を使用して、データが睡眠/休憩状態の患者から来ているかどうかを自動的に判定することができる。使用され得る1つの方法は、入力観察値または入力観察値のシーケンスを処理して、推論的モデルを通じてその分類を決定するものである。そのようなモデルは、例えば、各値がそれぞれ「クラス内でない(not in class)」と「クラス内である(in class)」に対応する2つの値(例えば、0と1)の間に及ぶ単一の出力変数を提供する、本発明による推論的なカーネルベースのモデルとすることができる。モデルを、正常な睡眠/休憩の例から訓練することができる。同様に、入力データがどのクラスの特徴であるのかを判定し、その分類を出力するための多様なクラスタリング技法が、当技術分野で知られている。例として、K平均クラスタリングは、よく知られた技法であり、入力として観察値の集合を受け入れて、該観察値を、ユーザ決定された数のクラスタにクラスタ化することができ、その後、新たな観察値を、適切なクラスタまたはクラスに関連付けることができる。次いで、睡眠/休憩クラスタに関連付けられた観察値がモニタリングされ、一方、このクラスタに適合しなかった観察値はフィルタ除去される。最後に、エキスパートルールを使用して、入力観察値を処理し、睡眠/休憩状態にあるか否かを判定することが知られている。そのようなルールは、心拍数および呼吸速度を判定することを含むことができ、これらが特定の範囲内にあると判定し、呼吸の速度が予想ブレスとを変更またはスキップしなかったと判定すると、状態は睡眠/休憩状態である。
【0096】
データ中の破壊的イベント(disruptive event)に対処するための別の方法は、破壊的イベントを複数の方法でフィルタリングするものである。典型的な破壊的イベントは、(スキップされた、または過剰な)異常心拍、または呼吸の正常なプロファイルを妨害する咳/会話を含むことができる。破壊的イベントは、データ中の興味深いパターンであり、医学的に関心の対象となり得るが、これらのパラメータを互いにモデル化して関係付ける目的では、これらをフィルタ除去することが有用である。したがって、スキップされた、または過剰な拍を識別して、そのデータポイントをなくすことによって、心拍数を平滑化することができる。これを行うための1つの方法は、R−R間隔で瞬間心拍数を計算して、得られる心拍数信号に、3〜5個のデータポイントのウィンドウでメジアンフィルタなどのフィルタを適用することである。その結果、過剰な拍で高く跳ね上がることがある、またはスキップされた拍の際に低く降下することがある異常な瞬間心拍数が、異常値でない可能性が高い、ウィンドウ内のメジアン値で置き換えられる。不適合な呼吸サイクルをなくすための1つの方法は、不適合な領域のいずれかの側で正常な呼吸を識別し、データを完全に削除するものである。不適合な呼吸サイクルを、プロトタイプの呼吸パターン(例えば、谷で始まり、ピークまで増加し、谷に降下して戻る)に十分にはマッチしないサイクルとして識別することができる。信号においてプロトタイプパターンを瞬間的なウィンドウにマッチングさせるための複数のパターンのマッチング技法が当技術分野で知られており、これらの技法をこの目的で使用することができる。
【0097】
1つまたはそれ以上のモデルを使用して人の健康をモニタリングすることができ、パラメータを、複数のモデルで共有することができる。したがって、本発明の一実施形態は、全ての他の利用可能なパラメータの集合からのバイタルサインまたは他のパラメータそれぞれについて推論的モデルを形成する。したがって、使用されるモデルの総数は、モニタリングされるパラメータの数に等しい。さらに、人のモニタリングを、様々な割合でサンプリングされるデータを使用して様々なモデルで行うことができる。例えば、あるモデルは、RR間隔など何らかのトリガによって形成される観察値を有するデータを使用することがあり、一方、別のモデルは、毎分1回形成される観察値を使用することがある。別の例として、第1のモデルは、心臓血管機能をモニタリングするのに必要な生物学的パラメータを含むことがあり、第2のモデルは、免疫動作をモニタリングするのに必要な生物学的パラメータを含むことがある。さらに別の例として、同じパラメータの複数のモデルを使用するが、異なる活動状態またはクラスで訓練することがある。このとき、入力観察値が、それが表す活動のタイプ(上記のような睡眠/休憩、または運動、またはウォーキングなど)に従って分類されると、そのクラスの活動を学習した本発明によるモデルを使用して、その観察値または観察値のウィンドウをモニタリングする。
【0098】
本発明の特定の実施形態は、平均心拍数、平均呼吸速度、平均最高血圧、平均最低血圧、平均の呼吸の深さ/量、および平均血液酸素化のパーセンテージ(酸素測定)のパラメータを含む10秒から1分の間の間隔の観察値を有する、自動連想的モデルを備える。心拍数および呼吸パラメータは、生信号とすることがあり、または平滑化されることがあり、平滑化は、異常な(過剰な、または不足の)拍動または異常な呼吸(咳など)の除去を意味する。また、間隔にわたる上記の値の平均の代わりに、メジアン、最大、または最小など何らかの他の統計値を使用することができる。
【0099】
また、本発明は、化学的、免疫学的、微生物学的、組織学的、血液学的、および同様のテスト結果、より具体的には、血液成分測定値、尿成分測定値など(一般に「検査結果(lab results)」または「検査(labs)」と呼ばれる)を使用してヒトの健康のモニタリングを提供する。そのような測定値を、本発明において非常に有利に使用することができる。これは、(a)測定値は典型的に多変数であり、(b)多変数の結果は、おおよそ単一の時間での体液構成(fluid makeup)を表し、そして(c)検査は典型的には不定期に要求されるが、本発明はそれでもなお、そのような非定期的なやり方でサンプリングされたデータを使用することができるためである。検査データの従来の使用に勝る本発明のさらなる利点は、変化を判別する能力がより高いことである。従来、例えば、血液中の成分の各測定値は、別々に調べられて、健康な集団に関する「正常」な範囲と比較される。対照的に、本発明によれば、互いと比較した各成分の正常なダイナミクスがモデル化されて考慮され、その結果、偏差が十分に従来のアプローチの下の「正常」な範囲内にあるとしても、成分の値の小さな偏差でさえも検出することができる。
【0100】
臨床検査の結果データを用いてモデル化される生物学的パラメータは、血糖(グルコース)、酸素、二酸化炭素、重炭酸塩などの血中ガス、pHなど酸性度の基準、クレアチニンや血中尿素窒素(BUN)など分解産物の基準、ナトリウム、カリウム、および塩化物など電解質の基準、クレアチニンキナーゼ、アルブミン、C動作性蛋白質、ビリルビンなど酵素および蛋白質の基準、ならびにカルシウム、鉄、マグネシウム、亜鉛などミネラルの基準などを含め、複数の典型的な測定値のいずれかを含むことができる。これらのパラメータの多くは、性別、年齢、体重などとともに変化するので、モデルの学習標本は、集団内の複数の健康な個人、より具体的には、モニタリングされる人と同様の人口学的特色を有する人の例示的な血液サンプリングのテスト結果を含むことができる。したがって、正常の体重の若い男性患者の検査をモニタリングするために、正常な体重の若い男性の正常な血液成分ダイナミクスのモデルは、日周サイクル中の様々な時間に集められ、且つこれらのパラメータが正常な活動および健康の間に互いに関してどのように変化するかについてのダイナミクスを網羅するのに十分な、多くのそのような個人からの実際のテスト結果を含むことがある。患者の結果がモデルに入力されると、様々な正常な学習標本に基づいたパラメータの推定値が、患者の実際の結果と比較されて残差を生成し、正常な集団におけるそれらのパラメータの範囲より小さいが、それでもなお健康容態(初期的な悪化および悪化の傾向であっても、単に静的な疾病状態であっても)の重要な指標である残差の偏差が存在することがある。患者が、血液、尿、または他の体液の一連のテストを受ける場合、これらの残差結果自体が、本発明による後の分析のための時系列を構成することができる。
【0101】
病棟、看護施設、または診療所で患者をモニタリングする状況では、本発明を、以下のように実践することができる。患者に、患者のバイタルサインおよび他の生物学的パラメータをモニタリングするためのベッドサイドのデバイスに取り付けられたセンサを、取り付ける。このデータは、ベッドサイドのデバイスから、典型的にはコンピュータネットワークを介して、本発明によるデータを処理するためのソフトウェアを実行するコンピュータに提供される。コンピュータは、患者からのセンサデータの観察値の受信に応答して推定値を生成するのに使用するための1つまたは複数のモデルを構成する標本データを格納するか、または格納された標本データへのアクセスを有する。また、患者の臨床検査の結果に関するデータがコンピュータに提供されることもあり、典型的には、その結果が入力されている病院情報システムから提供される。例えば、患者は、約毎分1回のデータサンプリング周波数で、ベッドサイドのバイタルサインの集合に関する、或るモデルによってモニタリングされることがある。第2のモデルは、不定期な間隔でコンピュータによって受信され得る患者の検査結果を処理するために使用される。患者のデータをモニタリングするために使用され得る各モデルから、データの推定値が生成され、推定値と実際の値との比較で残差が生成される。コンピュータはさらに、本明細書の他の箇所で説明される、残差に対する様々なモデリング後の分析ステップを適用するように配置され、診断の目的で、偏差を検出して、偏差のパターンを認識する。測定されたデータ、推定値、および残差を、ローカルおよび/またはリモートでアクセス可能なディスプレイシステム上で、またはウェブサイト上で、医療スタッフに利用可能にすることができる。また、そのようなディスプレイでは、任意の検出された偏差、認識されたパターン、および結果として得られる、自動生成される提案される診断も利用可能である。コンピュータは、そのインターフェースを介して、またはウェブブラウザもしくはクライアントサーバプログラムを介して他のワークステーションに、残差、偏差、パターン、および診断に関する患者の医療記録に注釈を付けるためのユーザインターフェースを提供することができる。診断は、医療関係者によって、「調査中」、「不正確」、「確認済」、または他の状態とマーク付けされることがある。ユーザは、偏差などとしてコンピュータによってフラグが立てられているデータの特定の観察値を、実際には正常な逸脱していないデータ(non-deviating)としてマーク付けすることもできる。それに応答して、コンピュータの適応モジュールは、実際のデータを使用して、そのデータに異常とフラグを立てられたモデルを修正することができ、その後、任意のさらなるそのようなデータが、モデルによって異常と検出されることはない。
【0102】
モデルを適応させるプロセスは、新たな観察値または観察値の集合を、元のカーネルベースモデルが「訓練」された参照データの集合に追加することを含む。最も単純な実施形態では、全ての参照データがモデル標本として使用され、したがって、モデルを適応させることは、モデルの標本集合に新たな(1つまたは複数の)観察値を追加することを意味する。訓練方法を使用して、参照観察値を、システムダイナミクスの「代表」として格納された部分集合に対してダウンサンプルする(dowmsample)場合、新たな観察値が、元の参照データ集合に追加され、ダウンサンプリング技法を適用して、新たな代表的な標本集合を導出し、この新たな代表的な標本集合は次いで、新たな観察値の代表を含むべきである。また、ダウンサンプリング技法を再実行することなく、単に新たな観察値を標本のダウンサンプル集合に追加することも可能である。さらに、その場合、モデルから一部の標本を除去するのに有用であることがあり、その結果、それらの標本は新たな観察値によって効果的に置き換えられ、モデルサイズは扱いやすいサイズに保たれる。どの古い標本を除去すべきかについての基準は、クラスタリングおよび類似性の判定を含むことができ、これらは、新たな観察値を古いものと比較して、新たな観察値に最も似たものを置き換える。
【0103】
人の健康状態の家庭または現場モニタリングの状況では、PDAまたは携帯電話のようなものと同等の装着可能または携帯可能なコンピューティングデバイスが、人に取り付けられた複数のセンサからのデータを、直接有線接続、またはブルートゥースなど非常にローカルな無線通信を介して記録する。データは、基地局にダウンロードするためにコンピューティングデバイス内に維持される。またコンピューティングデバイスが、携帯電話などの無線通信デバイスでもある場合、分析のために通信ネットワークを介してリモートコンピュータにデータをアップロードすることができる。あるいは、範囲内にある場合はブルートゥースを介して、またはデバイスをコンピュータにリンクするための有線クレイドル(wired cradle)を介して、基地局にデータをダウンロードすることができる。次いで、アップロードまたはダウンロードされたデータは、本発明のモデルベースモニタリングアプローチを使用して、利用可能にされるときに定期的に処理される。データがリモートコンピュータにアップロードされる場合、そのリモートコンピュータ(または、リーモーとコンピュータとネットワーク接続されたコンピュータ)は、データを処理するのに必要とされるモデルへのアクセスを有する。データがローカルのパーソナルコンピュータ、例えばホームコンピュータにダウンロードされる場合、モデルデータは、ローカルでの分析のためにそこに存在することができ、あるいは、例えばインターネット接続で、データの処理に必要なモデルを有するリモートコンピュータにデータをアップロードするように、そのコンピュータを構成することができる。処理の結果、例えば推定値、残差、検出された偏差/警報、健康/重症度指標、および自動診断を、ウェブサイトの形式でリモートコンピュータから利用可能にすることができ、あるいは所望の受信者に伝送することができる。任意の場合に、データを処理するために使用される(1つまたは複数の)モデルは、他のヒトからの標本観察値から構成される汎用モデルとすることができ、あるいはモニタリングされている人の以前の観察値から構成される個別モデルとすることができる。
【0104】
様々な態様において、前述の好ましい実施形態に対する修正がなされることがあることを当業者は理解されよう。他の変形態様も機能し、本発明の範囲および精神内にあることは明らかであろう。本発明は、特に特許請求の範囲に詳細に記載されている。当業者および本出願の教示に精通する者に明らかなように、本発明の精神および範囲は、好ましい実施形態に対するそのような修正および代替を包含すると考えられる。
【技術分野】
【0001】
本発明は、一般に、ヒトの健康のモニタリング(human health monitoring)の分野に関し、より詳細には、ヒトの健康の指標(human health indicator)に関する残差ベースの評価(residual-based assessment)を提供するために、生物学的パラメータ(biological parameter)の測定値を分析するための多変数モデル(multivariate model)の使用に関する。
【背景技術】
【0002】
ヒトの病状の検出および診断は、個人の健康を維持すること、および患者の回復を助けることにとって、非常に重要である。早期の積極的な検出が非常に望ましいが、このことは、誤警報(false alert)および誤診断についての医療提供のコストとバランスを取る必要がある。明らかになりつつある健康問題(health issue)の正確で実施可能な検出は、例えば、集中治療室(ICU)などのスピードが重視される状況においてであっても、慢性病の人々のホームモニタリング(home monitoring)やアスリートの運動能力のモニタリング(performance monitoring)などの長期的な健康のモニタリングにおいてであっても、非常に医療の注目の的となっている問題である。現在の人口統計学的傾向(demographic trend)は、人々がより長く生きるにつれて、対処すべき慢性的な健康問題の数が増加していることを示す。さらに、以前は高い死亡率を有していた一部の疾病(disease)は、扱いやすい長期的な慢性の病気になっている。その結果として、ますます多くの人々が継続的モニタリング(ongoing monitoring)を必要とし、医療提供システム(healthcare delivery system)に重く負担がかかっている。
【0003】
従来的な医療業務(medical practice)によると、救命救急診療の環境におけるヒトの健康のモニタリングは、典型的に、心電図(ECG)、パルス酸素濃度計、呼吸、および血圧などの様々なリアルタイムセンサ測定(real-time sensor measurements)、ならびに血液、尿、および他の体液についての臨床検査によって実施される。より長期的なモニタリングは、これらの変数、ならびに体重測定、薬物投与測定、および病気についての他の定性的評価(qualitative assessment)を含むことができる。これらの測定値は典型的に、単変数の手法(univariate manner)で、一般に(健康な)集団として知られる所定の正常範囲(normal range)と比較され、病気の兆候または発現中の悪い健康状態が、これらの測定値と標準の範囲(standard range)との対比から診断される。医療訓練を受けた職員による定性的観察と組み合わせて、これは、健康障害の状態および疾病を検出する目的のため、患者および健康な個人のモニタリングの際の医学の分野におけるベースラインの業務(baseline practice)を形成し、医療の提供に対するスタッフ集約的なアプローチ(staff-intensive approach)である。
【0004】
長い間、医療的ケアの目標は、センサおよびコンピュータ技術を使用して、自動化された信頼性ある患者のモニタリングを提供することであった。最近では、デジタル器具の利用性の改善、および医療関係者の専門知識(expertise)を具現化するコンピュータシステムに関する研究によって、バイタルサインおよび臨床検査の結果に基づいて患者のルールベースのモニタリング(rules-based monitoring)を提供するシステムが利用可能になっている。そのようなシステムを病院環境で使用して、例えばICU内の患者をモニタリングする、補助サポートシステム(auxiliary support system)を提供する。エキスパートルールの実行エンジン(expert rules execution engine)を、様々な信号に渡ってしきい値検出のトリガを組み合わせて診断をするように、または人間の医療スタッフの診療を必要とする病気を除外するようにプログラムすることができる。
【0005】
これらのシステムは、限られた成功しか収めていない。エキスパートルールは、人間の集団および患者が呈する様々な状態にわたって、効果的に汎用化できる方法で設計することは困難である。回復中の若い外傷患者にとって正確であり得ることが、高齢の心臓病患者に適用されると誤警報および検出誤りとなり得ることがある。
【0006】
従来技術の別のアプローチでは、ニューラルネットワークなどの、専門家のデータ融合能力とおそらくよく似ている人工知能手法は、より良い自動モニタリングおよび診断を提供するためにヒト患者モニタリング(human patient monitoring)からのデータに適用されている。ニューラルネットワークは、何らかの関連性およびパターンを学習するように標本(example)の集合から訓練される。例えば、疾病の状態(disease state)に関連付けられる患者データの集合と、健康な状態に関連付けられる患者データの別の集合とを使用して、疾病の状態を認識して診断するようにニューラルネットワークを訓練する。典型的に、患者データの集合を、訓練されたニューラルネットワークに入力し、健康か病気かの判定、または特定の病気の診断のいずれかのような分類を出力として得ることが知られている。また当技術分野で知られている代替的なアプローチは、患者データの集合をニューラルネットワークに入力し、スカラ速度値(scalar rating value)、例えば病気の程度または疾病の進行を出力として得るものである。しかし、ニューラルネットワーク出力を入力データおよびトレーニングデータに基づいて生成する手法は、ニューラルコンピューティングの非線形性質(nonlinear nature)のため、観察者にとって不明瞭である。さらに、このような「ブラックボックス」アプローチを、トレーニングデータをはるかにこえて汎用化する方法で設計することは困難である。結果として、これらのアプローチは、成功に広いばらつきがあり、最終的にその信頼性が損なわれる。
【0007】
全てのこれら従来技術のアプローチに関する主要な問題は、生物系(biological system)の動的性質(dynamic nature)である。ヒトは、血圧、血液の化学的性質、酸素化などのような、健康状態の重大な側面を調整するために、身体の条件および要求に応答する複雑な内部制御およびフィードバックシステムを有する生物系を表す。健康状態をモニタリングするために典型的に行われる測定は、活動状態(activity state)、年齢、体重、栄養、および疾病の状態に応じて広く変動しやすい。結果として、適切なトリガレベルを、モニタリングされる変数のしきい値に割り当てることは困難であり、したがってしきい値は、重要かつ即時の健康障害(health problem)しか示すことができないレベルで、人口学的基準で設定される傾向がある。例えば、脈拍数のモニタリング(pulse rate monitoring)を、非常に高いまたは非常に低い(もしくはゼロ)脈拍数のみがアラームをトリガするように設定することができる。変数およびしきい値を多変数のルール(multivariate rules)に組み合わせる、より進んだ従来技術の解決策においてであっても、低い誤警報率を維持しつつ、発現中の真の問題(genuine developing problem)についての実施可能なリードタイム通知(lead time notice)を提供するルールを設計することは非常に困難なままである。同様に、分類のためのニューラルネットワークは、生データ内の変動のため汎用化に関して複雑になっている。言うまでもなく、医学の分野における従来の統計的/人口学的なアプローチは、データの動的変動を許容できず、データを非常に厳しい条件(例えば、血圧の検査に適した標準化された条件)で取得するか、または変動を単純に無視し、それに伴い精度が失われる。
【発明の概要】
【発明が解決しようとする課題】
【0008】
医療上の健康のモニタリングにおけるコンピュータ自動アシスタンス(computer automated assistance)の提供という背景においては、初期の健康障害についての正確かつ実施可能な早期の検出および診断を提供するために、モニタリングされるヒトからのセンサデータおよび検査データを処理して分析するアプローチの改善が、大いに必要である。より具体的には、必要とされることは、ヒトの健康障害についてのより良いコンピュータ自動警戒(computer automated vigilance)を提供して、どの患者が、ヒトの医学的な専門知識(human medical expertise)の注目を必要とするか正確に優先順位を付けるために、既存のセンサ測定を利用するシステムである。改善された自動モニタリング(automated monitoring)は、限られたエキスパートの医療スタッフを活用し、医療提供全体の質および効率を改善するという大きな利点を提供することになる。
【課題を解決するための手段】
【0009】
本発明は、集中治療室または長期的な健康モニタリングなどにおいて、ヒトの健康状態についてのコンピュータ自動モニタリング(computer automated monitoring)に関する新規の方法および装置を提供する。したがって、本発明では、ヒトのバイタルサイン、および他の生物学的パラメータ、または身体の化学的性質(bodily chemistry)の測定値を表すセンサデータをモニタリングして、初期の健康障害についての早期の警告を提供し、どのパラメータが正常な動作(normal behavior)から逸脱しているかについての洞察を医師に提供し、医師の注目の優先順位を提供する。有利には、本発明は、より高感度および低い誤警報率で、健康障害を検出し、健康障害の診断を補助し、所与のレベルの医療スタッフが扱うことができる患者モニタリングの割り当てを増加させる。本発明はまた、より早くより正確な自動化された問題の検出および診断を提供することによって、長期かつリモートでのヒトの健康のモニタリングを非常に容易にする。
【0010】
しきい値またはルールを単一パラメータ(例えば、健康な血圧の範囲)に適用する従来の方法とは対照的に、本発明では、複数の生物学的パラメータを、正常な多変数変動(normal multivariate variation)のモデルを使用して、測定し、分析する。より具体的には、複数の生物学的パラメータについての一連の観察結果(observation)を、パラメータがとるべき推定値を出力するそれらのパラメータの正常な動作についての経験的モデル(empirical model)に入力する。推定値は、パラメータ毎に、実際の測定値と比較されて、差(difference)または残差(residual)を提供する。従来的に行われるように、しきい値、ルール、または統計値を生の測定値に適用するのではなく、健康障害は、モデルによって提供される残差を分析することによって明らかにされる。しきい値、ルール、および統計値を残差に適用して、初期の病状または健康障害が存在するかどうかを判定することができ、早期の検出および治療が可能になる。生データではなく残差データの分析を実施することによって、本発明は重要なことに、測定されたパラメータの正常な生物学的変動(normal biological variation)を調整し、したがって、より低い誤警報率で、真の偏差(genuine deviation)についてより高感度の検出を提供する。
【0011】
本発明の経験的モデルは、健康なヒトの生物学的パラメータの正常な変動を表すデータを使用して生成される。より具体的には、カーネルベースの手法(kernel-based technique)を使用して、健康なヒトからの多変数の標本(multivariate example)に基づいて正常な動的動作(dynamic behavior)のモデルを提供することができる。モデルは、生物学的パラメータの実際の測定値の入力に応答して、実際の測定値の状態に最も近い正常な状態を表す生物学的パラメータの値の推定値を生成する。実際の測定値と推定値との比較により、理想的にはほぼゼロであるべき残差が得られる。分散(variance)またはバイアス(bias)(ドリフト)において残差が通常よりも大きくなる場合、これは、その残差に対応するパラメータの初期の障害を示す。
【0012】
さらに、本発明によると、残差偏差(residual deviation)のパターンおよび傾向を、診断の目的で、特定の知られている発現中の健康障害と関連付けることができる。しきい値を残差に適用して、警報をトリガすることができる。ルールを使用して、根本にあるどの疾病メカニズム(disease mechanism)が働いているのかについての統合ピクチャ(integrated picture)に残差偏差の情報を組み合わせること、または何らかの推察される条件を除外することができる。統計値を残差の時系列に適用して、傾向を識別することができる。
【0013】
本発明の一実施形態によると、健康のモニタリングセンタ(health monitoring center)は、健康状態をモニタリングされている患者の器具から生物学的パラメータデータを受信する。センタは、病院の病棟に設置されることがあり、あるいは、オフサイトに設置されて、異なる場所に位置する複数の病院または診療所にネットワーク接続されることがある。各患者からのパラメータ測定値の集合は、訓練されて生物学的パラメータの正常な変動を学習する1つまたは複数の経験的モデルに入力される。各モデルは、実際の測定値と比較される推定値を生成し、所与の各患者について残差を生成する。残差は、そのセンタ配属の医療職員に対して検査に利用可能である。しかし、自動化されたテストおよび分析を、コンピュータシステム内で残差に実施し、残差は、医療スタッフに提示される警報および診断にマッピングされる。医療スタッフは、分析および警報の結果を利用して、患者の病状に関するマニュアル検査に優先順位を付け、警報および診断によって識別される全ての病状の治療に順序付けをする。医療スタッフは、警報を確認または却下することができ、あるいは、経験的モデルを、指定された或る実際の測定値をモデルに適応させ、組み込ませることができる。
【0014】
別の実施形態では、家庭生活環境においてモニタリングされるべき人に、生物学的パラメータの散発的な測定またはリアルタイム測定のいずれかを行うため、およびそのようなデータを遠隔計算センタ(remote computing center)に伝送するための器具が提供される。初めにデータを使用して、その人の個別モデル(代替方法では汎用モデルも企図される)を生成し、一定の時間の後、該モデルを使用して、その後に送信されたデータを分析することができる。モニタリングデータにより、残差、および対応する警報と診断が得られる。モニタリングデータおよび分析結果は、ウェブサイトでその人の医師に利用可能にされ、該医師はこれらを再検討して、検査に来るようにその人に指示することや治療策を変更するために、さらなる情報に関してその人と連絡を取ることができる。
【0015】
別の実施形態では、一般的に「ミッション(mission)」に関与し、かつその健康状態が該ミッションに関連する人に、生物学的パラメータを測定するためのセンサを装備し、本発明に従ってそのようなデータを分析するためのコンピューティングデバイス(computing device)を取り付ける。さらに、その人は、モデルベースおよび残差ベースの分析から得られる健康状態の指標(health status indication)をリモート位置に伝送するため、コンピューティングデバイスに結合された通信デバイスを有する。ミッション管理は、ミッション決定のために健康状態の情報を使用する。
【0016】
様々な生物学的パラメータは、本発明によるモデル化および分析に適用可能である。ECG、呼吸パラメータ、血液酸素化、およびパルス酸素測定データ、血圧などの、典型的な生物学的パラメータを使用することができる。さらに、これらの測定値から導出される特性、例えば心拍数の変動は、本発明におけるモデル化に対する入力を提供することもできる。
【0017】
本発明を特徴付けるものと考えられる新規の特徴は、特許請求の範囲に記載されている。しかし、本発明自体、ならびに本発明の好ましい形態の使用、さらなる目的、および利点は、実施形態に関する以下の詳細な説明を添付の図面とあわせて参照することによって最も良く理解される。
【図面の簡単な説明】
【0018】
【図1】本発明を実施するための一実施形態にかかる一般的な構成を示す図である。
【図2】本発明の一実施形態にかかるモデルのローカリゼーションのための流れ図である。
【図3】本発明に従って生成される信号、その推定値、および残差信号を有するチャートである。
【発明を実施するための形態】
【0019】
本発明は、一般に、複数の生物学的パラメータについてのモデルベースの分析によって、ヒトの健康状態の自動モニタリングと、健康の悪化または疾患を示す病気の検出とを提供する。したがって、正常な動的変動およびパラメータ間の相互関係をモデル化し、実際の測定値の集合の受信に応答してそれらのパラメータの推定値を生成するモデルが提供される。例として、モデルには、心拍数、心拍数の変動、呼吸速度、酸素測定、血圧、体温などを含めることができる。それらのパラメータの測定値がモデルに入力され、該モデルは、それらの同じパラメータに関する推定値を生成し、該推定値は、実際の測定値の統合ピクチャを前提として、それらのパラメータがとるべき値を表す。推定値は、各実際の測定値との差分を計算されて、各パラメータの残差を提供する。正常な状況下では、残差は、(生データが、時間とともに動的に変動している場合であっても)ほぼゼロであるべきである。健康障害が発現している場合、その影響を受ける1つまたは複数のパラメータの残差は、バイアスとなるか分散が増加する可能性が高い。コンピュータの論理的ルール(logic rule)(単純なしきい値から、複雑なエキスパートルールまで)を残差に適用して、健康障害を示す偏差に関する持続性/信頼性を判定することができる。そこから警報を生成することができ、該警報を、データが測定された人のモニタリングに関与する医療関係者に提供することができる。警報は、偏差についての単純な通知を含むことができ、あるいは、診療を必要とする病気の診断を含むことができる。また、論理的ルールを使用して、疾病の進行についての評価、すなわち、モニタリングされる人の病状に関する持続的な重症度の格付け(continuous severity rating)を生成することもできる。
【0020】
有利には、本発明の残差ベースの手法に基づいたこれらの警報、診断、および評価は、生データに対するしきい値、ルール、および従来技術の他の技法の適用より正確かつ高感度で信頼性がある。ヒトなどの生物系の正常な変動の範囲にわたって推定を行うことが可能なモデルを提供することによって、正常な変動を除去し、偏差(残差)を、計測または導出された特性のパラメータそれぞれの正常な変動の全範囲よりもかなり小さいレベルで識別することができ、そうでなければ、これは大きなスケールの正常な変動では失われてしまう。
【0021】
本発明によるヒトの健康をモニタリングするために使用される1つまたは複数のモデルは、既知の健康状態のモデルであり、より具体的には、ヒトの正常な健康状態のモデルである(しかし、完全には健康でないが、患者の容態を前提として安定であること、例えば術後の安定状態であることが知られている既知の容態をモデル化することが望ましいこともある)。本発明で使用するモデルは、特定の生物学的パラメータの入力に基づいて特定の生物学的パラメータの推定値を出力するように配置される。一実施形態では、推定されるパラメータは、入力パラメータに対応し、モデルは「自動連想的(autoassociative)」である。別の実施形態では、モデルは、モデルへの入力として提供されない1つまたは複数のパラメータに関する推定を行い、この場合、モデルは「推論的(inferential)」である。推論的モデルから推定されるパラメータは、やはりそれらのパラメータからなる実際の測定値と比較される。ただし、実際の測定値は、モデルへの入力には含まれない。
【0022】
本発明にとって適切なモデルは、経験的モデルであるが、これは、パラメータ間の正確な関係が、ヒト生物系内で第一原理モデル(first-principles model)の基礎とするほど十分には理解されていないことが多いからである。さらに、適切な経験的モデルは、数学的カーネル(mathematical kernel)を使用して入力観察値(input observation)とメモリに格納された標本観察値(exemplar observation)とに基づいて問題となっている生物学的パラメータの推定値を生成する、カーネルベースのモデルとすることができる。標本観察値は、カーネルベースの方法のための、健康または安定状態の人において見られる値の正常な組合せを具現化するライブラリを形成する。カーネル演算(kernel operation)自体が、これらの標本観察値を入力観察値に関係付けて、入力値を前提として正常である推定値を生成する。この方法では、経験的データ(すなわち標本観察値)を使用して、相互関係が明確に知られていないパラメータに関する正確な推定モデルを生成することができる。
【0023】
本発明を、1つまたは複数のコンピュータで実行されるコンピュータプログラムで具現化することができる。一実施形態では、スタンドアロンのコンピュータは、1人の人のモニタリング専用のプログラムを、例えばホームコンピュータで実行し、その人に取り付けられた器具および/または埋め込まれた器具から通信プロトコル(例えば、Bluetooth、WLAN)を介して、あるいはその人が定期的に利用する測定ステーションから、センサデータを受信するように配置される。スタンドアロンのコンピュータはさらに、本発明のモデルベース、残差ベースのアプローチでデータを処理して、データをその人にローカルで提示する、および/またはデータをリモートの報告ステーション、例えば医師への電子メールまたは医師が利用可能なウェブページなどにアップロードするように配置される。別の実施形態では、病院のICUの機器が、病棟内のデータステーションに接続され、データステーションは、複数の患者に関するデータを、本発明に従って該データを分析するためにプログラムを実行する1つまたは複数のコンピュータを有する処理センタに転送する。結果として得られる処理されたデータ、警報、および診断などが、医療スタッフによる観察のために、病院および/またはリモートのモニタリングセンタにあるディスプレイ画面に中継される。さらに別の実施形態では、身体に取り付けられた、または埋め込まれたセンサ器具を有する人は、携帯情報端末(PDA)など、小さなコンピューティングプラットフォームも携帯し、このコンピューティングプラットフォームは、データを受信し、本発明のモデルベース、残差ベースのアプローチでデータをローカルで処理して、ローカルで報告され得る結果、および/または医療スタッフによる閲覧のためにリモート位置に伝送され得る結果を生成する。
【0024】
図1に移ると、ブロック図は、生物学的パラメータセンサ、またはセンサデータから導出される「特性(feature)」データストリームを用いて人をモニタリングする、本発明の一実施形態を概略的に示している。生体信号源105は、複数の生物学的パラメータの読取値(readings)をモデルモジュール114に、および任意的に特性抽出モジュール(feature extraction module)110に提供する。特性抽出モジュール110は、例えば、入力源105からのECG信号のデータフィード(data feed)に基づく心拍数データを提供することができる。特性抽出モジュール110によって計算することができる他の特性を、本明細書において以下に述べる。
【0025】
モデル114は、モニタリングされることが望ましい特定の生物学的パラメータの推定値を生成する。自動連想的な実施形態では、生成された推定値は、入力源105からの入力(および/または、そこから特性抽出モジュール110によって生成される特性)に対応する。推論的な実施形態では、モデル114は、入力には存在しないがモデルによって事前に学習された何らかの方法で入力に関係付けられる生物学的パラメータに対応する、1つまたは複数の値を生成することができる。その後、モデル114からの推定値は、推定値と入力源105から提供される測定された実際の値との差から残差を生成する、比較モジュール120に対して利用可能となる。
【0026】
得られる残差は、残差に対する様々なテストのいずれかを実施して健康関連の診断、警報、重症度などを判定する、分析モジュール127に提供される。この分析モジュールは、1つまたは複数の残差値を使用してルールロジックを評価するために、ルールエンジンを実行することができる。ルールは、単純な単変数のしきい値基準(threshold measure)から、多変数および/または時系列の論理まで、様々な一般に使用されるルールのいずれかとすることができる。さらに、例えば単純なしきい値ルールを、ウィンドウの警報カウントルール(windowed alert counting rule)(例えば、y観察値におけるxしきい値警報)に入れるときのように、一部のルールの出力は、他のルールに対する入力とすることができる。さらに、統計的な手法を残差データに対して使用して、それ自身をルールに入力することができる他の基準および信号を導出することがある。適用可能な統計的分析は、これらには限られないが移動ウィンドウの統計値(moving window statistic)(平均、メジアン、標準偏差、最大、最小、歪度、尖度など)、統計的な仮説検定(statistical hypothesis test)、傾向および統計的なプロセス制御(CUSUM、Sチャートなど)を含め、当技術分野で知られている多種多様な手法から選択することができる。
【0027】
残差分析モジュール127は、出力として、論理ルールおよび統計的な検定(statistical test)の適用の結果を提供し、これには、警報、診断結果、および重症度の格付けが含まれる。これらの結果は、これらの結果を表示するための手段(例えば、コンピュータ画面、PDA画面、プリントアウト、またはウェブサーバ)、結果を格納するための手段(例えば、照会機能を有するデータベース、フラットファイル、XMLファイル)、ならびに、リモート位置または他のコンピュータプログラムに結果を通信するための手段(例えば、ソフトウェアインターフェース、XMLデータグラム、電子メールデータパケット、非同期メッセージ、同期メッセージ、FTPファイル、サービス、パイプコマンド(piped command)など)を含むことができる、出力モジュール130に提供される。
【0028】
医療スタッフが、残差分析モジュール127からの結果に注釈を付けて増補して、結果に優先順位を付けて、特定の警報または診断を却下または保留にすることをできるようにし、あるいは結果に対して取られる応答をシステムに登録することができるようにする、警報管理モジュール135も提供することができる。さらに、モデル114、残差ジェネレータ120、および残差分析モジュール127によって異常と分析されたが、医療スタッフは正常と見なす可能性があり、モデル114に組み込む必要がある、入力源105からのデータが存在する可能性がある。したがって、警報管理モジュール135は、データセグメントの識別(identification)を、そのデータをモデル114の学習に組み込むタスクを課される任意的な適応モジュール140に提供することもできる。さらに、適応モジュール140は、任意的に、データおよび/または残差分析結果に対する自己の自動化されたテストを実施し、モデル114を更新することができる。
【0029】
前述したように、本発明による正常またはベースラインダイナミクス(baseline dynamics)の多変数モデルは、参照データから作成される経験的モデルとすることができる。本発明で使用するためのモデルの好ましい形式は、一般的なカーネルベースの推定量の自動連想的または推論的形式である。自動連想的形式は、一般に、
【0030】
【数1】

【0031】
であり、ここで、生物学的パラメータの自動連想的な推定値ベクトルXestは、Ciとカーネル関数Kからの結果との線形結合から生成され、カーネル関数Kは、生物学的パラメータの測定値(または特性)の入力ベクトルXnewを、そのような測定値のL個の学習パターンまたは標本Xiと比較する。多変数の推定値ベクトルXestを提供するために、Ciはベクトルであり、カーネルベース推定量に変化の発生をもたらし、かつ入力Xnewおよび/または標本Xiの一部の関数である可能性のある複数の異なる方法に従ってCiを決定することができる。学習パターンは、モデルが訓練される「データの動作(data behavior)」についてのクラス、例えば正常または健康なヒト、あるいは術後の安定した容態によってもたらされる。本明細書で以下にさらに詳細に説明されるように、標本は、特に年齢、性別、体重、状態など、またはそれらの組合せに基づいて、特定のヒトのタイプに関する正常な状態を表すように選択されることがあり、その結果、例えば高齢の女性患者をモニタリングする目的では、モデルは、例として、その集団から得られる標本に基づく高齢の女性に関する正常な生物学的パラメータのモデルとすることができる。
【0032】
一般的なカーネルベースの推定量の推論的形式は、
【0033】
【数2】

【0034】
であり、ここで、生物学的パラメータ値のベクトルYは、他の生物学的パラメータの入力ベクトルXnewと、それらのパラメータのL個の学習標本(learned exemplar)Xiとのカーネルベースの比較から推定される。各学習標本Xiは、推定されるべきパラメータの別の標本ベクトルYiと関連付けられ、これらは、カーネルKおよびベクトルCi(少なくとも一部はYiの関数である)による重み付けのやり方で組み合わされて、出力Yを予測する。
【0035】
カーネルベースの推定量に共通することは、カーネル関数と、標本を具現化するカーネル結果およびベクトルCiに基づいた標本の線形結合からの結果の生成である。カーネル関数Kは、一般化された内積(inner product)であるが、好ましくは、XnewとXiが同一であるときにその絶対値が最大であるというさらなる特徴を有する。
【0036】
本発明の一実施形態によると、モデルを提供するのに使用することができるカーネルベースの推定量は、Nadaraya−Watsonカーネル回帰形式によって例示されるカーネル回帰(Kernel Regression)である。
【0037】
【数3】

【0038】
推論的形式では、推論される生物学的パラメータの多変数推定値Yestは、パラメータ測定値の入力ベクトルXnewとL個の学習標本Xiとに対するカーネルK演算子を、各Xiとそれぞれ関連付けられる各学習ベクトルYiに従って線形結合してカーネル結果の和によって正規化した結果から生成される。Yiは、Xにおけるパラメータの学習測定値(learned measurement)と関連付けられた(すなわち、同時に測定された)、Yにおけるパラメータに関する学習測定値のL個の集合を表す。例として、Xは、複数の動脈圧読取値を含むことができ、一方、Yは、対応する複数の末梢血圧読取値を表すことができる。
【0039】
カーネル回帰の自動連想的形式では、生物学的パラメータの多変数推定値Xestは、それらのパラメータの学習測定値Xiの正規化された線形結合に、学習観察値(learned observation)Xiと比較した入力ベクトルXnewに関するカーネル演算結果を乗算することによって生成される。
【0040】
本発明の目的のためのカーネル回帰では、上の式1および式2からのCiは、カーネル比較値の和によって正規化された学習標本から構成されることが分かる。推定値ベクトルYestまたはXestは、本発明に従って実際の測定された値(推論的ケースではモデルに入力されないXnewまたはYnew)と差分計算されて残差を提供する、推定されたパラメータの集合を含む。
【0041】
別の実施形態では、相似ベースのモデル(SBM:similarity-based model)を、本発明によるモデルとして使用することができる。Nadaraya−Watsonカーネル回帰は、(場合によっては雑音の多い)学習標本の集合を前提として、平滑化された推定値である推定値を提供するのに対して、SBMは、補間された推定値を提供し、該推定値は、学習標本が入力にもなるとき、すなわち入力ベクトルが学習標本の1つと同一である場合に学習標本に適合する。これは、カーネル回帰アプローチと比べて、これらの信号の雑音が幾分オーバーフィットし(雑音が、モデルが作成された標本に同様に存在した場合)、したがって残差から雑音をいくらか除去するので、生物学的パラメータの偏差を検出するのに有利となり得る。カーネル関数Kを、演算子
【0042】
【数4】

【0043】
と書き換え、学習標本Xiの集合を行列Dとして、行を構成するXiの要素および列を形成するXi観察値と同等に扱うことによって、SBMを、カーネルベース推定量の一形式として理解することができる。
【0044】
【数5】

【0045】
ここで、Dは転置されており、D内の各観察値Xiに対して1つのカーネル値の列ベクトルが得られる。同様に、全ての標本を互いに比較することを、
【0046】
【数6】

【0047】
と表すことができる。
SBMの自動連想的形式は、
【0048】
【数7】

【0049】
に従って推定値ベクトルを生成し、ここで、X(est)は、推定値ベクトルであり、X(in)は、入力観察値(上記にXnewとして示される)であり、Dは、生物学的パラメータの学習標本観察値の集合(または部分集合)を含む学習ベクトル行列(learned vector matrix)である。相似演算(similarity operation)またはカーネルは、記号
【0050】
【数8】

【0051】
によって表され、各オペランドからの任意の2つのベクトルの比較のための相似性スコア(similarity score)をレンダリングするという一般的な性質を有する。したがって、式6に示されるように、最初の項
【0052】
【数9】

【0053】
により、D内の観察値の数に等しいサイズの値の正方行列を得られることになる。式5に示されるように、項
【0054】
【数10】

【0055】
により、D内の各ベクトルに対して1つの相似値(similarity value)のベクトルが得られることになる。この相似演算子(similarity operator)を、以下でさらに詳細に論じる。
【0056】
推定値を、以下の式に従って推定値をデータの原点とは無関係にすることによってさらに改善することができ、ここで、推定値は、相似演算子から作られた「重み(weight)」の和で割ることによって正規化される。
【0057】
【数11】

【0058】
相似ベースモデリングの推論的形式では、推論されるパラメータベクトルYestは、
【0059】
【数12】

【0060】
に従って、学習観察値および入力から推定される。ここで、学習標本の行列Dを、
【0061】
【数13】

【0062】
として理解することができる。重みの和を使用する前述の正規化は、
【0063】
【数14】

【0064】
である。
【0065】
本発明に従って使用することができる上記と類似のさらなる別のカーネルベースモデリング手法は、放射基底関数(radial basis function)の手法である。ニューラル構造(neurological structure)に基づいて、放射基底関数は、ニューラルネットワークの特殊な形式で受容フィールド(receptive field)を利用し、ここで、各基底関数は、入力ベクトルのn次元空間内に受容フィールドを形成し、ニューラルネットワーク内の隠れ層ノード(hidden layer node)によって表される。受容フィールドは、上述のカーネルの形式を有し、受容フィールドの「中心」は、特定の隠れユニット(hidden unit)が表す標本である。存在する標本と同数の隠れユニット受容フィールドが存在する。多変数の入力観察値(multivariate input observation)が、隠れ層と完全に接続された入力層に入る。したがって、各隠れユニットは、完全な多変数の入力観察値を受け取り、入力が受容フィールドの「中心」にマッチするときに最大となる結果を作成し、(上述のSBMと同様に)それらがますます相違するにつれて減少する。受容フィールドノードの隠れ層(hidden layer)の出力は、(式1において上述した)重みciに従って組み合わされる。
【0066】
本発明によるモデル化の上述の方法は全て、前述のカーネルベースのアプローチを利用して、標本のライブラリを利用する。標本(参照観察値または参照ベクトルとも呼ばれる)は、モデル化された生物学的パラメータによって見られるように、モデル化されたシステムの「正常」な動作を表す。任意的に、利用可能な参照データをダウンセレクトして、標本のライブラリとして働くように特徴的な部分集合を提供することができ、この場合、カーネルベースモデルを「訓練」するためのいくつかの手法を採用することができる。好ましい訓練方法によると、少なくとも、全ての利用可能な参照観察値にわたる所与の生物学的パラメータの最高値または最低値を有する観察値がライブラリに含まれる。これを、追加の観察値のランダムな選択、またはデータの散乱(scatter)またはクラスタリング(clustering)を忠実に表すように選ばれた選択で補うことができる。代替的に、参照データがクラスタ化されることがあり、クラスタの代表的な「重心(centroids)」が、新たな人工的に生成された標本として形成され、次いでライブラリを形成する。標本のライブラリを含む観察値を選択するための多種多様な技法が、当技術分野で知られている。
【0067】
上述のように、カーネルを、あり得る様々なカーネルから選択することができ、好ましくは、そのカーネルによって返される全ての値の最大絶対値を有する2つの同一のベクトルを比較するための値(または相似性スコア)を返すように選択する。いくつかの例を本明細書で提供するが、それらは本発明の範囲の限定を意味するものではない。下記は、任意の2つのベクトルXaとXbの比較のために、本発明に従って使用され得るカーネル/相似演算子の例である。
【0068】
【数15】

【0069】
式12〜14では、2つのベクトルのベクトル差または「ノルム(norm)」が使用される。一般に、これは2ノルムであるが、1ノルムまたはpノルムとすることができる。パラメータhは、一般に、しばしばカーネルの「帯域幅(bandwidth)」と呼ばれる定数であり、各標本が有意な結果を返す「フィールド」のサイズに影響を与える。指数λも使用されることがあるが、1に設定することができる。各標本Xiに対して異なるhおよびλを用いることができる。好ましくは、ベクトル差またはノルムを用いるカーネルを使用するとき、例えばセンサデータの集合の最小読取値の値を、全てのセンサ値に加算または全てのセンサ値から減算して、全ての結果をそのセンサの範囲で割ることによって、測定されたデータを最初に0から1の範囲(または他の選択された範囲)に正規化すべきである。代替的に、データは、標準偏差が1(または他の定数)に設定されたゼロ中心の平均データ(zero-centered mean data)に変換することによって正規化することもできる。さらに、本発明によるカーネル/相似演算子を、観察値の要素に関して定義することもでき、すなわち、相似性をベクトルの各次元で判定し、それらの個々の要素の相似性が、全体のベクトル相似性を提供するために何らかの様式で組み合わされる。典型的に、これは、任意の2つのベクトルxとyのカーネル比較に関する要素の相似性を平均化する程度の単純なものとすることができる。
【0070】
【数16】

【0071】
このとき、本発明に従って使用され得る要素の相似演算子には、
【0072】
【数17】

【0073】
が含まれるが、これらには限定されない。帯域幅hは、上記に示されるものなど、要素カーネル(elemental kernels)の場合、観察値ベクトルの第mパラメータの予測範囲についてのある種の基準となるように選択されることがある。これは、例えば、全ての標本にわたるパラメータの最大値と最小値との差を見つけることによって決定することができる。代替的に、これは、例えば、妥当な生理学的予測に基づいて心拍数パラメータの予測範囲を毎秒40から180回に設定することによって、標本または参照ベクトルに存在するデータに関係なく専門知識を使用して設定することができ、したがってhは、心拍数であるモデル内の第mパラメータに関して「140」である。さらに、差分関数を使用するベクトルと要素カーネルとの両方に関して、差を帯域幅で割った値が1よりも大きい場合、その値を1に設定することができ、例えば式13、14、17、および18のカーネル値が0となることに留意されたい。また、カーネルまたは相似演算子は、1、h、λなどの代わりに、様々な定数の加算または乗算によって修正することができることが容易に分かる。三角関数が使用されることもあり、例えば、
【0074】
【数18】

【0075】
である。最も好ましくは、相似演算またはカーネルは、一般に、2つの同一次元ベクトルの比較に関する相似性スコアを提供し、この相似性スコアは、
1.各端部で境界を画されたスカラ範囲内にあり、
2.2つのベクトルが同一である場合には、境界を画された端部の一方の端部の値を有し、
3.スカラ範囲にわたって単調に変化し、
4.2つのベクトルアプローチが同一であるときに増加する絶対値を有する。
【0076】
本発明の重要な代替的な実施形態では、経験的カーネルベースモデルの推論的形式および自動連想的形式を、入力される観察値の質に基づいて「オンザフライ(on-the-fly)」で生成することができ、学習観察値の大きな集合、すなわち参照集合から得られる。このプロセスは、ローカリゼーションと呼ばれる。したがって、本発明の好ましい形式は、カーネルベースモデリングの推論的および自動連想的形式に関する上述の計算を、入力観察値に基づいて、参照観察値のより大きな集合から選択される学習観察値xiの集合またはDを使用して行うことができるものである。カーネルベースモデルは、1回のパスで訓練され、迅速に更新され得るため、この種のローカリゼーションに非常に良く適している。有利には、候補標本の大きな集合を利用し、しかし推定値を生成する目的でそれぞれの新たな入力観察値で部分集合を選択することによって、モデリング計算の速度を短縮することができ、モデルのロバスト性を改善することができ、一方、モデル化されているシステムのダイナミクスを依然として良く特徴付けている。
【0077】
様々な基準を使用して、相似演算子自体の適用を含め、ローカル化されたD行列のメンバーシップを構成することができる。しかし、一般に、プロセスを、図2を参照することで理解することができる。モニタリングプロセスの一部としてのモデルによって推定されるべきである生物学的パラメータまたは導出された特性の集合を含んでいる、入力観察値205は、ローカリゼーションモジュール209に提供され、ローカリゼーションモジュール209は、標本観察値の部分集合を選択してモデルを構築するために、参照ライブラリ212の形式のこれらの標本観察値の大きなストアにアクセスする。ローカリゼーションモジュール209は、入力観察値205に関連するライブラリ212から標本を選択し、これは、ライブラリのサイズよりもはるかに小さい集合とすることができる。例として、参照ライブラリ212は、モデル化されているパラメータによって表される生物系の正常なダイナミクスを特徴付ける100,000個の標本観察値を備えることがあるが、ローカリゼーションモジュール209は、入力観察値205の受信に応答して、数ダースの観察値のみを選択して、ローカルライズされたモデルを構築することがある。次いで、選択された標本観察値は、ローカルライズされたモデル224に提供され、これらの観察値は、(上記でSBMに関連してDとしても示される)カーネルベース推定量のための学習標本Xiの集合を備える。次いで、推定観察値230が、それに応じて上述のように生成される。次の入力観察値205が本発明のモニタリングシステムに提示されるとき、プロセスが繰り返され、新たな入力観察値に基づいて、ライブラリ212から標本の新たな選択、場合によっては異なる部分集合の選択が行われる。
【0078】
本発明の一実施形態によると、入力観察値205を、クラスタリング技法に基づいて、学習観察値の参照ライブラリ212と比較することができる。それに応じて、ライブラリ212内の標本観察値は、ベクトルをクラスタ化するための当技術分野で知られている複数の技法のいずれかを使用してクラスタ化され、ローカリゼーションモジュール209は、入力観察値205がどのクラスタに最も近いかを識別し、そのクラスタのメンバー標本を、ローカルライズされたモデル224に提供されるローカライズされた観察値となるように選択する。適切なクラスタリング方法は、k平均およびファジーc平均クラスタリング、または自己組織化マップのニューラルネットワーク(self-organizing map neural network)を含む。
【0079】
本発明の別の実施形態によると、カーネルを使用して、入力観察値205をライブラリ212内の各標本と比較して、入力観察値と比べた参照観察値のランキングを提供する相似値を得ることができる。次いで、それらの特定の上位部分(top fraction)をローカライズされたD行列に含むことができる。このローカリゼーションの態様のさらなる改良として、全ての参照観察値のランク付けリスト内の観察値は、ライブラリ212内の他の観察値が入力に対してより高い相似性を有する場合であっても、それら観察値の構成要素(component element)の1つが、入力ベクトル内の対応する値を「ブラケット(bracket)」する値を提供する程度まで、ローカライズされたDに含まれる。ランク付けリストのこのサーチダウンは、入力ベクトルの全ての値が、ローカルライズされたDに含まれる参照観察値の1つの値によって、低い側と高い側の両方でブラケットされるまで、または、D内に含むためのベクトルがユーザ選択可能な最大限度に達するまで、または含まれる相似性しきい値を超えるほど、入力に十分に高い相似性を有するさらなる参照観察値が存在しなくなるまで行われる。
【0080】
ローカルライズされたDのメンバーシップを決定する際の他の修正形態は、本発明の範囲内である。例として、上述のクラスタリング選択方法および相似性選択方法の両方では、クラスタ化されるベクトルまたは相似性についてカーネルで比較されるベクトルを備えるのに使用される要素の集合、すなわちパラメータの集合は、モデルおよび推定値を生成するのに使用されるものと同一ではない可能性があるが、代わりに、パラメータの部分集合、または部分的に重なる集合である可能性がある。例えば、心拍数、呼吸量、血圧、体温など、半ダース以上の生物学的パラメータおよび特性の集合で、本発明に従って患者をモニタリングする際、ローカリゼーションを、心拍数および呼吸パラメータのみを利用して行うことができる。
【0081】
図3に移ると、任意のチャート化された、モデル化されている任意の生物学的パラメータを表し得る生信号305と、その推定値310と、チャートの下半分にプロットされた対応する残差315とを参照することで、本発明のアプローチをより良く理解することができる。信号305は、(自動連想的に、または推論的に)モデル化されている複数のパラメータの1つであるが、他の信号は図中に示されていない。生信号は変動を示し、環境、活動、代謝、日周タイミング(diurnal timing)などにより生物学的パラメータが変動することがある生物系の典型である範囲320を有することが分かる。従来のアプローチでは、区間(limits)324は、信号305が、正常または健康とみなされる許容範囲の外に出るときを検出するために提供される。したがって、信号305が区間324の外に出るとき、少し後まで問題が検出されないままの可能性がある。しかし、パラメータ305のモデル生成された推定値310を提供し、それらを差分計算して残差315を生成することによって、別の残差の区間336を使用して、信号305がその正常範囲320にわたって変動するときであっても、信号305が、予測されるものから逸脱しているときを検出することができる。したがって、異常な値の検出を、信号305が依然として十分にその正常範囲320内にあるときであっても、かなり早期の時間340に実現することができる。
【0082】
有利には、本発明によって提供される残差を分析することによって、生データに対する同じ分析の適用に比べて、より良い診断および警報発生が可能である。次に説明の目的で議論される多種多様な統計的、論理的、および数学的手法を使用して、本発明に従ってモニタリングされる各生物学的パラメータに関して残差を分析することができる。
【0083】
使用され得る第1の手法は、パラメータに関する残差にしきい値を適用するものである。従来の医学では、しきい値は典型的に、生データに適用されるが、残差しきい値(residual threshold)は、推定値と実際のデータとの差分計算によって正常な変動が除去されているので、より高い誤警報率をもたらすことなくはるかに厳しい制限が可能である。残差しきい値は、上限、下限、またはその両方とすることができ、警報は、残差がしきい値を超えるときに登録される。しきい値は、専門知識から決定することができ、または特定のパラメータに関する残差データの雑音分布(noise distribution)の関数として設定することができる。例えば、特定の測定デバイスが、非常に雑音の多い生データを提供することがあり、その結果、残差は、対応して高い雑音レベルを有する。この雑音レベルは、残差信号の分布を特徴付けるのに十分な数の観察値に関して観察されることがあり、その際、しきい値は、この明らかになった分布の関数(5×標準偏差など)として設定され、それにより測定デバイスの雑音レベルに対処する。モニタリングされる各患者の各生物学的パラメータは、それ独自の設定されたしきい値レベルを有することがある。
【0084】
しきい値は、ルールシステムまたはエキスパートシステムにおける、ごく単純な形式のルールである。そのようなシステムは、本発明による残差の分析の柔軟性および能力(power)を拡張することができる。例えば、単純なしきい値は、残差が観察値の移動ウィンドウ内で十分な回数だけしきい値を超えたときに、偏差検出アラームをトリガするためのルールにまで拡張されることがある(「y観察値におけるx警報」ルール)。アラームまたは通知を、2つ以上のパラメータにわたる残差に対する条件の組合せに関して構成することもできる。例えば、1つの残差信号がその上限を超え、別の残差信号がその下限を超えるときに、健康容態の可能性の通知を、本発明のモニタリングシステムによって生成することができる。多変数ルールは、残差の観察値の時系列を利用することもできる。ルール自体が、他のルールをトリガするように、または他のルールの結果を拒否するように、互いに連鎖されることがある。生データを取り扱うための多種多様なエキスパートルールシステムが当技術分野で知られており、これらのルール構造を、残差に関するルールに変換することによって本発明に容易に適応させることができる。例えば、以前の生データルール構造は、特定のパラメータが、集団の「平均」値を超えて2より大きい標準偏差であるときに、あり得る健康への脅威を示すことがあるが(従来の分布アプローチ)、新規のルールは、残差が、その残差信号に関してゼロから2より大きい標準偏差(または、何らかの他のしきい値)離れているときに、同じ通知を提供することがある(標準偏差は、その患者から導出された信号から決定されることがあり、あるいは臨床用途でモデルを準備する際にそのパラメータおよびそのモデルを用いて人々をモニタリングした実験から導出されることがある)。パラメータに関する一連の残差値が信号を生成し、その信号は、上述されるように、傾向および仮説検定のための様々な統計的技法を用いて処理することができる。Waldの逐次確率比検定などの統計的仮説検定を使用することができる。
【0085】
様々なパターン認識技法をさらに使用して、残差のパターンを、患者の容態に関する警報、診断結果、または重症度格付けに関連付けることができる。そのような技法の1つは、複数のモニタリングされたパラメータに関する残差の集合を、入力を診断条件と関連付けるように訓練されたニューラルネットワークに提供するものである。
【0086】
本発明のモニタリング目的のためにモデル化され得る生物学的パラメータの選択について、本発明の検出の感度および正確さについての利点は、特に、パラメータを別々にテストする従来の医療業務とは対照的に、生物学的パラメータに対して取られる多変数アプローチによるものである。したがって、本発明のカーネルベース推定量を使用すると、生物学的パラメータの観察値は、各観察値が通常、複数のパラメータそれぞれに対するデータ値(直接センサ読取値であっても、センサデータの何らかの導出された特性であっても)を含むものであるから多変数であり、ほぼ同時の瞬間または周期(period)であることに起因する。例えば、観察値は、ある瞬間の複数のパラメータデータ値のスナップショットを含むことができる。重要なことに、本発明のカーネルベース方法は、スナップショットを定期的に獲得することを必要とせず、スナップショットを不定期な間隔で獲得することができる。
【0087】
したがって、生物学的パラメータに関するデータ値は、直接センサ測定値、例えば時間tの体温とすることができ、または時間tに起因する瞬間心拍数またはウィンドウ平均(window-averaged)の心拍数などの導出される特性とすることができる。観察値を定期的にサンプリングする必要はないので、様々な定期的にサンプルされる信号(ECG、呼吸、酸素測定、圧力、体温など)を、識別される半定期的または不定期的トリガに合わせることが可能である。一実施形態では、観察値が、ECG信号のQRSピークに適合されて生成され、全ての他のサンプリングされる信号は、その時点で、またはRR間隔(あるQRSピークから次のQRSピークまで)にわたって測定される。心拍数は、生来いくらか不規則であることが知られており、したがって、パラメータに関するデータ値を、ECG信号のQRSピーク(または任意の他の識別可能なポイント)に応じて生成することができる。別の実施形態では、観察値は、毎分1回など定期的な間隔で生成され、1分での生の値、1分にわたる信号の統計量、あるいは毎分の測定による累積または平均の移動ウィンドウの値(moving window value)を含むことがある。したがって、モデル化可能な生物学的パラメータは、(a)生の瞬間信号値、(b)何らかの他の信号イベント(QRSピークなど)によって定義されるウィンドウ内の信号からの統計値、(c)1組のそのようなウィンドウにわたる信号からの累積/平均統計値、(d)直前のウィンドウから現在のウィンドウまでの上述した値の1つについての変化の割合、および(e)定期的な時間ウィンドウ(time window)にわたる(例えば、毎分1回)信号からの累積/平均尺度から選択されることがある。
【0088】
例示の目的で、ECG信号のQRSピークのようなキーイングイベント(keying event)を使用して、ヒトの健康をモニタリングするカーネルベースモデルの使用において導出されることがある特性は、以下のものを含む。
瞬間心拍数(Instantaneous Heart Rate)−直前のQRSピークからの時間、または次のQRSピークまでの時間。
「最高」血圧(Blood Pressure “Systolic”)−ECGの現在のQRSピークから次の(または直前の)QRSピークまでのウィンドウ(window)における、連続血圧測定デバイス(カテーテル挿入型または非観血式(non-invasive))からの最高血圧の読取値。
「最低」血圧(Blood Pressure “Diastolic”)−ECGの現在のQRSピークから次の(または直前の)QRSピークまでのウィンドウにおける、連続血圧測定デバイス(カテーテル挿入型または非観血式(non-invasive))からの最低血圧の読取値。
「最高」血圧のラグ(“Systolic” BP Lag)−連続BP(血圧)測定センサからの血圧信号のQRSピークと次の「収縮(systolic)」(すなわち最高(highest))ピークとの間の時間。
「最低」血圧のラグ(“Diastolic” BP Lag)−連続BP(血圧)測定センサからの血圧信号のQRSピークと次の「拡張(diastolic)」(すなわち最低(lowest))ピークとの間の時間。
酸素飽和度ピーク(Oxygen Saturation Peak)(Ebb)−現在のQRSピークと次のQRSピークとの間の酸素飽和度(SpO2)の最高(最低)測定値。
温度(Temperature)−あるQRSピークから次のQRSピークまでのウィンドウにわたる温度センサの平均値、最大値、最小値、またはメジアン値。
【0089】
さらに、以下のパラメータは、呼吸サイクルを、データ収集のためのキーイングイベントとして使用する場合に、使用され得るパラメータの例である。
瞬間呼吸速度(Instantaneous Respiration Rate)−ある完全な呼吸から次の呼吸までの時間。
心拍数(Heart beat count)−ある完全な呼吸中の心拍の数。
酸素化ラグ(Oxygenation lag)−呼吸サイクルのあるポイント、例えば吸入の終了と、例えば酸素濃度計からの血液酸素化信号のピークとの間のタイムラグ。
【0090】
当然、上記のパラメータまたはそれらの生体源信号のメジアン値、平均値、高低差(範囲)などを決定することなど、上記の他の統計的基準を代用することもできる。
【0091】
さらに、例示のために、QRSピークのようなイベントによって定義される1組のウィンドウで導出され得る特性には、以下が含まれる。
ウィンドウでの呼吸速度(Windowed Respiration Rate)−QRSピーク間隔(RR間隔としても知られる)によって定義される直前のm個のウィンドウにわたって測定される呼吸速度。値は、現在のQRSピークイベントに適合させた観察値に起因する。呼吸速度は、瞬間(現在の呼吸の周期)のもの、または平均化したものとすることができる。呼吸速度がm個のウィンドウ全体のスパンより長い場合、その呼吸サイクルの完全な呼吸速度の推定値を、部分的なサイクルから外挿(extrapolation)によって生成することができる。
ウィンドウでの呼吸の深さ(Windowed Respiration Depth)−QRSピーク間隔によって定義される直前のm個のウィンドウにわたって測定される呼気の最大量。値は、現在のQRSピークイベントに適合させた観察値に起因する。
心拍数変動(SDNNタイプ)−QRSピーク間隔によって定義される直前のm個のウィンドウにわたる瞬間心拍数の分散または標準偏差。m個のウィンドウの1つずつが瞬間心拍数を有し、分散または標準偏差は、m個全ての値にわたって計算される。
心拍数変動(RMSSDタイプ)−直前のm個のウィンドウにわたる瞬間心拍数(または、心拍周期)の連続する差の二乗の和の平方根。
【0092】
例として使用され得る他のパラメータを、人工呼吸器など患者に接続される他のデバイスから導出することができる。典型的な換気パラメータ(ventilation parameter)を、本発明による患者モニタリングのためのカーネルベースモデルで使用することができる。これらには、以下のものが含まれる。
1回換気量(または分時換気量)−(瞬間、またはウィンドウ、例えば1分間の平均/累積の)吐き出される空気または吸入される空気の量の基準。
CO2−吐き出される二酸化炭素の量、分圧、または濃度の測定値。
ピーク吸気圧力(Peak Inspiratory Pressure)−吸気サイクル中に人工呼吸器によって適用される最大圧力。
呼気終末陽圧(Positive End Expiratory Pressure)−呼気の終了時のベースライン陽圧。このパラメータは、ローカライズ変数として特に有用である可能性がある。
FIO2−吸入された空気中の酸素濃度、典型的にはパーセンテージ。この変数も、ローカライズ変数として特に有用である可能性がある。
PIF、PEF−空気のピーク吸気流/呼気流。
気道抵抗−陽圧換気に対する肺の抵抗の基準。
【0093】
家庭でのテルヘルス(home telehealth)モニタリング環境において、被験者に、ますます多様なセンサを取り付けることがあり、あるいは、本発明のモデリングで使用することができる定期的な測定を行うように指示することがある。定期的な測定には、以下のものが含まれる。
体重−被験者/患者のスケール測定された体重。
血中グルコースレベル−血液の小滴をサンプリングし、血液のグルコースレベルを測定する器具、または光学測定値から血中のグルコースレベルの判定を行う器具。
活動(Activity)−加速度計(accelerometer)を使用して、患者の運動の量を測定することがある。場合によっては、加速度計を取り付けて、特定の方向(例えば、上下対横)の運動を提供することができる。
周囲温度の差-外気と皮膚または周辺との間の温度の差の基準。
汗−被験者が発汗している度合いの基準。
【0094】
パラメータの上記のリストは、本発明のカーネルベースモデルリングのアプローチで使用可能な、ヒト被験者から得ることができる変数のタイプの例示にすぎないものと意図される。このリストは、限定を意図するものではない。観察値を形成するために本発明において使用される生物学的パラメータは、温度、圧力、活動範囲(例えば、呼吸の量)、速度(呼吸速度、心拍数)、伝導性、電気的活動(例えば、EEG)、化学的測定値、流速(flow rate)、および任意の他の公知のもしくは将来開発されるヒト生物系のメトリクスを含むことができる。好ましくは、モニタリングの目的でモデルに組み合わされるパラメータは、(a)因果関係または併用効果として、(知られているものでも、推察されるものでも)何らかの方法で関係付けられると考えられ、(b)一般に、ほぼ等しい時間内で、身体の変化または身体のフィードバック制御のループに応答し、そして(c)それらの1つまたは複数で偏差が見つかった場合に根本的な原因を示すのに有用である。好ましくは、ヒトの健康をモニタリングするための本発明によるモデルは、心拍数、血液酸素化値、呼吸メトリクス、血圧メトリクス、および温度メトリクスの1つまたは複数を含む。本発明の好ましい実施形態では、ヒトの健康をモニタリングする際に使用するモデルは、3つまたはそれ以上のパラメータ、より好ましくは5つまたはそれ以上のパラメータ(生の信号、または信号から導出された特性)を備える。有利には、本発明のカーネルベースモデリングのアプローチは、多数の変数、すなわち20〜30より多い関連パラメータを用いても効果的である。
【0095】
特定の種類の生体信号に対する何らかの活動の破壊的性質(disruptive nature)が原因で、咳や会話が呼吸信号にどのように影響を及ぼすかなど、本発明の別の態様は、入力観察値のフィルタリングを提供することになる。一般に、ICUにおける患者の回復などの背景においては、観察値は、好ましくは、会話、咳、移動中ではなく、データがよく動作する状態に患者があるとき、特に患者が睡眠または休憩しているときにのみモニタリングされる。データフィルタリングモジュールを提供することができ、このモジュールは、睡眠または休憩状態を自動的に認識し、他のデータをフィルタ除去し、睡眠/休憩状態からのデータのみをモニタリングのために残す。複数の技法を使用して、データが睡眠/休憩状態の患者から来ているかどうかを自動的に判定することができる。使用され得る1つの方法は、入力観察値または入力観察値のシーケンスを処理して、推論的モデルを通じてその分類を決定するものである。そのようなモデルは、例えば、各値がそれぞれ「クラス内でない(not in class)」と「クラス内である(in class)」に対応する2つの値(例えば、0と1)の間に及ぶ単一の出力変数を提供する、本発明による推論的なカーネルベースのモデルとすることができる。モデルを、正常な睡眠/休憩の例から訓練することができる。同様に、入力データがどのクラスの特徴であるのかを判定し、その分類を出力するための多様なクラスタリング技法が、当技術分野で知られている。例として、K平均クラスタリングは、よく知られた技法であり、入力として観察値の集合を受け入れて、該観察値を、ユーザ決定された数のクラスタにクラスタ化することができ、その後、新たな観察値を、適切なクラスタまたはクラスに関連付けることができる。次いで、睡眠/休憩クラスタに関連付けられた観察値がモニタリングされ、一方、このクラスタに適合しなかった観察値はフィルタ除去される。最後に、エキスパートルールを使用して、入力観察値を処理し、睡眠/休憩状態にあるか否かを判定することが知られている。そのようなルールは、心拍数および呼吸速度を判定することを含むことができ、これらが特定の範囲内にあると判定し、呼吸の速度が予想ブレスとを変更またはスキップしなかったと判定すると、状態は睡眠/休憩状態である。
【0096】
データ中の破壊的イベント(disruptive event)に対処するための別の方法は、破壊的イベントを複数の方法でフィルタリングするものである。典型的な破壊的イベントは、(スキップされた、または過剰な)異常心拍、または呼吸の正常なプロファイルを妨害する咳/会話を含むことができる。破壊的イベントは、データ中の興味深いパターンであり、医学的に関心の対象となり得るが、これらのパラメータを互いにモデル化して関係付ける目的では、これらをフィルタ除去することが有用である。したがって、スキップされた、または過剰な拍を識別して、そのデータポイントをなくすことによって、心拍数を平滑化することができる。これを行うための1つの方法は、R−R間隔で瞬間心拍数を計算して、得られる心拍数信号に、3〜5個のデータポイントのウィンドウでメジアンフィルタなどのフィルタを適用することである。その結果、過剰な拍で高く跳ね上がることがある、またはスキップされた拍の際に低く降下することがある異常な瞬間心拍数が、異常値でない可能性が高い、ウィンドウ内のメジアン値で置き換えられる。不適合な呼吸サイクルをなくすための1つの方法は、不適合な領域のいずれかの側で正常な呼吸を識別し、データを完全に削除するものである。不適合な呼吸サイクルを、プロトタイプの呼吸パターン(例えば、谷で始まり、ピークまで増加し、谷に降下して戻る)に十分にはマッチしないサイクルとして識別することができる。信号においてプロトタイプパターンを瞬間的なウィンドウにマッチングさせるための複数のパターンのマッチング技法が当技術分野で知られており、これらの技法をこの目的で使用することができる。
【0097】
1つまたはそれ以上のモデルを使用して人の健康をモニタリングすることができ、パラメータを、複数のモデルで共有することができる。したがって、本発明の一実施形態は、全ての他の利用可能なパラメータの集合からのバイタルサインまたは他のパラメータそれぞれについて推論的モデルを形成する。したがって、使用されるモデルの総数は、モニタリングされるパラメータの数に等しい。さらに、人のモニタリングを、様々な割合でサンプリングされるデータを使用して様々なモデルで行うことができる。例えば、あるモデルは、RR間隔など何らかのトリガによって形成される観察値を有するデータを使用することがあり、一方、別のモデルは、毎分1回形成される観察値を使用することがある。別の例として、第1のモデルは、心臓血管機能をモニタリングするのに必要な生物学的パラメータを含むことがあり、第2のモデルは、免疫動作をモニタリングするのに必要な生物学的パラメータを含むことがある。さらに別の例として、同じパラメータの複数のモデルを使用するが、異なる活動状態またはクラスで訓練することがある。このとき、入力観察値が、それが表す活動のタイプ(上記のような睡眠/休憩、または運動、またはウォーキングなど)に従って分類されると、そのクラスの活動を学習した本発明によるモデルを使用して、その観察値または観察値のウィンドウをモニタリングする。
【0098】
本発明の特定の実施形態は、平均心拍数、平均呼吸速度、平均最高血圧、平均最低血圧、平均の呼吸の深さ/量、および平均血液酸素化のパーセンテージ(酸素測定)のパラメータを含む10秒から1分の間の間隔の観察値を有する、自動連想的モデルを備える。心拍数および呼吸パラメータは、生信号とすることがあり、または平滑化されることがあり、平滑化は、異常な(過剰な、または不足の)拍動または異常な呼吸(咳など)の除去を意味する。また、間隔にわたる上記の値の平均の代わりに、メジアン、最大、または最小など何らかの他の統計値を使用することができる。
【0099】
また、本発明は、化学的、免疫学的、微生物学的、組織学的、血液学的、および同様のテスト結果、より具体的には、血液成分測定値、尿成分測定値など(一般に「検査結果(lab results)」または「検査(labs)」と呼ばれる)を使用してヒトの健康のモニタリングを提供する。そのような測定値を、本発明において非常に有利に使用することができる。これは、(a)測定値は典型的に多変数であり、(b)多変数の結果は、おおよそ単一の時間での体液構成(fluid makeup)を表し、そして(c)検査は典型的には不定期に要求されるが、本発明はそれでもなお、そのような非定期的なやり方でサンプリングされたデータを使用することができるためである。検査データの従来の使用に勝る本発明のさらなる利点は、変化を判別する能力がより高いことである。従来、例えば、血液中の成分の各測定値は、別々に調べられて、健康な集団に関する「正常」な範囲と比較される。対照的に、本発明によれば、互いと比較した各成分の正常なダイナミクスがモデル化されて考慮され、その結果、偏差が十分に従来のアプローチの下の「正常」な範囲内にあるとしても、成分の値の小さな偏差でさえも検出することができる。
【0100】
臨床検査の結果データを用いてモデル化される生物学的パラメータは、血糖(グルコース)、酸素、二酸化炭素、重炭酸塩などの血中ガス、pHなど酸性度の基準、クレアチニンや血中尿素窒素(BUN)など分解産物の基準、ナトリウム、カリウム、および塩化物など電解質の基準、クレアチニンキナーゼ、アルブミン、C動作性蛋白質、ビリルビンなど酵素および蛋白質の基準、ならびにカルシウム、鉄、マグネシウム、亜鉛などミネラルの基準などを含め、複数の典型的な測定値のいずれかを含むことができる。これらのパラメータの多くは、性別、年齢、体重などとともに変化するので、モデルの学習標本は、集団内の複数の健康な個人、より具体的には、モニタリングされる人と同様の人口学的特色を有する人の例示的な血液サンプリングのテスト結果を含むことができる。したがって、正常の体重の若い男性患者の検査をモニタリングするために、正常な体重の若い男性の正常な血液成分ダイナミクスのモデルは、日周サイクル中の様々な時間に集められ、且つこれらのパラメータが正常な活動および健康の間に互いに関してどのように変化するかについてのダイナミクスを網羅するのに十分な、多くのそのような個人からの実際のテスト結果を含むことがある。患者の結果がモデルに入力されると、様々な正常な学習標本に基づいたパラメータの推定値が、患者の実際の結果と比較されて残差を生成し、正常な集団におけるそれらのパラメータの範囲より小さいが、それでもなお健康容態(初期的な悪化および悪化の傾向であっても、単に静的な疾病状態であっても)の重要な指標である残差の偏差が存在することがある。患者が、血液、尿、または他の体液の一連のテストを受ける場合、これらの残差結果自体が、本発明による後の分析のための時系列を構成することができる。
【0101】
病棟、看護施設、または診療所で患者をモニタリングする状況では、本発明を、以下のように実践することができる。患者に、患者のバイタルサインおよび他の生物学的パラメータをモニタリングするためのベッドサイドのデバイスに取り付けられたセンサを、取り付ける。このデータは、ベッドサイドのデバイスから、典型的にはコンピュータネットワークを介して、本発明によるデータを処理するためのソフトウェアを実行するコンピュータに提供される。コンピュータは、患者からのセンサデータの観察値の受信に応答して推定値を生成するのに使用するための1つまたは複数のモデルを構成する標本データを格納するか、または格納された標本データへのアクセスを有する。また、患者の臨床検査の結果に関するデータがコンピュータに提供されることもあり、典型的には、その結果が入力されている病院情報システムから提供される。例えば、患者は、約毎分1回のデータサンプリング周波数で、ベッドサイドのバイタルサインの集合に関する、或るモデルによってモニタリングされることがある。第2のモデルは、不定期な間隔でコンピュータによって受信され得る患者の検査結果を処理するために使用される。患者のデータをモニタリングするために使用され得る各モデルから、データの推定値が生成され、推定値と実際の値との比較で残差が生成される。コンピュータはさらに、本明細書の他の箇所で説明される、残差に対する様々なモデリング後の分析ステップを適用するように配置され、診断の目的で、偏差を検出して、偏差のパターンを認識する。測定されたデータ、推定値、および残差を、ローカルおよび/またはリモートでアクセス可能なディスプレイシステム上で、またはウェブサイト上で、医療スタッフに利用可能にすることができる。また、そのようなディスプレイでは、任意の検出された偏差、認識されたパターン、および結果として得られる、自動生成される提案される診断も利用可能である。コンピュータは、そのインターフェースを介して、またはウェブブラウザもしくはクライアントサーバプログラムを介して他のワークステーションに、残差、偏差、パターン、および診断に関する患者の医療記録に注釈を付けるためのユーザインターフェースを提供することができる。診断は、医療関係者によって、「調査中」、「不正確」、「確認済」、または他の状態とマーク付けされることがある。ユーザは、偏差などとしてコンピュータによってフラグが立てられているデータの特定の観察値を、実際には正常な逸脱していないデータ(non-deviating)としてマーク付けすることもできる。それに応答して、コンピュータの適応モジュールは、実際のデータを使用して、そのデータに異常とフラグを立てられたモデルを修正することができ、その後、任意のさらなるそのようなデータが、モデルによって異常と検出されることはない。
【0102】
モデルを適応させるプロセスは、新たな観察値または観察値の集合を、元のカーネルベースモデルが「訓練」された参照データの集合に追加することを含む。最も単純な実施形態では、全ての参照データがモデル標本として使用され、したがって、モデルを適応させることは、モデルの標本集合に新たな(1つまたは複数の)観察値を追加することを意味する。訓練方法を使用して、参照観察値を、システムダイナミクスの「代表」として格納された部分集合に対してダウンサンプルする(dowmsample)場合、新たな観察値が、元の参照データ集合に追加され、ダウンサンプリング技法を適用して、新たな代表的な標本集合を導出し、この新たな代表的な標本集合は次いで、新たな観察値の代表を含むべきである。また、ダウンサンプリング技法を再実行することなく、単に新たな観察値を標本のダウンサンプル集合に追加することも可能である。さらに、その場合、モデルから一部の標本を除去するのに有用であることがあり、その結果、それらの標本は新たな観察値によって効果的に置き換えられ、モデルサイズは扱いやすいサイズに保たれる。どの古い標本を除去すべきかについての基準は、クラスタリングおよび類似性の判定を含むことができ、これらは、新たな観察値を古いものと比較して、新たな観察値に最も似たものを置き換える。
【0103】
人の健康状態の家庭または現場モニタリングの状況では、PDAまたは携帯電話のようなものと同等の装着可能または携帯可能なコンピューティングデバイスが、人に取り付けられた複数のセンサからのデータを、直接有線接続、またはブルートゥースなど非常にローカルな無線通信を介して記録する。データは、基地局にダウンロードするためにコンピューティングデバイス内に維持される。またコンピューティングデバイスが、携帯電話などの無線通信デバイスでもある場合、分析のために通信ネットワークを介してリモートコンピュータにデータをアップロードすることができる。あるいは、範囲内にある場合はブルートゥースを介して、またはデバイスをコンピュータにリンクするための有線クレイドル(wired cradle)を介して、基地局にデータをダウンロードすることができる。次いで、アップロードまたはダウンロードされたデータは、本発明のモデルベースモニタリングアプローチを使用して、利用可能にされるときに定期的に処理される。データがリモートコンピュータにアップロードされる場合、そのリモートコンピュータ(または、リーモーとコンピュータとネットワーク接続されたコンピュータ)は、データを処理するのに必要とされるモデルへのアクセスを有する。データがローカルのパーソナルコンピュータ、例えばホームコンピュータにダウンロードされる場合、モデルデータは、ローカルでの分析のためにそこに存在することができ、あるいは、例えばインターネット接続で、データの処理に必要なモデルを有するリモートコンピュータにデータをアップロードするように、そのコンピュータを構成することができる。処理の結果、例えば推定値、残差、検出された偏差/警報、健康/重症度指標、および自動診断を、ウェブサイトの形式でリモートコンピュータから利用可能にすることができ、あるいは所望の受信者に伝送することができる。任意の場合に、データを処理するために使用される(1つまたは複数の)モデルは、他のヒトからの標本観察値から構成される汎用モデルとすることができ、あるいはモニタリングされている人の以前の観察値から構成される個別モデルとすることができる。
【0104】
様々な態様において、前述の好ましい実施形態に対する修正がなされることがあることを当業者は理解されよう。他の変形態様も機能し、本発明の範囲および精神内にあることは明らかであろう。本発明は、特に特許請求の範囲に詳細に記載されている。当業者および本出願の教示に精通する者に明らかなように、本発明の精神および範囲は、好ましい実施形態に対するそのような修正および代替を包含すると考えられる。
【特許請求の範囲】
【請求項1】
コンピュータで実行される、ヒトの健康状態をモニタリングするための方法であって、
前記ヒトから複数のバイタルサインの観察値を取得するステップであって、各バイタルサインは、生体信号の直接センサ測定値、または該直接センサ測定値のコンピュータ変換値である、ステップと、
取得された前記観察値が少なくとも1つの活動状態の特徴を示すかどうかをテストするステップと、
既知の健康状態下で前記少なくとも1つの活動状態における前記複数のバイタルサインの少なくとも一部のバイタルサインの動作の特徴を示すカーネルベースのモデルを、コンピュータメモリに提供するステップであって、前記カーネルベースのモデルは、前記複数のバイタルサインの格納された標本観察値のセットを備え、入力が同一のときに最大絶対値を有する出力を生成する少なくとも1つのカーネル演算子を利用する、ステップと、
取得された前記観察値が前記少なくとも1つの活動状態の特徴を示すとき、前記標本観察値の少なくとも一部の線形結合を使用して、前記観察値に基づいて前記カーネルベースのモデルを用いて前記複数のバイタルサインのうちの少なくとも1つバイタルサインの推定値を計算するステップと、
前記推定値を、前記観察値内の前記複数のバイタルサインのうちの前記少なくとも1つのバイタルサインに対応する測定値と比較して、比較結果から前記ヒトの健康状態の判定を行うステップと
を含むことを特徴とする方法。
【請求項1】
コンピュータで実行される、ヒトの健康状態をモニタリングするための方法であって、
前記ヒトから複数のバイタルサインの観察値を取得するステップであって、各バイタルサインは、生体信号の直接センサ測定値、または該直接センサ測定値のコンピュータ変換値である、ステップと、
取得された前記観察値が少なくとも1つの活動状態の特徴を示すかどうかをテストするステップと、
既知の健康状態下で前記少なくとも1つの活動状態における前記複数のバイタルサインの少なくとも一部のバイタルサインの動作の特徴を示すカーネルベースのモデルを、コンピュータメモリに提供するステップであって、前記カーネルベースのモデルは、前記複数のバイタルサインの格納された標本観察値のセットを備え、入力が同一のときに最大絶対値を有する出力を生成する少なくとも1つのカーネル演算子を利用する、ステップと、
取得された前記観察値が前記少なくとも1つの活動状態の特徴を示すとき、前記標本観察値の少なくとも一部の線形結合を使用して、前記観察値に基づいて前記カーネルベースのモデルを用いて前記複数のバイタルサインのうちの少なくとも1つバイタルサインの推定値を計算するステップと、
前記推定値を、前記観察値内の前記複数のバイタルサインのうちの前記少なくとも1つのバイタルサインに対応する測定値と比較して、比較結果から前記ヒトの健康状態の判定を行うステップと
を含むことを特徴とする方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−196484(P2012−196484A)
【公開日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願番号】特願2012−127443(P2012−127443)
【出願日】平成24年6月4日(2012.6.4)
【分割の表示】特願2008−543413(P2008−543413)の分割
【原出願日】平成18年11月29日(2006.11.29)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.BLUETOOTH
【出願人】(508160060)ベンチャー ゲイン リミテッド ライアビリティー カンパニー (3)
【Fターム(参考)】
【公開日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願日】平成24年6月4日(2012.6.4)
【分割の表示】特願2008−543413(P2008−543413)の分割
【原出願日】平成18年11月29日(2006.11.29)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.BLUETOOTH
【出願人】(508160060)ベンチャー ゲイン リミテッド ライアビリティー カンパニー (3)
【Fターム(参考)】
[ Back to top ]

