ヒトの癌におけるPIK3CA遺伝子の変異
【課題】シグナル伝達経路の重要な調節因子であるホスファチジルイノシトール3-キナーゼ(PI3K)の遺伝子ファミリーの1つで、変異の大半がPI3Kのへリックスドメイン内またはキナーゼドメイン内の2か所の近傍に集中し、ヒトの癌では未だ同定されていない、極めて高度に変異している癌遺伝子の1つである、遺伝子PIK3CAの利用方法を提供する。
【解決手段】癌を有することが疑われるヒトの身体試料中のPIK3CAのコード配列中における非同義遺伝子内変異を決定し、身体試料中に前記変異が認められる場合に癌を有する可能性が高いと評価する方法。
【解決手段】癌を有することが疑われるヒトの身体試料中のPIK3CAのコード配列中における非同義遺伝子内変異を決定し、身体試料中に前記変異が認められる場合に癌を有する可能性が高いと評価する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、米国政府が拠出した資金によって実施された(助成金番号NIH-CA 62924およびNIH-CA 43460)。したがって米国政府は、本発明に一定の権利を保持する。
【0002】
発明の分野
本発明は、癌の診断検査法および治療法の分野に関する。
【背景技術】
【0003】
発明の背景
PI3Kは、細胞表面受容体の下流のシグナル伝達因子として機能する脂質キナーゼであり、細胞の成長、増殖、接着、生存、および運動に重要な役割を果たす経路に関与する(1、2)(非特許文献1、2)。PI3Kの活性の上昇は、多くの結腸直腸の腫瘍および他の腫瘍で認められているが(3、4)(非特許文献3、4)、PI3Kの遺伝子内変異は同定されていない。
【0004】
PIK3経路の構成要素は、癌で変化することが過去に報告されている。例として、機能がPI3Kが介在するリン酸化(17、18)(非特許文献5、6)を逆転させることであるPTEN腫瘍抑制遺伝子(15、16)(非特許文献7、8)が挙げられる。PIK3CAおよびAKT2を含む染色体領域の重複または増幅は、ヒトの一部の癌で報告されている(2、19、20)(非特許文献2、9、10)が、このような大規模な遺伝的事象の標的となる遺伝子は見つかっておらず、また容易に見つからない。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】R. Katso et al., Annu Rev Cell Dev Biol 17, 615-75 (2001)
【非特許文献2】I. Nivanco, C. L. Sawyers, Nat Rev Cancer 2, 489-501 (Jul, 2002)
【非特許文献3】W. A. Phillips, F. St Clair, A. D. Munday, R. J. Thomas, C. A. Mitchell, Cancer 83, 41-7 (Jul 1, 1998)
【非特許文献4】E. S. Gershtein, V. A. Shatskaya, V. D. Ermilova, Ν. E. Kushlinsky, M. A. Krasil'nikov, Clin Chim Acta 287, 59-67 (Sep, 1999)
【非特許文献5】T. Maehama, J. E. Dixon, J Biol Chem 273, 13375-8 (May 29, 1998)
【非特許文献6】M. P. Myers et al., Proc Natl Acad Sci USA 95, 13513-8 (Nov 10, 1998)
【非特許文献7】J. Li et al., Science 275, 1943-7 (1997)
【非特許文献8】P. A. Steck et al., Nat Genet 15, 356-62 (1997)
【非特許文献9】L. Shayesteh et al., Nat Genet 21, 99-102 (Jan, 1999)
【非特許文献10】J. Q. Cheng et al., Proc Natl Acad Sci USA 89, 9267-71 (Oct 1, 1992)
【発明の概要】
【0006】
発明の簡単な概要
第1の態様では、患者が癌であることが疑われるヒト組織における癌を評価する方法を提供する。PIK3CAのコード配列における非同義の遺伝子内変異は、癌であることが疑われるヒトの身体試料中に検出される。このようなヒトは、PIK3CAのコード配列中の非同義の遺伝子内変異が身体試料中で見出された場合に、癌である可能性が高いと判断される。
【0007】
本発明の第2の態様では、ヒトにおける腫瘍の進行を抑制する方法を提供する。アンチセンスオリゴヌクレオチドまたはアンチセンスコンストラクトを腫瘍に投与する。アンチセンスオリゴヌクレオチド、またはアンチセンスコンストラクトから転写されるRNAは、PIK3CAから転写されるmRNAに相補的である。したがって、腫瘍が発現するp110αタンパク質の量は減少する。
【0008】
本発明の別の態様は、ヒトにおける腫瘍の進行を抑制する方法を提供する。2ヌクレオチドの3'突出末端を有する、ヒトのPIK3CAのmRNAの19〜21 bpの2本鎖を含むsiRNAをヒトに投与する。2本鎖の一方の鎖は、PIK3CA(配列番号:2)から転写されるmRNAから選択される隣接配列を含む。したがって、腫瘍が発現するp110αタンパク質の量は減少する。
【0009】
本発明の別の局面では、腫瘍の進行を抑制する方法を提供する。抗体結合領域を含む分子を腫瘍に投与する。抗体結合領域はPIK3CA(配列番号:3)に特異的に結合する。
【0010】
本発明の別の態様は、化学療法剤候補を同定する方法を提供する。野生型または活性化変異体のp110α(配列番号:3)に被験化合物を接触させる。続いてP110αの活性を測定する。p110α活性を阻害する被験化合物は化学療法剤候補であると判断される。
【0011】
本発明のさらに別の態様は、適切な化学療法剤を、治療を必要とする患者に輸送する方法である。PIK3CAのコード配列(配列番号:1)中の非同義の遺伝子内変異を、患者の被験組織を対象に決定する。p110α阻害剤を患者に投与する。
【0012】
本発明の別の局面は、PIK3CAの増幅用および/または配列決定用の、一連の1つもしくは複数のプライマーを提供する。プライマーは、フォワードプライマー、リバースプライマー、および配列決定用プライマーからなる群より選択される。フォワードプライマーは配列番号:6〜158からなる群より選択され、リバースプライマーは配列番号:159〜310からなる群より選択され、また配列決定用プライマーは配列番号:311〜461からなる群より選択される。
【図面の簡単な説明】
【0013】
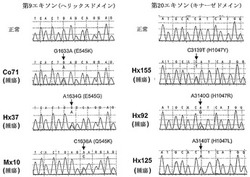
【図1】PIK3CA中の変異の検出。第9エキソンおよび第20エキソン内における変異の代表例。それぞれについて、上の配列のクロマトグラムは正常組織から得られ、また下の3つの配列のクロマトグラムは記載の腫瘍から得られたものである。矢印は、ミスセンス変異の位置を示す。ヌクレオチドおよびアミノ酸の変化を矢印の上に示す。
【図2】PIK3CA中における変異の分布。矢印はミスセンス変異の位置を示し、またボックスは機能ドメイン(p85BD=p85結合ドメイン、RBD=Ras結合ドメイン、C2ドメイン、ヘリックスドメイン、キナーゼドメイン)を示す。癌において、各領域内に検出された変異のパーセンテージを下に示す。
【図3】変異型p110αの脂質キナーゼ活性の上昇。NIH3T3細胞に、レーンの上に示す空のベクター、または野生型p110α、もしくは変異型p110α(H1047R)のいずれかを含むベクターコンストラクトをトランスフェクトした。IgG対照または抗p85ポリクローナル抗体のいずれかを使用して免疫沈殿法を実施した(図3A)。免疫沈殿の半分を対象に、基質としてホスファチジルイノシトールを使用するPI3-キナーゼアッセイ法を行った。「PI3P」は、標準的なホスファチジルマーカーを使用して決定されたPI-3-リン酸の位置を意味し、また「Ori」は起点を意味する(図3B)。免疫沈殿の残りの半分は、抗p110α抗体を使用するウェスタンブロッティングによって解析した(図3C)。トランスフェクトした細胞の細胞溶解液は、抗α-チューブリン抗体を使用したウェスタンブロッティングによる決定の結果、同等量の総タンパク質を含むことが判明した。この図に示す結果と同じ結果が、3回の独立したトランスフェクション実験で得られた。
【発明を実施するための形態】
【0014】
発明の詳細な説明
PIK3CA中に変異が集中することから、同遺伝子は、疾患の早期検出のための、または疾患の進行を追跡するための優れたマーカーとなる。変異集中領域を中心に試験を行うことで、大半の変異対立遺伝子が得られる。
【0015】
ヒトのPIK3CAのコード配列は文献に報告されており、これを配列番号:1に示す。これは、ヒト集団の1人の特定の個体の配列である。ヒトは、その遺伝子配列が互いに異なる。こうした変化は非常に少なく、1つの遺伝子あたり約1〜10ヌクレオチドの頻度で生じることがある。任意の特定の遺伝子の異なる型が、ヒト集団には存在する。こうしたさまざまな型は対立遺伝子異型と呼ばれる。対立遺伝子異型は、コードされたタンパク質のアミノ酸配列を変化しないことが多い。このような異型は「同義」であると表現される。たとえこれらについて、コードされたアミノ酸(非同義)が変化しているとしても、タンパク質の機能は通常、影響を受けない。このような変化は、進化的または機能的に中性である。本出願において、ヒトのPIK3CAについて言う場合、全ての対立遺伝子異型が、この表現に含まれることが意図される。配列番号:1の配列は、野生型のヒト配列の代表例として提供されるに過ぎない。本発明は、PIK3CAのこの1つの対立遺伝子型に制限されない。変異を決定する目的で、被験試料中に見出されたPIK3CA配列を、ヒトのさまざまな組織中において見出された配列と比較することができる。2つの組織の配列に差が認められれば、体細胞変異の存在が明らかとなる。あるいは、被験試料中のPIK3CA遺伝子中に見出された配列を、配列番号:1の配列と比較することができる。被験試料の配列と、配列番号:1の間に差が認められれば、それを変異であると判定することができる。癌性であることが疑われる組織は、腫瘍または癌細胞から剥がれ落ちた細胞を含むことが推定可能な身体試料と同様に試験することができる。試験に適した身体試料には、血液、血清、血漿、痰、尿、便、乳頭吸引物、唾液、および脳脊髄液などがある。
【0016】
PIK3CA上の変異は、第9エキソン(配列番号:4)および第20エキソン(配列番号:5)内に集中する。他の変異も存在するが、これら2つのエキソンが、変異のホットスポットであると考えられる。多くの変異は、PIK3CAのへリックスドメイン(配列番号:2のnt 1567〜2124)、およびPIK3CAのキナーゼドメイン(配列番号:2のnt 2095〜3096)に存在する。PIK3CAのP85BDドメイン(配列番号:2のnt 103〜335)内には変異はほとんど存在しない。変異は、第1エキソン、第2エキソン、第4エキソン、第5エキソン、第7エキソン、第9エキソン、第13エキソン、第18エキソン、および第20エキソン内に見出されている。これらのエキソンの任意の組み合わせを、任意選択で、他のエキソンの試験とともに試験することができる。変異の試験は、コード配列の全体を対象に行えるほか、変異が集中することがわかっている領域を特に対象とすることができる。特定の変異ホットスポットは、PIK3CAのコード配列のヌクレオチド位置1624、1633、1636、および3140である。
【0017】
PIK3CAの変異は多種多様な腫瘍に見出されている。したがって、任意のさまざまな腫瘍を、PIK3CAの変異に関して試験することができる。このような組織には、結腸直腸組織、脳組織、胃組織、乳房組織、および肺組織などがあるが、これらに限定されない。
【0018】
任意の種類の遺伝子内変異を検出することができる。このような変異には、置換変異、欠失変異、および挿入変異などがある。変異の長さは短いことが多く、1〜3ヌクレオチドの場合がある。検出可能な変異には、G1624A、G1633A、C1636A、A3140G、G113A、T1258C、G3129T、C3139T、およびG2702Tなどがあるが、これらに限定されない。これらの変異の任意の組み合わせを試験することができる。
【0019】
PIK3CA中に見出される変異は活性化変異であると考えられる。したがって、p110αの活性または発現の阻害を含む治療法によって、ヒトにおける腫瘍の進行を抑制することができる。使用可能な阻害性分子には、アンチセンスオリゴヌクレオチドまたはアンチセンスコンストラクト、抗体結合領域を含む分子、およびsiRNA分子などがある。抗体結合領域を含む分子は、完全な抗体、1本鎖可変領域、抗体断片、抗体コンジュゲートなどの場合がある。抗体結合領域は、PIK3CAのキナーゼドメイン(配列番号:2のnt 2095〜3096)、PIK3CAのへリックスドメイン(配列番号:2のnt 1567〜2124)、またはPIK3CAのP85BDドメイン(配列番号:2のnt 103〜335)に含まれるエピトープに結合する可能性があるが、結合する必要は必ずしもない。
【0020】
アンチセンスコンストラクト、アンチセンスオリゴヌクレオチド、RNA干渉コンストラクト、またはsiRNA 2本鎖RNA分子を用いて、PIK3CAの発現に干渉させることができる。典型的には、PIK3CAのmRNA配列の相補物の少なくとも15ヌクレオチド、17ヌクレオチド、19ヌクレオチド、または21ヌクレオチドが、アンチセンス分子として十分である。典型的には、PIK3CAの少なくとも19ヌクレオチド、21ヌクレオチド、22ヌクレオチド、または23ヌクレオチドが、RNA干渉分子として十分である。好ましくはRNA干渉分子は、2ヌクレオチドの3'突出末端を有する。仮にRNA干渉分子が、例えば所望のPIK3CA配列のヘアピン分子に由来する、または逆方向反復に由来するコンストラクトが由来する細胞中で発現されるならば、内因性の細胞装置が突出末端を作ることになる。siRNA分子は、化学合成、インビトロ転写、または長いdsRNAのRnase IIIもしくはDicerによる切断によって作製することができる。siRNA分子は細胞内に、トランスフェクション、エレクトロポレーション、または当技術分野で周知の他の方法で導入することができる。これについては文献を参照されたい(Hannon, GJ, 2002, RNA Interference, Nature 418: 244-251; Bernstein E et al., 2002, The rest is silence. RNA 7: 1509-1521; Hutvagner G et al., RNAi: Nature abhors a double-strand. Curr. Opin. Genetics & Developmet 12: 225-232; Brummelkamp, 2002, A system for stable expression of short interfering RNAs in mammalian cells. Science 296: 550-553; Lee NS, Dohjima T. Bauer G. Li H, Li M-J, Ehsani A, Salvaterra P. and Rossi J. (2002). Expression of small interfering RNAs targeted against HIV-1 rev transcripts in human cells. Nature Biotechnol. 20: 500-505; Miyagishi M, and Taira K. (2002). U6 promoter-driven siRNAs with four uridine 3' overhangs efficiently suppress targeted gene expression in mammalian cells. Nature Biotechnol. 20: 497-500; Paddison PJ, Caudy AA, Bernstein E, Hannon GJ, and Conklin DS. (2002). Short hairpin RNAs (shRNAs) induce sequence-specific silencing in mammalian cells. Genes & Dev. 16: 948-958; Paul CP, Good PD, Winer I, and Engelke DR. (2002). Effective expression of small interfering RNA in human cells. Nature Biotechnol. 20: 505-508; Sui G. Soohoo C, Affar E-B, Gay F, Shi A, Forrester WC, and Shi Y. (2002). A DNA vector-based RNAi technology to suppress gene expression in mammalian cells. Proc. Natl. Acad. Sci. USA 99(6): 5515-5520; Yu J-Y, DeRuiter SL, and Turner DL. (2002). RNA interference by expression of short-interfering RNAs and hairpin RNAs in mammalian cells. Proc. Natl. Acad. Sci. USA 99(9):6047-6052)。
【0021】
アンチセンス分子またはRNA干渉分子は、インビトロで細胞に、またはインビボで例えば哺乳類の腫瘍に輸送することができる。当技術分野で周知の典型的な輸送手段を使用することができる。例えば、腫瘍への輸送は、腫瘍内への注入によって達成可能である。静脈内、筋肉内、腹腔内、動脈内、外科手術中の局所輸送、内視鏡経由、皮下、および経口を含むが、これらに限定されない他の輸送様式を使用することができる。マウスモデルでは、アンチセンス分子またはRNA干渉分子をインビトロで腫瘍細胞に導入することが可能であり、また続いて腫瘍細胞をマウスに投与することができる。ベクターは、任意の特定の応用を鑑みて、所望の特性を考慮して選択することができる。ベクターは、ウイルスベクターまたはプラスミドベクターの場合がある。アデノウイルスベクターは、この点で有用である。組織特異的なプロモーター、細胞型特異的なプロモーター、または調節型プロモーターを使用して、阻害性ポリヌクレオチド分子の転写を制御することができる。リポソームまたはナノ粒子などの非ウイルス担体を使用することもできる。
【0022】
当業者であれば、本発明のp110αタンパク質を使用することで、対象タンパク質に特異的に結合する抗体を容易に作製することができる。このような抗体は、モノクローナル抗体またはポリクローナルの場合がある。このような抗体は、キメラ抗体、ヒト化抗体、または全体がヒト由来の抗体の場合がある。Fab、Fab'、Fab2、Fab'2、および1本鎖可変領域を含む、抗体の任意の機能性断片または誘導体を使用することができる。断片または誘導体は、内皮のマーカータンパク質に対する結合の特異性を保持している限りにおいて使用することができる。抗体の結合特異性は、任意の一連の条件で、無関係の抗原または抗原混合物に対する結合を、適切な抗原に対する結合と比較することで試験できる。仮に抗体が、無関係な抗原または抗原混合物に対する結合より、少なくとも2倍、5倍、7倍、および好ましくは10倍強く、適切な抗原と結合する場合は、結合は特異的であると見なされる。
【0023】
このような部分的なヒト抗体または完全なヒト抗体を作製する手法は当技術分野で周知であり、またそのような任意の手法を使用することができる。1つの特に好ましい態様によれば、完全ヒト抗体の配列は、ヒトの重鎖および軽鎖の抗体遺伝子を発現するように作製されたトランスジェニックマウスで作製される。さまざまなクラスの抗体を産生可能な、このようなトランスジェニックマウスの多数の系列が作製されている。所望の抗体を産生するトランスジェニックマウスに由来するB細胞を融合させて、所望の抗体の連続産生用のハイブリドーマ細胞系列を作製することができる。これについては文献を参照されたい(Nina D. Russel, Jose R. F. Corvalan, Michael L. Gallo, C. Geoffrey Davis, Liise-Anne Pirofski. Production of Protective Human Antipneumococcal Antibodies by Transgenic Mice with Human Immunoglobulin Loci Infection and Immunity April 2000, p.1820-1826; Michael L. Gallo, Vladimir E. Ivanov, Aya Jakobovits, and C. Geoffrey Davis. The human immunoglobulin loci introduced into mice: V(D) and J gene segment usage similar to that of adult humans European Journal of Immunology 30: 534-540, 2000; Larry L. Green. Antibody engineering via genetic engineering of the mouse: XenoMouse strains are a vehicle for the facile generation of therapeutic human monoclonal antibodies. Journal of Immunological Methods 231 11-23, 1999; Yang X-D, Corvalan JRF, Wang P. Roy CM-N and Davis CG. Fully Human Anti-interleukin-8 Monoclonal Antibodies: Potential Therapeutics for the Treatment of Inflammatory Disease States. Journal of Leucocyte Biology Vol.66, pp401-410 (1999); Yang X-D, Jia X-C, Corvalan JRE:, Wang P. CG Davis and Jakobovits A. Eradication of Established Tumors by a Fully Human Monoclonal Antibody to the Epidermal Growth Factor Receptor without Concomitant Chemotherapy. Cancer Research Vol.59, Number 6, ppl236-1243. (1999); Jakobovits A. Production and selection of antigen-specific fully human monoclonal antibodies from mice engineered with human Ig loci. Advanced Drug Delivery Reviews Vol.31, pp:33-42 (1998); Green L and Jakobovits A. Regulation of B cell development by variable gene complexity in mice reconstituted with human immunoglobulin yeast artificial chromosomes. J. Exp. Med. Vol.188, Number 3, pp:483-495 (1998); Jakobovits A. The long-awaited magic bullets: therapeutic human monoclonal antibodies from transgenic mice. Exp. Opin. Invest. Drugs Vol.7(4), pp:607-614 (1998); Tsuda H. Maynard-Currie K, Reid L, Yoshida T. Edamura K, Maeda N. Smithies O. Jakobovits A. Inactivation of Mouse HPRT locus by a 203-bp retrotransposon insertion and a 55-kb gene-targeted deletion: establishment of new HPRT-Deficient mouse embryonic stem cell lines. Genomics Vol.42, pp:413-421 (1997); Sherman-Gold, R. Monoclonal Antibodies: The Evolution from '80s Magic Bullets To Mature, Mainstream Applications as Clinical Therapeutics. Genetic Engineering News Vol.17, Number 14 (August 1997); Mendez M, Green L, Corvalan J. Jia X-C, Maynard-Currie C, Yang X-d, Gallo M, Louie D, Lee D, Erickson K, Luna J. Roy C, Abderrahim H. Kirschenbaum F. Noguchi M, Smith D, Fukushima A, Hales J. Finer M, Davis C, Zsebo K, Jakobovits A. Functional transplant of megabase human immunoglobulin loci recapitulates human antibody response in mice. Nature Genetics Vol.15, pp:146-156 (1997); Jakobovits A. Mice engineered with human immunoglobulin YACs: A new technology for production of fully human antibodies for autoimmunity therapy. Weir's Handbook of Experimental Immunology, The Integrated Immune System Vol.IV, pp:194.1-194.7 (1996); Jakobovits A. Production of fully human antibodies by transgenic mice. Current Opinion in Biotechnology Vol.6, No.5, pp:561-566 (1995); Mendez M, Abderrahim H. Noguchi M, David N. Hardy M, Green L, Tsuda H. Yoast S. Maynard-Currie C, Garza D, Gemmill R. Jakobovits A, Klapholz S. Analysis of the structural integrity of; YACs comprising human immunoglobulin genes in yeast and in embryonic stem cells. Genomics Vol.26, pp:294-307 (1995); Jakobovits A. YAC Vectors: Humanizing the mouse genome. Current Biology Vol.4, No.8, pp:761-763 (1994); Arbones M, Ord D, Ley K, Ratech H. Maynard-Curry K, Otten G. Capon D, Tedder T. Lymphocyte homing and leukocyte rolling and migration are impaired in L- selectin-deficient mice. Immunity Vol.1, No.4, pp:247-260 (1994); Green L, Hardy M, Maynard-Curry K, Tsuda H. Louie D, Mendez M, Abderrahim H. Noguchi M, Smith D, Zeng Y. et. al. Antigen specific human monoclonal antibodies from mice engineered with human Ig heavy and light chain YACs. Nature Genetics Vol.7, No.1, pp:13-21 (1994); Jakobovits A, Moore A, Green L, Vergara G. Maynard-Curry K, Austin H. Klapholz S. Germ-line transmission and expression of a human-derived yeast artificial chromosome. Nature Vol.362, No.6417, pp:255-258 (1993); Jakobovits A, Vergara G. Kennedy J, Hales J, McGuinness R, Casentini-Borocz D, Brenner D, Otten G. Analysis of homozygous mutant chimeric mice: deletion of the immunoglobulin heavy-chain joining region blocks B-cell development and antibody production. Proceedings of the National Academy of Sciences USA Vol.90, No.6, pp:2551-2555 (1993); Kucherlapati et al., U.S. 6,1075,181)。
【0024】
抗体は、ファージディスプレイ法で作製することもできる。このような手法で一次抗体を単離することができるほか、特異性または抗体結合力の特徴を変化させた異型を作製することができる。利便性を考慮して、1本鎖Fvを使用することもできる。これらは望ましいならば、ワクチンを接種したトランスジェニックマウスから作製することができる。抗体は、細胞培養で、ファージ中で、またはウシ、ウサギ、ヤギ、マウス、ラット、ハムスター、モルモット、ヒツジ、イヌ、ネコ、サル、チンパンジー、類人猿を含むが、これらに限定されない、さまざまな動物で産生させることができる。
【0025】
抗体は、放射性原子、発色団、フルオロフォアなどの検出用部分で標識することができる。このような標識された抗体を、インビボまたは単離された被験試料のいずれかを対象とした診断法に使用することができる。抗体には例えば、化学療法剤やトキシンなどの薬剤を結合させることも可能である。薬剤は、サイトカインに、リガンドに、または他の抗体に連結可能である。抗腫瘍作用を引き出すための、抗体とのカップリングに適した薬剤には、インターロイキン2(IL-2)や腫瘍壊死因子(TNF)などのサイトカイン;アルミニウム(III)フタロシアニンテトラスルホン酸、ヘマトポルフィリン、およびフタロシアニンを含む、光線力学療法に使用される光増感物質;ヨウ素-131(131I)、イットリウム-90(90Y)、ビスマス-212(212Bi)、ビスマス-213(213Bi)、テクネチウム-99m(99mTc)、レニウム-186(186Re)、およびレニウム-188(188Re)などの放射性核種;ドキソルビシン、アドリアマイシン、ダウノルビシン、メトトレキセート、ダウノマイシン、ネオカルチノスタチン、およびカルボプラチンなどの抗生物質;ジフテリアトキシン、シュードモナス属外毒素A、ブドウ球菌エンテロトキシンA、アブリン-Aトキシン、リシンA(脱グリコシル化リシンAおよび天然のリシンA)、TGF-アルファトキシン、タイワンコブラ(naja naja atra)の細胞毒、およびゲロニン(植物トキシン)などの、細菌、植物、および他のトキシン;レストリクトシン(restrictocin)(Aspergillus restrictusが産生するリボソーム不活性化タンパク質)、サポリン(サボンソウ(Saponaria officinalis)のリボソーム不活性化タンパク質)などの、植物、細菌、および真菌のリボソーム不活性化タンパク質ならびにRNase;チロシンキナーゼ阻害剤;ly207702(ジフルオロ化プリンヌクレオシド);抗腫瘍剤(例えばアンチセンスオリゴヌクレオチド、トキシン(メトトレキセートなど)をコードするプラスミド)を含むリポソーム;ならびに他の抗体またはF(ab)などの抗体断片などがある。
【0026】
当業者であれば、当技術分野で周知である、このような抗体誘導体を容易に理解して作製することができる。抗体は、それ自体が細胞障害性を有する場合があるほか、細胞毒性薬を体内の特定部位に輸送するために使用することができる。抗体は、治療を必要とする個体に、受動免疫の様式で投与することができる。
【0027】
低分子タンパク質キナーゼ阻害剤の成功を考えれば、上記のような変異を有する癌患者、または一般に癌である多数の患者の治療用に、p110αの特異的もしくは非特異的な阻害剤を開発することができる。広域のPI3K阻害剤を開発することは、LY294002およびワートマニンに関する研究(2、21、22)で明らかにされているように、明らかに可能である。発明者らが得たデータは、p110αを標的とするが他のPI3Kは標的としない、特異性の高い阻害剤の開発が有用なことを示唆している。
【0028】
化学療法剤候補は、p110αの活性または発現を阻害する薬剤として同定することができる。被験化合物は、合成化合物または天然化合物の場合がある。被験化合物は、生理的活性を有するか否かについて既知である可能性がある。化学療法剤候補に関する試験は、無細胞系を対象に、または細胞全体を対象として実施できる。p110αの活性は、当技術分野で既知の手段で試験することができる。このような手段には、参考文献2、22、およびTruitt et al., J. Exp. Med., 179, 1071-1076 (1994)に記載された方法などがある。発現は、PI3KCAのタンパク質またはmRNAを決定することで追跡できる。ウェスタンブロッティングなどの抗体を使用する方法でタンパク質を決定することができる。ノーザンブロッティングでmRNAを測定することができる。他の方法を使用することができるが、それらに限定されない。化学療法剤を試験する際は、アッセイ法で使用されるp110αは野生型または活性化型の場合がある。活性化型は、E542K、E545K、Q546K、およびH1047Rからなる群より選択される置換変異を含む場合がある。また阻害剤を試験して、p110αまたはp110αの活性化型のいずれかに対する特異性を決定することができる。比較試験をPIK3CB、PIK3CG、PIK3C2A、PIK3C2B、PIK3C2G、PIK3C3、A-TM、ATR、FRAP1、LAT1-3TM、SMG1、PRKDC、およびTRRAPを含む類似の酵素を対象に実施することで、p110α酵素に対する相対的な特異性を決定できる。
【0029】
PIK3CAのコード配列中の非同義の遺伝子内変異が、患者の被験組織中に同定されたら、こうした情報を元に治療に関する判断を下すことができる。このような変異を有する患者は、p110α阻害剤を使用する治療の有力な候補となる。このような阻害剤は、阻害剤のファミリーに特異的な場合もあれば一般的な場合もある。このような阻害剤にはLY294002やワートマニンなどがある。このような阻害剤はさらに、p110αに特異的な抗体結合領域を含む分子を含む。このような分子については既に説明した。
【0030】
PIK3CAの増幅用および/または配列決定用のプライマーのセットは、キットの状態で、または個々の成分がまとめられた状態で提供される場合がある。有用なプライマーセットは、任意選択で配列決定用プライマーと組み合わされた、フォワードプライマーとリバースプライマーの対を含む。フォワードプライマーを配列番号:6〜158に示す。リバースプライマーを配列番号:159〜310に示す。配列決定用プライマーを配列番号:311〜461に示す。対または三つ組、またはこれらの対もしくは三つ組の組み合わせを包装して、PIK3CA遺伝子の配列の一部を増幅および/または配列決定する際に、ともに使用することができる。プライマー対は、1個または複数の容器内に包装することができる。本発明の方法に用いるプライマーの使用に関する指示書は、利便性を考慮して、紙、電子媒体、またはワールドワイドウェブのアドレスを含む任意のメディアとして提供される場合がある。
【0031】
本発明を、本発明の現時点で好ましい実施様式を含む特定の実施例に関して説明したが、当業者であれば、上述した系および手法に、添付の特許請求の範囲に記載された本発明の趣旨および範囲に含まれる数多くの変更や入れ替えがありうることを理解すると思われる。
【実施例】
【0032】
実施例
実施例1-本実施例は、PIK3CAの遺伝子が、この遺伝子ファミリーにおける主な標的であることを示す
PI3Kが腫瘍形成に遺伝学的に関与するか否かを評価するために、発明者らは、結腸直腸癌における、この遺伝子ファミリーの遺伝子群のDNA配列を直接調べた。
【0033】
PI3Kの触媒サブユニットは、その基質特異性に応じて3つの主なクラスに分けられる(5)。加えて、mTORファミリーのタンパク質を含む、より遠縁の一連のタンパク質は第4のクラスを構成する(6)。発明者らは、隠れマルコフモデルを用いて、ヒトゲノム上の既知のPI3Kのドメインに関連するキナーゼドメインを含む15のヒト遺伝子を同定した(7)。内訳は、PI3Kが7つ、mTORサブファミリーの遺伝子が6つ、および未同定のPI3K様遺伝子が2つである(表1)。
【0034】
(表1)解析したPI3K遺伝子

*PI3K遺伝子群は、過去に報告されたクラス(S3、S4)に分けられる。クラスI、クラスII、およびクラスIIIはPI3K触媒サブユニットを含み、クラスIVは、mTOR(target of rapamycin)、ATM(ataxia telangiectasia mutated)、およびDNAPK(DNA-dependent protein kinase)のサブファミリーのメンバーを含む、PI3K様遺伝子、ならびに過去に未同定の2つの遺伝子を含む。
【0035】
発明者らはまず、これらの遺伝子の推定キナーゼドメインをコードする111のエキソンを調べた(表2)。エキソンをポリメラーゼ連鎖反応(PCR)で増幅し、35の結腸直腸癌のゲノムDNAから配列を直接決定した(8)。1つの遺伝子(PIK3CA)のみが、いくつかの体細胞(すなわち腫瘍特異的な)変異を含んでいた。
【0036】
(表2)PCRによる増幅および配列決定に使用したプライマー






1配列番号:6〜165(フォワードプライマー)
2配列番号:166〜325(リバースプライマー)
3配列番号:326〜485(配列決定用プライマー)
【0037】
実施例2-本実施例は、PIK3CA遺伝子内における変異の顕著な集中について示す
次に、別の199の結腸直腸癌を対象にPIK3CAの全コードエキソンを解析した結果、計74(32%)の腫瘍に変異の存在が明らかとなった(表3および図1の例)。
【0038】
(表3)ヒトの癌におけるPIK3CAの変異

*変異に起因するヌクレオチドおよびアミノ酸の変化があるエキソン番号。ヌクレオチドの位置は、コード配列中の位置を示す(位置1は、開始コドンの先頭に対応する)。機能ドメインについては、図1のレジェンドに示す。#個々の腫瘍に見出された非同義変異の数。Colon=結腸直腸癌、GBM=膠芽腫、gastric=胃癌、breast=乳癌、lung=肺癌、pancreas=膵臓癌、medulloblastoma=髄芽腫、adenomas=良性の結腸直腸腫瘍。列挙した全ての変異は体細胞変異であるが、対応する正常組織が得られなかった5つの結腸直腸癌および1つの膠芽腫は例外とする。変異は、201例のミスマッチ修復(MMR)能を有する結腸直腸癌の58例で、33例のMMR能を有なさい結腸直腸癌の16例で同定された。PIK3CAに変異を有する一部の腫瘍は、KRASまたはBRAFに変異を含むが、他の腫瘍は含まない。この事実は、これらの遺伝子群が独立した経路で作用することを示唆している。7つの腫瘍は2つの体細胞変異を含んでいた。表に記載された92の非同義変異に加えて、発明者らは3つの同義変異を見出した。
【0039】
実施例3-本実施例は、PIK3CAの変異が腫瘍形成の後期に現われることを示す
新生物の進行中におけるPIK3CAの変異のタイミングを決定するために、発明者らは、大きさおよび異形成の程度が多様な76の前悪性結腸直腸腫瘍の評価を行った。直径が5 cmを上回り、腺管絨毛状の極めて進行した線種で、PIK3CAの2つの変異(E542KおよびE542V)のみが見出された。この結果は、PIK3CAの異常が、新形成の比較的後期、すなわち腫瘍が浸潤および転移を開始する時期の近くで現われることを示唆している。
【0040】
実施例4-本実施例は、多種多様な種類の癌におけるPIK3CAの変異を示す
次に発明者らは、他の種類の腫瘍における遺伝子変化に関してPIK3CAの評価を行った(表1)。変異は、膠芽腫の15例中4例(27%)で、胃癌の12例中3例(25%)で、乳癌の13例中1例(8%)で、また肺癌の24例中1例(4%)で同定された。膵臓癌の11例と髄芽腫の12例では変異は認められなかった。合計すると89の変異が認められた。そのうち3つの変異はヘテロ接合性であった。
【0041】
実施例5-本実施例は、認められた遺伝子変化がランダムではないことを示す
5種類の異なる癌について、PIK3CAにかなりの数の変異が認められたことは、これらの変異が機能的に重要なことを強く示唆する。この結論は、別の2つの独立した証拠によって支持される。第1に、非同義変異と同義変異の比率の解析は、腫瘍の進行中における選択の適切な尺度となる。というのは、サイレントな変化に増殖上の利点がある可能性は低いからである。PIK3CAにおける非同義変異:同義変異の比は89:2であり、偶然による推定値2:1の比をはるかに上回った(P<1x10-4)。第2に、PI3Kの触媒ドメインおよびアクセサリードメインに位置する非同義的変化の出現率は、1 Mbの腫瘍DNAあたり約120であり、癌細胞のゲノム上に観察された非機能的変化のバックグラウンドの変異出現率より100倍以上高い(P<1x10-4)(9)。
【0042】
キナーゼ機能に対する、これらの変異の作用は、実験によって試験されていないものの、PIK3CA内における変異の位置および性質は、変異が活性化変異である可能性が高いことを意味している。切断型の変異は認められず、75%を上回る変異が第9エキソンおよび第20エキソンの2つの小さな集中領域中に認められた(表2および図1)。これらの集中領域内で変化した残基は、進化的に高度に保存されており、性質がマウス、ラット、およびニワトリで保持されている。特定のドメインにおける体細胞のミスセンス変異の集中は、RAS(10)、BRAF(11、12)、β-カテニン(13)、およびチロシンキノーム(14)の遺伝子などの他の癌遺伝子の活性化変異に関して認められた結果と同等である。
【0043】
以上の遺伝学的データは、変異型のPIK3CAが、ヒトの癌における癌遺伝子として機能する可能性が高いことを示唆している。
【0044】
実施例6-本実施例は、PIK3CAの遺伝子増幅が一般的ではないことを示す
96の結腸直腸癌を対象としたPIK3CAの定量的PCR解析では遺伝子増幅の証拠は得られず、遺伝子のコピー数の変化が、この腫瘍における活性化の重要な機構ではないことが示唆された。使用したプライマーを以下に示す:
リアルタイムPI3K hCT1640694 20-1F(イントロン)

;および
リアルタイムPI3K hCT1640694 20-1R

【0045】
本出願の最後に添付した配列表は、以下の配列を含む:
配列番号:1=コード配列のみ(配列番号:2のnt 13〜3201)
配列番号:2=mRNA配列(NM_006218)
配列番号:3=タンパク質配列(NP_006209)
配列番号:4=第9エキソン
配列番号:5=第20エキソン
配列番号:6〜165=フォワードプライマー
配列番号:166〜325=リバースプライマー
配列番号:326〜485=配列決定用プライマー
配列番号:486および487=増幅用プライマー
【0046】
参考文献および注記

7.PI3Kの触媒サブユニットは、Celera社の概要ヒトゲノム配列中に存在するInterPro(IPR)PI3Kドメイン(IPR000403)の解析によって同定された。この結果、15のPI3K遺伝子および関連するPI3K遺伝子が同定された。PIK3CD遺伝子のキナーゼドメインは、現時点のヒトゲノム概要配列には記載されていなかったので、本研究の対象から外した。
8.同定されたPI3Kのキナーゼドメインを含む、全ての注釈付きエキソンおよび隣接するイントロンの配列を、Celera社の概要ヒトゲノム配列(URLアドレス:wwwホストサーバ、ドメイン名celera.com)から抽出した。解析した全ての遺伝子のCelera社およびゲンバンクのアクセッション番号を表1に示す。PCRによる増幅および配列決定用のプライマーは、Primer 3プログラム(URLアドレス:httpファイル型式、www-genome.wi.mit.eduホストサーバ、cgi-binドメイン名、プライマーディレクトリ、primer3_www.cgiサブディレクトリ)を使用して設計され、MWG(High Point, NC)またはIDT(Coralville, IA)によって合成された。PCRによる増幅および配列決定は、初期の継代細胞系列、または一次腫瘍に由来する腫瘍のDNAを対象に、384キャピラリ自動配列決定装置(Spectrumedix, State College, PA)を使用して、文献(12)に記載された手順で実施された。配列の読み取り波形データを整列化して解析し、潜在的なゲノム変化を、Mutation Explorerソフトウェアパッケージ(SoftGenetics, State College, PA)を使用して同定した。抽出されたエキソンのうち96%の解析に成功した。PCRによる増幅および配列決定に使用された全てのプライマーの配列を表S1に示す。

【技術分野】
【0001】
本出願は、米国政府が拠出した資金によって実施された(助成金番号NIH-CA 62924およびNIH-CA 43460)。したがって米国政府は、本発明に一定の権利を保持する。
【0002】
発明の分野
本発明は、癌の診断検査法および治療法の分野に関する。
【背景技術】
【0003】
発明の背景
PI3Kは、細胞表面受容体の下流のシグナル伝達因子として機能する脂質キナーゼであり、細胞の成長、増殖、接着、生存、および運動に重要な役割を果たす経路に関与する(1、2)(非特許文献1、2)。PI3Kの活性の上昇は、多くの結腸直腸の腫瘍および他の腫瘍で認められているが(3、4)(非特許文献3、4)、PI3Kの遺伝子内変異は同定されていない。
【0004】
PIK3経路の構成要素は、癌で変化することが過去に報告されている。例として、機能がPI3Kが介在するリン酸化(17、18)(非特許文献5、6)を逆転させることであるPTEN腫瘍抑制遺伝子(15、16)(非特許文献7、8)が挙げられる。PIK3CAおよびAKT2を含む染色体領域の重複または増幅は、ヒトの一部の癌で報告されている(2、19、20)(非特許文献2、9、10)が、このような大規模な遺伝的事象の標的となる遺伝子は見つかっておらず、また容易に見つからない。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】R. Katso et al., Annu Rev Cell Dev Biol 17, 615-75 (2001)
【非特許文献2】I. Nivanco, C. L. Sawyers, Nat Rev Cancer 2, 489-501 (Jul, 2002)
【非特許文献3】W. A. Phillips, F. St Clair, A. D. Munday, R. J. Thomas, C. A. Mitchell, Cancer 83, 41-7 (Jul 1, 1998)
【非特許文献4】E. S. Gershtein, V. A. Shatskaya, V. D. Ermilova, Ν. E. Kushlinsky, M. A. Krasil'nikov, Clin Chim Acta 287, 59-67 (Sep, 1999)
【非特許文献5】T. Maehama, J. E. Dixon, J Biol Chem 273, 13375-8 (May 29, 1998)
【非特許文献6】M. P. Myers et al., Proc Natl Acad Sci USA 95, 13513-8 (Nov 10, 1998)
【非特許文献7】J. Li et al., Science 275, 1943-7 (1997)
【非特許文献8】P. A. Steck et al., Nat Genet 15, 356-62 (1997)
【非特許文献9】L. Shayesteh et al., Nat Genet 21, 99-102 (Jan, 1999)
【非特許文献10】J. Q. Cheng et al., Proc Natl Acad Sci USA 89, 9267-71 (Oct 1, 1992)
【発明の概要】
【0006】
発明の簡単な概要
第1の態様では、患者が癌であることが疑われるヒト組織における癌を評価する方法を提供する。PIK3CAのコード配列における非同義の遺伝子内変異は、癌であることが疑われるヒトの身体試料中に検出される。このようなヒトは、PIK3CAのコード配列中の非同義の遺伝子内変異が身体試料中で見出された場合に、癌である可能性が高いと判断される。
【0007】
本発明の第2の態様では、ヒトにおける腫瘍の進行を抑制する方法を提供する。アンチセンスオリゴヌクレオチドまたはアンチセンスコンストラクトを腫瘍に投与する。アンチセンスオリゴヌクレオチド、またはアンチセンスコンストラクトから転写されるRNAは、PIK3CAから転写されるmRNAに相補的である。したがって、腫瘍が発現するp110αタンパク質の量は減少する。
【0008】
本発明の別の態様は、ヒトにおける腫瘍の進行を抑制する方法を提供する。2ヌクレオチドの3'突出末端を有する、ヒトのPIK3CAのmRNAの19〜21 bpの2本鎖を含むsiRNAをヒトに投与する。2本鎖の一方の鎖は、PIK3CA(配列番号:2)から転写されるmRNAから選択される隣接配列を含む。したがって、腫瘍が発現するp110αタンパク質の量は減少する。
【0009】
本発明の別の局面では、腫瘍の進行を抑制する方法を提供する。抗体結合領域を含む分子を腫瘍に投与する。抗体結合領域はPIK3CA(配列番号:3)に特異的に結合する。
【0010】
本発明の別の態様は、化学療法剤候補を同定する方法を提供する。野生型または活性化変異体のp110α(配列番号:3)に被験化合物を接触させる。続いてP110αの活性を測定する。p110α活性を阻害する被験化合物は化学療法剤候補であると判断される。
【0011】
本発明のさらに別の態様は、適切な化学療法剤を、治療を必要とする患者に輸送する方法である。PIK3CAのコード配列(配列番号:1)中の非同義の遺伝子内変異を、患者の被験組織を対象に決定する。p110α阻害剤を患者に投与する。
【0012】
本発明の別の局面は、PIK3CAの増幅用および/または配列決定用の、一連の1つもしくは複数のプライマーを提供する。プライマーは、フォワードプライマー、リバースプライマー、および配列決定用プライマーからなる群より選択される。フォワードプライマーは配列番号:6〜158からなる群より選択され、リバースプライマーは配列番号:159〜310からなる群より選択され、また配列決定用プライマーは配列番号:311〜461からなる群より選択される。
【図面の簡単な説明】
【0013】
【図1】PIK3CA中の変異の検出。第9エキソンおよび第20エキソン内における変異の代表例。それぞれについて、上の配列のクロマトグラムは正常組織から得られ、また下の3つの配列のクロマトグラムは記載の腫瘍から得られたものである。矢印は、ミスセンス変異の位置を示す。ヌクレオチドおよびアミノ酸の変化を矢印の上に示す。
【図2】PIK3CA中における変異の分布。矢印はミスセンス変異の位置を示し、またボックスは機能ドメイン(p85BD=p85結合ドメイン、RBD=Ras結合ドメイン、C2ドメイン、ヘリックスドメイン、キナーゼドメイン)を示す。癌において、各領域内に検出された変異のパーセンテージを下に示す。
【図3】変異型p110αの脂質キナーゼ活性の上昇。NIH3T3細胞に、レーンの上に示す空のベクター、または野生型p110α、もしくは変異型p110α(H1047R)のいずれかを含むベクターコンストラクトをトランスフェクトした。IgG対照または抗p85ポリクローナル抗体のいずれかを使用して免疫沈殿法を実施した(図3A)。免疫沈殿の半分を対象に、基質としてホスファチジルイノシトールを使用するPI3-キナーゼアッセイ法を行った。「PI3P」は、標準的なホスファチジルマーカーを使用して決定されたPI-3-リン酸の位置を意味し、また「Ori」は起点を意味する(図3B)。免疫沈殿の残りの半分は、抗p110α抗体を使用するウェスタンブロッティングによって解析した(図3C)。トランスフェクトした細胞の細胞溶解液は、抗α-チューブリン抗体を使用したウェスタンブロッティングによる決定の結果、同等量の総タンパク質を含むことが判明した。この図に示す結果と同じ結果が、3回の独立したトランスフェクション実験で得られた。
【発明を実施するための形態】
【0014】
発明の詳細な説明
PIK3CA中に変異が集中することから、同遺伝子は、疾患の早期検出のための、または疾患の進行を追跡するための優れたマーカーとなる。変異集中領域を中心に試験を行うことで、大半の変異対立遺伝子が得られる。
【0015】
ヒトのPIK3CAのコード配列は文献に報告されており、これを配列番号:1に示す。これは、ヒト集団の1人の特定の個体の配列である。ヒトは、その遺伝子配列が互いに異なる。こうした変化は非常に少なく、1つの遺伝子あたり約1〜10ヌクレオチドの頻度で生じることがある。任意の特定の遺伝子の異なる型が、ヒト集団には存在する。こうしたさまざまな型は対立遺伝子異型と呼ばれる。対立遺伝子異型は、コードされたタンパク質のアミノ酸配列を変化しないことが多い。このような異型は「同義」であると表現される。たとえこれらについて、コードされたアミノ酸(非同義)が変化しているとしても、タンパク質の機能は通常、影響を受けない。このような変化は、進化的または機能的に中性である。本出願において、ヒトのPIK3CAについて言う場合、全ての対立遺伝子異型が、この表現に含まれることが意図される。配列番号:1の配列は、野生型のヒト配列の代表例として提供されるに過ぎない。本発明は、PIK3CAのこの1つの対立遺伝子型に制限されない。変異を決定する目的で、被験試料中に見出されたPIK3CA配列を、ヒトのさまざまな組織中において見出された配列と比較することができる。2つの組織の配列に差が認められれば、体細胞変異の存在が明らかとなる。あるいは、被験試料中のPIK3CA遺伝子中に見出された配列を、配列番号:1の配列と比較することができる。被験試料の配列と、配列番号:1の間に差が認められれば、それを変異であると判定することができる。癌性であることが疑われる組織は、腫瘍または癌細胞から剥がれ落ちた細胞を含むことが推定可能な身体試料と同様に試験することができる。試験に適した身体試料には、血液、血清、血漿、痰、尿、便、乳頭吸引物、唾液、および脳脊髄液などがある。
【0016】
PIK3CA上の変異は、第9エキソン(配列番号:4)および第20エキソン(配列番号:5)内に集中する。他の変異も存在するが、これら2つのエキソンが、変異のホットスポットであると考えられる。多くの変異は、PIK3CAのへリックスドメイン(配列番号:2のnt 1567〜2124)、およびPIK3CAのキナーゼドメイン(配列番号:2のnt 2095〜3096)に存在する。PIK3CAのP85BDドメイン(配列番号:2のnt 103〜335)内には変異はほとんど存在しない。変異は、第1エキソン、第2エキソン、第4エキソン、第5エキソン、第7エキソン、第9エキソン、第13エキソン、第18エキソン、および第20エキソン内に見出されている。これらのエキソンの任意の組み合わせを、任意選択で、他のエキソンの試験とともに試験することができる。変異の試験は、コード配列の全体を対象に行えるほか、変異が集中することがわかっている領域を特に対象とすることができる。特定の変異ホットスポットは、PIK3CAのコード配列のヌクレオチド位置1624、1633、1636、および3140である。
【0017】
PIK3CAの変異は多種多様な腫瘍に見出されている。したがって、任意のさまざまな腫瘍を、PIK3CAの変異に関して試験することができる。このような組織には、結腸直腸組織、脳組織、胃組織、乳房組織、および肺組織などがあるが、これらに限定されない。
【0018】
任意の種類の遺伝子内変異を検出することができる。このような変異には、置換変異、欠失変異、および挿入変異などがある。変異の長さは短いことが多く、1〜3ヌクレオチドの場合がある。検出可能な変異には、G1624A、G1633A、C1636A、A3140G、G113A、T1258C、G3129T、C3139T、およびG2702Tなどがあるが、これらに限定されない。これらの変異の任意の組み合わせを試験することができる。
【0019】
PIK3CA中に見出される変異は活性化変異であると考えられる。したがって、p110αの活性または発現の阻害を含む治療法によって、ヒトにおける腫瘍の進行を抑制することができる。使用可能な阻害性分子には、アンチセンスオリゴヌクレオチドまたはアンチセンスコンストラクト、抗体結合領域を含む分子、およびsiRNA分子などがある。抗体結合領域を含む分子は、完全な抗体、1本鎖可変領域、抗体断片、抗体コンジュゲートなどの場合がある。抗体結合領域は、PIK3CAのキナーゼドメイン(配列番号:2のnt 2095〜3096)、PIK3CAのへリックスドメイン(配列番号:2のnt 1567〜2124)、またはPIK3CAのP85BDドメイン(配列番号:2のnt 103〜335)に含まれるエピトープに結合する可能性があるが、結合する必要は必ずしもない。
【0020】
アンチセンスコンストラクト、アンチセンスオリゴヌクレオチド、RNA干渉コンストラクト、またはsiRNA 2本鎖RNA分子を用いて、PIK3CAの発現に干渉させることができる。典型的には、PIK3CAのmRNA配列の相補物の少なくとも15ヌクレオチド、17ヌクレオチド、19ヌクレオチド、または21ヌクレオチドが、アンチセンス分子として十分である。典型的には、PIK3CAの少なくとも19ヌクレオチド、21ヌクレオチド、22ヌクレオチド、または23ヌクレオチドが、RNA干渉分子として十分である。好ましくはRNA干渉分子は、2ヌクレオチドの3'突出末端を有する。仮にRNA干渉分子が、例えば所望のPIK3CA配列のヘアピン分子に由来する、または逆方向反復に由来するコンストラクトが由来する細胞中で発現されるならば、内因性の細胞装置が突出末端を作ることになる。siRNA分子は、化学合成、インビトロ転写、または長いdsRNAのRnase IIIもしくはDicerによる切断によって作製することができる。siRNA分子は細胞内に、トランスフェクション、エレクトロポレーション、または当技術分野で周知の他の方法で導入することができる。これについては文献を参照されたい(Hannon, GJ, 2002, RNA Interference, Nature 418: 244-251; Bernstein E et al., 2002, The rest is silence. RNA 7: 1509-1521; Hutvagner G et al., RNAi: Nature abhors a double-strand. Curr. Opin. Genetics & Developmet 12: 225-232; Brummelkamp, 2002, A system for stable expression of short interfering RNAs in mammalian cells. Science 296: 550-553; Lee NS, Dohjima T. Bauer G. Li H, Li M-J, Ehsani A, Salvaterra P. and Rossi J. (2002). Expression of small interfering RNAs targeted against HIV-1 rev transcripts in human cells. Nature Biotechnol. 20: 500-505; Miyagishi M, and Taira K. (2002). U6 promoter-driven siRNAs with four uridine 3' overhangs efficiently suppress targeted gene expression in mammalian cells. Nature Biotechnol. 20: 497-500; Paddison PJ, Caudy AA, Bernstein E, Hannon GJ, and Conklin DS. (2002). Short hairpin RNAs (shRNAs) induce sequence-specific silencing in mammalian cells. Genes & Dev. 16: 948-958; Paul CP, Good PD, Winer I, and Engelke DR. (2002). Effective expression of small interfering RNA in human cells. Nature Biotechnol. 20: 505-508; Sui G. Soohoo C, Affar E-B, Gay F, Shi A, Forrester WC, and Shi Y. (2002). A DNA vector-based RNAi technology to suppress gene expression in mammalian cells. Proc. Natl. Acad. Sci. USA 99(6): 5515-5520; Yu J-Y, DeRuiter SL, and Turner DL. (2002). RNA interference by expression of short-interfering RNAs and hairpin RNAs in mammalian cells. Proc. Natl. Acad. Sci. USA 99(9):6047-6052)。
【0021】
アンチセンス分子またはRNA干渉分子は、インビトロで細胞に、またはインビボで例えば哺乳類の腫瘍に輸送することができる。当技術分野で周知の典型的な輸送手段を使用することができる。例えば、腫瘍への輸送は、腫瘍内への注入によって達成可能である。静脈内、筋肉内、腹腔内、動脈内、外科手術中の局所輸送、内視鏡経由、皮下、および経口を含むが、これらに限定されない他の輸送様式を使用することができる。マウスモデルでは、アンチセンス分子またはRNA干渉分子をインビトロで腫瘍細胞に導入することが可能であり、また続いて腫瘍細胞をマウスに投与することができる。ベクターは、任意の特定の応用を鑑みて、所望の特性を考慮して選択することができる。ベクターは、ウイルスベクターまたはプラスミドベクターの場合がある。アデノウイルスベクターは、この点で有用である。組織特異的なプロモーター、細胞型特異的なプロモーター、または調節型プロモーターを使用して、阻害性ポリヌクレオチド分子の転写を制御することができる。リポソームまたはナノ粒子などの非ウイルス担体を使用することもできる。
【0022】
当業者であれば、本発明のp110αタンパク質を使用することで、対象タンパク質に特異的に結合する抗体を容易に作製することができる。このような抗体は、モノクローナル抗体またはポリクローナルの場合がある。このような抗体は、キメラ抗体、ヒト化抗体、または全体がヒト由来の抗体の場合がある。Fab、Fab'、Fab2、Fab'2、および1本鎖可変領域を含む、抗体の任意の機能性断片または誘導体を使用することができる。断片または誘導体は、内皮のマーカータンパク質に対する結合の特異性を保持している限りにおいて使用することができる。抗体の結合特異性は、任意の一連の条件で、無関係の抗原または抗原混合物に対する結合を、適切な抗原に対する結合と比較することで試験できる。仮に抗体が、無関係な抗原または抗原混合物に対する結合より、少なくとも2倍、5倍、7倍、および好ましくは10倍強く、適切な抗原と結合する場合は、結合は特異的であると見なされる。
【0023】
このような部分的なヒト抗体または完全なヒト抗体を作製する手法は当技術分野で周知であり、またそのような任意の手法を使用することができる。1つの特に好ましい態様によれば、完全ヒト抗体の配列は、ヒトの重鎖および軽鎖の抗体遺伝子を発現するように作製されたトランスジェニックマウスで作製される。さまざまなクラスの抗体を産生可能な、このようなトランスジェニックマウスの多数の系列が作製されている。所望の抗体を産生するトランスジェニックマウスに由来するB細胞を融合させて、所望の抗体の連続産生用のハイブリドーマ細胞系列を作製することができる。これについては文献を参照されたい(Nina D. Russel, Jose R. F. Corvalan, Michael L. Gallo, C. Geoffrey Davis, Liise-Anne Pirofski. Production of Protective Human Antipneumococcal Antibodies by Transgenic Mice with Human Immunoglobulin Loci Infection and Immunity April 2000, p.1820-1826; Michael L. Gallo, Vladimir E. Ivanov, Aya Jakobovits, and C. Geoffrey Davis. The human immunoglobulin loci introduced into mice: V(D) and J gene segment usage similar to that of adult humans European Journal of Immunology 30: 534-540, 2000; Larry L. Green. Antibody engineering via genetic engineering of the mouse: XenoMouse strains are a vehicle for the facile generation of therapeutic human monoclonal antibodies. Journal of Immunological Methods 231 11-23, 1999; Yang X-D, Corvalan JRF, Wang P. Roy CM-N and Davis CG. Fully Human Anti-interleukin-8 Monoclonal Antibodies: Potential Therapeutics for the Treatment of Inflammatory Disease States. Journal of Leucocyte Biology Vol.66, pp401-410 (1999); Yang X-D, Jia X-C, Corvalan JRE:, Wang P. CG Davis and Jakobovits A. Eradication of Established Tumors by a Fully Human Monoclonal Antibody to the Epidermal Growth Factor Receptor without Concomitant Chemotherapy. Cancer Research Vol.59, Number 6, ppl236-1243. (1999); Jakobovits A. Production and selection of antigen-specific fully human monoclonal antibodies from mice engineered with human Ig loci. Advanced Drug Delivery Reviews Vol.31, pp:33-42 (1998); Green L and Jakobovits A. Regulation of B cell development by variable gene complexity in mice reconstituted with human immunoglobulin yeast artificial chromosomes. J. Exp. Med. Vol.188, Number 3, pp:483-495 (1998); Jakobovits A. The long-awaited magic bullets: therapeutic human monoclonal antibodies from transgenic mice. Exp. Opin. Invest. Drugs Vol.7(4), pp:607-614 (1998); Tsuda H. Maynard-Currie K, Reid L, Yoshida T. Edamura K, Maeda N. Smithies O. Jakobovits A. Inactivation of Mouse HPRT locus by a 203-bp retrotransposon insertion and a 55-kb gene-targeted deletion: establishment of new HPRT-Deficient mouse embryonic stem cell lines. Genomics Vol.42, pp:413-421 (1997); Sherman-Gold, R. Monoclonal Antibodies: The Evolution from '80s Magic Bullets To Mature, Mainstream Applications as Clinical Therapeutics. Genetic Engineering News Vol.17, Number 14 (August 1997); Mendez M, Green L, Corvalan J. Jia X-C, Maynard-Currie C, Yang X-d, Gallo M, Louie D, Lee D, Erickson K, Luna J. Roy C, Abderrahim H. Kirschenbaum F. Noguchi M, Smith D, Fukushima A, Hales J. Finer M, Davis C, Zsebo K, Jakobovits A. Functional transplant of megabase human immunoglobulin loci recapitulates human antibody response in mice. Nature Genetics Vol.15, pp:146-156 (1997); Jakobovits A. Mice engineered with human immunoglobulin YACs: A new technology for production of fully human antibodies for autoimmunity therapy. Weir's Handbook of Experimental Immunology, The Integrated Immune System Vol.IV, pp:194.1-194.7 (1996); Jakobovits A. Production of fully human antibodies by transgenic mice. Current Opinion in Biotechnology Vol.6, No.5, pp:561-566 (1995); Mendez M, Abderrahim H. Noguchi M, David N. Hardy M, Green L, Tsuda H. Yoast S. Maynard-Currie C, Garza D, Gemmill R. Jakobovits A, Klapholz S. Analysis of the structural integrity of; YACs comprising human immunoglobulin genes in yeast and in embryonic stem cells. Genomics Vol.26, pp:294-307 (1995); Jakobovits A. YAC Vectors: Humanizing the mouse genome. Current Biology Vol.4, No.8, pp:761-763 (1994); Arbones M, Ord D, Ley K, Ratech H. Maynard-Curry K, Otten G. Capon D, Tedder T. Lymphocyte homing and leukocyte rolling and migration are impaired in L- selectin-deficient mice. Immunity Vol.1, No.4, pp:247-260 (1994); Green L, Hardy M, Maynard-Curry K, Tsuda H. Louie D, Mendez M, Abderrahim H. Noguchi M, Smith D, Zeng Y. et. al. Antigen specific human monoclonal antibodies from mice engineered with human Ig heavy and light chain YACs. Nature Genetics Vol.7, No.1, pp:13-21 (1994); Jakobovits A, Moore A, Green L, Vergara G. Maynard-Curry K, Austin H. Klapholz S. Germ-line transmission and expression of a human-derived yeast artificial chromosome. Nature Vol.362, No.6417, pp:255-258 (1993); Jakobovits A, Vergara G. Kennedy J, Hales J, McGuinness R, Casentini-Borocz D, Brenner D, Otten G. Analysis of homozygous mutant chimeric mice: deletion of the immunoglobulin heavy-chain joining region blocks B-cell development and antibody production. Proceedings of the National Academy of Sciences USA Vol.90, No.6, pp:2551-2555 (1993); Kucherlapati et al., U.S. 6,1075,181)。
【0024】
抗体は、ファージディスプレイ法で作製することもできる。このような手法で一次抗体を単離することができるほか、特異性または抗体結合力の特徴を変化させた異型を作製することができる。利便性を考慮して、1本鎖Fvを使用することもできる。これらは望ましいならば、ワクチンを接種したトランスジェニックマウスから作製することができる。抗体は、細胞培養で、ファージ中で、またはウシ、ウサギ、ヤギ、マウス、ラット、ハムスター、モルモット、ヒツジ、イヌ、ネコ、サル、チンパンジー、類人猿を含むが、これらに限定されない、さまざまな動物で産生させることができる。
【0025】
抗体は、放射性原子、発色団、フルオロフォアなどの検出用部分で標識することができる。このような標識された抗体を、インビボまたは単離された被験試料のいずれかを対象とした診断法に使用することができる。抗体には例えば、化学療法剤やトキシンなどの薬剤を結合させることも可能である。薬剤は、サイトカインに、リガンドに、または他の抗体に連結可能である。抗腫瘍作用を引き出すための、抗体とのカップリングに適した薬剤には、インターロイキン2(IL-2)や腫瘍壊死因子(TNF)などのサイトカイン;アルミニウム(III)フタロシアニンテトラスルホン酸、ヘマトポルフィリン、およびフタロシアニンを含む、光線力学療法に使用される光増感物質;ヨウ素-131(131I)、イットリウム-90(90Y)、ビスマス-212(212Bi)、ビスマス-213(213Bi)、テクネチウム-99m(99mTc)、レニウム-186(186Re)、およびレニウム-188(188Re)などの放射性核種;ドキソルビシン、アドリアマイシン、ダウノルビシン、メトトレキセート、ダウノマイシン、ネオカルチノスタチン、およびカルボプラチンなどの抗生物質;ジフテリアトキシン、シュードモナス属外毒素A、ブドウ球菌エンテロトキシンA、アブリン-Aトキシン、リシンA(脱グリコシル化リシンAおよび天然のリシンA)、TGF-アルファトキシン、タイワンコブラ(naja naja atra)の細胞毒、およびゲロニン(植物トキシン)などの、細菌、植物、および他のトキシン;レストリクトシン(restrictocin)(Aspergillus restrictusが産生するリボソーム不活性化タンパク質)、サポリン(サボンソウ(Saponaria officinalis)のリボソーム不活性化タンパク質)などの、植物、細菌、および真菌のリボソーム不活性化タンパク質ならびにRNase;チロシンキナーゼ阻害剤;ly207702(ジフルオロ化プリンヌクレオシド);抗腫瘍剤(例えばアンチセンスオリゴヌクレオチド、トキシン(メトトレキセートなど)をコードするプラスミド)を含むリポソーム;ならびに他の抗体またはF(ab)などの抗体断片などがある。
【0026】
当業者であれば、当技術分野で周知である、このような抗体誘導体を容易に理解して作製することができる。抗体は、それ自体が細胞障害性を有する場合があるほか、細胞毒性薬を体内の特定部位に輸送するために使用することができる。抗体は、治療を必要とする個体に、受動免疫の様式で投与することができる。
【0027】
低分子タンパク質キナーゼ阻害剤の成功を考えれば、上記のような変異を有する癌患者、または一般に癌である多数の患者の治療用に、p110αの特異的もしくは非特異的な阻害剤を開発することができる。広域のPI3K阻害剤を開発することは、LY294002およびワートマニンに関する研究(2、21、22)で明らかにされているように、明らかに可能である。発明者らが得たデータは、p110αを標的とするが他のPI3Kは標的としない、特異性の高い阻害剤の開発が有用なことを示唆している。
【0028】
化学療法剤候補は、p110αの活性または発現を阻害する薬剤として同定することができる。被験化合物は、合成化合物または天然化合物の場合がある。被験化合物は、生理的活性を有するか否かについて既知である可能性がある。化学療法剤候補に関する試験は、無細胞系を対象に、または細胞全体を対象として実施できる。p110αの活性は、当技術分野で既知の手段で試験することができる。このような手段には、参考文献2、22、およびTruitt et al., J. Exp. Med., 179, 1071-1076 (1994)に記載された方法などがある。発現は、PI3KCAのタンパク質またはmRNAを決定することで追跡できる。ウェスタンブロッティングなどの抗体を使用する方法でタンパク質を決定することができる。ノーザンブロッティングでmRNAを測定することができる。他の方法を使用することができるが、それらに限定されない。化学療法剤を試験する際は、アッセイ法で使用されるp110αは野生型または活性化型の場合がある。活性化型は、E542K、E545K、Q546K、およびH1047Rからなる群より選択される置換変異を含む場合がある。また阻害剤を試験して、p110αまたはp110αの活性化型のいずれかに対する特異性を決定することができる。比較試験をPIK3CB、PIK3CG、PIK3C2A、PIK3C2B、PIK3C2G、PIK3C3、A-TM、ATR、FRAP1、LAT1-3TM、SMG1、PRKDC、およびTRRAPを含む類似の酵素を対象に実施することで、p110α酵素に対する相対的な特異性を決定できる。
【0029】
PIK3CAのコード配列中の非同義の遺伝子内変異が、患者の被験組織中に同定されたら、こうした情報を元に治療に関する判断を下すことができる。このような変異を有する患者は、p110α阻害剤を使用する治療の有力な候補となる。このような阻害剤は、阻害剤のファミリーに特異的な場合もあれば一般的な場合もある。このような阻害剤にはLY294002やワートマニンなどがある。このような阻害剤はさらに、p110αに特異的な抗体結合領域を含む分子を含む。このような分子については既に説明した。
【0030】
PIK3CAの増幅用および/または配列決定用のプライマーのセットは、キットの状態で、または個々の成分がまとめられた状態で提供される場合がある。有用なプライマーセットは、任意選択で配列決定用プライマーと組み合わされた、フォワードプライマーとリバースプライマーの対を含む。フォワードプライマーを配列番号:6〜158に示す。リバースプライマーを配列番号:159〜310に示す。配列決定用プライマーを配列番号:311〜461に示す。対または三つ組、またはこれらの対もしくは三つ組の組み合わせを包装して、PIK3CA遺伝子の配列の一部を増幅および/または配列決定する際に、ともに使用することができる。プライマー対は、1個または複数の容器内に包装することができる。本発明の方法に用いるプライマーの使用に関する指示書は、利便性を考慮して、紙、電子媒体、またはワールドワイドウェブのアドレスを含む任意のメディアとして提供される場合がある。
【0031】
本発明を、本発明の現時点で好ましい実施様式を含む特定の実施例に関して説明したが、当業者であれば、上述した系および手法に、添付の特許請求の範囲に記載された本発明の趣旨および範囲に含まれる数多くの変更や入れ替えがありうることを理解すると思われる。
【実施例】
【0032】
実施例
実施例1-本実施例は、PIK3CAの遺伝子が、この遺伝子ファミリーにおける主な標的であることを示す
PI3Kが腫瘍形成に遺伝学的に関与するか否かを評価するために、発明者らは、結腸直腸癌における、この遺伝子ファミリーの遺伝子群のDNA配列を直接調べた。
【0033】
PI3Kの触媒サブユニットは、その基質特異性に応じて3つの主なクラスに分けられる(5)。加えて、mTORファミリーのタンパク質を含む、より遠縁の一連のタンパク質は第4のクラスを構成する(6)。発明者らは、隠れマルコフモデルを用いて、ヒトゲノム上の既知のPI3Kのドメインに関連するキナーゼドメインを含む15のヒト遺伝子を同定した(7)。内訳は、PI3Kが7つ、mTORサブファミリーの遺伝子が6つ、および未同定のPI3K様遺伝子が2つである(表1)。
【0034】
(表1)解析したPI3K遺伝子

*PI3K遺伝子群は、過去に報告されたクラス(S3、S4)に分けられる。クラスI、クラスII、およびクラスIIIはPI3K触媒サブユニットを含み、クラスIVは、mTOR(target of rapamycin)、ATM(ataxia telangiectasia mutated)、およびDNAPK(DNA-dependent protein kinase)のサブファミリーのメンバーを含む、PI3K様遺伝子、ならびに過去に未同定の2つの遺伝子を含む。
【0035】
発明者らはまず、これらの遺伝子の推定キナーゼドメインをコードする111のエキソンを調べた(表2)。エキソンをポリメラーゼ連鎖反応(PCR)で増幅し、35の結腸直腸癌のゲノムDNAから配列を直接決定した(8)。1つの遺伝子(PIK3CA)のみが、いくつかの体細胞(すなわち腫瘍特異的な)変異を含んでいた。
【0036】
(表2)PCRによる増幅および配列決定に使用したプライマー






1配列番号:6〜165(フォワードプライマー)
2配列番号:166〜325(リバースプライマー)
3配列番号:326〜485(配列決定用プライマー)
【0037】
実施例2-本実施例は、PIK3CA遺伝子内における変異の顕著な集中について示す
次に、別の199の結腸直腸癌を対象にPIK3CAの全コードエキソンを解析した結果、計74(32%)の腫瘍に変異の存在が明らかとなった(表3および図1の例)。
【0038】
(表3)ヒトの癌におけるPIK3CAの変異

*変異に起因するヌクレオチドおよびアミノ酸の変化があるエキソン番号。ヌクレオチドの位置は、コード配列中の位置を示す(位置1は、開始コドンの先頭に対応する)。機能ドメインについては、図1のレジェンドに示す。#個々の腫瘍に見出された非同義変異の数。Colon=結腸直腸癌、GBM=膠芽腫、gastric=胃癌、breast=乳癌、lung=肺癌、pancreas=膵臓癌、medulloblastoma=髄芽腫、adenomas=良性の結腸直腸腫瘍。列挙した全ての変異は体細胞変異であるが、対応する正常組織が得られなかった5つの結腸直腸癌および1つの膠芽腫は例外とする。変異は、201例のミスマッチ修復(MMR)能を有する結腸直腸癌の58例で、33例のMMR能を有なさい結腸直腸癌の16例で同定された。PIK3CAに変異を有する一部の腫瘍は、KRASまたはBRAFに変異を含むが、他の腫瘍は含まない。この事実は、これらの遺伝子群が独立した経路で作用することを示唆している。7つの腫瘍は2つの体細胞変異を含んでいた。表に記載された92の非同義変異に加えて、発明者らは3つの同義変異を見出した。
【0039】
実施例3-本実施例は、PIK3CAの変異が腫瘍形成の後期に現われることを示す
新生物の進行中におけるPIK3CAの変異のタイミングを決定するために、発明者らは、大きさおよび異形成の程度が多様な76の前悪性結腸直腸腫瘍の評価を行った。直径が5 cmを上回り、腺管絨毛状の極めて進行した線種で、PIK3CAの2つの変異(E542KおよびE542V)のみが見出された。この結果は、PIK3CAの異常が、新形成の比較的後期、すなわち腫瘍が浸潤および転移を開始する時期の近くで現われることを示唆している。
【0040】
実施例4-本実施例は、多種多様な種類の癌におけるPIK3CAの変異を示す
次に発明者らは、他の種類の腫瘍における遺伝子変化に関してPIK3CAの評価を行った(表1)。変異は、膠芽腫の15例中4例(27%)で、胃癌の12例中3例(25%)で、乳癌の13例中1例(8%)で、また肺癌の24例中1例(4%)で同定された。膵臓癌の11例と髄芽腫の12例では変異は認められなかった。合計すると89の変異が認められた。そのうち3つの変異はヘテロ接合性であった。
【0041】
実施例5-本実施例は、認められた遺伝子変化がランダムではないことを示す
5種類の異なる癌について、PIK3CAにかなりの数の変異が認められたことは、これらの変異が機能的に重要なことを強く示唆する。この結論は、別の2つの独立した証拠によって支持される。第1に、非同義変異と同義変異の比率の解析は、腫瘍の進行中における選択の適切な尺度となる。というのは、サイレントな変化に増殖上の利点がある可能性は低いからである。PIK3CAにおける非同義変異:同義変異の比は89:2であり、偶然による推定値2:1の比をはるかに上回った(P<1x10-4)。第2に、PI3Kの触媒ドメインおよびアクセサリードメインに位置する非同義的変化の出現率は、1 Mbの腫瘍DNAあたり約120であり、癌細胞のゲノム上に観察された非機能的変化のバックグラウンドの変異出現率より100倍以上高い(P<1x10-4)(9)。
【0042】
キナーゼ機能に対する、これらの変異の作用は、実験によって試験されていないものの、PIK3CA内における変異の位置および性質は、変異が活性化変異である可能性が高いことを意味している。切断型の変異は認められず、75%を上回る変異が第9エキソンおよび第20エキソンの2つの小さな集中領域中に認められた(表2および図1)。これらの集中領域内で変化した残基は、進化的に高度に保存されており、性質がマウス、ラット、およびニワトリで保持されている。特定のドメインにおける体細胞のミスセンス変異の集中は、RAS(10)、BRAF(11、12)、β-カテニン(13)、およびチロシンキノーム(14)の遺伝子などの他の癌遺伝子の活性化変異に関して認められた結果と同等である。
【0043】
以上の遺伝学的データは、変異型のPIK3CAが、ヒトの癌における癌遺伝子として機能する可能性が高いことを示唆している。
【0044】
実施例6-本実施例は、PIK3CAの遺伝子増幅が一般的ではないことを示す
96の結腸直腸癌を対象としたPIK3CAの定量的PCR解析では遺伝子増幅の証拠は得られず、遺伝子のコピー数の変化が、この腫瘍における活性化の重要な機構ではないことが示唆された。使用したプライマーを以下に示す:
リアルタイムPI3K hCT1640694 20-1F(イントロン)

;および
リアルタイムPI3K hCT1640694 20-1R

【0045】
本出願の最後に添付した配列表は、以下の配列を含む:
配列番号:1=コード配列のみ(配列番号:2のnt 13〜3201)
配列番号:2=mRNA配列(NM_006218)
配列番号:3=タンパク質配列(NP_006209)
配列番号:4=第9エキソン
配列番号:5=第20エキソン
配列番号:6〜165=フォワードプライマー
配列番号:166〜325=リバースプライマー
配列番号:326〜485=配列決定用プライマー
配列番号:486および487=増幅用プライマー
【0046】
参考文献および注記

7.PI3Kの触媒サブユニットは、Celera社の概要ヒトゲノム配列中に存在するInterPro(IPR)PI3Kドメイン(IPR000403)の解析によって同定された。この結果、15のPI3K遺伝子および関連するPI3K遺伝子が同定された。PIK3CD遺伝子のキナーゼドメインは、現時点のヒトゲノム概要配列には記載されていなかったので、本研究の対象から外した。
8.同定されたPI3Kのキナーゼドメインを含む、全ての注釈付きエキソンおよび隣接するイントロンの配列を、Celera社の概要ヒトゲノム配列(URLアドレス:wwwホストサーバ、ドメイン名celera.com)から抽出した。解析した全ての遺伝子のCelera社およびゲンバンクのアクセッション番号を表1に示す。PCRによる増幅および配列決定用のプライマーは、Primer 3プログラム(URLアドレス:httpファイル型式、www-genome.wi.mit.eduホストサーバ、cgi-binドメイン名、プライマーディレクトリ、primer3_www.cgiサブディレクトリ)を使用して設計され、MWG(High Point, NC)またはIDT(Coralville, IA)によって合成された。PCRによる増幅および配列決定は、初期の継代細胞系列、または一次腫瘍に由来する腫瘍のDNAを対象に、384キャピラリ自動配列決定装置(Spectrumedix, State College, PA)を使用して、文献(12)に記載された手順で実施された。配列の読み取り波形データを整列化して解析し、潜在的なゲノム変化を、Mutation Explorerソフトウェアパッケージ(SoftGenetics, State College, PA)を使用して同定した。抽出されたエキソンのうち96%の解析に成功した。PCRによる増幅および配列決定に使用された全てのプライマーの配列を表S1に示す。

【特許請求の範囲】
【請求項1】
以下の段階を含む、癌を有することが疑われるヒトの身体試料における癌を評価する方法:
身体試料中のPIK3CAのコード配列中の非同義の遺伝子内変異を決定する段階であって、ここで野生型のPIK3CAのコード配列が、配列番号:2で表される配列を含む段階;
PIK3CAのコード配列中の非同義の遺伝子内変異が、身体試料中に認められる場合に、癌を有する可能性が高いヒトであると同定する段階。
【請求項2】
身体試料が、新生物であることが疑われる第1の組織であり、かつ以下の段階をさらに含む、請求項1記載の方法:
第1および第2の組織がヒトから単離され、非同義変異の存在に関して、新生物であることが疑われていない第2の組織を試験する段階;
変異が第2の組織に存在しない場合に、非同義の遺伝子内変異が体細胞変異であると同定する段階。
【請求項3】
非同義の遺伝子内変異が第9エキソン(配列番号:4)に存在する、請求項1記載の方法。
【請求項4】
非同義の遺伝子内変異が第20エキソン(配列番号:5)に存在する、請求項1記載の方法。
【請求項5】
非同義の遺伝子内変異がPIK3CAのへリックスドメイン(配列番号:2のnt 1567〜2124)に存在する、請求項1記載の方法。
【請求項6】
非同義の遺伝子内変異がPIK3CAのキナーゼドメイン(配列番号:2のnt 2095〜3096)に存在する、請求項1記載の方法。
【請求項7】
非同義の遺伝子内変異がPIK3CAのP85BDドメイン(配列番号:2のnt 103〜335)に存在する、請求項1記載の方法。
【請求項8】
身体試料が結腸直腸組織である、請求項1記載の方法。
【請求項9】
身体試料が脳組織である、請求項1記載の方法。
【請求項10】
身体試料が胃組織である、請求項1記載の方法。
【請求項11】
身体試料が乳房組織である、請求項1記載の方法。
【請求項12】
身体試料が肺組織である、請求項1記載の方法。
【請求項13】
身体試料が血液、血清、または血漿である、請求項1記載の方法。
【請求項14】
身体試料が痰である、請求項1記載の方法。
【請求項15】
身体試料が唾液である、請求項1記載の方法。
【請求項16】
身体試料が尿である、請求項1記載の方法。
【請求項17】
身体試料が便である、請求項1記載の方法。
【請求項18】
身体試料が乳頭吸引物である、請求項1記載の方法。
【請求項19】
第9エキソンおよび第20エキソンからなるPIK3CAのエキソンを試験して非同義変異を決定する、請求項1記載の方法。
【請求項20】
第9エキソンおよび第20エキソンを含むPIK3CAのエキソンを試験して非同義変異を決定する、請求項1記載の方法。
【請求項21】
非同義の遺伝子内変異が置換変異である、請求項1記載の方法。
【請求項22】
非同義の遺伝子内変異がG1624Aである、請求項1記載の方法。
【請求項23】
非同義の遺伝子内変異がG1633Aである、請求項1記載の方法。
【請求項24】
非同義の遺伝子内変異がC1636Aである、請求項1記載の方法。
【請求項25】
非同義の遺伝子内変異がA3140Gである、請求項1記載の方法。
【請求項26】
身体試料を、PIK3CAのコード配列のヌクレオチド位置1624、1633、1636、および3140における変異に関して試験する、請求項1記載の方法。
【請求項27】
身体試料を、変異G1624A、G1633A、C1636A、およびA3140Gに関して試験する、請求項1記載の方法。
【請求項28】
身体試料を、変異G113A、T1258C、G3129T、およびC3139Tに関して、さらに試験する、請求項21記載の方法。
【請求項29】
身体試料を、変異G2702Tに関して、さらに試験する、請求項27記載の方法。
【請求項30】
非同義の遺伝子内変異が欠失変異である、請求項1記載の方法。
【請求項31】
以下の段階を含む、ヒトにおける腫瘍の進行を阻害する方法:
腫瘍に対するアンチセンスオリゴヌクレオチドまたはアンチセンスコンストラクトをヒトに投与する段階であって、ここでアンチセンスオリゴヌクレオチド、またはアンチセンスコンストラクトから転写されるRNAは、PIK3CA(配列番号:2)から転写されるmRNAに相補的であり、それによって腫瘍で発現されるp110αタンパク質の量を減少させる段階。
【請求項32】
アンチセンスオリゴヌクレオチド、またはアンチセンスコンストラクトから転写されるRNAが、mRNAの最初のメチオニンコドンを含む該mRNAの領域と相補的である、請求項31記載の方法。
【請求項33】
以下の段階を含む、ヒトにおける腫瘍の進行を阻害する方法:
2ヌクレオチドの3'突出末端を有するヒトPIK3CAのmRNAの19〜21 bpの2本鎖を含むsiRNAをヒトに投与する段階であって、ここで2本鎖の一方の鎖は、PIK3CA(配列番号:2)から転写されるmRNAから選択される隣接配列を含み、それによって腫瘍で発現されるp110αタンパク質の量を減少させる段階。
【請求項34】
隣接配列が、mRNAの最初のメチオニンコドンを含む、請求項33記載の方法。
【請求項35】
以下の段階を含む、腫瘍の進行を阻害する方法:
p110α(配列番号:3)に特異的に結合する抗体結合領域を含む分子を腫瘍に投与する段階。
【請求項36】
抗体結合領域が、PIK3CAのキナーゼドメイン(配列番号:2のnt 2095〜3096)に特異的に結合する、請求項35記載の方法。
【請求項37】
抗体結合領域が、PIK3CAのへリックスドメイン(配列番号:2のnt 1567〜2124)に特異的に結合する、請求項35記載の方法。
【請求項38】
抗体結合領域が、PIK3CAのP85BDドメイン(配列番号:2のnt 103〜335)に特異的に結合する、請求項35記載の方法。
【請求項39】
以下の段階を含む、化学療法剤候補を同定する方法:
野生型または活性化変異型のp110α(配列番号:3)に被験化合物を接触させる段階;
p110α活性を測定する段階;
被験化合物がp110α活性を阻害した場合に、被験化合物を化学療法剤候補であると同定する段階。
【請求項40】
E542K、E545K、Q546K、およびH1047Rからなる群より選択される置換変異を含むp110αの変異型を被験化合物に接触させる、請求項39記載の方法。
【請求項41】
被験化合物を、p110αの活性化変異を有する腫瘍の治療用の候補化学療法剤であると同定する、請求項39記載の方法。
【請求項42】
被験化合物を、PIK3CAの置換変異を有する腫瘍の治療用の化学療法剤候補であると同定する、請求項39記載の方法。
【請求項43】
被験化合物を、PIK3CAの活性化変異をPIK3CAのキナーゼドメイン(配列番号:2のnt 2095〜3096)に有する腫瘍の治療用の化学療法剤候補であると同定する、請求項39記載の方法。
【請求項44】
被験化合物を、PIK3CAの活性化変異をPIK3CAのへリックスドメイン(配列番号:2のnt 1567〜2124)に有する腫瘍の治療用の化学療法剤候補であると同定する、請求項39記載の方法。
【請求項45】
被験化合物を、PIK3CAの活性化変異をPIK3CAのP85BDドメイン(配列番号:2のnt 103〜335)に有する腫瘍の治療用の化学療法剤候補であると同定する、請求項39記載の方法。
【請求項46】
以下の段階をさらに含む、請求項39記載の方法:
被験化合物を、PIK3CB、PIK3CG、PIK3C2A、PIK3C2B、PIK3C2G、PIK3C3、A-TM、ATR、FRAP1、LAT1-3TM、SMG1、PRKDC、およびTRRAPからなる群より選択される1つもしくは複数の酵素に接触させる段階;
被験化合物が、p110αを阻害するよりも、1つもしくは複数の該酵素を弱く阻害する場合に、被験化合物を特異的な化学療法剤候補であると同定する段階。
【請求項47】
PIK3CB、PIK3CG、PIK3C2A、PIK3C2B、PIK3C2G、およびPIK3C3を、p110α(PIK3CA)を阻害するよりも弱く阻害する被験化合物を、高度に特異的な化学療法剤候補であると同定する、請求項46記載の方法。
【請求項48】
PIK3CBおよびPIK3CGを阻害するよりも強くp110αを阻害する被験化合物を、高度に特異的であると同定する、請求項46記載の方法。
【請求項49】
接触させる段階を無細胞系で行う、請求項39記載の方法。
【請求項50】
接触させる段階を細胞全体において行う、請求項39記載の方法。
【請求項51】
以下の段階を含む、それを必要とする患者に、適切な化学療法剤を輸送する方法:
患者の身体試料中のPIK3CAのコード配列(配列番号:1)中における非同義の遺伝子内変異を決定する段階;
p110α阻害剤を患者に投与する段階。
【請求項52】
p110α阻害剤がLY294002である、請求項51記載の方法。
【請求項53】
p110α阻害剤がワートマニンである、請求項51記載の方法。
【請求項54】
p110α阻害剤が、p110αに特異的な抗体結合領域を含む分子である、請求項51記載の方法。
【請求項55】
抗体結合領域が、キナーゼドメイン(配列番号:2のnt 2095〜3096)と結合する、請求項54記載の方法。
【請求項56】
抗体結合領域が、へリックスドメイン(配列番号:2のnt 1567〜2124)と結合する、請求項54記載の方法。
【請求項57】
抗体結合領域が、P85BDドメイン(配列番号:2のnt 103〜335)と結合する、請求項54記載の方法。
【請求項58】
フォワードプライマーは配列番号:6〜165からなる群より選択され、リバースプライマーは配列番号:166〜325からなる群より選択され、かつ配列決定用プライマーは配列番号:326〜485からなる群より選択される、フォワードプライマー、リバースプライマー、および配列決定用プライマーからなる群より選択される、PIK3CAの増幅用および/または配列決定用の1つもしくは複数のプライマーのセット。
【請求項59】
1つまたは複数のプライマーが、PIK3CAのセグメント増幅用の少なくとも1つのフォワードプライマーおよび少なくとも1つのリバースプライマーを含む、請求項58記載のセット。
【請求項60】
1つまたは複数のプライマーが、PIK3CAのセグメントの増幅および配列決定用の少なくとも1つのフォワードプライマー、少なくとも1つのリバースプライマー、および少なくとも1つの配列決定用プライマーを含む、請求項58記載のセット。
【請求項61】
1つまたは複数のプライマーが、フォワードプライマー、リバースプライマー、および配列決定用プライマーの全てを含む、請求項58記載のセット。
【請求項62】
1つの分割された、または分割されていない容器内に収納された、請求項58記載のセット。
【請求項63】
1つの分割された、または分割されていない容器内に収納された、請求項59記載のセット。
【請求項64】
1つの分割された、または分割されていない容器内に収納された、請求項60記載のセット。
【請求項65】
1つの分割された、または分割されていない容器内に収納された、請求項61記載のセット。
【請求項1】
以下の段階を含む、癌を有することが疑われるヒトの身体試料における癌を評価する方法:
身体試料中のPIK3CAのコード配列中の非同義の遺伝子内変異を決定する段階であって、ここで野生型のPIK3CAのコード配列が、配列番号:2で表される配列を含む段階;
PIK3CAのコード配列中の非同義の遺伝子内変異が、身体試料中に認められる場合に、癌を有する可能性が高いヒトであると同定する段階。
【請求項2】
身体試料が、新生物であることが疑われる第1の組織であり、かつ以下の段階をさらに含む、請求項1記載の方法:
第1および第2の組織がヒトから単離され、非同義変異の存在に関して、新生物であることが疑われていない第2の組織を試験する段階;
変異が第2の組織に存在しない場合に、非同義の遺伝子内変異が体細胞変異であると同定する段階。
【請求項3】
非同義の遺伝子内変異が第9エキソン(配列番号:4)に存在する、請求項1記載の方法。
【請求項4】
非同義の遺伝子内変異が第20エキソン(配列番号:5)に存在する、請求項1記載の方法。
【請求項5】
非同義の遺伝子内変異がPIK3CAのへリックスドメイン(配列番号:2のnt 1567〜2124)に存在する、請求項1記載の方法。
【請求項6】
非同義の遺伝子内変異がPIK3CAのキナーゼドメイン(配列番号:2のnt 2095〜3096)に存在する、請求項1記載の方法。
【請求項7】
非同義の遺伝子内変異がPIK3CAのP85BDドメイン(配列番号:2のnt 103〜335)に存在する、請求項1記載の方法。
【請求項8】
身体試料が結腸直腸組織である、請求項1記載の方法。
【請求項9】
身体試料が脳組織である、請求項1記載の方法。
【請求項10】
身体試料が胃組織である、請求項1記載の方法。
【請求項11】
身体試料が乳房組織である、請求項1記載の方法。
【請求項12】
身体試料が肺組織である、請求項1記載の方法。
【請求項13】
身体試料が血液、血清、または血漿である、請求項1記載の方法。
【請求項14】
身体試料が痰である、請求項1記載の方法。
【請求項15】
身体試料が唾液である、請求項1記載の方法。
【請求項16】
身体試料が尿である、請求項1記載の方法。
【請求項17】
身体試料が便である、請求項1記載の方法。
【請求項18】
身体試料が乳頭吸引物である、請求項1記載の方法。
【請求項19】
第9エキソンおよび第20エキソンからなるPIK3CAのエキソンを試験して非同義変異を決定する、請求項1記載の方法。
【請求項20】
第9エキソンおよび第20エキソンを含むPIK3CAのエキソンを試験して非同義変異を決定する、請求項1記載の方法。
【請求項21】
非同義の遺伝子内変異が置換変異である、請求項1記載の方法。
【請求項22】
非同義の遺伝子内変異がG1624Aである、請求項1記載の方法。
【請求項23】
非同義の遺伝子内変異がG1633Aである、請求項1記載の方法。
【請求項24】
非同義の遺伝子内変異がC1636Aである、請求項1記載の方法。
【請求項25】
非同義の遺伝子内変異がA3140Gである、請求項1記載の方法。
【請求項26】
身体試料を、PIK3CAのコード配列のヌクレオチド位置1624、1633、1636、および3140における変異に関して試験する、請求項1記載の方法。
【請求項27】
身体試料を、変異G1624A、G1633A、C1636A、およびA3140Gに関して試験する、請求項1記載の方法。
【請求項28】
身体試料を、変異G113A、T1258C、G3129T、およびC3139Tに関して、さらに試験する、請求項21記載の方法。
【請求項29】
身体試料を、変異G2702Tに関して、さらに試験する、請求項27記載の方法。
【請求項30】
非同義の遺伝子内変異が欠失変異である、請求項1記載の方法。
【請求項31】
以下の段階を含む、ヒトにおける腫瘍の進行を阻害する方法:
腫瘍に対するアンチセンスオリゴヌクレオチドまたはアンチセンスコンストラクトをヒトに投与する段階であって、ここでアンチセンスオリゴヌクレオチド、またはアンチセンスコンストラクトから転写されるRNAは、PIK3CA(配列番号:2)から転写されるmRNAに相補的であり、それによって腫瘍で発現されるp110αタンパク質の量を減少させる段階。
【請求項32】
アンチセンスオリゴヌクレオチド、またはアンチセンスコンストラクトから転写されるRNAが、mRNAの最初のメチオニンコドンを含む該mRNAの領域と相補的である、請求項31記載の方法。
【請求項33】
以下の段階を含む、ヒトにおける腫瘍の進行を阻害する方法:
2ヌクレオチドの3'突出末端を有するヒトPIK3CAのmRNAの19〜21 bpの2本鎖を含むsiRNAをヒトに投与する段階であって、ここで2本鎖の一方の鎖は、PIK3CA(配列番号:2)から転写されるmRNAから選択される隣接配列を含み、それによって腫瘍で発現されるp110αタンパク質の量を減少させる段階。
【請求項34】
隣接配列が、mRNAの最初のメチオニンコドンを含む、請求項33記載の方法。
【請求項35】
以下の段階を含む、腫瘍の進行を阻害する方法:
p110α(配列番号:3)に特異的に結合する抗体結合領域を含む分子を腫瘍に投与する段階。
【請求項36】
抗体結合領域が、PIK3CAのキナーゼドメイン(配列番号:2のnt 2095〜3096)に特異的に結合する、請求項35記載の方法。
【請求項37】
抗体結合領域が、PIK3CAのへリックスドメイン(配列番号:2のnt 1567〜2124)に特異的に結合する、請求項35記載の方法。
【請求項38】
抗体結合領域が、PIK3CAのP85BDドメイン(配列番号:2のnt 103〜335)に特異的に結合する、請求項35記載の方法。
【請求項39】
以下の段階を含む、化学療法剤候補を同定する方法:
野生型または活性化変異型のp110α(配列番号:3)に被験化合物を接触させる段階;
p110α活性を測定する段階;
被験化合物がp110α活性を阻害した場合に、被験化合物を化学療法剤候補であると同定する段階。
【請求項40】
E542K、E545K、Q546K、およびH1047Rからなる群より選択される置換変異を含むp110αの変異型を被験化合物に接触させる、請求項39記載の方法。
【請求項41】
被験化合物を、p110αの活性化変異を有する腫瘍の治療用の候補化学療法剤であると同定する、請求項39記載の方法。
【請求項42】
被験化合物を、PIK3CAの置換変異を有する腫瘍の治療用の化学療法剤候補であると同定する、請求項39記載の方法。
【請求項43】
被験化合物を、PIK3CAの活性化変異をPIK3CAのキナーゼドメイン(配列番号:2のnt 2095〜3096)に有する腫瘍の治療用の化学療法剤候補であると同定する、請求項39記載の方法。
【請求項44】
被験化合物を、PIK3CAの活性化変異をPIK3CAのへリックスドメイン(配列番号:2のnt 1567〜2124)に有する腫瘍の治療用の化学療法剤候補であると同定する、請求項39記載の方法。
【請求項45】
被験化合物を、PIK3CAの活性化変異をPIK3CAのP85BDドメイン(配列番号:2のnt 103〜335)に有する腫瘍の治療用の化学療法剤候補であると同定する、請求項39記載の方法。
【請求項46】
以下の段階をさらに含む、請求項39記載の方法:
被験化合物を、PIK3CB、PIK3CG、PIK3C2A、PIK3C2B、PIK3C2G、PIK3C3、A-TM、ATR、FRAP1、LAT1-3TM、SMG1、PRKDC、およびTRRAPからなる群より選択される1つもしくは複数の酵素に接触させる段階;
被験化合物が、p110αを阻害するよりも、1つもしくは複数の該酵素を弱く阻害する場合に、被験化合物を特異的な化学療法剤候補であると同定する段階。
【請求項47】
PIK3CB、PIK3CG、PIK3C2A、PIK3C2B、PIK3C2G、およびPIK3C3を、p110α(PIK3CA)を阻害するよりも弱く阻害する被験化合物を、高度に特異的な化学療法剤候補であると同定する、請求項46記載の方法。
【請求項48】
PIK3CBおよびPIK3CGを阻害するよりも強くp110αを阻害する被験化合物を、高度に特異的であると同定する、請求項46記載の方法。
【請求項49】
接触させる段階を無細胞系で行う、請求項39記載の方法。
【請求項50】
接触させる段階を細胞全体において行う、請求項39記載の方法。
【請求項51】
以下の段階を含む、それを必要とする患者に、適切な化学療法剤を輸送する方法:
患者の身体試料中のPIK3CAのコード配列(配列番号:1)中における非同義の遺伝子内変異を決定する段階;
p110α阻害剤を患者に投与する段階。
【請求項52】
p110α阻害剤がLY294002である、請求項51記載の方法。
【請求項53】
p110α阻害剤がワートマニンである、請求項51記載の方法。
【請求項54】
p110α阻害剤が、p110αに特異的な抗体結合領域を含む分子である、請求項51記載の方法。
【請求項55】
抗体結合領域が、キナーゼドメイン(配列番号:2のnt 2095〜3096)と結合する、請求項54記載の方法。
【請求項56】
抗体結合領域が、へリックスドメイン(配列番号:2のnt 1567〜2124)と結合する、請求項54記載の方法。
【請求項57】
抗体結合領域が、P85BDドメイン(配列番号:2のnt 103〜335)と結合する、請求項54記載の方法。
【請求項58】
フォワードプライマーは配列番号:6〜165からなる群より選択され、リバースプライマーは配列番号:166〜325からなる群より選択され、かつ配列決定用プライマーは配列番号:326〜485からなる群より選択される、フォワードプライマー、リバースプライマー、および配列決定用プライマーからなる群より選択される、PIK3CAの増幅用および/または配列決定用の1つもしくは複数のプライマーのセット。
【請求項59】
1つまたは複数のプライマーが、PIK3CAのセグメント増幅用の少なくとも1つのフォワードプライマーおよび少なくとも1つのリバースプライマーを含む、請求項58記載のセット。
【請求項60】
1つまたは複数のプライマーが、PIK3CAのセグメントの増幅および配列決定用の少なくとも1つのフォワードプライマー、少なくとも1つのリバースプライマー、および少なくとも1つの配列決定用プライマーを含む、請求項58記載のセット。
【請求項61】
1つまたは複数のプライマーが、フォワードプライマー、リバースプライマー、および配列決定用プライマーの全てを含む、請求項58記載のセット。
【請求項62】
1つの分割された、または分割されていない容器内に収納された、請求項58記載のセット。
【請求項63】
1つの分割された、または分割されていない容器内に収納された、請求項59記載のセット。
【請求項64】
1つの分割された、または分割されていない容器内に収納された、請求項60記載のセット。
【請求項65】
1つの分割された、または分割されていない容器内に収納された、請求項61記載のセット。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−183065(P2012−183065A)
【公開日】平成24年9月27日(2012.9.27)
【国際特許分類】
【出願番号】特願2012−52427(P2012−52427)
【出願日】平成24年3月9日(2012.3.9)
【分割の表示】特願2007−501815(P2007−501815)の分割
【原出願日】平成17年2月18日(2005.2.18)
【出願人】(301059640)ジョンズ ホプキンス ユニバーシティ (34)
【Fターム(参考)】
【公開日】平成24年9月27日(2012.9.27)
【国際特許分類】
【出願日】平成24年3月9日(2012.3.9)
【分割の表示】特願2007−501815(P2007−501815)の分割
【原出願日】平成17年2月18日(2005.2.18)
【出願人】(301059640)ジョンズ ホプキンス ユニバーシティ (34)
【Fターム(参考)】
[ Back to top ]

