ヒトサイトメガロウイルスの免疫ー反応性ペプチドCTLエピトープ
【課題】潜伏感染しているヒトサイトメガロウイルス(HCMV)の活性化〜発病を防止できる、ワクチンの提供。
【解決手段】潜伏HCMVを保有する患者のCD8+クラスI MHC拘束性細胞傷害性T-リンパ球により認識される免疫原性エピトープである複数のペプチド(およびその免疫学的に機能的な変異体)からなる、HCMVに対するワクチン。また、脂質化したペプチド、DNAアジュバント、または抗原提示細胞を含む細胞性ワクチン。さらに該ペプチドをコードする、ウイルスベクターワクチン。これらワクチンは、HCMVに対するCTLおよびCTLpを活性化することができ、HCMVに対する細胞性免疫応答を引き出すために有用である。
【解決手段】潜伏HCMVを保有する患者のCD8+クラスI MHC拘束性細胞傷害性T-リンパ球により認識される免疫原性エピトープである複数のペプチド(およびその免疫学的に機能的な変異体)からなる、HCMVに対するワクチン。また、脂質化したペプチド、DNAアジュバント、または抗原提示細胞を含む細胞性ワクチン。さらに該ペプチドをコードする、ウイルスベクターワクチン。これらワクチンは、HCMVに対するCTLおよびCTLpを活性化することができ、HCMVに対する細胞性免疫応答を引き出すために有用である。
【発明の詳細な説明】
【発明の詳細な説明】
【0001】
連邦政府委託研究に関する記述
本発明は、米国保健社会福祉省からの助成番号CA30206、CA77544およびCA33572の形式における政府の支援を用いて行われた。政府は本発明において特定の権利を有しうる。
【0002】
発明の背景
1.技術分野
本発明は、ヒトサイトメガロウイルス(HCMV)、および特にヒトにおいてHCMVのT-細胞エピトープとして機能する1つあるいはそれ以上のサブユニットタンパク質由来のペプチド断片に関する。本発明のペプチドは、ヒト細胞傷害性Tリンパ球(CTL)がHCMVの感染と同等にヒト細胞を認識して融解することを指示することが可能である。これらのペプチドを使用して製剤化されるワクチンも、本発明により提供される。
【0003】
2.背景技術の説明
HCMVゲノムは比較的大きく(約235k塩基対)、200以上のタンパク質をコードする能力を有する。HCMVは、構造的あるいは酵素的な機能を有するカプシドタンパク質により囲まれる二本鎖DNAの核複合体、および外側の糖ペプチド-および糖脂質-含有膜エンベロープから成る。HCMVはヘルペスウイルス科の一員であり、多くの臨床的症候群に関連している。
【0004】
HCMV感染は比較的よくあり、通常は健康で免疫応答のある小児あるいは大人において自己制限的であるが(L. Rasmussen, Curr. Top. Microbiol. Immunol. 154:221-254, 1990)、しかし、全新生児の約10%がHCMVを保持しており、ウイルスは胎児あるいは幼児に重篤な先天性疾患を引き起こす可能性がある。これらの新生児のある者は、先天的な出生欠損症を受ける。新生児の別の者は、疾患の症状を示す前のある期間サイトメガロウイルスを保持する。HCMVは、活性のある感染を保持していた母親から子宮内で感染を受けた小児における精神遅滞のよくある原因である。
【0005】
いくつかの研究は、それ以外は健康な大人における持続的で一見すると無症状なHCMV感染が、ある個人において健康のリスクであるかどうかを問うことを始めた。例えば、冠動脈血管形成術を行った個人は時々、その後に動脈リモデリングの結果として再狭窄を生じる。ある研究では、再狭窄を有するそのような患者の約3分の1が、彼らの動脈病変に検出可能なHCMV DNAを有していた(E. Speir et al., Science 265:391-394 (1994))。別の研究では、CMV血清陽性の患者は、それらの血清陰性の対照者より5倍以上再狭窄を生じやすかった(Y.F. Zhou et al., New England J. Med. 335:624-630 (1996))。これらの研究は、HCMVに感染した宿主細胞の数を減少させることは特定の個人にとって有益でありうることを示唆する。
【0006】
HCMVはまた、免疫不全の患者における罹患率および死亡率にも関連した。HCMVは、後天性免疫不全症候群(AIDS)にかかっている患者の治療において重要に考慮されるものである。明確な合併症はウイルス性網膜炎であり、それはもし治療されないと、失明する可能性がある。歴史的に、CMV病はHIV-1感染個人をおそう日和見感染のよりひどいものの一つであった。CD4+T細胞数が100/mm3以下に低下したときに現れるCMVウイルス血症の疾患徴候は、脳炎、腸炎および肺炎を含む。剖検では、重篤なCMV網膜炎を有したAIDS患者の多くでCMV病の多臓器関与がある。HCMVに感染した患者はしばしば、唾液腺、脳、腎臓、肝臓および肺を含む、彼らの生命維持に必要な臓器のいくつかの損傷を受ける。さらに、HCMVは、単球増多症および間質性肺炎を含む古典的な広いスペクトルの症候群に関連する。HCMVはまた、発癌の可能性およびカポジ肉腫を含むある型の悪性腫瘍との関連の可能性も有する。
【0007】
HCMVは日和見感染を起こして、例えば、免疫抑制された臓器移植患者に様々な合併症を引き起こしうる。抗ウイルス化学療法が使用される以前は、HCMV感染は骨髄移植(BMT)後合併症の実質的な割合の原因であった(J. Meyers et al., J. Infect Dis. 153:478-488 (1986))。実質的な抗-HCMV活性を有するガンシクロビルなどの薬物の出現により、BMT後CMV感染に関連する合併症が劇的に減少した(G. Schmidt et al. New England J. Med. 324:1005-1011 (1991); J.M. Goodrich et al., New England J. Med. 325:1601-1607 (1991))。
【0008】
ガンシクロビルは、HCMV感染の診断前に予防的に投与するとき最も効果がある。しかし、このアプローチは、好中球減少をきたすレシピエントの割合の増加(3分の1)および随伴する致命的な細菌および真菌病の数の増加を含むいくつかのネガティブな結果を有する(J.M. Goodrich et al., Ann. Intern. Med. 118:173-178 (1993))。HCMV抗原あるいはDNAが培養方法により最初に検出されるときにガンシクロビルを与える代替アプローチは、全ての患者の予防あるいは治療後疾患と比較して、生存的な利点は提供しなかった(D.J. Winston et al., Ann. Intern. Med. 118:179-184 (1993))。結局、副作用の急激な性質のため、治療された患者には入院の延長および成長因子の投与が必要となり、ガンシクロビル予防の費用につながり、BMT後ケアの費用を増加させる。
【0009】
ヒトサイトメガロウイルスは比較的一般的であり、さらに極度に深刻な健康状態に関連しているため、相当な努力をして、疾患の診断の向上ならびに予防および治療的ストラテジーの開発の目的をもって、ウイルスの生物学が研究された。CD8+CTL反応の増大(mounting)は、ある急性ウイルス性感染に対する重要な哺乳類宿主反応であると考えられている。HCMV感染が広範で持続的であり、免疫抑制をされた患者において再発されおよび臨床的に明らかであり得るという観察は、HCMV-特異的CTLを含むウイルス-特異的T細胞が、持続感染の調節およびHCMV疾患からの回復において重要な役割をしていることを示唆する。
【0010】
ヒトでは、免疫抑制されたBMTレシピエントにおけるCMV疾患の進行の防止は、測定可能なCD8+CMV-特異的クラスI MHC-拘束性T細胞反応の回復と相関する(Quinnan et al., New Eng. J. Med. 307:7-13 (1982); Reusser et al., Blood 78:1373-1380 (1991))。これらの観察により、研究者はドナー-由来HCMV-特異的CD8+CTLをガンシクロビル予防および治療の代替としてBMTレシピエントに注入する臨床試験を実行した(S.R. Riddell et al., Science 257:238-241 (1992))。CD8+CTLクローンをアロジェニック骨髄移植レシピエントへ移すと、検出可能CTL-ベースのHCMV免疫、およびBMT後HCMV疾患の統計的に有意な減少を生じた(E.A. Walter et al., New Eng. J. Med. 333:1038-1044 (1995))。
【0011】
このアプローチは、適用の成功にも関わらず、患者に再注入するためのin vitroでのHCMV-特異的CTLを誘導するために、洗練された(高度に労働集約的で、費用も高い)実験室設備が必要であるという不都合を有する。所望される代替は、BMTレシピエント、固体臓器レシピエント、心臓疾患患者、AIDS患者あるいは妊娠期間の女性に対して免疫を与えるHCMV由来ワクチンを、HCMV-特異的CTLのex vivo拡大(expansion)を必要とすることなく送達することであろう。しかし、そのようなワクチンは現在入手できない。そのようなワクチンを開発するためには、宿主に防御様式にてHCMVを認識させるウイルスペプチドを同定しなければならず、そうすればそれらのアミノ酸配列情報が決定できる。
【0012】
ウイルスの生活環は、最大限にウイルスの産生および拡大を崩壊させるためのワクチンを標的とする最も効果的な時間枠に関しての洞察を提供する。宿主細胞へのHCMVの侵入および脱殻の後、ウイルスゲノムは前初期(0-2時間)を経て、初期(2-24時間)および後期(>24時間)ウイルスタンパク質を連続的に発現する。しかし、pp65などの特定のウイルス構造タンパク質は、大量のウイルス粒子が存在するため、細胞内でシャペロン化(chaperoned)される。多くの注目が、HCMV-特異的CTL反応のための潜在的イムノドミナント(immunodominant)標的抗原としての構造ビリオンタンパク質に集中した。
【0013】
1つのウイルス構造タンパク質、pp65、は、最も無症状のCMV血清陽性個体の末梢血由来CMV-特異的クラスI MHC拘束性CTLの標的抗原として同定された(E. Mclaughlin-Taylor et al., J. Med. Virol. 43:103-110 (1994))。前初期(IE)タンパク質はプロセスされて、多くの正常血液ドナーにおいてIE-特異的CTLの刺激を引き起こすCTLエピトープを形成する(F. Kern et al., J. Virol. 73(10):8179-8184 (1999); C. Retiere et al., J. Virol. 74(9):3948-3952 (2000); G. Zyulai et al., J. Infect. Dis. 181:1537-1546 (2000); F. Kern et al., Eur. J. Immunol. 30:1676-1682 (2000))。それにもかかわらず、IE-特異的CTLは、pp65あるいはpp150などの構造タンパク質に対して特異的なCTLと同様に、CMV感染標的細胞を殺すあるいは溶解することは示されなかった。重要なことに、pp65に特異的なCD8+クラスI MHC拘束性CTLは、おそらく感染中に細胞内に移されるpp65の内在性貯蔵(internal depot)のプロセッシングの結果として、ウイルス遺伝子発現を必要とせずに自己由来HCMV感染細胞を認識するであろう(M.J. Gilbert et al., J. Virology 67:3461-3469 (1993))。pp65あるいはpp150(頻繁に認識されるもう一つの基質タンパク質)に対するCTLは、ウイルス遺伝子発現のない感染の1時間以内にin vitroでHCMV感染細胞を認識して溶解できる(S.R. Riddell and P.D. Greenberg, Curr. Top. Microbiol. Immunol. 189:934 (1994))。このように、これらのCTLはCMV疾患へのHCMV再活性化および進行を制限するための重要なエフェクター細胞を表している可能性があり、また免疫不全および正常な個体の両方におけるそのような細胞性免疫応答は非常に重要であろう(C.-R. Li et al., Blood 83:1971-1979 (1994))。エンベロープタンパク質を認識するCTLはpp65およびpp150 CTLの代用にはならず、なぜならそれらはほとんど見出されず、感染の後期に出現し、そしてそれらは必要なクラスI MHC分子の抑制制御のために弱い溶解エフェクターであるからである(M.J. Gilbert et al., J. Virology 67:3461-3469 (1993))。ゆえに、pp65あるいはpp150に対する免疫を刺激するワクチンは、CMV感染に対する防御免疫を引き出すための好ましい機序でありうる。
【0014】
個々のMHCクラスI分子は、所定のモチーフのペプチドを優先的に結合する。モチーフの特異的な位置のアミノ酸配列は不変であり、所定のペプチドを高い親和性でMHCクラスI分子に結合させる。これらは“アンカー位置”として言及される(K. Falk et al., Nature 351:290-296 (1991))。アンカー位置以外のアミノ酸位置もまた、MHCクラスI分子に結合するペプチドの特異性に寄与する。さらに、それにもかかわらず、MHCと相互作用しないCTLエピトープ内の位置にある残基は、おそらくT細胞受容体(TCR)を結合させることによりT細胞と相互作用しうる。ペプチドアミノ酸残基のMHCあるいはTCR構造への結合は独立して支配されており、そのため多くの場合においてTCR結合アミノ酸残基の置換は、抗原提示細胞の表面上のMHC分子への結合を干渉しないであろう。
【0015】
エドマン分解に続くN末端配列解析を使用して、MHCクラスIペプチド結合溝に結合するペプチド混合物を配列決定した。大半の場合、これらのペプチドの長さは9から11アミノ酸の間である。HPLC分離ペプチド混合物のマススペクトロメトリーにより、個々のペプチドの一次配列を解明することができる。この様式で同定されたMHCに結合するペプチド断片は、“自然にプロセスされたエピトープ”として言及される。あるいは、所定の長さ、9-11アミノ酸の間のいずれのペプチドが、モチーフとの一致に基づいて個々のHLAクラスIアリルと最適に結合するのであろうかという予測ができる(K. Falk et al., Nature 351:290-296 (1991))。1つのそのようなモチーフは、HLA A*0201について確立された。ノナペプチドアンカー残基はHLA A*0201について位置2および9に配置され、結合強度の重要性の高い順に位置1、4、3、5、6、7、8から結合することに副次的に寄与する(J.W. Drijfhout et al., Human Immunology 43:1-12 (1995))。同様なモチーフは、HLA A*0201のデカマーおよびウンデカマー(undecamer)について確立された。相応して、独特なアミノ酸モチーフはその他のHLA AおよびBアリルのサブセットについて確立され、8-11アミノ酸の間の結合ペプチドが予測された(H.G. Rammensee et al., Immuno enetics 41 (4):178-228 (1995))。
【0016】
CTLは、哺乳類生物がウイルスによる感染およびおそらく癌に対して自身を守る重要な機序であると認識される。MHCクラスI分子と共同する、例えばウイルスタンパク質最小細胞傷害性エピトープ(MCE)のプロセス型は、CD8+CTLなどのT細胞により認識される。ウイルス-および腫瘍-特異的T細胞の機能的な研究により、8-12アミノ酸のMCEは抗原提示細胞(APC)をプライム化して、APCが細胞表面上でペプチドを結合させるであろう正しいMHC分子を発現するときに限り、CD8+CTLにより溶解されることが確かめられた。
【0017】
タンパク質の細胞内への侵入のルートは、それがMHCクラスIあるいはII分子のいずれかに結合する抗原としてプロセスされるかどうかを決定する、ということが示された。タンパク質分解の内在的あるいはクラスI経路はしばしば、感染ウイルスが細胞内に存在するときにそれらにより使用される。完全長分子として細胞表面に決して到達しないであろうウイルス核タンパク質は、さらに細胞内でプロセスされて、そして分解された部分はMHCクラスI分子を介して表面に移動させられる。ウイルスエンベロープ糖タンパク質は、単に細胞表面分子であるため、義務的にはCTL認識を誘導しない。むしろ、ウイルス核タンパク質は、プロセスされたエピトープの形において優勢であり、CD8+CTLにより認識される標的抗原である(A. Townsend et al., Philos. Trans. R. Soc. Lond.(Biol). 323:527-533 (1989))。
【0018】
外因性経路(飲食作用など)を介して細胞内に入る抗原は、クラスI MHC分子により典型的にはプロセスおよび提示されない。ゆえに、細胞質中に直接タンパク質を導入する方法がワクチン開発の焦点となった。支持を獲得したアプローチは、組換えワクシニアウイルスを使用して細胞を感染させて、大量の細胞内抗原を送達することである。しかし、ワクチンとしてワクシニアウイルスを使用する魅惑は減少した、なぜなら、これらのウイルスがWestern Reserve株を基礎におくBMTレシピエントなどの免疫を抑制された患者において疾患を引き起こす可能性があるためである。ワクチンに対するもう一つのアプローチは、抗原性タンパク質をアジュバントと混ぜて、皮下注射により皮膚の下に混合物を導入することである。
【0019】
CTLを引き出すための免疫に対するさらなるもう一つの可能性のあるアプローチは、特定のMHC拘束性要素の文脈においてウイルス抗原について定義されたMCEを使用して、ウイルスに対するCTL記憶応答をブーストすることである。感染ウイルスの致死量によるチャレンジに対して防御免疫を提供するMCEの能力は、文献にて議論された。ワクチン開発者は、ワクチンとしてMCEを利用することへの興味の増加を発展させた、なぜなら、それは内在化あるいはプロセッシングなしで細胞表面分子の外因性結合を介してMHCクラスI分子に結合できるからである。
【0020】
歴史的に、MCEはヘルパーCD4エピトープと共に脂質化(lipidated)ペプチドとして合成されるときに免疫原として最も効果的であった(A. Vitiello et al., J. Clin. Invest. 95:341-349 (1995)およびB. Livingston et al., J. Immunol. 159:1383-1392, 1997)。二重特異性ワクチンのその他の修飾は、最大活性を到達させるための小胞体の保持および標的のためのシグナル配列(KDEL)の包含を含む。文献中には、特定の型のAPC(例えば、樹状細胞)により提示されるMCEは、ウイルス感染あるいはウイルスあるいは腫瘍細胞との先の接触がない場合に一次免疫応答を引き起こしうるという証拠もある。
【0021】
レシピエントへのCMV-特異的CTLの導入は、HCMV感染に対して免疫される必要がありうる全てのリスク保持個人に対して免疫を与えるための一般的に適用されるそして実用的なストラテジーではない。従って、CTLにより認識されるHCMVタンパク質を同定すること、ならびにHCMV後期構造タンパク質pp65の特異的同定に対する顕著な努力にもかかわらず、HCMV感染を予防および治療する方法の向上が必要とされる。
【0022】
発明の概略
結果的に、本発明の一つの観点は、ヒトにおいてHCMVに対する細胞性免疫応答を引き出すことができる免疫学的に活性なペプチド、およびその機能的変異体、例えば、SEQ ID NO: 10-25および30-41に関する。ペプチドは、ヒトCTLを指示してHCMVに感染したヒト細胞を認識して融解させることができる。そのような免疫学的に活性なペプチドは、MHCクラスI分子に関連しており、潜在的な(不活性な)HCMV感染を有する個体のCTLにより認識される。
【0023】
本発明のもう一つの観点は、患者のCTLおよび/あるいはCTLp(CTL前駆体)により認識されるであろう本発明に従う少なくとも1つの免疫学的に活性なペプチドあるいはペプチド誘導体を投与することによって、免疫系の増大を必要とする患者(すなわち、潜在的なあるいは不活性なCMV感染を有している患者)の免疫系を増大させる方法を提供する。
【0024】
本発明のさらなるもう一つの観点において、少なくとも1つの免疫学的に活性なペプチドを非感染個体に投与して、HCMVによる将来的な感染に対する免疫を提供する。そのようなペプチドは、場合によりアジュバントと共に、ペプチドあるいはリポペプチドワクチンの形で投与されうる。
【0025】
あるいは、ペプチドはペプチドを表面で提示するためにin vitroで処理された自己由来のあるいはアロジェニックな抗原提示細胞あるいは樹状細胞の投与を介して、細胞性ワクチンの形で投与されうる。
【0026】
本発明のさらにもう一つの観点は、潜在的にCMVに感染し、そしてCMV感染の再活性化のリスクを有する個体の免疫応答を増大させる方法であり、そこではT細胞を個体から取り出して本発明のペプチドを用いてin vitroで処理する。結果として得られたCMV-反応性CTLは、患者、例えばBMTレシピエント、に自己由来的にあるいはアロジェニック的に再注入する。
【0027】
さらに別の観点において、以前に感染していない個体にHCMV感染に対する免疫を与える方法は、個体からT細胞を取り出し、T細胞をin vitroで本発明のペプチドに暴露し、そして結果として得られたHCMV-反応性CTLを個体に再注入するステップを含む。
【0028】
本発明のペプチドはまた、以前に感染したあるいは非感染の患者、あるいはin vitroでT細胞にポリヌクレオチド(DNA-ベースの)ワクチンの形で投与する可能性もあり、そこでは、適した発現制御配列の調節の下でペプチド断片をコードするDNAを含有するプラスミドあるいは操作されたウイルスベクターなどの、適した遺伝子運搬ベクターを患者あるいは培養中のT細胞に投与する。
【0029】
さらに別のその観点において、本発明は、CTL機能を刺激および延長する組換えウイルスにおけるヘルパーCD4エピトープを場合により含む、免疫学的に活性なペプチド断片をコードするDNA配列を含有するワクシニアウイルスベクター、修飾ワクシニア アンカラ(Vaccinia Ankara)ウイルスベクター、カナリア痘ウイルスベクターあるいはその他の真核ウイルスベクターを提供する。ベクターは、潜在的(不活性)HCMV感染を有するCTL患者により認識されるであろう抗原を次々に提示する抗原提示細胞に感染する。
【0030】
本発明のさらなる観点は、静止HCMV感染に対する活性の存在の検出のための診断的試薬に関する。本発明に従うペプチドは、in vitroで直接にCTLpを刺激することができ、そのため、HCMVにより引き起こされる免疫刺激の程度を決定するアッセイに使用することができる。ペプチドはまた、血清陽性の個体と血清陰性の個体とを識別するためにも使用できる。患者由来のT細胞は、本発明に従うペプチドを用いてプライム化した抗原提示細胞とin vitroで接触させることができる。
【0031】
本発明は、SEQ ID NO: 10-25および30-41に従うペプチドおよびSEQ ID NO: 1、10-25および30-41のペプチドを含むワクチンを含む。細胞性ワクチンもまた提供され、これはSEQ ID NO: 1、10-25および30-41のいずれか一つに従うペプチドを提示するためにin vitroで処理された抗原提示細胞を含む。さらに、本発明は、SEQ ID NO: 1-14、19、26-28および30のいずれか一つに従うペプチドをコードする遺伝子を発現する組換えウイルスベクターワクチンを含む。加えて、さらなる態様は、ヒトサイトメガロウイルス感染に対する免疫応答をモジュレートする方法を含み、上記のようなワクチンを投与することを含む。
【0032】
好ましい態様の詳細な説明
配列NLVPMVATV(pp65495-503)(SEQ ID NO: 1)を有するノナペプチドは、現在まで調べられているCMV実験室株AD169およびTowneおよびその他の野生型分離株由来のpp65の免疫原性エピトープである。エピトープは、潜在的なCMV感染を保有する患者のCD8+クラスI MHC拘束性細胞傷害性T-リンパ球により認識される。ペプチドは活性ウイルス複製がない状態でCTLを活性化することができ、従って、正常および免疫不全患者の両方の免疫系を増大させるために、ならびにHCMVタンパク質のクラスI抗原プロセス経路の研究において有用である。位置2および9にあるアミノ酸残基は、HLA A*0201およびあるサブタイプのHLA A*02XX、ここではXX = サブタイプ02-22、との相互作用のためそれらの位置での好ましい残基である(J.W. Drijfhout et al., Human Immunology 43:1-12 (1995))。それにもかかわらず、その他のより好ましくないアミノ酸残基は好ましいアンカーを置換する可能性があり、ペプチドはHLA A*0201およびあるサブタイプのHLA A*02XXを結合する能力を示し、およびHCMV-特異的CD8+CTLを刺激し続けることができる。
【0033】
このように、一つの観点において、本発明はヒトサイトメガロウイルス感染に対する細胞性免疫応答を引き出すことができる、好ましい配列:
NLVPMVATV(SEQ ID NO: 1)である免疫学的に活性なペプチドを提供する。
【0034】
好ましいペプチドの配列変異体は、配列NX1VPMVATX2のペプチドを含み、X1はL、I、M、TあるいはV、およびX2はV、A、C、I、LあるいはTである(SEQ ID NO: 2)。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる、例えば、AAKXVAAWTLKAAANLVPMVATV、ここでXはシクロヘキシルアラニンである;SEQ ID 番号:15あるいは(d)AAKXVAAWTLKAAANLVPMVATV、ここでXはシクロヘキシルアラニンを表す(SEQ ID NO: 16)。
【0035】
本発明に従うその他の免疫学的に活性なペプチドは、以下のペプチドを含む。
YSEHPTFTSQY(SEQ ID NO: 3)
は、A*0101およびそのサブタイプを含むHLA A*01XXに結合する。このペプチドの配列変異体は、XがS、TあるいはLである配列YXEHPTFTSQY(SEQ ID NO: 4)のペプチドを含む。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0036】
FVFPTKDVALR(SEQ ID NO: 5)
は、A*6801およびそのサブタイプを含むHLA A*68XXに結合する。このペプチドの配列変異体は、X1がVあるいはTおよびX2がL、RあるいはKである配列FX1FPTKDVALX2(SEQ ID NO: 6)のペプチドを含む。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0037】
TPRVTGGGAM(SEQ ID NO: 7)
は、B*0702およびそのサブタイプを含むHLA B*07XXに結合する。このペプチドの配列変異体は、XがL、F、あるいはMである配列TPRVTGGGAX(SEQ ID NO: 8)のペプチドを含む。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0038】
FPTKDVAL(SEQ ID NO: 9)
は、互換性ペプチド結合部位を有するB*3502、B*3504、B*3506およびその他のそのサブタイプを含むHLA B*35XXに結合する。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0039】
RPHERNGFTVL(SEQ ID NO: 10)
は、互換性ペプチド結合部位を有するB*0702およびその他のそのサブタイプを含むHLA B*07XXに結合する。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0040】
SVLGPISGHVLK(SEQ ID NO: 11)
は、互換性ペプチド結合部位を有するA*1101およびその他のそのサブタイプを含むHLA A*11XXに結合する。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0041】
PTFTSQYRIQGKL(SEQ ID NO: 12)
は、互換性ペプチド結合部位を有するHLA B*3801/2およびその他のそのサブタイプに結合する。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0042】
EFFWDANDIY(SEQ ID NO: 13)
は、互換性ペプチド結合部位を有するB*4402およびその他のそのサブタイプを含むHLA B*44XXに結合する。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0043】
FTSQYRIQGKL(SEQ ID NO: 14)
は、互換性結合部位を有するA*2402およびその他のそのサブタイプを含むHLA A*24XXに結合する。本発明は、TFTSQYRIQGKL(SEQ ID NO: 44)などのその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0044】
以下の構造物は、本発明に従うペプチドワクチンを例示するが、それらに限定する意図はない:
AKXVAAWTLKAAANLVPMVATV(SEQ ID NO: 17)
dAKXVAAWTLKAAANLVPMVATV(SEQ ID NO: 18)
VSTIVPYIGPALNIAAANLVPMVATV(SEQ ID NO: 19)
AKXVAAWTLKAAAYLVPMVATV-NH2(SEQ ID NO: 20)
dAKXVAAWTLKAAAYLVPMVATV- NH2(SEQ ID NO: 21)
AKXVAAWTLKAAANLVPMVATV- NH2(SEQ ID NO: 22)
AKXVAAWTLKAAAYLVPMVASV- NH2(SEQ ID NO: 23)
AKXVAAWTLKAAANLLPMVASV- NH2(SEQ ID NO: 24)
AKXVAAWTLKAAASVLGPISGHVLK(SEQ ID NO: 25)
ここでX = シクロヘキシルアラニンおよびd =右旋性である。
【0045】
ワクシニアウイルスにおいて発現されるpp65(Diamond et al. 1997)タンパク質のトランケーション(truncation)は、HLA型CMV-血清陽性個体由来のpp65-特異的T細胞(CD8+)クローンに対してスクリーニングされた(Walter et al., New Engl. J. Med. 333:1038-1044 (1995); McLaughlin-Taylor et al., J. Med. Virol. 43:103-110 (1994))。CTLエピトープの細かな縮尺マッピングを容易にするために、アミノ末端欠失およびカルボキシル末端欠失の両方を用いて、pp65遺伝子中にわたる100-200ヌクレオチドにより分離されるpp65断片を発現する組換えワクシニアウイルスを調製した。組換えワクシニアウイルスにより囲まれる領域が100アミノ酸程度であったとき、一連の重複ペプチドが合成された。pp65由来の一連の15 merペプチドは、3つのアミノ酸により重複され、CTLエピトープを同定するために使用された(Longmate et al., Immuno genetics (2000))。この方法におけるpp65の100アミノ酸長のスクリーニングは、全体で29の異なるペプチドが必要である。自己由来およびHLAミスマッチのエプスタイン-バーウイルス形質転換リンパ球細胞株(抗原提示細胞)は、50μMの濃度で1-2時間スクリーニングペプチドを用いて感作して、洗浄およびクロム化(chromate)した。関連したCTLクローンは、ペプチドを用いて感作したリンパ球細胞株と共にインキベートして、そして標準的なクロム放出アッセイを行って溶解の感受性を決定した。そして、pp65-特異的T細胞クローンによる溶解に対してうまくリンパ球を感作したペプチドはさらにアミノおよびカルボキシル末端で短縮し、再試験した。これらのペプチドは、使用したT細胞クローンのHLAアリルに対応する最小の細胞傷害性エピトープを明らかにするまで、繰り返した。pp65の例示的なエピトープは表6に示した。
【0046】
上で概略した方法を使用して、ワクチン産生に適したペプチドを様々なハプロタイプを有する個体由来のT細胞クローンのために同定できる。この方法では、大きな多人種(multi-ethnic)ヒト集団にワクチンを接種するのに有用なカクテルワクチンがつくられうる。もしワクチンが大半の人種集団の少なくとも90%に使用できるほど広く十分に反応性を有していれば、それは公衆衛生のために使用されることに適している。HCMVに対する多重エピトープペプチドワクチンは、HLA-型の全てのヒトではないが、移植レシピエント、AIDS患者、および妊娠胎児を含むいくつかの様々なリスクを有する患者群にとって非常に有益であろう。
【0047】
本発明に従うペプチドは、いずれかの適した方法に従ってワクチンとして製剤化されうる。裸の(naked)ペプチドあるいは脂質化ペプチドは、適したアジュバントあるいはいずれかの他の医薬的に許容可能なキャリア中で製剤化されうる。細胞性ワクチンは、いずれかの既知の方法により調製されうる。本発明に従うHCMVペプチドは、単独、あるいはポリクローナルヘルパーTリンパ球ペプチドであるPADREなどのヘルパーペプチドと共に投与されうる。CTLエピトープおよびHTLペプチドは一緒にあるいは別々に投与されうるが、それらを時間的に近接させて投与することが好ましい。
【0048】
代替ワクチンは、ヘルパーCD4ペプチドエピトープとCTLエピトープとの融合を含む。ペプチドはどちらの順序からも融合され、所望するならそれらの間にリンカー配列を含有することもありうる。ヘルパーCD4エピトープの例は、合成配列PADRE(J. Alexander et al., Immunity 1:751-761 (1994))および破傷風菌-特異的ペプチドであるが、しかし、いずれのヘルパーTリンパ球ペプチドであっても使用されうる。いくつかの場合、これらの融合ペプチドは、皮下、鼻腔内、腹腔内あるいは静脈内ルートで投与されるとき、さらなる共有脂質修飾あるいはアジュバントを必要としないこともある。あるいは、CpGモチーフあるいはいずれかの他のアジュバントを含有する一本鎖DNAは、限界濃度で同時に提供されるときに融合ペプチドの活性の増加を提供するために共投与されうる。
【0049】
好ましい代替は、抗原性ペプチドをPADREに結合させて2つの配列を1つのペプチド鎖にすることである。所望するなら、PADREは抗原性HCMVペプチドのN-あるいはC-末端に配置され、リンカー配列は2つの配列の間あるいはN-末端配列の前に配置されうる。ワクチンペプチドのこの型の好ましい構造は、AAKXVAAWTLKAAANLVPMVATVであり、ここでXはシクロヘキシルアラニンを示し(SEQ ID NO: 15)、あるいは(d)AAKXVAAWTLKAAANLVPMVATVであり、そこではXはシクロヘキシルアラニンを示す(SEQ ID NO: 16)。
【0050】
本発明のペプチドは脂質化されていても、あるいは脂質を欠いていてもよい。非脂質化ペプチドは、ヘルパーペプチド配列を組み込むかあるいは組み込まないかに関わらず、1脂質化、2脂質化あるいは3脂質化ペプチドワクチンとして、本発明により企図される。ペプチド配列に結合しうる適した脂質は、パルミチン酸、ステアリン酸、ミリスチン酸、ラウリン酸、カプリン酸、デカン酸などを含むが、これらには限定されない。脂質は、いずれかの位置でおよび当該技術分野で既知のいずれかの都合の良い方法でペプチドに接着しうる。
【0051】
アジュバントはワクチン製剤の一部を形成しうる。完全あるいは不完全フロインドアジュバント、水酸化アルミニウムなどのアジュバントが企図されるが、しかし、好ましいアジュバントは、特にヒトにおける使用に関しては、DNAアジュバントである。シトシン-リン酸-グアノシン(CpG)を含む特異的配列を含む一本鎖DNAアジュバントは、当該技術分野で知られており、本発明を用いた使用に関して企図される。これらのCpG配列を欠くDNAアジュバントもまた、本発明を用いて有用である。例示的なDNAアジュバントは、2つのCpGモチーフを有する20 merのヌクレオチド、あるいはいずれかのDNAオリゴマー、一般的には約20から約25ヌクレオチド長、を含みうる。配列の安定性の増加は、ヌクレオチドバックボーン中のリン酸基を2つの基で置換して、ホスホロ-ジエステルバックボーンよりもホスホロ-チオエートバックボーンをつくることにより得られうる。
【0052】
HCMVペプチド-特異的ヒトCTL応答の評価は、以下のように、よく許容される動物モデルであるHLA-A2.1/kbトランスジェニックマウスにて行った。マウスはワクチン調製剤を用いて注射する。ブースターは、所望するなら、12日後に与えうる。最終免疫の約1週間後、脾臓細胞を免疫化マウスの脾臓から調製して培養する。免疫化細胞のin vitroでの刺激のためのリポ多糖(LPS)胚(blast)は、25μg/mL LPSおよび7μg/mL硫酸デキストランを加えることにより、免疫化マウス脾臓細胞(1.0-1.5×106細胞/mL)の懸濁液から無菌的に調製されうる。これらの細胞は、トランスジェニックマウスを免疫して抗原提示細胞をつくるために使用したのと同じCTLエピトープペプチドを用いてロードする。これらの抗原提示細胞を使用して、最終免疫の約12-14日後にin vitroで免疫化トランスジェニックマウス由来の培養脾臓細胞を刺激する。第2のin vitro刺激、あるいはさらなるin vitro刺激は、所望される場合に行われうる。第2の刺激は好ましく、最初のin vitro刺激の5-7日後に行われうる。最後のin vitro刺激の約1週間後、クロム放出アッセイを行って、ワクチンの抗原性ペプチドを用いてロードしたマウスあるいはヒト標的細胞を特異的に認識および殺す免疫化トランスジェニック脾臓細胞の能力を試験しうる。
【実施例】
【0053】
実施例1. T細胞クローンの誘導
CMV血清陽性個体からT細胞クローンを誘導する方法は、文献に記載されている(上記参考文献参照)。40から50ミリリットルの全末梢血の試料は、(標準的抗体法により検出された)CMV血清陽性のボランティアから得た。白血球(WBC)は、Ficoll-HyPaque(DuPont)密度勾配遠心分離を使用して分離した。全血は最初に卓上遠心機にて1400 rpmで10分間遠心分離して、赤血球細胞の数を減少させた。軟膜(buffy coat)をリン酸緩衝食塩水(PBS)を用いて12 mlに希釈して、6 mlを1/2量のFicoll-HyPaqueの上に重層した。最上層は、卓上遠心機において2000 rpmで15-30分間の遠心分離後に除去した。WBCを含有する界面(interface)を除去し、PBSで希釈して8-12分間1000 rpmで再び遠心分離することで、WBCをペレットにした。細胞をPBSに再懸濁してさらにもう1回上記のように洗浄した。4から5百万 WBC/mlを、プールしたAB+(血液型)CMV血清陰性ドナー(HAB)から得たヒト血清を用いたT細胞培地(TCM)に再懸濁した。
【0054】
実施例2. LCL抗原-提示細胞の誘導
同時に、自己抗原提示細胞株をPBLのエプスタインバーウイルス不死化により調製した(Current Protocols in Immunology, Unit 7.22, Wiley-Liss Press (1993)参照)。同じ個体からのCTLおよび抗原提示細胞の誘導は、細胞株の間のHLAマッチングを確実にした。
【0055】
実施例3. HCMVによるin vitro刺激
WBCのin vitro刺激を開始するため、WBCとして同じボランティアから得た自己由来皮膚線維芽細胞の単層を、DMSO-10%HAB中にて105細胞/ml/ウェルで12-ウェルプレートにおいて細胞を24時間平板培養(plate)することにより確立した。培養の24時間後、線維芽細胞をCMVビリオン(AD169あるいはTowne株)に1および5の間の感染多重度で2時間感染させた。培地およびウイルスを単層から吸引して、1 mlの新鮮なDMEM-HABを加えた。単層はさらに4時間培地中でインキベートして、その時間の後、培地を吸引した。8-10百万WBCを含有する培地の2ミリリットルを、CMV感染線維芽細胞を含有するウェル毎に加えた。WBCおよび線維芽細胞は、50 U/mlペニシリン、50μg/mlストレプトマイシン、4 mM L-グルタミン、25μM 2-メルカプトエタノール、10 mM HEPESおよび10%HAB(TCM-HAB)を含有するRPMI-1640(Irvine Scientific)中で培養した。これは最初の刺激と名付けられ、細胞は7日間共インキベート(co-incubate)した。TCM-HABはもし消耗された場合は交換し、培養はもし活発な細胞増殖があった場合は拡張した。
【0056】
WBCは、上記のように調製したHCMV-感染自己由来線維芽細胞の新鮮な単層上で平板培養することにより、第7日に再刺激した。さらに、γ-放射線照射(2500 rad)自己由来PBL(5倍以上のWBC)をフィーダー細胞として加え、培地はこの第2の刺激の第2日および第4日に組換えIL-2(10 IU/ml, Chiron-Cetus)を追加した。急速な細胞増殖を示すウェルは、培地が消耗されたので、IL-2含有の新しい培地が必要である。
【0057】
培養の12-16日後、細胞はクロム放出アッセイ(CRA)におけるCMVマトリックスタンパク質の認識のため回収してアッセイされた。CRAは、T細胞クローンに対して自己由来あるいはHLA-ミスマッチである標的細胞として抗原提示細胞を使用して行った。細胞は、pp28(pp28vac)、pp65(pp65vac)およびppl50(ppl50vac)などのHCMVタンパク質のためのDNAを含有する組換えワクシニアウイルスあるいは野生型ウイルス株WRの感染により調製した。
【0058】
一晩の感染後、抗原提示細胞をクロム-51と共にインキベートして、洗浄し、Current Protocols in Immunology, WileyLiss Press, Unit 7.17, (1993)に記載されるようにアッセイを実行した。CRAにおいて、ワクシニア感染標的細胞はクロム-51を用いてロードして、そしてT細胞クローン(エフェクター細胞)由来の細胞と混合した。細胞は、20:1から1:1に変化する一連のエフェクター:標的細胞比で混合した。4時間のインキベーション期間の後、細胞をインキベートした培地を回収した。培地への放射活性の放出(Re)は、ガンマシンチレーションカウンターを用いて定量した。抗原提示細胞に感染した程度は自然溶解を示し、CTLの非存在下での放射線の放出(Re)は各々のウイルスベクターについて確立した。標的細胞に取り込まれて放出可能な放射線の最大量(Rmax)は、洗浄(1%Triton X100; Sigma)溶液における標的細胞の溶解により確立した。パーセンテージ細胞傷害性は、以下のように表した:
100×((Re)-(Rs) / ((Rmax)-(Rs))。
アッセイは非許容可能であるとみなされ、自然放出(Rs)が30%以下でない場合は繰り返した。
【0059】
アッセイの解析は記載したようであり、陽性結果はpp65vac感染自己APCの特異的認識により示された。pp65についての陽性結果は、試験したポリクローナル集団において、ウイルスにより発現されるpp65 HCMVタンパク質を認識するT細胞があることを示した。
【0060】
実施例4. CTLエピトープの同定のための手順
皮膚線維芽細胞上にてHCMVにより2回刺激されたWBCは、以下のように96ウェルU底プレート中での限界希釈法によりクローン化した。2つのHCMV刺激の後、抗CD4抗体に結合する常磁性ビーズを用いたインキベーションを使用して、陰性選択(negative selection)によりWBCからCD4+T細胞を取り除いた。結果として生じた集団は、一般に90-95%がCD8+(信頼できるT細胞サブセットマーカー)であり、および一般に90%がCD3+(大半の末梢血T細胞のマーカー)であり、フローサイトメトリーあるいは蛍光顕微鏡のいずれかによりアッセイされる。この最終集団は、終量150μlにおいてウェル毎0.3-3細胞の間の濃度で平板培養した。各々のウェルはまた、50-100 IU/ml組換えIL-2(Chiron-Cetus)および0.5 pg/ml PHA(Murex)を追加したTCM-HAB中に、γ-放射線照射の1.0-3.0×105アロジェニック末梢血単核細胞(PBMC)も含有した。
【0061】
培養の3日後、PHAは75μlとrIL-2を追加した新鮮培養培地を交換することで2倍に希釈した。ウェルに3-4日毎に新鮮rIL-2を追加し、培地は必要に応じて交換した。細胞は12-14日後に上記のように新鮮アロジェニックPBMCで再刺激して、個々のウェルでの増殖のためにプレートを注意深く観察した。明白な細胞増殖は、拡張したT細胞をより大きなウェルに移す必要があることを示した。T細胞は2週間毎に再刺激して、次第により大きなウェルに移した。数百万の細胞が蓄積する段階で、いくつかは低温保存して、他のはさらにCRAを受けさせた。このCRAでは、標的はHCMV感染線維芽細胞、非感染線維芽細胞、あるいは野生型ワクシニアあるいはpp28、pp65あるいはpp150のいずれかを発現するワクシニアウイルスに感染した自己由来LCLであった。HLAミスマッチ線維芽細胞およびLCLは、対照として使用した。いくつか試験したもののうちの1つのT細胞クローンは、3-3F4と示されるが、CMVおよびpp65-特異性の両方の特徴を有しており、特異的な様式にて自己由来標的のみに対して反応性であった。異なるHLA表現型を有するその他のT細胞クローンは、最初の末梢血試料が異なるボランティア由来であったこと以外は、同じ方法で最初に単離された。
【0062】
pp65に対するT細胞クローン3-3F4の認識を拘束するHLA成分を同定した。一連のLCLは、3-3F4細胞株の各々のHLAアリルを有する個々に自己由来である標的として使用した。各々の標的はpp65vac、野生型ワクシニアに別々に感染させた、あるいは全く感染させなかった。結果は、HLA A*0201アリルに対して自己由来であるLCLのみが3-3F4 T細胞株により認識および殺されたことを示した。また、3-3F4はCD8+T細胞サブセットに属し、クラスI拘束性ペプチドを認識するCTLの特徴を有することが確立された。細胞株がモノクローナルであるかどうかは、一連の26種のヒトVβ遺伝子セグメントプライマーを使用するPCRレパートリー解析を実行することで試験した。26種のプライマーの一つ、Vβ13.1プライマーのみが、顕著なシグナルを与え、それにより3-3F4 T細胞クローンの明らかなモノクローナル性が説明された。
【0063】
T細胞クローン3-3F4により認識される正確なエピトープあるいはペプチドを同定するために、カルボキシ末端からアミノ末端に向かってpp65タンパク質を削除する一連のワクシニアトランケーションを使用した。CRAは、pp65タンパク質のトランケーション産生物を発現するワクシニアウイルスに感染させた自己由来およびHLAミスマッチLCL標的を利用して行った。この実験は、標的を殺すために必要なアミノ酸377および561の間の領域に配置された。アミノ末端削除の小さなサブユニットを使用して、殺傷に必要な領域をアミノ酸477および561の間にさらに配置した。間接的殺傷(killing)アッセイを利用して、サル腎臓細胞株に分子HLAアリルHLA A*0201およびpp65遺伝子の一部をトランスフェクションして、アミノ酸452-561を含有する断片にその領域を配置した。HLA A*0201により結合される配列に対応して、T細胞クローン3-3F4により認識されるペプチド配列の最終的な決定は、Synergy(Applied Biosystems Model 432)ペプチド合成機にて9-10アミノ酸ペプチドを産生することにより行った。公開された情報を使用して、HLA A*0201の顕著な特徴を有する一連の候補配列を決定して、アミノ酸452-561の間の領域に配置させた。これらは以下のものである:
【0064】
【表1】

これらのペプチドのただ1つのみ(“495ペプチド”あるいは“pp65495-503”として言及される)(SEQ ID NO: 1)が、自己由来LCLがCD8+CTL 3-3F4により認識および殺されるようにプライム化することが可能であること証明した。またHLA A*0201モチーフにも従うpp65由来のその他の9-10アミノ酸ペプチドは、CRAにおいて試験した。いずれか活性を示したものはなかった。全てのペプチドは、移動相としてアセトニトリル/TFAを使用してVydac C18カラムにおけるHPLCによって純度について調べた。それらは平均して70-80%あるいはそれ以上純粋であり、0.1%酢酸溶液から希釈して使用した。
【0065】
実施例5. 細胞溶解を誘導するための495ペプチドの使用
495ペプチドの階段希釈は、CRAにおいて自己由来LCLがT細胞クローン3-3F4により殺されるようにプライム化することにおける、10μMおよび0.01μMの間の活性では変化を示さなかった。1/2-最大(half-maximal)溶解は、0.5 nMペプチドの近くで起きた。ペプチド-トランスポーター欠損細胞株T2(D.B. Crumpacker et al., J. Immunol. 148:3004-3011 (1992))は、HLA A*0201陽性であり、またCRAにおけるペプチドの認識について3-3F4 T細胞クローンの感受性のより下方限界を試験するために使用した。0.1 nMほどの少ないペプチドが、10 nMペプチドの条件と等しく、T2細胞の最大溶解を引き起こすことが見出された。これらの実験は、この最小細胞傷害性エピトープがHLA A*0201アリルに対する強力な結合物質(binder)であることを説明する。
【0066】
表1に示される495ペプチドは、Synergy(Applied Biosystems Model 432)ペプチド合成機にて調製した。皮膚線維芽細胞はペプチドでプライム化して、そして2時間、37℃で10μMの495ペプチドと共に、最後の1時間はクロム-51と共にインキベーションすることによりクロム-51を用いてロードした。ペプチドおよびクロム-51は培地から洗い落とした。
【0067】
T細胞クローン3-3F4(CD8+CTL)は、HCMV血清陽性個体(HLA A*0201陽性)由来であり、CRAにおいてHCMV感染線維芽細胞ならびにペプチドプライム化線維芽細胞を認識することが可能であった。非感染および非プライム化線維芽細胞は、T細胞クローンにより認識あるいは殺されなかった。さらに、ドナー線維芽細胞上に見出されるHLA A*0201アリルのないHLA-ミスマッチ線維芽細胞は、それがHCMVにより感染されるあるいは495ペプチドによりプライム化されるかのいずれかであるとき、T細胞クローンにより認識あるいは殺されなかった。このように、本発明の495ペプチドは全HCMVウイルスの代替として働くことができ、正常T細胞が、もしそれらがHCMVに感染した場合と同じくらい効果的にあるいはより良く線維芽細胞を認識および殺するようにすることができる。
【0068】
実施例6. T細胞クローンによるTNF-αの生成
TNF-αは、多くの細胞型にとって細胞傷害性であるT細胞リンホカインであり、HCMV感染に対して増加するin vivoでの免疫応答に寄与しうる。3-3F4 T細胞クローンの細胞は、全HCMVビリオンあるいは表1の495ペプチドでプライム化されるかのどちらかでプレインキベート(pre-incubate)した自己由来線維芽細胞と共にインキベートした。24時間後、共インキベートした細胞からの上清を上記したようにバイオアッセイにおいて指示(indicator)細胞株に適用した。指示細胞株はWEHI誘導体であり、ピコモルレベルでTNF-αの細胞傷害作用に対して感受性がある。
【0069】
ペプチドプライム化線維芽細胞は、HCMV感染線維芽細胞と同程度かあるいはそれ以上のレベルのT細胞クローン3-3F4由来TNF-αの産生物を誘導した。SEQ ID NO: 1のペプチドは、T細胞なしでインキベートした自己由来線維芽細胞、あるいはT細胞クローンと共にインキベートした非HLA A*0201発現線維芽細胞のいずれかによるTNF-α産生物を誘導しなかった。
【0070】
実施例7. ペプチドSEQ ID NO: 1はHCMV血清陽性個体のPBLからCTLを誘導できる
HCMV血清陽性個体からのPBLは7日間、SEQ ID NO: 1のペプチドプライム化した自己由来線維芽細胞上での平板培養、あるいはSEQ ID NO: 1ペプチドで感作した放射線照射自己由来PBLと共にインキベートした。一度刺激したPBLは、CD4 T細胞の消耗を用いてあるいは用いずに、同様な様式で再刺激した。2週間後、ペプチドプライム化、CMV感染、あるいは未処理自己由来線維芽細胞のいずれかを標的として使用してクロム放出アッセイを行った。CD8+T細胞は、ペプチドプライム化およびHCMV感染線維芽細胞あるいはSEQ ID NO: 1でプライム化したEBVLCLの著しいパーセンテージを溶解したが、未処理細胞は溶解しなかった。自己由来線維芽細胞標的は、同じ条件下で新鮮に取られた血液からのCD4-消耗PBLによっては溶解されなかった。実験は、15人の健康な成人ボランティア由来のT細胞を用いて繰り返した。1つ以外の全ての場合において、マッチングHLAアリルを保持するドナーはSEQ ID NO: 1に応答するT細胞を有した。同様な実験は、T細胞のin vitro刺激を用いずに、HIV患者で行った。マッチングHLAアリルを有するHIV陽性ドナーの大半はまた、SEQ ID NO: 1でプライム化された自己由来EBVLCLを認識できるT細胞クローンも保持していた。
【0071】
実施例8. A*0201以外の分子サブタイプを有する、HLA A2を発現するヒト細胞株は495ペプチドによる溶解に対して感作される
12種の細胞株は、それらを495ペプチド(pp65495-503)ノナマーでパルスして、クロム-51を用いてロードして、495ペプチドおよびHCMVを認識する2つの異なるHLA A*0201拘束性CTLと共にインキベートするクロム放出アッセイに供した。特異的細胞傷害性を計算して、1μMおよび1 nM濃度の495ペプチドについて以下の表形式で示した。プラス記号(+)は30%以上の細胞傷害性を表し、プラス/マイナス記号(+/-)は5%および30%の間の細胞傷害性を表し、マイナス記号(-)は15%以下の細胞傷害性を表す。
【0072】
【表2】

データは、全ての試験をしたサブタイプが1μMでの495ペプチドと機能的に結合し、細胞株はHCMVおよびpp65特異的CTLにより溶解されることを示した。これらのデータはまた、ここに示す細胞株サブタイプが495ペプチドによる溶解について感受性をもたすことができることも示した。データはまた、これらのサブタイプを保持する個体由来の細胞が、たとえHLA A*0201について見出されるものよりも大半の場合において高い濃度でも、CTL認識および溶解についてペプチドにより感作されうることも示した。このように、これらのHLA A2サブタイプのいずれかを保持する個体は、ワクチンとして495ペプチドに応答することができる。
【0073】
実施例9. 495ペプチド(SEQ ID NO: 1)を使用した動物研究
事前にHCMV暴露がないトランスジェニックマウスモデル、HLA A2.1マウス(E.J. Bernhard et al., J. Exp. Med. 168:1157-1162 (1988))、を利用して、495ペプチドが事前にウイルス暴露がないCTLを刺激してワクチンとして機能できるかどうかを試験した。これらの実験は、ウイルスにより感染されたかあるいはSEQ ID NO: 1のペプチドあるいは非特異的対照ペプチドでのプライム化されたもののいずれかの、マウスおよびヒト細胞標的を使用するin vitro解析を含む。
【0074】
3尾のマウスは、IFA(不完全フロインドアジュバント)中で乳化された20μgのポリクローナルヘルパーTリンパ球(HTL)ペプチド(PADRE; SEQ ID NO: 29)(J. Alexander et al., Immunity. 1:751-761 (1994))と共に50μgの495ペブチド(pp65495-503)あるいはp53由来のペプチドp53149-157(M. Theobald et al., Proc. Natl. Acad. Sci. U.S.A. 92:11993-11997 (1995))を尾の基部に皮下的に接種して免疫した。12日後、脾臓を免疫化マウスから取り出し、脾臓懸濁液をつくり、エフェクター細胞をp53149-157あるいはp65495-503ペプチド感作同系リポ多糖処理脾臓胚細胞(splenic blast cell)を使用して1週間再刺激した(P.A. Wentworth et al., Eur. J. Immunol. 26:97-101 (1996))。その後、次のin vitro刺激のため、刺激細胞(stimulator cell)はJurkat A2.1細胞であり、弱酸処理および続くペプチドのローディングにより調製した(Z. Yu et al., Journal of Surgical Research 69:337-343 (1997))。2回のin vitro再刺激サイクルの後、マウス脾臓エフェクター集団をp53149-157あるいはp65495-503ペプチドをロードしたT2細胞の認識について試験した。適切に免疫したマウスではp65495-503あるいはp53149-157ペプチドの実質的な認識があったが、非免疫ペプチドの認識はなかった。
【0075】
マウス脾臓エフェクターが、pp65Vacに感染したヒトHLA A*0201 EBVLCL標的を用いたクロム放出アッセイにおいて、内因的にプロセスされたpp65を認識することもまた説明された(D.J. Diamond et al., Blood 90 (5):1751-1767 (1997))。p65495-503ペプチドがウイルス感染細胞の認識を引き起こすことのさらなる証明は、標的としてHCMV感染ヒト線維芽細胞、およびエフェクター集団としてp65495-503ペプチド刺激から誘導されたマウスCTLを使用したクロム放出アッセイによってもたらされた。HCMVに感染したHLA A*0201線維芽細胞はCTLによる溶解が可能であるが、一方、非感染およびミスマッチの両方の線維芽細胞は認識されなかった(D.J. Diamond et al. Blood 90 (5):1751-1767 (1997))。総合すれば、これらの結果は、p65495-503を用いた一次免疫化からの脾臓エフェクター集団がHLA A*0201拘束性様式において内因的にプロセスされたpp65およびHCMVを認識することを明らかに示した。
【0076】
さらなる研究により、495ペプチドは動物において長寿命免疫応答を誘導することが説明された。12尾のマウスを495ペプチド(SEQ ID NO: 1)+PADRE(AKXVAAWTLKAAA; SEQ ID NO: 29)+IFAを用いて同時に免疫して、2尾のさらなる対照マウスをPADRE+IFAのみを用いて免疫した。免疫後2週間、6週間、10週間および14週間目に、2尾の免疫化マウス由来の脾臓を495ペプチドあるいはヒトp53由来の対照ペプチド(p53149-157)に対する免疫について解析した。さらに、2および6週間目に、495ペブチドを用いずに免疫したマウスもまた屠殺して、それらの脾臓細胞を495ペブチドあるいはヒトp53ペプチドに対する免疫応答について解析した。パーセント特異的細胞傷害性(495ペブチド標的の細胞傷害性 - p53標的細胞傷害性)は14週間後で依然40%レベルであったが、一方、ナイーブ動物はいかなる5%以上の特異的細胞傷害性も示さなかった。これは、TheradigmTMリポペプチド(B. Livingston et al., J. Immunol. 159:1383-1392 (1997))を用いてヒトボランティアを免疫することから得られた、18週間にわたる4回の免疫の最終の後38週間に平均して最初の応答の60%を維持した、という最近の結果と十分に比較した。
【0077】
実施例10. 動物におけるIFA-アジュバント非依存ワクチンとしてのp65495-503(SEQ ID NO: 1)を取り込む脂質化ペプチド
免疫原性を亢進させるためにアジュバントを使用することは動物研究では一般的なストラテジーであるが、ヒトにおけるそれらの使用に関しては重要な制限がある。それゆえ、本発明の1つの態様は、脂質分子を取り込むペプチドを含む。このストラテジーは、動物(K. Deres et al., Nature 342:561-564 (1989))およびヒト臨床的研究(A. Vitiello et al., J. Clin. Invest. 95:341-349 (1995))の両方において効果的であり、アジュバントの使用の必要性を回避した。
【0078】
1あるいは2つのいずれかのパルミチン酸部分を、495ペブチドのアミノ末端に接着させ、一連の免疫研究をトランスジェニックHLA A2.1マウスにて行った。直接的脂質化ペプチドの一次構造は表3に示す。
【0079】
【表3】

表3.ペプチドはABI 432(Applied Biosystems)にて合成して、記載されるように精製して解析した(D.J. Diamond et al., Blood 90 (5):1751-1767 (1997))。パルミチン酸(Aldrich)はジメチルホルムアミドに溶解して、自動的にアミノ末端リジンに結合させた。ペプチドのモノ脂質化(monolipidated)形態のアミノ末端リジンは、2つの保護基、FmocおよびBocにより保護した。Fmoc基のみ合成中に開裂されて、単一脂質部分を加えることができる。ジ脂質化(dilipidated)形態のために、アミノ末端リジンは2つのFmoc基で保護され、それゆえ2つの脂質部分を加えることができた。ペプチドはまた、当該技術分野でよく知られる方法によりその他の位置で脂質化されることもあり、ここでの使用が企図される。
【0080】
別々のマウスは、PADREエピトープと共に非修飾pp65495-503、およびペプチドのモノ脂質化あるいはジ脂質化形態のいずれか用いて免疫した。脂質化ペプチドがフロインドアジュバントの共投与を用いずに免疫を刺激するであろうということが以前に示されていたので(H. Schild et al., Eur. J. Immunol. 21:2649-2654 (1991))、IFA中のペプチドの乳化を用いるあるいは用いずにマウスを免疫することを比較した。上の実施例9に記載した手順と同様な手順にて、接種後12日にマウスに脾臓摘出術をして、脾臓細胞集団をin vitroで2回再刺激した。そして、脾臓エフェクター細胞はペプチド-ロード(loaded)T2細胞、pp65Vvacに感染したEBVLCL標的、およびHCMV感染線維芽細胞を用いてクロム放出アッセイにて試験した(D.J. Diamond et al., Blood 90 , (5):1751-1767 (1997))。結果は、アジュバントにおける乳化を用いない495ペブチドの脂質化形態は、内因的にプロセスされたpp65およびHCMV感染ヒト細胞を認識することができる免疫応答を誘導することを説明する。モノ脂質化形態は、(IFAを用いるあるいは用いないのと比較して)より弱い免疫応答を誘導するようであったが、一方、非修飾フリーペプチドはIFAにおいて乳化されなければ活性をもたなかった(図1-3参照)。
【0081】
これらのデータは、ヒトを含む温血動物における使用のための都合の良い免疫化/ワクチン接種(vaccination)手順を説明する。この手順は、液体溶媒系(aqueous solvent system)における2つのペプチドの混合物を内包する(脂質化495ペブチド+PADREあるいは830-843アミノ酸破傷風ペプチドのいずれか、表3)。混合物は、HCMV血清陽性あるいは血清陰性の被験体のいずれかに皮下あるいは他の許容可能および効果的なルートを介して投与する。ブースター接種のさらなるセットは、一次ワクチン接種により誘導される免疫を亢進させるために利用されうる。
【0082】
実施例11. 脂質化ワクチンの製剤化
495ペブチドおよびその機能的配列変異体は、共有結合HTLエピトープを有する脂質化ペプチドとしてのワクチンとして製剤化できる。HTLエピトープは、古典的ヘルパー応答を刺激するためのヒトMHCクラスIIに対する広い反応性を有するいずれかのペプチドでありうる。そのような分子は、破傷風毒素由来のアミノ酸830-843(P. Panina-Bordignon et al., Eur. J. Immun. 19:2237-2242 (1989))、HIVエンベロープタンパク質由来のHTLエピトープ(J.A. Berzofsky et al., J. Clin. Invest. 88:876-884 (1991))、あるいは既知のアンカー残基から推測される合成版(PADRE)(J. Alexander et al., Immunity 1:751-761 (1994))を含むが、それらには限定されない。
【0083】
HTL+CTLエピトープの脂質化は、好ましくはHTLエピトープのアミノ末端で行われ、HTLエピトープはCTLエピトープに対するアミノ末端である。適した脂質部分は、既知であるかあるいは文献中に記載される(H. Schild et al., Eur. J. Immunol.21:2649-2654 (1991); A. Vitiello et al., J. Clin. Invest. 95:341-349 (1995); K. Deres et al., Nature 342:561-564 (1989))。あるいは、CTLエピトープ、続いてHTLエピトープをそのアミノ末端で脂質化することができ、あるいは脂質は、続くCTLあるいはHTLエピトープのいずれかで、カルボキシル末端にて見出すことができる。3つのアミノ酸スペーサーあるいは他のいずれかのスペーサーは、HTLおよびCTLエピトープの間に挿入することができ、あるいはエピトープはインフレームで直接融合させることができる。あるいは、アミノ末端上で脂質化されるCTLエピトープは、共有結合接着を用いずに、HTLエピトープと共に投与できる。ワクチンエピトープは、一次構造にかかわらず、一回、標準的な製剤化緩衝液(PBSあるいはPBS/10%DMSOあるいはより高濃度/0.01%トリフルオロ酢酸あるいはあるいは同じあるいは異なる濃度のその他の酸あるいはアルコール)にて前腕に皮下的に接種されうる。3から6週間後、同じ物質のブースター接種が投与されうる。3から6週間間隔の複数のブースター接種は、必要ならば続けて投与できる。
【0084】
この接種シリーズは、ウイルスについて陽性あるいは陰性のいずれかの、患者あるいはリスクを持つ個体、あるいは骨髄移植のドナーに投与できる。脂質化ワクチンペプチドの具体例は、例えば以下のものを含む:
【0085】
【表4】

ここでは、Xはシクロヘキシルアラニンあるいはフェニルアラニンである。本ケースをとおして、全てのアミノ酸はそれらの国際一文字コード(universal one-letter code)により表す。“Pam”はパルミチン酸である。3つの-Aあるいは-Gスペーサー(下線)は、ワクチンペプチド間での交換が可能である。上に示されるペプチドのフォーマットは(アミノ末端から)次のように記載される:脂質-K/CSS--HTLエピトープ(イタリック)--アミノ酸スペーサー(下線)--CTLエピトープ。CTLおよびHTLエピトープの位置は交換可能である。CTLエピトープ(あるいはその機能的配列変異体)はさらにリーダー配列を加えることにより修飾されることもあり、および/あるいはアミノ酸KDELはカルボキシル末端に追加して小胞体内での維持および標的化(targeting)を亢進することができる。パルミチン酸あるいはいずれかの適した脂質が使用されることもあり、ステアリン酸、ミリスチン酸、ラウリン酸、カプリン酸およびデカン酸を含むが、それらには限定されない。
【0086】
実施例12. トランスジェニックマウス研究における単一成分ワクチンとしての、アミノ末端にて脂質化される、結合HTLおよびCTLエピトープの使用
各々脂質を含有する2つのさらなる分子、HTLおよびCTLエピトープ、を構築してマウスにて試験した:
【0087】
【表5】

表5の名称は、表4での凡例に見出すことができる。
【0088】
分子A(SEQ ID NO: 37)は、マウスおよびヒトにおいて働く能力を有するワクチンであり、一方、分子B(SEQ ID NO: 38)はマウスでのみ機能的であるべきある。2.5%ヘキサフルオロイソプロパノールを用いたリン酸緩衝生理食塩水中25%ジメチルスルホキシド中の100ナノモルの各々のこれらのワクチンペプチドを、別々のトランスジェニックHLA A2.1マウスに皮下的に接種した。
【0089】
実施例9および10において言及される方法を使用して、pp65およびHCMVに対して特異的な細胞を含有する脾臓細胞集団を誘導した。免疫化マウス由来の脾臓細胞は、特異的および非特異的ペプチド感作された標的、HCMV感染および非感染HLA A*0201およびHLA-ミスマッチ線維芽細胞標的に対する認識および細胞溶解について試験した。495 pp65495-503ペプチド感作標的は効果的に溶解されたが、一方、HLA A*0201(p53149-157)に結合する他のタンパク質(ヒトp53)由来のペプチドで感作された標的は効果がなかった。さらに、および重要なことに、HCMV感染HLA A*0201線維芽細胞は効果的に溶解されたが、非感染線維芽細胞あるいはHLA-ミスマッチのそれらは、HCMV感染にかかわらず、認識あるいは溶解されなかった。これらの結果は分子AおよびBの両方で得られたが、分子Aは2つのうちでより強力であった。しかし、50 nmoleより少ない量でワクチンAを用いて免疫したマウスの2回目の免疫化(ブースター)は、1回の免疫化が効果的でないときに検出可能な免疫応答を引き起こした(表5)。ブースターの刺激効果はBに一致する(Livingston et al., J. Immunol. 159:1383-1392 (1997))。これらのデータは、ワクチンの単一分子形態が液体媒介物(例えば、PBS/DMSO/HFIP)中のワクチン分子AあるいはB以外のいずれかの追加的分子あるいはアジュバントを用いずに、動物モデルにおいてHCMV免疫を刺激する機能を有することを示した。データはまた、ワクチンがHCMV-ナイーブマウスにおいてHCMVに対するde novo免疫応答を刺激できることを説明した。
【0090】
実施例13. HLA AおよびBアリルに特異的なさらなるHCMV pp65 CTLエピトープ
100以上のAおよびB遺伝子のHLAクラスIアリルがある(J.G. Bodmer et al., Tissue Antigens 49:297-321 (1997))。推定するアルゴリズムおよびトランケーション解析を組み合わせて使用することで、MHC-拘束性ヒトCTLにより溶解される自己由来およびアロジェニック細胞の両方を感作するpp65由来のさらなるペプチドを同定した。実施例1で考察したように、CTLはHCMV血清陽性なヒトから生じる;それゆえ、pp65由来の明確なエピトープは、内因的HCMV再活性化あるいはウイルス血症を抑制するためにヒトにより使用されるものであった。特異的HLAアリルと組み合わせてHCMV pp65に対するCTL反応を明確にするため、個々のクローン化CTL株は、CTLを誘導するために使用される血液を有する個体に見出されるHLA AあるいはBアリルの1つを含有するpp65vacを用いて感染させたEBVLCLの認識について試験した。少なくとも1つのHLAアリルがEBVLCL標的およびCTLの間で共用される場合は、認識および溶解のための感作が観察された。この実験は、拘束性アリルを含有する少なくとも3つの独立細胞株を用いて繰り返された。表6は、pp65エピトープ、それらのHLA拘束性、感作される同じ拘束性の独立細胞株の数、およびエピトープの描写の方法を示す。
【0091】
【表6】

決定の方法:(A)単一HLAアリルがマッチする細胞株を使用するHLA拘束;(B)ワクシニアウイルスにおけるpp65トランケーション;(C)TNF-αアッセイを使用する活性の検出を用いたプラスミドにおけるpp65トランケーション;(D)公開されるモチーフを使用するアミノ酸残基のマッチング;(E)順序づけされた重複エピトープを使用する機能的解析。
【0092】
実施例14. 1つ以上のCTLエピトープを含むワクチン分子
本明細書中に記載される手順に従って、同じあるいは異なるHLAクラスI拘束成分に特異的である、pp150および/あるいはpp65エピトープの組み合わせを含むワクチンを調製した。ヒトのワクチン接種のため、各々のエピトープは同じMHC拘束を有する必要性はない。2つあるいはそれ以上のMHC拘束成分を標的とするワクチン分子は好ましいことがあり、なぜならそれはより少ないワクチン分子の産生を可能にして、さらに多型集団において大半のHLAアリルが標的とされることを確実にするからである。頻繁に発現するHLAアリル(表1および6参照)により拘束されるCTLエピトープを有するペプチドは好ましく、およびpp65およびpp150タンパク質の両方からのエピトープならびにHTLエピトープを含有するポリペプチドワクチンは、HCMVに対するヒトワクチン接種にとって特に好ましい。表1および6に示されるHLAアリルは、複数CTLエピトープワクチン分子において含まれる可能性のあるHLA A、B、およびC CTLエピトープのサブセットである。複数CTLエピトープおよびHTLエピトープを含ませることにより、ペプチドを長くするであろう(40-50アミノ酸の範囲内)。あるいは、HCMVポリペプチドワクチンは、共有結合的に接着されるHTLエピトープを用いずに、表3に示されるように、3つのアラニン残基あるいは各々のエピトープの間のアミノ酸の他の組み合わせのスペーサー、および、N末端での2つのパルミチン酸-リシルアミドを有する複数CTLエピトープを使用することにより調製されうる。
【0093】
配列の疎水性は重要な因子である。疎水性を低下させるために、脂質修飾は省略されうる。加えて、複数HLAエピトープはカクテルワクチン(cocktail vaccine)中で製剤化されうる。好ましくは、混合物における各々の個々のCTLエピトープは、上記のようにCD4 T細胞エピトープに融合されるであろう。このように、カクテルワクチンは、表6に示される配列を使用して複数-人種集団の約75%から約90%を網羅するのに十分なエピトープを含有するために製剤化することができた。
【0094】
実施例15. BMT患者の免疫化
本発明に従う抗原ペプチドの治療的な活性形態は、骨髄移植の前の所定の日数あるいは週数により分割される単一あるいは複数用量にて、十分な時間(例えば、6から8週)でHCMV血清陽性骨髄移植ドナーに投与されて、抗HCMV細胞性免疫応答の発生を可能にする。抗原ペプチドは、それ自体既知の様式にて(例えば、場合によりヘルパーペプチドおよび/あるいはアジュバントと組み合わせて、脂質化ペプチドとして)製剤化することができ、好ましくは、複数用量において投与されるであろう。例えば、ヘルパーペプチドおよび抗原ペプチドが1つの配列において一緒に結合されるペプチドは、この目的に適している。
【0095】
さらなるワクチン計画は、ポリヌクレオチドウイルスワクチン、例えば、表6に示される完全長pp65、pp65断片あるいは1つあるいはそれ以上のCTLエピトープ、を含有する修飾ワクシニア アンカラ(Vaccinia Ankara)(MVA)を用いてドナーをプライム化すること、その後、実施例12および14に記載されるペプチドワクチンを用いてブーストすること、から成る。当業者は、ペプチドおよびウイルス投与の様々な組み合わせを使用するワクチン接種のための計画を十分に考案することができ、これらの変化は本発明を用いた使用のために企図される。もし無操作BMT移植片がレシピエントに与えられるなら、その移植片は25%あるいはそれ以上の成熟T細胞を含有するであろう。T細胞はBMTレシピエント患者に活性免疫を与える。あるいは、T細胞消耗BMT移植片を利用するとき、免疫化ドナーからのT細胞のアリコートはBMTの(例えば、約21から35日)後に患者に投与して、レシピエント患者にHCMV免疫を提供することができる。
【0096】
実施例16. HCMV感染細胞のためのin vitroアッセイ
本発明のペプチドをin vitroアッセイに使用して、HCMV状態(感染あるいは非感染)が未知の患者から得たHCMV感染細胞の有無を検出する。患者から得たTリンパ球は、本発明のペプチドを用いてプライム化された抗原提示細胞と共にインキベートする。CTLあるいはCTLpの活性化により、患者がHCMVに感染したことが明らかになる。
【0097】
実施例17. 非脂質化ペプチドを用いたトランスジェニックマウスのワクチン接種による免疫応答の誘導
2尾のHLA-A2.1kbトランスジェニックマウスに、15-30秒間の音波処理により不完全フロインドアジュバントと1:1比で乳化した、10%DMSO中の100 nmoleのA2 HCMV pp65ペプチドNLVPMVATV(SEQ ID NO: 1)、20μgのT-ヘルパーペプチドを含む0.1%酢酸、PADRE(AKXVAAWTLKAAA、Xはシクロヘキシルアラニンを表す;SEQ ID NO: 29)を接種した。移送中の損失を計上するため、注射に必要とされる以上の300μLあるいはそれ以上の過剰な乳化ワクチンを調製した。ペプチドワクチン(上の100μLの全量乳化調製)は、外側尾静脈(lateral tail vain)を避けて、各々の側に50μLずつ、尾の基部に皮下的に注射した。陽性対照動物は、無関係なHLA-A2.1拘束hu p531147-157ペプチドおよびPADREを用いて同じ様式で注射された。ブースターは7日後に投与した。ブースター免疫の1週間後、脾臓細胞を回収、培養、およびin vitroで刺激した。培養のため、細胞を脾臓から単離して、40 mL培地に懸濁させて計数した。赤血球は計数から除外した。そして、細胞を20%Rat-Stim(Collaborative Biomedical Cat #40115, Waltham, MA)を含有する培地中でミリリットルあたり3百万細胞の濃度にして、24ウェルプレート中にて1 mL/ウェルで平板培養した。細胞を刺激するため、1 mLの懸濁抗原提示細胞(3免疫化脾臓細胞に対して1抗原提示細胞の割合)を培養に加えた。細胞は37℃で7日間インキベートした。新鮮培地は必要に応じて加えた。刺激は、上のように1 mLの懸濁抗原提示細胞を加えることにより、平板培養後7日毎に行った。
【0098】
抗原提示細胞は以下のように調製した。マウスの各々の免疫化群について、3尾のマウスの脾臓を無菌的に取り出して、25μg/mLのLPSおよび7μg/mLの硫酸デキストランを含有する10%FCSを含むRPMI中にて1 mLあたり1.0-1.5×106細胞の濃度で、5%CO2中にて37℃で3日間懸濁した。そして、細胞を集めて、沈降させて、血清なし培地に再懸濁して、計数した。細胞は、15 mLの円錐形遠心チューブ中に2千5百万細胞を含有する量で分配して、1200 rpmで6分間穏やかに沈降させた。上清を吸引して、チューブに100μLを残した。ペプチド(SEQ ID NO: 1)(100μM)をチューブに加えて、よく混合して、37℃および5%CO2で4時間インキベートした。細胞は、チューブあたり2 mLの完全培地(10-12 mM HEPES、2mM L-グルタミン、100 U/mLペニシリン、100 U/mLストレプトマイシン、50μMβ-メルカプトエタノールおよび10%熱不活化牛胎児血清を含有するRPMI 1640)中に再懸濁して、滅菌PBSにて濃縮した。そして、細胞は137Cs源由来の2500ラドで放射線照射して、次に、免疫化脾臓細胞を刺激するときに使用するために完全培地中で1 mLあたり百万細胞の濃度にした。
【0099】
in vitro刺激の6から7日後、免疫化脾臓細胞(エフェクター細胞)を集めて、細胞の細胞傷害活性を51Cr放出アッセイを使用してペプチド-ロードあるいは非処理標的細胞に対してアッセイした。HLA-A2.1kb免疫化マウス由来のpp65495-503(SEQ ID NO: 1)に特異的でありペプチドを用いて毎週刺激される大量の細胞株は、陽性対照株として使用した。T2細胞は、非ロードあるいはSEQ ID NO: 1のペプチドあるいはp53由来のヒト対照ペプチドのどちらかを用いてロードした標的として使用した。実施例9参照。クロム放出アッセイのための標的を調製するために、対数増殖期中のT2細胞を沈降させて、各々の非ロードしあるいはロード群について10 mL LCL培地(1%HEPES、10%牛胎児血清、2%L-グルタミンおよび抗生物質を含有するRPMI 1640)に再懸濁した。細胞は計数して、再沈降させて、1 mLあるいはより少ないLCL培地に懸濁させた。細胞は、非ロードあるいは抗原提示細胞の刺激のために上記のように適したペプチドの5 mM溶液の10μlでロードされるかのどちらかであった。全ての細胞は、10 mCi/mLのNa251CrO4を含有する20μlの51Cr原液を用いてロードした。そして、細胞のチューブを37℃の水槽中で45-60分間インキベートして、15分毎に穏やかに振盪した。次に、細胞を10 mLのRPMI中で3回洗浄して、1 mL のLCL培地に再懸濁した。標的細胞を再計数して、適量のLCL培地に懸濁して20,000細胞/mLにし、そして次に、ウェルあたり100μLで96ウェルプレート中で平板培養した。
【0100】
エフェクター細胞(免疫化脾臓細胞)は、10%FCS含有RPMI中で1 mLあたり2百万細胞にして、図4に示すように様々なエフェクター:標的比で標的細胞に加えた。培地のみ(100μL)を陰性対照ウェルに加えて51Crの自発的放出を測定し、および2%ドデシル硫酸ナトリウムを含有する培地(100μL)を陽性対照ウェルに加えて51Crの全可能放出を測定した。プレートは、Sorvall RT7遠心機(Kendro Laboratory Products; Newtown, CT)にて休みなく6分間600 rpmを受けさせて、37℃および5%CO2で4時間インキベートして、次に1200 rpmで6分間再沈降させた。次に、上清を回収して放射能をPackard Cobra II γカウンター(Packard Instruments; Meriden, CT)を用いて測定した。特異的CTL活性は次のように計算した:
%特異的放出 = 100×(実験的放出 - 自発的放出)/(全放出 - 自発的放出)
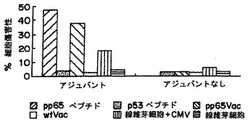
自発的放出が最大全放出の30%あるいはそれ以上である実験は放棄した。図4Aは1回のin vitro刺激後の結果を示し、図4Bは2回のin vitro刺激後の結果を示し、および図4Cは4回のin vitro刺激後の結果を示す。この図および続く図では、“T2 A2パルス”はSEQ ID NO: 1のペプチドを提示する細胞を示し、“T2 p53パルス”はヒト対照ペプチドp53149-157を提示する細胞を示す。データは、本発明のペプチドワクチンを用いたワクチン接種が適した標的細胞を認識して殺すことができる特異的CTLを確実に生じさせたことを示した。結果は、2回目のin vitro刺激で向上した。
【0101】
実施例18. 脂質化ワクチン製剤の比較
マウスは実施例17に記載されるように、Xがシクロヘキシルアラニンを表す(Pam)2- KSSAKXVAAWTLKAAANLVPMVATV(SEQ ID NO: 37)を含有するワクチンの4つの異なる製剤を用いてワクチン接種した。脾臓細胞をアッセイした。クロム放出アッセイにおけるエフェクター対標的比は、結果を示す図5に示したとおりである。図5Aは、99.9%DMSOおよび0.1%蟻酸を含有する溶液中での100 nmoleのペプチドを用いて接種したマウスについての結果を提供する。図5Bは、50%DMSO、49.9%PBSおよび0.1%蟻酸を含有するビヒクル中に懸濁した100 nmoleのペプチドを用いてワクチン接種したマウスについての結果を提供する。図5Cは、41.7%DMSO、57.7%PBSおよび0.6%蟻酸に溶解した83.3nmoleのペプチドを用い注射したマウスについて言及する。図5Dは、66.7%DMSO、26.7%酢酸および6.7%Tween 20に懸濁した83.3 nmoleのペプチドを用いて注射したマウスについての結果を提供する。99.9%DMSO溶液ワクチンは、対照に対して最大の細胞傷害を有するマウス脾臓細胞を提供した。
【0102】
実施例19. PADREを含有するモノ脂質化ワクチンを用いたトランスジェニックマウスのワクチン接種
マウスは上記されるように、(Pam)2- KSSAKXVAAWTLKAAANLVPMVATV(ここではXがシクロヘキシルアラニンを表す)(SEQ ID NO: 37)の増加量をワクチン接種およびアッセイをした。ペプチドは、図6に示す量にて80%DMSO、20%PBSおよび0.08%蟻酸における溶液中に提供された。100あるいは150 nmoleのペプチドを用いたワクチン接種は、強力な特異的細胞傷害を引き起こし、150 nmoleではより強力な結果であった。
【0103】
実施例20. 細胞傷害性の特異性
マウスは上記されるように、実施例19におけるように製剤化されたSEQ ID NO: 37のペプチドの150あるいは25 nmoleを用いてワクチン接種をした。脾臓細胞は、様々な異なるペプチドによりパルスし、そして提示するT2細胞の細胞傷害性についてアッセイした。図7参照。“T2 177パルス”はSEQ ID NO: 39(NLVPMVATV-NH2)のアミド化(amidated)ペプチドを提示する細胞を示す;“T2 118パルス”はSEQ ID NO: 40(YLVPMVASV-NH2)のアミド化ペプチドを提示する細胞を示す。“T2 193パルス”はSEQ ID NO: 41(YLVPMVATV-NH2)のアミド化ペプチドを提示する細胞を示す。結果は、高度の特異性を示した。
【0104】
実施例21 様々なDMSO製剤におけるモノ脂質化ワクチンについての比較データ
マウスを免疫して、それらの脾臓細胞を様々なDSMO濃度を含有するビヒクルにおける100あるいは150 nmoleのSEQ ID NO: 37を用いて実施例17に記載するようにアッセイした。クロム放出アッセイの結果について図8参照。図8A:80%DMSO、20%PBSおよび0.08%蟻酸中100 nmole。図8B:80%DMSO、60%PBSおよび0.04%蟻酸中100 nmole。図8C:80%DMSO、20%PBSおよび0.08%蟻酸中150 nmole。図8D:40%DMSO、60%PBSおよび0.04%蟻酸中150 nmole。モノ脂質化ワクチンの製剤は、完全にワクチンペプチドを可溶性にするのに十分なDMSO濃度で提供されるときにより効き目があった。理論により縛られることを望まないが、脂質化ペプチドワクチンの完全な可溶性を生じさせるDMSOの濃度は、よりすぐれた結果を提供すると信じられる。
【0105】
実施例22. 様々なDMSO濃度を用いたワクチン接種実験
マウスを免疫して、それらの脾臓細胞をDSMOの減少量を含有する以下のビヒクルにおける100 nmoleのSEQ ID NO: 37を用いて実施例17に記載するようにアッセイした。図9A:80%DMSO、20%PBSおよび0.02%蟻酸;図9B:70%DMSO、30%PBSおよび0.07%蟻酸;図9C:60%DMSO、40%PBSおよび0.06%蟻酸;図9D:50%DMSO、50%PBSおよび0.02%蟻酸。図9Aについての製剤は溶液であり、より少ないDMSOを含有する残りの製剤は懸濁液であった。図9Dにおける結果はブースターを受けたマウスを反映しており、一方、図9の残りのパネルは1回のワクチン接種のみを受けたマウスからのデータを示す。これらのデータは、ワクチンが最高の結果のために完全に可溶化されるべきであるという仮説を確認にする。
【0106】
実施例23. 様々なDMSO濃度を用いたワクチン接種実験
実施例22の方法を、以下の製剤を使用して繰り返した。図10A:80%DMSO、20%PBSおよび0.02%蟻酸;図10B:70%DMSO、30%PBSおよび0.02%蟻酸;図10C:60%DMSO、40%PBSおよび0.02%蟻酸;図10D:50%DMSO、50%PBSおよび0.02%蟻酸。前のように、図10Aにおいてデータを産生するために使用したワクチン調製は溶液であり、一方、残りの製剤は懸濁液であった。図10Dにおいてアッセイされる脾臓細胞を提供するマウスは、ブースター免疫を受けた。
【0107】
実施例24. ブースター免疫の効果
マウスを免疫して、それらの脾臓細胞を25あるいは50 nmoleのSEQ ID NO: 37の1あるいは2回の免疫を使用して実施例17に記載するようにアッセイした。図11における結果を参照。図11A:50 nmole;図11B:25 nmole;図11C:50 nmole+1回のブースター;図11D:50 nmole+1回のブースター。ブースター注射は、50 nmole投与量についての免疫により達成される細胞傷害効果を増加させたが、25 nmole投与量について向上の提供は明らかにほとんどないあるいはなかった
実施例25. 変化可能な蟻酸濃度の効果
マウスを免疫して、それらの脾臓細胞を0.08%蟻酸(図12Aおよび12B)あるいは0.02%蟻酸(図12Cおよび12D)を含有する、80%DMSO、20%PBS中のSEQ ID NO: 37の1回の免疫を使用して実施例17に記載するようにアッセイした。注射したペプチドの量は、150 nmole(図12A)、100 nmole(図12B)、50 nmole(図12C)あるいは25 nmole(図12D)であった。より多量の投与量では明らかに、ワクチン接種後のより高い特異的細胞傷害性を生じた。
【0108】
実施例26. PADREに結合する非脂質化ペプチドを使用するワクチン接種
マウスを免疫して、それらの脾臓細胞を、不完全フロインドアジュバントを用いて乳化した1つの配列(100 nmole;KS SAKXVAAWTLKAAANLVPMVATV、ここではXはシクロヘキシルアラニンである;SEQ ID NO: 37)を形成するために直接PADREに結合する、SEQ ID NO: 1のHCMVペプチドの1回の注射を使用して実施例17に記載するようにアッセイした。投与したワクチンは、5%DMSO、45%通常食塩水および50%不完全フロインドアジュバントを含有する100μLの乳濁液であった。10%Rat-Stimの存在下で2回刺激したSEQ ID NO: 1のペプチドを提示するT2細胞を使用して試験すると、免疫化脾臓細胞は100のE/T比では11.22%および20のE/T比では3.18%の特異的細胞障害性を示した。免疫化脾臓細胞は、対照p53ペプチドを提示するT2細胞については-4.44%および-0.10%、SEQ ID NO: 39のペプチドを提示するT2細胞については3.31%および3.44%、および未処理T2細胞については-6.39%および-1.81%、の平均%細胞傷害性を示した。
【0109】
実施例27. DNAアジュバントにおける非脂質化結合ペプチドを使用するワクチン接種
2尾のマウスは、CpG配列を含有する50μg DNAアジュバント(陽性DNAアジュバント)と共に100 nmoleのSEQ ID NO: 37のペプチドを用いて1回免疫した。使用したDNA配列は、Z. Moldoveanu, Vaccine 16(11/12):1216-1224 (1998)に記載されるように、(1826)5' TCCATGACGTTCCTGACGTT 3'(SEQ ID NO: 42)であった。これらの免疫化脾臓細胞からのクロム放出アッセイデータは、以下に表7において提供する。
【0110】
実施例28. DNAアジュバントにおける非脂質化結合ペプチドを使用するワクチン接種
実施例27は、CpG配列を欠くDNAアジュバント(陰性DNAアジュバント)を使用して繰り返した。使用したDNA配列は、Z. Moldoveanu, Vaccine 16(11/12):1216-1224 (1998)に記載されるように、(1982)5' TCCAGGACTTCTCTCAGGTT 3'(SEQ ID NO: 43)であった。これらクロム放出アッセイデータは、以下に表7において提供する。
【0111】
【表7】

本発明の特定の好ましい態様および実施例を記載したが、本発明は限定されない。当業者は、本発明が診断および治療の分野において広く適応可能であり、修飾および変化がその意図および範囲から離れずに本発明に対して行われうることを理解するであろう。
【図面の簡単な説明】
【0112】
【図1】図1は、脂質化(lipidation)のない状態でペプチドにより引き出される細胞傷害性応答を示す。
【図2】図2は、モノ脂質化(monolipidated)ペプチドにより引き出される細胞傷害性応答を示す。
【図3】図3は、ジ脂質化(bilipidated)ペプチドにより引き出される細胞傷害性応答を示す。
【図4】図4は、1回(A)、2回(B)あるいは4回(C)in vitro刺激後に免疫された脾臓細胞による抗原提示細胞の細胞傷害性を示す棒グラフである。
【図5】図5は、SEQ ID NO: 37を用いて免疫した細胞についてのクロム放出アッセイの結果を示す。
【図6】図6は、SEQ ID NO: 37を用いて免疫した細胞についてのクロム放出アッセイの結果を示す。
【図7】図7は、100あるいは25 nmoleのSEQ ID NO: 37を用いて免疫したマウス由来の細胞についての比較細胞傷害性データを示す。
【図8】図8は、様々なワクチン製剤におけるSEQ ID NO: 37を用いて免疫した細胞についての細胞傷害性データを比較する。
【図9】図9は、SEQ ID NO: 37を含有するワクチンおよびDMSOの様々な濃度の効果を比較する。
【図10】図10は、SEQ ID NO: 37の様々なワクチン製剤を用いて免疫した細胞由来の細胞傷害性データを比較する。
【図11】図11は、ブースター免疫化を用いるあるいは用いずに25あるいは50 nmoleのSEQ ID NO: 37を用いて免疫した細胞由来の細胞傷害性データを比較する。
【図12】図12は、様々な製剤におけるSEQ ID NO: 37を用いて免疫した細胞由来の細胞傷害性データを比較する。
【発明の詳細な説明】
【0001】
連邦政府委託研究に関する記述
本発明は、米国保健社会福祉省からの助成番号CA30206、CA77544およびCA33572の形式における政府の支援を用いて行われた。政府は本発明において特定の権利を有しうる。
【0002】
発明の背景
1.技術分野
本発明は、ヒトサイトメガロウイルス(HCMV)、および特にヒトにおいてHCMVのT-細胞エピトープとして機能する1つあるいはそれ以上のサブユニットタンパク質由来のペプチド断片に関する。本発明のペプチドは、ヒト細胞傷害性Tリンパ球(CTL)がHCMVの感染と同等にヒト細胞を認識して融解することを指示することが可能である。これらのペプチドを使用して製剤化されるワクチンも、本発明により提供される。
【0003】
2.背景技術の説明
HCMVゲノムは比較的大きく(約235k塩基対)、200以上のタンパク質をコードする能力を有する。HCMVは、構造的あるいは酵素的な機能を有するカプシドタンパク質により囲まれる二本鎖DNAの核複合体、および外側の糖ペプチド-および糖脂質-含有膜エンベロープから成る。HCMVはヘルペスウイルス科の一員であり、多くの臨床的症候群に関連している。
【0004】
HCMV感染は比較的よくあり、通常は健康で免疫応答のある小児あるいは大人において自己制限的であるが(L. Rasmussen, Curr. Top. Microbiol. Immunol. 154:221-254, 1990)、しかし、全新生児の約10%がHCMVを保持しており、ウイルスは胎児あるいは幼児に重篤な先天性疾患を引き起こす可能性がある。これらの新生児のある者は、先天的な出生欠損症を受ける。新生児の別の者は、疾患の症状を示す前のある期間サイトメガロウイルスを保持する。HCMVは、活性のある感染を保持していた母親から子宮内で感染を受けた小児における精神遅滞のよくある原因である。
【0005】
いくつかの研究は、それ以外は健康な大人における持続的で一見すると無症状なHCMV感染が、ある個人において健康のリスクであるかどうかを問うことを始めた。例えば、冠動脈血管形成術を行った個人は時々、その後に動脈リモデリングの結果として再狭窄を生じる。ある研究では、再狭窄を有するそのような患者の約3分の1が、彼らの動脈病変に検出可能なHCMV DNAを有していた(E. Speir et al., Science 265:391-394 (1994))。別の研究では、CMV血清陽性の患者は、それらの血清陰性の対照者より5倍以上再狭窄を生じやすかった(Y.F. Zhou et al., New England J. Med. 335:624-630 (1996))。これらの研究は、HCMVに感染した宿主細胞の数を減少させることは特定の個人にとって有益でありうることを示唆する。
【0006】
HCMVはまた、免疫不全の患者における罹患率および死亡率にも関連した。HCMVは、後天性免疫不全症候群(AIDS)にかかっている患者の治療において重要に考慮されるものである。明確な合併症はウイルス性網膜炎であり、それはもし治療されないと、失明する可能性がある。歴史的に、CMV病はHIV-1感染個人をおそう日和見感染のよりひどいものの一つであった。CD4+T細胞数が100/mm3以下に低下したときに現れるCMVウイルス血症の疾患徴候は、脳炎、腸炎および肺炎を含む。剖検では、重篤なCMV網膜炎を有したAIDS患者の多くでCMV病の多臓器関与がある。HCMVに感染した患者はしばしば、唾液腺、脳、腎臓、肝臓および肺を含む、彼らの生命維持に必要な臓器のいくつかの損傷を受ける。さらに、HCMVは、単球増多症および間質性肺炎を含む古典的な広いスペクトルの症候群に関連する。HCMVはまた、発癌の可能性およびカポジ肉腫を含むある型の悪性腫瘍との関連の可能性も有する。
【0007】
HCMVは日和見感染を起こして、例えば、免疫抑制された臓器移植患者に様々な合併症を引き起こしうる。抗ウイルス化学療法が使用される以前は、HCMV感染は骨髄移植(BMT)後合併症の実質的な割合の原因であった(J. Meyers et al., J. Infect Dis. 153:478-488 (1986))。実質的な抗-HCMV活性を有するガンシクロビルなどの薬物の出現により、BMT後CMV感染に関連する合併症が劇的に減少した(G. Schmidt et al. New England J. Med. 324:1005-1011 (1991); J.M. Goodrich et al., New England J. Med. 325:1601-1607 (1991))。
【0008】
ガンシクロビルは、HCMV感染の診断前に予防的に投与するとき最も効果がある。しかし、このアプローチは、好中球減少をきたすレシピエントの割合の増加(3分の1)および随伴する致命的な細菌および真菌病の数の増加を含むいくつかのネガティブな結果を有する(J.M. Goodrich et al., Ann. Intern. Med. 118:173-178 (1993))。HCMV抗原あるいはDNAが培養方法により最初に検出されるときにガンシクロビルを与える代替アプローチは、全ての患者の予防あるいは治療後疾患と比較して、生存的な利点は提供しなかった(D.J. Winston et al., Ann. Intern. Med. 118:179-184 (1993))。結局、副作用の急激な性質のため、治療された患者には入院の延長および成長因子の投与が必要となり、ガンシクロビル予防の費用につながり、BMT後ケアの費用を増加させる。
【0009】
ヒトサイトメガロウイルスは比較的一般的であり、さらに極度に深刻な健康状態に関連しているため、相当な努力をして、疾患の診断の向上ならびに予防および治療的ストラテジーの開発の目的をもって、ウイルスの生物学が研究された。CD8+CTL反応の増大(mounting)は、ある急性ウイルス性感染に対する重要な哺乳類宿主反応であると考えられている。HCMV感染が広範で持続的であり、免疫抑制をされた患者において再発されおよび臨床的に明らかであり得るという観察は、HCMV-特異的CTLを含むウイルス-特異的T細胞が、持続感染の調節およびHCMV疾患からの回復において重要な役割をしていることを示唆する。
【0010】
ヒトでは、免疫抑制されたBMTレシピエントにおけるCMV疾患の進行の防止は、測定可能なCD8+CMV-特異的クラスI MHC-拘束性T細胞反応の回復と相関する(Quinnan et al., New Eng. J. Med. 307:7-13 (1982); Reusser et al., Blood 78:1373-1380 (1991))。これらの観察により、研究者はドナー-由来HCMV-特異的CD8+CTLをガンシクロビル予防および治療の代替としてBMTレシピエントに注入する臨床試験を実行した(S.R. Riddell et al., Science 257:238-241 (1992))。CD8+CTLクローンをアロジェニック骨髄移植レシピエントへ移すと、検出可能CTL-ベースのHCMV免疫、およびBMT後HCMV疾患の統計的に有意な減少を生じた(E.A. Walter et al., New Eng. J. Med. 333:1038-1044 (1995))。
【0011】
このアプローチは、適用の成功にも関わらず、患者に再注入するためのin vitroでのHCMV-特異的CTLを誘導するために、洗練された(高度に労働集約的で、費用も高い)実験室設備が必要であるという不都合を有する。所望される代替は、BMTレシピエント、固体臓器レシピエント、心臓疾患患者、AIDS患者あるいは妊娠期間の女性に対して免疫を与えるHCMV由来ワクチンを、HCMV-特異的CTLのex vivo拡大(expansion)を必要とすることなく送達することであろう。しかし、そのようなワクチンは現在入手できない。そのようなワクチンを開発するためには、宿主に防御様式にてHCMVを認識させるウイルスペプチドを同定しなければならず、そうすればそれらのアミノ酸配列情報が決定できる。
【0012】
ウイルスの生活環は、最大限にウイルスの産生および拡大を崩壊させるためのワクチンを標的とする最も効果的な時間枠に関しての洞察を提供する。宿主細胞へのHCMVの侵入および脱殻の後、ウイルスゲノムは前初期(0-2時間)を経て、初期(2-24時間)および後期(>24時間)ウイルスタンパク質を連続的に発現する。しかし、pp65などの特定のウイルス構造タンパク質は、大量のウイルス粒子が存在するため、細胞内でシャペロン化(chaperoned)される。多くの注目が、HCMV-特異的CTL反応のための潜在的イムノドミナント(immunodominant)標的抗原としての構造ビリオンタンパク質に集中した。
【0013】
1つのウイルス構造タンパク質、pp65、は、最も無症状のCMV血清陽性個体の末梢血由来CMV-特異的クラスI MHC拘束性CTLの標的抗原として同定された(E. Mclaughlin-Taylor et al., J. Med. Virol. 43:103-110 (1994))。前初期(IE)タンパク質はプロセスされて、多くの正常血液ドナーにおいてIE-特異的CTLの刺激を引き起こすCTLエピトープを形成する(F. Kern et al., J. Virol. 73(10):8179-8184 (1999); C. Retiere et al., J. Virol. 74(9):3948-3952 (2000); G. Zyulai et al., J. Infect. Dis. 181:1537-1546 (2000); F. Kern et al., Eur. J. Immunol. 30:1676-1682 (2000))。それにもかかわらず、IE-特異的CTLは、pp65あるいはpp150などの構造タンパク質に対して特異的なCTLと同様に、CMV感染標的細胞を殺すあるいは溶解することは示されなかった。重要なことに、pp65に特異的なCD8+クラスI MHC拘束性CTLは、おそらく感染中に細胞内に移されるpp65の内在性貯蔵(internal depot)のプロセッシングの結果として、ウイルス遺伝子発現を必要とせずに自己由来HCMV感染細胞を認識するであろう(M.J. Gilbert et al., J. Virology 67:3461-3469 (1993))。pp65あるいはpp150(頻繁に認識されるもう一つの基質タンパク質)に対するCTLは、ウイルス遺伝子発現のない感染の1時間以内にin vitroでHCMV感染細胞を認識して溶解できる(S.R. Riddell and P.D. Greenberg, Curr. Top. Microbiol. Immunol. 189:934 (1994))。このように、これらのCTLはCMV疾患へのHCMV再活性化および進行を制限するための重要なエフェクター細胞を表している可能性があり、また免疫不全および正常な個体の両方におけるそのような細胞性免疫応答は非常に重要であろう(C.-R. Li et al., Blood 83:1971-1979 (1994))。エンベロープタンパク質を認識するCTLはpp65およびpp150 CTLの代用にはならず、なぜならそれらはほとんど見出されず、感染の後期に出現し、そしてそれらは必要なクラスI MHC分子の抑制制御のために弱い溶解エフェクターであるからである(M.J. Gilbert et al., J. Virology 67:3461-3469 (1993))。ゆえに、pp65あるいはpp150に対する免疫を刺激するワクチンは、CMV感染に対する防御免疫を引き出すための好ましい機序でありうる。
【0014】
個々のMHCクラスI分子は、所定のモチーフのペプチドを優先的に結合する。モチーフの特異的な位置のアミノ酸配列は不変であり、所定のペプチドを高い親和性でMHCクラスI分子に結合させる。これらは“アンカー位置”として言及される(K. Falk et al., Nature 351:290-296 (1991))。アンカー位置以外のアミノ酸位置もまた、MHCクラスI分子に結合するペプチドの特異性に寄与する。さらに、それにもかかわらず、MHCと相互作用しないCTLエピトープ内の位置にある残基は、おそらくT細胞受容体(TCR)を結合させることによりT細胞と相互作用しうる。ペプチドアミノ酸残基のMHCあるいはTCR構造への結合は独立して支配されており、そのため多くの場合においてTCR結合アミノ酸残基の置換は、抗原提示細胞の表面上のMHC分子への結合を干渉しないであろう。
【0015】
エドマン分解に続くN末端配列解析を使用して、MHCクラスIペプチド結合溝に結合するペプチド混合物を配列決定した。大半の場合、これらのペプチドの長さは9から11アミノ酸の間である。HPLC分離ペプチド混合物のマススペクトロメトリーにより、個々のペプチドの一次配列を解明することができる。この様式で同定されたMHCに結合するペプチド断片は、“自然にプロセスされたエピトープ”として言及される。あるいは、所定の長さ、9-11アミノ酸の間のいずれのペプチドが、モチーフとの一致に基づいて個々のHLAクラスIアリルと最適に結合するのであろうかという予測ができる(K. Falk et al., Nature 351:290-296 (1991))。1つのそのようなモチーフは、HLA A*0201について確立された。ノナペプチドアンカー残基はHLA A*0201について位置2および9に配置され、結合強度の重要性の高い順に位置1、4、3、5、6、7、8から結合することに副次的に寄与する(J.W. Drijfhout et al., Human Immunology 43:1-12 (1995))。同様なモチーフは、HLA A*0201のデカマーおよびウンデカマー(undecamer)について確立された。相応して、独特なアミノ酸モチーフはその他のHLA AおよびBアリルのサブセットについて確立され、8-11アミノ酸の間の結合ペプチドが予測された(H.G. Rammensee et al., Immuno enetics 41 (4):178-228 (1995))。
【0016】
CTLは、哺乳類生物がウイルスによる感染およびおそらく癌に対して自身を守る重要な機序であると認識される。MHCクラスI分子と共同する、例えばウイルスタンパク質最小細胞傷害性エピトープ(MCE)のプロセス型は、CD8+CTLなどのT細胞により認識される。ウイルス-および腫瘍-特異的T細胞の機能的な研究により、8-12アミノ酸のMCEは抗原提示細胞(APC)をプライム化して、APCが細胞表面上でペプチドを結合させるであろう正しいMHC分子を発現するときに限り、CD8+CTLにより溶解されることが確かめられた。
【0017】
タンパク質の細胞内への侵入のルートは、それがMHCクラスIあるいはII分子のいずれかに結合する抗原としてプロセスされるかどうかを決定する、ということが示された。タンパク質分解の内在的あるいはクラスI経路はしばしば、感染ウイルスが細胞内に存在するときにそれらにより使用される。完全長分子として細胞表面に決して到達しないであろうウイルス核タンパク質は、さらに細胞内でプロセスされて、そして分解された部分はMHCクラスI分子を介して表面に移動させられる。ウイルスエンベロープ糖タンパク質は、単に細胞表面分子であるため、義務的にはCTL認識を誘導しない。むしろ、ウイルス核タンパク質は、プロセスされたエピトープの形において優勢であり、CD8+CTLにより認識される標的抗原である(A. Townsend et al., Philos. Trans. R. Soc. Lond.(Biol). 323:527-533 (1989))。
【0018】
外因性経路(飲食作用など)を介して細胞内に入る抗原は、クラスI MHC分子により典型的にはプロセスおよび提示されない。ゆえに、細胞質中に直接タンパク質を導入する方法がワクチン開発の焦点となった。支持を獲得したアプローチは、組換えワクシニアウイルスを使用して細胞を感染させて、大量の細胞内抗原を送達することである。しかし、ワクチンとしてワクシニアウイルスを使用する魅惑は減少した、なぜなら、これらのウイルスがWestern Reserve株を基礎におくBMTレシピエントなどの免疫を抑制された患者において疾患を引き起こす可能性があるためである。ワクチンに対するもう一つのアプローチは、抗原性タンパク質をアジュバントと混ぜて、皮下注射により皮膚の下に混合物を導入することである。
【0019】
CTLを引き出すための免疫に対するさらなるもう一つの可能性のあるアプローチは、特定のMHC拘束性要素の文脈においてウイルス抗原について定義されたMCEを使用して、ウイルスに対するCTL記憶応答をブーストすることである。感染ウイルスの致死量によるチャレンジに対して防御免疫を提供するMCEの能力は、文献にて議論された。ワクチン開発者は、ワクチンとしてMCEを利用することへの興味の増加を発展させた、なぜなら、それは内在化あるいはプロセッシングなしで細胞表面分子の外因性結合を介してMHCクラスI分子に結合できるからである。
【0020】
歴史的に、MCEはヘルパーCD4エピトープと共に脂質化(lipidated)ペプチドとして合成されるときに免疫原として最も効果的であった(A. Vitiello et al., J. Clin. Invest. 95:341-349 (1995)およびB. Livingston et al., J. Immunol. 159:1383-1392, 1997)。二重特異性ワクチンのその他の修飾は、最大活性を到達させるための小胞体の保持および標的のためのシグナル配列(KDEL)の包含を含む。文献中には、特定の型のAPC(例えば、樹状細胞)により提示されるMCEは、ウイルス感染あるいはウイルスあるいは腫瘍細胞との先の接触がない場合に一次免疫応答を引き起こしうるという証拠もある。
【0021】
レシピエントへのCMV-特異的CTLの導入は、HCMV感染に対して免疫される必要がありうる全てのリスク保持個人に対して免疫を与えるための一般的に適用されるそして実用的なストラテジーではない。従って、CTLにより認識されるHCMVタンパク質を同定すること、ならびにHCMV後期構造タンパク質pp65の特異的同定に対する顕著な努力にもかかわらず、HCMV感染を予防および治療する方法の向上が必要とされる。
【0022】
発明の概略
結果的に、本発明の一つの観点は、ヒトにおいてHCMVに対する細胞性免疫応答を引き出すことができる免疫学的に活性なペプチド、およびその機能的変異体、例えば、SEQ ID NO: 10-25および30-41に関する。ペプチドは、ヒトCTLを指示してHCMVに感染したヒト細胞を認識して融解させることができる。そのような免疫学的に活性なペプチドは、MHCクラスI分子に関連しており、潜在的な(不活性な)HCMV感染を有する個体のCTLにより認識される。
【0023】
本発明のもう一つの観点は、患者のCTLおよび/あるいはCTLp(CTL前駆体)により認識されるであろう本発明に従う少なくとも1つの免疫学的に活性なペプチドあるいはペプチド誘導体を投与することによって、免疫系の増大を必要とする患者(すなわち、潜在的なあるいは不活性なCMV感染を有している患者)の免疫系を増大させる方法を提供する。
【0024】
本発明のさらなるもう一つの観点において、少なくとも1つの免疫学的に活性なペプチドを非感染個体に投与して、HCMVによる将来的な感染に対する免疫を提供する。そのようなペプチドは、場合によりアジュバントと共に、ペプチドあるいはリポペプチドワクチンの形で投与されうる。
【0025】
あるいは、ペプチドはペプチドを表面で提示するためにin vitroで処理された自己由来のあるいはアロジェニックな抗原提示細胞あるいは樹状細胞の投与を介して、細胞性ワクチンの形で投与されうる。
【0026】
本発明のさらにもう一つの観点は、潜在的にCMVに感染し、そしてCMV感染の再活性化のリスクを有する個体の免疫応答を増大させる方法であり、そこではT細胞を個体から取り出して本発明のペプチドを用いてin vitroで処理する。結果として得られたCMV-反応性CTLは、患者、例えばBMTレシピエント、に自己由来的にあるいはアロジェニック的に再注入する。
【0027】
さらに別の観点において、以前に感染していない個体にHCMV感染に対する免疫を与える方法は、個体からT細胞を取り出し、T細胞をin vitroで本発明のペプチドに暴露し、そして結果として得られたHCMV-反応性CTLを個体に再注入するステップを含む。
【0028】
本発明のペプチドはまた、以前に感染したあるいは非感染の患者、あるいはin vitroでT細胞にポリヌクレオチド(DNA-ベースの)ワクチンの形で投与する可能性もあり、そこでは、適した発現制御配列の調節の下でペプチド断片をコードするDNAを含有するプラスミドあるいは操作されたウイルスベクターなどの、適した遺伝子運搬ベクターを患者あるいは培養中のT細胞に投与する。
【0029】
さらに別のその観点において、本発明は、CTL機能を刺激および延長する組換えウイルスにおけるヘルパーCD4エピトープを場合により含む、免疫学的に活性なペプチド断片をコードするDNA配列を含有するワクシニアウイルスベクター、修飾ワクシニア アンカラ(Vaccinia Ankara)ウイルスベクター、カナリア痘ウイルスベクターあるいはその他の真核ウイルスベクターを提供する。ベクターは、潜在的(不活性)HCMV感染を有するCTL患者により認識されるであろう抗原を次々に提示する抗原提示細胞に感染する。
【0030】
本発明のさらなる観点は、静止HCMV感染に対する活性の存在の検出のための診断的試薬に関する。本発明に従うペプチドは、in vitroで直接にCTLpを刺激することができ、そのため、HCMVにより引き起こされる免疫刺激の程度を決定するアッセイに使用することができる。ペプチドはまた、血清陽性の個体と血清陰性の個体とを識別するためにも使用できる。患者由来のT細胞は、本発明に従うペプチドを用いてプライム化した抗原提示細胞とin vitroで接触させることができる。
【0031】
本発明は、SEQ ID NO: 10-25および30-41に従うペプチドおよびSEQ ID NO: 1、10-25および30-41のペプチドを含むワクチンを含む。細胞性ワクチンもまた提供され、これはSEQ ID NO: 1、10-25および30-41のいずれか一つに従うペプチドを提示するためにin vitroで処理された抗原提示細胞を含む。さらに、本発明は、SEQ ID NO: 1-14、19、26-28および30のいずれか一つに従うペプチドをコードする遺伝子を発現する組換えウイルスベクターワクチンを含む。加えて、さらなる態様は、ヒトサイトメガロウイルス感染に対する免疫応答をモジュレートする方法を含み、上記のようなワクチンを投与することを含む。
【0032】
好ましい態様の詳細な説明
配列NLVPMVATV(pp65495-503)(SEQ ID NO: 1)を有するノナペプチドは、現在まで調べられているCMV実験室株AD169およびTowneおよびその他の野生型分離株由来のpp65の免疫原性エピトープである。エピトープは、潜在的なCMV感染を保有する患者のCD8+クラスI MHC拘束性細胞傷害性T-リンパ球により認識される。ペプチドは活性ウイルス複製がない状態でCTLを活性化することができ、従って、正常および免疫不全患者の両方の免疫系を増大させるために、ならびにHCMVタンパク質のクラスI抗原プロセス経路の研究において有用である。位置2および9にあるアミノ酸残基は、HLA A*0201およびあるサブタイプのHLA A*02XX、ここではXX = サブタイプ02-22、との相互作用のためそれらの位置での好ましい残基である(J.W. Drijfhout et al., Human Immunology 43:1-12 (1995))。それにもかかわらず、その他のより好ましくないアミノ酸残基は好ましいアンカーを置換する可能性があり、ペプチドはHLA A*0201およびあるサブタイプのHLA A*02XXを結合する能力を示し、およびHCMV-特異的CD8+CTLを刺激し続けることができる。
【0033】
このように、一つの観点において、本発明はヒトサイトメガロウイルス感染に対する細胞性免疫応答を引き出すことができる、好ましい配列:
NLVPMVATV(SEQ ID NO: 1)である免疫学的に活性なペプチドを提供する。
【0034】
好ましいペプチドの配列変異体は、配列NX1VPMVATX2のペプチドを含み、X1はL、I、M、TあるいはV、およびX2はV、A、C、I、LあるいはTである(SEQ ID NO: 2)。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる、例えば、AAKXVAAWTLKAAANLVPMVATV、ここでXはシクロヘキシルアラニンである;SEQ ID 番号:15あるいは(d)AAKXVAAWTLKAAANLVPMVATV、ここでXはシクロヘキシルアラニンを表す(SEQ ID NO: 16)。
【0035】
本発明に従うその他の免疫学的に活性なペプチドは、以下のペプチドを含む。
YSEHPTFTSQY(SEQ ID NO: 3)
は、A*0101およびそのサブタイプを含むHLA A*01XXに結合する。このペプチドの配列変異体は、XがS、TあるいはLである配列YXEHPTFTSQY(SEQ ID NO: 4)のペプチドを含む。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0036】
FVFPTKDVALR(SEQ ID NO: 5)
は、A*6801およびそのサブタイプを含むHLA A*68XXに結合する。このペプチドの配列変異体は、X1がVあるいはTおよびX2がL、RあるいはKである配列FX1FPTKDVALX2(SEQ ID NO: 6)のペプチドを含む。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0037】
TPRVTGGGAM(SEQ ID NO: 7)
は、B*0702およびそのサブタイプを含むHLA B*07XXに結合する。このペプチドの配列変異体は、XがL、F、あるいはMである配列TPRVTGGGAX(SEQ ID NO: 8)のペプチドを含む。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0038】
FPTKDVAL(SEQ ID NO: 9)
は、互換性ペプチド結合部位を有するB*3502、B*3504、B*3506およびその他のそのサブタイプを含むHLA B*35XXに結合する。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0039】
RPHERNGFTVL(SEQ ID NO: 10)
は、互換性ペプチド結合部位を有するB*0702およびその他のそのサブタイプを含むHLA B*07XXに結合する。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0040】
SVLGPISGHVLK(SEQ ID NO: 11)
は、互換性ペプチド結合部位を有するA*1101およびその他のそのサブタイプを含むHLA A*11XXに結合する。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0041】
PTFTSQYRIQGKL(SEQ ID NO: 12)
は、互換性ペプチド結合部位を有するHLA B*3801/2およびその他のそのサブタイプに結合する。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0042】
EFFWDANDIY(SEQ ID NO: 13)
は、互換性ペプチド結合部位を有するB*4402およびその他のそのサブタイプを含むHLA B*44XXに結合する。本発明はその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0043】
FTSQYRIQGKL(SEQ ID NO: 14)
は、互換性結合部位を有するA*2402およびその他のそのサブタイプを含むHLA A*24XXに結合する。本発明は、TFTSQYRIQGKL(SEQ ID NO: 44)などのその他の機能的な配列変異体の構造および選択を含み、本開示に基づいて当業者により実行されることができる。本明細書で開示されるペプチドあるいは構造変異体もまた、本明細書で開示される免疫学的な効果を産生するより長いペプチドの機能的部分でありうる。
【0044】
以下の構造物は、本発明に従うペプチドワクチンを例示するが、それらに限定する意図はない:
AKXVAAWTLKAAANLVPMVATV(SEQ ID NO: 17)
dAKXVAAWTLKAAANLVPMVATV(SEQ ID NO: 18)
VSTIVPYIGPALNIAAANLVPMVATV(SEQ ID NO: 19)
AKXVAAWTLKAAAYLVPMVATV-NH2(SEQ ID NO: 20)
dAKXVAAWTLKAAAYLVPMVATV- NH2(SEQ ID NO: 21)
AKXVAAWTLKAAANLVPMVATV- NH2(SEQ ID NO: 22)
AKXVAAWTLKAAAYLVPMVASV- NH2(SEQ ID NO: 23)
AKXVAAWTLKAAANLLPMVASV- NH2(SEQ ID NO: 24)
AKXVAAWTLKAAASVLGPISGHVLK(SEQ ID NO: 25)
ここでX = シクロヘキシルアラニンおよびd =右旋性である。
【0045】
ワクシニアウイルスにおいて発現されるpp65(Diamond et al. 1997)タンパク質のトランケーション(truncation)は、HLA型CMV-血清陽性個体由来のpp65-特異的T細胞(CD8+)クローンに対してスクリーニングされた(Walter et al., New Engl. J. Med. 333:1038-1044 (1995); McLaughlin-Taylor et al., J. Med. Virol. 43:103-110 (1994))。CTLエピトープの細かな縮尺マッピングを容易にするために、アミノ末端欠失およびカルボキシル末端欠失の両方を用いて、pp65遺伝子中にわたる100-200ヌクレオチドにより分離されるpp65断片を発現する組換えワクシニアウイルスを調製した。組換えワクシニアウイルスにより囲まれる領域が100アミノ酸程度であったとき、一連の重複ペプチドが合成された。pp65由来の一連の15 merペプチドは、3つのアミノ酸により重複され、CTLエピトープを同定するために使用された(Longmate et al., Immuno genetics (2000))。この方法におけるpp65の100アミノ酸長のスクリーニングは、全体で29の異なるペプチドが必要である。自己由来およびHLAミスマッチのエプスタイン-バーウイルス形質転換リンパ球細胞株(抗原提示細胞)は、50μMの濃度で1-2時間スクリーニングペプチドを用いて感作して、洗浄およびクロム化(chromate)した。関連したCTLクローンは、ペプチドを用いて感作したリンパ球細胞株と共にインキベートして、そして標準的なクロム放出アッセイを行って溶解の感受性を決定した。そして、pp65-特異的T細胞クローンによる溶解に対してうまくリンパ球を感作したペプチドはさらにアミノおよびカルボキシル末端で短縮し、再試験した。これらのペプチドは、使用したT細胞クローンのHLAアリルに対応する最小の細胞傷害性エピトープを明らかにするまで、繰り返した。pp65の例示的なエピトープは表6に示した。
【0046】
上で概略した方法を使用して、ワクチン産生に適したペプチドを様々なハプロタイプを有する個体由来のT細胞クローンのために同定できる。この方法では、大きな多人種(multi-ethnic)ヒト集団にワクチンを接種するのに有用なカクテルワクチンがつくられうる。もしワクチンが大半の人種集団の少なくとも90%に使用できるほど広く十分に反応性を有していれば、それは公衆衛生のために使用されることに適している。HCMVに対する多重エピトープペプチドワクチンは、HLA-型の全てのヒトではないが、移植レシピエント、AIDS患者、および妊娠胎児を含むいくつかの様々なリスクを有する患者群にとって非常に有益であろう。
【0047】
本発明に従うペプチドは、いずれかの適した方法に従ってワクチンとして製剤化されうる。裸の(naked)ペプチドあるいは脂質化ペプチドは、適したアジュバントあるいはいずれかの他の医薬的に許容可能なキャリア中で製剤化されうる。細胞性ワクチンは、いずれかの既知の方法により調製されうる。本発明に従うHCMVペプチドは、単独、あるいはポリクローナルヘルパーTリンパ球ペプチドであるPADREなどのヘルパーペプチドと共に投与されうる。CTLエピトープおよびHTLペプチドは一緒にあるいは別々に投与されうるが、それらを時間的に近接させて投与することが好ましい。
【0048】
代替ワクチンは、ヘルパーCD4ペプチドエピトープとCTLエピトープとの融合を含む。ペプチドはどちらの順序からも融合され、所望するならそれらの間にリンカー配列を含有することもありうる。ヘルパーCD4エピトープの例は、合成配列PADRE(J. Alexander et al., Immunity 1:751-761 (1994))および破傷風菌-特異的ペプチドであるが、しかし、いずれのヘルパーTリンパ球ペプチドであっても使用されうる。いくつかの場合、これらの融合ペプチドは、皮下、鼻腔内、腹腔内あるいは静脈内ルートで投与されるとき、さらなる共有脂質修飾あるいはアジュバントを必要としないこともある。あるいは、CpGモチーフあるいはいずれかの他のアジュバントを含有する一本鎖DNAは、限界濃度で同時に提供されるときに融合ペプチドの活性の増加を提供するために共投与されうる。
【0049】
好ましい代替は、抗原性ペプチドをPADREに結合させて2つの配列を1つのペプチド鎖にすることである。所望するなら、PADREは抗原性HCMVペプチドのN-あるいはC-末端に配置され、リンカー配列は2つの配列の間あるいはN-末端配列の前に配置されうる。ワクチンペプチドのこの型の好ましい構造は、AAKXVAAWTLKAAANLVPMVATVであり、ここでXはシクロヘキシルアラニンを示し(SEQ ID NO: 15)、あるいは(d)AAKXVAAWTLKAAANLVPMVATVであり、そこではXはシクロヘキシルアラニンを示す(SEQ ID NO: 16)。
【0050】
本発明のペプチドは脂質化されていても、あるいは脂質を欠いていてもよい。非脂質化ペプチドは、ヘルパーペプチド配列を組み込むかあるいは組み込まないかに関わらず、1脂質化、2脂質化あるいは3脂質化ペプチドワクチンとして、本発明により企図される。ペプチド配列に結合しうる適した脂質は、パルミチン酸、ステアリン酸、ミリスチン酸、ラウリン酸、カプリン酸、デカン酸などを含むが、これらには限定されない。脂質は、いずれかの位置でおよび当該技術分野で既知のいずれかの都合の良い方法でペプチドに接着しうる。
【0051】
アジュバントはワクチン製剤の一部を形成しうる。完全あるいは不完全フロインドアジュバント、水酸化アルミニウムなどのアジュバントが企図されるが、しかし、好ましいアジュバントは、特にヒトにおける使用に関しては、DNAアジュバントである。シトシン-リン酸-グアノシン(CpG)を含む特異的配列を含む一本鎖DNAアジュバントは、当該技術分野で知られており、本発明を用いた使用に関して企図される。これらのCpG配列を欠くDNAアジュバントもまた、本発明を用いて有用である。例示的なDNAアジュバントは、2つのCpGモチーフを有する20 merのヌクレオチド、あるいはいずれかのDNAオリゴマー、一般的には約20から約25ヌクレオチド長、を含みうる。配列の安定性の増加は、ヌクレオチドバックボーン中のリン酸基を2つの基で置換して、ホスホロ-ジエステルバックボーンよりもホスホロ-チオエートバックボーンをつくることにより得られうる。
【0052】
HCMVペプチド-特異的ヒトCTL応答の評価は、以下のように、よく許容される動物モデルであるHLA-A2.1/kbトランスジェニックマウスにて行った。マウスはワクチン調製剤を用いて注射する。ブースターは、所望するなら、12日後に与えうる。最終免疫の約1週間後、脾臓細胞を免疫化マウスの脾臓から調製して培養する。免疫化細胞のin vitroでの刺激のためのリポ多糖(LPS)胚(blast)は、25μg/mL LPSおよび7μg/mL硫酸デキストランを加えることにより、免疫化マウス脾臓細胞(1.0-1.5×106細胞/mL)の懸濁液から無菌的に調製されうる。これらの細胞は、トランスジェニックマウスを免疫して抗原提示細胞をつくるために使用したのと同じCTLエピトープペプチドを用いてロードする。これらの抗原提示細胞を使用して、最終免疫の約12-14日後にin vitroで免疫化トランスジェニックマウス由来の培養脾臓細胞を刺激する。第2のin vitro刺激、あるいはさらなるin vitro刺激は、所望される場合に行われうる。第2の刺激は好ましく、最初のin vitro刺激の5-7日後に行われうる。最後のin vitro刺激の約1週間後、クロム放出アッセイを行って、ワクチンの抗原性ペプチドを用いてロードしたマウスあるいはヒト標的細胞を特異的に認識および殺す免疫化トランスジェニック脾臓細胞の能力を試験しうる。
【実施例】
【0053】
実施例1. T細胞クローンの誘導
CMV血清陽性個体からT細胞クローンを誘導する方法は、文献に記載されている(上記参考文献参照)。40から50ミリリットルの全末梢血の試料は、(標準的抗体法により検出された)CMV血清陽性のボランティアから得た。白血球(WBC)は、Ficoll-HyPaque(DuPont)密度勾配遠心分離を使用して分離した。全血は最初に卓上遠心機にて1400 rpmで10分間遠心分離して、赤血球細胞の数を減少させた。軟膜(buffy coat)をリン酸緩衝食塩水(PBS)を用いて12 mlに希釈して、6 mlを1/2量のFicoll-HyPaqueの上に重層した。最上層は、卓上遠心機において2000 rpmで15-30分間の遠心分離後に除去した。WBCを含有する界面(interface)を除去し、PBSで希釈して8-12分間1000 rpmで再び遠心分離することで、WBCをペレットにした。細胞をPBSに再懸濁してさらにもう1回上記のように洗浄した。4から5百万 WBC/mlを、プールしたAB+(血液型)CMV血清陰性ドナー(HAB)から得たヒト血清を用いたT細胞培地(TCM)に再懸濁した。
【0054】
実施例2. LCL抗原-提示細胞の誘導
同時に、自己抗原提示細胞株をPBLのエプスタインバーウイルス不死化により調製した(Current Protocols in Immunology, Unit 7.22, Wiley-Liss Press (1993)参照)。同じ個体からのCTLおよび抗原提示細胞の誘導は、細胞株の間のHLAマッチングを確実にした。
【0055】
実施例3. HCMVによるin vitro刺激
WBCのin vitro刺激を開始するため、WBCとして同じボランティアから得た自己由来皮膚線維芽細胞の単層を、DMSO-10%HAB中にて105細胞/ml/ウェルで12-ウェルプレートにおいて細胞を24時間平板培養(plate)することにより確立した。培養の24時間後、線維芽細胞をCMVビリオン(AD169あるいはTowne株)に1および5の間の感染多重度で2時間感染させた。培地およびウイルスを単層から吸引して、1 mlの新鮮なDMEM-HABを加えた。単層はさらに4時間培地中でインキベートして、その時間の後、培地を吸引した。8-10百万WBCを含有する培地の2ミリリットルを、CMV感染線維芽細胞を含有するウェル毎に加えた。WBCおよび線維芽細胞は、50 U/mlペニシリン、50μg/mlストレプトマイシン、4 mM L-グルタミン、25μM 2-メルカプトエタノール、10 mM HEPESおよび10%HAB(TCM-HAB)を含有するRPMI-1640(Irvine Scientific)中で培養した。これは最初の刺激と名付けられ、細胞は7日間共インキベート(co-incubate)した。TCM-HABはもし消耗された場合は交換し、培養はもし活発な細胞増殖があった場合は拡張した。
【0056】
WBCは、上記のように調製したHCMV-感染自己由来線維芽細胞の新鮮な単層上で平板培養することにより、第7日に再刺激した。さらに、γ-放射線照射(2500 rad)自己由来PBL(5倍以上のWBC)をフィーダー細胞として加え、培地はこの第2の刺激の第2日および第4日に組換えIL-2(10 IU/ml, Chiron-Cetus)を追加した。急速な細胞増殖を示すウェルは、培地が消耗されたので、IL-2含有の新しい培地が必要である。
【0057】
培養の12-16日後、細胞はクロム放出アッセイ(CRA)におけるCMVマトリックスタンパク質の認識のため回収してアッセイされた。CRAは、T細胞クローンに対して自己由来あるいはHLA-ミスマッチである標的細胞として抗原提示細胞を使用して行った。細胞は、pp28(pp28vac)、pp65(pp65vac)およびppl50(ppl50vac)などのHCMVタンパク質のためのDNAを含有する組換えワクシニアウイルスあるいは野生型ウイルス株WRの感染により調製した。
【0058】
一晩の感染後、抗原提示細胞をクロム-51と共にインキベートして、洗浄し、Current Protocols in Immunology, WileyLiss Press, Unit 7.17, (1993)に記載されるようにアッセイを実行した。CRAにおいて、ワクシニア感染標的細胞はクロム-51を用いてロードして、そしてT細胞クローン(エフェクター細胞)由来の細胞と混合した。細胞は、20:1から1:1に変化する一連のエフェクター:標的細胞比で混合した。4時間のインキベーション期間の後、細胞をインキベートした培地を回収した。培地への放射活性の放出(Re)は、ガンマシンチレーションカウンターを用いて定量した。抗原提示細胞に感染した程度は自然溶解を示し、CTLの非存在下での放射線の放出(Re)は各々のウイルスベクターについて確立した。標的細胞に取り込まれて放出可能な放射線の最大量(Rmax)は、洗浄(1%Triton X100; Sigma)溶液における標的細胞の溶解により確立した。パーセンテージ細胞傷害性は、以下のように表した:
100×((Re)-(Rs) / ((Rmax)-(Rs))。
アッセイは非許容可能であるとみなされ、自然放出(Rs)が30%以下でない場合は繰り返した。
【0059】
アッセイの解析は記載したようであり、陽性結果はpp65vac感染自己APCの特異的認識により示された。pp65についての陽性結果は、試験したポリクローナル集団において、ウイルスにより発現されるpp65 HCMVタンパク質を認識するT細胞があることを示した。
【0060】
実施例4. CTLエピトープの同定のための手順
皮膚線維芽細胞上にてHCMVにより2回刺激されたWBCは、以下のように96ウェルU底プレート中での限界希釈法によりクローン化した。2つのHCMV刺激の後、抗CD4抗体に結合する常磁性ビーズを用いたインキベーションを使用して、陰性選択(negative selection)によりWBCからCD4+T細胞を取り除いた。結果として生じた集団は、一般に90-95%がCD8+(信頼できるT細胞サブセットマーカー)であり、および一般に90%がCD3+(大半の末梢血T細胞のマーカー)であり、フローサイトメトリーあるいは蛍光顕微鏡のいずれかによりアッセイされる。この最終集団は、終量150μlにおいてウェル毎0.3-3細胞の間の濃度で平板培養した。各々のウェルはまた、50-100 IU/ml組換えIL-2(Chiron-Cetus)および0.5 pg/ml PHA(Murex)を追加したTCM-HAB中に、γ-放射線照射の1.0-3.0×105アロジェニック末梢血単核細胞(PBMC)も含有した。
【0061】
培養の3日後、PHAは75μlとrIL-2を追加した新鮮培養培地を交換することで2倍に希釈した。ウェルに3-4日毎に新鮮rIL-2を追加し、培地は必要に応じて交換した。細胞は12-14日後に上記のように新鮮アロジェニックPBMCで再刺激して、個々のウェルでの増殖のためにプレートを注意深く観察した。明白な細胞増殖は、拡張したT細胞をより大きなウェルに移す必要があることを示した。T細胞は2週間毎に再刺激して、次第により大きなウェルに移した。数百万の細胞が蓄積する段階で、いくつかは低温保存して、他のはさらにCRAを受けさせた。このCRAでは、標的はHCMV感染線維芽細胞、非感染線維芽細胞、あるいは野生型ワクシニアあるいはpp28、pp65あるいはpp150のいずれかを発現するワクシニアウイルスに感染した自己由来LCLであった。HLAミスマッチ線維芽細胞およびLCLは、対照として使用した。いくつか試験したもののうちの1つのT細胞クローンは、3-3F4と示されるが、CMVおよびpp65-特異性の両方の特徴を有しており、特異的な様式にて自己由来標的のみに対して反応性であった。異なるHLA表現型を有するその他のT細胞クローンは、最初の末梢血試料が異なるボランティア由来であったこと以外は、同じ方法で最初に単離された。
【0062】
pp65に対するT細胞クローン3-3F4の認識を拘束するHLA成分を同定した。一連のLCLは、3-3F4細胞株の各々のHLAアリルを有する個々に自己由来である標的として使用した。各々の標的はpp65vac、野生型ワクシニアに別々に感染させた、あるいは全く感染させなかった。結果は、HLA A*0201アリルに対して自己由来であるLCLのみが3-3F4 T細胞株により認識および殺されたことを示した。また、3-3F4はCD8+T細胞サブセットに属し、クラスI拘束性ペプチドを認識するCTLの特徴を有することが確立された。細胞株がモノクローナルであるかどうかは、一連の26種のヒトVβ遺伝子セグメントプライマーを使用するPCRレパートリー解析を実行することで試験した。26種のプライマーの一つ、Vβ13.1プライマーのみが、顕著なシグナルを与え、それにより3-3F4 T細胞クローンの明らかなモノクローナル性が説明された。
【0063】
T細胞クローン3-3F4により認識される正確なエピトープあるいはペプチドを同定するために、カルボキシ末端からアミノ末端に向かってpp65タンパク質を削除する一連のワクシニアトランケーションを使用した。CRAは、pp65タンパク質のトランケーション産生物を発現するワクシニアウイルスに感染させた自己由来およびHLAミスマッチLCL標的を利用して行った。この実験は、標的を殺すために必要なアミノ酸377および561の間の領域に配置された。アミノ末端削除の小さなサブユニットを使用して、殺傷に必要な領域をアミノ酸477および561の間にさらに配置した。間接的殺傷(killing)アッセイを利用して、サル腎臓細胞株に分子HLAアリルHLA A*0201およびpp65遺伝子の一部をトランスフェクションして、アミノ酸452-561を含有する断片にその領域を配置した。HLA A*0201により結合される配列に対応して、T細胞クローン3-3F4により認識されるペプチド配列の最終的な決定は、Synergy(Applied Biosystems Model 432)ペプチド合成機にて9-10アミノ酸ペプチドを産生することにより行った。公開された情報を使用して、HLA A*0201の顕著な特徴を有する一連の候補配列を決定して、アミノ酸452-561の間の領域に配置させた。これらは以下のものである:
【0064】
【表1】

これらのペプチドのただ1つのみ(“495ペプチド”あるいは“pp65495-503”として言及される)(SEQ ID NO: 1)が、自己由来LCLがCD8+CTL 3-3F4により認識および殺されるようにプライム化することが可能であること証明した。またHLA A*0201モチーフにも従うpp65由来のその他の9-10アミノ酸ペプチドは、CRAにおいて試験した。いずれか活性を示したものはなかった。全てのペプチドは、移動相としてアセトニトリル/TFAを使用してVydac C18カラムにおけるHPLCによって純度について調べた。それらは平均して70-80%あるいはそれ以上純粋であり、0.1%酢酸溶液から希釈して使用した。
【0065】
実施例5. 細胞溶解を誘導するための495ペプチドの使用
495ペプチドの階段希釈は、CRAにおいて自己由来LCLがT細胞クローン3-3F4により殺されるようにプライム化することにおける、10μMおよび0.01μMの間の活性では変化を示さなかった。1/2-最大(half-maximal)溶解は、0.5 nMペプチドの近くで起きた。ペプチド-トランスポーター欠損細胞株T2(D.B. Crumpacker et al., J. Immunol. 148:3004-3011 (1992))は、HLA A*0201陽性であり、またCRAにおけるペプチドの認識について3-3F4 T細胞クローンの感受性のより下方限界を試験するために使用した。0.1 nMほどの少ないペプチドが、10 nMペプチドの条件と等しく、T2細胞の最大溶解を引き起こすことが見出された。これらの実験は、この最小細胞傷害性エピトープがHLA A*0201アリルに対する強力な結合物質(binder)であることを説明する。
【0066】
表1に示される495ペプチドは、Synergy(Applied Biosystems Model 432)ペプチド合成機にて調製した。皮膚線維芽細胞はペプチドでプライム化して、そして2時間、37℃で10μMの495ペプチドと共に、最後の1時間はクロム-51と共にインキベーションすることによりクロム-51を用いてロードした。ペプチドおよびクロム-51は培地から洗い落とした。
【0067】
T細胞クローン3-3F4(CD8+CTL)は、HCMV血清陽性個体(HLA A*0201陽性)由来であり、CRAにおいてHCMV感染線維芽細胞ならびにペプチドプライム化線維芽細胞を認識することが可能であった。非感染および非プライム化線維芽細胞は、T細胞クローンにより認識あるいは殺されなかった。さらに、ドナー線維芽細胞上に見出されるHLA A*0201アリルのないHLA-ミスマッチ線維芽細胞は、それがHCMVにより感染されるあるいは495ペプチドによりプライム化されるかのいずれかであるとき、T細胞クローンにより認識あるいは殺されなかった。このように、本発明の495ペプチドは全HCMVウイルスの代替として働くことができ、正常T細胞が、もしそれらがHCMVに感染した場合と同じくらい効果的にあるいはより良く線維芽細胞を認識および殺するようにすることができる。
【0068】
実施例6. T細胞クローンによるTNF-αの生成
TNF-αは、多くの細胞型にとって細胞傷害性であるT細胞リンホカインであり、HCMV感染に対して増加するin vivoでの免疫応答に寄与しうる。3-3F4 T細胞クローンの細胞は、全HCMVビリオンあるいは表1の495ペプチドでプライム化されるかのどちらかでプレインキベート(pre-incubate)した自己由来線維芽細胞と共にインキベートした。24時間後、共インキベートした細胞からの上清を上記したようにバイオアッセイにおいて指示(indicator)細胞株に適用した。指示細胞株はWEHI誘導体であり、ピコモルレベルでTNF-αの細胞傷害作用に対して感受性がある。
【0069】
ペプチドプライム化線維芽細胞は、HCMV感染線維芽細胞と同程度かあるいはそれ以上のレベルのT細胞クローン3-3F4由来TNF-αの産生物を誘導した。SEQ ID NO: 1のペプチドは、T細胞なしでインキベートした自己由来線維芽細胞、あるいはT細胞クローンと共にインキベートした非HLA A*0201発現線維芽細胞のいずれかによるTNF-α産生物を誘導しなかった。
【0070】
実施例7. ペプチドSEQ ID NO: 1はHCMV血清陽性個体のPBLからCTLを誘導できる
HCMV血清陽性個体からのPBLは7日間、SEQ ID NO: 1のペプチドプライム化した自己由来線維芽細胞上での平板培養、あるいはSEQ ID NO: 1ペプチドで感作した放射線照射自己由来PBLと共にインキベートした。一度刺激したPBLは、CD4 T細胞の消耗を用いてあるいは用いずに、同様な様式で再刺激した。2週間後、ペプチドプライム化、CMV感染、あるいは未処理自己由来線維芽細胞のいずれかを標的として使用してクロム放出アッセイを行った。CD8+T細胞は、ペプチドプライム化およびHCMV感染線維芽細胞あるいはSEQ ID NO: 1でプライム化したEBVLCLの著しいパーセンテージを溶解したが、未処理細胞は溶解しなかった。自己由来線維芽細胞標的は、同じ条件下で新鮮に取られた血液からのCD4-消耗PBLによっては溶解されなかった。実験は、15人の健康な成人ボランティア由来のT細胞を用いて繰り返した。1つ以外の全ての場合において、マッチングHLAアリルを保持するドナーはSEQ ID NO: 1に応答するT細胞を有した。同様な実験は、T細胞のin vitro刺激を用いずに、HIV患者で行った。マッチングHLAアリルを有するHIV陽性ドナーの大半はまた、SEQ ID NO: 1でプライム化された自己由来EBVLCLを認識できるT細胞クローンも保持していた。
【0071】
実施例8. A*0201以外の分子サブタイプを有する、HLA A2を発現するヒト細胞株は495ペプチドによる溶解に対して感作される
12種の細胞株は、それらを495ペプチド(pp65495-503)ノナマーでパルスして、クロム-51を用いてロードして、495ペプチドおよびHCMVを認識する2つの異なるHLA A*0201拘束性CTLと共にインキベートするクロム放出アッセイに供した。特異的細胞傷害性を計算して、1μMおよび1 nM濃度の495ペプチドについて以下の表形式で示した。プラス記号(+)は30%以上の細胞傷害性を表し、プラス/マイナス記号(+/-)は5%および30%の間の細胞傷害性を表し、マイナス記号(-)は15%以下の細胞傷害性を表す。
【0072】
【表2】

データは、全ての試験をしたサブタイプが1μMでの495ペプチドと機能的に結合し、細胞株はHCMVおよびpp65特異的CTLにより溶解されることを示した。これらのデータはまた、ここに示す細胞株サブタイプが495ペプチドによる溶解について感受性をもたすことができることも示した。データはまた、これらのサブタイプを保持する個体由来の細胞が、たとえHLA A*0201について見出されるものよりも大半の場合において高い濃度でも、CTL認識および溶解についてペプチドにより感作されうることも示した。このように、これらのHLA A2サブタイプのいずれかを保持する個体は、ワクチンとして495ペプチドに応答することができる。
【0073】
実施例9. 495ペプチド(SEQ ID NO: 1)を使用した動物研究
事前にHCMV暴露がないトランスジェニックマウスモデル、HLA A2.1マウス(E.J. Bernhard et al., J. Exp. Med. 168:1157-1162 (1988))、を利用して、495ペプチドが事前にウイルス暴露がないCTLを刺激してワクチンとして機能できるかどうかを試験した。これらの実験は、ウイルスにより感染されたかあるいはSEQ ID NO: 1のペプチドあるいは非特異的対照ペプチドでのプライム化されたもののいずれかの、マウスおよびヒト細胞標的を使用するin vitro解析を含む。
【0074】
3尾のマウスは、IFA(不完全フロインドアジュバント)中で乳化された20μgのポリクローナルヘルパーTリンパ球(HTL)ペプチド(PADRE; SEQ ID NO: 29)(J. Alexander et al., Immunity. 1:751-761 (1994))と共に50μgの495ペブチド(pp65495-503)あるいはp53由来のペプチドp53149-157(M. Theobald et al., Proc. Natl. Acad. Sci. U.S.A. 92:11993-11997 (1995))を尾の基部に皮下的に接種して免疫した。12日後、脾臓を免疫化マウスから取り出し、脾臓懸濁液をつくり、エフェクター細胞をp53149-157あるいはp65495-503ペプチド感作同系リポ多糖処理脾臓胚細胞(splenic blast cell)を使用して1週間再刺激した(P.A. Wentworth et al., Eur. J. Immunol. 26:97-101 (1996))。その後、次のin vitro刺激のため、刺激細胞(stimulator cell)はJurkat A2.1細胞であり、弱酸処理および続くペプチドのローディングにより調製した(Z. Yu et al., Journal of Surgical Research 69:337-343 (1997))。2回のin vitro再刺激サイクルの後、マウス脾臓エフェクター集団をp53149-157あるいはp65495-503ペプチドをロードしたT2細胞の認識について試験した。適切に免疫したマウスではp65495-503あるいはp53149-157ペプチドの実質的な認識があったが、非免疫ペプチドの認識はなかった。
【0075】
マウス脾臓エフェクターが、pp65Vacに感染したヒトHLA A*0201 EBVLCL標的を用いたクロム放出アッセイにおいて、内因的にプロセスされたpp65を認識することもまた説明された(D.J. Diamond et al., Blood 90 (5):1751-1767 (1997))。p65495-503ペプチドがウイルス感染細胞の認識を引き起こすことのさらなる証明は、標的としてHCMV感染ヒト線維芽細胞、およびエフェクター集団としてp65495-503ペプチド刺激から誘導されたマウスCTLを使用したクロム放出アッセイによってもたらされた。HCMVに感染したHLA A*0201線維芽細胞はCTLによる溶解が可能であるが、一方、非感染およびミスマッチの両方の線維芽細胞は認識されなかった(D.J. Diamond et al. Blood 90 (5):1751-1767 (1997))。総合すれば、これらの結果は、p65495-503を用いた一次免疫化からの脾臓エフェクター集団がHLA A*0201拘束性様式において内因的にプロセスされたpp65およびHCMVを認識することを明らかに示した。
【0076】
さらなる研究により、495ペプチドは動物において長寿命免疫応答を誘導することが説明された。12尾のマウスを495ペプチド(SEQ ID NO: 1)+PADRE(AKXVAAWTLKAAA; SEQ ID NO: 29)+IFAを用いて同時に免疫して、2尾のさらなる対照マウスをPADRE+IFAのみを用いて免疫した。免疫後2週間、6週間、10週間および14週間目に、2尾の免疫化マウス由来の脾臓を495ペプチドあるいはヒトp53由来の対照ペプチド(p53149-157)に対する免疫について解析した。さらに、2および6週間目に、495ペブチドを用いずに免疫したマウスもまた屠殺して、それらの脾臓細胞を495ペブチドあるいはヒトp53ペプチドに対する免疫応答について解析した。パーセント特異的細胞傷害性(495ペブチド標的の細胞傷害性 - p53標的細胞傷害性)は14週間後で依然40%レベルであったが、一方、ナイーブ動物はいかなる5%以上の特異的細胞傷害性も示さなかった。これは、TheradigmTMリポペプチド(B. Livingston et al., J. Immunol. 159:1383-1392 (1997))を用いてヒトボランティアを免疫することから得られた、18週間にわたる4回の免疫の最終の後38週間に平均して最初の応答の60%を維持した、という最近の結果と十分に比較した。
【0077】
実施例10. 動物におけるIFA-アジュバント非依存ワクチンとしてのp65495-503(SEQ ID NO: 1)を取り込む脂質化ペプチド
免疫原性を亢進させるためにアジュバントを使用することは動物研究では一般的なストラテジーであるが、ヒトにおけるそれらの使用に関しては重要な制限がある。それゆえ、本発明の1つの態様は、脂質分子を取り込むペプチドを含む。このストラテジーは、動物(K. Deres et al., Nature 342:561-564 (1989))およびヒト臨床的研究(A. Vitiello et al., J. Clin. Invest. 95:341-349 (1995))の両方において効果的であり、アジュバントの使用の必要性を回避した。
【0078】
1あるいは2つのいずれかのパルミチン酸部分を、495ペブチドのアミノ末端に接着させ、一連の免疫研究をトランスジェニックHLA A2.1マウスにて行った。直接的脂質化ペプチドの一次構造は表3に示す。
【0079】
【表3】

表3.ペプチドはABI 432(Applied Biosystems)にて合成して、記載されるように精製して解析した(D.J. Diamond et al., Blood 90 (5):1751-1767 (1997))。パルミチン酸(Aldrich)はジメチルホルムアミドに溶解して、自動的にアミノ末端リジンに結合させた。ペプチドのモノ脂質化(monolipidated)形態のアミノ末端リジンは、2つの保護基、FmocおよびBocにより保護した。Fmoc基のみ合成中に開裂されて、単一脂質部分を加えることができる。ジ脂質化(dilipidated)形態のために、アミノ末端リジンは2つのFmoc基で保護され、それゆえ2つの脂質部分を加えることができた。ペプチドはまた、当該技術分野でよく知られる方法によりその他の位置で脂質化されることもあり、ここでの使用が企図される。
【0080】
別々のマウスは、PADREエピトープと共に非修飾pp65495-503、およびペプチドのモノ脂質化あるいはジ脂質化形態のいずれか用いて免疫した。脂質化ペプチドがフロインドアジュバントの共投与を用いずに免疫を刺激するであろうということが以前に示されていたので(H. Schild et al., Eur. J. Immunol. 21:2649-2654 (1991))、IFA中のペプチドの乳化を用いるあるいは用いずにマウスを免疫することを比較した。上の実施例9に記載した手順と同様な手順にて、接種後12日にマウスに脾臓摘出術をして、脾臓細胞集団をin vitroで2回再刺激した。そして、脾臓エフェクター細胞はペプチド-ロード(loaded)T2細胞、pp65Vvacに感染したEBVLCL標的、およびHCMV感染線維芽細胞を用いてクロム放出アッセイにて試験した(D.J. Diamond et al., Blood 90 , (5):1751-1767 (1997))。結果は、アジュバントにおける乳化を用いない495ペブチドの脂質化形態は、内因的にプロセスされたpp65およびHCMV感染ヒト細胞を認識することができる免疫応答を誘導することを説明する。モノ脂質化形態は、(IFAを用いるあるいは用いないのと比較して)より弱い免疫応答を誘導するようであったが、一方、非修飾フリーペプチドはIFAにおいて乳化されなければ活性をもたなかった(図1-3参照)。
【0081】
これらのデータは、ヒトを含む温血動物における使用のための都合の良い免疫化/ワクチン接種(vaccination)手順を説明する。この手順は、液体溶媒系(aqueous solvent system)における2つのペプチドの混合物を内包する(脂質化495ペブチド+PADREあるいは830-843アミノ酸破傷風ペプチドのいずれか、表3)。混合物は、HCMV血清陽性あるいは血清陰性の被験体のいずれかに皮下あるいは他の許容可能および効果的なルートを介して投与する。ブースター接種のさらなるセットは、一次ワクチン接種により誘導される免疫を亢進させるために利用されうる。
【0082】
実施例11. 脂質化ワクチンの製剤化
495ペブチドおよびその機能的配列変異体は、共有結合HTLエピトープを有する脂質化ペプチドとしてのワクチンとして製剤化できる。HTLエピトープは、古典的ヘルパー応答を刺激するためのヒトMHCクラスIIに対する広い反応性を有するいずれかのペプチドでありうる。そのような分子は、破傷風毒素由来のアミノ酸830-843(P. Panina-Bordignon et al., Eur. J. Immun. 19:2237-2242 (1989))、HIVエンベロープタンパク質由来のHTLエピトープ(J.A. Berzofsky et al., J. Clin. Invest. 88:876-884 (1991))、あるいは既知のアンカー残基から推測される合成版(PADRE)(J. Alexander et al., Immunity 1:751-761 (1994))を含むが、それらには限定されない。
【0083】
HTL+CTLエピトープの脂質化は、好ましくはHTLエピトープのアミノ末端で行われ、HTLエピトープはCTLエピトープに対するアミノ末端である。適した脂質部分は、既知であるかあるいは文献中に記載される(H. Schild et al., Eur. J. Immunol.21:2649-2654 (1991); A. Vitiello et al., J. Clin. Invest. 95:341-349 (1995); K. Deres et al., Nature 342:561-564 (1989))。あるいは、CTLエピトープ、続いてHTLエピトープをそのアミノ末端で脂質化することができ、あるいは脂質は、続くCTLあるいはHTLエピトープのいずれかで、カルボキシル末端にて見出すことができる。3つのアミノ酸スペーサーあるいは他のいずれかのスペーサーは、HTLおよびCTLエピトープの間に挿入することができ、あるいはエピトープはインフレームで直接融合させることができる。あるいは、アミノ末端上で脂質化されるCTLエピトープは、共有結合接着を用いずに、HTLエピトープと共に投与できる。ワクチンエピトープは、一次構造にかかわらず、一回、標準的な製剤化緩衝液(PBSあるいはPBS/10%DMSOあるいはより高濃度/0.01%トリフルオロ酢酸あるいはあるいは同じあるいは異なる濃度のその他の酸あるいはアルコール)にて前腕に皮下的に接種されうる。3から6週間後、同じ物質のブースター接種が投与されうる。3から6週間間隔の複数のブースター接種は、必要ならば続けて投与できる。
【0084】
この接種シリーズは、ウイルスについて陽性あるいは陰性のいずれかの、患者あるいはリスクを持つ個体、あるいは骨髄移植のドナーに投与できる。脂質化ワクチンペプチドの具体例は、例えば以下のものを含む:
【0085】
【表4】

ここでは、Xはシクロヘキシルアラニンあるいはフェニルアラニンである。本ケースをとおして、全てのアミノ酸はそれらの国際一文字コード(universal one-letter code)により表す。“Pam”はパルミチン酸である。3つの-Aあるいは-Gスペーサー(下線)は、ワクチンペプチド間での交換が可能である。上に示されるペプチドのフォーマットは(アミノ末端から)次のように記載される:脂質-K/CSS--HTLエピトープ(イタリック)--アミノ酸スペーサー(下線)--CTLエピトープ。CTLおよびHTLエピトープの位置は交換可能である。CTLエピトープ(あるいはその機能的配列変異体)はさらにリーダー配列を加えることにより修飾されることもあり、および/あるいはアミノ酸KDELはカルボキシル末端に追加して小胞体内での維持および標的化(targeting)を亢進することができる。パルミチン酸あるいはいずれかの適した脂質が使用されることもあり、ステアリン酸、ミリスチン酸、ラウリン酸、カプリン酸およびデカン酸を含むが、それらには限定されない。
【0086】
実施例12. トランスジェニックマウス研究における単一成分ワクチンとしての、アミノ末端にて脂質化される、結合HTLおよびCTLエピトープの使用
各々脂質を含有する2つのさらなる分子、HTLおよびCTLエピトープ、を構築してマウスにて試験した:
【0087】
【表5】

表5の名称は、表4での凡例に見出すことができる。
【0088】
分子A(SEQ ID NO: 37)は、マウスおよびヒトにおいて働く能力を有するワクチンであり、一方、分子B(SEQ ID NO: 38)はマウスでのみ機能的であるべきある。2.5%ヘキサフルオロイソプロパノールを用いたリン酸緩衝生理食塩水中25%ジメチルスルホキシド中の100ナノモルの各々のこれらのワクチンペプチドを、別々のトランスジェニックHLA A2.1マウスに皮下的に接種した。
【0089】
実施例9および10において言及される方法を使用して、pp65およびHCMVに対して特異的な細胞を含有する脾臓細胞集団を誘導した。免疫化マウス由来の脾臓細胞は、特異的および非特異的ペプチド感作された標的、HCMV感染および非感染HLA A*0201およびHLA-ミスマッチ線維芽細胞標的に対する認識および細胞溶解について試験した。495 pp65495-503ペプチド感作標的は効果的に溶解されたが、一方、HLA A*0201(p53149-157)に結合する他のタンパク質(ヒトp53)由来のペプチドで感作された標的は効果がなかった。さらに、および重要なことに、HCMV感染HLA A*0201線維芽細胞は効果的に溶解されたが、非感染線維芽細胞あるいはHLA-ミスマッチのそれらは、HCMV感染にかかわらず、認識あるいは溶解されなかった。これらの結果は分子AおよびBの両方で得られたが、分子Aは2つのうちでより強力であった。しかし、50 nmoleより少ない量でワクチンAを用いて免疫したマウスの2回目の免疫化(ブースター)は、1回の免疫化が効果的でないときに検出可能な免疫応答を引き起こした(表5)。ブースターの刺激効果はBに一致する(Livingston et al., J. Immunol. 159:1383-1392 (1997))。これらのデータは、ワクチンの単一分子形態が液体媒介物(例えば、PBS/DMSO/HFIP)中のワクチン分子AあるいはB以外のいずれかの追加的分子あるいはアジュバントを用いずに、動物モデルにおいてHCMV免疫を刺激する機能を有することを示した。データはまた、ワクチンがHCMV-ナイーブマウスにおいてHCMVに対するde novo免疫応答を刺激できることを説明した。
【0090】
実施例13. HLA AおよびBアリルに特異的なさらなるHCMV pp65 CTLエピトープ
100以上のAおよびB遺伝子のHLAクラスIアリルがある(J.G. Bodmer et al., Tissue Antigens 49:297-321 (1997))。推定するアルゴリズムおよびトランケーション解析を組み合わせて使用することで、MHC-拘束性ヒトCTLにより溶解される自己由来およびアロジェニック細胞の両方を感作するpp65由来のさらなるペプチドを同定した。実施例1で考察したように、CTLはHCMV血清陽性なヒトから生じる;それゆえ、pp65由来の明確なエピトープは、内因的HCMV再活性化あるいはウイルス血症を抑制するためにヒトにより使用されるものであった。特異的HLAアリルと組み合わせてHCMV pp65に対するCTL反応を明確にするため、個々のクローン化CTL株は、CTLを誘導するために使用される血液を有する個体に見出されるHLA AあるいはBアリルの1つを含有するpp65vacを用いて感染させたEBVLCLの認識について試験した。少なくとも1つのHLAアリルがEBVLCL標的およびCTLの間で共用される場合は、認識および溶解のための感作が観察された。この実験は、拘束性アリルを含有する少なくとも3つの独立細胞株を用いて繰り返された。表6は、pp65エピトープ、それらのHLA拘束性、感作される同じ拘束性の独立細胞株の数、およびエピトープの描写の方法を示す。
【0091】
【表6】

決定の方法:(A)単一HLAアリルがマッチする細胞株を使用するHLA拘束;(B)ワクシニアウイルスにおけるpp65トランケーション;(C)TNF-αアッセイを使用する活性の検出を用いたプラスミドにおけるpp65トランケーション;(D)公開されるモチーフを使用するアミノ酸残基のマッチング;(E)順序づけされた重複エピトープを使用する機能的解析。
【0092】
実施例14. 1つ以上のCTLエピトープを含むワクチン分子
本明細書中に記載される手順に従って、同じあるいは異なるHLAクラスI拘束成分に特異的である、pp150および/あるいはpp65エピトープの組み合わせを含むワクチンを調製した。ヒトのワクチン接種のため、各々のエピトープは同じMHC拘束を有する必要性はない。2つあるいはそれ以上のMHC拘束成分を標的とするワクチン分子は好ましいことがあり、なぜならそれはより少ないワクチン分子の産生を可能にして、さらに多型集団において大半のHLAアリルが標的とされることを確実にするからである。頻繁に発現するHLAアリル(表1および6参照)により拘束されるCTLエピトープを有するペプチドは好ましく、およびpp65およびpp150タンパク質の両方からのエピトープならびにHTLエピトープを含有するポリペプチドワクチンは、HCMVに対するヒトワクチン接種にとって特に好ましい。表1および6に示されるHLAアリルは、複数CTLエピトープワクチン分子において含まれる可能性のあるHLA A、B、およびC CTLエピトープのサブセットである。複数CTLエピトープおよびHTLエピトープを含ませることにより、ペプチドを長くするであろう(40-50アミノ酸の範囲内)。あるいは、HCMVポリペプチドワクチンは、共有結合的に接着されるHTLエピトープを用いずに、表3に示されるように、3つのアラニン残基あるいは各々のエピトープの間のアミノ酸の他の組み合わせのスペーサー、および、N末端での2つのパルミチン酸-リシルアミドを有する複数CTLエピトープを使用することにより調製されうる。
【0093】
配列の疎水性は重要な因子である。疎水性を低下させるために、脂質修飾は省略されうる。加えて、複数HLAエピトープはカクテルワクチン(cocktail vaccine)中で製剤化されうる。好ましくは、混合物における各々の個々のCTLエピトープは、上記のようにCD4 T細胞エピトープに融合されるであろう。このように、カクテルワクチンは、表6に示される配列を使用して複数-人種集団の約75%から約90%を網羅するのに十分なエピトープを含有するために製剤化することができた。
【0094】
実施例15. BMT患者の免疫化
本発明に従う抗原ペプチドの治療的な活性形態は、骨髄移植の前の所定の日数あるいは週数により分割される単一あるいは複数用量にて、十分な時間(例えば、6から8週)でHCMV血清陽性骨髄移植ドナーに投与されて、抗HCMV細胞性免疫応答の発生を可能にする。抗原ペプチドは、それ自体既知の様式にて(例えば、場合によりヘルパーペプチドおよび/あるいはアジュバントと組み合わせて、脂質化ペプチドとして)製剤化することができ、好ましくは、複数用量において投与されるであろう。例えば、ヘルパーペプチドおよび抗原ペプチドが1つの配列において一緒に結合されるペプチドは、この目的に適している。
【0095】
さらなるワクチン計画は、ポリヌクレオチドウイルスワクチン、例えば、表6に示される完全長pp65、pp65断片あるいは1つあるいはそれ以上のCTLエピトープ、を含有する修飾ワクシニア アンカラ(Vaccinia Ankara)(MVA)を用いてドナーをプライム化すること、その後、実施例12および14に記載されるペプチドワクチンを用いてブーストすること、から成る。当業者は、ペプチドおよびウイルス投与の様々な組み合わせを使用するワクチン接種のための計画を十分に考案することができ、これらの変化は本発明を用いた使用のために企図される。もし無操作BMT移植片がレシピエントに与えられるなら、その移植片は25%あるいはそれ以上の成熟T細胞を含有するであろう。T細胞はBMTレシピエント患者に活性免疫を与える。あるいは、T細胞消耗BMT移植片を利用するとき、免疫化ドナーからのT細胞のアリコートはBMTの(例えば、約21から35日)後に患者に投与して、レシピエント患者にHCMV免疫を提供することができる。
【0096】
実施例16. HCMV感染細胞のためのin vitroアッセイ
本発明のペプチドをin vitroアッセイに使用して、HCMV状態(感染あるいは非感染)が未知の患者から得たHCMV感染細胞の有無を検出する。患者から得たTリンパ球は、本発明のペプチドを用いてプライム化された抗原提示細胞と共にインキベートする。CTLあるいはCTLpの活性化により、患者がHCMVに感染したことが明らかになる。
【0097】
実施例17. 非脂質化ペプチドを用いたトランスジェニックマウスのワクチン接種による免疫応答の誘導
2尾のHLA-A2.1kbトランスジェニックマウスに、15-30秒間の音波処理により不完全フロインドアジュバントと1:1比で乳化した、10%DMSO中の100 nmoleのA2 HCMV pp65ペプチドNLVPMVATV(SEQ ID NO: 1)、20μgのT-ヘルパーペプチドを含む0.1%酢酸、PADRE(AKXVAAWTLKAAA、Xはシクロヘキシルアラニンを表す;SEQ ID NO: 29)を接種した。移送中の損失を計上するため、注射に必要とされる以上の300μLあるいはそれ以上の過剰な乳化ワクチンを調製した。ペプチドワクチン(上の100μLの全量乳化調製)は、外側尾静脈(lateral tail vain)を避けて、各々の側に50μLずつ、尾の基部に皮下的に注射した。陽性対照動物は、無関係なHLA-A2.1拘束hu p531147-157ペプチドおよびPADREを用いて同じ様式で注射された。ブースターは7日後に投与した。ブースター免疫の1週間後、脾臓細胞を回収、培養、およびin vitroで刺激した。培養のため、細胞を脾臓から単離して、40 mL培地に懸濁させて計数した。赤血球は計数から除外した。そして、細胞を20%Rat-Stim(Collaborative Biomedical Cat #40115, Waltham, MA)を含有する培地中でミリリットルあたり3百万細胞の濃度にして、24ウェルプレート中にて1 mL/ウェルで平板培養した。細胞を刺激するため、1 mLの懸濁抗原提示細胞(3免疫化脾臓細胞に対して1抗原提示細胞の割合)を培養に加えた。細胞は37℃で7日間インキベートした。新鮮培地は必要に応じて加えた。刺激は、上のように1 mLの懸濁抗原提示細胞を加えることにより、平板培養後7日毎に行った。
【0098】
抗原提示細胞は以下のように調製した。マウスの各々の免疫化群について、3尾のマウスの脾臓を無菌的に取り出して、25μg/mLのLPSおよび7μg/mLの硫酸デキストランを含有する10%FCSを含むRPMI中にて1 mLあたり1.0-1.5×106細胞の濃度で、5%CO2中にて37℃で3日間懸濁した。そして、細胞を集めて、沈降させて、血清なし培地に再懸濁して、計数した。細胞は、15 mLの円錐形遠心チューブ中に2千5百万細胞を含有する量で分配して、1200 rpmで6分間穏やかに沈降させた。上清を吸引して、チューブに100μLを残した。ペプチド(SEQ ID NO: 1)(100μM)をチューブに加えて、よく混合して、37℃および5%CO2で4時間インキベートした。細胞は、チューブあたり2 mLの完全培地(10-12 mM HEPES、2mM L-グルタミン、100 U/mLペニシリン、100 U/mLストレプトマイシン、50μMβ-メルカプトエタノールおよび10%熱不活化牛胎児血清を含有するRPMI 1640)中に再懸濁して、滅菌PBSにて濃縮した。そして、細胞は137Cs源由来の2500ラドで放射線照射して、次に、免疫化脾臓細胞を刺激するときに使用するために完全培地中で1 mLあたり百万細胞の濃度にした。
【0099】
in vitro刺激の6から7日後、免疫化脾臓細胞(エフェクター細胞)を集めて、細胞の細胞傷害活性を51Cr放出アッセイを使用してペプチド-ロードあるいは非処理標的細胞に対してアッセイした。HLA-A2.1kb免疫化マウス由来のpp65495-503(SEQ ID NO: 1)に特異的でありペプチドを用いて毎週刺激される大量の細胞株は、陽性対照株として使用した。T2細胞は、非ロードあるいはSEQ ID NO: 1のペプチドあるいはp53由来のヒト対照ペプチドのどちらかを用いてロードした標的として使用した。実施例9参照。クロム放出アッセイのための標的を調製するために、対数増殖期中のT2細胞を沈降させて、各々の非ロードしあるいはロード群について10 mL LCL培地(1%HEPES、10%牛胎児血清、2%L-グルタミンおよび抗生物質を含有するRPMI 1640)に再懸濁した。細胞は計数して、再沈降させて、1 mLあるいはより少ないLCL培地に懸濁させた。細胞は、非ロードあるいは抗原提示細胞の刺激のために上記のように適したペプチドの5 mM溶液の10μlでロードされるかのどちらかであった。全ての細胞は、10 mCi/mLのNa251CrO4を含有する20μlの51Cr原液を用いてロードした。そして、細胞のチューブを37℃の水槽中で45-60分間インキベートして、15分毎に穏やかに振盪した。次に、細胞を10 mLのRPMI中で3回洗浄して、1 mL のLCL培地に再懸濁した。標的細胞を再計数して、適量のLCL培地に懸濁して20,000細胞/mLにし、そして次に、ウェルあたり100μLで96ウェルプレート中で平板培養した。
【0100】
エフェクター細胞(免疫化脾臓細胞)は、10%FCS含有RPMI中で1 mLあたり2百万細胞にして、図4に示すように様々なエフェクター:標的比で標的細胞に加えた。培地のみ(100μL)を陰性対照ウェルに加えて51Crの自発的放出を測定し、および2%ドデシル硫酸ナトリウムを含有する培地(100μL)を陽性対照ウェルに加えて51Crの全可能放出を測定した。プレートは、Sorvall RT7遠心機(Kendro Laboratory Products; Newtown, CT)にて休みなく6分間600 rpmを受けさせて、37℃および5%CO2で4時間インキベートして、次に1200 rpmで6分間再沈降させた。次に、上清を回収して放射能をPackard Cobra II γカウンター(Packard Instruments; Meriden, CT)を用いて測定した。特異的CTL活性は次のように計算した:
%特異的放出 = 100×(実験的放出 - 自発的放出)/(全放出 - 自発的放出)
自発的放出が最大全放出の30%あるいはそれ以上である実験は放棄した。図4Aは1回のin vitro刺激後の結果を示し、図4Bは2回のin vitro刺激後の結果を示し、および図4Cは4回のin vitro刺激後の結果を示す。この図および続く図では、“T2 A2パルス”はSEQ ID NO: 1のペプチドを提示する細胞を示し、“T2 p53パルス”はヒト対照ペプチドp53149-157を提示する細胞を示す。データは、本発明のペプチドワクチンを用いたワクチン接種が適した標的細胞を認識して殺すことができる特異的CTLを確実に生じさせたことを示した。結果は、2回目のin vitro刺激で向上した。
【0101】
実施例18. 脂質化ワクチン製剤の比較
マウスは実施例17に記載されるように、Xがシクロヘキシルアラニンを表す(Pam)2- KSSAKXVAAWTLKAAANLVPMVATV(SEQ ID NO: 37)を含有するワクチンの4つの異なる製剤を用いてワクチン接種した。脾臓細胞をアッセイした。クロム放出アッセイにおけるエフェクター対標的比は、結果を示す図5に示したとおりである。図5Aは、99.9%DMSOおよび0.1%蟻酸を含有する溶液中での100 nmoleのペプチドを用いて接種したマウスについての結果を提供する。図5Bは、50%DMSO、49.9%PBSおよび0.1%蟻酸を含有するビヒクル中に懸濁した100 nmoleのペプチドを用いてワクチン接種したマウスについての結果を提供する。図5Cは、41.7%DMSO、57.7%PBSおよび0.6%蟻酸に溶解した83.3nmoleのペプチドを用い注射したマウスについて言及する。図5Dは、66.7%DMSO、26.7%酢酸および6.7%Tween 20に懸濁した83.3 nmoleのペプチドを用いて注射したマウスについての結果を提供する。99.9%DMSO溶液ワクチンは、対照に対して最大の細胞傷害を有するマウス脾臓細胞を提供した。
【0102】
実施例19. PADREを含有するモノ脂質化ワクチンを用いたトランスジェニックマウスのワクチン接種
マウスは上記されるように、(Pam)2- KSSAKXVAAWTLKAAANLVPMVATV(ここではXがシクロヘキシルアラニンを表す)(SEQ ID NO: 37)の増加量をワクチン接種およびアッセイをした。ペプチドは、図6に示す量にて80%DMSO、20%PBSおよび0.08%蟻酸における溶液中に提供された。100あるいは150 nmoleのペプチドを用いたワクチン接種は、強力な特異的細胞傷害を引き起こし、150 nmoleではより強力な結果であった。
【0103】
実施例20. 細胞傷害性の特異性
マウスは上記されるように、実施例19におけるように製剤化されたSEQ ID NO: 37のペプチドの150あるいは25 nmoleを用いてワクチン接種をした。脾臓細胞は、様々な異なるペプチドによりパルスし、そして提示するT2細胞の細胞傷害性についてアッセイした。図7参照。“T2 177パルス”はSEQ ID NO: 39(NLVPMVATV-NH2)のアミド化(amidated)ペプチドを提示する細胞を示す;“T2 118パルス”はSEQ ID NO: 40(YLVPMVASV-NH2)のアミド化ペプチドを提示する細胞を示す。“T2 193パルス”はSEQ ID NO: 41(YLVPMVATV-NH2)のアミド化ペプチドを提示する細胞を示す。結果は、高度の特異性を示した。
【0104】
実施例21 様々なDMSO製剤におけるモノ脂質化ワクチンについての比較データ
マウスを免疫して、それらの脾臓細胞を様々なDSMO濃度を含有するビヒクルにおける100あるいは150 nmoleのSEQ ID NO: 37を用いて実施例17に記載するようにアッセイした。クロム放出アッセイの結果について図8参照。図8A:80%DMSO、20%PBSおよび0.08%蟻酸中100 nmole。図8B:80%DMSO、60%PBSおよび0.04%蟻酸中100 nmole。図8C:80%DMSO、20%PBSおよび0.08%蟻酸中150 nmole。図8D:40%DMSO、60%PBSおよび0.04%蟻酸中150 nmole。モノ脂質化ワクチンの製剤は、完全にワクチンペプチドを可溶性にするのに十分なDMSO濃度で提供されるときにより効き目があった。理論により縛られることを望まないが、脂質化ペプチドワクチンの完全な可溶性を生じさせるDMSOの濃度は、よりすぐれた結果を提供すると信じられる。
【0105】
実施例22. 様々なDMSO濃度を用いたワクチン接種実験
マウスを免疫して、それらの脾臓細胞をDSMOの減少量を含有する以下のビヒクルにおける100 nmoleのSEQ ID NO: 37を用いて実施例17に記載するようにアッセイした。図9A:80%DMSO、20%PBSおよび0.02%蟻酸;図9B:70%DMSO、30%PBSおよび0.07%蟻酸;図9C:60%DMSO、40%PBSおよび0.06%蟻酸;図9D:50%DMSO、50%PBSおよび0.02%蟻酸。図9Aについての製剤は溶液であり、より少ないDMSOを含有する残りの製剤は懸濁液であった。図9Dにおける結果はブースターを受けたマウスを反映しており、一方、図9の残りのパネルは1回のワクチン接種のみを受けたマウスからのデータを示す。これらのデータは、ワクチンが最高の結果のために完全に可溶化されるべきであるという仮説を確認にする。
【0106】
実施例23. 様々なDMSO濃度を用いたワクチン接種実験
実施例22の方法を、以下の製剤を使用して繰り返した。図10A:80%DMSO、20%PBSおよび0.02%蟻酸;図10B:70%DMSO、30%PBSおよび0.02%蟻酸;図10C:60%DMSO、40%PBSおよび0.02%蟻酸;図10D:50%DMSO、50%PBSおよび0.02%蟻酸。前のように、図10Aにおいてデータを産生するために使用したワクチン調製は溶液であり、一方、残りの製剤は懸濁液であった。図10Dにおいてアッセイされる脾臓細胞を提供するマウスは、ブースター免疫を受けた。
【0107】
実施例24. ブースター免疫の効果
マウスを免疫して、それらの脾臓細胞を25あるいは50 nmoleのSEQ ID NO: 37の1あるいは2回の免疫を使用して実施例17に記載するようにアッセイした。図11における結果を参照。図11A:50 nmole;図11B:25 nmole;図11C:50 nmole+1回のブースター;図11D:50 nmole+1回のブースター。ブースター注射は、50 nmole投与量についての免疫により達成される細胞傷害効果を増加させたが、25 nmole投与量について向上の提供は明らかにほとんどないあるいはなかった
実施例25. 変化可能な蟻酸濃度の効果
マウスを免疫して、それらの脾臓細胞を0.08%蟻酸(図12Aおよび12B)あるいは0.02%蟻酸(図12Cおよび12D)を含有する、80%DMSO、20%PBS中のSEQ ID NO: 37の1回の免疫を使用して実施例17に記載するようにアッセイした。注射したペプチドの量は、150 nmole(図12A)、100 nmole(図12B)、50 nmole(図12C)あるいは25 nmole(図12D)であった。より多量の投与量では明らかに、ワクチン接種後のより高い特異的細胞傷害性を生じた。
【0108】
実施例26. PADREに結合する非脂質化ペプチドを使用するワクチン接種
マウスを免疫して、それらの脾臓細胞を、不完全フロインドアジュバントを用いて乳化した1つの配列(100 nmole;KS SAKXVAAWTLKAAANLVPMVATV、ここではXはシクロヘキシルアラニンである;SEQ ID NO: 37)を形成するために直接PADREに結合する、SEQ ID NO: 1のHCMVペプチドの1回の注射を使用して実施例17に記載するようにアッセイした。投与したワクチンは、5%DMSO、45%通常食塩水および50%不完全フロインドアジュバントを含有する100μLの乳濁液であった。10%Rat-Stimの存在下で2回刺激したSEQ ID NO: 1のペプチドを提示するT2細胞を使用して試験すると、免疫化脾臓細胞は100のE/T比では11.22%および20のE/T比では3.18%の特異的細胞障害性を示した。免疫化脾臓細胞は、対照p53ペプチドを提示するT2細胞については-4.44%および-0.10%、SEQ ID NO: 39のペプチドを提示するT2細胞については3.31%および3.44%、および未処理T2細胞については-6.39%および-1.81%、の平均%細胞傷害性を示した。
【0109】
実施例27. DNAアジュバントにおける非脂質化結合ペプチドを使用するワクチン接種
2尾のマウスは、CpG配列を含有する50μg DNAアジュバント(陽性DNAアジュバント)と共に100 nmoleのSEQ ID NO: 37のペプチドを用いて1回免疫した。使用したDNA配列は、Z. Moldoveanu, Vaccine 16(11/12):1216-1224 (1998)に記載されるように、(1826)5' TCCATGACGTTCCTGACGTT 3'(SEQ ID NO: 42)であった。これらの免疫化脾臓細胞からのクロム放出アッセイデータは、以下に表7において提供する。
【0110】
実施例28. DNAアジュバントにおける非脂質化結合ペプチドを使用するワクチン接種
実施例27は、CpG配列を欠くDNAアジュバント(陰性DNAアジュバント)を使用して繰り返した。使用したDNA配列は、Z. Moldoveanu, Vaccine 16(11/12):1216-1224 (1998)に記載されるように、(1982)5' TCCAGGACTTCTCTCAGGTT 3'(SEQ ID NO: 43)であった。これらクロム放出アッセイデータは、以下に表7において提供する。
【0111】
【表7】

本発明の特定の好ましい態様および実施例を記載したが、本発明は限定されない。当業者は、本発明が診断および治療の分野において広く適応可能であり、修飾および変化がその意図および範囲から離れずに本発明に対して行われうることを理解するであろう。
【図面の簡単な説明】
【0112】
【図1】図1は、脂質化(lipidation)のない状態でペプチドにより引き出される細胞傷害性応答を示す。
【図2】図2は、モノ脂質化(monolipidated)ペプチドにより引き出される細胞傷害性応答を示す。
【図3】図3は、ジ脂質化(bilipidated)ペプチドにより引き出される細胞傷害性応答を示す。
【図4】図4は、1回(A)、2回(B)あるいは4回(C)in vitro刺激後に免疫された脾臓細胞による抗原提示細胞の細胞傷害性を示す棒グラフである。
【図5】図5は、SEQ ID NO: 37を用いて免疫した細胞についてのクロム放出アッセイの結果を示す。
【図6】図6は、SEQ ID NO: 37を用いて免疫した細胞についてのクロム放出アッセイの結果を示す。
【図7】図7は、100あるいは25 nmoleのSEQ ID NO: 37を用いて免疫したマウス由来の細胞についての比較細胞傷害性データを示す。
【図8】図8は、様々なワクチン製剤におけるSEQ ID NO: 37を用いて免疫した細胞についての細胞傷害性データを比較する。
【図9】図9は、SEQ ID NO: 37を含有するワクチンおよびDMSOの様々な濃度の効果を比較する。
【図10】図10は、SEQ ID NO: 37の様々なワクチン製剤を用いて免疫した細胞由来の細胞傷害性データを比較する。
【図11】図11は、ブースター免疫化を用いるあるいは用いずに25あるいは50 nmoleのSEQ ID NO: 37を用いて免疫した細胞由来の細胞傷害性データを比較する。
【図12】図12は、様々な製剤におけるSEQ ID NO: 37を用いて免疫した細胞由来の細胞傷害性データを比較する。
【特許請求の範囲】
【請求項1】
SEQ ID NO: 10-25および30-41から選択したペプチド。
【請求項2】
SEQ ID NO: 1、10-25および30-41から選択した配列を有するペプチドおよび医薬的に許容可能なキャリアを含むヒトサイトメガロウイルスに対するワクチン。
【請求項3】
さらにアジュバントを含む、請求項2に従うワクチン。
【請求項4】
前記アジュバントがDNAアジュバントである、請求項3に従うワクチン。
【請求項5】
前記ペプチドが脂質化されない、請求項2に従うワクチン。
【請求項6】
前記ペプチドが脂質化される、請求項2に従うワクチン。
【請求項7】
前記ペプチドがモノ脂質化される、請求項6に従うワクチン。
【請求項8】
前記ペプチドがジ脂質化される、請求項6に従うワクチン。
【請求項9】
SEQ ID NO: 1、10-25および30-41のいずれか1つに従うペプチドを提示するためにin vitroで処理された抗原提示細胞を含む、ヒトサイトメガロウイルスに対する細胞性ワクチン。
【請求項10】
前記抗原提示細胞が自己由来のものである、請求項9に従う細胞性ワクチン。
【請求項11】
前記抗原提示細胞がアロジェニックである、請求項9に従う細胞性ワクチン。
【請求項12】
SEQ ID NO: 1-14、19、26-28および30のいずれか1つに従うペプチドをコードする遺伝子を発現する、組換えウイルスベクターワクチン。
【請求項13】
請求項2、3、4、9あるいは12のいずれか1項に従うワクチンを投与することを含む、ヒトサイトメガロウイスル感染に対する免疫応答をモジュレートする方法。
【請求項14】
請求項2に従うワクチンを投与することを含む、ヒトサイトメガロウイスル感染に対する免疫応答をモジュレートする方法。
【請求項15】
請求項9に従うワクチンを投与することを含む、ヒトサイトメガロウイスル感染に対する免疫応答をモジュレートする方法。
【請求項16】
請求項12に従うワクチンを投与することを含む、ヒトサイトメガロウイスル感染に対する免疫応答をモジュレートする方法。
【請求項17】
ヒトサイトメガロウイルスの天然にプロセスされたエピトープおよびDNAアジュバントを含む、ヒトサイトメガロウイルスに対するワクチン。
【請求項18】
SEQ ID NO: 1の配列を有するペプチドおよびDNAアジュバントを含む、ヒトサイトメガロウイルスに対するワクチン。
【請求項19】
請求項4に従うワクチンを投与することを含む、ヒトサイトメガロウイスル感染に対する免疫応答をモジュレートする方法。
【請求項1】
SEQ ID NO: 10-25および30-41から選択したペプチド。
【請求項2】
SEQ ID NO: 1、10-25および30-41から選択した配列を有するペプチドおよび医薬的に許容可能なキャリアを含むヒトサイトメガロウイルスに対するワクチン。
【請求項3】
さらにアジュバントを含む、請求項2に従うワクチン。
【請求項4】
前記アジュバントがDNAアジュバントである、請求項3に従うワクチン。
【請求項5】
前記ペプチドが脂質化されない、請求項2に従うワクチン。
【請求項6】
前記ペプチドが脂質化される、請求項2に従うワクチン。
【請求項7】
前記ペプチドがモノ脂質化される、請求項6に従うワクチン。
【請求項8】
前記ペプチドがジ脂質化される、請求項6に従うワクチン。
【請求項9】
SEQ ID NO: 1、10-25および30-41のいずれか1つに従うペプチドを提示するためにin vitroで処理された抗原提示細胞を含む、ヒトサイトメガロウイルスに対する細胞性ワクチン。
【請求項10】
前記抗原提示細胞が自己由来のものである、請求項9に従う細胞性ワクチン。
【請求項11】
前記抗原提示細胞がアロジェニックである、請求項9に従う細胞性ワクチン。
【請求項12】
SEQ ID NO: 1-14、19、26-28および30のいずれか1つに従うペプチドをコードする遺伝子を発現する、組換えウイルスベクターワクチン。
【請求項13】
請求項2、3、4、9あるいは12のいずれか1項に従うワクチンを投与することを含む、ヒトサイトメガロウイスル感染に対する免疫応答をモジュレートする方法。
【請求項14】
請求項2に従うワクチンを投与することを含む、ヒトサイトメガロウイスル感染に対する免疫応答をモジュレートする方法。
【請求項15】
請求項9に従うワクチンを投与することを含む、ヒトサイトメガロウイスル感染に対する免疫応答をモジュレートする方法。
【請求項16】
請求項12に従うワクチンを投与することを含む、ヒトサイトメガロウイスル感染に対する免疫応答をモジュレートする方法。
【請求項17】
ヒトサイトメガロウイルスの天然にプロセスされたエピトープおよびDNAアジュバントを含む、ヒトサイトメガロウイルスに対するワクチン。
【請求項18】
SEQ ID NO: 1の配列を有するペプチドおよびDNAアジュバントを含む、ヒトサイトメガロウイルスに対するワクチン。
【請求項19】
請求項4に従うワクチンを投与することを含む、ヒトサイトメガロウイスル感染に対する免疫応答をモジュレートする方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2012−87126(P2012−87126A)
【公開日】平成24年5月10日(2012.5.10)
【国際特許分類】
【出願番号】特願2011−243962(P2011−243962)
【出願日】平成23年11月7日(2011.11.7)
【分割の表示】特願2001−571713(P2001−571713)の分割
【原出願日】平成13年3月16日(2001.3.16)
【出願人】(598004424)シティ・オブ・ホープ (15)
【氏名又は名称原語表記】City of Hope
【住所又は居所原語表記】1500 East,Duarte Road,Duarte,California 91010−0269,United States of America
【Fターム(参考)】
【公開日】平成24年5月10日(2012.5.10)
【国際特許分類】
【出願日】平成23年11月7日(2011.11.7)
【分割の表示】特願2001−571713(P2001−571713)の分割
【原出願日】平成13年3月16日(2001.3.16)
【出願人】(598004424)シティ・オブ・ホープ (15)
【氏名又は名称原語表記】City of Hope
【住所又は居所原語表記】1500 East,Duarte Road,Duarte,California 91010−0269,United States of America
【Fターム(参考)】
[ Back to top ]

