ヒトパピローマウイルスワクチン製剤
【課題】増強された長期安定性を示すヒトパピローマウイルス(HPV)ワクチン製剤の提供。
【解決手段】a)アルミニウムアジュバント上に吸着されたHPVウイルス様粒子(VLP)、b)塩、c)ワクチン溶液のpH範囲をpH約6.0〜約6.5にするバッファー、およびd)非イオン性界面活性剤を含んでなるヒトパピローマウイルス(HPV)ワクチン製剤。該塩が、NaCl、KCl、Na2SO4、(NH4)2SO4、リン酸ナトリウムおよびクエン酸ナトリウムよりなる群から選ばれる。該非イオン性界面活性剤が、ポリソルベート(Polysorbate)20、ポリソルベート80、ポリソルベート20、NP−40(登録商標)、トリトン(Triton)X−100(登録商標)、トリトンX−114(登録商標)、スパン(Span)85、ブリジ(Brij)35(登録商標)、ブリジ58(登録商標)よりなる群から選ばれる。
【解決手段】a)アルミニウムアジュバント上に吸着されたHPVウイルス様粒子(VLP)、b)塩、c)ワクチン溶液のpH範囲をpH約6.0〜約6.5にするバッファー、およびd)非イオン性界面活性剤を含んでなるヒトパピローマウイルス(HPV)ワクチン製剤。該塩が、NaCl、KCl、Na2SO4、(NH4)2SO4、リン酸ナトリウムおよびクエン酸ナトリウムよりなる群から選ばれる。該非イオン性界面活性剤が、ポリソルベート(Polysorbate)20、ポリソルベート80、ポリソルベート20、NP−40(登録商標)、トリトン(Triton)X−100(登録商標)、トリトンX−114(登録商標)、スパン(Span)85、ブリジ(Brij)35(登録商標)、ブリジ58(登録商標)よりなる群から選ばれる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、増強された長期保存安定性をもたらすヒトパピローマウイルス(HPV)ワクチン製剤に関する。
【背景技術】
【0002】
ヒトパピローマウイルス(HPV)は生殖管に感染し、種々の形成異常、癌および他の疾患に関連づけられている。これらの疾患は、現在、ワクチン開発の標的となっており、L1を含有する又はL1+L2タンパク質の組合せを含有するウイルス様粒子(VLP)を含むワクチンが、現在臨床治験中である。
【0003】
しかしながら、HPV VLPは、溶液中であってもアルミニウムアジュバント粒子上に吸着された場合であっても、長期保存中に安定でないことが判明している。
【0004】
商業的に有用なワクチンを開発するためには、安定な製剤が必要とされている。
【発明の概要】
【0005】
本発明は、a)アルミニウムアジュバント上に吸着されたHPVウイルス様粒子(VLP)、b)塩、c)ワクチン溶液のpH範囲をpH約6.0〜約6.5にするバッファー、およびd)非イオン性界面活性剤を含んでなる、長期安定性を示すヒトパピローマウイルス(HPV)ワクチン製剤に関する。もう1つの実施形態においては、該製剤は更に、高分子ポリアニオン安定化剤を含む。
【0006】
本発明のもう1つの実施形態は、a)アルミニウム上に吸着された10〜200mcg/mlの各HPV VLP型(該VLPは、HPV6a、HPV6b、HPV11、HPV16、HPV18およびそれらの混合物よりなる群から選ばれる)、b)0.15M NaCl、c)0.05%カルボキシメチルセルロース、ならびにd)所望により使用する緩衝剤および/または非イオン性界面活性剤を含んでなるワクチンである。
【0007】
本発明はまた、(i)溶液のイオン強度を種々の濃度の塩で調節し、該溶液のpHを個々の緩衝剤で調節し制御し、(iii)非イオン性界面活性剤を加え、(iv)高分子ポリアニオン形態の追加的な安定化賦形剤を加えることにより製造された改良された安定なワクチン製剤に関する。
【図面の簡単な説明】
【0008】
【図1A】2〜8℃におけるHPV16 VLP−アルミニウム製剤の安定性に対するNaClの濃度および添加された賦形剤の効果を示すグラフである。
【図1B】15℃におけるHPV16 VLP−アルミニウム製剤の安定性に対するNaClの濃度および添加された賦形剤の効果を示すグラフである。
【図2】HPV16 VLP−アルミニウム製剤の促進(accelerated)安定性に対する賦形剤の効果を示すグラフである。
【図3】HPV16 VLP−アルミニウム製剤の促進安定性に対するポリアニオン賦形剤の効果を示す棒グラフである。
【図4】HPV16 VLP−アルミニウム製剤の促進安定性に対するカルボキシ−メチルセルロース(CMC)の濃度の効果を示す棒グラフである。
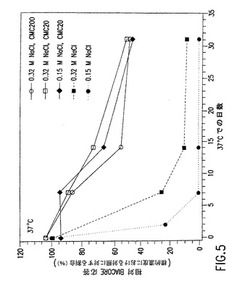
【図5】HPV16 VLP−アルミニウム製剤の促進安定性に対するカルボキシメチルセルロース(CMC)の分子量およびNaClの濃度の効果を示すグラフである。
【0009】
塩およびpHの生理的溶液条件下では、ヒトパピローマウイルス(HPV)L1タンパク質のウイルス様粒子(VLP)は、2〜8℃では溶液中であってもアルミニウムアジュバントへの吸着後であっても長期保存中に安定でない。したがって、本発明は、改善された保存安定性を有するアルミニウムアジュバント化および非アルミニウムアジュバント化HPV VLPワクチンの新規製剤に関する。該製剤は水溶液でありうる。一般に、該HPVはアルミニウムアジュバント上に吸収される。
【0010】
本発明においては、該ワクチン製剤の抗原部分として、任意の型のHPV VLPを使用することができる。該VLPは、L1タンパク質だけを含有することが可能であり、あるいはL1およびL2の両方のタンパク質から構成されうる。該タンパク質は、野生型アミノ酸組成のものでありうる。あるいはそれは突然変異を含有しうる。野生型アミノ酸組成のものであるL1タンパク質だけを含有するVLPが好ましい。
【0011】
特に好ましいHPVは、HPV6a、HPV6b、HPV11、HPV16およびHPV18を含む(これらに限定されるものではない)、疾患に関連したHPVである。また、本発明の製剤は、HPV6、11、16および18の組合せなどの複数のHPV抗原を含有する多価ワクチンを含む、種々のHPV型の組合せに適している。該VLPを、当技術分野で公知のとおりに組換え技術により製造するのが好ましい。該VLPを製造するのに使用する宿主細胞は酵母細胞であることが特に好ましいが、細菌、昆虫および哺乳類などの他の細胞型が公知であり、宿主として現在使用されている。
【0012】
一般には、アルミニウム上に吸収されるHPV VLPの濃度は、各HPV VLP型当たり約10〜200mcg/mlである。これは、特定の型のHPVの抗原性、「カクテル」型ワクチン中の複数の型のHPVの存在などの要因に応じて調節することができる。
【0013】
本発明の1つの実施形態は、a)アルミニウムアジュバント上に吸着されたHPVウイルス様粒子(VLP)、b)塩、c)ワクチン溶液のpH範囲をpH約6.0〜約6.5にするバッファー、およびd)非イオン性界面活性剤を含んでなるワクチンである。本発明のもう1つの実施形態は更に、高分子ポリアニオン安定化剤を含む。本発明のもう1つの実施形態は、より高い塩濃度を含まない、ならびにアルミニウム上に吸収されたHPV VLP、生理的濃度の塩(約0.15M)および高分子ポリアニオン安定化剤を、緩衝剤および非イオン性界面活性剤の存在下または不存在下で含む製剤である。
【0014】
塩
該溶液のイオン強度は、塩の存在により維持される。該イオン強度の制御に寄与しうるほとんどすべての塩を使用することができる。イオン強度の調節に使用しうる好ましい塩としては、生理的に許容される任意の塩、例えば、NaCl、KCl、Na2SO4、(NH4)2SO4、リン酸ナトリウムおよびクエン酸ナトリウムが挙げられる。特に好ましい塩は、NaCl、KClおよびNa2SO4である。イオン強度の増加は熱誘発性凝集に対するHPV VLPの安定性を劇的に増強することが判明している。例えば、UV分光光度計を使用して(曇り点の測定のための濁度アッセイ)、HPV VLPタンパク質溶液の安定性を温度の関数として凝集形成に関して分析した。その曇り点のデータは、イオン強度の増加(0.15M〜1M NaClを使用)が熱誘発性凝集に対する溶液中のHPV VLPの安定性を劇的に増強する(混濁形成の開始の温度を約7℃上昇させた)ことを示している。
【0015】
該塩は、約0.10M〜1Mの濃度で存在すべきである。しかし、高い塩濃度の非経口的注射の実施上の制約のため、非常に高い濃度は好ましくない。その代わりに、より妥当な塩濃度、例えば、0.15M〜0.32M NaClによる、約0.15M〜約0.5Mの、より生理的な濃度が好ましい。
【0016】
バッファー
本発明のいくつかの製剤はまた、該ワクチンが最適HPV VLP安定性にて非刺激性pH範囲内となるようにpH範囲を維持するためのバッファーを含有する。また、溶液中およびアルミニウム製剤に吸着された場合の両方におけるHPVの安定性に対するpHの効果を、本発明に従い調べた。結果は、pH5.5〜7.0の相対的に狭い範囲内でのみ、HPV VLPが安定であること、および好ましいpH範囲が6.0〜6.5であり、特に6.2である(インビトロ抗原性により測定した場合)ことを示している。
【0017】
HPV−アルミニウム製剤の保存安定性を、バッファーおよび非イオン性界面活性剤の添加に関して更に試験した。保存中のアルミニウムアジュバント化HPV VLPワクチンの、より良好なpH制御が、緩衝(バッファー)剤としてヒスチジンまたはイミダゾールのいずれかを加えた場合に認められた。一般に、該バッファーの濃度は、約2mM〜約100mMであるべきであり、5mM〜約20mMが好ましく、10mMがもう1つの好ましい濃度である。リン酸含有バッファーは、アルミニウムアジュバントと相互作用しうるため、一般には好ましくない。リン酸バッファーイオンとアルミニウムアジュバントとが相互作用すること、ならびにヒスチジンおよびイミダゾールバッファーとアルミニウムアジュバントとが相互作用しないことは、アルミニウムアジュバントの表面電荷のゼータ電位測定により証明された。
【0018】
非イオン性界面活性剤
本発明の製剤のいくつかにおけるもう1つの成分は、非イオン性界面活性剤である。該界面活性剤は、ポリオキシエチレンソルビタン脂肪酸エステル(Polysorbates)、例えば、ポリソルベート(Polysorbate)80(例えば、TWEEN80(登録商標))、ポリソルベート20(例えば、TWEEN20(登録商標))、ポリオキシエチレンアルキルエーテル(例えば、ブリジ(Brij)35(登録商標)およびブリジ58(登録商標))、ならびにその他の該界面活性剤、例えば、トリトン(Triton)X−100(登録商標)、トリトンX−114(登録商標)、NP−40(登録商標)、スパン(Span)85および一連のプルロニック(Pluronic)の非イオン性界面活性剤(例えば、プルロニック121)よりなる群から選ばれうる。特に、ポリソルベート80が好ましい。該界面活性剤は、一般には、約0.0005%〜約0.5%(wt/vol)の濃度で存在する。ポリソルベート80は、模擬輸送ストレス(すなわち、振とうまたは攪拌)中にHPV VLP−アルミニウムが不活性化されるのを防ぐことが判明した。ポリソルベート80の場合、好ましい濃度は約0.01%である。
【0019】
高分子ポリアニオン安定化剤
該HPV−VLP製剤の安定性の更なる有意な増強は、ポリアニオン高分子賦形剤(例えば、安定化剤)の添加によっても達成されうる。本明細書および特許請求の範囲の全体にわたり用いる「ポリアニオン高分子」なる語は、長い一本鎖を有する化合物または複数の架橋した鎖を有する化合物を意味し、どちらのタイプも、溶液中で、該鎖に沿った複数の負電荷を有する。ポリアニオン高分子の具体例には、タンパク質、ポリアニオン、ペプチドおよびポリ核酸が含まれる。具体的な安定化剤は、
カルボキシメチルセルロース(特に10〜800cps)、
ヘパリン(6〜30kDa)、
ポリアミノ酸(2〜100kDa)、例えば、ポリ(Glu)、ポリ(Asp)およびポリ(Glu,Phe)、
酸化型グルタチオン[Glu−Cys−Gly]2(613Da)、
ポリヌクレオチド、例えば、ポリシチジル酸(200〜700kDa)およびポリアデニル酸(200〜700kDa)、
RNA、
DNAおよび
血清アルブミンよりなる群から選ばれうる。
【0020】
該安定化剤の濃度は、それが存在する場合には、約0.01%〜約0.5%、特に、約0.05〜0.1(重量)%であるが、それより10倍少ない量のポリアニオン賦形剤(例えば、0.01%アルブミン、DNAまたはヘパリン)の添加であっても、尚も、HPV VLP−アルミニウム製剤の安定性の増強をもたらす。しかし、おそらく低濃度のため、該安定化効果は、相対的にそれほど顕著でなくなる。実施例において更に詳しく説明するとおり、ポリアニオンは、HPV−アルミニウム製剤の劇的な安定化をもたらした。これらのクラスの賦形剤の安定化メカニズムは、HPV VLP分子への直接的結合(例えば、DNAで生じるもの)、HPV VLPまたはHPV VLP−アルミニウムの表面吸着の抑制、溶液粘度の増加、表面電荷の中和、HPV VLPのジスルフィド結合の再形成、またはアミノ酸側鎖の酸化の妨害、および/またはHPV VLPのコンホメーション剛性の増加など様々でありうる。HPV VLP L1タンパク質は、該タンパク質のC末端領域内に、正に荷電した複数のアミノ酸のポリアニオン結合部位を含有することに注目することが重要である。
【0021】
これらのポリアニオンを、37℃の促進安定性研究条件下で更に試験した。HPV−アルミニウムのポリアニオン含有製剤はインビトロ抗原性の約80%を保有し、一方、該対照HPV製剤(ポリアニオンを加えなかったもの)は、37℃で1週間インキュベートした後にインビトロ抗原性をほとんど有さなかった。37℃で2週間インキュベートした後の同じ組のサンプルは、その1週間のデータとの有意な相違を示さない。このことは、これらのポリアニオン賦形剤の強力な安定化効果を示している。
【0022】
また、37℃の促進条件下の溶液中のHPV VLPに関して、該ポリアニオン安定化効果を調べた。ポリヌクレオチドポリアニオンであるポリ(A)またはポリ(C)の場合、HPV16 VLP(80mcg/mlタンパク質)がインビトロ抗原性による測定で熱誘発性不活性化に対する最大安定性を維持するためには、0.001(重量)%(すなわち10mcg/ml)の濃度が必要であることが、該データから示されている。沈降およびUV分析は、ポリアニオンが該VLPに直接結合することを示している
【0023】
また、アルミニウムアジュバントへのHPV VLPの吸着は、HPV VLPへのポリアニオンの前結合により抑制されうる。例えば、カルボキシメチルセルロースは、該ポリアニオンの或る濃度においてアルミニウムへのHPV VLPの結合を抑制しうる。しかし、アルミニウムアジュバントへのHPV VLPの吸着後のカルボキシメチルセルロースの添加は、アルミニウムからのHPV VLPの検出可能な遊離を実質的に引き起こさず、濃度依存的な劇的な安定性の増強をもたらす。
【0024】
ポリアニオン(0.001〜0.25重量%)の中で特に好ましいのは、50,000〜700,000Daの近似典型分子量を有するカルボキシメチルセルロース(10〜800cps)であり、より低い粘度の10〜200cpsのカルボキシメチルセルロースが特に好ましい。
【0025】
本発明の好ましい製剤は、以下を含む。
I.a)アルミニウム上に吸収された10〜200mcg/mlの各HPV VLP型(該VLPは、HPV6a、HPV6b、HPV11、HPV16、HPV18およびそれらの混合物よりなる群から選ばれる)、b)0.32M NaCl、c)10mMヒスチジンバッファー(pH6.2)、およびd)0.01%ポリソルベート80。
II.a)アルミニウム上に吸収された10〜200mcg/mlの各HPV VLP型(該VLPは、HPV6a、HPV6b、HPV11、HPV16、HPV18およびそれらの混合物よりなる群から選ばれる)、b)0.32M NaCl、c)10mMヒスチジンバッファー(pH6.2)、およびd)0.01%ポリソルベート80および0.05%カルボキシメチルセルロース。
III.a)アルミニウム上に吸着された10〜200mcg/mlの各HPV VLP型(該VLPは、HPV6a、HPV6b、HPV11、HPV16、HPV18およびそれらの混合物よりなる群から選ばれる)、b)0.15M NaCl、およびc)0.05%カルボキシメチルセルロース、およびd)所望により使用する10mMヒスチジン(pH6.2)および0.01%ポリソルベート80。
【0026】
以下の非限定的な実施例は、本発明を更に例示するために記載されている。
【0027】
実施例1
一般的方法
0.5M NaCl、0.003%ポリソルベート80(pHは約6.2)中の870mcg/mlのタンパク質濃度の酵母由来組換えL1タンパク質HPV16 VLP(95%を超える純度を有する)の凍結溶液を、これらの実験のほとんどに使用した。アルミニウムアジュバントはMerckにおいて製造された。賦形剤は商業的に購入した。すべてのワクチン製剤は、以下のとおりに調製した。希釈した又は希釈していない該HPV VLPを、HPV VLPミョウバン吸着用にアルミニウムアジュバントに加え、ついで該賦形剤を加えた。該製剤中のすべての賦形剤、HPV VLPおよびアルミニウムアジュバントに関するすべての所望の最終濃度には、計画された容積での直接的混合により、または沈降/デカント法での調節により近づけることができた。
【0028】
インビトロ抗原性アッセイ
該アルミニウムアジュバントからHPVを遊離させるために、クエン酸とポリソルベート80とを含有する高塩溶液中にHPV−アルミニウム製剤を希釈することを含むアルミニウム解離方法を開発した。該アルミニウム解離方法からのHPV VLPサンプルを、直接、Biacore分析を用いるインビトロ抗原性アッセイ(HPV VLP型特異的中和抗体を使用するもの)に付す。該アルミニウムアジュバント化安定性研究からのHPV VLPサンプルを、同じHPV VLPの凍結ストック溶液と直接比較して、インビトロ抗原性を測定する。
【0029】
pHの測定
HPV−アルミニウム製剤のpHの測定は、モデル420AのOrion pHメーターを使用して室温で行なった。種々の温度でインキュベートしたすべてのサンプルを、pHの測定の前に室温で30分間平衡化した。該pHメーターは、予想サンプルpH域を挟む2つの標準バッファーを使用して、95%〜100%の相関係数で手動で校正した。ヒスチジン緩衝溶液のpHに対する温度の効果は、温度を4℃から37℃まで徐々に変化させることにより判定した。
【0030】
タンパク質濃度の測定(UV分光法)
バルク溶液および製剤化サンプル(アルミニウム解離後)の両方におけるHPVのタンパク質濃度を、HP8452A Diode Array分光光度計と経路長1cmのキュベットとを使用するUV吸収スペクトル測定により室温で測定した。用いたサンプル容積は約200〜250マイクロリットルであった。HPV VLP用に開発された多成分二次導関数解析技術を用いて、該タンパク質濃度を算出した。
【0031】
他の分析
Beckman XL1分析用超遠心機を使用して、沈降速度実験を行なった。
【0032】
HP845X UV−Visible系ソフトウェアと温度制御系とを備えたHP8452A Diode Array分光光度計を使用して、濁度アッセイを行なった。温度を約25℃から80℃まで増加させることにより、該プログラムの速度論(kinetic)モードにて320〜350nmで該溶液の光散乱を追跡した。
【0033】
該溶液のpHを4から9まで変化させながら又は該賦形剤濃度を変化させながら、Malvern Zetasizer3000 Systemを使用して、アルミニウム粒子およびHPV VLPのゼータ電位を測定した。
【0034】
促進安定性およびリアルタイム安定性の研究
促進条件およびリアルタイム条件の両方の条件下で、HPV−アルミニウム製剤の安定性の研究を行なった。促進安定性研究の温度は15℃から37℃までの様々な温度であった。リアルタイム安定性研究の温度は2〜8℃であった。これらの温度範囲は、HPV VLPの不活性化速度が温度に非常に感受性であるという事実に基づいて選択した。生物物理学的測定によるコンホメーションの完全性に関するこれまでのデータは、温度を40〜45℃以上に増加させると、溶液中のHPV VLPの有意なコンホメーション変化が誘発されることを示しており、これは、促進安定性研究においては避けなければならない条件である。
【0035】
実施例2
安定性に対する塩および賦形剤の効果
2〜8℃におけるHPV16 VLP−アルミニウム製剤の安定性に対するNaCl濃度および添加賦形剤の効果を調べた。0.01%ポリソルベート80、10mMヒスチジンの添加を伴う/伴わない種々のNaCl濃度の溶液中の450mcg/mlアルミニウムアジュバント上の160mcg/ml HPV16 VLPの製剤を、2〜8℃でインキュベートした。ついで該製剤のインビトロ抗原性を、種々のインキュベーション時間の後にBiacore分析によりアッセイした。結果を図1Aに示す。ついで該実験を、15℃でのインキュベーションに関して繰返した。図1Bは、15℃でインキュベートした場合の結果を示す。どちらのグラフにおいても、黒塗りの四角は0.15M NaClに関する点であり、白抜きの四角は0.30M NaClに関する点であり、黒塗りの丸は0.30M NaCl、0.01%ポリソルベート(POLYSORBATE)80および10mMヒスチジンに関する点である。該データは、塩濃度の増加が該ワクチン安定性を増強すること、およびバッファーおよびポリソルベートの添加が該安定性を更に増強することを示している。
【0036】
実施例3
安定化剤の効果
HPV16 VLP−アルミニウム製剤の促進安定性に対する安定化賦形剤の効果を調べた。種々の安定化賦形剤の添加を伴う/伴わない450mcg/mlアルミニウムアジュバント上の200mcg/ml HPV16 VLPの製剤を、pH6.2および25℃でインキュベートした。ついで該製剤のインビトロ抗原性を、種々のインキュベーション時間の後にBiacore分析によりアッセイした。該製剤組成を図2に示す。黒塗りの丸は0.3 NaCl+0.1%ポリグルタミン酸(ポリ(POLY)−Glu)、十字付きの四角は0.3M NaCl+0.1%ポリアデニル酸(ポリ−A)、白抜きの四角は0.3M NaCl+10mMヒスチジン+0.01%ポリソルベート(POLYSORBATE)80、白抜きの三角は0.3M NaCl、白抜きの丸は0.15M NaClである。該データは、25℃においては、0.15Mから0.3Mへの塩濃度の増加ならびにバッファーおよびポリソルベートの添加が該製剤の安定性を増強することを示している。しかし、ポリアニオンの添加は、インビトロ抗原性の熱誘発性喪失に対する、アルミニウムに吸着されたHPV VLPの安定性を、より劇的に増強する。
【0037】
実施例4
安定性に対するポリアニオンの効果
HPV16 VLP−アルミニウム製剤の促進安定性に対するポリアニオン賦形剤の効果を、さらに詳しく調べた。ポリアニオン賦形剤の添加を伴う/伴わない0.3M NaCl、0.01%ポリソルベート80、10mMヒスチジン(pH6.2)中の450mcg/mlアルミニウムアジュバント上の160mcg/ml HPV16 VLPの製剤を、37℃で1週間インキュベートした。ついで該製剤のインビトロ抗原性をBiacore分析によりアッセイした。加えたポリアニオン賦形剤の種類および濃度は、図3に示すとおりであり、左から右に、対照、0.1%ポリアデニル酸(ポリ(POLY)A)、0.1%ポリシチジル酸(ポリC)、0.1%ポリアスパラギン酸(ポリAsp)(5〜15K)、0.1%ポリグルタミン酸(ポリ−Glu)(5〜15K)、0.1%ポリグルタミン酸(ポリ−Glu)(50〜100K)、0.1%ウシ血清アルブミン(BSA)、0.1%ポリグルタミン酸−フェニルアラニン(ポリGlu,Phe)、0.1%ヘパリン、0.25%ヘパリン、2mM酸化型グルタチオン、0.1%カルボキシメチルセルロース(CMC)(200cps)、0.1%カルボキシメチルセルロース(CMC)(800cps)である。
【0038】
Biacoreで測定した場合のインビトロ抗原性の維持により認められるとおり、、これらの高分子ポリアニオンはすべて、HPV16 VLP−アルミニウム製剤を有意に安定化しうることが認められうる。
【0039】
実施例5
カルボキシメチルセルロースの効果
HPV16 VLP−アルミニウム製剤の促進安定性に対するカルボキシメチルセルロース(CMC)濃度の効果を調べた。種々の量のCMC(200cps)の添加を伴う/伴わない0.3M NaCl、0.01%ポリソルベート80、10mMヒスチジン(pH6.2)中の450mcg/mlアルミニウムアジュバント上の160mcg/ml HPV16の製剤を、37℃で1週間インキュベートした。ついで該製剤のインビトロ抗原性をBiacore分析によりアッセイした。結果を、0、0.005%、0.01%、0.05%、0.1%および0.2%CMCに関して図4に示す。該データは、安定性の増強が、加えられたCMC濃度の関数であることを示している。インビトロ抗原性は、少なくとも0.05%CMCの存在下で維持される。
【0040】
実施例6
CMCのサイズの効果
HPV16 VLP−アルミニウム製剤の促進安定性に対するカルボキシメチルセルロース(CMC)の分子量およびNaClの濃度の効果を調べた。CMCの添加を伴う/伴わない10mMヒスチジン(pH6.2)、0.01%ポリソルベート80中の450mcg/mlアルミニウムアジュバント上の160mcg/ml HPV16 VLPの製剤を、37℃でインキュベートした。ついで該製剤のインビトロ抗原性を、種々のインキュベーション時間の後にBiacore分析によりアッセイした。該CMC濃度は0.05%であった。該CMC分子量は10〜20cpsまたは200cpsのレベルである。結果を図5に示す。白抜きの丸は0.32M NaCl、CMC 200cps、実線の白抜きの四角は0.32M NaCl、CMC 10〜20cps、黒塗り菱形は0.15M NaCl、CMC 10〜20cps、点線の白抜きの四角は0.32M NaCl、黒塗りの丸は0.15M NaClを示す。該データは、より小さな分子量(約10〜20cps)を有するCMCが、200cpsのCMCを有するHPV VLP−アルミニウム製剤と同様の安定性の増強を基本的にもたらすこと、およびCMCの存在が生理的塩濃度(0.15M NaCl)での該ワクチン製剤の製剤化を可能にすることを示している。
【技術分野】
【0001】
本発明は、増強された長期保存安定性をもたらすヒトパピローマウイルス(HPV)ワクチン製剤に関する。
【背景技術】
【0002】
ヒトパピローマウイルス(HPV)は生殖管に感染し、種々の形成異常、癌および他の疾患に関連づけられている。これらの疾患は、現在、ワクチン開発の標的となっており、L1を含有する又はL1+L2タンパク質の組合せを含有するウイルス様粒子(VLP)を含むワクチンが、現在臨床治験中である。
【0003】
しかしながら、HPV VLPは、溶液中であってもアルミニウムアジュバント粒子上に吸着された場合であっても、長期保存中に安定でないことが判明している。
【0004】
商業的に有用なワクチンを開発するためには、安定な製剤が必要とされている。
【発明の概要】
【0005】
本発明は、a)アルミニウムアジュバント上に吸着されたHPVウイルス様粒子(VLP)、b)塩、c)ワクチン溶液のpH範囲をpH約6.0〜約6.5にするバッファー、およびd)非イオン性界面活性剤を含んでなる、長期安定性を示すヒトパピローマウイルス(HPV)ワクチン製剤に関する。もう1つの実施形態においては、該製剤は更に、高分子ポリアニオン安定化剤を含む。
【0006】
本発明のもう1つの実施形態は、a)アルミニウム上に吸着された10〜200mcg/mlの各HPV VLP型(該VLPは、HPV6a、HPV6b、HPV11、HPV16、HPV18およびそれらの混合物よりなる群から選ばれる)、b)0.15M NaCl、c)0.05%カルボキシメチルセルロース、ならびにd)所望により使用する緩衝剤および/または非イオン性界面活性剤を含んでなるワクチンである。
【0007】
本発明はまた、(i)溶液のイオン強度を種々の濃度の塩で調節し、該溶液のpHを個々の緩衝剤で調節し制御し、(iii)非イオン性界面活性剤を加え、(iv)高分子ポリアニオン形態の追加的な安定化賦形剤を加えることにより製造された改良された安定なワクチン製剤に関する。
【図面の簡単な説明】
【0008】
【図1A】2〜8℃におけるHPV16 VLP−アルミニウム製剤の安定性に対するNaClの濃度および添加された賦形剤の効果を示すグラフである。
【図1B】15℃におけるHPV16 VLP−アルミニウム製剤の安定性に対するNaClの濃度および添加された賦形剤の効果を示すグラフである。
【図2】HPV16 VLP−アルミニウム製剤の促進(accelerated)安定性に対する賦形剤の効果を示すグラフである。
【図3】HPV16 VLP−アルミニウム製剤の促進安定性に対するポリアニオン賦形剤の効果を示す棒グラフである。
【図4】HPV16 VLP−アルミニウム製剤の促進安定性に対するカルボキシ−メチルセルロース(CMC)の濃度の効果を示す棒グラフである。
【図5】HPV16 VLP−アルミニウム製剤の促進安定性に対するカルボキシメチルセルロース(CMC)の分子量およびNaClの濃度の効果を示すグラフである。
【0009】
塩およびpHの生理的溶液条件下では、ヒトパピローマウイルス(HPV)L1タンパク質のウイルス様粒子(VLP)は、2〜8℃では溶液中であってもアルミニウムアジュバントへの吸着後であっても長期保存中に安定でない。したがって、本発明は、改善された保存安定性を有するアルミニウムアジュバント化および非アルミニウムアジュバント化HPV VLPワクチンの新規製剤に関する。該製剤は水溶液でありうる。一般に、該HPVはアルミニウムアジュバント上に吸収される。
【0010】
本発明においては、該ワクチン製剤の抗原部分として、任意の型のHPV VLPを使用することができる。該VLPは、L1タンパク質だけを含有することが可能であり、あるいはL1およびL2の両方のタンパク質から構成されうる。該タンパク質は、野生型アミノ酸組成のものでありうる。あるいはそれは突然変異を含有しうる。野生型アミノ酸組成のものであるL1タンパク質だけを含有するVLPが好ましい。
【0011】
特に好ましいHPVは、HPV6a、HPV6b、HPV11、HPV16およびHPV18を含む(これらに限定されるものではない)、疾患に関連したHPVである。また、本発明の製剤は、HPV6、11、16および18の組合せなどの複数のHPV抗原を含有する多価ワクチンを含む、種々のHPV型の組合せに適している。該VLPを、当技術分野で公知のとおりに組換え技術により製造するのが好ましい。該VLPを製造するのに使用する宿主細胞は酵母細胞であることが特に好ましいが、細菌、昆虫および哺乳類などの他の細胞型が公知であり、宿主として現在使用されている。
【0012】
一般には、アルミニウム上に吸収されるHPV VLPの濃度は、各HPV VLP型当たり約10〜200mcg/mlである。これは、特定の型のHPVの抗原性、「カクテル」型ワクチン中の複数の型のHPVの存在などの要因に応じて調節することができる。
【0013】
本発明の1つの実施形態は、a)アルミニウムアジュバント上に吸着されたHPVウイルス様粒子(VLP)、b)塩、c)ワクチン溶液のpH範囲をpH約6.0〜約6.5にするバッファー、およびd)非イオン性界面活性剤を含んでなるワクチンである。本発明のもう1つの実施形態は更に、高分子ポリアニオン安定化剤を含む。本発明のもう1つの実施形態は、より高い塩濃度を含まない、ならびにアルミニウム上に吸収されたHPV VLP、生理的濃度の塩(約0.15M)および高分子ポリアニオン安定化剤を、緩衝剤および非イオン性界面活性剤の存在下または不存在下で含む製剤である。
【0014】
塩
該溶液のイオン強度は、塩の存在により維持される。該イオン強度の制御に寄与しうるほとんどすべての塩を使用することができる。イオン強度の調節に使用しうる好ましい塩としては、生理的に許容される任意の塩、例えば、NaCl、KCl、Na2SO4、(NH4)2SO4、リン酸ナトリウムおよびクエン酸ナトリウムが挙げられる。特に好ましい塩は、NaCl、KClおよびNa2SO4である。イオン強度の増加は熱誘発性凝集に対するHPV VLPの安定性を劇的に増強することが判明している。例えば、UV分光光度計を使用して(曇り点の測定のための濁度アッセイ)、HPV VLPタンパク質溶液の安定性を温度の関数として凝集形成に関して分析した。その曇り点のデータは、イオン強度の増加(0.15M〜1M NaClを使用)が熱誘発性凝集に対する溶液中のHPV VLPの安定性を劇的に増強する(混濁形成の開始の温度を約7℃上昇させた)ことを示している。
【0015】
該塩は、約0.10M〜1Mの濃度で存在すべきである。しかし、高い塩濃度の非経口的注射の実施上の制約のため、非常に高い濃度は好ましくない。その代わりに、より妥当な塩濃度、例えば、0.15M〜0.32M NaClによる、約0.15M〜約0.5Mの、より生理的な濃度が好ましい。
【0016】
バッファー
本発明のいくつかの製剤はまた、該ワクチンが最適HPV VLP安定性にて非刺激性pH範囲内となるようにpH範囲を維持するためのバッファーを含有する。また、溶液中およびアルミニウム製剤に吸着された場合の両方におけるHPVの安定性に対するpHの効果を、本発明に従い調べた。結果は、pH5.5〜7.0の相対的に狭い範囲内でのみ、HPV VLPが安定であること、および好ましいpH範囲が6.0〜6.5であり、特に6.2である(インビトロ抗原性により測定した場合)ことを示している。
【0017】
HPV−アルミニウム製剤の保存安定性を、バッファーおよび非イオン性界面活性剤の添加に関して更に試験した。保存中のアルミニウムアジュバント化HPV VLPワクチンの、より良好なpH制御が、緩衝(バッファー)剤としてヒスチジンまたはイミダゾールのいずれかを加えた場合に認められた。一般に、該バッファーの濃度は、約2mM〜約100mMであるべきであり、5mM〜約20mMが好ましく、10mMがもう1つの好ましい濃度である。リン酸含有バッファーは、アルミニウムアジュバントと相互作用しうるため、一般には好ましくない。リン酸バッファーイオンとアルミニウムアジュバントとが相互作用すること、ならびにヒスチジンおよびイミダゾールバッファーとアルミニウムアジュバントとが相互作用しないことは、アルミニウムアジュバントの表面電荷のゼータ電位測定により証明された。
【0018】
非イオン性界面活性剤
本発明の製剤のいくつかにおけるもう1つの成分は、非イオン性界面活性剤である。該界面活性剤は、ポリオキシエチレンソルビタン脂肪酸エステル(Polysorbates)、例えば、ポリソルベート(Polysorbate)80(例えば、TWEEN80(登録商標))、ポリソルベート20(例えば、TWEEN20(登録商標))、ポリオキシエチレンアルキルエーテル(例えば、ブリジ(Brij)35(登録商標)およびブリジ58(登録商標))、ならびにその他の該界面活性剤、例えば、トリトン(Triton)X−100(登録商標)、トリトンX−114(登録商標)、NP−40(登録商標)、スパン(Span)85および一連のプルロニック(Pluronic)の非イオン性界面活性剤(例えば、プルロニック121)よりなる群から選ばれうる。特に、ポリソルベート80が好ましい。該界面活性剤は、一般には、約0.0005%〜約0.5%(wt/vol)の濃度で存在する。ポリソルベート80は、模擬輸送ストレス(すなわち、振とうまたは攪拌)中にHPV VLP−アルミニウムが不活性化されるのを防ぐことが判明した。ポリソルベート80の場合、好ましい濃度は約0.01%である。
【0019】
高分子ポリアニオン安定化剤
該HPV−VLP製剤の安定性の更なる有意な増強は、ポリアニオン高分子賦形剤(例えば、安定化剤)の添加によっても達成されうる。本明細書および特許請求の範囲の全体にわたり用いる「ポリアニオン高分子」なる語は、長い一本鎖を有する化合物または複数の架橋した鎖を有する化合物を意味し、どちらのタイプも、溶液中で、該鎖に沿った複数の負電荷を有する。ポリアニオン高分子の具体例には、タンパク質、ポリアニオン、ペプチドおよびポリ核酸が含まれる。具体的な安定化剤は、
カルボキシメチルセルロース(特に10〜800cps)、
ヘパリン(6〜30kDa)、
ポリアミノ酸(2〜100kDa)、例えば、ポリ(Glu)、ポリ(Asp)およびポリ(Glu,Phe)、
酸化型グルタチオン[Glu−Cys−Gly]2(613Da)、
ポリヌクレオチド、例えば、ポリシチジル酸(200〜700kDa)およびポリアデニル酸(200〜700kDa)、
RNA、
DNAおよび
血清アルブミンよりなる群から選ばれうる。
【0020】
該安定化剤の濃度は、それが存在する場合には、約0.01%〜約0.5%、特に、約0.05〜0.1(重量)%であるが、それより10倍少ない量のポリアニオン賦形剤(例えば、0.01%アルブミン、DNAまたはヘパリン)の添加であっても、尚も、HPV VLP−アルミニウム製剤の安定性の増強をもたらす。しかし、おそらく低濃度のため、該安定化効果は、相対的にそれほど顕著でなくなる。実施例において更に詳しく説明するとおり、ポリアニオンは、HPV−アルミニウム製剤の劇的な安定化をもたらした。これらのクラスの賦形剤の安定化メカニズムは、HPV VLP分子への直接的結合(例えば、DNAで生じるもの)、HPV VLPまたはHPV VLP−アルミニウムの表面吸着の抑制、溶液粘度の増加、表面電荷の中和、HPV VLPのジスルフィド結合の再形成、またはアミノ酸側鎖の酸化の妨害、および/またはHPV VLPのコンホメーション剛性の増加など様々でありうる。HPV VLP L1タンパク質は、該タンパク質のC末端領域内に、正に荷電した複数のアミノ酸のポリアニオン結合部位を含有することに注目することが重要である。
【0021】
これらのポリアニオンを、37℃の促進安定性研究条件下で更に試験した。HPV−アルミニウムのポリアニオン含有製剤はインビトロ抗原性の約80%を保有し、一方、該対照HPV製剤(ポリアニオンを加えなかったもの)は、37℃で1週間インキュベートした後にインビトロ抗原性をほとんど有さなかった。37℃で2週間インキュベートした後の同じ組のサンプルは、その1週間のデータとの有意な相違を示さない。このことは、これらのポリアニオン賦形剤の強力な安定化効果を示している。
【0022】
また、37℃の促進条件下の溶液中のHPV VLPに関して、該ポリアニオン安定化効果を調べた。ポリヌクレオチドポリアニオンであるポリ(A)またはポリ(C)の場合、HPV16 VLP(80mcg/mlタンパク質)がインビトロ抗原性による測定で熱誘発性不活性化に対する最大安定性を維持するためには、0.001(重量)%(すなわち10mcg/ml)の濃度が必要であることが、該データから示されている。沈降およびUV分析は、ポリアニオンが該VLPに直接結合することを示している
【0023】
また、アルミニウムアジュバントへのHPV VLPの吸着は、HPV VLPへのポリアニオンの前結合により抑制されうる。例えば、カルボキシメチルセルロースは、該ポリアニオンの或る濃度においてアルミニウムへのHPV VLPの結合を抑制しうる。しかし、アルミニウムアジュバントへのHPV VLPの吸着後のカルボキシメチルセルロースの添加は、アルミニウムからのHPV VLPの検出可能な遊離を実質的に引き起こさず、濃度依存的な劇的な安定性の増強をもたらす。
【0024】
ポリアニオン(0.001〜0.25重量%)の中で特に好ましいのは、50,000〜700,000Daの近似典型分子量を有するカルボキシメチルセルロース(10〜800cps)であり、より低い粘度の10〜200cpsのカルボキシメチルセルロースが特に好ましい。
【0025】
本発明の好ましい製剤は、以下を含む。
I.a)アルミニウム上に吸収された10〜200mcg/mlの各HPV VLP型(該VLPは、HPV6a、HPV6b、HPV11、HPV16、HPV18およびそれらの混合物よりなる群から選ばれる)、b)0.32M NaCl、c)10mMヒスチジンバッファー(pH6.2)、およびd)0.01%ポリソルベート80。
II.a)アルミニウム上に吸収された10〜200mcg/mlの各HPV VLP型(該VLPは、HPV6a、HPV6b、HPV11、HPV16、HPV18およびそれらの混合物よりなる群から選ばれる)、b)0.32M NaCl、c)10mMヒスチジンバッファー(pH6.2)、およびd)0.01%ポリソルベート80および0.05%カルボキシメチルセルロース。
III.a)アルミニウム上に吸着された10〜200mcg/mlの各HPV VLP型(該VLPは、HPV6a、HPV6b、HPV11、HPV16、HPV18およびそれらの混合物よりなる群から選ばれる)、b)0.15M NaCl、およびc)0.05%カルボキシメチルセルロース、およびd)所望により使用する10mMヒスチジン(pH6.2)および0.01%ポリソルベート80。
【0026】
以下の非限定的な実施例は、本発明を更に例示するために記載されている。
【0027】
実施例1
一般的方法
0.5M NaCl、0.003%ポリソルベート80(pHは約6.2)中の870mcg/mlのタンパク質濃度の酵母由来組換えL1タンパク質HPV16 VLP(95%を超える純度を有する)の凍結溶液を、これらの実験のほとんどに使用した。アルミニウムアジュバントはMerckにおいて製造された。賦形剤は商業的に購入した。すべてのワクチン製剤は、以下のとおりに調製した。希釈した又は希釈していない該HPV VLPを、HPV VLPミョウバン吸着用にアルミニウムアジュバントに加え、ついで該賦形剤を加えた。該製剤中のすべての賦形剤、HPV VLPおよびアルミニウムアジュバントに関するすべての所望の最終濃度には、計画された容積での直接的混合により、または沈降/デカント法での調節により近づけることができた。
【0028】
インビトロ抗原性アッセイ
該アルミニウムアジュバントからHPVを遊離させるために、クエン酸とポリソルベート80とを含有する高塩溶液中にHPV−アルミニウム製剤を希釈することを含むアルミニウム解離方法を開発した。該アルミニウム解離方法からのHPV VLPサンプルを、直接、Biacore分析を用いるインビトロ抗原性アッセイ(HPV VLP型特異的中和抗体を使用するもの)に付す。該アルミニウムアジュバント化安定性研究からのHPV VLPサンプルを、同じHPV VLPの凍結ストック溶液と直接比較して、インビトロ抗原性を測定する。
【0029】
pHの測定
HPV−アルミニウム製剤のpHの測定は、モデル420AのOrion pHメーターを使用して室温で行なった。種々の温度でインキュベートしたすべてのサンプルを、pHの測定の前に室温で30分間平衡化した。該pHメーターは、予想サンプルpH域を挟む2つの標準バッファーを使用して、95%〜100%の相関係数で手動で校正した。ヒスチジン緩衝溶液のpHに対する温度の効果は、温度を4℃から37℃まで徐々に変化させることにより判定した。
【0030】
タンパク質濃度の測定(UV分光法)
バルク溶液および製剤化サンプル(アルミニウム解離後)の両方におけるHPVのタンパク質濃度を、HP8452A Diode Array分光光度計と経路長1cmのキュベットとを使用するUV吸収スペクトル測定により室温で測定した。用いたサンプル容積は約200〜250マイクロリットルであった。HPV VLP用に開発された多成分二次導関数解析技術を用いて、該タンパク質濃度を算出した。
【0031】
他の分析
Beckman XL1分析用超遠心機を使用して、沈降速度実験を行なった。
【0032】
HP845X UV−Visible系ソフトウェアと温度制御系とを備えたHP8452A Diode Array分光光度計を使用して、濁度アッセイを行なった。温度を約25℃から80℃まで増加させることにより、該プログラムの速度論(kinetic)モードにて320〜350nmで該溶液の光散乱を追跡した。
【0033】
該溶液のpHを4から9まで変化させながら又は該賦形剤濃度を変化させながら、Malvern Zetasizer3000 Systemを使用して、アルミニウム粒子およびHPV VLPのゼータ電位を測定した。
【0034】
促進安定性およびリアルタイム安定性の研究
促進条件およびリアルタイム条件の両方の条件下で、HPV−アルミニウム製剤の安定性の研究を行なった。促進安定性研究の温度は15℃から37℃までの様々な温度であった。リアルタイム安定性研究の温度は2〜8℃であった。これらの温度範囲は、HPV VLPの不活性化速度が温度に非常に感受性であるという事実に基づいて選択した。生物物理学的測定によるコンホメーションの完全性に関するこれまでのデータは、温度を40〜45℃以上に増加させると、溶液中のHPV VLPの有意なコンホメーション変化が誘発されることを示しており、これは、促進安定性研究においては避けなければならない条件である。
【0035】
実施例2
安定性に対する塩および賦形剤の効果
2〜8℃におけるHPV16 VLP−アルミニウム製剤の安定性に対するNaCl濃度および添加賦形剤の効果を調べた。0.01%ポリソルベート80、10mMヒスチジンの添加を伴う/伴わない種々のNaCl濃度の溶液中の450mcg/mlアルミニウムアジュバント上の160mcg/ml HPV16 VLPの製剤を、2〜8℃でインキュベートした。ついで該製剤のインビトロ抗原性を、種々のインキュベーション時間の後にBiacore分析によりアッセイした。結果を図1Aに示す。ついで該実験を、15℃でのインキュベーションに関して繰返した。図1Bは、15℃でインキュベートした場合の結果を示す。どちらのグラフにおいても、黒塗りの四角は0.15M NaClに関する点であり、白抜きの四角は0.30M NaClに関する点であり、黒塗りの丸は0.30M NaCl、0.01%ポリソルベート(POLYSORBATE)80および10mMヒスチジンに関する点である。該データは、塩濃度の増加が該ワクチン安定性を増強すること、およびバッファーおよびポリソルベートの添加が該安定性を更に増強することを示している。
【0036】
実施例3
安定化剤の効果
HPV16 VLP−アルミニウム製剤の促進安定性に対する安定化賦形剤の効果を調べた。種々の安定化賦形剤の添加を伴う/伴わない450mcg/mlアルミニウムアジュバント上の200mcg/ml HPV16 VLPの製剤を、pH6.2および25℃でインキュベートした。ついで該製剤のインビトロ抗原性を、種々のインキュベーション時間の後にBiacore分析によりアッセイした。該製剤組成を図2に示す。黒塗りの丸は0.3 NaCl+0.1%ポリグルタミン酸(ポリ(POLY)−Glu)、十字付きの四角は0.3M NaCl+0.1%ポリアデニル酸(ポリ−A)、白抜きの四角は0.3M NaCl+10mMヒスチジン+0.01%ポリソルベート(POLYSORBATE)80、白抜きの三角は0.3M NaCl、白抜きの丸は0.15M NaClである。該データは、25℃においては、0.15Mから0.3Mへの塩濃度の増加ならびにバッファーおよびポリソルベートの添加が該製剤の安定性を増強することを示している。しかし、ポリアニオンの添加は、インビトロ抗原性の熱誘発性喪失に対する、アルミニウムに吸着されたHPV VLPの安定性を、より劇的に増強する。
【0037】
実施例4
安定性に対するポリアニオンの効果
HPV16 VLP−アルミニウム製剤の促進安定性に対するポリアニオン賦形剤の効果を、さらに詳しく調べた。ポリアニオン賦形剤の添加を伴う/伴わない0.3M NaCl、0.01%ポリソルベート80、10mMヒスチジン(pH6.2)中の450mcg/mlアルミニウムアジュバント上の160mcg/ml HPV16 VLPの製剤を、37℃で1週間インキュベートした。ついで該製剤のインビトロ抗原性をBiacore分析によりアッセイした。加えたポリアニオン賦形剤の種類および濃度は、図3に示すとおりであり、左から右に、対照、0.1%ポリアデニル酸(ポリ(POLY)A)、0.1%ポリシチジル酸(ポリC)、0.1%ポリアスパラギン酸(ポリAsp)(5〜15K)、0.1%ポリグルタミン酸(ポリ−Glu)(5〜15K)、0.1%ポリグルタミン酸(ポリ−Glu)(50〜100K)、0.1%ウシ血清アルブミン(BSA)、0.1%ポリグルタミン酸−フェニルアラニン(ポリGlu,Phe)、0.1%ヘパリン、0.25%ヘパリン、2mM酸化型グルタチオン、0.1%カルボキシメチルセルロース(CMC)(200cps)、0.1%カルボキシメチルセルロース(CMC)(800cps)である。
【0038】
Biacoreで測定した場合のインビトロ抗原性の維持により認められるとおり、、これらの高分子ポリアニオンはすべて、HPV16 VLP−アルミニウム製剤を有意に安定化しうることが認められうる。
【0039】
実施例5
カルボキシメチルセルロースの効果
HPV16 VLP−アルミニウム製剤の促進安定性に対するカルボキシメチルセルロース(CMC)濃度の効果を調べた。種々の量のCMC(200cps)の添加を伴う/伴わない0.3M NaCl、0.01%ポリソルベート80、10mMヒスチジン(pH6.2)中の450mcg/mlアルミニウムアジュバント上の160mcg/ml HPV16の製剤を、37℃で1週間インキュベートした。ついで該製剤のインビトロ抗原性をBiacore分析によりアッセイした。結果を、0、0.005%、0.01%、0.05%、0.1%および0.2%CMCに関して図4に示す。該データは、安定性の増強が、加えられたCMC濃度の関数であることを示している。インビトロ抗原性は、少なくとも0.05%CMCの存在下で維持される。
【0040】
実施例6
CMCのサイズの効果
HPV16 VLP−アルミニウム製剤の促進安定性に対するカルボキシメチルセルロース(CMC)の分子量およびNaClの濃度の効果を調べた。CMCの添加を伴う/伴わない10mMヒスチジン(pH6.2)、0.01%ポリソルベート80中の450mcg/mlアルミニウムアジュバント上の160mcg/ml HPV16 VLPの製剤を、37℃でインキュベートした。ついで該製剤のインビトロ抗原性を、種々のインキュベーション時間の後にBiacore分析によりアッセイした。該CMC濃度は0.05%であった。該CMC分子量は10〜20cpsまたは200cpsのレベルである。結果を図5に示す。白抜きの丸は0.32M NaCl、CMC 200cps、実線の白抜きの四角は0.32M NaCl、CMC 10〜20cps、黒塗り菱形は0.15M NaCl、CMC 10〜20cps、点線の白抜きの四角は0.32M NaCl、黒塗りの丸は0.15M NaClを示す。該データは、より小さな分子量(約10〜20cps)を有するCMCが、200cpsのCMCを有するHPV VLP−アルミニウム製剤と同様の安定性の増強を基本的にもたらすこと、およびCMCの存在が生理的塩濃度(0.15M NaCl)での該ワクチン製剤の製剤化を可能にすることを示している。
【特許請求の範囲】
【請求項1】
a)アルミニウムアジュバント上に吸着されたHPVウイルス様粒子(VLP)、
b)塩、
c)ワクチン溶液のpH範囲をpH約6.0〜約6.5にするバッファー、および
d)非イオン性界面活性剤
を含んでなるヒトパピローマウイルス(HPV)ワクチン製剤。
【請求項2】
該塩が、NaCl、KCl、Na2SO4、(NH4)2SO4、リン酸ナトリウムおよびクエン酸ナトリウムよりなる群から選ばれる、請求項1に記載のワクチン。
【請求項3】
該塩が約0.10M〜約0.5Mの濃度で存在する、請求項2に記載のワクチン。
【請求項4】
該塩が0.32M NaClである、請求項3に記載のワクチン。
【請求項5】
該バッファーがヒスチジンまたはイミダゾールである、請求項1に記載のワクチン。
【請求項6】
該バッファーが約2mM〜約100mMの濃度で存在する、請求項5に記載のワクチン。
【請求項7】
該バッファーが10mMヒスチジン(pH6.2)である、請求項6に記載のワクチン。
【請求項8】
該非イオン性界面活性剤が、ポリソルベート(Polysorbate)20、ポリソルベート80、ポリソルベート20、NP−40(登録商標)、トリトン(Triton)X−100(登録商標)、トリトンX−114(登録商標)、スパン(Span)85、ブリジ(Brij)35(登録商標)、ブリジ58(登録商標)よりなる群から選ばれる、請求項1に記載のワクチン。
【請求項9】
該界面活性剤が約0.0005%〜約0.5%(wt/vol)の濃度で存在する、請求項8に記載のワクチン。
【請求項10】
a)アルミニウム上に吸収された10〜200mcg/mlの各HPV VLP型(該VLPは、HPV6a、HPV6b、HPV11、HPV16、HPV18およびそれらの混合物よりなる群から選ばれる)、
b)0.32M NaCl、
c)10mMヒスチジンバッファー(pH6.2)、および
d)0.01%ポリソルベート80
を含む、請求項1に記載のワクチン製剤。
【請求項11】
水溶液である、請求項1に記載のワクチン製剤。
【請求項12】
高分子ポリアニオン安定化剤を更に含む、請求項1に記載のワクチン。
【請求項13】
該安定化剤が、カルボキシメチルセルロース(CMC)、ヘパリン、ポリ(Glu)、ポリ(Asp)、ポリ(Glu,Phe)、酸化型グルタチオン、ポリシチジル酸、ポリアデニル酸、RNA、DNAおよび血清アルブミンよりなる群から選ばれる、請求項8に記載のワクチン。
【請求項14】
該安定化剤がCMCである、請求項13に記載のワクチン。
【請求項15】
該安定化剤の濃度が約0.01%〜約0.5%(重量/容積)である、請求項13に記載のワクチン。
【請求項16】
水溶液である、請求項15に記載のワクチン。
【請求項17】
a)アルミニウム上に吸着された10〜200mcg/mlの各HPV VLP型(該VLPは、HPV6a、HPV6b、HPV11、HPV16、HPV18およびそれらの混合物よりなる群から選ばれる)、
b)0.32M NaCl、
c)10mMヒスチジンバッファー(pH6.2)、
d)0.01%ポリソルベート80、および
e)0.05%カルボキシメチルセルロース
を含んでなるHPVワクチン製剤。
【請求項18】
a)アルミニウム上に吸着されたHPVウイルス様粒子(VLP)、
b)塩、
c)高分子ポリアニオン安定化剤、ならびに
d)所望により使用するバッファーおよび/または非イオン性界面活性剤
を含んでなるヒトパピローマウイルス(HPV)ワクチン。
【請求項19】
該塩が、NaCl、KCl、Na2SO4、(NH4)2SO4、リン酸ナトリウムおよびクエン酸ナトリウムよりなる群から選ばれる、請求項18に記載のワクチン。
【請求項20】
該塩が約0.1M〜約0.5Mの濃度で存在する、請求項19に記載のワクチン。
【請求項21】
該塩が0.15M NaClである、請求項20に記載のワクチン。
【請求項22】
該高分子ポリアニオン安定化剤が、カルボキシメチルセルロース(CMC)、ヘパリン、ポリ(Glu)、ポリ(Asp)、ポリ(Glu,Phe)、酸化型グルタチオン、ポリシチジル酸、ポリアデニル酸、RNA、DNAおよび血清アルブミンよりなる群から選ばれる、請求項18に記載のワクチン。
【請求項23】
該安定化剤がカルボキシメチルセルロース(CMC)である、請求項22に記載のワクチン。
【請求項24】
該安定化剤の濃度が約0.001%〜約0.5%である、請求項23に記載のワクチン。
【請求項25】
a)アルミニウム上に吸着された10〜200mcg/mlの各HPV VLP型(該VLPは、HPV6a、HPV6b、HPV11、HPV16、HPV18およびそれらの混合物よりなる群から選ばれる)、
b)0.15M NaCl、
c)0.05%カルボキシメチルセルロース、ならびに
d)所望により使用するバッファーおよび/または非イオン性界面活性剤
を含んでなるワクチン。
【請求項26】
水溶液である、請求項25に記載のワクチン。
【請求項1】
a)アルミニウムアジュバント上に吸着されたHPVウイルス様粒子(VLP)、
b)塩、
c)ワクチン溶液のpH範囲をpH約6.0〜約6.5にするバッファー、および
d)非イオン性界面活性剤
を含んでなるヒトパピローマウイルス(HPV)ワクチン製剤。
【請求項2】
該塩が、NaCl、KCl、Na2SO4、(NH4)2SO4、リン酸ナトリウムおよびクエン酸ナトリウムよりなる群から選ばれる、請求項1に記載のワクチン。
【請求項3】
該塩が約0.10M〜約0.5Mの濃度で存在する、請求項2に記載のワクチン。
【請求項4】
該塩が0.32M NaClである、請求項3に記載のワクチン。
【請求項5】
該バッファーがヒスチジンまたはイミダゾールである、請求項1に記載のワクチン。
【請求項6】
該バッファーが約2mM〜約100mMの濃度で存在する、請求項5に記載のワクチン。
【請求項7】
該バッファーが10mMヒスチジン(pH6.2)である、請求項6に記載のワクチン。
【請求項8】
該非イオン性界面活性剤が、ポリソルベート(Polysorbate)20、ポリソルベート80、ポリソルベート20、NP−40(登録商標)、トリトン(Triton)X−100(登録商標)、トリトンX−114(登録商標)、スパン(Span)85、ブリジ(Brij)35(登録商標)、ブリジ58(登録商標)よりなる群から選ばれる、請求項1に記載のワクチン。
【請求項9】
該界面活性剤が約0.0005%〜約0.5%(wt/vol)の濃度で存在する、請求項8に記載のワクチン。
【請求項10】
a)アルミニウム上に吸収された10〜200mcg/mlの各HPV VLP型(該VLPは、HPV6a、HPV6b、HPV11、HPV16、HPV18およびそれらの混合物よりなる群から選ばれる)、
b)0.32M NaCl、
c)10mMヒスチジンバッファー(pH6.2)、および
d)0.01%ポリソルベート80
を含む、請求項1に記載のワクチン製剤。
【請求項11】
水溶液である、請求項1に記載のワクチン製剤。
【請求項12】
高分子ポリアニオン安定化剤を更に含む、請求項1に記載のワクチン。
【請求項13】
該安定化剤が、カルボキシメチルセルロース(CMC)、ヘパリン、ポリ(Glu)、ポリ(Asp)、ポリ(Glu,Phe)、酸化型グルタチオン、ポリシチジル酸、ポリアデニル酸、RNA、DNAおよび血清アルブミンよりなる群から選ばれる、請求項8に記載のワクチン。
【請求項14】
該安定化剤がCMCである、請求項13に記載のワクチン。
【請求項15】
該安定化剤の濃度が約0.01%〜約0.5%(重量/容積)である、請求項13に記載のワクチン。
【請求項16】
水溶液である、請求項15に記載のワクチン。
【請求項17】
a)アルミニウム上に吸着された10〜200mcg/mlの各HPV VLP型(該VLPは、HPV6a、HPV6b、HPV11、HPV16、HPV18およびそれらの混合物よりなる群から選ばれる)、
b)0.32M NaCl、
c)10mMヒスチジンバッファー(pH6.2)、
d)0.01%ポリソルベート80、および
e)0.05%カルボキシメチルセルロース
を含んでなるHPVワクチン製剤。
【請求項18】
a)アルミニウム上に吸着されたHPVウイルス様粒子(VLP)、
b)塩、
c)高分子ポリアニオン安定化剤、ならびに
d)所望により使用するバッファーおよび/または非イオン性界面活性剤
を含んでなるヒトパピローマウイルス(HPV)ワクチン。
【請求項19】
該塩が、NaCl、KCl、Na2SO4、(NH4)2SO4、リン酸ナトリウムおよびクエン酸ナトリウムよりなる群から選ばれる、請求項18に記載のワクチン。
【請求項20】
該塩が約0.1M〜約0.5Mの濃度で存在する、請求項19に記載のワクチン。
【請求項21】
該塩が0.15M NaClである、請求項20に記載のワクチン。
【請求項22】
該高分子ポリアニオン安定化剤が、カルボキシメチルセルロース(CMC)、ヘパリン、ポリ(Glu)、ポリ(Asp)、ポリ(Glu,Phe)、酸化型グルタチオン、ポリシチジル酸、ポリアデニル酸、RNA、DNAおよび血清アルブミンよりなる群から選ばれる、請求項18に記載のワクチン。
【請求項23】
該安定化剤がカルボキシメチルセルロース(CMC)である、請求項22に記載のワクチン。
【請求項24】
該安定化剤の濃度が約0.001%〜約0.5%である、請求項23に記載のワクチン。
【請求項25】
a)アルミニウム上に吸着された10〜200mcg/mlの各HPV VLP型(該VLPは、HPV6a、HPV6b、HPV11、HPV16、HPV18およびそれらの混合物よりなる群から選ばれる)、
b)0.15M NaCl、
c)0.05%カルボキシメチルセルロース、ならびに
d)所望により使用するバッファーおよび/または非イオン性界面活性剤
を含んでなるワクチン。
【請求項26】
水溶液である、請求項25に記載のワクチン。
【図1A】


【図1B】


【図2】


【図3】


【図4】


【図5】




【図1B】


【図2】


【図3】


【図4】


【図5】


【公開番号】特開2011−225578(P2011−225578A)
【公開日】平成23年11月10日(2011.11.10)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−121539(P2011−121539)
【出願日】平成23年5月31日(2011.5.31)
【分割の表示】特願2000−596960(P2000−596960)の分割
【原出願日】平成12年2月1日(2000.2.1)
【出願人】(390023526)メルク・シャープ・エンド・ドーム・コーポレイション (924)
【Fターム(参考)】
【公開日】平成23年11月10日(2011.11.10)
【国際特許分類】
【出願番号】特願2011−121539(P2011−121539)
【出願日】平成23年5月31日(2011.5.31)
【分割の表示】特願2000−596960(P2000−596960)の分割
【原出願日】平成12年2月1日(2000.2.1)
【出願人】(390023526)メルク・シャープ・エンド・ドーム・コーポレイション (924)
【Fターム(参考)】
[ Back to top ]

