ヒトモノクローナル抗体ヒトCD134(OX40)ならびにその作製および使用方法
本発明は、OX40(CD134)と特異的に結合する、OX40抗体、抗OX40または抗OX40抗体と呼ばれる抗体を提供する。OX40と特異的に結合する本発明抗体には、哺乳類(ヒト、霊長類など)抗OX40抗体、ヒト化抗OX40抗体およびキメラ抗OX40抗体が含まれる。OX40と特異的に結合する本発明抗体および抗体部分配列(フラグメント)には、精製および単離された抗体、ならびにそれらの医薬製剤が含まれ、治療法、スクリーニング方法および検出方法を含む様々な方法に有用である。
Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
OX40細胞外ドメインのアミノ酸配列中のエピトープと特異的に結合する単離または精製された抗体であって、該抗体がヒト抗体、ヒト化抗体またはキメラ抗体を含み、かつ該抗体がOX40アンタゴニスト活性を有する、前記抗体。
【請求項2】
前記OX40アンタゴニスト活性が、サイトカインもしくはインターフェロンの産生、活性化T細胞、エフェクターT細胞、記憶T細胞もしくは制御性T細胞の生存または増殖、抗アポトーシスタンパク質もしくはプロアポトーシスタンパク質の発現を減少または増加させる、請求項1に記載の抗体。
【請求項3】
前記サイトカインがIL-1、IL-2、IL-4、IL-5、IL-6、IL-9、IL-10、IL-14、IL-16、IL-17、IL-23、IL-26、TNF-α、インターフェロンγ、およびGM-CSFから選択される、請求項2に記載の抗体。
【請求項4】
前記抗アポトーシスタンパク質またはプロアポトーシスタンパク質がBcl-xL、Bcl-2、BadおよびBimから選択される、請求項2に記載の抗体。
【請求項5】
前記OX40細胞外ドメインのアミノ酸配列中のエピトープが、
MCVGARRLGRGPCAALLLLGLGLSTVTGLHCVGDTYPSNDRCCHECRPGNGMVSRCSRSQNTVCRPCGPGFYNDVVSSKPCKPCTWCNLRSGSERKQLCTATGDTVCRCRAGTQPLDSYKPGVDCAPCPPGHFSPGDNQACKPWTNCTLAGKHTLQPASNSSDAICEDRDPPATQPQETQGPPARPITVQPTEAWPRTSQGPS(配列番号50)
として記載される配列内に存在する、請求項1に記載の抗体。
【請求項6】
OX40細胞外ドメインのアミノ酸配列中のエピトープと特異的に結合する単離または精製された抗体であって、該抗体が、112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体が結合するアミノ酸配列と結合するヒト抗体、ヒト化抗体またはキメラ抗体を含む、前記抗体。
【請求項7】
112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体の約1〜5000倍の範囲内でOX40結合親和性を有する、単離または精製された抗体。
【請求項8】
112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体よりも高いまたは低いOX40結合親和性を有する、請求項7に記載の抗体。
【請求項9】
112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体の約KD 10-6M〜約KD 10-13Mの範囲内でOX40結合親和性を有する、請求項1、請求項6、請求項7または請求項8のいずれか一項に記載の抗体。
【請求項10】
112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体の結合特異性を有し;あるいはOX40との結合について112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体と競合する、請求項1、請求項6、請求項7または請求項8のいずれか一項に記載の抗体。
【請求項11】
112V8、112Y55およびY131のものと同じエピトープと結合し、OX40リガンド(OX40L)とのOX40の結合を85%以上阻害または阻止する、請求項1に記載の抗体。
【請求項12】
112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される、請求項1に記載の抗体。
【請求項13】
ELISAアッセイによって決定されるように、112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体のOX40との結合を阻害または阻止する、請求項1、請求項6、請求項7または請求項8のいずれか一項に記載の抗体。
【請求項14】
ELISAアッセイによって決定されるように、112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体のOX40との結合の少なくとも50%を阻害する、請求項1、請求項6、請求項7または請求項8のいずれか一項に記載の抗体。
【請求項15】
非T細胞で発現されるOX40と特異的に結合する抗体であって、所望により、該非T細胞がナチュラルキラー細胞、顆粒球、単球、B細胞またはOX40でトランスフェクトされた非T細胞系から選択され、所望により、OX40でトランスフェクトされた該非T細胞系がCHO細胞、L929細胞およびHELA細胞から選択される、請求項1、請求項6、請求項7または請求項8のいずれか一項に記載の抗体。
【請求項16】
配列番号7〜10および配列番号44〜49で示される成熟重鎖または軽鎖可変領域配列、あるいは配列番号7〜10および配列番号44〜49で示される成熟重鎖または軽鎖可変領域配列の部分配列を含む、請求項1に記載の抗体。
【請求項17】
前記部分配列が、Fab、Fab'、F(ab')2、Fv、Fd、単鎖Fv(scFv)、ジスルフィド結合Fv(sdFv)およびVLまたはVHから選択される、請求項16に記載の抗体。
【請求項18】
前記抗体の配列番号7〜10および配列番号44〜49で示される成熟重鎖または軽鎖可変領域配列が、定常領域、相補性決定領域(CDR)またはフレームワーク(FR)領域の内部または外部に1つ以上のアミノ酸置換を有する、請求項16に記載の抗体。
【請求項19】
前記アミノ酸置換が定常領域、相補性決定領域(CDR)またはフレームワーク(FR)領域の内部または外部での保存的アミノ酸置換である、請求項18に記載の抗体。
【請求項20】
前記アミノ酸置換が1〜3個、3〜5個、5〜10個またはそれより多いアミノ酸残基を含む、請求項18に記載の抗体。
【請求項21】
112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体の検出可能な活性を保持する、請求項1、請求項6、請求項7または請求項8のいずれか一項に記載の抗体。
【請求項22】
前記活性がT細胞の増殖または生存、あるいは活性化T細胞、エフェクターT細胞、記憶T細胞または制御性T細胞の数、あるいは活性化T細胞、エフェクターT細胞、記憶T細胞または制御性T細胞の枯渇をモジュレートすることを含む、請求項21に記載の抗体。
【請求項23】
前記活性がOX40シグナル伝達を阻害することを含む、請求項21に記載の抗体。
【請求項24】
前記活性が自己抗原に特異的な自己反応性T細胞の数を低減または除去することを含み、所望により、該自己抗原がミエリン塩基性タンパク質、ミエリン乏突起神経膠細胞糖タンパク質、プロテオリピドタンパク質、コラーゲン、滑膜関節組織抗原、インスリン、グルタミン酸デカルボキシラーゼ、腸抗原、甲状腺抗原、ヒストンタンパク質、筋肉抗原および皮膚抗原から選択される、請求項21に記載の抗体。
【請求項25】
OX40細胞外ドメインのアミノ酸配列中のエピトープと特異的に結合する単離または精製された抗体であって、該抗体が、配列番号7〜10および配列番号44〜49で示される成熟重鎖または軽鎖可変領域配列の配列に対して、80%〜85%、85%〜90%、90%〜95%、96%、97%、98%、99%、またはそれより高い同一性を有する、前記抗体。
【請求項26】
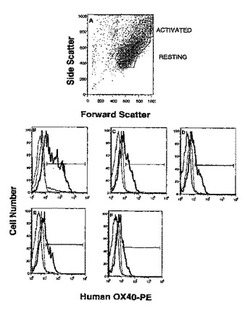
休止T細胞ではなく、活性化ヒトT細胞と特異的に結合する、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項27】
ELISAアッセイによって決定されるように、抗体L106のOX40との結合を阻害または阻止しない、請求項1に記載の抗体。
【請求項28】
OX40リガンドのOX40との結合を阻害または阻止する、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項29】
OX40リガンドの活性化T細胞との結合を阻害または阻止する、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項30】
OX40媒介細胞シグナル伝達をモジュレートしまたはOX40媒介細胞応答をモジュレートする、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項31】
OX40媒介細胞シグナル伝達を阻害または阻止する、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項32】
OX40媒介細胞応答を阻害または阻止する、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項33】
前記OX40媒介細胞応答が、リンパ球増殖、サイトカイン発現、リンパ球生存、NF-kBの活性化、PKB(Akt)活性の維持、またはサバイビンのアップレギュレーションを含む、請求項32に記載の抗体。
【請求項34】
ナチュラルキラー細胞、マクロファージまたは好中球の媒介によりEL4-ヒトOX40発現細胞または活性化ヒトT細胞を溶解し、10μg/mlの抗体で誘導される特異的細胞溶解率(%)が、約15〜75%、25〜65%、または30〜60%、または50〜100%である、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項35】
急性または慢性異種移植片宿主病モデルにおいて移植片対宿主病の症状を軽減、減少または抑制し、あるいは急性または慢性異種移植片宿主病モデルにおいて移植片対宿主病の緩解または退行をもたらす、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項36】
前記異種移植片宿主病モデルが抗IL2Rβ鎖抗体の投与と亜致死線量の照射の後にヒト末梢血単核細胞(PBMC)受けた免疫不全(SCID)マウスを含む、請求項35に記載の抗体。
【請求項37】
移植片対宿主病の症状が、体重減少、脱毛、皮膚発疹、血尿、腹水、および肝臓、腸管、肺、皮膚中への炎症細胞浸潤、および死から選択される、請求項35に記載の抗体。
【請求項38】
肺、皮膚、または腸における炎症を軽減、減少または抑制する、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項39】
自己免疫障害の症状を軽減、減少または抑制する、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項40】
前記自己免疫障害が関節リウマチ、多発性硬化症、糖尿病、クローン病、炎症性腸疾患、潰瘍性大腸炎、セリアック病、乾癬、増殖性ループス腎炎、肉芽腫性筋疾患、および多発性筋炎から選択される、請求項39に記載の抗体。
【請求項41】
前記OX40がヒトである、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項42】
前記OX40が配列:MCVGARRLGRGPCAALLLLGLGLSTVTGLHCVGDTYPSNDRCCHECRPGNGMVSRCSRSQNTVCRPCGPGFYNDVVSSKPCKPCTWCNLRSGSERKQLCTATQDTVCRCRAGTQPLDSYKPGVDCAPCPPGHFSPGDNQACKPWTNCTLAGKHTLQPASNSSDAICEDRDPPATQPQETQGPPARPITVQPTEAWPRTSQGPSTRPVEVPGGRAVAAILGLGLVLGLLGPLAILLALYLLRRDQRLPPDAHKPPGGGSFRTPIQEEQADAHSTLAKI(配列番号49)を含む、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項43】
モノクローナルまたはポリクローナルである、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項44】
IgG1、IgG2、IgG3、IgG4、IgA、IgM、IgE、IgDイソタイプである、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項45】
異種ドメインをさらに含む、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項46】
請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体と、製薬上許容される担体または賦形剤とを含む、医薬組成物。
【請求項47】
配列番号7〜10および配列番号44〜49で示される成熟重鎖または軽鎖可変領域配列の配列、あるいはその部分配列をコードする、単離核酸。
【請求項48】
前記配列が、配列番号3〜6および配列番号38〜43、または配列番号3〜6および配列番号38〜43に関する縮重配列を含む、請求項47に記載の単離核酸。
【請求項49】
発現制御配列をさらに含む、請求項47に記載の単離核酸。
【請求項50】
ベクターをさらに含む、請求項47に記載の単離核酸。
【請求項51】
宿主細胞をさらに含む、請求項47に記載の単離核酸。
【請求項52】
配列番号7〜10および配列番号44〜49で示される重鎖または軽鎖可変領域配列の、1個以上の置換、付加または欠失されたアミノ酸残基を有するアミノ酸配列をコードする核酸であって、該アミノ酸配列がOX40細胞外ドメインのエピトープに対して結合親和性を有する、前記核酸。
【請求項53】
配列番号7〜10および配列番号44〜49で示される重鎖または軽鎖可変領域配列の1個以上の置換、付加または欠失されたアミノ酸残基を有するアミノ酸配列をコードする核酸であって、該アミノ酸配列が112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体の活性を有する、前記核酸。
【請求項54】
112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体と、該抗体による処置を必要とする被験体に該抗体を投与するための使用説明書とを含む、キット。
【請求項55】
112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体としての結合特異性を有する抗体を発現する、単離細胞。
【請求項56】
処置を必要とする被験体において慢性または急性免疫疾患または障害、あるいは慢性または急性免疫疾患または障害の症状を治療するための方法であって、該被験体に、該被験体において該慢性または急性免疫疾患または障害、あるいは該慢性または急性免疫疾患または障害の症状を治療するのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項46に記載の医薬組成物を投与することを含む、前記方法。
【請求項57】
前記被験体が慢性または急性免疫疾患または障害の候補であるかあるいは慢性または急性免疫疾患または障害の治療を受けたものである、請求項56に記載の方法。
【請求項58】
前記処置が、慢性または急性免疫疾患または障害に関連する1種以上の有害な症状または身体的影響の軽減または改善をもたらす、請求項56に記載の方法。
【請求項59】
移植片対宿主病を治療する方法であって、処置を必要とする被験体に、移植片対宿主病を治療するのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項47に記載の医薬組成物を投与することを含む、前記方法。
【請求項60】
前記被験体が移植片対宿主病の候補であるかあるいは移植片対宿主病の治療を受けたものである、請求項59に記載の方法。
【請求項61】
前記処置が移植片対宿主病に関連する1種以上の有害な症状または身体的影響の発症、頻度、期間または重症度を軽減、減少または抑制し、あるいは前記処置が移植片対宿主病の緩解または退行をもたらし、あるいは前記処置が移植片対宿主病の予防をもたらす、請求項59に記載の方法。
【請求項62】
前記移植片対宿主病の症状が体重減少、脱毛、皮膚発疹、血尿、腹水、肝臓、腸管、肺中への炎症細胞浸潤および死から選択される、請求項61に記載の方法。
【請求項63】
前記移植片が骨髄、造血幹細胞、末梢血幹細胞または臍帯血幹細胞を含む、請求項59に記載の方法。
【請求項64】
移植拒絶を治療する方法であって、処置を必要とする被験体に、移植拒絶を治療するのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項46に記載の医薬組成物を投与することを含む、方法。
【請求項65】
前記被験体が移植拒絶の候補であるかあるいは移植拒絶の治療を受けた、請求項64に記載の方法。
【請求項66】
前記処置が移植拒絶に関連する1種以上の有害な症状または身体的影響の発症、頻度、期間または重症度を軽減、減少または抑制し、あるいは前記処置が移植拒絶の緩解または退行をもたらし、あるいは前記処置が移植拒絶の予防をもたらす、請求項64に記載の方法。
【請求項67】
前記移植拒絶の症状が移植物に対する免疫応答または移植細胞もしくは組織の破壊を含む、請求項66に記載の方法。
【請求項68】
前記移植物が腎臓、心臓、肺、皮膚、肝臓または膵臓を含む、請求項64に記載の方法。
【請求項69】
炎症を軽減、減少または抑制する方法であって、処置を必要とする被験体に、炎症の発症、頻度、期間または重症度を軽減、減少または抑制するのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項46に記載の医薬組成物を投与することを含む、前記方法。
【請求項70】
前記炎症が肺、関節、筋肉、皮膚、中枢もしくは末梢神経系、または腸に存在する、請求項69に記載の方法。
【請求項71】
前記被験体が炎症の候補であるかあるいは炎症の治療を受けたものである、請求項69に記載の方法。
【請求項72】
前記処置が炎症に関連する1種以上の有害な症状または身体的影響の発症、頻度、期間または重症度の軽減をもたらす、請求項69に記載の方法。
【請求項73】
自己免疫障害を治療する方法であって、処置を必要とする被験体に、自己免疫障害の症状の発症、頻度、期間または重症度を軽減、減少または抑制するのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項46に記載の医薬組成物を投与することを含む、前記方法。
【請求項74】
前記自己免疫障害が関節リウマチ、多発性硬化症、糖尿病、クローン病、炎症性腸疾患、潰瘍性大腸炎、セリアック病、乾癬、増殖性ループス腎炎、肉芽腫性筋疾患、および多発性筋炎から選択される、請求項73に記載の方法。
【請求項75】
前記被験体が自己免疫障害の候補であるかあるいは自己免疫障害の治療を受けたものである、請求項73に記載の方法。
【請求項76】
処置が自己免疫障害に関連する1種以上の有害な症状または身体的影響の発症、頻度、期間または重症度の軽減、減少または抑制をもたらす、請求項73に記載の方法。
【請求項77】
OX40媒介細胞応答を阻害または抑制する方法であって、OX40媒介細胞応答の阻害または抑制を必要とする被験体に、OX40媒介細胞応答を阻害または抑制するのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項46に記載の医薬組成物を投与することを含む、前記方法。
【請求項78】
前記細胞応答がリンパ球増殖、サイトカイン発現、またはリンパ球生存を含む、請求項77に記載の方法。
【請求項79】
前記被験体がOX40媒介細胞応答の候補であるかあるいはOX40媒介細胞応答の治療を受けたものである、請求項77に記載の方法。
【請求項80】
活性化T細胞とのOX40リガンドの結合を阻害または遮断する方法であって、活性化T細胞とのOX40リガンドの結合の遮断、阻害または阻止を必要とする被験体に、活性化T細胞とのOX40リガンドの結合を阻害または阻止するのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項46に記載の医薬組成物を投与することを含む、前記方法。
【請求項81】
OX40とのOX40リガンドの結合を阻害または遮断する方法であって、OX40とのOX40リガンドの結合の遮断、阻害または阻止を必要とする被験体に、OX40とのOX40リガンドの結合を阻害または阻止するのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項46に記載の医薬組成物を投与することを含む、方法。
【請求項82】
OX40媒介細胞シグナル伝達をモジュレートする方法であって、OX40媒介細胞シグナル伝達のモジュレーションを必要とする被験体に、OX40媒介細胞シグナル伝達をモジュレートするのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項46に記載の医薬組成物を投与することを含む、前記方法。
【請求項83】
活性化T細胞、エフェクターT細胞、記憶T細胞または制御性T細胞の数を低減する方法であって、活性化T細胞、エフェクターT細胞、記憶T細胞または制御性T細胞の数の低減を必要とする被験体に、活性化T細胞、エフェクターT細胞、記憶T細胞または制御性T細胞の数を低減するのに十分な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載のある量の抗体を投与することを含む、前記方法。
【請求項84】
活性化T細胞、エフェクターT細胞、記憶T細胞または制御性T細胞に起因する疾患または障害を治療する方法であって、被験体に、活性化T細胞、エフェクターT細胞、記憶T細胞または制御性T細胞に起因する該疾患または障害の進行を軽減、減少または抑制し、あるいは活性化T細胞、エフェクターT細胞、記憶T細胞または制御性T細胞を枯渇させるのに十分な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載のある量の抗体を投与することを含む、前記方法。
【請求項85】
前記疾患または障害が移植片対宿主病、炎症または自己免疫障害を含む、請求項84に記載の方法。
【請求項86】
前記被験体が哺乳類である、請求項56〜85のいずれか一項に記載の方法。
【請求項87】
前記被験体がヒトである、請求項56〜85のいずれか一項に記載の方法。
【請求項88】
前記抗体が被験体に局所的に、局部的に、または全身的に投与される、請求項56〜85のいずれか一項に記載の方法。
【請求項89】
急性または慢性異種移植片宿主病モデルにおいて血液、脾臓、リンパ節、腸、肝臓、肺、または皮膚中の活性化T細胞の数を減少させる方法であって、該急性または慢性異種移植片宿主病モデルに、血液、脾臓、リンパ節、腸、肝臓、肺、または皮膚中の活性化T細胞の数を減少させるのに十分な量の請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体を投与することを含む、方法。
【請求項90】
OX40アンタゴニスト活性を有するヒトOX40抗体を作製する方法であって、
a)ヒトFc組換えタンパク質とコンジュゲートされたヒトOX40細胞外ドメインまたは活性化ヒトT細胞を、ヒト免疫グロブリンを発現可能な動物に投与すること;
b)該動物をヒトOX40抗体の発現についてスクリーニングすること;
c)ヒトOX40抗体を産生する動物を選択すること;
d)選択された動物から抗体を単離すること;
e)該ヒトOX40抗体がOX40アンタゴニスト活性を有するかどうかを判定すること
を含む、前記方法。
【請求項91】
OX40リガンド(OX40L)とのOX40の結合を阻害または阻止するヒトOX40抗体を作製する方法であって、
a)ヒトFc組換えタンパク質とコンジュゲートされたヒトOX40細胞外ドメインまたは活性化ヒトT細胞を、ヒト免疫グロブリンを発現可能な動物に投与すること;
b)該動物をヒトOX40抗体の発現についてスクリーニングすること;
c)ヒトOX40抗体を産生する動物を選択すること;
d)選択された動物から抗体を単離すること;
e)該ヒトOX40抗体がOX40リガンド(OX40L)とのOX40の結合を阻害または阻止するかどうかを判定すること
を含む、前記方法。
【請求項92】
前記ヒト免疫グロブリンを発現可能な動物がトランスジェニックマウスまたはトランスジェニックウシを含む、請求項90または請求項91のいずれか一項に記載の方法。
【請求項93】
非ヒトトランスジェニック動物であって、
a)112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体と同一である抗体;
b)112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体が結合するOX40細胞外ドメインのアミノ酸配列中のエピトープと結合する抗体;
c)112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体の約1〜5000倍の範囲内でOX40結合親和性を有する抗体;
d)112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体の約KD 10-6M〜約KD 10-12Mの範囲内でOX40結合親和性を有する抗体;
e)112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体の結合特異性を有する抗体;あるいは
f)OX40との結合について112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体と競合する抗体、
を発現する、前記非ヒトトランスジェニック動物。
【請求項1】
OX40細胞外ドメインのアミノ酸配列中のエピトープと特異的に結合する単離または精製された抗体であって、該抗体がヒト抗体、ヒト化抗体またはキメラ抗体を含み、かつ該抗体がOX40アンタゴニスト活性を有する、前記抗体。
【請求項2】
前記OX40アンタゴニスト活性が、サイトカインもしくはインターフェロンの産生、活性化T細胞、エフェクターT細胞、記憶T細胞もしくは制御性T細胞の生存または増殖、抗アポトーシスタンパク質もしくはプロアポトーシスタンパク質の発現を減少または増加させる、請求項1に記載の抗体。
【請求項3】
前記サイトカインがIL-1、IL-2、IL-4、IL-5、IL-6、IL-9、IL-10、IL-14、IL-16、IL-17、IL-23、IL-26、TNF-α、インターフェロンγ、およびGM-CSFから選択される、請求項2に記載の抗体。
【請求項4】
前記抗アポトーシスタンパク質またはプロアポトーシスタンパク質がBcl-xL、Bcl-2、BadおよびBimから選択される、請求項2に記載の抗体。
【請求項5】
前記OX40細胞外ドメインのアミノ酸配列中のエピトープが、
MCVGARRLGRGPCAALLLLGLGLSTVTGLHCVGDTYPSNDRCCHECRPGNGMVSRCSRSQNTVCRPCGPGFYNDVVSSKPCKPCTWCNLRSGSERKQLCTATGDTVCRCRAGTQPLDSYKPGVDCAPCPPGHFSPGDNQACKPWTNCTLAGKHTLQPASNSSDAICEDRDPPATQPQETQGPPARPITVQPTEAWPRTSQGPS(配列番号50)
として記載される配列内に存在する、請求項1に記載の抗体。
【請求項6】
OX40細胞外ドメインのアミノ酸配列中のエピトープと特異的に結合する単離または精製された抗体であって、該抗体が、112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体が結合するアミノ酸配列と結合するヒト抗体、ヒト化抗体またはキメラ抗体を含む、前記抗体。
【請求項7】
112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体の約1〜5000倍の範囲内でOX40結合親和性を有する、単離または精製された抗体。
【請求項8】
112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体よりも高いまたは低いOX40結合親和性を有する、請求項7に記載の抗体。
【請求項9】
112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体の約KD 10-6M〜約KD 10-13Mの範囲内でOX40結合親和性を有する、請求項1、請求項6、請求項7または請求項8のいずれか一項に記載の抗体。
【請求項10】
112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体の結合特異性を有し;あるいはOX40との結合について112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体と競合する、請求項1、請求項6、請求項7または請求項8のいずれか一項に記載の抗体。
【請求項11】
112V8、112Y55およびY131のものと同じエピトープと結合し、OX40リガンド(OX40L)とのOX40の結合を85%以上阻害または阻止する、請求項1に記載の抗体。
【請求項12】
112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される、請求項1に記載の抗体。
【請求項13】
ELISAアッセイによって決定されるように、112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体のOX40との結合を阻害または阻止する、請求項1、請求項6、請求項7または請求項8のいずれか一項に記載の抗体。
【請求項14】
ELISAアッセイによって決定されるように、112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体のOX40との結合の少なくとも50%を阻害する、請求項1、請求項6、請求項7または請求項8のいずれか一項に記載の抗体。
【請求項15】
非T細胞で発現されるOX40と特異的に結合する抗体であって、所望により、該非T細胞がナチュラルキラー細胞、顆粒球、単球、B細胞またはOX40でトランスフェクトされた非T細胞系から選択され、所望により、OX40でトランスフェクトされた該非T細胞系がCHO細胞、L929細胞およびHELA細胞から選択される、請求項1、請求項6、請求項7または請求項8のいずれか一項に記載の抗体。
【請求項16】
配列番号7〜10および配列番号44〜49で示される成熟重鎖または軽鎖可変領域配列、あるいは配列番号7〜10および配列番号44〜49で示される成熟重鎖または軽鎖可変領域配列の部分配列を含む、請求項1に記載の抗体。
【請求項17】
前記部分配列が、Fab、Fab'、F(ab')2、Fv、Fd、単鎖Fv(scFv)、ジスルフィド結合Fv(sdFv)およびVLまたはVHから選択される、請求項16に記載の抗体。
【請求項18】
前記抗体の配列番号7〜10および配列番号44〜49で示される成熟重鎖または軽鎖可変領域配列が、定常領域、相補性決定領域(CDR)またはフレームワーク(FR)領域の内部または外部に1つ以上のアミノ酸置換を有する、請求項16に記載の抗体。
【請求項19】
前記アミノ酸置換が定常領域、相補性決定領域(CDR)またはフレームワーク(FR)領域の内部または外部での保存的アミノ酸置換である、請求項18に記載の抗体。
【請求項20】
前記アミノ酸置換が1〜3個、3〜5個、5〜10個またはそれより多いアミノ酸残基を含む、請求項18に記載の抗体。
【請求項21】
112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体の検出可能な活性を保持する、請求項1、請求項6、請求項7または請求項8のいずれか一項に記載の抗体。
【請求項22】
前記活性がT細胞の増殖または生存、あるいは活性化T細胞、エフェクターT細胞、記憶T細胞または制御性T細胞の数、あるいは活性化T細胞、エフェクターT細胞、記憶T細胞または制御性T細胞の枯渇をモジュレートすることを含む、請求項21に記載の抗体。
【請求項23】
前記活性がOX40シグナル伝達を阻害することを含む、請求項21に記載の抗体。
【請求項24】
前記活性が自己抗原に特異的な自己反応性T細胞の数を低減または除去することを含み、所望により、該自己抗原がミエリン塩基性タンパク質、ミエリン乏突起神経膠細胞糖タンパク質、プロテオリピドタンパク質、コラーゲン、滑膜関節組織抗原、インスリン、グルタミン酸デカルボキシラーゼ、腸抗原、甲状腺抗原、ヒストンタンパク質、筋肉抗原および皮膚抗原から選択される、請求項21に記載の抗体。
【請求項25】
OX40細胞外ドメインのアミノ酸配列中のエピトープと特異的に結合する単離または精製された抗体であって、該抗体が、配列番号7〜10および配列番号44〜49で示される成熟重鎖または軽鎖可変領域配列の配列に対して、80%〜85%、85%〜90%、90%〜95%、96%、97%、98%、99%、またはそれより高い同一性を有する、前記抗体。
【請求項26】
休止T細胞ではなく、活性化ヒトT細胞と特異的に結合する、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項27】
ELISAアッセイによって決定されるように、抗体L106のOX40との結合を阻害または阻止しない、請求項1に記載の抗体。
【請求項28】
OX40リガンドのOX40との結合を阻害または阻止する、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項29】
OX40リガンドの活性化T細胞との結合を阻害または阻止する、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項30】
OX40媒介細胞シグナル伝達をモジュレートしまたはOX40媒介細胞応答をモジュレートする、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項31】
OX40媒介細胞シグナル伝達を阻害または阻止する、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項32】
OX40媒介細胞応答を阻害または阻止する、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項33】
前記OX40媒介細胞応答が、リンパ球増殖、サイトカイン発現、リンパ球生存、NF-kBの活性化、PKB(Akt)活性の維持、またはサバイビンのアップレギュレーションを含む、請求項32に記載の抗体。
【請求項34】
ナチュラルキラー細胞、マクロファージまたは好中球の媒介によりEL4-ヒトOX40発現細胞または活性化ヒトT細胞を溶解し、10μg/mlの抗体で誘導される特異的細胞溶解率(%)が、約15〜75%、25〜65%、または30〜60%、または50〜100%である、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項35】
急性または慢性異種移植片宿主病モデルにおいて移植片対宿主病の症状を軽減、減少または抑制し、あるいは急性または慢性異種移植片宿主病モデルにおいて移植片対宿主病の緩解または退行をもたらす、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項36】
前記異種移植片宿主病モデルが抗IL2Rβ鎖抗体の投与と亜致死線量の照射の後にヒト末梢血単核細胞(PBMC)受けた免疫不全(SCID)マウスを含む、請求項35に記載の抗体。
【請求項37】
移植片対宿主病の症状が、体重減少、脱毛、皮膚発疹、血尿、腹水、および肝臓、腸管、肺、皮膚中への炎症細胞浸潤、および死から選択される、請求項35に記載の抗体。
【請求項38】
肺、皮膚、または腸における炎症を軽減、減少または抑制する、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項39】
自己免疫障害の症状を軽減、減少または抑制する、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項40】
前記自己免疫障害が関節リウマチ、多発性硬化症、糖尿病、クローン病、炎症性腸疾患、潰瘍性大腸炎、セリアック病、乾癬、増殖性ループス腎炎、肉芽腫性筋疾患、および多発性筋炎から選択される、請求項39に記載の抗体。
【請求項41】
前記OX40がヒトである、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項42】
前記OX40が配列:MCVGARRLGRGPCAALLLLGLGLSTVTGLHCVGDTYPSNDRCCHECRPGNGMVSRCSRSQNTVCRPCGPGFYNDVVSSKPCKPCTWCNLRSGSERKQLCTATQDTVCRCRAGTQPLDSYKPGVDCAPCPPGHFSPGDNQACKPWTNCTLAGKHTLQPASNSSDAICEDRDPPATQPQETQGPPARPITVQPTEAWPRTSQGPSTRPVEVPGGRAVAAILGLGLVLGLLGPLAILLALYLLRRDQRLPPDAHKPPGGGSFRTPIQEEQADAHSTLAKI(配列番号49)を含む、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項43】
モノクローナルまたはポリクローナルである、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項44】
IgG1、IgG2、IgG3、IgG4、IgA、IgM、IgE、IgDイソタイプである、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項45】
異種ドメインをさらに含む、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体。
【請求項46】
請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体と、製薬上許容される担体または賦形剤とを含む、医薬組成物。
【請求項47】
配列番号7〜10および配列番号44〜49で示される成熟重鎖または軽鎖可変領域配列の配列、あるいはその部分配列をコードする、単離核酸。
【請求項48】
前記配列が、配列番号3〜6および配列番号38〜43、または配列番号3〜6および配列番号38〜43に関する縮重配列を含む、請求項47に記載の単離核酸。
【請求項49】
発現制御配列をさらに含む、請求項47に記載の単離核酸。
【請求項50】
ベクターをさらに含む、請求項47に記載の単離核酸。
【請求項51】
宿主細胞をさらに含む、請求項47に記載の単離核酸。
【請求項52】
配列番号7〜10および配列番号44〜49で示される重鎖または軽鎖可変領域配列の、1個以上の置換、付加または欠失されたアミノ酸残基を有するアミノ酸配列をコードする核酸であって、該アミノ酸配列がOX40細胞外ドメインのエピトープに対して結合親和性を有する、前記核酸。
【請求項53】
配列番号7〜10および配列番号44〜49で示される重鎖または軽鎖可変領域配列の1個以上の置換、付加または欠失されたアミノ酸残基を有するアミノ酸配列をコードする核酸であって、該アミノ酸配列が112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体の活性を有する、前記核酸。
【請求項54】
112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体と、該抗体による処置を必要とする被験体に該抗体を投与するための使用説明書とを含む、キット。
【請求項55】
112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体としての結合特異性を有する抗体を発現する、単離細胞。
【請求項56】
処置を必要とする被験体において慢性または急性免疫疾患または障害、あるいは慢性または急性免疫疾患または障害の症状を治療するための方法であって、該被験体に、該被験体において該慢性または急性免疫疾患または障害、あるいは該慢性または急性免疫疾患または障害の症状を治療するのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項46に記載の医薬組成物を投与することを含む、前記方法。
【請求項57】
前記被験体が慢性または急性免疫疾患または障害の候補であるかあるいは慢性または急性免疫疾患または障害の治療を受けたものである、請求項56に記載の方法。
【請求項58】
前記処置が、慢性または急性免疫疾患または障害に関連する1種以上の有害な症状または身体的影響の軽減または改善をもたらす、請求項56に記載の方法。
【請求項59】
移植片対宿主病を治療する方法であって、処置を必要とする被験体に、移植片対宿主病を治療するのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項47に記載の医薬組成物を投与することを含む、前記方法。
【請求項60】
前記被験体が移植片対宿主病の候補であるかあるいは移植片対宿主病の治療を受けたものである、請求項59に記載の方法。
【請求項61】
前記処置が移植片対宿主病に関連する1種以上の有害な症状または身体的影響の発症、頻度、期間または重症度を軽減、減少または抑制し、あるいは前記処置が移植片対宿主病の緩解または退行をもたらし、あるいは前記処置が移植片対宿主病の予防をもたらす、請求項59に記載の方法。
【請求項62】
前記移植片対宿主病の症状が体重減少、脱毛、皮膚発疹、血尿、腹水、肝臓、腸管、肺中への炎症細胞浸潤および死から選択される、請求項61に記載の方法。
【請求項63】
前記移植片が骨髄、造血幹細胞、末梢血幹細胞または臍帯血幹細胞を含む、請求項59に記載の方法。
【請求項64】
移植拒絶を治療する方法であって、処置を必要とする被験体に、移植拒絶を治療するのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項46に記載の医薬組成物を投与することを含む、方法。
【請求項65】
前記被験体が移植拒絶の候補であるかあるいは移植拒絶の治療を受けた、請求項64に記載の方法。
【請求項66】
前記処置が移植拒絶に関連する1種以上の有害な症状または身体的影響の発症、頻度、期間または重症度を軽減、減少または抑制し、あるいは前記処置が移植拒絶の緩解または退行をもたらし、あるいは前記処置が移植拒絶の予防をもたらす、請求項64に記載の方法。
【請求項67】
前記移植拒絶の症状が移植物に対する免疫応答または移植細胞もしくは組織の破壊を含む、請求項66に記載の方法。
【請求項68】
前記移植物が腎臓、心臓、肺、皮膚、肝臓または膵臓を含む、請求項64に記載の方法。
【請求項69】
炎症を軽減、減少または抑制する方法であって、処置を必要とする被験体に、炎症の発症、頻度、期間または重症度を軽減、減少または抑制するのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項46に記載の医薬組成物を投与することを含む、前記方法。
【請求項70】
前記炎症が肺、関節、筋肉、皮膚、中枢もしくは末梢神経系、または腸に存在する、請求項69に記載の方法。
【請求項71】
前記被験体が炎症の候補であるかあるいは炎症の治療を受けたものである、請求項69に記載の方法。
【請求項72】
前記処置が炎症に関連する1種以上の有害な症状または身体的影響の発症、頻度、期間または重症度の軽減をもたらす、請求項69に記載の方法。
【請求項73】
自己免疫障害を治療する方法であって、処置を必要とする被験体に、自己免疫障害の症状の発症、頻度、期間または重症度を軽減、減少または抑制するのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項46に記載の医薬組成物を投与することを含む、前記方法。
【請求項74】
前記自己免疫障害が関節リウマチ、多発性硬化症、糖尿病、クローン病、炎症性腸疾患、潰瘍性大腸炎、セリアック病、乾癬、増殖性ループス腎炎、肉芽腫性筋疾患、および多発性筋炎から選択される、請求項73に記載の方法。
【請求項75】
前記被験体が自己免疫障害の候補であるかあるいは自己免疫障害の治療を受けたものである、請求項73に記載の方法。
【請求項76】
処置が自己免疫障害に関連する1種以上の有害な症状または身体的影響の発症、頻度、期間または重症度の軽減、減少または抑制をもたらす、請求項73に記載の方法。
【請求項77】
OX40媒介細胞応答を阻害または抑制する方法であって、OX40媒介細胞応答の阻害または抑制を必要とする被験体に、OX40媒介細胞応答を阻害または抑制するのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項46に記載の医薬組成物を投与することを含む、前記方法。
【請求項78】
前記細胞応答がリンパ球増殖、サイトカイン発現、またはリンパ球生存を含む、請求項77に記載の方法。
【請求項79】
前記被験体がOX40媒介細胞応答の候補であるかあるいはOX40媒介細胞応答の治療を受けたものである、請求項77に記載の方法。
【請求項80】
活性化T細胞とのOX40リガンドの結合を阻害または遮断する方法であって、活性化T細胞とのOX40リガンドの結合の遮断、阻害または阻止を必要とする被験体に、活性化T細胞とのOX40リガンドの結合を阻害または阻止するのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項46に記載の医薬組成物を投与することを含む、前記方法。
【請求項81】
OX40とのOX40リガンドの結合を阻害または遮断する方法であって、OX40とのOX40リガンドの結合の遮断、阻害または阻止を必要とする被験体に、OX40とのOX40リガンドの結合を阻害または阻止するのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項46に記載の医薬組成物を投与することを含む、方法。
【請求項82】
OX40媒介細胞シグナル伝達をモジュレートする方法であって、OX40媒介細胞シグナル伝達のモジュレーションを必要とする被験体に、OX40媒介細胞シグナル伝達をモジュレートするのに有効な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体あるいは請求項46に記載の医薬組成物を投与することを含む、前記方法。
【請求項83】
活性化T細胞、エフェクターT細胞、記憶T細胞または制御性T細胞の数を低減する方法であって、活性化T細胞、エフェクターT細胞、記憶T細胞または制御性T細胞の数の低減を必要とする被験体に、活性化T細胞、エフェクターT細胞、記憶T細胞または制御性T細胞の数を低減するのに十分な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載のある量の抗体を投与することを含む、前記方法。
【請求項84】
活性化T細胞、エフェクターT細胞、記憶T細胞または制御性T細胞に起因する疾患または障害を治療する方法であって、被験体に、活性化T細胞、エフェクターT細胞、記憶T細胞または制御性T細胞に起因する該疾患または障害の進行を軽減、減少または抑制し、あるいは活性化T細胞、エフェクターT細胞、記憶T細胞または制御性T細胞を枯渇させるのに十分な、請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載のある量の抗体を投与することを含む、前記方法。
【請求項85】
前記疾患または障害が移植片対宿主病、炎症または自己免疫障害を含む、請求項84に記載の方法。
【請求項86】
前記被験体が哺乳類である、請求項56〜85のいずれか一項に記載の方法。
【請求項87】
前記被験体がヒトである、請求項56〜85のいずれか一項に記載の方法。
【請求項88】
前記抗体が被験体に局所的に、局部的に、または全身的に投与される、請求項56〜85のいずれか一項に記載の方法。
【請求項89】
急性または慢性異種移植片宿主病モデルにおいて血液、脾臓、リンパ節、腸、肝臓、肺、または皮膚中の活性化T細胞の数を減少させる方法であって、該急性または慢性異種移植片宿主病モデルに、血液、脾臓、リンパ節、腸、肝臓、肺、または皮膚中の活性化T細胞の数を減少させるのに十分な量の請求項1、請求項6、請求項7、請求項8または請求項25のいずれか一項に記載の抗体を投与することを含む、方法。
【請求項90】
OX40アンタゴニスト活性を有するヒトOX40抗体を作製する方法であって、
a)ヒトFc組換えタンパク質とコンジュゲートされたヒトOX40細胞外ドメインまたは活性化ヒトT細胞を、ヒト免疫グロブリンを発現可能な動物に投与すること;
b)該動物をヒトOX40抗体の発現についてスクリーニングすること;
c)ヒトOX40抗体を産生する動物を選択すること;
d)選択された動物から抗体を単離すること;
e)該ヒトOX40抗体がOX40アンタゴニスト活性を有するかどうかを判定すること
を含む、前記方法。
【請求項91】
OX40リガンド(OX40L)とのOX40の結合を阻害または阻止するヒトOX40抗体を作製する方法であって、
a)ヒトFc組換えタンパク質とコンジュゲートされたヒトOX40細胞外ドメインまたは活性化ヒトT細胞を、ヒト免疫グロブリンを発現可能な動物に投与すること;
b)該動物をヒトOX40抗体の発現についてスクリーニングすること;
c)ヒトOX40抗体を産生する動物を選択すること;
d)選択された動物から抗体を単離すること;
e)該ヒトOX40抗体がOX40リガンド(OX40L)とのOX40の結合を阻害または阻止するかどうかを判定すること
を含む、前記方法。
【請求項92】
前記ヒト免疫グロブリンを発現可能な動物がトランスジェニックマウスまたはトランスジェニックウシを含む、請求項90または請求項91のいずれか一項に記載の方法。
【請求項93】
非ヒトトランスジェニック動物であって、
a)112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体と同一である抗体;
b)112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体が結合するOX40細胞外ドメインのアミノ酸配列中のエピトープと結合する抗体;
c)112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体の約1〜5000倍の範囲内でOX40結合親和性を有する抗体;
d)112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体の約KD 10-6M〜約KD 10-12Mの範囲内でOX40結合親和性を有する抗体;
e)112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体の結合特異性を有する抗体;あるいは
f)OX40との結合について112F32、112V8、112Y131、112Y55、または112Z5として示されるハイブリドーマ細胞系によって産生される抗体と競合する抗体、
を発現する、前記非ヒトトランスジェニック動物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9A−B】


【図9C】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9A−B】


【図9C】


【図10】


【公表番号】特表2009−518005(P2009−518005A)
【公表日】平成21年5月7日(2009.5.7)
【国際特許分類】
【出願番号】特願2008−542473(P2008−542473)
【出願日】平成18年11月27日(2006.11.27)
【国際出願番号】PCT/US2006/045522
【国際公開番号】WO2007/062245
【国際公開日】平成19年5月31日(2007.5.31)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.フロッピー
【出願人】(000001029)協和発酵キリン株式会社 (276)
【出願人】(508154184)ラ ホヤ インスティチュート フォー アラジー アンド イムノロジー (1)
【Fターム(参考)】
【公表日】平成21年5月7日(2009.5.7)
【国際特許分類】
【出願日】平成18年11月27日(2006.11.27)
【国際出願番号】PCT/US2006/045522
【国際公開番号】WO2007/062245
【国際公開日】平成19年5月31日(2007.5.31)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.フロッピー
【出願人】(000001029)協和発酵キリン株式会社 (276)
【出願人】(508154184)ラ ホヤ インスティチュート フォー アラジー アンド イムノロジー (1)
【Fターム(参考)】
[ Back to top ]

