ヒト型化抗EGFR抗体リジン置換可変領域断片及びその利用
【課題】標的細胞に対する結合活性(親和性)を十分に保持し、更に、様々な化学修飾を部位特異的にかつ均一に達成することができるような、ヒト型化抗EGFR抗体リジン置換L鎖又は同H鎖可変領域断片、又はそれらから構成される一本鎖抗体等の提供。
【解決手段】特定のアミノ酸配列から成る抗ヒト上皮細胞成長因子受容体1(Her1)抗体528のL鎖又はH鎖のヒト型化可変領域において、全てのリジン残基又は特定の一つの部位のリジン残基以外の全てのリジン残基が他のアミノ酸に置換されて成る、ヒト型化抗EGFR抗体リジン置換L鎖可変領域断片。
【解決手段】特定のアミノ酸配列から成る抗ヒト上皮細胞成長因子受容体1(Her1)抗体528のL鎖又はH鎖のヒト型化可変領域において、全てのリジン残基又は特定の一つの部位のリジン残基以外の全てのリジン残基が他のアミノ酸に置換されて成る、ヒト型化抗EGFR抗体リジン置換L鎖可変領域断片。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗ヒト上皮細胞成長因子受容体1抗体528ヒト型化可変領域の(H鎖又はL鎖)において、全てのリジン残基、又は、任意に選択される特定の一つの部位のリジン残基以外の全てのリジン残基を他の適当なアミノ酸に置換して得られる「ヒト型化抗EGFR抗体リジン置換可変領域断片」及びその利用等に関する。
【背景技術】
【0002】
がん(悪性腫瘍)及びリウマチ等に対する安全な治療法として、近年、免疫療法が用いられている。がんに対する免疫療法では、がんに対して特異的に細胞傷害活性を示す抗体が使用される。このような抗体から成る抗体医薬は、副作用の少ない、安心安全で治療効果の高いことが認められる一方、確立された動物細胞を用いて製造する必要があるためにコスト高が問題となっている。
【0003】
このため、ある抗体のVHとVLのドメインが一本のポリペプチド鎖中にある一本鎖抗体(scFv)のような低分子抗体の作製が世界的な潮流となっている。このような低分子抗体は安価な大腸菌でも製造可能であるが、分子量の低下によって体内半減期が低下し、薬効持続時間が減少することが懸念される。また、IgGの様な完全抗体は、標的抗原に対し多価で結合するのに対し、通常、低分子抗体は結合価が一価となるため、親和性の低下も問題となっている。更に、抗体医薬の主な作用機序はFc領域を介した抗体依存性細胞傷害活性(ADCC)ともされているため、Fc領域を有さないscFvは効果の低さが懸念される。尚、scFvについては、非特許文献1を参照することができる。
【0004】
このため、がん細胞と免疫細胞を架橋するよう特異付けた低分子二重特異性抗体などが開発されてきており、BiTEと呼ばれる、2つのscFv同士を連結させたtandem scFv型の低分子二重特異性抗体が唯一臨床治験に進んでいる(Science. 2008 Aug 15;321(5891):974-7.)。しかしながらこのBiTEは、動物細胞を用いて調製しているため、収量や製造コストが問題となっている。BiTEのようなtandem scFv型の低分子二重特異性抗体は、低分子であるものの大腸菌可溶性画からの調製は困難であるとの報告もあり(J Mol Biol. 2003 330(1):99-111.)、事実BiTEは動物細胞を用いて調製されている。
【0005】
多重特異性抗体のうちの一つである二重特異性抗体(Bispecific Antibody:BsAb)は2つの異なる抗原に対して特異的に結合することが可能であるため、この特性を生かして特異的な抗腫瘍効果を持った治療薬としての利用法が可能であるとして、その研究が盛んに行われている。ダイアボディ(diabody:Db)とはこのような二重特異性抗体の最小単位であり、それぞれ同じ親抗体由来の重鎖(H鎖)の可変領域(V領域)(「VH」と表わされる)VHと軽鎖(L鎖)の可変領域(V領域)(「VL」と表わされる)VLとが互いに非共有結合によりヘテロ二量体を形成するという性質を利用し考案されたものである(非特許文献2)。
【0006】
このようなダイアボディ型二重特異性抗体の特徴としては、低分子(分子量約60,000)であることによる低免疫原性及び腫瘍組織への高浸透性、更には、例えば、大腸菌等の微生物を利用した安価な大量製造が可能であること、又、遺伝子工学を利用した機能改変が容易であることを挙げることができる。
【0007】
本発明者等は、これまでに、抗ヒト上皮細胞成長因子受容体1(Her1)抗体528及び抗CD3抗体OKT3を用いて作製したダイアボディ型二重特異性抗体(Ex3)及び該抗体をヒト型化したダイアボディ型二重特異性抗体(hExh3)は極めて強力な抗腫瘍効果を有していることを見出している(特許文献1)。更に、他の抗体を用いて作製したダイアボディ型二重特異性抗体との比較により、該が上記の優れた効果を発揮する為には、ヒト型化528抗体及びヒト型化OKT3抗体のヒト型化可変領域自身の構造的安定性、及びこれらの組み合わせが非常に重要であることが推測された。
【0008】
更に、本発明者等はヒト型化ダイアボディ型二重特異性抗体等に基づき多様な構造を有する高機能性二重特異性抗体を開発している(特許文献2)。
【0009】
又、ダイアボディ型二重特異性抗体以外の二重特異性抗体の調製等は、以下の非特許文献3及び非特許文献4に記載されている。
【0010】
抗ヒト上皮細胞成長因子受容体1(Her1)抗体528はがん細胞の成長阻害効果を有する。しかしながら、既に記載したように、EGFRへの結合価が一価の場合、抗原との親和性が低く、その効果がほとんど見られないことが知られている。実際にヒト型化528の一本鎖抗体(scFv)にはがん細胞成長阻害効果が認められなかった。scFvが有するこのような欠点を克服するために、既にリンカーの改変によるscFvの多量体化が試みられてきた(非特許文献5)。近年では、リンパ腫にアポトーシスを誘導するscFv二量体なども報告されている(非特許文献6)。しかしながら、固形がんやEGFR陽性がん腫に対して、成長阻害効果を発揮するscFv多量体の例は報告されていない。
【0011】
本発明者は、抗ヒト上皮細胞成長因子受容体1(Her1)抗体528に基づく一本鎖抗体(scFv)から構成される多量体化低分子抗体を開発し、これらは優れたがん細胞成長阻害効果を有することが示された(特許文献3)。
【0012】
低分子抗体が抱える体内半減期の低下及び親和性の低下等の問題を解決する他の方法として、従来から、ポリエチレングリコール(PEG)等の高分子ポリマーの付加、薬効の向上に向けては、抗がん剤などによる化学修飾が行われてきた。抗体のような生理活性を有するタンパク質の化学修飾のために、リジン残基を変異させることが従来から行われている。例えば、ファージ提示法を用いてTNFαのリジン置換に成功した例などがある(非特許文献7)。しかしながらその手順は必ずしも簡便ではない。一方、抗体断片は生殖配列データベースを利用することで、活性を保持したまま比較的簡便にリジンを置換することができる(非特許文献8)。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】特許第3803790号明細書
【特許文献2】国際公開第WO2007/108152号パンフレット
【特許文献3】特開2010−119303号公報
【非特許文献】
【0014】
【非特許文献1】Rosenburg and Moore (Ed.), “The Pharmacology of Monoclonal Antibodies", Vol. 113, Springer-Verlag, New York, pp.269-315 (1994)
【非特許文献2】Hollinger, et al., Proc. Natl. Acad. Sci. USA 90, 6444-6448, 1993
【非特許文献3】Alt M, et. al. Novel tetravalent and bispecific IgG-like antibody molecules combining single-chain diabodies with the immunoglobulin gamma1 Fc or CH3 region. FEBS Lett., 454, 90-4. (1999)
【非特許文献4】Lu D, et. al. A fully human recombinant IgG-like bispecific antibody to both the epidermal growth factor receptor and the insulin-like growth factor receptor for enhanced antitumor activity. J Biol Chem., 280, 19665-72. (2005)
【非特許文献5】Biomol Eng. 2001 18(3):95-108
【非特許文献6】Biochem Biophys Res Commun. 2004 315(4):912-8
【非特許文献7】Nat Biotechnol. 2003;21(5):546-52.
【非特許文献8】Bioconjug Chem. 2003;14(2):480-7
【発明の開示】
【発明が解決しようとする課題】
【0015】
上記のようにタンパク質の化学修飾の標的残基として最も汎用的に用いられるリジンは、通常タンパク質表面に複数存在するため、均一な修飾が困難である他に大幅に活性が低下する場合もある。更に、抗体分子の修飾では、標的抗原と直接相互作用するCDR中のリジンを置換した場合には活性の低下や消失が懸念される。実際に、特定の一つの部位のリジン残基のみを残してその他のリジン残基を全て他のアミノ酸に置換してし、PEG化等の部位特異的化学修飾に成功した例はこれまでにない。
【0016】
従って、本発明の主な目的は、上記の課題を解決すべく、特定のリジン残基又はN末端アミノ基のみを部位特異的修飾できるような抗体の可変領域断片等を提供することを目的とする。
【課題を解決するための手段】
【0017】
本発明者は上記課題を解決すべく鋭意検討の結果、抗ヒト上皮細胞成長因子受容体1抗体528のヒト型化可変領域(CDR内も含む)のリジン残基を、公知の生殖配列データベースに基づき全て他のアミノ酸に置換したところ、若干の親和性の低下はみられたものの十分に結合活性を保持しており、更に、分子置換法により決定したヒト化型528抗体の立体構造を考慮しつつ、528ヒト型化可変領域のH鎖又はL鎖において1ヶ所のみを本来のリジンに再置換したところ、機能を保持していることが確認された。そこで、実際に化学修飾の例としてPEG化を行った結果、期待通りの部位特異的修飾、即ち、リジンに再置換された特定の位置に1分子だけPEGを付加させることに成功し、本発明を完成した。
【0018】
即ち、本発明は以下に示す各態様に係るものである。
[態様1]
配列番号2で示されるアミノ酸配列から成る抗ヒト上皮細胞成長因子受容体1(Her1)抗体528のL鎖のヒト型化可変領域(5L)において、全てのリジン残基又は特定の一つの部位のリジン残基以外の全てのリジン残基が他のアミノ酸に置換されて成る、ヒト型化抗EGFR抗体リジン置換L鎖可変領域断片。
[態様2]
5Lにおける108番目のリジン残基以外の全てのリジン残基が他のアミノ酸残基に置換されていることを特徴とする、態様1記載のリジン置換L鎖可変領域断片。
[態様3]
5Lにおける以下の置換の少なくとも一つを含む、態様1または2記載のリジン置換L鎖可変領域断片:
44番目のリジン残基がアルギニン残基、
55番目のリジン残基がグルタミン残基、
79番目のリジン残基がトレオニン残基、
108番目のリジン残基がグルタミン酸残基、又は、
112番目のリジン残基がグルタミン酸残基。
[態様4]
5Lにおける以下の置換を含む、態様1記載のリジン置換L鎖可変領域断片:
44番目のリジン残基がアルギニン残基、
55番目のリジン残基がグルタミン残基、
79番目のリジン残基がトレオニン残基、
108番目のリジン残基がグルタミン酸残基、及び
112番目のリジン残基がグルタミン酸残基。
[態様5]
配列番号4で示されるアミノ酸配列から成る抗ヒト上皮細胞成長因子受容体1(Her1)抗体528のH鎖のヒト型化可変領域(5H)において、全てのリジン残基又は特定の一つのリジン残基以外の全てのリジン残基が他のアミノ酸に置換されて成る、ヒト型化抗EGFR抗体リジン置換H鎖可変領域断片。
[態様6]
5Hにおける19番目のリジン残基以外のリジン残基が他のアミノ酸残基に置換されていることを特徴とする、態様5記載のリジン置換H鎖可変領域断片。
[態様7]
5Hにおける以下の置換の少なくとも一つを含む、態様5または6記載のリジン置換H鎖可変領域断片:
12番目のリジン残基がアラニン残基、
13番目のリジン残基がグルタミン酸残基、
19番目のリジン残基がグルタミン残基、
23番目のリジン残基がアラニン残基、
63番目のリジン残基がグルタミン酸残基、又は、
65番のリジン残基がグルタミン残基。
[態様8]
5Hにおける以下の置換を含む、態様5記載のリジン置換H鎖可変領域断片:
12番目のリジン残基がアラニン残基、
13番目のリジン残基がグルタミン酸残基、
19番目のリジン残基がグルタミン残基、
23番目のリジン残基がアラニン残基、
63番目のリジン残基がグルタミン酸残基、及び、
65番のリジン残基がグルタミン残基。
[態様9]
一つのリジン残基又はN末端アミノ基が部位特異的に修飾されている、態様1〜8のいずれか一項に記載のリジン置換L鎖可変領域断片又はリジン置換H鎖可変領域断片。
[態様10]
ポリエチレングリコールによって部位特異的に修飾されている態様9記載のリジン置換L鎖可変領域断片又はリジン置換H鎖可変領域断片。
[態様11]
態様1〜4、9又は10記載のリジン置換L鎖可変領域断片及び態様5〜8、9又は10記載のリジン置換H鎖可変領域断片を構成要素として含む抗体分子。
[態様12]IgG型抗体分子、一本鎖抗体(scFv)、一本鎖抗体の二量体、二重特異性抗体、ダイアボディ型二重特異性抗体、高機能性二重特異性抗体又は多量体化低分子抗体から成る群から選択される、態様11記載の抗体分子。
[態様13]
リジン置換L鎖可変領域断片又はリジン置換H鎖可変領域断片に含まれる一つのリジン残基が架橋されてなる、態様12記載の二量体。
[態様14]
抗CD3抗体OKT3のL鎖のヒト型化可変領域(OL)、及び、抗CD3抗体OKT3のH鎖のヒト型化可変領域(OH)が、夫々、配列番号6及び配列番号8で示されるアミノ酸配列から成る、態様11記載のダイアボディ型二重特異性抗体。
[態様15]態様11〜14のいずれか一項に記載の抗体分子を構成する一本鎖ポリペプチド。
[態様16]態様1〜8のいずれか一項に記載のリジン置換可変領域断片、又は、態様15に記載の一本鎖ポリペプチドをコードする核酸分子。
[態様17]態様11〜14のいずれか一項に記載の抗体分子を構成する2種類の一本鎖ポリペプチドを共にコードする核酸分子。
[態様18]態様16又は17記載の核酸分子を含有する複製可能なクローニングベクター又は発現ベクター。
[態様19]共発現ベクターである、態様18記載のベクター。
[態様20]プラスミドベクターである、態様18又は19記載のベクター。
[態様21]態様19ないし20のいずれか一項に記載のベクターで形質転換された宿主細胞。
[態様22]態様11又は12記載の抗体分子の製造方法であって、態様21に記載の宿主細胞を培養し、該抗体分子を構成する2種類の一本鎖ポリペプチドを発現させ、該ポリペプチドを回収・精製し、該2種類の一本鎖ポリペプチドを会合させ、形成された抗体分子を分離・回収することから成る、前記方法。
[態様23]原核細胞が大腸菌であり、2種類の一本鎖ポリペプチドを大腸菌の培養培地上清、ペリズマ画分、菌体内可溶性画分、又は、菌体内不溶性画分から回収する、態様22記載の製造方法。
[態様24]態様14記載の抗体分子の製造方法であって、態様19記載の共発現ベクターで形質転換された宿主細胞を培養し該抗体分子を構成する2種類の一本鎖ポリペプチドを発現させ、該形質転換菌内でダイアボディ型二重特異性抗体を形成せしめ、形成された二重特異性抗体を分離・回収することから成る、前記方法。
[態様25] 態様11〜14のいずれか一項に記載の抗体分子を有効成分として含有することを特徴とする医薬組成物。
[態様26]腫瘍細胞を排除する、殺傷する、傷害する及び/又は減少せしめるためのものであることを特徴とする態様25記載の医薬組成物。
【発明の効果】
【0019】
本発明のヒト型化抗EGFR抗体リジン置換L鎖又は同H鎖可変領域断片、又はそれらから構成される一本鎖抗体は、そこに含まれるリジン残基を特定の1箇所に制限することによっても標的細胞に対する結合活性(親和性)を十分に保持していることが確認された。この結果、様々な化学修飾を部位特異的にかつ均一に達成することができた。
ヒト型化抗EGFR抗体リジン置換L鎖可変領域断片及び同H鎖可変領域断片から構成される一本鎖抗体に残るリジン残基を介して化学架橋剤を用いて連結させて得られた二量体には期待通りの増殖抑制効果がみられ、架橋剤の長さに応じた効果の増強もみられた。
更に、ポリエチレングリコールで特定のリジン残基のみを部位特異的に化学修飾した可変領域断片を含むヒト型化ダイアボディ型二重特異性抗体が元のヒト型化ダイアボディ型二重特異性抗体と同様の抗原結合活性を有していることが確認された。
【図面の簡単な説明】
【0020】
【図1】フローサイトメトリーによる一本鎖抗体(リジン置換scFv)のA431細胞に対する結合活性の結果を示す。
【図2】リジン置換scFvのPEG化を示す。
【図3】リジン置換scFvの二量体化の手法を示す。
【図4】リジン置換scFvの二量体の細胞増殖阻害活性を示す。
【図5】PEG化ダイアボディ型二重特異性抗体の調製の様子を示す。
【図6】フローサイトメトリーによるPEG化ダイアボディ型二重特異性抗体の結合活性を示す
【発明を実施するための形態】
【0021】
本発明のヒト型化抗EGFR抗体リジン置換L鎖可変領域断片又はヒト型化抗EGFR抗体リジン置換H鎖可変領域断片(この両者をまとめて、「リジン置換可変領域断片」ともいう)は、夫々、配列番号2又は配列番号4で示されるアミノ酸配列から成る抗ヒト上皮細胞成長因子受容体1(Her1)抗体528のL鎖のヒト型化可変領域(5L)又はH鎖のヒト型化可変領域(5H)において、全てのリジン残基、又は、任意に選択される特定の一つの部位のリジン残基以外の全てのリジン残基を他のアミノ酸が置換されて成ることを特徴とする。
【0022】
5Lには、配列番号2で示されるアミノ酸配列において、44、55、79、108、及び112番目の5ヶ所所にリジン残基があり、その中の任意の特定の一つのリジン残基を残すことが出来る。例えば、実施例では5Lの108番目のリジン残基以外のリジン残基が他のアミノ酸残基に置換されている。
【0023】
一方、5Hには、配列番号4で示されるアミノ酸配列において、12、13、19、23,63及び65番目の6ヶ所所にリジン残基があり、その中の任意の特定の一つの部位のリジン残基を残すことが出来る。例えば、実施例では5Hの19番目のリジン残基以外のリジン残基が他のアミノ酸残基に置換されている。
【0024】
リジン残基と置換される他のアミノ酸残基の種類に特に制限はない。例えば、ヒト型化抗体528の結晶構造を参考にし、あるいは、当業者に公知の抗体の生殖配列データベース(非特許文献8)を利用して各々の位置での存在確率の高いアミノ酸を選択し、部位特異的変異導入法を用いてこれらのアミノ酸への置換を行って本願発明のH鎖可変領域断片及びL鎖可変領域断片を作製することができる、更に、それらから成る一本鎖抗体(scFv)を当業者に公知の方法を用いて調製し、その後、例えば、ヒト扁平上皮がん細胞株であるA431細胞(ATCC No.CRL-1555)のようなEGFRを発現している適当な細胞に対する結合活性(親和性)を測定することによって、リジン残基置換前の一本鎖抗体(h528scFv)の活性が実質的に保持されているものを容易に選択することが出来る。
【0025】
例えば、5Lにおける各リジン残基の置換の具体例として以下の置換例を挙げることが出来る:
44番目のリジン残基がアルギニン残基、
55番目のリジン残基がグルタミン残基、
79番目のリジン残基がトレオニン残基、
108番目のリジン残基がグルタミン酸残基、又は、
112番目のリジン残基がグルタミン酸残基。
【0026】
又は、5Hにおける各リジン残基の置換の具体例として以下の置換例を挙げることが出来る:
5Hにおける以下の置換:
12番目のリジン残基がアラニン残基、
13番目のリジン残基がグルタミン酸残基、
19番目のリジン残基がグルタミン残基、
23番目のリジン残基がアラニン残基、
63番目のリジン残基がグルタミン酸残基、又は、
65番のリジン残基がグルタミン残基。
【0027】
本発明のリジン置換可変領域断片は上記の全てのリジン残基、又は、任意に選択される特定の一つの部位のリジン残基以外の全てのリジン残基が他のアミノ酸と置換されているので、適当な条件下で、係る特定の一つのリジン残基又はN末端アミノ基を部位特異的に修飾することができる。このような部位特異的修飾を利用して、例えば、抗体の体内半減期の低下及び親和性の低下等を防ぐ機能を有するポリエチレングリコール(PEG化)又は適当な薬剤(抗癌剤、放射性同位体等)を本発明のリジン置換可変領域断片の特定の一つのリジン残基又はN末端アミノ基に結合させることが可能となる。
【0028】
本発明のリジン置換可変領域断片を構成要素として、様々な型の抗体分子を作製することが出来る。この例として、例えば、通常のIgG型抗体分子、一本鎖抗体(scFv)、一本鎖抗体の二量体、二重特異性抗体、ダイアボディ型二重特異性抗体(特許文献1)、高機能性二重特異性抗体(特許文献2)又は多量体化低分子抗体(特許文献3)を挙げることが出来る。
【0029】
本発明のリジン置換L鎖可変領域断片及びリジン置換H鎖可変領域断片を含む一本鎖抗体は従来技術を用いて容易に作製することが出来る。以下の実施例で示されるように、従来技術からは予想外なことに、この一本鎖抗体(特定の一つの位置のみにリジン残基を含む)はリジン残基置換前の一本鎖抗体(h528scFv)の活性を実質的に保持していることが確認された。
【0030】
このような一本鎖抗体に含まれる特定の一つの部位のリジン残基又はN末端アミノ基を介して互いに架橋することによって二量体等の多量体を調製することが出来る。例えば、二量体において特定の一つのリジン残基はL鎖又はH鎖のいずれに存在させることも出来る。二量体を構成する各一本鎖抗体に含まれる一つのリジン残基の部位がH鎖にある場合(HK)には「HK−HK」、共にL鎖にある場合(LK)には「LK−LK」という構造のホモ二量体となる。一方の一本鎖抗体に含まれる一つのリジン残基の部位がL鎖にあり、もう一方の一本鎖抗体に含まれる一つのリジン残基の部位がH鎖にある場合には、LKとHKとから成る二量体となる。
【0031】
更に、本発明の一本鎖抗体を他の抗原特異性を有する一本鎖抗体と架橋させることによって、二重特異性抗体を容易に作製することも出来る。
【0032】
架橋反応は、例えば、SANH(succinimidyl 4-hydrazinonicotinate acetone hydrazone)及びSFB(succinimidyl 4-formylbenzoate) 等の当業者に公知の適当な架橋試薬を用いて行うことができる。架橋距離の異なる架橋試薬を用いて各一本鎖抗体の間の距離を自由に調整することが出来る。更に、分岐数の多い化学架橋剤を用いることで、高多価の分子を容易に作製することも出来る。
【0033】
ヒト型化高機能性二重特異性抗体(BsAb)に含まれる様々な型の具体的な構造及びその製造方法は国際公開第WO2007/108152号パンフレット(特許文献2)に詳細に記載されている。本発明のBsAbに含まれる定常領域又はFc領域はヒト抗体に由来するものである限り特に制限はない。例えば、CLはκまたはλ鎖の何れに由来するものでも良い。又、Fc領域又はH鎖定常領域は、通常、IgGのγ鎖に由来するものが使用される。CH1、CH2及びCH3、並びにCLの一例として、夫々、特許文献2に開示された配列番号29及び配列番号30、配列番号33に示したアミノ酸配列を有するものを挙げることができる。
【0034】
このBsAbを構成する一本鎖ポリペプチドに含まれる、PreSission配列、ヒンジ領域、ペプチドリンカー、シグナルペプチド等のアミノ酸配列の代表例として、特許文献2の図3−3及び図3−4に開示された配列を挙げることが出来る。尚、PreSission配列はプロテアーゼ切断部位を含む配列である。使用するプロテアーゼの種類に特に制限はなく、例えば、Thrombin及びFactor Xa等の当業者に公知の酵素を使用することが出来、それに応じて、プロテアーゼ切断部位を含むアミノ酸配列を適宜選択することが出来る。
【0035】
又、ヒト型化ダイアボディ型二重特異性抗体及び上記高機能性二重特異性抗体等を構成する各ポリペプチドにおいて、L鎖可変領域がH鎖可変領域のN末側にあること(LH型)を特徴とする各種の抗体(抗体分子)も本発明に含まれる。ヒト型化ダイアボディ型二重特異性抗体においては、本発明の各リジン置換可変領域断片と同様に、生殖配列データベースを基に抗CD3抗体のH鎖及びL鎖可変領域断片の完全リジン置換体(含まれる全てのリジン残基を他のアミノ酸残基に置換したもの)を作製し、本発明の各リジン置換可変領域断片と組み合わせて各種の二重特異性抗体を構築することが出来る。
【0036】
更に、上記の一本鎖抗体(scFv)から構成される多量体化低分子抗体は、特許文献3に詳細に記載されている。該多量体化低分子抗体は、例えば、2〜4個の該一本鎖抗体が会合して成り、更に、各一本鎖抗体においてN末端側にあるリジン置換可変領域断片のC末端の1ないし数個のアミノ酸、又は、C末端側にあるリジン置換可変領域断片のN末端の1ないし数個のアミノ酸が除去されていても良い。従って、本発明のリジン置換L鎖可変領域断片又はリジン置換H鎖可変領域断片を含む一本鎖抗体も特許文献3に記載の多量体化低分子抗体の構成要素として使用することが出来る。
【0037】
更に、ポリエチレングリコール等によって部位特異的に修飾されている本発明のリジン置換可変領域断片を構成要素として含む上記の各抗体分子は、本発明のリジン置換可変領域断片を構成要素として含む抗体分子を作製した後に、PEG化等の当業者に公知の適当な化学的修飾方法で容易に調製することが出来る。
【0038】
抗EGFR抗体産生マウスB細胞ハイブリドーマ528は、東北大学加齢医学研究所付属医用細胞資源センターに寄託されている(ID:TKG0555)。更に、528抗体を産生するハイブリドーマはアメリカン・タイプ・カルチャー・コレクション(ATCC)においてATCC No.HB-8509 として保管されており、かかる寄託機関からも容易に入手可能である。
【0039】
一方、抗CD3抗体OKT3も東北大学加齢医学研究所付属医用細胞資源センターに寄託されている(ID:TKG0235)。又、OKT3抗体を産生するハイブリドーマはアメリカン・タイプ・カルチャー・コレクション(ATCC)においてATCC No.CRL-8001 として保管されており、かかる寄託機関からも容易に入手可能である。
【0040】
これらを用いて、当業者に公知の方法によってcDNAを調製することが出来る。例えば、ISOGEN(ニッポンジーン社)を用いmRNAを抽出、First-Strand cDNA Synthesis Kit(Amersham Biosciences社)によりcDNAを調製し、参考論文(Krebber, A. et al. Reliable cloning of functional antibody variable domains from hybridomas and spleen cell repertoires employing a reengineered phage display system. J Immunol Methods 201, 35-55. (1997))に基づき合成したクローニングプライマーを用いPCRを行いこれら各抗体のH鎖及びL鎖の可変領域の配列を決定することができる。
【0041】
本発明のリジン置換可変領域断片又は抗体分子を構成する一本鎖ポリペプチドに含まれる可変領域の「ヒト型化」とは、ヒト免疫グロブリン(レシピエント抗体)のヒト型化可変領域における相補性決定領域 (complementarity-determining region; CDR)の残基の少なくとも一部において、マウス、ラット、またはウサギといったような非ヒト動物(ドナー抗体)であり且つ所望の特異性、親和性、および能力を有するCDR に由来する残基によって置換されている抗体を意味する。いくつかの場合において、ヒト免疫グロブリンのFvフレームワーク(FR)残基が対応する非ヒト残基によって置換される場合もある。さらに、ヒト型化抗体は、レシピエント抗体および導入されたCDR またはフレームワーク配列のいずれにおいても見出されない残基を含み得る。これらの改変は、抗体の性能をさらに優れたものあるいは最適なものとするために行われる。更に詳しくは、Jones et al., Nature 321, 522-525 (1986); Reichmann et al., Nature 332, 323-329 (1988);EP-B-239400; Presta, Curr. Op. Struct. Biol. 2, 593-596(1992); およびEP-B-451216 を参照することができる。
【0042】
このような抗体のヒト型化可変領域のヒト型化は当業者に公知の方法に従って実施することが出来る。例えば、レシピエント抗体及びドナー抗体の3次元イムノグロブリンモデルを使用し、種々の概念的ヒト型化生成物を分析する工程により、ヒト型化抗体が調製される。3次元イムノグロブリンモデルは、当業者にはよく知られている。更に詳細については、WO92/22653等を参照することができる。
【0043】
従って、ヒト型化されたヒト型化可変領域の例として、ヒト型化可変領域における相補性決定領域(CDR)がマウス抗体由来であり、その他の部分がヒト抗体由来である抗体を挙げることができる。
【0044】
本発明では更に、ヒト型化によって抗体自身の機能低下等が生起する場合があるので、一本鎖ポリペプチド中の適当な部位、例えば、CDR構造に影響を与える可能性があるフレームワーク(FR)中の部位、例えば、canonical 配列又はvernier 配列において部位特異的変異を起こさせることによってヒト型化抗体の機能の改善をすることが出来る。
【0045】
具体的には、528ヒト型化可変領域のヒト型化はCDR grafting法により行った。まずVH、VLそれぞれ相同性検索を行い、各CDR(complementarity determining region)の長さ等を考慮した上でもっとも相同性の高いFR(frame work)をもつヒト抗体配列を選択する。選択したヒト抗体のCDRを528のCDRと入れ換えたアミノ酸配列を設計し、対応するコドンについては先と同様に大腸菌至適コドンを用いることが好ましく、オーバーラップPCR法により遺伝子の全合成を行うことが出来る。
【0046】
又、ヒト型化OKT3ヒト型化可変領域はすでに報告されており、マウスOKT3に比べて十分に活性を保持していることも確かめられている(Adair, J. R. et al. Humanization of the murine anti-human CD3 monoclonal antibody OKT3. Hum Antibodies Hybridomas 5, 41-7. (1994))。この文献に記載されているヒト型化OKT3ヒト型化可変領域のアミノ酸配列を基に、オーバーラップPCR法により遺伝子の全合成を行った。この際にコドンは大腸菌における至適コドンを用いることが好ましく、至適コドンに置換した全合成遺伝子を用いることでの大腸菌における発現量の増加はすでに報告されている。
【0047】
本発明の各種抗体分子の書く構成要素の基となる、抗ヒト上皮細胞成長因子受容体1抗体528のL鎖のヒト型化可変領域(5L)、抗ヒト上皮細胞成長因子受容体1抗体528のH鎖のヒト型化可変領域(5H)、抗CD3抗体OKT3のL鎖のヒト型化可変領域(OL)、及び、抗CD3抗体OKT3のH鎖のヒト型化可変領域(OH)の塩基配列及びそれがコードするアミノ酸配列の一例を、夫々、配列番号1及び2、配列番号3及び4、配列番号5及び6、並びに、配列番号7及び8で示す。
【0048】
各一本鎖ポリペプチドにおけるリジン置換L鎖可変領域断片及びリジン置換H鎖可変領域断片は適当なペプチドリンカーで連結されていることが好ましい。該ペプチドリンカーは、一本鎖抗体の分子内での相互作用を困難にし、複数の一本鎖抗体による多量体の形成を可能ならしめ、その結果、互いに別の一本鎖抗体に由来するVHとVLが適切に会合することによって、オリジナルのタンパク質(当該ポリペプチドは該オリジナルのタンパク質に由来するものあるいは該オリジナルのタンパク質から誘導されたものである)の機能、例えば生物活性などの一部あるいはその全てを模擬又は促進する構造をとることができるようなものであれば特に限定されず、例えば当該分野で広く知られたものあるいは該公知のリンカーを改変したものの中から選択して使用することが可能である。例えば、ペプチドリンカーは1〜20個、好ましくは1〜15個、より好ましくは2〜10個のアミノ酸の長さであることが好ましい。
【0049】
更に、各一本鎖ポリペプチドは上記のペプチドリンカーを含まずに、二つのリジン置換可変領域断片が直接結合していても良い。このような場合には、各一本鎖抗体の三次元的自由度を高めて多量体化を促進させるために、各一本鎖ポリペプチドにおいてN末端側にあるリジン置換可変領域断片のC末端の1ないし数個のアミノ酸、又は、C末端側にあるリジン置換可変領域断片のN末端の1ないし数個のアミノ酸が除去されていることが好ましい。
【0050】
更に、上記の各配列番号で示される各アミノ酸配列において、一個又は数個のアミノ酸が置換、欠失、挿入若しくは付加されたアミノ酸配列(但し、配列番号4において本発明のリジン置換可変領域断片が有するアミノ酸変異は保持される)であって、元のアミノ酸配列からなるポリペプチドの機能・活性、例えば、リジン置換可変領域断片の抗原特異性と実質的に保持しているアミノ酸配列も本発明の抗体分子を構成する一本鎖抗体のポリペプチドとして使用することが出来る。欠失、置換、挿入若しくは付加されるアミノ酸は、好ましくは、同族アミノ酸(極性・非極性アミノ酸、疎水性・親水性アミノ酸、陽性・陰性荷電アミノ酸、芳香族アミノ酸など)同士が置換されるか、又は、アミノ酸の欠失若しくは付加によって、蛋白質の三次元構造及び/又は局所的電荷状態に大きな変化が生じない、又は、実質的にそれらが影響を受けないようなものが好ましい。このような欠失、置換又は付加されるアミノ酸を有するポリペプチドは、例えば、部位特異的変異導入法(点突然変異導入及びカセット式変異導入等)、遺伝子相同組換え法、プライマー伸長法、及びPCR法等の当業者に周知の方法を適宜組み合わせて、容易に作製することが可能である。尚、これらの一個又は数個のアミノ酸が置換、欠失、挿入若しくは付加されたアミノ酸配列は、元のアミノ酸配列全長に対して、90%以上、好ましくは95%以上、更に好ましくは99%以上の配列相同性(同一性)を示すものということもできる。
【0051】
本発明のリジン置換可変領域断片及び各抗体分子に含まれる一本鎖ポリペプチドに含まれる各領域又は配列をコードする核酸分子(オリゴヌクレオチド)の代表例は、上記の各配列番号に示された塩基配列を有するものである。その他に、各配列番号に記載の塩基配列の全長と90%以上、好ましくは95%以上、更に好ましくは99%以上の配列相同性を示すような塩基配列から成る核酸分子(但し、配列番号4における本発明のリジン置換可変領域断片が有するアミノ酸変異は保持される)は、上記の各領域又は配列と実質的に同等の活性又は機能を有するポリペプチドをコードしていると考えられるので、これらの核酸分子も上記の本発明の核酸に含まれる。このような核酸分子には本発明のダイアボディ型二重特異性抗体を構成する2種類の一本鎖ポリペプチドの少なくともいずれか一つのポリペプチドをコードする塩基配列が含まれているが、2種類の一本鎖ポリペプチドを夫々コードする2種類に塩基配列が共に含まれていることが好ましい。
【0052】
2つのアミノ酸配列又は塩基配列における配列相同性を決定するために、配列は比較に最適な状態に前処理される。例えば、一方の配列にギャップを入れることにより、他方の配列とのアラインメントの最適化を行なう。その後、各部位におけるアミノ酸残基又は塩基が比較される。第一の配列におけるある部位に、第二の配列の相当する部位と同じアミノ酸残基又は塩基が存在する場合、それらの配列は、その部位において同一である。2つの配列における配列相同性は、配列間での同一である部位数の全部位(全アミノ酸又は全塩基)数に対する百分率で示される。
【0053】
ここで、「相同性(同一性)」とは、ポリペプチド配列(あるいはアミノ酸配列)又はポリヌクレオチド配列(あるいは塩基配列)における2本の鎖の間で該鎖を構成している各アミノ酸残基同志又は各塩基同士の互いの適合関係において同一であると決定できるようなものの量(数)を意味し、二つのポリペプチド配列又は二つのポリヌクレオチド配列の間の配列相関性の程度を意味するものである。相同性は容易に算出できる。二つのポリヌクレオチド配列又はポリペプチド配列間の相同性を測定する方法は数多く知られており、「相同性」なる用語は、当業者には周知である (例えば、Lesk, A. M. (Ed.), Computational Molecular Biology, Oxford University Press, New York, (1988);Smith, D. W. (Ed.), Biocomputing: Informatics and Genome Projects, Academic Press, New York, (1993); Grifin, A. M. & Grifin, H. G. (Ed.), Computer Analysis of Sequence Data: Part I, Human Press, New Jersey, (1994);von Heinje, G., Sequence Analysis in Molecular Biology, Academic Press,New York, (1987); Gribskov, M. & Devereux, J. (Ed.), Sequence Analysis Primer, M-Stockton Press, New York, (1991) 等) 。二つの配列の相同性を測定するのに用いる一般的な方法には、Martin, J. Bishop (Ed.), Guide to Huge Computers, Academic Press, San Diego, (1994); Carillo, H. & Lipman, D., SIAM J. Applied Math., 48: 1073 (1988) 等に開示されているものが挙げられるが、これらに限定されるものではない。相同性を測定するための好ましい方法としては、試験する二つの配列間の最も大きな適合関係部分を得るように設計したものが挙げられる。このような方法は、コンピュータープログラムとして組み立てられているものが挙げられる。二つの配列間の相同性を測定するための好ましいコンピュータープログラム法としては、GCG プログラムパッケージ (Devereux, J. et al., Nucleic Acids Research, 12(1): 387 (1984)) 、BLASTP、BLASTN、FASTA (Atschul, S. F. et al., J. Molec. Biol., 215: 403 (1990)) 等が挙げられるが、これらに限定されるものでなく、当該分野で公知の方法を使用することができる。
【0054】
更に、上記の各核酸分子は、各配列番号で表される塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつ上記配列番号で示された各ポリペプチドの機能・活性と実質的に同じものを有するポリペプチドをコードするDNAを含むものである。
【0055】
ここで、ハイブリダイゼーションは、Molecular cloning third.ed.(Cold Spring Harbor Lab.Press,2001)に記載の方法等、当業界で公知の方法あるいはそれに準じる方法に従って行なうことができる。また、市販のライブラリーを使用する場合、添付の使用説明書に記載の方法に従って行なうことができる。
【0056】
ハイブリダイゼーションは、例えば、カレント・プロトコールズ・イン・モレキュラー・バイオロジー(Current protocols in molecular biology(edited by Frederick M. Ausubel et al., 1987))に記載の方法等、当業界で公知の方法あるいはそれに準じる方法に従って行なうことができる。また、市販のライブラリーを使用する場合、添付の使用説明書に記載の方法に従って行なうことができる。
【0057】
本明細書において、DNAのハイブリダイズにおける「ストリンジェント(stringent)な条件」は、塩濃度、有機溶媒(例えば、ホルムアミド)、温度、及びその他公知の条件の適当な組み合わせによって定義される。すなわち、塩濃度を減じるか、有機溶媒濃度を増加させるか、またはハイブリダイゼーション温度を上昇させるかによってストリンジェンシー(stringency)は増加する。更に、ハイブリダイゼーション後の洗浄の条件もストリンジェンシーに影響する。この洗浄条件もまた、塩濃度と温度によって定義され、塩濃度の減少と温度の上昇によって洗浄のストリンジェンシーは増加する。
【0058】
従って、「ストリンジェントな条件」とは、各塩基配列間の相同性の程度が、例えば、全体の平均で約80%以上、好ましくは約90%以上、より好ましくは約95%以上であるような、高い相同性を有する塩基配列間のみで、特異的にハイブリッドが形成されるような条件を意味する。具体的には、例えば、温度60℃〜68℃において、ナトリウム濃度150〜900mM、好ましくは600〜900mM、pH 6〜8であるような条件を挙げることが出来る。ストリンジェントな条件の一具体例としては、5 x SSC (750 mM NaCl、75 mM クエン酸三ナトリウム)、1% SDS、5 x デンハルト溶液50% ホルムアルデヒド、及び42℃の条件でハイブリダイゼーションを行い、0.1 x SSC (15 mM NaCl、1.5 mM クエン酸三ナトリウム)、0.1% SDS、及び55℃の条件で洗浄を行うものである。
【0059】
更に、各一本鎖ポリペプチドにおけるリジン置換可変領域断片をコードする核酸を作製する場合には、予め設計されたアミノ酸配列に基づきオーバーラップPCR法により全合成することができる。尚、「核酸」とは、一本鎖ポリペプチドをコードする分子であれば、その化学構造及び取得経路に特に制限はなく、例えば、gDNA、cDNA、化学合成DNA及びmRNA等を含むものものである。
【0060】
具体的には、cDNAライブラリーから、文献記載の配列に基づいてハイブリダイゼーションにより、あるいはポリメラーゼチェインリアクション(PCR) 技術により単離されうる。一旦単離されれば、DNA は発現ベクター中に配置され、次いでこれを、大腸菌(E. coli )細胞、COS 細胞、チャイニーズハムスター卵巣細胞(CHO細胞) 、またはイムノグロブリンを産生しないミエローマ細胞等の宿主細胞にトランスフェクションさせ、該組換え宿主細胞中でモノクローナル抗体を合成させることができる。PCR 反応は、当該分野で公知の方法あるいはそれと実質的に同様な方法や改変法により行うことができるが、例えば R. Saiki, et al., Science, 230: 1350, 1985; R. Saiki, et al., Science, 239: 487, 1988 ; H. A. Erlich ed., PCR Technology, Stockton Press, 1989 ; D. M. Glover et al. ed., “DNA Cloning", 2nd ed., Vol. 1, (The Practical Approach Series), IRL Press, Oxford University Press (1995) ; M. A. Innis et al. ed., “PCR Protocols: a guide to methods and applications", Academic Press, New York (1990)); M. J. McPherson, P. Quirke and G. R. Taylor (Ed.), PCR: a practical approach, IRL Press, Oxford (1991); M. A. Frohman et al., Proc. Natl. Acad. Sci. USA, 85, 8998-9002 (1988)などに記載された方法あるいはそれを修飾したり、改変した方法に従って行うことができる。また、PCR 法は、それに適した市販のキットを用いて行うことができ、キット製造業者あるいはキット販売業者により明らかにされているプロトコルに従って実施することもできる。
【0061】
DNA など核酸の配列決定は、例えばSanger et al., Proc. Natl. Acad. Sci. USA 74: 5463-5467 (1977)などを参考にすることができる。また一般的な組換えDNA 技術は、J. Sambrook, E. F. Fritsch & T. Maniatis (ed.), “Molecular Cloning: A Laboratory Manual (2nd edition)", Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York (1989)及び D. M. Glover et al. (ed.), “DNA Cloning", 2nd ed., Vol. 1 to 4, (The Practical Approach Series), IRL Press, Oxford University Press (1995) などを参考にできる。
【0062】
こうして取得された本発明の抗体分子を構成する一本鎖ポリペプチド又はそれに含まれる各領域をコードする核酸は、目的に応じて、当業者に公知の手段により適宜所望のペプチド又はアミノ酸をコードするように改変することができる。この様にDNA を遺伝子的に改変又は修飾する技術は、Mutagenesis: a Practical Approach, M.J.Mcpherson (Ed.), (IRL Press, Oxford, UK(1991) における総説において示されており、例えば、位置指定変異導入法(部位特異的変異導入法)、カセット変異誘発法及びポリメラーゼチェインリアクション(PCR) 変異生成法を挙げることができる。
【0063】
ここで、核酸の「改変」とは、得られたオリジナルの核酸において、アミノ酸残基をコードする少なくとも一つのコドンにおける、塩基の挿入、欠失または置換を意味する。例えば、オリジナルのアミノ酸残基をコードするコドンを、別のアミノ酸残基をコードするコドンにより置換することにより一本鎖ポリペプチドを構成するアミノ酸配列自体を改変する方法がある。
【0064】
又は、本明細書の実施例に記載されているように、アミノ酸自体は変更せずに、大腸菌等の宿主細胞にあったコドン(至適コドン)を使用するように、一本鎖ポリペプチドをコードする核酸を改変することも出来る。このように至適コドンに改変することによって、宿主細胞内における一本鎖ポリペプチドの発現効率等の向上を図ることが出来る。
【0065】
本発明の抗体分子は、当業者に公知の方法、例えば、遺伝子工学的手法又は化学合成等の各種手段を用いて製造することが出来る。遺伝子工学的手法としては、例えば、該二重特異性抗体を構成する夫々の一本鎖抗体のポリペプチドをコードする核酸を含有する複製可能なクローニングベクター又は発現ベクターを作製し、このベクターで宿主細胞を形質転換せしめ、該形質転換された宿主細胞を培養して宿主細胞中で一本鎖ポリペプチドを発現させ、該ポリペプチドを回収・精製し、それらの一本鎖ポリペプチドを会合させ、形成された抗体分子を分離・回収することによって製造することが出来る。
【0066】
ここで、「複製可能な発現ベクター(replicable expression vector)」および「発現ベクター(expression vector) 」は、DNA(通常は二本鎖である)の断片(piece) をいい、該DNAは、その中に外来のDNAの断片を挿入せしめることができる。外来のDNAは、異種DNA (heterologous DNA)として定義され、このものは、対象宿主細胞においては天然では見出されないDNA である。ベクターは、外来DNAまたは異種DNA を適切な宿主細胞に運ぶために使用される。一旦、宿主細胞中に入ると、ベクターは、宿主染色体DNA とは独立に複製することが可能であり、そしてベクターおよびその挿入された(外来)DNA のいくつかのコピーが生成され得る。さらに、ベクターは外来DNAのポリペプチドへの翻訳を可能にするのに不可欠なエレメントを含む。従って、外来DNAによってコードされるポリペプチドの多くの分子が迅速に合成されることができる。
【0067】
このようなベクターは、適切な宿主中で DNA配列を発現するように、適切な制御配列(control sequence)とそれが機能するように(operably)(即ち、外来DNAが発現できるように)連結せしめられたDNA配列を含有する DNA構築物(DNA construct) を意味している。そうした制御配列としては、転写(transcription) させるためのプロモーター、そうした転写を制御するための任意のオペレーター配列、適切なmRNAリボソーム結合部位をコードしている配列、エンハンサー、リアデニル化配列、及び転写や翻訳(translation) の終了を制御する配列等が挙げられる。更にベクターは、、当業者に公知の各種の配列、例えば、制限酵素切断部位、薬剤耐性遺伝子等のマーカー遺伝子(選択遺伝子)、シグナル配列、リーダー配列等を必要に応じて適宜含むことが出来る。これらの各種配列又は要素は、外来DNAの種類、使用する宿主細胞、培養培地等の条件に応じて、当業者が適宜選択して使用することが出来る。更に、製造した一本鎖ポリペプチドの検出及び精製等を容易にする目的のために、当業者に公知の各種のペプチドタグ(例えば、c−mycタグ及びHis−tag)をコードする配列を一本鎖ポリペプチドに対応する配列の末端等に含ませることが出来る。
【0068】
該ベクターは、プラスミド、ファージ粒子、あるいは単純にゲノムの挿入体(genomic insert)等の任意の形態が可能である。一旦、適切な宿主の中に形質転換で導入せしめられると、該ベクターは宿住のゲノムとは独立して複製したり機能するものであり得る。又は、該ベクターはゲノムの中に組み込まれるものであってもよい。
【0069】
宿主細胞としては当業者に公知の任意の細胞を使用することができるが、例えば、代表的な宿主細胞としては、大腸菌(E. coli) 等の原核細胞、及び、チャイニーズハムスター卵巣細胞(CHO細胞) 、ヒト由来細胞などの哺乳動物細胞、酵母、昆虫細胞等の真核細胞が挙げることができる。形質転換菌は当業者に公知の任意の抵当な条件・方法で培養することができる。宿主として、例えば、BL21 star(DE3)株、培地として2xYT培地、培養温度28℃前後、0.5 mM 程度のIPTGで発現を誘導することによって、培養上清又は可溶性画分における本発明の抗体分子の収量を大幅に向上させることができ、製造効率を高めることが可能となる。
【0070】
このような宿主細胞における発現等により得られた一本鎖ポリペプチドは一般に分泌されたポリペプチドとして培養培地から回収されるが、それが分泌シグナルを持たずに直接に産生された場合には宿主細胞溶解物から回収することが出来る。一本鎖ポリペプチドが膜結合性である場合には、適当な洗浄剤(例えば、トライトン-X100) を使用して膜から遊離せしめることができる。
【0071】
精製操作は当業者に公知の任の方法を適宜組み合わせて行うことが出来る。例えば、必用に応じてPEG化等の化学修飾を行った後、遠心分離、ヒドロキシルアパタイトクロマトグラフィー、ゲル電気泳動、透析、イオン交換カラム上での分画、エタノール沈殿、逆相HPLC、シリカでのクロマトグラフィー、ヘパリンセファロースでのクロマトグラフィー、陰イオンまたは陽イオン樹脂クロマトグラフィー(ポリアスパラギン酸カラム等)、クロマトフォーカシング、SDS-PAGE、硫酸アンモニウム沈殿、及びアフィニティクロマトグラフィーによって好適に精製される。アフィニティクロマトグラフィーは、一本鎖ポリペプチドが有するぺプチドタグとの親和力を利用した効率が高い好ましい精製技術の一つである。
【0072】
尚、回収された一本鎖ポリペプチドは不溶性画分に含まれていることも多いために、精製操作は、一本鎖ポリペプチドを可溶化し変性状態にした上で行うことが好ましい。この可溶化処理は、エタノールなどのアルコール類、グアニジン塩酸塩、尿素などの解離剤として当業者に公知の任意の薬剤を使用して行うことが出来る。更に、こうして精製された2種類の一本鎖ポリペプチドを会合(巻き戻し)せしめ、形成された抗体分子を分離して回収することによって、本発明の抗体分子を製造することが出来る。
【0073】
会合処理は、単独の一本鎖ポリペプチドを適切な空間的配置に戻すことによって、所望の生物活性を有する状態に戻すことを意味する。従って、会合処理は、ポリペプチド同志あるいはドメイン同志を会合した状態に戻すという意味も有しているので「再会合」ともいうことができるし、所望の生物活性を有するものにするという意味で、再構成ということもでき、或いは、リフォールディング (refolding)とも呼ぶことが出来る。会合処理は当業者に公知の任意の方法で行うことが出来るが、例えば、透析操作により、一本鎖ポリペプチドを含むバッファ溶液中の変性剤(例えば、塩酸グアニジン)の濃度を段階的に下げる方法が好ましい。この過程で、凝集抑制剤、及び酸化剤を反応系に適宜添加することによって、酸化反応の促進を図ることも可能である。形成された多量体化低分子抗体の分離及び回収も当業者に公知の任意の方法で行うことが出来る。
【0074】
以上に示したように、本発明の抗体分子は、例えば、大腸菌など培養宿主細胞の培養培地上清、ペリズマ画分、菌体内可溶性画分、又は、菌体内不溶性画分から調製することが可能である。
【0075】
本発明のベクターとして、本発明の抗体分子を構成する一本鎖ポリペプチドに対応する核酸分子を共に含む共発現ベクターを用いることによって、又は、一本鎖ポリペプチドの夫々をコードする核酸分子を含む発現ベクターを同一の宿主細胞を形質転換せしめ、該形質転換菌内で夫々の一本鎖ポリペプチドが発現した後に抗体分子が形成され、それを大腸菌など培養宿主細胞の培養培地上清又は可溶性画分から調製することが可能である。従って、このような場合には、上記の会合(巻き戻し)処理は不要となり、低コストで高生産性が得られる。
【0076】
更に、該形質転換菌の菌体内可溶性画分からの調製量を向上させるためには、以下のような条件とすることが好ましい。宿主としてBL21 star(DE3)株(Invitrogen)を用い、培養は2xYT培地を用い28℃で行う。一晩振盪培養後(600 nmのO.D.が 約5)となったところで、終濃度0.5 mM のIPTGにより発現を誘導し、さらに16時間培養後に、培地上清画分と菌体を浸透圧処理後の画分(ペリプラズム画分)から目的タンパク質を回収する。
【0077】
本発明の医薬組成物は、本発明の抗体分子、一本鎖ポリペプチド、核酸、ベクター、及び形質転換された宿主細胞から成る群から選ばれたものを有効成分として含有することを特徴とする。かかる有効成分は、以下の実施例に示されているように、インビトロ及びインビボで上皮細胞成長因子受容体を発現する(陽性)腫瘍細胞を有意に排除・殺傷・傷害する作用を有しているので、本発明の医薬組成物はこのような腫瘍細胞に対する抗腫瘍剤として使用することが出来る。
【0078】
本発明の有効成分の有効量は、例えば治療目的、腫瘍の種類、部位及び大きさ等の投与対象における病状、患者の諸条件、及び投与経路等によって当業者が適宜決めることが出来る。典型的な1回の投与量又は日用量は、上記の条件に応じ、可能ならば、例えば当分野で既知の腫瘍細胞の生存又は生長についての検定法を使用して、まずインビトロで、そして次に、人間の患者のための用量範囲を外挿し得る適切な動物モデルで、適当な用量範囲を決定することもできる。
【0079】
本発明の医薬組成物には、有効成分の種類、薬剤形態、投与方法・目的、投与対象の病態等の各種条件に応じて、有効成分に加えて当業者に周知の薬学上許容し得る各種成分(例えば、担体、賦形剤、緩衝剤、安定化剤、等)を適宜添加することが出来る。
【0080】
本発明の医薬組成物は、上記各種条件に応じて、錠剤、液剤、粉末、ゲル、及び、噴霧剤、或いは、マイクロカプセル、コロイド状分配系(リポソーム、マイクロエマルジョン等)、及びマクロエマルジョン等の種々薬剤形態をとり得る。
【0081】
投与方法としては、静脈内、腹腔内、脳内、脊髄内、筋肉内、眼内、動脈内、特には胆管内、又は病変内経路による注入又は注射、及び持続放出型システム製剤による方法が挙げられる。本発明の活性物質は、輸液により連続的に、または大量注射により投与されることができる。尚、本発明の医薬組成物を投与する場合には、食作用又は細胞傷害活性を有する細胞と共に投与することが好ましい。或いは、投与前に本発明のLH型ダイアボディ型二重特異性抗体のような有効成分と上記細胞とを混合することによって、投与前に該抗体を予め該細胞に結合させておくことが好ましい。
【0082】
持続放出製剤は、一般的には、そこから本発明の活性物質をある程度の時間放出することのできる形態のものであり、持続放出調製物の好適な例は、蛋白質を含む固体疎水性ポリマーの半透過性担体を含み、該担体は、例えばフィルムまたはマイクロカプセル等の成型物の形態のものである。
【0083】
本発明の医薬組成物は、当業者に公知の方法、例えば日本薬局方解説書編集委員会編、第十三改正 日本薬局方解説書、平成8年7月10日発行、株式会社廣川書店などの記載を参考にしてそれらのうちから必要に応じて適宜選択して製造することができる。
【0084】
尚、本明細書及び図面において、用語はIUPAC-IUB Commission on Biochemical Nomenclatureによるか、あるいは当該分野において慣用的に使用される用語の意味に基づくものである。
【0085】
以下に参考例及び実施例を参照して本発明を具体的に説明するが、これらは単に本発明の説明のため、その具体的な態様の参考のために提供されているものである。これらの例示は本発明の特定の具体的な態様を説明するためのものであるが、本願で開示する発明の範囲を限定したり、あるいは制限することを表すものではない。本発明では、本明細書の思想に基づく様々な実施形態が可能であることは理解されるべきである。
【0086】
全ての参考例及び実施例は、他に詳細に記載するもの以外は、標準的な技術を用いて実施したもの、又は実施することのできるものであり、これは当業者にとり周知で慣用的なものである。尚、以下の実施例において、特に指摘が無い場合には、具体的な操作並びに処理条件などは、DNA クローニングでは J. Sambrook, E. F. Fritsch & T. Maniatis, “Molecular Cloning", 2nd ed., Cold Spring Harbor Laboratory,Cold Spring Harbor, N. Y. (1989) 及び D. M. Glover et al. ed., “DNA Cloning", 2nd ed., Vol. 1 to 4, (The Practical Approach Series), IRL Press, Oxford University Press (1995) ; 特にPCR 法では、H. A. Erlich ed., PCR Technology, Stockton Press, 1989 ; D. M. Glover et al. ed.,“DNA Cloning", 2nd ed., Vol. 1, (The Practical Approach Series), IRL Press, Oxford University Press (1995) 及び M. A. Innis et al. ed.,“PCR Protocols", Academic Press, New York (1990)に記載の方法に準じて行っているし、また市販の試薬あるいはキットを用いている場合はそれらに添付の指示書(protocols) や添付の薬品等を使用している。
【実施例1】
【0087】
ヒト上皮細胞成長因子受容体1(Her1)抗体528のヒト型化可変領域(5H又は5L)のリジン置換可変領域断片の作製
まず、ヒト化型528抗体の結晶構造を分子置換法により決定した。その結果を表1に示す。こうして得られた構造を参照し、且つ、生殖配列データベース(非特許文献8)を利用することで、公知の位置指定変異導入法(部位特異的変異導入法)を用いて、配列番号2で示される抗ヒト上皮細胞成長因子受容体1(Her1)抗体528のL鎖のヒト型化可変領域(5L)、及び、配列番号4で示される抗ヒト上皮細胞成長因子受容体1(Her1)抗体528のH鎖のヒト型化可変領域(5H)において、各領域内のCDR中のリジン残基も含めて全てのリジン残基を他の適当なアミノ酸で置換させた。
【0088】
【表1】

【0089】
その結果、リジン置換可変領域断片の例として、全てのリジン残基が以下のような他のアミノ酸に置換された可変領域断片5H(VH0K)及び5L(VL0K)が得られた。
【0090】
5Lにおけるリジン残基の置換:
44番目のリジン残基がアルギニン残基、
55番目のリジン残基がグルタミン残基、
79番目のリジン残基がトレオニン残基、
108番目のリジン残基がグルタミン酸残基、及び
112番目のリジン残基がグルタミン酸残基。
【0091】
5Hにおけるリジン残基の置換:
12番目のリジン残基がアラニン残基、
13番目のリジン残基がグルタミン酸残基、
19番目のリジン残基がグルタミン残基、
23番目のリジン残基がアラニン残基、
63番目のリジン残基がグルタミン酸残基、及び、
65番のリジン残基がグルタミン残基。
【0092】
更に、5L又は5Hにおける上記の任意の部位で元のリジン残基に再置換し、5Hの19番目のグルタミン残基がリジン残基に再置換されたヒト型化抗EGFR抗体リジン置換H鎖可変領域断片「VH1K」、及び、5Lの108番目のグルタミン酸残基がリジン残基に再置換されたヒト型化抗EGFR抗体リジン置換L鎖可変領域断片「VL1K」を作製した。
【実施例2】
【0093】
リジン置換可変領域断片を含む一本鎖抗体(scFv)の作製
次に、こうして選択された各リジン置換可変領域断片を含む一本鎖抗体(リジン置換scFv )として、VH0K及びVL0Kを含む「0K」、VH1K及びVL0Kを含む「HK」、及びVH0K及びVL1Kを含む「LK」の3種類を以下の概要で調製した。
発現ベクターはすでに本発明者等によって構築されているヒト型化528scFv発現ベクター(pRA-h5Hh5L(G1):特許文献3)を基に作製した。即ち、それぞれのベクターを制限酵素NcoIとEagIで消化後、リンカー配列を含めてh5H部位あるいはh5L部位を入れ換えることで、15アミノ酸リンカー(GGGGS)3を有する各ヒト型化scFv発現ベクターを作製した。C末端側には精製のためのHis-tag (Hisx6:ヒスチジン6量体tag)が並列に導入されている。これを大腸菌を宿主として用いて発現させ、本発明の一本鎖抗体を得た。
【0094】
フローサイトメトリー(Flow cytometry)により一本鎖抗体のヒト扁平上皮がん細胞株であるA431細胞(ATCC No.CRL-1555)に対する結合活性を調べた。標的細胞に対し一次抗体として各scFvを100pmol加え30分、4℃で静置後、0.1%NaN3/PBSで2回洗浄し、続いて二次抗体としてEx3ダイアボディで免疫したウサギの抗血清を加え同様の操作を行った。最後に三次抗体としてFITC-conjugate anti-rabbit
抗体を加え同様の操作を行った後、蛍光を測定した。ネガティブコントロール(以下、「NC」)は一次抗体の代わりにPBS/0.1%/NaN3を加え、ポジティブコントロール(以下、「PC」)には一次抗体としてh528scFv(配列番号9、10)を用いた。図1に示す結果が得られた。
【0095】
更に、これらの一本鎖抗体をSPR法(J Biol Chem. 2010 Jul 2;285(27):20844-9.)による速度解析したところ、以下の表2に示すような結果が得られた。
【0096】
【表2】

【0097】
以上のことから、本発明の3種類の一本鎖抗体のA431細胞に対する結合活性(親和性)は、リジン残基置換前の一本鎖抗体(h528scFv)の活性と比べて実質的に変わらない(保持されている)ことが確認された。
【実施例3】
【0098】
リジン置換可変領域断片を含む一本鎖抗体(scFv)のPEG化
次に、実施例2で作製したHK又はLK(20μM)を含む6M Gdn-HCl/PBS溶液に一端にNHSエステルを有する5kDaのPEG(2mM)を加え、25℃で2時間(pH7〜10)静置してHK及びLKに含まれる特定の一つのリジン残基を部位特異的にPEG化し、その反応液をSDS−PAGEにかけた。得られた結果を図2に示す。これによれば、pH8.5において部位特異的PEG化が高い効率(64〜73%程度)で達成することが出来た。
【実施例4】
【0099】
リジン置換可変領域断片を含む一本鎖抗体の二量体の作製及び細胞傷害活性
更に、架橋試薬として、SANH(succinimidyl 4-hydrazinonicotinate acetone hydrazone)とSFB(succinimidyl 4-formylbenzoate)を用いてscFvであるHK及びLKの二量体化を行った。SANHは、一端にNHSエステル、逆端にヒドラジン基を持ち、SFBは一端にNHSエステル、逆端にアルデヒド基を持つ分子である。これらとHK又はLKをそれぞれ結合させた後、SANHと結合したHK又はLKと、SFBと結合したHK又はLKを混合することで、ヒドラゾン結合を形成させ、二量体化抗体を作製することができる。まず、NHSエステルとアミノ基の結合反応は、ホウ酸バッファ(pH 8.5、25℃)に透析後、ジメチルスルホキシド(DMSO)で20 mMに調製したSANH、またはSFBを終濃度2 mMとなるように加え(10% DMSO)、25℃で2時間静置し行った。ヒドラゾン結合は、pH 7.0以下のバッファに2時間透析することにより、過剰なSANH、SFBの除去と同時に、pHの変更を行い、透析完了後のSANH、SFBが結合したサンプルを混合し(pH 6.0(PBS))、25℃で2時間静置することで、二量体の形成を行った(図3)。ここで、架橋距離の異なる二種類の架橋試薬を用いることで各scFv間の距離が異なる二量体を作製することが出来た。
【0100】
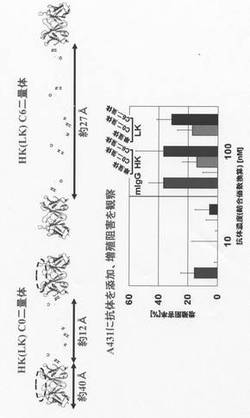
A431細胞の増殖がこうして得られた本発明の二量体によりどれほど阻害されるかをMTS assayにより検討した。セルカウントを行い、RPMI(10 % FBS)100μLあたり細胞2×103個になるよう調整し、96穴プレートに100μLずつ分注、37℃で一晩静置した。目的蛋白質を目的濃度になるようにRPMIで希釈、前日準備したプレートに抗体蛋白質を200μLずつ分注し、37℃で96時間培養した。プレートの培養液を取り除き、PBS により洗浄、MTS、PMS、RPMIを加え、37℃で30〜60分インキュベートした後、プレートリーダーで490nm の吸光度を測定した。その結果、図4に表されるように、本発明の二量体は単量体(HK又はLK)では見られない細胞増殖阻害活性を誘導することがわかった。
(注) MTS 試薬 (CellTiter 96 AQueous Non-Radioactive Cell Proliferation Assay, Promega社製) 、PMS(CellTiter 96 AQueous Non-Radioactive Cell Proliferation Assay,Promega 社製)
【実施例5】
【0101】
PEG化ダイアボディ型二重特異性抗体の調製
更に、特許文献1に記載された方法に準じて本発明のダイアボディ型二重特異性抗体を作製した。まず、本発明のリジン置換L鎖可変領域断片(VL1K)、及び、配列番号8で示されるアミノ酸配列から成る抗CD3抗体OKT3のH鎖のヒト型化可変領域(OH)の完全リジン置換体(含まれる全てのリジン残基を他のアミノ酸残基に置換したもの)から成る一本鎖ポリペプチド(528VL 1K (Lys108)-OKT3 VH Lys(-)))を作製し、これを実施例3に記載の条件(pH8.5)でPEG化し、528抗体のL鎖可変領域断片の108番目のリジンのみ部位特異的にPEG化されたリジン置換L鎖可変領域断片を含むPEG化一本鎖ポリペプチドを得た。
同様に、配列番号4で示される抗体528のH鎖のヒト型化可変領域(5H)及び配列番号6で示される抗CD3抗体OKT3のL鎖のヒト型化可変領域(OL)から成る一本鎖ポリペプチド(528VH -OKT3 VL)を作製した。
こうして作製した未精製のPEG化一本鎖ポリペプチドともう一方の一本鎖ポリペプチドを等モル混合し、透析法による巻き戻し後、ゲルろ過クロマトグラフィ(Hiload superdex(商標)200 26/60 PG、流速2 mL/min、溶出液PBS)により精製し、保持体積120-200 mL各画分をSDS-PAGEにかけた。その結果、ピーク2に、528抗体のL鎖可変領域断片の108番目のリジンのみ部位特異的にPEG化されたリジン置換L鎖可変領域断片を構成要素として含む本発明のダイアボディ型二重特異性抗体(PEG Ex3)を均一に含む(1 μM/mL)画分が得られた。以上の結果を図5に示す。
【実施例6】
【0102】
PEG化ダイアボディ型二重特異性抗体の結合活性
実施例5で作製したダイアボディ型二重特異性抗体について、実施例2に記載のフローサイトメトリー(Flow cytometry)を実施した。一次抗体試料としてゲルろ過クロマトグラフィににおけるピーク1及びピーク2から取得したPEG化ダイアボディ型二重特異性抗体(100 pmol)を使用した。但し、ゲルろ過クロマトグラフィにおけるピーク2に含まれるダイアボディ型二重特異性抗体とT-LAKとの反応については265 pmolの抗体試料を用いた。ポジティブコントロール(以下、「PC」)には一次抗体としてリジン残基が未置換であるExを用いた。続いて検出抗体としてFITC-conjugate anti-HA
抗体を加え蛍光を測定した。
【0103】
その結果、図6に表されるように、ゲルろ過クロマトグラフィにおけるピーク2に含まれるダイアボディ型二重特異性抗体は、EGFR及びCD3に対して結合活性を有することが示された。
【産業上の利用可能性】
【0104】
一本鎖抗体(h528scFv)は多量体化させることで多価性の結合を獲得し、結果増殖抑制効果を示すが(特許文献3)、可変領域間の距離を自由に変化させることはできない。これに対して、反応基として特定の一箇所のみリジン残基を有する本発明に係る一本鎖抗体は、均一な化学修飾が可能、且つ、化学架橋剤に応じた様々な高機能性設計も可能な点で技術的優位性が高い。例えば、分岐数の多い化学架橋剤を用いることで、高多価の分子を創出したり、抗がん剤他、放射性同位体による修飾など、がん関連抗原を標的とした抗体断片のリジン置換体は利用価値が極めて高いといえる。
【0105】
更に、本発明のヒト型化抗EGFR抗体リジン置換L鎖又は同H鎖可変領域断片、又はそれらから構成される一本鎖抗体は様々な抗体分子の構成要素として利用し、更なる高機能化を図ることが出来る。
【技術分野】
【0001】
本発明は、抗ヒト上皮細胞成長因子受容体1抗体528ヒト型化可変領域の(H鎖又はL鎖)において、全てのリジン残基、又は、任意に選択される特定の一つの部位のリジン残基以外の全てのリジン残基を他の適当なアミノ酸に置換して得られる「ヒト型化抗EGFR抗体リジン置換可変領域断片」及びその利用等に関する。
【背景技術】
【0002】
がん(悪性腫瘍)及びリウマチ等に対する安全な治療法として、近年、免疫療法が用いられている。がんに対する免疫療法では、がんに対して特異的に細胞傷害活性を示す抗体が使用される。このような抗体から成る抗体医薬は、副作用の少ない、安心安全で治療効果の高いことが認められる一方、確立された動物細胞を用いて製造する必要があるためにコスト高が問題となっている。
【0003】
このため、ある抗体のVHとVLのドメインが一本のポリペプチド鎖中にある一本鎖抗体(scFv)のような低分子抗体の作製が世界的な潮流となっている。このような低分子抗体は安価な大腸菌でも製造可能であるが、分子量の低下によって体内半減期が低下し、薬効持続時間が減少することが懸念される。また、IgGの様な完全抗体は、標的抗原に対し多価で結合するのに対し、通常、低分子抗体は結合価が一価となるため、親和性の低下も問題となっている。更に、抗体医薬の主な作用機序はFc領域を介した抗体依存性細胞傷害活性(ADCC)ともされているため、Fc領域を有さないscFvは効果の低さが懸念される。尚、scFvについては、非特許文献1を参照することができる。
【0004】
このため、がん細胞と免疫細胞を架橋するよう特異付けた低分子二重特異性抗体などが開発されてきており、BiTEと呼ばれる、2つのscFv同士を連結させたtandem scFv型の低分子二重特異性抗体が唯一臨床治験に進んでいる(Science. 2008 Aug 15;321(5891):974-7.)。しかしながらこのBiTEは、動物細胞を用いて調製しているため、収量や製造コストが問題となっている。BiTEのようなtandem scFv型の低分子二重特異性抗体は、低分子であるものの大腸菌可溶性画からの調製は困難であるとの報告もあり(J Mol Biol. 2003 330(1):99-111.)、事実BiTEは動物細胞を用いて調製されている。
【0005】
多重特異性抗体のうちの一つである二重特異性抗体(Bispecific Antibody:BsAb)は2つの異なる抗原に対して特異的に結合することが可能であるため、この特性を生かして特異的な抗腫瘍効果を持った治療薬としての利用法が可能であるとして、その研究が盛んに行われている。ダイアボディ(diabody:Db)とはこのような二重特異性抗体の最小単位であり、それぞれ同じ親抗体由来の重鎖(H鎖)の可変領域(V領域)(「VH」と表わされる)VHと軽鎖(L鎖)の可変領域(V領域)(「VL」と表わされる)VLとが互いに非共有結合によりヘテロ二量体を形成するという性質を利用し考案されたものである(非特許文献2)。
【0006】
このようなダイアボディ型二重特異性抗体の特徴としては、低分子(分子量約60,000)であることによる低免疫原性及び腫瘍組織への高浸透性、更には、例えば、大腸菌等の微生物を利用した安価な大量製造が可能であること、又、遺伝子工学を利用した機能改変が容易であることを挙げることができる。
【0007】
本発明者等は、これまでに、抗ヒト上皮細胞成長因子受容体1(Her1)抗体528及び抗CD3抗体OKT3を用いて作製したダイアボディ型二重特異性抗体(Ex3)及び該抗体をヒト型化したダイアボディ型二重特異性抗体(hExh3)は極めて強力な抗腫瘍効果を有していることを見出している(特許文献1)。更に、他の抗体を用いて作製したダイアボディ型二重特異性抗体との比較により、該が上記の優れた効果を発揮する為には、ヒト型化528抗体及びヒト型化OKT3抗体のヒト型化可変領域自身の構造的安定性、及びこれらの組み合わせが非常に重要であることが推測された。
【0008】
更に、本発明者等はヒト型化ダイアボディ型二重特異性抗体等に基づき多様な構造を有する高機能性二重特異性抗体を開発している(特許文献2)。
【0009】
又、ダイアボディ型二重特異性抗体以外の二重特異性抗体の調製等は、以下の非特許文献3及び非特許文献4に記載されている。
【0010】
抗ヒト上皮細胞成長因子受容体1(Her1)抗体528はがん細胞の成長阻害効果を有する。しかしながら、既に記載したように、EGFRへの結合価が一価の場合、抗原との親和性が低く、その効果がほとんど見られないことが知られている。実際にヒト型化528の一本鎖抗体(scFv)にはがん細胞成長阻害効果が認められなかった。scFvが有するこのような欠点を克服するために、既にリンカーの改変によるscFvの多量体化が試みられてきた(非特許文献5)。近年では、リンパ腫にアポトーシスを誘導するscFv二量体なども報告されている(非特許文献6)。しかしながら、固形がんやEGFR陽性がん腫に対して、成長阻害効果を発揮するscFv多量体の例は報告されていない。
【0011】
本発明者は、抗ヒト上皮細胞成長因子受容体1(Her1)抗体528に基づく一本鎖抗体(scFv)から構成される多量体化低分子抗体を開発し、これらは優れたがん細胞成長阻害効果を有することが示された(特許文献3)。
【0012】
低分子抗体が抱える体内半減期の低下及び親和性の低下等の問題を解決する他の方法として、従来から、ポリエチレングリコール(PEG)等の高分子ポリマーの付加、薬効の向上に向けては、抗がん剤などによる化学修飾が行われてきた。抗体のような生理活性を有するタンパク質の化学修飾のために、リジン残基を変異させることが従来から行われている。例えば、ファージ提示法を用いてTNFαのリジン置換に成功した例などがある(非特許文献7)。しかしながらその手順は必ずしも簡便ではない。一方、抗体断片は生殖配列データベースを利用することで、活性を保持したまま比較的簡便にリジンを置換することができる(非特許文献8)。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】特許第3803790号明細書
【特許文献2】国際公開第WO2007/108152号パンフレット
【特許文献3】特開2010−119303号公報
【非特許文献】
【0014】
【非特許文献1】Rosenburg and Moore (Ed.), “The Pharmacology of Monoclonal Antibodies", Vol. 113, Springer-Verlag, New York, pp.269-315 (1994)
【非特許文献2】Hollinger, et al., Proc. Natl. Acad. Sci. USA 90, 6444-6448, 1993
【非特許文献3】Alt M, et. al. Novel tetravalent and bispecific IgG-like antibody molecules combining single-chain diabodies with the immunoglobulin gamma1 Fc or CH3 region. FEBS Lett., 454, 90-4. (1999)
【非特許文献4】Lu D, et. al. A fully human recombinant IgG-like bispecific antibody to both the epidermal growth factor receptor and the insulin-like growth factor receptor for enhanced antitumor activity. J Biol Chem., 280, 19665-72. (2005)
【非特許文献5】Biomol Eng. 2001 18(3):95-108
【非特許文献6】Biochem Biophys Res Commun. 2004 315(4):912-8
【非特許文献7】Nat Biotechnol. 2003;21(5):546-52.
【非特許文献8】Bioconjug Chem. 2003;14(2):480-7
【発明の開示】
【発明が解決しようとする課題】
【0015】
上記のようにタンパク質の化学修飾の標的残基として最も汎用的に用いられるリジンは、通常タンパク質表面に複数存在するため、均一な修飾が困難である他に大幅に活性が低下する場合もある。更に、抗体分子の修飾では、標的抗原と直接相互作用するCDR中のリジンを置換した場合には活性の低下や消失が懸念される。実際に、特定の一つの部位のリジン残基のみを残してその他のリジン残基を全て他のアミノ酸に置換してし、PEG化等の部位特異的化学修飾に成功した例はこれまでにない。
【0016】
従って、本発明の主な目的は、上記の課題を解決すべく、特定のリジン残基又はN末端アミノ基のみを部位特異的修飾できるような抗体の可変領域断片等を提供することを目的とする。
【課題を解決するための手段】
【0017】
本発明者は上記課題を解決すべく鋭意検討の結果、抗ヒト上皮細胞成長因子受容体1抗体528のヒト型化可変領域(CDR内も含む)のリジン残基を、公知の生殖配列データベースに基づき全て他のアミノ酸に置換したところ、若干の親和性の低下はみられたものの十分に結合活性を保持しており、更に、分子置換法により決定したヒト化型528抗体の立体構造を考慮しつつ、528ヒト型化可変領域のH鎖又はL鎖において1ヶ所のみを本来のリジンに再置換したところ、機能を保持していることが確認された。そこで、実際に化学修飾の例としてPEG化を行った結果、期待通りの部位特異的修飾、即ち、リジンに再置換された特定の位置に1分子だけPEGを付加させることに成功し、本発明を完成した。
【0018】
即ち、本発明は以下に示す各態様に係るものである。
[態様1]
配列番号2で示されるアミノ酸配列から成る抗ヒト上皮細胞成長因子受容体1(Her1)抗体528のL鎖のヒト型化可変領域(5L)において、全てのリジン残基又は特定の一つの部位のリジン残基以外の全てのリジン残基が他のアミノ酸に置換されて成る、ヒト型化抗EGFR抗体リジン置換L鎖可変領域断片。
[態様2]
5Lにおける108番目のリジン残基以外の全てのリジン残基が他のアミノ酸残基に置換されていることを特徴とする、態様1記載のリジン置換L鎖可変領域断片。
[態様3]
5Lにおける以下の置換の少なくとも一つを含む、態様1または2記載のリジン置換L鎖可変領域断片:
44番目のリジン残基がアルギニン残基、
55番目のリジン残基がグルタミン残基、
79番目のリジン残基がトレオニン残基、
108番目のリジン残基がグルタミン酸残基、又は、
112番目のリジン残基がグルタミン酸残基。
[態様4]
5Lにおける以下の置換を含む、態様1記載のリジン置換L鎖可変領域断片:
44番目のリジン残基がアルギニン残基、
55番目のリジン残基がグルタミン残基、
79番目のリジン残基がトレオニン残基、
108番目のリジン残基がグルタミン酸残基、及び
112番目のリジン残基がグルタミン酸残基。
[態様5]
配列番号4で示されるアミノ酸配列から成る抗ヒト上皮細胞成長因子受容体1(Her1)抗体528のH鎖のヒト型化可変領域(5H)において、全てのリジン残基又は特定の一つのリジン残基以外の全てのリジン残基が他のアミノ酸に置換されて成る、ヒト型化抗EGFR抗体リジン置換H鎖可変領域断片。
[態様6]
5Hにおける19番目のリジン残基以外のリジン残基が他のアミノ酸残基に置換されていることを特徴とする、態様5記載のリジン置換H鎖可変領域断片。
[態様7]
5Hにおける以下の置換の少なくとも一つを含む、態様5または6記載のリジン置換H鎖可変領域断片:
12番目のリジン残基がアラニン残基、
13番目のリジン残基がグルタミン酸残基、
19番目のリジン残基がグルタミン残基、
23番目のリジン残基がアラニン残基、
63番目のリジン残基がグルタミン酸残基、又は、
65番のリジン残基がグルタミン残基。
[態様8]
5Hにおける以下の置換を含む、態様5記載のリジン置換H鎖可変領域断片:
12番目のリジン残基がアラニン残基、
13番目のリジン残基がグルタミン酸残基、
19番目のリジン残基がグルタミン残基、
23番目のリジン残基がアラニン残基、
63番目のリジン残基がグルタミン酸残基、及び、
65番のリジン残基がグルタミン残基。
[態様9]
一つのリジン残基又はN末端アミノ基が部位特異的に修飾されている、態様1〜8のいずれか一項に記載のリジン置換L鎖可変領域断片又はリジン置換H鎖可変領域断片。
[態様10]
ポリエチレングリコールによって部位特異的に修飾されている態様9記載のリジン置換L鎖可変領域断片又はリジン置換H鎖可変領域断片。
[態様11]
態様1〜4、9又は10記載のリジン置換L鎖可変領域断片及び態様5〜8、9又は10記載のリジン置換H鎖可変領域断片を構成要素として含む抗体分子。
[態様12]IgG型抗体分子、一本鎖抗体(scFv)、一本鎖抗体の二量体、二重特異性抗体、ダイアボディ型二重特異性抗体、高機能性二重特異性抗体又は多量体化低分子抗体から成る群から選択される、態様11記載の抗体分子。
[態様13]
リジン置換L鎖可変領域断片又はリジン置換H鎖可変領域断片に含まれる一つのリジン残基が架橋されてなる、態様12記載の二量体。
[態様14]
抗CD3抗体OKT3のL鎖のヒト型化可変領域(OL)、及び、抗CD3抗体OKT3のH鎖のヒト型化可変領域(OH)が、夫々、配列番号6及び配列番号8で示されるアミノ酸配列から成る、態様11記載のダイアボディ型二重特異性抗体。
[態様15]態様11〜14のいずれか一項に記載の抗体分子を構成する一本鎖ポリペプチド。
[態様16]態様1〜8のいずれか一項に記載のリジン置換可変領域断片、又は、態様15に記載の一本鎖ポリペプチドをコードする核酸分子。
[態様17]態様11〜14のいずれか一項に記載の抗体分子を構成する2種類の一本鎖ポリペプチドを共にコードする核酸分子。
[態様18]態様16又は17記載の核酸分子を含有する複製可能なクローニングベクター又は発現ベクター。
[態様19]共発現ベクターである、態様18記載のベクター。
[態様20]プラスミドベクターである、態様18又は19記載のベクター。
[態様21]態様19ないし20のいずれか一項に記載のベクターで形質転換された宿主細胞。
[態様22]態様11又は12記載の抗体分子の製造方法であって、態様21に記載の宿主細胞を培養し、該抗体分子を構成する2種類の一本鎖ポリペプチドを発現させ、該ポリペプチドを回収・精製し、該2種類の一本鎖ポリペプチドを会合させ、形成された抗体分子を分離・回収することから成る、前記方法。
[態様23]原核細胞が大腸菌であり、2種類の一本鎖ポリペプチドを大腸菌の培養培地上清、ペリズマ画分、菌体内可溶性画分、又は、菌体内不溶性画分から回収する、態様22記載の製造方法。
[態様24]態様14記載の抗体分子の製造方法であって、態様19記載の共発現ベクターで形質転換された宿主細胞を培養し該抗体分子を構成する2種類の一本鎖ポリペプチドを発現させ、該形質転換菌内でダイアボディ型二重特異性抗体を形成せしめ、形成された二重特異性抗体を分離・回収することから成る、前記方法。
[態様25] 態様11〜14のいずれか一項に記載の抗体分子を有効成分として含有することを特徴とする医薬組成物。
[態様26]腫瘍細胞を排除する、殺傷する、傷害する及び/又は減少せしめるためのものであることを特徴とする態様25記載の医薬組成物。
【発明の効果】
【0019】
本発明のヒト型化抗EGFR抗体リジン置換L鎖又は同H鎖可変領域断片、又はそれらから構成される一本鎖抗体は、そこに含まれるリジン残基を特定の1箇所に制限することによっても標的細胞に対する結合活性(親和性)を十分に保持していることが確認された。この結果、様々な化学修飾を部位特異的にかつ均一に達成することができた。
ヒト型化抗EGFR抗体リジン置換L鎖可変領域断片及び同H鎖可変領域断片から構成される一本鎖抗体に残るリジン残基を介して化学架橋剤を用いて連結させて得られた二量体には期待通りの増殖抑制効果がみられ、架橋剤の長さに応じた効果の増強もみられた。
更に、ポリエチレングリコールで特定のリジン残基のみを部位特異的に化学修飾した可変領域断片を含むヒト型化ダイアボディ型二重特異性抗体が元のヒト型化ダイアボディ型二重特異性抗体と同様の抗原結合活性を有していることが確認された。
【図面の簡単な説明】
【0020】
【図1】フローサイトメトリーによる一本鎖抗体(リジン置換scFv)のA431細胞に対する結合活性の結果を示す。
【図2】リジン置換scFvのPEG化を示す。
【図3】リジン置換scFvの二量体化の手法を示す。
【図4】リジン置換scFvの二量体の細胞増殖阻害活性を示す。
【図5】PEG化ダイアボディ型二重特異性抗体の調製の様子を示す。
【図6】フローサイトメトリーによるPEG化ダイアボディ型二重特異性抗体の結合活性を示す
【発明を実施するための形態】
【0021】
本発明のヒト型化抗EGFR抗体リジン置換L鎖可変領域断片又はヒト型化抗EGFR抗体リジン置換H鎖可変領域断片(この両者をまとめて、「リジン置換可変領域断片」ともいう)は、夫々、配列番号2又は配列番号4で示されるアミノ酸配列から成る抗ヒト上皮細胞成長因子受容体1(Her1)抗体528のL鎖のヒト型化可変領域(5L)又はH鎖のヒト型化可変領域(5H)において、全てのリジン残基、又は、任意に選択される特定の一つの部位のリジン残基以外の全てのリジン残基を他のアミノ酸が置換されて成ることを特徴とする。
【0022】
5Lには、配列番号2で示されるアミノ酸配列において、44、55、79、108、及び112番目の5ヶ所所にリジン残基があり、その中の任意の特定の一つのリジン残基を残すことが出来る。例えば、実施例では5Lの108番目のリジン残基以外のリジン残基が他のアミノ酸残基に置換されている。
【0023】
一方、5Hには、配列番号4で示されるアミノ酸配列において、12、13、19、23,63及び65番目の6ヶ所所にリジン残基があり、その中の任意の特定の一つの部位のリジン残基を残すことが出来る。例えば、実施例では5Hの19番目のリジン残基以外のリジン残基が他のアミノ酸残基に置換されている。
【0024】
リジン残基と置換される他のアミノ酸残基の種類に特に制限はない。例えば、ヒト型化抗体528の結晶構造を参考にし、あるいは、当業者に公知の抗体の生殖配列データベース(非特許文献8)を利用して各々の位置での存在確率の高いアミノ酸を選択し、部位特異的変異導入法を用いてこれらのアミノ酸への置換を行って本願発明のH鎖可変領域断片及びL鎖可変領域断片を作製することができる、更に、それらから成る一本鎖抗体(scFv)を当業者に公知の方法を用いて調製し、その後、例えば、ヒト扁平上皮がん細胞株であるA431細胞(ATCC No.CRL-1555)のようなEGFRを発現している適当な細胞に対する結合活性(親和性)を測定することによって、リジン残基置換前の一本鎖抗体(h528scFv)の活性が実質的に保持されているものを容易に選択することが出来る。
【0025】
例えば、5Lにおける各リジン残基の置換の具体例として以下の置換例を挙げることが出来る:
44番目のリジン残基がアルギニン残基、
55番目のリジン残基がグルタミン残基、
79番目のリジン残基がトレオニン残基、
108番目のリジン残基がグルタミン酸残基、又は、
112番目のリジン残基がグルタミン酸残基。
【0026】
又は、5Hにおける各リジン残基の置換の具体例として以下の置換例を挙げることが出来る:
5Hにおける以下の置換:
12番目のリジン残基がアラニン残基、
13番目のリジン残基がグルタミン酸残基、
19番目のリジン残基がグルタミン残基、
23番目のリジン残基がアラニン残基、
63番目のリジン残基がグルタミン酸残基、又は、
65番のリジン残基がグルタミン残基。
【0027】
本発明のリジン置換可変領域断片は上記の全てのリジン残基、又は、任意に選択される特定の一つの部位のリジン残基以外の全てのリジン残基が他のアミノ酸と置換されているので、適当な条件下で、係る特定の一つのリジン残基又はN末端アミノ基を部位特異的に修飾することができる。このような部位特異的修飾を利用して、例えば、抗体の体内半減期の低下及び親和性の低下等を防ぐ機能を有するポリエチレングリコール(PEG化)又は適当な薬剤(抗癌剤、放射性同位体等)を本発明のリジン置換可変領域断片の特定の一つのリジン残基又はN末端アミノ基に結合させることが可能となる。
【0028】
本発明のリジン置換可変領域断片を構成要素として、様々な型の抗体分子を作製することが出来る。この例として、例えば、通常のIgG型抗体分子、一本鎖抗体(scFv)、一本鎖抗体の二量体、二重特異性抗体、ダイアボディ型二重特異性抗体(特許文献1)、高機能性二重特異性抗体(特許文献2)又は多量体化低分子抗体(特許文献3)を挙げることが出来る。
【0029】
本発明のリジン置換L鎖可変領域断片及びリジン置換H鎖可変領域断片を含む一本鎖抗体は従来技術を用いて容易に作製することが出来る。以下の実施例で示されるように、従来技術からは予想外なことに、この一本鎖抗体(特定の一つの位置のみにリジン残基を含む)はリジン残基置換前の一本鎖抗体(h528scFv)の活性を実質的に保持していることが確認された。
【0030】
このような一本鎖抗体に含まれる特定の一つの部位のリジン残基又はN末端アミノ基を介して互いに架橋することによって二量体等の多量体を調製することが出来る。例えば、二量体において特定の一つのリジン残基はL鎖又はH鎖のいずれに存在させることも出来る。二量体を構成する各一本鎖抗体に含まれる一つのリジン残基の部位がH鎖にある場合(HK)には「HK−HK」、共にL鎖にある場合(LK)には「LK−LK」という構造のホモ二量体となる。一方の一本鎖抗体に含まれる一つのリジン残基の部位がL鎖にあり、もう一方の一本鎖抗体に含まれる一つのリジン残基の部位がH鎖にある場合には、LKとHKとから成る二量体となる。
【0031】
更に、本発明の一本鎖抗体を他の抗原特異性を有する一本鎖抗体と架橋させることによって、二重特異性抗体を容易に作製することも出来る。
【0032】
架橋反応は、例えば、SANH(succinimidyl 4-hydrazinonicotinate acetone hydrazone)及びSFB(succinimidyl 4-formylbenzoate) 等の当業者に公知の適当な架橋試薬を用いて行うことができる。架橋距離の異なる架橋試薬を用いて各一本鎖抗体の間の距離を自由に調整することが出来る。更に、分岐数の多い化学架橋剤を用いることで、高多価の分子を容易に作製することも出来る。
【0033】
ヒト型化高機能性二重特異性抗体(BsAb)に含まれる様々な型の具体的な構造及びその製造方法は国際公開第WO2007/108152号パンフレット(特許文献2)に詳細に記載されている。本発明のBsAbに含まれる定常領域又はFc領域はヒト抗体に由来するものである限り特に制限はない。例えば、CLはκまたはλ鎖の何れに由来するものでも良い。又、Fc領域又はH鎖定常領域は、通常、IgGのγ鎖に由来するものが使用される。CH1、CH2及びCH3、並びにCLの一例として、夫々、特許文献2に開示された配列番号29及び配列番号30、配列番号33に示したアミノ酸配列を有するものを挙げることができる。
【0034】
このBsAbを構成する一本鎖ポリペプチドに含まれる、PreSission配列、ヒンジ領域、ペプチドリンカー、シグナルペプチド等のアミノ酸配列の代表例として、特許文献2の図3−3及び図3−4に開示された配列を挙げることが出来る。尚、PreSission配列はプロテアーゼ切断部位を含む配列である。使用するプロテアーゼの種類に特に制限はなく、例えば、Thrombin及びFactor Xa等の当業者に公知の酵素を使用することが出来、それに応じて、プロテアーゼ切断部位を含むアミノ酸配列を適宜選択することが出来る。
【0035】
又、ヒト型化ダイアボディ型二重特異性抗体及び上記高機能性二重特異性抗体等を構成する各ポリペプチドにおいて、L鎖可変領域がH鎖可変領域のN末側にあること(LH型)を特徴とする各種の抗体(抗体分子)も本発明に含まれる。ヒト型化ダイアボディ型二重特異性抗体においては、本発明の各リジン置換可変領域断片と同様に、生殖配列データベースを基に抗CD3抗体のH鎖及びL鎖可変領域断片の完全リジン置換体(含まれる全てのリジン残基を他のアミノ酸残基に置換したもの)を作製し、本発明の各リジン置換可変領域断片と組み合わせて各種の二重特異性抗体を構築することが出来る。
【0036】
更に、上記の一本鎖抗体(scFv)から構成される多量体化低分子抗体は、特許文献3に詳細に記載されている。該多量体化低分子抗体は、例えば、2〜4個の該一本鎖抗体が会合して成り、更に、各一本鎖抗体においてN末端側にあるリジン置換可変領域断片のC末端の1ないし数個のアミノ酸、又は、C末端側にあるリジン置換可変領域断片のN末端の1ないし数個のアミノ酸が除去されていても良い。従って、本発明のリジン置換L鎖可変領域断片又はリジン置換H鎖可変領域断片を含む一本鎖抗体も特許文献3に記載の多量体化低分子抗体の構成要素として使用することが出来る。
【0037】
更に、ポリエチレングリコール等によって部位特異的に修飾されている本発明のリジン置換可変領域断片を構成要素として含む上記の各抗体分子は、本発明のリジン置換可変領域断片を構成要素として含む抗体分子を作製した後に、PEG化等の当業者に公知の適当な化学的修飾方法で容易に調製することが出来る。
【0038】
抗EGFR抗体産生マウスB細胞ハイブリドーマ528は、東北大学加齢医学研究所付属医用細胞資源センターに寄託されている(ID:TKG0555)。更に、528抗体を産生するハイブリドーマはアメリカン・タイプ・カルチャー・コレクション(ATCC)においてATCC No.HB-8509 として保管されており、かかる寄託機関からも容易に入手可能である。
【0039】
一方、抗CD3抗体OKT3も東北大学加齢医学研究所付属医用細胞資源センターに寄託されている(ID:TKG0235)。又、OKT3抗体を産生するハイブリドーマはアメリカン・タイプ・カルチャー・コレクション(ATCC)においてATCC No.CRL-8001 として保管されており、かかる寄託機関からも容易に入手可能である。
【0040】
これらを用いて、当業者に公知の方法によってcDNAを調製することが出来る。例えば、ISOGEN(ニッポンジーン社)を用いmRNAを抽出、First-Strand cDNA Synthesis Kit(Amersham Biosciences社)によりcDNAを調製し、参考論文(Krebber, A. et al. Reliable cloning of functional antibody variable domains from hybridomas and spleen cell repertoires employing a reengineered phage display system. J Immunol Methods 201, 35-55. (1997))に基づき合成したクローニングプライマーを用いPCRを行いこれら各抗体のH鎖及びL鎖の可変領域の配列を決定することができる。
【0041】
本発明のリジン置換可変領域断片又は抗体分子を構成する一本鎖ポリペプチドに含まれる可変領域の「ヒト型化」とは、ヒト免疫グロブリン(レシピエント抗体)のヒト型化可変領域における相補性決定領域 (complementarity-determining region; CDR)の残基の少なくとも一部において、マウス、ラット、またはウサギといったような非ヒト動物(ドナー抗体)であり且つ所望の特異性、親和性、および能力を有するCDR に由来する残基によって置換されている抗体を意味する。いくつかの場合において、ヒト免疫グロブリンのFvフレームワーク(FR)残基が対応する非ヒト残基によって置換される場合もある。さらに、ヒト型化抗体は、レシピエント抗体および導入されたCDR またはフレームワーク配列のいずれにおいても見出されない残基を含み得る。これらの改変は、抗体の性能をさらに優れたものあるいは最適なものとするために行われる。更に詳しくは、Jones et al., Nature 321, 522-525 (1986); Reichmann et al., Nature 332, 323-329 (1988);EP-B-239400; Presta, Curr. Op. Struct. Biol. 2, 593-596(1992); およびEP-B-451216 を参照することができる。
【0042】
このような抗体のヒト型化可変領域のヒト型化は当業者に公知の方法に従って実施することが出来る。例えば、レシピエント抗体及びドナー抗体の3次元イムノグロブリンモデルを使用し、種々の概念的ヒト型化生成物を分析する工程により、ヒト型化抗体が調製される。3次元イムノグロブリンモデルは、当業者にはよく知られている。更に詳細については、WO92/22653等を参照することができる。
【0043】
従って、ヒト型化されたヒト型化可変領域の例として、ヒト型化可変領域における相補性決定領域(CDR)がマウス抗体由来であり、その他の部分がヒト抗体由来である抗体を挙げることができる。
【0044】
本発明では更に、ヒト型化によって抗体自身の機能低下等が生起する場合があるので、一本鎖ポリペプチド中の適当な部位、例えば、CDR構造に影響を与える可能性があるフレームワーク(FR)中の部位、例えば、canonical 配列又はvernier 配列において部位特異的変異を起こさせることによってヒト型化抗体の機能の改善をすることが出来る。
【0045】
具体的には、528ヒト型化可変領域のヒト型化はCDR grafting法により行った。まずVH、VLそれぞれ相同性検索を行い、各CDR(complementarity determining region)の長さ等を考慮した上でもっとも相同性の高いFR(frame work)をもつヒト抗体配列を選択する。選択したヒト抗体のCDRを528のCDRと入れ換えたアミノ酸配列を設計し、対応するコドンについては先と同様に大腸菌至適コドンを用いることが好ましく、オーバーラップPCR法により遺伝子の全合成を行うことが出来る。
【0046】
又、ヒト型化OKT3ヒト型化可変領域はすでに報告されており、マウスOKT3に比べて十分に活性を保持していることも確かめられている(Adair, J. R. et al. Humanization of the murine anti-human CD3 monoclonal antibody OKT3. Hum Antibodies Hybridomas 5, 41-7. (1994))。この文献に記載されているヒト型化OKT3ヒト型化可変領域のアミノ酸配列を基に、オーバーラップPCR法により遺伝子の全合成を行った。この際にコドンは大腸菌における至適コドンを用いることが好ましく、至適コドンに置換した全合成遺伝子を用いることでの大腸菌における発現量の増加はすでに報告されている。
【0047】
本発明の各種抗体分子の書く構成要素の基となる、抗ヒト上皮細胞成長因子受容体1抗体528のL鎖のヒト型化可変領域(5L)、抗ヒト上皮細胞成長因子受容体1抗体528のH鎖のヒト型化可変領域(5H)、抗CD3抗体OKT3のL鎖のヒト型化可変領域(OL)、及び、抗CD3抗体OKT3のH鎖のヒト型化可変領域(OH)の塩基配列及びそれがコードするアミノ酸配列の一例を、夫々、配列番号1及び2、配列番号3及び4、配列番号5及び6、並びに、配列番号7及び8で示す。
【0048】
各一本鎖ポリペプチドにおけるリジン置換L鎖可変領域断片及びリジン置換H鎖可変領域断片は適当なペプチドリンカーで連結されていることが好ましい。該ペプチドリンカーは、一本鎖抗体の分子内での相互作用を困難にし、複数の一本鎖抗体による多量体の形成を可能ならしめ、その結果、互いに別の一本鎖抗体に由来するVHとVLが適切に会合することによって、オリジナルのタンパク質(当該ポリペプチドは該オリジナルのタンパク質に由来するものあるいは該オリジナルのタンパク質から誘導されたものである)の機能、例えば生物活性などの一部あるいはその全てを模擬又は促進する構造をとることができるようなものであれば特に限定されず、例えば当該分野で広く知られたものあるいは該公知のリンカーを改変したものの中から選択して使用することが可能である。例えば、ペプチドリンカーは1〜20個、好ましくは1〜15個、より好ましくは2〜10個のアミノ酸の長さであることが好ましい。
【0049】
更に、各一本鎖ポリペプチドは上記のペプチドリンカーを含まずに、二つのリジン置換可変領域断片が直接結合していても良い。このような場合には、各一本鎖抗体の三次元的自由度を高めて多量体化を促進させるために、各一本鎖ポリペプチドにおいてN末端側にあるリジン置換可変領域断片のC末端の1ないし数個のアミノ酸、又は、C末端側にあるリジン置換可変領域断片のN末端の1ないし数個のアミノ酸が除去されていることが好ましい。
【0050】
更に、上記の各配列番号で示される各アミノ酸配列において、一個又は数個のアミノ酸が置換、欠失、挿入若しくは付加されたアミノ酸配列(但し、配列番号4において本発明のリジン置換可変領域断片が有するアミノ酸変異は保持される)であって、元のアミノ酸配列からなるポリペプチドの機能・活性、例えば、リジン置換可変領域断片の抗原特異性と実質的に保持しているアミノ酸配列も本発明の抗体分子を構成する一本鎖抗体のポリペプチドとして使用することが出来る。欠失、置換、挿入若しくは付加されるアミノ酸は、好ましくは、同族アミノ酸(極性・非極性アミノ酸、疎水性・親水性アミノ酸、陽性・陰性荷電アミノ酸、芳香族アミノ酸など)同士が置換されるか、又は、アミノ酸の欠失若しくは付加によって、蛋白質の三次元構造及び/又は局所的電荷状態に大きな変化が生じない、又は、実質的にそれらが影響を受けないようなものが好ましい。このような欠失、置換又は付加されるアミノ酸を有するポリペプチドは、例えば、部位特異的変異導入法(点突然変異導入及びカセット式変異導入等)、遺伝子相同組換え法、プライマー伸長法、及びPCR法等の当業者に周知の方法を適宜組み合わせて、容易に作製することが可能である。尚、これらの一個又は数個のアミノ酸が置換、欠失、挿入若しくは付加されたアミノ酸配列は、元のアミノ酸配列全長に対して、90%以上、好ましくは95%以上、更に好ましくは99%以上の配列相同性(同一性)を示すものということもできる。
【0051】
本発明のリジン置換可変領域断片及び各抗体分子に含まれる一本鎖ポリペプチドに含まれる各領域又は配列をコードする核酸分子(オリゴヌクレオチド)の代表例は、上記の各配列番号に示された塩基配列を有するものである。その他に、各配列番号に記載の塩基配列の全長と90%以上、好ましくは95%以上、更に好ましくは99%以上の配列相同性を示すような塩基配列から成る核酸分子(但し、配列番号4における本発明のリジン置換可変領域断片が有するアミノ酸変異は保持される)は、上記の各領域又は配列と実質的に同等の活性又は機能を有するポリペプチドをコードしていると考えられるので、これらの核酸分子も上記の本発明の核酸に含まれる。このような核酸分子には本発明のダイアボディ型二重特異性抗体を構成する2種類の一本鎖ポリペプチドの少なくともいずれか一つのポリペプチドをコードする塩基配列が含まれているが、2種類の一本鎖ポリペプチドを夫々コードする2種類に塩基配列が共に含まれていることが好ましい。
【0052】
2つのアミノ酸配列又は塩基配列における配列相同性を決定するために、配列は比較に最適な状態に前処理される。例えば、一方の配列にギャップを入れることにより、他方の配列とのアラインメントの最適化を行なう。その後、各部位におけるアミノ酸残基又は塩基が比較される。第一の配列におけるある部位に、第二の配列の相当する部位と同じアミノ酸残基又は塩基が存在する場合、それらの配列は、その部位において同一である。2つの配列における配列相同性は、配列間での同一である部位数の全部位(全アミノ酸又は全塩基)数に対する百分率で示される。
【0053】
ここで、「相同性(同一性)」とは、ポリペプチド配列(あるいはアミノ酸配列)又はポリヌクレオチド配列(あるいは塩基配列)における2本の鎖の間で該鎖を構成している各アミノ酸残基同志又は各塩基同士の互いの適合関係において同一であると決定できるようなものの量(数)を意味し、二つのポリペプチド配列又は二つのポリヌクレオチド配列の間の配列相関性の程度を意味するものである。相同性は容易に算出できる。二つのポリヌクレオチド配列又はポリペプチド配列間の相同性を測定する方法は数多く知られており、「相同性」なる用語は、当業者には周知である (例えば、Lesk, A. M. (Ed.), Computational Molecular Biology, Oxford University Press, New York, (1988);Smith, D. W. (Ed.), Biocomputing: Informatics and Genome Projects, Academic Press, New York, (1993); Grifin, A. M. & Grifin, H. G. (Ed.), Computer Analysis of Sequence Data: Part I, Human Press, New Jersey, (1994);von Heinje, G., Sequence Analysis in Molecular Biology, Academic Press,New York, (1987); Gribskov, M. & Devereux, J. (Ed.), Sequence Analysis Primer, M-Stockton Press, New York, (1991) 等) 。二つの配列の相同性を測定するのに用いる一般的な方法には、Martin, J. Bishop (Ed.), Guide to Huge Computers, Academic Press, San Diego, (1994); Carillo, H. & Lipman, D., SIAM J. Applied Math., 48: 1073 (1988) 等に開示されているものが挙げられるが、これらに限定されるものではない。相同性を測定するための好ましい方法としては、試験する二つの配列間の最も大きな適合関係部分を得るように設計したものが挙げられる。このような方法は、コンピュータープログラムとして組み立てられているものが挙げられる。二つの配列間の相同性を測定するための好ましいコンピュータープログラム法としては、GCG プログラムパッケージ (Devereux, J. et al., Nucleic Acids Research, 12(1): 387 (1984)) 、BLASTP、BLASTN、FASTA (Atschul, S. F. et al., J. Molec. Biol., 215: 403 (1990)) 等が挙げられるが、これらに限定されるものでなく、当該分野で公知の方法を使用することができる。
【0054】
更に、上記の各核酸分子は、各配列番号で表される塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつ上記配列番号で示された各ポリペプチドの機能・活性と実質的に同じものを有するポリペプチドをコードするDNAを含むものである。
【0055】
ここで、ハイブリダイゼーションは、Molecular cloning third.ed.(Cold Spring Harbor Lab.Press,2001)に記載の方法等、当業界で公知の方法あるいはそれに準じる方法に従って行なうことができる。また、市販のライブラリーを使用する場合、添付の使用説明書に記載の方法に従って行なうことができる。
【0056】
ハイブリダイゼーションは、例えば、カレント・プロトコールズ・イン・モレキュラー・バイオロジー(Current protocols in molecular biology(edited by Frederick M. Ausubel et al., 1987))に記載の方法等、当業界で公知の方法あるいはそれに準じる方法に従って行なうことができる。また、市販のライブラリーを使用する場合、添付の使用説明書に記載の方法に従って行なうことができる。
【0057】
本明細書において、DNAのハイブリダイズにおける「ストリンジェント(stringent)な条件」は、塩濃度、有機溶媒(例えば、ホルムアミド)、温度、及びその他公知の条件の適当な組み合わせによって定義される。すなわち、塩濃度を減じるか、有機溶媒濃度を増加させるか、またはハイブリダイゼーション温度を上昇させるかによってストリンジェンシー(stringency)は増加する。更に、ハイブリダイゼーション後の洗浄の条件もストリンジェンシーに影響する。この洗浄条件もまた、塩濃度と温度によって定義され、塩濃度の減少と温度の上昇によって洗浄のストリンジェンシーは増加する。
【0058】
従って、「ストリンジェントな条件」とは、各塩基配列間の相同性の程度が、例えば、全体の平均で約80%以上、好ましくは約90%以上、より好ましくは約95%以上であるような、高い相同性を有する塩基配列間のみで、特異的にハイブリッドが形成されるような条件を意味する。具体的には、例えば、温度60℃〜68℃において、ナトリウム濃度150〜900mM、好ましくは600〜900mM、pH 6〜8であるような条件を挙げることが出来る。ストリンジェントな条件の一具体例としては、5 x SSC (750 mM NaCl、75 mM クエン酸三ナトリウム)、1% SDS、5 x デンハルト溶液50% ホルムアルデヒド、及び42℃の条件でハイブリダイゼーションを行い、0.1 x SSC (15 mM NaCl、1.5 mM クエン酸三ナトリウム)、0.1% SDS、及び55℃の条件で洗浄を行うものである。
【0059】
更に、各一本鎖ポリペプチドにおけるリジン置換可変領域断片をコードする核酸を作製する場合には、予め設計されたアミノ酸配列に基づきオーバーラップPCR法により全合成することができる。尚、「核酸」とは、一本鎖ポリペプチドをコードする分子であれば、その化学構造及び取得経路に特に制限はなく、例えば、gDNA、cDNA、化学合成DNA及びmRNA等を含むものものである。
【0060】
具体的には、cDNAライブラリーから、文献記載の配列に基づいてハイブリダイゼーションにより、あるいはポリメラーゼチェインリアクション(PCR) 技術により単離されうる。一旦単離されれば、DNA は発現ベクター中に配置され、次いでこれを、大腸菌(E. coli )細胞、COS 細胞、チャイニーズハムスター卵巣細胞(CHO細胞) 、またはイムノグロブリンを産生しないミエローマ細胞等の宿主細胞にトランスフェクションさせ、該組換え宿主細胞中でモノクローナル抗体を合成させることができる。PCR 反応は、当該分野で公知の方法あるいはそれと実質的に同様な方法や改変法により行うことができるが、例えば R. Saiki, et al., Science, 230: 1350, 1985; R. Saiki, et al., Science, 239: 487, 1988 ; H. A. Erlich ed., PCR Technology, Stockton Press, 1989 ; D. M. Glover et al. ed., “DNA Cloning", 2nd ed., Vol. 1, (The Practical Approach Series), IRL Press, Oxford University Press (1995) ; M. A. Innis et al. ed., “PCR Protocols: a guide to methods and applications", Academic Press, New York (1990)); M. J. McPherson, P. Quirke and G. R. Taylor (Ed.), PCR: a practical approach, IRL Press, Oxford (1991); M. A. Frohman et al., Proc. Natl. Acad. Sci. USA, 85, 8998-9002 (1988)などに記載された方法あるいはそれを修飾したり、改変した方法に従って行うことができる。また、PCR 法は、それに適した市販のキットを用いて行うことができ、キット製造業者あるいはキット販売業者により明らかにされているプロトコルに従って実施することもできる。
【0061】
DNA など核酸の配列決定は、例えばSanger et al., Proc. Natl. Acad. Sci. USA 74: 5463-5467 (1977)などを参考にすることができる。また一般的な組換えDNA 技術は、J. Sambrook, E. F. Fritsch & T. Maniatis (ed.), “Molecular Cloning: A Laboratory Manual (2nd edition)", Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York (1989)及び D. M. Glover et al. (ed.), “DNA Cloning", 2nd ed., Vol. 1 to 4, (The Practical Approach Series), IRL Press, Oxford University Press (1995) などを参考にできる。
【0062】
こうして取得された本発明の抗体分子を構成する一本鎖ポリペプチド又はそれに含まれる各領域をコードする核酸は、目的に応じて、当業者に公知の手段により適宜所望のペプチド又はアミノ酸をコードするように改変することができる。この様にDNA を遺伝子的に改変又は修飾する技術は、Mutagenesis: a Practical Approach, M.J.Mcpherson (Ed.), (IRL Press, Oxford, UK(1991) における総説において示されており、例えば、位置指定変異導入法(部位特異的変異導入法)、カセット変異誘発法及びポリメラーゼチェインリアクション(PCR) 変異生成法を挙げることができる。
【0063】
ここで、核酸の「改変」とは、得られたオリジナルの核酸において、アミノ酸残基をコードする少なくとも一つのコドンにおける、塩基の挿入、欠失または置換を意味する。例えば、オリジナルのアミノ酸残基をコードするコドンを、別のアミノ酸残基をコードするコドンにより置換することにより一本鎖ポリペプチドを構成するアミノ酸配列自体を改変する方法がある。
【0064】
又は、本明細書の実施例に記載されているように、アミノ酸自体は変更せずに、大腸菌等の宿主細胞にあったコドン(至適コドン)を使用するように、一本鎖ポリペプチドをコードする核酸を改変することも出来る。このように至適コドンに改変することによって、宿主細胞内における一本鎖ポリペプチドの発現効率等の向上を図ることが出来る。
【0065】
本発明の抗体分子は、当業者に公知の方法、例えば、遺伝子工学的手法又は化学合成等の各種手段を用いて製造することが出来る。遺伝子工学的手法としては、例えば、該二重特異性抗体を構成する夫々の一本鎖抗体のポリペプチドをコードする核酸を含有する複製可能なクローニングベクター又は発現ベクターを作製し、このベクターで宿主細胞を形質転換せしめ、該形質転換された宿主細胞を培養して宿主細胞中で一本鎖ポリペプチドを発現させ、該ポリペプチドを回収・精製し、それらの一本鎖ポリペプチドを会合させ、形成された抗体分子を分離・回収することによって製造することが出来る。
【0066】
ここで、「複製可能な発現ベクター(replicable expression vector)」および「発現ベクター(expression vector) 」は、DNA(通常は二本鎖である)の断片(piece) をいい、該DNAは、その中に外来のDNAの断片を挿入せしめることができる。外来のDNAは、異種DNA (heterologous DNA)として定義され、このものは、対象宿主細胞においては天然では見出されないDNA である。ベクターは、外来DNAまたは異種DNA を適切な宿主細胞に運ぶために使用される。一旦、宿主細胞中に入ると、ベクターは、宿主染色体DNA とは独立に複製することが可能であり、そしてベクターおよびその挿入された(外来)DNA のいくつかのコピーが生成され得る。さらに、ベクターは外来DNAのポリペプチドへの翻訳を可能にするのに不可欠なエレメントを含む。従って、外来DNAによってコードされるポリペプチドの多くの分子が迅速に合成されることができる。
【0067】
このようなベクターは、適切な宿主中で DNA配列を発現するように、適切な制御配列(control sequence)とそれが機能するように(operably)(即ち、外来DNAが発現できるように)連結せしめられたDNA配列を含有する DNA構築物(DNA construct) を意味している。そうした制御配列としては、転写(transcription) させるためのプロモーター、そうした転写を制御するための任意のオペレーター配列、適切なmRNAリボソーム結合部位をコードしている配列、エンハンサー、リアデニル化配列、及び転写や翻訳(translation) の終了を制御する配列等が挙げられる。更にベクターは、、当業者に公知の各種の配列、例えば、制限酵素切断部位、薬剤耐性遺伝子等のマーカー遺伝子(選択遺伝子)、シグナル配列、リーダー配列等を必要に応じて適宜含むことが出来る。これらの各種配列又は要素は、外来DNAの種類、使用する宿主細胞、培養培地等の条件に応じて、当業者が適宜選択して使用することが出来る。更に、製造した一本鎖ポリペプチドの検出及び精製等を容易にする目的のために、当業者に公知の各種のペプチドタグ(例えば、c−mycタグ及びHis−tag)をコードする配列を一本鎖ポリペプチドに対応する配列の末端等に含ませることが出来る。
【0068】
該ベクターは、プラスミド、ファージ粒子、あるいは単純にゲノムの挿入体(genomic insert)等の任意の形態が可能である。一旦、適切な宿主の中に形質転換で導入せしめられると、該ベクターは宿住のゲノムとは独立して複製したり機能するものであり得る。又は、該ベクターはゲノムの中に組み込まれるものであってもよい。
【0069】
宿主細胞としては当業者に公知の任意の細胞を使用することができるが、例えば、代表的な宿主細胞としては、大腸菌(E. coli) 等の原核細胞、及び、チャイニーズハムスター卵巣細胞(CHO細胞) 、ヒト由来細胞などの哺乳動物細胞、酵母、昆虫細胞等の真核細胞が挙げることができる。形質転換菌は当業者に公知の任意の抵当な条件・方法で培養することができる。宿主として、例えば、BL21 star(DE3)株、培地として2xYT培地、培養温度28℃前後、0.5 mM 程度のIPTGで発現を誘導することによって、培養上清又は可溶性画分における本発明の抗体分子の収量を大幅に向上させることができ、製造効率を高めることが可能となる。
【0070】
このような宿主細胞における発現等により得られた一本鎖ポリペプチドは一般に分泌されたポリペプチドとして培養培地から回収されるが、それが分泌シグナルを持たずに直接に産生された場合には宿主細胞溶解物から回収することが出来る。一本鎖ポリペプチドが膜結合性である場合には、適当な洗浄剤(例えば、トライトン-X100) を使用して膜から遊離せしめることができる。
【0071】
精製操作は当業者に公知の任の方法を適宜組み合わせて行うことが出来る。例えば、必用に応じてPEG化等の化学修飾を行った後、遠心分離、ヒドロキシルアパタイトクロマトグラフィー、ゲル電気泳動、透析、イオン交換カラム上での分画、エタノール沈殿、逆相HPLC、シリカでのクロマトグラフィー、ヘパリンセファロースでのクロマトグラフィー、陰イオンまたは陽イオン樹脂クロマトグラフィー(ポリアスパラギン酸カラム等)、クロマトフォーカシング、SDS-PAGE、硫酸アンモニウム沈殿、及びアフィニティクロマトグラフィーによって好適に精製される。アフィニティクロマトグラフィーは、一本鎖ポリペプチドが有するぺプチドタグとの親和力を利用した効率が高い好ましい精製技術の一つである。
【0072】
尚、回収された一本鎖ポリペプチドは不溶性画分に含まれていることも多いために、精製操作は、一本鎖ポリペプチドを可溶化し変性状態にした上で行うことが好ましい。この可溶化処理は、エタノールなどのアルコール類、グアニジン塩酸塩、尿素などの解離剤として当業者に公知の任意の薬剤を使用して行うことが出来る。更に、こうして精製された2種類の一本鎖ポリペプチドを会合(巻き戻し)せしめ、形成された抗体分子を分離して回収することによって、本発明の抗体分子を製造することが出来る。
【0073】
会合処理は、単独の一本鎖ポリペプチドを適切な空間的配置に戻すことによって、所望の生物活性を有する状態に戻すことを意味する。従って、会合処理は、ポリペプチド同志あるいはドメイン同志を会合した状態に戻すという意味も有しているので「再会合」ともいうことができるし、所望の生物活性を有するものにするという意味で、再構成ということもでき、或いは、リフォールディング (refolding)とも呼ぶことが出来る。会合処理は当業者に公知の任意の方法で行うことが出来るが、例えば、透析操作により、一本鎖ポリペプチドを含むバッファ溶液中の変性剤(例えば、塩酸グアニジン)の濃度を段階的に下げる方法が好ましい。この過程で、凝集抑制剤、及び酸化剤を反応系に適宜添加することによって、酸化反応の促進を図ることも可能である。形成された多量体化低分子抗体の分離及び回収も当業者に公知の任意の方法で行うことが出来る。
【0074】
以上に示したように、本発明の抗体分子は、例えば、大腸菌など培養宿主細胞の培養培地上清、ペリズマ画分、菌体内可溶性画分、又は、菌体内不溶性画分から調製することが可能である。
【0075】
本発明のベクターとして、本発明の抗体分子を構成する一本鎖ポリペプチドに対応する核酸分子を共に含む共発現ベクターを用いることによって、又は、一本鎖ポリペプチドの夫々をコードする核酸分子を含む発現ベクターを同一の宿主細胞を形質転換せしめ、該形質転換菌内で夫々の一本鎖ポリペプチドが発現した後に抗体分子が形成され、それを大腸菌など培養宿主細胞の培養培地上清又は可溶性画分から調製することが可能である。従って、このような場合には、上記の会合(巻き戻し)処理は不要となり、低コストで高生産性が得られる。
【0076】
更に、該形質転換菌の菌体内可溶性画分からの調製量を向上させるためには、以下のような条件とすることが好ましい。宿主としてBL21 star(DE3)株(Invitrogen)を用い、培養は2xYT培地を用い28℃で行う。一晩振盪培養後(600 nmのO.D.が 約5)となったところで、終濃度0.5 mM のIPTGにより発現を誘導し、さらに16時間培養後に、培地上清画分と菌体を浸透圧処理後の画分(ペリプラズム画分)から目的タンパク質を回収する。
【0077】
本発明の医薬組成物は、本発明の抗体分子、一本鎖ポリペプチド、核酸、ベクター、及び形質転換された宿主細胞から成る群から選ばれたものを有効成分として含有することを特徴とする。かかる有効成分は、以下の実施例に示されているように、インビトロ及びインビボで上皮細胞成長因子受容体を発現する(陽性)腫瘍細胞を有意に排除・殺傷・傷害する作用を有しているので、本発明の医薬組成物はこのような腫瘍細胞に対する抗腫瘍剤として使用することが出来る。
【0078】
本発明の有効成分の有効量は、例えば治療目的、腫瘍の種類、部位及び大きさ等の投与対象における病状、患者の諸条件、及び投与経路等によって当業者が適宜決めることが出来る。典型的な1回の投与量又は日用量は、上記の条件に応じ、可能ならば、例えば当分野で既知の腫瘍細胞の生存又は生長についての検定法を使用して、まずインビトロで、そして次に、人間の患者のための用量範囲を外挿し得る適切な動物モデルで、適当な用量範囲を決定することもできる。
【0079】
本発明の医薬組成物には、有効成分の種類、薬剤形態、投与方法・目的、投与対象の病態等の各種条件に応じて、有効成分に加えて当業者に周知の薬学上許容し得る各種成分(例えば、担体、賦形剤、緩衝剤、安定化剤、等)を適宜添加することが出来る。
【0080】
本発明の医薬組成物は、上記各種条件に応じて、錠剤、液剤、粉末、ゲル、及び、噴霧剤、或いは、マイクロカプセル、コロイド状分配系(リポソーム、マイクロエマルジョン等)、及びマクロエマルジョン等の種々薬剤形態をとり得る。
【0081】
投与方法としては、静脈内、腹腔内、脳内、脊髄内、筋肉内、眼内、動脈内、特には胆管内、又は病変内経路による注入又は注射、及び持続放出型システム製剤による方法が挙げられる。本発明の活性物質は、輸液により連続的に、または大量注射により投与されることができる。尚、本発明の医薬組成物を投与する場合には、食作用又は細胞傷害活性を有する細胞と共に投与することが好ましい。或いは、投与前に本発明のLH型ダイアボディ型二重特異性抗体のような有効成分と上記細胞とを混合することによって、投与前に該抗体を予め該細胞に結合させておくことが好ましい。
【0082】
持続放出製剤は、一般的には、そこから本発明の活性物質をある程度の時間放出することのできる形態のものであり、持続放出調製物の好適な例は、蛋白質を含む固体疎水性ポリマーの半透過性担体を含み、該担体は、例えばフィルムまたはマイクロカプセル等の成型物の形態のものである。
【0083】
本発明の医薬組成物は、当業者に公知の方法、例えば日本薬局方解説書編集委員会編、第十三改正 日本薬局方解説書、平成8年7月10日発行、株式会社廣川書店などの記載を参考にしてそれらのうちから必要に応じて適宜選択して製造することができる。
【0084】
尚、本明細書及び図面において、用語はIUPAC-IUB Commission on Biochemical Nomenclatureによるか、あるいは当該分野において慣用的に使用される用語の意味に基づくものである。
【0085】
以下に参考例及び実施例を参照して本発明を具体的に説明するが、これらは単に本発明の説明のため、その具体的な態様の参考のために提供されているものである。これらの例示は本発明の特定の具体的な態様を説明するためのものであるが、本願で開示する発明の範囲を限定したり、あるいは制限することを表すものではない。本発明では、本明細書の思想に基づく様々な実施形態が可能であることは理解されるべきである。
【0086】
全ての参考例及び実施例は、他に詳細に記載するもの以外は、標準的な技術を用いて実施したもの、又は実施することのできるものであり、これは当業者にとり周知で慣用的なものである。尚、以下の実施例において、特に指摘が無い場合には、具体的な操作並びに処理条件などは、DNA クローニングでは J. Sambrook, E. F. Fritsch & T. Maniatis, “Molecular Cloning", 2nd ed., Cold Spring Harbor Laboratory,Cold Spring Harbor, N. Y. (1989) 及び D. M. Glover et al. ed., “DNA Cloning", 2nd ed., Vol. 1 to 4, (The Practical Approach Series), IRL Press, Oxford University Press (1995) ; 特にPCR 法では、H. A. Erlich ed., PCR Technology, Stockton Press, 1989 ; D. M. Glover et al. ed.,“DNA Cloning", 2nd ed., Vol. 1, (The Practical Approach Series), IRL Press, Oxford University Press (1995) 及び M. A. Innis et al. ed.,“PCR Protocols", Academic Press, New York (1990)に記載の方法に準じて行っているし、また市販の試薬あるいはキットを用いている場合はそれらに添付の指示書(protocols) や添付の薬品等を使用している。
【実施例1】
【0087】
ヒト上皮細胞成長因子受容体1(Her1)抗体528のヒト型化可変領域(5H又は5L)のリジン置換可変領域断片の作製
まず、ヒト化型528抗体の結晶構造を分子置換法により決定した。その結果を表1に示す。こうして得られた構造を参照し、且つ、生殖配列データベース(非特許文献8)を利用することで、公知の位置指定変異導入法(部位特異的変異導入法)を用いて、配列番号2で示される抗ヒト上皮細胞成長因子受容体1(Her1)抗体528のL鎖のヒト型化可変領域(5L)、及び、配列番号4で示される抗ヒト上皮細胞成長因子受容体1(Her1)抗体528のH鎖のヒト型化可変領域(5H)において、各領域内のCDR中のリジン残基も含めて全てのリジン残基を他の適当なアミノ酸で置換させた。
【0088】
【表1】

【0089】
その結果、リジン置換可変領域断片の例として、全てのリジン残基が以下のような他のアミノ酸に置換された可変領域断片5H(VH0K)及び5L(VL0K)が得られた。
【0090】
5Lにおけるリジン残基の置換:
44番目のリジン残基がアルギニン残基、
55番目のリジン残基がグルタミン残基、
79番目のリジン残基がトレオニン残基、
108番目のリジン残基がグルタミン酸残基、及び
112番目のリジン残基がグルタミン酸残基。
【0091】
5Hにおけるリジン残基の置換:
12番目のリジン残基がアラニン残基、
13番目のリジン残基がグルタミン酸残基、
19番目のリジン残基がグルタミン残基、
23番目のリジン残基がアラニン残基、
63番目のリジン残基がグルタミン酸残基、及び、
65番のリジン残基がグルタミン残基。
【0092】
更に、5L又は5Hにおける上記の任意の部位で元のリジン残基に再置換し、5Hの19番目のグルタミン残基がリジン残基に再置換されたヒト型化抗EGFR抗体リジン置換H鎖可変領域断片「VH1K」、及び、5Lの108番目のグルタミン酸残基がリジン残基に再置換されたヒト型化抗EGFR抗体リジン置換L鎖可変領域断片「VL1K」を作製した。
【実施例2】
【0093】
リジン置換可変領域断片を含む一本鎖抗体(scFv)の作製
次に、こうして選択された各リジン置換可変領域断片を含む一本鎖抗体(リジン置換scFv )として、VH0K及びVL0Kを含む「0K」、VH1K及びVL0Kを含む「HK」、及びVH0K及びVL1Kを含む「LK」の3種類を以下の概要で調製した。
発現ベクターはすでに本発明者等によって構築されているヒト型化528scFv発現ベクター(pRA-h5Hh5L(G1):特許文献3)を基に作製した。即ち、それぞれのベクターを制限酵素NcoIとEagIで消化後、リンカー配列を含めてh5H部位あるいはh5L部位を入れ換えることで、15アミノ酸リンカー(GGGGS)3を有する各ヒト型化scFv発現ベクターを作製した。C末端側には精製のためのHis-tag (Hisx6:ヒスチジン6量体tag)が並列に導入されている。これを大腸菌を宿主として用いて発現させ、本発明の一本鎖抗体を得た。
【0094】
フローサイトメトリー(Flow cytometry)により一本鎖抗体のヒト扁平上皮がん細胞株であるA431細胞(ATCC No.CRL-1555)に対する結合活性を調べた。標的細胞に対し一次抗体として各scFvを100pmol加え30分、4℃で静置後、0.1%NaN3/PBSで2回洗浄し、続いて二次抗体としてEx3ダイアボディで免疫したウサギの抗血清を加え同様の操作を行った。最後に三次抗体としてFITC-conjugate anti-rabbit
抗体を加え同様の操作を行った後、蛍光を測定した。ネガティブコントロール(以下、「NC」)は一次抗体の代わりにPBS/0.1%/NaN3を加え、ポジティブコントロール(以下、「PC」)には一次抗体としてh528scFv(配列番号9、10)を用いた。図1に示す結果が得られた。
【0095】
更に、これらの一本鎖抗体をSPR法(J Biol Chem. 2010 Jul 2;285(27):20844-9.)による速度解析したところ、以下の表2に示すような結果が得られた。
【0096】
【表2】

【0097】
以上のことから、本発明の3種類の一本鎖抗体のA431細胞に対する結合活性(親和性)は、リジン残基置換前の一本鎖抗体(h528scFv)の活性と比べて実質的に変わらない(保持されている)ことが確認された。
【実施例3】
【0098】
リジン置換可変領域断片を含む一本鎖抗体(scFv)のPEG化
次に、実施例2で作製したHK又はLK(20μM)を含む6M Gdn-HCl/PBS溶液に一端にNHSエステルを有する5kDaのPEG(2mM)を加え、25℃で2時間(pH7〜10)静置してHK及びLKに含まれる特定の一つのリジン残基を部位特異的にPEG化し、その反応液をSDS−PAGEにかけた。得られた結果を図2に示す。これによれば、pH8.5において部位特異的PEG化が高い効率(64〜73%程度)で達成することが出来た。
【実施例4】
【0099】
リジン置換可変領域断片を含む一本鎖抗体の二量体の作製及び細胞傷害活性
更に、架橋試薬として、SANH(succinimidyl 4-hydrazinonicotinate acetone hydrazone)とSFB(succinimidyl 4-formylbenzoate)を用いてscFvであるHK及びLKの二量体化を行った。SANHは、一端にNHSエステル、逆端にヒドラジン基を持ち、SFBは一端にNHSエステル、逆端にアルデヒド基を持つ分子である。これらとHK又はLKをそれぞれ結合させた後、SANHと結合したHK又はLKと、SFBと結合したHK又はLKを混合することで、ヒドラゾン結合を形成させ、二量体化抗体を作製することができる。まず、NHSエステルとアミノ基の結合反応は、ホウ酸バッファ(pH 8.5、25℃)に透析後、ジメチルスルホキシド(DMSO)で20 mMに調製したSANH、またはSFBを終濃度2 mMとなるように加え(10% DMSO)、25℃で2時間静置し行った。ヒドラゾン結合は、pH 7.0以下のバッファに2時間透析することにより、過剰なSANH、SFBの除去と同時に、pHの変更を行い、透析完了後のSANH、SFBが結合したサンプルを混合し(pH 6.0(PBS))、25℃で2時間静置することで、二量体の形成を行った(図3)。ここで、架橋距離の異なる二種類の架橋試薬を用いることで各scFv間の距離が異なる二量体を作製することが出来た。
【0100】
A431細胞の増殖がこうして得られた本発明の二量体によりどれほど阻害されるかをMTS assayにより検討した。セルカウントを行い、RPMI(10 % FBS)100μLあたり細胞2×103個になるよう調整し、96穴プレートに100μLずつ分注、37℃で一晩静置した。目的蛋白質を目的濃度になるようにRPMIで希釈、前日準備したプレートに抗体蛋白質を200μLずつ分注し、37℃で96時間培養した。プレートの培養液を取り除き、PBS により洗浄、MTS、PMS、RPMIを加え、37℃で30〜60分インキュベートした後、プレートリーダーで490nm の吸光度を測定した。その結果、図4に表されるように、本発明の二量体は単量体(HK又はLK)では見られない細胞増殖阻害活性を誘導することがわかった。
(注) MTS 試薬 (CellTiter 96 AQueous Non-Radioactive Cell Proliferation Assay, Promega社製) 、PMS(CellTiter 96 AQueous Non-Radioactive Cell Proliferation Assay,Promega 社製)
【実施例5】
【0101】
PEG化ダイアボディ型二重特異性抗体の調製
更に、特許文献1に記載された方法に準じて本発明のダイアボディ型二重特異性抗体を作製した。まず、本発明のリジン置換L鎖可変領域断片(VL1K)、及び、配列番号8で示されるアミノ酸配列から成る抗CD3抗体OKT3のH鎖のヒト型化可変領域(OH)の完全リジン置換体(含まれる全てのリジン残基を他のアミノ酸残基に置換したもの)から成る一本鎖ポリペプチド(528VL 1K (Lys108)-OKT3 VH Lys(-)))を作製し、これを実施例3に記載の条件(pH8.5)でPEG化し、528抗体のL鎖可変領域断片の108番目のリジンのみ部位特異的にPEG化されたリジン置換L鎖可変領域断片を含むPEG化一本鎖ポリペプチドを得た。
同様に、配列番号4で示される抗体528のH鎖のヒト型化可変領域(5H)及び配列番号6で示される抗CD3抗体OKT3のL鎖のヒト型化可変領域(OL)から成る一本鎖ポリペプチド(528VH -OKT3 VL)を作製した。
こうして作製した未精製のPEG化一本鎖ポリペプチドともう一方の一本鎖ポリペプチドを等モル混合し、透析法による巻き戻し後、ゲルろ過クロマトグラフィ(Hiload superdex(商標)200 26/60 PG、流速2 mL/min、溶出液PBS)により精製し、保持体積120-200 mL各画分をSDS-PAGEにかけた。その結果、ピーク2に、528抗体のL鎖可変領域断片の108番目のリジンのみ部位特異的にPEG化されたリジン置換L鎖可変領域断片を構成要素として含む本発明のダイアボディ型二重特異性抗体(PEG Ex3)を均一に含む(1 μM/mL)画分が得られた。以上の結果を図5に示す。
【実施例6】
【0102】
PEG化ダイアボディ型二重特異性抗体の結合活性
実施例5で作製したダイアボディ型二重特異性抗体について、実施例2に記載のフローサイトメトリー(Flow cytometry)を実施した。一次抗体試料としてゲルろ過クロマトグラフィににおけるピーク1及びピーク2から取得したPEG化ダイアボディ型二重特異性抗体(100 pmol)を使用した。但し、ゲルろ過クロマトグラフィにおけるピーク2に含まれるダイアボディ型二重特異性抗体とT-LAKとの反応については265 pmolの抗体試料を用いた。ポジティブコントロール(以下、「PC」)には一次抗体としてリジン残基が未置換であるExを用いた。続いて検出抗体としてFITC-conjugate anti-HA
抗体を加え蛍光を測定した。
【0103】
その結果、図6に表されるように、ゲルろ過クロマトグラフィにおけるピーク2に含まれるダイアボディ型二重特異性抗体は、EGFR及びCD3に対して結合活性を有することが示された。
【産業上の利用可能性】
【0104】
一本鎖抗体(h528scFv)は多量体化させることで多価性の結合を獲得し、結果増殖抑制効果を示すが(特許文献3)、可変領域間の距離を自由に変化させることはできない。これに対して、反応基として特定の一箇所のみリジン残基を有する本発明に係る一本鎖抗体は、均一な化学修飾が可能、且つ、化学架橋剤に応じた様々な高機能性設計も可能な点で技術的優位性が高い。例えば、分岐数の多い化学架橋剤を用いることで、高多価の分子を創出したり、抗がん剤他、放射性同位体による修飾など、がん関連抗原を標的とした抗体断片のリジン置換体は利用価値が極めて高いといえる。
【0105】
更に、本発明のヒト型化抗EGFR抗体リジン置換L鎖又は同H鎖可変領域断片、又はそれらから構成される一本鎖抗体は様々な抗体分子の構成要素として利用し、更なる高機能化を図ることが出来る。
【特許請求の範囲】
【請求項1】
配列番号2で示されるアミノ酸配列から成る抗ヒト上皮細胞成長因子受容体1(Her1)抗体528のL鎖のヒト型化可変領域(5L)において、全てのリジン残基又は特定の一つの部位のリジン残基以外の全てのリジン残基が他のアミノ酸に置換されて成る、ヒト型化抗EGFR抗体リジン置換L鎖可変領域断片。
【請求項2】
5Lにおける108番目のリジン残基以外の全てのリジン残基が他のアミノ酸残基に置換されていることを特徴とする、請求項1記載のリジン置換L鎖可変領域断片。
【請求項3】
5Lにおける以下の置換の少なくとも一つを含む、請求項1または2記載のリジン置換L鎖可変領域断片:
44番目のリジン残基がアルギニン残基、
55番目のリジン残基がグルタミン残基、
79番目のリジン残基がトレオニン残基、
108番目のリジン残基がグルタミン酸残基、又は、
112番目のリジン残基がグルタミン酸残基。
【請求項4】
5Lにおける以下の置換を含む、請求項1記載のリジン置換L鎖可変領域断片:
44番目のリジン残基がアルギニン残基、
55番目のリジン残基がグルタミン残基、
79番目のリジン残基がトレオニン残基、
108番目のリジン残基がグルタミン酸残基、及び
112番目のリジン残基がグルタミン酸残基。
【請求項5】
配列番号4で示されるアミノ酸配列から成る抗ヒト上皮細胞成長因子受容体1(Her1)抗体528のH鎖のヒト型化可変領域(5H)において、全てのリジン残基又は特定の一つのリジン残基以外の全てのリジン残基が他のアミノ酸に置換されて成る、ヒト型化抗EGFR抗体リジン置換H鎖可変領域断片。
【請求項6】
5Hにおける19番目のリジン残基以外のリジン残基が他のアミノ酸残基に置換されていることを特徴とする、請求項5記載のリジン置換H鎖可変領域断片。
【請求項7】
5Hにおける以下の置換の少なくとも一つを含む、請求項5または6記載のリジン置換H鎖可変領域断片:
12番目のリジン残基がアラニン残基、
13番目のリジン残基がグルタミン酸残基、
19番目のリジン残基がグルタミン残基、
23番目のリジン残基がアラニン残基、
63番目のリジン残基がグルタミン酸残基、又は、
65番のリジン残基がグルタミン残基。
【請求項8】
5Hにおける以下の置換を含む、請求項5記載のリジン置換H鎖可変領域断片:
12番目のリジン残基がアラニン残基、
13番目のリジン残基がグルタミン酸残基、
19番目のリジン残基がグルタミン残基、
23番目のリジン残基がアラニン残基、
63番目のリジン残基がグルタミン酸残基、及び、
65番のリジン残基がグルタミン残基。
【請求項9】
一つのリジン残基又はN末端アミノ基が部位特異的に修飾されている、請求項1〜8のいずれか一項に記載のリジン置換L鎖可変領域断片又はリジン置換H鎖可変領域断片。
【請求項10】
ポリエチレングリコールによって部位特異的に修飾されている請求項9記載のリジン置換L鎖可変領域断片又はリジン置換H鎖可変領域断片。
【請求項11】
請求項1〜4、9又は10記載のリジン置換L鎖可変領域断片及び請求項5〜8、9又は10記載のリジン置換H鎖可変領域断片を構成要素として含む抗体分子。
【請求項12】
IgG型抗体分子、一本鎖抗体(scFv)、一本鎖抗体の二量体、二重特異性抗体、ダイアボディ型二重特異性抗体、高機能性二重特異性抗体又は多量体化低分子抗体から成る群から選択される、請求項11記載の抗体分子。
【請求項13】
リジン置換L鎖可変領域断片又はリジン置換H鎖可変領域断片に含まれる一つのリジン残基が架橋されてなる、請求項12記載の二量体。
【請求項14】
抗CD3抗体OKT3のL鎖のヒト型化可変領域(OL)、及び、抗CD3抗体OKT3のH鎖のヒト型化可変領域(OH)が、夫々、配列番号6及び配列番号8で示されるアミノ酸配列から成る、請求項11記載のダイアボディ型二重特異性抗体。
【請求項15】
請求項11〜14のいずれか一項に記載の抗体分子を構成する一本鎖ポリペプチド。
【請求項16】
請求項1〜8のいずれか一項に記載のリジン置換可変領域断片、又は、請求項15に記載の一本鎖ポリペプチドをコードする核酸分子。
【請求項17】
請求項11〜14のいずれか一項に記載の抗体分子を構成する2種類の一本鎖ポリペプチドを共にコードする核酸分子。
【請求項18】
請求項16又は17記載の核酸分子を含有する複製可能なクローニングベクター又は発現ベクター。
【請求項19】
共発現ベクターである、請求項18記載のベクター。
【請求項20】
プラスミドベクターである、請求項18又は19記載のベクター。
【請求項21】
請求項19ないし20のいずれか一項に記載のベクターで形質転換された宿主細胞。
【請求項22】
請求項11又は12記載の抗体分子の製造方法であって、請求項21に記載の宿主細胞を培養し、該抗体分子を構成する2種類の一本鎖ポリペプチドを発現させ、該ポリペプチドを回収・精製し、該2種類の一本鎖ポリペプチドを会合させ、形成された抗体分子を分離・回収することから成る、前記方法。
【請求項23】
原核細胞が大腸菌であり、2種類の一本鎖ポリペプチドを大腸菌の培養培地上清、ペリズマ画分、菌体内可溶性画分、又は、菌体内不溶性画分から回収する、請求項22記載の製造方法。
【請求項24】
請求項14記載の抗体分子の製造方法であって、請求項19記載の共発現ベクターで形質転換された宿主細胞を培養し該抗体分子を構成する2種類の一本鎖ポリペプチドを発現させ、該形質転換菌内でダイアボディ型二重特異性抗体を形成せしめ、形成された二重特異性抗体を分離・回収することから成る、前記方法。
【請求項25】
請求項11〜14のいずれか一項に記載の抗体分子を有効成分として含有することを特徴とする医薬組成物。
【請求項26】
腫瘍細胞を排除する、殺傷する、傷害する及び/又は減少せしめるためのものであることを特徴とする請求項25記載の医薬組成物。
【請求項1】
配列番号2で示されるアミノ酸配列から成る抗ヒト上皮細胞成長因子受容体1(Her1)抗体528のL鎖のヒト型化可変領域(5L)において、全てのリジン残基又は特定の一つの部位のリジン残基以外の全てのリジン残基が他のアミノ酸に置換されて成る、ヒト型化抗EGFR抗体リジン置換L鎖可変領域断片。
【請求項2】
5Lにおける108番目のリジン残基以外の全てのリジン残基が他のアミノ酸残基に置換されていることを特徴とする、請求項1記載のリジン置換L鎖可変領域断片。
【請求項3】
5Lにおける以下の置換の少なくとも一つを含む、請求項1または2記載のリジン置換L鎖可変領域断片:
44番目のリジン残基がアルギニン残基、
55番目のリジン残基がグルタミン残基、
79番目のリジン残基がトレオニン残基、
108番目のリジン残基がグルタミン酸残基、又は、
112番目のリジン残基がグルタミン酸残基。
【請求項4】
5Lにおける以下の置換を含む、請求項1記載のリジン置換L鎖可変領域断片:
44番目のリジン残基がアルギニン残基、
55番目のリジン残基がグルタミン残基、
79番目のリジン残基がトレオニン残基、
108番目のリジン残基がグルタミン酸残基、及び
112番目のリジン残基がグルタミン酸残基。
【請求項5】
配列番号4で示されるアミノ酸配列から成る抗ヒト上皮細胞成長因子受容体1(Her1)抗体528のH鎖のヒト型化可変領域(5H)において、全てのリジン残基又は特定の一つのリジン残基以外の全てのリジン残基が他のアミノ酸に置換されて成る、ヒト型化抗EGFR抗体リジン置換H鎖可変領域断片。
【請求項6】
5Hにおける19番目のリジン残基以外のリジン残基が他のアミノ酸残基に置換されていることを特徴とする、請求項5記載のリジン置換H鎖可変領域断片。
【請求項7】
5Hにおける以下の置換の少なくとも一つを含む、請求項5または6記載のリジン置換H鎖可変領域断片:
12番目のリジン残基がアラニン残基、
13番目のリジン残基がグルタミン酸残基、
19番目のリジン残基がグルタミン残基、
23番目のリジン残基がアラニン残基、
63番目のリジン残基がグルタミン酸残基、又は、
65番のリジン残基がグルタミン残基。
【請求項8】
5Hにおける以下の置換を含む、請求項5記載のリジン置換H鎖可変領域断片:
12番目のリジン残基がアラニン残基、
13番目のリジン残基がグルタミン酸残基、
19番目のリジン残基がグルタミン残基、
23番目のリジン残基がアラニン残基、
63番目のリジン残基がグルタミン酸残基、及び、
65番のリジン残基がグルタミン残基。
【請求項9】
一つのリジン残基又はN末端アミノ基が部位特異的に修飾されている、請求項1〜8のいずれか一項に記載のリジン置換L鎖可変領域断片又はリジン置換H鎖可変領域断片。
【請求項10】
ポリエチレングリコールによって部位特異的に修飾されている請求項9記載のリジン置換L鎖可変領域断片又はリジン置換H鎖可変領域断片。
【請求項11】
請求項1〜4、9又は10記載のリジン置換L鎖可変領域断片及び請求項5〜8、9又は10記載のリジン置換H鎖可変領域断片を構成要素として含む抗体分子。
【請求項12】
IgG型抗体分子、一本鎖抗体(scFv)、一本鎖抗体の二量体、二重特異性抗体、ダイアボディ型二重特異性抗体、高機能性二重特異性抗体又は多量体化低分子抗体から成る群から選択される、請求項11記載の抗体分子。
【請求項13】
リジン置換L鎖可変領域断片又はリジン置換H鎖可変領域断片に含まれる一つのリジン残基が架橋されてなる、請求項12記載の二量体。
【請求項14】
抗CD3抗体OKT3のL鎖のヒト型化可変領域(OL)、及び、抗CD3抗体OKT3のH鎖のヒト型化可変領域(OH)が、夫々、配列番号6及び配列番号8で示されるアミノ酸配列から成る、請求項11記載のダイアボディ型二重特異性抗体。
【請求項15】
請求項11〜14のいずれか一項に記載の抗体分子を構成する一本鎖ポリペプチド。
【請求項16】
請求項1〜8のいずれか一項に記載のリジン置換可変領域断片、又は、請求項15に記載の一本鎖ポリペプチドをコードする核酸分子。
【請求項17】
請求項11〜14のいずれか一項に記載の抗体分子を構成する2種類の一本鎖ポリペプチドを共にコードする核酸分子。
【請求項18】
請求項16又は17記載の核酸分子を含有する複製可能なクローニングベクター又は発現ベクター。
【請求項19】
共発現ベクターである、請求項18記載のベクター。
【請求項20】
プラスミドベクターである、請求項18又は19記載のベクター。
【請求項21】
請求項19ないし20のいずれか一項に記載のベクターで形質転換された宿主細胞。
【請求項22】
請求項11又は12記載の抗体分子の製造方法であって、請求項21に記載の宿主細胞を培養し、該抗体分子を構成する2種類の一本鎖ポリペプチドを発現させ、該ポリペプチドを回収・精製し、該2種類の一本鎖ポリペプチドを会合させ、形成された抗体分子を分離・回収することから成る、前記方法。
【請求項23】
原核細胞が大腸菌であり、2種類の一本鎖ポリペプチドを大腸菌の培養培地上清、ペリズマ画分、菌体内可溶性画分、又は、菌体内不溶性画分から回収する、請求項22記載の製造方法。
【請求項24】
請求項14記載の抗体分子の製造方法であって、請求項19記載の共発現ベクターで形質転換された宿主細胞を培養し該抗体分子を構成する2種類の一本鎖ポリペプチドを発現させ、該形質転換菌内でダイアボディ型二重特異性抗体を形成せしめ、形成された二重特異性抗体を分離・回収することから成る、前記方法。
【請求項25】
請求項11〜14のいずれか一項に記載の抗体分子を有効成分として含有することを特徴とする医薬組成物。
【請求項26】
腫瘍細胞を排除する、殺傷する、傷害する及び/又は減少せしめるためのものであることを特徴とする請求項25記載の医薬組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2012−34668(P2012−34668A)
【公開日】平成24年2月23日(2012.2.23)
【国際特許分類】
【出願番号】特願2010−180693(P2010−180693)
【出願日】平成22年8月12日(2010.8.12)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
【公開日】平成24年2月23日(2012.2.23)
【国際特許分類】
【出願日】平成22年8月12日(2010.8.12)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
[ Back to top ]

