ヒト型Fcレセプターをコードするポリヌクレオチド、およびそれを利用したヒト型Fcレセプターの製造方法
【課題】工業生産規模においてヒト型FcレセプターFcγRIを生産する微生物を作製し、さらには、新規Fcレセプター生産系を利用してヒト型FcγRI生産を行ない、該FcγRIを提供すること。
【解決の手段】ヒト型FcγRIをコードするポリヌクレオチドのコドンをヒト型からバチルス属細菌型に変換したポリヌクレオチドを調製し、当該ポリヌクレオチドが挿入されたプラスミドベクターをバチルス属細菌に形質転換することでヒト型FcγRIを可溶化等の操作をせずに大量発現させることが可能となる。
【解決の手段】ヒト型FcγRIをコードするポリヌクレオチドのコドンをヒト型からバチルス属細菌型に変換したポリヌクレオチドを調製し、当該ポリヌクレオチドが挿入されたプラスミドベクターをバチルス属細菌に形質転換することでヒト型FcγRIを可溶化等の操作をせずに大量発現させることが可能となる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヒト型FcレセプターのひとつであるFcγRIを、バチルス属に属する細菌を用いることで、可溶化等の操作をせずに大量発現させる方法に関する。
【背景技術】
【0002】
Fcレセプターは、免疫グロブリン分子のFc領域に結合する一群の分子である。Fcレセプターはその結合する免疫グロブリンの種類によって分類されており、IgGのFc領域に結合するFcγレセプター、IgEのFc領域に結合するFcεレセプター、IgAのFc領域に結合するFcαレセプター等がある(非特許文献1)。また、各レセプターは、その構造の違いによりさらに細かく分類され、Fcγレセプターの場合、FcγRI、FcγRII、FcγRIIIの存在が報告されている(非特許文献1)。
【0003】
Fcγレセプターの一つであるFcγRIは単球とマクロファージ中で発現しており、好中球ではγインターフェロンにより誘導的に発現される(非特許文献1)。また、FcγRIはIgGに対する結合親和性が高く、その平衡解離定数(Kd)は10−8M以下である(非特許文献2)。FcγRIは、細胞外領域、細胞膜貫通領域、細胞質内領域に区分され、IgGとの結合は、IgGのFc領域とFcγRIの細胞外領域で起こり、その後細胞質へとシグナルが伝達される。FcγRIはIgGとの結合に直接関わる分子量約42000のα鎖と、γ鎖の2種類のサブユニットによって構成されており、γ鎖は細胞膜と細胞外領域との境界で共有結合することでホモダイマーを形成している(非特許文献3)。
【0004】
ヒト型FcγRIのアミノ酸配列、および遺伝子配列(配列番号1)はExPASy(Primary accession number:P12314)などの公的データベースに公表されている。また、FcγRIの構造上の機能ドメイン、細胞膜を貫通するためのシグナルペプチド配列、細胞膜貫通領域の位置についても同様に公表されており、図1にヒト型FcγRIの構造略図を示す。なお、図中のアミノ酸番号は配列番号1に記載のアミノ酸番号に対応する。すなわち、配列番号1のアミノ酸番号1のメチオニン(Met)から289のバリン(Val)までが細胞外領域、配列番号1のアミノ酸番号290のロイシン(Leu)から374のスレオニン(Thr)までが細胞膜貫通領域および細胞内領域とされている。
【0005】
近年になり、Fcレセプターの予想外の免疫抑制的な生物学的特性は、特に自己免疫疾患または自己免疫症候群、移植物の拒絶および悪性リンパ増殖の領域において医薬として注目を浴びつつある(非特許文献2)。また、FcγRIの機能である抗体の吸着能は各種抗体精製用クロマトグラフィーゲルの捕捉機能を担うタンパク質としても利用することができる。
【0006】
FcγRIα鎖のアミノ酸配列および遺伝子塩基配列(非特許文献4)はJanet等により明らかにされ、その後、遺伝子組換え技術により、大腸菌(特許文献1)あるいは動物細胞を利用した発現が報告されている。しかしながら、大腸菌を利用した発現系においてはFcγRIの細胞外領域タンパク質の発現量は極めて低く、また、発現されたタンパク質は菌体内発現のため、多くの場合発現したタンパク質は不溶性の封入体となる。封入体タンパク質は可溶化等の操作をすることにより、活性型タンパク質として調製することは可能であるが、煩雑な操作を必要とする。また、動物細胞を用いた系では、大腸菌以上の発現量が報告(非特許文献3)されているが培養に多大な時間を要し、かつ、生産性も高くない。
【0007】
【特許文献1】特表2004−530419号公報
【非特許文献1】J.V.Ravetch等,Annu.Rev.Immunol.,9,457,1991
【非特許文献2】Toshiyuki Takai,Jpn.J.Clin.Immunol.,28,318,2005
【非特許文献3】A.Paetz等,Biochem.Biophys.Res.Commun.,338,1811,2005
【非特許文献4】J.M.Allen等,Science,243,378,1989
【非特許文献5】Nucleic Acid Res.,30,e43,2002
【非特許文献6】Protein Expr Purif.、47、441−445、2006
【非特許文献7】Masaya Nagao等、Biosci.Biotech.Biochem.、61、670、1997
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明の目的は工業生産規模においてヒト型FcレセプターFcγRIを高い生産性を以って生産する微生物を作製することである。さらには、新規Fcレセプター生産系を利用してヒト型FcγRI生産を行ない、当該ヒト型FcγRIを提供することにある。
【課題を解決するための手段】
【0009】
本願発明者らは、上記課題に関し鋭意検討した結果、ヒト型FcレセプターFcγRI遺伝子のコドンをヒト型からバチルス(Bacillus)属細菌型に変換後、変換したポリヌクレオチドを発現プラスミドベクターに挿入し、当該挿入されたプラスミドベクターにより形質転換されたバチルス属に属する細菌を用いて発現させることで、可溶化等の操作が不要な活性型FcγRIを直接生産することができ、かつ、その発現量も飛躍的に向上することを見出した。
【0010】
すなわち、本発明は、以下の発明を包含する:
(1)配列番号1に示すヒト型FcレセプターFcγRIをコードするポリヌクレオチド配列のうち、少なくとも64番目から867番目のポリヌクレオチドのコドンがヒト型からバチルス属細菌型に変換されたことを特徴とする、ヒト型FcレセプターFcγRIをコードするポリヌクレオチド。
(2)前記ポリヌクレオチドが、配列番号3のポリヌクレオチドであることを特徴とする、(1)に記載のヒト型FcレセプターFcγRIをコードするポリヌクレオチド。
(3)(1)または(2)に記載のポリヌクレオチドが挿入されたプラスミドベクター。
(4)(3)に記載のプラスミドベクターをバチルス属に属する細菌に形質転換することにより得られる、形質転換体。
(5)(4)に記載の形質転換体を培養する工程を含むヒト型FcレセプターFcγRIポリペプチドの製造方法。
【0011】
以下、本発明について詳細に説明する。
【0012】
本発明のポリヌクレオチドは、配列番号1に示す、ヒト型Fcレセプターの一つであるFcγRIをコードするポリヌクレオチド配列のうち、少なくとも64番目から867番目のポリヌクレオチド(配列番号1のアミノ酸番号22のアラニン(Ala)から269のバリン(Val)をコードするポリヌクレオチド)のコドンをヒト型からバチルス属細菌型に変換したポリヌクレオチドを含むことを特徴とする、ヒト型FcレセプターFcγRIをコードするポリヌクレオチドであり、好ましくは、上記64番目から867番目のポリヌクレオチドのコドンをヒト型からバチルス属細菌型に変換したポリヌクレオチドが、配列番号3のポリヌクレオチドであることを特徴とする、ヒト型FcレセプターFcγRIをコードするポリヌクレオチドである。
【0013】
本発明のFcγRIをコードするポリヌクレオチドのコドンをヒト型からバチルス属細菌型に変換したポリヌクレオチドは、ヒト型FcγRIをコードする遺伝子のうち、少なくとも配列番号1の64番目から867番目のポリヌクレオチド中に存在するバチルス属細菌におけるレアコドン(rare codon)を、コードするアミノ酸を同一のまま、バチルス属細菌の翻訳機構において利用頻度が高いコドン(codon)に変換することにより得られる。なお、レアコドンとは、その宿主におけるコドンの使用頻度が少ないものをいう。宿主におけるコドンの使用頻度は、ゲノム遺伝子の塩基配列等の解析結果等から推測することが可能であり、例えば、バチルス属細菌の一種であるBrevibacillus choshinensisにおけるレアコドンとしては、アミノ酸セリン(Ser)コドンのUCA、ロイシン(Leu)コドンのCUA、アルギニン(Arg)コドンのCGG、AGA、AGG、イソロイシン(Ile)コドンのAUAがあげられる。また、コドンの使用頻度の情報は公的データベース(http://www.kazusa.or.jp/codon/)からも得ることができる。レアコドンから利用頻度の高いコドンへの変換は対応する塩基配列を変換することにより可能であり、塩基配列の変換はSite−directed mutagenesis法など公知の変異導入法を利用することができるが、好ましい変換方法は、合成オリゴヌクレオチドとPCRを組合わせたDNAWorks法(非特許文献5)やSynthetic Gene Designer法(非特許文献6)である。上記方法では、ポリペプチドをコードするアミノ酸配列を基にして、数十塩基からなるオリゴヌクレオチド群を合成し、PCR法により合成オリゴヌクレオチドをアッセンブリーさせることによって完全長の遺伝子を作製することができる。なお、ヒト型FcγRIをコードするポリヌクレオチドのヒト型からバチルス属細菌型へのコドン変換は、実施例に記載のように、ヒト型FcγRI遺伝子配列(配列番号1)のすべてのレアコドンをヒト型からバチルス属細菌型に変換(配列番号2)しても良いし、一部のレアコドン、例えば配列番号1に示すポリヌクレオチド配列のうち64番目から867番目にあるレアコドンをヒト型からバチルス属細菌型に変換(配列番号3)してもよい。
【0014】
さらにヒト型FcγRIをコードするポリヌクレオチドは、ヒト型FcγRIをコードするポリヌクレオチドのコドンをヒト型からバチルス属細菌型に変換したポリヌクレオチドの5’末端側に、転写を開始するためのメチオニンをコードするオリゴヌクレオチドを付加しても良く、また上記記載のポリヌクレオチドの5’末端側にシグナルペプチド配列をコードするオリゴヌクレオチドを付加しても良い。ここに述べる、シグナルペプチドとは、細胞質内で発現したタンパク質が細胞膜を通過し、細胞膜外において分泌するためのポリペプチドであり、通常、当該タンパク質のN末端側に存在しており、細胞膜通過後、特定のプロテアーゼ酵素によって切断される。シグナルペプチドの例としては、配列番号1のアミノ酸番号1から15、あるいは1から20のペプチドをあげることができる。
【0015】
本発明は、ヒト型FcγRIを簡便に精製することを目的として、上記記載のポリヌクレオチドに、タグ(tag)となるペプチドをコードするオリゴヌクレオチドを付加させてもよい。タグペプチドとしてはポリヒスチジンタグ(His−tag)、ミックタグ(C−myc tag)等を例示することができる。付加させる位置は、上述のポリペプチドの生物活性を損なわない限りにおいて、N末端側、C末端側どちらでも構わない。上記記載のオリゴヌクレオチドへのタグペプチドをコードするオリゴヌクレオチドの付加は、当業者に周知の方法にて遺伝子工学的に作製することが可能である。
【0016】
本発明の、コドンをヒト型からバチルス属細菌型に変換したヒト型FcγRIポリヌクレオチドが挿入された遺伝子組換えプラスミドベクターは、上記記載のヒト型FcγRIポリヌクレオチドを公知の発現プラスミドベクターの適当な位置に遺伝子工学的に挿入することにより、ヒト型FcγRIが発現可能な遺伝子組換えプラスミドベクターを得ることができる。公知の発現プラスミドベクターとしては、例えば、バチルス属細菌の形質転換に利用されるpUB110、pC194、pE194、pWVO1等をあげることができる。ここで述べる適当な位置とはプラスミドベクターの複製機能、所望の抗生物質マーカー、あるいは伝達性に関わる領域を破壊しないような位置等を意味する。そして、上記記載の遺伝子組換えプラスミドベクターをバチルス属の属する細菌に形質転換して得られる形質転換体を培養することにより、ヒト型FcγRIを発現させることがきる。
【0017】
本発明で形質転換に用いる宿主細胞は、コドンの変換対象であるバチルス属に属する細菌であれば良く、例えばBacillus amyloliquefaciens、Bacillus circulans、Bacillus licheniformis、Bacillus stearothermophilus、 Bacillus subtilis、Bacillus polymyxa、Bacillus cereus、Bacillus megaterium、Bacillus mecerans、Bacillus coagulans、Bacillus lentus等をあげることができる。特に、胞子形成関連遺伝子が破壊されており、かつ、菌体内プロテアーゼ遺伝子jmpや菌体外プロテアーゼ遺伝子empも破壊されている、Brevibacillus choshinensis(非特許文献7)を宿主細胞として用いるのが好ましい。また、上記バチルス属に属する細菌を変異処理することにより誘導されるバチルス属細菌変異株を利用することもできる。変異処理はニトロソグアニジン、メタンスルホン酸エチル、紫外線、放射線等の当業者において周知の変異処理剤を利用して行なえばよい。
【0018】
本発明の、バチルス属細菌への外来遺伝子の導入および発現のための手順、および方法は、実施例に記載した方法のほかにも、遺伝子工学の分野により慣用されているものを含み、具体的にはエレクトロポレーション法、Tris−PEG法等をあげることができる。
【0019】
本発明の、ヒト型FcγRIを生産するために用いられるバチルス属に属する細菌は、選択した宿主細胞の培養に好適な公知の培地で増殖させることができる。なお、本発明に用いる培地としては細菌が増殖し、ヒト型FcγRIを生産し得るものであれば何れも使用してよく、炭素源には廃糖蜜、グルコース、フルクトース、マルトース、ショ糖、デンプン、乳糖、グリセロール、酢酸などが、窒素源にはコーンスティープリカー、ペプトン、酵母エキス、肉エキス、大豆粕等の天然成分や、酢酸アンモニウム、アスパラギン酸、グリシン等のアミノ酸類が、無機塩にはリン酸一ナトリウム、リン酸二ナトリウム、リン酸一カリウム、リン酸二カリウム等のリン酸塩や塩化ナトリウムなどが、金属イオンには塩化マグネシウム、硫酸マグネシウム、硫酸第一鉄、硫酸第二鉄、塩化第一鉄、塩化第二鉄、クエン酸鉄、硫酸アンモニウム鉄、塩化カルシウム二水和物、硫酸カルシウム、硫酸亜鉛、硫酸銅、塩化銅、硫酸マンガン、塩化マンガン等が、ビタミン類としては酵母エキス、ビオチン、ニコチン酸、チアミン、リボフラビン、イノシトール、ピリドキシン等が使用できる。好ましい実施態様では、発現プラスミドベクターを含有するバチルス属細菌の増殖を選択的に可能にするために、培地は発現プラスミドベクターの構成を基にした選抜剤を含んでもよい。例えば、ネオマイシン耐性遺伝子を発現する細胞の増殖のためにネオマイシンを培地に添加する。培地には、炭素、窒素および無機塩供給源の他に、適当な栄養源を加えてもよい。所望により、グルタチオン、システイン、シスタミン、チオグリコレート、ジチオスレイトールからなる群から選択される一種類以上の還元剤を含んでも良い。バチルス属細菌増殖における培養温度は、約20から40℃、好ましくは25から35℃であり、より好ましくは約30℃である。培地のpHは、約5から10、好ましくは7.0である。
【0020】
本発明の発現プラスミドベクターに宿主菌の細胞壁タンパク質由来のプロモータを用いる場合には、菌の生育が定常期に入ってから活発に働くため、培養液の濁度(600nmにおける吸光度)を測定し、対数増殖期から定常期に移行した後、引き続き培養することによりタンパク質を培養液中へ分泌発現させることができる。培養時間は24から96時間、好ましくは40から50時間であるが、最適な培養時間は培地成分、培養温度、および通気量といった条件により変化するため、発現したタンパク質の発現量や活性等を測定して決定するのが好ましい。
【0021】
培養液から、本発明のヒト型FcγRIを取得するには、発現の形態によって適宜抽出方法を選択すればよい。培養上清に発現する場合は菌体を遠心分離操作によって分離し、得られる培養上清からヒト型FcγRIを抽出すればよい。細胞質内で発現する場合には、遠心分離操作により菌体を集め、酵素処理剤や界面活性剤等を添加することにより菌体を破砕し、ヒト型FcγRIを抽出することができる。抽出タンパク質の中からヒト型FcγRIを分離・精製するためには液体クロマトグラフィーを利用することができる。液体クロマトグラフィーとしては、イオン交換クロマトグラフィー、疎水性相互作用クロマトグラフィー、ゲルろ過クロマトグラフィー、アフィニティークロマトグラフィー等を挙げることができる。これらのクロマトグラフィーを組み合わせて精製操作を行なうことにより高純度なヒト型FcγRIを調製することができる。
【0022】
本発明により得られた精製したヒト型FcγRIを、固定相に固定化することにより抗体を液相から吸着させ分離することができる。固定相としてはセルロース、アガロース等の多糖類、ガラス、セラミックス、あるいは、ポリプロピレン、塩化ビニル、ポリスチレン等のプラスチック素材を例示することができる。また、固相に固定したヒト型FcγRIをカラムに充填することにより抗体に対するクロマトグラフィーゲルとしても利用することができる。また、ヒト血清を検体にすることにより特異性の高いイムノアッセイが可能であり各種診断材料としても利用することができる。
【発明の効果】
【0023】
ヒト型FcレセプターFcγRIをコードする遺伝子のコドンを、ヒト型からバチルス属細菌型に変換し、当該ポリヌクレオチドが挿入されたプラスミドをバチルス属に属する細菌に形質転換させることで、ヒト型FcγRIを可溶化等の操作なく大量に発現させることが可能となる。この発現系は、工業生産規模におけるヒト型FcγRIの生産に有用なものである。
【発明を実施するための最良の形態】
【0024】
以下、実施例により本発明をさらに具体的に説明するが、本発明はこれらの実施例に限定されるものではない。
実施例1 ヒト型FcレセプターをコードするDNA配列の設計
配列番号1に記載のヒト型FcレセプターFcγRIのアミノ酸配列を基にDNAworks法(非特許文献5)により、コドンをブレビバチルス属細菌型に変換した。該方法によりコドンを変換したヒト型FcγRIの塩基配列(配列番号2)とコドン変換前のヒト型FcγRIの塩基配列(配列番号1)を比較した結果を図2に示す。図2の通り、アミノ酸配列はそのままにDNA配列の変換が行われ、そのDNA配列間の類似性は75%であった。
実施例2 ヒト型FcレセプターをコードするDNA配列の作製
ヒト型FcγRI遺伝子のコドンをヒト型からブレビバチルス属細菌型に変換したDNA配列を以下の方法で作製した。
(1)ヒト型FcγRI遺伝子のコドンをヒト型からブレビバチルス属細菌型に変換したDNA配列を作製するための52種類のオリゴヌクレオチドを合成した。合成したオリゴヌクレオチドを配列番号4から55に示す。
(2)(1)で合成したオリゴヌクレオチドから完全長のヒト型FcγRIをコードするDNAを作製するために、二段階のPCRを行なった。
(2−1)一段階目のPCRの反応液は表1の通りで、反応条件は94℃・5分の熱処理後、94℃・30秒間の第一ステップ、62℃・30秒間の第二ステップ、72℃・1分間の第三ステップを25サイクル行ない、次いで、72℃・7分の第四ステップである。表1中のDNAミックスは52種類の合成した50pmol/μLのオリゴヌクレオチドをそれぞれ一定量サンプリングし混合した溶液である。
【0025】
【表1】

(2−2)二段階目のPCRは一段階目のPCRの反応液を用いて、表2の反応液組成で行なった。PCRプライマーの配列は、配列番号4(5’−ATgTggTTCTTgACAACTCTCCTgCTTTgggTCCC−3’)と配列番号55(5’−AgTAgCgCCTTgCggTTCTTTACgATgCACgCCCTCC−3’)のオリゴヌクレオチドを用いた。反応条件は94℃・5分の熱処理後、94℃・30秒間の第一ステップ、65℃・30秒間の第二ステップ、72℃・1分間の第三ステップを25サイクル行ない、最後に、72℃・7分の第四ステップである。
【0026】
【表2】

反応終了後0.9%のアガロース電気泳動で確認したところ、設計通りのサイズのDNAバンド(約1100塩基対)を確認することができた。
(3)目的バンドをアガロースゲルから抽出(QIAquick Gel extraction kit(商品名):キアゲン社製)後、抽出DNAの5’末端をリン酸化し、制限酵素SmaIで消化したpUC19プラスミドベクターに挿入し、50μg/mLの抗生物質カルベシニリンを添加したLB寒天培地により大腸菌JM109株(タカラバイオ社製)を形質転換した。これをpBBFcRとした。図3に構造を示す。
実施例3 ヒト型FcγRI細胞外領域発現プラスミドベクターの作製
ヒト型FcγRIの細胞外領域を発現させるために、以下に示す方法でヒト型FcγRI発現プラスミドベクターの作製を行なった。
(1)pBBFcRをテンプレートにし配列番号56(5’−ACATg[CCATgg]CTTTCgCTgCAggATCCgCTgTAATCACTCTgCAgCCAC−3’:角かっこ内の塩基は制限酵素NcoIサイト)と配列番号57(5’−gC[TCTAgA]CTAATggTgATggTgATggTggACTggAgTAggCAgTTg−3’:角かっこ内の塩基は制限酵素XbaIサイト)のオリゴヌクレオチドをプライマーにしてPCRを行ない、細胞外領域をコードするDNAを増幅した。なお、ヒト型FcγRIの調製および定量を行なうために、発現タンパク質のC末端側にポリヒスチジンタグが付加されるようにPCRプライマーを設計した(配列番号57)。反応条件は94℃・5分の熱処理後、94℃・30秒間の第一ステップ、65℃・30秒間の第二ステップ、72℃・1分間の第三ステップを25サイクル行ない、最後に、72℃・7分の第四ステップである。反応液組成を表3に示す。
【0027】
【表3】

反応終了後、0.9%のアガロース電気泳動で確認したところ、設計通りのサイズのDNAバンドを確認することができた。
(2)目的バンドをアガロースゲルから抽出(QIAquick Gel extraction kit(商品名):キアゲン社製)後、抽出DNAを制限酵素NcoIとXbaIにより消化し、これらの制限酵素により事前に消化したpNCMO2(タカラバイオ社製)とライゲーションし、50μg/mLの抗生物質カルベシニリンを添加したLB寒天培地により大腸菌JM109株を形質転換し調製した。これをpNCBBFcRとした。図4にpNCMO2プラスミドベクターのマルチクローニングサイト周辺の塩基配列、図5に上記に記載したプラスミドベクターpNCBBFcRの作製方法の概略を示す。
(3)並行して、ヒト型FcγRIの細胞外領域をコードするヒト型コドンのDNAを用いた発現ベクターも作製した。挿入断片の作製はPCRで行ない、Human cDNA clone TC119841プラスミドベクター(Origene社製)をテンプレートとし、配列番号58(5’−CgC[ggATCC]gCAgTgATCACTTTgCAgCCTCCATggg−3’:角かっこ内の塩基は制限酵素BamHIサイト)と配列番号59(5’−gC[TCTAgA]CTAATggTgATggTgATggTggACAggAgTTggTAACTgg−3’:角かっこ内の塩基は制限酵素XbaIサイト)のオリゴヌクレオチドをPCRプライマーとして使用した。なお、ヒト型FcγRIの調製および定量を行なうために、発現タンパク質のC末端側にポリヒスチジンタグが付加されるようにPCRプライマーを設計した(配列番号59)。PCRは94℃・5分の熱処理後、94℃・30秒間の第一ステップ、65℃・30秒間の第二ステップ、72℃・1分間の第三ステップを25サイクル行ない、最後に、72℃・7分の第四ステップである。反応液組成を表4に示す。
【0028】
【表4】

反応終了後0.9%のアガロース電気泳動で確認したところ、設計通りのサイズのDNAバンドを確認することができた。
(4)目的バンドをアガロースゲルから抽出(QIAquick Gel extraction kit(商品名):キアゲン社製)後、抽出DNAを制限酵素BamHIとXbaIにより消化し、これらの制限酵素により事前に消化したpNCMO2(タカラバイオ社製)とライゲーションし(Ligation Kit Ver.2(商品名):タカラバイオ社製)、50μg/mLの抗生物質カルベシニリンを添加したLB寒天培地により大腸菌JM109株を形質転換し調製した。これをpNCHUFcRとした。図6に、上記に記載したプラスミドベクターpNCHUFcRの作製方法の概略を示す。
実施例4 配列の確認
実施例3において作製したpNCBBFcR およびpNCHUFcRプラスミドベクターに挿入したDNAの配列をチェーンターミネータ法に基づくBig Dye Terminator v3.1 Cycle Sequencing kit(商品名)(PEアプライドバイオシステム社)を用いてサイクルシークエンス反応に供し、全自動DNAシークエンサーABI Prism 310 DNA analyzer(商品名)(PEアプライドバイオシステム社)にて解析した。なお、配列番号60(5’−CgCTTgCAggATTCgg−3’)と61(5’−CAATgTAATTgTTCCCTACCTgC−3’)に示すオリゴヌクレオチドをシークエンス用プライマーとして使用した。
【0029】
解析の結果、pNCBBFcRおよびpNCHUFcRに挿入したDNAの塩基配列は設計通りであることを確認した。pNCBBFcRおよびpNCHURcRにより発現されるヒト型FcγRIのアミノ酸配列を配列番号62および63にそれぞれ示す。それぞれの配列にはpNCMO2プラスミドベクター上のシグナル配列を含めている。
実施例5 形質転換体の培養
pNCBBFcRプラスミドベクターを10μg/mLの抗生物質ネオマイシンを添加したTM寒天培地(表5)によりBrevibacillus choshinensis SP3株(タカラバイオ社製)に形質転換した。
【0030】
【表5】

37℃で18時間培養後、出現した任意のコロニーを選択し10μg/mLの抗生物質ネオマイシンを添加したTM液体培地1mLを含む試験管に接種した。表6にTM液体培地の組成を示す。
【0031】
【表6】

激しく撹拌しながら30℃で48時間培養後、遠心分離操作(10000rpm、10分間)により菌体と培養上清に分離した。pBBHUFcRプラスミドベクターについても同様に操作し、任意にコロニーから培養上清を調製した。
実施例6 形質転換体の抗体結合活性評価
実施例5で調製した形質転換体の培養上清をELISA反応により抗体結合活性を評価した。
(1)96穴のELISAプレート(Nunc社製)に50μg/mLから段階的に希釈したガンマグロブリン製剤(化学及血清療法研究所製)を各ウェルに100μLずつ添加し、4℃で18時間静置することにより固定した。
(2)TBS緩衝液(0.2%(w/v)Tween 20、150mM NaClを含むTris−HCl緩衝液(pH8.0))で洗浄後、Starting Block Blocking Buffers(PIERCE社製)によりブロッキング操作を施した。
(3)同様に、TBS緩衝液で洗浄後、実施例5で調製した任意のコロニー由来の培養上清を100μL添加し、固定化した抗体であるヒトガンマグロブリンと反応させた(30℃、2時間)。反応終了後、TBS緩衝液で洗浄し、His−probe(H−15)HRP抗体(Santa Cruz Biotechnology社製)を添加した。
(4)反応終了後、TBS緩衝液で洗浄し、TMB Peroxidase Substrate(KPL社製)を添加し450nmの吸光度を測定した。
【0032】
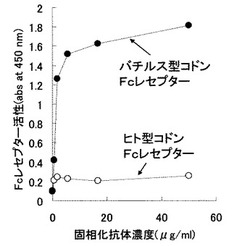
結果を図7に示す。図7の通り、pNCBBFcRにより形質転換されたバチルス属細菌由来の培養上清の抗体結合活性はpNCHUFcRのものに比べて有意に高いことが分かった。すなわち、ヒト型FcγRIを宿主バチルス属細菌において発現させる場合、同タンパク質をコードする塩基配列のコドンをヒト型からバチルス属細菌型に変換した遺伝子の方がバチルス属細菌宿主にとっては高発現であった。また、実施例5で調製した形質転換体を用いて発現させたヒト型FcγRIは、可溶化等の操作をしなくても抗体結合性を持った活性型のタンパク質が得られたことから、実施例5で調製した形質転換体を用いた当該タンパク質の生産方法は従来技術である大腸菌や動物細胞を用いた系と比較し、当該タンパク質の生産に有用なものといえる。
実施例7 pNCBBFcRにより形質転換されたバチルス属細菌の培養経時変化
実施例5で評価した任意のコロニーの中から最も抗体結合活性の高かったクローンを選択しフラスコにより培養した。すなわち、10μg/mLの抗生物質ネオマイシンを添加した200mLのTM液体培地(表6)を添加した500mL容のバッフル付フラスコに高活性クローンを接種し、150rpmの撹拌により30℃で培養した。適当な時間、培養液をサンプリングし実施例6と同様に培養上清を調製し、実施例6と同様に抗体結合活性を評価した。結果を図8に示した。図8の通り、ヒト型FcγRIは培養約24時間から生産され培養53時間で最も多く生産されることが分かった。
実施例8 ウエスタンブロッティング法によるFcレセプターの検出
実施例7で調製した培養上清をSDS―PAGE電気泳動に供し、ウエスタンブロッティング法による検出を行なった。
(1)培養上清10μLとメルカプトエタノールを含むサンプル緩衝液10μLを混合し、98℃、5分間の熱処理後、10から20%グラジエントのポリアクリルアミドゲルを使用した電気泳動を行なった。
(2)CBB染色後、4%のスキンミルクにより事前にブロッキングしたPVDFメンブランに転写した(150mA、120分間)。
(3)0.05%(w/v)のTween20を含むリン酸緩衝液で2000倍希釈した抗CD64(FcレセプターFcγRIの別名)抗体(goat polyclonal抗体)(R&D systems社製)を添加し、30℃で2時間反応させた。
(4)反応終了後、0.05%(w/v)のTween20を含むリン酸緩衝液を用いて洗浄し、二次抗体である抗goatIgG(H+L)抗体−HRP標識(ZYMED Laboratories社製)を2000倍希釈し添加、反応させた。
(5)0.05%(w/v)のTween20を含むリン酸緩衝液で洗浄後、電気泳動ゲル1枚あたり2mLのECL plus solution(GEヘルスケアバイオサイエンス社製)を添加し、メンブラン上で5分間静置後、フィルムを感光させた。
【0033】
現像結果を図9に示す。図9の通り、培養24時間後から100時間後までの間にサンプリングした調製液からヒト型FcγRIが検出された。
【図面の簡単な説明】
【0034】
【図1】ヒト型FcレセプターFcγRIの構造を示す図である。
【図2】ヒト型FcγRIのヒト型コドンおよびバチルス属細菌型コドン間の塩基配列を比較した図である。図中、BacillusFcγRIがバチルス属細菌型コドンに変換したヒト型FcγRIの塩基配列(配列番号2)、HumanFcγRIがコドン変換前のヒト型FcγRIの塩基配列(配列番号1)である。
【図3】プラスミドベクターpBBFcRの構造を示す図である。
【図4】プラスミドベクターpNCMO2マルチクローニングサイトの塩基配列を示す図である。
【図5】プラスミドベクターpNCBBFcRの作製方法を示す図である。
【図6】プラスミドベクターpNCHUFcRの作製方法を示す図である。
【図7】実施例5で調製した形質転換体(ヒト型コドン由来、またはバチルス属細菌型コドン由来)を用いて発現させたヒト型FcγRIの抗体結合活性を比較した図である。
【図8】バチルス属細菌によるヒト型FcγRIの生産を示す図である。
【図9】ウエスタンブロッティング法によるヒト型FcγRIの検出結果を示す図である。なお、図中のレーン番号は、1が培養24時間後、2が33時間後、3が48時間後、4が58時間後、5が100時間経過後の培養上清に対して、抗CD64抗体により検出した結果である。
【技術分野】
【0001】
本発明は、ヒト型FcレセプターのひとつであるFcγRIを、バチルス属に属する細菌を用いることで、可溶化等の操作をせずに大量発現させる方法に関する。
【背景技術】
【0002】
Fcレセプターは、免疫グロブリン分子のFc領域に結合する一群の分子である。Fcレセプターはその結合する免疫グロブリンの種類によって分類されており、IgGのFc領域に結合するFcγレセプター、IgEのFc領域に結合するFcεレセプター、IgAのFc領域に結合するFcαレセプター等がある(非特許文献1)。また、各レセプターは、その構造の違いによりさらに細かく分類され、Fcγレセプターの場合、FcγRI、FcγRII、FcγRIIIの存在が報告されている(非特許文献1)。
【0003】
Fcγレセプターの一つであるFcγRIは単球とマクロファージ中で発現しており、好中球ではγインターフェロンにより誘導的に発現される(非特許文献1)。また、FcγRIはIgGに対する結合親和性が高く、その平衡解離定数(Kd)は10−8M以下である(非特許文献2)。FcγRIは、細胞外領域、細胞膜貫通領域、細胞質内領域に区分され、IgGとの結合は、IgGのFc領域とFcγRIの細胞外領域で起こり、その後細胞質へとシグナルが伝達される。FcγRIはIgGとの結合に直接関わる分子量約42000のα鎖と、γ鎖の2種類のサブユニットによって構成されており、γ鎖は細胞膜と細胞外領域との境界で共有結合することでホモダイマーを形成している(非特許文献3)。
【0004】
ヒト型FcγRIのアミノ酸配列、および遺伝子配列(配列番号1)はExPASy(Primary accession number:P12314)などの公的データベースに公表されている。また、FcγRIの構造上の機能ドメイン、細胞膜を貫通するためのシグナルペプチド配列、細胞膜貫通領域の位置についても同様に公表されており、図1にヒト型FcγRIの構造略図を示す。なお、図中のアミノ酸番号は配列番号1に記載のアミノ酸番号に対応する。すなわち、配列番号1のアミノ酸番号1のメチオニン(Met)から289のバリン(Val)までが細胞外領域、配列番号1のアミノ酸番号290のロイシン(Leu)から374のスレオニン(Thr)までが細胞膜貫通領域および細胞内領域とされている。
【0005】
近年になり、Fcレセプターの予想外の免疫抑制的な生物学的特性は、特に自己免疫疾患または自己免疫症候群、移植物の拒絶および悪性リンパ増殖の領域において医薬として注目を浴びつつある(非特許文献2)。また、FcγRIの機能である抗体の吸着能は各種抗体精製用クロマトグラフィーゲルの捕捉機能を担うタンパク質としても利用することができる。
【0006】
FcγRIα鎖のアミノ酸配列および遺伝子塩基配列(非特許文献4)はJanet等により明らかにされ、その後、遺伝子組換え技術により、大腸菌(特許文献1)あるいは動物細胞を利用した発現が報告されている。しかしながら、大腸菌を利用した発現系においてはFcγRIの細胞外領域タンパク質の発現量は極めて低く、また、発現されたタンパク質は菌体内発現のため、多くの場合発現したタンパク質は不溶性の封入体となる。封入体タンパク質は可溶化等の操作をすることにより、活性型タンパク質として調製することは可能であるが、煩雑な操作を必要とする。また、動物細胞を用いた系では、大腸菌以上の発現量が報告(非特許文献3)されているが培養に多大な時間を要し、かつ、生産性も高くない。
【0007】
【特許文献1】特表2004−530419号公報
【非特許文献1】J.V.Ravetch等,Annu.Rev.Immunol.,9,457,1991
【非特許文献2】Toshiyuki Takai,Jpn.J.Clin.Immunol.,28,318,2005
【非特許文献3】A.Paetz等,Biochem.Biophys.Res.Commun.,338,1811,2005
【非特許文献4】J.M.Allen等,Science,243,378,1989
【非特許文献5】Nucleic Acid Res.,30,e43,2002
【非特許文献6】Protein Expr Purif.、47、441−445、2006
【非特許文献7】Masaya Nagao等、Biosci.Biotech.Biochem.、61、670、1997
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明の目的は工業生産規模においてヒト型FcレセプターFcγRIを高い生産性を以って生産する微生物を作製することである。さらには、新規Fcレセプター生産系を利用してヒト型FcγRI生産を行ない、当該ヒト型FcγRIを提供することにある。
【課題を解決するための手段】
【0009】
本願発明者らは、上記課題に関し鋭意検討した結果、ヒト型FcレセプターFcγRI遺伝子のコドンをヒト型からバチルス(Bacillus)属細菌型に変換後、変換したポリヌクレオチドを発現プラスミドベクターに挿入し、当該挿入されたプラスミドベクターにより形質転換されたバチルス属に属する細菌を用いて発現させることで、可溶化等の操作が不要な活性型FcγRIを直接生産することができ、かつ、その発現量も飛躍的に向上することを見出した。
【0010】
すなわち、本発明は、以下の発明を包含する:
(1)配列番号1に示すヒト型FcレセプターFcγRIをコードするポリヌクレオチド配列のうち、少なくとも64番目から867番目のポリヌクレオチドのコドンがヒト型からバチルス属細菌型に変換されたことを特徴とする、ヒト型FcレセプターFcγRIをコードするポリヌクレオチド。
(2)前記ポリヌクレオチドが、配列番号3のポリヌクレオチドであることを特徴とする、(1)に記載のヒト型FcレセプターFcγRIをコードするポリヌクレオチド。
(3)(1)または(2)に記載のポリヌクレオチドが挿入されたプラスミドベクター。
(4)(3)に記載のプラスミドベクターをバチルス属に属する細菌に形質転換することにより得られる、形質転換体。
(5)(4)に記載の形質転換体を培養する工程を含むヒト型FcレセプターFcγRIポリペプチドの製造方法。
【0011】
以下、本発明について詳細に説明する。
【0012】
本発明のポリヌクレオチドは、配列番号1に示す、ヒト型Fcレセプターの一つであるFcγRIをコードするポリヌクレオチド配列のうち、少なくとも64番目から867番目のポリヌクレオチド(配列番号1のアミノ酸番号22のアラニン(Ala)から269のバリン(Val)をコードするポリヌクレオチド)のコドンをヒト型からバチルス属細菌型に変換したポリヌクレオチドを含むことを特徴とする、ヒト型FcレセプターFcγRIをコードするポリヌクレオチドであり、好ましくは、上記64番目から867番目のポリヌクレオチドのコドンをヒト型からバチルス属細菌型に変換したポリヌクレオチドが、配列番号3のポリヌクレオチドであることを特徴とする、ヒト型FcレセプターFcγRIをコードするポリヌクレオチドである。
【0013】
本発明のFcγRIをコードするポリヌクレオチドのコドンをヒト型からバチルス属細菌型に変換したポリヌクレオチドは、ヒト型FcγRIをコードする遺伝子のうち、少なくとも配列番号1の64番目から867番目のポリヌクレオチド中に存在するバチルス属細菌におけるレアコドン(rare codon)を、コードするアミノ酸を同一のまま、バチルス属細菌の翻訳機構において利用頻度が高いコドン(codon)に変換することにより得られる。なお、レアコドンとは、その宿主におけるコドンの使用頻度が少ないものをいう。宿主におけるコドンの使用頻度は、ゲノム遺伝子の塩基配列等の解析結果等から推測することが可能であり、例えば、バチルス属細菌の一種であるBrevibacillus choshinensisにおけるレアコドンとしては、アミノ酸セリン(Ser)コドンのUCA、ロイシン(Leu)コドンのCUA、アルギニン(Arg)コドンのCGG、AGA、AGG、イソロイシン(Ile)コドンのAUAがあげられる。また、コドンの使用頻度の情報は公的データベース(http://www.kazusa.or.jp/codon/)からも得ることができる。レアコドンから利用頻度の高いコドンへの変換は対応する塩基配列を変換することにより可能であり、塩基配列の変換はSite−directed mutagenesis法など公知の変異導入法を利用することができるが、好ましい変換方法は、合成オリゴヌクレオチドとPCRを組合わせたDNAWorks法(非特許文献5)やSynthetic Gene Designer法(非特許文献6)である。上記方法では、ポリペプチドをコードするアミノ酸配列を基にして、数十塩基からなるオリゴヌクレオチド群を合成し、PCR法により合成オリゴヌクレオチドをアッセンブリーさせることによって完全長の遺伝子を作製することができる。なお、ヒト型FcγRIをコードするポリヌクレオチドのヒト型からバチルス属細菌型へのコドン変換は、実施例に記載のように、ヒト型FcγRI遺伝子配列(配列番号1)のすべてのレアコドンをヒト型からバチルス属細菌型に変換(配列番号2)しても良いし、一部のレアコドン、例えば配列番号1に示すポリヌクレオチド配列のうち64番目から867番目にあるレアコドンをヒト型からバチルス属細菌型に変換(配列番号3)してもよい。
【0014】
さらにヒト型FcγRIをコードするポリヌクレオチドは、ヒト型FcγRIをコードするポリヌクレオチドのコドンをヒト型からバチルス属細菌型に変換したポリヌクレオチドの5’末端側に、転写を開始するためのメチオニンをコードするオリゴヌクレオチドを付加しても良く、また上記記載のポリヌクレオチドの5’末端側にシグナルペプチド配列をコードするオリゴヌクレオチドを付加しても良い。ここに述べる、シグナルペプチドとは、細胞質内で発現したタンパク質が細胞膜を通過し、細胞膜外において分泌するためのポリペプチドであり、通常、当該タンパク質のN末端側に存在しており、細胞膜通過後、特定のプロテアーゼ酵素によって切断される。シグナルペプチドの例としては、配列番号1のアミノ酸番号1から15、あるいは1から20のペプチドをあげることができる。
【0015】
本発明は、ヒト型FcγRIを簡便に精製することを目的として、上記記載のポリヌクレオチドに、タグ(tag)となるペプチドをコードするオリゴヌクレオチドを付加させてもよい。タグペプチドとしてはポリヒスチジンタグ(His−tag)、ミックタグ(C−myc tag)等を例示することができる。付加させる位置は、上述のポリペプチドの生物活性を損なわない限りにおいて、N末端側、C末端側どちらでも構わない。上記記載のオリゴヌクレオチドへのタグペプチドをコードするオリゴヌクレオチドの付加は、当業者に周知の方法にて遺伝子工学的に作製することが可能である。
【0016】
本発明の、コドンをヒト型からバチルス属細菌型に変換したヒト型FcγRIポリヌクレオチドが挿入された遺伝子組換えプラスミドベクターは、上記記載のヒト型FcγRIポリヌクレオチドを公知の発現プラスミドベクターの適当な位置に遺伝子工学的に挿入することにより、ヒト型FcγRIが発現可能な遺伝子組換えプラスミドベクターを得ることができる。公知の発現プラスミドベクターとしては、例えば、バチルス属細菌の形質転換に利用されるpUB110、pC194、pE194、pWVO1等をあげることができる。ここで述べる適当な位置とはプラスミドベクターの複製機能、所望の抗生物質マーカー、あるいは伝達性に関わる領域を破壊しないような位置等を意味する。そして、上記記載の遺伝子組換えプラスミドベクターをバチルス属の属する細菌に形質転換して得られる形質転換体を培養することにより、ヒト型FcγRIを発現させることがきる。
【0017】
本発明で形質転換に用いる宿主細胞は、コドンの変換対象であるバチルス属に属する細菌であれば良く、例えばBacillus amyloliquefaciens、Bacillus circulans、Bacillus licheniformis、Bacillus stearothermophilus、 Bacillus subtilis、Bacillus polymyxa、Bacillus cereus、Bacillus megaterium、Bacillus mecerans、Bacillus coagulans、Bacillus lentus等をあげることができる。特に、胞子形成関連遺伝子が破壊されており、かつ、菌体内プロテアーゼ遺伝子jmpや菌体外プロテアーゼ遺伝子empも破壊されている、Brevibacillus choshinensis(非特許文献7)を宿主細胞として用いるのが好ましい。また、上記バチルス属に属する細菌を変異処理することにより誘導されるバチルス属細菌変異株を利用することもできる。変異処理はニトロソグアニジン、メタンスルホン酸エチル、紫外線、放射線等の当業者において周知の変異処理剤を利用して行なえばよい。
【0018】
本発明の、バチルス属細菌への外来遺伝子の導入および発現のための手順、および方法は、実施例に記載した方法のほかにも、遺伝子工学の分野により慣用されているものを含み、具体的にはエレクトロポレーション法、Tris−PEG法等をあげることができる。
【0019】
本発明の、ヒト型FcγRIを生産するために用いられるバチルス属に属する細菌は、選択した宿主細胞の培養に好適な公知の培地で増殖させることができる。なお、本発明に用いる培地としては細菌が増殖し、ヒト型FcγRIを生産し得るものであれば何れも使用してよく、炭素源には廃糖蜜、グルコース、フルクトース、マルトース、ショ糖、デンプン、乳糖、グリセロール、酢酸などが、窒素源にはコーンスティープリカー、ペプトン、酵母エキス、肉エキス、大豆粕等の天然成分や、酢酸アンモニウム、アスパラギン酸、グリシン等のアミノ酸類が、無機塩にはリン酸一ナトリウム、リン酸二ナトリウム、リン酸一カリウム、リン酸二カリウム等のリン酸塩や塩化ナトリウムなどが、金属イオンには塩化マグネシウム、硫酸マグネシウム、硫酸第一鉄、硫酸第二鉄、塩化第一鉄、塩化第二鉄、クエン酸鉄、硫酸アンモニウム鉄、塩化カルシウム二水和物、硫酸カルシウム、硫酸亜鉛、硫酸銅、塩化銅、硫酸マンガン、塩化マンガン等が、ビタミン類としては酵母エキス、ビオチン、ニコチン酸、チアミン、リボフラビン、イノシトール、ピリドキシン等が使用できる。好ましい実施態様では、発現プラスミドベクターを含有するバチルス属細菌の増殖を選択的に可能にするために、培地は発現プラスミドベクターの構成を基にした選抜剤を含んでもよい。例えば、ネオマイシン耐性遺伝子を発現する細胞の増殖のためにネオマイシンを培地に添加する。培地には、炭素、窒素および無機塩供給源の他に、適当な栄養源を加えてもよい。所望により、グルタチオン、システイン、シスタミン、チオグリコレート、ジチオスレイトールからなる群から選択される一種類以上の還元剤を含んでも良い。バチルス属細菌増殖における培養温度は、約20から40℃、好ましくは25から35℃であり、より好ましくは約30℃である。培地のpHは、約5から10、好ましくは7.0である。
【0020】
本発明の発現プラスミドベクターに宿主菌の細胞壁タンパク質由来のプロモータを用いる場合には、菌の生育が定常期に入ってから活発に働くため、培養液の濁度(600nmにおける吸光度)を測定し、対数増殖期から定常期に移行した後、引き続き培養することによりタンパク質を培養液中へ分泌発現させることができる。培養時間は24から96時間、好ましくは40から50時間であるが、最適な培養時間は培地成分、培養温度、および通気量といった条件により変化するため、発現したタンパク質の発現量や活性等を測定して決定するのが好ましい。
【0021】
培養液から、本発明のヒト型FcγRIを取得するには、発現の形態によって適宜抽出方法を選択すればよい。培養上清に発現する場合は菌体を遠心分離操作によって分離し、得られる培養上清からヒト型FcγRIを抽出すればよい。細胞質内で発現する場合には、遠心分離操作により菌体を集め、酵素処理剤や界面活性剤等を添加することにより菌体を破砕し、ヒト型FcγRIを抽出することができる。抽出タンパク質の中からヒト型FcγRIを分離・精製するためには液体クロマトグラフィーを利用することができる。液体クロマトグラフィーとしては、イオン交換クロマトグラフィー、疎水性相互作用クロマトグラフィー、ゲルろ過クロマトグラフィー、アフィニティークロマトグラフィー等を挙げることができる。これらのクロマトグラフィーを組み合わせて精製操作を行なうことにより高純度なヒト型FcγRIを調製することができる。
【0022】
本発明により得られた精製したヒト型FcγRIを、固定相に固定化することにより抗体を液相から吸着させ分離することができる。固定相としてはセルロース、アガロース等の多糖類、ガラス、セラミックス、あるいは、ポリプロピレン、塩化ビニル、ポリスチレン等のプラスチック素材を例示することができる。また、固相に固定したヒト型FcγRIをカラムに充填することにより抗体に対するクロマトグラフィーゲルとしても利用することができる。また、ヒト血清を検体にすることにより特異性の高いイムノアッセイが可能であり各種診断材料としても利用することができる。
【発明の効果】
【0023】
ヒト型FcレセプターFcγRIをコードする遺伝子のコドンを、ヒト型からバチルス属細菌型に変換し、当該ポリヌクレオチドが挿入されたプラスミドをバチルス属に属する細菌に形質転換させることで、ヒト型FcγRIを可溶化等の操作なく大量に発現させることが可能となる。この発現系は、工業生産規模におけるヒト型FcγRIの生産に有用なものである。
【発明を実施するための最良の形態】
【0024】
以下、実施例により本発明をさらに具体的に説明するが、本発明はこれらの実施例に限定されるものではない。
実施例1 ヒト型FcレセプターをコードするDNA配列の設計
配列番号1に記載のヒト型FcレセプターFcγRIのアミノ酸配列を基にDNAworks法(非特許文献5)により、コドンをブレビバチルス属細菌型に変換した。該方法によりコドンを変換したヒト型FcγRIの塩基配列(配列番号2)とコドン変換前のヒト型FcγRIの塩基配列(配列番号1)を比較した結果を図2に示す。図2の通り、アミノ酸配列はそのままにDNA配列の変換が行われ、そのDNA配列間の類似性は75%であった。
実施例2 ヒト型FcレセプターをコードするDNA配列の作製
ヒト型FcγRI遺伝子のコドンをヒト型からブレビバチルス属細菌型に変換したDNA配列を以下の方法で作製した。
(1)ヒト型FcγRI遺伝子のコドンをヒト型からブレビバチルス属細菌型に変換したDNA配列を作製するための52種類のオリゴヌクレオチドを合成した。合成したオリゴヌクレオチドを配列番号4から55に示す。
(2)(1)で合成したオリゴヌクレオチドから完全長のヒト型FcγRIをコードするDNAを作製するために、二段階のPCRを行なった。
(2−1)一段階目のPCRの反応液は表1の通りで、反応条件は94℃・5分の熱処理後、94℃・30秒間の第一ステップ、62℃・30秒間の第二ステップ、72℃・1分間の第三ステップを25サイクル行ない、次いで、72℃・7分の第四ステップである。表1中のDNAミックスは52種類の合成した50pmol/μLのオリゴヌクレオチドをそれぞれ一定量サンプリングし混合した溶液である。
【0025】
【表1】

(2−2)二段階目のPCRは一段階目のPCRの反応液を用いて、表2の反応液組成で行なった。PCRプライマーの配列は、配列番号4(5’−ATgTggTTCTTgACAACTCTCCTgCTTTgggTCCC−3’)と配列番号55(5’−AgTAgCgCCTTgCggTTCTTTACgATgCACgCCCTCC−3’)のオリゴヌクレオチドを用いた。反応条件は94℃・5分の熱処理後、94℃・30秒間の第一ステップ、65℃・30秒間の第二ステップ、72℃・1分間の第三ステップを25サイクル行ない、最後に、72℃・7分の第四ステップである。
【0026】
【表2】

反応終了後0.9%のアガロース電気泳動で確認したところ、設計通りのサイズのDNAバンド(約1100塩基対)を確認することができた。
(3)目的バンドをアガロースゲルから抽出(QIAquick Gel extraction kit(商品名):キアゲン社製)後、抽出DNAの5’末端をリン酸化し、制限酵素SmaIで消化したpUC19プラスミドベクターに挿入し、50μg/mLの抗生物質カルベシニリンを添加したLB寒天培地により大腸菌JM109株(タカラバイオ社製)を形質転換した。これをpBBFcRとした。図3に構造を示す。
実施例3 ヒト型FcγRI細胞外領域発現プラスミドベクターの作製
ヒト型FcγRIの細胞外領域を発現させるために、以下に示す方法でヒト型FcγRI発現プラスミドベクターの作製を行なった。
(1)pBBFcRをテンプレートにし配列番号56(5’−ACATg[CCATgg]CTTTCgCTgCAggATCCgCTgTAATCACTCTgCAgCCAC−3’:角かっこ内の塩基は制限酵素NcoIサイト)と配列番号57(5’−gC[TCTAgA]CTAATggTgATggTgATggTggACTggAgTAggCAgTTg−3’:角かっこ内の塩基は制限酵素XbaIサイト)のオリゴヌクレオチドをプライマーにしてPCRを行ない、細胞外領域をコードするDNAを増幅した。なお、ヒト型FcγRIの調製および定量を行なうために、発現タンパク質のC末端側にポリヒスチジンタグが付加されるようにPCRプライマーを設計した(配列番号57)。反応条件は94℃・5分の熱処理後、94℃・30秒間の第一ステップ、65℃・30秒間の第二ステップ、72℃・1分間の第三ステップを25サイクル行ない、最後に、72℃・7分の第四ステップである。反応液組成を表3に示す。
【0027】
【表3】

反応終了後、0.9%のアガロース電気泳動で確認したところ、設計通りのサイズのDNAバンドを確認することができた。
(2)目的バンドをアガロースゲルから抽出(QIAquick Gel extraction kit(商品名):キアゲン社製)後、抽出DNAを制限酵素NcoIとXbaIにより消化し、これらの制限酵素により事前に消化したpNCMO2(タカラバイオ社製)とライゲーションし、50μg/mLの抗生物質カルベシニリンを添加したLB寒天培地により大腸菌JM109株を形質転換し調製した。これをpNCBBFcRとした。図4にpNCMO2プラスミドベクターのマルチクローニングサイト周辺の塩基配列、図5に上記に記載したプラスミドベクターpNCBBFcRの作製方法の概略を示す。
(3)並行して、ヒト型FcγRIの細胞外領域をコードするヒト型コドンのDNAを用いた発現ベクターも作製した。挿入断片の作製はPCRで行ない、Human cDNA clone TC119841プラスミドベクター(Origene社製)をテンプレートとし、配列番号58(5’−CgC[ggATCC]gCAgTgATCACTTTgCAgCCTCCATggg−3’:角かっこ内の塩基は制限酵素BamHIサイト)と配列番号59(5’−gC[TCTAgA]CTAATggTgATggTgATggTggACAggAgTTggTAACTgg−3’:角かっこ内の塩基は制限酵素XbaIサイト)のオリゴヌクレオチドをPCRプライマーとして使用した。なお、ヒト型FcγRIの調製および定量を行なうために、発現タンパク質のC末端側にポリヒスチジンタグが付加されるようにPCRプライマーを設計した(配列番号59)。PCRは94℃・5分の熱処理後、94℃・30秒間の第一ステップ、65℃・30秒間の第二ステップ、72℃・1分間の第三ステップを25サイクル行ない、最後に、72℃・7分の第四ステップである。反応液組成を表4に示す。
【0028】
【表4】

反応終了後0.9%のアガロース電気泳動で確認したところ、設計通りのサイズのDNAバンドを確認することができた。
(4)目的バンドをアガロースゲルから抽出(QIAquick Gel extraction kit(商品名):キアゲン社製)後、抽出DNAを制限酵素BamHIとXbaIにより消化し、これらの制限酵素により事前に消化したpNCMO2(タカラバイオ社製)とライゲーションし(Ligation Kit Ver.2(商品名):タカラバイオ社製)、50μg/mLの抗生物質カルベシニリンを添加したLB寒天培地により大腸菌JM109株を形質転換し調製した。これをpNCHUFcRとした。図6に、上記に記載したプラスミドベクターpNCHUFcRの作製方法の概略を示す。
実施例4 配列の確認
実施例3において作製したpNCBBFcR およびpNCHUFcRプラスミドベクターに挿入したDNAの配列をチェーンターミネータ法に基づくBig Dye Terminator v3.1 Cycle Sequencing kit(商品名)(PEアプライドバイオシステム社)を用いてサイクルシークエンス反応に供し、全自動DNAシークエンサーABI Prism 310 DNA analyzer(商品名)(PEアプライドバイオシステム社)にて解析した。なお、配列番号60(5’−CgCTTgCAggATTCgg−3’)と61(5’−CAATgTAATTgTTCCCTACCTgC−3’)に示すオリゴヌクレオチドをシークエンス用プライマーとして使用した。
【0029】
解析の結果、pNCBBFcRおよびpNCHUFcRに挿入したDNAの塩基配列は設計通りであることを確認した。pNCBBFcRおよびpNCHURcRにより発現されるヒト型FcγRIのアミノ酸配列を配列番号62および63にそれぞれ示す。それぞれの配列にはpNCMO2プラスミドベクター上のシグナル配列を含めている。
実施例5 形質転換体の培養
pNCBBFcRプラスミドベクターを10μg/mLの抗生物質ネオマイシンを添加したTM寒天培地(表5)によりBrevibacillus choshinensis SP3株(タカラバイオ社製)に形質転換した。
【0030】
【表5】

37℃で18時間培養後、出現した任意のコロニーを選択し10μg/mLの抗生物質ネオマイシンを添加したTM液体培地1mLを含む試験管に接種した。表6にTM液体培地の組成を示す。
【0031】
【表6】

激しく撹拌しながら30℃で48時間培養後、遠心分離操作(10000rpm、10分間)により菌体と培養上清に分離した。pBBHUFcRプラスミドベクターについても同様に操作し、任意にコロニーから培養上清を調製した。
実施例6 形質転換体の抗体結合活性評価
実施例5で調製した形質転換体の培養上清をELISA反応により抗体結合活性を評価した。
(1)96穴のELISAプレート(Nunc社製)に50μg/mLから段階的に希釈したガンマグロブリン製剤(化学及血清療法研究所製)を各ウェルに100μLずつ添加し、4℃で18時間静置することにより固定した。
(2)TBS緩衝液(0.2%(w/v)Tween 20、150mM NaClを含むTris−HCl緩衝液(pH8.0))で洗浄後、Starting Block Blocking Buffers(PIERCE社製)によりブロッキング操作を施した。
(3)同様に、TBS緩衝液で洗浄後、実施例5で調製した任意のコロニー由来の培養上清を100μL添加し、固定化した抗体であるヒトガンマグロブリンと反応させた(30℃、2時間)。反応終了後、TBS緩衝液で洗浄し、His−probe(H−15)HRP抗体(Santa Cruz Biotechnology社製)を添加した。
(4)反応終了後、TBS緩衝液で洗浄し、TMB Peroxidase Substrate(KPL社製)を添加し450nmの吸光度を測定した。
【0032】
結果を図7に示す。図7の通り、pNCBBFcRにより形質転換されたバチルス属細菌由来の培養上清の抗体結合活性はpNCHUFcRのものに比べて有意に高いことが分かった。すなわち、ヒト型FcγRIを宿主バチルス属細菌において発現させる場合、同タンパク質をコードする塩基配列のコドンをヒト型からバチルス属細菌型に変換した遺伝子の方がバチルス属細菌宿主にとっては高発現であった。また、実施例5で調製した形質転換体を用いて発現させたヒト型FcγRIは、可溶化等の操作をしなくても抗体結合性を持った活性型のタンパク質が得られたことから、実施例5で調製した形質転換体を用いた当該タンパク質の生産方法は従来技術である大腸菌や動物細胞を用いた系と比較し、当該タンパク質の生産に有用なものといえる。
実施例7 pNCBBFcRにより形質転換されたバチルス属細菌の培養経時変化
実施例5で評価した任意のコロニーの中から最も抗体結合活性の高かったクローンを選択しフラスコにより培養した。すなわち、10μg/mLの抗生物質ネオマイシンを添加した200mLのTM液体培地(表6)を添加した500mL容のバッフル付フラスコに高活性クローンを接種し、150rpmの撹拌により30℃で培養した。適当な時間、培養液をサンプリングし実施例6と同様に培養上清を調製し、実施例6と同様に抗体結合活性を評価した。結果を図8に示した。図8の通り、ヒト型FcγRIは培養約24時間から生産され培養53時間で最も多く生産されることが分かった。
実施例8 ウエスタンブロッティング法によるFcレセプターの検出
実施例7で調製した培養上清をSDS―PAGE電気泳動に供し、ウエスタンブロッティング法による検出を行なった。
(1)培養上清10μLとメルカプトエタノールを含むサンプル緩衝液10μLを混合し、98℃、5分間の熱処理後、10から20%グラジエントのポリアクリルアミドゲルを使用した電気泳動を行なった。
(2)CBB染色後、4%のスキンミルクにより事前にブロッキングしたPVDFメンブランに転写した(150mA、120分間)。
(3)0.05%(w/v)のTween20を含むリン酸緩衝液で2000倍希釈した抗CD64(FcレセプターFcγRIの別名)抗体(goat polyclonal抗体)(R&D systems社製)を添加し、30℃で2時間反応させた。
(4)反応終了後、0.05%(w/v)のTween20を含むリン酸緩衝液を用いて洗浄し、二次抗体である抗goatIgG(H+L)抗体−HRP標識(ZYMED Laboratories社製)を2000倍希釈し添加、反応させた。
(5)0.05%(w/v)のTween20を含むリン酸緩衝液で洗浄後、電気泳動ゲル1枚あたり2mLのECL plus solution(GEヘルスケアバイオサイエンス社製)を添加し、メンブラン上で5分間静置後、フィルムを感光させた。
【0033】
現像結果を図9に示す。図9の通り、培養24時間後から100時間後までの間にサンプリングした調製液からヒト型FcγRIが検出された。
【図面の簡単な説明】
【0034】
【図1】ヒト型FcレセプターFcγRIの構造を示す図である。
【図2】ヒト型FcγRIのヒト型コドンおよびバチルス属細菌型コドン間の塩基配列を比較した図である。図中、BacillusFcγRIがバチルス属細菌型コドンに変換したヒト型FcγRIの塩基配列(配列番号2)、HumanFcγRIがコドン変換前のヒト型FcγRIの塩基配列(配列番号1)である。
【図3】プラスミドベクターpBBFcRの構造を示す図である。
【図4】プラスミドベクターpNCMO2マルチクローニングサイトの塩基配列を示す図である。
【図5】プラスミドベクターpNCBBFcRの作製方法を示す図である。
【図6】プラスミドベクターpNCHUFcRの作製方法を示す図である。
【図7】実施例5で調製した形質転換体(ヒト型コドン由来、またはバチルス属細菌型コドン由来)を用いて発現させたヒト型FcγRIの抗体結合活性を比較した図である。
【図8】バチルス属細菌によるヒト型FcγRIの生産を示す図である。
【図9】ウエスタンブロッティング法によるヒト型FcγRIの検出結果を示す図である。なお、図中のレーン番号は、1が培養24時間後、2が33時間後、3が48時間後、4が58時間後、5が100時間経過後の培養上清に対して、抗CD64抗体により検出した結果である。
【特許請求の範囲】
【請求項1】
配列番号1に示すヒト型FcレセプターFcγRIをコードするポリヌクレオチド配列のうち、少なくとも64番目から867番目のポリヌクレオチドのコドンがヒト型からバチルス属細菌型に変換されたことを特徴とする、ヒト型FcレセプターFcγRIをコードするポリヌクレオチド。
【請求項2】
前記ポリヌクレオチドが、配列番号3のポリヌクレオチドであることを特徴とする、請求項1に記載のヒト型FcレセプターFcγRIをコードするポリヌクレオチド。
【請求項3】
請求項1または2に記載のポリヌクレオチドが挿入されたプラスミドベクター。
【請求項4】
請求項3に記載のプラスミドベクターをバチルス属に属する細菌に形質転換することにより得られる、形質転換体。
【請求項5】
請求項4に記載の形質転換体を培養する工程を含むヒト型FcレセプターFcγRIポリペプチドの製造方法。
【請求項1】
配列番号1に示すヒト型FcレセプターFcγRIをコードするポリヌクレオチド配列のうち、少なくとも64番目から867番目のポリヌクレオチドのコドンがヒト型からバチルス属細菌型に変換されたことを特徴とする、ヒト型FcレセプターFcγRIをコードするポリヌクレオチド。
【請求項2】
前記ポリヌクレオチドが、配列番号3のポリヌクレオチドであることを特徴とする、請求項1に記載のヒト型FcレセプターFcγRIをコードするポリヌクレオチド。
【請求項3】
請求項1または2に記載のポリヌクレオチドが挿入されたプラスミドベクター。
【請求項4】
請求項3に記載のプラスミドベクターをバチルス属に属する細菌に形質転換することにより得られる、形質転換体。
【請求項5】
請求項4に記載の形質転換体を培養する工程を含むヒト型FcレセプターFcγRIポリペプチドの製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2009−201403(P2009−201403A)
【公開日】平成21年9月10日(2009.9.10)
【国際特許分類】
【出願番号】特願2008−46438(P2008−46438)
【出願日】平成20年2月27日(2008.2.27)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成21年9月10日(2009.9.10)
【国際特許分類】
【出願日】平成20年2月27日(2008.2.27)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

