ヒトTh1/Th2分化誘導の評価方法
【課題】Ras/MAPK経路あるいはCa2+/CN経路に関わる化合物等、又は、それらの経路が動いている条件でヒトTh1/Th2分化誘導を修飾する化合物等を検索できる新規なスクリーニング系の提供。
【解決手段】計13種類のTh2特異的発現遺伝子の少なくとも一つ、及び/又は、2種類のTh1特異的発現遺伝子の少なくとも一つの発現強度を測定し、それらの強度に基づきTh1又はTh2への分化誘導の程度を評価する方法、及び、該評価方法を用いるヒトナイーブCD4T細胞のTh1及び/又はTh2分化誘導に対する被検化合物の影響をスクリーニングする方法。
【解決手段】計13種類のTh2特異的発現遺伝子の少なくとも一つ、及び/又は、2種類のTh1特異的発現遺伝子の少なくとも一つの発現強度を測定し、それらの強度に基づきTh1又はTh2への分化誘導の程度を評価する方法、及び、該評価方法を用いるヒトナイーブCD4T細胞のTh1及び/又はTh2分化誘導に対する被検化合物の影響をスクリーニングする方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヒトナイーブT細胞を用いるヒトTh1/Th2分化誘導系、分化誘導された細胞の検出方法、並びに、該分化誘導に対する被検化合物の影響(促進又は抑制等)のスクリーニング方法及びスクリーニングキット等に関する。
【背景技術】
【0002】
ヘルパーT細胞(Th)は抗原を認識してヘルパー因子と総称される各種サイトカインを産生し、免疫応答誘導を調節するT細胞群である。例えば、B細胞が抗体産生細胞に分化するにはB細胞自身による当該抗原の認識の他にヘルパーT細胞から産生されるインターロイキン(IL)4,5及び6等のサイトカインが必要となる。又、キラーT細胞のエフェクター誘導に際してもIL−2及びインターフェロンγが関与することが多い。このようなヘルパーT細胞は、IL−2及びインターフェロンγを産生するTh1、及びIL−4,5、6等を産生するTh2のサブセットに分類される。これらのサブセットは抗原刺激によって活性化され互いのサブセットに抑制的に働くことが知られており、両者のいずれかが優勢になるかによって生体の免疫応答の様式が左右される重要な細胞集団である。
【0003】
以前、本発明者はマウスTh1/Th2分化誘導系を確立し、解析が進んでいなかった末梢T細胞のTh1/Th2分化における Ras/MAPK経路及びCa2+/CN経路の役割を解析した(山下政克,中山俊憲、実験医学,19:570-575,2001)。即ち、マウスTh1/Th2分化誘導系を用いることによって、Ras/MAPK経路では、3つのカスケードのうちMEK/Erkカスケードが重要であること(Yamashita,M. et al., Proc. Natl. Acad. Sci. UST, 96:1024-1029, 1999, Yamashita,M. et al., J Biol Chem., 280:29409-29419, 2005)、又、カルシニューリン(CN)を標的分子とするFK506とシクロスポリンがマウスTh1/Th2分化誘導系を変調することを示した(Yamashita,M. et al., J. Exp. Med., 191:1869-1879, 2000)。これらの研究から、マウスにおけるTh1/Th2分化誘導系、とりわけRas/MAPK経路あるいはCa2+/CN経路が働いている条件下において、化合物等によるTh1またはTh2への分化誘導を評価することが可能となった。
【0004】
又、ヒトの系については、特開2002-186482号公報に、ヒト臍帯血白血球を刺激して得られるTh1細胞あるいはTh2細胞について記載がみられるが、Th1培養では臍帯血由来白血球をIL-12とIL-4中和抗体含む培地組成を用い、Th2培養ではIL-4とIL-12中和抗体を含む培地組成を用いて誘導するという従来からある一般的な分化誘導方法が用いられている。又、サイトカインの細胞内免疫蛍光染色法として、透過性処理したヒト臍帯血由来Th1細胞あるいはTh2細胞をIL-4またはIFN-γに関して染色している。
【0005】
更に、ヒトナイーブT細胞からIL-4あるいはIFNγを用いたTh1/Th2に分化誘導する方法(Torres, K. C. et al., Hum Immunol. 2004 Nov;65(11):1328-35)、また、CD3モノクローナル抗体を用いた方法(Suzuki Y, et al., J Virol. 1999 Jan;73(1):316-24., Demeure, C.E. et al., Eur J Immunol. 1995 Sep;25(9):2722-5)の報告はある。しかし、ヒト末梢T細胞のRas/MAPK経路あるいはCa2+/CN経路が働いている条件下におけるTh1/Th2分化誘導系について報告はない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2002-186482号公報
【非特許文献】
【0007】
【非特許文献1】山下政克,中山俊憲、実験医学,19:570-575,2001
【非特許文献2】Yamashita,M. et al., Proc. Natl. Acad. Sci. UST, 96:1024-1029, 1999, Yamashita,M. et al., J Biol Chem., 280:29409-29419, 20
【非特許文献3】Yamashita,M. et al., J. Exp. Med., 191:1869-1879, 2000
【非特許文献4】Torres, K. C. et al., Hum Immunol. 2004 Nov;65(11):1328-35
【非特許文献5】Suzuki Y, et al., J Virol. 1999 Jan;73(1):316-24., Demeure, C.E. et al., Eur J Immunol. 1995 Sep;25(9):2722-5
【発明の概要】
【発明が解決しようとする課題】
【0008】
ところで、マウス等齧歯類の Th1/Th2分化誘導系において陽性を示した化合物が、必ずしもヒトの系で陽性になるとは限らない。即ち、マウス等齧歯類とヒトとの間で種差が大きい互いに反応しないケースとして、ナイーブCD4T細胞をターゲットとするIL-4、IL-12あるいはIFN-γが挙げられる。これらのサイトカインが関係するシグナル伝達系もその進化の過程からするとマウス等齧歯類とヒトとの間で種差が大きいケースに相当することは十分考えられる。
【0009】
既に記載したように、従来、ヒトTh1/Th2分化誘導系を評価する適当な手段がなく、ヒトにおける末梢T細胞のTh1/Th2分化誘導系、とりわけRas/MAPK経路あるいはCa2+/CN経路に関わる薬物を評価可能なヒト Th1/Th2分化誘導系を確立することが、それらの経路によるヒトのTh1/Th2分化誘導を変調する化合物等を検索するためには必須であった。
【課題を解決するための手段】
【0010】
そこで、本発明者は、末梢T細胞のヒトナイーブT細胞を用いたヒトTh1分化誘導あるいはTh2分化誘導を、それぞれインビトロで刺激するための組成物その及び方法等について鋭意研究の結果、新規なヒトTh1/Th2分化誘導系を開発することに成功し、本発明を完成した。
【0011】
即ち、本発明は、以下の各態様に係るものである。
[1]ヒトナイーブCD4T細胞を、IL-2、IL-12及び抗IL-4抗体を含む分化誘導培地(Th1分化誘導条件)にて抗CD3抗体による刺激下で培養し、又は、IL-2、IL-4及び抗IFNγ抗体を含む分化誘導培地(Th2分化誘導条件)にて抗CD3抗体による刺激下培養し、更に、該分化誘導培地から、夫々、抗IL-4抗体又は抗IFNγ抗体のみを除いた培養条件下で抗CD3抗体による刺激なしで更に培養することから成る、該ヒトナイーブCD4T細胞のTh1及び/又はTh2分化誘導方法。
【0012】
[2]本発明の分化誘導方法により、ヒトTh1/Th2分化誘導させた後に、IFNγ、IL-4及び CD4に対する標識抗体を用いて細胞内染色を施し、次に、抗CD4抗体を用いてT細胞のみを選別し、選別した細胞についてIL-4及び IFNγ細胞内染色強度を測定し、それらの強度に基きTh1又はTh2への分化誘導の程度を評価する方法。
【0013】
[3]表1及び表2に記載された計13種類のTh2特異的発現遺伝子の少なくとも一つ、及び/又は、表3に記載された2種類のTh1特異的発現遺伝子の少なくとも一つの発現強度を測定し、それらの強度に基きTh1又はTh2への分化誘導の程度を評価する方法。
【0014】
[4]ヒトナイーブCD4T細胞のTh1及び/又はTh2分化誘導に対する被検化合物の影響をスクリーニングする方法であって、所定量の被検化合物を添加した分化誘導培地を用いて、本発明の分化誘導方法により、ヒトTh1/Th2分化誘導させた後に、Th1又はTh2への分化誘導の程度を評価することから成る、前記スクリーニング方法。
【0015】
[5]本発明の方法に使用されるキット。
【発明の効果】
【0016】
発明のヒトTh1/Th2分化誘導方法は、Ras/MAPK経路あるいはCa2+/CN経路に関わる化合物が反応することから、それらの経路に関わる化合物等あるいはそれらの経路が動いている条件でヒトTh1/Th2分化誘導を修飾する化合物等を検索できる、今までにない新規なスクリーニング系である。
【0017】
又、本発明の評価方法では、分化誘導操作後に抗IFNγ抗体及び抗IL-4抗体を用いて細胞内染色を施し、次に抗CD4抗体を用いてT細胞のみを選択し、選別した細胞についてのみIL-4及び IFNγ細胞内染色強度を直接的に測定するので、ヒトのTh1またはTh2への分化誘導を直接的に評価することを可能である。更に、分化誘導したヒトTh1/Th2で特異的な発現変動のみられる遺伝子の発現強度を用いる、ヒトTh1/Th2分化誘導の程度を評価する方法が提供される。あるいは、被倹薬化合物がヒトTh1/Th2 分化誘導に及ぼす影響を正確に直接的に評価する方法が提供される。
【0018】
従って、本発明において、以上の方法を利用して、Ras/MAPK経路あるいはCa2+/CN経路に関わる化合物等あるいはそれらの経路が動いている条件でヒトTh1/Th2分化誘導を修飾する化合物等を検索でき、従来にはない新規なスクリーニング系を提供することができる。
【図面の簡単な説明】
【0019】
【図1】自動磁気細胞分離装置(AutoMACS )で分離したヒトナイーブCD4T細胞の表面抗原を細胞解析装置(FACScalibur )で測定を行った結果を示す。
【図2】ヒト末梢血ナイーブT 細胞からTh1分化誘導細胞あるいはTh2分化誘導細胞の細胞内に蓄積させたサイトカイン量について細胞解析装置(FACScalibur)を使用して解析を行った結果を示す。
【図3】ヒトTh1/Th2分化誘導系におけるFK506あるいはヒドロコーチゾンによる修飾の結果を示す。上段はTh1誘導条件にて得られた細胞で各種化合物の影響を調べた結果で、上段はTh2誘導条件にて得られた細胞で各種化合物の影響を調べた結果を示す。左列は化合物の代わりに生理食塩水を用いた陰性コントロール、中央2列及び右2列は、夫々、FK506及びヒドロコーチゾン添加条件でそれぞれTh1誘導条件とTh2誘導条件に於ける化合物の影響を調べた結果を示す。
【図4】ヒトTh1/Th2分化誘導系における低濃度FK506あるいはシクロスポリンAによる修飾の結果を示す。左側はTh1誘導条件にて得られた細胞で各種化合物の影響を調べた結果で、右側はTh2誘導条件にて得られた細胞で各種化合物の影響を調べた結果を示す。Controlは化合物の代わりに生理食塩水を用いた陰性コントロールを示す。
【図5】ヒトTh1/Th2分化誘導系における低濃度PD98509による修飾による結果を示す。Controlは化合物の代わりに生理食塩水を用いた陰性コントロールを示す。
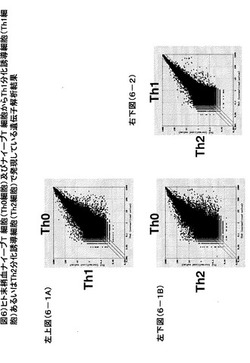
【図6】ヒト末梢血ナイーブT 細胞(Th0細胞)及びナイーブT 細胞からTh1分化誘導細胞(Th1細胞)あるいはTh2分化誘導細胞(Th2細胞)で発現している遺伝子をAffimetrix 社のGeneChipTM,Human Genome U133A Plus 2.0 Arrayを用いて解析した結果を分布図で示す。
【発明を実施するための形態】
【0020】
本発明のTh1及び/又はTh2分化誘導方法で使用されるヒトナイーブCD4T細胞が発現する分化抗原(細胞表面抗原)はCD4+CD8-CD45RO-で示される。このような細胞は通常、ヒト末梢血、ヒト臍帯血、ヒトリンパ組織等から、これらの分化抗原に対する抗体、各種の細胞分離装置、細胞解析装置等を使用して当業者に公知の任意の方法を用いて容易に分離することが出来る。
【0021】
本発明の分化誘導方法において、抗CD3抗体による刺激は当業者に公知の任意の方法で行うことが出来るが、例えば、抗CD3抗体を固層した培養プレート内で細胞を培養することにより簡易に抗CD3抗体による刺激操作を行うことが出来る。
【0022】
本発明の分化誘導方法において、抗CD3抗体による刺激下で通常1〜3日間、好ましくは、2日間培養し、且つ、抗CD3抗体による刺激なしで通常4〜6日間、好ましくは5日間培養する。
【0023】
抗CD3抗体による刺激下での培養に際しては、Th1分化誘導条件又はTh2分化誘導条件において、分化誘導培地に、通常、IL-2が5〜500U/ml、IL-12が0.1〜100ng/ml、抗IL-4抗体が0.5〜50μg/ml、IL-4が0.1〜100ng/ml、及び、抗IFNγ抗体が0.5〜50μg/mlの濃度で含まれることが好ましい。
【0024】
一方、抗CD3抗体による刺激なしでの培養に際しては使用する分化誘導培地には上記の抗IL-4抗体又は抗IFNγ抗体は含まれず、IL-2、IL-12、IL-4などのサイトカインは含まれる。
【0025】
又、Th2分化誘導条件における抗CD3抗体による刺激下の培養、及び、同分化誘導条件による抗CD3抗体による刺激なしの培養からなる培養サイクルを複数回連続して行うことにより、分化誘導の効率がより高められる。
【0026】
本発明の評価方法で使用するIFNγ、IL-4及び CD4に対する標識抗体において、標識物質としては当業者に公知の任意の化合物を使用することが出来る。例えば、FITC(フルオレセインイソチオシアネート)、PE(フィコエリスリン)、又はAPC(アロフィコシアニン)等を挙げることが出来る。これらの抗体の標識は当業者に公知の任意の方法で行うことが出来、或いは、又は標識抗体として市販品を使用することも出来る。
【0027】
抗CD4抗体を用いたT細胞の選別、及び、選別した細胞についてのIL-4及び IFNγ細胞内染色強度の測定は、蛍光活性化セルソーター(FACS)等の当業者に公知の適当な細胞自動解析分離装置を用いて行うことが出来る。
【0028】
更に、Th1又はTh2特異的発現遺伝子の発現強度を測定することにより、Th1又はTh2への分化誘導の程度を評価することが出来る。このような遺伝子の例として、例えば、表1及び表2に記載された計13種類のTh2特異的発現遺伝子、及び、表3に記載された2種類のTh1特異的発現遺伝子を挙げることが出来る。
【0029】
このようなTh1又はTh2特異的発現遺伝子の発現強度は、例えば、対象となる細胞におけるこれら遺伝子のmRNA(cDNA)又は発現産物(蛋白質)の発現量を測定することよって行うことが出来る。尚、このような測定は、測定方法・原理に応じて、定量的、半定量的、又は定性的であり得る。
【0030】
このようなcDNA又はそれに対応するmRNAを含む核酸分子は、当業者に公知の任意の方法・手段、例えば、RT−PCR法、リアルタイムPCR等の各種定量的PCR法、電気化学的検出法を応用したハイブリダイゼーション強度測定法並びに各種のマイクロアレイ(DNAチップ)法等の当業者に公知の方法で行うことが出来る。PCR法で増幅された核酸分子の検出は、その塩基配列を直接決定する方法(シークエンス法)、電気化学的検出法、又は電気泳動との組み合わせ等、適当な方法で行うことが出来る。尚、このような方法で使用する各種プライマー及びプローブは、各データベースから入手できる遺伝子の塩基配列情報に基き、当業者であれば、適宜、設計し調製することが出来る。
【0031】
尚、プライマーの設計に際しては、鋳型との特異的な結合が可能となるような塩基数、例えば、15−40塩基、より具体的には、15−25塩基程度を有することが好ましく、更には、プライマー内でヘアピン構造をとったり、センス鎖とアンチセンス鎖とが互いにアニーリングしないような塩基配列とすることも重要である。例えば、OligoTM(National Bioscience Inc.製)のような市販のプライマー設計用のソフトウェアを使用することも可能である。
【0032】
蛋白質の発現量は当業者に公知の任意の方法で測定することが可能である。例として、例えば、適当な抗体を用いた免疫染色及びEIA等の各種の免疫学的特異反応を利用する方法、エドマン法を用いた気相シークエンサー等ペプチドのアミノ酸配列分析法、更には、MALDI−TOF/MS及びESI Q−TOF/MS法等に代表される質量分析によって検出することが出来る。
【0033】
抗体は、該当する蛋白質、又はその適当な部分ポリペプチド(ペプチド断片)又はそれらの各種誘導体又は複合体等を抗原物質又は免疫原として用いて、当業者に公知の適当な方法で調製することが可能である。例えば、ポリクローナル抗体の場合には、マウス、ラット、ウサギ、ヤギ、ニワトリ等の適当な動物に投与し、その抗血清から調製することが可能である。或いは、モノクローナル抗体作成法(「単クローン抗体」、長宗香明、寺田弘共著、廣川書店、1990年; "Monoclonal Antibody" James W. Goding, third edition, Academic Press, 1996)等に記載の公知の細胞融合を用いる方法でモノクローナル抗体として調製することも可能である。
【0034】
尚、このような抗体は、その元来の抗体活性を失わない限り、遺伝子工学(DNA組換え技術)により、例えば、Fab、F(ab')2、Fv断片等の完全な抗体由来の各種誘導体を含む、当業者に公知の様々な形態に改変された誘導体、組換え体又はフラグメントであっても良い。
【0035】
尚、このような抗体には、酵素、放射性同位体蛍光色素、及び金属原子等の当業者に公知の各種の標識物質で適宜標識されている。
【0036】
本発明のスクリーニングする方法においては、所定量の被検化合物を添加した分化誘導培地を用いた本発明の分化誘導方法により、ヒトTh1/Th2分化誘導させた後に、Th1又はTh2への分化誘導の程度を評価することによって、ヒトナイーブCD4T細胞のTh1及び/又はTh2分化誘導に対する被検化合物の影響(修飾)をスクリーニングすることが出来る。被検化合物を添加する量及び時期等は、被検化合物の性質等に応じて適宜調整することが可能である。
通常、被検化合物は抗CD3抗体による刺激下での培養工程、及び、それに続く抗CD3抗体非刺激下での培養工程の両方を通して所定量添加する。しかしながら、添加する化合物の性質等に応じて、抗CD3抗体による刺激下、又は、抗CD3抗体非刺激下での培養のいずれか一方における培養過程でのみ被検化合物を添加することも可能である。
【0037】
Th1又はTh2への分化誘導の程度は、具体的には、既に記載した本発明の評価方法での評価することが出来る。その結果、ヒトTh1/Th2分化誘導を促進又は抑制する化合物、Th1/Th2バランスを変調する化合物等、Th1及び/又はTh2分化誘導に影響を与える化合物をスクリーニングすることが可能となる。このような化合物の一例として、例えば、アレルギー抑制化合物を挙げることが出来る。
【0038】
尚、これまでに記載した各方法において、細胞の各種培養条件(細胞培養密度、培地成分、培養時間、培養温度、酸素/二酸化炭素濃度等)、又は、細胞培養装置等は、各方法の目的、細胞又は被検化合物の種類及び量等に応じて当業者が適宜選択することが出来る。
【0039】
本発明の各種方法に使用されるキット(例えば、スクリーニングキット)は、測定対象又は測定原理等に応じて、適当な構成をとることが出来る。該キットは、その構成要素として、例えば、各種(標識)抗体、mRNA(cDNA)の増幅用プライマー及びDNAチップ等で使用するハイブリダイゼーション用のプローブ(例えば、10〜100個程度の連続した塩基配列から成る)を含むことが出来る。更に、上記キットには、その構成・使用目的などに応じて、当業者に公知の他の要素又は成分、例えば、各種試薬、酵素、緩衝液、反応プレート(容器)等が含まれる。
【0040】
以下、本発明を実施例によって詳細に説明するが、本発明の技術的範囲は以下の実施例の記載によって何ら限定して解釈されるものではない。又、特に記載のない場合には、以下の実施例は、例えば、Sambrook and Maniatis, in Molecular Cloning-A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, 1989; Ausubel, F. M. et al., Current Protocols in Molecular Biology, John Wiley & Sons, New York, N.Y, 1995等に記載されている、当業者に公知の標準的な遺伝子工学及び分子生物学的技術に従い、実施することが出来る。又、本明細書中に引用された文献の記載内容は本明細書の開示内容の一部を構成するものである。
【実施例1】
【0041】
ヒトナイーブCD4 T細胞の分離
ヒトナイーブCD4 T 細胞の分離は自動磁気細胞分離装置(autoMACS, Miltenyi Biotec GmbH)を用いて以下に示す方法で行なった。ヒト末梢血を50ml採取し、D-PBS溶液(Product Number D5652 , Sigma-Aldrich Inc) 50mlで等倍に希釈した。次に、12.5mlの Ficoll-Paque Plus(Catalog No.17-1440-02, Amersham Biosciences)を分注した4本の遠心チューブに上記の希釈末梢血25mlをゆっくり重層し、水平ローターを装着した遠心機を用いて室温で950Gにて30分間の遠心分離を行った。遠心後、Ficoll-Paqueと上清との間の中間層に存在するリンパ球を回収し、3%仔牛胎児血清(FCS:Cat No. 2103-500M, JRH Biosiences),2mMEDTA(Cat No 345-01865, Dojindo Inc)を含むD-PBS溶液 (以下、「MACSバッファー」という)を用いて懸濁し、遠心機を用いて4℃にて500Gにて5分間の遠心を行ってリンパ球を沈降させた。沈降したリンパ球細胞ペレットを再度MACSバッファーに懸濁し500Gにて5分間の遠心を行ってリンパ球を沈降させ、2回洗浄したリンパ球細胞ペレットを得た。この細胞ペレットを再度MACSバッファーに1x108個/mlになるように細胞を懸濁し、リンパ球1x107個に対してFITC標識抗ヒトCD8抗体(Cat.No 555366, BD BioScience Phamingen) 2μL, FITC標識抗ヒトCD45RO抗体(Cat.No. 555492, BD BioScience Phamingen)を2μLそれぞれ添加して氷上で30分間反応させて各々の抗体を結合させた後に、MACSバッファーを加え遠心し4℃にて2回洗浄した。次に各々の抗体を結合させたリンパ球1x107個に対して10μLの抗FITCマイクロビーズ(Cat No.120-000-293, Miltenyi Biotec GmbH)を添加して氷上で15分間反応させた後にMACSバッファーを加え遠心し4℃にて2回洗浄した。得られた細胞ペレットを5x107/mlの細胞濃度になるようにMACSバッファーで調製してナイロンメッシュ(#200 アベ科学)を通過させた後、自動磁気細胞分離装置(AutoMACS, Miltenyi Biotec GmbH)を用いCD8及びCD45ROネガティブフラクションを回収する事によってヒトナイーブCD4T 細胞を分離し、Th1分化誘導あるいはTh2分化誘導実験に供した。
【0042】
次にTh1分化誘導後あるいはTh2分化誘導後の遺伝子発現を検討することを目的とし、上記にて分離したヒトナイーブCD4 T 細胞をフィコエリスリンで標識した抗ヒトCD4抗体(CD4 PE)を用いて細胞の染色を行い目的とするナイーブCD4細胞の含有率を調べた。ヒトナイーブCD4 T 細胞を1x108個/mlに懸濁し、1x107個の細胞に対して2μLのCD4 PEを添加して氷上で30分間反応させて該抗体を結合させた後に、MACSバッファーで2回洗浄した。細胞解析装置(FACScalibur, Becton Dickinson)を用いて定法により測定して以下の結果を得た。調製した細胞群において、ヒトCD4を発現する細胞について調べたところ、目的とするヒトCD4のみを発現している細胞の含有率は36.3%であるが(図1−A)、ヒトCD8/CD45ROの発現している細胞は0%で、CD8T細胞やCD45RO陽性メモリーT細胞を完全に除く事が出来た。またそれ以外の細胞(ほとんどは非T細胞)の含有率は63.5%であった(図1−B)。このことにより、ヒトナイーブCD4 T 細胞の分離として良好であることが確認された。ここで得たナイーブT細胞(Th0細胞)の一部は遺伝子発現強度を測定する実験で使用した。
【実施例2】
【0043】
ヒト末梢血CD4 T 細胞からのTh1/Th2分化誘導
実施例1でヒト末梢血から分離調製したナイーブT細胞を用い、本発明の分化誘導方法を実施し、ヒトTh1誘導細胞及びヒトTh2誘導細胞を得た。すなわち、ヒト末梢血から分離したナイーブCD4T細胞を、Th1分化条件では5x105細胞/0.5ml/ウェルとなるように幡種して以下の条件下で刺激とそれに続く培養を行った。Th1刺激とそれに続く培養あるいはTh2刺激とそれに続く培養は、CO2インキュベーターを用い水蒸気で飽和させた5%CO2を含む空気のもと37℃にて行った。
【0044】
Th1分化条件では、10%仔牛胎児血清(FCS:Cat. No., 2103-500M JRH, Biosiences), 10mM HEPES(Cat. No. 15630-130, GIBCO), 100μM Non-Essential Amino Acids(Cat. No.
11140-076, GIBCO), 1mMSodiumPyruvate(Cat.No. 11360-070, GIBCO), 55μM 2-Mercaptethanol(Cat. No. 21985-023, GIBCO)を含むRPMI-1640培地(Cat. No. 2006-06, SIGMA)(以降、「分化誘導培地」と呼ぶ)に、50U/mlの濃度となるようにIL-2(イムネース,塩野義)、1ng/mlの濃度となるようにIL-12(Cat.No. 200-12, ペプロテック)及び5μg/mlの濃度となるように抗IL-4抗体(Cat.No BD-554481, Pharmingen) を添加した。抗CD3抗体20μg/ml(オルソクローンOKT3,ヤンセンファーマ)で固層化した平底48穴組織培養プレート(code,3548, Costor)を使用し2日間培養した。更に抗CD3抗体を含まない非固層化プレートに細胞を移し換えて、抗IL-4抗体を含まないが、IL-2及びIL-12を含むTh1分化条件の培養条件にてさらに5日間培養した。
【0045】
また、Th2分化条件では5x105細胞/0.5ml/ウエルとなるようにナイーブT細胞を幡種して以下の条件下で刺激して行った。すなわち、50U/mlの濃度となるように添加したIL-2( イムネース,塩野義)、1ng/mlの濃度となるように添加したIL-4(Cat.No.204-IL-050, R&D Systems)及び5μg/mlの濃度となるように添加した抗IFNγ抗体(Cat.No. BD-5545471, Pharmingen)を含む分化誘導培地を用いた培養条件にて抗CD3抗体固層化プレートを使用し2日間刺激し、更に抗CD3抗体を含まない非固層化プレートに細胞を移し替えて、抗IFNγ抗体を含まないが、IL-2及びIL-4を含むTh2分化条件の培養条件にて5日間培養した。Th2細胞分化の場合は、2日間に続く5日間の分化誘導を目的とした培養を2サイクル連続して続ける本発明の方法により初めて良好な結果が得られた。Th1分化誘導した細胞(Th1細胞)、Th2分化誘導した細胞(Th2細胞)は、遺伝子発現強度を測定する実験にそれぞれ細胞を供した。
【実施例3】
【0046】
Th1分化誘導細胞あるいはTh2分化誘導細胞の細胞内染色
実施例2でTh1分化誘導した細胞(Th1細胞)、Th2分化誘導した細胞(Th2細胞)をMonensin(Cat No.M-5273 Sigma)存在下でPMA(Phorbol-12-Myristate-13-Acetate,ProducNo.P1585Siguma-Aldrich), Ionomycin (Cat.No 407952, Calbiochem )を添加した培地を使用し、4時間培養し刺激を行った。刺激を行なった後に細胞内染色を以下の方法によりTh1分化誘導の程度あるいはTh2分化誘導の程度について細胞解析装置(FACScalibur, Becton Dickinson)を用いた解析により評価した。詳細には、Th1誘導細胞あるいはTh2誘導細胞を平底48穴組織培養プレートに1ウエルあたり5-10x105の細胞となる様に幡種し、2μMのMonensin存在下、10ng/mlのPMA, 1μMの Ionomycin1の濃度になるように添加し、37℃にて5%の CO2を含む飽和水蒸気を含む空気中でCO2インキュベーターを使用して4時間培養し刺激を行った。上記のMonensin(Cat No.M-5273, Sigma)存在下でPMA、Ionomycin刺激したTh1分化誘導あるいはTh2分化誘導した細胞をPE標識した抗ヒトIL-4抗体(IL-4 PE)とFITCで標識した抗ヒトIFNγ抗体(IFNγFITC)(CatNo.340456Becton-Dickinson)を用いて細胞内に蓄積させたヒトIL-4あるいはヒトIFNγのサイトカイン量を細胞内染色により評価した。また、同時にAPC標識抗ヒトCD4(CD4 APC (CatNo.555349 BD Biosciences)抗体により細胞内染色も行い、細胞解析装置(FACScalibur, Becton Dickinson)を用い測定した。解析はCD4を発現するT細胞のみにゲートをかけて行った。
【0047】
その結果、Th1分化誘導では、CD-4陽性のTリンパ球画分は67.3%(図2−A1)で、そのCD-4陽性のTリンパ球画分のうちTh1分化誘導細胞(Th1細胞)すなわちIL-4を産生せずIFNγを産生する細胞の割合が54.3%でIL-4およびIFNγ両方を産生する細胞は3.1%でTh1分化誘導細胞として良好であることが確認された(図2−A2)。また、Th2分化誘導では、CD-4陽性のTリンパ球画分は57.4%(図2−B1)で、そのCD-4陽性のTリンパ球画分のうちIFNγを産生せずIL-4を産生する細胞、すなわちTh2分化誘導細胞(Th2細胞)の割合が23.0%でIL-4およびIFNγ両方を産生する細胞は0.8%でTh2分化誘導細胞として良好であることが確認された(図2−B2)。ここで得られたTh1分化誘導した細胞(Th1細胞)、Th2分化誘導した細胞(Th2細胞)は、遺伝子発現強度を測定する実験に供した。また、実施例2で示した分化誘導条件を用いて、化合物添加の条件下で化合物の及ぼす影響を調べる実験にも細胞を供した。
【実施例4】
【0048】
ナイーブT細胞を用いた本発明のヒトTh1/Th2分化誘導系におけるFK506あるいはヒドロコーチゾンによる修飾
実施例1の方法でヒト末梢血から分離調製したナイーブT細胞を用い、抗CD3抗体による刺激下での培養に際して被検化合物としてFK506(F4679-5, Sigma)を0.01μMあるいは0.1μMになるよう分化誘導培地に加えた以外は、実施例2で示したヒトTh1/Th2分化誘導系を使用し、それぞれヒトTh1分化誘導あるいはTh2分化誘導を実施し、添加した化合物がヒトTh1誘導あるいはヒトTh2誘導を修飾するか否かを、実施例3に記載した方法によって細胞内染色して評価した。また、ステロイドとして用いられる化合物としてヒドロコーチゾン(Hydrocortisone;H0396, Sigma) を0.1μMあるいは1.0μMになるよう分化誘導培地に加えて、あるいは陰性コントロールとして生理食塩水を用いて上記のFK506と平行してヒトTh1/Th2分化誘導系における各種化合物による修飾について調べた。なお、Th1分化誘導あるいはTh2分化誘導における上記の化合物添加による修飾は、抗CD3抗体固層化プレートを使用し2日間の培養と、続く抗CD3抗体を含まない非固層化プレートに細胞を移し替えて5日間の培養する培養工程の両方の培養工程の全培養工程を通じて化合物添加条件下によりその影響を調べた。
【0049】
その結果、Th1分化誘導条件では、陰性コントロールとして用いた生理食塩水添加におけるTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率は61.1%であった。これに対し0.1μM FK506存在下でTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が26.5%と陰性コントロールに比較し大きく低下した。また、0.01μM FK506存在下では、Th1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が28.3%となり同様に低下させた。また、1.0μMあるいは0.1μMヒドロコーチゾン(Hydrocortisone) 存在下では、Th1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が各々66.0%、65.5%となり僅かに増大させる傾向を示した。(図3上段)。
【0050】
Th2分化誘導条件では、陰性コントロールとして用いた生理食塩水添加ではTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が30.2%となった。しかし0.1μM , 0.01μM FK506存在下では化合物の濃度が高すぎるために細胞にダメージを与え効果を測定する事は出来なかった。この結果よりFK506における影響を確認する為には濃度を更に下げる必要性があることが判明した。ヒドロコーチゾン(Hidrocortisone)が与える影響については、1.0μMあるいは0.1μMヒドロコーチゾン(Hydrocortisone) 存在下では、Th2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が各々18.0%、22.1%となり抑制が認められた。図3下段)。
【0051】
これにより、本発明のヒトTh1/Th2分化誘導系において免疫抑制剤FK506およびステロイド剤(ヒドロコーチゾン)により修飾が認められ、FK506におけるTh2分化誘導の影響は更に低い濃度での添加が必要であることが判明した。本発明のヒトTh1/Th2分化誘導系が有用であることが示された。
【実施例5】
【0052】
ヒトTh1/Th2分化誘導系におけるシクロスポリンAあるいは低濃度FK506による修飾
実施例4に記載した方法において、Ca2+/CN経路を阻害することが知られているシクロスポリンA(CyA)(0.01μM及び0.1μM, Cyclosporin A; C3662, Sigma)及び実施例4より低濃度(0.001μM及び0.01μM)のFK506 (F4679-5, Sigma)を被検化合物としてTh1/Th2分化誘導の修飾を評価する試験に供した。なお、Th1分化誘導あるいはTh2分化誘導における上記の化合物添加による修飾は、抗CD3抗体固層化プレートを使用し2日間の培養と、続く抗CD3抗体を含まない非固層化プレートに細胞を移し替えて培養する5日間の培養の両方の工程の全培養工程を通じて化合物添加条件下によりその影響を調べた。
【0053】
CyAを添加した結果は以下のとおりであった。即ち、Th1分化誘導条件では、陰性コントロールとして用いた生理食塩水添加ではTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率は62.8%であった。これに対し0.1μM CyA存在下でTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が30.4%と陰性コントロールに比較し大きく低下した。また、0.01μM CyA 存在下ではTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が57.9%となりやや低下させた(図4上段左)。
【0054】
Th2分化誘導条件では、陰性コントロールとして用いた生理食塩水添加ではTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が22.1%となった。これに対し0.1μM CyA存在下でTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が陰性コントロールに比較し10.5%と大きく低下した。また、0.01μMCyA存在下ではTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が26.6%となり抑制は認められなかった(図4上段右)。
【0055】
これらの結果から、CyA添加では0.1μM においてTh1分化誘導条件では強いTh1分化抑制が認められ、Th2分化誘導条件においても強いTh2分化誘導抑制が認められた。以上の結果からCyAは細胞のTh1,Th2分化において抑制的に働く因子であることが示唆された。
【0056】
次に、0.001μMあるいは0.01μMになるようにFK506を添加した結果は以下のとおりであった。Th1分化誘導条件では、陰性コントロールとして用いた生理食塩水添加ではTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率は62.2%であった。これに対し0.01μM FK506存在下でTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が29.3%と陰性コントロールに比較し大きく低下した。また、0.001μM FK506存在下ではTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が62.4%となりコントロールに比較して変化が認められなかった(図4下段左)。
【0057】
Th2分化誘導条件では、陰性コントロールとして用いた生理食塩水添加ではTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が21.9%となった。これに対し0.01μM FK506存在下でTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が陰性コントロールに比較し7.1%と大きく低下した。また、0.001μM FK506存在下ではTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が16.6%となり少し低下させた(図4下段右)。
【0058】
これらの結果から、FK506添加においてTh1分化誘導条件で強い分化誘導抑制が認められ、さらにTh2分化誘導条件でも強い分化誘導抑制が認められた。この結果からFK506はCyAよりも、Th1,Th2分化においてより強く抑制的に働く因子であることが示唆された。
【実施例6】
【0059】
ヒトTh1/Th2分化誘導系におけるPD98509による修飾
実施例4に記載した方法において、Ras/MAPK経路を阻害することが知られているマップキナーゼ阻害剤としてPD98509(3μM及び30μM, No. 513000, Calbiochem)を被検化合物としてTh1/ Th2分化誘導の修飾を評価する試験に供した。
【0060】
その結果、Th1分化誘導条件では、陰性コントロールとして用いた生理食塩水添加ではTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率は62.9%であった。これに対し30μM PD98509存在下でTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が73.3%と陰性コントロールに比較してある程度増加し、3μM PD98509存在下においてもTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が68.4%となりコントロールに比較してある程度増加した
【0061】
Th2分化誘導条件では、陰性コントロールとして用いた生理食塩水添加ではTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率は24.9%であった。これに対し30μMおよび3μM PD98509存在下でTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が20.3%、17.8%と陰性コントロールに比較してある程度抑制した。さらに、Th1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が18,4%.22,1%とやや増加傾向にあった。
【0062】
以上の結果からPD98509は、Th1分化誘導条件においてTh1細胞をやや増加させる傾向にあること、さらにTh2分化誘導条件ではTh2細胞をやや抑制する傾向があることが明らかになり、PD98509はTh2分化誘導を抑制しTh1誘導はやや増大させることが示唆された(図5)。
【実施例7】
【0063】
ナイーブT細胞を用いた本発明のヒトTh1/Th2分化誘導系での特異的遺伝子発現の解析
Th1分化誘導あるいはTh2分化誘導に分化誘導を行う前のナイーブTを5x106細胞(Th0細胞)、Th1分化誘導により得た5x106細胞(Th1細胞)、またTh2分化誘導により得た5x106細胞(Th2細胞)をそれぞれ出発材料として、Trizol溶液(Invitrogen社のTRIsol試薬)とRNase-free水(Invitrogen社の DNase/RNase Free)を使用しトータルRNAを調製した。詳しくは、各々の細胞を1.5mLのポリプロピレン製遠心チューブ中で1mlのTrizol溶液に溶解した、200μLのクロロホルム(Trizol液:クロロホルム=1:4の比)を添加し、ボルテックスミキサーを使用してよく振とうした後3分間室温にて放置し、小型冷却遠心機を用いて4℃にて15,000rpmで15分間遠心した。遠心により分離した上層(水溶液層)を別の1.5mLのポリプロピレン製遠心チューブに採取し、グリコーゲン飽和水溶液1μLとイソプロパノールを250μL添加しボルテックスミキサーを使用してよく振とうしてから室温にて10分間放置した後に、室温にて15,000rpmで15分間遠心した。遠心した後に上清を取り除き、冷70%エタノールを1ml加え、4℃にて15,000rpmで10分間遠心した。遠心後に再び上清を取り除き、1.5mL遠心チューブの底に沈殿したトータルRNAを室温にて風乾した。乾燥したトータルRNAに対しRNase-free水20μLを加えピペッティングにてトータルRNAを溶解させ、60℃に保温した水槽で5分間保温した後に氷上に置いた。
【0064】
こうして取得したTh0細胞、Th1細胞、及びTh2細胞由来のトータルRNAの量は、それぞれ8.9μg(557μg /mLの濃度で16μL)、12.7μg(794μg /mLで濃度16μL)、11.94μg(746μg /mLの濃度で16μL)であった。得られたTh0細胞、Th1細胞、及びTh2細胞由来のトータルRNA のRNA Integrity Number(RIA)はそれぞれの9.4, 9.7, 9.7でAffymetrix社が推奨するRNAの純度を満足していた。また、RNA含量は、260nmにおける吸光度1を40μg/mLとして算出した。
【0065】
Th0細胞由来トータルRNA、Th1細胞由来トータルRNAあるいは Th2細胞由来トータルRNAそれぞれ2.5μgを材料として、Affymetrix社が供給するGeneChip One-Cycle c DNA Synthesis Kit (One-Cycle Target Labeling and Control Reagents, #900493) を用いAffymetrix社が示す方法にて、T7-Oligo(dT) プライマー(5’-GGCCAGTGAATTGTAATACGACTCACTATAGGGAGGCGG-(dT)24 -3’)、及び逆転写酵素(SuperScript II Reveres transcriptase, Invitrogen社)を使用しcDNA第一鎖を作製した。次に、Affymetrix社が供給するFirst Cycle, Second-strand Master Mix を使用し、作製したTh0細胞由来cDNA、Th1細由来cDNAあるいは Th2細胞由来cDNAの第一鎖をそれぞれ鋳型として、RNaseH 、E.coli DNA ポリメラーゼ、及びE.coli DNA リガーゼを使用した第二鎖伸張反応によりcDNA第二鎖を合成した。二本鎖cDNA用の精製カラム(cDNA Cleanup Spin Column, Affymetrix社)を使用することにより合成した二本鎖cDNAの純度を高めた。
【0066】
プローブとして用いるビオチン標識cRNAの合成は、Th0細胞由来cDNA、Th1細由来cDNAあるいは Th2細胞由来cDNAをそれぞれ出発材料(鋳型cDNA)として使用し、Affymetrix社が供給するGeneChip IVT Labeling Kitを用い、T7 RNA ポリポリメラ―ゼによるcRNA伸長反応により作製した。作製した各々のビオチン標識cRNAは、Affymetrix社が供給するビオチン標識cRNA用の精製カラム(GeneChip IVT cRNA Cleanup Spin Column, Affymetrix社)を使用することによりビオチン標識cRNAの純度を高めた。また、Th0細胞由来ラベル化cRNA、Th1細由来ラベル化cRNAあるいは Th2細胞由来ラベル化cRNAの濃度は、それぞれ502ng/μL、644ng/μL、 574ng/μLであった。
【0067】
合成したビオチンラベル化cRNAを用い、Affymetrix社が示す方法によりフラグメント化を行った。Th0細胞由来フラグメント化標識cRNA、Th1細由来フラグメント化標識cRNAあるいは Th2細胞由来フラグメント化標識cRNAの濃度は、それぞれ95ng/μL、115ng/μL、 134ng/μLであった。次に、Affymetrix社が供給するGeneChip(R)オリゴヌクレオチドμアレイ(GeneChipTM,Human Genome U133 Plus 2.0 Array, #900466)を用いて、Affymetrix社の示す方法によりハイブリダイゼーションを行った。ハイブリダイゼーションオーブンはAffymetrix社の製品番号640(Hybridization Oven 640、P/N800138, Affymetrix社)を使用した。ハイブリダイゼーションと洗浄が終了した各々のアレイチップについて、Affymetrix社が示す方法で、ビオチン化抗ヤギ-ストレプトレプトアビジン抗体(P/N BA-0500, Vector Laboratories)、R-Phycoerythrin Streptavidin(P/NS-866, Molecular Probes)を使用して蛍光発色に必要な処理を行った。
【0068】
蛍光発色に必要な処理を終了した各々のアレイチップについて、DNAチップ解析装置を用いて蛍光強度の測定及び解析を行った。すなわち、Affymetrix社が供給する共焦点レーザー顕微鏡技術を応用したDNAチップ解析用蛍光スキャニング装置(Array Scanner 428, Affymetrix社)、及び発現データ解析用ソフト(GeneChip Operating Softoware, Affymetrix社)を使用して蛍光強度を測定し有意性ある遺伝子発現について解析を行った。
【0069】
得られたTh0細胞、Th1細胞あるいは Th2細胞でのmRNAレベルの発現強度を解析したところ、発現強度がTh0細胞に比較してTh1細胞で100倍以上高い遺伝子のスポットが複数認められた(図6−1A)。又、発現強度がTh0細胞に比較してTh2細胞で100倍以上高い遺伝子のスポットが複数認められた(図6−1B)。更に、Th1細胞での発現強度に比較してTh2細胞で40倍以上高い発現強度が認められた遺伝子が34種、100倍以上高い発現強度が認められた遺伝子が2種見出された。Th2細胞での発現強度に比較してTh1細胞で50倍以上高い発現強度が認められた遺伝子が47種、100倍以上高い発現強度が認められた遺伝子が9種見出された(図6−2)。
【0070】
発現量が比較的高いTh2特異的発現遺伝子として、 Th1/Th2の比率が0.025以下(40倍の差がある)、Th0/Th2の比率が約0.1以下(10倍の差がある)、かつTh2rawに示される蛍光強度が100以上として絞り込み9遺伝子を選択した(表1)。次に、発現量が比較的高いTh2特異的発現KIAA遺伝子として、 Th1/Th2の比率が0.1以下(10倍の差がある) 、Th0/Th2の比率が約0.14以下(約7倍の差がある)、かつTh2rawに示される蛍光強度が100以上として絞り込み4遺伝子を選択した(表2)。ここで、KIAA遺伝子とは、財団法人かずさディー・エヌ・エー研究所で発見・作製したcDNAクローンを示す呼称である。
更に、発現量が比較的高いTh1特異的発現遺伝子として、 Th1/Th2の比率が50以上(50倍の差がある)、Th0/Th1の比率が0.25以下(4倍の差がある)かつTh1rawに示される蛍光強度が100以上として絞り込み2遺伝子を選択した(表3)。
【0071】
【表1】

【0072】
【表2】

【0073】
【表3】

【産業上の利用可能性】
【0074】
本発明のヒトTh1/Th2分化誘導系は、 Th1/Th2バランスを変調する薬物、例えばTh1/Th2バランスがTh2に傾いた場合に症状が出るといわれている花粉アレルギー等を軽減する化合物スクリーニング方法を提供するので有用である
【技術分野】
【0001】
本発明は、ヒトナイーブT細胞を用いるヒトTh1/Th2分化誘導系、分化誘導された細胞の検出方法、並びに、該分化誘導に対する被検化合物の影響(促進又は抑制等)のスクリーニング方法及びスクリーニングキット等に関する。
【背景技術】
【0002】
ヘルパーT細胞(Th)は抗原を認識してヘルパー因子と総称される各種サイトカインを産生し、免疫応答誘導を調節するT細胞群である。例えば、B細胞が抗体産生細胞に分化するにはB細胞自身による当該抗原の認識の他にヘルパーT細胞から産生されるインターロイキン(IL)4,5及び6等のサイトカインが必要となる。又、キラーT細胞のエフェクター誘導に際してもIL−2及びインターフェロンγが関与することが多い。このようなヘルパーT細胞は、IL−2及びインターフェロンγを産生するTh1、及びIL−4,5、6等を産生するTh2のサブセットに分類される。これらのサブセットは抗原刺激によって活性化され互いのサブセットに抑制的に働くことが知られており、両者のいずれかが優勢になるかによって生体の免疫応答の様式が左右される重要な細胞集団である。
【0003】
以前、本発明者はマウスTh1/Th2分化誘導系を確立し、解析が進んでいなかった末梢T細胞のTh1/Th2分化における Ras/MAPK経路及びCa2+/CN経路の役割を解析した(山下政克,中山俊憲、実験医学,19:570-575,2001)。即ち、マウスTh1/Th2分化誘導系を用いることによって、Ras/MAPK経路では、3つのカスケードのうちMEK/Erkカスケードが重要であること(Yamashita,M. et al., Proc. Natl. Acad. Sci. UST, 96:1024-1029, 1999, Yamashita,M. et al., J Biol Chem., 280:29409-29419, 2005)、又、カルシニューリン(CN)を標的分子とするFK506とシクロスポリンがマウスTh1/Th2分化誘導系を変調することを示した(Yamashita,M. et al., J. Exp. Med., 191:1869-1879, 2000)。これらの研究から、マウスにおけるTh1/Th2分化誘導系、とりわけRas/MAPK経路あるいはCa2+/CN経路が働いている条件下において、化合物等によるTh1またはTh2への分化誘導を評価することが可能となった。
【0004】
又、ヒトの系については、特開2002-186482号公報に、ヒト臍帯血白血球を刺激して得られるTh1細胞あるいはTh2細胞について記載がみられるが、Th1培養では臍帯血由来白血球をIL-12とIL-4中和抗体含む培地組成を用い、Th2培養ではIL-4とIL-12中和抗体を含む培地組成を用いて誘導するという従来からある一般的な分化誘導方法が用いられている。又、サイトカインの細胞内免疫蛍光染色法として、透過性処理したヒト臍帯血由来Th1細胞あるいはTh2細胞をIL-4またはIFN-γに関して染色している。
【0005】
更に、ヒトナイーブT細胞からIL-4あるいはIFNγを用いたTh1/Th2に分化誘導する方法(Torres, K. C. et al., Hum Immunol. 2004 Nov;65(11):1328-35)、また、CD3モノクローナル抗体を用いた方法(Suzuki Y, et al., J Virol. 1999 Jan;73(1):316-24., Demeure, C.E. et al., Eur J Immunol. 1995 Sep;25(9):2722-5)の報告はある。しかし、ヒト末梢T細胞のRas/MAPK経路あるいはCa2+/CN経路が働いている条件下におけるTh1/Th2分化誘導系について報告はない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2002-186482号公報
【非特許文献】
【0007】
【非特許文献1】山下政克,中山俊憲、実験医学,19:570-575,2001
【非特許文献2】Yamashita,M. et al., Proc. Natl. Acad. Sci. UST, 96:1024-1029, 1999, Yamashita,M. et al., J Biol Chem., 280:29409-29419, 20
【非特許文献3】Yamashita,M. et al., J. Exp. Med., 191:1869-1879, 2000
【非特許文献4】Torres, K. C. et al., Hum Immunol. 2004 Nov;65(11):1328-35
【非特許文献5】Suzuki Y, et al., J Virol. 1999 Jan;73(1):316-24., Demeure, C.E. et al., Eur J Immunol. 1995 Sep;25(9):2722-5
【発明の概要】
【発明が解決しようとする課題】
【0008】
ところで、マウス等齧歯類の Th1/Th2分化誘導系において陽性を示した化合物が、必ずしもヒトの系で陽性になるとは限らない。即ち、マウス等齧歯類とヒトとの間で種差が大きい互いに反応しないケースとして、ナイーブCD4T細胞をターゲットとするIL-4、IL-12あるいはIFN-γが挙げられる。これらのサイトカインが関係するシグナル伝達系もその進化の過程からするとマウス等齧歯類とヒトとの間で種差が大きいケースに相当することは十分考えられる。
【0009】
既に記載したように、従来、ヒトTh1/Th2分化誘導系を評価する適当な手段がなく、ヒトにおける末梢T細胞のTh1/Th2分化誘導系、とりわけRas/MAPK経路あるいはCa2+/CN経路に関わる薬物を評価可能なヒト Th1/Th2分化誘導系を確立することが、それらの経路によるヒトのTh1/Th2分化誘導を変調する化合物等を検索するためには必須であった。
【課題を解決するための手段】
【0010】
そこで、本発明者は、末梢T細胞のヒトナイーブT細胞を用いたヒトTh1分化誘導あるいはTh2分化誘導を、それぞれインビトロで刺激するための組成物その及び方法等について鋭意研究の結果、新規なヒトTh1/Th2分化誘導系を開発することに成功し、本発明を完成した。
【0011】
即ち、本発明は、以下の各態様に係るものである。
[1]ヒトナイーブCD4T細胞を、IL-2、IL-12及び抗IL-4抗体を含む分化誘導培地(Th1分化誘導条件)にて抗CD3抗体による刺激下で培養し、又は、IL-2、IL-4及び抗IFNγ抗体を含む分化誘導培地(Th2分化誘導条件)にて抗CD3抗体による刺激下培養し、更に、該分化誘導培地から、夫々、抗IL-4抗体又は抗IFNγ抗体のみを除いた培養条件下で抗CD3抗体による刺激なしで更に培養することから成る、該ヒトナイーブCD4T細胞のTh1及び/又はTh2分化誘導方法。
【0012】
[2]本発明の分化誘導方法により、ヒトTh1/Th2分化誘導させた後に、IFNγ、IL-4及び CD4に対する標識抗体を用いて細胞内染色を施し、次に、抗CD4抗体を用いてT細胞のみを選別し、選別した細胞についてIL-4及び IFNγ細胞内染色強度を測定し、それらの強度に基きTh1又はTh2への分化誘導の程度を評価する方法。
【0013】
[3]表1及び表2に記載された計13種類のTh2特異的発現遺伝子の少なくとも一つ、及び/又は、表3に記載された2種類のTh1特異的発現遺伝子の少なくとも一つの発現強度を測定し、それらの強度に基きTh1又はTh2への分化誘導の程度を評価する方法。
【0014】
[4]ヒトナイーブCD4T細胞のTh1及び/又はTh2分化誘導に対する被検化合物の影響をスクリーニングする方法であって、所定量の被検化合物を添加した分化誘導培地を用いて、本発明の分化誘導方法により、ヒトTh1/Th2分化誘導させた後に、Th1又はTh2への分化誘導の程度を評価することから成る、前記スクリーニング方法。
【0015】
[5]本発明の方法に使用されるキット。
【発明の効果】
【0016】
発明のヒトTh1/Th2分化誘導方法は、Ras/MAPK経路あるいはCa2+/CN経路に関わる化合物が反応することから、それらの経路に関わる化合物等あるいはそれらの経路が動いている条件でヒトTh1/Th2分化誘導を修飾する化合物等を検索できる、今までにない新規なスクリーニング系である。
【0017】
又、本発明の評価方法では、分化誘導操作後に抗IFNγ抗体及び抗IL-4抗体を用いて細胞内染色を施し、次に抗CD4抗体を用いてT細胞のみを選択し、選別した細胞についてのみIL-4及び IFNγ細胞内染色強度を直接的に測定するので、ヒトのTh1またはTh2への分化誘導を直接的に評価することを可能である。更に、分化誘導したヒトTh1/Th2で特異的な発現変動のみられる遺伝子の発現強度を用いる、ヒトTh1/Th2分化誘導の程度を評価する方法が提供される。あるいは、被倹薬化合物がヒトTh1/Th2 分化誘導に及ぼす影響を正確に直接的に評価する方法が提供される。
【0018】
従って、本発明において、以上の方法を利用して、Ras/MAPK経路あるいはCa2+/CN経路に関わる化合物等あるいはそれらの経路が動いている条件でヒトTh1/Th2分化誘導を修飾する化合物等を検索でき、従来にはない新規なスクリーニング系を提供することができる。
【図面の簡単な説明】
【0019】
【図1】自動磁気細胞分離装置(AutoMACS )で分離したヒトナイーブCD4T細胞の表面抗原を細胞解析装置(FACScalibur )で測定を行った結果を示す。
【図2】ヒト末梢血ナイーブT 細胞からTh1分化誘導細胞あるいはTh2分化誘導細胞の細胞内に蓄積させたサイトカイン量について細胞解析装置(FACScalibur)を使用して解析を行った結果を示す。
【図3】ヒトTh1/Th2分化誘導系におけるFK506あるいはヒドロコーチゾンによる修飾の結果を示す。上段はTh1誘導条件にて得られた細胞で各種化合物の影響を調べた結果で、上段はTh2誘導条件にて得られた細胞で各種化合物の影響を調べた結果を示す。左列は化合物の代わりに生理食塩水を用いた陰性コントロール、中央2列及び右2列は、夫々、FK506及びヒドロコーチゾン添加条件でそれぞれTh1誘導条件とTh2誘導条件に於ける化合物の影響を調べた結果を示す。
【図4】ヒトTh1/Th2分化誘導系における低濃度FK506あるいはシクロスポリンAによる修飾の結果を示す。左側はTh1誘導条件にて得られた細胞で各種化合物の影響を調べた結果で、右側はTh2誘導条件にて得られた細胞で各種化合物の影響を調べた結果を示す。Controlは化合物の代わりに生理食塩水を用いた陰性コントロールを示す。
【図5】ヒトTh1/Th2分化誘導系における低濃度PD98509による修飾による結果を示す。Controlは化合物の代わりに生理食塩水を用いた陰性コントロールを示す。
【図6】ヒト末梢血ナイーブT 細胞(Th0細胞)及びナイーブT 細胞からTh1分化誘導細胞(Th1細胞)あるいはTh2分化誘導細胞(Th2細胞)で発現している遺伝子をAffimetrix 社のGeneChipTM,Human Genome U133A Plus 2.0 Arrayを用いて解析した結果を分布図で示す。
【発明を実施するための形態】
【0020】
本発明のTh1及び/又はTh2分化誘導方法で使用されるヒトナイーブCD4T細胞が発現する分化抗原(細胞表面抗原)はCD4+CD8-CD45RO-で示される。このような細胞は通常、ヒト末梢血、ヒト臍帯血、ヒトリンパ組織等から、これらの分化抗原に対する抗体、各種の細胞分離装置、細胞解析装置等を使用して当業者に公知の任意の方法を用いて容易に分離することが出来る。
【0021】
本発明の分化誘導方法において、抗CD3抗体による刺激は当業者に公知の任意の方法で行うことが出来るが、例えば、抗CD3抗体を固層した培養プレート内で細胞を培養することにより簡易に抗CD3抗体による刺激操作を行うことが出来る。
【0022】
本発明の分化誘導方法において、抗CD3抗体による刺激下で通常1〜3日間、好ましくは、2日間培養し、且つ、抗CD3抗体による刺激なしで通常4〜6日間、好ましくは5日間培養する。
【0023】
抗CD3抗体による刺激下での培養に際しては、Th1分化誘導条件又はTh2分化誘導条件において、分化誘導培地に、通常、IL-2が5〜500U/ml、IL-12が0.1〜100ng/ml、抗IL-4抗体が0.5〜50μg/ml、IL-4が0.1〜100ng/ml、及び、抗IFNγ抗体が0.5〜50μg/mlの濃度で含まれることが好ましい。
【0024】
一方、抗CD3抗体による刺激なしでの培養に際しては使用する分化誘導培地には上記の抗IL-4抗体又は抗IFNγ抗体は含まれず、IL-2、IL-12、IL-4などのサイトカインは含まれる。
【0025】
又、Th2分化誘導条件における抗CD3抗体による刺激下の培養、及び、同分化誘導条件による抗CD3抗体による刺激なしの培養からなる培養サイクルを複数回連続して行うことにより、分化誘導の効率がより高められる。
【0026】
本発明の評価方法で使用するIFNγ、IL-4及び CD4に対する標識抗体において、標識物質としては当業者に公知の任意の化合物を使用することが出来る。例えば、FITC(フルオレセインイソチオシアネート)、PE(フィコエリスリン)、又はAPC(アロフィコシアニン)等を挙げることが出来る。これらの抗体の標識は当業者に公知の任意の方法で行うことが出来、或いは、又は標識抗体として市販品を使用することも出来る。
【0027】
抗CD4抗体を用いたT細胞の選別、及び、選別した細胞についてのIL-4及び IFNγ細胞内染色強度の測定は、蛍光活性化セルソーター(FACS)等の当業者に公知の適当な細胞自動解析分離装置を用いて行うことが出来る。
【0028】
更に、Th1又はTh2特異的発現遺伝子の発現強度を測定することにより、Th1又はTh2への分化誘導の程度を評価することが出来る。このような遺伝子の例として、例えば、表1及び表2に記載された計13種類のTh2特異的発現遺伝子、及び、表3に記載された2種類のTh1特異的発現遺伝子を挙げることが出来る。
【0029】
このようなTh1又はTh2特異的発現遺伝子の発現強度は、例えば、対象となる細胞におけるこれら遺伝子のmRNA(cDNA)又は発現産物(蛋白質)の発現量を測定することよって行うことが出来る。尚、このような測定は、測定方法・原理に応じて、定量的、半定量的、又は定性的であり得る。
【0030】
このようなcDNA又はそれに対応するmRNAを含む核酸分子は、当業者に公知の任意の方法・手段、例えば、RT−PCR法、リアルタイムPCR等の各種定量的PCR法、電気化学的検出法を応用したハイブリダイゼーション強度測定法並びに各種のマイクロアレイ(DNAチップ)法等の当業者に公知の方法で行うことが出来る。PCR法で増幅された核酸分子の検出は、その塩基配列を直接決定する方法(シークエンス法)、電気化学的検出法、又は電気泳動との組み合わせ等、適当な方法で行うことが出来る。尚、このような方法で使用する各種プライマー及びプローブは、各データベースから入手できる遺伝子の塩基配列情報に基き、当業者であれば、適宜、設計し調製することが出来る。
【0031】
尚、プライマーの設計に際しては、鋳型との特異的な結合が可能となるような塩基数、例えば、15−40塩基、より具体的には、15−25塩基程度を有することが好ましく、更には、プライマー内でヘアピン構造をとったり、センス鎖とアンチセンス鎖とが互いにアニーリングしないような塩基配列とすることも重要である。例えば、OligoTM(National Bioscience Inc.製)のような市販のプライマー設計用のソフトウェアを使用することも可能である。
【0032】
蛋白質の発現量は当業者に公知の任意の方法で測定することが可能である。例として、例えば、適当な抗体を用いた免疫染色及びEIA等の各種の免疫学的特異反応を利用する方法、エドマン法を用いた気相シークエンサー等ペプチドのアミノ酸配列分析法、更には、MALDI−TOF/MS及びESI Q−TOF/MS法等に代表される質量分析によって検出することが出来る。
【0033】
抗体は、該当する蛋白質、又はその適当な部分ポリペプチド(ペプチド断片)又はそれらの各種誘導体又は複合体等を抗原物質又は免疫原として用いて、当業者に公知の適当な方法で調製することが可能である。例えば、ポリクローナル抗体の場合には、マウス、ラット、ウサギ、ヤギ、ニワトリ等の適当な動物に投与し、その抗血清から調製することが可能である。或いは、モノクローナル抗体作成法(「単クローン抗体」、長宗香明、寺田弘共著、廣川書店、1990年; "Monoclonal Antibody" James W. Goding, third edition, Academic Press, 1996)等に記載の公知の細胞融合を用いる方法でモノクローナル抗体として調製することも可能である。
【0034】
尚、このような抗体は、その元来の抗体活性を失わない限り、遺伝子工学(DNA組換え技術)により、例えば、Fab、F(ab')2、Fv断片等の完全な抗体由来の各種誘導体を含む、当業者に公知の様々な形態に改変された誘導体、組換え体又はフラグメントであっても良い。
【0035】
尚、このような抗体には、酵素、放射性同位体蛍光色素、及び金属原子等の当業者に公知の各種の標識物質で適宜標識されている。
【0036】
本発明のスクリーニングする方法においては、所定量の被検化合物を添加した分化誘導培地を用いた本発明の分化誘導方法により、ヒトTh1/Th2分化誘導させた後に、Th1又はTh2への分化誘導の程度を評価することによって、ヒトナイーブCD4T細胞のTh1及び/又はTh2分化誘導に対する被検化合物の影響(修飾)をスクリーニングすることが出来る。被検化合物を添加する量及び時期等は、被検化合物の性質等に応じて適宜調整することが可能である。
通常、被検化合物は抗CD3抗体による刺激下での培養工程、及び、それに続く抗CD3抗体非刺激下での培養工程の両方を通して所定量添加する。しかしながら、添加する化合物の性質等に応じて、抗CD3抗体による刺激下、又は、抗CD3抗体非刺激下での培養のいずれか一方における培養過程でのみ被検化合物を添加することも可能である。
【0037】
Th1又はTh2への分化誘導の程度は、具体的には、既に記載した本発明の評価方法での評価することが出来る。その結果、ヒトTh1/Th2分化誘導を促進又は抑制する化合物、Th1/Th2バランスを変調する化合物等、Th1及び/又はTh2分化誘導に影響を与える化合物をスクリーニングすることが可能となる。このような化合物の一例として、例えば、アレルギー抑制化合物を挙げることが出来る。
【0038】
尚、これまでに記載した各方法において、細胞の各種培養条件(細胞培養密度、培地成分、培養時間、培養温度、酸素/二酸化炭素濃度等)、又は、細胞培養装置等は、各方法の目的、細胞又は被検化合物の種類及び量等に応じて当業者が適宜選択することが出来る。
【0039】
本発明の各種方法に使用されるキット(例えば、スクリーニングキット)は、測定対象又は測定原理等に応じて、適当な構成をとることが出来る。該キットは、その構成要素として、例えば、各種(標識)抗体、mRNA(cDNA)の増幅用プライマー及びDNAチップ等で使用するハイブリダイゼーション用のプローブ(例えば、10〜100個程度の連続した塩基配列から成る)を含むことが出来る。更に、上記キットには、その構成・使用目的などに応じて、当業者に公知の他の要素又は成分、例えば、各種試薬、酵素、緩衝液、反応プレート(容器)等が含まれる。
【0040】
以下、本発明を実施例によって詳細に説明するが、本発明の技術的範囲は以下の実施例の記載によって何ら限定して解釈されるものではない。又、特に記載のない場合には、以下の実施例は、例えば、Sambrook and Maniatis, in Molecular Cloning-A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, 1989; Ausubel, F. M. et al., Current Protocols in Molecular Biology, John Wiley & Sons, New York, N.Y, 1995等に記載されている、当業者に公知の標準的な遺伝子工学及び分子生物学的技術に従い、実施することが出来る。又、本明細書中に引用された文献の記載内容は本明細書の開示内容の一部を構成するものである。
【実施例1】
【0041】
ヒトナイーブCD4 T細胞の分離
ヒトナイーブCD4 T 細胞の分離は自動磁気細胞分離装置(autoMACS, Miltenyi Biotec GmbH)を用いて以下に示す方法で行なった。ヒト末梢血を50ml採取し、D-PBS溶液(Product Number D5652 , Sigma-Aldrich Inc) 50mlで等倍に希釈した。次に、12.5mlの Ficoll-Paque Plus(Catalog No.17-1440-02, Amersham Biosciences)を分注した4本の遠心チューブに上記の希釈末梢血25mlをゆっくり重層し、水平ローターを装着した遠心機を用いて室温で950Gにて30分間の遠心分離を行った。遠心後、Ficoll-Paqueと上清との間の中間層に存在するリンパ球を回収し、3%仔牛胎児血清(FCS:Cat No. 2103-500M, JRH Biosiences),2mMEDTA(Cat No 345-01865, Dojindo Inc)を含むD-PBS溶液 (以下、「MACSバッファー」という)を用いて懸濁し、遠心機を用いて4℃にて500Gにて5分間の遠心を行ってリンパ球を沈降させた。沈降したリンパ球細胞ペレットを再度MACSバッファーに懸濁し500Gにて5分間の遠心を行ってリンパ球を沈降させ、2回洗浄したリンパ球細胞ペレットを得た。この細胞ペレットを再度MACSバッファーに1x108個/mlになるように細胞を懸濁し、リンパ球1x107個に対してFITC標識抗ヒトCD8抗体(Cat.No 555366, BD BioScience Phamingen) 2μL, FITC標識抗ヒトCD45RO抗体(Cat.No. 555492, BD BioScience Phamingen)を2μLそれぞれ添加して氷上で30分間反応させて各々の抗体を結合させた後に、MACSバッファーを加え遠心し4℃にて2回洗浄した。次に各々の抗体を結合させたリンパ球1x107個に対して10μLの抗FITCマイクロビーズ(Cat No.120-000-293, Miltenyi Biotec GmbH)を添加して氷上で15分間反応させた後にMACSバッファーを加え遠心し4℃にて2回洗浄した。得られた細胞ペレットを5x107/mlの細胞濃度になるようにMACSバッファーで調製してナイロンメッシュ(#200 アベ科学)を通過させた後、自動磁気細胞分離装置(AutoMACS, Miltenyi Biotec GmbH)を用いCD8及びCD45ROネガティブフラクションを回収する事によってヒトナイーブCD4T 細胞を分離し、Th1分化誘導あるいはTh2分化誘導実験に供した。
【0042】
次にTh1分化誘導後あるいはTh2分化誘導後の遺伝子発現を検討することを目的とし、上記にて分離したヒトナイーブCD4 T 細胞をフィコエリスリンで標識した抗ヒトCD4抗体(CD4 PE)を用いて細胞の染色を行い目的とするナイーブCD4細胞の含有率を調べた。ヒトナイーブCD4 T 細胞を1x108個/mlに懸濁し、1x107個の細胞に対して2μLのCD4 PEを添加して氷上で30分間反応させて該抗体を結合させた後に、MACSバッファーで2回洗浄した。細胞解析装置(FACScalibur, Becton Dickinson)を用いて定法により測定して以下の結果を得た。調製した細胞群において、ヒトCD4を発現する細胞について調べたところ、目的とするヒトCD4のみを発現している細胞の含有率は36.3%であるが(図1−A)、ヒトCD8/CD45ROの発現している細胞は0%で、CD8T細胞やCD45RO陽性メモリーT細胞を完全に除く事が出来た。またそれ以外の細胞(ほとんどは非T細胞)の含有率は63.5%であった(図1−B)。このことにより、ヒトナイーブCD4 T 細胞の分離として良好であることが確認された。ここで得たナイーブT細胞(Th0細胞)の一部は遺伝子発現強度を測定する実験で使用した。
【実施例2】
【0043】
ヒト末梢血CD4 T 細胞からのTh1/Th2分化誘導
実施例1でヒト末梢血から分離調製したナイーブT細胞を用い、本発明の分化誘導方法を実施し、ヒトTh1誘導細胞及びヒトTh2誘導細胞を得た。すなわち、ヒト末梢血から分離したナイーブCD4T細胞を、Th1分化条件では5x105細胞/0.5ml/ウェルとなるように幡種して以下の条件下で刺激とそれに続く培養を行った。Th1刺激とそれに続く培養あるいはTh2刺激とそれに続く培養は、CO2インキュベーターを用い水蒸気で飽和させた5%CO2を含む空気のもと37℃にて行った。
【0044】
Th1分化条件では、10%仔牛胎児血清(FCS:Cat. No., 2103-500M JRH, Biosiences), 10mM HEPES(Cat. No. 15630-130, GIBCO), 100μM Non-Essential Amino Acids(Cat. No.
11140-076, GIBCO), 1mMSodiumPyruvate(Cat.No. 11360-070, GIBCO), 55μM 2-Mercaptethanol(Cat. No. 21985-023, GIBCO)を含むRPMI-1640培地(Cat. No. 2006-06, SIGMA)(以降、「分化誘導培地」と呼ぶ)に、50U/mlの濃度となるようにIL-2(イムネース,塩野義)、1ng/mlの濃度となるようにIL-12(Cat.No. 200-12, ペプロテック)及び5μg/mlの濃度となるように抗IL-4抗体(Cat.No BD-554481, Pharmingen) を添加した。抗CD3抗体20μg/ml(オルソクローンOKT3,ヤンセンファーマ)で固層化した平底48穴組織培養プレート(code,3548, Costor)を使用し2日間培養した。更に抗CD3抗体を含まない非固層化プレートに細胞を移し換えて、抗IL-4抗体を含まないが、IL-2及びIL-12を含むTh1分化条件の培養条件にてさらに5日間培養した。
【0045】
また、Th2分化条件では5x105細胞/0.5ml/ウエルとなるようにナイーブT細胞を幡種して以下の条件下で刺激して行った。すなわち、50U/mlの濃度となるように添加したIL-2( イムネース,塩野義)、1ng/mlの濃度となるように添加したIL-4(Cat.No.204-IL-050, R&D Systems)及び5μg/mlの濃度となるように添加した抗IFNγ抗体(Cat.No. BD-5545471, Pharmingen)を含む分化誘導培地を用いた培養条件にて抗CD3抗体固層化プレートを使用し2日間刺激し、更に抗CD3抗体を含まない非固層化プレートに細胞を移し替えて、抗IFNγ抗体を含まないが、IL-2及びIL-4を含むTh2分化条件の培養条件にて5日間培養した。Th2細胞分化の場合は、2日間に続く5日間の分化誘導を目的とした培養を2サイクル連続して続ける本発明の方法により初めて良好な結果が得られた。Th1分化誘導した細胞(Th1細胞)、Th2分化誘導した細胞(Th2細胞)は、遺伝子発現強度を測定する実験にそれぞれ細胞を供した。
【実施例3】
【0046】
Th1分化誘導細胞あるいはTh2分化誘導細胞の細胞内染色
実施例2でTh1分化誘導した細胞(Th1細胞)、Th2分化誘導した細胞(Th2細胞)をMonensin(Cat No.M-5273 Sigma)存在下でPMA(Phorbol-12-Myristate-13-Acetate,ProducNo.P1585Siguma-Aldrich), Ionomycin (Cat.No 407952, Calbiochem )を添加した培地を使用し、4時間培養し刺激を行った。刺激を行なった後に細胞内染色を以下の方法によりTh1分化誘導の程度あるいはTh2分化誘導の程度について細胞解析装置(FACScalibur, Becton Dickinson)を用いた解析により評価した。詳細には、Th1誘導細胞あるいはTh2誘導細胞を平底48穴組織培養プレートに1ウエルあたり5-10x105の細胞となる様に幡種し、2μMのMonensin存在下、10ng/mlのPMA, 1μMの Ionomycin1の濃度になるように添加し、37℃にて5%の CO2を含む飽和水蒸気を含む空気中でCO2インキュベーターを使用して4時間培養し刺激を行った。上記のMonensin(Cat No.M-5273, Sigma)存在下でPMA、Ionomycin刺激したTh1分化誘導あるいはTh2分化誘導した細胞をPE標識した抗ヒトIL-4抗体(IL-4 PE)とFITCで標識した抗ヒトIFNγ抗体(IFNγFITC)(CatNo.340456Becton-Dickinson)を用いて細胞内に蓄積させたヒトIL-4あるいはヒトIFNγのサイトカイン量を細胞内染色により評価した。また、同時にAPC標識抗ヒトCD4(CD4 APC (CatNo.555349 BD Biosciences)抗体により細胞内染色も行い、細胞解析装置(FACScalibur, Becton Dickinson)を用い測定した。解析はCD4を発現するT細胞のみにゲートをかけて行った。
【0047】
その結果、Th1分化誘導では、CD-4陽性のTリンパ球画分は67.3%(図2−A1)で、そのCD-4陽性のTリンパ球画分のうちTh1分化誘導細胞(Th1細胞)すなわちIL-4を産生せずIFNγを産生する細胞の割合が54.3%でIL-4およびIFNγ両方を産生する細胞は3.1%でTh1分化誘導細胞として良好であることが確認された(図2−A2)。また、Th2分化誘導では、CD-4陽性のTリンパ球画分は57.4%(図2−B1)で、そのCD-4陽性のTリンパ球画分のうちIFNγを産生せずIL-4を産生する細胞、すなわちTh2分化誘導細胞(Th2細胞)の割合が23.0%でIL-4およびIFNγ両方を産生する細胞は0.8%でTh2分化誘導細胞として良好であることが確認された(図2−B2)。ここで得られたTh1分化誘導した細胞(Th1細胞)、Th2分化誘導した細胞(Th2細胞)は、遺伝子発現強度を測定する実験に供した。また、実施例2で示した分化誘導条件を用いて、化合物添加の条件下で化合物の及ぼす影響を調べる実験にも細胞を供した。
【実施例4】
【0048】
ナイーブT細胞を用いた本発明のヒトTh1/Th2分化誘導系におけるFK506あるいはヒドロコーチゾンによる修飾
実施例1の方法でヒト末梢血から分離調製したナイーブT細胞を用い、抗CD3抗体による刺激下での培養に際して被検化合物としてFK506(F4679-5, Sigma)を0.01μMあるいは0.1μMになるよう分化誘導培地に加えた以外は、実施例2で示したヒトTh1/Th2分化誘導系を使用し、それぞれヒトTh1分化誘導あるいはTh2分化誘導を実施し、添加した化合物がヒトTh1誘導あるいはヒトTh2誘導を修飾するか否かを、実施例3に記載した方法によって細胞内染色して評価した。また、ステロイドとして用いられる化合物としてヒドロコーチゾン(Hydrocortisone;H0396, Sigma) を0.1μMあるいは1.0μMになるよう分化誘導培地に加えて、あるいは陰性コントロールとして生理食塩水を用いて上記のFK506と平行してヒトTh1/Th2分化誘導系における各種化合物による修飾について調べた。なお、Th1分化誘導あるいはTh2分化誘導における上記の化合物添加による修飾は、抗CD3抗体固層化プレートを使用し2日間の培養と、続く抗CD3抗体を含まない非固層化プレートに細胞を移し替えて5日間の培養する培養工程の両方の培養工程の全培養工程を通じて化合物添加条件下によりその影響を調べた。
【0049】
その結果、Th1分化誘導条件では、陰性コントロールとして用いた生理食塩水添加におけるTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率は61.1%であった。これに対し0.1μM FK506存在下でTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が26.5%と陰性コントロールに比較し大きく低下した。また、0.01μM FK506存在下では、Th1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が28.3%となり同様に低下させた。また、1.0μMあるいは0.1μMヒドロコーチゾン(Hydrocortisone) 存在下では、Th1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が各々66.0%、65.5%となり僅かに増大させる傾向を示した。(図3上段)。
【0050】
Th2分化誘導条件では、陰性コントロールとして用いた生理食塩水添加ではTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が30.2%となった。しかし0.1μM , 0.01μM FK506存在下では化合物の濃度が高すぎるために細胞にダメージを与え効果を測定する事は出来なかった。この結果よりFK506における影響を確認する為には濃度を更に下げる必要性があることが判明した。ヒドロコーチゾン(Hidrocortisone)が与える影響については、1.0μMあるいは0.1μMヒドロコーチゾン(Hydrocortisone) 存在下では、Th2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が各々18.0%、22.1%となり抑制が認められた。図3下段)。
【0051】
これにより、本発明のヒトTh1/Th2分化誘導系において免疫抑制剤FK506およびステロイド剤(ヒドロコーチゾン)により修飾が認められ、FK506におけるTh2分化誘導の影響は更に低い濃度での添加が必要であることが判明した。本発明のヒトTh1/Th2分化誘導系が有用であることが示された。
【実施例5】
【0052】
ヒトTh1/Th2分化誘導系におけるシクロスポリンAあるいは低濃度FK506による修飾
実施例4に記載した方法において、Ca2+/CN経路を阻害することが知られているシクロスポリンA(CyA)(0.01μM及び0.1μM, Cyclosporin A; C3662, Sigma)及び実施例4より低濃度(0.001μM及び0.01μM)のFK506 (F4679-5, Sigma)を被検化合物としてTh1/Th2分化誘導の修飾を評価する試験に供した。なお、Th1分化誘導あるいはTh2分化誘導における上記の化合物添加による修飾は、抗CD3抗体固層化プレートを使用し2日間の培養と、続く抗CD3抗体を含まない非固層化プレートに細胞を移し替えて培養する5日間の培養の両方の工程の全培養工程を通じて化合物添加条件下によりその影響を調べた。
【0053】
CyAを添加した結果は以下のとおりであった。即ち、Th1分化誘導条件では、陰性コントロールとして用いた生理食塩水添加ではTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率は62.8%であった。これに対し0.1μM CyA存在下でTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が30.4%と陰性コントロールに比較し大きく低下した。また、0.01μM CyA 存在下ではTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が57.9%となりやや低下させた(図4上段左)。
【0054】
Th2分化誘導条件では、陰性コントロールとして用いた生理食塩水添加ではTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が22.1%となった。これに対し0.1μM CyA存在下でTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が陰性コントロールに比較し10.5%と大きく低下した。また、0.01μMCyA存在下ではTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が26.6%となり抑制は認められなかった(図4上段右)。
【0055】
これらの結果から、CyA添加では0.1μM においてTh1分化誘導条件では強いTh1分化抑制が認められ、Th2分化誘導条件においても強いTh2分化誘導抑制が認められた。以上の結果からCyAは細胞のTh1,Th2分化において抑制的に働く因子であることが示唆された。
【0056】
次に、0.001μMあるいは0.01μMになるようにFK506を添加した結果は以下のとおりであった。Th1分化誘導条件では、陰性コントロールとして用いた生理食塩水添加ではTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率は62.2%であった。これに対し0.01μM FK506存在下でTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が29.3%と陰性コントロールに比較し大きく低下した。また、0.001μM FK506存在下ではTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が62.4%となりコントロールに比較して変化が認められなかった(図4下段左)。
【0057】
Th2分化誘導条件では、陰性コントロールとして用いた生理食塩水添加ではTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が21.9%となった。これに対し0.01μM FK506存在下でTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が陰性コントロールに比較し7.1%と大きく低下した。また、0.001μM FK506存在下ではTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が16.6%となり少し低下させた(図4下段右)。
【0058】
これらの結果から、FK506添加においてTh1分化誘導条件で強い分化誘導抑制が認められ、さらにTh2分化誘導条件でも強い分化誘導抑制が認められた。この結果からFK506はCyAよりも、Th1,Th2分化においてより強く抑制的に働く因子であることが示唆された。
【実施例6】
【0059】
ヒトTh1/Th2分化誘導系におけるPD98509による修飾
実施例4に記載した方法において、Ras/MAPK経路を阻害することが知られているマップキナーゼ阻害剤としてPD98509(3μM及び30μM, No. 513000, Calbiochem)を被検化合物としてTh1/ Th2分化誘導の修飾を評価する試験に供した。
【0060】
その結果、Th1分化誘導条件では、陰性コントロールとして用いた生理食塩水添加ではTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率は62.9%であった。これに対し30μM PD98509存在下でTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が73.3%と陰性コントロールに比較してある程度増加し、3μM PD98509存在下においてもTh1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が68.4%となりコントロールに比較してある程度増加した
【0061】
Th2分化誘導条件では、陰性コントロールとして用いた生理食塩水添加ではTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率は24.9%であった。これに対し30μMおよび3μM PD98509存在下でTh2細胞(IL-4陽性かつIFNγ陰性細胞)の比率が20.3%、17.8%と陰性コントロールに比較してある程度抑制した。さらに、Th1細胞(IL-4陰性かつIFNγ陽性細胞)の比率が18,4%.22,1%とやや増加傾向にあった。
【0062】
以上の結果からPD98509は、Th1分化誘導条件においてTh1細胞をやや増加させる傾向にあること、さらにTh2分化誘導条件ではTh2細胞をやや抑制する傾向があることが明らかになり、PD98509はTh2分化誘導を抑制しTh1誘導はやや増大させることが示唆された(図5)。
【実施例7】
【0063】
ナイーブT細胞を用いた本発明のヒトTh1/Th2分化誘導系での特異的遺伝子発現の解析
Th1分化誘導あるいはTh2分化誘導に分化誘導を行う前のナイーブTを5x106細胞(Th0細胞)、Th1分化誘導により得た5x106細胞(Th1細胞)、またTh2分化誘導により得た5x106細胞(Th2細胞)をそれぞれ出発材料として、Trizol溶液(Invitrogen社のTRIsol試薬)とRNase-free水(Invitrogen社の DNase/RNase Free)を使用しトータルRNAを調製した。詳しくは、各々の細胞を1.5mLのポリプロピレン製遠心チューブ中で1mlのTrizol溶液に溶解した、200μLのクロロホルム(Trizol液:クロロホルム=1:4の比)を添加し、ボルテックスミキサーを使用してよく振とうした後3分間室温にて放置し、小型冷却遠心機を用いて4℃にて15,000rpmで15分間遠心した。遠心により分離した上層(水溶液層)を別の1.5mLのポリプロピレン製遠心チューブに採取し、グリコーゲン飽和水溶液1μLとイソプロパノールを250μL添加しボルテックスミキサーを使用してよく振とうしてから室温にて10分間放置した後に、室温にて15,000rpmで15分間遠心した。遠心した後に上清を取り除き、冷70%エタノールを1ml加え、4℃にて15,000rpmで10分間遠心した。遠心後に再び上清を取り除き、1.5mL遠心チューブの底に沈殿したトータルRNAを室温にて風乾した。乾燥したトータルRNAに対しRNase-free水20μLを加えピペッティングにてトータルRNAを溶解させ、60℃に保温した水槽で5分間保温した後に氷上に置いた。
【0064】
こうして取得したTh0細胞、Th1細胞、及びTh2細胞由来のトータルRNAの量は、それぞれ8.9μg(557μg /mLの濃度で16μL)、12.7μg(794μg /mLで濃度16μL)、11.94μg(746μg /mLの濃度で16μL)であった。得られたTh0細胞、Th1細胞、及びTh2細胞由来のトータルRNA のRNA Integrity Number(RIA)はそれぞれの9.4, 9.7, 9.7でAffymetrix社が推奨するRNAの純度を満足していた。また、RNA含量は、260nmにおける吸光度1を40μg/mLとして算出した。
【0065】
Th0細胞由来トータルRNA、Th1細胞由来トータルRNAあるいは Th2細胞由来トータルRNAそれぞれ2.5μgを材料として、Affymetrix社が供給するGeneChip One-Cycle c DNA Synthesis Kit (One-Cycle Target Labeling and Control Reagents, #900493) を用いAffymetrix社が示す方法にて、T7-Oligo(dT) プライマー(5’-GGCCAGTGAATTGTAATACGACTCACTATAGGGAGGCGG-(dT)24 -3’)、及び逆転写酵素(SuperScript II Reveres transcriptase, Invitrogen社)を使用しcDNA第一鎖を作製した。次に、Affymetrix社が供給するFirst Cycle, Second-strand Master Mix を使用し、作製したTh0細胞由来cDNA、Th1細由来cDNAあるいは Th2細胞由来cDNAの第一鎖をそれぞれ鋳型として、RNaseH 、E.coli DNA ポリメラーゼ、及びE.coli DNA リガーゼを使用した第二鎖伸張反応によりcDNA第二鎖を合成した。二本鎖cDNA用の精製カラム(cDNA Cleanup Spin Column, Affymetrix社)を使用することにより合成した二本鎖cDNAの純度を高めた。
【0066】
プローブとして用いるビオチン標識cRNAの合成は、Th0細胞由来cDNA、Th1細由来cDNAあるいは Th2細胞由来cDNAをそれぞれ出発材料(鋳型cDNA)として使用し、Affymetrix社が供給するGeneChip IVT Labeling Kitを用い、T7 RNA ポリポリメラ―ゼによるcRNA伸長反応により作製した。作製した各々のビオチン標識cRNAは、Affymetrix社が供給するビオチン標識cRNA用の精製カラム(GeneChip IVT cRNA Cleanup Spin Column, Affymetrix社)を使用することによりビオチン標識cRNAの純度を高めた。また、Th0細胞由来ラベル化cRNA、Th1細由来ラベル化cRNAあるいは Th2細胞由来ラベル化cRNAの濃度は、それぞれ502ng/μL、644ng/μL、 574ng/μLであった。
【0067】
合成したビオチンラベル化cRNAを用い、Affymetrix社が示す方法によりフラグメント化を行った。Th0細胞由来フラグメント化標識cRNA、Th1細由来フラグメント化標識cRNAあるいは Th2細胞由来フラグメント化標識cRNAの濃度は、それぞれ95ng/μL、115ng/μL、 134ng/μLであった。次に、Affymetrix社が供給するGeneChip(R)オリゴヌクレオチドμアレイ(GeneChipTM,Human Genome U133 Plus 2.0 Array, #900466)を用いて、Affymetrix社の示す方法によりハイブリダイゼーションを行った。ハイブリダイゼーションオーブンはAffymetrix社の製品番号640(Hybridization Oven 640、P/N800138, Affymetrix社)を使用した。ハイブリダイゼーションと洗浄が終了した各々のアレイチップについて、Affymetrix社が示す方法で、ビオチン化抗ヤギ-ストレプトレプトアビジン抗体(P/N BA-0500, Vector Laboratories)、R-Phycoerythrin Streptavidin(P/NS-866, Molecular Probes)を使用して蛍光発色に必要な処理を行った。
【0068】
蛍光発色に必要な処理を終了した各々のアレイチップについて、DNAチップ解析装置を用いて蛍光強度の測定及び解析を行った。すなわち、Affymetrix社が供給する共焦点レーザー顕微鏡技術を応用したDNAチップ解析用蛍光スキャニング装置(Array Scanner 428, Affymetrix社)、及び発現データ解析用ソフト(GeneChip Operating Softoware, Affymetrix社)を使用して蛍光強度を測定し有意性ある遺伝子発現について解析を行った。
【0069】
得られたTh0細胞、Th1細胞あるいは Th2細胞でのmRNAレベルの発現強度を解析したところ、発現強度がTh0細胞に比較してTh1細胞で100倍以上高い遺伝子のスポットが複数認められた(図6−1A)。又、発現強度がTh0細胞に比較してTh2細胞で100倍以上高い遺伝子のスポットが複数認められた(図6−1B)。更に、Th1細胞での発現強度に比較してTh2細胞で40倍以上高い発現強度が認められた遺伝子が34種、100倍以上高い発現強度が認められた遺伝子が2種見出された。Th2細胞での発現強度に比較してTh1細胞で50倍以上高い発現強度が認められた遺伝子が47種、100倍以上高い発現強度が認められた遺伝子が9種見出された(図6−2)。
【0070】
発現量が比較的高いTh2特異的発現遺伝子として、 Th1/Th2の比率が0.025以下(40倍の差がある)、Th0/Th2の比率が約0.1以下(10倍の差がある)、かつTh2rawに示される蛍光強度が100以上として絞り込み9遺伝子を選択した(表1)。次に、発現量が比較的高いTh2特異的発現KIAA遺伝子として、 Th1/Th2の比率が0.1以下(10倍の差がある) 、Th0/Th2の比率が約0.14以下(約7倍の差がある)、かつTh2rawに示される蛍光強度が100以上として絞り込み4遺伝子を選択した(表2)。ここで、KIAA遺伝子とは、財団法人かずさディー・エヌ・エー研究所で発見・作製したcDNAクローンを示す呼称である。
更に、発現量が比較的高いTh1特異的発現遺伝子として、 Th1/Th2の比率が50以上(50倍の差がある)、Th0/Th1の比率が0.25以下(4倍の差がある)かつTh1rawに示される蛍光強度が100以上として絞り込み2遺伝子を選択した(表3)。
【0071】
【表1】

【0072】
【表2】

【0073】
【表3】

【産業上の利用可能性】
【0074】
本発明のヒトTh1/Th2分化誘導系は、 Th1/Th2バランスを変調する薬物、例えばTh1/Th2バランスがTh2に傾いた場合に症状が出るといわれている花粉アレルギー等を軽減する化合物スクリーニング方法を提供するので有用である
【特許請求の範囲】
【請求項1】
表1及び表2に記載された計13種類のTh2特異的発現遺伝子の少なくとも一つ、及び/又は、表3に記載された2種類のTh1特異的発現遺伝子の少なくとも一つの発現強度を測定し、それらの強度に基づきTh1又はTh2への分化誘導の程度を評価する方法。
【請求項2】
各遺伝子の発現強度をmRNA又は発現産物で測定することを特徴とする、請求項1記載の評価方法。
【請求項3】
所定量の被検化合物を添加した分化誘導培地を用いて、ヒトナイーブCD4T細胞を、IL-2、IL-12及び抗IL-4抗体を含む分化誘導培地(Th1分化誘導条件)にて抗CD3抗体による刺激下で培養し、又は、IL-2、IL-4及び抗IFNγ抗体を含む分化誘導培地(Th2分化誘導条件)にて抗CD3抗体による刺激下培養し、更に、該分化誘導培地から、夫々、抗IL-4抗体又は抗IFNγ抗体のみを除いた培養条件下で抗CD3抗体による刺激なしで更に培養することから成る、該ヒトナイーブCD4T細胞のTh1及び/又はTh2分化誘導方法によりヒトTh1/Th2分化誘導させた後に、Th1又はTh2への分化誘導の程度を評価することから成る、ヒトナイーブCD4T細胞のTh1及び/又はTh2分化誘導に対する被検化合物の影響をスクリーニングする方法であって、請求項1又は2に記載の評価方法を用いる、前記スクリーニング方法。
【請求項4】
請求項3記載のスクリーニング方法を用いる、アレルギー抑制化合物の探索方法。
【請求項1】
表1及び表2に記載された計13種類のTh2特異的発現遺伝子の少なくとも一つ、及び/又は、表3に記載された2種類のTh1特異的発現遺伝子の少なくとも一つの発現強度を測定し、それらの強度に基づきTh1又はTh2への分化誘導の程度を評価する方法。
【請求項2】
各遺伝子の発現強度をmRNA又は発現産物で測定することを特徴とする、請求項1記載の評価方法。
【請求項3】
所定量の被検化合物を添加した分化誘導培地を用いて、ヒトナイーブCD4T細胞を、IL-2、IL-12及び抗IL-4抗体を含む分化誘導培地(Th1分化誘導条件)にて抗CD3抗体による刺激下で培養し、又は、IL-2、IL-4及び抗IFNγ抗体を含む分化誘導培地(Th2分化誘導条件)にて抗CD3抗体による刺激下培養し、更に、該分化誘導培地から、夫々、抗IL-4抗体又は抗IFNγ抗体のみを除いた培養条件下で抗CD3抗体による刺激なしで更に培養することから成る、該ヒトナイーブCD4T細胞のTh1及び/又はTh2分化誘導方法によりヒトTh1/Th2分化誘導させた後に、Th1又はTh2への分化誘導の程度を評価することから成る、ヒトナイーブCD4T細胞のTh1及び/又はTh2分化誘導に対する被検化合物の影響をスクリーニングする方法であって、請求項1又は2に記載の評価方法を用いる、前記スクリーニング方法。
【請求項4】
請求項3記載のスクリーニング方法を用いる、アレルギー抑制化合物の探索方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2012−50440(P2012−50440A)
【公開日】平成24年3月15日(2012.3.15)
【国際特許分類】
【出願番号】特願2011−203124(P2011−203124)
【出願日】平成23年9月16日(2011.9.16)
【分割の表示】特願2006−93086(P2006−93086)の分割
【原出願日】平成18年3月30日(2006.3.30)
【出願人】(304021831)国立大学法人 千葉大学 (601)
【出願人】(596175810)財団法人かずさディー・エヌ・エー研究所 (40)
【Fターム(参考)】
【公開日】平成24年3月15日(2012.3.15)
【国際特許分類】
【出願日】平成23年9月16日(2011.9.16)
【分割の表示】特願2006−93086(P2006−93086)の分割
【原出願日】平成18年3月30日(2006.3.30)
【出願人】(304021831)国立大学法人 千葉大学 (601)
【出願人】(596175810)財団法人かずさディー・エヌ・エー研究所 (40)
【Fターム(参考)】
[ Back to top ]

