ヒドロキシルラジカル濃度の測定方法及び測定装置
【課題】 更なる添加物との反応を必要とせず、インラインで分光学的な測定が正確に行えるヒドロキシルラジカル濃度の測定方法及び測定装置を提供する。
【解決手段】 本発明のヒドロキシルラジカル濃度の測定装置は、ヒドロキシルラジカルを含む測定対象液1に、ヒドロキシルラジカルと瞬時に反応する反応物を添加する手段2と、添加された測定対象液を導入して、添加時から遅れて前記反応物を分光学的に測定する手段3と、その測定時における前記反応物の副反応による前記添加時からの減量分に関するデータから、前記添加時における前記反応物の反応による減量分を算出する手段4とを含む。
【解決手段】 本発明のヒドロキシルラジカル濃度の測定装置は、ヒドロキシルラジカルを含む測定対象液1に、ヒドロキシルラジカルと瞬時に反応する反応物を添加する手段2と、添加された測定対象液を導入して、添加時から遅れて前記反応物を分光学的に測定する手段3と、その測定時における前記反応物の副反応による前記添加時からの減量分に関するデータから、前記添加時における前記反応物の反応による減量分を算出する手段4とを含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はヒドロキシルラジカル(OHラジカル)濃度の測定方法及び測定装置に関し、特に、AOP法(Advanced Oxidation Processes;促進酸化法)で発生させたOHラジカルの濃度をインラインで測定する技術として有用である。
【背景技術】
【0002】
従来の水処理技術では対処できない難分解性物質や微量有害物質の分解等を目的とした水処理の新技術として、オゾン、紫外線、過酸化水素等の酸化処理技術を組み合わせたAOP法が注目されている。AOP法は、化学酸化剤や光化学反応によって水中に生じた酸化力の強いOHラジカルが汚濁物質を酸化・分解する作用メカニズムに基づいていると言われている。
【0003】
OHラジカルを定量する技術としては、例えばJIS R1704:2007に規定された方法が知られている。この方法は、下記の反応式に基づいて、OHラジカルをジメチルスルフォキシド(DMSO)と反応させた時に生成するメタンスルホン酸(MSA)を測定するものである。具体的には、反応によって生成したMSAの量をイオンクロマトグラフで測定し、得られた測定値及び測定に供されたラジカル水の量よりOHラジカル濃度を算出する。
【0004】
(CH3)2SO+・OH→CH3S(O)OH+・CH3
CH3S(O)OH+・OH+O2→CH3S(O)2OH+・OOH
(CH3)2SO+・OOH→CH3S(O)2OH+・CH3
しかし、この方法では、反応生成物を分光光度計によって定量するのが困難であり、インラインでの測定に不向きであるという問題があった。
【0005】
そこで、特許文献1には、水中のヒドロキシルラジカルをジメチルスルフォキシドと反応させた時に生成するメタンスルフィン酸を測定する際に、メタンスルフィン酸と反応してジアゾ硫酸化合物を生成するアゾ色素等を添加することで、分光光度計による測定が行えるヒドロキシルラジカル濃度の測定方法が開示されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2000−180430号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、特許文献1に記載された方法では、分光光度計による測定が可能であるものの、アゾ色素等を添加して反応させる工程を更に含むため、その反応に時間がかかり、インラインでの測定がより困難となるという問題があった。
【0008】
一方、反応によるDMSOの減少量を分光光度計で測定して、OHラジカル濃度を算出する方法も考えられるが、この方法では、DMSOの添加時期と測定時期とのタイムラグ(時間差)によって、正確な測定が行えないことが判明した。
【0009】
そこで、本発明の目的は、更なる添加物との反応を必要とせず、インラインで分光学的な測定が正確に行えるOHラジカル濃度の測定方法及び測定装置を提供することにある。
【課題を解決するための手段】
【0010】
上記目的は、下記の如き本発明により達成できる。
すなわち、本発明のOHラジカル濃度の測定方法は、OHラジカルを含む測定対象液に、OHラジカルと瞬時に反応する反応物を添加する工程と、その添加時から遅れて前記反応物を分光学的に測定する工程と、その測定時における前記反応物の副反応による前記添加時からの減量分を考慮して、前記添加時における前記反応物の反応による減量分を算出する工程と、を含むことを特徴とする。
【0011】
本発明のOHラジカル濃度の測定方法によると、基本的に反応物の反応による減量分を測定する方法であるため、更なる添加物との反応を必要とせず、反応物として分光学的に測定可能なものを選択することで、インラインで分光学的な測定がより容易になる。その際、測定時における前記反応物の副反応による前記添加時からの減量分を考慮して、前記添加時における前記反応物の反応による減量分を算出するため、測定のタイムラグ(時間差)による誤差を除去して、より正確な測定を行うことができる。その結果、更なる添加物との反応を必要とせず、インラインで分光学的な測定が正確に行えるOHラジカル濃度の測定方法を提供することができる。
【0012】
上記において、前記反応物は、DMSOであり、測定対象液がオゾンを含むものであることが好ましい。DMSOは、ヒドロキジメチルスルフォキシド反応し、分光学的に測定可能なため、本発明に好ましい反応物であるが、OHラジカルを発生させる際に使用するオゾンと反応(本発明における副反応)が生じることが判明した。このため、測定のタイムラグによる誤差が生じ易くなるが、上記の如き本発明により、当該誤差を解消できるため、本発明が特に有効となる。
【0013】
一方、本発明のOHラジカル濃度の測定装置は、OHラジカルを含む測定対象液に、OHラジカルと瞬時に反応する反応物を添加する手段と、添加された測定対象液を導入して、添加時から遅れて前記反応物を分光学的に測定する手段と、その測定時における前記反応物の副反応による前記添加時からの減量分に関するデータから、前記添加時における前記反応物の反応による減量分を算出する手段と、を含むことを特徴とする。
【0014】
本発明のOHラジカル濃度の測定装置によると、基本的に反応物の反応による減量分を測定する方法であるため、更なる添加物との反応を必要とせず、反応物として分光学的に測定可能なものを選択することで、インラインで分光学的な測定がより容易になる。その際、測定時における前記反応物の副反応による前記添加時からの減量分に関するデータから、前記添加時における前記反応物の反応による減量分を算出する手段を含むため、測定のタイムラグ(時間差)による誤差を除去して、より正確な測定を行うことができる。その結果、更なる添加物との反応を必要とせず、インラインで分光学的な測定が正確に行えるOHラジカル濃度の測定装置を提供することができる。
【0015】
上記において、前記反応物は、DMSOであり、測定対象液がオゾンを含むものであることが好ましい。DMSOは、ヒドロキジメチルスルフォキシド反応し、分光学的に測定可能なため、本発明に好ましい反応物であるが、OHラジカルを発生させる際に使用するオゾンと反応(本発明における副反応)が生じることが判明した。このため、測定のタイムラグによる誤差が生じ易くなるが、上記の如き本発明により、当該誤差を解消できるため、本発明が特に有効となる。
【図面の簡単な説明】
【0016】
【図1】予備実験における原液の遠紫外スペクトルを示すグラフ
【図2】予備実験におけるオゾンおよびDMSO由来のバンドの吸光度変化を示すグラフ
【図3】実施例1におけるDMSO+過酸化水素+オゾンの水溶液の時間経過によるスペクトルの変化を示すグラフ
【図4】実施例1におけるDMSO+過酸化水素+オゾンの水溶液のスペクトルから計算したDMSO濃度および近似曲線の時間経過を示すグラフ
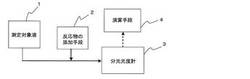
【図5】本発明のOHラジカル濃度の測定装置の一例を示す概略構成図
【発明を実施するための形態】
【0017】
本発明のOHラジカル濃度の測定方法は、OHラジカルを含む測定対象液に、OHラジカルと瞬時に反応する反応物を添加する工程を含むものである。
【0018】
測定対象液に含まれるOHラジカルとしては、オゾン、紫外線、過酸化水素等の酸化処理技術を組み合わせたAOP法によって生成したものが好ましいが、AOP法以外の方法で生成したものでもよい。また、ラジカルの長寿命化を目的として、AOP法において、更に、水溶性有機物、無機酸、前記無機酸の塩、及び、ヒドラジンからなる群より選択される少なくとも1種以上の添加物質を添加して生成されたものでもよい。従って、測定対象液には、これらの物質が含まれていてもよい。
【0019】
上記水溶性有機物としては、例えば、メタノール、エタノール、n−プロパノール、iso−プロパノール、n−ブタノール、iso−ブタノール、t−ブタノール等のアルコール類、アセトン、酢酸、蟻酸、クエン酸等が挙げられる。また、上記無機酸又は上記無機酸の塩としては、例えば、塩酸、硫酸、炭酸、炭酸塩、炭酸水素塩、亜硝酸、亜硝酸塩、亜硫酸、亜硫酸塩、亜硫酸水素塩、フッ酸を挙げることができる。
【0020】
オゾン、過酸化水素、及び、添加物質の純水への溶解順序は、同じ系に対してこれらの3成分が添加される限り特に制限されないが、オゾンと過酸化水素を混ぜた時点でオゾン分解・ラジカル生成反応が起こり、ラジカルがすぐに消滅してしまうため、オゾンと過酸化水素を混ぜ合わせる前に添加物質を混ぜておくのが好ましい。例えば、(1)純水にオゾン、添加物質及び過酸化水素をこの順序で添加して溶解させてもよいし、(2)純水にオゾンを溶解させた後、過酸化水素及び添加物質を同時に添加して溶解させてもよいし、(3)純水に添加物質、オゾン及び過酸化水素をこの順序で添加して溶解させてもよいし、(4)純水に添加物質、過酸化水素及びオゾンをこの順序で添加して溶解させてもよいし、(5)純水に過酸化水素、添加物質及びオゾンをこの順序で添加して溶解させてもよいし、(6)純水にオゾン、過酸化水素及び添加物質を同時に添加して溶解させてもよい。
【0021】
測定対象液に含まれるOHラジカルの濃度としては、例えば0〜10ppmであり、分光学的な測定を容易にする観点から、0〜5ppmが好ましい。
【0022】
OHラジカルと瞬時に反応する反応物としては、0.1秒以内に両者の反応が略完了するものが挙げられ、具体的には25℃における反応定数K =105(M−1s−1)以上のものが挙げられ、反応定数K =106〜1010(M−1s−1)のものが好ましい。このような物質は、OHラジカルのスカベンジャとして、多数公知である。本発明では、反応物を分光学的に測定する必要があるため、OHラジカルとの反応の前後で特定のバンドにおける吸光度が変化する反応物を選択する。
【0023】
このような反応物としては、DMSO、5,5−ジメチル−1−ピロリンN−オキシド(DMPO)、3,3,5,5−テトラメチル−1−ピロリンN−オキシド(M4PO)、N−t―ブチル―α―フェニルニトロン(PBN)などが挙げられる。本発明では、前記ジメチルスルフォキシドであり、測定対象液がオゾンを含むものであることが好ましい。
【0024】
反応物の添加量は、測定対象液に含まれるOHラジカルとの理論化学反応量に対して、100%以上であることが好ましく、100〜500%であることがより好ましく、200〜300%であることが更に好ましい。
【0025】
反応物の添加時期は、OHラジカルの発生と同時、即ち、測定対象液の調製時や調製前でもよいが、系外で測定を行う観点から、測定対象液の調製後にサンプリングしたものに対して添加するのが好ましい。
【0026】
本発明のOHラジカル濃度の測定方法は、反応物の添加時から遅れて前記反応物を分光学的(単一波長での測定をも包含する)に測定する工程を含むものである。分光学的な測定は、測定対象液の導入のための時間や、波長走査のための時間などによって、添加時からの遅れが生じる。この遅れ時間は、測定装置によって異なるが、5〜120秒程度である。
【0027】
分光学的な測定は、分光光度計などで、反応物に特異的なバンドの吸光度、吸光係数、透過率、反射率等を測定することにより行うことができる。反応物の濃度は、これらの測定データより、検量線、相関関係テーブル等に基づいて測定することができる。
【0028】
OHラジカルは、例えば反応物であるDMSOと接触すると酸化され、MSAを生成する。このため、DMSOの吸収スペクトルからその減少量を求めることで、OHラジカルの濃度を間接的に測定することができる。その際、OHラジカルとDMSOとが接触してMSAを生成するだけであれば、DMSOの減少量=OHラジカル生成量と考えることができるので測定も容易なのであるが、オゾンが共存するとオゾンがDMSOを酸化してDMSO2を生成する反応系(副反応)があり、DMSOの減少量=OHラジカル生成量と容易に相関付けられない。そこで、反応定数K=7×109(M−1s−1)であるDMSOのOHラジカル捕捉の時間とDMSOとオゾンとの反応時間との違いにより、両者の反応で減少したDMSOを区別するのが有効である。
【0029】
このため、本発明では、分光学的な測定時における前記反応物の副反応による前記添加時からの減量分を考慮して、前記添加時における前記反応物の反応による減量分を算出する工程を含む。副反応としては、反応物との反応によって測定時に影響を受けるようなものが挙げられるが、例えば反応物がDMSOの場合、オゾン、過酸化水素などとの副反応が例示される。
【0030】
副反応による添加時からの減量分は、適当な時間間隔で反応物の濃度を測定し、これを経過時間ゼロに外挿(外挿補正)することで算出することができる。また、既知の反応速度定数及び反応次数を使用したり、実験で反応速度定数及び反応次数を求めておき、これを利用して、添加時と測定時の時間間隔から、副反応による添加時からの減量分を算出することも可能である。いずれにしても、測定時における反応物の濃度を、経過時間ゼロに外挿することで、添加時における反応物の反応による減量分を算出することができる。
【0031】
この反応物の反応による減量分は、OHラジカルとの反応分に相当するため、この値からOHラジカルの濃度を容易に求めることができる。例えば、OHラジカルと反応物とが等モル反応する場合、反応物の反応による減量分に相当するモル濃度と、測定対象液に含まれていたOHラジカルのモル濃度は、等しくなる。また、モル濃度から重量濃度等への換算も可能となる。
【0032】
本発明のOHラジカル濃度の測定方法は、本発明のOHラジカル濃度の測定装置を用いて、好適に実施することができる。即ち、本発明のOHラジカル濃度の測定装置は、OHラジカルを含む測定対象液に、OHラジカルと瞬時に反応する反応物を添加する手段と、添加された測定対象液を導入して、添加時から遅れて前記反応物を分光学的に測定する手段と、その測定時における前記反応物の副反応による前記添加時からの減量分に関するデータから、前記添加時における前記反応物の反応による減量分を算出する手段とを含む。
【0033】
本実施形態では、図5に示すように、測定対象液1に反応物を添加する反応物の添加手段2と、添加後の測定対象液1を導入して反応物を分光学的に測定する分光光度計3と、その測定時における減量分に関するデータから、添加時における反応物の反応による減量分を算出する演算手段4とを含む例を示す。
【0034】
この測定装置では、測定対象液1を導入する経路を有し、添加手段2は、この経路に対して、反応物を添加する。図示した例では、添加した反応物を積極的に混合する混合装置を設けていないが、当該混合装置を設けてもよい。添加手段2には、添加を行うためのポンプやバルブの他、流量をモニタするための流量計、濃度をモニタするための濃度計などを設けてもよい。
【0035】
反応物を添加する位置は、測定誤差をできるだけ少なくする観点から、分光光度計3に近い位置が好ましく、分光光度計3のサンプリング装置の直前が好ましい。
【0036】
分光光度計3は、一般に、光源部、波長選択部、試料室、測光部、および表示記録部などを備えている。光源部、波長選択部、測光部は、反応物の吸収特性に応じて、選択される。例えば、DMSOを反応物として使用する場合、波長210nm付近の吸収の測定が必要となる。
【0037】
分光光度計3には、波長を走査するタイプと、全波長域を同時に測光するタイプとがあるが、測定時間をできるだけ短くする観点から、後者のタイプ(例えばフォトダイオード分光光度計)が好ましい。また、反応物や添加物等の種類により、反応物の吸収特性のある波長およびその他何点かを選択して主成分解析を行う場合や、反応物の吸光度等を1つの波長(単波長)で測定することも可能な場合があり、その場合、より簡易な装置構成とすることができる。
【0038】
図示した例では、分光光度計3とは別に、演算手段4を設けた例を示しているが、分光光度計3が内蔵する演算手段を利用して、本発明の演算を行ってもよい。
【0039】
演算手段4は、測定時における前記反応物の副反応による前記添加時からの減量分に関するデータから、前記添加時における前記反応物の反応による減量分を算出することができる。減量分に関するデータとは、1回の測定時点又は複数回の測定時点における反応物の分光学的な測定データを指す。
【0040】
副反応による減量分に関するデータから、添加時における反応物の反応による減量分(真の減量分)を算出するには、例えば、適当な時間間隔で反応物の濃度を測定して得られたデータを使用して、これを経過時間ゼロに外挿(外挿補正)することで算出することができる。具体的には、各測定時間における時間と測定値が分光光度計3より入力されて、当該データから近似曲線を計算して、経過時間ゼロにおける外挿値を求めれる演算を行えばよい。近似曲線の計算は、各種アルゴリズムが公知であり、それらを利用して演算を行うことができる。
【0041】
また、反応速度定数及び反応次数を利用して、添加時と測定時の時間間隔から、副反応による添加時からの減量分を算出することも可能である。例えばDMSOを反応物として使用する場合、オゾンとの反応次数は、二次であり、反応速度定数K=0.03(M−1s−1)であることが知られている。
【0042】
一般的な二次反応では、時間tにおける反応物の濃度=初期濃度/(1+(K×t×初期濃度))であるため、測定時間tにおける反応物の濃度と時間より、反応物の初期濃度を求めることができる。この初期濃度と反応物の添加量から計算される濃度との差より、添加時における反応物の反応による減量分(真の減量分)を算出することができる。
【0043】
反応物の反応による減量分は、OHラジカルとの反応分に相当するため、この値からOHラジカルの濃度を容易に求めることができる。例えば、OHラジカルと反応物とが等モル反応する場合、反応物の反応による減量分に相当するモル濃度と、測定対象液に含まれていたOHラジカルのモル濃度は、等しくなる。また、モル濃度から重量濃度等への換算も可能となる。
【0044】
本発明のOHラジカル濃度の測定方法及び測定装置は、微量のサンプリングでリアルタイムの測定が可能となるため、特に、AOP法で発生させたOHラジカルの濃度をインラインで測定する技術として有用である。
【実施例】
【0045】
以下に実施例を挙げて本発明を更に詳しく説明するが、本発明はこれら実施例に限定されるものではない。
【0046】
予備実験1
OHラジカルはDMSOと接触すると酸化され、MSAを生成する。従来はこのMSAをイオンクロマトグラフにより定量し、OHラジカルの生成量を確認していた(DMSO法)が、分光学的な測定によって、より簡単にOHラジカル量の定量を行うことを目的とした。
【0047】
しかし、図1に示すように、MSAの吸収スペクトルのピークは、OHラジカルを発生又は長寿命化させるための物質である、過酸化水素、イソプロピルアルコールや、反応物であるDMSOの吸収スペクトルとの分離が困難である。このため、DMSOの吸収スペクトルからその減少量を求めることが有効と考えた。
【0048】
OHラジカルとDMSOとが接触してMSAを生成するだけであれば、DMSOの減少量=OHラジカル生成量と考えることができるので測定も容易なのであるが、オゾンが共存するとオゾンがDMSOを酸化してジメチルスルフォン(DMSO2)を生成する反応系があり、DMSOの減少量=OHラジカル生成量と容易に相関付けられない。そこで、反応定数はK=7×109(M−1s−1)であるDMSOのOHラジカル捕捉の時間とDMSOとオゾンとの反応時間との違いにより、反応したDMSOを区別できないかと考えた。
【0049】
そこでまず、DMSOとオゾンのみの水溶液に対して、紫外可視分光光度計「UV−2550」(島津製作所製)による吸光度の測定(約90秒間隔)を行った。DMSOとオゾンのみの水溶液を測定した場合、図2に示すように測定を開始して10分程度でオゾンのバンドがなくなり、ほぼ同時にDMSOのピークの減少も止まることがわかった。この結果よりこのDMSOおよびオゾンのバンドの吸光度変化は、オゾンによるDMSOの酸化によるものであることと、それがOHラジカルとの反応と比べてゆっくりであることがわかる。このことから、「OHラジカルと反応して減少したDMSO」と「オゾンに酸化されて減少したDMSO」を分けることができると考え、DMSO濃度の時間変化を測定した。
なお、以下の例ではオゾン水に過酸化水素を添加してOHラジカルを発生させるAOP法を用いるので、210nm付近のDMSOの吸収スペクトルに過酸化水素の吸収帯が重なる。そこでDMSO濃度の測定は、あらかじめDMSOと過酸化水素の混合溶液において各成分の濃度を変化させて測定したスペクトルを主成分解析して検量線を作成して行った。
【0050】
実施例1
OHラジカルを生成させるために過酸化水素を加えた、DMSO(50ppm)+過酸化水素(50ppm) + オゾン(60ppm)の水溶液を調整し、DMSOとOHラジカルおよびDMSOとオゾンとの反応について、紫外可視分光光度計「UV−2550」(島津製作所製)による吸光スペクトルの測定(約90秒間隔)を行った。得られたスペクトルを図3に示す。この系でも、DMSOのバンドの吸光度が徐々に低下していることが分かるが、これはオゾンによるDMSOの酸化によるものである。
【0051】
このスペクトルを用い、DMSOと過酸化水素により作成した検量線によりDMSO濃度推定を行った。計算より導き出した濃度を経過時間に対してプロットしたものを図4に示す。最初の測定時においては、DMSOの添加時から60秒が経過しており、その吸光度に対応するDMSOの濃度は39.2ppmであった。この減少が単純にOHラジカルとDMSOが反応したことによると考えると、OHラジカルと反応したDMSOの濃度が10.8ppmであったことになり、これによって逆算されるOHラジカル濃度は2.3ppmとなる。
【0052】
一方、図4に示す値を曲線で近似し、経過時間ゼロでのDMSO濃度を求めたところ44.2ppmであった。つまり、反応物の添加時から複数の経過時間において反応物(DMSO)の副反応(オゾンとの反応)による減少量を測定することによって、添加直後における反応物のOHラジカルとの反応による減量分を算出することができる。その減量分、即ちOHラジカルとの反応に消費されたDMSOは5.8ppmと推定され、この系で生成したOHラジカル濃度が1.3ppmであると逆算された。また、確認としてイオンクロマトグラフにより測定したMSA量は9.2 ppmであった。この結果から計算されるOHラジカル濃度は1.6 ppmになり、上記の推定結果が十分に有意な値であることが示された。
【符号の説明】
【0053】
1 測定対象液
2 反応物の添加手段
3 分光学的に測定する手段(分光光度計)
4 減量分を算出する手段(演算手段)
【技術分野】
【0001】
本発明はヒドロキシルラジカル(OHラジカル)濃度の測定方法及び測定装置に関し、特に、AOP法(Advanced Oxidation Processes;促進酸化法)で発生させたOHラジカルの濃度をインラインで測定する技術として有用である。
【背景技術】
【0002】
従来の水処理技術では対処できない難分解性物質や微量有害物質の分解等を目的とした水処理の新技術として、オゾン、紫外線、過酸化水素等の酸化処理技術を組み合わせたAOP法が注目されている。AOP法は、化学酸化剤や光化学反応によって水中に生じた酸化力の強いOHラジカルが汚濁物質を酸化・分解する作用メカニズムに基づいていると言われている。
【0003】
OHラジカルを定量する技術としては、例えばJIS R1704:2007に規定された方法が知られている。この方法は、下記の反応式に基づいて、OHラジカルをジメチルスルフォキシド(DMSO)と反応させた時に生成するメタンスルホン酸(MSA)を測定するものである。具体的には、反応によって生成したMSAの量をイオンクロマトグラフで測定し、得られた測定値及び測定に供されたラジカル水の量よりOHラジカル濃度を算出する。
【0004】
(CH3)2SO+・OH→CH3S(O)OH+・CH3
CH3S(O)OH+・OH+O2→CH3S(O)2OH+・OOH
(CH3)2SO+・OOH→CH3S(O)2OH+・CH3
しかし、この方法では、反応生成物を分光光度計によって定量するのが困難であり、インラインでの測定に不向きであるという問題があった。
【0005】
そこで、特許文献1には、水中のヒドロキシルラジカルをジメチルスルフォキシドと反応させた時に生成するメタンスルフィン酸を測定する際に、メタンスルフィン酸と反応してジアゾ硫酸化合物を生成するアゾ色素等を添加することで、分光光度計による測定が行えるヒドロキシルラジカル濃度の測定方法が開示されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2000−180430号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、特許文献1に記載された方法では、分光光度計による測定が可能であるものの、アゾ色素等を添加して反応させる工程を更に含むため、その反応に時間がかかり、インラインでの測定がより困難となるという問題があった。
【0008】
一方、反応によるDMSOの減少量を分光光度計で測定して、OHラジカル濃度を算出する方法も考えられるが、この方法では、DMSOの添加時期と測定時期とのタイムラグ(時間差)によって、正確な測定が行えないことが判明した。
【0009】
そこで、本発明の目的は、更なる添加物との反応を必要とせず、インラインで分光学的な測定が正確に行えるOHラジカル濃度の測定方法及び測定装置を提供することにある。
【課題を解決するための手段】
【0010】
上記目的は、下記の如き本発明により達成できる。
すなわち、本発明のOHラジカル濃度の測定方法は、OHラジカルを含む測定対象液に、OHラジカルと瞬時に反応する反応物を添加する工程と、その添加時から遅れて前記反応物を分光学的に測定する工程と、その測定時における前記反応物の副反応による前記添加時からの減量分を考慮して、前記添加時における前記反応物の反応による減量分を算出する工程と、を含むことを特徴とする。
【0011】
本発明のOHラジカル濃度の測定方法によると、基本的に反応物の反応による減量分を測定する方法であるため、更なる添加物との反応を必要とせず、反応物として分光学的に測定可能なものを選択することで、インラインで分光学的な測定がより容易になる。その際、測定時における前記反応物の副反応による前記添加時からの減量分を考慮して、前記添加時における前記反応物の反応による減量分を算出するため、測定のタイムラグ(時間差)による誤差を除去して、より正確な測定を行うことができる。その結果、更なる添加物との反応を必要とせず、インラインで分光学的な測定が正確に行えるOHラジカル濃度の測定方法を提供することができる。
【0012】
上記において、前記反応物は、DMSOであり、測定対象液がオゾンを含むものであることが好ましい。DMSOは、ヒドロキジメチルスルフォキシド反応し、分光学的に測定可能なため、本発明に好ましい反応物であるが、OHラジカルを発生させる際に使用するオゾンと反応(本発明における副反応)が生じることが判明した。このため、測定のタイムラグによる誤差が生じ易くなるが、上記の如き本発明により、当該誤差を解消できるため、本発明が特に有効となる。
【0013】
一方、本発明のOHラジカル濃度の測定装置は、OHラジカルを含む測定対象液に、OHラジカルと瞬時に反応する反応物を添加する手段と、添加された測定対象液を導入して、添加時から遅れて前記反応物を分光学的に測定する手段と、その測定時における前記反応物の副反応による前記添加時からの減量分に関するデータから、前記添加時における前記反応物の反応による減量分を算出する手段と、を含むことを特徴とする。
【0014】
本発明のOHラジカル濃度の測定装置によると、基本的に反応物の反応による減量分を測定する方法であるため、更なる添加物との反応を必要とせず、反応物として分光学的に測定可能なものを選択することで、インラインで分光学的な測定がより容易になる。その際、測定時における前記反応物の副反応による前記添加時からの減量分に関するデータから、前記添加時における前記反応物の反応による減量分を算出する手段を含むため、測定のタイムラグ(時間差)による誤差を除去して、より正確な測定を行うことができる。その結果、更なる添加物との反応を必要とせず、インラインで分光学的な測定が正確に行えるOHラジカル濃度の測定装置を提供することができる。
【0015】
上記において、前記反応物は、DMSOであり、測定対象液がオゾンを含むものであることが好ましい。DMSOは、ヒドロキジメチルスルフォキシド反応し、分光学的に測定可能なため、本発明に好ましい反応物であるが、OHラジカルを発生させる際に使用するオゾンと反応(本発明における副反応)が生じることが判明した。このため、測定のタイムラグによる誤差が生じ易くなるが、上記の如き本発明により、当該誤差を解消できるため、本発明が特に有効となる。
【図面の簡単な説明】
【0016】
【図1】予備実験における原液の遠紫外スペクトルを示すグラフ
【図2】予備実験におけるオゾンおよびDMSO由来のバンドの吸光度変化を示すグラフ
【図3】実施例1におけるDMSO+過酸化水素+オゾンの水溶液の時間経過によるスペクトルの変化を示すグラフ
【図4】実施例1におけるDMSO+過酸化水素+オゾンの水溶液のスペクトルから計算したDMSO濃度および近似曲線の時間経過を示すグラフ
【図5】本発明のOHラジカル濃度の測定装置の一例を示す概略構成図
【発明を実施するための形態】
【0017】
本発明のOHラジカル濃度の測定方法は、OHラジカルを含む測定対象液に、OHラジカルと瞬時に反応する反応物を添加する工程を含むものである。
【0018】
測定対象液に含まれるOHラジカルとしては、オゾン、紫外線、過酸化水素等の酸化処理技術を組み合わせたAOP法によって生成したものが好ましいが、AOP法以外の方法で生成したものでもよい。また、ラジカルの長寿命化を目的として、AOP法において、更に、水溶性有機物、無機酸、前記無機酸の塩、及び、ヒドラジンからなる群より選択される少なくとも1種以上の添加物質を添加して生成されたものでもよい。従って、測定対象液には、これらの物質が含まれていてもよい。
【0019】
上記水溶性有機物としては、例えば、メタノール、エタノール、n−プロパノール、iso−プロパノール、n−ブタノール、iso−ブタノール、t−ブタノール等のアルコール類、アセトン、酢酸、蟻酸、クエン酸等が挙げられる。また、上記無機酸又は上記無機酸の塩としては、例えば、塩酸、硫酸、炭酸、炭酸塩、炭酸水素塩、亜硝酸、亜硝酸塩、亜硫酸、亜硫酸塩、亜硫酸水素塩、フッ酸を挙げることができる。
【0020】
オゾン、過酸化水素、及び、添加物質の純水への溶解順序は、同じ系に対してこれらの3成分が添加される限り特に制限されないが、オゾンと過酸化水素を混ぜた時点でオゾン分解・ラジカル生成反応が起こり、ラジカルがすぐに消滅してしまうため、オゾンと過酸化水素を混ぜ合わせる前に添加物質を混ぜておくのが好ましい。例えば、(1)純水にオゾン、添加物質及び過酸化水素をこの順序で添加して溶解させてもよいし、(2)純水にオゾンを溶解させた後、過酸化水素及び添加物質を同時に添加して溶解させてもよいし、(3)純水に添加物質、オゾン及び過酸化水素をこの順序で添加して溶解させてもよいし、(4)純水に添加物質、過酸化水素及びオゾンをこの順序で添加して溶解させてもよいし、(5)純水に過酸化水素、添加物質及びオゾンをこの順序で添加して溶解させてもよいし、(6)純水にオゾン、過酸化水素及び添加物質を同時に添加して溶解させてもよい。
【0021】
測定対象液に含まれるOHラジカルの濃度としては、例えば0〜10ppmであり、分光学的な測定を容易にする観点から、0〜5ppmが好ましい。
【0022】
OHラジカルと瞬時に反応する反応物としては、0.1秒以内に両者の反応が略完了するものが挙げられ、具体的には25℃における反応定数K =105(M−1s−1)以上のものが挙げられ、反応定数K =106〜1010(M−1s−1)のものが好ましい。このような物質は、OHラジカルのスカベンジャとして、多数公知である。本発明では、反応物を分光学的に測定する必要があるため、OHラジカルとの反応の前後で特定のバンドにおける吸光度が変化する反応物を選択する。
【0023】
このような反応物としては、DMSO、5,5−ジメチル−1−ピロリンN−オキシド(DMPO)、3,3,5,5−テトラメチル−1−ピロリンN−オキシド(M4PO)、N−t―ブチル―α―フェニルニトロン(PBN)などが挙げられる。本発明では、前記ジメチルスルフォキシドであり、測定対象液がオゾンを含むものであることが好ましい。
【0024】
反応物の添加量は、測定対象液に含まれるOHラジカルとの理論化学反応量に対して、100%以上であることが好ましく、100〜500%であることがより好ましく、200〜300%であることが更に好ましい。
【0025】
反応物の添加時期は、OHラジカルの発生と同時、即ち、測定対象液の調製時や調製前でもよいが、系外で測定を行う観点から、測定対象液の調製後にサンプリングしたものに対して添加するのが好ましい。
【0026】
本発明のOHラジカル濃度の測定方法は、反応物の添加時から遅れて前記反応物を分光学的(単一波長での測定をも包含する)に測定する工程を含むものである。分光学的な測定は、測定対象液の導入のための時間や、波長走査のための時間などによって、添加時からの遅れが生じる。この遅れ時間は、測定装置によって異なるが、5〜120秒程度である。
【0027】
分光学的な測定は、分光光度計などで、反応物に特異的なバンドの吸光度、吸光係数、透過率、反射率等を測定することにより行うことができる。反応物の濃度は、これらの測定データより、検量線、相関関係テーブル等に基づいて測定することができる。
【0028】
OHラジカルは、例えば反応物であるDMSOと接触すると酸化され、MSAを生成する。このため、DMSOの吸収スペクトルからその減少量を求めることで、OHラジカルの濃度を間接的に測定することができる。その際、OHラジカルとDMSOとが接触してMSAを生成するだけであれば、DMSOの減少量=OHラジカル生成量と考えることができるので測定も容易なのであるが、オゾンが共存するとオゾンがDMSOを酸化してDMSO2を生成する反応系(副反応)があり、DMSOの減少量=OHラジカル生成量と容易に相関付けられない。そこで、反応定数K=7×109(M−1s−1)であるDMSOのOHラジカル捕捉の時間とDMSOとオゾンとの反応時間との違いにより、両者の反応で減少したDMSOを区別するのが有効である。
【0029】
このため、本発明では、分光学的な測定時における前記反応物の副反応による前記添加時からの減量分を考慮して、前記添加時における前記反応物の反応による減量分を算出する工程を含む。副反応としては、反応物との反応によって測定時に影響を受けるようなものが挙げられるが、例えば反応物がDMSOの場合、オゾン、過酸化水素などとの副反応が例示される。
【0030】
副反応による添加時からの減量分は、適当な時間間隔で反応物の濃度を測定し、これを経過時間ゼロに外挿(外挿補正)することで算出することができる。また、既知の反応速度定数及び反応次数を使用したり、実験で反応速度定数及び反応次数を求めておき、これを利用して、添加時と測定時の時間間隔から、副反応による添加時からの減量分を算出することも可能である。いずれにしても、測定時における反応物の濃度を、経過時間ゼロに外挿することで、添加時における反応物の反応による減量分を算出することができる。
【0031】
この反応物の反応による減量分は、OHラジカルとの反応分に相当するため、この値からOHラジカルの濃度を容易に求めることができる。例えば、OHラジカルと反応物とが等モル反応する場合、反応物の反応による減量分に相当するモル濃度と、測定対象液に含まれていたOHラジカルのモル濃度は、等しくなる。また、モル濃度から重量濃度等への換算も可能となる。
【0032】
本発明のOHラジカル濃度の測定方法は、本発明のOHラジカル濃度の測定装置を用いて、好適に実施することができる。即ち、本発明のOHラジカル濃度の測定装置は、OHラジカルを含む測定対象液に、OHラジカルと瞬時に反応する反応物を添加する手段と、添加された測定対象液を導入して、添加時から遅れて前記反応物を分光学的に測定する手段と、その測定時における前記反応物の副反応による前記添加時からの減量分に関するデータから、前記添加時における前記反応物の反応による減量分を算出する手段とを含む。
【0033】
本実施形態では、図5に示すように、測定対象液1に反応物を添加する反応物の添加手段2と、添加後の測定対象液1を導入して反応物を分光学的に測定する分光光度計3と、その測定時における減量分に関するデータから、添加時における反応物の反応による減量分を算出する演算手段4とを含む例を示す。
【0034】
この測定装置では、測定対象液1を導入する経路を有し、添加手段2は、この経路に対して、反応物を添加する。図示した例では、添加した反応物を積極的に混合する混合装置を設けていないが、当該混合装置を設けてもよい。添加手段2には、添加を行うためのポンプやバルブの他、流量をモニタするための流量計、濃度をモニタするための濃度計などを設けてもよい。
【0035】
反応物を添加する位置は、測定誤差をできるだけ少なくする観点から、分光光度計3に近い位置が好ましく、分光光度計3のサンプリング装置の直前が好ましい。
【0036】
分光光度計3は、一般に、光源部、波長選択部、試料室、測光部、および表示記録部などを備えている。光源部、波長選択部、測光部は、反応物の吸収特性に応じて、選択される。例えば、DMSOを反応物として使用する場合、波長210nm付近の吸収の測定が必要となる。
【0037】
分光光度計3には、波長を走査するタイプと、全波長域を同時に測光するタイプとがあるが、測定時間をできるだけ短くする観点から、後者のタイプ(例えばフォトダイオード分光光度計)が好ましい。また、反応物や添加物等の種類により、反応物の吸収特性のある波長およびその他何点かを選択して主成分解析を行う場合や、反応物の吸光度等を1つの波長(単波長)で測定することも可能な場合があり、その場合、より簡易な装置構成とすることができる。
【0038】
図示した例では、分光光度計3とは別に、演算手段4を設けた例を示しているが、分光光度計3が内蔵する演算手段を利用して、本発明の演算を行ってもよい。
【0039】
演算手段4は、測定時における前記反応物の副反応による前記添加時からの減量分に関するデータから、前記添加時における前記反応物の反応による減量分を算出することができる。減量分に関するデータとは、1回の測定時点又は複数回の測定時点における反応物の分光学的な測定データを指す。
【0040】
副反応による減量分に関するデータから、添加時における反応物の反応による減量分(真の減量分)を算出するには、例えば、適当な時間間隔で反応物の濃度を測定して得られたデータを使用して、これを経過時間ゼロに外挿(外挿補正)することで算出することができる。具体的には、各測定時間における時間と測定値が分光光度計3より入力されて、当該データから近似曲線を計算して、経過時間ゼロにおける外挿値を求めれる演算を行えばよい。近似曲線の計算は、各種アルゴリズムが公知であり、それらを利用して演算を行うことができる。
【0041】
また、反応速度定数及び反応次数を利用して、添加時と測定時の時間間隔から、副反応による添加時からの減量分を算出することも可能である。例えばDMSOを反応物として使用する場合、オゾンとの反応次数は、二次であり、反応速度定数K=0.03(M−1s−1)であることが知られている。
【0042】
一般的な二次反応では、時間tにおける反応物の濃度=初期濃度/(1+(K×t×初期濃度))であるため、測定時間tにおける反応物の濃度と時間より、反応物の初期濃度を求めることができる。この初期濃度と反応物の添加量から計算される濃度との差より、添加時における反応物の反応による減量分(真の減量分)を算出することができる。
【0043】
反応物の反応による減量分は、OHラジカルとの反応分に相当するため、この値からOHラジカルの濃度を容易に求めることができる。例えば、OHラジカルと反応物とが等モル反応する場合、反応物の反応による減量分に相当するモル濃度と、測定対象液に含まれていたOHラジカルのモル濃度は、等しくなる。また、モル濃度から重量濃度等への換算も可能となる。
【0044】
本発明のOHラジカル濃度の測定方法及び測定装置は、微量のサンプリングでリアルタイムの測定が可能となるため、特に、AOP法で発生させたOHラジカルの濃度をインラインで測定する技術として有用である。
【実施例】
【0045】
以下に実施例を挙げて本発明を更に詳しく説明するが、本発明はこれら実施例に限定されるものではない。
【0046】
予備実験1
OHラジカルはDMSOと接触すると酸化され、MSAを生成する。従来はこのMSAをイオンクロマトグラフにより定量し、OHラジカルの生成量を確認していた(DMSO法)が、分光学的な測定によって、より簡単にOHラジカル量の定量を行うことを目的とした。
【0047】
しかし、図1に示すように、MSAの吸収スペクトルのピークは、OHラジカルを発生又は長寿命化させるための物質である、過酸化水素、イソプロピルアルコールや、反応物であるDMSOの吸収スペクトルとの分離が困難である。このため、DMSOの吸収スペクトルからその減少量を求めることが有効と考えた。
【0048】
OHラジカルとDMSOとが接触してMSAを生成するだけであれば、DMSOの減少量=OHラジカル生成量と考えることができるので測定も容易なのであるが、オゾンが共存するとオゾンがDMSOを酸化してジメチルスルフォン(DMSO2)を生成する反応系があり、DMSOの減少量=OHラジカル生成量と容易に相関付けられない。そこで、反応定数はK=7×109(M−1s−1)であるDMSOのOHラジカル捕捉の時間とDMSOとオゾンとの反応時間との違いにより、反応したDMSOを区別できないかと考えた。
【0049】
そこでまず、DMSOとオゾンのみの水溶液に対して、紫外可視分光光度計「UV−2550」(島津製作所製)による吸光度の測定(約90秒間隔)を行った。DMSOとオゾンのみの水溶液を測定した場合、図2に示すように測定を開始して10分程度でオゾンのバンドがなくなり、ほぼ同時にDMSOのピークの減少も止まることがわかった。この結果よりこのDMSOおよびオゾンのバンドの吸光度変化は、オゾンによるDMSOの酸化によるものであることと、それがOHラジカルとの反応と比べてゆっくりであることがわかる。このことから、「OHラジカルと反応して減少したDMSO」と「オゾンに酸化されて減少したDMSO」を分けることができると考え、DMSO濃度の時間変化を測定した。
なお、以下の例ではオゾン水に過酸化水素を添加してOHラジカルを発生させるAOP法を用いるので、210nm付近のDMSOの吸収スペクトルに過酸化水素の吸収帯が重なる。そこでDMSO濃度の測定は、あらかじめDMSOと過酸化水素の混合溶液において各成分の濃度を変化させて測定したスペクトルを主成分解析して検量線を作成して行った。
【0050】
実施例1
OHラジカルを生成させるために過酸化水素を加えた、DMSO(50ppm)+過酸化水素(50ppm) + オゾン(60ppm)の水溶液を調整し、DMSOとOHラジカルおよびDMSOとオゾンとの反応について、紫外可視分光光度計「UV−2550」(島津製作所製)による吸光スペクトルの測定(約90秒間隔)を行った。得られたスペクトルを図3に示す。この系でも、DMSOのバンドの吸光度が徐々に低下していることが分かるが、これはオゾンによるDMSOの酸化によるものである。
【0051】
このスペクトルを用い、DMSOと過酸化水素により作成した検量線によりDMSO濃度推定を行った。計算より導き出した濃度を経過時間に対してプロットしたものを図4に示す。最初の測定時においては、DMSOの添加時から60秒が経過しており、その吸光度に対応するDMSOの濃度は39.2ppmであった。この減少が単純にOHラジカルとDMSOが反応したことによると考えると、OHラジカルと反応したDMSOの濃度が10.8ppmであったことになり、これによって逆算されるOHラジカル濃度は2.3ppmとなる。
【0052】
一方、図4に示す値を曲線で近似し、経過時間ゼロでのDMSO濃度を求めたところ44.2ppmであった。つまり、反応物の添加時から複数の経過時間において反応物(DMSO)の副反応(オゾンとの反応)による減少量を測定することによって、添加直後における反応物のOHラジカルとの反応による減量分を算出することができる。その減量分、即ちOHラジカルとの反応に消費されたDMSOは5.8ppmと推定され、この系で生成したOHラジカル濃度が1.3ppmであると逆算された。また、確認としてイオンクロマトグラフにより測定したMSA量は9.2 ppmであった。この結果から計算されるOHラジカル濃度は1.6 ppmになり、上記の推定結果が十分に有意な値であることが示された。
【符号の説明】
【0053】
1 測定対象液
2 反応物の添加手段
3 分光学的に測定する手段(分光光度計)
4 減量分を算出する手段(演算手段)
【特許請求の範囲】
【請求項1】
ヒドロキシルラジカルを含む測定対象液に、ヒドロキシルラジカルと瞬時に反応する反応物を添加する工程と、
その添加時から遅れて前記反応物を分光学的に測定する工程と、
その測定時における前記反応物の副反応による前記添加時からの減量分を考慮して、前記添加時における前記反応物の反応による減量分を算出する工程と、を含むヒドロキシルラジカル濃度の測定方法。
【請求項2】
前記反応物は、ジメチルスルフォキシドであり、測定対象液がオゾンを含むものである請求項1に記載の測定方法。
【請求項3】
ヒドロキシルラジカルを含む測定対象液に、ヒドロキシルラジカルと瞬時に反応する反応物を添加する手段と、
添加された測定対象液を導入して、添加時から遅れて前記反応物を分光学的に測定する手段と、
その測定時における前記反応物の副反応による前記添加時からの減量分に関するデータから、前記添加時における前記反応物の反応による減量分を算出する手段と、を含むヒドロキシルラジカル濃度の測定装置。
【請求項4】
前記反応物は、ジメチルスルフォキシドであり、測定対象液がオゾンを含むものである請求項3に記載の測定装置。
【請求項1】
ヒドロキシルラジカルを含む測定対象液に、ヒドロキシルラジカルと瞬時に反応する反応物を添加する工程と、
その添加時から遅れて前記反応物を分光学的に測定する工程と、
その測定時における前記反応物の副反応による前記添加時からの減量分を考慮して、前記添加時における前記反応物の反応による減量分を算出する工程と、を含むヒドロキシルラジカル濃度の測定方法。
【請求項2】
前記反応物は、ジメチルスルフォキシドであり、測定対象液がオゾンを含むものである請求項1に記載の測定方法。
【請求項3】
ヒドロキシルラジカルを含む測定対象液に、ヒドロキシルラジカルと瞬時に反応する反応物を添加する手段と、
添加された測定対象液を導入して、添加時から遅れて前記反応物を分光学的に測定する手段と、
その測定時における前記反応物の副反応による前記添加時からの減量分に関するデータから、前記添加時における前記反応物の反応による減量分を算出する手段と、を含むヒドロキシルラジカル濃度の測定装置。
【請求項4】
前記反応物は、ジメチルスルフォキシドであり、測定対象液がオゾンを含むものである請求項3に記載の測定装置。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2011−242166(P2011−242166A)
【公開日】平成23年12月1日(2011.12.1)
【国際特許分類】
【出願番号】特願2010−112443(P2010−112443)
【出願日】平成22年5月14日(2010.5.14)
【出願人】(000001096)倉敷紡績株式会社 (296)
【出願人】(503092180)学校法人関西学院 (71)
【Fターム(参考)】
【公開日】平成23年12月1日(2011.12.1)
【国際特許分類】
【出願日】平成22年5月14日(2010.5.14)
【出願人】(000001096)倉敷紡績株式会社 (296)
【出願人】(503092180)学校法人関西学院 (71)
【Fターム(参考)】
[ Back to top ]

