ビカルタミドを含有する医薬組成物及びその製造方法
【課題】 従来技術の難点を解消し、難溶性薬物であるビカルタミドを含有する医薬組成物であって、含有されるビカルタミドの溶出性が改善され、しかも残留溶媒の危険性がない医薬組成物、及び、このビカルタミドを含有する医薬組成物の製造方法を提供する。
【解決手段】 本発明の医薬組成物は、ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を粉砕してなると共に、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化していないことを特徴とするものであり、又、本発明の医薬組成物用の製造方法は、ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化しないように粉砕することを特徴とするものである。
【解決手段】 本発明の医薬組成物は、ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を粉砕してなると共に、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化していないことを特徴とするものであり、又、本発明の医薬組成物用の製造方法は、ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化しないように粉砕することを特徴とするものである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、難溶性薬物であるビカルタミドを含有する医薬組成物であって、含有されるビカルタミドの溶出性が改善され、しかも残留溶媒の危険性が全くない医薬組成物、及び、このビカルタミドを含有する医薬組成物の安全且つ簡便な製造方法に関するものである。
【背景技術】
【0002】
(RS)-N-[4-Cyano-3-(trifluoromethyl)phenyl]-3-[(4-fluorophenyl)sulfonyl]-2-hydroxy-2-methylpropanamide(一般名:ビカルタミド)は、抗アンドロゲン活性を有する非ステロイド系化合物であり、前立腺癌の有用な治療薬として、CASODEX(AstraZeneca社)の商品名で世界の多数の国々で承認されている。
【0003】
しかしビカルタミドは、優れた特性を有する反面、水に対してほとんど溶出性を示さず、原薬1グラムを溶解するのに水10リットル以上を必要とするという難溶性の高い薬物である。従って、ビカルタミドの生物学的利用能を増加させるには、例えば担体を用いた薬物微細化や溶出性改善剤の添加等による溶出性の改善が必須であり、担体を用いた薬物微細化の一つの方法として、固体分散体による溶解度の改善がある。
【0004】
上記固体分散体法は、難溶性薬物における溶出性の改善法として当業者には周知の方法であり、高分子ポリマーや無機物の担体中に薬物を固体状態で分散させ、結晶性を低下もしくは非晶質化させることにより、薬物の溶解度を上昇させる方法であり、従来技術では、ポリビニルピロリドン(PVP)或いは3から6のpKaを有する腸溶性ポリマーを用いた溶媒法による、ビカルタミドの固体分散体の製造方法が開示されている。
【0005】
しかしながら一方で、溶媒法による固体分散体法では、ビカルタミドの物性、特にその溶出性からアセトンやジクロロメタンといった有害な有機溶媒の、しかも多量の使用が避けられないために、作業環境上からみて好ましくない方法という認識もなされていた(特許文献1、2)し、得られた固体分散体にはそれら有害な有機溶媒が残留する可能性があるという問題が指摘されていた。
【0006】
加えて、溶媒法によるビカルタミドの固体分散体法には、さまざまな工程の変数の調節が難しく、又、条件によっては結晶性が低下もしくは非晶質化したビカルタミドが結晶化してしまうため、その製造には厳密なパラメーター管理を必要とするなど熟練を要するという問題があり、更に、固体分散体を調製した後に、粉砕工程を必要とするため、製造工程が長くなることも問題視されていた。
【0007】
【特許文献1】特表2004−525164号
【特許文献2】特開2004−143185号
【発明の開示】
【発明が解決しようとする課題】
【0008】
従って、有害な有機溶媒を用いることなく、ビカルタミドの溶出性を改善して生物学的利用能を増加させることのできる医薬組成物、及び、そのための安全且つ簡便な製造手段を開発することが急務の課題であった。
【課題を解決するための手段】
【0009】
上記課題を解決するため、本発明の発明者らが鋭意検討した結果、有機溶媒を使用する溶媒法によるビカルタミドの固体分散体法に拠ることなく、ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を所定の条件下に粉砕することにより、ビカルタミドの溶出性が有意に改善されることを見出し、本発明を完成するに至った。
【0010】
即ち、本発明は、以下の構成により上記課題を解決しようとするものである。
【0011】
[1] ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を粉砕してなると共に、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化していないことを特徴とする医薬組成物。
【0012】
[2] ビカルタミド1.0重量部に対してクロスポビドン及び/又はコポリビドン0.05〜0.5重量部を含んでなる[1]に記載の医薬組成物。
【0013】
[3] 更に、薬学的に許容される他の成分を含んでなる[1]又は[2]に記載の医薬組成物。
【0014】
[4]ポリオキシエチレンソルビタンモノオレエート及びラウリル硫酸ナトリウムから選ばれる1種以上の界面活性剤を1.0(W/V)%以上含有する試験液におけるビカルタミドの溶解度が、70%以上を示す[1]乃至[3]のいずれかに記載の医薬組成物。
【0015】
[5] ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化しないように粉砕することを特徴とする医薬組成物用の製造方法。
【0016】
[6] ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物が、ビカルタミド1.0重量部に対してクロスポビドン及び/又はコポリビドン0.05〜0.5重量部を含んでなる[5]に記載の医薬組成物の製造方法。
【0017】
[7] [1]乃至[4]のいずれかに記載の医薬組成物よりなる打錠用粉体。
【0018】
[8] [7]に記載の打錠用粉体を打錠した錠剤。
【発明の効果】
【0019】
本発明により、有機溶媒を使用しないために残留有機溶媒の危険性がなく、従って安全性が高い医薬組成物が提供され、しかもこの医薬組成物では、ビカルタミドの溶出性が改善されている。
【0020】
更に、本発明の医薬組成物の製造方法は、安全且つ簡便に実施が可能である。
【発明を実施するための最良の形態】
【0021】
以下に本発明を詳細に説明する。
【0022】
本発明の医薬組成物の主剤はビカルタミドであり、このビカルタミドは、優れた特性を有する反面、原薬1グラムを溶解するのに水10リットル以上を必要とするという難溶性の高い薬物であることは上述の通りである。
【0023】
本発明の医薬組成物において、ビカルタミドと併用される他の成分はクロスポビドン又はコポリビドンであり、クロスポビドンは一般に崩壊剤として用いられ、ポビドン(1−ビニル−2−ピロリドンの直鎖重合物)の架橋型合成ホモポリマーであり、一方のコポリビドンは一般に結合剤として用いられ、ポビドンと酢酸ビニルとの共重合物である。
【0024】
一般に、薬物と担体の混合比を、担体の比率が通常の場合よりも大きくなるように例えば1:1に調整し、長時間例えば1日以上かけて粉砕することにより、溶出性の改善された固体分散体となり、更に粉砕を続けることにより薬物の結晶性が低下して、最終的には非晶質化も可能であり、即ち、このような方法に拠れば、有機溶媒を使用しないために残留有機溶媒の危険性はないが、長い粉砕時間が必要であったり、大量の担体を必要とするために製剤が大型化するばかりか、一般に、非晶質化物(結晶性の低下した薬剤も含む)には再結晶化や分解などがみられ、経時的安定性に劣る場合が多く、様々な条件下で運搬、保存される医薬品にとって必ずしも望ましい状態ではない。
【0025】
上記ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物の粉砕は、ビカルタミドの結晶性を上記のように変更することを目的としてはおらず、即ち、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化していないのである。
【0026】
「実質的に」とは、粉砕によりビカルタミドの結晶性が著しく低下したり、或いは、転移が起こっていない状態を示す。
【0027】
ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化しないように粉砕するには、例えば、ビカルタミド1.0重量部に対して、クロスポビドン及び/又はコポリビドン0.05〜0.5重量部となるようにこれらを混合し、粉砕すればよい。
【0028】
又、ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物の粉砕には、医薬品製造用に用いられる粉砕方法、粉砕装置であれば特に問題なく採用することができ、粉砕装置としては例えば、ボールミル、ロッドミル、振動ミル等の微粉砕機や、ハンマーミル、ピンミル、カッターミル等の中砕機を挙げることができるが、ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物の粉砕は、固体分散体の製造を目的としているのではないので、ハンマーミル、ピンミル、カッターミル等の中砕機で十分である。
【0029】
従って、本発明によれば、固体分散体を製造するよりもより緩和な条件、例えば数分〜数十分で粉砕を終了することにより、ビカルタミドの溶出性の向上を図ることが可能となる。
【0030】
又、本発明の医薬組成物には、適切な賦形剤等、例えば、1以上の賦形剤、結合剤、崩壊剤、湿潤剤、滑沢剤を含んでよい。この目的のために使用される充填剤、結合剤、崩壊剤、湿潤剤、滑沢剤としては、「医薬品添加物辞典2005」(薬事日報社(株)発行)に記載されているものを挙げることができる。
【0031】
好適な賦形剤には、例えば、乳糖、無水乳糖、結晶セルロース、粉末セルロース、D-マンニトール、ソルビトーール、キシリトール、白糖、フルクトース、コーンスターチ、バレイショデンプン、ヒドロキシプロピルスターチ、無水リン酸カルシウム、メタケイ酸アルミン酸マグネシウム、含水二酸化ケイ素、軽質無水ケイ酸などが含まれる。
【0032】
好適な結合剤には、例えば、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、エチルセルロース、メチルセルロース、ポビドン、ポリビニルアルコールなどが含まれる。
【0033】
好適な崩壊剤には、例えば、クロスカルメロースナトリウム、カルボキシメチルスターチナトリウム、クロスポビドン、カルメロースカルシウム、低置換度ヒドロキシプロピルセルロース、ヒドロキシプロピルスターチ、部分アルファー化デンプンなどが含まれる。
【0034】
好適な湿潤剤には、例えば、ラウリル硫酸ナトリウム、ポリオキシエチレン硬化ヒマシ油、ポロクサマー、ポリソルビタンモノオレエート、グリセリン、マクロゴール、プロピレングリコールなどが含まれる。
【0035】
適切な滑沢剤としてステアリン酸マグネシウム、ステアリン酸、ステアリン酸カルシウム、フマル酸ステアリルナトリウム、ショ糖脂肪酸エステル、含水二酸化ケイ素、タルクなどが含まれる。
【0036】
本発明の本発明の医薬組成物では、その溶出性が有意に改善されていて、例えば、ポリオキシエチレンソルビタンモノオレエート及びラウリル硫酸ナトリウムから選ばれる1種以上の界面活性剤を1.0(W/V)%以上含有する試験液における溶解度は、70%以上である。
【0037】
又、本発明の、ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化しないように粉砕する製造方法により製造される医薬組成物は、このまま細粒剤、顆粒剤としたり、或いは、カプセルに充填するなどしてもよく、更にこれを打錠用粉体として打錠し、錠剤としてもよい。
【0038】
以下に実施例を示す。尚、これらは本発明を限定するものではない。
【0039】
実施例1
ビカルタミド800g、クロスポビドン90g、乳糖820gを混合し、ハンマーミルにて混合粉砕した後、PVP200gを混合して、高速撹拌造粒機にて造粒した。これを乾燥し、乾燥物を42号の篩にて整粒した。この整粒物に、クロスポビドン、カルボキシメチルスターチナトリウムを添加してよく混合した後、ステアリン酸マグネシウムを混合して打錠粉体を製した。この粉体を直径7.5mm、1錠重量205mgにて打錠した。
【0040】
実施例2
ビカルタミド800g、コポリビドン100g、クロスポビドン40g、乳糖820gを混合し、ハンマーミルにて混合粉砕した後、PVP100gを混合して、高速撹拌造粒機にて造粒した。これを乾燥し、乾燥物を42号の篩にて整粒した。この整粒物にカルボキシメチルスターチナトリウムを添加してよく混合した後、ステアリン酸マグネシウムを混合して打錠粉体を製した。この粉体を直径7.5mm 、1錠重量205mgにて打錠した。
【0041】
実施例3
ビカルタミド800g、クロスポビドン240g、結晶セルロース900gを混合し、ハンマーミルにて混合粉砕した後、流動層造粒機にて造粒した。これを乾燥し、乾燥物を30号の篩にて整粒した。この整粒物に、クロスカルメロースナトリウムを添加してよく混合した後、ステアリン酸マグネシウムを混合して打錠粉体を製した。この粉体を直径7.5mm 、1錠重量205mgにて打錠した。
【0042】
比較例1
ビカルタミド800g、乳糖910gを混合し、ハンマーミルにて混合粉砕した後、以下実施例1と同様の方法で錠剤を製した。
【0043】
比較例2
ビカルタミド800g、乳糖960gを混合し、ハンマーミルにて混合粉砕した後、以下実施例2と同様の方法で錠剤を製した。
【0044】
比較例3
ビカルタミド800g、結晶セルロース1140gを混合し、ハンマーミルにて混合粉砕した後、以下実施例3と同様の方法で錠剤を製した。
【0045】
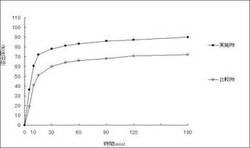
実施例及び比較例について溶出性を比較した結果を図1、2、3に示した。試験は第15改正日本薬局方溶出試験法第2法{パドルの回転数;50回転/分,試験液;日局第2液にTween80を1.0(W/V)%加えたもの(900mL)}により行った。
【0046】
実施例では、比較例に比べていずれも溶出性が上昇しており、本発明の医薬組成物では溶出性の改善が可能であることが確認された。又、上記実施例の記載の通り、有機溶媒は使用されていないので、得られた医薬組成物に有機溶媒が残留する可能性は全くない。
【0047】
尚、この溶出性の改善効果は、ビカルタミドとクロスポビドン及び/又はコポリビドンの混合粉砕物においても、同様に認められた。
【0048】
実施例における各種条件下(25℃・90%RH、40℃・75%RH、60℃、いずれも1ヶ月)における安定性を表1に示す。含量及び溶出の各項目に、保存による変化は認められなかった。
【0049】
【表1】

【産業上の利用可能性】
【0050】
本発明では、有機溶媒を使用する溶媒法によるビカルタミドの固体分散体法に拠ることなく、ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を所定の条件下に粉砕することにより、ビカルタミドの溶出性が有意に改善することに成功しており、製剤中に有機溶媒が残留することがないことから極めて安全な医薬組成物を提供することができる。
【0051】
又、本発明の医薬組成物の製造方法は、有機溶媒を使用しないため、作業環境上からも望ましく、しかもビカルタミドが固体分散体となるまで長時間の混合粉砕が必要ではないため、工程が短時間で済み、安全且つ簡便に実施が可能で効率的である。
【図面の簡単な説明】
【0052】
【図1】実施例1、比較例1の溶出曲線である。
【図2】実施例2、比較例2の溶出曲線である。
【図3】実施例3、比較例3の溶出曲線である。
【技術分野】
【0001】
本発明は、難溶性薬物であるビカルタミドを含有する医薬組成物であって、含有されるビカルタミドの溶出性が改善され、しかも残留溶媒の危険性が全くない医薬組成物、及び、このビカルタミドを含有する医薬組成物の安全且つ簡便な製造方法に関するものである。
【背景技術】
【0002】
(RS)-N-[4-Cyano-3-(trifluoromethyl)phenyl]-3-[(4-fluorophenyl)sulfonyl]-2-hydroxy-2-methylpropanamide(一般名:ビカルタミド)は、抗アンドロゲン活性を有する非ステロイド系化合物であり、前立腺癌の有用な治療薬として、CASODEX(AstraZeneca社)の商品名で世界の多数の国々で承認されている。
【0003】
しかしビカルタミドは、優れた特性を有する反面、水に対してほとんど溶出性を示さず、原薬1グラムを溶解するのに水10リットル以上を必要とするという難溶性の高い薬物である。従って、ビカルタミドの生物学的利用能を増加させるには、例えば担体を用いた薬物微細化や溶出性改善剤の添加等による溶出性の改善が必須であり、担体を用いた薬物微細化の一つの方法として、固体分散体による溶解度の改善がある。
【0004】
上記固体分散体法は、難溶性薬物における溶出性の改善法として当業者には周知の方法であり、高分子ポリマーや無機物の担体中に薬物を固体状態で分散させ、結晶性を低下もしくは非晶質化させることにより、薬物の溶解度を上昇させる方法であり、従来技術では、ポリビニルピロリドン(PVP)或いは3から6のpKaを有する腸溶性ポリマーを用いた溶媒法による、ビカルタミドの固体分散体の製造方法が開示されている。
【0005】
しかしながら一方で、溶媒法による固体分散体法では、ビカルタミドの物性、特にその溶出性からアセトンやジクロロメタンといった有害な有機溶媒の、しかも多量の使用が避けられないために、作業環境上からみて好ましくない方法という認識もなされていた(特許文献1、2)し、得られた固体分散体にはそれら有害な有機溶媒が残留する可能性があるという問題が指摘されていた。
【0006】
加えて、溶媒法によるビカルタミドの固体分散体法には、さまざまな工程の変数の調節が難しく、又、条件によっては結晶性が低下もしくは非晶質化したビカルタミドが結晶化してしまうため、その製造には厳密なパラメーター管理を必要とするなど熟練を要するという問題があり、更に、固体分散体を調製した後に、粉砕工程を必要とするため、製造工程が長くなることも問題視されていた。
【0007】
【特許文献1】特表2004−525164号
【特許文献2】特開2004−143185号
【発明の開示】
【発明が解決しようとする課題】
【0008】
従って、有害な有機溶媒を用いることなく、ビカルタミドの溶出性を改善して生物学的利用能を増加させることのできる医薬組成物、及び、そのための安全且つ簡便な製造手段を開発することが急務の課題であった。
【課題を解決するための手段】
【0009】
上記課題を解決するため、本発明の発明者らが鋭意検討した結果、有機溶媒を使用する溶媒法によるビカルタミドの固体分散体法に拠ることなく、ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を所定の条件下に粉砕することにより、ビカルタミドの溶出性が有意に改善されることを見出し、本発明を完成するに至った。
【0010】
即ち、本発明は、以下の構成により上記課題を解決しようとするものである。
【0011】
[1] ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を粉砕してなると共に、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化していないことを特徴とする医薬組成物。
【0012】
[2] ビカルタミド1.0重量部に対してクロスポビドン及び/又はコポリビドン0.05〜0.5重量部を含んでなる[1]に記載の医薬組成物。
【0013】
[3] 更に、薬学的に許容される他の成分を含んでなる[1]又は[2]に記載の医薬組成物。
【0014】
[4]ポリオキシエチレンソルビタンモノオレエート及びラウリル硫酸ナトリウムから選ばれる1種以上の界面活性剤を1.0(W/V)%以上含有する試験液におけるビカルタミドの溶解度が、70%以上を示す[1]乃至[3]のいずれかに記載の医薬組成物。
【0015】
[5] ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化しないように粉砕することを特徴とする医薬組成物用の製造方法。
【0016】
[6] ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物が、ビカルタミド1.0重量部に対してクロスポビドン及び/又はコポリビドン0.05〜0.5重量部を含んでなる[5]に記載の医薬組成物の製造方法。
【0017】
[7] [1]乃至[4]のいずれかに記載の医薬組成物よりなる打錠用粉体。
【0018】
[8] [7]に記載の打錠用粉体を打錠した錠剤。
【発明の効果】
【0019】
本発明により、有機溶媒を使用しないために残留有機溶媒の危険性がなく、従って安全性が高い医薬組成物が提供され、しかもこの医薬組成物では、ビカルタミドの溶出性が改善されている。
【0020】
更に、本発明の医薬組成物の製造方法は、安全且つ簡便に実施が可能である。
【発明を実施するための最良の形態】
【0021】
以下に本発明を詳細に説明する。
【0022】
本発明の医薬組成物の主剤はビカルタミドであり、このビカルタミドは、優れた特性を有する反面、原薬1グラムを溶解するのに水10リットル以上を必要とするという難溶性の高い薬物であることは上述の通りである。
【0023】
本発明の医薬組成物において、ビカルタミドと併用される他の成分はクロスポビドン又はコポリビドンであり、クロスポビドンは一般に崩壊剤として用いられ、ポビドン(1−ビニル−2−ピロリドンの直鎖重合物)の架橋型合成ホモポリマーであり、一方のコポリビドンは一般に結合剤として用いられ、ポビドンと酢酸ビニルとの共重合物である。
【0024】
一般に、薬物と担体の混合比を、担体の比率が通常の場合よりも大きくなるように例えば1:1に調整し、長時間例えば1日以上かけて粉砕することにより、溶出性の改善された固体分散体となり、更に粉砕を続けることにより薬物の結晶性が低下して、最終的には非晶質化も可能であり、即ち、このような方法に拠れば、有機溶媒を使用しないために残留有機溶媒の危険性はないが、長い粉砕時間が必要であったり、大量の担体を必要とするために製剤が大型化するばかりか、一般に、非晶質化物(結晶性の低下した薬剤も含む)には再結晶化や分解などがみられ、経時的安定性に劣る場合が多く、様々な条件下で運搬、保存される医薬品にとって必ずしも望ましい状態ではない。
【0025】
上記ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物の粉砕は、ビカルタミドの結晶性を上記のように変更することを目的としてはおらず、即ち、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化していないのである。
【0026】
「実質的に」とは、粉砕によりビカルタミドの結晶性が著しく低下したり、或いは、転移が起こっていない状態を示す。
【0027】
ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化しないように粉砕するには、例えば、ビカルタミド1.0重量部に対して、クロスポビドン及び/又はコポリビドン0.05〜0.5重量部となるようにこれらを混合し、粉砕すればよい。
【0028】
又、ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物の粉砕には、医薬品製造用に用いられる粉砕方法、粉砕装置であれば特に問題なく採用することができ、粉砕装置としては例えば、ボールミル、ロッドミル、振動ミル等の微粉砕機や、ハンマーミル、ピンミル、カッターミル等の中砕機を挙げることができるが、ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物の粉砕は、固体分散体の製造を目的としているのではないので、ハンマーミル、ピンミル、カッターミル等の中砕機で十分である。
【0029】
従って、本発明によれば、固体分散体を製造するよりもより緩和な条件、例えば数分〜数十分で粉砕を終了することにより、ビカルタミドの溶出性の向上を図ることが可能となる。
【0030】
又、本発明の医薬組成物には、適切な賦形剤等、例えば、1以上の賦形剤、結合剤、崩壊剤、湿潤剤、滑沢剤を含んでよい。この目的のために使用される充填剤、結合剤、崩壊剤、湿潤剤、滑沢剤としては、「医薬品添加物辞典2005」(薬事日報社(株)発行)に記載されているものを挙げることができる。
【0031】
好適な賦形剤には、例えば、乳糖、無水乳糖、結晶セルロース、粉末セルロース、D-マンニトール、ソルビトーール、キシリトール、白糖、フルクトース、コーンスターチ、バレイショデンプン、ヒドロキシプロピルスターチ、無水リン酸カルシウム、メタケイ酸アルミン酸マグネシウム、含水二酸化ケイ素、軽質無水ケイ酸などが含まれる。
【0032】
好適な結合剤には、例えば、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、エチルセルロース、メチルセルロース、ポビドン、ポリビニルアルコールなどが含まれる。
【0033】
好適な崩壊剤には、例えば、クロスカルメロースナトリウム、カルボキシメチルスターチナトリウム、クロスポビドン、カルメロースカルシウム、低置換度ヒドロキシプロピルセルロース、ヒドロキシプロピルスターチ、部分アルファー化デンプンなどが含まれる。
【0034】
好適な湿潤剤には、例えば、ラウリル硫酸ナトリウム、ポリオキシエチレン硬化ヒマシ油、ポロクサマー、ポリソルビタンモノオレエート、グリセリン、マクロゴール、プロピレングリコールなどが含まれる。
【0035】
適切な滑沢剤としてステアリン酸マグネシウム、ステアリン酸、ステアリン酸カルシウム、フマル酸ステアリルナトリウム、ショ糖脂肪酸エステル、含水二酸化ケイ素、タルクなどが含まれる。
【0036】
本発明の本発明の医薬組成物では、その溶出性が有意に改善されていて、例えば、ポリオキシエチレンソルビタンモノオレエート及びラウリル硫酸ナトリウムから選ばれる1種以上の界面活性剤を1.0(W/V)%以上含有する試験液における溶解度は、70%以上である。
【0037】
又、本発明の、ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化しないように粉砕する製造方法により製造される医薬組成物は、このまま細粒剤、顆粒剤としたり、或いは、カプセルに充填するなどしてもよく、更にこれを打錠用粉体として打錠し、錠剤としてもよい。
【0038】
以下に実施例を示す。尚、これらは本発明を限定するものではない。
【0039】
実施例1
ビカルタミド800g、クロスポビドン90g、乳糖820gを混合し、ハンマーミルにて混合粉砕した後、PVP200gを混合して、高速撹拌造粒機にて造粒した。これを乾燥し、乾燥物を42号の篩にて整粒した。この整粒物に、クロスポビドン、カルボキシメチルスターチナトリウムを添加してよく混合した後、ステアリン酸マグネシウムを混合して打錠粉体を製した。この粉体を直径7.5mm、1錠重量205mgにて打錠した。
【0040】
実施例2
ビカルタミド800g、コポリビドン100g、クロスポビドン40g、乳糖820gを混合し、ハンマーミルにて混合粉砕した後、PVP100gを混合して、高速撹拌造粒機にて造粒した。これを乾燥し、乾燥物を42号の篩にて整粒した。この整粒物にカルボキシメチルスターチナトリウムを添加してよく混合した後、ステアリン酸マグネシウムを混合して打錠粉体を製した。この粉体を直径7.5mm 、1錠重量205mgにて打錠した。
【0041】
実施例3
ビカルタミド800g、クロスポビドン240g、結晶セルロース900gを混合し、ハンマーミルにて混合粉砕した後、流動層造粒機にて造粒した。これを乾燥し、乾燥物を30号の篩にて整粒した。この整粒物に、クロスカルメロースナトリウムを添加してよく混合した後、ステアリン酸マグネシウムを混合して打錠粉体を製した。この粉体を直径7.5mm 、1錠重量205mgにて打錠した。
【0042】
比較例1
ビカルタミド800g、乳糖910gを混合し、ハンマーミルにて混合粉砕した後、以下実施例1と同様の方法で錠剤を製した。
【0043】
比較例2
ビカルタミド800g、乳糖960gを混合し、ハンマーミルにて混合粉砕した後、以下実施例2と同様の方法で錠剤を製した。
【0044】
比較例3
ビカルタミド800g、結晶セルロース1140gを混合し、ハンマーミルにて混合粉砕した後、以下実施例3と同様の方法で錠剤を製した。
【0045】
実施例及び比較例について溶出性を比較した結果を図1、2、3に示した。試験は第15改正日本薬局方溶出試験法第2法{パドルの回転数;50回転/分,試験液;日局第2液にTween80を1.0(W/V)%加えたもの(900mL)}により行った。
【0046】
実施例では、比較例に比べていずれも溶出性が上昇しており、本発明の医薬組成物では溶出性の改善が可能であることが確認された。又、上記実施例の記載の通り、有機溶媒は使用されていないので、得られた医薬組成物に有機溶媒が残留する可能性は全くない。
【0047】
尚、この溶出性の改善効果は、ビカルタミドとクロスポビドン及び/又はコポリビドンの混合粉砕物においても、同様に認められた。
【0048】
実施例における各種条件下(25℃・90%RH、40℃・75%RH、60℃、いずれも1ヶ月)における安定性を表1に示す。含量及び溶出の各項目に、保存による変化は認められなかった。
【0049】
【表1】

【産業上の利用可能性】
【0050】
本発明では、有機溶媒を使用する溶媒法によるビカルタミドの固体分散体法に拠ることなく、ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を所定の条件下に粉砕することにより、ビカルタミドの溶出性が有意に改善することに成功しており、製剤中に有機溶媒が残留することがないことから極めて安全な医薬組成物を提供することができる。
【0051】
又、本発明の医薬組成物の製造方法は、有機溶媒を使用しないため、作業環境上からも望ましく、しかもビカルタミドが固体分散体となるまで長時間の混合粉砕が必要ではないため、工程が短時間で済み、安全且つ簡便に実施が可能で効率的である。
【図面の簡単な説明】
【0052】
【図1】実施例1、比較例1の溶出曲線である。
【図2】実施例2、比較例2の溶出曲線である。
【図3】実施例3、比較例3の溶出曲線である。
【特許請求の範囲】
【請求項1】
ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を粉砕してなると共に、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化していないことを特徴とする医薬組成物。
【請求項2】
ビカルタミド1.0重量部に対してクロスポビドン及び/又はコポリビドン0.05〜0.5重量部を含んでなる請求項1に記載の医薬組成物。
【請求項3】
更に、薬学的に許容される他の成分を含んでなる請求項1又は2に記載の医薬組成物。
【請求項4】
ポリオキシエチレンソルビタンモノオレエート及びラウリル硫酸ナトリウムから選ばれる1種以上の界面活性剤を1.0(W/V)%以上含有する試験液におけるビカルタミドの溶解度が、70%以上を示す請求項1乃至3のいずれかに記載の医薬組成物。
【請求項5】
ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化しないように粉砕することを特徴とする医薬組成物用の製造方法。
【請求項6】
ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物が、ビカルタミド1.0重量部に対してクロスポビドン及び/又はコポリビドン0.05〜0.5重量部を含んでなる請求項5に記載の医薬組成物の製造方法。
【請求項7】
請求項1乃至4のいずれかに記載の医薬組成物よりなる打錠用粉体。
【請求項8】
請求項7に記載の打錠用粉体を打錠した錠剤。
【請求項1】
ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を粉砕してなると共に、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化していないことを特徴とする医薬組成物。
【請求項2】
ビカルタミド1.0重量部に対してクロスポビドン及び/又はコポリビドン0.05〜0.5重量部を含んでなる請求項1に記載の医薬組成物。
【請求項3】
更に、薬学的に許容される他の成分を含んでなる請求項1又は2に記載の医薬組成物。
【請求項4】
ポリオキシエチレンソルビタンモノオレエート及びラウリル硫酸ナトリウムから選ばれる1種以上の界面活性剤を1.0(W/V)%以上含有する試験液におけるビカルタミドの溶解度が、70%以上を示す請求項1乃至3のいずれかに記載の医薬組成物。
【請求項5】
ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物を、成分中の前記ビカルタミドの結晶性が粉砕前後で実質的に変化しないように粉砕することを特徴とする医薬組成物用の製造方法。
【請求項6】
ビカルタミドとクロスポビドン及び/又はコポリビドンの混合物が、ビカルタミド1.0重量部に対してクロスポビドン及び/又はコポリビドン0.05〜0.5重量部を含んでなる請求項5に記載の医薬組成物の製造方法。
【請求項7】
請求項1乃至4のいずれかに記載の医薬組成物よりなる打錠用粉体。
【請求項8】
請求項7に記載の打錠用粉体を打錠した錠剤。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2009−29713(P2009−29713A)
【公開日】平成21年2月12日(2009.2.12)
【国際特許分類】
【出願番号】特願2007−192287(P2007−192287)
【出願日】平成19年7月24日(2007.7.24)
【出願人】(393016952)小林化工株式会社 (4)
【Fターム(参考)】
【公開日】平成21年2月12日(2009.2.12)
【国際特許分類】
【出願日】平成19年7月24日(2007.7.24)
【出願人】(393016952)小林化工株式会社 (4)
【Fターム(参考)】
[ Back to top ]

