ビシクロ[3.1.0]ヘキサン誘導体およびその中間体の製造方法関連出願に対する相互参照本出願は、2003年11月7日に出願された米国仮出願第60/518,391号の合衆国法典第35巻(35U.S.C.)第119条(e)に基づく優先権を主張する。
本発明は、mGluRアゴニストとして有用なビシクロ[3.1.0]ヘキサン誘導体の新規な製造方法、およびこの製造方法で得られる新規な中間体に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、代謝型グルタミン酸受容体の調節物質として有用なビシクロ[3.1.0]ヘキサン誘導体の製造方法に関する。また、本発明は、この製造工程で製造される新規な中間体化合物ならびに(+)−(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.1.0]ヘキサン−2,6−ジカルボン酸の塩酸塩およびその多形体に関する。
【背景技術】
【0002】
グルタミン酸等の興奮性アミノ酸は、哺乳類の中枢神経系(CNS)において、長期増強(学習および記憶)、シナプス可塑性の発生、運動制御、呼吸、心血管調節および知覚といった種々の生理的プロセスを調節する。
【0003】
グルタミン酸は、少なくと二つの異なるクラスの受容体を介して作用する。そのクラスの一つは、イオンチャネル型グルタミン酸(iGlu)受容体であって、リガンド依存性イオンチャネルとして機能する。第二のクラスは、Gタンパク質または第二メッセンジャー結合性「代謝型」グルタミン酸(mGluR)受容体である。いずれのクラスの受容体も、興奮性経路に従って正常なシナプス伝達に介在しているようである。これらは、また、発生段階から生涯を通じてシナプス結合の修飾に関与しているようである。
Schoepp, Bockaert, and Sladeczek, Trends in pharmacol. Sci., 11, 508 (1990); McDonald and Johnson, Brain Research Reviews, 15,41 (1990).
【0004】
種々の機能性ビシクロ[3.1.0]ヘキサン誘導体化合物が、mGluRの調節物質として認められている。mGluRの調節物質は、精神疾患、統合失調症、不安神経症および関連疾患、うつ病、躁うつ病およびてんかん、ならびに薬物依存症、認識力障害、アルツハイマー病、ハンチントン舞踏病、パーキンソン病、筋硬直に付随する運動障害、脳虚血、脳障害、脊髄症および頭部外傷といった神経系の疾病への処置または予防のための治療上有用である。たとえば、2001年12月25日発行の米国特許第6,333,428号明細書には、mGluRアゴニストとして、下記式に示される2−アミノ−6−フルオロビシクロ[3.1.0]ヘキサン誘導体およびその薬学上許容される塩が開示されている。
【0005】
【化1】

【0006】
式中、R1およびR2は、それぞれ、
(1)水素;
(2)C1-10アルキル基;
(3)C3-8シクロアルキル基;および
(4)C3-8シクロアルキル−C1-5アルキル基
からなる群から選択される。「428」号特許明細書には、当該発明の化合物が、ラセミ体であってもよく、また、エナンチオマーであってもよいことが記載されている。また、「428」号特許明細書には、下記式で示される新規な中間体が開示されている。
【0007】
【化2】

【0008】
式中、R1は、上記に定義されたものである。
【0009】
2000年12月12日発行の米国特許第6,160,009号明細書には、機能性ビシクロ[3.1.0]ヘキサン誘導体が開示されている。これは、mGluRアゴニストとして治療上有用であり、下記式で示される。
【0010】
【化3】

【0011】
式中、R1およびR2は、ともに、=Oである。
【0012】
1998年5月12日発行の米国特許第5,750,566号明細書には、下記式で示されるmGluRアゴニストが開示されている。
【0013】
【化4】

これは、LY354740として知られる。
【0014】
上記mGluRの調節物質およびその中間体の調製は、上述した特許明細書、Nakazatoら、J. Med. Chem.、2000、43、4893−4909およびWO02/00595(これはEP1 295 862号として英語で発行された。)に開示されている。ところが、開示された合成は、大量生産には適していない点が不利であった。たとえば、「428」号明細書およびNakazatoの文献に開示された合成では、ラセミ中間体の調製が必要となるため、HPLCの使用を伴う複雑な分離の手順が必要となる結果、生産性が低下する。また、通常、公知の合成方法は、化学量論量のPd(OAc)2や(PhSe)2およびCH2N2等の高価で有害な試薬を必要とする。Nakazatoの合成方法は、また、合成の最終工程において、H2SO4を用い、高温(145℃)、5日間という厳しい加水分解を必要とするため、収率が低い。また、この方法は、ヒダントイン誘導体の前駆体から最終製品を単離するという困難な操作を必要とする。
【0015】
もちろん、米国特許第6,333,428号明細書、第6,160,009号明細書および5,570,566明細書に開示されたmGluR調節物質は、治療薬として有用であるから、これらの化合物の製造方法において、容易にスケールアップでき、費用効果があって安全な試薬を用いることができ、これにより、実用化して大量生産できる方法の開発が必要とされている。
【0016】
出願人は、一連の鏡像異性的に純粋な機能性ビシクロ[3.1.0]ヘキサン誘導体の新規な合成方法および一連の鏡像異性的に純粋な中間体化合物を発見した。
【非特許文献1】Schoepp, Bockaert, and Sladeczek, Trends in 11,508 (1990); McDonald and Johnson, Brain Research Reviews, 15,41 (1990).
【非特許文献2】Nakazatoら、J. Med. Chem.、2000、43、4893−4909
【非特許文献3】Dominguezら、Tetrahedron:Asymmetry、1997、8、511−514
【非特許文献4】Partidgeら、Org.Synth.1985、83、44
【特許文献1】米国特許第6,333,428号明細書
【特許文献2】米国特許第6,160,009号明細書
【特許文献3】米国特許第5,750,566号明細書
【特許文献4】国際公開第2002/00595号パンフレット
【発明の開示】
【0017】
本発明は、式(I)で示される機能性ビシクロ[3.1.0]ヘキサン誘導体mGluR調節物質類およびその薬学的に許容される塩の新規な合成方法に関する。
【0018】
【化5】

【0019】
式中、R1およびR2は、独立して、
(1)水素、
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)−(CH2)n−フェニル基
からなる群から選択される。
ただし、nは1または2であり、前記アルキル基、前記シクロアルキル基および前記フェニル基は、未置換または一以上のハロゲン、水酸基、C1-6アルキル基もしくはC1-6アルコキシ基で置換されている。
Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。
また、Qは、−CH2−または−C(=O)−である。
【0020】
また、本発明は、式(II)に示される化合物およびその塩の新規な製造方法に関する。
【0021】
【化6】

【0022】
式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは、
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、当該C1-10アルキル基およびC3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
RgおよびRhは、水素、C1-10アルキル基、およびC3-8シクロアルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【0023】
【化7】

【0024】
式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
Rdは、水素またはC1-10アルキル基である。
Xは、
(1)ハロゲン、および
(2)水素
からなる群から選択される。
また、R4は、
(1)水素
(2)C1-10アルキル基、
(3)Si−(R9)(R10)(R11)、
(4)C(=O)−R12、
(5)CH2−フェニル基、ただし、前記フェニル基は未置換またはニトロ基、ハロゲン、C1-10アルキル基およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されている。
(6)(CH2)p−O−(CH2)q−X’−R14、および
(7)テトラヒドロピラニル基
からなる群から選択される。
ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基であり、R14は、
(a)水素および
(b)C1-10アルキル基
からなる群から選択される。
また、pは1または2であり、
qは1から10の整数であり、
X’はOまたは単結合である。
【0025】
また、本発明は、式(XII)に示される化合物またはそのエナンチオマー(XII’)およびその塩類の新規な製造方法に関する。
【0026】
【化8】

【0027】
【化9】

【0028】
式中、R3およびXの定義は上記のとおりである。
【0029】
式(II)、(XII)および(XII’)に示される化合物は、式(I)で示されるmGluR調節物質の合成において調製される中間体である。化合物(XII)または(XII’)を用いて式(I)に示したmGluR調節物質を形成する工程は、上述した「566」号、「428」号および「009」号特許明細書、ならびにNakazatoら、J. Med. Chem. 2000、43、4893−4909に開示されている。本発明は、また、本発明の合成中に調製される新規な中間体に関する。
【発明を実施するための最良の形態】
【0030】
本発明は、式(I)に示される機能性ビシクロ[3.1.0]ヘキサン誘導体およびその薬学的に許容される塩の製造方法を対象とする。
【0031】
【化10】

【0032】
式中、R1およびR2は、独立して、
(1)水素、
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)(CH2)n−フェニル基
からなる群から選択される。
ただし、nは1または2であり、当該アルキル基、当該シクロアルキル基および当該フェニル基は、未置換または一以上のハロゲン、水酸基、C1-6アルキル基もしくはC1-6アルコキシ基で置換されている。
Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。
また、Qは、−CH2−または−C(=O)−である。
【0033】
本発明の一実施形態は、式(IA)に示される化合物の製造方法を対象とする。
【0034】
【化11】

【0035】
式中、X、R1およびR2は、上記の定義のとおりである。
【0036】
本発明の実施形態は、
式(II)に示される中間体化合物を酸化して、式(IV)に示される化合物を形成する工程、
式(IV)に示される化合物の水酸基を脱保護して式(V)に示される化合物を形成する工程、
式(V)に示される化合物と式(VI)に示される化合物とを反応させて、式(VII)に示される化合物を得る工程、
を含む。
【0037】
【化12】

【0038】
式中、X、R3およびR4は、上記の定義のとおりである。
【0039】
【化13】

【0040】
【化14】

【0041】
【化15】

【0042】
式中、R5およびR6は、独立して、
(1)水素、
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)(CH2)m−フェニル基
からなる群から選択される。
ただし、mは0、1または2である。
R7は、
(1)水素、および
(2)Si−(R9)(R10)(R11)、ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基である、
からなる群から選択される。
【0043】
【化16】

【0044】
その後、式(VII)に示した化合物を酸化して式(VIII)に示される化合物を得る。
【0045】
【化17】

【0046】
式(VIII)に示した化合物は、式(IX)に示される化合物に変換される。
【0047】
【化18】

【0048】
そして、式(IX)に示した化合物を、目的とする式(IA)に示される化合物に変換する。
【0049】
【化19】

【0050】
式中、X、R1およびR2は、上記の定義通りである。
【0051】
式(IA)に示した化合物の製造方法の好ましい実施形態においては、Xはフルオロ基である。他の好ましい実施形態においては、Xは水素である。
【0052】
式(IA)に示した化合物の製造方法の好ましい実施形態においては、R1およびR2が水素である。
【0053】
式(IA)に示した化合物の製造方法の好ましい実施形態においては、R3がメトキシ基、エトキシ基、またはベンジルオキシ基である。
【0054】
式(IA)に示した化合物の製造方法の好ましい実施形態においては、R4基は、TBS、TMSおよびTESである。また、R7基は、好ましくはTMSである。
【0055】
式(IA)に示した化合物の製造方法の好ましい実施形態において、R5およびR6は、メチル基およびフェニル基からなる群から選択される。また、R5=R6であることが好ましい。
【0056】
式(IA)に示した化合物の製造方法の好ましい実施形態において、式(IX)に示した化合物を式(I)に示した化合物に変換する工程は、式(IX)に示した化合物を加水分解する工程を含む。
【0057】
また、本発明は、式(VII)、(VIII)および(IX)に示される新規な中間体化合物およびその塩を対象とする。
【0058】
【化20】

【0059】
これらは、式(I)に示したmGluR調節物質の合成過程で調製される。化合物(VII)、(VIII)および(IX)において、R3、R5、R6およびXは上記の定義通りである。
【0060】
また、本発明は、式(II)に示す中間体化合物およびその塩の製造工程を対象とする。
【0061】
【化21】

【0062】
式中、R3、XおよびR4の定義は上記の通りである。この製造方法において、式(X)に示す化合物がエポキシ化される。エポキシ化は、たとえば、tert−ブチルヒドロペルオキシド等の過酸化物あるいは他の酸化剤(たとえば、過安息香酸や過酢酸等の過酸)と反応させることにより行われ、好ましくはVO(acac)2等の金属触媒存在下で行われる。
【0063】
【化22】

【0064】
式中、Xは水素であり、R3は前述の定義通りである。
【0065】
化合物(X)の水酸基を、その後、たとえばTBSまたはTMSで保護し、式(XI)に示す化合物としてもよい
【0066】
【化23】

【0067】
式中、Xは水素であり、R4は前述の定義通りである。式(XI)に示した化合物を、その後フッ化してもよい(式中、Xがフッ素となる。)。または、式(X)に示す化合物をまずフッ化した後(式中、Xがフッ素となる。)、フッ化化合物を上述のようにエポキシ化してもよい。
【0068】
あるいは、ハロゲン源との反応により得られるハロヒドリンを介してエポキシ誘導体を形成してもよい。たとえば、化合物(X)をN−ブロモスクシンイミドと反応させた後、塩基処理してもよい。その後、エポキシド生成物を単離する。
【0069】
そして、保護されたエポキシド誘導体(XI)を、ルイス酸の存在下で適当な塩基と反応させて、式(II)に示される化合物を得る。
【0070】
【化24】

【0071】
式中、X、R3およびR4は前述した定義通りである。その後、化合物(II)を酸化して化合物(IV)を得ることもできる。
【0072】
【化25】

【0073】
得られた化合物は、上述した製造方法の手順により、式(IA)に示した化合物に変換される。
【0074】
あるいは、式(IV)に示す化合物を、従来技術に記載の方法により変換して式(IA)に示す化合物としてもよい。たとえば、Nakazato、J. Med. Chem.、2000、43、4893−4909には、p.4898のスキーム5に、式(IV)に示した化合物を用いて式(IA)に示した化合物を形成することが記載されている。Nakazatoが教示する方法においては、ジチオケタールを形成した後、ヒダントイン誘導体を形成することが必要となる。
【0075】
米国特許第6,160,009号明細書には、第8から13段に、式(IV)に示した化合物を用いて式(IA)に示した化合物を形成することが記載されている。この反応は、ヒダントイン誘導体を経て進行する。
【0076】
式(II)に示した化合物の製造方法の好ましい実施形態において、R3は、メトキシ基、エトキシ基またはベンジルオキシ基である。
【0077】
式(II)に示した化合物の製造方法の好ましい実施形態において、Xはフルオロ基である。他の好ましい実施形態において、Xは水素である。
【0078】
式(II)に示した化合物の製造方法において、R4基は、好ましくはTBS、TMSおよびTESである。
【0079】
この製造方法の他の好ましい実施形態において、化合物(II)を酸化する工程は、化合物(II)をRuCl3および酸化剤に接触させる工程を含む。好ましい酸化剤として、漂白剤が挙げられる。好ましい漂白剤は、NaClOである。
【0080】
また、本発明は、以下に示される式(XA)、(XI)、(IVA)および(II)で示される新規な中間体化合物を対象とする。
【0081】
【化26】

【0082】
化合物(XA)、(XI)、(IVA)および(II)において、R3、XおよびR4は上述の定義通りである。
【0083】
また、本発明は、中間体である式(XII)のエノン化合物およびそのエナンチオマー(XII’)およびそれらの塩の製造方法を対象とする。
【0084】
【化27】

【0085】
【化28】

【0086】
式中、R3およびXは、上述した定義の通りである。
【0087】
式(XII)に示した化合物の製造方法の実施形態において、式(II)に示される化合物は、脱離基R8を有する下記式(XIII)で示される化合物の形成反応に供される。
【0088】
【化29】

【0089】
式中、X、R3およびR4は、上述した定義の通りである。
【0090】
【化30】

【0091】
式中、R8は、
(1)ハロゲン、および
(2)O−SO2−R12、ただし、R12は、
(a)C1-10アルキル基、
(b)C1-10パーフルオロアルキル基または
(c)未置換またはニトロ基、ハロゲン、C1-10アルキル基およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されたフェニル基
からなる群から選択される。
【0092】
その後、R4基を除去して下記(XIV)のヒドロキシエステル誘導体を得る。
【0093】
【化31】

【0094】
そして、これを酸化し目的の式(XII)に示される[3.1.0]−二環式−α,β不飽和ケトンを得る。
【0095】
【化32】

【0096】
また、式(XII’)に示した化合物の製造方法の実施形態においては、式(II)に示した化合物を酸化して式(IV)に示される化合物を形成する。
【0097】
【化33】

式中、X、R3およびR4は、上述した定義の通りである。その後、化合物(IV)を、脱離反応、たとえばDBU等の塩基との反応に供し、式(XII’)に示す化合物を得る。
【0098】
【化34】

【0099】
この化合物は、式(XII)に示した化合物に対応するエナンチオマーである。
【0100】
式(XII)または式(XII’)に示したエノン化合物を、従来技術において知られた方法により式(I)に示した化合物に変換してもよい。たとえば、Nakazato、J.Med.Chem.、2000、43、4893−4909には、式(XII)に示した化合物を用いて式(IA)に示した化合物を形成することが、4898ページのスキーム5に記載されている。
【0101】
また、米国特許第5.750,566号明細書には、式(XII)に示した化合物を用いて、式(I)のQがCH2である化合物を形成することが、第12段のスキームIVに記載されている。
【0102】
また、Dominguezら、Tetrahedron:Asymmetry、1997、8、511−514には、式(XII)に示した化合物を用いて式(I)ののQがCH2である化合物を形成することが、513ページのスキーム2に記載されている。この製造方法は、ヒダントイン誘導体を形成する必要がある。
【0103】
式(XII)および式(XII’)に示した化合物の製造方法の好ましい実施形態において、R3は、メトキシ基、エトキシ基またはベンジルオキシ基である。
【0104】
式(XII)および式(XII’)に示した化合物の製造方法の好ましい実施形態において、Xはフルオロ基である。他の好ましい実施形態においては、Xは水素である。
【0105】
式(XII)および式(XII’)に示した化合物の製造方法において、保護基R4は、好ましくはTBS、TMSおよびTESである。
【0106】
式(XII)および式(XII’)に示した化合物の製造方法において、R8基は、好ましくはO−トシル基(パラトルエンスルホニル基)、O−メシル基およびO−トリフレート基である。
【0107】
また、本発明は、式(I)に示した化合物の塩酸塩を対象とする。好ましい実施形態において、塩酸塩は、式(I)においてXがフルオロ基であって、R1およびR2がいずれも水素である化合物(I’)の塩である。
【0108】
【化35】

【0109】
この化合物は、(+)−(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.1.0]ヘキサン−2,6−ジカルボン酸である。また、本発明は、化合物(I’)塩酸塩の新規な結晶多形体を対象とする。
【0110】
定義
ここで、「Strecker合成反応」または「Strecker反応」とは、有機合成の当業者に、アルファアミノニトリルを調製するための反応として知られる反応のことをいう。
【0111】
ここで、「実質的に鏡像異性的に純粋な形で」とは、目的とするエナンチオマーが、目的としないエナンチオマーに対して、少なくとも50%e/e(鏡像体過剰率)存在することを意味する。
【0112】
ここで、「Lewis酸」とは、電子を受容できる化合物のことをいう。
【0113】
ここで、「アリール基」とは、多価不飽和芳香族炭化水素置換基を指し、単環または多環(好ましくは単環から3環)とすることができ、多環中の環は融合していても共有結合していてもよい。アリール基は特に限定されないが、たとえば、フェニル基、ナフチル基およびビフェニル基が挙げられる。
【0114】
ここで、「ヘテロアリール基」とは、環骨格中に少なくとも一つのヘテロ原子(窒素、酸素または硫黄)を有する多価不飽和芳香環のことをいう。ヘテロアリール基は、単環または多環(好ましくは単環から3環)とすることができ、多環中の環は融合していても共有結合していてもよい。ヘテロアリール基は特に限定されないが、たとえば、ピロール、ピラゾール、イミダゾール、ピリジン、ピラジン、ピリミジン、フラン、ピラン、オキサゾール、イソオキサゾール、プリン、ベンズイミダゾール、キノリン、イソキノリン、インドール等が挙げられる。
【0115】
ここで定義されるヘテロアリール基が置換されている場合、置換基は、ヘテロアリール基の環を構成する炭素原子に結合していてもよいし、また、環を構成するヘテロ原子(窒素、酸素または硫黄)に結合していてもよく、置換可能な原子価を有する。置換基は、好ましくは環を構成する炭素原子に結合する。
【0116】
ここで、「ハロゲン」とは、フッ素、塩素および臭素である。好ましいハロゲンとして、フッ素が挙げられる。
【0117】
ここで、「アルキル基」とは、それ自身または他の置換基の一部として、直鎖状または分岐鎖を有する炭化水素ラジカルを意味し、指定された数の炭素原子を有する(たとえば、C1-10アルキル基とは、1から10の炭素原子を有することを意味する。)。アルキル基の例として、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、t−ブチル基、イソブチル基、sec−ブチル基、ペンチル基、ヘキシル基等が挙げられる。
【0118】
ここで、「アルコキシ基」とは、それ自身または他の置換基の一部として、O−アルキル基を意味する。ここで、アルキル基は上記定義通りであり、直鎖状または分岐鎖を有するアルキル基を含む。
【0119】
ここで、「シクロアルキル基」とは、それ自身または他の置換基の一部として、飽和環状炭化水素ラジカルを意味し、指定された数の炭素原子(たとえば、C3-8シクロアルキルとは、3から8の炭素原子を有するシクロアルキル基を意味する。)を有する。
【0120】
ここで、「薬学的に許容される」とは、人間に投与した際に「一般的に安全とみなされている」分子群および組成物であって、たとえば、生理的に許容され、通常、アレルギーまたは同様の有害な反応を生じさせないことをいう。こうした反応として、たとえば異常亢進、めまい等が挙げられる。「薬学的に許容される」とは、好ましくは、連邦規制機関もしくは州政府で認可されているか、または、動物への使用、さらに具体的には人間への使用について米国薬局方もしくは他の公認の薬局方に掲載されたことをいう。
【0121】
本発明の製造方法の一実施形態は、下記スキーム1に示される。
【0122】
【化36】

【0123】
ここで、R1、R2、R3、R4、R5、R6、R7、R8、およびXは、前述の定義通りである。
【0124】
光学活性なトランスヒドロキシエステル1は、Partidgeら、Org.Synth.1985、83、44(Tolstikovら、J.Org.Chem.USSR、1989、25(1.2)および1990、26(7.1、1274)も参照のこと。)の教示により得られる。トランスヒドロキシエステル1は、好ましくは90%e/eより大きく、さらに好ましくは95%e/eより大きく、より一層好ましくは96%e/eより大きい。
【0125】
二級アルコールを保護せずにトランスヒドロキシエステル1をフッ化し、化合物2を得ることができる。
【0126】
【化37】

【0127】
所望のフッ素化を行う方法として、強塩基存在下、テトラヒドロフラン等の適当な溶媒中でN−フルオロベンゼンスルホンイミド(NFSI)等のフッ素化剤と反応させる方法が挙げられる。この反応は−65℃より低温で行うことが好ましく、より好ましくは−75℃より低温、最も好ましくは−78℃より低温である。共塩基として適当なものとして、たとえばリチウムジイソプロピルアミド(LDA)、リチウムテトラメチルピペラジド、リチウムヘキサメチルジシラジド(LHMDS)、または対応するカリウムもしくはナトリウム塩が挙げられる。
【0128】
続いて、トルエン中で、過酸化物誘導体(たとえば、tert−ブチルヒドロペルオキシド)等の酸化剤および触媒(たとえば、触媒量のバナジルアセチルアセトネート(VO(acac)2)と反応させることにより、2の立体選択的なエポキシ化を行ってもよい。この反応は、0℃程度から40℃程度で行うことが好ましい。
【0129】
【化38】

【0130】
酸化剤として、他に、メタ−クロロ過安息香酸(mCPBA)が挙げられる。エポキシド3がトランス異性体として得られる。
【0131】
また、トランス−ヒドロキシエステル1をまず立体選択的なエポキシ反応に供し、得られたエポキシド2’をフッ化して化合物3を得てもよい。
【0132】
【化39】

【0133】
また、エポキシ化は、1(またはフッ化化合物2)を、適当な溶媒(たとえばDMSOと水の混合物)中でNBSやNIS等のハロゲン化剤処理することにより行ってもよい。その後、化合物1は、ハロヒドリン誘導体を形成する。この化合物は、塩基(たとえばDBU)とともに結晶化し、エポキシドを形成する。
【0134】
保護試薬R4としてたとえばtert−ブチルジメチルシリルクロライド(TBSCl)等のシリル保護試薬を用い、イミダゾールおよびDMF中等の適切な条件下で3の水酸基を保護することにより、以下に示す保護されたエポキシド化合物4が製造される。
【0135】
【化40】

【0136】
その後、保護されたエポキシド4を、エポキシドの開環を伴う分子内シクロプロパン化反応に供してもよい。この反応はEt3Al等のルイス酸の存在下で塩基を添加することにより進行する。また、−50℃程度で反応させることが好ましい。
【0137】
好ましい実施形態においては、まず、化合物4をEt3Alで処理した後、LiHMDSを滴下する。反応は、−20℃から−80℃の温度で0.5から6時間進行させる。好ましい反応時間は、1時間程度である。また、好ましい反応温度は、−60℃である。この反応に用いられる他のルイス酸として、RTi(OR)3、R2Ti(OR)2、RAlX2またはR2AlXが挙げられる。ここで、Xはハロゲンまたは無機ラジカルであって、Rはそれぞれ炭化水素基である。ルイス酸として、たとえば、Al(OiPr)3、Ti(OiPr)4、BF3エーテル、Et2Zn、Et3AlおよびSc(OTf)3が挙げられる。化合物5は所望の立体異性体として得られる。
【0138】
【化41】

【0139】
この結果生じた未保護のアルコールを酸化し、保護基を除去することにより、二環式ヒドロキシケトン7(化合物II)が得られる。好ましい酸化剤としては、試薬用の次亜塩素酸ナトリウムまたは市販の漂白剤が挙げられる。この反応は、アセトニトリル中、触媒量のRuCl3および酢酸(1.5当量)の存在下、0℃で行うことができる。そして、過剰の次亜塩素酸ナトリウムを(たとえばイソプロピルアルコールとともに反応停止(クエンチ)することにより)除去する。アセトニトリル溶液に酸(たとえば、1M HClを20mol%)を添加することにより、保護基のR4を開裂させる。
【0140】
【化42】

【0141】
また、化合物7をジオール誘導体と反応させることにより保護し、ケタール8としてもよい。R7として、好ましくはTMSが挙げられる。
【0142】
【化43】

【0143】
この反応は、酸(たとえば、0.1当量)の存在下、0℃程度から−10℃程度において進行する。好ましい酸として、TfOHまたはTfOTMSが挙げられる。
【0144】
8の二級アルコールを酸化することにより、ケトン9が得られる。
【0145】
【化44】

【0146】
酸化反応は、Swern酸化等どのような酸化条件で行ってもよい。
また、酸化を、RuCl3(0.5mol%)の存在下、NaClOを含むアセトニトリルおよび酢酸中、0℃から室温で行ってもよい。
【0147】
そして、化合物9をアンモニアとStrecker反応させる。この反応は、アンモニアを含むアルコール溶媒(たとえばメタノール)中、室温で進行させることができる。
【0148】
【化45】

【0149】
その後、TMSCNを−10℃から0℃で添加する。TMSCNは、酸の存在下でKCN/NaCNに置換することができる。この反応の促進に、チタンイソプロポキシド(Ti(OiPr)4)等のチタン化合物を用いてもよい。この反応により、目的とするアミノニトリル10が高いジアステレオ選択性で得られる。
【0150】
そして、化合物10を加水分解し、所望の2−アミノ−6−フルオロビシクロ[3.1.0]ヘキサン(化合物11)を得る。
【0151】
【化46】

【0152】
加水分解反応には酢酸と8M HClの1:3混合物を用い、75℃で5時間進行させる。また、60%のH2SO4の存在下、100℃程度で2時間程度反応させてもよい。または、酢酸/H2SO4による処理を60℃で2時間程度行ってもよい。
【0153】
その後、当業者に知られた方法により、目的とする化合物11を塩酸塩として単離する。
【0154】
本発明の製造方法の他の実施形態は、下記スキーム2に示される。
【0155】
【化47】

【0156】
式中、X、R3、R4およびR8は、前述した定義の通りである。
【0157】
スキーム2中、光学活性なトランス−ヒドロキシエステル12は、スキーム1の説明において上述した方法により得られる。12は、ジアステレオ選択的にエポキシ化されて、エポキシド13となる。13の水酸基を保護することにより、14が得られる。そして、14をルイス酸で処理した後、塩基処理することにより、ビシクロ[3.1.0]化合物15が製造される。12のエナンチオマーは、Partridgeら、Org.Synth、1985、83、44に開示されており、これをエナンチオマー13、14および15の合成に適用できる。
【0158】
[3.1.0]二環式ジオールのモノ保護体15(スキーム1の5と同一)は、[3.1.0]二環式α,β−不飽和ケトンに変換される。このスキームにおいて、アルコール15の水酸基は、脱離基R8に変換され、保護基R4が除去されて、ヒドロキシエステル17が得られる。R8脱離基に適したものとして、スルホン酸(たとえば、パラトルエンスルホン酸)およびハライドが挙げられる。R8脱離基の開裂により17が酸化されて、[3.1.0]二環式α,β不飽和ケトン18が得られる。この化合物は、mGluRアゴニスト19(スキーム1の11と同一)および20の合成に用いられる。この合成は、米国特許第5,750,566号明細書、米国特許第6,333,428号明細書、米国特許第6,160,009号明細書およびNakazatoら、J.Med.Chem.、2000、43、4893−4909の教示によって行われる。
【0159】
本発明の合成方法の他の実施形態は、下記スキーム3に示される。
【0160】
【化48】

【0161】
式中、X、R3およびR4の定義は前述した通りである。スキーム3には、エノン18(スキーム2)のエナンチオマーの合成が示されている。
【0162】
上記化学構造は、鏡像異性的に純粋なエナンチオマーであってもよいし、エナンチオマーの混合物であってもよい。
【0163】
ここで、出発材料および試薬は市販品、文献で公知のもの、類似化合物に関する文献記載の方法により調製されたもののいずれであってもよい。反応および反応の結果得られた生成物の精製は、当業者に知られた方法による。精製方法としては、結晶化、蒸留、順相または逆相クロマトグラフィーが挙げられる。
【実施例】
【0164】
以下、さらに具体的な実施例を示すが、本発明の開示はこれに限定されない。実施例1〜10に、スキーム1の方法を示す。実施例11〜15に、スキーム2の方法を示す。また、実施例16および17に、スキーム3の方法を示す。
【0165】
(実施例1)
メチル フルオロ[(1R,5R)−5−ヒドロキシシクロペンタ−2−エン−1−イル]アセテート2
【0166】
【化49】

【0167】
ジイソプロピルアミン(10.8mL、76.8mmol)のTHF(28mL)溶液に、ブチルリチウム(28.2mL、70.4mmol、2.5Mヘキサン溶液)を40分間にわたって添加した。その間、内部の温度を0℃から5℃の間に保った。得られた溶液を0℃で3分間攪拌した後、ドライアイス−アセトン浴により−78℃に冷却した。エステル1(5.00g、32.0mmol)のTHF(41.3mL)溶液をLDA溶液に45分にわたって滴下した。その間、内部温度を−73℃以下に保持した。得られた溶液を、−78℃で20分間攪拌し、オレンジ(または濃いオレンジ)色のジアニオン溶液を形成した。別のフラスコに、N−フルオロベンゼンスルホンイミド(14.1g、44.8mmol)およびTHF(62mL)を入れ、液体窒素−アセトン浴中で−96℃に冷却した。ジアニオン溶液を添加漏斗でフッ素化試薬の懸濁液に1時間かけて加えた。その間、内部の温度を−95℃付近に保った。漏斗およびフラスコを2.5mLのTHFで洗い流して反応混合物中に加えた。得られた混合物を−96℃で1時間攪拌した後、−80℃に30分間かけて昇温した。酢酸(11mL)のTHF(5mL)溶液を7分間かけてゆっくりと添加した。MTBE(100mL)を添加した後、混合物を常温まで温めた。残存する固形物を濾過して除去し、MTBE(70mL×6)で充分に洗浄した。濾液と洗浄液を合わせて再度濾過し、HPLCで分析した。化学収率は、86%と測定された。シリカゲル(30g)を詰めたショートカラムに濾液を通し、カラムをMTBE(200mL)で洗浄した。これらのMTBE溶液を合わせ、減圧濃縮した。残渣をEtOAc(250mL)に溶かし、飽和NaHCO3水溶液(170mL)で洗浄した。水層をEtOAc(60mL×2)で逆抽出し、これらの有機溶液を合わせて塩水(60mL)で洗浄した後、Na2SO4で乾燥させた。溶媒を蒸発させて、粗製エステルを得、これをバルブ−トゥー−バルブ蒸留(1.6Torr)に供し、黄色の油状物としてエステルを得た。さらにフラッシュシリカゲルカラムクロマトグラフィーにより、無色の油状物として分析的に高純度の試料を得た。
【0168】
【数1】

【0169】
(実施例2)
メチル フルオロ[(1R,2S,3R,5S)−3−ヒドロキシ−6−オキサビシクロ[3.1.0]ヘキサ−2−イル]アセテート3
【0170】
【化50】

【0171】
オレフィン2(1.92kg、11.0mol)のトルエン(4.83L)溶液に、バナジルアセチルアセトナート(VO(acac)2、58.3g、0.22mol)を0℃にて加えた。これにTBHP溶液(デカン中5.7M、38.6mL)を0℃で加えた後、得られた懸濁液を14℃に昇温させた。さらにTBHP溶液(デカン中5.7M、4.36L)を反応混合物に50分にわたってゆっくりと追加した。その間、バッチ温度を14℃から28℃の間に保った。得られた懸濁液をさらに2時間攪拌した後、40℃で8時間加熱した。Na2S2O3水溶液(2.95kgNa2S2O3および4.71kgH2O)を0℃でゆっくりと添加して、過剰のTBHPをクエンチした。得られた混合物を20℃で1.5時間攪拌した。試験紙により過酸化物の消失を確認した。水層を分離し、EtOAc(9.42L×2)で抽出した。有機層を合わせて塩水(6.33L)にて洗浄した。塩水層をEtOAc(3.42L×4)にて逆抽出した。有機溶液を合わせてGC分析を行ったところ、生成物3の存在が示された。合わせた有機溶液を濃縮し、得られた残渣を、フィルターポット中、シリカゲルクロマトグラフィーにより精製した(最初にヘキサン/EtOAc(4/1)で抽出した後、純EtOAcで抽出した。)。フラッシュシリカゲルカラムクロマトグラフィー(ヘキサン/MTBE)の後、再結晶(EtOAc)することにより、分析的に高純度の試料を淡黄色結晶として得た。
【0172】
【数2】

【0173】
(実施例2A)
メチル[(1R,2R,3R,5S)−3−ヒドロキシ−6−オキサビシクロ[3.1.0]ヘキサ−2−イル]アセテート
【0174】
【化51】

【0175】
オレフィン2’(50.0mg、0.320mmol)のウエットDMSO(1.2mLDMSO中、6.4μL H2O)溶液に、室温でNBS(68.4mg、0.384mmol)を添加した。これを室温で4.5時間攪拌した後、さらに10mgのNBSを添加した。反応物を室温で2時間攪拌し、EtOAcで希釈し、H2Oで洗浄した。水層をEtOAc(2回)で抽出し、有機層を合わせてNa2SO4で乾燥させた。減圧下、溶媒を除去して得られた残渣をCH2Cl2(1.2mL)中に回収した。この溶液にDBU(57.4μL、0.384mmol)を添加し、室温で18時間攪拌した。溶媒を蒸発させて、残渣をフラッシュシリカゲルカラムクロマトグラフィーで精製した。これにより、エポキシド3’が、クロマトグラフィーでは分離できないジアステレオマー混合物として得られた。主要な異性体のスペクトルデータは、以下の通りである。
【0176】
【数3】

【0177】
同様の反応条件で、以下のエポキシドを調製した。
【化52】

【0178】
(実施例3)
メチル((1R,2R,3R,5S)−3−{[tert−ブチル(ジメチル)シリル]オキシ}−6−オキサビシクロ[3.1.0]ヘキサ−2−イル)フルオロアセテート4
【0179】
【化53】

【0180】
エポキシアルコール3(1.60kg、8.40mol)およびDMF(3.40L)の溶液に、イミダゾール(1.26kg、18.5mol)を10℃で加えた。この反応混合物のバッチ温度を8℃以下に保ち、TBSCl(1.52kg、10.1mol)を添加した。得られた溶液を5℃で10分間攪拌した後、30分かけて20℃に昇温させ、同温度で2時間攪拌した。出発物質のアルコールの消費をGCによりモニタし、反応混合物を冷トルエン(17.5L、5℃)で希釈した。反応混合物をH2O(5.67L)、飽和NaHCO3水溶液(5.67L)、H2O(5.67L×2)および塩水(5.67L)で洗浄した。有機溶液を分析したところ、4の存在が示された。溶液を濃縮することにより、4が黄色の液体として得られた。これを、さらに精製することなく、次のステップに用いた。フラッシュシリカゲルカラムクロマトグラフィー(ヘキサン/MTBE)により、分析的に高純度の試料が無色結晶として得られた。
【0181】
【数4】

【0182】
(実施例4)
メチル(1R,2R,4S,5S,6R)−2−{[tert−ブチル(ジメチル)シリル]オキシ}−6−フルオロ−4−ヒドロキシビシクロ[3.1.0]ヘキサン−6−カルボキシレート5
【0183】
【化54】

【0184】
エポキシドTBS−エーテル4(分析値 質量1.60kg、5.24mol)のTHF(16.1L)溶液に、バッチ温度を−60℃に保ちながら、Et3Al溶液(ヘキサン中1.0M、6.81L、6.81mol)を1時間かけて添加し、得られた溶液を−60℃で20分間攪拌した。LHMDS溶液(ヘキサン中1.0M、7.86L、7.86mol)を、バッチ温度を−60℃以下に保ちながら、反応混合物に1時間かけて添加し、−60℃で反応物を熟成させた。反応の進行をGCでモニタした。エポキシドが完全に消費された(6時間)後、クエン酸水溶液(3M、10.5L)を1時間かけて添加した。その間、バッチ温度を−50℃以下に保持した。MTBE(12.4L)を添加した後、得られた懸濁液を攪拌しながら徐々に昇温させて15℃とした。この混合物にH2O(4.93L)を添加し、二相溶液とした。有機層を分離し、飽和NaHCO3水溶液(11.1L、その後5.6L)で2回洗浄した。有機溶液をGC分析したところ、化合物5の存在が示された。有機層を濃縮することにより、粗製アルコールが黄色油状物として得られ、これをさらに精製することなく次の反応に用いた。
また、フラッシュシリカゲルカラムクロマトグラフィーにより、分析的に高純度の試料が無色のアモルファス状の固形物として得られた。
【0185】
【数5】

【0186】
(実施例5)
メチル(1R,2R,5S,6S)−2−{[tert−ブチル(ジメチル)シリル]オキシ}−6−フルオロ−4−オキソビシクロ[3.1.0]ヘキサン−6−カルボキシレート6
【0187】
【化55】

【0188】
二環式モノ−TBS−ジオール5(2.08kg、6.83mol)のアセトニトリル(8.0L)溶液に、酢酸(0.70L)および水(2.5L)を−5℃で添加した後、さらにRuCl3水和物(14.20g)を添加した。混合物に、次亜塩素酸ナトリウム水溶液(〜13%、7.0L)を2時間かけて添加した。その間、0℃付近の温度に保った。二環式モノ−TBS−ジオール5がすべて消失するまで、得られた混合物を0℃でさらに1時間攪拌した。二環式モノ−TBS−ジオール5の消失は、TLCおよびNMRで測定した。イソプロパノール(0.70L)を添加して0℃で15分熟成することにより、過剰の次亜塩素酸水溶液を分解した。二つの層を切り分けて水層を捨てた。この溶液をさらに処理せずに次の反応に用いた。また、フラッシュシリカゲルカラムクロマトグラフィー(MTBE/ヘキサン)により、分析的に高純度の試料が無色の結晶として得られた。
【0189】
【数6】

【0190】
(実施例6)
メチル(1R,2R,5S,6S)−6−フルオロ−2−ヒドロキシ−4−オキソビシクロ[3.1.0]ヘキサン−6−カルボキシレート7
【0191】
【化56】

【0192】
上述したTBS−ケトン6(6.83mol)を含む有機層を22℃に温め、1MHCl(1.37L)を添加した。すべてのTBS基が除去されるまで、この混合物を22℃から24℃で3.5時間攪拌した。得られた混合物に飽和炭酸水素ナトリウム溶液(4.8L)を添加した。混合物を15分間攪拌し、イソプロピルアセテート(20L)で希釈した後、有機層を分離した。水層をイソプロピルアセテート(6L)で逆抽出した。有機溶液を合わせて濃縮乾燥させて、得られた化合物をフィルターポット中でのシリカゲルクロマトグラフィー(まず30%MTBEヘキサン溶液で溶出した後、MTBE単独で溶出)で精製し、オフホワイトの結晶として化合物7を得た。フラッシュシリカゲルカラムを行うことにより、分析的に高純度の試料を無色の結晶として得た。
【0193】
【数7】

【0194】
(実施例6A)
メチル(1S,2R,5R,6R)−2−ヒドロキシ−4−オキソビシクロ[3.1.0]ヘキサン−6−カルボキシレート
【0195】
【化57】

【0196】
TBS−エーテル6’(150mg、0.528mmol)を1M HCl(0.106mL)アセトニトリル(0.8mL)溶液で室温中、2時間処理した。反応物をEtOAcで希釈し、少量の飽和NaHCO3水溶液を添加することにより反応停止し、H2Oおよび塩水(2回)で洗浄し、Na2SO4で乾燥させた。減圧下で溶媒を除去し、残渣をフラッシュシリカゲルカラムクロマトグラフィーで精製し、ヒドロキシケトン7’を無色の固形物として得た。
【0197】
【数8】

【0198】
(実施例7)
メチル(1S,4R,4’S,5R,5’S,6S)−6−フルオロ−4−ヒドロキシ−4’,5’−ジフェニルスピロ[ビシクロ[3.1.0]ヘキサン−2,2’−[1.3]ジオキソラン]−6−カルボキシレート8
【0199】
【化58】

【0200】
ヒドロキシケトン7(1.09kg、5.76mol)およびCH2Cl2(7.7L)の溶液に、(S,S)−ビス−O−TMS−ヒドロベンゾイン(分析値2.01kg、5.65mol)およびCH2Cl2(2.55L)の溶液を添加した。この溶液を−20℃に冷却した。TfOH(50.9mL、0.576mol)を添加漏斗から4分にわたって−15℃から−20℃で加えた。この溶液を−10℃に温め、−10℃で1.5時間熟成させた。(S,S)−ビス−O−TMS−ヒドロベンゾイン(分析値107g、0.298mol)のCH2Cl2(188g)を−10℃で反応混合物にさらに加えた。−10℃でさらに熟成させて30分後、反応を完了させた。ピリジン(46.9mL、0.576mol)を−15℃未満の温度で添加することにより、反応停止した。溶液を−10℃に温めて、5wt%の冷NaHCO3水溶液(3.75L)、1Mの冷HCl水溶液(8.6L)、5wt%の冷NaHCO3溶液(3.75L)、および10wt%の冷NaCl溶液(5.0L)で順に洗浄し、Na2SO4(1.5kg)で乾燥させた。有機溶液の溶媒をアセトニトリルに置換し、さらに精製することなく次の反応に用いた。この時点の溶液のHPLC分析により、ケタールアルコール8の存在が示された。フラッシュシリカゲルカラムクロマトグラフィーにより、分析的に高純度の試料が無色の結晶として得られた。
【0201】
【数9】

【0202】
(実施例8)
メチル(1S,4’S,5R,5’S,6S)−6−フルオロ−4−オキソ−4’,5’−ジフェニルスピロ[ビシクロ[3.1.0]ヘキサン−2,2’−[1.3]ジオキソラン]−6−カルボキシレート9
【0203】
【化59】

【0204】
ヒドロキシケタール8(分析値2.04kg、5.31mol)のアセトニトリル(36.7L)溶液に、RuCl3水和物(8.25g)を加えた後、水(2.0L)および酢酸(0.41L)を0℃で加えた。反応温度を4℃以下に保持しながら次亜塩素酸ナトリウム水溶液(〜13%、5.37L)を反応溶液にゆっくりと19分間にわたって加えた。この溶液を0℃から3.5℃で2時間熟成させた。イソプロパノール(2.2L)を3.5℃で添加し、反応を停止した。同じ温度で30分間熟成させた後、混合物に冷NaHCO3水溶液(5wt%、10.7L)を12分間かけて0.4℃から3.3℃で添加した。得られたスラリーを3℃で30分間攪拌し、生成物9を濾過した。湿ったケークを冷水(2L×2)で洗浄し、乾燥させて、最初のケタールケトン9を取得した。濾液および洗浄溶液を合わせて層を分離し、有機層を減圧濃縮した。得られたスラリーを濾過した。ケークを水(0.48L×2)で洗浄し、アセトニトリル(1.8L)および水(1.08L)で再結晶し、2番目のケタールケトン9を取得した。フラスコシリカゲルカラムクロマトグラフィーにより、分析的に高純度の試料が無色の結晶として得られた。
【0205】
【数10】

【0206】
(実施例9)
(1S,4’S,5R,5’S,6S)−4−アミノ−4−シアノ−6−フルオロ−4’,5’−ジフェニルスピロ[ビシクロ[3.1.0]ヘキサン−2,2’−[1.3]ジオキソラン]−6−カルボキサミド10
【0207】
【化60】

【0208】
7Mのアンモニアのメタノール(7.4L、47.8mol)およびTi(OiPr)4(1.77L、5.93mol)溶液に、23℃でケタールケトン9(2.11kg、高純度の9として1.89kg、4.94mol)を添加した。混合物を20℃から23℃で4時間攪拌した。この混合物を−12℃に冷却し、TMSCN(505g、5.09mol)を添加した。混合物を−4.5℃に昇温し、この温度で16時間攪拌した。混合物を濾過し、結晶を冷MeOH(7.0L)で洗浄して、20℃から25℃で減圧乾燥し、アミノニトリル10を無色の固形物として得た。シリカゲルカラムクロマトグラフィーにより、分析的に高純度の試料を無色の結晶として得た。
【0209】
【数11】

【0210】
(実施例10)
(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.10]ヘキサン−2,6−ジカルボン酸11
【0211】
【化61】

【0212】
アミノニトリル10(未精製品1.63kg、純品基準で1.55kg)、HOAc(3.25L)、H2O(3.25L)および濃HCl(6.50L)の混合物を75±2℃で4時間加熱した。19FNMRにより、反応が完了していることが示された。溶液を18℃に冷却してCH2Cl2(1×9Lおよび2×5L)で抽出した。水層を10から25Torr、内部温度50℃で2Lまで濃縮した。得られたスラリーを0℃に冷却し、1時間攪拌した。冷却したスラリーを濾過し、生成物11のHCl塩を含むケークを5から10分間減圧濾過して、可能な限り濾液を除去した。上記により得られたHCl塩のケークに水(5.0L)を65℃で添加し、熱水(300mL)中でリンスした。溶液を17℃まで45分にわたり冷却した。50%NaOH(230mL)により、pHを1.25に調整した。このスラリーを0℃に冷却して45分間攪拌した。スラリーを濾過し、H2O(2×1L)で洗浄し、窒素下で乾燥させて、オフホワイトの結晶生成物11を一水和物として得た。分析的に高純度の11のHCl塩が20%HClから得られた。
【0213】
【数12】

【0214】
(実施例11)
メチル((1R,2R,3R,5S)−3−{[tert−ブチル(ジメチル)シリル]オキシ}−6−オキサビシクロ[3.1.0]ヘキサ−2−イル)アセテート
【0215】
【化62】

【0216】
オレフィン12(4.25g、27.2mol)のトルエン(10.8mL)溶液に、バナジルアセチルアセトナート(VO(acac)2、289mg、1.09mmol、4mol%)を添加した。内部温度を28℃以下に保持し、TBHP(14.3mL、81.6mmol、デカン中5.7M)溶液を30分にわたって添加した。得られた混合物を室温で5.5時間攪拌し、飽和Na2S2O3水溶液を添加して反応停止した。水層を分離して、酢酸エチル(×5)で抽出した。有機層を合わせて塩水で洗浄し、Na2SO4で乾燥させた。溶媒を蒸発させた残渣をフラッシュシリカゲルクロマトグラフィーで精製し、エポキシアルコール13を、分離できない副生成物を含む無色の液体として得た。このアルコール(3.21g)をDMF(7.2mL)中、常温で、イミダゾール(2.78g、40.9mmol)およびTBSCl(3.36g、22.3mmol)で処理し、水酸基をTBS−エーテルに変換した。反応混合物を室温で2.5時間攪拌した後、MTBE(36mL)およびH2O(12mL)で処理した。有機層を分離し、飽和NaHCO3水溶液、H2Oおよび塩水で洗浄し、Na2SO4で乾燥させた。溶媒を蒸発させ、残渣をフラッシュシリカゲルクロマトグラフィーで精製してTBS−エーテル14を無色の液体として得た。
【0217】
【数13】

【0218】
(実施例12)
メチル(1S,2R,4S,5R,6S)−2−{[tert−ブチル(ジメチル)シリル]オキシ}−4−ヒドロキシビシクロ[3.1.0]ヘキサン−6−カルボキシレート
【0219】
【化63】

【0220】
エポキシド14(3.52g、12.3mmol)のTHF(37.8mL)溶液に、−70℃でEt3Al溶液(16.0mL、16.0mmol、ヘキサン中1M)を添加した。得られた溶液を−70℃で10分間攪拌した後、LHMDS溶液(18.4mL,18.4mmol、ヘキサン中1M)をゆっくりと30分間かけて添加した。得られた溶液を−70℃で100分攪拌し、クエン酸水溶液(24.9mL、3M)を添加して反応停止した。トルエン(24.9mL)を添加した後、混合物を常温に温め、H2O(11.7mL)を添加した。水層を分離して、MTBE(20mL)で抽出した。有機層を合わせて飽和NaHCO3水溶液(36mL×2)および塩水で洗浄し、Na2SO4で乾燥させた。溶媒を蒸発させた残渣をフラッシュシリカゲルカラムクロマトグラフィーで精製することにより、二環式アルコール15を無色の油状物として得た。
【0221】
【数14】

【0222】
(実施例13)
メチル(1S,2R,4S,5R,6R)−2−{[tert−ブチル(ジメチル)シリル]オキシ}−4−{[(4−メチルフェニル)スルホニル]オキシ}ビシクロ[3.1.0]ヘキサン−6−カルボキシレート
【0223】
【化64】

【0224】
アルコール15(929mg、3.24mmol)のCH2Cl2(3.8mL)溶液を0℃で攪拌しながらピリジン(2.62mL、32.4mmol)およびp−トルエンスルホニルクロライド(1.24g、6.49mmol)を添加した。混合物を常温に温め、同じ温度で15時間攪拌した。飽和NaHCO3水溶液(5mL)を反応混合物に添加して、反応混合物を室温で1時間攪拌した。水層を分離してMTBE(10mL×2)で抽出した。有機層を合わせて1M HCl(40mL)、飽和NaHCO3水溶液(10mL)および塩水(10mL)で洗浄し、Na2SO4で乾燥させた。溶媒を蒸発させて、残渣をフラッシュシリカゲルクロマトグラフィーで精製し、p−トルエンスルホネートエーテル16を無色の固形物として得た。
【0225】
【数15】

【0226】
(実施例14)
メチル(1S,2R,4S,5R,6R)−2−ヒドロキシ−4−{[(4−メチルフェニル)スルホニル]オキシ}ビシクロ[3.1.0]ヘキサン−6−カルボキシレート
【0227】
【化65】

【0228】
TBSエーテル16(1.86g、4.22mmol)をアセトニトリル(9.4mL)中、室温で0.84mLのHCl水溶液(1M)で4時間処理した。飽和NaHCO3水溶液(8.7mL)およびMTBE(20mL)を添加して、反応を停止した。水層を分離してMTBE(10mL×2)で抽出した。有機層を合わせ、Na2SO4で乾燥させ、減圧濃縮した。残渣をヘキサン処理することにより、結晶が得られた。これを濾過し、ヘキサン/EtOAcから再結晶することにより、高純度のアルコール17を無色の結晶として得た。
【0229】
【数16】

【0230】
(実施例15)
メチル(1R,5S,6S)−4−オキソビシクロ[3.1.0]ヘキサ−2−エン−6−カルボキシレート
【0231】
【化66】

【0232】
DMSO(0.404mL,5.70mmol)のCH2Cl2(2.6mL)溶液に、トリフルオロ酢酸無水物(0.604mL、4.28mmol)のCH2Cl2(1.5mL)溶液を−78℃で添加した。この溶液を−78℃で30分間攪拌し、アルコール17(0.885g、2.85mmol)のCH2Cl2(4.1mL)溶液を添加した(フラスコを1.0mLのCH2Cl2でリンスした)。この溶液を−78℃で30分間攪拌した後、Et3N(1.59mL、11.4mmol)をゆっくりと添加した。混合物を−78℃で2.5時間攪拌し、H2O(5mL)を添加することにより反応を停止した。MTBE(10mL)を添加した後、混合物を室温まで温めて、水層を分離し、MTBE(10ML)で抽出した。有機層を合わせて1M HCl(15mL)、飽和NaHCO3水溶液(10mL)、H2O(10mL)および塩水で洗浄し、Na2SO4で乾燥させた。溶媒を蒸発させて、残渣をフラッシュシリカゲルカラムクロマトグラフィーで精製し、α,β−不飽和ケトン18を淡黄色結晶として得た。
【0233】
【数17】

【0234】
(実施例16)
メチル(1S,2R,5R,6R)−2−{[tert−ブチル(ジメチル)シリル]オキシ}−4−オキソビシクロ[3.1.0]ヘキサン−6−カルボキシレート(21)
【0235】
【化67】

【0236】
DMSO(0.358mL,5.04mmol)のCH2Cl2(2.5mL)溶液に、トリフルオロ酢酸無水物(0.534mL、3.78mmol)のCH2Cl2(1.3mL)溶液を滴下した。反応温度は−70℃以下に保った。この溶液を−78℃で55分間攪拌した。アルコール15(722mg、2.52mmol)のCH2Cl2(3.7mL+1.0mLリンス)を滴下した。このとき、内部温度を−75℃に保った。−78℃で30分間攪拌した後、トリエチルアミン(1.05mL、7.56mmol)をゆっくりと15分かけて添加した。反応温度は−74.5℃以下に保った。混合物を−78℃で30分間攪拌した後、−20℃まで20分間かけて昇温させた。−20℃でさらに30分間攪拌して反応させた後、H2Oの添加により反応停止した。有機層を分離してMTBEで希釈し、0.5M HCl、H2O、飽和NaHCO3水溶液および塩水で洗浄し、Na2SO4で乾燥させた。溶媒を減圧除去し、残渣をフラッシュシリカゲルカラムクロマトグラフィーで精製し、無色の固形物21(673mg、収率94%)を得た。
【0237】
【数18】

【0238】
(実施例17)
メチル(1S,5R,6R)−4−オキソビシクロ[3.1.0]ヘキサ−2−エン−6−カルボキシレート(22)
【0239】
【化68】

【0240】
TBSエーテル21(50.0mg、0.176mmol)をCH2Cl2(0.9mL)中、室温で1時間DBU(0.0789mL、0.528mmol)処理した。反応物をMTBEで希釈し、1M HClおよび塩水(2回)で洗浄し、Na2SO4で乾燥させた。溶媒を減圧除去し、残渣をフラッシュシリカゲルカラムクロマトグラフィーで精製し、無色の固形物22を得た。
【0241】
【数19】

【0242】
その他のスペクトルは、実施例15で得られたα,β−不飽和ケトン18のものと一致した。
【0243】
(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.10]ヘキサン−2,6−ジカルボン酸塩酸塩11の多形体のキャラクタリゼーション
粉末X線回折による研究は、分子構造、結晶性および多形性を明らかにするために広く用いられている。実施例10で得られた塩酸塩の試料の結晶形について、Phillips回折計を用いて粉末X線回折(XRPD)パタンを集めた。測定は、3.0080度から39.9830度(2θ)まで行った。
【0244】
XRPDを図1に示す。結晶形の同定には、以下の回折を用いることができる。
【0245】
【数20】

【0246】
XPRDのピークリストを下記表1に示す。
【0247】
【表1】

【0248】
これより、ある実施形態においては、(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.10]ヘキサン−2,6−ジカルボン酸HClの多形体のCuK αを用いた粉末X線回折により決定される格子面間隔(d−spacing)が、5.37オングストローム程度である。他の実施形態にいおいては、(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.10]ヘキサン−2,6−ジカルボン酸HCl多形体のCuK αを用いた粉末X線回折により決定される格子面間隔の少なくとも一つが、4.52、4.05、3.84、3.37、2.96、2.73、2.67、2.59または2.42オングストローム程度である。
実施例10で得られた塩酸塩の試料の示差走査熱測定(DSC)を行った。装置としては、TA Instruments DSC 2910を用い、窒素雰囲気中、開いたパンを用いた。20℃から175℃までの昇温速度を10℃/分、175℃から255℃までの昇温速度を2℃/分とした。結果を図2に示す。その結果、184℃付近を開始点とする幅広い融点が示された後、227℃より高温に発熱分解が示された。
【0249】
よって、ある実施形態において、(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.10]ヘキサン−2,6−ジカルボン酸HClは、示差走査熱量測定の外挿値として、184℃付近に融解開始点を有する。
【0250】
以下の略語が本文全体で用いられる。
Me:メチル
Et:エチル
iPr:イソプロピル
Bu:ブチル
Ac:アセチル
DBU:1,8−ジアザビシクロ[5.4.0]ウンデカ−7−エン
NBS:N−ブロモスクシンイミド
NIS:N−ヨードスクシンイミド
DMF:N,N’−ジメチルホルムアミド
THF:テトラヒドロフラン
TBHP:tert−ブチルヒドロペルオキシド
MTBE:メチル−tert−ブチルエーテル
LDA:リチウムジイソプロピルアミド
TBS:tert−ブチルジメチルシリル
TMS:トリメチルシリル
TES:トリエチルシリル
DMSO:ジメチルスルホキシド
TfOH:トリフルオロメタンスルホン酸
LHMDS:リチウムヘキサメチルジシラジド
Ts:p−トルエンスルホニル(トシル)
HPLC:高速液体クロマトグラフィー
GC:ガスクロマトグラフィー
NMR:核磁気共鳴
DSC:示差走査熱測定
TLC:薄層クロマトグラフィー
XRPD:粉末X線回折
rt:室温
【0251】
以上、本発明を、特定の実施形態を参照して記載し説明した。ただし、本発明の精神および開示の範囲を超えることなく、種々の適合、変形、改良、置換、削除、または手順およびプロトコルの追加を行ってもよいことが、当業者には明らかである。たとえば、上に示した本発明の製造方法から試薬や化合物の調製手順を変更することに伴い、上述した個々の条件以外の反応条件を適用することができる。同様に、出発物質の比反応性を、個々の置換基または製造条件に依存して変えることもできる。こうした予測される変形や結果の相違も、本発明の目的および実施において想到されるものである。したがって、本発明は、請求の範囲で定義され、請求の範囲は妥当な範囲で最大限広く解釈される。
【0252】
また、すべての値は近似値であり、説明のためのものであることが理解される。特許、特許出願、出版物、製品説明書およびプロトコルは、本出願全体を通じて引用される。これらを参照することにより、その開示は、その全体について、すべての目的において、本発明に含まれる。
【図面の簡単な説明】
【0253】
本発明は、付随する以下の図面とともに説明される。
【図1】(+)−(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.1.0]ヘキサン−2,6−ジカルボン酸塩酸塩の結晶体の粉末X線回折(XPRD)パタンを示す図である。
【図2】(+)−(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.1.0]ヘキサン−2,6−ジカルボン酸塩酸塩の結晶体の示差走査熱量測定のカーブを示す図である。
【技術分野】
【0001】
本発明は、代謝型グルタミン酸受容体の調節物質として有用なビシクロ[3.1.0]ヘキサン誘導体の製造方法に関する。また、本発明は、この製造工程で製造される新規な中間体化合物ならびに(+)−(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.1.0]ヘキサン−2,6−ジカルボン酸の塩酸塩およびその多形体に関する。
【背景技術】
【0002】
グルタミン酸等の興奮性アミノ酸は、哺乳類の中枢神経系(CNS)において、長期増強(学習および記憶)、シナプス可塑性の発生、運動制御、呼吸、心血管調節および知覚といった種々の生理的プロセスを調節する。
【0003】
グルタミン酸は、少なくと二つの異なるクラスの受容体を介して作用する。そのクラスの一つは、イオンチャネル型グルタミン酸(iGlu)受容体であって、リガンド依存性イオンチャネルとして機能する。第二のクラスは、Gタンパク質または第二メッセンジャー結合性「代謝型」グルタミン酸(mGluR)受容体である。いずれのクラスの受容体も、興奮性経路に従って正常なシナプス伝達に介在しているようである。これらは、また、発生段階から生涯を通じてシナプス結合の修飾に関与しているようである。
Schoepp, Bockaert, and Sladeczek, Trends in pharmacol. Sci., 11, 508 (1990); McDonald and Johnson, Brain Research Reviews, 15,41 (1990).
【0004】
種々の機能性ビシクロ[3.1.0]ヘキサン誘導体化合物が、mGluRの調節物質として認められている。mGluRの調節物質は、精神疾患、統合失調症、不安神経症および関連疾患、うつ病、躁うつ病およびてんかん、ならびに薬物依存症、認識力障害、アルツハイマー病、ハンチントン舞踏病、パーキンソン病、筋硬直に付随する運動障害、脳虚血、脳障害、脊髄症および頭部外傷といった神経系の疾病への処置または予防のための治療上有用である。たとえば、2001年12月25日発行の米国特許第6,333,428号明細書には、mGluRアゴニストとして、下記式に示される2−アミノ−6−フルオロビシクロ[3.1.0]ヘキサン誘導体およびその薬学上許容される塩が開示されている。
【0005】
【化1】

【0006】
式中、R1およびR2は、それぞれ、
(1)水素;
(2)C1-10アルキル基;
(3)C3-8シクロアルキル基;および
(4)C3-8シクロアルキル−C1-5アルキル基
からなる群から選択される。「428」号特許明細書には、当該発明の化合物が、ラセミ体であってもよく、また、エナンチオマーであってもよいことが記載されている。また、「428」号特許明細書には、下記式で示される新規な中間体が開示されている。
【0007】
【化2】

【0008】
式中、R1は、上記に定義されたものである。
【0009】
2000年12月12日発行の米国特許第6,160,009号明細書には、機能性ビシクロ[3.1.0]ヘキサン誘導体が開示されている。これは、mGluRアゴニストとして治療上有用であり、下記式で示される。
【0010】
【化3】

【0011】
式中、R1およびR2は、ともに、=Oである。
【0012】
1998年5月12日発行の米国特許第5,750,566号明細書には、下記式で示されるmGluRアゴニストが開示されている。
【0013】
【化4】

これは、LY354740として知られる。
【0014】
上記mGluRの調節物質およびその中間体の調製は、上述した特許明細書、Nakazatoら、J. Med. Chem.、2000、43、4893−4909およびWO02/00595(これはEP1 295 862号として英語で発行された。)に開示されている。ところが、開示された合成は、大量生産には適していない点が不利であった。たとえば、「428」号明細書およびNakazatoの文献に開示された合成では、ラセミ中間体の調製が必要となるため、HPLCの使用を伴う複雑な分離の手順が必要となる結果、生産性が低下する。また、通常、公知の合成方法は、化学量論量のPd(OAc)2や(PhSe)2およびCH2N2等の高価で有害な試薬を必要とする。Nakazatoの合成方法は、また、合成の最終工程において、H2SO4を用い、高温(145℃)、5日間という厳しい加水分解を必要とするため、収率が低い。また、この方法は、ヒダントイン誘導体の前駆体から最終製品を単離するという困難な操作を必要とする。
【0015】
もちろん、米国特許第6,333,428号明細書、第6,160,009号明細書および5,570,566明細書に開示されたmGluR調節物質は、治療薬として有用であるから、これらの化合物の製造方法において、容易にスケールアップでき、費用効果があって安全な試薬を用いることができ、これにより、実用化して大量生産できる方法の開発が必要とされている。
【0016】
出願人は、一連の鏡像異性的に純粋な機能性ビシクロ[3.1.0]ヘキサン誘導体の新規な合成方法および一連の鏡像異性的に純粋な中間体化合物を発見した。
【非特許文献1】Schoepp, Bockaert, and Sladeczek, Trends in 11,508 (1990); McDonald and Johnson, Brain Research Reviews, 15,41 (1990).
【非特許文献2】Nakazatoら、J. Med. Chem.、2000、43、4893−4909
【非特許文献3】Dominguezら、Tetrahedron:Asymmetry、1997、8、511−514
【非特許文献4】Partidgeら、Org.Synth.1985、83、44
【特許文献1】米国特許第6,333,428号明細書
【特許文献2】米国特許第6,160,009号明細書
【特許文献3】米国特許第5,750,566号明細書
【特許文献4】国際公開第2002/00595号パンフレット
【発明の開示】
【0017】
本発明は、式(I)で示される機能性ビシクロ[3.1.0]ヘキサン誘導体mGluR調節物質類およびその薬学的に許容される塩の新規な合成方法に関する。
【0018】
【化5】

【0019】
式中、R1およびR2は、独立して、
(1)水素、
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)−(CH2)n−フェニル基
からなる群から選択される。
ただし、nは1または2であり、前記アルキル基、前記シクロアルキル基および前記フェニル基は、未置換または一以上のハロゲン、水酸基、C1-6アルキル基もしくはC1-6アルコキシ基で置換されている。
Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。
また、Qは、−CH2−または−C(=O)−である。
【0020】
また、本発明は、式(II)に示される化合物およびその塩の新規な製造方法に関する。
【0021】
【化6】

【0022】
式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは、
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、当該C1-10アルキル基およびC3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
RgおよびRhは、水素、C1-10アルキル基、およびC3-8シクロアルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【0023】
【化7】

【0024】
式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
Rdは、水素またはC1-10アルキル基である。
Xは、
(1)ハロゲン、および
(2)水素
からなる群から選択される。
また、R4は、
(1)水素
(2)C1-10アルキル基、
(3)Si−(R9)(R10)(R11)、
(4)C(=O)−R12、
(5)CH2−フェニル基、ただし、前記フェニル基は未置換またはニトロ基、ハロゲン、C1-10アルキル基およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されている。
(6)(CH2)p−O−(CH2)q−X’−R14、および
(7)テトラヒドロピラニル基
からなる群から選択される。
ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基であり、R14は、
(a)水素および
(b)C1-10アルキル基
からなる群から選択される。
また、pは1または2であり、
qは1から10の整数であり、
X’はOまたは単結合である。
【0025】
また、本発明は、式(XII)に示される化合物またはそのエナンチオマー(XII’)およびその塩類の新規な製造方法に関する。
【0026】
【化8】

【0027】
【化9】

【0028】
式中、R3およびXの定義は上記のとおりである。
【0029】
式(II)、(XII)および(XII’)に示される化合物は、式(I)で示されるmGluR調節物質の合成において調製される中間体である。化合物(XII)または(XII’)を用いて式(I)に示したmGluR調節物質を形成する工程は、上述した「566」号、「428」号および「009」号特許明細書、ならびにNakazatoら、J. Med. Chem. 2000、43、4893−4909に開示されている。本発明は、また、本発明の合成中に調製される新規な中間体に関する。
【発明を実施するための最良の形態】
【0030】
本発明は、式(I)に示される機能性ビシクロ[3.1.0]ヘキサン誘導体およびその薬学的に許容される塩の製造方法を対象とする。
【0031】
【化10】

【0032】
式中、R1およびR2は、独立して、
(1)水素、
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)(CH2)n−フェニル基
からなる群から選択される。
ただし、nは1または2であり、当該アルキル基、当該シクロアルキル基および当該フェニル基は、未置換または一以上のハロゲン、水酸基、C1-6アルキル基もしくはC1-6アルコキシ基で置換されている。
Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。
また、Qは、−CH2−または−C(=O)−である。
【0033】
本発明の一実施形態は、式(IA)に示される化合物の製造方法を対象とする。
【0034】
【化11】

【0035】
式中、X、R1およびR2は、上記の定義のとおりである。
【0036】
本発明の実施形態は、
式(II)に示される中間体化合物を酸化して、式(IV)に示される化合物を形成する工程、
式(IV)に示される化合物の水酸基を脱保護して式(V)に示される化合物を形成する工程、
式(V)に示される化合物と式(VI)に示される化合物とを反応させて、式(VII)に示される化合物を得る工程、
を含む。
【0037】
【化12】

【0038】
式中、X、R3およびR4は、上記の定義のとおりである。
【0039】
【化13】

【0040】
【化14】

【0041】
【化15】

【0042】
式中、R5およびR6は、独立して、
(1)水素、
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)(CH2)m−フェニル基
からなる群から選択される。
ただし、mは0、1または2である。
R7は、
(1)水素、および
(2)Si−(R9)(R10)(R11)、ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基である、
からなる群から選択される。
【0043】
【化16】

【0044】
その後、式(VII)に示した化合物を酸化して式(VIII)に示される化合物を得る。
【0045】
【化17】

【0046】
式(VIII)に示した化合物は、式(IX)に示される化合物に変換される。
【0047】
【化18】

【0048】
そして、式(IX)に示した化合物を、目的とする式(IA)に示される化合物に変換する。
【0049】
【化19】

【0050】
式中、X、R1およびR2は、上記の定義通りである。
【0051】
式(IA)に示した化合物の製造方法の好ましい実施形態においては、Xはフルオロ基である。他の好ましい実施形態においては、Xは水素である。
【0052】
式(IA)に示した化合物の製造方法の好ましい実施形態においては、R1およびR2が水素である。
【0053】
式(IA)に示した化合物の製造方法の好ましい実施形態においては、R3がメトキシ基、エトキシ基、またはベンジルオキシ基である。
【0054】
式(IA)に示した化合物の製造方法の好ましい実施形態においては、R4基は、TBS、TMSおよびTESである。また、R7基は、好ましくはTMSである。
【0055】
式(IA)に示した化合物の製造方法の好ましい実施形態において、R5およびR6は、メチル基およびフェニル基からなる群から選択される。また、R5=R6であることが好ましい。
【0056】
式(IA)に示した化合物の製造方法の好ましい実施形態において、式(IX)に示した化合物を式(I)に示した化合物に変換する工程は、式(IX)に示した化合物を加水分解する工程を含む。
【0057】
また、本発明は、式(VII)、(VIII)および(IX)に示される新規な中間体化合物およびその塩を対象とする。
【0058】
【化20】

【0059】
これらは、式(I)に示したmGluR調節物質の合成過程で調製される。化合物(VII)、(VIII)および(IX)において、R3、R5、R6およびXは上記の定義通りである。
【0060】
また、本発明は、式(II)に示す中間体化合物およびその塩の製造工程を対象とする。
【0061】
【化21】

【0062】
式中、R3、XおよびR4の定義は上記の通りである。この製造方法において、式(X)に示す化合物がエポキシ化される。エポキシ化は、たとえば、tert−ブチルヒドロペルオキシド等の過酸化物あるいは他の酸化剤(たとえば、過安息香酸や過酢酸等の過酸)と反応させることにより行われ、好ましくはVO(acac)2等の金属触媒存在下で行われる。
【0063】
【化22】

【0064】
式中、Xは水素であり、R3は前述の定義通りである。
【0065】
化合物(X)の水酸基を、その後、たとえばTBSまたはTMSで保護し、式(XI)に示す化合物としてもよい
【0066】
【化23】

【0067】
式中、Xは水素であり、R4は前述の定義通りである。式(XI)に示した化合物を、その後フッ化してもよい(式中、Xがフッ素となる。)。または、式(X)に示す化合物をまずフッ化した後(式中、Xがフッ素となる。)、フッ化化合物を上述のようにエポキシ化してもよい。
【0068】
あるいは、ハロゲン源との反応により得られるハロヒドリンを介してエポキシ誘導体を形成してもよい。たとえば、化合物(X)をN−ブロモスクシンイミドと反応させた後、塩基処理してもよい。その後、エポキシド生成物を単離する。
【0069】
そして、保護されたエポキシド誘導体(XI)を、ルイス酸の存在下で適当な塩基と反応させて、式(II)に示される化合物を得る。
【0070】
【化24】

【0071】
式中、X、R3およびR4は前述した定義通りである。その後、化合物(II)を酸化して化合物(IV)を得ることもできる。
【0072】
【化25】

【0073】
得られた化合物は、上述した製造方法の手順により、式(IA)に示した化合物に変換される。
【0074】
あるいは、式(IV)に示す化合物を、従来技術に記載の方法により変換して式(IA)に示す化合物としてもよい。たとえば、Nakazato、J. Med. Chem.、2000、43、4893−4909には、p.4898のスキーム5に、式(IV)に示した化合物を用いて式(IA)に示した化合物を形成することが記載されている。Nakazatoが教示する方法においては、ジチオケタールを形成した後、ヒダントイン誘導体を形成することが必要となる。
【0075】
米国特許第6,160,009号明細書には、第8から13段に、式(IV)に示した化合物を用いて式(IA)に示した化合物を形成することが記載されている。この反応は、ヒダントイン誘導体を経て進行する。
【0076】
式(II)に示した化合物の製造方法の好ましい実施形態において、R3は、メトキシ基、エトキシ基またはベンジルオキシ基である。
【0077】
式(II)に示した化合物の製造方法の好ましい実施形態において、Xはフルオロ基である。他の好ましい実施形態において、Xは水素である。
【0078】
式(II)に示した化合物の製造方法において、R4基は、好ましくはTBS、TMSおよびTESである。
【0079】
この製造方法の他の好ましい実施形態において、化合物(II)を酸化する工程は、化合物(II)をRuCl3および酸化剤に接触させる工程を含む。好ましい酸化剤として、漂白剤が挙げられる。好ましい漂白剤は、NaClOである。
【0080】
また、本発明は、以下に示される式(XA)、(XI)、(IVA)および(II)で示される新規な中間体化合物を対象とする。
【0081】
【化26】

【0082】
化合物(XA)、(XI)、(IVA)および(II)において、R3、XおよびR4は上述の定義通りである。
【0083】
また、本発明は、中間体である式(XII)のエノン化合物およびそのエナンチオマー(XII’)およびそれらの塩の製造方法を対象とする。
【0084】
【化27】

【0085】
【化28】

【0086】
式中、R3およびXは、上述した定義の通りである。
【0087】
式(XII)に示した化合物の製造方法の実施形態において、式(II)に示される化合物は、脱離基R8を有する下記式(XIII)で示される化合物の形成反応に供される。
【0088】
【化29】

【0089】
式中、X、R3およびR4は、上述した定義の通りである。
【0090】
【化30】

【0091】
式中、R8は、
(1)ハロゲン、および
(2)O−SO2−R12、ただし、R12は、
(a)C1-10アルキル基、
(b)C1-10パーフルオロアルキル基または
(c)未置換またはニトロ基、ハロゲン、C1-10アルキル基およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されたフェニル基
からなる群から選択される。
【0092】
その後、R4基を除去して下記(XIV)のヒドロキシエステル誘導体を得る。
【0093】
【化31】

【0094】
そして、これを酸化し目的の式(XII)に示される[3.1.0]−二環式−α,β不飽和ケトンを得る。
【0095】
【化32】

【0096】
また、式(XII’)に示した化合物の製造方法の実施形態においては、式(II)に示した化合物を酸化して式(IV)に示される化合物を形成する。
【0097】
【化33】

式中、X、R3およびR4は、上述した定義の通りである。その後、化合物(IV)を、脱離反応、たとえばDBU等の塩基との反応に供し、式(XII’)に示す化合物を得る。
【0098】
【化34】

【0099】
この化合物は、式(XII)に示した化合物に対応するエナンチオマーである。
【0100】
式(XII)または式(XII’)に示したエノン化合物を、従来技術において知られた方法により式(I)に示した化合物に変換してもよい。たとえば、Nakazato、J.Med.Chem.、2000、43、4893−4909には、式(XII)に示した化合物を用いて式(IA)に示した化合物を形成することが、4898ページのスキーム5に記載されている。
【0101】
また、米国特許第5.750,566号明細書には、式(XII)に示した化合物を用いて、式(I)のQがCH2である化合物を形成することが、第12段のスキームIVに記載されている。
【0102】
また、Dominguezら、Tetrahedron:Asymmetry、1997、8、511−514には、式(XII)に示した化合物を用いて式(I)ののQがCH2である化合物を形成することが、513ページのスキーム2に記載されている。この製造方法は、ヒダントイン誘導体を形成する必要がある。
【0103】
式(XII)および式(XII’)に示した化合物の製造方法の好ましい実施形態において、R3は、メトキシ基、エトキシ基またはベンジルオキシ基である。
【0104】
式(XII)および式(XII’)に示した化合物の製造方法の好ましい実施形態において、Xはフルオロ基である。他の好ましい実施形態においては、Xは水素である。
【0105】
式(XII)および式(XII’)に示した化合物の製造方法において、保護基R4は、好ましくはTBS、TMSおよびTESである。
【0106】
式(XII)および式(XII’)に示した化合物の製造方法において、R8基は、好ましくはO−トシル基(パラトルエンスルホニル基)、O−メシル基およびO−トリフレート基である。
【0107】
また、本発明は、式(I)に示した化合物の塩酸塩を対象とする。好ましい実施形態において、塩酸塩は、式(I)においてXがフルオロ基であって、R1およびR2がいずれも水素である化合物(I’)の塩である。
【0108】
【化35】

【0109】
この化合物は、(+)−(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.1.0]ヘキサン−2,6−ジカルボン酸である。また、本発明は、化合物(I’)塩酸塩の新規な結晶多形体を対象とする。
【0110】
定義
ここで、「Strecker合成反応」または「Strecker反応」とは、有機合成の当業者に、アルファアミノニトリルを調製するための反応として知られる反応のことをいう。
【0111】
ここで、「実質的に鏡像異性的に純粋な形で」とは、目的とするエナンチオマーが、目的としないエナンチオマーに対して、少なくとも50%e/e(鏡像体過剰率)存在することを意味する。
【0112】
ここで、「Lewis酸」とは、電子を受容できる化合物のことをいう。
【0113】
ここで、「アリール基」とは、多価不飽和芳香族炭化水素置換基を指し、単環または多環(好ましくは単環から3環)とすることができ、多環中の環は融合していても共有結合していてもよい。アリール基は特に限定されないが、たとえば、フェニル基、ナフチル基およびビフェニル基が挙げられる。
【0114】
ここで、「ヘテロアリール基」とは、環骨格中に少なくとも一つのヘテロ原子(窒素、酸素または硫黄)を有する多価不飽和芳香環のことをいう。ヘテロアリール基は、単環または多環(好ましくは単環から3環)とすることができ、多環中の環は融合していても共有結合していてもよい。ヘテロアリール基は特に限定されないが、たとえば、ピロール、ピラゾール、イミダゾール、ピリジン、ピラジン、ピリミジン、フラン、ピラン、オキサゾール、イソオキサゾール、プリン、ベンズイミダゾール、キノリン、イソキノリン、インドール等が挙げられる。
【0115】
ここで定義されるヘテロアリール基が置換されている場合、置換基は、ヘテロアリール基の環を構成する炭素原子に結合していてもよいし、また、環を構成するヘテロ原子(窒素、酸素または硫黄)に結合していてもよく、置換可能な原子価を有する。置換基は、好ましくは環を構成する炭素原子に結合する。
【0116】
ここで、「ハロゲン」とは、フッ素、塩素および臭素である。好ましいハロゲンとして、フッ素が挙げられる。
【0117】
ここで、「アルキル基」とは、それ自身または他の置換基の一部として、直鎖状または分岐鎖を有する炭化水素ラジカルを意味し、指定された数の炭素原子を有する(たとえば、C1-10アルキル基とは、1から10の炭素原子を有することを意味する。)。アルキル基の例として、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、t−ブチル基、イソブチル基、sec−ブチル基、ペンチル基、ヘキシル基等が挙げられる。
【0118】
ここで、「アルコキシ基」とは、それ自身または他の置換基の一部として、O−アルキル基を意味する。ここで、アルキル基は上記定義通りであり、直鎖状または分岐鎖を有するアルキル基を含む。
【0119】
ここで、「シクロアルキル基」とは、それ自身または他の置換基の一部として、飽和環状炭化水素ラジカルを意味し、指定された数の炭素原子(たとえば、C3-8シクロアルキルとは、3から8の炭素原子を有するシクロアルキル基を意味する。)を有する。
【0120】
ここで、「薬学的に許容される」とは、人間に投与した際に「一般的に安全とみなされている」分子群および組成物であって、たとえば、生理的に許容され、通常、アレルギーまたは同様の有害な反応を生じさせないことをいう。こうした反応として、たとえば異常亢進、めまい等が挙げられる。「薬学的に許容される」とは、好ましくは、連邦規制機関もしくは州政府で認可されているか、または、動物への使用、さらに具体的には人間への使用について米国薬局方もしくは他の公認の薬局方に掲載されたことをいう。
【0121】
本発明の製造方法の一実施形態は、下記スキーム1に示される。
【0122】
【化36】

【0123】
ここで、R1、R2、R3、R4、R5、R6、R7、R8、およびXは、前述の定義通りである。
【0124】
光学活性なトランスヒドロキシエステル1は、Partidgeら、Org.Synth.1985、83、44(Tolstikovら、J.Org.Chem.USSR、1989、25(1.2)および1990、26(7.1、1274)も参照のこと。)の教示により得られる。トランスヒドロキシエステル1は、好ましくは90%e/eより大きく、さらに好ましくは95%e/eより大きく、より一層好ましくは96%e/eより大きい。
【0125】
二級アルコールを保護せずにトランスヒドロキシエステル1をフッ化し、化合物2を得ることができる。
【0126】
【化37】

【0127】
所望のフッ素化を行う方法として、強塩基存在下、テトラヒドロフラン等の適当な溶媒中でN−フルオロベンゼンスルホンイミド(NFSI)等のフッ素化剤と反応させる方法が挙げられる。この反応は−65℃より低温で行うことが好ましく、より好ましくは−75℃より低温、最も好ましくは−78℃より低温である。共塩基として適当なものとして、たとえばリチウムジイソプロピルアミド(LDA)、リチウムテトラメチルピペラジド、リチウムヘキサメチルジシラジド(LHMDS)、または対応するカリウムもしくはナトリウム塩が挙げられる。
【0128】
続いて、トルエン中で、過酸化物誘導体(たとえば、tert−ブチルヒドロペルオキシド)等の酸化剤および触媒(たとえば、触媒量のバナジルアセチルアセトネート(VO(acac)2)と反応させることにより、2の立体選択的なエポキシ化を行ってもよい。この反応は、0℃程度から40℃程度で行うことが好ましい。
【0129】
【化38】

【0130】
酸化剤として、他に、メタ−クロロ過安息香酸(mCPBA)が挙げられる。エポキシド3がトランス異性体として得られる。
【0131】
また、トランス−ヒドロキシエステル1をまず立体選択的なエポキシ反応に供し、得られたエポキシド2’をフッ化して化合物3を得てもよい。
【0132】
【化39】

【0133】
また、エポキシ化は、1(またはフッ化化合物2)を、適当な溶媒(たとえばDMSOと水の混合物)中でNBSやNIS等のハロゲン化剤処理することにより行ってもよい。その後、化合物1は、ハロヒドリン誘導体を形成する。この化合物は、塩基(たとえばDBU)とともに結晶化し、エポキシドを形成する。
【0134】
保護試薬R4としてたとえばtert−ブチルジメチルシリルクロライド(TBSCl)等のシリル保護試薬を用い、イミダゾールおよびDMF中等の適切な条件下で3の水酸基を保護することにより、以下に示す保護されたエポキシド化合物4が製造される。
【0135】
【化40】

【0136】
その後、保護されたエポキシド4を、エポキシドの開環を伴う分子内シクロプロパン化反応に供してもよい。この反応はEt3Al等のルイス酸の存在下で塩基を添加することにより進行する。また、−50℃程度で反応させることが好ましい。
【0137】
好ましい実施形態においては、まず、化合物4をEt3Alで処理した後、LiHMDSを滴下する。反応は、−20℃から−80℃の温度で0.5から6時間進行させる。好ましい反応時間は、1時間程度である。また、好ましい反応温度は、−60℃である。この反応に用いられる他のルイス酸として、RTi(OR)3、R2Ti(OR)2、RAlX2またはR2AlXが挙げられる。ここで、Xはハロゲンまたは無機ラジカルであって、Rはそれぞれ炭化水素基である。ルイス酸として、たとえば、Al(OiPr)3、Ti(OiPr)4、BF3エーテル、Et2Zn、Et3AlおよびSc(OTf)3が挙げられる。化合物5は所望の立体異性体として得られる。
【0138】
【化41】

【0139】
この結果生じた未保護のアルコールを酸化し、保護基を除去することにより、二環式ヒドロキシケトン7(化合物II)が得られる。好ましい酸化剤としては、試薬用の次亜塩素酸ナトリウムまたは市販の漂白剤が挙げられる。この反応は、アセトニトリル中、触媒量のRuCl3および酢酸(1.5当量)の存在下、0℃で行うことができる。そして、過剰の次亜塩素酸ナトリウムを(たとえばイソプロピルアルコールとともに反応停止(クエンチ)することにより)除去する。アセトニトリル溶液に酸(たとえば、1M HClを20mol%)を添加することにより、保護基のR4を開裂させる。
【0140】
【化42】

【0141】
また、化合物7をジオール誘導体と反応させることにより保護し、ケタール8としてもよい。R7として、好ましくはTMSが挙げられる。
【0142】
【化43】

【0143】
この反応は、酸(たとえば、0.1当量)の存在下、0℃程度から−10℃程度において進行する。好ましい酸として、TfOHまたはTfOTMSが挙げられる。
【0144】
8の二級アルコールを酸化することにより、ケトン9が得られる。
【0145】
【化44】

【0146】
酸化反応は、Swern酸化等どのような酸化条件で行ってもよい。
また、酸化を、RuCl3(0.5mol%)の存在下、NaClOを含むアセトニトリルおよび酢酸中、0℃から室温で行ってもよい。
【0147】
そして、化合物9をアンモニアとStrecker反応させる。この反応は、アンモニアを含むアルコール溶媒(たとえばメタノール)中、室温で進行させることができる。
【0148】
【化45】

【0149】
その後、TMSCNを−10℃から0℃で添加する。TMSCNは、酸の存在下でKCN/NaCNに置換することができる。この反応の促進に、チタンイソプロポキシド(Ti(OiPr)4)等のチタン化合物を用いてもよい。この反応により、目的とするアミノニトリル10が高いジアステレオ選択性で得られる。
【0150】
そして、化合物10を加水分解し、所望の2−アミノ−6−フルオロビシクロ[3.1.0]ヘキサン(化合物11)を得る。
【0151】
【化46】

【0152】
加水分解反応には酢酸と8M HClの1:3混合物を用い、75℃で5時間進行させる。また、60%のH2SO4の存在下、100℃程度で2時間程度反応させてもよい。または、酢酸/H2SO4による処理を60℃で2時間程度行ってもよい。
【0153】
その後、当業者に知られた方法により、目的とする化合物11を塩酸塩として単離する。
【0154】
本発明の製造方法の他の実施形態は、下記スキーム2に示される。
【0155】
【化47】

【0156】
式中、X、R3、R4およびR8は、前述した定義の通りである。
【0157】
スキーム2中、光学活性なトランス−ヒドロキシエステル12は、スキーム1の説明において上述した方法により得られる。12は、ジアステレオ選択的にエポキシ化されて、エポキシド13となる。13の水酸基を保護することにより、14が得られる。そして、14をルイス酸で処理した後、塩基処理することにより、ビシクロ[3.1.0]化合物15が製造される。12のエナンチオマーは、Partridgeら、Org.Synth、1985、83、44に開示されており、これをエナンチオマー13、14および15の合成に適用できる。
【0158】
[3.1.0]二環式ジオールのモノ保護体15(スキーム1の5と同一)は、[3.1.0]二環式α,β−不飽和ケトンに変換される。このスキームにおいて、アルコール15の水酸基は、脱離基R8に変換され、保護基R4が除去されて、ヒドロキシエステル17が得られる。R8脱離基に適したものとして、スルホン酸(たとえば、パラトルエンスルホン酸)およびハライドが挙げられる。R8脱離基の開裂により17が酸化されて、[3.1.0]二環式α,β不飽和ケトン18が得られる。この化合物は、mGluRアゴニスト19(スキーム1の11と同一)および20の合成に用いられる。この合成は、米国特許第5,750,566号明細書、米国特許第6,333,428号明細書、米国特許第6,160,009号明細書およびNakazatoら、J.Med.Chem.、2000、43、4893−4909の教示によって行われる。
【0159】
本発明の合成方法の他の実施形態は、下記スキーム3に示される。
【0160】
【化48】

【0161】
式中、X、R3およびR4の定義は前述した通りである。スキーム3には、エノン18(スキーム2)のエナンチオマーの合成が示されている。
【0162】
上記化学構造は、鏡像異性的に純粋なエナンチオマーであってもよいし、エナンチオマーの混合物であってもよい。
【0163】
ここで、出発材料および試薬は市販品、文献で公知のもの、類似化合物に関する文献記載の方法により調製されたもののいずれであってもよい。反応および反応の結果得られた生成物の精製は、当業者に知られた方法による。精製方法としては、結晶化、蒸留、順相または逆相クロマトグラフィーが挙げられる。
【実施例】
【0164】
以下、さらに具体的な実施例を示すが、本発明の開示はこれに限定されない。実施例1〜10に、スキーム1の方法を示す。実施例11〜15に、スキーム2の方法を示す。また、実施例16および17に、スキーム3の方法を示す。
【0165】
(実施例1)
メチル フルオロ[(1R,5R)−5−ヒドロキシシクロペンタ−2−エン−1−イル]アセテート2
【0166】
【化49】

【0167】
ジイソプロピルアミン(10.8mL、76.8mmol)のTHF(28mL)溶液に、ブチルリチウム(28.2mL、70.4mmol、2.5Mヘキサン溶液)を40分間にわたって添加した。その間、内部の温度を0℃から5℃の間に保った。得られた溶液を0℃で3分間攪拌した後、ドライアイス−アセトン浴により−78℃に冷却した。エステル1(5.00g、32.0mmol)のTHF(41.3mL)溶液をLDA溶液に45分にわたって滴下した。その間、内部温度を−73℃以下に保持した。得られた溶液を、−78℃で20分間攪拌し、オレンジ(または濃いオレンジ)色のジアニオン溶液を形成した。別のフラスコに、N−フルオロベンゼンスルホンイミド(14.1g、44.8mmol)およびTHF(62mL)を入れ、液体窒素−アセトン浴中で−96℃に冷却した。ジアニオン溶液を添加漏斗でフッ素化試薬の懸濁液に1時間かけて加えた。その間、内部の温度を−95℃付近に保った。漏斗およびフラスコを2.5mLのTHFで洗い流して反応混合物中に加えた。得られた混合物を−96℃で1時間攪拌した後、−80℃に30分間かけて昇温した。酢酸(11mL)のTHF(5mL)溶液を7分間かけてゆっくりと添加した。MTBE(100mL)を添加した後、混合物を常温まで温めた。残存する固形物を濾過して除去し、MTBE(70mL×6)で充分に洗浄した。濾液と洗浄液を合わせて再度濾過し、HPLCで分析した。化学収率は、86%と測定された。シリカゲル(30g)を詰めたショートカラムに濾液を通し、カラムをMTBE(200mL)で洗浄した。これらのMTBE溶液を合わせ、減圧濃縮した。残渣をEtOAc(250mL)に溶かし、飽和NaHCO3水溶液(170mL)で洗浄した。水層をEtOAc(60mL×2)で逆抽出し、これらの有機溶液を合わせて塩水(60mL)で洗浄した後、Na2SO4で乾燥させた。溶媒を蒸発させて、粗製エステルを得、これをバルブ−トゥー−バルブ蒸留(1.6Torr)に供し、黄色の油状物としてエステルを得た。さらにフラッシュシリカゲルカラムクロマトグラフィーにより、無色の油状物として分析的に高純度の試料を得た。
【0168】
【数1】

【0169】
(実施例2)
メチル フルオロ[(1R,2S,3R,5S)−3−ヒドロキシ−6−オキサビシクロ[3.1.0]ヘキサ−2−イル]アセテート3
【0170】
【化50】

【0171】
オレフィン2(1.92kg、11.0mol)のトルエン(4.83L)溶液に、バナジルアセチルアセトナート(VO(acac)2、58.3g、0.22mol)を0℃にて加えた。これにTBHP溶液(デカン中5.7M、38.6mL)を0℃で加えた後、得られた懸濁液を14℃に昇温させた。さらにTBHP溶液(デカン中5.7M、4.36L)を反応混合物に50分にわたってゆっくりと追加した。その間、バッチ温度を14℃から28℃の間に保った。得られた懸濁液をさらに2時間攪拌した後、40℃で8時間加熱した。Na2S2O3水溶液(2.95kgNa2S2O3および4.71kgH2O)を0℃でゆっくりと添加して、過剰のTBHPをクエンチした。得られた混合物を20℃で1.5時間攪拌した。試験紙により過酸化物の消失を確認した。水層を分離し、EtOAc(9.42L×2)で抽出した。有機層を合わせて塩水(6.33L)にて洗浄した。塩水層をEtOAc(3.42L×4)にて逆抽出した。有機溶液を合わせてGC分析を行ったところ、生成物3の存在が示された。合わせた有機溶液を濃縮し、得られた残渣を、フィルターポット中、シリカゲルクロマトグラフィーにより精製した(最初にヘキサン/EtOAc(4/1)で抽出した後、純EtOAcで抽出した。)。フラッシュシリカゲルカラムクロマトグラフィー(ヘキサン/MTBE)の後、再結晶(EtOAc)することにより、分析的に高純度の試料を淡黄色結晶として得た。
【0172】
【数2】

【0173】
(実施例2A)
メチル[(1R,2R,3R,5S)−3−ヒドロキシ−6−オキサビシクロ[3.1.0]ヘキサ−2−イル]アセテート
【0174】
【化51】

【0175】
オレフィン2’(50.0mg、0.320mmol)のウエットDMSO(1.2mLDMSO中、6.4μL H2O)溶液に、室温でNBS(68.4mg、0.384mmol)を添加した。これを室温で4.5時間攪拌した後、さらに10mgのNBSを添加した。反応物を室温で2時間攪拌し、EtOAcで希釈し、H2Oで洗浄した。水層をEtOAc(2回)で抽出し、有機層を合わせてNa2SO4で乾燥させた。減圧下、溶媒を除去して得られた残渣をCH2Cl2(1.2mL)中に回収した。この溶液にDBU(57.4μL、0.384mmol)を添加し、室温で18時間攪拌した。溶媒を蒸発させて、残渣をフラッシュシリカゲルカラムクロマトグラフィーで精製した。これにより、エポキシド3’が、クロマトグラフィーでは分離できないジアステレオマー混合物として得られた。主要な異性体のスペクトルデータは、以下の通りである。
【0176】
【数3】

【0177】
同様の反応条件で、以下のエポキシドを調製した。
【化52】

【0178】
(実施例3)
メチル((1R,2R,3R,5S)−3−{[tert−ブチル(ジメチル)シリル]オキシ}−6−オキサビシクロ[3.1.0]ヘキサ−2−イル)フルオロアセテート4
【0179】
【化53】

【0180】
エポキシアルコール3(1.60kg、8.40mol)およびDMF(3.40L)の溶液に、イミダゾール(1.26kg、18.5mol)を10℃で加えた。この反応混合物のバッチ温度を8℃以下に保ち、TBSCl(1.52kg、10.1mol)を添加した。得られた溶液を5℃で10分間攪拌した後、30分かけて20℃に昇温させ、同温度で2時間攪拌した。出発物質のアルコールの消費をGCによりモニタし、反応混合物を冷トルエン(17.5L、5℃)で希釈した。反応混合物をH2O(5.67L)、飽和NaHCO3水溶液(5.67L)、H2O(5.67L×2)および塩水(5.67L)で洗浄した。有機溶液を分析したところ、4の存在が示された。溶液を濃縮することにより、4が黄色の液体として得られた。これを、さらに精製することなく、次のステップに用いた。フラッシュシリカゲルカラムクロマトグラフィー(ヘキサン/MTBE)により、分析的に高純度の試料が無色結晶として得られた。
【0181】
【数4】

【0182】
(実施例4)
メチル(1R,2R,4S,5S,6R)−2−{[tert−ブチル(ジメチル)シリル]オキシ}−6−フルオロ−4−ヒドロキシビシクロ[3.1.0]ヘキサン−6−カルボキシレート5
【0183】
【化54】

【0184】
エポキシドTBS−エーテル4(分析値 質量1.60kg、5.24mol)のTHF(16.1L)溶液に、バッチ温度を−60℃に保ちながら、Et3Al溶液(ヘキサン中1.0M、6.81L、6.81mol)を1時間かけて添加し、得られた溶液を−60℃で20分間攪拌した。LHMDS溶液(ヘキサン中1.0M、7.86L、7.86mol)を、バッチ温度を−60℃以下に保ちながら、反応混合物に1時間かけて添加し、−60℃で反応物を熟成させた。反応の進行をGCでモニタした。エポキシドが完全に消費された(6時間)後、クエン酸水溶液(3M、10.5L)を1時間かけて添加した。その間、バッチ温度を−50℃以下に保持した。MTBE(12.4L)を添加した後、得られた懸濁液を攪拌しながら徐々に昇温させて15℃とした。この混合物にH2O(4.93L)を添加し、二相溶液とした。有機層を分離し、飽和NaHCO3水溶液(11.1L、その後5.6L)で2回洗浄した。有機溶液をGC分析したところ、化合物5の存在が示された。有機層を濃縮することにより、粗製アルコールが黄色油状物として得られ、これをさらに精製することなく次の反応に用いた。
また、フラッシュシリカゲルカラムクロマトグラフィーにより、分析的に高純度の試料が無色のアモルファス状の固形物として得られた。
【0185】
【数5】

【0186】
(実施例5)
メチル(1R,2R,5S,6S)−2−{[tert−ブチル(ジメチル)シリル]オキシ}−6−フルオロ−4−オキソビシクロ[3.1.0]ヘキサン−6−カルボキシレート6
【0187】
【化55】

【0188】
二環式モノ−TBS−ジオール5(2.08kg、6.83mol)のアセトニトリル(8.0L)溶液に、酢酸(0.70L)および水(2.5L)を−5℃で添加した後、さらにRuCl3水和物(14.20g)を添加した。混合物に、次亜塩素酸ナトリウム水溶液(〜13%、7.0L)を2時間かけて添加した。その間、0℃付近の温度に保った。二環式モノ−TBS−ジオール5がすべて消失するまで、得られた混合物を0℃でさらに1時間攪拌した。二環式モノ−TBS−ジオール5の消失は、TLCおよびNMRで測定した。イソプロパノール(0.70L)を添加して0℃で15分熟成することにより、過剰の次亜塩素酸水溶液を分解した。二つの層を切り分けて水層を捨てた。この溶液をさらに処理せずに次の反応に用いた。また、フラッシュシリカゲルカラムクロマトグラフィー(MTBE/ヘキサン)により、分析的に高純度の試料が無色の結晶として得られた。
【0189】
【数6】

【0190】
(実施例6)
メチル(1R,2R,5S,6S)−6−フルオロ−2−ヒドロキシ−4−オキソビシクロ[3.1.0]ヘキサン−6−カルボキシレート7
【0191】
【化56】

【0192】
上述したTBS−ケトン6(6.83mol)を含む有機層を22℃に温め、1MHCl(1.37L)を添加した。すべてのTBS基が除去されるまで、この混合物を22℃から24℃で3.5時間攪拌した。得られた混合物に飽和炭酸水素ナトリウム溶液(4.8L)を添加した。混合物を15分間攪拌し、イソプロピルアセテート(20L)で希釈した後、有機層を分離した。水層をイソプロピルアセテート(6L)で逆抽出した。有機溶液を合わせて濃縮乾燥させて、得られた化合物をフィルターポット中でのシリカゲルクロマトグラフィー(まず30%MTBEヘキサン溶液で溶出した後、MTBE単独で溶出)で精製し、オフホワイトの結晶として化合物7を得た。フラッシュシリカゲルカラムを行うことにより、分析的に高純度の試料を無色の結晶として得た。
【0193】
【数7】

【0194】
(実施例6A)
メチル(1S,2R,5R,6R)−2−ヒドロキシ−4−オキソビシクロ[3.1.0]ヘキサン−6−カルボキシレート
【0195】
【化57】

【0196】
TBS−エーテル6’(150mg、0.528mmol)を1M HCl(0.106mL)アセトニトリル(0.8mL)溶液で室温中、2時間処理した。反応物をEtOAcで希釈し、少量の飽和NaHCO3水溶液を添加することにより反応停止し、H2Oおよび塩水(2回)で洗浄し、Na2SO4で乾燥させた。減圧下で溶媒を除去し、残渣をフラッシュシリカゲルカラムクロマトグラフィーで精製し、ヒドロキシケトン7’を無色の固形物として得た。
【0197】
【数8】

【0198】
(実施例7)
メチル(1S,4R,4’S,5R,5’S,6S)−6−フルオロ−4−ヒドロキシ−4’,5’−ジフェニルスピロ[ビシクロ[3.1.0]ヘキサン−2,2’−[1.3]ジオキソラン]−6−カルボキシレート8
【0199】
【化58】

【0200】
ヒドロキシケトン7(1.09kg、5.76mol)およびCH2Cl2(7.7L)の溶液に、(S,S)−ビス−O−TMS−ヒドロベンゾイン(分析値2.01kg、5.65mol)およびCH2Cl2(2.55L)の溶液を添加した。この溶液を−20℃に冷却した。TfOH(50.9mL、0.576mol)を添加漏斗から4分にわたって−15℃から−20℃で加えた。この溶液を−10℃に温め、−10℃で1.5時間熟成させた。(S,S)−ビス−O−TMS−ヒドロベンゾイン(分析値107g、0.298mol)のCH2Cl2(188g)を−10℃で反応混合物にさらに加えた。−10℃でさらに熟成させて30分後、反応を完了させた。ピリジン(46.9mL、0.576mol)を−15℃未満の温度で添加することにより、反応停止した。溶液を−10℃に温めて、5wt%の冷NaHCO3水溶液(3.75L)、1Mの冷HCl水溶液(8.6L)、5wt%の冷NaHCO3溶液(3.75L)、および10wt%の冷NaCl溶液(5.0L)で順に洗浄し、Na2SO4(1.5kg)で乾燥させた。有機溶液の溶媒をアセトニトリルに置換し、さらに精製することなく次の反応に用いた。この時点の溶液のHPLC分析により、ケタールアルコール8の存在が示された。フラッシュシリカゲルカラムクロマトグラフィーにより、分析的に高純度の試料が無色の結晶として得られた。
【0201】
【数9】

【0202】
(実施例8)
メチル(1S,4’S,5R,5’S,6S)−6−フルオロ−4−オキソ−4’,5’−ジフェニルスピロ[ビシクロ[3.1.0]ヘキサン−2,2’−[1.3]ジオキソラン]−6−カルボキシレート9
【0203】
【化59】

【0204】
ヒドロキシケタール8(分析値2.04kg、5.31mol)のアセトニトリル(36.7L)溶液に、RuCl3水和物(8.25g)を加えた後、水(2.0L)および酢酸(0.41L)を0℃で加えた。反応温度を4℃以下に保持しながら次亜塩素酸ナトリウム水溶液(〜13%、5.37L)を反応溶液にゆっくりと19分間にわたって加えた。この溶液を0℃から3.5℃で2時間熟成させた。イソプロパノール(2.2L)を3.5℃で添加し、反応を停止した。同じ温度で30分間熟成させた後、混合物に冷NaHCO3水溶液(5wt%、10.7L)を12分間かけて0.4℃から3.3℃で添加した。得られたスラリーを3℃で30分間攪拌し、生成物9を濾過した。湿ったケークを冷水(2L×2)で洗浄し、乾燥させて、最初のケタールケトン9を取得した。濾液および洗浄溶液を合わせて層を分離し、有機層を減圧濃縮した。得られたスラリーを濾過した。ケークを水(0.48L×2)で洗浄し、アセトニトリル(1.8L)および水(1.08L)で再結晶し、2番目のケタールケトン9を取得した。フラスコシリカゲルカラムクロマトグラフィーにより、分析的に高純度の試料が無色の結晶として得られた。
【0205】
【数10】

【0206】
(実施例9)
(1S,4’S,5R,5’S,6S)−4−アミノ−4−シアノ−6−フルオロ−4’,5’−ジフェニルスピロ[ビシクロ[3.1.0]ヘキサン−2,2’−[1.3]ジオキソラン]−6−カルボキサミド10
【0207】
【化60】

【0208】
7Mのアンモニアのメタノール(7.4L、47.8mol)およびTi(OiPr)4(1.77L、5.93mol)溶液に、23℃でケタールケトン9(2.11kg、高純度の9として1.89kg、4.94mol)を添加した。混合物を20℃から23℃で4時間攪拌した。この混合物を−12℃に冷却し、TMSCN(505g、5.09mol)を添加した。混合物を−4.5℃に昇温し、この温度で16時間攪拌した。混合物を濾過し、結晶を冷MeOH(7.0L)で洗浄して、20℃から25℃で減圧乾燥し、アミノニトリル10を無色の固形物として得た。シリカゲルカラムクロマトグラフィーにより、分析的に高純度の試料を無色の結晶として得た。
【0209】
【数11】

【0210】
(実施例10)
(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.10]ヘキサン−2,6−ジカルボン酸11
【0211】
【化61】

【0212】
アミノニトリル10(未精製品1.63kg、純品基準で1.55kg)、HOAc(3.25L)、H2O(3.25L)および濃HCl(6.50L)の混合物を75±2℃で4時間加熱した。19FNMRにより、反応が完了していることが示された。溶液を18℃に冷却してCH2Cl2(1×9Lおよび2×5L)で抽出した。水層を10から25Torr、内部温度50℃で2Lまで濃縮した。得られたスラリーを0℃に冷却し、1時間攪拌した。冷却したスラリーを濾過し、生成物11のHCl塩を含むケークを5から10分間減圧濾過して、可能な限り濾液を除去した。上記により得られたHCl塩のケークに水(5.0L)を65℃で添加し、熱水(300mL)中でリンスした。溶液を17℃まで45分にわたり冷却した。50%NaOH(230mL)により、pHを1.25に調整した。このスラリーを0℃に冷却して45分間攪拌した。スラリーを濾過し、H2O(2×1L)で洗浄し、窒素下で乾燥させて、オフホワイトの結晶生成物11を一水和物として得た。分析的に高純度の11のHCl塩が20%HClから得られた。
【0213】
【数12】

【0214】
(実施例11)
メチル((1R,2R,3R,5S)−3−{[tert−ブチル(ジメチル)シリル]オキシ}−6−オキサビシクロ[3.1.0]ヘキサ−2−イル)アセテート
【0215】
【化62】

【0216】
オレフィン12(4.25g、27.2mol)のトルエン(10.8mL)溶液に、バナジルアセチルアセトナート(VO(acac)2、289mg、1.09mmol、4mol%)を添加した。内部温度を28℃以下に保持し、TBHP(14.3mL、81.6mmol、デカン中5.7M)溶液を30分にわたって添加した。得られた混合物を室温で5.5時間攪拌し、飽和Na2S2O3水溶液を添加して反応停止した。水層を分離して、酢酸エチル(×5)で抽出した。有機層を合わせて塩水で洗浄し、Na2SO4で乾燥させた。溶媒を蒸発させた残渣をフラッシュシリカゲルクロマトグラフィーで精製し、エポキシアルコール13を、分離できない副生成物を含む無色の液体として得た。このアルコール(3.21g)をDMF(7.2mL)中、常温で、イミダゾール(2.78g、40.9mmol)およびTBSCl(3.36g、22.3mmol)で処理し、水酸基をTBS−エーテルに変換した。反応混合物を室温で2.5時間攪拌した後、MTBE(36mL)およびH2O(12mL)で処理した。有機層を分離し、飽和NaHCO3水溶液、H2Oおよび塩水で洗浄し、Na2SO4で乾燥させた。溶媒を蒸発させ、残渣をフラッシュシリカゲルクロマトグラフィーで精製してTBS−エーテル14を無色の液体として得た。
【0217】
【数13】

【0218】
(実施例12)
メチル(1S,2R,4S,5R,6S)−2−{[tert−ブチル(ジメチル)シリル]オキシ}−4−ヒドロキシビシクロ[3.1.0]ヘキサン−6−カルボキシレート
【0219】
【化63】

【0220】
エポキシド14(3.52g、12.3mmol)のTHF(37.8mL)溶液に、−70℃でEt3Al溶液(16.0mL、16.0mmol、ヘキサン中1M)を添加した。得られた溶液を−70℃で10分間攪拌した後、LHMDS溶液(18.4mL,18.4mmol、ヘキサン中1M)をゆっくりと30分間かけて添加した。得られた溶液を−70℃で100分攪拌し、クエン酸水溶液(24.9mL、3M)を添加して反応停止した。トルエン(24.9mL)を添加した後、混合物を常温に温め、H2O(11.7mL)を添加した。水層を分離して、MTBE(20mL)で抽出した。有機層を合わせて飽和NaHCO3水溶液(36mL×2)および塩水で洗浄し、Na2SO4で乾燥させた。溶媒を蒸発させた残渣をフラッシュシリカゲルカラムクロマトグラフィーで精製することにより、二環式アルコール15を無色の油状物として得た。
【0221】
【数14】

【0222】
(実施例13)
メチル(1S,2R,4S,5R,6R)−2−{[tert−ブチル(ジメチル)シリル]オキシ}−4−{[(4−メチルフェニル)スルホニル]オキシ}ビシクロ[3.1.0]ヘキサン−6−カルボキシレート
【0223】
【化64】

【0224】
アルコール15(929mg、3.24mmol)のCH2Cl2(3.8mL)溶液を0℃で攪拌しながらピリジン(2.62mL、32.4mmol)およびp−トルエンスルホニルクロライド(1.24g、6.49mmol)を添加した。混合物を常温に温め、同じ温度で15時間攪拌した。飽和NaHCO3水溶液(5mL)を反応混合物に添加して、反応混合物を室温で1時間攪拌した。水層を分離してMTBE(10mL×2)で抽出した。有機層を合わせて1M HCl(40mL)、飽和NaHCO3水溶液(10mL)および塩水(10mL)で洗浄し、Na2SO4で乾燥させた。溶媒を蒸発させて、残渣をフラッシュシリカゲルクロマトグラフィーで精製し、p−トルエンスルホネートエーテル16を無色の固形物として得た。
【0225】
【数15】

【0226】
(実施例14)
メチル(1S,2R,4S,5R,6R)−2−ヒドロキシ−4−{[(4−メチルフェニル)スルホニル]オキシ}ビシクロ[3.1.0]ヘキサン−6−カルボキシレート
【0227】
【化65】

【0228】
TBSエーテル16(1.86g、4.22mmol)をアセトニトリル(9.4mL)中、室温で0.84mLのHCl水溶液(1M)で4時間処理した。飽和NaHCO3水溶液(8.7mL)およびMTBE(20mL)を添加して、反応を停止した。水層を分離してMTBE(10mL×2)で抽出した。有機層を合わせ、Na2SO4で乾燥させ、減圧濃縮した。残渣をヘキサン処理することにより、結晶が得られた。これを濾過し、ヘキサン/EtOAcから再結晶することにより、高純度のアルコール17を無色の結晶として得た。
【0229】
【数16】

【0230】
(実施例15)
メチル(1R,5S,6S)−4−オキソビシクロ[3.1.0]ヘキサ−2−エン−6−カルボキシレート
【0231】
【化66】

【0232】
DMSO(0.404mL,5.70mmol)のCH2Cl2(2.6mL)溶液に、トリフルオロ酢酸無水物(0.604mL、4.28mmol)のCH2Cl2(1.5mL)溶液を−78℃で添加した。この溶液を−78℃で30分間攪拌し、アルコール17(0.885g、2.85mmol)のCH2Cl2(4.1mL)溶液を添加した(フラスコを1.0mLのCH2Cl2でリンスした)。この溶液を−78℃で30分間攪拌した後、Et3N(1.59mL、11.4mmol)をゆっくりと添加した。混合物を−78℃で2.5時間攪拌し、H2O(5mL)を添加することにより反応を停止した。MTBE(10mL)を添加した後、混合物を室温まで温めて、水層を分離し、MTBE(10ML)で抽出した。有機層を合わせて1M HCl(15mL)、飽和NaHCO3水溶液(10mL)、H2O(10mL)および塩水で洗浄し、Na2SO4で乾燥させた。溶媒を蒸発させて、残渣をフラッシュシリカゲルカラムクロマトグラフィーで精製し、α,β−不飽和ケトン18を淡黄色結晶として得た。
【0233】
【数17】

【0234】
(実施例16)
メチル(1S,2R,5R,6R)−2−{[tert−ブチル(ジメチル)シリル]オキシ}−4−オキソビシクロ[3.1.0]ヘキサン−6−カルボキシレート(21)
【0235】
【化67】

【0236】
DMSO(0.358mL,5.04mmol)のCH2Cl2(2.5mL)溶液に、トリフルオロ酢酸無水物(0.534mL、3.78mmol)のCH2Cl2(1.3mL)溶液を滴下した。反応温度は−70℃以下に保った。この溶液を−78℃で55分間攪拌した。アルコール15(722mg、2.52mmol)のCH2Cl2(3.7mL+1.0mLリンス)を滴下した。このとき、内部温度を−75℃に保った。−78℃で30分間攪拌した後、トリエチルアミン(1.05mL、7.56mmol)をゆっくりと15分かけて添加した。反応温度は−74.5℃以下に保った。混合物を−78℃で30分間攪拌した後、−20℃まで20分間かけて昇温させた。−20℃でさらに30分間攪拌して反応させた後、H2Oの添加により反応停止した。有機層を分離してMTBEで希釈し、0.5M HCl、H2O、飽和NaHCO3水溶液および塩水で洗浄し、Na2SO4で乾燥させた。溶媒を減圧除去し、残渣をフラッシュシリカゲルカラムクロマトグラフィーで精製し、無色の固形物21(673mg、収率94%)を得た。
【0237】
【数18】

【0238】
(実施例17)
メチル(1S,5R,6R)−4−オキソビシクロ[3.1.0]ヘキサ−2−エン−6−カルボキシレート(22)
【0239】
【化68】

【0240】
TBSエーテル21(50.0mg、0.176mmol)をCH2Cl2(0.9mL)中、室温で1時間DBU(0.0789mL、0.528mmol)処理した。反応物をMTBEで希釈し、1M HClおよび塩水(2回)で洗浄し、Na2SO4で乾燥させた。溶媒を減圧除去し、残渣をフラッシュシリカゲルカラムクロマトグラフィーで精製し、無色の固形物22を得た。
【0241】
【数19】

【0242】
その他のスペクトルは、実施例15で得られたα,β−不飽和ケトン18のものと一致した。
【0243】
(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.10]ヘキサン−2,6−ジカルボン酸塩酸塩11の多形体のキャラクタリゼーション
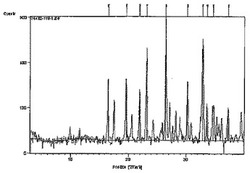
粉末X線回折による研究は、分子構造、結晶性および多形性を明らかにするために広く用いられている。実施例10で得られた塩酸塩の試料の結晶形について、Phillips回折計を用いて粉末X線回折(XRPD)パタンを集めた。測定は、3.0080度から39.9830度(2θ)まで行った。
【0244】
XRPDを図1に示す。結晶形の同定には、以下の回折を用いることができる。
【0245】
【数20】

【0246】
XPRDのピークリストを下記表1に示す。
【0247】
【表1】

【0248】
これより、ある実施形態においては、(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.10]ヘキサン−2,6−ジカルボン酸HClの多形体のCuK αを用いた粉末X線回折により決定される格子面間隔(d−spacing)が、5.37オングストローム程度である。他の実施形態にいおいては、(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.10]ヘキサン−2,6−ジカルボン酸HCl多形体のCuK αを用いた粉末X線回折により決定される格子面間隔の少なくとも一つが、4.52、4.05、3.84、3.37、2.96、2.73、2.67、2.59または2.42オングストローム程度である。
実施例10で得られた塩酸塩の試料の示差走査熱測定(DSC)を行った。装置としては、TA Instruments DSC 2910を用い、窒素雰囲気中、開いたパンを用いた。20℃から175℃までの昇温速度を10℃/分、175℃から255℃までの昇温速度を2℃/分とした。結果を図2に示す。その結果、184℃付近を開始点とする幅広い融点が示された後、227℃より高温に発熱分解が示された。
【0249】
よって、ある実施形態において、(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.10]ヘキサン−2,6−ジカルボン酸HClは、示差走査熱量測定の外挿値として、184℃付近に融解開始点を有する。
【0250】
以下の略語が本文全体で用いられる。
Me:メチル
Et:エチル
iPr:イソプロピル
Bu:ブチル
Ac:アセチル
DBU:1,8−ジアザビシクロ[5.4.0]ウンデカ−7−エン
NBS:N−ブロモスクシンイミド
NIS:N−ヨードスクシンイミド
DMF:N,N’−ジメチルホルムアミド
THF:テトラヒドロフラン
TBHP:tert−ブチルヒドロペルオキシド
MTBE:メチル−tert−ブチルエーテル
LDA:リチウムジイソプロピルアミド
TBS:tert−ブチルジメチルシリル
TMS:トリメチルシリル
TES:トリエチルシリル
DMSO:ジメチルスルホキシド
TfOH:トリフルオロメタンスルホン酸
LHMDS:リチウムヘキサメチルジシラジド
Ts:p−トルエンスルホニル(トシル)
HPLC:高速液体クロマトグラフィー
GC:ガスクロマトグラフィー
NMR:核磁気共鳴
DSC:示差走査熱測定
TLC:薄層クロマトグラフィー
XRPD:粉末X線回折
rt:室温
【0251】
以上、本発明を、特定の実施形態を参照して記載し説明した。ただし、本発明の精神および開示の範囲を超えることなく、種々の適合、変形、改良、置換、削除、または手順およびプロトコルの追加を行ってもよいことが、当業者には明らかである。たとえば、上に示した本発明の製造方法から試薬や化合物の調製手順を変更することに伴い、上述した個々の条件以外の反応条件を適用することができる。同様に、出発物質の比反応性を、個々の置換基または製造条件に依存して変えることもできる。こうした予測される変形や結果の相違も、本発明の目的および実施において想到されるものである。したがって、本発明は、請求の範囲で定義され、請求の範囲は妥当な範囲で最大限広く解釈される。
【0252】
また、すべての値は近似値であり、説明のためのものであることが理解される。特許、特許出願、出版物、製品説明書およびプロトコルは、本出願全体を通じて引用される。これらを参照することにより、その開示は、その全体について、すべての目的において、本発明に含まれる。
【図面の簡単な説明】
【0253】
本発明は、付随する以下の図面とともに説明される。
【図1】(+)−(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.1.0]ヘキサン−2,6−ジカルボン酸塩酸塩の結晶体の粉末X線回折(XPRD)パタンを示す図である。
【図2】(+)−(1R,2S,5S,6S)−2−アミノ−6−フルオロ−4−オキソビシクロ[3.1.0]ヘキサン−2,6−ジカルボン酸塩酸塩の結晶体の示差走査熱量測定のカーブを示す図である。
【特許請求の範囲】
【請求項1】
式(IA)に示される化合物およびその薬学的に許容される塩の製造方法であって、
【化1】

(式中、R1およびR2は、それぞれ、
(1)水素、
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)−(CH2)n−フェニル基
からなる群から選択される。
ただし、nは1または2であり、前記アルキル基、前記シクロアルキル基および前記フェニル基は、未置換または一以上のハロゲン、水酸基、C1-6アルキル基もしくはC1-6アルコキシ基で置換されている。
Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。)
(A)式(II)に示される化合物を酸化して、式(IV)に示される化合物を形成する工程と、
【化2】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)ハロゲン、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、またはC3-8シクロアルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化3】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
Rdは、水素またはC1-10アルキル基である。
また、R4は、
(1)水素
(2)C1-10アルキル基、
(3)Si−(R9)(R10)(R11)、
(4)C(=O)−R12、
(5)CH2−フェニル基、ただし、前記フェニル基は未置換またはニトロ基、ハロゲン、C1-10アルキル基およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されている。
(6)(CH2)p−O−(CH2)q−X’−R14、および
(7)テトラヒドロピラニル基
からなる群から選択される。
ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基であり、R14は、
(a)水素および
(b)C1-10アルキル基
からなる群から選択される。
また、pは1または2であり、
qは1から10の整数であり、
X’はOまたは単結合である。)
【化4】

(B)前記式(IV)に示される化合物を脱保護して式(V)に示される化合物を形成する工程と、
【化5】

(C)前記式(V)に示される化合物を式(VI)に示される化合物と反応させて、式(VII)に示される化合物を得る工程と、
【化6】

(式中、R5およびR6は、それぞれ独立して、
(1)水素
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)(CH2)mフェニル基
からなる群から選択される。
ただし、mは0、1または2である。
また、R7は、
(1)水素、および
(2)Si−(R9)(R10)(R11)、
からなる群から選択される。ただしR9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基である。)
【化7】

(D)前記式(VII)に示される化合物を酸化して、式(VIII)に示される化合物を得る工程と、
【化8】

(E)前記式(VIII)に示される化合物を、式(IX)に示される化合物に変換する工程と、
【化9】

(F)前記式(IX)に示される化合物を、前記式(IA)に示される化合物に変換する工程と、
を含む製造方法。
【請求項2】
請求項1に記載の製造方法において、R5およびR6がメチル基である製造方法。
【請求項3】
請求項1に記載の製造方法において、R5およびR6がフェニル基である製造方法。
【請求項4】
請求項1に記載の製造方法において、R3がメトキシ基である製造方法。
【請求項5】
請求項1に記載の製造方法において、R1およびR2が水素である製造方法。
【請求項6】
請求項1に記載の製造方法において、R7がトリメチルシリル基である製造方法。
【請求項7】
請求項1に記載の製造方法において、Xが水素である製造方法。
【請求項8】
請求項1に記載の製造方法において、Xがフルオロ基である製造方法。
【請求項9】
請求項1に記載の製造方法において、R4がtert−ブチルジメチルシリル基である製造方法。
【請求項10】
式(IA)に示される化合物およびその薬学的に許容される塩の製造方法であって、
【化10】

(式中、R1およびR2は、それぞれ、
(1)水素、
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)−(CH2)n−フェニル基
からなる群から選択される。
ただし、nは1または2であり、前記アルキル基、前記シクロアルキル基および前記フェニル基は、未置換または一以上のハロゲン、水酸基、C1-6アルキル基もしくはC1-6アルコキシ基で置換されている。
Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。)
式(IX)に示される化合物を前記式(IA)に示される化合物に変換する工程を含む製造方法。
【化11】

(式中、R5およびR6は、それぞれ独立して
(1)水素、
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)(CH2)m−フェニル基
からなる群から選択される。
ただし、mは0、1または2である。)
【請求項11】
請求項10に記載の製造方法において、R5およびR6がメチル基である製造方法。
【請求項12】
請求項10に記載の製造方法において、R5およびR6がフェニル基である製造方法。
【請求項13】
請求項10に記載の製造方法において、Xがフルオロ基である製造方法。
【請求項14】
請求項10に記載の製造方法において、Xが水素である製造方法。
【請求項15】
式(II)に示される化合物の製造方法であって、
【化12】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、
Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、またはC3-8シクロアルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化13】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
Rdは、水素またはC1-10アルキル基である。
Xは、
(1)ハロゲン、および
(2)水素
からなる群から選択される。
また、R4は、
(1)水素
(2)C1-10アルキル基、
(3)Si−(R9)(R10)(R11)、
(4)C(=O)−R12、
(5)CH2−フェニル基、ただし、前記フェニル基は未置換またはニトロ基、ハロゲン、C1-10アルキル基およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されている。
(6)(CH2)p−O−(CH2)q−X’−R14、および
(7)テトラヒドロピラニル基
からなる群から選択される。
ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基であり、R14は、
(a)水素および
(b)C1-10アルキル基
からなる群から選択される。
また、pは1または2であり、
qは1から10の整数であり、
X’はOまたは単結合である。)
(A)式(X)に示される化合物を式(XI)に示される化合物に変換する工程と、
【化14】

【化15】

(B)ルイス酸の存在下で、式(XI)に示される化合物と塩基とを反応させて、式(II)に示される化合物を得る工程と、
を含む製造方法。
【請求項16】
請求項5に記載の製造方法において、
式(X)に示される化合物を式(XI)に示される化合物に変換する前記工程が、過酸化物源および触媒量のVO(acac)2の存在下で、式(X)に示される化合物をエポキシ化する工程を含む製造方法。
【請求項17】
請求項5に記載の製造方法において、
式(X)に示される化合物を式(XI)に示される化合物に変換する前記工程が、式(X)に示される化合物をハロゲン化剤で処理した後、塩基処理する工程を含む製造方法。
【請求項18】
請求項15に記載の製造方法において、Xがフルオロ基である製造方法。
【請求項19】
請求項15に記載の製造方法において、Xが水素である製造方法。
【請求項20】
請求項5に記載の製造方法において、式(II)に示される前記化合物を酸化して式(IV)に示される化合物を形成する工程をさらに含む製造方法。
【化16】

【請求項21】
請求項20に記載の製造方法において、Xがフルオロ基である製造方法。
【請求項22】
請求項20に記載の製造方法において、Xが水素である製造方法。
【請求項23】
式(XII)に示す化合物の製造方法であって、
【化17】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、
Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、またはC3-8シクロアルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化18】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
Rdは、水素またはC1-10アルキル基である。
Xは、
(1)ハロゲン、および
(2)水素
からなる群から選択される。)
(A)式(II)に示される化合物を式(XIII)に示される化合物に変換する工程と、
【化19】

(式中、R4は、
(1)水素
(2)C1-10アルキル基、
(3)Si−(R9)(R10)(R11)、
(4)C(=O)−R12、
(5)CH2−フェニル基、ただし、前記フェニル基は未置換またはニトロ基、ハロゲン、C1-10アルキル基およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されている。
(6)(CH2)p−O−(CH2)q−X’−R14、および
(7)テトラヒドロピラニル基
からなる群から選択される。
ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基であり、R14は、
(a)水素および
(b)C1-10アルキル基
からなる群から選択される。
また、pは1または2であり、
qは1から10の整数であり、
X’はOまたは単結合である。)
【化20】

(式中、R8は、
(1)ハロゲン、および
(2)O−SO2−R12、ただし、R12は、
(a)C1-10アルキル基、
(b)C1-10パーフルオロアルキル基または
(c)未置換またはニトロ基、ハロゲン、C1-10アルキル基またはC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されたフェニル基からなる群から選択される。)
(B)R4を除去して式(XIV)に示す化合物を形成する工程と、
【化21】

(C)式(XIV)に示した化合物を酸化して式(XII)に示した前記化合物を形成する工程と、
を含む製造方法。
【請求項24】
請求項23に記載の製造方法において、R3がメトキシ基である製造方法。
【請求項25】
式(XII’)に示す化合物の製造方法であって、
【化22】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、
Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh、
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、またはC3-8シクロアルキル基からなる群から選択される。
Rdは、水素またはC1-10アルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化23】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
Xは、
(1)ハロゲン、および
(2)水素
からなる群から選択される。
R4は、
(1)水素
(2)C1-10アルキル基、
(3)Si−(R9)(R10)(R11)、
(4)C(=O)−R12、
(5)CH2−フェニル基、ただし、前記フェニル基は未置換またはニトロ基、ハロゲン、C1-10およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されている。
(6)(CH2)p−O−(CH2)q−X’−R14、および
(7)テトラヒドロピラニル基
からなる群から選択される。
ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基であり、R14は、
(a)水素および
(b)C1-10アルキル基
からなる群から選択される。
また、pは1または2であり、
qは1から10の整数であり、
X’はOまたは単結合である。)
式(IV)に示される化合物を式(XII’)に示される化合物に変換する工程を含む製造方法。
【化24】

【請求項26】
式(VII)に示す化合物およびその塩。
【化25】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、
Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、またはC3-8シクロアルキル基からなる群から選択される。
Rdは、水素またはC1-10アルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化26】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
R5およびR6は、独立して、
(1)水素
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)(CH2)m−フェニル基
からなる群から選択される。
ただし、mは0、1または2である。
また、Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。)
【請求項27】
式(VIII)に示す化合物およびその塩。
【化27】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、またはC3-8シクロアルキル基である。
Rdは、水素またはC1-10アルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化28】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
R5およびR6は、独立して、
(1)水素
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)(CH2)mフェニル基
からなる群から選択される。
ただし、mは0、1または2である。
また、Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。)
【請求項28】
式(IX)に示す化合物およびその塩。
【化29】

(式中、R5およびR6は、独立して、
(1)水素
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)(CH2)m−フェニル基
からなる群から選択される。
ただし、mは0、1または2である。
また、Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。)
【請求項29】
式(XA)に示す化合物およびその塩。
【化30】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、
Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、またはC3-8シクロアルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化31】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
Rdは、水素またはC1-10アルキル基である。)
【請求項30】
式(XI)に示す化合物およびその塩。
【化32】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、
Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、およびC3-8シクロアルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化33】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
Rdは、水素またはC1-10アルキル基である。
R4は、
(1)水素
(2)C1-10アルキル基、
(3)Si−(R9)(R10)(R11)、
(4)C(=O)−R12、
(5)CH2−フェニル基、ただし、前記フェニル基は未置換またはニトロ基、ハロゲン、C1-10アルキル基およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されている。
(6)(CH2)p−O−(CH2)q−X’−R14、および
(7)テトラヒドロピラニル基
からなる群から選択される。
ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基であり、R14は、
(a)水素および
(b)C1-10アルキル基
からなる群から選択される。
また、pは1または2であり、
qは1から10の整数であり、
X’はOまたは単結合である。
Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。)
【請求項31】
式(IVA)に示す化合物およびその塩。
【化34】

(式中、Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。
また、R4は、
(1)水素
(2)C1-10アルキル基、
(3)Si−(R9)(R10)(R11)、
(4)C(=O)−R12、
(5)CH2−フェニル基、ただし、前記フェニル基は未置換またはニトロ基、ハロゲン、C1-10アルキル基およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されている。
(6)(CH2)p−O−(CH2)q−X’−R14、および
(7)テトラヒドロピラニル基
からなる群から選択される。
ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基であり、R14は、
(a)水素および
(b)C1-10アルキル基
からなる群から選択される。
また、pは1または2であり、
qは1から10の整数であり、
X’はOまたは単結合である。)
【請求項32】
式(II)に示す化合物およびその塩。
【化35】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、
Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、およびC3-8シクロアルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化36】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
Rdは、水素またはC1-10アルキル基である。
R4は、
(1)水素
(2)C1-10アルキル基、
(3)Si−(R9)(R10)(R11)、
(4)C(=O)−R12、
(5)CH2−フェニル基、ただし、前記フェニル基は未置換またはニトロ基、ハロゲン、C1-10アルキル基およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されている。
(6)(CH2)p−O−(CH2)q−X’−R14、および
(7)テトラヒドロピラニル基
からなる群から選択される。
ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基であり、R14は、
(a)水素および
(b)C1-10アルキル基
からなる群から選択される。
また、pは1または2であり、
qは1から10の整数であり、
X’はOまたは単結合である。
Xは、
(1)ハロゲン、および
(2)水素
からなる群から選択される。)
【請求項33】
下記式に示される化合物。
【化37】

【請求項34】
請求項34に記載の化合物の多形体であって、当該多形体が、CuKα線に粉末X線回折で決定される格子面間隔が約5.37オングストロームである多形体。
【請求項35】
請求項35に記載の多形体において、さらに、CuKα線による粉末X線回折で決定される格子面間隔が、約4.52、4.05、3.84、3.37、2.96、2.73、2.67、2.59または2.42オングストロームのうち少なくとも一つを有する多形体。
【請求項36】
請求項34に記載の多形体において、示差走査熱量測定による融解開始温度の外挿値が約184℃である多形体。
【請求項1】
式(IA)に示される化合物およびその薬学的に許容される塩の製造方法であって、
【化1】

(式中、R1およびR2は、それぞれ、
(1)水素、
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)−(CH2)n−フェニル基
からなる群から選択される。
ただし、nは1または2であり、前記アルキル基、前記シクロアルキル基および前記フェニル基は、未置換または一以上のハロゲン、水酸基、C1-6アルキル基もしくはC1-6アルコキシ基で置換されている。
Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。)
(A)式(II)に示される化合物を酸化して、式(IV)に示される化合物を形成する工程と、
【化2】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)ハロゲン、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、またはC3-8シクロアルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化3】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
Rdは、水素またはC1-10アルキル基である。
また、R4は、
(1)水素
(2)C1-10アルキル基、
(3)Si−(R9)(R10)(R11)、
(4)C(=O)−R12、
(5)CH2−フェニル基、ただし、前記フェニル基は未置換またはニトロ基、ハロゲン、C1-10アルキル基およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されている。
(6)(CH2)p−O−(CH2)q−X’−R14、および
(7)テトラヒドロピラニル基
からなる群から選択される。
ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基であり、R14は、
(a)水素および
(b)C1-10アルキル基
からなる群から選択される。
また、pは1または2であり、
qは1から10の整数であり、
X’はOまたは単結合である。)
【化4】

(B)前記式(IV)に示される化合物を脱保護して式(V)に示される化合物を形成する工程と、
【化5】

(C)前記式(V)に示される化合物を式(VI)に示される化合物と反応させて、式(VII)に示される化合物を得る工程と、
【化6】

(式中、R5およびR6は、それぞれ独立して、
(1)水素
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)(CH2)mフェニル基
からなる群から選択される。
ただし、mは0、1または2である。
また、R7は、
(1)水素、および
(2)Si−(R9)(R10)(R11)、
からなる群から選択される。ただしR9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基である。)
【化7】

(D)前記式(VII)に示される化合物を酸化して、式(VIII)に示される化合物を得る工程と、
【化8】

(E)前記式(VIII)に示される化合物を、式(IX)に示される化合物に変換する工程と、
【化9】

(F)前記式(IX)に示される化合物を、前記式(IA)に示される化合物に変換する工程と、
を含む製造方法。
【請求項2】
請求項1に記載の製造方法において、R5およびR6がメチル基である製造方法。
【請求項3】
請求項1に記載の製造方法において、R5およびR6がフェニル基である製造方法。
【請求項4】
請求項1に記載の製造方法において、R3がメトキシ基である製造方法。
【請求項5】
請求項1に記載の製造方法において、R1およびR2が水素である製造方法。
【請求項6】
請求項1に記載の製造方法において、R7がトリメチルシリル基である製造方法。
【請求項7】
請求項1に記載の製造方法において、Xが水素である製造方法。
【請求項8】
請求項1に記載の製造方法において、Xがフルオロ基である製造方法。
【請求項9】
請求項1に記載の製造方法において、R4がtert−ブチルジメチルシリル基である製造方法。
【請求項10】
式(IA)に示される化合物およびその薬学的に許容される塩の製造方法であって、
【化10】

(式中、R1およびR2は、それぞれ、
(1)水素、
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)−(CH2)n−フェニル基
からなる群から選択される。
ただし、nは1または2であり、前記アルキル基、前記シクロアルキル基および前記フェニル基は、未置換または一以上のハロゲン、水酸基、C1-6アルキル基もしくはC1-6アルコキシ基で置換されている。
Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。)
式(IX)に示される化合物を前記式(IA)に示される化合物に変換する工程を含む製造方法。
【化11】

(式中、R5およびR6は、それぞれ独立して
(1)水素、
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)(CH2)m−フェニル基
からなる群から選択される。
ただし、mは0、1または2である。)
【請求項11】
請求項10に記載の製造方法において、R5およびR6がメチル基である製造方法。
【請求項12】
請求項10に記載の製造方法において、R5およびR6がフェニル基である製造方法。
【請求項13】
請求項10に記載の製造方法において、Xがフルオロ基である製造方法。
【請求項14】
請求項10に記載の製造方法において、Xが水素である製造方法。
【請求項15】
式(II)に示される化合物の製造方法であって、
【化12】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、
Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、またはC3-8シクロアルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化13】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
Rdは、水素またはC1-10アルキル基である。
Xは、
(1)ハロゲン、および
(2)水素
からなる群から選択される。
また、R4は、
(1)水素
(2)C1-10アルキル基、
(3)Si−(R9)(R10)(R11)、
(4)C(=O)−R12、
(5)CH2−フェニル基、ただし、前記フェニル基は未置換またはニトロ基、ハロゲン、C1-10アルキル基およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されている。
(6)(CH2)p−O−(CH2)q−X’−R14、および
(7)テトラヒドロピラニル基
からなる群から選択される。
ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基であり、R14は、
(a)水素および
(b)C1-10アルキル基
からなる群から選択される。
また、pは1または2であり、
qは1から10の整数であり、
X’はOまたは単結合である。)
(A)式(X)に示される化合物を式(XI)に示される化合物に変換する工程と、
【化14】

【化15】

(B)ルイス酸の存在下で、式(XI)に示される化合物と塩基とを反応させて、式(II)に示される化合物を得る工程と、
を含む製造方法。
【請求項16】
請求項5に記載の製造方法において、
式(X)に示される化合物を式(XI)に示される化合物に変換する前記工程が、過酸化物源および触媒量のVO(acac)2の存在下で、式(X)に示される化合物をエポキシ化する工程を含む製造方法。
【請求項17】
請求項5に記載の製造方法において、
式(X)に示される化合物を式(XI)に示される化合物に変換する前記工程が、式(X)に示される化合物をハロゲン化剤で処理した後、塩基処理する工程を含む製造方法。
【請求項18】
請求項15に記載の製造方法において、Xがフルオロ基である製造方法。
【請求項19】
請求項15に記載の製造方法において、Xが水素である製造方法。
【請求項20】
請求項5に記載の製造方法において、式(II)に示される前記化合物を酸化して式(IV)に示される化合物を形成する工程をさらに含む製造方法。
【化16】

【請求項21】
請求項20に記載の製造方法において、Xがフルオロ基である製造方法。
【請求項22】
請求項20に記載の製造方法において、Xが水素である製造方法。
【請求項23】
式(XII)に示す化合物の製造方法であって、
【化17】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、
Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、またはC3-8シクロアルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化18】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
Rdは、水素またはC1-10アルキル基である。
Xは、
(1)ハロゲン、および
(2)水素
からなる群から選択される。)
(A)式(II)に示される化合物を式(XIII)に示される化合物に変換する工程と、
【化19】

(式中、R4は、
(1)水素
(2)C1-10アルキル基、
(3)Si−(R9)(R10)(R11)、
(4)C(=O)−R12、
(5)CH2−フェニル基、ただし、前記フェニル基は未置換またはニトロ基、ハロゲン、C1-10アルキル基およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されている。
(6)(CH2)p−O−(CH2)q−X’−R14、および
(7)テトラヒドロピラニル基
からなる群から選択される。
ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基であり、R14は、
(a)水素および
(b)C1-10アルキル基
からなる群から選択される。
また、pは1または2であり、
qは1から10の整数であり、
X’はOまたは単結合である。)
【化20】

(式中、R8は、
(1)ハロゲン、および
(2)O−SO2−R12、ただし、R12は、
(a)C1-10アルキル基、
(b)C1-10パーフルオロアルキル基または
(c)未置換またはニトロ基、ハロゲン、C1-10アルキル基またはC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されたフェニル基からなる群から選択される。)
(B)R4を除去して式(XIV)に示す化合物を形成する工程と、
【化21】

(C)式(XIV)に示した化合物を酸化して式(XII)に示した前記化合物を形成する工程と、
を含む製造方法。
【請求項24】
請求項23に記載の製造方法において、R3がメトキシ基である製造方法。
【請求項25】
式(XII’)に示す化合物の製造方法であって、
【化22】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、
Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh、
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、またはC3-8シクロアルキル基からなる群から選択される。
Rdは、水素またはC1-10アルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化23】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
Xは、
(1)ハロゲン、および
(2)水素
からなる群から選択される。
R4は、
(1)水素
(2)C1-10アルキル基、
(3)Si−(R9)(R10)(R11)、
(4)C(=O)−R12、
(5)CH2−フェニル基、ただし、前記フェニル基は未置換またはニトロ基、ハロゲン、C1-10およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されている。
(6)(CH2)p−O−(CH2)q−X’−R14、および
(7)テトラヒドロピラニル基
からなる群から選択される。
ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基であり、R14は、
(a)水素および
(b)C1-10アルキル基
からなる群から選択される。
また、pは1または2であり、
qは1から10の整数であり、
X’はOまたは単結合である。)
式(IV)に示される化合物を式(XII’)に示される化合物に変換する工程を含む製造方法。
【化24】

【請求項26】
式(VII)に示す化合物およびその塩。
【化25】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、
Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、またはC3-8シクロアルキル基からなる群から選択される。
Rdは、水素またはC1-10アルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化26】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
R5およびR6は、独立して、
(1)水素
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)(CH2)m−フェニル基
からなる群から選択される。
ただし、mは0、1または2である。
また、Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。)
【請求項27】
式(VIII)に示す化合物およびその塩。
【化27】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、またはC3-8シクロアルキル基である。
Rdは、水素またはC1-10アルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化28】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
R5およびR6は、独立して、
(1)水素
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)(CH2)mフェニル基
からなる群から選択される。
ただし、mは0、1または2である。
また、Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。)
【請求項28】
式(IX)に示す化合物およびその塩。
【化29】

(式中、R5およびR6は、独立して、
(1)水素
(2)C1-10アルキル基、
(3)C3-8シクロアルキル基、および
(4)(CH2)m−フェニル基
からなる群から選択される。
ただし、mは0、1または2である。
また、Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。)
【請求項29】
式(XA)に示す化合物およびその塩。
【化30】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、
Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、またはC3-8シクロアルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化31】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
Rdは、水素またはC1-10アルキル基である。)
【請求項30】
式(XI)に示す化合物およびその塩。
【化32】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、
Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、およびC3-8シクロアルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化33】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
Rdは、水素またはC1-10アルキル基である。
R4は、
(1)水素
(2)C1-10アルキル基、
(3)Si−(R9)(R10)(R11)、
(4)C(=O)−R12、
(5)CH2−フェニル基、ただし、前記フェニル基は未置換またはニトロ基、ハロゲン、C1-10アルキル基およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されている。
(6)(CH2)p−O−(CH2)q−X’−R14、および
(7)テトラヒドロピラニル基
からなる群から選択される。
ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基であり、R14は、
(a)水素および
(b)C1-10アルキル基
からなる群から選択される。
また、pは1または2であり、
qは1から10の整数であり、
X’はOまたは単結合である。
Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。)
【請求項31】
式(IVA)に示す化合物およびその塩。
【化34】

(式中、Xは、
(1)ハロゲンおよび
(2)水素
からなる群から選択される。
また、R4は、
(1)水素
(2)C1-10アルキル基、
(3)Si−(R9)(R10)(R11)、
(4)C(=O)−R12、
(5)CH2−フェニル基、ただし、前記フェニル基は未置換またはニトロ基、ハロゲン、C1-10アルキル基およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されている。
(6)(CH2)p−O−(CH2)q−X’−R14、および
(7)テトラヒドロピラニル基
からなる群から選択される。
ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基であり、R14は、
(a)水素および
(b)C1-10アルキル基
からなる群から選択される。
また、pは1または2であり、
qは1から10の整数であり、
X’はOまたは単結合である。)
【請求項32】
式(II)に示す化合物およびその塩。
【化35】

(式中、R3は、
(1)−OH、
(2)−O−Ra、および
(3)−NRbRc
からなる群から選択される。
ただし、Raは、
(a)C1-10アルキル基、および
(b)C3-8シクロアルキル基
からなる群から選択され、Raは、未置換または一以上の
(i)C1-10アルコキシ基、
(ii)水酸基、
(iii)ハロゲン、
(iv)SRd、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(vi)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vii)NReRf
で置換されている。
Rb、Rc、ReおよびRfは
(a)水素、
(b)C1-10アルキル基、および
(c)C3-8シクロアルキル基
からなる群から選択され、
Rb、Rc、ReおよびRfがC1-10アルキル基またはC3-8シクロアルキル基であるとき、前記C1-10アルキル基および前記C3-8シクロアルキル基は、未置換または一以上の
(i)水酸基
(ii)C1-10アルコキシ基、
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されている。
ただし、RgおよびRhは、水素、C1-10アルキル基、およびC3-8シクロアルキル基である。
あるいは、RbおよびRcが、これらが結合するN原子とともに下記式に示す基を形成している。
【化36】

式中、rは1または2であり、前記NRbRc基は、未置換または環を構成する炭素原子が、一以上の
(i)水酸基
(ii)C1-10アルコキシ基
(iii)SRd、
(iv)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたアリール基、
(v)未置換または一以上の水酸基、C1-10アルコキシ基、C1-10アルキル基またはハロゲンで置換されたヘテロアリール基、および
(vi)NRgRh
で置換されていてもよい。
Rdは、水素またはC1-10アルキル基である。
R4は、
(1)水素
(2)C1-10アルキル基、
(3)Si−(R9)(R10)(R11)、
(4)C(=O)−R12、
(5)CH2−フェニル基、ただし、前記フェニル基は未置換またはニトロ基、ハロゲン、C1-10アルキル基およびC1-10アルコキシ基からなる群から選択される一以上の置換基で置換されている。
(6)(CH2)p−O−(CH2)q−X’−R14、および
(7)テトラヒドロピラニル基
からなる群から選択される。
ただし、R9、R10およびR11は、それぞれ、C1-10アルキル基またはフェニル基であり、R14は、
(a)水素および
(b)C1-10アルキル基
からなる群から選択される。
また、pは1または2であり、
qは1から10の整数であり、
X’はOまたは単結合である。
Xは、
(1)ハロゲン、および
(2)水素
からなる群から選択される。)
【請求項33】
下記式に示される化合物。
【化37】

【請求項34】
請求項34に記載の化合物の多形体であって、当該多形体が、CuKα線に粉末X線回折で決定される格子面間隔が約5.37オングストロームである多形体。
【請求項35】
請求項35に記載の多形体において、さらに、CuKα線による粉末X線回折で決定される格子面間隔が、約4.52、4.05、3.84、3.37、2.96、2.73、2.67、2.59または2.42オングストロームのうち少なくとも一つを有する多形体。
【請求項36】
請求項34に記載の多形体において、示差走査熱量測定による融解開始温度の外挿値が約184℃である多形体。
【図1】


【図2】




【図2】


【公表番号】特表2007−513070(P2007−513070A)
【公表日】平成19年5月24日(2007.5.24)
【国際特許分類】
【出願番号】特願2006−538449(P2006−538449)
【出願日】平成16年11月3日(2004.11.3)
【国際出願番号】PCT/US2004/036574
【国際公開番号】WO2005/047215
【国際公開日】平成17年5月26日(2005.5.26)
【出願人】(000002819)大正製薬株式会社 (437)
【Fターム(参考)】
【公表日】平成19年5月24日(2007.5.24)
【国際特許分類】
【出願日】平成16年11月3日(2004.11.3)
【国際出願番号】PCT/US2004/036574
【国際公開番号】WO2005/047215
【国際公開日】平成17年5月26日(2005.5.26)
【出願人】(000002819)大正製薬株式会社 (437)
【Fターム(参考)】
[ Back to top ]

