ビタミンB12の製造方法及びビタミンB12製造用材料
【課題】培地調整や特定の条件を特に必要とせずに簡便に効率よくビタミンB12を製造する。
【解決手段】培養液中の珪藻類及びその付着細菌を、明暗サイクルによる第1の培養期間及び暗条件のみの第2の培養期間による培養条件下で培養し、前記培養によって生成されたビタミンB12を前記培養液から回収する。前記珪藻類は、スケルトネマ・コスタツム、ユーカンピア・ゾディアカス及びステリオネラ・グラシアリスからなる群より選択された少なくとも1つであることが好ましい。また、前記珪藻類の付着細菌は、メチロファーガ属、チオバシルス属、チオハロモナス属、バクテロイデテス属、フルビコラ属及びミューカスバクテリウム属からなる群より選択された少なくとも1種であることが好ましい。
【解決手段】培養液中の珪藻類及びその付着細菌を、明暗サイクルによる第1の培養期間及び暗条件のみの第2の培養期間による培養条件下で培養し、前記培養によって生成されたビタミンB12を前記培養液から回収する。前記珪藻類は、スケルトネマ・コスタツム、ユーカンピア・ゾディアカス及びステリオネラ・グラシアリスからなる群より選択された少なくとも1つであることが好ましい。また、前記珪藻類の付着細菌は、メチロファーガ属、チオバシルス属、チオハロモナス属、バクテロイデテス属、フルビコラ属及びミューカスバクテリウム属からなる群より選択された少なくとも1種であることが好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ビタミンB12の製造方法及びビタミンB12製造用材料に関し、特に、微生物を用いたビタミンB12を製造する製造方法及びビタミンB12製造用材料に関する。
【背景技術】
【0002】
ビタミンB12は、その構造が複雑であることから化学合成するよりも微生物を用いた生物学的手法により製造されている。従来、ビタミンB12の生産に利用される微生物としては、プロピオニバクテリウム属、アセトバクテリウム属、ロドシュードモナス属、リゾビウム・コバラミノゲヌム、メタノサシルナ属などが挙げられ、これらの放線菌や細菌による発酵生産による製造方法が多く開発されている(例えば、特許文献1〜6)。
【特許文献1】特許第3611811号公報
【特許文献2】特許第3009120号公報
【特許文献3】特許第2892386号公報
【特許文献4】特表2002−540760号公報
【特許文献5】特表2000−509992号公報
【特許文献6】特公平5−4073号公報
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかしながら、放線菌や細菌による物質生産には、放線菌及び細菌を所定の培養条件下で培養することが必要である。例えば特許文献3では、アセトバクテリウム属から得た菌株を、メタノールを主要炭素源とする培地で、嫌気的条件下で培養することが必要である。また発酵には適当な炭素源が必要であるため、培地の組成を種々調整する必要がある。
従って、本発明の目的は、培地調整や特定の条件を特に必要とせずに簡便に効率よくビタミンB12を製造するための方法及びそのために使用可能な材料を提供することである。
【課題を解決するための手段】
【0004】
本発明のビタミンB12の製造方法は、培養液中の珪藻類及びその付着細菌を、明暗サイクルによる第1の培養期間及び暗条件のみの第2の培養期間による培養条件下で培養する培養工程と、前記培養によって生成されたビタミンB12を前記培養液から回収する回収工程と、を含むものである。
また本発明のビタミンB12製造用材料は、珪藻類及びその付着細菌を含むものである。
【0005】
ここで、前記珪藻類が、スケルトネマ・コスタツム(Skeletonema costatum)、ユーカンピア・ゾディアカス(Eucampia zodiacus) 及び アステリオネラ・グラシアリス(Asterionella glacialis)からなる群より選択された少なくとも1つであることが好ましい。
また、前記珪藻類の付着細菌が、前記珪藻類の付着細菌が、メチロファーガ属(Methylophaga sp.)、チオバシルス属(Thiobacillus sp.)、チオハロモナス属(Thiohalomonas sp.)、バクテロイデテス属(Bacteroidetes sp.)、フルビコラ属(Fluviicola sp.)及びミューカスバクテリウム属(Mucusbacterium sp.)からなる群より選択された少なくとも1種であることが好ましい。
前記製造方法において前記培養液は、海洋深層水であることが好ましい。
【発明の効果】
【0006】
本発明によれば、培地調整や特定の条件を特に必要とせずに簡便に効率よくビタミンB12を製造することができる。
【発明を実施するための最良の形態】
【0007】
本発明のビタミンB12の製造方法は、培養液中の珪藻類及びその付着細菌を、明暗サイクルによる第1の培養期間及び暗条件のみの第2の培養期間による培養条件下で培養する培養工程と、前記培養によって生成されたビタミンB12を前記培養液から回収する回収工程と、を含むものである。
珪藻類は、天然状態で細菌が付着した状態で存在することが多く、珪藻類とこの付着細菌との間には、栄養分の授受を含む所定の共生関係が考えられている。本発明では、このような珪藻類とその付着細菌との間の一定の関係をそのまま利用し、特定の明暗条件下で培養することにより、特別な培地組成や条件を設定することなく、簡便にビタミンB12を生成することができる。
【0008】
本発明におけるビタミンB12は、一般にコバルトコリノイドファミリーと呼ばれる化合物のうち、コバラミン類の化合物であるシアノ型ビタミンB12(シアノコバラミン)、メチルコバラミン、アデノシルコバラミン、及びヒドロキソコバラミンを挙げることができ、特にシアノコバラミン及びヒドロキソコバラミンであることが好ましい。
【0009】
本発明における珪藻類としては、海洋性植物プランクトンであって、天然状態の海水中に生存しているものであり、好ましくは、スケルトネマ・コスタツム、ユーカンピア・ゾディアカス及びアステリオネラ・グラシアリスからなる群より選択された少なくとも1つである。これらは単独で用いてもよく、2種以上を組み合わせて使用してもよい。
スケルトネマ・コスタツムは、普遍的にみられる海洋性植物プランクトンであり、沿岸、内湾域、場合によって汽水域の海水中で確認できる珪藻類である。ユーカンピア・ゾディアカスは、極域を除く世界各地の沿岸域に広く分布し、沿岸、内湾域の海水中で確認できる珪藻類である。アステリオネラ・グラシアリスは、沿岸域の海水中で確認できる珪藻類である。これらの珪藻類のうち、ビタミンB12の生成量及び生産効率の観点から、スケルトネマ・コスタツム及びユーカンピア・ゾディアカスのいずれかであることが更に好ましく、スケルトネマ・コスタツムであることが最も好ましい。
【0010】
珪藻類の付着細菌は、天然状態で容易に離脱しない程度に藻体に付着して存在するものであれば特に制限されないが、ビタミンB12の生産性の観点から、メチロファーガ属、チオバシルス属、チオハロモナス属、バクテロイデテス属、フルビコラ属及びミューカスバクテリウム属からなる群より選択された少なくとも1つであることが好ましい。
【0011】
上記珪藻類及びその付着細菌を培養するために用いられる培養液は、珪藻類及びその付着細菌の培養が可能なものであればよく、滅菌済表層海水、人工海水等を挙げることができるが、珪藻類が天然に存在している海水を含むものであることが好ましい。なお、珪藻類及びその付着細菌の培養系に海水を培養液として追加する場合には、他の微生物や浮遊物などの混入を避けるために、追加される海水を滅菌することが好ましい。滅菌方法としては、水温や栄養塩の分解を避けるためのフィルターによる濾過など、このような目的のために用いられる既知の手段を適用することができる。
【0012】
このような海水としては、水温の安定性や高栄養価の観点から海洋深層水、特に、採取された海洋深層水をそのまま用いるものであることが好ましい。
本発明に使用可能な海洋深層水は、深度200m以深の海域、海水に含まれる栄養塩濃度の観点から好ましくは300m以下、特に深度650m以下の海域から採取されたものが好ましい。一般に海洋において光は水深と共に指数関数的に減衰する。このため、深度200m以深では光合成が実施不能となるので、海洋深層水に光合成を行う微生物が存在することは期待されてなく、一般に存在しないとする認識が高い。このような海洋深層水において天然状態で海藻類及びその付着細菌が存在し、相互作用を行いながらビタミンB12を生成していることは、本発明において初めて見出されたものである。このような海洋深層水を培養液として用いる場合には、珪藻類及び付着細菌を採取した状態の海洋深層水をそのまま利用でき、培養液に対して特別な調整を行う必要性を排除することができる。
【0013】
本発明で使用可能な海洋深層水は、いずれの海洋深層水由来のものであってもよいが、珪藻類及びその付着細菌の存在頻度の観点から、日本近海、特に駿河湾深層水由来のものであることが好ましい。駿河湾深層水は、例えば、石廊崎〜御前崎を結んだ線の内側の領海の海域のものから採取したものがよい。また、「採取された海洋深層水」とは、採取された組成の海洋深層水をそのまま用いたものをいい、滅菌処理が未実施であり、他の微生物を追加してしない状態をいう。このため、必ずしも採取直後の海洋深層水でなくてもよい。
【0014】
培養液は、培養液調整の容易性の観点及び清浄性の観点から海洋深層水の割合が多いほど好ましく、少なくとも20質量%以上、好ましくは70質量%以上の海洋深層水を含むものであり、最も好ましくは海洋深層水のみで構成した培養液である。なお、用いられる海洋深層水は、異なる場所から採取されたものを混合したものであってもよい。
【0015】
また培養に用いられる培養液には、特に添加剤を必要とせずに培養に使用することができるが、栄養塩類(硝酸、リン酸、ケイ酸)、鉄、コバルト、銅、亜鉛等の添加剤を添加してもよい。これらの添加剤は、各成分として一般的に海洋性植物プランクトンの培養に用いられる濃度であれば特に制限されない。培養系中の微生物群集の数の調整の観点から、栄養塩類の含有量としては、300μg/L〜500μg/Lであることが好ましい。他の成分の場合には、培養系中の微生物群集の増殖速度及び成育状態の観点から、レッドフィールド比に基づいて適宜調整されたものであることが好ましい。レッドフィールド比に基づく調整は、当業者であれば容易に行うことができる。
【0016】
本発明における珪藻類及びその付着細菌の培養は、通常の植物プランクトンの培養条件に従ったものであればよい。具体的には、温度は、15〜30℃、微生物群集の増殖速度及び成育状態の観点から好ましくは20〜25℃であり、通常の好気的条件下で培養すればよい。このとき、培養液中の微生物群集に対して適当な空気を供給するために、また後述するような培養液の回流の発生にも利用可能なエアレーションを行うことが好ましい。
【0017】
また、培養工程では、培養液を回流させることが、培養液中の微生物群集の浮遊状態を維持することができるため好ましい。これにより、微生物群集が浮遊した状態で光合成を行うことができるため、より効率よく生理活性物質の生成を行うことができる。
培養液の回流は、微生物群集が沈殿しない程度の速度で培養液を系内で循環させればよく、培養液中の微生物群集の種類及び密度によって適宜変更可能である。また培養液の回流は、微生物群集の過度の集中や沈殿が生じない限り、一方向(層流)であっても多方向(乱流)であってもよいが、微生物群集の増殖速度の観点から多方向であることが好ましく、特に上昇流を含む循環形態であることが更に好ましい。このような回流は、ポンプ等を用いて実現することができる。
【0018】
本発明における培養工程は、明暗サイクルを用いた第1の培養期間と、暗条件のみの第2の培養期間とで構成されている。第1の培養期間では、明条件及び暗条件を所定の周期で繰り返す明暗サイクルでの培養期間であるのに対して、第2の培養期間では、暗条件のみによる培養期間である。このような暗条件のみの培養によって、培養系内の珪藻類が光合成を行うことができず、付着細菌の活性が優位となり、この結果、より効率よくビタミンB12を生成することができる。
【0019】
第1の培養期間において、明条件による培養を構成するための光照射条件としては、微生物群集の成育状態によって異なるが、一般に20μmol/m2/秒〜300μmol/m2/秒、微生物群集の増殖速度及び成育状態の観点から好ましくは50μmol/m2/秒〜200μmol/m2/秒の光照射で、例えば2〜18時間、微生物群集の増殖速度及び成育状態の観点から好ましくは8〜16時間、更に好ましくは11〜12時間の照射時間とすることができる。第1の培養期間における暗条件は、微生物群集の生活環及び明条件の照射時間に応じて適宜設定することができるが、珪藻類の光合成活性の観点から24時間以内であることが好ましく、微生物群集の増殖速度及び成育状態の観点から11〜12時間であることが更に好ましい。
【0020】
第2の培養期間では、暗条件のみで行われる。このような所定期間の暗条件によって、光合成が強制的に停止して珪藻類の自己崩壊や活性低下に起因した付着細菌の捕食による破壊が生じ、植物プランクトンの遺骸を栄養源として付着細菌が増殖する過程において、ビタミンB12が生成されると考えられる。
【0021】
第2の培養期間への切り替え時期(即ち、第1の培養期間の長さ)は、珪藻類及びその付着細菌によって効率よくビタミンB12を生成させる観点から、珪藻類の藻体数が最大となる時期に行うことが好ましく、培養開始後10日以降、好ましくは培養開始後14日とすることができる。一方、第2の培養期間は、長期間であれば多くのビタミンB12を回収することができるが、珪藻類の崩壊及び付着細菌による効率的なビタミンB12の生成の観点から、20日間〜100日間であることが好ましく40日間〜80日間であることが更に好ましい。
【0022】
回収工程は、前記培養工程において生成されたビタミンB12を培養液から回収することを含む。
培養液中のビタミンB12は、既知の精製方法によって回収することができる。培養液中のビタミンB12の精製方法としては、例えばフェノールなどを用いた溶媒抽出法や、イオン交換樹脂、シリカゲル、活性炭などを用いたクロマトグラフィー法や固相抽出法などを挙げることができる。なお、ビタミンB12を精製する際には、フィルター等を用いて、藻体の破片などの培養系中の固形物を除去することが好ましい。
一方、菌体内のビタミンB12の精製方法としては、例えば、培養液から遠心分離等により菌体を得た後、菌体にシアンイオンを加え、塩酸等の酸でpH4.5〜5に調整して煮沸することによりシアノ型ビタミンB12として分離・抽出する方法を挙げることができる。なお、菌体中のメチルコバラミン(CH3−B12)として培養液から分離する場合には、80%エタノールを用いる沸点での抽出、冷50%アセトンでの抽出、20%ピリジンを用いる抽出などを用いることができる。
【0023】
本発明のビタミンB12製造用材料は、上述した珪藻類及びその付着細菌を含むものである。このビタミンB12製造用材料は、上記本発明の製造方法における第1の培養工程及び第2の培養工程並びに回収工程にそのまま適用することにより、簡便にビタミンB12を得ることができる。
【0024】
ここでビタミンB12製造用材料は、珪藻類及びその付着細菌を含む培養液で構成されたものとすることができる。この場合に用いられる培養液としては、上記製造方法で記述されたものをそのまま適用することができる。
また、本発明のビタミンB12製造用材料は、液体の形態に限定されず、例えば、珪藻類とその付着細菌とを保持可能な支持担体で構成された固体形態であってもよい。固体形態とした場合には、取扱いを容易にすることができる。
【0025】
固体形態とするための支持担体としては、珪藻類及びその付着細菌を保持可能であればいずれのものであってよく、例えば紙、グラスファイバー、メチルセルロース、ポリビニルアルコール等の吸水性ポリマー、寒天、アルギン酸、カラゲナン、キトサン等の多糖類、その他のゲル状物質等を挙げることができる。支持担体への珪藻類及びその付着細菌の支持は、例えば、珪藻類及びその付着細菌を含む培養液を塗布、含浸などによって支持担体上又は内部に付着させればよい。珪藻類及び付着細菌の生物活性を維持する観点から、支持担体には適度に湿度が保持されていることが好ましく、また、このような湿度を保持するために、更に材料全体をフィルム等で覆って密封してもよい。
固体形態のビタミンB12製造用材料は、例えば、適当な培養液に投入することにより、珪藻類及びその付着細菌の活性を回復させ、光合成活性の回復後又は回復を目的として上記ビタミンB12製造方法の第1の培養期間を開始させることができる。支持担体の種類によっては、投入の際に予め小片化しておいてもよい。
【0026】
なお、本発明のビタミンB12製造用材料は、例えば海洋深層水中の珪藻類及び付着細菌のように低い活性を保持した状態(例えば、休眠状態)の場合には、遮光や不活性ガスを封入することが好ましい。
【0027】
本発明によって得られたビタミンB12は、各種細胞の成育補助剤として細胞用培地や飼育用飼料の添加剤として使用される他、飲料、食品、化粧品などに、単体として又は誘導体として広く使用することができる。
【実施例】
【0028】
以下に本発明の実施例について説明するが、これに限定されるものではない。
(1)珪藻類の単離及び培養
駿河湾深層水水産利用施設沖に設置された取水管より、深度397m及び687mの海水を汲み上げ、温度20℃、照度60μmol/m2/秒、明暗サイクル12時間明期/12時間暗期の条件下で培養を行った。
増殖した植物プランクトンについては、それぞれの形態から光学顕微鏡を用いて同定を行った。即ち、円形で直径2〜22μmの蓋殻、2〜60μm殻高を示し、多数の細胞が周縁有基突起でしっかりと連結して長い群体を形成することから、スケルトネマ・コスタツムが確認できた。また、扁平、長径10〜100μmの蓋殻、蓋殻面の両極の大きな突起の形態と、螺旋状の群体を形成することから、ユーカンピア・ゾディアカスが確認できた。更には、細長く基部のみが膨らんだ形状をとり、楕円形で幅8〜12μmの蓋殻面、三角形の帯面の形態と、蓋殻面末端でつながったらせん状の群体を形成することから、アステリオネラ・グラシアリスが確認できた。
その後、培養液よりピペット洗浄法を用いて珪藻細胞を単離した。単離した株は、濾過滅菌した深度397m及び687mの深層水を用いて温度20℃、照度60μmol/m2/秒、明暗サイクル8時間明期/16時間暗期の条件下で培養を行い、3週間ごとに継代培養を行った。
【0029】
(2)植物プランクトンの培養によるビタミンB12の製造
駿河湾深層水水産利用施設にてポンプで汲み上げられた深度687mの深層水を、メンブレンカートリッジフィルター(孔径0.2μm、ADVANTEC社製)で濾過して、培養用の深層水とした。培養用深層水の初期栄養塩濃度は、比色法を用いた栄養塩自動分析装置(オートアナライザー)(ブラン・ルーベ社製)による測定で、硝酸態窒素29μmol/L、リン酸態リン2μmol/L、ケイ酸態ケイ素64μmol/Lであった。
【0030】
この培養用深層水10リットルを培養ボトルに充填し、これに上記(1)で確認された植物プランクトン、スケルトネマ・コスタツム、ユーカンピア・ゾディアカス又はアステリオネラ・グラシアリスと、それぞれの付着細菌とを添加し、エアレーションによる通気条件下で、温度20℃、光強度60μmol/m2/秒、明暗サイクル12時間明期/12時間暗期の培養を行った。培養ボトルの藻体の初期細胞密度は、1細胞/mLになるように調整し、各ボトルに添加した。培養開始後14日目以降は暗条件下で継続して培養を行い、植物プランクトンの成育を阻止し、死滅させた。
【0031】
培養開始後3日、10日、14日、20日、35日、65日及び94日目に培養系の一部をサンプルとして採取し、培養系中の藻個体数、細菌数、溶存ビタミンB12量を測定した。また65日目の培養系の一部を用いて付着細菌の同定を行った。
[藻個体数]
サンプル採取後、試料を5%(v/v)の中性ホルマリンで固定し、計数まで室温にて保存した。培養ボトルを静置させて藻体を沈殿させることによって濃縮後、倒立顕微鏡下で直接計数した。
[細菌数]
サンプル採取後、試料を25%(v/v)グルタルアルデヒドで固定し、計数まで4℃で冷蔵保存した。試料の一部にDAPI(4’,6−ジアミジノ−2−フェニルインドール)溶液を添加し(終濃度0.5μg/mL)、15分間室温にて反応させた。試料をブラックメンブレンフィルター(孔径0.2μm、ミリポア社製)で濾過し、フィルター上に細菌を捕集した後、フィルターをスライドグラスにのせ、落射蛍光顕微鏡(ニコン社製)による直接計数を行った。
【0032】
[付着細菌の同定]
付着細菌は、培養系からメンブレンフィルター(孔径0.2μm、ミリポア社製)を用いた濾過によって回収した後に、常法に従って16S rDNAの塩配列を決定し、DNAデータベース(DDBJ)にアクセスして、BLASTプログラムを用いて、16S rDNAの相同性検索を行った。結果、メチロファーガ(Methylophaga sp. V4.MO.19、 Accession No. AJ244762、99%、Methylophaga sp. V4.ME.29、 Accession No. AJ244761、99%)、チオハロモナス・ニトラチレデュセンス(Thiohalomonas nitratireducens、Accession No. DQ836238、94%)、チオバシルス・プロスペラス(Thiobacillus prosperus、Accession No. AY034139、95%)、バクテリオデテス・バクテリウム(Bacteroidetes bacterium GMDJE10E6、Accession No. AY162091、89%)、フルビコラ・タフェンシス(Fluviicola taffensis、 Accession No. AF493694、87%)及びミューカス・バクテリウム(Mucus bacterium 36、Accession No. AY654772、97%)にそれぞれ高い相同性を有した。この結果から、これらの細菌を珪藻類の付着細菌として認定した。
【0033】
[溶存ビタミンB12の抽出及び定量]
試料をメンブレンフィルター(孔径2μm及び0.2μm、ミリポア社製)で2回濾過後、濾液中の溶存ビタミンB12を固相抽出(SPE)法で回収した。使用したカラムは、スチレンジビニルベンゼン共重合体基材のカラム(STRATA X(商品名)、Phenomenex社製)であり、通液の流速を1mL/秒以下とし、固相抽出の作業を遮光して行い、ビタミンB12の光分解を回避した。試料の通液終了後にMilliQを流して、カラムに保持されている夾雑物を除去し、その後カラムを脱水して更に15分間、通液せずに吸引し、カラムに含まれている水分を充分に取り除いた。その後、5mLのメタノール(HPLC用、純度:99.8%、和光純薬工業社製)をカラムになじませながら通液させ、カラムに保持されていたビタミンB12を抽出した。抽出液は共栓付ガラス管に入れてすぐにアルミホイルで遮光し、保存が必要な場合はそのまま−20℃で冷凍保存した。
固相抽出後、抽出液(メタノール溶出液)5mLを、減圧下で最大遠心力225×gの条件で遠心し、メタノールを揮発させた。これにより、試料を100μL以下の容量に濃縮し、Milli−Qで0.5mLに定容し、4000倍に濃縮した。
【0034】
濃縮試料液を、HPLCを用いてビタミンB12を定量した。カラム及び分析条件は下記のとおりである。
固定相
C18カラム(オクタデシルシラン基(ODS)結合シリカ、4.6mm×150mm、5μm)(LUNAC18、Phenomenex社製)
移動相
A液:酢酸アンモニウム(0.05mol/L、pH6.1〜6.7)
B液:100%メタノール
グラジェント
A:B=92.5:7.5(0〜1.5分)
84:16(1.6分)
70:30(〜20分)
カラム恒温槽温度:25℃
流速:1mL/分
ビタミンB12の検出は、362nmの吸光度に基づいて行った。
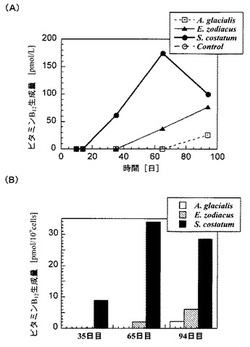
藻体及びその付着細菌の数の変化を図1に、培養系におけるビタミンB12量については表1、表2及び図2に示す。
【0035】
【表1】

【0036】
【表2】

【0037】
図1に示されるように、培養14日目ではいずれの植物プランクトンも藻体数が最大となっていた(図1(A)参照)。この最大藻体数の時期に暗条件へ切り替えることにより、植物プランクトンの数が減少したが、その後、付着細菌の菌数は増加した(図1(B)参照)。このことは、植物プランクトンの崩壊又は付着細菌による有機物分解が進行したため、植物プランクトンを栄養源として付着細菌が増殖したことを示唆している。
また、表1及び図2に示されるように、アステリオネラ・グラシアリス、ユーカンピア・ゾディアカス及びスケルトネマ・コスタツムを含む培養系では、ビタミンB12が生成されていることが確認できた。特に、ビタミンB12の生成量は、付着細菌が最大数となった後に最大量となっており(図2(A)参照)、植物プランクトン又は付着細菌がそれぞれ、良好な成育状態のときに単独で生成しているものでないことが示される。これらのことから、植物プランクトンが死滅することで付着細菌に栄養分が供給され、付着細菌がこれを有効利用し、ビタミンB12を生成していることが示唆される。
特にスケルトネマ・コスタツムの場合は、表2及び図2(B)に示されるように、付着細菌109個あたりと培養液1リットルあたりの双方においてビタミンB12の生成量が多く、最も効率よくビタミンB12を生成できることは明らかであった。
【0038】
このことから、本発明によれば、珪藻類及びその付着細菌を用いて培地調整や特定の条件を特に必要とせずに簡便に効率よくビタミンB12を製造することができる。
【図面の簡単な説明】
【0039】
【図1】本発明の実施例にかかる植物プランクトンの増殖を示すグラフ(A)と、付着細菌の増殖を示すグラフ(B)である。
【図2】本発明の実施例にかかる培養用海洋深層水1LあたりのビタミンB12の生成量を示すグラフ(A)と、付着細菌数あたりのビタミンB12の生成量を示すグラフ(B)である。
【技術分野】
【0001】
本発明は、ビタミンB12の製造方法及びビタミンB12製造用材料に関し、特に、微生物を用いたビタミンB12を製造する製造方法及びビタミンB12製造用材料に関する。
【背景技術】
【0002】
ビタミンB12は、その構造が複雑であることから化学合成するよりも微生物を用いた生物学的手法により製造されている。従来、ビタミンB12の生産に利用される微生物としては、プロピオニバクテリウム属、アセトバクテリウム属、ロドシュードモナス属、リゾビウム・コバラミノゲヌム、メタノサシルナ属などが挙げられ、これらの放線菌や細菌による発酵生産による製造方法が多く開発されている(例えば、特許文献1〜6)。
【特許文献1】特許第3611811号公報
【特許文献2】特許第3009120号公報
【特許文献3】特許第2892386号公報
【特許文献4】特表2002−540760号公報
【特許文献5】特表2000−509992号公報
【特許文献6】特公平5−4073号公報
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかしながら、放線菌や細菌による物質生産には、放線菌及び細菌を所定の培養条件下で培養することが必要である。例えば特許文献3では、アセトバクテリウム属から得た菌株を、メタノールを主要炭素源とする培地で、嫌気的条件下で培養することが必要である。また発酵には適当な炭素源が必要であるため、培地の組成を種々調整する必要がある。
従って、本発明の目的は、培地調整や特定の条件を特に必要とせずに簡便に効率よくビタミンB12を製造するための方法及びそのために使用可能な材料を提供することである。
【課題を解決するための手段】
【0004】
本発明のビタミンB12の製造方法は、培養液中の珪藻類及びその付着細菌を、明暗サイクルによる第1の培養期間及び暗条件のみの第2の培養期間による培養条件下で培養する培養工程と、前記培養によって生成されたビタミンB12を前記培養液から回収する回収工程と、を含むものである。
また本発明のビタミンB12製造用材料は、珪藻類及びその付着細菌を含むものである。
【0005】
ここで、前記珪藻類が、スケルトネマ・コスタツム(Skeletonema costatum)、ユーカンピア・ゾディアカス(Eucampia zodiacus) 及び アステリオネラ・グラシアリス(Asterionella glacialis)からなる群より選択された少なくとも1つであることが好ましい。
また、前記珪藻類の付着細菌が、前記珪藻類の付着細菌が、メチロファーガ属(Methylophaga sp.)、チオバシルス属(Thiobacillus sp.)、チオハロモナス属(Thiohalomonas sp.)、バクテロイデテス属(Bacteroidetes sp.)、フルビコラ属(Fluviicola sp.)及びミューカスバクテリウム属(Mucusbacterium sp.)からなる群より選択された少なくとも1種であることが好ましい。
前記製造方法において前記培養液は、海洋深層水であることが好ましい。
【発明の効果】
【0006】
本発明によれば、培地調整や特定の条件を特に必要とせずに簡便に効率よくビタミンB12を製造することができる。
【発明を実施するための最良の形態】
【0007】
本発明のビタミンB12の製造方法は、培養液中の珪藻類及びその付着細菌を、明暗サイクルによる第1の培養期間及び暗条件のみの第2の培養期間による培養条件下で培養する培養工程と、前記培養によって生成されたビタミンB12を前記培養液から回収する回収工程と、を含むものである。
珪藻類は、天然状態で細菌が付着した状態で存在することが多く、珪藻類とこの付着細菌との間には、栄養分の授受を含む所定の共生関係が考えられている。本発明では、このような珪藻類とその付着細菌との間の一定の関係をそのまま利用し、特定の明暗条件下で培養することにより、特別な培地組成や条件を設定することなく、簡便にビタミンB12を生成することができる。
【0008】
本発明におけるビタミンB12は、一般にコバルトコリノイドファミリーと呼ばれる化合物のうち、コバラミン類の化合物であるシアノ型ビタミンB12(シアノコバラミン)、メチルコバラミン、アデノシルコバラミン、及びヒドロキソコバラミンを挙げることができ、特にシアノコバラミン及びヒドロキソコバラミンであることが好ましい。
【0009】
本発明における珪藻類としては、海洋性植物プランクトンであって、天然状態の海水中に生存しているものであり、好ましくは、スケルトネマ・コスタツム、ユーカンピア・ゾディアカス及びアステリオネラ・グラシアリスからなる群より選択された少なくとも1つである。これらは単独で用いてもよく、2種以上を組み合わせて使用してもよい。
スケルトネマ・コスタツムは、普遍的にみられる海洋性植物プランクトンであり、沿岸、内湾域、場合によって汽水域の海水中で確認できる珪藻類である。ユーカンピア・ゾディアカスは、極域を除く世界各地の沿岸域に広く分布し、沿岸、内湾域の海水中で確認できる珪藻類である。アステリオネラ・グラシアリスは、沿岸域の海水中で確認できる珪藻類である。これらの珪藻類のうち、ビタミンB12の生成量及び生産効率の観点から、スケルトネマ・コスタツム及びユーカンピア・ゾディアカスのいずれかであることが更に好ましく、スケルトネマ・コスタツムであることが最も好ましい。
【0010】
珪藻類の付着細菌は、天然状態で容易に離脱しない程度に藻体に付着して存在するものであれば特に制限されないが、ビタミンB12の生産性の観点から、メチロファーガ属、チオバシルス属、チオハロモナス属、バクテロイデテス属、フルビコラ属及びミューカスバクテリウム属からなる群より選択された少なくとも1つであることが好ましい。
【0011】
上記珪藻類及びその付着細菌を培養するために用いられる培養液は、珪藻類及びその付着細菌の培養が可能なものであればよく、滅菌済表層海水、人工海水等を挙げることができるが、珪藻類が天然に存在している海水を含むものであることが好ましい。なお、珪藻類及びその付着細菌の培養系に海水を培養液として追加する場合には、他の微生物や浮遊物などの混入を避けるために、追加される海水を滅菌することが好ましい。滅菌方法としては、水温や栄養塩の分解を避けるためのフィルターによる濾過など、このような目的のために用いられる既知の手段を適用することができる。
【0012】
このような海水としては、水温の安定性や高栄養価の観点から海洋深層水、特に、採取された海洋深層水をそのまま用いるものであることが好ましい。
本発明に使用可能な海洋深層水は、深度200m以深の海域、海水に含まれる栄養塩濃度の観点から好ましくは300m以下、特に深度650m以下の海域から採取されたものが好ましい。一般に海洋において光は水深と共に指数関数的に減衰する。このため、深度200m以深では光合成が実施不能となるので、海洋深層水に光合成を行う微生物が存在することは期待されてなく、一般に存在しないとする認識が高い。このような海洋深層水において天然状態で海藻類及びその付着細菌が存在し、相互作用を行いながらビタミンB12を生成していることは、本発明において初めて見出されたものである。このような海洋深層水を培養液として用いる場合には、珪藻類及び付着細菌を採取した状態の海洋深層水をそのまま利用でき、培養液に対して特別な調整を行う必要性を排除することができる。
【0013】
本発明で使用可能な海洋深層水は、いずれの海洋深層水由来のものであってもよいが、珪藻類及びその付着細菌の存在頻度の観点から、日本近海、特に駿河湾深層水由来のものであることが好ましい。駿河湾深層水は、例えば、石廊崎〜御前崎を結んだ線の内側の領海の海域のものから採取したものがよい。また、「採取された海洋深層水」とは、採取された組成の海洋深層水をそのまま用いたものをいい、滅菌処理が未実施であり、他の微生物を追加してしない状態をいう。このため、必ずしも採取直後の海洋深層水でなくてもよい。
【0014】
培養液は、培養液調整の容易性の観点及び清浄性の観点から海洋深層水の割合が多いほど好ましく、少なくとも20質量%以上、好ましくは70質量%以上の海洋深層水を含むものであり、最も好ましくは海洋深層水のみで構成した培養液である。なお、用いられる海洋深層水は、異なる場所から採取されたものを混合したものであってもよい。
【0015】
また培養に用いられる培養液には、特に添加剤を必要とせずに培養に使用することができるが、栄養塩類(硝酸、リン酸、ケイ酸)、鉄、コバルト、銅、亜鉛等の添加剤を添加してもよい。これらの添加剤は、各成分として一般的に海洋性植物プランクトンの培養に用いられる濃度であれば特に制限されない。培養系中の微生物群集の数の調整の観点から、栄養塩類の含有量としては、300μg/L〜500μg/Lであることが好ましい。他の成分の場合には、培養系中の微生物群集の増殖速度及び成育状態の観点から、レッドフィールド比に基づいて適宜調整されたものであることが好ましい。レッドフィールド比に基づく調整は、当業者であれば容易に行うことができる。
【0016】
本発明における珪藻類及びその付着細菌の培養は、通常の植物プランクトンの培養条件に従ったものであればよい。具体的には、温度は、15〜30℃、微生物群集の増殖速度及び成育状態の観点から好ましくは20〜25℃であり、通常の好気的条件下で培養すればよい。このとき、培養液中の微生物群集に対して適当な空気を供給するために、また後述するような培養液の回流の発生にも利用可能なエアレーションを行うことが好ましい。
【0017】
また、培養工程では、培養液を回流させることが、培養液中の微生物群集の浮遊状態を維持することができるため好ましい。これにより、微生物群集が浮遊した状態で光合成を行うことができるため、より効率よく生理活性物質の生成を行うことができる。
培養液の回流は、微生物群集が沈殿しない程度の速度で培養液を系内で循環させればよく、培養液中の微生物群集の種類及び密度によって適宜変更可能である。また培養液の回流は、微生物群集の過度の集中や沈殿が生じない限り、一方向(層流)であっても多方向(乱流)であってもよいが、微生物群集の増殖速度の観点から多方向であることが好ましく、特に上昇流を含む循環形態であることが更に好ましい。このような回流は、ポンプ等を用いて実現することができる。
【0018】
本発明における培養工程は、明暗サイクルを用いた第1の培養期間と、暗条件のみの第2の培養期間とで構成されている。第1の培養期間では、明条件及び暗条件を所定の周期で繰り返す明暗サイクルでの培養期間であるのに対して、第2の培養期間では、暗条件のみによる培養期間である。このような暗条件のみの培養によって、培養系内の珪藻類が光合成を行うことができず、付着細菌の活性が優位となり、この結果、より効率よくビタミンB12を生成することができる。
【0019】
第1の培養期間において、明条件による培養を構成するための光照射条件としては、微生物群集の成育状態によって異なるが、一般に20μmol/m2/秒〜300μmol/m2/秒、微生物群集の増殖速度及び成育状態の観点から好ましくは50μmol/m2/秒〜200μmol/m2/秒の光照射で、例えば2〜18時間、微生物群集の増殖速度及び成育状態の観点から好ましくは8〜16時間、更に好ましくは11〜12時間の照射時間とすることができる。第1の培養期間における暗条件は、微生物群集の生活環及び明条件の照射時間に応じて適宜設定することができるが、珪藻類の光合成活性の観点から24時間以内であることが好ましく、微生物群集の増殖速度及び成育状態の観点から11〜12時間であることが更に好ましい。
【0020】
第2の培養期間では、暗条件のみで行われる。このような所定期間の暗条件によって、光合成が強制的に停止して珪藻類の自己崩壊や活性低下に起因した付着細菌の捕食による破壊が生じ、植物プランクトンの遺骸を栄養源として付着細菌が増殖する過程において、ビタミンB12が生成されると考えられる。
【0021】
第2の培養期間への切り替え時期(即ち、第1の培養期間の長さ)は、珪藻類及びその付着細菌によって効率よくビタミンB12を生成させる観点から、珪藻類の藻体数が最大となる時期に行うことが好ましく、培養開始後10日以降、好ましくは培養開始後14日とすることができる。一方、第2の培養期間は、長期間であれば多くのビタミンB12を回収することができるが、珪藻類の崩壊及び付着細菌による効率的なビタミンB12の生成の観点から、20日間〜100日間であることが好ましく40日間〜80日間であることが更に好ましい。
【0022】
回収工程は、前記培養工程において生成されたビタミンB12を培養液から回収することを含む。
培養液中のビタミンB12は、既知の精製方法によって回収することができる。培養液中のビタミンB12の精製方法としては、例えばフェノールなどを用いた溶媒抽出法や、イオン交換樹脂、シリカゲル、活性炭などを用いたクロマトグラフィー法や固相抽出法などを挙げることができる。なお、ビタミンB12を精製する際には、フィルター等を用いて、藻体の破片などの培養系中の固形物を除去することが好ましい。
一方、菌体内のビタミンB12の精製方法としては、例えば、培養液から遠心分離等により菌体を得た後、菌体にシアンイオンを加え、塩酸等の酸でpH4.5〜5に調整して煮沸することによりシアノ型ビタミンB12として分離・抽出する方法を挙げることができる。なお、菌体中のメチルコバラミン(CH3−B12)として培養液から分離する場合には、80%エタノールを用いる沸点での抽出、冷50%アセトンでの抽出、20%ピリジンを用いる抽出などを用いることができる。
【0023】
本発明のビタミンB12製造用材料は、上述した珪藻類及びその付着細菌を含むものである。このビタミンB12製造用材料は、上記本発明の製造方法における第1の培養工程及び第2の培養工程並びに回収工程にそのまま適用することにより、簡便にビタミンB12を得ることができる。
【0024】
ここでビタミンB12製造用材料は、珪藻類及びその付着細菌を含む培養液で構成されたものとすることができる。この場合に用いられる培養液としては、上記製造方法で記述されたものをそのまま適用することができる。
また、本発明のビタミンB12製造用材料は、液体の形態に限定されず、例えば、珪藻類とその付着細菌とを保持可能な支持担体で構成された固体形態であってもよい。固体形態とした場合には、取扱いを容易にすることができる。
【0025】
固体形態とするための支持担体としては、珪藻類及びその付着細菌を保持可能であればいずれのものであってよく、例えば紙、グラスファイバー、メチルセルロース、ポリビニルアルコール等の吸水性ポリマー、寒天、アルギン酸、カラゲナン、キトサン等の多糖類、その他のゲル状物質等を挙げることができる。支持担体への珪藻類及びその付着細菌の支持は、例えば、珪藻類及びその付着細菌を含む培養液を塗布、含浸などによって支持担体上又は内部に付着させればよい。珪藻類及び付着細菌の生物活性を維持する観点から、支持担体には適度に湿度が保持されていることが好ましく、また、このような湿度を保持するために、更に材料全体をフィルム等で覆って密封してもよい。
固体形態のビタミンB12製造用材料は、例えば、適当な培養液に投入することにより、珪藻類及びその付着細菌の活性を回復させ、光合成活性の回復後又は回復を目的として上記ビタミンB12製造方法の第1の培養期間を開始させることができる。支持担体の種類によっては、投入の際に予め小片化しておいてもよい。
【0026】
なお、本発明のビタミンB12製造用材料は、例えば海洋深層水中の珪藻類及び付着細菌のように低い活性を保持した状態(例えば、休眠状態)の場合には、遮光や不活性ガスを封入することが好ましい。
【0027】
本発明によって得られたビタミンB12は、各種細胞の成育補助剤として細胞用培地や飼育用飼料の添加剤として使用される他、飲料、食品、化粧品などに、単体として又は誘導体として広く使用することができる。
【実施例】
【0028】
以下に本発明の実施例について説明するが、これに限定されるものではない。
(1)珪藻類の単離及び培養
駿河湾深層水水産利用施設沖に設置された取水管より、深度397m及び687mの海水を汲み上げ、温度20℃、照度60μmol/m2/秒、明暗サイクル12時間明期/12時間暗期の条件下で培養を行った。
増殖した植物プランクトンについては、それぞれの形態から光学顕微鏡を用いて同定を行った。即ち、円形で直径2〜22μmの蓋殻、2〜60μm殻高を示し、多数の細胞が周縁有基突起でしっかりと連結して長い群体を形成することから、スケルトネマ・コスタツムが確認できた。また、扁平、長径10〜100μmの蓋殻、蓋殻面の両極の大きな突起の形態と、螺旋状の群体を形成することから、ユーカンピア・ゾディアカスが確認できた。更には、細長く基部のみが膨らんだ形状をとり、楕円形で幅8〜12μmの蓋殻面、三角形の帯面の形態と、蓋殻面末端でつながったらせん状の群体を形成することから、アステリオネラ・グラシアリスが確認できた。
その後、培養液よりピペット洗浄法を用いて珪藻細胞を単離した。単離した株は、濾過滅菌した深度397m及び687mの深層水を用いて温度20℃、照度60μmol/m2/秒、明暗サイクル8時間明期/16時間暗期の条件下で培養を行い、3週間ごとに継代培養を行った。
【0029】
(2)植物プランクトンの培養によるビタミンB12の製造
駿河湾深層水水産利用施設にてポンプで汲み上げられた深度687mの深層水を、メンブレンカートリッジフィルター(孔径0.2μm、ADVANTEC社製)で濾過して、培養用の深層水とした。培養用深層水の初期栄養塩濃度は、比色法を用いた栄養塩自動分析装置(オートアナライザー)(ブラン・ルーベ社製)による測定で、硝酸態窒素29μmol/L、リン酸態リン2μmol/L、ケイ酸態ケイ素64μmol/Lであった。
【0030】
この培養用深層水10リットルを培養ボトルに充填し、これに上記(1)で確認された植物プランクトン、スケルトネマ・コスタツム、ユーカンピア・ゾディアカス又はアステリオネラ・グラシアリスと、それぞれの付着細菌とを添加し、エアレーションによる通気条件下で、温度20℃、光強度60μmol/m2/秒、明暗サイクル12時間明期/12時間暗期の培養を行った。培養ボトルの藻体の初期細胞密度は、1細胞/mLになるように調整し、各ボトルに添加した。培養開始後14日目以降は暗条件下で継続して培養を行い、植物プランクトンの成育を阻止し、死滅させた。
【0031】
培養開始後3日、10日、14日、20日、35日、65日及び94日目に培養系の一部をサンプルとして採取し、培養系中の藻個体数、細菌数、溶存ビタミンB12量を測定した。また65日目の培養系の一部を用いて付着細菌の同定を行った。
[藻個体数]
サンプル採取後、試料を5%(v/v)の中性ホルマリンで固定し、計数まで室温にて保存した。培養ボトルを静置させて藻体を沈殿させることによって濃縮後、倒立顕微鏡下で直接計数した。
[細菌数]
サンプル採取後、試料を25%(v/v)グルタルアルデヒドで固定し、計数まで4℃で冷蔵保存した。試料の一部にDAPI(4’,6−ジアミジノ−2−フェニルインドール)溶液を添加し(終濃度0.5μg/mL)、15分間室温にて反応させた。試料をブラックメンブレンフィルター(孔径0.2μm、ミリポア社製)で濾過し、フィルター上に細菌を捕集した後、フィルターをスライドグラスにのせ、落射蛍光顕微鏡(ニコン社製)による直接計数を行った。
【0032】
[付着細菌の同定]
付着細菌は、培養系からメンブレンフィルター(孔径0.2μm、ミリポア社製)を用いた濾過によって回収した後に、常法に従って16S rDNAの塩配列を決定し、DNAデータベース(DDBJ)にアクセスして、BLASTプログラムを用いて、16S rDNAの相同性検索を行った。結果、メチロファーガ(Methylophaga sp. V4.MO.19、 Accession No. AJ244762、99%、Methylophaga sp. V4.ME.29、 Accession No. AJ244761、99%)、チオハロモナス・ニトラチレデュセンス(Thiohalomonas nitratireducens、Accession No. DQ836238、94%)、チオバシルス・プロスペラス(Thiobacillus prosperus、Accession No. AY034139、95%)、バクテリオデテス・バクテリウム(Bacteroidetes bacterium GMDJE10E6、Accession No. AY162091、89%)、フルビコラ・タフェンシス(Fluviicola taffensis、 Accession No. AF493694、87%)及びミューカス・バクテリウム(Mucus bacterium 36、Accession No. AY654772、97%)にそれぞれ高い相同性を有した。この結果から、これらの細菌を珪藻類の付着細菌として認定した。
【0033】
[溶存ビタミンB12の抽出及び定量]
試料をメンブレンフィルター(孔径2μm及び0.2μm、ミリポア社製)で2回濾過後、濾液中の溶存ビタミンB12を固相抽出(SPE)法で回収した。使用したカラムは、スチレンジビニルベンゼン共重合体基材のカラム(STRATA X(商品名)、Phenomenex社製)であり、通液の流速を1mL/秒以下とし、固相抽出の作業を遮光して行い、ビタミンB12の光分解を回避した。試料の通液終了後にMilliQを流して、カラムに保持されている夾雑物を除去し、その後カラムを脱水して更に15分間、通液せずに吸引し、カラムに含まれている水分を充分に取り除いた。その後、5mLのメタノール(HPLC用、純度:99.8%、和光純薬工業社製)をカラムになじませながら通液させ、カラムに保持されていたビタミンB12を抽出した。抽出液は共栓付ガラス管に入れてすぐにアルミホイルで遮光し、保存が必要な場合はそのまま−20℃で冷凍保存した。
固相抽出後、抽出液(メタノール溶出液)5mLを、減圧下で最大遠心力225×gの条件で遠心し、メタノールを揮発させた。これにより、試料を100μL以下の容量に濃縮し、Milli−Qで0.5mLに定容し、4000倍に濃縮した。
【0034】
濃縮試料液を、HPLCを用いてビタミンB12を定量した。カラム及び分析条件は下記のとおりである。
固定相
C18カラム(オクタデシルシラン基(ODS)結合シリカ、4.6mm×150mm、5μm)(LUNAC18、Phenomenex社製)
移動相
A液:酢酸アンモニウム(0.05mol/L、pH6.1〜6.7)
B液:100%メタノール
グラジェント
A:B=92.5:7.5(0〜1.5分)
84:16(1.6分)
70:30(〜20分)
カラム恒温槽温度:25℃
流速:1mL/分
ビタミンB12の検出は、362nmの吸光度に基づいて行った。
藻体及びその付着細菌の数の変化を図1に、培養系におけるビタミンB12量については表1、表2及び図2に示す。
【0035】
【表1】

【0036】
【表2】

【0037】
図1に示されるように、培養14日目ではいずれの植物プランクトンも藻体数が最大となっていた(図1(A)参照)。この最大藻体数の時期に暗条件へ切り替えることにより、植物プランクトンの数が減少したが、その後、付着細菌の菌数は増加した(図1(B)参照)。このことは、植物プランクトンの崩壊又は付着細菌による有機物分解が進行したため、植物プランクトンを栄養源として付着細菌が増殖したことを示唆している。
また、表1及び図2に示されるように、アステリオネラ・グラシアリス、ユーカンピア・ゾディアカス及びスケルトネマ・コスタツムを含む培養系では、ビタミンB12が生成されていることが確認できた。特に、ビタミンB12の生成量は、付着細菌が最大数となった後に最大量となっており(図2(A)参照)、植物プランクトン又は付着細菌がそれぞれ、良好な成育状態のときに単独で生成しているものでないことが示される。これらのことから、植物プランクトンが死滅することで付着細菌に栄養分が供給され、付着細菌がこれを有効利用し、ビタミンB12を生成していることが示唆される。
特にスケルトネマ・コスタツムの場合は、表2及び図2(B)に示されるように、付着細菌109個あたりと培養液1リットルあたりの双方においてビタミンB12の生成量が多く、最も効率よくビタミンB12を生成できることは明らかであった。
【0038】
このことから、本発明によれば、珪藻類及びその付着細菌を用いて培地調整や特定の条件を特に必要とせずに簡便に効率よくビタミンB12を製造することができる。
【図面の簡単な説明】
【0039】
【図1】本発明の実施例にかかる植物プランクトンの増殖を示すグラフ(A)と、付着細菌の増殖を示すグラフ(B)である。
【図2】本発明の実施例にかかる培養用海洋深層水1LあたりのビタミンB12の生成量を示すグラフ(A)と、付着細菌数あたりのビタミンB12の生成量を示すグラフ(B)である。
【特許請求の範囲】
【請求項1】
培養液中の珪藻類及びその付着細菌を、明暗サイクルによる第1の培養期間及び暗条件のみの第2の培養期間による培養条件下で培養する培養工程と、
前記培養によって生成されたビタミンB12を前記培養液から回収する回収工程と、
を含むビタミンB12の製造方法。
【請求項2】
前記珪藻類が、スケルトネマ・コスタツム、ユーカンピア・ゾディアカス及びアステリオネラ・グラシアリスからなる群より選択された少なくとも1つである請求項1記載のビタミンB12の製造方法。
【請求項3】
前記珪藻類の付着細菌が、メチロファーガ属、チオバシルス属、チオハロモナス属、バクテロイデテス属、フルビコラ属及びミューカスバクテリウム属からなる群より選択された少なくとも1種である請求項1又は請求項2記載のビタミンB12の製造方法。
【請求項4】
前記培養液が、海洋深層水である請求項1〜請求項3のいずれか1項記載のビタミンB12の製造方法。
【請求項5】
珪藻類及びその付着細菌を含むビタミンB12製造用材料。
【請求項1】
培養液中の珪藻類及びその付着細菌を、明暗サイクルによる第1の培養期間及び暗条件のみの第2の培養期間による培養条件下で培養する培養工程と、
前記培養によって生成されたビタミンB12を前記培養液から回収する回収工程と、
を含むビタミンB12の製造方法。
【請求項2】
前記珪藻類が、スケルトネマ・コスタツム、ユーカンピア・ゾディアカス及びアステリオネラ・グラシアリスからなる群より選択された少なくとも1つである請求項1記載のビタミンB12の製造方法。
【請求項3】
前記珪藻類の付着細菌が、メチロファーガ属、チオバシルス属、チオハロモナス属、バクテロイデテス属、フルビコラ属及びミューカスバクテリウム属からなる群より選択された少なくとも1種である請求項1又は請求項2記載のビタミンB12の製造方法。
【請求項4】
前記培養液が、海洋深層水である請求項1〜請求項3のいずれか1項記載のビタミンB12の製造方法。
【請求項5】
珪藻類及びその付着細菌を含むビタミンB12製造用材料。
【図1】


【図2】




【図2】


【公開番号】特開2008−193982(P2008−193982A)
【公開日】平成20年8月28日(2008.8.28)
【国際特許分類】
【出願番号】特願2007−34142(P2007−34142)
【出願日】平成19年2月14日(2007.2.14)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成18年8月15日、https://exponet.nikkeibp.co.jp/ij2006/matching/appoint/search.cgi?class=Appoint::Msg::Master&mode=add&c_id=364&action=newを通じて発表
【出願人】(304023318)国立大学法人静岡大学 (416)
【Fターム(参考)】
【公開日】平成20年8月28日(2008.8.28)
【国際特許分類】
【出願日】平成19年2月14日(2007.2.14)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成18年8月15日、https://exponet.nikkeibp.co.jp/ij2006/matching/appoint/search.cgi?class=Appoint::Msg::Master&mode=add&c_id=364&action=newを通じて発表
【出願人】(304023318)国立大学法人静岡大学 (416)
【Fターム(参考)】
[ Back to top ]

