ビナフトール誘導体並びに光学分割及び変換方法
【課題】アミノアルコール、アミノ酸の光学分割剤、およびアミノ酸のD、L−formの光学変換に有用な化合物を提供する。
【解決手段】グアニジンあるいはイミダゾリウム基などを有する、アミノアルコールをキラル選択的に認識し、アミノ酸のL−型をD−型に変換させる能力を有する特定構造を持つアラニンラセマーゼ模倣ビナフトール誘導体。
【解決手段】グアニジンあるいはイミダゾリウム基などを有する、アミノアルコールをキラル選択的に認識し、アミノ酸のL−型をD−型に変換させる能力を有する特定構造を持つアラニンラセマーゼ模倣ビナフトール誘導体。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アミノ酸またはアミノアルコールの光学分割(Optical Resolution)及びアミノ酸のD、L−formの光学変換(Optical Transformation)に有用なビナフトール誘導体に関する。
【0002】
本発明はまた、該誘導体を用いてラセミアミノ酸またはラセミアミノアルコールを光学分割して、光学的に純粋なアミノ酸または光学的に純粋なアミノアルコールを得る方法に関する。
【0003】
本発明はさらにまた、該誘導体を用いてアミノ酸のD、L−formを光学変換させる方法に関する。
【背景技術】
【0004】
光学的に純粋なアミノ酸及びアミノアルコールは不斉触媒(Asymmetric catalyst)のリガンドとして使われたり、各種医薬品及び生理活性物質を合成するのに必要な出発物質或いは中間体として広範に使われて、産業的に非常に重要な化合物である((a)Coppola,G.M.;Schuster,H.H.Asymmetric Synthesis.Construction of chiral Molecules Using Amino Acids;Wiley:New York,1987;(b)Bergmeier,S.C.Tetrahedron 2000,56,2561−2576;(c)Noyori,R.Asymmetric Catalysis in Organic Synthesis;John Wiley&Sons:New York,1994;(d)Helmchen,G.;Pfaltz,A.Acc.Chem.Res.2000,33,336−345.(e)Ager,D.J.;Prakash,I.;Schaad,D.R.Chem.Rev.1996,96,835−876)。
【0005】
上記光学的に純粋なアミノアルコールの製造方法に対してドイツ特許公開公報第4341605号には、これを光学的に純粋なアミノ酸から合成する方法を示している。
【0006】
しかし、L−formアミノ酸とは異なり、D−formアミノ酸は自然から得られず、一般に生体酵素触媒を用いて産業的に合成しなければならない。この場合、生体酵素の不安定性及び基質への高選択性から、製造コストが高くなり、多様なD−formアミノ酸の生産が非常に難しくなる。このため、それに相応する多様なアミノアルコールを生産することが難しくなり、製造コストが非常に高くなって、需要に比べて供給が円滑でないという不都合がある。
【0007】
このため、純粋なD−formアミノ酸を容易且つ安価に得る方法への工夫が続いている((a)Williams,R.M.In Synthesis of Optically Active Amino Acids;Baldwin,J.E.,Ed.;Organic Chemistry Series;Pergamon Press:Oxford,1989.(b)Williams,R.M.;Hendrix,J.A.Chem.Rev.1992,92,889.(c)Duthaler,R.O.Tetrahedron 1994、50,1539.(d)Seebach,D.;Sting,A.R.;Hoffman,M.Angew.Chem.,Int.Ed.Engl.1996,35,2708.(e)Maruoka,K.;Ooi,T.Chem.Rev.2003,103,3013.)。
【0008】
Favrettoら(Tetraheron Lett.2002,43,2581)は、光学的に純粋なアミノアルコールをキラルエポキシド(epoxide)から合成する方法を示していたが、これも高価なキラルエポキシドを使用しなければならなく、歩留まり、位置選択性(regioselectivity)、立体特異性(stereospecificity)などに問題があって、産業的に適用するには限界があるという不都合がある。
【0009】
近年、反応抽出工程(reactive extraction process)によるアミノアルコールの光学分割(optical resolution)は産業的に魅力的な選択として考慮されており、これは費用の側面から最も効率的な工程と見られるためである。 (Steensma, M.; Kuipers, N.J.M.; Haan, A.B.;Kwant, G. Chirality 2006, 18, 314.).
【0010】
N. Kuipers and Prelogsは反応抽出により多様なキラルレセプタ(Chiral receptor)を化学的に関連しているアミノアルコール及びアミンにキラル分離するためのテストを行った。しかし、選択性が5.0に近接したHiroseの アゾフェノリッククラウンエーテル(azophenolic crown ether )を除いては大部分のテストレセプタ(test receptor)の選択性はあまりにも低くて商業的に適用されるのには限界があった(Naemura, K.; Nishioka, K.; Ogasahara K.; Nishikawa, Y.; Hirose, K.; Tobe, Y. Tetrahedron: Asymmetry 1998, 9, 563.)。
【0011】
これに対して、本発明者らは、アルデヒド基付きビナフトール誘導体(下記、化合物1)を用いて、立体選択的にイミン結合によってキラルアミノアルコール及びアミノ酸のキラル性を認識し、L−アミノ酸をD−アミノ酸に変換させる方法を開発したことがある((a)Park,H.;Kim,K.M.;Lee,A.;Ham,S.;Nam,W.;Chin,J.J.Am.Chem.Soc.2007,129,1518−1519;(b)Kim,K.M.;Park,H.;Kim,H.;Chin,J.;Nam,W.Org.Lett., 2005,7,3525−3527)。
【0012】
[化合物1]

【0013】
上記ビナフトール誘導体(化合物1)は、アミノ酸ラセマーゼという酵素の活性において中心の役割を果たすPLP化合物((a)Shaw,J.P.;Petsko,G.A.Ringe,D.Biochemistry,1997,36,1329−1342;(b)Walsh,C.T.J.Biol.Chem.1989,264,2393−2396)の作用機転から着目して開発されたことである。
【0014】
上記ビナフトール誘導体(化合物1)は、立体選択的にイミン結合形成によってキラルアミンを認識し、アミノアルコールを各々の光学異性体に分離する。また、これらはDL-アミノ酸をD-アミノ酸に変換させることができ、光学的に純粋な非天然アミノ酸またはD-アミノ酸を製造するのに非常に有用である。
【0015】
上記ビナフトール誘導体(化合物1)は、アミノアルコールと反応してキラル選択的にイミン化合物を作って、その選択性が1:3?1:5程度に示された。しかし、該選択性が大きい場合、より容易にアミノアルコールを各々の光学異性体に分離することができる。従って、より高い立体選択性(stereoselectivity)を有する新たなビナフトール誘導体の開発はアミノアルコールの分割(resolution)のためのより効率的な産業化工程のために必要である。 さらに、エチルアセテートまたはクロロフォルムに優れた溶解度及び高い立体選択性のような化学的特性を有するキラルビナフトール誘導体は、費用効率的な反応抽出(reactive extraction)工程に適用され得るので、経済的な側面からも非常に有用である。
【発明の開示】
【発明が解決しようとする課題】
【0016】
上記の問題点に鑑みて、本発明者らは−OH基或いは−CO2−基と強力な水素結合をすることができ、陽電荷を有することによって電気的な結合が追加に可能なグアニジン、イミダゾリウム基を有する、新たなビナフトール誘導体(化学式1〜6)を作って、これによってD−form及びL−formのアミノ酸またはアミノアルコールをより効果的に光学分割できる、新規な化合物を提供しようとした。
【0017】
併せて、このようなビナフトール誘導体は合成過程で多くの不要な生成物を作り出すため、該問題を解決して高歩留まりにそれらを合成する方法を開発しようとした。
【特許文献1】特開2006−213712
【課題を解決するための手段】
【0018】
化合物1がアミノアルコール或いはアミノ酸をキラル選択的に認識する根拠は、立体障害の差のためである。即ち、下図のように、イミン窒素とフェノール−OHとの間の水素結合及び−OH或いは−CO2−基とユリル基との間の水素結合により硬直化したイミン化合物のキラル性によって、立体障害の差が生じる。

【0019】
キラル選択性を増加させるためには、イミン化合物の硬直性が大きくなければならなく、このためにはアミノアルコールの−OH基とビナフトール誘導体のユリル基との間の結合力がより大きくならなければならない。このため、ユリル基より強力な水素結合提供基が必要である。
【0020】
グアニジン、イミダゾリウムは陽電荷を有する水素結合を提供するので、ユリル基より強力に−OH或いは−CO2−基と水素結合を形成してキラル選択性を高めることができる。
【0021】
本発明者らはこれに着目して、グアニジン或いはイミダゾリウム基の導入された新たなビナフトール誘導体(化学式1〜6)を設計し、これを高歩留まりに合成することに成功し、該新たな誘導体が以前に公開されたビナフトール誘導体化合物1より卓越なキラル選択性を示すことを確認した。
【0022】
本発明は、下記の化学式1〜化学式6及びその誘導体化合物に関するものである。
[化学式1]

[化学式2]

[化学式3]

[化学式4]

[化学式5]

[化学式6]

【0023】
上記化学式においてR1〜R8は各々、i)−OH,水素またはハロゲンに置換可能な直鎖または分岐鎖アルキル、ii)−OHまたはハロゲンに置換可能なシクリックアルキル、アルケニル、アルキニル、またはiii)−OHまたはハロゲンに置換可能なアリールである。
【0024】
上記化合物には各々、下記の異性体が存在する。

【0025】
また、本発明は上記化学式1〜化学式6の化合物を用いたラセミアミノアルコールまたはラセミアミノ酸の光学分割方法に関するものである。
【0026】
また、本発明は上記化学式1〜化学式6の化合物を用いたD−formアミノ酸からL−formアミノ酸に、またはL−formアミノ酸からD−formアミノ酸に変換する方法に関するものである。
【0027】
1.化学式1〜6の化合物の製造方法
【0028】
以下、上記化合物の製造方法について説明する。
上記化学式1〜化学式6の化合物を合成する方法は、いずれにしてもよいが、一般に下記のスキーム等によって合成されることができる。
【0029】
(1)化学式1の化合物の製造方法
上記化学式1の化合物は一般に、下記スキーム1によって合成されることができる。
[スキーム1]

(上記スキーム1において、MOMはメトキシメチル(methoxymethyl)基を示し、Bocはt−ブトキシカルボニル(t−butoxy carbonyl)基を示し、PCCはピリジニウムクロロクロメート(pyridinium chlorochromate)を示し、PPAはポリりん酸(polyphosphoric acid)を示す)
【0030】
上記スキーム1において、化合物1,3−ビス−BOC−2−メチル−2−チオプソイドウレア(1,3−biS−BOC−2−methyl−2−thiopseudourea)の代わりに、N−Boc−2−メチルチオ−2−イミダゾリン(N−Boc−2−methylthio−2−imidazoline)を用いてスキーム1の反応を進行すると、化合物9を得ることができる。
【0031】
上記スキーム1において、3−ニトロベンジルブロミド(3−nitrobenzyl bromide)の代わりに、2−ニトロベンジルブロミドまたは4−ニトロベンジルブロミドを用いてスキーム1の反応を進行すると、化合物10及び化合物11を各々得ることができる。
【0032】
これらの化合物は、いずれもアミノアルコールまたはアミノ酸の光学異性体の分割及びアミノ酸のキラル変換に用いられ得る。
【0033】
(2)化学式2の化合物の製造方法
【0034】
上記化学式2の化合物(化合物12)は一般に、上記スキーム1において3−ニトロベンジルブロミド(3−nitrobenzyl bromide)の代わりに、2,4−ジニトロベンジルブロミド(2、4−dinitrobenzyl bromide)を用いてスキーム1の反応を進行して得ることができる。この化合物はやはりアミノアルコールまたはアミノ酸の光学異性体の分割及びアミノ酸のキラル変換に用いられる。
【0035】
既に公開されている特許(大韓民国特許公開第2006−0088489号)では、ユリル基付きビナフトール誘導体を合成の時、スキーム1の2−O位置にMOMが置換された化合物2の代わりに、2,2'−ビナフトール−3−アルデヒド(2,2'−binaphthoL−3−aldehyde)を用いたが、この場合、様々な副産物が多く生じ、最終化合物を合成するのに歩留まりが多く減少し、純度を高めるのに困難さがあって、本発明ではスキーム1の方法を新たに開発するようになった。
【0036】
下記スキーム2〜スキーム5に対しても同様な原理で、出発物質として2,2'−ビナフトール(2,2'−binaphthol)及びその誘導体の2−O位置にMOMが置換された化合物を用いることが、歩留まり及び純度を向上する上で、望ましい。
【0037】
(3)化学式3及び化学式4の製造方法
【0038】
化学式3及び化学式4は一般に、各々スキーム2及びスキーム3によって合成されることができる。
[スキーム2]

[スキーム3]

【0039】
上記の方法において、1,2−ジアミノベンゼン(1,2−diaminobenzene)の代わりに、ジアルキルエチレンジアミン(Dialkylethylenediamine:(NH2)RC=CR(NH2))を用いると、これに相応する多様なジアルキルイミダゾリウム誘導体を得ることができる。
【0040】
(4)化学式5の製造方法
【0041】
また、化学式5は一般に、下記スキーム4により合成されることができる。
[スキーム4]

【0042】
(5)化学式6の製造方法
【0043】
化学式6は、スキーム1において、ニトロベンジルブロミド(nitrobenzyl bromide)の代わりに、ジニトロベンジルブロミド(dinitrobenzyl bromide)を用いて得た化合物のニトロ基を−NH2基に還元させた後、下記スキーム5により合成されることができる。
[スキーム5]

【0044】
上記全てのスキームは、S−ビナフトールを挙げて説明してきたが、R−ビナフトールの反応も同様である。
【0045】
2.光学分割方法及び光学変換方法
【0046】
本発明の各化合物は、ラセミアミノアルコールまたはラセミアミノ酸の光学分割及びラセミアミノ酸の光学変換に有用である。
【0047】
(1)ラセミアミノアルコールまたはラセミアミノ酸の光学分割方法
【0048】
本発明の化合物により光学分割できるアミノアルコールとは、下記化学式7の化合物を指すことで、分子内に不斉炭素によりR−formまたはS−formの光学異性体が存在する。
[化学式7]

【0049】
上記化学式7において、R9〜R12は各々独立して水素を含む1価の有機基(Organic group)またはハロゲンであり、望ましくは置換または非置換のアルキル、置換または非置換のアルケニル、置換または非置換のシクリックアルキル、または置換または非置換のアリールである。
【0050】
本発明の化合物は下記化学式8のアミノ酸を光学分割することができる。
[化学式8]

【0051】
上記化学式8において、R13〜R15は各々独立して水素を含む1価の有機基であり、望ましくは置換または非置換のアルキル、置換または非置換のアルケニル、置換または非置換のシクリックアルキル、または置換または非置換のアリールである。
【0052】
化学式1〜化学式6の化合物を用いてラセミアミノアルコールまたはラセミアミノ酸を光学分割する方法は、当業界において公知の諸方法が可能である。即ち、溶媒を用いた配置方式、カラムに充填させて用いるカラム方式などで使用することができる。特に、費用効率的な反応性抽出(reactive extraction)工程に適用され得るので経済的な側面からも非常に有用である。必要によって、1次光学分割したアミノアルコールまたはアミノ酸を繰り返して光学分割することによって、より高い光学純度付きアミノアルコールまたはアミノ酸を得ることができる。
【0053】
3.ラセミアミノ酸の光学変換方法
【0054】
本発明の化合物は、上記化学式8のアミノ酸のD−formとL−formを互いに変換することができる。本発明のS−ビナフトール誘導体の場合は、L−formアミノ酸からD−formアミノ酸に変換させることができ、R−ビナフトール誘導体の場合は、D−formアミノ酸からL−formアミノ酸に変換させることができる。上記のような現象はキラル化合物のキラル性認識による結果である。
【0055】
(1)本発明は、下記の化学構造

を共通に含むビナフトール誘導体であって、上記[化学式1]〜[化学式6](上記化学式1〜6中のR1〜R8は各々、
i)−OH、水素またはハロゲンに置換可能な直鎖または分岐鎖アルキル、
ii)−OH、またはハロゲンに置換可能なシクリックアルキル、アルケニル、アルキニル、または
iii)−OH、またはハロゲンに置換可能なアリールである)
からなる群より選択されることを特徴とするビナフトール誘導体を提供する。
【0056】
(2)本発明は、上記(1)に記載の化合物を用いて、下記[化学式7]
[化学式7]

(上記化学式7中のR9〜R12は各々独立して水素を含む1価の有機基(Organic group)またはハロゲンである)
のラセミアミノアルコール、または下記[化学式8]
[化学式8]

(上記化学式8中のR13〜R15は各々独立して水素を含む1価の有機基である)
のラセミアミノ酸を光学分割(Optical Resolution)する方法を提供する。
【0057】
(3)本発明は、前記R9〜R12は各々独立して水素を含む1価の有機基であって、置換または非置換のアルキル、置換または非置換のアルケニル、置換または非置換のシクリックアルキル、または置換または非置換のアリールであることを特徴とする上記(2)に記載の光学分割方法を提供する。
【0058】
(4)本発明は、前記R13〜R15は各々独立して水素を含む1価の有機基であって、置換または非置換のアルキル、置換または非置換のアルケニル、置換または非置換のシクリックアルキル、または置換または非置換のアリールであることを特徴とする上記(2)に記載の光学分割方法を提供する。
【0059】
(5)本発明は、上記(1)に記載の化合物を用いて、下記の化学式9
[化学式9]

(前記化学式9中のR13〜R15は、各々独立して水素を含む1価の有機基である)
のアミノ酸のD−formをL−formに、またはL−formをD−formに光学変換(Optical Transformation)する光学変換方法を提供する。
【0060】
(6)本発明は、前記R13〜R15は各々独立して水素を含む1価の有機基であって、置換または非置換のアルキル、置換または非置換のアルケニル、置換または非置換のシクリックアルキル、または置換または非置換のアリールであることを特徴とする上記(5)に記載の光学変換方法を提供する。
【発明の効果】
【0061】
本発明のビナフトール誘導体は、アミノアルコールのヒドロキシ基(−OH)及びカルボキシレート基(−CO2−)と強い結合をすることができるように考案した発明であって、キラルアミノアルコールまたはアミノ酸に対するキラル性認識効果を先の発明に比べて卓越に高めることによって、産業的な応用をより容易にしたという長所を有している。
【0062】
特に、先に公開されたユリル基付きビナフトール誘導体化合物1の場合、アミノアルコールのR−formのアミノアルコールとS−formより4?5倍ほどよくイミンを形成する一方、本発明において(+)電荷の追加されたグアニジン基を有する化合物8の場合、R−formとS−formより20?30倍程度よくイミンを形成することによって、非常に大きい発展をなしてきた。本発明では、アミノアルコール或いはアミノ酸をキラル認識し、L−アミノ酸とD−アミノ酸とを互いに変換することができるビナフトール誘導体の合成効率を画期的に上げることによって、経済的にビナフトール誘導体を合成することができる道を開いて置いた。
【発明を実施するための最良の形態】
【0063】
[実施例]
以下、添付の図面を参照しながら、本発明の好適な実施形態例を詳記する。下記の実施例は説明の目的のためのもので、本発明を限定するものではない。
【0064】
実施例1.化合物8のS−ビナフトール誘導体の製造
【0065】
(1)化合物3の製造((S)−1−メトキシメチル−1'−(3−ニトロベンジル)−バイ−2−ナフトールアルデヒド)
【0066】
(S)−1−メトキシメチル−バイ−2−ナフトールアルデヒド(化合物2)(0.6g、1.67mmol)を5ml DMFに溶かした後、NaH(0.081g、2.0mmol)を添加し、10分間攪拌した。ここに、3−ニトロベンジルブロミド(0.434g、2.0mmol)を添加し、4時間常温で攪拌して化合物3を得た。

【0067】
歩留まり95%、1H NMR(CDCl3、250MHz):10.60(s,1H,CHO)、8.61(s,1H)、8.03−7.83(m,5H)、7.48−7.20(m,9H)、5.19(dd,2H,benzylic)、4.73(dd,2H,−OCH2O−)、2.89(s,3H,−OCH3)。
【0068】
(2)化合物4の製造((S)−1−メトキシメチル−1'−(3−ニトロベンジル)−2−ヒドロキシメチル−ビナフトール)
【0069】
NaBH4(60mg、1.56mmol)をメタノール溶液の化合物3(0.643g、1.3mmol)に添加して化合物4を得た。

【0070】
歩留まり98%、1H NMR(CDCl3、250MHz):8.02−7.79(m,6H)、7.43−7.11(m,9H)、5.11(dd,2H,−OCH2Ar)、4.95(s,2H,ArCH2OH)、4.55(dd,2H,−OCH2O−)、3.57(s,br,1H,OH)、3.12(s,3H,OCH3)。
【0071】
(3)化合物5の製造((S)−1−メトキシメチル−1'−(3−アミノベンジル)−2−ヒドロキシメチル−ビナフトール)
【0072】
化合物4(0.646g、1.3mmol)をエタノール/ジオキサン/水の1:1:1混合溶液に、鉄粉(iron powder)(0.504g、9.1mmol)、塩化アンモニウム(ammonium chloride)(0.126g、2.34mmol)を入れて反応して化合物5を得た。

【0073】
歩留まり95%、1H NMR(CDCl3、250MHz):8.03−8.78(m,4H)、7.49−7.24(m,7H)、6.96(m,1H)、6.48(m,2H)、6.13(s,1H)、5.04−4.86(m,4H)、4.60(dd,2H,−OCH2O−)、3.51(br,3H,NH2 and OH)、3.18(s,3H,−OCH3)。
【0074】
(4)化合物6の製造((S)−1−メトキシメチル−1'−(3−(4,5−ジヒドロ−1H−イミダゾール−2−イアミノベンジル)−2−ヒドロキシメチル−ビナフトール)
【0075】
化合物5(0.56g、1.2mmol)と1,3−ビス−BOC−2−メチル−2−チオプソイドウレア(1,3−bis−BOC−2−methyl−2−thiopseudourea)(0.35g、1.4mmol)のAcOH/EtOH(1:9v/v)溶液50mlを16時間加熱して化合物6を得た。

【0076】
歩留まり85%、1H NMR(CDCl3、250MHz):8.11(s,1H)、7.96(d,1H,J=9.0Hz)、7.87(s,2H,J=9.0Hz)、7.47(d,1H,J=9.0Hz)、7.38−7.02(m,7H)、6.83(d,1H)、6.66(d,1H,J=7.5Hz)、6.57(s,1H)、5.13−4.79(m,4H)、4.51(s,2H,−OCH2O−)、4.16(br,3H)、3.43(s,4H,guanidine CH2)、2.96(s,3H,−OCH3)。
【0077】
(5)化合物8の製造((S)−l−1'−(3−(4,5−ジヒドロ−1H−イミダゾール−2−イアミノ)ベンジル)−バイ−2−ナフトールアルデヒド)
【0078】
化合物6にPCCを処理した後、MOMをHCl溶液に落として化合物8を得た。

【0079】
歩留まり95%、1H NMR(DMSO−d6、250MHz):10.40(s,br,1H,NH)、10.36(s,1H,CHO)、10.15(s,br,OH)、8.68(s,1H)、8.23−8.07(m,4H)、7.97(d,1H,J=8.0Hz)、7.64(d,1H,J=9.0Hz)、7.45−7.22(m,5H)、7.55−6.99(m,4H)、6.87(s,1H)、5.21(s,2H,benzylic CH2)、3.63(s,4H,guanidine CH2)。
【0080】
実施例2.化合物8のR−ビナフトール誘導体の製造
【0081】
(S)−1−メトキシメチル−バイ−2−ナフトールアルデヒドの代わりに、(R)−1−メトキシメチル−バイ−2−ナフトールアルデヒドを用いたことを除いては、実施例1と同じく行った。
【0082】
実施例3.化合物9のS−ビナフトール誘導体の製造
【0083】
1,3−ビス−BOC−2−メチル−2−チオプソイドウレアの代わりに、N−BOC−2−メチルチオ−2−イミダゾールリンを用いたことを除いては、実施例1と同じく行った。

【0084】
1H NMR(DMSO−d6、250MHz):10.34(s,1H,CHO)、10.26(s,1H,NH)、9.02(s,1H,NH)、8.67(s,1H)、8.17−8.07(m,2H)、7.97(d,1H,J=7.9Hz)、7.63(d,1H,J=9.1Hz)、7.45−7.20(m,9H)、7.07−6.96(m,4H)、6.81(s,1H)、5.19(s,2H,benzylic CH2)。
【0085】
実施例4.化合物9のR−ビナフトール誘導体の製造
【0086】
(S)−1−メトキシメチル−バイ−2−ナフトールアルデヒドの代わりに、(R)−1−メトキシメチル−バイ−2−ナフトールアルデヒドを用いたことを除いては、実施例3と同じく行った。
【0087】
実施例5.化合物17のS−ビナフトール誘導体の製造
【0088】
(1)化合物14の製造
(S)−1−メトキシメチル−2−ヒドロキシメチル−ビナフトール(化合物13、0.41mmol)に、NaH(11mg、0.46mmol)及び3−(ブロモメチル)ベンズアルデヒド(82mg、0.42mmol)を添加して、DMFで攪拌して化合物14を得た。

【0089】
歩留まり80%、1H NMR(CDCl3、250MHz):9.72(s,1H,−CHO)、7.88−8.02(m,4H)、7.13−7.64(m,11H)、5.06−5.20(dd,2H,MOM−CH2)、4.93(d,2H,−CH2OH)、4.48−4.61(dd,2H,2−O−benzylic CH2)、3.15(s,3H,−OCH3)。
【0090】
(2)化合物15の製造
【0091】
化合物14(300mg、0.627mmol)、パラフェニレンジアミン(para phenylene diamine)(75mg、0.693mmol)、NaHSO3(65mg、0.627mmol)をエタノール溶液で10時間炊いて化合物15を得た。

【0092】
歩留まり76%、1H NMR(CDCl3、250MHz):10.69(s,1H,−OH)、7.18−8.07(m,20H)、5.19−5.27(dd,2H,−CH2)、4.99−5.04(d,2H,−O−CH2)、4.60−4.70(dd,2H,−O−CH2−OCH3)、3.14(s,3H,−O−CH2−OCH3)。
【0093】
(3)化合物17の製造
【0094】
化合物15にPCCを処理した後、HClを加えて化合物17を得た。

【0095】
歩留まり84%、1H NMR(DMSO−d6、250MHz):12.81(br,1H,−OH)、10.33(s,1H,−CHO)、8.62(s,1H)、6.96−8.09(m,20H)、5.29(s,2H,−OCH2−)。
【0096】
実施例6.化合物22のS−ビナフトール誘導体の製造((S)−1−ヒドロキシ−1'−(3−ジエチルアミノメチルベンジル)−2−アルデヒド−ビナフトール)
【0097】
氷槽(ice bath)のDMFで、NaH(2.4 equiv.0.12)を入れ、化合物2(0.43g、1.12mmol)を入れた後、1時間が過ぎてジエチルアミノメチルベンジルブロミド(diethylaminomethyl benzylbromide)(0.42g、1.23mmol)を入れて反応して、下記化合物((S)−1−メトキシメチル−1'−(3−ジエチルアミノメチルベンジル)−2−アルデヒド−ビナフトール)を得た。

【0098】
上記化合物((S)−1−メトキシメチル−1'−(3−ジエチルアミノメチルベンジル)−2−アルデヒド−ビナフトール)0.2g、0.37mmolをエタノールで塩化水素を入れて加熱して化合物22を得た。

【0099】
歩留まり90%、1H NMR(DMSO−d6、250MHz);δ0.48(s,1H,−CHO)、10.35(s,1H,−OH)、8.80(s,1H,−CH)、8.23〜7.14(m,14H)、5.34(s,2H,−OCH2−)、4.16(s,2H,−NCH2−)、3.04(q、4H,−CH2 of ethyl)、1.26(t、6H,−CH3 of ethyl)
【0100】
実施例7.化合物8及び化合物9を用いたアミノアルコールの光学分割
【0101】
(1)試験
【0102】
本発明のビナフトール誘導体を用いたアミノアルコールの光学分割程度は次の通り試験した。
【0103】
ビナフトール誘導体は、本発明の代表的な化合物である化合物8(実施例1及び2で製造)及び化合物9(実施例3及び4で製造)が各々使われた。
【0104】
ラセミアミノアルコールはアミノプロパノールを含む4種のアミノアルコール(下記[表1]参照)が各々使われた。
【0105】
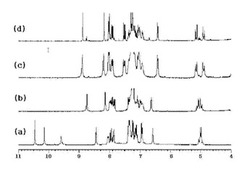
まず、NMRチューブに0.7mlのCDCl3、0.04mmolのR−formとS−formが1:1に混合されている上記(R、S)−2−アミノプロパノール、0.02mmolの上記ビナフトール誘導体を入れて1H−NMRを測定した。これを図1の(d)で示した。
【0106】
比較のために、化合物8のみの1H−NMRスペクトルを図1の(a)で示した。
【0107】
イミン化合物は5分以内に全て形成され、平衡に到達した。
【0108】
同量で各々R−form及びS−formのみを入れて1H NMRを確認し、ラセミ混合物の各ピークの位置を指定した。化合物8と(S)−2−アミノプロパノールとによるイミン化合物の1H NMRスペクトルを図1の(b)で、化合物8と(R)−2−アミノプロパノールとによるイミン化合物の1H−NMRスペクトルを図1の(c)で示した。
【0109】
キラル選択性は、R−formに該当するピークとS−formに該当するピークとを積分して計算した。
【0110】
(2)結果
【0111】
図1(d)の化合物8とラセミアミノプロパノールとの間に作られたイミン化合物の1H NMRを見ると、R−formとS−formとの間に選択性が示されるのを分かる。
【0112】
図1の(b)によれば、R−formアミノアルコールによるイミンプロトンピークは8.95ppmで、図1の(c)によれば、S−formアミノアルコールによるイミンプロトンピークは8.80ppmで示されるのを分かる。
【0113】
従って、図1の(d)スペクトルにおいて、8.95ppm及び8.80ppmピークの大きさを測定することによって、化合物8とイミン結合を形成したR−form及びS−formの量を分かる。
【0114】
上記1H NMRを見ると、R−formのイミンに該当するピークがS−formのイミンに該当するピークより5.0倍も大きく示されるのが分かる。即ち、R−formのアミノアルコールはS−formのアミノアルコールより、化合物8と5.02=25倍程度イミン結合を良く形成するのが分かる。
【0115】
化合物9と異なる様々なアミノアルコールに対して同一の実験をした時も、やはり良いキラル選択性を示した。この結果を[表1]にまとめた。
【0116】
比較例1.公知のビナフトール誘導体を用いたアミノアルコールの光学分割
【0117】
先行公開特許(大韓民国特許公開第2006−0088489号)に公知された下記のビナフトール誘導体を用いたことを除いては、実施例8と同じく、アミノアルコールの光学分割試験を実施した。この結果も[表1]にまとめた。

[表1] 実施例8(化合物8及び化合物9)及び比較例1におけるアミノアルコールに対するキラル選択性(KR=R−アミノアルコールによるイミン形成定数;KS=S−アミノアルコールによるイミン形成定数)

【0118】
実施例8.化合物8及び化合物9を用いたL−アミノ酸のD−アミノ酸への光学変換
【0119】
(1)試験
本発明のビナフトール誘導体を用いたアミノ酸の光学変換程度は次の通り試験した。
【0120】
ビナフトール誘導体は、本発明の代表的な化合物である化合物8(実施例1及び2で製造)及び化合物9(実施例3及び4で製造)が各々使われた。
【0121】
ラセミアミノ酸は、トリエチルアミンを含む6種のアミノ酸(下記[表2]参照)が各々使われた。
【0122】
まず、NMRチューブに0.7mlのDMSO−d6、0.022mmolのL−アミノ酸、0.08mmolのトリエチルアミン(triethylamine)、0.02mmolのビナフトール誘導体を入れて1H−NMRを測定した。
【0123】
L−アミノ酸が全てビナフトール誘導体と反応してイミンを直ちに形成した。
【0124】
以後、時間別に1H−NMRを測定し、L−アミノ酸がD−アミノ酸に変わるのを確認した。
【0125】
図2に、代表的化合物8がL−フェニルアラニンをD−フェニルアラニンに変換させるのを1H−NMRで示した。
【0126】
図2において、一番上のスペクトルは化合物8のS−ビナフトール誘導体とL−フェニルアラニンとが反応して作られたイミン化合物に対する1H−NMRをEt3N 4当量を添加し、反応1時間後写したものである。その下の1H NMRは反応5時間後、8時間後、24時間後及び48時間後に写したものである。
【0127】
このスペクトルを見ると、反応直後から新たなピークが示されるが、これは化合物8とD−フェニルアラニンとが反応して作られたイミンの各ピークと一致する。48時間後、L−フェニルアラニンによるピークがほぼ消えて、D−フェニルアラニンによるピークが主をなす。即ち、L−フェニルアラニンがD−フェニルアラニンに変換されたというものを意味する。
【0128】
図2によれば、化合物8とL−アラニンとが反応して作られた化合物において、約48時間経過後、L−フェニルアラニンがD−フェニルアラニンに97.7%程度変換されたことを分かる(ピークの面積を計算してみると、L:Dの比率1:42)。一方、D−フェニルアラニンでは、L−フェニルアラニンがほぼ生じなかった。
【0129】
これは、上記化合物8がS−ビナフトール誘導体であるためで、R−ビナフトール誘導体に変えると、逆にD−アミノ酸をL−アミノ酸に変えることができる。
【0130】
結果として、本発明の化合物を用いてラセミアミノ酸から光学的に純粋なD−アミノ酸またはL−アミノ酸の一つの異性体のみを得ることができるという効果がある。
【0131】
化合物8と9を用いて、その他イミノ酸に対して同一の実験を行って、その結果、最終状態のL−アミノ酸とD−アミノ酸との比率を[表2]にまとめた。
【0132】
比較例2.公知のビナフトール誘導体を用いたL−アミノ酸のD−アミノ酸への光学変換
【0133】
比較例1のビナフトール誘導体を用いたことを除いては、実施例9と同じく、アミノ酸の光学変換試験を実施した。この結果も[表2]にまとめた。
[表2]平衡状態でD−アミノ酸/L−アミノ酸の比率(1H NMRの積分比(integration ratio)で測定した)

【0134】
本発明の各化合物がアミノアルコールとキラル選択的に結合してL−アミノ酸をD−アミノ酸に変換させる理由は、先行公開特許(大韓民国特許公開第2006−0088489号)の場合と同一であると判断される。しかし、化合物8と9が先行公開特許の化合物より選択性の遥かに高いことは、化合物8と9のグアニジン基が陽電荷を有して、より立派な水素結合を提供しているためと判断される。
【0135】
アミノ酸のカルボキシレート基(−CO2−)とグアニジンとの間の強力な水素結合は、全体イミンの構造を硬直化させ、結果として、キラル選択性を高めると判断される。化学式6の場合、2つのユリル基を有するので、一個のユリル基のみを有する化合物より強く−OHまたは−CO2−基と結合することができる。
【図面の簡単な説明】
【0136】
【図1】溶媒CDCl3中の1H−NMRスペクトルであって、(a)は化合物8のスペクトル、(b)は化合物8と(S)−2−アミノプロパノールとが反応して作られたイミン化合物に対するスペクトル、(c)は化合物8と(R)−2−アミノプロパノールとが反応して作られたイミン化合物に対するスペクトル、(d)は化合物8と2当量の(R、S)−2−アミノプロパノールとが反応して作られたイミン化合物に対するスペクトルである。
【図2】Et3N 4当量を添加した状態で化合物8とL−フェニルアラニンとが反応して作られたイミン化合物に対する1H NMRスペクトルであって、図中の上から1番目は反応1時間後写したスペクトル、その下には各々5時間、8時間、24時間、48時間経過後写したスペクトルである。
【技術分野】
【0001】
本発明は、アミノ酸またはアミノアルコールの光学分割(Optical Resolution)及びアミノ酸のD、L−formの光学変換(Optical Transformation)に有用なビナフトール誘導体に関する。
【0002】
本発明はまた、該誘導体を用いてラセミアミノ酸またはラセミアミノアルコールを光学分割して、光学的に純粋なアミノ酸または光学的に純粋なアミノアルコールを得る方法に関する。
【0003】
本発明はさらにまた、該誘導体を用いてアミノ酸のD、L−formを光学変換させる方法に関する。
【背景技術】
【0004】
光学的に純粋なアミノ酸及びアミノアルコールは不斉触媒(Asymmetric catalyst)のリガンドとして使われたり、各種医薬品及び生理活性物質を合成するのに必要な出発物質或いは中間体として広範に使われて、産業的に非常に重要な化合物である((a)Coppola,G.M.;Schuster,H.H.Asymmetric Synthesis.Construction of chiral Molecules Using Amino Acids;Wiley:New York,1987;(b)Bergmeier,S.C.Tetrahedron 2000,56,2561−2576;(c)Noyori,R.Asymmetric Catalysis in Organic Synthesis;John Wiley&Sons:New York,1994;(d)Helmchen,G.;Pfaltz,A.Acc.Chem.Res.2000,33,336−345.(e)Ager,D.J.;Prakash,I.;Schaad,D.R.Chem.Rev.1996,96,835−876)。
【0005】
上記光学的に純粋なアミノアルコールの製造方法に対してドイツ特許公開公報第4341605号には、これを光学的に純粋なアミノ酸から合成する方法を示している。
【0006】
しかし、L−formアミノ酸とは異なり、D−formアミノ酸は自然から得られず、一般に生体酵素触媒を用いて産業的に合成しなければならない。この場合、生体酵素の不安定性及び基質への高選択性から、製造コストが高くなり、多様なD−formアミノ酸の生産が非常に難しくなる。このため、それに相応する多様なアミノアルコールを生産することが難しくなり、製造コストが非常に高くなって、需要に比べて供給が円滑でないという不都合がある。
【0007】
このため、純粋なD−formアミノ酸を容易且つ安価に得る方法への工夫が続いている((a)Williams,R.M.In Synthesis of Optically Active Amino Acids;Baldwin,J.E.,Ed.;Organic Chemistry Series;Pergamon Press:Oxford,1989.(b)Williams,R.M.;Hendrix,J.A.Chem.Rev.1992,92,889.(c)Duthaler,R.O.Tetrahedron 1994、50,1539.(d)Seebach,D.;Sting,A.R.;Hoffman,M.Angew.Chem.,Int.Ed.Engl.1996,35,2708.(e)Maruoka,K.;Ooi,T.Chem.Rev.2003,103,3013.)。
【0008】
Favrettoら(Tetraheron Lett.2002,43,2581)は、光学的に純粋なアミノアルコールをキラルエポキシド(epoxide)から合成する方法を示していたが、これも高価なキラルエポキシドを使用しなければならなく、歩留まり、位置選択性(regioselectivity)、立体特異性(stereospecificity)などに問題があって、産業的に適用するには限界があるという不都合がある。
【0009】
近年、反応抽出工程(reactive extraction process)によるアミノアルコールの光学分割(optical resolution)は産業的に魅力的な選択として考慮されており、これは費用の側面から最も効率的な工程と見られるためである。 (Steensma, M.; Kuipers, N.J.M.; Haan, A.B.;Kwant, G. Chirality 2006, 18, 314.).
【0010】
N. Kuipers and Prelogsは反応抽出により多様なキラルレセプタ(Chiral receptor)を化学的に関連しているアミノアルコール及びアミンにキラル分離するためのテストを行った。しかし、選択性が5.0に近接したHiroseの アゾフェノリッククラウンエーテル(azophenolic crown ether )を除いては大部分のテストレセプタ(test receptor)の選択性はあまりにも低くて商業的に適用されるのには限界があった(Naemura, K.; Nishioka, K.; Ogasahara K.; Nishikawa, Y.; Hirose, K.; Tobe, Y. Tetrahedron: Asymmetry 1998, 9, 563.)。
【0011】
これに対して、本発明者らは、アルデヒド基付きビナフトール誘導体(下記、化合物1)を用いて、立体選択的にイミン結合によってキラルアミノアルコール及びアミノ酸のキラル性を認識し、L−アミノ酸をD−アミノ酸に変換させる方法を開発したことがある((a)Park,H.;Kim,K.M.;Lee,A.;Ham,S.;Nam,W.;Chin,J.J.Am.Chem.Soc.2007,129,1518−1519;(b)Kim,K.M.;Park,H.;Kim,H.;Chin,J.;Nam,W.Org.Lett., 2005,7,3525−3527)。
【0012】
[化合物1]

【0013】
上記ビナフトール誘導体(化合物1)は、アミノ酸ラセマーゼという酵素の活性において中心の役割を果たすPLP化合物((a)Shaw,J.P.;Petsko,G.A.Ringe,D.Biochemistry,1997,36,1329−1342;(b)Walsh,C.T.J.Biol.Chem.1989,264,2393−2396)の作用機転から着目して開発されたことである。
【0014】
上記ビナフトール誘導体(化合物1)は、立体選択的にイミン結合形成によってキラルアミンを認識し、アミノアルコールを各々の光学異性体に分離する。また、これらはDL-アミノ酸をD-アミノ酸に変換させることができ、光学的に純粋な非天然アミノ酸またはD-アミノ酸を製造するのに非常に有用である。
【0015】
上記ビナフトール誘導体(化合物1)は、アミノアルコールと反応してキラル選択的にイミン化合物を作って、その選択性が1:3?1:5程度に示された。しかし、該選択性が大きい場合、より容易にアミノアルコールを各々の光学異性体に分離することができる。従って、より高い立体選択性(stereoselectivity)を有する新たなビナフトール誘導体の開発はアミノアルコールの分割(resolution)のためのより効率的な産業化工程のために必要である。 さらに、エチルアセテートまたはクロロフォルムに優れた溶解度及び高い立体選択性のような化学的特性を有するキラルビナフトール誘導体は、費用効率的な反応抽出(reactive extraction)工程に適用され得るので、経済的な側面からも非常に有用である。
【発明の開示】
【発明が解決しようとする課題】
【0016】
上記の問題点に鑑みて、本発明者らは−OH基或いは−CO2−基と強力な水素結合をすることができ、陽電荷を有することによって電気的な結合が追加に可能なグアニジン、イミダゾリウム基を有する、新たなビナフトール誘導体(化学式1〜6)を作って、これによってD−form及びL−formのアミノ酸またはアミノアルコールをより効果的に光学分割できる、新規な化合物を提供しようとした。
【0017】
併せて、このようなビナフトール誘導体は合成過程で多くの不要な生成物を作り出すため、該問題を解決して高歩留まりにそれらを合成する方法を開発しようとした。
【特許文献1】特開2006−213712
【課題を解決するための手段】
【0018】
化合物1がアミノアルコール或いはアミノ酸をキラル選択的に認識する根拠は、立体障害の差のためである。即ち、下図のように、イミン窒素とフェノール−OHとの間の水素結合及び−OH或いは−CO2−基とユリル基との間の水素結合により硬直化したイミン化合物のキラル性によって、立体障害の差が生じる。

【0019】
キラル選択性を増加させるためには、イミン化合物の硬直性が大きくなければならなく、このためにはアミノアルコールの−OH基とビナフトール誘導体のユリル基との間の結合力がより大きくならなければならない。このため、ユリル基より強力な水素結合提供基が必要である。
【0020】
グアニジン、イミダゾリウムは陽電荷を有する水素結合を提供するので、ユリル基より強力に−OH或いは−CO2−基と水素結合を形成してキラル選択性を高めることができる。
【0021】
本発明者らはこれに着目して、グアニジン或いはイミダゾリウム基の導入された新たなビナフトール誘導体(化学式1〜6)を設計し、これを高歩留まりに合成することに成功し、該新たな誘導体が以前に公開されたビナフトール誘導体化合物1より卓越なキラル選択性を示すことを確認した。
【0022】
本発明は、下記の化学式1〜化学式6及びその誘導体化合物に関するものである。
[化学式1]

[化学式2]

[化学式3]

[化学式4]

[化学式5]

[化学式6]

【0023】
上記化学式においてR1〜R8は各々、i)−OH,水素またはハロゲンに置換可能な直鎖または分岐鎖アルキル、ii)−OHまたはハロゲンに置換可能なシクリックアルキル、アルケニル、アルキニル、またはiii)−OHまたはハロゲンに置換可能なアリールである。
【0024】
上記化合物には各々、下記の異性体が存在する。

【0025】
また、本発明は上記化学式1〜化学式6の化合物を用いたラセミアミノアルコールまたはラセミアミノ酸の光学分割方法に関するものである。
【0026】
また、本発明は上記化学式1〜化学式6の化合物を用いたD−formアミノ酸からL−formアミノ酸に、またはL−formアミノ酸からD−formアミノ酸に変換する方法に関するものである。
【0027】
1.化学式1〜6の化合物の製造方法
【0028】
以下、上記化合物の製造方法について説明する。
上記化学式1〜化学式6の化合物を合成する方法は、いずれにしてもよいが、一般に下記のスキーム等によって合成されることができる。
【0029】
(1)化学式1の化合物の製造方法
上記化学式1の化合物は一般に、下記スキーム1によって合成されることができる。
[スキーム1]

(上記スキーム1において、MOMはメトキシメチル(methoxymethyl)基を示し、Bocはt−ブトキシカルボニル(t−butoxy carbonyl)基を示し、PCCはピリジニウムクロロクロメート(pyridinium chlorochromate)を示し、PPAはポリりん酸(polyphosphoric acid)を示す)
【0030】
上記スキーム1において、化合物1,3−ビス−BOC−2−メチル−2−チオプソイドウレア(1,3−biS−BOC−2−methyl−2−thiopseudourea)の代わりに、N−Boc−2−メチルチオ−2−イミダゾリン(N−Boc−2−methylthio−2−imidazoline)を用いてスキーム1の反応を進行すると、化合物9を得ることができる。
【0031】
上記スキーム1において、3−ニトロベンジルブロミド(3−nitrobenzyl bromide)の代わりに、2−ニトロベンジルブロミドまたは4−ニトロベンジルブロミドを用いてスキーム1の反応を進行すると、化合物10及び化合物11を各々得ることができる。
【0032】
これらの化合物は、いずれもアミノアルコールまたはアミノ酸の光学異性体の分割及びアミノ酸のキラル変換に用いられ得る。
【0033】
(2)化学式2の化合物の製造方法
【0034】
上記化学式2の化合物(化合物12)は一般に、上記スキーム1において3−ニトロベンジルブロミド(3−nitrobenzyl bromide)の代わりに、2,4−ジニトロベンジルブロミド(2、4−dinitrobenzyl bromide)を用いてスキーム1の反応を進行して得ることができる。この化合物はやはりアミノアルコールまたはアミノ酸の光学異性体の分割及びアミノ酸のキラル変換に用いられる。
【0035】
既に公開されている特許(大韓民国特許公開第2006−0088489号)では、ユリル基付きビナフトール誘導体を合成の時、スキーム1の2−O位置にMOMが置換された化合物2の代わりに、2,2'−ビナフトール−3−アルデヒド(2,2'−binaphthoL−3−aldehyde)を用いたが、この場合、様々な副産物が多く生じ、最終化合物を合成するのに歩留まりが多く減少し、純度を高めるのに困難さがあって、本発明ではスキーム1の方法を新たに開発するようになった。
【0036】
下記スキーム2〜スキーム5に対しても同様な原理で、出発物質として2,2'−ビナフトール(2,2'−binaphthol)及びその誘導体の2−O位置にMOMが置換された化合物を用いることが、歩留まり及び純度を向上する上で、望ましい。
【0037】
(3)化学式3及び化学式4の製造方法
【0038】
化学式3及び化学式4は一般に、各々スキーム2及びスキーム3によって合成されることができる。
[スキーム2]

[スキーム3]

【0039】
上記の方法において、1,2−ジアミノベンゼン(1,2−diaminobenzene)の代わりに、ジアルキルエチレンジアミン(Dialkylethylenediamine:(NH2)RC=CR(NH2))を用いると、これに相応する多様なジアルキルイミダゾリウム誘導体を得ることができる。
【0040】
(4)化学式5の製造方法
【0041】
また、化学式5は一般に、下記スキーム4により合成されることができる。
[スキーム4]

【0042】
(5)化学式6の製造方法
【0043】
化学式6は、スキーム1において、ニトロベンジルブロミド(nitrobenzyl bromide)の代わりに、ジニトロベンジルブロミド(dinitrobenzyl bromide)を用いて得た化合物のニトロ基を−NH2基に還元させた後、下記スキーム5により合成されることができる。
[スキーム5]

【0044】
上記全てのスキームは、S−ビナフトールを挙げて説明してきたが、R−ビナフトールの反応も同様である。
【0045】
2.光学分割方法及び光学変換方法
【0046】
本発明の各化合物は、ラセミアミノアルコールまたはラセミアミノ酸の光学分割及びラセミアミノ酸の光学変換に有用である。
【0047】
(1)ラセミアミノアルコールまたはラセミアミノ酸の光学分割方法
【0048】
本発明の化合物により光学分割できるアミノアルコールとは、下記化学式7の化合物を指すことで、分子内に不斉炭素によりR−formまたはS−formの光学異性体が存在する。
[化学式7]

【0049】
上記化学式7において、R9〜R12は各々独立して水素を含む1価の有機基(Organic group)またはハロゲンであり、望ましくは置換または非置換のアルキル、置換または非置換のアルケニル、置換または非置換のシクリックアルキル、または置換または非置換のアリールである。
【0050】
本発明の化合物は下記化学式8のアミノ酸を光学分割することができる。
[化学式8]

【0051】
上記化学式8において、R13〜R15は各々独立して水素を含む1価の有機基であり、望ましくは置換または非置換のアルキル、置換または非置換のアルケニル、置換または非置換のシクリックアルキル、または置換または非置換のアリールである。
【0052】
化学式1〜化学式6の化合物を用いてラセミアミノアルコールまたはラセミアミノ酸を光学分割する方法は、当業界において公知の諸方法が可能である。即ち、溶媒を用いた配置方式、カラムに充填させて用いるカラム方式などで使用することができる。特に、費用効率的な反応性抽出(reactive extraction)工程に適用され得るので経済的な側面からも非常に有用である。必要によって、1次光学分割したアミノアルコールまたはアミノ酸を繰り返して光学分割することによって、より高い光学純度付きアミノアルコールまたはアミノ酸を得ることができる。
【0053】
3.ラセミアミノ酸の光学変換方法
【0054】
本発明の化合物は、上記化学式8のアミノ酸のD−formとL−formを互いに変換することができる。本発明のS−ビナフトール誘導体の場合は、L−formアミノ酸からD−formアミノ酸に変換させることができ、R−ビナフトール誘導体の場合は、D−formアミノ酸からL−formアミノ酸に変換させることができる。上記のような現象はキラル化合物のキラル性認識による結果である。
【0055】
(1)本発明は、下記の化学構造

を共通に含むビナフトール誘導体であって、上記[化学式1]〜[化学式6](上記化学式1〜6中のR1〜R8は各々、
i)−OH、水素またはハロゲンに置換可能な直鎖または分岐鎖アルキル、
ii)−OH、またはハロゲンに置換可能なシクリックアルキル、アルケニル、アルキニル、または
iii)−OH、またはハロゲンに置換可能なアリールである)
からなる群より選択されることを特徴とするビナフトール誘導体を提供する。
【0056】
(2)本発明は、上記(1)に記載の化合物を用いて、下記[化学式7]
[化学式7]

(上記化学式7中のR9〜R12は各々独立して水素を含む1価の有機基(Organic group)またはハロゲンである)
のラセミアミノアルコール、または下記[化学式8]
[化学式8]

(上記化学式8中のR13〜R15は各々独立して水素を含む1価の有機基である)
のラセミアミノ酸を光学分割(Optical Resolution)する方法を提供する。
【0057】
(3)本発明は、前記R9〜R12は各々独立して水素を含む1価の有機基であって、置換または非置換のアルキル、置換または非置換のアルケニル、置換または非置換のシクリックアルキル、または置換または非置換のアリールであることを特徴とする上記(2)に記載の光学分割方法を提供する。
【0058】
(4)本発明は、前記R13〜R15は各々独立して水素を含む1価の有機基であって、置換または非置換のアルキル、置換または非置換のアルケニル、置換または非置換のシクリックアルキル、または置換または非置換のアリールであることを特徴とする上記(2)に記載の光学分割方法を提供する。
【0059】
(5)本発明は、上記(1)に記載の化合物を用いて、下記の化学式9
[化学式9]

(前記化学式9中のR13〜R15は、各々独立して水素を含む1価の有機基である)
のアミノ酸のD−formをL−formに、またはL−formをD−formに光学変換(Optical Transformation)する光学変換方法を提供する。
【0060】
(6)本発明は、前記R13〜R15は各々独立して水素を含む1価の有機基であって、置換または非置換のアルキル、置換または非置換のアルケニル、置換または非置換のシクリックアルキル、または置換または非置換のアリールであることを特徴とする上記(5)に記載の光学変換方法を提供する。
【発明の効果】
【0061】
本発明のビナフトール誘導体は、アミノアルコールのヒドロキシ基(−OH)及びカルボキシレート基(−CO2−)と強い結合をすることができるように考案した発明であって、キラルアミノアルコールまたはアミノ酸に対するキラル性認識効果を先の発明に比べて卓越に高めることによって、産業的な応用をより容易にしたという長所を有している。
【0062】
特に、先に公開されたユリル基付きビナフトール誘導体化合物1の場合、アミノアルコールのR−formのアミノアルコールとS−formより4?5倍ほどよくイミンを形成する一方、本発明において(+)電荷の追加されたグアニジン基を有する化合物8の場合、R−formとS−formより20?30倍程度よくイミンを形成することによって、非常に大きい発展をなしてきた。本発明では、アミノアルコール或いはアミノ酸をキラル認識し、L−アミノ酸とD−アミノ酸とを互いに変換することができるビナフトール誘導体の合成効率を画期的に上げることによって、経済的にビナフトール誘導体を合成することができる道を開いて置いた。
【発明を実施するための最良の形態】
【0063】
[実施例]
以下、添付の図面を参照しながら、本発明の好適な実施形態例を詳記する。下記の実施例は説明の目的のためのもので、本発明を限定するものではない。
【0064】
実施例1.化合物8のS−ビナフトール誘導体の製造
【0065】
(1)化合物3の製造((S)−1−メトキシメチル−1'−(3−ニトロベンジル)−バイ−2−ナフトールアルデヒド)
【0066】
(S)−1−メトキシメチル−バイ−2−ナフトールアルデヒド(化合物2)(0.6g、1.67mmol)を5ml DMFに溶かした後、NaH(0.081g、2.0mmol)を添加し、10分間攪拌した。ここに、3−ニトロベンジルブロミド(0.434g、2.0mmol)を添加し、4時間常温で攪拌して化合物3を得た。

【0067】
歩留まり95%、1H NMR(CDCl3、250MHz):10.60(s,1H,CHO)、8.61(s,1H)、8.03−7.83(m,5H)、7.48−7.20(m,9H)、5.19(dd,2H,benzylic)、4.73(dd,2H,−OCH2O−)、2.89(s,3H,−OCH3)。
【0068】
(2)化合物4の製造((S)−1−メトキシメチル−1'−(3−ニトロベンジル)−2−ヒドロキシメチル−ビナフトール)
【0069】
NaBH4(60mg、1.56mmol)をメタノール溶液の化合物3(0.643g、1.3mmol)に添加して化合物4を得た。

【0070】
歩留まり98%、1H NMR(CDCl3、250MHz):8.02−7.79(m,6H)、7.43−7.11(m,9H)、5.11(dd,2H,−OCH2Ar)、4.95(s,2H,ArCH2OH)、4.55(dd,2H,−OCH2O−)、3.57(s,br,1H,OH)、3.12(s,3H,OCH3)。
【0071】
(3)化合物5の製造((S)−1−メトキシメチル−1'−(3−アミノベンジル)−2−ヒドロキシメチル−ビナフトール)
【0072】
化合物4(0.646g、1.3mmol)をエタノール/ジオキサン/水の1:1:1混合溶液に、鉄粉(iron powder)(0.504g、9.1mmol)、塩化アンモニウム(ammonium chloride)(0.126g、2.34mmol)を入れて反応して化合物5を得た。

【0073】
歩留まり95%、1H NMR(CDCl3、250MHz):8.03−8.78(m,4H)、7.49−7.24(m,7H)、6.96(m,1H)、6.48(m,2H)、6.13(s,1H)、5.04−4.86(m,4H)、4.60(dd,2H,−OCH2O−)、3.51(br,3H,NH2 and OH)、3.18(s,3H,−OCH3)。
【0074】
(4)化合物6の製造((S)−1−メトキシメチル−1'−(3−(4,5−ジヒドロ−1H−イミダゾール−2−イアミノベンジル)−2−ヒドロキシメチル−ビナフトール)
【0075】
化合物5(0.56g、1.2mmol)と1,3−ビス−BOC−2−メチル−2−チオプソイドウレア(1,3−bis−BOC−2−methyl−2−thiopseudourea)(0.35g、1.4mmol)のAcOH/EtOH(1:9v/v)溶液50mlを16時間加熱して化合物6を得た。

【0076】
歩留まり85%、1H NMR(CDCl3、250MHz):8.11(s,1H)、7.96(d,1H,J=9.0Hz)、7.87(s,2H,J=9.0Hz)、7.47(d,1H,J=9.0Hz)、7.38−7.02(m,7H)、6.83(d,1H)、6.66(d,1H,J=7.5Hz)、6.57(s,1H)、5.13−4.79(m,4H)、4.51(s,2H,−OCH2O−)、4.16(br,3H)、3.43(s,4H,guanidine CH2)、2.96(s,3H,−OCH3)。
【0077】
(5)化合物8の製造((S)−l−1'−(3−(4,5−ジヒドロ−1H−イミダゾール−2−イアミノ)ベンジル)−バイ−2−ナフトールアルデヒド)
【0078】
化合物6にPCCを処理した後、MOMをHCl溶液に落として化合物8を得た。

【0079】
歩留まり95%、1H NMR(DMSO−d6、250MHz):10.40(s,br,1H,NH)、10.36(s,1H,CHO)、10.15(s,br,OH)、8.68(s,1H)、8.23−8.07(m,4H)、7.97(d,1H,J=8.0Hz)、7.64(d,1H,J=9.0Hz)、7.45−7.22(m,5H)、7.55−6.99(m,4H)、6.87(s,1H)、5.21(s,2H,benzylic CH2)、3.63(s,4H,guanidine CH2)。
【0080】
実施例2.化合物8のR−ビナフトール誘導体の製造
【0081】
(S)−1−メトキシメチル−バイ−2−ナフトールアルデヒドの代わりに、(R)−1−メトキシメチル−バイ−2−ナフトールアルデヒドを用いたことを除いては、実施例1と同じく行った。
【0082】
実施例3.化合物9のS−ビナフトール誘導体の製造
【0083】
1,3−ビス−BOC−2−メチル−2−チオプソイドウレアの代わりに、N−BOC−2−メチルチオ−2−イミダゾールリンを用いたことを除いては、実施例1と同じく行った。

【0084】
1H NMR(DMSO−d6、250MHz):10.34(s,1H,CHO)、10.26(s,1H,NH)、9.02(s,1H,NH)、8.67(s,1H)、8.17−8.07(m,2H)、7.97(d,1H,J=7.9Hz)、7.63(d,1H,J=9.1Hz)、7.45−7.20(m,9H)、7.07−6.96(m,4H)、6.81(s,1H)、5.19(s,2H,benzylic CH2)。
【0085】
実施例4.化合物9のR−ビナフトール誘導体の製造
【0086】
(S)−1−メトキシメチル−バイ−2−ナフトールアルデヒドの代わりに、(R)−1−メトキシメチル−バイ−2−ナフトールアルデヒドを用いたことを除いては、実施例3と同じく行った。
【0087】
実施例5.化合物17のS−ビナフトール誘導体の製造
【0088】
(1)化合物14の製造
(S)−1−メトキシメチル−2−ヒドロキシメチル−ビナフトール(化合物13、0.41mmol)に、NaH(11mg、0.46mmol)及び3−(ブロモメチル)ベンズアルデヒド(82mg、0.42mmol)を添加して、DMFで攪拌して化合物14を得た。

【0089】
歩留まり80%、1H NMR(CDCl3、250MHz):9.72(s,1H,−CHO)、7.88−8.02(m,4H)、7.13−7.64(m,11H)、5.06−5.20(dd,2H,MOM−CH2)、4.93(d,2H,−CH2OH)、4.48−4.61(dd,2H,2−O−benzylic CH2)、3.15(s,3H,−OCH3)。
【0090】
(2)化合物15の製造
【0091】
化合物14(300mg、0.627mmol)、パラフェニレンジアミン(para phenylene diamine)(75mg、0.693mmol)、NaHSO3(65mg、0.627mmol)をエタノール溶液で10時間炊いて化合物15を得た。

【0092】
歩留まり76%、1H NMR(CDCl3、250MHz):10.69(s,1H,−OH)、7.18−8.07(m,20H)、5.19−5.27(dd,2H,−CH2)、4.99−5.04(d,2H,−O−CH2)、4.60−4.70(dd,2H,−O−CH2−OCH3)、3.14(s,3H,−O−CH2−OCH3)。
【0093】
(3)化合物17の製造
【0094】
化合物15にPCCを処理した後、HClを加えて化合物17を得た。

【0095】
歩留まり84%、1H NMR(DMSO−d6、250MHz):12.81(br,1H,−OH)、10.33(s,1H,−CHO)、8.62(s,1H)、6.96−8.09(m,20H)、5.29(s,2H,−OCH2−)。
【0096】
実施例6.化合物22のS−ビナフトール誘導体の製造((S)−1−ヒドロキシ−1'−(3−ジエチルアミノメチルベンジル)−2−アルデヒド−ビナフトール)
【0097】
氷槽(ice bath)のDMFで、NaH(2.4 equiv.0.12)を入れ、化合物2(0.43g、1.12mmol)を入れた後、1時間が過ぎてジエチルアミノメチルベンジルブロミド(diethylaminomethyl benzylbromide)(0.42g、1.23mmol)を入れて反応して、下記化合物((S)−1−メトキシメチル−1'−(3−ジエチルアミノメチルベンジル)−2−アルデヒド−ビナフトール)を得た。

【0098】
上記化合物((S)−1−メトキシメチル−1'−(3−ジエチルアミノメチルベンジル)−2−アルデヒド−ビナフトール)0.2g、0.37mmolをエタノールで塩化水素を入れて加熱して化合物22を得た。

【0099】
歩留まり90%、1H NMR(DMSO−d6、250MHz);δ0.48(s,1H,−CHO)、10.35(s,1H,−OH)、8.80(s,1H,−CH)、8.23〜7.14(m,14H)、5.34(s,2H,−OCH2−)、4.16(s,2H,−NCH2−)、3.04(q、4H,−CH2 of ethyl)、1.26(t、6H,−CH3 of ethyl)
【0100】
実施例7.化合物8及び化合物9を用いたアミノアルコールの光学分割
【0101】
(1)試験
【0102】
本発明のビナフトール誘導体を用いたアミノアルコールの光学分割程度は次の通り試験した。
【0103】
ビナフトール誘導体は、本発明の代表的な化合物である化合物8(実施例1及び2で製造)及び化合物9(実施例3及び4で製造)が各々使われた。
【0104】
ラセミアミノアルコールはアミノプロパノールを含む4種のアミノアルコール(下記[表1]参照)が各々使われた。
【0105】
まず、NMRチューブに0.7mlのCDCl3、0.04mmolのR−formとS−formが1:1に混合されている上記(R、S)−2−アミノプロパノール、0.02mmolの上記ビナフトール誘導体を入れて1H−NMRを測定した。これを図1の(d)で示した。
【0106】
比較のために、化合物8のみの1H−NMRスペクトルを図1の(a)で示した。
【0107】
イミン化合物は5分以内に全て形成され、平衡に到達した。
【0108】
同量で各々R−form及びS−formのみを入れて1H NMRを確認し、ラセミ混合物の各ピークの位置を指定した。化合物8と(S)−2−アミノプロパノールとによるイミン化合物の1H NMRスペクトルを図1の(b)で、化合物8と(R)−2−アミノプロパノールとによるイミン化合物の1H−NMRスペクトルを図1の(c)で示した。
【0109】
キラル選択性は、R−formに該当するピークとS−formに該当するピークとを積分して計算した。
【0110】
(2)結果
【0111】
図1(d)の化合物8とラセミアミノプロパノールとの間に作られたイミン化合物の1H NMRを見ると、R−formとS−formとの間に選択性が示されるのを分かる。
【0112】
図1の(b)によれば、R−formアミノアルコールによるイミンプロトンピークは8.95ppmで、図1の(c)によれば、S−formアミノアルコールによるイミンプロトンピークは8.80ppmで示されるのを分かる。
【0113】
従って、図1の(d)スペクトルにおいて、8.95ppm及び8.80ppmピークの大きさを測定することによって、化合物8とイミン結合を形成したR−form及びS−formの量を分かる。
【0114】
上記1H NMRを見ると、R−formのイミンに該当するピークがS−formのイミンに該当するピークより5.0倍も大きく示されるのが分かる。即ち、R−formのアミノアルコールはS−formのアミノアルコールより、化合物8と5.02=25倍程度イミン結合を良く形成するのが分かる。
【0115】
化合物9と異なる様々なアミノアルコールに対して同一の実験をした時も、やはり良いキラル選択性を示した。この結果を[表1]にまとめた。
【0116】
比較例1.公知のビナフトール誘導体を用いたアミノアルコールの光学分割
【0117】
先行公開特許(大韓民国特許公開第2006−0088489号)に公知された下記のビナフトール誘導体を用いたことを除いては、実施例8と同じく、アミノアルコールの光学分割試験を実施した。この結果も[表1]にまとめた。

[表1] 実施例8(化合物8及び化合物9)及び比較例1におけるアミノアルコールに対するキラル選択性(KR=R−アミノアルコールによるイミン形成定数;KS=S−アミノアルコールによるイミン形成定数)

【0118】
実施例8.化合物8及び化合物9を用いたL−アミノ酸のD−アミノ酸への光学変換
【0119】
(1)試験
本発明のビナフトール誘導体を用いたアミノ酸の光学変換程度は次の通り試験した。
【0120】
ビナフトール誘導体は、本発明の代表的な化合物である化合物8(実施例1及び2で製造)及び化合物9(実施例3及び4で製造)が各々使われた。
【0121】
ラセミアミノ酸は、トリエチルアミンを含む6種のアミノ酸(下記[表2]参照)が各々使われた。
【0122】
まず、NMRチューブに0.7mlのDMSO−d6、0.022mmolのL−アミノ酸、0.08mmolのトリエチルアミン(triethylamine)、0.02mmolのビナフトール誘導体を入れて1H−NMRを測定した。
【0123】
L−アミノ酸が全てビナフトール誘導体と反応してイミンを直ちに形成した。
【0124】
以後、時間別に1H−NMRを測定し、L−アミノ酸がD−アミノ酸に変わるのを確認した。
【0125】
図2に、代表的化合物8がL−フェニルアラニンをD−フェニルアラニンに変換させるのを1H−NMRで示した。
【0126】
図2において、一番上のスペクトルは化合物8のS−ビナフトール誘導体とL−フェニルアラニンとが反応して作られたイミン化合物に対する1H−NMRをEt3N 4当量を添加し、反応1時間後写したものである。その下の1H NMRは反応5時間後、8時間後、24時間後及び48時間後に写したものである。
【0127】
このスペクトルを見ると、反応直後から新たなピークが示されるが、これは化合物8とD−フェニルアラニンとが反応して作られたイミンの各ピークと一致する。48時間後、L−フェニルアラニンによるピークがほぼ消えて、D−フェニルアラニンによるピークが主をなす。即ち、L−フェニルアラニンがD−フェニルアラニンに変換されたというものを意味する。
【0128】
図2によれば、化合物8とL−アラニンとが反応して作られた化合物において、約48時間経過後、L−フェニルアラニンがD−フェニルアラニンに97.7%程度変換されたことを分かる(ピークの面積を計算してみると、L:Dの比率1:42)。一方、D−フェニルアラニンでは、L−フェニルアラニンがほぼ生じなかった。
【0129】
これは、上記化合物8がS−ビナフトール誘導体であるためで、R−ビナフトール誘導体に変えると、逆にD−アミノ酸をL−アミノ酸に変えることができる。
【0130】
結果として、本発明の化合物を用いてラセミアミノ酸から光学的に純粋なD−アミノ酸またはL−アミノ酸の一つの異性体のみを得ることができるという効果がある。
【0131】
化合物8と9を用いて、その他イミノ酸に対して同一の実験を行って、その結果、最終状態のL−アミノ酸とD−アミノ酸との比率を[表2]にまとめた。
【0132】
比較例2.公知のビナフトール誘導体を用いたL−アミノ酸のD−アミノ酸への光学変換
【0133】
比較例1のビナフトール誘導体を用いたことを除いては、実施例9と同じく、アミノ酸の光学変換試験を実施した。この結果も[表2]にまとめた。
[表2]平衡状態でD−アミノ酸/L−アミノ酸の比率(1H NMRの積分比(integration ratio)で測定した)

【0134】
本発明の各化合物がアミノアルコールとキラル選択的に結合してL−アミノ酸をD−アミノ酸に変換させる理由は、先行公開特許(大韓民国特許公開第2006−0088489号)の場合と同一であると判断される。しかし、化合物8と9が先行公開特許の化合物より選択性の遥かに高いことは、化合物8と9のグアニジン基が陽電荷を有して、より立派な水素結合を提供しているためと判断される。
【0135】
アミノ酸のカルボキシレート基(−CO2−)とグアニジンとの間の強力な水素結合は、全体イミンの構造を硬直化させ、結果として、キラル選択性を高めると判断される。化学式6の場合、2つのユリル基を有するので、一個のユリル基のみを有する化合物より強く−OHまたは−CO2−基と結合することができる。
【図面の簡単な説明】
【0136】
【図1】溶媒CDCl3中の1H−NMRスペクトルであって、(a)は化合物8のスペクトル、(b)は化合物8と(S)−2−アミノプロパノールとが反応して作られたイミン化合物に対するスペクトル、(c)は化合物8と(R)−2−アミノプロパノールとが反応して作られたイミン化合物に対するスペクトル、(d)は化合物8と2当量の(R、S)−2−アミノプロパノールとが反応して作られたイミン化合物に対するスペクトルである。
【図2】Et3N 4当量を添加した状態で化合物8とL−フェニルアラニンとが反応して作られたイミン化合物に対する1H NMRスペクトルであって、図中の上から1番目は反応1時間後写したスペクトル、その下には各々5時間、8時間、24時間、48時間経過後写したスペクトルである。
【特許請求の範囲】
【請求項1】
下記の化学構造

を共通に含むビナフトール誘導体であって、下記の[化学式1]〜[化学式6]
[化学式1]

[化学式2]

[化学式3]

[化学式4]

[化学式5]

[化学式6]

(上記化学式1〜6中のR1〜R8は各々、
i)−OH、水素またはハロゲンに置換可能な直鎖または分岐鎖アルキル、
ii)−OH、またはハロゲンに置換可能なシクリックアルキル、アルケニル、アルキニル、または
iii)−OH、またはハロゲンに置換可能なアリールである)
からなる群より選択されることを特徴とするビナフトール誘導体。
【請求項2】
請求項1に記載の化合物を用いて、下記[化学式7]
[化学式7]

(上記化学式7中のR9〜R12は各々独立して水素を含む1価の有機基(Organic group)またはハロゲンである)
のラセミアミノアルコール、または下記[化学式8]
[化学式8]

(上記化学式8中のR13〜R15は各々独立して水素を含む1価の有機基である)
のラセミアミノ酸を光学分割(Optical Resolution)する方法。
【請求項3】
前記R9〜R12は各々独立して水素を含む1価の有機基であって、置換または非置換のアルキル、置換または非置換のアルケニル、置換または非置換のシクリックアルキル、または置換または非置換のアリールであることを特徴とする請求項2に記載の光学分割方法。
【請求項4】
前記R13〜R15は各々独立して水素を含む1価の有機基であって、置換または非置換のアルキル、置換または非置換のアルケニル、置換または非置換のシクリックアルキル、または置換または非置換のアリールであることを特徴とする請求項2に記載の光学分割方法。
【請求項5】
請求項1に記載の化合物を用いて、下記の化学式9
[化学式9]

(前記化学式9中のR13〜R15は、各々独立して水素を含む1価の有機基である)
のアミノ酸のD−formをL−formに、またはL−formをD−formに光学変換(Optical Transformation)する光学変換方法。
【請求項6】
前記R13〜R15は各々独立して水素を含む1価の有機基であって、置換または非置換のアルキル、置換または非置換のアルケニル、置換または非置換のシクリックアルキル、または置換または非置換のアリールであることを特徴とする請求項5に記載の光学変換方法。
【請求項1】
下記の化学構造

を共通に含むビナフトール誘導体であって、下記の[化学式1]〜[化学式6]
[化学式1]

[化学式2]

[化学式3]

[化学式4]

[化学式5]

[化学式6]

(上記化学式1〜6中のR1〜R8は各々、
i)−OH、水素またはハロゲンに置換可能な直鎖または分岐鎖アルキル、
ii)−OH、またはハロゲンに置換可能なシクリックアルキル、アルケニル、アルキニル、または
iii)−OH、またはハロゲンに置換可能なアリールである)
からなる群より選択されることを特徴とするビナフトール誘導体。
【請求項2】
請求項1に記載の化合物を用いて、下記[化学式7]
[化学式7]

(上記化学式7中のR9〜R12は各々独立して水素を含む1価の有機基(Organic group)またはハロゲンである)
のラセミアミノアルコール、または下記[化学式8]
[化学式8]

(上記化学式8中のR13〜R15は各々独立して水素を含む1価の有機基である)
のラセミアミノ酸を光学分割(Optical Resolution)する方法。
【請求項3】
前記R9〜R12は各々独立して水素を含む1価の有機基であって、置換または非置換のアルキル、置換または非置換のアルケニル、置換または非置換のシクリックアルキル、または置換または非置換のアリールであることを特徴とする請求項2に記載の光学分割方法。
【請求項4】
前記R13〜R15は各々独立して水素を含む1価の有機基であって、置換または非置換のアルキル、置換または非置換のアルケニル、置換または非置換のシクリックアルキル、または置換または非置換のアリールであることを特徴とする請求項2に記載の光学分割方法。
【請求項5】
請求項1に記載の化合物を用いて、下記の化学式9
[化学式9]

(前記化学式9中のR13〜R15は、各々独立して水素を含む1価の有機基である)
のアミノ酸のD−formをL−formに、またはL−formをD−formに光学変換(Optical Transformation)する光学変換方法。
【請求項6】
前記R13〜R15は各々独立して水素を含む1価の有機基であって、置換または非置換のアルキル、置換または非置換のアルケニル、置換または非置換のシクリックアルキル、または置換または非置換のアリールであることを特徴とする請求項5に記載の光学変換方法。
【図1】


【図2】




【図2】


【公開番号】特開2009−23989(P2009−23989A)
【公開日】平成21年2月5日(2009.2.5)
【国際特許分類】
【出願番号】特願2008−29515(P2008−29515)
【出願日】平成20年2月8日(2008.2.8)
【出願人】(506036426)梨花女子大學校 産學協力團 (2)
【Fターム(参考)】
【公開日】平成21年2月5日(2009.2.5)
【国際特許分類】
【出願日】平成20年2月8日(2008.2.8)
【出願人】(506036426)梨花女子大學校 産學協力團 (2)
【Fターム(参考)】
[ Back to top ]

