ビフェニル類の製造法
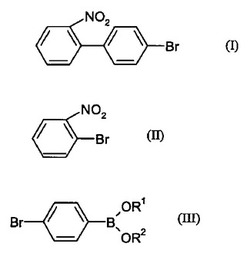
本発明は、式(I)の化合物を調製するための新規な方法であって、式(II):の化合物と一般式(III ):の化合物(式中R1及びR2はHもしくはC1-4アルキル基であるか、又はR1とR2が互いに結合してC2-3アルキレン基を形成し所望により1から4個のメチル又はエチル基で置換されている)、又は化合物(III )の無水物とを、塩基及び
(a)所望により付加量のトリアリールホスフィン配位子存在下での、パラジュウム(0)-又はパラジウム(II)-トリアリールホスフィン錯体、又は
(b)トリアリールホスフィン配位子存在下での、パラジウム(II)塩、又は
(c)所望により担体に担持された、トリアリールホスフィン存在下での金属パラジウム;
であるパラジウム触媒の存在下、化合物(II)に対して0.9から2モルの化合物(III )を用いて反応させることを含む方法。
(a)所望により付加量のトリアリールホスフィン配位子存在下での、パラジュウム(0)-又はパラジウム(II)-トリアリールホスフィン錯体、又は
(b)トリアリールホスフィン配位子存在下での、パラジウム(II)塩、又は
(c)所望により担体に担持された、トリアリールホスフィン存在下での金属パラジウム;
であるパラジウム触媒の存在下、化合物(II)に対して0.9から2モルの化合物(III )を用いて反応させることを含む方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、2-ニトロ-4’-ブロモ-ビフェニルの新規な製造法、及びその、WO 2004/058723に記載されているタイプのビフェニル殺菌剤の製造中間体として使用できる2-ニトロ-及び2-アミノ-4’-アルキニル-ビフェニル化合物の製造への使用に関する。本発明はまた、2-ニトロブロモベンゼンから新規化合物であるある種の中間体を経て2-ニトロ-4’-アルキニル-ビフェニル中間体を製造するための単一容器(one pot)製造法を含む。
【背景技術】
【0002】
ある種の2-ニトロビフェニル類の製造法は米国特許第6,087,542号に記載されている。不運にも、そこに記載された方法は2-ニトロ-4’-ブロモビフェニルの製造に適さない。何故なら、その方法では、望ましくない式(A):
【化1】

の2重(bis)カップリング生成物が多量に生成するからである。
【0003】
Suzukiの交差カップリング法により5-ベンジルオキシ-2-ブロモニトロベンゼンと4-ブロモフェニル硼酸とから5-ベンジルオキシ-2-(4-ブロモフェニル)ニトロベンゼンを製造する方法が米国出願2003/0040538に記載されている。しかし、この方法でよい収率を得るためには4-ブロモフェニル硼酸を5倍モル超使用する必要があり、経済的にも環境上からも満足できる方法ではない。
【発明の開示】
【発明が解決しようとする課題】
【0004】
副生物が少なく、経済的にも環境上も好ましいビフェニル類の製造方法を提供する。
【課題を解決するための手段】
【0005】
本発明によれば、
式(I):
【化2】

の化合物(2-ニトロ-4'-ブロモビフェニル)を製造する方法であって、式(II):
【化3】

の化合物(2-ニトロブロモベンゼン)と一般式(III ):
【化4】

の化合物(式中R1及びR2はHもしくはC1-4アルキル基であるか、又はR1とR2が互いに結合してC2-3アルキレン基を形成し所望により1から4個のメチル又はエチル基で置換されている)、又は化合物(III )の無水物とを、塩基及び
(a)所望により付加量のトリアリールホスフィン配位子存在下での、パラジウム(0)-又はパラジウム(II)-トリアリールホスフィン錯体、又は
(b)トリアリールホスフィン配位子存在下での、パラジウム(II)塩、又は
(c)所望により担体に担持された、トリアリールホスフィン存在下での金属パラジウム;
であるパラジウム触媒の存在下、化合物(II)に対して0.9から2モルの化合物(III )を用いて反応させることを含む方法、が提供される。
【0006】
該C1-6アルキル基は、1から6個の炭素原子を含む分岐又は非分岐のアルキル基、例えば、メチル、エチル、n-プロピル、n-ブチル、iso-プロピル、sec-ブチル、iso-ブチル、tert-ブチル、n-ペンチル、又はn-ヘキシルである。該C2-3アルキレン基、(R1とR2が互いに結合して形成することが出来る)は、所望により1から4個のメチル基又はエチル基で置換されていても良いエチレン又はプロピレンである。
【0007】
式(III )の化合物の無水物は、2又はより多い等量の化合物(III )が、水が外れることにより結合した生成物であり、B-O-B架橋を持つ、例えば式(III a):
【化5】

の環状無水物である。
【0008】
好ましくは、4-ブロモフェニル硼酸が用いられる。アルキルエステルを用いる場合は、ジメチル、ジエチル又はジ-iso-プロピルエステルが好都合である。
【0009】
本発明の方法に用いられる化合物(III )の量は、化合物(II)1モル当り0.9から2モル、通常1.0から1.5モル、好ましくは約1.1モルである。
【0010】
使用される塩基は、三級アミンのような有機塩基、例えばトリエチルアミン又はジメチルシクロヘキシルアミンでもよいが、好ましくはアルカリ金属又はアルカリ土類金属の水酸化物、炭酸塩、酢酸塩またはアルコキサイド、アルカリ金属のリン酸塩又は重炭酸塩、又はそれらの混合物である。特に適するのはナトリウム、カリウム、リチウム、カルシウム及びバリウムの水酸化物又は炭酸塩、及びナトリウム又はカリウムのリン酸塩である。
塩基の使用量は選んだ塩基に拠るが、ナトリウム又はカリウムの水酸化物のような強い無機塩基の場合、化合物(III )1モル当り、通常1から4モル、好都合には1.5から4モル、典型的には約3モルである。
【0011】
本発明方法は、
(a)所望により付加量のトリアリールホスフィン配位子存在下での、パラジュウム(0)-又はパラジウム(II)-トリアリールホスフィン錯体、又は
(b)トリアリールホスフィン配位子存在下での、パラジウム(II)塩、又は
(c)所望により担体に担持された、トリアリールホスフィン存在下での金属パラジウム;
であるパラジウム触媒のどれかの存在下で行われる。
そのような触媒は方法に熟練した化学者によく知られている(例えば、Angew. Chem. 105(1993), 1589参照)。
【0012】
酸化状態0のパラジウムを持つパラジウム錯体としは、テトラキス(トリフェニルホスフィン)パラジウム及びテトラキス[トリ(o-トリル)ホスフィン]パラジウムが特に適する。酸化状態がプラスIIのパラジウムを持つパラジウム錯体としては、ジ(トリフェニルホスフィン)パラジウム(II)アセテート(Pd(O2CCH3)2([C6H5]P)2)及びジ-(トリフェニルホスフィン)パラジウム(II)クロライド(PdCl2([C6H5]3P)2)が特に適する。
【0013】
トリフェニルホスフィン又はトリ(o-トリル)ホスフィン配位子のようなトリアリールホスフィンの存在下で使用されるパラジウム(II)塩としては、パラジウム(II)アセテート又はパラジウムジクロライドが適する。
典型的には、2から6当量のトリアリールホスフィン配位子が1当量のパラジウム塩と錯体を形成し、又は付加的にパラジウム-トリアリール錯体と共に用いられる。
【0014】
金属パラジウムは、好ましくは粉状で又は担体に坦持して、例えば活性炭上パラジウム、酸化アルミニウム上パラジウム、炭酸バリウム上パラジウム、硫酸バリウム上パラジウム、炭酸カルシウム上パラジウム、モンモリロナイトのような珪酸アルミニウム上パラジウム及びシリカ上パラジウムとして用いられ、(担持触媒中の)パラジウム含有量は0.5から12重量%である。そのような担持触媒は付加的に更に鉛のようなドーピング物質を含んでいても良い。
【0015】
担持された、またはされていない金属パラジウムを用いる場合、上記したタイプの錯体配位子を同時に用いると有利であり、特に活性炭上のパラジウムをトリフェニルホスフィン、トリ(o-トリル)ホスフィン又は他のトリアリールホスフィン、アリール基は1から3個のスルホン酸基で適宜置換されていても良い、の存在下で用いるとよい。これらの配位子はパラジウム金属1当量当り2から3当量で用いるのが適切である。
【0016】
好ましいパラジウム触媒は、ジ-(トリフェニルホスフィン)パラジウム(II)アセテート、ジ-(トリフェニルホスフィン)パラジウム(II)クロライド及びトリフェニルホスフィン又はトリ-(o-トリル)ホスフィン配位子存在下でのパラジウム(II)クロライドである。
【0017】
本発明方法において、パラジウム触媒は化合物(II)に対し、0.01から10モル%、好ましくは0.05から5モル%、特には0.1から3モル%の比率で使用される。
【0018】
本発明方法は、適切な溶媒中で行われ、溶媒は有機溶媒又は水のどちらでもよく、好ましくは両者の混合物であり、混合物の場合有機溶媒は、水と混和するか1部混和するものが好ましい。適切な有機溶媒は、例えば、ジメトキシエタン、ジエチレングリコールジメチルエーテル、テトラヒドロフラン(THF)、ジオキサン及びtert-ブチルメチルエーテルのようなエーテル;メタノール、エタノール1-プロパノール、2-ブタノール、エチレングリコール、1-ブタノール、2-ブタノール及びtert-ブタノールのようなアルコール;アセトン、エチルメチルケトン、及びiso-ブチルメチルケトンのようなケトン;N,N-ジエチルホルムアミド、N,N-ジメチルアセトアミド及びN-メチルピロリドンのようなアミド、である。これらの溶剤の2種又はより多種の混合物を用いてもよく、その場合特に1種の溶剤は水である。
【0019】
本方法は、0から150℃、通常室温から150℃の温度で行うことができる。通常、反応は使用される溶媒系の還流温度で行われる。
【0020】
反応時間は、特に、方法の規模、使用される触媒と配位子の割合及び温度に依存するが、通常は1から48時間、例えば6から24時間、典型的には10から20時間を要するであろう。
【0021】
本方法は、化合物(II)と化合物(III )とを、水混和性有機溶媒中、必要ではないが好ましくは不活性気体、最も好都合にはアルゴン又は窒素、雰囲気下で混合し、塩基と水を加え、次いでパラジウム触媒と配位子を加えることにより好都合に行われる。しかし、添加の順序は必然的ではない。
【0022】
例えば反応混合物試料のガスクロマトグラフィー分析により反応の完結が判定されたら、粗生成物は濾過によりパラジウム触媒を除き且つ溶媒を除くことにより単離することができる。単離物は標準的な実験室手法により精製することができる。生成物は、粗生成物でも精製された物でも、例えばWO 2004/058723中に記載されているタイプのビフェニル殺菌剤製造の中間体として有用である。この場合、生成物は末端アルキン、例えば下記の式(IV)のもの、と、よく知られたSonogashira法を用いて反応させて下記の式(V)の化合物を作り、又は標準的な還元条件で還元して下記の式(VI)の化合物を作り、化合物(VI)は次いで末端アルキンとSonogashira法を用いて反応させ下記の式(VII )の化合物を作る。
【0023】
かくて、本発明の1態様によれば、前記のようにして式(I)の化合物を調製し、次いで式(I)の化合物を一般式(IV)
【化6】

の化合物(式中R3は、H、C1-6アルキル[所望により、ハロゲン、水酸基、C1-4アルコキシ、C1-4ハロアルコキシ、C1-4アルキルチオ、C1-4ハロアルキルチオ、C1-4アルキルアミノ、ジ-(C1-4)アルキルアミノ、C1-4アルコキシカルボニル、C1-4アルキルカルボニルオキシ、及びトリ-(C1-4)アルキルシリルから各々独立に選ばれた1個又はより多くの置換基で置換された]、C2-4アルケニル[所望により、ハロゲンから各々独立に選ばれた1個又はより多くの置換基で置換された]、C3-7のシクロアルキル[所望により、ハロゲン、C1-4アルキル及びC1-4ハロアルキルから各々独立に選ばれた1個又はより多くの置換基で置換された]、又はトリ-(C1-4)アルキルシリルである)、と、塩基、前記したようなパラジウム触媒及び銅(I)塩の存在下で反応させ一般式(V)
【化7】

の化合物(式中R3は上記された意味を持つ)を作ることを含む方法が提供される。
【0024】
アルキル基及びアルコキシ、アルキルチオ、アルキルアミノ、等のアルキル部分は、上記のR1及びR2について定義したアルキルを意味する。R3は、典型的には、水素、メチル、iso-プロピル、iso-ブチル、tert-ブチル、シクロプロピル、1,1-ヂメチルプロピル、2,2-ジメチルプロピル、ヒドロキシメチル、ヒドロキシエチル、1-ヒドロキシ-1-メチルエチル、1-ヒドロキシ-1-メチルプロピル、1-ヒドロキシメチル-1-メチルエチル、1-iso-プロピルオキシ-1-メチルエチル、2-メトキシ-2-メチルブチル、2,2,2,-トリフルオロエトキシメチル、1-メトキシカルボニル-1-メチルエチル、1-メチルカルボニルオキシ-1-メチルエチル、トリメチルシリル、及びトリメチルシリルメチル、を意味する。
【0025】
本発明のこの態様において用いられる塩基は、好ましくは、ピペリジン、ピロリジントリエチルアミン、ジイソプロピルエチルアミン、ジエチルアミン又はn-ブチルアミンのような、脂肪族又は脂環族の1級、2級又は3級アミンである。使用量は、化合物(IV)1モル当り、通常1から4、好都合には1.5から4、典型的には約3モルであろう。
【0026】
用いられるパラジウム触媒は、化合物(I)の調製方法で定義されたタイプの如何なる触媒でもよく、使用量も同様である。
【0027】
銅(I)塩は、好ましくはヨウ化第1銅である。使用量は、触媒使用量当り通常1から6、典型的には1から2当量である。
【0028】
用いられるアルキン(IV)の量は、化合物(I)1モル当り1から2モル、典型的には1.1から1.5モルである。
【0029】
好都合には、化合物(V)を作る方法は、化合物(I)の調製法として記載された方法と同様の溶媒系中で、室温又は高められた温度、例えば15から50℃、典型的には40℃で、所望により少し高められた圧力下で、行われる。
【0030】
しかしながら、化合物(I)の調製後に化合物(I)の反応混合物を用いてSonogashira法を行う、単一容器(one pot)中の逐次的反応によって化合物(V)を調製すると特別に有利であることが見出された。分離した、2工程による方法は通常、工程の完結と精製の間に触媒の不活性化と除去、及び第2のSonogashira工程のための新しい触媒の使用を必要とする。本発明の単一容器法によればこれを避けることができ、全体として使用される触媒量を減らすことができるばかりでなく結合した段階を通じて収率が改善され、全体としての製造コストを低減できる。これは、工程の完結と精製の手順を省いた結果でもあるが、更にまた、驚くべきことには、単離された化合物(I)からのSonogashira法を実施する際に見られるアルキレンの酸化カップリング生成物の形成が明らかに減少することにも拠る。
【0031】
かくて、本発明のもう1つの態様において、上記した方法即ち式(I)の化合物を一般式(IV)の化合物と反応させる付加工程を、化合物(I)を調製した同じ反応槽中で、式(I)の化合物が最初に調製された反応混合物のpHを9未満まで下げて行う方法が提供される。
【0032】
この単一容器法においては、化合物(I)の調製の完了後、それは常用のクロマトグラフィー技術で評価できる、粗反応混合物が典型的には室温まで冷却され、そして希釈された酸の添加により、pHが9未満、例えば8未満、典型的には6超8未満となるまで中和される。
pH範囲の下限は臨界的ではない。しかし、反応混合物が余りに酸性であると、引続くSonogashira工程において、必要以上の塩基の添加を要するであろう。中和に用いる酸は、有機酸でも無機酸でもよく、プロピオン酸または硫酸のようなものであり、又は、好ましくは酢酸又は塩酸である。塩基、第1銅塩及び末端アルキン(IV)は逐次的に添加され、反応は先に論じられたように、所望により高められた温度で、所望により少し高められた圧力下で進めることが許容される。反応の完結は標準的なクロマトグラフィー技術で判定できる。
【0033】
本発明の更にもう1つの態様において、前記のように式(I)の化合物を調製し、次いで式(I)の化合物を還元して式(VI)
【化8】

の化合物、2-アミノ-4’-ブロモ-ビフェニルを作る方法が提供される。
【0034】
還元は、芳香族ニトロ化合物をアニリン類に還元ための適当なよく知られた文献方法で行うことができる。そのような方法、特に触媒水素化、移動水素化、金属又は金属塩による還元の何れでもよく、ハロゲン又は不飽和基のような付加的な官能基が存在していてもよい、は、例えば、Houben Weyl: Methoden der organishen Chemmie IV/1c, 506頁 及び続く頁., 575頁及び続く頁.,742頁及び続く頁;Houben Weil: Methoden der organishen Chemie XI/1, 394頁及び続く頁、それは産業上有用な、鉄を用いる" Bechamp reduction"
を解説している;シリーズである、Compendium of Organic Synthetic Methods, Volumes 1-11(wiley-Interscience), 「ニトロ化合物からのアミン類の調製」という題名を持つ;及び、Handbook of Catalytic Hydrogenation for Organic Synthesis(S.Nishimura;J.Wiley 2001), Chapter 9.3、に記載されている。
【0035】
更にまたもう一つの本発明の態様において、上記したように式(VI)の化合物を調製し、次いで式(VI)の化合物を一般式(IV)
【化9】

の化合物(式中R3は上記の意味を持つ)と、塩基、先に定義したパラジウム触媒及び銅(I)塩の存在下で反応させ一般式(VII ):
【化10】

の化合物を作ることを含む方法が提供される。
【0036】
本発明のこの態様は、化合物(I)から化合物(V)を調製するための上記したSonogashira法の場合と同様な仕方で、同様な試薬及び触媒を同様の割合で用いて行うことができる。
【0037】
一般式(V)の中間化学物質は新規化合物と信じられ、又更なる本発明の態様を成す。
【0038】
かくて、本発明はまた、一般式(V)
【化11】

の化合物(式中R3は、H、C1-6アルキル[所望により、ハロゲン、水酸基、C1-4アルコキシ、C1-4ハロアルコキシ、C1-4アルキルチオ、C1-4ハロアルキルチオ、C1-4アルキルアミノ、ジ-(C1-4)アルキルアミノ、C1-4アルコキシカルボニル、C1-4アルキルカルボニルオキシ、及びトリ-(C1-4)アルキルシリルから各々独立に選ばれた1個又はより多くの置換基で置換された]、C2-4アルケニル[所望により、ハロゲンから各々独立に選ばれた1個又はより多くの置換基で置換された]、C3-7のシクロアルキル[所望により、ハロゲン、C1-4アルキル及びC1-4ハロアルキルから各々独立に選ばれた1個又はより多くの置換基で置換された]、又はトリ-(C1-4)アルキルシリルである)を提供する。
【0039】
特に、R3は、H、C1-6アルキル、C3-6シクロアルキル、C1-4ハロアルキル、ヒドロキシ(C1-6)アルキル、C1-4アルコキシ(C1-6)アルキルC1-4ハロアルコキシ(C1-6)アルキル、C1-4アルコキシカルボニル(C1-6)アルキル、C1-4アルキルカルボニルオキシ(C1-6)アルキル、トリ-C1-4アルキルシリル、又はアルキルシリル(C1-4)アルキルである。
【0040】
特に重要な化合物(V)は、R3がtert-ブチル、1-メチル-1-メトキシエチル又は1-メチル-1-エトキシメチルのものである。
【0041】
式(V)の化合物の例は下記表1に挙げた化合物である。R3の意味は、物性データと共に表中で与えられる。
【0042】
【表1】

【0043】
一般式(V)の化合物は、式(I)の化合物を還元し式(IV)の化合物とするための方法として上記したタイプの適当な還元法により還元して一般式(VII )のアミノ化合物とすることができる。かくて、又更なる本発明の態様において、一般式(V):
【化12】

の化合物(式中R3はを上に与えられた意味を持つ)を上記のように調製し、次いで一般式(V)の化合物を還元して一般式(VII ):
【化13】

の化合物(式中R3は同じ意味を持つ)とすることを含む方法が提供される。
【0044】
一般式(VII )の化合物は、WO 2004/058723中にきされているタイプのビフェニル殺菌剤の製造中間体として有用である。
【0045】
次の、本発明を限定するものではない実施例は、本発明をより詳しく説明する。
【実施例】
【0046】
実施例1
2-ニトロ-4'-ブロモ-ビフェニルの調製
2-ニトロブロモベンゼン(18.3g)と4-ブロモフェニル-硼酸(20.0g)は、THF(40ml)とジメトキシエチレン(60ml)との混合物中に窒素雰囲気下で混合された。室温で、炭酸カリウム(31.3g)と水(60ml)との溶液が加えられた。温度は300Cに上昇し、黄色のエマルジョンは数分間攪拌された。テトラキス(トリフェニルホスフィン)パラジウム(0.63g)が次いで加えられ、得られた混合物は一晩還流された。
【0047】
反応混合物は室温に冷却され、濾過され、濾液は酢酸エチルで希釈された。有機相は分離され、水相は酢酸エチルで2度洗浄され、有機相は水とブラインで洗浄され、硫酸ナトリウムで乾燥された。溶媒を蒸発させた後、残渣はシリカゲルによるクロマトグラフィー(ヘキサン:酢酸エチル 19:1)にかけられた。
【0048】
収量:19.1g(75.8%)2-ニトロ-4'-ブロモ-ビフェニル、式(A):
【化14】

の2-ニトロ-4'-(4"-ブロモフェニル)ビフェニル2.95g(9.2%)共
【0049】
望ましくない2倍カップリング物質(A)の生成量が低いことは、本発明による方法の重要な利点である。式(I)の化合物の調製法に米国特許第6,087,542の教示を適用すると、典型的に、望ましくない2倍カップリング物質の顕著な形成をもたらす。一般に、望ましい式(I)の化合物と望ましくない2倍カップリング物質の比率が1:1の領域になることが認められる。本発明の方法によれば、実施例Iで述べられているように、典型的に、式(I)の化合物と望ましくない2倍カップリング物質の比は少なくとも8:1の領域で得ることができる。
【0050】
実施例2
「単1槽」法による、2-ニトロブロモベンゼンからの2-ニトロ-4'-(3,3-ジメチル-ブチン-1-イル)-ビフェニル(化合物1.3)の調製
2-ニトロベンゼン(4.6g)と4-ブロモフェニル-硼酸(5.0g)がTHF(25ml)中に窒素ガス雰囲気下で混合された。室温で、水酸化ナトリウム(3.6g)と水(25ml)の溶液が加えられた。温度は330Cに上昇し、黄色のエマルジョンは数分間攪拌された。酢酸パラジウム(0.051g)とトリフェニルホスフィン(0.28g)が加えられ、得られた混合物は16時間還流された。この時間後、反応はガスクロマトグラフィー(GC)で判定され完結した。GC分析は1%未満の2倍カップリング物質の形成を示した。
【0051】
反応混合物は室温に冷却され、2モル濃度の塩酸水溶液がpH7.5になるまで注意深く加えられ、そしてトリエチルアミン(50ml)及びヨウ化第1銅(0.043g)が加えられた。3,3-ジメチル-1-ブチン(5.5ml)が1時間以内に加えられた。反応混合物は次いで室温で24時間及び40℃で15時間攪拌された。冷却した後、減圧下で溶媒が除かれ、残渣はtert-ブチルメチルエーテルと水の中に分散された。有機相は分離され、水とブラインとで逆流洗浄(back-wash)され、そして溶媒は蒸発された。残った固体(7.7g)は熱ヘキサンに溶解され、熱いうちにろ過された。
収量5.5g(88.1%;工程毎の平均収率93%超に相当する)
【技術分野】
【0001】
本発明は、2-ニトロ-4’-ブロモ-ビフェニルの新規な製造法、及びその、WO 2004/058723に記載されているタイプのビフェニル殺菌剤の製造中間体として使用できる2-ニトロ-及び2-アミノ-4’-アルキニル-ビフェニル化合物の製造への使用に関する。本発明はまた、2-ニトロブロモベンゼンから新規化合物であるある種の中間体を経て2-ニトロ-4’-アルキニル-ビフェニル中間体を製造するための単一容器(one pot)製造法を含む。
【背景技術】
【0002】
ある種の2-ニトロビフェニル類の製造法は米国特許第6,087,542号に記載されている。不運にも、そこに記載された方法は2-ニトロ-4’-ブロモビフェニルの製造に適さない。何故なら、その方法では、望ましくない式(A):
【化1】

の2重(bis)カップリング生成物が多量に生成するからである。
【0003】
Suzukiの交差カップリング法により5-ベンジルオキシ-2-ブロモニトロベンゼンと4-ブロモフェニル硼酸とから5-ベンジルオキシ-2-(4-ブロモフェニル)ニトロベンゼンを製造する方法が米国出願2003/0040538に記載されている。しかし、この方法でよい収率を得るためには4-ブロモフェニル硼酸を5倍モル超使用する必要があり、経済的にも環境上からも満足できる方法ではない。
【発明の開示】
【発明が解決しようとする課題】
【0004】
副生物が少なく、経済的にも環境上も好ましいビフェニル類の製造方法を提供する。
【課題を解決するための手段】
【0005】
本発明によれば、
式(I):
【化2】

の化合物(2-ニトロ-4'-ブロモビフェニル)を製造する方法であって、式(II):
【化3】

の化合物(2-ニトロブロモベンゼン)と一般式(III ):
【化4】

の化合物(式中R1及びR2はHもしくはC1-4アルキル基であるか、又はR1とR2が互いに結合してC2-3アルキレン基を形成し所望により1から4個のメチル又はエチル基で置換されている)、又は化合物(III )の無水物とを、塩基及び
(a)所望により付加量のトリアリールホスフィン配位子存在下での、パラジウム(0)-又はパラジウム(II)-トリアリールホスフィン錯体、又は
(b)トリアリールホスフィン配位子存在下での、パラジウム(II)塩、又は
(c)所望により担体に担持された、トリアリールホスフィン存在下での金属パラジウム;
であるパラジウム触媒の存在下、化合物(II)に対して0.9から2モルの化合物(III )を用いて反応させることを含む方法、が提供される。
【0006】
該C1-6アルキル基は、1から6個の炭素原子を含む分岐又は非分岐のアルキル基、例えば、メチル、エチル、n-プロピル、n-ブチル、iso-プロピル、sec-ブチル、iso-ブチル、tert-ブチル、n-ペンチル、又はn-ヘキシルである。該C2-3アルキレン基、(R1とR2が互いに結合して形成することが出来る)は、所望により1から4個のメチル基又はエチル基で置換されていても良いエチレン又はプロピレンである。
【0007】
式(III )の化合物の無水物は、2又はより多い等量の化合物(III )が、水が外れることにより結合した生成物であり、B-O-B架橋を持つ、例えば式(III a):
【化5】

の環状無水物である。
【0008】
好ましくは、4-ブロモフェニル硼酸が用いられる。アルキルエステルを用いる場合は、ジメチル、ジエチル又はジ-iso-プロピルエステルが好都合である。
【0009】
本発明の方法に用いられる化合物(III )の量は、化合物(II)1モル当り0.9から2モル、通常1.0から1.5モル、好ましくは約1.1モルである。
【0010】
使用される塩基は、三級アミンのような有機塩基、例えばトリエチルアミン又はジメチルシクロヘキシルアミンでもよいが、好ましくはアルカリ金属又はアルカリ土類金属の水酸化物、炭酸塩、酢酸塩またはアルコキサイド、アルカリ金属のリン酸塩又は重炭酸塩、又はそれらの混合物である。特に適するのはナトリウム、カリウム、リチウム、カルシウム及びバリウムの水酸化物又は炭酸塩、及びナトリウム又はカリウムのリン酸塩である。
塩基の使用量は選んだ塩基に拠るが、ナトリウム又はカリウムの水酸化物のような強い無機塩基の場合、化合物(III )1モル当り、通常1から4モル、好都合には1.5から4モル、典型的には約3モルである。
【0011】
本発明方法は、
(a)所望により付加量のトリアリールホスフィン配位子存在下での、パラジュウム(0)-又はパラジウム(II)-トリアリールホスフィン錯体、又は
(b)トリアリールホスフィン配位子存在下での、パラジウム(II)塩、又は
(c)所望により担体に担持された、トリアリールホスフィン存在下での金属パラジウム;
であるパラジウム触媒のどれかの存在下で行われる。
そのような触媒は方法に熟練した化学者によく知られている(例えば、Angew. Chem. 105(1993), 1589参照)。
【0012】
酸化状態0のパラジウムを持つパラジウム錯体としは、テトラキス(トリフェニルホスフィン)パラジウム及びテトラキス[トリ(o-トリル)ホスフィン]パラジウムが特に適する。酸化状態がプラスIIのパラジウムを持つパラジウム錯体としては、ジ(トリフェニルホスフィン)パラジウム(II)アセテート(Pd(O2CCH3)2([C6H5]P)2)及びジ-(トリフェニルホスフィン)パラジウム(II)クロライド(PdCl2([C6H5]3P)2)が特に適する。
【0013】
トリフェニルホスフィン又はトリ(o-トリル)ホスフィン配位子のようなトリアリールホスフィンの存在下で使用されるパラジウム(II)塩としては、パラジウム(II)アセテート又はパラジウムジクロライドが適する。
典型的には、2から6当量のトリアリールホスフィン配位子が1当量のパラジウム塩と錯体を形成し、又は付加的にパラジウム-トリアリール錯体と共に用いられる。
【0014】
金属パラジウムは、好ましくは粉状で又は担体に坦持して、例えば活性炭上パラジウム、酸化アルミニウム上パラジウム、炭酸バリウム上パラジウム、硫酸バリウム上パラジウム、炭酸カルシウム上パラジウム、モンモリロナイトのような珪酸アルミニウム上パラジウム及びシリカ上パラジウムとして用いられ、(担持触媒中の)パラジウム含有量は0.5から12重量%である。そのような担持触媒は付加的に更に鉛のようなドーピング物質を含んでいても良い。
【0015】
担持された、またはされていない金属パラジウムを用いる場合、上記したタイプの錯体配位子を同時に用いると有利であり、特に活性炭上のパラジウムをトリフェニルホスフィン、トリ(o-トリル)ホスフィン又は他のトリアリールホスフィン、アリール基は1から3個のスルホン酸基で適宜置換されていても良い、の存在下で用いるとよい。これらの配位子はパラジウム金属1当量当り2から3当量で用いるのが適切である。
【0016】
好ましいパラジウム触媒は、ジ-(トリフェニルホスフィン)パラジウム(II)アセテート、ジ-(トリフェニルホスフィン)パラジウム(II)クロライド及びトリフェニルホスフィン又はトリ-(o-トリル)ホスフィン配位子存在下でのパラジウム(II)クロライドである。
【0017】
本発明方法において、パラジウム触媒は化合物(II)に対し、0.01から10モル%、好ましくは0.05から5モル%、特には0.1から3モル%の比率で使用される。
【0018】
本発明方法は、適切な溶媒中で行われ、溶媒は有機溶媒又は水のどちらでもよく、好ましくは両者の混合物であり、混合物の場合有機溶媒は、水と混和するか1部混和するものが好ましい。適切な有機溶媒は、例えば、ジメトキシエタン、ジエチレングリコールジメチルエーテル、テトラヒドロフラン(THF)、ジオキサン及びtert-ブチルメチルエーテルのようなエーテル;メタノール、エタノール1-プロパノール、2-ブタノール、エチレングリコール、1-ブタノール、2-ブタノール及びtert-ブタノールのようなアルコール;アセトン、エチルメチルケトン、及びiso-ブチルメチルケトンのようなケトン;N,N-ジエチルホルムアミド、N,N-ジメチルアセトアミド及びN-メチルピロリドンのようなアミド、である。これらの溶剤の2種又はより多種の混合物を用いてもよく、その場合特に1種の溶剤は水である。
【0019】
本方法は、0から150℃、通常室温から150℃の温度で行うことができる。通常、反応は使用される溶媒系の還流温度で行われる。
【0020】
反応時間は、特に、方法の規模、使用される触媒と配位子の割合及び温度に依存するが、通常は1から48時間、例えば6から24時間、典型的には10から20時間を要するであろう。
【0021】
本方法は、化合物(II)と化合物(III )とを、水混和性有機溶媒中、必要ではないが好ましくは不活性気体、最も好都合にはアルゴン又は窒素、雰囲気下で混合し、塩基と水を加え、次いでパラジウム触媒と配位子を加えることにより好都合に行われる。しかし、添加の順序は必然的ではない。
【0022】
例えば反応混合物試料のガスクロマトグラフィー分析により反応の完結が判定されたら、粗生成物は濾過によりパラジウム触媒を除き且つ溶媒を除くことにより単離することができる。単離物は標準的な実験室手法により精製することができる。生成物は、粗生成物でも精製された物でも、例えばWO 2004/058723中に記載されているタイプのビフェニル殺菌剤製造の中間体として有用である。この場合、生成物は末端アルキン、例えば下記の式(IV)のもの、と、よく知られたSonogashira法を用いて反応させて下記の式(V)の化合物を作り、又は標準的な還元条件で還元して下記の式(VI)の化合物を作り、化合物(VI)は次いで末端アルキンとSonogashira法を用いて反応させ下記の式(VII )の化合物を作る。
【0023】
かくて、本発明の1態様によれば、前記のようにして式(I)の化合物を調製し、次いで式(I)の化合物を一般式(IV)
【化6】

の化合物(式中R3は、H、C1-6アルキル[所望により、ハロゲン、水酸基、C1-4アルコキシ、C1-4ハロアルコキシ、C1-4アルキルチオ、C1-4ハロアルキルチオ、C1-4アルキルアミノ、ジ-(C1-4)アルキルアミノ、C1-4アルコキシカルボニル、C1-4アルキルカルボニルオキシ、及びトリ-(C1-4)アルキルシリルから各々独立に選ばれた1個又はより多くの置換基で置換された]、C2-4アルケニル[所望により、ハロゲンから各々独立に選ばれた1個又はより多くの置換基で置換された]、C3-7のシクロアルキル[所望により、ハロゲン、C1-4アルキル及びC1-4ハロアルキルから各々独立に選ばれた1個又はより多くの置換基で置換された]、又はトリ-(C1-4)アルキルシリルである)、と、塩基、前記したようなパラジウム触媒及び銅(I)塩の存在下で反応させ一般式(V)
【化7】

の化合物(式中R3は上記された意味を持つ)を作ることを含む方法が提供される。
【0024】
アルキル基及びアルコキシ、アルキルチオ、アルキルアミノ、等のアルキル部分は、上記のR1及びR2について定義したアルキルを意味する。R3は、典型的には、水素、メチル、iso-プロピル、iso-ブチル、tert-ブチル、シクロプロピル、1,1-ヂメチルプロピル、2,2-ジメチルプロピル、ヒドロキシメチル、ヒドロキシエチル、1-ヒドロキシ-1-メチルエチル、1-ヒドロキシ-1-メチルプロピル、1-ヒドロキシメチル-1-メチルエチル、1-iso-プロピルオキシ-1-メチルエチル、2-メトキシ-2-メチルブチル、2,2,2,-トリフルオロエトキシメチル、1-メトキシカルボニル-1-メチルエチル、1-メチルカルボニルオキシ-1-メチルエチル、トリメチルシリル、及びトリメチルシリルメチル、を意味する。
【0025】
本発明のこの態様において用いられる塩基は、好ましくは、ピペリジン、ピロリジントリエチルアミン、ジイソプロピルエチルアミン、ジエチルアミン又はn-ブチルアミンのような、脂肪族又は脂環族の1級、2級又は3級アミンである。使用量は、化合物(IV)1モル当り、通常1から4、好都合には1.5から4、典型的には約3モルであろう。
【0026】
用いられるパラジウム触媒は、化合物(I)の調製方法で定義されたタイプの如何なる触媒でもよく、使用量も同様である。
【0027】
銅(I)塩は、好ましくはヨウ化第1銅である。使用量は、触媒使用量当り通常1から6、典型的には1から2当量である。
【0028】
用いられるアルキン(IV)の量は、化合物(I)1モル当り1から2モル、典型的には1.1から1.5モルである。
【0029】
好都合には、化合物(V)を作る方法は、化合物(I)の調製法として記載された方法と同様の溶媒系中で、室温又は高められた温度、例えば15から50℃、典型的には40℃で、所望により少し高められた圧力下で、行われる。
【0030】
しかしながら、化合物(I)の調製後に化合物(I)の反応混合物を用いてSonogashira法を行う、単一容器(one pot)中の逐次的反応によって化合物(V)を調製すると特別に有利であることが見出された。分離した、2工程による方法は通常、工程の完結と精製の間に触媒の不活性化と除去、及び第2のSonogashira工程のための新しい触媒の使用を必要とする。本発明の単一容器法によればこれを避けることができ、全体として使用される触媒量を減らすことができるばかりでなく結合した段階を通じて収率が改善され、全体としての製造コストを低減できる。これは、工程の完結と精製の手順を省いた結果でもあるが、更にまた、驚くべきことには、単離された化合物(I)からのSonogashira法を実施する際に見られるアルキレンの酸化カップリング生成物の形成が明らかに減少することにも拠る。
【0031】
かくて、本発明のもう1つの態様において、上記した方法即ち式(I)の化合物を一般式(IV)の化合物と反応させる付加工程を、化合物(I)を調製した同じ反応槽中で、式(I)の化合物が最初に調製された反応混合物のpHを9未満まで下げて行う方法が提供される。
【0032】
この単一容器法においては、化合物(I)の調製の完了後、それは常用のクロマトグラフィー技術で評価できる、粗反応混合物が典型的には室温まで冷却され、そして希釈された酸の添加により、pHが9未満、例えば8未満、典型的には6超8未満となるまで中和される。
pH範囲の下限は臨界的ではない。しかし、反応混合物が余りに酸性であると、引続くSonogashira工程において、必要以上の塩基の添加を要するであろう。中和に用いる酸は、有機酸でも無機酸でもよく、プロピオン酸または硫酸のようなものであり、又は、好ましくは酢酸又は塩酸である。塩基、第1銅塩及び末端アルキン(IV)は逐次的に添加され、反応は先に論じられたように、所望により高められた温度で、所望により少し高められた圧力下で進めることが許容される。反応の完結は標準的なクロマトグラフィー技術で判定できる。
【0033】
本発明の更にもう1つの態様において、前記のように式(I)の化合物を調製し、次いで式(I)の化合物を還元して式(VI)
【化8】

の化合物、2-アミノ-4’-ブロモ-ビフェニルを作る方法が提供される。
【0034】
還元は、芳香族ニトロ化合物をアニリン類に還元ための適当なよく知られた文献方法で行うことができる。そのような方法、特に触媒水素化、移動水素化、金属又は金属塩による還元の何れでもよく、ハロゲン又は不飽和基のような付加的な官能基が存在していてもよい、は、例えば、Houben Weyl: Methoden der organishen Chemmie IV/1c, 506頁 及び続く頁., 575頁及び続く頁.,742頁及び続く頁;Houben Weil: Methoden der organishen Chemie XI/1, 394頁及び続く頁、それは産業上有用な、鉄を用いる" Bechamp reduction"
を解説している;シリーズである、Compendium of Organic Synthetic Methods, Volumes 1-11(wiley-Interscience), 「ニトロ化合物からのアミン類の調製」という題名を持つ;及び、Handbook of Catalytic Hydrogenation for Organic Synthesis(S.Nishimura;J.Wiley 2001), Chapter 9.3、に記載されている。
【0035】
更にまたもう一つの本発明の態様において、上記したように式(VI)の化合物を調製し、次いで式(VI)の化合物を一般式(IV)
【化9】

の化合物(式中R3は上記の意味を持つ)と、塩基、先に定義したパラジウム触媒及び銅(I)塩の存在下で反応させ一般式(VII ):
【化10】

の化合物を作ることを含む方法が提供される。
【0036】
本発明のこの態様は、化合物(I)から化合物(V)を調製するための上記したSonogashira法の場合と同様な仕方で、同様な試薬及び触媒を同様の割合で用いて行うことができる。
【0037】
一般式(V)の中間化学物質は新規化合物と信じられ、又更なる本発明の態様を成す。
【0038】
かくて、本発明はまた、一般式(V)
【化11】

の化合物(式中R3は、H、C1-6アルキル[所望により、ハロゲン、水酸基、C1-4アルコキシ、C1-4ハロアルコキシ、C1-4アルキルチオ、C1-4ハロアルキルチオ、C1-4アルキルアミノ、ジ-(C1-4)アルキルアミノ、C1-4アルコキシカルボニル、C1-4アルキルカルボニルオキシ、及びトリ-(C1-4)アルキルシリルから各々独立に選ばれた1個又はより多くの置換基で置換された]、C2-4アルケニル[所望により、ハロゲンから各々独立に選ばれた1個又はより多くの置換基で置換された]、C3-7のシクロアルキル[所望により、ハロゲン、C1-4アルキル及びC1-4ハロアルキルから各々独立に選ばれた1個又はより多くの置換基で置換された]、又はトリ-(C1-4)アルキルシリルである)を提供する。
【0039】
特に、R3は、H、C1-6アルキル、C3-6シクロアルキル、C1-4ハロアルキル、ヒドロキシ(C1-6)アルキル、C1-4アルコキシ(C1-6)アルキルC1-4ハロアルコキシ(C1-6)アルキル、C1-4アルコキシカルボニル(C1-6)アルキル、C1-4アルキルカルボニルオキシ(C1-6)アルキル、トリ-C1-4アルキルシリル、又はアルキルシリル(C1-4)アルキルである。
【0040】
特に重要な化合物(V)は、R3がtert-ブチル、1-メチル-1-メトキシエチル又は1-メチル-1-エトキシメチルのものである。
【0041】
式(V)の化合物の例は下記表1に挙げた化合物である。R3の意味は、物性データと共に表中で与えられる。
【0042】
【表1】

【0043】
一般式(V)の化合物は、式(I)の化合物を還元し式(IV)の化合物とするための方法として上記したタイプの適当な還元法により還元して一般式(VII )のアミノ化合物とすることができる。かくて、又更なる本発明の態様において、一般式(V):
【化12】

の化合物(式中R3はを上に与えられた意味を持つ)を上記のように調製し、次いで一般式(V)の化合物を還元して一般式(VII ):
【化13】

の化合物(式中R3は同じ意味を持つ)とすることを含む方法が提供される。
【0044】
一般式(VII )の化合物は、WO 2004/058723中にきされているタイプのビフェニル殺菌剤の製造中間体として有用である。
【0045】
次の、本発明を限定するものではない実施例は、本発明をより詳しく説明する。
【実施例】
【0046】
実施例1
2-ニトロ-4'-ブロモ-ビフェニルの調製
2-ニトロブロモベンゼン(18.3g)と4-ブロモフェニル-硼酸(20.0g)は、THF(40ml)とジメトキシエチレン(60ml)との混合物中に窒素雰囲気下で混合された。室温で、炭酸カリウム(31.3g)と水(60ml)との溶液が加えられた。温度は300Cに上昇し、黄色のエマルジョンは数分間攪拌された。テトラキス(トリフェニルホスフィン)パラジウム(0.63g)が次いで加えられ、得られた混合物は一晩還流された。
【0047】
反応混合物は室温に冷却され、濾過され、濾液は酢酸エチルで希釈された。有機相は分離され、水相は酢酸エチルで2度洗浄され、有機相は水とブラインで洗浄され、硫酸ナトリウムで乾燥された。溶媒を蒸発させた後、残渣はシリカゲルによるクロマトグラフィー(ヘキサン:酢酸エチル 19:1)にかけられた。
【0048】
収量:19.1g(75.8%)2-ニトロ-4'-ブロモ-ビフェニル、式(A):
【化14】

の2-ニトロ-4'-(4"-ブロモフェニル)ビフェニル2.95g(9.2%)共
【0049】
望ましくない2倍カップリング物質(A)の生成量が低いことは、本発明による方法の重要な利点である。式(I)の化合物の調製法に米国特許第6,087,542の教示を適用すると、典型的に、望ましくない2倍カップリング物質の顕著な形成をもたらす。一般に、望ましい式(I)の化合物と望ましくない2倍カップリング物質の比率が1:1の領域になることが認められる。本発明の方法によれば、実施例Iで述べられているように、典型的に、式(I)の化合物と望ましくない2倍カップリング物質の比は少なくとも8:1の領域で得ることができる。
【0050】
実施例2
「単1槽」法による、2-ニトロブロモベンゼンからの2-ニトロ-4'-(3,3-ジメチル-ブチン-1-イル)-ビフェニル(化合物1.3)の調製
2-ニトロベンゼン(4.6g)と4-ブロモフェニル-硼酸(5.0g)がTHF(25ml)中に窒素ガス雰囲気下で混合された。室温で、水酸化ナトリウム(3.6g)と水(25ml)の溶液が加えられた。温度は330Cに上昇し、黄色のエマルジョンは数分間攪拌された。酢酸パラジウム(0.051g)とトリフェニルホスフィン(0.28g)が加えられ、得られた混合物は16時間還流された。この時間後、反応はガスクロマトグラフィー(GC)で判定され完結した。GC分析は1%未満の2倍カップリング物質の形成を示した。
【0051】
反応混合物は室温に冷却され、2モル濃度の塩酸水溶液がpH7.5になるまで注意深く加えられ、そしてトリエチルアミン(50ml)及びヨウ化第1銅(0.043g)が加えられた。3,3-ジメチル-1-ブチン(5.5ml)が1時間以内に加えられた。反応混合物は次いで室温で24時間及び40℃で15時間攪拌された。冷却した後、減圧下で溶媒が除かれ、残渣はtert-ブチルメチルエーテルと水の中に分散された。有機相は分離され、水とブラインとで逆流洗浄(back-wash)され、そして溶媒は蒸発された。残った固体(7.7g)は熱ヘキサンに溶解され、熱いうちにろ過された。
収量5.5g(88.1%;工程毎の平均収率93%超に相当する)
【特許請求の範囲】
【請求項1】
式(I):
【化1】

の化合物を製造する方法であって、式(II):
【化2】

の化合物と一般式(III ):
【化3】

の化合物(式中R1及びR2はHもしくはC1-4アルキル基であるか、又はR1とR2が互いに結合してC2-3アルキレン基を形成し所望により1から4個のメチル又はエチル基で置換されている)、又は化合物(III )の無水物とを、塩基及び
(a)所望により付加量のトリアリールホスフィン配位子存在下での、パラジウム(0)-又はパラジウム(II)-トリアリールホスフィン錯体、又は
(b)トリアリールホスフィン配位子存在下での、パラジウム(II)塩、又は
(c)所望により担体に担持された、トリアリールホスフィン存在下での金属パラジウム;
であるパラジウム触媒の存在下、化合物(II)に対して0.9から2モルの化合物(III )を用いて反応させることを含む方法。
【請求項2】
式(I)の化合物を一般式(IV):
【化4】

の化合物(式中R3はH、C1-6アルキル[所望により、ハロゲン、水酸基、C1-4アルコキシ、C1-4ハロアルコキシ、C1-4アルキルチオ、C1-4ハロアルキルチオ、C1-4アルキルアミノ、ジ-(C1-4)-アルキルアミノ、C1-4アルコキシカルボニル、C1-4アルキルカルボニルオキシ、及びトリ-(C1-4)アルキルシリルから各々独立に選ばれた1個又はより多くの置換基で置換された]、C1-4アルケニル[所望によりハロゲンか各々独立に選ばれた1個又はより多くの置換基で置換された]、C3-7シクロアルキル[所望によりハロゲン、C1-4アルキル及びC1-4ハロアルキルから各々独立に選ばれた1個またはより多くの置換基で置換された]、又はトリ-(C1-4)アルキルシリルである);
と、塩基、請求項Iで定義したパラジウム触媒及び銅(I)塩の存在下で反応させ、一般式(V)
【化5】

の化合物(式中R3は上記した意味を持つ)を作る付加工程を含む、請求項Iの方法。
【請求項3】
式(I)の化合物と一般式(IV)の化合物とを反応させる付加工程が、式(I)の化合物を製造したのと同じ反応器中で、且つ最初に式(I)の化合物が製造された反応混合物のpHを9未満に下げて行われる、請求項2の方法。
【請求項4】
式(I)の化合物を還元し、式(VI)
【化6】

の化合物を作る付加工程を含む、請求項1の方法。
【請求項5】
式(VI)の化合物を一般式(IV)
【化7】

の化合物(式中R3は請求項3で与えられた意味を持つ)と、塩基及び銅(I)塩の存在下で反応させ、一般式(VII )
【化8】

の化合物を作る更なる工程を含む、請求項4の方法。
【請求項6】
一般式(V)
【化9】

(式中R3は請求項2で与えられた意味を持つ)の化合物。
【請求項7】
R3が、H、C1-6アルキル、C3-6シクロアルキル、C1-4ハロアルキル、ヒドロキシ(C1-6)アルキル、C1-4アルコキシ(C1-6)アルキルC1-4ハロアルコキシ(C1-6)アルキル、C1-4アルコキシカルボニル(C1-6)アルキル、C1-4アルキルカルボニルオキシ(C1-6)アルキル、トリ-C1-4アルキルシリル、又はトリ-C1-4アルキルシリル(C1-4)アルキルである、請求項6の化合物。
【請求項8】
R3が、tert-ブチル、1-メチル-1-メトキシエチル、又は1-メチル-1-エトキシエチルである、請求項6の化合物。
【請求項9】
一般式(V)
【化10】

の化合物(式中R3は請求項2で与えられた意味を持つ)を還元し一般式(VII )
【化11】

の化合物(式中R3は同じ意味を持つ)を作る更なる工程を含む、請求項2または3の方法。
【請求項1】
式(I):
【化1】

の化合物を製造する方法であって、式(II):
【化2】

の化合物と一般式(III ):
【化3】

の化合物(式中R1及びR2はHもしくはC1-4アルキル基であるか、又はR1とR2が互いに結合してC2-3アルキレン基を形成し所望により1から4個のメチル又はエチル基で置換されている)、又は化合物(III )の無水物とを、塩基及び
(a)所望により付加量のトリアリールホスフィン配位子存在下での、パラジウム(0)-又はパラジウム(II)-トリアリールホスフィン錯体、又は
(b)トリアリールホスフィン配位子存在下での、パラジウム(II)塩、又は
(c)所望により担体に担持された、トリアリールホスフィン存在下での金属パラジウム;
であるパラジウム触媒の存在下、化合物(II)に対して0.9から2モルの化合物(III )を用いて反応させることを含む方法。
【請求項2】
式(I)の化合物を一般式(IV):
【化4】

の化合物(式中R3はH、C1-6アルキル[所望により、ハロゲン、水酸基、C1-4アルコキシ、C1-4ハロアルコキシ、C1-4アルキルチオ、C1-4ハロアルキルチオ、C1-4アルキルアミノ、ジ-(C1-4)-アルキルアミノ、C1-4アルコキシカルボニル、C1-4アルキルカルボニルオキシ、及びトリ-(C1-4)アルキルシリルから各々独立に選ばれた1個又はより多くの置換基で置換された]、C1-4アルケニル[所望によりハロゲンか各々独立に選ばれた1個又はより多くの置換基で置換された]、C3-7シクロアルキル[所望によりハロゲン、C1-4アルキル及びC1-4ハロアルキルから各々独立に選ばれた1個またはより多くの置換基で置換された]、又はトリ-(C1-4)アルキルシリルである);
と、塩基、請求項Iで定義したパラジウム触媒及び銅(I)塩の存在下で反応させ、一般式(V)
【化5】

の化合物(式中R3は上記した意味を持つ)を作る付加工程を含む、請求項Iの方法。
【請求項3】
式(I)の化合物と一般式(IV)の化合物とを反応させる付加工程が、式(I)の化合物を製造したのと同じ反応器中で、且つ最初に式(I)の化合物が製造された反応混合物のpHを9未満に下げて行われる、請求項2の方法。
【請求項4】
式(I)の化合物を還元し、式(VI)
【化6】

の化合物を作る付加工程を含む、請求項1の方法。
【請求項5】
式(VI)の化合物を一般式(IV)
【化7】

の化合物(式中R3は請求項3で与えられた意味を持つ)と、塩基及び銅(I)塩の存在下で反応させ、一般式(VII )
【化8】

の化合物を作る更なる工程を含む、請求項4の方法。
【請求項6】
一般式(V)
【化9】

(式中R3は請求項2で与えられた意味を持つ)の化合物。
【請求項7】
R3が、H、C1-6アルキル、C3-6シクロアルキル、C1-4ハロアルキル、ヒドロキシ(C1-6)アルキル、C1-4アルコキシ(C1-6)アルキルC1-4ハロアルコキシ(C1-6)アルキル、C1-4アルコキシカルボニル(C1-6)アルキル、C1-4アルキルカルボニルオキシ(C1-6)アルキル、トリ-C1-4アルキルシリル、又はトリ-C1-4アルキルシリル(C1-4)アルキルである、請求項6の化合物。
【請求項8】
R3が、tert-ブチル、1-メチル-1-メトキシエチル、又は1-メチル-1-エトキシエチルである、請求項6の化合物。
【請求項9】
一般式(V)
【化10】

の化合物(式中R3は請求項2で与えられた意味を持つ)を還元し一般式(VII )
【化11】

の化合物(式中R3は同じ意味を持つ)を作る更なる工程を含む、請求項2または3の方法。
【公表番号】特表2009−515841(P2009−515841A)
【公表日】平成21年4月16日(2009.4.16)
【国際特許分類】
【出願番号】特願2008−539355(P2008−539355)
【出願日】平成18年11月13日(2006.11.13)
【国際出願番号】PCT/EP2006/010864
【国際公開番号】WO2007/057138
【国際公開日】平成19年5月24日(2007.5.24)
【出願人】(500584309)シンジェンタ パーティシペーションズ アクチェンゲゼルシャフト (352)
【Fターム(参考)】
【公表日】平成21年4月16日(2009.4.16)
【国際特許分類】
【出願日】平成18年11月13日(2006.11.13)
【国際出願番号】PCT/EP2006/010864
【国際公開番号】WO2007/057138
【国際公開日】平成19年5月24日(2007.5.24)
【出願人】(500584309)シンジェンタ パーティシペーションズ アクチェンゲゼルシャフト (352)
【Fターム(参考)】
[ Back to top ]

