ピラゾロ[1,5−a]−1,3,5−トリアジン誘導体、その調製、及びその治療的使用方法
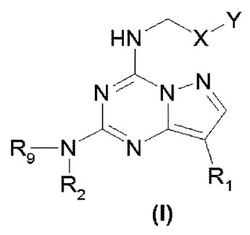
本発明は以下の式(I)の化合物であって、R1は、(C1-C6)アルキル基又は(C3-C6)シクロアルキル基であり;R2及びR3は、独立に、(i)1〜3のヒドロキシル基により又は (ii)NRaRb基により置換されている、(C1-C6)アルキル基、(C3-C6)シクロアルキル基、(C1-C6)アルケニル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、又は、R2は、1〜3のヒドロキシル基により置換されているピロリジニルメチル基であり、R9は水素原子であってもよいことを仮定すると、又はR2及びR3は、それらの窒素原子と一緒にヘテロ環化合物であり;X及びYは独立にフェニル基又はヘテロアリール基であり、該ヘテロアリール基及び該フェニル基は置換可能であり、該へテロアリール基は、チエニル基、ピリジル基、ピリミジニル基、チアゾリル基、ピロリル基、及びフラニル基から選ばれるものである、前記化合物、並びにその医薬的に許容できる塩に関する。本発明はまた、同じものを含む組成物、並びにその治療的使用方法に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ピラゾロ[1,5-a]-1,3,5-トリアジン誘導体、その調製、及びその治療的使用方法に関する。
【背景技術】
【0002】
或る数の文献が、ピラゾロ[1,5-a]-1,3,5-トリアジンから得られる化合物を記載している。
【0003】
すなわち、キナーゼインヒビターとしてのピラゾロトリアジン化合物は、文献国際公開第2005/082908号パンフレットから知られている。
【0004】
サイクリン依存性キナーゼ(CDK)のインヒビター及びグリコーゲンシンターゼキナーゼ−3(GSK−3)のインヒビターである化合物は、文献国際公開第2002/50079号パンフレットから知られている。
【0005】
最後に、文献国際公開第2004/011464号パンフレットは、とりわけ、ホスホジエステラーゼPDE2及びPDE4のインヒビターである化合物を記載している。
【0006】
さらに、Bettayebら、 "N-&-N, a new class of cell death-inducing kinase inhibitors derived from the purine roscovitine", Mol. Cancer Ther. 2008, 7, 2713、及び"Pyrazolo[1,5-a]-1,3,5-triazine as a purine bioisostere: access to potent cyclin-dependent kinase inhibitor (R)-roscovitine analogue", J. Med. Chem. 2009, 52, 655, はN-&-N1:

と呼ばれる化合物の抗腫瘍能力を記載している。
【発明の概要】
【課題を解決するための手段】
【0007】
本発明の主題は、以下の式(I)に対応する化合物及び医薬的に許容できるその塩である:

ここで、
R1は、(C1-C6)アルキル基又は(C3-C6)シクロアルキル基であり、
R2は、(i)1〜3のヒドロキシル基により又は (ii)NRaRb基(ここでRa及びRbは独立に水素原子又は (C1-C3)アルキル基である)により置換されている、(C1-C6)アルキル基、(C3-C6)シクロアルキル基、(C1-C6)アルケニル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基、
又は、R2は、1〜3のヒドロキシル基により置換されているピロリジニルメチル基である、
該R2基は、-OCOR3基により置換されていてもよく、ここでR3は、天然の若しくは非天然のアミノ酸誘導体又は式(B)のピペリジル基であり、

ここで、
R4は、水素、ハロゲン原子、(C1-C3)アルキル基、ヒドロキシ(C1-C3)アルキル基、又は-NRaRb基、ここでRa及びRbは上で定義されたとおりであり、及び、R5は、水素、 (C1-C3)アルキル基、-N(Me)2基、ピペリジル基、又はモルホリニル基であり、
R9は、R2と同じ意味を有し及び水素原子であってもよい、
あるいは、R2及びR9は一緒になって、それらと結合している窒素原子と一緒に、ピロリジニル基、ピペリジニル基、ピペラジニル基、及びピペリジニルピペリジニル基から選ばれるヘテロ環を成し、これらヘテロ環は、ヒドロキシル、(C1-C6)アルキル又は(C1-C6)アルコキシ(C1-C6)アルキルから選ばれる1〜3の基により置換されていてもよく、これらの後の2つの基は(i)1〜3のヒドロキシル基により又は(ii) NRaRb基により置換されており、ここでRa及びRbは独立に水素原子又は(C1-C3)アルキル基である、
X及びYは独立にフェニル基又はヘテロアリール基であり、該ヘテロアリール基及び該フェニル基は、(C1-C2)アルキル基、(C1-C2)アルコキシ基、ハロゲン原子、 (C1-C2)フルオロアルキル基、(C1-C2)フルオロアルコキシ基、ヒドロキシル基、-COOH基、-CONHR6基及び-NRaRb基から独立に選ばれる1又は2の基により置換されていてもよく、ここでRa及びRbは上で定義されたとおりである、
R6は、水素又は(C1-C3)アルキル基である、
該ヘテロアリール基は、チエニル基、ピリジル基、ピリミジニル基、チアゾリル基、ピロリル基、及びフラニル基から選ばれるものである。
【0008】
該天然の又は非天然のアミノ酸から得られる基は、20の天然アミノ酸から得られうる。該天然のアミノ酸のうち、特に、L−バリン、L−ロイシン、L−セリン、L−スレオニン、L−アスパラギン及びアスパラギン酸が言及されうる。
【0009】
該非天然のアミノ酸誘導体のうち、該天然アミノ酸のアシル誘導体が言及されてよく、すなわち、末端-COOH基の代わりに、 (C1-C3)アルキルカルボニル基又は(C1-C4)アルコキシカルボニル基、特にはアセチル化誘導体を与えるメチルカルボニル基又はBoc誘導体を与えるtert-ブトキシカルボニル基を含む。
【0010】
D−立体配置アミノ酸誘導体も用いられうる。
【0011】
本発明の一つの局面に従い、該ヘテロアリール基は、チエニル基、フラニル基、及びピラジル基から選ばれる。
【0012】
本発明の一つの特定の局面に従い、R3は、以下の式(a−1)〜(a−5)の一つであり、及びそれらのエナンチオマーであってもよく、

ここでBocは、tert-ブトキシカルボニル基及びAcはアセチル基である。
【0013】
式(I)の化合物は、1又はそれより多い不斉炭素原子を含みうる。それ故に、それは、エナンチオマーの形又はジアステレオイソマーの形で存在しうる。これらのエナンチオマー及びジアステレオイソマー、並びにそれらの混合物(ラセミ混合物も含む)は、本発明の一部である。
【0014】
式(I)の化合物は、塩基の形又は酸との付加塩の形で存在しうる。そのような付加塩は本発明の一部である。
【0015】
これらの塩は、医薬的に許容できる酸と一緒に有利に調製されるが、例えば式(I)の化合物を精製又は単離する為に有用である他の酸の塩もまた本発明の一部である。
【0016】
該医薬的に許容できる酸のうち、特に塩化水素酸、臭化水素酸、トリフルオロ酢酸、フマル酸、酒石酸、クエン酸、アスコルビン酸、及びマレイン酸が言及されうる。
【0017】
式(I)の化合物は、水和物の形又は溶媒和物の形で存在してもよく、すなわち、1又はそれより多い水分子と又は溶媒との会合物又は組み合わせの形で存在してもよい。そのような水和物及び溶媒和物もまた本発明の一部である。
【0018】
本発明の文脈において:
「t及びzが1〜6の値を有しうるところの(Ct-Cz)」は、tからzの炭素原子を有しうる炭素に基づく鎖を意味することが意図され、例えば「(C1-C3)」は、1から3の炭素原子を有しうる炭素に基づく鎖を意味する;
「ハロゲン」は、フッ素、塩素、臭素、及びヨウ素から選ばれる原子、特にはフッ素、塩素、及び臭素から選ばれる原子を意味することが意図される;
「アルキル基」は、直鎖状又は分岐した飽和脂肪族基を意味することが意図される。例として、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、tert-ブチル、ペンチル等の基が言及されうる;
「アルケニル基」は、1又は2の不飽和を有する直鎖状又は分岐した脂肪族基を意味することが意図される。例として、エテニル、プロペニル、イソプロペニル、ブテニル、イソブテニル、tert-ブテニル、ペンテニル等の基が言及されうる;
「シクロアルキル基」は、環状アルキル基を意味することが意図される。例として、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル等の基が言及されうる;
「アルコキシ基」は、アルキル基が上記で定義されたとおりであるところのO-アルキル基を意味することが意図される;
「フェニル基」は、(一価の)フェニル基及び対応する二価基フェニレンの両方を意味することが意図される;
「ヘテロアリール基」は、(一価の)ヘテロアリール基及び対応する二価基ヘテロアリーレンの両方を意味することが意図され、該ヘテロアリール基は、1又は2のヘテロ原子、例えば窒素、酸素又は硫黄など、を含む芳香族若しくは非芳香族の単環式若しくは二環式の基である;
「フルオロアルキル基」及び「フルオロアルコキシ基」は、少なくとも1つのフッ素原子により置換されている、上記で定義されたとおりのアルキル基及びアルコキシ基をそれぞれ意味することが意図される。例として、パーフルオロアルキル基、例えばトリフルオロメチル又はパーフルオロプロピルなど、が言及されうる。
【0019】
一つの特定の実施態様に従い、R1基は、エチル基又はイソプロピル基である。
【0020】
一つの特定の実施態様に従い、X基及びY基は、置換されていない。
【0021】
他の特定の実施態様に従い、X基及びY基の少なくとも1つが置換されている場合、それは1又は2の置換基を有し、且つ、該置換基は(C1-C2)アルキル基、(C1-C2)フルオロアルキル基、(C1-C2)アルコキシ基、(C1-C2)フルオロアルコキシ基、ハロゲン原子、ヒドロキシル基、及び-COOH基から独立に有利に選ばれる。
【0022】
さらにこの他の実施態様従い、Yがヘテロアリール基であり且つ一置換されている場合、該置換は有利には3位又は5位にある。
【0023】
他の特定の実施態様に従い、R2基は、以下の式の一つであり、R9基はそのときは水素原子である:


【0024】
1のさらにより特定の実施態様に従い、R2基は、上記で定義されたとおりの式(b−1)、(b−2)、(b−10)、(b−11)、(b−13)、(b−14)又は(b−15)の一つである。
【0025】
一つの特定の実施態様に従い、R2基及びR9基は一緒になって、ヘテロ環を成し、ピロリジニル基は有利にはピロリジン-1-イル基であり、ピペリジニル基は有利にはピペリジン−1−イル基であり、ピペラジニル基は有利にはピペラジン-1-イル基であり、及び、ピペリジニルピペリジニル基は有利にはピペリジン-4-イルピペリジン-1-イル基である。
【0026】
さらに他の特定の実施態様に従い、該NR2R9基は以下の式の一つである:

【0027】
さらに他の特定の実施態様に従い、該NR2R9基は、(b−38)及び(b−39)基を除く、式(b−35)〜(b−43)の一つを有する。
【0028】
他のさらにより特定の実施態様に従い、本発明は、上記で定義されたとおりの式(I)の化合物に関し、ここでR1はイソプロピル基であり;R2は(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)又は(b-15)の一つであり;及びX及びYは上記で定義されたとおりであり且つ置換されておらず、及び有利には独立にフェニル基、ピリジル基又はチエニル基であり、X及びYは同時にチエニル基又はピリジル基でないことが理解される。
【0029】
さらに他の特定の実施態様に従い、式(B)の該ピペリジル基は以下の基の一つである:

【0030】
本発明の対象である化合物のうち、式(I)に含められる式(Ia)の化合物の第一の群が言及されうる:

ここで:
R1は、上記で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2及びR9は独立に、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、 (C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、R9は水素原子であってもよく、及び有利にはR2は上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つであり、R9は水素原子である、
又はR2及びR9は一緒になって、それらと結合している窒素原子と一緒に、ピペリジン-1-イル又はピペリジン-4-イルピペリジン-1-イル基を成し、該基は、ヒドロキシル基により置換されている1〜3の(C1-C6)アルキル基により置換されており、及び有利にはR2及びR9は一緒になって、上記で定義されたとおりの式(b-37)、(b-38)、(b-39)、又は(b-40)の一つである、
R7及びR8は独立に、水素原子、(C1-C2)アルキル基、(C1-C2)フルオロアルキル基、 (C1-C2)アルコキシ基、(C1-C2)フルオロアルコキシ基、ハロゲン原子、ヒドロキシル基、又は-COOH基である、
Gは、-CH=又は-N=であり、且つ、
Gが-CH=である場合、該W基及びZ基は、同時に-CH=であるか、又は一方が-N=であり且つ他方が-CH=である、
Gが-N=である場合, そのときはW及びZは-CH=である。
【0031】
本発明の対象である化合物のうち、式(I)に含まれる式(Ib)の化合物の第2の群が言及されうる:

ここで、
R1は、上記で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2は、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には、上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つである、且つ
R7及びR8は独立に、水素原子、(C1- C2)アルキル基、(C1-C2)フルオロアルキル基、(C1-C2)アルコキシ基、(C1-C2)フルオロアルコキシ基、ハロゲン原子、ヒドロキシル基、又は-COOH基である。
【0032】
本発明の対象である化合物のうち、式(I)に含まれる式(Ic)の化合物の第3の群が言及されうる:

ここで、
R1は、上記で定義されたとおりであり、及び有利にはエチル基又はイソプロピル基であり、
R9は水素原子であり、且つ、R2は、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には、上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つである、
又はR2及びR9は一緒になって、それらと結合している窒素原子と一緒に、ピペリジン-1-イル又はピペリジン-4-イルピペリジン-1-イル基を成し、該基は、ヒドロキシル基により置換されている1〜3の(C1-C6)アルキル基により置換されており、及び有利にはR2及びR9は一緒になって、上記で定義されたとおりの式(b-37)、(b-38)、(b- 39)、又は(b-40)の一つであり、
R7及びR8は独立に、水素原子、(C1-C2)アルキル基、(C1-C2)フルオロアルキル基、(C1-C2)アルコキシ基、(C1-C2)フルオロアルコキシ基、ハロゲン原子、ヒドロキシル基、又は-COOH基である。
【0033】
本発明の対象である化合物のうち、式(I)に含まれる式(Id)の化合物の第3の群が言及されうる:

ここで、
R1は、上記で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2は、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には、上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つであり、且つ
R7は、水素原子、(C1- C2)アルキル基、(C1-C2)フルオロアルキル基、(C1-C2)アルコキシ基、(C1-C2)フルオロアルコキシ基、ハロゲン原子、ヒドロキシル基、又は-COOH基である。
【0034】
本発明の対象である化合物のうち、式(I)に含まれる式(Ie)の化合物の第4の群が言及されうる:

ここで、
R1は、上記で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2は、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には、上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つである。
【0035】
本発明の対象である化合物のうち、式(I)に含まれる式(If)の化合物の第5の群が言及されうる:

ここで、
R1は、上記で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2は、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には、上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つである。
【0036】
式(Ia)、(Ib)、(Ic)、(Id)、(Ie)及び(If)の化合物の医薬的に許容できる塩も本発明の一部である。
【0037】
本発明の式(I)の化合物のうち、特に以下の化合物が言及されうる:
- (R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-(4-フェニルベンジルアミノ)ピラゾロ[1,5-a]-1,3,5-トリアジン (1)
- (R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (2)
- (R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (3)
- (S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (4)
- (S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (5)
- (R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (6)
- (S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (7)
- (S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (8)
- (S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (9)
- (R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (10)
- (R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (11)
- (2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (12)
- (2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (13)
- (2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (14)
- (2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (15)
- (2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (16)
- 2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (17)
- 2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (18)
- 2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (19)
- (S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (20)
- (2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (21)
- (S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (22)
- (2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (23)
- 2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (24)
- (R)-2-(1-ヒドロキシ-4-メチルペント-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (25)
- (S)-2-(1-ヒドロキシ-4-メチルペント-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (26)
- (S)-2-(1-ヒドロキシ-3,3-ジメチルブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (27)
- (S)-2-(1-ヒドロキシ-3-メチルブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (28)
- 2-[4-[1-[8-イソプロピル-4-[[4-(ピリジン-2-イル)フェニル]メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン-2-イル]ピペリジン-4-イル]ピペリジン-1-イル]エタノール (29)
- 2-[4-[8-イソプロピル-4-[[4-(ピリジン-2-イル)フェニル]メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン-2-イル]ピペラジン-1-イル]エタノール (30)
- (R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (31)
- [(2R)-3-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチル-アミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]-2-ヒドロキシプロピル] (2R)-2-Bocアミノ-3-メチルブタノエート (32)
- 塩基又は塩の形にある、特にはジヒドロクロリドの形にある[(2R)-3-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]-2-ヒドロキシプロピル] (2R)-2-アミノ-3-メチルブタノエート (33)
- (S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (34)
- (S)-8-エチル-2-(1-ヒドロキシブト-2-イルアミノ)-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (35)
- (R)-8-エチル-2-(1-ヒドロキシブト-2-イルアミノ)-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (36)
- 2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (37)
- 2-[(2S)-1-[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]-2-ピペリジル]エタノール (38)
- 2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]-(2-ヒドロキシエチル)アミノ]エタノール (39)
- (2R,3R)-2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]ブタン-1,3-ジオール (40)
- (2S,3S)-2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]ブタン-1,3-ジオール (41)
及びまた、医薬的に許容できる酸のそれらの任意の塩。
【0038】
以下の化合物もまた本発明の一部である。





及び医薬的に許容できる酸のそれらの塩。
【0039】
また、本発明の主題は、式(I)の化合物を調製する為の方法である。
【0040】
本発明の化合物は、以下に記載されたスキーム1に従い記載された種々の方法に従い調製されうる。

【0041】
スキーム1に従い、式(IIa)の化合物(ここでX、Y及びR1は上記で定義されたとおりである)は、例えば0℃でジクロロメタン中で、メタ−クロロ過安息香酸(mcpba)の存在下で酸化反応に付されて、対応するスルホンを生成する。後者は、式NH-R2R9(ここでR2及びR9は上記で定義されたとおりである)の第1級アミンの存在下において、100〜180℃の温度で、例えば140℃で、芳香族求核置換反応(NSAR)に直接に用いられて、式の(I)の化合物を生成する。あるいは、タイプ(I)の化合物が、式(IIb)の化合物から調製されてもよい。これらの化合物(IIb)(ここでX及びR1は上記で定義されたとおりである)が、最初に、金属により、例えばパラジウム(Suzuki-Miyaura反応又はStille反応)又はニッケルなど、により触媒されるカップリング反応において用いられて、中間体(IIa)を与える。これらの同じ化合物(IIb)は、メタ−クロロ過安息香酸(meta-chloroperbenzoic acid)の存在下においてジクロロメタン中で0℃でスルホンを生成するように酸化されてよく、該スルホンは、式(III)の化合物を与えるように、1級アミン(NSAR)により置換される(NSAR)。後者は、金属により、例えばパラジウム又はニッケルにより、触媒されるカップリング反応に付されたときに、式(I)の化合物を生成する。
【0042】
このように、その局面の一つに従い、本発明は、本発明に従う式(I)の化合物を調製する為の方法に関し、該方法は、以下のとおりの式(IIa)の化合物(ここでX、Y及びR1は上記で定義されたとおりである)

が、酸化反応においてメタ−クロロ過安息香酸と反応させられること、及び、得られたスルホンが、100〜180℃の温度で、例えば140℃の温度で、式NH2R2(ここでR2は上記で定義されたとおりである)の第1級アミンの存在下において求核置換反応において直接に用いられて、式(I)の化合物を生成することにおいて特徴付けられ、又は、式(IIb)の化合物(ここでX及びR1は上記で定義されたとおりである)

が、金属、例えばパラジウム又はニッケル、と反応させられて、上記で定義されたとおりの式(IIa)の化合物を与えること、又は代りに上記で定義されたとおりの式(IIb)の化合物が、メタ−クロロ過安息香酸により、酸化反応において反応させられ、得られたスルホンが式NH-R2R9(ここでR2及びR9は上記で定義されたとおりである)の第1級アミンの存在下における求核置換反応において直接に用いられて、式(III)の化合物

(ここでX1、R1及びR2は上記で定義されたとおりである)を与え、これが、金属により、例えばパラジウム又はニッケル、により触媒されたカップリング反応に付されて、式(I).の化合物を生成することにおいて特徴づけられる。
【0043】
本発明の式(I)の化合物を調製する為に用いられる式(IIa)又は(IIb)の誘導体を調製する為の方法が本明細書内以下に記載される。
【0044】
式(IIa)又は(IIb)の誘導体は、化合物(IV)から、文献"pyrazolo[1,5-a]-1,3,5-triazine as a purine bioisostere: access to potent cyclin-dependent kinase inhibitor (R)-roscovitine analogue", J. Med. Chem. 2009, 52, 655、に記載された方法により調製されうる。
【0045】
一般に、8位で置換されている該4-(N-メチル-N-フェニルアミノ)-2-チオメチルピラゾロ [1,5-a]-1,3,5-トリアジン(ここでR1は上記で定義されたとおりである)(IV)が、該アリール−又はヘテロアリールメチレンアミン(ここでX及びYは上記で定義されたとおりである)(V)と、100〜180℃の温度で、例えば140℃で、反応させられて、以下に記載されたスキーム2に従い、式(IIa)又は(IIb)の化合物を生成する。

【0046】
式(IV)の化合物は、それらが市販入手可能でない場合、文献、例えば刊行物"pyrazolo[1,5-a]-1,3,5-triazine as a purine bioisostere: access to potent cyclin-dependent kinase inhibitor (R)-roscovitine analogue"(上記で言及された)に記載された方法を用いて調製されうる。
【0047】
式(V)の化合物は、それらが市販入手可能でない場合、文献に、例えば刊行物国際公開第2003/022805号パンフレットに記載された方法を用いて調製されうる。
【0048】
該一般的合成スキーム1及び2において、該出発化合物及び該反応物は、それらを調製する為の方法が記載されていない場合、市販入手可能であり又は該文献に記載されており、又はそれらに記載された方法又は当技術分野の当業者に知られている方法に従い調製されうる。
【0049】
本発明の主題は、その局面の他に従い、式(II)の化合物でもあり、ここでX、Y及びR1は上記で定義されたとおりである。

【0050】
これらの化合物は、式(I)の化合物の合成の為の中間体として利用できる。式(II)の化合物の例は、本明細書以下の表1において与えられる。
【0051】
以下の実施例もまた、本発明に従う式(I)の化合物の調製を記載している。これらの実施例は、本発明を限定するものでなく、本発明を単に説明する。例示される化合物の番号は、表2に与えられたものをいい、これは本発明のいくつかの化合物の化学的構造及び物理的特性を説明する。
【0052】
以下の調製及び実施例において、
- Mp = 毎分1℃の温度勾配によるBuchi B545装置で測定されたときの融点(℃)
- NMR =Bruker 300MHz又は400MHzスペクトロメータにより実施された核磁気共鳴。用いられた溶媒は、DMSO−d6及びCDCl3であり、及び、化学シフトはTMSに対して表される。用いられた略称は
- s =シングレット、
- d =ダブレット、
- dd = ダブルダブレット(double of doublets)、
- t =トリプレット、
- m = マルチプレット、
- bs =ブロードシングレット、
である。
【0053】
I. 中間体の調製
【0054】
調製I.1
8-イソプロピ-2-(メチルスルファニル)-4-(4-フェニルベンジルアミノ)ピラゾロ[1,5-a]-1,3,5-トリアジン (IIa.1)

封をされたチューブ中で、8-イソプロピル-4-(N-メチル-N-フェニルアミノ)-2-(メチルスルファニル)ピラゾロ[1,5-a]-1,3,5-トリアジン (114 mg, 0.36 mmol)及び4フェニルベンジルアミン(100 mg, 0.55 mmol)の溶液が、140℃で24時間加熱される。冷却した後、溶媒が蒸発される。集められた粗化合物が、フラッシュクロマトグラフィー(EP/Et2O 9:1)により精製されて、IIa.1 (95 mg, 67%)を与える。

【0055】
調製I.2
8-イソプロピル-2-(メチルスルファニル)-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (IIa.2)

化合物IIa.1の調製を結果する同じ条件に従い、化合物IIa.2が、8-イソプロピル-4-(N-メチル-N-フェニルアミノ)-2-(メチルスルファニル)ピラゾロ[1,5-a]-1,3,5-トリアジン及び4-(ピリジン-2-イル)ベンジルアミンから調製される。収率=60%。

【0056】
調製I.3
8-イソプロピル-2-(メチルスルファニル)-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン(IIa.3)

化合物IIa.1の調製を結果する同じ条件に従い、化合物IIa.3が、8-イソプロピル-4-(N-メチル-N-フェニルアミノ)-2-(メチルスルファニル)ピラゾロ[1,5-a]-1,3,5-トリアジン及び4-(チオフェン-3-イル)ベンジルアミンから調製される。収率= 74%。

【0057】
調製I.4
4-(4-ブロモベンジルアミノ)-8-イソプロピル-2-(メチルスルファニル)ピラゾロ[1,5-a]-1,3,5-トリアジン(IIb.4)

化合物IIa.2の調製を結果する同じ条件に従い、化合物IIb.4が、8-イロプロピル-4-(N-メチル-N-フェニルアミノ)-2-(メチルスルファニル)ピラゾロ[1,5-a]-1,3,5-トリアジン及び4-ブロモベンジルアミンから調製される。収率= 75%。

【0058】
調製I.5
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-4-(4-ブロモベンジルアミノ)-8-イソプロピルピラゾロ[1,5-a]-1,3,5-トリアジン(III.5)

ジクロロメタン(CH2Cl2) (6 ml)中のIIb.4 (200 mg, 0.51 mmol)の溶液が、0℃で撹拌される。70-75%のメタ−クロロ過安息香酸(126 mg, 0.51 mmol)が添加され、そして次に該溶液が1時間撹拌される。同量の酸が、二回目に添加される。最終溶液が、2時間、0℃で撹拌される。NaHCO3の溶液の添加後、液−液抽出が実施される。分離された有機相がNaClの溶液により洗浄され、MgSO4上で乾燥され、そして次に、減圧下で蒸発される。該スルホンが、定量的な収率とともに得られ、そして次にさらなる精製無しで以下の工程において用いられる。スルホン(216 mg, 0.51 mmol)及び市販の(R)-(-)-2-アミノブタノール(247μl, 2.62 mmol)の溶液が、140℃で24時間加熱される。冷却した後、溶媒が蒸発される。集められた該粗化合物が、フラッシュクロマトグラフィー(EP/EtOAc 9:1〜6:4)により精製されて、III.5 (103 mg, 47%)を与える。オイル(oil)。

【0059】
調製I.6
8-イソプロピル-2-メチルスルファニル-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン(IIa.4)

化合物IIa.2の製造を結果する同じ条件に従い、化合物IIa.4が、
8-イソプロピル-4-(N-メチル-N-フェニルアミノ)-2-(メチルスルファニル)ピラゾロ[1,5-a]-1,3,5-トリアジン及び4-(ピリジン-3-イル)ベンジルアミン
から調製される。収率= 65%。

【0060】
調製I.7
8-イソプロピル-2-メチルスルファニル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン-4-アミン(IIa.5)

化合物IIa.2の製造を結果する同じ条件に従い、化合物IIa.5が、8-イソプロピル-4-(N-メチル-N-フェニルアミノ)-2-(メチルスルファニル)ピラゾロ[1,5-a]-1,3,5-トリアジン及び(6-フェニルピリジン-3-イル)メタンアミンから調製される。

【0061】
【表1】

【0062】
以下の実施例が、本発明を限定することなく、本発明を説明する。
【0063】
II.式(I)の化合物の調製
【実施例1】
【0064】
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-フェニルベンジルアミノ)ピラゾロ [1,5-a]-1,3,5-トリアジン (1)

CH2Cl2 (4 ml)中のIIa.1 (160 mg, 0.41 mmol)の溶液が、0℃で攪拌される。70-75% のメタ−クロロ過安息香酸(meta-chloroperbenzoic acid)(100 mg, 0.41 mmol)が添加され、そして次に該溶液が1時間攪拌される。同量の酸が二回目に添加される。最終的な溶液が、2時間、0℃で攪拌される。NaHCO3の溶液の添加後、液−液抽出が実施される。分離された有機相がNaClの溶液により洗浄され、MgSO4上で乾燥され、そして次に減圧下で蒸発される。スルホンが、定量的な収率と共に得られ、そして次に、さらなる精製無しで、以下の工程において用いられる。8-イソプロピル-2-(メチルスルホニル)-4-[N-(4-フェニル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン(173 mg, 0.41 mmol)及び市販の(R)-(-)-2-アミノブタノール(193μl, 2.03 mmol)の溶液が、 140℃で24時間加熱される。冷却した後、溶媒が蒸発される。集められた粗化合物が、フラッシュクロマトグラフィー(EP/EtOAc 8:2, 次に1:1)により精製されて、1(75 mg, 43%)を与える。オイル(oil)。

【実施例2】
【0065】
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ [1,5-a]-1,3,5-トリアジン(2)

CH2Cl2 (12 ml)中のIIa.2 (400 mg, 1.02 mmol) の溶液が0℃で攪拌される。70-75% メタクロロ過安息香酸 (250 mg, 1.02 mmol)が添加され、そして次に該溶液が1時間攪拌される。同量の酸が二回目に添加される。最終的な溶液が2時間0℃で攪拌される。NaHCO3の溶液の添加後、液−液抽出が実施される。分離された有機相がNaClの溶液により洗浄され、MgSO4上で乾燥され、そして次に、減圧下で蒸発される。スルホンが、定量的収率とともに得られ、そして次にさらなる精製無しで以下の工程において用いられる。スルホン(430 mg, 1.02 mmol)及び市販の (R)-(-)-2-アミノブタノール(482μl, 5.09 mmol)の溶液が140℃で12時間、加熱される。冷却した後、溶媒が蒸発される。集められた粗化合物がフラッシュクロマトグラフィー(EP/EtOAc 9:1から6:4へ)により精製されて、2(200 mg, 45%)を与える。フォーム(foam)。

【実施例3】
【0066】
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ [1,5-a]-1,3,5-トリアジン(2)
封をされたチューブ中で、化合物III.5 (103 mg, 0.24 mmol)が、トルエン(10 ml)中のトリ-n-ブチル(ピリジン-2-イル)スタンナン(177 mg, 0.48 mmol)及びPd(PPh3)4 (23 mg, 0.02 mmol)の脱ガスされた溶液に添加される。該脱ガスされた最終的な溶液が110℃で一晩加熱される。冷却及びNaHCO3の溶液による希釈の後、該溶液がCH2Cl2 (3×12 ml)により抽出される。分離された有機相が、NaClにより洗浄される。MgSO4上での乾燥後、溶媒が減圧下で蒸発される。残留物がフラッシュクロマトグラフィー(EP/EtOAc 9:1 to 6:4)により精製されて、2 (35 mg, 34%)を与える。フォーム(foam)。

【実施例4】
【0067】
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ [1,5-a]-1,3,5-トリアジンフマレート(3)
生成物2が、EtOH/Et2O中でフマル酸により処理される。該フマル酸塩3は、0℃で反応媒体から結晶化する。

【実施例5】
【0068】
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ [1,5-a]-1,3,5-トリアジン(4)

化合物2の調製を結果する同じ条件に従い、化合物4が、IIa.2から、硫黄原子の酸化反応そして次に市販の(S)-(+)-2-アミノブタノールの導入により調製される。収率=48%。フォーム(Foam)。

【実施例6】
【0069】
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ [1,5-a]-1,3,5-トリアジンフマレート (5)
生成物4が、EtOH/Et2O中でフマル酸により処理される。該フマル酸塩5は、反応媒体から結晶化する。

【実施例7】
【0070】
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ [1,5-a]-1,3,5-トリアジン(6)

化合物2の調製を結果する同じ条件に従い、化合物6が、IIa.3から、硫黄原子の酸化反応そして次に市販の(R)-(-)-2-アミノブタノールの導入により調製される。収率= 50%。オイル(Oil)。

【実施例8】
【0071】
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (6)

封をしたチューブ中で、化合物III.5 (180 mg, 0.41 mmol)が、トルエン(10 ml)中のチオフェン-3-イルボロン酸(79 mg, 0.62 mmol)、Pd(PPh3)4(47 mg, 0.04 mmol)、及び2 MのNaHCO3 (2 ml)の脱ガスされた溶液へ添加される。最終的な溶液が140℃で一晩加熱される。冷却及びH2Oによる希釈の後、該溶液がCH2Cl2 により抽出される(3×12 ml)。分離された有機相が、NaClの溶液により洗浄される。MgSO4上の乾燥後、溶媒が減圧下で蒸発される。残留物が、フラッシュクロマトグラフィー(EP/EtOAc 9:1から6:4へ)により精製されて、6(90 mg, 50%)を与える。オイル(oil)。

【実施例9】
【0072】
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン(7)

化合物2の調製を結果する同じ条件に従い、化合物6が、IIa.3から、硫黄原子の酸化反応そして次に市販の(S)-(+)-2-アミノブタノールの導入により調製される。収率= 49%。オイル(Oil)。

【実施例10】
【0073】
(S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (8)

化合物2の調製を結果する同じ条件に従い、化合物8が、IIa.2から、硫黄原子の酸化反応そして次に市販の(S)-3-アミノ-1,2-プロパンジオールの導入により調製される。収率= 20%。オイル(Oil)。

【実施例11】
【0074】
(S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンフマレート (9)
生成物8が、EtOH/Et2O溶液中でフマル酸により処理される。該フマル酸塩9は、反応媒体から結晶化する。

【実施例12】
【0075】
(R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (10)

化合物2の調製を結果する同じ条件に従い、化合物10が、IIa.2から、硫黄原子の酸化反応そして次に市販の(R)-3-アミノ-1,2-プロパンジオールの導入により調製される。収率= 35%。オイル(Oil)。

【実施例13】
【0076】
(R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンフマレート (11)
生成物10が、EtOH/Et2O溶液中でフマル酸により処理される。該フマル酸塩11は、反応媒体から結晶化する。

【実施例14】
【0077】
(2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (12)

化合物2の調製を結果する同じ条件に従い、化合物12が、IIa.2から、硫黄原子の酸化反応そして次にL-スレオニノールの導入により調製される。収率= 43%。オイル(Oil)。

【実施例15】
【0078】
(2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンフマレート (13)
生成物12が、EtOH/Et2O溶液中でフマル酸により処理される。該フマル酸塩13は、反応媒体から結晶化する。

【実施例16】
【0079】
(2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (14)

化合物2の調製を結果する同じ条件に従い、化合物12が、IIa.2から、硫黄原子の酸化反応そして次にD-スレオニノールの導入により調製される。収率= 42%。オイル(Oil)。

【実施例17】
【0080】
(2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンフマレート (15)
生成物14が、EtOH/Et2O溶液中でフマル酸により処理される。該フマル酸塩15は、反応媒体から結晶化する。

【実施例18】
【0081】
(2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (16)

化合物2の調製を結果する同じ条件に従い、化合物6が、IIa.3から、硫黄原子の酸化反応そして次に市販のL-スレオニノールの導入により調製される。収率= 40%。オイル(Oil)。

【実施例19】
【0082】
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (17)

化合物2の調製を結果する同じ条件に従い、化合物17が、IIa.2から、硫黄原子の酸化反応そして次にセリノールの導入により調製される。収率= 30%。オイル(Oil)。

【実施例20】
【0083】
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンフマレート(18)
生成物17が、EtOH/Et2O溶液中でフマル酸により処理される。該フマル酸塩18は、反応媒体から結晶化する。

【実施例21】
【0084】
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (19)

a. 8-イソプロピル-2-(メチルスルホキシル)-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (IVa)

この化合物は、以下のプロトコルに従い、メタ−クロロ過安息香酸により酸化される。277 mlのジクロロメタン中に溶解したIIa.4 (5.22 g, 13.3 mmol)の溶液が0℃に冷却され、そして次に、3.46gの80%メタ−クロロ過安息香酸がそこに添加される。1時間の撹拌後、混合物が炭酸ナトリウム溶液により洗浄される。生成物が濃縮により結晶化する。沈殿(IVa)が、少量のエーテルにより洗浄される。収率= 84%。

b. 2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (19)を得る
0.2 gのスルホキシド(IVa)が、140℃で4時間、0.36 g (3.9 mmol)の量のセリノール(2-アミノプロパン-1,3-ジオール)の存在下で、12時間140℃で加熱されて、生成物19を成し、これがエチルアセテート及びエチルエーテルの混合物から結晶化により単離される。収率= 75%。

【実施例22】
【0085】
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (20)

生成物20が、19と同じ条件下で、0.2 gのスルホキシドIVaの、0.368 mlの市販の (S)-(+)-2-アミノブタノールとの加熱により調製される。収率= 91%。

【実施例23】
【0086】
(2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (21)

a) 2-(メチルスルホキシル)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (IVb)

酸化が、IVa の調製についてと同様に、0℃で、4.76 gのIIa.5を、259.8 mlのCH2Cl2中で2 gのメタ−クロロ過安息香酸と一緒に撹拌することにより、実施される。スルホキシドIVbが87%の収率で得られる。

b) (2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (21)の調製
生成物21が、生成物20と同様に、140℃で、0.2 gのIVbを0.413 gの (2S,3S)-スレオニノールと一緒に加熱することにより調製される。冷却した後、生成物21が、エチルアセテートにより抽出され、そして、溶出液として100%エチルアセテートによりシリカカラムで精製される。収率= 82%。

【実施例24】
【0087】
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (22)

この生成物が、0.3 gのスルホキシドIVbを0.553 mlの市販の(S)-(+)-2-アミノブタノールと一緒に140℃で4時間加熱することにより得られる。4時間後、該生成物が、エチルアセテートによる抽出により単離され、そして、シリカカラム上で(溶出液:EtOAc/CH2Cl2 1:1)精製される。収率= 80%。

【実施例25】
【0088】
(2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (23)

この化合物は、スルホキシドIVbから、(2R,3R)-スレオニノールを用いて、前の実施例において用いられたものと同一のプロトコルに従い得られる。生成物23は、シリカカラムクロマトグラフィー(溶出液:EtOAc/CH2Cl28:2)により精製される。収率= 91%。

【実施例26】
【0089】
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (24)

この生成物は、スルホキシドIVbをセリノールと一緒に実施例23において記載された条件に従い加熱することにより調製される。該生成物は、シリカカラム上で(溶出液:EtOAc)精製される。収率= 78%。

【実施例27】
【0090】
(R)-2-[[8-イソプロピル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]-4-メチルペンタン-1-オール又は(R)-2-(1-ヒドロキシ-4-メチルペント-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (25)

この生成物は、スルホキシドIVa (0.2 g)をD-バリノール(0.406 g)と一緒に、実施例23において記載された条件に従い加熱することにより調製される。該生成物は、シリカカラム上で(溶出液: EtOAc/シクロヘキサン 1:1)精製される。収率= 76%。

【実施例28】
【0091】
(S)-2-[[8-イソプロピル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]-4-メチルペンタン-1-オール又は (S)-2-(1-ヒドロキシ-4-メチルペント-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (26)

この生成物は、スルホキシドIVa (0.2 g)をL-バリノール (0.406 g)と一緒に実施例23において記載された条件に従い加熱することにより調製される。該生成物は、シリカカラム上で (溶出液: EtOAc/シクロヘキサン 1:1)精製される。収率= 76%。

【実施例29】
【0092】
(S)-2-(1-ヒドロキシ-3,3-ジメチルブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (27)

a) 2-(メチルスルホキシル)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (IVc)

酸化が、IVbの調製についてと同様に、0℃で、4.76 gのIIa2を、259.8 mlのCH2Cl2中で2 gのメタ−クロロ過安息香酸と一緒に撹拌することにより実施される。収率= 90%。

b) 2-(1-ヒドロキシ-3,3-ジメチルブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (27)
誘導体27が、生成物IVc 0.2 gを0.512 gの(S)-tert-ロイシノールと一緒に140℃での4時間の加熱後に加熱することにより調製される。EtOAcによる抽出及び水による洗浄後、形成された生成物が、溶媒の濃縮により結晶化する。

【実施例30】
【0093】
(S)-2-(1-ヒドロキシ-3-メチルブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (28)

誘導体28が、実施例29におけるものと同様に、生成物IVcを(S)-(L)-バリノールと一緒に加熱することにより調製される。収率= 72%。

【実施例31】
【0094】
2-[4-[1-[8-イソプロピル-4-[[4-(ピリジン-2-イル)フェニル]メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン-2-イル]ピペリジン-4-イル]ピペリジン-1-イル]エタノール(29)

誘導体29が、実施例29におけるように、生成物IVcを、P. Leon, C. Garbay-Jaureguiberry, B. Lambert, J. B. Le Pecq, B. P. Roques. Asymmetrical bisintercalators as potential antitumor agents J. Med. Chem., 1988, 31 (5), pp 1021-1026、により記載されたビスピペリジン−エタノールと一緒に加熱することにより、調製される。
収率= 78%。

【実施例32】
【0095】
2-[4-[8-イソプロピル-4-[[4-(ピリジン-2-イル)フェニル]メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン-2-イル]ピペリジン-1-イル]エタノール (30)

生成物30が、実施例29におけるように、生成物IVcを、2-ピペラジニルエタノールと一緒に加熱することにより調製される。収率= 65%。

【実施例33】
【0096】
(R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (31)

生成物31は、Z Nie, C Perretta, Ph Erickson, S Margosiak, Ji Lu, A Averill, Rt Almassy, Shaosong hu. Structure-based design and synthesis of novel macrocyclic pyrazolo[1,5-a] [1,3,5]triazine compounds as potent inhibitors of protein kinase CK2 and their anticancer activities Bioorganic & Medicinal Chemistry Letters, Volume 18, Issue 2, 15 January 2008, Pages 619-623、により記載されたとおりに得られた中間体VIから調製される。
中間体VIIIはNMRにより特徴付けられる。

生成物31は、中間体VIIIを、140℃で、実施例23の条件下で、市販の(R)-3-アミノ-1,2-プロパンジオールと一緒に加熱することにより調製される。収率= 76%。

【実施例34】
【0097】
生成物31からのエステル33の調製

a)Boc-D-バリンによるエステル化
0.7 gのBoc-D-バリンと0.49 gのヒドロキシベンゾトリアゾール(HOBt)との10 mlのEtOAc中の溶液が、攪拌しながら0℃へ冷却される。0.763 gのジシクロヘキシルカルボジイミド(DCC)がこの溶液に添加される。その混合物が次に、2時間、周囲温度で攪拌され、そして次に、ろ過される。沈殿物(ジシクロヘキシルウレア)が、3mlのEtOAcによりリンスされる。ろ液は、テトラヒドロフラン(THF, 15 ml)中の0.73 gの31とトリエチルアミン(1.5 ml)との溶液へとすぐに添加される。混合物は、24時間、周囲温度(ambient temperature)で攪拌され、そして次に、真空下で濃縮され、そしてEtOAcにより溶解される。有機相が、クエン酸溶液により、そして次に、炭酸ナトリウム溶液により及び水により洗浄される。有機相は乾燥され、そして次に真空下で蒸発させられる。残留物が実質的に純粋なエステルを含み、これはシリカカラム上で精製されてもよい(溶出液: EtOAc/シクロヘキサン/THF/Et3N 45:50:4:1)。該エステル32は、75%の収率で得られる。このエステル化反応において、第2級アルコールも同様の条件下においてエステル化されうるが、第1級アルコールのエステルの専らの形成が、予期せずに観察される。
b)塩33を得る
エチルエーテル中の無水塩化水素酸(2 M)の溶液が、エチルエーテル中の溶液中のエステル32へ添加される。周囲温度での30分後、沈殿(33)が、ろ過され、エーテルにより洗浄され、そして、真空下で乾燥される。収率= 90%。

【実施例35】
【0098】
(S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (34)

この生成物は、そのエナンチオマー31(実施例34)のように調製される。アッセイされた4つのキナーゼについての試験において、誘導体34は、誘導体31よりも活性であると示される。
【実施例36】
【0099】
(S)-8-エチル-2-(1-ヒドロキシブト-2-イルアミノ)-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (35)

生成物31は、中間体VIIIを、140℃で、実施例23の条件下において、市販の(S)-(+)-2-アミノブタノールと一緒に加熱することにより調製される。

【実施例37】
【0100】
(R)-8-エチル-2-(1-ヒドロキシブト-2-イルアミノ)-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (36)
生成物36は、中間体VIIIを140℃で、実施例23の条件下で、市販の(R)-(-)-2-アミノブタノールと一緒に加熱することにより調製される。


【実施例38】
【0101】
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (37)

生成物37は、中間体VIIIを140℃で、実施例23の条件下で、セリノールと一緒に加熱することにより調製される。
【実施例39】
【0102】
2-[(2S)-1-[8-エチル-4-[[4-(ピリジン-2-イル)フェニル]メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン-2-イル]ピペリジン-2-イル]エタノール (38)

生成物38は、中間体VIIIを、140℃で、実施例23の条件下で、(S)-2-(ピペリジン-2-イル)エタノールと一緒に加熱することにより、調製される。収率= 75%。

【実施例40】
【0103】
2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル](2-ヒドロキシエチル)アミノ]エタノール (39)
生成物39は、中間体VIIIを140℃で、実施例23の条件下で、ジエタノールアミンと一緒に加熱することにより調製される。

収率= 78%。

【実施例41】
【0104】
(2R,3R)-2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]ブタン-1,3-ジオール (40)
生成物40は、中間体VIIIを、140℃で、実施例23の条件下で、L-スレオニノール(2R,3R-スレオニノール)と一緒に加熱することにより調製される。

収率= 78%。

【実施例42】
【0105】
(2S,3S)-2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]ブタン-1,3-ジオール (41)
生成物41は、中間体VIIIを、140℃で、実施例23の条件下で、D-スレオニノール(2S,3S-スレオニノール)と一緒に加熱することにより調製される。

収率= 75%。

【0106】
本明細書以下の表2は、本発明に従う式(I)の化合物のいくつかの例の化学的構造及び物理的特性を示す。この表において、
- Mp = 融点, ℃における、
- "Yld" は、収率(%)を意味する、
- MH+ = マススペクトロメトリー(m/z)、
- isoPr は、イソプロピル基である、
- Etは、エチル基である、
- 「塩」の欄において、「-」は、遊離塩基の形にある化合物を表し、一方で「fu」は、そのフマレートの形にある化合物を表す、
- (+) は、化合物が右旋性エナンチオマーであることを示し、(-)は、左旋性のエナンチオマーであることを示す。

【0107】
【表2】



【0108】
本発明に従う化合物が、プロテインキナーゼ活性に対するそれらの阻害効果を決定する為の薬理学的アッセイの対象であった。
【0109】
第一のシリーズの薬理学的アッセイに従い、該化合物が、本明細書以下に記載された方法論に従い7つのプロテインキナーゼについて試験された。
【0110】
特に、本発明に従う化合物の、CDK1、CDK2、CDK5、及びCDK9に対する阻害活性は一般に、0.050μm付近のIC50を示す(CDK1: 0.015-0.070 μM; CDK2: 0.012-0.060 μM; CDK5: 0.018-0.064 μM; CDK9: 0.030-0.091 μM)。CK1に対して、本発明の化合物は、0.06及び0.2μmの間のIC50を示す一方で、DYRK1A及びGSK-3に対して、IC50値は、それぞれ約0.5-2.0μM及び>2.8μMである。
【0111】
表IIIは、μmで報告されたIC50値についての結果を順に並べる。
【0112】
材料及び方法
【0113】
バッファー
【0114】
ホモジナイゼーションバッファー: 60 mMのβ-グリセロホスフェート、15 mMのp-ニトロフェニルホスフェート、25 mMのMops (pH 7.2)、15 mMのEGTA、15 mMのMgCl2、 1 mMのDTT、1 mMのバナジウム酸ナトリウム、1 mMのNaF、1 mMのフェニルホスフェート、10 μgロイペプチン/ml、10 μgアプロチニン/ml、10 μg大豆トリプシンインヒビター/ml、及び100 μM ベンズアミジン。
【0115】
バッファーA: 10 mMのMgCl2、1 mMのEGTA、1 mMのDTT、25 mMのTris-HCl pH 7.5、50μgヘパリン/ml。
【0116】
バッファーC: 60 mMのβ-グリセロホスフェート、15 mMのp-ニトロフェニルホスフェート、25 mMのMops (pH 7.2)、5 mMのEGTA、15 mMのMgCl2、 1 mMのDTT、1 mMのバナジウム酸ナトリウム、1 mMのフェニルホスフェート、10μgロイペプチン/ml、10μgアプロチニン/ml、及び100 μMベンズアミジン。
【0117】
キナーゼの調製及びアッセイ
【0118】
キナーゼが、バッファーA又はバッファーC中で、30℃で、15μMの最終ATP濃度でアッセイされた。ブランク値が差し引かれ、そして、活性が、10分のインキュベーション当たりに組み込まれたホスフェートのμmoleとして計算された。活性は、通常、最大の活性(すなわちインヒビターの不在下における)の%(百分率)として表される。対照は、ジメチルスルホキシドの適切な希釈により実施された。
【0119】
CDK1/cyclin B:は、M期ヒトデ(Marthasterias glacialis)卵母細胞からのホモジナイゼーションバッファーにおいて抽出され、そして、p9CKShs1により標識されたセファロースビーズに対するアフィニティークロマトグラフィーにより精製され、そこからそれが、遊離p9CKShs1により、以前にMeijer et al., (1997) "Biochemical and cellular effects of roscovitine, a potent and selective inhibitor of the cyclin-dependent kinases cdc2, cdk2 and cdk5", Eur. J. Biochem. 1997, 243, 527-536、において記載された通りに溶出された。キナーゼ活性は、バッファーC中で、1mgのヒストンH1/mlにより、15μMの[γ-33P] ATP (3000 Ci/mmol; 10 mCi/ml)の存在下で、30μlの最終量においてアッセイされた。30℃での30分間のインキュベーション後、25μlの上清のアリコートが、Whatman P81ホスホセルロースペーパーフィルター上にスポットされ、そして、20秒後、該フィルターが5回(それぞれの回で少なくとも5分間)、10mlのリン酸/1リットルの水の溶液中で洗浄された。該濡れたフィルターが、AmershamからのACSシンチレーション流体の存在下における計数に付された。
【0120】
CDK2/cyclin A (ヒト、組み換え、昆虫細胞において発現された)が、CDK1/cyclin Bについて記載されたとおりにアッセイされた。
【0121】
CDK5/p25は、E. coli中において発現された等量の組み換え哺乳類CDK5及びp25を混合することにより、GST(グルタチオン−S−トランスフェラーゼ)融合タンパク質として、再構成され、グルタチオン−アガロースに対するアフィニティクロマトグラフィーにより精製された(p25は、p35(35 kDaのCDK5アクチベーター)の切り取られたバージョンである)。その活性は、ヒストンH1により、バッファーC中で、CDK1/cyclin Bについて記載されたとおりにアッセイされた。
【0122】
CDK9/cyclin T (ヒト、組み換え、昆虫細胞において発現された)が、基質としてpRB フラグメント(a.a. 773-928) (3.5 μg/アッセイ)を用いたこと以外は、CDK1/cyclin Bについて記載されたとおりにアッセイされた。
【0123】
GSK-3α/β(ブタ脳、ネイティブ、アフィニティ精製された)が、バッファーAにおいて及びGSK-3について特異的な基質(GS-1: YRRAAVPPSPSLSRHSSPHQSpEDEEE) (Sp: serine phosphorylated)により行われた以外は、CDK1について記載されたとおりにアッセイされる(Bach S. et al. J Biol Chem 2005; 280:31208-19)。
【0124】
CK1δ/ε(ブタ脳、ネイティブ、アフィニティ精製された)が、CDK1について記載されたとおりに、CK1について特異的な基質、RRKHAAIGSpAYSITA (Reinhardt J. et al. Protein Expr & Purif 2007; 54:101-9)、によりアッセイされる。
【0125】
DYRK1A (ヒト、組み換え、E. coli中でGST融合タンパク質として発現された)が、グルタチオンアガロース上で精製され、CDK1/cyclin Bについて記載されたとおりに、基質としてのミエリン塩基性タンパク質(1 mg/ml)を用いてアッセイされた。
【0126】
【表3】

【0127】
薬理学的アッセイの第2のシリーズに従い、細胞に対する試験が、より特にはSH-SY5Y及びCLL株に対して、本明細書以下に記載された方法論に従い実施された。表IVは、μMにおけるIC50値における結果の例を順に並べる。
【0128】
材料及び方法
【0129】
A. SH-SY5Yヒト神経芽腫細胞
【0130】
化学的試薬
【0131】
MTS試薬を有するCell Titer 96(商標)キットが、Promega(Madison, WI, 米国)から購入された。プロテアーゼインヒビターカクテルが、Rocheから、そして、ウシ胎仔血清(FCS)がInvitrogenから入手された。掲載されていない試薬は、他に示されない限り、Sigmaから入手された。
【0132】
細胞株及び培養条件
【0133】
SH-SY5Yヒト神経芽腫細胞株が、Invitrogen (Cergy Pontoise, フランス)からのL-グルタミン、抗生物質、及びInvitrogenからの10体積%のFCSを有するDMEM培地中で増殖させられた。一般的な培養条件は、5%CO2の大気及び37℃の温度であった。培養プレート及び他のディスポーザブルプラスチックツールは、Corning (Corning, NY, 米国)により供給された。本発明の化合物による処理は、培養物に対して時間にわたる指数的増殖において及び示された濃度で実施された。対照実験もまた、DMSOの適切な希釈を用いて実施された。
【0134】
細胞生存能力の実証
【0135】
細胞生存能力が、3-(4,5-ジメチルチアゾール-2-イル)-5-(3-カルボキシメトキシフェニル)-2-(4-スルホフェニル)-2H-テトラゾリウム(MTS)の還元を測定することにより決定された。手順は、Ribas J. et al., 2004, "Cell differentiation, caspase inhibition, and macromolecular synthesis blockage, but not BCL-2 or BCL-XL proteins, protect SH-SYS5 cells from apoptosis triggered by two CDK inhibitory drugs", Exp. Cell Res, 2004, 195, 9-24、において詳細に記載されたとおりであった。
【0136】
B. ヒト慢性リンパ性白血病 (B-CLL) リンパ球
【0137】
患者及び細胞精製
【0138】
CLL細胞が、インフォームドコンセントの得られた後の未処置の患者のヘパリン化血から単離された。
【0139】
単核細胞が、Lymphosep密度勾配(Biowest)上での遠心により単離された。すべてのB−CLL試料は、4又は5のMatutesスコアを有した。B−CLLリンパ球のパーセンテージが、CD19-PE (クローンJ4,119) 及びCD5-PC5 (クローンBL1a)による標識化の後にフローサイトメトリーにより評価され、そして、細胞が、FACS(EPICS XL, Beckman Coulter, フランス)により分析された。CD19+/CD5+細胞のパーセンテージが、90%より少ない場合、Bリンパ球が、単球、NK細胞、顆粒球及びTリンパ球の免疫磁性的枯渇によるB細胞富化の為のキットII(Miltenyi Biotech)を用いて富化された。
【0140】
アポトーシス
【0141】
B−CLL細胞が、37℃で、10%のFCS (InVitrogen)を有するRPMI 1640培地(Lonza)中で、種々の濃度の本発明の化合物と一緒に培養(300 000 細胞/ウェル)された。インキュベーション後、B−CLL細胞が回収され、PBS中で洗浄され、そして、FITCが結合したアネキシンV及びよう化プロピジウムを有する100μlの1×バインディングバッファー(Beckman Coulter Apoptosis Detection Kit)中に再懸濁された。氷上での10分間のインキュベーション後、細胞が、フローサイトメトリーにより分析され、アポトーシスを受けている細胞のパーセンテージが決定された。
【0142】
本発明の化合物は概して、考慮下の2つの細胞株について、1μm未満のIC50を有する。
【0143】
【表4】

【0144】
それ故に、本発明に従う化合物は、医薬を調製する為に、特にはプロテインキナーゼに対する、及び、特にはサイクリン依存性キナーゼ(CDK)に対する、カゼインキナーゼ1(CK1)に対する、及びDYRKに対する、阻害活性を有する医薬を調製する為に用いられうる。
【0145】
すなわち、本発明の主題は、その局面の他に従い、式(I)の化合物、又は、該化合物の医薬的に許容できる酸との付加塩又は水和物若しくは溶媒和物を含む医薬である。
【0146】
これらの医薬は、治療において、特には種々の病理学的状態、例えばガン、慢性神経変性疾患、例えばアルツハイマー病若しくはパーキンソン病、急性神経変性疾患、例えば脳外傷、脳卒中、てんかん、肺炎症、関節炎、ウィルス感染(AIDS、ヘルペス)、疼痛治療、糖尿病、特には2型糖尿病、腎臓疾患、例えば多嚢胞性腎(renal polycystosis)又は糸球体腎炎、白血病、例えば慢性リンパ性白血病、特にはB細胞タイプのもの、又は寄生生物、例えばPlasmodium及びLeishmaniaなどの予防及び処置において、それらの用途を見出す。
【0147】
本発明の化合物は、最も特には、以下の疾患:ガン、慢性リンパ性白血病、アルツハイマー病、パーキンソン病、脳卒中、肺炎症、AIDS、多嚢胞性腎、糸球体腎炎、を予防及び/又は処置する為に有用である。
【0148】
その局面の他に従い、本発明は、活性成分として本発明に従う化合物を含む医薬組成物に関する。これらの医薬組成物は、有効投与量の本発明に従う少なくとも1つの化合物又は該化合物の医薬的に許容できる塩、水和物若しくは溶媒和物及び少なくとも1つの医薬的に許容できる添加物を含む。
【0149】
該添加物は、所望の医薬形態及び投与方法に従い、当技術分野の当業者に知られている通常の添加物から選ばれる。
【0150】
経口的、舌下の、皮下の、筋肉内の、静脈内の、局部的な、局所的な、気管内の、鼻腔内の、経皮的、又は直腸への投与の為の本発明の医薬組成物において、上記式(I)の活性成分又はその任意的な塩、水和物若しくは溶媒和物は、単位投与形態で、慣用の医薬的添加物と一緒の混合物として、ヒトに、上記で言及された異常又は疾患の予防又は処置の為に投与されうる。
【0151】
適切な単位投与形態は、経口投与の為の形態、例えばタブレット、ソフト若しくはハードゲルカプセル、パウダー、顆粒、及び経口溶液若しくは縣濁物、舌下への、頬への、気管内への、眼内及び鼻腔内への投与形態、吸入による投与形態、局所的、経皮的、皮下への、筋肉内への、又は静脈内への投与形態、直腸投与形態、及びインプラントを含む。
【0152】
経口投与により、1日当たりに投与される活性成分の投与量は、1又はそれより多い摂取において、1〜500 mg/kgに達しうる。
【0153】
より高い又はより低い投与量が適切である特定の場合がありうる;そのような投与量は、本発明の内容から離れない。通常の実践に従い、それぞれの患者にとって適切な投与量は、投与方法に従い及び該患者の体重及び応答に従い、医師により決定される。
【0154】
その局面の1つい従い、本発明は、式(I)、(Ia)、(Ib)、(Ic)、(Id)、(Ie)、(If)、又は(1)〜(38)の化合物、又はその医薬的に許容できる塩を、上記で言及された疾患の少なくとも1つ、及び特にはガンを処置することが意図された医薬の調製の為に使用する方法に関する。
【0155】
その局面の他に従い、本発明は、式(I)、(Ia)、(Ib)、(Ic)、(Id)、(Ie)、(If)、又は(1)〜(38)の化合物、又はその医薬的に許容できる塩であって、上記言及された疾患の少なくとも1つを処置及び予防することが意図された医薬として、及び特には抗ガン剤としてのそれらの使用の為の前記化合物又は塩に関する。
【0156】
その局面のさらに他に従い、本発明はまた、上記で示された病理学的状態を予防し及び/又は処置する為の方法に関し、これは患者に、本発明に従う化合物又はその医薬的に許容できる塩又は水和物又は溶媒和物の有効投与量の投与を含む。
【0157】
本発明に従う医薬組成物はまた、獣医学的分野における使用も見出し、及び、上記で言及された異常又は疾患の予防又は処置の為に動物、例えばイヌ及びネコなど、に投与されうる。
【技術分野】
【0001】
本発明は、ピラゾロ[1,5-a]-1,3,5-トリアジン誘導体、その調製、及びその治療的使用方法に関する。
【背景技術】
【0002】
或る数の文献が、ピラゾロ[1,5-a]-1,3,5-トリアジンから得られる化合物を記載している。
【0003】
すなわち、キナーゼインヒビターとしてのピラゾロトリアジン化合物は、文献国際公開第2005/082908号パンフレットから知られている。
【0004】
サイクリン依存性キナーゼ(CDK)のインヒビター及びグリコーゲンシンターゼキナーゼ−3(GSK−3)のインヒビターである化合物は、文献国際公開第2002/50079号パンフレットから知られている。
【0005】
最後に、文献国際公開第2004/011464号パンフレットは、とりわけ、ホスホジエステラーゼPDE2及びPDE4のインヒビターである化合物を記載している。
【0006】
さらに、Bettayebら、 "N-&-N, a new class of cell death-inducing kinase inhibitors derived from the purine roscovitine", Mol. Cancer Ther. 2008, 7, 2713、及び"Pyrazolo[1,5-a]-1,3,5-triazine as a purine bioisostere: access to potent cyclin-dependent kinase inhibitor (R)-roscovitine analogue", J. Med. Chem. 2009, 52, 655, はN-&-N1:

と呼ばれる化合物の抗腫瘍能力を記載している。
【発明の概要】
【課題を解決するための手段】
【0007】
本発明の主題は、以下の式(I)に対応する化合物及び医薬的に許容できるその塩である:

ここで、
R1は、(C1-C6)アルキル基又は(C3-C6)シクロアルキル基であり、
R2は、(i)1〜3のヒドロキシル基により又は (ii)NRaRb基(ここでRa及びRbは独立に水素原子又は (C1-C3)アルキル基である)により置換されている、(C1-C6)アルキル基、(C3-C6)シクロアルキル基、(C1-C6)アルケニル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基、
又は、R2は、1〜3のヒドロキシル基により置換されているピロリジニルメチル基である、
該R2基は、-OCOR3基により置換されていてもよく、ここでR3は、天然の若しくは非天然のアミノ酸誘導体又は式(B)のピペリジル基であり、

ここで、
R4は、水素、ハロゲン原子、(C1-C3)アルキル基、ヒドロキシ(C1-C3)アルキル基、又は-NRaRb基、ここでRa及びRbは上で定義されたとおりであり、及び、R5は、水素、 (C1-C3)アルキル基、-N(Me)2基、ピペリジル基、又はモルホリニル基であり、
R9は、R2と同じ意味を有し及び水素原子であってもよい、
あるいは、R2及びR9は一緒になって、それらと結合している窒素原子と一緒に、ピロリジニル基、ピペリジニル基、ピペラジニル基、及びピペリジニルピペリジニル基から選ばれるヘテロ環を成し、これらヘテロ環は、ヒドロキシル、(C1-C6)アルキル又は(C1-C6)アルコキシ(C1-C6)アルキルから選ばれる1〜3の基により置換されていてもよく、これらの後の2つの基は(i)1〜3のヒドロキシル基により又は(ii) NRaRb基により置換されており、ここでRa及びRbは独立に水素原子又は(C1-C3)アルキル基である、
X及びYは独立にフェニル基又はヘテロアリール基であり、該ヘテロアリール基及び該フェニル基は、(C1-C2)アルキル基、(C1-C2)アルコキシ基、ハロゲン原子、 (C1-C2)フルオロアルキル基、(C1-C2)フルオロアルコキシ基、ヒドロキシル基、-COOH基、-CONHR6基及び-NRaRb基から独立に選ばれる1又は2の基により置換されていてもよく、ここでRa及びRbは上で定義されたとおりである、
R6は、水素又は(C1-C3)アルキル基である、
該ヘテロアリール基は、チエニル基、ピリジル基、ピリミジニル基、チアゾリル基、ピロリル基、及びフラニル基から選ばれるものである。
【0008】
該天然の又は非天然のアミノ酸から得られる基は、20の天然アミノ酸から得られうる。該天然のアミノ酸のうち、特に、L−バリン、L−ロイシン、L−セリン、L−スレオニン、L−アスパラギン及びアスパラギン酸が言及されうる。
【0009】
該非天然のアミノ酸誘導体のうち、該天然アミノ酸のアシル誘導体が言及されてよく、すなわち、末端-COOH基の代わりに、 (C1-C3)アルキルカルボニル基又は(C1-C4)アルコキシカルボニル基、特にはアセチル化誘導体を与えるメチルカルボニル基又はBoc誘導体を与えるtert-ブトキシカルボニル基を含む。
【0010】
D−立体配置アミノ酸誘導体も用いられうる。
【0011】
本発明の一つの局面に従い、該ヘテロアリール基は、チエニル基、フラニル基、及びピラジル基から選ばれる。
【0012】
本発明の一つの特定の局面に従い、R3は、以下の式(a−1)〜(a−5)の一つであり、及びそれらのエナンチオマーであってもよく、

ここでBocは、tert-ブトキシカルボニル基及びAcはアセチル基である。
【0013】
式(I)の化合物は、1又はそれより多い不斉炭素原子を含みうる。それ故に、それは、エナンチオマーの形又はジアステレオイソマーの形で存在しうる。これらのエナンチオマー及びジアステレオイソマー、並びにそれらの混合物(ラセミ混合物も含む)は、本発明の一部である。
【0014】
式(I)の化合物は、塩基の形又は酸との付加塩の形で存在しうる。そのような付加塩は本発明の一部である。
【0015】
これらの塩は、医薬的に許容できる酸と一緒に有利に調製されるが、例えば式(I)の化合物を精製又は単離する為に有用である他の酸の塩もまた本発明の一部である。
【0016】
該医薬的に許容できる酸のうち、特に塩化水素酸、臭化水素酸、トリフルオロ酢酸、フマル酸、酒石酸、クエン酸、アスコルビン酸、及びマレイン酸が言及されうる。
【0017】
式(I)の化合物は、水和物の形又は溶媒和物の形で存在してもよく、すなわち、1又はそれより多い水分子と又は溶媒との会合物又は組み合わせの形で存在してもよい。そのような水和物及び溶媒和物もまた本発明の一部である。
【0018】
本発明の文脈において:
「t及びzが1〜6の値を有しうるところの(Ct-Cz)」は、tからzの炭素原子を有しうる炭素に基づく鎖を意味することが意図され、例えば「(C1-C3)」は、1から3の炭素原子を有しうる炭素に基づく鎖を意味する;
「ハロゲン」は、フッ素、塩素、臭素、及びヨウ素から選ばれる原子、特にはフッ素、塩素、及び臭素から選ばれる原子を意味することが意図される;
「アルキル基」は、直鎖状又は分岐した飽和脂肪族基を意味することが意図される。例として、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、tert-ブチル、ペンチル等の基が言及されうる;
「アルケニル基」は、1又は2の不飽和を有する直鎖状又は分岐した脂肪族基を意味することが意図される。例として、エテニル、プロペニル、イソプロペニル、ブテニル、イソブテニル、tert-ブテニル、ペンテニル等の基が言及されうる;
「シクロアルキル基」は、環状アルキル基を意味することが意図される。例として、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル等の基が言及されうる;
「アルコキシ基」は、アルキル基が上記で定義されたとおりであるところのO-アルキル基を意味することが意図される;
「フェニル基」は、(一価の)フェニル基及び対応する二価基フェニレンの両方を意味することが意図される;
「ヘテロアリール基」は、(一価の)ヘテロアリール基及び対応する二価基ヘテロアリーレンの両方を意味することが意図され、該ヘテロアリール基は、1又は2のヘテロ原子、例えば窒素、酸素又は硫黄など、を含む芳香族若しくは非芳香族の単環式若しくは二環式の基である;
「フルオロアルキル基」及び「フルオロアルコキシ基」は、少なくとも1つのフッ素原子により置換されている、上記で定義されたとおりのアルキル基及びアルコキシ基をそれぞれ意味することが意図される。例として、パーフルオロアルキル基、例えばトリフルオロメチル又はパーフルオロプロピルなど、が言及されうる。
【0019】
一つの特定の実施態様に従い、R1基は、エチル基又はイソプロピル基である。
【0020】
一つの特定の実施態様に従い、X基及びY基は、置換されていない。
【0021】
他の特定の実施態様に従い、X基及びY基の少なくとも1つが置換されている場合、それは1又は2の置換基を有し、且つ、該置換基は(C1-C2)アルキル基、(C1-C2)フルオロアルキル基、(C1-C2)アルコキシ基、(C1-C2)フルオロアルコキシ基、ハロゲン原子、ヒドロキシル基、及び-COOH基から独立に有利に選ばれる。
【0022】
さらにこの他の実施態様従い、Yがヘテロアリール基であり且つ一置換されている場合、該置換は有利には3位又は5位にある。
【0023】
他の特定の実施態様に従い、R2基は、以下の式の一つであり、R9基はそのときは水素原子である:


【0024】
1のさらにより特定の実施態様に従い、R2基は、上記で定義されたとおりの式(b−1)、(b−2)、(b−10)、(b−11)、(b−13)、(b−14)又は(b−15)の一つである。
【0025】
一つの特定の実施態様に従い、R2基及びR9基は一緒になって、ヘテロ環を成し、ピロリジニル基は有利にはピロリジン-1-イル基であり、ピペリジニル基は有利にはピペリジン−1−イル基であり、ピペラジニル基は有利にはピペラジン-1-イル基であり、及び、ピペリジニルピペリジニル基は有利にはピペリジン-4-イルピペリジン-1-イル基である。
【0026】
さらに他の特定の実施態様に従い、該NR2R9基は以下の式の一つである:

【0027】
さらに他の特定の実施態様に従い、該NR2R9基は、(b−38)及び(b−39)基を除く、式(b−35)〜(b−43)の一つを有する。
【0028】
他のさらにより特定の実施態様に従い、本発明は、上記で定義されたとおりの式(I)の化合物に関し、ここでR1はイソプロピル基であり;R2は(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)又は(b-15)の一つであり;及びX及びYは上記で定義されたとおりであり且つ置換されておらず、及び有利には独立にフェニル基、ピリジル基又はチエニル基であり、X及びYは同時にチエニル基又はピリジル基でないことが理解される。
【0029】
さらに他の特定の実施態様に従い、式(B)の該ピペリジル基は以下の基の一つである:

【0030】
本発明の対象である化合物のうち、式(I)に含められる式(Ia)の化合物の第一の群が言及されうる:

ここで:
R1は、上記で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2及びR9は独立に、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、 (C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、R9は水素原子であってもよく、及び有利にはR2は上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つであり、R9は水素原子である、
又はR2及びR9は一緒になって、それらと結合している窒素原子と一緒に、ピペリジン-1-イル又はピペリジン-4-イルピペリジン-1-イル基を成し、該基は、ヒドロキシル基により置換されている1〜3の(C1-C6)アルキル基により置換されており、及び有利にはR2及びR9は一緒になって、上記で定義されたとおりの式(b-37)、(b-38)、(b-39)、又は(b-40)の一つである、
R7及びR8は独立に、水素原子、(C1-C2)アルキル基、(C1-C2)フルオロアルキル基、 (C1-C2)アルコキシ基、(C1-C2)フルオロアルコキシ基、ハロゲン原子、ヒドロキシル基、又は-COOH基である、
Gは、-CH=又は-N=であり、且つ、
Gが-CH=である場合、該W基及びZ基は、同時に-CH=であるか、又は一方が-N=であり且つ他方が-CH=である、
Gが-N=である場合, そのときはW及びZは-CH=である。
【0031】
本発明の対象である化合物のうち、式(I)に含まれる式(Ib)の化合物の第2の群が言及されうる:

ここで、
R1は、上記で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2は、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には、上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つである、且つ
R7及びR8は独立に、水素原子、(C1- C2)アルキル基、(C1-C2)フルオロアルキル基、(C1-C2)アルコキシ基、(C1-C2)フルオロアルコキシ基、ハロゲン原子、ヒドロキシル基、又は-COOH基である。
【0032】
本発明の対象である化合物のうち、式(I)に含まれる式(Ic)の化合物の第3の群が言及されうる:

ここで、
R1は、上記で定義されたとおりであり、及び有利にはエチル基又はイソプロピル基であり、
R9は水素原子であり、且つ、R2は、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には、上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つである、
又はR2及びR9は一緒になって、それらと結合している窒素原子と一緒に、ピペリジン-1-イル又はピペリジン-4-イルピペリジン-1-イル基を成し、該基は、ヒドロキシル基により置換されている1〜3の(C1-C6)アルキル基により置換されており、及び有利にはR2及びR9は一緒になって、上記で定義されたとおりの式(b-37)、(b-38)、(b- 39)、又は(b-40)の一つであり、
R7及びR8は独立に、水素原子、(C1-C2)アルキル基、(C1-C2)フルオロアルキル基、(C1-C2)アルコキシ基、(C1-C2)フルオロアルコキシ基、ハロゲン原子、ヒドロキシル基、又は-COOH基である。
【0033】
本発明の対象である化合物のうち、式(I)に含まれる式(Id)の化合物の第3の群が言及されうる:

ここで、
R1は、上記で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2は、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には、上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つであり、且つ
R7は、水素原子、(C1- C2)アルキル基、(C1-C2)フルオロアルキル基、(C1-C2)アルコキシ基、(C1-C2)フルオロアルコキシ基、ハロゲン原子、ヒドロキシル基、又は-COOH基である。
【0034】
本発明の対象である化合物のうち、式(I)に含まれる式(Ie)の化合物の第4の群が言及されうる:

ここで、
R1は、上記で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2は、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には、上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つである。
【0035】
本発明の対象である化合物のうち、式(I)に含まれる式(If)の化合物の第5の群が言及されうる:

ここで、
R1は、上記で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2は、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には、上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つである。
【0036】
式(Ia)、(Ib)、(Ic)、(Id)、(Ie)及び(If)の化合物の医薬的に許容できる塩も本発明の一部である。
【0037】
本発明の式(I)の化合物のうち、特に以下の化合物が言及されうる:
- (R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-(4-フェニルベンジルアミノ)ピラゾロ[1,5-a]-1,3,5-トリアジン (1)
- (R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (2)
- (R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (3)
- (S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (4)
- (S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (5)
- (R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (6)
- (S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (7)
- (S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (8)
- (S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (9)
- (R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (10)
- (R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (11)
- (2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (12)
- (2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (13)
- (2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (14)
- (2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (15)
- (2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (16)
- 2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (17)
- 2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (18)
- 2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (19)
- (S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (20)
- (2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (21)
- (S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (22)
- (2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (23)
- 2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (24)
- (R)-2-(1-ヒドロキシ-4-メチルペント-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (25)
- (S)-2-(1-ヒドロキシ-4-メチルペント-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (26)
- (S)-2-(1-ヒドロキシ-3,3-ジメチルブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (27)
- (S)-2-(1-ヒドロキシ-3-メチルブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (28)
- 2-[4-[1-[8-イソプロピル-4-[[4-(ピリジン-2-イル)フェニル]メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン-2-イル]ピペリジン-4-イル]ピペリジン-1-イル]エタノール (29)
- 2-[4-[8-イソプロピル-4-[[4-(ピリジン-2-イル)フェニル]メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン-2-イル]ピペラジン-1-イル]エタノール (30)
- (R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (31)
- [(2R)-3-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチル-アミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]-2-ヒドロキシプロピル] (2R)-2-Bocアミノ-3-メチルブタノエート (32)
- 塩基又は塩の形にある、特にはジヒドロクロリドの形にある[(2R)-3-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]-2-ヒドロキシプロピル] (2R)-2-アミノ-3-メチルブタノエート (33)
- (S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (34)
- (S)-8-エチル-2-(1-ヒドロキシブト-2-イルアミノ)-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (35)
- (R)-8-エチル-2-(1-ヒドロキシブト-2-イルアミノ)-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (36)
- 2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (37)
- 2-[(2S)-1-[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]-2-ピペリジル]エタノール (38)
- 2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]-(2-ヒドロキシエチル)アミノ]エタノール (39)
- (2R,3R)-2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]ブタン-1,3-ジオール (40)
- (2S,3S)-2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]ブタン-1,3-ジオール (41)
及びまた、医薬的に許容できる酸のそれらの任意の塩。
【0038】
以下の化合物もまた本発明の一部である。





及び医薬的に許容できる酸のそれらの塩。
【0039】
また、本発明の主題は、式(I)の化合物を調製する為の方法である。
【0040】
本発明の化合物は、以下に記載されたスキーム1に従い記載された種々の方法に従い調製されうる。

【0041】
スキーム1に従い、式(IIa)の化合物(ここでX、Y及びR1は上記で定義されたとおりである)は、例えば0℃でジクロロメタン中で、メタ−クロロ過安息香酸(mcpba)の存在下で酸化反応に付されて、対応するスルホンを生成する。後者は、式NH-R2R9(ここでR2及びR9は上記で定義されたとおりである)の第1級アミンの存在下において、100〜180℃の温度で、例えば140℃で、芳香族求核置換反応(NSAR)に直接に用いられて、式の(I)の化合物を生成する。あるいは、タイプ(I)の化合物が、式(IIb)の化合物から調製されてもよい。これらの化合物(IIb)(ここでX及びR1は上記で定義されたとおりである)が、最初に、金属により、例えばパラジウム(Suzuki-Miyaura反応又はStille反応)又はニッケルなど、により触媒されるカップリング反応において用いられて、中間体(IIa)を与える。これらの同じ化合物(IIb)は、メタ−クロロ過安息香酸(meta-chloroperbenzoic acid)の存在下においてジクロロメタン中で0℃でスルホンを生成するように酸化されてよく、該スルホンは、式(III)の化合物を与えるように、1級アミン(NSAR)により置換される(NSAR)。後者は、金属により、例えばパラジウム又はニッケルにより、触媒されるカップリング反応に付されたときに、式(I)の化合物を生成する。
【0042】
このように、その局面の一つに従い、本発明は、本発明に従う式(I)の化合物を調製する為の方法に関し、該方法は、以下のとおりの式(IIa)の化合物(ここでX、Y及びR1は上記で定義されたとおりである)

が、酸化反応においてメタ−クロロ過安息香酸と反応させられること、及び、得られたスルホンが、100〜180℃の温度で、例えば140℃の温度で、式NH2R2(ここでR2は上記で定義されたとおりである)の第1級アミンの存在下において求核置換反応において直接に用いられて、式(I)の化合物を生成することにおいて特徴付けられ、又は、式(IIb)の化合物(ここでX及びR1は上記で定義されたとおりである)

が、金属、例えばパラジウム又はニッケル、と反応させられて、上記で定義されたとおりの式(IIa)の化合物を与えること、又は代りに上記で定義されたとおりの式(IIb)の化合物が、メタ−クロロ過安息香酸により、酸化反応において反応させられ、得られたスルホンが式NH-R2R9(ここでR2及びR9は上記で定義されたとおりである)の第1級アミンの存在下における求核置換反応において直接に用いられて、式(III)の化合物

(ここでX1、R1及びR2は上記で定義されたとおりである)を与え、これが、金属により、例えばパラジウム又はニッケル、により触媒されたカップリング反応に付されて、式(I).の化合物を生成することにおいて特徴づけられる。
【0043】
本発明の式(I)の化合物を調製する為に用いられる式(IIa)又は(IIb)の誘導体を調製する為の方法が本明細書内以下に記載される。
【0044】
式(IIa)又は(IIb)の誘導体は、化合物(IV)から、文献"pyrazolo[1,5-a]-1,3,5-triazine as a purine bioisostere: access to potent cyclin-dependent kinase inhibitor (R)-roscovitine analogue", J. Med. Chem. 2009, 52, 655、に記載された方法により調製されうる。
【0045】
一般に、8位で置換されている該4-(N-メチル-N-フェニルアミノ)-2-チオメチルピラゾロ [1,5-a]-1,3,5-トリアジン(ここでR1は上記で定義されたとおりである)(IV)が、該アリール−又はヘテロアリールメチレンアミン(ここでX及びYは上記で定義されたとおりである)(V)と、100〜180℃の温度で、例えば140℃で、反応させられて、以下に記載されたスキーム2に従い、式(IIa)又は(IIb)の化合物を生成する。

【0046】
式(IV)の化合物は、それらが市販入手可能でない場合、文献、例えば刊行物"pyrazolo[1,5-a]-1,3,5-triazine as a purine bioisostere: access to potent cyclin-dependent kinase inhibitor (R)-roscovitine analogue"(上記で言及された)に記載された方法を用いて調製されうる。
【0047】
式(V)の化合物は、それらが市販入手可能でない場合、文献に、例えば刊行物国際公開第2003/022805号パンフレットに記載された方法を用いて調製されうる。
【0048】
該一般的合成スキーム1及び2において、該出発化合物及び該反応物は、それらを調製する為の方法が記載されていない場合、市販入手可能であり又は該文献に記載されており、又はそれらに記載された方法又は当技術分野の当業者に知られている方法に従い調製されうる。
【0049】
本発明の主題は、その局面の他に従い、式(II)の化合物でもあり、ここでX、Y及びR1は上記で定義されたとおりである。

【0050】
これらの化合物は、式(I)の化合物の合成の為の中間体として利用できる。式(II)の化合物の例は、本明細書以下の表1において与えられる。
【0051】
以下の実施例もまた、本発明に従う式(I)の化合物の調製を記載している。これらの実施例は、本発明を限定するものでなく、本発明を単に説明する。例示される化合物の番号は、表2に与えられたものをいい、これは本発明のいくつかの化合物の化学的構造及び物理的特性を説明する。
【0052】
以下の調製及び実施例において、
- Mp = 毎分1℃の温度勾配によるBuchi B545装置で測定されたときの融点(℃)
- NMR =Bruker 300MHz又は400MHzスペクトロメータにより実施された核磁気共鳴。用いられた溶媒は、DMSO−d6及びCDCl3であり、及び、化学シフトはTMSに対して表される。用いられた略称は
- s =シングレット、
- d =ダブレット、
- dd = ダブルダブレット(double of doublets)、
- t =トリプレット、
- m = マルチプレット、
- bs =ブロードシングレット、
である。
【0053】
I. 中間体の調製
【0054】
調製I.1
8-イソプロピ-2-(メチルスルファニル)-4-(4-フェニルベンジルアミノ)ピラゾロ[1,5-a]-1,3,5-トリアジン (IIa.1)

封をされたチューブ中で、8-イソプロピル-4-(N-メチル-N-フェニルアミノ)-2-(メチルスルファニル)ピラゾロ[1,5-a]-1,3,5-トリアジン (114 mg, 0.36 mmol)及び4フェニルベンジルアミン(100 mg, 0.55 mmol)の溶液が、140℃で24時間加熱される。冷却した後、溶媒が蒸発される。集められた粗化合物が、フラッシュクロマトグラフィー(EP/Et2O 9:1)により精製されて、IIa.1 (95 mg, 67%)を与える。

【0055】
調製I.2
8-イソプロピル-2-(メチルスルファニル)-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (IIa.2)

化合物IIa.1の調製を結果する同じ条件に従い、化合物IIa.2が、8-イソプロピル-4-(N-メチル-N-フェニルアミノ)-2-(メチルスルファニル)ピラゾロ[1,5-a]-1,3,5-トリアジン及び4-(ピリジン-2-イル)ベンジルアミンから調製される。収率=60%。

【0056】
調製I.3
8-イソプロピル-2-(メチルスルファニル)-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン(IIa.3)

化合物IIa.1の調製を結果する同じ条件に従い、化合物IIa.3が、8-イソプロピル-4-(N-メチル-N-フェニルアミノ)-2-(メチルスルファニル)ピラゾロ[1,5-a]-1,3,5-トリアジン及び4-(チオフェン-3-イル)ベンジルアミンから調製される。収率= 74%。

【0057】
調製I.4
4-(4-ブロモベンジルアミノ)-8-イソプロピル-2-(メチルスルファニル)ピラゾロ[1,5-a]-1,3,5-トリアジン(IIb.4)

化合物IIa.2の調製を結果する同じ条件に従い、化合物IIb.4が、8-イロプロピル-4-(N-メチル-N-フェニルアミノ)-2-(メチルスルファニル)ピラゾロ[1,5-a]-1,3,5-トリアジン及び4-ブロモベンジルアミンから調製される。収率= 75%。

【0058】
調製I.5
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-4-(4-ブロモベンジルアミノ)-8-イソプロピルピラゾロ[1,5-a]-1,3,5-トリアジン(III.5)

ジクロロメタン(CH2Cl2) (6 ml)中のIIb.4 (200 mg, 0.51 mmol)の溶液が、0℃で撹拌される。70-75%のメタ−クロロ過安息香酸(126 mg, 0.51 mmol)が添加され、そして次に該溶液が1時間撹拌される。同量の酸が、二回目に添加される。最終溶液が、2時間、0℃で撹拌される。NaHCO3の溶液の添加後、液−液抽出が実施される。分離された有機相がNaClの溶液により洗浄され、MgSO4上で乾燥され、そして次に、減圧下で蒸発される。該スルホンが、定量的な収率とともに得られ、そして次にさらなる精製無しで以下の工程において用いられる。スルホン(216 mg, 0.51 mmol)及び市販の(R)-(-)-2-アミノブタノール(247μl, 2.62 mmol)の溶液が、140℃で24時間加熱される。冷却した後、溶媒が蒸発される。集められた該粗化合物が、フラッシュクロマトグラフィー(EP/EtOAc 9:1〜6:4)により精製されて、III.5 (103 mg, 47%)を与える。オイル(oil)。

【0059】
調製I.6
8-イソプロピル-2-メチルスルファニル-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン(IIa.4)

化合物IIa.2の製造を結果する同じ条件に従い、化合物IIa.4が、
8-イソプロピル-4-(N-メチル-N-フェニルアミノ)-2-(メチルスルファニル)ピラゾロ[1,5-a]-1,3,5-トリアジン及び4-(ピリジン-3-イル)ベンジルアミン
から調製される。収率= 65%。

【0060】
調製I.7
8-イソプロピル-2-メチルスルファニル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン-4-アミン(IIa.5)

化合物IIa.2の製造を結果する同じ条件に従い、化合物IIa.5が、8-イソプロピル-4-(N-メチル-N-フェニルアミノ)-2-(メチルスルファニル)ピラゾロ[1,5-a]-1,3,5-トリアジン及び(6-フェニルピリジン-3-イル)メタンアミンから調製される。

【0061】
【表1】

【0062】
以下の実施例が、本発明を限定することなく、本発明を説明する。
【0063】
II.式(I)の化合物の調製
【実施例1】
【0064】
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-フェニルベンジルアミノ)ピラゾロ [1,5-a]-1,3,5-トリアジン (1)

CH2Cl2 (4 ml)中のIIa.1 (160 mg, 0.41 mmol)の溶液が、0℃で攪拌される。70-75% のメタ−クロロ過安息香酸(meta-chloroperbenzoic acid)(100 mg, 0.41 mmol)が添加され、そして次に該溶液が1時間攪拌される。同量の酸が二回目に添加される。最終的な溶液が、2時間、0℃で攪拌される。NaHCO3の溶液の添加後、液−液抽出が実施される。分離された有機相がNaClの溶液により洗浄され、MgSO4上で乾燥され、そして次に減圧下で蒸発される。スルホンが、定量的な収率と共に得られ、そして次に、さらなる精製無しで、以下の工程において用いられる。8-イソプロピル-2-(メチルスルホニル)-4-[N-(4-フェニル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン(173 mg, 0.41 mmol)及び市販の(R)-(-)-2-アミノブタノール(193μl, 2.03 mmol)の溶液が、 140℃で24時間加熱される。冷却した後、溶媒が蒸発される。集められた粗化合物が、フラッシュクロマトグラフィー(EP/EtOAc 8:2, 次に1:1)により精製されて、1(75 mg, 43%)を与える。オイル(oil)。

【実施例2】
【0065】
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ [1,5-a]-1,3,5-トリアジン(2)

CH2Cl2 (12 ml)中のIIa.2 (400 mg, 1.02 mmol) の溶液が0℃で攪拌される。70-75% メタクロロ過安息香酸 (250 mg, 1.02 mmol)が添加され、そして次に該溶液が1時間攪拌される。同量の酸が二回目に添加される。最終的な溶液が2時間0℃で攪拌される。NaHCO3の溶液の添加後、液−液抽出が実施される。分離された有機相がNaClの溶液により洗浄され、MgSO4上で乾燥され、そして次に、減圧下で蒸発される。スルホンが、定量的収率とともに得られ、そして次にさらなる精製無しで以下の工程において用いられる。スルホン(430 mg, 1.02 mmol)及び市販の (R)-(-)-2-アミノブタノール(482μl, 5.09 mmol)の溶液が140℃で12時間、加熱される。冷却した後、溶媒が蒸発される。集められた粗化合物がフラッシュクロマトグラフィー(EP/EtOAc 9:1から6:4へ)により精製されて、2(200 mg, 45%)を与える。フォーム(foam)。

【実施例3】
【0066】
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ [1,5-a]-1,3,5-トリアジン(2)
封をされたチューブ中で、化合物III.5 (103 mg, 0.24 mmol)が、トルエン(10 ml)中のトリ-n-ブチル(ピリジン-2-イル)スタンナン(177 mg, 0.48 mmol)及びPd(PPh3)4 (23 mg, 0.02 mmol)の脱ガスされた溶液に添加される。該脱ガスされた最終的な溶液が110℃で一晩加熱される。冷却及びNaHCO3の溶液による希釈の後、該溶液がCH2Cl2 (3×12 ml)により抽出される。分離された有機相が、NaClにより洗浄される。MgSO4上での乾燥後、溶媒が減圧下で蒸発される。残留物がフラッシュクロマトグラフィー(EP/EtOAc 9:1 to 6:4)により精製されて、2 (35 mg, 34%)を与える。フォーム(foam)。

【実施例4】
【0067】
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ [1,5-a]-1,3,5-トリアジンフマレート(3)
生成物2が、EtOH/Et2O中でフマル酸により処理される。該フマル酸塩3は、0℃で反応媒体から結晶化する。

【実施例5】
【0068】
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ [1,5-a]-1,3,5-トリアジン(4)

化合物2の調製を結果する同じ条件に従い、化合物4が、IIa.2から、硫黄原子の酸化反応そして次に市販の(S)-(+)-2-アミノブタノールの導入により調製される。収率=48%。フォーム(Foam)。

【実施例6】
【0069】
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ [1,5-a]-1,3,5-トリアジンフマレート (5)
生成物4が、EtOH/Et2O中でフマル酸により処理される。該フマル酸塩5は、反応媒体から結晶化する。

【実施例7】
【0070】
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ [1,5-a]-1,3,5-トリアジン(6)

化合物2の調製を結果する同じ条件に従い、化合物6が、IIa.3から、硫黄原子の酸化反応そして次に市販の(R)-(-)-2-アミノブタノールの導入により調製される。収率= 50%。オイル(Oil)。

【実施例8】
【0071】
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (6)

封をしたチューブ中で、化合物III.5 (180 mg, 0.41 mmol)が、トルエン(10 ml)中のチオフェン-3-イルボロン酸(79 mg, 0.62 mmol)、Pd(PPh3)4(47 mg, 0.04 mmol)、及び2 MのNaHCO3 (2 ml)の脱ガスされた溶液へ添加される。最終的な溶液が140℃で一晩加熱される。冷却及びH2Oによる希釈の後、該溶液がCH2Cl2 により抽出される(3×12 ml)。分離された有機相が、NaClの溶液により洗浄される。MgSO4上の乾燥後、溶媒が減圧下で蒸発される。残留物が、フラッシュクロマトグラフィー(EP/EtOAc 9:1から6:4へ)により精製されて、6(90 mg, 50%)を与える。オイル(oil)。

【実施例9】
【0072】
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン(7)

化合物2の調製を結果する同じ条件に従い、化合物6が、IIa.3から、硫黄原子の酸化反応そして次に市販の(S)-(+)-2-アミノブタノールの導入により調製される。収率= 49%。オイル(Oil)。

【実施例10】
【0073】
(S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (8)

化合物2の調製を結果する同じ条件に従い、化合物8が、IIa.2から、硫黄原子の酸化反応そして次に市販の(S)-3-アミノ-1,2-プロパンジオールの導入により調製される。収率= 20%。オイル(Oil)。

【実施例11】
【0074】
(S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンフマレート (9)
生成物8が、EtOH/Et2O溶液中でフマル酸により処理される。該フマル酸塩9は、反応媒体から結晶化する。

【実施例12】
【0075】
(R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (10)

化合物2の調製を結果する同じ条件に従い、化合物10が、IIa.2から、硫黄原子の酸化反応そして次に市販の(R)-3-アミノ-1,2-プロパンジオールの導入により調製される。収率= 35%。オイル(Oil)。

【実施例13】
【0076】
(R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンフマレート (11)
生成物10が、EtOH/Et2O溶液中でフマル酸により処理される。該フマル酸塩11は、反応媒体から結晶化する。

【実施例14】
【0077】
(2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (12)

化合物2の調製を結果する同じ条件に従い、化合物12が、IIa.2から、硫黄原子の酸化反応そして次にL-スレオニノールの導入により調製される。収率= 43%。オイル(Oil)。

【実施例15】
【0078】
(2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンフマレート (13)
生成物12が、EtOH/Et2O溶液中でフマル酸により処理される。該フマル酸塩13は、反応媒体から結晶化する。

【実施例16】
【0079】
(2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (14)

化合物2の調製を結果する同じ条件に従い、化合物12が、IIa.2から、硫黄原子の酸化反応そして次にD-スレオニノールの導入により調製される。収率= 42%。オイル(Oil)。

【実施例17】
【0080】
(2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンフマレート (15)
生成物14が、EtOH/Et2O溶液中でフマル酸により処理される。該フマル酸塩15は、反応媒体から結晶化する。

【実施例18】
【0081】
(2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (16)

化合物2の調製を結果する同じ条件に従い、化合物6が、IIa.3から、硫黄原子の酸化反応そして次に市販のL-スレオニノールの導入により調製される。収率= 40%。オイル(Oil)。

【実施例19】
【0082】
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (17)

化合物2の調製を結果する同じ条件に従い、化合物17が、IIa.2から、硫黄原子の酸化反応そして次にセリノールの導入により調製される。収率= 30%。オイル(Oil)。

【実施例20】
【0083】
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンフマレート(18)
生成物17が、EtOH/Et2O溶液中でフマル酸により処理される。該フマル酸塩18は、反応媒体から結晶化する。

【実施例21】
【0084】
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (19)

a. 8-イソプロピル-2-(メチルスルホキシル)-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (IVa)

この化合物は、以下のプロトコルに従い、メタ−クロロ過安息香酸により酸化される。277 mlのジクロロメタン中に溶解したIIa.4 (5.22 g, 13.3 mmol)の溶液が0℃に冷却され、そして次に、3.46gの80%メタ−クロロ過安息香酸がそこに添加される。1時間の撹拌後、混合物が炭酸ナトリウム溶液により洗浄される。生成物が濃縮により結晶化する。沈殿(IVa)が、少量のエーテルにより洗浄される。収率= 84%。

b. 2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (19)を得る
0.2 gのスルホキシド(IVa)が、140℃で4時間、0.36 g (3.9 mmol)の量のセリノール(2-アミノプロパン-1,3-ジオール)の存在下で、12時間140℃で加熱されて、生成物19を成し、これがエチルアセテート及びエチルエーテルの混合物から結晶化により単離される。収率= 75%。

【実施例22】
【0085】
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (20)

生成物20が、19と同じ条件下で、0.2 gのスルホキシドIVaの、0.368 mlの市販の (S)-(+)-2-アミノブタノールとの加熱により調製される。収率= 91%。

【実施例23】
【0086】
(2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (21)

a) 2-(メチルスルホキシル)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (IVb)

酸化が、IVa の調製についてと同様に、0℃で、4.76 gのIIa.5を、259.8 mlのCH2Cl2中で2 gのメタ−クロロ過安息香酸と一緒に撹拌することにより、実施される。スルホキシドIVbが87%の収率で得られる。

b) (2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (21)の調製
生成物21が、生成物20と同様に、140℃で、0.2 gのIVbを0.413 gの (2S,3S)-スレオニノールと一緒に加熱することにより調製される。冷却した後、生成物21が、エチルアセテートにより抽出され、そして、溶出液として100%エチルアセテートによりシリカカラムで精製される。収率= 82%。

【実施例24】
【0087】
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (22)

この生成物が、0.3 gのスルホキシドIVbを0.553 mlの市販の(S)-(+)-2-アミノブタノールと一緒に140℃で4時間加熱することにより得られる。4時間後、該生成物が、エチルアセテートによる抽出により単離され、そして、シリカカラム上で(溶出液:EtOAc/CH2Cl2 1:1)精製される。収率= 80%。

【実施例25】
【0088】
(2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (23)

この化合物は、スルホキシドIVbから、(2R,3R)-スレオニノールを用いて、前の実施例において用いられたものと同一のプロトコルに従い得られる。生成物23は、シリカカラムクロマトグラフィー(溶出液:EtOAc/CH2Cl28:2)により精製される。収率= 91%。

【実施例26】
【0089】
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (24)

この生成物は、スルホキシドIVbをセリノールと一緒に実施例23において記載された条件に従い加熱することにより調製される。該生成物は、シリカカラム上で(溶出液:EtOAc)精製される。収率= 78%。

【実施例27】
【0090】
(R)-2-[[8-イソプロピル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]-4-メチルペンタン-1-オール又は(R)-2-(1-ヒドロキシ-4-メチルペント-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (25)

この生成物は、スルホキシドIVa (0.2 g)をD-バリノール(0.406 g)と一緒に、実施例23において記載された条件に従い加熱することにより調製される。該生成物は、シリカカラム上で(溶出液: EtOAc/シクロヘキサン 1:1)精製される。収率= 76%。

【実施例28】
【0091】
(S)-2-[[8-イソプロピル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]-4-メチルペンタン-1-オール又は (S)-2-(1-ヒドロキシ-4-メチルペント-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (26)

この生成物は、スルホキシドIVa (0.2 g)をL-バリノール (0.406 g)と一緒に実施例23において記載された条件に従い加熱することにより調製される。該生成物は、シリカカラム上で (溶出液: EtOAc/シクロヘキサン 1:1)精製される。収率= 76%。

【実施例29】
【0092】
(S)-2-(1-ヒドロキシ-3,3-ジメチルブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (27)

a) 2-(メチルスルホキシル)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (IVc)

酸化が、IVbの調製についてと同様に、0℃で、4.76 gのIIa2を、259.8 mlのCH2Cl2中で2 gのメタ−クロロ過安息香酸と一緒に撹拌することにより実施される。収率= 90%。

b) 2-(1-ヒドロキシ-3,3-ジメチルブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (27)
誘導体27が、生成物IVc 0.2 gを0.512 gの(S)-tert-ロイシノールと一緒に140℃での4時間の加熱後に加熱することにより調製される。EtOAcによる抽出及び水による洗浄後、形成された生成物が、溶媒の濃縮により結晶化する。

【実施例30】
【0093】
(S)-2-(1-ヒドロキシ-3-メチルブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (28)

誘導体28が、実施例29におけるものと同様に、生成物IVcを(S)-(L)-バリノールと一緒に加熱することにより調製される。収率= 72%。

【実施例31】
【0094】
2-[4-[1-[8-イソプロピル-4-[[4-(ピリジン-2-イル)フェニル]メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン-2-イル]ピペリジン-4-イル]ピペリジン-1-イル]エタノール(29)

誘導体29が、実施例29におけるように、生成物IVcを、P. Leon, C. Garbay-Jaureguiberry, B. Lambert, J. B. Le Pecq, B. P. Roques. Asymmetrical bisintercalators as potential antitumor agents J. Med. Chem., 1988, 31 (5), pp 1021-1026、により記載されたビスピペリジン−エタノールと一緒に加熱することにより、調製される。
収率= 78%。

【実施例32】
【0095】
2-[4-[8-イソプロピル-4-[[4-(ピリジン-2-イル)フェニル]メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン-2-イル]ピペリジン-1-イル]エタノール (30)

生成物30が、実施例29におけるように、生成物IVcを、2-ピペラジニルエタノールと一緒に加熱することにより調製される。収率= 65%。

【実施例33】
【0096】
(R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (31)

生成物31は、Z Nie, C Perretta, Ph Erickson, S Margosiak, Ji Lu, A Averill, Rt Almassy, Shaosong hu. Structure-based design and synthesis of novel macrocyclic pyrazolo[1,5-a] [1,3,5]triazine compounds as potent inhibitors of protein kinase CK2 and their anticancer activities Bioorganic & Medicinal Chemistry Letters, Volume 18, Issue 2, 15 January 2008, Pages 619-623、により記載されたとおりに得られた中間体VIから調製される。
中間体VIIIはNMRにより特徴付けられる。

生成物31は、中間体VIIIを、140℃で、実施例23の条件下で、市販の(R)-3-アミノ-1,2-プロパンジオールと一緒に加熱することにより調製される。収率= 76%。

【実施例34】
【0097】
生成物31からのエステル33の調製

a)Boc-D-バリンによるエステル化
0.7 gのBoc-D-バリンと0.49 gのヒドロキシベンゾトリアゾール(HOBt)との10 mlのEtOAc中の溶液が、攪拌しながら0℃へ冷却される。0.763 gのジシクロヘキシルカルボジイミド(DCC)がこの溶液に添加される。その混合物が次に、2時間、周囲温度で攪拌され、そして次に、ろ過される。沈殿物(ジシクロヘキシルウレア)が、3mlのEtOAcによりリンスされる。ろ液は、テトラヒドロフラン(THF, 15 ml)中の0.73 gの31とトリエチルアミン(1.5 ml)との溶液へとすぐに添加される。混合物は、24時間、周囲温度(ambient temperature)で攪拌され、そして次に、真空下で濃縮され、そしてEtOAcにより溶解される。有機相が、クエン酸溶液により、そして次に、炭酸ナトリウム溶液により及び水により洗浄される。有機相は乾燥され、そして次に真空下で蒸発させられる。残留物が実質的に純粋なエステルを含み、これはシリカカラム上で精製されてもよい(溶出液: EtOAc/シクロヘキサン/THF/Et3N 45:50:4:1)。該エステル32は、75%の収率で得られる。このエステル化反応において、第2級アルコールも同様の条件下においてエステル化されうるが、第1級アルコールのエステルの専らの形成が、予期せずに観察される。
b)塩33を得る
エチルエーテル中の無水塩化水素酸(2 M)の溶液が、エチルエーテル中の溶液中のエステル32へ添加される。周囲温度での30分後、沈殿(33)が、ろ過され、エーテルにより洗浄され、そして、真空下で乾燥される。収率= 90%。

【実施例35】
【0098】
(S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (34)

この生成物は、そのエナンチオマー31(実施例34)のように調製される。アッセイされた4つのキナーゼについての試験において、誘導体34は、誘導体31よりも活性であると示される。
【実施例36】
【0099】
(S)-8-エチル-2-(1-ヒドロキシブト-2-イルアミノ)-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (35)

生成物31は、中間体VIIIを、140℃で、実施例23の条件下において、市販の(S)-(+)-2-アミノブタノールと一緒に加熱することにより調製される。

【実施例37】
【0100】
(R)-8-エチル-2-(1-ヒドロキシブト-2-イルアミノ)-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (36)
生成物36は、中間体VIIIを140℃で、実施例23の条件下で、市販の(R)-(-)-2-アミノブタノールと一緒に加熱することにより調製される。


【実施例38】
【0101】
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (37)

生成物37は、中間体VIIIを140℃で、実施例23の条件下で、セリノールと一緒に加熱することにより調製される。
【実施例39】
【0102】
2-[(2S)-1-[8-エチル-4-[[4-(ピリジン-2-イル)フェニル]メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン-2-イル]ピペリジン-2-イル]エタノール (38)

生成物38は、中間体VIIIを、140℃で、実施例23の条件下で、(S)-2-(ピペリジン-2-イル)エタノールと一緒に加熱することにより、調製される。収率= 75%。

【実施例40】
【0103】
2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル](2-ヒドロキシエチル)アミノ]エタノール (39)
生成物39は、中間体VIIIを140℃で、実施例23の条件下で、ジエタノールアミンと一緒に加熱することにより調製される。

収率= 78%。

【実施例41】
【0104】
(2R,3R)-2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]ブタン-1,3-ジオール (40)
生成物40は、中間体VIIIを、140℃で、実施例23の条件下で、L-スレオニノール(2R,3R-スレオニノール)と一緒に加熱することにより調製される。

収率= 78%。

【実施例42】
【0105】
(2S,3S)-2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]ブタン-1,3-ジオール (41)
生成物41は、中間体VIIIを、140℃で、実施例23の条件下で、D-スレオニノール(2S,3S-スレオニノール)と一緒に加熱することにより調製される。

収率= 75%。

【0106】
本明細書以下の表2は、本発明に従う式(I)の化合物のいくつかの例の化学的構造及び物理的特性を示す。この表において、
- Mp = 融点, ℃における、
- "Yld" は、収率(%)を意味する、
- MH+ = マススペクトロメトリー(m/z)、
- isoPr は、イソプロピル基である、
- Etは、エチル基である、
- 「塩」の欄において、「-」は、遊離塩基の形にある化合物を表し、一方で「fu」は、そのフマレートの形にある化合物を表す、
- (+) は、化合物が右旋性エナンチオマーであることを示し、(-)は、左旋性のエナンチオマーであることを示す。

【0107】
【表2】



【0108】
本発明に従う化合物が、プロテインキナーゼ活性に対するそれらの阻害効果を決定する為の薬理学的アッセイの対象であった。
【0109】
第一のシリーズの薬理学的アッセイに従い、該化合物が、本明細書以下に記載された方法論に従い7つのプロテインキナーゼについて試験された。
【0110】
特に、本発明に従う化合物の、CDK1、CDK2、CDK5、及びCDK9に対する阻害活性は一般に、0.050μm付近のIC50を示す(CDK1: 0.015-0.070 μM; CDK2: 0.012-0.060 μM; CDK5: 0.018-0.064 μM; CDK9: 0.030-0.091 μM)。CK1に対して、本発明の化合物は、0.06及び0.2μmの間のIC50を示す一方で、DYRK1A及びGSK-3に対して、IC50値は、それぞれ約0.5-2.0μM及び>2.8μMである。
【0111】
表IIIは、μmで報告されたIC50値についての結果を順に並べる。
【0112】
材料及び方法
【0113】
バッファー
【0114】
ホモジナイゼーションバッファー: 60 mMのβ-グリセロホスフェート、15 mMのp-ニトロフェニルホスフェート、25 mMのMops (pH 7.2)、15 mMのEGTA、15 mMのMgCl2、 1 mMのDTT、1 mMのバナジウム酸ナトリウム、1 mMのNaF、1 mMのフェニルホスフェート、10 μgロイペプチン/ml、10 μgアプロチニン/ml、10 μg大豆トリプシンインヒビター/ml、及び100 μM ベンズアミジン。
【0115】
バッファーA: 10 mMのMgCl2、1 mMのEGTA、1 mMのDTT、25 mMのTris-HCl pH 7.5、50μgヘパリン/ml。
【0116】
バッファーC: 60 mMのβ-グリセロホスフェート、15 mMのp-ニトロフェニルホスフェート、25 mMのMops (pH 7.2)、5 mMのEGTA、15 mMのMgCl2、 1 mMのDTT、1 mMのバナジウム酸ナトリウム、1 mMのフェニルホスフェート、10μgロイペプチン/ml、10μgアプロチニン/ml、及び100 μMベンズアミジン。
【0117】
キナーゼの調製及びアッセイ
【0118】
キナーゼが、バッファーA又はバッファーC中で、30℃で、15μMの最終ATP濃度でアッセイされた。ブランク値が差し引かれ、そして、活性が、10分のインキュベーション当たりに組み込まれたホスフェートのμmoleとして計算された。活性は、通常、最大の活性(すなわちインヒビターの不在下における)の%(百分率)として表される。対照は、ジメチルスルホキシドの適切な希釈により実施された。
【0119】
CDK1/cyclin B:は、M期ヒトデ(Marthasterias glacialis)卵母細胞からのホモジナイゼーションバッファーにおいて抽出され、そして、p9CKShs1により標識されたセファロースビーズに対するアフィニティークロマトグラフィーにより精製され、そこからそれが、遊離p9CKShs1により、以前にMeijer et al., (1997) "Biochemical and cellular effects of roscovitine, a potent and selective inhibitor of the cyclin-dependent kinases cdc2, cdk2 and cdk5", Eur. J. Biochem. 1997, 243, 527-536、において記載された通りに溶出された。キナーゼ活性は、バッファーC中で、1mgのヒストンH1/mlにより、15μMの[γ-33P] ATP (3000 Ci/mmol; 10 mCi/ml)の存在下で、30μlの最終量においてアッセイされた。30℃での30分間のインキュベーション後、25μlの上清のアリコートが、Whatman P81ホスホセルロースペーパーフィルター上にスポットされ、そして、20秒後、該フィルターが5回(それぞれの回で少なくとも5分間)、10mlのリン酸/1リットルの水の溶液中で洗浄された。該濡れたフィルターが、AmershamからのACSシンチレーション流体の存在下における計数に付された。
【0120】
CDK2/cyclin A (ヒト、組み換え、昆虫細胞において発現された)が、CDK1/cyclin Bについて記載されたとおりにアッセイされた。
【0121】
CDK5/p25は、E. coli中において発現された等量の組み換え哺乳類CDK5及びp25を混合することにより、GST(グルタチオン−S−トランスフェラーゼ)融合タンパク質として、再構成され、グルタチオン−アガロースに対するアフィニティクロマトグラフィーにより精製された(p25は、p35(35 kDaのCDK5アクチベーター)の切り取られたバージョンである)。その活性は、ヒストンH1により、バッファーC中で、CDK1/cyclin Bについて記載されたとおりにアッセイされた。
【0122】
CDK9/cyclin T (ヒト、組み換え、昆虫細胞において発現された)が、基質としてpRB フラグメント(a.a. 773-928) (3.5 μg/アッセイ)を用いたこと以外は、CDK1/cyclin Bについて記載されたとおりにアッセイされた。
【0123】
GSK-3α/β(ブタ脳、ネイティブ、アフィニティ精製された)が、バッファーAにおいて及びGSK-3について特異的な基質(GS-1: YRRAAVPPSPSLSRHSSPHQSpEDEEE) (Sp: serine phosphorylated)により行われた以外は、CDK1について記載されたとおりにアッセイされる(Bach S. et al. J Biol Chem 2005; 280:31208-19)。
【0124】
CK1δ/ε(ブタ脳、ネイティブ、アフィニティ精製された)が、CDK1について記載されたとおりに、CK1について特異的な基質、RRKHAAIGSpAYSITA (Reinhardt J. et al. Protein Expr & Purif 2007; 54:101-9)、によりアッセイされる。
【0125】
DYRK1A (ヒト、組み換え、E. coli中でGST融合タンパク質として発現された)が、グルタチオンアガロース上で精製され、CDK1/cyclin Bについて記載されたとおりに、基質としてのミエリン塩基性タンパク質(1 mg/ml)を用いてアッセイされた。
【0126】
【表3】

【0127】
薬理学的アッセイの第2のシリーズに従い、細胞に対する試験が、より特にはSH-SY5Y及びCLL株に対して、本明細書以下に記載された方法論に従い実施された。表IVは、μMにおけるIC50値における結果の例を順に並べる。
【0128】
材料及び方法
【0129】
A. SH-SY5Yヒト神経芽腫細胞
【0130】
化学的試薬
【0131】
MTS試薬を有するCell Titer 96(商標)キットが、Promega(Madison, WI, 米国)から購入された。プロテアーゼインヒビターカクテルが、Rocheから、そして、ウシ胎仔血清(FCS)がInvitrogenから入手された。掲載されていない試薬は、他に示されない限り、Sigmaから入手された。
【0132】
細胞株及び培養条件
【0133】
SH-SY5Yヒト神経芽腫細胞株が、Invitrogen (Cergy Pontoise, フランス)からのL-グルタミン、抗生物質、及びInvitrogenからの10体積%のFCSを有するDMEM培地中で増殖させられた。一般的な培養条件は、5%CO2の大気及び37℃の温度であった。培養プレート及び他のディスポーザブルプラスチックツールは、Corning (Corning, NY, 米国)により供給された。本発明の化合物による処理は、培養物に対して時間にわたる指数的増殖において及び示された濃度で実施された。対照実験もまた、DMSOの適切な希釈を用いて実施された。
【0134】
細胞生存能力の実証
【0135】
細胞生存能力が、3-(4,5-ジメチルチアゾール-2-イル)-5-(3-カルボキシメトキシフェニル)-2-(4-スルホフェニル)-2H-テトラゾリウム(MTS)の還元を測定することにより決定された。手順は、Ribas J. et al., 2004, "Cell differentiation, caspase inhibition, and macromolecular synthesis blockage, but not BCL-2 or BCL-XL proteins, protect SH-SYS5 cells from apoptosis triggered by two CDK inhibitory drugs", Exp. Cell Res, 2004, 195, 9-24、において詳細に記載されたとおりであった。
【0136】
B. ヒト慢性リンパ性白血病 (B-CLL) リンパ球
【0137】
患者及び細胞精製
【0138】
CLL細胞が、インフォームドコンセントの得られた後の未処置の患者のヘパリン化血から単離された。
【0139】
単核細胞が、Lymphosep密度勾配(Biowest)上での遠心により単離された。すべてのB−CLL試料は、4又は5のMatutesスコアを有した。B−CLLリンパ球のパーセンテージが、CD19-PE (クローンJ4,119) 及びCD5-PC5 (クローンBL1a)による標識化の後にフローサイトメトリーにより評価され、そして、細胞が、FACS(EPICS XL, Beckman Coulter, フランス)により分析された。CD19+/CD5+細胞のパーセンテージが、90%より少ない場合、Bリンパ球が、単球、NK細胞、顆粒球及びTリンパ球の免疫磁性的枯渇によるB細胞富化の為のキットII(Miltenyi Biotech)を用いて富化された。
【0140】
アポトーシス
【0141】
B−CLL細胞が、37℃で、10%のFCS (InVitrogen)を有するRPMI 1640培地(Lonza)中で、種々の濃度の本発明の化合物と一緒に培養(300 000 細胞/ウェル)された。インキュベーション後、B−CLL細胞が回収され、PBS中で洗浄され、そして、FITCが結合したアネキシンV及びよう化プロピジウムを有する100μlの1×バインディングバッファー(Beckman Coulter Apoptosis Detection Kit)中に再懸濁された。氷上での10分間のインキュベーション後、細胞が、フローサイトメトリーにより分析され、アポトーシスを受けている細胞のパーセンテージが決定された。
【0142】
本発明の化合物は概して、考慮下の2つの細胞株について、1μm未満のIC50を有する。
【0143】
【表4】

【0144】
それ故に、本発明に従う化合物は、医薬を調製する為に、特にはプロテインキナーゼに対する、及び、特にはサイクリン依存性キナーゼ(CDK)に対する、カゼインキナーゼ1(CK1)に対する、及びDYRKに対する、阻害活性を有する医薬を調製する為に用いられうる。
【0145】
すなわち、本発明の主題は、その局面の他に従い、式(I)の化合物、又は、該化合物の医薬的に許容できる酸との付加塩又は水和物若しくは溶媒和物を含む医薬である。
【0146】
これらの医薬は、治療において、特には種々の病理学的状態、例えばガン、慢性神経変性疾患、例えばアルツハイマー病若しくはパーキンソン病、急性神経変性疾患、例えば脳外傷、脳卒中、てんかん、肺炎症、関節炎、ウィルス感染(AIDS、ヘルペス)、疼痛治療、糖尿病、特には2型糖尿病、腎臓疾患、例えば多嚢胞性腎(renal polycystosis)又は糸球体腎炎、白血病、例えば慢性リンパ性白血病、特にはB細胞タイプのもの、又は寄生生物、例えばPlasmodium及びLeishmaniaなどの予防及び処置において、それらの用途を見出す。
【0147】
本発明の化合物は、最も特には、以下の疾患:ガン、慢性リンパ性白血病、アルツハイマー病、パーキンソン病、脳卒中、肺炎症、AIDS、多嚢胞性腎、糸球体腎炎、を予防及び/又は処置する為に有用である。
【0148】
その局面の他に従い、本発明は、活性成分として本発明に従う化合物を含む医薬組成物に関する。これらの医薬組成物は、有効投与量の本発明に従う少なくとも1つの化合物又は該化合物の医薬的に許容できる塩、水和物若しくは溶媒和物及び少なくとも1つの医薬的に許容できる添加物を含む。
【0149】
該添加物は、所望の医薬形態及び投与方法に従い、当技術分野の当業者に知られている通常の添加物から選ばれる。
【0150】
経口的、舌下の、皮下の、筋肉内の、静脈内の、局部的な、局所的な、気管内の、鼻腔内の、経皮的、又は直腸への投与の為の本発明の医薬組成物において、上記式(I)の活性成分又はその任意的な塩、水和物若しくは溶媒和物は、単位投与形態で、慣用の医薬的添加物と一緒の混合物として、ヒトに、上記で言及された異常又は疾患の予防又は処置の為に投与されうる。
【0151】
適切な単位投与形態は、経口投与の為の形態、例えばタブレット、ソフト若しくはハードゲルカプセル、パウダー、顆粒、及び経口溶液若しくは縣濁物、舌下への、頬への、気管内への、眼内及び鼻腔内への投与形態、吸入による投与形態、局所的、経皮的、皮下への、筋肉内への、又は静脈内への投与形態、直腸投与形態、及びインプラントを含む。
【0152】
経口投与により、1日当たりに投与される活性成分の投与量は、1又はそれより多い摂取において、1〜500 mg/kgに達しうる。
【0153】
より高い又はより低い投与量が適切である特定の場合がありうる;そのような投与量は、本発明の内容から離れない。通常の実践に従い、それぞれの患者にとって適切な投与量は、投与方法に従い及び該患者の体重及び応答に従い、医師により決定される。
【0154】
その局面の1つい従い、本発明は、式(I)、(Ia)、(Ib)、(Ic)、(Id)、(Ie)、(If)、又は(1)〜(38)の化合物、又はその医薬的に許容できる塩を、上記で言及された疾患の少なくとも1つ、及び特にはガンを処置することが意図された医薬の調製の為に使用する方法に関する。
【0155】
その局面の他に従い、本発明は、式(I)、(Ia)、(Ib)、(Ic)、(Id)、(Ie)、(If)、又は(1)〜(38)の化合物、又はその医薬的に許容できる塩であって、上記言及された疾患の少なくとも1つを処置及び予防することが意図された医薬として、及び特には抗ガン剤としてのそれらの使用の為の前記化合物又は塩に関する。
【0156】
その局面のさらに他に従い、本発明はまた、上記で示された病理学的状態を予防し及び/又は処置する為の方法に関し、これは患者に、本発明に従う化合物又はその医薬的に許容できる塩又は水和物又は溶媒和物の有効投与量の投与を含む。
【0157】
本発明に従う医薬組成物はまた、獣医学的分野における使用も見出し、及び、上記で言及された異常又は疾患の予防又は処置の為に動物、例えばイヌ及びネコなど、に投与されうる。
【特許請求の範囲】
【請求項1】
以下の式(I)の化合物又はその医薬的に許容できる塩、

ここで、
R1は、(C1-C6)アルキル基又は(C3-C6)シクロアルキル基であり、
R2は、(i)1〜3のヒドロキシル基により又は (ii)NRaRb基(Ra及びRbは独立に水素原子又は (C1-C3)アルキル基である)により置換されている、(C1-C6)アルキル基、(C3-C6)シクロアルキル基、(C1-C6)アルケニル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、
又は、R2は、1〜3のヒドロキシル基により置換されているピロリジニルメチル基であり、
該R2基は、-OCOR3基により置換されていてもよく、ここでR3は、天然の若しくは非天然のアミノ酸誘導体又は式(B)のピペリジル基であり、

ここで、
R4は、水素、ハロゲン原子、(C1-C3)アルキル基、ヒドロキシ(C1-C3)アルキル基、又は-NRaRb基(ここでRa及びRbは上で定義されたとおりである)であり、及び、R5は、水素、 (C1-C3)アルキル基、-N(Me)2基、ピペリジル基、又はモルホリニル基であり、
R9は、R2と同じものを意味し及び水素原子であってもよい、
あるいは、R2及びR9は一緒になって、それらと結合している窒素原子と一緒に、ピロリジニル基、ピペリジニル基、ピペラジニル基、及びピペリジニルピペリジニル基から選ばれるヘテロ環を成し、これらヘテロ環は、ヒドロキシル、(C1-C6)アルキル又は(C1-C6)アルコキシ(C1-C6)アルキルから選ばれる1〜3の基により置換されていてもよく、これらの後の2つの基は(i)1〜3のヒドロキシル基により又は(ii) NRaRb基により置換されており、ここでRa及びRbは独立に水素原子又は(C1-C3)アルキル基である、
X及びYは独立にフェニル基又はヘテロアリール基であり、該ヘテロアリール基及び該フェニル基は、(C1-C2)アルキル基、(C1-C2)アルコキシ基、ハロゲン原子、 (C1-C2)フルオロアルキル基、(C1-C2)フルオロアルコキシ基、ヒドロキシル基、-COOH基、-CONHR6基及び-NRaRb基から独立に選ばれる1又は2の基により置換されていてもよく、ここでRa及びRbは上で定義されたとおりである、
R6は、水素又は(C1-C3)アルキル基である、
該ヘテロアリール基は、チエニル基、ピリジル基、ピリミジニル基、チアゾリル基、ピロリル基、及びフラニル基から選ばれるものである。
【請求項2】
請求項1に記載された化合物又はそのエナンチオマーであって、
R3が、以下の式(a−1)〜(a−5)の一つであることにおいて特徴付けられ、

ここでBocはtert-ブトキシカルボニル基であり、Acはアセチル基である、
前記化合物又はエナンチオマー。
【請求項3】
請求項1又は2に記載された化合物であって、X基及びY基の少なくとも1つが置換されており且つ1又は2の置換基を有することにおいて特徴付けられ、該置換基が(C1-C2)アルキル基、(C1-C2)フルオロアルキル基、(C1-C2)アルコキシ基、(C1-C2)フルオロアルコキシ基、ハロゲン原子、ヒドロキシル基、及び-COOH基から選ばれるものである、前記化合物。
【請求項4】
請求項1〜3のいずれか1項に記載された化合物であって、
R2基が、以下の式の一つであること、


特にはR2基は、式(b−1)、(b−2)、(b−10)、(b−11)、(b−13)、(b−14)又は(b−15)の一つであることにおいて特徴付けられ、又はR2及びR9が一緒になって、それらと結合している窒素原子と一緒に、以下の式の一つ、

特には式(b−37)、(b−38)、(b−39)又は(b−40)の一つを成す、
前記化合物。
【請求項5】
請求項1〜4のいずれか1項に記載された化合物又はその医薬的に許容できる塩であって、
それが式(Ia)を有することにおいて特徴付けられ、

ここで:
R1は、請求項1で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2及びR9は独立に、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、 (C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、R9は水素原子であってもよく、及び有利にはR2は上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つであり、R9は水素原子である、
又はR2及びR9は一緒になって、それらと結合している窒素原子と一緒に、ピペリジン-1-イル又はピペリジン-4-イルピペリジン-1-イル基を成し、該基は、ヒドロキシル基により置換されている1〜3の(C1-C6)アルキル基により置換されており、及び有利にはR2及びR9は一緒になって、上記で定義されたとおりの式(b-37)、(b-38)、(b-39)、又は(b-40)の一つである、
R7及びR8は独立に、水素原子、(C1-C2)アルキル基、(C1-C2)フルオロアルキル基、 (C1-C2)アルコキシ基、(C1-C2)フルオロアルコキシ基、ハロゲン原子、ヒドロキシル基、又は-COOH基である、
Gは、-CH=又は-N=であり、且つ、
Gが-CH=である場合、該W基及びZ基は、同時に-CH=であるか、又は一方が-N=であり且つ他方が-CH=である、
Gが-N=である場合、W及びZは-CH=である、
前記化合物又はその塩。
【請求項6】
請求項1〜4のいずれか1項に記載された化合物又はその医薬的に許容できる塩であって、
それが式(Ib)を有することにおいて特徴付けられ、

ここで、
R1は、請求項1で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2、R7、及びR8は、請求項5で定義されたとおりである、
前記化合物又はその塩。
【請求項7】
請求項1〜4のいずれか1項に記載された化合物又はその医薬的に許容できる塩であって、
それが、式(Ic)を有することにおいて特徴付けられ、

ここで、
R1は、請求項1で定義されたとおりであり、及び有利にはエチル基又はイソプロピル基であり、
R9は水素原子であり、且つ、R2は、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には、上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つである、
又は代りにR2及びR9は一緒になって、それらと結合している窒素原子と一緒に、ピペリジン-1-イル又はピペリジン-4-イルピペリジン-1-イル基を成し、該基は、ヒドロキシル基により置換されている1〜3の(C1-C6)アルキル基により置換されており、及び有利にはR2及びR9は一緒になって、上記で定義されたとおりの式(b-37)、(b-38)、(b-39)、又は(b-40)の一つであり、且つ
R7及びR8は、請求項5において定義されたとおりである、
前記化合物又はその塩。
【請求項8】
請求項1〜4のいずれか1項に記載された化合物又はその医薬的に許容できる塩であって、
それが式(Id)を有することにおいて特徴付けられ、

ここで、
R1は、請求項1で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2及びR7は、請求項5で定義されたとおりである、
前記化合物又はその塩。
【請求項9】
請求項1〜4のいずれか1項に記載された化合物であって、
それが式(Ie)を有することにおいて特徴付けられ、

ここで、
R1は、請求項1で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2は、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には、上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つであり、
又は、それが式(If)を有することにおいて特徴付けられ、

ここで、
R1は、請求項1で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2は、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には、上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つである、
前記化合物。
【請求項10】
請求項1〜9のいずれか1項に記載された化合物又は医薬的に許容できる酸とのそれらの塩であって、該化合物が以下の1つから選ばれることにおいて特徴付けられる前記化合物又はそれらの塩、
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-(4-フェニルベンジルアミノ)ピラゾロ[1,5-a]-1,3,5-トリアジン (1)
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (2)
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (3)
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (4)
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (5)
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (6)
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (7)
(S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (8)
(S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (9)
(R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (10)
(R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (11)
(2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (12)
(2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (13)
(2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (14)
(2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (15)
(2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (16)
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (17)
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (18)
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (19)
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (20)
(2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (21)
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (22)
(2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (23)
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (24)
(R)-2-(1-ヒドロキシ-4-メチルペント-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (25)
(S)-2-(1-ヒドロキシ-4-メチルペント-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (26)
(S)-2-(1-ヒドロキシ-3,3-ジメチルブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (27)
(S)-2-(1-ヒドロキシ-3-メチルブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (28)
2-[4-[1-[8-イソプロピル-4-[[4-(ピリジン-2-イル)フェニル]メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン-2-イル]ピペリジン-4-イル]ピペリジン-1-イル]エタノール (29)
2-[4-[8-イソプロピル-4-[[4-(ピリジン-2-イル)フェニル]メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン-2-イル]ピペラジン-1-イル]エタノール (30)
(R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (31)
[(2R)-3-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]-2-ヒドロキシプロピル] (2R)-2-Bocアミノ-3-メチルブタノエート (32)
塩基又は塩の形にある、特にはジヒドロクロリドの形にある[(2R)-3-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]-2-ヒドロキシプロピル] (2R)-2-アミノ-3-メチルブタノエート (33)
(S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (34)
(S)-8-エチル-2-(1-ヒドロキシブト-2-イルアミノ)-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (35)
(R)-8-エチル-2-(1-ヒドロキシブト-2-イルアミノ)-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (36)
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (37)
2-[(2S)-1-[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]-2-ピペリジル]エタノール (38)
2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]-(2-ヒドロキシエチル)アミノ]エタノール (39)
(2R,3R)-2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]ブタン-1,3-ジオール (40)
(2S,3S)-2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]ブタン-1,3-ジオール (41)。
【請求項11】
請求項1〜10のいずれか1項に記載された式(I)の化合物を調製する為の方法であって、以下の式(IIa)の化合物(ここでX、Y及びR1は請求項1で定義されたとおりである)

がメタ−クロロ過安息香酸と酸化反応において反応させられること、及び、得られたスルホンが、100〜180℃の温度での、式NH-R2R9(ここでR2及びR9は請求項1で定義されたとおりである)の第1級アミンの存在下における求核置換反応において直接に用いられて、式(I)の化合物を生成することにおいて特徴付けられる、
又は、式(IIb)の化合物(ここでX及びR1は請求項1で定義されたとおりである)

が、金属、例えばパラジウム又はニッケル、と反応させられて、上記で定義されたとおりの式(IIa)の化合物を与えること、又は上記で定義されたとおりの式(IIb)の化合物が、メタ−クロロ過安息香酸と酸化反応において反応させられ、得られたスルホンが式NH-R2R9(ここでR2及びR9は請求項1で定義されたとおりである)の第1級アミンの存在下における求核置換反応において直接に用いられて、式(III)の化合物(ここでX1、R1及びR2は請求項1で定義されたとおりである)を与え、

これが、金属、例えばパラジウム又はニッケル、により触媒されるカップリング反応に付されて、式(I)の化合物を生成することにおいて特徴付けられる、
前記方法。
【請求項12】
式(II)の化合物であって、

X、Y及びR1が請求項1、2、又は3において定義されたとおりである、前記化合物。
【請求項13】
請求項1〜10のいずれか1項に記載された式(I)の化合物を含むことを特徴とする医薬。
【請求項14】
請求項1〜10のいずれか1項に記載された式(I)の化合物及び少なくとも1つの医薬的に許容できる添加物を含むことを特徴とする医薬組成物。
【請求項15】
請求項1〜10のいずれか1項に記載された式(I)の化合物であって、以下の疾患を処置し及び予防する為の医薬としてのその使用の為の前記化合物:
ガン、慢性神経変性疾患、例えばアルツハイマー病若しくはパーキンソン病、急性神経変性疾患、例えば脳外傷、脳卒中、てんかん、肺炎症、関節炎、ウィルス感染(AIDS、ヘルペス)、疼痛治療、糖尿病、特には2型糖尿病、腎臓疾患、例えば多嚢胞性腎又は糸球体腎炎、白血病、例えば慢性リンパ性白血病、特にはB細胞タイプのもの、又は寄生生物、例えばPlasmodium及びLeishmaniaなど。
【請求項1】
以下の式(I)の化合物又はその医薬的に許容できる塩、

ここで、
R1は、(C1-C6)アルキル基又は(C3-C6)シクロアルキル基であり、
R2は、(i)1〜3のヒドロキシル基により又は (ii)NRaRb基(Ra及びRbは独立に水素原子又は (C1-C3)アルキル基である)により置換されている、(C1-C6)アルキル基、(C3-C6)シクロアルキル基、(C1-C6)アルケニル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、
又は、R2は、1〜3のヒドロキシル基により置換されているピロリジニルメチル基であり、
該R2基は、-OCOR3基により置換されていてもよく、ここでR3は、天然の若しくは非天然のアミノ酸誘導体又は式(B)のピペリジル基であり、

ここで、
R4は、水素、ハロゲン原子、(C1-C3)アルキル基、ヒドロキシ(C1-C3)アルキル基、又は-NRaRb基(ここでRa及びRbは上で定義されたとおりである)であり、及び、R5は、水素、 (C1-C3)アルキル基、-N(Me)2基、ピペリジル基、又はモルホリニル基であり、
R9は、R2と同じものを意味し及び水素原子であってもよい、
あるいは、R2及びR9は一緒になって、それらと結合している窒素原子と一緒に、ピロリジニル基、ピペリジニル基、ピペラジニル基、及びピペリジニルピペリジニル基から選ばれるヘテロ環を成し、これらヘテロ環は、ヒドロキシル、(C1-C6)アルキル又は(C1-C6)アルコキシ(C1-C6)アルキルから選ばれる1〜3の基により置換されていてもよく、これらの後の2つの基は(i)1〜3のヒドロキシル基により又は(ii) NRaRb基により置換されており、ここでRa及びRbは独立に水素原子又は(C1-C3)アルキル基である、
X及びYは独立にフェニル基又はヘテロアリール基であり、該ヘテロアリール基及び該フェニル基は、(C1-C2)アルキル基、(C1-C2)アルコキシ基、ハロゲン原子、 (C1-C2)フルオロアルキル基、(C1-C2)フルオロアルコキシ基、ヒドロキシル基、-COOH基、-CONHR6基及び-NRaRb基から独立に選ばれる1又は2の基により置換されていてもよく、ここでRa及びRbは上で定義されたとおりである、
R6は、水素又は(C1-C3)アルキル基である、
該ヘテロアリール基は、チエニル基、ピリジル基、ピリミジニル基、チアゾリル基、ピロリル基、及びフラニル基から選ばれるものである。
【請求項2】
請求項1に記載された化合物又はそのエナンチオマーであって、
R3が、以下の式(a−1)〜(a−5)の一つであることにおいて特徴付けられ、

ここでBocはtert-ブトキシカルボニル基であり、Acはアセチル基である、
前記化合物又はエナンチオマー。
【請求項3】
請求項1又は2に記載された化合物であって、X基及びY基の少なくとも1つが置換されており且つ1又は2の置換基を有することにおいて特徴付けられ、該置換基が(C1-C2)アルキル基、(C1-C2)フルオロアルキル基、(C1-C2)アルコキシ基、(C1-C2)フルオロアルコキシ基、ハロゲン原子、ヒドロキシル基、及び-COOH基から選ばれるものである、前記化合物。
【請求項4】
請求項1〜3のいずれか1項に記載された化合物であって、
R2基が、以下の式の一つであること、


特にはR2基は、式(b−1)、(b−2)、(b−10)、(b−11)、(b−13)、(b−14)又は(b−15)の一つであることにおいて特徴付けられ、又はR2及びR9が一緒になって、それらと結合している窒素原子と一緒に、以下の式の一つ、

特には式(b−37)、(b−38)、(b−39)又は(b−40)の一つを成す、
前記化合物。
【請求項5】
請求項1〜4のいずれか1項に記載された化合物又はその医薬的に許容できる塩であって、
それが式(Ia)を有することにおいて特徴付けられ、

ここで:
R1は、請求項1で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2及びR9は独立に、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、 (C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、R9は水素原子であってもよく、及び有利にはR2は上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つであり、R9は水素原子である、
又はR2及びR9は一緒になって、それらと結合している窒素原子と一緒に、ピペリジン-1-イル又はピペリジン-4-イルピペリジン-1-イル基を成し、該基は、ヒドロキシル基により置換されている1〜3の(C1-C6)アルキル基により置換されており、及び有利にはR2及びR9は一緒になって、上記で定義されたとおりの式(b-37)、(b-38)、(b-39)、又は(b-40)の一つである、
R7及びR8は独立に、水素原子、(C1-C2)アルキル基、(C1-C2)フルオロアルキル基、 (C1-C2)アルコキシ基、(C1-C2)フルオロアルコキシ基、ハロゲン原子、ヒドロキシル基、又は-COOH基である、
Gは、-CH=又は-N=であり、且つ、
Gが-CH=である場合、該W基及びZ基は、同時に-CH=であるか、又は一方が-N=であり且つ他方が-CH=である、
Gが-N=である場合、W及びZは-CH=である、
前記化合物又はその塩。
【請求項6】
請求項1〜4のいずれか1項に記載された化合物又はその医薬的に許容できる塩であって、
それが式(Ib)を有することにおいて特徴付けられ、

ここで、
R1は、請求項1で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2、R7、及びR8は、請求項5で定義されたとおりである、
前記化合物又はその塩。
【請求項7】
請求項1〜4のいずれか1項に記載された化合物又はその医薬的に許容できる塩であって、
それが、式(Ic)を有することにおいて特徴付けられ、

ここで、
R1は、請求項1で定義されたとおりであり、及び有利にはエチル基又はイソプロピル基であり、
R9は水素原子であり、且つ、R2は、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には、上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つである、
又は代りにR2及びR9は一緒になって、それらと結合している窒素原子と一緒に、ピペリジン-1-イル又はピペリジン-4-イルピペリジン-1-イル基を成し、該基は、ヒドロキシル基により置換されている1〜3の(C1-C6)アルキル基により置換されており、及び有利にはR2及びR9は一緒になって、上記で定義されたとおりの式(b-37)、(b-38)、(b-39)、又は(b-40)の一つであり、且つ
R7及びR8は、請求項5において定義されたとおりである、
前記化合物又はその塩。
【請求項8】
請求項1〜4のいずれか1項に記載された化合物又はその医薬的に許容できる塩であって、
それが式(Id)を有することにおいて特徴付けられ、

ここで、
R1は、請求項1で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2及びR7は、請求項5で定義されたとおりである、
前記化合物又はその塩。
【請求項9】
請求項1〜4のいずれか1項に記載された化合物であって、
それが式(Ie)を有することにおいて特徴付けられ、

ここで、
R1は、請求項1で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2は、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には、上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つであり、
又は、それが式(If)を有することにおいて特徴付けられ、

ここで、
R1は、請求項1で定義されたとおりであり、及び有利にはイソプロピル基であり、
R2は、(C1-C6)アルキル基、(C1-C6)フルオロアルキル基、(C1-C3)フルオロアルコキシ基、又は(C1-C6)アルコキシ(C1-C6)アルキル基であり、該基は1〜3のヒドロキシル基により置換されており、及び有利には、上記で定義されたとおりの式(b-1)、(b-2)、(b-10)、(b-11)、(b-13)、(b-14)、又は(b-15)の一つである、
前記化合物。
【請求項10】
請求項1〜9のいずれか1項に記載された化合物又は医薬的に許容できる酸とのそれらの塩であって、該化合物が以下の1つから選ばれることにおいて特徴付けられる前記化合物又はそれらの塩、
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-(4-フェニルベンジルアミノ)ピラゾロ[1,5-a]-1,3,5-トリアジン (1)
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (2)
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (3)
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (4)
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (5)
(R)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (6)
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (7)
(S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (8)
(S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (9)
(R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (10)
(R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (11)
(2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (12)
(2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (13)
(2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (14)
(2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (15)
(2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(チオフェン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (16)
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (17)
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジンのフマル酸塩 (18)
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (19)
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-3-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (20)
(2S,3S)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (21)
(S)-2-(1-ヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (22)
(2R,3R)-2-(1,3-ジヒドロキシブト-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (23)
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (24)
(R)-2-(1-ヒドロキシ-4-メチルペント-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (25)
(S)-2-(1-ヒドロキシ-4-メチルペント-2-イルアミノ)-8-イソプロピル-4-[4-フェニル(ピリジン-3-イル)メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (26)
(S)-2-(1-ヒドロキシ-3,3-ジメチルブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (27)
(S)-2-(1-ヒドロキシ-3-メチルブト-2-イルアミノ)-8-イソプロピル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (28)
2-[4-[1-[8-イソプロピル-4-[[4-(ピリジン-2-イル)フェニル]メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン-2-イル]ピペリジン-4-イル]ピペリジン-1-イル]エタノール (29)
2-[4-[8-イソプロピル-4-[[4-(ピリジン-2-イル)フェニル]メチルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン-2-イル]ピペラジン-1-イル]エタノール (30)
(R)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (31)
[(2R)-3-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]-2-ヒドロキシプロピル] (2R)-2-Bocアミノ-3-メチルブタノエート (32)
塩基又は塩の形にある、特にはジヒドロクロリドの形にある[(2R)-3-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]-2-ヒドロキシプロピル] (2R)-2-アミノ-3-メチルブタノエート (33)
(S)-2-(1,2-ジヒドロキシプロパン-3-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (34)
(S)-8-エチル-2-(1-ヒドロキシブト-2-イルアミノ)-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (35)
(R)-8-エチル-2-(1-ヒドロキシブト-2-イルアミノ)-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (36)
2-(1,3-ジヒドロキシプロプ-2-イルアミノ)-8-エチル-4-[4-(ピリジン-2-イル)ベンジルアミノ]ピラゾロ[1,5-a]-1,3,5-トリアジン (37)
2-[(2S)-1-[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]-2-ピペリジル]エタノール (38)
2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]-(2-ヒドロキシエチル)アミノ]エタノール (39)
(2R,3R)-2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]ブタン-1,3-ジオール (40)
(2S,3S)-2-[[8-エチル-4-[[4-(2-ピリジル)フェニル]メチルアミノ]ピラゾロ[1,5-a][1,3,5]トリアジン-2-イル]アミノ]ブタン-1,3-ジオール (41)。
【請求項11】
請求項1〜10のいずれか1項に記載された式(I)の化合物を調製する為の方法であって、以下の式(IIa)の化合物(ここでX、Y及びR1は請求項1で定義されたとおりである)

がメタ−クロロ過安息香酸と酸化反応において反応させられること、及び、得られたスルホンが、100〜180℃の温度での、式NH-R2R9(ここでR2及びR9は請求項1で定義されたとおりである)の第1級アミンの存在下における求核置換反応において直接に用いられて、式(I)の化合物を生成することにおいて特徴付けられる、
又は、式(IIb)の化合物(ここでX及びR1は請求項1で定義されたとおりである)

が、金属、例えばパラジウム又はニッケル、と反応させられて、上記で定義されたとおりの式(IIa)の化合物を与えること、又は上記で定義されたとおりの式(IIb)の化合物が、メタ−クロロ過安息香酸と酸化反応において反応させられ、得られたスルホンが式NH-R2R9(ここでR2及びR9は請求項1で定義されたとおりである)の第1級アミンの存在下における求核置換反応において直接に用いられて、式(III)の化合物(ここでX1、R1及びR2は請求項1で定義されたとおりである)を与え、

これが、金属、例えばパラジウム又はニッケル、により触媒されるカップリング反応に付されて、式(I)の化合物を生成することにおいて特徴付けられる、
前記方法。
【請求項12】
式(II)の化合物であって、

X、Y及びR1が請求項1、2、又は3において定義されたとおりである、前記化合物。
【請求項13】
請求項1〜10のいずれか1項に記載された式(I)の化合物を含むことを特徴とする医薬。
【請求項14】
請求項1〜10のいずれか1項に記載された式(I)の化合物及び少なくとも1つの医薬的に許容できる添加物を含むことを特徴とする医薬組成物。
【請求項15】
請求項1〜10のいずれか1項に記載された式(I)の化合物であって、以下の疾患を処置し及び予防する為の医薬としてのその使用の為の前記化合物:
ガン、慢性神経変性疾患、例えばアルツハイマー病若しくはパーキンソン病、急性神経変性疾患、例えば脳外傷、脳卒中、てんかん、肺炎症、関節炎、ウィルス感染(AIDS、ヘルペス)、疼痛治療、糖尿病、特には2型糖尿病、腎臓疾患、例えば多嚢胞性腎又は糸球体腎炎、白血病、例えば慢性リンパ性白血病、特にはB細胞タイプのもの、又は寄生生物、例えばPlasmodium及びLeishmaniaなど。
【公表番号】特表2012−520288(P2012−520288A)
【公表日】平成24年9月6日(2012.9.6)
【国際特許分類】
【出願番号】特願2011−553591(P2011−553591)
【出願日】平成22年3月11日(2010.3.11)
【国際出願番号】PCT/IB2010/051063
【国際公開番号】WO2010/103486
【国際公開日】平成22年9月16日(2010.9.16)
【出願人】(500531141)セントレ・ナショナル・デ・ラ・レシェルシェ・サイエンティフィーク (84)
【出願人】(511214495)ユニヴェルシテ パリ デカルト (3)
【出願人】(500034033)ユニヴェルシテ・クロード・ベルナール・リヨン・プルミエ (2)
【出願人】(511142062)アンスティチュート ナショナル デ ラ サンテ エ デ ラ レシェルシュ メディカル(アンセルム) (3)
【Fターム(参考)】
【公表日】平成24年9月6日(2012.9.6)
【国際特許分類】
【出願日】平成22年3月11日(2010.3.11)
【国際出願番号】PCT/IB2010/051063
【国際公開番号】WO2010/103486
【国際公開日】平成22年9月16日(2010.9.16)
【出願人】(500531141)セントレ・ナショナル・デ・ラ・レシェルシェ・サイエンティフィーク (84)
【出願人】(511214495)ユニヴェルシテ パリ デカルト (3)
【出願人】(500034033)ユニヴェルシテ・クロード・ベルナール・リヨン・プルミエ (2)
【出願人】(511142062)アンスティチュート ナショナル デ ラ サンテ エ デ ラ レシェルシュ メディカル(アンセルム) (3)
【Fターム(参考)】
[ Back to top ]

