ピリミジン−5−カルボン酸誘導体の抗肥満剤としての新規用途
【課題】肥満症の治療に有用な医薬組成物の提供。
【解決手段】肥満症の予防または治療に用いるための医薬組成物であって、有効成分として、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸、または医薬上許容されるその塩もしくは溶媒和物を含んでなる、医薬組成物。
【解決手段】肥満症の予防または治療に用いるための医薬組成物であって、有効成分として、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸、または医薬上許容されるその塩もしくは溶媒和物を含んでなる、医薬組成物。
【発明の詳細な説明】
【発明の背景】
【0001】
発明の分野
本発明は、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸(化合物A)の抗肥満剤としての新規用途に関する。
【0002】
背景技術
肥満とは、脂肪細胞が増殖、肥大し、蓄積することである。近年の研究により、脂肪細胞は単に脂肪をため込んでいるエネルギー貯蔵庫ではなく、食欲、血圧、血糖、血流、免疫などを調節するホルモン様物質を分泌するなど、生理作用をもつことが明らかになっている。
【0003】
肥満は、原発性肥満(単純性肥満)と二次性肥満(症候性肥満)とに分類される。臨床的に肥満と判定されるものの大部分は原発性肥満である。その原因としては、エネルギーの過剰摂取、エネルギーの利用不足、放出熱量の低下などが挙げられる。一方で、二次性肥満は何らかの基礎疾患が原因となって生じる肥満であり、内分泌性肥満、視床下部性肥満、遺伝性肥満などが挙げられる。
【0004】
肥満は健康に対する危険因子であり、様々な疾患の原因となっている。とりわけ、肥満と糖尿病との間には強い相関関係があり、肥満になると10倍以上の高い確率で糖尿病を誘発する。肥満、特に内臓脂肪型肥満になると、大量に脂肪酸が血中に放出され、骨格筋や肝臓でエネルギー源としての糖利用が低下し、インスリンの効力が低下するインスリン抵抗性を招く。また、内臓脂肪型肥満では、インスリン感受性を上げるアディポネクチンが減少し、インスリン感受性を低下させるTNF−αが増加して、インスリン抵抗性が強くなる。従って、肥満になるとインスリンの必要量が増えることから、膵臓のβ細胞がインスリンを増産し、高インスリン血症をきたす。インスリンが一定量を超えると、レセプターの量が相対的に減少し、血糖の利用効率が落ちて高血糖を招き、血糖を正常にするためにさらにインスリン増産が続く。このインスリンの増産により、β細胞にも異常が起きてインスリン分泌も不足し、その結果として糖尿病が誘発される。
【0005】
また、近年先進国において重大な問題となっているメタボリックシンドロームの中心的な症状も肥満である。生活習慣、高脂肪食、運動不足により肥満が生じると、糖尿病、高脂血症、高血圧といった生活習慣病を生じやすくなる。さらに、これらの危険因子が合併すると、心筋梗塞、脳梗塞などの動脈硬化性疾患による死亡率は相乗的に増加する。
【0006】
また疫学研究により、メタボリックシンドロームの基盤病態として全身の軽度の炎症反応が指摘されている。肥満の状態では肥大した脂肪組織にマクロファージが浸潤し、脂肪細胞が活性化される。この活性化により脂肪組織は炎症反応を起こし、レプチン、レジスチン、アンジオテンシノーゲン、CRP、PAI−1、TNF−α、IL−1β、IL−6など、様々な炎症性メディエーターを産生する。これらの炎症性メディエーターがインスリン感受性や動脈硬化などのメタボリックシンドロームの病態形成に重要な役割を果たしている。
【0007】
すなわち、メタボリックシンドロームでは、内臓肥満やインスリン抵抗性を背景とし、リポ蛋白異常、高血圧、アディポサイトカイン、炎症反応の増悪等の病態が相互に影響し、動脈硬化性疾患の発症進展に寄与している。ゆえに、肥満を防ぐことがメタボリックシンドロームを予防する上で重要な要素となっている。
【0008】
肥満によって最も変化する組織は白色脂肪組織である。ゆえに、増殖、肥大し、様々なメディエーターを産生するようになった脂肪組織の性質を、正常な状態へ転換する作用を有する抗肥満剤の臨床開発への期待は大きい。
【0009】
2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸(以下「化合物A」という)は、糖尿病の予防または治療のために用いる医薬として合成されたものである(特許文献1:国際公開第00/66595号パンフレット)。化合物AはレチノイドX受容体(RXR)アゴニストとしての作用を有する(非特許文献1:Chem. Pharm. Bull. 48, 1504-1513, 2000)。
【0010】
レチノイドX受容体(RXR)は、主に核内に存在し、リガンド依存的に遺伝子の発現を制御する転写因子として働く核内受容体の一種である。レチノイドX受容体(RXR)は、ペルオキシソーム増殖剤活性化受容体(Peroxisome proliferator-activated receptor, PPAR)、肝X受容体(Liver X receptor, LXR)、ファルネソイドX受容体(Farnesoid X receptor, FXR)、レチン酸受容体(Retinoic Acid Receptor, RAR)、甲状腺ホルモン受容体(Thyroid Hormone Receptorm, TR)、ビタミンD受容体(Vitamin D Receptor, VDR)などの様々な受容体とヘテロ2量体を形成し、遺伝子の転写を調節している。
【0011】
レチノイドX受容体(RXR)ヘテロダイマーは、感受型と非感受型に分類されることが報告されている(非特許文献2:A.I.Shulman et. al, N Engl J Med 2005; 353; 604-15)。感受型には、RXRとPPAR、LXRおよびFXRとのヘテロダイマーがあり、これらはRXRアゴニストおよびそれぞれのパートナー受容体アゴニストのいずれによっても活性化される。一方で、非感受型には、RXRとVDR、TRなどとのヘテロダイマーがあり、それぞれのアゴニストによってのみ活性化される。
【0012】
レチノイドX受容体(RXR)と感受型ヘテロダイマーを形成するLXR、FXRおよびPPARは脂質を内在性リガンドとして作用する核内受容体であり、近年、メタボリックシンドロームとの関連が注目されている。
【0013】
特に、PPARγは脂肪細胞分化に必須の転写因子であり、白色脂肪組織において小型の脂肪細胞を増加させ、炎症性メディエーターの産生を抑制する。さらに肝での糖新生を抑制するとともに筋肉でのグルコース取り込みを活性化し、組織のインスリン感受性を亢進させる作用を有し、糖尿病治療のターゲットの一つとして注目されている。ロジグリタゾンやピオグリタゾンなどのチアゾリジン誘導体が抗糖尿病薬として現在臨床で用いられている。
【0014】
レチノイドX受容体(RXR)アゴニストはPPARγヘテロダイマーを活性化し、インスリン感受性を亢進させて抗糖尿病作用を示すことが報告されている(非特許文献3:Stumvoll et al., Horm. Res. 2001, 55:3-13)。
【0015】
一方で、PPARγアゴニストは脂肪細胞の分化促進により脂肪細胞数を著明に増加させ、また、脂肪蓄積を強力に促進するために、高脂肪食下では脂肪細胞が肥大し、肥満を助長する。
【0016】
化合物AはレチノイドX受容体(RXR)アゴニストとしての作用を有することから、PPARγアゴニストと同様にRXRとPPARγとのヘテロダイマーを活性化し、よってPPARγアゴニストと同様の効果が期待される。すなわち、化合物Aは、PPARγアゴニストと同様に、高脂肪食下において脂肪細胞を肥大させ、肥満を助長するものと予想される。
【0017】
レチノイドX受容体(RXR)に作用する他の化合物の投与によって抗肥満作用が得られたという文献上の報告はあるが(非特許文献4:Endocrinology 145:565-573, 2004; Metabolism 49:1610, 2000)、これは摂餌量の低下に伴う効果である。よって、RXRアゴニストが、摂餌量に影響されることなく抗肥満効果を示すことは報告されていない。
【0018】
【特許文献1】国際公開第00/66595号パンフレット
【非特許文献1】Chem. Pharm. Bull. 48, 1504-1513, 2000
【非特許文献2】A.I.Shulman et. al, N Engl J Med 2005; 353; 604-15
【非特許文献3】Stumvoll et al., Horm. Res. 2001, 55:3-13
【非特許文献4】Endocrinology 145:565-573, 2004; Metabolism 49:1610, 2000
【発明の概要】
【0019】
本発明者らは、驚くべきことに、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸(化合物A)が有用な抗肥満作用を有することを見出した。本発明は、この知見に基づくものである。
【0020】
従って、本発明の目的は、肥満症の治療に有用な医薬組成物を提供することにある。
【0021】
そして、本発明による医薬組成物は、肥満症の予防または治療に用いるための医薬組成物であって、有効成分として、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸、または医薬上許容されるその塩もしくは溶媒和物を含んでなるものである。
【0022】
本発明によれば、肥満症を効率的に治療することが可能となる。特に、本発明による肥満症の治療は、被験体が摂取する食物(特に高脂肪食)の量を制限する必要がないという有利な効果を有する。
【発明の具体的説明】
【0023】
本発明による医薬組成物の有効成分は、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸(以下「化合物A」という)である。この化合物は、その製造方法とともに国際公開第WO00/66595号パンフレットに開示されており、その構造式は以下に示すとおりである。
【0024】
【化1】

【0025】
化合物AはレチノイドX受容体(RXR)アゴニストであり、RXRとPPARγとのヘテロダイマーを活性化する作用を発揮する。しかし、PPARγ活性化剤とは異なり、高脂肪食による肥満を抑制するという新規な作用を有する。すなわち、化合物Aは、投与された被験体に対して、食物(特に高脂肪食)の摂取量を低下させることなく、強い抗肥満効果を発揮する。多くの肥満症患者にとって食物摂取量の制限は強いストレスとなることから、食物摂取量の制限が不要であることは特に有益である。
【0026】
上述の抗肥満効果に関連して、本明細書では、化合物Aが白色脂肪組織を小型化し、さらには白色脂肪組織における遺伝子発現を褐色脂肪組織に特徴的な型に変換することが実証されている。具体的には、化合物Aの作用として、白色脂肪細胞のサイズを低下させる作用、白色脂肪細胞による炎症性メディエーターの発現を抑制する作用、ならびに白色脂肪細胞によるエネルギー消費関連遺伝子の発現を増強する作用が実証されている。
【0027】
従って、本発明によれば、被験体において白色脂肪細胞のサイズを低下させるための医薬組成物、被験体において白色脂肪細胞による炎症性メディエーターの発現を抑制するための医薬組成物、ならびに被験体において白色脂肪細胞によるエネルギー消費関連遺伝子の発現を増強するための医薬組成物も提供される。これらの医薬組成物もまた、有効成分として化合物Aを含む。
【0028】
本明細書において「肥満症」とは、脂肪細胞が増殖し、肥大し、蓄積した病的な状態を意味する。肥満症には、一般に原発性肥満(単純性肥満)と二次性肥満(症候性肥満)とが含まれ、本発明においてはいずれの病態も治療の対象とされるが、好ましくは原発性肥満とされ、さらに好ましくは高脂肪食の摂取を原因とする肥満症とされる。
【0029】
本明細書において「炎症性メディエーター」とは、白色脂肪細胞により発現され、被験体の体内で炎症を引き起こす物質を意味する。このような物質は当技術分野において公知であり、本明細書において特に制限されるものではないが、好ましくはレプチン、TNFα、IL−6および/またはIL−1βとされる。
【0030】
本明細書において「エネルギー消費関連遺伝子」とは、白色脂肪細胞により発現され、被験体の体内におけるエネルギー消費に関与する遺伝子を意味する。このような遺伝子は当技術分野において公知であり、本明細書において特に制限されるものではないが、好ましくはアコニターゼ、アコニターゼ2(ミトコンドリア)、Cyp2e1、Cyp2f2、ヘキソキナーゼ、P450オキシドレダクターゼ、プロテインホスファターゼ1、NADHデヒドロゲナーゼ1α5サブコンプレックス、NADHデヒドロゲナーゼ1α7サブコンプレックス、NADHデヒドロゲナーゼ1β8サブコンプレックス、および/またはATPアーゼ遺伝子とされる。
【0031】
本明細書において「被験体」とは、体内に脂肪細胞または脂肪組織を有するいかなる動物をも意味し、特に制限されるものではないが、好ましくは哺乳動物とされ、さらに好ましくはヒトとされる。
【0032】
本発明に用いられる化合物Aは、医薬上許容される塩または溶媒和物の形態であってもよい。ここで「医薬上許容される」とは、化合物Aの塩または溶媒和物が被験体に投与されたときに、その被験体に対して毒性を示さず、その有効成分としての機能を保持していることを意味する。医薬上許容される塩としては、当技術分野において公知のいかなる塩を用いてもよく、例えば、ナトリウム塩、カリウム塩、マグネシウム塩、カルシウム塩などの金属塩、アンモニウム塩などの有機アミン塩等が挙げられる。医薬上許容される溶媒和物としては、当技術分野において公知のいかなる溶媒和物を用いてもよく、例えば、水和物、他の溶媒和物等が挙げられる。
【0033】
本発明による医薬組成物は、局所、静脈内、皮下、筋肉内、経口、直腸、粘膜など、様々な投与経路に適した剤型として製造することができる。本発明の好ましい実施態様によれば、本発明による医薬組成物は、経口投与のためのものとされる。経口投与のための医薬組成物としては、錠剤、粉剤、カプセル剤、発泡剤、液剤、トローチ剤など、当技術分野において公知のいかなる経口製剤としてもよい。あるいは、本発明による医薬組成物は、食品添加物として製剤化してもよく、化合物Aを含有する食品添加物は食物に添加することによって好適に被験体に摂取させることができる。
【0034】
本発明による医薬組成物は、医薬上許容される担体をさらに含んでもよい。ここで「医薬上許容される」とは、本発明による医薬組成物が被験体に投与されたときに、その被験体に対して毒性を示さず、有効成分である化合物Aの機能を阻害しないことを意味する。このような担体としては、ベヒクル、賦形剤、希釈剤等が挙げられ、投与経路などに応じて当業者により適宜選択される。
【0035】
本発明の他の態様によれば、被験体において、肥満症を予防または治療する方法、白色脂肪細胞のサイズを低下させる方法、白色脂肪細胞による炎症性メディエーターの発現を抑制する方法、ならびに白色脂肪細胞によるエネルギー消費関連遺伝子の発現を増強する方法が提供される。これらの方法は、有効な量の化合物Aまたは医薬上許容されるその塩もしくは溶媒和物を被験体に投与することを含んでなる。
【0036】
化合物Aは、局所、静脈内、皮下、筋肉内、経口、直腸、粘膜など、適切な経路で投与することができる。本発明の好ましい実施態様によれば、化合物Aは、錠剤、粉剤、カプセル剤、発泡剤、液剤、トローチ剤など、当技術分野において公知の経口製剤の形で被験体に経口投与される。あるいは、化合物Aは、食物に添加することによって好適に被験体に摂取させることができる。また、その治療上の有効量は、症状の重篤度、被検者の年齢、投与経路、投与の頻度などに従って、医師または獣医によって適宜決定される。一般的には、前記有効量は、一日当たり、約0.001〜約1000mg/体重kg、好ましくは約0.01〜約10mg/体重kg、より好ましくは約0.01〜約1mg/体重kgである。
【0037】
本発明の他の態様によれば、薬剤の製造における化合物Aまたは医薬上許容されるその塩もしくは溶媒和物の使用が提供される。この薬剤は、肥満症の予防または治療に用いるための薬剤、被験体において白色脂肪細胞のサイズを低下させるための薬剤、被験体において白色脂肪細胞による炎症性メディエーターの発現を抑制するための薬剤、または被験体において白色脂肪細胞によるエネルギー消費関連遺伝子の発現を増強するための薬剤である。
【実施例】
【0038】
以下、実施例を挙げて本発明をさらに具体的に説明するが、本発明はこれらに限定されるものではない。
【0039】
実施例1:2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸(化合物A)の製造
本実施例では、国際公開第00/66595号パンフレットに記載の方法に従って、化合物Aを製造した。
【0040】
(i)2−[N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸エチルの製造
2−クロロピリミジン−5−カルボン酸エチル 100mg、5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−アミン 108mg、およびK2CO3 400mgの混合物を110℃で加熱した。TLCで原料消失を確認した後、反応液を水にあけ、CH2Cl2で抽出した。有機層をNa2SO4で乾燥させ、溶媒を留去した。残渣をフラッシュシリカゲルカラムクロマトグラフィー(n−ヘキサン:AcOEt=20:1)にて精製し、2−[N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸エチルの白色結晶170mg(91%)を得た。
【0041】
Colorless cottons (n-hexane-AcOEt);
1H-NMR (400 MHz, CDCl3) δ 8.95 (s, 2H), 7.56 (br s, 1H), 7.44 (dd, J=2.4, 9.0 Hz, 1H), 7.44 (d, J=2.4 Hz, 1H), 7.31 (d, J=9.2 Hz, 1H), 4.37 (q, J=7.0 Hz, 2H), 1.69 (s, 4H), 1.39 (t, J=7.1 Hz, 3H), 1.30 (s, 6H), 1.28 (s, 6H).
【0042】
(ii)2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸エチルの製造
2−[N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸エチル 100mgをDMF 2mlに溶解させ、そこにNaH 30mgをDMF 1.5mlに懸濁させた懸濁液を添加した。得られた混合物に臭化シクロプロピルメチル 0.3mlを添加し、攪拌した。TLCで原料消失を確認した後、反応液を水にあけ、CH2Cl2で抽出した。有機層をNa2SO4で乾燥させ、溶媒を留去した。残渣をフラッシュシリカゲルカラムクロマトグラフィー(n−ヘキサン:AcOEt=20:1)にて精製し、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸エチル 63mg(55%)を得た。
【0043】
1H-NMR (400 MHz, CDCl3) δ 8.85 (s, 2H), 7.33 (d, J=8.4 Hz, 1H), 7.18 (d, J=2.2 Hz, 1H), 7.01 (dd, J=2.2, 8.3 Hz, 1H), 4.33 (q, J=7.2 Hz, 2H), 3.86 (d, J=7.0 Hz, 2H), 1.70 (s, 4H), 1.35 (t, J=7.0 Hz, 3H), 1.30 (s, 6H), 1.27 (s, 6H), 1.17 (br m, 1H), 0.46 (dd, J=5.9, 12.6 Hz, 2H), 0.19 (dd, J=5.0, 10 Hz, 2H).
【0044】
(iii)2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸の製造
2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸エチル 63mgをエタノール 4mlに溶解させ、20%KOH水溶液 0.5mlを添加して還流した。TLCで原料消失を確認した後、反応液を2N HClにあけ、酢酸エチルで抽出した。有機層をNa2SO4で乾燥させ、溶媒を留去して、標題化合物である2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸(化合物A)の白色粗結晶 55mg(85.5%)を得た。
【0045】
Colorless needles (n-hexane-AcOEt); mp 232℃;
1H-NMR (400 MHz, DMSO-d6) δ 8.73 (s, 2H), 7.36 (d, J=8.4 Hz, 1H), 7.22 (d, J=1.2 Hz, 1H), 7.02 (dd, J=1.2, 8.4 Hz, 1H), 3.84 (d, J=6.8 Hz, 2H), 1.67 (s, 4H), 1.28 (s, 6H), 1.24 (s, 6H), 1.18 (br m, 1H), 0.42 (dd, J=5.1, 13 Hz, 2H), 0.14 (dd, J=5.1, 10 Hz, 2H);
Anal. Calcd for C23H28N3O2・1/10H2O, C: 72.64%, H: 7.47%, N: 11.05%; Found C: 72.35%, H: 7.67%, N: 10.81%.
【0046】
実施例2:化合物AのRXRヘテロダイマー活性化能の評価
本実施例では、レポータージーンアッセイにより、化合物AのRXRヘテロダイマー活性化能を評価した。
【0047】
(1)使用したプラスミド
ヒトPPARγ発現ベクターおよびヒトRXRα発現ベクターは、ヒトPPARγおよびRXRαの完全長cDNAをPCRクローニングし、pcDNA3.1(Invitrogen)に挿入して作製した。PPAR応答領域(PPRE)を結合したホタルルシフェラーゼ遺伝子を有するレポーターコンストラクトは、2コピーのアシルCoAオキシダーゼのPPREをホタルルシフェラーゼtk−pGL3(Promega)に挿入して作製した(Suzuki S, et al., Arterioscler Thromb Vasc Biol 2004;24:519-525)。SV40が結合したLacZコントラストを有するコントロールプラスミドとして、pSV-beta-galactosidase control vector (Promega)を用いた。
【0048】
(2)試験方法
レポータージーンアッセイはCOS1細胞の一過性トランスフェクションによって行い、化合物AがヒトPPARγとヒトRXRαとのヘテロダイマーを活性化する能力を評価した。前日に48ウェルプレートに播種したCOS1細胞に、ポリフェクト(Polyfect; QIAGEN)を用いて、PPARγ発現ベクター、RXRα発現ベクター、核内受容体の応答領域が結合したホタルルシフェラーゼ遺伝子を有するレポーターコンストラクト、およびSV40が結合したLacZコンストラクトを有するコントロールプラスミドをトランスフェクトした。3時間後、細胞を洗浄し、PPARγのアゴニストであるトログリタゾン(troglitazone)1nMおよび化合物Aを含む脂肪酸フリーのBSA0.1%含有培地を添加し、24時間インキュベートした。細胞を回収し、核内受容体活性化をルシフェラーゼアッセイシステムおよびクロロフェノールレッドβガラクトピラノシド(CRPG)の加水分解によるβガラクトシダーゼ活性により定量した。転写活性は、次の式:
(真の転写活性)=(ルシフェラーゼ活性測定値)/(βガラクトシダーゼ活性測定値)
に従って評価した。
【0049】
(3)結果
図1に示したように、RXRアゴニストである化合物Aは、単独で濃度依存的にPPARγを活性化した。また、単独ではほとんど作用を有さない少量(1nM)のPPARγ合成アゴニスト(トログリタゾン)との共存下では、化合物AはPPARγアゴニストの作用を相乗的に増大させた。このように、化合物AはPPARγを活性化し、PPARγアゴニストの作用も増大させることが明らかとなった。
【0050】
実施例3:化合物Aの抗動脈硬化作用および抗肥満作用の検討
本実施例では、高脂血症および動脈硬化を自然発症するApoEノックアウトマウスを用い、以下の方法に従って化合物Aの抗動脈硬化作用および抗肥満作用を検討した。
【0051】
(1)試験方法
(i)動物
雄性ApoEノックアウトマウス(C57BL/6J−ApoE Jackson Laboratory)および雄性C57BL/6Crマウス(日本SLC)を通常の飼育条件下で飼育し、8週齢となった個体を試験に用いた。餌として、高脂肪食(リサーチダイエット社)を与えた。
【0052】
(ii)化合物Aの投与方法・期間
化合物Aは、30mg/kg/dayとなるように粉末餌(高脂肪食)に混餌し、ApoEノックアウトマウスに経口投与した(薬物処置群9例)。第一対照群(薬物未投与群)は、粉末餌(高脂肪食)単独で飼育したマウス(10例)とし、第二対照群(薬物未投与群)は通常の粉末餌で飼育したマウス(5例)とした。それぞれの群に含まれる全てのマウスを、10週間(18週齢まで)継続して飼育した。週に一度、体重および摂餌量を測定し、1週、4週および10週後に血液および臓器を摘出し、各種実験を行った。
【0053】
酸素消費量の実験には雄性C57BL/6Crマウスを用いた。化合物Aは、30mg/kg/dayとなるように粉末餌(高脂肪食)に混餌し、経口投与した(薬物処置群6例)。対照群(薬物未投与群)は、粉末餌(高脂肪食)単独で飼育したマウス(6例)とした。それぞれの群に含まれる全てのマウスを、12週間(20週齢まで)継続して飼育した。週に一度、体重および摂餌量を測定した。
【0054】
(iii)観察および検査方法
A.血中ケミカルメディエーター濃度
最終投与終了後、マウスを絶食させた。翌朝、エーテル麻酔下で頚椎脱臼によりマウスを安楽死させ、開腹して腹部大静脈を露出させ、0.5〜1.0mlの血液を採取した。採取した血液を3000rpmで15分間遠心分離して血漿を分取した。
【0055】
血漿中のレプチンおよびアディポネクチン値はELISAによって検出した。レプチンの測定には、マウスレプチン測定キット((株)森永生科学研究所)を用いた。アディポネクチンの測定には、マウス/ラットアディポネクチンELISAキット(大塚製薬(株))を用いた。
【0056】
B.組織学的評価
a.脂肪組織の観察
採血後、白色脂肪を摘出し、総重量を測定した後、一部を凍結切片用に包埋した。連続切片を作製し、スライドグラスに接着後、速やかにPFA固定し、洗浄後、ヘマトキシリンエオジン染色を行った。
【0057】
b.脂肪組織のmRNA変化解析(リアルタイムPCR)
採血後、白色脂肪を採取し、RNAeasy mini kit(QIAGEN)を用いて全RNAを抽出した。特定遺伝子の発現をリアルタイムRT−PCRで測定した。この実験には、標的遺伝子特異的なTaqmanプライマープローブセットとして、以下の配列を有するオリゴヌクレオチドを用いた。データはすべて18Sの値で補正した。
【0058】
脱共役プロテインUCP1:
フォワードプライマー:5'-AAGCTGTGCGATGTCCATGTAC-3'(配列番号1);
リバースプライマー:5'-AGAAGCCACAAACCCTTTGAAA-3'(配列番号2);
TaqManプローブ:5'-CCAAGGAAGGACCGACGGCCT-3'(配列番号3)。
【0059】
アドレナリンβ3受容体(ARbeta3):
フォワードプライマー:5'-CCCAGCCAGCCCTGTTG-3'(配列番号4);
リバースプライマー:5'-GCACCTTCATAGCCATCAAACC-3'(配列番号5);
TaqManプローブ:5'-CCAGGCAGAGTCCACCGCTCAAC-3'(配列番号6)。
【0060】
c.脂肪組織のmRNA変化解析(DNAチップ)
採血後、白色脂肪を採取し、RNAeasy mini kit(QIAGEN)を用いて全RNAを抽出した。マウスDNAチップ(U74AVS)を用いて、対照群および薬物処置群のそれぞれ3例についてチップ解析を行い、t検定により有意に2倍の変動がある遺伝子を抽出し、Ontology解析を行った。
【0061】
(iv)マウスの酸素消費量(VO2)測定
化合物Aを30mg/kg/dayで12週間経口投与したマウス(薬物処置群6例)および対照群のマウス(薬物未投与群6例)の酸素消費量は、小動物用代謝計測システムMK-5000RQ(MUROMACHI KIKAI CO., LTD.)を用いて測定した。安静期の2時間の平均酸素消費量VO2(酸素消費値/マウスの体重)を計算した。
【0062】
(v)統計学的解析およびデータ処理法
得られた結果は平均値±標準誤差で示した。対照群と薬物処置群の有意差検定はt検定および多重検定によって行った。
【0063】
(2)結果
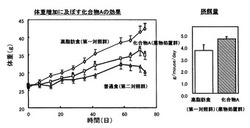
図2に各群の体重変化のグラフを示す。高脂肪食を与えた第一対照群のマウスでは、普通食を与えた第二対照群のマウスと比較して体重が増大した。これに対し、高脂肪食に化合物Aを混餌して与えた薬物処置群のマウスでは、第一対照群のマウスと比較して強く体重が抑制された。また、図2右側の摂餌量のグラフから、この体重抑制効果が摂餌量による変化ではないことも示された。
【0064】
図3に、薬物処置群(T)、第一対照群(Cont1)、および第二対照群(Cont2)における白色脂肪の重量、レプチン値およびアディポネクチン値を示す。精巣周辺の白色脂肪組織の量を計量すると、薬物処置群において著名な脂肪量の減少が認められ、化合物Aに抗肥満効果があることが明らかとなった。脂肪細胞から分泌されるレプチンの量は、薬物処置群で低値となった。一方、小型脂肪細胞から分泌され、肥満の際には減少するアディポネクチン値は変化しなかった。
【0065】
図4に、ヘマトキシリンエオジン染色した白色脂肪組織の顕微鏡写真を示す。第一対照群では脂肪滴がたまり、細胞が肥大しているが、薬物処置群では脂肪細胞が小型化していることが観察された。
【0066】
図5のパネルAには、アドレナリンβ3受容体(ARbeta3)mRNA発現に及ぼす化合物Aの作用を示す。アドレナリンβ3受容体は主として白色脂肪細胞および褐色脂肪細胞に存在し、アドレナリン刺激によって白色脂肪の分解および褐色脂肪細胞での熱産生を促進する。β3受容体の異常は、エネルギー代謝を抑制し、肥満となる可能性が高いことが指摘されている。白色脂肪組織のアドレナリンβ3受容体mRNAが化合物A処置によって増大することが明らかとなった。
【0067】
図5のパネルBには、脱共役プロテインUCP1mRNA発現に及ぼす化合物Aの作用を示す。UCP1は、褐色脂肪組織に特異的に存在する脱共役プロテインであり、ミトコンドリアの酸化的リン酸化を脱共役させてエネルギーを熱として発散させるため、肥満のターゲット分子として注目されている。通常は白色脂肪組織にないUCP1mRNAが化合物A処置によって増大することが明らかとなった。
【0068】
表1および表2には、白色脂肪組織において化合物Aの作用により変動する遺伝子群のDNAチップ解析の結果を示す。これらの表では、対照群および薬物処置群のそれぞれ3例ずつについてチップ解析を行い、t検定により有意に2倍の変動がある遺伝子の一部をリストアップしている。
【0069】
【表1】

【0070】
【表2】

【0071】
表1および表2によれば、ATP合成酵素やNAD脱水素酵素など、エネルギー産生系の遺伝子群が化合物Aの作用によって全般的に増大している。さらに、ミトコンドリア内膜の構成成分の特異的遺伝子群が発現増大しており、化合物Aにより、白色脂肪組織において褐色脂肪組織に多いミトコンドリアが増大していることが示された。
【0072】
以上のように、化合物Aは白色脂肪細胞を小型化する。さらに、化合物Aは、白色脂肪組織にアドレナリンβ3受容体やUCP1遺伝子、エネルギー産生系遺伝子群や、ミトコンドリア特異的遺伝子を発現誘導する。すなわち、化合物Aは、白色脂肪組織において褐色脂肪組織に特徴的な遺伝子発現を増大させるという特徴的な作用を発揮することが示された。
【0073】
脂肪組織は様々なアディポサイトカインを分泌し、その産生異常が動脈硬化巣の病変悪化をもたらしている。アディポサイトカインの中には炎症性のサイトカインが多く含まれ、これらは血液中の単球を遊走させ、血管内皮に接着させてマクロファージ化し、動脈硬化巣の形成に関与することが報告されている。
【0074】
図6に、薬物処置群(T)、第一対照群(Cont1)、および第二対照群(Cont2)の脂肪組織における炎症性サイトカインmRNA発現を示す。薬物処置群では、脂肪組織のTNFα(TNF alpha)、IL−6およびIL−1β(IL−1 beta)のmRNA発現が強く抑制された。
【0075】
図7に薬物処置群および対照群の酸素消費量を示す。薬物処置群において、20%程度の有意な酸素消費量の増大が示された。
【0076】
以上のように、化合物Aは白色脂肪組織における炎症性メディエーター発現を抑制する。また、化合物Aは脂肪細胞を小型化する。さらに、化合物Aは、白色脂肪組織にエネルギー消費関連遺伝子発現誘導を引き起こす特徴的な作用により、エネルギー消費を増大する。従って、化合物Aは効果的な抗肥満剤として有用である。
【図面の簡単な説明】
【0077】
【図1】図1は、化合物AのPPARγ活性に及ぼす効果を示すグラフである。
【図2】図2は、化合物Aがマウスの体重抑制および摂餌量に及ぼす効果を示すグラフである。
【図3】図3は、化合物Aが白色脂肪組織量に及ぼす効果、ならびに血中のレプチン濃度およびアディポネクチン濃度に及ぼす効果を示すグラフである。
【図4】図4は、薬物処置群および第一対照群のマウスから得られた白色脂肪組織のHE染色像を示す顕微鏡写真である。
【図5】図5は、化合物Aが白色脂肪組織におけるADRβ3およびUCP1のmRNA発現に及ぼす効果を示すグラフである。
【図6】図6は、化合物Aが脂肪組織のサイトカインmRNA発現に及ぼす効果を示すグラフである。
【図7】図7は、化合物Aがマウスの酸素消費量に及ぼす効果を示すグラフである。
【発明の背景】
【0001】
発明の分野
本発明は、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸(化合物A)の抗肥満剤としての新規用途に関する。
【0002】
背景技術
肥満とは、脂肪細胞が増殖、肥大し、蓄積することである。近年の研究により、脂肪細胞は単に脂肪をため込んでいるエネルギー貯蔵庫ではなく、食欲、血圧、血糖、血流、免疫などを調節するホルモン様物質を分泌するなど、生理作用をもつことが明らかになっている。
【0003】
肥満は、原発性肥満(単純性肥満)と二次性肥満(症候性肥満)とに分類される。臨床的に肥満と判定されるものの大部分は原発性肥満である。その原因としては、エネルギーの過剰摂取、エネルギーの利用不足、放出熱量の低下などが挙げられる。一方で、二次性肥満は何らかの基礎疾患が原因となって生じる肥満であり、内分泌性肥満、視床下部性肥満、遺伝性肥満などが挙げられる。
【0004】
肥満は健康に対する危険因子であり、様々な疾患の原因となっている。とりわけ、肥満と糖尿病との間には強い相関関係があり、肥満になると10倍以上の高い確率で糖尿病を誘発する。肥満、特に内臓脂肪型肥満になると、大量に脂肪酸が血中に放出され、骨格筋や肝臓でエネルギー源としての糖利用が低下し、インスリンの効力が低下するインスリン抵抗性を招く。また、内臓脂肪型肥満では、インスリン感受性を上げるアディポネクチンが減少し、インスリン感受性を低下させるTNF−αが増加して、インスリン抵抗性が強くなる。従って、肥満になるとインスリンの必要量が増えることから、膵臓のβ細胞がインスリンを増産し、高インスリン血症をきたす。インスリンが一定量を超えると、レセプターの量が相対的に減少し、血糖の利用効率が落ちて高血糖を招き、血糖を正常にするためにさらにインスリン増産が続く。このインスリンの増産により、β細胞にも異常が起きてインスリン分泌も不足し、その結果として糖尿病が誘発される。
【0005】
また、近年先進国において重大な問題となっているメタボリックシンドロームの中心的な症状も肥満である。生活習慣、高脂肪食、運動不足により肥満が生じると、糖尿病、高脂血症、高血圧といった生活習慣病を生じやすくなる。さらに、これらの危険因子が合併すると、心筋梗塞、脳梗塞などの動脈硬化性疾患による死亡率は相乗的に増加する。
【0006】
また疫学研究により、メタボリックシンドロームの基盤病態として全身の軽度の炎症反応が指摘されている。肥満の状態では肥大した脂肪組織にマクロファージが浸潤し、脂肪細胞が活性化される。この活性化により脂肪組織は炎症反応を起こし、レプチン、レジスチン、アンジオテンシノーゲン、CRP、PAI−1、TNF−α、IL−1β、IL−6など、様々な炎症性メディエーターを産生する。これらの炎症性メディエーターがインスリン感受性や動脈硬化などのメタボリックシンドロームの病態形成に重要な役割を果たしている。
【0007】
すなわち、メタボリックシンドロームでは、内臓肥満やインスリン抵抗性を背景とし、リポ蛋白異常、高血圧、アディポサイトカイン、炎症反応の増悪等の病態が相互に影響し、動脈硬化性疾患の発症進展に寄与している。ゆえに、肥満を防ぐことがメタボリックシンドロームを予防する上で重要な要素となっている。
【0008】
肥満によって最も変化する組織は白色脂肪組織である。ゆえに、増殖、肥大し、様々なメディエーターを産生するようになった脂肪組織の性質を、正常な状態へ転換する作用を有する抗肥満剤の臨床開発への期待は大きい。
【0009】
2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸(以下「化合物A」という)は、糖尿病の予防または治療のために用いる医薬として合成されたものである(特許文献1:国際公開第00/66595号パンフレット)。化合物AはレチノイドX受容体(RXR)アゴニストとしての作用を有する(非特許文献1:Chem. Pharm. Bull. 48, 1504-1513, 2000)。
【0010】
レチノイドX受容体(RXR)は、主に核内に存在し、リガンド依存的に遺伝子の発現を制御する転写因子として働く核内受容体の一種である。レチノイドX受容体(RXR)は、ペルオキシソーム増殖剤活性化受容体(Peroxisome proliferator-activated receptor, PPAR)、肝X受容体(Liver X receptor, LXR)、ファルネソイドX受容体(Farnesoid X receptor, FXR)、レチン酸受容体(Retinoic Acid Receptor, RAR)、甲状腺ホルモン受容体(Thyroid Hormone Receptorm, TR)、ビタミンD受容体(Vitamin D Receptor, VDR)などの様々な受容体とヘテロ2量体を形成し、遺伝子の転写を調節している。
【0011】
レチノイドX受容体(RXR)ヘテロダイマーは、感受型と非感受型に分類されることが報告されている(非特許文献2:A.I.Shulman et. al, N Engl J Med 2005; 353; 604-15)。感受型には、RXRとPPAR、LXRおよびFXRとのヘテロダイマーがあり、これらはRXRアゴニストおよびそれぞれのパートナー受容体アゴニストのいずれによっても活性化される。一方で、非感受型には、RXRとVDR、TRなどとのヘテロダイマーがあり、それぞれのアゴニストによってのみ活性化される。
【0012】
レチノイドX受容体(RXR)と感受型ヘテロダイマーを形成するLXR、FXRおよびPPARは脂質を内在性リガンドとして作用する核内受容体であり、近年、メタボリックシンドロームとの関連が注目されている。
【0013】
特に、PPARγは脂肪細胞分化に必須の転写因子であり、白色脂肪組織において小型の脂肪細胞を増加させ、炎症性メディエーターの産生を抑制する。さらに肝での糖新生を抑制するとともに筋肉でのグルコース取り込みを活性化し、組織のインスリン感受性を亢進させる作用を有し、糖尿病治療のターゲットの一つとして注目されている。ロジグリタゾンやピオグリタゾンなどのチアゾリジン誘導体が抗糖尿病薬として現在臨床で用いられている。
【0014】
レチノイドX受容体(RXR)アゴニストはPPARγヘテロダイマーを活性化し、インスリン感受性を亢進させて抗糖尿病作用を示すことが報告されている(非特許文献3:Stumvoll et al., Horm. Res. 2001, 55:3-13)。
【0015】
一方で、PPARγアゴニストは脂肪細胞の分化促進により脂肪細胞数を著明に増加させ、また、脂肪蓄積を強力に促進するために、高脂肪食下では脂肪細胞が肥大し、肥満を助長する。
【0016】
化合物AはレチノイドX受容体(RXR)アゴニストとしての作用を有することから、PPARγアゴニストと同様にRXRとPPARγとのヘテロダイマーを活性化し、よってPPARγアゴニストと同様の効果が期待される。すなわち、化合物Aは、PPARγアゴニストと同様に、高脂肪食下において脂肪細胞を肥大させ、肥満を助長するものと予想される。
【0017】
レチノイドX受容体(RXR)に作用する他の化合物の投与によって抗肥満作用が得られたという文献上の報告はあるが(非特許文献4:Endocrinology 145:565-573, 2004; Metabolism 49:1610, 2000)、これは摂餌量の低下に伴う効果である。よって、RXRアゴニストが、摂餌量に影響されることなく抗肥満効果を示すことは報告されていない。
【0018】
【特許文献1】国際公開第00/66595号パンフレット
【非特許文献1】Chem. Pharm. Bull. 48, 1504-1513, 2000
【非特許文献2】A.I.Shulman et. al, N Engl J Med 2005; 353; 604-15
【非特許文献3】Stumvoll et al., Horm. Res. 2001, 55:3-13
【非特許文献4】Endocrinology 145:565-573, 2004; Metabolism 49:1610, 2000
【発明の概要】
【0019】
本発明者らは、驚くべきことに、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸(化合物A)が有用な抗肥満作用を有することを見出した。本発明は、この知見に基づくものである。
【0020】
従って、本発明の目的は、肥満症の治療に有用な医薬組成物を提供することにある。
【0021】
そして、本発明による医薬組成物は、肥満症の予防または治療に用いるための医薬組成物であって、有効成分として、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸、または医薬上許容されるその塩もしくは溶媒和物を含んでなるものである。
【0022】
本発明によれば、肥満症を効率的に治療することが可能となる。特に、本発明による肥満症の治療は、被験体が摂取する食物(特に高脂肪食)の量を制限する必要がないという有利な効果を有する。
【発明の具体的説明】
【0023】
本発明による医薬組成物の有効成分は、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸(以下「化合物A」という)である。この化合物は、その製造方法とともに国際公開第WO00/66595号パンフレットに開示されており、その構造式は以下に示すとおりである。
【0024】
【化1】

【0025】
化合物AはレチノイドX受容体(RXR)アゴニストであり、RXRとPPARγとのヘテロダイマーを活性化する作用を発揮する。しかし、PPARγ活性化剤とは異なり、高脂肪食による肥満を抑制するという新規な作用を有する。すなわち、化合物Aは、投与された被験体に対して、食物(特に高脂肪食)の摂取量を低下させることなく、強い抗肥満効果を発揮する。多くの肥満症患者にとって食物摂取量の制限は強いストレスとなることから、食物摂取量の制限が不要であることは特に有益である。
【0026】
上述の抗肥満効果に関連して、本明細書では、化合物Aが白色脂肪組織を小型化し、さらには白色脂肪組織における遺伝子発現を褐色脂肪組織に特徴的な型に変換することが実証されている。具体的には、化合物Aの作用として、白色脂肪細胞のサイズを低下させる作用、白色脂肪細胞による炎症性メディエーターの発現を抑制する作用、ならびに白色脂肪細胞によるエネルギー消費関連遺伝子の発現を増強する作用が実証されている。
【0027】
従って、本発明によれば、被験体において白色脂肪細胞のサイズを低下させるための医薬組成物、被験体において白色脂肪細胞による炎症性メディエーターの発現を抑制するための医薬組成物、ならびに被験体において白色脂肪細胞によるエネルギー消費関連遺伝子の発現を増強するための医薬組成物も提供される。これらの医薬組成物もまた、有効成分として化合物Aを含む。
【0028】
本明細書において「肥満症」とは、脂肪細胞が増殖し、肥大し、蓄積した病的な状態を意味する。肥満症には、一般に原発性肥満(単純性肥満)と二次性肥満(症候性肥満)とが含まれ、本発明においてはいずれの病態も治療の対象とされるが、好ましくは原発性肥満とされ、さらに好ましくは高脂肪食の摂取を原因とする肥満症とされる。
【0029】
本明細書において「炎症性メディエーター」とは、白色脂肪細胞により発現され、被験体の体内で炎症を引き起こす物質を意味する。このような物質は当技術分野において公知であり、本明細書において特に制限されるものではないが、好ましくはレプチン、TNFα、IL−6および/またはIL−1βとされる。
【0030】
本明細書において「エネルギー消費関連遺伝子」とは、白色脂肪細胞により発現され、被験体の体内におけるエネルギー消費に関与する遺伝子を意味する。このような遺伝子は当技術分野において公知であり、本明細書において特に制限されるものではないが、好ましくはアコニターゼ、アコニターゼ2(ミトコンドリア)、Cyp2e1、Cyp2f2、ヘキソキナーゼ、P450オキシドレダクターゼ、プロテインホスファターゼ1、NADHデヒドロゲナーゼ1α5サブコンプレックス、NADHデヒドロゲナーゼ1α7サブコンプレックス、NADHデヒドロゲナーゼ1β8サブコンプレックス、および/またはATPアーゼ遺伝子とされる。
【0031】
本明細書において「被験体」とは、体内に脂肪細胞または脂肪組織を有するいかなる動物をも意味し、特に制限されるものではないが、好ましくは哺乳動物とされ、さらに好ましくはヒトとされる。
【0032】
本発明に用いられる化合物Aは、医薬上許容される塩または溶媒和物の形態であってもよい。ここで「医薬上許容される」とは、化合物Aの塩または溶媒和物が被験体に投与されたときに、その被験体に対して毒性を示さず、その有効成分としての機能を保持していることを意味する。医薬上許容される塩としては、当技術分野において公知のいかなる塩を用いてもよく、例えば、ナトリウム塩、カリウム塩、マグネシウム塩、カルシウム塩などの金属塩、アンモニウム塩などの有機アミン塩等が挙げられる。医薬上許容される溶媒和物としては、当技術分野において公知のいかなる溶媒和物を用いてもよく、例えば、水和物、他の溶媒和物等が挙げられる。
【0033】
本発明による医薬組成物は、局所、静脈内、皮下、筋肉内、経口、直腸、粘膜など、様々な投与経路に適した剤型として製造することができる。本発明の好ましい実施態様によれば、本発明による医薬組成物は、経口投与のためのものとされる。経口投与のための医薬組成物としては、錠剤、粉剤、カプセル剤、発泡剤、液剤、トローチ剤など、当技術分野において公知のいかなる経口製剤としてもよい。あるいは、本発明による医薬組成物は、食品添加物として製剤化してもよく、化合物Aを含有する食品添加物は食物に添加することによって好適に被験体に摂取させることができる。
【0034】
本発明による医薬組成物は、医薬上許容される担体をさらに含んでもよい。ここで「医薬上許容される」とは、本発明による医薬組成物が被験体に投与されたときに、その被験体に対して毒性を示さず、有効成分である化合物Aの機能を阻害しないことを意味する。このような担体としては、ベヒクル、賦形剤、希釈剤等が挙げられ、投与経路などに応じて当業者により適宜選択される。
【0035】
本発明の他の態様によれば、被験体において、肥満症を予防または治療する方法、白色脂肪細胞のサイズを低下させる方法、白色脂肪細胞による炎症性メディエーターの発現を抑制する方法、ならびに白色脂肪細胞によるエネルギー消費関連遺伝子の発現を増強する方法が提供される。これらの方法は、有効な量の化合物Aまたは医薬上許容されるその塩もしくは溶媒和物を被験体に投与することを含んでなる。
【0036】
化合物Aは、局所、静脈内、皮下、筋肉内、経口、直腸、粘膜など、適切な経路で投与することができる。本発明の好ましい実施態様によれば、化合物Aは、錠剤、粉剤、カプセル剤、発泡剤、液剤、トローチ剤など、当技術分野において公知の経口製剤の形で被験体に経口投与される。あるいは、化合物Aは、食物に添加することによって好適に被験体に摂取させることができる。また、その治療上の有効量は、症状の重篤度、被検者の年齢、投与経路、投与の頻度などに従って、医師または獣医によって適宜決定される。一般的には、前記有効量は、一日当たり、約0.001〜約1000mg/体重kg、好ましくは約0.01〜約10mg/体重kg、より好ましくは約0.01〜約1mg/体重kgである。
【0037】
本発明の他の態様によれば、薬剤の製造における化合物Aまたは医薬上許容されるその塩もしくは溶媒和物の使用が提供される。この薬剤は、肥満症の予防または治療に用いるための薬剤、被験体において白色脂肪細胞のサイズを低下させるための薬剤、被験体において白色脂肪細胞による炎症性メディエーターの発現を抑制するための薬剤、または被験体において白色脂肪細胞によるエネルギー消費関連遺伝子の発現を増強するための薬剤である。
【実施例】
【0038】
以下、実施例を挙げて本発明をさらに具体的に説明するが、本発明はこれらに限定されるものではない。
【0039】
実施例1:2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸(化合物A)の製造
本実施例では、国際公開第00/66595号パンフレットに記載の方法に従って、化合物Aを製造した。
【0040】
(i)2−[N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸エチルの製造
2−クロロピリミジン−5−カルボン酸エチル 100mg、5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−アミン 108mg、およびK2CO3 400mgの混合物を110℃で加熱した。TLCで原料消失を確認した後、反応液を水にあけ、CH2Cl2で抽出した。有機層をNa2SO4で乾燥させ、溶媒を留去した。残渣をフラッシュシリカゲルカラムクロマトグラフィー(n−ヘキサン:AcOEt=20:1)にて精製し、2−[N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸エチルの白色結晶170mg(91%)を得た。
【0041】
Colorless cottons (n-hexane-AcOEt);
1H-NMR (400 MHz, CDCl3) δ 8.95 (s, 2H), 7.56 (br s, 1H), 7.44 (dd, J=2.4, 9.0 Hz, 1H), 7.44 (d, J=2.4 Hz, 1H), 7.31 (d, J=9.2 Hz, 1H), 4.37 (q, J=7.0 Hz, 2H), 1.69 (s, 4H), 1.39 (t, J=7.1 Hz, 3H), 1.30 (s, 6H), 1.28 (s, 6H).
【0042】
(ii)2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸エチルの製造
2−[N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸エチル 100mgをDMF 2mlに溶解させ、そこにNaH 30mgをDMF 1.5mlに懸濁させた懸濁液を添加した。得られた混合物に臭化シクロプロピルメチル 0.3mlを添加し、攪拌した。TLCで原料消失を確認した後、反応液を水にあけ、CH2Cl2で抽出した。有機層をNa2SO4で乾燥させ、溶媒を留去した。残渣をフラッシュシリカゲルカラムクロマトグラフィー(n−ヘキサン:AcOEt=20:1)にて精製し、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸エチル 63mg(55%)を得た。
【0043】
1H-NMR (400 MHz, CDCl3) δ 8.85 (s, 2H), 7.33 (d, J=8.4 Hz, 1H), 7.18 (d, J=2.2 Hz, 1H), 7.01 (dd, J=2.2, 8.3 Hz, 1H), 4.33 (q, J=7.2 Hz, 2H), 3.86 (d, J=7.0 Hz, 2H), 1.70 (s, 4H), 1.35 (t, J=7.0 Hz, 3H), 1.30 (s, 6H), 1.27 (s, 6H), 1.17 (br m, 1H), 0.46 (dd, J=5.9, 12.6 Hz, 2H), 0.19 (dd, J=5.0, 10 Hz, 2H).
【0044】
(iii)2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸の製造
2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸エチル 63mgをエタノール 4mlに溶解させ、20%KOH水溶液 0.5mlを添加して還流した。TLCで原料消失を確認した後、反応液を2N HClにあけ、酢酸エチルで抽出した。有機層をNa2SO4で乾燥させ、溶媒を留去して、標題化合物である2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸(化合物A)の白色粗結晶 55mg(85.5%)を得た。
【0045】
Colorless needles (n-hexane-AcOEt); mp 232℃;
1H-NMR (400 MHz, DMSO-d6) δ 8.73 (s, 2H), 7.36 (d, J=8.4 Hz, 1H), 7.22 (d, J=1.2 Hz, 1H), 7.02 (dd, J=1.2, 8.4 Hz, 1H), 3.84 (d, J=6.8 Hz, 2H), 1.67 (s, 4H), 1.28 (s, 6H), 1.24 (s, 6H), 1.18 (br m, 1H), 0.42 (dd, J=5.1, 13 Hz, 2H), 0.14 (dd, J=5.1, 10 Hz, 2H);
Anal. Calcd for C23H28N3O2・1/10H2O, C: 72.64%, H: 7.47%, N: 11.05%; Found C: 72.35%, H: 7.67%, N: 10.81%.
【0046】
実施例2:化合物AのRXRヘテロダイマー活性化能の評価
本実施例では、レポータージーンアッセイにより、化合物AのRXRヘテロダイマー活性化能を評価した。
【0047】
(1)使用したプラスミド
ヒトPPARγ発現ベクターおよびヒトRXRα発現ベクターは、ヒトPPARγおよびRXRαの完全長cDNAをPCRクローニングし、pcDNA3.1(Invitrogen)に挿入して作製した。PPAR応答領域(PPRE)を結合したホタルルシフェラーゼ遺伝子を有するレポーターコンストラクトは、2コピーのアシルCoAオキシダーゼのPPREをホタルルシフェラーゼtk−pGL3(Promega)に挿入して作製した(Suzuki S, et al., Arterioscler Thromb Vasc Biol 2004;24:519-525)。SV40が結合したLacZコントラストを有するコントロールプラスミドとして、pSV-beta-galactosidase control vector (Promega)を用いた。
【0048】
(2)試験方法
レポータージーンアッセイはCOS1細胞の一過性トランスフェクションによって行い、化合物AがヒトPPARγとヒトRXRαとのヘテロダイマーを活性化する能力を評価した。前日に48ウェルプレートに播種したCOS1細胞に、ポリフェクト(Polyfect; QIAGEN)を用いて、PPARγ発現ベクター、RXRα発現ベクター、核内受容体の応答領域が結合したホタルルシフェラーゼ遺伝子を有するレポーターコンストラクト、およびSV40が結合したLacZコンストラクトを有するコントロールプラスミドをトランスフェクトした。3時間後、細胞を洗浄し、PPARγのアゴニストであるトログリタゾン(troglitazone)1nMおよび化合物Aを含む脂肪酸フリーのBSA0.1%含有培地を添加し、24時間インキュベートした。細胞を回収し、核内受容体活性化をルシフェラーゼアッセイシステムおよびクロロフェノールレッドβガラクトピラノシド(CRPG)の加水分解によるβガラクトシダーゼ活性により定量した。転写活性は、次の式:
(真の転写活性)=(ルシフェラーゼ活性測定値)/(βガラクトシダーゼ活性測定値)
に従って評価した。
【0049】
(3)結果
図1に示したように、RXRアゴニストである化合物Aは、単独で濃度依存的にPPARγを活性化した。また、単独ではほとんど作用を有さない少量(1nM)のPPARγ合成アゴニスト(トログリタゾン)との共存下では、化合物AはPPARγアゴニストの作用を相乗的に増大させた。このように、化合物AはPPARγを活性化し、PPARγアゴニストの作用も増大させることが明らかとなった。
【0050】
実施例3:化合物Aの抗動脈硬化作用および抗肥満作用の検討
本実施例では、高脂血症および動脈硬化を自然発症するApoEノックアウトマウスを用い、以下の方法に従って化合物Aの抗動脈硬化作用および抗肥満作用を検討した。
【0051】
(1)試験方法
(i)動物
雄性ApoEノックアウトマウス(C57BL/6J−ApoE Jackson Laboratory)および雄性C57BL/6Crマウス(日本SLC)を通常の飼育条件下で飼育し、8週齢となった個体を試験に用いた。餌として、高脂肪食(リサーチダイエット社)を与えた。
【0052】
(ii)化合物Aの投与方法・期間
化合物Aは、30mg/kg/dayとなるように粉末餌(高脂肪食)に混餌し、ApoEノックアウトマウスに経口投与した(薬物処置群9例)。第一対照群(薬物未投与群)は、粉末餌(高脂肪食)単独で飼育したマウス(10例)とし、第二対照群(薬物未投与群)は通常の粉末餌で飼育したマウス(5例)とした。それぞれの群に含まれる全てのマウスを、10週間(18週齢まで)継続して飼育した。週に一度、体重および摂餌量を測定し、1週、4週および10週後に血液および臓器を摘出し、各種実験を行った。
【0053】
酸素消費量の実験には雄性C57BL/6Crマウスを用いた。化合物Aは、30mg/kg/dayとなるように粉末餌(高脂肪食)に混餌し、経口投与した(薬物処置群6例)。対照群(薬物未投与群)は、粉末餌(高脂肪食)単独で飼育したマウス(6例)とした。それぞれの群に含まれる全てのマウスを、12週間(20週齢まで)継続して飼育した。週に一度、体重および摂餌量を測定した。
【0054】
(iii)観察および検査方法
A.血中ケミカルメディエーター濃度
最終投与終了後、マウスを絶食させた。翌朝、エーテル麻酔下で頚椎脱臼によりマウスを安楽死させ、開腹して腹部大静脈を露出させ、0.5〜1.0mlの血液を採取した。採取した血液を3000rpmで15分間遠心分離して血漿を分取した。
【0055】
血漿中のレプチンおよびアディポネクチン値はELISAによって検出した。レプチンの測定には、マウスレプチン測定キット((株)森永生科学研究所)を用いた。アディポネクチンの測定には、マウス/ラットアディポネクチンELISAキット(大塚製薬(株))を用いた。
【0056】
B.組織学的評価
a.脂肪組織の観察
採血後、白色脂肪を摘出し、総重量を測定した後、一部を凍結切片用に包埋した。連続切片を作製し、スライドグラスに接着後、速やかにPFA固定し、洗浄後、ヘマトキシリンエオジン染色を行った。
【0057】
b.脂肪組織のmRNA変化解析(リアルタイムPCR)
採血後、白色脂肪を採取し、RNAeasy mini kit(QIAGEN)を用いて全RNAを抽出した。特定遺伝子の発現をリアルタイムRT−PCRで測定した。この実験には、標的遺伝子特異的なTaqmanプライマープローブセットとして、以下の配列を有するオリゴヌクレオチドを用いた。データはすべて18Sの値で補正した。
【0058】
脱共役プロテインUCP1:
フォワードプライマー:5'-AAGCTGTGCGATGTCCATGTAC-3'(配列番号1);
リバースプライマー:5'-AGAAGCCACAAACCCTTTGAAA-3'(配列番号2);
TaqManプローブ:5'-CCAAGGAAGGACCGACGGCCT-3'(配列番号3)。
【0059】
アドレナリンβ3受容体(ARbeta3):
フォワードプライマー:5'-CCCAGCCAGCCCTGTTG-3'(配列番号4);
リバースプライマー:5'-GCACCTTCATAGCCATCAAACC-3'(配列番号5);
TaqManプローブ:5'-CCAGGCAGAGTCCACCGCTCAAC-3'(配列番号6)。
【0060】
c.脂肪組織のmRNA変化解析(DNAチップ)
採血後、白色脂肪を採取し、RNAeasy mini kit(QIAGEN)を用いて全RNAを抽出した。マウスDNAチップ(U74AVS)を用いて、対照群および薬物処置群のそれぞれ3例についてチップ解析を行い、t検定により有意に2倍の変動がある遺伝子を抽出し、Ontology解析を行った。
【0061】
(iv)マウスの酸素消費量(VO2)測定
化合物Aを30mg/kg/dayで12週間経口投与したマウス(薬物処置群6例)および対照群のマウス(薬物未投与群6例)の酸素消費量は、小動物用代謝計測システムMK-5000RQ(MUROMACHI KIKAI CO., LTD.)を用いて測定した。安静期の2時間の平均酸素消費量VO2(酸素消費値/マウスの体重)を計算した。
【0062】
(v)統計学的解析およびデータ処理法
得られた結果は平均値±標準誤差で示した。対照群と薬物処置群の有意差検定はt検定および多重検定によって行った。
【0063】
(2)結果
図2に各群の体重変化のグラフを示す。高脂肪食を与えた第一対照群のマウスでは、普通食を与えた第二対照群のマウスと比較して体重が増大した。これに対し、高脂肪食に化合物Aを混餌して与えた薬物処置群のマウスでは、第一対照群のマウスと比較して強く体重が抑制された。また、図2右側の摂餌量のグラフから、この体重抑制効果が摂餌量による変化ではないことも示された。
【0064】
図3に、薬物処置群(T)、第一対照群(Cont1)、および第二対照群(Cont2)における白色脂肪の重量、レプチン値およびアディポネクチン値を示す。精巣周辺の白色脂肪組織の量を計量すると、薬物処置群において著名な脂肪量の減少が認められ、化合物Aに抗肥満効果があることが明らかとなった。脂肪細胞から分泌されるレプチンの量は、薬物処置群で低値となった。一方、小型脂肪細胞から分泌され、肥満の際には減少するアディポネクチン値は変化しなかった。
【0065】
図4に、ヘマトキシリンエオジン染色した白色脂肪組織の顕微鏡写真を示す。第一対照群では脂肪滴がたまり、細胞が肥大しているが、薬物処置群では脂肪細胞が小型化していることが観察された。
【0066】
図5のパネルAには、アドレナリンβ3受容体(ARbeta3)mRNA発現に及ぼす化合物Aの作用を示す。アドレナリンβ3受容体は主として白色脂肪細胞および褐色脂肪細胞に存在し、アドレナリン刺激によって白色脂肪の分解および褐色脂肪細胞での熱産生を促進する。β3受容体の異常は、エネルギー代謝を抑制し、肥満となる可能性が高いことが指摘されている。白色脂肪組織のアドレナリンβ3受容体mRNAが化合物A処置によって増大することが明らかとなった。
【0067】
図5のパネルBには、脱共役プロテインUCP1mRNA発現に及ぼす化合物Aの作用を示す。UCP1は、褐色脂肪組織に特異的に存在する脱共役プロテインであり、ミトコンドリアの酸化的リン酸化を脱共役させてエネルギーを熱として発散させるため、肥満のターゲット分子として注目されている。通常は白色脂肪組織にないUCP1mRNAが化合物A処置によって増大することが明らかとなった。
【0068】
表1および表2には、白色脂肪組織において化合物Aの作用により変動する遺伝子群のDNAチップ解析の結果を示す。これらの表では、対照群および薬物処置群のそれぞれ3例ずつについてチップ解析を行い、t検定により有意に2倍の変動がある遺伝子の一部をリストアップしている。
【0069】
【表1】

【0070】
【表2】

【0071】
表1および表2によれば、ATP合成酵素やNAD脱水素酵素など、エネルギー産生系の遺伝子群が化合物Aの作用によって全般的に増大している。さらに、ミトコンドリア内膜の構成成分の特異的遺伝子群が発現増大しており、化合物Aにより、白色脂肪組織において褐色脂肪組織に多いミトコンドリアが増大していることが示された。
【0072】
以上のように、化合物Aは白色脂肪細胞を小型化する。さらに、化合物Aは、白色脂肪組織にアドレナリンβ3受容体やUCP1遺伝子、エネルギー産生系遺伝子群や、ミトコンドリア特異的遺伝子を発現誘導する。すなわち、化合物Aは、白色脂肪組織において褐色脂肪組織に特徴的な遺伝子発現を増大させるという特徴的な作用を発揮することが示された。
【0073】
脂肪組織は様々なアディポサイトカインを分泌し、その産生異常が動脈硬化巣の病変悪化をもたらしている。アディポサイトカインの中には炎症性のサイトカインが多く含まれ、これらは血液中の単球を遊走させ、血管内皮に接着させてマクロファージ化し、動脈硬化巣の形成に関与することが報告されている。
【0074】
図6に、薬物処置群(T)、第一対照群(Cont1)、および第二対照群(Cont2)の脂肪組織における炎症性サイトカインmRNA発現を示す。薬物処置群では、脂肪組織のTNFα(TNF alpha)、IL−6およびIL−1β(IL−1 beta)のmRNA発現が強く抑制された。
【0075】
図7に薬物処置群および対照群の酸素消費量を示す。薬物処置群において、20%程度の有意な酸素消費量の増大が示された。
【0076】
以上のように、化合物Aは白色脂肪組織における炎症性メディエーター発現を抑制する。また、化合物Aは脂肪細胞を小型化する。さらに、化合物Aは、白色脂肪組織にエネルギー消費関連遺伝子発現誘導を引き起こす特徴的な作用により、エネルギー消費を増大する。従って、化合物Aは効果的な抗肥満剤として有用である。
【図面の簡単な説明】
【0077】
【図1】図1は、化合物AのPPARγ活性に及ぼす効果を示すグラフである。
【図2】図2は、化合物Aがマウスの体重抑制および摂餌量に及ぼす効果を示すグラフである。
【図3】図3は、化合物Aが白色脂肪組織量に及ぼす効果、ならびに血中のレプチン濃度およびアディポネクチン濃度に及ぼす効果を示すグラフである。
【図4】図4は、薬物処置群および第一対照群のマウスから得られた白色脂肪組織のHE染色像を示す顕微鏡写真である。
【図5】図5は、化合物Aが白色脂肪組織におけるADRβ3およびUCP1のmRNA発現に及ぼす効果を示すグラフである。
【図6】図6は、化合物Aが脂肪組織のサイトカインmRNA発現に及ぼす効果を示すグラフである。
【図7】図7は、化合物Aがマウスの酸素消費量に及ぼす効果を示すグラフである。
【特許請求の範囲】
【請求項1】
肥満症の予防または治療に用いるための医薬組成物であって、有効成分として、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸、または医薬上許容されるその塩もしくは溶媒和物を含んでなる、医薬組成物。
【請求項2】
肥満症が、高脂肪食の摂取を原因とするものである、請求項1に記載の医薬組成物。
【請求項3】
経口投与のための、請求項1に記載の医薬組成物。
【請求項4】
被験体において白色脂肪細胞のサイズを低下させるための医薬組成物であって、有効成分として、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸、または医薬上許容されるその塩もしくは溶媒和物を含んでなる、医薬組成物。
【請求項5】
経口投与のための、請求項4に記載の医薬組成物。
【請求項6】
被験体において白色脂肪細胞による炎症性メディエーターの発現を抑制するための医薬組成物であって、有効成分として、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸、または医薬上許容されるその塩もしくは溶媒和物を含んでなる、医薬組成物。
【請求項7】
前記炎症性メディエーターが、レプチン、TNFα、IL−6およびIL−1βからなる群より選択されるものである、請求項6に記載の医薬組成物。
【請求項8】
経口投与のための、請求項6に記載の医薬組成物。
【請求項9】
被験体において白色脂肪細胞によるエネルギー消費関連遺伝子の発現を増強するための医薬組成物であって、有効成分として、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸、または医薬上許容されるその塩もしくは溶媒和物を含んでなる、医薬組成物。
【請求項10】
前記エネルギー消費関連遺伝子が、アコニターゼ、アコニターゼ2(ミトコンドリア)、Cyp2e1、Cyp2f2、ヘキソキナーゼ、P450オキシドレダクターゼ、プロテインホスファターゼ1、NADHデヒドロゲナーゼ1α5サブコンプレックス、NADHデヒドロゲナーゼ1α7サブコンプレックス、NADHデヒドロゲナーゼ1β8サブコンプレックス、およびATPアーゼ遺伝子からなる群より選択されるものである、請求項9に記載の医薬組成物。
【請求項11】
経口投与のための、請求項9に記載の医薬組成物。
【請求項1】
肥満症の予防または治療に用いるための医薬組成物であって、有効成分として、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸、または医薬上許容されるその塩もしくは溶媒和物を含んでなる、医薬組成物。
【請求項2】
肥満症が、高脂肪食の摂取を原因とするものである、請求項1に記載の医薬組成物。
【請求項3】
経口投与のための、請求項1に記載の医薬組成物。
【請求項4】
被験体において白色脂肪細胞のサイズを低下させるための医薬組成物であって、有効成分として、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸、または医薬上許容されるその塩もしくは溶媒和物を含んでなる、医薬組成物。
【請求項5】
経口投与のための、請求項4に記載の医薬組成物。
【請求項6】
被験体において白色脂肪細胞による炎症性メディエーターの発現を抑制するための医薬組成物であって、有効成分として、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸、または医薬上許容されるその塩もしくは溶媒和物を含んでなる、医薬組成物。
【請求項7】
前記炎症性メディエーターが、レプチン、TNFα、IL−6およびIL−1βからなる群より選択されるものである、請求項6に記載の医薬組成物。
【請求項8】
経口投与のための、請求項6に記載の医薬組成物。
【請求項9】
被験体において白色脂肪細胞によるエネルギー消費関連遺伝子の発現を増強するための医薬組成物であって、有効成分として、2−[N−シクロプロピルメチル−N−(5,6,7,8−テトラヒドロ−5,5,8,8−テトラメチルナフタレン−2−イル)アミノ]ピリミジン−5−カルボン酸、または医薬上許容されるその塩もしくは溶媒和物を含んでなる、医薬組成物。
【請求項10】
前記エネルギー消費関連遺伝子が、アコニターゼ、アコニターゼ2(ミトコンドリア)、Cyp2e1、Cyp2f2、ヘキソキナーゼ、P450オキシドレダクターゼ、プロテインホスファターゼ1、NADHデヒドロゲナーゼ1α5サブコンプレックス、NADHデヒドロゲナーゼ1α7サブコンプレックス、NADHデヒドロゲナーゼ1β8サブコンプレックス、およびATPアーゼ遺伝子からなる群より選択されるものである、請求項9に記載の医薬組成物。
【請求項11】
経口投与のための、請求項9に記載の医薬組成物。
【図1】


【図2】


【図3】


【図5】


【図6】


【図7】


【図4】




【図2】


【図3】


【図5】


【図6】


【図7】


【図4】


【公開番号】特開2009−215178(P2009−215178A)
【公開日】平成21年9月24日(2009.9.24)
【国際特許分類】
【出願番号】特願2008−57645(P2008−57645)
【出願日】平成20年3月7日(2008.3.7)
【出願人】(597128004)国立医薬品食品衛生研究所長 (22)
【Fターム(参考)】
【公開日】平成21年9月24日(2009.9.24)
【国際特許分類】
【出願日】平成20年3月7日(2008.3.7)
【出願人】(597128004)国立医薬品食品衛生研究所長 (22)
【Fターム(参考)】
[ Back to top ]

