ピロール系化合物およびそれを含む有機光電素子
本発明は、ピロール系化合物およびこれを含む有機光電素子に関し、より詳しくは、それらは有機溶媒に対する溶解度が高く、赤色波長から青色波長で蛍光および燐光を発生させることができ、有機光電素子において有機発光層のホスト材料、電子伝達材料、正孔阻止材料に有用に適用されうる、下記一般式1で表される新規なピロール系化合物およびこれを含む有機光電素子を提供する。
本発明の一実施形態による有機光電素子用ピロール系化合物は、下記一般式1で表される。

(前記一般式1において、R'、Ar1〜Ar7、X1〜X10およびnの定義は、明細書に記載されたとおりである。)
本発明の一実施形態による有機光電素子用ピロール系化合物は、下記一般式1で表される。

(前記一般式1において、R'、Ar1〜Ar7、X1〜X10およびnの定義は、明細書に記載されたとおりである。)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ピロール系化合物およびこれを含む有機光電素子に関し、より詳しくは、有機溶媒に対する溶解度が高く、赤色波長から青色波長の範囲で蛍光および燐光を発生する、有機光電素子用の有機発光層のホスト材料、正孔伝達材料、電子遮断材料に有用な新規なピロール系化合物およびこれを含む有機光電素子に関する。
【背景技術】
【0002】
有機光電素子(organic photoelectric device)は次世代ディスプレイデバイスとして注目されている。前記有機光電素子は低い電圧で駆動が可能であり、薄型化、広視野角、速い応答速度など、薄膜トランジスター−液晶ディスプレイ(Thin Film Transistor−Liquid Crystal Display;TFT−LCD)に比べて有利である。また、中型以下ではTFT−LCDと同等またはそれ以上の画質を有することができ、製造工程も単純であるため、今後の価格競争で有利である。
【0003】
有機光電素子は、透明ガラス基板上に陽極としてITO透明電極パターンが形成されている下板と、基板上に陰極として金属電極が形成されている上板との間の空間に有機発光素材が形成され、前記透明電極と前記金属電極との間に所定の電圧が印加される時、有機発光素材に電流が流れて発光する。
【0004】
このような有機光電素子に使用される有機発光素材は、1987年イーストマンコダック(Eastman Kodak)社で最初に開発された。それは発光層形成用材料として低分子である芳香族ジアミンとアルミニウム錯体を利用している(Applied Physics Letters,51,913,1987)。有機光電素子については、1987年にC.W.Tangらは最初に実用的な性能を有する素子を報告した(Applied Physics Letters,51(12),913〜915,1987)。
【0005】
前記文献は有機層としてジアミン誘導体の薄膜(正孔輸送層、HTL)とトリス(8−ヒドロキシ−キノレート)アルミニウム(tris(8−hydroxy−quinolate)aluminum、Alq3)の薄膜を積層した構造を開示している。前記Alq3の薄膜は電子輸送のための発光層として機能する。
【0006】
一般に、有機光電素子は透明電極を含む陽極(anode)、発光領域を含む有機薄膜層、および金属電極(cathode)の順にガラス基板上に形成されている。この時、前記有機薄膜層は、発光層、正孔注入層(HIL)、正孔輸送層(HTL)、電子輸送層(ETL)、または電子注入層(EIL)を含んでも良く、発光層の発光特性上、電子阻止層または正孔阻止層を追加的に含んでも良い。
【0007】
このような構造の有機光電素子に電場が加えられると陽極と陰極からそれぞれ正孔と電子が注入され、注入された正孔と電子はそれぞれの正孔輸送層と電子輸送層を経て発光層で再結合して発光励起子を形成する。このように形成された発光励起子は、基底状態に遷移し発光する。
【0008】
発光素子はそのメカニズムにより一重項励起子からなる蛍光と三重項励起子からなる燐光とに区分される。
【0009】
最近は、蛍光発光物質のみならず、燐光発光物質も有機光電素子の発光物質として使用されうることが知らており(D.F.O'Brien et.al.,Applied Physics Letters,74(3),442〜444,1999;M.A.Baldo et.al.,Applied Physics letters,75(1),4〜6,1999)、このような燐光発光は基底状態から励起状態に電子が遷移することで起こり、系間遷移(intersystem crossing)により一重項励起子が三重項励起子に非放射遷移した後、三重項励起子が基底状態に遷移しながら発光する。
【0010】
この時、三重項励起子は、遷移時、直接基底状態に遷移することができず、電子スピンの反転後に基底状態に遷移するため、蛍光よりも寿命(持続時間)が長くなる。
【0011】
つまり、蛍光の持続期間(emission duration)は数ナノ秒に過ぎないが、燐光の持続時間は相対的に長時間である数マイクロ秒に相当する。したがって、燐光の寿命は蛍光の寿命よりも長くなる。
【0012】
また、量子力学的に考察すれば、有機光電素子において陽極に注入された正孔と陰極に注入された電子とが再結合して発光励起子を形成する場合、一重項と三重項の生成比率は1:3であり、三重項発光励起子が一重項発光励起子よりも3倍多く生成される。
【0013】
したがって、蛍光の場合、一重項励起状態の確率が25%(三重項状態75%)であり、発光効率の限界がある反面、燐光を使用する場合、三重項励起状態の確率75%と一重項励起状態の確率25%まで利用することができるため、理論的には内部量子効率が100%まで可能である。したがって、燐光発光物質を使用する場合、蛍光発光物質に比べて4倍程度高い発光効率を達成することができるという長所がある。
【0014】
前述のような構造を有する有機発光ダイオードにおいて、発光状態の効率と安定性を増加させるために発光色素(ドーパント)を発光層(ホスト)に添加することもある。
【0015】
このような構造においては発光層にいかなるホスト材料を使用するかによって発光ダイオードの効率と性能が変動するが、その間の発光層(ホスト)研究を通じてナフタレン、アントラセン、フェナントレン、テトラセン、ピレン、ベンゾピレン、クリセン、ピセン、カルバゾール、フルオレン、ビフェニル、テルフェニル、トリフェニレンオキシド、ジハロビフェニル、トランス−スチルベンおよび1,4−ジフェニルブタジエンなどが含まれた物質が有機ホスト物質の例として提示されてきた。
【0016】
ホスト材料として4,4−N,N−ジカルバゾールビフェニル(CBP)が主に使用されるが、この化合物はガラス転移温度が110℃以下であり、熱分解温度が400℃以下と熱安定性が低く、対称性が過度に良いため、結晶化し易く、素子の耐熱試験の結果、短絡や画素欠陥が発生するなどの問題の原因となる。
【0017】
また、CBPを含む大部分のホスト材料は正孔輸送性が電子輸送性よりも良い材料であって、注入された正孔の移動が注入された電子の移動よりも速いため、発光層で励起子が効果的に形成されないことによって、素子の発光効率が減少する現象が現れる。
【発明の概要】
【発明が解決しようとする課題】
【0018】
したがって、ホスト材料、正孔伝達材料、または電子伝達材料として使用される、熱的安定性が高く、三重項励起エネルギー(T1)が高い電荷輸送材料の開発が必要である。
【課題を解決するための手段】
【0019】
本発明の一実施形態は、ホスト材料、正孔伝達材料、または電子遮断材料として使用されうる電荷輸送材料を提供するために、高い電荷輸送性、膜安定性、および高い三重項励起エネルギー(T1)を有する新規なピロール系化合物を提供することにその目的がある。
【0020】
本発明の他の実施形態は、前記ピロール系化合物を含む有機光電素子を提供することにその目的がある。
【0021】
本発明が目的とする技術的課題は、以上で言及した技術的課題に制限されず、言及されていない他の技術的課題は下記の記載から当業者であれば明確に理解しうる。
【0022】
本発明の一実施形態によれば、下記一般式1で表される有機光電素子用ピロール系化合物を提供する。
【0023】
【化1】

【0024】
(前記一般式1において、
R'は、水素、および炭素数1〜6のアルキル基からなる群より選択され、
Ar1〜Ar7は、互いに同一または異なるものであって、それぞれ独立して、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、ただし、前記Ar1〜Ar5は、ピロール誘導体ではなく、
X1〜X10は、互いに同一または異なるものであって、それぞれ独立して、CR’’、およびNからなる群より選択され、
前記R’’は、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、
nは、1〜2の整数である。)
本発明の他の実施形態によれば、陽極、陰極、および前記陽極と陰極との間に有機薄膜層を含み、前記有機薄膜層は、前記ピロール系化合物を含む。
【0025】
その他、本発明の実施形態の具体的な事項は以下の詳細な説明に記載されている。
【発明の効果】
【0026】
本発明によるピロール系化合物は、ホスト材料、正孔伝達材料、または電子遮断材料として使用されうるため、有機光電素子の有機発光層、正孔輸送層、電子阻止層などの有機薄膜層に極めて有用に適用されうる。
【図面の簡単な説明】
【0027】
【図1】本発明の一実施形態による有機光電素子の断面図である。
【図2】本発明の実施例1で製造したM−7化合物の1H−NMRスペクトルを示す図である。
【図3】本発明の実施例2で製造したM−8化合物の1H−NMRスペクトルを示す図である。
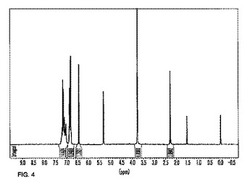
【図4】本発明の実施例9で製造したM−15化合物の1H−NMRスペクトルを示す図である。
【図5】本発明の実施例2で製造したM−8化合物のフォトルミネッセンス(PL)を示すグラフである。
【図6】本発明の実施例18で製造したM−14化合物を含む有機発光ダイオードの電流密度を示すグラフである。
【図7】本発明の実施例18で製造したM−14化合物を含む有機発光ダイオードの電圧に対する輝度を示すグラフである。
【図8】本発明の実施例18で製造したM−14化合物を含む有機発光ダイオードの発光効率に対する輝度を示すグラフである。
【発明を実施するための形態】
【0028】
以下、本発明の実施形態を詳しく説明する。ただし、これは例示として提示されるものであり、これにより本発明が制限されず、本発明は後述する特許請求の範囲の範疇により定義される。
【0029】
本明細書で「置換」とは、別途の定義がない限り、それぞれ炭素数1〜30のアルキル基、ハロゲン基、炭素数1〜30のアルコキシ基、炭素数1〜30のハロアルキル基、炭素数6〜30のアリール基、および炭素数2〜30のヘテロアリール基からなる群より選択される置換基で少なくとも1つ置換されていることを意味する。
【0030】
本明細書で「ヘテロ」とは、別途の定義がない限り、一つの環基内にN、O、S、およびPからなる群より選択されるヘテロ原子を1〜3個含有し、残りは炭素であることを意味する。
【0031】
本発明の一実施形態によれば、下記一般式1で表されるピロール系化合物を提供する。
【0032】
【化2】

【0033】
(前記一般式1において、
R'は、水素、および炭素数1〜6のアルキル基からなる群より選択され、
Ar1〜Ar7は、互いに同一または異なるものであって、それぞれ独立して、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、ただし、前記Ar1〜Ar5は、ピロール誘導体ではなく、
X1〜X10は、互いに同一または異なるものであって、それぞれ独立して、CR’’、およびNからなる群より選択され、
前記R’’は、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、
nは、1〜2の整数である。)
前記一般式1において、nは、1または2の整数である。nが0である場合、UV吸収波長およびPL発光波長を調節するのが難しい。したがって、本発明の一実施形態によるピロール系化合物を燐光ホストとして使用して青色から赤色まで発光色を発現し難くなるおそれがある。しかしながら、nが前記範囲である場合、このような問題を解決することができる。
【0034】
前記一般式1において、Ar1〜Ar5は、ピロール誘導体でありえない。特に、前記ピロール誘導体は、下記一般式2で表される化合物ではない。Ar1〜Ar5が下記一般式2で表される化合物である場合、三重項励起エネルギー(T1)の調節が難しいため、燐光ホストとして使用されうる。したがって、ピロール化合物をより多様な用途で使用することが容易ではない。
【0035】
【化3】

【0036】
(前記一般式2において、
互いに同一または異なるものであって、それぞれ独立して、CR’’、およびNからなる群より選択され、
前記R’’は、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、
Ar6〜Ar7は、互いに同一または異なるものであって、それぞれ独立して、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択されるものである。)
特に、前記一般式1および2において、Ar1〜Ar7は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のカルバゾール基;置換または非置換のアリールアミン基;置換または非置換のフェニル基;置換または非置換のトリル基;置換または非置換のナフチル基;置換または非置換のスチルベン基;置換または非置換のフルオレン基;置換または非置換のアントラセニル基;置換または非置換のテルフェニル基;置換または非置換のピレニル基;置換または非置換のジフェニルアントラセニル基;置換または非置換のジナフチルアントラセニル基;置換または非置換のペンタセニル基;置換または非置換のブロモフェニル基;置換または非置換のヒドロキシフェニル基;置換または非置換のチエニル基;置換または非置換のピリジル基;置換または非置換のアゾベンゼニル基;および置換または非置換のフェロセニル基からなる群より選択されるものをより好ましく使用することができる。
【0037】
前記一般式1および2において、Ar1〜Ar7は、互いに同一または異なるものであって、それぞれ独立して、下記の化学式1〜29で表される化合物からなる群より選択されるものを使用することがより好ましい。
【0038】
【化4−1】

【0039】
【化4−2】

【0040】
【化4−3】

【0041】
(前記化学式1〜29において、R1〜R76は、それぞれ独立して、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、
n1〜n67は、それぞれ独立して、0〜5の整数である。)
本発明によるピロール系化合物のより具体的な例を挙げれば、下記の化学式30〜91で表される通りである。
【0042】
【化5−1】

【0043】
【化5−2】

【0044】
【化5−3】

【0045】
【化5−4】

【0046】
【化5−5】

【0047】
【化5−6】

【0048】
【化5−7】

【0049】
【化5−8】

【0050】
【化5−9】

【0051】
【化5−10】

【0052】
【化5−11】

【0053】
【化5−12】

【0054】
【化5−13】

【0055】
【化5−14】

【0056】
【化5−15】

【0057】
【化5−16】

【0058】
【化5−17】

【0059】
【化5−18】

【0060】
【化5−19】

【0061】
【化5−20】

【0062】
【化5−21】

【0063】
【化5−22】

【0064】
本発明によるピロール系化合物が電子阻止層および正孔輸送層に使用される場合、正孔阻止性は分子内の正孔輸送骨格により低下する傾向があるため、電子阻止層として使用される場合には電子輸送骨格が含まれないことが好ましい。この電子輸送骨格としては、ベンゾイミダゾール、ピリジン、ピラジン、ピリミジン、トリアジン、キノリン、イソキノリンなどを例示することができる。ただし、本発明の化合物が電子輸送性、正孔輸送性の両方を要求される場合には、前記電子輸送骨格を導入することが発光ダイオードの寿命向上させ駆動電圧を減少させる。
【0065】
前記本発明によるピロール系化合物は、最大発光波長が320〜500nmの範囲を示し、三重項励起エネルギー(T1)が2.0eV以上、より具体的に2.0〜4.0eVの範囲であるものであって、高い三重項励起エネルギーを有するホストの電荷がドーパントに良好に伝達されてドーパントの発光効率を上げることができ、材料のHOMOとLUMOエネルギー準位を自由に調節して駆動電圧を下げることができる。そのため、ピロール系化合物は、ホスト材料または電荷輸送材料として極めて有用に使用されうる。
【0066】
しかも、前記ピロール系化合物は、その光活性および電気的な性質のため、非線形光学素材、電極材料、変色材料、光スイッチ、センサー、モジュール、ウェーブガイド、有機トランジスタ、レーザー、光吸収体、誘電体および分離膜などの材料としても極めて有用に適用されうる。特に、本発明によるピロール系化合物は、光電素子用としてより有用に適用されうる。
【0067】
本発明の他の一実施形態によれば、陽極、陰極、および前記陽極と陰極との間に介される有機薄膜層を含み、前記有機薄膜層は、本発明によるピロール系化合物を含む有機光電素子を提供する。前記有機光電素子は、有機発光素子、有機太陽電池、有機トランジスター、有機感光体ドラム、有機メモリ素子などを意味する。特に、前記有機光電素子は、有機発光ダイオードであることが好ましい。
【0068】
前記本発明によるピロール系化合物は、発光層の有機薄膜層に含まれても良い。また、正孔注入層(HIL)、正孔輸送層(HTL)、正孔阻止層およびこれらの組み合わせからなる群より選択される有機薄膜層、または電子注入層(EIL)、電子輸送層(ETL)、電子阻止層、およびこれらの組み合わせからなる群より選択される有機薄膜層に含まれても良い。
【0069】
陽極、陰極、および前記陽極と陰極との間に有機薄膜層を含む有機光電素子は、陽極、発光層、および陰極を含む一般的な素子構成を有しても良い。前記有機光電素子の前記有機薄膜層は中間層、正孔輸送層(HTL)、および電子輸送層(ETL)をさらに含んで構成されても良い。この時、前記中間層は、正孔注入層(HIL)、正孔阻止層、電子注入層(EIL)、電子阻止層のようなバッファー層を意味する。
【0070】
図1は、本発明の一実施形態による有機光電素子1の断面図を模式的に示した図面である。図1は、基板11、陽極12、正孔輸送層(HTL)13、発光層14、電子輸送層(ETL)15、および陰極16から構成された有機光電素子の構造を示す。
【0071】
以下、図1を参照して前記化合物を利用して有機光電素子を製造する方法を説明する。
【0072】
まず、基板11上に陽極12用物質をコーティングする。
【0073】
ここで、基板11としては、通常の有機光電素子として使用される基板を使用するが、透明性、表面平滑性、取り扱いの容易性、および撥水性に優れたガラス基板、または透明プラスチック基板を使用しても良い。
【0074】
また、前記陽極12用物質としては、透明で伝導性に優れた酸化インジウム錫(ITO)、酸化錫(SnO2)、酸化亜鉛(ZnO)などを使用しても良い。
【0075】
次に、正孔輸送層(HTL)13が陽極12上に真空蒸着、スパッタリング、またはスピンコーティングを利用して形成されても良く、前記正孔輸送層(HTL)13上に発光層14が真空蒸着、スピンコーティング、インクジェットプリンティングなどの溶液コーティング法を利用して形成されても良い。
【0076】
また、電子輸送層15が発光層14と陰極16の中間に形成される。
【0077】
この時、前記発光層14、正孔輸送層(HTL)13、および電子輸送層(ETL)15の厚さは当該分野で使用する範囲で形成し、特に限定しないが、前記発光層14の厚さは、5nm〜1μmであることが好ましく、10〜500nmであることがより好ましく、前記正孔輸送層(HTL)13、および電子輸送層(ETL)15の厚さは、それぞれ10〜10,000Åであることが好ましい。
【0078】
前記電子輸送層(ETL)15には、通常の電子輸送層(ETL)15に用いる物質を使用して真空蒸着、スパッタリング、またはスピンコーティングを利用して形成されても良い。
【0079】
前記正孔輸送層(HTL)13および電子輸送層(ETL)15は、運搬者を発光層14に効率的に伝達させることによって、発光層14内で発光による結合の確率を高める役割を果たす。
【0080】
前記正孔輸送層(HTL)13に用いる物質は、特に制限されないが、ポリ(スチレンスルホン酸)(PSS)でドーピングされたポリ(3,4−エチレンジオキシ−チオフェン)(PEDOT)、N,N'−ビス(3−メチルフェニル)−N,N−ジフェニル−[1,1'−ビフェニル]−4,4'−ジアミン(TPD)を使用するのが好ましい。
【0081】
前記電子輸送層(ETL)15に用いる物質は、特に制限されないが、アルミニウムトリヒドロキシキノリン(Alq3)、1,3,4−オキサジアゾール誘導体である2−(4−ビフェニルイル−5−フェニル−1,3,4−オキサジアゾール(PBD)、キノキサリン誘導体である1,3,4−トリス[3−フェニル−6−トリフルオロメチル)キノキサリン−2−イル]ベンゼン(TPQ)、およびトリアゾール誘導体などを使用するのが好ましい。
【0082】
また、高分子は、燐光発光可能な有機化合物と混合して使用しても良い。前記燐光有機化合物としては、三重項状態から燐光発光可能な有機金属錯体であり、少なくともGregor Johann Mendelの周基律表VIII族金属イオンを含む金属錯体を好ましく使用しても良い。前記周基律表VIII族金属イオンは、Fe、Co、Ni、Ru、Rh、Pd、Os、Ir、およびPtからなる群より選択される金属イオンを使用するのが好ましく、IrまたはPtを使用するのがより好ましい。
【0083】
下記の化学式92〜94に具体的な金属錯体の例に挙げるが、前記金属錯体はこれらに限定されない。
【0084】
【化6】

【0085】
一方、溶液コーティング法を利用して前記発明化合物で前記有機膜を形成する場合、他の低分子ホスト材料と混合して使用しても良い。下記の化学式95〜98に低分子ホスト材料の具体的な例を挙げるが、本発明はこれらに限定されない。
【0086】
【化7】

【0087】
また、前記化合物は、フッ素系高分子、ポリフェニレンビニレン系高分子、ポリパラフェニレン系高分子などの共役二重結合を有する高分子と混合して使用しても良く、場合によってはバインダー樹脂を混合して使用しても良い。
【0088】
前記バインダー樹脂は、ポリビニルカルバゾール(PVK)、ポリカーボネート、ポリエステル、ポリアンアリーレート(polyan arylate)、ポリスチレン、アクリル系高分子、メタクリル系高分子、ポリブチラール、ポリビニルアセタール、ジアリルフタレート系高分子、フェノール系樹脂、エポキシ系樹脂、シリコン系樹脂、ポリスルホン系樹脂、または尿素系樹脂などがあり、この樹脂は単独または組み合わせて使用しても良い。
【0089】
選択的には、正孔阻止層を真空蒸着などの方法で形成させて発光層14の正孔の輸送速度を制限し、電子−正孔の再結合の確率を増加させることができる。
【0090】
前記電子輸送層(ETL)上に陰極16用物質をコーティングする。
【0091】
前記陰極用物質としては、仕事関数が小さいリチウム(Li)、マグネシウム(Mg)、カルシウム(Ca)、アルミニウム(Al)、Al:Li、Ba:Li、またはCa:Liなどが使用される。
【実施例】
【0092】
以下、本発明の具体的な実施例を提示する。ただし、以下に記載された実施例は本発明を具体的に例示したり説明したりするためのものに過ぎず、これらによって本発明を制限してはならない。
【0093】
また、ここに記載されていない内容は、当該技術分野で通常の知識を有する者であれば十分に技術的に理解することができる。
【0094】
以下の合成例1〜6では、本発明の一実施形態による化合物を製造するための単量体M−1〜M−6をそれぞれ反応式1〜6の通り製造した。
【0095】
〔合成例1〕:M−1の合成
【0096】
【化8】

【0097】
メカニカル撹拌機を備え、溶媒として200mlのアセトンが入っている500mlの丸底フラスコにエチニルベンゼン23g(0.22mol)、塩化銅(I)1.2g(12.1mmol)およびN,N,N',N'−テトラメチルエチレンジアミン(TMEDA)1.4g(12mmol)を入れ、常温で酸素をバブリングしながら1時間強く撹拌した。反応終結後、減圧乾燥して溶媒を除去し、5%塩酸水溶液に沈殿させて白色の固体を得た。得られた固体をエタノールで再結晶して乾燥した結果、透明な結晶M−1を18.4g(収率:81%)得た。その融点は87〜88℃であった。
【0098】
〔合成例2〕:M−2の合成
【0099】
【化9】

【0100】
アルゴン雰囲気下、250mlの丸底フラスコに1,4−ジ−フェニルブタジエン(M−1)5g(24.7mmol)、p−ブロモアニリン4.67g(27.1mmol)および塩化銅(I)0.58g(5.9mmol)を入れて150℃で撹拌しながら5時間反応させた。反応後に反応物を冷却し、塩化メチレンに溶解して、5%塩酸で数回洗浄した。得られた有機溶液を再び水で数回洗浄した後、有機溶液を無水硫酸マグネシウムで乾燥し、溶媒を除去して得られた固体を酢酸エチルで再結晶して白色の固体M−2を4.5g(収率:48.7%)得た。固体M−2の融点は218〜219℃であった。
【0101】
〔合成例3〕:M−3の合成
【0102】
【化10】

【0103】
アルゴン雰囲気下、250mlの丸底フラスコに1,4−ジフェニルブタジエン(M−1)5g(24.7mmol)、3−ブロモ−4−メチルアニリン5.06g(27.1mmol)のおよび塩化銅(I)0.58g(5.9mmol)を入れて150℃で撹拌しながら5時間反応させた。反応後に反応物を冷却し、塩化メチレンに溶解して、5%塩酸で数回洗浄した。得られた有機溶液を再び水で数回洗浄した後、有機溶液を無水硫酸マグネシウムで乾燥し、溶媒を除去して得られた固体を酢酸エチルで再結晶して、白色の固体M−3を5.94g(収率:62%)得た。
【0104】
〔合成例4〕:M−4の合成
【0105】
【化11】

【0106】
メカニカル撹拌機を備えた、溶媒として200mlのアセトンが入っている500mlの丸底フラスコに1−エチニル−4−メチルベンゼン25g(0.21mol)、塩化銅(I)1.2g(12.1mmol)およびN,N,N',N'−テトラメチルエチレンジアミン(TMEDA)1.4g(12mmol)を入れ、常温で1時間酸素をバブリングしながら撹拌した。反応終結後、減圧乾燥して溶媒を除去し、5%塩酸水溶液に沈殿させて白色の固体を得てこれをろ過した。得られた固体をエタノールで再結晶して乾燥させた結果、透明な結晶M−4を18.8g(収率:78%)得た。その融点は182〜183℃であった。
【0107】
〔合成例5〕:M−5の合成
【0108】
【化12】

【0109】
アルゴン雰囲気下、250mlの丸底フラスコに1,4−ビス(p−トリル)ブタジエン(M−4)5g(21.7mmol)、p−ブロモアニリン4.1g(23.8mmol)および塩化銅(I)0.51g(5.2mmol)を入れて150℃で撹拌しながら5時間反応させた。反応後に反応物を冷却し、塩化メチレンに溶解して5%塩酸で数回洗浄した。得られた有機溶液を再び水で数回洗浄した後、有機溶液を無水硫酸マグネシウムで乾燥し、溶媒を除去して得られた固体を酢酸エチルで再結晶して、白色の固体M−5を5.5g(収率:63%)得た。
【0110】
〔合成例6]:M−6の合成
【0111】
【化13】

【0112】
アルゴン雰囲気下、250mlの丸底フラスコに1,4−ビス(p−トリル)ブタジエン(M−4)6g(26mmol)、3−ブロモアニリン4.9g(28mmol)および塩化銅(I)0.61g(6.2mmol)を入れて150℃で撹拌しながら5時間反応させた。反応後に反応物を冷却し、塩化メチレンに溶解して5%塩酸で数回洗浄した。得られた有機溶液を再び水で数回洗浄した後、有機溶液を無水硫酸マグネシウムで乾燥し、溶媒を除去して得られた固体を塩化メチレン/ヘキサン(1:2体積比)混合溶媒によりシリカゲルカラムクロマトグラフィーで精製して白色のM−6を5.8g(収率:66.4%)得た。
【0113】
下記の実施例1〜10では本発明の一実施形態によるピロール系化合物を製造した。
【0114】
〔実施例1〕:M−7の合成
【0115】
【化14】

【0116】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−2(1.5g、4.0mmol)、物質A(2.13g、4.4mmol)、テトラキストリフェニルホスフィンパラジウム(0.14g、0.12mmol)を30mLのテトラヒドロフラン(THF)に溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0117】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0118】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過し、溶媒を除去した。
【0119】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒によりシリカゲルカラムクロマトグラフィーで精製した後、塩化メチレン/ヘキサン(体積比1:3)混合溶媒を用いて再結晶し、白色のM−7を1.6g(収率:61.6%)得た。白色のM−7の薄膜状態での最大発光波長は405nmであった。
【0120】
〔実施例2〕:M−8の合成
【0121】
【化15】

【0122】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−5(1.5g、3.7mmol)、物質B(2.19g、4.1mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0123】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0124】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過し、溶媒を除去した。
【0125】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒によりシリカゲルカラムクロマトグラフィーで精製した後、塩化メチレン/ヘキサン(体積比1:3)混合溶媒を用いて再結晶し、白色のM−8を1.7g(収率:62.7%)得た。白色のM−8の薄膜状態での最大発光波長は442nmであった。
【0126】
〔実施例3〕:M−9の合成
【0127】
【化16】

【0128】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−5(1.5g、3.7mmol)、物質C(1.51g、4.1mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0129】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0130】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過し、溶媒を除去した。
【0131】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒によりシリカゲルカラムクロマトグラフィーで精製した後、塩化メチレン/ヘキサン(体積比1:3)混合溶媒を用いて再結晶し、白色のM−9を1.5g(収率:71.4%)得た。白色のM−9の薄膜状態での最大発光波長は422nmであった。
【0132】
〔実施例4〕:M−10の合成
【0133】
【化17】

【0134】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−2(1.5g、4.0mmol)、物質D(1.63g、4.4mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0135】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0136】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過し、溶媒を除去した。
【0137】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒を用いて再結晶し、白色のM−10を1.2g(収率:55.8%)得た。白色のM−10の薄膜状態での最大発光波長は398nmであった。
【0138】
〔実施例5〕:M−11の合成
【0139】
【化18】

【0140】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−6(1.5g、3.7mmol)、物質B(2.19g、4.1mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0141】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0142】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過した後、溶媒を除去した。
【0143】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒によりシリカゲルカラムクロマトグラフィーで精製した後、塩化メチレン/ヘキサン(体積比1:3)混合溶媒を用いて再結晶し、白色のM−11を1.95g(収率:72%)得た。白色のM−11の薄膜状態での最大発光波長は423nmであった。
【0144】
〔実施例6〕:M−12の合成
【0145】
【化19】

【0146】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−6(1.5g、3.7mmol)、物質A(1.98g、4.1mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0147】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0148】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過した後、溶媒を除去した。
【0149】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒を用いて再結晶し、白色のM−12を1.86g(収率:74%)得た。前記M−12の薄膜状態での最大発光波長は405nmであった。
【0150】
〔実施例7〕:M−13の合成
【0151】
【化20】

【0152】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−3(1.5g、3.8mmol)、物質B(2.27g、4.2mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0153】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0154】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過した後、溶媒を除去した。
【0155】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒を用いて再結晶し、白色のM−13を1.87g(収率:67.7%)得た。白色のM−13の薄膜状態での最大発光波長は391nmであった。
【0156】
〔実施例8〕:M−14の合成
【0157】
【化21】

【0158】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−3(1.5g、3.8mmol)、物質A(1.96g、4.0mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0159】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0160】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過した後、溶媒を除去した。
【0161】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒によりシリカゲルカラムクロマトグラフィーで精製し、白色のM−14を1.33g(収率:52%)得た。白色のM−14の薄膜状態での最大発光波長は378nmであった。
【0162】
〔実施例9〕:M−15の合成
【0163】
【化22】

【0164】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−3(1.5g、3.8mmol)、物質E(1.99g、4.6mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0165】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0166】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過した後、溶媒を除去した。
【0167】
前記反応物を塩化メチレン/ヘキサン(体積比2:1)混合溶媒によりシリカゲルカラムクロマトグラフィーで精製した後、塩化メチレン/ヘキサン(体積比2:1)混合溶媒を用いて再結晶して白色のM−15を1.5g(収率:63.4%)得た。白色のM−15の薄膜状態での最大発光波長は417nmであった。
【0168】
〔実施例10〕:M−16の合成
【0169】
【化23】

【0170】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−6(1.2g、3.0mmol)、物質F(1.32g、3.2mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0171】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0172】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過した後、溶媒を除去した。
【0173】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒を用いて再結晶して白色のM−16を1.3g(収率:72.7%)得た。白色のM−16の薄膜状態での最大発光波長は435nmであった。
【0174】
〔前記化合物の分析および特性測定〕
前記実施例1〜10で製造されたM−7〜M−16化合物の構造分析のためにCD2Cl2溶媒に溶かした後、300MHzのNMR装置を利用して1H−NMRを測定した。前記実施例1で製造されたM−7の1H−NMRの結果を図2に示し、実施例2で製造されたM−8の1H−NMRの結果を図3に示し、実施例9で製造されたM−15の1H−NMRの結果を図4に示す。前記M−7〜M−16の蛍光特性を測定するために、ガラス基板に薄膜を形成した後、HITACHI F−4500を利用してPL(photoluminescence)波長を測定した。前記実施例2で製造されたM−8に対するPL波長測定の結果を図5に示す。
【0175】
図5より、M−8の薄膜状態での最大発光波長は442nmであることをが分かる。
【0176】
〔実施例11〜20]:有機発光ダイオードの製造
陽極としてはITO基板を使用し、前記基板上にポリ(3,4−エチレンジオキシ−チオフェン)(PEDOT)をスピンコーティングした。
【0177】
次に、前記PEDOT上に、実施例1〜10で製造された化合物をホストとして使用し、Ir(phq)2acacを7重量%でドーピングして発光層をスピンコーティングにより形成した。
【0178】
発光層上にBAlqを真空蒸着して50Å厚さの正孔阻止層を形成した。
【0179】
その後、前記発光層上にAlq3を真空蒸着して200Å厚さの電子輸送層(ETL)を形成した。
【0180】
前記電子輸送層(ETL)上にLiFを10ÅとAlを1000Å、順次に真空蒸着して陰極を形成することによって有機発光素子を完成した。
【0181】
前記有機発光素子は、5層の有機薄膜層を有する構造からなっており、具体的には、Al(1000Å)/LiF(10Å)/Alq3(200Å)/BAlq(50Å)/EML(M−14:Ir(phq)2acac)/PEDOT/ITO(1500Å)の構造で製造した。
【0182】
〔有機発光ダイオードの性能測定〕
実施例11〜21による有機発光ダイオードに対して電圧変化に対する電流密度変化、および電圧変化に対する輝度変化を測定した。具体的な測定方法は次の通りである。
【0183】
1)電圧に対する電流密度の変化測定
前記製造されたそれぞれの有機発光ダイオードに対し、電圧を0Vから上昇させながら電流−電圧計(Keithley 2400)を利用して単位素子に流れる電流値を測定し、測定された電流値を面積で分けて電流密度を測定した。
【0184】
前記M−14化合物を利用して製造された実施例18の有機発光ダイオードの電圧変化による電流密度の変化の結果を図6に示す。
【0185】
2)電圧変化に対する輝度変化測定
前記M−14化合物を利用して製造された実施例18の有機発光ダイオードに対し、電圧を0Vから上昇させながら輝度計(Minolta Cs−1000A)を利用して輝度を測定した。その結果を図7に示した。
【0186】
3)輝度変化に対する発光効率測定
前記M−14を利用して製造された実施例18による有機発光素子の輝度変化による電流効率(発光効率)変化測定結果を図8に示した。
【0187】
図6〜図8を参照すれば、前記M−14は有機発光素子用ホスト物質として有機発光素子の駆動電圧を下げ、輝度と効率を向上させることが分かる。
【0188】
〔電気化学的特性測定〕
前記製造されたM−7〜M−16化合物の電気化学的特性をサイクリックボルタンメトリー装置を利用して測定し、その結果を以下の表1に示した。
【0189】
【表1】

【0190】
表1によれば、前記実施例1〜10で製造されたM−7〜M−16は正孔輸送層および電子阻止層として使用されうることが分かる。
【0191】
本発明は前記実施例に限定されず、互いに異なる多様な形態で製造され、本発明が属する技術分野で通常の知識を有する者は本発明の精神および範囲に含まれる特徴を変更せずにさまざまな変更および等価な改良を行うだろう。したがって、以上で記述した実施例はすべての面で例示的なものであり、本発明をいかなる方法によっても限定するものではない。
【符号の説明】
【0192】
11 基板
12 陽極
13 正孔輸送層(HTL)
14 有機発光層
15 電子輸送層(ETL)
16 陰極
【技術分野】
【0001】
本発明は、ピロール系化合物およびこれを含む有機光電素子に関し、より詳しくは、有機溶媒に対する溶解度が高く、赤色波長から青色波長の範囲で蛍光および燐光を発生する、有機光電素子用の有機発光層のホスト材料、正孔伝達材料、電子遮断材料に有用な新規なピロール系化合物およびこれを含む有機光電素子に関する。
【背景技術】
【0002】
有機光電素子(organic photoelectric device)は次世代ディスプレイデバイスとして注目されている。前記有機光電素子は低い電圧で駆動が可能であり、薄型化、広視野角、速い応答速度など、薄膜トランジスター−液晶ディスプレイ(Thin Film Transistor−Liquid Crystal Display;TFT−LCD)に比べて有利である。また、中型以下ではTFT−LCDと同等またはそれ以上の画質を有することができ、製造工程も単純であるため、今後の価格競争で有利である。
【0003】
有機光電素子は、透明ガラス基板上に陽極としてITO透明電極パターンが形成されている下板と、基板上に陰極として金属電極が形成されている上板との間の空間に有機発光素材が形成され、前記透明電極と前記金属電極との間に所定の電圧が印加される時、有機発光素材に電流が流れて発光する。
【0004】
このような有機光電素子に使用される有機発光素材は、1987年イーストマンコダック(Eastman Kodak)社で最初に開発された。それは発光層形成用材料として低分子である芳香族ジアミンとアルミニウム錯体を利用している(Applied Physics Letters,51,913,1987)。有機光電素子については、1987年にC.W.Tangらは最初に実用的な性能を有する素子を報告した(Applied Physics Letters,51(12),913〜915,1987)。
【0005】
前記文献は有機層としてジアミン誘導体の薄膜(正孔輸送層、HTL)とトリス(8−ヒドロキシ−キノレート)アルミニウム(tris(8−hydroxy−quinolate)aluminum、Alq3)の薄膜を積層した構造を開示している。前記Alq3の薄膜は電子輸送のための発光層として機能する。
【0006】
一般に、有機光電素子は透明電極を含む陽極(anode)、発光領域を含む有機薄膜層、および金属電極(cathode)の順にガラス基板上に形成されている。この時、前記有機薄膜層は、発光層、正孔注入層(HIL)、正孔輸送層(HTL)、電子輸送層(ETL)、または電子注入層(EIL)を含んでも良く、発光層の発光特性上、電子阻止層または正孔阻止層を追加的に含んでも良い。
【0007】
このような構造の有機光電素子に電場が加えられると陽極と陰極からそれぞれ正孔と電子が注入され、注入された正孔と電子はそれぞれの正孔輸送層と電子輸送層を経て発光層で再結合して発光励起子を形成する。このように形成された発光励起子は、基底状態に遷移し発光する。
【0008】
発光素子はそのメカニズムにより一重項励起子からなる蛍光と三重項励起子からなる燐光とに区分される。
【0009】
最近は、蛍光発光物質のみならず、燐光発光物質も有機光電素子の発光物質として使用されうることが知らており(D.F.O'Brien et.al.,Applied Physics Letters,74(3),442〜444,1999;M.A.Baldo et.al.,Applied Physics letters,75(1),4〜6,1999)、このような燐光発光は基底状態から励起状態に電子が遷移することで起こり、系間遷移(intersystem crossing)により一重項励起子が三重項励起子に非放射遷移した後、三重項励起子が基底状態に遷移しながら発光する。
【0010】
この時、三重項励起子は、遷移時、直接基底状態に遷移することができず、電子スピンの反転後に基底状態に遷移するため、蛍光よりも寿命(持続時間)が長くなる。
【0011】
つまり、蛍光の持続期間(emission duration)は数ナノ秒に過ぎないが、燐光の持続時間は相対的に長時間である数マイクロ秒に相当する。したがって、燐光の寿命は蛍光の寿命よりも長くなる。
【0012】
また、量子力学的に考察すれば、有機光電素子において陽極に注入された正孔と陰極に注入された電子とが再結合して発光励起子を形成する場合、一重項と三重項の生成比率は1:3であり、三重項発光励起子が一重項発光励起子よりも3倍多く生成される。
【0013】
したがって、蛍光の場合、一重項励起状態の確率が25%(三重項状態75%)であり、発光効率の限界がある反面、燐光を使用する場合、三重項励起状態の確率75%と一重項励起状態の確率25%まで利用することができるため、理論的には内部量子効率が100%まで可能である。したがって、燐光発光物質を使用する場合、蛍光発光物質に比べて4倍程度高い発光効率を達成することができるという長所がある。
【0014】
前述のような構造を有する有機発光ダイオードにおいて、発光状態の効率と安定性を増加させるために発光色素(ドーパント)を発光層(ホスト)に添加することもある。
【0015】
このような構造においては発光層にいかなるホスト材料を使用するかによって発光ダイオードの効率と性能が変動するが、その間の発光層(ホスト)研究を通じてナフタレン、アントラセン、フェナントレン、テトラセン、ピレン、ベンゾピレン、クリセン、ピセン、カルバゾール、フルオレン、ビフェニル、テルフェニル、トリフェニレンオキシド、ジハロビフェニル、トランス−スチルベンおよび1,4−ジフェニルブタジエンなどが含まれた物質が有機ホスト物質の例として提示されてきた。
【0016】
ホスト材料として4,4−N,N−ジカルバゾールビフェニル(CBP)が主に使用されるが、この化合物はガラス転移温度が110℃以下であり、熱分解温度が400℃以下と熱安定性が低く、対称性が過度に良いため、結晶化し易く、素子の耐熱試験の結果、短絡や画素欠陥が発生するなどの問題の原因となる。
【0017】
また、CBPを含む大部分のホスト材料は正孔輸送性が電子輸送性よりも良い材料であって、注入された正孔の移動が注入された電子の移動よりも速いため、発光層で励起子が効果的に形成されないことによって、素子の発光効率が減少する現象が現れる。
【発明の概要】
【発明が解決しようとする課題】
【0018】
したがって、ホスト材料、正孔伝達材料、または電子伝達材料として使用される、熱的安定性が高く、三重項励起エネルギー(T1)が高い電荷輸送材料の開発が必要である。
【課題を解決するための手段】
【0019】
本発明の一実施形態は、ホスト材料、正孔伝達材料、または電子遮断材料として使用されうる電荷輸送材料を提供するために、高い電荷輸送性、膜安定性、および高い三重項励起エネルギー(T1)を有する新規なピロール系化合物を提供することにその目的がある。
【0020】
本発明の他の実施形態は、前記ピロール系化合物を含む有機光電素子を提供することにその目的がある。
【0021】
本発明が目的とする技術的課題は、以上で言及した技術的課題に制限されず、言及されていない他の技術的課題は下記の記載から当業者であれば明確に理解しうる。
【0022】
本発明の一実施形態によれば、下記一般式1で表される有機光電素子用ピロール系化合物を提供する。
【0023】
【化1】

【0024】
(前記一般式1において、
R'は、水素、および炭素数1〜6のアルキル基からなる群より選択され、
Ar1〜Ar7は、互いに同一または異なるものであって、それぞれ独立して、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、ただし、前記Ar1〜Ar5は、ピロール誘導体ではなく、
X1〜X10は、互いに同一または異なるものであって、それぞれ独立して、CR’’、およびNからなる群より選択され、
前記R’’は、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、
nは、1〜2の整数である。)
本発明の他の実施形態によれば、陽極、陰極、および前記陽極と陰極との間に有機薄膜層を含み、前記有機薄膜層は、前記ピロール系化合物を含む。
【0025】
その他、本発明の実施形態の具体的な事項は以下の詳細な説明に記載されている。
【発明の効果】
【0026】
本発明によるピロール系化合物は、ホスト材料、正孔伝達材料、または電子遮断材料として使用されうるため、有機光電素子の有機発光層、正孔輸送層、電子阻止層などの有機薄膜層に極めて有用に適用されうる。
【図面の簡単な説明】
【0027】
【図1】本発明の一実施形態による有機光電素子の断面図である。
【図2】本発明の実施例1で製造したM−7化合物の1H−NMRスペクトルを示す図である。
【図3】本発明の実施例2で製造したM−8化合物の1H−NMRスペクトルを示す図である。
【図4】本発明の実施例9で製造したM−15化合物の1H−NMRスペクトルを示す図である。
【図5】本発明の実施例2で製造したM−8化合物のフォトルミネッセンス(PL)を示すグラフである。
【図6】本発明の実施例18で製造したM−14化合物を含む有機発光ダイオードの電流密度を示すグラフである。
【図7】本発明の実施例18で製造したM−14化合物を含む有機発光ダイオードの電圧に対する輝度を示すグラフである。
【図8】本発明の実施例18で製造したM−14化合物を含む有機発光ダイオードの発光効率に対する輝度を示すグラフである。
【発明を実施するための形態】
【0028】
以下、本発明の実施形態を詳しく説明する。ただし、これは例示として提示されるものであり、これにより本発明が制限されず、本発明は後述する特許請求の範囲の範疇により定義される。
【0029】
本明細書で「置換」とは、別途の定義がない限り、それぞれ炭素数1〜30のアルキル基、ハロゲン基、炭素数1〜30のアルコキシ基、炭素数1〜30のハロアルキル基、炭素数6〜30のアリール基、および炭素数2〜30のヘテロアリール基からなる群より選択される置換基で少なくとも1つ置換されていることを意味する。
【0030】
本明細書で「ヘテロ」とは、別途の定義がない限り、一つの環基内にN、O、S、およびPからなる群より選択されるヘテロ原子を1〜3個含有し、残りは炭素であることを意味する。
【0031】
本発明の一実施形態によれば、下記一般式1で表されるピロール系化合物を提供する。
【0032】
【化2】

【0033】
(前記一般式1において、
R'は、水素、および炭素数1〜6のアルキル基からなる群より選択され、
Ar1〜Ar7は、互いに同一または異なるものであって、それぞれ独立して、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、ただし、前記Ar1〜Ar5は、ピロール誘導体ではなく、
X1〜X10は、互いに同一または異なるものであって、それぞれ独立して、CR’’、およびNからなる群より選択され、
前記R’’は、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、
nは、1〜2の整数である。)
前記一般式1において、nは、1または2の整数である。nが0である場合、UV吸収波長およびPL発光波長を調節するのが難しい。したがって、本発明の一実施形態によるピロール系化合物を燐光ホストとして使用して青色から赤色まで発光色を発現し難くなるおそれがある。しかしながら、nが前記範囲である場合、このような問題を解決することができる。
【0034】
前記一般式1において、Ar1〜Ar5は、ピロール誘導体でありえない。特に、前記ピロール誘導体は、下記一般式2で表される化合物ではない。Ar1〜Ar5が下記一般式2で表される化合物である場合、三重項励起エネルギー(T1)の調節が難しいため、燐光ホストとして使用されうる。したがって、ピロール化合物をより多様な用途で使用することが容易ではない。
【0035】
【化3】

【0036】
(前記一般式2において、
互いに同一または異なるものであって、それぞれ独立して、CR’’、およびNからなる群より選択され、
前記R’’は、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、
Ar6〜Ar7は、互いに同一または異なるものであって、それぞれ独立して、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択されるものである。)
特に、前記一般式1および2において、Ar1〜Ar7は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のカルバゾール基;置換または非置換のアリールアミン基;置換または非置換のフェニル基;置換または非置換のトリル基;置換または非置換のナフチル基;置換または非置換のスチルベン基;置換または非置換のフルオレン基;置換または非置換のアントラセニル基;置換または非置換のテルフェニル基;置換または非置換のピレニル基;置換または非置換のジフェニルアントラセニル基;置換または非置換のジナフチルアントラセニル基;置換または非置換のペンタセニル基;置換または非置換のブロモフェニル基;置換または非置換のヒドロキシフェニル基;置換または非置換のチエニル基;置換または非置換のピリジル基;置換または非置換のアゾベンゼニル基;および置換または非置換のフェロセニル基からなる群より選択されるものをより好ましく使用することができる。
【0037】
前記一般式1および2において、Ar1〜Ar7は、互いに同一または異なるものであって、それぞれ独立して、下記の化学式1〜29で表される化合物からなる群より選択されるものを使用することがより好ましい。
【0038】
【化4−1】

【0039】
【化4−2】

【0040】
【化4−3】

【0041】
(前記化学式1〜29において、R1〜R76は、それぞれ独立して、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、
n1〜n67は、それぞれ独立して、0〜5の整数である。)
本発明によるピロール系化合物のより具体的な例を挙げれば、下記の化学式30〜91で表される通りである。
【0042】
【化5−1】

【0043】
【化5−2】

【0044】
【化5−3】

【0045】
【化5−4】

【0046】
【化5−5】

【0047】
【化5−6】

【0048】
【化5−7】

【0049】
【化5−8】

【0050】
【化5−9】

【0051】
【化5−10】

【0052】
【化5−11】

【0053】
【化5−12】

【0054】
【化5−13】

【0055】
【化5−14】

【0056】
【化5−15】

【0057】
【化5−16】

【0058】
【化5−17】

【0059】
【化5−18】

【0060】
【化5−19】

【0061】
【化5−20】

【0062】
【化5−21】

【0063】
【化5−22】

【0064】
本発明によるピロール系化合物が電子阻止層および正孔輸送層に使用される場合、正孔阻止性は分子内の正孔輸送骨格により低下する傾向があるため、電子阻止層として使用される場合には電子輸送骨格が含まれないことが好ましい。この電子輸送骨格としては、ベンゾイミダゾール、ピリジン、ピラジン、ピリミジン、トリアジン、キノリン、イソキノリンなどを例示することができる。ただし、本発明の化合物が電子輸送性、正孔輸送性の両方を要求される場合には、前記電子輸送骨格を導入することが発光ダイオードの寿命向上させ駆動電圧を減少させる。
【0065】
前記本発明によるピロール系化合物は、最大発光波長が320〜500nmの範囲を示し、三重項励起エネルギー(T1)が2.0eV以上、より具体的に2.0〜4.0eVの範囲であるものであって、高い三重項励起エネルギーを有するホストの電荷がドーパントに良好に伝達されてドーパントの発光効率を上げることができ、材料のHOMOとLUMOエネルギー準位を自由に調節して駆動電圧を下げることができる。そのため、ピロール系化合物は、ホスト材料または電荷輸送材料として極めて有用に使用されうる。
【0066】
しかも、前記ピロール系化合物は、その光活性および電気的な性質のため、非線形光学素材、電極材料、変色材料、光スイッチ、センサー、モジュール、ウェーブガイド、有機トランジスタ、レーザー、光吸収体、誘電体および分離膜などの材料としても極めて有用に適用されうる。特に、本発明によるピロール系化合物は、光電素子用としてより有用に適用されうる。
【0067】
本発明の他の一実施形態によれば、陽極、陰極、および前記陽極と陰極との間に介される有機薄膜層を含み、前記有機薄膜層は、本発明によるピロール系化合物を含む有機光電素子を提供する。前記有機光電素子は、有機発光素子、有機太陽電池、有機トランジスター、有機感光体ドラム、有機メモリ素子などを意味する。特に、前記有機光電素子は、有機発光ダイオードであることが好ましい。
【0068】
前記本発明によるピロール系化合物は、発光層の有機薄膜層に含まれても良い。また、正孔注入層(HIL)、正孔輸送層(HTL)、正孔阻止層およびこれらの組み合わせからなる群より選択される有機薄膜層、または電子注入層(EIL)、電子輸送層(ETL)、電子阻止層、およびこれらの組み合わせからなる群より選択される有機薄膜層に含まれても良い。
【0069】
陽極、陰極、および前記陽極と陰極との間に有機薄膜層を含む有機光電素子は、陽極、発光層、および陰極を含む一般的な素子構成を有しても良い。前記有機光電素子の前記有機薄膜層は中間層、正孔輸送層(HTL)、および電子輸送層(ETL)をさらに含んで構成されても良い。この時、前記中間層は、正孔注入層(HIL)、正孔阻止層、電子注入層(EIL)、電子阻止層のようなバッファー層を意味する。
【0070】
図1は、本発明の一実施形態による有機光電素子1の断面図を模式的に示した図面である。図1は、基板11、陽極12、正孔輸送層(HTL)13、発光層14、電子輸送層(ETL)15、および陰極16から構成された有機光電素子の構造を示す。
【0071】
以下、図1を参照して前記化合物を利用して有機光電素子を製造する方法を説明する。
【0072】
まず、基板11上に陽極12用物質をコーティングする。
【0073】
ここで、基板11としては、通常の有機光電素子として使用される基板を使用するが、透明性、表面平滑性、取り扱いの容易性、および撥水性に優れたガラス基板、または透明プラスチック基板を使用しても良い。
【0074】
また、前記陽極12用物質としては、透明で伝導性に優れた酸化インジウム錫(ITO)、酸化錫(SnO2)、酸化亜鉛(ZnO)などを使用しても良い。
【0075】
次に、正孔輸送層(HTL)13が陽極12上に真空蒸着、スパッタリング、またはスピンコーティングを利用して形成されても良く、前記正孔輸送層(HTL)13上に発光層14が真空蒸着、スピンコーティング、インクジェットプリンティングなどの溶液コーティング法を利用して形成されても良い。
【0076】
また、電子輸送層15が発光層14と陰極16の中間に形成される。
【0077】
この時、前記発光層14、正孔輸送層(HTL)13、および電子輸送層(ETL)15の厚さは当該分野で使用する範囲で形成し、特に限定しないが、前記発光層14の厚さは、5nm〜1μmであることが好ましく、10〜500nmであることがより好ましく、前記正孔輸送層(HTL)13、および電子輸送層(ETL)15の厚さは、それぞれ10〜10,000Åであることが好ましい。
【0078】
前記電子輸送層(ETL)15には、通常の電子輸送層(ETL)15に用いる物質を使用して真空蒸着、スパッタリング、またはスピンコーティングを利用して形成されても良い。
【0079】
前記正孔輸送層(HTL)13および電子輸送層(ETL)15は、運搬者を発光層14に効率的に伝達させることによって、発光層14内で発光による結合の確率を高める役割を果たす。
【0080】
前記正孔輸送層(HTL)13に用いる物質は、特に制限されないが、ポリ(スチレンスルホン酸)(PSS)でドーピングされたポリ(3,4−エチレンジオキシ−チオフェン)(PEDOT)、N,N'−ビス(3−メチルフェニル)−N,N−ジフェニル−[1,1'−ビフェニル]−4,4'−ジアミン(TPD)を使用するのが好ましい。
【0081】
前記電子輸送層(ETL)15に用いる物質は、特に制限されないが、アルミニウムトリヒドロキシキノリン(Alq3)、1,3,4−オキサジアゾール誘導体である2−(4−ビフェニルイル−5−フェニル−1,3,4−オキサジアゾール(PBD)、キノキサリン誘導体である1,3,4−トリス[3−フェニル−6−トリフルオロメチル)キノキサリン−2−イル]ベンゼン(TPQ)、およびトリアゾール誘導体などを使用するのが好ましい。
【0082】
また、高分子は、燐光発光可能な有機化合物と混合して使用しても良い。前記燐光有機化合物としては、三重項状態から燐光発光可能な有機金属錯体であり、少なくともGregor Johann Mendelの周基律表VIII族金属イオンを含む金属錯体を好ましく使用しても良い。前記周基律表VIII族金属イオンは、Fe、Co、Ni、Ru、Rh、Pd、Os、Ir、およびPtからなる群より選択される金属イオンを使用するのが好ましく、IrまたはPtを使用するのがより好ましい。
【0083】
下記の化学式92〜94に具体的な金属錯体の例に挙げるが、前記金属錯体はこれらに限定されない。
【0084】
【化6】

【0085】
一方、溶液コーティング法を利用して前記発明化合物で前記有機膜を形成する場合、他の低分子ホスト材料と混合して使用しても良い。下記の化学式95〜98に低分子ホスト材料の具体的な例を挙げるが、本発明はこれらに限定されない。
【0086】
【化7】

【0087】
また、前記化合物は、フッ素系高分子、ポリフェニレンビニレン系高分子、ポリパラフェニレン系高分子などの共役二重結合を有する高分子と混合して使用しても良く、場合によってはバインダー樹脂を混合して使用しても良い。
【0088】
前記バインダー樹脂は、ポリビニルカルバゾール(PVK)、ポリカーボネート、ポリエステル、ポリアンアリーレート(polyan arylate)、ポリスチレン、アクリル系高分子、メタクリル系高分子、ポリブチラール、ポリビニルアセタール、ジアリルフタレート系高分子、フェノール系樹脂、エポキシ系樹脂、シリコン系樹脂、ポリスルホン系樹脂、または尿素系樹脂などがあり、この樹脂は単独または組み合わせて使用しても良い。
【0089】
選択的には、正孔阻止層を真空蒸着などの方法で形成させて発光層14の正孔の輸送速度を制限し、電子−正孔の再結合の確率を増加させることができる。
【0090】
前記電子輸送層(ETL)上に陰極16用物質をコーティングする。
【0091】
前記陰極用物質としては、仕事関数が小さいリチウム(Li)、マグネシウム(Mg)、カルシウム(Ca)、アルミニウム(Al)、Al:Li、Ba:Li、またはCa:Liなどが使用される。
【実施例】
【0092】
以下、本発明の具体的な実施例を提示する。ただし、以下に記載された実施例は本発明を具体的に例示したり説明したりするためのものに過ぎず、これらによって本発明を制限してはならない。
【0093】
また、ここに記載されていない内容は、当該技術分野で通常の知識を有する者であれば十分に技術的に理解することができる。
【0094】
以下の合成例1〜6では、本発明の一実施形態による化合物を製造するための単量体M−1〜M−6をそれぞれ反応式1〜6の通り製造した。
【0095】
〔合成例1〕:M−1の合成
【0096】
【化8】

【0097】
メカニカル撹拌機を備え、溶媒として200mlのアセトンが入っている500mlの丸底フラスコにエチニルベンゼン23g(0.22mol)、塩化銅(I)1.2g(12.1mmol)およびN,N,N',N'−テトラメチルエチレンジアミン(TMEDA)1.4g(12mmol)を入れ、常温で酸素をバブリングしながら1時間強く撹拌した。反応終結後、減圧乾燥して溶媒を除去し、5%塩酸水溶液に沈殿させて白色の固体を得た。得られた固体をエタノールで再結晶して乾燥した結果、透明な結晶M−1を18.4g(収率:81%)得た。その融点は87〜88℃であった。
【0098】
〔合成例2〕:M−2の合成
【0099】
【化9】

【0100】
アルゴン雰囲気下、250mlの丸底フラスコに1,4−ジ−フェニルブタジエン(M−1)5g(24.7mmol)、p−ブロモアニリン4.67g(27.1mmol)および塩化銅(I)0.58g(5.9mmol)を入れて150℃で撹拌しながら5時間反応させた。反応後に反応物を冷却し、塩化メチレンに溶解して、5%塩酸で数回洗浄した。得られた有機溶液を再び水で数回洗浄した後、有機溶液を無水硫酸マグネシウムで乾燥し、溶媒を除去して得られた固体を酢酸エチルで再結晶して白色の固体M−2を4.5g(収率:48.7%)得た。固体M−2の融点は218〜219℃であった。
【0101】
〔合成例3〕:M−3の合成
【0102】
【化10】

【0103】
アルゴン雰囲気下、250mlの丸底フラスコに1,4−ジフェニルブタジエン(M−1)5g(24.7mmol)、3−ブロモ−4−メチルアニリン5.06g(27.1mmol)のおよび塩化銅(I)0.58g(5.9mmol)を入れて150℃で撹拌しながら5時間反応させた。反応後に反応物を冷却し、塩化メチレンに溶解して、5%塩酸で数回洗浄した。得られた有機溶液を再び水で数回洗浄した後、有機溶液を無水硫酸マグネシウムで乾燥し、溶媒を除去して得られた固体を酢酸エチルで再結晶して、白色の固体M−3を5.94g(収率:62%)得た。
【0104】
〔合成例4〕:M−4の合成
【0105】
【化11】

【0106】
メカニカル撹拌機を備えた、溶媒として200mlのアセトンが入っている500mlの丸底フラスコに1−エチニル−4−メチルベンゼン25g(0.21mol)、塩化銅(I)1.2g(12.1mmol)およびN,N,N',N'−テトラメチルエチレンジアミン(TMEDA)1.4g(12mmol)を入れ、常温で1時間酸素をバブリングしながら撹拌した。反応終結後、減圧乾燥して溶媒を除去し、5%塩酸水溶液に沈殿させて白色の固体を得てこれをろ過した。得られた固体をエタノールで再結晶して乾燥させた結果、透明な結晶M−4を18.8g(収率:78%)得た。その融点は182〜183℃であった。
【0107】
〔合成例5〕:M−5の合成
【0108】
【化12】

【0109】
アルゴン雰囲気下、250mlの丸底フラスコに1,4−ビス(p−トリル)ブタジエン(M−4)5g(21.7mmol)、p−ブロモアニリン4.1g(23.8mmol)および塩化銅(I)0.51g(5.2mmol)を入れて150℃で撹拌しながら5時間反応させた。反応後に反応物を冷却し、塩化メチレンに溶解して5%塩酸で数回洗浄した。得られた有機溶液を再び水で数回洗浄した後、有機溶液を無水硫酸マグネシウムで乾燥し、溶媒を除去して得られた固体を酢酸エチルで再結晶して、白色の固体M−5を5.5g(収率:63%)得た。
【0110】
〔合成例6]:M−6の合成
【0111】
【化13】

【0112】
アルゴン雰囲気下、250mlの丸底フラスコに1,4−ビス(p−トリル)ブタジエン(M−4)6g(26mmol)、3−ブロモアニリン4.9g(28mmol)および塩化銅(I)0.61g(6.2mmol)を入れて150℃で撹拌しながら5時間反応させた。反応後に反応物を冷却し、塩化メチレンに溶解して5%塩酸で数回洗浄した。得られた有機溶液を再び水で数回洗浄した後、有機溶液を無水硫酸マグネシウムで乾燥し、溶媒を除去して得られた固体を塩化メチレン/ヘキサン(1:2体積比)混合溶媒によりシリカゲルカラムクロマトグラフィーで精製して白色のM−6を5.8g(収率:66.4%)得た。
【0113】
下記の実施例1〜10では本発明の一実施形態によるピロール系化合物を製造した。
【0114】
〔実施例1〕:M−7の合成
【0115】
【化14】

【0116】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−2(1.5g、4.0mmol)、物質A(2.13g、4.4mmol)、テトラキストリフェニルホスフィンパラジウム(0.14g、0.12mmol)を30mLのテトラヒドロフラン(THF)に溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0117】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0118】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過し、溶媒を除去した。
【0119】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒によりシリカゲルカラムクロマトグラフィーで精製した後、塩化メチレン/ヘキサン(体積比1:3)混合溶媒を用いて再結晶し、白色のM−7を1.6g(収率:61.6%)得た。白色のM−7の薄膜状態での最大発光波長は405nmであった。
【0120】
〔実施例2〕:M−8の合成
【0121】
【化15】

【0122】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−5(1.5g、3.7mmol)、物質B(2.19g、4.1mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0123】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0124】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過し、溶媒を除去した。
【0125】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒によりシリカゲルカラムクロマトグラフィーで精製した後、塩化メチレン/ヘキサン(体積比1:3)混合溶媒を用いて再結晶し、白色のM−8を1.7g(収率:62.7%)得た。白色のM−8の薄膜状態での最大発光波長は442nmであった。
【0126】
〔実施例3〕:M−9の合成
【0127】
【化16】

【0128】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−5(1.5g、3.7mmol)、物質C(1.51g、4.1mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0129】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0130】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過し、溶媒を除去した。
【0131】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒によりシリカゲルカラムクロマトグラフィーで精製した後、塩化メチレン/ヘキサン(体積比1:3)混合溶媒を用いて再結晶し、白色のM−9を1.5g(収率:71.4%)得た。白色のM−9の薄膜状態での最大発光波長は422nmであった。
【0132】
〔実施例4〕:M−10の合成
【0133】
【化17】

【0134】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−2(1.5g、4.0mmol)、物質D(1.63g、4.4mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0135】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0136】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過し、溶媒を除去した。
【0137】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒を用いて再結晶し、白色のM−10を1.2g(収率:55.8%)得た。白色のM−10の薄膜状態での最大発光波長は398nmであった。
【0138】
〔実施例5〕:M−11の合成
【0139】
【化18】

【0140】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−6(1.5g、3.7mmol)、物質B(2.19g、4.1mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0141】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0142】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過した後、溶媒を除去した。
【0143】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒によりシリカゲルカラムクロマトグラフィーで精製した後、塩化メチレン/ヘキサン(体積比1:3)混合溶媒を用いて再結晶し、白色のM−11を1.95g(収率:72%)得た。白色のM−11の薄膜状態での最大発光波長は423nmであった。
【0144】
〔実施例6〕:M−12の合成
【0145】
【化19】

【0146】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−6(1.5g、3.7mmol)、物質A(1.98g、4.1mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0147】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0148】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過した後、溶媒を除去した。
【0149】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒を用いて再結晶し、白色のM−12を1.86g(収率:74%)得た。前記M−12の薄膜状態での最大発光波長は405nmであった。
【0150】
〔実施例7〕:M−13の合成
【0151】
【化20】

【0152】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−3(1.5g、3.8mmol)、物質B(2.27g、4.2mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0153】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0154】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過した後、溶媒を除去した。
【0155】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒を用いて再結晶し、白色のM−13を1.87g(収率:67.7%)得た。白色のM−13の薄膜状態での最大発光波長は391nmであった。
【0156】
〔実施例8〕:M−14の合成
【0157】
【化21】

【0158】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−3(1.5g、3.8mmol)、物質A(1.96g、4.0mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0159】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0160】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過した後、溶媒を除去した。
【0161】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒によりシリカゲルカラムクロマトグラフィーで精製し、白色のM−14を1.33g(収率:52%)得た。白色のM−14の薄膜状態での最大発光波長は378nmであった。
【0162】
〔実施例9〕:M−15の合成
【0163】
【化22】

【0164】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−3(1.5g、3.8mmol)、物質E(1.99g、4.6mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0165】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0166】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過した後、溶媒を除去した。
【0167】
前記反応物を塩化メチレン/ヘキサン(体積比2:1)混合溶媒によりシリカゲルカラムクロマトグラフィーで精製した後、塩化メチレン/ヘキサン(体積比2:1)混合溶媒を用いて再結晶して白色のM−15を1.5g(収率:63.4%)得た。白色のM−15の薄膜状態での最大発光波長は417nmであった。
【0168】
〔実施例10〕:M−16の合成
【0169】
【化23】

【0170】
アルゴン雰囲気下、温度計と還流コンデンサ、撹拌機を備えた100mlの丸底フラスコ内で、M−6(1.2g、3.0mmol)、物質F(1.32g、3.2mmol)、テトラキストリフェニルホスフィンパラジウム0.13g(0.11mmol)を30mLのTHFに溶かし、ここに20%テトラトリエチルアンモニウムヒドロキシド15mLを入れた後、75℃で24時間還流させて反応させた。
【0171】
反応終了後、反応物を室温まで冷却し、塩化メチレンで数回抽出した後、抽出物を水で数回洗浄した。
【0172】
その後、無水硫酸マグネシウムで洗浄した反応物の水分を除去し、これをろ過した後、溶媒を除去した。
【0173】
前記反応物を塩化メチレン/ヘキサン(体積比1:3)混合溶媒を用いて再結晶して白色のM−16を1.3g(収率:72.7%)得た。白色のM−16の薄膜状態での最大発光波長は435nmであった。
【0174】
〔前記化合物の分析および特性測定〕
前記実施例1〜10で製造されたM−7〜M−16化合物の構造分析のためにCD2Cl2溶媒に溶かした後、300MHzのNMR装置を利用して1H−NMRを測定した。前記実施例1で製造されたM−7の1H−NMRの結果を図2に示し、実施例2で製造されたM−8の1H−NMRの結果を図3に示し、実施例9で製造されたM−15の1H−NMRの結果を図4に示す。前記M−7〜M−16の蛍光特性を測定するために、ガラス基板に薄膜を形成した後、HITACHI F−4500を利用してPL(photoluminescence)波長を測定した。前記実施例2で製造されたM−8に対するPL波長測定の結果を図5に示す。
【0175】
図5より、M−8の薄膜状態での最大発光波長は442nmであることをが分かる。
【0176】
〔実施例11〜20]:有機発光ダイオードの製造
陽極としてはITO基板を使用し、前記基板上にポリ(3,4−エチレンジオキシ−チオフェン)(PEDOT)をスピンコーティングした。
【0177】
次に、前記PEDOT上に、実施例1〜10で製造された化合物をホストとして使用し、Ir(phq)2acacを7重量%でドーピングして発光層をスピンコーティングにより形成した。
【0178】
発光層上にBAlqを真空蒸着して50Å厚さの正孔阻止層を形成した。
【0179】
その後、前記発光層上にAlq3を真空蒸着して200Å厚さの電子輸送層(ETL)を形成した。
【0180】
前記電子輸送層(ETL)上にLiFを10ÅとAlを1000Å、順次に真空蒸着して陰極を形成することによって有機発光素子を完成した。
【0181】
前記有機発光素子は、5層の有機薄膜層を有する構造からなっており、具体的には、Al(1000Å)/LiF(10Å)/Alq3(200Å)/BAlq(50Å)/EML(M−14:Ir(phq)2acac)/PEDOT/ITO(1500Å)の構造で製造した。
【0182】
〔有機発光ダイオードの性能測定〕
実施例11〜21による有機発光ダイオードに対して電圧変化に対する電流密度変化、および電圧変化に対する輝度変化を測定した。具体的な測定方法は次の通りである。
【0183】
1)電圧に対する電流密度の変化測定
前記製造されたそれぞれの有機発光ダイオードに対し、電圧を0Vから上昇させながら電流−電圧計(Keithley 2400)を利用して単位素子に流れる電流値を測定し、測定された電流値を面積で分けて電流密度を測定した。
【0184】
前記M−14化合物を利用して製造された実施例18の有機発光ダイオードの電圧変化による電流密度の変化の結果を図6に示す。
【0185】
2)電圧変化に対する輝度変化測定
前記M−14化合物を利用して製造された実施例18の有機発光ダイオードに対し、電圧を0Vから上昇させながら輝度計(Minolta Cs−1000A)を利用して輝度を測定した。その結果を図7に示した。
【0186】
3)輝度変化に対する発光効率測定
前記M−14を利用して製造された実施例18による有機発光素子の輝度変化による電流効率(発光効率)変化測定結果を図8に示した。
【0187】
図6〜図8を参照すれば、前記M−14は有機発光素子用ホスト物質として有機発光素子の駆動電圧を下げ、輝度と効率を向上させることが分かる。
【0188】
〔電気化学的特性測定〕
前記製造されたM−7〜M−16化合物の電気化学的特性をサイクリックボルタンメトリー装置を利用して測定し、その結果を以下の表1に示した。
【0189】
【表1】

【0190】
表1によれば、前記実施例1〜10で製造されたM−7〜M−16は正孔輸送層および電子阻止層として使用されうることが分かる。
【0191】
本発明は前記実施例に限定されず、互いに異なる多様な形態で製造され、本発明が属する技術分野で通常の知識を有する者は本発明の精神および範囲に含まれる特徴を変更せずにさまざまな変更および等価な改良を行うだろう。したがって、以上で記述した実施例はすべての面で例示的なものであり、本発明をいかなる方法によっても限定するものではない。
【符号の説明】
【0192】
11 基板
12 陽極
13 正孔輸送層(HTL)
14 有機発光層
15 電子輸送層(ETL)
16 陰極
【特許請求の範囲】
【請求項1】
下記一般式1で表される有機光電素子用ピロール系化合物。
【化1】

(前記一般式1において、
R'は、水素、および炭素数1〜6のアルキル基からなる群より選択され、
Ar1〜Ar7は、互いに同一または異なるものであって、それぞれ独立して、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、ただし、前記Ar1〜Ar5は、ピロール誘導体ではなく、
X1〜X10は、互いに同一または異なるものであって、それぞれ独立して、CR’’、およびNからなる群より選択され、
前記R’’は、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、
nは、1〜2の整数である。)
【請求項2】
前記一般式1および2において、Ar1〜Ar7が、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のカルバゾール基;置換または非置換のアリールアミン基;置換または非置換のフェニル基;置換または非置換のトリル基;置換または非置換のナフチル基;置換または非置換のスチルベン基;置換または非置換のフルオレン基;置換または非置換のアントラセニル基;置換または非置換のテルフェニル基;置換または非置換のピレニル基;置換または非置換のジフェニルアントラセニル基;置換または非置換のジナフチルアントラセニル基;置換または非置換のペンタセニル基;置換または非置換のブロモフェニル基;置換または非置換のヒドロキシフェニル基;置換または非置換のチエニル基;置換または非置換のピリジル基;置換または非置換のアゾベンゼニル基;および置換または非置換のフェロセニル基からなる群より選択されるものである、請求項1に記載のピロール系化合物。
【請求項3】
前記一般式1および2において、Ar1〜Ar7が、互いに同一または異なるものであって、それぞれ独立して、下記の化学式1〜30で表される化合物からなる群より選択されるものである、請求項1に記載のピロール系化合物。
【化2−1】

【化2−2】

【化2−3】

(前記化学式1〜29において、
R1〜R76は、互いに同一または異なるものであって、それぞれ独立して、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、
前記n1〜n67は、それぞれ独立して、0〜5の整数である。)
【請求項4】
ホスト材料または電荷輸送材料として使用される、請求項1に記載のピロール系化合物。
【請求項5】
320〜500nmの範囲の最大発光波長を示す、請求項1に記載のピロール系化合物。
【請求項6】
2.0eV以上の三重項励起エネルギー(T1)を有する、請求項1に記載のピロール系化合物。
【請求項7】
陽極;陰極;および前記陽極と陰極との間に介される有機薄膜層を含み、
前記有機薄膜層に、請求項1〜6のいずれか一項に記載のベンズイミダゾール化合物を含む、有機光電素子。
【請求項8】
前記有機薄膜層が、発光層である、請求項7に記載の有機光電素子。
【請求項9】
前記有機薄膜層が、正孔注入層(HIL)、正孔輸送層(HTL)、正孔阻止層およびこれらの組み合わせからなる群より選択されるものである、請求項7に記載の有機光電素子。
【請求項10】
前記有機薄膜層が、電子注入層(EIL)、電子輸送層(ETL)、電子阻止層、およびこれらの組み合わせからなる群より選択されるものである、請求項7に記載の有機光電素子。
【請求項1】
下記一般式1で表される有機光電素子用ピロール系化合物。
【化1】

(前記一般式1において、
R'は、水素、および炭素数1〜6のアルキル基からなる群より選択され、
Ar1〜Ar7は、互いに同一または異なるものであって、それぞれ独立して、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、ただし、前記Ar1〜Ar5は、ピロール誘導体ではなく、
X1〜X10は、互いに同一または異なるものであって、それぞれ独立して、CR’’、およびNからなる群より選択され、
前記R’’は、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、
nは、1〜2の整数である。)
【請求項2】
前記一般式1および2において、Ar1〜Ar7が、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のカルバゾール基;置換または非置換のアリールアミン基;置換または非置換のフェニル基;置換または非置換のトリル基;置換または非置換のナフチル基;置換または非置換のスチルベン基;置換または非置換のフルオレン基;置換または非置換のアントラセニル基;置換または非置換のテルフェニル基;置換または非置換のピレニル基;置換または非置換のジフェニルアントラセニル基;置換または非置換のジナフチルアントラセニル基;置換または非置換のペンタセニル基;置換または非置換のブロモフェニル基;置換または非置換のヒドロキシフェニル基;置換または非置換のチエニル基;置換または非置換のピリジル基;置換または非置換のアゾベンゼニル基;および置換または非置換のフェロセニル基からなる群より選択されるものである、請求項1に記載のピロール系化合物。
【請求項3】
前記一般式1および2において、Ar1〜Ar7が、互いに同一または異なるものであって、それぞれ独立して、下記の化学式1〜30で表される化合物からなる群より選択されるものである、請求項1に記載のピロール系化合物。
【化2−1】

【化2−2】

【化2−3】

(前記化学式1〜29において、
R1〜R76は、互いに同一または異なるものであって、それぞれ独立して、水素;ハロゲン基;シアノ基;ヒドロキシル基;置換または非置換の炭素数1〜20のアミノ基;ニトロ基;カルボキシル基;フェロセニル基;置換または非置換の炭素数1〜20のアルキル基;置換または非置換の炭素数2〜20のアルケニル基;置換または非置換の炭素数6〜30のアリール基;置換または非置換の炭素数2〜30のヘテロアリール基;置換または非置換の炭素数1〜20のアルコキシ基;置換または非置換の炭素数6〜20のアリールオキシ基;置換または非置換の炭素数3〜40のシリルオキシ基;置換または非置換の炭素数1〜20のアシル基;置換または非置換の炭素数2〜20のアルコキシカルボニル基;置換または非置換の炭素数2〜20のアシルオキシ基;置換または非置換の炭素数2〜20のアシルアミノ基;置換または非置換の炭素数2〜20のアルコキシカルボニルアミノ基;置換または非置換の炭素数7〜20のアリールオキシカルボニルアミノ基;置換または非置換の炭素数1〜20のスルファモイルアミノ基;置換または非置換の炭素数1〜20のスルホニル基;置換または非置換の炭素数1〜20のアルキルチオール基;置換または非置換の炭素数6〜20のアリールチオール基;置換または非置換の炭素数1〜20のヘテロシクロチオール基;置換または非置換の炭素数1〜20のウレイド基;置換または非置換の炭素数1〜20の燐酸アミド基;および置換または非置換の炭素数3〜40のシリル基からなる群より選択され、
前記n1〜n67は、それぞれ独立して、0〜5の整数である。)
【請求項4】
ホスト材料または電荷輸送材料として使用される、請求項1に記載のピロール系化合物。
【請求項5】
320〜500nmの範囲の最大発光波長を示す、請求項1に記載のピロール系化合物。
【請求項6】
2.0eV以上の三重項励起エネルギー(T1)を有する、請求項1に記載のピロール系化合物。
【請求項7】
陽極;陰極;および前記陽極と陰極との間に介される有機薄膜層を含み、
前記有機薄膜層に、請求項1〜6のいずれか一項に記載のベンズイミダゾール化合物を含む、有機光電素子。
【請求項8】
前記有機薄膜層が、発光層である、請求項7に記載の有機光電素子。
【請求項9】
前記有機薄膜層が、正孔注入層(HIL)、正孔輸送層(HTL)、正孔阻止層およびこれらの組み合わせからなる群より選択されるものである、請求項7に記載の有機光電素子。
【請求項10】
前記有機薄膜層が、電子注入層(EIL)、電子輸送層(ETL)、電子阻止層、およびこれらの組み合わせからなる群より選択されるものである、請求項7に記載の有機光電素子。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公表番号】特表2012−501319(P2012−501319A)
【公表日】平成24年1月19日(2012.1.19)
【国際特許分類】
【出願番号】特願2011−524878(P2011−524878)
【出願日】平成20年12月31日(2008.12.31)
【国際出願番号】PCT/KR2008/007908
【国際公開番号】WO2010/027129
【国際公開日】平成22年3月11日(2010.3.11)
【出願人】(500005066)チェイル インダストリーズ インコーポレイテッド (263)
【Fターム(参考)】
【公表日】平成24年1月19日(2012.1.19)
【国際特許分類】
【出願日】平成20年12月31日(2008.12.31)
【国際出願番号】PCT/KR2008/007908
【国際公開番号】WO2010/027129
【国際公開日】平成22年3月11日(2010.3.11)
【出願人】(500005066)チェイル インダストリーズ インコーポレイテッド (263)
【Fターム(参考)】
[ Back to top ]

