フェニルボロン酸基と特異的に結合するオリゴペプチド配列
【課題】本発明は、蛋白質分子を固定化する方法として、固定化する分子の配向を制御することができ、煩雑な工程が必要なく、安定して固定化することができ、そして、固定化に使用する化学基が蛋白質の活性や機能に影響を及ぼさないような蛋白質固定化方法及び手段を提供することを目的とする。
【解決手段】水酸基含有アミノ酸を含む標識ペプチド配列を分子に付着させて標識分子を形成する工程と、フェニルボロン酸基を有する分子を前記標識分子と接触させることによって前記標識分子をフェニルボロン酸基を有する分子に捕捉する工程とを含む、分子の固定化方法。
【解決手段】水酸基含有アミノ酸を含む標識ペプチド配列を分子に付着させて標識分子を形成する工程と、フェニルボロン酸基を有する分子を前記標識分子と接触させることによって前記標識分子をフェニルボロン酸基を有する分子に捕捉する工程とを含む、分子の固定化方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、分子、例えば蛋白質分子を固定化する方法に関し、具体的には、フェニルボロン酸基を有する分子及び該フェニルボロン酸基と特異的かつ自発的に結合するペプチド配列を利用して、分子を固定化する方法に関する。また本発明は、分子の固定化方法に使用するための固体支持体及び発現ベクター、並びに分子固相化デバイス及びセンサに関する。
【背景技術】
【0002】
従来、蛋白質固定化方法としていくつかの方法が知られている。酵素(すなわち蛋白質)の産業利用を企図して、蛋白質内の様々なアミノ酸残基のうち反応性の高い側鎖と固体支持体上の官能基との間に結合生成させることにより、蛋白質分子を様々な固体支持体へ固定化する方法がいくつか開発されている。これらのうち反応の簡便さと、蛋白質分子を変性させずに穏やかな条件で反応させることが可能であるため広く用いられているものとして、アミンカップリング法と表面チオールカップリング法がある。
【0003】
アミンカップリング法とは固体支持体上に予め固定化しておいたカルボキシル基をN-ヒドロキシスクシンイミドと1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミドでスクシンイミジルエステルに変換して活性化しておき、そこへ蛋白質を添加することで、蛋白質分子表面のアミノ基と共有結合させる方法である(非特許文献1)。
【0004】
表面チオールカップリング法とは固体支持体上にスペーサーを経てチオール基を導入しておき、そこに活性化した蛋白質を添加して共有結合させる方法である(非特許文献2)。具体的には次の手順で行う。まず、蛋白質分子中のカルボキシル基を1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド存在下で2-(2-ピリジニルジチオ)エチルアミンと反応させ、活性なS-S結合を持つ誘導体へと変換しておく。次にアミンカップリングと同じ方法で活性化しておいた固体支持体にシスタミンを添加し、次いで還元することでチオール基へと誘導する。ここに先に誘導化した蛋白質を添加し、ジスルフィド交換を行うことで共有結合させ固定化が完了する。
【0005】
アミンカップリング法と表面チオールカップリング法は、両者とも特定の化学基を固定化対象とする(アミンカップリング法ではアミノ基(-NH2)、表面チオールカップリング法ではチオール基(-SH))方法であり、蛋白質分子を固定する際に蛋白質分子中の特定のアミノ酸側鎖の官能基に対して、固定基材側の化学基が反応する。典型的な真核生物由来の蛋白質分子の分子量は約5万であることから、その中には400〜500のアミノ酸残基が含まれており、従って同種のアミノ酸が複数個、分子表面の様々な方向を向いて存在している。このため蛋白質分子を固定した際、分子の配向が不均一となる。このため、引き続き行う相互作用解析や固体支持体上での酵素反応に不向きな配向に蛋白質が固定される場合が多々ある。
【0006】
この様な固定化の際の配向の不均一性を回避するため、生体高分子間の特異的相互作用を利用した固定化法が開発されている(非特許文献3)。アビジン-ビオチン相互作用を応用した系は両分子の安定性と、中性pH付近で自発的に両分子が結合することなどから広く実用化されている。アビジン-ビオチン複合体については結晶構造も解明されており、原子レベルで相互作用の様式が明らかにされている。
【0007】
ビオチン分子が基盤蛋白質アビジンに結合した複合体の三次元構造から、アビジン分子表面のうち広く周辺に暴露されている部分にビオチン分子が結合していることが明らかになった。このため、ビオチン分子により修飾された(蛋白質分子等の)巨大分子の作用を立体障害で阻害することが無く、これもこれまで広範に応用されてきた理由の一つとなっている。さらに、蛋白質分子中の特定の位置にビオチン化配列を導入できることから、蛋白質分子の固定化の際の分子の配向を均一にすることができる。
【0008】
しかし、この方法は固定化に先立ってターゲット分子(蛋白質)をビオチン修飾する必要があり、かつ、固定先の固体支持体の方にも何らかの方法でアビジン分子を先に固定化する必要もあり、煩雑な工程を要する。また、ターゲット蛋白質に十数残基に及ぶアミノ酸配列をビオチン修飾用に導入する必要があり、これがターゲット蛋白質の本来の機能を損なう恐れもある。さらに、固体支持体にアビジンの様な巨大分子を固定化する必要があるため、系全体に関与する分子量が増大し、固定化後に電荷移動や微妙な分子量変化を測定する必要がある場合には適当ではない。
【0009】
蛋白質分子への固体支持体に対する配向が制御でき、かつ、系に導入される化学基による分子量変化の少ない固定化法としてヒスチジンタグを利用する方法がある(特許文献1〜3)。ヒスチジンタグはヒスチジン4〜6残基からなるペプチド配列であり、この部位が金属イオンをキレートできる。この配列は蛋白質分子中の任意の箇所に導入できることから、固体支持体に固定する際の蛋白質分子の配向制御が可能である。また、ペプチド配列は4〜6残基であり、固体支持体上において金属イオンを保持する環状配位子の分子量も高々200程度であるため、系全体の分子量増大は少ない。
【0010】
しかし、ヒスチジンタグを利用した方法は、金属イオンをキレートして結合する配位結合であるため、共有結合に比して、その結合安定性及び結合強度は低く、pH変化や周辺の塩濃度変化に影響され易く解離が起こり易い。蛋白質固定化固体支持体としての安定性は上記三法に比して劣る。
【0011】
その他、非天然アミノ酸を組み込んだポリペプチドと、該非天然アミノ酸の側鎖と特異的に相互作用する官能基を有する分子を用いて、ポリペプチドを検出する方法(特許文献4)や、非天然アミノ酸を組み込んだポリペプチドを、該非天然アミノ酸によって固体支持体に付着させて、固体支持体結合蛋白質を調製する方法(特許文献5)が報告されている。
【0012】
一方、ポリ ((2-メタクリロイロキシエチルホスホリルコリン)-co-(n-ブチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))(本明細書中、「PMBV」と称する)は、3つのユニットからなる高分子である。それぞれのユニットはMPC、BMA及びVPBAと呼ばれるもので、各ユニットが独自の役割を担っている。
【0013】
MPCユニットのホスホリルコリン基は、生体内において、細胞膜の脂質二重層における親水基の1つとして知られている。脂質二重層は生体内における液−液界面の境界(細胞膜)をなすものであるため、ほとんどの生体高分子はこの境界面に対して非特異吸着しないようにできている。これにより、MPCユニットはPMBVポリマーへ蛋白質等の生体高分子が非特異吸着することを妨げ、PMBVポリマーをコートした基材の生体適合性を向上させる役割を担っている(非特許文献4)。
【0014】
BMAユニットは、ポリマー合成の際に重合速度が速くなりすぎることを抑制する役を担っている。また、MPC及びVPBAのみでは、それぞれが極度に親水性(MPC)及び疎水性(VPBA)であるために、MPCが外側、VPBAが内側となった粒状のミセル形成が促進されるが、BMAはMPCとVPBAとの中間の親水性を持つため、これを添加することによりミセル形成を抑制し、ポリマーを水溶液中に均一に展開できるようにする役割を担っている。
【0015】
VPBAユニットは、他の分子との共有結合形成反応活性を有する活性残基である。PMBVポリマーはそれ自身のみでコーティング剤として基材の生体適合性を上昇させる機能を持っている。しかし、他のポリマーと反応させることでゲルやシートに加工し、それ自身を生体適合性基材として用いることもできる。このとき、ポリビニルアルコール(PVA)の様に分子内に-OH基を複数有し、それらがある距離内に近接できるフレキシブルな構造を持っているポリマーと反応させると、VPBA内のボロン酸(boronic acid)基がこれら複数の-OH基と反応することにより二価の共有結合を形成することができる。このようにPMBVはPVAと反応させることで簡単にゲルやシートに加工することができ、PMBV中の各ユニットの組成比を変化させることにより含水率や硬度も調整することができる(非特許文献5)。
【0016】
このような3つのユニットから成るPMBVは、細胞膜成分由来のホスホリルコリン基に起因する生体不活性(bioinert)な性質を利用して、人工血管や人工関節のコーティングに用いられ、それらの長期使用を可能にしている(非特許文献6及び7)。さらに、PVA等と反応させることにより簡単にゲル化する性質を利用して、ゲル内で細胞一つ一つを独立させて培養する技術への応用も始まっている(非特許文献5)。これは今後広まっていくと考えられている一細胞解析に必須な要素技術として期待されている。
【先行技術文献】
【特許文献】
【0017】
【特許文献1】特表2007−525653号公報
【特許文献2】特開2005−261313号公報
【特許文献3】特表2004−534730号公報
【特許文献4】特表2009−520949号公報
【特許文献5】特表2006−511797号公報
【非特許文献】
【0018】
【非特許文献1】Symington F. W., Subbarao B., Mosier D. E., Sprent J. Immunogenetics, 16:381-391, 1982年
【非特許文献2】Lofas S., Johnsson B., Edstrom A., Hansson A., Lindquist G., Muller Hillgren R-.M., Stigh L. Biosensors & Bioelectronics, 10:813-822, 1995年
【非特許文献3】Nilsson P., Persson B., Uhlen M., Nygren P.A. Anal. Biochem., 224:400-408, 1995年
【非特許文献4】Ishihara K., Nomura H., Mihara T., Kurita K., Iwasaki Y., Nakabayashi N. J. Biomed. Mater. Res., 39:323-330, 1998年
【非特許文献5】Konno T., Ishihara K. Biomaterials, 28:1170-1177, 2007年
【非特許文献6】Ishihara K., Fukumoto K., Iwasaki Y., Nakabayashi N. Biomaterials, 20:1553-1559, 1999年
【非特許文献7】Moro T., Takatori Y., Ishihara K., Konno T., Takigawa Y., Matsushita T., Chung U.I., Nakamura K., Kawaguchi H. Nature Mater., 3:829-836, 2004年
【発明の概要】
【発明が解決しようとする課題】
【0019】
本発明は、蛋白質分子を固定化する際に、固定化する分子の配向を制御することができ、煩雑な工程が必要なく、安定して固定化することができ、そして、固定化に使用する化学基が蛋白質の活性や機能に影響を及ぼさないような蛋白質固定化方法及び手段を提供することを目的とする。
【課題を解決するための手段】
【0020】
本発明者は上記課題を解決するため鋭意検討を行った結果、水酸基含有アミノ酸を含むペプチド配列が、フェニルボロン酸基と安定した共役結合を形成することから、該ペプチド配列とフェニルボロン酸基を有する分子を用いて、蛋白質分子等の分子を固定化することができるという知見を得た。また、(i)蛋白質分子の特定の位置に上記ペプチド配列を導入することで固定化の際の蛋白質分子の配向を制御することができ、(ii)分子内に予め固定化に必要なペプチド配列を導入することで先立つ煩雑な工程を省略でき、(iii)そして、結合反応に関与する化学基(リンカー)は、フェニルボロン酸基を有する分子のみで数百程度の分子量であり、またペプチド配列の分子量は数百から千数百とすることで、結合に関与する分子量の増大を制御可能であることも見出した。本発明は、上記知見に基づくものであり、上述した従来の課題を解決するものである。
【0021】
従って、本発明は以下を提供する。
[1]分子を固定化する方法であって、
水酸基含有アミノ酸を含む標識ペプチド配列を分子に付着させて標識分子を形成する工程と、
フェニルボロン酸基を有する分子を前記標識分子と接触させることによって前記標識分子をフェニルボロン酸基を有する分子に捕捉する工程と
を含む、分子の固定化方法。
[2]前記標識ペプチド配列が水酸基含有アミノ酸を2残基以上含むペプチド配列である、[1]に記載の方法。
[3]前記水酸基含有アミノ酸が、セリン、スレオニン及びチロシンからなる群より選択される1種以上である、[1]又は[2]に記載の方法。
[4]前記標識ペプチド配列が、前記水酸基含有アミノ酸に加えて、1〜3残基の塩基性アミノ酸を含む、[1]〜[3]のいずれかに記載の方法。
[5]前記塩基性アミノ酸が、リジン、アルギニン及びトリプトファンからなる群より選択される1種以上である、[4]に記載の方法。
[6]前記標識ペプチド配列が、連続した4〜6残基の水酸基含有アミノ酸からなるか、又は3〜5残基の水酸基含有アミノ酸と1〜3残基の塩基性アミノ酸の合計4〜6残基のアミノ酸からなる、[1]〜[5]のいずれかに記載の方法。
[7]前記標識ペプチド配列が、連続した7残基以上の水酸基含有アミノ酸からなるか、又は4残基以上の水酸基含有アミノ酸と1〜3残基の塩基性アミノ酸の合計7残基以上のアミノ酸からなる、[1]〜[5]のいずれかに記載の方法。
[8]前記分子が蛋白質である、[1]〜[7]のいずれかに記載の方法。
[9]前記標識ペプチド配列が、前記分子の活性部位又は認識領域から離れた位置で前記分子に共有結合により付着している、[1]〜[8]のいずれかに記載の方法。
[10]前記フェニルボロン酸基を有する分子が、2以上のフェニルボロン酸基を有するポリマーである、[1]〜[9]のいずれかに記載の方法。
[11]前記フェニルボロン酸基を有する分子が、ポリ((2-メタクリロイロキシエチルホスホリルコリン)-co-(n-ブチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))、又はポリ ((2-メタクリロイロキシエチルホスホリルコリン)-co-(ジメチルアミノエチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))である、[1]〜[10]のいずれかに記載の方法。
【0022】
[12]前記フェニルボロン酸基を有する分子が固体支持体に結合されている、[1]〜[11]のいずれかに記載の方法。
[13]前記フェニルボロン酸基を有する分子が固体支持体の表面に結合されており、前記分子が固体支持体の表面に固定化される、[1]〜[12]のいずれかに記載の方法。
[14]前記分子が前記固体支持体の表面に同一配向で保持されている単分子膜として固定化される、[13]に記載の方法。
[15]前記フェニルボロン酸基を有する分子が、フェニルボロン酸基と頭部基を含み、該頭部基が固体支持体と共有結合可能な官能基である、[12]〜[14]のいずれかに記載の方法。
[16]前記固体支持体が貴金属である、[12]〜[15]のいずれかに記載の方法。
[17]前記貴金属が、銀、金、白金及びパラジウムからなる群より選択される、[16]に記載の方法。
[18]前記固体支持体が電極である、[12]〜[15]のいずれかに記載の方法。
[19]前記固体支持体がプラスチックである、[12]〜[15]のいずれかに記載の方法。
[20]前記プラスチックが、ポリカーボネート、ポリエチレン、ポリプロピレン、ポリスチレン、ポリ塩化ビニル、及びポリエチレンテレフタレートからなる群より選択される、[19]に記載の方法。
[21]前記フェニルボロン酸基を有する分子が、直接又はスペーサー配列を介して固体支持体に結合されている、[12]〜[20]のいずれかに記載の方法。
【0023】
[22]前記フェニルボロン酸基を有する分子が架橋分子により架橋されて固定化基材を形成し、前記分子が該固定化基材に固定化される、[1]〜[11]のいずれかに記載の方法。
[23]前記架橋分子が多価アルコールである、[22]に記載の方法。
[24]前記多価アルコールがポリビニルアルコールである、[23]に記載の方法。
[25]前記固定化基材が、固体、高分子膜、高分子半透膜、固相ゲル及び液相ゲルからなる群より選択される1種以上である、[22]〜[24]のいずれかに記載の方法。
【0024】
[26]分子固相化用固体支持体であって、該固体支持体の表面に結合されたフェニルボロン酸基を有する分子を有することを特徴とする分子固相化用固体支持体。
[27]水酸基含有アミノ酸を含む標識ペプチド配列をコードするDNAと、蛋白質分子をコードするDNAを挿入するためのカセットとを含むことを特徴とする、標識ペプチド配列との融合蛋白質を発現するための発現ベクター。
[28]水酸基含有アミノ酸を含む標識ペプチド配列と付着した分子が、フェニルボロン酸基を有する分子を介して固体支持体に固定化されていることを特徴とする分子固相化デバイス。
[29]水酸基含有アミノ酸を含む標識ペプチド配列と付着した分子が、フェニルボロン酸基を有する分子を介して固定化基材に固定化されており、該固定化基材が、フェニルボロン酸基を有する分子を架橋分子により架橋して形成されていることを特徴とする分子固相化デバイス。
[30][28]又は[29]に記載の分子固相化デバイスと、分子間相互作用を検出する手段とを備えることを特徴とするセンサ。
【発明の効果】
【0025】
本発明により、分子を固定化するための方法及び手段が提供される。本方法及び手段は、分子(例えば蛋白質分子)の任意の部位に固定に必要なペプチド配列を導入することができるため、固体支持体上における分子の配向を制御することができる。また、分子を固定化するための結合反応は中性pH付近で自発的に起こるため前処理工程を必要としない。固定化する分子に導入されるペプチド配列は5〜8アミノ酸残基程度に調整できるため、系全体の分子量変化も少ない。さらに形成される結合は共有結合であるため、分子の固定化はpH変化や塩濃度変化に対して安定である。
上記した以外の、課題、構成及び効果は、以下の実施形態の説明により明らかにされる。
【図面の簡単な説明】
【0026】
【図1】フェニルボロン酸基を有する分子と多価水酸基含有オリゴペプチドとが結合する概念図(A)、及び水酸基含有アミノ酸の化学構造式(B)を示す。図1Bにおいて、括弧内はアミノ酸の3文字表記及び1文字表記を示す。
【図2−1】フェニルボロン酸基と結合するペプチド配列のスクリーニングのため用いた合成ペプチドの化学構造式一覧である。
【図2−2】フェニルボロン酸基と結合するペプチド配列のスクリーニングのため用いた合成ペプチドの化学構造式一覧である。
【図3】フェニルボロン酸基と結合するペプチド配列のスクリーニングのために用いたフェニルボロン酸特異的結合色素(アリザリンレッドS)の構造式とフェニルボロン酸基との結合により蛍光を発する反応の概念図(A)、及び実施例1で用いたフェニルボロン酸基含有ポリマー(PMBV)の化学構造式(B)を示す。
【図4】フェニルボロン酸基と結合するペプチド配列のスクリーニングのため、フェニルボロン酸特異的結合色素とフェニルボロン酸基との反応を図2で示した各種合成ペプチドがどの程度阻害するかを示した棒グラフである。
【図5】合成ペプチド6SW(A)、6YW(B)及び6Y2K(C)について、表面プラズモン共鳴を用いてフェニルボロン酸基含有ポリマーで表面被覆したチップ上への相互作用を確認したセンサーグラムを示す。
【図6−1】フェニルボロン酸基と結合するペプチド配列の最適化のために用いた合成ペプチドの化学構造式一覧である。
【図6−2】フェニルボロン酸基と結合するペプチド配列の最適化のために用いた合成ペプチドの化学構造式一覧である。
【図7】フェニルボロン酸基と結合するペプチド配列の最適化のため、フェニルボロン酸特異的結合色素とフェニルボロン酸基との反応を図6で示した各種合成ペプチドがどの程度阻害するかを示した棒グラフである。
【図8】フェニルボロン酸基含有ポリマー(PMBV)の化学構造式(A)と、フェニルボロン酸基含有ポリマー(PMDV)の化学構造式(B)を示す。
【図9】フェニルボロン酸基含有ポリマーPMBV(A)及びPMDV(B)を用いた、フェニルボロン酸特異的結合色素とフェニルボロン酸基との反応を各種合成ペプチドがどの程度阻害するかを示した棒グラフである。
【図10】蛋白質分子の固定化に使用する、フェニルボロン酸基を有する分子を結合させた固体支持体の概要(A)と、標識ペプチド配列との融合蛋白質を生成するための発現ベクターの概要(B)を示す。
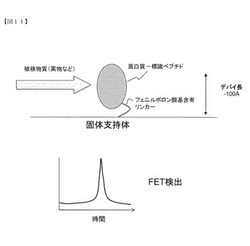
【図11】フェニルボロン酸基を含有する分子をリンカーとして蛋白質を固体支持体に固相化したデバイスを用いた測定系の一例を示す。
【図12】フェニルボロン酸基を含有する分子を架橋して形成される固定化基材(ゲル、フィルム)に蛋白質を固相化したデバイスを用いた測定系の一例を示す。
【図13】標識ペプチド配列を有する融合蛋白質を生成するための発現ベクターの構築例(A)と、該発現ベクターを用いた標識ペプチド配列の導入工程(B)を示す。
【発明を実施するための形態】
【0027】
本発明は、フェニルボロン酸基が、その水酸基と別の分子に含まれる水酸基との共有結合によって安定化する性質に基づいて、フェニルボロン酸基を有する分子をリンカーとして、水酸基含有アミノ酸を含むペプチド配列で標識した分子を固定化することに関する。具体的には、フェニルボロン酸基に含まれる水酸基は、弱塩基性から塩基性の条件下で、水酸基含有アミノ酸を含むペプチド配列における2つの水酸基と共有結合する(図1A)。従って、図1Bに例示するような水酸基含有アミノ酸を標識ペプチド配列に組み込むことによって、フェニルボロン酸基を有する分子と特異的にかつ自発的に結合する標識ペプチド配列が得られる。このような標識ペプチド配列は、自然界の蛋白質にはほとんど見いだされない配列を有し、また遺伝子工学的手法により任意の蛋白質分子に簡便に挿入又は付加することができる。
【0028】
本発明において「標識ペプチド配列」は、分子を固定化するためのリンカーとなるフェニルボロン酸基を有する分子と結合可能であるペプチド配列を指し、「オリゴペプチド配列」ともいう。標識ペプチド配列は、その側鎖に水酸基を含有するアミノ酸、すなわち水酸基含有アミノ酸を含むものであれば、その長さ及び組成(配列)は特に限定されるものではない。水酸基含有アミノ酸としては、セリン(Ser、S)、スレオニン(Thr、T)及びチロシン(Tyr、Y)が好適であり、標識ペプチド配列は、これらのうち1種又は複数種を含むことができる。標識ペプチド配列は、水酸基含有アミノ酸としてチロシンを含むことが好ましい。
【0029】
本発明において、標識ペプチド配列が効率的なフェニルボロン酸結合能を有するためには、立体的に2つの水酸基が近接して存在してフェニルボロン酸基に対して水酸基を供給する必要があるため(図1A)、標識ペプチド配列は、2つ以上の水酸基含有アミノ酸を含むものであることが好ましい。標識ペプチド配列において、一次配列上、隣接する2つの水酸基含有アミノ酸、又はその間に1残基のアミノ酸を挟んだ2つの水酸基含有アミノ酸は、フェニルボロン酸との結合に適した、水酸基のコンフォメーションをとることが難しいこともある。そのため、フェニルボロン酸基に近接させることができる2つの水酸基の組合せの数を増大させるため、連続した4〜6残基の水酸基含有アミノ酸からなるペプチド配列であることが好ましい。あるいは、連続した7残基以上(例えば7〜50残基)の水酸基含有アミノ酸からなるペプチド配列も可能であるが、水酸基含有アミノ酸の連続数が長くなるほど、標識ペプチド配列と付着する分子の構造形成又は活性に影響を及ぼす可能性があるため、その影響を考慮して標識ペプチド配列を設計することが好ましい。
【0030】
また、2つ以上の水酸基含有アミノ酸の間に非水酸基含有アミノ酸が含まれてもよいし、又は水酸基含有アミノ酸の末端に非水酸基含有アミノ酸が付加されていてもよい。例えば、2残基以上の任意のアミノ酸を挟んで両端の2残基が水酸基含有アミノ酸残基であるペプチド配列を用いることができる。
【0031】
さらに、フェニルボロン酸結合効率を上昇させるため、結合反応が生じる部位の局所pHが塩基性であることが望ましいことがわかっている。そこで標識ペプチド配列において、1〜4残基(好ましくは1〜3残基)の塩基性アミノ酸が、上述の連続した水酸基含有アミノ酸に隣接するか、又は連続した水酸基含有アミノ酸の配列中に挿入されていることが好適である。ここで、塩基性アミノ酸とは、リジン(Lys、K)、アルギニン(Arg、R)及びトリプトファン(Trp、W)から選択されるアミノ酸を意味し、標識ペプチド配列はこれらのうち1種又は複数種を含むことができる。例えば、標識ペプチド配列は、3〜5残基の水酸基含有アミノ酸と1〜3残基の塩基性アミノ酸の合計4〜6残基のアミノ酸からなるペプチド配列、又は4残基以上の水酸基含有アミノ酸と1〜3残基の塩基性アミノ酸の合計7残基以上のアミノ酸からなるペプチド配列が挙げられる。
【0032】
具体的な標識ペプチド配列の例を以下に示す:
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr(6Y)(配列番号1)
Ser-Ser-Ser-Ser-Ser-Ser-Trp(6SW)(配列番号2)
Ser-Ser-Ser-Ser-Trp(4SW)(配列番号3)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Trp(6YW)(配列番号4)
Tyr-Tyr-Tyr-Tyr-Trp(4YW)(配列番号5)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Gly-Gly(6Y2G)(配列番号6)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Lys-Lys(6Y2K)(配列番号7)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Gly-Lys(6YGK)(配列番号8)
Tyr-Tyr-Tyr-Tyr-Trp-Tyr-Tyr(4YW2Y)(配列番号9)
Tyr-Tyr-Tyr-Trp-Tyr-Tyr-Tyr(3YW3Y)(配列番号10)
Tyr-Tyr-Tyr-Tyr-Tyr-Trp-Tyr(5YWY)(配列番号11)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Lys-Lys-Trp(6Y2KW)(配列番号12)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Trp-Lys-Lys(6YW2K)(配列番号13)
【0033】
本発明では、上述したような標識ペプチド配列を分子に付着させて、標識分子を形成する。ここで「分子」とは、固定化が望まれる分子であれば任意の分子であってよく、例えば蛋白質(ペプチド、ポリペプチドなど)、他にも標識ペプチド配列にシステインなどを導入することにより金粒子などが含まれる。本発明では、標識ペプチド配列を簡便かつ効率的に付着させることができ、また特に固定化が望まれているという点で、蛋白質分子を対象とすることが好ましい。蛋白質としては、例えば酵素、受容体、抗体、抗原、アクチンやキネシン等のフィラメント形成蛋白質など、並びにそれらの一部又はサブユニットが挙げられる。
【0034】
標識ペプチド配列は、分子の任意の部位に付着させることができる。但し、標識ペプチド配列が対象の分子の立体構造や活性に影響を及ぼさないように、標識ペプチド配列は、分子の活性部位又は認識領域から離れた位置で、その分子に共有結合により付着していることが好ましい。
【0035】
また標識ペプチド配列は、当技術分野で公知の方法及び手段により、分子に付着させることができる。例えば蛋白質分子の固定化を行う場合には、蛋白質分子を標識ペプチド配列との融合蛋白質として生成することにより、標識ペプチド配列を蛋白質分子に付着させることができる。
【0036】
融合蛋白質の調製方法は当技術分野で周知であり、例えば化学合成法及び遺伝子組換え法がある。化学合成法の場合には、公知のペプチド合成手法に従って、例えば市販のペプチド合成機や市販のペプチド合成用キットを用いて、融合蛋白質を調製することができる。遺伝子組換え法では、例えば、対象の蛋白質分子をコードするDNAと、標識ペプチド配列をコードするDNAとを、直接連結して又はリンカー配列を介して連結して、プラスミド等の公知のベクターに挿入し、該ベクターを宿主細胞に導入し、該宿主細胞において融合蛋白質(標識分子)を発現させることができる。標識ペプチド配列は、好ましくは蛋白質分子のカルボキシル末端及び/又はアミノ末端に付加される。蛋白質分子のカルボキシル末端又はアミノ末端は分子の端点として溶媒接触可能領域に突出していることが多いため、ここに標識ペプチド配列を付加することで蛋白質の正しい三次元構造形成への影響を抑制し、かつ蛋白質の本来の機能を阻害することも抑制することができる。
【0037】
さらに標識ペプチド配列を蛋白質分子のカルボキシル末端及び/又はアミノ末端に付加する際に、その蛋白質の機能阻害の可能性をさらに低減させるため、カルボキシル末端に付加する際は標識ペプチド配列のアミノ末端側に、またアミノ末端に付加する際は標識ペプチド配列のカルボキシル末端側に、数残基程度のリンカー配列を付加することが好ましい。蛋白質分子と標識ペプチド配列との間に挿入されるリンカー配列は、当技術分野で公知のリンカー配列でよく、例えば1〜20アミノ酸、好ましくは1〜10アミノ酸、より好ましくは2〜6アミノ酸のリンカー配列を用いることができる。具体的なリンカー配列としては、コンフォメーションの自由度の高さの点に利点がある、4〜6残基程度の連続したグリシン残基がある。
【0038】
融合蛋白質の発現に使用するベクターとしては、プラスミド、ファージミド、ウイルスに基づくベクター(レトロウイルス、アデノウイルス及びワクシニアウイルスなどの動物ウイルスベクター、バキュロウイルスなどの昆虫ウイルスベクター)、人工染色体などの公知のベクターであれば任意のものを用いることができる。融合蛋白質を発現させるための発現ベクターは、蛋白質分子をコードするDNAと標識ペプチド配列をコードするDNAとを、融合蛋白質が発現されるようにベクターに連結することにより得ることができる。なお、発現ベクターには、プロモーター、転写終結シグナル、所望によりエンハンサー、スプライシングシグナル、ポリA付加シグナル、選択マーカーなどを連結することが好ましい。
【0039】
本発明では、標識ペプチド配列と付着した蛋白質分子を融合蛋白質として簡便かつ効率的に調製するために、標識ペプチド配列をコードするDNAと、蛋白質分子をコードするDNAを挿入するためのカセットとを備えた発現ベクターを利用することができる(図10B)。かかる発現ベクターを用いた場合には、発現ベクターのカセットに蛋白質分子をコードするDNAを挿入するのみで、標識ペプチド配列との融合蛋白質を発現するための発現ベクターを構築することができる。従って、発現ベクターは、少なくとも標識ペプチド配列(例えば配列番号1〜13に示されるアミノ酸配列)をコードするDNA、及び蛋白質分子をコードするDNAを挿入するためのカセット(制限酵素部位、マルチクローニングサイトなど)を含み、場合により標識ペプチド配列と蛋白質分子とを連結するリンカー配列をコードするDNA、融合蛋白質の発現に有用な調節配列などを含んでもよい。
【0040】
構築した発現ベクターを、宿主細胞中に導入し、形質転換体を作製する。形質転換に使用する宿主としては、融合蛋白質を発現し、産生できるものであれば特に限定されるものではなく、例えば、細菌(大腸菌等)、酵母、動物細胞、昆虫細胞などが挙げられる。宿主細胞への発現ベクターの導入も、当技術分野で公知の方法、例えばエレクトロポレーション法、リン酸カルシウム法、リポフェクション法などにより行うことができる。融合蛋白質は、形質転換体を培養し、その培養物から単離・精製することにより得ることができる。
以上のようにして、標識ペプチド配列を分子に付着させて標識分子を形成することができる。
【0041】
フェニルボロン酸基を有する分子は、フェニル基にボロン酸(B(OH)2)が結合したフェニルボロン酸基(ジヒドロキシフェニルボランとも称する)を有する分子であれば任意の分子を用いることができる。例えば、フェニルボロン酸であってもよいし、1若しくは複数のフェニルボロン酸基を有する有機化合物であってもよいし、又はフェニルボロン酸基を有するモノマーが重合したポリマー化合物であってもよい。好適には、2以上のフェニルボロン酸基を有するポリマーを用いる。
【0042】
フェニルボロン酸基を有する分子は、フェニルボロン酸基に加えて、標識ペプチド配列との結合反応、固体支持体への結合、固定化した分子の反応などに好適な1以上の官能基を含むものであってもよい。例えば、フェニルボロン酸基と標識ペプチド配列との結合反応が生じる部位の局所pHが塩基性となるような基(ジメチルアミノエチル基、ジエチルアミノエチル基など)、固体支持体と共有結合可能な頭部基(チオール基、スクシンイミド基など)、分子の流動性を高め、それにより分子の反応効率を高める官能基(2-メタクリロイロキシエチルホスホリルコリンなど)が挙げられる。
【0043】
フェニルボロン酸基を有するポリマー分子の具体例として、例えばポリ ((2-メタクリロイロキシエチルホスホリルコリン)-co-(n-ブチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))(以下、PMBVと略す)は、2-メタクリロイロキシエチルホスホリルコリン(MPC)基の働きにより、固液界面における水分子の水素結合クラスターを分解する機能があるため、界面近傍の自由水含率が高くなり、液体の流動度が高くなることが知られている。このため、酵素等の蛋白質分子を固定して固体支持体と液相との界面で様々な反応を行う際、酵素基質等の他の分子の拡散係数が高くなることで、分子の反応効率が大幅に上昇することが見込まれる。
【0044】
また、フェニルボロン酸基を有するポリマー分子であるポリ ((2-メタクリロイロキシエチルホスホリルコリン)-co-(ジメチルアミノエチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))(以下、PMDVと略す)は、塩基性官能基としてジメチルアミノエチルメタクリル酸基が含まれている。上述したように、フェニルボロン酸基と標識ペプチド配列との結合反応が生じる部位の局所pHが塩基性であることが望ましいことから、PMDVは、上記のPMBVの効果を維持しつつ、フェニルボロン酸基と標識ペプチド配列との結合活性を上昇させ、より高効率な分子の固定化を行うことができる。
【0045】
フェニルボロン酸基を有する分子は、固体支持体に結合することができ、それにより対象の分子を固体支持体に固定化することが可能となる(図11)。好ましくは、フェニルボロン酸基を有する分子が固体支持体の表面に結合されており、対象の分子が固体支持体の表面に固定化される。使用する固体支持体は、当技術分野で一般的に使用される固体支持体であれば特に限定されるものではない。具体的には、貴金属(金、銀、白金、パラジウム等)、銅、アルミニウム、タングステン、モリブデン、クロム、チタン、ニッケル等の金属;ステンレス、ハステロイ、インコネル、モネル、ジュラルミン等の合金;半導体素子等の電極(トランジスタ、FETなど);シリコン;ガラス、石英ガラス、溶融石英、合成石英、アルミナ、サファイア、セラミクス、フォルステライト及び感光性ガラス等のガラス材料;ポリエステル、ポリスチレン、ポリエチレン、ポリプロピレン、ナイロン、アクリル、ポリカーボネート、ポリエチレンテレフタレート(PET)、ポリウレタン、フェノール樹脂、メラミン樹脂、エポキシ樹脂及びポリ塩化ビニル等のプラスチック;アガロース、デキストラン、セルロース、ポリビニルアルコール、ニトロセルロース、キチン、キトサンが挙げられる。また、固体支持体の形状についても、特に限定はなく、平面により形成されるもの(例えばタイタープレート、多孔質若しくは細孔アレー、マイクロ流路など)、平板、フィルム、チューブ及び粒子(磁性粒子等)が挙げられる。
【0046】
フェニルボロン酸基を有する分子を固体支持体に結合させる方法は、特に限定されるものではない。例えば、共有結合、イオン結合、物理吸着によってフェニルボロン酸基を有する分子を固体支持体に結合させることができる。具体的には、例えばフェニルボロン酸基を有する分子を混和させた有機溶媒等の溶液を固体支持体上に塗布し、乾燥させることにより固体支持体の表面にフェニルボロン酸を有する分子を結合させることができる。また、フェニルボロン酸基を有する分子が他の官能基を有する場合には、固体支持体の性質や固定対象の分子の性質、それらを用いて固体支持体上で行う化学反応の性質、などにより様々なものを取捨選択することが可能である。フェニルボロン酸基を有する分子は、スペーサー配列、例えば1〜10個の炭素原子を含む炭化水素基を介して、固体支持体に結合させてもよい。
【0047】
共有結合を介したフェニルボロン酸基を有する分子の固体支持体への結合は、例えば、フェニルボロン酸基を有する分子に含まれる頭部基と反応性の官能基を固体支持体に導入して両者を反応させることにより実施できる。フェニルボロン酸基を有する分子が固体支持体(例えば貴金属)と共有結合可能な頭部基を有する場合には、その頭部基を利用して、フェニルボロン酸基を有する分子を金や白金等の貴金属固体支持体に共有結合を介して結合させることができる。金や白金等は原子レベルで配列制御ができる。すなわち金属結晶として成長させた格子面は1原子レベルの凹凸も無い平板状加工が可能である。ここにフェニルボロン酸基を有する分子の単分子層を構築することにより、標識ペプチド配列を捕捉することができる平板状固体支持体を得ることができる。このフェニルボロン酸基を有する分子の単分子層を持つ金属材でできた固体支持体上に、標識ペプチド配列と付着させた分子を結合させることで、金属平面上にその分子の配向が制御された上で、かつ数オングストロームの誤差で固定された分子の高さが制御されたデバイスを提供することができる。例えば、固体支持体の表面上に対象の分子を同一配向で保持されている単分子膜として固定化することができる。
【0048】
このように数オングストロームの誤差範囲で分子を電極等の貴金属支持体上に配向制御した状態で結合させることができるため、固定化した分子(例えば蛋白質、とりわけ酵素)の活性部位を貴金属支持体表面から約100オングストローム以内におさめて固定することも可能となる(真核生物由来の蛋白質の平均分子量は5万程度と言われており、分子の最大長は100オングストローム程度である)。これによって、数十から百数十オングストロームと推定されているFETのデバイ長内に酵素反応(種々の電荷移動反応を含むことが多い)を惹起させることが可能となるため、任意の酵素反応をFETを用いて検出する系の構築が可能となる。
【0049】
また例えば、フェニルボロン酸基を有する分子の頭部基としてアミノ基を使用し、固体支持体に活性エステル基、エポキシ基、アルデヒド基、カルボジイミド基、イソチオシアネート基又はイソシアネート基を導入することにより共有結合を形成できる。また、頭部基としてチオール基を使用し、固体支持体に活性エステル基、マレイミド基又はジスルフィド基を導入してもよい。活性エステル基としては、例えば、p-ニトロフェニル基、N-ヒドロキシスクシンイミド基、コハク酸イミド基、フタル酸イミド基、5-ノルボルネン-2、3-ジカルボキシイミド基等が挙げられる。官能基を固相担体に導入する方法の一つとしては、所望の官能基を有するシランカップリング剤(γ-アミノプロピルトリエトキシシランなど)によって固体表面を処理する方法が挙げられる。別の方法としては、プラズマ処理が挙げられる。
【0050】
固体支持体にフェニルボロン酸基を有する分子を結合させる具体的な方法としては、例えば、(i)ポリスチレン、ポリカーボネート、ポリ塩化ビニルといったプラスチック基材、又は金、白金、銅等の金属基材等の表面に、エタノールなどの有機溶媒にフェニルボロン酸基を有する分子(PMBV等)を含む溶液を塗布し、乾燥させることと、(ii)標識ペプチド配列と付着させた分子(蛋白質など)を含む溶液をその基材上に添加することにより、配列制御された分子によりコーティングされた基材を形成することを含む。
【0051】
上述のようにして、フェニルボロン酸基を有する分子を固体支持体に結合させることができる。本発明は、予めフェニルボロン酸基を有する分子(好ましくはPMBV又はPBDV)を固体支持体の表面に結合させた固体支持体も提供する。この固体支持体を用いることにより、標識ペプチド配列に付着させた分子を単に適用するのみで、分子を簡便かつ効率的に固体支持体に固定化することができる(例を図10Aに示す)。
【0052】
また、分子の固定化は、固体支持体への固定化に限定されるものではない。本発明では別の方法として、フェニルボロン酸基を有する分子における、標識ペプチド配列との結合に必要な水酸基以外の官能基(例えば水酸基)を架橋分子を用いて架橋することにより、固定化基材を形成することができる。その結果、架橋形成された固定化基材に対象の分子が固定化されることになる。使用する架橋分子としては、多価アルコール、例えばポリビニルアルコールや、多糖類、例えばデキストランなどが挙げられる。
【0053】
形成することができる固定化基材としては、固体、高分子膜、高分子半透膜、フィルム、固相ゲル及び液相ゲルなどが挙げられる。したがって、本発明は、分子(例えば酵素等の蛋白質分子)を、半透膜などのフィルム状物質や、様々な含水率を有するゲル状物質中に安定的に共有結合により固定化したデバイスをも提供する(図12)。また、これらの固定化基材は、微小な、例えばマイクロメーター又はナノメーターのサイズとすることが可能である。
【0054】
さらに、標識ペプチド配列が特異的に認識し、自発的に結合するのはフェニルボロン酸基であるため、任意の蛋白質を、他にも様々な物質にフェニルボロン酸基単独、あるいは他の化学基とフェニルボロン酸基が共存した分子の状態で固定されたフェニルボロン酸基を介して固定することが可能である。
【0055】
標的ペプチド配列と付着させた分子(標識分子)をフェニルボロン酸基を有する分子に捕捉させて分子を固定化するには、中性pH付近の緩衝液などの水溶液中に混和した標識分子溶液を、フェニルボロン酸基を有する分子を含む溶液又は固体支持体に結合させたフェニルボロン酸基を有する分子と接触させ、5〜40℃にて、好ましくは室温にて、数分から数十分放置する。
【0056】
上述のようにして、フェニルボロン酸基に特異的かつ自発的に結合する標識ペプチド配列を固定対象の分子に付着させることで、フェニルボロン酸基と標識ペプチド配列との結合に基づいて、該フェニルボロン酸基を有する分子をリンカーとして固体支持体上又は固定化基材中に該分子を任意の配向性で安定的に固定化することができる。
【0057】
また本発明は、標識ペプチド配列と付着した分子が、フェニルボロン酸基を有する分子を介して固定化されている分子固相化デバイスを提供する。分子固相化デバイスにおいて、標識ペプチド配列と付着した分子は、フェニルボロン酸基を有する分子を介して固体支持体に固定化されていてもよいし、あるいはフェニルボロン酸基を有する分子が架橋分子により架橋されて固定化基材を形成しており、その固定化基材に標識ペプチド配列と付着した分子が固定化されていてもよい。分子固相化デバイスの形状は、固定化された分子を含む限り特に限定されず、固体支持体の形状、例えば基板状(プロテインチップ等)若しくは粒子状(ナノ粒子等)であってもよいし、又は固定化基材の形状、例えば膜状、フィルム状若しくはゲル状であってもよい。
【0058】
本発明の分子固相化デバイスは、対象の分子を、その配向を制御して、及び/又は単分子層で固定化することができるため、分子の多様な分析に有用である。
【0059】
従って、本発明は、対象の分子を固相化したデバイスと、分子間相互作用を検出する手段とを備えるセンサを提供する。ここで、分子間相互作用とは、固相化されている分子と他の分子(例えば被検物質)との相互作用であれば、任意の相互作用、例えば結合、解離などであってよい。検出手段は、FETのような電気的検出手段、表面プラズモン共鳴のような光学的検出など、周知の検出手段のいずれであってもよい。以下、代表的な例について記載する。また、図11及び12に、分子として蛋白質を固相化したデバイスを用いた測定系の例を示す。
【0060】
フィールドエフェクトトランジスタ(Field-Effect Transistor, FET)は、電気的検出を利用したセンサに汎用されている技術である。原理は、ソース電極からドレイン電極へ流れる電流を、第三の電極であるゲート電極で制御し、そのゲート電極表面で分子間相互作用を起こさせるとゲート電極の電荷が変化するため、電流的応答が変化する(図11)。
【0061】
FETはセンサチップ上に電荷移動が生じる反応が起こった場合、高感度な検出ができるが、その反応ができるだけゲート電極表面に近い場所で起こる必要があり、検出できる距離は数ナノメートルとされている。そのため、本発明のように、配向が制御され、かつ高さが高精度で揃えられた分子を固定した固相化デバイスをゲート電極として使用した場合、数ナノメートルの検出限界内に分子を配列制御することが可能である。そのため、本発明の分子固相化デバイスは、高感度なFETを利用したセンサに有用である。
【0062】
なお、酵素等の蛋白質の大きさは概ね数ナノメートル径であり、FETの検出限界と拮抗する。そのため、本発明を利用した蛋白質分子の配向制御は、機能的なフィールドエフェクトトランジスタ用センサを作製するのに有効な手段となる。
【0063】
上述の配列制御は固定する蛋白質の三次元構造が既知の場合、特にその意図が達成されやすいが、三次元構造が不明の場合も試行錯誤的に電荷移動反応検出に最適化することができる。本発明では、蛋白質分子中の任意の位置にフェニルボロン酸結合能を有する標識ペプチド配列を簡便に挿入することができるため、標識ペプチド配列を種々の位置に付着させた蛋白質分子を調製してその反応を簡便に確認することが可能である。
【0064】
センサの作製は、例えば、(i)金、白金等の金属基材等の表面にチオール化したフェニルボロン酸基を反応させフェニルボロン酸の単分子層を形成することと、(ii)標識ペプチド配列をリンカー配列を介して付着した蛋白質分子を含む溶液をその基材上に添加することにより、配向制御された蛋白質分子の単分子層によりコーティングされたセンサチップを形成することを含む。
【0065】
また、表面プラズモン共鳴センサは、表面プラズモン共鳴を利用し、センサチップ上で分子間相互作用をリアルタイムで解析できるセンサである。例えば、市販の表面プラズモン共鳴センサ(例えば、BIAcore社製のもの)は容易に入手可能である。本発明に従ってセンサチップ上に対象の分子を固定化し、センサチップ上にマイクロ流路を設け、ここに被検物質を含むサンプルを一定の流速で送液する。固定化した分子と被検物質が相互作用をすれば、表面プラズモン現象により、結合と解離が光学的に検出され、センサグラムとしてリアルタイムでモニターできる。表面プラズモン共鳴センサは、微量サンプルを高感度に検出できるとともに、相互作用のキネティクスをリアルタイムで解析できるという利点がある。
【0066】
さらにリフレクトメトリーとは、レーザーを試料板に反射させ、反射光を測定することによって、試料版表面への蛋白質吸着量を測定する手法である。このリフレクトメトリーの原理とマイクロ流体チップを組み合わせたリフレクトメトリーバイオセンサは容易に入手可能である。本発明に従ってセンサーチップ上に分子を固定化し、センサーチップ上にマイクロ流路を設け、ここに被検物質を含むサンプルを一定の流速で送液する。固定化された分子と被検物質が相互作用をすれば、吸着タンパク質量がセンサグラムとしてリアルタイムでモニターできる。リフレクトメトリーバイオセンサは、微量サンプルを高感度に検出できるとともに、相互作用のキネティクスをリアルタイムで解析できるという利点がある。
【0067】
分子固相化デバイスとして分子を膜状、フィルム状又はゲル状の固定化基材に固定したものを使用する場合には、溶液置換でしか行うことができなかった複数の分子反応を、分子固相化デバイスの微細ゲル配列により行うことも可能であり(図12)、計測装置への組込みが簡便化される。
【0068】
また本発明の分子固相化デバイスが、粒子状(ナノサイズ、マイクロサイズ)、膜状又はゲル状である場合には、マイクロ流路内における高感度分析に有用である。
【0069】
さらに分子固相化デバイスが粒子状である場合には、粒子上に分子(蛋白質分子)が固定化されるため水溶液中での分散性がよく、被検物質と効率よく反応する。完全分散が達成されると、分子間相互作用がおきたとき粒子が凝集するため、簡便に分子間の結合が解析できる。なお、こうした分散性は、インクジェット手法やスプレー手法でナノ粒子をパターニングする場合にも重要である。
【実施例】
【0070】
<実施例1>フェニルボロン酸結合能を有するペプチド配列の探索
ポリ((2-メタクリロイロキシエチルホスホリルコリン)-co-(n-ブチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))(以下、PMBVと略す)を、60モル% 2-メタクリロイロキシエチルホスホリルコリン基、20モル% n-ブチルメタクリル酸、及び20モル% p-ビニルフェニルボロン酸となるように重合した。
【0071】
このPMBVをリン酸緩衝生理食塩水(PBS:10mM NaH2PO4/Na2HPO4、150mM NaCl pH7.3)に0.25mg/mlとなるように溶解し、各200μlを96穴ウエルプレートに分注した。
【0072】
上記溶液をいれたウエルに、図2に示した各化学構造式を有するオリゴペプチド(PBS中)を各々0.05mMとなるように分注し、混和した。具体的には、下記のオリゴペプチドを使用した:
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr(6Y)(配列番号1)
Ser-Ser-Ser-Ser-Ser-Ser-Trp(6SW)(配列番号2)
Ser-Ser-Ser-Ser-Trp(4SW)(配列番号3)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Trp(6YW)(配列番号4)
Tyr-Tyr-Tyr-Tyr-Trp(4YW)(配列番号5)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Gly-Gly(6Y2G)(配列番号6)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Lys-Lys(6Y2K)(配列番号7)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Gly-Lys(6YGK)(配列番号8)
【0073】
ウエルプレートを25℃で2時間、振盪した(700rpm、TAITEC MBR-022UP)。
振盪後、PMBV中のフェニルボロン酸基に特異的に結合する蛍光色素アリザリンレッドSを各ウエルに各0.05mMとなるように分注し、混和した。アリザリンレッドSの分子式、及びフェニルボロン酸と結合することで蛍光を発する機構を図3に示す。ウエルプレートを25℃で1時間、振盪した(700rpm、TAITEC MBR-022UP)。
【0074】
フェニルボロン酸にどの程度のアリザリンレッドSが結合できたかを知るために、アリザリンレッドS由来の蛍光強度を測定した。モレキュラーデバイス社のフルオロスペクトロメーターGemini XSを用いて、励起光波長495nmで励起し、蛍光の発光強度測定は520nmから640nmの範囲を10nm間隔で強度測定を連続的に行い、極大値を持って蛍光強度とした。
【0075】
ペプチド添加無し、及び各ペプチドを添加した場合の各々のアリザリンレッドS由来の蛍光強度極大値を棒グラフにしたものを図4に示す。各棒グラフのエラーバーは試行回数三回における標準偏差である。棒グラフの高さが低く、アリザリンレッドS由来の蛍光強度が低いペプチドほど、アリザリンレッドSのフェニルボロン酸基への結合を阻害していることになり、ペプチドとフェニルボロン酸基の結合量が多いことが示唆される。
【0076】
図4に示す結果から、いずれのオリゴペプチドもフェニルボロン酸基へ結合しているが、特に4YW、6YW、6Y、6YGK及び6Y2Kの結合量が多いことがわかった。
【0077】
<実施例2>フェニルボロン酸とペプチドとの表面プラズモン共鳴法による結合確認
PMBVを、25モル% 2-メタクリロイロキシエチルホスホリルコリン基、55モル% n-ブチルメタクリル酸、及び20モル% p-ビニルフェニルボロン酸となるように調製した。表面プラズモン共鳴測定装置用基板をエタノールで5分間超音波洗浄し、自然乾燥させてから、0.2重量%PMBVをエタノールに溶解した溶液を各基板上に40μl滴下し、毎分1000回転で30秒間遠心しスピン塗布を行った。その後、各基板をデシケータ(約0.2気圧)にて2時間減圧乾燥させた。
【0078】
アセトン洗浄し、乾燥させた表面プラズモン共鳴測定装置用プリズムに上記基板を密着させ、表面プラズモン共鳴測定装置(MORITEX、SPR-670M)内にセットした。装置内でリン酸緩衝生理食塩水(10mM NaH2PO4/Na2HPO4、150mM NaCl pH7.3)にて基板をセンサーグラムが安定するまで洗浄(30μl/min)した。
【0079】
同じリン酸緩衝生理食塩水に1mg/mlになる様に溶解した3種類のペプチド(実施例1においてフェニルボロン酸特異的結合色素とフェニルボロン酸との反応阻害効果が低かった合成ペプチド1種(6SW、配列番号2)、反応阻害効果が大きいと認められた合成ペプチド2種(6YW、配列番号4;6Y2K、配列番号7))を用意した。
【0080】
センサーグラムが安定したのを見計らって、各ペプチド溶液を240秒間基板上に流し(30μl/min)、各ペプチドの結合曲線を取得した。その後、リン酸緩衝生理食塩水を同流速で基板上に流し、各ペプチドの解離曲線を取得した。
【0081】
図5に各センサーグラムを示す。実施例1においてフェニルボロン酸特異的結合色素とフェニルボロン酸との反応阻害効果が低かった合成ペプチド6SW(配列番号2)は、結合曲線部(180sec.近辺から420sec.近辺まで)の上昇から、PMBVに対して親和性を持つことは示したが、解離曲線部(420sec.近辺以降)において示される速やかな下降からPMBVとの結合があまり安定ではないことが示された(図5A)。これに対し、フェニルボロン酸特異的結合色素とフェニルボロン酸との反応阻害効果が大きいと認められた合成ペプチド6YW(配列番号4)と6Y2K(配列番号7)に関しては、解離曲線部においてセンサーグラムがバックグラウンドレベルまで下降せず、図5B及びCに示すように結合量を反映した上昇分が認められた。特に、6Y2Kに関しては、解離曲線部において早々に(470sec.近辺)バックグラウンドレベルより有意に高い位置で安定し、かつ下降しないことから、非常に安定な結合を形成していることが示された(図5C)。
【0082】
上記の結果は、実施例1で行ったフェニルボロン酸特異的結合色素とフェニルボロン酸との反応阻害実験による、フェニルボロン酸結合能を有するペプチド配列の探索結果と高い一貫性を示している。
【0083】
<実施例3>フェニルボロン酸結合能を有するペプチド配列最適化
リン酸緩衝生理食塩水(10mM NaH2PO4/Na2HPO4、150mM NaCl、pH7.3)に、60モル% 2-メタクリロイロキシエチルホスホリルコリン基、20モル% n-ブチルメタクリル酸、及び20モル% p-ビニルフェニルボロン酸となるように重合したPMBVを0.25mg/mlとなるように溶解し、各200μlを96穴ウエルプレートに分注した。
【0084】
上記溶液をいれたウエルに、図6に示した各化学構造式を有するオリゴペプチドを各々0.2mM(実施例1より意図的に低い濃度とした)となるように分注し、混和した。具体的には、下記のオリゴペプチドを使用した:
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Trp(6YW)(配列番号4)
Tyr-Tyr-Tyr-Tyr-Trp-Tyr-Tyr(4YW2Y)(配列番号9)
Tyr-Tyr-Tyr-Trp-Tyr-Tyr-Tyr(3YW3Y)(配列番号10)
Tyr-Tyr-Tyr-Tyr-Tyr-Trp-Tyr(5YWY)(配列番号11)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Lys-Lys-Trp(6Y2KW)(配列番号12)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Trp-Lys-Lys(6YW2K)(配列番号13)
【0085】
ウエルプレートを25℃で2時間、振盪した(700rpm、TAITEC MBR-022UP)。
振盪後、PMBV中のフェニルボロン酸基に特異的に結合する蛍光色素アリザリンレッドSを各ウエルに各0.05mMとなるように分注し、混和した。ウエルプレートを25℃で1時間、振盪した(700rpm、TAITEC MBR-022UP)。
【0086】
フェニルボロン酸にどの程度のアリザリンレッドSが結合できたかを知るために、アリザリンレッドS由来の蛍光強度を測定した。モレキュラーデバイス社のフルオロスペクトロメーターGemini XSを用いて、励起光波長495nmで励起し、蛍光の発光強度測定は520nmから640nmの範囲を10nm間隔で強度測定を連続的に行い、極大値を持って蛍光強度とした。
【0087】
ペプチド添加無し、及び各ペプチドを添加した場合の各々のアリザリンレッドS由来の蛍光強度極大値を棒グラフにしたものを図7に示す。各棒グラフのエラーバーは試行回数三回における標準偏差である。図7Aのグラフにより、ペプチド配列に付加すると結合効率を上昇させる塩基性残基(特にトリプトファン)は連続したチロシン残基中のどの位置にあってもその効果は大差ないことが示された。また、図7Bのグラフにより、ペプチド配列に付加すると結合効率を上昇させる2種の塩基性残基(リジンとトリプトファン)は組み合わせて用いることにより、フェニルボロン酸結合能を相加的に上昇させることがわかった。
【0088】
<実施例4>フェニルボロン酸結合能を増進するフェニルボロン酸基含有ポリマー組成の最適化
フェニルボロン酸結合能が高いペプチド配列には、塩基性残基が含まれていることから、溶液におけるフェニルボロン酸基近傍の局所的pHを上昇させることが結合効率上昇に大きな影響を及ぼしていることが予想される。そのため、ペプチド配列側でなくフェニルボロン酸基含有ポリマー側に塩基性残基を新たに導入することで、同様の効果が得られるかどうかについて、実施例1及び3と同様のフェニルボロン酸特異的結合色素の結合阻害実験を行った。
【0089】
PMBVは、実施例1と同様に調製した。また、ポリ((2-メタクリロイロキシエチルホスホリルコリン)-co-(ジメチルアミノエチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))(以下、PMDVと略す)を、60モル% 2-メタクリロイロキシエチルホスホリルコリン基、20モル% ジメチルアミノエチルメタクリル酸、及び20モル% p-ビニルフェニルボロン酸となるように調製した。PMBV及びPMDVの構造を、図8に示す。
【0090】
リン酸緩衝生理食塩水(10mM NaH2PO4/Na2HPO4、150mM NaCl pH7.3)に、PMBVを0.25mg/mlとなるように溶解したもの(PMBV溶液)と、PMDVを0.25mg/mlとなるように溶解したもの(PMDV溶液)の2種類のポリマー溶液を用意し、各々、200μlを96穴ウエルプレートに分注した。
【0091】
上記溶液をいれたウエルに、図2に示した各化学構造式を有するオリゴペプチド(PBS中)(配列番号1〜8)を各々0.2mMとなるように分注し、混和した。
【0092】
ウエルプレートを25℃で1時間、振盪した(700rpm、TAITEC MBR-022UP)。なお、ペプチド濃度、振盪時間ともに阻害効果が低くなるように設定した。振盪後、ポリマー中のフェニルボロン酸基に特異的に結合する蛍光色素アリザリンレッドSを各ウエルに各0.05mMとなるように分注し、混和した。ウエルプレートを25℃で1時間、振盪した(700rpm、TAITEC MBR-022UP)。
【0093】
フェニルボロン酸にどの程度のアリザリンレッドSが結合できたかを知るために、アリザリンレッドS由来の蛍光強度を測定した。モレキュラーデバイス社のフルオロスペクトロメーターGemini XSを用いて、励起光波長495nmで励起し、蛍光の発光強度測定は520nmから640nmの範囲を10nm間隔で強度測定を連続的に行い、極大値を持って蛍光強度とした。
【0094】
ペプチド添加無し、及び各ペプチドを添加した場合の各々のアリザリンレッドS由来の蛍光強度極大値を棒グラフにしたものを図9に示す。各棒グラフのエラーバーは試行回数三回における標準偏差である。棒グラフの高さが低く、アリザリンレッドS由来の蛍光強度が低いペプチドほど、アリザリンレッドSのフェニルボロン酸基への結合を阻害していることになり、ペプチドとフェニルボロン酸基の結合量が多いことが示唆される。この結果、塩基性官能基(ジメチルアミノエチルメタクリル酸基)を導入したポリマーPMDVを用いたとき、実施例1においてPMBVに対して高い結合効率を示していたペプチド配列6Y2K(配列番号7)に関しては、色素結合阻害効果がわずかだったが、ペプチド配列6YW(配列番号4)に対して極めて高い色素結合阻害効果を確認することができた。これにより、PMDVを用いた場合の方が、PMBVを用いた場合より、結合ペプチド配列の選択性が高まり、かつフェニルボロン酸への結合効率が飛躍的に上昇することが示された。
【0095】
<実施例5>フェニルボロン酸結合能を有するペプチド配列を導入したルシフェラーゼをコードするプラスミドの構築
ルシフェラーゼ(以下Luc)発現プラスミドであるpURE2 Lucプラスミドをテンプレートとして、蛋白質分子に6Y2K(配列番号7)及び6YW(配列番号4)のペプチド配列を4残基のグリシン残基を介してC末端に付加できるように導入した。プラスミドへの導入方法としてInverse PCR法を用いた。この概要を図13A及びBに示す。Inverse PCR法では環状DNAの配列導入部位を基準として背中合わせになる様にプライマーを選択する(図13A)。このときプライマーには導入しようとする配列をアンカー配列1及び2として付加しておく(図13A)。この条件でPCR反応を行うと末端にアンカー配列1及び2が付加された直鎖状の2本鎖DNAが生成する。これをセルフライゲーション反応で繋ぎ合わせることにより、望みの部位にアンカー配列が導入された環状二本鎖DNAを得ることができる(図13B)。
【0096】
プライマーには6Y2K用Forward primerとして配列5’-TATTATTATAAAAAATAGCATATGAAGCTTTAGCATAACCCCTT-3’(配列番号14)、6YW用Forward primerとして、配列5’-TATTATTATTGGTAGCATATGAAGCTTTAGCATAACCCCTT-3’(配列番号15)を用い、共通のReverse primerとして、配列5’-ATAATAATAACCACCACCACCCAATTTGGACTTTCCGCCCT-3’(配列番号16)を使用した。
【0097】
Inverse PCR反応液はテンプレートプラスミドpURE2 Lucを20fmol、Forward primerとReverse primerを各々15pmol、KOD-Plus DNA polymerase(東洋紡)を2.5U、10×KOD bufferを5μl、10mM dNTPを5μl加えて全量が50μlになるようdH2Oで調整した。増幅反応は95℃で1分間の反応後、98℃ 30秒、55℃ 1分、68℃ 4分のサイクル反応を30回繰り返した後、4℃に冷却した。
【0098】
サンプル50μlを回収し、DpnI(20U/μl、NEB社)を1μl添加して37℃で1時間反応させテンプレートプラスミドを分解した。反応後の溶液にエタノール150μlとNaOAC 5μlを添加し4℃ 15000rpmにて30分遠心分離し、上清を捨てた(エタノール沈殿)。
【0099】
沈殿を10μl dH2Oに溶解し、T4 kinase(TaKaRa社)1μlとLigation high(東洋紡社)14μlと混合後、37℃で1時間反応させ、その後更にLigation high 5μlを添加し、4℃で1時間反応させてセルフライゲーション反応を行った。
【0100】
セルフライゲーション反応液5μlをコンピテントセルJM109(TaKaRa社)50μlと混合し、氷上で10分間静置後、42℃ 45秒間のヒートショック反応を行い、大腸菌を形質転換した。溶液をLB-amp(LBブロス:Invitrogen社、アガー:和光純薬工業社、アンピシリン:SIGMA社)プレートに播種し、37℃で一晩培養して大腸菌コロニーを形成させた。いくつかのコロニーをピックアップし、20mLのLB-amp培養液で一晩培養後集菌し、Plasmid Miniprep system(Marligen社)を用いてプラスミドを抽出精製した。精製したプラスミドのシーケンスを行い、配列導入が確認されたプラスミドを保存した。
【0101】
<実施例6>フェニルボロン酸結合能を有するペプチド配列を導入したルシフェラーゼの精製
LucのC末端側に6Y2K配列(配列番号7)を導入したプラスミド(Luc6Y2K)及び6YW配列(配列番号4)を導入したプラスミド(Luc6YW)各100ng/μlの各1μlを、蛋白質発現用コンピータントセルBL21(Novagen社)50μlに添加し、4℃ 10分間静置し、42℃ 30秒間ヒートショック反応を行い形質転換を行った。溶液をLB-amp(LBブロス:Invitrogen社、アガー:和光純薬工業社、アンピシリン:SIGMA社)プレートに播種し、37℃で一晩培養して大腸菌コロニーを形成させた。いくつかのコロニーをピックアップし、2LのLB-amp培養液で25℃で一晩培養後集菌した。
【0102】
菌体を細胞膜破砕液に懸濁し室温で10分間穏やかに回転混和した後、遠心分離(30,000g、30分間)し、上清を回収した。Luc-6Y2K、Luc-6YWともにN末端側にStrep-tag配列を有しているので、アビジン−ビオチン相互作用を利用したアフィニティークロマトグラフィー精製をAKTA explorer10Sシステムを用いて行った。0.1μmフィルター濾過した遠心分離上清液をStrepTrap HP 5ml(GEヘルスケアジャパン社)に5ml/分の流速で注入し、サンプル吸着させた。サンプル吸着後、10mlのリン酸緩衝生理食塩水(10mM NaH2PO4/Na2HPO4、150mM NaCl pH7.3)でカラムを洗浄した。desthiobiotin(シグマアルドリッチ社)を溶解させたリン酸緩衝生理食塩水を用いてカラムに吸着した目的蛋白質を溶出させた。溶出サンプルはフラクションごとにSDSポリアクリルアミド電気泳動で目的蛋白質が発現し、かつ他の夾雑蛋白質が取り除かれていることを確認した。
【0103】
なお、本発明は上記した実施例に限定されるものではなく、様々な変形例が含まれる。例えば、上記した実施例は本発明を分かりやすく説明するために詳細に説明したものであり、必ずしも説明した全ての構成を備えるものに限定されるものではない。また、ある実施例の構成の一部を他の実施例の構成に置き換えることが可能であり、また、ある実施例の構成に他の実施例の構成を加えることも可能である。また、各実施例の構成の一部について、他の構成の追加、削除、置換をすることが可能である。
【配列表フリーテキスト】
【0104】
配列番号1〜13:人工配列(合成オリゴペプチド)
配列番号14〜16:人工配列(合成オリゴヌクレオチド)
【技術分野】
【0001】
本発明は、分子、例えば蛋白質分子を固定化する方法に関し、具体的には、フェニルボロン酸基を有する分子及び該フェニルボロン酸基と特異的かつ自発的に結合するペプチド配列を利用して、分子を固定化する方法に関する。また本発明は、分子の固定化方法に使用するための固体支持体及び発現ベクター、並びに分子固相化デバイス及びセンサに関する。
【背景技術】
【0002】
従来、蛋白質固定化方法としていくつかの方法が知られている。酵素(すなわち蛋白質)の産業利用を企図して、蛋白質内の様々なアミノ酸残基のうち反応性の高い側鎖と固体支持体上の官能基との間に結合生成させることにより、蛋白質分子を様々な固体支持体へ固定化する方法がいくつか開発されている。これらのうち反応の簡便さと、蛋白質分子を変性させずに穏やかな条件で反応させることが可能であるため広く用いられているものとして、アミンカップリング法と表面チオールカップリング法がある。
【0003】
アミンカップリング法とは固体支持体上に予め固定化しておいたカルボキシル基をN-ヒドロキシスクシンイミドと1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミドでスクシンイミジルエステルに変換して活性化しておき、そこへ蛋白質を添加することで、蛋白質分子表面のアミノ基と共有結合させる方法である(非特許文献1)。
【0004】
表面チオールカップリング法とは固体支持体上にスペーサーを経てチオール基を導入しておき、そこに活性化した蛋白質を添加して共有結合させる方法である(非特許文献2)。具体的には次の手順で行う。まず、蛋白質分子中のカルボキシル基を1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド存在下で2-(2-ピリジニルジチオ)エチルアミンと反応させ、活性なS-S結合を持つ誘導体へと変換しておく。次にアミンカップリングと同じ方法で活性化しておいた固体支持体にシスタミンを添加し、次いで還元することでチオール基へと誘導する。ここに先に誘導化した蛋白質を添加し、ジスルフィド交換を行うことで共有結合させ固定化が完了する。
【0005】
アミンカップリング法と表面チオールカップリング法は、両者とも特定の化学基を固定化対象とする(アミンカップリング法ではアミノ基(-NH2)、表面チオールカップリング法ではチオール基(-SH))方法であり、蛋白質分子を固定する際に蛋白質分子中の特定のアミノ酸側鎖の官能基に対して、固定基材側の化学基が反応する。典型的な真核生物由来の蛋白質分子の分子量は約5万であることから、その中には400〜500のアミノ酸残基が含まれており、従って同種のアミノ酸が複数個、分子表面の様々な方向を向いて存在している。このため蛋白質分子を固定した際、分子の配向が不均一となる。このため、引き続き行う相互作用解析や固体支持体上での酵素反応に不向きな配向に蛋白質が固定される場合が多々ある。
【0006】
この様な固定化の際の配向の不均一性を回避するため、生体高分子間の特異的相互作用を利用した固定化法が開発されている(非特許文献3)。アビジン-ビオチン相互作用を応用した系は両分子の安定性と、中性pH付近で自発的に両分子が結合することなどから広く実用化されている。アビジン-ビオチン複合体については結晶構造も解明されており、原子レベルで相互作用の様式が明らかにされている。
【0007】
ビオチン分子が基盤蛋白質アビジンに結合した複合体の三次元構造から、アビジン分子表面のうち広く周辺に暴露されている部分にビオチン分子が結合していることが明らかになった。このため、ビオチン分子により修飾された(蛋白質分子等の)巨大分子の作用を立体障害で阻害することが無く、これもこれまで広範に応用されてきた理由の一つとなっている。さらに、蛋白質分子中の特定の位置にビオチン化配列を導入できることから、蛋白質分子の固定化の際の分子の配向を均一にすることができる。
【0008】
しかし、この方法は固定化に先立ってターゲット分子(蛋白質)をビオチン修飾する必要があり、かつ、固定先の固体支持体の方にも何らかの方法でアビジン分子を先に固定化する必要もあり、煩雑な工程を要する。また、ターゲット蛋白質に十数残基に及ぶアミノ酸配列をビオチン修飾用に導入する必要があり、これがターゲット蛋白質の本来の機能を損なう恐れもある。さらに、固体支持体にアビジンの様な巨大分子を固定化する必要があるため、系全体に関与する分子量が増大し、固定化後に電荷移動や微妙な分子量変化を測定する必要がある場合には適当ではない。
【0009】
蛋白質分子への固体支持体に対する配向が制御でき、かつ、系に導入される化学基による分子量変化の少ない固定化法としてヒスチジンタグを利用する方法がある(特許文献1〜3)。ヒスチジンタグはヒスチジン4〜6残基からなるペプチド配列であり、この部位が金属イオンをキレートできる。この配列は蛋白質分子中の任意の箇所に導入できることから、固体支持体に固定する際の蛋白質分子の配向制御が可能である。また、ペプチド配列は4〜6残基であり、固体支持体上において金属イオンを保持する環状配位子の分子量も高々200程度であるため、系全体の分子量増大は少ない。
【0010】
しかし、ヒスチジンタグを利用した方法は、金属イオンをキレートして結合する配位結合であるため、共有結合に比して、その結合安定性及び結合強度は低く、pH変化や周辺の塩濃度変化に影響され易く解離が起こり易い。蛋白質固定化固体支持体としての安定性は上記三法に比して劣る。
【0011】
その他、非天然アミノ酸を組み込んだポリペプチドと、該非天然アミノ酸の側鎖と特異的に相互作用する官能基を有する分子を用いて、ポリペプチドを検出する方法(特許文献4)や、非天然アミノ酸を組み込んだポリペプチドを、該非天然アミノ酸によって固体支持体に付着させて、固体支持体結合蛋白質を調製する方法(特許文献5)が報告されている。
【0012】
一方、ポリ ((2-メタクリロイロキシエチルホスホリルコリン)-co-(n-ブチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))(本明細書中、「PMBV」と称する)は、3つのユニットからなる高分子である。それぞれのユニットはMPC、BMA及びVPBAと呼ばれるもので、各ユニットが独自の役割を担っている。
【0013】
MPCユニットのホスホリルコリン基は、生体内において、細胞膜の脂質二重層における親水基の1つとして知られている。脂質二重層は生体内における液−液界面の境界(細胞膜)をなすものであるため、ほとんどの生体高分子はこの境界面に対して非特異吸着しないようにできている。これにより、MPCユニットはPMBVポリマーへ蛋白質等の生体高分子が非特異吸着することを妨げ、PMBVポリマーをコートした基材の生体適合性を向上させる役割を担っている(非特許文献4)。
【0014】
BMAユニットは、ポリマー合成の際に重合速度が速くなりすぎることを抑制する役を担っている。また、MPC及びVPBAのみでは、それぞれが極度に親水性(MPC)及び疎水性(VPBA)であるために、MPCが外側、VPBAが内側となった粒状のミセル形成が促進されるが、BMAはMPCとVPBAとの中間の親水性を持つため、これを添加することによりミセル形成を抑制し、ポリマーを水溶液中に均一に展開できるようにする役割を担っている。
【0015】
VPBAユニットは、他の分子との共有結合形成反応活性を有する活性残基である。PMBVポリマーはそれ自身のみでコーティング剤として基材の生体適合性を上昇させる機能を持っている。しかし、他のポリマーと反応させることでゲルやシートに加工し、それ自身を生体適合性基材として用いることもできる。このとき、ポリビニルアルコール(PVA)の様に分子内に-OH基を複数有し、それらがある距離内に近接できるフレキシブルな構造を持っているポリマーと反応させると、VPBA内のボロン酸(boronic acid)基がこれら複数の-OH基と反応することにより二価の共有結合を形成することができる。このようにPMBVはPVAと反応させることで簡単にゲルやシートに加工することができ、PMBV中の各ユニットの組成比を変化させることにより含水率や硬度も調整することができる(非特許文献5)。
【0016】
このような3つのユニットから成るPMBVは、細胞膜成分由来のホスホリルコリン基に起因する生体不活性(bioinert)な性質を利用して、人工血管や人工関節のコーティングに用いられ、それらの長期使用を可能にしている(非特許文献6及び7)。さらに、PVA等と反応させることにより簡単にゲル化する性質を利用して、ゲル内で細胞一つ一つを独立させて培養する技術への応用も始まっている(非特許文献5)。これは今後広まっていくと考えられている一細胞解析に必須な要素技術として期待されている。
【先行技術文献】
【特許文献】
【0017】
【特許文献1】特表2007−525653号公報
【特許文献2】特開2005−261313号公報
【特許文献3】特表2004−534730号公報
【特許文献4】特表2009−520949号公報
【特許文献5】特表2006−511797号公報
【非特許文献】
【0018】
【非特許文献1】Symington F. W., Subbarao B., Mosier D. E., Sprent J. Immunogenetics, 16:381-391, 1982年
【非特許文献2】Lofas S., Johnsson B., Edstrom A., Hansson A., Lindquist G., Muller Hillgren R-.M., Stigh L. Biosensors & Bioelectronics, 10:813-822, 1995年
【非特許文献3】Nilsson P., Persson B., Uhlen M., Nygren P.A. Anal. Biochem., 224:400-408, 1995年
【非特許文献4】Ishihara K., Nomura H., Mihara T., Kurita K., Iwasaki Y., Nakabayashi N. J. Biomed. Mater. Res., 39:323-330, 1998年
【非特許文献5】Konno T., Ishihara K. Biomaterials, 28:1170-1177, 2007年
【非特許文献6】Ishihara K., Fukumoto K., Iwasaki Y., Nakabayashi N. Biomaterials, 20:1553-1559, 1999年
【非特許文献7】Moro T., Takatori Y., Ishihara K., Konno T., Takigawa Y., Matsushita T., Chung U.I., Nakamura K., Kawaguchi H. Nature Mater., 3:829-836, 2004年
【発明の概要】
【発明が解決しようとする課題】
【0019】
本発明は、蛋白質分子を固定化する際に、固定化する分子の配向を制御することができ、煩雑な工程が必要なく、安定して固定化することができ、そして、固定化に使用する化学基が蛋白質の活性や機能に影響を及ぼさないような蛋白質固定化方法及び手段を提供することを目的とする。
【課題を解決するための手段】
【0020】
本発明者は上記課題を解決するため鋭意検討を行った結果、水酸基含有アミノ酸を含むペプチド配列が、フェニルボロン酸基と安定した共役結合を形成することから、該ペプチド配列とフェニルボロン酸基を有する分子を用いて、蛋白質分子等の分子を固定化することができるという知見を得た。また、(i)蛋白質分子の特定の位置に上記ペプチド配列を導入することで固定化の際の蛋白質分子の配向を制御することができ、(ii)分子内に予め固定化に必要なペプチド配列を導入することで先立つ煩雑な工程を省略でき、(iii)そして、結合反応に関与する化学基(リンカー)は、フェニルボロン酸基を有する分子のみで数百程度の分子量であり、またペプチド配列の分子量は数百から千数百とすることで、結合に関与する分子量の増大を制御可能であることも見出した。本発明は、上記知見に基づくものであり、上述した従来の課題を解決するものである。
【0021】
従って、本発明は以下を提供する。
[1]分子を固定化する方法であって、
水酸基含有アミノ酸を含む標識ペプチド配列を分子に付着させて標識分子を形成する工程と、
フェニルボロン酸基を有する分子を前記標識分子と接触させることによって前記標識分子をフェニルボロン酸基を有する分子に捕捉する工程と
を含む、分子の固定化方法。
[2]前記標識ペプチド配列が水酸基含有アミノ酸を2残基以上含むペプチド配列である、[1]に記載の方法。
[3]前記水酸基含有アミノ酸が、セリン、スレオニン及びチロシンからなる群より選択される1種以上である、[1]又は[2]に記載の方法。
[4]前記標識ペプチド配列が、前記水酸基含有アミノ酸に加えて、1〜3残基の塩基性アミノ酸を含む、[1]〜[3]のいずれかに記載の方法。
[5]前記塩基性アミノ酸が、リジン、アルギニン及びトリプトファンからなる群より選択される1種以上である、[4]に記載の方法。
[6]前記標識ペプチド配列が、連続した4〜6残基の水酸基含有アミノ酸からなるか、又は3〜5残基の水酸基含有アミノ酸と1〜3残基の塩基性アミノ酸の合計4〜6残基のアミノ酸からなる、[1]〜[5]のいずれかに記載の方法。
[7]前記標識ペプチド配列が、連続した7残基以上の水酸基含有アミノ酸からなるか、又は4残基以上の水酸基含有アミノ酸と1〜3残基の塩基性アミノ酸の合計7残基以上のアミノ酸からなる、[1]〜[5]のいずれかに記載の方法。
[8]前記分子が蛋白質である、[1]〜[7]のいずれかに記載の方法。
[9]前記標識ペプチド配列が、前記分子の活性部位又は認識領域から離れた位置で前記分子に共有結合により付着している、[1]〜[8]のいずれかに記載の方法。
[10]前記フェニルボロン酸基を有する分子が、2以上のフェニルボロン酸基を有するポリマーである、[1]〜[9]のいずれかに記載の方法。
[11]前記フェニルボロン酸基を有する分子が、ポリ((2-メタクリロイロキシエチルホスホリルコリン)-co-(n-ブチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))、又はポリ ((2-メタクリロイロキシエチルホスホリルコリン)-co-(ジメチルアミノエチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))である、[1]〜[10]のいずれかに記載の方法。
【0022】
[12]前記フェニルボロン酸基を有する分子が固体支持体に結合されている、[1]〜[11]のいずれかに記載の方法。
[13]前記フェニルボロン酸基を有する分子が固体支持体の表面に結合されており、前記分子が固体支持体の表面に固定化される、[1]〜[12]のいずれかに記載の方法。
[14]前記分子が前記固体支持体の表面に同一配向で保持されている単分子膜として固定化される、[13]に記載の方法。
[15]前記フェニルボロン酸基を有する分子が、フェニルボロン酸基と頭部基を含み、該頭部基が固体支持体と共有結合可能な官能基である、[12]〜[14]のいずれかに記載の方法。
[16]前記固体支持体が貴金属である、[12]〜[15]のいずれかに記載の方法。
[17]前記貴金属が、銀、金、白金及びパラジウムからなる群より選択される、[16]に記載の方法。
[18]前記固体支持体が電極である、[12]〜[15]のいずれかに記載の方法。
[19]前記固体支持体がプラスチックである、[12]〜[15]のいずれかに記載の方法。
[20]前記プラスチックが、ポリカーボネート、ポリエチレン、ポリプロピレン、ポリスチレン、ポリ塩化ビニル、及びポリエチレンテレフタレートからなる群より選択される、[19]に記載の方法。
[21]前記フェニルボロン酸基を有する分子が、直接又はスペーサー配列を介して固体支持体に結合されている、[12]〜[20]のいずれかに記載の方法。
【0023】
[22]前記フェニルボロン酸基を有する分子が架橋分子により架橋されて固定化基材を形成し、前記分子が該固定化基材に固定化される、[1]〜[11]のいずれかに記載の方法。
[23]前記架橋分子が多価アルコールである、[22]に記載の方法。
[24]前記多価アルコールがポリビニルアルコールである、[23]に記載の方法。
[25]前記固定化基材が、固体、高分子膜、高分子半透膜、固相ゲル及び液相ゲルからなる群より選択される1種以上である、[22]〜[24]のいずれかに記載の方法。
【0024】
[26]分子固相化用固体支持体であって、該固体支持体の表面に結合されたフェニルボロン酸基を有する分子を有することを特徴とする分子固相化用固体支持体。
[27]水酸基含有アミノ酸を含む標識ペプチド配列をコードするDNAと、蛋白質分子をコードするDNAを挿入するためのカセットとを含むことを特徴とする、標識ペプチド配列との融合蛋白質を発現するための発現ベクター。
[28]水酸基含有アミノ酸を含む標識ペプチド配列と付着した分子が、フェニルボロン酸基を有する分子を介して固体支持体に固定化されていることを特徴とする分子固相化デバイス。
[29]水酸基含有アミノ酸を含む標識ペプチド配列と付着した分子が、フェニルボロン酸基を有する分子を介して固定化基材に固定化されており、該固定化基材が、フェニルボロン酸基を有する分子を架橋分子により架橋して形成されていることを特徴とする分子固相化デバイス。
[30][28]又は[29]に記載の分子固相化デバイスと、分子間相互作用を検出する手段とを備えることを特徴とするセンサ。
【発明の効果】
【0025】
本発明により、分子を固定化するための方法及び手段が提供される。本方法及び手段は、分子(例えば蛋白質分子)の任意の部位に固定に必要なペプチド配列を導入することができるため、固体支持体上における分子の配向を制御することができる。また、分子を固定化するための結合反応は中性pH付近で自発的に起こるため前処理工程を必要としない。固定化する分子に導入されるペプチド配列は5〜8アミノ酸残基程度に調整できるため、系全体の分子量変化も少ない。さらに形成される結合は共有結合であるため、分子の固定化はpH変化や塩濃度変化に対して安定である。
上記した以外の、課題、構成及び効果は、以下の実施形態の説明により明らかにされる。
【図面の簡単な説明】
【0026】
【図1】フェニルボロン酸基を有する分子と多価水酸基含有オリゴペプチドとが結合する概念図(A)、及び水酸基含有アミノ酸の化学構造式(B)を示す。図1Bにおいて、括弧内はアミノ酸の3文字表記及び1文字表記を示す。
【図2−1】フェニルボロン酸基と結合するペプチド配列のスクリーニングのため用いた合成ペプチドの化学構造式一覧である。
【図2−2】フェニルボロン酸基と結合するペプチド配列のスクリーニングのため用いた合成ペプチドの化学構造式一覧である。
【図3】フェニルボロン酸基と結合するペプチド配列のスクリーニングのために用いたフェニルボロン酸特異的結合色素(アリザリンレッドS)の構造式とフェニルボロン酸基との結合により蛍光を発する反応の概念図(A)、及び実施例1で用いたフェニルボロン酸基含有ポリマー(PMBV)の化学構造式(B)を示す。
【図4】フェニルボロン酸基と結合するペプチド配列のスクリーニングのため、フェニルボロン酸特異的結合色素とフェニルボロン酸基との反応を図2で示した各種合成ペプチドがどの程度阻害するかを示した棒グラフである。
【図5】合成ペプチド6SW(A)、6YW(B)及び6Y2K(C)について、表面プラズモン共鳴を用いてフェニルボロン酸基含有ポリマーで表面被覆したチップ上への相互作用を確認したセンサーグラムを示す。
【図6−1】フェニルボロン酸基と結合するペプチド配列の最適化のために用いた合成ペプチドの化学構造式一覧である。
【図6−2】フェニルボロン酸基と結合するペプチド配列の最適化のために用いた合成ペプチドの化学構造式一覧である。
【図7】フェニルボロン酸基と結合するペプチド配列の最適化のため、フェニルボロン酸特異的結合色素とフェニルボロン酸基との反応を図6で示した各種合成ペプチドがどの程度阻害するかを示した棒グラフである。
【図8】フェニルボロン酸基含有ポリマー(PMBV)の化学構造式(A)と、フェニルボロン酸基含有ポリマー(PMDV)の化学構造式(B)を示す。
【図9】フェニルボロン酸基含有ポリマーPMBV(A)及びPMDV(B)を用いた、フェニルボロン酸特異的結合色素とフェニルボロン酸基との反応を各種合成ペプチドがどの程度阻害するかを示した棒グラフである。
【図10】蛋白質分子の固定化に使用する、フェニルボロン酸基を有する分子を結合させた固体支持体の概要(A)と、標識ペプチド配列との融合蛋白質を生成するための発現ベクターの概要(B)を示す。
【図11】フェニルボロン酸基を含有する分子をリンカーとして蛋白質を固体支持体に固相化したデバイスを用いた測定系の一例を示す。
【図12】フェニルボロン酸基を含有する分子を架橋して形成される固定化基材(ゲル、フィルム)に蛋白質を固相化したデバイスを用いた測定系の一例を示す。
【図13】標識ペプチド配列を有する融合蛋白質を生成するための発現ベクターの構築例(A)と、該発現ベクターを用いた標識ペプチド配列の導入工程(B)を示す。
【発明を実施するための形態】
【0027】
本発明は、フェニルボロン酸基が、その水酸基と別の分子に含まれる水酸基との共有結合によって安定化する性質に基づいて、フェニルボロン酸基を有する分子をリンカーとして、水酸基含有アミノ酸を含むペプチド配列で標識した分子を固定化することに関する。具体的には、フェニルボロン酸基に含まれる水酸基は、弱塩基性から塩基性の条件下で、水酸基含有アミノ酸を含むペプチド配列における2つの水酸基と共有結合する(図1A)。従って、図1Bに例示するような水酸基含有アミノ酸を標識ペプチド配列に組み込むことによって、フェニルボロン酸基を有する分子と特異的にかつ自発的に結合する標識ペプチド配列が得られる。このような標識ペプチド配列は、自然界の蛋白質にはほとんど見いだされない配列を有し、また遺伝子工学的手法により任意の蛋白質分子に簡便に挿入又は付加することができる。
【0028】
本発明において「標識ペプチド配列」は、分子を固定化するためのリンカーとなるフェニルボロン酸基を有する分子と結合可能であるペプチド配列を指し、「オリゴペプチド配列」ともいう。標識ペプチド配列は、その側鎖に水酸基を含有するアミノ酸、すなわち水酸基含有アミノ酸を含むものであれば、その長さ及び組成(配列)は特に限定されるものではない。水酸基含有アミノ酸としては、セリン(Ser、S)、スレオニン(Thr、T)及びチロシン(Tyr、Y)が好適であり、標識ペプチド配列は、これらのうち1種又は複数種を含むことができる。標識ペプチド配列は、水酸基含有アミノ酸としてチロシンを含むことが好ましい。
【0029】
本発明において、標識ペプチド配列が効率的なフェニルボロン酸結合能を有するためには、立体的に2つの水酸基が近接して存在してフェニルボロン酸基に対して水酸基を供給する必要があるため(図1A)、標識ペプチド配列は、2つ以上の水酸基含有アミノ酸を含むものであることが好ましい。標識ペプチド配列において、一次配列上、隣接する2つの水酸基含有アミノ酸、又はその間に1残基のアミノ酸を挟んだ2つの水酸基含有アミノ酸は、フェニルボロン酸との結合に適した、水酸基のコンフォメーションをとることが難しいこともある。そのため、フェニルボロン酸基に近接させることができる2つの水酸基の組合せの数を増大させるため、連続した4〜6残基の水酸基含有アミノ酸からなるペプチド配列であることが好ましい。あるいは、連続した7残基以上(例えば7〜50残基)の水酸基含有アミノ酸からなるペプチド配列も可能であるが、水酸基含有アミノ酸の連続数が長くなるほど、標識ペプチド配列と付着する分子の構造形成又は活性に影響を及ぼす可能性があるため、その影響を考慮して標識ペプチド配列を設計することが好ましい。
【0030】
また、2つ以上の水酸基含有アミノ酸の間に非水酸基含有アミノ酸が含まれてもよいし、又は水酸基含有アミノ酸の末端に非水酸基含有アミノ酸が付加されていてもよい。例えば、2残基以上の任意のアミノ酸を挟んで両端の2残基が水酸基含有アミノ酸残基であるペプチド配列を用いることができる。
【0031】
さらに、フェニルボロン酸結合効率を上昇させるため、結合反応が生じる部位の局所pHが塩基性であることが望ましいことがわかっている。そこで標識ペプチド配列において、1〜4残基(好ましくは1〜3残基)の塩基性アミノ酸が、上述の連続した水酸基含有アミノ酸に隣接するか、又は連続した水酸基含有アミノ酸の配列中に挿入されていることが好適である。ここで、塩基性アミノ酸とは、リジン(Lys、K)、アルギニン(Arg、R)及びトリプトファン(Trp、W)から選択されるアミノ酸を意味し、標識ペプチド配列はこれらのうち1種又は複数種を含むことができる。例えば、標識ペプチド配列は、3〜5残基の水酸基含有アミノ酸と1〜3残基の塩基性アミノ酸の合計4〜6残基のアミノ酸からなるペプチド配列、又は4残基以上の水酸基含有アミノ酸と1〜3残基の塩基性アミノ酸の合計7残基以上のアミノ酸からなるペプチド配列が挙げられる。
【0032】
具体的な標識ペプチド配列の例を以下に示す:
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr(6Y)(配列番号1)
Ser-Ser-Ser-Ser-Ser-Ser-Trp(6SW)(配列番号2)
Ser-Ser-Ser-Ser-Trp(4SW)(配列番号3)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Trp(6YW)(配列番号4)
Tyr-Tyr-Tyr-Tyr-Trp(4YW)(配列番号5)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Gly-Gly(6Y2G)(配列番号6)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Lys-Lys(6Y2K)(配列番号7)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Gly-Lys(6YGK)(配列番号8)
Tyr-Tyr-Tyr-Tyr-Trp-Tyr-Tyr(4YW2Y)(配列番号9)
Tyr-Tyr-Tyr-Trp-Tyr-Tyr-Tyr(3YW3Y)(配列番号10)
Tyr-Tyr-Tyr-Tyr-Tyr-Trp-Tyr(5YWY)(配列番号11)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Lys-Lys-Trp(6Y2KW)(配列番号12)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Trp-Lys-Lys(6YW2K)(配列番号13)
【0033】
本発明では、上述したような標識ペプチド配列を分子に付着させて、標識分子を形成する。ここで「分子」とは、固定化が望まれる分子であれば任意の分子であってよく、例えば蛋白質(ペプチド、ポリペプチドなど)、他にも標識ペプチド配列にシステインなどを導入することにより金粒子などが含まれる。本発明では、標識ペプチド配列を簡便かつ効率的に付着させることができ、また特に固定化が望まれているという点で、蛋白質分子を対象とすることが好ましい。蛋白質としては、例えば酵素、受容体、抗体、抗原、アクチンやキネシン等のフィラメント形成蛋白質など、並びにそれらの一部又はサブユニットが挙げられる。
【0034】
標識ペプチド配列は、分子の任意の部位に付着させることができる。但し、標識ペプチド配列が対象の分子の立体構造や活性に影響を及ぼさないように、標識ペプチド配列は、分子の活性部位又は認識領域から離れた位置で、その分子に共有結合により付着していることが好ましい。
【0035】
また標識ペプチド配列は、当技術分野で公知の方法及び手段により、分子に付着させることができる。例えば蛋白質分子の固定化を行う場合には、蛋白質分子を標識ペプチド配列との融合蛋白質として生成することにより、標識ペプチド配列を蛋白質分子に付着させることができる。
【0036】
融合蛋白質の調製方法は当技術分野で周知であり、例えば化学合成法及び遺伝子組換え法がある。化学合成法の場合には、公知のペプチド合成手法に従って、例えば市販のペプチド合成機や市販のペプチド合成用キットを用いて、融合蛋白質を調製することができる。遺伝子組換え法では、例えば、対象の蛋白質分子をコードするDNAと、標識ペプチド配列をコードするDNAとを、直接連結して又はリンカー配列を介して連結して、プラスミド等の公知のベクターに挿入し、該ベクターを宿主細胞に導入し、該宿主細胞において融合蛋白質(標識分子)を発現させることができる。標識ペプチド配列は、好ましくは蛋白質分子のカルボキシル末端及び/又はアミノ末端に付加される。蛋白質分子のカルボキシル末端又はアミノ末端は分子の端点として溶媒接触可能領域に突出していることが多いため、ここに標識ペプチド配列を付加することで蛋白質の正しい三次元構造形成への影響を抑制し、かつ蛋白質の本来の機能を阻害することも抑制することができる。
【0037】
さらに標識ペプチド配列を蛋白質分子のカルボキシル末端及び/又はアミノ末端に付加する際に、その蛋白質の機能阻害の可能性をさらに低減させるため、カルボキシル末端に付加する際は標識ペプチド配列のアミノ末端側に、またアミノ末端に付加する際は標識ペプチド配列のカルボキシル末端側に、数残基程度のリンカー配列を付加することが好ましい。蛋白質分子と標識ペプチド配列との間に挿入されるリンカー配列は、当技術分野で公知のリンカー配列でよく、例えば1〜20アミノ酸、好ましくは1〜10アミノ酸、より好ましくは2〜6アミノ酸のリンカー配列を用いることができる。具体的なリンカー配列としては、コンフォメーションの自由度の高さの点に利点がある、4〜6残基程度の連続したグリシン残基がある。
【0038】
融合蛋白質の発現に使用するベクターとしては、プラスミド、ファージミド、ウイルスに基づくベクター(レトロウイルス、アデノウイルス及びワクシニアウイルスなどの動物ウイルスベクター、バキュロウイルスなどの昆虫ウイルスベクター)、人工染色体などの公知のベクターであれば任意のものを用いることができる。融合蛋白質を発現させるための発現ベクターは、蛋白質分子をコードするDNAと標識ペプチド配列をコードするDNAとを、融合蛋白質が発現されるようにベクターに連結することにより得ることができる。なお、発現ベクターには、プロモーター、転写終結シグナル、所望によりエンハンサー、スプライシングシグナル、ポリA付加シグナル、選択マーカーなどを連結することが好ましい。
【0039】
本発明では、標識ペプチド配列と付着した蛋白質分子を融合蛋白質として簡便かつ効率的に調製するために、標識ペプチド配列をコードするDNAと、蛋白質分子をコードするDNAを挿入するためのカセットとを備えた発現ベクターを利用することができる(図10B)。かかる発現ベクターを用いた場合には、発現ベクターのカセットに蛋白質分子をコードするDNAを挿入するのみで、標識ペプチド配列との融合蛋白質を発現するための発現ベクターを構築することができる。従って、発現ベクターは、少なくとも標識ペプチド配列(例えば配列番号1〜13に示されるアミノ酸配列)をコードするDNA、及び蛋白質分子をコードするDNAを挿入するためのカセット(制限酵素部位、マルチクローニングサイトなど)を含み、場合により標識ペプチド配列と蛋白質分子とを連結するリンカー配列をコードするDNA、融合蛋白質の発現に有用な調節配列などを含んでもよい。
【0040】
構築した発現ベクターを、宿主細胞中に導入し、形質転換体を作製する。形質転換に使用する宿主としては、融合蛋白質を発現し、産生できるものであれば特に限定されるものではなく、例えば、細菌(大腸菌等)、酵母、動物細胞、昆虫細胞などが挙げられる。宿主細胞への発現ベクターの導入も、当技術分野で公知の方法、例えばエレクトロポレーション法、リン酸カルシウム法、リポフェクション法などにより行うことができる。融合蛋白質は、形質転換体を培養し、その培養物から単離・精製することにより得ることができる。
以上のようにして、標識ペプチド配列を分子に付着させて標識分子を形成することができる。
【0041】
フェニルボロン酸基を有する分子は、フェニル基にボロン酸(B(OH)2)が結合したフェニルボロン酸基(ジヒドロキシフェニルボランとも称する)を有する分子であれば任意の分子を用いることができる。例えば、フェニルボロン酸であってもよいし、1若しくは複数のフェニルボロン酸基を有する有機化合物であってもよいし、又はフェニルボロン酸基を有するモノマーが重合したポリマー化合物であってもよい。好適には、2以上のフェニルボロン酸基を有するポリマーを用いる。
【0042】
フェニルボロン酸基を有する分子は、フェニルボロン酸基に加えて、標識ペプチド配列との結合反応、固体支持体への結合、固定化した分子の反応などに好適な1以上の官能基を含むものであってもよい。例えば、フェニルボロン酸基と標識ペプチド配列との結合反応が生じる部位の局所pHが塩基性となるような基(ジメチルアミノエチル基、ジエチルアミノエチル基など)、固体支持体と共有結合可能な頭部基(チオール基、スクシンイミド基など)、分子の流動性を高め、それにより分子の反応効率を高める官能基(2-メタクリロイロキシエチルホスホリルコリンなど)が挙げられる。
【0043】
フェニルボロン酸基を有するポリマー分子の具体例として、例えばポリ ((2-メタクリロイロキシエチルホスホリルコリン)-co-(n-ブチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))(以下、PMBVと略す)は、2-メタクリロイロキシエチルホスホリルコリン(MPC)基の働きにより、固液界面における水分子の水素結合クラスターを分解する機能があるため、界面近傍の自由水含率が高くなり、液体の流動度が高くなることが知られている。このため、酵素等の蛋白質分子を固定して固体支持体と液相との界面で様々な反応を行う際、酵素基質等の他の分子の拡散係数が高くなることで、分子の反応効率が大幅に上昇することが見込まれる。
【0044】
また、フェニルボロン酸基を有するポリマー分子であるポリ ((2-メタクリロイロキシエチルホスホリルコリン)-co-(ジメチルアミノエチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))(以下、PMDVと略す)は、塩基性官能基としてジメチルアミノエチルメタクリル酸基が含まれている。上述したように、フェニルボロン酸基と標識ペプチド配列との結合反応が生じる部位の局所pHが塩基性であることが望ましいことから、PMDVは、上記のPMBVの効果を維持しつつ、フェニルボロン酸基と標識ペプチド配列との結合活性を上昇させ、より高効率な分子の固定化を行うことができる。
【0045】
フェニルボロン酸基を有する分子は、固体支持体に結合することができ、それにより対象の分子を固体支持体に固定化することが可能となる(図11)。好ましくは、フェニルボロン酸基を有する分子が固体支持体の表面に結合されており、対象の分子が固体支持体の表面に固定化される。使用する固体支持体は、当技術分野で一般的に使用される固体支持体であれば特に限定されるものではない。具体的には、貴金属(金、銀、白金、パラジウム等)、銅、アルミニウム、タングステン、モリブデン、クロム、チタン、ニッケル等の金属;ステンレス、ハステロイ、インコネル、モネル、ジュラルミン等の合金;半導体素子等の電極(トランジスタ、FETなど);シリコン;ガラス、石英ガラス、溶融石英、合成石英、アルミナ、サファイア、セラミクス、フォルステライト及び感光性ガラス等のガラス材料;ポリエステル、ポリスチレン、ポリエチレン、ポリプロピレン、ナイロン、アクリル、ポリカーボネート、ポリエチレンテレフタレート(PET)、ポリウレタン、フェノール樹脂、メラミン樹脂、エポキシ樹脂及びポリ塩化ビニル等のプラスチック;アガロース、デキストラン、セルロース、ポリビニルアルコール、ニトロセルロース、キチン、キトサンが挙げられる。また、固体支持体の形状についても、特に限定はなく、平面により形成されるもの(例えばタイタープレート、多孔質若しくは細孔アレー、マイクロ流路など)、平板、フィルム、チューブ及び粒子(磁性粒子等)が挙げられる。
【0046】
フェニルボロン酸基を有する分子を固体支持体に結合させる方法は、特に限定されるものではない。例えば、共有結合、イオン結合、物理吸着によってフェニルボロン酸基を有する分子を固体支持体に結合させることができる。具体的には、例えばフェニルボロン酸基を有する分子を混和させた有機溶媒等の溶液を固体支持体上に塗布し、乾燥させることにより固体支持体の表面にフェニルボロン酸を有する分子を結合させることができる。また、フェニルボロン酸基を有する分子が他の官能基を有する場合には、固体支持体の性質や固定対象の分子の性質、それらを用いて固体支持体上で行う化学反応の性質、などにより様々なものを取捨選択することが可能である。フェニルボロン酸基を有する分子は、スペーサー配列、例えば1〜10個の炭素原子を含む炭化水素基を介して、固体支持体に結合させてもよい。
【0047】
共有結合を介したフェニルボロン酸基を有する分子の固体支持体への結合は、例えば、フェニルボロン酸基を有する分子に含まれる頭部基と反応性の官能基を固体支持体に導入して両者を反応させることにより実施できる。フェニルボロン酸基を有する分子が固体支持体(例えば貴金属)と共有結合可能な頭部基を有する場合には、その頭部基を利用して、フェニルボロン酸基を有する分子を金や白金等の貴金属固体支持体に共有結合を介して結合させることができる。金や白金等は原子レベルで配列制御ができる。すなわち金属結晶として成長させた格子面は1原子レベルの凹凸も無い平板状加工が可能である。ここにフェニルボロン酸基を有する分子の単分子層を構築することにより、標識ペプチド配列を捕捉することができる平板状固体支持体を得ることができる。このフェニルボロン酸基を有する分子の単分子層を持つ金属材でできた固体支持体上に、標識ペプチド配列と付着させた分子を結合させることで、金属平面上にその分子の配向が制御された上で、かつ数オングストロームの誤差で固定された分子の高さが制御されたデバイスを提供することができる。例えば、固体支持体の表面上に対象の分子を同一配向で保持されている単分子膜として固定化することができる。
【0048】
このように数オングストロームの誤差範囲で分子を電極等の貴金属支持体上に配向制御した状態で結合させることができるため、固定化した分子(例えば蛋白質、とりわけ酵素)の活性部位を貴金属支持体表面から約100オングストローム以内におさめて固定することも可能となる(真核生物由来の蛋白質の平均分子量は5万程度と言われており、分子の最大長は100オングストローム程度である)。これによって、数十から百数十オングストロームと推定されているFETのデバイ長内に酵素反応(種々の電荷移動反応を含むことが多い)を惹起させることが可能となるため、任意の酵素反応をFETを用いて検出する系の構築が可能となる。
【0049】
また例えば、フェニルボロン酸基を有する分子の頭部基としてアミノ基を使用し、固体支持体に活性エステル基、エポキシ基、アルデヒド基、カルボジイミド基、イソチオシアネート基又はイソシアネート基を導入することにより共有結合を形成できる。また、頭部基としてチオール基を使用し、固体支持体に活性エステル基、マレイミド基又はジスルフィド基を導入してもよい。活性エステル基としては、例えば、p-ニトロフェニル基、N-ヒドロキシスクシンイミド基、コハク酸イミド基、フタル酸イミド基、5-ノルボルネン-2、3-ジカルボキシイミド基等が挙げられる。官能基を固相担体に導入する方法の一つとしては、所望の官能基を有するシランカップリング剤(γ-アミノプロピルトリエトキシシランなど)によって固体表面を処理する方法が挙げられる。別の方法としては、プラズマ処理が挙げられる。
【0050】
固体支持体にフェニルボロン酸基を有する分子を結合させる具体的な方法としては、例えば、(i)ポリスチレン、ポリカーボネート、ポリ塩化ビニルといったプラスチック基材、又は金、白金、銅等の金属基材等の表面に、エタノールなどの有機溶媒にフェニルボロン酸基を有する分子(PMBV等)を含む溶液を塗布し、乾燥させることと、(ii)標識ペプチド配列と付着させた分子(蛋白質など)を含む溶液をその基材上に添加することにより、配列制御された分子によりコーティングされた基材を形成することを含む。
【0051】
上述のようにして、フェニルボロン酸基を有する分子を固体支持体に結合させることができる。本発明は、予めフェニルボロン酸基を有する分子(好ましくはPMBV又はPBDV)を固体支持体の表面に結合させた固体支持体も提供する。この固体支持体を用いることにより、標識ペプチド配列に付着させた分子を単に適用するのみで、分子を簡便かつ効率的に固体支持体に固定化することができる(例を図10Aに示す)。
【0052】
また、分子の固定化は、固体支持体への固定化に限定されるものではない。本発明では別の方法として、フェニルボロン酸基を有する分子における、標識ペプチド配列との結合に必要な水酸基以外の官能基(例えば水酸基)を架橋分子を用いて架橋することにより、固定化基材を形成することができる。その結果、架橋形成された固定化基材に対象の分子が固定化されることになる。使用する架橋分子としては、多価アルコール、例えばポリビニルアルコールや、多糖類、例えばデキストランなどが挙げられる。
【0053】
形成することができる固定化基材としては、固体、高分子膜、高分子半透膜、フィルム、固相ゲル及び液相ゲルなどが挙げられる。したがって、本発明は、分子(例えば酵素等の蛋白質分子)を、半透膜などのフィルム状物質や、様々な含水率を有するゲル状物質中に安定的に共有結合により固定化したデバイスをも提供する(図12)。また、これらの固定化基材は、微小な、例えばマイクロメーター又はナノメーターのサイズとすることが可能である。
【0054】
さらに、標識ペプチド配列が特異的に認識し、自発的に結合するのはフェニルボロン酸基であるため、任意の蛋白質を、他にも様々な物質にフェニルボロン酸基単独、あるいは他の化学基とフェニルボロン酸基が共存した分子の状態で固定されたフェニルボロン酸基を介して固定することが可能である。
【0055】
標的ペプチド配列と付着させた分子(標識分子)をフェニルボロン酸基を有する分子に捕捉させて分子を固定化するには、中性pH付近の緩衝液などの水溶液中に混和した標識分子溶液を、フェニルボロン酸基を有する分子を含む溶液又は固体支持体に結合させたフェニルボロン酸基を有する分子と接触させ、5〜40℃にて、好ましくは室温にて、数分から数十分放置する。
【0056】
上述のようにして、フェニルボロン酸基に特異的かつ自発的に結合する標識ペプチド配列を固定対象の分子に付着させることで、フェニルボロン酸基と標識ペプチド配列との結合に基づいて、該フェニルボロン酸基を有する分子をリンカーとして固体支持体上又は固定化基材中に該分子を任意の配向性で安定的に固定化することができる。
【0057】
また本発明は、標識ペプチド配列と付着した分子が、フェニルボロン酸基を有する分子を介して固定化されている分子固相化デバイスを提供する。分子固相化デバイスにおいて、標識ペプチド配列と付着した分子は、フェニルボロン酸基を有する分子を介して固体支持体に固定化されていてもよいし、あるいはフェニルボロン酸基を有する分子が架橋分子により架橋されて固定化基材を形成しており、その固定化基材に標識ペプチド配列と付着した分子が固定化されていてもよい。分子固相化デバイスの形状は、固定化された分子を含む限り特に限定されず、固体支持体の形状、例えば基板状(プロテインチップ等)若しくは粒子状(ナノ粒子等)であってもよいし、又は固定化基材の形状、例えば膜状、フィルム状若しくはゲル状であってもよい。
【0058】
本発明の分子固相化デバイスは、対象の分子を、その配向を制御して、及び/又は単分子層で固定化することができるため、分子の多様な分析に有用である。
【0059】
従って、本発明は、対象の分子を固相化したデバイスと、分子間相互作用を検出する手段とを備えるセンサを提供する。ここで、分子間相互作用とは、固相化されている分子と他の分子(例えば被検物質)との相互作用であれば、任意の相互作用、例えば結合、解離などであってよい。検出手段は、FETのような電気的検出手段、表面プラズモン共鳴のような光学的検出など、周知の検出手段のいずれであってもよい。以下、代表的な例について記載する。また、図11及び12に、分子として蛋白質を固相化したデバイスを用いた測定系の例を示す。
【0060】
フィールドエフェクトトランジスタ(Field-Effect Transistor, FET)は、電気的検出を利用したセンサに汎用されている技術である。原理は、ソース電極からドレイン電極へ流れる電流を、第三の電極であるゲート電極で制御し、そのゲート電極表面で分子間相互作用を起こさせるとゲート電極の電荷が変化するため、電流的応答が変化する(図11)。
【0061】
FETはセンサチップ上に電荷移動が生じる反応が起こった場合、高感度な検出ができるが、その反応ができるだけゲート電極表面に近い場所で起こる必要があり、検出できる距離は数ナノメートルとされている。そのため、本発明のように、配向が制御され、かつ高さが高精度で揃えられた分子を固定した固相化デバイスをゲート電極として使用した場合、数ナノメートルの検出限界内に分子を配列制御することが可能である。そのため、本発明の分子固相化デバイスは、高感度なFETを利用したセンサに有用である。
【0062】
なお、酵素等の蛋白質の大きさは概ね数ナノメートル径であり、FETの検出限界と拮抗する。そのため、本発明を利用した蛋白質分子の配向制御は、機能的なフィールドエフェクトトランジスタ用センサを作製するのに有効な手段となる。
【0063】
上述の配列制御は固定する蛋白質の三次元構造が既知の場合、特にその意図が達成されやすいが、三次元構造が不明の場合も試行錯誤的に電荷移動反応検出に最適化することができる。本発明では、蛋白質分子中の任意の位置にフェニルボロン酸結合能を有する標識ペプチド配列を簡便に挿入することができるため、標識ペプチド配列を種々の位置に付着させた蛋白質分子を調製してその反応を簡便に確認することが可能である。
【0064】
センサの作製は、例えば、(i)金、白金等の金属基材等の表面にチオール化したフェニルボロン酸基を反応させフェニルボロン酸の単分子層を形成することと、(ii)標識ペプチド配列をリンカー配列を介して付着した蛋白質分子を含む溶液をその基材上に添加することにより、配向制御された蛋白質分子の単分子層によりコーティングされたセンサチップを形成することを含む。
【0065】
また、表面プラズモン共鳴センサは、表面プラズモン共鳴を利用し、センサチップ上で分子間相互作用をリアルタイムで解析できるセンサである。例えば、市販の表面プラズモン共鳴センサ(例えば、BIAcore社製のもの)は容易に入手可能である。本発明に従ってセンサチップ上に対象の分子を固定化し、センサチップ上にマイクロ流路を設け、ここに被検物質を含むサンプルを一定の流速で送液する。固定化した分子と被検物質が相互作用をすれば、表面プラズモン現象により、結合と解離が光学的に検出され、センサグラムとしてリアルタイムでモニターできる。表面プラズモン共鳴センサは、微量サンプルを高感度に検出できるとともに、相互作用のキネティクスをリアルタイムで解析できるという利点がある。
【0066】
さらにリフレクトメトリーとは、レーザーを試料板に反射させ、反射光を測定することによって、試料版表面への蛋白質吸着量を測定する手法である。このリフレクトメトリーの原理とマイクロ流体チップを組み合わせたリフレクトメトリーバイオセンサは容易に入手可能である。本発明に従ってセンサーチップ上に分子を固定化し、センサーチップ上にマイクロ流路を設け、ここに被検物質を含むサンプルを一定の流速で送液する。固定化された分子と被検物質が相互作用をすれば、吸着タンパク質量がセンサグラムとしてリアルタイムでモニターできる。リフレクトメトリーバイオセンサは、微量サンプルを高感度に検出できるとともに、相互作用のキネティクスをリアルタイムで解析できるという利点がある。
【0067】
分子固相化デバイスとして分子を膜状、フィルム状又はゲル状の固定化基材に固定したものを使用する場合には、溶液置換でしか行うことができなかった複数の分子反応を、分子固相化デバイスの微細ゲル配列により行うことも可能であり(図12)、計測装置への組込みが簡便化される。
【0068】
また本発明の分子固相化デバイスが、粒子状(ナノサイズ、マイクロサイズ)、膜状又はゲル状である場合には、マイクロ流路内における高感度分析に有用である。
【0069】
さらに分子固相化デバイスが粒子状である場合には、粒子上に分子(蛋白質分子)が固定化されるため水溶液中での分散性がよく、被検物質と効率よく反応する。完全分散が達成されると、分子間相互作用がおきたとき粒子が凝集するため、簡便に分子間の結合が解析できる。なお、こうした分散性は、インクジェット手法やスプレー手法でナノ粒子をパターニングする場合にも重要である。
【実施例】
【0070】
<実施例1>フェニルボロン酸結合能を有するペプチド配列の探索
ポリ((2-メタクリロイロキシエチルホスホリルコリン)-co-(n-ブチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))(以下、PMBVと略す)を、60モル% 2-メタクリロイロキシエチルホスホリルコリン基、20モル% n-ブチルメタクリル酸、及び20モル% p-ビニルフェニルボロン酸となるように重合した。
【0071】
このPMBVをリン酸緩衝生理食塩水(PBS:10mM NaH2PO4/Na2HPO4、150mM NaCl pH7.3)に0.25mg/mlとなるように溶解し、各200μlを96穴ウエルプレートに分注した。
【0072】
上記溶液をいれたウエルに、図2に示した各化学構造式を有するオリゴペプチド(PBS中)を各々0.05mMとなるように分注し、混和した。具体的には、下記のオリゴペプチドを使用した:
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr(6Y)(配列番号1)
Ser-Ser-Ser-Ser-Ser-Ser-Trp(6SW)(配列番号2)
Ser-Ser-Ser-Ser-Trp(4SW)(配列番号3)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Trp(6YW)(配列番号4)
Tyr-Tyr-Tyr-Tyr-Trp(4YW)(配列番号5)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Gly-Gly(6Y2G)(配列番号6)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Lys-Lys(6Y2K)(配列番号7)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Gly-Lys(6YGK)(配列番号8)
【0073】
ウエルプレートを25℃で2時間、振盪した(700rpm、TAITEC MBR-022UP)。
振盪後、PMBV中のフェニルボロン酸基に特異的に結合する蛍光色素アリザリンレッドSを各ウエルに各0.05mMとなるように分注し、混和した。アリザリンレッドSの分子式、及びフェニルボロン酸と結合することで蛍光を発する機構を図3に示す。ウエルプレートを25℃で1時間、振盪した(700rpm、TAITEC MBR-022UP)。
【0074】
フェニルボロン酸にどの程度のアリザリンレッドSが結合できたかを知るために、アリザリンレッドS由来の蛍光強度を測定した。モレキュラーデバイス社のフルオロスペクトロメーターGemini XSを用いて、励起光波長495nmで励起し、蛍光の発光強度測定は520nmから640nmの範囲を10nm間隔で強度測定を連続的に行い、極大値を持って蛍光強度とした。
【0075】
ペプチド添加無し、及び各ペプチドを添加した場合の各々のアリザリンレッドS由来の蛍光強度極大値を棒グラフにしたものを図4に示す。各棒グラフのエラーバーは試行回数三回における標準偏差である。棒グラフの高さが低く、アリザリンレッドS由来の蛍光強度が低いペプチドほど、アリザリンレッドSのフェニルボロン酸基への結合を阻害していることになり、ペプチドとフェニルボロン酸基の結合量が多いことが示唆される。
【0076】
図4に示す結果から、いずれのオリゴペプチドもフェニルボロン酸基へ結合しているが、特に4YW、6YW、6Y、6YGK及び6Y2Kの結合量が多いことがわかった。
【0077】
<実施例2>フェニルボロン酸とペプチドとの表面プラズモン共鳴法による結合確認
PMBVを、25モル% 2-メタクリロイロキシエチルホスホリルコリン基、55モル% n-ブチルメタクリル酸、及び20モル% p-ビニルフェニルボロン酸となるように調製した。表面プラズモン共鳴測定装置用基板をエタノールで5分間超音波洗浄し、自然乾燥させてから、0.2重量%PMBVをエタノールに溶解した溶液を各基板上に40μl滴下し、毎分1000回転で30秒間遠心しスピン塗布を行った。その後、各基板をデシケータ(約0.2気圧)にて2時間減圧乾燥させた。
【0078】
アセトン洗浄し、乾燥させた表面プラズモン共鳴測定装置用プリズムに上記基板を密着させ、表面プラズモン共鳴測定装置(MORITEX、SPR-670M)内にセットした。装置内でリン酸緩衝生理食塩水(10mM NaH2PO4/Na2HPO4、150mM NaCl pH7.3)にて基板をセンサーグラムが安定するまで洗浄(30μl/min)した。
【0079】
同じリン酸緩衝生理食塩水に1mg/mlになる様に溶解した3種類のペプチド(実施例1においてフェニルボロン酸特異的結合色素とフェニルボロン酸との反応阻害効果が低かった合成ペプチド1種(6SW、配列番号2)、反応阻害効果が大きいと認められた合成ペプチド2種(6YW、配列番号4;6Y2K、配列番号7))を用意した。
【0080】
センサーグラムが安定したのを見計らって、各ペプチド溶液を240秒間基板上に流し(30μl/min)、各ペプチドの結合曲線を取得した。その後、リン酸緩衝生理食塩水を同流速で基板上に流し、各ペプチドの解離曲線を取得した。
【0081】
図5に各センサーグラムを示す。実施例1においてフェニルボロン酸特異的結合色素とフェニルボロン酸との反応阻害効果が低かった合成ペプチド6SW(配列番号2)は、結合曲線部(180sec.近辺から420sec.近辺まで)の上昇から、PMBVに対して親和性を持つことは示したが、解離曲線部(420sec.近辺以降)において示される速やかな下降からPMBVとの結合があまり安定ではないことが示された(図5A)。これに対し、フェニルボロン酸特異的結合色素とフェニルボロン酸との反応阻害効果が大きいと認められた合成ペプチド6YW(配列番号4)と6Y2K(配列番号7)に関しては、解離曲線部においてセンサーグラムがバックグラウンドレベルまで下降せず、図5B及びCに示すように結合量を反映した上昇分が認められた。特に、6Y2Kに関しては、解離曲線部において早々に(470sec.近辺)バックグラウンドレベルより有意に高い位置で安定し、かつ下降しないことから、非常に安定な結合を形成していることが示された(図5C)。
【0082】
上記の結果は、実施例1で行ったフェニルボロン酸特異的結合色素とフェニルボロン酸との反応阻害実験による、フェニルボロン酸結合能を有するペプチド配列の探索結果と高い一貫性を示している。
【0083】
<実施例3>フェニルボロン酸結合能を有するペプチド配列最適化
リン酸緩衝生理食塩水(10mM NaH2PO4/Na2HPO4、150mM NaCl、pH7.3)に、60モル% 2-メタクリロイロキシエチルホスホリルコリン基、20モル% n-ブチルメタクリル酸、及び20モル% p-ビニルフェニルボロン酸となるように重合したPMBVを0.25mg/mlとなるように溶解し、各200μlを96穴ウエルプレートに分注した。
【0084】
上記溶液をいれたウエルに、図6に示した各化学構造式を有するオリゴペプチドを各々0.2mM(実施例1より意図的に低い濃度とした)となるように分注し、混和した。具体的には、下記のオリゴペプチドを使用した:
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Trp(6YW)(配列番号4)
Tyr-Tyr-Tyr-Tyr-Trp-Tyr-Tyr(4YW2Y)(配列番号9)
Tyr-Tyr-Tyr-Trp-Tyr-Tyr-Tyr(3YW3Y)(配列番号10)
Tyr-Tyr-Tyr-Tyr-Tyr-Trp-Tyr(5YWY)(配列番号11)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Lys-Lys-Trp(6Y2KW)(配列番号12)
Tyr-Tyr-Tyr-Tyr-Tyr-Tyr-Trp-Lys-Lys(6YW2K)(配列番号13)
【0085】
ウエルプレートを25℃で2時間、振盪した(700rpm、TAITEC MBR-022UP)。
振盪後、PMBV中のフェニルボロン酸基に特異的に結合する蛍光色素アリザリンレッドSを各ウエルに各0.05mMとなるように分注し、混和した。ウエルプレートを25℃で1時間、振盪した(700rpm、TAITEC MBR-022UP)。
【0086】
フェニルボロン酸にどの程度のアリザリンレッドSが結合できたかを知るために、アリザリンレッドS由来の蛍光強度を測定した。モレキュラーデバイス社のフルオロスペクトロメーターGemini XSを用いて、励起光波長495nmで励起し、蛍光の発光強度測定は520nmから640nmの範囲を10nm間隔で強度測定を連続的に行い、極大値を持って蛍光強度とした。
【0087】
ペプチド添加無し、及び各ペプチドを添加した場合の各々のアリザリンレッドS由来の蛍光強度極大値を棒グラフにしたものを図7に示す。各棒グラフのエラーバーは試行回数三回における標準偏差である。図7Aのグラフにより、ペプチド配列に付加すると結合効率を上昇させる塩基性残基(特にトリプトファン)は連続したチロシン残基中のどの位置にあってもその効果は大差ないことが示された。また、図7Bのグラフにより、ペプチド配列に付加すると結合効率を上昇させる2種の塩基性残基(リジンとトリプトファン)は組み合わせて用いることにより、フェニルボロン酸結合能を相加的に上昇させることがわかった。
【0088】
<実施例4>フェニルボロン酸結合能を増進するフェニルボロン酸基含有ポリマー組成の最適化
フェニルボロン酸結合能が高いペプチド配列には、塩基性残基が含まれていることから、溶液におけるフェニルボロン酸基近傍の局所的pHを上昇させることが結合効率上昇に大きな影響を及ぼしていることが予想される。そのため、ペプチド配列側でなくフェニルボロン酸基含有ポリマー側に塩基性残基を新たに導入することで、同様の効果が得られるかどうかについて、実施例1及び3と同様のフェニルボロン酸特異的結合色素の結合阻害実験を行った。
【0089】
PMBVは、実施例1と同様に調製した。また、ポリ((2-メタクリロイロキシエチルホスホリルコリン)-co-(ジメチルアミノエチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))(以下、PMDVと略す)を、60モル% 2-メタクリロイロキシエチルホスホリルコリン基、20モル% ジメチルアミノエチルメタクリル酸、及び20モル% p-ビニルフェニルボロン酸となるように調製した。PMBV及びPMDVの構造を、図8に示す。
【0090】
リン酸緩衝生理食塩水(10mM NaH2PO4/Na2HPO4、150mM NaCl pH7.3)に、PMBVを0.25mg/mlとなるように溶解したもの(PMBV溶液)と、PMDVを0.25mg/mlとなるように溶解したもの(PMDV溶液)の2種類のポリマー溶液を用意し、各々、200μlを96穴ウエルプレートに分注した。
【0091】
上記溶液をいれたウエルに、図2に示した各化学構造式を有するオリゴペプチド(PBS中)(配列番号1〜8)を各々0.2mMとなるように分注し、混和した。
【0092】
ウエルプレートを25℃で1時間、振盪した(700rpm、TAITEC MBR-022UP)。なお、ペプチド濃度、振盪時間ともに阻害効果が低くなるように設定した。振盪後、ポリマー中のフェニルボロン酸基に特異的に結合する蛍光色素アリザリンレッドSを各ウエルに各0.05mMとなるように分注し、混和した。ウエルプレートを25℃で1時間、振盪した(700rpm、TAITEC MBR-022UP)。
【0093】
フェニルボロン酸にどの程度のアリザリンレッドSが結合できたかを知るために、アリザリンレッドS由来の蛍光強度を測定した。モレキュラーデバイス社のフルオロスペクトロメーターGemini XSを用いて、励起光波長495nmで励起し、蛍光の発光強度測定は520nmから640nmの範囲を10nm間隔で強度測定を連続的に行い、極大値を持って蛍光強度とした。
【0094】
ペプチド添加無し、及び各ペプチドを添加した場合の各々のアリザリンレッドS由来の蛍光強度極大値を棒グラフにしたものを図9に示す。各棒グラフのエラーバーは試行回数三回における標準偏差である。棒グラフの高さが低く、アリザリンレッドS由来の蛍光強度が低いペプチドほど、アリザリンレッドSのフェニルボロン酸基への結合を阻害していることになり、ペプチドとフェニルボロン酸基の結合量が多いことが示唆される。この結果、塩基性官能基(ジメチルアミノエチルメタクリル酸基)を導入したポリマーPMDVを用いたとき、実施例1においてPMBVに対して高い結合効率を示していたペプチド配列6Y2K(配列番号7)に関しては、色素結合阻害効果がわずかだったが、ペプチド配列6YW(配列番号4)に対して極めて高い色素結合阻害効果を確認することができた。これにより、PMDVを用いた場合の方が、PMBVを用いた場合より、結合ペプチド配列の選択性が高まり、かつフェニルボロン酸への結合効率が飛躍的に上昇することが示された。
【0095】
<実施例5>フェニルボロン酸結合能を有するペプチド配列を導入したルシフェラーゼをコードするプラスミドの構築
ルシフェラーゼ(以下Luc)発現プラスミドであるpURE2 Lucプラスミドをテンプレートとして、蛋白質分子に6Y2K(配列番号7)及び6YW(配列番号4)のペプチド配列を4残基のグリシン残基を介してC末端に付加できるように導入した。プラスミドへの導入方法としてInverse PCR法を用いた。この概要を図13A及びBに示す。Inverse PCR法では環状DNAの配列導入部位を基準として背中合わせになる様にプライマーを選択する(図13A)。このときプライマーには導入しようとする配列をアンカー配列1及び2として付加しておく(図13A)。この条件でPCR反応を行うと末端にアンカー配列1及び2が付加された直鎖状の2本鎖DNAが生成する。これをセルフライゲーション反応で繋ぎ合わせることにより、望みの部位にアンカー配列が導入された環状二本鎖DNAを得ることができる(図13B)。
【0096】
プライマーには6Y2K用Forward primerとして配列5’-TATTATTATAAAAAATAGCATATGAAGCTTTAGCATAACCCCTT-3’(配列番号14)、6YW用Forward primerとして、配列5’-TATTATTATTGGTAGCATATGAAGCTTTAGCATAACCCCTT-3’(配列番号15)を用い、共通のReverse primerとして、配列5’-ATAATAATAACCACCACCACCCAATTTGGACTTTCCGCCCT-3’(配列番号16)を使用した。
【0097】
Inverse PCR反応液はテンプレートプラスミドpURE2 Lucを20fmol、Forward primerとReverse primerを各々15pmol、KOD-Plus DNA polymerase(東洋紡)を2.5U、10×KOD bufferを5μl、10mM dNTPを5μl加えて全量が50μlになるようdH2Oで調整した。増幅反応は95℃で1分間の反応後、98℃ 30秒、55℃ 1分、68℃ 4分のサイクル反応を30回繰り返した後、4℃に冷却した。
【0098】
サンプル50μlを回収し、DpnI(20U/μl、NEB社)を1μl添加して37℃で1時間反応させテンプレートプラスミドを分解した。反応後の溶液にエタノール150μlとNaOAC 5μlを添加し4℃ 15000rpmにて30分遠心分離し、上清を捨てた(エタノール沈殿)。
【0099】
沈殿を10μl dH2Oに溶解し、T4 kinase(TaKaRa社)1μlとLigation high(東洋紡社)14μlと混合後、37℃で1時間反応させ、その後更にLigation high 5μlを添加し、4℃で1時間反応させてセルフライゲーション反応を行った。
【0100】
セルフライゲーション反応液5μlをコンピテントセルJM109(TaKaRa社)50μlと混合し、氷上で10分間静置後、42℃ 45秒間のヒートショック反応を行い、大腸菌を形質転換した。溶液をLB-amp(LBブロス:Invitrogen社、アガー:和光純薬工業社、アンピシリン:SIGMA社)プレートに播種し、37℃で一晩培養して大腸菌コロニーを形成させた。いくつかのコロニーをピックアップし、20mLのLB-amp培養液で一晩培養後集菌し、Plasmid Miniprep system(Marligen社)を用いてプラスミドを抽出精製した。精製したプラスミドのシーケンスを行い、配列導入が確認されたプラスミドを保存した。
【0101】
<実施例6>フェニルボロン酸結合能を有するペプチド配列を導入したルシフェラーゼの精製
LucのC末端側に6Y2K配列(配列番号7)を導入したプラスミド(Luc6Y2K)及び6YW配列(配列番号4)を導入したプラスミド(Luc6YW)各100ng/μlの各1μlを、蛋白質発現用コンピータントセルBL21(Novagen社)50μlに添加し、4℃ 10分間静置し、42℃ 30秒間ヒートショック反応を行い形質転換を行った。溶液をLB-amp(LBブロス:Invitrogen社、アガー:和光純薬工業社、アンピシリン:SIGMA社)プレートに播種し、37℃で一晩培養して大腸菌コロニーを形成させた。いくつかのコロニーをピックアップし、2LのLB-amp培養液で25℃で一晩培養後集菌した。
【0102】
菌体を細胞膜破砕液に懸濁し室温で10分間穏やかに回転混和した後、遠心分離(30,000g、30分間)し、上清を回収した。Luc-6Y2K、Luc-6YWともにN末端側にStrep-tag配列を有しているので、アビジン−ビオチン相互作用を利用したアフィニティークロマトグラフィー精製をAKTA explorer10Sシステムを用いて行った。0.1μmフィルター濾過した遠心分離上清液をStrepTrap HP 5ml(GEヘルスケアジャパン社)に5ml/分の流速で注入し、サンプル吸着させた。サンプル吸着後、10mlのリン酸緩衝生理食塩水(10mM NaH2PO4/Na2HPO4、150mM NaCl pH7.3)でカラムを洗浄した。desthiobiotin(シグマアルドリッチ社)を溶解させたリン酸緩衝生理食塩水を用いてカラムに吸着した目的蛋白質を溶出させた。溶出サンプルはフラクションごとにSDSポリアクリルアミド電気泳動で目的蛋白質が発現し、かつ他の夾雑蛋白質が取り除かれていることを確認した。
【0103】
なお、本発明は上記した実施例に限定されるものではなく、様々な変形例が含まれる。例えば、上記した実施例は本発明を分かりやすく説明するために詳細に説明したものであり、必ずしも説明した全ての構成を備えるものに限定されるものではない。また、ある実施例の構成の一部を他の実施例の構成に置き換えることが可能であり、また、ある実施例の構成に他の実施例の構成を加えることも可能である。また、各実施例の構成の一部について、他の構成の追加、削除、置換をすることが可能である。
【配列表フリーテキスト】
【0104】
配列番号1〜13:人工配列(合成オリゴペプチド)
配列番号14〜16:人工配列(合成オリゴヌクレオチド)
【特許請求の範囲】
【請求項1】
分子を固定化する方法であって、
水酸基含有アミノ酸を含む標識ペプチド配列を分子に付着させて標識分子を形成する工程と、
フェニルボロン酸基を有する分子を前記標識分子と接触させることによって前記標識分子をフェニルボロン酸基を有する分子に捕捉する工程と
を含む、分子の固定化方法。
【請求項2】
前記標識ペプチド配列が水酸基含有アミノ酸を2残基以上含むペプチド配列である、請求項1に記載の方法。
【請求項3】
前記水酸基含有アミノ酸が、セリン、スレオニン及びチロシンからなる群より選択される1種以上である、請求項1又は2に記載の方法。
【請求項4】
前記標識ペプチド配列が、前記水酸基含有アミノ酸に加えて、1〜3残基の塩基性アミノ酸を含む、請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記塩基性アミノ酸が、リジン、アルギニン及びトリプトファンからなる群より選択される1種以上である、請求項4に記載の方法。
【請求項6】
前記標識ペプチド配列が、連続した4〜6残基の水酸基含有アミノ酸からなるか、又は3〜5残基の水酸基含有アミノ酸と1〜3残基の塩基性アミノ酸の合計4〜6残基のアミノ酸からなる、請求項1〜5のいずれか1項に記載の方法。
【請求項7】
前記標識ペプチド配列が、連続した7残基以上の水酸基含有アミノ酸からなるか、又は4残基以上の水酸基含有アミノ酸と1〜3残基の塩基性アミノ酸の合計7残基以上のアミノ酸からなる、請求項1〜5のいずれか1項に記載の方法。
【請求項8】
前記分子が蛋白質である、請求項1〜7のいずれか1項に記載の方法。
【請求項9】
前記標識ペプチド配列が、前記分子の活性部位又は認識領域から離れた位置で前記分子に共有結合により付着している、請求項1〜8のいずれか1項に記載の方法。
【請求項10】
前記フェニルボロン酸基を有する分子が、2以上のフェニルボロン酸基を有するポリマーである、請求項1〜9のいずれか1項に記載の方法。
【請求項11】
前記フェニルボロン酸基を有する分子が、ポリ ((2-メタクリロイロキシエチルホスホリルコリン)-co-(n-ブチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))、又はポリ ((2-メタクリロイロキシエチルホスホリルコリン)-co-(ジメチルアミノエチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))である、請求項1〜10のいずれか1項に記載の方法。
【請求項12】
前記フェニルボロン酸基を有する分子が固体支持体に結合されている、請求項1〜11のいずれか1項に記載の方法。
【請求項13】
前記フェニルボロン酸基を有する分子が固体支持体の表面に結合されており、前記分子が固体支持体の表面に固定化される、請求項1〜12のいずれか1項に記載の方法。
【請求項14】
前記分子が前記固体支持体の表面に同一配向で保持されている単分子膜として固定化される、請求項13に記載の方法。
【請求項15】
前記フェニルボロン酸基を有する分子が、フェニルボロン酸基と頭部基を含み、該頭部基が固体支持体と共有結合可能な官能基である、請求項12〜14のいずれか1項に記載の方法。
【請求項16】
前記固体支持体が貴金属である、請求項12〜15のいずれか1項に記載の方法。
【請求項17】
前記貴金属が、銀、金、白金及びパラジウムからなる群より選択される、請求項16に記載の方法。
【請求項18】
前記固体支持体が電極である、請求項12〜15のいずれか1項に記載の方法。
【請求項19】
前記固体支持体がプラスチックである、請求項12〜15のいずれか1項に記載の方法。
【請求項20】
前記プラスチックが、ポリカーボネート、ポリエチレン、ポリプロピレン、ポリスチレン、ポリ塩化ビニル、及びポリエチレンテレフタレートからなる群より選択される、請求項19に記載の方法。
【請求項21】
前記フェニルボロン酸基を有する分子が、直接又はスペーサー配列を介して固体支持体に結合されている、請求項12〜20のいずれか1項に記載の方法。
【請求項22】
前記フェニルボロン酸基を有する分子が架橋分子により架橋されて固定化基材を形成し、前記分子が該固定化基材に固定化される、請求項1〜11のいずれか1項に記載の方法。
【請求項23】
前記架橋分子が多価アルコールである、請求項22に記載の方法。
【請求項24】
前記多価アルコールがポリビニルアルコールである、請求項23に記載の方法。
【請求項25】
前記固定化基材が、固体、高分子膜、高分子半透膜、フィルム、固相ゲル及び液相ゲルからなる群より選択される1種以上である、請求項22〜24のいずれか1項に記載の方法。
【請求項26】
分子固相化用固体支持体であって、該固体支持体の表面に結合されたフェニルボロン酸基を有する分子を有することを特徴とする分子固相化用固体支持体。
【請求項27】
水酸基含有アミノ酸を含む標識ペプチド配列をコードするDNAと、蛋白質分子をコードするDNAを挿入するためのカセットとを含むことを特徴とする、標識ペプチド配列との融合蛋白質を発現するための発現ベクター。
【請求項28】
水酸基含有アミノ酸を含む標識ペプチド配列と付着した分子が、フェニルボロン酸基を有する分子を介して固体支持体に固定化されていることを特徴とする分子固相化デバイス。
【請求項29】
水酸基含有アミノ酸を含む標識ペプチド配列と付着した分子が、フェニルボロン酸基を有する分子を介して固定化基材に固定化されており、該固定化基材が、フェニルボロン酸基を有する分子を架橋分子により架橋して形成されていることを特徴とする分子固相化デバイス。
【請求項30】
請求項28又は29に記載の分子固相化デバイスと、分子間相互作用を検出する手段とを備えることを特徴とするセンサ。
【請求項1】
分子を固定化する方法であって、
水酸基含有アミノ酸を含む標識ペプチド配列を分子に付着させて標識分子を形成する工程と、
フェニルボロン酸基を有する分子を前記標識分子と接触させることによって前記標識分子をフェニルボロン酸基を有する分子に捕捉する工程と
を含む、分子の固定化方法。
【請求項2】
前記標識ペプチド配列が水酸基含有アミノ酸を2残基以上含むペプチド配列である、請求項1に記載の方法。
【請求項3】
前記水酸基含有アミノ酸が、セリン、スレオニン及びチロシンからなる群より選択される1種以上である、請求項1又は2に記載の方法。
【請求項4】
前記標識ペプチド配列が、前記水酸基含有アミノ酸に加えて、1〜3残基の塩基性アミノ酸を含む、請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記塩基性アミノ酸が、リジン、アルギニン及びトリプトファンからなる群より選択される1種以上である、請求項4に記載の方法。
【請求項6】
前記標識ペプチド配列が、連続した4〜6残基の水酸基含有アミノ酸からなるか、又は3〜5残基の水酸基含有アミノ酸と1〜3残基の塩基性アミノ酸の合計4〜6残基のアミノ酸からなる、請求項1〜5のいずれか1項に記載の方法。
【請求項7】
前記標識ペプチド配列が、連続した7残基以上の水酸基含有アミノ酸からなるか、又は4残基以上の水酸基含有アミノ酸と1〜3残基の塩基性アミノ酸の合計7残基以上のアミノ酸からなる、請求項1〜5のいずれか1項に記載の方法。
【請求項8】
前記分子が蛋白質である、請求項1〜7のいずれか1項に記載の方法。
【請求項9】
前記標識ペプチド配列が、前記分子の活性部位又は認識領域から離れた位置で前記分子に共有結合により付着している、請求項1〜8のいずれか1項に記載の方法。
【請求項10】
前記フェニルボロン酸基を有する分子が、2以上のフェニルボロン酸基を有するポリマーである、請求項1〜9のいずれか1項に記載の方法。
【請求項11】
前記フェニルボロン酸基を有する分子が、ポリ ((2-メタクリロイロキシエチルホスホリルコリン)-co-(n-ブチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))、又はポリ ((2-メタクリロイロキシエチルホスホリルコリン)-co-(ジメチルアミノエチルメタクリル酸)-co-(p-ビニルフェニルボロン酸))である、請求項1〜10のいずれか1項に記載の方法。
【請求項12】
前記フェニルボロン酸基を有する分子が固体支持体に結合されている、請求項1〜11のいずれか1項に記載の方法。
【請求項13】
前記フェニルボロン酸基を有する分子が固体支持体の表面に結合されており、前記分子が固体支持体の表面に固定化される、請求項1〜12のいずれか1項に記載の方法。
【請求項14】
前記分子が前記固体支持体の表面に同一配向で保持されている単分子膜として固定化される、請求項13に記載の方法。
【請求項15】
前記フェニルボロン酸基を有する分子が、フェニルボロン酸基と頭部基を含み、該頭部基が固体支持体と共有結合可能な官能基である、請求項12〜14のいずれか1項に記載の方法。
【請求項16】
前記固体支持体が貴金属である、請求項12〜15のいずれか1項に記載の方法。
【請求項17】
前記貴金属が、銀、金、白金及びパラジウムからなる群より選択される、請求項16に記載の方法。
【請求項18】
前記固体支持体が電極である、請求項12〜15のいずれか1項に記載の方法。
【請求項19】
前記固体支持体がプラスチックである、請求項12〜15のいずれか1項に記載の方法。
【請求項20】
前記プラスチックが、ポリカーボネート、ポリエチレン、ポリプロピレン、ポリスチレン、ポリ塩化ビニル、及びポリエチレンテレフタレートからなる群より選択される、請求項19に記載の方法。
【請求項21】
前記フェニルボロン酸基を有する分子が、直接又はスペーサー配列を介して固体支持体に結合されている、請求項12〜20のいずれか1項に記載の方法。
【請求項22】
前記フェニルボロン酸基を有する分子が架橋分子により架橋されて固定化基材を形成し、前記分子が該固定化基材に固定化される、請求項1〜11のいずれか1項に記載の方法。
【請求項23】
前記架橋分子が多価アルコールである、請求項22に記載の方法。
【請求項24】
前記多価アルコールがポリビニルアルコールである、請求項23に記載の方法。
【請求項25】
前記固定化基材が、固体、高分子膜、高分子半透膜、フィルム、固相ゲル及び液相ゲルからなる群より選択される1種以上である、請求項22〜24のいずれか1項に記載の方法。
【請求項26】
分子固相化用固体支持体であって、該固体支持体の表面に結合されたフェニルボロン酸基を有する分子を有することを特徴とする分子固相化用固体支持体。
【請求項27】
水酸基含有アミノ酸を含む標識ペプチド配列をコードするDNAと、蛋白質分子をコードするDNAを挿入するためのカセットとを含むことを特徴とする、標識ペプチド配列との融合蛋白質を発現するための発現ベクター。
【請求項28】
水酸基含有アミノ酸を含む標識ペプチド配列と付着した分子が、フェニルボロン酸基を有する分子を介して固体支持体に固定化されていることを特徴とする分子固相化デバイス。
【請求項29】
水酸基含有アミノ酸を含む標識ペプチド配列と付着した分子が、フェニルボロン酸基を有する分子を介して固定化基材に固定化されており、該固定化基材が、フェニルボロン酸基を有する分子を架橋分子により架橋して形成されていることを特徴とする分子固相化デバイス。
【請求項30】
請求項28又は29に記載の分子固相化デバイスと、分子間相互作用を検出する手段とを備えることを特徴とするセンサ。
【図1】


【図2−1】


【図2−2】


【図3】


【図4】


【図5】


【図6−1】


【図6−2】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2−1】


【図2−2】


【図3】


【図4】


【図5】


【図6−1】


【図6−2】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2012−159352(P2012−159352A)
【公開日】平成24年8月23日(2012.8.23)
【国際特許分類】
【出願番号】特願2011−18163(P2011−18163)
【出願日】平成23年1月31日(2011.1.31)
【出願人】(000005108)株式会社日立製作所 (27,607)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
【公開日】平成24年8月23日(2012.8.23)
【国際特許分類】
【出願日】平成23年1月31日(2011.1.31)
【出願人】(000005108)株式会社日立製作所 (27,607)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
[ Back to top ]

