フェンタニル含有口腔内粘膜貼付製剤
【課題】口腔内粘膜に貼付して効率良く、かつ速やかにフェンタニルを吸収させ、薬効を発揮させることの可能な口腔内粘膜貼付製剤を提供すること。
【解決手段】本発明のフェンタニル含有口腔内粘膜貼付製剤10は、薬物層1と、当該薬物層1の両側に配置された支持層2とから構成されるものであり、薬物層1は有効成分としてのフェンタニル又はその塩と、可食性水溶性高分子を含有し、支持層2はコーティング剤と及び可食性水溶性高分子を含有することを特徴とするものである。
【解決手段】本発明のフェンタニル含有口腔内粘膜貼付製剤10は、薬物層1と、当該薬物層1の両側に配置された支持層2とから構成されるものであり、薬物層1は有効成分としてのフェンタニル又はその塩と、可食性水溶性高分子を含有し、支持層2はコーティング剤と及び可食性水溶性高分子を含有することを特徴とするものである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、有効成分としてフェンタニル又はその塩を含有する口腔内粘膜貼付製剤に関する。
【背景技術】
【0002】
フェンタニルは、臨床条件で中枢神経系に主要な薬理効果を発揮するオピオイド系鎮痛薬である。主な薬効は鎮痛及び鎮静であり、特に急性の術後の痛み及び慢性のがん疼痛から解放するために、クエン酸フェンタニルを含有する注射剤や、フェンタニルを有効成分とする経皮吸収剤(パッチ剤、特許文献1)として臨床的に用いられている。また、口腔内粘膜に貼付してフェンタニルを吸収させる粘膜貼付剤が知られている(特許文献2)。
【0003】
しかしながら、前記注射剤は、短時間でフェンタニル血中濃度が高められ即効性が得られるものの、投与する際の患者への負担が大きい。また、特許文献1の経皮吸収剤は、フェンタニルを皮膚に浸透させて吸収させるものであるが、フェンタニルが十分に吸収性され難いため、短時間で血中濃度を高めることが困難である。更に、特許文献2の粘膜貼付剤は、持続的にフェンタニルを放出させて徐々に血中濃度を高めるものであるため、短時間でフェンタニルを有効血中濃度に上昇させることが困難である。
近年、簡便な手段により短時間でフェンタニル血中濃度を上昇させることの可能な製剤が求められているが、患者への負担を軽減しつつ、即効性の得られるフェンタニル含有製剤は未だ知られていない。
【0004】
【特許文献1】特許第2547726号公報
【特許文献2】特開2002−275066号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
したがって、本発明の課題は、口腔内粘膜に貼付して効率良く、かつ速やかにフェンタニルを吸収させ、薬効を発揮させることの可能な口腔内粘膜貼付製剤を提供することにある。
【課題を解決するための手段】
【0006】
本発明者らは上記の課題を解決すべく鋭意研究を行った結果、意外にも、フェンタニル又はその塩と特定成分を含有する薬物層の両側に、特定成分を含有する支持層を積層したフィルム状製剤とすることで、口腔内の水分により迅速に溶解又は崩壊してフェンタニル血中濃度を速やかに上昇させることが可能な製剤が得られることを見出した。
すなわち、本発明は、フェンタニル又はその塩と、可食性水溶性高分子を含有する薬物層と、当該薬物層の両面に配置され、コーティング剤及び可食性水溶性高分子を含有する支持層とを備える、フェンタニル含有口腔内粘膜貼付製剤を提供するものである。
【発明の効果】
【0007】
本発明のフェンタニル含有口腔内粘膜貼付製剤は、粘膜吸収性を備えており、口腔内に貼付して口腔内の水分により迅速に溶解又は崩壊(速溶性)し、製剤から放出されたフェンタニルを口腔粘膜を介して速やかに吸収させることが可能である。これにより、患者の負担を軽減しつつ、フェンタニル血中濃度を速やかに上昇させて即効的な鎮痛及び鎮静作用を発現することができ、特に突出痛に対して有効である。
また、本発明のフェンタニル含有口腔内粘膜貼付製剤は、口腔内の水分だけで服用可能であることからハンドリング性が良好であり、更に携帯性にも優れるものである。
【発明を実施するための最良の形態】
【0008】
先ず、本明細書で使用する用語について説明する。
本明細書で使用する「口腔内粘膜貼付製剤」なる用語は、当該製剤が口腔内で溶解又は崩壊して製剤から放出されたフェンタニルが口腔粘膜を介して吸収される製剤をいう。
「口腔内粘膜貼付」なる用語は、口腔内で粘液に覆われている粘膜に対して貼付することを意味する。「口腔内粘膜」としては、例えば、口床の粘膜(舌下粘膜)、頬の粘膜(バッカル粘膜)、歯茎の粘膜(歯肉粘膜)、口蓋の粘膜(パラタル粘膜)、唇のラインの粘膜が例示される。中でも、製剤の両側に配置された支持層をそれぞれ粘膜に付着させることが可能な点で、歯肉粘膜、舌下粘膜が好ましい。これにより、2つの支持層から放出されたフェンタニルをそれぞれの粘膜を介して吸収させ、より一層速やかにフェンタニル血中濃度を高めることができる。
「速溶性」なる用語は、水なしで製剤を服用しても口腔内で迅速に溶解又は崩壊することをいう。
「単位製剤」なる用語は、服用に供される製剤の最小単位を意味し、例えば、一つひとつ個別包装された製剤においては、その一つの製剤であり、また形状を画定する切断線が設けられた複数個の製剤が行列状に配置されたシート状製剤の場合、その切断線に沿って分離された一つの製剤である。
【0009】
以下、添付図面を参照しながら本発明の実施形態を詳細に説明する。なお、図面の説明において同一の要素には同一の符号を付し、重複する説明を省略する。また、図示の便宜上、図面の寸法比率は説明のものと必ずしも一致しない。
【0010】
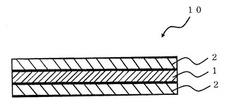
図1は、本発明のフェンタニル含有口腔内粘膜貼付製剤(以下、単に「口腔内粘膜貼付製剤」とも称する)の一実施形態を示す断面図である。
本実施形態に係る口腔内粘膜貼付製剤10は、薬物層1と、その両側に配置された支持層2とから構成されており、3層構造を有するものである。
薬物層1は有効成分としてのフェンタニル又はその塩と、可食性水溶性高分子を含有し、支持層2はコーティング剤及び可食性水溶性高分子を含有することを特徴とする。
【0011】
フェンタニル又はその塩としては、当該技術分野において通常用いられているものを特に限定なく使用することができるが、薬物吸収性の点から、遊離塩基の形態が好適である。フェンタニルの塩としては、薬理的に許容される塩であれば特に限定されないが、例えば、薬理的に許容される酸との酸付加塩が好ましく、具体的には、塩酸、硫酸、リン酸、臭化水素酸等の無機塩との塩;シュウ酸、マレイン酸、フマル酸、リンゴ酸、酒石酸、クエン酸、安息香酸、酢酸、乳酸、p−トルエンスルホン酸、メタンスルホン酸等の有機酸との塩が例示される。
【0012】
本発明の口腔内粘膜貼付製剤中のフェンタニル又はその塩の含有量は適宜設定することが可能であるが、単位製剤の全質量基準で0.1〜10質量%、更に0.2〜8質量%、特に0.3〜7質量%であることが好ましい。また、薬物層中のフェンタニル又はその塩の含有量は、0.1〜15質量%、更に0.2〜10質量%、特に0.3〜9質量%が好ましい。このような含有量とすることで、即効的な鎮痛作用をより確実に発現することができる。
なお、本発明の口腔内粘膜貼付製剤は、1日当たり1回〜数回に分けて口腔内投与することが可能であり、また年齢、体重、病状により投与量を適宜増減してもよい。
【0013】
また、可食性水溶性高分子としては、その水溶液を乾燥したときにフィルムを形成する性質を有する食用可能な高分子化合物であれば特に限定されるものではないが、ヒドロキシプロピルセルロース(HPC)、ヒドロキシプロピルメチルセルロース(HPMC、ヒプロメロース)、ヒドロキシエチルセルロース(HEC)、カルボキシメチルセルロース・ナトリウム(CMC−Na)、カルボキシメチルセルロース・カルシウム(CMC−Ca)、カルボキシメチルセルロース・カリウム(CMC−K)、カルボキシメチルセルロース(CMC)、ポリビニルピロリドン(PVP)及びアルギン酸ナトリウムからなる群より選ばれる少なくとも1種が好適に使用される。これにより、口腔内の唾液等の水分による溶解又は崩壊の制御が容易になり、またフィルム強度を高めることができる。
中でも、HPC、HPMC、PVPが好適であり、HPC及びPVPを薬物層に含有させ、HPMCを支持層に含有させることが特に好ましい。
【0014】
HPCとしては、公知の方法により製造したものを使用してもよく、また市販品(例えば、三栄源エフ・エフ・アイ(株)、日本曹達(株)等)を使用してもよい。HPCにおける置換度は特に限定されるものではないが、ヒドロキシプロポキシル基を50〜80%、特に53.4〜77.5%含有するものが好適である。なお、HPCの粘度は特に限定されるものではないが、例えば、20℃における2質量%水溶液の動粘度が2.0〜10mPa・s、特に2.0〜5.9mPa・sが好ましい。なお、本明細書において、2質量%水溶液の動粘度とは、第15改正日本薬局方に記載の方法で測定したものである。
【0015】
他方、HPMCとしては、公知の方法により製造したものを使用してもよく、また市販品(例えば、信越化学工業(株)、ダウ・ケミカル日本(株)、松本油脂製薬(株)等)を使用してもよい。
HPMCにおけるメトキシル基とヒドロキシプロポキシル基の置換度は特に限定されるものではないが、メトキシル基を10〜50%、更に16.5〜40%、特に28〜30%含有するものが好ましく、またヒドロキシプロポキシル基を2〜35%、更に4〜32%。特に7〜12%含有するものが好ましい。中でも、メトキシル基を25〜33%含有し、かつヒドロキシプロポキシル基を5〜15%含有するHPMCが特に好適である。市販品としては、例えば、HPMC1828、HPMC2208、HPMC2906及びHPMC2910が好適であり、特にHPMC2910が好適である。なお、HPMCの粘度は特に限定されるものではないが、例えば、20℃における2質量%水溶液の動粘度(第15改正日本薬局方)が3.0〜15mPa・s、特に3.0〜6mPa・sが好ましい。
【0016】
PVPとしては、公知の方法により製造したものを使用してもよく、また市販品(例えば、第一工業製薬(株)、BASFジャパン(株)、五協産業(株)等)を使用してもよい。
PVPにおけるK値と平均分子量(Mw)は特に限定されるものではないが、フィルム強度向上の点から、K値が10〜120、更に15〜110、更に25〜100、特に80〜100であるものが好ましく、また平均分子量(Mw)は2500〜3000000、更に8000〜2000000、特に30000〜1500000が好ましい。なお、K値とは、毛細管粘度計により測定される、水に対する相対粘度値(25℃)をFikentscherの式に適用して計算された値であり、またMwは、光散乱法により測定された値である。
【0017】
本発明の口腔内粘膜貼付製剤における可食性水溶性高分子の含有量は適宜設定することが可能であるが、単位製剤の全質量基準で60〜98質量%、更に70〜97質量%、特に80〜97質量%が好ましい。また、薬物層中の可食性水溶性高分子の含有量は70〜98質量%、更に80〜98質量%、特に85〜98質量%が好ましく、また支持層中の可食性水溶性高分子の含有量は80〜98質量%、更に85〜95質量%、特に87〜92質量%が好ましい。
【0018】
コーティング剤としては、可食性であれば特に限定されるものではないが、例えば、酸化チタン、エチルセルロース、カオリン、カルボキシビニルポリマー、カルボキシメチルエチルセルロース、結晶セルロース、ステアリン酸、ステアリン酸カルシウム、セラックが例示される。中でも、ハンドリング性向上の観点から、酸化チタン、カオリン、セラックが好適であり、特に酸化チタンが好適である。
【0019】
本発明の口腔内粘膜貼付製剤におけるコーティング剤の含有量は適宜設定することが可能であるが、単位製剤の全質量基準で0.1〜1.0質量%、更に0.2〜0.7質量%、特に0.3〜0.5質量%が好ましい。また、支持層中のコーティング剤の含有量は、0.5〜5質量%、更に1〜3.5質量%、特に1.5〜3質量%が好ましい。なお、薬物層にもコーティング剤を含有させることも可能であるが、薬物層の圧着性能の観点から、コーティング剤を含有しないことが好ましい。
【0020】
また、本発明においては、薬物層及び/又は支持層に更に可塑剤を含有させることができる。可塑剤としては、可食性水溶性高分子と相溶性がよく、かつ柔軟性を付与できれば特に限定されるものではないが、例えば、グリセリン、ゴマ油、ソルビトール、ヒマシ油、プロピレングリコール、ポリオキシエチレンポリオキシプロピレングリコール、ポリソルベート80(ポリオキシエチレン(20)ソルビタンオレイン酸エステル)、ポリエチレングリコール[例えば、マクロゴール400(オキシエチレン単位の重合度nが7〜9、以下、同様)、マクロゴール600(nが11〜13)、マクロゴール1500(nが5〜6と、nが28〜36との等量混合物)、マクロゴール4000(nが59〜84)、マクロゴール6000(nが165〜210)]が例示され、これらから選ばれる1種又は2種以上の組み合せが好ましい。中でも、グリセリン、プロピレングリコール、ポリエチレングリコールが好適であり、特にオキシエチレン単位の重合度が7〜9であるポリエチレングリコールが好適である。
【0021】
可塑剤の含有量は、単位製剤の全質量基準で1〜15質量%、更に2〜10質量%、特に3〜7質量%が好ましい。また、薬物層中の可塑剤の含有量は1〜15質量%、更に2〜10質量%、特に3〜7質量%であることが好ましく、また支持層中の可塑剤の含有量は1〜20質量%、更に3〜15質量%、特に5〜10質量%が好ましい。
【0022】
また、本発明の口腔内粘膜貼付製剤は、必要に応じて、通常用いられる薬理学的に許容される担体を1種又は2種以上含有していてもよい。担体としては、例えば、賦形剤、着色剤、崩壊剤、抗酸化剤、矯味剤が例示されるが、これらに限定されるものではない。なお、本発明の口腔内粘膜貼付製剤においては、薬物層及び支持層にpH調整剤を含有することを要しない。
【0023】
賦形剤としては、水酸化アルミナマグネシウム、二酸化ケイ素、無水硫酸ナトリウム、無水リン酸水素カルシウム、塩化ナトリウム、含水無晶形酸化ケイ素、ケイ酸アルミン酸マグネシウム、ケイ酸カルシウム、ケイ酸マグネシウム、軽質無水ケイ酸、重質無水ケイ酸、酸化マグネシウム、硫酸カルシウム等の無機系賦形剤;アメ粉、デンプン、果糖、カラメル、カンテン、キシリトール、パラフィン、セルロース、ソルビトール、ショ糖、果糖、麦芽糖、乳糖、白糖、ブドウ糖、プルラン、ポリオキシエチレン硬化ヒマシ油、マルチトール、還元麦芽糖水アメ、粉末還元麦芽糖水アメ、ソルビトール、エリスリトール、キシリトール、マンニトール、ラクチトール、トレハロース、還元パラチノース、マルトース等の有機系賦形剤が例示される。これらは、単独で又は組み合わせて使用することができる。中でも、口腔内での溶解性又は崩壊性向上の観点から、粉末還元麦芽糖水アメ、マンニトールが好適である。
【0024】
着色剤としては、当該技術分野において常用され、かつ可食性であれば特に限定されるものではないが、例えば、黄色三二酸化鉄、褐色酸化鉄、カラメル、黒酸化鉄、酸化チタン、三二酸化鉄、タール色素、アルミニウムレーキ色素、銅クロロフィリンナトリウムが例示される。これらは、単独で又は組み合わせて使用することができる。中でも、溶解性、分散性の観点から、酸化チタン、アルミニウムレーキ色素が好適である。
【0025】
崩壊剤としては、例えば、カルメロース及びその塩、デンプン、ショ糖脂肪酸エステル、ゼラチン、デキストリン、デヒドロ酢酸及びその塩、ポビドン、ポリオキシエチレン硬化ヒマシ油、ポリオキシエチレンポリオキシプロピレングリコールが例示される。
【0026】
抗酸化剤としては、例えば、アスコルビン酸、亜硫酸水素ナトリウム、亜硫酸ナトリウム、エデト酸ナトリウム、エリソルビン酸、酢酸トコフェロール、ジブチルヒドロキシトルエン、天然ビタミンE、トコフェロール、ブチルヒドロキシアニソールが例示される。
【0027】
矯味剤としては、例えば、アスコルビン酸、リンゴ酸及びこれらの塩等の酸味剤;アスパルテーム、ステビア、スクラロース、グリチルリチン酸、ソーマチン、アセスルファムカリウム、サッカリン、サッカリンナトリウム等の甘味剤が例示される。
【0028】
なお、これら医薬品添加物の含有量は適宜設定することが可能であるが、例えば、賦形剤の含有量は、単位製剤の全質量基準で0.1〜5質量%が好ましく、着色剤は単位製剤の全質量基準で0.05〜10質量%が好ましい。また、崩壊剤の含有量は、単位製剤の全質量基準で1〜8質量%が好ましく、難水溶性高分子物質は単位製剤の全質量基準で1〜10質量%が好ましい。更に、抗酸化剤は単位製剤の全質量基準で0.1〜5質量%が好ましく、矯味剤は単位製剤の全質量基準で1〜10質量%が好ましい。
【0029】
本発明の口腔内粘膜貼付製剤は、支持層、薬物層、支持層が順次積層された3層構造を基本形態とするものであるが、同一種の層を隣接して積層した場合、それらは互いに密着し一体となって同一の機能を奏するため、本発明においては実質的に一層として取り扱うものとする。また、本発明の口腔内粘膜貼付製剤は、本発明の目的を阻害しない範囲内において薬物層と支持層との間に機能層を設けてもよい。このような機能層としては、例えば、エチルセルロースを主体とし、防湿のための防湿層等が例示される。
【0030】
本発明の口腔内粘膜貼付製剤全体の厚みは、10〜300μm、更に30〜200μm、特に50〜150μmが好ましい。また、支持層の厚みは、1〜100μm、更に3〜50μm、特に5〜30μmが好ましく、薬物層の厚みは、9〜250μm、更に30〜200μm、特に50〜150μmが好ましい。これにより、口腔内において速やかに溶解又は崩壊させることが可能になり、フェンタニルの吸収をより一層促進させることができる。なお、機能層の厚みは、本発明の目的を阻害しない範囲内において適宜設定することが可能である。
また、本発明の口腔内粘膜貼付製剤の大きさは服用しやすいものであれば特に限定されるものではないが、例えば、1〜4cm2程度の大きさにすることが好ましい。また、その形状も服用しやすいものであれば特に限定されるものではないが、例えば、方形、円形、楕円形等の形状を適宜選択することが可能である。
【0031】
本発明の口腔内粘膜貼付製剤は、口腔内で迅速に溶解又は崩壊してフェンタニル血中濃度を速やかに上昇させるために、水に対して5分以内に溶解又は崩壊することが好ましい。なお、水に対する溶解時間は、5分以内、特に3分以内が好ましい。また、薬剤溶出率は85質量%以上/15分、特に90質量%以上/15分であることが好ましい。
ここで、本明細書において、水に対する溶解時間及び薬剤溶出率とは下記の水溶解性試験により測定したものをいう。
【0032】
水溶解性試験
方形120mm2のサイズに裁断した試験片を採取し、それを試験液(精製水900mL)に入れ、第15改正日本薬局方 [B]一般試験法 6.製剤試験法 6.10溶出試験法 パドル法(P587)にしたがって、シンカーを使用し毎分50回転で試験を行う。目視にて完全溶解を確認し、その経過時間を溶解時間とする。試験は5回行い、その平均値を水溶解時間とする。また、15分経過時点での薬剤溶出量を5回測定し、薬剤溶出量から算出される薬剤溶出率の平均値を薬剤溶出率とする。
【0033】
本発明の口腔内粘膜貼付製剤は、口腔内で180分以内、更に120分以内、特に90分以内溶解又は崩壊することが好ましい。なお、本明細書において、口腔内における溶解時間とは、下記の口腔内溶解試験により測定したものである。
【0034】
口腔内溶解試験
方形120mm2のサイズに裁断した試験片を採取し、それを健康な成人の口腔内粘膜に貼付し、試験片が口腔内の唾液のみで完全に溶解するまでの時間を測定する。
【0035】
本発明の口腔内粘膜貼付製剤は、慣用又は公知の方法を適宜選択して製造することが可能である。例えば、ポリエチレンテレフタレートフィルム(PET)等の剥離フィルム上に、第1の支持層を積層し、更に薬物層を積層した後、当該薬物層上に第2の支持層を積層することにより製造することができる。また、剥離フィルム上に、第1の支持層を積層し、更に第1の薬物層を積層した中間製品1と、別途、剥離フィルム上に第2の支持層を積層し、更に第2の薬物層を積層した中間製品2を作製し、次いで両者の薬物層同士が対向するように張り合わせて圧着することによっても製造することが可能である。なお、第1及び第2の支持層、第1及び第2の薬物層の組成はそれぞれ同一でもあっても、異なっていてもよい。
【実施例】
【0036】
以下、実施例等により本発明をさらに具体的に説明するが、本発明は下記の実施例に限定されるものではない。
【0037】
[実施例1]
無水エタノール94.50gに酸化チタン0.90gを加えた液に、超音波槽内で超音波処理を行い、酸化チタン分散液を得た。次いで、得られた酸化チタン分散液を200メッシュのフィルターを用いて濾過し、精製水40.50g、マクロゴール400 3.60g及びHPMC40.50gを加えて攪拌混合して支持層調製液を得た。
無水エタノール60.00gにフェンタニル0.10g及びマクロゴール400 1.50gを加えて攪拌混合しフェンタニル含有溶液を得た。次いで、HPC−SSL20.00g及びポリビニルピロリドンK90 2.40gをフェンタニル含有溶液に加えて攪拌混合し薬物層調製液を得た。
【0038】
各調製液を用いて、下記の手順によりフェンタニル含有口腔内粘膜貼付製剤を作製した。
1)中間製品1の製造工程
シリコーン剥離処理したPETフィルムを塗工機巻き出し軸にセットし、ダム部に支持層調製液を供給して、PETフィルムの表面(シリコーン剥離処理していない面)に支持層調製液を塗布した後、70℃の温風にて乾燥し厚さ約10μmの第1の支持層を形成した。次いで、第1の支持層を形成したPETフィルムを再度巻き出し軸にセットし、第1の支持層上に薬物層調製液を塗布した後、40℃の温風にて乾燥し厚さ約40μmの第1の薬物層を形成した中間製品1を得た。
2)中間製品2の製造工程
中間製品1と同様の手順により、厚さ約10μmの第2の支持層と、厚さ約40μmの第2の薬物層を有する中間製品2を得た。
3)圧着工程
中間製品1の第1の薬物層と、中間製品2の第2の薬物層が互いに対向するように貼り合わせ、圧着温度70℃で両者を圧着し、支持層、薬物層及び支持層が順次積層された3層構造を有する中間製品3を得た。
4)剥離工程
中間製品3の一方のPETフィルムを剥離した。次いで、面積1.2cm2に裁断し、もう一方のPETフィルムを剥離して、本発明に係るフェンタニル含有口腔内粘膜貼付製剤を得た。
【0039】
[実施例2〜8]
各配合成分及び配合量を表1に記載のものに変更したこと以外は、実施例1と同様の方法により実施例2〜8のフェンタニル含有口腔内粘膜貼付製剤をそれぞれ製造した。
【0040】
[比較例1]
無水エタノール94.50gに酸化チタン0.90gを加えた液に、超音波槽内で超音波処理を行い、酸化チタン分散液を得た。次いで、得られた酸化チタン分散液を200メッシュのフィルターを用いて濾過し、精製水40.50g、マクロゴール400 3.60g及びHPMC40.50gを加えて攪拌混合して支持層調製液Iを得た。
無水エタノール94.50gに酸化チタン0.90gを加えた液に、超音波槽内で超音波処理を行い、酸化チタン分散液を得た。次いで、得られた酸化チタン分散液を200メッシュのフィルターを用いて濾過し、精製水40.50g、マクロゴール400 3.60g及びヒドロキシプロピルメチルセルロースフタレート(ヒプロメロースフタル酸エステル、HPMCP)40.50gを加えて攪拌混合して支持層調製液IIを得た。
無水エタノール60.00gにフェンタニル0.10g及びマクロゴール400 0.50gを加えて攪拌混合しフェンタニル含有溶液を得た。次いで、HPC−SSL21.00g及びポリビニルピロリドン2.40gをフェンタニル含有溶液に加えて攪拌混合し薬物層調製液を得た。
【0041】
1)中間製品1の製造工程
シリコーン剥離処理したPETフィルムを塗工機巻き出し軸にセットし、ダム部に支持層調製液Iを供給して、PETフィルムの表面(シリコーン剥離処理していない面)に支持層調製液Iを塗布した後、70℃の温風にて乾燥し厚さ約10μmの第1の支持層を形成した。次いで、第1の支持層を形成したPETフィルムを再度巻き出し軸にセットし、第1の支持層上に薬物層調製液を塗布した後、40℃の温風にて乾燥し厚さ約40μmの第1の薬物層を形成した中間製品1を得た。
2)中間製品2の製造工程
シリコーン剥離処理したPETフィルムを塗工機巻き出し軸にセットし、ダム部に支持層調製液IIを供給して、PETフィルムの表面(シリコーン剥離処理していない面)に支持層調製液IIを塗布した後、70℃の温風にて乾燥し厚さ約10μmの第2の支持層を形成した。次いで、第2の支持層を形成したPETフィルムを再度巻き出し軸にセットし、第2の支持層上に薬物層調製液を塗布した後、40℃の温風にて乾燥し厚さ約40μmの第1の薬物層を形成した中間製品2を得た。
3)圧着工程
中間製品1の第1の薬物層と、中間製品2の第2の薬物層が互いに対向するように貼り合わせ、圧着温度70℃で両者を圧着し、支持層I、薬物層及び支持層IIが順次積層された3層構造を有する中間製品3を得た。
4)剥離工程
中間製品3の一方のPETフィルムを剥離した。次いで、面積1.2cm2に裁断し、もう一方のPETフィルムを剥離して、フェンタニル含有口腔内粘膜貼付製剤を得た。
【0042】
各実施例及び比較例で得られた単位製剤(フェンタニル含有口腔粘膜貼付製剤1枚)当たりの組成を表1に示す。
【0043】
【表1】

【0044】
各実施例及び比較例で得られた口腔内粘膜貼付製剤について、下記の水への溶解性試験及び口腔内溶解試験を行った。その結果を表2に示す。
【0045】
水溶解性試験
方形120mm2のサイズに裁断した試験片を採取し、それを試験液(精製水900mL)に入れ、第15改正日本薬局方 [B]一般試験法 6.製剤試験法 6.10溶出試験法 パドル法(P587)にしたがって、シンカーを使用し毎分50回転で試験を行った。目視にて完全溶解を確認し、その経過時間を溶解時間とした。試験は5回行い、その平均値を水溶解時間とした。また、15分経過時点での薬剤溶出量を5回測定し、薬剤溶出量から算出される薬剤溶出率の平均値を薬剤溶出率とした。
【0046】
【表2】

【0047】
表2から明らかなように、実施例1〜8で得られた口腔内粘膜貼付製剤は、水に対して5分以内で溶解又は崩壊し、かつ薬剤溶出率が85質量%以上/15分の製剤であった。これに対し、比較例1で得られた口腔内粘膜貼付製剤は、水に対する溶解又は崩壊が30分以上で、さらに、薬剤溶出率が44.1質量%/15分であり、溶解又は崩壊し難い製剤であった。
【図面の簡単な説明】
【0048】
【図1】本発明のフェンタニル含有口腔粘膜貼付製剤の一実施形態を示す図である。
【符号の説明】
【0049】
1 :薬物層
2 :支持層
10:フェンタニル含有口腔内粘膜貼付製剤
【技術分野】
【0001】
本発明は、有効成分としてフェンタニル又はその塩を含有する口腔内粘膜貼付製剤に関する。
【背景技術】
【0002】
フェンタニルは、臨床条件で中枢神経系に主要な薬理効果を発揮するオピオイド系鎮痛薬である。主な薬効は鎮痛及び鎮静であり、特に急性の術後の痛み及び慢性のがん疼痛から解放するために、クエン酸フェンタニルを含有する注射剤や、フェンタニルを有効成分とする経皮吸収剤(パッチ剤、特許文献1)として臨床的に用いられている。また、口腔内粘膜に貼付してフェンタニルを吸収させる粘膜貼付剤が知られている(特許文献2)。
【0003】
しかしながら、前記注射剤は、短時間でフェンタニル血中濃度が高められ即効性が得られるものの、投与する際の患者への負担が大きい。また、特許文献1の経皮吸収剤は、フェンタニルを皮膚に浸透させて吸収させるものであるが、フェンタニルが十分に吸収性され難いため、短時間で血中濃度を高めることが困難である。更に、特許文献2の粘膜貼付剤は、持続的にフェンタニルを放出させて徐々に血中濃度を高めるものであるため、短時間でフェンタニルを有効血中濃度に上昇させることが困難である。
近年、簡便な手段により短時間でフェンタニル血中濃度を上昇させることの可能な製剤が求められているが、患者への負担を軽減しつつ、即効性の得られるフェンタニル含有製剤は未だ知られていない。
【0004】
【特許文献1】特許第2547726号公報
【特許文献2】特開2002−275066号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
したがって、本発明の課題は、口腔内粘膜に貼付して効率良く、かつ速やかにフェンタニルを吸収させ、薬効を発揮させることの可能な口腔内粘膜貼付製剤を提供することにある。
【課題を解決するための手段】
【0006】
本発明者らは上記の課題を解決すべく鋭意研究を行った結果、意外にも、フェンタニル又はその塩と特定成分を含有する薬物層の両側に、特定成分を含有する支持層を積層したフィルム状製剤とすることで、口腔内の水分により迅速に溶解又は崩壊してフェンタニル血中濃度を速やかに上昇させることが可能な製剤が得られることを見出した。
すなわち、本発明は、フェンタニル又はその塩と、可食性水溶性高分子を含有する薬物層と、当該薬物層の両面に配置され、コーティング剤及び可食性水溶性高分子を含有する支持層とを備える、フェンタニル含有口腔内粘膜貼付製剤を提供するものである。
【発明の効果】
【0007】
本発明のフェンタニル含有口腔内粘膜貼付製剤は、粘膜吸収性を備えており、口腔内に貼付して口腔内の水分により迅速に溶解又は崩壊(速溶性)し、製剤から放出されたフェンタニルを口腔粘膜を介して速やかに吸収させることが可能である。これにより、患者の負担を軽減しつつ、フェンタニル血中濃度を速やかに上昇させて即効的な鎮痛及び鎮静作用を発現することができ、特に突出痛に対して有効である。
また、本発明のフェンタニル含有口腔内粘膜貼付製剤は、口腔内の水分だけで服用可能であることからハンドリング性が良好であり、更に携帯性にも優れるものである。
【発明を実施するための最良の形態】
【0008】
先ず、本明細書で使用する用語について説明する。
本明細書で使用する「口腔内粘膜貼付製剤」なる用語は、当該製剤が口腔内で溶解又は崩壊して製剤から放出されたフェンタニルが口腔粘膜を介して吸収される製剤をいう。
「口腔内粘膜貼付」なる用語は、口腔内で粘液に覆われている粘膜に対して貼付することを意味する。「口腔内粘膜」としては、例えば、口床の粘膜(舌下粘膜)、頬の粘膜(バッカル粘膜)、歯茎の粘膜(歯肉粘膜)、口蓋の粘膜(パラタル粘膜)、唇のラインの粘膜が例示される。中でも、製剤の両側に配置された支持層をそれぞれ粘膜に付着させることが可能な点で、歯肉粘膜、舌下粘膜が好ましい。これにより、2つの支持層から放出されたフェンタニルをそれぞれの粘膜を介して吸収させ、より一層速やかにフェンタニル血中濃度を高めることができる。
「速溶性」なる用語は、水なしで製剤を服用しても口腔内で迅速に溶解又は崩壊することをいう。
「単位製剤」なる用語は、服用に供される製剤の最小単位を意味し、例えば、一つひとつ個別包装された製剤においては、その一つの製剤であり、また形状を画定する切断線が設けられた複数個の製剤が行列状に配置されたシート状製剤の場合、その切断線に沿って分離された一つの製剤である。
【0009】
以下、添付図面を参照しながら本発明の実施形態を詳細に説明する。なお、図面の説明において同一の要素には同一の符号を付し、重複する説明を省略する。また、図示の便宜上、図面の寸法比率は説明のものと必ずしも一致しない。
【0010】
図1は、本発明のフェンタニル含有口腔内粘膜貼付製剤(以下、単に「口腔内粘膜貼付製剤」とも称する)の一実施形態を示す断面図である。
本実施形態に係る口腔内粘膜貼付製剤10は、薬物層1と、その両側に配置された支持層2とから構成されており、3層構造を有するものである。
薬物層1は有効成分としてのフェンタニル又はその塩と、可食性水溶性高分子を含有し、支持層2はコーティング剤及び可食性水溶性高分子を含有することを特徴とする。
【0011】
フェンタニル又はその塩としては、当該技術分野において通常用いられているものを特に限定なく使用することができるが、薬物吸収性の点から、遊離塩基の形態が好適である。フェンタニルの塩としては、薬理的に許容される塩であれば特に限定されないが、例えば、薬理的に許容される酸との酸付加塩が好ましく、具体的には、塩酸、硫酸、リン酸、臭化水素酸等の無機塩との塩;シュウ酸、マレイン酸、フマル酸、リンゴ酸、酒石酸、クエン酸、安息香酸、酢酸、乳酸、p−トルエンスルホン酸、メタンスルホン酸等の有機酸との塩が例示される。
【0012】
本発明の口腔内粘膜貼付製剤中のフェンタニル又はその塩の含有量は適宜設定することが可能であるが、単位製剤の全質量基準で0.1〜10質量%、更に0.2〜8質量%、特に0.3〜7質量%であることが好ましい。また、薬物層中のフェンタニル又はその塩の含有量は、0.1〜15質量%、更に0.2〜10質量%、特に0.3〜9質量%が好ましい。このような含有量とすることで、即効的な鎮痛作用をより確実に発現することができる。
なお、本発明の口腔内粘膜貼付製剤は、1日当たり1回〜数回に分けて口腔内投与することが可能であり、また年齢、体重、病状により投与量を適宜増減してもよい。
【0013】
また、可食性水溶性高分子としては、その水溶液を乾燥したときにフィルムを形成する性質を有する食用可能な高分子化合物であれば特に限定されるものではないが、ヒドロキシプロピルセルロース(HPC)、ヒドロキシプロピルメチルセルロース(HPMC、ヒプロメロース)、ヒドロキシエチルセルロース(HEC)、カルボキシメチルセルロース・ナトリウム(CMC−Na)、カルボキシメチルセルロース・カルシウム(CMC−Ca)、カルボキシメチルセルロース・カリウム(CMC−K)、カルボキシメチルセルロース(CMC)、ポリビニルピロリドン(PVP)及びアルギン酸ナトリウムからなる群より選ばれる少なくとも1種が好適に使用される。これにより、口腔内の唾液等の水分による溶解又は崩壊の制御が容易になり、またフィルム強度を高めることができる。
中でも、HPC、HPMC、PVPが好適であり、HPC及びPVPを薬物層に含有させ、HPMCを支持層に含有させることが特に好ましい。
【0014】
HPCとしては、公知の方法により製造したものを使用してもよく、また市販品(例えば、三栄源エフ・エフ・アイ(株)、日本曹達(株)等)を使用してもよい。HPCにおける置換度は特に限定されるものではないが、ヒドロキシプロポキシル基を50〜80%、特に53.4〜77.5%含有するものが好適である。なお、HPCの粘度は特に限定されるものではないが、例えば、20℃における2質量%水溶液の動粘度が2.0〜10mPa・s、特に2.0〜5.9mPa・sが好ましい。なお、本明細書において、2質量%水溶液の動粘度とは、第15改正日本薬局方に記載の方法で測定したものである。
【0015】
他方、HPMCとしては、公知の方法により製造したものを使用してもよく、また市販品(例えば、信越化学工業(株)、ダウ・ケミカル日本(株)、松本油脂製薬(株)等)を使用してもよい。
HPMCにおけるメトキシル基とヒドロキシプロポキシル基の置換度は特に限定されるものではないが、メトキシル基を10〜50%、更に16.5〜40%、特に28〜30%含有するものが好ましく、またヒドロキシプロポキシル基を2〜35%、更に4〜32%。特に7〜12%含有するものが好ましい。中でも、メトキシル基を25〜33%含有し、かつヒドロキシプロポキシル基を5〜15%含有するHPMCが特に好適である。市販品としては、例えば、HPMC1828、HPMC2208、HPMC2906及びHPMC2910が好適であり、特にHPMC2910が好適である。なお、HPMCの粘度は特に限定されるものではないが、例えば、20℃における2質量%水溶液の動粘度(第15改正日本薬局方)が3.0〜15mPa・s、特に3.0〜6mPa・sが好ましい。
【0016】
PVPとしては、公知の方法により製造したものを使用してもよく、また市販品(例えば、第一工業製薬(株)、BASFジャパン(株)、五協産業(株)等)を使用してもよい。
PVPにおけるK値と平均分子量(Mw)は特に限定されるものではないが、フィルム強度向上の点から、K値が10〜120、更に15〜110、更に25〜100、特に80〜100であるものが好ましく、また平均分子量(Mw)は2500〜3000000、更に8000〜2000000、特に30000〜1500000が好ましい。なお、K値とは、毛細管粘度計により測定される、水に対する相対粘度値(25℃)をFikentscherの式に適用して計算された値であり、またMwは、光散乱法により測定された値である。
【0017】
本発明の口腔内粘膜貼付製剤における可食性水溶性高分子の含有量は適宜設定することが可能であるが、単位製剤の全質量基準で60〜98質量%、更に70〜97質量%、特に80〜97質量%が好ましい。また、薬物層中の可食性水溶性高分子の含有量は70〜98質量%、更に80〜98質量%、特に85〜98質量%が好ましく、また支持層中の可食性水溶性高分子の含有量は80〜98質量%、更に85〜95質量%、特に87〜92質量%が好ましい。
【0018】
コーティング剤としては、可食性であれば特に限定されるものではないが、例えば、酸化チタン、エチルセルロース、カオリン、カルボキシビニルポリマー、カルボキシメチルエチルセルロース、結晶セルロース、ステアリン酸、ステアリン酸カルシウム、セラックが例示される。中でも、ハンドリング性向上の観点から、酸化チタン、カオリン、セラックが好適であり、特に酸化チタンが好適である。
【0019】
本発明の口腔内粘膜貼付製剤におけるコーティング剤の含有量は適宜設定することが可能であるが、単位製剤の全質量基準で0.1〜1.0質量%、更に0.2〜0.7質量%、特に0.3〜0.5質量%が好ましい。また、支持層中のコーティング剤の含有量は、0.5〜5質量%、更に1〜3.5質量%、特に1.5〜3質量%が好ましい。なお、薬物層にもコーティング剤を含有させることも可能であるが、薬物層の圧着性能の観点から、コーティング剤を含有しないことが好ましい。
【0020】
また、本発明においては、薬物層及び/又は支持層に更に可塑剤を含有させることができる。可塑剤としては、可食性水溶性高分子と相溶性がよく、かつ柔軟性を付与できれば特に限定されるものではないが、例えば、グリセリン、ゴマ油、ソルビトール、ヒマシ油、プロピレングリコール、ポリオキシエチレンポリオキシプロピレングリコール、ポリソルベート80(ポリオキシエチレン(20)ソルビタンオレイン酸エステル)、ポリエチレングリコール[例えば、マクロゴール400(オキシエチレン単位の重合度nが7〜9、以下、同様)、マクロゴール600(nが11〜13)、マクロゴール1500(nが5〜6と、nが28〜36との等量混合物)、マクロゴール4000(nが59〜84)、マクロゴール6000(nが165〜210)]が例示され、これらから選ばれる1種又は2種以上の組み合せが好ましい。中でも、グリセリン、プロピレングリコール、ポリエチレングリコールが好適であり、特にオキシエチレン単位の重合度が7〜9であるポリエチレングリコールが好適である。
【0021】
可塑剤の含有量は、単位製剤の全質量基準で1〜15質量%、更に2〜10質量%、特に3〜7質量%が好ましい。また、薬物層中の可塑剤の含有量は1〜15質量%、更に2〜10質量%、特に3〜7質量%であることが好ましく、また支持層中の可塑剤の含有量は1〜20質量%、更に3〜15質量%、特に5〜10質量%が好ましい。
【0022】
また、本発明の口腔内粘膜貼付製剤は、必要に応じて、通常用いられる薬理学的に許容される担体を1種又は2種以上含有していてもよい。担体としては、例えば、賦形剤、着色剤、崩壊剤、抗酸化剤、矯味剤が例示されるが、これらに限定されるものではない。なお、本発明の口腔内粘膜貼付製剤においては、薬物層及び支持層にpH調整剤を含有することを要しない。
【0023】
賦形剤としては、水酸化アルミナマグネシウム、二酸化ケイ素、無水硫酸ナトリウム、無水リン酸水素カルシウム、塩化ナトリウム、含水無晶形酸化ケイ素、ケイ酸アルミン酸マグネシウム、ケイ酸カルシウム、ケイ酸マグネシウム、軽質無水ケイ酸、重質無水ケイ酸、酸化マグネシウム、硫酸カルシウム等の無機系賦形剤;アメ粉、デンプン、果糖、カラメル、カンテン、キシリトール、パラフィン、セルロース、ソルビトール、ショ糖、果糖、麦芽糖、乳糖、白糖、ブドウ糖、プルラン、ポリオキシエチレン硬化ヒマシ油、マルチトール、還元麦芽糖水アメ、粉末還元麦芽糖水アメ、ソルビトール、エリスリトール、キシリトール、マンニトール、ラクチトール、トレハロース、還元パラチノース、マルトース等の有機系賦形剤が例示される。これらは、単独で又は組み合わせて使用することができる。中でも、口腔内での溶解性又は崩壊性向上の観点から、粉末還元麦芽糖水アメ、マンニトールが好適である。
【0024】
着色剤としては、当該技術分野において常用され、かつ可食性であれば特に限定されるものではないが、例えば、黄色三二酸化鉄、褐色酸化鉄、カラメル、黒酸化鉄、酸化チタン、三二酸化鉄、タール色素、アルミニウムレーキ色素、銅クロロフィリンナトリウムが例示される。これらは、単独で又は組み合わせて使用することができる。中でも、溶解性、分散性の観点から、酸化チタン、アルミニウムレーキ色素が好適である。
【0025】
崩壊剤としては、例えば、カルメロース及びその塩、デンプン、ショ糖脂肪酸エステル、ゼラチン、デキストリン、デヒドロ酢酸及びその塩、ポビドン、ポリオキシエチレン硬化ヒマシ油、ポリオキシエチレンポリオキシプロピレングリコールが例示される。
【0026】
抗酸化剤としては、例えば、アスコルビン酸、亜硫酸水素ナトリウム、亜硫酸ナトリウム、エデト酸ナトリウム、エリソルビン酸、酢酸トコフェロール、ジブチルヒドロキシトルエン、天然ビタミンE、トコフェロール、ブチルヒドロキシアニソールが例示される。
【0027】
矯味剤としては、例えば、アスコルビン酸、リンゴ酸及びこれらの塩等の酸味剤;アスパルテーム、ステビア、スクラロース、グリチルリチン酸、ソーマチン、アセスルファムカリウム、サッカリン、サッカリンナトリウム等の甘味剤が例示される。
【0028】
なお、これら医薬品添加物の含有量は適宜設定することが可能であるが、例えば、賦形剤の含有量は、単位製剤の全質量基準で0.1〜5質量%が好ましく、着色剤は単位製剤の全質量基準で0.05〜10質量%が好ましい。また、崩壊剤の含有量は、単位製剤の全質量基準で1〜8質量%が好ましく、難水溶性高分子物質は単位製剤の全質量基準で1〜10質量%が好ましい。更に、抗酸化剤は単位製剤の全質量基準で0.1〜5質量%が好ましく、矯味剤は単位製剤の全質量基準で1〜10質量%が好ましい。
【0029】
本発明の口腔内粘膜貼付製剤は、支持層、薬物層、支持層が順次積層された3層構造を基本形態とするものであるが、同一種の層を隣接して積層した場合、それらは互いに密着し一体となって同一の機能を奏するため、本発明においては実質的に一層として取り扱うものとする。また、本発明の口腔内粘膜貼付製剤は、本発明の目的を阻害しない範囲内において薬物層と支持層との間に機能層を設けてもよい。このような機能層としては、例えば、エチルセルロースを主体とし、防湿のための防湿層等が例示される。
【0030】
本発明の口腔内粘膜貼付製剤全体の厚みは、10〜300μm、更に30〜200μm、特に50〜150μmが好ましい。また、支持層の厚みは、1〜100μm、更に3〜50μm、特に5〜30μmが好ましく、薬物層の厚みは、9〜250μm、更に30〜200μm、特に50〜150μmが好ましい。これにより、口腔内において速やかに溶解又は崩壊させることが可能になり、フェンタニルの吸収をより一層促進させることができる。なお、機能層の厚みは、本発明の目的を阻害しない範囲内において適宜設定することが可能である。
また、本発明の口腔内粘膜貼付製剤の大きさは服用しやすいものであれば特に限定されるものではないが、例えば、1〜4cm2程度の大きさにすることが好ましい。また、その形状も服用しやすいものであれば特に限定されるものではないが、例えば、方形、円形、楕円形等の形状を適宜選択することが可能である。
【0031】
本発明の口腔内粘膜貼付製剤は、口腔内で迅速に溶解又は崩壊してフェンタニル血中濃度を速やかに上昇させるために、水に対して5分以内に溶解又は崩壊することが好ましい。なお、水に対する溶解時間は、5分以内、特に3分以内が好ましい。また、薬剤溶出率は85質量%以上/15分、特に90質量%以上/15分であることが好ましい。
ここで、本明細書において、水に対する溶解時間及び薬剤溶出率とは下記の水溶解性試験により測定したものをいう。
【0032】
水溶解性試験
方形120mm2のサイズに裁断した試験片を採取し、それを試験液(精製水900mL)に入れ、第15改正日本薬局方 [B]一般試験法 6.製剤試験法 6.10溶出試験法 パドル法(P587)にしたがって、シンカーを使用し毎分50回転で試験を行う。目視にて完全溶解を確認し、その経過時間を溶解時間とする。試験は5回行い、その平均値を水溶解時間とする。また、15分経過時点での薬剤溶出量を5回測定し、薬剤溶出量から算出される薬剤溶出率の平均値を薬剤溶出率とする。
【0033】
本発明の口腔内粘膜貼付製剤は、口腔内で180分以内、更に120分以内、特に90分以内溶解又は崩壊することが好ましい。なお、本明細書において、口腔内における溶解時間とは、下記の口腔内溶解試験により測定したものである。
【0034】
口腔内溶解試験
方形120mm2のサイズに裁断した試験片を採取し、それを健康な成人の口腔内粘膜に貼付し、試験片が口腔内の唾液のみで完全に溶解するまでの時間を測定する。
【0035】
本発明の口腔内粘膜貼付製剤は、慣用又は公知の方法を適宜選択して製造することが可能である。例えば、ポリエチレンテレフタレートフィルム(PET)等の剥離フィルム上に、第1の支持層を積層し、更に薬物層を積層した後、当該薬物層上に第2の支持層を積層することにより製造することができる。また、剥離フィルム上に、第1の支持層を積層し、更に第1の薬物層を積層した中間製品1と、別途、剥離フィルム上に第2の支持層を積層し、更に第2の薬物層を積層した中間製品2を作製し、次いで両者の薬物層同士が対向するように張り合わせて圧着することによっても製造することが可能である。なお、第1及び第2の支持層、第1及び第2の薬物層の組成はそれぞれ同一でもあっても、異なっていてもよい。
【実施例】
【0036】
以下、実施例等により本発明をさらに具体的に説明するが、本発明は下記の実施例に限定されるものではない。
【0037】
[実施例1]
無水エタノール94.50gに酸化チタン0.90gを加えた液に、超音波槽内で超音波処理を行い、酸化チタン分散液を得た。次いで、得られた酸化チタン分散液を200メッシュのフィルターを用いて濾過し、精製水40.50g、マクロゴール400 3.60g及びHPMC40.50gを加えて攪拌混合して支持層調製液を得た。
無水エタノール60.00gにフェンタニル0.10g及びマクロゴール400 1.50gを加えて攪拌混合しフェンタニル含有溶液を得た。次いで、HPC−SSL20.00g及びポリビニルピロリドンK90 2.40gをフェンタニル含有溶液に加えて攪拌混合し薬物層調製液を得た。
【0038】
各調製液を用いて、下記の手順によりフェンタニル含有口腔内粘膜貼付製剤を作製した。
1)中間製品1の製造工程
シリコーン剥離処理したPETフィルムを塗工機巻き出し軸にセットし、ダム部に支持層調製液を供給して、PETフィルムの表面(シリコーン剥離処理していない面)に支持層調製液を塗布した後、70℃の温風にて乾燥し厚さ約10μmの第1の支持層を形成した。次いで、第1の支持層を形成したPETフィルムを再度巻き出し軸にセットし、第1の支持層上に薬物層調製液を塗布した後、40℃の温風にて乾燥し厚さ約40μmの第1の薬物層を形成した中間製品1を得た。
2)中間製品2の製造工程
中間製品1と同様の手順により、厚さ約10μmの第2の支持層と、厚さ約40μmの第2の薬物層を有する中間製品2を得た。
3)圧着工程
中間製品1の第1の薬物層と、中間製品2の第2の薬物層が互いに対向するように貼り合わせ、圧着温度70℃で両者を圧着し、支持層、薬物層及び支持層が順次積層された3層構造を有する中間製品3を得た。
4)剥離工程
中間製品3の一方のPETフィルムを剥離した。次いで、面積1.2cm2に裁断し、もう一方のPETフィルムを剥離して、本発明に係るフェンタニル含有口腔内粘膜貼付製剤を得た。
【0039】
[実施例2〜8]
各配合成分及び配合量を表1に記載のものに変更したこと以外は、実施例1と同様の方法により実施例2〜8のフェンタニル含有口腔内粘膜貼付製剤をそれぞれ製造した。
【0040】
[比較例1]
無水エタノール94.50gに酸化チタン0.90gを加えた液に、超音波槽内で超音波処理を行い、酸化チタン分散液を得た。次いで、得られた酸化チタン分散液を200メッシュのフィルターを用いて濾過し、精製水40.50g、マクロゴール400 3.60g及びHPMC40.50gを加えて攪拌混合して支持層調製液Iを得た。
無水エタノール94.50gに酸化チタン0.90gを加えた液に、超音波槽内で超音波処理を行い、酸化チタン分散液を得た。次いで、得られた酸化チタン分散液を200メッシュのフィルターを用いて濾過し、精製水40.50g、マクロゴール400 3.60g及びヒドロキシプロピルメチルセルロースフタレート(ヒプロメロースフタル酸エステル、HPMCP)40.50gを加えて攪拌混合して支持層調製液IIを得た。
無水エタノール60.00gにフェンタニル0.10g及びマクロゴール400 0.50gを加えて攪拌混合しフェンタニル含有溶液を得た。次いで、HPC−SSL21.00g及びポリビニルピロリドン2.40gをフェンタニル含有溶液に加えて攪拌混合し薬物層調製液を得た。
【0041】
1)中間製品1の製造工程
シリコーン剥離処理したPETフィルムを塗工機巻き出し軸にセットし、ダム部に支持層調製液Iを供給して、PETフィルムの表面(シリコーン剥離処理していない面)に支持層調製液Iを塗布した後、70℃の温風にて乾燥し厚さ約10μmの第1の支持層を形成した。次いで、第1の支持層を形成したPETフィルムを再度巻き出し軸にセットし、第1の支持層上に薬物層調製液を塗布した後、40℃の温風にて乾燥し厚さ約40μmの第1の薬物層を形成した中間製品1を得た。
2)中間製品2の製造工程
シリコーン剥離処理したPETフィルムを塗工機巻き出し軸にセットし、ダム部に支持層調製液IIを供給して、PETフィルムの表面(シリコーン剥離処理していない面)に支持層調製液IIを塗布した後、70℃の温風にて乾燥し厚さ約10μmの第2の支持層を形成した。次いで、第2の支持層を形成したPETフィルムを再度巻き出し軸にセットし、第2の支持層上に薬物層調製液を塗布した後、40℃の温風にて乾燥し厚さ約40μmの第1の薬物層を形成した中間製品2を得た。
3)圧着工程
中間製品1の第1の薬物層と、中間製品2の第2の薬物層が互いに対向するように貼り合わせ、圧着温度70℃で両者を圧着し、支持層I、薬物層及び支持層IIが順次積層された3層構造を有する中間製品3を得た。
4)剥離工程
中間製品3の一方のPETフィルムを剥離した。次いで、面積1.2cm2に裁断し、もう一方のPETフィルムを剥離して、フェンタニル含有口腔内粘膜貼付製剤を得た。
【0042】
各実施例及び比較例で得られた単位製剤(フェンタニル含有口腔粘膜貼付製剤1枚)当たりの組成を表1に示す。
【0043】
【表1】

【0044】
各実施例及び比較例で得られた口腔内粘膜貼付製剤について、下記の水への溶解性試験及び口腔内溶解試験を行った。その結果を表2に示す。
【0045】
水溶解性試験
方形120mm2のサイズに裁断した試験片を採取し、それを試験液(精製水900mL)に入れ、第15改正日本薬局方 [B]一般試験法 6.製剤試験法 6.10溶出試験法 パドル法(P587)にしたがって、シンカーを使用し毎分50回転で試験を行った。目視にて完全溶解を確認し、その経過時間を溶解時間とした。試験は5回行い、その平均値を水溶解時間とした。また、15分経過時点での薬剤溶出量を5回測定し、薬剤溶出量から算出される薬剤溶出率の平均値を薬剤溶出率とした。
【0046】
【表2】

【0047】
表2から明らかなように、実施例1〜8で得られた口腔内粘膜貼付製剤は、水に対して5分以内で溶解又は崩壊し、かつ薬剤溶出率が85質量%以上/15分の製剤であった。これに対し、比較例1で得られた口腔内粘膜貼付製剤は、水に対する溶解又は崩壊が30分以上で、さらに、薬剤溶出率が44.1質量%/15分であり、溶解又は崩壊し難い製剤であった。
【図面の簡単な説明】
【0048】
【図1】本発明のフェンタニル含有口腔粘膜貼付製剤の一実施形態を示す図である。
【符号の説明】
【0049】
1 :薬物層
2 :支持層
10:フェンタニル含有口腔内粘膜貼付製剤
【特許請求の範囲】
【請求項1】
フェンタニル又はその塩と、可食性水溶性高分子を含有する薬物層と、
当該薬物層の両側に配置され、コーティング剤及び可食性水溶性高分子を含有する支持層と
を備える、フェンタニル含有口腔内粘膜貼付製剤。
【請求項2】
前記薬物層及び支持層が更に可塑剤を含有する、請求項1記載の口腔内粘膜貼付製剤
【請求項3】
前記可食性水溶性高分子がヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシエチルセルロース、カルボキシメチルセルロース・ナトリウム、カルボキシメチルセルロース・カルシウム、カルボキシメチルセルロース・カリウム、カルボキシメチルセルロース、ポリビニルピロリドン及びアルギン酸ナトリウムからなる群より選ばれる少なくとも1種である、請求項1又は2記載の口腔内粘膜貼付製剤。
【請求項4】
前記コーティング剤が酸化チタンである、請求項1〜3のいずれか1項に記載の口腔内粘膜貼付製剤。
【請求項5】
前記可食性水溶性高分子が、20℃における2質量%水溶液の動粘度が2.0〜10mPa・sであるヒドロキシプロピルセルロース又は20℃における2質量%水溶液の動粘度が3.0〜15.0mPa・sであるヒドロキシプロピルメチルセルロースである、請求項1〜4のいずれか1項に記載の口腔内粘膜貼付製剤。
【請求項6】
水に対する溶解時間が5分以内であり、かつ薬剤溶出率が85質量%以上/15分である、請求項1〜5のいずれか1項に記載の口腔内粘膜貼付製剤。
【請求項7】
口腔内粘膜が歯肉粘膜又は舌下粘膜である、請求項1〜6のいずれか1項に記載の口腔内粘膜貼付製剤。
【請求項1】
フェンタニル又はその塩と、可食性水溶性高分子を含有する薬物層と、
当該薬物層の両側に配置され、コーティング剤及び可食性水溶性高分子を含有する支持層と
を備える、フェンタニル含有口腔内粘膜貼付製剤。
【請求項2】
前記薬物層及び支持層が更に可塑剤を含有する、請求項1記載の口腔内粘膜貼付製剤
【請求項3】
前記可食性水溶性高分子がヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシエチルセルロース、カルボキシメチルセルロース・ナトリウム、カルボキシメチルセルロース・カルシウム、カルボキシメチルセルロース・カリウム、カルボキシメチルセルロース、ポリビニルピロリドン及びアルギン酸ナトリウムからなる群より選ばれる少なくとも1種である、請求項1又は2記載の口腔内粘膜貼付製剤。
【請求項4】
前記コーティング剤が酸化チタンである、請求項1〜3のいずれか1項に記載の口腔内粘膜貼付製剤。
【請求項5】
前記可食性水溶性高分子が、20℃における2質量%水溶液の動粘度が2.0〜10mPa・sであるヒドロキシプロピルセルロース又は20℃における2質量%水溶液の動粘度が3.0〜15.0mPa・sであるヒドロキシプロピルメチルセルロースである、請求項1〜4のいずれか1項に記載の口腔内粘膜貼付製剤。
【請求項6】
水に対する溶解時間が5分以内であり、かつ薬剤溶出率が85質量%以上/15分である、請求項1〜5のいずれか1項に記載の口腔内粘膜貼付製剤。
【請求項7】
口腔内粘膜が歯肉粘膜又は舌下粘膜である、請求項1〜6のいずれか1項に記載の口腔内粘膜貼付製剤。
【図1】




【公開番号】特開2010−138123(P2010−138123A)
【公開日】平成22年6月24日(2010.6.24)
【国際特許分類】
【出願番号】特願2008−316732(P2008−316732)
【出願日】平成20年12月12日(2008.12.12)
【出願人】(000161714)救急薬品工業株式会社 (14)
【Fターム(参考)】
【公開日】平成22年6月24日(2010.6.24)
【国際特許分類】
【出願日】平成20年12月12日(2008.12.12)
【出願人】(000161714)救急薬品工業株式会社 (14)
【Fターム(参考)】
[ Back to top ]

