フッ素化芳香族ビス(アシル)含有化合物及びそれから調製されるポリエステル
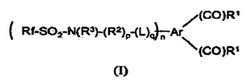
フッ素化ビス(アシル)含有化合物及びフッ素化(I)(式中、R1、Ar、L、R2、R3、Rf、n、p、及びqは、特許請求の範囲に定義された通りである)、及びフッ素化ビス(アシル)含有化合物から形成されるフッ素化ポリエステルについて記載する。より具体的には、フッ素化ビス(アシル)は、2個のアシル基に結合している芳香環に加えて、ペルフルオロアルキルスルホンアミド基を含む少なくとも1個の第3の基を有する。前記フッ素化ビス(アシル)含有化合物から形成されるフッ素化ポリエステルを用いて、多くの他のポリエステルに比べて比較的屈折率の低い低エネルギー表面を提供することができる。式Rf1−L2−Hの化合物と式W−CH2−Ar2−CH2−Wの化合物とを反応させることによって、式Rf1−L2−CH2−Ar2−CH2−W(式中、Ar2、Rf1、L2、R6及びWは、特許請求の範囲に定義された通りである)の一置換アリーレン化合物を調製する方法。


【発明の詳細な説明】
【技術分野】
【0001】
フッ素化芳香族ビス(アシル)含有化合物及び前記フッ素化芳香族ビス(アシル)含有化合物から調製されるポリエステルについて記載する。
【背景技術】
【0002】
撥油性及び撥水性が強化されていることが望ましい用途で用いることができるフッ素化高分子物質は、以前から調製されている。これらフッ素化高分子物質の一部は、ペルフルオロオクチル基を含んでいた。特定のペルフルオロオクチル含有化合物は、生物において生体内蓄積する傾向がある。この傾向は、幾つかのフルオロケミカル物質に関する潜在的な問題として言及されている。
【発明の概要】
【発明が解決しようとする課題】
【0003】
体内から効率的に排出されることができかつ有効な撥水性及び撥油性を提供する新規フルオロケミカル物質が望まれている。
【課題を解決するための手段】
【0004】
フッ素化及び芳香族ビス(アシル)含有化合物、及びビス(アシル)含有化合物から調製されるフッ素化ポリエステルについて記載する。より具体的には、ビス(アシル)含有化合物は、芳香環を有し、かつペルフルオロアルキルスルホンアミド基を含有する。ビス(アシル)含有化合物から調製されるフッ素化ポリエステルを用いて、多くの他の既知のポリエステルに比べて比較的屈折率の低い低エネルギー表面を提供することができる。
【0005】
1つの態様では、式(I)の化合物が提供される。
【化1】

式(I)では、各R1は、独立して、ハロ、ヒドロキシル、アルコキシ、又はアリールオキシであり、前記アルコキシは、非置換であるか、又はアリールで置換され、アリールオキシは、非置換であるか、又はハロ、アルキル、若しくはこれらの組み合わせで置換される。基Arは、少なくとも6個の炭素原子を有する炭素環式芳香環構造である。基Lは、オキシ、チオ、又はスルホニルである。基R2は、アルキレン、ヘテロアルキレン、アリーレン、又はこれらの組み合わせから選択される二価基である。基R3は、アルキルであり、基Rfは、ペルフルオロアルキルである。変数nは、1〜4の範囲の整数に等しい。変数p及びqは、それぞれ0又は1に等しくてもよいが、但し、pが0に等しいとき、qは0に等しい。
【0006】
別の態様では、(a)上に記載されている式(I)の化合物、及び(b)ジオール、を含む複数のモノマーの縮合反応生成物であるフッ素化ポリエステルが提供される。
【0007】
更に別の態様では、(a)上に記載されている式(I)の化合物、(b)ジオール、及び(c)式(I)の化合物又はジオールと反応性である一官能性末端保護化合物、を含む複数のモノマーの縮合反応生成物であるフッ素化ポリエステルが提供される。
【0008】
更なる態様では、式(II)の化合物が提供される。
【化2】

式(II)では、Rfは、ペルフルオロアルキルであり、R3は、アルキルであり、yは、1〜20の範囲の整数であり、Ar1は、フェニレン又はジフェニレンであり、Qは、ハロ又は式−OSO2−R4(式中、R4は、アルキル、ペルフルオロアルキル、アリール、又はアルキルで置換されたアリールである)から選択される。
【0009】
本発明の別の態様は、式(XV)Rf1−L2−CH2−Ar2−CH2−W(式中、Ar2は、フェニレン又はジフェニレンであり、Rf1は、鎖内に任意でO又はNを含むペルフルオロアルキルであり、L2は、−O−、−SO2−、−CH2−O−、−C2H4−O−、−C2H4−S−、及び−SO2−N(R6)−から選択され、R6は、C1〜C4アルキルであり、Wは脱離基である)の一置換アリーレン化合物を調製する方法である。該方法は、式(XVI)Rf1−L2−Hの化合物、式(XVII)の化合物W−CH2−Ar2−CH2−W、及び有機溶媒を含む成分と塩基とを、式(XV)(式中、Rf1は、鎖内に任意でO又はNを含むペルフルオロアルキルであり;L2は、−O−、−SO2−、−CH2−O−、−C2H4−O−、−C2H4−S−、及び−SO2−N(R6)−(式中、R6 C1〜C4アルキルである)から選択され、Ar2は、フェニレン又はジフェニレンであり、Wは脱離基である)の一置換アリーレン化合物を形成するのに有効な時間合わせることを含む。
【0010】
上記の本発明の概要は、本発明のそれぞれの実施形態又は全ての実現形態を説明することを意図したものではない。以下の図面、発明を実施するための形態、及び実施例により、これらの実施形態をより詳しく例示する。
【発明を実施するための形態】
【0011】
フッ素化及び芳香族ビス(アシル)含有化合物及びフッ素化芳香族ビス(アシル)含有化合物から形成されるフッ素化ポリエステルについて記載する。
【0012】
「a」、「an」、及び「the」という用語は、「少なくとも1つの」と互換可能に用いられ、記載される要素のうちの1以上を意味する。
【0013】
用語「アルキル」とは、アルカンのラジカルである一価の基を指し、直鎖、分岐鎖、環状、又はこれらの組み合わせである基を含む。アルキル基は通常、1〜30個の炭素原子を有する。幾つかの実施形態では、アルキル基は、1〜20個の炭素原子、1〜10個の炭素原子、1〜6個の炭素原子又は1〜4個の炭素原子を含有する。アルキル基の例としては、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、tert−ブチル、n−ペンチル、n−ヘキシル、シクロヘキシル、n−ヘプチル、n−オクチル、及びエチルヘキシルが挙げられるが、これらに限定されない。
【0014】
「アルキレン」という用語は、アルカンのラジカルである二価基を指す。アルキレンは、直鎖、分岐鎖、環状、又はこれらの組み合わせであり得る。アルキレンは通常、1〜30個の炭素原子を有する。幾つかの実施形態では、アルキレンは、1〜20個、1〜10個、1〜6個、又は1〜4個の炭素原子を含有する。アルキレンのラジカル中心は、同一炭素原子上(即ち、アルキリデン)、又は異なる炭素原子上に存在しうる。
【0015】
用語「アルコキシ」は、式−OR(式中、Rはアルキル基である)の一価基を指す。
【0016】
用語「芳香族ビス(アシル)」は、式−(CO)−Ar−(CO)−の基を指す。基Arは、少なくとも6個の炭素原子を有する炭素環式芳香環である。2つのカルボニル基は、芳香環に直接結合する。各カルボニル基は、例えば、ハロ、アルコキシ、アリールオキシ、又はヒドロキシル等の別の基に更に結合される。即ち、芳香族ビス(アシル)基を含む化合物は、芳香族ビス(アシルハロゲン化物)、芳香族ビス(エステル)、又は芳香族ビス(カルボン酸)であることが多い。芳香族ビス(アシルハロゲン化物)は、基Arに結合する式−(CO)Xの2つの基を有する。基Xは、典型的に、ブロモ、クロロ、ヨード、又はフルオロから選択されるハロである。芳香族ビス(エステル)は、Ar基に結合する式−(CO)ORaの2つの基を有する。基Raは、アルキル;アリールで置換されるアルキル;アリール;ハロ、アルキル、又はこれらの組み合わせで置換されるアリール;である。芳香族ビス(カルボン酸)は、基Arに結合する2つの基−(CO)OH又はその塩を有する。
【0017】
用語「アリール」は、芳香族及び炭素環式である一価の基を指す。アリールは、芳香環と結合又は縮合した1〜5個の環を有しうる。その他の環構造は、芳香族、非芳香族、又はこれらの組み合わせであることができる。アリール基の例としては、これらに限定されるものではないが、フェニル、ビフェニル、テルフェニル、アンスリル、ナフチル、アセナフチル、アントラキノニル、フェナンスリル、アントラセニル、ピレニル、ペリレニル、及びフルオレニルが挙げられる。
【0018】
用語「アリーレン」とは、炭素環式及び芳香族である、二価の基を指す。この基は、結合している、縮合している、又はこれらの組み合わせである1〜5個の環を有する。その他の環は、芳香族、非芳香族、又はこれらの組み合わせであることができる。いくつかの実施形態では、アリーレン基は、5個以下の環、4個以下の環、3個以下の環、2個以下の環、又は1個の芳香環を有する。例えば、アリーレン基は、フェニレンであることができる。
【0019】
用語「アリールオキシ」は、式−O−Ar1(式中、Ar1はアリールである)の基を指す。
【0020】
用語「(CO)」又は「(OC)」は、互換的に用いられて、カルボニル基を指す。
【0021】
用語「ハロ」は、フルオロ、クロロ、ブロモ、又はヨードを指す。
【0022】
用語「ヘテロアルキレン」は、チオ、オキシ又は−NRb−(式中、Rbは水素又はアルキルである)で置換された1個以上の−CH2−基を有する二価のアルキレンを指す。ヘテロアルキレンは、直鎖、分岐鎖、環状、又はこれらの組み合わせであることができ、60個以下の炭素原子及び15個以下のヘテロ原子を含むことができる。幾つかの実施形態では、ヘテロアルキレンは、50個以下の炭素原子、40個以下の炭素原子、30個以下の炭素原子、20個以下の炭素原子、又は10個以下の炭素原子を含む。
【0023】
用語「ペルフルオロアルキル」は、水素原子が全てフッ素原子で置換されているアルキルを指す。
【0024】
用語「オキシ」は、二価基−O−を指す。
【0025】
用語「スルホニル」は、二価基−SO2−を指す。
【0026】
用語「チオ」は、二価基−S−を指す。
【0027】
用語「の範囲」は、指定の範囲の両端点を含む。
【0028】
式(I)のフッ素化芳香族ビス(アシル)含有化合物が提供される。
【化3】

この式のAr基は、少なくとも6個の炭素原子を有する炭素環式芳香環構造である。式(I)における各R1は、独立して、ハロ、ヒドロキシル、アルコキシ、又はアリールオキシであり、アルコキシは、非置換であるか、又はアリールで置換され、アリールオキシは、非置換であるか、又はアルキル、ハロ、若しくはこれらの組み合わせで置換される。基Lは、オキシ、チオ、又はスルホニルである。基R2は、アルキレン、ヘテロアルキレン、アリーレン、又はこれらの組み合わせから選択される二価基である。基R3は、アルキルであり、基Rfは、ペルフルオロアルキルである。変数nは、1〜4の範囲の整数に等しく、変数p及びqは、それぞれ0又は1に等しくてもよいが、但し、pが0に等しいとき、qは0に等しい。即ち、Lは、式(I)において−N(R3)−に直接は結合しない。
【0029】
式(I)の幾つかの実施形態では、式(Ia)に示されるようにp及びqの両方が1に等しく、
【化4】

ペルフルオロアルキルスルホンアミド基は、二価基−R2−L−によって芳香環構造から分離される。他の実施形態では、式(Ib)に示されるようにp及びqの両方が0に等しく、
【化5】

ペルフルオロアルキルスルホンアミド基は、芳香環Arに直接結合する。更に他の実施形態では、式(Ic)に示されるようにpは1に等しく、qは0に等しく、
【化6】

ペルフルオロアルキルスルホンアミド基は、二価基−R2−によって芳香環構造から分離される。
【0030】
式(I)におけるAr基は、1個の炭素環式芳香環である(即ち、Ar基がベンゼン環である)ことが多い。あるいは、Ar基は、縮合しているか(例えば、ナフタレン)、又は単結合によって連結されている(例えば、ビフェニル)2個以上の芳香環を含んでもよい。Ar基が複数の芳香環を含むとき、式(I)におけるAr基に結合している少なくとも3個の基が全て同じ芳香環に結合してもよく、又は少なくとも3個の基が複数の芳香環に任意の好適な構成で分布してもよい。
【0031】
式(I)における各R1は、独立して、ハロ、ヒドロキシル、アルコキシ、又はアリールオキシである。両R1基が同一であることが多い。好適なハロ基としては、クロロ、ブロモ、及びヨードが挙げられる。好適なR1基は、1〜10個の炭素原子、1〜8個の炭素原子、1〜6個の炭素原子、又は1〜4個の炭素原子を有することが多い。任意のアルコキシ基は、例えば、フェニル基又はビフェニル基等のアリール基で更に置換されてもよい。好適なアリールオキシ基は、1個の芳香環を有するか(即ち、アリールオキシ基は、フェノキシである)、又は2個以上の芳香環が単結合で連結されていることが多い。アリールオキシ基は、ハロ、又は1〜10個の炭素原子、1〜8個の炭素原子、1〜6個の炭素原子、若しくは1〜4個の炭素原子を有するアルキル基等のアルキル基で更に置換されてもよい。
【0032】
基R2は、pが1に等しいとき式(I)に含まれる。存在する場合、R2基は、アルキレン、ヘテロアルキレン、アリーレン、又はこれらの組み合わせから選択される二価基であってもよい。好適なアルキレン基は、1〜20個の炭素原子、1〜16個の炭素原子、1〜12個の炭素原子、1〜10個の炭素原子、1〜8個の炭素原子、1〜6個の炭素原子、又は1〜4個の炭素原子を有することが多い。好適なヘテロアルキレン基は、酸素ヘテロ原子を有することが多く、2〜20個、2〜16個、2〜12個、2〜8個、又は2〜4個の炭素原子を含む。好適なアリーレン基は、1個又は2個の芳香環を有することが多い。代表的なアリーレン基としては、フェニレン及びビフェニレンが挙げられるが、これらに限定されない。これら基の任意の組み合わせが存在し得る。
【0033】
式(I)の幾つかの代表的な化合物において、基R2はアルキレンである。即ち、基R2は、式−(CyH2y)−(式中、yは1〜20の範囲、1〜12の範囲、1〜8の範囲、又は1〜4の範囲の整数に等しい)の二価基であってもよい。
【0034】
式(I)の他の代表的な化合物において、基R2は、1個以上のアリーレン基及び1個以上のアルキレン基の組み合わせである。例えば、第1のアルキレンは、アリーレンに結合することができ、アリーレンは、第2のアリーレンに更に結合してもよい。即ち、R2は、式−(CyH2y)−Ar1−(CyH2y)−(式中、Ar1は、アリーレンであり、各変数yは、1〜20の範囲、1〜12の範囲、1〜8の範囲、又は1〜4の範囲の整数である)である。基Ar1は、典型的に、縮合又は単結合で連結された1〜3個の芳香環を含む。幾つかの例としては、式−(CyH2y)−C6H4−(CyH2y)−の基、例えば、−CH2−C6H4−CH2−等、又は式−(CyH2y)−C6H4−C6H4−(CyH2y)−の基、例えば、−CH2−C6H4−C6H4−CH2−等が挙げられるが、これらに限定されない。
【0035】
式(I)における基R3は、アルキルである。好適なアルキル基は、1〜18個の炭素原子、1〜12個の炭素原子、1〜8個の炭素原子、又は1〜4個の炭素原子を有することが多い。多くの実施形態では、R3はメチルである。
【0036】
基Rfは、ペルフルオロアルキルである。好適なペルフルオロアルキルは、1〜20個の炭素原子、1〜10個の炭素原子、1〜8個の炭素原子、1〜6個の炭素原子、又は1〜4個の炭素原子を有することが多い。多くの実施形態では、基Rfは、−C4F9、−C6F13又は−C8F17である。より具体的には、Rf基は、n−ペルフルオロブチル(即ち、直鎖−C4F9基)であることが多い。
【0037】
式(I)の幾つかの代表的な化合物は、式(Id)又は(Ie)の化合物である。
【化7】

これらの式では、式(I)における基Arは、ベンゼン環である。基L、R1、R2、及びRfは、式(I)について上に定義されたものと同一である。式(I)の変数nは、式(Id)において1に等しく、式(Ie)において2に等しい。式(I)における変数p及びqは、式(Id)及び(Ie)において両方とも1に等しい。式(Id)及び(Ie)において、基−(CO)R1及び−LR2N(CH3)SO2Rfは、ベンゼン環の任意の炭素原子に結合することができる。
【0038】
式(Id)又は(Ie)の幾つかの実施形態では、R2は、式(If)及び(Ig)に示されるようなアルキレンであり、式中、R2は、二価基−(CyH2y)−(式中、yは上に定義されたものと同一である)に等しい。
【化8】

式(If)の代表的な化合物としては、以下が挙げられるが、これらに限定されない
【化9】

式(Ig)の代表的な化合物としては、以下が挙げられるが、これらに限定されない。
【化10】

【0039】
式(Id)の他の実施形態では、R2は、式(Ih)に示されるような二価基−(CyH2y)−Ar1−(CyH2y)−に等しく、式中、Ar1は、フェニレン又はジフェニレンであり、yは、上に定義されたものと同一である。
【化11】

式(Ih)の代表的な化合物としては、以下が挙げられるが、これらに限定されない。
【化12】

【0040】
式(Id)の更に他の代表的な化合物において、R2は、式(Ii)に示されるような二価基−Ar1−(CyH2y)−に等しく、式中、Ar1は、フェニレン又はジフェニレンであり、yは、上に定義されたものと同一である。
【化13】

式(Ii)の具体的な化合物としては、以下が挙げられるが、これらに限定されない。
【化14】

【0041】
式(I)の他の実施形態において、変数p及びqは、上記式(Ib)に示されるように両方とも0に等しい。これらの実施形態では、化合物は、式(Ij)の化合物であることが多い。
【化15】

式(Ij)の代表的な化合物としては、以下が挙げられるが、これらに限定されない。
【化16】

【0042】
式(I)の更に他の実施形態において、変数pは1に等しいが、変数qは、上記式(Ic)に示されるように0に等しい。これらの実施形態では、化合物は、式(Ik)の化合物であることが多い。
【化17】

この式の多くの実施形態において、R2は、式(Il)に示されるような式−(CyH2y)−のアルキレンであり、式中、yは、上に定義されたものと同一である。
【化18】

式(Il)の代表的な化合物としては、以下が挙げられるが、これらに限定されない。
【化19】

【0043】
式(I)の化合物は、任意の好適なプロセスによって調製することができる。多くの実施形態において、変数p及びqは、両方とも1に等しく、化合物は、反応スキームAを用いて調製することができる。
【化20】

この反応スキームでは、式(III)のペルフルオロアルキルスルホンアミド化合物を、式(IV)の芳香族ビス(アシル)前駆体と反応させて、式(Ia)のフッ素化及び芳香族ビス(アシル)含有化合物を調製する。これらの様々な式において、基L1は、オキシ又はチオであるが、更なる酸化工程を含んで、チオ基をスルホニル基に変換してもよい。基Qは、(a)クロロ、ブロモ、又はヨード等のハロ、又は(b)式−OSO2−R4(式中、R4は、アルキル、ペルフルオロアルキル、アリール、又はアルキル、ハロ、若しくは両方で置換されたアリールである)の基から選択される。基R2は、アルキレン、ヘテロアルキレン、アリーレン、又はこれらの組み合わせから選択される二価基である。基R3は、アルキルであり、基Rfは、ペルフルオロアルキルである。各R1基は、典型的に、この反応スキームではアルコキシ又はアリールオキシである。アルコキシR1基は、非置換であってもよく、又はアリールで置換されてもよく、アリールオキシR1基は、非置換であってもよく、又はハロ、アルキル、若しくは両方で置換されてもよい。基Arは、少なくとも6個の炭素原子を有する炭素環式芳香環構造である。
【0044】
式(IV)の芳香族ビス(アシル)前駆体は、1個の−L1H基である。nが1超の整数に等しい式(I)の化合物を調製するために、1超の−L1H基を含む類似の芳香族ビス(アシル)前駆体を用いてもよい。
【0045】
式(III)のペルフルオロアルキルスルホンアミド化合物(式中、Qは、式−OSO2−R4である)は、反応スキームBに示すように、式(V)のフッ素化アルコールと式(VI)のスルホニルハロゲン化物との反応によって調製することができる。
【化21】

【0046】
式(V)の多くの好適なフッ素化アルコールは、式CF3(CF2)3SO2N(R3)−R2OH(式中、R3は、1〜4個の炭素原子を有するアルキルから選択され、R2は、アルキレン、ヘテロアルキレン、又はこれらの組み合わせである)である。代表的な式(V)のフッ素化アルコールとしては、以下が挙げられるが、これらに限定されない。
CF3(CF2)3SO2N(CH3)−CH2CH2OH、CF3(CF2)3SO2N(CH3)−CH(CH3)CH2OH、CF3(CF2)3SO2N(CH3)−CH2CH(CH3)OH、CF3(CF2)3SO2N(CH3)−(CH2)4OH、CF3(CF2)3SO2N(C2H5)−CH2CH2OH、CF3(CF2)3SO2N(C2H5)−(CH2)6OH、CF3(CF2)3SO2N(C3H7)−CH2OCH2CH2CH2OH、CF3(CF2)3SO2N(C3H7)−CH2CH2OH、CF3(CF2)3SO2N(C4H9)−CH2CH2OH、及びCF3(CF2)3SO2N(C4H9)−(CH2)4OH。式(V)の好適なフッ素化アルコールの調製は、例えば、米国特許第6,664,353号(Savuら)、米国特許第6,852,781号(Savuら)、及び米国特許第7,361,782号(Klunら)に記載されている。
【0047】
代表的な式(VI)のスルホニルハロゲン化物としては、CH3SO2Cl、CF3SO2F、C4F9SO2F、及びCH3−C6H4−SO2Cl(即ち、4−トルエンスルホニルクロリド)が挙げられるが、これらに限定されない。
【0048】
更に他の式(III)のペルフルオロアルキルスルホンアミド化合物は、式(VIII)のペルフルオロアルキルスルホンアミドと式(VII)の二ハロゲン化物とを反応させることによって反応スキームCに示すように調製することができる。式(VII)における基Xは、クロロ、ブロモ、又はヨード等のハロである。基Rf、R2、及びR3は、上に定義されたものと同一である。式(VIII)のペルフルオロアルキルスルホンアミドは、米国特許第6,852.781号(Savuら)に記載されているように、C4F9SO2F等の式(IX)のペルフルオロアルキルスルホニルハロゲン化物と、一級アルキルアミン(例えば、メチルアミン、エチルアミン、及びプロピルアミン)とを反応させることによって調製することができる。
【化22】

代表的な式(VII)の二ハロゲン化物としては、二塩化メチレン、二塩化エチレン、二臭化エチレン、及び二塩化プロピレン、ClCH2−C6H4−CH2Cl、及びClCH2−C6H4−C6H4−CH2Clが挙げられるが、これらに限定されない。代表的な式(VIII)のフッ素化スルホンアミドとしては、C4F9SO2N(CH3)H及びC4F9SO2N(C2H5)Hが挙げられるが、これらに限定されない。
【0049】
最初に合成されたように、式(I)の芳香族ビス(アシル)含有化合物は、アルコキシ又はアリールオキシ基であるR1基を有することが多い。この化合物は、ジエステルであり、加水分解して、各R1基がヒドロキシルである芳香族ビス(アシル)含有化合物を調製することができる。得られる化合物は、二塩基酸であり、SO2Clと更に反応させて、各R1基がハロである芳香族ビス(アシル)含有化合物を調製することができる。
【0050】
式(III)、(IIIa)、及び(IIIb)の幾つかの代表的な化合物は、1個以上のアリーレン基及び1個以上の(one of more)アルキレン基の組み合わせであるR2基を含む。より具体的には、式(III)の化合物は、式(II)の化合物であってもよい。
【化23】

式(II)では、Ar1は、フェニレン又はジフェニレンであり、Rfは、ペルフルオロアルキルであり、R3は、アルキルであり、基Qは、ハロ又は式−OSO2−R4(式中、R4は、アルキル、ペルフルオロアルキル、アリール、又はアルキルで置換されたアリールである)の基から選択される。式(II)及び式(III)の幾つかのより具体的な化合物は、式(IIIc)及び式(IIId)の化合物である。
【化24】

これらの式では、基Q、R3、及びRfは、既に定義されたものと同一である。式(IIIc)及び式(IIId)の化合物は、Qが式−O−SO2−R4である式(IIIa)の化合物、又はQがハロである式(IIIb)の化合物である。変数yは、1以上の整数であり、1〜10の範囲、1〜8の範囲、1〜4の範囲、1〜3の範囲、又は1〜2の範囲の整数であることが多い。式(IIIc)の幾つかの化合物において、R3は、メチルであり、Rfは、−C4F9であり、yは、1〜4の範囲の整数である。式(IIIc)及び(IIId)の幾つかの代表的な化合物は、それぞれ、式(IIIe)及び(IIIf)の化合物である。
【化25】

幾つかの更により具体的な化合物では、式(IIIe)及び(IIIf)におけるRfは、−C4F9に等しい。式(IIIe)及び(IIIf)の幾つかのより具体的な化合物としては、以下が挙げられるが、これらに限定されない。
【化26】

これらの化合物は、反応スキームCを用いて非常に高収率(例えば、70パーセント超)で調製することができる。
【0051】
式(Ib)の芳香族ビス(アシル)含有化合物(p及びqは、両方とも0に等しい)は、式(X)の芳香族アミンと式(IX)のペルフルオロアルキルスルホニルフッ化物とを反応させることによって反応スキームDに示すように調製することができる。この反応の生成物(即ち、式(XI))を、水酸化ナトリウムの存在下で(CH3)2SO4と更に反応させて式(Ib)の芳香族ビス(アシル)含有化合物を調製してもよい。反応スキームDに示すように、得られる化合物は1に等しいnを有する。nが1超である式(Ib)の化合物を生成するために、より多くの一級アミノ基(−NH2基)を伴う芳香族アミンを式(X)の芳香族モノアミンの代わりに選択してもよい。
【化27】

代表的な式(X)の化合物としては、以下の式の化合物が挙げられるが、これらに限定されない。
【化28】

基−(CO)OCH3及び−NH2は、ベンゼン環の任意の炭素原子に結合することができる。代表的な式(IX)のペルフルオロアルキルスルホニルフッ化物としては、C4F9SO2F又はC6F13SO2Fが挙げられるが、これらに限定されない。
【0052】
式(Ic)の化合物(式(I)におけるpが1に等しく、qが0に等しい)は、反応スキームEに示すように調製することができる。
【化29】

基R3、Rf、R1、Ar、R2及びQは、既に定義されたものと同一である。
【0053】
別の態様では、(a)上に記載されている式(I)の芳香族ビス(アシル)含有化合物及び(b)式(XIII)のジオールを含む複数のモノマーの縮合反応生成物であるフッ素化ポリエステルが提供される。重合反応は、反応スキームFに示される。ポリマーは、式(XIV)(式中、mは1超の整数であり、アスタリスクは、別の繰り返し単位又は末端保護基等のポリマー中の別の基に対する結合部位を示す)である。
【化30】

基Ar、R1、R2、R3、Rfは、上に定義されたものと同一である。R5は、アルキレン、ヘテロアルキレン、アリーレン、又はこれらの組み合わせを含むことが多く、任意で、ペルフルオロアルキル基、スルホンアミド基、又は両方を含んでもよい。アルキレン基及びヘテロアルキレン基は、非置換であってもよく、アルキル、ハロ、若しくはアリールで置換されてもよい。アリーレン基は、非置換であってもよく、アルキル、ハロ、若しくは両方で置換されてもよい。変数mは、少なくとも2に等しい整数である。変数mは、通常、少なくとも5、少なくとも10、少なくとも20、少なくとも50、又は少なくとも100に等しい。
【0054】
式(XIII)の幾つかの好適なジオールは、例えば、1,2−エタンジオール、1,2−プロパンジオール、3−クロロ−1,2−プロパンジオール、1,3−プロパンジオール、1,3−ブタンジオール、1,4−ブタンジオール、2−メチル−1,3−プロパンジオール、2−メチル−1,2−プロパンジオール、2,2−ジメチル−1,3−プロパンジオール、2−エチル−1,3−プロパンジオール、2,2−ジエチル−1,3−プロパンジオール、1,5−ペンタンジオール、2−エチル−1,3−ペンタンジオール、2,2,4−トリメチル−1,3−ペンタンジオール、3−メチル−1,5−ペンタンジオール、1,2−ヘキサンジオール、1,5−ヘキサンジオール、1,6−ヘキサンジオール、2−エチル−1,6−ヘキサンジオール、ビス(ヒドロキシメチル)シクロヘキサン、1,8−オクタンジオール、ビシクロ−オクタンジオール、1,10−デカンジオール、トリシクロ−デカンジオール、1,12−ドデカンジオール、ノルボルナンジオール、及び1,18−オクタデカンジオール等のアルカンジオールである。
【0055】
式(XIII)の他の好適なジオールは、酸素ヘテロ原子を含むヘテロアルキレンジオールである。例としては、ジ(エチレングリコール)、トリ(エチレングリコール)、テトラ(エチレングリコール)、ジ(プロピレングリコール)、ジ(イソプロピレングリコール)、トリ(プロピレングリコール)、ポリ(エチレングリコール)ジオール、ポリ(プロピレングリコール)ジオール、ポリ(エチレングリコール)及びポリ(プロピレングリコール)のブロックコポリマー、ポリカプロラクトンジオールが挙げられるが、これらに限定されない。
【0056】
式(XIII)の更に他の好適なジオールとしては、例えば、レゾルシノール、ヒドロキノン、1,6−ジヒドロキシナフタレン、2,5−ジヒドロキシナフタレン、2,6−ジヒドロキシナフタレン、2,7−ジヒドロキシナフタレン;4,4’−ビフェノール、ビスフェノールA、1,4−ビス(ヒドロキシメチル)ベンゼン、4,4’−ビス(ヒドロキシメチル)ビフェニル、ビス(4−ヒドロキシエトキシフェニル)スルホン、ビスフェノールAのビス(ヒドロキシエチルエーテル)、及びビス(4−ヒドロキシフェニル)メタン等の芳香環が挙げられる。
【0057】
式(XIII)の更に他の好適なジオールは、フッ素含有ジオールである。代表的なフッ素含有ジオールとしては、N,N−ビス(2−ヒドロキシエチル)ペルフルオロブチルスルホンアミド、N−ビス(ヒドロキシブチル)ペルフルオロブチルスルホンアミド、C4F9SO2N(C3H7)CH2CH(OH)CH2OH;C4F9CH2(CO)N(CH2CH2OH)2C4F9OCH2CH(OH)CH2OH、C4F9CH2CH2CH2OCH2CH(OH)CH2OH、(HOCH2CF2OC2F4O(CF2)4OC2F4OCF2CH2OH)、及び(HOCH2CF2CF2O(CF2)4OCF2CF2CH2OH)が挙げられるが、これらに限定されない。
【0058】
重合反応は、エステル交換反応後に進行することが多い。エステル交換中、式(I)の芳香族ビス(アシル)含有化合物と式(XIII)のジオールとが反応して、比較的低分子量のプレポリマーを形成する。エステル交換反応のアルコール(R1OH)副生成物は、除去されることが多い。エステル交換反応は、典型的に、周囲圧力以上で、約160℃〜約260℃の範囲の温度で実施される。テトラ−n−ブチルチタン酸塩(TBT)等の触媒を添加してもよい。次いで、温度を約220℃〜280℃の範囲で維持して、0.01気圧(1.0kPa)未満、0.005気圧(0.5kPa)未満、又は0.001気圧(0.1kPa)未満等の減圧下で重合を完了させる。
【0059】
式(XIII)のジオール中のヒドロキシル基の全当量数の、式(I)の芳香族ビス(アシル)含有化合物中の式−(CO)R1の基の全当量数に対する比は、典型的に、1:1又は2:1である。僅かに過剰のジオールを用いて反応の完了を促進し、重合反応の完了後に過剰量を除去することが多い。
【0060】
別の態様では、式(XIV)のフッ素化ポリエステルは、オリゴマー物質である。本明細書で使用するとき、用語「オリゴマー」又は「オリゴマーの」は、10個以下の繰り返し単位を有する高分子物質を指す(即ち、式(XIV)における変数mは10以下である)。多くの場合、変数mは、8以下、6以下、又は5以下である。オリゴマー物質は、一官能性末端保護化合物を添加して重合反応を終結させることによって調製することができる。別の言い方をすれば、(a)上に記載されている式(I)の芳香族ビス(アシル)含有化合物、(b)ジオール、及び(c)前記式(I)の芳香族ビス(アシル)含有化合物又は前記ジオールと反応性である一官能性末端保護化合物を含む複数のモノマーの縮合反応生成物であるフッ素化ポリエステルが提供される。
【0061】
この態様では、一官能性末端保護化合物が式(I)の化合物と反応することができる場合、フッ素化ポリエステルを形成するために用いられる反応混合物は、ジオールに対して過剰モルの式(I)の化合物を含有する。−(CO)R1基の全てがジオール又は一官能性末端保護化合物と反応できるように、十分な一官能性化合物を添加する。逆に、一官能性末端保護化合物がジオールと反応することができる場合、フッ素化ポリエステルを形成するために用いられる反応混合物は、式(I)の化合物に対して過剰モルのジオールを含有する。ジオールの全てが式(I)の化合物又は一官能性末端保護化合物のいずれかと反応するように、十分な一官能性化合物を添加する。
【0062】
一官能性末端保護化合物は、式(I)の化合物の−(CO)R1基のうちの1つと反応できる一官能性アルコールであることが多い。任意の好適なフッ素化又は非フッ素化一官能性アルコールを用いることができる。幾つかの実施形態では、一官能性アルコールは、1〜22個の炭素原子を有するアルカノールである。他の実施形態では、一官能性アルコールはフッ素含有アルコールである。例えば、フッ素含有アルコールは、ペルフルオロアルキル基を有してもよい。より多くのペルフルオロアルキル基をポリエステルに導入すると、得られる高分子物質の撥水性及び撥油性を更に強化することができる場合が多い。フッ素含有一官能性末端保護化合物の例としては、例えば、C4F9SO2N(CH3)−CH2CH2OH、C4F9SO2N(H)−CH2CH2OH、C4F9SO2N(CH3)(CH2)4OH、C4F9SO2N(C2H5)CH2CH2OH、CF3(CF2)3SO2N(CH3)CH2CH(CH3)OH、CF3(CF2)3SO2N(CH3)CH(CH3)CH2OH、CF3(CF2)3SO2N(C2H5)CH2CH2OH、C2F5O(C2F4O)3CF2(CO)NHC2H4OH、C4F9CH2CH2OH、N−メチル−N−(4−ヒドロキシブチル)ペルフルオロヘキサンスルホンアミド、1,1,2,2−テトラヒドロペルフルオロオクタノール、1,1−ジヒドロペルフルオロオクタノール、c−C6F11CH2OH、C4F9OC2F4OCF2CH2OCH2CH2OH、C3F7CON(H)CH2CH2OH、1,1,2,2,3,3−ヘキサヒドロペルフルオロデカノール、CF3O(CF2CF2O)1〜36CF2CH2OH、及びC3F7O(CF(CF3)CF2O)1〜36CF(CF3)CH2OHが挙げられる。
【0063】
あるいは、一官能性末端保護化合物は、ジオールのヒドロキシル基のうちの1つと反応することができる一官能性エステル、一官能性カルボン酸、又は一官能性アシルハロゲン化物であることが多い。これら一官能性末端保護化合物はいずれもフッ素化されていてもよく、又はフッ素化されていなくてもよい。好適な非フッ素化一官能性カルボン酸としては、ブタン酸、ペンタン酸、ヘキサン酸、安息香酸、及びフェニル酢酸が挙げられるが、これらに限定されない。好適なフッ素化一官能性カルボン酸としては、ペルフルオロブタン酸(C3F7(CO)OH)、12−(2−ペルフルオロイソプロポキシペルフルオロエチル)ドデカン酸、
6−(2−ペルフルオロシクロブトキシペルフルオロエチル)ヘキサン酸、4−(2−ビス(ペルフルオロイソプロピル)フルオロメトキシペルフルオロエチル)ブタン酸、
2−(N−(エチル)ペルフルオロブタンスルホンアミド)酢酸、
N−メチル−ペルフルオロブタンスルホンアミド酪酸、及び
2−(N−(メチル)ペルフルオロブタンスルホンアミド)酢酸が挙げられるが、これらに限定されない。
【0064】
フッ素化ポリエステルを好適な溶媒に溶解させて、基材の表面に塗布できるコーティング組成物を調製することができる。溶媒は、基材にコーティングを塗布した後に除去してもよい。好適な溶媒としては、アルコール、エステル、エーテル、グリコールエーテル、アミド、ケトン、炭化水素、クロロ炭化水素、ヒドロフルオロエーテル、クロロカーボン、及びこれらの混合物が挙げられるが、これらに限定されない。コーティング組成物は、0.1〜10重量パーセント、0.1〜5重量パーセント、又は0.5〜5重量パーセントのフッ素化ポリエステルを含有することが多い。
【0065】
コーティング組成物は、任意の好適な基材に塗布することができる。幾つかの実施形態では、コーティング組成物は、織布、メリヤス生地、不織布、織物、カーペット、皮革、又は紙等の繊維に塗布される。他の基材としては、ガラス、セラミック、メーソンリー、コンクリート、天然石、金属、木材、プラスチック、及び塗装表面が挙げられるが、これらに限定されない。基材は、平面又は曲面を有してもよく、粒子又は顆粒であってもよい。
【0066】
コーティング組成物は、例えば、噴霧、パディング、浸漬、ロールコーティング、又はブラッシング等の任意の好適な塗布方法を用いて基材に塗布することができる。適切な大きさの平坦な基材をコーティングするとき、ナイフコーティング又はバーコーティング法を用いて、確実に基材を均一にコーティングしてもよい。コーティングの厚さは、所望の忌避性等の所望の特性を得るために必要な任意の好適な厚さであってもよい。このコーティングの厚さは、基材の所望の特徴を損なわせることなく調整できることが多い。例えば、コーティングは、数マイクロメートル(例えば、1〜5マイクロメートル)から約50マイクロメートルまで、又は更にはそれ以上、約30マイクロメートルまで、約20マイクロメートルまで、又は約10マイクロメートルまでの範囲であってもよい。
【0067】
また、ポリエステルを加熱し、次いで、押出成形又は成型してもよい。当該技術分野において公知である任意の方法を用いることができる。幾つかの実施形態では、フッ素化ポリエステルを押出成形して、光学用途で使用するのに好適な透明フィルムを形成する。ポリエステルは、約150℃〜約300℃の範囲、又は約150℃〜約250℃の範囲の温度で押出成形されることが多い。
【0068】
フッ素化ポリエステルは、その撥水性及び撥油性によって示されるように低表面エネルギーを有することができる。多くの非フッ素化ポリエステルと比べて、水及びヘキサデカンに対する接触角が大きくなる傾向がある。即ち、これらのポリマーを用いて、撥水性かつ撥油性である表面を提供することができる。このような表面は、清浄な状態を保つ傾向があり、多くの非フッ素化表面よりも容易に清浄化される。
【0069】
フッ素化ポリエステルの屈折率は、非フッ素化ポリエステルよりも低いことが多い。ポリエステルは、良好な透明度を有する傾向があり、光学用途で使用することができる。ポリエステルは、例えば、低屈折率、光学的透明度、及び易清浄化特性の組み合わせが望ましい光学フィルムにおいて用いることができる。
【0070】
本発明の別の態様では、式(XV)の特定の化合物(本明細書では一置換アリーレン化合物と呼ばれる)を作製する方法を提供する:
Rf1−L2−CH2−Ar2−CH2−W
(XV)
式中、Ar2はフェニレン(−C6H4−)又はジフェニレン(−C6H4−C6H4−)(特定の実施形態では、Ar2は、ジフェニレンである)であり;Rf1は、鎖内に任意でO又はNを含むペルフルオロアルキルであり;L2は、−O−、−SO2−、−CH2−O−、−C2H4−O−、−C2H4−S−、及び−SO2−N(R6)−から選択され、R6は、C1〜C4アルキルであり、Wは脱離基である。
【0071】
この状況では、用語「脱離基」は、不均一結合開裂において離れる1対の電子を有する原子又は原子団を指す。典型的に、これは、例えば、ハロゲン化物(フッ化物、塩化物、臭化物、又はヨウ化物)及びスルホネートエステル(例えば、メタンスルホネート)等の強酸の安定なアニオンである。用語「一置換アリーレン化合物」は、アリーレン含有前駆体の2個の脱離基のうちの1個が、1個のフルオロケミカル基によって置換されている化合物を指す。
【0072】
式(XV)の特定の実施形態では、基Wは、好ましくは、ハロゲン化物及び擬ハロゲン化物基から選択される。より好ましくは、基Wは、Cl、Br、又は−OSO2R7(式中、R7は、アルキル、アリール、フッ素化アルキル、又はこれらの組み合わせ(例えば、メチル、トリル、及びベンジル)である)から選択される。
【0073】
式(XV)の化合物では、基Rf1は、鎖内に任意でO又はNを含むペルフルオロアルキルである。好適なペルフルオロアルキル基は、1〜60個の炭素原子、1〜30個の炭素原子、1〜20個の炭素原子、1〜10個の炭素原子、1〜8個の炭素原子、1〜6個の炭素原子(特定の実施形態では3〜6個の炭素原子)、又は1〜4個の炭素原子を有することが多い。特定の実施形態では、Rf1基は、式CxxF2xx+1(OCyyF2yy)aaOCppF2pp−(式中、xxは1〜4であり、yyは1〜4であり、ppは1〜4であり、aaは0〜20(特定の実施形態では4〜20)であり、任意の1分子において、各変数は独立して選択される)の基である。特定の実施形態では、Rf1基は、式C3F7(OCF2CF(CF3))aaOCF(CF3)−(式中、aaは4〜20である)の基である。多くの実施形態では、基Rf1は、−C3F7、−C4F9、−C6F13、又は−C8F17である。より具体的には、Rf1は、−C3F7、−C4F9、又は−C6F13である。更により具体的には、Rf1基は、−C4F9又は−C6F13である。
【0074】
式(XV)の化合物では、基L2は、−O−(オキシ基)、−SO2−(スルホニル基)、−CH2−O−、−C2H4−O−、−C2H4−S−、及び−SO2−N(R6)−から選択される。特定の実施形態では、基L2は、−CH2−O−、−C2H4−O−、及び−SO2−N(R6)−から選択される。特定の実施形態では、L2は、−SO2−N(R6)−又は−C2H4−O−である。
【0075】
式(XV)の化合物では、基R6は、C1〜C4アルキルである。特定の実施形態では、R6は、−CH3である。
【0076】
このような化合物は、実施例2、11、及び12に例示するように、塩基と、式(XVI)Rf1−L2−Hの化合物、式(XVII)W−CH2−Ar2−CH2−Wの化合物、及び有機溶媒とを合わせることを含む方法を用いて調製することができる。好ましくは、式(XVI)及び(XVII)の化合物を有機溶媒で溶液にして、この溶液に塩基を添加する。反応(例えば、式(XVI)及び(XVII)の化合物の溶液に対する塩基の添加)は、式(XV)の一置換アリーレン化合物を形成するのに有効な時間実施される。
【0077】
出発物質である式(XVI)の化合物において:Rf1は、鎖内に任意でO又はNを含むペルフルオロアルキルであり(代表的かつ好ましいRf1基は、式(XV)の化合物について本明細書で論じられた基である);L2は、−O−、−SO2−、−CH2−O−、−C2H4−O−、−C2H4−S−、及び−SO2−N(R6)−(式中、R6は、C1〜C4アルキルであり、好ましくは、R6は、−CH3である)から選択される。特定の実施形態では、基L2は、−CH2−O−、−C2H4−O−、及び−SO2−N(R6)−から選択される。特定の実施形態では、L2は、−SO2−N(R6)−又は−C2H4−O−から選択される。
【0078】
出発物質である式(XVII)の化合物において:Ar2は、フェニレン又はジフェニレン(好ましくは、ジフェニレン)であり;Wは、(代表的かつ好ましいW基は、式(XV)の化合物について本明細書で論じられた)脱離基である。式(XVII)の化合物において、Wは、独立して選択してもよい。
【0079】
式(XV)の一置換アリーレン化合物を作製する方法の特定の実施形態では(例えば、スルホンアミド化合物では)、塩基は、炭酸ナトリウムよりも塩基性である。この方法の特定の実施形態では、塩基は有機塩基である。この方法の特定の実施形態では、有機塩基は、1,8−ジアザビシクロ[5.4.0]ウンデカ−7−エン、1,5−ジアザビシクロ[4.3.0]ノナ−5−エン、及び(R8)4NOH(式中、R8はC1〜C4アルキルである)から選択される。特定の方法では、塩基は、NaOH又はNaH等の無機塩基である。
【0080】
式(XV)の一置換アリーレン化合物を作製する方法の特定の実施形態では、有機溶媒は、アセトン、THF、DMF、トルエン、又はこれらの混合物から選択される。代表的な有機溶媒は、例えば、25℃〜50℃の温度で式(XV)の一置換アリーレン化合物を溶解するものである。式(XVI)の出発物質と式(XVII)の出発物質との間の反応温度は、特に重要ではない。即ち、当業者が実用的、有効、かつ効率的であると判定することができる温度範囲を用いることができる。例えば、0℃以上の温度を用いることができ、並びに溶媒の還流温度を用いることができる。典型的に、25℃〜50℃の温度が用いられる。
【0081】
式(XV)の一置換アリーレン化合物を作製する方法の特定の実施形態では、塩基は、式(XVI)及び(XVII)の出発物質の溶液に添加される。しかし、あるいは、反応物質のうちの1つ、典型的に、式(XVI)の出発物質に塩基を添加し、次いで、その混合物を、式(XVII)W−CH2−Ar2−CH2−Wの出発物質に添加してもよい。典型的に、塩基(両出発物質の溶液に添加するか、式(XVI)の出発物質と組み合わせて添加するか)は、式(XVII)W−CH2−Ar2−CH2−Wの化合物が反応求核剤に対して過剰になるように、比較的ゆっくり添加される。典型的に、塩基は、少なくとも1時間、多くの場合少なくとも2時間にわたって添加されるが、より短い時間を用いてもよい。
【0082】
式(XV)の一置換アリーレン化合物を作製する方法の特定の実施形態では、このような化合物は、少なくとも70モル%の収率で形成される。
【0083】
式(XV)の一置換アリーレン化合物を作製する方法の特定の実施形態では、このような化合物は、固体の総重量に基づいて、少なくとも70重量%の純度で形成される。
【0084】
式(XV)の一置換アリーレン化合物を作製する方法の特定の実施形態では、このような化合物は、更に使用する前に反応混合物から単離される。
【実施例】
【0085】
本発明の目的及び利点は、以下の実施例によって更に例示されるが、これらの実施例において列挙された特定の材料及びその量は、他の諸条件及び詳細と同様に本発明を過度に制限するものと解釈されるべきではない。これらの実施例は、単にあくまで例示を目的としたものであり、添付した請求項の範囲を限定することを意味するものではない。
【0086】
使用される溶媒及び他の試薬は、特に記載のない限り、Aldrich Chemical Company,Milwaukee,WIから入手した。
【0087】
試験方法
接触角の測定
受け取ったままの状態の試薬等級のヘキサデカン及び濾過システム(Millipore Corporation,Billerica,MA)から入手)を通して濾過した脱イオン水を用い、ビデオ接触角分析計(Billerica,MAのAST Productsから製品番号VCA−2500XEとして入手可能)により測定を行った。報告した値は、それぞれ、右側及び左側で測定した少なくとも3滴の測定値から得られた平均結果である。液滴体積は、静的接触角測定の場合5μL(マイクロリットル)、前進及び後退接触角測定の場合1〜3μLであった。ヘキサデカンの場合には、前進接触角及び後退接触角のみを報告しているが、その理由は、静止接触角と前進接触角とがほぼ同じであることが見出されたからである。
【0088】
示差走査熱量計(DSC)分析
フッ素化ポリエステルのサンプル(7〜10ミリグラム)をTZEROアルミニウムパンに入れ、蓋をし(TA Instruments,New Castle,DEから入手)、1分間当たり50mLの窒素流下でTA Q2000 DSC(TA Instruments,New Castle,DE)内で稼働させた。サンプルを30℃で平衡化し、1分間当たり20℃ずつ290℃に加熱し、290℃で3分間保持し、1分間当たり20℃ずつ30℃に冷却し、1分間当たり20℃ずつ290℃に加熱した。
【0089】
屈折率の測定
Metricon Prismカップラー(Metricon Corporation,Pennington,N.J.)を用いてMD(伸長方向、即ち、x方向)、TD(伸長方向に対して垂直であるが同一表面内、即ち、y方向)、及びTM(x−y平面に対して垂直、即ち、z方向)方向の屈折率を測定した。MD及びTDは、面内方向であり、TMは、サンプルがフィルムとして調製される場合、フィルム表面に対して垂直である。MD、TD、及びTMの屈折率を平均して、バルク屈折率を求めた。
【0090】
(実施例1)
以下の一般反応スキームに従ってフッ素化ジエステル化合物Cを調製した:
【化31】

【0091】
化合物Aの合成
5−ヒドロキシイソフタル酸(250グラム、1.54モル)のメタノール(750mL)溶液に濃硫酸(50mL)を添加した。得られた溶液を6時間加熱還流し、次いで、約0.013〜0.052気圧(1.3〜5.3kPa)の減圧下で濃縮した。得られた油状白色固体を酢酸エチル(500mL)に溶解させ、重炭酸ナトリウム飽和水溶液、水、次いで塩化ナトリウム飽和溶液で連続して洗浄した。得られた有機層を硫酸マグネシウム上で乾燥させ、濾過し、約0.013〜0.052気圧(1.3〜5.3kPa)の減圧下で濃縮した。残渣は、融点165〜166℃の所望のジエステル化合物A(56グラム、収率78%)であった。
【0092】
化合物Bの合成
米国特許第6,664,354 B2号の実施例2(A部)に記載されているように、フッ素化アルコールC4F9SO2N(Me)CH2CH2OHを調製した。C4F9SO2N(Me)CH2CH2OH(535.5グラム、1.5モル)、CH3SO2Cl(182.3グラム、1.56モル、GSF Chemicals,Powell,OHから入手)、及び2000mLの酢酸エチル(J T Baker,Phillipsburg,NJから入手)を機械的に撹拌しながら3つ口フラスコに充填した。反応溶液を氷水浴中で0℃に冷却した後、Et3N(1.56モル、157.6グラム)を滴下した。混合物を一晩反応させた。反応生成物溶液を、重炭酸ナトリウム飽和水溶液、水、次いで塩化ナトリウム飽和溶液で連続して洗浄した。有機層を無水硫酸マグネシウム上で乾燥させ、濾過し、約0.013〜0.052気圧(1.3〜5.3kPa)の減圧下で濃縮した。残渣は、所望の化合物(762グラム、収率95パーセント)であった。
【0093】
化合物Cの合成
化合物A(0.3モル、63グラム)、化合物B(0.3モル、130.5グラム)、炭酸カリウム(0.3モル、41.4グラム)、18−crown−6(0.03グラム)(Aldrich,Milwaukee,WI)、ブタノン700mL、及びN,N’−ジメチルホルムアミド(700mL、EMD Chemical Inc.Darmstadt,Germanyから入手)を機械的撹拌しながら3つ口フラスコに入れた。混合物を5時間還流させ、次いで、水に注いだ。酢酸エチル(100mL)を添加して、生成物を抽出した。有機層を、水酸化ナトリウム水溶液、水、及び塩化ナトリウム飽和溶液で連続して洗浄した。有機層を硫酸マグネシウムを用いて乾燥させ、濾過し、約0.013〜0.052気圧(1.3〜5.3kPa)の減圧下で濃縮した。残渣をエタノールから再結晶化させ、所望の化合物C(102g、収率63%)を調製した。
【0094】
(実施例2)
以下の一般反応スキームに従ってフッ素化ジエステル化合物Hを調製した:
【化32】

米国特許出願公開第2003/0139549 A1号(Savuら)の実施例1に記載の通り、化合物Dを調製した。化合物D(0.15モル、47グラム)及び化合物E(0.15モル、37.7グラム)(Aldrich,Milwaukee,WI)を250mLのアセトンに溶解させた。溶液を50℃に加熱した。溶液温度を50℃に維持しながら、(C4H9)4NOH(水中55重量パーセント、0.15モル、70.8グラム)の溶液を3時間にわたってゆっくり添加した。添加が終了した後、反応混合物を50℃で更に1時間維持した。固体を濾取し、100mLのアセトンで洗浄した。ロータリーエバポレーターを用いてアセトンを除去した。固体を酢酸エチルに再溶解させ、水で洗浄し、無水硫酸マグネシウム上で乾燥させた。ロータリーエバポレーターを用いて溶解を除去して、60グラムの化合物F(収率76パーセント、純度94パーセント)を得た。
【0095】
上記の通り調製した化合物F(0.04モル、21グラム)、化合物A(0.04モル、8.4グラム)、炭酸カリウム(0.06モル、8.4グラム)及びジメチルスルホキシド、DMSO(40mL)をフラスコに充填した。溶液を40℃で6時間加熱した。溶液を酢酸エチルで希釈し、水で洗浄し、無水硫酸マグネシウム上で乾燥させた。ロータリーエバポレーターで溶媒を蒸発させて、固体の粗生成物を得た。メタノール(50mL)及び酢酸エチル(20mL)の混合物から粗生成物を再結晶化させた。約18グラムの純化合物Hが生成された。
【0096】
(実施例3)
以下の一般反応スキームに従ってフッ素化ジエステル化合物Kを調製した:
【化33】

【0097】
化合物J(0.1モル、25.4グラム)、実施例1に記載されたように調製した化合物B(0.2モル、87g)、炭酸カリウム(0.3モル、41.4グラム)、N,N’−ジメチルホルムアミド(300mL、EMD Chemical Inc.Darmstadt,Germanyから入手)を機械的に撹拌しながら3つ口フラスコに入れた。混合物を10時間120℃に加熱し、次いで、水に注いだ。酢酸エチル(100mL)を添加して、生成物を抽出した。有機層を、水酸化ナトリウム水溶液、水、及び塩化ナトリウム飽和溶液で連続して洗浄した。有機層を硫酸マグネシウム上で乾燥させ、濾過し、約0.013〜0.052気圧(1.3〜5.3kPa)の減圧下で濃縮した。残渣をメタノールから2回再結晶化させ、所望の化合物K(51.6グラム、収率55パーセント)を調製した。
【0098】
(実施例4〜8)
【化34】

実施例4〜8では、実施例1で調製したフッ素化ジエステル化合物C(0.03mmol)、ジオール(0.066mmol)、及び500ppmのテトラ−n−ブチルチタン酸塩(TBT)を、N2入口、機械的撹拌機、及び凝縮器を備える3つ口フラスコに添加した。ジオールは、実施例4ではHO−CH2CH2−OH、実施例5ではHO−CH2CH2CH2CH2−OH、実施例6ではHO−(CH2)12−OH、実施例7では(HO−CH2CH2)2NSO2C4F9、実施例8ではHO−CH2C(CH3)2CH2−OHであった。上記式中におけるR5は、実施例4では二価基−CH2CH2−、実施例5では二価基−CH2CH2CH2CH2−、実施例6では二価基−(CH2)12−、実施例7では二価基n−C4F9SO2N(CH2−)2、実施例8では二価基−CH3C(CH3)2CH2−に等しい。実施例7で用いるジオールは、等モル量のC4F9SO2NH2をC8F17SO2NH2に置換したことを除いて、米国特許第3,787,351号(Olson)の実施例8に記載の通り調製することができる。化合物C4F9SO2NH2は、C4F9SO2Fと等モル量のNH3とを反応させることによって調製することができる。
【0099】
混合物を徐々に220℃に加熱した(約40分間にわたって)。温度が約180℃〜210℃になったとき、メタノールが蒸留し始めた。反応を2時間220〜230℃で維持して、エステル交換反応を完了させた。真空を適用し、約30分間にわたって徐々に約0.0003気圧(30.4kPa)に増加させた。温度を230〜260℃に上昇させ、3時間維持した。重合中、融解粘度が増加した。反応を停止させ、ポリマーを分離した。
【0100】
次いで、上記DSC分析法を用いて融点(Tm)及びガラス転移温度(Tg)を測定することによって、得られたポリエステルを特性評価した。また、上記屈折率を測定するプロセスを用いて屈折率を測定することによって、ポリエステルを特性評価した。表1に、実施例4〜8及び市販のPET(Eastman Chemical,Kingsport,TNから入手したPET−9921)のTm、Tg、及び屈折率を要約する。
【0101】
【表1】

【0102】
実施例6のフッ素化ポリエステルを塩化メチレンに溶解させた。実施例4、5、7、及び8のフッ素化ポリエステルをシクロペンタノンに溶解させた。これらの溶液の固形分パーセントは、約5重量パーセントであった。これら5つの溶液を、厚さ約0.1〜0.3ミリメートルのフィルムに流延した。ガラス板上に前記溶液を広げ、空気中で24時間乾燥させることによってフィルムを調製した。乾燥したサンプルを更に真空箱中で24時間室温にて、次いで、更に48時間60℃にて、更に乾燥させた。乾燥後、イソプロピルアルコール(IPA)中で手で撹拌することによって1分間サンプルをすすぎ、これを蒸発させた後、水及びヘキサデカン接触角を測定した。
【0103】
上記方法を用いて水(H2O)及びヘキサデカン(HD)接触角を測定した。表2及び3に、実施例4〜8のポリエステル、並びに2つの市販ポリエステルPET(Eastman Chemical,Kingsport,TNから入手したPET−9921)及びポリ−MeFBSEAと呼ばれるMeFBSEAから形成される高分子物質の水及びヘキサデカン接触角を要約する。
【0104】
MeFBSEAは、N−メチル−ペルフルオロブタンスルホニルエチルアクリレート(C4F9SO2N(CH3)CH2CH2O(CO)CH=CH2)を指し、米国特許第6,852,781号(Savuら)の実施例2に記載の通り調製した。125mLの重合瓶に、10.0グラムのMeFBSEA、100ミリグラムの2.2’−アゾビス(2−メチルブチロニトリル(DuPont,Wilmington,DEから商品名VAZO 67として市販)、及び30グラムの酢酸エチルを入れることによって、ポリ−MeFBSEAを調製した。混合物を1分間、1リットル/分の窒素でパージし、次いで、密閉した。その瓶を60℃で24時間水浴中にて回転させた。得られた高分子物質は、粘性溶液であった。
【0105】
5つの調製されたフィルムについて得られた接触角を、市販のポリエチレンテレフタレートフィルム(Eastman,Kingsport,TN製PET−9921)及びフッ素化ポリマー(ポリ−MeFBSEA)について得られた接触角と比較した。
【0106】
【表2】

【0107】
【表3】

【0108】
(実施例9)
非混合押出成形軸を備える0.75インチ(1.91cm)のBrabender実験室用押出成形機(Brabender Instruments Inc.,New Jerseyから入手)において、実施例4のフッ素化ポリエステルのフィルムを調製した。軸速度は100毎分回転数であり、トルクは0.75N−mであった。融解し、押出成形バレルの3つのゾーン(ゾーン1、2、及び3)を通して押出成形機を輸送された後、押出品に6インチ(15.24cm)の平坦な流延押出成形ダイを通して押し出して、所望の設定で溶融フィルムを形成する。押出成形機内のゾーン1、2、3、アダプタ、及びダイの温度は、全て400℃(205℃)に設定した。得られた溶融押出品を冷却ロール積み重ね体に通して、その押出品を固化フィルムに冷却した。ライン速度は、約4ミル(100マイクロメートル)のキャリパーを用いて固化フィルムが製造されるように調整した。
【0109】
上記方法を用いて、得られた押出成形フィルムの水及びヘキサデカン接触角について試験した。水に対する静的接触角は104であった。前進接触角は、水の場合115.6、HDの場合68.6であった。後退接触角は、水の場合110.2、HDの場合65.2であった。
【0110】
(実施例10)
5.8847グラムの実施例3で調製したフッ素化ジエステル化合物K(0.006310mmol)、0.7833グラムのエチレングリコール(Aldrich、0.01262mmol)、0.9015gのCF3(CF2)3SO2N(CH3)−CH2CH2OH(0.002524mmol)、及び29ミリグラムのテトラ−n−ブチルチタン酸塩(TBT、約500ppm、Aldrich)を、N2入口、機械的撹拌器、及び凝縮器を備える3つ口フラスコに添加した。
【0111】
混合物を約150分間にわたって徐々に235℃に加熱した。温度が約235℃になったとき、エタノールが蒸留し始めた。反応を1.5時間235〜250℃で維持して、エステル交換反応を完了させた。真空を適用し、約30分間にわたって徐々に約0.00066気圧(66.9kPa)に上昇させた。温度を2時間250℃で維持した。融解粘度は、重合中僅かに増加した。反応を停止させ、高分子物質を排出した。
【0112】
DSCを用いて高分子物質を特性評価した。ガラス転移温度は76℃であり、融解温度は177℃であった。
【0113】
(実施例11)
4−(ヘプタフルオロブトキシメチル)−4’−クロロメチルフェニルの調製
【化35】

【0114】
20.0gの(0.1mol)C3F7CH2OH及び60mLのDMFの混合物を4.0gの60% NaH/鉱油で10℃にて少しずつ処理した。得られた溶液を1時間にわたって50℃の25.1g(0.1mol)の4,4’−ビス(クロロメチル)ビフェニルの110mL DMF溶液に滴下した。5時間後、混合物を1リットル(L)の水に注ぎ、得られた白色固体を濾過によって回収した。GLC(熱伝導率検出器)は、2つの新規物質(5%及び39%)及び50%の未反応出発二塩化物を示した。GC/MSによって、これらは、それぞれ4,4’−ビス(ヘプタフルオロブトキシメチル)ビフェニル及び4−(ヘプタフルオロブトキシメチル)−4’−クロロメチルビフェニルであると確認された。固体(35.4g)を600mLの沸騰ヘキサンに溶解させた。形成された顆粒状沈殿物(5.8g)を23℃に冷却した。上清液体を蒸発させて、収量17.5gの、10%ジエーテル、60%モノエーテル、及び30%二塩化物を得た。
【0115】
(実施例12)
4−((1H,1H,2H,2H−ペルフルオロ−1−オクチル)オキシメチル)−4’−クロロメチルビフェニルの調製
【化36】

【0116】
40.0g(0.1mol)の1H,1H,2H,2H−ペルフルオロ−1−オクタノール及び25.1g(0.1mol)の4,4’−ビス(クロロメチル)ビフェニルの150mL THF沸騰溶液を、8.0gの50% NaOH/水で1時間にわたって液滴処理した。2.5時間で反応を停止させ、水でクエンチし、塩化メチレンで抽出した。この物質(61.5g)は、淡黄色の固体であり、GLCによれば少量の液体C6F13C2H4OHを含んでいた。ヘキサンと共に粉砕したところ19.3gの固体が残り、GLCによって55%二塩化物及び2つの新規物質であることが示された。ヘキサンを36.4gまで蒸発させた。ペルフルオロメチルモルホリンと共に粉砕したところ26.4gの固体が残った。GC/MSは、主成分(74%)が所望の4−((1H,1H,2H,2H−ペルフルオロ−1−オクチル)オキシメチル)−4’−クロロメチルビフェニルであり、微量成分としてジエーテル(4,4’−ビス((1H,1H,2H,2H−ペルフルオロ−1−オクチル)オキシメチル)ビフェニルを含むことを示した。
【技術分野】
【0001】
フッ素化芳香族ビス(アシル)含有化合物及び前記フッ素化芳香族ビス(アシル)含有化合物から調製されるポリエステルについて記載する。
【背景技術】
【0002】
撥油性及び撥水性が強化されていることが望ましい用途で用いることができるフッ素化高分子物質は、以前から調製されている。これらフッ素化高分子物質の一部は、ペルフルオロオクチル基を含んでいた。特定のペルフルオロオクチル含有化合物は、生物において生体内蓄積する傾向がある。この傾向は、幾つかのフルオロケミカル物質に関する潜在的な問題として言及されている。
【発明の概要】
【発明が解決しようとする課題】
【0003】
体内から効率的に排出されることができかつ有効な撥水性及び撥油性を提供する新規フルオロケミカル物質が望まれている。
【課題を解決するための手段】
【0004】
フッ素化及び芳香族ビス(アシル)含有化合物、及びビス(アシル)含有化合物から調製されるフッ素化ポリエステルについて記載する。より具体的には、ビス(アシル)含有化合物は、芳香環を有し、かつペルフルオロアルキルスルホンアミド基を含有する。ビス(アシル)含有化合物から調製されるフッ素化ポリエステルを用いて、多くの他の既知のポリエステルに比べて比較的屈折率の低い低エネルギー表面を提供することができる。
【0005】
1つの態様では、式(I)の化合物が提供される。
【化1】

式(I)では、各R1は、独立して、ハロ、ヒドロキシル、アルコキシ、又はアリールオキシであり、前記アルコキシは、非置換であるか、又はアリールで置換され、アリールオキシは、非置換であるか、又はハロ、アルキル、若しくはこれらの組み合わせで置換される。基Arは、少なくとも6個の炭素原子を有する炭素環式芳香環構造である。基Lは、オキシ、チオ、又はスルホニルである。基R2は、アルキレン、ヘテロアルキレン、アリーレン、又はこれらの組み合わせから選択される二価基である。基R3は、アルキルであり、基Rfは、ペルフルオロアルキルである。変数nは、1〜4の範囲の整数に等しい。変数p及びqは、それぞれ0又は1に等しくてもよいが、但し、pが0に等しいとき、qは0に等しい。
【0006】
別の態様では、(a)上に記載されている式(I)の化合物、及び(b)ジオール、を含む複数のモノマーの縮合反応生成物であるフッ素化ポリエステルが提供される。
【0007】
更に別の態様では、(a)上に記載されている式(I)の化合物、(b)ジオール、及び(c)式(I)の化合物又はジオールと反応性である一官能性末端保護化合物、を含む複数のモノマーの縮合反応生成物であるフッ素化ポリエステルが提供される。
【0008】
更なる態様では、式(II)の化合物が提供される。
【化2】

式(II)では、Rfは、ペルフルオロアルキルであり、R3は、アルキルであり、yは、1〜20の範囲の整数であり、Ar1は、フェニレン又はジフェニレンであり、Qは、ハロ又は式−OSO2−R4(式中、R4は、アルキル、ペルフルオロアルキル、アリール、又はアルキルで置換されたアリールである)から選択される。
【0009】
本発明の別の態様は、式(XV)Rf1−L2−CH2−Ar2−CH2−W(式中、Ar2は、フェニレン又はジフェニレンであり、Rf1は、鎖内に任意でO又はNを含むペルフルオロアルキルであり、L2は、−O−、−SO2−、−CH2−O−、−C2H4−O−、−C2H4−S−、及び−SO2−N(R6)−から選択され、R6は、C1〜C4アルキルであり、Wは脱離基である)の一置換アリーレン化合物を調製する方法である。該方法は、式(XVI)Rf1−L2−Hの化合物、式(XVII)の化合物W−CH2−Ar2−CH2−W、及び有機溶媒を含む成分と塩基とを、式(XV)(式中、Rf1は、鎖内に任意でO又はNを含むペルフルオロアルキルであり;L2は、−O−、−SO2−、−CH2−O−、−C2H4−O−、−C2H4−S−、及び−SO2−N(R6)−(式中、R6 C1〜C4アルキルである)から選択され、Ar2は、フェニレン又はジフェニレンであり、Wは脱離基である)の一置換アリーレン化合物を形成するのに有効な時間合わせることを含む。
【0010】
上記の本発明の概要は、本発明のそれぞれの実施形態又は全ての実現形態を説明することを意図したものではない。以下の図面、発明を実施するための形態、及び実施例により、これらの実施形態をより詳しく例示する。
【発明を実施するための形態】
【0011】
フッ素化及び芳香族ビス(アシル)含有化合物及びフッ素化芳香族ビス(アシル)含有化合物から形成されるフッ素化ポリエステルについて記載する。
【0012】
「a」、「an」、及び「the」という用語は、「少なくとも1つの」と互換可能に用いられ、記載される要素のうちの1以上を意味する。
【0013】
用語「アルキル」とは、アルカンのラジカルである一価の基を指し、直鎖、分岐鎖、環状、又はこれらの組み合わせである基を含む。アルキル基は通常、1〜30個の炭素原子を有する。幾つかの実施形態では、アルキル基は、1〜20個の炭素原子、1〜10個の炭素原子、1〜6個の炭素原子又は1〜4個の炭素原子を含有する。アルキル基の例としては、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、tert−ブチル、n−ペンチル、n−ヘキシル、シクロヘキシル、n−ヘプチル、n−オクチル、及びエチルヘキシルが挙げられるが、これらに限定されない。
【0014】
「アルキレン」という用語は、アルカンのラジカルである二価基を指す。アルキレンは、直鎖、分岐鎖、環状、又はこれらの組み合わせであり得る。アルキレンは通常、1〜30個の炭素原子を有する。幾つかの実施形態では、アルキレンは、1〜20個、1〜10個、1〜6個、又は1〜4個の炭素原子を含有する。アルキレンのラジカル中心は、同一炭素原子上(即ち、アルキリデン)、又は異なる炭素原子上に存在しうる。
【0015】
用語「アルコキシ」は、式−OR(式中、Rはアルキル基である)の一価基を指す。
【0016】
用語「芳香族ビス(アシル)」は、式−(CO)−Ar−(CO)−の基を指す。基Arは、少なくとも6個の炭素原子を有する炭素環式芳香環である。2つのカルボニル基は、芳香環に直接結合する。各カルボニル基は、例えば、ハロ、アルコキシ、アリールオキシ、又はヒドロキシル等の別の基に更に結合される。即ち、芳香族ビス(アシル)基を含む化合物は、芳香族ビス(アシルハロゲン化物)、芳香族ビス(エステル)、又は芳香族ビス(カルボン酸)であることが多い。芳香族ビス(アシルハロゲン化物)は、基Arに結合する式−(CO)Xの2つの基を有する。基Xは、典型的に、ブロモ、クロロ、ヨード、又はフルオロから選択されるハロである。芳香族ビス(エステル)は、Ar基に結合する式−(CO)ORaの2つの基を有する。基Raは、アルキル;アリールで置換されるアルキル;アリール;ハロ、アルキル、又はこれらの組み合わせで置換されるアリール;である。芳香族ビス(カルボン酸)は、基Arに結合する2つの基−(CO)OH又はその塩を有する。
【0017】
用語「アリール」は、芳香族及び炭素環式である一価の基を指す。アリールは、芳香環と結合又は縮合した1〜5個の環を有しうる。その他の環構造は、芳香族、非芳香族、又はこれらの組み合わせであることができる。アリール基の例としては、これらに限定されるものではないが、フェニル、ビフェニル、テルフェニル、アンスリル、ナフチル、アセナフチル、アントラキノニル、フェナンスリル、アントラセニル、ピレニル、ペリレニル、及びフルオレニルが挙げられる。
【0018】
用語「アリーレン」とは、炭素環式及び芳香族である、二価の基を指す。この基は、結合している、縮合している、又はこれらの組み合わせである1〜5個の環を有する。その他の環は、芳香族、非芳香族、又はこれらの組み合わせであることができる。いくつかの実施形態では、アリーレン基は、5個以下の環、4個以下の環、3個以下の環、2個以下の環、又は1個の芳香環を有する。例えば、アリーレン基は、フェニレンであることができる。
【0019】
用語「アリールオキシ」は、式−O−Ar1(式中、Ar1はアリールである)の基を指す。
【0020】
用語「(CO)」又は「(OC)」は、互換的に用いられて、カルボニル基を指す。
【0021】
用語「ハロ」は、フルオロ、クロロ、ブロモ、又はヨードを指す。
【0022】
用語「ヘテロアルキレン」は、チオ、オキシ又は−NRb−(式中、Rbは水素又はアルキルである)で置換された1個以上の−CH2−基を有する二価のアルキレンを指す。ヘテロアルキレンは、直鎖、分岐鎖、環状、又はこれらの組み合わせであることができ、60個以下の炭素原子及び15個以下のヘテロ原子を含むことができる。幾つかの実施形態では、ヘテロアルキレンは、50個以下の炭素原子、40個以下の炭素原子、30個以下の炭素原子、20個以下の炭素原子、又は10個以下の炭素原子を含む。
【0023】
用語「ペルフルオロアルキル」は、水素原子が全てフッ素原子で置換されているアルキルを指す。
【0024】
用語「オキシ」は、二価基−O−を指す。
【0025】
用語「スルホニル」は、二価基−SO2−を指す。
【0026】
用語「チオ」は、二価基−S−を指す。
【0027】
用語「の範囲」は、指定の範囲の両端点を含む。
【0028】
式(I)のフッ素化芳香族ビス(アシル)含有化合物が提供される。
【化3】

この式のAr基は、少なくとも6個の炭素原子を有する炭素環式芳香環構造である。式(I)における各R1は、独立して、ハロ、ヒドロキシル、アルコキシ、又はアリールオキシであり、アルコキシは、非置換であるか、又はアリールで置換され、アリールオキシは、非置換であるか、又はアルキル、ハロ、若しくはこれらの組み合わせで置換される。基Lは、オキシ、チオ、又はスルホニルである。基R2は、アルキレン、ヘテロアルキレン、アリーレン、又はこれらの組み合わせから選択される二価基である。基R3は、アルキルであり、基Rfは、ペルフルオロアルキルである。変数nは、1〜4の範囲の整数に等しく、変数p及びqは、それぞれ0又は1に等しくてもよいが、但し、pが0に等しいとき、qは0に等しい。即ち、Lは、式(I)において−N(R3)−に直接は結合しない。
【0029】
式(I)の幾つかの実施形態では、式(Ia)に示されるようにp及びqの両方が1に等しく、
【化4】

ペルフルオロアルキルスルホンアミド基は、二価基−R2−L−によって芳香環構造から分離される。他の実施形態では、式(Ib)に示されるようにp及びqの両方が0に等しく、
【化5】

ペルフルオロアルキルスルホンアミド基は、芳香環Arに直接結合する。更に他の実施形態では、式(Ic)に示されるようにpは1に等しく、qは0に等しく、
【化6】

ペルフルオロアルキルスルホンアミド基は、二価基−R2−によって芳香環構造から分離される。
【0030】
式(I)におけるAr基は、1個の炭素環式芳香環である(即ち、Ar基がベンゼン環である)ことが多い。あるいは、Ar基は、縮合しているか(例えば、ナフタレン)、又は単結合によって連結されている(例えば、ビフェニル)2個以上の芳香環を含んでもよい。Ar基が複数の芳香環を含むとき、式(I)におけるAr基に結合している少なくとも3個の基が全て同じ芳香環に結合してもよく、又は少なくとも3個の基が複数の芳香環に任意の好適な構成で分布してもよい。
【0031】
式(I)における各R1は、独立して、ハロ、ヒドロキシル、アルコキシ、又はアリールオキシである。両R1基が同一であることが多い。好適なハロ基としては、クロロ、ブロモ、及びヨードが挙げられる。好適なR1基は、1〜10個の炭素原子、1〜8個の炭素原子、1〜6個の炭素原子、又は1〜4個の炭素原子を有することが多い。任意のアルコキシ基は、例えば、フェニル基又はビフェニル基等のアリール基で更に置換されてもよい。好適なアリールオキシ基は、1個の芳香環を有するか(即ち、アリールオキシ基は、フェノキシである)、又は2個以上の芳香環が単結合で連結されていることが多い。アリールオキシ基は、ハロ、又は1〜10個の炭素原子、1〜8個の炭素原子、1〜6個の炭素原子、若しくは1〜4個の炭素原子を有するアルキル基等のアルキル基で更に置換されてもよい。
【0032】
基R2は、pが1に等しいとき式(I)に含まれる。存在する場合、R2基は、アルキレン、ヘテロアルキレン、アリーレン、又はこれらの組み合わせから選択される二価基であってもよい。好適なアルキレン基は、1〜20個の炭素原子、1〜16個の炭素原子、1〜12個の炭素原子、1〜10個の炭素原子、1〜8個の炭素原子、1〜6個の炭素原子、又は1〜4個の炭素原子を有することが多い。好適なヘテロアルキレン基は、酸素ヘテロ原子を有することが多く、2〜20個、2〜16個、2〜12個、2〜8個、又は2〜4個の炭素原子を含む。好適なアリーレン基は、1個又は2個の芳香環を有することが多い。代表的なアリーレン基としては、フェニレン及びビフェニレンが挙げられるが、これらに限定されない。これら基の任意の組み合わせが存在し得る。
【0033】
式(I)の幾つかの代表的な化合物において、基R2はアルキレンである。即ち、基R2は、式−(CyH2y)−(式中、yは1〜20の範囲、1〜12の範囲、1〜8の範囲、又は1〜4の範囲の整数に等しい)の二価基であってもよい。
【0034】
式(I)の他の代表的な化合物において、基R2は、1個以上のアリーレン基及び1個以上のアルキレン基の組み合わせである。例えば、第1のアルキレンは、アリーレンに結合することができ、アリーレンは、第2のアリーレンに更に結合してもよい。即ち、R2は、式−(CyH2y)−Ar1−(CyH2y)−(式中、Ar1は、アリーレンであり、各変数yは、1〜20の範囲、1〜12の範囲、1〜8の範囲、又は1〜4の範囲の整数である)である。基Ar1は、典型的に、縮合又は単結合で連結された1〜3個の芳香環を含む。幾つかの例としては、式−(CyH2y)−C6H4−(CyH2y)−の基、例えば、−CH2−C6H4−CH2−等、又は式−(CyH2y)−C6H4−C6H4−(CyH2y)−の基、例えば、−CH2−C6H4−C6H4−CH2−等が挙げられるが、これらに限定されない。
【0035】
式(I)における基R3は、アルキルである。好適なアルキル基は、1〜18個の炭素原子、1〜12個の炭素原子、1〜8個の炭素原子、又は1〜4個の炭素原子を有することが多い。多くの実施形態では、R3はメチルである。
【0036】
基Rfは、ペルフルオロアルキルである。好適なペルフルオロアルキルは、1〜20個の炭素原子、1〜10個の炭素原子、1〜8個の炭素原子、1〜6個の炭素原子、又は1〜4個の炭素原子を有することが多い。多くの実施形態では、基Rfは、−C4F9、−C6F13又は−C8F17である。より具体的には、Rf基は、n−ペルフルオロブチル(即ち、直鎖−C4F9基)であることが多い。
【0037】
式(I)の幾つかの代表的な化合物は、式(Id)又は(Ie)の化合物である。
【化7】

これらの式では、式(I)における基Arは、ベンゼン環である。基L、R1、R2、及びRfは、式(I)について上に定義されたものと同一である。式(I)の変数nは、式(Id)において1に等しく、式(Ie)において2に等しい。式(I)における変数p及びqは、式(Id)及び(Ie)において両方とも1に等しい。式(Id)及び(Ie)において、基−(CO)R1及び−LR2N(CH3)SO2Rfは、ベンゼン環の任意の炭素原子に結合することができる。
【0038】
式(Id)又は(Ie)の幾つかの実施形態では、R2は、式(If)及び(Ig)に示されるようなアルキレンであり、式中、R2は、二価基−(CyH2y)−(式中、yは上に定義されたものと同一である)に等しい。
【化8】

式(If)の代表的な化合物としては、以下が挙げられるが、これらに限定されない
【化9】

式(Ig)の代表的な化合物としては、以下が挙げられるが、これらに限定されない。
【化10】

【0039】
式(Id)の他の実施形態では、R2は、式(Ih)に示されるような二価基−(CyH2y)−Ar1−(CyH2y)−に等しく、式中、Ar1は、フェニレン又はジフェニレンであり、yは、上に定義されたものと同一である。
【化11】

式(Ih)の代表的な化合物としては、以下が挙げられるが、これらに限定されない。
【化12】

【0040】
式(Id)の更に他の代表的な化合物において、R2は、式(Ii)に示されるような二価基−Ar1−(CyH2y)−に等しく、式中、Ar1は、フェニレン又はジフェニレンであり、yは、上に定義されたものと同一である。
【化13】

式(Ii)の具体的な化合物としては、以下が挙げられるが、これらに限定されない。
【化14】

【0041】
式(I)の他の実施形態において、変数p及びqは、上記式(Ib)に示されるように両方とも0に等しい。これらの実施形態では、化合物は、式(Ij)の化合物であることが多い。
【化15】

式(Ij)の代表的な化合物としては、以下が挙げられるが、これらに限定されない。
【化16】

【0042】
式(I)の更に他の実施形態において、変数pは1に等しいが、変数qは、上記式(Ic)に示されるように0に等しい。これらの実施形態では、化合物は、式(Ik)の化合物であることが多い。
【化17】

この式の多くの実施形態において、R2は、式(Il)に示されるような式−(CyH2y)−のアルキレンであり、式中、yは、上に定義されたものと同一である。
【化18】

式(Il)の代表的な化合物としては、以下が挙げられるが、これらに限定されない。
【化19】

【0043】
式(I)の化合物は、任意の好適なプロセスによって調製することができる。多くの実施形態において、変数p及びqは、両方とも1に等しく、化合物は、反応スキームAを用いて調製することができる。
【化20】

この反応スキームでは、式(III)のペルフルオロアルキルスルホンアミド化合物を、式(IV)の芳香族ビス(アシル)前駆体と反応させて、式(Ia)のフッ素化及び芳香族ビス(アシル)含有化合物を調製する。これらの様々な式において、基L1は、オキシ又はチオであるが、更なる酸化工程を含んで、チオ基をスルホニル基に変換してもよい。基Qは、(a)クロロ、ブロモ、又はヨード等のハロ、又は(b)式−OSO2−R4(式中、R4は、アルキル、ペルフルオロアルキル、アリール、又はアルキル、ハロ、若しくは両方で置換されたアリールである)の基から選択される。基R2は、アルキレン、ヘテロアルキレン、アリーレン、又はこれらの組み合わせから選択される二価基である。基R3は、アルキルであり、基Rfは、ペルフルオロアルキルである。各R1基は、典型的に、この反応スキームではアルコキシ又はアリールオキシである。アルコキシR1基は、非置換であってもよく、又はアリールで置換されてもよく、アリールオキシR1基は、非置換であってもよく、又はハロ、アルキル、若しくは両方で置換されてもよい。基Arは、少なくとも6個の炭素原子を有する炭素環式芳香環構造である。
【0044】
式(IV)の芳香族ビス(アシル)前駆体は、1個の−L1H基である。nが1超の整数に等しい式(I)の化合物を調製するために、1超の−L1H基を含む類似の芳香族ビス(アシル)前駆体を用いてもよい。
【0045】
式(III)のペルフルオロアルキルスルホンアミド化合物(式中、Qは、式−OSO2−R4である)は、反応スキームBに示すように、式(V)のフッ素化アルコールと式(VI)のスルホニルハロゲン化物との反応によって調製することができる。
【化21】

【0046】
式(V)の多くの好適なフッ素化アルコールは、式CF3(CF2)3SO2N(R3)−R2OH(式中、R3は、1〜4個の炭素原子を有するアルキルから選択され、R2は、アルキレン、ヘテロアルキレン、又はこれらの組み合わせである)である。代表的な式(V)のフッ素化アルコールとしては、以下が挙げられるが、これらに限定されない。
CF3(CF2)3SO2N(CH3)−CH2CH2OH、CF3(CF2)3SO2N(CH3)−CH(CH3)CH2OH、CF3(CF2)3SO2N(CH3)−CH2CH(CH3)OH、CF3(CF2)3SO2N(CH3)−(CH2)4OH、CF3(CF2)3SO2N(C2H5)−CH2CH2OH、CF3(CF2)3SO2N(C2H5)−(CH2)6OH、CF3(CF2)3SO2N(C3H7)−CH2OCH2CH2CH2OH、CF3(CF2)3SO2N(C3H7)−CH2CH2OH、CF3(CF2)3SO2N(C4H9)−CH2CH2OH、及びCF3(CF2)3SO2N(C4H9)−(CH2)4OH。式(V)の好適なフッ素化アルコールの調製は、例えば、米国特許第6,664,353号(Savuら)、米国特許第6,852,781号(Savuら)、及び米国特許第7,361,782号(Klunら)に記載されている。
【0047】
代表的な式(VI)のスルホニルハロゲン化物としては、CH3SO2Cl、CF3SO2F、C4F9SO2F、及びCH3−C6H4−SO2Cl(即ち、4−トルエンスルホニルクロリド)が挙げられるが、これらに限定されない。
【0048】
更に他の式(III)のペルフルオロアルキルスルホンアミド化合物は、式(VIII)のペルフルオロアルキルスルホンアミドと式(VII)の二ハロゲン化物とを反応させることによって反応スキームCに示すように調製することができる。式(VII)における基Xは、クロロ、ブロモ、又はヨード等のハロである。基Rf、R2、及びR3は、上に定義されたものと同一である。式(VIII)のペルフルオロアルキルスルホンアミドは、米国特許第6,852.781号(Savuら)に記載されているように、C4F9SO2F等の式(IX)のペルフルオロアルキルスルホニルハロゲン化物と、一級アルキルアミン(例えば、メチルアミン、エチルアミン、及びプロピルアミン)とを反応させることによって調製することができる。
【化22】

代表的な式(VII)の二ハロゲン化物としては、二塩化メチレン、二塩化エチレン、二臭化エチレン、及び二塩化プロピレン、ClCH2−C6H4−CH2Cl、及びClCH2−C6H4−C6H4−CH2Clが挙げられるが、これらに限定されない。代表的な式(VIII)のフッ素化スルホンアミドとしては、C4F9SO2N(CH3)H及びC4F9SO2N(C2H5)Hが挙げられるが、これらに限定されない。
【0049】
最初に合成されたように、式(I)の芳香族ビス(アシル)含有化合物は、アルコキシ又はアリールオキシ基であるR1基を有することが多い。この化合物は、ジエステルであり、加水分解して、各R1基がヒドロキシルである芳香族ビス(アシル)含有化合物を調製することができる。得られる化合物は、二塩基酸であり、SO2Clと更に反応させて、各R1基がハロである芳香族ビス(アシル)含有化合物を調製することができる。
【0050】
式(III)、(IIIa)、及び(IIIb)の幾つかの代表的な化合物は、1個以上のアリーレン基及び1個以上の(one of more)アルキレン基の組み合わせであるR2基を含む。より具体的には、式(III)の化合物は、式(II)の化合物であってもよい。
【化23】

式(II)では、Ar1は、フェニレン又はジフェニレンであり、Rfは、ペルフルオロアルキルであり、R3は、アルキルであり、基Qは、ハロ又は式−OSO2−R4(式中、R4は、アルキル、ペルフルオロアルキル、アリール、又はアルキルで置換されたアリールである)の基から選択される。式(II)及び式(III)の幾つかのより具体的な化合物は、式(IIIc)及び式(IIId)の化合物である。
【化24】

これらの式では、基Q、R3、及びRfは、既に定義されたものと同一である。式(IIIc)及び式(IIId)の化合物は、Qが式−O−SO2−R4である式(IIIa)の化合物、又はQがハロである式(IIIb)の化合物である。変数yは、1以上の整数であり、1〜10の範囲、1〜8の範囲、1〜4の範囲、1〜3の範囲、又は1〜2の範囲の整数であることが多い。式(IIIc)の幾つかの化合物において、R3は、メチルであり、Rfは、−C4F9であり、yは、1〜4の範囲の整数である。式(IIIc)及び(IIId)の幾つかの代表的な化合物は、それぞれ、式(IIIe)及び(IIIf)の化合物である。
【化25】

幾つかの更により具体的な化合物では、式(IIIe)及び(IIIf)におけるRfは、−C4F9に等しい。式(IIIe)及び(IIIf)の幾つかのより具体的な化合物としては、以下が挙げられるが、これらに限定されない。
【化26】

これらの化合物は、反応スキームCを用いて非常に高収率(例えば、70パーセント超)で調製することができる。
【0051】
式(Ib)の芳香族ビス(アシル)含有化合物(p及びqは、両方とも0に等しい)は、式(X)の芳香族アミンと式(IX)のペルフルオロアルキルスルホニルフッ化物とを反応させることによって反応スキームDに示すように調製することができる。この反応の生成物(即ち、式(XI))を、水酸化ナトリウムの存在下で(CH3)2SO4と更に反応させて式(Ib)の芳香族ビス(アシル)含有化合物を調製してもよい。反応スキームDに示すように、得られる化合物は1に等しいnを有する。nが1超である式(Ib)の化合物を生成するために、より多くの一級アミノ基(−NH2基)を伴う芳香族アミンを式(X)の芳香族モノアミンの代わりに選択してもよい。
【化27】

代表的な式(X)の化合物としては、以下の式の化合物が挙げられるが、これらに限定されない。
【化28】

基−(CO)OCH3及び−NH2は、ベンゼン環の任意の炭素原子に結合することができる。代表的な式(IX)のペルフルオロアルキルスルホニルフッ化物としては、C4F9SO2F又はC6F13SO2Fが挙げられるが、これらに限定されない。
【0052】
式(Ic)の化合物(式(I)におけるpが1に等しく、qが0に等しい)は、反応スキームEに示すように調製することができる。
【化29】

基R3、Rf、R1、Ar、R2及びQは、既に定義されたものと同一である。
【0053】
別の態様では、(a)上に記載されている式(I)の芳香族ビス(アシル)含有化合物及び(b)式(XIII)のジオールを含む複数のモノマーの縮合反応生成物であるフッ素化ポリエステルが提供される。重合反応は、反応スキームFに示される。ポリマーは、式(XIV)(式中、mは1超の整数であり、アスタリスクは、別の繰り返し単位又は末端保護基等のポリマー中の別の基に対する結合部位を示す)である。
【化30】

基Ar、R1、R2、R3、Rfは、上に定義されたものと同一である。R5は、アルキレン、ヘテロアルキレン、アリーレン、又はこれらの組み合わせを含むことが多く、任意で、ペルフルオロアルキル基、スルホンアミド基、又は両方を含んでもよい。アルキレン基及びヘテロアルキレン基は、非置換であってもよく、アルキル、ハロ、若しくはアリールで置換されてもよい。アリーレン基は、非置換であってもよく、アルキル、ハロ、若しくは両方で置換されてもよい。変数mは、少なくとも2に等しい整数である。変数mは、通常、少なくとも5、少なくとも10、少なくとも20、少なくとも50、又は少なくとも100に等しい。
【0054】
式(XIII)の幾つかの好適なジオールは、例えば、1,2−エタンジオール、1,2−プロパンジオール、3−クロロ−1,2−プロパンジオール、1,3−プロパンジオール、1,3−ブタンジオール、1,4−ブタンジオール、2−メチル−1,3−プロパンジオール、2−メチル−1,2−プロパンジオール、2,2−ジメチル−1,3−プロパンジオール、2−エチル−1,3−プロパンジオール、2,2−ジエチル−1,3−プロパンジオール、1,5−ペンタンジオール、2−エチル−1,3−ペンタンジオール、2,2,4−トリメチル−1,3−ペンタンジオール、3−メチル−1,5−ペンタンジオール、1,2−ヘキサンジオール、1,5−ヘキサンジオール、1,6−ヘキサンジオール、2−エチル−1,6−ヘキサンジオール、ビス(ヒドロキシメチル)シクロヘキサン、1,8−オクタンジオール、ビシクロ−オクタンジオール、1,10−デカンジオール、トリシクロ−デカンジオール、1,12−ドデカンジオール、ノルボルナンジオール、及び1,18−オクタデカンジオール等のアルカンジオールである。
【0055】
式(XIII)の他の好適なジオールは、酸素ヘテロ原子を含むヘテロアルキレンジオールである。例としては、ジ(エチレングリコール)、トリ(エチレングリコール)、テトラ(エチレングリコール)、ジ(プロピレングリコール)、ジ(イソプロピレングリコール)、トリ(プロピレングリコール)、ポリ(エチレングリコール)ジオール、ポリ(プロピレングリコール)ジオール、ポリ(エチレングリコール)及びポリ(プロピレングリコール)のブロックコポリマー、ポリカプロラクトンジオールが挙げられるが、これらに限定されない。
【0056】
式(XIII)の更に他の好適なジオールとしては、例えば、レゾルシノール、ヒドロキノン、1,6−ジヒドロキシナフタレン、2,5−ジヒドロキシナフタレン、2,6−ジヒドロキシナフタレン、2,7−ジヒドロキシナフタレン;4,4’−ビフェノール、ビスフェノールA、1,4−ビス(ヒドロキシメチル)ベンゼン、4,4’−ビス(ヒドロキシメチル)ビフェニル、ビス(4−ヒドロキシエトキシフェニル)スルホン、ビスフェノールAのビス(ヒドロキシエチルエーテル)、及びビス(4−ヒドロキシフェニル)メタン等の芳香環が挙げられる。
【0057】
式(XIII)の更に他の好適なジオールは、フッ素含有ジオールである。代表的なフッ素含有ジオールとしては、N,N−ビス(2−ヒドロキシエチル)ペルフルオロブチルスルホンアミド、N−ビス(ヒドロキシブチル)ペルフルオロブチルスルホンアミド、C4F9SO2N(C3H7)CH2CH(OH)CH2OH;C4F9CH2(CO)N(CH2CH2OH)2C4F9OCH2CH(OH)CH2OH、C4F9CH2CH2CH2OCH2CH(OH)CH2OH、(HOCH2CF2OC2F4O(CF2)4OC2F4OCF2CH2OH)、及び(HOCH2CF2CF2O(CF2)4OCF2CF2CH2OH)が挙げられるが、これらに限定されない。
【0058】
重合反応は、エステル交換反応後に進行することが多い。エステル交換中、式(I)の芳香族ビス(アシル)含有化合物と式(XIII)のジオールとが反応して、比較的低分子量のプレポリマーを形成する。エステル交換反応のアルコール(R1OH)副生成物は、除去されることが多い。エステル交換反応は、典型的に、周囲圧力以上で、約160℃〜約260℃の範囲の温度で実施される。テトラ−n−ブチルチタン酸塩(TBT)等の触媒を添加してもよい。次いで、温度を約220℃〜280℃の範囲で維持して、0.01気圧(1.0kPa)未満、0.005気圧(0.5kPa)未満、又は0.001気圧(0.1kPa)未満等の減圧下で重合を完了させる。
【0059】
式(XIII)のジオール中のヒドロキシル基の全当量数の、式(I)の芳香族ビス(アシル)含有化合物中の式−(CO)R1の基の全当量数に対する比は、典型的に、1:1又は2:1である。僅かに過剰のジオールを用いて反応の完了を促進し、重合反応の完了後に過剰量を除去することが多い。
【0060】
別の態様では、式(XIV)のフッ素化ポリエステルは、オリゴマー物質である。本明細書で使用するとき、用語「オリゴマー」又は「オリゴマーの」は、10個以下の繰り返し単位を有する高分子物質を指す(即ち、式(XIV)における変数mは10以下である)。多くの場合、変数mは、8以下、6以下、又は5以下である。オリゴマー物質は、一官能性末端保護化合物を添加して重合反応を終結させることによって調製することができる。別の言い方をすれば、(a)上に記載されている式(I)の芳香族ビス(アシル)含有化合物、(b)ジオール、及び(c)前記式(I)の芳香族ビス(アシル)含有化合物又は前記ジオールと反応性である一官能性末端保護化合物を含む複数のモノマーの縮合反応生成物であるフッ素化ポリエステルが提供される。
【0061】
この態様では、一官能性末端保護化合物が式(I)の化合物と反応することができる場合、フッ素化ポリエステルを形成するために用いられる反応混合物は、ジオールに対して過剰モルの式(I)の化合物を含有する。−(CO)R1基の全てがジオール又は一官能性末端保護化合物と反応できるように、十分な一官能性化合物を添加する。逆に、一官能性末端保護化合物がジオールと反応することができる場合、フッ素化ポリエステルを形成するために用いられる反応混合物は、式(I)の化合物に対して過剰モルのジオールを含有する。ジオールの全てが式(I)の化合物又は一官能性末端保護化合物のいずれかと反応するように、十分な一官能性化合物を添加する。
【0062】
一官能性末端保護化合物は、式(I)の化合物の−(CO)R1基のうちの1つと反応できる一官能性アルコールであることが多い。任意の好適なフッ素化又は非フッ素化一官能性アルコールを用いることができる。幾つかの実施形態では、一官能性アルコールは、1〜22個の炭素原子を有するアルカノールである。他の実施形態では、一官能性アルコールはフッ素含有アルコールである。例えば、フッ素含有アルコールは、ペルフルオロアルキル基を有してもよい。より多くのペルフルオロアルキル基をポリエステルに導入すると、得られる高分子物質の撥水性及び撥油性を更に強化することができる場合が多い。フッ素含有一官能性末端保護化合物の例としては、例えば、C4F9SO2N(CH3)−CH2CH2OH、C4F9SO2N(H)−CH2CH2OH、C4F9SO2N(CH3)(CH2)4OH、C4F9SO2N(C2H5)CH2CH2OH、CF3(CF2)3SO2N(CH3)CH2CH(CH3)OH、CF3(CF2)3SO2N(CH3)CH(CH3)CH2OH、CF3(CF2)3SO2N(C2H5)CH2CH2OH、C2F5O(C2F4O)3CF2(CO)NHC2H4OH、C4F9CH2CH2OH、N−メチル−N−(4−ヒドロキシブチル)ペルフルオロヘキサンスルホンアミド、1,1,2,2−テトラヒドロペルフルオロオクタノール、1,1−ジヒドロペルフルオロオクタノール、c−C6F11CH2OH、C4F9OC2F4OCF2CH2OCH2CH2OH、C3F7CON(H)CH2CH2OH、1,1,2,2,3,3−ヘキサヒドロペルフルオロデカノール、CF3O(CF2CF2O)1〜36CF2CH2OH、及びC3F7O(CF(CF3)CF2O)1〜36CF(CF3)CH2OHが挙げられる。
【0063】
あるいは、一官能性末端保護化合物は、ジオールのヒドロキシル基のうちの1つと反応することができる一官能性エステル、一官能性カルボン酸、又は一官能性アシルハロゲン化物であることが多い。これら一官能性末端保護化合物はいずれもフッ素化されていてもよく、又はフッ素化されていなくてもよい。好適な非フッ素化一官能性カルボン酸としては、ブタン酸、ペンタン酸、ヘキサン酸、安息香酸、及びフェニル酢酸が挙げられるが、これらに限定されない。好適なフッ素化一官能性カルボン酸としては、ペルフルオロブタン酸(C3F7(CO)OH)、12−(2−ペルフルオロイソプロポキシペルフルオロエチル)ドデカン酸、
6−(2−ペルフルオロシクロブトキシペルフルオロエチル)ヘキサン酸、4−(2−ビス(ペルフルオロイソプロピル)フルオロメトキシペルフルオロエチル)ブタン酸、
2−(N−(エチル)ペルフルオロブタンスルホンアミド)酢酸、
N−メチル−ペルフルオロブタンスルホンアミド酪酸、及び
2−(N−(メチル)ペルフルオロブタンスルホンアミド)酢酸が挙げられるが、これらに限定されない。
【0064】
フッ素化ポリエステルを好適な溶媒に溶解させて、基材の表面に塗布できるコーティング組成物を調製することができる。溶媒は、基材にコーティングを塗布した後に除去してもよい。好適な溶媒としては、アルコール、エステル、エーテル、グリコールエーテル、アミド、ケトン、炭化水素、クロロ炭化水素、ヒドロフルオロエーテル、クロロカーボン、及びこれらの混合物が挙げられるが、これらに限定されない。コーティング組成物は、0.1〜10重量パーセント、0.1〜5重量パーセント、又は0.5〜5重量パーセントのフッ素化ポリエステルを含有することが多い。
【0065】
コーティング組成物は、任意の好適な基材に塗布することができる。幾つかの実施形態では、コーティング組成物は、織布、メリヤス生地、不織布、織物、カーペット、皮革、又は紙等の繊維に塗布される。他の基材としては、ガラス、セラミック、メーソンリー、コンクリート、天然石、金属、木材、プラスチック、及び塗装表面が挙げられるが、これらに限定されない。基材は、平面又は曲面を有してもよく、粒子又は顆粒であってもよい。
【0066】
コーティング組成物は、例えば、噴霧、パディング、浸漬、ロールコーティング、又はブラッシング等の任意の好適な塗布方法を用いて基材に塗布することができる。適切な大きさの平坦な基材をコーティングするとき、ナイフコーティング又はバーコーティング法を用いて、確実に基材を均一にコーティングしてもよい。コーティングの厚さは、所望の忌避性等の所望の特性を得るために必要な任意の好適な厚さであってもよい。このコーティングの厚さは、基材の所望の特徴を損なわせることなく調整できることが多い。例えば、コーティングは、数マイクロメートル(例えば、1〜5マイクロメートル)から約50マイクロメートルまで、又は更にはそれ以上、約30マイクロメートルまで、約20マイクロメートルまで、又は約10マイクロメートルまでの範囲であってもよい。
【0067】
また、ポリエステルを加熱し、次いで、押出成形又は成型してもよい。当該技術分野において公知である任意の方法を用いることができる。幾つかの実施形態では、フッ素化ポリエステルを押出成形して、光学用途で使用するのに好適な透明フィルムを形成する。ポリエステルは、約150℃〜約300℃の範囲、又は約150℃〜約250℃の範囲の温度で押出成形されることが多い。
【0068】
フッ素化ポリエステルは、その撥水性及び撥油性によって示されるように低表面エネルギーを有することができる。多くの非フッ素化ポリエステルと比べて、水及びヘキサデカンに対する接触角が大きくなる傾向がある。即ち、これらのポリマーを用いて、撥水性かつ撥油性である表面を提供することができる。このような表面は、清浄な状態を保つ傾向があり、多くの非フッ素化表面よりも容易に清浄化される。
【0069】
フッ素化ポリエステルの屈折率は、非フッ素化ポリエステルよりも低いことが多い。ポリエステルは、良好な透明度を有する傾向があり、光学用途で使用することができる。ポリエステルは、例えば、低屈折率、光学的透明度、及び易清浄化特性の組み合わせが望ましい光学フィルムにおいて用いることができる。
【0070】
本発明の別の態様では、式(XV)の特定の化合物(本明細書では一置換アリーレン化合物と呼ばれる)を作製する方法を提供する:
Rf1−L2−CH2−Ar2−CH2−W
(XV)
式中、Ar2はフェニレン(−C6H4−)又はジフェニレン(−C6H4−C6H4−)(特定の実施形態では、Ar2は、ジフェニレンである)であり;Rf1は、鎖内に任意でO又はNを含むペルフルオロアルキルであり;L2は、−O−、−SO2−、−CH2−O−、−C2H4−O−、−C2H4−S−、及び−SO2−N(R6)−から選択され、R6は、C1〜C4アルキルであり、Wは脱離基である。
【0071】
この状況では、用語「脱離基」は、不均一結合開裂において離れる1対の電子を有する原子又は原子団を指す。典型的に、これは、例えば、ハロゲン化物(フッ化物、塩化物、臭化物、又はヨウ化物)及びスルホネートエステル(例えば、メタンスルホネート)等の強酸の安定なアニオンである。用語「一置換アリーレン化合物」は、アリーレン含有前駆体の2個の脱離基のうちの1個が、1個のフルオロケミカル基によって置換されている化合物を指す。
【0072】
式(XV)の特定の実施形態では、基Wは、好ましくは、ハロゲン化物及び擬ハロゲン化物基から選択される。より好ましくは、基Wは、Cl、Br、又は−OSO2R7(式中、R7は、アルキル、アリール、フッ素化アルキル、又はこれらの組み合わせ(例えば、メチル、トリル、及びベンジル)である)から選択される。
【0073】
式(XV)の化合物では、基Rf1は、鎖内に任意でO又はNを含むペルフルオロアルキルである。好適なペルフルオロアルキル基は、1〜60個の炭素原子、1〜30個の炭素原子、1〜20個の炭素原子、1〜10個の炭素原子、1〜8個の炭素原子、1〜6個の炭素原子(特定の実施形態では3〜6個の炭素原子)、又は1〜4個の炭素原子を有することが多い。特定の実施形態では、Rf1基は、式CxxF2xx+1(OCyyF2yy)aaOCppF2pp−(式中、xxは1〜4であり、yyは1〜4であり、ppは1〜4であり、aaは0〜20(特定の実施形態では4〜20)であり、任意の1分子において、各変数は独立して選択される)の基である。特定の実施形態では、Rf1基は、式C3F7(OCF2CF(CF3))aaOCF(CF3)−(式中、aaは4〜20である)の基である。多くの実施形態では、基Rf1は、−C3F7、−C4F9、−C6F13、又は−C8F17である。より具体的には、Rf1は、−C3F7、−C4F9、又は−C6F13である。更により具体的には、Rf1基は、−C4F9又は−C6F13である。
【0074】
式(XV)の化合物では、基L2は、−O−(オキシ基)、−SO2−(スルホニル基)、−CH2−O−、−C2H4−O−、−C2H4−S−、及び−SO2−N(R6)−から選択される。特定の実施形態では、基L2は、−CH2−O−、−C2H4−O−、及び−SO2−N(R6)−から選択される。特定の実施形態では、L2は、−SO2−N(R6)−又は−C2H4−O−である。
【0075】
式(XV)の化合物では、基R6は、C1〜C4アルキルである。特定の実施形態では、R6は、−CH3である。
【0076】
このような化合物は、実施例2、11、及び12に例示するように、塩基と、式(XVI)Rf1−L2−Hの化合物、式(XVII)W−CH2−Ar2−CH2−Wの化合物、及び有機溶媒とを合わせることを含む方法を用いて調製することができる。好ましくは、式(XVI)及び(XVII)の化合物を有機溶媒で溶液にして、この溶液に塩基を添加する。反応(例えば、式(XVI)及び(XVII)の化合物の溶液に対する塩基の添加)は、式(XV)の一置換アリーレン化合物を形成するのに有効な時間実施される。
【0077】
出発物質である式(XVI)の化合物において:Rf1は、鎖内に任意でO又はNを含むペルフルオロアルキルであり(代表的かつ好ましいRf1基は、式(XV)の化合物について本明細書で論じられた基である);L2は、−O−、−SO2−、−CH2−O−、−C2H4−O−、−C2H4−S−、及び−SO2−N(R6)−(式中、R6は、C1〜C4アルキルであり、好ましくは、R6は、−CH3である)から選択される。特定の実施形態では、基L2は、−CH2−O−、−C2H4−O−、及び−SO2−N(R6)−から選択される。特定の実施形態では、L2は、−SO2−N(R6)−又は−C2H4−O−から選択される。
【0078】
出発物質である式(XVII)の化合物において:Ar2は、フェニレン又はジフェニレン(好ましくは、ジフェニレン)であり;Wは、(代表的かつ好ましいW基は、式(XV)の化合物について本明細書で論じられた)脱離基である。式(XVII)の化合物において、Wは、独立して選択してもよい。
【0079】
式(XV)の一置換アリーレン化合物を作製する方法の特定の実施形態では(例えば、スルホンアミド化合物では)、塩基は、炭酸ナトリウムよりも塩基性である。この方法の特定の実施形態では、塩基は有機塩基である。この方法の特定の実施形態では、有機塩基は、1,8−ジアザビシクロ[5.4.0]ウンデカ−7−エン、1,5−ジアザビシクロ[4.3.0]ノナ−5−エン、及び(R8)4NOH(式中、R8はC1〜C4アルキルである)から選択される。特定の方法では、塩基は、NaOH又はNaH等の無機塩基である。
【0080】
式(XV)の一置換アリーレン化合物を作製する方法の特定の実施形態では、有機溶媒は、アセトン、THF、DMF、トルエン、又はこれらの混合物から選択される。代表的な有機溶媒は、例えば、25℃〜50℃の温度で式(XV)の一置換アリーレン化合物を溶解するものである。式(XVI)の出発物質と式(XVII)の出発物質との間の反応温度は、特に重要ではない。即ち、当業者が実用的、有効、かつ効率的であると判定することができる温度範囲を用いることができる。例えば、0℃以上の温度を用いることができ、並びに溶媒の還流温度を用いることができる。典型的に、25℃〜50℃の温度が用いられる。
【0081】
式(XV)の一置換アリーレン化合物を作製する方法の特定の実施形態では、塩基は、式(XVI)及び(XVII)の出発物質の溶液に添加される。しかし、あるいは、反応物質のうちの1つ、典型的に、式(XVI)の出発物質に塩基を添加し、次いで、その混合物を、式(XVII)W−CH2−Ar2−CH2−Wの出発物質に添加してもよい。典型的に、塩基(両出発物質の溶液に添加するか、式(XVI)の出発物質と組み合わせて添加するか)は、式(XVII)W−CH2−Ar2−CH2−Wの化合物が反応求核剤に対して過剰になるように、比較的ゆっくり添加される。典型的に、塩基は、少なくとも1時間、多くの場合少なくとも2時間にわたって添加されるが、より短い時間を用いてもよい。
【0082】
式(XV)の一置換アリーレン化合物を作製する方法の特定の実施形態では、このような化合物は、少なくとも70モル%の収率で形成される。
【0083】
式(XV)の一置換アリーレン化合物を作製する方法の特定の実施形態では、このような化合物は、固体の総重量に基づいて、少なくとも70重量%の純度で形成される。
【0084】
式(XV)の一置換アリーレン化合物を作製する方法の特定の実施形態では、このような化合物は、更に使用する前に反応混合物から単離される。
【実施例】
【0085】
本発明の目的及び利点は、以下の実施例によって更に例示されるが、これらの実施例において列挙された特定の材料及びその量は、他の諸条件及び詳細と同様に本発明を過度に制限するものと解釈されるべきではない。これらの実施例は、単にあくまで例示を目的としたものであり、添付した請求項の範囲を限定することを意味するものではない。
【0086】
使用される溶媒及び他の試薬は、特に記載のない限り、Aldrich Chemical Company,Milwaukee,WIから入手した。
【0087】
試験方法
接触角の測定
受け取ったままの状態の試薬等級のヘキサデカン及び濾過システム(Millipore Corporation,Billerica,MA)から入手)を通して濾過した脱イオン水を用い、ビデオ接触角分析計(Billerica,MAのAST Productsから製品番号VCA−2500XEとして入手可能)により測定を行った。報告した値は、それぞれ、右側及び左側で測定した少なくとも3滴の測定値から得られた平均結果である。液滴体積は、静的接触角測定の場合5μL(マイクロリットル)、前進及び後退接触角測定の場合1〜3μLであった。ヘキサデカンの場合には、前進接触角及び後退接触角のみを報告しているが、その理由は、静止接触角と前進接触角とがほぼ同じであることが見出されたからである。
【0088】
示差走査熱量計(DSC)分析
フッ素化ポリエステルのサンプル(7〜10ミリグラム)をTZEROアルミニウムパンに入れ、蓋をし(TA Instruments,New Castle,DEから入手)、1分間当たり50mLの窒素流下でTA Q2000 DSC(TA Instruments,New Castle,DE)内で稼働させた。サンプルを30℃で平衡化し、1分間当たり20℃ずつ290℃に加熱し、290℃で3分間保持し、1分間当たり20℃ずつ30℃に冷却し、1分間当たり20℃ずつ290℃に加熱した。
【0089】
屈折率の測定
Metricon Prismカップラー(Metricon Corporation,Pennington,N.J.)を用いてMD(伸長方向、即ち、x方向)、TD(伸長方向に対して垂直であるが同一表面内、即ち、y方向)、及びTM(x−y平面に対して垂直、即ち、z方向)方向の屈折率を測定した。MD及びTDは、面内方向であり、TMは、サンプルがフィルムとして調製される場合、フィルム表面に対して垂直である。MD、TD、及びTMの屈折率を平均して、バルク屈折率を求めた。
【0090】
(実施例1)
以下の一般反応スキームに従ってフッ素化ジエステル化合物Cを調製した:
【化31】

【0091】
化合物Aの合成
5−ヒドロキシイソフタル酸(250グラム、1.54モル)のメタノール(750mL)溶液に濃硫酸(50mL)を添加した。得られた溶液を6時間加熱還流し、次いで、約0.013〜0.052気圧(1.3〜5.3kPa)の減圧下で濃縮した。得られた油状白色固体を酢酸エチル(500mL)に溶解させ、重炭酸ナトリウム飽和水溶液、水、次いで塩化ナトリウム飽和溶液で連続して洗浄した。得られた有機層を硫酸マグネシウム上で乾燥させ、濾過し、約0.013〜0.052気圧(1.3〜5.3kPa)の減圧下で濃縮した。残渣は、融点165〜166℃の所望のジエステル化合物A(56グラム、収率78%)であった。
【0092】
化合物Bの合成
米国特許第6,664,354 B2号の実施例2(A部)に記載されているように、フッ素化アルコールC4F9SO2N(Me)CH2CH2OHを調製した。C4F9SO2N(Me)CH2CH2OH(535.5グラム、1.5モル)、CH3SO2Cl(182.3グラム、1.56モル、GSF Chemicals,Powell,OHから入手)、及び2000mLの酢酸エチル(J T Baker,Phillipsburg,NJから入手)を機械的に撹拌しながら3つ口フラスコに充填した。反応溶液を氷水浴中で0℃に冷却した後、Et3N(1.56モル、157.6グラム)を滴下した。混合物を一晩反応させた。反応生成物溶液を、重炭酸ナトリウム飽和水溶液、水、次いで塩化ナトリウム飽和溶液で連続して洗浄した。有機層を無水硫酸マグネシウム上で乾燥させ、濾過し、約0.013〜0.052気圧(1.3〜5.3kPa)の減圧下で濃縮した。残渣は、所望の化合物(762グラム、収率95パーセント)であった。
【0093】
化合物Cの合成
化合物A(0.3モル、63グラム)、化合物B(0.3モル、130.5グラム)、炭酸カリウム(0.3モル、41.4グラム)、18−crown−6(0.03グラム)(Aldrich,Milwaukee,WI)、ブタノン700mL、及びN,N’−ジメチルホルムアミド(700mL、EMD Chemical Inc.Darmstadt,Germanyから入手)を機械的撹拌しながら3つ口フラスコに入れた。混合物を5時間還流させ、次いで、水に注いだ。酢酸エチル(100mL)を添加して、生成物を抽出した。有機層を、水酸化ナトリウム水溶液、水、及び塩化ナトリウム飽和溶液で連続して洗浄した。有機層を硫酸マグネシウムを用いて乾燥させ、濾過し、約0.013〜0.052気圧(1.3〜5.3kPa)の減圧下で濃縮した。残渣をエタノールから再結晶化させ、所望の化合物C(102g、収率63%)を調製した。
【0094】
(実施例2)
以下の一般反応スキームに従ってフッ素化ジエステル化合物Hを調製した:
【化32】

米国特許出願公開第2003/0139549 A1号(Savuら)の実施例1に記載の通り、化合物Dを調製した。化合物D(0.15モル、47グラム)及び化合物E(0.15モル、37.7グラム)(Aldrich,Milwaukee,WI)を250mLのアセトンに溶解させた。溶液を50℃に加熱した。溶液温度を50℃に維持しながら、(C4H9)4NOH(水中55重量パーセント、0.15モル、70.8グラム)の溶液を3時間にわたってゆっくり添加した。添加が終了した後、反応混合物を50℃で更に1時間維持した。固体を濾取し、100mLのアセトンで洗浄した。ロータリーエバポレーターを用いてアセトンを除去した。固体を酢酸エチルに再溶解させ、水で洗浄し、無水硫酸マグネシウム上で乾燥させた。ロータリーエバポレーターを用いて溶解を除去して、60グラムの化合物F(収率76パーセント、純度94パーセント)を得た。
【0095】
上記の通り調製した化合物F(0.04モル、21グラム)、化合物A(0.04モル、8.4グラム)、炭酸カリウム(0.06モル、8.4グラム)及びジメチルスルホキシド、DMSO(40mL)をフラスコに充填した。溶液を40℃で6時間加熱した。溶液を酢酸エチルで希釈し、水で洗浄し、無水硫酸マグネシウム上で乾燥させた。ロータリーエバポレーターで溶媒を蒸発させて、固体の粗生成物を得た。メタノール(50mL)及び酢酸エチル(20mL)の混合物から粗生成物を再結晶化させた。約18グラムの純化合物Hが生成された。
【0096】
(実施例3)
以下の一般反応スキームに従ってフッ素化ジエステル化合物Kを調製した:
【化33】

【0097】
化合物J(0.1モル、25.4グラム)、実施例1に記載されたように調製した化合物B(0.2モル、87g)、炭酸カリウム(0.3モル、41.4グラム)、N,N’−ジメチルホルムアミド(300mL、EMD Chemical Inc.Darmstadt,Germanyから入手)を機械的に撹拌しながら3つ口フラスコに入れた。混合物を10時間120℃に加熱し、次いで、水に注いだ。酢酸エチル(100mL)を添加して、生成物を抽出した。有機層を、水酸化ナトリウム水溶液、水、及び塩化ナトリウム飽和溶液で連続して洗浄した。有機層を硫酸マグネシウム上で乾燥させ、濾過し、約0.013〜0.052気圧(1.3〜5.3kPa)の減圧下で濃縮した。残渣をメタノールから2回再結晶化させ、所望の化合物K(51.6グラム、収率55パーセント)を調製した。
【0098】
(実施例4〜8)
【化34】

実施例4〜8では、実施例1で調製したフッ素化ジエステル化合物C(0.03mmol)、ジオール(0.066mmol)、及び500ppmのテトラ−n−ブチルチタン酸塩(TBT)を、N2入口、機械的撹拌機、及び凝縮器を備える3つ口フラスコに添加した。ジオールは、実施例4ではHO−CH2CH2−OH、実施例5ではHO−CH2CH2CH2CH2−OH、実施例6ではHO−(CH2)12−OH、実施例7では(HO−CH2CH2)2NSO2C4F9、実施例8ではHO−CH2C(CH3)2CH2−OHであった。上記式中におけるR5は、実施例4では二価基−CH2CH2−、実施例5では二価基−CH2CH2CH2CH2−、実施例6では二価基−(CH2)12−、実施例7では二価基n−C4F9SO2N(CH2−)2、実施例8では二価基−CH3C(CH3)2CH2−に等しい。実施例7で用いるジオールは、等モル量のC4F9SO2NH2をC8F17SO2NH2に置換したことを除いて、米国特許第3,787,351号(Olson)の実施例8に記載の通り調製することができる。化合物C4F9SO2NH2は、C4F9SO2Fと等モル量のNH3とを反応させることによって調製することができる。
【0099】
混合物を徐々に220℃に加熱した(約40分間にわたって)。温度が約180℃〜210℃になったとき、メタノールが蒸留し始めた。反応を2時間220〜230℃で維持して、エステル交換反応を完了させた。真空を適用し、約30分間にわたって徐々に約0.0003気圧(30.4kPa)に増加させた。温度を230〜260℃に上昇させ、3時間維持した。重合中、融解粘度が増加した。反応を停止させ、ポリマーを分離した。
【0100】
次いで、上記DSC分析法を用いて融点(Tm)及びガラス転移温度(Tg)を測定することによって、得られたポリエステルを特性評価した。また、上記屈折率を測定するプロセスを用いて屈折率を測定することによって、ポリエステルを特性評価した。表1に、実施例4〜8及び市販のPET(Eastman Chemical,Kingsport,TNから入手したPET−9921)のTm、Tg、及び屈折率を要約する。
【0101】
【表1】

【0102】
実施例6のフッ素化ポリエステルを塩化メチレンに溶解させた。実施例4、5、7、及び8のフッ素化ポリエステルをシクロペンタノンに溶解させた。これらの溶液の固形分パーセントは、約5重量パーセントであった。これら5つの溶液を、厚さ約0.1〜0.3ミリメートルのフィルムに流延した。ガラス板上に前記溶液を広げ、空気中で24時間乾燥させることによってフィルムを調製した。乾燥したサンプルを更に真空箱中で24時間室温にて、次いで、更に48時間60℃にて、更に乾燥させた。乾燥後、イソプロピルアルコール(IPA)中で手で撹拌することによって1分間サンプルをすすぎ、これを蒸発させた後、水及びヘキサデカン接触角を測定した。
【0103】
上記方法を用いて水(H2O)及びヘキサデカン(HD)接触角を測定した。表2及び3に、実施例4〜8のポリエステル、並びに2つの市販ポリエステルPET(Eastman Chemical,Kingsport,TNから入手したPET−9921)及びポリ−MeFBSEAと呼ばれるMeFBSEAから形成される高分子物質の水及びヘキサデカン接触角を要約する。
【0104】
MeFBSEAは、N−メチル−ペルフルオロブタンスルホニルエチルアクリレート(C4F9SO2N(CH3)CH2CH2O(CO)CH=CH2)を指し、米国特許第6,852,781号(Savuら)の実施例2に記載の通り調製した。125mLの重合瓶に、10.0グラムのMeFBSEA、100ミリグラムの2.2’−アゾビス(2−メチルブチロニトリル(DuPont,Wilmington,DEから商品名VAZO 67として市販)、及び30グラムの酢酸エチルを入れることによって、ポリ−MeFBSEAを調製した。混合物を1分間、1リットル/分の窒素でパージし、次いで、密閉した。その瓶を60℃で24時間水浴中にて回転させた。得られた高分子物質は、粘性溶液であった。
【0105】
5つの調製されたフィルムについて得られた接触角を、市販のポリエチレンテレフタレートフィルム(Eastman,Kingsport,TN製PET−9921)及びフッ素化ポリマー(ポリ−MeFBSEA)について得られた接触角と比較した。
【0106】
【表2】

【0107】
【表3】

【0108】
(実施例9)
非混合押出成形軸を備える0.75インチ(1.91cm)のBrabender実験室用押出成形機(Brabender Instruments Inc.,New Jerseyから入手)において、実施例4のフッ素化ポリエステルのフィルムを調製した。軸速度は100毎分回転数であり、トルクは0.75N−mであった。融解し、押出成形バレルの3つのゾーン(ゾーン1、2、及び3)を通して押出成形機を輸送された後、押出品に6インチ(15.24cm)の平坦な流延押出成形ダイを通して押し出して、所望の設定で溶融フィルムを形成する。押出成形機内のゾーン1、2、3、アダプタ、及びダイの温度は、全て400℃(205℃)に設定した。得られた溶融押出品を冷却ロール積み重ね体に通して、その押出品を固化フィルムに冷却した。ライン速度は、約4ミル(100マイクロメートル)のキャリパーを用いて固化フィルムが製造されるように調整した。
【0109】
上記方法を用いて、得られた押出成形フィルムの水及びヘキサデカン接触角について試験した。水に対する静的接触角は104であった。前進接触角は、水の場合115.6、HDの場合68.6であった。後退接触角は、水の場合110.2、HDの場合65.2であった。
【0110】
(実施例10)
5.8847グラムの実施例3で調製したフッ素化ジエステル化合物K(0.006310mmol)、0.7833グラムのエチレングリコール(Aldrich、0.01262mmol)、0.9015gのCF3(CF2)3SO2N(CH3)−CH2CH2OH(0.002524mmol)、及び29ミリグラムのテトラ−n−ブチルチタン酸塩(TBT、約500ppm、Aldrich)を、N2入口、機械的撹拌器、及び凝縮器を備える3つ口フラスコに添加した。
【0111】
混合物を約150分間にわたって徐々に235℃に加熱した。温度が約235℃になったとき、エタノールが蒸留し始めた。反応を1.5時間235〜250℃で維持して、エステル交換反応を完了させた。真空を適用し、約30分間にわたって徐々に約0.00066気圧(66.9kPa)に上昇させた。温度を2時間250℃で維持した。融解粘度は、重合中僅かに増加した。反応を停止させ、高分子物質を排出した。
【0112】
DSCを用いて高分子物質を特性評価した。ガラス転移温度は76℃であり、融解温度は177℃であった。
【0113】
(実施例11)
4−(ヘプタフルオロブトキシメチル)−4’−クロロメチルフェニルの調製
【化35】

【0114】
20.0gの(0.1mol)C3F7CH2OH及び60mLのDMFの混合物を4.0gの60% NaH/鉱油で10℃にて少しずつ処理した。得られた溶液を1時間にわたって50℃の25.1g(0.1mol)の4,4’−ビス(クロロメチル)ビフェニルの110mL DMF溶液に滴下した。5時間後、混合物を1リットル(L)の水に注ぎ、得られた白色固体を濾過によって回収した。GLC(熱伝導率検出器)は、2つの新規物質(5%及び39%)及び50%の未反応出発二塩化物を示した。GC/MSによって、これらは、それぞれ4,4’−ビス(ヘプタフルオロブトキシメチル)ビフェニル及び4−(ヘプタフルオロブトキシメチル)−4’−クロロメチルビフェニルであると確認された。固体(35.4g)を600mLの沸騰ヘキサンに溶解させた。形成された顆粒状沈殿物(5.8g)を23℃に冷却した。上清液体を蒸発させて、収量17.5gの、10%ジエーテル、60%モノエーテル、及び30%二塩化物を得た。
【0115】
(実施例12)
4−((1H,1H,2H,2H−ペルフルオロ−1−オクチル)オキシメチル)−4’−クロロメチルビフェニルの調製
【化36】

【0116】
40.0g(0.1mol)の1H,1H,2H,2H−ペルフルオロ−1−オクタノール及び25.1g(0.1mol)の4,4’−ビス(クロロメチル)ビフェニルの150mL THF沸騰溶液を、8.0gの50% NaOH/水で1時間にわたって液滴処理した。2.5時間で反応を停止させ、水でクエンチし、塩化メチレンで抽出した。この物質(61.5g)は、淡黄色の固体であり、GLCによれば少量の液体C6F13C2H4OHを含んでいた。ヘキサンと共に粉砕したところ19.3gの固体が残り、GLCによって55%二塩化物及び2つの新規物質であることが示された。ヘキサンを36.4gまで蒸発させた。ペルフルオロメチルモルホリンと共に粉砕したところ26.4gの固体が残った。GC/MSは、主成分(74%)が所望の4−((1H,1H,2H,2H−ペルフルオロ−1−オクチル)オキシメチル)−4’−クロロメチルビフェニルであり、微量成分としてジエーテル(4,4’−ビス((1H,1H,2H,2H−ペルフルオロ−1−オクチル)オキシメチル)ビフェニルを含むことを示した。
【特許請求の範囲】
【請求項1】
式(I)の化合物
【化1】

(式中、
各R1は、独立して、ハロ、ヒドロキシル、アルコキシ、又はアリールオキシであり、前記アルコキシは、非置換であるか又はアリールで置換され、前記アリールオキシは、非置換であるか又はハロ、アルキル、若しくはこれらの組み合わせで置換され、
Arは、少なくとも6個の炭素原子を有する芳香環構造であり、
Lは、単結合、オキシ、チオ、スルホニルであり、
R2は、アルキレン、ヘテロアルキレン、アリーレン、又はこれらの組み合わせから選択される二価基であり、
R3は、アルキルであり、
Rfは、ペルフルオロアルキルであり、
nは、1〜4の範囲の整数であり、
pは、0又は1に等しい整数であり、
qは、0又は1に等しい整数であるが、但し、pが0に等しいとき、qは0に等しい)。
【請求項2】
p及びqが両方とも1に等しい、請求項1に記載の化合物。
【請求項3】
式(I)の化合物が式(Id)又は(Ie)の化合物である、請求項1又は2に記載の化合物。
【化2】

【請求項4】
R2が式−(CyH2y)−(式中、yは1〜20の範囲の整数である)のアルキレンを含む、請求項1〜3のいずれか一項に記載の化合物。
【請求項5】
R2が、1個以上のアルキレン基及び1個以上のアリーレン基の組み合わせを含む、請求項1〜3のいずれか一項に記載の化合物。
【請求項6】
R2が、式
−(CyH2y)−Ar1−(CyH2y)−(式中、yは1〜20の範囲の整数であり、Ar1は、フェニレン又はジフェニレンである)の基である、請求項5に記載の化合物。
【請求項7】
化合物が、
【化3】

である、請求項1に記載の化合物。
【請求項8】
以下を含む複数のモノマーの縮合反応生成物を含むフッ素化ポリエステル:
a)式(I)の化合物
【化4】

(式中、
各R1は、独立して、ハロ、ヒドロキシル、アルコキシ、又はアリールオキシであり、前記アルコキシは、非置換であるか又はアリールで置換され、前記アリールオキシは、非置換であるか又はハロ、アルキル、若しくはこれらの組み合わせで置換され、
Arは、少なくとも6個の炭素原子を有する芳香環構造であり、
Lは、単結合、オキシ、チオ、スルホニルであり、
R2は、アルキレン、ヘテロアルキレン、アリーレン、又はこれらの組み合わせから選択される二価基であり、
R3は、アルキルであり、
Rfは、ペルフルオロアルキルであり、
nは、1〜4の範囲の整数であり、
pは、0又は1に等しい整数であり、
qは、0又は1に等しい整数であるが、但し、pが0に等しいとき、qは0に等しい)、及び
b)ジオール。
【請求項9】
式(I)の化合物のp及びqが両方とも1に等しい、請求項8に記載のフッ素化ポリエステル。
【請求項10】
式(I)の化合物が式(Id)又は(Ie)の化合物である、請求項8又は9に記載のフッ素化ポリエステル。
【化5】

【請求項11】
前記ジオールがフッ素化されている、請求項8〜10のいずれか一項に記載のフッ素化ポリエステル。
【請求項12】
前記複数のモノマーが、式(I)の化合物又はジオールと反応性である一官能性末端保護化合物を更に含む、請求項8〜11のいずれか一項に記載のフッ素化ポリエステル。
【請求項13】
式(II)の化合物
【化6】

(式中、
Rfは、ペルフルオロアルキルであり、
R3は、アルキルであり、
Ar1は、フェニレン又はジフェニレンであり、
yは、1〜20の範囲の整数であり、
Qは、ハロ又は式−OSO2−R4(式中、R4は、アルキル、ペルフルオロアルキル、アリール、又はアルキルで置換されたアリールである)の基から選択される)。
【請求項14】
化合物が式(IIIe)及び(IIIf)の化合物である、請求項13に記載の化合物。
【化7】

【請求項15】
化合物が、
【化8】

である、請求項13又は14に記載の化合物。
【請求項16】
式(XV)の一置換アリーレン化合物を調製する方法であって
Rf1−L2−CH2−Ar2−CH2−W
(XV)
(式中、
Ar2は、フェニレン又はジフェニレンであり、
Rf1は、鎖内に任意でO又はNを含むペルフルオロアルキルであり、
L2は、−O−、−SO2−、−CH2−O−、−C2H4−O−、−C2H4−S−、及び−SO2−N(R6)−から選択され、
R6は、C1〜C4アルキルであり、
Wは、脱離基である)、
塩基を、
式(XVI)Rf1−L2−Hの化合物、
式(XVII)W−CH2−Ar2−CH2−Wの化合物、及び
有機溶媒を含む成分と、
式(XV)の一置換アリーレン化合物を形成するのに有効な時間合わせることを含む方法(式中、
Rf1は、鎖内に任意でO又はNを含むペルフルオロアルキルであり、
L2は、−O−、−SO2−、−CH2−O−、−C2H4−O−、−C2H4−S−、及び
−SO2−N(R6)−(式中、R6は、C1〜C4アルキルである)から選択され、
Ar2は、フェニレン又はジフェニレンであり、
Wは、脱離基である)。
【請求項17】
前記塩基が、炭酸ナトリウムよりも塩基性である、請求項16に記載の方法。
【請求項18】
前記塩基が有機塩基である、請求項16又は17に記載の方法。
【請求項19】
前記有機塩基が、
1,8−ジアザビシクロ[5.4.0]ウンデカ−7−エン、1,5−ジアザビシクロ[4.3.0]ノナ−5−エン、及び(R8)4NOH(式中、R8は、C1〜C4アルキルである)から選択される、請求項18に記載の方法。
【請求項20】
前記有機溶媒が、アセトン、THF、DMF、トルエン、又はこれらの混合物から選択される、請求項16〜19のいずれか一項に記載の方法。
【請求項21】
前記塩基が、少なくとも2時間にわたって、式(XVI)及び(XVII)の化合物を含む溶液に添加される、請求項16〜20のいずれか一項に記載の方法。
【請求項22】
前記式(XV)の一置換アリーレン化合物が少なくとも70モル%の収率で形成される、請求項16〜21のいずれか一項に記載の方法。
【請求項23】
前記式(XV)の一置換アリーレン化合物が、固体の総重量に基づいて、少なくとも70重量%の純度で形成される、請求項16〜22のいずれか一項に記載の方法。
【請求項1】
式(I)の化合物
【化1】

(式中、
各R1は、独立して、ハロ、ヒドロキシル、アルコキシ、又はアリールオキシであり、前記アルコキシは、非置換であるか又はアリールで置換され、前記アリールオキシは、非置換であるか又はハロ、アルキル、若しくはこれらの組み合わせで置換され、
Arは、少なくとも6個の炭素原子を有する芳香環構造であり、
Lは、単結合、オキシ、チオ、スルホニルであり、
R2は、アルキレン、ヘテロアルキレン、アリーレン、又はこれらの組み合わせから選択される二価基であり、
R3は、アルキルであり、
Rfは、ペルフルオロアルキルであり、
nは、1〜4の範囲の整数であり、
pは、0又は1に等しい整数であり、
qは、0又は1に等しい整数であるが、但し、pが0に等しいとき、qは0に等しい)。
【請求項2】
p及びqが両方とも1に等しい、請求項1に記載の化合物。
【請求項3】
式(I)の化合物が式(Id)又は(Ie)の化合物である、請求項1又は2に記載の化合物。
【化2】

【請求項4】
R2が式−(CyH2y)−(式中、yは1〜20の範囲の整数である)のアルキレンを含む、請求項1〜3のいずれか一項に記載の化合物。
【請求項5】
R2が、1個以上のアルキレン基及び1個以上のアリーレン基の組み合わせを含む、請求項1〜3のいずれか一項に記載の化合物。
【請求項6】
R2が、式
−(CyH2y)−Ar1−(CyH2y)−(式中、yは1〜20の範囲の整数であり、Ar1は、フェニレン又はジフェニレンである)の基である、請求項5に記載の化合物。
【請求項7】
化合物が、
【化3】

である、請求項1に記載の化合物。
【請求項8】
以下を含む複数のモノマーの縮合反応生成物を含むフッ素化ポリエステル:
a)式(I)の化合物
【化4】

(式中、
各R1は、独立して、ハロ、ヒドロキシル、アルコキシ、又はアリールオキシであり、前記アルコキシは、非置換であるか又はアリールで置換され、前記アリールオキシは、非置換であるか又はハロ、アルキル、若しくはこれらの組み合わせで置換され、
Arは、少なくとも6個の炭素原子を有する芳香環構造であり、
Lは、単結合、オキシ、チオ、スルホニルであり、
R2は、アルキレン、ヘテロアルキレン、アリーレン、又はこれらの組み合わせから選択される二価基であり、
R3は、アルキルであり、
Rfは、ペルフルオロアルキルであり、
nは、1〜4の範囲の整数であり、
pは、0又は1に等しい整数であり、
qは、0又は1に等しい整数であるが、但し、pが0に等しいとき、qは0に等しい)、及び
b)ジオール。
【請求項9】
式(I)の化合物のp及びqが両方とも1に等しい、請求項8に記載のフッ素化ポリエステル。
【請求項10】
式(I)の化合物が式(Id)又は(Ie)の化合物である、請求項8又は9に記載のフッ素化ポリエステル。
【化5】

【請求項11】
前記ジオールがフッ素化されている、請求項8〜10のいずれか一項に記載のフッ素化ポリエステル。
【請求項12】
前記複数のモノマーが、式(I)の化合物又はジオールと反応性である一官能性末端保護化合物を更に含む、請求項8〜11のいずれか一項に記載のフッ素化ポリエステル。
【請求項13】
式(II)の化合物
【化6】

(式中、
Rfは、ペルフルオロアルキルであり、
R3は、アルキルであり、
Ar1は、フェニレン又はジフェニレンであり、
yは、1〜20の範囲の整数であり、
Qは、ハロ又は式−OSO2−R4(式中、R4は、アルキル、ペルフルオロアルキル、アリール、又はアルキルで置換されたアリールである)の基から選択される)。
【請求項14】
化合物が式(IIIe)及び(IIIf)の化合物である、請求項13に記載の化合物。
【化7】

【請求項15】
化合物が、
【化8】

である、請求項13又は14に記載の化合物。
【請求項16】
式(XV)の一置換アリーレン化合物を調製する方法であって
Rf1−L2−CH2−Ar2−CH2−W
(XV)
(式中、
Ar2は、フェニレン又はジフェニレンであり、
Rf1は、鎖内に任意でO又はNを含むペルフルオロアルキルであり、
L2は、−O−、−SO2−、−CH2−O−、−C2H4−O−、−C2H4−S−、及び−SO2−N(R6)−から選択され、
R6は、C1〜C4アルキルであり、
Wは、脱離基である)、
塩基を、
式(XVI)Rf1−L2−Hの化合物、
式(XVII)W−CH2−Ar2−CH2−Wの化合物、及び
有機溶媒を含む成分と、
式(XV)の一置換アリーレン化合物を形成するのに有効な時間合わせることを含む方法(式中、
Rf1は、鎖内に任意でO又はNを含むペルフルオロアルキルであり、
L2は、−O−、−SO2−、−CH2−O−、−C2H4−O−、−C2H4−S−、及び
−SO2−N(R6)−(式中、R6は、C1〜C4アルキルである)から選択され、
Ar2は、フェニレン又はジフェニレンであり、
Wは、脱離基である)。
【請求項17】
前記塩基が、炭酸ナトリウムよりも塩基性である、請求項16に記載の方法。
【請求項18】
前記塩基が有機塩基である、請求項16又は17に記載の方法。
【請求項19】
前記有機塩基が、
1,8−ジアザビシクロ[5.4.0]ウンデカ−7−エン、1,5−ジアザビシクロ[4.3.0]ノナ−5−エン、及び(R8)4NOH(式中、R8は、C1〜C4アルキルである)から選択される、請求項18に記載の方法。
【請求項20】
前記有機溶媒が、アセトン、THF、DMF、トルエン、又はこれらの混合物から選択される、請求項16〜19のいずれか一項に記載の方法。
【請求項21】
前記塩基が、少なくとも2時間にわたって、式(XVI)及び(XVII)の化合物を含む溶液に添加される、請求項16〜20のいずれか一項に記載の方法。
【請求項22】
前記式(XV)の一置換アリーレン化合物が少なくとも70モル%の収率で形成される、請求項16〜21のいずれか一項に記載の方法。
【請求項23】
前記式(XV)の一置換アリーレン化合物が、固体の総重量に基づいて、少なくとも70重量%の純度で形成される、請求項16〜22のいずれか一項に記載の方法。
【公表番号】特表2012−529556(P2012−529556A)
【公表日】平成24年11月22日(2012.11.22)
【国際特許分類】
【出願番号】特願2012−515018(P2012−515018)
【出願日】平成22年6月7日(2010.6.7)
【国際出願番号】PCT/US2010/037607
【国際公開番号】WO2011/005396
【国際公開日】平成23年1月13日(2011.1.13)
【出願人】(505005049)スリーエム イノベイティブ プロパティズ カンパニー (2,080)
【Fターム(参考)】
【公表日】平成24年11月22日(2012.11.22)
【国際特許分類】
【出願日】平成22年6月7日(2010.6.7)
【国際出願番号】PCT/US2010/037607
【国際公開番号】WO2011/005396
【国際公開日】平成23年1月13日(2011.1.13)
【出願人】(505005049)スリーエム イノベイティブ プロパティズ カンパニー (2,080)
【Fターム(参考)】
[ Back to top ]

