フラボノイド化合物の製造方法
【課題】カニンガメラ属の微生物による微生物変換を用いてグリコシル化したフラボノイド化合物を低コストで効率良く製造する製造方法を提供することを目的とする。
【解決手段】本発明に係るフラボノイド化合物の製造方法によれば、カニンガメラ属に属する微生物による微生物変換を用いることで、比較的多くの量のグリコシル化したフラボノイド化合物を低コストで製造することが可能となる。また、本願発明に用いるカニンガメラ属に属する微生物は、フラボノイド化合物の3位の官能基を糖鎖で置換してグリコシル化するため、保護基等の脱着が必要なく容易にグリコシル化したフラボノイド化合物を製造することができる。
【解決手段】本発明に係るフラボノイド化合物の製造方法によれば、カニンガメラ属に属する微生物による微生物変換を用いることで、比較的多くの量のグリコシル化したフラボノイド化合物を低コストで製造することが可能となる。また、本願発明に用いるカニンガメラ属に属する微生物は、フラボノイド化合物の3位の官能基を糖鎖で置換してグリコシル化するため、保護基等の脱着が必要なく容易にグリコシル化したフラボノイド化合物を製造することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、微生物変換を用いてグリコシル化したフラボノイド化合物を製造するフラボノイド化合物の製造方法に関するものである。
【背景技術】
【0002】
フラボノイド化合物は植物界に多く存在し、代表的な天然化合物の一群である。フラボノイド化合物は現在3000種以上が知られ、その多様性と多面的な生理活性から注目を集めている。これらの具体的な報告例としてはカテキン類の抗菌活性、ポリフェノール類の抗酸化作用などが挙げられる。また、植物の花色や青果物の色を決定する色素として重要なアントシアン類もこのフラボノイド化合物群に属し、水酸基の数や位置によって多様な色を呈する。このように、フラボノイド化合物は薬理作用、抗菌作用、食品への機能性の付与等、様々なものへの応用が期待されている。
【0003】
これら応用が期待されているフラボノイド化合物群のひとつとして、糖鎖が結合しているグリコシル化したフラボノイド化合物がある。グリコシル化したフラボノイド化合物はこれ自体が抗菌活性および生活習慣病予防のための各種生理活性を有しているほか、他のフラボノイド化合物等の合成中間体としても期待されている。
【0004】
ただし、ある特定のフラボノイド化合物を医薬品(医薬部外品)や食品に応用するためには、そのフラボノイド化合物に対する薬効や安全性評価等の生物評価を行わなければならない。この生物評価のためには目的のフラボノイド化合物がある程度の量必要である。しかしながら、目的のフラボノイド化合物が基本的なフラボノイド化合物の類縁体である場合、この類縁体のみを化学合成することは困難な場合が多い。上記のグリコシル化したフラボノイド化合物もこの化学合成が困難なものに属し、例えば、下記[化10]のフラボノイド化合物を化学的方法で合成する場合、比較的容易に入手できる下記[化9]のフラボノイド化合物を出発原料として、[化9]のフラボノイド化合物の7位の水酸基以外の官能基に保護基を付けた上で7位の水酸基のみを糖鎖と置換してグリコシル化を行い、その後、保護基を除去するなどの操作が必要となる。このような複雑な反応工程が必要では、化学的方法によるグリコシル化したフラボノイド化合物の製造の実用化は、技術面及びコスト面から困難であると考えられる。
【0005】
ところで、微生物変換は微生物菌体またはその培養物に基となる化合物を接触させることによって当該化合物を変換する方法であり、水酸化をはじめ還元、加水分解、スルホン酸化、グリコシル化など多くの反応が可能であることが知られている。また、この微生物変換は、常温常圧、中性付近で反応が進行することが多いため環境負荷が小さいこと、基質の部位特異性や立体特異的に優れ、反応に際して保護基が不要であることなどの点で優れている。
【0006】
ここで、下記[非特許文献1]には、カニンガメラ属の微生物変換によるスルホン酸化の例が、また下記[非特許文献2]には、コムギの根毛を用いたフラボノールのグルコシル化の例がそれぞれ記載されている。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Chem.Pharm.Bull.56巻、1253〜1258頁(2008年)
【非特許文献2】Biosci.Biotechnol.Biochem.68巻、2032〜2039頁(2004年)
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、[非特許文献2]によるコムギの根毛を用いたフラボノールのグルコシル化では得られる量が極めて微量であり、生物評価等に使用できるほどの量を得ることができない。
【0009】
本発明は上記事情に鑑みて成されたものであり、カニンガメラ属の微生物による微生物変換を用いてグリコシル化したフラボノイド化合物を低コストで効率良く製造する製造方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
(1)化5の一般式に示す第1のフラボノイド化合物を化6の一般式に示す第2のフラボノイド化合物にグリコシル化するカニンガメラ属(genus Cunninghamella)に属する微生物を前記第1のフラボノイド化合物と糖類とを含有する培地で培養する、または、糖類を含有する培地で培養した前記微生物の培養菌体もしくは当該培養菌体の菌体破砕物もしくは当該培養菌体から抽出した酵素抽出液を前記第1のフラボノイド化合物と接触させることで、前記第1のフラボノイド化合物を第2のフラボノイド化合物にグリコシル化し、
当該第2のフラボノイド化合物を採取することを特徴とするフラボノイド化合物の製造方法を提供することにより、上記課題を解決する。
【0011】
【化5】

【0012】
【化6】

(但し、[化5]、[化6]のR5、R7、R2’、R3’、R4’ は水素または水酸基であり、[化6]のRはグルコースまたはグルクロン酸またはガラクトースまたはマンノースである。)
(2)化5の一般式に示す第1のフラボノイド化合物を化6の一般式に示す第2のフラボノイド化合物にグリコシル化するカニンガメラ属(genus Cunninghamella)に属する微生物の培養菌体もしくは当該培養菌体の菌体破砕物もしくは当該培養菌体から抽出した酵素抽出液を前記第1のフラボノイド化合物及びウリジンヌクレオチド二リン酸グルコースまたはウリジン二リン酸グルクロン酸またはウリジンヌクレオチド二リン酸ガラクトースまたはウリジンヌクレオチド二リン酸マンノースと接触させることで、前記第1のフラボノイド化合物を第2のフラボノイド化合物にグリコシル化し、
当該第2のフラボノイド化合物を採取することを特徴とするフラボノイド化合物の製造方法を提供することにより、上記課題を解決する。
(3)化7の一般式に示すフラバノンを化8の一般式に示す第3のフラボノイド化合物にグリコシル化するカニンガメラ属(genus Cunninghamella)の微生物をフラバノンと糖類とを含有する培地で培養する、または、糖類を含有する培地で培養した前記微生物の培養菌体もしくは当該培養菌体の菌体破砕物もしくは当該培養菌体から抽出した酵素抽出液をフラバノンと接触させることで、当該フラバノンを第3のフラボノイド化合物にグリコシル化し、
当該第3のフラボノイド化合物を採取することを特徴とするフラボノイド化合物の製造方法を提供することにより、上記課題を解決する。
【0013】
【化7】

【0014】
【化8】

(但し、[化8]のRはグルコースまたはグルクロン酸またはガラクトースまたはマンノースである。)
(4)化7の一般式に示すフラバノンを化8の一般式に示す第3のフラボノイド化合物にグリコシル化するカニンガメラ属(genus Cunninghamella)の微生物の培養菌体もしくは当該培養菌体の菌体破砕物もしくは当該培養菌体から抽出した酵素抽出液をフラバノン及びウリジンヌクレオチド二リン酸グルコースまたはウリジン二リン酸グルクロン酸またはウリジンヌクレオチド二リン酸ガラクトースまたはウリジンヌクレオチド二リン酸マンノースと接触させることで、当該フラバノンを第3のフラボノイド化合物にグリコシル化し、
当該第3のフラボノイド化合物を採取することを特徴とするフラボノイド化合物の製造方法を提供することにより、上記課題を解決する。
【発明の効果】
【0015】
本発明に係るフラボノイド化合物の製造方法は、カニンガメラ属の微生物による微生物変換を用いることにより、グリコシル化したフラボノイド化合物を低コストで効率良く製造することができる。
【図面の簡単な説明】
【0016】
【図1】本発明により製造されたフラボノイド化合物の同定結果を示す図である。
【発明を実施するための形態】
【0017】
本発明に係るフラボノイド化合物の製造方法の実施の形態について詳細に説明する。
【0018】
先ず、本発明に係るフラボノイド化合物の製造方法の原理について簡単に説明する。本願発明者はある特定のカニンガメラ属(genus Cunninghamella)に属する微生物が、代謝等の生体反応により糖類をウリジンヌクレオチド二リン酸化(UDP化)するとともに、UDP化した糖類(の糖鎖)とフラボノイド化合物の特定位置の官能基(の水素)とを置換する酵素(以後、変換酵素とする。)を生成することを見出した。本発明に係るフラボノイド化合物の製造方法は、この特定のカニンガメラ属に属する微生物を用いて原材料となるフラボノイド化合物をグリコシル化し、目的となるグリコシル化したフラボノイド化合物の製造を行うものである。
【0019】
ここで、特定のカニンガメラ属に属する具体的な微生物としては、Cunninghamella
echinulata(カニンガメラ・エキヌラータ)、C. bainieri(カニンガメラ・バイニエリ)、C. blakesleeana(カニンガメラ・ブラケスリーアナ)、C.elegans(カニンガメラ・エレガンス)等が挙げられる。中でも特に、公的な菌株分譲機関に保存された菌株であるCunninghamella echinulata CBS 596. 68 の使用が最も好ましい。ただし、カニンガメラ属等の糸状菌の諸性質は一定したものでなく、自然的、人工的に容易に変化することは周知のとおりである。よって、本発明で使用しうるカニンガメラ属の微生物は上記のものに限定されるわけではなく、カニンガメラ属に属し[化9]の第1のフラボノイド化合物もしくは[化11]のフラバノンを[化10]の第2のフラボノイド化合物もしくは[化12]の第3のフラボノイド化合物へ変換し得る菌株すべてを包含するものとする。
【0020】
【化9】

【0021】
【化10】

(但し、[化9]、[化10]のR5、R7、R2’、R3’、R4’ は水素または水酸基であり、[化10]のRはグルコースまたはグルクロン酸またはガラクトースまたはマンノースである。)
【0022】
【化11】

【0023】
【化12】

(但し、[化12]のRはグルコースまたはグルクロン酸またはガラクトースまたはマンノースである。)
尚、以後の記載では本発明に用いるカニンガメラ属の微生物を変換菌と記述する。また、第1のフラボノイド化合物及びフラバノンを原料化合物と記述する。また、本願の製造方法により得られる生成物は、必ずしも全てが第2、第3のフラボノイド化合物となるわけではない。従って基本的に、本発明に係るフラボノイド化合物の製造方法によって得られた生成物を生成化合物と記述し、生成化合物に含まれる上記の第2、第3のフラボノイド化合物をグリコシル化フラボノイド化合物と記述するものとする。
【0024】
変換菌を培養する培地は、通常微生物が利用出来る栄養物を含有するものを使用することができる。例えば炭素源(糖類)としては、グルコース、グルクロン酸、ガラクトース、マンノース、シュクロース、マルトース、乳糖、デンプン、グリセリン、水飴、糖蜜、大豆油等の一般の放線菌の培養に使用する炭素源が使用可能である。また、窒素源としては、大豆粉、小麦はい芽、肉粉、魚粉、肉エキス、ペプトン、コーンステイープリカー、乾燥酵母、硝酸アンモニウムなどのアンモニウム塩等が使用可能である。その他、必要に応じて、食塩、塩化カリウム、炭酸カルシウム、リン酸塩等の無機塩、変換菌の発育を助けるとともに変換酵素の生産を促進する添加物、例えば酵母エキスや麦芽エキス等を適宜組み合わせても良い。
【0025】
尚、培地に使用する炭素源にグルコースのみを用いれば、得られるグリコシル化フラボノイド化合物([化10]、[化12])のRはグルコースとなり、グルクロン酸、ガラクトース、マンノースのみを炭素源に用いれば、得られるグリコシル化フラボノイド化合物([化10]、[化12])のRはそれぞれグルクロン酸、ガラクトース、マンノースとなる。また、その他の炭素源もしくは複数種の糖類が混合した炭素源を用いる場合には、その炭素源中に存在するもしくは培養中に生じたグルコース、グルクロン酸、ガラクトース、マンノース等の量に応じて、[化10]、[化12]中のRの異なるグリコシル化フラボノイド化合物が生成され、生成化合物はそれらの混合物となる。このことは、UDP化した糖類を添加する後述の第三の形態のフラボノイド化合物の製造方法以外は基本的に同じである。尚、炭素源中のグルコース、グルクロン酸、ガラクトース、マンノースの混合比と、得られるグリコシル化フラボノイド化合物のそれぞれの混合比とは必ずしも一致しない。
【0026】
また、天然のフラボノイド化合物は植物由来である場合が多く、このような植物由来のフラボノイド化合物は多種の類縁したフラボノイド化合物が種々の割合で混合している。そして、この混合したフラボノイド化合物のうち特定のフラボノイド化合物を単離して本願発明の原料化合物とすれば、この原料化合物に対しグリコシル化が行われる。また、フラボノイド化合物を混合物のまま原料化合物とすれば、それぞれのフラボノイド化合物に対しグリコシル化が行われ、得られる生成化合物もこれらのグリコシル化フラボノイド化合物の混合物となる。
【0027】
次に、本発明に係る第一の形態のフラボノイド化合物の製造方法を説明する。第一の形態のフラボノイド化合物の製造方法は、変換菌を原料化合物と糖類とを含有する培地で培養することで、グリコシル化フラボノイド化合物を製造するものである。尚、原料化合物の添加は培養当初から行うのではなく、ある程度変換菌を培養した後に行うことが好ましい。
【0028】
第一の形態のフラボノイド化合物の製造方法は、先ず、所定の糖類(炭素源)を含有する培地に変換菌を植菌し、好気的条件の下、培養温度20℃〜40℃、好適には23℃〜30℃、最適には28℃で所定の期間、変換菌の培養を行う。この培養期間は使用する変換菌の培養条件、特に培養装置、培地組成、培養温度等により異なるが、変換菌による変換酵素の生産能(これをグリコシル化能とする。)が高い時期がよく、通常は変換菌の培養開始後1日〜5日経過した時点が好ましい。この培養の期間中、変換菌は増殖しながら糖類をUDP化するとともに変換酵素を生成、蓄積する。
【0029】
次に、この培地に原料化合物を添加する。原料化合物の添加量は、培地に対して0.01%〜5.0%、好ましくは0.025%〜2.0%である。尚、本願中の%は基本的にg/100mlとする。原料化合物添加後の変換菌の培養は、好気的条件下で上記と同様の培養温度で行なう。培養期間は、原料化合物の添加後1〜8日程度である。この培養期間中にも変換菌は糖類をUDP化するとともに変換酵素を生成する。そして、生成された変換酵素はUDP化した糖類の糖鎖と原料化合物の特定位置の官能基とを変換してグリコシル化し、グリコシル化フラボノイド化合物を製造する。
【0030】
グリコシル化の変換反応終了後、グリコシル化フラボノイド化合物を含む生成化合物は培地から既知の方法で採取、分離、精製される。例えば、培地を濾過し、得られた濾液を酢酸エチルのような水と混和しにくい有機溶媒で抽出し、抽出液から溶媒を留去した後、得られた粗生成化合物をシリカゲル、アルミナ、セパビーズ(三菱化学)等を用いたカラムクロマトグラフィーに付し、適切な溶離剤で溶出することによってグリコシル化フラボノイド化合物を分離、精製する。
【実施例1】
【0031】
500ml容三角フラスコ2本に次の組成の培地80mlをそれぞれ入れ、変換菌としてカニンガメラ・エキヌラータ(C.echinulata CBS596. 68)を植菌した(培地組成:溶媒 蒸留水(pH無修正)、D−グルコース5.0%、ポリペプトン(日本製薬)0.5%、酵母エキス(Bacto)0.3%)。これを、2日間、培養温度28℃、210rpmの条件で振とう培養し、変換菌の培養を行った。次に、原料化合物としてのフラボノール(3-hydroxyflavone)40mgをジメチルスルホキシド(DMSO)0.8mlに溶解したものをそれぞれの培地に添加し、更に8日間、培養温度28℃、210rpmの条件で振とう培養した。
【0032】
培養終了後、培養液を酢酸エチル80mlで2回抽出し、この抽出液を無水硫酸ナトリウムで乾燥したのち濃縮した。この濃縮物をセパビーズSP70(三菱化学)カラムに吸着、洗浄後、100%メタノールで溶出することにより精製した。これにより原料化合物80mgに対し生成化合物40mgを採取した。
【0033】
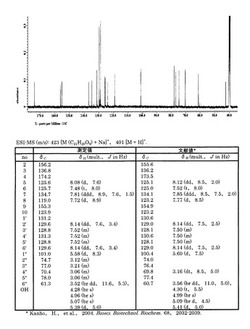
この生成化合物を酢酸エチルを展開溶媒としたシリカゲル薄層クロマトグラフィー(分析条件 シリカゲル薄層:メルク社40mm×100mm、溶媒:100%酢酸エチル、検出方法:ヨウ素またはアンスロン硫酸(1%/75%硫酸)噴霧による検出)により確認した。その結果、フラボノールの3−O−グルコシル体が確認された。尚、原料化合物であるフラボノールはほとんど確認できなかった。またこの生成化合物の質量スペクトルをESI−MS(日本電子(株)社製:HX−110)を用いて測定した。また、この生成化合物のDMSO−d6中における核磁気共鳴スペクトル(1H−NMRおよび13C−MNR)をNMR(日本電子(株)社製:JNM−AL300およびJNM−ECA600)を用いて測定した。そして、ESI−MSのイオンピークおよびNMRの化学シフト値を文献値と比較した。この結果、特にNMRでのグルコースの各プロトン、炭素に帰属されるシグナル、アノメリックプロトン(1’’位)のカップリング定数(8.3Hz)およびグルコースの1位からフラボン骨格の3位へのHMBC(Hetero-Multiple-bond-Connectivity)が、3−O−グルコシルフラボン(flavone-3-β-O-glucopyranoside)の文献値とほぼ同等であった。よって、生成化合物は3−O−グルコシルフラボンであることが判明した。尚、参考のため、図1に生成化合物の13C−MNRスペクトル、測定値、及び3−O−グルコシルフラボンの文献値を示す。
【0034】
ここで、実施例1での原料化合物はフラボノールであるから、[化9]中の3位には水酸基が、5位、7位(R5、R7)並びに2’位、3’位、4’位(R2’、R3’、R4’)には水素が結合している。また、得られたグリコシル化フラボノイド化合物は3−O−グルコシルフラボンであるから[化10]中の3位がOR(R=グルコース)で、5位、7位(R5、R7)並びに2’位、3’位、4’位(R2’、R3’、R4’)は水素のままである。つまり、特定のカニンガメラ属による微生物変換を用いた本発明に係るフラボノイド化合物の製造方法によれば、保護基等を用いなくとも特定の3位の官能基([化9]中のOHの水素)のみを糖鎖(グルコース)に変換してグリコシル化し、その他の構造を変化させないことが分かる。
【実施例2】
【0035】
原料化合物を下記[表1]に示す、クエルセチン(quercetin)、フィセチン(fisetin)、モリン(morin)、ケムフェロール(kaempferol)、フラバノン(flavanone)とした以外は[実施例1]と同様の手順により、生成化合物をそれぞれ生成、採取した。
【0036】
これら5種の生成化合物をそれぞれシリカゲル薄層クロマトグラフィーによりグリコシル体へと変換されているかを確認した。また、これら5種の生成化合物を水に溶解させた後、塩酸でpH2に調整のうえ80℃で約16時間加水分解した。これを水酸化ナトリウム水溶液で中和後、グルコースオキシダーゼを用いた酵素法によるグルコース測定キット(F−キット、JKインターナショナル社)で測定し、グルコースの結合の有無を確認した。
【0037】
この結果、表1に示すように、本例で用いた変換菌としてのカニンガメラ・エキヌラータは、[実施例1]のフラボノールに加え、ケムフェロール、フラバノンの原料化合物に対してもグリコシル化(本例ではグルコシル化)を効率良く行うことが判明した。また、フィセチン、モリンに対しても一定のグリコシル化(グルコシル化)を示した。
【0038】
【表1】

尚、実施例2においても3位の官能基のみをグルコースで置換してグリコシル化し、その他の構造を変化させることはない。
【0039】
また、培地組成の炭素源であるグルコースを、グルクロン酸、ガラクトース、マンノースとすれば、グリコシル化フラボノイド化合物としてグルクロン酸が結合したフラボノール、フラボノールのガラクトシル体、フラボノールのマンノシル体がそれぞれ生成される。さらに、原料化合物を仮にフラバノンやケムフェロール等の第1のフラボノイド化合物とすれば、得られるグリコシル化フラボノイド化合物はフラバノンや第1のフラボノイド化合物の3位にグルクロン酸、ガラクトース、マンノースが結合したものとなる。
【0040】
以上のことから、本発明に係る第一の形態のフラボノイド化合物の製造方法によれば、変換菌を所定の炭素源及び原料化合物を含有する培地で培養するだけで、グリコシル化フラボノイド化合物を製造可能であることがわかる。
【0041】
次に、本発明に係る第二の形態のフラボノイド化合物の製造方法を説明する。第二の形態のフラボノイド化合物の製造方法は、変換菌を糖類を含有する培地で培養し、その培養した変換菌の培養菌体、もしくはこの培養菌体の菌体破砕物、もしくはこの培養菌体(の菌体破砕物)から抽出した酵素抽出液、を分離した上で原料化合物と接触させてグリコシル化フラボノイド化合物を製造するものである。
【0042】
第二の形態のフラボノイド化合物の製造方法は、先ず、第一の形態のフラボノイド化合物の製造方法と同様にして、変換菌を糖類を含む培地でグリコシル化能が高くなるまで培養する。このとき、培地に少量の原料化合物を添加しても良い。次に、変換菌の集菌を行う。変換菌の集菌は培養物に対する遠心分離や濾過等の既知の方法によって行う。集菌された培養菌体は、生理食塩水、緩衝液等で洗浄して使用することが好ましい。
【0043】
また、菌体破砕物の取得は、集菌した培養菌体を水性媒体、例えばpH5〜9のリン酸緩衝液に懸濁させ、磨砕や超音波処理等の既知の手法により行う。さらに、酵素抽出液の取得は、上記の菌体破砕物に対し遠心分離等の物理的手法、有機溶媒、界面活性剤、酵素処理等による科学的手法等を施すことにより行う。
【0044】
これらの培養菌体、菌体破砕物、酵素抽出液と原料化合物とを接触させてグリコシル化フラボノイド化合物を製造する場合、例えば培養菌体もしくは菌体破砕物もしくは酵素抽出液と原料化合物とを20℃〜45℃、好適には25℃〜30℃の水性媒体中、例えばpH5〜9のリン酸緩衝液中で混合することにより行う。原料化合物の濃度は、培養時の培地に対して0.01%〜5.0%が好ましい。また、変換反応時間は、原料化合物の濃度、反応温度等にもよるが、通常は1〜5日位である。
【0045】
このようにして製造された生成化合物は、第一の形態のフラボノイド化合物の製造方法で示したような既知の方法で採取、分離、精製される。
【実施例3】
【0046】
[実施例1]と同様にして変換菌の培養を行った。次に、培地を濾過して培養菌体を分離、取得した。取得した培養菌体4gを1/15Mのリン酸緩衝液(pH7.0)で2回洗浄した後、同リン酸緩衝液8mlに懸濁させた。これを氷冷したのち乳鉢で磨砕し培養菌体の菌体破砕物を取得した。この菌体破砕物を2000×g(g:重力加速度9.8m/s2)で15分間遠心分離し、その上澄液を採取して酵素抽出液とした。この酵素抽出液に原料化合物としてのフラボノールを5%のジメチルスルホキシドに溶解した上で、酵素抽出液に対して約0.1%となるように添加し、酵素抽出液中の変換酵素と接触させた。これを、温度28℃、210rpmの条件で24時間振とうした。次に[実施例1]と同様にして、振とう後の縣濁液から生成化合物を採取した。この生成化合物をシリカゲル薄層クロマトグラフィーにより確認した。その結果、フラボノールのグリコシル体が確認された。
【0047】
上記の第二の形態のフラボノイド化合物の製造方法では、先ず変換菌の培養時にUDP化した糖と変換酵素とを生成させる。次に、このUDP化した糖と変換酵素とを培地から分離した上で原料化合物と接触させてグリコシル化フラボノイド化合物を製造する。よって、第二の形態のフラボノイド化合物の製造方法では、培地に関与する不純物を除去した環境でグリコシル化フラボノイド化合物の製造を行うことができる。さらに、酵素抽出液を用いれば培地に関与する不純物に加え変換菌の菌体に関与する不純物を除去した環境でグリコシル化フラボノイド化合物の製造を行うことができる。従って、変換反応時の不純物による悪影響を低減することができる。
【0048】
尚、本例では酵素抽出液を原料化合物に接触させる例を示したが、培養菌体もしくは菌体破砕物を用いても同様にグリコシル化フラボノイド化合物を製造することができる。
【0049】
また、本例では糖類としてグルコース、原料化合物としてフラボノールを用いた例を示したが、グリコシル化フラボノイド化合物の製造原理は第一の形態のフラボノイド化合物の製造方法と同等であるため、培養時に添加した糖類を仮にグルクロン酸、ガラクトース、マンノースとすれば、得られるグリコシル化フラボノイド化合物はグルクロン酸、ガラクトース、マンノースがそれぞれ結合したものとなる。また、原料化合物を仮にフラバノンやケムフェロール等の第1のフラボノイド化合物とすれば、得られるグリコシル化フラボノイド化合物はフラバノンや第1のフラボノイド化合物の3位に培養時に添加した糖類の糖鎖が結合したものとなる。
【0050】
次に、本発明に係る第三の形態のフラボノイド化合物の製造方法を説明する。第三の形態のフラボノイド化合物の製造方法は、第二の形態のフラボノイド化合物の製造方法と同様、先ず変換菌の培養菌体もしくは培養菌体の菌体破砕物もしくは培養菌体から抽出した酵素抽出液、を取得する。そして、培養菌体もしくは菌体破砕物もしくは酵素抽出液に別途製造されたUDP化した糖類を加えた上で原料化合物と接触させる。これにより、原料化合物をグリコシル化してグリコシル化フラボノイド化合物を製造する。
【0051】
前述の第一の形態及び第二の形態のフラボノイド化合物の製造方法では、変換菌が生成したUDP化した糖を用いてグリコシル化フラボノイド化合物を製造する。このため、グリコシル化フラボノイド化合物の量は変換菌が生成したUDP化した糖の量に左右される。しかし、第三の形態のフラボノイド化合物の製造方法では、人工的に別途作製されたUDP化した糖を使用するため、より安定してグリコシル化フラボノイド化合物の製造を行うことができる。
【実施例4】
【0052】
[実施例3]と同様にして酵素抽出液を取得した。この酵素抽出液1mlを18mm径の試験管に入れ、ウリジンヌクレオチド二リン酸グルコース(UDP−Glc)を最終濃度100mMとなるよう添加した。また、フラボノールを5%のジメチルスルホキシド溶液を用いて最終濃度で0.1%になるように添加した。これを振とうしながら28℃で24時間保持した後、[実施例1]と同様にして生成化合物を採取した。これにより、生成化合物0.05mgが取得された。この生成化合物をシリカゲル薄層クロマトグラフィーにより分析した結果、フラボノールのグルコシル体を確認した。さらに、この生成化合物の構造を質量スペクトル(ESI−MS)および核磁気共鳴スペクトル(1H−NMRおよび13C−MNR)により確認したところ、生成化合物は3’-β-O-グルコピラノシル-フラボンであることを確認した。尚、生成化合物中には原料化合物であるフラボノールが残存していた。
【0053】
尚、[実施例4]では、酵素抽出液とウリジンヌクレオチド二リン酸グルコースとを用いた例を示したが、培養菌体もしくは菌体破砕物を用いても同様にグリコシル化フラボノイド化合物を製造することができる。また、添加物質であるウリジンヌクレオチド二リン酸グルコースを、ウリジン二リン酸グルクロン酸、ウリジンヌクレオチド二リン酸ガラクトース、ウリジンヌクレオチド二リン酸マンノースとすれば、グリコシル化フラボノイド化合物として、グルクロン酸が結合したフラボノール、フラボノールのガラクトシル体、フラボノールのマンノシル体がそれぞれ生成される。さらに、原料化合物を仮にフラバノンやケムフェロール等の第1のフラボノイド化合物とすれば、得られるグリコシル化フラボノイド化合物はフラバノンや第1のフラボノイド化合物がグリコシル化されたものとなる。
【0054】
以上のように、本発明に係るフラボノイド化合物の製造方法によれば、カニンガメラ属に属する微生物による微生物変換を用いることで、比較的多くの量のグリコシル化したフラボノイド化合物を低コストで製造することが可能となる。また、本願発明に用いるカニンガメラ属に属する微生物は、フラボノイド化合物の3位の官能基を糖鎖で置換してグリコシル化するため、保護基等の脱着が必要なく容易にグリコシル化したフラボノイド化合物を製造することができる。さらに、本発明に係るフラボノイド化合物の製造方法は微生物変換を用いており、常温常圧、中性付近でグリコシル化したフラボノイド化合物を製造することができるため、製造装置の構成を単純化することができる。
【0055】
尚、上記の例は本願の好適な一例であるから、使用する添加物、添加方法、培養方法、培養条件、変換反応時の条件、生成物の分離、採取、精製方法、その他条件等は、上記の例に限定されるものではない。また、本例では実験レベルの比較的小規模の設備による製造方法の例を示したが、装置規模を大型化すればグリコシル化したフラボノイド化合物をある程度大量に製造することも可能である。さらに、本発明は本発明の要旨を逸脱しない範囲で変更して実施することが可能である。
【技術分野】
【0001】
本発明は、微生物変換を用いてグリコシル化したフラボノイド化合物を製造するフラボノイド化合物の製造方法に関するものである。
【背景技術】
【0002】
フラボノイド化合物は植物界に多く存在し、代表的な天然化合物の一群である。フラボノイド化合物は現在3000種以上が知られ、その多様性と多面的な生理活性から注目を集めている。これらの具体的な報告例としてはカテキン類の抗菌活性、ポリフェノール類の抗酸化作用などが挙げられる。また、植物の花色や青果物の色を決定する色素として重要なアントシアン類もこのフラボノイド化合物群に属し、水酸基の数や位置によって多様な色を呈する。このように、フラボノイド化合物は薬理作用、抗菌作用、食品への機能性の付与等、様々なものへの応用が期待されている。
【0003】
これら応用が期待されているフラボノイド化合物群のひとつとして、糖鎖が結合しているグリコシル化したフラボノイド化合物がある。グリコシル化したフラボノイド化合物はこれ自体が抗菌活性および生活習慣病予防のための各種生理活性を有しているほか、他のフラボノイド化合物等の合成中間体としても期待されている。
【0004】
ただし、ある特定のフラボノイド化合物を医薬品(医薬部外品)や食品に応用するためには、そのフラボノイド化合物に対する薬効や安全性評価等の生物評価を行わなければならない。この生物評価のためには目的のフラボノイド化合物がある程度の量必要である。しかしながら、目的のフラボノイド化合物が基本的なフラボノイド化合物の類縁体である場合、この類縁体のみを化学合成することは困難な場合が多い。上記のグリコシル化したフラボノイド化合物もこの化学合成が困難なものに属し、例えば、下記[化10]のフラボノイド化合物を化学的方法で合成する場合、比較的容易に入手できる下記[化9]のフラボノイド化合物を出発原料として、[化9]のフラボノイド化合物の7位の水酸基以外の官能基に保護基を付けた上で7位の水酸基のみを糖鎖と置換してグリコシル化を行い、その後、保護基を除去するなどの操作が必要となる。このような複雑な反応工程が必要では、化学的方法によるグリコシル化したフラボノイド化合物の製造の実用化は、技術面及びコスト面から困難であると考えられる。
【0005】
ところで、微生物変換は微生物菌体またはその培養物に基となる化合物を接触させることによって当該化合物を変換する方法であり、水酸化をはじめ還元、加水分解、スルホン酸化、グリコシル化など多くの反応が可能であることが知られている。また、この微生物変換は、常温常圧、中性付近で反応が進行することが多いため環境負荷が小さいこと、基質の部位特異性や立体特異的に優れ、反応に際して保護基が不要であることなどの点で優れている。
【0006】
ここで、下記[非特許文献1]には、カニンガメラ属の微生物変換によるスルホン酸化の例が、また下記[非特許文献2]には、コムギの根毛を用いたフラボノールのグルコシル化の例がそれぞれ記載されている。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Chem.Pharm.Bull.56巻、1253〜1258頁(2008年)
【非特許文献2】Biosci.Biotechnol.Biochem.68巻、2032〜2039頁(2004年)
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、[非特許文献2]によるコムギの根毛を用いたフラボノールのグルコシル化では得られる量が極めて微量であり、生物評価等に使用できるほどの量を得ることができない。
【0009】
本発明は上記事情に鑑みて成されたものであり、カニンガメラ属の微生物による微生物変換を用いてグリコシル化したフラボノイド化合物を低コストで効率良く製造する製造方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
(1)化5の一般式に示す第1のフラボノイド化合物を化6の一般式に示す第2のフラボノイド化合物にグリコシル化するカニンガメラ属(genus Cunninghamella)に属する微生物を前記第1のフラボノイド化合物と糖類とを含有する培地で培養する、または、糖類を含有する培地で培養した前記微生物の培養菌体もしくは当該培養菌体の菌体破砕物もしくは当該培養菌体から抽出した酵素抽出液を前記第1のフラボノイド化合物と接触させることで、前記第1のフラボノイド化合物を第2のフラボノイド化合物にグリコシル化し、
当該第2のフラボノイド化合物を採取することを特徴とするフラボノイド化合物の製造方法を提供することにより、上記課題を解決する。
【0011】
【化5】

【0012】
【化6】

(但し、[化5]、[化6]のR5、R7、R2’、R3’、R4’ は水素または水酸基であり、[化6]のRはグルコースまたはグルクロン酸またはガラクトースまたはマンノースである。)
(2)化5の一般式に示す第1のフラボノイド化合物を化6の一般式に示す第2のフラボノイド化合物にグリコシル化するカニンガメラ属(genus Cunninghamella)に属する微生物の培養菌体もしくは当該培養菌体の菌体破砕物もしくは当該培養菌体から抽出した酵素抽出液を前記第1のフラボノイド化合物及びウリジンヌクレオチド二リン酸グルコースまたはウリジン二リン酸グルクロン酸またはウリジンヌクレオチド二リン酸ガラクトースまたはウリジンヌクレオチド二リン酸マンノースと接触させることで、前記第1のフラボノイド化合物を第2のフラボノイド化合物にグリコシル化し、
当該第2のフラボノイド化合物を採取することを特徴とするフラボノイド化合物の製造方法を提供することにより、上記課題を解決する。
(3)化7の一般式に示すフラバノンを化8の一般式に示す第3のフラボノイド化合物にグリコシル化するカニンガメラ属(genus Cunninghamella)の微生物をフラバノンと糖類とを含有する培地で培養する、または、糖類を含有する培地で培養した前記微生物の培養菌体もしくは当該培養菌体の菌体破砕物もしくは当該培養菌体から抽出した酵素抽出液をフラバノンと接触させることで、当該フラバノンを第3のフラボノイド化合物にグリコシル化し、
当該第3のフラボノイド化合物を採取することを特徴とするフラボノイド化合物の製造方法を提供することにより、上記課題を解決する。
【0013】
【化7】

【0014】
【化8】

(但し、[化8]のRはグルコースまたはグルクロン酸またはガラクトースまたはマンノースである。)
(4)化7の一般式に示すフラバノンを化8の一般式に示す第3のフラボノイド化合物にグリコシル化するカニンガメラ属(genus Cunninghamella)の微生物の培養菌体もしくは当該培養菌体の菌体破砕物もしくは当該培養菌体から抽出した酵素抽出液をフラバノン及びウリジンヌクレオチド二リン酸グルコースまたはウリジン二リン酸グルクロン酸またはウリジンヌクレオチド二リン酸ガラクトースまたはウリジンヌクレオチド二リン酸マンノースと接触させることで、当該フラバノンを第3のフラボノイド化合物にグリコシル化し、
当該第3のフラボノイド化合物を採取することを特徴とするフラボノイド化合物の製造方法を提供することにより、上記課題を解決する。
【発明の効果】
【0015】
本発明に係るフラボノイド化合物の製造方法は、カニンガメラ属の微生物による微生物変換を用いることにより、グリコシル化したフラボノイド化合物を低コストで効率良く製造することができる。
【図面の簡単な説明】
【0016】
【図1】本発明により製造されたフラボノイド化合物の同定結果を示す図である。
【発明を実施するための形態】
【0017】
本発明に係るフラボノイド化合物の製造方法の実施の形態について詳細に説明する。
【0018】
先ず、本発明に係るフラボノイド化合物の製造方法の原理について簡単に説明する。本願発明者はある特定のカニンガメラ属(genus Cunninghamella)に属する微生物が、代謝等の生体反応により糖類をウリジンヌクレオチド二リン酸化(UDP化)するとともに、UDP化した糖類(の糖鎖)とフラボノイド化合物の特定位置の官能基(の水素)とを置換する酵素(以後、変換酵素とする。)を生成することを見出した。本発明に係るフラボノイド化合物の製造方法は、この特定のカニンガメラ属に属する微生物を用いて原材料となるフラボノイド化合物をグリコシル化し、目的となるグリコシル化したフラボノイド化合物の製造を行うものである。
【0019】
ここで、特定のカニンガメラ属に属する具体的な微生物としては、Cunninghamella
echinulata(カニンガメラ・エキヌラータ)、C. bainieri(カニンガメラ・バイニエリ)、C. blakesleeana(カニンガメラ・ブラケスリーアナ)、C.elegans(カニンガメラ・エレガンス)等が挙げられる。中でも特に、公的な菌株分譲機関に保存された菌株であるCunninghamella echinulata CBS 596. 68 の使用が最も好ましい。ただし、カニンガメラ属等の糸状菌の諸性質は一定したものでなく、自然的、人工的に容易に変化することは周知のとおりである。よって、本発明で使用しうるカニンガメラ属の微生物は上記のものに限定されるわけではなく、カニンガメラ属に属し[化9]の第1のフラボノイド化合物もしくは[化11]のフラバノンを[化10]の第2のフラボノイド化合物もしくは[化12]の第3のフラボノイド化合物へ変換し得る菌株すべてを包含するものとする。
【0020】
【化9】

【0021】
【化10】

(但し、[化9]、[化10]のR5、R7、R2’、R3’、R4’ は水素または水酸基であり、[化10]のRはグルコースまたはグルクロン酸またはガラクトースまたはマンノースである。)
【0022】
【化11】

【0023】
【化12】

(但し、[化12]のRはグルコースまたはグルクロン酸またはガラクトースまたはマンノースである。)
尚、以後の記載では本発明に用いるカニンガメラ属の微生物を変換菌と記述する。また、第1のフラボノイド化合物及びフラバノンを原料化合物と記述する。また、本願の製造方法により得られる生成物は、必ずしも全てが第2、第3のフラボノイド化合物となるわけではない。従って基本的に、本発明に係るフラボノイド化合物の製造方法によって得られた生成物を生成化合物と記述し、生成化合物に含まれる上記の第2、第3のフラボノイド化合物をグリコシル化フラボノイド化合物と記述するものとする。
【0024】
変換菌を培養する培地は、通常微生物が利用出来る栄養物を含有するものを使用することができる。例えば炭素源(糖類)としては、グルコース、グルクロン酸、ガラクトース、マンノース、シュクロース、マルトース、乳糖、デンプン、グリセリン、水飴、糖蜜、大豆油等の一般の放線菌の培養に使用する炭素源が使用可能である。また、窒素源としては、大豆粉、小麦はい芽、肉粉、魚粉、肉エキス、ペプトン、コーンステイープリカー、乾燥酵母、硝酸アンモニウムなどのアンモニウム塩等が使用可能である。その他、必要に応じて、食塩、塩化カリウム、炭酸カルシウム、リン酸塩等の無機塩、変換菌の発育を助けるとともに変換酵素の生産を促進する添加物、例えば酵母エキスや麦芽エキス等を適宜組み合わせても良い。
【0025】
尚、培地に使用する炭素源にグルコースのみを用いれば、得られるグリコシル化フラボノイド化合物([化10]、[化12])のRはグルコースとなり、グルクロン酸、ガラクトース、マンノースのみを炭素源に用いれば、得られるグリコシル化フラボノイド化合物([化10]、[化12])のRはそれぞれグルクロン酸、ガラクトース、マンノースとなる。また、その他の炭素源もしくは複数種の糖類が混合した炭素源を用いる場合には、その炭素源中に存在するもしくは培養中に生じたグルコース、グルクロン酸、ガラクトース、マンノース等の量に応じて、[化10]、[化12]中のRの異なるグリコシル化フラボノイド化合物が生成され、生成化合物はそれらの混合物となる。このことは、UDP化した糖類を添加する後述の第三の形態のフラボノイド化合物の製造方法以外は基本的に同じである。尚、炭素源中のグルコース、グルクロン酸、ガラクトース、マンノースの混合比と、得られるグリコシル化フラボノイド化合物のそれぞれの混合比とは必ずしも一致しない。
【0026】
また、天然のフラボノイド化合物は植物由来である場合が多く、このような植物由来のフラボノイド化合物は多種の類縁したフラボノイド化合物が種々の割合で混合している。そして、この混合したフラボノイド化合物のうち特定のフラボノイド化合物を単離して本願発明の原料化合物とすれば、この原料化合物に対しグリコシル化が行われる。また、フラボノイド化合物を混合物のまま原料化合物とすれば、それぞれのフラボノイド化合物に対しグリコシル化が行われ、得られる生成化合物もこれらのグリコシル化フラボノイド化合物の混合物となる。
【0027】
次に、本発明に係る第一の形態のフラボノイド化合物の製造方法を説明する。第一の形態のフラボノイド化合物の製造方法は、変換菌を原料化合物と糖類とを含有する培地で培養することで、グリコシル化フラボノイド化合物を製造するものである。尚、原料化合物の添加は培養当初から行うのではなく、ある程度変換菌を培養した後に行うことが好ましい。
【0028】
第一の形態のフラボノイド化合物の製造方法は、先ず、所定の糖類(炭素源)を含有する培地に変換菌を植菌し、好気的条件の下、培養温度20℃〜40℃、好適には23℃〜30℃、最適には28℃で所定の期間、変換菌の培養を行う。この培養期間は使用する変換菌の培養条件、特に培養装置、培地組成、培養温度等により異なるが、変換菌による変換酵素の生産能(これをグリコシル化能とする。)が高い時期がよく、通常は変換菌の培養開始後1日〜5日経過した時点が好ましい。この培養の期間中、変換菌は増殖しながら糖類をUDP化するとともに変換酵素を生成、蓄積する。
【0029】
次に、この培地に原料化合物を添加する。原料化合物の添加量は、培地に対して0.01%〜5.0%、好ましくは0.025%〜2.0%である。尚、本願中の%は基本的にg/100mlとする。原料化合物添加後の変換菌の培養は、好気的条件下で上記と同様の培養温度で行なう。培養期間は、原料化合物の添加後1〜8日程度である。この培養期間中にも変換菌は糖類をUDP化するとともに変換酵素を生成する。そして、生成された変換酵素はUDP化した糖類の糖鎖と原料化合物の特定位置の官能基とを変換してグリコシル化し、グリコシル化フラボノイド化合物を製造する。
【0030】
グリコシル化の変換反応終了後、グリコシル化フラボノイド化合物を含む生成化合物は培地から既知の方法で採取、分離、精製される。例えば、培地を濾過し、得られた濾液を酢酸エチルのような水と混和しにくい有機溶媒で抽出し、抽出液から溶媒を留去した後、得られた粗生成化合物をシリカゲル、アルミナ、セパビーズ(三菱化学)等を用いたカラムクロマトグラフィーに付し、適切な溶離剤で溶出することによってグリコシル化フラボノイド化合物を分離、精製する。
【実施例1】
【0031】
500ml容三角フラスコ2本に次の組成の培地80mlをそれぞれ入れ、変換菌としてカニンガメラ・エキヌラータ(C.echinulata CBS596. 68)を植菌した(培地組成:溶媒 蒸留水(pH無修正)、D−グルコース5.0%、ポリペプトン(日本製薬)0.5%、酵母エキス(Bacto)0.3%)。これを、2日間、培養温度28℃、210rpmの条件で振とう培養し、変換菌の培養を行った。次に、原料化合物としてのフラボノール(3-hydroxyflavone)40mgをジメチルスルホキシド(DMSO)0.8mlに溶解したものをそれぞれの培地に添加し、更に8日間、培養温度28℃、210rpmの条件で振とう培養した。
【0032】
培養終了後、培養液を酢酸エチル80mlで2回抽出し、この抽出液を無水硫酸ナトリウムで乾燥したのち濃縮した。この濃縮物をセパビーズSP70(三菱化学)カラムに吸着、洗浄後、100%メタノールで溶出することにより精製した。これにより原料化合物80mgに対し生成化合物40mgを採取した。
【0033】
この生成化合物を酢酸エチルを展開溶媒としたシリカゲル薄層クロマトグラフィー(分析条件 シリカゲル薄層:メルク社40mm×100mm、溶媒:100%酢酸エチル、検出方法:ヨウ素またはアンスロン硫酸(1%/75%硫酸)噴霧による検出)により確認した。その結果、フラボノールの3−O−グルコシル体が確認された。尚、原料化合物であるフラボノールはほとんど確認できなかった。またこの生成化合物の質量スペクトルをESI−MS(日本電子(株)社製:HX−110)を用いて測定した。また、この生成化合物のDMSO−d6中における核磁気共鳴スペクトル(1H−NMRおよび13C−MNR)をNMR(日本電子(株)社製:JNM−AL300およびJNM−ECA600)を用いて測定した。そして、ESI−MSのイオンピークおよびNMRの化学シフト値を文献値と比較した。この結果、特にNMRでのグルコースの各プロトン、炭素に帰属されるシグナル、アノメリックプロトン(1’’位)のカップリング定数(8.3Hz)およびグルコースの1位からフラボン骨格の3位へのHMBC(Hetero-Multiple-bond-Connectivity)が、3−O−グルコシルフラボン(flavone-3-β-O-glucopyranoside)の文献値とほぼ同等であった。よって、生成化合物は3−O−グルコシルフラボンであることが判明した。尚、参考のため、図1に生成化合物の13C−MNRスペクトル、測定値、及び3−O−グルコシルフラボンの文献値を示す。
【0034】
ここで、実施例1での原料化合物はフラボノールであるから、[化9]中の3位には水酸基が、5位、7位(R5、R7)並びに2’位、3’位、4’位(R2’、R3’、R4’)には水素が結合している。また、得られたグリコシル化フラボノイド化合物は3−O−グルコシルフラボンであるから[化10]中の3位がOR(R=グルコース)で、5位、7位(R5、R7)並びに2’位、3’位、4’位(R2’、R3’、R4’)は水素のままである。つまり、特定のカニンガメラ属による微生物変換を用いた本発明に係るフラボノイド化合物の製造方法によれば、保護基等を用いなくとも特定の3位の官能基([化9]中のOHの水素)のみを糖鎖(グルコース)に変換してグリコシル化し、その他の構造を変化させないことが分かる。
【実施例2】
【0035】
原料化合物を下記[表1]に示す、クエルセチン(quercetin)、フィセチン(fisetin)、モリン(morin)、ケムフェロール(kaempferol)、フラバノン(flavanone)とした以外は[実施例1]と同様の手順により、生成化合物をそれぞれ生成、採取した。
【0036】
これら5種の生成化合物をそれぞれシリカゲル薄層クロマトグラフィーによりグリコシル体へと変換されているかを確認した。また、これら5種の生成化合物を水に溶解させた後、塩酸でpH2に調整のうえ80℃で約16時間加水分解した。これを水酸化ナトリウム水溶液で中和後、グルコースオキシダーゼを用いた酵素法によるグルコース測定キット(F−キット、JKインターナショナル社)で測定し、グルコースの結合の有無を確認した。
【0037】
この結果、表1に示すように、本例で用いた変換菌としてのカニンガメラ・エキヌラータは、[実施例1]のフラボノールに加え、ケムフェロール、フラバノンの原料化合物に対してもグリコシル化(本例ではグルコシル化)を効率良く行うことが判明した。また、フィセチン、モリンに対しても一定のグリコシル化(グルコシル化)を示した。
【0038】
【表1】

尚、実施例2においても3位の官能基のみをグルコースで置換してグリコシル化し、その他の構造を変化させることはない。
【0039】
また、培地組成の炭素源であるグルコースを、グルクロン酸、ガラクトース、マンノースとすれば、グリコシル化フラボノイド化合物としてグルクロン酸が結合したフラボノール、フラボノールのガラクトシル体、フラボノールのマンノシル体がそれぞれ生成される。さらに、原料化合物を仮にフラバノンやケムフェロール等の第1のフラボノイド化合物とすれば、得られるグリコシル化フラボノイド化合物はフラバノンや第1のフラボノイド化合物の3位にグルクロン酸、ガラクトース、マンノースが結合したものとなる。
【0040】
以上のことから、本発明に係る第一の形態のフラボノイド化合物の製造方法によれば、変換菌を所定の炭素源及び原料化合物を含有する培地で培養するだけで、グリコシル化フラボノイド化合物を製造可能であることがわかる。
【0041】
次に、本発明に係る第二の形態のフラボノイド化合物の製造方法を説明する。第二の形態のフラボノイド化合物の製造方法は、変換菌を糖類を含有する培地で培養し、その培養した変換菌の培養菌体、もしくはこの培養菌体の菌体破砕物、もしくはこの培養菌体(の菌体破砕物)から抽出した酵素抽出液、を分離した上で原料化合物と接触させてグリコシル化フラボノイド化合物を製造するものである。
【0042】
第二の形態のフラボノイド化合物の製造方法は、先ず、第一の形態のフラボノイド化合物の製造方法と同様にして、変換菌を糖類を含む培地でグリコシル化能が高くなるまで培養する。このとき、培地に少量の原料化合物を添加しても良い。次に、変換菌の集菌を行う。変換菌の集菌は培養物に対する遠心分離や濾過等の既知の方法によって行う。集菌された培養菌体は、生理食塩水、緩衝液等で洗浄して使用することが好ましい。
【0043】
また、菌体破砕物の取得は、集菌した培養菌体を水性媒体、例えばpH5〜9のリン酸緩衝液に懸濁させ、磨砕や超音波処理等の既知の手法により行う。さらに、酵素抽出液の取得は、上記の菌体破砕物に対し遠心分離等の物理的手法、有機溶媒、界面活性剤、酵素処理等による科学的手法等を施すことにより行う。
【0044】
これらの培養菌体、菌体破砕物、酵素抽出液と原料化合物とを接触させてグリコシル化フラボノイド化合物を製造する場合、例えば培養菌体もしくは菌体破砕物もしくは酵素抽出液と原料化合物とを20℃〜45℃、好適には25℃〜30℃の水性媒体中、例えばpH5〜9のリン酸緩衝液中で混合することにより行う。原料化合物の濃度は、培養時の培地に対して0.01%〜5.0%が好ましい。また、変換反応時間は、原料化合物の濃度、反応温度等にもよるが、通常は1〜5日位である。
【0045】
このようにして製造された生成化合物は、第一の形態のフラボノイド化合物の製造方法で示したような既知の方法で採取、分離、精製される。
【実施例3】
【0046】
[実施例1]と同様にして変換菌の培養を行った。次に、培地を濾過して培養菌体を分離、取得した。取得した培養菌体4gを1/15Mのリン酸緩衝液(pH7.0)で2回洗浄した後、同リン酸緩衝液8mlに懸濁させた。これを氷冷したのち乳鉢で磨砕し培養菌体の菌体破砕物を取得した。この菌体破砕物を2000×g(g:重力加速度9.8m/s2)で15分間遠心分離し、その上澄液を採取して酵素抽出液とした。この酵素抽出液に原料化合物としてのフラボノールを5%のジメチルスルホキシドに溶解した上で、酵素抽出液に対して約0.1%となるように添加し、酵素抽出液中の変換酵素と接触させた。これを、温度28℃、210rpmの条件で24時間振とうした。次に[実施例1]と同様にして、振とう後の縣濁液から生成化合物を採取した。この生成化合物をシリカゲル薄層クロマトグラフィーにより確認した。その結果、フラボノールのグリコシル体が確認された。
【0047】
上記の第二の形態のフラボノイド化合物の製造方法では、先ず変換菌の培養時にUDP化した糖と変換酵素とを生成させる。次に、このUDP化した糖と変換酵素とを培地から分離した上で原料化合物と接触させてグリコシル化フラボノイド化合物を製造する。よって、第二の形態のフラボノイド化合物の製造方法では、培地に関与する不純物を除去した環境でグリコシル化フラボノイド化合物の製造を行うことができる。さらに、酵素抽出液を用いれば培地に関与する不純物に加え変換菌の菌体に関与する不純物を除去した環境でグリコシル化フラボノイド化合物の製造を行うことができる。従って、変換反応時の不純物による悪影響を低減することができる。
【0048】
尚、本例では酵素抽出液を原料化合物に接触させる例を示したが、培養菌体もしくは菌体破砕物を用いても同様にグリコシル化フラボノイド化合物を製造することができる。
【0049】
また、本例では糖類としてグルコース、原料化合物としてフラボノールを用いた例を示したが、グリコシル化フラボノイド化合物の製造原理は第一の形態のフラボノイド化合物の製造方法と同等であるため、培養時に添加した糖類を仮にグルクロン酸、ガラクトース、マンノースとすれば、得られるグリコシル化フラボノイド化合物はグルクロン酸、ガラクトース、マンノースがそれぞれ結合したものとなる。また、原料化合物を仮にフラバノンやケムフェロール等の第1のフラボノイド化合物とすれば、得られるグリコシル化フラボノイド化合物はフラバノンや第1のフラボノイド化合物の3位に培養時に添加した糖類の糖鎖が結合したものとなる。
【0050】
次に、本発明に係る第三の形態のフラボノイド化合物の製造方法を説明する。第三の形態のフラボノイド化合物の製造方法は、第二の形態のフラボノイド化合物の製造方法と同様、先ず変換菌の培養菌体もしくは培養菌体の菌体破砕物もしくは培養菌体から抽出した酵素抽出液、を取得する。そして、培養菌体もしくは菌体破砕物もしくは酵素抽出液に別途製造されたUDP化した糖類を加えた上で原料化合物と接触させる。これにより、原料化合物をグリコシル化してグリコシル化フラボノイド化合物を製造する。
【0051】
前述の第一の形態及び第二の形態のフラボノイド化合物の製造方法では、変換菌が生成したUDP化した糖を用いてグリコシル化フラボノイド化合物を製造する。このため、グリコシル化フラボノイド化合物の量は変換菌が生成したUDP化した糖の量に左右される。しかし、第三の形態のフラボノイド化合物の製造方法では、人工的に別途作製されたUDP化した糖を使用するため、より安定してグリコシル化フラボノイド化合物の製造を行うことができる。
【実施例4】
【0052】
[実施例3]と同様にして酵素抽出液を取得した。この酵素抽出液1mlを18mm径の試験管に入れ、ウリジンヌクレオチド二リン酸グルコース(UDP−Glc)を最終濃度100mMとなるよう添加した。また、フラボノールを5%のジメチルスルホキシド溶液を用いて最終濃度で0.1%になるように添加した。これを振とうしながら28℃で24時間保持した後、[実施例1]と同様にして生成化合物を採取した。これにより、生成化合物0.05mgが取得された。この生成化合物をシリカゲル薄層クロマトグラフィーにより分析した結果、フラボノールのグルコシル体を確認した。さらに、この生成化合物の構造を質量スペクトル(ESI−MS)および核磁気共鳴スペクトル(1H−NMRおよび13C−MNR)により確認したところ、生成化合物は3’-β-O-グルコピラノシル-フラボンであることを確認した。尚、生成化合物中には原料化合物であるフラボノールが残存していた。
【0053】
尚、[実施例4]では、酵素抽出液とウリジンヌクレオチド二リン酸グルコースとを用いた例を示したが、培養菌体もしくは菌体破砕物を用いても同様にグリコシル化フラボノイド化合物を製造することができる。また、添加物質であるウリジンヌクレオチド二リン酸グルコースを、ウリジン二リン酸グルクロン酸、ウリジンヌクレオチド二リン酸ガラクトース、ウリジンヌクレオチド二リン酸マンノースとすれば、グリコシル化フラボノイド化合物として、グルクロン酸が結合したフラボノール、フラボノールのガラクトシル体、フラボノールのマンノシル体がそれぞれ生成される。さらに、原料化合物を仮にフラバノンやケムフェロール等の第1のフラボノイド化合物とすれば、得られるグリコシル化フラボノイド化合物はフラバノンや第1のフラボノイド化合物がグリコシル化されたものとなる。
【0054】
以上のように、本発明に係るフラボノイド化合物の製造方法によれば、カニンガメラ属に属する微生物による微生物変換を用いることで、比較的多くの量のグリコシル化したフラボノイド化合物を低コストで製造することが可能となる。また、本願発明に用いるカニンガメラ属に属する微生物は、フラボノイド化合物の3位の官能基を糖鎖で置換してグリコシル化するため、保護基等の脱着が必要なく容易にグリコシル化したフラボノイド化合物を製造することができる。さらに、本発明に係るフラボノイド化合物の製造方法は微生物変換を用いており、常温常圧、中性付近でグリコシル化したフラボノイド化合物を製造することができるため、製造装置の構成を単純化することができる。
【0055】
尚、上記の例は本願の好適な一例であるから、使用する添加物、添加方法、培養方法、培養条件、変換反応時の条件、生成物の分離、採取、精製方法、その他条件等は、上記の例に限定されるものではない。また、本例では実験レベルの比較的小規模の設備による製造方法の例を示したが、装置規模を大型化すればグリコシル化したフラボノイド化合物をある程度大量に製造することも可能である。さらに、本発明は本発明の要旨を逸脱しない範囲で変更して実施することが可能である。
【特許請求の範囲】
【請求項1】
化1の一般式に示す第1のフラボノイド化合物を化2の一般式に示す第2のフラボノイド化合物にグリコシル化するカニンガメラ属(genus Cunninghamella)に属する微生物を前記第1のフラボノイド化合物と糖類とを含有する培地で培養する、または、糖類を含有する培地で培養した前記微生物の培養菌体もしくは当該培養菌体の菌体破砕物もしくは当該培養菌体から抽出した酵素抽出液を前記第1のフラボノイド化合物と接触させることで、前記第1のフラボノイド化合物を第2のフラボノイド化合物にグリコシル化し、
当該第2のフラボノイド化合物を採取することを特徴とするフラボノイド化合物の製造方法。
【化1】

【化2】

(但し、[化1]、[化2]のR5、R7、R2’、R3’、R4’ は水素または水酸基であり、[化2]のRはグルコースまたはグルクロン酸またはガラクトースまたはマンノースである。)
【請求項2】
化1の一般式に示す第1のフラボノイド化合物を化2の一般式に示す第2のフラボノイド化合物にグリコシル化するカニンガメラ属(genus Cunninghamella)に属する微生物の培養菌体もしくは当該培養菌体の菌体破砕物もしくは当該培養菌体から抽出した酵素抽出液を前記第1のフラボノイド化合物及びウリジンヌクレオチド二リン酸グルコースまたはウリジン二リン酸グルクロン酸またはウリジンヌクレオチド二リン酸ガラクトースまたはウリジンヌクレオチド二リン酸マンノースと接触させることで、前記第1のフラボノイド化合物を第2のフラボノイド化合物にグリコシル化し、
当該第2のフラボノイド化合物を採取することを特徴とするフラボノイド化合物の製造方法。
【請求項3】
化3の一般式に示すフラバノンを化4の一般式に示す第3のフラボノイド化合物にグリコシル化するカニンガメラ属(genus Cunninghamella)の微生物をフラバノンと糖類とを含有する培地で培養する、または、糖類を含有する培地で培養した前記微生物の培養菌体もしくは当該培養菌体の菌体破砕物もしくは当該培養菌体から抽出した酵素抽出液をフラバノンと接触させることで、当該フラバノンを第3のフラボノイド化合物にグリコシル化し、
当該第3のフラボノイド化合物を採取することを特徴とするフラボノイド化合物の製造方法。
【化3】

【化4】

(但し、[化4]のRはグルコースまたはグルクロン酸またはガラクトースまたはマンノースである。)
【請求項4】
化3の一般式に示すフラバノンを化4の一般式に示す第3のフラボノイド化合物にグリコシル化するカニンガメラ属(genus Cunninghamella)の微生物の培養菌体もしくは当該培養菌体の菌体破砕物もしくは当該培養菌体から抽出した酵素抽出液をフラバノン及びウリジンヌクレオチド二リン酸グルコースまたはウリジン二リン酸グルクロン酸またはウリジンヌクレオチド二リン酸ガラクトースまたはウリジンヌクレオチド二リン酸マンノースと接触させることで、当該フラバノンを第3のフラボノイド化合物にグリコシル化し、
当該第3のフラボノイド化合物を採取することを特徴とするフラボノイド化合物の製造方法。
【請求項1】
化1の一般式に示す第1のフラボノイド化合物を化2の一般式に示す第2のフラボノイド化合物にグリコシル化するカニンガメラ属(genus Cunninghamella)に属する微生物を前記第1のフラボノイド化合物と糖類とを含有する培地で培養する、または、糖類を含有する培地で培養した前記微生物の培養菌体もしくは当該培養菌体の菌体破砕物もしくは当該培養菌体から抽出した酵素抽出液を前記第1のフラボノイド化合物と接触させることで、前記第1のフラボノイド化合物を第2のフラボノイド化合物にグリコシル化し、
当該第2のフラボノイド化合物を採取することを特徴とするフラボノイド化合物の製造方法。
【化1】

【化2】

(但し、[化1]、[化2]のR5、R7、R2’、R3’、R4’ は水素または水酸基であり、[化2]のRはグルコースまたはグルクロン酸またはガラクトースまたはマンノースである。)
【請求項2】
化1の一般式に示す第1のフラボノイド化合物を化2の一般式に示す第2のフラボノイド化合物にグリコシル化するカニンガメラ属(genus Cunninghamella)に属する微生物の培養菌体もしくは当該培養菌体の菌体破砕物もしくは当該培養菌体から抽出した酵素抽出液を前記第1のフラボノイド化合物及びウリジンヌクレオチド二リン酸グルコースまたはウリジン二リン酸グルクロン酸またはウリジンヌクレオチド二リン酸ガラクトースまたはウリジンヌクレオチド二リン酸マンノースと接触させることで、前記第1のフラボノイド化合物を第2のフラボノイド化合物にグリコシル化し、
当該第2のフラボノイド化合物を採取することを特徴とするフラボノイド化合物の製造方法。
【請求項3】
化3の一般式に示すフラバノンを化4の一般式に示す第3のフラボノイド化合物にグリコシル化するカニンガメラ属(genus Cunninghamella)の微生物をフラバノンと糖類とを含有する培地で培養する、または、糖類を含有する培地で培養した前記微生物の培養菌体もしくは当該培養菌体の菌体破砕物もしくは当該培養菌体から抽出した酵素抽出液をフラバノンと接触させることで、当該フラバノンを第3のフラボノイド化合物にグリコシル化し、
当該第3のフラボノイド化合物を採取することを特徴とするフラボノイド化合物の製造方法。
【化3】

【化4】

(但し、[化4]のRはグルコースまたはグルクロン酸またはガラクトースまたはマンノースである。)
【請求項4】
化3の一般式に示すフラバノンを化4の一般式に示す第3のフラボノイド化合物にグリコシル化するカニンガメラ属(genus Cunninghamella)の微生物の培養菌体もしくは当該培養菌体の菌体破砕物もしくは当該培養菌体から抽出した酵素抽出液をフラバノン及びウリジンヌクレオチド二リン酸グルコースまたはウリジン二リン酸グルクロン酸またはウリジンヌクレオチド二リン酸ガラクトースまたはウリジンヌクレオチド二リン酸マンノースと接触させることで、当該フラバノンを第3のフラボノイド化合物にグリコシル化し、
当該第3のフラボノイド化合物を採取することを特徴とするフラボノイド化合物の製造方法。
【図1】




【公開番号】特開2011−41531(P2011−41531A)
【公開日】平成23年3月3日(2011.3.3)
【国際特許分類】
【出願番号】特願2009−192692(P2009−192692)
【出願日】平成21年8月24日(2009.8.24)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 発行者名 社団法人日本農芸化学会 刊行物名 日本農芸化学会2009年度(平成21年度)大会講演要旨集 該当ページ 第123ページ 発行日 平成21年3月5日
【出願人】(504237050)独立行政法人国立高等専門学校機構 (656)
【Fターム(参考)】
【公開日】平成23年3月3日(2011.3.3)
【国際特許分類】
【出願日】平成21年8月24日(2009.8.24)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 発行者名 社団法人日本農芸化学会 刊行物名 日本農芸化学会2009年度(平成21年度)大会講演要旨集 該当ページ 第123ページ 発行日 平成21年3月5日
【出願人】(504237050)独立行政法人国立高等専門学校機構 (656)
【Fターム(参考)】
[ Back to top ]

