ブルッカイト型酸化チタンの製造方法
【課題】優れた光触媒能を有するブルッカイト型酸化チタンの製造方法を提供する。
【解決手段】本発明のブルッカイト型酸化チタンの製造方法は、ヒドロキシカルボン酸チタン錯体を含有する水溶液に尿素を0.5〜8mol/L添加し、反応温度110℃〜220℃、その反応温度における飽和蒸気圧以上の圧力下、2時間以上水熱処理を施す水熱処理工程を有する。前記ヒドロキシカルボン酸チタン錯体としては、ペルオキソチタン酸錯体とヒドロキシカルボン酸を反応させて得られる化合物が好ましい。
【解決手段】本発明のブルッカイト型酸化チタンの製造方法は、ヒドロキシカルボン酸チタン錯体を含有する水溶液に尿素を0.5〜8mol/L添加し、反応温度110℃〜220℃、その反応温度における飽和蒸気圧以上の圧力下、2時間以上水熱処理を施す水熱処理工程を有する。前記ヒドロキシカルボン酸チタン錯体としては、ペルオキソチタン酸錯体とヒドロキシカルボン酸を反応させて得られる化合物が好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、本発明は、光触媒等として有用なブルッカイト型酸化チタンの製造方法、及び該製造方法により得られるブルッカイト型酸化チタンに関する。
【背景技術】
【0002】
酸化チタンには、アナターゼ型、ルチル型、ブルッカイト型の3種の結晶形態が存在する。なかでもブルッカイト型酸化チタンは、アナターゼ型、及びルチル型酸化チタンに比べて、より微弱な光でも高い光触媒能を発揮できるため特に有用である。
【0003】
ブルッカイト型酸化チタンの製造方法としては、原料チタン化合物をペルオキソ化した後、アミン類及び/又はアンモニアを添加してpHを特定の範囲に維持しながら水熱処理する方法等が知られている(特許文献1、2参照)。しかしながら、前記方法で得られるブルッカイト型酸化チタンは、光触媒能の点で必ずしも満足できるものではなかった。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2000−335919号公報
【特許文献2】特開2007−246301号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
従って、本発明の目的は、優れた光触媒能を有するブルッカイト型酸化チタンの製造方法を提供することにある。
本発明の他の目的は、優れた光触媒能を有するブルッカイト型酸化チタンを提供することにある。
さらに本発明の他の目的は、紫外線域から可視光線域までの広い波長範囲の光に対して優れた応答性を有し、太陽光や白熱灯、蛍光灯等の通常の生活空間における光を吸収して、強い酸化作用を発揮することができるブルッカイト型酸化チタンの製造方法を提供することにある。
さらにまた本発明の他の目的は、紫外線域から可視光線域までの広い波長範囲の光に対して優れた応答性を有し、太陽光や白熱灯、蛍光灯等の通常の生活空間における光を吸収して、強い酸化作用を発揮することができるブルッカイト型酸化チタンを提供することにある。
【課題を解決するための手段】
【0006】
本発明者等は、上記課題を解決するため鋭意検討した結果、原料チタン化合物をペルオキソ化した後、水熱処理する工程において、アミン類及び/又はアンモニアに代えて尿素を添加すると、反応系内で発生したアンモニアによって反応系内のpHを一定に調整することができ、安定化された錯体が緩やかに結晶化するため、極めて高い光触媒能を有するブルッカイト型酸化チタンを選択的に得ることができることを見いだした。本発明はこれらの知見に基づいて完成させたものである。
【0007】
すなわち、本発明はヒドロキシカルボン酸チタン錯体を含有する水溶液に尿素を0.5〜8mol/L添加し、反応温度110℃〜220℃、その反応温度における飽和蒸気圧以上の圧力下、2時間以上水熱処理を施す水熱処理工程を有するブルッカイト型酸化チタンの製造方法を提供する。
【0008】
前記ヒドロキシカルボン酸チタン錯体としては、ペルオキソチタン酸錯体とヒドロキシカルボン酸を反応させて得られる化合物が好ましく、例えば、ジヒドロキシビス(アンモニウムラクタト)チタン(IV)が好ましい。
【0009】
本発明のブルッカイト型酸化チタンの製造方法には、水熱処理工程を経て得られたブルッカイト型酸化チタンに、遷移金属イオンの担持を行う遷移金属イオン担持工程を設けることが好ましい。
【0010】
前記遷移金属イオンとしては三価の鉄イオンが好ましく、前記遷移金属イオンを、ブルッカイト型酸化チタンの酸化反応面に選択的に担持することが好ましく、励起光照射下で、ブルッカイト型酸化チタンに遷移金属イオンを担持することが好ましい。
【0011】
本発明は、また、前記ブルッカイト型酸化チタンの製造方法により得られるブルッカイト型酸化チタンを提供する。
【0012】
前記ブルッカイト型酸化チタンはアスペクト比[長辺/短辺(長さ)の比率]が2.5以上であることが好ましい。
【発明の効果】
【0013】
本発明に係るブルッカイト型酸化チタンの製造方法によれば、容易且つ選択的に、優れた光触媒能を有するブルッカイト型酸化チタンを得ることができる。特に、遷移金属イオンを担持する工程を経て得られたブルッカイト型酸化チタンは、紫外線域から可視光線域までの広い波長範囲の光に対して優れた応答性を有し、光を照射することにより極めて強い酸化作用を発揮することができる。そのため、太陽光や白熱灯、蛍光灯等の通常の生活空間における光を吸収して、有機物質を効率よく酸化することができ、大気の浄化、脱臭、浄水、抗菌、防汚等の目的に有用である。
【図面の簡単な説明】
【0014】
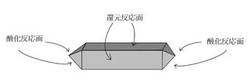
【図1】ブルッカイト型酸化チタンの酸化反応面及び還元反応面を示す概略図である。
【図2】実施例1で得られた酸化チタン(1)の走査型電子顕微鏡(SEM)写真(a)、及び透過型電子顕微鏡(TEM)写真(b)である。
【図3】実施例2で得られた酸化チタン(2)の走査型電子顕微鏡(SEM)写真(a)、及び透過型電子顕微鏡(TEM)写真(b)である。
【図4】比較例1で得られた酸化チタン(3)の走査型電子顕微鏡(SEM)写真(a)、及び透過型電子顕微鏡(TEM)写真(b)である。
【図5】実施例2で得られた酸化チタン(2)、比較例1で得られた酸化チタン(3)、及びアナターゼ型光触媒(商品名「ST−01」、石原産業(株)製)を光触媒として使用し、トルエンを酸化した際に生成したCO2濃度と紫外線照射量との関係を示す図である。
【発明を実施するための形態】
【0015】
本発明に係るブルッカイト型酸化チタンの製造方法は、ヒドロキシカルボン酸チタン錯体を含有する水性媒体に尿素を0.5〜8mol/Lとなるように添加し、反応温度110℃〜220℃、その反応温度における飽和蒸気圧以上の圧力下、2時間以上水熱処理を施す水熱処理工程を有する。
【0016】
[ヒドロキシカルボン酸チタン錯体]
本発明のヒドロキシカルボン酸チタン錯体は、ペルオキソチタン酸錯体と結晶制御剤としてのヒドロキシカルボン酸を反応させて得られる化合物である。ペルオキソチタン酸錯体は加水分解されやすいが、結晶制御剤としての作用を有するヒドロキシカルボン酸と反応すると、安定な錯化合物であるヒドロキシカルボン酸チタン錯体を形成することができる。
【0017】
(ペルオキソチタン酸錯体)
ペルオキソチタン酸錯体は、下記反応式(1)で表されるように、チタン化合物に過酸化水素とアンモニアを添加することにより得られる。
Ti+3H2O2+NH3→[Ti(OH)3O2]-+H2O+NH4+ (1)
【0018】
チタン化合物としては、例えば、3価のチタン化合物、4価のチタン化合物等を挙げることができる。
【0019】
3価のチタン化合物としては、例えば、三塩化チタンや三臭化チタン等のトリハロゲン化チタン等を挙げることができる。
【0020】
4価のチタン化合物としては、例えば、下記式(2)
Ti(OR)tX4-t (2)
(式中、Rは炭化水素基を示し、Xはハロゲン原子を示す。tは0〜3の整数を示す)
で表される化合物やアモルファス酸化チタン(TiO2)等を挙げることができる。
【0021】
式(2)中のRにおける炭化水素基としては、例えば、メチル、エチル、プロピル、イソプロピル、n−ブチル、sec−ブチル、tert−ブチル等のC1-4脂肪族炭化水素基等を挙げることができる。
【0022】
式(2)中のXにおけるハロゲン原子としては、塩素、臭素、ヨウ素等を挙げることができる。
【0023】
式(2)で表される4価のチタン化合物としては、例えば、TiCl4、TiBr4、TiI4等のテトラハロゲン化チタン;Ti(OCH3)Cl3、Ti(OC2H5)Cl3、Ti(OC4H9)Cl3、Ti(OC2H5)Br3、Ti(OC4H9)Br3等のトリハロゲン化アルコキシチタン;Ti(OCH3)2Cl2、Ti(OC2H5)2Cl2、Ti(OC4H9)2Cl2、Ti(OC2H5)2Br2等のジハロゲン化ジアルコキシチタン;Ti(OCH3)3Cl、Ti(OC2H5)3Cl、Ti(OC4H9)3Cl、Ti(OC2H5)3Br等のモノハロゲン化トリアルコキシチタン等を挙げることができる。
【0024】
本発明におけるチタン化合物としては、なかでも、より強い酸化作用を発揮することができる点で、4価のチタン化合物[なかでも、安価、且つ、入手が容易な点で、テトラハロゲン化チタン[特に四塩化チタン(TiCl4)]、及びアモルファス酸化チタンが好ましい]が好ましい。
【0025】
過酸化水素の添加量としては、例えば、チタン化合物の150〜5000重量%程度、好ましくは1500〜3000重量%程度である。また、アンモニアの添加量としては、例えば、チタン化合物の25〜500重量%程度、好ましくは150〜300重量%程度である。
【0026】
ペルオキソチタン酸錯体は、チタン化合物に上記範囲内の量の過酸化水素及びアンモニアを添加し、撹拌することにより製造することができる。過剰の過酸化水素及びアンモニアは、例えば、60℃で一晩加熱撹拌することにより分解することができる。
【0027】
(ヒドロキシカルボン酸)
ヒドロキシカルボン酸は、例えば下記式(3)で表される。
HO−R’−COOH (3)
(式中、R’は置換基を有していてもよい2価の脂肪族炭化水素基、2価の脂環式炭化水素基、又は2価の芳香族炭化水素基を示す)
【0028】
R’における2価の脂肪族炭化水素基としては、例えば、メチレン、エチレン、メチルエチレン、トリメチレン、1−メチルトリメチレン、2−メチルトリメチレン、2,2−ジメチルトリメチレン、テトラメチレン、ペンタメチレン、ヘキサメチレン、ヘプタメチレン、オクタメチレン、ノナメチレン、2,2,4−トリメチルヘキサメチレン、デカメチレン、ドデカメチレン基等の炭素数1〜18の直鎖状又は分岐鎖状アルキレン基;プロペニレン基等の炭素数2〜6程度のアルケニレン基;プロピニレン基等の炭素数2〜6程度のアルキニレン基等を挙げることができる。
【0029】
R’における2価の脂環式炭化水素基としては、例えば、シクロヘキシリデン、1,2−シクロペンチレン、1,2−シクロへキシレン、1,3−シクロへキシレン、1,4−シクロへキシレン等のシクロアルキレン基;2−シクロヘキセン−1,4−ジイル基等のシクロアルケニレン基;アダマンタン−1,3−ジイル基等の2価の橋かけ環式基等を挙げることができる。
【0030】
R’における2価の芳香族炭化水素基としては、例えば、1,2−フェニレン、1,3−フェニレン、1,4−フェニレン、1,4−ナフチレン、ビフェニレン基等を挙げることができる。
【0031】
R’が有していてもよい置換基としては、例えば、カルボキシル基、ヒドロキシル基、アミノ基、フェニル基等を挙げることができる。
【0032】
ヒドロキシカルボン酸の具体例としては、例えば、グリコール酸、乳酸、2−ヒドロキシ−n−酪酸、2−ヒドロキシイソ酪酸、酒石酸、リンゴ酸、クエン酸、イソクエン酸、グリセリン酸、メバロン酸、サリチル酸、没食子酸、シキミ酸等を挙げることができる。
【0033】
本発明におけるヒドロキシカルボン酸としては、カルボキシル基のα位又はβ位にヒドロキシル基を有する化合物が、より安定な錯化合物を形成することができる点で好ましく、特に、グリコール酸、乳酸、2−ヒドロキシ−n−酪酸、2−ヒドロキシイソ酪酸、リンゴ酸、酒石酸等のカルボキシル基のα位にヒドロキシル基を有する化合物が好ましい。
【0034】
ヒドロキシカルボン酸の使用量としては、例えば、ペルオキソチタン酸錯体の50〜150重量%程度、好ましくは75〜100重量%程度である。ヒドロキシカルボン酸の使用量が上記範囲を上回ると、ルチル相が結晶化して混在する傾向がある。一方、ヒドロキシカルボン酸の使用量が上記範囲を下回ると、アナターゼ相が結晶化して混在する傾向がある。
【0035】
本発明のヒドロキシカルボン酸チタン錯体は、下記式(4)で表される。
【化1】

(式中、R’は上記に同じ)
【0036】
ヒドロキシカルボン酸として、例えばグリコール酸(HO−CH2−COOH)を使用する場合は、ヒドロキシカルボン酸チタン錯体として、下記式(4-1)で表される化合物が得られる。
【化2】

【0037】
ヒドロキシカルボン酸として、例えば乳酸(CH3CHOH−COOH)を使用する場合は、ヒドロキシカルボン酸チタン錯体として、下記式(4-2)で表されるジヒドロキシビス(アンモニウムラクタト)チタン(IV)(=Titanium bis (ammonium lactato) dihydroxide)が得られる。
【化3】

【0038】
[水性媒体]
水熱処理の際に用いる水性媒体としては、例えば、水又は水と水溶性有機溶媒との混合液等を挙げることができる。前記水溶性有機溶媒としては、例えば、メタノール、エタノール等のアルコール;エチレングリコールジメチルエーテル等のエーテル;アセトン等のケトン;アセトニトリル等のニトリル;酢酸等のカルボン酸等を挙げることができる。水と水溶性有機溶媒との混合比率は、前者/後者(重量比)=10/90〜99.9/0.1、好ましくは50/50〜99/1程度である。本発明においては、なかでも有機溶媒の回収作業が不要な点で水を使用することが好ましい。
【0039】
水性媒体中のヒドロキシカルボン酸チタン錯体濃度(チタン換算)としては、例えば1.5〜17.0重量%程度(好ましくは2.5〜15.0重量%、特に好ましくは2.5〜8.0重量%)となる濃度であることが好ましい。水性媒体中のヒドロキシカルボン酸チタン錯体濃度(チタン換算)が上記範囲を上回ると、ルチル相が結晶化して混在する傾向がある。一方、水性媒体中のヒドロキシカルボン酸チタン錯体濃度(チタン換算)が上記範囲を下回ると、アナターゼ相が結晶化して混在する傾向がある。
【0040】
[水熱処理工程]
本発明の水熱処理工程では、ヒドロキシカルボン酸チタン錯体を含有する水溶液に尿素を0.5〜8mol/L添加し、反応温度110℃〜220℃、その反応温度における飽和蒸気圧以上の圧力下、2時間以上水熱処理を施すことを特徴とする。
【0041】
本発明においては、反応系内に、アンモニアを添加することなく、尿素を0.5〜8mol/L(好ましくは6〜8mol/L、特に好ましくは6.5〜8mol/L)添加し、反応系内でアンモニアを順次発生させ、発生したアンモニアによってヒドロキシカルボン酸チタン錯体を含有する水溶液のpHを調整するため、水熱処理工程の間、反応系内のpHを8〜14(好ましくは、10〜12)の範囲内でほぼ一定に調整することができる。それによって安定化された錯体が緩やかに結晶化するため、アスペクト比が大きいブルッカイト型酸化チタンを選択的に得ることができる。
【0042】
水熱処理時の反応温度は110℃〜220℃(好ましくは120℃〜220℃、特に好ましくは120℃〜200℃)である。水熱処理時の反応温度が上記範囲を上回ると、ルチル相が結晶化して混在する傾向がある。一方、水熱処理時の反応温度が上記範囲を下回ると、アナターゼ相が結晶化して混在する傾向がある。
【0043】
水熱処理は反応温度における飽和蒸気圧以上の圧力下(すなわち、密閉系で)行われる。水熱処理時の反応圧力(絶対圧)は、例えば、0.14MPa〜2.4MPa(好ましくは0.2MPa〜2.4MPa、特に好ましくは0.2MPa〜1.6MPa)である。
【0044】
また、水熱処理を施す時間は2時間以上(例えば、2〜60時間、好ましくは10〜60時間、特に好ましくは15〜60時間)である。水熱処理を施す時間が長すぎると生産性が低下する傾向がある。一方、水熱処理を施す時間が短すぎると結晶型の均一性が低下する。
【0045】
水熱処理は、回分式、半回分式、連続式等の慣用の方法により行うことができ、例えば、オートクレーブ等の密閉系反応容器を使用して、反応温度、反応圧力、反応時間、及び水性媒体中のヒドロキシカルボン酸チタン錯体濃度(チタン換算)を上記範囲に調整することにより行うことができる。
【0046】
水熱処理後は、遠心分離することによりブルッカイト型酸化チタンを取得することができる。遠心分離は、例えば、1000〜10000rpm程度の回転数で、10〜60分程度である。遠心分離後、上澄み(不透明)を濾過し、濾物(濾さい)を、例えば0.1mol/Lの塩酸で洗浄し、さらにイオン交換水で伝導度が例えば10μS/cm2以下になるまで洗浄し、真空乾燥することにより、高純度のブルッカイト型酸化チタンを得ることができる。
【0047】
本発明に係るブルッカイト型酸化チタンの製造方法によれば、ブルッカイト型酸化チタンを単相で得ることができる。尚、本発明において「単相」とは、単一の結晶構造を有する事を示し、アナターゼ型やルチル型等のブルッカイト型以外の結晶構造を含有しないことを意味する。
【0048】
前記ブルッカイト型酸化チタンとしては、ロッド状ブルッカイト型酸化チタンが好ましく、特にアスペクト比[長辺/短辺(長さ)の比率]が2.5以上(好ましくは2.5〜10、特に好ましくは3〜5)のブルッカイト型酸化チタンが好ましい。ロッド状ブルッカイト型酸化チタンは、先端面が酸化反応面、側面が還元反応面として機能する(図1参照)。そして、ブルッカイト型酸化チタンによる光触媒反応では、単位面積当たりの酸化反応力に比べて単位面積当たりの還元反応力が弱いことが分かっている。また、酸化反応と還元反応を引き起こす正孔と電子は対になって消費されるため、還元反応力が弱いと酸化反応力も阻害されるが、ブルッカイト型酸化チタンがロッド状ブルッカイト型酸化チタン(特に、アスペクト比が2.5以上のブルッカイト型酸化チタン)である場合、酸化反応面に比べて還元反応面が大きく、弱い還元反応力を還元反応面の広さで補うことができるため、酸化反応力が阻害されず優れた酸化反応を発揮することができる。一方、アスペクト比が上記範囲を下回ると、還元反応面積が小さくなり、それに伴い酸化反応力が阻害されて光触媒能が不十分となる傾向がある。
【0049】
また、上記製造方法により得られるブルッカイト型酸化チタンの比表面積としては、例えば、10〜70m2/g、好ましくは、40〜50m2/gである。ブルッカイト型酸化チタンの比表面積が上記範囲を下回ると、反応物質の吸着能力が低下して光触媒能が低下する傾向がある。一方、ブルッカイト型酸化チタンの比表面積が上記範囲を上回ると、励起電子とホールの分離性が低下し、励起電子とホールとの再結合や逆反応の進行により光触媒能が低下する傾向がある。
【0050】
さらに、上記製造方法により得られるブルッカイト型酸化チタンの平均粒子径としては、例えば10〜200nm程度、好ましくは50〜100nm程度である。本発明において平均粒子径は、10万倍の透過型電子顕微鏡写真から、ブルッカイト型酸化チタン微粒子20個を無作為に選択し、1粒子毎にその差し渡し長さの平均(すなわち、短径と長径の平均)を計測し、該20個について相加平均をとったものである。平均粒子径が上記範囲を下回ると、励起電子とホールの分離性が低下し、励起電子とホールとの再結合や逆反応の進行により光触媒能が低下する傾向がある。一方、平均粒子径が上記範囲を上回ると、反応物質の吸着能力が低下して光触媒能が低下する傾向がある。
【0051】
[遷移金属イオン担持工程]
本発明に係るブルッカイト型酸化チタンの製造方法においては、前記水熱処理工程を経て得られたブルッカイト型酸化チタンに遷移金属イオンの担持を行う工程を設けることが好ましい。ブルッカイト型酸化チタンは紫外線を吸収すると、強い酸化作用を発揮することができる。しかし、太陽光や白熱灯、蛍光灯等の通常の生活空間における光源に含まれる紫外線量は4%程度と少なく、大部分が可視光線と赤外線で構成されていることから、このような光源下では、ブルッカイト型酸化チタンの光触媒能を十分発揮させることは困難である。ブルッカイト型酸化チタンに特定の遷移金属イオンを担持すると、バンドギャップを小さくすることができ、可視光応答性を付与することができる。
【0052】
遷移金属イオンの担持は、ブルッカイト型酸化チタンの結晶面のうち、酸化反応面に選択的に行うことが好ましい。遷移金属イオンを酸化反応面に選択的に担持することにより、酸化反応と還元反応の反応場の分離性を高め、励起電子とホールとの再結合を抑制し、逆反応の進行を抑制して、光触媒活性を飛躍的に向上させることができるからである。
【0053】
本発明において、「遷移金属イオンを酸化反応面に選択的に担持」とは、ブルッカイト型酸化チタンに担持する遷移金属イオンの50%を超える量(好ましくは70%以上、特に好ましくは80%以上)が酸化反応面及び還元反応面のうち、酸化反応面に担持されていることをいう。尚、選択率の上限は100%である。面選択性は、透過型電子顕微鏡(TEM)やエネルギー分散型蛍光X線分析装置(EDX)を使用し、遷移金属イオン由来のシグナルを確認することで、判定できる。
【0054】
遷移金属イオンとしては、可視光領域に吸収スペクトルを有し、励起状態で伝導帯に電子を注入することができるものが好ましく、例えば、周期表第3〜第11族元素イオン、なかでも周期表第8〜第11族元素イオンが好ましく、特に、三価の鉄イオン(Fe3+)が好ましい。鉄イオンのブルッカイト型酸化チタンへの担持においては、三価の鉄イオン(Fe3+)は吸着しやすく、二価の鉄イオン(Fe2+)は吸着しにくい特性を有するため、その特性を利用することにより容易に酸化反応面に選択的に担持することができる。
【0055】
遷移金属イオンの担持量としては、例えば、0ppmを超え、10000ppm以下程度(なかでも10〜5000ppm程度、好ましくは50〜1500ppm程度、特に好ましくは100〜1000ppm程度)である。遷移金属イオンの担持量が上記範囲を上回ると、可視光線応答性には優れるが、注入電子の逆電子移動等により励起電子が有効に作用せず、光触媒活性が低下する傾向がある。一方、遷移金属イオンの担持量が少なすぎると、可視光線応答性が低下する傾向がある。
【0056】
ブルッカイト型酸化チタンへの遷移金属イオンの担持は、例えば、ブルッカイト型酸化チタンに遷移金属イオンを含浸する含浸法により行うことができる。具体的には、上記水熱処理工程を経て得られたブルッカイト型酸化チタンの水分散液中に、撹拌しながら、遷移金属イオンを添加することにより行うことができ、例えば、遷移金属イオンとして三価の鉄イオン(Fe3+)を使用する場合は、鉄化合物(例えば、硝酸鉄(III)、硫酸鉄(III)、塩化鉄(III)等)を添加することにより行うことができる。
【0057】
遷移金属イオンの添加量としては、ブルッカイト型酸化チタンに対して、例えば0.01〜3.0重量%程度、好ましくは0.01〜1.0重量%程度である。遷移金属イオンの添加量が上記範囲を下回ると、ブルッカイト型酸化チタン表面への遷移金属イオンの担持量が低下し、光触媒活性が低下する傾向があり、一方、遷移金属イオンの添加量が上記範囲を上回ると、注入電子の逆電子移動等により励起電子が有効に作用せず、光触媒活性が低下する傾向がある。含浸時間としては、例えば、10分から48時間程度、好ましくは10分から24時間程度である。
【0058】
そして、本発明においては、ブルッカイト型酸化チタンに遷移金属イオンを含浸する際に励起光を照射することが、大掛かりな設備等を要することなく容易に、且つ効率よく、酸化反応面に選択的に遷移金属イオンを担持することができる点で好ましい。励起光を照射すると、ブルッカイト型酸化チタンの価電子帯の電子が伝導帯に励起し、価電子帯にホール、伝導帯に励起電子が生成し、これらは粒子表面へ拡散し、各結晶面の特性に従って励起電子とホールとが分離されて酸化反応面と還元反応面とを形成する。この状態で遷移金属イオンとして、例えば三価の鉄イオンの含浸を行うと、酸化反応面では三価の鉄イオン(Fe3+)が吸着するが、還元反応面では三価の鉄イオン(Fe3+)は二価の鉄イオン(Fe2+)に還元され、二価の鉄イオン(Fe2+)は吸着しにくい特性を有するため、吸着せずに溶液中に溶出する。結果として酸化反応面に選択的に鉄イオン(Fe3+)が担持された鉄イオン担持ブルッカイト型酸化チタンを得ることができる。
【0059】
励起光の照射方法としては、バンドギャップエネルギー以上のエネルギーを有する光を照射することができればよく、例えば、紫外線を照射することにより行うことができる。紫外線照射手段としては、例えば、中・高圧水銀灯、UVレーザー、UV−LED、ブラックライト等の紫外線を効率よく発生させる光源を有する紫外線露光装置等を使用することができる。励起光の照射量としては、例えば、0.1〜300mW/cm2程度、好ましくは1〜5mW/cm2程度である。
【0060】
さらに、本発明においては、含浸の際に犠牲剤を添加することが好ましい。犠牲剤を添加することにより、ブルッカイト型酸化チタンの酸化反応面に高い選択率で遷移金属イオンを担持させることができる。犠牲剤としては、それ自体が電子を放出しやすい有機化合物を使用することが好ましく、例えば、メタノール、エタノール等のアルコール;酢酸等のカルボン酸;エチレンジアミン四酢酸(EDTA)、トリエタノールアミン(TEA)等のアミン等を挙げることができる。
【0061】
犠牲剤の添加量としては、適宜調整することができ、例えば、0.5〜5.0vol%程度、好ましくは1.0〜2.0vol%程度である。犠牲剤は過剰量を使用してもよい。
【0062】
遷移金属イオン担持工程を経て得られた遷移金属イオン担持ブルッカイト型酸化チタンは、周知慣用の方法、例えば、濾過、濃縮、蒸留、抽出、晶析、再結晶、カラムクロマトグラフィー等や、これらを組み合わせた方法により精製することができる。
【0063】
本発明に係るブルッカイト型酸化チタンの製造方法により得られるブルッカイト型酸化チタンは、太陽光や白熱灯、蛍光灯等の通常の生活空間における光を吸収して、有害化学物質を水や二酸化炭素にまで分解することが可能である。そのため、抗菌防かび、脱臭、大気浄化、水質浄化、防汚等さまざまに応用することができ、室内の壁紙や家具をはじめ家庭内や病院、学校等の公共施設内での環境浄化、家電製品の高機能化等、広範囲への応用が可能である。
【実施例】
【0064】
以下、実施例により本発明をより具体的に説明するが、本発明はこれらの実施例により限定されるものではない。
【0065】
実施例1
(ペルオキソチタン酸錯体の調製)
アモルファスTiO2 1gに30%H2O2溶液 40mL、及び25%NH3溶液 10mLを添加して、ペルオキソチタン錯体溶液を調製した。
【0066】
(ヒドロキシカルボン酸チタン錯体の調製)
次に、結晶制御剤としてのグリコール酸 1.426gを上記ペルオキソチタン錯体溶液に添加し、余分なH2O2とNH3を分解するために60℃で一晩加熱撹拌して、黄色透明のゲル状物質を得た。
【0067】
(水熱処理)
得られたゲル状物質を再溶解させ、7Mの尿素(和光純薬工業(株)社製試薬)を添加して得られた溶液(1) 50mLを、テフロン(登録商標)カップが装着された容量500mLのオートクレーブに入れ、水熱処理(200℃、48時間)を施した。
得られた反応物を遠心分離し、脱イオン水でリンスし、真空乾燥機(バキュームオーブン)で乾燥して、酸化チタン(1)を得た。得られた酸化チタン(1)を走査型電子顕微鏡(SEM)、及び透過型電子顕微鏡(TEM)で確認したところ、(210)(212)面を有するロッド状ブルッカイト型酸化チタン(比表面積:45m2/g、アスペクト比:3.7)であった(図2)。
【0068】
実施例2
ジヒドロキシビス(アンモニウムラクタト)チタン(IV)(TALH)溶液に7Mの尿素(和光純薬工業(株)社製試薬)を添加して得られた溶液(2) 50mLを、テフロン(登録商標)カップが装着された容量500mLのオートクレーブに入れ、水熱処理(200℃、48時間)を施した。
得られた反応物を遠心分離し、脱イオン水でリンスし、真空乾燥機(バキュームオーブン)で乾燥して、酸化チタン(2)を得た。得られた酸化チタン(2)を走査型電子顕微鏡(SEM)、及び透過型電子顕微鏡(TEM)で確認したところ、(210)(212)面を有するロッド状ブルッカイト型酸化チタン(比表面積:41m2/g、アスペクト比:4.9)であった(図3)。
【0069】
比較例1
7Mの尿素(和光純薬工業(株)社製試薬)を添加して得られた溶液(1)に代えて、25%NH3溶液を添加してpHを10に調整することにより得られた溶液(2)を使用した以外は実施例1と同様にして、酸化チタン(3)を得た。得られた酸化チタン(3)を走査型電子顕微鏡(SEM)、及び透過型電子顕微鏡(TEM)で確認したところ、(210)(212)面を有するロッド状ブルッカイト型酸化チタン(比表面積:45m2/g、アスペクト比:2.9)であった(図4)。
【0070】
実施例3
実施例1で得られた酸化チタン(1)[ロッド状ブルッカイト型酸化チタン、比表面積:45m2/g、アスペクト比:2.9]を水に分散して得られた水分散液に塩化鉄水溶液(35重量%)0.2gを添加し、室温(25℃)にて1時間撹拌した。その後、メタノール 6mLを添加し、100Wの高圧水銀ランプを使用して紫外線を3時間照射して、鉄イオン担持酸化チタン水分散液を得た。得られた鉄イオン担持酸化チタン水分散液を水洗し、遠心分離して、鉄イオン担持酸化チタンを得た。得られた鉄イオン担持酸化チタンの鉄の含有量は410ppmであった。また下記光触媒活性測定方法において、光照射を365nmから455nmに変更した以外は同様にして測定した光触媒能は620ppmであった。
【0071】
<光触媒活性評価>
実施例2で得られた酸化チタン(2)、比較例1で得られた酸化チタン(3)、及びアナターゼ型光触媒(商品名「ST−01」、比表面積:300m2/g、石原産業(株)製)の光触媒能を、気相にてトルエンを酸化し、生成するCO2量を測定する下記光触媒活性測定方法により評価した(図5)。
光触媒活性測定方法
テドラーバッグ(アズワン(株)製)500mLを反応容器として使用した。酸化チタン 100mgをそれぞれガラス製皿に広げ、反応容器の中に入れ、500ppmのトルエン飽和ガスを反応容器に吹き込んだ。ガスとトルエンが平衡に達した後、室温(25℃)で光照射(365nm)を行った。光源には500Wのキセノンランプ用光源装置(商品名「SX−UI501XQ」、ウシオ電機(株)製)を使用した。さらに、ファインステンレス製のメッシュを光量調節用フィルターとして使用して光量を100μW/cm2に調整した。
光照射開始から150分後のCO2の生成量(反応容器内のCO2濃度)をメタナイザーが付属した水素炎イオン化検出器付きガスクロマトグラフ(商品名「GC−8A」、「GC−14A」、島津製作所製)を使用して測定した。
【技術分野】
【0001】
本発明は、本発明は、光触媒等として有用なブルッカイト型酸化チタンの製造方法、及び該製造方法により得られるブルッカイト型酸化チタンに関する。
【背景技術】
【0002】
酸化チタンには、アナターゼ型、ルチル型、ブルッカイト型の3種の結晶形態が存在する。なかでもブルッカイト型酸化チタンは、アナターゼ型、及びルチル型酸化チタンに比べて、より微弱な光でも高い光触媒能を発揮できるため特に有用である。
【0003】
ブルッカイト型酸化チタンの製造方法としては、原料チタン化合物をペルオキソ化した後、アミン類及び/又はアンモニアを添加してpHを特定の範囲に維持しながら水熱処理する方法等が知られている(特許文献1、2参照)。しかしながら、前記方法で得られるブルッカイト型酸化チタンは、光触媒能の点で必ずしも満足できるものではなかった。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2000−335919号公報
【特許文献2】特開2007−246301号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
従って、本発明の目的は、優れた光触媒能を有するブルッカイト型酸化チタンの製造方法を提供することにある。
本発明の他の目的は、優れた光触媒能を有するブルッカイト型酸化チタンを提供することにある。
さらに本発明の他の目的は、紫外線域から可視光線域までの広い波長範囲の光に対して優れた応答性を有し、太陽光や白熱灯、蛍光灯等の通常の生活空間における光を吸収して、強い酸化作用を発揮することができるブルッカイト型酸化チタンの製造方法を提供することにある。
さらにまた本発明の他の目的は、紫外線域から可視光線域までの広い波長範囲の光に対して優れた応答性を有し、太陽光や白熱灯、蛍光灯等の通常の生活空間における光を吸収して、強い酸化作用を発揮することができるブルッカイト型酸化チタンを提供することにある。
【課題を解決するための手段】
【0006】
本発明者等は、上記課題を解決するため鋭意検討した結果、原料チタン化合物をペルオキソ化した後、水熱処理する工程において、アミン類及び/又はアンモニアに代えて尿素を添加すると、反応系内で発生したアンモニアによって反応系内のpHを一定に調整することができ、安定化された錯体が緩やかに結晶化するため、極めて高い光触媒能を有するブルッカイト型酸化チタンを選択的に得ることができることを見いだした。本発明はこれらの知見に基づいて完成させたものである。
【0007】
すなわち、本発明はヒドロキシカルボン酸チタン錯体を含有する水溶液に尿素を0.5〜8mol/L添加し、反応温度110℃〜220℃、その反応温度における飽和蒸気圧以上の圧力下、2時間以上水熱処理を施す水熱処理工程を有するブルッカイト型酸化チタンの製造方法を提供する。
【0008】
前記ヒドロキシカルボン酸チタン錯体としては、ペルオキソチタン酸錯体とヒドロキシカルボン酸を反応させて得られる化合物が好ましく、例えば、ジヒドロキシビス(アンモニウムラクタト)チタン(IV)が好ましい。
【0009】
本発明のブルッカイト型酸化チタンの製造方法には、水熱処理工程を経て得られたブルッカイト型酸化チタンに、遷移金属イオンの担持を行う遷移金属イオン担持工程を設けることが好ましい。
【0010】
前記遷移金属イオンとしては三価の鉄イオンが好ましく、前記遷移金属イオンを、ブルッカイト型酸化チタンの酸化反応面に選択的に担持することが好ましく、励起光照射下で、ブルッカイト型酸化チタンに遷移金属イオンを担持することが好ましい。
【0011】
本発明は、また、前記ブルッカイト型酸化チタンの製造方法により得られるブルッカイト型酸化チタンを提供する。
【0012】
前記ブルッカイト型酸化チタンはアスペクト比[長辺/短辺(長さ)の比率]が2.5以上であることが好ましい。
【発明の効果】
【0013】
本発明に係るブルッカイト型酸化チタンの製造方法によれば、容易且つ選択的に、優れた光触媒能を有するブルッカイト型酸化チタンを得ることができる。特に、遷移金属イオンを担持する工程を経て得られたブルッカイト型酸化チタンは、紫外線域から可視光線域までの広い波長範囲の光に対して優れた応答性を有し、光を照射することにより極めて強い酸化作用を発揮することができる。そのため、太陽光や白熱灯、蛍光灯等の通常の生活空間における光を吸収して、有機物質を効率よく酸化することができ、大気の浄化、脱臭、浄水、抗菌、防汚等の目的に有用である。
【図面の簡単な説明】
【0014】
【図1】ブルッカイト型酸化チタンの酸化反応面及び還元反応面を示す概略図である。
【図2】実施例1で得られた酸化チタン(1)の走査型電子顕微鏡(SEM)写真(a)、及び透過型電子顕微鏡(TEM)写真(b)である。
【図3】実施例2で得られた酸化チタン(2)の走査型電子顕微鏡(SEM)写真(a)、及び透過型電子顕微鏡(TEM)写真(b)である。
【図4】比較例1で得られた酸化チタン(3)の走査型電子顕微鏡(SEM)写真(a)、及び透過型電子顕微鏡(TEM)写真(b)である。
【図5】実施例2で得られた酸化チタン(2)、比較例1で得られた酸化チタン(3)、及びアナターゼ型光触媒(商品名「ST−01」、石原産業(株)製)を光触媒として使用し、トルエンを酸化した際に生成したCO2濃度と紫外線照射量との関係を示す図である。
【発明を実施するための形態】
【0015】
本発明に係るブルッカイト型酸化チタンの製造方法は、ヒドロキシカルボン酸チタン錯体を含有する水性媒体に尿素を0.5〜8mol/Lとなるように添加し、反応温度110℃〜220℃、その反応温度における飽和蒸気圧以上の圧力下、2時間以上水熱処理を施す水熱処理工程を有する。
【0016】
[ヒドロキシカルボン酸チタン錯体]
本発明のヒドロキシカルボン酸チタン錯体は、ペルオキソチタン酸錯体と結晶制御剤としてのヒドロキシカルボン酸を反応させて得られる化合物である。ペルオキソチタン酸錯体は加水分解されやすいが、結晶制御剤としての作用を有するヒドロキシカルボン酸と反応すると、安定な錯化合物であるヒドロキシカルボン酸チタン錯体を形成することができる。
【0017】
(ペルオキソチタン酸錯体)
ペルオキソチタン酸錯体は、下記反応式(1)で表されるように、チタン化合物に過酸化水素とアンモニアを添加することにより得られる。
Ti+3H2O2+NH3→[Ti(OH)3O2]-+H2O+NH4+ (1)
【0018】
チタン化合物としては、例えば、3価のチタン化合物、4価のチタン化合物等を挙げることができる。
【0019】
3価のチタン化合物としては、例えば、三塩化チタンや三臭化チタン等のトリハロゲン化チタン等を挙げることができる。
【0020】
4価のチタン化合物としては、例えば、下記式(2)
Ti(OR)tX4-t (2)
(式中、Rは炭化水素基を示し、Xはハロゲン原子を示す。tは0〜3の整数を示す)
で表される化合物やアモルファス酸化チタン(TiO2)等を挙げることができる。
【0021】
式(2)中のRにおける炭化水素基としては、例えば、メチル、エチル、プロピル、イソプロピル、n−ブチル、sec−ブチル、tert−ブチル等のC1-4脂肪族炭化水素基等を挙げることができる。
【0022】
式(2)中のXにおけるハロゲン原子としては、塩素、臭素、ヨウ素等を挙げることができる。
【0023】
式(2)で表される4価のチタン化合物としては、例えば、TiCl4、TiBr4、TiI4等のテトラハロゲン化チタン;Ti(OCH3)Cl3、Ti(OC2H5)Cl3、Ti(OC4H9)Cl3、Ti(OC2H5)Br3、Ti(OC4H9)Br3等のトリハロゲン化アルコキシチタン;Ti(OCH3)2Cl2、Ti(OC2H5)2Cl2、Ti(OC4H9)2Cl2、Ti(OC2H5)2Br2等のジハロゲン化ジアルコキシチタン;Ti(OCH3)3Cl、Ti(OC2H5)3Cl、Ti(OC4H9)3Cl、Ti(OC2H5)3Br等のモノハロゲン化トリアルコキシチタン等を挙げることができる。
【0024】
本発明におけるチタン化合物としては、なかでも、より強い酸化作用を発揮することができる点で、4価のチタン化合物[なかでも、安価、且つ、入手が容易な点で、テトラハロゲン化チタン[特に四塩化チタン(TiCl4)]、及びアモルファス酸化チタンが好ましい]が好ましい。
【0025】
過酸化水素の添加量としては、例えば、チタン化合物の150〜5000重量%程度、好ましくは1500〜3000重量%程度である。また、アンモニアの添加量としては、例えば、チタン化合物の25〜500重量%程度、好ましくは150〜300重量%程度である。
【0026】
ペルオキソチタン酸錯体は、チタン化合物に上記範囲内の量の過酸化水素及びアンモニアを添加し、撹拌することにより製造することができる。過剰の過酸化水素及びアンモニアは、例えば、60℃で一晩加熱撹拌することにより分解することができる。
【0027】
(ヒドロキシカルボン酸)
ヒドロキシカルボン酸は、例えば下記式(3)で表される。
HO−R’−COOH (3)
(式中、R’は置換基を有していてもよい2価の脂肪族炭化水素基、2価の脂環式炭化水素基、又は2価の芳香族炭化水素基を示す)
【0028】
R’における2価の脂肪族炭化水素基としては、例えば、メチレン、エチレン、メチルエチレン、トリメチレン、1−メチルトリメチレン、2−メチルトリメチレン、2,2−ジメチルトリメチレン、テトラメチレン、ペンタメチレン、ヘキサメチレン、ヘプタメチレン、オクタメチレン、ノナメチレン、2,2,4−トリメチルヘキサメチレン、デカメチレン、ドデカメチレン基等の炭素数1〜18の直鎖状又は分岐鎖状アルキレン基;プロペニレン基等の炭素数2〜6程度のアルケニレン基;プロピニレン基等の炭素数2〜6程度のアルキニレン基等を挙げることができる。
【0029】
R’における2価の脂環式炭化水素基としては、例えば、シクロヘキシリデン、1,2−シクロペンチレン、1,2−シクロへキシレン、1,3−シクロへキシレン、1,4−シクロへキシレン等のシクロアルキレン基;2−シクロヘキセン−1,4−ジイル基等のシクロアルケニレン基;アダマンタン−1,3−ジイル基等の2価の橋かけ環式基等を挙げることができる。
【0030】
R’における2価の芳香族炭化水素基としては、例えば、1,2−フェニレン、1,3−フェニレン、1,4−フェニレン、1,4−ナフチレン、ビフェニレン基等を挙げることができる。
【0031】
R’が有していてもよい置換基としては、例えば、カルボキシル基、ヒドロキシル基、アミノ基、フェニル基等を挙げることができる。
【0032】
ヒドロキシカルボン酸の具体例としては、例えば、グリコール酸、乳酸、2−ヒドロキシ−n−酪酸、2−ヒドロキシイソ酪酸、酒石酸、リンゴ酸、クエン酸、イソクエン酸、グリセリン酸、メバロン酸、サリチル酸、没食子酸、シキミ酸等を挙げることができる。
【0033】
本発明におけるヒドロキシカルボン酸としては、カルボキシル基のα位又はβ位にヒドロキシル基を有する化合物が、より安定な錯化合物を形成することができる点で好ましく、特に、グリコール酸、乳酸、2−ヒドロキシ−n−酪酸、2−ヒドロキシイソ酪酸、リンゴ酸、酒石酸等のカルボキシル基のα位にヒドロキシル基を有する化合物が好ましい。
【0034】
ヒドロキシカルボン酸の使用量としては、例えば、ペルオキソチタン酸錯体の50〜150重量%程度、好ましくは75〜100重量%程度である。ヒドロキシカルボン酸の使用量が上記範囲を上回ると、ルチル相が結晶化して混在する傾向がある。一方、ヒドロキシカルボン酸の使用量が上記範囲を下回ると、アナターゼ相が結晶化して混在する傾向がある。
【0035】
本発明のヒドロキシカルボン酸チタン錯体は、下記式(4)で表される。
【化1】

(式中、R’は上記に同じ)
【0036】
ヒドロキシカルボン酸として、例えばグリコール酸(HO−CH2−COOH)を使用する場合は、ヒドロキシカルボン酸チタン錯体として、下記式(4-1)で表される化合物が得られる。
【化2】

【0037】
ヒドロキシカルボン酸として、例えば乳酸(CH3CHOH−COOH)を使用する場合は、ヒドロキシカルボン酸チタン錯体として、下記式(4-2)で表されるジヒドロキシビス(アンモニウムラクタト)チタン(IV)(=Titanium bis (ammonium lactato) dihydroxide)が得られる。
【化3】

【0038】
[水性媒体]
水熱処理の際に用いる水性媒体としては、例えば、水又は水と水溶性有機溶媒との混合液等を挙げることができる。前記水溶性有機溶媒としては、例えば、メタノール、エタノール等のアルコール;エチレングリコールジメチルエーテル等のエーテル;アセトン等のケトン;アセトニトリル等のニトリル;酢酸等のカルボン酸等を挙げることができる。水と水溶性有機溶媒との混合比率は、前者/後者(重量比)=10/90〜99.9/0.1、好ましくは50/50〜99/1程度である。本発明においては、なかでも有機溶媒の回収作業が不要な点で水を使用することが好ましい。
【0039】
水性媒体中のヒドロキシカルボン酸チタン錯体濃度(チタン換算)としては、例えば1.5〜17.0重量%程度(好ましくは2.5〜15.0重量%、特に好ましくは2.5〜8.0重量%)となる濃度であることが好ましい。水性媒体中のヒドロキシカルボン酸チタン錯体濃度(チタン換算)が上記範囲を上回ると、ルチル相が結晶化して混在する傾向がある。一方、水性媒体中のヒドロキシカルボン酸チタン錯体濃度(チタン換算)が上記範囲を下回ると、アナターゼ相が結晶化して混在する傾向がある。
【0040】
[水熱処理工程]
本発明の水熱処理工程では、ヒドロキシカルボン酸チタン錯体を含有する水溶液に尿素を0.5〜8mol/L添加し、反応温度110℃〜220℃、その反応温度における飽和蒸気圧以上の圧力下、2時間以上水熱処理を施すことを特徴とする。
【0041】
本発明においては、反応系内に、アンモニアを添加することなく、尿素を0.5〜8mol/L(好ましくは6〜8mol/L、特に好ましくは6.5〜8mol/L)添加し、反応系内でアンモニアを順次発生させ、発生したアンモニアによってヒドロキシカルボン酸チタン錯体を含有する水溶液のpHを調整するため、水熱処理工程の間、反応系内のpHを8〜14(好ましくは、10〜12)の範囲内でほぼ一定に調整することができる。それによって安定化された錯体が緩やかに結晶化するため、アスペクト比が大きいブルッカイト型酸化チタンを選択的に得ることができる。
【0042】
水熱処理時の反応温度は110℃〜220℃(好ましくは120℃〜220℃、特に好ましくは120℃〜200℃)である。水熱処理時の反応温度が上記範囲を上回ると、ルチル相が結晶化して混在する傾向がある。一方、水熱処理時の反応温度が上記範囲を下回ると、アナターゼ相が結晶化して混在する傾向がある。
【0043】
水熱処理は反応温度における飽和蒸気圧以上の圧力下(すなわち、密閉系で)行われる。水熱処理時の反応圧力(絶対圧)は、例えば、0.14MPa〜2.4MPa(好ましくは0.2MPa〜2.4MPa、特に好ましくは0.2MPa〜1.6MPa)である。
【0044】
また、水熱処理を施す時間は2時間以上(例えば、2〜60時間、好ましくは10〜60時間、特に好ましくは15〜60時間)である。水熱処理を施す時間が長すぎると生産性が低下する傾向がある。一方、水熱処理を施す時間が短すぎると結晶型の均一性が低下する。
【0045】
水熱処理は、回分式、半回分式、連続式等の慣用の方法により行うことができ、例えば、オートクレーブ等の密閉系反応容器を使用して、反応温度、反応圧力、反応時間、及び水性媒体中のヒドロキシカルボン酸チタン錯体濃度(チタン換算)を上記範囲に調整することにより行うことができる。
【0046】
水熱処理後は、遠心分離することによりブルッカイト型酸化チタンを取得することができる。遠心分離は、例えば、1000〜10000rpm程度の回転数で、10〜60分程度である。遠心分離後、上澄み(不透明)を濾過し、濾物(濾さい)を、例えば0.1mol/Lの塩酸で洗浄し、さらにイオン交換水で伝導度が例えば10μS/cm2以下になるまで洗浄し、真空乾燥することにより、高純度のブルッカイト型酸化チタンを得ることができる。
【0047】
本発明に係るブルッカイト型酸化チタンの製造方法によれば、ブルッカイト型酸化チタンを単相で得ることができる。尚、本発明において「単相」とは、単一の結晶構造を有する事を示し、アナターゼ型やルチル型等のブルッカイト型以外の結晶構造を含有しないことを意味する。
【0048】
前記ブルッカイト型酸化チタンとしては、ロッド状ブルッカイト型酸化チタンが好ましく、特にアスペクト比[長辺/短辺(長さ)の比率]が2.5以上(好ましくは2.5〜10、特に好ましくは3〜5)のブルッカイト型酸化チタンが好ましい。ロッド状ブルッカイト型酸化チタンは、先端面が酸化反応面、側面が還元反応面として機能する(図1参照)。そして、ブルッカイト型酸化チタンによる光触媒反応では、単位面積当たりの酸化反応力に比べて単位面積当たりの還元反応力が弱いことが分かっている。また、酸化反応と還元反応を引き起こす正孔と電子は対になって消費されるため、還元反応力が弱いと酸化反応力も阻害されるが、ブルッカイト型酸化チタンがロッド状ブルッカイト型酸化チタン(特に、アスペクト比が2.5以上のブルッカイト型酸化チタン)である場合、酸化反応面に比べて還元反応面が大きく、弱い還元反応力を還元反応面の広さで補うことができるため、酸化反応力が阻害されず優れた酸化反応を発揮することができる。一方、アスペクト比が上記範囲を下回ると、還元反応面積が小さくなり、それに伴い酸化反応力が阻害されて光触媒能が不十分となる傾向がある。
【0049】
また、上記製造方法により得られるブルッカイト型酸化チタンの比表面積としては、例えば、10〜70m2/g、好ましくは、40〜50m2/gである。ブルッカイト型酸化チタンの比表面積が上記範囲を下回ると、反応物質の吸着能力が低下して光触媒能が低下する傾向がある。一方、ブルッカイト型酸化チタンの比表面積が上記範囲を上回ると、励起電子とホールの分離性が低下し、励起電子とホールとの再結合や逆反応の進行により光触媒能が低下する傾向がある。
【0050】
さらに、上記製造方法により得られるブルッカイト型酸化チタンの平均粒子径としては、例えば10〜200nm程度、好ましくは50〜100nm程度である。本発明において平均粒子径は、10万倍の透過型電子顕微鏡写真から、ブルッカイト型酸化チタン微粒子20個を無作為に選択し、1粒子毎にその差し渡し長さの平均(すなわち、短径と長径の平均)を計測し、該20個について相加平均をとったものである。平均粒子径が上記範囲を下回ると、励起電子とホールの分離性が低下し、励起電子とホールとの再結合や逆反応の進行により光触媒能が低下する傾向がある。一方、平均粒子径が上記範囲を上回ると、反応物質の吸着能力が低下して光触媒能が低下する傾向がある。
【0051】
[遷移金属イオン担持工程]
本発明に係るブルッカイト型酸化チタンの製造方法においては、前記水熱処理工程を経て得られたブルッカイト型酸化チタンに遷移金属イオンの担持を行う工程を設けることが好ましい。ブルッカイト型酸化チタンは紫外線を吸収すると、強い酸化作用を発揮することができる。しかし、太陽光や白熱灯、蛍光灯等の通常の生活空間における光源に含まれる紫外線量は4%程度と少なく、大部分が可視光線と赤外線で構成されていることから、このような光源下では、ブルッカイト型酸化チタンの光触媒能を十分発揮させることは困難である。ブルッカイト型酸化チタンに特定の遷移金属イオンを担持すると、バンドギャップを小さくすることができ、可視光応答性を付与することができる。
【0052】
遷移金属イオンの担持は、ブルッカイト型酸化チタンの結晶面のうち、酸化反応面に選択的に行うことが好ましい。遷移金属イオンを酸化反応面に選択的に担持することにより、酸化反応と還元反応の反応場の分離性を高め、励起電子とホールとの再結合を抑制し、逆反応の進行を抑制して、光触媒活性を飛躍的に向上させることができるからである。
【0053】
本発明において、「遷移金属イオンを酸化反応面に選択的に担持」とは、ブルッカイト型酸化チタンに担持する遷移金属イオンの50%を超える量(好ましくは70%以上、特に好ましくは80%以上)が酸化反応面及び還元反応面のうち、酸化反応面に担持されていることをいう。尚、選択率の上限は100%である。面選択性は、透過型電子顕微鏡(TEM)やエネルギー分散型蛍光X線分析装置(EDX)を使用し、遷移金属イオン由来のシグナルを確認することで、判定できる。
【0054】
遷移金属イオンとしては、可視光領域に吸収スペクトルを有し、励起状態で伝導帯に電子を注入することができるものが好ましく、例えば、周期表第3〜第11族元素イオン、なかでも周期表第8〜第11族元素イオンが好ましく、特に、三価の鉄イオン(Fe3+)が好ましい。鉄イオンのブルッカイト型酸化チタンへの担持においては、三価の鉄イオン(Fe3+)は吸着しやすく、二価の鉄イオン(Fe2+)は吸着しにくい特性を有するため、その特性を利用することにより容易に酸化反応面に選択的に担持することができる。
【0055】
遷移金属イオンの担持量としては、例えば、0ppmを超え、10000ppm以下程度(なかでも10〜5000ppm程度、好ましくは50〜1500ppm程度、特に好ましくは100〜1000ppm程度)である。遷移金属イオンの担持量が上記範囲を上回ると、可視光線応答性には優れるが、注入電子の逆電子移動等により励起電子が有効に作用せず、光触媒活性が低下する傾向がある。一方、遷移金属イオンの担持量が少なすぎると、可視光線応答性が低下する傾向がある。
【0056】
ブルッカイト型酸化チタンへの遷移金属イオンの担持は、例えば、ブルッカイト型酸化チタンに遷移金属イオンを含浸する含浸法により行うことができる。具体的には、上記水熱処理工程を経て得られたブルッカイト型酸化チタンの水分散液中に、撹拌しながら、遷移金属イオンを添加することにより行うことができ、例えば、遷移金属イオンとして三価の鉄イオン(Fe3+)を使用する場合は、鉄化合物(例えば、硝酸鉄(III)、硫酸鉄(III)、塩化鉄(III)等)を添加することにより行うことができる。
【0057】
遷移金属イオンの添加量としては、ブルッカイト型酸化チタンに対して、例えば0.01〜3.0重量%程度、好ましくは0.01〜1.0重量%程度である。遷移金属イオンの添加量が上記範囲を下回ると、ブルッカイト型酸化チタン表面への遷移金属イオンの担持量が低下し、光触媒活性が低下する傾向があり、一方、遷移金属イオンの添加量が上記範囲を上回ると、注入電子の逆電子移動等により励起電子が有効に作用せず、光触媒活性が低下する傾向がある。含浸時間としては、例えば、10分から48時間程度、好ましくは10分から24時間程度である。
【0058】
そして、本発明においては、ブルッカイト型酸化チタンに遷移金属イオンを含浸する際に励起光を照射することが、大掛かりな設備等を要することなく容易に、且つ効率よく、酸化反応面に選択的に遷移金属イオンを担持することができる点で好ましい。励起光を照射すると、ブルッカイト型酸化チタンの価電子帯の電子が伝導帯に励起し、価電子帯にホール、伝導帯に励起電子が生成し、これらは粒子表面へ拡散し、各結晶面の特性に従って励起電子とホールとが分離されて酸化反応面と還元反応面とを形成する。この状態で遷移金属イオンとして、例えば三価の鉄イオンの含浸を行うと、酸化反応面では三価の鉄イオン(Fe3+)が吸着するが、還元反応面では三価の鉄イオン(Fe3+)は二価の鉄イオン(Fe2+)に還元され、二価の鉄イオン(Fe2+)は吸着しにくい特性を有するため、吸着せずに溶液中に溶出する。結果として酸化反応面に選択的に鉄イオン(Fe3+)が担持された鉄イオン担持ブルッカイト型酸化チタンを得ることができる。
【0059】
励起光の照射方法としては、バンドギャップエネルギー以上のエネルギーを有する光を照射することができればよく、例えば、紫外線を照射することにより行うことができる。紫外線照射手段としては、例えば、中・高圧水銀灯、UVレーザー、UV−LED、ブラックライト等の紫外線を効率よく発生させる光源を有する紫外線露光装置等を使用することができる。励起光の照射量としては、例えば、0.1〜300mW/cm2程度、好ましくは1〜5mW/cm2程度である。
【0060】
さらに、本発明においては、含浸の際に犠牲剤を添加することが好ましい。犠牲剤を添加することにより、ブルッカイト型酸化チタンの酸化反応面に高い選択率で遷移金属イオンを担持させることができる。犠牲剤としては、それ自体が電子を放出しやすい有機化合物を使用することが好ましく、例えば、メタノール、エタノール等のアルコール;酢酸等のカルボン酸;エチレンジアミン四酢酸(EDTA)、トリエタノールアミン(TEA)等のアミン等を挙げることができる。
【0061】
犠牲剤の添加量としては、適宜調整することができ、例えば、0.5〜5.0vol%程度、好ましくは1.0〜2.0vol%程度である。犠牲剤は過剰量を使用してもよい。
【0062】
遷移金属イオン担持工程を経て得られた遷移金属イオン担持ブルッカイト型酸化チタンは、周知慣用の方法、例えば、濾過、濃縮、蒸留、抽出、晶析、再結晶、カラムクロマトグラフィー等や、これらを組み合わせた方法により精製することができる。
【0063】
本発明に係るブルッカイト型酸化チタンの製造方法により得られるブルッカイト型酸化チタンは、太陽光や白熱灯、蛍光灯等の通常の生活空間における光を吸収して、有害化学物質を水や二酸化炭素にまで分解することが可能である。そのため、抗菌防かび、脱臭、大気浄化、水質浄化、防汚等さまざまに応用することができ、室内の壁紙や家具をはじめ家庭内や病院、学校等の公共施設内での環境浄化、家電製品の高機能化等、広範囲への応用が可能である。
【実施例】
【0064】
以下、実施例により本発明をより具体的に説明するが、本発明はこれらの実施例により限定されるものではない。
【0065】
実施例1
(ペルオキソチタン酸錯体の調製)
アモルファスTiO2 1gに30%H2O2溶液 40mL、及び25%NH3溶液 10mLを添加して、ペルオキソチタン錯体溶液を調製した。
【0066】
(ヒドロキシカルボン酸チタン錯体の調製)
次に、結晶制御剤としてのグリコール酸 1.426gを上記ペルオキソチタン錯体溶液に添加し、余分なH2O2とNH3を分解するために60℃で一晩加熱撹拌して、黄色透明のゲル状物質を得た。
【0067】
(水熱処理)
得られたゲル状物質を再溶解させ、7Mの尿素(和光純薬工業(株)社製試薬)を添加して得られた溶液(1) 50mLを、テフロン(登録商標)カップが装着された容量500mLのオートクレーブに入れ、水熱処理(200℃、48時間)を施した。
得られた反応物を遠心分離し、脱イオン水でリンスし、真空乾燥機(バキュームオーブン)で乾燥して、酸化チタン(1)を得た。得られた酸化チタン(1)を走査型電子顕微鏡(SEM)、及び透過型電子顕微鏡(TEM)で確認したところ、(210)(212)面を有するロッド状ブルッカイト型酸化チタン(比表面積:45m2/g、アスペクト比:3.7)であった(図2)。
【0068】
実施例2
ジヒドロキシビス(アンモニウムラクタト)チタン(IV)(TALH)溶液に7Mの尿素(和光純薬工業(株)社製試薬)を添加して得られた溶液(2) 50mLを、テフロン(登録商標)カップが装着された容量500mLのオートクレーブに入れ、水熱処理(200℃、48時間)を施した。
得られた反応物を遠心分離し、脱イオン水でリンスし、真空乾燥機(バキュームオーブン)で乾燥して、酸化チタン(2)を得た。得られた酸化チタン(2)を走査型電子顕微鏡(SEM)、及び透過型電子顕微鏡(TEM)で確認したところ、(210)(212)面を有するロッド状ブルッカイト型酸化チタン(比表面積:41m2/g、アスペクト比:4.9)であった(図3)。
【0069】
比較例1
7Mの尿素(和光純薬工業(株)社製試薬)を添加して得られた溶液(1)に代えて、25%NH3溶液を添加してpHを10に調整することにより得られた溶液(2)を使用した以外は実施例1と同様にして、酸化チタン(3)を得た。得られた酸化チタン(3)を走査型電子顕微鏡(SEM)、及び透過型電子顕微鏡(TEM)で確認したところ、(210)(212)面を有するロッド状ブルッカイト型酸化チタン(比表面積:45m2/g、アスペクト比:2.9)であった(図4)。
【0070】
実施例3
実施例1で得られた酸化チタン(1)[ロッド状ブルッカイト型酸化チタン、比表面積:45m2/g、アスペクト比:2.9]を水に分散して得られた水分散液に塩化鉄水溶液(35重量%)0.2gを添加し、室温(25℃)にて1時間撹拌した。その後、メタノール 6mLを添加し、100Wの高圧水銀ランプを使用して紫外線を3時間照射して、鉄イオン担持酸化チタン水分散液を得た。得られた鉄イオン担持酸化チタン水分散液を水洗し、遠心分離して、鉄イオン担持酸化チタンを得た。得られた鉄イオン担持酸化チタンの鉄の含有量は410ppmであった。また下記光触媒活性測定方法において、光照射を365nmから455nmに変更した以外は同様にして測定した光触媒能は620ppmであった。
【0071】
<光触媒活性評価>
実施例2で得られた酸化チタン(2)、比較例1で得られた酸化チタン(3)、及びアナターゼ型光触媒(商品名「ST−01」、比表面積:300m2/g、石原産業(株)製)の光触媒能を、気相にてトルエンを酸化し、生成するCO2量を測定する下記光触媒活性測定方法により評価した(図5)。
光触媒活性測定方法
テドラーバッグ(アズワン(株)製)500mLを反応容器として使用した。酸化チタン 100mgをそれぞれガラス製皿に広げ、反応容器の中に入れ、500ppmのトルエン飽和ガスを反応容器に吹き込んだ。ガスとトルエンが平衡に達した後、室温(25℃)で光照射(365nm)を行った。光源には500Wのキセノンランプ用光源装置(商品名「SX−UI501XQ」、ウシオ電機(株)製)を使用した。さらに、ファインステンレス製のメッシュを光量調節用フィルターとして使用して光量を100μW/cm2に調整した。
光照射開始から150分後のCO2の生成量(反応容器内のCO2濃度)をメタナイザーが付属した水素炎イオン化検出器付きガスクロマトグラフ(商品名「GC−8A」、「GC−14A」、島津製作所製)を使用して測定した。
【特許請求の範囲】
【請求項1】
ヒドロキシカルボン酸チタン錯体を含有する水溶液に尿素を0.5〜8mol/L添加し、反応温度110℃〜220℃、その反応温度における飽和蒸気圧以上の圧力下、2時間以上水熱処理を施す水熱処理工程を有するブルッカイト型酸化チタンの製造方法。
【請求項2】
ヒドロキシカルボン酸チタン錯体が、ペルオキソチタン酸錯体とヒドロキシカルボン酸を反応させて得られる化合物である請求項1に記載のブルッカイト型酸化チタンの製造方法。
【請求項3】
ヒドロキシカルボン酸チタン錯体が、ジヒドロキシビス(アンモニウムラクタト)チタン(IV)である請求項1に記載のブルッカイト型酸化チタンの製造方法。
【請求項4】
水熱処理工程を経て得られたブルッカイト型酸化チタンに、遷移金属イオンの担持を行う遷移金属イオン担持工程を有する請求項1〜3の何れかの項に記載のブルッカイト型酸化チタンの製造方法。
【請求項5】
遷移金属イオンが三価の鉄イオンである請求項4に記載のブルッカイト型酸化チタンの製造方法。
【請求項6】
遷移金属イオンを、ブルッカイト型酸化チタンの酸化反応面に選択的に担持する請求項4又は5に記載のブルッカイト型酸化チタンの製造方法。
【請求項7】
励起光照射下で、ブルッカイト型酸化チタンに遷移金属イオンを担持する請求項4〜6の何れかの項に記載のブルッカイト型酸化チタンの製造方法。
【請求項8】
実施例1〜7の何れかの項に記載のブルッカイト型酸化チタンの製造方法により得られるブルッカイト型酸化チタン。
【請求項9】
アスペクト比[長辺/短辺(長さ)の比率]が2.5以上であることを特徴とする請求項8に記載のブルッカイト型酸化チタン。
【請求項1】
ヒドロキシカルボン酸チタン錯体を含有する水溶液に尿素を0.5〜8mol/L添加し、反応温度110℃〜220℃、その反応温度における飽和蒸気圧以上の圧力下、2時間以上水熱処理を施す水熱処理工程を有するブルッカイト型酸化チタンの製造方法。
【請求項2】
ヒドロキシカルボン酸チタン錯体が、ペルオキソチタン酸錯体とヒドロキシカルボン酸を反応させて得られる化合物である請求項1に記載のブルッカイト型酸化チタンの製造方法。
【請求項3】
ヒドロキシカルボン酸チタン錯体が、ジヒドロキシビス(アンモニウムラクタト)チタン(IV)である請求項1に記載のブルッカイト型酸化チタンの製造方法。
【請求項4】
水熱処理工程を経て得られたブルッカイト型酸化チタンに、遷移金属イオンの担持を行う遷移金属イオン担持工程を有する請求項1〜3の何れかの項に記載のブルッカイト型酸化チタンの製造方法。
【請求項5】
遷移金属イオンが三価の鉄イオンである請求項4に記載のブルッカイト型酸化チタンの製造方法。
【請求項6】
遷移金属イオンを、ブルッカイト型酸化チタンの酸化反応面に選択的に担持する請求項4又は5に記載のブルッカイト型酸化チタンの製造方法。
【請求項7】
励起光照射下で、ブルッカイト型酸化チタンに遷移金属イオンを担持する請求項4〜6の何れかの項に記載のブルッカイト型酸化チタンの製造方法。
【請求項8】
実施例1〜7の何れかの項に記載のブルッカイト型酸化チタンの製造方法により得られるブルッカイト型酸化チタン。
【請求項9】
アスペクト比[長辺/短辺(長さ)の比率]が2.5以上であることを特徴とする請求項8に記載のブルッカイト型酸化チタン。
【図5】


【図1】


【図2】


【図3】


【図4】




【図1】


【図2】


【図3】


【図4】


【公開番号】特開2013−14443(P2013−14443A)
【公開日】平成25年1月24日(2013.1.24)
【国際特許分類】
【出願番号】特願2011−146226(P2011−146226)
【出願日】平成23年6月30日(2011.6.30)
【出願人】(000002901)株式会社ダイセル (1,236)
【Fターム(参考)】
【公開日】平成25年1月24日(2013.1.24)
【国際特許分類】
【出願日】平成23年6月30日(2011.6.30)
【出願人】(000002901)株式会社ダイセル (1,236)
【Fターム(参考)】
[ Back to top ]

