ブレオマイシン水解酵素産生促進剤
【課題】新規のブレオマイシン水解酵素産生促進剤の提供。
【解決手段】イザヨイバラエキス、トウキエキス、オウバクエキス、オドリコソウエキス、ローズマリーエキス、ベンゼンスルホニルGABA及びエリスリトールからなる群から選ばれる1又は複数を活性成分として含有する、ブレオマイシン水解酵素産生促進剤、天然保湿因子産生促進剤、乾燥肌改善剤を提供する。
【解決手段】イザヨイバラエキス、トウキエキス、オウバクエキス、オドリコソウエキス、ローズマリーエキス、ベンゼンスルホニルGABA及びエリスリトールからなる群から選ばれる1又は複数を活性成分として含有する、ブレオマイシン水解酵素産生促進剤、天然保湿因子産生促進剤、乾燥肌改善剤を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ブレオマイシン水解酵素産生促進剤、それを含有する天然保湿因子産生促進剤又は乾燥肌改善剤を提供する。
【背景技術】
【0002】
表皮の顆粒層のケラチン線維は、角化する際にフィラグリンと呼ばれるタンパク質に結合して凝集し、“ケラチンパターン”と称される特異的な形態をつくる。顆粒細胞内のケラトヒアリン顆粒にはフィラグリンの前駆物質であるプロフィラグリン(フィラグリン単位が10乃至12個縦に並んだもの)が多量に存在するが、角化の際、フィラグリンモノマーが生成されるとともに脱リン酸化によりケラチン線維を凝集させる。その後、ペプチジルアルギニンデイミナーゼ(PAD)という酵素の作用によって脱イミノ化され、ケラチンと遊離した後、角層上層でアミノ酸などに分解される。これらのアミノ酸は天然保湿因子(natural moisturizing factor ; NMF)と呼ばれ、角層水分量の保持に重要な役割を担い、また紫外線吸収能をもつことで知られる(Blank I.H. J.I. Dermatol., 18, 433 (1952); Blank I.H. J.I. Dermatol., 21, 259 (1953))。
【0003】
NMFの主成分であるアミノ酸がフィグラリンに由来することが明らかになって以来、乾燥肌を呈する病態とフィグラリンの関連性についての研究が進められている。近年、老人性乾皮症、アトピー性疾患などの乾燥肌において角層中のアミノ酸が減少していることが明らかになっている(Horii I. et al., Br. J. Dermatol., 121, 587-592(1989); Tanaka M. et al., Br. J. Dermatol., 139, 618-621(1989))。
【0004】
PADはフィラグリンのアルギニン残基に作用して脱イミノ化させ、シトルリン残基に変換させる。このようにフィラグリンが脱イミノ化されることでフィラグリンとケラチン繊維との親和性が弱まり、ケラチン繊維が遊離し、その結果フィラグリンはプロテアーゼの作用を受け易くなり、最終的にNMFにまで分解されるものと考えられる。
【0005】
本発明者は、PADで脱イミノ化したフィラグリンを分解する酵素として、カルパイン−1を特定しており、その分解産物としての小さいペプチド断片がブレオマイシン水解酵素(BH)によってアミノ酸単位、即ちNMFにまで分解されることを明らかにしている(Journal of Investigative Dermatology (2008), Volume 128, ABSTRACTS, S90, 539, 第30回日本分子生物学会年会・第80回日本生化学会大会 合同大会 講演要旨集、第583頁、JOURNAL OF BIOLOGICAL CHEMISTRY 284, NO. 19, pp. 12829-12836, 2009、3P−0251、及び特願2008−135944号(以下第944号出願と称する))。
【0006】
最近の研究で、アトピー性皮膚炎の一部は、プロフィラグリン遺伝子の異常により生じることが知られており、アトピー性皮膚炎患者の5-50%程度で当該遺伝子の異常が見られる(Smith FJD, et al. Nat Genet 38:337-42 (2006); Aileen Sandilands1, et al., J. I. Dermatol., 127, 1282-1284 (2007) 及びNomura T, et al., J. I. Dermatol., 128(6):1436-41 (2008))。しかしながら、アトピー性皮膚炎患者の皮膚では、必ずしもフィラグリンの発現が劇的に低下しているわけではない。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Blank I.H. J.I. Dermatol., 18, 433 (1952)
【非特許文献2】Blank I.H. J.I. Dermatol., 21, 259 (1953)
【非特許文献3】Horii I. et al., Br. J. Dermatol., 121, 587-592(1989)
【非特許文献4】Tanaka M. et al., Br. J. Dermatol., 139, 618-621(1989)
【非特許文献5】Kamata et al., J. Biochem., 141, 69-76, 2007
【非特許文献6】Journal of Investigative Dermatology (2008), Volume 128, ABSTRACTS, S90, 539
【非特許文献7】第30回日本分子生物学会年会・第80回日本生化学会大会 合同大会 講演要旨集、第583頁、3P−0251
【非特許文献8】JOURNAL OF BIOLOGICAL CHEMISTRY 284, NO. 19, pp. 12829-12836, 2009
【非特許文献9】Smith FJD, et al. Nat Genet 38:337-42 (2006)
【非特許文献10】Aileen Sandilands1, et al., J. I. Dermatol., 127, 1282-1284
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明者は、ブレオマイシン水解酵素産生促進剤の提供を課題とする。
【課題を解決するための手段】
【0009】
上記第944号出願において、本発明者は、ブレオマイシン水解酵素の活性亢進がNMFの産生を介して皮膚バリアー機能を改善することを明らかにした。このように、ブレオマイシン水解酵素はNMF産生の最終段階で働いていると考えられる。しかし、興味深いことに、アトピー性皮膚炎により生じる乾燥肌に関しては、多くのアトピー性皮膚炎患者で依然としてフィラグリンの発現が見られることから、フィラグリン遺伝子の異常とは別の原因で生じることが予想される。
【0010】
本発明者は、ヒト皮膚におけるブレオマイシン水解酵素の発現低下が、MMF産生機構の異常によって生じる皮膚バリアー機能の低下のみならず、主に免疫異常に起因するアトピー性皮膚炎や当該皮膚炎によって生じる乾燥皮膚等とも関係しているとの仮説のもと、乾燥肌ヒト試験による当該酵素の発現の変動を検証し、そしてその発現制御機構の解析等を行った。その結果、本発明者は、ブレオマイシン水解酵素の発現低下がアトピー性皮膚炎によって生じる乾燥肌と関連しており、且つ当該酵素をコードする遺伝子の5’フランキング領域内に当該酵素の発現を顕著に誘導する制御領域が存在することを見出した。詳しくは、本発明者は、BHの5’‐フランキング領域をクローニングした。その欠失分析では、−216bp上流の中にBHプロモーター活性に重要な領域が同定された。電気泳動移動度シフト・アッセイでは、試験管内において、MZF‐1、Sp‐1、及びインターフェロン調節因子(IRF)‐1/2がこの領域に結合できることを明らかにした。そのうえ、MZF‐1及びSp‐1モチーフの部位特異的突然変異誘発では、BHプロモーター活性が大きく低下した。これらのデータは、BH発現がMZF‐1及びSp‐1を介して上方制御されることを示唆した。興味深いことに、Th1サイトカインであるインターフェロン(IFN)‐γは、BHの発現を有意に減少させた。部位特異的突然変異誘発と低分子干渉RNAを用いた分析では、BH発現に対するIFN‐γの抑制効果を立証した。その一方、Th2サイトカインであるIL‐4は、BH発現に対して直接的な作用を全く示さなかった。しかしながら、それは培養ケラチノサイトにおいてMZF‐1及びSp‐1を下方制御したので、IL‐4がBH調整のサプレッサーとして働くことができることが示唆された。最後に、ADを患っている患者の皮膚においてBHの発現を調べた。BH活性と発現はAD病変皮膚において大きく減少していたので、ADにおけるフィラグリン分解経路の欠陥が示唆された。以上のとおり、本発明者は、BHの転写が分化中及び炎症中の両方で調節されているであろうことを見出した。従って、本発明者は様々な薬剤、生薬についてそのブレオマイシン水解酵素産生促進活性を調べたところ、所定の薬剤。生薬についてそのような活性があることを見出し、本発明を完成するに至った。
【0011】
本願は以下の発明を包含する。
(1)イザヨイバラエキス、トウキエキス、オウバクエキス、オドリコソウエキス、ローズマリーエキス、ベンゼンスルホニルGABA及びエリスリトールからなる群から選ばれる1又は複数を活性成分として含有する、ブレオマイシン水解酵素産生促進剤。
(2)天然保湿因子産生促進剤である、(1)のブレオマイシン水解酵素産生促進剤。
(3)乾燥肌改善剤である、(1)のブレオマイシン水解酵素産生促進剤。
(4)(1)〜(3)のいずれかのブレオマイシン水解酵素産生促進剤を、乾燥肌の改善又は予防を必要とする被験者に適用することを含んでなる、乾燥肌を改善又は予防する方法。
(5)乾燥肌がアトピー性皮膚炎によるものである、(4)の方法。
(6)乾燥肌の改善又は予防のための、(1)〜(3)のいずれかのブレオマイシン水解酵素産生促進剤の使用。
(7)乾燥肌がアトピー性皮膚炎によるものである、(6)の使用。
【発明の効果】
【0012】
本発明者により、新規のNMF産生促進剤や乾燥肌改善剤の提供が可能となる。
【図面の簡単な説明】
【0013】
【図1】テープストリッピングにより得られたヒト皮膚抽出液中のブレオマイシン酵素量とテープストリッピングの回数との関係を示すウェスタンブロット図。
【図2】ヒト皮膚抽出液中のブレオマイシン酵素量と乾燥肌との関係を示すウェスタンブロット図。T,A:乾燥を感じない被験者由来のサンプル;N:やや乾燥を感じる被験者由来のサンプル及び;M:乾燥を感じる被験者由来のサンプル。
【図3】ヒトの腕の角層抽出液中のブレオマイシン水解酵素量とその酵素活性との関係を示すグラフ。横軸の番号は被験者の識別番号を表す。
【図4】図3で得られたブレオマイシン水解酵素量と活性との関係についての最小二乗法による一次近似。
【図5】ヒトの腕の角層抽出液中のブレオマイシン水解酵素と皮膚パラメーター(A:遊離アミノ酸、B:活性、C:TEWL)に関する統計的解析。BH low: ブレオマイシン水解酵素量<10、活性<1.5(nmol/min/ml); BH high: ブレオマイシン水解酵素量≧10、活性≧1.5(nmol/min/ml)。
【図6】肌分類用アンケートフローチャート。
【図7】図6のフローチャートに従い分類された被験者の角層の皮膚パラメーター測定結果。
【図8】正常皮膚におけるブレオマイシン水解酵素及びフィラグリンの局在を示す組織染色図。
【図9】アトピー患者皮膚におけるブレオマイシン水解酵素及びフィラグリンの局在を示す組織染色図。
【図10】定量的PCRを用いたケラチノサイトの分化とブレオマイシン水解酵素の発現量との関係を示すグラフ。縦軸の値は、80%コンフルエントの発現量を1とした場合の相対量を表す。
【図11】ブレオマイシン水解酵素をコードする遺伝子の5’フランキング領域を示す模式図。
【図12】ヒト表皮ケラチノサイトを用いたBHプロモーターのルシフェラーゼアッセイの結果を示すグラフ。
【図13】転写因子SP1, MZF1及びGATA1の発現とUV照射との関係を示すグラフ。
【図14】正常ヒト表皮角化細胞におけるブレオマイシン水解酵素及びプロテアーゼの発現とUV照射との関係を示すグラフ。
【図15】BHの5’‐フランキング領域の連続的な5’‐欠失突然変異株をPCRによって作成するために使用したプライマー。
【図16】BH及び関連因子の転写レベルを定量的リアルタイムRT‐PCRによって分析するために使用したプライマー。
【図17】電気泳動移動度シフト分析に使用したプローブ。
【図18】(A)ヒトBHの5’−フランキング領域の模式図を示す。5’‐フランキング領域内の推定転写因子結合部位はGenome Net MOTIFプログラムによる検索で明らかにした。(B)欠失分析で決定されたBHのプロモーター領域。(C)BHの最小プロモーターの配列及び推定転写因子結合部位を含む−216/−1領域のヌクレオチド配列を示す推定転写因子結合部位に下線を付した。
【図19】(A)部位特異的突然変異誘発によるBHプロモーターにおける転写因子結合部位の特性決定。推定転写因子結合部位の欠失構築体の模式図及び培養ケラチノサイトにおけるそのルシフェラーザ活性を示す。部位特異的突然変異誘発は−616/+1領域のヌクレオチド配列をまたぐ構築体で実施した。(B)BHプロモーターのcis-作用エレメントに対するMZF‐1、Sp‐1、GATA‐1、又はIRF‐1/2の結合を示す。実験は、培養ケラチノサイトからの核抽出物、及び推定転写因子結合部位MZF‐1、Sp‐1、GATA‐1、又はIRF‐1/2を含むビオチン化二本鎖オリゴヌクレオチドプローブを用いる電気泳動移動度シフト・アッセイ(EMSA)で行った。レーン1は核抽出物でのビオチニル化プローブの結合プロフィール、レーン2は2倍過剰量の非ラベル化プローブと競合させた後のビオチニル化プローブの結合プロフィールを示す。
【図20】(A)BH発現のリアルタイムRT−PCR分析。BH遺伝子発現に対するTh1、Th2、及びTh17サイトカインの効果を示す。(B)IRF‐1/2結合部位の突然変異分析。IFN‐γの存在下での培養ケラチノサイトにおけるBHプロモーター活性を示す。ケラチノサイトをBHプロモーター領域のインタクトIRF‐1/2結合部位を含むpGL3−216でトランスフェクションし、IFN‐γで24時間処理した(上パネル)。ケラチノサイトを△pGL3−616(IRF‐1/2欠失突然変異体)でトランスフェクションし、10ng/mlのIFN‐γ又はIL−4の存在下又は不在下で24時間処理した(下パネル)。(C)IRF‐1/2がBHのIFN‐γ誘発性下方調節の必須メディエーターであるかどうか判断するための低分子干渉RNA(siRNA)を使用したIRF‐1及びIRF‐2遺伝子発現の測定。ケラチノサイトをIRF‐1又はIRF‐2のsiRNA(40nM)でトランスフェクションし、24時間培養し、10ng/mlのIFN‐γで処理し、さらに24時間培養してからRNA単離を行った。右パネルにはIRF‐1及びIRF‐2のサイレンシングの効果を示す。
【図21】(A)表皮における転写調節の機構を調査するためのリアルタイムPCR法による増殖型又は分化型細胞におけるBH、カルパインI、及び推定転写因子の発現分析。(B)培養ケラチノサイトにおける転写因子MZF‐1、Sp‐1、GATA‐1、IRF‐1及びIRF‐2発現パターン分析。
【図22】(A)推定転写因子IRF‐1及びIRF‐2の発現に対するIFN‐γの効果。(B)推定転写因子IRF‐1、IRF‐2、MZF−1及びSp−1の発現に対するIL‐4の効果。
【図23】(A)正常表皮での、抗BH抗体と抗フィラグリン抗体での二重染色により示される、顆粒層におけるBHとフィラグリンの同時局在。(B)AD患者の病変皮膚と非病変皮膚からの抽出物のBH活性。
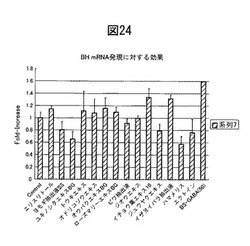
【図24】各種生薬及び薬剤のブレオマイシン水解酵素酸性促進効果を示す。
【発明を実施するための形態】
【0014】
ブレオマイシン水解酵素は分子量250〜280kDa(六量体)の細胞質システインペプチド加水分解酵素であり、当初知られていた機能は、癌の組み合わせ化学療法に頻繁に使用される糖ペプチドブレオマイシンの代謝不活性化である。システインタンパク質分解酵素パパインスーパーファミリーの特徴的な活性部位残基を含み、コード遺伝子はヒトでは遺伝子座17q11.2に存在する(Takeda et al., J Biochem., 119, 29-36, 1996)。あらゆる組織に存在し、皮膚におけるその存在も知られていたが(Kamata et al., J. Biochem., 141, 69-76, 2007)、フィラグリンとの関係については本発明者が明らかにするまで全く知られていなかった。
【0015】
組織染色の結果から、ブレオマイシン水解酵素は、フィラグリンと同様に、正常皮膚では表皮上層で多く発現していることが明らかになった(図8)。一方、アトピー性皮膚炎患者では、アトピー皮疹部で当該酵素及びフィラグリンの発現が低下する(図9)。これは、プロフィラグリン遺伝子の異常ではなく、その分解酵素系の異常がアトピー性皮膚炎の原因となることを強く示唆するものである。また、アトピー皮膚炎患者の皮膚では、病変部のみならず、非病変部でもブレオマイシン水解酵素活性は有意に低い(データは示さない)。
【0016】
更に、ブレオマイシン水解酵素の発現量の変動について培養ケラチノサイトを用いて検討した結果、当該酵素は、分化していないケラチノサイトではあまり発現していないのに対し、コンフルエントに達し分化が進んだケラチノサイトで高発現していること、基底細胞ではほとんど発現せず、分化が進み表皮細胞へと移行してから高発現することが分かった(図10)。この結果は、上記細胞染色の結果を裏づけている。ブレオマイシン水解酵素をコードする遺伝子の5’−フランキング領域、特に転写調節領域と、当該領域に結合する転写因子とを図11に示す。ブレオマイシン水解酵素の発現には、当該酵素のコード配列から少なくとも216bp下流までの領域を含んでいればよい。図11に記載の転写因子の中でも、この領域に含まれるIRF-1, IRF-2, MZF-1, SP-1, GATA-1の結合活性を亢進することで、ブレオマイシン水解酵素の発現は特に亢進すると考えられる。事実、ブレオマイシン水解酵素は、紫外線(UV)照射によってその発現が亢進されるところ(データは示さない)、MZF-1, GATA-1の発現亢進とUVの強度及び照射時間との間には相関関係が見られる(図13)。
【0017】
ブレオマイシン水解酵素産生促進は、サイトカインによっても影響を受ける。例えば、アトピー性皮膚炎に関与していることが知られている、Th2サイトカインの一種であるインターロイキン−4(IL-4)は、ブレオマイシン水解酵素の発現をダウンレギュレートする。これは、アトピー性皮膚炎患者の皮膚で見られるブレオマイシン水解酵素の低発現を裏付けるものである。一方、IL-4と反対にIgE産生を抑制する働きを有するTh1サイトカインの代表、インターフェロンγは、ブレオマイシン水解酵素の発現を有意に亢進する。また、Th2サイトカインで炎症性サイトカインの代表である腫瘍細胞壊死因子アルファ(TNFα)も当該酵素の発現を有意に亢進させる。これらの物質のみならず、ブレオマイシン水解酵素の発現及び/又は活性は、UV照射によっても亢進される。結果は示さないが、体表面の中でも、紫外線照射を受けやすい頬などの皮膚におけるブレオマイシン水解酵素の活性は、UV照射によって亢進されることが確認されている。
【0018】
イザヨイバラエキス、トウキエキス、オウバクエキス、オドリコソウエキス及びローズマリーエキスについては皮膚外用剤に使用されているものはあるが、いずれのエキスもブレオマイシン水解酵素産生促進効果、NMF産生促進効果、乾燥肌改善効果を有することは知られていない。ベンゼンスルホニルGABA(ベンゼンスルホニル−γアミノ酪酸)、エリスリトールも同様に、皮膚外用剤に使用されているものはあるが、いずれの薬剤もブレオマイシン水解酵素促進効果、NMF産生促進効果、乾燥肌改善効果を有することは知られていない。
【0019】
上記エキスは常法により得ることができ、例えばその起源となる植物の一部又は全部を抽出溶媒とともに常温で又は加熱して浸漬または加熱還流した後、濾過し、濃縮して得ることができる。溶媒抽出の前に、抽出部位を乾燥させてもよい。抽出溶媒としては、通常抽出に用いられる溶媒であれば任意に用いることができ、例えば、有機溶媒、例えばメタノール、エタノール、プロピレングリコール、1,3−ブチレングリコール、グリセリン等のアルコール類、含水アルコール類、クロロホルム、ジクロルエタン、四塩化炭素、アセトン、酢酸エチル、ヘキサン等、あるいは水性溶媒、例えば水、生理食塩水、リン酸緩衝液、ホウ酸緩衝液等を、それぞれ単独で、あるいは組み合わせて用いることができる。好ましくは、溶媒として、水、メタノール、エタノール、1,3−ブチレングリコールから選ばれる1種または2種以上が好適に使用される。
【0020】
上記溶媒で抽出して得られたエキスをそのまま、あるいは例えば凍結乾燥などにより濃縮したエキスを使用でき、また必要であれば吸着法、例えばイオン交換樹脂を用いて不純物を除去したものや、ポーラスポリマー(例えばアンバーライトXAD−2)のカラムにて吸着させた後、所望の溶媒で溶出し、さらに濃縮したものも使用することができる。
【0021】
イザヨイバラエキス、トウキエキス、オウバクエキス、オドリコソウエキス及びローズマリーエキスなどのエキスやベンゼンスルホニルGABA、エリスリトールなどの薬剤は、濃度依存的にブレオマイシン水解酵素産生促進作用を示す。従って、このような観点からは、本発明のブレオマイシン水解酵素産生促進剤中のイザヨイバラエキス、トウキエキス、オウバクエキス、オドリコソウエキス及び/又はローズマリーエキスなどのエキスの配合量は、剤全量中、乾燥物として0.0001〜20.0質量%、好ましくは0.0001〜10.0質量%、より好ましくは0.001〜1質量%である。ベンゼンスルホニルGABA及び/又はエリスリトールなどの薬剤の配合量は、剤全量中、乾燥物として0.0001〜20.0mmol、好ましくは0.0001〜10.0mmol、より好ましくは0.001〜1mmolである。
【0022】
本発明に係るブレオマイシン水解酵素産生促進剤は、常法に従って製造することができ、また同ブレオマイシン水解酵素産生促進剤を構成する成分として、上記エキスや薬剤1種又は2種以上単独でも調製可能であるが、通常医薬部外品を含む化粧品や医薬品等の皮膚外用剤等に用いられる成分、例えば油分、界面活性剤、粉末、色材、水、アルコール類、増粘剤、キレート剤、シリコーン類、酸化防止剤、紫外線吸収剤、保湿剤、香料、各種薬効成分、防腐剤、pH調整剤、中和剤等必要に応じて適宜配合される。
【0023】
本発明のブレオマイシン水解酵素産生促進剤の剤型は特に限定されるものではなく、例えば、溶液系、可溶化系、乳化系、粉末分散系、水−油二層系、水−油−粉末三層系、軟膏、ゲル、エアゾール等の任意の剤型をとることができる。また、使用形態も特に限定されるものではなく、例えば、化粧水、乳液、クリーム、エッセンス、ゼリー、ジェル、軟膏、パック、マスク、ファンデーション等の任意の形態をとることができる。
【0024】
本発明のブレオマイシン水解酵素産生促進剤は肌に適用することで、乾燥肌の予防及び/又は改善を図るための美容方法に利用できる。かかる美容方法における本発明のブレオマイシン水解酵素産生促進剤の用法、用量も特に限定されるものではなく、剤型や処置する肌のしわの状態により適宜決定されるが、典型的には、1日当たり数回、例えば1回〜5回、適量、例えば1平方cm2当たり0.1mlから1ml、肌に直接すり込むか、又その適量をガーゼなどに染み込ませてから肌に貼付することができる。
【0025】
以下、具体例を挙げて、本発明を更に具体的に説明する。なお、本発明はこれにより限定されるものではない。
【実施例】
【0026】
本実験では以下の材料を使用した。
カルパインIは、EMD Bioscience社より購入した。ブレオマイシン水解酵素は、ヒト表皮角層より、非特許文献5に従い作製した。ヒトIL‐4及びIFN‐γは、PEPROTECH EC(London, England)から購入した。ヒトIL‐13及びIL‐17A/Fは、R&D SYSTEM(MINNEAPOLIS, MN)製のものとした。シトルリン4‐メチルクマリル‐7‐アミド(Cit‐MCA)をBachem Bioscience(Bubendorf, Switzerland)から入手した。使用される他のすべての化学物質は、試薬グレードのものであった。
【0027】
ケラチノサイトの培養
新生児期表皮由来の正常ヒト表皮ケラチノサイト(Kurabo、Osaka, Japan)を、低濃度(0.03mM)のカルシウム、及びHKGS Growth Supplement(Cascade Biologics)を含むEpiLife培地(Cascade Biologics、Portland, OR)中で培養した。すべての細胞を5%のCO2を加えながら37℃にてインキュベートし、そして継代4代以内に使用した。ケラチノサイトを、コンフルエント70%、コンフルエント100%、コンフルエントの2日後、及び2mMのカルシウム中コンフルエントの2日後に採取した。
【0028】
実験1
ブレオマイシン水解酵素は、NMF産生の最終段階で働いていると考えられる。この場合、乾燥肌では本酵素の発現が低下している可能性がある。本実験では、皮膚におけるブレオマイシン水解酵素の発現及び/又は活性の低下が、乾燥肌と関連しているか否かについて検討した。
【0029】
皮膚角層試料は、透明粘着テープ(セロテープ(登録商標)(NICHIBAN))を腕の皮膚表面に貼付したのち剥離するテープストリッピングにより採取した。皮膚角層の付着したこのテープを裁断、抽出バッファー(0.1M Tris-HCl(pH8.0), 0.14M NaCl, 0.1% Tween-20, 1ml)に浸漬、超音波処理(20 sec ×4)にかけ、角層抽出液を作成した。当該抽出液をウェスタンブロットにかけた。使用した抗ブレオマイシン水解酵素(BH)抗体は、鎌田ら(Journal of Biological Chemistry 2009)により作製された抗体を用いた。具体的には、角層抽出液をSDS電気泳動後、Immobilon-P (Millipore社)に転写し、この転写された膜を洗浄後、抗BH抗体と室温で1時間反応させた。さらに洗浄により抗体を除去したのち、HRP結合二次抗体を反応させた。洗浄後、ECL Plus Western Blotting Detection Kit (GE Healthcare)により発光させたBH蛋白バンドをX線フィルムに焼付け、バンドの濃淡により、発現量を推定した。結果を図1及び図2に示す。
【0030】
図1中、検体1は本人が乾燥肌と自分で思っている人の皮膚角層試料であり、検体2は乾燥肌ではないと考えている健康な学生の皮膚角層試料である。また、図2中の検体T及びAは、乾燥を感じない被験者由来のものであり、検体Nはやや乾燥すると感じる被験者、そして検体Mは乾燥を感じる被験者由来のものである。検体1中のブレオマイシン水解酵素の発現量は少なく、一方、検体2中の当該酵素発現量は多い。この結果から、検体1、2は、それぞれ乾燥肌、潤い肌に由来するものであることがわかる。また、検体1を用いた結果からは、乾燥肌では、NMF産生の場である表皮表面に近いほど、ブレオマイシン水解酵素量が低下していることがわかる。図2において、検体TおよびAは、特に乾燥を感じない検体から得られた抽出液、検体NおよびMは、乾燥を強く意識する検体から得られた抽出液のウェスタンブロット像を示す。
【0031】
実験2
本実験では、ヒト皮膚におけるブレオマイシン水解酵素の量や活性の個体差と、当該酵素量と活性の相関とについて検討した。実験1に記載の方法に従い、20〜25才の女子学生40名の腕の皮膚から角層抽出液を作成した。当該抽出液中のブレオマイシン水解酵素量とその酵素活性を、Kamata et al (J. Biol. Chem., Vol. 284, Issue 19, 12829-12836, May 8, 2009)らの方法に従い測定した。発現量はウェスタンブロットにより、そして酵素活性は、当該酵素のアミノペプチダーゼ活性について、蛍光基質であるCit−β−NAの分解量を測定することで評価した。結果を図3に、そしてその相関図を図4に示す。図4の結果から明らかなように、ブレオマイシン水解酵素量とその活性との間には相関関係が存在している。
【0032】
続いて、上記角層抽出液について、ブレオマイシン水解酵素と様々な皮膚パラメーターに関して統計的な解析を行った。本実験では、40人の角層抽出液を以下の2種類に分類した。ウェスタンブロットの結果から明らかとなったブレオマイシン水解酵素量をデンシトメーターで数値化した後、1を任意の単位として表示した場合にブレオマイシン水解酵素量が10未満であり、且つ当該酵素の活性が1.5nmol/min/ml未満である抽出液:ブレオマイシン水解酵素のタンパク質量が少なく、且つ活性が低いもの(BH low);それ以外のもの:タンパク質量が多く、且つ活性が高いもの(BH high)。
【0033】
遊離アミノ酸は、Kamata et al (J. Biol. Chem., Vol. 284, Issue 19, 12829-12836, May 8, 2009)らの方法に従い測定した。具体的には、カルパインIで分解したフィラグリンペプチドと各抽出液とを反応させ、フルオレサミンを用いてアミノ基を定量することで遊離アミノ酸量を測定した。遊離アミノ酸の測定結果を図5Aに示す。図5A中の縦軸の単位は、測定試料3ml中の総遊離アミノ酸量(nmol)を表す。
【0034】
ブレオマイシン水解酵素の活性は、上述のとおり、当該酵素のアミノペプチダーゼ活性を、蛍光基質であるCit−β−NAの分解量を測定することで評価した。ブレオマイシン水解酵素活性の測定結果を図5Bに示す。図5B中の縦軸の単位は、Cit−β−NAの分解量(nmol/min/ml))を表す。
【0035】
上記学生の皮膚のTEWL は、Vapometer (Delfin Technologies, Ltd, Finland)を用いて測定し、 g/m2/hとして表示した。TEWLの測定結果を図5Cに示す。
【0036】
図5Cに示すとおり、ブレオマイシン水解酵素活性の低い群(2.5U<)と高い群とでは、角層水分量に有意な差が存在していた。更に、当該酵素の量と活性の両方が低い群では、遊離アミノ酸が少なく、そしてTEWLも高い(図5A及び5C)。
【0037】
データは示さないが、遊離アミノ酸の低い群(1000<)と高い群とでは、NMF、ウロカニン酸の量に有意な差が、そしてNMFの低い群(0.8<)と高い群とでは、ウロカニン酸に有意な差が存在していた。また、TEWLの低い群(2.5<)と高い群とでは、NMF、乳酸、尿素に有意な差が存在していた。ウロカニン酸がフィラグリンに多数含まれるヒスチジンより作られることを考慮すると、ブレオマイシン水解酵素がフィラグリン分解において重要であることが分かる。
【0038】
本実験の結果から、ブレオマイシン水解酵素の絶対量が少ない場合、遊離アミノ酸量及びバリアー機能が共に有意に低下することが分かる。データは示さないが、頬由来の角層抽出液を用いた場合でも、ブレオマイシン水解酵素量とバリアー機能との比例関係が確認されている。
【0039】
実験3
本実験では、図6に記載のフローチャートに基づいて上記女子学生にアンケートを行い、各学生の肌を潤い肌、乾燥肌、乾燥型脂性肌、脂性肌の4つ分類した。アンケート結果と、上記実験2で測定した皮膚パラメーターの結果との相関関係を図7に示す。図7からは、脂性乾燥肌と分類された学生のブレオマイシン水解酵素活性が有意に高いことが分かる。
【0040】
実験4
本実験では、皮膚におけるブレオマイシン水解酵素とフィラグリンの局在について検討する。
【0041】
免疫組織化学染色
免疫組織化学染色は、Kamata et al (J. Biol. Chem., Vol. 284, Issue 19, 12829-12836, May 8, 2009)に記載の方法により行った。材料は5μm厚のヒト皮膚の冷凍切片、そして抗ラットBH IgGを用いた。詳しくは、ヒト皮膚標本を、インフォームドコンセントの上で、東京医科大学のアトピー性皮膚炎を患っている患者から得た。本研究は、倫理(Human Ethics)に関する東京医科大学施設内審査委員会と資生堂特別部会によって承認された。
ヒト・アトピー性皮膚炎(病変皮膚と非病変皮膚)及び正常皮膚の切片を、抗ラットBH IgG及び抗ヒト・フィラグリンIgGと共に室温にて1時間インキュベートし、その後、PBSで洗浄し、そして蛍光結合二次抗体であるAlexa Fluor 555又は488(Molecular Probes Inc.、Eugene, OR)と共にさらにインキュベートした。DAPI(4’,6’‐ジアミジノ‐2‐フェニルインドール;Molecular Probes)を核の可視化に使用した。
【0042】
正常皮膚の組織染色結果を図8に、そして健常者由来の皮膚(正常皮膚)とアトピー性皮膚炎患者由来の皮膚(アトピー皮疹部)との対比結果を図9に示す。図8に示すとおり、ブレオマイシン水解酵素は、表皮上層で高発現しており、フィラグリンと同一局在を示した。一方、アトピー皮疹部では、正常皮膚と比較してブレオマイシン水解酵素及びフィラグリンの発現が低かった(図9)。
【0043】
定量的PCR
ケラチノサイトにおけるブレオマイシン水解酵素の発現量は、以下の方法で、定量的PCRにより測定した。Light Cycler 480 (Roche Diagnostics GmbH, Mannheim, Germany, 試薬はLight Cycler FastStart DNA Master CYBR Green Iを用いた。SYBR Green I master mix 10 μlに以下のブレオマイシン水解酵素プライマーをそれぞれ 0.6 μl、水を6.8 μl加え、全量を20 μlとし、95℃ 15秒、55℃ 20秒、72℃ 20秒で、45サイクルのPCRを行なった。得られた結果は、ハウスキーピング遺伝子であるG3PDHの結果と比較して補正した。
フォワードプライマー: TGTGGTTTGGCTGTGATGTT (配列番号1)
リバースプライマー: GCACCATCCTGATCATCCTT (配列番号2)
【0044】
上記定量的PCRの結果を図10に示す。図10に示すとおり、ブレオマイシン水解酵素は、80%コンフルエントのケラチノサイト、すなわち、分化していないケラチノサイトと比較して、コンフルエントに達した、すなわち、分化したケラチノサイトで高発現していた。言い換えると、本実験結果から、当該酵素が分化前の基底細胞ではあまり発現しないことが分かる。この定量的PCRの結果は、上記組織染色の結果を裏付けるものである。
【0045】
実験5
1)ヒト表皮ケラチノサイトを用いたBHプロモーターのルシフェラーゼアッセイ:
増殖期(約80%コンフルエント)もしくは、分化後(コンフルエント後、空気曝露し、2 mMカルシウムを添加し、さらに2日培養を継続したもの)のケラチノサイトに、Lysis buffer(200 μlを加え、細胞を溶解させる。測定には、Bright-Glo Luciferase assay System (Promega Co., Madison, WI, USA)を用いた。サンプル20 μlを所定のチューブに移し、Auto Lumat Plus (LB953)8Berthhold GmbH & Co. KG. Bad Wildbad Germany)を用いて測定した。図12の結果から、ブレオマイシン水解酵素が発現するには、上記転写調節領域は、当該酵素のコード配列から少なくとも216bp下流までの領域を有していればよいことが分かる。
【0046】
2)NHEKへのUV照射:
30 mJもしくは、60 mJのUVBを照射し(Torex Fl20S-E-30/DMR, 20W, Toshiba Medical Supply)、3時間後、24時間後、48時間後に所定の方法にてRNAを回収し、定量PCRにより、ブレオマイシン水解酵素及びカルパインのmRNA発現を測定した。測定の結果、30mJ照射後48時間で回収した試料が最もブレオマイシン水解酵素のmRNAを発現していた(図13)。
【0047】
3)ブレオマイシン発現に及ぼすサイトカインの影響
IL-4 (終濃度:0.1, 1.0, 10 ng/ml)、TNFα(終濃度:0.1, 1.0, 10 ng/ml)、IFNγ(終濃度: 1.0, 10, 100 ng/ml)のそれぞれを、増殖期の培養ケラチノサイトに添加し、24時間インキュベートした後、Isogenを用いてRNAを採取した。定量PCRにより、ブレオマイシン水解酵素のmRNA発現を測定した。結果を図14に示す。図14の結果から、Th2サイトカインの一種であるインターロイキン−4(IL-4)は、ブレオマイシン水解酵素の発現をダウンレギュレートすることが分かる。
【0048】
実験6
ヒトBH遺伝子の特性決定
1)BHの5’‐フランキング領域のクローニング
ヒトBH遺伝子のヌクレオチド配列に基づいて、5’‐フランキング領域を、遺伝子特異的プライマー1(GSP1)、5’‐tccctcgagtctgtatcagagcagctaca‐3’(配列番号3)と遺伝子特異的プライマー2(GSP2)、5’‐tgaacacgcgtccgagctgctcatggcg‐3’(配列番号4)を使用して、製造業者の取扱説明書に従いGenome Walker Kit(Clontech、Mountain View, CA)を用いて増幅した。簡単に言えば、5%のジメチルスルホキシドの存在下、Ex Taq DNAポリメラーゼ(Takara、Shiga, Japan)を用いる、製造業者によって推奨されるツーステップPCRプロトコール:94℃にて25秒間、そして72℃にて4分間を7サイクル、それに続いて94℃にて25秒間、そして67℃にて4分間を32サイクル、そして最後の伸長67℃にて4分間、を使用して、GSP1とアダプタープライマー(AP)1を用いた一次PCRを実施した。次いで、一次PCR混合物を希釈し、そしてGSP2とAP2を用いた二次PCR増幅の鋳型として使用した。7サイクルの代わりに5サイクルの初回サイクルと、それに続く32サイクルの代わりに20サイクルの使用を除いて、二次PCRは一次PCRと同一であった。BHの5’‐フランキング領域の連続的な5’‐欠失突然変異株を、図15に列挙したプライマーを使用したPCRによって産出した。増幅後に、すべてのPCR産物をpGEM‐T簡易ベクター(Promega、Madison, WI)内にクローン化し、そしてABI Prism 310 Genetic Analyzer(Applied Biosystems、Foster City, CA)を用いて配列決定した。
【0049】
レポーター・プラスミドpGL3‐1216/+1を構築するために、PCRを、以下の条件下:最初の変性94℃にて4分間、94℃にて30秒間、60℃にて1分間、72℃にて1分間を30サイクル、そして最後に伸長72℃にて4分間、鋳型としてのpGEM‐T‐1216/+1、並びに制限部位Kpn I及びMlu Iを含む1組の特異的なBHプライマー(5’‐ccgggtaccatcagagttccttagaa‐3’(配列番号5)及び5’‐taaatacgcgttggcgcccacgctgccg‐3’)(配列番号6)を使用して実施した。得られたPCR産物を、Kpn I及びMlu Iで消化し、そしてpGL3‐Basicベクター(Promega)内にクローニングした。なお、pGL3‐Basicベクターは、ホタル・ルシフェラーゼ遺伝子を含んでいる。構築物のすべてを、QIAGEN Plasmid Midi Kit(QIAGEN、Duesseldorf, Germany)を使用することで調製した。
【0050】
2)部位特異的突然変異誘発
MZF‐1、Sp‐1、及びIRF‐1/2結合部位の突然変異誘発を、製造業者の取扱説明書に従ってQuick change site‐directed mutagenesisキット(Stratagene、La Jolla, CA)を使用することによって実施した。Sp‐1に欠失変異を作製するために、5’‐ggaccccgtttcagcctccccgcc-3’ (配列番号7)(突然変異体Sp‐1部位の順方向プライマー)と5’‐ggcggggaggctgaaacggggtcc‐3’ (配列番号8)(突然変異体Sp‐1部位の逆方向プライマー)を使用した。MZF‐1突然変異体については、5’‐gactcagcaacgcggttttgtccctccgc‐3’(配列番号9)(突然変異体MZF‐1部位の順方向プライマー)と5’‐gcggagggacaaaaccgcgttgctgagtca‐3’(配列番号10)(突然変異体MZF‐1部位の逆方向プライマー)を使用した。IRF‐1/2突然変異体については、5’‐gccgccgagcctccggcgctcc‐3’ (配列番号11)(突然変異体IRF‐1/2部位の順方向プライマー)と5’‐ggagcgccggaggctcggcggc‐3’ (配列番号12)(IRF‐1/2部位の逆方向プライマー)を使用した。
【0051】
3)トランスフェンクションとプロモーター活性の計測
ケラチノサイトを、5×104細胞/ウェルの密度にて12ウェル組織培養プレート内で培養し、そしてFuGene HD Transfection試薬(Roche Diagnostics、Basel, Switzerland)を使用して、それぞれの構築物1μgを用いてトランスフェンクションした。トランスフェンクション効率を補正するために、すべての細胞にHSV‐TKプロモーターの制御下にあるウミシイタケ(Renilla)ルシフェラーゼ遺伝子を含むpGL4.74[hRluc‐TK]ベクターPromega)を同時トランスフェンクションした。特に断りのない限り、細胞を、トランスフェンクションの24時間後に採集し、そして1ウェルあたり250μlのPassive lysisバッファー(Promega)を用いて溶解した。ルシフェラーゼ活性を、Dual Luciferase Reporter Assay System(Promega)及びAutolumat plus luminometer(Berthold Technologies、Bad Wildbad, Germany)を用いて分析した。ホタル・ルシフェラーゼ活性を、ウミシイタケ・ルシフェラーゼ活性について標準化した。各構築物について、3つのトランスフェンクションを独立に実施し、そして結果を平均値として表した。
【0052】
4)定量的リアルタイムRT‐PCR分析
BH及び関連因子の転写レベルを、定量的リアルタイムRT‐PCRによって分析した。全RNAを、製造業者の取扱説明書に従ってISOGEN(Nippon Gene、Tokyo, Japan)を用いて培養細胞から抽出した。SuperScript(商標)II(Invitrogen、Carlsbad, CA)を用いてcDNAに逆転写した。リアルタイムRT‐PCRを、製造業者の取扱説明書に従ってLightCycler 480 SYBR Green I Master(Roche Diagnostics)を使用してLightCycler raid cyclerシステムにより実施した。使用したプライマーに関する情報を、図16に示す。グリセルアルデヒド‐3‐リン酸デヒドロゲナーゼ(GAPDH)を基準遺伝子として使用した。増幅した断片の特異性を、LightCycler分析ソフトウェアによる融解曲線の定量分析によって確認した。mRNAの量を、GAPDHのmRNAに対して標準化し、そして最終的に未処理対照のmRNAに対する比として示した。
【0053】
5)IRF‐1及び‐2のsiRNAベースの抑制
培養ケラチノサイトを、製造業者の取扱説明書に従って、40nMのsiIRF‐1、siIRF‐2、及びsiControl A(Santa Cruz Biotechnology、Santa Cruz, CA)と共にLipofectamine RNAi Max(Invitrogen、Carlsbad, CA)を使用してトランスフェンクションした。その細胞を、抗生物質不含培地中で24時間培養し、その後、全RNAを抽出し、そして上記したように、リアルタイムRT‐PCRによって分析した。
【0054】
6)電気泳動移動度シフト分析(EMSA)
二本鎖オリゴヌクレオチドプローブを、一本鎖ビオチン化オリゴヌクレオチドと一本鎖未標識オリゴヌクレオチドをアニーリングすることによって調製した(図17)。核の抽出とEMSAを、Nuclear Extractionキット及びEMSA gel shiftキット(Panomics、Santa Clara, CA)を使用することで実施した。核抽出物(4μg)を、1×結合バッファー及び1μgのポリd(I‐C)、並びにMZF‐1、Sp‐1、IRF‐1/2、及びGATA‐1結合部位に対応するビオチン化プローブ(50pmol)と共に15℃にて30分間インキュベートした。競合アッセイのために、2倍の過剰の未標識プローブを、ビオチン化プローブの添加前に結合反応に加えた。これらのインキュベーション混合物を、次に、0.5×TBEバッファーと共に8%のポリアクリルアミドゲル中で電気泳動し、そしてBiodyne Bナイロン膜(Pall、Port Washington, NY)に転写した。EMSA gel shiftキットの中の化学発光検出試薬を使用することで、バンドを可視化した。
【0055】
7)結果
ヒトBH遺伝子プロモーターの単離と特性決定
Genome Net MOTIFプログラムによる検索で、ヒトBHの5’‐フランキング領域内の多数の推定転写因子結合部位が明らかになった(図18A)。特に、転写開始部位の位置に近い−216/+1領域の中に、MZF1、Sp‐1、IRF‐1/2、及びGATA‐1/2によって認識されるコンセンサス配列によく合致した配列が存在したので、これらの転写因子がBHプロモーター活性の調整にかかわっていることが示唆された。より厳密にBHのプロモーター領域を決定するために、欠失分析を実施した(図18B)。最高レベルのルシフェラーゼ活性を、pGL3‐816でトランスフェンクションした分化型ケラチノサイトにおいて検出した。しかしながら、欠失プラスミドの相対ルシフェラーゼ活性は、欠失がpGL3‐216に進むまで高いままで残っていた。構築体の中で、(pGL3‐444と表示)断片−444/+1を含むプラスミドは、培養ケラチノサイトにおいて有意に低い活性を示し、−616/−444領域における上流サプレッサー活性の存在が示唆された。これらの結果が−216/−1領域がBH遺伝子転写のための最小プロモーターを含んでいることを実証したので、そのヌクレオチド配列を図18Cに示す。この配列はTATA‐又はCCAAT‐ボックスを含んでいなかったので、この遺伝子のハウスキーピング性質が示唆された。その一方で、いくつかの転写性因子結合部位、例えばMZF‐1、Sp‐1、IRF‐1/2、及びGATA‐1/2などがこのコア・プロモーター領域に存在していた。
【0056】
BH遺伝子調節に関与する潜在的cis‐エレメントの同定
BH遺伝子発現の転写調節に関与する最小プロモーターの潜在的cis‐エレメントを決定するために、各cis‐エレメントを標的とした新しい一連の欠失突然変異株を構築した。MZF‐1、Sp‐1、及びIRF‐1/2の結合部位を欠失した場合、プロモーター活性が大きく下方制御された(図19A)。
さらに、これらの転写因子が推定結合部位のそれぞれに実際に結合できるかどうか調査した。このために、電気泳動移動度シフト・アッセイ(EMSA)を培養ケラチノサイトからの核抽出物、及びMZF‐1、Sp‐1、GATA‐1、又はIRF‐1/2結合部位を含むビオチン化二本鎖オリゴヌクレオチドプローブを用いて実施した。図19Bに示されているように、Sp‐1、MZF‐1、及びIRF1/2は、BHプロモーターの対応する標的部位に結合したが、GATA‐1/2は結合しなかった。これらの結果は、−216〜−105bpのプロモーター領域のこれらの結合部位が、BH転写のためのcis‐エレメントに不可欠であることを示している。
【0057】
BH遺伝子発現のサイトカイン媒介性調節
BHはNMF産出酵素であるので、それがADの病態生理に関与する可能性もある。よって、BH遺伝子発現に対するTh1、Th2、及びTh17サイトカインの効果を調べた。図20Aは、増殖型ケラチノサイトにおいて、Th1サイトカインであるIFN‐γが、用量依存的様式でBH mRNA発現を下方制御したことを示した。その一方、Th2及びTh17サイトカインは、BHの発現に対して有意な効果を全く示さなかった。同様の結果が分化型ケラチノサイトによって得られた(データ未掲載)。BH遺伝子発現の調整におけるIFN‐γの役割を解明するために、プロモーターアッセイを実施して、サイトカイン応答要素を特定した。図20Bに示されているように、IFN‐γは、−131〜−120の間にIRF‐1/2結合配列を含んだpGL3‐BH‐616でトランスフェンクションした培養ケラチノサイトにおいてBHプロモーター活性を下方制御した。この配列の欠失後には、IFN‐γがプロモーター活性を抑制することはもうなかった(図20B)。加えて、IRF‐1/2がBHのIFN‐γ誘発性下方調節の必須メディエーターであるかどうか判断するために、低分子干渉RNA(siRNA)を使用して、IRF‐1及びIRF‐2遺伝子発現を抑制した。IFN‐γの活性は、IRF‐1又は‐2 siRNA(40nM)のいずれかでトランスフェンクションした培養ケラチノサイトにおいて有意に抑制された(図20C)。これらの結果は、IRF‐1/2結合配列がBH遺伝子発現のIFN‐γ誘発性下方調節に不可欠であることを強く示唆している。
【0058】
培養ケラチノサイトにおけるBH及び関連因子の発現
表皮における転写調節の機構を調査するために、リアルタイムPCR法によって増殖型又は分化型細胞におけるBH、カルパインI、及び推定転写因子の発現を分析した。図21Aに示されているように、BH mRNAは、例えば、増殖型ケラチノサイトと比較した、集密期の2日後のもの(3.6倍)、及び高カルシウム濃度にて培養したもの(8.6倍)などのように、分化型ケラチノサイトにおいて上方制御された。これらの結果は、プロモーターアッセイデータと一致している(図18B)。同様の結果を、カルパインI(約2.5倍の上方制御)に関して得た。また、培養ケラチノサイトにおいて、様々な転写因子、例えば、MZF‐1、Sp‐1、GATA‐1、IRF‐1及びIRF‐2などの発現パターンを調べた。図21Bに示されているように、これらの転写因子は、BHの発現に沿って、分化型ケラチノサイトにおいて上方制御された。しかしながら、GATA‐1 mRNA発現は、他の因子と比較して有意に低かった(<1/32)。GATA‐1はケラチノサイトにおいて重要な役割を担っていないように思われる。よって、BHがMZF‐1及びSp‐1を介して分化依存的様式で合成されることを示唆する。IRF‐1及びIRF‐2がまた、分化刺激によっても上方制御されたという事実は、BH発現がIFN‐γに対して非常に感受性であることを示している。
【0059】
推定転写因子の発現に対するTh1及びTh2サイトカインの効果
これらの転写因子のサイトカイン依存性調節についてさらに調査した。図22Aは、IFN‐γが、用量依存式にIRF‐1 mRNA発現を強く上方制御したことを示す。同様に、IRF‐2発現は、IFN‐γの存在下で上方制御された。対照的に、IRF‐1及びIRF‐2の発現は、100ng/mlにおいてのみIL‐4の存在下で有意に増強された(図22B)。興味深いことに、MZF‐1及びSp‐1は共に、10ng/mlのIL‐4の存在下で最も効果的に下方制御された(図22C)。これらの結果は、BH発現が、それぞれ、直接的及び間接的にTh1及びTh2サイトカインによって調節されていることを示唆している。
【0060】
アトピー性皮膚炎皮膚においてBHは下方制御される
FLGの機能喪失型突然変異はADの発症機序に関連するが、遺伝子欠損だけではなく、分解経路の障害もまたADの病理に関連する可能性がある。そのため、AD患者の病変皮膚及び非病変皮膚におけるBH及びフィラグリンの局在、並びにBH活性を次に調べた。正常表皮では、抗BH抗体と抗フィラグリン抗体での二重染色は、上面表皮における、特に、先に報告されたように、顆粒層におけるBHとフィラグリンの同時局在を示した(図23A)。より高い倍率では、BHが顆粒層から角化層までに局所している一方で、フィラグリンが顆粒細胞に限定されていることが明確に示された。対照的に、BH発現は、この研究で診察したAD患者(n=7)の病変皮膚及び非病変皮膚において劇的に減少した。これらの患者のすべては、有意な染色が常に検出されたにもかかわらず、比較的弱いフィラグリン染色を示した(図23A)。免疫組織化学に加えて、BH活性を18人のAD患者及び30人の健常ボランティアから得たテープ剥離サンプルからの角質細胞抽出物において計測した。AD患者の病変皮膚と非病変皮膚からの抽出物は、健常人からのそれと比較して、(それぞれ27.1と8.8%まで)実質的に低いBH活性を示した(図23B)。これらの結果は、BHがフィラグリンと同時局在化され、そしてその活性がADを患っている患者の皮膚において劇的に低減されることを実証した。
【0061】
考察
この研究では、BH遺伝子発現の調節機序を、プロモーター領域のクローニング及び機能の特徴づけによって研究した。プロモーター解析では、−216bp上流の中にBHプロモーター活性にとって重要な領域を同定した(図18B)。この領域では、推定MZF‐1及びSp‐1結合部位が、BHプロモーター活性に対して有意な効果を示した(図18C及び19A)。興味深いことに、Sp‐1及びMZF‐1もまた、フィラグリン分解の開始にとって重要な酵素であるPAD1の調整に関与することが報告されている。Sp‐1は、哺乳動物細胞において転写因子として機能するジンク・フィンガー・タンパク質のSp/Kruppel様ファミリーの典型的なメンバーである。増殖、アポトーシス、分化、及び腫瘍性形質転換を含めた細胞機能のほとんどすべての面に関与すると考えられる。ヒト表皮において、Sp‐1は、インボルクリン、ロリクリン、トランスグルタミナーゼ、PAD1、2、及び3のそれを含めて、表皮分化に参加する遺伝子の重要な調節因子である。MZF‐1は、ジンク・フィンガー・タンパク質のKruppleファミリーに属する転写因子であり、分化全能性造血性細胞、並びに骨髄始原細胞において発現される。しかしながら、哺乳動物表皮における転写調節でのMZF‐1の機能は報告されていない。増殖型ケラチノサイトと比較して、分化型ケラチノサイトにおいてMZF‐1及びSp‐1、並びにBHを同時に上方制御することを見つけ(図21B)、ハウスキーピング的な役割よりむしろ分化におけるBHの役割を示した。我々の結果は、これらの転写因子がケラチノサイト最終分化中のBHの基本的な転写調節のための活性化因子として機能することを明確に示した。
その一方で、cis作用エレメントの調査は、この領域内のIRF‐1/2結合部位をさらに規定した。EMSAを使用して、BHプロモーター領域へのIRFsの直接結合を確認した(図19B)。この結合配列の部位特異的突然変異誘発は、BHプロモーター活性の有意な減少をもたらした(図19A)。そのため、IRF‐1/2転写因子もまた、基本条件の下、BH遺伝子の最小プロモーター活性に必要であろう。IRFファミリーは転写因子の群であり、今までのところ、9つのIRFメンバー(IRF‐1〜‐9)が様々な細胞型及び組織で同定された。これらのIRF分子は、IFN‐α、β、及びγによる刺激の下で、抗ウイルス防御、免疫応答/調節、及び細胞成長調節において役割を果たしている。IRF‐1及び‐2は、多くのIFN‐γ誘導性遺伝子の調整に関与する作動薬‐拮抗薬対として機能することが示されている。興味深いことに、IFN‐γは、BH mRNA発現を顕著に抑制した(図20A及びB)。ノックダウン及び部位特異的突然変異誘発分析では、IRF‐1/2結合部位がBH発現のIFN‐γ媒介性抑制に関与することを確認した(図20B及びC)。これらの結果は、IRF‐1/2がヒトケラチノサイトにおけるBH遺伝子のIFN‐γ媒介性下方調節のメディエーターであることを明確に示している。その一方で、Th2サイトカインであるIL‐4及びIL‐13は、24時間のインキュベーションの間、直接的な作用をまったく示さなかった(図20A)。しかしながら、これらのTh2サイトカインは、アクチベーター分子であるMZF‐1及びSp‐1の発現を有意に抑制した。よって、Th2サイトカインがBH発現を負に調節するのは妥当なことである。
【0062】
また、BHが病変及び非病変AD皮膚において劇的に下方制御されたことも示した(図23A及びB)。フィラグリン突然変異はADなどのバリアー障害関連疾患の主な危険因子であるが、突然変異分析では、アイルランドでの発生の50%未満、そして日本での〜20%の割合しか占めていないことが指摘された。フィラグリン合成不全だけではなく、フィラグリンの分解傷害もバリアー機能の崩壊に関与すると仮定した。NMFの減少が乾燥肌をもたらし、それがバリアーの崩壊を進行させることは明確である。ADがTh2極性化疾患であることは周知である。しかしながら、最近の報告は、Th1サイトカインもまたADにおいて役割を担っていることを示唆している。例えば、「内因性AD」は、IL‐4、IL‐5、及びIL‐13の低い発現、及びIFN‐γの高い発現によって免疫学的に特徴づけられる。加えて、Th1からTh2へのシフトが、AD皮膚における急性相から慢性相への間に起こる。我々の結果は、ADにおいて、IFN‐γが考えられていたより重要な役割を担っている可能性もあることを示している。
【0063】
結論として、我々の結果は、ヒト表皮におけるBH転写が二重様式で調節されることを示している。一方の経路はケラチノサイト最終分化の制御下にあり、そして、もう一方はTh1及びTh2サイトカインに依存している。これらの経路は、相互に関連しているので、バランスがBH発現の下方調節に向かって容易にシフトするであろう。BHの低下がNMFの不足をもたらし、それを受けて乾燥肌か、さらにはバリアーの崩壊につながる。これらの結果は、BH調整とADの発症機序への新しい見識を提供する。
【0064】
実験7
ブレオマイシン水解酵素産生促進効果を示す薬剤・生薬のスクリーニング
正常な包皮に由来するヒトケラチノサイト(Cascade Biologics社、ポートランド、メリーランド州)を、上皮増殖因子(0.1ng/ml)、インスリン(10μg/ml)、ヒドロコルチゾン(0.5μg/ml)、ウシ下垂体抽出物(0.4%)、ゲンタマイシン(50μg/ml)、アンホテリシンB(50ng/ml)を補足したMCDB 153培地からなるケラチノサイト増殖培地の中で、図24に示す各種生薬エキス又は薬剤(5-50 μg/ml)の存在下で24時間室温で培養した。コントロールとしては、0.1% 1,3−ブチレングリコールを用いた。
【0065】
RT−PCR
上記のとおりに培養したヒトケラチノサイトから単離した全RNA(500ng)を、ランダム・ヘキサマーとSuperscript II RNアーゼH-逆転写酵素(Gibco-BRL社、ゲサースバーグ、メリーランド州)を用いて逆転写した後、Taq DNAポリメラーゼ(Takara社、京都、日本国)と下記のプライマーを用いてPCR増幅した。94℃で30秒間、60℃で1分間、72℃で1分間という増幅サイクルを40回実行した。
【0066】
図24の結果より、コントロールと比較して、イザヨイバラエキス(10μg/ml)、トウキエキス(10μg/ml)、オウバクエキス(10μg/ml)、オドリコソウエキス(10μg/ml)及びローズマリーエキス(10μg/ml)などのエキスやベンゼンスルホニルGABA(50μg/ml)、エリスリトール(50μg/ml)が、ブレオマイシン水解酵素の発現を有意に亢進させることが分かる。従って、これらの抽出がいずれもブレオマイシン水解酵素の発現を促進することがわかった。PCRに使用したプライマーは以下のとおりである。
フォワードプライマー: 5’‐TGTGGTTTGGCTGTGATGTT‐3’(配列番号13)
リバースプライマー: 5’‐GCACCATCCTGATCATCCTT‐3’(配列番号14)
また、内部対照としてGAPDHをPCR増幅し、使用したプライマーは下記のとおりである。
フォワードプライマー: GGTGAAGGTCGGAGTCAACGGATTTGGTCG(配列番号15)
リバースプライマー: TATTGGAACATGTAAACCATGTAGTTGAGG(配列番号16)
【技術分野】
【0001】
本発明は、ブレオマイシン水解酵素産生促進剤、それを含有する天然保湿因子産生促進剤又は乾燥肌改善剤を提供する。
【背景技術】
【0002】
表皮の顆粒層のケラチン線維は、角化する際にフィラグリンと呼ばれるタンパク質に結合して凝集し、“ケラチンパターン”と称される特異的な形態をつくる。顆粒細胞内のケラトヒアリン顆粒にはフィラグリンの前駆物質であるプロフィラグリン(フィラグリン単位が10乃至12個縦に並んだもの)が多量に存在するが、角化の際、フィラグリンモノマーが生成されるとともに脱リン酸化によりケラチン線維を凝集させる。その後、ペプチジルアルギニンデイミナーゼ(PAD)という酵素の作用によって脱イミノ化され、ケラチンと遊離した後、角層上層でアミノ酸などに分解される。これらのアミノ酸は天然保湿因子(natural moisturizing factor ; NMF)と呼ばれ、角層水分量の保持に重要な役割を担い、また紫外線吸収能をもつことで知られる(Blank I.H. J.I. Dermatol., 18, 433 (1952); Blank I.H. J.I. Dermatol., 21, 259 (1953))。
【0003】
NMFの主成分であるアミノ酸がフィグラリンに由来することが明らかになって以来、乾燥肌を呈する病態とフィグラリンの関連性についての研究が進められている。近年、老人性乾皮症、アトピー性疾患などの乾燥肌において角層中のアミノ酸が減少していることが明らかになっている(Horii I. et al., Br. J. Dermatol., 121, 587-592(1989); Tanaka M. et al., Br. J. Dermatol., 139, 618-621(1989))。
【0004】
PADはフィラグリンのアルギニン残基に作用して脱イミノ化させ、シトルリン残基に変換させる。このようにフィラグリンが脱イミノ化されることでフィラグリンとケラチン繊維との親和性が弱まり、ケラチン繊維が遊離し、その結果フィラグリンはプロテアーゼの作用を受け易くなり、最終的にNMFにまで分解されるものと考えられる。
【0005】
本発明者は、PADで脱イミノ化したフィラグリンを分解する酵素として、カルパイン−1を特定しており、その分解産物としての小さいペプチド断片がブレオマイシン水解酵素(BH)によってアミノ酸単位、即ちNMFにまで分解されることを明らかにしている(Journal of Investigative Dermatology (2008), Volume 128, ABSTRACTS, S90, 539, 第30回日本分子生物学会年会・第80回日本生化学会大会 合同大会 講演要旨集、第583頁、JOURNAL OF BIOLOGICAL CHEMISTRY 284, NO. 19, pp. 12829-12836, 2009、3P−0251、及び特願2008−135944号(以下第944号出願と称する))。
【0006】
最近の研究で、アトピー性皮膚炎の一部は、プロフィラグリン遺伝子の異常により生じることが知られており、アトピー性皮膚炎患者の5-50%程度で当該遺伝子の異常が見られる(Smith FJD, et al. Nat Genet 38:337-42 (2006); Aileen Sandilands1, et al., J. I. Dermatol., 127, 1282-1284 (2007) 及びNomura T, et al., J. I. Dermatol., 128(6):1436-41 (2008))。しかしながら、アトピー性皮膚炎患者の皮膚では、必ずしもフィラグリンの発現が劇的に低下しているわけではない。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Blank I.H. J.I. Dermatol., 18, 433 (1952)
【非特許文献2】Blank I.H. J.I. Dermatol., 21, 259 (1953)
【非特許文献3】Horii I. et al., Br. J. Dermatol., 121, 587-592(1989)
【非特許文献4】Tanaka M. et al., Br. J. Dermatol., 139, 618-621(1989)
【非特許文献5】Kamata et al., J. Biochem., 141, 69-76, 2007
【非特許文献6】Journal of Investigative Dermatology (2008), Volume 128, ABSTRACTS, S90, 539
【非特許文献7】第30回日本分子生物学会年会・第80回日本生化学会大会 合同大会 講演要旨集、第583頁、3P−0251
【非特許文献8】JOURNAL OF BIOLOGICAL CHEMISTRY 284, NO. 19, pp. 12829-12836, 2009
【非特許文献9】Smith FJD, et al. Nat Genet 38:337-42 (2006)
【非特許文献10】Aileen Sandilands1, et al., J. I. Dermatol., 127, 1282-1284
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明者は、ブレオマイシン水解酵素産生促進剤の提供を課題とする。
【課題を解決するための手段】
【0009】
上記第944号出願において、本発明者は、ブレオマイシン水解酵素の活性亢進がNMFの産生を介して皮膚バリアー機能を改善することを明らかにした。このように、ブレオマイシン水解酵素はNMF産生の最終段階で働いていると考えられる。しかし、興味深いことに、アトピー性皮膚炎により生じる乾燥肌に関しては、多くのアトピー性皮膚炎患者で依然としてフィラグリンの発現が見られることから、フィラグリン遺伝子の異常とは別の原因で生じることが予想される。
【0010】
本発明者は、ヒト皮膚におけるブレオマイシン水解酵素の発現低下が、MMF産生機構の異常によって生じる皮膚バリアー機能の低下のみならず、主に免疫異常に起因するアトピー性皮膚炎や当該皮膚炎によって生じる乾燥皮膚等とも関係しているとの仮説のもと、乾燥肌ヒト試験による当該酵素の発現の変動を検証し、そしてその発現制御機構の解析等を行った。その結果、本発明者は、ブレオマイシン水解酵素の発現低下がアトピー性皮膚炎によって生じる乾燥肌と関連しており、且つ当該酵素をコードする遺伝子の5’フランキング領域内に当該酵素の発現を顕著に誘導する制御領域が存在することを見出した。詳しくは、本発明者は、BHの5’‐フランキング領域をクローニングした。その欠失分析では、−216bp上流の中にBHプロモーター活性に重要な領域が同定された。電気泳動移動度シフト・アッセイでは、試験管内において、MZF‐1、Sp‐1、及びインターフェロン調節因子(IRF)‐1/2がこの領域に結合できることを明らかにした。そのうえ、MZF‐1及びSp‐1モチーフの部位特異的突然変異誘発では、BHプロモーター活性が大きく低下した。これらのデータは、BH発現がMZF‐1及びSp‐1を介して上方制御されることを示唆した。興味深いことに、Th1サイトカインであるインターフェロン(IFN)‐γは、BHの発現を有意に減少させた。部位特異的突然変異誘発と低分子干渉RNAを用いた分析では、BH発現に対するIFN‐γの抑制効果を立証した。その一方、Th2サイトカインであるIL‐4は、BH発現に対して直接的な作用を全く示さなかった。しかしながら、それは培養ケラチノサイトにおいてMZF‐1及びSp‐1を下方制御したので、IL‐4がBH調整のサプレッサーとして働くことができることが示唆された。最後に、ADを患っている患者の皮膚においてBHの発現を調べた。BH活性と発現はAD病変皮膚において大きく減少していたので、ADにおけるフィラグリン分解経路の欠陥が示唆された。以上のとおり、本発明者は、BHの転写が分化中及び炎症中の両方で調節されているであろうことを見出した。従って、本発明者は様々な薬剤、生薬についてそのブレオマイシン水解酵素産生促進活性を調べたところ、所定の薬剤。生薬についてそのような活性があることを見出し、本発明を完成するに至った。
【0011】
本願は以下の発明を包含する。
(1)イザヨイバラエキス、トウキエキス、オウバクエキス、オドリコソウエキス、ローズマリーエキス、ベンゼンスルホニルGABA及びエリスリトールからなる群から選ばれる1又は複数を活性成分として含有する、ブレオマイシン水解酵素産生促進剤。
(2)天然保湿因子産生促進剤である、(1)のブレオマイシン水解酵素産生促進剤。
(3)乾燥肌改善剤である、(1)のブレオマイシン水解酵素産生促進剤。
(4)(1)〜(3)のいずれかのブレオマイシン水解酵素産生促進剤を、乾燥肌の改善又は予防を必要とする被験者に適用することを含んでなる、乾燥肌を改善又は予防する方法。
(5)乾燥肌がアトピー性皮膚炎によるものである、(4)の方法。
(6)乾燥肌の改善又は予防のための、(1)〜(3)のいずれかのブレオマイシン水解酵素産生促進剤の使用。
(7)乾燥肌がアトピー性皮膚炎によるものである、(6)の使用。
【発明の効果】
【0012】
本発明者により、新規のNMF産生促進剤や乾燥肌改善剤の提供が可能となる。
【図面の簡単な説明】
【0013】
【図1】テープストリッピングにより得られたヒト皮膚抽出液中のブレオマイシン酵素量とテープストリッピングの回数との関係を示すウェスタンブロット図。
【図2】ヒト皮膚抽出液中のブレオマイシン酵素量と乾燥肌との関係を示すウェスタンブロット図。T,A:乾燥を感じない被験者由来のサンプル;N:やや乾燥を感じる被験者由来のサンプル及び;M:乾燥を感じる被験者由来のサンプル。
【図3】ヒトの腕の角層抽出液中のブレオマイシン水解酵素量とその酵素活性との関係を示すグラフ。横軸の番号は被験者の識別番号を表す。
【図4】図3で得られたブレオマイシン水解酵素量と活性との関係についての最小二乗法による一次近似。
【図5】ヒトの腕の角層抽出液中のブレオマイシン水解酵素と皮膚パラメーター(A:遊離アミノ酸、B:活性、C:TEWL)に関する統計的解析。BH low: ブレオマイシン水解酵素量<10、活性<1.5(nmol/min/ml); BH high: ブレオマイシン水解酵素量≧10、活性≧1.5(nmol/min/ml)。
【図6】肌分類用アンケートフローチャート。
【図7】図6のフローチャートに従い分類された被験者の角層の皮膚パラメーター測定結果。
【図8】正常皮膚におけるブレオマイシン水解酵素及びフィラグリンの局在を示す組織染色図。
【図9】アトピー患者皮膚におけるブレオマイシン水解酵素及びフィラグリンの局在を示す組織染色図。
【図10】定量的PCRを用いたケラチノサイトの分化とブレオマイシン水解酵素の発現量との関係を示すグラフ。縦軸の値は、80%コンフルエントの発現量を1とした場合の相対量を表す。
【図11】ブレオマイシン水解酵素をコードする遺伝子の5’フランキング領域を示す模式図。
【図12】ヒト表皮ケラチノサイトを用いたBHプロモーターのルシフェラーゼアッセイの結果を示すグラフ。
【図13】転写因子SP1, MZF1及びGATA1の発現とUV照射との関係を示すグラフ。
【図14】正常ヒト表皮角化細胞におけるブレオマイシン水解酵素及びプロテアーゼの発現とUV照射との関係を示すグラフ。
【図15】BHの5’‐フランキング領域の連続的な5’‐欠失突然変異株をPCRによって作成するために使用したプライマー。
【図16】BH及び関連因子の転写レベルを定量的リアルタイムRT‐PCRによって分析するために使用したプライマー。
【図17】電気泳動移動度シフト分析に使用したプローブ。
【図18】(A)ヒトBHの5’−フランキング領域の模式図を示す。5’‐フランキング領域内の推定転写因子結合部位はGenome Net MOTIFプログラムによる検索で明らかにした。(B)欠失分析で決定されたBHのプロモーター領域。(C)BHの最小プロモーターの配列及び推定転写因子結合部位を含む−216/−1領域のヌクレオチド配列を示す推定転写因子結合部位に下線を付した。
【図19】(A)部位特異的突然変異誘発によるBHプロモーターにおける転写因子結合部位の特性決定。推定転写因子結合部位の欠失構築体の模式図及び培養ケラチノサイトにおけるそのルシフェラーザ活性を示す。部位特異的突然変異誘発は−616/+1領域のヌクレオチド配列をまたぐ構築体で実施した。(B)BHプロモーターのcis-作用エレメントに対するMZF‐1、Sp‐1、GATA‐1、又はIRF‐1/2の結合を示す。実験は、培養ケラチノサイトからの核抽出物、及び推定転写因子結合部位MZF‐1、Sp‐1、GATA‐1、又はIRF‐1/2を含むビオチン化二本鎖オリゴヌクレオチドプローブを用いる電気泳動移動度シフト・アッセイ(EMSA)で行った。レーン1は核抽出物でのビオチニル化プローブの結合プロフィール、レーン2は2倍過剰量の非ラベル化プローブと競合させた後のビオチニル化プローブの結合プロフィールを示す。
【図20】(A)BH発現のリアルタイムRT−PCR分析。BH遺伝子発現に対するTh1、Th2、及びTh17サイトカインの効果を示す。(B)IRF‐1/2結合部位の突然変異分析。IFN‐γの存在下での培養ケラチノサイトにおけるBHプロモーター活性を示す。ケラチノサイトをBHプロモーター領域のインタクトIRF‐1/2結合部位を含むpGL3−216でトランスフェクションし、IFN‐γで24時間処理した(上パネル)。ケラチノサイトを△pGL3−616(IRF‐1/2欠失突然変異体)でトランスフェクションし、10ng/mlのIFN‐γ又はIL−4の存在下又は不在下で24時間処理した(下パネル)。(C)IRF‐1/2がBHのIFN‐γ誘発性下方調節の必須メディエーターであるかどうか判断するための低分子干渉RNA(siRNA)を使用したIRF‐1及びIRF‐2遺伝子発現の測定。ケラチノサイトをIRF‐1又はIRF‐2のsiRNA(40nM)でトランスフェクションし、24時間培養し、10ng/mlのIFN‐γで処理し、さらに24時間培養してからRNA単離を行った。右パネルにはIRF‐1及びIRF‐2のサイレンシングの効果を示す。
【図21】(A)表皮における転写調節の機構を調査するためのリアルタイムPCR法による増殖型又は分化型細胞におけるBH、カルパインI、及び推定転写因子の発現分析。(B)培養ケラチノサイトにおける転写因子MZF‐1、Sp‐1、GATA‐1、IRF‐1及びIRF‐2発現パターン分析。
【図22】(A)推定転写因子IRF‐1及びIRF‐2の発現に対するIFN‐γの効果。(B)推定転写因子IRF‐1、IRF‐2、MZF−1及びSp−1の発現に対するIL‐4の効果。
【図23】(A)正常表皮での、抗BH抗体と抗フィラグリン抗体での二重染色により示される、顆粒層におけるBHとフィラグリンの同時局在。(B)AD患者の病変皮膚と非病変皮膚からの抽出物のBH活性。
【図24】各種生薬及び薬剤のブレオマイシン水解酵素酸性促進効果を示す。
【発明を実施するための形態】
【0014】
ブレオマイシン水解酵素は分子量250〜280kDa(六量体)の細胞質システインペプチド加水分解酵素であり、当初知られていた機能は、癌の組み合わせ化学療法に頻繁に使用される糖ペプチドブレオマイシンの代謝不活性化である。システインタンパク質分解酵素パパインスーパーファミリーの特徴的な活性部位残基を含み、コード遺伝子はヒトでは遺伝子座17q11.2に存在する(Takeda et al., J Biochem., 119, 29-36, 1996)。あらゆる組織に存在し、皮膚におけるその存在も知られていたが(Kamata et al., J. Biochem., 141, 69-76, 2007)、フィラグリンとの関係については本発明者が明らかにするまで全く知られていなかった。
【0015】
組織染色の結果から、ブレオマイシン水解酵素は、フィラグリンと同様に、正常皮膚では表皮上層で多く発現していることが明らかになった(図8)。一方、アトピー性皮膚炎患者では、アトピー皮疹部で当該酵素及びフィラグリンの発現が低下する(図9)。これは、プロフィラグリン遺伝子の異常ではなく、その分解酵素系の異常がアトピー性皮膚炎の原因となることを強く示唆するものである。また、アトピー皮膚炎患者の皮膚では、病変部のみならず、非病変部でもブレオマイシン水解酵素活性は有意に低い(データは示さない)。
【0016】
更に、ブレオマイシン水解酵素の発現量の変動について培養ケラチノサイトを用いて検討した結果、当該酵素は、分化していないケラチノサイトではあまり発現していないのに対し、コンフルエントに達し分化が進んだケラチノサイトで高発現していること、基底細胞ではほとんど発現せず、分化が進み表皮細胞へと移行してから高発現することが分かった(図10)。この結果は、上記細胞染色の結果を裏づけている。ブレオマイシン水解酵素をコードする遺伝子の5’−フランキング領域、特に転写調節領域と、当該領域に結合する転写因子とを図11に示す。ブレオマイシン水解酵素の発現には、当該酵素のコード配列から少なくとも216bp下流までの領域を含んでいればよい。図11に記載の転写因子の中でも、この領域に含まれるIRF-1, IRF-2, MZF-1, SP-1, GATA-1の結合活性を亢進することで、ブレオマイシン水解酵素の発現は特に亢進すると考えられる。事実、ブレオマイシン水解酵素は、紫外線(UV)照射によってその発現が亢進されるところ(データは示さない)、MZF-1, GATA-1の発現亢進とUVの強度及び照射時間との間には相関関係が見られる(図13)。
【0017】
ブレオマイシン水解酵素産生促進は、サイトカインによっても影響を受ける。例えば、アトピー性皮膚炎に関与していることが知られている、Th2サイトカインの一種であるインターロイキン−4(IL-4)は、ブレオマイシン水解酵素の発現をダウンレギュレートする。これは、アトピー性皮膚炎患者の皮膚で見られるブレオマイシン水解酵素の低発現を裏付けるものである。一方、IL-4と反対にIgE産生を抑制する働きを有するTh1サイトカインの代表、インターフェロンγは、ブレオマイシン水解酵素の発現を有意に亢進する。また、Th2サイトカインで炎症性サイトカインの代表である腫瘍細胞壊死因子アルファ(TNFα)も当該酵素の発現を有意に亢進させる。これらの物質のみならず、ブレオマイシン水解酵素の発現及び/又は活性は、UV照射によっても亢進される。結果は示さないが、体表面の中でも、紫外線照射を受けやすい頬などの皮膚におけるブレオマイシン水解酵素の活性は、UV照射によって亢進されることが確認されている。
【0018】
イザヨイバラエキス、トウキエキス、オウバクエキス、オドリコソウエキス及びローズマリーエキスについては皮膚外用剤に使用されているものはあるが、いずれのエキスもブレオマイシン水解酵素産生促進効果、NMF産生促進効果、乾燥肌改善効果を有することは知られていない。ベンゼンスルホニルGABA(ベンゼンスルホニル−γアミノ酪酸)、エリスリトールも同様に、皮膚外用剤に使用されているものはあるが、いずれの薬剤もブレオマイシン水解酵素促進効果、NMF産生促進効果、乾燥肌改善効果を有することは知られていない。
【0019】
上記エキスは常法により得ることができ、例えばその起源となる植物の一部又は全部を抽出溶媒とともに常温で又は加熱して浸漬または加熱還流した後、濾過し、濃縮して得ることができる。溶媒抽出の前に、抽出部位を乾燥させてもよい。抽出溶媒としては、通常抽出に用いられる溶媒であれば任意に用いることができ、例えば、有機溶媒、例えばメタノール、エタノール、プロピレングリコール、1,3−ブチレングリコール、グリセリン等のアルコール類、含水アルコール類、クロロホルム、ジクロルエタン、四塩化炭素、アセトン、酢酸エチル、ヘキサン等、あるいは水性溶媒、例えば水、生理食塩水、リン酸緩衝液、ホウ酸緩衝液等を、それぞれ単独で、あるいは組み合わせて用いることができる。好ましくは、溶媒として、水、メタノール、エタノール、1,3−ブチレングリコールから選ばれる1種または2種以上が好適に使用される。
【0020】
上記溶媒で抽出して得られたエキスをそのまま、あるいは例えば凍結乾燥などにより濃縮したエキスを使用でき、また必要であれば吸着法、例えばイオン交換樹脂を用いて不純物を除去したものや、ポーラスポリマー(例えばアンバーライトXAD−2)のカラムにて吸着させた後、所望の溶媒で溶出し、さらに濃縮したものも使用することができる。
【0021】
イザヨイバラエキス、トウキエキス、オウバクエキス、オドリコソウエキス及びローズマリーエキスなどのエキスやベンゼンスルホニルGABA、エリスリトールなどの薬剤は、濃度依存的にブレオマイシン水解酵素産生促進作用を示す。従って、このような観点からは、本発明のブレオマイシン水解酵素産生促進剤中のイザヨイバラエキス、トウキエキス、オウバクエキス、オドリコソウエキス及び/又はローズマリーエキスなどのエキスの配合量は、剤全量中、乾燥物として0.0001〜20.0質量%、好ましくは0.0001〜10.0質量%、より好ましくは0.001〜1質量%である。ベンゼンスルホニルGABA及び/又はエリスリトールなどの薬剤の配合量は、剤全量中、乾燥物として0.0001〜20.0mmol、好ましくは0.0001〜10.0mmol、より好ましくは0.001〜1mmolである。
【0022】
本発明に係るブレオマイシン水解酵素産生促進剤は、常法に従って製造することができ、また同ブレオマイシン水解酵素産生促進剤を構成する成分として、上記エキスや薬剤1種又は2種以上単独でも調製可能であるが、通常医薬部外品を含む化粧品や医薬品等の皮膚外用剤等に用いられる成分、例えば油分、界面活性剤、粉末、色材、水、アルコール類、増粘剤、キレート剤、シリコーン類、酸化防止剤、紫外線吸収剤、保湿剤、香料、各種薬効成分、防腐剤、pH調整剤、中和剤等必要に応じて適宜配合される。
【0023】
本発明のブレオマイシン水解酵素産生促進剤の剤型は特に限定されるものではなく、例えば、溶液系、可溶化系、乳化系、粉末分散系、水−油二層系、水−油−粉末三層系、軟膏、ゲル、エアゾール等の任意の剤型をとることができる。また、使用形態も特に限定されるものではなく、例えば、化粧水、乳液、クリーム、エッセンス、ゼリー、ジェル、軟膏、パック、マスク、ファンデーション等の任意の形態をとることができる。
【0024】
本発明のブレオマイシン水解酵素産生促進剤は肌に適用することで、乾燥肌の予防及び/又は改善を図るための美容方法に利用できる。かかる美容方法における本発明のブレオマイシン水解酵素産生促進剤の用法、用量も特に限定されるものではなく、剤型や処置する肌のしわの状態により適宜決定されるが、典型的には、1日当たり数回、例えば1回〜5回、適量、例えば1平方cm2当たり0.1mlから1ml、肌に直接すり込むか、又その適量をガーゼなどに染み込ませてから肌に貼付することができる。
【0025】
以下、具体例を挙げて、本発明を更に具体的に説明する。なお、本発明はこれにより限定されるものではない。
【実施例】
【0026】
本実験では以下の材料を使用した。
カルパインIは、EMD Bioscience社より購入した。ブレオマイシン水解酵素は、ヒト表皮角層より、非特許文献5に従い作製した。ヒトIL‐4及びIFN‐γは、PEPROTECH EC(London, England)から購入した。ヒトIL‐13及びIL‐17A/Fは、R&D SYSTEM(MINNEAPOLIS, MN)製のものとした。シトルリン4‐メチルクマリル‐7‐アミド(Cit‐MCA)をBachem Bioscience(Bubendorf, Switzerland)から入手した。使用される他のすべての化学物質は、試薬グレードのものであった。
【0027】
ケラチノサイトの培養
新生児期表皮由来の正常ヒト表皮ケラチノサイト(Kurabo、Osaka, Japan)を、低濃度(0.03mM)のカルシウム、及びHKGS Growth Supplement(Cascade Biologics)を含むEpiLife培地(Cascade Biologics、Portland, OR)中で培養した。すべての細胞を5%のCO2を加えながら37℃にてインキュベートし、そして継代4代以内に使用した。ケラチノサイトを、コンフルエント70%、コンフルエント100%、コンフルエントの2日後、及び2mMのカルシウム中コンフルエントの2日後に採取した。
【0028】
実験1
ブレオマイシン水解酵素は、NMF産生の最終段階で働いていると考えられる。この場合、乾燥肌では本酵素の発現が低下している可能性がある。本実験では、皮膚におけるブレオマイシン水解酵素の発現及び/又は活性の低下が、乾燥肌と関連しているか否かについて検討した。
【0029】
皮膚角層試料は、透明粘着テープ(セロテープ(登録商標)(NICHIBAN))を腕の皮膚表面に貼付したのち剥離するテープストリッピングにより採取した。皮膚角層の付着したこのテープを裁断、抽出バッファー(0.1M Tris-HCl(pH8.0), 0.14M NaCl, 0.1% Tween-20, 1ml)に浸漬、超音波処理(20 sec ×4)にかけ、角層抽出液を作成した。当該抽出液をウェスタンブロットにかけた。使用した抗ブレオマイシン水解酵素(BH)抗体は、鎌田ら(Journal of Biological Chemistry 2009)により作製された抗体を用いた。具体的には、角層抽出液をSDS電気泳動後、Immobilon-P (Millipore社)に転写し、この転写された膜を洗浄後、抗BH抗体と室温で1時間反応させた。さらに洗浄により抗体を除去したのち、HRP結合二次抗体を反応させた。洗浄後、ECL Plus Western Blotting Detection Kit (GE Healthcare)により発光させたBH蛋白バンドをX線フィルムに焼付け、バンドの濃淡により、発現量を推定した。結果を図1及び図2に示す。
【0030】
図1中、検体1は本人が乾燥肌と自分で思っている人の皮膚角層試料であり、検体2は乾燥肌ではないと考えている健康な学生の皮膚角層試料である。また、図2中の検体T及びAは、乾燥を感じない被験者由来のものであり、検体Nはやや乾燥すると感じる被験者、そして検体Mは乾燥を感じる被験者由来のものである。検体1中のブレオマイシン水解酵素の発現量は少なく、一方、検体2中の当該酵素発現量は多い。この結果から、検体1、2は、それぞれ乾燥肌、潤い肌に由来するものであることがわかる。また、検体1を用いた結果からは、乾燥肌では、NMF産生の場である表皮表面に近いほど、ブレオマイシン水解酵素量が低下していることがわかる。図2において、検体TおよびAは、特に乾燥を感じない検体から得られた抽出液、検体NおよびMは、乾燥を強く意識する検体から得られた抽出液のウェスタンブロット像を示す。
【0031】
実験2
本実験では、ヒト皮膚におけるブレオマイシン水解酵素の量や活性の個体差と、当該酵素量と活性の相関とについて検討した。実験1に記載の方法に従い、20〜25才の女子学生40名の腕の皮膚から角層抽出液を作成した。当該抽出液中のブレオマイシン水解酵素量とその酵素活性を、Kamata et al (J. Biol. Chem., Vol. 284, Issue 19, 12829-12836, May 8, 2009)らの方法に従い測定した。発現量はウェスタンブロットにより、そして酵素活性は、当該酵素のアミノペプチダーゼ活性について、蛍光基質であるCit−β−NAの分解量を測定することで評価した。結果を図3に、そしてその相関図を図4に示す。図4の結果から明らかなように、ブレオマイシン水解酵素量とその活性との間には相関関係が存在している。
【0032】
続いて、上記角層抽出液について、ブレオマイシン水解酵素と様々な皮膚パラメーターに関して統計的な解析を行った。本実験では、40人の角層抽出液を以下の2種類に分類した。ウェスタンブロットの結果から明らかとなったブレオマイシン水解酵素量をデンシトメーターで数値化した後、1を任意の単位として表示した場合にブレオマイシン水解酵素量が10未満であり、且つ当該酵素の活性が1.5nmol/min/ml未満である抽出液:ブレオマイシン水解酵素のタンパク質量が少なく、且つ活性が低いもの(BH low);それ以外のもの:タンパク質量が多く、且つ活性が高いもの(BH high)。
【0033】
遊離アミノ酸は、Kamata et al (J. Biol. Chem., Vol. 284, Issue 19, 12829-12836, May 8, 2009)らの方法に従い測定した。具体的には、カルパインIで分解したフィラグリンペプチドと各抽出液とを反応させ、フルオレサミンを用いてアミノ基を定量することで遊離アミノ酸量を測定した。遊離アミノ酸の測定結果を図5Aに示す。図5A中の縦軸の単位は、測定試料3ml中の総遊離アミノ酸量(nmol)を表す。
【0034】
ブレオマイシン水解酵素の活性は、上述のとおり、当該酵素のアミノペプチダーゼ活性を、蛍光基質であるCit−β−NAの分解量を測定することで評価した。ブレオマイシン水解酵素活性の測定結果を図5Bに示す。図5B中の縦軸の単位は、Cit−β−NAの分解量(nmol/min/ml))を表す。
【0035】
上記学生の皮膚のTEWL は、Vapometer (Delfin Technologies, Ltd, Finland)を用いて測定し、 g/m2/hとして表示した。TEWLの測定結果を図5Cに示す。
【0036】
図5Cに示すとおり、ブレオマイシン水解酵素活性の低い群(2.5U<)と高い群とでは、角層水分量に有意な差が存在していた。更に、当該酵素の量と活性の両方が低い群では、遊離アミノ酸が少なく、そしてTEWLも高い(図5A及び5C)。
【0037】
データは示さないが、遊離アミノ酸の低い群(1000<)と高い群とでは、NMF、ウロカニン酸の量に有意な差が、そしてNMFの低い群(0.8<)と高い群とでは、ウロカニン酸に有意な差が存在していた。また、TEWLの低い群(2.5<)と高い群とでは、NMF、乳酸、尿素に有意な差が存在していた。ウロカニン酸がフィラグリンに多数含まれるヒスチジンより作られることを考慮すると、ブレオマイシン水解酵素がフィラグリン分解において重要であることが分かる。
【0038】
本実験の結果から、ブレオマイシン水解酵素の絶対量が少ない場合、遊離アミノ酸量及びバリアー機能が共に有意に低下することが分かる。データは示さないが、頬由来の角層抽出液を用いた場合でも、ブレオマイシン水解酵素量とバリアー機能との比例関係が確認されている。
【0039】
実験3
本実験では、図6に記載のフローチャートに基づいて上記女子学生にアンケートを行い、各学生の肌を潤い肌、乾燥肌、乾燥型脂性肌、脂性肌の4つ分類した。アンケート結果と、上記実験2で測定した皮膚パラメーターの結果との相関関係を図7に示す。図7からは、脂性乾燥肌と分類された学生のブレオマイシン水解酵素活性が有意に高いことが分かる。
【0040】
実験4
本実験では、皮膚におけるブレオマイシン水解酵素とフィラグリンの局在について検討する。
【0041】
免疫組織化学染色
免疫組織化学染色は、Kamata et al (J. Biol. Chem., Vol. 284, Issue 19, 12829-12836, May 8, 2009)に記載の方法により行った。材料は5μm厚のヒト皮膚の冷凍切片、そして抗ラットBH IgGを用いた。詳しくは、ヒト皮膚標本を、インフォームドコンセントの上で、東京医科大学のアトピー性皮膚炎を患っている患者から得た。本研究は、倫理(Human Ethics)に関する東京医科大学施設内審査委員会と資生堂特別部会によって承認された。
ヒト・アトピー性皮膚炎(病変皮膚と非病変皮膚)及び正常皮膚の切片を、抗ラットBH IgG及び抗ヒト・フィラグリンIgGと共に室温にて1時間インキュベートし、その後、PBSで洗浄し、そして蛍光結合二次抗体であるAlexa Fluor 555又は488(Molecular Probes Inc.、Eugene, OR)と共にさらにインキュベートした。DAPI(4’,6’‐ジアミジノ‐2‐フェニルインドール;Molecular Probes)を核の可視化に使用した。
【0042】
正常皮膚の組織染色結果を図8に、そして健常者由来の皮膚(正常皮膚)とアトピー性皮膚炎患者由来の皮膚(アトピー皮疹部)との対比結果を図9に示す。図8に示すとおり、ブレオマイシン水解酵素は、表皮上層で高発現しており、フィラグリンと同一局在を示した。一方、アトピー皮疹部では、正常皮膚と比較してブレオマイシン水解酵素及びフィラグリンの発現が低かった(図9)。
【0043】
定量的PCR
ケラチノサイトにおけるブレオマイシン水解酵素の発現量は、以下の方法で、定量的PCRにより測定した。Light Cycler 480 (Roche Diagnostics GmbH, Mannheim, Germany, 試薬はLight Cycler FastStart DNA Master CYBR Green Iを用いた。SYBR Green I master mix 10 μlに以下のブレオマイシン水解酵素プライマーをそれぞれ 0.6 μl、水を6.8 μl加え、全量を20 μlとし、95℃ 15秒、55℃ 20秒、72℃ 20秒で、45サイクルのPCRを行なった。得られた結果は、ハウスキーピング遺伝子であるG3PDHの結果と比較して補正した。
フォワードプライマー: TGTGGTTTGGCTGTGATGTT (配列番号1)
リバースプライマー: GCACCATCCTGATCATCCTT (配列番号2)
【0044】
上記定量的PCRの結果を図10に示す。図10に示すとおり、ブレオマイシン水解酵素は、80%コンフルエントのケラチノサイト、すなわち、分化していないケラチノサイトと比較して、コンフルエントに達した、すなわち、分化したケラチノサイトで高発現していた。言い換えると、本実験結果から、当該酵素が分化前の基底細胞ではあまり発現しないことが分かる。この定量的PCRの結果は、上記組織染色の結果を裏付けるものである。
【0045】
実験5
1)ヒト表皮ケラチノサイトを用いたBHプロモーターのルシフェラーゼアッセイ:
増殖期(約80%コンフルエント)もしくは、分化後(コンフルエント後、空気曝露し、2 mMカルシウムを添加し、さらに2日培養を継続したもの)のケラチノサイトに、Lysis buffer(200 μlを加え、細胞を溶解させる。測定には、Bright-Glo Luciferase assay System (Promega Co., Madison, WI, USA)を用いた。サンプル20 μlを所定のチューブに移し、Auto Lumat Plus (LB953)8Berthhold GmbH & Co. KG. Bad Wildbad Germany)を用いて測定した。図12の結果から、ブレオマイシン水解酵素が発現するには、上記転写調節領域は、当該酵素のコード配列から少なくとも216bp下流までの領域を有していればよいことが分かる。
【0046】
2)NHEKへのUV照射:
30 mJもしくは、60 mJのUVBを照射し(Torex Fl20S-E-30/DMR, 20W, Toshiba Medical Supply)、3時間後、24時間後、48時間後に所定の方法にてRNAを回収し、定量PCRにより、ブレオマイシン水解酵素及びカルパインのmRNA発現を測定した。測定の結果、30mJ照射後48時間で回収した試料が最もブレオマイシン水解酵素のmRNAを発現していた(図13)。
【0047】
3)ブレオマイシン発現に及ぼすサイトカインの影響
IL-4 (終濃度:0.1, 1.0, 10 ng/ml)、TNFα(終濃度:0.1, 1.0, 10 ng/ml)、IFNγ(終濃度: 1.0, 10, 100 ng/ml)のそれぞれを、増殖期の培養ケラチノサイトに添加し、24時間インキュベートした後、Isogenを用いてRNAを採取した。定量PCRにより、ブレオマイシン水解酵素のmRNA発現を測定した。結果を図14に示す。図14の結果から、Th2サイトカインの一種であるインターロイキン−4(IL-4)は、ブレオマイシン水解酵素の発現をダウンレギュレートすることが分かる。
【0048】
実験6
ヒトBH遺伝子の特性決定
1)BHの5’‐フランキング領域のクローニング
ヒトBH遺伝子のヌクレオチド配列に基づいて、5’‐フランキング領域を、遺伝子特異的プライマー1(GSP1)、5’‐tccctcgagtctgtatcagagcagctaca‐3’(配列番号3)と遺伝子特異的プライマー2(GSP2)、5’‐tgaacacgcgtccgagctgctcatggcg‐3’(配列番号4)を使用して、製造業者の取扱説明書に従いGenome Walker Kit(Clontech、Mountain View, CA)を用いて増幅した。簡単に言えば、5%のジメチルスルホキシドの存在下、Ex Taq DNAポリメラーゼ(Takara、Shiga, Japan)を用いる、製造業者によって推奨されるツーステップPCRプロトコール:94℃にて25秒間、そして72℃にて4分間を7サイクル、それに続いて94℃にて25秒間、そして67℃にて4分間を32サイクル、そして最後の伸長67℃にて4分間、を使用して、GSP1とアダプタープライマー(AP)1を用いた一次PCRを実施した。次いで、一次PCR混合物を希釈し、そしてGSP2とAP2を用いた二次PCR増幅の鋳型として使用した。7サイクルの代わりに5サイクルの初回サイクルと、それに続く32サイクルの代わりに20サイクルの使用を除いて、二次PCRは一次PCRと同一であった。BHの5’‐フランキング領域の連続的な5’‐欠失突然変異株を、図15に列挙したプライマーを使用したPCRによって産出した。増幅後に、すべてのPCR産物をpGEM‐T簡易ベクター(Promega、Madison, WI)内にクローン化し、そしてABI Prism 310 Genetic Analyzer(Applied Biosystems、Foster City, CA)を用いて配列決定した。
【0049】
レポーター・プラスミドpGL3‐1216/+1を構築するために、PCRを、以下の条件下:最初の変性94℃にて4分間、94℃にて30秒間、60℃にて1分間、72℃にて1分間を30サイクル、そして最後に伸長72℃にて4分間、鋳型としてのpGEM‐T‐1216/+1、並びに制限部位Kpn I及びMlu Iを含む1組の特異的なBHプライマー(5’‐ccgggtaccatcagagttccttagaa‐3’(配列番号5)及び5’‐taaatacgcgttggcgcccacgctgccg‐3’)(配列番号6)を使用して実施した。得られたPCR産物を、Kpn I及びMlu Iで消化し、そしてpGL3‐Basicベクター(Promega)内にクローニングした。なお、pGL3‐Basicベクターは、ホタル・ルシフェラーゼ遺伝子を含んでいる。構築物のすべてを、QIAGEN Plasmid Midi Kit(QIAGEN、Duesseldorf, Germany)を使用することで調製した。
【0050】
2)部位特異的突然変異誘発
MZF‐1、Sp‐1、及びIRF‐1/2結合部位の突然変異誘発を、製造業者の取扱説明書に従ってQuick change site‐directed mutagenesisキット(Stratagene、La Jolla, CA)を使用することによって実施した。Sp‐1に欠失変異を作製するために、5’‐ggaccccgtttcagcctccccgcc-3’ (配列番号7)(突然変異体Sp‐1部位の順方向プライマー)と5’‐ggcggggaggctgaaacggggtcc‐3’ (配列番号8)(突然変異体Sp‐1部位の逆方向プライマー)を使用した。MZF‐1突然変異体については、5’‐gactcagcaacgcggttttgtccctccgc‐3’(配列番号9)(突然変異体MZF‐1部位の順方向プライマー)と5’‐gcggagggacaaaaccgcgttgctgagtca‐3’(配列番号10)(突然変異体MZF‐1部位の逆方向プライマー)を使用した。IRF‐1/2突然変異体については、5’‐gccgccgagcctccggcgctcc‐3’ (配列番号11)(突然変異体IRF‐1/2部位の順方向プライマー)と5’‐ggagcgccggaggctcggcggc‐3’ (配列番号12)(IRF‐1/2部位の逆方向プライマー)を使用した。
【0051】
3)トランスフェンクションとプロモーター活性の計測
ケラチノサイトを、5×104細胞/ウェルの密度にて12ウェル組織培養プレート内で培養し、そしてFuGene HD Transfection試薬(Roche Diagnostics、Basel, Switzerland)を使用して、それぞれの構築物1μgを用いてトランスフェンクションした。トランスフェンクション効率を補正するために、すべての細胞にHSV‐TKプロモーターの制御下にあるウミシイタケ(Renilla)ルシフェラーゼ遺伝子を含むpGL4.74[hRluc‐TK]ベクターPromega)を同時トランスフェンクションした。特に断りのない限り、細胞を、トランスフェンクションの24時間後に採集し、そして1ウェルあたり250μlのPassive lysisバッファー(Promega)を用いて溶解した。ルシフェラーゼ活性を、Dual Luciferase Reporter Assay System(Promega)及びAutolumat plus luminometer(Berthold Technologies、Bad Wildbad, Germany)を用いて分析した。ホタル・ルシフェラーゼ活性を、ウミシイタケ・ルシフェラーゼ活性について標準化した。各構築物について、3つのトランスフェンクションを独立に実施し、そして結果を平均値として表した。
【0052】
4)定量的リアルタイムRT‐PCR分析
BH及び関連因子の転写レベルを、定量的リアルタイムRT‐PCRによって分析した。全RNAを、製造業者の取扱説明書に従ってISOGEN(Nippon Gene、Tokyo, Japan)を用いて培養細胞から抽出した。SuperScript(商標)II(Invitrogen、Carlsbad, CA)を用いてcDNAに逆転写した。リアルタイムRT‐PCRを、製造業者の取扱説明書に従ってLightCycler 480 SYBR Green I Master(Roche Diagnostics)を使用してLightCycler raid cyclerシステムにより実施した。使用したプライマーに関する情報を、図16に示す。グリセルアルデヒド‐3‐リン酸デヒドロゲナーゼ(GAPDH)を基準遺伝子として使用した。増幅した断片の特異性を、LightCycler分析ソフトウェアによる融解曲線の定量分析によって確認した。mRNAの量を、GAPDHのmRNAに対して標準化し、そして最終的に未処理対照のmRNAに対する比として示した。
【0053】
5)IRF‐1及び‐2のsiRNAベースの抑制
培養ケラチノサイトを、製造業者の取扱説明書に従って、40nMのsiIRF‐1、siIRF‐2、及びsiControl A(Santa Cruz Biotechnology、Santa Cruz, CA)と共にLipofectamine RNAi Max(Invitrogen、Carlsbad, CA)を使用してトランスフェンクションした。その細胞を、抗生物質不含培地中で24時間培養し、その後、全RNAを抽出し、そして上記したように、リアルタイムRT‐PCRによって分析した。
【0054】
6)電気泳動移動度シフト分析(EMSA)
二本鎖オリゴヌクレオチドプローブを、一本鎖ビオチン化オリゴヌクレオチドと一本鎖未標識オリゴヌクレオチドをアニーリングすることによって調製した(図17)。核の抽出とEMSAを、Nuclear Extractionキット及びEMSA gel shiftキット(Panomics、Santa Clara, CA)を使用することで実施した。核抽出物(4μg)を、1×結合バッファー及び1μgのポリd(I‐C)、並びにMZF‐1、Sp‐1、IRF‐1/2、及びGATA‐1結合部位に対応するビオチン化プローブ(50pmol)と共に15℃にて30分間インキュベートした。競合アッセイのために、2倍の過剰の未標識プローブを、ビオチン化プローブの添加前に結合反応に加えた。これらのインキュベーション混合物を、次に、0.5×TBEバッファーと共に8%のポリアクリルアミドゲル中で電気泳動し、そしてBiodyne Bナイロン膜(Pall、Port Washington, NY)に転写した。EMSA gel shiftキットの中の化学発光検出試薬を使用することで、バンドを可視化した。
【0055】
7)結果
ヒトBH遺伝子プロモーターの単離と特性決定
Genome Net MOTIFプログラムによる検索で、ヒトBHの5’‐フランキング領域内の多数の推定転写因子結合部位が明らかになった(図18A)。特に、転写開始部位の位置に近い−216/+1領域の中に、MZF1、Sp‐1、IRF‐1/2、及びGATA‐1/2によって認識されるコンセンサス配列によく合致した配列が存在したので、これらの転写因子がBHプロモーター活性の調整にかかわっていることが示唆された。より厳密にBHのプロモーター領域を決定するために、欠失分析を実施した(図18B)。最高レベルのルシフェラーゼ活性を、pGL3‐816でトランスフェンクションした分化型ケラチノサイトにおいて検出した。しかしながら、欠失プラスミドの相対ルシフェラーゼ活性は、欠失がpGL3‐216に進むまで高いままで残っていた。構築体の中で、(pGL3‐444と表示)断片−444/+1を含むプラスミドは、培養ケラチノサイトにおいて有意に低い活性を示し、−616/−444領域における上流サプレッサー活性の存在が示唆された。これらの結果が−216/−1領域がBH遺伝子転写のための最小プロモーターを含んでいることを実証したので、そのヌクレオチド配列を図18Cに示す。この配列はTATA‐又はCCAAT‐ボックスを含んでいなかったので、この遺伝子のハウスキーピング性質が示唆された。その一方で、いくつかの転写性因子結合部位、例えばMZF‐1、Sp‐1、IRF‐1/2、及びGATA‐1/2などがこのコア・プロモーター領域に存在していた。
【0056】
BH遺伝子調節に関与する潜在的cis‐エレメントの同定
BH遺伝子発現の転写調節に関与する最小プロモーターの潜在的cis‐エレメントを決定するために、各cis‐エレメントを標的とした新しい一連の欠失突然変異株を構築した。MZF‐1、Sp‐1、及びIRF‐1/2の結合部位を欠失した場合、プロモーター活性が大きく下方制御された(図19A)。
さらに、これらの転写因子が推定結合部位のそれぞれに実際に結合できるかどうか調査した。このために、電気泳動移動度シフト・アッセイ(EMSA)を培養ケラチノサイトからの核抽出物、及びMZF‐1、Sp‐1、GATA‐1、又はIRF‐1/2結合部位を含むビオチン化二本鎖オリゴヌクレオチドプローブを用いて実施した。図19Bに示されているように、Sp‐1、MZF‐1、及びIRF1/2は、BHプロモーターの対応する標的部位に結合したが、GATA‐1/2は結合しなかった。これらの結果は、−216〜−105bpのプロモーター領域のこれらの結合部位が、BH転写のためのcis‐エレメントに不可欠であることを示している。
【0057】
BH遺伝子発現のサイトカイン媒介性調節
BHはNMF産出酵素であるので、それがADの病態生理に関与する可能性もある。よって、BH遺伝子発現に対するTh1、Th2、及びTh17サイトカインの効果を調べた。図20Aは、増殖型ケラチノサイトにおいて、Th1サイトカインであるIFN‐γが、用量依存的様式でBH mRNA発現を下方制御したことを示した。その一方、Th2及びTh17サイトカインは、BHの発現に対して有意な効果を全く示さなかった。同様の結果が分化型ケラチノサイトによって得られた(データ未掲載)。BH遺伝子発現の調整におけるIFN‐γの役割を解明するために、プロモーターアッセイを実施して、サイトカイン応答要素を特定した。図20Bに示されているように、IFN‐γは、−131〜−120の間にIRF‐1/2結合配列を含んだpGL3‐BH‐616でトランスフェンクションした培養ケラチノサイトにおいてBHプロモーター活性を下方制御した。この配列の欠失後には、IFN‐γがプロモーター活性を抑制することはもうなかった(図20B)。加えて、IRF‐1/2がBHのIFN‐γ誘発性下方調節の必須メディエーターであるかどうか判断するために、低分子干渉RNA(siRNA)を使用して、IRF‐1及びIRF‐2遺伝子発現を抑制した。IFN‐γの活性は、IRF‐1又は‐2 siRNA(40nM)のいずれかでトランスフェンクションした培養ケラチノサイトにおいて有意に抑制された(図20C)。これらの結果は、IRF‐1/2結合配列がBH遺伝子発現のIFN‐γ誘発性下方調節に不可欠であることを強く示唆している。
【0058】
培養ケラチノサイトにおけるBH及び関連因子の発現
表皮における転写調節の機構を調査するために、リアルタイムPCR法によって増殖型又は分化型細胞におけるBH、カルパインI、及び推定転写因子の発現を分析した。図21Aに示されているように、BH mRNAは、例えば、増殖型ケラチノサイトと比較した、集密期の2日後のもの(3.6倍)、及び高カルシウム濃度にて培養したもの(8.6倍)などのように、分化型ケラチノサイトにおいて上方制御された。これらの結果は、プロモーターアッセイデータと一致している(図18B)。同様の結果を、カルパインI(約2.5倍の上方制御)に関して得た。また、培養ケラチノサイトにおいて、様々な転写因子、例えば、MZF‐1、Sp‐1、GATA‐1、IRF‐1及びIRF‐2などの発現パターンを調べた。図21Bに示されているように、これらの転写因子は、BHの発現に沿って、分化型ケラチノサイトにおいて上方制御された。しかしながら、GATA‐1 mRNA発現は、他の因子と比較して有意に低かった(<1/32)。GATA‐1はケラチノサイトにおいて重要な役割を担っていないように思われる。よって、BHがMZF‐1及びSp‐1を介して分化依存的様式で合成されることを示唆する。IRF‐1及びIRF‐2がまた、分化刺激によっても上方制御されたという事実は、BH発現がIFN‐γに対して非常に感受性であることを示している。
【0059】
推定転写因子の発現に対するTh1及びTh2サイトカインの効果
これらの転写因子のサイトカイン依存性調節についてさらに調査した。図22Aは、IFN‐γが、用量依存式にIRF‐1 mRNA発現を強く上方制御したことを示す。同様に、IRF‐2発現は、IFN‐γの存在下で上方制御された。対照的に、IRF‐1及びIRF‐2の発現は、100ng/mlにおいてのみIL‐4の存在下で有意に増強された(図22B)。興味深いことに、MZF‐1及びSp‐1は共に、10ng/mlのIL‐4の存在下で最も効果的に下方制御された(図22C)。これらの結果は、BH発現が、それぞれ、直接的及び間接的にTh1及びTh2サイトカインによって調節されていることを示唆している。
【0060】
アトピー性皮膚炎皮膚においてBHは下方制御される
FLGの機能喪失型突然変異はADの発症機序に関連するが、遺伝子欠損だけではなく、分解経路の障害もまたADの病理に関連する可能性がある。そのため、AD患者の病変皮膚及び非病変皮膚におけるBH及びフィラグリンの局在、並びにBH活性を次に調べた。正常表皮では、抗BH抗体と抗フィラグリン抗体での二重染色は、上面表皮における、特に、先に報告されたように、顆粒層におけるBHとフィラグリンの同時局在を示した(図23A)。より高い倍率では、BHが顆粒層から角化層までに局所している一方で、フィラグリンが顆粒細胞に限定されていることが明確に示された。対照的に、BH発現は、この研究で診察したAD患者(n=7)の病変皮膚及び非病変皮膚において劇的に減少した。これらの患者のすべては、有意な染色が常に検出されたにもかかわらず、比較的弱いフィラグリン染色を示した(図23A)。免疫組織化学に加えて、BH活性を18人のAD患者及び30人の健常ボランティアから得たテープ剥離サンプルからの角質細胞抽出物において計測した。AD患者の病変皮膚と非病変皮膚からの抽出物は、健常人からのそれと比較して、(それぞれ27.1と8.8%まで)実質的に低いBH活性を示した(図23B)。これらの結果は、BHがフィラグリンと同時局在化され、そしてその活性がADを患っている患者の皮膚において劇的に低減されることを実証した。
【0061】
考察
この研究では、BH遺伝子発現の調節機序を、プロモーター領域のクローニング及び機能の特徴づけによって研究した。プロモーター解析では、−216bp上流の中にBHプロモーター活性にとって重要な領域を同定した(図18B)。この領域では、推定MZF‐1及びSp‐1結合部位が、BHプロモーター活性に対して有意な効果を示した(図18C及び19A)。興味深いことに、Sp‐1及びMZF‐1もまた、フィラグリン分解の開始にとって重要な酵素であるPAD1の調整に関与することが報告されている。Sp‐1は、哺乳動物細胞において転写因子として機能するジンク・フィンガー・タンパク質のSp/Kruppel様ファミリーの典型的なメンバーである。増殖、アポトーシス、分化、及び腫瘍性形質転換を含めた細胞機能のほとんどすべての面に関与すると考えられる。ヒト表皮において、Sp‐1は、インボルクリン、ロリクリン、トランスグルタミナーゼ、PAD1、2、及び3のそれを含めて、表皮分化に参加する遺伝子の重要な調節因子である。MZF‐1は、ジンク・フィンガー・タンパク質のKruppleファミリーに属する転写因子であり、分化全能性造血性細胞、並びに骨髄始原細胞において発現される。しかしながら、哺乳動物表皮における転写調節でのMZF‐1の機能は報告されていない。増殖型ケラチノサイトと比較して、分化型ケラチノサイトにおいてMZF‐1及びSp‐1、並びにBHを同時に上方制御することを見つけ(図21B)、ハウスキーピング的な役割よりむしろ分化におけるBHの役割を示した。我々の結果は、これらの転写因子がケラチノサイト最終分化中のBHの基本的な転写調節のための活性化因子として機能することを明確に示した。
その一方で、cis作用エレメントの調査は、この領域内のIRF‐1/2結合部位をさらに規定した。EMSAを使用して、BHプロモーター領域へのIRFsの直接結合を確認した(図19B)。この結合配列の部位特異的突然変異誘発は、BHプロモーター活性の有意な減少をもたらした(図19A)。そのため、IRF‐1/2転写因子もまた、基本条件の下、BH遺伝子の最小プロモーター活性に必要であろう。IRFファミリーは転写因子の群であり、今までのところ、9つのIRFメンバー(IRF‐1〜‐9)が様々な細胞型及び組織で同定された。これらのIRF分子は、IFN‐α、β、及びγによる刺激の下で、抗ウイルス防御、免疫応答/調節、及び細胞成長調節において役割を果たしている。IRF‐1及び‐2は、多くのIFN‐γ誘導性遺伝子の調整に関与する作動薬‐拮抗薬対として機能することが示されている。興味深いことに、IFN‐γは、BH mRNA発現を顕著に抑制した(図20A及びB)。ノックダウン及び部位特異的突然変異誘発分析では、IRF‐1/2結合部位がBH発現のIFN‐γ媒介性抑制に関与することを確認した(図20B及びC)。これらの結果は、IRF‐1/2がヒトケラチノサイトにおけるBH遺伝子のIFN‐γ媒介性下方調節のメディエーターであることを明確に示している。その一方で、Th2サイトカインであるIL‐4及びIL‐13は、24時間のインキュベーションの間、直接的な作用をまったく示さなかった(図20A)。しかしながら、これらのTh2サイトカインは、アクチベーター分子であるMZF‐1及びSp‐1の発現を有意に抑制した。よって、Th2サイトカインがBH発現を負に調節するのは妥当なことである。
【0062】
また、BHが病変及び非病変AD皮膚において劇的に下方制御されたことも示した(図23A及びB)。フィラグリン突然変異はADなどのバリアー障害関連疾患の主な危険因子であるが、突然変異分析では、アイルランドでの発生の50%未満、そして日本での〜20%の割合しか占めていないことが指摘された。フィラグリン合成不全だけではなく、フィラグリンの分解傷害もバリアー機能の崩壊に関与すると仮定した。NMFの減少が乾燥肌をもたらし、それがバリアーの崩壊を進行させることは明確である。ADがTh2極性化疾患であることは周知である。しかしながら、最近の報告は、Th1サイトカインもまたADにおいて役割を担っていることを示唆している。例えば、「内因性AD」は、IL‐4、IL‐5、及びIL‐13の低い発現、及びIFN‐γの高い発現によって免疫学的に特徴づけられる。加えて、Th1からTh2へのシフトが、AD皮膚における急性相から慢性相への間に起こる。我々の結果は、ADにおいて、IFN‐γが考えられていたより重要な役割を担っている可能性もあることを示している。
【0063】
結論として、我々の結果は、ヒト表皮におけるBH転写が二重様式で調節されることを示している。一方の経路はケラチノサイト最終分化の制御下にあり、そして、もう一方はTh1及びTh2サイトカインに依存している。これらの経路は、相互に関連しているので、バランスがBH発現の下方調節に向かって容易にシフトするであろう。BHの低下がNMFの不足をもたらし、それを受けて乾燥肌か、さらにはバリアーの崩壊につながる。これらの結果は、BH調整とADの発症機序への新しい見識を提供する。
【0064】
実験7
ブレオマイシン水解酵素産生促進効果を示す薬剤・生薬のスクリーニング
正常な包皮に由来するヒトケラチノサイト(Cascade Biologics社、ポートランド、メリーランド州)を、上皮増殖因子(0.1ng/ml)、インスリン(10μg/ml)、ヒドロコルチゾン(0.5μg/ml)、ウシ下垂体抽出物(0.4%)、ゲンタマイシン(50μg/ml)、アンホテリシンB(50ng/ml)を補足したMCDB 153培地からなるケラチノサイト増殖培地の中で、図24に示す各種生薬エキス又は薬剤(5-50 μg/ml)の存在下で24時間室温で培養した。コントロールとしては、0.1% 1,3−ブチレングリコールを用いた。
【0065】
RT−PCR
上記のとおりに培養したヒトケラチノサイトから単離した全RNA(500ng)を、ランダム・ヘキサマーとSuperscript II RNアーゼH-逆転写酵素(Gibco-BRL社、ゲサースバーグ、メリーランド州)を用いて逆転写した後、Taq DNAポリメラーゼ(Takara社、京都、日本国)と下記のプライマーを用いてPCR増幅した。94℃で30秒間、60℃で1分間、72℃で1分間という増幅サイクルを40回実行した。
【0066】
図24の結果より、コントロールと比較して、イザヨイバラエキス(10μg/ml)、トウキエキス(10μg/ml)、オウバクエキス(10μg/ml)、オドリコソウエキス(10μg/ml)及びローズマリーエキス(10μg/ml)などのエキスやベンゼンスルホニルGABA(50μg/ml)、エリスリトール(50μg/ml)が、ブレオマイシン水解酵素の発現を有意に亢進させることが分かる。従って、これらの抽出がいずれもブレオマイシン水解酵素の発現を促進することがわかった。PCRに使用したプライマーは以下のとおりである。
フォワードプライマー: 5’‐TGTGGTTTGGCTGTGATGTT‐3’(配列番号13)
リバースプライマー: 5’‐GCACCATCCTGATCATCCTT‐3’(配列番号14)
また、内部対照としてGAPDHをPCR増幅し、使用したプライマーは下記のとおりである。
フォワードプライマー: GGTGAAGGTCGGAGTCAACGGATTTGGTCG(配列番号15)
リバースプライマー: TATTGGAACATGTAAACCATGTAGTTGAGG(配列番号16)
【特許請求の範囲】
【請求項1】
イザヨイバラエキス、トウキエキス、オウバクエキス、オドリコソウエキス、ローズマリーエキス、ベンゼンスルホニルGABA及びエリスリトールからなる群から選ばれる1又は複数を活性成分として含有する、ブレオマイシン水解酵素産生促進剤。
【請求項2】
天然保湿因子産生促進剤である、請求項1記載のブレオマイシン水解酵素産生促進剤。
【請求項3】
乾燥肌改善剤である、請求項1記載のブレオマイシン水解酵素産生促進剤。
【請求項1】
イザヨイバラエキス、トウキエキス、オウバクエキス、オドリコソウエキス、ローズマリーエキス、ベンゼンスルホニルGABA及びエリスリトールからなる群から選ばれる1又は複数を活性成分として含有する、ブレオマイシン水解酵素産生促進剤。
【請求項2】
天然保湿因子産生促進剤である、請求項1記載のブレオマイシン水解酵素産生促進剤。
【請求項3】
乾燥肌改善剤である、請求項1記載のブレオマイシン水解酵素産生促進剤。
【図3】


【図4】


【図5】


【図6】


【図7】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図20】


【図21】


【図22】


【図24】


【図1】


【図2】


【図8】


【図9】


【図19】


【図23】




【図4】


【図5】


【図6】


【図7】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図20】


【図21】


【図22】


【図24】


【図1】


【図2】


【図8】


【図9】


【図19】


【図23】


【公開番号】特開2012−193136(P2012−193136A)
【公開日】平成24年10月11日(2012.10.11)
【国際特許分類】
【出願番号】特願2011−57126(P2011−57126)
【出願日】平成23年3月15日(2011.3.15)
【出願人】(000001959)株式会社 資生堂 (1,748)
【Fターム(参考)】
【公開日】平成24年10月11日(2012.10.11)
【国際特許分類】
【出願日】平成23年3月15日(2011.3.15)
【出願人】(000001959)株式会社 資生堂 (1,748)
【Fターム(参考)】
[ Back to top ]

