ブロッキング剤
【課題】本発明は、蛍光色素で標識した試料中の抗原を、抗原抗体反応を利用して測定する方法において、抗体と未反応蛍光色素の非特異反応自体を抑制するためのブロッキング剤を提供することを課題とする。
【解決手段】蛍光色素と抗体との非特異反応を抑制するためのブロッキング剤であって、エチルアセチミデート、エチルアセチミデートの塩、トリス塩酸、グリシン、又はリン酸水素ナトリウムのいずれか1以上を含むことを特徴とするブロッキング剤を提供する。
【解決手段】蛍光色素と抗体との非特異反応を抑制するためのブロッキング剤であって、エチルアセチミデート、エチルアセチミデートの塩、トリス塩酸、グリシン、又はリン酸水素ナトリウムのいずれか1以上を含むことを特徴とするブロッキング剤を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、標識試薬と抗体との非特異的な反応を抑制するブロッキング剤に関する。さらに詳しくは、蛍光色素で標識した試料中の抗原を、抗原抗体反応を利用して検出する方法において、蛍光色素と抗体との非特異的な反応を抑制するためのブロッキング剤に関する。また、本発明は、前記ブロッキング剤を用いたタンパク質検出方法及びタンパク質検出装置に関する。
【背景技術】
【0002】
免疫反応を利用して試料中の目的抗原を検出する方法において、試料を蛍光色素と結合させて、試料中の目的抗原を蛍光標識し、抗原抗体複合体の標識蛍光色素を検出することにより、試料中の目的抗原を定性的にあるいは定量的に測定する方法が知られている。本方法において、試料中の抗原と結合しなかった蛍光色素(未反応蛍光色素)が試料中に残存すると、抗体に未反応蛍光色素が非特異的に結合し、バックグラウンドが高くなることが知られている。このような蛍光色素と抗体との非特異反応を防止し、蛍光検出時のバックグラウンドを低減するため、従来、当該未反応蛍光色素をゲル濾過カラムにより取り除き、試料の精製を行っていた。しかし、ゲルろ過カラムを用いて試料を精製すると時間がかかるうえに、工程も増えるという問題があり、測定の簡略化、スピード化が求められていた。
ここで、非特異的な反応によるバックグラウンドの低減を目的とする技術として次のような従来技術が知られている。特許文献1には、DNAマイクロアレイにおける非特異的に吸着した蛍光色素付DNA及び未精製蛍光色素誘導体などの影響を受けずに、消光剤を用いて従来よりも検出感度と再現性を向上させる方法が開示されている。そして、消光剤としては、蛍光共鳴エネルギー転移により蛍光を消光させる物質を用いるとあり、具体的には、DNP、テトラメチルローダミンなどが挙げられている。特許文献2には、ハイブリダイゼーション用の特定の固体支持体を調製し、非特異的バックグラウンドを低減する方法が開示されている。
しかし、抗体と未反応蛍光色素の非特異反応自体をブロックするようなブロッキング剤についてはなんら開示も示唆もされていない。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2003-84002号公報
【特許文献2】特表平11-514872号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、抗原抗体反応を利用して蛍光色素で標識した試料中の抗原を検出する方法において、抗体と未反応蛍光色素の非特異反応自体を抑制するためのブロッキング剤を提供することを課題とする。また、本発明は、前記ブロッキング剤を用いたタンパク質検出方法及びタンパク質検出装置の提供も課題とする。
【課題を解決するための手段】
【0005】
本発明は、上記課題を解決するために、さまざまな化合物や緩衝液について、未反応蛍光色素の免疫反応に対する非特異反応抑制効果を検討したところ、驚くべきことに、エチルアセチミデート、エチルアセチミデートの塩、トリス塩酸、グリシン、又はリン酸水素ナトリウムのいずれか1以上を用いた場合に、前記非特異反応を抑制できることをつきとめ、本発明を完成するに至った。
すなわち、本発明は以下の構成を有する。
〔1〕蛍光色素と抗体との非特異反応を抑制するためのブロッキング剤であって、エチルアセチミデート、エチルアセチミデートの塩、トリス塩酸、グリシン、又はリン酸水素ナトリウムのいずれか1以上を含むことを特徴とするブロッキング剤。
〔2〕蛍光色素と抗体との非特異反応を抑制するためのブロッキング剤であって、エチルアセチミデート及び/又はエチルアセチミデートの塩を含むことを特徴とするブロッキング剤。
〔3〕抗原抗体反応を利用し蛍光色素で標識した試料中の抗原を検出するタンパク質検出方法において、〔1〕又は〔2〕に記載のブロッキング剤を用いることを特徴とするタンパク質検出方法。
〔4〕抗原抗体反応が、基板に抗体が固定化されている抗体チップを用いた反応である〔3〕に記載のタンパク質検出方法。
〔5〕〔3〕又は〔4〕に記載のタンパク質検出方法を使用するタンパク質自動検出装置であって、以下の手段を有する検出装置。
(1)試料からタンパク質を抽出する手段
(2)(1)で得られたタンパク質と蛍光色素を反応させ蛍光色素標識タンパク質を作製する手段
(3)〔1〕又は〔2〕に記載のブロッキング剤を用いて蛍光色素と抗体との非特異反応を抑制する手段
(4)(2)で得られた蛍光色素標識タンパク質を抗体チップと反応させる手段
(5)(4)の反応後の抗体チップの蛍光色素を検出する手段
【発明の効果】
【0006】
本発明のブロッキング剤によれば、抗原抗体反応を阻害することなく、抗体と未反応蛍光色素との非特異反応のみを抑制し、バックグラウンドを抑えることができた。
また、本発明のブロッキング剤を用いた検出方法により、従来の検出方法ではサンプルの標識反応から測定まで約3時間程度かかっていたところ、1/2〜1/3程度まで時間を短縮することができた。
【図面の簡単な説明】
【0007】
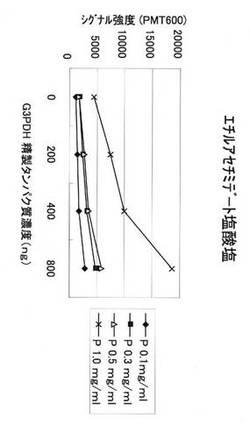
【図1】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、G3PDH抗体チップを用いて行った試験結果を示す図である。
【図2】本発明のブロッキング剤(トリス塩酸)の未反応蛍光色素の抗体への結合抑制効果について、G3PDH抗体チップを用いて行った試験結果を示す図である。
【図3】本発明のブロッキング剤(グリシン)の未反応蛍光色素の抗体への結合抑制効果について、G3PDH抗体チップを用いて行った試験結果を示す図である。
【図4】本発明のブロッキング剤(リン酸水素ナトリウム)の未反応蛍光色素の抗体への結合抑制効果について、G3PDH抗体チップを用いて行った試験結果を示す図である。
【図5】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、AnnexinII抗体チップを用いて行った試験結果を示す図である。
【図6】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、Arginase−1抗体チップを用いて行った試験結果を示す図である。
【図7】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、Keratin2e抗体チップを用いて行った試験結果を示す図である。
【図8】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、Keratin7抗体チップを用いて行った試験結果を示す図である。
【図9】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、Keratin15抗体チップを用いて行った試験結果を示す図である。
【図10】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、Profilin−1抗体チップを用いて行った試験結果を示す図である。
【図11】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、SCCA2抗体チップを用いて行った試験結果を示す図である。
【図12】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、uPA抗体チップを用いて行った試験結果を示す図である。
【図13】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、BLMH抗体チップを用いて行った試験結果を示す図である。
【図14】本発明のブロッキング剤(トリス塩酸)のブロッキング効果の濃度依存性についてBLMH抗体チップを用いて行った試験結果を示す図である。
【図15】本発明のブロッキング剤(トリス塩酸)のブロッキング効果の濃度依存性についてAnnexinII抗体チップを用いて行った試験結果を示す図である。
【図16】本発明のブロッキング剤(グリシン)のブロッキング効果の濃度依存性についてBLMH抗体チップを用いて行った試験結果を示す図である。
【図17】本発明のブロッキング剤(グリシン)のブロッキング効果の濃度依存性についてAnnexinII抗体チップを用いて行った試験結果を示す図である。
【発明を実施するための形態】
【0008】
本発明のブロッキング剤は、蛍光色素と抗体との非特異反応を抑制するためのブロッキング剤であって、エチルアセチミデート、その塩、トリス塩酸、グリシン、又はリン酸水素ナトリウムのいずれか1以上を含むことを特徴としている。
本発明のブロッキング剤が抑制する非特異反応とは、蛍光色素と抗体との非特異反応であり、測定対象である抗原を蛍光色素で標識した場合に、余剰の未反応蛍光色素が測定用の抗体と起こす反応のことをいう。
【0009】
抗原を標識する蛍光色素としては、本発明のブロッキング剤が未反応蛍光色素と抗体との非特異反応抑制効果を発揮できるような蛍光色素であればどのようなものでもよく、タンパク質検出方法に用いられる蛍光色素が対象とされる。例えば、Cyanine類、Alexa Fluor類、DyLight類等のタンパク質のアミノ基に結合する蛍光試薬が挙げられる。Cyanine類としては、Cyanine3、3.5、5、5.5、7、Alexa Fluor類としてはAlexa Fluor 350、555、DyLight類としてはDyLight 549、649等が挙げられる。
【0010】
本発明のブロッキング剤は、抗原を蛍光色素で標識して蛍光検出するような免疫反応であればいずれの免疫反応にも用いることができる。従って、測定対象の抗原もさまざまなものが挙げられるが、例えば、G3PDH、AnnexinII、Arginase−1、Keratin2e、Keratin7、Keratin15、Profilin−1、SCCA2、uPA、BLMH、MMP2、HSP70、β−Catenin、Apolipoprotein A1、maspin、IgE、HSP27、FABP−5、galectin−7、KLK7、enolase−1、Cathepsin D、β−actin等が挙げられる。
【0011】
本発明のブロッキング剤が抑制する非特異反応において、抗体は、固相に固定化されて用いられる。抗体が固定化される固相としては、ストリップ状の試験片、プラスチック基板、粒子、ニトロセルロース膜、PVDF膜などが挙げられ、固相への抗体の固定化はそれ自体周知の方法によって行うことができる。また、プラスチック基板に抗体が固定化されている例としては、プラスチック基板に抗体が点状にスポットされ固定化された抗体チップや抗体アレイが挙げられる。
【0012】
本発明のブロッキング剤の免疫反応への適用方法としては、(1)固相に固定化される抗体側をあらかじめブロッキング剤によって処理する方法や、(2)蛍光色素で標識した抗原と抗体を反応させる前に未反応蛍光色素をブロッキング剤で処理することにより、未反応蛍光色素と抗体との非特異反応を防ぐ方法や、(3)未反応蛍光色素が抗体に結合できないように蛍光色素と試料を反応させた後溶液中のpHを中性にする方法が挙げられる。(1)の抗体側のブロッキングは、(1−1)抗体が固相に固定化された後に、固相にブロッキング剤を供給して、抗体をブロッキング処理する方法と、(1−2)抗体が固相に固定化される前に、溶液中で遊離した状態の抗体にブロッキング剤を供給して、抗体をブロッキング処理し、これを固相に供給して、ブロッキングされた状態の抗体を固相に固定化する方法が挙げられる。
また、用いられるブロッキング剤としては、(1)の方法にはエチルアセチミデート及び/又はその塩が好ましく用いられ、(2)の方法には、トリス塩酸、グリシン、(3)の方法にはリン酸水素ナトリウムが好ましく用いられる。ここで、エチルアセチミデート(Ethyl acetimidate)はC4H9NOの元素組成を有する次式の化合物であり、CAS RNは2208−07−3である。エチルアセチミデートは、溶解性の点で塩を用いることが好ましく、例えば、エチルアセチミデート塩酸塩(Ethyl acetimidate hydrochroride)が挙げられる。
【0013】
【化1】

【0014】
前記、ブロッキング剤の免疫反応への適用方法のうち、(1)の方法によれば、ブロッキング剤によって抗体側をブロッキング処理しておくため、免疫反応時に全溶液の容量が増えず、(2)、(3)の方法に比べ抗体との反応性が上がる。
【0015】
本発明のブロッキング剤としては、エチルアセチミデート及び/又はその塩、トリス塩酸、グリシン、又はリン酸水素ナトリウム緩衝液のいずれか1以上を用いることができ、使用濃度としては、エチルアセチミデート及び/又はその塩は、濃度10〜1000mMの範囲で用いられ、好ましくは濃度30〜300mMの範囲で用いられる。トリス塩酸、グリシン、又はリン酸水素ナトリウムは0.1〜3M(終濃度:0.04〜1.2M)の範囲で用いられ、好ましくは0.1〜2M(終濃度:0.04〜0.8M)、さらに好ましくは0.5〜2M(終濃度:0.2〜0.8M)の範囲で用いられる。
【0016】
本発明のブロッキング剤は、蛍光色素で標識した試料中の抗原について抗原抗体反応を利用して検出するタンパク質検出方法に用いることができ、当該タンパク質検出方法において、バックグラウンドを低減することができる。また、本発明の検出方法により、従来の測定方法ではサンプルの標識反応から測定まで約3時間程度かかっていたものを、1/2〜1/3程度まで時間を短縮することができた。
また、本発明のタンパク質検出方法は、定量的な検出、定性的な検出のいずれにも用いることができる。
【0017】
また、本発明の蛍光検出方法を使用するタンパク質検出装置としては、少なくとも以下の(1)〜(5)の手段を有する検出装置が挙げられる。
(1)試料からタンパク質を抽出する手段
(2)(1)で得られたタンパク質と蛍光色素を反応させ蛍光色素標識タンパク質を作製する手段
(3)本発明のブロッキング剤を用いて蛍光色素と抗体との非特異反応を抑制する手段
(4)(2)で得られた蛍光色素標識タンパク質を抗体チップと反応させる手段
(5)(4)の反応後の抗体チップの蛍光色素を検出する手段
【実施例】
【0018】
本発明の具体的な実施方法について以下説明するが、本発明は、これに限定されるものではない。
〔実施例1〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、G3PDH抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、200、400、800ng のG3PDH 精製タンパク質(AbFRONTIER社:LF−P0008)
(1−2)抗体チップ
抗G3PDH抗体(AbFRONTIER社:LF−MA0038)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたG3PDH抗体チップを用いた。
1つの抗体チップには、8個のウェルが載置され、各ウェルには、20個の抗体スポットが固定化されている。抗体の各濃度について1ウェルにつき5スポットずつ固定した抗体チップを用いて試験を行った。各試料濃度について各1ウェルに適用し測定した。なお、抗体チップの作製は、住友ベークライト株式会社に依頼して行った(以下の実施例においても同様)。
(1−3)蛍光色素
Cyanine5(製品名:Cy5 monofunctional dye 、GE Healthcare社製(PA25001)、以下単にCy5と省略することがある。)
(1−4)ブロッキング剤
エチルアセチミデート塩酸塩(Alfa aesar社:2208−07−03)を用いた。
(2)試験方法
以下の手順により、測定を行った。
(i)50mM エチルアセチミデート塩酸塩(100μl)を抗体チップ基板と25℃で2時間処理した。
(ii)抗体チップ基板を20mM HEPES(pH7.5)で3回洗浄した。
(iii)各濃度の試料と0.1M Na2CO3(15μl)とを混合し、1分間室温で放置した。
(iv)Cy5(1mg分のタンパク質ラベルに必要な量の1/20量)に試料(50μl)を加えて37℃で10分間反応させた。
(v)抗体チップの各wellに試料を(65μl)添加し37℃で30分間反応させi)室温下、Wash buffer(0.1%Tween 20/PBS)で抗体チップを5回洗浄した。
(vii)室温下、超純水で抗体チップを2回洗浄した。
(viii)以下の蛍光測定機器及び条件により、蛍光強度を測定した。
蛍光測定機器:Molecular Devices社製 GenePix 4000B
測定条件:PMT Gain(光電子増倍管の感度)を600に設定してレーザースキャンを行い、スキャン後、それぞれのスポットに対するシグナル値を出し、n=5での平均値を算出した。
(3)試験結果
測定結果を図1に示す。抗体濃度1.0mg/mlにおいて、バックグラウンドが抑えられ、試料濃度依存性が見られた。
【0019】
〔実施例2〕
本発明のブロッキング剤(トリス塩酸)の未反応蛍光色素の抗体への結合阻害効果について、G3PDH抗体チップを用いて確認を行った。
(1)材料
ブロッキング剤としてエチルアセチミデート塩酸塩の代わりにトリス塩酸(pH7.4)(和光純薬)を用いた以外は実施例1と同じ材料を用いた。
(2)試験方法
以下の手順により、測定を行った。
(i)1.5ml容量のプラスチックチューブ(以下チューブとする)に各濃度の試料(50μl)と0.1M Na2CO3(15μl)とを混合し、1分間、室温で放置した。
(ii)Cy5を入れたチューブ前記混合試料を加えて37℃で10分間反応させた。
(iii)1M トリス塩酸を(ii)で反応させた試料に40μl加える。
(iv)抗体チップの各ウェルに試料を添加し37℃で30分間反応させた。
(v)室温下、Wash bufferで抗体チップを5回洗浄した。
(vi)室温下、超純水で抗体チップを2回洗浄した。
(vii)蛍光強度を測定した。蛍光強度の測定機器及び条件は実施例1と同じ。
(3)試験結果
測定結果を図2に示す。抗体濃度1.0mg/mlにおいて、バックグラウンドが抑えられ、試料濃度依存性が見られた。
【0020】
〔実施例3〕
本発明のブロッキング剤(グリシン)の未反応蛍光色素の抗体への結合阻害効果について、G3PDH抗体チップを用いて確認を行った。
(1)材料及び試験方法
ブロッキング剤としてトリス塩酸(pH7.4)の代わりにグリシン(和光純薬)を用いた以外は実施例2と同じ材料及び試験方法に従った。
(2)試験結果
測定結果を図3に示す。抗体濃度1.0mg/mlにおいて、バックグラウンドが抑えられ、試料濃度依存性が見られた。
【0021】
〔実施例4〕
本発明のブロッキング剤(リン酸水素ナトリウム)の未反応蛍光色素の抗体への結合阻害効果について、G3PDH抗体チップを用いて確認を行った。
(1)材料及び試験方法
ブロッキング剤としてトリス塩酸(pH7.4)の代わりにリン酸水素ナトリウム(pH4.1)(和光純薬)を用いた以外は実施例2と同じ材料及び試験方法に従った。
(2)試験結果
測定結果を図4に示す。
抗体濃度1.0mg/mlにおいて、バックグラウンドが抑えられ、試料濃度依存性が見られた。
実施例1〜4の結果によれば、エチルアセチミデート塩酸塩の方が、トリス塩酸、グリシン、リン酸水素ナトリウムに比べ、 得られるシグナル値が高く、感度の高い測定が可能であることがわかった。
【0022】
〔実施例5〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、AnnexinII抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、7.81、15.6、31.2、62.4、125、250、500 ngのAnnexinII 精製タンパク質(AmProx社:No.8168−10)
(1−2)抗体チップ
抗AnnexinII 抗体(Santa Cruz社:sc−47696)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたAnnexinII抗体チップを用いた。
(1−3)蛍光色素
実施例1と同じものを用いた。
(1−4)ブロッキング剤
エチルアセチミデート塩酸塩(Alfa aesar社)を用いた。
(2)試験方法
実施例1のエチルアセチミデート塩酸塩の場合と同じ試験方法に従った。
(3)試験結果
測定結果を図5に示す。
【0023】
〔実施例6〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、Arginase−1抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、50、100、250、500、1000、2000、5000ngのテープストリッピングサンプル(テープストリッピングサンプルは、皮膚からテープで採取したサンプルのことであり、精製タンパク質が市販されていない場合に用いた)
(1−2)抗体チップ
抗Arginase−1抗体(Santa Cruz社:sc−47715)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたArginase−1抗体チップを用いた。
(1−3)蛍光色素及びブロッキング剤
実施例1と同じものを用いた。
(2)試験方法
実施例1と同じ試験方法に従った。
(3)試験結果
測定結果を図6に示す。
【0024】
〔実施例7〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、Keratin2e抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、50、100、250、500、1000、2000、5000ngのテープストリッピングサンプル
(1−2)抗体チップ
抗Keratin2e抗体(Progen社:No.65191)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたKeratin2e抗体チップを用いた。
(1−3)蛍光色素及びブロッキング剤
実施例1と同じものを用いた。
(2)試験方法
実施例1と同じ試験方法に従った。
(3)試験結果
測定結果を図7に示す。
【0025】
〔実施例8〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、Keratin7抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、50、100、250、500、1000、2000、5000ngのテープストリッピングサンプル
(1−2)抗体チップ
抗Keratin7抗体(Santa Cruz社:sc−17118)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたKeratin7抗体チップを用いた。
(1−3)蛍光色素及びブロッキング剤
実施例1と同じものを用いた。
(2)試験方法
実施例1と同じ試験方法に従った。
(3)試験結果
測定結果を図8に示す。
【0026】
〔実施例9〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、Keratin15抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、125、250、500、1000、2000、4000、8000ngのテープストリッピングサンプル
(1−2)抗体チップ
抗Keratin15抗体(Millipore社:CBL272)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたKeratin15抗体チップを用いた。
(1−3)蛍光色素及びブロッキング剤
実施例1と同じものを用いた。
(2)試験方法
実施例1と同じ試験方法に従った。
(3)試験結果
測定結果を図9に示す。
【0027】
〔実施例10〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、Profilin−1抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、25、50、100、200、400、800、1200ngのProfilin−1精製タンパク質(Abnova社:H00005216−P01)
(1−2)抗体チップ
抗Profilin−1抗体(Abnova社:H00005216−A01)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたProfilin−1抗体チップを用いた。
(1−3)蛍光色素及びブロッキング剤
実施例1と同じものを用いた。
(2)試験方法
実施例1と同じ試験方法に従った。
(3)試験結果
測定結果を図10に示す。
【0028】
〔実施例11〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、SCCA2抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、100、250、500、1000、2000、5000ngのテープストリッピングサンプル
(1−2)抗体チップ
抗SCCA2抗体(Santa Cruz社:sc−21793)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたSCCA2抗体チップを用いた。
(1−3)蛍光色素及びブロッキング剤
実施例1と同じものを用いた。
(2)試験方法
実施例1と同じ試験方法に従った。
(3)試験結果
測定結果を図11に示す。
【0029】
〔実施例12〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、uPA抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、25、50、100、200、400、800、1200ngのuPA精製タンパク質(Millipore社:CC4000)
(1−2)抗体チップ
抗uPA抗体(Millipore社:MAB7776)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたuPA抗体チップを用いた。
(1−3)蛍光色素及びブロッキング剤
実施例1と同じものを用いた。
(2)試験方法
実施例1と同じ試験方法に従った。
(3)試験結果
測定結果を図12に示す。
【0030】
〔実施例13〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、BLMH抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、50、100、250、500、1000、2000、5000ngのテープストリッピングサンプル
(1−2)抗体チップ
抗BLMH抗体(Abnova社:H00000642−A01)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたBLMH抗体チップを用いた。
(1−3)蛍光色素及びブロッキング剤
実施例1と同じものを用いた。
(2)試験方法
実施例1と同じ試験方法に従った。
(3)試験結果
測定結果を図13に示す。
実施例5〜13によれば、本発明のブロッキング剤は、免疫反応の種類を問わず、汎用的に非特異反応の抑制効果を奏することが判明した。
【0031】
〔実施例14〕
未反応蛍光色素の抗体への結合阻害試薬(濃度)の検討(トリス塩酸)
本発明のブロッキング剤(トリス塩酸)の未反応蛍光色素の抗体への結合阻害効果について、有効濃度範囲の検討を行った。
(1)材料
(1−1)試料
BLMH精製タンパク質(Abnova社:H00000642−Q01) 0ng(試料なし)、125ng(試料あり)
(1−2)抗体チップ
抗BLMH抗体(Abnova社:H00000642−A01)が最終濃度0.5、1.0mg/mlとなるように、基板に固定化されたBLMH抗体チップを用いた。1つの抗体チップには、10個のウェルが載置され、各ウェルには、20個の 抗体スポットが固定化されている。抗体の各濃度について1ウェルにつき5スポットずつ固定した抗体チップを用いて試験を行った。各ブロッキング剤濃度について試料を各1ウェルに適用し測定した。
(1−3)蛍光色素
実施例1と同じものを用いた。
(1−4)ブロッキング剤
0、0.1、0.5、1、2Mのトリス塩酸(pH7.4、和光純薬工業)を用いた。
(2)試験方法
実施例2の試験方法に同じ。
(3)試験結果
抗BLMH抗体濃度が1Mの場合の結果を図14に示す。これによれば、トリス塩酸 1Mの場合に、サンプルありの測定値とサンプルなしの測定値の差が最大であり、本濃度での感度が最大であることがわかった。
【0032】
〔実施例15〕
未反応蛍光色素の抗体への結合阻害試薬(濃度)の検討(トリス塩酸)
本発明のブロッキング剤(トリス塩酸)の未反応蛍光色素の抗体への結合阻害効果について、有効濃度範囲の検討を行った。
試料として、BLMH精製タンパク質の代わりにAnnexinII精製タンパク質(AmProx社:No.8168−10)、抗体として抗BLMH抗体の代わりに抗AnnexinII抗体(Santa Cruz社:sc−47696)を用いた以外は、実施例14と同様に行った。抗AnnexinII抗体濃度が1Mの場合の結果を図15に示す。これによれば、抗体チップが変わってもトリス塩酸が1Mでサンプルありの測定値とサンプルなしの測定値の差が最大であり、本濃度での感度が最大であることがわかった。
【0033】
〔実施例16〕
未反応蛍光色素の抗体への結合阻害試薬(濃度)の検討(グリシン)
本発明のブロッキング剤(グリシン)の未反応蛍光色素の抗体への結合阻害効果について、有効濃度範囲の検討を行った。
ブロッキング剤として、トリス塩酸の代わりにグリシンを用いた以外は、実施例14と同様に行った。抗BLMH抗体濃度が1Mの場合の結果を図16に示す。これによれば、グリシンが1Mでサンプルありの測定値とサンプルなしの測定値の差が最大であり、本濃度での感度が最大であることがわかった。
【0034】
〔実施例17〕
未反応蛍光色素の抗体への結合阻害試薬(濃度)の検討(グリシン)
本発明のブロッキング剤(グリシン)の未反応蛍光色素の抗体への結合阻害効果について、有効濃度範囲の検討を行った。ブロッキング剤として、トリス塩酸の代わりにグリシンを用いた以外は、実施例15と同様に行った。抗AnnexinII抗体濃度が1Mの場合の結果を図17に示す。これによれば、抗体チップが変わってもグリシンが1Mでサンプルありの測定値とサンプルなしの測定値の差が最大であり、本濃度での感度が最大であることがわかった。
【産業上の利用可能性】
【0035】
本発明のブロッキング剤によれば、蛍光色素で標識した試料中の抗原を、抗原抗体反応を利用して測定する方法において、抗原抗体反応を阻害することなく、非特異反応を抑制し、バックグラウンドを抑えることができる。従って、従来よりも非常に簡易な方法、短時間で正確かつ高感度の測定をすることが可能となり、抗体を多数固定化した抗体チップを用いた測定方法・測定装置にも適用が可能である。
【技術分野】
【0001】
本発明は、標識試薬と抗体との非特異的な反応を抑制するブロッキング剤に関する。さらに詳しくは、蛍光色素で標識した試料中の抗原を、抗原抗体反応を利用して検出する方法において、蛍光色素と抗体との非特異的な反応を抑制するためのブロッキング剤に関する。また、本発明は、前記ブロッキング剤を用いたタンパク質検出方法及びタンパク質検出装置に関する。
【背景技術】
【0002】
免疫反応を利用して試料中の目的抗原を検出する方法において、試料を蛍光色素と結合させて、試料中の目的抗原を蛍光標識し、抗原抗体複合体の標識蛍光色素を検出することにより、試料中の目的抗原を定性的にあるいは定量的に測定する方法が知られている。本方法において、試料中の抗原と結合しなかった蛍光色素(未反応蛍光色素)が試料中に残存すると、抗体に未反応蛍光色素が非特異的に結合し、バックグラウンドが高くなることが知られている。このような蛍光色素と抗体との非特異反応を防止し、蛍光検出時のバックグラウンドを低減するため、従来、当該未反応蛍光色素をゲル濾過カラムにより取り除き、試料の精製を行っていた。しかし、ゲルろ過カラムを用いて試料を精製すると時間がかかるうえに、工程も増えるという問題があり、測定の簡略化、スピード化が求められていた。
ここで、非特異的な反応によるバックグラウンドの低減を目的とする技術として次のような従来技術が知られている。特許文献1には、DNAマイクロアレイにおける非特異的に吸着した蛍光色素付DNA及び未精製蛍光色素誘導体などの影響を受けずに、消光剤を用いて従来よりも検出感度と再現性を向上させる方法が開示されている。そして、消光剤としては、蛍光共鳴エネルギー転移により蛍光を消光させる物質を用いるとあり、具体的には、DNP、テトラメチルローダミンなどが挙げられている。特許文献2には、ハイブリダイゼーション用の特定の固体支持体を調製し、非特異的バックグラウンドを低減する方法が開示されている。
しかし、抗体と未反応蛍光色素の非特異反応自体をブロックするようなブロッキング剤についてはなんら開示も示唆もされていない。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2003-84002号公報
【特許文献2】特表平11-514872号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、抗原抗体反応を利用して蛍光色素で標識した試料中の抗原を検出する方法において、抗体と未反応蛍光色素の非特異反応自体を抑制するためのブロッキング剤を提供することを課題とする。また、本発明は、前記ブロッキング剤を用いたタンパク質検出方法及びタンパク質検出装置の提供も課題とする。
【課題を解決するための手段】
【0005】
本発明は、上記課題を解決するために、さまざまな化合物や緩衝液について、未反応蛍光色素の免疫反応に対する非特異反応抑制効果を検討したところ、驚くべきことに、エチルアセチミデート、エチルアセチミデートの塩、トリス塩酸、グリシン、又はリン酸水素ナトリウムのいずれか1以上を用いた場合に、前記非特異反応を抑制できることをつきとめ、本発明を完成するに至った。
すなわち、本発明は以下の構成を有する。
〔1〕蛍光色素と抗体との非特異反応を抑制するためのブロッキング剤であって、エチルアセチミデート、エチルアセチミデートの塩、トリス塩酸、グリシン、又はリン酸水素ナトリウムのいずれか1以上を含むことを特徴とするブロッキング剤。
〔2〕蛍光色素と抗体との非特異反応を抑制するためのブロッキング剤であって、エチルアセチミデート及び/又はエチルアセチミデートの塩を含むことを特徴とするブロッキング剤。
〔3〕抗原抗体反応を利用し蛍光色素で標識した試料中の抗原を検出するタンパク質検出方法において、〔1〕又は〔2〕に記載のブロッキング剤を用いることを特徴とするタンパク質検出方法。
〔4〕抗原抗体反応が、基板に抗体が固定化されている抗体チップを用いた反応である〔3〕に記載のタンパク質検出方法。
〔5〕〔3〕又は〔4〕に記載のタンパク質検出方法を使用するタンパク質自動検出装置であって、以下の手段を有する検出装置。
(1)試料からタンパク質を抽出する手段
(2)(1)で得られたタンパク質と蛍光色素を反応させ蛍光色素標識タンパク質を作製する手段
(3)〔1〕又は〔2〕に記載のブロッキング剤を用いて蛍光色素と抗体との非特異反応を抑制する手段
(4)(2)で得られた蛍光色素標識タンパク質を抗体チップと反応させる手段
(5)(4)の反応後の抗体チップの蛍光色素を検出する手段
【発明の効果】
【0006】
本発明のブロッキング剤によれば、抗原抗体反応を阻害することなく、抗体と未反応蛍光色素との非特異反応のみを抑制し、バックグラウンドを抑えることができた。
また、本発明のブロッキング剤を用いた検出方法により、従来の検出方法ではサンプルの標識反応から測定まで約3時間程度かかっていたところ、1/2〜1/3程度まで時間を短縮することができた。
【図面の簡単な説明】
【0007】
【図1】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、G3PDH抗体チップを用いて行った試験結果を示す図である。
【図2】本発明のブロッキング剤(トリス塩酸)の未反応蛍光色素の抗体への結合抑制効果について、G3PDH抗体チップを用いて行った試験結果を示す図である。
【図3】本発明のブロッキング剤(グリシン)の未反応蛍光色素の抗体への結合抑制効果について、G3PDH抗体チップを用いて行った試験結果を示す図である。
【図4】本発明のブロッキング剤(リン酸水素ナトリウム)の未反応蛍光色素の抗体への結合抑制効果について、G3PDH抗体チップを用いて行った試験結果を示す図である。
【図5】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、AnnexinII抗体チップを用いて行った試験結果を示す図である。
【図6】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、Arginase−1抗体チップを用いて行った試験結果を示す図である。
【図7】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、Keratin2e抗体チップを用いて行った試験結果を示す図である。
【図8】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、Keratin7抗体チップを用いて行った試験結果を示す図である。
【図9】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、Keratin15抗体チップを用いて行った試験結果を示す図である。
【図10】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、Profilin−1抗体チップを用いて行った試験結果を示す図である。
【図11】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、SCCA2抗体チップを用いて行った試験結果を示す図である。
【図12】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、uPA抗体チップを用いて行った試験結果を示す図である。
【図13】本発明のブロッキング剤(エチルアセチミデート塩酸塩)の未反応蛍光色素の抗体への結合抑制効果について、BLMH抗体チップを用いて行った試験結果を示す図である。
【図14】本発明のブロッキング剤(トリス塩酸)のブロッキング効果の濃度依存性についてBLMH抗体チップを用いて行った試験結果を示す図である。
【図15】本発明のブロッキング剤(トリス塩酸)のブロッキング効果の濃度依存性についてAnnexinII抗体チップを用いて行った試験結果を示す図である。
【図16】本発明のブロッキング剤(グリシン)のブロッキング効果の濃度依存性についてBLMH抗体チップを用いて行った試験結果を示す図である。
【図17】本発明のブロッキング剤(グリシン)のブロッキング効果の濃度依存性についてAnnexinII抗体チップを用いて行った試験結果を示す図である。
【発明を実施するための形態】
【0008】
本発明のブロッキング剤は、蛍光色素と抗体との非特異反応を抑制するためのブロッキング剤であって、エチルアセチミデート、その塩、トリス塩酸、グリシン、又はリン酸水素ナトリウムのいずれか1以上を含むことを特徴としている。
本発明のブロッキング剤が抑制する非特異反応とは、蛍光色素と抗体との非特異反応であり、測定対象である抗原を蛍光色素で標識した場合に、余剰の未反応蛍光色素が測定用の抗体と起こす反応のことをいう。
【0009】
抗原を標識する蛍光色素としては、本発明のブロッキング剤が未反応蛍光色素と抗体との非特異反応抑制効果を発揮できるような蛍光色素であればどのようなものでもよく、タンパク質検出方法に用いられる蛍光色素が対象とされる。例えば、Cyanine類、Alexa Fluor類、DyLight類等のタンパク質のアミノ基に結合する蛍光試薬が挙げられる。Cyanine類としては、Cyanine3、3.5、5、5.5、7、Alexa Fluor類としてはAlexa Fluor 350、555、DyLight類としてはDyLight 549、649等が挙げられる。
【0010】
本発明のブロッキング剤は、抗原を蛍光色素で標識して蛍光検出するような免疫反応であればいずれの免疫反応にも用いることができる。従って、測定対象の抗原もさまざまなものが挙げられるが、例えば、G3PDH、AnnexinII、Arginase−1、Keratin2e、Keratin7、Keratin15、Profilin−1、SCCA2、uPA、BLMH、MMP2、HSP70、β−Catenin、Apolipoprotein A1、maspin、IgE、HSP27、FABP−5、galectin−7、KLK7、enolase−1、Cathepsin D、β−actin等が挙げられる。
【0011】
本発明のブロッキング剤が抑制する非特異反応において、抗体は、固相に固定化されて用いられる。抗体が固定化される固相としては、ストリップ状の試験片、プラスチック基板、粒子、ニトロセルロース膜、PVDF膜などが挙げられ、固相への抗体の固定化はそれ自体周知の方法によって行うことができる。また、プラスチック基板に抗体が固定化されている例としては、プラスチック基板に抗体が点状にスポットされ固定化された抗体チップや抗体アレイが挙げられる。
【0012】
本発明のブロッキング剤の免疫反応への適用方法としては、(1)固相に固定化される抗体側をあらかじめブロッキング剤によって処理する方法や、(2)蛍光色素で標識した抗原と抗体を反応させる前に未反応蛍光色素をブロッキング剤で処理することにより、未反応蛍光色素と抗体との非特異反応を防ぐ方法や、(3)未反応蛍光色素が抗体に結合できないように蛍光色素と試料を反応させた後溶液中のpHを中性にする方法が挙げられる。(1)の抗体側のブロッキングは、(1−1)抗体が固相に固定化された後に、固相にブロッキング剤を供給して、抗体をブロッキング処理する方法と、(1−2)抗体が固相に固定化される前に、溶液中で遊離した状態の抗体にブロッキング剤を供給して、抗体をブロッキング処理し、これを固相に供給して、ブロッキングされた状態の抗体を固相に固定化する方法が挙げられる。
また、用いられるブロッキング剤としては、(1)の方法にはエチルアセチミデート及び/又はその塩が好ましく用いられ、(2)の方法には、トリス塩酸、グリシン、(3)の方法にはリン酸水素ナトリウムが好ましく用いられる。ここで、エチルアセチミデート(Ethyl acetimidate)はC4H9NOの元素組成を有する次式の化合物であり、CAS RNは2208−07−3である。エチルアセチミデートは、溶解性の点で塩を用いることが好ましく、例えば、エチルアセチミデート塩酸塩(Ethyl acetimidate hydrochroride)が挙げられる。
【0013】
【化1】

【0014】
前記、ブロッキング剤の免疫反応への適用方法のうち、(1)の方法によれば、ブロッキング剤によって抗体側をブロッキング処理しておくため、免疫反応時に全溶液の容量が増えず、(2)、(3)の方法に比べ抗体との反応性が上がる。
【0015】
本発明のブロッキング剤としては、エチルアセチミデート及び/又はその塩、トリス塩酸、グリシン、又はリン酸水素ナトリウム緩衝液のいずれか1以上を用いることができ、使用濃度としては、エチルアセチミデート及び/又はその塩は、濃度10〜1000mMの範囲で用いられ、好ましくは濃度30〜300mMの範囲で用いられる。トリス塩酸、グリシン、又はリン酸水素ナトリウムは0.1〜3M(終濃度:0.04〜1.2M)の範囲で用いられ、好ましくは0.1〜2M(終濃度:0.04〜0.8M)、さらに好ましくは0.5〜2M(終濃度:0.2〜0.8M)の範囲で用いられる。
【0016】
本発明のブロッキング剤は、蛍光色素で標識した試料中の抗原について抗原抗体反応を利用して検出するタンパク質検出方法に用いることができ、当該タンパク質検出方法において、バックグラウンドを低減することができる。また、本発明の検出方法により、従来の測定方法ではサンプルの標識反応から測定まで約3時間程度かかっていたものを、1/2〜1/3程度まで時間を短縮することができた。
また、本発明のタンパク質検出方法は、定量的な検出、定性的な検出のいずれにも用いることができる。
【0017】
また、本発明の蛍光検出方法を使用するタンパク質検出装置としては、少なくとも以下の(1)〜(5)の手段を有する検出装置が挙げられる。
(1)試料からタンパク質を抽出する手段
(2)(1)で得られたタンパク質と蛍光色素を反応させ蛍光色素標識タンパク質を作製する手段
(3)本発明のブロッキング剤を用いて蛍光色素と抗体との非特異反応を抑制する手段
(4)(2)で得られた蛍光色素標識タンパク質を抗体チップと反応させる手段
(5)(4)の反応後の抗体チップの蛍光色素を検出する手段
【実施例】
【0018】
本発明の具体的な実施方法について以下説明するが、本発明は、これに限定されるものではない。
〔実施例1〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、G3PDH抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、200、400、800ng のG3PDH 精製タンパク質(AbFRONTIER社:LF−P0008)
(1−2)抗体チップ
抗G3PDH抗体(AbFRONTIER社:LF−MA0038)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたG3PDH抗体チップを用いた。
1つの抗体チップには、8個のウェルが載置され、各ウェルには、20個の抗体スポットが固定化されている。抗体の各濃度について1ウェルにつき5スポットずつ固定した抗体チップを用いて試験を行った。各試料濃度について各1ウェルに適用し測定した。なお、抗体チップの作製は、住友ベークライト株式会社に依頼して行った(以下の実施例においても同様)。
(1−3)蛍光色素
Cyanine5(製品名:Cy5 monofunctional dye 、GE Healthcare社製(PA25001)、以下単にCy5と省略することがある。)
(1−4)ブロッキング剤
エチルアセチミデート塩酸塩(Alfa aesar社:2208−07−03)を用いた。
(2)試験方法
以下の手順により、測定を行った。
(i)50mM エチルアセチミデート塩酸塩(100μl)を抗体チップ基板と25℃で2時間処理した。
(ii)抗体チップ基板を20mM HEPES(pH7.5)で3回洗浄した。
(iii)各濃度の試料と0.1M Na2CO3(15μl)とを混合し、1分間室温で放置した。
(iv)Cy5(1mg分のタンパク質ラベルに必要な量の1/20量)に試料(50μl)を加えて37℃で10分間反応させた。
(v)抗体チップの各wellに試料を(65μl)添加し37℃で30分間反応させi)室温下、Wash buffer(0.1%Tween 20/PBS)で抗体チップを5回洗浄した。
(vii)室温下、超純水で抗体チップを2回洗浄した。
(viii)以下の蛍光測定機器及び条件により、蛍光強度を測定した。
蛍光測定機器:Molecular Devices社製 GenePix 4000B
測定条件:PMT Gain(光電子増倍管の感度)を600に設定してレーザースキャンを行い、スキャン後、それぞれのスポットに対するシグナル値を出し、n=5での平均値を算出した。
(3)試験結果
測定結果を図1に示す。抗体濃度1.0mg/mlにおいて、バックグラウンドが抑えられ、試料濃度依存性が見られた。
【0019】
〔実施例2〕
本発明のブロッキング剤(トリス塩酸)の未反応蛍光色素の抗体への結合阻害効果について、G3PDH抗体チップを用いて確認を行った。
(1)材料
ブロッキング剤としてエチルアセチミデート塩酸塩の代わりにトリス塩酸(pH7.4)(和光純薬)を用いた以外は実施例1と同じ材料を用いた。
(2)試験方法
以下の手順により、測定を行った。
(i)1.5ml容量のプラスチックチューブ(以下チューブとする)に各濃度の試料(50μl)と0.1M Na2CO3(15μl)とを混合し、1分間、室温で放置した。
(ii)Cy5を入れたチューブ前記混合試料を加えて37℃で10分間反応させた。
(iii)1M トリス塩酸を(ii)で反応させた試料に40μl加える。
(iv)抗体チップの各ウェルに試料を添加し37℃で30分間反応させた。
(v)室温下、Wash bufferで抗体チップを5回洗浄した。
(vi)室温下、超純水で抗体チップを2回洗浄した。
(vii)蛍光強度を測定した。蛍光強度の測定機器及び条件は実施例1と同じ。
(3)試験結果
測定結果を図2に示す。抗体濃度1.0mg/mlにおいて、バックグラウンドが抑えられ、試料濃度依存性が見られた。
【0020】
〔実施例3〕
本発明のブロッキング剤(グリシン)の未反応蛍光色素の抗体への結合阻害効果について、G3PDH抗体チップを用いて確認を行った。
(1)材料及び試験方法
ブロッキング剤としてトリス塩酸(pH7.4)の代わりにグリシン(和光純薬)を用いた以外は実施例2と同じ材料及び試験方法に従った。
(2)試験結果
測定結果を図3に示す。抗体濃度1.0mg/mlにおいて、バックグラウンドが抑えられ、試料濃度依存性が見られた。
【0021】
〔実施例4〕
本発明のブロッキング剤(リン酸水素ナトリウム)の未反応蛍光色素の抗体への結合阻害効果について、G3PDH抗体チップを用いて確認を行った。
(1)材料及び試験方法
ブロッキング剤としてトリス塩酸(pH7.4)の代わりにリン酸水素ナトリウム(pH4.1)(和光純薬)を用いた以外は実施例2と同じ材料及び試験方法に従った。
(2)試験結果
測定結果を図4に示す。
抗体濃度1.0mg/mlにおいて、バックグラウンドが抑えられ、試料濃度依存性が見られた。
実施例1〜4の結果によれば、エチルアセチミデート塩酸塩の方が、トリス塩酸、グリシン、リン酸水素ナトリウムに比べ、 得られるシグナル値が高く、感度の高い測定が可能であることがわかった。
【0022】
〔実施例5〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、AnnexinII抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、7.81、15.6、31.2、62.4、125、250、500 ngのAnnexinII 精製タンパク質(AmProx社:No.8168−10)
(1−2)抗体チップ
抗AnnexinII 抗体(Santa Cruz社:sc−47696)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたAnnexinII抗体チップを用いた。
(1−3)蛍光色素
実施例1と同じものを用いた。
(1−4)ブロッキング剤
エチルアセチミデート塩酸塩(Alfa aesar社)を用いた。
(2)試験方法
実施例1のエチルアセチミデート塩酸塩の場合と同じ試験方法に従った。
(3)試験結果
測定結果を図5に示す。
【0023】
〔実施例6〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、Arginase−1抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、50、100、250、500、1000、2000、5000ngのテープストリッピングサンプル(テープストリッピングサンプルは、皮膚からテープで採取したサンプルのことであり、精製タンパク質が市販されていない場合に用いた)
(1−2)抗体チップ
抗Arginase−1抗体(Santa Cruz社:sc−47715)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたArginase−1抗体チップを用いた。
(1−3)蛍光色素及びブロッキング剤
実施例1と同じものを用いた。
(2)試験方法
実施例1と同じ試験方法に従った。
(3)試験結果
測定結果を図6に示す。
【0024】
〔実施例7〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、Keratin2e抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、50、100、250、500、1000、2000、5000ngのテープストリッピングサンプル
(1−2)抗体チップ
抗Keratin2e抗体(Progen社:No.65191)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたKeratin2e抗体チップを用いた。
(1−3)蛍光色素及びブロッキング剤
実施例1と同じものを用いた。
(2)試験方法
実施例1と同じ試験方法に従った。
(3)試験結果
測定結果を図7に示す。
【0025】
〔実施例8〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、Keratin7抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、50、100、250、500、1000、2000、5000ngのテープストリッピングサンプル
(1−2)抗体チップ
抗Keratin7抗体(Santa Cruz社:sc−17118)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたKeratin7抗体チップを用いた。
(1−3)蛍光色素及びブロッキング剤
実施例1と同じものを用いた。
(2)試験方法
実施例1と同じ試験方法に従った。
(3)試験結果
測定結果を図8に示す。
【0026】
〔実施例9〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、Keratin15抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、125、250、500、1000、2000、4000、8000ngのテープストリッピングサンプル
(1−2)抗体チップ
抗Keratin15抗体(Millipore社:CBL272)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたKeratin15抗体チップを用いた。
(1−3)蛍光色素及びブロッキング剤
実施例1と同じものを用いた。
(2)試験方法
実施例1と同じ試験方法に従った。
(3)試験結果
測定結果を図9に示す。
【0027】
〔実施例10〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、Profilin−1抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、25、50、100、200、400、800、1200ngのProfilin−1精製タンパク質(Abnova社:H00005216−P01)
(1−2)抗体チップ
抗Profilin−1抗体(Abnova社:H00005216−A01)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたProfilin−1抗体チップを用いた。
(1−3)蛍光色素及びブロッキング剤
実施例1と同じものを用いた。
(2)試験方法
実施例1と同じ試験方法に従った。
(3)試験結果
測定結果を図10に示す。
【0028】
〔実施例11〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、SCCA2抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、100、250、500、1000、2000、5000ngのテープストリッピングサンプル
(1−2)抗体チップ
抗SCCA2抗体(Santa Cruz社:sc−21793)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたSCCA2抗体チップを用いた。
(1−3)蛍光色素及びブロッキング剤
実施例1と同じものを用いた。
(2)試験方法
実施例1と同じ試験方法に従った。
(3)試験結果
測定結果を図11に示す。
【0029】
〔実施例12〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、uPA抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、25、50、100、200、400、800、1200ngのuPA精製タンパク質(Millipore社:CC4000)
(1−2)抗体チップ
抗uPA抗体(Millipore社:MAB7776)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたuPA抗体チップを用いた。
(1−3)蛍光色素及びブロッキング剤
実施例1と同じものを用いた。
(2)試験方法
実施例1と同じ試験方法に従った。
(3)試験結果
測定結果を図12に示す。
【0030】
〔実施例13〕
本発明のブロッキング剤の未反応蛍光色素の抗体への結合阻害効果について、BLMH抗体チップを用いて確認を行った。
(1)材料
(1−1)試料
0、50、100、250、500、1000、2000、5000ngのテープストリッピングサンプル
(1−2)抗体チップ
抗BLMH抗体(Abnova社:H00000642−A01)が最終濃度0.1、0.3、0.5、1.0mg/mlとなるように、基板に固定化されたBLMH抗体チップを用いた。
(1−3)蛍光色素及びブロッキング剤
実施例1と同じものを用いた。
(2)試験方法
実施例1と同じ試験方法に従った。
(3)試験結果
測定結果を図13に示す。
実施例5〜13によれば、本発明のブロッキング剤は、免疫反応の種類を問わず、汎用的に非特異反応の抑制効果を奏することが判明した。
【0031】
〔実施例14〕
未反応蛍光色素の抗体への結合阻害試薬(濃度)の検討(トリス塩酸)
本発明のブロッキング剤(トリス塩酸)の未反応蛍光色素の抗体への結合阻害効果について、有効濃度範囲の検討を行った。
(1)材料
(1−1)試料
BLMH精製タンパク質(Abnova社:H00000642−Q01) 0ng(試料なし)、125ng(試料あり)
(1−2)抗体チップ
抗BLMH抗体(Abnova社:H00000642−A01)が最終濃度0.5、1.0mg/mlとなるように、基板に固定化されたBLMH抗体チップを用いた。1つの抗体チップには、10個のウェルが載置され、各ウェルには、20個の 抗体スポットが固定化されている。抗体の各濃度について1ウェルにつき5スポットずつ固定した抗体チップを用いて試験を行った。各ブロッキング剤濃度について試料を各1ウェルに適用し測定した。
(1−3)蛍光色素
実施例1と同じものを用いた。
(1−4)ブロッキング剤
0、0.1、0.5、1、2Mのトリス塩酸(pH7.4、和光純薬工業)を用いた。
(2)試験方法
実施例2の試験方法に同じ。
(3)試験結果
抗BLMH抗体濃度が1Mの場合の結果を図14に示す。これによれば、トリス塩酸 1Mの場合に、サンプルありの測定値とサンプルなしの測定値の差が最大であり、本濃度での感度が最大であることがわかった。
【0032】
〔実施例15〕
未反応蛍光色素の抗体への結合阻害試薬(濃度)の検討(トリス塩酸)
本発明のブロッキング剤(トリス塩酸)の未反応蛍光色素の抗体への結合阻害効果について、有効濃度範囲の検討を行った。
試料として、BLMH精製タンパク質の代わりにAnnexinII精製タンパク質(AmProx社:No.8168−10)、抗体として抗BLMH抗体の代わりに抗AnnexinII抗体(Santa Cruz社:sc−47696)を用いた以外は、実施例14と同様に行った。抗AnnexinII抗体濃度が1Mの場合の結果を図15に示す。これによれば、抗体チップが変わってもトリス塩酸が1Mでサンプルありの測定値とサンプルなしの測定値の差が最大であり、本濃度での感度が最大であることがわかった。
【0033】
〔実施例16〕
未反応蛍光色素の抗体への結合阻害試薬(濃度)の検討(グリシン)
本発明のブロッキング剤(グリシン)の未反応蛍光色素の抗体への結合阻害効果について、有効濃度範囲の検討を行った。
ブロッキング剤として、トリス塩酸の代わりにグリシンを用いた以外は、実施例14と同様に行った。抗BLMH抗体濃度が1Mの場合の結果を図16に示す。これによれば、グリシンが1Mでサンプルありの測定値とサンプルなしの測定値の差が最大であり、本濃度での感度が最大であることがわかった。
【0034】
〔実施例17〕
未反応蛍光色素の抗体への結合阻害試薬(濃度)の検討(グリシン)
本発明のブロッキング剤(グリシン)の未反応蛍光色素の抗体への結合阻害効果について、有効濃度範囲の検討を行った。ブロッキング剤として、トリス塩酸の代わりにグリシンを用いた以外は、実施例15と同様に行った。抗AnnexinII抗体濃度が1Mの場合の結果を図17に示す。これによれば、抗体チップが変わってもグリシンが1Mでサンプルありの測定値とサンプルなしの測定値の差が最大であり、本濃度での感度が最大であることがわかった。
【産業上の利用可能性】
【0035】
本発明のブロッキング剤によれば、蛍光色素で標識した試料中の抗原を、抗原抗体反応を利用して測定する方法において、抗原抗体反応を阻害することなく、非特異反応を抑制し、バックグラウンドを抑えることができる。従って、従来よりも非常に簡易な方法、短時間で正確かつ高感度の測定をすることが可能となり、抗体を多数固定化した抗体チップを用いた測定方法・測定装置にも適用が可能である。
【特許請求の範囲】
【請求項1】
蛍光色素と抗体との非特異反応を抑制するためのブロッキング剤であって、エチルアセチミデート、エチルアセチミデートの塩、トリス塩酸、グリシン、又はリン酸水素ナトリウムのいずれか1以上を含むことを特徴とするブロッキング剤。
【請求項2】
蛍光色素と抗体との非特異反応を抑制するためのブロッキング剤であって、エチルアセチミデート及び/又はエチルアセチミデートの塩を含むことを特徴とするブロッキング剤。
【請求項3】
抗原抗体反応を利用し蛍光色素で標識した試料中の抗原を検出するタンパク質検出方法において、請求項1又は2に記載のブロッキング剤を用いることを特徴とするタンパク質検出方法。
【請求項4】
抗原抗体反応が、基板に抗体が固定化されている抗体チップを用いた反応である請求項3に記載のタンパク質検出方法。
【請求項5】
請求項3又は4に記載のタンパク質検出方法を使用するタンパク質自動検出装置であって、以下の手段を有する検出装置。
(1)試料からタンパク質を抽出する手段
(2)(1)で得られたタンパク質と蛍光色素を反応させ蛍光色素標識タンパク質を作製する手段
(3)請求項1又は2に記載のブロッキング剤を用いて蛍光色素と抗体との非特異反応を抑制する手段
(4)(2)で得られた蛍光色素標識タンパク質を抗体チップと反応させる手段
(5)(4)の反応後の抗体チップの蛍光色素を検出する手段
【請求項1】
蛍光色素と抗体との非特異反応を抑制するためのブロッキング剤であって、エチルアセチミデート、エチルアセチミデートの塩、トリス塩酸、グリシン、又はリン酸水素ナトリウムのいずれか1以上を含むことを特徴とするブロッキング剤。
【請求項2】
蛍光色素と抗体との非特異反応を抑制するためのブロッキング剤であって、エチルアセチミデート及び/又はエチルアセチミデートの塩を含むことを特徴とするブロッキング剤。
【請求項3】
抗原抗体反応を利用し蛍光色素で標識した試料中の抗原を検出するタンパク質検出方法において、請求項1又は2に記載のブロッキング剤を用いることを特徴とするタンパク質検出方法。
【請求項4】
抗原抗体反応が、基板に抗体が固定化されている抗体チップを用いた反応である請求項3に記載のタンパク質検出方法。
【請求項5】
請求項3又は4に記載のタンパク質検出方法を使用するタンパク質自動検出装置であって、以下の手段を有する検出装置。
(1)試料からタンパク質を抽出する手段
(2)(1)で得られたタンパク質と蛍光色素を反応させ蛍光色素標識タンパク質を作製する手段
(3)請求項1又は2に記載のブロッキング剤を用いて蛍光色素と抗体との非特異反応を抑制する手段
(4)(2)で得られた蛍光色素標識タンパク質を抗体チップと反応させる手段
(5)(4)の反応後の抗体チップの蛍光色素を検出する手段
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公開番号】特開2011−47871(P2011−47871A)
【公開日】平成23年3月10日(2011.3.10)
【国際特許分類】
【出願番号】特願2009−198176(P2009−198176)
【出願日】平成21年8月28日(2009.8.28)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
【公開日】平成23年3月10日(2011.3.10)
【国際特許分類】
【出願日】平成21年8月28日(2009.8.28)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
[ Back to top ]

