ブロック共重合体およびそれを被覆した医療用具
【課題】湿潤時にMRI下での診断および治療に用いる医療器具を容易に視認でき、かつ表面潤滑性を同時に発現するブロック共重合体およびそれを被覆してなる医療器具を提供する。
【解決手段】分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質と親水性化合物の共重合体からなる第1のセグメントと、反応性官能基を有する化合物からなる第2のセグメントを含むことを特徴とするブロック共重合体およびそれを基材表面に被覆したことを特徴とする医療器具。
【解決手段】分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質と親水性化合物の共重合体からなる第1のセグメントと、反応性官能基を有する化合物からなる第2のセグメントを含むことを特徴とするブロック共重合体およびそれを基材表面に被覆したことを特徴とする医療器具。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、湿潤時に磁気共鳴画像下において診断または治療に用いる医療器具を磁気共鳴画像下において視認可能とし、かつ表面潤滑性を同時に発現させるブロック共重合体と、それを被覆してなる医療器具に関する。
【背景技術】
【0002】
近年、臨床画像診断の進歩は著しく、磁気共鳴画像診断法(以下、MRIと称する)、X線撮影法、超音波画像診断法、X線CT(コンピュータ断層撮影法)、シンチグラフィー等を用いた診断、治療の重要性が高まっている。特に、MRIは、放射線被曝をすることなく任意多方向からの断面像が優れた組織分解能で得られ、さらに血流、拡散、温度等の機能情報も得られることから、画像診断領域においてその有用性が高く評価されている。
【0003】
最近のMRIに関するハードウエアおよび撮像シーケンスの進歩によって、画像診断のみでなく、MRI下で診断、治療手技を行う、「インターベンショナル(Interventional)MRI」の臨床応用が注目されてきた。その手技は、経皮的穿刺生検術、各種ドレナージ術、腫瘍焼灼術などの非血管領域にとどまるものではなく、血管形成術、ステント留置術、下大動脈フィルター留置術など、血管領域への応用に向けて研究が進められている。
【0004】
現在、上記血管領域の診断および治療にかかわる手技は、主にX線透視下で行われている。X線透視は2次元画像しか取得できない。また、血管領域の診断および治療の手技にかかる時間は平均約3時間であるが、難しい症例では8時間以上を要する場合もある。したがって、X線透視下の場合、患者および医療従事者は手技中に有害な放射線に晒され続けることとなる。
【0005】
一方、MRIは3次元画像を容易に取得できるので、X線透視と比較して脳動静脈奇形や動脈瘤など、複雑な血管異常を理解する上で非常に有用な各種機能情報を得ることが可能である。また、MRIに用いられる造影剤は、X線透視に用いられるヨード系造影剤と比較して、人体への有害性が低い。加えて、放射線被曝の心配もない。このように、血管領域の診断および治療をMRI下で行うことは、X線透視下での場合と比較して多くの利点がある。
【0006】
しかしながら、血管領域の診断および治療に用いられる医療器具のほとんどは、高分子材料、金属、セラミックまたはこれらの複合物から形成されており、MRIでは適切な信号を得ることができず、MRI下で視認することができない。従って、安全で正確な手技のために、MRI下での医療器具の視認化技術が望まれている。
【0007】
MRI下での医療器具の視認化技術には、能動的手法と受動的手法の2つが提案されている。能動的手法とは、1個以上の高周波(RF)コイルをカテーテルのような医療器具に取り付け、コイルにより検出された磁気共鳴信号をもとにコンピュータで位置を計算し、先に取得した組織画像に重ねて表示させる手法である。しかしながら、この手法ではコイルの取り付けられた位置しか視認できないため、器具の全体像を把握することができない。そのため、カテーテルのような可撓性器具を視認するには限界がある。コイルを複数個導入することも考えられるが、機械的物性に影響を与えカテーテルの本来の機能が損なわれるため、好ましくない。また、RF誘導電流による器具の発熱も問題となる。
【0008】
一方、受動的手法とは、磁気共鳴信号の損失により医療器具を視認する手法である。一つの例として、プラスチック等の検出可能な磁気共鳴信号を持たない非磁性体で器具を形成し、MRI上で無信号領域として描出する技術がある。この方法は、器具の全体像を把握できる点で能動的手法よりも優れているが、器具の信号損失を空気、流動血液等の信号損失と混同しうる点が問題である。また別の例として、周辺組織と異なる磁化率を有する材料で器具を形成し、磁化率効果による器具周辺の画像の歪み(アーチファクト)を利用して描出する技術があるが、磁化率効果はMRIの静磁場に対する器具の配向に依存し、器具の寸法が正確に画像化されないという問題がある。
【0009】
これを解決する手段として、常磁性イオンキレート錯体が、その周辺に存在するプロトンの磁気共鳴(以下、MRと称する)による緩和時間を短縮する効果を利用して、MR画像上で医療器具を高信号に視認化する技術が考案されている。例えば、医療器具を構成する基材表面に常磁性イオンキレート錯体を化学的に固定する方法(特許文献1)、常磁性イオンキレート錯体を含む水膨潤性重合体(特許文献2)で医療器具表面に皮膜を形成させる方法が開示されている(特許文献3、4)。上記の手法により、カテーテル等の可撓性器具の全体を正確な寸法で視認することが可能となる。
【0010】
ところで、血管領域での診断および治療に用いる医療器具には、組織への損傷を低減し、目的部位へ確実に挿入するために、器具に表面潤滑性を付与することが必要である。そのため、該磁気共鳴信号を発する皮膜上にさらに表面潤滑性を有する皮膜を設ける方法が開示されている(特許文献4、非特許文献1)。しかしながら、皮膜が多層となることで、視認性の発現までに時間を要する、膜厚が厚くなり剥離しやすくなる、コーティング工程が複数回となる等の問題があった。
【0011】
以上のように、血管領域でのインターベンショナルMRIは有用性が高く、今後大きく発展することが期待されるにもかかわらず、従来技術では、MRI下での診断および治療を行うにあたり、医療器具全体が視認化でき、かつ特に血管領域での手技において必要な表面潤滑性を同時に発現するための好適な方法は得られていない。
【特許文献1】特表2002−516132号公報
【特許文献2】特開2005−239641号公報
【特許文献3】特表2005−525176号公報
【特許文献4】特表2006−503594号公報
【非特許文献1】第32回日本磁気共鳴医学会大会予稿集、2004年、p.185、181−22A
【発明の開示】
【発明が解決しようとする課題】
【0012】
本発明は、このような問題点に鑑みてなされ、湿潤時にMRI下での診断および治療に用いる医療器具を容易に視認でき、かつ表面潤滑性を同時に発現するブロック共重合体およびそれを被覆してなる医療器具を提供することを目的とする。
【課題を解決するための手段】
【0013】
このような目的は、下記(1)から(8)の本発明により達成される。
【0014】
(1)分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質と親水性化合物の共重合体からなる第1のセグメントと、
反応性官能基を有する化合物からなる第2のセグメントを含むことを特徴とするブロック共重合体。
【0015】
(2)前記分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質が、分子内にアミド結合を有するキレート化合物と、前記キレート化合物に配位された常磁性イオンから形成されていることを特徴とする(1)に記載のブロック共重合体。
【0016】
(3)前記分子内にアミド結合を有するキレート化合物が、下記一般式1で示されるキレート化合物であることを特徴とする(2)に記載のブロック共重合体。
【0017】
【化1】

(式1中、n=1〜5である)
【0018】
(4)前記常磁性イオンが、ガドリニウム(III)であることを特徴とする(2)または(3)に記載のブロック共重合体。
【0019】
(5)前記親水性化合物が、アクリルアミド、アクリル酸、メタクリル酸、マレイン酸、無水マレイン酸、ビニルピロリドンおよびそれらの誘導体からなる群から選択される少なくも一つであることを特徴とする(1)〜(4)のいずれかに記載のブロック共重合体。
【0020】
(6)前記反応性官能基が、ヒドロキシル基、アミノ基、エポキシ基、カルボキシル基、酸クロリド基、アルデヒド基、イソシアネート基およびイソチオシアネート基からなる群から選択される少なくも一つであることを特徴とする(1)〜(5)のいずれかに記載のブロック共重合体。
【0021】
(7)前記ブロック共重合体が、湿潤時における表面潤滑性と磁気共鳴画像における視認性を発現することを特徴とする(1)〜(6)のいずれかに記載のブロック共重合体。
【0022】
(8)(1)〜(7)のいずれかに記載のブロック共重合体を基材表面に被覆したことを特徴とする医療器具。
【発明の効果】
【0023】
以上述べたごとく、本発明のブロック共重合体は、MRI下で高信号を生じ、コーティングを施した医療器具全体を容易に視認可能とする。さらに、前記ブロック共重合体は、湿潤時に表面潤滑性を発現し、特に血管領域の診断および治療に適用する医療器具に被覆(コーティング)された場合、組織への損傷を低減し、目的部位への確実な挿入を可能とする。また、MRI視認性と表面潤滑性を同一のブロック共重合体で達成できるので、器具表面からの剥離や製造工程の煩雑さのない被覆層(コーティング層)を得ることができる。
【図面の簡単な説明】
【0024】
【図1】図1は、本発明のブロック共重合体の好ましい態様を示す模式図である。
【図2】図2は、本発明のワイヤーの表面潤滑性の試験方法を示す全体図である。
【図3】図3は、本発明の一実施例に係る血管拡張用カテーテルの斜視図である。
【図4】図4は、本発明の一実施例に係る血管拡張用カテーテルの先端部付近の縦断面図である。
【発明を実施するための最良の形態】
【0025】
以下、本発明を詳細に説明する。
本発明は、湿潤時にMRI下で診断または治療に用いる医療器具をMRI下において視認可能とし、かつ医療器具の表面潤滑性を同時に発現させるブロック共重合体と、それを被覆してなる医療器具に関する。ここで、前記ブロック共重合体は、分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質と親水性化合物の共重合体からなる第1のセグメントと、反応性官能基を有する化合物からなる第2のセグメントから形成されたブロック共重合体である。
【0026】
本発明において、MRI視認性とは、MRIで撮影された画像において医療器具が周辺組織像と区別されて確認可能であることを意味する。また、本発明において、表面潤滑性とは、唾液、消化液、血液等の体液や生理食塩水、水等の水系液体に濡れた状態で、挿入、脱着、移動、体内留置時等に、摩擦抵抗が低い状態を意味する。具体的には表面潤滑性は以下に示す方法で測定される。
【0027】
<表面潤滑性の評価方法>
表面潤滑性、すなわち摩擦抵抗の測定は、以下に示すような方法で行うことができる。
表面を本発明のブロック共重合体で被覆した医療用ワイヤー21を作成し、図2に示す治具を用いて、ワイヤー21の摩擦抵抗値を測定する。ワイヤー21を蒸留水に10分間浸漬し本発明のブロック共重合体を充分膨潤させた後、水23中にて円形シリコン弁体22に貫通させ、オートグラフを用いて600mm/minの速さで幅20mmを100回繰り返して移動させ、摩擦抵抗値を測定する。表面潤滑性の指標として100回試験後の最終摩擦抵抗値、また表面潤滑性の持続的指標として、式1の摩擦抵抗値の変化(Δ摩擦抵抗値)を計算する。
Δ摩擦抵抗値 = (最終摩擦抵抗値) − (初期摩擦抵抗値) (式1)
【0028】
簡易的には、指で擦ることにより評価できる。本発明のブロック共重合体が被覆されたワイヤーの表面は、ヌルヌルとした感触を有することが特徴である。
【0029】
<第1のセグメント>
本発明のブロック共重合体の第1のセグメントは、分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質と親水性化合物の共重合体により形成されている。これにより、前記ブロック共重合体中ないしその近傍に存在する前記核種のMR信号強度を変化させ、前記ブロック共重合体およびそれを被覆した医療器具を周辺組織像から区別して描出させることが可能となる。そして、それと同時に湿潤時に表面潤滑性を発現し、特に血管領域の診断および治療に適用する医療器具に前記ブロック共重合体が被覆された場合、組織への損傷を低減し、目的部位への確実な挿入を可能とする。
【0030】
前記MRにて検出可能な核種としては、特に限定されないが、好ましくはプロトン(水素原子核)である。前記プロトンは、人体組織、体液等に存在する水分子やヒドロキシル基内に含まれるプロトンが挙げられる。前記ヒドロキシル基を含む化合物としては、アルカノール等のヒドロキシル基を含む化合物、例えばエタノール、グリセリン(グリコール)、エチレングリコール、プロピレングリコール、ポリエチレングリコール、ポリプロピレングリコール、公知の非毒性のヒドロキシル化化合物、ポリヒドロキシル化化合物等がある。本発明のブロック共重合体中に存在する水分子やヒドロキシル基に存在するプロトンも前記核種に含まれる。
【0031】
前記分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質は、例えば分子内にアミド結合を有するキレート化合物と、前記キレート化合物に配位された常磁性イオンから形成されている。常磁性イオンは、キレート化合物に配位されることにより、毒性が低減され、生体適合性が向上する。
【0032】
前記分子内にアミド結合を有するキレート化合物としては、例えばN−(3−アミノアルキル)メタクリルアミドにキレート試薬であるジエチレントリアミン五酢酸(DTPA)を共有結合させることによって得られた下記一般式1で示されるキレート化合物が例示され、より好ましくはN−(3−アミノプロピル)メタクリルアミドにDTPAを共有結合させることによって得られた、下記一般式1においてn=3であるキレート化合物である。
【0033】
【化2】

(式1中、n=1〜5である)
【0034】
なお、分子内にアミド結合を有するキレート化合物の他の例としては、上述のN−(3−アミノアルキル)メタクリルアミドに、1,4,7,10−テトラアザシクロドデカン−N,N’,N”,N”’−四酢酸(DOTA)、1,4,8,11−テトラアザシクロテトラデカン−N,N’,N”,N”’−四酢酸(TETA)、ジエチレントリアミン五酢酸−N,N’−ビス(メチルアミド)(DTPA−BMA)、ジエチレントリアミン五酢酸−N,N’−ビス(メトキシエチルアミド)(DTPA−BMEA)、s−4−(4−エトキシベンジル)−3,6,9−トリス[(カルボキシラートメチル)]−3,6,9−トリアザウンデカンジオン酸(EOB−DTPA)、ベンジルオキシプロピオンテトラアセテート(BOPTA)、(4R)−4−[ビス(カルボキシメチルアミノ)]−3,6,9−トリアザウンデカンジオン酸(MS−325)、1,4,7−トリス(カルボキシメチル)−10−(2’−ヒドロキシプロピル)−1,4,7,10−テトラアザシクロドデカン(HP−DO3A)、DO3A−ブトロール等のキレート試薬を共有結合させることによって得られるキレート化合物が挙げられる。
【0035】
前記常磁性イオンとしては、原子番号21〜29、42、44および58〜70の元素からなる多価金属イオンが例示される。具体的には、クロム(III)、マンガン(II)、鉄(III)、鉄(II)、コバルト(II)、銅(II)、ニッケル(II)、プラセオジウム(III)、ネオジウム(III)、サマリウム(III)、イッテルビウム(III)、ガドリニウム(III)、テルビウム(III)、ジスプロシウム(III)、ホルミウム(III)、エルビウム(III)が挙げられる。特に、強い磁気モーメントを有することから、ガドリニウム(III)、マンガン(II)、鉄(III)等のイオンが好ましい。より好ましくは、最も強い磁気モーメントを有するガドリニウム(III)である。
【0036】
なお、前記分子内にアミド結合を有するキレート化合物や常磁性イオンは、適当な化合物と塩を形成していてもよい。このような塩としては、ナトリウムやカリウム等の金属、エタノールアミン、モルホリン、メグルミン(N−メチルグルカミン)等の有機塩基、アルギニン、オルニチン等のアミノ酸などが例示できる。
【0037】
本発明のブロック共重合体に含まれる常磁性イオンの濃度は、それを撮像するMRI装置の静磁場強度、傾斜磁場強度、撮像シーケンス等に依存するため、使用する撮像シーケンスにおいて撮像対象組織とブロック共重合体のコントラストが明瞭となるような濃度が選択される。一般的に、常磁性イオンは、近傍に存在するプロトンの緩和時間に対して、低濃度ではT1緩和時間短縮効果が、高濃度ではT2緩和時間短縮効果が優位となり、その効果は静磁場強度に比例する。前記ブロック共重合体中に含まれる常磁性イオンの濃度は、例えば、ICP(誘導結合プラズマ)発光分光分析法にて適切な波長を選択することにより定量できる。
【0038】
前記親水性化合物としては、湿潤時に表面潤滑性を発現するものであれは特に限定されず、アクリルアミド、アクリル酸、メタクリル酸、マレイン酸、無水マレイン酸、ビニルピロリドンあるいはそれらの誘導体が例示され、N−メチルアクリルアミド、N,N−ジメチルアクリルアミド、アクリルアミド、アクリロイルモルホリン、N,N−ジメチルアミノエチルアクリレート、2−メタクリロイルオキシエチルフォスフォリルコリン、2−メタクリロイルオキシエチル−D−グリコシド、2−メタクリロイルオキシエチル−D−マンノシド、ビニルピロリドン、ビニルメチルエーテル、ヒドロキシエチルメタクリレートが好適に例示される。合成の容易性や操作性の観点から、より好ましくは、N,N−ジメチルアクリルアミドである。
【0039】
前記分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質と親水性化合物を共重合体する際の重合形式は特に限定されず、例えばランダム共重合、ブロック共重合、グラフト共重合が挙げられる。
【0040】
<第2セグメント>
前記第2のセグメントは、医療器具を構成する基材と結合し得るか、もしくは互いに結合して架橋し得うる反応性官能基を分子内に有する化合物(単量体)もしくはその繰り返し部分により形成されている。したがって、前記ブロック共重合体が医療器具に被覆された際、器具表面からの剥離が防止される。
【0041】
反応性官能基としては、ヒドロキシル基、アミノ基、エポキシ基、カルボキシル基、酸クロリド基、アルデヒド基、イソシアネート基、イソチオシアネート基などが挙げられるが、加熱操作等で反応させる際の反応速度が穏やかであるエポキシ基が好ましい。そして、エポキシ基を有する化合物(単量体)としては、反応が熱により促進され、架橋構造を形成することで不溶化して本発明のブロック共重合体の医療器具表面から剥離が確実に防止され、取り扱いも比較的容易であることからグリシジルアクリレートやグリシジルメタクリレートが好ましい。
【0042】
<本発明の好ましい態様>
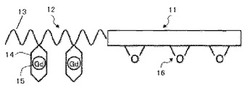
図1は、本発明のブロック共重合体の好ましい態様を示す模式図である。図1は、第2セグメント11を形成する反応性官能基を有する化合物(単量体)としてエポキシ基16を有するグリシジルメタクリレート(GMA)、第1セグメント12を形成する親水性化合物13としてN,N−ジメチルアクリルアミド(DMAA)、分子内にアミド結合を有するキレート化合物14としてN−(3−アミノプロピル)メタクリルアミドにDTPAを共有結合させることによって得られたキレート化合物、常磁性イオン15としてガドリニウム(III)を用いた例である。その製造方法の一例を示すと、まず、GMAモノマーに重合開始剤を添加して重合し、分子内にラジカル(パーオキサイド基)を有するポリGMAを得る。続いて、このポリGMAを重合開始剤とし、DMAAおよび予めキレート試薬であるDTPAを共有結合させておいたN−(3−アミノプロピル)メタクリルアミドを同時に添加して重合を行い、GMAホモポリマー(第2セグメント11)、並びにDMAAおよび予めDTPAを共有結合させておいたN−(3−アミノプロピル)メタクリルアミドに結合したポリマー(第1セグメント12)の2種類のポリマーが連結したブロック共重合体を得る。さらに常磁性イオン15としてガドリニウムをキレート内に配位させることにより、目的のブロック共重合体を得る。
【0043】
このようにして得られた、本発明のブロック共重合体は、以下の効果を有する。(1)被覆層の剥離がなく、永続的な表面潤滑性が得られる。(2)医療器具に被覆したとき、比較的親水性の低い反応性官能基を有する第2セグメント11が医療器具側に、親水性化合物を有する第1セグメント12が表面側にそれぞれ配置されると考えられるため、反応性官能基を有する化合物と親水性化合物をランダム共重合した場合と比較してより高い表面潤滑性が得られる。(3)ひとつのブロック共重合体中に、医療器具を構成する基材と結合し得るか、もしくは互いに結合して架橋し得る反応性官能基を有する部位(第2セグメント11)、湿潤時に表面潤滑性を発現する部位およびMRI視認性を有する部位(第1セグメント12)が含まれていることから、特別なプライマ溶液を必要とせず、一回の塗布操作で医療器具に被覆でき、製造上の操作性・安全性に優れている。(4)磁気共鳴にて検出可能な核種の緩和時間を短縮する物質が親水性化合物と共重合体されているので、常磁性イオンが短期間で流出することがなく、安全性の面で優れている。
【0044】
<その他>
本発明のブロック共重合体は、該ブロック共重合体の耐久性の向上や表面潤滑性の制御を目的として、該ブロック共重合体に架橋処理を施してもよい。前記架橋処理の方法としては、公知の方法が適用可能であり、例えば、光、熱、または放射線等により活性ラジカルを発生させる方法や重合性多官能モノマーを添加する方法、多官能性の架橋剤を塗布する方法、触媒を用いて分子内の反応性官能基同士を架橋させる方法などが挙げられる。エポキシ基のように、反応性の高い反応性官能基を含むブロック共重合体であれば、エポキシ基間での重合、ジアミノ化合物、ジヒドロキシ化合物、ジアルデヒド化合物などにより、容易に架橋することができる。
【0045】
本発明におけるブロック共重合体には、診断や治療の効果向上や徐放を目的として、生理活性物質や薬物を担持させてもよい。そのような生理活性物質および薬物の具体的な例としては、抗癌剤、抗生物質、生理活性を有するポリペプチド、下熱剤、鎮静剤、免疫賦活剤、抗炎症剤、鎮咳剤、抗てんかん剤、抗ヒスタミン剤、降圧利尿剤、糖尿病治療剤、筋弛緩剤、抗腫瘍剤、抗うつ剤、抗アレルギー剤、強心剤、不整脈治療剤、血管拡張剤、抗凝血剤、麻薬拮抗剤、止血剤、抗結核剤、ホルモン剤などが挙げられる。
【0046】
<ブロック共重合体を被覆した医療用具およびその製造方法>
本発明の医療器具の基材としては、特に限定されないが、例えば、合成または天然の高分子、金属、セラミック等が挙げられる。前記合成高分子の例としては、ポリエチレン、ポリプロピレン、ポリブタジエン等のポリオレフィン、ポリ塩化ビニル、ポリウレタン、エチレン−酢酸ビニル共重合体、ポリエチレンテレフタレート、ポリブチレンテレフタレート等のポリエステル、ポリアミド、ポリエーテルポリアミド、ポリエステルポリアミド、軟質ポリ塩化ビニル、ABS樹脂、AS樹脂、ポリテトラフルオロエチレン等のフッ素系樹脂、形状記憶樹脂等の各種樹脂材料や、スチレン系、ポリオレフィン系、ポリウレタン系、ポリエステル系、ポリアミド系、ポリブタジエン系、トランスポリイソプレン系、フッ素ゴム系、塩素化ポリエチレン系等の各種熱可塑性エラストマー、さらには、これらのうちの2種以上を組合せたもの(ポリマーアロイ、ポリマーブレンド、積層体等)が挙げられる。これらの基材は、被覆される本発明のブロック共重合体との親和性向上や共有結合形成を目的とした表面処理を施してもよい。
【0047】
本発明におけるブロック共重合体を医療器具に被覆する方法としては、公知の被覆方法が使用できる。例えば、被覆する医療器具の全体または一部を本発明のブロック共重合体を含有する溶液、懸濁液または乳濁液に浸漬させた後、乾燥によって溶媒を除去することによって、医療器具を構成する基材表面に本発明のブロック共重合体からなる被覆層を形成することができる。また、前記ブロック共重合体を含有する溶液、懸濁液または乳濁液を基材の表面に噴霧した後に乾燥を行ってもよい。このとき、基材表面とブロック共重合体が反応し、共有結合を形成していてもよい。特に、特許第3580843号公報には、酸無水物を有する合成高分子を構成成分とする基材表面に、該酸無水物と反応しうる官能基を有する重合体を被覆し、30℃以上で加熱処理を行うことによって被覆層を形成する方法が開示されている。また、特許第3631781号公報では、重合体を該重合体と反応する反応性基を有していない医療用器具を構成する高分子基材が膨潤率1〜100%で膨潤する溶媒に溶解して該重合体溶液を作製し、該溶液に該高分子基材を浸漬して膨潤させ、さらに該高分子基材表面と該重合体を架橋または高分子化させることによって、該高分子基材表面と該重合体との間に相互貫入網目構造を生成させる方法が開示されている。これらの方法を用いて被覆すると、前記ブロック共重合体が医療器具の基材表面に強固に固定され、耐剥離性に優れた被覆層を得ることができるので好適である。本発明は、上記の具体例を含めて前記ブロック共重合体からなる被覆層を形成することを含む。
【0048】
本発明におけるブロック共重合体は、医療器具の表面を被覆する被覆層として好適に使用できる。前記医療器具とは、医療行為において目的とする手技を行うために必要とされる器具を意味する。MRI視認性と表面潤滑性が要求される医療器具として、特に血管内で使用されるカテーテルやガイドワイヤー類を好適に例示できるが、その他にも下記の医療器具を例示できる。
(1)胃管カテーテル、栄養カテーテル、経管栄養用(ED)チューブ等の経口または経鼻的に消化器官内に挿入または留置されるカテーテル類。
(2)酸素カテーテル、酸素カヌラ、気管内チューブのチューブやカフ、気管切開チューブのチューブやカフ、気管内吸引カテーテル等、経口または経鼻的に気道または器官内に挿入または留置されるカテーテル類。
(3)尿道カテーテル、導尿カテーテル、バルーンカテーテルのカテーテルやバルーン等、尿道または尿管内に挿入または留置されるカテーテル類。
(4)吸引カテーテル、排液カテーテル、直腸カテーテル等、各種体腔、臓器、組織内に挿入または留置されるカテーテル類。
(5)留置針、IVHカテーテル、サーモダイリューションカテーテル、血管造影用カテーテル、血管拡張用カテーテルおよびダイレーターもしくはイントロデューサーなどの血管内に挿入または留置されるカテーテル類。または、これらのカテーテル用のガイドワイヤー、スタイレット等。
(6)ステント類や人工血管、人工器官、人工気管支等。
(7)体外循環治療用の医療用器具(人工心臓、人工肺、人工腎臓)やその回路。
【0049】
図3は、本発明の一実施例に係る血管拡張用カテーテルの斜視図、図4は、図3に示す血管拡張用カテーテルの先端部付近の縦断面図である。図3に示すように、血管拡張用カテーテル31は先端45と基端46とを有し、その間にカテーテル本体32が延在する。さらに、血管拡張用カテーテル31は、カテーテル本体32と、カテーテル本体32の先端部に装着された、拡張・収縮可能なバルーン33と、カテーテル本体32の基端部に装着されたハブ34とを備えている。図4の縦断面図に示すように、カテーテル本体32中には、先端45から基端46にかけて貫通したガイドワイヤールーメン42とバルーンルーメン41とを備えている。ガイドワイヤールーメン42にはガイドワイヤー50が挿通されている。
【0050】
ガイドワイヤー50は、先端と基端とを有する線状部材である。ガイドワイヤー50の長さは、血管拡張用カテーテル31の全長以上である。
以上のような血管拡張用カテーテル31およびガイドワイヤー50は、ガイディングカテーテル60内に挿入して使用される。ガイディングカテーテル60は、先端61と基端62とを有し、その間にガイディングカテーテル本体63が延在する。ガイディングカテーテル60の基端側には、Yコネクタ70が装着されている。このYコネクタ70の内部には、それらの長手方向に沿って内腔が形成され、この内腔はガイディングカテーテル60の内腔と連通しており、血管拡張用カテーテル31およびガイドワイヤー50は、ガイディングカテーテル60およびYコネクタ70の内腔を通って、Yコネクタ70の基端より突出している。また、Yコネクタ70には、管状の分岐部71が形成されている。
【0051】
血管拡張用カテーテル31はPTCA術(Percutaneous Transluminal Coronary Angioplasty:経皮的冠状動脈経血管形成術)等に適用した場合使用される。セルジンガー法によりカテーテルイントロデューサーのシースより、ガイドワイヤー(図示せず)を挿通したガイディングカテーテル60を動脈内に挿入し、ガイドワイヤーを先行させながら、進退、回転を繰返し、その先端部を冠動脈入口部へ到達させ、留置する。前記ガイドワイヤーを抜去した後、ガイドワイヤー50を挿通した血管拡張用カテーテル31をガイディングカテーテル60の内腔に沿って先端方向へ前進させ、血管拡張用カテーテル31の先端部45をガイディングカテーテルの先端61開口より突出させる。血管拡張用カテーテル31の先端部が冠動脈内に到達したら、ガイドワイヤー50を必要に応じ回転しながら前進させて、その先端部を目的部である冠動脈狭搾部を通過させる。ガイドワイヤー50の先端が冠動脈狭窄部を通り過ぎたら、ガイドワイヤー50の前進を停止し、次いで、血管拡張用カテーテル31をガイドワイヤー50に沿ってゆっくりと前進させ、バルーン33を冠動脈狭窄部に位置させる。次に、ハブ34より作動流体を注入し、ハブ34の内腔およびバルーンルーメン41を介してバルーン33内に供給し、バルーン33を拡張させる。これにより、冠動脈狭窄部が拡張される。
【0052】
本発明のブロック共重合体を基材表面に被覆した血管拡張用カテーテルやガイドワイヤーを用いると、以上のような操作を容易、かつ安全に行うことができる。前記ブロック共重合体を被覆する部位については、血管拡張用カテーテルやガイドワイヤーの表面全体、またはその一部であってもよい。特に、ガイディングカテーテル60表面のYコネクタ70よりも先端側、バルーン33を含む血管拡張用カテーテルの先端部位、ガイドワイヤー50の表面全体、ガイドワイヤー50が挿入される血管拡張用カテーテル内腔表面の先端部位などを本発明のブロック共重合体で被覆することが好ましい。
【0053】
然るべき血管モデルや体管モデルを予め作製しておき、処理部位の位置と長さ、表面潤滑性のレベルなどを変えたサンプルを各種用意して、相互比較することにより、本発明のブロック共重合体の好適な被覆部位を決めることも可能である。
【0054】
更に、本発明のブロック共重合体は、MRI視認性と表面潤滑性を同時に発現するが、従来技術である表面潤滑性のみを発現する物質で被覆する部位と本発明のブロック共重合体で被覆する部位とに分けて用いてもよい。例えば、ガイドワイヤーと血管拡張用カテーテルの先端部のみを本発明のブロック共重合体で被覆し、MRI視認性と表面潤滑性との両方の機能を発現させ、それ以外のガイドワイヤー、血管拡張カテーテルの部位およびガイディングカテーテル全体は表面潤滑性のみを発現する物質で被覆してもよい。
【実施例】
【0055】
以下、実施例をあげて本発明を具体的に説明するが、本発明はこれに限定されるものではない。
【0056】
(実施例1)
<ブロック共重合体の合成>
1.分子内にパーオキサイド基を有するポリGMA(第2のブロック)の合成
セバシン酸ジクロリド(東京化成社製)5.5gに50℃でトリエチレングリコール(東京化成社製)1.7gを滴下した後、50℃で3時間塩酸を減圧除去して得られたオリゴエステル6.5gにメチルエチルケトン(ナカライテスク社製)0.61gを加え、水酸化ナトリウム(水酸化ナトリウム(粒状)、関東化学社製)2.1g、31%過酸化水素(過酸化水素(過酸化水素水)、関東化学社製)1.4g、界面活性剤ジオクチルフォスフェート(Aldrich社製)0.06g、水150mlよりなる溶液中に滴下し、−5℃で1時間反応させた。反応物は、水洗、メタノール洗浄を繰り返した後、乾燥させて分子内に複数のパーオキサイド基を有するポリ過酸化物(PPO)を得た。
続いて、このPPOを重合開始剤として1.0g、グリシジルメタクリレート(GMA、和光純薬工業社製)9.0gを、1,4−ジオキサン(ナカライテスク社製)40gを溶媒として、80℃で2時間、窒素雰囲気下で攪拌しながら重合した。反応物は、貧溶媒をn−ヘキサン(国産化学社製)、良溶媒をテトラヒドロフラン(関東化学社製)として精製し、分子内にパーオキサイド基を有するポリGMAを得た。
【0057】
2.分子内にアミド結合を有するキレート化合物の合成
ジエチレントリアミン五酢酸二無水物(DTPAda、Aldrich社製)4.3g(12mmol)を無水エタノール(和光純薬工業社製)700mlに溶かした溶液に、N−(3−アミノプロピル)メタクリルアミド塩酸塩(Polysciences Inc.社製)2.1g(12mmol)およびトリエチルアミン(和光純薬工業社製)2.0ml(14mmol)を無水エタノール50mlに溶かした溶液を室温にて滴下した後、30分間還流した。溶液を室温まで冷却した後、2N塩化水素エタノール溶液(国産化学社製)を加えて酸性とし、さらに8時間以上還流した。その後、溶液を濃縮して得られた化合物に飽和水酸化ナトリウム水溶液430mlを加えて溶解させ、塩化メチレン(関東化学社製)で抽出、有機層を濃縮した。得られた粗生成物を、シリカゲルクロマトグラフィーにより精製し、エステル保護されたキレート化合物を得た。
続いて、エステル保護されたキレート化合物に1N水酸化ナトリウム水溶液(4.2当量)を加え、50℃で30分攪拌した後、陽イオン交換樹脂を用いて処理した溶液を濃縮して、分子内にアミド結合を有するキレート化合物を得た。
【0058】
3.ブロック共重合体の合成
2.で得たキレート化合物0.079g(0.15mmol)を無水ジメチルスルホキシド(DMSO、和光純薬工業社製)50mlに溶かし、80℃で攪拌しながら窒素を導入してバブリングを行った。1時間後、N,N−ジメチルアクリルアミド(DMAA、和光純薬工業社製)5.3g(53mmol)と1.で得たポリGMA0.63g(4.4mmol)を無水DMSO30mlに溶かした溶液を前記バブリングした溶液に加え、同温度で17時間重合を行った。続いて、0.1M酢酸ガドリニウム・4水和物のDMSO溶液1.5mlを添加し、さらに1時間反応させた。氷冷により反応を停止した後、テトラヒドロフランで希釈し、ジエチルエーテル(国産化学社製)に滴下して、ポリマーを沈殿させた。この沈殿物を濾別、減圧乾燥して、本発明のブロック共重合体1を得た。
【0059】
<評価>
4.キャストフィルムの作製
実施例1で得られたブロック共重合体1をメタノール(国産化学社製)またはクロロホルム(関東化学社製)を溶媒として2wt%溶液を調製し、その5mlをポリテトラフルオロエチレンシャーレ(φ30mm)に展開し乾燥させて、厚さ50μm〜100μmのキャストフィルム(フィルム1)を作製した。
【0060】
5.キャストフィルム中に含まれるガドリニウム(III)の定量
フィルム1をナイロンバッグ(255メッシュ、10×20cm)に入れ、流水で24時間洗浄した後減圧乾燥した。洗浄後のフィルムを秤量して磁性るつぼにとり、硝酸(原子吸光用、関東化学社製)500μlを加えて、300℃のホットプレート上で白煙を生じなくなるまで加熱して炭化した後、500℃の電気マッフル炉中で灰化した。冷却後、得られた灰化物を硝酸100μlに溶かし、蒸留水を加えて10mlとして、ICP(誘導結合プラズマ)発光分析法にてガドリニウム(III)の定量を行い(ICPS−8000、島津製作所社製、測定波長342.247nm)、重合体単位重量当たりに含まれるガドリニウム重量(mg/g)を算出し、表1に示した。
【0061】
6.フィルムのMRI視認性評価
フィルム1をφ8mmの円形に打ち抜き、蒸留水で十分に洗浄した後、生理食塩水(テルモ生食、テルモ社製)5mlとともにポリスチレン製瓶に入れ、MRI撮像を行った。MRI装置はSigna EXITE Twin Speed 1.5T Ver.11(静磁場強度1.5T、GE Healthcare社製)、受信RFコイルはQD Head Coilを用い、撮像条件はSE、FLAIRシーケンスを使用した。MRIの画像上でキャストフィルムの視認性を評価した。
【0062】
(実施例2)
実施例1の3.において、キレート化合物を0.30g、DMAAを7.1g、ポリGMAを0.43g、0.1M酢酸ガドリニウム・4水和物のDMSO溶液の添加量を5.8mlとした以外は、実施例1と同様に行い、ブロック共重合体2およびフィルム2を得て、フィルム2のガドリニウム(III)の定量およびMRI視認性の評価を行った。
【0063】
(実施例3)
実施例1の3.において、キレート化合物を0.24g、DMAAを5.1g、ポリGMAを0.61g、0.1M酢酸ガドリニウム・4水和物のDMSO溶液の添加量を4.6mlとした以外は、実施例1と同様に行い、ブロック共重合体3およびフィルム3を得て、フィルム3のガドリニウム(III)の定量およびMRI視認性の評価を行った。
【0064】
(実施例4)
実施例1の3.において、キレート化合物を0.064g、DMAAを4.5g、ポリGMAを0.53g、0.1M酢酸ガドリニウム・4水和物のDMSO溶液の添加量を0.97mlとしたこと、および実施例1の6.の評価を行わなかったこと以外は、実施例1と同様に行い、ブロック共重合体4およびフィルム4を得て、フィルム4のガドリニウム(III)の定量を行った。
【0065】
7.ワイヤーの作製
クロロホルムとメタノール(3/1、v/v)を溶媒として、ブロック共重合体4の6.5wt%溶液を調製した。ガイドワイヤー(外径0.035インチ、テルモ社製)を重合体溶液に浸漬し、直後に100mm/minの速さで引き上げ、80℃で3時間乾燥させて、ガイドワイヤー表面に高分子層を形成させた。続いて、流水で24時間洗浄した後、50℃で3時間乾燥させて、ワイヤー4を得た。
【0066】
8.チューブの作製
7.において、ガイドワイヤーの代わりにウレタン製チューブ(外径1.55mm、内径1.10mm)を用いたこと以外は、7.と同様に行い、チューブ4を得た。
【0067】
9. チューブおよびワイヤーのMRI視認性評価
ワイヤー4およびチューブ4を生理食塩水中に固定し、MRI撮像を行った。MRI装置はSigna EXITE Twin Speed 1.5T Ver.11(静磁場強度1.5T、GE Healthcare社製)、受信RFコイルはQD Head Coilを用い、撮像条件はGRE、FLAIRシーケンスを使用した。MRIの画像上でワイヤーおよびチューブの視認性を評価した。
【0068】
(実施例5)
実施例1の3.において、キレート化合物を0.10g、DMAAを4.5g、ポリGMAを0.53g、0.1M酢酸ガドリニウム・4水和物のDMSO溶液の添加量を2.0mlとしたこと、および実施例1の6.の評価を行わなかったこと以外は、実施例1と同様に行い、ブロック共重合体5およびフィルム5を得て、フィルム5のガドリニウム(III)の定量を行った。
そして、実施例4の7.〜9.と同様の方法で、ワイヤー5およびチューブ5を作製して、それぞれのMRI視認性の評価を行った。
【0069】
(実施例6)
実施例1の3.において、キレート化合物を0.17g、DMAAを4.5g、ポリGMAを0.53g、0.1M酢酸ガドリニウム・4水和物のDMSO溶液の添加量を3.3mlとしたこと、および実施例1の6.の評価を行わなかったこと以外は、実施例1と同様に行い、ブロック共重合体6およびフィルム6を得て、フィルム6のガドリニウム(III)の定量を行った。
そして、実施例4の7.〜9.と同様の方法で、ワイヤー6およびチューブ6を作製して、それぞれのMRI視認性の評価を行った。
【0070】
(比較例1)
実施例1の3.において、キレート化合物および0.1M酢酸ガドリニウム・4水和物を使用しなかった以外は、実施例1と同様に行い、ブロック共重合体7およびフィルム7を得て、フィルム7のガドリニウム(III)の定量およびMRI視認性の評価を行った。
そして、実施例4の7.〜9.と同様の方法で、ワイヤー7およびチューブ7を作製して、それぞれのMRI視認性の評価を行った。
【0071】
(比較例2)
実施例4の7.および8.において高分子層を形成させていないガイドワイヤー(ワイヤー8)およびウレタン製チューブ(チューブ8)について、それぞれ実施例4の9.と同様の方法でMRI視認性の評価を行った。
【0072】
上記実施例と比較例で得られたフィルム1〜7、ワイヤー4〜8およびチューブ4〜8の評価結果を表1に示した。ここで、MRI視認性評価においては、核磁気共鳴画像で視認できたものを「○」、視認できなかったものを「×」、評価自体実施しなかったものを「−」とした。
【0073】
【表1】

【0074】
10.ワイヤーの表面潤滑性評価
実施例5と比較例2で得られたワイヤー5およびワイヤー8について、図2示す治具を用いて摩擦抵抗値を測定した。
ガイドワイヤー表面に高分子層を形成させたワイヤー5の最終摩擦抵抗値は0.20N、Δ摩擦抵抗値は0.01N以下であり100回の移動試験後においても安定した低摩擦性を示した。一方、ガイドワイヤー表面に高分子層を形成させなかったワイヤー8の最終摩擦抵抗値は0.94Nであり、低摩擦性を示さなかった。
【技術分野】
【0001】
本発明は、湿潤時に磁気共鳴画像下において診断または治療に用いる医療器具を磁気共鳴画像下において視認可能とし、かつ表面潤滑性を同時に発現させるブロック共重合体と、それを被覆してなる医療器具に関する。
【背景技術】
【0002】
近年、臨床画像診断の進歩は著しく、磁気共鳴画像診断法(以下、MRIと称する)、X線撮影法、超音波画像診断法、X線CT(コンピュータ断層撮影法)、シンチグラフィー等を用いた診断、治療の重要性が高まっている。特に、MRIは、放射線被曝をすることなく任意多方向からの断面像が優れた組織分解能で得られ、さらに血流、拡散、温度等の機能情報も得られることから、画像診断領域においてその有用性が高く評価されている。
【0003】
最近のMRIに関するハードウエアおよび撮像シーケンスの進歩によって、画像診断のみでなく、MRI下で診断、治療手技を行う、「インターベンショナル(Interventional)MRI」の臨床応用が注目されてきた。その手技は、経皮的穿刺生検術、各種ドレナージ術、腫瘍焼灼術などの非血管領域にとどまるものではなく、血管形成術、ステント留置術、下大動脈フィルター留置術など、血管領域への応用に向けて研究が進められている。
【0004】
現在、上記血管領域の診断および治療にかかわる手技は、主にX線透視下で行われている。X線透視は2次元画像しか取得できない。また、血管領域の診断および治療の手技にかかる時間は平均約3時間であるが、難しい症例では8時間以上を要する場合もある。したがって、X線透視下の場合、患者および医療従事者は手技中に有害な放射線に晒され続けることとなる。
【0005】
一方、MRIは3次元画像を容易に取得できるので、X線透視と比較して脳動静脈奇形や動脈瘤など、複雑な血管異常を理解する上で非常に有用な各種機能情報を得ることが可能である。また、MRIに用いられる造影剤は、X線透視に用いられるヨード系造影剤と比較して、人体への有害性が低い。加えて、放射線被曝の心配もない。このように、血管領域の診断および治療をMRI下で行うことは、X線透視下での場合と比較して多くの利点がある。
【0006】
しかしながら、血管領域の診断および治療に用いられる医療器具のほとんどは、高分子材料、金属、セラミックまたはこれらの複合物から形成されており、MRIでは適切な信号を得ることができず、MRI下で視認することができない。従って、安全で正確な手技のために、MRI下での医療器具の視認化技術が望まれている。
【0007】
MRI下での医療器具の視認化技術には、能動的手法と受動的手法の2つが提案されている。能動的手法とは、1個以上の高周波(RF)コイルをカテーテルのような医療器具に取り付け、コイルにより検出された磁気共鳴信号をもとにコンピュータで位置を計算し、先に取得した組織画像に重ねて表示させる手法である。しかしながら、この手法ではコイルの取り付けられた位置しか視認できないため、器具の全体像を把握することができない。そのため、カテーテルのような可撓性器具を視認するには限界がある。コイルを複数個導入することも考えられるが、機械的物性に影響を与えカテーテルの本来の機能が損なわれるため、好ましくない。また、RF誘導電流による器具の発熱も問題となる。
【0008】
一方、受動的手法とは、磁気共鳴信号の損失により医療器具を視認する手法である。一つの例として、プラスチック等の検出可能な磁気共鳴信号を持たない非磁性体で器具を形成し、MRI上で無信号領域として描出する技術がある。この方法は、器具の全体像を把握できる点で能動的手法よりも優れているが、器具の信号損失を空気、流動血液等の信号損失と混同しうる点が問題である。また別の例として、周辺組織と異なる磁化率を有する材料で器具を形成し、磁化率効果による器具周辺の画像の歪み(アーチファクト)を利用して描出する技術があるが、磁化率効果はMRIの静磁場に対する器具の配向に依存し、器具の寸法が正確に画像化されないという問題がある。
【0009】
これを解決する手段として、常磁性イオンキレート錯体が、その周辺に存在するプロトンの磁気共鳴(以下、MRと称する)による緩和時間を短縮する効果を利用して、MR画像上で医療器具を高信号に視認化する技術が考案されている。例えば、医療器具を構成する基材表面に常磁性イオンキレート錯体を化学的に固定する方法(特許文献1)、常磁性イオンキレート錯体を含む水膨潤性重合体(特許文献2)で医療器具表面に皮膜を形成させる方法が開示されている(特許文献3、4)。上記の手法により、カテーテル等の可撓性器具の全体を正確な寸法で視認することが可能となる。
【0010】
ところで、血管領域での診断および治療に用いる医療器具には、組織への損傷を低減し、目的部位へ確実に挿入するために、器具に表面潤滑性を付与することが必要である。そのため、該磁気共鳴信号を発する皮膜上にさらに表面潤滑性を有する皮膜を設ける方法が開示されている(特許文献4、非特許文献1)。しかしながら、皮膜が多層となることで、視認性の発現までに時間を要する、膜厚が厚くなり剥離しやすくなる、コーティング工程が複数回となる等の問題があった。
【0011】
以上のように、血管領域でのインターベンショナルMRIは有用性が高く、今後大きく発展することが期待されるにもかかわらず、従来技術では、MRI下での診断および治療を行うにあたり、医療器具全体が視認化でき、かつ特に血管領域での手技において必要な表面潤滑性を同時に発現するための好適な方法は得られていない。
【特許文献1】特表2002−516132号公報
【特許文献2】特開2005−239641号公報
【特許文献3】特表2005−525176号公報
【特許文献4】特表2006−503594号公報
【非特許文献1】第32回日本磁気共鳴医学会大会予稿集、2004年、p.185、181−22A
【発明の開示】
【発明が解決しようとする課題】
【0012】
本発明は、このような問題点に鑑みてなされ、湿潤時にMRI下での診断および治療に用いる医療器具を容易に視認でき、かつ表面潤滑性を同時に発現するブロック共重合体およびそれを被覆してなる医療器具を提供することを目的とする。
【課題を解決するための手段】
【0013】
このような目的は、下記(1)から(8)の本発明により達成される。
【0014】
(1)分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質と親水性化合物の共重合体からなる第1のセグメントと、
反応性官能基を有する化合物からなる第2のセグメントを含むことを特徴とするブロック共重合体。
【0015】
(2)前記分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質が、分子内にアミド結合を有するキレート化合物と、前記キレート化合物に配位された常磁性イオンから形成されていることを特徴とする(1)に記載のブロック共重合体。
【0016】
(3)前記分子内にアミド結合を有するキレート化合物が、下記一般式1で示されるキレート化合物であることを特徴とする(2)に記載のブロック共重合体。
【0017】
【化1】

(式1中、n=1〜5である)
【0018】
(4)前記常磁性イオンが、ガドリニウム(III)であることを特徴とする(2)または(3)に記載のブロック共重合体。
【0019】
(5)前記親水性化合物が、アクリルアミド、アクリル酸、メタクリル酸、マレイン酸、無水マレイン酸、ビニルピロリドンおよびそれらの誘導体からなる群から選択される少なくも一つであることを特徴とする(1)〜(4)のいずれかに記載のブロック共重合体。
【0020】
(6)前記反応性官能基が、ヒドロキシル基、アミノ基、エポキシ基、カルボキシル基、酸クロリド基、アルデヒド基、イソシアネート基およびイソチオシアネート基からなる群から選択される少なくも一つであることを特徴とする(1)〜(5)のいずれかに記載のブロック共重合体。
【0021】
(7)前記ブロック共重合体が、湿潤時における表面潤滑性と磁気共鳴画像における視認性を発現することを特徴とする(1)〜(6)のいずれかに記載のブロック共重合体。
【0022】
(8)(1)〜(7)のいずれかに記載のブロック共重合体を基材表面に被覆したことを特徴とする医療器具。
【発明の効果】
【0023】
以上述べたごとく、本発明のブロック共重合体は、MRI下で高信号を生じ、コーティングを施した医療器具全体を容易に視認可能とする。さらに、前記ブロック共重合体は、湿潤時に表面潤滑性を発現し、特に血管領域の診断および治療に適用する医療器具に被覆(コーティング)された場合、組織への損傷を低減し、目的部位への確実な挿入を可能とする。また、MRI視認性と表面潤滑性を同一のブロック共重合体で達成できるので、器具表面からの剥離や製造工程の煩雑さのない被覆層(コーティング層)を得ることができる。
【図面の簡単な説明】
【0024】
【図1】図1は、本発明のブロック共重合体の好ましい態様を示す模式図である。
【図2】図2は、本発明のワイヤーの表面潤滑性の試験方法を示す全体図である。
【図3】図3は、本発明の一実施例に係る血管拡張用カテーテルの斜視図である。
【図4】図4は、本発明の一実施例に係る血管拡張用カテーテルの先端部付近の縦断面図である。
【発明を実施するための最良の形態】
【0025】
以下、本発明を詳細に説明する。
本発明は、湿潤時にMRI下で診断または治療に用いる医療器具をMRI下において視認可能とし、かつ医療器具の表面潤滑性を同時に発現させるブロック共重合体と、それを被覆してなる医療器具に関する。ここで、前記ブロック共重合体は、分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質と親水性化合物の共重合体からなる第1のセグメントと、反応性官能基を有する化合物からなる第2のセグメントから形成されたブロック共重合体である。
【0026】
本発明において、MRI視認性とは、MRIで撮影された画像において医療器具が周辺組織像と区別されて確認可能であることを意味する。また、本発明において、表面潤滑性とは、唾液、消化液、血液等の体液や生理食塩水、水等の水系液体に濡れた状態で、挿入、脱着、移動、体内留置時等に、摩擦抵抗が低い状態を意味する。具体的には表面潤滑性は以下に示す方法で測定される。
【0027】
<表面潤滑性の評価方法>
表面潤滑性、すなわち摩擦抵抗の測定は、以下に示すような方法で行うことができる。
表面を本発明のブロック共重合体で被覆した医療用ワイヤー21を作成し、図2に示す治具を用いて、ワイヤー21の摩擦抵抗値を測定する。ワイヤー21を蒸留水に10分間浸漬し本発明のブロック共重合体を充分膨潤させた後、水23中にて円形シリコン弁体22に貫通させ、オートグラフを用いて600mm/minの速さで幅20mmを100回繰り返して移動させ、摩擦抵抗値を測定する。表面潤滑性の指標として100回試験後の最終摩擦抵抗値、また表面潤滑性の持続的指標として、式1の摩擦抵抗値の変化(Δ摩擦抵抗値)を計算する。
Δ摩擦抵抗値 = (最終摩擦抵抗値) − (初期摩擦抵抗値) (式1)
【0028】
簡易的には、指で擦ることにより評価できる。本発明のブロック共重合体が被覆されたワイヤーの表面は、ヌルヌルとした感触を有することが特徴である。
【0029】
<第1のセグメント>
本発明のブロック共重合体の第1のセグメントは、分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質と親水性化合物の共重合体により形成されている。これにより、前記ブロック共重合体中ないしその近傍に存在する前記核種のMR信号強度を変化させ、前記ブロック共重合体およびそれを被覆した医療器具を周辺組織像から区別して描出させることが可能となる。そして、それと同時に湿潤時に表面潤滑性を発現し、特に血管領域の診断および治療に適用する医療器具に前記ブロック共重合体が被覆された場合、組織への損傷を低減し、目的部位への確実な挿入を可能とする。
【0030】
前記MRにて検出可能な核種としては、特に限定されないが、好ましくはプロトン(水素原子核)である。前記プロトンは、人体組織、体液等に存在する水分子やヒドロキシル基内に含まれるプロトンが挙げられる。前記ヒドロキシル基を含む化合物としては、アルカノール等のヒドロキシル基を含む化合物、例えばエタノール、グリセリン(グリコール)、エチレングリコール、プロピレングリコール、ポリエチレングリコール、ポリプロピレングリコール、公知の非毒性のヒドロキシル化化合物、ポリヒドロキシル化化合物等がある。本発明のブロック共重合体中に存在する水分子やヒドロキシル基に存在するプロトンも前記核種に含まれる。
【0031】
前記分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質は、例えば分子内にアミド結合を有するキレート化合物と、前記キレート化合物に配位された常磁性イオンから形成されている。常磁性イオンは、キレート化合物に配位されることにより、毒性が低減され、生体適合性が向上する。
【0032】
前記分子内にアミド結合を有するキレート化合物としては、例えばN−(3−アミノアルキル)メタクリルアミドにキレート試薬であるジエチレントリアミン五酢酸(DTPA)を共有結合させることによって得られた下記一般式1で示されるキレート化合物が例示され、より好ましくはN−(3−アミノプロピル)メタクリルアミドにDTPAを共有結合させることによって得られた、下記一般式1においてn=3であるキレート化合物である。
【0033】
【化2】

(式1中、n=1〜5である)
【0034】
なお、分子内にアミド結合を有するキレート化合物の他の例としては、上述のN−(3−アミノアルキル)メタクリルアミドに、1,4,7,10−テトラアザシクロドデカン−N,N’,N”,N”’−四酢酸(DOTA)、1,4,8,11−テトラアザシクロテトラデカン−N,N’,N”,N”’−四酢酸(TETA)、ジエチレントリアミン五酢酸−N,N’−ビス(メチルアミド)(DTPA−BMA)、ジエチレントリアミン五酢酸−N,N’−ビス(メトキシエチルアミド)(DTPA−BMEA)、s−4−(4−エトキシベンジル)−3,6,9−トリス[(カルボキシラートメチル)]−3,6,9−トリアザウンデカンジオン酸(EOB−DTPA)、ベンジルオキシプロピオンテトラアセテート(BOPTA)、(4R)−4−[ビス(カルボキシメチルアミノ)]−3,6,9−トリアザウンデカンジオン酸(MS−325)、1,4,7−トリス(カルボキシメチル)−10−(2’−ヒドロキシプロピル)−1,4,7,10−テトラアザシクロドデカン(HP−DO3A)、DO3A−ブトロール等のキレート試薬を共有結合させることによって得られるキレート化合物が挙げられる。
【0035】
前記常磁性イオンとしては、原子番号21〜29、42、44および58〜70の元素からなる多価金属イオンが例示される。具体的には、クロム(III)、マンガン(II)、鉄(III)、鉄(II)、コバルト(II)、銅(II)、ニッケル(II)、プラセオジウム(III)、ネオジウム(III)、サマリウム(III)、イッテルビウム(III)、ガドリニウム(III)、テルビウム(III)、ジスプロシウム(III)、ホルミウム(III)、エルビウム(III)が挙げられる。特に、強い磁気モーメントを有することから、ガドリニウム(III)、マンガン(II)、鉄(III)等のイオンが好ましい。より好ましくは、最も強い磁気モーメントを有するガドリニウム(III)である。
【0036】
なお、前記分子内にアミド結合を有するキレート化合物や常磁性イオンは、適当な化合物と塩を形成していてもよい。このような塩としては、ナトリウムやカリウム等の金属、エタノールアミン、モルホリン、メグルミン(N−メチルグルカミン)等の有機塩基、アルギニン、オルニチン等のアミノ酸などが例示できる。
【0037】
本発明のブロック共重合体に含まれる常磁性イオンの濃度は、それを撮像するMRI装置の静磁場強度、傾斜磁場強度、撮像シーケンス等に依存するため、使用する撮像シーケンスにおいて撮像対象組織とブロック共重合体のコントラストが明瞭となるような濃度が選択される。一般的に、常磁性イオンは、近傍に存在するプロトンの緩和時間に対して、低濃度ではT1緩和時間短縮効果が、高濃度ではT2緩和時間短縮効果が優位となり、その効果は静磁場強度に比例する。前記ブロック共重合体中に含まれる常磁性イオンの濃度は、例えば、ICP(誘導結合プラズマ)発光分光分析法にて適切な波長を選択することにより定量できる。
【0038】
前記親水性化合物としては、湿潤時に表面潤滑性を発現するものであれは特に限定されず、アクリルアミド、アクリル酸、メタクリル酸、マレイン酸、無水マレイン酸、ビニルピロリドンあるいはそれらの誘導体が例示され、N−メチルアクリルアミド、N,N−ジメチルアクリルアミド、アクリルアミド、アクリロイルモルホリン、N,N−ジメチルアミノエチルアクリレート、2−メタクリロイルオキシエチルフォスフォリルコリン、2−メタクリロイルオキシエチル−D−グリコシド、2−メタクリロイルオキシエチル−D−マンノシド、ビニルピロリドン、ビニルメチルエーテル、ヒドロキシエチルメタクリレートが好適に例示される。合成の容易性や操作性の観点から、より好ましくは、N,N−ジメチルアクリルアミドである。
【0039】
前記分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質と親水性化合物を共重合体する際の重合形式は特に限定されず、例えばランダム共重合、ブロック共重合、グラフト共重合が挙げられる。
【0040】
<第2セグメント>
前記第2のセグメントは、医療器具を構成する基材と結合し得るか、もしくは互いに結合して架橋し得うる反応性官能基を分子内に有する化合物(単量体)もしくはその繰り返し部分により形成されている。したがって、前記ブロック共重合体が医療器具に被覆された際、器具表面からの剥離が防止される。
【0041】
反応性官能基としては、ヒドロキシル基、アミノ基、エポキシ基、カルボキシル基、酸クロリド基、アルデヒド基、イソシアネート基、イソチオシアネート基などが挙げられるが、加熱操作等で反応させる際の反応速度が穏やかであるエポキシ基が好ましい。そして、エポキシ基を有する化合物(単量体)としては、反応が熱により促進され、架橋構造を形成することで不溶化して本発明のブロック共重合体の医療器具表面から剥離が確実に防止され、取り扱いも比較的容易であることからグリシジルアクリレートやグリシジルメタクリレートが好ましい。
【0042】
<本発明の好ましい態様>
図1は、本発明のブロック共重合体の好ましい態様を示す模式図である。図1は、第2セグメント11を形成する反応性官能基を有する化合物(単量体)としてエポキシ基16を有するグリシジルメタクリレート(GMA)、第1セグメント12を形成する親水性化合物13としてN,N−ジメチルアクリルアミド(DMAA)、分子内にアミド結合を有するキレート化合物14としてN−(3−アミノプロピル)メタクリルアミドにDTPAを共有結合させることによって得られたキレート化合物、常磁性イオン15としてガドリニウム(III)を用いた例である。その製造方法の一例を示すと、まず、GMAモノマーに重合開始剤を添加して重合し、分子内にラジカル(パーオキサイド基)を有するポリGMAを得る。続いて、このポリGMAを重合開始剤とし、DMAAおよび予めキレート試薬であるDTPAを共有結合させておいたN−(3−アミノプロピル)メタクリルアミドを同時に添加して重合を行い、GMAホモポリマー(第2セグメント11)、並びにDMAAおよび予めDTPAを共有結合させておいたN−(3−アミノプロピル)メタクリルアミドに結合したポリマー(第1セグメント12)の2種類のポリマーが連結したブロック共重合体を得る。さらに常磁性イオン15としてガドリニウムをキレート内に配位させることにより、目的のブロック共重合体を得る。
【0043】
このようにして得られた、本発明のブロック共重合体は、以下の効果を有する。(1)被覆層の剥離がなく、永続的な表面潤滑性が得られる。(2)医療器具に被覆したとき、比較的親水性の低い反応性官能基を有する第2セグメント11が医療器具側に、親水性化合物を有する第1セグメント12が表面側にそれぞれ配置されると考えられるため、反応性官能基を有する化合物と親水性化合物をランダム共重合した場合と比較してより高い表面潤滑性が得られる。(3)ひとつのブロック共重合体中に、医療器具を構成する基材と結合し得るか、もしくは互いに結合して架橋し得る反応性官能基を有する部位(第2セグメント11)、湿潤時に表面潤滑性を発現する部位およびMRI視認性を有する部位(第1セグメント12)が含まれていることから、特別なプライマ溶液を必要とせず、一回の塗布操作で医療器具に被覆でき、製造上の操作性・安全性に優れている。(4)磁気共鳴にて検出可能な核種の緩和時間を短縮する物質が親水性化合物と共重合体されているので、常磁性イオンが短期間で流出することがなく、安全性の面で優れている。
【0044】
<その他>
本発明のブロック共重合体は、該ブロック共重合体の耐久性の向上や表面潤滑性の制御を目的として、該ブロック共重合体に架橋処理を施してもよい。前記架橋処理の方法としては、公知の方法が適用可能であり、例えば、光、熱、または放射線等により活性ラジカルを発生させる方法や重合性多官能モノマーを添加する方法、多官能性の架橋剤を塗布する方法、触媒を用いて分子内の反応性官能基同士を架橋させる方法などが挙げられる。エポキシ基のように、反応性の高い反応性官能基を含むブロック共重合体であれば、エポキシ基間での重合、ジアミノ化合物、ジヒドロキシ化合物、ジアルデヒド化合物などにより、容易に架橋することができる。
【0045】
本発明におけるブロック共重合体には、診断や治療の効果向上や徐放を目的として、生理活性物質や薬物を担持させてもよい。そのような生理活性物質および薬物の具体的な例としては、抗癌剤、抗生物質、生理活性を有するポリペプチド、下熱剤、鎮静剤、免疫賦活剤、抗炎症剤、鎮咳剤、抗てんかん剤、抗ヒスタミン剤、降圧利尿剤、糖尿病治療剤、筋弛緩剤、抗腫瘍剤、抗うつ剤、抗アレルギー剤、強心剤、不整脈治療剤、血管拡張剤、抗凝血剤、麻薬拮抗剤、止血剤、抗結核剤、ホルモン剤などが挙げられる。
【0046】
<ブロック共重合体を被覆した医療用具およびその製造方法>
本発明の医療器具の基材としては、特に限定されないが、例えば、合成または天然の高分子、金属、セラミック等が挙げられる。前記合成高分子の例としては、ポリエチレン、ポリプロピレン、ポリブタジエン等のポリオレフィン、ポリ塩化ビニル、ポリウレタン、エチレン−酢酸ビニル共重合体、ポリエチレンテレフタレート、ポリブチレンテレフタレート等のポリエステル、ポリアミド、ポリエーテルポリアミド、ポリエステルポリアミド、軟質ポリ塩化ビニル、ABS樹脂、AS樹脂、ポリテトラフルオロエチレン等のフッ素系樹脂、形状記憶樹脂等の各種樹脂材料や、スチレン系、ポリオレフィン系、ポリウレタン系、ポリエステル系、ポリアミド系、ポリブタジエン系、トランスポリイソプレン系、フッ素ゴム系、塩素化ポリエチレン系等の各種熱可塑性エラストマー、さらには、これらのうちの2種以上を組合せたもの(ポリマーアロイ、ポリマーブレンド、積層体等)が挙げられる。これらの基材は、被覆される本発明のブロック共重合体との親和性向上や共有結合形成を目的とした表面処理を施してもよい。
【0047】
本発明におけるブロック共重合体を医療器具に被覆する方法としては、公知の被覆方法が使用できる。例えば、被覆する医療器具の全体または一部を本発明のブロック共重合体を含有する溶液、懸濁液または乳濁液に浸漬させた後、乾燥によって溶媒を除去することによって、医療器具を構成する基材表面に本発明のブロック共重合体からなる被覆層を形成することができる。また、前記ブロック共重合体を含有する溶液、懸濁液または乳濁液を基材の表面に噴霧した後に乾燥を行ってもよい。このとき、基材表面とブロック共重合体が反応し、共有結合を形成していてもよい。特に、特許第3580843号公報には、酸無水物を有する合成高分子を構成成分とする基材表面に、該酸無水物と反応しうる官能基を有する重合体を被覆し、30℃以上で加熱処理を行うことによって被覆層を形成する方法が開示されている。また、特許第3631781号公報では、重合体を該重合体と反応する反応性基を有していない医療用器具を構成する高分子基材が膨潤率1〜100%で膨潤する溶媒に溶解して該重合体溶液を作製し、該溶液に該高分子基材を浸漬して膨潤させ、さらに該高分子基材表面と該重合体を架橋または高分子化させることによって、該高分子基材表面と該重合体との間に相互貫入網目構造を生成させる方法が開示されている。これらの方法を用いて被覆すると、前記ブロック共重合体が医療器具の基材表面に強固に固定され、耐剥離性に優れた被覆層を得ることができるので好適である。本発明は、上記の具体例を含めて前記ブロック共重合体からなる被覆層を形成することを含む。
【0048】
本発明におけるブロック共重合体は、医療器具の表面を被覆する被覆層として好適に使用できる。前記医療器具とは、医療行為において目的とする手技を行うために必要とされる器具を意味する。MRI視認性と表面潤滑性が要求される医療器具として、特に血管内で使用されるカテーテルやガイドワイヤー類を好適に例示できるが、その他にも下記の医療器具を例示できる。
(1)胃管カテーテル、栄養カテーテル、経管栄養用(ED)チューブ等の経口または経鼻的に消化器官内に挿入または留置されるカテーテル類。
(2)酸素カテーテル、酸素カヌラ、気管内チューブのチューブやカフ、気管切開チューブのチューブやカフ、気管内吸引カテーテル等、経口または経鼻的に気道または器官内に挿入または留置されるカテーテル類。
(3)尿道カテーテル、導尿カテーテル、バルーンカテーテルのカテーテルやバルーン等、尿道または尿管内に挿入または留置されるカテーテル類。
(4)吸引カテーテル、排液カテーテル、直腸カテーテル等、各種体腔、臓器、組織内に挿入または留置されるカテーテル類。
(5)留置針、IVHカテーテル、サーモダイリューションカテーテル、血管造影用カテーテル、血管拡張用カテーテルおよびダイレーターもしくはイントロデューサーなどの血管内に挿入または留置されるカテーテル類。または、これらのカテーテル用のガイドワイヤー、スタイレット等。
(6)ステント類や人工血管、人工器官、人工気管支等。
(7)体外循環治療用の医療用器具(人工心臓、人工肺、人工腎臓)やその回路。
【0049】
図3は、本発明の一実施例に係る血管拡張用カテーテルの斜視図、図4は、図3に示す血管拡張用カテーテルの先端部付近の縦断面図である。図3に示すように、血管拡張用カテーテル31は先端45と基端46とを有し、その間にカテーテル本体32が延在する。さらに、血管拡張用カテーテル31は、カテーテル本体32と、カテーテル本体32の先端部に装着された、拡張・収縮可能なバルーン33と、カテーテル本体32の基端部に装着されたハブ34とを備えている。図4の縦断面図に示すように、カテーテル本体32中には、先端45から基端46にかけて貫通したガイドワイヤールーメン42とバルーンルーメン41とを備えている。ガイドワイヤールーメン42にはガイドワイヤー50が挿通されている。
【0050】
ガイドワイヤー50は、先端と基端とを有する線状部材である。ガイドワイヤー50の長さは、血管拡張用カテーテル31の全長以上である。
以上のような血管拡張用カテーテル31およびガイドワイヤー50は、ガイディングカテーテル60内に挿入して使用される。ガイディングカテーテル60は、先端61と基端62とを有し、その間にガイディングカテーテル本体63が延在する。ガイディングカテーテル60の基端側には、Yコネクタ70が装着されている。このYコネクタ70の内部には、それらの長手方向に沿って内腔が形成され、この内腔はガイディングカテーテル60の内腔と連通しており、血管拡張用カテーテル31およびガイドワイヤー50は、ガイディングカテーテル60およびYコネクタ70の内腔を通って、Yコネクタ70の基端より突出している。また、Yコネクタ70には、管状の分岐部71が形成されている。
【0051】
血管拡張用カテーテル31はPTCA術(Percutaneous Transluminal Coronary Angioplasty:経皮的冠状動脈経血管形成術)等に適用した場合使用される。セルジンガー法によりカテーテルイントロデューサーのシースより、ガイドワイヤー(図示せず)を挿通したガイディングカテーテル60を動脈内に挿入し、ガイドワイヤーを先行させながら、進退、回転を繰返し、その先端部を冠動脈入口部へ到達させ、留置する。前記ガイドワイヤーを抜去した後、ガイドワイヤー50を挿通した血管拡張用カテーテル31をガイディングカテーテル60の内腔に沿って先端方向へ前進させ、血管拡張用カテーテル31の先端部45をガイディングカテーテルの先端61開口より突出させる。血管拡張用カテーテル31の先端部が冠動脈内に到達したら、ガイドワイヤー50を必要に応じ回転しながら前進させて、その先端部を目的部である冠動脈狭搾部を通過させる。ガイドワイヤー50の先端が冠動脈狭窄部を通り過ぎたら、ガイドワイヤー50の前進を停止し、次いで、血管拡張用カテーテル31をガイドワイヤー50に沿ってゆっくりと前進させ、バルーン33を冠動脈狭窄部に位置させる。次に、ハブ34より作動流体を注入し、ハブ34の内腔およびバルーンルーメン41を介してバルーン33内に供給し、バルーン33を拡張させる。これにより、冠動脈狭窄部が拡張される。
【0052】
本発明のブロック共重合体を基材表面に被覆した血管拡張用カテーテルやガイドワイヤーを用いると、以上のような操作を容易、かつ安全に行うことができる。前記ブロック共重合体を被覆する部位については、血管拡張用カテーテルやガイドワイヤーの表面全体、またはその一部であってもよい。特に、ガイディングカテーテル60表面のYコネクタ70よりも先端側、バルーン33を含む血管拡張用カテーテルの先端部位、ガイドワイヤー50の表面全体、ガイドワイヤー50が挿入される血管拡張用カテーテル内腔表面の先端部位などを本発明のブロック共重合体で被覆することが好ましい。
【0053】
然るべき血管モデルや体管モデルを予め作製しておき、処理部位の位置と長さ、表面潤滑性のレベルなどを変えたサンプルを各種用意して、相互比較することにより、本発明のブロック共重合体の好適な被覆部位を決めることも可能である。
【0054】
更に、本発明のブロック共重合体は、MRI視認性と表面潤滑性を同時に発現するが、従来技術である表面潤滑性のみを発現する物質で被覆する部位と本発明のブロック共重合体で被覆する部位とに分けて用いてもよい。例えば、ガイドワイヤーと血管拡張用カテーテルの先端部のみを本発明のブロック共重合体で被覆し、MRI視認性と表面潤滑性との両方の機能を発現させ、それ以外のガイドワイヤー、血管拡張カテーテルの部位およびガイディングカテーテル全体は表面潤滑性のみを発現する物質で被覆してもよい。
【実施例】
【0055】
以下、実施例をあげて本発明を具体的に説明するが、本発明はこれに限定されるものではない。
【0056】
(実施例1)
<ブロック共重合体の合成>
1.分子内にパーオキサイド基を有するポリGMA(第2のブロック)の合成
セバシン酸ジクロリド(東京化成社製)5.5gに50℃でトリエチレングリコール(東京化成社製)1.7gを滴下した後、50℃で3時間塩酸を減圧除去して得られたオリゴエステル6.5gにメチルエチルケトン(ナカライテスク社製)0.61gを加え、水酸化ナトリウム(水酸化ナトリウム(粒状)、関東化学社製)2.1g、31%過酸化水素(過酸化水素(過酸化水素水)、関東化学社製)1.4g、界面活性剤ジオクチルフォスフェート(Aldrich社製)0.06g、水150mlよりなる溶液中に滴下し、−5℃で1時間反応させた。反応物は、水洗、メタノール洗浄を繰り返した後、乾燥させて分子内に複数のパーオキサイド基を有するポリ過酸化物(PPO)を得た。
続いて、このPPOを重合開始剤として1.0g、グリシジルメタクリレート(GMA、和光純薬工業社製)9.0gを、1,4−ジオキサン(ナカライテスク社製)40gを溶媒として、80℃で2時間、窒素雰囲気下で攪拌しながら重合した。反応物は、貧溶媒をn−ヘキサン(国産化学社製)、良溶媒をテトラヒドロフラン(関東化学社製)として精製し、分子内にパーオキサイド基を有するポリGMAを得た。
【0057】
2.分子内にアミド結合を有するキレート化合物の合成
ジエチレントリアミン五酢酸二無水物(DTPAda、Aldrich社製)4.3g(12mmol)を無水エタノール(和光純薬工業社製)700mlに溶かした溶液に、N−(3−アミノプロピル)メタクリルアミド塩酸塩(Polysciences Inc.社製)2.1g(12mmol)およびトリエチルアミン(和光純薬工業社製)2.0ml(14mmol)を無水エタノール50mlに溶かした溶液を室温にて滴下した後、30分間還流した。溶液を室温まで冷却した後、2N塩化水素エタノール溶液(国産化学社製)を加えて酸性とし、さらに8時間以上還流した。その後、溶液を濃縮して得られた化合物に飽和水酸化ナトリウム水溶液430mlを加えて溶解させ、塩化メチレン(関東化学社製)で抽出、有機層を濃縮した。得られた粗生成物を、シリカゲルクロマトグラフィーにより精製し、エステル保護されたキレート化合物を得た。
続いて、エステル保護されたキレート化合物に1N水酸化ナトリウム水溶液(4.2当量)を加え、50℃で30分攪拌した後、陽イオン交換樹脂を用いて処理した溶液を濃縮して、分子内にアミド結合を有するキレート化合物を得た。
【0058】
3.ブロック共重合体の合成
2.で得たキレート化合物0.079g(0.15mmol)を無水ジメチルスルホキシド(DMSO、和光純薬工業社製)50mlに溶かし、80℃で攪拌しながら窒素を導入してバブリングを行った。1時間後、N,N−ジメチルアクリルアミド(DMAA、和光純薬工業社製)5.3g(53mmol)と1.で得たポリGMA0.63g(4.4mmol)を無水DMSO30mlに溶かした溶液を前記バブリングした溶液に加え、同温度で17時間重合を行った。続いて、0.1M酢酸ガドリニウム・4水和物のDMSO溶液1.5mlを添加し、さらに1時間反応させた。氷冷により反応を停止した後、テトラヒドロフランで希釈し、ジエチルエーテル(国産化学社製)に滴下して、ポリマーを沈殿させた。この沈殿物を濾別、減圧乾燥して、本発明のブロック共重合体1を得た。
【0059】
<評価>
4.キャストフィルムの作製
実施例1で得られたブロック共重合体1をメタノール(国産化学社製)またはクロロホルム(関東化学社製)を溶媒として2wt%溶液を調製し、その5mlをポリテトラフルオロエチレンシャーレ(φ30mm)に展開し乾燥させて、厚さ50μm〜100μmのキャストフィルム(フィルム1)を作製した。
【0060】
5.キャストフィルム中に含まれるガドリニウム(III)の定量
フィルム1をナイロンバッグ(255メッシュ、10×20cm)に入れ、流水で24時間洗浄した後減圧乾燥した。洗浄後のフィルムを秤量して磁性るつぼにとり、硝酸(原子吸光用、関東化学社製)500μlを加えて、300℃のホットプレート上で白煙を生じなくなるまで加熱して炭化した後、500℃の電気マッフル炉中で灰化した。冷却後、得られた灰化物を硝酸100μlに溶かし、蒸留水を加えて10mlとして、ICP(誘導結合プラズマ)発光分析法にてガドリニウム(III)の定量を行い(ICPS−8000、島津製作所社製、測定波長342.247nm)、重合体単位重量当たりに含まれるガドリニウム重量(mg/g)を算出し、表1に示した。
【0061】
6.フィルムのMRI視認性評価
フィルム1をφ8mmの円形に打ち抜き、蒸留水で十分に洗浄した後、生理食塩水(テルモ生食、テルモ社製)5mlとともにポリスチレン製瓶に入れ、MRI撮像を行った。MRI装置はSigna EXITE Twin Speed 1.5T Ver.11(静磁場強度1.5T、GE Healthcare社製)、受信RFコイルはQD Head Coilを用い、撮像条件はSE、FLAIRシーケンスを使用した。MRIの画像上でキャストフィルムの視認性を評価した。
【0062】
(実施例2)
実施例1の3.において、キレート化合物を0.30g、DMAAを7.1g、ポリGMAを0.43g、0.1M酢酸ガドリニウム・4水和物のDMSO溶液の添加量を5.8mlとした以外は、実施例1と同様に行い、ブロック共重合体2およびフィルム2を得て、フィルム2のガドリニウム(III)の定量およびMRI視認性の評価を行った。
【0063】
(実施例3)
実施例1の3.において、キレート化合物を0.24g、DMAAを5.1g、ポリGMAを0.61g、0.1M酢酸ガドリニウム・4水和物のDMSO溶液の添加量を4.6mlとした以外は、実施例1と同様に行い、ブロック共重合体3およびフィルム3を得て、フィルム3のガドリニウム(III)の定量およびMRI視認性の評価を行った。
【0064】
(実施例4)
実施例1の3.において、キレート化合物を0.064g、DMAAを4.5g、ポリGMAを0.53g、0.1M酢酸ガドリニウム・4水和物のDMSO溶液の添加量を0.97mlとしたこと、および実施例1の6.の評価を行わなかったこと以外は、実施例1と同様に行い、ブロック共重合体4およびフィルム4を得て、フィルム4のガドリニウム(III)の定量を行った。
【0065】
7.ワイヤーの作製
クロロホルムとメタノール(3/1、v/v)を溶媒として、ブロック共重合体4の6.5wt%溶液を調製した。ガイドワイヤー(外径0.035インチ、テルモ社製)を重合体溶液に浸漬し、直後に100mm/minの速さで引き上げ、80℃で3時間乾燥させて、ガイドワイヤー表面に高分子層を形成させた。続いて、流水で24時間洗浄した後、50℃で3時間乾燥させて、ワイヤー4を得た。
【0066】
8.チューブの作製
7.において、ガイドワイヤーの代わりにウレタン製チューブ(外径1.55mm、内径1.10mm)を用いたこと以外は、7.と同様に行い、チューブ4を得た。
【0067】
9. チューブおよびワイヤーのMRI視認性評価
ワイヤー4およびチューブ4を生理食塩水中に固定し、MRI撮像を行った。MRI装置はSigna EXITE Twin Speed 1.5T Ver.11(静磁場強度1.5T、GE Healthcare社製)、受信RFコイルはQD Head Coilを用い、撮像条件はGRE、FLAIRシーケンスを使用した。MRIの画像上でワイヤーおよびチューブの視認性を評価した。
【0068】
(実施例5)
実施例1の3.において、キレート化合物を0.10g、DMAAを4.5g、ポリGMAを0.53g、0.1M酢酸ガドリニウム・4水和物のDMSO溶液の添加量を2.0mlとしたこと、および実施例1の6.の評価を行わなかったこと以外は、実施例1と同様に行い、ブロック共重合体5およびフィルム5を得て、フィルム5のガドリニウム(III)の定量を行った。
そして、実施例4の7.〜9.と同様の方法で、ワイヤー5およびチューブ5を作製して、それぞれのMRI視認性の評価を行った。
【0069】
(実施例6)
実施例1の3.において、キレート化合物を0.17g、DMAAを4.5g、ポリGMAを0.53g、0.1M酢酸ガドリニウム・4水和物のDMSO溶液の添加量を3.3mlとしたこと、および実施例1の6.の評価を行わなかったこと以外は、実施例1と同様に行い、ブロック共重合体6およびフィルム6を得て、フィルム6のガドリニウム(III)の定量を行った。
そして、実施例4の7.〜9.と同様の方法で、ワイヤー6およびチューブ6を作製して、それぞれのMRI視認性の評価を行った。
【0070】
(比較例1)
実施例1の3.において、キレート化合物および0.1M酢酸ガドリニウム・4水和物を使用しなかった以外は、実施例1と同様に行い、ブロック共重合体7およびフィルム7を得て、フィルム7のガドリニウム(III)の定量およびMRI視認性の評価を行った。
そして、実施例4の7.〜9.と同様の方法で、ワイヤー7およびチューブ7を作製して、それぞれのMRI視認性の評価を行った。
【0071】
(比較例2)
実施例4の7.および8.において高分子層を形成させていないガイドワイヤー(ワイヤー8)およびウレタン製チューブ(チューブ8)について、それぞれ実施例4の9.と同様の方法でMRI視認性の評価を行った。
【0072】
上記実施例と比較例で得られたフィルム1〜7、ワイヤー4〜8およびチューブ4〜8の評価結果を表1に示した。ここで、MRI視認性評価においては、核磁気共鳴画像で視認できたものを「○」、視認できなかったものを「×」、評価自体実施しなかったものを「−」とした。
【0073】
【表1】

【0074】
10.ワイヤーの表面潤滑性評価
実施例5と比較例2で得られたワイヤー5およびワイヤー8について、図2示す治具を用いて摩擦抵抗値を測定した。
ガイドワイヤー表面に高分子層を形成させたワイヤー5の最終摩擦抵抗値は0.20N、Δ摩擦抵抗値は0.01N以下であり100回の移動試験後においても安定した低摩擦性を示した。一方、ガイドワイヤー表面に高分子層を形成させなかったワイヤー8の最終摩擦抵抗値は0.94Nであり、低摩擦性を示さなかった。
【特許請求の範囲】
【請求項1】
分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質と親水性化合物の共重合体からなる第1のセグメントと、
反応性官能基を有する化合物からなる第2のセグメントを含むことを特徴とするブロック共重合体。
【請求項2】
前記分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質が、分子内にアミド結合を有するキレート化合物と、前記キレート化合物に配位された常磁性イオンから形成されていることを特徴とする請求項1に記載のブロック共重合体。
【請求項3】
前記分子内にアミド結合を有するキレート化合物が、下記一般式1で示されるキレート化合物であることを特徴とする請求項2に記載のブロック共重合体。
【化1】

(式1中、n=1〜5である)
【請求項4】
前記常磁性イオンが、ガドリニウム(III)であることを特徴とする請求項2または3に記載のブロック共重合体。
【請求項5】
前記親水性化合物が、アクリルアミド、アクリル酸、メタクリル酸、マレイン酸、無水マレイン酸、ビニルピロリドンおよびそれらの誘導体からなる群から選択される少なくも一つであることを特徴とする請求項1〜4のいずれかに記載のブロック共重合体。
【請求項6】
前記反応性官能基が、ヒドロキシル基、アミノ基、エポキシ基、カルボキシル基、酸クロリド基、アルデヒド基、イソシアネート基およびイソチオシアネート基からなる群から選択される少なくも一つであることを特徴とする請求項1〜5のいずれかに記載のブロック共重合体。
【請求項7】
前記ブロック共重合体が、湿潤時における表面潤滑性と磁気共鳴画像における視認性を発現することを特徴とする請求項1〜6のいずれかに記載のブロック共重合体。
【請求項8】
請求項1〜7のいずれかに記載のブロック共重合体を基材表面に被覆したことを特徴とする医療器具。
【請求項1】
分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質と親水性化合物の共重合体からなる第1のセグメントと、
反応性官能基を有する化合物からなる第2のセグメントを含むことを特徴とするブロック共重合体。
【請求項2】
前記分子内にアミド結合を有する磁気共鳴にて検出可能な核種の緩和時間を短縮する物質が、分子内にアミド結合を有するキレート化合物と、前記キレート化合物に配位された常磁性イオンから形成されていることを特徴とする請求項1に記載のブロック共重合体。
【請求項3】
前記分子内にアミド結合を有するキレート化合物が、下記一般式1で示されるキレート化合物であることを特徴とする請求項2に記載のブロック共重合体。
【化1】

(式1中、n=1〜5である)
【請求項4】
前記常磁性イオンが、ガドリニウム(III)であることを特徴とする請求項2または3に記載のブロック共重合体。
【請求項5】
前記親水性化合物が、アクリルアミド、アクリル酸、メタクリル酸、マレイン酸、無水マレイン酸、ビニルピロリドンおよびそれらの誘導体からなる群から選択される少なくも一つであることを特徴とする請求項1〜4のいずれかに記載のブロック共重合体。
【請求項6】
前記反応性官能基が、ヒドロキシル基、アミノ基、エポキシ基、カルボキシル基、酸クロリド基、アルデヒド基、イソシアネート基およびイソチオシアネート基からなる群から選択される少なくも一つであることを特徴とする請求項1〜5のいずれかに記載のブロック共重合体。
【請求項7】
前記ブロック共重合体が、湿潤時における表面潤滑性と磁気共鳴画像における視認性を発現することを特徴とする請求項1〜6のいずれかに記載のブロック共重合体。
【請求項8】
請求項1〜7のいずれかに記載のブロック共重合体を基材表面に被覆したことを特徴とする医療器具。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2010−229046(P2010−229046A)
【公開日】平成22年10月14日(2010.10.14)
【国際特許分類】
【出願番号】特願2009−75712(P2009−75712)
【出願日】平成21年3月26日(2009.3.26)
【出願人】(000109543)テルモ株式会社 (2,232)
【Fターム(参考)】
【公開日】平成22年10月14日(2010.10.14)
【国際特許分類】
【出願日】平成21年3月26日(2009.3.26)
【出願人】(000109543)テルモ株式会社 (2,232)
【Fターム(参考)】
[ Back to top ]

