ブロモドメイン阻害剤としての縮合アゼピン誘導体
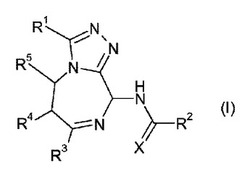
式(I)のベンゾジアゼピン化合物およびその塩、そのような化合物を含む医薬組成物、ならびにそれらの療法における使用。


【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ベンゾジアゼピン化合物、そのような化合物を含む医薬組成物、および療法におけるそれらの使用に関する。
【背景技術】
【0002】
真核生物のゲノムは細胞核内で高度に組織化されている。二重鎖DNAの長い鎖は、ヌクレオソームを形成するためにヒストンタンパク質(ほとんどはヒストンH2A、H2B H3およびH4の2つのコピーを含む)の八量体周囲で覆われている。次いでこの基本単位はさらに、ヌクレオソームの凝集およびフォールディングにより圧縮されて、非常に凝縮されたクロマチン構造を形成する。様々な異なる状態の凝縮が可能であり、この構造の緊密度は細胞周期の間、変化し、細胞分裂のプロセスの間、最もコンパクトになる。クロマチン構造は、非常に凝縮されたクロマチンから効率的に起こり得ない、遺伝子転写を調節する際に重要な役割を果たす。クロマチン構造は、ヒストンタンパク質、特にヒストンH3およびH4に対する、ならびに通常、コアヌクレオソーム構造を超えて伸長するヒストン尾部内の一連の翻訳後修飾によって制御される。これらの修飾には、アセチル化、メチル化、リン酸化、ユビキチン化およびSUMO化が含まれる。これらの後成的マーカーは、ヒストン尾部内の特異的残基上に標識を取り付ける、特異的酵素によって書き出され、消去され、それによって、後成的コードを形成し、次いでそれは、細胞に読み取られて、クロマチン構造の遺伝子特異的調節およびそれによる転写を可能にする。
【0003】
修飾が、静電気を変化させることによってDNAとヒストン八量体との相互作用を緩めるため、ヒストンアセチル化は、通常、遺伝子転写の活性化と関連する。この物理的変化に加えて、特異的タンパク質はヒストン内でアセチル化リシン残基と結合して、後成的コードを読み取る。ブロモドメインは、ヒストンとの関連に限らないが、通常、アセチル化リシン残基と結合するタンパク質内の小さい(約110アミノ酸)特徴的なドメインである。ブロモドメインを含有することが知られている約50タンパク質のファミリーが存在し、それらは細胞内で様々な機能を有する。
【0004】
ブロモドメインを含有するタンパク質のBETファミリーは、近接して2つのアセチル化リシン残基に結合できるタンデムブロモドメインを含有する4つのタンパク質(BRD2、BRD3、BRD4およびBRD−t)を含み、相互作用の特異性を増加させる。BRD2およびBRD3は、活性な転写遺伝子と共にヒストンと会合することが報告されており、転写伸長を促進することに関与し得(Leroyら,Mol.Cell.2008 30(1):51−60)、一方、BRD4は、RNAポリメーラーゼのリン酸化を生じる、遺伝子を誘導するためのpTEF−B複合体の動員に関与し、転写生産を増加させるように見える(Hargreavesら,Cell,2009 138(1):129−145)。また、BRD4およびBRD3は、上皮新性組織形成の非常に悪性な形態において、新規融合癌遺伝子、BRD4−NUTを形成する、NUT(睾丸中の核タンパク質)と融合することが報告されている(Frenchら,Cancer Research,2003,63,304−307およびFrenchら,Journal of Clinical Oncology,2004,22(20),4135−4139)。データは、BRD−NUT融合タンパク質が発癌の原因であることを示唆している(Oncogene,2008,27,2237−2242)。BRD−tは睾丸および卵巣において一意的に発現される。全てのファミリーメンバーは、細胞周期の局面を制御または実行する一部の機能を有すると報告されており、細胞分裂の間、染色体との複合体に存在することが示されており、後成的メモリの維持における役割が示唆される。加えて、一部のウイルスは、ウイルス複製のプロセスの一部として、それらのタンパク質を使用して、それらのゲノムを宿主細胞クロマチンにつなぎ止める(Youら,Cell,2004 117(3):349−60)。
【0005】
特開2008−156311号公報は、ウイルス感染/増殖に対して有用性を有するBRD2ブロモドメイン結合剤と言われているベンズイミダゾール誘導体を開示している。
【0006】
国際特許出願第2009/084693A1号は、アセチル化ヒストンと、抗癌剤として有用であると言われているブロモドメイン含有タンパク質との間の結合を阻害すると言われている一連のチエノトリアゾロジアゼピン誘導体を開示している。
【0007】
ブロモドメインと、その同種アセチル化タンパク質との結合を阻害、より具体的には、アセチル化リシン残基に対するBETファミリーのブロモドメインの結合を阻害する化合物が見出されている。このような化合物は、本明細書以下で「ブロモドメイン阻害剤」と称される。
【発明の概要】
【課題を解決するための手段】
【0008】
本発明の第1の態様において、式(I)の化合物またはその塩、より具体的には式(I)の化合物またはその薬学上許容可能な塩
【化1】

【0009】
が提供される。
【0010】
本発明の第2の態様において、式(I)の化合物またはその薬学上許容可能な塩と、1種以上の薬学上許容可能な担体、希釈剤または賦形剤とを含む、医薬組成物が提供される。
【0011】
本発明の第3の態様において、治療、特にブロモドメイン阻害剤が適応される疾患または病態の治療に使用するための、式(I)の化合物、またはその薬学上許容可能な塩が提供される。
【0012】
本発明の第4の態様において、治療有効量の式(I)の化合物またはその薬学上許容可能な塩を投与することを含む、それを必要とする被験体においてブロモドメイン阻害剤が適応される疾患または病態を治療する方法が提供される。
【0013】
本発明の第5の態様において、ブロモドメイン阻害剤が適応される疾患または病態を治療するための薬剤の製造における式(I)の化合物、またはその薬学上許容可能な塩の使用が提供される。
【発明を実施するための形態】
【0014】
一実施形態において、本発明は、式(I)の化合物またはその塩
【化2】

【0015】
(式中、
XはOまたはSであり、
R1はC1−6アルキル、ハロC1−6アルキル、−(CH2)nOR1aまたは−(CH2)mNR1bR1cであり、ここで、R1aは、水素、C1−6アルキルまたはハロC1−6アルキルであり、同じであっても、異なっていてもよい、R1bおよびR1cは、水素、C1−6アルキルまたはハロC1−6アルキルであり、同じであっても、異なっていてもよい、mおよびnは、1、2または3であり、
R2は、R2a、−OR2bまたは−NR2cR2dであり、ここで、R2aおよびR2bは、カルボシクリル、カルボシクリルC1−4アルキル、ヘテロシクリルまたはヘテロシクリルC1−4アルキルであるか、あるいはR2aは、カルボシクリルエテニルまたはヘテロシクリルエテニルであり、ここで、R2aおよびR2bについて定義されるカルボシクリルまたはヘテロシクリル基は、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノ、ジメチルアミノ、ベンゾイルおよびアジドから独立して選択される1つ以上の基で置換されてもよく、または相互結合する原子と一緒にR2aもしくはR2bについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれか上の2つの隣接する基は、環が、O、SおよびNから独立して選択される1個もしくは2個のヘテロ原子を含んでもよい5員もしくは6員環を形成し、またはR2aおよびR2bは、C1−6アルキルもしくはハロC1−6アルキルであり、同じであっても、異なっていてもよい、R2cおよびR2dは、カルボシクリル、カルボシクリルC1−4アルキル、ヘテロシクリルもしくはヘテロシクリルC1−4アルキルであり、ここで、R2cおよびR2dについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノおよび−CO2C1−4アルキルから独立して選択される1つ以上の基により置換されてもよく、または相互結合する原子と一緒にR2cおよびR2dについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれか上の2つの隣接する基は、環が、O、SおよびNから独立して選択される1個もしくは2個のヘテロ原子を含んでもよい5員もしくは6員環を形成し、またはR2cおよびR2dは、水素、C1−6アルキルもしくはハロC1−6アルキルであり、
R3は、カルボシクリルまたはヘテロシクリルであり、それらのいずれかは、1つ以上のハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロもしくはシアノにより独立して置換されてもよく、またはR3はC1−6アルキルであり、
相互結合炭素原子と一緒にR4およびR5は、ベンゼンもしくは芳香族複素環を形成し、それらの各々は置換されてもよい)
に関する。
【0016】
別の実施形態において、本発明は、式(I)の化合物またはその塩
【化3】

【0017】
(式中、
XはOまたはSであり、
R1は、C1−6アルキル、ハロC1−6アルキル、−(CH2)nOR1aもしくは−(CH2)mNR1bR1cであり、ここで、R1aは、水素、C1−6アルキルもしくはハロC1−6アルキルであり、同じであっても、異なっていてもよい、R1bおよびR1cは、水素、C1−6アルキルもしくはハロC1−6アルキルであり、同じであっても、異なっていてもよい、mおよびnは1、2もしくは3であり、
R2は、R2a、−OR2bもしくは−NR2cR2dであり、ここで、R2aおよびR2bは、カルボシクリル、カルボシクリルC1−4アルキル、ヘテロシクリルもしくはヘテロシクリルC1−4アルキルであり、またはR2aは、カルボシクリルエテニルもしくはヘテロシクリルエテニルであり、R2aもしくはR2bについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノ、ジメチルアミノ、ベンゾイルおよびアジドから独立して選択される1つ以上の基により置換されてもよく、または相互結合する原子と一緒にR2aもしくはR2bについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれか上の2つの隣接する基は、環が、O、SおよびNから独立して選択される1個もしくは2個のヘテロ原子を含んでもよい5員もしくは6員環を形成し、またはR2aおよびR2bは、C1−6アルキルもしくはハロC1−6アルキルであり、同じであっても、異なっていてもよい、R2cおよびR2dは、カルボシクリル、カルボシクリルC1−4アルキル、ヘテロシクリルもしくはヘテロシクリルC1−4アルキルであり、ここで、R2cおよびR2dについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよく、または相互結合する原子と一緒にR2cおよびR2dについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれか上の2つの隣接する基は、環が、O、SおよびNから独立して選択される1個もしくは2個のヘテロ原子を含んでもよい5員もしくは6員環を形成し、またはR2cおよびR2dは、水素、C1−6アルキルもしくはハロC1−6アルキルであり、
R3は、カルボシクリルもしくはヘテロシクリルであり、それらのいずれかは、1つ以上のハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロもしくはシアノにより独立して置換されてもよく、またはR3は、C1−6アルキルであり、
相互結合炭素原子と一緒にR4およびR5は、ベンゼンもしくは芳香族複素環を形成し、それらの各々は置換されてもよい)
に関する。
【0018】
本発明の一実施形態において、式(I)の化合物はS鏡像異性体である。
【0019】
他に示さない限り、任意のアルキル基は、直鎖または分岐であってもよく、1〜6個の炭素原子、好ましくは1〜4個、特に1〜3個の炭素原子である。本明細書に使用する「アルキル」の例としては、限定されないが、メチル、エチル、n−プロピル、n−ブチル、n−ペンチル、n−ヘキシル、イソブチル、イソプロピル、t−ブチルおよび1,1−ジメチルプロピルが挙げられる。
【0020】
本明細書で使用する、用語「アルコキシ」とは、規定数の炭素原子を含有する直鎖または分岐アルコキシ基を指す。例えば、C1−6アルコキシとは、少なくとも1個、および多くても6個の炭素原子を含有する直鎖または分岐アルコキシ基を意味する。本明細書で使用する「アルコキシ」の例としては、限定されないが、メトキシ、エトキシ、プロポキシ、プロパ−2−オキシ、ブトキシ、ブト−2−オキシ、2−メチルプロパ−1−オキシ、2−メチルプロパ−2−オキシ、ペントキシまたはヘキシルオキシが挙げられる。
【0021】
他に示さない限り、任意のカルボシクリル基は、3〜14個の環原子、例えば3〜10個の環原子、またはさらなる例において、3〜8個の環原子を含み、飽和、不飽和または芳香族であってもよい。好ましい飽和カルボシクリル基は、シクロプロピル、シクロペンチルまたはシクロヘキシルである。好ましい不飽和カルボシクリル基は3個までの二重結合を含む。好ましい芳香族カルボシクリル基はフェニルである。用語、炭素環は同様に解釈されるべきである。加えて、用語、カルボシクリルは、カルボシクリル基の任意の縮合した組み合わせ、例えばナフチル、フェナントリル、インダニルおよびインデニルを含む。
【0022】
他に示さない限り、任意のヘテロシクリル基は、5〜9個の環原子、例えば5〜7個の環原子を含み、その4個までは、窒素、酸素および硫黄などのヘテロ原子であってもよく、飽和、不飽和または芳香族であってもよい。ヘテロシクリル基の例は、フリル、チエニル、ピロリル、ピロリニル、ピロリジニル、イミダゾリル、ジオキソラニル、オキサゾリル、チアゾリル、イミダゾリル、イミダゾリニル、イミダゾリジニル、ピラゾリル、ピラゾリニル、ピラゾリジニル、イソオキサゾリル、イソチアゾリル、オキサジアゾリル、トリアゾリル、チアジアゾリル、ピラニル、ピリジル、ピペリジニル、ジオキサニル、モルホリノ、ジチアニル、チオモルホリノ、ピリダジニル、ピリミジニル、ピラジニル、ピペラジニル、スルホラニル、テトラゾリル、トリアジニル、アゼピニル、オキサゼピニル、チアゼピニル、ジアゼピニルおよびチアゾリニルである。加えて、用語、ヘテロシクリルとしては、縮合ヘテロシクリル基、例えばベンズイミダゾリル、ベンゾオキサゾリル、イミダゾピリジニル、ベンズオキサジニル、ベンゾチアジニル、オキサゾロピリジニル、ベンゾフラニル、キノリニル、キナゾリニル、キノキサリニル、ジヒドロキナゾリニル、ベンゾチアゾリル、フタルイミド、ベンゾフラニル、ベンゾジアゼピニル、インドリルおよびイソインドリルが挙げられる。用語、複素環は同様に解釈されるべきである。
【0023】
ハロは、フルオロ、クロロ、ブロモまたはヨードである。
【0024】
一実施形態において、本発明は、式(I)の化合物(式中、R2は−OR2b)を提供する。一実施形態において、R2bは、C1−6アルキル、ベンジルまたはフェニルC1−6アルキルであり、ここで、ベンジルはフルオロにより置換されてもよい。別の実施形態において、R2bは、エチル、イソプロピル、ベンジル、4−フルオロベンジルまたは−CH(CH3)フェニルである。
【0025】
一実施形態において、本発明は、式(I)の化合物またはその塩を提供し、式中、R2は−OR2bである(ただし、式(I)の化合物は、以下ではない:
a)フェニルメチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート、
b)フェニル[4−(2−クロロフェニル)−2−エチル−9−メチル−6H−チエノ[3,2−f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−6−イル]カルバメート、
c)フェニルメチル[6−フェニル−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート)。
【0026】
好ましくは、XはOである。
【0027】
一実施形態において、
XがOであり、
R1が、C1−6アルキル、ハロC1−6アルキル、−(CH2)nOR1aもしくは−(CH2)mNR1bR1Cであり、ここで、R1aは、水素、C1−6アルキル、もしくはハロC1−6アルキルであり、同じであっても、異なっていてもよい、R1bおよびR1cは、水素、C1−6アルキルもしくはハロC1−6アルキルであり、同じであっても、異なっていてもよい、mおよびnは、1、2もしくは3であり、
R2が、R2a、−OR2bもしくは−NR2cR2dであり、ここで、R2aおよびR2bは、カルボシクリル、カルボシクリルC1−4アルキル、ヘテロシクリルもしくはヘテロシクリルC1−4アルキルであり、ここで、カルボシクリルもしくはヘテロシクリル基のいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロもしくはシアノにより置換されてもよく、または相互結合する原子と一緒にカルボシクリルもしくはヘテロシクリル基のいずれか上の2つの隣接する基は、環が、O、SもしくはNから独立して選択される1個もしくは2個のヘテロ原子を含んでもよい5員もしくは6員環を形成し、またはR2aおよびR2bは、C1−6アルキルもしくはハロC1−6アルキルであり、同じであっても、異なっていてもよい、R2cおよびR2dは、カルボシクリル、カルボシクリルC1−4アルキル、ヘテロシクリルもしくはヘテロシクリルC1−4アルキルであり、ここで、カルボシクリルもしくはヘテロシクリル基のいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロもしくはシアノにより置換されてもよく、または相互接続する原子と一緒にカルボシクリルもしくはヘテロシクリル基のいずれか上の2つの隣接する基は、環が、O、SもしくはNから独立して選択される1個もしくは2個のヘテロ原子を含んでもよい5員もしくは6員環を形成し、またはR2cおよびR2dは、水素、C1−6アルキルもしくはハロC1−6アルキルであり、
R3が、カルボシクリルもしくはヘテロシクリルであり、そのうちのいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロもしくはシアノにより置換されてもよく、またはR3は、C1−6アルキルであり、
相互結合炭素原子と一緒にR4およびR5は、ベンゼンもしくは芳香族複素環を形成し、それらの各々は置換されてもよい、
化合物またはその塩が提供される。
【0028】
一実施形態において、R1はC1−6アルキルである。特定の実施形態において、R1はメチルである。
【0029】
一実施形態において、R2は、R2a、−OR2bもしくは−NR2cR2dであり、ここで、R2aおよびR2bは、フェニル、ベンジルもしくはC3−6シクロアルキルであり、そのいずれかの環は、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよく、または相互結合する原子と一緒に環のいずれか上の2つの隣接する基は、メチレンジオキシ基を形成し、またはR2aおよびR2bは、C1−6アルキルもしくはハロC1−6アルキルであり、同じであっても、異なっていてもよい、R2cおよびR2dは、フェニル、ベンジルもしくはC1−6シクロアルキルであり、それらの任意の環は、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよく、または相互結合する原子と一緒に環のいずれか上の2つの隣接する基は、メチレンジオキシ基を形成し、またはR2cおよびR2dは、水素、C1−6アルキルもしくはハロC1−6アルキルである。
【0030】
特定の実施形態において、R2は−OR2bである。R2bは、好ましくは、C1−6アルキルもしくはベンジルである。
【0031】
一実施形態において、R2がR2aである式(I)の化合物またはその塩が提供される。一実施形態において、R2aは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノ、ジメチルアミノ、ベンゾイルおよびアジドから独立して選択される1つ以上の基により置換されてもよいカルボシクリルエテニルである。別の実施形態において、R2aは、フルオロ、クロロおよびメトキシから選択される1つの基により置換されてもよいカルボシクリルエテニルである。別の実施形態において、R2aは、C1−6アルキル、C1−6アルコキシおよびベンゾイルから独立して選択される1つ以上の基により置換されてもよいカルボシクリルまたはヘテロシクリルである。さらなる実施形態において、R2aは、メチル、メトキシおよびベンゾイルから選択される1つの基により置換されてもよいフェニル、ナフチルエチルまたはインドリルである。
【0032】
一実施形態において、R2が−NR2cR2dである式(I)の化合物またはその塩が提供される。一実施形態において、R2cは水素であり、R2dは、ハロゲン、C1−6アルキル、C1−6アルコキシおよび−CO2C1−4アルキルから選択される1つの基により置換されてもよいフェニルまたはベンジルである。別の実施形態において、R2cは水素であり、R2dは、臭素、エチル、メトキシおよび−CO2CH2CH3から選択される1つの基により置換される。
【0033】
一実施形態において、R3は、フェニル、チエニル、フリルまたはピリジルであり、そのうちのいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよく、R3はC1−6アルキルである。別の実施形態において、R3は、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよいフェニルである。別の実施形態において、R3は、メチル、クロロおよびメトキシから選択される1つ以上の基により置換されてもよいフェニルである。別の実施形態において、R3は、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基によりパラ位置にて置換されるフェニルである。さらなる実施形態において、R3は非置換フェニルである。
【0034】
一実施形態において、相互結合する原子と一緒に、R4およびR5は、ベンゼン、チオフェン、フランまたはベンゾフラン環(より好ましくはベンゼン、チオフェンまたはフラン環)を形成し、そのうちのいずれかは、ハロゲン、C1−6アルキル、C2−6アルケニル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノおよびヘテロシクリルから独立して選択される1つ以上の基により置換されてもよい。好ましいヘテロシクリル基はフリルまたはチエニルである。一実施形態において、相互結合する原子と一緒にR4およびR5は、置換されてもよいベンゼン環を形成する。別の実施形態において、相互結合する原子と一緒にR4およびR5は、ヨウ素により置換されてもよいベンゼン環を形成する。
【0035】
特定の実施形態において、
XはOであり、
R1はC1−6アルキルであり、
R2はR2a、−OR2bもしくは−NR2cR2dであり、ここで、R2aおよびR2bは、フェニル、ベンジルもしくはC1−6シクロアルキルであり、それらのうちの任意の環は、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよく、または相互結合する原子と一緒に環のいずれか上の2つの隣接する基はメチレンジオキシ基を形成し、またはR2aおよびR2bは、C1−6アルキルまたはハロC1−6アルキルであり、同じであっても、異なっていてもよい、R2cおよびR2dは、フェニル、ベンジルもしくはC3−6シクロアルキルであり、それらのうちのいずれかの環は、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよく、または相互結合する原子と一緒に環のいずれか上の2つの隣接する基はメチレンジオキシ基を形成し、またはR2cおよびR2dは、水素、C1−6アルキルもしくはハロC1−6アルキルであり、
R3は、フェニル、チエニル、フリルもしくはピリジルであり、それらのうちのいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよく、またはR3はC1−6アルキルであり、
相互結合する原子と一緒にR4およびR5は、ベンゼン、チオフェンもしくはフラン環を形成し、それらのいずれかは、ハロゲン、C1−6アルキル、C2−6アルケニル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノおよびヘテロシクリルから独立して選択される1つ以上の基により置換されてもよい。
【0036】
各可変物についての実施形態は、概して、各可変物について別々に上に記載しているが、本発明は、式(I)のいくつかまたは各々の実施形態が、上に記載される実施形態の各々から選択されるそれらの化合物を含む。したがって、本発明は、その塩を含む、本明細書中で上記した各々の可変物についての実施形態の全ての組み合わせを含むことを意図する。
【0037】
一実施形態において、式(I)の化合物は以下から選択される:
フェニルメチル[6−(4−フルオロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例1)、
フェニルメチル[6−(4−クロロフェニル)−1−エチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例3)、
エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例4)、
エチル[6−(4−クロロフェニル)−1−エチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例5)、
フェニルメチル[1−メチル−8−(メチルオキシ)−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例6)、
フェニルメチル{1−メチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート(実施例7)、
フェニルメチル[1−メチル−6−(4−メチルフェニル)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例8)、
フェニルメチル{1−メチル−6−[3−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート(実施例9)、
フェニルメチル(1,9−ジメチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例10)、
フェニルメチル(8−クロロ−1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例11)、
フェニルメチル(9−メチル−4−フェニル−6H−チエノ[3,2−f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−6−イル)カルバメート(実施例12)、
フェニルメチル(1−メチル−6−フェニル−4H−チエノ[2,3−f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル)カルバメート(実施例13)、
フェニルメチル[6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例14)、
フェニルメチル(1−エチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例15)、
フェニルメチル(1−メチル−6−フェニル−4H−[1]ベンゾフロ[2,3−f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル)カルバメート(実施例18)、
フェニルメチル[6−(4−クロロフェニル)−1−メチル−4H−[1]ベンゾフロ[2,3−f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル]カルバメート(実施例20)、
フェニルメチル{1−エチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート(実施例21)、
フェニルメチル[1−エチル−6−(4−フルオロフェニル)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例22)、
エチル[6−(4−フルオロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例23)、
フェニルメチル[6−(2−フルオロフェニル)−8−(2−フラニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例26)、
(+)−フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例27)、
(+)−エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例28)、
エチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例29)、
エチル[1−エチル−6−(4−フルオロフェニル)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例30)、
エチル{1−メチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート5実施例31)、
(+)−エチル1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イルカルバメート(実施例32)、
シクロヘキシル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例37)、
メチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例39)、
2,2,2−トリフルオロエチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例40)、
2−(1H−イミダゾール−1−イル)エチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例41)、
2−(4−メチル−1,3−チアゾール−5−イル)エチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例42)、
2−チエニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例43)、
2−フラニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例44)、
[4−(メチルオキシ)フェニル]メチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例45)、
2−ピリジニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例46)、
(4−クロロフェニル)メチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例47)、
シクロペンチルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例48)、
シクロペンチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例49)、
2−シクロプロピルエチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例50)、および
シクロブチルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例52)、またはそれらの塩。
【0038】
別の実施形態において、式(I)の化合物は以下から選択される:
エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例4)、
フェニルメチル[1−メチル−8−(メチルオキシ)−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例6)、
フェニルメチル{1−メチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート(実施例7)、
フェニルメチル[1−メチル−6−(4−メチルフェニル)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例8)、
フェニルメチル{1−メチル−6−[3−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート(実施例9)、
フェニルメチル(9−メチル−4−フェニル−6H−チエノ[3,2−f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−6−イル)カルバメート(実施例12)、
フェニルメチル(8−ヨード−1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例24)、
(+)−フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例27)、
(+)−エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例28)、
エチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例29)、
エチル{1−メチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート(実施例31)、
(+)−エチル1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イルカルバメート(実施例32)、
(4−フルオロフェニル)メチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例34)、
(1S)−1−フェニルエチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例36)、
6−(メチルオキシ)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−1H−インドール−2−カルボキシアミド(実施例53)、
N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−4−(フェニルカルボニル)ベンズアミド(実施例54)、
(2E)−3−[4−(メチルオキシ)フェニル]−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド(実施例56)、
(2E)−3−(4−クロロフェニル)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド(実施例57)、
(2E)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−3−(2−チエニル)−2−プロペンアミド(実施例58)、
5−メチル−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−1H−インドール−2−カルボキシアミド(実施例61)、
(2E)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−3−フェニル−2−プロペンアミド(実施例64)、
(2E)−3−(4−フルオロフェニル)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド(実施例65)、
N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−N’−フェニル尿素(実施例70)、
N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−N’−(フェニルメチル)尿素(実施例71)、
N−{[4−(メチルオキシ)フェニル]メチル}−N’−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)尿素(実施例75)、
3−ブロモ−N−(1−メチル−6−フェニル−4H−ベンゾ[f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル)ベンズアミド(実施例85)、
N−(1−メチル−6−フェニル−4H−ベンゾ[f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル)−2−ナフトアミド(実施例86)、
フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例87)、
エチル4−({[(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)アミノ]カルボニル}アミノ)ベンゾエート(実施例88)、
1−メチルエチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例89)、および
4−エチル−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)ベンズアミド(実施例97)、またはそれらの塩。
【0039】
さらなる実施形態において、式(I)の化合物は以下から選択される:
(+)−フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例27)、
(+)−エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例28)、
(+)−エチル1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イルカルバメート(実施例32)、
6−(メチルオキシ)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−1H−インドール−2−カルボキシアミド(実施例53)、
(2E)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−3−フェニル−2−プロペンアミド(実施例64)、および
(2E)−3−(4−フルオロフェニル)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド(実施例65)、またはそれらの塩。
【0040】
本発明が、遊離塩基としての、およびその塩としての、例えばその薬学上許容可能な塩としての式(I)の化合物を包含することは理解されるであろう。一実施形態では、本発明は、本発明は、式(I)の化合物およびその薬学上許容可能な塩に関する。
【0041】
式(I)の化合物の塩は薬剤において使用される可能性が高いため、式(I)の化合物の塩は、望ましくは薬学上許容可能なものである。好適な薬学上許容可能な塩としては、酸付加塩または塩基付加塩を挙げることができる。本明細書で使用する、用語「薬学上許容可能な塩」とは、受容者への投与時に(直接または間接的に)提供できる、式(I)の化合物の任意の薬学上許容可能な塩または溶媒和物を意味する。好適な塩に関する総説として、Bergeら、J. Pharm. Sci., 66:1−19, (1977)を参照のこと。典型的には、薬学上許容可能な塩は、所望の酸または塩基を適宜使用することにより、容易に調製され得る。得られる塩は、溶液から沈殿され、ろ過によって集められてもよく、または溶媒のエバポレートによって回収されてもよい。
【0042】
薬学上許容可能な塩基付加塩は、好適な溶媒の中で行われてもよい、式(I)の化合物と、好適な無機または有機の塩基、(例えばトリエチルアミン、エタノールアミン、トリエタノールアミン、コリン、アルギニン、リジンまたはヒスチジン)との反応で塩基付加塩を得て、この塩基付加塩を、例えば結晶化およびろ過によって通常単離することによって形成され得る。薬学上許容可能な塩基塩としては、アンモニウム塩、ナトリウムおよびカリウムの塩などのアルカリ金属塩、カルシウムおよびマグネシウムの塩などのアルカリ土類金属塩、ならびにイソプロピルアミン、ジエチルアミン、エタノールアミン、トリメチルアミン、ジシクロヘキシルアミンおよびN−メチル−D−グルカミンなどの第一級、第二級および第三級アミンの塩を含めた有機塩基との塩が挙げられる。
【0043】
薬学上許容可能な酸付加塩は、有機溶媒などの好適な溶媒の中で行われてもよい、式(I)の化合物と、好適な無機または有機の酸(例えば、臭化水素酸、塩化水素酸、硫酸、硝酸、リン酸、コハク酸、マレイン酸、酢酸、プロピオン酸、フマル酸、クエン酸、酒石酸、乳酸、安息香酸、サリチル酸、グルタミン酸、アスパラギン酸、p−トルエンスルホン酸、ベンゼンスルホン酸、メタンスルホン酸、エタンスルホン酸、2−ナフタレンスルホン酸などのナフタレンスルホン酸、またはヘキサン酸)との反応で塩を得て、この塩を、例えば結晶化およびろ過によって通常単離することによって形成され得る。式(I)の化合物の薬学上許容可能な酸付加塩は、例えば、臭化水素酸塩、塩化水素酸塩、硫酸塩、硝酸塩、リン酸塩、コハク酸塩、マレイン酸塩、酢酸塩、プロピオン酸塩、フマル酸塩、クエン酸塩、酒石酸塩、乳酸塩、安息香酸塩、サリチル酸塩、グルタミン酸塩、アスパラギン酸塩、p−トルエンスルホン酸塩、ベンゼンスルホン酸塩、メタンスルホン酸塩、エタンスルホン酸塩、ナフタレンスルホン酸塩(例えば2−ナフタレンスルホン酸塩)またはヘキサン酸塩を含み得、またはこれらであり得る。
【0044】
他の薬学上許容可能でない塩、例えばギ酸塩、シュウ酸塩またはトリフルオロ酢酸塩は、例えば式(I)の化合物の単離において使用され得るため、本発明の範囲内に含まれる。
【0045】
本発明は、その範囲内に、式(I)の化合物の塩のすべての可能な化学量論形態および非化学量論形態を含む。
【0046】
多くの有機化合物が、その多くの有機化合物の反応が行われるかまたは多くの有機化合物が沈殿もしくは結晶化する際に使用される溶媒と複合体を形成し得ることは理解されるであろう。これらの複合体は「溶媒和物」として知られる。例えば、水との複合体は「水和物」として知られる。高沸点を有しかつ/または水素結合を形成することができる溶媒、例えば水、キシレン、N−メチルピロリジノン、メタノールおよびエタノールは、溶媒和物を形成するために使用され得る。溶媒和物の同定のための方法としては、NMRおよび微量分析が挙げられるが、これらに限定されない。式(I)の化合物の溶媒和物は本発明の範囲内にある。
【0047】
本発明は、その範囲内に、式(I)の化合物の溶媒和物のすべての可能な化学量論形態および非化学量論形態を含む。
【0048】
本発明は、受容者への投与の際に(直接的にまたは間接的に)式(I)の化合物もしくはその薬学上許容可能な塩、またはその活性な代謝産物もしくはまたは残基を与えることができる、式(I)の化合物およびその薬学上許容可能な塩のすべてのプロドラッグを包含する。このような誘導体は、当業者にとって、過度の実験をすることなく認識できる。しかし、Burger’s Medicinal Chemistry and Drug Discovery, 5th Edition, Vol 1: Principles and Practiceの教示が参照され、この文献は、このような誘導体を教示する範囲まで、参照により本明細書に援用される。
【0049】
式(I)の化合物は、結晶性形態または非晶性形態にあり得る。さらに、式(I)の化合物の結晶性形態のうちのいくつかは、多形として存在し得、この多形は本発明の範囲内に含まれる。式(I)の化合物の多形形態は、特に限定されないが、X線粉末回折(XRPD)パターン、赤外(IR)スペクトル、ラマンスペクトル、示差走査熱量測定(DSC)、熱重量分析(TGA)および固体状態核磁気共鳴(SSNMR)などのいくつかの従来の分析技法を使用して特徴づけおよび区別され得る。
【0050】
本明細書に記載される化合物はキラル原子を含有し、その結果、光学異性体、例えば鏡像異性体またはジアステレオ異性体が形成され得る。従って、本発明は、実質的に他の異性体を含まないもの(すなわち純粋である)として単離された個々の異性体としてであろうと、または混合物(すなわちラセミ化合物およびラセミ混合物)としてであろうと、式(I)の化合物のすべての異性体を包含する。
【0051】
同様に、本発明は、式(I)の化合物の配座異性体および上記化合物のいずれの幾何(cisおよび/またはtrans)異性体にも及ぶ。
【0052】
実質的に他の異性体を含まないもの(すなわち純粋である)として単離された個々の異性体は、他の異性体が10%未満、特に約1%未満、例えば約0.1%未満存在するように単離され得る。
【0053】
異性体の分離は、当業者に公知の従来の技法によって、例えば分別晶出、クロマトグラフィーまたはHPLCによって達成され得る。
【0054】
特定の式(I)の化合物は、いくつかの互変異性体のうちの1つとして存在し得る。本発明は、個々の互変異性体としてであろうと、またはこれらの混合物としてであろうと、式(I)の化合物のすべての互変異性体を包含することは理解されるであろう。
【0055】
式(I)の化合物およびその塩の溶媒和物、異性体および多形形態が本発明の範囲内に包含されることは、上記の記載から理解されるであろう。
【0056】
式(I)の化合物またはその薬学上許容可能な塩は、標準的な化学を含めた様々な方法によって製造され得る。特段の記載がない限り、これまでに定義された変更要素のいずれも、これまでに定義された意味を持ち続ける。例示的な一般的な合成方法が以下に示され、次いで、具体的な式(I)の化合物およびその薬学上許容可能な塩が、作業実施例で調製される。これらのプロセスは、本発明のさらなる態様を形成する。
【0057】
本明細書全体を通して、一般式は、ローマ数字(I)、(II)、(III)、(IV)などによって指定される。これらの一般式のサブセットは、(Ia)、(Ib)、(Ic)など....(IVa)、(IVb)、(IVc)などと定義される。
【0058】
式(Ia)の化合物、すなわち、R2がOR2bであり、XはOである一般式(I)の化合物は、式(III)の化合物と、ヒドラジン一水和物とを反応させ、続いて、得られたヒドラゾン(II)とR1COClまたはR1C(OR)3とを反応させることによって反応スキーム1に従って調製され得る。好ましくは、ヒドラゾン(II)はさらに精製せずに使用され、室温にてR1COClと反応する。
【0059】
スキーム1
【化4】

【0060】
代替として式(Ia)の化合物、すなわち、R2がOR2aであり、XがOである式(I)の化合物は、式(IV)の化合物と、a)式ClCOOR2bの化合物、b)式(X)の化合物、c)1,1−カルボニルジイミダゾールと式R2bOHの化合物との組み合わせ、またはd)式R2bOH、トリホスゲンおよびピリジンの化合物、のいずれかとを反応させることによって、反応スキーム2に従って調製できる。好ましい条件は、室温にてトリエチルアミンの存在下で式(IV)の化合物と、ClCOOR2bとを反応させることを含む。式(X)の化合物は、ジクロロメタンおよびピリジン中でクロロギ酸4−ニトロフェニルと、R2bOHとを反応させることによって調製できる。
【0061】
スキーム2
【化5】

【0062】
式(Ib)の化合物、すなわち、R2がR2aであり、XがOである式(I)の化合物は、反応スキーム3に従って調製できる。好ましい反応条件は、EDCおよびHOBtの存在下で式(IV)の化合物と、カルボン酸R2aCO2Hとを反応させることを含む。代替として式(Ib)の化合物は、トリエチルアミンの存在下で式(IV)の化合物と、酸塩化物R2aCOClとを反応させることによって調製できる。
【0063】
スキーム3
【化6】

【0064】
式(Ic)の化合物、すなわち、R2が−NHR2cであり、XがOである式(I)の化合物は、式(IV)の化合物と、R2cNCOとを反応させることによって反応スキーム4に従って調製できる。
【0065】
スキーム4
【化7】

【0066】
式(Id)の化合物、すなわち、R2が−NHR2cであり、XがSである式(I)の化合物は、式(IV)の化合物と、R2cNCSとを反応させることによって反応スキーム5に従って調製できる。
【0067】
スキーム5
【化8】

【0068】
式(IV)の化合物は、水素雰囲気下、またはシクロヘキサジエンの存在下のいずれかで、式(Ie)の化合物、すなわち、R2がベンジルオキシであり、XがOである式(I)の化合物と、パラジウム活性炭とを反応させることによって反応スキーム6に従って調製できる。
【0069】
スキーム6
【化9】

【0070】
式(IV)の化合物はまた、還流ジクロロメタン中で式(If)の化合物、すなわち、R2がtert−ブトキシであり、XがOである式(I)の化合物と、トリフルオロ酢酸とを反応させることによって、反応スキーム7に従って調製できる。
【0071】
スキーム7
【化10】

【0072】
式(III)の化合物は、ローソン試薬またはP4S10で処理することによって式(V)の化合物から反応スキーム8に従って調製できる。好ましい反応条件は、還流トルエン中で中間体(V)と、ローソン試薬とを反応させることを含む。
【0073】
スキーム8
【化11】

【0074】
代替として式(V)の化合物は、トリエチルアミンの存在下で式(VI)の化合物と、式ClCOOR2bの化合物または式O(COOR2b)2の化合物とを反応させることによって反応スキーム9に従って調製できる。
【0075】
スキーム9
【化12】

【0076】
式(VI)の化合物は、80℃にて、酢酸中の臭化水素で処理することによって、式(Va)の化合物、すなわち、R2がベンジルオキシである式(V)の化合物から反応スキーム10に従って調製できる。
【0077】
スキーム10
【化13】

【0078】
式(V)の化合物は、室温にて、酢酸中の酢酸アンモニウムで処理することによって、式(VII)の化合物から反応スキーム11に従って調製できる。
【0079】
スキーム11
【化14】

【0080】
式(VII)の化合物は、室温にて、アンモニアのメタノール溶液で処理することによって、式(VIII)の化合物から反応スキーム12に従って調製できる。
【0081】
スキーム12
【化15】

【0082】
式(VIII)の化合物は、EDCおよびHOBt、または塩化オキサリルでの処理、およびその後、室温での式(X)の化合物とのカップリング反応により中間体(IX)から反応スキーム13に従って調製できる。
【0083】
スキーム13
【化16】

【0084】
式(IX)の化合物は、J.Org.Chem.1990,2206に記載される手順に従って調製できる。
【0085】
上記のプロセスに記載される化合物の1つ以上の官能基を保護することが好都合であり得ることは、当業者によって理解されるであろう。保護基およびそれら保護基の除去のための手段の例は、T.W.Greene「Protective Groups in Organic Synthesis」(4th edition,J.Wiley and Sons,2006)に見出され得る。好適なアミン保護基としては、アシル(例えばアセチル、カルバメート(例えば2’,2’,2’−トリクロロエトキシカルボニル、ベンジルオキシカルボニルまたはt−ブトキシカルボニル)およびアリールアルキル(例えばベンジル)が挙げられ、これらの基は、適宜、加水分解(例えば、ジオキサン中の塩化水素酸もしくはジクロロメタン中のトリフルオロ酢酸などの酸を使用する)によって、または還元的に(例えばベンジルもしくはベンジルオキシカルボニル基の水素化分解または酢酸中で亜鉛を使用する2’,2’,2’−トリクロロエトキシカルボニル基の還元的除去)除去され得る。他の好適なアミン保護基としては、塩基触媒による加水分解によって除去され得るトリフルオロアセチル(−COCF3)が挙げられる。
【0086】
上記の経路のいずれにおいても、種々の基および部分が分子へと導入される合成工程の正確な順序は変わり得ることは理解されるであろう。このプロセスの1つの段階で導入される基または部分が、その後の変換および反応によって影響を受けないことを確実にすること、およびそれに応じて合成工程の順序を選択することは、当業者の技能の範囲内であろう。
【0087】
上記の特定の中間体化合物は、新規であると考えられ、従って本発明のなおさらなる態様を形成する。
【0088】
式(I)の化合物およびその塩はブロモドメイン阻害剤であり、従って、ブロモドメイン阻害剤が適応される疾患または病態の治療において潜在的な有用性を有すると考えられる。
【0089】
従って本発明は、治療に使用するための式(I)の化合物またはその薬学上許容可能な塩を提供する。式(I)の化合物またはその薬学上許容可能な塩は、ブロモドメイン阻害剤が適応される疾患または病態の治療に使用するためであり得る。
【0090】
一実施形態において、ブロモドメイン阻害剤が適応されるいずれかの疾患または病態の治療に使用するための式(I)の化合物またはその薬学上許容可能な塩を提供する。別の実施形態において、慢性自己免疫および/または炎症病態の治療に使用するための化合物またはその薬学上許容可能な塩を提供する。さらなる実施形態において、正中線癌(midline carcinoma)などの癌の治療に使用するための化合物またはその薬学上許容可能な塩を提供する。
【0091】
一実施形態において、ブロモドメイン阻害剤が適応される疾患または病態を治療するための薬剤の製造における式(I)の化合物またはその薬学上許容可能な塩の使用を提供する。別の実施形態において、慢性自己免疫および/または炎症病態を治療するための薬剤の製造における式(I)の化合物またはその薬学上許容可能な塩の使用を提供する。さらなる実施形態において、正中線癌などの癌を治療するための薬剤の製造における式(I)の化合物またはその薬学上許容可能な塩の使用を提供する。
【0092】
一実施形態において、治療有効量の式(I)の化合物またはその薬学上許容可能な塩を投与することを含む、それを必要とする被験体においてブロモドメイン阻害剤が適応される疾患または病態を治療する方法を提供する。別の実施形態において、治療有効量の式(I)の化合物またはその薬学上許容可能な塩を投与することを含む、それを必要とする被験体において慢性自己免疫および/または炎症病態を治療するための方法を提供する。さらなる実施形態において、治療有効量の式(I)の化合物またはその薬学上許容可能な塩を、それを必要とする被験体において正中線癌などの癌を治療するための方法を提供する。
【0093】
一実施形態において、それを必要とする被験体は哺乳動物、好ましくはヒトである。
【0094】
本発明で使用する用語「有効量」は、例えば研究者または臨床医によって求められている組織、系、動物またはヒトの生物学的応答または医学的応答を引き出すであろう、薬物または医薬品の量を意味する。さらに、用語「治療有効量」は、そのような量を投与されたことがない対応する被験体と比較して、疾患、障害、もしくは副作用の改善された治療、治癒、予防、もしくは寛解、または疾患もしくは障害の前進の速度の低下を生じるいずれかの量を意味する。また、この用語は、その範囲の内に、正常な生理学的機能を亢進するために有効な量を包含する。
【0095】
ブロモドメイン阻害剤は、全身性炎症または組織の炎症、感染または低酸素症に対する炎症反応、細胞の活性化および増殖、脂質代謝、線維症に関連する様々な疾患または病態の治療、ならびにウイルス感染症の予防および治療において有用であると考えられる。
【0096】
ブロモドメイン阻害剤は、慢性関節リウマチ、変形性関節症、急性痛風、乾癬、全身性紅斑性狼瘡、多発性硬化症、炎症性腸疾患(クローン病および潰瘍性大腸炎)、喘息、慢性閉塞性気道疾患、間質性肺炎、心筋炎、心膜炎、筋炎、湿疹、皮膚炎、脱毛症、白斑、水疱性皮膚症、腎炎、血管炎、アテローム性動脈硬化症、アルツハイマー病、うつ病、網膜炎、ブドウ膜炎、強膜炎、肝炎、膵炎、原発性胆汁性肝硬変、硬化性胆管炎、アジソン病、下垂体炎、甲状腺炎、I型糖尿病および移植された臓器の急性拒絶反応などの実に様々な慢性の自己免疫性のおよび炎症性の病態の治療において有用であり得る。
【0097】
ブロモドメイン阻害剤は、急性痛風、巨細胞性動脈炎、ループス腎炎などの腎炎、糸球体腎炎などの臓器障害を伴う血管炎、巨細胞性動脈炎などの血管炎、ウェゲナー肉芽腫症、結節性多発動脈炎、ベーチェット病、川崎病、高安動脈炎、臓器障害を伴う血管炎および移植された臓器の急性拒絶反応などの実に様々な急性の炎症性の病態の治療において有用であり得る。
【0098】
ブロモドメイン阻害剤は、細菌、ウイルス、真菌、寄生生物またはそれらの毒素による感染に対する炎症反応を伴う疾患または病態、例えば、敗血症、敗血症症候群、敗血症性ショック、内毒血症、全身性炎症反応症候群(SIRS)、多臓器不全症候群、毒素性ショック症候群、急性肺傷害、ARDS(成人呼吸促迫症候群)、急性腎不全、劇症肝炎、熱傷、急性膵炎、手術後症候群、サルコイドーシス、ヘルクスハイマー反応、脳炎、脊髄炎、髄膜炎、マラリア、ならびにインフルエンザ、帯状疱疹、単純ヘルペスおよびコロナウイルスなどのウイルス感染症と関連するSIRSの予防または治療において有用であり得る。
【0099】
ブロモドメイン阻害剤は、心筋梗塞、脳血管虚血(発作)、急性冠症候群、腎臓再灌流傷害、臓器移植、冠動脈バイパス移植、心肺バイパス術、肺、腎臓、肝臓、胃腸内または肢末梢部の塞栓症などの虚血再灌流傷害と関連する病態の予防または治療において有用であり得る。
【0100】
ブロモドメイン阻害剤は、高コレステロール血症、アテローム性動脈硬化症およびアルツハイマー病などのAPO−A1の調節を介する脂質代謝の障害の治療において有用であり得る。
【0101】
ブロモドメイン阻害剤は、特発性肺線維症、腎臓の線維化、術後狭窄、ケロイド生成、強皮症および心臓繊維化などの繊維性の病態の治療において有用であり得る。
【0102】
ブロモドメイン阻害剤は、ヘルペスウイルス、ヒトパピローマウイルス、アデノウイルスおよびポックスウイルスおよび他のDNAウイルスなどのウイルス感染症の予防および治療において有用であり得る。
【0103】
ブロモドメイン阻害剤は、血液癌、上皮癌(肺癌を含む)、乳癌および結腸癌、上皮性悪性腫瘍(midline carcinoma)、間葉系腫瘍、肝腫瘍、腎腫瘍および神経腫瘍などの癌の治療において有用であり得る。
【0104】
一実施形態では、ブロモドメイン阻害剤が適応される疾患または病態は、全身性炎症反応症候群に関連する疾患、例えば敗血症、熱傷、膵炎、重症外傷、出血および虚血から選択される。この実施形態では、ブロモドメイン阻害剤は、SIRS、ショック発症、多臓器不全症候群(これは、急性肺傷害、ARDS、急性の腎臓、肝臓、心臓および胃腸内の傷害の発症を含む)の発生率ならびに死亡率を低下させるために、診断の時点で投与されるであろう。別の実施形態では、このブロモドメイン阻害剤は、高いリスクの敗血症、出血、広範囲の組織の損傷、SIRSまたはMODS(多臓器不全症候群)に関連する手術または他の術式に先だって投与され得る。特定の実施形態では、ブロモドメイン阻害剤が適応される疾患または病態は、敗血症、敗血症症候群、敗血症性ショックおよび内毒血症である。別の実施形態では、ブロモドメイン阻害剤は、急性膵炎または慢性膵炎の治療に適応される。別の実施形態では、ブロモドメイン阻害剤は熱傷の治療に適応される。
【0105】
一実施形態では、ブロモドメイン阻害剤が適応される疾患または病態は、単純ヘルペスの感染および再賦活、口唇ヘルペス、帯状疱疹(herpes zoster)の感染および再賦活、水痘、帯状疱疹(shingles)、ヒトパピローマウイルス、頸部新生物、アデノウイルス感染(急性呼吸器疾患を含む)、牛痘および天然痘およびアフリカブタ熱ウイルスなどのポックスウイルス感染から選択される。1つの特定の実施形態では、ブロモドメイン阻害剤は、皮膚または子宮頸部上皮のヒトパピローマウイルス感染の治療に適応される。
【0106】
用語「ブロモドメイン阻害剤が適応される疾患または病態」は、上記の病状のいずれかまたはすべてを包含することが意図されている。
【0107】
一実施形態では、ブロモドメインを式(I)の化合物またはその薬学上許容可能な塩と接触する工程を含む、ブロモドメインを阻害するための方法が提供される。
【0108】
療法に使用するため、式(I)の化合物およびその薬学上許容可能な塩はそのままの化学物質として投与され得ることが可能であるが、一方で、活性成分を医薬組成物として提供することが一般的である。
【0109】
従って、さらなる態様では、本発明は、式(I)の化合物または薬学上許容可能な塩と、1つ以上の薬学上許容可能な担体、希釈剤および/または賦形剤とを含む医薬組成物を提供する。式(I)の化合物およびその薬学上許容可能な塩は上記の通りである。担体(1つまたは複数)、希釈剤(1つまたは複数)または賦形剤(1つまたは複数)は、その組成物の他の成分と適合性でありかつ組成物のレシピエントにとって有害ではないという意味で許容できるものである必要がある。本発明の別の態様によれば、式(I)の化合物、またはその薬学上許容可能な塩を、1つ以上の薬学上許容可能な担体、希釈剤または賦形剤と混合する工程を含む、医薬組成物の製造方法も提供される。この医薬組成物は、本明細書に記載される病態のうちのいずれのものの治療において使用され得る。
【0110】
式(I)の化合物は医薬組成物に使用するために意図されるため、それらは、各々、実質的に純粋な形態、例えば少なくとも60%純粋、より好適には少なくとも75%純粋、好ましくは少なくとも85%純粋、とりわけ少なくとも98%純粋(重量基準に対する重量%)で与えられることが好ましいことはすぐに理解されるであろう。
【0111】
医薬組成物は、単位用量あたり所定の量の活性成分を含む単位用量形態で提示され得る。好ましい単位投薬量組成物は、1日用量もしくは分割日量、またはその適切な一部分、の活性成分を含む組成物である。従ってこのような単位用量は、1日1回よりも多く投与され得る。好ましい単位投薬量組成物は、本明細書中ですでに記載したように、1日用量もしくは(1日1回よりも多い投与のための)分割日量、またはその適切な一部分、の活性成分を含む組成物である。
【0112】
医薬組成物は、いずれかの適切な経路による、例えば経口(口腔内または舌下を含む)、経直腸、吸入、鼻腔内、局所(口腔内、舌下または経皮を含む)、膣内または非経口(皮下、筋肉内、静脈内または皮内を含む)経路による投与のために適合し得る。このような組成物は、薬学の技術分野で公知のいずれかの方法によって、例えばこの活性成分を担体(1つまたは複数)または賦形剤(1つまたは複数)と合わせることによって調製され得る。
【0113】
一実施形態では、経口投与に適合される式(I)の化合物またはその薬学上許容可能な塩を含む医薬組成物を提供する。
【0114】
一実施形態では、その医薬組成物は非経口投与、特に静脈内投与に適合される。
【0115】
非経口投与に適合させた医薬組成物としては、抗酸化剤、バッファー、静菌薬、および組成物を意図されたレシピエントの血液と等張性であるようにする溶質を含有し得る水性および非水性の滅菌注射液、ならびに懸濁剤および増粘剤を含み得る水性および非水性の滅菌懸濁剤が挙げられる。この組成物は、単位用量容器または複数用量容器、例えば密封されたアンプルおよびバイアルの中で提示され得、使用直前に、注入のために、滅菌した液体担体、例えば水の添加だけを必要とするフリーズドライの(凍結乾燥された)状態で保存され得る。すぐに使用できる注射液および懸濁剤は、滅菌された粉末、顆粒および錠剤から調製され得る。
【0116】
経口投与に適合させた医薬組成物は、カプセルもしくは錠剤、粉末もしくは顆粒、水性もしくは非水性液体中の液剤もしくは懸濁剤、食用フォームまたはホイップ、または水中油型乳濁液もしくは油中水型乳濁液などの個別単位として提示され得る。
【0117】
例えば、錠剤またはカプセル剤の形態での経口投与のために、活性薬物成分は、エタノール、グリセロール、水などの、経口用の、無毒な薬学上許容可能な不活性な担体と組み合わされ得る。錠剤またはカプセルの中へと組み込むのに好適な粉末は、当該化合物を(例えば微粉化によって)好適な微細サイズへと細かく砕き、例えば、デンプンまたはマンニトールなどの食用炭水化物などの、同様に調製した薬学上の担体と混合することにより調製される。着香剤、防腐剤、分散剤および着色剤も存在し得る。
【0118】
カプセルは、粉末混合物を上記のように調製し、形成されたゼラチンシースに充填することにより作製される。コロイドシリカ、タルク、ステアリン酸マグネシウム、ステアリン酸カルシウムまたは固体ポリエチレングリコールなどの滑剤および潤滑剤が、充填操作の前に、この粉末混合物に添加され得る。カプセル剤が服用されるときの薬剤の利用能を改善するために、寒天、炭酸カルシウムまたは炭酸ナトリウムなどの崩壊剤または溶解補助剤も、加えられ得る。
【0119】
さらに、所望される場合または必要な場合、好適な結合剤、滑剤、潤滑剤、甘味剤、香料、崩壊剤および着色剤も当該混合物の中へと組み込まれ得る。好適な結合剤としては、デンプン、ゼラチン、グルコースまたはβ−ラクトースなどの天然の糖、トウモロコシ甘味料、アラビアゴム、トラガントまたはアルギン酸ナトリウムなどの天然および合成のゴム、カルボキシメチルセルロース、ポリエチレングリコール、ワックスなどが挙げられる。これらの剤形の中で使用される潤滑剤としては、オレイン酸ナトリウム、ステアリン酸ナトリウム、ステアリン酸マグネシウム、安息香酸ナトリウム、酢酸ナトリウム、塩化ナトリウムなどが挙げられる。崩壊剤としては、デンプン、メチルセルロース、寒天、ベントナイト、キサンタンガムなどが挙げられるが、これらに限定されない。錠剤は、例えば、粉末混合物を調製し、顆粒にするかまたは小塊にし、潤滑剤および崩壊剤を添加し、そして錠剤へと押し固めることにより製剤化される。粉末混合物は、当該化合物、好適には細かく砕いた当該化合物を上記のとおりの希釈剤またはベースと、そして必要に応じてカルボキシメチルセルロース、アルギン酸塩もしくはアルギン酸エステル、ゼラチン、もしくはポリビニルピロリドンなどの結合剤、パラフィンなどの溶解遅延剤、第四級塩などの再吸収促進剤、および/またはベントナイト、カオリンもしくはリン酸二カルシウムなどの吸収剤と混合することにより調製される。この粉末混合物は、シロップ、デンプンペースト、アラビアゴム粘液、またはセルロース誘導体もしくは高分子材料の溶液などの結合剤を用いて湿らせ、ふるいに押し通すことにより顆粒化され得る。顆粒化に代わるものとして、粉末混合物は錠剤機に通され得、その結果物は不完全に形成された小塊であり、これが顆粒へと破壊される。この顆粒は、錠剤形成押型への付着を防止するために、ステアリン酸、ステアリン酸塩、タルクまたは鉱油の添加によって潤滑され得る。この潤滑された混合物は、次いで、錠剤へと圧縮される。また、式(I)の化合物およびその薬学上許容可能な塩は、自由流動性の不活性な担体と組み合わされて、顆粒化または小塊化の工程を経ることなく直接錠剤へと圧縮され得る。セラックの封止被膜、糖または高分子材料のコーティング、およびワックスの艶出しコーティングからなる透明または不透明な保護コーティングが設けられ得る。異なる単位投薬量を区別するために、色素がこれらのコーティングに添加され得る。
【0120】
液剤、シロップおよびエリキシル剤などの経口用液体は、与えられた量が所定の量の当該化合物を含むように、投薬単位形態の中に調製され得る。シロップは、当該化合物を好適に風味付けされた水性溶液に溶解させることにより調製され得るのに対し、エリキシル剤は、無毒なアルコール性のビヒクルの使用によって調製される。懸濁剤は、当該化合物を無毒なビヒクルに分散させることにより製剤化され得る。エトキシル化イソステアリルアルコールおよびポリオキシエチレンソルビトールエーテルなどの可溶化剤および乳化剤、防腐剤、ペパーミント油などの香料添加物、または天然甘味料もしくはサッカリンもしくは他の人工甘味料なども、添加され得る。
【0121】
適宜、経口投与のための投薬量単位組成物はマイクロカプセル化され得る。この製剤は、例えば、微粒子物質をポリマー、ワックスなどでコーティングするかまたは微粒子物質をポリマー、ワックスなどの中に埋め込むことにより、放出を長期化または持続させるためにも調製され得る。
【0122】
式(I)の化合物およびその薬学上許容可能な塩は、小型単層小胞体(small unilamellar vesicle)、大型単層小胞体(large unilamellar vesicle)および多層小胞体(multilamellar vesicle)などのリポソーム送達システムの形態でも投与され得る。リポソームは、コレステロール、ステアリルアミンまたはホスファチジルコリンなどの様々なリン脂質から形成され得る。
【0123】
局所投与に適合させた医薬組成物は、軟膏剤、クリーム、懸濁剤、ローション剤、粉末、液剤、ペースト、ゲル、スプレー、エアロゾルまたはオイルとして製剤化され得る。
【0124】
目または他の外部組織、例えば口および皮膚の治療のために、当該組成物は、好ましくは、局所用の軟膏剤またはクリームとして適用される。軟膏剤の中で製剤化されるとき、当該活性成分は、パラフィン系軟膏基剤または水混和性軟膏基剤のいずれかとともに用いられ得る。あるいは、その活性成分は、水中油型クリーム基剤または油中水型基剤とともにクリームの中で製剤化され得る。
【0125】
目への局所投与に適合させた医薬組成物としては、活性成分が好適な担体、とりわけ水性溶媒に溶解または懸濁されている点眼薬が挙げられる。
【0126】
鼻内投与または吸入投与のための剤形は、エアロゾル、液剤、懸濁剤、ゲルまたは乾燥粉末として製剤化されることが便利であり得る。
【0127】
吸入投与に好適かつ/または吸入投与に適合させた組成物について、式(I)の化合物またはその薬学上許容可能な塩は、例えば微粉化によって得られる粒子サイズを小さくした形態にあることが好ましい。サイズを小さくした(例えば、微粉化した)化合物または塩の好ましい粒径は、約0.5−約10ミクロン(例えば、レーザー回折を使用して測定される)のD50値によって規定される。
【0128】
例えば吸入投与のためのエアロゾル製剤は、薬学上許容可能な水性または非水性の溶媒の中の活性物質の溶液または微細懸濁液を含み得る。エアロゾル製剤は、噴霧装置もしくは吸入器と共に使用するためのカートリッジまたは詰め替え容器の形態をとり得る密閉容器中の滅菌された形態で単回用量または複数用量の量で提示され得る。あるいは、この密閉容器は、容器の内容物を使い尽くすと処分することが意図されている、計量弁(定量吸入器)が内蔵された単回投与の鼻吸入器またはエアロゾルディスペンサーなどの単一の分注デバイスであり得る。
【0129】
剤形がエアロゾルディスペンサーを含む場合、その剤形は、好ましくは、圧縮空気、二酸化炭素またはヒドロフルオロカーボン(HFC)などの有機噴霧剤などの加圧下の好適な噴霧剤を含む。好適なHFC噴霧剤としては、1,1,1,2,3,3,3−ヘプタフルオロプロパンおよび1,1,1,2−テトラフルオロエタンが挙げられる。このエアロゾル剤形はポンプ噴霧器の形態を取り得る。加圧されたエアロゾルは、活性化合物の溶液または懸濁液を含有し得る。これは、懸濁液製剤の分散特性および均質性を改善するために、さらなる賦形剤、例えば共溶媒および/または界面活性剤の組み込みを必要とし得る。液剤製剤は、エタノールなどの共溶媒の添加も必要とし得る。
【0130】
吸入投与に好適かつ/または吸入投与に適合させた医薬組成物について、医薬組成物は、乾燥粉末吸入用組成物であり得る。このような組成物は、ラクトース、グルコース、トレハロース、マンニトールまたはデンプンなどの粉末基剤と、式(I)の化合物またはその薬学上許容可能な塩(好ましくは、粒子サイズを小さくした形態、例えば微粉化した形態にある)と、必要に応じて性能調整剤(performance modifier)、例えばL−ロイシンまたは別のアミノ酸および/またはステアリン酸マグネシウムもしくはステアリン酸カルシウムなどのステアリン酸の金属塩とを含み得る。好ましくは、この乾燥粉末吸入用組成物は、ラクトース、例えばラクトース一水和物と、式(I)の化合物またはその塩との乾燥粉末混合物を含む。このような組成物は、例えば英国特許出願公開第2242134(A)号に記載されている、GlaxoSmithKlineによって販売されているDISKUS(登録商標)デバイスなどの好適なデバイスを使用することによって、患者に投与され得る。
【0131】
式(I)の化合物およびその薬学上許容可能な塩は、液体ディスペンサー、例えば、使用者が加えた力が液体ディスペンサーのポンプ機構に加えられた際に定量の液体製剤が分注されるときに通る分注用ノズルまたは分注用オリフィスを有する液体ディスペンサーからの送達のための液体製剤として製剤化され得る。このような液体ディスペンサーは、一般に、液体製剤の複数定量のタンクを具え、用量は連続的なポンプ操作によって分注することができる。分注用のノズルまたはオリフィスは、鼻腔の中への液体製剤のスプレー分注のために、使用者の鼻孔の中へと挿入するように構成され得る。上述のタイプの液体ディスペンサーは、国際公開第2005/044354(A1)号パンフレットに記載、説明されている。
【0132】
式(I)の化合物またはその薬学上許容可能な塩の治療有効量は、例えば動物の年齢および体重、治療を必要とする正確な病態、病態の重症度、製剤の性質、および投与経路などのいくつかの要因に依存するであろう。最終的には、この治療有効量は、主治医または主治獣医の判断によることになろう。上記医薬組成物では、経口投与または非経口投与のための各投薬量単位は、遊離塩基として算出して、好ましくは0.01−3000mg、より好ましくは0.5−1000mgの式(I)の化合物またはその薬学上許容可能な塩を含む。鼻内投与または吸入投与のための各投薬量単位は、遊離塩基として算出して、好ましくは0.001−50mg、より好ましくは0.01−5mgの式(I)の化合物またはその薬学上許容可能な塩を含む。
【0133】
薬学上許容可能な式(I)の化合物およびその薬学上許容可能な塩は、遊離塩基として算出して、例えば、1日あたり0.01mg−3000mgもしくは1日あたり0.5−1000mgの式(I)の化合物もしくはその薬学上許容可能な塩の経口用量もしくは非経口用量、または1日あたり0.001−50mgもしくは1日あたり0.01−5mgの式(I)の化合物もしくはその薬学上許容可能な塩の鼻内用量もしくは吸入用量の(成人の患者についての)1日用量で投与され得る。この量は、1日あたり単回投与で、またはより通常は、合計の1日用量が同じであるように1日あたりある数(2、3、4、5または6など)の分割日量で与えられ得る。その塩の有効量は、式(I)の化合物自体の有効量のある割合として決定され得る。
【0134】
式(I)の化合物およびその薬学上許容可能な塩は、単独でまたは他の治療薬と組み合わせて用いられ得る。従って、本発明に係る併用療法は、少なくとも1つの式(I)の化合物またはその薬学上許容可能な塩の投与、および少なくとも1つの他の薬学的に活性な薬剤の使用を含む。好ましくは、本発明に係る併用療法は、少なくとも1つの式(I)の化合物またはその薬学上許容可能な塩、および少なくとも1つの他の薬学的に活性な薬剤の投与を含む。式(I)の化合物(1つまたは複数)およびその薬学上許容可能な塩、ならびに上記他の薬学的に活性な薬剤(1つまたは複数)は、単一の医薬組成物の中で一緒に、または別々に投与され得、別々に投与されるとき、これは、同時にまたは任意の順序で連続的に行われ得る。式(I)の化合物(1つまたは複数)およびその薬学上許容可能な塩、ならびに上記他の薬学的に活性な薬剤(1つまたは複数)の量ならびに相対的な投与のタイミングは、所望の複合的な治療効果を成し遂げるように選択されるであろう。従って、さらなる態様では、式(I)の化合物またはその薬学上許容可能な塩と、少なくとも1つの他の薬学的に活性な薬剤とを含む組み合わせが提供される。
【0135】
従って、1つの態様では、式(I)の化合物およびその薬学上許容可能な塩、ならびに式(I)の化合物およびその薬学上許容可能な塩を含む医薬組成物は、例えば抗生物質、抗ウイルス薬、グルココルチコステロイド、ムスカリンアンタゴニストおよびβ−2アゴニストから選択される1つ以上の他の治療薬と組み合わせて使用され得、またはこのような1つ以上の他の治療薬を含み得る。
【0136】
吸入経路、静脈内経路、経口経路または鼻腔内経路によって通常投与される他の治療薬と組み合わせて式(I)の化合物またはその薬学上許容可能な塩が投与されるとき、得られる医薬組成物は同じ経路によって投与され得ることは理解されるであろう。あるいは、その組成物の個々の構成成分は、異なる経路によって投与され得る。
【0137】
本発明の一実施形態は、1つまたは2つの他の治療薬を含む組み合わせを包含する。
【0138】
適宜、上記他の治療成分(1つまたは複数)の活性および/または安定性および/または物理的特徴(溶解性など)を最適化するために、その治療成分は、例えばアルカリ金属塩もしくはアミン塩として、または酸付加塩としての塩の形態で、またはプロドラッグ、またはエステル、例えば低級アルキルエステルとして、または溶媒和物、例えば水和物として使用され得ることは、当業者には明らかであろう。適宜、この治療成分は純粋であってもよい形態で使用され得ることも明らかであろう。
【0139】
上記の組み合わせは、医薬組成物の形態で使用のために提供されることが便利であり得、従って、薬学上許容可能な希釈剤または担体と一緒に、上で定義された組み合わせを含む医薬組成物は本発明のさらなる態様を表す。
【0140】
式(I)の化合物およびその塩は、以下に記載される方法によって、または類似の方法によって調製され得る。従って、以下の中間体および実施例は、式(I)の化合物およびその塩の調製を例証する働きをするが、決して、本発明の範囲を限定すると考えられるべきではない。
【0141】
一般的な実験の詳細
全ての温度は℃で表す。
【0142】
略語
【表1】

【0143】
LC/MSは、2種類の装置で行った分析用HPLCによる分析を意味する。
【0144】
a)水の中の0.1% HCO2Hおよび0.01M 酢酸アンモニウム(溶媒A)、および水の中の95% アセトニトリルおよび0.05% HCO2H(溶媒B)を用いて、3mL/分の流量で、0〜0.7分 0%B、0.7〜4.2分 0→100%B、4.2〜5.3分 100%B、5.3〜5.5分 100→0%Bの溶出グラジエントを使用して溶出するSupelcosil LCABZ+PLUSカラム(3μm、3.3cm×4.6mm内径)にて。質量スペクトル(MS)は、エレクトロスプレー正イオン化[(ES+ve、[M+H]+および[M+NH4]+分子イオンを与える]またはエレクトロスプレー負イオン化[(ES−ve、[M−H]−分子イオンを与える]モードを使用してFisons VG Platform質量分析装置で記録した。この装置から得た分析データは、以下の形式で与えられる:[M+H]+または[M−H]−。
【0145】
b)水の中の0.01M 酢酸アンモニウム(溶媒A)および100% アセトニトリル(溶媒B)を用いて、5mL/分の流量で、0〜4分 0→100% B、4〜5分 100% Bの溶出グラジエントを使用して溶出するChromolith Performance RP 18カラム(100×4.6mm内径)にて。質量スペクトル(MS)は、大気圧化学正イオン化[AP+ve、MH+分子イオンを与える]または大気圧化学負イオン化[AP−ve、(M−H)−分子イオンを与える]モードを使用してmicromass Platform−LC質量分析装置で記録した。この装置から得た分析データは、以下の形式で与えられる:両方の質量分析源を特定するために、頭文字APCIを前に付けた[M+H]+または[M−H]−。
【0146】
c)50℃にて、水の中の0.2%v/vギ酸溶液(溶媒系A)およびアセトニトリルの中の0.15%v/vギ酸溶液(溶媒系B)で溶出するWaters Acquity UPLC BEH C18カラム(2mm×50mm内径、1.7μm充填直径)にて。以下のグラジエントを使用した。
【表2】

【0147】
UV検出系は210nm〜350nm波長からの平均シグナルであり、質量スペクトルは、交互スキャン正および負モードのエレクトロスプレーイオン化を用いて質量分析計で記録した。
【0148】
LC/HRMS:水の中の0.01M 酢酸アンモニウム(溶媒A)および100% アセトニトリル(溶媒B)を用いて、1.3mL/分の流量で、0〜0.5分 5% B、0.5〜3.75分 5→100% B、3.75〜4.5 100% B、4.5〜5 100→5% B、5〜5.5 5% Bの溶出グラジエントを使用して溶出するUptisphere−hscカラム(3μm33×3mm内径)で分析用HPLCを行った。質量スペクトル(MS)は、エレクトロスプレー正イオン化[ES+ve、MH+分子イオンを与える]またはエレクトロスプレー負イオン化[ES−ve、(M−H)−分子イオンを与える]モードを使用してmicromass LCT質量分析装置で記録した。
【0149】
Biotage(商標)クロマトグラフィーは、Dyax Corporationによって販売されている装置(Flash 40iまたはFlash 150iのいずれか)およびKP−SilTMシリカが予め充填されたカートリッジを使用して実施される精製を意味する。
【0150】
質量指向性自動分取(mass directed auto−prep HPLC)は、物質が、水の中の0.1% HCO2Hおよび95% MeCN、5% 水(0.5% HCO2H)を用いて、8mL/分の流量で、0〜1.0分 5%B、1.0〜8.0分 5→30%B、8.0〜8.9分 30%B、8.9〜9.0分 30→95%B、9.0〜9.9分 95%B、9.9〜10分 95→0%Bのグラジエント溶出条件を利用して、HPLCABZ+5μmカラム(5cm×10mm内径)で、高性能液体クロマトグラフィーによって精製される方法を意味する。Gilson 202フラクションコレクターは、注目する質量を検出した際に、VG Platform質量分析装置によって起動された。
【0151】
プロトンNMR(1H NMR)スペクトルは、室温にて、内部標準として溶媒を用いてBruker Avance 300DPXスペクトロメーターで記録し、プロトン化学シフトは個々の溶媒においてppmで表す。NMRシグナルの多重度について以下の略語を使用する:s=一重項、d=二重項、t=三重項、q=四重項、dd=双二重項(double doublet)、m=多重項。
【0152】
SPE(固相抽出)は、International Sorbent Technology Ltdによって販売されているカートリッジの使用を意味する。SCXはベンゼンスルホン酸固定相である。
【0153】
TLC(薄層クロマトグラフィー)は、シリカゲル60 F254でコーティングされたMerckによって販売されているTLCプレートの使用を意味する。
【実施例】
【0154】
実施例1:フェニルメチル[6−(4−フルオロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート
【化17】

【0155】
窒素雰囲気下で乾燥メタノール(3.3mL)中の中間体1(204mg、0.49mmol)の溶液にヒドラジン一水和物(0.36mL、7.3mmol)を加え、その溶液を室温にて2時間攪拌した。溶媒を減圧下で除去し、残渣をDCM(15mL)に溶解した。有機相を水で2回洗浄し、濃縮した。窒素雰囲気下で、乾燥THF(2mL)を加え、混合物を氷浴中で0℃に冷却した。DIPEA(0.085mL、0.51mmol)および塩化アセチル(0.036mL、5.11mmol)を加え、混合物を30分間攪拌した。溶媒を真空中で除去し、残渣を酢酸(4.1mL)に溶解し、混合物を30分間、還流にて攪拌した。溶媒を真空中で除去して、残渣を得て、それをクロロホルムに溶解し、飽和NaHCO3で洗浄した。有機相をクロロホルムで調整済みの10Si SPEカートリッジに加えた。カートリッジを1:1のEtOAc:シクロヘキサン、次いで3:1のEtOAc:シクロヘキサンで洗浄し、生成物をEtOAcで溶出した。溶媒を除去し、生成物を1,4−ジオキサンから凍結乾燥して、標題化合物を得た;LC/MS:m/z442[M+H]+,Rt=3.09分。
【0156】
式(Ia)の実施例2〜15(表1参照)を、表に示した中間体および適切な塩化アシルを用いて実施例1について記載したものと同様の方法によって調製した。
【化18】

【0157】
表1
【表3】

【0158】
実施例16:フェニルメチル[6−(2−フルオロフェニル)−8−ヨード−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート
【化19】

【0159】
乾燥DCM(3mL)中の中間体17(15mg、0.02mmol)の溶液に、ヨウ素(7.8mg、0.03mmol、1.5当量)を加え、混合物を室温にて一晩攪拌した。有機層をNa2S2O5で処理し、分離し、Na2SO4で乾燥させ、濃縮し、2滴のアセトニトリルによりジイソプロピルエーテル中で粉砕し、濾過し、フラッシュクロマトグラフィーにより精製して、橙色の固体として標題化合物(10mg)を得た:LC/MS,APCI,(M+H)+568.03,(M−H)565.98。
【0160】
実施例17:フェニルメチル[8−ブロモ−6−(2−フルオロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート
【化20】

【0161】
エタノール(10mL)中のオルト酢酸トリメチル(280μL、2.2mmol)および中間体18の溶液を、室温にて触媒量の濃硫酸(2滴)で処理し、混合物を一晩攪拌した。反応混合物を濃縮し、残渣をDCMに溶解し、水およびブラインで洗浄し、乾燥させ(Na2SO4)、濾過し、溶媒を蒸発させた。ジエチルエーテルを加え、得られた沈殿物を濾過して、標題生成物を得た;m.p.160〜170℃;HRMS C25H19BrFN5O2(M+H)+についての計算値:520.0836;実測値:520.0784。
【0162】
式(Ia)の実施例18〜25(表2参照)を、表に示した中間体および適切なオルトエステルを用いて実施例17について記載したものと同様の方法によって調製した。実施例18、19、20、21、22、23、24についてPPTSを濃硫酸の代わりに使用し、反応物を2時間還流した。
【化21】

【0163】
表2
【表4】

【0164】
実施例26:フェニルメチル[6−(2−フルオロフェニル)−8−(2−フラニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート
【化22】

【0165】
乾燥THF(10mL)中の実施例17(0.3mmole)、トリブチル(2−フラニル)スタンナン(535mg)およびPd(PPh3)4(0.1当量)の混合物を40℃にて一晩攪拌した。さらにトリブチル(2−フラニル)スタンナン(535mg)およびさらにPd(PPh3)4(0.1当量)を加え、反応混合物をさらに6時間、40℃にて攪拌した。冷却時に、塩化アンモニウム水溶液(50mL)を加え、混合物をDCM(150mL)で3回抽出した。合わせた有機層を乾燥させ(Na2SO4)、濾過し、真空中で濃縮して、残渣を得て、それを、DCM/MeOH:98/2で溶出するシリカゲルでのクロマトグラフィーにより精製した。真空中で濃縮し、EtOH/iPrOH/H2Oの混合物中で残渣を粉砕して、白色の固体として標題化合物を得た;LC/MS:APCI,m/z508.14[M+H]+,Rt=2.79分;HRMS C29H22FN5O3 (M+H)+についての計算値508.1785 実測値508.1843。
【0166】
実施例27:(+)−フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート
【化23】

【0167】
フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメートのラセミ混合物[J.Med.Chem.,(1988,31(1),176−181)に記載される手順に従って調製した]を、移動相としてヘキサン/EtOHを有する(R,R)whelk−01カラムを用いてHPLCにより分離した。サンプルを、80/20のEtOH/ヘキサン混合物中で調製した(注意:サンプルはカラムに添加する前に加熱および濾過を必要とした)。分取法に使用した系は以下の通りであった:カラム:(R,R)Whel−01 51×250mmカラム(2インチカラム);移動相:50/50、ヘキサン/EtOH;流量:45.0mL/分;UV波長:254nm。標題化合物は第1のピークとして49分で溶出した。[α]D=+44.7 c=1.0525(g/100mL)/MeOH。他の鏡像異性体は58分で現れた。
【0168】
実施例28:(+)−エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート
【化24】

【0169】
エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例4)のラセミ混合物を、移動相としてヘキサン/EtOHを有するChiralPack AD(250*4.6mm−10μm)カラムを用いてHPLCにより分離した。サンプルを60/40のEtOH/ヘキサン混合物中で調製した(注意:サンプルはカラムに添加する前に加熱および濾過を必要とした)。分取法に使用した系は以下の通りであった:ChiralPack AD(250*20mm−10μm)カラム;移動相:40/60、ヘキサン/EtOH;流量:18.0mL/分;UV波長:254nm。標題化合物は第1のピークとして16.65分に溶出した。25℃にて[α]D=+30.7 c=0.961(g/100mL)/MeOH。第2の鏡像異性体は35.40分に現れた。
【0170】
実施例29:エチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート
【化25】

【0171】
乾燥DCM(10mL)中の中間体28(140mg、0.48mmole)およびピリジン(500μL)の溶液に、1当量のクロロギ酸エチル(46μL)を加え、その溶液を室温にて一晩攪拌した。追加当量のクロロギ酸エチルを加え、反応混合物をさらに3時間、室温にて攪拌した。反応混合物を真空中で濃縮し、DCM(150mL)に溶解し、1N HCl(30mL)で2回洗浄する。有機相を炭酸水素ナトリウム溶液(30mL)およびブライン(30mL)で洗浄し、乾燥させ(Na2SO4)、濾過し、濾液を真空中で濃縮した。ジエチルエーテルを追加して、沈殿物を得て、それを濾過して、標題化合物を得た;m.p.198〜202℃;HRMS(M+H)+ C20H19N5O2についての計算値362.1539 実測値362.1548。
【0172】
式(Ig)の実施例30〜31(表3参照)を、ピリジンの代わりに触媒量のDMAPの存在下で、表に示した中間体およびトリエチルアミンを用いて実施例29について記載されるものと同様の方法によって調製した。
【化26】

【0173】
表3
【表5】

【0174】
実施例32:(+)−エチル1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イルカルバメート
【化27】

【0175】
ラセミ体の実施例29の鏡像異性体(260mg)を、15mL/分の流量で、EtOH/ヘプタン(80:20)で溶出する、1”Chiralpak ADカラムを用いて分離した。標題化合物を第1の溶出した異性体として室温にて7.5分で溶出した(125mg)。[α]D=+46.9,c=0.738(g/100mL)/MeOH。第2の鏡像異性体は室温にて13分で溶出した。
【0176】
実施例33:1−(4−フルオロフェニル)エチル1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イルカルバメート
【化28】

【0177】
乾燥MeCN(3mL)中の中間体28(150mg、0.52mmol)、中間体84(158mg、0.52mmol)およびトリエチルアミン(72μl、0.52mmol)の溶液を窒素下で4日間、75℃で加熱した。溶媒を蒸発させ、残渣を10gのSi SPEカートリッジに適用した。シクロヘキサン、次いでシクロヘキサン/DCM(3:1〜1:1〜1:3)、DCM、DCM/EtOAc(3:1〜1:1)、EtOAc/MeCN(1:1)で溶出して、標題化合物を得た;67mg、28%;LC/MS:m/z456[M+H]+,Rt 3.1分。
【0178】
式(Ih)の実施例34〜36を、示した出発物質を用いて実施例33について記載されるものと同様の方法によって調製した(表4参照)。
【化29】

【0179】
表4
【表6】

【0180】
実施例37:シクロヘキシル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート
【化30】

【0181】
THF(0.5mL)中の1,1’−カルボニルジイミダゾール(0.062g、0.038mmol、1.1当量)の溶液に、中間体28(0.010g、0.035mmol、1当量)を加え、混合物を窒素雰囲気下で16時間攪拌した。シクロヘキサノール(0.021g、0.210mmol、5.5当量)を加え、混合物を窒素雰囲気下で48時間還流した。粗物質を、Si−SPEカートリッジ(DCM/MeOH、95/5で溶出する)を用いて精製し、次いで質量指向性自動分取HPLCによってさらに精製して、白色の固体(0.006g、42%)として標題化合物を得た;LC/MS:m/z416.20[M+H]+,Rt 3.11分。
【0182】
式(Ih)の実施例38〜45を、示した中間体28および対応するアルコール(表5参照)を用いて実施例37について記載されるものと同様の方法によって調製した。実施例45についてのピリジンの代わりにDIPEAを使用し、実施例38〜44を、質量指向性自動分取HPLCよりむしろ分取HPLCを用いて精製した。
【化31】

【0183】
表5
【表7】

【0184】
実施例46:2−ピリジニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート
【化32】

【0185】
0℃(氷浴)にてTHF(1ml)中の2−ピリジニルメタノール(0.011g、0.101mmol、1.2当量)の溶液に、THF(0.5mL)中のトリホスゲン(0.010g、0.034mmol、0.4当量)およびピリジン(0.010g、0.130mmol、1.5当量)の溶液を加え、混合物を2.5時間攪拌し、次いで窒素雰囲気下で室温まで加温した。THF(2mL)中の中間体28(0.025g、0.087mmol、1当量)を滴下して加え、混合物をさらに16時間攪拌した。PS−TsCl樹脂を加え(0.140g、0.280mmol、3.2当量)、混合物を50℃にて2時間加熱し、次いで攪拌しながらさらに16時間室温まで冷却した。反応混合物を濾過し、樹脂をTHF(3×8mL)で洗浄し、粗物質を真空遠心分離により濃縮した。樹脂を分取h.p.l.c.により精製して、白色の固体として標題化合物(0.005g、14%)を得た;LC/MS:m/z425.29,Rt 2.59分。
【0186】
式(Ih)の実施例47〜52を、示した中間体28および対応するアルコール(表6参照)を用いて実施例46について記載されるものと同様の方法によって調製した。
【化33】

【0187】
表6
【表8】

【0188】
実施例53:6−(メチルオキシ)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−1H−インドール−2−カルボキシアミド
【化34】

【0189】
乾燥THF(10mL)中のHOBt(135mg、1mmol)、EDC(191mg、1mmol)、N,N−ジイソプロピルエチルアミン(140μl)および6−(メトキシ)−1H−インドール−2−カルボン酸(Aldrich)(96mg、0.6mmole)の溶液を室温にて10分間攪拌した。DCM(10mL)中の中間体28(145mg、0.5mmol)を加え、24時間攪拌した。次いでDCM(100mL)および8%炭酸水素ナトリウム溶液(1mL)を加え、有機相を乾燥させた(Na2SO4)。混合物を濾過し、真空中で濃縮して、残渣を得て、それを水で粉砕して、沈殿物を得て、それを濾過し、iPr2O(20mL)で洗浄した。アセトニトリルからの再結晶により、標題化合物を得た;m.p.160〜170℃、LC/MS:APCI m/z463.32[M+H]+,Rt=2.79分。
【0190】
式(Ii)の実施例54〜59(表7)を、示した中間体28および適切なカルボン酸を用いて実施例53について記載されるものと同様の方法によって調製した。実施例59においてN,N−ジイソプロピルエチルアミンの代わりにHOBTの存在下でトリエチルアミンを使用した。
【化35】

【0191】
表7
【表9】

【0192】
実施例60:5−(メチルオキシ)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−1−ベンゾチオフェン−2−カルボキシアミド
【化36】

【0193】
無水THF(2mL)中の5−(メチルオキシ)−1−ベンゾチオフェン−2−カルボン酸[Tetrahedron,1969,25(14),2781−2785を参照のこと](31mg、150μmol)の溶液に、PSカルボジイミドargonaut樹脂(230mg、1.31mmole/g)を加え、混合物を15分間攪拌した。中間体28(30mg、100μmol)を加え、混合物を室温にて16時間攪拌した。混合物を濾過し、真空中で濃縮し、DCM/MeOH 95/5で溶出するフラッシュクロマトグラフィーにより残渣を精製した。残渣をジイソプロピルエーテルから粉砕して、標題化合物を得た;LC/MS:APCI m/z480.13[M+H]+,Rt=2.53分;1H NMR(300MHz,CDCl3)δppm:8.17(d,1H);7.91(s,1H);7.68(m,2H);7.52−7.23(m,11H);7.04(dd,1H);6.30(d,1H);3.83(s,3H);2.63(s,3H)。
【0194】
式(Ii)の実施例61〜63(表8参照)を、示した中間体28および適切なカルボン酸を用いて実施例60について記載されるものと同様の方法によって調製した。
【化37】

【0195】
表8
【表10】

【0196】
実施例64:(2E)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−3−フェニル−2−プロペンアミド
【化38】

【0197】
HOBt(23mg、0.17mmol)、TBTU(55mg、0.17mmol)およびN,Nジイソプロピルエチルアミン(59μl、0.34mmol、2当量)を、室温にてDMF(乾燥、2.5mL)中の(2E)−3−フェニルプロパ−2−エン酸(Aldrich、27mg、0.17mmol)に加え、混合物を10分間攪拌した。中間体28(50mg、0.17mmol)を加え、混合物を5時間攪拌した。溶媒を蒸発させ、残渣を最小体積のDCMに溶解し、5gのSi SPEカートリッジを用いて精製した。多いDCMからDCM/EtOAc(3:1〜1:1〜1:3)次いでEtOAcで溶出して、白色の固体として標題化合物(60mg、83%)を得た;LC/MS:m/z420[M+H]+,Rt 3.0分。
【0198】
実施例65:(2E)−3−(4−フルオロフェニル)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド
【化39】

【0199】
標題化合物を、(2E)−3−(4−フルオロフェニル)プロパ−2−エン酸(Aldrich)から実施例64と同様の方法で調製した。LC/MS:m/z438[M+H]+,Rt 3.1分。
【0200】
実施例66:N−[2−(メチルオキシ)フェニル]−N’−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)尿素
【化40】

【0201】
DCM(2mL)中の2−メトキシフェニルイソシアネート(8.7mg、0.058mmol)の溶液に、DCM(1mL)中の1当量の中間体28を加え、反応混合物を一晩攪拌した。混合物を真空中で濃縮して、残渣を得て、それをMeOHから結晶化した後、白色の粉末として標題化合物を得た;HRMS(M+H)+ C25H23N6O2(M+H)+についての計算値439.1882;実測値439.1888。
【0202】
式(Ij)の実施例67〜78を、示した出発物質(表9参照)を用いて実施例66について記載されるものと同様の方法によって調製した。
【化41】

【0203】
表9
【表11】

【0204】

【0205】
実施例79:N−(8−ヨード−1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−N’−[4−(フェニルカルボニル)フェニル]尿素
【化42】

【0206】
THF中の中間体29(100mg、0.24mmol)、中間体88(105mg、0.29mmol、1.2当量)およびTEA(1mL)の溶液を室温にて4時間攪拌した。次いで0.5当量の中間体29を再度加え、混合物を1時間攪拌し、その後濃縮し、酢酸エチル/1N NaOHで抽出し、水およびブラインで洗浄し、Na2SO4で乾燥させ、濃縮した。粗生成物をアセトニトリルの高温溶液中で2回粉砕し、この温度で濾過して、クリーム色の固体として標題化合物を得た;LC/MS:APCI(M+H)+639.01;(M−H)=636.96;Rt 2.77。
【0207】
実施例80:N−{1−メチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}−N’−[4−フェニルカルボニル)フェニル]尿素
【化43】

【0208】
0℃にて、DCM(2mL)中の中間体27(140mg、0.44mmol、1当量)、中間体88(175mg、0.48mmol、1.1当量)の溶液に、TEA(74μL、0.53mmol、1.2当量)を加えた。反応混合物をこの温度で5時間30分攪拌し、その後、1N HClでクエンチした。有機層をNaOH 1N、ブラインで洗浄し、Na2SO4で乾燥させ、乾燥するまで蒸発させた。残渣をアセトニトリルで再結晶し、ジエチルエーテルで2回洗浄して、白色の固体として標題化合物を得た;m.p.225°C;HRMS C32H27N6O3(M+H)+について計算値543.2145 実測値543.2108;Rt=2.82分。
【0209】
実施例81:N−(4−アジドフェニル)−N’−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)チオ尿素
【化44】

【0210】
乾燥DCM(6mL)中の中間体28(50mg、0.173mmol)および4−アジドフェニルイソチオシアネート(30.5mg、0.173mmol;1当量)の溶液を、光から保護して室温にて一晩攪拌した。形成した固体を濾過して、クリーム色の固体を得た。LC/MS(M+H)+466.12;(M−H)464.10。
【0211】
式(Id)の実施例82〜84を、示した出発物質(表10参照)を用いて実施例81について記載されるものと同様の方法によって調製した。
【化45】

【0212】
表10
【表12】

【0213】
実施例85:3−ブロモ−N−(1−メチル−6−フェニル−4H−ベンゾ[f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル)ベンズアミド
【化46】

【0214】
DCM(1mL)中の1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−アミン(50mg、0.173mmol)、および3−ブロモベンゾイルクロリド(45.5mg、0.207mmol)の溶液を含有するバイアルに、TEA(0.036mL、0.259mmol)を加えた。混合物を室温にて一晩攪拌し、乾燥するまで濃縮した。Agilent HPLC(20〜100%MeCN/水+0.05%TFA)によって残渣を精製し、濃縮して、標題化合物(22.8mg、0.048mmol)を得た。LC/MS(M(79Br)+H)+472,(M(81Br)+H)+474;RT0.89分。
【0215】
実施例86:N−(1−メチル−6−フェニル−4H−ベンゾ[f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル)−2−ナフトアミド
【化47】

【0216】
DCM(1mL)中の1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−アミン(50mg、0.173mmol)、および2−ナフタレンカルボニルクロリド(39.5mg、0.207mmol)
溶液を含有するバイアルに、TEA(0.036mL、0.259mmol)を加えた。混合物を室温にて一晩攪拌し、乾燥するまで濃縮した。残渣をAgilent HPLC(20〜100%MeCN/水+0.05%TFA)により精製し、濃縮して、標題化合物(29.6mg、0.067mmol)を得た。LC/MS(M+H)+444;RT 0.90分。
【0217】
本発明のさらなる例としては以下が挙げられる:
【表13】

【0218】

【0219】

【0220】

【0221】

【0222】

【0223】
中間体
中間体1:フェニルメチル[5−(4−フルオロフェニル)−2−チオキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]カルバメート
【化48】

【0224】
ローソン試薬(252mg、0.6mmol、0.6当量)をトルエン(5mL)中の中間体37(419mg、1.0mmol)の懸濁液に加え、反応混合物を窒素下で4時間加熱還流し、次いで室温まで冷却した。得られた固体を濾過し、トルエン(40mL)および次いでEt2O(20mL)で洗浄して、クリーム色の固体として標題化合物(204mg、47%)を得た;LC/MS:m/z419[M+H]+,Rt 3.6分。
【0225】
式(III)の中間体2〜16を、示した出発物質(表11参照)から中間体1について記載されるものと同様の方法によって調製した。
【化49】

【0226】
表11
【表14】

【0227】

【0228】
中間体17:フェニルメチル[6−(2−フルオロフェニル)−1−メチル−8−(トリブチルスタンナニル)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート
【化50】

【0229】
乾燥トルエン(15mL)中の実施例17(600mg、1.15mmol)の溶液に、(Bu3Sn)2(1g、1.73mmol、1.5当量)およびPd(PPh3)4(触媒)を加えた。反応をマイクロ波(P=100W、T=200℃、10分 Pmax=10bars)下で実施し、クロマトグラフィー(DCM/MeOH 98/2)により精製した;APCI(M+H)=732.2、Rt=4.29分。
【0230】
中間体18:フェニルメチル{7−ブロモ−5−(2−フルオロフェニル)−2−[(1Z)−ヒドラジノ]−3H−1,4−ベンゾジアゼピン−3−イル}カルバメート
【化51】

【0231】
MeOH(25mL)中のフェニルメチル[7−ブロモ−5−(2−フルオロフェニル)−2−オキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]カルバメート(Neosystem;950mg、1.9mmol)の溶液にヒドラジン水和物(925μl、19mmol)を加え、混合物を室温にて2時間攪拌した。混合物を半分の体積まで濃縮し、EtOAc(2×50mL)で抽出した。抽出物を乾燥させ(硫酸ナトリウム)、減圧下で濃縮して、粗生成物として標題化合物を得て、それを精製せずに次の工程に使用した;LC/MS APCI m/z:496.23および498.23(Br同位体),Rt:2.83分。
【0232】
式(II)の中間体19〜25を、示した出発物質(表12参照)を用いて中間体18に記載されるものと同様の方法によって調製した。
【化52】

【0233】
表12
【表15】

【0234】
中間体26:1−エチル−6−(4−フルオロフェニル)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−アミン
【化53】

【0235】
室温にてMeOH(1mL)中の実施例22(100mg、0.22mmol)の懸濁液に、パラジウム炭素(100mg、10%、94μmol、0.4当量)および1,4−シクロヘキサジエン(0.11mL、1.1mmol、5当量)を加えた。反応混合物を1.5時間攪拌し、その後セライトで濾過し、濃縮して、無色の油として標題化合物(60mg、85%)を得た;Rf=0.54(DCM/MeOH:90/10);HRMS(M+H)+ C18H17FN5についての計算値322.1468 実測値322.1393。
【0236】
中間体27:1−メチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−アミン
【化54】

【0237】
室温にてMeOH(10mL)中の実施例21(0.85g、1.9mmol)の懸濁液に、パラジウム炭素(0.85g、10%、0.8mmol、0.4当量)および1,4−シクロヘキサジエン(0.95mL、9.4mmol、5当量)を加えた。反応混合物を2時間攪拌し、その後、セライトで濾過し、濃縮して、白色の固体として標題化合物(0.3g、85%)を得た;Rf=0.24(DCM/MeOH:95/5);LC/MS:m/z303[M−NH2]+,Rt 1.61分。
【0238】
中間体28:1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−アミン
【化55】

【0239】
窒素下で、メタノール(100mL)中のフェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメートの溶液[J.Med.CHem.,(1988),31(1),176−181を参照](4g、9.5mmol)に、パラジウム/炭素触媒(4g、10%)、続いて1,4シクロヘキサジエン(6mL)を加え、反応混合物を室温にて4時間攪拌した。混合物をセライトで濾過し、減圧下で濾液を蒸発させて、標題化合物を得て、それをさらに精製せずに次の工程に直接使用した。1H NMR(300MHz,CDCl3)δppm:7.6−7.2(m,9H),4.9(brs,1H),2.55(s,3H);[APCIMS]m/z273.2(MH+−NH3)。
【0240】
中間体29:8−ヨード−1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−アミン
【化56】

【0241】
DCM/TFA(8/2)中の実施例25(550mg、1.06mmol)の溶液を1時間還流した。得られた混合物をNaOH 1Nで塩基性にし、DCMで抽出し、Na2SO4で乾燥させ、濃縮して、ジエチルエーテル中で粉砕して、白色の粉末を得た;LC/MS:416.0374[M+H]+,Rt 2.34分。
【0242】
中間体30:エチル[5−(4−フルオロフェニル)−2−チオキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]カルバメート
【化57】

【0243】
ローソン試薬(1.6g、4.0mmol、0.6当量)を、トルエン(24mL)中の懸濁中間体50(2.3g、9.7mmol)に加えた。反応混合物を窒素下で2時間加熱還流して、その後減圧下で濃縮した。フラッシュクロマトグラフィー(DCM/MeOH:95/5)により精製して、黄色の固体として標題化合物(2.31g、96%)を得た;LC/MS:m/z358[M+H]+,Rt 2.48分;HRMS C18H17FN3O2S(M+H)+についての計算値358.1025 実測値358.0956。
【0244】
中間体31:フェニルメチル(7−ヨード−5−フェニル−2−チオキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル)カルバメート
【化58】

【0245】
トルエン(100mL)中の中間体51(5g、9.8mmol)の溶液およびローソン試薬(4.3g、10.8mmol、1.1当量)を100℃にて3時間加熱した。生成物をEtOAc/H2Oで抽出し、Na2SO4で乾燥させ、濃縮し、フラッシュクロマトグラフィーにより精製して、クリーム色の泡状物として標題化合物を得た;LC/MS:m/z528.16[M+H]+,526.16[M−H],Rt 3.13分。
【0246】
中間体32:1,1−ジメチルエチル(7−ヨード−5−フェニル−2−チオキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル)カルバメート
標題化合物を中間体33から中間体31と同様の方法で調製した。LC/MS:437.9585[M+H−tBu]+,Rt 3.38分。
【化59】

【0247】
中間体33:1,1−ジメチルエチル(7−ヨード−2−オキソ−5−フェニル−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル)カルバメート
【化60】

【0248】
乾燥THF中の中間体34(2.5g、6.6mmol)およびTEA(1.4mL、9.95mmol、1.5当量)の溶液に、THF中のBOC2O(1.44g、6.6mmol、1当量)の溶液を滴下して加えた。反応混合物を室温にて1時間攪拌した。得られた混合物をEtOAc/水で抽出し、有機層を飽和NaHCO3、ブラインで洗浄し、乾燥させ、濃縮した;HRMS C16H13IN3O3(M+H−tBu)+についての計算値422.0002 実測値421.9796。
【0249】
中間体34:3−アミノ−7−ヨード−5−フェニル−1,3−ジヒドロ−2H−1,4−ベンゾジアゼピン−2−オン
【化61】

【0250】
溶液HBr/AcOH 30%(50mL)に、中間体51(5g、0.98mmol)を注意深く加えた。反応混合物を80℃にて1時間攪拌した。室温まで戻した後、沈殿物を濾過し、ジエチルエーテルで2回洗浄し、次いでそれをEtOAc/H2Oに溶解し、NaOH 1Nで塩基性にした。不溶性物質を含有する有機層をエタノールに希釈し、蒸発させた;HRMS C15H13IN3O(M+H)+についての計算値378.0103 実測値378.9972。
【0251】
中間体35:エチル[5−(4−クロロフェニル)−2−オキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]カルバメート
【化62】

【0252】
THF(100mL)中の中間体36(5.34g、18.7mmol)の懸濁液に、TEA(2.87mL、20.57mmol、1.1当量)を加え、0℃まで冷却した。次いで、THF(10mL)中のクロロギ酸エチル(1.97mL、20.57mmol、1.1当量)の溶液を反応混合物に滴下して加えた。2時間の攪拌後、反応混合物を蒸発させ、DCMに希釈し、水で洗浄し、乾燥させ、乾燥するまで蒸発させた。フラッシュクロマトグラフィー(DCM/MeOH 98/2)により残渣を精製して、白色の固体として標題化合物を得た;LC/MS:m/z358.13[M+H]+,Rt 2.42分。
【0253】
中間体36:3−アミノ−5−(4−クロロフェニル)−1,3−ジヒドロ−2H−1,4−ベンゾジアゼピン−2−オン
【化63】

【0254】
AcOH(35mL)中の中間体38(7.5g、17.86mmol)の懸濁液に、HBr/AcOH37%(35mL、178.6mmol、10当量)を加え、80℃にて1時間加熱した。得られた混合物を室温まで冷却した後、黄色の固体を形成させ、それを濾過し、ジイソプロピルエーテルで洗浄した。次いで固体をDCM(250mL)およびNaOH 1N(250mL)の混合物中で1時間攪拌した。固体を濾過し、水で洗浄した。得られた有機層を水で洗浄し、乾燥させ、乾燥するまで蒸発させた;LC/MS:m/z286.04[M+H]+,Rt 1.87分。
【0255】
中間体37:フェニルメチル[5−(4−フルオロフェニル)−2−オキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]カルバメート
【化64】

【0256】
酢酸アンモニウム(470mg、6.1mmol、5当量)を氷酢酸(10mL)中の中間体52(515mg、1.22mmol)の溶液に加え、24時間室温にて攪拌した。溶媒を蒸発させ、残渣をトルエン(2×20mL)と共蒸発させた。混合物を2N NaOH(約20mL)で塩基性にし、EtOAc(3×50mL)で抽出し、乾燥させて(Na2SO4)、標題化合物を得た;LC/MS:m/z404[M+H]+,Rt 3.25分。;m.p.>260°C;HRMS C25H20N3O4についての計算値(M+H)+426.1454 実測値426.1436。
【0257】
式(V)の中間体38〜46を、示した出発物質(表13参照)から中間体37について記載されるものと同様の方法によって調製した。
【化65】

【0258】
表13
【表16】

【0259】
中間体47:フェニルメチル(2−オキソ−5−フェニル−2,3−ジヒドロ−1H−[1]ベンゾフロ[3,2−e][1,4]ジアゼピン−3−イル)カルバメート
【化66】

【0260】
MeOH(50mL)中の7Nアンモニアを窒素下で室温にて中間体75(想定21.1mmol)に加え、混合物を室温にて4時間攪拌した。次いで酢酸(20mL、0.35mol、17当量)を滴下して加えた。次いでMeOH(50mL)を加え、反応混合物を2日間攪拌した。混合物を減圧下で乾燥するまで蒸発させた。固体をトルエン(50mL)に懸濁し、過剰なAcOHを除去するために再度濃縮した(この手順を2回繰り返す)。次いで得られた固体をDCM(100ml)で希釈し、水(1×50mL)および飽和炭酸水素ナトリウム溶液(50mL)で洗浄し、その後、減圧下で濃縮した。フラッシュクロマトグラフィー(DCM100%〜DCM/MeOH:95/5)により精製して、黄色の泡状物として標題化合物(1.9g、22%)を得た;Rf=0.50(DCM/MeOH:95/5);m.p.>260°C;HRMS C25H20N3O4(M+H)+についての計算値426.1454 実測値426.1436。
【0261】
中間体48:エチル[5−(4−クロロフェニル)−2−オキソ−2,3−ジヒドロ−1H−[1]ベンゾフロ[3,2−e][1,4]ジアゼピン−3−イル]カルバメート
【化67】

【0262】
MeOH(15mL)中の7Nアンモニアを窒素下で室温にて中間体76(想定73.6mmol)に加え、混合物を室温にて3時間攪拌し、その後AcOH(90mL、1.6mol、17当量)を滴下して加えた。次いでMeOH(50mL)を加え、反応混合物を2日間攪拌し、その後濾過した。固体をトルエン(50mL)で洗浄し、高温CH3CN中で粉砕し、その後再度濾過して、緑黄色の固体として標題化合物(11.4g、39%)を得た;Rf=0.20(DCM/MeOH:95/5);m.p.>260℃;LC/MS:m/z398[M(35Cl)+H]+,Rt 2.64分。
【0263】
中間体49:フェニルメチル{5−[4−(メチルオキシ)フェニル]−2−オキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル}カルバメート
【化68】

【0264】
酢酸アンモニウム(22.4g、0.29mol、5当量)を室温にて氷酢酸(400mL)中の中間体66(58.1mmol)の溶液に加え、反応混合物を15時間室温にて攪拌し続けた。溶媒を蒸発させ、残渣をトルエン(2×200mL)で共蒸発させた。得られた固体を濾過し、トルエン(2×250mL)で洗浄し、濾液を飽和NaHCO3水溶液(3×75mL)で洗浄し、Na2SO4で乾燥させ、蒸発させた。フラッシュクロマトグラフィー(DCM/MeOH:98/2)により精製して、淡黄色の固体として標題化合物(3工程にわたって16.2g、67%)を得た;Rf=0.45(DCM/MeOH:95/5);1HNMR(300MHz,CDCl3)δppm:7.55−7.07(m,13H),6.86(d,2H,J=8.6Hz),5.38(d,1H,J=8.3Hz),5.20(s,2H),3.79(s,3H);HRMS(M+H)+ C24H22N3O4についての計算値416.1610 実測値416.1544。
【0265】
中間体50:エチル[5−(4−フルオロフェニル)−2−オキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]カルバメート
【化69】

【0266】
MeOH(50mL)中の7Nアンモニアを室温にて窒素下で中間体77(想定50.2mmol)に加え、混合物を2.5時間攪拌し、その後AcOH(30mL、0.52mol、10当量)を滴下して加えた。反応混合物を2日間攪拌し、その後乾燥するまで減圧下で濃縮した。得られた固体をDCM(100mL)に懸濁し、飽和炭酸水素ナトリウム溶液(150mL)およびブライン(100mL)で洗浄し、Na2SO4で乾燥させ、真空中で溶媒を除去した。フラッシュクロマトグラフィー(DCM/MeOH:95/5)により精製して、白色の固体として標題化合物(3工程にわたって2.3g、13%)を得た;Rf=0.22(DCM/MeOH:95/5);1H NMR(300MHz,DMSO d6)δppm:10.86(brs,1H),8.18(d,1H,J=8.5Hz),7.64(m,1H),7.57−7.49(m,2H),7.36−7.21(m,5H),5.00(d,1H,J=8.5Hz),4.02(q,2H,J=7.1Hz),1.19(t,3H,J=7.1Hz);LC/MS:m/z342[M+H]+,Rt2.18分;HRMS(M+H)+ C18H17FN3O3についての計算値342.1254 実測値342.1163。
【0267】
中間体51:フェニルメチル(7−ヨード−2−オキソ−5−フェニル−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル)カルバメート
【化70】

【0268】
酢酸アンモニウム(30g)を氷酢酸(200mL)中の中間体63(4.5g、8.8mmol)の溶液に加え、室温にて3時間攪拌した。形成した沈殿物を濾過し、水で3回、およびジエチルエーテルで2回洗浄して、白色の粉末として標題化合物を得た;LC/MS:m/z512.17[M+H]+、Rt=2.91分。
【0269】
中間体52:フェニルメチル[1−アミノ−2−({2−[(4−フルオロフェニル)カルボニル]フェニル}アミノ)−2−オキソエチル]カルバメート
【化71】

【0270】
MeOH(25mL)中の7Nアンモニアを窒素下で室温にて中間体64(633mg、1.2mmol)に加え、混合物を室温にて1時間攪拌した。反応混合物をEtOAc(100mL)で希釈し、1N NaOH溶液(2×50mL)で洗浄した。水層をEtOAc(50mL)で抽出し、合わせた有機物を乾燥させ(Na2SO4)、蒸発させて、黄色の泡状物として標題化合物(515mg、100%)を得た;LC/MS:m/z421[M+H]+,Rt 2.7分。
【0271】
一般式(VIa)の中間体53〜62を、示した出発物質(表14参照)を用いて中間体52について記載されるものと同様の方法によって調製した。
【化72】

【0272】
表14
【表17】

【0273】
中間体63:フェニルメチル(1−アミノ−2−{[4−ヨード−2−(フェニルカルボニル)フェニル]アミノ}−2−オキソエチル)カルバメート
【化73】

【0274】
0℃にて無水THF(500mL)中の中間体82(30g、92.8mmol)の溶液に、塩化オキサリル(55mL、111.5mmol、1.2当量)、続いてDMF(5mL)を滴下して加えた。0℃にて3時間攪拌した後、THF中のNMM(12.3mL、111.5mmol、1.2当量)および1H−1,2λ5,3−ベンゾトリアゾール−2−イル({[(フェニルメチル)オキシ]カルボニル}アミノ)酢酸(30.2mg、92.8mmol、1当量)の溶液を加えた。反応混合物を0℃にて1時間、室温にて一晩攪拌した。得られた混合物を水(200mL)で加水分解し、次いで有機層を酢酸エチルで抽出し、ブラインで洗浄し、乾燥させ、濃縮した。残渣をMeOH/NH3 7N(300mL)に部分的に溶解し、0℃にて1時間攪拌した。固体を濾過し、ジエチルエーテルで洗浄し、乾燥させて、標題化合物を得た。
【0275】
中間体64:フェニルメチル[1−(1H−1,2,3−ベンゾトリアゾール−1−イル)−2−({2−[4−フルオロフェニル)カルボニル]フェニル}アミノ)−2−オキソエチル]カルバメート
【化74】

【0276】
乾燥DCM(30mL)中の(2−アミノフェニル)(4−フルオロフェニル)メタノン(国際公開第00/05195号パンフレットに従って調製した)(440mg、2.0mmol)および1H−1,2,3−ベンゾトリアゾール−1−イル{[(ベンジルオキシ)カルボニル]アミノ}酢酸イルカルバメート(J.Org.Chem.,(1990),55,2206を参照のこと)(1.0g、3.8mmol、1.5当量)を窒素下で0℃に冷却した。EDC(3.07mmol)、および4−DMAP(30mg)を加え、続いて10分後に溶液を補助するためにN,N−ジイソプロピルエチルアミン(534μl、1.5当量)を加えた。得られた溶液を室温まで加温し、1時間攪拌した。反応物を8%飽和炭酸水素ナトリウム(2×40mL)およびブライン(2×40mL)で洗浄し、乾燥させた(水性抽出カートリッジ)。化合物を、DCM〜DCM/EtOAc(4:1)で溶出する、10gのSi/SPEカートリッジを用いて精製して、黄色の泡状物として標題化合物(633mg、59%)を得た;LC/MS:m/z524[M+H]+,Rt 3.6分。
【0277】
式(VIIa)の中間体65〜72を、以前の合成が既に文献に報告されている対応するアミノベンゾフェノン(表15参照)を用いて中間体64について記載されるものと同様の方法によって調製した。
【化75】

【0278】
表15
【表18】

【0279】
中間体73:フェニルメチル(1−(1H−1,2,3−ベンゾトリアゾール−1−イル)−2−{[2−[(4−クロロフェニル)カルボニル]−4−(メチルオキシ)フェニル]アミノ}−2−オキソエチル)カルバメート
【化76】

【0280】
−10℃にてTHF(170mL)中の1H−1,2,3−ベンゾトリアゾール−1−イル({[(フェニルメチル)オキシ]カルボニル}アミノ)酢酸(17.7g、54.29mmol)の懸濁液に、塩化オキサリル(27mL、65.15mmol、1.2当量)を滴下して加えた。5分後、DMFを加え(500μL)、反応混合物を0℃にて3時間攪拌した。次いで、この温度にて、THF(100mL)中の中間体80(11.8mg、54.29mmol、1当量)およびN−メチルモルホリン(5mL、54.29mmol、1当量)の溶液を滴下して加えた。得られた混合物を室温にて2日間攪拌した。形成した沈殿物を濾過し、水で洗浄し、乾燥させて、黄色の固体として標題化合物を得て、それをさらに精製せずに次の工程に使用した。
【0281】
中間体74:フェニルメチル{1−(1H−1,2,3−ベンゾトリアゾール−1−イル)−2−[(2−{[4−(メチルオキシ)フェニル]カルボニル}フェニル)アミノ]−2−オキソエチル}カルバメート
【化77】

【0282】
乾燥DCM(790mL)中の中間体78(13.2g、58.1mmol)および1H−1,2,3−ベンゾトリアゾール−1−イル{[(ベンジルオキシ)カルボニル]アミノ}酢酸(28.4g、87.0mmol 1.5当量)を窒素下で0℃に冷却した。EDCI(16.7g、87.0mmol、1.5当量)および4−DMAP(0.7g、5.8mmol、0.1当量)を0℃にて加え、得られた溶液を1時間攪拌した。反応物を飽和炭酸水素ナトリウム溶液(2×300mL)およびブライン(2×300mL)で洗浄した。有機層をNa2SO4で乾燥させ、真空中で溶媒を除去して、粗生成物として標題化合物を得て、それを精製せずに次の工程に使用した;LC/MS:m/z417[M−Bt]+,Rt 2.90分。
【0283】
中間体75:フェニルメチル(1−(1H−1,2,3−ベンゾトリアゾール−1−イル)−2−オキソ−2−{[2−(フェニルカルボニル)−1−ベンゾフラン−3−イル]アミノ}エチル)カルバメート
【化78】

【0284】
乾燥THF(60mL)中の1H−1,2,3−ベンゾトリアゾール−1−イル{[(ベンジルオキシ)カルボニル]アミノ}酢酸(J.Org.Chem.1990,55,2206に従って調製した)(6.9g、21.1mmol、1.0当量)を窒素下で0℃に冷却し、塩化オキサリル(11.6mL、23.2mmol、1.1当量)を滴下して加え、続いて乾燥DMF(4滴)を加えた。反応混合物をこの温度にて2時間攪拌し、その後乾燥THF(20mL)中の中間体81(5.0g、21.1mmol)およびNMM(2.3mL、21.1mmol、1.0当量)の溶液を滴下して加えた。得られた溶液を室温まで加温し、18時間攪拌し、その後濾過した。濾液を減圧下で濃縮して、粗生成物として標題化合物を得て、それを精製せずに次に工程に使用した。
【0285】
中間体76:エチル[1−(1H−1,2,3−ベンゾトリアゾール−1−イル)−2−({2−[(4−クロロフェニル)カルボニル]−1−ベンゾフラン−3−イル}アミノ)−2−オキソエチル]カルバメート
【化79】

【0286】
乾燥THF(500mL)中の1H−1,2,3−ベンゾトリアゾール−1−イル{[(エトキシ)カルボニル]アミノ}酢酸(J.Org.Chem.1990,55,2206に従って調製した)(25.3g、95.7mmol、1.3当量)を0℃にて窒素下で冷却し、塩化オキサリル(51.5mL、0.1mol、1.4当量)を滴下して加え、その後乾燥DMF(4滴)を滴下して加えた。反応混合物をこの温度で2時間攪拌し、その後乾燥THF(400mL)中の中間体82(20.0g、73.6mmol)およびNMM(10.5mL、95.7mmol、1.3当量)の溶液を滴下して加えた。得られた溶液を室温まで加温し、18時間攪拌し、その後濾過した。濾液を減圧下で濃縮して、粗生成物として標題化合物を得て、それを精製せずに次の工程に使用した。
【0287】
中間体77:エチル[1−(1H−1,2,3−ベンゾトリアゾール−1−イル)−2−({2−[(4−フルオロフェニル)カルボニル]フェニル}アミノ)−2−オキソエチル]カルバメート
【化80】

【0288】
乾燥DCM(680mL)中の(2−アミノフェニル)(4−フルオロフェニル)メタノン(国際公開第00/05195号パンフレット)(10.8g、50.2mmol)および1H−1,2,3−ベンゾトリアゾール−1−イル{[(エチルオキシ)カルボニル]アミノ}酢酸(19.9g、75.3mmol、1.5当量)を窒素下で0℃に冷却した。EDCI(14.4g、75.3mmol、1.5当量)およびi−Pr2NEt(13.1mL、75.3mmol、1.5当量)を0℃にて加え、得られた溶液を室温まで加温し、18時間攪拌した。反応物を飽和炭酸水素ナトリウム溶液(2×200mL)およびブライン(2×200mL)で洗浄した。有機層をNa2SO4で乾燥させ、真空中で溶媒を除去して、粗生成物として標題化合物を得て、それを精製せずに次の工程に使用した。
【0289】
中間体78:(2−アミノフェニル)[4−(メチルオキシ)フェニル]メタノン
【化81】

【0290】
−78℃にて乾燥THF(830mL)中の2−アミノ−N−メチル−N−(メチルオキシ)ベンズアミド酸(J.Org.Chem,1991,56,3750に従って調製した)(25.6g、0.14mol)および4−ブロモアニソール(17.8mL、0.14mol)の溶液に、n−BuLi(182.0mL、ヘキサン中に1.6M、0.29mol、2.05当量)を2時間、滴下して加えた。添加を行ったとき、反応混合物をこの温度で0.5時間攪拌し、その後1.2N HCl(256mL)でクエンチした。水層をEtOAc(3×300mL)で抽出し、合わせた有機層を水(500mL)、ブライン(500mL)で洗浄し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。フラッシュクロマトグラフィー(シクロヘキサン/エーテル:8/2次いで1/1)により精製して、暗橙色の油として標題化合物(22.7g、70%)を得た;1H NMR(300MHz,CDCl3)δppm:7.56(m,2H),7.34(m,1H),7.15(m,1H),6.83(m,2H),6.61(m,1H),6.50(m,1H),5.74(brs,2H),3.75(s,3H)。
【0291】
中間体79:[2−アミノ−5−(メチルオキシ)フェニル](4−クロロフェニル)メタノン
【化82】

【0292】
0℃にてトルエン/エーテル(2/1)混合物(760mL)中の中間体83(40.0g、0.21mol、1当量)の溶液に、4−クロロフェニルマグネシウムブロミド(170mL、Et2O中の1M、0.17mol、0.8当量)の溶液を滴下して加えた。反応混合物を室温まで加温し、1時間攪拌し、その後1N HCl(200mL)でクエンチした。水層をEtOAc(3×150mL)で抽出し、合わせた有機物をブライン(100mL)で洗浄し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。次いで粗化合物をEtOH(400mL)に溶解し、6N HCl(160mL)を加えた。反応混合物を2時間還流し、その後3分の1の体積まで濃縮した。得られた固体を濾過し、エーテルで2回洗浄し、その後EtOAcに懸濁し、1N NaOHで中和した。水層をEtOAc(3×150mL)で抽出し、合わせた有機物をブライン(150mL)で洗浄し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。標題化合物を黄色の固体(39g、88%収率)として得た;LC/MS:m/z262[M+H]+,Rt 2.57分。
【0293】
中間体80:(3−アミノ−1−ベンゾフラン−2−イル)(フェニル)メタノン
【化83】

【0294】
アセトン(1L)中の2−シアノフェノール(24.5g、0.2mol)および2−ブロモアセトフェノン(40.9g、0.2mol)の溶液に、炭酸カリウム(85.2g、0.6mol、3当量)を加えた。反応混合物を窒素下で18時間、60℃で加熱し、次いで室温に冷却した。K2CO3を濾過し、アセトン(100ml)で洗浄し、濾液を減圧下で濃縮して、黄色の固体として標題化合物(48.8g、100%)を得た;m.p.122−124°C;1H NMR(300MHz,CDCl3)δppm:8.17(dd,2H,J=7.7and1.8Hz),7.56(d,1H,J=7.9Hz),7.51−7.36(m,5H),7.19(m,1H),5.20(brs,2H);LC/MS:m/z238[M+H]+,Rt2.59分。
【0295】
中間体81:(3−アミノ−1−ベンゾフラン−2−イル)(4−クロロフェニル)メタノン
【化84】

【0296】
アセトン(500mL)中の2−シアノフェノール(15.0g、0.12mol)および2−ブロモ−4’−クロロアセトフェノン(29.4g、0.12mol)の溶液に、炭酸カリウム(52.2g、0.38mol、3当量)を加えた。反応混合物を窒素下で18時間加熱還流し、次いで室温まで冷却した。K2CO3を濾過し、アセトン(100ml)およびDCM(100mL)で洗浄し、減圧下で濾液を濃縮した。次いで粗固体を冷CH3CNで洗浄して、濾過後に黄色の固体として標題化合物(21.6g、63%)を得た。Rf=0.80(DCM/MeOH:98/2);m.p.202−204℃;1HNMR(300MHz,CDCl3)δppm:8.20(d,2H,J=8.4Hz),7.63(d,1H,J=7.9Hz),7.62−7.41(m,4H),7.28(m,1H),6.05(brs,2H);LC/MS:m/z272[M+H]+,Rt2.97分。
【0297】
中間体82:(2−アミノ−5−ヨードフェニル)(フェニル)メタノン
【化85】

【0298】
−70℃にて無水DCM(800mL)中の2−アミノベンゾフェノン(50g、263mmol)の溶液に、一塩化ヨウ素(49.4g、305mmol、1.2当量)を加えた。反応混合物を−60℃にて5時間、次いで室温にて一晩攪拌した。得られた混合物を飽和Na2SO4水溶液で加水分解し、次いでDCMで抽出した。得られた固体を濾過して、標題化合物を得て、それをさらに精製せずに使用した。
【0299】
中間体83:2−メチル−6−(メチルオキシ)−4H−3,1−ベンゾオキサジン−4−オン
【化86】

【0300】
5−メトキシアントラニル酸(Lancaster)(41.8g、0.25mol)の溶液を、無水酢酸(230mL)中で3.5時間、還流下で加熱し、その後、減圧下で濃縮した。次いで粗化合物をトルエンの存在下で2回濃縮し、次いで濾過した。得られた固体をエーテルで2回洗浄して、茶色の固体として標題化合物(33.7g、71%収率)を得た;LC/MS:m/z192[M+H]+,Rt 1.69分。
【0301】
中間体84:1−(4−フルオロフェニル)エチル4−ニトロフェニルカルボネート
【化87】

【0302】
乾燥DCM(10mL)中のクロロギ酸4−ニトロフェニル(673mg、3.34mmol)の溶液を、0℃にて窒素下で、乾燥DCM(10mL)中の1−(4−フルオロフェニル)エタノール(468mg、3.34mmol)およびピリジン(283μl、3.5mmol)の溶液に滴下して加え、混合物を0℃にて1時間、次いで室温にて2日間攪拌した。混合物を2N HClで洗浄し、層を分離した。有機抽出物をシクロヘキサンで希釈し、10gのSi SPEカートリッジに適用した。DCM/シクロヘキサン(1:1)、続いてDCMで溶出して、標題化合物(180mg、18%)を得た、LC/MS:m/z306[M+H]+,Rt 3.5分。
【0303】
式(X)の中間体85〜87を、示した出発物質(表16参照)を用いて中間体84について記載されるものと同様の方法によって調製した。
【化88】

【0304】
表16
【表19】

【0305】
中間体88:4−ニトロフェニル[3−(フェニルカルボニル)フェニル]カルバメート
【化89】

【0306】
DCM(250mL)中の4−アミノベンゾフェノン(3g、15.2mmol)の溶液にDMAP(1g)を加えた。次いでDCM中の4−ニトロフェニルクロリドカルボネート(9.2g、3当量)の溶液を滴下して加え、反応混合物を室温にて1時間攪拌した。沈殿物を濾過し、DCMおよびジイソプロピルエーテルで洗浄して、クリーム色の固体(1.8g)を得て、それをさらに精製せずに使用した。
【0307】
本明細書に参照したLC/MS法DおよびFの実験の詳細は以下の通りである:
LC/MS(方法D)は、水の中の0.1% HCO2Hおよび0.01M 酢酸アンモニウム(溶媒A)、および水の中の95% アセトニトリルおよび0.05% HCO2H(溶媒B)を用いて、3mL/分の流量で、0〜0.7分 0%B、0.7〜4.2分 0→100%B、4.2〜5.3分 100%B、5.3〜5.5分 100→0%Bの溶出グラジエントを使用して溶出するSupelcosil LCABZ+PLUSカラム(3μm、3.3cm×4.6mm内径)にて行った。質量スペクトル(MS)は、エレクトロスプレー正イオン化[(ES+ve、[M+H]+および[M+NH4]+分子イオンを与える]またはエレクトロスプレー負イオン化[(ES−ve、[M−H]−分子イオンを与える]モードを使用してFisons VG Platform質量分析装置で記録した。この装置から得た分析データは、以下の形式で与えられる:[M+H]+または[M−H]−。
【0308】
LC/MS(方法F)は、30℃にて、水の中の0.1%v/vトリフルオロ酢酸溶液(溶媒A)およびアセトニトリルの中の0.1%v/vトリフルオロ酢酸溶液(溶媒B)を用いて、3ml/分の流量で、0〜0.1分 3%B、0.1〜4.2分 3〜100%B、4.2〜4.8分 100%B、4.8〜4.9分 100〜3%B、4.9〜5.0分 3%Bの溶出グラジエントを使用して溶出するSunfire C18カラム(30mm×4.6mm内径、3.5μm充填直径)にて行った。UV検出は、210nm〜350nmの波長からの平均シグナルであり、質量スペクトルは、正エレクトロスプレーイオン化を用いて質量分析計で記録した。イオン化データは整数に四捨五入した。
【0309】
LC/HRMS:水の中の0.01M 酢酸アンモニウム(溶媒A)および100% アセトニトリル(溶媒B)を用いて、1.3mL/分の流量で、0〜0.5分 5% B、0.5〜3.75分 5→100% B、3.75〜4.5 100% B、4.5〜5 100→5% B、5〜5.5 5% Bの溶出グラジエントを使用して溶出するUptisphere−hscカラム(3μm33×3mm内径)で分析用HPLCを行った。質量スペクトル(MS)は、エレクトロスプレー正イオン化[ES+ve、MH+分子イオンを与える]またはエレクトロスプレー負イオン化[ES−ve、(M−H)−分子イオンを与える]モードを使用してmicromass LCT質量分析装置で記録した。
【0310】
TLC(薄層クロマトグラフィー)は、シリカゲル60 F254でコーティングされたMerckによって販売されているTLCプレートの使用を意味する。
【0311】
シリカクロマトグラフィー技術としては、自動(FlashmasterまたはBiotage SP4)技術または予め充填したカートリッジ(SPE)もしくは手動で充填したフラッシュカラム上での手動クロマトグラフィーが挙げられる。
【0312】
化合物または試薬の名称の後に商業的な供給業者の名称が与えられる場合、例えば「化合物X(Aldrich)」または「化合物X/Aldrich」、これは、化合物Xが、その名称の商業的な供給業者などの商業的な供給業者から得られることを意味する。
【0313】
基準化合物A:2−メチル−6−(メチルオキシ)−4H−3,1−ベンゾオキサジン−4−オン
【化90】

【0314】
5−メトキシアントラニル酸(ランカスター(Lancaster))(41.8g、0.25mol)の溶液を、減圧下で濃縮する前に、3.5時間、無水酢酸(230mL)中で還流した。粗化合物を、次いで、濾過する前に、トルエンの存在下で2回濃縮し、エーテルで2度洗浄し、標題化合物(33.7g、71%の収率)を茶色の固体として得た。LC/MS(方法D):m/z 192[M+H]+,Rt1.69分。
【0315】
基準化合物B:[2−アミノ−5−(メチルオキシ)フェニル](4−クロロフェニル)メタノン
【化91】

【0316】
0℃にて、トルエン/エーテル(2/1)混合物(760mL)中の2−メチル−6−(メチルオキシ)−4H−3,1−ベンゾオキサジン−4−オン(調製については、基準化合物Aを参照)(40.0g、0.21mol)の溶液に、4−クロロフェニル臭化マグネシウム(170mL、Et2O中1M、0.17mol)の溶液を滴下して加えた。反応混合物を、室温まで加温し、1NのHCl(200mL)でクエンチする前に1時間、攪拌した。水層をEtOAc(3×150mL)で抽出し、合わせた有機物をブライン(100mL)で洗浄し、Na2SO4で乾燥し、濾過し、減圧下で濃縮した。次いで粗化合物を、EtOH(400mL)に溶解し、6NのHCl(160mL)を加えた。反応混合物を、1/3の体積に濃縮する前に、2時間、還流した。得られた固体を濾過し、EtOAc中で懸濁する前に、エーテルで2度洗浄し、1NのNaOHで中和した。水層を、EtOAc(3×150mL)で抽出し、合わせた有機物をブライン(150mL)で洗浄し、Na2SO4で乾燥し、濾過し、減圧下で濃縮した。標題化合物を黄色の固体(39g、88%の収率)として得た。LC/MS(方法D):m/z 262[M+H]+,Rt2.57分。
【0317】
基準化合物C:メチルN1−[2−[(4−クロロフェニル)カルボニル]−4−(メチルオキシ)フェニル]−N2−{[(9H−フルオレン−9−イルメチル)オキシ]カルボニル}−L−α−アスパラギネート
【化92】

【0318】
メチルN−{[(9H−フルオレン−9−イルメチル)オキシ]カルボニル}−L−α−アスパルチルクロリド(Int.J.Peptide Protein Res.1992,40,13−18)(93g、0.24mol)をCHCl3(270mL)に溶解し、[2−アミノ−5−(メチルオキシ)フェニル](4−クロロフェニル)メタノン(調製については、基準化合物Bを参照)(53g、0.2mol)を加えた。得られた混合物を、冷却する前に、1時間、60℃で攪拌し、60%の体積に濃縮した。エーテルを0℃で加え、得られた沈殿物を濾過し、取り除いた。濾過物を減圧下で濃縮し、さらに精製せずに用いた。
【0319】
基準化合物D:メチル[(3S)−5−(4−クロロフェニル)−7−(メチルオキシ)−2−オキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]アセテート
【化93】

【0320】
DCM(500mL)中のメチルN1−[2−[(4−クロロフェニル)カルボニル]−4−(メチルオキシ)フェニル]−N2−{[(9H−フルオレン−9−イルメチル)オキシ]カルボニル}−L−α−アスパラギネート(調製については、基準化合物Cを参照)(推定0.2mol)の溶液に、Et3N(500mL、3.65mol)を加え、得られた混合物を、濃縮する前に24時間、還流した。得られた粗アミンを、1,2−DCE(1.5L)に溶解し、AcOH(104mL、1.8mol)を注意して加えた。反応混合物を、次いで、真空中で濃縮する前に、2時間、60℃で攪拌し、DCMに溶解した。有機層を、1NのHClで洗浄し、水層をDCM(×3)で抽出した。合わせた有機層を水およびブラインで2度洗浄し、Na2SO4で乾燥し、濾過し、減圧下で濃縮した。粗固体を、MeCN中で再結晶化し、標題化合物(51g)を淡黄色の固体として得た。濾過物を濃縮し、MeCN中で再結晶化し、別の10gの所望の生成物を得た。Rf=0.34(DCM/MeOH:95/5)。
【0321】
HRMS(M+H)+ C19H1835ClN2O4についての計算値373.0955;実測値373.0957。
【0322】
基準化合物E:メチル[(3S)−5−(4−クロロフェニル)−7−(メチルオキシ)−2−チオキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]アセテート
【化94】

【0323】
室温にて、1,2−DCE(700mL)中のP4S10(36.1g、81.1mmol)およびNa2CO3(8.6g、81.1mmol)の懸濁液を、メチル[(3S)−5−(4−クロロフェニル)−7−(メチルオキシ)−2−オキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]アセテート(調製については、基準化合物Dを参照)(16.8g、45.1mmol)を加える前に、2時間、攪拌した。得られた混合物を、冷却し、濾過する前に、2時間、70℃で攪拌した。固体を、DCMで2度洗浄し、濾過物を、飽和NaHCO3およびブラインで洗浄した。有機層をNa2SO4で乾燥し、濾過し、減圧下で濃縮した。粗生成物を、シリカゲル上でのフラッシュクロマトグラフィー(DCM/MeOH:99/1)によって精製し、標題化合物(17.2g、98%の収率)を、黄色がかった固体として得た。LC/MS(方法D):m/z 389[M(35Cl)+H]+,Rt2.64分。
【0324】
HRMS(M+H)+C19H1835ClN2O3Sについての計算値389.0727;実測値389.0714。
【0325】
基準化合物F:メチル[(3S)−2−[(1Z)2−アセチルヒドラジノ]−5−(4−クロロフェニル)−7−(メチルオキシ)−3H−1,4−ベンゾジアゼピン−3−イル]アセテート
【化95】

【0326】
0℃にて、THF(300mL)中のメチル[(3S)−5−(4−クロロフェニル)−7−(メチルオキシ)−2−チオキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]アセテート(調製については、基準化合物Eを参照)(9.0g、23.2mmol)の懸濁液に、ヒドラジン一水和物(3.4mL、69.6mmol)を滴下して加えた。反応混合物を、0℃で冷却する前に、5℃から15℃の間で5時間攪拌した。次いでEt3N(9.7m、69.6mmol)をゆっくりと加え、塩化アセチル(7.95mL、69.6mmol)を滴下して加えた。次いで混合物を、減圧下で濃縮する前に、16時間、室温まで加温した。粗生成物をDCMに溶解し、水で洗浄した。有機層をNa2SO4で乾燥し、濾過し、真空中で濃縮し、粗標題化合物(9.7g、98%の収率)を得て、それをさらに精製せずに用いた。Rf=0.49(DCM/MeOH:90/10)。
【0327】
基準化合物G:メチル[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]アセテート
【化96】

【0328】
粗メチル[(3S)−2−[(1Z)−2−アセチルヒドラジノ]−5−(4−クロロフェニル)−7−(メチルオキシ)−3H−1,4−ベンゾジアゼピン−3−イル]アセテート(調製については、基準化合物Fを参照)(推定9.7g)を、THF(100ml)に懸濁し、AcOH(60mL)を室温で加えた。反応混合物を、減圧下で濃縮する前に、2日間、この温度にて攪拌した。粗固体を、i−Pr2O中で粉砕し、濾過し、標題化合物(3工程に渡って8.7g、91%)をオフホワイト色の固体として得た。
【0329】
HRMS(M+H)+C21H20ClN4O3についての計算値411.1229;実測値411.1245。
【0330】
基準化合物H:[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]酢酸
【化97】

【0331】
室温にて、THF(130mL)中のメチル[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]アセテート(調製については、基準化合物Gを参照)(7.4g、18.1mmol)の溶液に、1NのNaOH(36.2mL、36.2mmol)を加えた。反応混合物を、1NのHCl(36.2mL)でクエンチする前に、5時間、この温度で攪拌し、真空中で濃縮した。次いで水を加え、水層をDCM(×3)で抽出し、合わせた有機層をNa2SO4で乾燥し、濾過し、減圧下で濃縮し、標題化合物(7g、98%の収率)を淡黄色の固体として得た。
【0332】
基準化合物H:1,1−ジメチルエチル[5−({[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]アセチル}アミノ)ペンチル]カルバメート
【化98】

【0333】
[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]酢酸(調製については、基準化合物Gを参照)(1.0g、2.5mmol)、HATU(1.9g、5mmol)およびDIPEA(0.88ml、5mmol)の混合物を、室温で80分間攪拌し、これに、1,1−ジメチルエチル(4−アミノブチル)カルバメート(1.05ml、5.0mmol、Aldrichから市販されている)を加えた。反応混合物を、濃縮する前に、2時間、室温で攪拌した。残渣をジクロロメタン中に取り、1NのHClで洗浄した。水層をジクロロメタンで2度抽出した。有機層を、1Nの水酸化ナトリウムで洗浄し、その後、飽和塩化ナトリウム溶液で洗浄し、硫酸ナトリウムで乾燥し、濃縮した。残渣を、ジクロロメタン/メタノール(95/5)を用いて、シリカでのフラッシュクロマトグラフィーによって精製し、標題化合物を、黄色の固体(1.2g)として得た。LC/MS(方法D):rt=3.04分。
【0334】
基準化合物J:N−(5−アミノペンチル)−2−[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]アセトアミドトリフルオロアセテート
【化99】

【0335】
ジクロロメタン(3ml)中の1,1−ジメチルエチル[5−({[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]アセチル}アミノ)ペンチル]カルバメート(調製については、基準化合物Hを参照)(0.2g、0.34mmol)の溶液に、トリフルオロ酢酸(0.053m、0.68mmol)を0℃で滴下して加えた。反応混合物を、3時間、0℃から室温で攪拌した。反応混合物を濃縮乾固し、標題化合物を吸湿性の黄色の油(200mg)として得た。
【0336】
LC/MS(方法D):rt=2.33分。
【0337】
HRMS(M+H)+C25H29ClN6O2についての計算値481.2119;実測値481.2162。
【0338】
基準化合物K:Alexa Fluor 488−N−(5−アミノペンチル)−2−[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]アセトアミドの5−および6−異性体の混合物
【化100】

【0339】
N−(5−アミノペンチル)−2−[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]アセトアミドトリフルオロアセテート(調製については、基準化合物Jを参照)(7.65mg、0.013mmol)を、N,N−ジメチルホルムアミド(DMF)(300μl)に溶解し、エッペンドルフ遠心チューブ中のAlexa Fluor 488 カルボン酸スクシンイミジルエステル(5mg、7.77μmol、Invitrogenから市販の5および6の異性体の混合物、製造番号A−20100)に加えた。ヒューニッヒ塩基(7.0μl、0.040mmol)を加え、混合物を一晩、ボルテックスで混合した。18時間後、反応混合物を蒸発乾固し、残渣をDMSO/水(50%、<1ml合計)に再溶解し、分取Phenomenex Jupiter C18カラムに付与して、10ml/分の流速で150分に渡って95%A:5%Bから100%B(A=0.1%の水中のトリフルオロ酢酸、B=0.1%TFA/90%アセトニトリル/10%水)の勾配で溶出した。同じ系を用いて、不純物画分を合わせて、再精製した。画分を合わせ、蒸発させ、標題生成物(2.8mg)を、示した2つの位置異性体の混合物として得た。LC/MS(方法F):,MH+=999,rt=1.88分。
【0340】
生物学的試験方法
蛍光異方性結合アッセイ
ブロモドメイン2、3および4に対する式(I)の化合物の結合を、蛍光異方性結合アッセイを用いて評価した。
【0341】
ブロモドメインタンパク質、蛍光リガンド(上記の基準化合物Kを参照)および種々の試験化合物を一緒にインキュベートして、試験化合物の非存在下で蛍光リガンドが有意に(>50%)結合し、十分な濃度の有効な阻害剤の存在下で結合していない蛍光リガンドの異方性が結合値と測定可能な程度に異なるような条件下で熱力学的平衡に到達させる。
【0342】
全てのデータを、各プレートで16の高いおよび16の低いコントロールウェルの平均に正規化した。次いで以下の式の4つのパラメータ曲線フィットを適用した:
y=a+((b−a)/(1+(10^×/10^c)^d)
式中、「a」は最小であり、「b」はヒル勾配(Hill slope)であり、「c」はpIC50であり、「d」は最大である。
【0343】
組換えヒトブロモドメイン(ブロモドメイン2(1−473)、ブロモドメイン3(1−435)およびブロモドメイン4(1−477))を、N末端において6個のHis標識を有する大腸菌細胞(pET15bベクター内)で発現させた。His標識化ブロモドメインを、0.1mg/mlリゾチームおよび超音波処理を用いて大腸菌細胞から抽出した。次いでブロモドメインを、20Cv以上で、線形10〜500mMイミダゾール勾配で溶出する、HisTRAP HPカラムでのアフィニティクロマトグラフィーにより精製した。さらなる精製を、Superdex200分取グレートサイズ排除カラムにより完了した。精製したタンパク質を20mM HEPES pH7.5および100mM NaCl中で−80℃にて保存した。
【0344】
ブロモドメイン2についてのプロトコル:全ての成分を、ブロモドメイン2、75nM、蛍光リガンド 5nMの最終濃度で50mMのHEPES pH7.4、150mmのNaClおよび0.5mMのCHAPSのバッファー組成に溶解した。10μlのこの反応混合物を、マイクロマルチドロップを用いて、Greiner384ウェルブラック低容量マイクロタイタープレート中で100nlの種々の濃度の試験化合物またはDMSOビヒクル(1%最終)を含有するウェルに加え、暗所で室温にて60分平衡化した。蛍光異方性をEnvision(λex=485nm、λEM=530nm;二色性−505nM)で読み取った。
【0345】
ブロモドメイン3についてのプロトコル:全ての成分を、ブロモドメイン3、75nM、蛍光リガンド 5nMの最終濃度で50mMのHEPES pH7.4、150mmのNaClおよび0.5mMのCHAPSのバッファー組成に溶解した。10μlのこの反応混合物を、マイクロマルチドロップを用いて、Greiner384ウェルブラック低容量マイクロタイタープレート中で100nlの種々の濃度の試験化合物またはDMSOビヒクル(1%最終)を含有するウェルに加え、暗所で室温にて60分平衡化した。蛍光異方性をEnvision(λex=485nm、λEM=530nm;二色性−505nM)で読み取った。
【0346】
ブロモドメイン4についてのプロトコル:全ての成分を、ブロモドメイン4、75nM、蛍光リガンド 5nMの最終濃度で50mMのHEPES pH7.4、150mmのNaClおよび0.5mMのCHAPSのバッファー組成に溶解した。10μlのこの反応混合物を、マイクロマルチドロップを用いて、Greiner384ウェルブラック低容量マイクロタイタープレート中で100nlの種々の濃度の試験化合物またはDMSOビヒクル(1%最終)を含有するウェルに加え、暗所で室温にて60分平衡化した。蛍光異方性をEnvision(λex=485nm、λEM=530nm;二色性−505nM)で読み取った。
【0347】
実施例3〜12、15、17、18、20、23、24、25、27〜34、36、44、53、54、56〜59、61、64、65、70、71、75、76、79、81および85〜125を上記のアッセイにおいて試験し、BRD2、BRD3およびBRD4アッセイのうちの1つ以上において、pIC50<5.0を有した実施例44および実施例117〜125を除いて、pIC50≧5.0を有することを見出した。実施例4、6〜9、12、24、27、28、29、31、32、34、36、53、54、56、57、58、61、64、65、70、71、75、85〜89および97は、上記のBRD2、BRD3およびBRD4のアッセイのうちの1つ以上においてpIC50≧6.0を有した。
【0348】
TNFαレベルを測定するLPS刺激性全血アッセイ
細菌性リポ多糖(LPS)などのtoll様受容体のアゴニストによる単球細胞の活性化により、TNFαを含む重要な炎症性メディエータの生成が生じる。そのような経路は、様々な自己免疫および炎症性疾患の病態生理学に重要であると広く認められている。
【0349】
試験する化合物を希釈して、様々な適切な濃度を得て、1μlの希釈ストックを96プレートのウェルに加える。全血(130μl)の添加後、プレートを37℃(5%CO2)にて30分間インキュベートし、その後、10μlの2.8μg/ml LPSを添加し、完全RPMI1640(最終濃度=200ng/ml)に希釈し、ウェルあたり140μlの全体積を得る。さらに37℃にて24時間のインキュベーション後、140μlのPBSを各ウェルに加える。プレートを密閉し、10分間振盪し、次いで遠心分離(2500rpm×10分)する。100μlの上清を除去し、TNFαレベルを、即座にまたは−20℃での保存後のいずれかで免疫学的検定により(典型的にメソスケールディスカバリー(MesoScale Discovery)技術により)アッセイした。各化合物についての用量反応曲線をデータから生成し、IC50値を算出した。
【0350】
実施例27、28、32、53、64および65を上記のアッセイにおいて試験し、pIC≧5.0を有することを見出した。
【0351】
これらのデータは、上記のアッセイにおいて試験したブロモドメイン阻害剤が重要な炎症性メディエータTNFαの生成を阻害することを実証する。これは、このような化合物が、抗炎症性プロファイルを有することを示唆する。
【0352】
限定されないが、本明細書に記載した特許および特許出願を含む全ての文献は、各々の個々の文献が具体的かつ個々に完全に記載されているように本明細書に参照として組み込まれることを示すように、本明細書に参照として組み込まれる。
【技術分野】
【0001】
本発明は、ベンゾジアゼピン化合物、そのような化合物を含む医薬組成物、および療法におけるそれらの使用に関する。
【背景技術】
【0002】
真核生物のゲノムは細胞核内で高度に組織化されている。二重鎖DNAの長い鎖は、ヌクレオソームを形成するためにヒストンタンパク質(ほとんどはヒストンH2A、H2B H3およびH4の2つのコピーを含む)の八量体周囲で覆われている。次いでこの基本単位はさらに、ヌクレオソームの凝集およびフォールディングにより圧縮されて、非常に凝縮されたクロマチン構造を形成する。様々な異なる状態の凝縮が可能であり、この構造の緊密度は細胞周期の間、変化し、細胞分裂のプロセスの間、最もコンパクトになる。クロマチン構造は、非常に凝縮されたクロマチンから効率的に起こり得ない、遺伝子転写を調節する際に重要な役割を果たす。クロマチン構造は、ヒストンタンパク質、特にヒストンH3およびH4に対する、ならびに通常、コアヌクレオソーム構造を超えて伸長するヒストン尾部内の一連の翻訳後修飾によって制御される。これらの修飾には、アセチル化、メチル化、リン酸化、ユビキチン化およびSUMO化が含まれる。これらの後成的マーカーは、ヒストン尾部内の特異的残基上に標識を取り付ける、特異的酵素によって書き出され、消去され、それによって、後成的コードを形成し、次いでそれは、細胞に読み取られて、クロマチン構造の遺伝子特異的調節およびそれによる転写を可能にする。
【0003】
修飾が、静電気を変化させることによってDNAとヒストン八量体との相互作用を緩めるため、ヒストンアセチル化は、通常、遺伝子転写の活性化と関連する。この物理的変化に加えて、特異的タンパク質はヒストン内でアセチル化リシン残基と結合して、後成的コードを読み取る。ブロモドメインは、ヒストンとの関連に限らないが、通常、アセチル化リシン残基と結合するタンパク質内の小さい(約110アミノ酸)特徴的なドメインである。ブロモドメインを含有することが知られている約50タンパク質のファミリーが存在し、それらは細胞内で様々な機能を有する。
【0004】
ブロモドメインを含有するタンパク質のBETファミリーは、近接して2つのアセチル化リシン残基に結合できるタンデムブロモドメインを含有する4つのタンパク質(BRD2、BRD3、BRD4およびBRD−t)を含み、相互作用の特異性を増加させる。BRD2およびBRD3は、活性な転写遺伝子と共にヒストンと会合することが報告されており、転写伸長を促進することに関与し得(Leroyら,Mol.Cell.2008 30(1):51−60)、一方、BRD4は、RNAポリメーラーゼのリン酸化を生じる、遺伝子を誘導するためのpTEF−B複合体の動員に関与し、転写生産を増加させるように見える(Hargreavesら,Cell,2009 138(1):129−145)。また、BRD4およびBRD3は、上皮新性組織形成の非常に悪性な形態において、新規融合癌遺伝子、BRD4−NUTを形成する、NUT(睾丸中の核タンパク質)と融合することが報告されている(Frenchら,Cancer Research,2003,63,304−307およびFrenchら,Journal of Clinical Oncology,2004,22(20),4135−4139)。データは、BRD−NUT融合タンパク質が発癌の原因であることを示唆している(Oncogene,2008,27,2237−2242)。BRD−tは睾丸および卵巣において一意的に発現される。全てのファミリーメンバーは、細胞周期の局面を制御または実行する一部の機能を有すると報告されており、細胞分裂の間、染色体との複合体に存在することが示されており、後成的メモリの維持における役割が示唆される。加えて、一部のウイルスは、ウイルス複製のプロセスの一部として、それらのタンパク質を使用して、それらのゲノムを宿主細胞クロマチンにつなぎ止める(Youら,Cell,2004 117(3):349−60)。
【0005】
特開2008−156311号公報は、ウイルス感染/増殖に対して有用性を有するBRD2ブロモドメイン結合剤と言われているベンズイミダゾール誘導体を開示している。
【0006】
国際特許出願第2009/084693A1号は、アセチル化ヒストンと、抗癌剤として有用であると言われているブロモドメイン含有タンパク質との間の結合を阻害すると言われている一連のチエノトリアゾロジアゼピン誘導体を開示している。
【0007】
ブロモドメインと、その同種アセチル化タンパク質との結合を阻害、より具体的には、アセチル化リシン残基に対するBETファミリーのブロモドメインの結合を阻害する化合物が見出されている。このような化合物は、本明細書以下で「ブロモドメイン阻害剤」と称される。
【発明の概要】
【課題を解決するための手段】
【0008】
本発明の第1の態様において、式(I)の化合物またはその塩、より具体的には式(I)の化合物またはその薬学上許容可能な塩
【化1】

【0009】
が提供される。
【0010】
本発明の第2の態様において、式(I)の化合物またはその薬学上許容可能な塩と、1種以上の薬学上許容可能な担体、希釈剤または賦形剤とを含む、医薬組成物が提供される。
【0011】
本発明の第3の態様において、治療、特にブロモドメイン阻害剤が適応される疾患または病態の治療に使用するための、式(I)の化合物、またはその薬学上許容可能な塩が提供される。
【0012】
本発明の第4の態様において、治療有効量の式(I)の化合物またはその薬学上許容可能な塩を投与することを含む、それを必要とする被験体においてブロモドメイン阻害剤が適応される疾患または病態を治療する方法が提供される。
【0013】
本発明の第5の態様において、ブロモドメイン阻害剤が適応される疾患または病態を治療するための薬剤の製造における式(I)の化合物、またはその薬学上許容可能な塩の使用が提供される。
【発明を実施するための形態】
【0014】
一実施形態において、本発明は、式(I)の化合物またはその塩
【化2】

【0015】
(式中、
XはOまたはSであり、
R1はC1−6アルキル、ハロC1−6アルキル、−(CH2)nOR1aまたは−(CH2)mNR1bR1cであり、ここで、R1aは、水素、C1−6アルキルまたはハロC1−6アルキルであり、同じであっても、異なっていてもよい、R1bおよびR1cは、水素、C1−6アルキルまたはハロC1−6アルキルであり、同じであっても、異なっていてもよい、mおよびnは、1、2または3であり、
R2は、R2a、−OR2bまたは−NR2cR2dであり、ここで、R2aおよびR2bは、カルボシクリル、カルボシクリルC1−4アルキル、ヘテロシクリルまたはヘテロシクリルC1−4アルキルであるか、あるいはR2aは、カルボシクリルエテニルまたはヘテロシクリルエテニルであり、ここで、R2aおよびR2bについて定義されるカルボシクリルまたはヘテロシクリル基は、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノ、ジメチルアミノ、ベンゾイルおよびアジドから独立して選択される1つ以上の基で置換されてもよく、または相互結合する原子と一緒にR2aもしくはR2bについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれか上の2つの隣接する基は、環が、O、SおよびNから独立して選択される1個もしくは2個のヘテロ原子を含んでもよい5員もしくは6員環を形成し、またはR2aおよびR2bは、C1−6アルキルもしくはハロC1−6アルキルであり、同じであっても、異なっていてもよい、R2cおよびR2dは、カルボシクリル、カルボシクリルC1−4アルキル、ヘテロシクリルもしくはヘテロシクリルC1−4アルキルであり、ここで、R2cおよびR2dについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノおよび−CO2C1−4アルキルから独立して選択される1つ以上の基により置換されてもよく、または相互結合する原子と一緒にR2cおよびR2dについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれか上の2つの隣接する基は、環が、O、SおよびNから独立して選択される1個もしくは2個のヘテロ原子を含んでもよい5員もしくは6員環を形成し、またはR2cおよびR2dは、水素、C1−6アルキルもしくはハロC1−6アルキルであり、
R3は、カルボシクリルまたはヘテロシクリルであり、それらのいずれかは、1つ以上のハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロもしくはシアノにより独立して置換されてもよく、またはR3はC1−6アルキルであり、
相互結合炭素原子と一緒にR4およびR5は、ベンゼンもしくは芳香族複素環を形成し、それらの各々は置換されてもよい)
に関する。
【0016】
別の実施形態において、本発明は、式(I)の化合物またはその塩
【化3】

【0017】
(式中、
XはOまたはSであり、
R1は、C1−6アルキル、ハロC1−6アルキル、−(CH2)nOR1aもしくは−(CH2)mNR1bR1cであり、ここで、R1aは、水素、C1−6アルキルもしくはハロC1−6アルキルであり、同じであっても、異なっていてもよい、R1bおよびR1cは、水素、C1−6アルキルもしくはハロC1−6アルキルであり、同じであっても、異なっていてもよい、mおよびnは1、2もしくは3であり、
R2は、R2a、−OR2bもしくは−NR2cR2dであり、ここで、R2aおよびR2bは、カルボシクリル、カルボシクリルC1−4アルキル、ヘテロシクリルもしくはヘテロシクリルC1−4アルキルであり、またはR2aは、カルボシクリルエテニルもしくはヘテロシクリルエテニルであり、R2aもしくはR2bについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノ、ジメチルアミノ、ベンゾイルおよびアジドから独立して選択される1つ以上の基により置換されてもよく、または相互結合する原子と一緒にR2aもしくはR2bについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれか上の2つの隣接する基は、環が、O、SおよびNから独立して選択される1個もしくは2個のヘテロ原子を含んでもよい5員もしくは6員環を形成し、またはR2aおよびR2bは、C1−6アルキルもしくはハロC1−6アルキルであり、同じであっても、異なっていてもよい、R2cおよびR2dは、カルボシクリル、カルボシクリルC1−4アルキル、ヘテロシクリルもしくはヘテロシクリルC1−4アルキルであり、ここで、R2cおよびR2dについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよく、または相互結合する原子と一緒にR2cおよびR2dについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれか上の2つの隣接する基は、環が、O、SおよびNから独立して選択される1個もしくは2個のヘテロ原子を含んでもよい5員もしくは6員環を形成し、またはR2cおよびR2dは、水素、C1−6アルキルもしくはハロC1−6アルキルであり、
R3は、カルボシクリルもしくはヘテロシクリルであり、それらのいずれかは、1つ以上のハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロもしくはシアノにより独立して置換されてもよく、またはR3は、C1−6アルキルであり、
相互結合炭素原子と一緒にR4およびR5は、ベンゼンもしくは芳香族複素環を形成し、それらの各々は置換されてもよい)
に関する。
【0018】
本発明の一実施形態において、式(I)の化合物はS鏡像異性体である。
【0019】
他に示さない限り、任意のアルキル基は、直鎖または分岐であってもよく、1〜6個の炭素原子、好ましくは1〜4個、特に1〜3個の炭素原子である。本明細書に使用する「アルキル」の例としては、限定されないが、メチル、エチル、n−プロピル、n−ブチル、n−ペンチル、n−ヘキシル、イソブチル、イソプロピル、t−ブチルおよび1,1−ジメチルプロピルが挙げられる。
【0020】
本明細書で使用する、用語「アルコキシ」とは、規定数の炭素原子を含有する直鎖または分岐アルコキシ基を指す。例えば、C1−6アルコキシとは、少なくとも1個、および多くても6個の炭素原子を含有する直鎖または分岐アルコキシ基を意味する。本明細書で使用する「アルコキシ」の例としては、限定されないが、メトキシ、エトキシ、プロポキシ、プロパ−2−オキシ、ブトキシ、ブト−2−オキシ、2−メチルプロパ−1−オキシ、2−メチルプロパ−2−オキシ、ペントキシまたはヘキシルオキシが挙げられる。
【0021】
他に示さない限り、任意のカルボシクリル基は、3〜14個の環原子、例えば3〜10個の環原子、またはさらなる例において、3〜8個の環原子を含み、飽和、不飽和または芳香族であってもよい。好ましい飽和カルボシクリル基は、シクロプロピル、シクロペンチルまたはシクロヘキシルである。好ましい不飽和カルボシクリル基は3個までの二重結合を含む。好ましい芳香族カルボシクリル基はフェニルである。用語、炭素環は同様に解釈されるべきである。加えて、用語、カルボシクリルは、カルボシクリル基の任意の縮合した組み合わせ、例えばナフチル、フェナントリル、インダニルおよびインデニルを含む。
【0022】
他に示さない限り、任意のヘテロシクリル基は、5〜9個の環原子、例えば5〜7個の環原子を含み、その4個までは、窒素、酸素および硫黄などのヘテロ原子であってもよく、飽和、不飽和または芳香族であってもよい。ヘテロシクリル基の例は、フリル、チエニル、ピロリル、ピロリニル、ピロリジニル、イミダゾリル、ジオキソラニル、オキサゾリル、チアゾリル、イミダゾリル、イミダゾリニル、イミダゾリジニル、ピラゾリル、ピラゾリニル、ピラゾリジニル、イソオキサゾリル、イソチアゾリル、オキサジアゾリル、トリアゾリル、チアジアゾリル、ピラニル、ピリジル、ピペリジニル、ジオキサニル、モルホリノ、ジチアニル、チオモルホリノ、ピリダジニル、ピリミジニル、ピラジニル、ピペラジニル、スルホラニル、テトラゾリル、トリアジニル、アゼピニル、オキサゼピニル、チアゼピニル、ジアゼピニルおよびチアゾリニルである。加えて、用語、ヘテロシクリルとしては、縮合ヘテロシクリル基、例えばベンズイミダゾリル、ベンゾオキサゾリル、イミダゾピリジニル、ベンズオキサジニル、ベンゾチアジニル、オキサゾロピリジニル、ベンゾフラニル、キノリニル、キナゾリニル、キノキサリニル、ジヒドロキナゾリニル、ベンゾチアゾリル、フタルイミド、ベンゾフラニル、ベンゾジアゼピニル、インドリルおよびイソインドリルが挙げられる。用語、複素環は同様に解釈されるべきである。
【0023】
ハロは、フルオロ、クロロ、ブロモまたはヨードである。
【0024】
一実施形態において、本発明は、式(I)の化合物(式中、R2は−OR2b)を提供する。一実施形態において、R2bは、C1−6アルキル、ベンジルまたはフェニルC1−6アルキルであり、ここで、ベンジルはフルオロにより置換されてもよい。別の実施形態において、R2bは、エチル、イソプロピル、ベンジル、4−フルオロベンジルまたは−CH(CH3)フェニルである。
【0025】
一実施形態において、本発明は、式(I)の化合物またはその塩を提供し、式中、R2は−OR2bである(ただし、式(I)の化合物は、以下ではない:
a)フェニルメチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート、
b)フェニル[4−(2−クロロフェニル)−2−エチル−9−メチル−6H−チエノ[3,2−f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−6−イル]カルバメート、
c)フェニルメチル[6−フェニル−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート)。
【0026】
好ましくは、XはOである。
【0027】
一実施形態において、
XがOであり、
R1が、C1−6アルキル、ハロC1−6アルキル、−(CH2)nOR1aもしくは−(CH2)mNR1bR1Cであり、ここで、R1aは、水素、C1−6アルキル、もしくはハロC1−6アルキルであり、同じであっても、異なっていてもよい、R1bおよびR1cは、水素、C1−6アルキルもしくはハロC1−6アルキルであり、同じであっても、異なっていてもよい、mおよびnは、1、2もしくは3であり、
R2が、R2a、−OR2bもしくは−NR2cR2dであり、ここで、R2aおよびR2bは、カルボシクリル、カルボシクリルC1−4アルキル、ヘテロシクリルもしくはヘテロシクリルC1−4アルキルであり、ここで、カルボシクリルもしくはヘテロシクリル基のいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロもしくはシアノにより置換されてもよく、または相互結合する原子と一緒にカルボシクリルもしくはヘテロシクリル基のいずれか上の2つの隣接する基は、環が、O、SもしくはNから独立して選択される1個もしくは2個のヘテロ原子を含んでもよい5員もしくは6員環を形成し、またはR2aおよびR2bは、C1−6アルキルもしくはハロC1−6アルキルであり、同じであっても、異なっていてもよい、R2cおよびR2dは、カルボシクリル、カルボシクリルC1−4アルキル、ヘテロシクリルもしくはヘテロシクリルC1−4アルキルであり、ここで、カルボシクリルもしくはヘテロシクリル基のいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロもしくはシアノにより置換されてもよく、または相互接続する原子と一緒にカルボシクリルもしくはヘテロシクリル基のいずれか上の2つの隣接する基は、環が、O、SもしくはNから独立して選択される1個もしくは2個のヘテロ原子を含んでもよい5員もしくは6員環を形成し、またはR2cおよびR2dは、水素、C1−6アルキルもしくはハロC1−6アルキルであり、
R3が、カルボシクリルもしくはヘテロシクリルであり、そのうちのいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロもしくはシアノにより置換されてもよく、またはR3は、C1−6アルキルであり、
相互結合炭素原子と一緒にR4およびR5は、ベンゼンもしくは芳香族複素環を形成し、それらの各々は置換されてもよい、
化合物またはその塩が提供される。
【0028】
一実施形態において、R1はC1−6アルキルである。特定の実施形態において、R1はメチルである。
【0029】
一実施形態において、R2は、R2a、−OR2bもしくは−NR2cR2dであり、ここで、R2aおよびR2bは、フェニル、ベンジルもしくはC3−6シクロアルキルであり、そのいずれかの環は、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよく、または相互結合する原子と一緒に環のいずれか上の2つの隣接する基は、メチレンジオキシ基を形成し、またはR2aおよびR2bは、C1−6アルキルもしくはハロC1−6アルキルであり、同じであっても、異なっていてもよい、R2cおよびR2dは、フェニル、ベンジルもしくはC1−6シクロアルキルであり、それらの任意の環は、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよく、または相互結合する原子と一緒に環のいずれか上の2つの隣接する基は、メチレンジオキシ基を形成し、またはR2cおよびR2dは、水素、C1−6アルキルもしくはハロC1−6アルキルである。
【0030】
特定の実施形態において、R2は−OR2bである。R2bは、好ましくは、C1−6アルキルもしくはベンジルである。
【0031】
一実施形態において、R2がR2aである式(I)の化合物またはその塩が提供される。一実施形態において、R2aは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノ、ジメチルアミノ、ベンゾイルおよびアジドから独立して選択される1つ以上の基により置換されてもよいカルボシクリルエテニルである。別の実施形態において、R2aは、フルオロ、クロロおよびメトキシから選択される1つの基により置換されてもよいカルボシクリルエテニルである。別の実施形態において、R2aは、C1−6アルキル、C1−6アルコキシおよびベンゾイルから独立して選択される1つ以上の基により置換されてもよいカルボシクリルまたはヘテロシクリルである。さらなる実施形態において、R2aは、メチル、メトキシおよびベンゾイルから選択される1つの基により置換されてもよいフェニル、ナフチルエチルまたはインドリルである。
【0032】
一実施形態において、R2が−NR2cR2dである式(I)の化合物またはその塩が提供される。一実施形態において、R2cは水素であり、R2dは、ハロゲン、C1−6アルキル、C1−6アルコキシおよび−CO2C1−4アルキルから選択される1つの基により置換されてもよいフェニルまたはベンジルである。別の実施形態において、R2cは水素であり、R2dは、臭素、エチル、メトキシおよび−CO2CH2CH3から選択される1つの基により置換される。
【0033】
一実施形態において、R3は、フェニル、チエニル、フリルまたはピリジルであり、そのうちのいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよく、R3はC1−6アルキルである。別の実施形態において、R3は、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよいフェニルである。別の実施形態において、R3は、メチル、クロロおよびメトキシから選択される1つ以上の基により置換されてもよいフェニルである。別の実施形態において、R3は、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基によりパラ位置にて置換されるフェニルである。さらなる実施形態において、R3は非置換フェニルである。
【0034】
一実施形態において、相互結合する原子と一緒に、R4およびR5は、ベンゼン、チオフェン、フランまたはベンゾフラン環(より好ましくはベンゼン、チオフェンまたはフラン環)を形成し、そのうちのいずれかは、ハロゲン、C1−6アルキル、C2−6アルケニル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノおよびヘテロシクリルから独立して選択される1つ以上の基により置換されてもよい。好ましいヘテロシクリル基はフリルまたはチエニルである。一実施形態において、相互結合する原子と一緒にR4およびR5は、置換されてもよいベンゼン環を形成する。別の実施形態において、相互結合する原子と一緒にR4およびR5は、ヨウ素により置換されてもよいベンゼン環を形成する。
【0035】
特定の実施形態において、
XはOであり、
R1はC1−6アルキルであり、
R2はR2a、−OR2bもしくは−NR2cR2dであり、ここで、R2aおよびR2bは、フェニル、ベンジルもしくはC1−6シクロアルキルであり、それらのうちの任意の環は、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよく、または相互結合する原子と一緒に環のいずれか上の2つの隣接する基はメチレンジオキシ基を形成し、またはR2aおよびR2bは、C1−6アルキルまたはハロC1−6アルキルであり、同じであっても、異なっていてもよい、R2cおよびR2dは、フェニル、ベンジルもしくはC3−6シクロアルキルであり、それらのうちのいずれかの環は、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよく、または相互結合する原子と一緒に環のいずれか上の2つの隣接する基はメチレンジオキシ基を形成し、またはR2cおよびR2dは、水素、C1−6アルキルもしくはハロC1−6アルキルであり、
R3は、フェニル、チエニル、フリルもしくはピリジルであり、それらのうちのいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよく、またはR3はC1−6アルキルであり、
相互結合する原子と一緒にR4およびR5は、ベンゼン、チオフェンもしくはフラン環を形成し、それらのいずれかは、ハロゲン、C1−6アルキル、C2−6アルケニル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノおよびヘテロシクリルから独立して選択される1つ以上の基により置換されてもよい。
【0036】
各可変物についての実施形態は、概して、各可変物について別々に上に記載しているが、本発明は、式(I)のいくつかまたは各々の実施形態が、上に記載される実施形態の各々から選択されるそれらの化合物を含む。したがって、本発明は、その塩を含む、本明細書中で上記した各々の可変物についての実施形態の全ての組み合わせを含むことを意図する。
【0037】
一実施形態において、式(I)の化合物は以下から選択される:
フェニルメチル[6−(4−フルオロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例1)、
フェニルメチル[6−(4−クロロフェニル)−1−エチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例3)、
エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例4)、
エチル[6−(4−クロロフェニル)−1−エチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例5)、
フェニルメチル[1−メチル−8−(メチルオキシ)−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例6)、
フェニルメチル{1−メチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート(実施例7)、
フェニルメチル[1−メチル−6−(4−メチルフェニル)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例8)、
フェニルメチル{1−メチル−6−[3−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート(実施例9)、
フェニルメチル(1,9−ジメチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例10)、
フェニルメチル(8−クロロ−1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例11)、
フェニルメチル(9−メチル−4−フェニル−6H−チエノ[3,2−f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−6−イル)カルバメート(実施例12)、
フェニルメチル(1−メチル−6−フェニル−4H−チエノ[2,3−f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル)カルバメート(実施例13)、
フェニルメチル[6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例14)、
フェニルメチル(1−エチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例15)、
フェニルメチル(1−メチル−6−フェニル−4H−[1]ベンゾフロ[2,3−f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル)カルバメート(実施例18)、
フェニルメチル[6−(4−クロロフェニル)−1−メチル−4H−[1]ベンゾフロ[2,3−f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル]カルバメート(実施例20)、
フェニルメチル{1−エチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート(実施例21)、
フェニルメチル[1−エチル−6−(4−フルオロフェニル)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例22)、
エチル[6−(4−フルオロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例23)、
フェニルメチル[6−(2−フルオロフェニル)−8−(2−フラニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例26)、
(+)−フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例27)、
(+)−エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例28)、
エチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例29)、
エチル[1−エチル−6−(4−フルオロフェニル)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例30)、
エチル{1−メチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート5実施例31)、
(+)−エチル1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イルカルバメート(実施例32)、
シクロヘキシル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例37)、
メチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例39)、
2,2,2−トリフルオロエチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例40)、
2−(1H−イミダゾール−1−イル)エチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例41)、
2−(4−メチル−1,3−チアゾール−5−イル)エチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例42)、
2−チエニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例43)、
2−フラニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例44)、
[4−(メチルオキシ)フェニル]メチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例45)、
2−ピリジニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例46)、
(4−クロロフェニル)メチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例47)、
シクロペンチルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例48)、
シクロペンチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例49)、
2−シクロプロピルエチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例50)、および
シクロブチルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例52)、またはそれらの塩。
【0038】
別の実施形態において、式(I)の化合物は以下から選択される:
エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例4)、
フェニルメチル[1−メチル−8−(メチルオキシ)−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例6)、
フェニルメチル{1−メチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート(実施例7)、
フェニルメチル[1−メチル−6−(4−メチルフェニル)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例8)、
フェニルメチル{1−メチル−6−[3−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート(実施例9)、
フェニルメチル(9−メチル−4−フェニル−6H−チエノ[3,2−f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−6−イル)カルバメート(実施例12)、
フェニルメチル(8−ヨード−1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例24)、
(+)−フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例27)、
(+)−エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例28)、
エチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例29)、
エチル{1−メチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート(実施例31)、
(+)−エチル1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イルカルバメート(実施例32)、
(4−フルオロフェニル)メチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例34)、
(1S)−1−フェニルエチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例36)、
6−(メチルオキシ)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−1H−インドール−2−カルボキシアミド(実施例53)、
N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−4−(フェニルカルボニル)ベンズアミド(実施例54)、
(2E)−3−[4−(メチルオキシ)フェニル]−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド(実施例56)、
(2E)−3−(4−クロロフェニル)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド(実施例57)、
(2E)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−3−(2−チエニル)−2−プロペンアミド(実施例58)、
5−メチル−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−1H−インドール−2−カルボキシアミド(実施例61)、
(2E)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−3−フェニル−2−プロペンアミド(実施例64)、
(2E)−3−(4−フルオロフェニル)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド(実施例65)、
N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−N’−フェニル尿素(実施例70)、
N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−N’−(フェニルメチル)尿素(実施例71)、
N−{[4−(メチルオキシ)フェニル]メチル}−N’−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)尿素(実施例75)、
3−ブロモ−N−(1−メチル−6−フェニル−4H−ベンゾ[f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル)ベンズアミド(実施例85)、
N−(1−メチル−6−フェニル−4H−ベンゾ[f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル)−2−ナフトアミド(実施例86)、
フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例87)、
エチル4−({[(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)アミノ]カルボニル}アミノ)ベンゾエート(実施例88)、
1−メチルエチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例89)、および
4−エチル−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)ベンズアミド(実施例97)、またはそれらの塩。
【0039】
さらなる実施形態において、式(I)の化合物は以下から選択される:
(+)−フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート(実施例27)、
(+)−エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例28)、
(+)−エチル1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イルカルバメート(実施例32)、
6−(メチルオキシ)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−1H−インドール−2−カルボキシアミド(実施例53)、
(2E)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−3−フェニル−2−プロペンアミド(実施例64)、および
(2E)−3−(4−フルオロフェニル)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド(実施例65)、またはそれらの塩。
【0040】
本発明が、遊離塩基としての、およびその塩としての、例えばその薬学上許容可能な塩としての式(I)の化合物を包含することは理解されるであろう。一実施形態では、本発明は、本発明は、式(I)の化合物およびその薬学上許容可能な塩に関する。
【0041】
式(I)の化合物の塩は薬剤において使用される可能性が高いため、式(I)の化合物の塩は、望ましくは薬学上許容可能なものである。好適な薬学上許容可能な塩としては、酸付加塩または塩基付加塩を挙げることができる。本明細書で使用する、用語「薬学上許容可能な塩」とは、受容者への投与時に(直接または間接的に)提供できる、式(I)の化合物の任意の薬学上許容可能な塩または溶媒和物を意味する。好適な塩に関する総説として、Bergeら、J. Pharm. Sci., 66:1−19, (1977)を参照のこと。典型的には、薬学上許容可能な塩は、所望の酸または塩基を適宜使用することにより、容易に調製され得る。得られる塩は、溶液から沈殿され、ろ過によって集められてもよく、または溶媒のエバポレートによって回収されてもよい。
【0042】
薬学上許容可能な塩基付加塩は、好適な溶媒の中で行われてもよい、式(I)の化合物と、好適な無機または有機の塩基、(例えばトリエチルアミン、エタノールアミン、トリエタノールアミン、コリン、アルギニン、リジンまたはヒスチジン)との反応で塩基付加塩を得て、この塩基付加塩を、例えば結晶化およびろ過によって通常単離することによって形成され得る。薬学上許容可能な塩基塩としては、アンモニウム塩、ナトリウムおよびカリウムの塩などのアルカリ金属塩、カルシウムおよびマグネシウムの塩などのアルカリ土類金属塩、ならびにイソプロピルアミン、ジエチルアミン、エタノールアミン、トリメチルアミン、ジシクロヘキシルアミンおよびN−メチル−D−グルカミンなどの第一級、第二級および第三級アミンの塩を含めた有機塩基との塩が挙げられる。
【0043】
薬学上許容可能な酸付加塩は、有機溶媒などの好適な溶媒の中で行われてもよい、式(I)の化合物と、好適な無機または有機の酸(例えば、臭化水素酸、塩化水素酸、硫酸、硝酸、リン酸、コハク酸、マレイン酸、酢酸、プロピオン酸、フマル酸、クエン酸、酒石酸、乳酸、安息香酸、サリチル酸、グルタミン酸、アスパラギン酸、p−トルエンスルホン酸、ベンゼンスルホン酸、メタンスルホン酸、エタンスルホン酸、2−ナフタレンスルホン酸などのナフタレンスルホン酸、またはヘキサン酸)との反応で塩を得て、この塩を、例えば結晶化およびろ過によって通常単離することによって形成され得る。式(I)の化合物の薬学上許容可能な酸付加塩は、例えば、臭化水素酸塩、塩化水素酸塩、硫酸塩、硝酸塩、リン酸塩、コハク酸塩、マレイン酸塩、酢酸塩、プロピオン酸塩、フマル酸塩、クエン酸塩、酒石酸塩、乳酸塩、安息香酸塩、サリチル酸塩、グルタミン酸塩、アスパラギン酸塩、p−トルエンスルホン酸塩、ベンゼンスルホン酸塩、メタンスルホン酸塩、エタンスルホン酸塩、ナフタレンスルホン酸塩(例えば2−ナフタレンスルホン酸塩)またはヘキサン酸塩を含み得、またはこれらであり得る。
【0044】
他の薬学上許容可能でない塩、例えばギ酸塩、シュウ酸塩またはトリフルオロ酢酸塩は、例えば式(I)の化合物の単離において使用され得るため、本発明の範囲内に含まれる。
【0045】
本発明は、その範囲内に、式(I)の化合物の塩のすべての可能な化学量論形態および非化学量論形態を含む。
【0046】
多くの有機化合物が、その多くの有機化合物の反応が行われるかまたは多くの有機化合物が沈殿もしくは結晶化する際に使用される溶媒と複合体を形成し得ることは理解されるであろう。これらの複合体は「溶媒和物」として知られる。例えば、水との複合体は「水和物」として知られる。高沸点を有しかつ/または水素結合を形成することができる溶媒、例えば水、キシレン、N−メチルピロリジノン、メタノールおよびエタノールは、溶媒和物を形成するために使用され得る。溶媒和物の同定のための方法としては、NMRおよび微量分析が挙げられるが、これらに限定されない。式(I)の化合物の溶媒和物は本発明の範囲内にある。
【0047】
本発明は、その範囲内に、式(I)の化合物の溶媒和物のすべての可能な化学量論形態および非化学量論形態を含む。
【0048】
本発明は、受容者への投与の際に(直接的にまたは間接的に)式(I)の化合物もしくはその薬学上許容可能な塩、またはその活性な代謝産物もしくはまたは残基を与えることができる、式(I)の化合物およびその薬学上許容可能な塩のすべてのプロドラッグを包含する。このような誘導体は、当業者にとって、過度の実験をすることなく認識できる。しかし、Burger’s Medicinal Chemistry and Drug Discovery, 5th Edition, Vol 1: Principles and Practiceの教示が参照され、この文献は、このような誘導体を教示する範囲まで、参照により本明細書に援用される。
【0049】
式(I)の化合物は、結晶性形態または非晶性形態にあり得る。さらに、式(I)の化合物の結晶性形態のうちのいくつかは、多形として存在し得、この多形は本発明の範囲内に含まれる。式(I)の化合物の多形形態は、特に限定されないが、X線粉末回折(XRPD)パターン、赤外(IR)スペクトル、ラマンスペクトル、示差走査熱量測定(DSC)、熱重量分析(TGA)および固体状態核磁気共鳴(SSNMR)などのいくつかの従来の分析技法を使用して特徴づけおよび区別され得る。
【0050】
本明細書に記載される化合物はキラル原子を含有し、その結果、光学異性体、例えば鏡像異性体またはジアステレオ異性体が形成され得る。従って、本発明は、実質的に他の異性体を含まないもの(すなわち純粋である)として単離された個々の異性体としてであろうと、または混合物(すなわちラセミ化合物およびラセミ混合物)としてであろうと、式(I)の化合物のすべての異性体を包含する。
【0051】
同様に、本発明は、式(I)の化合物の配座異性体および上記化合物のいずれの幾何(cisおよび/またはtrans)異性体にも及ぶ。
【0052】
実質的に他の異性体を含まないもの(すなわち純粋である)として単離された個々の異性体は、他の異性体が10%未満、特に約1%未満、例えば約0.1%未満存在するように単離され得る。
【0053】
異性体の分離は、当業者に公知の従来の技法によって、例えば分別晶出、クロマトグラフィーまたはHPLCによって達成され得る。
【0054】
特定の式(I)の化合物は、いくつかの互変異性体のうちの1つとして存在し得る。本発明は、個々の互変異性体としてであろうと、またはこれらの混合物としてであろうと、式(I)の化合物のすべての互変異性体を包含することは理解されるであろう。
【0055】
式(I)の化合物およびその塩の溶媒和物、異性体および多形形態が本発明の範囲内に包含されることは、上記の記載から理解されるであろう。
【0056】
式(I)の化合物またはその薬学上許容可能な塩は、標準的な化学を含めた様々な方法によって製造され得る。特段の記載がない限り、これまでに定義された変更要素のいずれも、これまでに定義された意味を持ち続ける。例示的な一般的な合成方法が以下に示され、次いで、具体的な式(I)の化合物およびその薬学上許容可能な塩が、作業実施例で調製される。これらのプロセスは、本発明のさらなる態様を形成する。
【0057】
本明細書全体を通して、一般式は、ローマ数字(I)、(II)、(III)、(IV)などによって指定される。これらの一般式のサブセットは、(Ia)、(Ib)、(Ic)など....(IVa)、(IVb)、(IVc)などと定義される。
【0058】
式(Ia)の化合物、すなわち、R2がOR2bであり、XはOである一般式(I)の化合物は、式(III)の化合物と、ヒドラジン一水和物とを反応させ、続いて、得られたヒドラゾン(II)とR1COClまたはR1C(OR)3とを反応させることによって反応スキーム1に従って調製され得る。好ましくは、ヒドラゾン(II)はさらに精製せずに使用され、室温にてR1COClと反応する。
【0059】
スキーム1
【化4】

【0060】
代替として式(Ia)の化合物、すなわち、R2がOR2aであり、XがOである式(I)の化合物は、式(IV)の化合物と、a)式ClCOOR2bの化合物、b)式(X)の化合物、c)1,1−カルボニルジイミダゾールと式R2bOHの化合物との組み合わせ、またはd)式R2bOH、トリホスゲンおよびピリジンの化合物、のいずれかとを反応させることによって、反応スキーム2に従って調製できる。好ましい条件は、室温にてトリエチルアミンの存在下で式(IV)の化合物と、ClCOOR2bとを反応させることを含む。式(X)の化合物は、ジクロロメタンおよびピリジン中でクロロギ酸4−ニトロフェニルと、R2bOHとを反応させることによって調製できる。
【0061】
スキーム2
【化5】

【0062】
式(Ib)の化合物、すなわち、R2がR2aであり、XがOである式(I)の化合物は、反応スキーム3に従って調製できる。好ましい反応条件は、EDCおよびHOBtの存在下で式(IV)の化合物と、カルボン酸R2aCO2Hとを反応させることを含む。代替として式(Ib)の化合物は、トリエチルアミンの存在下で式(IV)の化合物と、酸塩化物R2aCOClとを反応させることによって調製できる。
【0063】
スキーム3
【化6】

【0064】
式(Ic)の化合物、すなわち、R2が−NHR2cであり、XがOである式(I)の化合物は、式(IV)の化合物と、R2cNCOとを反応させることによって反応スキーム4に従って調製できる。
【0065】
スキーム4
【化7】

【0066】
式(Id)の化合物、すなわち、R2が−NHR2cであり、XがSである式(I)の化合物は、式(IV)の化合物と、R2cNCSとを反応させることによって反応スキーム5に従って調製できる。
【0067】
スキーム5
【化8】

【0068】
式(IV)の化合物は、水素雰囲気下、またはシクロヘキサジエンの存在下のいずれかで、式(Ie)の化合物、すなわち、R2がベンジルオキシであり、XがOである式(I)の化合物と、パラジウム活性炭とを反応させることによって反応スキーム6に従って調製できる。
【0069】
スキーム6
【化9】

【0070】
式(IV)の化合物はまた、還流ジクロロメタン中で式(If)の化合物、すなわち、R2がtert−ブトキシであり、XがOである式(I)の化合物と、トリフルオロ酢酸とを反応させることによって、反応スキーム7に従って調製できる。
【0071】
スキーム7
【化10】

【0072】
式(III)の化合物は、ローソン試薬またはP4S10で処理することによって式(V)の化合物から反応スキーム8に従って調製できる。好ましい反応条件は、還流トルエン中で中間体(V)と、ローソン試薬とを反応させることを含む。
【0073】
スキーム8
【化11】

【0074】
代替として式(V)の化合物は、トリエチルアミンの存在下で式(VI)の化合物と、式ClCOOR2bの化合物または式O(COOR2b)2の化合物とを反応させることによって反応スキーム9に従って調製できる。
【0075】
スキーム9
【化12】

【0076】
式(VI)の化合物は、80℃にて、酢酸中の臭化水素で処理することによって、式(Va)の化合物、すなわち、R2がベンジルオキシである式(V)の化合物から反応スキーム10に従って調製できる。
【0077】
スキーム10
【化13】

【0078】
式(V)の化合物は、室温にて、酢酸中の酢酸アンモニウムで処理することによって、式(VII)の化合物から反応スキーム11に従って調製できる。
【0079】
スキーム11
【化14】

【0080】
式(VII)の化合物は、室温にて、アンモニアのメタノール溶液で処理することによって、式(VIII)の化合物から反応スキーム12に従って調製できる。
【0081】
スキーム12
【化15】

【0082】
式(VIII)の化合物は、EDCおよびHOBt、または塩化オキサリルでの処理、およびその後、室温での式(X)の化合物とのカップリング反応により中間体(IX)から反応スキーム13に従って調製できる。
【0083】
スキーム13
【化16】

【0084】
式(IX)の化合物は、J.Org.Chem.1990,2206に記載される手順に従って調製できる。
【0085】
上記のプロセスに記載される化合物の1つ以上の官能基を保護することが好都合であり得ることは、当業者によって理解されるであろう。保護基およびそれら保護基の除去のための手段の例は、T.W.Greene「Protective Groups in Organic Synthesis」(4th edition,J.Wiley and Sons,2006)に見出され得る。好適なアミン保護基としては、アシル(例えばアセチル、カルバメート(例えば2’,2’,2’−トリクロロエトキシカルボニル、ベンジルオキシカルボニルまたはt−ブトキシカルボニル)およびアリールアルキル(例えばベンジル)が挙げられ、これらの基は、適宜、加水分解(例えば、ジオキサン中の塩化水素酸もしくはジクロロメタン中のトリフルオロ酢酸などの酸を使用する)によって、または還元的に(例えばベンジルもしくはベンジルオキシカルボニル基の水素化分解または酢酸中で亜鉛を使用する2’,2’,2’−トリクロロエトキシカルボニル基の還元的除去)除去され得る。他の好適なアミン保護基としては、塩基触媒による加水分解によって除去され得るトリフルオロアセチル(−COCF3)が挙げられる。
【0086】
上記の経路のいずれにおいても、種々の基および部分が分子へと導入される合成工程の正確な順序は変わり得ることは理解されるであろう。このプロセスの1つの段階で導入される基または部分が、その後の変換および反応によって影響を受けないことを確実にすること、およびそれに応じて合成工程の順序を選択することは、当業者の技能の範囲内であろう。
【0087】
上記の特定の中間体化合物は、新規であると考えられ、従って本発明のなおさらなる態様を形成する。
【0088】
式(I)の化合物およびその塩はブロモドメイン阻害剤であり、従って、ブロモドメイン阻害剤が適応される疾患または病態の治療において潜在的な有用性を有すると考えられる。
【0089】
従って本発明は、治療に使用するための式(I)の化合物またはその薬学上許容可能な塩を提供する。式(I)の化合物またはその薬学上許容可能な塩は、ブロモドメイン阻害剤が適応される疾患または病態の治療に使用するためであり得る。
【0090】
一実施形態において、ブロモドメイン阻害剤が適応されるいずれかの疾患または病態の治療に使用するための式(I)の化合物またはその薬学上許容可能な塩を提供する。別の実施形態において、慢性自己免疫および/または炎症病態の治療に使用するための化合物またはその薬学上許容可能な塩を提供する。さらなる実施形態において、正中線癌(midline carcinoma)などの癌の治療に使用するための化合物またはその薬学上許容可能な塩を提供する。
【0091】
一実施形態において、ブロモドメイン阻害剤が適応される疾患または病態を治療するための薬剤の製造における式(I)の化合物またはその薬学上許容可能な塩の使用を提供する。別の実施形態において、慢性自己免疫および/または炎症病態を治療するための薬剤の製造における式(I)の化合物またはその薬学上許容可能な塩の使用を提供する。さらなる実施形態において、正中線癌などの癌を治療するための薬剤の製造における式(I)の化合物またはその薬学上許容可能な塩の使用を提供する。
【0092】
一実施形態において、治療有効量の式(I)の化合物またはその薬学上許容可能な塩を投与することを含む、それを必要とする被験体においてブロモドメイン阻害剤が適応される疾患または病態を治療する方法を提供する。別の実施形態において、治療有効量の式(I)の化合物またはその薬学上許容可能な塩を投与することを含む、それを必要とする被験体において慢性自己免疫および/または炎症病態を治療するための方法を提供する。さらなる実施形態において、治療有効量の式(I)の化合物またはその薬学上許容可能な塩を、それを必要とする被験体において正中線癌などの癌を治療するための方法を提供する。
【0093】
一実施形態において、それを必要とする被験体は哺乳動物、好ましくはヒトである。
【0094】
本発明で使用する用語「有効量」は、例えば研究者または臨床医によって求められている組織、系、動物またはヒトの生物学的応答または医学的応答を引き出すであろう、薬物または医薬品の量を意味する。さらに、用語「治療有効量」は、そのような量を投与されたことがない対応する被験体と比較して、疾患、障害、もしくは副作用の改善された治療、治癒、予防、もしくは寛解、または疾患もしくは障害の前進の速度の低下を生じるいずれかの量を意味する。また、この用語は、その範囲の内に、正常な生理学的機能を亢進するために有効な量を包含する。
【0095】
ブロモドメイン阻害剤は、全身性炎症または組織の炎症、感染または低酸素症に対する炎症反応、細胞の活性化および増殖、脂質代謝、線維症に関連する様々な疾患または病態の治療、ならびにウイルス感染症の予防および治療において有用であると考えられる。
【0096】
ブロモドメイン阻害剤は、慢性関節リウマチ、変形性関節症、急性痛風、乾癬、全身性紅斑性狼瘡、多発性硬化症、炎症性腸疾患(クローン病および潰瘍性大腸炎)、喘息、慢性閉塞性気道疾患、間質性肺炎、心筋炎、心膜炎、筋炎、湿疹、皮膚炎、脱毛症、白斑、水疱性皮膚症、腎炎、血管炎、アテローム性動脈硬化症、アルツハイマー病、うつ病、網膜炎、ブドウ膜炎、強膜炎、肝炎、膵炎、原発性胆汁性肝硬変、硬化性胆管炎、アジソン病、下垂体炎、甲状腺炎、I型糖尿病および移植された臓器の急性拒絶反応などの実に様々な慢性の自己免疫性のおよび炎症性の病態の治療において有用であり得る。
【0097】
ブロモドメイン阻害剤は、急性痛風、巨細胞性動脈炎、ループス腎炎などの腎炎、糸球体腎炎などの臓器障害を伴う血管炎、巨細胞性動脈炎などの血管炎、ウェゲナー肉芽腫症、結節性多発動脈炎、ベーチェット病、川崎病、高安動脈炎、臓器障害を伴う血管炎および移植された臓器の急性拒絶反応などの実に様々な急性の炎症性の病態の治療において有用であり得る。
【0098】
ブロモドメイン阻害剤は、細菌、ウイルス、真菌、寄生生物またはそれらの毒素による感染に対する炎症反応を伴う疾患または病態、例えば、敗血症、敗血症症候群、敗血症性ショック、内毒血症、全身性炎症反応症候群(SIRS)、多臓器不全症候群、毒素性ショック症候群、急性肺傷害、ARDS(成人呼吸促迫症候群)、急性腎不全、劇症肝炎、熱傷、急性膵炎、手術後症候群、サルコイドーシス、ヘルクスハイマー反応、脳炎、脊髄炎、髄膜炎、マラリア、ならびにインフルエンザ、帯状疱疹、単純ヘルペスおよびコロナウイルスなどのウイルス感染症と関連するSIRSの予防または治療において有用であり得る。
【0099】
ブロモドメイン阻害剤は、心筋梗塞、脳血管虚血(発作)、急性冠症候群、腎臓再灌流傷害、臓器移植、冠動脈バイパス移植、心肺バイパス術、肺、腎臓、肝臓、胃腸内または肢末梢部の塞栓症などの虚血再灌流傷害と関連する病態の予防または治療において有用であり得る。
【0100】
ブロモドメイン阻害剤は、高コレステロール血症、アテローム性動脈硬化症およびアルツハイマー病などのAPO−A1の調節を介する脂質代謝の障害の治療において有用であり得る。
【0101】
ブロモドメイン阻害剤は、特発性肺線維症、腎臓の線維化、術後狭窄、ケロイド生成、強皮症および心臓繊維化などの繊維性の病態の治療において有用であり得る。
【0102】
ブロモドメイン阻害剤は、ヘルペスウイルス、ヒトパピローマウイルス、アデノウイルスおよびポックスウイルスおよび他のDNAウイルスなどのウイルス感染症の予防および治療において有用であり得る。
【0103】
ブロモドメイン阻害剤は、血液癌、上皮癌(肺癌を含む)、乳癌および結腸癌、上皮性悪性腫瘍(midline carcinoma)、間葉系腫瘍、肝腫瘍、腎腫瘍および神経腫瘍などの癌の治療において有用であり得る。
【0104】
一実施形態では、ブロモドメイン阻害剤が適応される疾患または病態は、全身性炎症反応症候群に関連する疾患、例えば敗血症、熱傷、膵炎、重症外傷、出血および虚血から選択される。この実施形態では、ブロモドメイン阻害剤は、SIRS、ショック発症、多臓器不全症候群(これは、急性肺傷害、ARDS、急性の腎臓、肝臓、心臓および胃腸内の傷害の発症を含む)の発生率ならびに死亡率を低下させるために、診断の時点で投与されるであろう。別の実施形態では、このブロモドメイン阻害剤は、高いリスクの敗血症、出血、広範囲の組織の損傷、SIRSまたはMODS(多臓器不全症候群)に関連する手術または他の術式に先だって投与され得る。特定の実施形態では、ブロモドメイン阻害剤が適応される疾患または病態は、敗血症、敗血症症候群、敗血症性ショックおよび内毒血症である。別の実施形態では、ブロモドメイン阻害剤は、急性膵炎または慢性膵炎の治療に適応される。別の実施形態では、ブロモドメイン阻害剤は熱傷の治療に適応される。
【0105】
一実施形態では、ブロモドメイン阻害剤が適応される疾患または病態は、単純ヘルペスの感染および再賦活、口唇ヘルペス、帯状疱疹(herpes zoster)の感染および再賦活、水痘、帯状疱疹(shingles)、ヒトパピローマウイルス、頸部新生物、アデノウイルス感染(急性呼吸器疾患を含む)、牛痘および天然痘およびアフリカブタ熱ウイルスなどのポックスウイルス感染から選択される。1つの特定の実施形態では、ブロモドメイン阻害剤は、皮膚または子宮頸部上皮のヒトパピローマウイルス感染の治療に適応される。
【0106】
用語「ブロモドメイン阻害剤が適応される疾患または病態」は、上記の病状のいずれかまたはすべてを包含することが意図されている。
【0107】
一実施形態では、ブロモドメインを式(I)の化合物またはその薬学上許容可能な塩と接触する工程を含む、ブロモドメインを阻害するための方法が提供される。
【0108】
療法に使用するため、式(I)の化合物およびその薬学上許容可能な塩はそのままの化学物質として投与され得ることが可能であるが、一方で、活性成分を医薬組成物として提供することが一般的である。
【0109】
従って、さらなる態様では、本発明は、式(I)の化合物または薬学上許容可能な塩と、1つ以上の薬学上許容可能な担体、希釈剤および/または賦形剤とを含む医薬組成物を提供する。式(I)の化合物およびその薬学上許容可能な塩は上記の通りである。担体(1つまたは複数)、希釈剤(1つまたは複数)または賦形剤(1つまたは複数)は、その組成物の他の成分と適合性でありかつ組成物のレシピエントにとって有害ではないという意味で許容できるものである必要がある。本発明の別の態様によれば、式(I)の化合物、またはその薬学上許容可能な塩を、1つ以上の薬学上許容可能な担体、希釈剤または賦形剤と混合する工程を含む、医薬組成物の製造方法も提供される。この医薬組成物は、本明細書に記載される病態のうちのいずれのものの治療において使用され得る。
【0110】
式(I)の化合物は医薬組成物に使用するために意図されるため、それらは、各々、実質的に純粋な形態、例えば少なくとも60%純粋、より好適には少なくとも75%純粋、好ましくは少なくとも85%純粋、とりわけ少なくとも98%純粋(重量基準に対する重量%)で与えられることが好ましいことはすぐに理解されるであろう。
【0111】
医薬組成物は、単位用量あたり所定の量の活性成分を含む単位用量形態で提示され得る。好ましい単位投薬量組成物は、1日用量もしくは分割日量、またはその適切な一部分、の活性成分を含む組成物である。従ってこのような単位用量は、1日1回よりも多く投与され得る。好ましい単位投薬量組成物は、本明細書中ですでに記載したように、1日用量もしくは(1日1回よりも多い投与のための)分割日量、またはその適切な一部分、の活性成分を含む組成物である。
【0112】
医薬組成物は、いずれかの適切な経路による、例えば経口(口腔内または舌下を含む)、経直腸、吸入、鼻腔内、局所(口腔内、舌下または経皮を含む)、膣内または非経口(皮下、筋肉内、静脈内または皮内を含む)経路による投与のために適合し得る。このような組成物は、薬学の技術分野で公知のいずれかの方法によって、例えばこの活性成分を担体(1つまたは複数)または賦形剤(1つまたは複数)と合わせることによって調製され得る。
【0113】
一実施形態では、経口投与に適合される式(I)の化合物またはその薬学上許容可能な塩を含む医薬組成物を提供する。
【0114】
一実施形態では、その医薬組成物は非経口投与、特に静脈内投与に適合される。
【0115】
非経口投与に適合させた医薬組成物としては、抗酸化剤、バッファー、静菌薬、および組成物を意図されたレシピエントの血液と等張性であるようにする溶質を含有し得る水性および非水性の滅菌注射液、ならびに懸濁剤および増粘剤を含み得る水性および非水性の滅菌懸濁剤が挙げられる。この組成物は、単位用量容器または複数用量容器、例えば密封されたアンプルおよびバイアルの中で提示され得、使用直前に、注入のために、滅菌した液体担体、例えば水の添加だけを必要とするフリーズドライの(凍結乾燥された)状態で保存され得る。すぐに使用できる注射液および懸濁剤は、滅菌された粉末、顆粒および錠剤から調製され得る。
【0116】
経口投与に適合させた医薬組成物は、カプセルもしくは錠剤、粉末もしくは顆粒、水性もしくは非水性液体中の液剤もしくは懸濁剤、食用フォームまたはホイップ、または水中油型乳濁液もしくは油中水型乳濁液などの個別単位として提示され得る。
【0117】
例えば、錠剤またはカプセル剤の形態での経口投与のために、活性薬物成分は、エタノール、グリセロール、水などの、経口用の、無毒な薬学上許容可能な不活性な担体と組み合わされ得る。錠剤またはカプセルの中へと組み込むのに好適な粉末は、当該化合物を(例えば微粉化によって)好適な微細サイズへと細かく砕き、例えば、デンプンまたはマンニトールなどの食用炭水化物などの、同様に調製した薬学上の担体と混合することにより調製される。着香剤、防腐剤、分散剤および着色剤も存在し得る。
【0118】
カプセルは、粉末混合物を上記のように調製し、形成されたゼラチンシースに充填することにより作製される。コロイドシリカ、タルク、ステアリン酸マグネシウム、ステアリン酸カルシウムまたは固体ポリエチレングリコールなどの滑剤および潤滑剤が、充填操作の前に、この粉末混合物に添加され得る。カプセル剤が服用されるときの薬剤の利用能を改善するために、寒天、炭酸カルシウムまたは炭酸ナトリウムなどの崩壊剤または溶解補助剤も、加えられ得る。
【0119】
さらに、所望される場合または必要な場合、好適な結合剤、滑剤、潤滑剤、甘味剤、香料、崩壊剤および着色剤も当該混合物の中へと組み込まれ得る。好適な結合剤としては、デンプン、ゼラチン、グルコースまたはβ−ラクトースなどの天然の糖、トウモロコシ甘味料、アラビアゴム、トラガントまたはアルギン酸ナトリウムなどの天然および合成のゴム、カルボキシメチルセルロース、ポリエチレングリコール、ワックスなどが挙げられる。これらの剤形の中で使用される潤滑剤としては、オレイン酸ナトリウム、ステアリン酸ナトリウム、ステアリン酸マグネシウム、安息香酸ナトリウム、酢酸ナトリウム、塩化ナトリウムなどが挙げられる。崩壊剤としては、デンプン、メチルセルロース、寒天、ベントナイト、キサンタンガムなどが挙げられるが、これらに限定されない。錠剤は、例えば、粉末混合物を調製し、顆粒にするかまたは小塊にし、潤滑剤および崩壊剤を添加し、そして錠剤へと押し固めることにより製剤化される。粉末混合物は、当該化合物、好適には細かく砕いた当該化合物を上記のとおりの希釈剤またはベースと、そして必要に応じてカルボキシメチルセルロース、アルギン酸塩もしくはアルギン酸エステル、ゼラチン、もしくはポリビニルピロリドンなどの結合剤、パラフィンなどの溶解遅延剤、第四級塩などの再吸収促進剤、および/またはベントナイト、カオリンもしくはリン酸二カルシウムなどの吸収剤と混合することにより調製される。この粉末混合物は、シロップ、デンプンペースト、アラビアゴム粘液、またはセルロース誘導体もしくは高分子材料の溶液などの結合剤を用いて湿らせ、ふるいに押し通すことにより顆粒化され得る。顆粒化に代わるものとして、粉末混合物は錠剤機に通され得、その結果物は不完全に形成された小塊であり、これが顆粒へと破壊される。この顆粒は、錠剤形成押型への付着を防止するために、ステアリン酸、ステアリン酸塩、タルクまたは鉱油の添加によって潤滑され得る。この潤滑された混合物は、次いで、錠剤へと圧縮される。また、式(I)の化合物およびその薬学上許容可能な塩は、自由流動性の不活性な担体と組み合わされて、顆粒化または小塊化の工程を経ることなく直接錠剤へと圧縮され得る。セラックの封止被膜、糖または高分子材料のコーティング、およびワックスの艶出しコーティングからなる透明または不透明な保護コーティングが設けられ得る。異なる単位投薬量を区別するために、色素がこれらのコーティングに添加され得る。
【0120】
液剤、シロップおよびエリキシル剤などの経口用液体は、与えられた量が所定の量の当該化合物を含むように、投薬単位形態の中に調製され得る。シロップは、当該化合物を好適に風味付けされた水性溶液に溶解させることにより調製され得るのに対し、エリキシル剤は、無毒なアルコール性のビヒクルの使用によって調製される。懸濁剤は、当該化合物を無毒なビヒクルに分散させることにより製剤化され得る。エトキシル化イソステアリルアルコールおよびポリオキシエチレンソルビトールエーテルなどの可溶化剤および乳化剤、防腐剤、ペパーミント油などの香料添加物、または天然甘味料もしくはサッカリンもしくは他の人工甘味料なども、添加され得る。
【0121】
適宜、経口投与のための投薬量単位組成物はマイクロカプセル化され得る。この製剤は、例えば、微粒子物質をポリマー、ワックスなどでコーティングするかまたは微粒子物質をポリマー、ワックスなどの中に埋め込むことにより、放出を長期化または持続させるためにも調製され得る。
【0122】
式(I)の化合物およびその薬学上許容可能な塩は、小型単層小胞体(small unilamellar vesicle)、大型単層小胞体(large unilamellar vesicle)および多層小胞体(multilamellar vesicle)などのリポソーム送達システムの形態でも投与され得る。リポソームは、コレステロール、ステアリルアミンまたはホスファチジルコリンなどの様々なリン脂質から形成され得る。
【0123】
局所投与に適合させた医薬組成物は、軟膏剤、クリーム、懸濁剤、ローション剤、粉末、液剤、ペースト、ゲル、スプレー、エアロゾルまたはオイルとして製剤化され得る。
【0124】
目または他の外部組織、例えば口および皮膚の治療のために、当該組成物は、好ましくは、局所用の軟膏剤またはクリームとして適用される。軟膏剤の中で製剤化されるとき、当該活性成分は、パラフィン系軟膏基剤または水混和性軟膏基剤のいずれかとともに用いられ得る。あるいは、その活性成分は、水中油型クリーム基剤または油中水型基剤とともにクリームの中で製剤化され得る。
【0125】
目への局所投与に適合させた医薬組成物としては、活性成分が好適な担体、とりわけ水性溶媒に溶解または懸濁されている点眼薬が挙げられる。
【0126】
鼻内投与または吸入投与のための剤形は、エアロゾル、液剤、懸濁剤、ゲルまたは乾燥粉末として製剤化されることが便利であり得る。
【0127】
吸入投与に好適かつ/または吸入投与に適合させた組成物について、式(I)の化合物またはその薬学上許容可能な塩は、例えば微粉化によって得られる粒子サイズを小さくした形態にあることが好ましい。サイズを小さくした(例えば、微粉化した)化合物または塩の好ましい粒径は、約0.5−約10ミクロン(例えば、レーザー回折を使用して測定される)のD50値によって規定される。
【0128】
例えば吸入投与のためのエアロゾル製剤は、薬学上許容可能な水性または非水性の溶媒の中の活性物質の溶液または微細懸濁液を含み得る。エアロゾル製剤は、噴霧装置もしくは吸入器と共に使用するためのカートリッジまたは詰め替え容器の形態をとり得る密閉容器中の滅菌された形態で単回用量または複数用量の量で提示され得る。あるいは、この密閉容器は、容器の内容物を使い尽くすと処分することが意図されている、計量弁(定量吸入器)が内蔵された単回投与の鼻吸入器またはエアロゾルディスペンサーなどの単一の分注デバイスであり得る。
【0129】
剤形がエアロゾルディスペンサーを含む場合、その剤形は、好ましくは、圧縮空気、二酸化炭素またはヒドロフルオロカーボン(HFC)などの有機噴霧剤などの加圧下の好適な噴霧剤を含む。好適なHFC噴霧剤としては、1,1,1,2,3,3,3−ヘプタフルオロプロパンおよび1,1,1,2−テトラフルオロエタンが挙げられる。このエアロゾル剤形はポンプ噴霧器の形態を取り得る。加圧されたエアロゾルは、活性化合物の溶液または懸濁液を含有し得る。これは、懸濁液製剤の分散特性および均質性を改善するために、さらなる賦形剤、例えば共溶媒および/または界面活性剤の組み込みを必要とし得る。液剤製剤は、エタノールなどの共溶媒の添加も必要とし得る。
【0130】
吸入投与に好適かつ/または吸入投与に適合させた医薬組成物について、医薬組成物は、乾燥粉末吸入用組成物であり得る。このような組成物は、ラクトース、グルコース、トレハロース、マンニトールまたはデンプンなどの粉末基剤と、式(I)の化合物またはその薬学上許容可能な塩(好ましくは、粒子サイズを小さくした形態、例えば微粉化した形態にある)と、必要に応じて性能調整剤(performance modifier)、例えばL−ロイシンまたは別のアミノ酸および/またはステアリン酸マグネシウムもしくはステアリン酸カルシウムなどのステアリン酸の金属塩とを含み得る。好ましくは、この乾燥粉末吸入用組成物は、ラクトース、例えばラクトース一水和物と、式(I)の化合物またはその塩との乾燥粉末混合物を含む。このような組成物は、例えば英国特許出願公開第2242134(A)号に記載されている、GlaxoSmithKlineによって販売されているDISKUS(登録商標)デバイスなどの好適なデバイスを使用することによって、患者に投与され得る。
【0131】
式(I)の化合物およびその薬学上許容可能な塩は、液体ディスペンサー、例えば、使用者が加えた力が液体ディスペンサーのポンプ機構に加えられた際に定量の液体製剤が分注されるときに通る分注用ノズルまたは分注用オリフィスを有する液体ディスペンサーからの送達のための液体製剤として製剤化され得る。このような液体ディスペンサーは、一般に、液体製剤の複数定量のタンクを具え、用量は連続的なポンプ操作によって分注することができる。分注用のノズルまたはオリフィスは、鼻腔の中への液体製剤のスプレー分注のために、使用者の鼻孔の中へと挿入するように構成され得る。上述のタイプの液体ディスペンサーは、国際公開第2005/044354(A1)号パンフレットに記載、説明されている。
【0132】
式(I)の化合物またはその薬学上許容可能な塩の治療有効量は、例えば動物の年齢および体重、治療を必要とする正確な病態、病態の重症度、製剤の性質、および投与経路などのいくつかの要因に依存するであろう。最終的には、この治療有効量は、主治医または主治獣医の判断によることになろう。上記医薬組成物では、経口投与または非経口投与のための各投薬量単位は、遊離塩基として算出して、好ましくは0.01−3000mg、より好ましくは0.5−1000mgの式(I)の化合物またはその薬学上許容可能な塩を含む。鼻内投与または吸入投与のための各投薬量単位は、遊離塩基として算出して、好ましくは0.001−50mg、より好ましくは0.01−5mgの式(I)の化合物またはその薬学上許容可能な塩を含む。
【0133】
薬学上許容可能な式(I)の化合物およびその薬学上許容可能な塩は、遊離塩基として算出して、例えば、1日あたり0.01mg−3000mgもしくは1日あたり0.5−1000mgの式(I)の化合物もしくはその薬学上許容可能な塩の経口用量もしくは非経口用量、または1日あたり0.001−50mgもしくは1日あたり0.01−5mgの式(I)の化合物もしくはその薬学上許容可能な塩の鼻内用量もしくは吸入用量の(成人の患者についての)1日用量で投与され得る。この量は、1日あたり単回投与で、またはより通常は、合計の1日用量が同じであるように1日あたりある数(2、3、4、5または6など)の分割日量で与えられ得る。その塩の有効量は、式(I)の化合物自体の有効量のある割合として決定され得る。
【0134】
式(I)の化合物およびその薬学上許容可能な塩は、単独でまたは他の治療薬と組み合わせて用いられ得る。従って、本発明に係る併用療法は、少なくとも1つの式(I)の化合物またはその薬学上許容可能な塩の投与、および少なくとも1つの他の薬学的に活性な薬剤の使用を含む。好ましくは、本発明に係る併用療法は、少なくとも1つの式(I)の化合物またはその薬学上許容可能な塩、および少なくとも1つの他の薬学的に活性な薬剤の投与を含む。式(I)の化合物(1つまたは複数)およびその薬学上許容可能な塩、ならびに上記他の薬学的に活性な薬剤(1つまたは複数)は、単一の医薬組成物の中で一緒に、または別々に投与され得、別々に投与されるとき、これは、同時にまたは任意の順序で連続的に行われ得る。式(I)の化合物(1つまたは複数)およびその薬学上許容可能な塩、ならびに上記他の薬学的に活性な薬剤(1つまたは複数)の量ならびに相対的な投与のタイミングは、所望の複合的な治療効果を成し遂げるように選択されるであろう。従って、さらなる態様では、式(I)の化合物またはその薬学上許容可能な塩と、少なくとも1つの他の薬学的に活性な薬剤とを含む組み合わせが提供される。
【0135】
従って、1つの態様では、式(I)の化合物およびその薬学上許容可能な塩、ならびに式(I)の化合物およびその薬学上許容可能な塩を含む医薬組成物は、例えば抗生物質、抗ウイルス薬、グルココルチコステロイド、ムスカリンアンタゴニストおよびβ−2アゴニストから選択される1つ以上の他の治療薬と組み合わせて使用され得、またはこのような1つ以上の他の治療薬を含み得る。
【0136】
吸入経路、静脈内経路、経口経路または鼻腔内経路によって通常投与される他の治療薬と組み合わせて式(I)の化合物またはその薬学上許容可能な塩が投与されるとき、得られる医薬組成物は同じ経路によって投与され得ることは理解されるであろう。あるいは、その組成物の個々の構成成分は、異なる経路によって投与され得る。
【0137】
本発明の一実施形態は、1つまたは2つの他の治療薬を含む組み合わせを包含する。
【0138】
適宜、上記他の治療成分(1つまたは複数)の活性および/または安定性および/または物理的特徴(溶解性など)を最適化するために、その治療成分は、例えばアルカリ金属塩もしくはアミン塩として、または酸付加塩としての塩の形態で、またはプロドラッグ、またはエステル、例えば低級アルキルエステルとして、または溶媒和物、例えば水和物として使用され得ることは、当業者には明らかであろう。適宜、この治療成分は純粋であってもよい形態で使用され得ることも明らかであろう。
【0139】
上記の組み合わせは、医薬組成物の形態で使用のために提供されることが便利であり得、従って、薬学上許容可能な希釈剤または担体と一緒に、上で定義された組み合わせを含む医薬組成物は本発明のさらなる態様を表す。
【0140】
式(I)の化合物およびその塩は、以下に記載される方法によって、または類似の方法によって調製され得る。従って、以下の中間体および実施例は、式(I)の化合物およびその塩の調製を例証する働きをするが、決して、本発明の範囲を限定すると考えられるべきではない。
【0141】
一般的な実験の詳細
全ての温度は℃で表す。
【0142】
略語
【表1】

【0143】
LC/MSは、2種類の装置で行った分析用HPLCによる分析を意味する。
【0144】
a)水の中の0.1% HCO2Hおよび0.01M 酢酸アンモニウム(溶媒A)、および水の中の95% アセトニトリルおよび0.05% HCO2H(溶媒B)を用いて、3mL/分の流量で、0〜0.7分 0%B、0.7〜4.2分 0→100%B、4.2〜5.3分 100%B、5.3〜5.5分 100→0%Bの溶出グラジエントを使用して溶出するSupelcosil LCABZ+PLUSカラム(3μm、3.3cm×4.6mm内径)にて。質量スペクトル(MS)は、エレクトロスプレー正イオン化[(ES+ve、[M+H]+および[M+NH4]+分子イオンを与える]またはエレクトロスプレー負イオン化[(ES−ve、[M−H]−分子イオンを与える]モードを使用してFisons VG Platform質量分析装置で記録した。この装置から得た分析データは、以下の形式で与えられる:[M+H]+または[M−H]−。
【0145】
b)水の中の0.01M 酢酸アンモニウム(溶媒A)および100% アセトニトリル(溶媒B)を用いて、5mL/分の流量で、0〜4分 0→100% B、4〜5分 100% Bの溶出グラジエントを使用して溶出するChromolith Performance RP 18カラム(100×4.6mm内径)にて。質量スペクトル(MS)は、大気圧化学正イオン化[AP+ve、MH+分子イオンを与える]または大気圧化学負イオン化[AP−ve、(M−H)−分子イオンを与える]モードを使用してmicromass Platform−LC質量分析装置で記録した。この装置から得た分析データは、以下の形式で与えられる:両方の質量分析源を特定するために、頭文字APCIを前に付けた[M+H]+または[M−H]−。
【0146】
c)50℃にて、水の中の0.2%v/vギ酸溶液(溶媒系A)およびアセトニトリルの中の0.15%v/vギ酸溶液(溶媒系B)で溶出するWaters Acquity UPLC BEH C18カラム(2mm×50mm内径、1.7μm充填直径)にて。以下のグラジエントを使用した。
【表2】

【0147】
UV検出系は210nm〜350nm波長からの平均シグナルであり、質量スペクトルは、交互スキャン正および負モードのエレクトロスプレーイオン化を用いて質量分析計で記録した。
【0148】
LC/HRMS:水の中の0.01M 酢酸アンモニウム(溶媒A)および100% アセトニトリル(溶媒B)を用いて、1.3mL/分の流量で、0〜0.5分 5% B、0.5〜3.75分 5→100% B、3.75〜4.5 100% B、4.5〜5 100→5% B、5〜5.5 5% Bの溶出グラジエントを使用して溶出するUptisphere−hscカラム(3μm33×3mm内径)で分析用HPLCを行った。質量スペクトル(MS)は、エレクトロスプレー正イオン化[ES+ve、MH+分子イオンを与える]またはエレクトロスプレー負イオン化[ES−ve、(M−H)−分子イオンを与える]モードを使用してmicromass LCT質量分析装置で記録した。
【0149】
Biotage(商標)クロマトグラフィーは、Dyax Corporationによって販売されている装置(Flash 40iまたはFlash 150iのいずれか)およびKP−SilTMシリカが予め充填されたカートリッジを使用して実施される精製を意味する。
【0150】
質量指向性自動分取(mass directed auto−prep HPLC)は、物質が、水の中の0.1% HCO2Hおよび95% MeCN、5% 水(0.5% HCO2H)を用いて、8mL/分の流量で、0〜1.0分 5%B、1.0〜8.0分 5→30%B、8.0〜8.9分 30%B、8.9〜9.0分 30→95%B、9.0〜9.9分 95%B、9.9〜10分 95→0%Bのグラジエント溶出条件を利用して、HPLCABZ+5μmカラム(5cm×10mm内径)で、高性能液体クロマトグラフィーによって精製される方法を意味する。Gilson 202フラクションコレクターは、注目する質量を検出した際に、VG Platform質量分析装置によって起動された。
【0151】
プロトンNMR(1H NMR)スペクトルは、室温にて、内部標準として溶媒を用いてBruker Avance 300DPXスペクトロメーターで記録し、プロトン化学シフトは個々の溶媒においてppmで表す。NMRシグナルの多重度について以下の略語を使用する:s=一重項、d=二重項、t=三重項、q=四重項、dd=双二重項(double doublet)、m=多重項。
【0152】
SPE(固相抽出)は、International Sorbent Technology Ltdによって販売されているカートリッジの使用を意味する。SCXはベンゼンスルホン酸固定相である。
【0153】
TLC(薄層クロマトグラフィー)は、シリカゲル60 F254でコーティングされたMerckによって販売されているTLCプレートの使用を意味する。
【実施例】
【0154】
実施例1:フェニルメチル[6−(4−フルオロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート
【化17】

【0155】
窒素雰囲気下で乾燥メタノール(3.3mL)中の中間体1(204mg、0.49mmol)の溶液にヒドラジン一水和物(0.36mL、7.3mmol)を加え、その溶液を室温にて2時間攪拌した。溶媒を減圧下で除去し、残渣をDCM(15mL)に溶解した。有機相を水で2回洗浄し、濃縮した。窒素雰囲気下で、乾燥THF(2mL)を加え、混合物を氷浴中で0℃に冷却した。DIPEA(0.085mL、0.51mmol)および塩化アセチル(0.036mL、5.11mmol)を加え、混合物を30分間攪拌した。溶媒を真空中で除去し、残渣を酢酸(4.1mL)に溶解し、混合物を30分間、還流にて攪拌した。溶媒を真空中で除去して、残渣を得て、それをクロロホルムに溶解し、飽和NaHCO3で洗浄した。有機相をクロロホルムで調整済みの10Si SPEカートリッジに加えた。カートリッジを1:1のEtOAc:シクロヘキサン、次いで3:1のEtOAc:シクロヘキサンで洗浄し、生成物をEtOAcで溶出した。溶媒を除去し、生成物を1,4−ジオキサンから凍結乾燥して、標題化合物を得た;LC/MS:m/z442[M+H]+,Rt=3.09分。
【0156】
式(Ia)の実施例2〜15(表1参照)を、表に示した中間体および適切な塩化アシルを用いて実施例1について記載したものと同様の方法によって調製した。
【化18】

【0157】
表1
【表3】

【0158】
実施例16:フェニルメチル[6−(2−フルオロフェニル)−8−ヨード−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート
【化19】

【0159】
乾燥DCM(3mL)中の中間体17(15mg、0.02mmol)の溶液に、ヨウ素(7.8mg、0.03mmol、1.5当量)を加え、混合物を室温にて一晩攪拌した。有機層をNa2S2O5で処理し、分離し、Na2SO4で乾燥させ、濃縮し、2滴のアセトニトリルによりジイソプロピルエーテル中で粉砕し、濾過し、フラッシュクロマトグラフィーにより精製して、橙色の固体として標題化合物(10mg)を得た:LC/MS,APCI,(M+H)+568.03,(M−H)565.98。
【0160】
実施例17:フェニルメチル[8−ブロモ−6−(2−フルオロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート
【化20】

【0161】
エタノール(10mL)中のオルト酢酸トリメチル(280μL、2.2mmol)および中間体18の溶液を、室温にて触媒量の濃硫酸(2滴)で処理し、混合物を一晩攪拌した。反応混合物を濃縮し、残渣をDCMに溶解し、水およびブラインで洗浄し、乾燥させ(Na2SO4)、濾過し、溶媒を蒸発させた。ジエチルエーテルを加え、得られた沈殿物を濾過して、標題生成物を得た;m.p.160〜170℃;HRMS C25H19BrFN5O2(M+H)+についての計算値:520.0836;実測値:520.0784。
【0162】
式(Ia)の実施例18〜25(表2参照)を、表に示した中間体および適切なオルトエステルを用いて実施例17について記載したものと同様の方法によって調製した。実施例18、19、20、21、22、23、24についてPPTSを濃硫酸の代わりに使用し、反応物を2時間還流した。
【化21】

【0163】
表2
【表4】

【0164】
実施例26:フェニルメチル[6−(2−フルオロフェニル)−8−(2−フラニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート
【化22】

【0165】
乾燥THF(10mL)中の実施例17(0.3mmole)、トリブチル(2−フラニル)スタンナン(535mg)およびPd(PPh3)4(0.1当量)の混合物を40℃にて一晩攪拌した。さらにトリブチル(2−フラニル)スタンナン(535mg)およびさらにPd(PPh3)4(0.1当量)を加え、反応混合物をさらに6時間、40℃にて攪拌した。冷却時に、塩化アンモニウム水溶液(50mL)を加え、混合物をDCM(150mL)で3回抽出した。合わせた有機層を乾燥させ(Na2SO4)、濾過し、真空中で濃縮して、残渣を得て、それを、DCM/MeOH:98/2で溶出するシリカゲルでのクロマトグラフィーにより精製した。真空中で濃縮し、EtOH/iPrOH/H2Oの混合物中で残渣を粉砕して、白色の固体として標題化合物を得た;LC/MS:APCI,m/z508.14[M+H]+,Rt=2.79分;HRMS C29H22FN5O3 (M+H)+についての計算値508.1785 実測値508.1843。
【0166】
実施例27:(+)−フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート
【化23】

【0167】
フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメートのラセミ混合物[J.Med.Chem.,(1988,31(1),176−181)に記載される手順に従って調製した]を、移動相としてヘキサン/EtOHを有する(R,R)whelk−01カラムを用いてHPLCにより分離した。サンプルを、80/20のEtOH/ヘキサン混合物中で調製した(注意:サンプルはカラムに添加する前に加熱および濾過を必要とした)。分取法に使用した系は以下の通りであった:カラム:(R,R)Whel−01 51×250mmカラム(2インチカラム);移動相:50/50、ヘキサン/EtOH;流量:45.0mL/分;UV波長:254nm。標題化合物は第1のピークとして49分で溶出した。[α]D=+44.7 c=1.0525(g/100mL)/MeOH。他の鏡像異性体は58分で現れた。
【0168】
実施例28:(+)−エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート
【化24】

【0169】
エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート(実施例4)のラセミ混合物を、移動相としてヘキサン/EtOHを有するChiralPack AD(250*4.6mm−10μm)カラムを用いてHPLCにより分離した。サンプルを60/40のEtOH/ヘキサン混合物中で調製した(注意:サンプルはカラムに添加する前に加熱および濾過を必要とした)。分取法に使用した系は以下の通りであった:ChiralPack AD(250*20mm−10μm)カラム;移動相:40/60、ヘキサン/EtOH;流量:18.0mL/分;UV波長:254nm。標題化合物は第1のピークとして16.65分に溶出した。25℃にて[α]D=+30.7 c=0.961(g/100mL)/MeOH。第2の鏡像異性体は35.40分に現れた。
【0170】
実施例29:エチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート
【化25】

【0171】
乾燥DCM(10mL)中の中間体28(140mg、0.48mmole)およびピリジン(500μL)の溶液に、1当量のクロロギ酸エチル(46μL)を加え、その溶液を室温にて一晩攪拌した。追加当量のクロロギ酸エチルを加え、反応混合物をさらに3時間、室温にて攪拌した。反応混合物を真空中で濃縮し、DCM(150mL)に溶解し、1N HCl(30mL)で2回洗浄する。有機相を炭酸水素ナトリウム溶液(30mL)およびブライン(30mL)で洗浄し、乾燥させ(Na2SO4)、濾過し、濾液を真空中で濃縮した。ジエチルエーテルを追加して、沈殿物を得て、それを濾過して、標題化合物を得た;m.p.198〜202℃;HRMS(M+H)+ C20H19N5O2についての計算値362.1539 実測値362.1548。
【0172】
式(Ig)の実施例30〜31(表3参照)を、ピリジンの代わりに触媒量のDMAPの存在下で、表に示した中間体およびトリエチルアミンを用いて実施例29について記載されるものと同様の方法によって調製した。
【化26】

【0173】
表3
【表5】

【0174】
実施例32:(+)−エチル1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イルカルバメート
【化27】

【0175】
ラセミ体の実施例29の鏡像異性体(260mg)を、15mL/分の流量で、EtOH/ヘプタン(80:20)で溶出する、1”Chiralpak ADカラムを用いて分離した。標題化合物を第1の溶出した異性体として室温にて7.5分で溶出した(125mg)。[α]D=+46.9,c=0.738(g/100mL)/MeOH。第2の鏡像異性体は室温にて13分で溶出した。
【0176】
実施例33:1−(4−フルオロフェニル)エチル1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イルカルバメート
【化28】

【0177】
乾燥MeCN(3mL)中の中間体28(150mg、0.52mmol)、中間体84(158mg、0.52mmol)およびトリエチルアミン(72μl、0.52mmol)の溶液を窒素下で4日間、75℃で加熱した。溶媒を蒸発させ、残渣を10gのSi SPEカートリッジに適用した。シクロヘキサン、次いでシクロヘキサン/DCM(3:1〜1:1〜1:3)、DCM、DCM/EtOAc(3:1〜1:1)、EtOAc/MeCN(1:1)で溶出して、標題化合物を得た;67mg、28%;LC/MS:m/z456[M+H]+,Rt 3.1分。
【0178】
式(Ih)の実施例34〜36を、示した出発物質を用いて実施例33について記載されるものと同様の方法によって調製した(表4参照)。
【化29】

【0179】
表4
【表6】

【0180】
実施例37:シクロヘキシル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート
【化30】

【0181】
THF(0.5mL)中の1,1’−カルボニルジイミダゾール(0.062g、0.038mmol、1.1当量)の溶液に、中間体28(0.010g、0.035mmol、1当量)を加え、混合物を窒素雰囲気下で16時間攪拌した。シクロヘキサノール(0.021g、0.210mmol、5.5当量)を加え、混合物を窒素雰囲気下で48時間還流した。粗物質を、Si−SPEカートリッジ(DCM/MeOH、95/5で溶出する)を用いて精製し、次いで質量指向性自動分取HPLCによってさらに精製して、白色の固体(0.006g、42%)として標題化合物を得た;LC/MS:m/z416.20[M+H]+,Rt 3.11分。
【0182】
式(Ih)の実施例38〜45を、示した中間体28および対応するアルコール(表5参照)を用いて実施例37について記載されるものと同様の方法によって調製した。実施例45についてのピリジンの代わりにDIPEAを使用し、実施例38〜44を、質量指向性自動分取HPLCよりむしろ分取HPLCを用いて精製した。
【化31】

【0183】
表5
【表7】

【0184】
実施例46:2−ピリジニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート
【化32】

【0185】
0℃(氷浴)にてTHF(1ml)中の2−ピリジニルメタノール(0.011g、0.101mmol、1.2当量)の溶液に、THF(0.5mL)中のトリホスゲン(0.010g、0.034mmol、0.4当量)およびピリジン(0.010g、0.130mmol、1.5当量)の溶液を加え、混合物を2.5時間攪拌し、次いで窒素雰囲気下で室温まで加温した。THF(2mL)中の中間体28(0.025g、0.087mmol、1当量)を滴下して加え、混合物をさらに16時間攪拌した。PS−TsCl樹脂を加え(0.140g、0.280mmol、3.2当量)、混合物を50℃にて2時間加熱し、次いで攪拌しながらさらに16時間室温まで冷却した。反応混合物を濾過し、樹脂をTHF(3×8mL)で洗浄し、粗物質を真空遠心分離により濃縮した。樹脂を分取h.p.l.c.により精製して、白色の固体として標題化合物(0.005g、14%)を得た;LC/MS:m/z425.29,Rt 2.59分。
【0186】
式(Ih)の実施例47〜52を、示した中間体28および対応するアルコール(表6参照)を用いて実施例46について記載されるものと同様の方法によって調製した。
【化33】

【0187】
表6
【表8】

【0188】
実施例53:6−(メチルオキシ)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−1H−インドール−2−カルボキシアミド
【化34】

【0189】
乾燥THF(10mL)中のHOBt(135mg、1mmol)、EDC(191mg、1mmol)、N,N−ジイソプロピルエチルアミン(140μl)および6−(メトキシ)−1H−インドール−2−カルボン酸(Aldrich)(96mg、0.6mmole)の溶液を室温にて10分間攪拌した。DCM(10mL)中の中間体28(145mg、0.5mmol)を加え、24時間攪拌した。次いでDCM(100mL)および8%炭酸水素ナトリウム溶液(1mL)を加え、有機相を乾燥させた(Na2SO4)。混合物を濾過し、真空中で濃縮して、残渣を得て、それを水で粉砕して、沈殿物を得て、それを濾過し、iPr2O(20mL)で洗浄した。アセトニトリルからの再結晶により、標題化合物を得た;m.p.160〜170℃、LC/MS:APCI m/z463.32[M+H]+,Rt=2.79分。
【0190】
式(Ii)の実施例54〜59(表7)を、示した中間体28および適切なカルボン酸を用いて実施例53について記載されるものと同様の方法によって調製した。実施例59においてN,N−ジイソプロピルエチルアミンの代わりにHOBTの存在下でトリエチルアミンを使用した。
【化35】

【0191】
表7
【表9】

【0192】
実施例60:5−(メチルオキシ)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−1−ベンゾチオフェン−2−カルボキシアミド
【化36】

【0193】
無水THF(2mL)中の5−(メチルオキシ)−1−ベンゾチオフェン−2−カルボン酸[Tetrahedron,1969,25(14),2781−2785を参照のこと](31mg、150μmol)の溶液に、PSカルボジイミドargonaut樹脂(230mg、1.31mmole/g)を加え、混合物を15分間攪拌した。中間体28(30mg、100μmol)を加え、混合物を室温にて16時間攪拌した。混合物を濾過し、真空中で濃縮し、DCM/MeOH 95/5で溶出するフラッシュクロマトグラフィーにより残渣を精製した。残渣をジイソプロピルエーテルから粉砕して、標題化合物を得た;LC/MS:APCI m/z480.13[M+H]+,Rt=2.53分;1H NMR(300MHz,CDCl3)δppm:8.17(d,1H);7.91(s,1H);7.68(m,2H);7.52−7.23(m,11H);7.04(dd,1H);6.30(d,1H);3.83(s,3H);2.63(s,3H)。
【0194】
式(Ii)の実施例61〜63(表8参照)を、示した中間体28および適切なカルボン酸を用いて実施例60について記載されるものと同様の方法によって調製した。
【化37】

【0195】
表8
【表10】

【0196】
実施例64:(2E)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−3−フェニル−2−プロペンアミド
【化38】

【0197】
HOBt(23mg、0.17mmol)、TBTU(55mg、0.17mmol)およびN,Nジイソプロピルエチルアミン(59μl、0.34mmol、2当量)を、室温にてDMF(乾燥、2.5mL)中の(2E)−3−フェニルプロパ−2−エン酸(Aldrich、27mg、0.17mmol)に加え、混合物を10分間攪拌した。中間体28(50mg、0.17mmol)を加え、混合物を5時間攪拌した。溶媒を蒸発させ、残渣を最小体積のDCMに溶解し、5gのSi SPEカートリッジを用いて精製した。多いDCMからDCM/EtOAc(3:1〜1:1〜1:3)次いでEtOAcで溶出して、白色の固体として標題化合物(60mg、83%)を得た;LC/MS:m/z420[M+H]+,Rt 3.0分。
【0198】
実施例65:(2E)−3−(4−フルオロフェニル)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド
【化39】

【0199】
標題化合物を、(2E)−3−(4−フルオロフェニル)プロパ−2−エン酸(Aldrich)から実施例64と同様の方法で調製した。LC/MS:m/z438[M+H]+,Rt 3.1分。
【0200】
実施例66:N−[2−(メチルオキシ)フェニル]−N’−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)尿素
【化40】

【0201】
DCM(2mL)中の2−メトキシフェニルイソシアネート(8.7mg、0.058mmol)の溶液に、DCM(1mL)中の1当量の中間体28を加え、反応混合物を一晩攪拌した。混合物を真空中で濃縮して、残渣を得て、それをMeOHから結晶化した後、白色の粉末として標題化合物を得た;HRMS(M+H)+ C25H23N6O2(M+H)+についての計算値439.1882;実測値439.1888。
【0202】
式(Ij)の実施例67〜78を、示した出発物質(表9参照)を用いて実施例66について記載されるものと同様の方法によって調製した。
【化41】

【0203】
表9
【表11】

【0204】

【0205】
実施例79:N−(8−ヨード−1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−N’−[4−(フェニルカルボニル)フェニル]尿素
【化42】

【0206】
THF中の中間体29(100mg、0.24mmol)、中間体88(105mg、0.29mmol、1.2当量)およびTEA(1mL)の溶液を室温にて4時間攪拌した。次いで0.5当量の中間体29を再度加え、混合物を1時間攪拌し、その後濃縮し、酢酸エチル/1N NaOHで抽出し、水およびブラインで洗浄し、Na2SO4で乾燥させ、濃縮した。粗生成物をアセトニトリルの高温溶液中で2回粉砕し、この温度で濾過して、クリーム色の固体として標題化合物を得た;LC/MS:APCI(M+H)+639.01;(M−H)=636.96;Rt 2.77。
【0207】
実施例80:N−{1−メチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}−N’−[4−フェニルカルボニル)フェニル]尿素
【化43】

【0208】
0℃にて、DCM(2mL)中の中間体27(140mg、0.44mmol、1当量)、中間体88(175mg、0.48mmol、1.1当量)の溶液に、TEA(74μL、0.53mmol、1.2当量)を加えた。反応混合物をこの温度で5時間30分攪拌し、その後、1N HClでクエンチした。有機層をNaOH 1N、ブラインで洗浄し、Na2SO4で乾燥させ、乾燥するまで蒸発させた。残渣をアセトニトリルで再結晶し、ジエチルエーテルで2回洗浄して、白色の固体として標題化合物を得た;m.p.225°C;HRMS C32H27N6O3(M+H)+について計算値543.2145 実測値543.2108;Rt=2.82分。
【0209】
実施例81:N−(4−アジドフェニル)−N’−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)チオ尿素
【化44】

【0210】
乾燥DCM(6mL)中の中間体28(50mg、0.173mmol)および4−アジドフェニルイソチオシアネート(30.5mg、0.173mmol;1当量)の溶液を、光から保護して室温にて一晩攪拌した。形成した固体を濾過して、クリーム色の固体を得た。LC/MS(M+H)+466.12;(M−H)464.10。
【0211】
式(Id)の実施例82〜84を、示した出発物質(表10参照)を用いて実施例81について記載されるものと同様の方法によって調製した。
【化45】

【0212】
表10
【表12】

【0213】
実施例85:3−ブロモ−N−(1−メチル−6−フェニル−4H−ベンゾ[f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル)ベンズアミド
【化46】

【0214】
DCM(1mL)中の1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−アミン(50mg、0.173mmol)、および3−ブロモベンゾイルクロリド(45.5mg、0.207mmol)の溶液を含有するバイアルに、TEA(0.036mL、0.259mmol)を加えた。混合物を室温にて一晩攪拌し、乾燥するまで濃縮した。Agilent HPLC(20〜100%MeCN/水+0.05%TFA)によって残渣を精製し、濃縮して、標題化合物(22.8mg、0.048mmol)を得た。LC/MS(M(79Br)+H)+472,(M(81Br)+H)+474;RT0.89分。
【0215】
実施例86:N−(1−メチル−6−フェニル−4H−ベンゾ[f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル)−2−ナフトアミド
【化47】

【0216】
DCM(1mL)中の1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−アミン(50mg、0.173mmol)、および2−ナフタレンカルボニルクロリド(39.5mg、0.207mmol)
溶液を含有するバイアルに、TEA(0.036mL、0.259mmol)を加えた。混合物を室温にて一晩攪拌し、乾燥するまで濃縮した。残渣をAgilent HPLC(20〜100%MeCN/水+0.05%TFA)により精製し、濃縮して、標題化合物(29.6mg、0.067mmol)を得た。LC/MS(M+H)+444;RT 0.90分。
【0217】
本発明のさらなる例としては以下が挙げられる:
【表13】

【0218】

【0219】

【0220】

【0221】

【0222】

【0223】
中間体
中間体1:フェニルメチル[5−(4−フルオロフェニル)−2−チオキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]カルバメート
【化48】

【0224】
ローソン試薬(252mg、0.6mmol、0.6当量)をトルエン(5mL)中の中間体37(419mg、1.0mmol)の懸濁液に加え、反応混合物を窒素下で4時間加熱還流し、次いで室温まで冷却した。得られた固体を濾過し、トルエン(40mL)および次いでEt2O(20mL)で洗浄して、クリーム色の固体として標題化合物(204mg、47%)を得た;LC/MS:m/z419[M+H]+,Rt 3.6分。
【0225】
式(III)の中間体2〜16を、示した出発物質(表11参照)から中間体1について記載されるものと同様の方法によって調製した。
【化49】

【0226】
表11
【表14】

【0227】

【0228】
中間体17:フェニルメチル[6−(2−フルオロフェニル)−1−メチル−8−(トリブチルスタンナニル)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート
【化50】

【0229】
乾燥トルエン(15mL)中の実施例17(600mg、1.15mmol)の溶液に、(Bu3Sn)2(1g、1.73mmol、1.5当量)およびPd(PPh3)4(触媒)を加えた。反応をマイクロ波(P=100W、T=200℃、10分 Pmax=10bars)下で実施し、クロマトグラフィー(DCM/MeOH 98/2)により精製した;APCI(M+H)=732.2、Rt=4.29分。
【0230】
中間体18:フェニルメチル{7−ブロモ−5−(2−フルオロフェニル)−2−[(1Z)−ヒドラジノ]−3H−1,4−ベンゾジアゼピン−3−イル}カルバメート
【化51】

【0231】
MeOH(25mL)中のフェニルメチル[7−ブロモ−5−(2−フルオロフェニル)−2−オキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]カルバメート(Neosystem;950mg、1.9mmol)の溶液にヒドラジン水和物(925μl、19mmol)を加え、混合物を室温にて2時間攪拌した。混合物を半分の体積まで濃縮し、EtOAc(2×50mL)で抽出した。抽出物を乾燥させ(硫酸ナトリウム)、減圧下で濃縮して、粗生成物として標題化合物を得て、それを精製せずに次の工程に使用した;LC/MS APCI m/z:496.23および498.23(Br同位体),Rt:2.83分。
【0232】
式(II)の中間体19〜25を、示した出発物質(表12参照)を用いて中間体18に記載されるものと同様の方法によって調製した。
【化52】

【0233】
表12
【表15】

【0234】
中間体26:1−エチル−6−(4−フルオロフェニル)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−アミン
【化53】

【0235】
室温にてMeOH(1mL)中の実施例22(100mg、0.22mmol)の懸濁液に、パラジウム炭素(100mg、10%、94μmol、0.4当量)および1,4−シクロヘキサジエン(0.11mL、1.1mmol、5当量)を加えた。反応混合物を1.5時間攪拌し、その後セライトで濾過し、濃縮して、無色の油として標題化合物(60mg、85%)を得た;Rf=0.54(DCM/MeOH:90/10);HRMS(M+H)+ C18H17FN5についての計算値322.1468 実測値322.1393。
【0236】
中間体27:1−メチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−アミン
【化54】

【0237】
室温にてMeOH(10mL)中の実施例21(0.85g、1.9mmol)の懸濁液に、パラジウム炭素(0.85g、10%、0.8mmol、0.4当量)および1,4−シクロヘキサジエン(0.95mL、9.4mmol、5当量)を加えた。反応混合物を2時間攪拌し、その後、セライトで濾過し、濃縮して、白色の固体として標題化合物(0.3g、85%)を得た;Rf=0.24(DCM/MeOH:95/5);LC/MS:m/z303[M−NH2]+,Rt 1.61分。
【0238】
中間体28:1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−アミン
【化55】

【0239】
窒素下で、メタノール(100mL)中のフェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメートの溶液[J.Med.CHem.,(1988),31(1),176−181を参照](4g、9.5mmol)に、パラジウム/炭素触媒(4g、10%)、続いて1,4シクロヘキサジエン(6mL)を加え、反応混合物を室温にて4時間攪拌した。混合物をセライトで濾過し、減圧下で濾液を蒸発させて、標題化合物を得て、それをさらに精製せずに次の工程に直接使用した。1H NMR(300MHz,CDCl3)δppm:7.6−7.2(m,9H),4.9(brs,1H),2.55(s,3H);[APCIMS]m/z273.2(MH+−NH3)。
【0240】
中間体29:8−ヨード−1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−アミン
【化56】

【0241】
DCM/TFA(8/2)中の実施例25(550mg、1.06mmol)の溶液を1時間還流した。得られた混合物をNaOH 1Nで塩基性にし、DCMで抽出し、Na2SO4で乾燥させ、濃縮して、ジエチルエーテル中で粉砕して、白色の粉末を得た;LC/MS:416.0374[M+H]+,Rt 2.34分。
【0242】
中間体30:エチル[5−(4−フルオロフェニル)−2−チオキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]カルバメート
【化57】

【0243】
ローソン試薬(1.6g、4.0mmol、0.6当量)を、トルエン(24mL)中の懸濁中間体50(2.3g、9.7mmol)に加えた。反応混合物を窒素下で2時間加熱還流して、その後減圧下で濃縮した。フラッシュクロマトグラフィー(DCM/MeOH:95/5)により精製して、黄色の固体として標題化合物(2.31g、96%)を得た;LC/MS:m/z358[M+H]+,Rt 2.48分;HRMS C18H17FN3O2S(M+H)+についての計算値358.1025 実測値358.0956。
【0244】
中間体31:フェニルメチル(7−ヨード−5−フェニル−2−チオキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル)カルバメート
【化58】

【0245】
トルエン(100mL)中の中間体51(5g、9.8mmol)の溶液およびローソン試薬(4.3g、10.8mmol、1.1当量)を100℃にて3時間加熱した。生成物をEtOAc/H2Oで抽出し、Na2SO4で乾燥させ、濃縮し、フラッシュクロマトグラフィーにより精製して、クリーム色の泡状物として標題化合物を得た;LC/MS:m/z528.16[M+H]+,526.16[M−H],Rt 3.13分。
【0246】
中間体32:1,1−ジメチルエチル(7−ヨード−5−フェニル−2−チオキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル)カルバメート
標題化合物を中間体33から中間体31と同様の方法で調製した。LC/MS:437.9585[M+H−tBu]+,Rt 3.38分。
【化59】

【0247】
中間体33:1,1−ジメチルエチル(7−ヨード−2−オキソ−5−フェニル−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル)カルバメート
【化60】

【0248】
乾燥THF中の中間体34(2.5g、6.6mmol)およびTEA(1.4mL、9.95mmol、1.5当量)の溶液に、THF中のBOC2O(1.44g、6.6mmol、1当量)の溶液を滴下して加えた。反応混合物を室温にて1時間攪拌した。得られた混合物をEtOAc/水で抽出し、有機層を飽和NaHCO3、ブラインで洗浄し、乾燥させ、濃縮した;HRMS C16H13IN3O3(M+H−tBu)+についての計算値422.0002 実測値421.9796。
【0249】
中間体34:3−アミノ−7−ヨード−5−フェニル−1,3−ジヒドロ−2H−1,4−ベンゾジアゼピン−2−オン
【化61】

【0250】
溶液HBr/AcOH 30%(50mL)に、中間体51(5g、0.98mmol)を注意深く加えた。反応混合物を80℃にて1時間攪拌した。室温まで戻した後、沈殿物を濾過し、ジエチルエーテルで2回洗浄し、次いでそれをEtOAc/H2Oに溶解し、NaOH 1Nで塩基性にした。不溶性物質を含有する有機層をエタノールに希釈し、蒸発させた;HRMS C15H13IN3O(M+H)+についての計算値378.0103 実測値378.9972。
【0251】
中間体35:エチル[5−(4−クロロフェニル)−2−オキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]カルバメート
【化62】

【0252】
THF(100mL)中の中間体36(5.34g、18.7mmol)の懸濁液に、TEA(2.87mL、20.57mmol、1.1当量)を加え、0℃まで冷却した。次いで、THF(10mL)中のクロロギ酸エチル(1.97mL、20.57mmol、1.1当量)の溶液を反応混合物に滴下して加えた。2時間の攪拌後、反応混合物を蒸発させ、DCMに希釈し、水で洗浄し、乾燥させ、乾燥するまで蒸発させた。フラッシュクロマトグラフィー(DCM/MeOH 98/2)により残渣を精製して、白色の固体として標題化合物を得た;LC/MS:m/z358.13[M+H]+,Rt 2.42分。
【0253】
中間体36:3−アミノ−5−(4−クロロフェニル)−1,3−ジヒドロ−2H−1,4−ベンゾジアゼピン−2−オン
【化63】

【0254】
AcOH(35mL)中の中間体38(7.5g、17.86mmol)の懸濁液に、HBr/AcOH37%(35mL、178.6mmol、10当量)を加え、80℃にて1時間加熱した。得られた混合物を室温まで冷却した後、黄色の固体を形成させ、それを濾過し、ジイソプロピルエーテルで洗浄した。次いで固体をDCM(250mL)およびNaOH 1N(250mL)の混合物中で1時間攪拌した。固体を濾過し、水で洗浄した。得られた有機層を水で洗浄し、乾燥させ、乾燥するまで蒸発させた;LC/MS:m/z286.04[M+H]+,Rt 1.87分。
【0255】
中間体37:フェニルメチル[5−(4−フルオロフェニル)−2−オキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]カルバメート
【化64】

【0256】
酢酸アンモニウム(470mg、6.1mmol、5当量)を氷酢酸(10mL)中の中間体52(515mg、1.22mmol)の溶液に加え、24時間室温にて攪拌した。溶媒を蒸発させ、残渣をトルエン(2×20mL)と共蒸発させた。混合物を2N NaOH(約20mL)で塩基性にし、EtOAc(3×50mL)で抽出し、乾燥させて(Na2SO4)、標題化合物を得た;LC/MS:m/z404[M+H]+,Rt 3.25分。;m.p.>260°C;HRMS C25H20N3O4についての計算値(M+H)+426.1454 実測値426.1436。
【0257】
式(V)の中間体38〜46を、示した出発物質(表13参照)から中間体37について記載されるものと同様の方法によって調製した。
【化65】

【0258】
表13
【表16】

【0259】
中間体47:フェニルメチル(2−オキソ−5−フェニル−2,3−ジヒドロ−1H−[1]ベンゾフロ[3,2−e][1,4]ジアゼピン−3−イル)カルバメート
【化66】

【0260】
MeOH(50mL)中の7Nアンモニアを窒素下で室温にて中間体75(想定21.1mmol)に加え、混合物を室温にて4時間攪拌した。次いで酢酸(20mL、0.35mol、17当量)を滴下して加えた。次いでMeOH(50mL)を加え、反応混合物を2日間攪拌した。混合物を減圧下で乾燥するまで蒸発させた。固体をトルエン(50mL)に懸濁し、過剰なAcOHを除去するために再度濃縮した(この手順を2回繰り返す)。次いで得られた固体をDCM(100ml)で希釈し、水(1×50mL)および飽和炭酸水素ナトリウム溶液(50mL)で洗浄し、その後、減圧下で濃縮した。フラッシュクロマトグラフィー(DCM100%〜DCM/MeOH:95/5)により精製して、黄色の泡状物として標題化合物(1.9g、22%)を得た;Rf=0.50(DCM/MeOH:95/5);m.p.>260°C;HRMS C25H20N3O4(M+H)+についての計算値426.1454 実測値426.1436。
【0261】
中間体48:エチル[5−(4−クロロフェニル)−2−オキソ−2,3−ジヒドロ−1H−[1]ベンゾフロ[3,2−e][1,4]ジアゼピン−3−イル]カルバメート
【化67】

【0262】
MeOH(15mL)中の7Nアンモニアを窒素下で室温にて中間体76(想定73.6mmol)に加え、混合物を室温にて3時間攪拌し、その後AcOH(90mL、1.6mol、17当量)を滴下して加えた。次いでMeOH(50mL)を加え、反応混合物を2日間攪拌し、その後濾過した。固体をトルエン(50mL)で洗浄し、高温CH3CN中で粉砕し、その後再度濾過して、緑黄色の固体として標題化合物(11.4g、39%)を得た;Rf=0.20(DCM/MeOH:95/5);m.p.>260℃;LC/MS:m/z398[M(35Cl)+H]+,Rt 2.64分。
【0263】
中間体49:フェニルメチル{5−[4−(メチルオキシ)フェニル]−2−オキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル}カルバメート
【化68】

【0264】
酢酸アンモニウム(22.4g、0.29mol、5当量)を室温にて氷酢酸(400mL)中の中間体66(58.1mmol)の溶液に加え、反応混合物を15時間室温にて攪拌し続けた。溶媒を蒸発させ、残渣をトルエン(2×200mL)で共蒸発させた。得られた固体を濾過し、トルエン(2×250mL)で洗浄し、濾液を飽和NaHCO3水溶液(3×75mL)で洗浄し、Na2SO4で乾燥させ、蒸発させた。フラッシュクロマトグラフィー(DCM/MeOH:98/2)により精製して、淡黄色の固体として標題化合物(3工程にわたって16.2g、67%)を得た;Rf=0.45(DCM/MeOH:95/5);1HNMR(300MHz,CDCl3)δppm:7.55−7.07(m,13H),6.86(d,2H,J=8.6Hz),5.38(d,1H,J=8.3Hz),5.20(s,2H),3.79(s,3H);HRMS(M+H)+ C24H22N3O4についての計算値416.1610 実測値416.1544。
【0265】
中間体50:エチル[5−(4−フルオロフェニル)−2−オキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]カルバメート
【化69】

【0266】
MeOH(50mL)中の7Nアンモニアを室温にて窒素下で中間体77(想定50.2mmol)に加え、混合物を2.5時間攪拌し、その後AcOH(30mL、0.52mol、10当量)を滴下して加えた。反応混合物を2日間攪拌し、その後乾燥するまで減圧下で濃縮した。得られた固体をDCM(100mL)に懸濁し、飽和炭酸水素ナトリウム溶液(150mL)およびブライン(100mL)で洗浄し、Na2SO4で乾燥させ、真空中で溶媒を除去した。フラッシュクロマトグラフィー(DCM/MeOH:95/5)により精製して、白色の固体として標題化合物(3工程にわたって2.3g、13%)を得た;Rf=0.22(DCM/MeOH:95/5);1H NMR(300MHz,DMSO d6)δppm:10.86(brs,1H),8.18(d,1H,J=8.5Hz),7.64(m,1H),7.57−7.49(m,2H),7.36−7.21(m,5H),5.00(d,1H,J=8.5Hz),4.02(q,2H,J=7.1Hz),1.19(t,3H,J=7.1Hz);LC/MS:m/z342[M+H]+,Rt2.18分;HRMS(M+H)+ C18H17FN3O3についての計算値342.1254 実測値342.1163。
【0267】
中間体51:フェニルメチル(7−ヨード−2−オキソ−5−フェニル−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル)カルバメート
【化70】

【0268】
酢酸アンモニウム(30g)を氷酢酸(200mL)中の中間体63(4.5g、8.8mmol)の溶液に加え、室温にて3時間攪拌した。形成した沈殿物を濾過し、水で3回、およびジエチルエーテルで2回洗浄して、白色の粉末として標題化合物を得た;LC/MS:m/z512.17[M+H]+、Rt=2.91分。
【0269】
中間体52:フェニルメチル[1−アミノ−2−({2−[(4−フルオロフェニル)カルボニル]フェニル}アミノ)−2−オキソエチル]カルバメート
【化71】

【0270】
MeOH(25mL)中の7Nアンモニアを窒素下で室温にて中間体64(633mg、1.2mmol)に加え、混合物を室温にて1時間攪拌した。反応混合物をEtOAc(100mL)で希釈し、1N NaOH溶液(2×50mL)で洗浄した。水層をEtOAc(50mL)で抽出し、合わせた有機物を乾燥させ(Na2SO4)、蒸発させて、黄色の泡状物として標題化合物(515mg、100%)を得た;LC/MS:m/z421[M+H]+,Rt 2.7分。
【0271】
一般式(VIa)の中間体53〜62を、示した出発物質(表14参照)を用いて中間体52について記載されるものと同様の方法によって調製した。
【化72】

【0272】
表14
【表17】

【0273】
中間体63:フェニルメチル(1−アミノ−2−{[4−ヨード−2−(フェニルカルボニル)フェニル]アミノ}−2−オキソエチル)カルバメート
【化73】

【0274】
0℃にて無水THF(500mL)中の中間体82(30g、92.8mmol)の溶液に、塩化オキサリル(55mL、111.5mmol、1.2当量)、続いてDMF(5mL)を滴下して加えた。0℃にて3時間攪拌した後、THF中のNMM(12.3mL、111.5mmol、1.2当量)および1H−1,2λ5,3−ベンゾトリアゾール−2−イル({[(フェニルメチル)オキシ]カルボニル}アミノ)酢酸(30.2mg、92.8mmol、1当量)の溶液を加えた。反応混合物を0℃にて1時間、室温にて一晩攪拌した。得られた混合物を水(200mL)で加水分解し、次いで有機層を酢酸エチルで抽出し、ブラインで洗浄し、乾燥させ、濃縮した。残渣をMeOH/NH3 7N(300mL)に部分的に溶解し、0℃にて1時間攪拌した。固体を濾過し、ジエチルエーテルで洗浄し、乾燥させて、標題化合物を得た。
【0275】
中間体64:フェニルメチル[1−(1H−1,2,3−ベンゾトリアゾール−1−イル)−2−({2−[4−フルオロフェニル)カルボニル]フェニル}アミノ)−2−オキソエチル]カルバメート
【化74】

【0276】
乾燥DCM(30mL)中の(2−アミノフェニル)(4−フルオロフェニル)メタノン(国際公開第00/05195号パンフレットに従って調製した)(440mg、2.0mmol)および1H−1,2,3−ベンゾトリアゾール−1−イル{[(ベンジルオキシ)カルボニル]アミノ}酢酸イルカルバメート(J.Org.Chem.,(1990),55,2206を参照のこと)(1.0g、3.8mmol、1.5当量)を窒素下で0℃に冷却した。EDC(3.07mmol)、および4−DMAP(30mg)を加え、続いて10分後に溶液を補助するためにN,N−ジイソプロピルエチルアミン(534μl、1.5当量)を加えた。得られた溶液を室温まで加温し、1時間攪拌した。反応物を8%飽和炭酸水素ナトリウム(2×40mL)およびブライン(2×40mL)で洗浄し、乾燥させた(水性抽出カートリッジ)。化合物を、DCM〜DCM/EtOAc(4:1)で溶出する、10gのSi/SPEカートリッジを用いて精製して、黄色の泡状物として標題化合物(633mg、59%)を得た;LC/MS:m/z524[M+H]+,Rt 3.6分。
【0277】
式(VIIa)の中間体65〜72を、以前の合成が既に文献に報告されている対応するアミノベンゾフェノン(表15参照)を用いて中間体64について記載されるものと同様の方法によって調製した。
【化75】

【0278】
表15
【表18】

【0279】
中間体73:フェニルメチル(1−(1H−1,2,3−ベンゾトリアゾール−1−イル)−2−{[2−[(4−クロロフェニル)カルボニル]−4−(メチルオキシ)フェニル]アミノ}−2−オキソエチル)カルバメート
【化76】

【0280】
−10℃にてTHF(170mL)中の1H−1,2,3−ベンゾトリアゾール−1−イル({[(フェニルメチル)オキシ]カルボニル}アミノ)酢酸(17.7g、54.29mmol)の懸濁液に、塩化オキサリル(27mL、65.15mmol、1.2当量)を滴下して加えた。5分後、DMFを加え(500μL)、反応混合物を0℃にて3時間攪拌した。次いで、この温度にて、THF(100mL)中の中間体80(11.8mg、54.29mmol、1当量)およびN−メチルモルホリン(5mL、54.29mmol、1当量)の溶液を滴下して加えた。得られた混合物を室温にて2日間攪拌した。形成した沈殿物を濾過し、水で洗浄し、乾燥させて、黄色の固体として標題化合物を得て、それをさらに精製せずに次の工程に使用した。
【0281】
中間体74:フェニルメチル{1−(1H−1,2,3−ベンゾトリアゾール−1−イル)−2−[(2−{[4−(メチルオキシ)フェニル]カルボニル}フェニル)アミノ]−2−オキソエチル}カルバメート
【化77】

【0282】
乾燥DCM(790mL)中の中間体78(13.2g、58.1mmol)および1H−1,2,3−ベンゾトリアゾール−1−イル{[(ベンジルオキシ)カルボニル]アミノ}酢酸(28.4g、87.0mmol 1.5当量)を窒素下で0℃に冷却した。EDCI(16.7g、87.0mmol、1.5当量)および4−DMAP(0.7g、5.8mmol、0.1当量)を0℃にて加え、得られた溶液を1時間攪拌した。反応物を飽和炭酸水素ナトリウム溶液(2×300mL)およびブライン(2×300mL)で洗浄した。有機層をNa2SO4で乾燥させ、真空中で溶媒を除去して、粗生成物として標題化合物を得て、それを精製せずに次の工程に使用した;LC/MS:m/z417[M−Bt]+,Rt 2.90分。
【0283】
中間体75:フェニルメチル(1−(1H−1,2,3−ベンゾトリアゾール−1−イル)−2−オキソ−2−{[2−(フェニルカルボニル)−1−ベンゾフラン−3−イル]アミノ}エチル)カルバメート
【化78】

【0284】
乾燥THF(60mL)中の1H−1,2,3−ベンゾトリアゾール−1−イル{[(ベンジルオキシ)カルボニル]アミノ}酢酸(J.Org.Chem.1990,55,2206に従って調製した)(6.9g、21.1mmol、1.0当量)を窒素下で0℃に冷却し、塩化オキサリル(11.6mL、23.2mmol、1.1当量)を滴下して加え、続いて乾燥DMF(4滴)を加えた。反応混合物をこの温度にて2時間攪拌し、その後乾燥THF(20mL)中の中間体81(5.0g、21.1mmol)およびNMM(2.3mL、21.1mmol、1.0当量)の溶液を滴下して加えた。得られた溶液を室温まで加温し、18時間攪拌し、その後濾過した。濾液を減圧下で濃縮して、粗生成物として標題化合物を得て、それを精製せずに次に工程に使用した。
【0285】
中間体76:エチル[1−(1H−1,2,3−ベンゾトリアゾール−1−イル)−2−({2−[(4−クロロフェニル)カルボニル]−1−ベンゾフラン−3−イル}アミノ)−2−オキソエチル]カルバメート
【化79】

【0286】
乾燥THF(500mL)中の1H−1,2,3−ベンゾトリアゾール−1−イル{[(エトキシ)カルボニル]アミノ}酢酸(J.Org.Chem.1990,55,2206に従って調製した)(25.3g、95.7mmol、1.3当量)を0℃にて窒素下で冷却し、塩化オキサリル(51.5mL、0.1mol、1.4当量)を滴下して加え、その後乾燥DMF(4滴)を滴下して加えた。反応混合物をこの温度で2時間攪拌し、その後乾燥THF(400mL)中の中間体82(20.0g、73.6mmol)およびNMM(10.5mL、95.7mmol、1.3当量)の溶液を滴下して加えた。得られた溶液を室温まで加温し、18時間攪拌し、その後濾過した。濾液を減圧下で濃縮して、粗生成物として標題化合物を得て、それを精製せずに次の工程に使用した。
【0287】
中間体77:エチル[1−(1H−1,2,3−ベンゾトリアゾール−1−イル)−2−({2−[(4−フルオロフェニル)カルボニル]フェニル}アミノ)−2−オキソエチル]カルバメート
【化80】

【0288】
乾燥DCM(680mL)中の(2−アミノフェニル)(4−フルオロフェニル)メタノン(国際公開第00/05195号パンフレット)(10.8g、50.2mmol)および1H−1,2,3−ベンゾトリアゾール−1−イル{[(エチルオキシ)カルボニル]アミノ}酢酸(19.9g、75.3mmol、1.5当量)を窒素下で0℃に冷却した。EDCI(14.4g、75.3mmol、1.5当量)およびi−Pr2NEt(13.1mL、75.3mmol、1.5当量)を0℃にて加え、得られた溶液を室温まで加温し、18時間攪拌した。反応物を飽和炭酸水素ナトリウム溶液(2×200mL)およびブライン(2×200mL)で洗浄した。有機層をNa2SO4で乾燥させ、真空中で溶媒を除去して、粗生成物として標題化合物を得て、それを精製せずに次の工程に使用した。
【0289】
中間体78:(2−アミノフェニル)[4−(メチルオキシ)フェニル]メタノン
【化81】

【0290】
−78℃にて乾燥THF(830mL)中の2−アミノ−N−メチル−N−(メチルオキシ)ベンズアミド酸(J.Org.Chem,1991,56,3750に従って調製した)(25.6g、0.14mol)および4−ブロモアニソール(17.8mL、0.14mol)の溶液に、n−BuLi(182.0mL、ヘキサン中に1.6M、0.29mol、2.05当量)を2時間、滴下して加えた。添加を行ったとき、反応混合物をこの温度で0.5時間攪拌し、その後1.2N HCl(256mL)でクエンチした。水層をEtOAc(3×300mL)で抽出し、合わせた有機層を水(500mL)、ブライン(500mL)で洗浄し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。フラッシュクロマトグラフィー(シクロヘキサン/エーテル:8/2次いで1/1)により精製して、暗橙色の油として標題化合物(22.7g、70%)を得た;1H NMR(300MHz,CDCl3)δppm:7.56(m,2H),7.34(m,1H),7.15(m,1H),6.83(m,2H),6.61(m,1H),6.50(m,1H),5.74(brs,2H),3.75(s,3H)。
【0291】
中間体79:[2−アミノ−5−(メチルオキシ)フェニル](4−クロロフェニル)メタノン
【化82】

【0292】
0℃にてトルエン/エーテル(2/1)混合物(760mL)中の中間体83(40.0g、0.21mol、1当量)の溶液に、4−クロロフェニルマグネシウムブロミド(170mL、Et2O中の1M、0.17mol、0.8当量)の溶液を滴下して加えた。反応混合物を室温まで加温し、1時間攪拌し、その後1N HCl(200mL)でクエンチした。水層をEtOAc(3×150mL)で抽出し、合わせた有機物をブライン(100mL)で洗浄し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。次いで粗化合物をEtOH(400mL)に溶解し、6N HCl(160mL)を加えた。反応混合物を2時間還流し、その後3分の1の体積まで濃縮した。得られた固体を濾過し、エーテルで2回洗浄し、その後EtOAcに懸濁し、1N NaOHで中和した。水層をEtOAc(3×150mL)で抽出し、合わせた有機物をブライン(150mL)で洗浄し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。標題化合物を黄色の固体(39g、88%収率)として得た;LC/MS:m/z262[M+H]+,Rt 2.57分。
【0293】
中間体80:(3−アミノ−1−ベンゾフラン−2−イル)(フェニル)メタノン
【化83】

【0294】
アセトン(1L)中の2−シアノフェノール(24.5g、0.2mol)および2−ブロモアセトフェノン(40.9g、0.2mol)の溶液に、炭酸カリウム(85.2g、0.6mol、3当量)を加えた。反応混合物を窒素下で18時間、60℃で加熱し、次いで室温に冷却した。K2CO3を濾過し、アセトン(100ml)で洗浄し、濾液を減圧下で濃縮して、黄色の固体として標題化合物(48.8g、100%)を得た;m.p.122−124°C;1H NMR(300MHz,CDCl3)δppm:8.17(dd,2H,J=7.7and1.8Hz),7.56(d,1H,J=7.9Hz),7.51−7.36(m,5H),7.19(m,1H),5.20(brs,2H);LC/MS:m/z238[M+H]+,Rt2.59分。
【0295】
中間体81:(3−アミノ−1−ベンゾフラン−2−イル)(4−クロロフェニル)メタノン
【化84】

【0296】
アセトン(500mL)中の2−シアノフェノール(15.0g、0.12mol)および2−ブロモ−4’−クロロアセトフェノン(29.4g、0.12mol)の溶液に、炭酸カリウム(52.2g、0.38mol、3当量)を加えた。反応混合物を窒素下で18時間加熱還流し、次いで室温まで冷却した。K2CO3を濾過し、アセトン(100ml)およびDCM(100mL)で洗浄し、減圧下で濾液を濃縮した。次いで粗固体を冷CH3CNで洗浄して、濾過後に黄色の固体として標題化合物(21.6g、63%)を得た。Rf=0.80(DCM/MeOH:98/2);m.p.202−204℃;1HNMR(300MHz,CDCl3)δppm:8.20(d,2H,J=8.4Hz),7.63(d,1H,J=7.9Hz),7.62−7.41(m,4H),7.28(m,1H),6.05(brs,2H);LC/MS:m/z272[M+H]+,Rt2.97分。
【0297】
中間体82:(2−アミノ−5−ヨードフェニル)(フェニル)メタノン
【化85】

【0298】
−70℃にて無水DCM(800mL)中の2−アミノベンゾフェノン(50g、263mmol)の溶液に、一塩化ヨウ素(49.4g、305mmol、1.2当量)を加えた。反応混合物を−60℃にて5時間、次いで室温にて一晩攪拌した。得られた混合物を飽和Na2SO4水溶液で加水分解し、次いでDCMで抽出した。得られた固体を濾過して、標題化合物を得て、それをさらに精製せずに使用した。
【0299】
中間体83:2−メチル−6−(メチルオキシ)−4H−3,1−ベンゾオキサジン−4−オン
【化86】

【0300】
5−メトキシアントラニル酸(Lancaster)(41.8g、0.25mol)の溶液を、無水酢酸(230mL)中で3.5時間、還流下で加熱し、その後、減圧下で濃縮した。次いで粗化合物をトルエンの存在下で2回濃縮し、次いで濾過した。得られた固体をエーテルで2回洗浄して、茶色の固体として標題化合物(33.7g、71%収率)を得た;LC/MS:m/z192[M+H]+,Rt 1.69分。
【0301】
中間体84:1−(4−フルオロフェニル)エチル4−ニトロフェニルカルボネート
【化87】

【0302】
乾燥DCM(10mL)中のクロロギ酸4−ニトロフェニル(673mg、3.34mmol)の溶液を、0℃にて窒素下で、乾燥DCM(10mL)中の1−(4−フルオロフェニル)エタノール(468mg、3.34mmol)およびピリジン(283μl、3.5mmol)の溶液に滴下して加え、混合物を0℃にて1時間、次いで室温にて2日間攪拌した。混合物を2N HClで洗浄し、層を分離した。有機抽出物をシクロヘキサンで希釈し、10gのSi SPEカートリッジに適用した。DCM/シクロヘキサン(1:1)、続いてDCMで溶出して、標題化合物(180mg、18%)を得た、LC/MS:m/z306[M+H]+,Rt 3.5分。
【0303】
式(X)の中間体85〜87を、示した出発物質(表16参照)を用いて中間体84について記載されるものと同様の方法によって調製した。
【化88】

【0304】
表16
【表19】

【0305】
中間体88:4−ニトロフェニル[3−(フェニルカルボニル)フェニル]カルバメート
【化89】

【0306】
DCM(250mL)中の4−アミノベンゾフェノン(3g、15.2mmol)の溶液にDMAP(1g)を加えた。次いでDCM中の4−ニトロフェニルクロリドカルボネート(9.2g、3当量)の溶液を滴下して加え、反応混合物を室温にて1時間攪拌した。沈殿物を濾過し、DCMおよびジイソプロピルエーテルで洗浄して、クリーム色の固体(1.8g)を得て、それをさらに精製せずに使用した。
【0307】
本明細書に参照したLC/MS法DおよびFの実験の詳細は以下の通りである:
LC/MS(方法D)は、水の中の0.1% HCO2Hおよび0.01M 酢酸アンモニウム(溶媒A)、および水の中の95% アセトニトリルおよび0.05% HCO2H(溶媒B)を用いて、3mL/分の流量で、0〜0.7分 0%B、0.7〜4.2分 0→100%B、4.2〜5.3分 100%B、5.3〜5.5分 100→0%Bの溶出グラジエントを使用して溶出するSupelcosil LCABZ+PLUSカラム(3μm、3.3cm×4.6mm内径)にて行った。質量スペクトル(MS)は、エレクトロスプレー正イオン化[(ES+ve、[M+H]+および[M+NH4]+分子イオンを与える]またはエレクトロスプレー負イオン化[(ES−ve、[M−H]−分子イオンを与える]モードを使用してFisons VG Platform質量分析装置で記録した。この装置から得た分析データは、以下の形式で与えられる:[M+H]+または[M−H]−。
【0308】
LC/MS(方法F)は、30℃にて、水の中の0.1%v/vトリフルオロ酢酸溶液(溶媒A)およびアセトニトリルの中の0.1%v/vトリフルオロ酢酸溶液(溶媒B)を用いて、3ml/分の流量で、0〜0.1分 3%B、0.1〜4.2分 3〜100%B、4.2〜4.8分 100%B、4.8〜4.9分 100〜3%B、4.9〜5.0分 3%Bの溶出グラジエントを使用して溶出するSunfire C18カラム(30mm×4.6mm内径、3.5μm充填直径)にて行った。UV検出は、210nm〜350nmの波長からの平均シグナルであり、質量スペクトルは、正エレクトロスプレーイオン化を用いて質量分析計で記録した。イオン化データは整数に四捨五入した。
【0309】
LC/HRMS:水の中の0.01M 酢酸アンモニウム(溶媒A)および100% アセトニトリル(溶媒B)を用いて、1.3mL/分の流量で、0〜0.5分 5% B、0.5〜3.75分 5→100% B、3.75〜4.5 100% B、4.5〜5 100→5% B、5〜5.5 5% Bの溶出グラジエントを使用して溶出するUptisphere−hscカラム(3μm33×3mm内径)で分析用HPLCを行った。質量スペクトル(MS)は、エレクトロスプレー正イオン化[ES+ve、MH+分子イオンを与える]またはエレクトロスプレー負イオン化[ES−ve、(M−H)−分子イオンを与える]モードを使用してmicromass LCT質量分析装置で記録した。
【0310】
TLC(薄層クロマトグラフィー)は、シリカゲル60 F254でコーティングされたMerckによって販売されているTLCプレートの使用を意味する。
【0311】
シリカクロマトグラフィー技術としては、自動(FlashmasterまたはBiotage SP4)技術または予め充填したカートリッジ(SPE)もしくは手動で充填したフラッシュカラム上での手動クロマトグラフィーが挙げられる。
【0312】
化合物または試薬の名称の後に商業的な供給業者の名称が与えられる場合、例えば「化合物X(Aldrich)」または「化合物X/Aldrich」、これは、化合物Xが、その名称の商業的な供給業者などの商業的な供給業者から得られることを意味する。
【0313】
基準化合物A:2−メチル−6−(メチルオキシ)−4H−3,1−ベンゾオキサジン−4−オン
【化90】

【0314】
5−メトキシアントラニル酸(ランカスター(Lancaster))(41.8g、0.25mol)の溶液を、減圧下で濃縮する前に、3.5時間、無水酢酸(230mL)中で還流した。粗化合物を、次いで、濾過する前に、トルエンの存在下で2回濃縮し、エーテルで2度洗浄し、標題化合物(33.7g、71%の収率)を茶色の固体として得た。LC/MS(方法D):m/z 192[M+H]+,Rt1.69分。
【0315】
基準化合物B:[2−アミノ−5−(メチルオキシ)フェニル](4−クロロフェニル)メタノン
【化91】

【0316】
0℃にて、トルエン/エーテル(2/1)混合物(760mL)中の2−メチル−6−(メチルオキシ)−4H−3,1−ベンゾオキサジン−4−オン(調製については、基準化合物Aを参照)(40.0g、0.21mol)の溶液に、4−クロロフェニル臭化マグネシウム(170mL、Et2O中1M、0.17mol)の溶液を滴下して加えた。反応混合物を、室温まで加温し、1NのHCl(200mL)でクエンチする前に1時間、攪拌した。水層をEtOAc(3×150mL)で抽出し、合わせた有機物をブライン(100mL)で洗浄し、Na2SO4で乾燥し、濾過し、減圧下で濃縮した。次いで粗化合物を、EtOH(400mL)に溶解し、6NのHCl(160mL)を加えた。反応混合物を、1/3の体積に濃縮する前に、2時間、還流した。得られた固体を濾過し、EtOAc中で懸濁する前に、エーテルで2度洗浄し、1NのNaOHで中和した。水層を、EtOAc(3×150mL)で抽出し、合わせた有機物をブライン(150mL)で洗浄し、Na2SO4で乾燥し、濾過し、減圧下で濃縮した。標題化合物を黄色の固体(39g、88%の収率)として得た。LC/MS(方法D):m/z 262[M+H]+,Rt2.57分。
【0317】
基準化合物C:メチルN1−[2−[(4−クロロフェニル)カルボニル]−4−(メチルオキシ)フェニル]−N2−{[(9H−フルオレン−9−イルメチル)オキシ]カルボニル}−L−α−アスパラギネート
【化92】

【0318】
メチルN−{[(9H−フルオレン−9−イルメチル)オキシ]カルボニル}−L−α−アスパルチルクロリド(Int.J.Peptide Protein Res.1992,40,13−18)(93g、0.24mol)をCHCl3(270mL)に溶解し、[2−アミノ−5−(メチルオキシ)フェニル](4−クロロフェニル)メタノン(調製については、基準化合物Bを参照)(53g、0.2mol)を加えた。得られた混合物を、冷却する前に、1時間、60℃で攪拌し、60%の体積に濃縮した。エーテルを0℃で加え、得られた沈殿物を濾過し、取り除いた。濾過物を減圧下で濃縮し、さらに精製せずに用いた。
【0319】
基準化合物D:メチル[(3S)−5−(4−クロロフェニル)−7−(メチルオキシ)−2−オキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]アセテート
【化93】

【0320】
DCM(500mL)中のメチルN1−[2−[(4−クロロフェニル)カルボニル]−4−(メチルオキシ)フェニル]−N2−{[(9H−フルオレン−9−イルメチル)オキシ]カルボニル}−L−α−アスパラギネート(調製については、基準化合物Cを参照)(推定0.2mol)の溶液に、Et3N(500mL、3.65mol)を加え、得られた混合物を、濃縮する前に24時間、還流した。得られた粗アミンを、1,2−DCE(1.5L)に溶解し、AcOH(104mL、1.8mol)を注意して加えた。反応混合物を、次いで、真空中で濃縮する前に、2時間、60℃で攪拌し、DCMに溶解した。有機層を、1NのHClで洗浄し、水層をDCM(×3)で抽出した。合わせた有機層を水およびブラインで2度洗浄し、Na2SO4で乾燥し、濾過し、減圧下で濃縮した。粗固体を、MeCN中で再結晶化し、標題化合物(51g)を淡黄色の固体として得た。濾過物を濃縮し、MeCN中で再結晶化し、別の10gの所望の生成物を得た。Rf=0.34(DCM/MeOH:95/5)。
【0321】
HRMS(M+H)+ C19H1835ClN2O4についての計算値373.0955;実測値373.0957。
【0322】
基準化合物E:メチル[(3S)−5−(4−クロロフェニル)−7−(メチルオキシ)−2−チオキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]アセテート
【化94】

【0323】
室温にて、1,2−DCE(700mL)中のP4S10(36.1g、81.1mmol)およびNa2CO3(8.6g、81.1mmol)の懸濁液を、メチル[(3S)−5−(4−クロロフェニル)−7−(メチルオキシ)−2−オキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]アセテート(調製については、基準化合物Dを参照)(16.8g、45.1mmol)を加える前に、2時間、攪拌した。得られた混合物を、冷却し、濾過する前に、2時間、70℃で攪拌した。固体を、DCMで2度洗浄し、濾過物を、飽和NaHCO3およびブラインで洗浄した。有機層をNa2SO4で乾燥し、濾過し、減圧下で濃縮した。粗生成物を、シリカゲル上でのフラッシュクロマトグラフィー(DCM/MeOH:99/1)によって精製し、標題化合物(17.2g、98%の収率)を、黄色がかった固体として得た。LC/MS(方法D):m/z 389[M(35Cl)+H]+,Rt2.64分。
【0324】
HRMS(M+H)+C19H1835ClN2O3Sについての計算値389.0727;実測値389.0714。
【0325】
基準化合物F:メチル[(3S)−2−[(1Z)2−アセチルヒドラジノ]−5−(4−クロロフェニル)−7−(メチルオキシ)−3H−1,4−ベンゾジアゼピン−3−イル]アセテート
【化95】

【0326】
0℃にて、THF(300mL)中のメチル[(3S)−5−(4−クロロフェニル)−7−(メチルオキシ)−2−チオキソ−2,3−ジヒドロ−1H−1,4−ベンゾジアゼピン−3−イル]アセテート(調製については、基準化合物Eを参照)(9.0g、23.2mmol)の懸濁液に、ヒドラジン一水和物(3.4mL、69.6mmol)を滴下して加えた。反応混合物を、0℃で冷却する前に、5℃から15℃の間で5時間攪拌した。次いでEt3N(9.7m、69.6mmol)をゆっくりと加え、塩化アセチル(7.95mL、69.6mmol)を滴下して加えた。次いで混合物を、減圧下で濃縮する前に、16時間、室温まで加温した。粗生成物をDCMに溶解し、水で洗浄した。有機層をNa2SO4で乾燥し、濾過し、真空中で濃縮し、粗標題化合物(9.7g、98%の収率)を得て、それをさらに精製せずに用いた。Rf=0.49(DCM/MeOH:90/10)。
【0327】
基準化合物G:メチル[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]アセテート
【化96】

【0328】
粗メチル[(3S)−2−[(1Z)−2−アセチルヒドラジノ]−5−(4−クロロフェニル)−7−(メチルオキシ)−3H−1,4−ベンゾジアゼピン−3−イル]アセテート(調製については、基準化合物Fを参照)(推定9.7g)を、THF(100ml)に懸濁し、AcOH(60mL)を室温で加えた。反応混合物を、減圧下で濃縮する前に、2日間、この温度にて攪拌した。粗固体を、i−Pr2O中で粉砕し、濾過し、標題化合物(3工程に渡って8.7g、91%)をオフホワイト色の固体として得た。
【0329】
HRMS(M+H)+C21H20ClN4O3についての計算値411.1229;実測値411.1245。
【0330】
基準化合物H:[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]酢酸
【化97】

【0331】
室温にて、THF(130mL)中のメチル[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]アセテート(調製については、基準化合物Gを参照)(7.4g、18.1mmol)の溶液に、1NのNaOH(36.2mL、36.2mmol)を加えた。反応混合物を、1NのHCl(36.2mL)でクエンチする前に、5時間、この温度で攪拌し、真空中で濃縮した。次いで水を加え、水層をDCM(×3)で抽出し、合わせた有機層をNa2SO4で乾燥し、濾過し、減圧下で濃縮し、標題化合物(7g、98%の収率)を淡黄色の固体として得た。
【0332】
基準化合物H:1,1−ジメチルエチル[5−({[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]アセチル}アミノ)ペンチル]カルバメート
【化98】

【0333】
[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]酢酸(調製については、基準化合物Gを参照)(1.0g、2.5mmol)、HATU(1.9g、5mmol)およびDIPEA(0.88ml、5mmol)の混合物を、室温で80分間攪拌し、これに、1,1−ジメチルエチル(4−アミノブチル)カルバメート(1.05ml、5.0mmol、Aldrichから市販されている)を加えた。反応混合物を、濃縮する前に、2時間、室温で攪拌した。残渣をジクロロメタン中に取り、1NのHClで洗浄した。水層をジクロロメタンで2度抽出した。有機層を、1Nの水酸化ナトリウムで洗浄し、その後、飽和塩化ナトリウム溶液で洗浄し、硫酸ナトリウムで乾燥し、濃縮した。残渣を、ジクロロメタン/メタノール(95/5)を用いて、シリカでのフラッシュクロマトグラフィーによって精製し、標題化合物を、黄色の固体(1.2g)として得た。LC/MS(方法D):rt=3.04分。
【0334】
基準化合物J:N−(5−アミノペンチル)−2−[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]アセトアミドトリフルオロアセテート
【化99】

【0335】
ジクロロメタン(3ml)中の1,1−ジメチルエチル[5−({[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]アセチル}アミノ)ペンチル]カルバメート(調製については、基準化合物Hを参照)(0.2g、0.34mmol)の溶液に、トリフルオロ酢酸(0.053m、0.68mmol)を0℃で滴下して加えた。反応混合物を、3時間、0℃から室温で攪拌した。反応混合物を濃縮乾固し、標題化合物を吸湿性の黄色の油(200mg)として得た。
【0336】
LC/MS(方法D):rt=2.33分。
【0337】
HRMS(M+H)+C25H29ClN6O2についての計算値481.2119;実測値481.2162。
【0338】
基準化合物K:Alexa Fluor 488−N−(5−アミノペンチル)−2−[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]アセトアミドの5−および6−異性体の混合物
【化100】

【0339】
N−(5−アミノペンチル)−2−[(4S)−6−(4−クロロフェニル)−1−メチル−8−(メチルオキシ)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]アセトアミドトリフルオロアセテート(調製については、基準化合物Jを参照)(7.65mg、0.013mmol)を、N,N−ジメチルホルムアミド(DMF)(300μl)に溶解し、エッペンドルフ遠心チューブ中のAlexa Fluor 488 カルボン酸スクシンイミジルエステル(5mg、7.77μmol、Invitrogenから市販の5および6の異性体の混合物、製造番号A−20100)に加えた。ヒューニッヒ塩基(7.0μl、0.040mmol)を加え、混合物を一晩、ボルテックスで混合した。18時間後、反応混合物を蒸発乾固し、残渣をDMSO/水(50%、<1ml合計)に再溶解し、分取Phenomenex Jupiter C18カラムに付与して、10ml/分の流速で150分に渡って95%A:5%Bから100%B(A=0.1%の水中のトリフルオロ酢酸、B=0.1%TFA/90%アセトニトリル/10%水)の勾配で溶出した。同じ系を用いて、不純物画分を合わせて、再精製した。画分を合わせ、蒸発させ、標題生成物(2.8mg)を、示した2つの位置異性体の混合物として得た。LC/MS(方法F):,MH+=999,rt=1.88分。
【0340】
生物学的試験方法
蛍光異方性結合アッセイ
ブロモドメイン2、3および4に対する式(I)の化合物の結合を、蛍光異方性結合アッセイを用いて評価した。
【0341】
ブロモドメインタンパク質、蛍光リガンド(上記の基準化合物Kを参照)および種々の試験化合物を一緒にインキュベートして、試験化合物の非存在下で蛍光リガンドが有意に(>50%)結合し、十分な濃度の有効な阻害剤の存在下で結合していない蛍光リガンドの異方性が結合値と測定可能な程度に異なるような条件下で熱力学的平衡に到達させる。
【0342】
全てのデータを、各プレートで16の高いおよび16の低いコントロールウェルの平均に正規化した。次いで以下の式の4つのパラメータ曲線フィットを適用した:
y=a+((b−a)/(1+(10^×/10^c)^d)
式中、「a」は最小であり、「b」はヒル勾配(Hill slope)であり、「c」はpIC50であり、「d」は最大である。
【0343】
組換えヒトブロモドメイン(ブロモドメイン2(1−473)、ブロモドメイン3(1−435)およびブロモドメイン4(1−477))を、N末端において6個のHis標識を有する大腸菌細胞(pET15bベクター内)で発現させた。His標識化ブロモドメインを、0.1mg/mlリゾチームおよび超音波処理を用いて大腸菌細胞から抽出した。次いでブロモドメインを、20Cv以上で、線形10〜500mMイミダゾール勾配で溶出する、HisTRAP HPカラムでのアフィニティクロマトグラフィーにより精製した。さらなる精製を、Superdex200分取グレートサイズ排除カラムにより完了した。精製したタンパク質を20mM HEPES pH7.5および100mM NaCl中で−80℃にて保存した。
【0344】
ブロモドメイン2についてのプロトコル:全ての成分を、ブロモドメイン2、75nM、蛍光リガンド 5nMの最終濃度で50mMのHEPES pH7.4、150mmのNaClおよび0.5mMのCHAPSのバッファー組成に溶解した。10μlのこの反応混合物を、マイクロマルチドロップを用いて、Greiner384ウェルブラック低容量マイクロタイタープレート中で100nlの種々の濃度の試験化合物またはDMSOビヒクル(1%最終)を含有するウェルに加え、暗所で室温にて60分平衡化した。蛍光異方性をEnvision(λex=485nm、λEM=530nm;二色性−505nM)で読み取った。
【0345】
ブロモドメイン3についてのプロトコル:全ての成分を、ブロモドメイン3、75nM、蛍光リガンド 5nMの最終濃度で50mMのHEPES pH7.4、150mmのNaClおよび0.5mMのCHAPSのバッファー組成に溶解した。10μlのこの反応混合物を、マイクロマルチドロップを用いて、Greiner384ウェルブラック低容量マイクロタイタープレート中で100nlの種々の濃度の試験化合物またはDMSOビヒクル(1%最終)を含有するウェルに加え、暗所で室温にて60分平衡化した。蛍光異方性をEnvision(λex=485nm、λEM=530nm;二色性−505nM)で読み取った。
【0346】
ブロモドメイン4についてのプロトコル:全ての成分を、ブロモドメイン4、75nM、蛍光リガンド 5nMの最終濃度で50mMのHEPES pH7.4、150mmのNaClおよび0.5mMのCHAPSのバッファー組成に溶解した。10μlのこの反応混合物を、マイクロマルチドロップを用いて、Greiner384ウェルブラック低容量マイクロタイタープレート中で100nlの種々の濃度の試験化合物またはDMSOビヒクル(1%最終)を含有するウェルに加え、暗所で室温にて60分平衡化した。蛍光異方性をEnvision(λex=485nm、λEM=530nm;二色性−505nM)で読み取った。
【0347】
実施例3〜12、15、17、18、20、23、24、25、27〜34、36、44、53、54、56〜59、61、64、65、70、71、75、76、79、81および85〜125を上記のアッセイにおいて試験し、BRD2、BRD3およびBRD4アッセイのうちの1つ以上において、pIC50<5.0を有した実施例44および実施例117〜125を除いて、pIC50≧5.0を有することを見出した。実施例4、6〜9、12、24、27、28、29、31、32、34、36、53、54、56、57、58、61、64、65、70、71、75、85〜89および97は、上記のBRD2、BRD3およびBRD4のアッセイのうちの1つ以上においてpIC50≧6.0を有した。
【0348】
TNFαレベルを測定するLPS刺激性全血アッセイ
細菌性リポ多糖(LPS)などのtoll様受容体のアゴニストによる単球細胞の活性化により、TNFαを含む重要な炎症性メディエータの生成が生じる。そのような経路は、様々な自己免疫および炎症性疾患の病態生理学に重要であると広く認められている。
【0349】
試験する化合物を希釈して、様々な適切な濃度を得て、1μlの希釈ストックを96プレートのウェルに加える。全血(130μl)の添加後、プレートを37℃(5%CO2)にて30分間インキュベートし、その後、10μlの2.8μg/ml LPSを添加し、完全RPMI1640(最終濃度=200ng/ml)に希釈し、ウェルあたり140μlの全体積を得る。さらに37℃にて24時間のインキュベーション後、140μlのPBSを各ウェルに加える。プレートを密閉し、10分間振盪し、次いで遠心分離(2500rpm×10分)する。100μlの上清を除去し、TNFαレベルを、即座にまたは−20℃での保存後のいずれかで免疫学的検定により(典型的にメソスケールディスカバリー(MesoScale Discovery)技術により)アッセイした。各化合物についての用量反応曲線をデータから生成し、IC50値を算出した。
【0350】
実施例27、28、32、53、64および65を上記のアッセイにおいて試験し、pIC≧5.0を有することを見出した。
【0351】
これらのデータは、上記のアッセイにおいて試験したブロモドメイン阻害剤が重要な炎症性メディエータTNFαの生成を阻害することを実証する。これは、このような化合物が、抗炎症性プロファイルを有することを示唆する。
【0352】
限定されないが、本明細書に記載した特許および特許出願を含む全ての文献は、各々の個々の文献が具体的かつ個々に完全に記載されているように本明細書に参照として組み込まれることを示すように、本明細書に参照として組み込まれる。
【特許請求の範囲】
【請求項1】
式(I)の化合物またはその塩
【化1】

(式中、
XはOまたはSであり、
R1はC1−6アルキル、ハロC1−6アルキル、−(CH2)nOR1aまたは−(CH2)mNR1bR1cであり、ここで、R1aは、水素、C1−6アルキルまたはハロC1−6アルキルであり、R1bおよびR1cは、同じであっても異なっていてもよく、水素、C1−6アルキルまたはハロC1−6アルキルであり、同じであっても、異なっていてもよい、mおよびnは、1、2または3であり、
R2は、R2a、−OR2bまたは−NR2cR2dであり、ここで、R2aおよびR2bは、カルボシクリル、カルボシクリルC1−4アルキル、ヘテロシクリルもしくはヘテロシクリルC1−4アルキルであるか、またはR2aは、カルボシクリルエテニルもしくはヘテロシクリルエテニルであり、ここで、R2aまたはR2bについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノ、ジメチルアミノ、ベンゾイルおよびアジドから独立して選択される1つ以上の基で置換されてもよく、または相互結合する原子と一緒にR2aもしくはR2bについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれか上の2つの隣接する基は、環が、O、SおよびNから独立して選択される1個もしくは2個のヘテロ原子を含んでもよい5員もしくは6員環を形成し、またはR2aおよびR2bは、C1−6アルキルもしくはハロC1−6アルキルであり、R2cおよびR2dは、同じであっても異なっていてもよく、カルボシクリル、カルボシクリルC1−4アルキル、ヘテロシクリルもしくはヘテロシクリルC1−4アルキルであり、ここで、R2cおよびR2dについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノおよび−CO2C1−4アルキルから独立して選択される1つ以上の基により置換されてもよく、または相互結合する原子と一緒にR2cおよびR2dについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれか上の2つの隣接する基は、環が、O、SおよびNから独立して選択される1個もしくは2個のヘテロ原子を含んでもよい5員もしくは6員環を形成し、またはR2cおよびR2dは、水素、C1−6アルキルもしくはハロC1−6アルキルであり、
R3は、カルボシクリルまたはヘテロシクリルであり、それらのいずれかは、1つ以上のハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロもしくはシアノにより独立して置換されてもよく、またはR3はC1−6アルキルであり、
R4およびR5は、相互結合炭素原子と一緒にベンゼンもしくは芳香族複素環を形成し、それらの各々は置換されてもよい)。
【請求項2】
R1がメチルである、請求項1に記載の化合物またはその塩。
【請求項3】
R2が−OR2bである、請求項1または2に記載の化合物またはその塩。
【請求項4】
R2bがC1−6アルキル、ベンジルまたはフェニルC1−6アルキルであり、ここで、ベンジルはフルオロにより置換されてもよい、請求項3に記載の化合物またはその塩。
【請求項5】
R2bがエチル、イソプロピル、ベンジル、4−フルオロベンジルまたは−CH(CH3)フェニルである、請求項4に記載の化合物またはその塩。
【請求項6】
R2aがハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノ、ジメチルアミノ、ベンゾイルおよびアジドから独立して選択される1つ以上の基により置換されてもよいカルボシクリルエテニルである、請求項1または2に記載の化合物またはその塩。
【請求項7】
R2aがフルオロ、クロロおよびメトキシから選択される1つの基により置換されてもよいカルボシクリルエテニルである、請求項6に記載の化合物またはその塩。
【請求項8】
R2aがC1−6アルキル、C1−6アルコキシおよびベンゾイルから独立して選択される1つ以上の基により置換されてもよいカルボシクリルまたはヘテロシクリルである、請求項1または2に記載の化合物またはその塩。
【請求項9】
R2aがメチル、メトキシおよびベンゾイルから選択される1つの基により置換されてもよいフェニル、ナフチレニルまたはインドリルである、請求項8に記載の化合物またはその塩。
【請求項10】
R2が−NR2cR2dである、請求項1または2に記載の化合物またはその塩。
【請求項11】
R2cが水素であり、R2dが、ハロゲン、C1−6アルキル、C1−6アルコキシおよび−CO2C1−4アルキルから選択される1つの基により置換されてもよいフェニルまたはベンジルである、請求項10に記載の化合物またはその塩。
【請求項12】
R2dが臭素、エチル、メトキシおよび−CO2CH2CH3から選択される1つの基により置換される、請求項11に記載の化合物またはその塩。
【請求項13】
R3がハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよいフェニルである、請求項1〜12のいずれか一項に記載の化合物またはその塩。
【請求項14】
R3が非置換フェニルである、請求項13に記載の化合物またはその塩。
【請求項15】
R3がメチル、クロロおよびメトキシから選択される1つの基により置換されるフェニルである、請求項13に記載の化合物またはその塩。
【請求項16】
R4およびR5が、相互結合する原子と一緒に、ベンゼン、チオフェンまたはフラン環を形成し、そのうちのいずれも、ハロゲン、C1−6アルキル、C2−6アルケニル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノおよびヘテロシクリルから独立して選択される1つ以上の基により置換されてもよい、請求項1〜15のいずれか一項に記載の化合物またはその塩。
【請求項17】
R4およびR5が、相互結合する原子と一緒に、ハロゲンにより置換されてもよいベンゼン環を形成する、請求項16に記載の化合物またはその塩。
【請求項18】
S鏡像異性体である、請求項1〜17のいずれか一項に記載の化合物またはその塩。
【請求項19】
実施例1〜84のいずれか一つまたはその塩である、化合物。
【請求項20】
実施例85〜125のいずれか一つまたはその塩である、化合物。
【請求項21】
エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート、
フェニルメチル[1−メチル−8−(メチルオキシ)−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート、
フェニルメチル{1−メチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート、
フェニルメチル[1−メチル−6−(4−メチルフェニル)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート、
フェニルメチル{1−メチル−6−[3−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート、
フェニルメチル(9−メチル−4−フェニル−6H−チエノ[3,2−f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−6−イル)カルバメート、
フェニルメチル(8−ヨード−1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート、
(+)−フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート、
(+)−エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート、
エチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート、
エチル{1−メチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート、
(+)−エチル1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イルカルバメート、
(4−フルオロフェニル)メチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート、
(1S)−1−フェニルエチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート、
6−(メチルオキシ)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−1H−インドール−2−カルボキシアミド、
N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−4−(フェニルカルボニル)ベンズアミド、
(2E)−3−[4−(メチルオキシ)フェニル]−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド、
(2E)−3−(4−クロロフェニル)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド、
(2E)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−3−(2−チエニル)−2−プロペンアミド、
5−メチル−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−1H−インドール−2−カルボキシアミド、
(2E)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−3−フェニル2−プロペンアミド、
(2E)−3−(4−フルオロフェニル)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド、
N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−N’−フェニル尿素、
N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−N’−(フェニルメチル)尿素、
N−{[4−(メチルオキシ)フェニル]メチル}−N’−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)尿素、
3−ブロモ−N−(1−メチル−6−フェニル−4H−ベンゾ[f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル)ベンズアミド、
N−(1−メチル−6−フェニル−4H−ベンゾ[f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル)−2−ナフトアミド、
フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート、
エチル4−({[(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)アミノ]カルボニル}アミノ)ベンゾエート、
1−メチルエチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート、および
4−エチル−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)ベンズアミド
から選択される化合物、またはその塩。
【請求項22】
(+)−フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート、
(+)−エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート、
(+)−エチル1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イルカルバメート、
6−(メチルオキシ)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−1H−(2E)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−3−フェニル−2−プロペンアミド、および
(2E)−3−(4−フルオロフェニル)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド
から選択される、請求項21に記載の化合物またはその塩。
【請求項23】
請求項1〜22のいずれか一項に記載の化合物、またはその薬学上許容可能な塩。
【請求項24】
請求項23に記載の式(I)の化合物またはその薬学上許容可能な塩と、1種以上の薬学上許容可能な担体、希釈剤または賦形剤とを含む、医薬組成物。
【請求項25】
1つ以上の他の治療活性剤と共に、請求項23に記載の式(I)の化合物またはその薬学上許容可能な塩を含む、組合わせ医薬品。
【請求項26】
療法に使用するための、請求項23に記載の式(I)の化合物またはその薬学上許容可能な塩。
【請求項27】
ブロモドメイン阻害剤が適応される疾患または病態の治療に使用するための、請求項23に記載の式(I)の化合物またはその薬学上許容可能な塩。
【請求項28】
前記疾患または病態が、慢性自己免疫および/または炎症病態である、請求項27に記載の使用のための式(I)の化合物またはその薬学上許容可能な塩。
【請求項29】
前記疾患または病態が、癌である、請求項27に記載の使用のための式(I)の化合物またはその薬学上許容可能な塩。
【請求項30】
ブロモドメイン阻害剤が適応される疾患または病態を治療するための薬剤の製造における、請求項23に記載の式(I)の化合物またはその薬学上許容可能な塩の使用。
【請求項31】
治療有効量の請求項23に記載の式(I)の化合物またはその薬学上許容可能な塩を投与することを含む、それを必要とする被験体において、ブロモドメイン阻害剤が適応される疾患または病態を治療する方法。
【請求項32】
前記疾患または病態が、慢性自己免疫および/または炎症病態である、請求項31に記載の治療する方法。
【請求項33】
前記疾患または病態が、癌である、請求項31に記載の治療する方法。
【請求項34】
前記被験体が、ヒトである、請求項31〜33のいずれか一項に記載の治療する方法。
【請求項35】
ブロモドメインと、請求項23に記載の式(I)の化合物またはその薬学上許容可能な塩とを接触させることを含む、ブロモドメインを阻害する方法。
【請求項1】
式(I)の化合物またはその塩
【化1】

(式中、
XはOまたはSであり、
R1はC1−6アルキル、ハロC1−6アルキル、−(CH2)nOR1aまたは−(CH2)mNR1bR1cであり、ここで、R1aは、水素、C1−6アルキルまたはハロC1−6アルキルであり、R1bおよびR1cは、同じであっても異なっていてもよく、水素、C1−6アルキルまたはハロC1−6アルキルであり、同じであっても、異なっていてもよい、mおよびnは、1、2または3であり、
R2は、R2a、−OR2bまたは−NR2cR2dであり、ここで、R2aおよびR2bは、カルボシクリル、カルボシクリルC1−4アルキル、ヘテロシクリルもしくはヘテロシクリルC1−4アルキルであるか、またはR2aは、カルボシクリルエテニルもしくはヘテロシクリルエテニルであり、ここで、R2aまたはR2bについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノ、ジメチルアミノ、ベンゾイルおよびアジドから独立して選択される1つ以上の基で置換されてもよく、または相互結合する原子と一緒にR2aもしくはR2bについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれか上の2つの隣接する基は、環が、O、SおよびNから独立して選択される1個もしくは2個のヘテロ原子を含んでもよい5員もしくは6員環を形成し、またはR2aおよびR2bは、C1−6アルキルもしくはハロC1−6アルキルであり、R2cおよびR2dは、同じであっても異なっていてもよく、カルボシクリル、カルボシクリルC1−4アルキル、ヘテロシクリルもしくはヘテロシクリルC1−4アルキルであり、ここで、R2cおよびR2dについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれかは、ハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノおよび−CO2C1−4アルキルから独立して選択される1つ以上の基により置換されてもよく、または相互結合する原子と一緒にR2cおよびR2dについて定義されるカルボシクリルもしくはヘテロシクリル基のいずれか上の2つの隣接する基は、環が、O、SおよびNから独立して選択される1個もしくは2個のヘテロ原子を含んでもよい5員もしくは6員環を形成し、またはR2cおよびR2dは、水素、C1−6アルキルもしくはハロC1−6アルキルであり、
R3は、カルボシクリルまたはヘテロシクリルであり、それらのいずれかは、1つ以上のハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロもしくはシアノにより独立して置換されてもよく、またはR3はC1−6アルキルであり、
R4およびR5は、相互結合炭素原子と一緒にベンゼンもしくは芳香族複素環を形成し、それらの各々は置換されてもよい)。
【請求項2】
R1がメチルである、請求項1に記載の化合物またはその塩。
【請求項3】
R2が−OR2bである、請求項1または2に記載の化合物またはその塩。
【請求項4】
R2bがC1−6アルキル、ベンジルまたはフェニルC1−6アルキルであり、ここで、ベンジルはフルオロにより置換されてもよい、請求項3に記載の化合物またはその塩。
【請求項5】
R2bがエチル、イソプロピル、ベンジル、4−フルオロベンジルまたは−CH(CH3)フェニルである、請求項4に記載の化合物またはその塩。
【請求項6】
R2aがハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノ、ジメチルアミノ、ベンゾイルおよびアジドから独立して選択される1つ以上の基により置換されてもよいカルボシクリルエテニルである、請求項1または2に記載の化合物またはその塩。
【請求項7】
R2aがフルオロ、クロロおよびメトキシから選択される1つの基により置換されてもよいカルボシクリルエテニルである、請求項6に記載の化合物またはその塩。
【請求項8】
R2aがC1−6アルキル、C1−6アルコキシおよびベンゾイルから独立して選択される1つ以上の基により置換されてもよいカルボシクリルまたはヘテロシクリルである、請求項1または2に記載の化合物またはその塩。
【請求項9】
R2aがメチル、メトキシおよびベンゾイルから選択される1つの基により置換されてもよいフェニル、ナフチレニルまたはインドリルである、請求項8に記載の化合物またはその塩。
【請求項10】
R2が−NR2cR2dである、請求項1または2に記載の化合物またはその塩。
【請求項11】
R2cが水素であり、R2dが、ハロゲン、C1−6アルキル、C1−6アルコキシおよび−CO2C1−4アルキルから選択される1つの基により置換されてもよいフェニルまたはベンジルである、請求項10に記載の化合物またはその塩。
【請求項12】
R2dが臭素、エチル、メトキシおよび−CO2CH2CH3から選択される1つの基により置換される、請求項11に記載の化合物またはその塩。
【請求項13】
R3がハロゲン、C1−6アルキル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロおよびシアノから独立して選択される1つ以上の基により置換されてもよいフェニルである、請求項1〜12のいずれか一項に記載の化合物またはその塩。
【請求項14】
R3が非置換フェニルである、請求項13に記載の化合物またはその塩。
【請求項15】
R3がメチル、クロロおよびメトキシから選択される1つの基により置換されるフェニルである、請求項13に記載の化合物またはその塩。
【請求項16】
R4およびR5が、相互結合する原子と一緒に、ベンゼン、チオフェンまたはフラン環を形成し、そのうちのいずれも、ハロゲン、C1−6アルキル、C2−6アルケニル、ハロC1−6アルキル、C1−6アルコキシ、ハロC1−6アルコキシ、ニトロ、シアノおよびヘテロシクリルから独立して選択される1つ以上の基により置換されてもよい、請求項1〜15のいずれか一項に記載の化合物またはその塩。
【請求項17】
R4およびR5が、相互結合する原子と一緒に、ハロゲンにより置換されてもよいベンゼン環を形成する、請求項16に記載の化合物またはその塩。
【請求項18】
S鏡像異性体である、請求項1〜17のいずれか一項に記載の化合物またはその塩。
【請求項19】
実施例1〜84のいずれか一つまたはその塩である、化合物。
【請求項20】
実施例85〜125のいずれか一つまたはその塩である、化合物。
【請求項21】
エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート、
フェニルメチル[1−メチル−8−(メチルオキシ)−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート、
フェニルメチル{1−メチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート、
フェニルメチル[1−メチル−6−(4−メチルフェニル)−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート、
フェニルメチル{1−メチル−6−[3−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート、
フェニルメチル(9−メチル−4−フェニル−6H−チエノ[3,2−f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−6−イル)カルバメート、
フェニルメチル(8−ヨード−1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート、
(+)−フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート、
(+)−エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート、
エチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート、
エチル{1−メチル−6−[4−(メチルオキシ)フェニル]−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル}カルバメート、
(+)−エチル1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イルカルバメート、
(4−フルオロフェニル)メチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート、
(1S)−1−フェニルエチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート、
6−(メチルオキシ)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−1H−インドール−2−カルボキシアミド、
N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−4−(フェニルカルボニル)ベンズアミド、
(2E)−3−[4−(メチルオキシ)フェニル]−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド、
(2E)−3−(4−クロロフェニル)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド、
(2E)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−3−(2−チエニル)−2−プロペンアミド、
5−メチル−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−1H−インドール−2−カルボキシアミド、
(2E)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−3−フェニル2−プロペンアミド、
(2E)−3−(4−フルオロフェニル)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド、
N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−N’−フェニル尿素、
N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−N’−(フェニルメチル)尿素、
N−{[4−(メチルオキシ)フェニル]メチル}−N’−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)尿素、
3−ブロモ−N−(1−メチル−6−フェニル−4H−ベンゾ[f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル)ベンズアミド、
N−(1−メチル−6−フェニル−4H−ベンゾ[f][1,2,4]トリアゾロ[4,3−a][1,4]ジアゼピン−4−イル)−2−ナフトアミド、
フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート、
エチル4−({[(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)アミノ]カルボニル}アミノ)ベンゾエート、
1−メチルエチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート、および
4−エチル−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)ベンズアミド
から選択される化合物、またはその塩。
【請求項22】
(+)−フェニルメチル(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)カルバメート、
(+)−エチル[6−(4−クロロフェニル)−1−メチル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル]カルバメート、
(+)−エチル1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イルカルバメート、
6−(メチルオキシ)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−1H−(2E)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−3−フェニル−2−プロペンアミド、および
(2E)−3−(4−フルオロフェニル)−N−(1−メチル−6−フェニル−4H−[1,2,4]トリアゾロ[4,3−a][1,4]ベンゾジアゼピン−4−イル)−2−プロペンアミド
から選択される、請求項21に記載の化合物またはその塩。
【請求項23】
請求項1〜22のいずれか一項に記載の化合物、またはその薬学上許容可能な塩。
【請求項24】
請求項23に記載の式(I)の化合物またはその薬学上許容可能な塩と、1種以上の薬学上許容可能な担体、希釈剤または賦形剤とを含む、医薬組成物。
【請求項25】
1つ以上の他の治療活性剤と共に、請求項23に記載の式(I)の化合物またはその薬学上許容可能な塩を含む、組合わせ医薬品。
【請求項26】
療法に使用するための、請求項23に記載の式(I)の化合物またはその薬学上許容可能な塩。
【請求項27】
ブロモドメイン阻害剤が適応される疾患または病態の治療に使用するための、請求項23に記載の式(I)の化合物またはその薬学上許容可能な塩。
【請求項28】
前記疾患または病態が、慢性自己免疫および/または炎症病態である、請求項27に記載の使用のための式(I)の化合物またはその薬学上許容可能な塩。
【請求項29】
前記疾患または病態が、癌である、請求項27に記載の使用のための式(I)の化合物またはその薬学上許容可能な塩。
【請求項30】
ブロモドメイン阻害剤が適応される疾患または病態を治療するための薬剤の製造における、請求項23に記載の式(I)の化合物またはその薬学上許容可能な塩の使用。
【請求項31】
治療有効量の請求項23に記載の式(I)の化合物またはその薬学上許容可能な塩を投与することを含む、それを必要とする被験体において、ブロモドメイン阻害剤が適応される疾患または病態を治療する方法。
【請求項32】
前記疾患または病態が、慢性自己免疫および/または炎症病態である、請求項31に記載の治療する方法。
【請求項33】
前記疾患または病態が、癌である、請求項31に記載の治療する方法。
【請求項34】
前記被験体が、ヒトである、請求項31〜33のいずれか一項に記載の治療する方法。
【請求項35】
ブロモドメインと、請求項23に記載の式(I)の化合物またはその薬学上許容可能な塩とを接触させることを含む、ブロモドメインを阻害する方法。
【公表番号】特表2013−510122(P2013−510122A)
【公表日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願番号】特願2012−537380(P2012−537380)
【出願日】平成22年11月3日(2010.11.3)
【国際出願番号】PCT/EP2010/066696
【国際公開番号】WO2011/054844
【国際公開日】平成23年5月12日(2011.5.12)
【出願人】(509329523)グラクソスミスクライン エルエルシー (38)
【Fターム(参考)】
【公表日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願日】平成22年11月3日(2010.11.3)
【国際出願番号】PCT/EP2010/066696
【国際公開番号】WO2011/054844
【国際公開日】平成23年5月12日(2011.5.12)
【出願人】(509329523)グラクソスミスクライン エルエルシー (38)
【Fターム(参考)】
[ Back to top ]

