プライマー及び特定植物、特定動物の検出方法
【課題】
アレルギーを引き起こす恐れのある特定の植物中のゴマ、メロン及び特定の動物中のまぐろ、ぶり、あじ、たら、たこ、ほたてがいを検出対象とし、当該特定植物、特定動物が食品原料や製品等に含まれていた場合に、その量が微量であっても高感度で検出する。
【解決手段】
アレルギーを引き起こす恐れのある特定の植物中のゴマ、メロン及び特定の動物中のまぐろ、ぶり、あじ、たら、たこ、ほたてがいを検出対象とし、それぞれの対象物に特異的なプライマーを提供する。また、当該プライマーを用いて当該特定植物、特定動物が食品原料や製品等に含まれていた場合に、その量が微量であっても高感度で検出することを可能とする特定植物、特定動物の検出方法を提供する。
アレルギーを引き起こす恐れのある特定の植物中のゴマ、メロン及び特定の動物中のまぐろ、ぶり、あじ、たら、たこ、ほたてがいを検出対象とし、当該特定植物、特定動物が食品原料や製品等に含まれていた場合に、その量が微量であっても高感度で検出する。
【解決手段】
アレルギーを引き起こす恐れのある特定の植物中のゴマ、メロン及び特定の動物中のまぐろ、ぶり、あじ、たら、たこ、ほたてがいを検出対象とし、それぞれの対象物に特異的なプライマーを提供する。また、当該プライマーを用いて当該特定植物、特定動物が食品原料や製品等に含まれていた場合に、その量が微量であっても高感度で検出することを可能とする特定植物、特定動物の検出方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アレルギーを引き起こす恐れのある特定の植物中のゴマ、メロン及び特定の動物中のまぐろ、ぶり、あじ、たら、たこ、ほたてがいを検出対象とし、当該特定植物、特定動物が食品原料や製品等に含まれていた場合に、その量が微量であっても高感度で検出することを可能とする特定植物の検出方法、並びにその方法に使用するPCRプライマー、プライマーセット、及びキットに関するものである。
【背景技術】
【0002】
特定の食物アレルギー疾患を持つ人の健康危害の発生を防止する観点から、食物アレルギーを引き起こすことが明らかになった食品のうち、特に発症数、重篤度から勘案して表示する必要性の高い小麦、そば、卵、乳、及び落花生の5品目は省令により「特定原材料」と定められ、過去に一定の頻度で重篤な健康危害が見られたアワビ、イカ、エビ、カニ、サケ、サバ、鶏肉、豚肉、いくら、牛肉、ゼラチン、オレンジ、キウイフルーツ、くるみ、大豆、まつたけ、もも、やまいも、りんごの19品目は通知により「特定原材料に準ずるもの」と定められた(厚生労働省医薬局食品保健部長通知、食品衛生法施行規則及び乳及び乳製品の成分規格等に関する省令の一部を改正する省令等の施行について、平成13年3月15日、食発第79号)。「特定原材料」を含む加工食品については、当該食品を含む旨を商品に表示することが義務付けられ、「特定原材料に準ずるもの」を含む加工食品については、当該食品を含む旨を可能な限り表示するよう努めることが推奨された。その後の食物アレルギーの実態及びアレルギー誘発物質の解明に関する研究成果を基に、アレルギー食品制度は適宜見直しが行われており、平成16年12月にバナナが「特定原材料に準ずるもの」に、平成20年6月に症例数が多く重篤な症状を引き起こすえび及びかにが「特定原材料」に追加され、「特定原材料」が7品目、「特定原材料に準ずるもの」が18品目となった(食品衛生法施行規則及び乳及び乳製品の成分規格等に関する省令の一部を改正する省令等の施行について、平成13年3月15日、食発第79号、改正 平成16年12月24日、食安発第1224002号)(食品衛生法施行規則の一部を改正する省令の施行について、平成20年6月3日、食安発第0603001号)。
【0003】
食物アレルギー原因食物は時代の変遷に伴い変化していくという観点から約3年ごとに行われている全国即時型食物アレルギーモニタリング調査によると、「特定原材料」、「特定原材料に準ずるもの」以外では、ゴマ、メロン、まぐろ、ぶり、あじ、たら、たこ、ほたてがいが原因食物となった症例数、アナフィキラシーショック症例数が多いことが判明している(平成19年3月食品の表示に関する共同会議)。調査年度によっては、これらの食物が原因食物となった症例数は、「特定原材料に準ずるもの」に含まれるりんごの症例数と同等以上であるため、これらの食物が適宜行われるアレルギー食品制度の見直しにより、「特定原材料に準ずるもの」に追加される可能性は大いにあると考えられる。また、ゴマはEU、カナダ、オーストラリア及びニュージーランドで、貝類、イカ、タコ等の軟体動物は、EUで当該食品を含む旨を商品に表示することが義務付けられている。
アレルギーを起こす恐れのある食品原料、特にアレルギー原因動植物は、生産、流通、加工段階での意図しない微量の混入も起こり得るため、食品原料ないし製品の提供者としては、それらにアレルギー原因動植物が混入されているか否かの品質管理を行うことが重要となる。
【0004】
「特定原材料」である小麦、そば、卵、乳、落花生、えび及びかにの検出法としては、ELISA法、ウェスタンブロッド法あるいはPCR法を用いた方法が確立されており、えび及びかにのPCR法以外の当該検出法は、検査キットとして商用的に入手、利用可能となっている(厚生労働省医薬局食品保健部長通知、アレルギー物質を含む食品の検査方法について、平成14年11月06日、食発第1106001号、改正 平成21年1月22日、食安発第0122001号)。「特定原材料に準ずるもの」に対する検出法は、鶏肉、豚肉、牛肉(特開2003-230383号、牛、豚、鶏検出用プライマー)、アワビ、イカ、サケ、サバ(特開2003-230383号、プライマー及び特定動物の検出方法)、キウイフルーツ、くるみ、大豆、やまいも、りんご及びバナナ(特開2006-333729号、プライマー及び特定植物の検出方法)は、PCR法を用いた検出方法が確立されていて、検査キットとして商用的に入手、利用可能となっている。また、検査キットとして商用的に入手、利用可能には至っていないが、ゼラチンはELISA法による検出法(土井啓利ら:第94回日本食品衛生学会学術講演会講演要旨集,2007)が、モモはPCR法による検出法(渡辺聡ら:第95回日本食品衛生学会学術講演会講演要旨集,2008)が、報告されている。しかし、「特定原材料に準ずるもの」に追加される可能性は大いにあると考えられる食物アレルギー原因食物の、ゴマ、メロン、まぐろ、ぶり、あじ、たら、たこ、ほたてがいの検出法については、現在まで明確な報告はない。従って、これらの検出法が定かでない食物アレルギー原因食物に相当する特定動植物の混入の有無に関して、科学的な検証をもって品質管理を行うことは、現在、困難な状況にある。
【0005】
様々な加工処理工程を経た食品原料や製品中から検出対象生物を検出する場合、「特定原材料」の検査法で確立されているように、検出対象生物に特徴的な蛋白質を検出する方法(ELISA法やウェスタンブロッド法)や検出対象生物に特徴的なDNA塩基配列を検出する方法(PCR法)が有望な手法となる(厚生労働省医薬局食品保健部長通知、アレルギー物質を含む食品の検査方法について、平成14年11月06日、食発第1106001号、改正 平成21年1月22日、食安発第0122001号)。一般に、蛋白質は、DNAと比べて、食品製造工程における様々な加工処理に対する安定性が低いため、蛋白質を検出する方法は、高度に加工された被験食品に対しては適用できない可能性が高い。それ故に、蛋白質よりも加工処理に比較的強いとされるDNAの塩基配列を標的とした検出方法は、様々な加工処理工程を経た食品原料や製品中から検出対象生物の混入の有無を調べる手法として、有望な方法と考えられる。また、動植物のDNA塩基配列には、rRNA遺伝子クラスターのようにコピー数の多い塩基配列が存在し、このような多コピー数の塩基配列を標的配列に使用できれば、検出法の感度を高めることも可能となる。さらに、細胞中に複数存在するクロロプラスト由来DNAあるいはミトコンドリア由来DNAの塩基配列を標的配列とする場合も、同様に検出法の感
度の向上化に寄与する。
【0006】
遺伝子組換え作物などをPCRで検出する場合、検出対象とするDNA塩基配列は、組換えられたDNA塩基配列に限定される。一方、自然界に存在する動植物の場合、無数にあるDNA塩基配列からどの塩基配列を検出対象に選ぶかという明確な知見はなく、さらには、様々な動植物について、選択した塩基配列の検出対象としての有効性の有無に関する明確な知見は見られない。検出対象とする動植物に特異的な蛋白質を選定し、その蛋白質をコードするDNA塩基配列を検出するための標的とすることも行われているが、この場合、個々の動植物に対して個別に特異的な蛋白質を選定する必要がある。また、このような特異的な蛋白質が選定できたとしても、そのDNA塩基配列のコピー数が少ない場合には、必要な検出感度が得られない場合があり、微量に混入する動植物の検出には、不都合となる。
【0007】
ゴマを検出する方法としては、ELISA法やPCR法を用いた方法がすでに報告されている。例えば、PCR法を用いた方法(非特許文献1)では、ゴマ2S alubumin遺伝子を増幅するPCRプライマーが用いられている。このゴマ検出PCRプライマーを用いたPCRでは、ゴマDNAが特異的に検出され、アーモンド、ヘーゼルナッツ等のナッツ類DNAは検出されないことが示されているが、ゴマ近縁種の食用植物であるエゴマ、シソDNAが検出されないことの確認は行っていない。また、このPCRプライマーの標的DNAは染色体DNAであり、一般に、その検出感度は、ミトコンドリア由来DNAやクロロプラスト由来DNAを標的としたPCRプライマーよりも低いことが予測される。
【0008】
被験試料であるウリ科キュウリ属メロンの分子系統分類を行うために、RAPD(randomly amplified polymorphic DNA)マーカーを利用した方法(非特許文献2)やAFLP(amplified fragment length polymorphism)マーカーを利用した方法(非特許文献3)が報告されている。これらの方法は、主たる被験試料がメロンあるいは単一種の植物である試料から抽出したDNAを試料として使用可能であるが、手法の特性上、複数の植物種が混合するような試料の場合、使用されるPCRプライマーは、他の植物DNAとも反応する可能性が非常に高いために、メロンを特異的に検出することは困難となる。それ故に、複数の植物を含む食品中のメロンDNAを特異的に検出するために、これらの方法を使用することはできない。
【0009】
また、マグロ属、カツオ属、スマ属、ソウダガツオ属、Allothunnus属が属するサバ科マグロ族の魚種を判別するために、ミトコンドリアのチトクロームb遺伝子配列を標的としたマルチプレックスPCR法を用いた判別法が報告されている(非特許文献4)。この方法に用いられたPCRプライマーは、被験試料であるマグロ属以外にサバ科マグロ族カツオ属のカツオDNAも検出するため、マグロ属に属するまぐろ類DNAを特異的に検出するために、この方法を使用することはできない。
【0010】
また、あじ塩干し加工品の魚種を判別するために、ミトコンドリアのND5タンパク遺伝子配列を標的としたPCR-制限酵素断片長多型法を用いた判別法が報告されている(非特許文献5)。この方法で使用されているPCRプライマーは、アジ科マアジ属のマアジ及びニシマアジから抽出されたDNAを増幅させることは可能であるが、その他の生物に対する当該PCRプライマーの交差反応性、すなわち、検出特異性の記載は無く、シマアジ、ムロアジ等の他のアジ亜科に属するあじ類DNAを特異的に検出する方法としては、十分に検証された方法ではない。
【0011】
また、商業的に重要なタラ科3種(スケトウダラ、マダラ、コマイ)の魚種を判別するために、ミトコンドリアのチトクロームb遺伝子配列を標的としたPCR-制限酵素断片長多型法及びマルチプレックスPCR法を用いた判別法が報告されている(非特許文献6)。これらの方法で使用されているPCRプライマーは、タラ科3種(スケトウダラ、マダラ、コマイ)から抽出されたDNAを増幅させることは可能であるが、その他の生物に対する当該PCRプライマーの交差反応性、すなわち、検出特異性の記載は無く、タラ類DNAを特異的に検出する方法としては、十分に検証された方法ではない。
【0012】
また、頭足類(イカやタコの仲間)の種を同定あるいは推定する方法として、ミトコンドリアのチトクロームオキシダーゼIII遺伝子配列や同じくチトクロームオキシダーゼII遺伝子配列を標的としたPCRプライマーによって増幅されたDNA塩基配列を公知の塩基配列と比較する方法も報告されている(非特許文献7)。この方法で使用されているPCRプライマーは、主成分が頭足類である試料から抽出されたDNAを増幅させることは可能であるが、その他の生物に対する当該PCRプライマーの交差反応性、すなわち、検出特異性の記載は無く、さらに、食品のように複数の動植物を含む試料中の頭足類DNAを特異的に検出できるという記載もなされていない。それ故に、複数の動植物を含む食品中の頭足類DNAを特異的に検出する方法としては、十分に検証された方法ではない。
【0013】
また、ホタテガイの分子系統分類を行うために、16SrRNA遺伝子配列を比較分析する方法が報告されている(特許文献1)。この方法で使用されているPCRプライマーは、主成分がホタテガイである試料から抽出されたDNAを増幅させることは可能であるが、その他の生物に対する当該PCRプライマーの交差反応性、すなわち、検出特異性の記載は無く、さらに、食品のように複数の動植物を含む試料中のほたてがいDNAを特異的に検出できるという記載もなされていない。また、PCR増幅産物が、約1.3kbp及び約1.5kbpと長く、加工食品のようなDNAの断片化が進んだ試料中からほたてがいDNAを検出するには不適であり、複数の動植物を含む食品中のほたてがいDNAを特異的に検出する方法としては、十分に検証された方法ではない。
【0014】
対象とする特定動植物の食品原料や製品中への混入の有無は、当該動植物に特異的な遺伝子配列が食品原料や製品中から検出されるか否かを調べることによって、検査できる。但し、その検査法は、目的とする植物に由来するDNAを検出できるが、食品原料や製品を構成する複数の目的としない動植物由来DNAを検出しないような方法であることが強く望まれる。
【0015】
上述したように、食物アレルギー原因食物であり、「特定原材料に準ずるもの」に追加される可能性が大いにあると考えられる食物アレルギー原因食物の、ゴマ、メロン、まぐろ、ブリ、あじ、たら、たこ、ほたてがいに対する明確な検出法は、報告されておらず、これらの特定動植物が食品原料や製品に混入しているか否かを科学的に検証可能な手法が、食品の品質管理手法として待望されている。
【先行技術文献】
【特許文献】
【0016】
【特許文献1】特開2001-321184、ホタテガイ系統解析方法
【非特許文献】
【0017】
【非特許文献1】Brzezinski JL; Detection of sesame seed DNA in foods using real-time PCR; Journal of food Protection, 70(4):1333-6, 2007
【非特許文献2】Katsunori T., Atuhi N., Yukari A., Yoshiteru S., Hidetaja N., Hiromichi Y, and Kenji K; Molecular characterization of South and East Asian melon,Cucumis melo L., and the origin og Group Conomon var.makuwa and var. conomon revealed by RAPD analysis; Euphytica, 153:233-247, 2007
【非特許文献3】Kazutoshi Y., Hiroyoshi I., Yukari A., Ken-o T., Maki K., Yoshihiko T., and Kenji K.; Genetic Relationship among East and South Asian Melon(Cucumis melo L.) Revealed by AFLP Analysis; Breeding Science, 55: 197-206, 2005
【非特許文献4】Michelini E., Cevenini L., Mezzanotte L., Simoni P., Baraldini M., De L., and Roda A; One-step triplex-polymerase chain reaction aasay for the authentication of yellowfin(Thunnus albacares),bigeye(Thunnus obseus),and skipjack(Katsuwonus pelamis)tuna DNA from fresh,frozen and canned tuna samples.; Journal of agiricultual and food chemistry, 55(19): 7638-47, 2007
【非特許文献5】Yasuharu T., Takami M., and Michiaki Y; Complete mitochondrial DNA sequence of Atlantic horse mackerel Trachurus trachurus and molecular identification of two commercially importane species T.trachurus and T.japonicus using PCR-RFLP;FISHERIES SCIENCE, 72:1054-1065, 2006
【非特許文献6】柳本 卓,北村 徹; mtDNA シトクロームb遺伝子による北海道周辺のタラ科3種の種判別;Nippon Suisan Gakkaihi, 68(6):893-899, 2002
【非特許文献7】Bonnaud L., R. Boucher-Rodoni, and M. Monnerot; Phylogeny of cephalopods inferred from mitochondrial DNA sequences; Molecular Phylogenetics and Evolution, 7: 44-54, 1997
【発明の開示】
【発明が解決しようとする課題】
【0018】
本発明は、アレルギーを引き起こす恐れのある特定の動植物のうちゴマ、メロン、まぐろ、ぶり、あじ、たら、たこ、ほたてがいを、食品原料や製品中から特異的に検出できる方法、及びこの方法に用いるPCRプライマー、プライマーセット、キットを提供することを、主目的とする。
【課題を解決するための手段】
【0019】
上記課題を達成するために、本発明者らは、分子生物学的観点から、検出対象とする動植物及びその他の生物の遺伝子配列における共通性と特異性に着目し、「特定原材料に準ずるもの」に追加される可能性が大いにあると考えられる食物アレルギー原因食物の、ゴマ、メロン、まぐろ、ブリ、あじ、たら、たこ、ほたてがい(本発明において、これらを「特定動植物」と称する)を高感度に検出することができる方法を鋭意研究した。その結果、ゴマ、メロン、まぐろ、ぶり、あじ、たら、たこ、あるいはほたてがいの各々に特徴的な塩基配列を見いだし、これらの塩基配列を利用してPCR法などの核酸分析を行うことで、ゴマ、メロン、まぐろ、ブリ、あじ、たら、たこ、あるいはほたてがいを簡便に検出し得ることを見いだし、更に鋭意検討を重ねて、本発明を完成するに至った。即ち、本発明は、以下の特定動植物検出用PCRプライマーセット、特定動植物検出法、並びに、特定動植物検出用キットに関与する。
【0020】
項1. 下記の(1)〜(16)のいずれかのPCRプライマーセット。
(1) 配列表の配列番号1における塩基番号13〜27の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号2における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるPCRプライマーセット。
(2) 配列表の配列番号3における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号4における塩基番号11〜25の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット。
(3) 配列表の配列番号5における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号6における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット。
(4) 配列表の配列番号7における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号8における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット。
(5) 配列表の配列番号9における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号10における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号11における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(6) 配列表の配列番号12における塩基番号6〜20の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号13における塩基番号4〜18の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー。
とからなるプライマーセット
(7) 配列表の配列番号14における塩基番号11〜25の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号15における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(8) 配列表の配列番号16における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号17における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号18における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号19における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(9) 配列表の配列番号1の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号2の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(10) 配列表の配列番号3の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号4の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(11) 配列表の配列番号5の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号6の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(12) 配列表の配列番号7の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号8の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(13) 配列表の配列番号9の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号10の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号11の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(14) 配列表の配列番号12の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号13の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(15) 配列表の配列番号14の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号15の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(16) 配列表の配列番号16の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号17の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号18の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号19の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
【0021】
項2. 請求項1の(1)に記載のプライマーセット。
【0022】
項3. 請求項1の(2)に記載のプライマーセット。
【0023】
項4. 請求項1の(3)に記載のプライマーセット。
【0024】
項5. 請求項1の(4)に記載のプライマーセット。
【0025】
項6. 請求項1の(5)に記載のプライマーセット。
【0026】
項7. 請求項1の(6)に記載のプライマーセット。
【0027】
項8. 請求項1の(7)に記載のプライマーセット。
【0028】
項9. 請求項1の(8)に記載のプライマーセット。
【0029】
項10. 請求項1の(9)に記載のプライマーセット。
【0030】
項11. 請求項1の(10)に記載のプライマーセット。
【0031】
項12. 請求項1の(11)に記載のプライマーセット。
【0032】
項13. 請求項1の(12)に記載のプライマーセット。
【0033】
項14. 請求項1の(13)に記載のプライマーセット。
【0034】
項15. 請求項1の(14)に記載のプライマーセット。
【0035】
項16. 請求項1の(15)に記載のプライマーセット。
【0036】
項17. 請求項1の(16)に記載のプライマーセット。
【0037】
項18. 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項2〜15のいずれかに記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中に特定動物、特定植物が存在しているか否かを検出する工程とを含む特定動物、特定植物の検出方法。
【0038】
項19. 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項2又は10記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にゴマが存在しているか否かを検出する工程とを含む特定植物の検出方法。
【0039】
項20. 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項3又は11記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にメロンが存在しているか否かを検出する工程とを含む特定植物の検出方法。
【0040】
項21. 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項4又は12記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にまぐろが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【0041】
項22. 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項5又は13記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にブリが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【0042】
項23. 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項6又は14記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にあじが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【0043】
項24 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項7又は15記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にたらが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【0044】
項25. 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項8又は16記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にたこが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【0045】
項26. 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項9又は17記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にほたてがいが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【発明の効果】
【0046】
本発明によれば、PCR等を用いた核酸分析による、精度及び検出感度の高い特定動植物(ゴマ、メロン、まぐろ、ブリ、あじ、たら、たこ、ほたてがい)由来DNAの検出を可能とし、被験食品原料や被験食品中に、上記特定動植物が混入しているか否か、又は、使用されているか否かといった品質管理検査の実施を可能にするという効果を奏する。また、アレルギーの未然防止、アレルギー症状が生じた際の原因物質の調査等にも寄与する。
【図面の簡単な説明】
【0047】
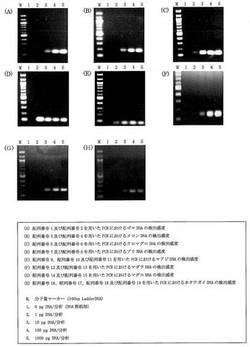
【図1】本発明におけるプライマーセットを用いた場合のDNAの検出感度を示した電気泳動後の写真である。(A)配列番号1及び配列番号2を用いたPCRにおけるゴマDNAの検出感度を示した電気泳動後の写真である。(B)配列番号3及び配列番号4を用いたPCRにおけるメロンDNAの検出感度を示した電気泳動後の写真である。(C)配列番号5及び配列番号6を用いたPCRにおけるクロマグロDNAの検出感度を示した電気泳動後の写真である。(D)配列番号7及び配列番号8を用いたPCRにおけるブリDNAの検出感度を示した電気泳動後の写真である。(E)配列番号9、配列番号10及び配列番号11を用いたPCRにおけるマアジDNAの検出感度を示した電気泳動後の写真である。(F)配列番号12及び配列番号13を用いたPCRにおけるマダラDNAの検出感度を示した電気泳動後の写真である。(G)配列番号14及び配列番号15を用いたPCRにおけるマダコDNAの検出感度を示した電気泳動後の写真である。(H)配列番号16、配列番号17、配列番号18及び配列番号19を用いたPCRにおけるホタテガイDNAの検出感度を示した電気泳動後の写真である。
【図2】本発明におけるプライマーセットを用い、特定動植物含有食品中の特定動植物由来DNAの検出を示した電気泳動後の写真である。(A)配列番号1及び配列番号2を用いたPCRにおける各動植物含有食品中の特定植物由来DNAの検出結果の電気泳動後の写真である。(B)配列番号3及び配列番号4を用いたPCRにおける各動植物含有食品中の特定植物由来DNAの検出結果の電気泳動後の写真である。(C)配列番号5及び配列番号6を用いたPCRにおける各動植物含有食品中の特定動物由来DNAの検出結果の電気泳動後の写真である。(D)配列番号7及び配列番号8を用いたPCRにおける各動植物含有食品中の特定動物由来DNAの検出結果の電気泳動後の写真である。(E)配列番号9、配列番号10及び配列番号11を用いたPCRにおける各動植物含有食品中の特定動物由来DNAの検出結果の電気泳動後の写真である。(F)配列番号12及び配列番号13を用いたPCRにおける各動植物含有食品中の特定動物由来DNAの検出結果の電気泳動後の写真である。(G)配列番号14及び配列番号15を用いたPCRにおける各動植物含有食品中の特定動物由来DNAの検出結果の電気泳動後の写真である。(H)配列番号16、配列番号17、配列番号18及び配列番号19を用いたPCRにおける各動植物含有食品中の特定動物由来DNAの検出結果の電気泳動後の写真である。
【発明を実施するための形態】
【0048】
以下、本発明を詳細に説明する。
特定動植物検出用PCRプライマーセット
本発明者等は、上記の目的に従い、以下の8種の特定動植物検出用PCRプライマーセットを開発した。本発明の特定動植物検出用PCRプライマーセットには、ゴマに特徴的な塩基配列を有するもの、メロンに特徴的な塩基配列を有するもの、まぐろに特徴的な塩基配列を有するもの、ブリに特徴的な塩基配列を有するもの、あじに特徴的な塩基配列を有するもの、たらに特徴的な塩基配列を有するもの、たこに特徴的な塩基配列を有するもの、及びほたてがいに特徴的な塩基配列を有するものがある。
【0049】
ゴマ検出用PCRプライマーセット、及びメロン検出用PCRプライマーセットの開発に際しては、まずゴマ近縁植物、メロン近縁植物を含む約550種の植物についてクロロプラストのrbcL(large subunit gene for ribulose-1,5-bisphosphate carboxylase/oxygenase)遺伝子配列を既知のDNAデータベース(GenBank nucleotide sequence database)から取得あるいは、一部の植物の当該遺伝子配列を独自に解析することによって取得し、それらの厖大な塩基配列の多重並列配列図を作成し、当該塩基配列の類似性や特異性等の性状を詳細に比較検討したが、当該遺伝子の塩基配列は、ゴマは近縁種のシソ科シソ属のシソと、メロンは近縁種のキュウリ等、キュウリ属植物と相同性が高く特異的な当該遺伝子配列領域を選出することが困難であった。そこで、ゴマ近縁植物、メロン近縁植物を含む約250種の植物についてクロロプラストのmatk(maturase-encoding gene)遺伝子配列を既知のDNAデータベース(GenBank nucleotide sequence database)から取得あるいは、一部の植物の当該遺伝子配列を独自に解析することによって取得し、それらの厖大な塩基配列の多重並列配列図を作成し、当該塩基配列の類似性や特異性等の性状を詳細に比較検討し直したところ、各々に特異的な当該遺伝子配列領域を選出することができ、それらの領域からPCRプライマーセットを新規に設計した。設計の際には、検出目的とする生物種をゴマについては、白色系統及び黒色系統のゴマに、メロンについては、メロン及びメロン変種のフユメロンに設定し、検出目的とした生物種の当該遺伝子配列領域とは、ストリンジェントな条件下でハイブリダイズするが、検出目的としない生物種とはハイブリダイズしないように創意工夫して、設計した。
【0050】
まぐろ検出用PCRプライマーセットの開発に際して、まず、マグロ類7種を含む、約250種の各種生物についてミトコンドリアのチトクロームb遺伝子配列を既知のDNAデータベースから取得あるいは、一部の生物の当該遺伝子配列を独自に解析することによって取得し、それらの厖大な塩基配列の多重並列配列図を作成した。当該遺伝子領域では、近縁種のサバ科カツオ属のカツオ等と相同性が高いため、特異的な当該遺伝子配列領域を選出することが難しく、PCRプライマーセットを設計することは困難であったが、作成した多重並列配列図を詳細に比較検討することによって、検出目的としたサバ科マグロ属のクロマグロ、キハダマグロ、メバチマグロ、ビンチョウマグロ、ミナミマグロ、コシナガ、タイセイヨウマグロに共通し、近縁種である同科カツオ属のカツオ、ソウダガツオ属のマルソウダを始めとした検出目的以外の生物種とは異なる遺伝子領域を選出し、その領域からPCRプライマーセットを新規に設計した。設計の際には、検出目的とする生物種の当該遺伝子配列領域とは、ストリンジェントな条件下でハイブリダイズするが、検出目的としない生物種とはハイブリダイズしないように創意工夫して、設計した。
【0051】
ブリ検出用PCRプライマーセットの開発に際して、まず、ブリ近縁種を含む、約250種の各種生物についてミトコンドリアのチトクロームb遺伝子配列を既知のDNAデータベースから取得あるいは、一部の生物の当該遺伝子配列を独自に解析することによって取得し、それらの厖大な塩基配列の多重並列配列図を作成した。当該遺伝子領域では、近縁種のアジ科ブリ属のヒラマサ、カンパチと相同性が高く、特異的な当該遺伝子配列領域を選出することが難しく、PCRプライマーセットを設計することは困難であったが、多重並列配列図を詳細に比較検討し、センスプライマー用の領域をヒラマサ、カンパチと相同性が高い領域から選出し、アンチセンスプライマー用の領域をヒラマサ、カンパチと相同性が低いが、マイワシとは相同性が高い領域を選出し、検出目的のブリ以外の生物種(ヒラマサ、カンパチ)に対して交錯性を示すセンスプライマーと、それらとはまた別の生物種(マイワシ)に対する交錯性を示すアンチセンスプライマーを互いに組み合わせることで、検出目的とするブリの当該遺伝子配列領域とは、ストリンジェントな条件下でハイブリダイズするが、検出目的としない生物種とはハイブリダイズしないPCRプライマーセットを創意工夫して、新規に設計した。
【0052】
あじ検出用PCRプライマーセットの開発に際して、まず、商業的に重要なアジ亜科に属する魚類を検出目的とし、アジ科約60種を含む約250種の各種生物についてミトコンドリアのチトクロームb遺伝子配列を既知のDNAデータベースから取得あるいは、一部の生物の当該遺伝子配列を独自に解析することによって取得し、それらの厖大な塩基配列の多重並列配列図を作成した。当該遺伝子領域では、検出目的としたアジ亜科の魚類に共通し、近縁種であるアジ科ブリ属のブリ等と相同性が低い特異的な当該遺伝子配列領域を選出することが難しく、PCRプライマーセットを設計することは困難であったが、多重並列配列図を詳細に比較検討し、センスプライマー、アンチセンスプライマーを特定の領域において2種ずつ設計し、ミックスプライマーとして用いることることを着想することで、検出目的とするアジ亜科に属する魚類の当該遺伝子配列領域とは、ストリンジェントな条件下でハイブリダイズするが、検出目的としない生物種とはハイブリダイズしないPCRプライマーセットを創意工夫して、新規に設計した。
【0053】
たら検出用PCRプライマーセットの開発に際して、まず、タラ科を含む約200種の各種生物についてミトコンドリアの16S rRNA遺伝子を既知のDNAデータベースから取得あるいは、一部の生物の当該遺伝子配列を独自に解析することによって取得し、それらの厖大な塩基配列の多重並列配列図を作成した。作成した多重並列配列図詳細に比較検討することによって、タラ科マダラ属のマダラ、タラ科マダラ属のタイセイヨウダラ、タラ科スケトウダラ属のスケトウダラ、タラ科コマイ属のコマイ等、商業的に重要なタラ科の魚類に共通し、検出目的以外の生物種とは異なる遺伝子領域を選出し、その領域からPCRプライマーセットを新規に設計した。設計の際には、検出目的とする生物種の当該遺伝子配列領域とは、ストリンジェントな条件下でハイブリダイズするが、検出目的としない生物種とはハイブリダイズしないように創意工夫して、新規に設計した。
【0054】
たこ検出用PCRプライマーセットの開発に際して、まず、タコ類、イカ類、貝類等の軟体動物約550種を含む約700種の各種生物についてミトコンドリアの16S rRNA遺伝子を既知のDNAデータベースから取得あるいは、一部の生物の当該遺伝子配列を独自に解析することによって取得し、それらの厖大な塩基配列の多重並列配列図を作成した。当該遺伝子領域では、検出目的としたタコ類(マダコ亜目、ヒゲダコ亜目)に共通し、近縁種であるイカ類(十腕目)と相同性が低い特異的な当該遺伝子配列領域を選出することが難しく、PCRプライマーセットを設計することは困難であったが、多重並列配列図を詳細に比較検討し、センスプライマー、アンチセンスプライマーを特定の領域において2種ずつ設計し、ミックスプライマーとして用いることを着想することで、検出目的とするタコ類に属する魚類の当該遺伝子配列領域とは、ストリンジェントな条件下でハイブリダイズするが、検出目的としない生物種とはハイブリダイズしないPCRプライマーセットを創意工夫して、新規に設計した。
【0055】
ほたてがい検出用PCRプライマーセットの開発に際して、まず、タコ類、イカ類、貝類等の軟体動物約550種を含む約700種の各種生物についてミトコンドリアの16S rRNA遺伝子を既知のDNAデータベースから取得あるいは、一部の生物の当該遺伝子配列を独自に解析することによって取得し、それらの厖大な塩基配列の多重並列配列図を作成した。当該遺伝子領域において、検出目的である日本近海に生息するイタヤガイ科Patinopecten属ホタテガイと、同様に検出目的である外海に生息する同科Pecten属のジェームスホタテ、ニュージーランドホタテ、ヨーロッパホタテ等では、塩基配列の相同性が極めて低いため、これらのほたてがいに共通し、近縁種である同科Aequipecten属のセイヨウイタヤDNA、Chlyms属のヒオウギガイDNAと相同性が低い特異的な当該遺伝子配列領域を選出することが難しく、PCRプライマーセットを設計することは困難であったが、イタヤガイ科Patinopecten属ホタテガイ検出用のプライマーセットとPecten属のジェームスホタテ、ニュージーランドホタテ、ヨーロッパホタテ等の外海に生息するホタテガイ類検出用のプライマーセットを特定の領域において各々設計し、ミックスプライマーとして用いることを着想することで、検出目的とするホタテガイ類の当該遺伝子配列領域とは、ストリンジェントな条件下でハイブリダイズしないPCRプライマーセットを創意工夫して、新規に設計した。
【0056】
本発明の特定植物検出用PCRプライマーセットを用いたPCR分析では、対象となる試料が加工品である場合も想定される。加工品を分析する場合、DNAが分解または、断片化している可能性があるので、70〜250 bp 程度の短めのPCR増幅産物を形成するようなPCRプライマーが、高感度分析のために好ましい。それ故に、PCRプライマーの設計の際には、PCR増幅産物の長さが250 bp以下となるように工夫して設計した。また、これらのPCRプライマーセットのPCR反応条件を同一条件にすることは、実際の分析における、PCR反応回数の低減化に寄与する。それ故に、PCR反応において、その反応条件を最も左右するPCRプライマーのアニーリング温度とアニーリング時間が同一となるように、具体的にはゴマ、メロン、たこは64℃で10秒間、まぐろ、ブリ、ほたてがいは66℃で10秒間のアニーリング条件となるように工夫して、PCRプライマーを設計した。
【0057】
従って、本発明の特定動植物検出用PCRプライマーセットを用いたPCR法などの核酸分析の手法を用いて、各種食品中に含まれるゴマ、メロン、まぐろ、ブリ、あじ、たら、たこ、あるいはほたてがい由来DNAを高感度かつ特異的に検出することができる。
ここで、核酸分析とは、生物分類における、個々の種、属、あるいは、グループによって特徴的な塩基配列が存在することを利用して、その特徴的な塩基配列の有無を分析することによって、その生物の種、属、あるいは、グループを把握するために有効な手段であって、特定の微生物の検出や生物種の同定などに有用に用いられる方法である。
【0058】
本発明が提供するプライマーの塩基配列は以下のとおりである。
塩基番号 123456789012345678901234567
配列番号1 (ゴマS) CGATTCTATCTCAACGAGTATTGTAAG
配列番号2 (ゴマAS) CCGTAGAAAGACGAAAATGGC
配列番号3 (メロンS) TTTCAAAAGATACGCCACTTCTT
配列番号4 (メロンAS) CCATACCACTGAAGTATTTAATCGA
配列番号5 (まぐろS) CTTCTTTTCCTTCACGAAACAGGT
配列番号6 (まぐろAS) CGAGTGCCACTAGCAGGATCA
配列番号7 (ブリS) GCTGGGCTTTGCTACCCTGCTG
配列番号8 (ブリAS) GTTACTAGGGGGTTTGCGGGGAC
配列番号9 (あじS) AACTCTAATGGCAAAnCTCCGT
(配列番号9において、nはC又はTを表す。)
但し、配列番号9のCのものと、Tのものは、ミックスプライマーとして用いる。以下、全て同様である。
配列番号10(あじAS1) GAGCAGGGAGGTCAATTAGTGA
配列番号11(あじAS2) GAGCAGGGAGGTCGATTAATGA
配列番号12(たらS) CTTAGTGATATTTACTGAAG
配列番号13(たらAS) GTTATACCGGATCAGAAA
配列番号14(たこS) GGCTAGAATGAATGGTTTGACGAnA
(配列番号14において、nはG又はAを表す。)
但し、配列番号14のGのものと、Aのものは、ミックスプライマーとして用いる。以下、全て同様である。
配列番号15(たこAS) TTATTCCTTGATCACCCCAAnC
(配列番号15において、nはC又はTを表す。)
但し、配列番号15のCのものと、Tのものは、ミックスプライマーとして用いる。以下、全て同様である。
配列番号16(ほたてがいS1) TGTGTCAGCGTTAAAGAGCAGATA
配列番号17(ほたてがいS2) CCGAATCGTTGAGGAGCACTA
配列番号18(ほたてがいAS1) TCAAGATTTTCATGTTTTGTGGG
配列番号19(ほたてがいAS2) TAATCACACCTTAATGTTTGTGGG
また、本発明が提供する30塩基のDNAからなるプライマーとしては、例えば以下の塩基配列のものを上げることができる。
配列番号20 (ゴマS) attCGATTCTATCTCAACGAGTATTGTAAG
配列番号21 (ゴマAS) agattggttCCGTAGAAAGACGAAAATGGC
配列番号22 (メロンS) attctggTTTCAAAAGATACGCCACTTCTT
配列番号23 (メロンAS) tgagtCCATACCACTGAAGTATTTAATCGA
配列番号24 (まぐろS) cttcacCTTCTTTTCCTTCACGAAACAGGT
配列番号25 (まぐろAS) ctagagaggCGAGTGCCACTAGCAGGATCA
配列番号26 (ブリS) aaggacctGCTGGGCTTTGCTACCCTGCTG
配列番号27 (ブリAS) aggcgggGTTACTAGGGGGTTTGCGGGGAC
配列番号28 (あじS) actacaagAACTCTAATGGCAAAnCTCCGT
(配列番号28において、nはC又はTを表す。)
但し、配列番号28のCのものと、Tのものは、ミックスプライマーとして用いる。以下、全て同様である。
配列番号29(あじAS1) gttcgaggGAGCAGGGAGGTCAATTAGTGA
配列番号30(あじAS2) gttcgaggGAGCAGGGAGGTCGATTAATGA
配列番号31(たらS) acagtaaaaaCTTAGTGATATTTACTGAAG
配列番号32(たらAS) gttcgttgatcgGTTATACCGGATCAGAAA
配列番号33(たこS) attagGGCTAGAATGAATGGTTTGACGAnA
(配列番号33において、nはG又はAを表す。)
但し、配列番号33のGのものと、Aのものは、ミックスプライマーとして用いる。以下、全て同様である。
配列番号34(たこAS) ttatatttTTATTCCTTGATCACCCCAAnC
(配列番号34において、nはC又はTを表す。)
但し、配列番号34のCのものと、Tのものは、ミックスプライマーとして用いる。以下、全て同様である。
配列番号35(ほたてがいS1) attgacTGTGTCAGCGTTAAAGAGCAGATA
配列番号36(ほたてがいS2) tatttgtggCCGAATCGTTGAGGAGCACTA
配列番号37(ほたてがいAS1) ctgttaaTCAAGATTTTCATGTTTTGTGGG
配列番号38(ほたてがいAS2) ttctgaTAATCACACCTTAATGTTTGTGGG
【0059】
本発明は、第1のプライマーセットとして、配列表の配列番号1における塩基番号13〜27の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをセンスプライマーとし、配列表の配列番号2における塩基番号7〜21の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットは、ゴマ検出用に好適に使用できる。本プライマーセットは、PCRに供与されることにより、双方ともゴマのクロロプラストのmatK遺伝子に特異的に結合するが、その他の生物由来クロロプラストのmatK遺伝子を検出可能に増幅しないので、ゴマDNAを検出するのためのPCR用プライマーセットとして使用できる。また、高感度に当該DNAを検出することができる。
【0060】
また、本発明は、第2のプライマーセットとして、配列表の配列番号3における塩基番号9〜23の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをセンスプライマーし、配列表の配列番号4における塩基番号11〜25の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットは、メロン検出用に好適に使用できる。本プライマーセットは、PCRに供与されることにより、双方ともメロンのクロロプラストのmatK遺伝子に特異的に結合するが、その他の生物由来クロロプラストのmatK遺伝子を検出可能に増幅しないので、メロンDNAを検出するのためのPCR用プライマーセットとして使用できる。また、高感度に当該DNAを検出することができる。
【0061】
また、本発明は、第3のプライマーセットとして、配列表の配列番号5における塩基番号10〜24の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをセンスプライマーとし、配列表の配列番号6における塩基番号7〜21の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットは、PCRに供されることにより、双方ともまぐろのミトコンドリアのチトクロームb遺伝子に特異的に結合するが、その他の生物由来ミトコンドリアのチトクロームb遺伝子を検出可能に増幅しないので、まぐろDNAを検出するのためのPCR用プライマーセットとして使用できる。また高感度に当該DNAを検出することができる。
【0062】
また、本発明は、第4のプライマーセットとして、配列表の配列番号7における塩基番号8〜22の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをセンスプライマーとし、配列表の配列番号8における塩基番号9〜23の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットは、PCRに供されることにより、双方ともブリのミトコンドリアのチトクロームb遺伝子に特異的に結合するが、その他の生物由来ミトコンドリアのチトクロームb遺伝子を検出可能に増幅しないので、ブリDNAを検出するのためのPCR用プライマーとして使用できる。また、高感度に当該DNAを検出することができる。
【0063】
また、本発明は、第5のプライマーセットとして、配列表の配列番号9における塩基番号8〜22の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをセンスプライマーとし、配列表の配列番号10における塩基番号8〜22の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマー及び配列表の配列番号11における塩基番号8〜22の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットは、PCRに供されることにより、双方ともあじのミトコンドリアのチトクロームb遺伝子に特異的に結合するが、その他の生物由来ミトコンドリアのチトクロームb遺伝子を検出可能に増幅しないので、あじDNAを検出するのためのPCR用プライマーとして使用できる。また、高感度に当該DNAを検出することができる。
【0064】
また、本発明は、第6のプライマーセットとして、配列表の配列番号12における塩基番号6〜20の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをセンスプライマーとし、配列表の配列番号13における塩基番号4〜18の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットは、PCRに供されることにより、双方ともたらのミトコンドリアの16S rRNA遺伝子に特異的に結合するが、その他の生物由来ミトコンドリアの16S rRNA遺伝子を検出可能に増幅しないので、たらDNAを検出するのためのPCR用プライマーとして使用できる。また、高感度に当該DNAを検出することができる。
【0065】
また、本発明は、第7のプライマーセットとして、配列表の配列番号14における塩基番号11〜25の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをセンスプライマーとし、第15のプライマーとして、配列表の配列番号15における塩基番号8〜22の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットは、PCRに供されることにより、双方ともたこのミトコンドリアの16S rRNA遺伝子に特異的に結合するが、その他の生物由来ミトコンドリアの16S rRNA遺伝子を検出可能に増幅しないので、たこDNAを検出するのためのPCR用プライマーとして使用できる。また、高感度に当該DNAを検出することができる。
【0066】
また、本発明は、第8のプライマーセットとして、配列表の配列番号16における塩基番号7〜21の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマー及び配列表の配列番号17における塩基番号10〜24の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをセンスプライマーとし、配列表の配列番号18における塩基番号10〜24の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマー及び配列表の配列番号19における塩基番号10〜24の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットは、PCRに供されることにより、双方ともほたてがいのミトコンドリアの16S rRNA遺伝子に特異的に結合するが、その他の生物由来ミトコンドリアの16S rRNA遺伝子を検出可能に増幅しないので、ほたてがいDNAを検出するのためのPCR用プライマーとして使用できる。また、高感度に当該DNAを検出することができる。
【0067】
前記各プライマーにおいて、塩基配列の長さを15から30とするのは、PCR用プライマーとしての塩基配列の適切な長さが15〜30程度であること、また、3´末端側15個の塩基配列を特定するのは、3´末端側15個程度がPCRの特異的な増幅反応において重要であって、5´末端側の塩基配列が若干異なっていたり、配列の長さが多少違っていたりしても、PCRの反応自体への悪影響が、たいていの場合、小さいためである。
【0068】
本発明においては、さらに、第1のプライマーセットの好ましい態様としては、配列表の配列番号1の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(1´)(最も好ましくは配列番号1の塩基配列のDNAからなるプライマー)をセンスプライマーとし、配列表の配列番号2の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(2´)(最も好ましくは配列番号2の塩基配列のDNAからなるプライマー)をアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットはゴマ検出用に好適に使用でき、配列番号1のプライマーと配列番号2のプライマーとをセットで用いることが最も好ましい。なお、(1´)の具体例としては配列番号20のプライマー、(2´)の具体例としては配列番号21のプライマーを例示できる。
【0069】
また、第2のプライマーセットの好ましい態様として、配列表の配列番号3の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(3´)(最も好ましくは配列番号3の塩基配列のDNAからなるプライマー)をセンスプライマーとし、配列表の配列番号4の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(4´)(最も好ましくは配列番号4の塩基配列のDNAからなるプライマー)をアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットはメロン検出用に好適に使用でき、配列番号3のプライマーと配列番号4のプライマーとをセットで用いることが最も好ましい。なお、(3´)の具体例としては配列番号22のプライマー、(4´)の具体例としては配列番号
23のプライマーを例示できる。
【0070】
また、第3のプライマーセットの好ましい態様として、配列表の配列番号5の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(5´)(最も好ましくは配列番号5の塩基配列のDNAからなるプライマー)をセンスプライマーとし、配列表の配列番号4の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(6´)(最も好ましくは配列番号6の塩基配列のDNAからなるプライマー)をアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットはまぐろ検出用に好適に使用でき、配列番号5のプライマーと配列番号6のプライマーとをセットで用いることが最も好ましい。なお、(5´)の具体例としては配列番号24のプライマー、(6´)の具体例としては配列番号25のプライマーを例示できる。
【0071】
また、第4のプライマーセットの好ましい態様として、配列表の配列番号7の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(7´)(最も好ましくは配列番号7の塩基配列のDNAからなるプライマー)をセンスプライマーとし、配列表の配列番号8の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(8´)(最も好ましくは配列番号8の塩基配列のDNAからなるプライマー)をアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットはぶり検出用に好適に使用でき、配列番号7のプライマーと配列番号8のプライマーとをセットで用いることが最も好ましい。なお、(7´)の具体例としては配列番号26のプライマー、(8´)の具体例としては配列番号28のプライマーを例示できる。
【0072】
また、第5のプライマーセットの好ましい態様として、配列表の配列番号9の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(9´)(最も好ましくは配列番号9の塩基配列のDNAからなるプライマー)をセンスプライマーとし、配列表の配列番号10の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(10´)(最も好ましくは配列番号10の塩基配列のDNAからなるプライマー)及び配列表の配列番号11の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(11´)(最も好ましくは配列番号11の塩基配列のDNAからなるプライマー)をアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットはあじ検出用に好適に使用でき、配列番号9のプライマー、配列番号10のプライマー、配列番号11のプライマーとをセットで用いることが最も好ましい。なお、(9´)の具体例としては配列番号28のプライマー、(10´)の具体例としては配列番号29のプライマー、(11´)の具体例としては配列番号30のプライマーを例示できる。
【0073】
また、第6のプライマーの好ましい態様として、配列表の配列番号12の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(12´)(最も好ましくは配列番号12の塩基配列のDNAからなるプライマー)をセンスプライマーとし、配列表の配列番号13の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(13´)(最も好ましくは配列番号8の塩基配列のDNAからなるプライマー)をアンチセンスプライマーとするプライマーセット提案する。本プライマーセットは、たら検出用に好適に使用、配列番号12のプライマーと配列番号13のプライマーとをセットで用いることが最も好ましい。なお、(12´)の具体例としては配列番号31のプライマー、(13´)の具体例としては配列番号32のプライマーを例示できる。
【0074】
また、第7のプライマーの好ましい態様として、配列表の配列番号14の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(14´)(最も好ましくは配列番号14の塩基配列のDNAからなるプライマー)をセンスプライマーとし、配列表の配列番号15の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(15´)(最も好ましくは配列番号15の塩基配列のDNAからなるプライマー)をアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットはたこ検出用に好適に使用でき、配列番号14のプライマーと配列番号15のプライマーとをセットで用いることが最も好ましい。なお、(14´)の具体例としては配列番号33のプライマー、(15´)の具体例としては配列番号34のプ
ライマーを例示できる。
【0075】
また、第8のプライマーセットの好ましい態様として、配列表の配列番号16の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(16´)(最も好ましくは配列番号16の塩基配列のDNAからなるプライマー)及び、配列表の配列番号17の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(17´)(最も好ましくは配列番号17の塩基配列のDNAからなるプライマー)をセンスプライマーとし、配列表の配列番号18の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(18´)(最も好ましくは配列番号18の塩基配列のDNAからなるプライマー)及び配列表の配列番号19の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(19´)(最も好ましくは配列番号19の塩基配列のDNAからなるプライマー)をアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットはほたてがい検出用に好適に使用でき、配列番号16のプライマー、配列番号17のプライマー、配列番号18のプライマー、配列番号19のプライマーとをセットで用いることが最も好ましい。なお、(16´)の具体例としては配列番号35のプライマー、(17´)の具体例としては配列番号36のプライマー、(18´)の具体例としては配列番号37のプライマー、(19´)の具体例としては配列番号38のプライマーを例示できる。
【0076】
なお、センスプライマーとアンチセンスプライマーのハイブリダイズや、個々のプライマー自身によるハイブリダイズを生じないように、すなわち、いわゆるプライマーダイマーの形成を極力回避するような工夫を施して、各々のプライマーを設計した。例えば、プライマーダイマーの形成を回避させるために、プライマーの検出特異性及び検出感度の低下を導かないような塩基置換をプライマーに施している。ゴマ検出用プライマーのセンスプライマーである配列番号1における塩基番号8の塩基は、本来、Tであるが、センスプライマーとアンチセンスプライマーによるプライマーダイマーの形成を回避するために、プライマーの検出特異性及び検出感度の低下を導かないような塩基置換として、Tの代わりにAを採用している。同様に、配列番号7における塩基番号13の塩基をAからTに、配列番号17における塩基番号4の塩基をCからAに置換している。
【0077】
本発明が提供するプライマーの塩基配列について網羅的に述べてきたが、理論上は首尾よく設計されたプライマーであっても、意図する性能(検出感度等)を保有しえないプライマーが設計される場合がある。例えば、本発明の研究段階において、配列番号39と配列番号40とからなるゴマ検出用PCRプライマーセット、配列番号41と配列番号42とからなるメロン検出用PCRプライマーセットを用いたPCRでは、低い検出感度(100 pg DNA)を示した。このように、単に論理的にプライマーを設計すれば、意図する性能(検出感度等)を取得できるとは限らず、必要な性能を保有しない場合も生じうるために、その設計の際には、論理的設計だけでなく、さらなる工夫とその性能評価試験が重要となる。本発明が提供するプライマーは、論理的設計の上に、さらなる工夫を施して設計したものであり、最終的には性能評価試験をクリアーしたものである。
【0078】
配列番号39 ゴマS AATTCTCATGTATGTGAATATGAAG
配列番号40 ゴマAS GTTCGCCTGAAAATCCTTAAC
配列番号41 メロンS GACAAAAAATCCAGTTTACTAATG
配列番号42 メロンAS GGATGTTTGTTATAATAATTAGACGAC
( Sはセンスプライマーを表し、ASはアンチセンスプライマーを表す。)
【0079】
特定動植物検出法
本発明の特定植物検出方法は、試料からDNAを抽出する工程と、このDNAを鋳型として、本発明のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にゴマ、メロン、まぐろ、ブリ、あじ、たら、たこ、又はほたてがいが存在しているか否かを検出する工程とを含む方法である。
【0080】
即ち、上記本発明の特定植物検出用PCRプライマーセットを用いて、試料中のDNAをPCR等で核酸分析することにより、試料中の特定植物を特異的に検出することが可能となる。このとき、ゴマを検出する場合には、ゴマ検出用PCRプライマーセットを使用し、同様にメロン、まぐろ、ブリ、あじ、たら、たこ、ほたてがいを検出する場合には、それぞれメロン検出用PCRプライマーセット、まぐろ検出用PCRプライマーセット、ブリ検出用PCRプライマーセット、あじ検出用PCRプライマーセット、たら検出用PCRプライマーセット、たこ検出用PCRプライマーセット、ほたてがい検出用PCRプライマーセットを使用すればよい。
【0081】
検出法(核酸分析)の種類は、特に限定されず、適宜公知の方法を用いることができる。例えば、PCRプライマーを用いてPCR増幅する方法やPCR増幅産物をプローブで検出する方法等を例示することができる。
【0082】
PCRプライマーを用いてPCR増幅する方法としては、検出目的に応じて選択した上記本発明の特定動植物検出用プライマーセットを用いて、試料中のDNAにおける標的塩基配列を選択的に増幅させ、PCR増幅産物の有無を測定する方法が挙げられる。PCR増幅産物の有無の確認は、通常、PCR増幅産物をアガロースゲル電気泳動により分離し、エチジウムブロマイドやサイバーグリーンIなどの核酸染色によって行うことができる。リアルタイムPCR装置を用いてPCRを行う場合は、その装置の検出システムにより自動的にPCR増幅産物の有無を確認することができる。例えば、PCR反応液中にサイバーグリーンIを添加した場合、サイバーグリーンIが二本鎖DNAに結合したときに発する蛍光量に依存したPCR増幅産物量をサイクル毎にモニターすることができる。さらに、PCR後に、PCR増幅産物の融解曲線分析を行い、その分析からPCR増幅産物の融解温度(Tm)値を導くことにより、PCR増幅産物が目的の増幅産物であるか否かを確認できる。状況によっては、このTm値による判断が困難な場合も想定されるが、そのような場合には、先述のアガロースゲル電気泳動によって増幅産物の有無とそのサイズを確認すればよい。
【0083】
具体的には、配列番号1記載のプライマーと配列番号2記載のプライマーを用いたPCR増幅産物のTm値は約77.3℃であり、PCR増幅産物のサイズは約150 bpである。融解曲線分析において、当該Tm値を得た場合、又は、アガロース電気泳動において当該サイズの増幅産物を検出した場合、被験試料中にゴマが存在していたことを示唆する。
【0084】
また、配列番号3記載のプライマーと配列番号4記載のプライマーを用いたPCR増幅産物のTm値は約79.5℃であり、PCR増幅産物のサイズは約179 bpである。融解曲線分析において、当該Tm値を得た場合、又は、アガロース電気泳動において当該サイズの増幅産物を検出した場合、被験試料中にメロンが存在していたことを示唆する。
【0085】
また、配列番号5記載のプライマーと配列番号6記載のプライマーを用いたPCR増幅産物のTm値は約80.5℃であり、PCR増幅産物のサイズは約130 bpである。融解曲線分析において、当該Tm値を得た場合、又は、アガロース電気泳動において当該サイズの増幅産物を検出した場合、被験試料中にまぐろが存在していたことを示唆する。
【0086】
また、配列番号7記載のプライマーと配列番号8記載のプライマーを用いたPCR増幅産物のTm値は約84.7℃であり、PCR増幅産物のサイズは約105 bpである。融解曲線分析において、当該Tm値を得た場合、又は、アガロース電気泳動において当該サイズの増幅産物を検出した場合、被験試料中にブリが存在していたことを示唆する。
【0087】
また、配列番号9記載のプライマー、配列番号10、配列番号11記載のプライマーを用いたPCR増幅産物のTm値は約79.5℃であり、PCR増幅産物のサイズは約77 bpである。融解曲線分析において、当該Tm値を得た場合、又は、アガロース電気泳動において当該サイズの増幅産物を検出した場合、被験試料中にあじが存在していたことを示唆する。
【0088】
また、配列番号12記載のプライマーと配列番号13記載のプライマーを用いたPCR増幅産物のTm値は約83.4℃であり、PCR増幅産物のサイズは約144 bpである。融解曲線分析において、当該Tm値を得た場合、又は、アガロース電気泳動において当該サイズの増幅産物を検出した場合、被験試料中にたらが存在していたことを示唆する。
【0089】
また、配列番号14記載のプライマーと配列番号15記載のプライマーを用いたPCR増幅産物のTm値は約76.4℃であり、PCR増幅産物のサイズは約204 bpである。融解曲線分析において、当該Tm値を得た場合、又は、アガロース電気泳動において当該サイズの増幅産物を検出した場合、被験試料中にたこが存在していたことを示唆する。
【0090】
また、配列番号16記載のプライマー、配列番号17記載のプライマー、配列番号18記載のプライマー及び配列番号19記載のプライマーを用いたPCR増幅産物のTm値は約83.8℃であり、PCR増幅産物のサイズは約145また約180 bpである。融解曲線分析において、当該Tm値を得た場合、又は、アガロース電気泳動において当該サイズの増幅産物を検出した場合、被験試料中にほたてがいが存在していたことを示唆する。
【0091】
PCR増幅産物をプローブで検出する方法としては、Taq Man法に代表されるように、PCR増幅産物の内部塩基配列とハイブリダイズするような蛍光物質標識プローブを反応液に添加し、該プローブがPCR増幅産物にハイブリダイズ後、該プローブが分解されるときに生じる蛍光量をリアルタイムPCR装置で自動的に検出することによって、PCR増幅産物の有無を確認する方法が挙げられる。なお、PCR増幅産物をプローブで検出するその他の方法としては、Molecular Beacon法、CycleavePCR法、ハイブリプローブを利用する方法等が挙げられる。これらの方法で使用するPCRプライマーは、本発明の特定動植物検出用PCRプライマーセットの何れかを使用すればよく、各々のPCRプライマーセットで増幅されるPCR増幅産物の内部塩基配列から標的とする生物種に共通な塩基配列領域を別途選択し、その領域に基づいたプローブを使用すればよい。
【0092】
本発明の特定動植物の検出法において、対象となる被験試料の種類は、特に限定されない。例えば、被験試料としては、食品原料や加工食品等が挙げられる。食品原料としては、特定動植物を取り扱う食品原料生産工場において、別途生産される特定動植物を意図的に含まない食品原料が挙げられる。加工食品としては、菓子類、麺類、粉末スープ、液体スープ、熱風乾燥又は凍結乾燥した具材、あるいは、これらの加工食品を含有する各種調理食品等が挙げられる。また、特定動植物を取り扱う食品製造工場において、別途生産される特定動植物を意図的に含まない加工食品が挙げられる。また、特定動植物を含む加工食品を製造後、特定動植物を含まない加工食品を製造する際には、特定動植物残渣の除去を念頭においた食品製造設備の入念な清掃作業が必須となる。この清掃作業方法の有効性、並びに、食品製造設備の特定動植物残渣の有無を確認する観点から、当該製造設備の拭き取り試料も被験試料として挙げられる。
【0093】
また、試料の形態も特に限定されず、一般的な既知のDNA抽出法(厚生労働省医薬局食品保健部長通知、アレルギー物質を含む食品の検査方法について、平成14年11月06日、食発第1106001号)や市販の各種DNA抽出キット[例えば、Nucleon PhytoPure, plant and fungal DNA extraction kits(Amersham Biosciences Corp., USA)、DNA Extraction IsoplantII kit(Nippon Gene Co. Ltd., Japan)、DNeasy Plant Mini Kit(Qiagen GmbH, Hilden, Germany)等]によって、DNAの回収が可能な試料であれば、上記の検出法に適用することができる。上記のDNA抽出法によって、ゲノムDNA及び細胞小器官由来DNA(ミトコンドリアDNAやクロロプラストDNA)を、通常、試料から抽出することができる。
【0094】
特定動植物検出用キット
本発明は、また、特定動植物検出キットに関する。当該キットは、上記本発明の特定動植物検出用PCRプライマーセットの少なくとも1セットを含んで成るものであれば、その構成は特に限定されない。
具体的には、配列番号1における塩基番号13〜27の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号2における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号3における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号4における塩基番号11〜25の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号5における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号6における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号7における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号8における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号9における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、配列番号10における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、及び配列番号11における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号12における塩基番号6〜20の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号13における塩基番号4〜18の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号14における塩基番号11〜25の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号15における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;及び
配列番号16における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、配列番号17における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、配列番号18における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、及び配列番号19における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセットの1セット以上を含む特定動植物検出キットが挙げられる。
【0095】
そして、好ましいものとして、配列番号1の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号2の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号3の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号4の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号5の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号6の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号7の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号8の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号9の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、配列番号10の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、及び配列番号11の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号12の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号13の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号14の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号15の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;及び
配列番号16の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、配列番号17の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、配列番号18の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、配列番号19の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセットの1セット以上を含む特定動植物検出キットが挙げられる。
【0096】
その中でも、特に好ましいものとして、配列番号1の塩基配列からなるプライマーと、配列番号2の塩基配列からなるプライマーとのセット;
配列番号3の塩基配列からなるプライマーと、配列番号4の塩基配列からなるプライマーとのセット;
配列番号5の塩基配列からなるプライマーと、配列番号6の塩基配列からなるプライマーとのセット;
配列番号7の塩基配列からなるプライマーと、配列番号8の塩基配列からなるプライマーとのセット;
配列番号9の塩基配列からなるプライマー、配列番号10の塩基配列からなるプライマー、及び配列番号11の塩基配列からなるプライマーとのセット;
配列番号12の塩基配列からなるプライマーと、配列番号13の塩基配列からなるプライマーとのセット;
配列番号14の塩基配列からなるプライマーと、配列番号15の塩基配列からなるプライマーとのセット;
配列番号16の塩基配列からなるプライマー、配列番号17の塩基配列からなるプライマー、配列番号18の塩基配列からなるプライマー、配列番号19の塩基配列からなるプライマーとのセットの1セット以上を含む特定動植物検出キットが挙げられる。
また、上記の各々のプライマーセット、及び当該の各々のプライマーセットで増幅されるPCR増幅産物を検出するためのプローブ等を含む特定動植物検出キットなども挙げられる。
【0097】
当該キットには、使用目的等に応じて、適当な試薬や各種容器等を含めることができる。具体的には、PCRプライマー伸長生成物を合成するための重合用試薬、例えば、耐熱性DNAポリメラーゼ、デオキシリボヌクレオチド、マグネシウム及び、PCR反応用緩衝液、並びに、それらの品質を適切に保持可能な保存容器等を含めることができる。
【0098】
実施例
以下に、本発明について実施例を用いて、さらに、詳細に説明するが、本発明は、これらの実施例に限定して解釈されるものではない。また、本発明の要旨を逸脱することなく、適宜変更することが可能である。
【0099】
実施例1
各種動物、植物、真菌及び、細菌由来DNAに対する特定植物用PCRプライマーセットの検出特異性の確認
本発明の特定植物用PCRプライマーセットを使用したPCR分析法の有効性を確認するために、各種生物由来DNAに対するPCRの検出特異性を調べる実験を、下記のように実施した。
ヒト、ウシ、ブタ、ニワトリ、アフリカツメガエル、及びチョウザメの精製DNAは、セマイン社(CeMines, LLC, USA)から購入したものを使用した。
クロマグロ、キハダマグロ、メバチマグロ、ビンチョウマグロ、カツオ、ゴマサバ、マサバ、タイセイヨウサバ、ブリ、ヒラマサ、カンパチ、マアジ、ニュージーランドマアジ、メアジ、シマアジ、マルアジ、マアナゴ、マイワシ、マダラ、サケ(シロザケ)、ギンザケ、スチールヘッド(ニジマス)、マダコ、ミズダコ、イイダコ、ヤナギダコ、スルメイカ、ヤリイカ、カミナリイカ、ホタルイカ、ホタテガイ、アメリカイタヤガイ、アメリカヒナイタヤガイ、タイラギ、ムラサキイガイ、アサリ、エゾアワビ、トコブシ、ベニズワイガニ、タラバガニ、及びブラックタイガーエビの精製DNAは、商店から購入した各々の試料の(筋)肉質部分を凍結後、マルチビーズショッカー(安井器械、大阪)で破砕した試料からNucleon PhytoPure, plant and fungal DNA extraction kits(Amersham Biosciences Corp., USA)、DNA Extraction IsoplantII kit(Nippon Gene Co. Ltd., Japan)、またはDNeasy Blood&Tissue kit(Qiagen GmbH, Germany)を用いて調製したものを使用した。
【0100】
クロゴキブリの精製DNAは、その脚の部分を70%エタノールで洗浄し、さらに、TBS緩衝液で洗浄後、マルチビーズショッカーで粉砕した試料からNucleon PhytoPure, plant and fungal DNA extraction kitsを用いて調製したものを使用した。
ゴマ(白色系統、黒色系統)、シソ、エゴマ、タイム、スペアミント、バジル、オレガノ、ローズマリー、ナス、ジャガイモ、トマト、トウガラシ、クコ、サツマイモ、キウイフルーツ、ニンジン、ゴボウ、メロン(アムスメロン、アールスメロン、レッドメロン、ハネデューメロン)、フユメロン(ハミウリ)、マクワウリ、シロウリ、キュウリ、スイカ、トウガン、カボチャ、ツルレイシ、ニガウリ、ダイズ(黄色系統)、アズキ、クリ、クルミ、リンゴ(フジ)、イチゴ、ナシ(幸水)、キャベツ、ウンシュウミカン、ネギ、アスパラガスは、商店から購入し、モモ(白鳳)、イチゴ、及びイネは国内栽培農家から入手した。これらの精製DNAは、各々の試料の一部(種子、果皮部、葉部、塊茎部)を70%エタノールで洗浄し、さらに、TE緩衝液で素早く洗浄後、マルチビーズショッカー(安井器械、大阪)で破砕した試料からNucleon PhytoPure, plant and fungal DNA extraction kits、 DNeasy plant Mini kits(Qiagen GmbH, Germany)または、DNA Extraction IsoplantII kitを用いて調製したものを使用した。
【0101】
ソバの精製DNAは、商店から購入したそば粉をマルチビーズショッカーで、さらに粉砕した試料からNucleon PhytoPure, plant and fungal DNA extraction kitsを用いて調製したものを使用した。
【0102】
コムギ及びトウモロコシの精製DNAは、バイオチェイン・インスティテュート社(BioChain Institute, Inc., USA)から購入したものを使用した。
【0103】
アスペルギウス・ニガー(Aspergillus niger IFO 9642)、サッカロマイセス・セレビシエ(Saccharomyces cerevisiae IFO 0282)、大腸菌(Escherichia coli JCM 1649T)、及びバチルス・セレウス菌(Bacillus cereus DSM 4312)の精製DNAは、各々の菌株を適切な培地で培養後、その培養液からPuregene Yeast and Gram-Positive DNA Isolation kit(Gentra Systems Inc., USA)を用いて調製したものを使用した。
【0104】
マツタケ、シイタケ、エノキダケ、ナメコ、及びエリンギの精製DNAは、商店から購入した試料の小片を凍結後、マルチビーズショッカーで破砕した試料からNucleon PhytoPure, plant and fungal DNA extraction kitsを用いて調製したものを使用した。
なお、いずれの精製DNAもRNA分解酵素によるRNAの除去操作を実施してある。
【0105】
配列番号1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、及び19に記載の各々のPCRプライマーは、オペロン・バイオテクノジー社(Operon Biotechnologies GmbH, Germany)で合成されたものを、以下のPCRで使用した。
【0106】
上述したように準備した各種動物、植物、真菌、及び細菌DNA量を測定後、滅菌水を用いて、動物、植物、及び真菌DNAの濃度を1 ng/μLに、細菌DNAの濃度を50 pg/μLに調製した。調製した1 μLのDNA試料液を含む20 μL容量の反応液は、タカラバイオ社のSYBR Premix Ex Taq(Takara Bio Inc., Japan)を用いて調製した。この試薬は、TaKaRa Ex Taq HS(ホットスタートタイプ)、dNTP Mixture、Mg2+およびSYBR Green Iを溶液中に含んでいる。反応液は、SYBR Premix Ex Taqをベースとし、250 nMセンスプライマー、250 nMアンチセンスプライマーを含む組成として、調製した。PCR反応は、LightCycler(Roche Diagnostics GmbH, Germany)で行い、増幅反応条件は以下の通りである。
【0107】
95℃で1分間のサイクルを一回実施後、20℃/秒の速度で95℃まで昇温後、5秒間同温度で保温、次に20℃/秒の速度でT℃まで降温後、10秒間同温度で保温、さらに10℃/秒の速度で72℃まで昇温後、20秒間同温度で保温する3つのステップからなる増幅サイクルをぶり検出用PCRプライマーの場合には30回、ゴマ、メロン、まぐろ、あじ、たら、たこ、及びほたてがい検出用PCRプライマーの場合には35回実施した。なお、Tは、ゴマ、メロン、及びたこ検出用PCRプライマーの場合には64、まぐろ、ぶり、及びほたてがい検出用PCRプライマーの場合には66、あじ検出用PCRプライマーの場合には62、たら検出用PCRプライマーの場合には53とした。PCR増幅産物は、SYBR Green I依存性の蛍光量として、各々のサイクルの最終ステップに記録した。増幅サイクル終了後、メルティングカーブは、20℃/秒の速度で95℃まで昇温後、次に20℃/秒の速度で60℃まで降温し、10秒間同温度で保温後、さらに0.2℃/秒の速度で97℃に至るまでのゆるやかな昇温中に0.2秒毎の蛍光強度を記録することによって得た。同PCR装置のソフトウェアによってメルティングカーブから得られたPCR増幅産物のTm値は、PCRによる特異的な増幅産物の有無を推定するために使用した。さらに、1.8%(wt/vol)アガロースゲル電気泳動によってPCR増幅産物(反応液の2 μL)を分離し、分離後のゲルをエチジウムブロマイドで染色後、UV照射下において増幅産物を視覚化することによって、増幅産物の有無を確認した。分子量マーカーとしてΦX174 HaeIII digest DNA(Takara)を使用した。これらのPCRの結果を表1に記載した。表中の+(プラス)は電気泳動により標的サイズの増幅産物が検出されたことを示し、−(マイナス)は当該増幅産物が検出されなかったことを示す。
【0108】
ゴマ検出用PCRプライマー(配列番号1及び2からなるPCRプライマーセット)を使用した場合、シソ目ゴマ科ゴマ属のゴマ(白色系統、黒色系統)DNAを使用した場合のみ150bp前後の増幅産物が確認され(表1)、これらの増幅産物のTm値は、約77.7℃であった。近縁種である同目シソ科シソ属のシソDNA、エゴマDNA、同目シソ科イブキジャコウソウ属のタイムDNA、同目シソ科ハッカ属のスペアミントDNA、同目シソ科メボウキ属のバジルDNA、同目シソ科ハナハッカ属のオレガノDNA、同目シソ科Rosmarinus属のローズマリーDNAや、他の植物を含むその他の生物種DNAを使用した場合には、増幅産物は見られなかった(表1)。
【0109】
なお、既知及び独自に解析した各種生物のクロロプラストのmatK遺伝子配列に関する多重並列配列図とPCRプライマー配列との関係から、当該PCRプライマーを用いたPCRは、ゴマ(白色系統、黒色系統)DNAを検出できるが、実施例1で供試しなかった他の植物を含むその他の生物種DNAを検出しないことが強く示唆されている。
【0110】
また、メロン検出用PCRプライマー(配列番号3及び4からなるPCRプライマーセット)は、ウリ科キュウリ属のメロン(アムスメロン、アールスメロン、赤肉メロン、ハネデューメロン)DNA、フユメロン(ハミウリ)DNAを使用した場合のみ、179 bp前後の増幅産物が確認され(表1)、これらの増幅産物のTm値は、約79.5℃であった。近縁種である同科同属のマクワウリDNA、シロウリDNA、ハミウリDNA、キュウリDNA、同科スイカ属スイカDNA、同科トウガン属トウガンDNA、同科カボチャ属セイヨウカボチャDNA、同科ツルレイシ属ツルレイシDNA、ニガウリDNAや植物を含むその他の生物種DNAを使用した場合には増幅産物は見られなかった(表1)。
【0111】
なお、既知及び独自に解析した各種生物のクロロプラストのmatK遺伝子配列に関する多重並列配列図とPCRプライマー配列との関係から、当該PCRプライマーを用いたPCRは、ウリ科キュウリ属のメロン(アムスメロン、アールスメロン、赤肉メロン、ハネデューメロン)DNA、フユメロン(ハミウリ)DNAを検出できるが、実施例1で供試しなかった他の植物を含むその他の生物種DNAを検出しないことが強く示唆されている。
【0112】
また、まぐろ検出用PCRプライマー(配列番号5及び6からなるPCRプライマーセット)を使用した場合、サバ科マグロ属のクロマグロDNA、キハダマグロDNA、メバチマグロDNA、ビンチョウマグロDNAを使用した場合のみ130bp前後の増幅産物が確認され(表2)、これらの増幅産物のTm値は、約80.5℃であった。近縁種である同科カツオ属のカツオDNA、同科サバ属のマサバDNA、ゴマサバDNA、タイセイヨウマサバDNAや他の魚類を含むその他の生物種DNAを使用した場合には、増幅産物は見られなかった(表2)。
【0113】
なお、既知及び、独自に解析した各種生物のミトコンドリアのチトクロームb遺伝子配列に関する多重並列配列図とPCRプライマー配列との関係から、当該PCRプライマーを用いたPCRは、実施例1で供試したサバ科マグロ属のクロマグロDNA、キハダマグロDNA、メバチマグロDNA、ビンチョウマグロDNAに加えて同科同属のミナミマグロDNA、コシナガDNA、タイセイヨウマグロDNAを検出できるが、近縁種である同科ハガツオ属のハガツオ、タイセイヨウハガツオ、同科ソウダガツオ属のマルソウダ(トックリガツオ)、並びに、サワラ属のサワラの仲間(Scomberomorus tritor)DNA及び、他の魚類を含むその他の生物種DNAを検出しないことが強く示唆されている。
【0114】
また、ブリ検出用PCRプライマー(配列番号7及び8からなるPCRプライマーセット)を使用した場合は、アジ科ブリモドキ亜科ブリ属のブリDNAを使用した場合のみ105bp前後の増幅産物が確認され(表2)、これらの増幅産物のTm値は、約84.7℃であった。近縁種である同科ブリモドキ亜科ブリ属のヒラマサDNA、カンパチDNA、同科アジ亜科マアジ属のマアジDNAや他の魚類を含むその他の生物種DNAを使用した場合には、増幅産物は見られなかった(表2)。
【0115】
なお、既知及び、独自に解析した各種生物のミトコンドリアのチトクロームb遺伝子配列に関する多重並列配列図とPCRプライマー配列との関係から、当該PCRプライマーを用いたPCRは、アジ科ブリモドキ亜科ブリ属のブリDNAを検出できるが、近縁種である同科同亜科アイブリ属のアイブリDNA、同科ツムブリ属のツムブリDNA及び、他の魚類を含むその他の生物種DNAを検出しないことが強く示唆されている。
【0116】
また、あじ検出用PCRプライマー(配列番号9、10及び11からなるPCRプライマーセット)を使用した場合、アジ科アジ亜科マアジ属マアジDNA、アジ科アジ亜科マアジ属ニュージーランドマアジDNA、アジ科アジ亜科メアジ属メアジDNA、アジ科アジ亜科シマアジ属シマアジDNA、アジ科アジ亜科ムロアジ属マルアジDNAを使用した場合のみ77bp前後の増幅産物が確認され(表2)、これらの増幅産物のTm値は、約79.5℃であった。近縁種である同科ブリモドキ亜科ブリ属のブリDNA、ヒラマサDNA、カンパチDNAや他の魚類を含むその他の生物種DNAを使用した場合には、増幅産物は見られなかった(表2)。なお、あじはアジ科に分類される魚類の総称で、特にアジ亜科に分類される魚類を指す。そのため、当該PCRプライマーはアジ亜科に分類される魚類を検出するよう意図的に設計しており、前述したようにアジ亜科に分類される魚類DNAを検出するが、アジ科ブリモドキ亜科に属する魚類DNAを検出しないことを確認した(表2)。
【0117】
なお、既知及び、独自に解析した各種生物のミトコンドリアのチトクロームb遺伝子配列に関する多重並列配列図とPCRプライマー配列との関係から、当該PCRプライマーを用いたPCRは、実施例1で供試したアジ科アジ亜科マアジ属マアジDNA、アジ科アジ亜科マアジ属ニュージーランドマアジDNA、アジ科アジ亜科メアジ属メアジDNA、アジ科アジ亜科シマアジ属シマアジDNA、アジ科アジ亜科ムロアジ属マルアジDNAに加えて、アジ亜科に属するあじDNA(例えばアジ亜科ムロアジ属のクサヤムロDNA、ムロアジDNA、アジ亜科ホソヒラアジ属のホソヒラアジDNA、アジ亜科マテアジ属のマテアジDNA、アジ亜科ギンガメアジ属のギンガメアジ、アジ亜科ヨロイアジ属のヨロイアジDNA、アジ亜科イトヒキアジ属のイトヒキアジDNA等)を検出できるが、ブリモドキ亜科アイブリ属のアイブリDNA、ブリモドキ亜科ツムブリ属のツムブリDNA、コバンアジ亜科コバンアジ属のコバンアジDNA、マルコバンDNA及び、他の魚類を含むその他の生物種DNAを検出しないことが強く示唆されている。
【0118】
また、たら検出用PCRプライマー(配列番号12及び13からなるPCRプライマーセット)を使用した場合は、タラ科マダラ属のマダラDNAを使用した場合のみ144bp前後の増幅産物が確認され(表2)、これらの増幅産物のTm値は、約83.4℃であった。他の魚類を含むその他の生物種DNAを使用した場合には、増幅産物は見られなかった(表2)。
【0119】
なお、既知及び、独自に解析した各種生物のミトコンドリアの16SrRNA遺伝子配列に関する多重並列配列図とPCRプライマー配列との関係から、当該PCRプライマーを用いたPCRは、実施例1で供試したタラ科マダラ属のマダラDNAに加えて、タラ科マダラ属のタイセイヨウダラDNA、タラ科スケトウダラ属のスケトウダラDNA、タラ科コマイ属のコマイDNA等の商業的に重要なタラ科の魚を検出できるが、他の魚類を含むその他の生物種DNAを検出しないことが強く示唆されている。
【0120】
また、たこ検出用PCRプライマー(配列番号14及び15からなるPCRプライマーセット)を使用した場合は、マダコDNA、ミズダコDNA、イイダコDNA、ヤナギダコDNAを使用した場合のみ204 bp前後の増幅産物が確認され(表2)、これらの増幅産物のTm値は、約76.4℃であった。イカや貝類を含むその他の生物種DNAを使用した場合には、増幅産物は見られなかった(表2)。
【0121】
なお、既知及び、独自に解析した各種生物のミトコンドリアの16S rRNA遺伝子配列に関する多重並列配列図とPCRプライマー配列との関係から、当該PCRプライマーを用いたPCRは、実施例1で供試したマダコ科マダコ属のマダコDNA、ミズダコDNA、イイダコDNA、ヤナギダコDNAに加えて、タコ類(八腕目)の属するタコDNA(例えば、マダコ科のテナガダコ、スナダコ、ワモンダコ、メンダコ科のメンダコ、カンテンダコ科のカンテンダコ、スカシダコ科のスカシダコ、クラゲダコ科のクラゲダコ属の一種、ワタゾコダコ亜科のチヒロダコ等)を検出できるが、イカ類(十腕目)や他の軟体動物を含むその他の生物種DNAを検出しないことが強く示唆されている。
【0122】
さらに、ほたてがい検出用PCRプライマー(配列番号16、17、18及び19からなるPCRプライマーセット)を使用した場合は、イタヤガイ科Patinopecten属のホタテガイDNAを使用した場合のみ180 bp前後の増幅産物が確認され(表2)、これらの増幅産物のTm値は、約83.8℃であった。近縁種である同科Argopecten属のアメリカホンイタヤガイDNA、アメリカヒナイタヤガイDNAや他の貝類、軟体動物を含むその他の生物種DNAを使用した場合には、増幅産物は見られなかった(表2)。
【0123】
なお、既知及び、独自に解析した各種生物のミトコンドリアの16S rRNA遺伝子配列に関する多重並列配列図とPCRプライマー配列との関係から、当該PCRプライマーを用いたPCRは、実施例1で供試したイタヤガイ科Patinopecten属のホタテガイDNAに加えて同科Pecten属のジェームスホタテDNA、ニュージーランドホタテDNA、ヨーロッパホタテDNAを検出できるが、近縁種である同科Aequipecten属のセイヨウイタヤDNA、Chlyms属のヒオウギガイDNA、アズマニシキガイDNA、フランスニシキDNA及び他の貝類を含むその他の生物種DNAを検出しないことが強く示唆されている。また、配列番号16、18のPCRプライマーは、日本近海で採れるホタテガイDNAの検出に好適であり、配列番号17、19のPCRプライマーは、海外で採れるジェームスホタテDNA、ニュージーランドホタテDNA、ヨーロッパホタテDNAを検出するのに好適である。
【0124】
【表1】

【0125】
【表2】

【0126】
実施例2
特定動植物用PCRプライマーセットを用いたPCRの検出感度の確認
実施例1で使用した特定動植物用PCRプライマーセットを用いたPCRの検出感度を調べるために、下記のような実験を実施した。
実施例1で調製したゴマ(白色系統)、メロン(アールスメロン)、クロマグロ、ブリ、マアジ、マダラ、マダコ、及びホタテガイの各DNAを滅菌水で希釈し、1 pg/μl、10 pg/μl、100 pg/μl、1000 pg/μlのDNA溶液の希釈系列を作製し、これらの希釈した被験DNA液の1 μLを、実施例1に記載したPCR反応条件で、PCRに供した。PCR反応後、実施例1に記載したようにして、PCR増幅産物のTm値を求め、さらに、増幅産物の有無をアガロースゲル電気泳動によって確認した。
【0127】
図1に示すように、ゴマ検出用PCRプライマー(配列番号1及び2からなるPCRプライマーセット)を使用した場合の検出感度は、1 pg DNA/分析であり、メロン検出用PCRプライマー(配列番号3及び4からなるPCRプライマーセット)を使用した場合の検出感度は、10 pg DNA/分析であり、まぐろ検出用PCRプライマー(配列番号5及び6からなるPCRプライマーセット)を使用した場合の検出感度は、1 pg DNA/分析であり、ブリ検出用PCRプライマー(配列番号7及び8からなるPCRプライマーセット)を使用した場合の検出感度は、1 pg DNA/分析であり、あじ検出用PCRプライマー(配列番号9及び10のPCRプライマーセット)を使用した場合の検出感度は、1 pg DNA/分析であり、たら検出用PCRプライマー(配列番号11及び12からなるPCRプライマーセット)を使用した場合の検出感度は、1 pg DNA/分析であり、たこ検出用PCRプライマー(配列番号11及び12からなるPCRプライマーセット)を使用した場合の検出感度は、10 pg DNA/分析であり、ほたてがい検出用PCRプライマー(配列番号11及び12からなるPCRプライマーセット)を使用した場合の検出感度は、10 pg DNA/分析であった。
【0128】
実施例3
特定動植物用PCRプライマーセットを用いたPCRによる特定動食物含有食品中の特定植物由来DNAの検出
ゴマ、メロン、まぐろ、あじ、たら、たこ、あるいはほたてがいを原料として含有する市販食品等に対する本発明の特定動物用PCRプライマーセットを用いたPCR分析を下記のように行い、本発明の実用性を検討した。
【0129】
ゴマ、メロン、まぐろ、あじ、たら、たこ、あるいはほたてがいをを原料として含有することを明記されている市販食品(表2)を準備し、1〜10 gをマルチビーズショッカーで粉砕した。その混合破砕物の0.1〜1 gから各々のDNAをDneasy Plant mini kitを用いて抽出した。抽出時には、RNA分解酵素によるRNAの除去操作も実施した。抽出した食品試料DNA量を測定後、滅菌水を用いて、食品試料DNAの濃度を10 ng/μLに調製した。なお、ぶりを原料として含有する市販食品の入手が困難であったため、ぶり含有食品の代替試料として、まぐろ薄削り(林久右衛門商店)(10 ng/μL)にぶりDNAを50 pg/μLの濃度で添加したものを使用した。これらの調製DNA液の1 μLを、実施例1で使用した特定動植物用PCRプライマーセットを用い、実施例1に記載したPCR反応条件で、PCRに供した。PCR反応後、実施例1に記載したようにして、PCR増幅産物のTm値を求め、さらに、増幅産物の有無をアガロースゲル電気泳動によって確認した。これらのPCRの結果を表2に記載した。表中の+(プラス)は電気泳動により標的サイズの増幅産物が検出されたことを示し、−(マイナス)は当該増幅産物が検出されなかったことを示し、NDは検査が未実施であることを示す。また、これらのPCRのアガロース電気泳動に関する結果を図2(A、B、C、D、E、F、G及び、H)に示した。さらに、食品試料DNAから増幅されたPCR増幅産物を、BigDye Terminator v3.1 Cycle Sequencing kit(Applied Biosystems社)を用いて、両方向からダイレクトシーケンス後、Applied Biosystems 310 Genetic Analyzer(Applied Biosystems社)によって塩基配列を分析した。分析した塩基配列データをGenBank nucleotide sequence database(BLAST search)もしくは、発明者らが保有するDNAデータベースと比較解析し、その塩基配列の類似性に基づいて、PCR増幅産物由来DNAの生物種を帰属・同定した。
【0130】
その結果、ゴマ検出用PCRプライマー(配列番号1及び2からなるPCRプライマーセット)を使用した場合、ゴマ含有食品である、出前一丁ごまとんこつ(日清食品)及び金のごまだれ(ミツカン)由来DNAにおいてのみ、150bp前後の増幅産物が確認され[表3、図2(A)]、この増幅産物のTm値は、約77.1℃であった。他の食品試料由来DNAを使用した場合には、増幅産物は見られなかった[表3、図2(A)]。なお、PCR増幅産物の塩基配列解析の結果、出前一丁ごまとんこつ(日清食品)及び金のごまだれ(ミツカン)由来DNAから増幅されたPCR増幅産物の塩基配列は、ゴマのクロロプラストのmatK遺伝子配列と一致した。すなわち、当該PCRプライマーを用いたPCRは、複数の市販食品において、ゴマ非含有食品試料からゴマ由来DNAやその他のDNAを検出しないが、ゴマ含有食品試料からゴマ由来DNAを特異的に検出できることを確認した。
【0131】
また、メロン検出用PCRプライマー(配列番号3及び4からなるPCRプライマーセット)を使用した場合、メロン含有食品である、夕張メロンキャラメル(札幌グルメフーズ)及び夕張メロンピュアゼリー(ホリ)由来DNAにおいてのみ、179bp前後の増幅産物が確認され[表3、図2(B)]、この増幅産物のTm値は、約79.2℃であった。他の食品試料由来DNAを使用した場合には、増幅産物は見られなかった[表3、図2(B)]。なお、PCR増幅産物の塩基配列解析の結果、出前一丁ごまとんこつ(日清食品)及び金のごまだれ(ミツカン)由来DNAから増幅されたPCR増幅産物の塩基配列は、メロンのクロロプラストのmatK遺伝子配列と一致した。すなわち、当該PCRプライマーを用いたPCRは、複数の市販食品において、メロン非含有食品試料からメロン由来DNAやその他のDNAを検出しないが、メロン含有食品試料からメロン由来DNAを特異的に検出できることを確認した。
【0132】
また、まぐろ検出用PCRプライマー(配列番号5及び6からなるPCRプライマーセット)を使用した場合、まぐろ含有食品である、Cezar吟撰ビーフまぐろ入り(マスターフーズ)及びまぐろ薄削り(株式会社 林久右衛門商店)由来DNAにおいてのみ、130bp前後の増幅産物が確認され[表3、図2(C)]、この増幅産物のTm値は、約80.6℃であった。他の食品試料由来DNAを使用した場合には、増幅産物は見られなかった[表3、図2(C)]。なお、PCR増幅産物の塩基配列解析の結果、Cezar吟撰ビーフまぐろ入り(マスターフーズ)及びまぐろ薄削り(株式会社 林久右衛門商店)由来DNAから増幅されたPCR増幅産物の塩基配列は、マグロ属(キハダマグロ等)のミトコンドリア由来チトクロームb遺伝子配列と一致した。すなわち、当該PCRプライマーを用いたPCRは、複数の市販食品において、まぐろ非含有食品試料からまぐろ由来DNAやその他のDNAを検出しないが、まぐろ含有食品試料からまぐろ由来DNAを特異的に検出できることを確認した。
【0133】
また、ブリ検出用PCRプライマー(配列番号7及び8からなるPCRプライマーセット)を使用した場合は、ぶり含有食品の代替試料[50pgブリDNAを添加したまぐろ薄削り(株式会社 林久右衛門商店)]由来DNAにおいてのみ、105 bp前後の増幅産物が確認され[表3、図2(D)]、この増幅産物のTm値は、約84.3℃であった。他の食品試料由来DNAを使用した場合には、増幅産物は見られなかった[表2、図2(D)]。なお、PCR増幅産物の塩基配列解析の結果、ぶり含有食品の代替試料由来DNAから増幅されたPCR増幅産物の塩基配列は、当然のことながら、ブリのミトコンドリア由来チトクロームb遺伝子配列と一致した。すなわち、当該PCRプライマーを用いたPCRは、複数の市販食品において、ブリ非含有食品試料からブリ由来DNAやその他のDNAを検出しないが、ブリ非含有食品中に添加された微量のブリ由来DNAを特異的に検出できることを確認した。
【0134】
また、あじ検出用PCRプライマー(配列番号9、10及び11からなるPCRプライマーセット)を使用した場合、あじ含有食品である、鯵揚(長崎・井上蒲鉾工房)及びトップバリュ焼きあじ(イオン)由来DNAにおいてのみ、77bp前後の増幅産物が確認され[表3、図2(E)]、この増幅産物のTm値は、約79.0℃であった。他の食品試料由来DNAを使用した場合には、増幅産物は見られなかった[表3、図2(E)]。なお、PCR増幅産物の塩基配列解析の結果、鯵揚(長崎・井上蒲鉾工房)及びトップバリュ焼きあじ(イオン)由来DNAから増幅されたPCR増幅産物の塩基配列は、いずれもマアジ属に属するあじ(マアジ等)のミトコンドリア由来チトクロームb遺伝子配列と最も高い類似性を示した。すなわち、当該PCRプライマーを用いたPCRは、複数の市販食品において、あじ非含有食品試料からあじ由来DNAやその他のDNAを検出しないが、あじ含有食品試料からあじ由来DNAを特異的に検出できることを確認した。
【0135】
また、たら検出用PCRプライマー(配列番号12及び13からなるPCRプライマーセット)を使用した場合、たら含有食品である、鯵揚(長崎・井上蒲鉾工房)、チーズかまぼこ(株式会社 やおきん)及びマヨたら(株式会社 一栄食品)由来DNAにおいてのみ、144bp前後の増幅産物が確認され[表3、図2(F)]、これらの増幅産物のTm値は、約82.9℃であった。他の食品試料由来DNAを使用した場合には、増幅産物は見られなかった[表3、図2(F)]。なお、PCR増幅産物の塩基配列解析の結果、鯵揚(長崎・井上蒲鉾工房)、チーズかまぼこ(株式会社 やおきん)及びマヨたら(株式会社 一栄食品)由来DNAから増幅されたPCR増幅産物の塩基配列は、いずれもマダラ属、スケトウダラ属に分類されるタラ類のミトコンドリア由来16SrRNA遺伝子配列と一致した。すなわち、当該PCRプライマーを用いたPCRは、複数の市販食品において、たら非含有食品試料からたら由来DNAやその他のDNAを検出しないが、たら含有食品試料からたら由来DNAを特異的に検出できることを確認した。
【0136】
また、たこ検出用PCRプライマー(配列番号14及び15からなるPCRプライマーセット)を使用した場合、たこ含有食品である、冷凍日清のたこ焼き(日清食品冷凍)及びちょうどおてごろたこせんべい(株式会社 かわさ)由来DNAにおいてのみ、204bp前後の増幅産物が確認され[表3、図2(G)]、これらの増幅産物のTm値は、約77.1℃であった。他の食品試料由来DNAを使用した場合には、増幅産物は見られなかった[表3、図2(G)]。なお、PCR増幅産物の塩基配列解析の結果、冷凍日清のたこ焼き(日清食品冷凍)及びちょうどおてごろたこせんべい(株式会社 かわさ)由来DNAから増幅されたPCR増幅産物の塩基配列は、いずれもマダコ属の分類されるタコ(マダコ等)のミトコンドリア由来16SrRNA遺伝子配列と一致した。すなわち、当該PCRプライマーを用いたPCRは、複数の市販食品において、たこ非含有食品試料からたこ由来DNAやその他のDNAを検出しないが、たこ含有食品試料からたこ由来DNAを特異的に検出できることを確認した。
【0137】
さらに、ほたてがい検出用PCRプライマー(配列番号16、17、18及び19からなるPCRプライマーセット)を使用した場合、ほたてがい含有食品である、ちょうどおてごろたこせんべい(株式会社 かわさ)、帆立だし(味の素)、ピアット帆立雑炊(エスビー食品)由来DNAにおいてのみ、180bp前後の増幅産物が確認され[表3、図2(H)]、これらの増幅産物のTm値は、約83.6℃であった。他の食品試料由来DNAを使用した場合には、増幅産物は見られなかった[表3、図2(H)]。なお、PCR増幅産物の塩基配列解析の結果、ちょうどおてごろたこせんべい(株式会社 かわさ)、帆立だし(味の素)、ピアット帆立雑炊(エスビー食品)由来DNAから増幅されたPCR増幅産物の塩基配列は、いずれもホタテガイのミトコンドリア由来16SrRNA遺伝子配列と一致した。すなわち、当該PCRプライマーを用いたPCRは、複数の市販食品において、ほたてがい非含有食品試料からほたてがい由来DNAやその他のDNAを検出しないが、ほたてがい含有食品試料からほたてがい由来DNAを特異的に検出できることを確認した。
【0138】
【表3】

【技術分野】
【0001】
本発明は、アレルギーを引き起こす恐れのある特定の植物中のゴマ、メロン及び特定の動物中のまぐろ、ぶり、あじ、たら、たこ、ほたてがいを検出対象とし、当該特定植物、特定動物が食品原料や製品等に含まれていた場合に、その量が微量であっても高感度で検出することを可能とする特定植物の検出方法、並びにその方法に使用するPCRプライマー、プライマーセット、及びキットに関するものである。
【背景技術】
【0002】
特定の食物アレルギー疾患を持つ人の健康危害の発生を防止する観点から、食物アレルギーを引き起こすことが明らかになった食品のうち、特に発症数、重篤度から勘案して表示する必要性の高い小麦、そば、卵、乳、及び落花生の5品目は省令により「特定原材料」と定められ、過去に一定の頻度で重篤な健康危害が見られたアワビ、イカ、エビ、カニ、サケ、サバ、鶏肉、豚肉、いくら、牛肉、ゼラチン、オレンジ、キウイフルーツ、くるみ、大豆、まつたけ、もも、やまいも、りんごの19品目は通知により「特定原材料に準ずるもの」と定められた(厚生労働省医薬局食品保健部長通知、食品衛生法施行規則及び乳及び乳製品の成分規格等に関する省令の一部を改正する省令等の施行について、平成13年3月15日、食発第79号)。「特定原材料」を含む加工食品については、当該食品を含む旨を商品に表示することが義務付けられ、「特定原材料に準ずるもの」を含む加工食品については、当該食品を含む旨を可能な限り表示するよう努めることが推奨された。その後の食物アレルギーの実態及びアレルギー誘発物質の解明に関する研究成果を基に、アレルギー食品制度は適宜見直しが行われており、平成16年12月にバナナが「特定原材料に準ずるもの」に、平成20年6月に症例数が多く重篤な症状を引き起こすえび及びかにが「特定原材料」に追加され、「特定原材料」が7品目、「特定原材料に準ずるもの」が18品目となった(食品衛生法施行規則及び乳及び乳製品の成分規格等に関する省令の一部を改正する省令等の施行について、平成13年3月15日、食発第79号、改正 平成16年12月24日、食安発第1224002号)(食品衛生法施行規則の一部を改正する省令の施行について、平成20年6月3日、食安発第0603001号)。
【0003】
食物アレルギー原因食物は時代の変遷に伴い変化していくという観点から約3年ごとに行われている全国即時型食物アレルギーモニタリング調査によると、「特定原材料」、「特定原材料に準ずるもの」以外では、ゴマ、メロン、まぐろ、ぶり、あじ、たら、たこ、ほたてがいが原因食物となった症例数、アナフィキラシーショック症例数が多いことが判明している(平成19年3月食品の表示に関する共同会議)。調査年度によっては、これらの食物が原因食物となった症例数は、「特定原材料に準ずるもの」に含まれるりんごの症例数と同等以上であるため、これらの食物が適宜行われるアレルギー食品制度の見直しにより、「特定原材料に準ずるもの」に追加される可能性は大いにあると考えられる。また、ゴマはEU、カナダ、オーストラリア及びニュージーランドで、貝類、イカ、タコ等の軟体動物は、EUで当該食品を含む旨を商品に表示することが義務付けられている。
アレルギーを起こす恐れのある食品原料、特にアレルギー原因動植物は、生産、流通、加工段階での意図しない微量の混入も起こり得るため、食品原料ないし製品の提供者としては、それらにアレルギー原因動植物が混入されているか否かの品質管理を行うことが重要となる。
【0004】
「特定原材料」である小麦、そば、卵、乳、落花生、えび及びかにの検出法としては、ELISA法、ウェスタンブロッド法あるいはPCR法を用いた方法が確立されており、えび及びかにのPCR法以外の当該検出法は、検査キットとして商用的に入手、利用可能となっている(厚生労働省医薬局食品保健部長通知、アレルギー物質を含む食品の検査方法について、平成14年11月06日、食発第1106001号、改正 平成21年1月22日、食安発第0122001号)。「特定原材料に準ずるもの」に対する検出法は、鶏肉、豚肉、牛肉(特開2003-230383号、牛、豚、鶏検出用プライマー)、アワビ、イカ、サケ、サバ(特開2003-230383号、プライマー及び特定動物の検出方法)、キウイフルーツ、くるみ、大豆、やまいも、りんご及びバナナ(特開2006-333729号、プライマー及び特定植物の検出方法)は、PCR法を用いた検出方法が確立されていて、検査キットとして商用的に入手、利用可能となっている。また、検査キットとして商用的に入手、利用可能には至っていないが、ゼラチンはELISA法による検出法(土井啓利ら:第94回日本食品衛生学会学術講演会講演要旨集,2007)が、モモはPCR法による検出法(渡辺聡ら:第95回日本食品衛生学会学術講演会講演要旨集,2008)が、報告されている。しかし、「特定原材料に準ずるもの」に追加される可能性は大いにあると考えられる食物アレルギー原因食物の、ゴマ、メロン、まぐろ、ぶり、あじ、たら、たこ、ほたてがいの検出法については、現在まで明確な報告はない。従って、これらの検出法が定かでない食物アレルギー原因食物に相当する特定動植物の混入の有無に関して、科学的な検証をもって品質管理を行うことは、現在、困難な状況にある。
【0005】
様々な加工処理工程を経た食品原料や製品中から検出対象生物を検出する場合、「特定原材料」の検査法で確立されているように、検出対象生物に特徴的な蛋白質を検出する方法(ELISA法やウェスタンブロッド法)や検出対象生物に特徴的なDNA塩基配列を検出する方法(PCR法)が有望な手法となる(厚生労働省医薬局食品保健部長通知、アレルギー物質を含む食品の検査方法について、平成14年11月06日、食発第1106001号、改正 平成21年1月22日、食安発第0122001号)。一般に、蛋白質は、DNAと比べて、食品製造工程における様々な加工処理に対する安定性が低いため、蛋白質を検出する方法は、高度に加工された被験食品に対しては適用できない可能性が高い。それ故に、蛋白質よりも加工処理に比較的強いとされるDNAの塩基配列を標的とした検出方法は、様々な加工処理工程を経た食品原料や製品中から検出対象生物の混入の有無を調べる手法として、有望な方法と考えられる。また、動植物のDNA塩基配列には、rRNA遺伝子クラスターのようにコピー数の多い塩基配列が存在し、このような多コピー数の塩基配列を標的配列に使用できれば、検出法の感度を高めることも可能となる。さらに、細胞中に複数存在するクロロプラスト由来DNAあるいはミトコンドリア由来DNAの塩基配列を標的配列とする場合も、同様に検出法の感
度の向上化に寄与する。
【0006】
遺伝子組換え作物などをPCRで検出する場合、検出対象とするDNA塩基配列は、組換えられたDNA塩基配列に限定される。一方、自然界に存在する動植物の場合、無数にあるDNA塩基配列からどの塩基配列を検出対象に選ぶかという明確な知見はなく、さらには、様々な動植物について、選択した塩基配列の検出対象としての有効性の有無に関する明確な知見は見られない。検出対象とする動植物に特異的な蛋白質を選定し、その蛋白質をコードするDNA塩基配列を検出するための標的とすることも行われているが、この場合、個々の動植物に対して個別に特異的な蛋白質を選定する必要がある。また、このような特異的な蛋白質が選定できたとしても、そのDNA塩基配列のコピー数が少ない場合には、必要な検出感度が得られない場合があり、微量に混入する動植物の検出には、不都合となる。
【0007】
ゴマを検出する方法としては、ELISA法やPCR法を用いた方法がすでに報告されている。例えば、PCR法を用いた方法(非特許文献1)では、ゴマ2S alubumin遺伝子を増幅するPCRプライマーが用いられている。このゴマ検出PCRプライマーを用いたPCRでは、ゴマDNAが特異的に検出され、アーモンド、ヘーゼルナッツ等のナッツ類DNAは検出されないことが示されているが、ゴマ近縁種の食用植物であるエゴマ、シソDNAが検出されないことの確認は行っていない。また、このPCRプライマーの標的DNAは染色体DNAであり、一般に、その検出感度は、ミトコンドリア由来DNAやクロロプラスト由来DNAを標的としたPCRプライマーよりも低いことが予測される。
【0008】
被験試料であるウリ科キュウリ属メロンの分子系統分類を行うために、RAPD(randomly amplified polymorphic DNA)マーカーを利用した方法(非特許文献2)やAFLP(amplified fragment length polymorphism)マーカーを利用した方法(非特許文献3)が報告されている。これらの方法は、主たる被験試料がメロンあるいは単一種の植物である試料から抽出したDNAを試料として使用可能であるが、手法の特性上、複数の植物種が混合するような試料の場合、使用されるPCRプライマーは、他の植物DNAとも反応する可能性が非常に高いために、メロンを特異的に検出することは困難となる。それ故に、複数の植物を含む食品中のメロンDNAを特異的に検出するために、これらの方法を使用することはできない。
【0009】
また、マグロ属、カツオ属、スマ属、ソウダガツオ属、Allothunnus属が属するサバ科マグロ族の魚種を判別するために、ミトコンドリアのチトクロームb遺伝子配列を標的としたマルチプレックスPCR法を用いた判別法が報告されている(非特許文献4)。この方法に用いられたPCRプライマーは、被験試料であるマグロ属以外にサバ科マグロ族カツオ属のカツオDNAも検出するため、マグロ属に属するまぐろ類DNAを特異的に検出するために、この方法を使用することはできない。
【0010】
また、あじ塩干し加工品の魚種を判別するために、ミトコンドリアのND5タンパク遺伝子配列を標的としたPCR-制限酵素断片長多型法を用いた判別法が報告されている(非特許文献5)。この方法で使用されているPCRプライマーは、アジ科マアジ属のマアジ及びニシマアジから抽出されたDNAを増幅させることは可能であるが、その他の生物に対する当該PCRプライマーの交差反応性、すなわち、検出特異性の記載は無く、シマアジ、ムロアジ等の他のアジ亜科に属するあじ類DNAを特異的に検出する方法としては、十分に検証された方法ではない。
【0011】
また、商業的に重要なタラ科3種(スケトウダラ、マダラ、コマイ)の魚種を判別するために、ミトコンドリアのチトクロームb遺伝子配列を標的としたPCR-制限酵素断片長多型法及びマルチプレックスPCR法を用いた判別法が報告されている(非特許文献6)。これらの方法で使用されているPCRプライマーは、タラ科3種(スケトウダラ、マダラ、コマイ)から抽出されたDNAを増幅させることは可能であるが、その他の生物に対する当該PCRプライマーの交差反応性、すなわち、検出特異性の記載は無く、タラ類DNAを特異的に検出する方法としては、十分に検証された方法ではない。
【0012】
また、頭足類(イカやタコの仲間)の種を同定あるいは推定する方法として、ミトコンドリアのチトクロームオキシダーゼIII遺伝子配列や同じくチトクロームオキシダーゼII遺伝子配列を標的としたPCRプライマーによって増幅されたDNA塩基配列を公知の塩基配列と比較する方法も報告されている(非特許文献7)。この方法で使用されているPCRプライマーは、主成分が頭足類である試料から抽出されたDNAを増幅させることは可能であるが、その他の生物に対する当該PCRプライマーの交差反応性、すなわち、検出特異性の記載は無く、さらに、食品のように複数の動植物を含む試料中の頭足類DNAを特異的に検出できるという記載もなされていない。それ故に、複数の動植物を含む食品中の頭足類DNAを特異的に検出する方法としては、十分に検証された方法ではない。
【0013】
また、ホタテガイの分子系統分類を行うために、16SrRNA遺伝子配列を比較分析する方法が報告されている(特許文献1)。この方法で使用されているPCRプライマーは、主成分がホタテガイである試料から抽出されたDNAを増幅させることは可能であるが、その他の生物に対する当該PCRプライマーの交差反応性、すなわち、検出特異性の記載は無く、さらに、食品のように複数の動植物を含む試料中のほたてがいDNAを特異的に検出できるという記載もなされていない。また、PCR増幅産物が、約1.3kbp及び約1.5kbpと長く、加工食品のようなDNAの断片化が進んだ試料中からほたてがいDNAを検出するには不適であり、複数の動植物を含む食品中のほたてがいDNAを特異的に検出する方法としては、十分に検証された方法ではない。
【0014】
対象とする特定動植物の食品原料や製品中への混入の有無は、当該動植物に特異的な遺伝子配列が食品原料や製品中から検出されるか否かを調べることによって、検査できる。但し、その検査法は、目的とする植物に由来するDNAを検出できるが、食品原料や製品を構成する複数の目的としない動植物由来DNAを検出しないような方法であることが強く望まれる。
【0015】
上述したように、食物アレルギー原因食物であり、「特定原材料に準ずるもの」に追加される可能性が大いにあると考えられる食物アレルギー原因食物の、ゴマ、メロン、まぐろ、ブリ、あじ、たら、たこ、ほたてがいに対する明確な検出法は、報告されておらず、これらの特定動植物が食品原料や製品に混入しているか否かを科学的に検証可能な手法が、食品の品質管理手法として待望されている。
【先行技術文献】
【特許文献】
【0016】
【特許文献1】特開2001-321184、ホタテガイ系統解析方法
【非特許文献】
【0017】
【非特許文献1】Brzezinski JL; Detection of sesame seed DNA in foods using real-time PCR; Journal of food Protection, 70(4):1333-6, 2007
【非特許文献2】Katsunori T., Atuhi N., Yukari A., Yoshiteru S., Hidetaja N., Hiromichi Y, and Kenji K; Molecular characterization of South and East Asian melon,Cucumis melo L., and the origin og Group Conomon var.makuwa and var. conomon revealed by RAPD analysis; Euphytica, 153:233-247, 2007
【非特許文献3】Kazutoshi Y., Hiroyoshi I., Yukari A., Ken-o T., Maki K., Yoshihiko T., and Kenji K.; Genetic Relationship among East and South Asian Melon(Cucumis melo L.) Revealed by AFLP Analysis; Breeding Science, 55: 197-206, 2005
【非特許文献4】Michelini E., Cevenini L., Mezzanotte L., Simoni P., Baraldini M., De L., and Roda A; One-step triplex-polymerase chain reaction aasay for the authentication of yellowfin(Thunnus albacares),bigeye(Thunnus obseus),and skipjack(Katsuwonus pelamis)tuna DNA from fresh,frozen and canned tuna samples.; Journal of agiricultual and food chemistry, 55(19): 7638-47, 2007
【非特許文献5】Yasuharu T., Takami M., and Michiaki Y; Complete mitochondrial DNA sequence of Atlantic horse mackerel Trachurus trachurus and molecular identification of two commercially importane species T.trachurus and T.japonicus using PCR-RFLP;FISHERIES SCIENCE, 72:1054-1065, 2006
【非特許文献6】柳本 卓,北村 徹; mtDNA シトクロームb遺伝子による北海道周辺のタラ科3種の種判別;Nippon Suisan Gakkaihi, 68(6):893-899, 2002
【非特許文献7】Bonnaud L., R. Boucher-Rodoni, and M. Monnerot; Phylogeny of cephalopods inferred from mitochondrial DNA sequences; Molecular Phylogenetics and Evolution, 7: 44-54, 1997
【発明の開示】
【発明が解決しようとする課題】
【0018】
本発明は、アレルギーを引き起こす恐れのある特定の動植物のうちゴマ、メロン、まぐろ、ぶり、あじ、たら、たこ、ほたてがいを、食品原料や製品中から特異的に検出できる方法、及びこの方法に用いるPCRプライマー、プライマーセット、キットを提供することを、主目的とする。
【課題を解決するための手段】
【0019】
上記課題を達成するために、本発明者らは、分子生物学的観点から、検出対象とする動植物及びその他の生物の遺伝子配列における共通性と特異性に着目し、「特定原材料に準ずるもの」に追加される可能性が大いにあると考えられる食物アレルギー原因食物の、ゴマ、メロン、まぐろ、ブリ、あじ、たら、たこ、ほたてがい(本発明において、これらを「特定動植物」と称する)を高感度に検出することができる方法を鋭意研究した。その結果、ゴマ、メロン、まぐろ、ぶり、あじ、たら、たこ、あるいはほたてがいの各々に特徴的な塩基配列を見いだし、これらの塩基配列を利用してPCR法などの核酸分析を行うことで、ゴマ、メロン、まぐろ、ブリ、あじ、たら、たこ、あるいはほたてがいを簡便に検出し得ることを見いだし、更に鋭意検討を重ねて、本発明を完成するに至った。即ち、本発明は、以下の特定動植物検出用PCRプライマーセット、特定動植物検出法、並びに、特定動植物検出用キットに関与する。
【0020】
項1. 下記の(1)〜(16)のいずれかのPCRプライマーセット。
(1) 配列表の配列番号1における塩基番号13〜27の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号2における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるPCRプライマーセット。
(2) 配列表の配列番号3における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号4における塩基番号11〜25の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット。
(3) 配列表の配列番号5における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号6における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット。
(4) 配列表の配列番号7における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号8における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット。
(5) 配列表の配列番号9における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号10における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号11における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(6) 配列表の配列番号12における塩基番号6〜20の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号13における塩基番号4〜18の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー。
とからなるプライマーセット
(7) 配列表の配列番号14における塩基番号11〜25の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号15における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(8) 配列表の配列番号16における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号17における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号18における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号19における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(9) 配列表の配列番号1の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号2の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(10) 配列表の配列番号3の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号4の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(11) 配列表の配列番号5の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号6の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(12) 配列表の配列番号7の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号8の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(13) 配列表の配列番号9の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号10の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号11の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(14) 配列表の配列番号12の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号13の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(15) 配列表の配列番号14の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号15の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(16) 配列表の配列番号16の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号17の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号18の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号19の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
【0021】
項2. 請求項1の(1)に記載のプライマーセット。
【0022】
項3. 請求項1の(2)に記載のプライマーセット。
【0023】
項4. 請求項1の(3)に記載のプライマーセット。
【0024】
項5. 請求項1の(4)に記載のプライマーセット。
【0025】
項6. 請求項1の(5)に記載のプライマーセット。
【0026】
項7. 請求項1の(6)に記載のプライマーセット。
【0027】
項8. 請求項1の(7)に記載のプライマーセット。
【0028】
項9. 請求項1の(8)に記載のプライマーセット。
【0029】
項10. 請求項1の(9)に記載のプライマーセット。
【0030】
項11. 請求項1の(10)に記載のプライマーセット。
【0031】
項12. 請求項1の(11)に記載のプライマーセット。
【0032】
項13. 請求項1の(12)に記載のプライマーセット。
【0033】
項14. 請求項1の(13)に記載のプライマーセット。
【0034】
項15. 請求項1の(14)に記載のプライマーセット。
【0035】
項16. 請求項1の(15)に記載のプライマーセット。
【0036】
項17. 請求項1の(16)に記載のプライマーセット。
【0037】
項18. 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項2〜15のいずれかに記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中に特定動物、特定植物が存在しているか否かを検出する工程とを含む特定動物、特定植物の検出方法。
【0038】
項19. 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項2又は10記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にゴマが存在しているか否かを検出する工程とを含む特定植物の検出方法。
【0039】
項20. 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項3又は11記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にメロンが存在しているか否かを検出する工程とを含む特定植物の検出方法。
【0040】
項21. 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項4又は12記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にまぐろが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【0041】
項22. 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項5又は13記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にブリが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【0042】
項23. 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項6又は14記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にあじが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【0043】
項24 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項7又は15記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にたらが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【0044】
項25. 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項8又は16記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にたこが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【0045】
項26. 試料からDNAを抽出する工程と、このDNAを鋳型として、請求項9又は17記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にほたてがいが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【発明の効果】
【0046】
本発明によれば、PCR等を用いた核酸分析による、精度及び検出感度の高い特定動植物(ゴマ、メロン、まぐろ、ブリ、あじ、たら、たこ、ほたてがい)由来DNAの検出を可能とし、被験食品原料や被験食品中に、上記特定動植物が混入しているか否か、又は、使用されているか否かといった品質管理検査の実施を可能にするという効果を奏する。また、アレルギーの未然防止、アレルギー症状が生じた際の原因物質の調査等にも寄与する。
【図面の簡単な説明】
【0047】
【図1】本発明におけるプライマーセットを用いた場合のDNAの検出感度を示した電気泳動後の写真である。(A)配列番号1及び配列番号2を用いたPCRにおけるゴマDNAの検出感度を示した電気泳動後の写真である。(B)配列番号3及び配列番号4を用いたPCRにおけるメロンDNAの検出感度を示した電気泳動後の写真である。(C)配列番号5及び配列番号6を用いたPCRにおけるクロマグロDNAの検出感度を示した電気泳動後の写真である。(D)配列番号7及び配列番号8を用いたPCRにおけるブリDNAの検出感度を示した電気泳動後の写真である。(E)配列番号9、配列番号10及び配列番号11を用いたPCRにおけるマアジDNAの検出感度を示した電気泳動後の写真である。(F)配列番号12及び配列番号13を用いたPCRにおけるマダラDNAの検出感度を示した電気泳動後の写真である。(G)配列番号14及び配列番号15を用いたPCRにおけるマダコDNAの検出感度を示した電気泳動後の写真である。(H)配列番号16、配列番号17、配列番号18及び配列番号19を用いたPCRにおけるホタテガイDNAの検出感度を示した電気泳動後の写真である。
【図2】本発明におけるプライマーセットを用い、特定動植物含有食品中の特定動植物由来DNAの検出を示した電気泳動後の写真である。(A)配列番号1及び配列番号2を用いたPCRにおける各動植物含有食品中の特定植物由来DNAの検出結果の電気泳動後の写真である。(B)配列番号3及び配列番号4を用いたPCRにおける各動植物含有食品中の特定植物由来DNAの検出結果の電気泳動後の写真である。(C)配列番号5及び配列番号6を用いたPCRにおける各動植物含有食品中の特定動物由来DNAの検出結果の電気泳動後の写真である。(D)配列番号7及び配列番号8を用いたPCRにおける各動植物含有食品中の特定動物由来DNAの検出結果の電気泳動後の写真である。(E)配列番号9、配列番号10及び配列番号11を用いたPCRにおける各動植物含有食品中の特定動物由来DNAの検出結果の電気泳動後の写真である。(F)配列番号12及び配列番号13を用いたPCRにおける各動植物含有食品中の特定動物由来DNAの検出結果の電気泳動後の写真である。(G)配列番号14及び配列番号15を用いたPCRにおける各動植物含有食品中の特定動物由来DNAの検出結果の電気泳動後の写真である。(H)配列番号16、配列番号17、配列番号18及び配列番号19を用いたPCRにおける各動植物含有食品中の特定動物由来DNAの検出結果の電気泳動後の写真である。
【発明を実施するための形態】
【0048】
以下、本発明を詳細に説明する。
特定動植物検出用PCRプライマーセット
本発明者等は、上記の目的に従い、以下の8種の特定動植物検出用PCRプライマーセットを開発した。本発明の特定動植物検出用PCRプライマーセットには、ゴマに特徴的な塩基配列を有するもの、メロンに特徴的な塩基配列を有するもの、まぐろに特徴的な塩基配列を有するもの、ブリに特徴的な塩基配列を有するもの、あじに特徴的な塩基配列を有するもの、たらに特徴的な塩基配列を有するもの、たこに特徴的な塩基配列を有するもの、及びほたてがいに特徴的な塩基配列を有するものがある。
【0049】
ゴマ検出用PCRプライマーセット、及びメロン検出用PCRプライマーセットの開発に際しては、まずゴマ近縁植物、メロン近縁植物を含む約550種の植物についてクロロプラストのrbcL(large subunit gene for ribulose-1,5-bisphosphate carboxylase/oxygenase)遺伝子配列を既知のDNAデータベース(GenBank nucleotide sequence database)から取得あるいは、一部の植物の当該遺伝子配列を独自に解析することによって取得し、それらの厖大な塩基配列の多重並列配列図を作成し、当該塩基配列の類似性や特異性等の性状を詳細に比較検討したが、当該遺伝子の塩基配列は、ゴマは近縁種のシソ科シソ属のシソと、メロンは近縁種のキュウリ等、キュウリ属植物と相同性が高く特異的な当該遺伝子配列領域を選出することが困難であった。そこで、ゴマ近縁植物、メロン近縁植物を含む約250種の植物についてクロロプラストのmatk(maturase-encoding gene)遺伝子配列を既知のDNAデータベース(GenBank nucleotide sequence database)から取得あるいは、一部の植物の当該遺伝子配列を独自に解析することによって取得し、それらの厖大な塩基配列の多重並列配列図を作成し、当該塩基配列の類似性や特異性等の性状を詳細に比較検討し直したところ、各々に特異的な当該遺伝子配列領域を選出することができ、それらの領域からPCRプライマーセットを新規に設計した。設計の際には、検出目的とする生物種をゴマについては、白色系統及び黒色系統のゴマに、メロンについては、メロン及びメロン変種のフユメロンに設定し、検出目的とした生物種の当該遺伝子配列領域とは、ストリンジェントな条件下でハイブリダイズするが、検出目的としない生物種とはハイブリダイズしないように創意工夫して、設計した。
【0050】
まぐろ検出用PCRプライマーセットの開発に際して、まず、マグロ類7種を含む、約250種の各種生物についてミトコンドリアのチトクロームb遺伝子配列を既知のDNAデータベースから取得あるいは、一部の生物の当該遺伝子配列を独自に解析することによって取得し、それらの厖大な塩基配列の多重並列配列図を作成した。当該遺伝子領域では、近縁種のサバ科カツオ属のカツオ等と相同性が高いため、特異的な当該遺伝子配列領域を選出することが難しく、PCRプライマーセットを設計することは困難であったが、作成した多重並列配列図を詳細に比較検討することによって、検出目的としたサバ科マグロ属のクロマグロ、キハダマグロ、メバチマグロ、ビンチョウマグロ、ミナミマグロ、コシナガ、タイセイヨウマグロに共通し、近縁種である同科カツオ属のカツオ、ソウダガツオ属のマルソウダを始めとした検出目的以外の生物種とは異なる遺伝子領域を選出し、その領域からPCRプライマーセットを新規に設計した。設計の際には、検出目的とする生物種の当該遺伝子配列領域とは、ストリンジェントな条件下でハイブリダイズするが、検出目的としない生物種とはハイブリダイズしないように創意工夫して、設計した。
【0051】
ブリ検出用PCRプライマーセットの開発に際して、まず、ブリ近縁種を含む、約250種の各種生物についてミトコンドリアのチトクロームb遺伝子配列を既知のDNAデータベースから取得あるいは、一部の生物の当該遺伝子配列を独自に解析することによって取得し、それらの厖大な塩基配列の多重並列配列図を作成した。当該遺伝子領域では、近縁種のアジ科ブリ属のヒラマサ、カンパチと相同性が高く、特異的な当該遺伝子配列領域を選出することが難しく、PCRプライマーセットを設計することは困難であったが、多重並列配列図を詳細に比較検討し、センスプライマー用の領域をヒラマサ、カンパチと相同性が高い領域から選出し、アンチセンスプライマー用の領域をヒラマサ、カンパチと相同性が低いが、マイワシとは相同性が高い領域を選出し、検出目的のブリ以外の生物種(ヒラマサ、カンパチ)に対して交錯性を示すセンスプライマーと、それらとはまた別の生物種(マイワシ)に対する交錯性を示すアンチセンスプライマーを互いに組み合わせることで、検出目的とするブリの当該遺伝子配列領域とは、ストリンジェントな条件下でハイブリダイズするが、検出目的としない生物種とはハイブリダイズしないPCRプライマーセットを創意工夫して、新規に設計した。
【0052】
あじ検出用PCRプライマーセットの開発に際して、まず、商業的に重要なアジ亜科に属する魚類を検出目的とし、アジ科約60種を含む約250種の各種生物についてミトコンドリアのチトクロームb遺伝子配列を既知のDNAデータベースから取得あるいは、一部の生物の当該遺伝子配列を独自に解析することによって取得し、それらの厖大な塩基配列の多重並列配列図を作成した。当該遺伝子領域では、検出目的としたアジ亜科の魚類に共通し、近縁種であるアジ科ブリ属のブリ等と相同性が低い特異的な当該遺伝子配列領域を選出することが難しく、PCRプライマーセットを設計することは困難であったが、多重並列配列図を詳細に比較検討し、センスプライマー、アンチセンスプライマーを特定の領域において2種ずつ設計し、ミックスプライマーとして用いることることを着想することで、検出目的とするアジ亜科に属する魚類の当該遺伝子配列領域とは、ストリンジェントな条件下でハイブリダイズするが、検出目的としない生物種とはハイブリダイズしないPCRプライマーセットを創意工夫して、新規に設計した。
【0053】
たら検出用PCRプライマーセットの開発に際して、まず、タラ科を含む約200種の各種生物についてミトコンドリアの16S rRNA遺伝子を既知のDNAデータベースから取得あるいは、一部の生物の当該遺伝子配列を独自に解析することによって取得し、それらの厖大な塩基配列の多重並列配列図を作成した。作成した多重並列配列図詳細に比較検討することによって、タラ科マダラ属のマダラ、タラ科マダラ属のタイセイヨウダラ、タラ科スケトウダラ属のスケトウダラ、タラ科コマイ属のコマイ等、商業的に重要なタラ科の魚類に共通し、検出目的以外の生物種とは異なる遺伝子領域を選出し、その領域からPCRプライマーセットを新規に設計した。設計の際には、検出目的とする生物種の当該遺伝子配列領域とは、ストリンジェントな条件下でハイブリダイズするが、検出目的としない生物種とはハイブリダイズしないように創意工夫して、新規に設計した。
【0054】
たこ検出用PCRプライマーセットの開発に際して、まず、タコ類、イカ類、貝類等の軟体動物約550種を含む約700種の各種生物についてミトコンドリアの16S rRNA遺伝子を既知のDNAデータベースから取得あるいは、一部の生物の当該遺伝子配列を独自に解析することによって取得し、それらの厖大な塩基配列の多重並列配列図を作成した。当該遺伝子領域では、検出目的としたタコ類(マダコ亜目、ヒゲダコ亜目)に共通し、近縁種であるイカ類(十腕目)と相同性が低い特異的な当該遺伝子配列領域を選出することが難しく、PCRプライマーセットを設計することは困難であったが、多重並列配列図を詳細に比較検討し、センスプライマー、アンチセンスプライマーを特定の領域において2種ずつ設計し、ミックスプライマーとして用いることを着想することで、検出目的とするタコ類に属する魚類の当該遺伝子配列領域とは、ストリンジェントな条件下でハイブリダイズするが、検出目的としない生物種とはハイブリダイズしないPCRプライマーセットを創意工夫して、新規に設計した。
【0055】
ほたてがい検出用PCRプライマーセットの開発に際して、まず、タコ類、イカ類、貝類等の軟体動物約550種を含む約700種の各種生物についてミトコンドリアの16S rRNA遺伝子を既知のDNAデータベースから取得あるいは、一部の生物の当該遺伝子配列を独自に解析することによって取得し、それらの厖大な塩基配列の多重並列配列図を作成した。当該遺伝子領域において、検出目的である日本近海に生息するイタヤガイ科Patinopecten属ホタテガイと、同様に検出目的である外海に生息する同科Pecten属のジェームスホタテ、ニュージーランドホタテ、ヨーロッパホタテ等では、塩基配列の相同性が極めて低いため、これらのほたてがいに共通し、近縁種である同科Aequipecten属のセイヨウイタヤDNA、Chlyms属のヒオウギガイDNAと相同性が低い特異的な当該遺伝子配列領域を選出することが難しく、PCRプライマーセットを設計することは困難であったが、イタヤガイ科Patinopecten属ホタテガイ検出用のプライマーセットとPecten属のジェームスホタテ、ニュージーランドホタテ、ヨーロッパホタテ等の外海に生息するホタテガイ類検出用のプライマーセットを特定の領域において各々設計し、ミックスプライマーとして用いることを着想することで、検出目的とするホタテガイ類の当該遺伝子配列領域とは、ストリンジェントな条件下でハイブリダイズしないPCRプライマーセットを創意工夫して、新規に設計した。
【0056】
本発明の特定植物検出用PCRプライマーセットを用いたPCR分析では、対象となる試料が加工品である場合も想定される。加工品を分析する場合、DNAが分解または、断片化している可能性があるので、70〜250 bp 程度の短めのPCR増幅産物を形成するようなPCRプライマーが、高感度分析のために好ましい。それ故に、PCRプライマーの設計の際には、PCR増幅産物の長さが250 bp以下となるように工夫して設計した。また、これらのPCRプライマーセットのPCR反応条件を同一条件にすることは、実際の分析における、PCR反応回数の低減化に寄与する。それ故に、PCR反応において、その反応条件を最も左右するPCRプライマーのアニーリング温度とアニーリング時間が同一となるように、具体的にはゴマ、メロン、たこは64℃で10秒間、まぐろ、ブリ、ほたてがいは66℃で10秒間のアニーリング条件となるように工夫して、PCRプライマーを設計した。
【0057】
従って、本発明の特定動植物検出用PCRプライマーセットを用いたPCR法などの核酸分析の手法を用いて、各種食品中に含まれるゴマ、メロン、まぐろ、ブリ、あじ、たら、たこ、あるいはほたてがい由来DNAを高感度かつ特異的に検出することができる。
ここで、核酸分析とは、生物分類における、個々の種、属、あるいは、グループによって特徴的な塩基配列が存在することを利用して、その特徴的な塩基配列の有無を分析することによって、その生物の種、属、あるいは、グループを把握するために有効な手段であって、特定の微生物の検出や生物種の同定などに有用に用いられる方法である。
【0058】
本発明が提供するプライマーの塩基配列は以下のとおりである。
塩基番号 123456789012345678901234567
配列番号1 (ゴマS) CGATTCTATCTCAACGAGTATTGTAAG
配列番号2 (ゴマAS) CCGTAGAAAGACGAAAATGGC
配列番号3 (メロンS) TTTCAAAAGATACGCCACTTCTT
配列番号4 (メロンAS) CCATACCACTGAAGTATTTAATCGA
配列番号5 (まぐろS) CTTCTTTTCCTTCACGAAACAGGT
配列番号6 (まぐろAS) CGAGTGCCACTAGCAGGATCA
配列番号7 (ブリS) GCTGGGCTTTGCTACCCTGCTG
配列番号8 (ブリAS) GTTACTAGGGGGTTTGCGGGGAC
配列番号9 (あじS) AACTCTAATGGCAAAnCTCCGT
(配列番号9において、nはC又はTを表す。)
但し、配列番号9のCのものと、Tのものは、ミックスプライマーとして用いる。以下、全て同様である。
配列番号10(あじAS1) GAGCAGGGAGGTCAATTAGTGA
配列番号11(あじAS2) GAGCAGGGAGGTCGATTAATGA
配列番号12(たらS) CTTAGTGATATTTACTGAAG
配列番号13(たらAS) GTTATACCGGATCAGAAA
配列番号14(たこS) GGCTAGAATGAATGGTTTGACGAnA
(配列番号14において、nはG又はAを表す。)
但し、配列番号14のGのものと、Aのものは、ミックスプライマーとして用いる。以下、全て同様である。
配列番号15(たこAS) TTATTCCTTGATCACCCCAAnC
(配列番号15において、nはC又はTを表す。)
但し、配列番号15のCのものと、Tのものは、ミックスプライマーとして用いる。以下、全て同様である。
配列番号16(ほたてがいS1) TGTGTCAGCGTTAAAGAGCAGATA
配列番号17(ほたてがいS2) CCGAATCGTTGAGGAGCACTA
配列番号18(ほたてがいAS1) TCAAGATTTTCATGTTTTGTGGG
配列番号19(ほたてがいAS2) TAATCACACCTTAATGTTTGTGGG
また、本発明が提供する30塩基のDNAからなるプライマーとしては、例えば以下の塩基配列のものを上げることができる。
配列番号20 (ゴマS) attCGATTCTATCTCAACGAGTATTGTAAG
配列番号21 (ゴマAS) agattggttCCGTAGAAAGACGAAAATGGC
配列番号22 (メロンS) attctggTTTCAAAAGATACGCCACTTCTT
配列番号23 (メロンAS) tgagtCCATACCACTGAAGTATTTAATCGA
配列番号24 (まぐろS) cttcacCTTCTTTTCCTTCACGAAACAGGT
配列番号25 (まぐろAS) ctagagaggCGAGTGCCACTAGCAGGATCA
配列番号26 (ブリS) aaggacctGCTGGGCTTTGCTACCCTGCTG
配列番号27 (ブリAS) aggcgggGTTACTAGGGGGTTTGCGGGGAC
配列番号28 (あじS) actacaagAACTCTAATGGCAAAnCTCCGT
(配列番号28において、nはC又はTを表す。)
但し、配列番号28のCのものと、Tのものは、ミックスプライマーとして用いる。以下、全て同様である。
配列番号29(あじAS1) gttcgaggGAGCAGGGAGGTCAATTAGTGA
配列番号30(あじAS2) gttcgaggGAGCAGGGAGGTCGATTAATGA
配列番号31(たらS) acagtaaaaaCTTAGTGATATTTACTGAAG
配列番号32(たらAS) gttcgttgatcgGTTATACCGGATCAGAAA
配列番号33(たこS) attagGGCTAGAATGAATGGTTTGACGAnA
(配列番号33において、nはG又はAを表す。)
但し、配列番号33のGのものと、Aのものは、ミックスプライマーとして用いる。以下、全て同様である。
配列番号34(たこAS) ttatatttTTATTCCTTGATCACCCCAAnC
(配列番号34において、nはC又はTを表す。)
但し、配列番号34のCのものと、Tのものは、ミックスプライマーとして用いる。以下、全て同様である。
配列番号35(ほたてがいS1) attgacTGTGTCAGCGTTAAAGAGCAGATA
配列番号36(ほたてがいS2) tatttgtggCCGAATCGTTGAGGAGCACTA
配列番号37(ほたてがいAS1) ctgttaaTCAAGATTTTCATGTTTTGTGGG
配列番号38(ほたてがいAS2) ttctgaTAATCACACCTTAATGTTTGTGGG
【0059】
本発明は、第1のプライマーセットとして、配列表の配列番号1における塩基番号13〜27の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをセンスプライマーとし、配列表の配列番号2における塩基番号7〜21の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットは、ゴマ検出用に好適に使用できる。本プライマーセットは、PCRに供与されることにより、双方ともゴマのクロロプラストのmatK遺伝子に特異的に結合するが、その他の生物由来クロロプラストのmatK遺伝子を検出可能に増幅しないので、ゴマDNAを検出するのためのPCR用プライマーセットとして使用できる。また、高感度に当該DNAを検出することができる。
【0060】
また、本発明は、第2のプライマーセットとして、配列表の配列番号3における塩基番号9〜23の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをセンスプライマーし、配列表の配列番号4における塩基番号11〜25の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットは、メロン検出用に好適に使用できる。本プライマーセットは、PCRに供与されることにより、双方ともメロンのクロロプラストのmatK遺伝子に特異的に結合するが、その他の生物由来クロロプラストのmatK遺伝子を検出可能に増幅しないので、メロンDNAを検出するのためのPCR用プライマーセットとして使用できる。また、高感度に当該DNAを検出することができる。
【0061】
また、本発明は、第3のプライマーセットとして、配列表の配列番号5における塩基番号10〜24の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをセンスプライマーとし、配列表の配列番号6における塩基番号7〜21の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットは、PCRに供されることにより、双方ともまぐろのミトコンドリアのチトクロームb遺伝子に特異的に結合するが、その他の生物由来ミトコンドリアのチトクロームb遺伝子を検出可能に増幅しないので、まぐろDNAを検出するのためのPCR用プライマーセットとして使用できる。また高感度に当該DNAを検出することができる。
【0062】
また、本発明は、第4のプライマーセットとして、配列表の配列番号7における塩基番号8〜22の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをセンスプライマーとし、配列表の配列番号8における塩基番号9〜23の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットは、PCRに供されることにより、双方ともブリのミトコンドリアのチトクロームb遺伝子に特異的に結合するが、その他の生物由来ミトコンドリアのチトクロームb遺伝子を検出可能に増幅しないので、ブリDNAを検出するのためのPCR用プライマーとして使用できる。また、高感度に当該DNAを検出することができる。
【0063】
また、本発明は、第5のプライマーセットとして、配列表の配列番号9における塩基番号8〜22の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをセンスプライマーとし、配列表の配列番号10における塩基番号8〜22の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマー及び配列表の配列番号11における塩基番号8〜22の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットは、PCRに供されることにより、双方ともあじのミトコンドリアのチトクロームb遺伝子に特異的に結合するが、その他の生物由来ミトコンドリアのチトクロームb遺伝子を検出可能に増幅しないので、あじDNAを検出するのためのPCR用プライマーとして使用できる。また、高感度に当該DNAを検出することができる。
【0064】
また、本発明は、第6のプライマーセットとして、配列表の配列番号12における塩基番号6〜20の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをセンスプライマーとし、配列表の配列番号13における塩基番号4〜18の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットは、PCRに供されることにより、双方ともたらのミトコンドリアの16S rRNA遺伝子に特異的に結合するが、その他の生物由来ミトコンドリアの16S rRNA遺伝子を検出可能に増幅しないので、たらDNAを検出するのためのPCR用プライマーとして使用できる。また、高感度に当該DNAを検出することができる。
【0065】
また、本発明は、第7のプライマーセットとして、配列表の配列番号14における塩基番号11〜25の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをセンスプライマーとし、第15のプライマーとして、配列表の配列番号15における塩基番号8〜22の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットは、PCRに供されることにより、双方ともたこのミトコンドリアの16S rRNA遺伝子に特異的に結合するが、その他の生物由来ミトコンドリアの16S rRNA遺伝子を検出可能に増幅しないので、たこDNAを検出するのためのPCR用プライマーとして使用できる。また、高感度に当該DNAを検出することができる。
【0066】
また、本発明は、第8のプライマーセットとして、配列表の配列番号16における塩基番号7〜21の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマー及び配列表の配列番号17における塩基番号10〜24の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをセンスプライマーとし、配列表の配列番号18における塩基番号10〜24の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマー及び配列表の配列番号19における塩基番号10〜24の塩基配列を3´末端側に含む最短15最大30塩基のDNAからなるPCRプライマーをアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットは、PCRに供されることにより、双方ともほたてがいのミトコンドリアの16S rRNA遺伝子に特異的に結合するが、その他の生物由来ミトコンドリアの16S rRNA遺伝子を検出可能に増幅しないので、ほたてがいDNAを検出するのためのPCR用プライマーとして使用できる。また、高感度に当該DNAを検出することができる。
【0067】
前記各プライマーにおいて、塩基配列の長さを15から30とするのは、PCR用プライマーとしての塩基配列の適切な長さが15〜30程度であること、また、3´末端側15個の塩基配列を特定するのは、3´末端側15個程度がPCRの特異的な増幅反応において重要であって、5´末端側の塩基配列が若干異なっていたり、配列の長さが多少違っていたりしても、PCRの反応自体への悪影響が、たいていの場合、小さいためである。
【0068】
本発明においては、さらに、第1のプライマーセットの好ましい態様としては、配列表の配列番号1の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(1´)(最も好ましくは配列番号1の塩基配列のDNAからなるプライマー)をセンスプライマーとし、配列表の配列番号2の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(2´)(最も好ましくは配列番号2の塩基配列のDNAからなるプライマー)をアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットはゴマ検出用に好適に使用でき、配列番号1のプライマーと配列番号2のプライマーとをセットで用いることが最も好ましい。なお、(1´)の具体例としては配列番号20のプライマー、(2´)の具体例としては配列番号21のプライマーを例示できる。
【0069】
また、第2のプライマーセットの好ましい態様として、配列表の配列番号3の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(3´)(最も好ましくは配列番号3の塩基配列のDNAからなるプライマー)をセンスプライマーとし、配列表の配列番号4の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(4´)(最も好ましくは配列番号4の塩基配列のDNAからなるプライマー)をアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットはメロン検出用に好適に使用でき、配列番号3のプライマーと配列番号4のプライマーとをセットで用いることが最も好ましい。なお、(3´)の具体例としては配列番号22のプライマー、(4´)の具体例としては配列番号
23のプライマーを例示できる。
【0070】
また、第3のプライマーセットの好ましい態様として、配列表の配列番号5の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(5´)(最も好ましくは配列番号5の塩基配列のDNAからなるプライマー)をセンスプライマーとし、配列表の配列番号4の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(6´)(最も好ましくは配列番号6の塩基配列のDNAからなるプライマー)をアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットはまぐろ検出用に好適に使用でき、配列番号5のプライマーと配列番号6のプライマーとをセットで用いることが最も好ましい。なお、(5´)の具体例としては配列番号24のプライマー、(6´)の具体例としては配列番号25のプライマーを例示できる。
【0071】
また、第4のプライマーセットの好ましい態様として、配列表の配列番号7の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(7´)(最も好ましくは配列番号7の塩基配列のDNAからなるプライマー)をセンスプライマーとし、配列表の配列番号8の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(8´)(最も好ましくは配列番号8の塩基配列のDNAからなるプライマー)をアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットはぶり検出用に好適に使用でき、配列番号7のプライマーと配列番号8のプライマーとをセットで用いることが最も好ましい。なお、(7´)の具体例としては配列番号26のプライマー、(8´)の具体例としては配列番号28のプライマーを例示できる。
【0072】
また、第5のプライマーセットの好ましい態様として、配列表の配列番号9の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(9´)(最も好ましくは配列番号9の塩基配列のDNAからなるプライマー)をセンスプライマーとし、配列表の配列番号10の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(10´)(最も好ましくは配列番号10の塩基配列のDNAからなるプライマー)及び配列表の配列番号11の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(11´)(最も好ましくは配列番号11の塩基配列のDNAからなるプライマー)をアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットはあじ検出用に好適に使用でき、配列番号9のプライマー、配列番号10のプライマー、配列番号11のプライマーとをセットで用いることが最も好ましい。なお、(9´)の具体例としては配列番号28のプライマー、(10´)の具体例としては配列番号29のプライマー、(11´)の具体例としては配列番号30のプライマーを例示できる。
【0073】
また、第6のプライマーの好ましい態様として、配列表の配列番号12の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(12´)(最も好ましくは配列番号12の塩基配列のDNAからなるプライマー)をセンスプライマーとし、配列表の配列番号13の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(13´)(最も好ましくは配列番号8の塩基配列のDNAからなるプライマー)をアンチセンスプライマーとするプライマーセット提案する。本プライマーセットは、たら検出用に好適に使用、配列番号12のプライマーと配列番号13のプライマーとをセットで用いることが最も好ましい。なお、(12´)の具体例としては配列番号31のプライマー、(13´)の具体例としては配列番号32のプライマーを例示できる。
【0074】
また、第7のプライマーの好ましい態様として、配列表の配列番号14の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(14´)(最も好ましくは配列番号14の塩基配列のDNAからなるプライマー)をセンスプライマーとし、配列表の配列番号15の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(15´)(最も好ましくは配列番号15の塩基配列のDNAからなるプライマー)をアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットはたこ検出用に好適に使用でき、配列番号14のプライマーと配列番号15のプライマーとをセットで用いることが最も好ましい。なお、(14´)の具体例としては配列番号33のプライマー、(15´)の具体例としては配列番号34のプ
ライマーを例示できる。
【0075】
また、第8のプライマーセットの好ましい態様として、配列表の配列番号16の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(16´)(最も好ましくは配列番号16の塩基配列のDNAからなるプライマー)及び、配列表の配列番号17の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(17´)(最も好ましくは配列番号17の塩基配列のDNAからなるプライマー)をセンスプライマーとし、配列表の配列番号18の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(18´)(最も好ましくは配列番号18の塩基配列のDNAからなるプライマー)及び配列表の配列番号19の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー(19´)(最も好ましくは配列番号19の塩基配列のDNAからなるプライマー)をアンチセンスプライマーとするプライマーセットを提案する。本プライマーセットはほたてがい検出用に好適に使用でき、配列番号16のプライマー、配列番号17のプライマー、配列番号18のプライマー、配列番号19のプライマーとをセットで用いることが最も好ましい。なお、(16´)の具体例としては配列番号35のプライマー、(17´)の具体例としては配列番号36のプライマー、(18´)の具体例としては配列番号37のプライマー、(19´)の具体例としては配列番号38のプライマーを例示できる。
【0076】
なお、センスプライマーとアンチセンスプライマーのハイブリダイズや、個々のプライマー自身によるハイブリダイズを生じないように、すなわち、いわゆるプライマーダイマーの形成を極力回避するような工夫を施して、各々のプライマーを設計した。例えば、プライマーダイマーの形成を回避させるために、プライマーの検出特異性及び検出感度の低下を導かないような塩基置換をプライマーに施している。ゴマ検出用プライマーのセンスプライマーである配列番号1における塩基番号8の塩基は、本来、Tであるが、センスプライマーとアンチセンスプライマーによるプライマーダイマーの形成を回避するために、プライマーの検出特異性及び検出感度の低下を導かないような塩基置換として、Tの代わりにAを採用している。同様に、配列番号7における塩基番号13の塩基をAからTに、配列番号17における塩基番号4の塩基をCからAに置換している。
【0077】
本発明が提供するプライマーの塩基配列について網羅的に述べてきたが、理論上は首尾よく設計されたプライマーであっても、意図する性能(検出感度等)を保有しえないプライマーが設計される場合がある。例えば、本発明の研究段階において、配列番号39と配列番号40とからなるゴマ検出用PCRプライマーセット、配列番号41と配列番号42とからなるメロン検出用PCRプライマーセットを用いたPCRでは、低い検出感度(100 pg DNA)を示した。このように、単に論理的にプライマーを設計すれば、意図する性能(検出感度等)を取得できるとは限らず、必要な性能を保有しない場合も生じうるために、その設計の際には、論理的設計だけでなく、さらなる工夫とその性能評価試験が重要となる。本発明が提供するプライマーは、論理的設計の上に、さらなる工夫を施して設計したものであり、最終的には性能評価試験をクリアーしたものである。
【0078】
配列番号39 ゴマS AATTCTCATGTATGTGAATATGAAG
配列番号40 ゴマAS GTTCGCCTGAAAATCCTTAAC
配列番号41 メロンS GACAAAAAATCCAGTTTACTAATG
配列番号42 メロンAS GGATGTTTGTTATAATAATTAGACGAC
( Sはセンスプライマーを表し、ASはアンチセンスプライマーを表す。)
【0079】
特定動植物検出法
本発明の特定植物検出方法は、試料からDNAを抽出する工程と、このDNAを鋳型として、本発明のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にゴマ、メロン、まぐろ、ブリ、あじ、たら、たこ、又はほたてがいが存在しているか否かを検出する工程とを含む方法である。
【0080】
即ち、上記本発明の特定植物検出用PCRプライマーセットを用いて、試料中のDNAをPCR等で核酸分析することにより、試料中の特定植物を特異的に検出することが可能となる。このとき、ゴマを検出する場合には、ゴマ検出用PCRプライマーセットを使用し、同様にメロン、まぐろ、ブリ、あじ、たら、たこ、ほたてがいを検出する場合には、それぞれメロン検出用PCRプライマーセット、まぐろ検出用PCRプライマーセット、ブリ検出用PCRプライマーセット、あじ検出用PCRプライマーセット、たら検出用PCRプライマーセット、たこ検出用PCRプライマーセット、ほたてがい検出用PCRプライマーセットを使用すればよい。
【0081】
検出法(核酸分析)の種類は、特に限定されず、適宜公知の方法を用いることができる。例えば、PCRプライマーを用いてPCR増幅する方法やPCR増幅産物をプローブで検出する方法等を例示することができる。
【0082】
PCRプライマーを用いてPCR増幅する方法としては、検出目的に応じて選択した上記本発明の特定動植物検出用プライマーセットを用いて、試料中のDNAにおける標的塩基配列を選択的に増幅させ、PCR増幅産物の有無を測定する方法が挙げられる。PCR増幅産物の有無の確認は、通常、PCR増幅産物をアガロースゲル電気泳動により分離し、エチジウムブロマイドやサイバーグリーンIなどの核酸染色によって行うことができる。リアルタイムPCR装置を用いてPCRを行う場合は、その装置の検出システムにより自動的にPCR増幅産物の有無を確認することができる。例えば、PCR反応液中にサイバーグリーンIを添加した場合、サイバーグリーンIが二本鎖DNAに結合したときに発する蛍光量に依存したPCR増幅産物量をサイクル毎にモニターすることができる。さらに、PCR後に、PCR増幅産物の融解曲線分析を行い、その分析からPCR増幅産物の融解温度(Tm)値を導くことにより、PCR増幅産物が目的の増幅産物であるか否かを確認できる。状況によっては、このTm値による判断が困難な場合も想定されるが、そのような場合には、先述のアガロースゲル電気泳動によって増幅産物の有無とそのサイズを確認すればよい。
【0083】
具体的には、配列番号1記載のプライマーと配列番号2記載のプライマーを用いたPCR増幅産物のTm値は約77.3℃であり、PCR増幅産物のサイズは約150 bpである。融解曲線分析において、当該Tm値を得た場合、又は、アガロース電気泳動において当該サイズの増幅産物を検出した場合、被験試料中にゴマが存在していたことを示唆する。
【0084】
また、配列番号3記載のプライマーと配列番号4記載のプライマーを用いたPCR増幅産物のTm値は約79.5℃であり、PCR増幅産物のサイズは約179 bpである。融解曲線分析において、当該Tm値を得た場合、又は、アガロース電気泳動において当該サイズの増幅産物を検出した場合、被験試料中にメロンが存在していたことを示唆する。
【0085】
また、配列番号5記載のプライマーと配列番号6記載のプライマーを用いたPCR増幅産物のTm値は約80.5℃であり、PCR増幅産物のサイズは約130 bpである。融解曲線分析において、当該Tm値を得た場合、又は、アガロース電気泳動において当該サイズの増幅産物を検出した場合、被験試料中にまぐろが存在していたことを示唆する。
【0086】
また、配列番号7記載のプライマーと配列番号8記載のプライマーを用いたPCR増幅産物のTm値は約84.7℃であり、PCR増幅産物のサイズは約105 bpである。融解曲線分析において、当該Tm値を得た場合、又は、アガロース電気泳動において当該サイズの増幅産物を検出した場合、被験試料中にブリが存在していたことを示唆する。
【0087】
また、配列番号9記載のプライマー、配列番号10、配列番号11記載のプライマーを用いたPCR増幅産物のTm値は約79.5℃であり、PCR増幅産物のサイズは約77 bpである。融解曲線分析において、当該Tm値を得た場合、又は、アガロース電気泳動において当該サイズの増幅産物を検出した場合、被験試料中にあじが存在していたことを示唆する。
【0088】
また、配列番号12記載のプライマーと配列番号13記載のプライマーを用いたPCR増幅産物のTm値は約83.4℃であり、PCR増幅産物のサイズは約144 bpである。融解曲線分析において、当該Tm値を得た場合、又は、アガロース電気泳動において当該サイズの増幅産物を検出した場合、被験試料中にたらが存在していたことを示唆する。
【0089】
また、配列番号14記載のプライマーと配列番号15記載のプライマーを用いたPCR増幅産物のTm値は約76.4℃であり、PCR増幅産物のサイズは約204 bpである。融解曲線分析において、当該Tm値を得た場合、又は、アガロース電気泳動において当該サイズの増幅産物を検出した場合、被験試料中にたこが存在していたことを示唆する。
【0090】
また、配列番号16記載のプライマー、配列番号17記載のプライマー、配列番号18記載のプライマー及び配列番号19記載のプライマーを用いたPCR増幅産物のTm値は約83.8℃であり、PCR増幅産物のサイズは約145また約180 bpである。融解曲線分析において、当該Tm値を得た場合、又は、アガロース電気泳動において当該サイズの増幅産物を検出した場合、被験試料中にほたてがいが存在していたことを示唆する。
【0091】
PCR増幅産物をプローブで検出する方法としては、Taq Man法に代表されるように、PCR増幅産物の内部塩基配列とハイブリダイズするような蛍光物質標識プローブを反応液に添加し、該プローブがPCR増幅産物にハイブリダイズ後、該プローブが分解されるときに生じる蛍光量をリアルタイムPCR装置で自動的に検出することによって、PCR増幅産物の有無を確認する方法が挙げられる。なお、PCR増幅産物をプローブで検出するその他の方法としては、Molecular Beacon法、CycleavePCR法、ハイブリプローブを利用する方法等が挙げられる。これらの方法で使用するPCRプライマーは、本発明の特定動植物検出用PCRプライマーセットの何れかを使用すればよく、各々のPCRプライマーセットで増幅されるPCR増幅産物の内部塩基配列から標的とする生物種に共通な塩基配列領域を別途選択し、その領域に基づいたプローブを使用すればよい。
【0092】
本発明の特定動植物の検出法において、対象となる被験試料の種類は、特に限定されない。例えば、被験試料としては、食品原料や加工食品等が挙げられる。食品原料としては、特定動植物を取り扱う食品原料生産工場において、別途生産される特定動植物を意図的に含まない食品原料が挙げられる。加工食品としては、菓子類、麺類、粉末スープ、液体スープ、熱風乾燥又は凍結乾燥した具材、あるいは、これらの加工食品を含有する各種調理食品等が挙げられる。また、特定動植物を取り扱う食品製造工場において、別途生産される特定動植物を意図的に含まない加工食品が挙げられる。また、特定動植物を含む加工食品を製造後、特定動植物を含まない加工食品を製造する際には、特定動植物残渣の除去を念頭においた食品製造設備の入念な清掃作業が必須となる。この清掃作業方法の有効性、並びに、食品製造設備の特定動植物残渣の有無を確認する観点から、当該製造設備の拭き取り試料も被験試料として挙げられる。
【0093】
また、試料の形態も特に限定されず、一般的な既知のDNA抽出法(厚生労働省医薬局食品保健部長通知、アレルギー物質を含む食品の検査方法について、平成14年11月06日、食発第1106001号)や市販の各種DNA抽出キット[例えば、Nucleon PhytoPure, plant and fungal DNA extraction kits(Amersham Biosciences Corp., USA)、DNA Extraction IsoplantII kit(Nippon Gene Co. Ltd., Japan)、DNeasy Plant Mini Kit(Qiagen GmbH, Hilden, Germany)等]によって、DNAの回収が可能な試料であれば、上記の検出法に適用することができる。上記のDNA抽出法によって、ゲノムDNA及び細胞小器官由来DNA(ミトコンドリアDNAやクロロプラストDNA)を、通常、試料から抽出することができる。
【0094】
特定動植物検出用キット
本発明は、また、特定動植物検出キットに関する。当該キットは、上記本発明の特定動植物検出用PCRプライマーセットの少なくとも1セットを含んで成るものであれば、その構成は特に限定されない。
具体的には、配列番号1における塩基番号13〜27の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号2における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号3における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号4における塩基番号11〜25の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号5における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号6における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号7における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号8における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号9における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、配列番号10における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、及び配列番号11における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号12における塩基番号6〜20の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号13における塩基番号4〜18の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号14における塩基番号11〜25の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号15における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;及び
配列番号16における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、配列番号17における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、配列番号18における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、及び配列番号19における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセットの1セット以上を含む特定動植物検出キットが挙げられる。
【0095】
そして、好ましいものとして、配列番号1の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号2の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号3の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号4の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号5の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号6の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号7の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号8の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号9の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、配列番号10の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、及び配列番号11の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号12の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号13の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;
配列番号14の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーと、配列番号15の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセット;及び
配列番号16の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、配列番号17の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、配列番号18の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマー、配列番号19の塩基配列を3´末端側に含む最大30塩基のDNAからなるプライマーとのセットの1セット以上を含む特定動植物検出キットが挙げられる。
【0096】
その中でも、特に好ましいものとして、配列番号1の塩基配列からなるプライマーと、配列番号2の塩基配列からなるプライマーとのセット;
配列番号3の塩基配列からなるプライマーと、配列番号4の塩基配列からなるプライマーとのセット;
配列番号5の塩基配列からなるプライマーと、配列番号6の塩基配列からなるプライマーとのセット;
配列番号7の塩基配列からなるプライマーと、配列番号8の塩基配列からなるプライマーとのセット;
配列番号9の塩基配列からなるプライマー、配列番号10の塩基配列からなるプライマー、及び配列番号11の塩基配列からなるプライマーとのセット;
配列番号12の塩基配列からなるプライマーと、配列番号13の塩基配列からなるプライマーとのセット;
配列番号14の塩基配列からなるプライマーと、配列番号15の塩基配列からなるプライマーとのセット;
配列番号16の塩基配列からなるプライマー、配列番号17の塩基配列からなるプライマー、配列番号18の塩基配列からなるプライマー、配列番号19の塩基配列からなるプライマーとのセットの1セット以上を含む特定動植物検出キットが挙げられる。
また、上記の各々のプライマーセット、及び当該の各々のプライマーセットで増幅されるPCR増幅産物を検出するためのプローブ等を含む特定動植物検出キットなども挙げられる。
【0097】
当該キットには、使用目的等に応じて、適当な試薬や各種容器等を含めることができる。具体的には、PCRプライマー伸長生成物を合成するための重合用試薬、例えば、耐熱性DNAポリメラーゼ、デオキシリボヌクレオチド、マグネシウム及び、PCR反応用緩衝液、並びに、それらの品質を適切に保持可能な保存容器等を含めることができる。
【0098】
実施例
以下に、本発明について実施例を用いて、さらに、詳細に説明するが、本発明は、これらの実施例に限定して解釈されるものではない。また、本発明の要旨を逸脱することなく、適宜変更することが可能である。
【0099】
実施例1
各種動物、植物、真菌及び、細菌由来DNAに対する特定植物用PCRプライマーセットの検出特異性の確認
本発明の特定植物用PCRプライマーセットを使用したPCR分析法の有効性を確認するために、各種生物由来DNAに対するPCRの検出特異性を調べる実験を、下記のように実施した。
ヒト、ウシ、ブタ、ニワトリ、アフリカツメガエル、及びチョウザメの精製DNAは、セマイン社(CeMines, LLC, USA)から購入したものを使用した。
クロマグロ、キハダマグロ、メバチマグロ、ビンチョウマグロ、カツオ、ゴマサバ、マサバ、タイセイヨウサバ、ブリ、ヒラマサ、カンパチ、マアジ、ニュージーランドマアジ、メアジ、シマアジ、マルアジ、マアナゴ、マイワシ、マダラ、サケ(シロザケ)、ギンザケ、スチールヘッド(ニジマス)、マダコ、ミズダコ、イイダコ、ヤナギダコ、スルメイカ、ヤリイカ、カミナリイカ、ホタルイカ、ホタテガイ、アメリカイタヤガイ、アメリカヒナイタヤガイ、タイラギ、ムラサキイガイ、アサリ、エゾアワビ、トコブシ、ベニズワイガニ、タラバガニ、及びブラックタイガーエビの精製DNAは、商店から購入した各々の試料の(筋)肉質部分を凍結後、マルチビーズショッカー(安井器械、大阪)で破砕した試料からNucleon PhytoPure, plant and fungal DNA extraction kits(Amersham Biosciences Corp., USA)、DNA Extraction IsoplantII kit(Nippon Gene Co. Ltd., Japan)、またはDNeasy Blood&Tissue kit(Qiagen GmbH, Germany)を用いて調製したものを使用した。
【0100】
クロゴキブリの精製DNAは、その脚の部分を70%エタノールで洗浄し、さらに、TBS緩衝液で洗浄後、マルチビーズショッカーで粉砕した試料からNucleon PhytoPure, plant and fungal DNA extraction kitsを用いて調製したものを使用した。
ゴマ(白色系統、黒色系統)、シソ、エゴマ、タイム、スペアミント、バジル、オレガノ、ローズマリー、ナス、ジャガイモ、トマト、トウガラシ、クコ、サツマイモ、キウイフルーツ、ニンジン、ゴボウ、メロン(アムスメロン、アールスメロン、レッドメロン、ハネデューメロン)、フユメロン(ハミウリ)、マクワウリ、シロウリ、キュウリ、スイカ、トウガン、カボチャ、ツルレイシ、ニガウリ、ダイズ(黄色系統)、アズキ、クリ、クルミ、リンゴ(フジ)、イチゴ、ナシ(幸水)、キャベツ、ウンシュウミカン、ネギ、アスパラガスは、商店から購入し、モモ(白鳳)、イチゴ、及びイネは国内栽培農家から入手した。これらの精製DNAは、各々の試料の一部(種子、果皮部、葉部、塊茎部)を70%エタノールで洗浄し、さらに、TE緩衝液で素早く洗浄後、マルチビーズショッカー(安井器械、大阪)で破砕した試料からNucleon PhytoPure, plant and fungal DNA extraction kits、 DNeasy plant Mini kits(Qiagen GmbH, Germany)または、DNA Extraction IsoplantII kitを用いて調製したものを使用した。
【0101】
ソバの精製DNAは、商店から購入したそば粉をマルチビーズショッカーで、さらに粉砕した試料からNucleon PhytoPure, plant and fungal DNA extraction kitsを用いて調製したものを使用した。
【0102】
コムギ及びトウモロコシの精製DNAは、バイオチェイン・インスティテュート社(BioChain Institute, Inc., USA)から購入したものを使用した。
【0103】
アスペルギウス・ニガー(Aspergillus niger IFO 9642)、サッカロマイセス・セレビシエ(Saccharomyces cerevisiae IFO 0282)、大腸菌(Escherichia coli JCM 1649T)、及びバチルス・セレウス菌(Bacillus cereus DSM 4312)の精製DNAは、各々の菌株を適切な培地で培養後、その培養液からPuregene Yeast and Gram-Positive DNA Isolation kit(Gentra Systems Inc., USA)を用いて調製したものを使用した。
【0104】
マツタケ、シイタケ、エノキダケ、ナメコ、及びエリンギの精製DNAは、商店から購入した試料の小片を凍結後、マルチビーズショッカーで破砕した試料からNucleon PhytoPure, plant and fungal DNA extraction kitsを用いて調製したものを使用した。
なお、いずれの精製DNAもRNA分解酵素によるRNAの除去操作を実施してある。
【0105】
配列番号1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、及び19に記載の各々のPCRプライマーは、オペロン・バイオテクノジー社(Operon Biotechnologies GmbH, Germany)で合成されたものを、以下のPCRで使用した。
【0106】
上述したように準備した各種動物、植物、真菌、及び細菌DNA量を測定後、滅菌水を用いて、動物、植物、及び真菌DNAの濃度を1 ng/μLに、細菌DNAの濃度を50 pg/μLに調製した。調製した1 μLのDNA試料液を含む20 μL容量の反応液は、タカラバイオ社のSYBR Premix Ex Taq(Takara Bio Inc., Japan)を用いて調製した。この試薬は、TaKaRa Ex Taq HS(ホットスタートタイプ)、dNTP Mixture、Mg2+およびSYBR Green Iを溶液中に含んでいる。反応液は、SYBR Premix Ex Taqをベースとし、250 nMセンスプライマー、250 nMアンチセンスプライマーを含む組成として、調製した。PCR反応は、LightCycler(Roche Diagnostics GmbH, Germany)で行い、増幅反応条件は以下の通りである。
【0107】
95℃で1分間のサイクルを一回実施後、20℃/秒の速度で95℃まで昇温後、5秒間同温度で保温、次に20℃/秒の速度でT℃まで降温後、10秒間同温度で保温、さらに10℃/秒の速度で72℃まで昇温後、20秒間同温度で保温する3つのステップからなる増幅サイクルをぶり検出用PCRプライマーの場合には30回、ゴマ、メロン、まぐろ、あじ、たら、たこ、及びほたてがい検出用PCRプライマーの場合には35回実施した。なお、Tは、ゴマ、メロン、及びたこ検出用PCRプライマーの場合には64、まぐろ、ぶり、及びほたてがい検出用PCRプライマーの場合には66、あじ検出用PCRプライマーの場合には62、たら検出用PCRプライマーの場合には53とした。PCR増幅産物は、SYBR Green I依存性の蛍光量として、各々のサイクルの最終ステップに記録した。増幅サイクル終了後、メルティングカーブは、20℃/秒の速度で95℃まで昇温後、次に20℃/秒の速度で60℃まで降温し、10秒間同温度で保温後、さらに0.2℃/秒の速度で97℃に至るまでのゆるやかな昇温中に0.2秒毎の蛍光強度を記録することによって得た。同PCR装置のソフトウェアによってメルティングカーブから得られたPCR増幅産物のTm値は、PCRによる特異的な増幅産物の有無を推定するために使用した。さらに、1.8%(wt/vol)アガロースゲル電気泳動によってPCR増幅産物(反応液の2 μL)を分離し、分離後のゲルをエチジウムブロマイドで染色後、UV照射下において増幅産物を視覚化することによって、増幅産物の有無を確認した。分子量マーカーとしてΦX174 HaeIII digest DNA(Takara)を使用した。これらのPCRの結果を表1に記載した。表中の+(プラス)は電気泳動により標的サイズの増幅産物が検出されたことを示し、−(マイナス)は当該増幅産物が検出されなかったことを示す。
【0108】
ゴマ検出用PCRプライマー(配列番号1及び2からなるPCRプライマーセット)を使用した場合、シソ目ゴマ科ゴマ属のゴマ(白色系統、黒色系統)DNAを使用した場合のみ150bp前後の増幅産物が確認され(表1)、これらの増幅産物のTm値は、約77.7℃であった。近縁種である同目シソ科シソ属のシソDNA、エゴマDNA、同目シソ科イブキジャコウソウ属のタイムDNA、同目シソ科ハッカ属のスペアミントDNA、同目シソ科メボウキ属のバジルDNA、同目シソ科ハナハッカ属のオレガノDNA、同目シソ科Rosmarinus属のローズマリーDNAや、他の植物を含むその他の生物種DNAを使用した場合には、増幅産物は見られなかった(表1)。
【0109】
なお、既知及び独自に解析した各種生物のクロロプラストのmatK遺伝子配列に関する多重並列配列図とPCRプライマー配列との関係から、当該PCRプライマーを用いたPCRは、ゴマ(白色系統、黒色系統)DNAを検出できるが、実施例1で供試しなかった他の植物を含むその他の生物種DNAを検出しないことが強く示唆されている。
【0110】
また、メロン検出用PCRプライマー(配列番号3及び4からなるPCRプライマーセット)は、ウリ科キュウリ属のメロン(アムスメロン、アールスメロン、赤肉メロン、ハネデューメロン)DNA、フユメロン(ハミウリ)DNAを使用した場合のみ、179 bp前後の増幅産物が確認され(表1)、これらの増幅産物のTm値は、約79.5℃であった。近縁種である同科同属のマクワウリDNA、シロウリDNA、ハミウリDNA、キュウリDNA、同科スイカ属スイカDNA、同科トウガン属トウガンDNA、同科カボチャ属セイヨウカボチャDNA、同科ツルレイシ属ツルレイシDNA、ニガウリDNAや植物を含むその他の生物種DNAを使用した場合には増幅産物は見られなかった(表1)。
【0111】
なお、既知及び独自に解析した各種生物のクロロプラストのmatK遺伝子配列に関する多重並列配列図とPCRプライマー配列との関係から、当該PCRプライマーを用いたPCRは、ウリ科キュウリ属のメロン(アムスメロン、アールスメロン、赤肉メロン、ハネデューメロン)DNA、フユメロン(ハミウリ)DNAを検出できるが、実施例1で供試しなかった他の植物を含むその他の生物種DNAを検出しないことが強く示唆されている。
【0112】
また、まぐろ検出用PCRプライマー(配列番号5及び6からなるPCRプライマーセット)を使用した場合、サバ科マグロ属のクロマグロDNA、キハダマグロDNA、メバチマグロDNA、ビンチョウマグロDNAを使用した場合のみ130bp前後の増幅産物が確認され(表2)、これらの増幅産物のTm値は、約80.5℃であった。近縁種である同科カツオ属のカツオDNA、同科サバ属のマサバDNA、ゴマサバDNA、タイセイヨウマサバDNAや他の魚類を含むその他の生物種DNAを使用した場合には、増幅産物は見られなかった(表2)。
【0113】
なお、既知及び、独自に解析した各種生物のミトコンドリアのチトクロームb遺伝子配列に関する多重並列配列図とPCRプライマー配列との関係から、当該PCRプライマーを用いたPCRは、実施例1で供試したサバ科マグロ属のクロマグロDNA、キハダマグロDNA、メバチマグロDNA、ビンチョウマグロDNAに加えて同科同属のミナミマグロDNA、コシナガDNA、タイセイヨウマグロDNAを検出できるが、近縁種である同科ハガツオ属のハガツオ、タイセイヨウハガツオ、同科ソウダガツオ属のマルソウダ(トックリガツオ)、並びに、サワラ属のサワラの仲間(Scomberomorus tritor)DNA及び、他の魚類を含むその他の生物種DNAを検出しないことが強く示唆されている。
【0114】
また、ブリ検出用PCRプライマー(配列番号7及び8からなるPCRプライマーセット)を使用した場合は、アジ科ブリモドキ亜科ブリ属のブリDNAを使用した場合のみ105bp前後の増幅産物が確認され(表2)、これらの増幅産物のTm値は、約84.7℃であった。近縁種である同科ブリモドキ亜科ブリ属のヒラマサDNA、カンパチDNA、同科アジ亜科マアジ属のマアジDNAや他の魚類を含むその他の生物種DNAを使用した場合には、増幅産物は見られなかった(表2)。
【0115】
なお、既知及び、独自に解析した各種生物のミトコンドリアのチトクロームb遺伝子配列に関する多重並列配列図とPCRプライマー配列との関係から、当該PCRプライマーを用いたPCRは、アジ科ブリモドキ亜科ブリ属のブリDNAを検出できるが、近縁種である同科同亜科アイブリ属のアイブリDNA、同科ツムブリ属のツムブリDNA及び、他の魚類を含むその他の生物種DNAを検出しないことが強く示唆されている。
【0116】
また、あじ検出用PCRプライマー(配列番号9、10及び11からなるPCRプライマーセット)を使用した場合、アジ科アジ亜科マアジ属マアジDNA、アジ科アジ亜科マアジ属ニュージーランドマアジDNA、アジ科アジ亜科メアジ属メアジDNA、アジ科アジ亜科シマアジ属シマアジDNA、アジ科アジ亜科ムロアジ属マルアジDNAを使用した場合のみ77bp前後の増幅産物が確認され(表2)、これらの増幅産物のTm値は、約79.5℃であった。近縁種である同科ブリモドキ亜科ブリ属のブリDNA、ヒラマサDNA、カンパチDNAや他の魚類を含むその他の生物種DNAを使用した場合には、増幅産物は見られなかった(表2)。なお、あじはアジ科に分類される魚類の総称で、特にアジ亜科に分類される魚類を指す。そのため、当該PCRプライマーはアジ亜科に分類される魚類を検出するよう意図的に設計しており、前述したようにアジ亜科に分類される魚類DNAを検出するが、アジ科ブリモドキ亜科に属する魚類DNAを検出しないことを確認した(表2)。
【0117】
なお、既知及び、独自に解析した各種生物のミトコンドリアのチトクロームb遺伝子配列に関する多重並列配列図とPCRプライマー配列との関係から、当該PCRプライマーを用いたPCRは、実施例1で供試したアジ科アジ亜科マアジ属マアジDNA、アジ科アジ亜科マアジ属ニュージーランドマアジDNA、アジ科アジ亜科メアジ属メアジDNA、アジ科アジ亜科シマアジ属シマアジDNA、アジ科アジ亜科ムロアジ属マルアジDNAに加えて、アジ亜科に属するあじDNA(例えばアジ亜科ムロアジ属のクサヤムロDNA、ムロアジDNA、アジ亜科ホソヒラアジ属のホソヒラアジDNA、アジ亜科マテアジ属のマテアジDNA、アジ亜科ギンガメアジ属のギンガメアジ、アジ亜科ヨロイアジ属のヨロイアジDNA、アジ亜科イトヒキアジ属のイトヒキアジDNA等)を検出できるが、ブリモドキ亜科アイブリ属のアイブリDNA、ブリモドキ亜科ツムブリ属のツムブリDNA、コバンアジ亜科コバンアジ属のコバンアジDNA、マルコバンDNA及び、他の魚類を含むその他の生物種DNAを検出しないことが強く示唆されている。
【0118】
また、たら検出用PCRプライマー(配列番号12及び13からなるPCRプライマーセット)を使用した場合は、タラ科マダラ属のマダラDNAを使用した場合のみ144bp前後の増幅産物が確認され(表2)、これらの増幅産物のTm値は、約83.4℃であった。他の魚類を含むその他の生物種DNAを使用した場合には、増幅産物は見られなかった(表2)。
【0119】
なお、既知及び、独自に解析した各種生物のミトコンドリアの16SrRNA遺伝子配列に関する多重並列配列図とPCRプライマー配列との関係から、当該PCRプライマーを用いたPCRは、実施例1で供試したタラ科マダラ属のマダラDNAに加えて、タラ科マダラ属のタイセイヨウダラDNA、タラ科スケトウダラ属のスケトウダラDNA、タラ科コマイ属のコマイDNA等の商業的に重要なタラ科の魚を検出できるが、他の魚類を含むその他の生物種DNAを検出しないことが強く示唆されている。
【0120】
また、たこ検出用PCRプライマー(配列番号14及び15からなるPCRプライマーセット)を使用した場合は、マダコDNA、ミズダコDNA、イイダコDNA、ヤナギダコDNAを使用した場合のみ204 bp前後の増幅産物が確認され(表2)、これらの増幅産物のTm値は、約76.4℃であった。イカや貝類を含むその他の生物種DNAを使用した場合には、増幅産物は見られなかった(表2)。
【0121】
なお、既知及び、独自に解析した各種生物のミトコンドリアの16S rRNA遺伝子配列に関する多重並列配列図とPCRプライマー配列との関係から、当該PCRプライマーを用いたPCRは、実施例1で供試したマダコ科マダコ属のマダコDNA、ミズダコDNA、イイダコDNA、ヤナギダコDNAに加えて、タコ類(八腕目)の属するタコDNA(例えば、マダコ科のテナガダコ、スナダコ、ワモンダコ、メンダコ科のメンダコ、カンテンダコ科のカンテンダコ、スカシダコ科のスカシダコ、クラゲダコ科のクラゲダコ属の一種、ワタゾコダコ亜科のチヒロダコ等)を検出できるが、イカ類(十腕目)や他の軟体動物を含むその他の生物種DNAを検出しないことが強く示唆されている。
【0122】
さらに、ほたてがい検出用PCRプライマー(配列番号16、17、18及び19からなるPCRプライマーセット)を使用した場合は、イタヤガイ科Patinopecten属のホタテガイDNAを使用した場合のみ180 bp前後の増幅産物が確認され(表2)、これらの増幅産物のTm値は、約83.8℃であった。近縁種である同科Argopecten属のアメリカホンイタヤガイDNA、アメリカヒナイタヤガイDNAや他の貝類、軟体動物を含むその他の生物種DNAを使用した場合には、増幅産物は見られなかった(表2)。
【0123】
なお、既知及び、独自に解析した各種生物のミトコンドリアの16S rRNA遺伝子配列に関する多重並列配列図とPCRプライマー配列との関係から、当該PCRプライマーを用いたPCRは、実施例1で供試したイタヤガイ科Patinopecten属のホタテガイDNAに加えて同科Pecten属のジェームスホタテDNA、ニュージーランドホタテDNA、ヨーロッパホタテDNAを検出できるが、近縁種である同科Aequipecten属のセイヨウイタヤDNA、Chlyms属のヒオウギガイDNA、アズマニシキガイDNA、フランスニシキDNA及び他の貝類を含むその他の生物種DNAを検出しないことが強く示唆されている。また、配列番号16、18のPCRプライマーは、日本近海で採れるホタテガイDNAの検出に好適であり、配列番号17、19のPCRプライマーは、海外で採れるジェームスホタテDNA、ニュージーランドホタテDNA、ヨーロッパホタテDNAを検出するのに好適である。
【0124】
【表1】

【0125】
【表2】

【0126】
実施例2
特定動植物用PCRプライマーセットを用いたPCRの検出感度の確認
実施例1で使用した特定動植物用PCRプライマーセットを用いたPCRの検出感度を調べるために、下記のような実験を実施した。
実施例1で調製したゴマ(白色系統)、メロン(アールスメロン)、クロマグロ、ブリ、マアジ、マダラ、マダコ、及びホタテガイの各DNAを滅菌水で希釈し、1 pg/μl、10 pg/μl、100 pg/μl、1000 pg/μlのDNA溶液の希釈系列を作製し、これらの希釈した被験DNA液の1 μLを、実施例1に記載したPCR反応条件で、PCRに供した。PCR反応後、実施例1に記載したようにして、PCR増幅産物のTm値を求め、さらに、増幅産物の有無をアガロースゲル電気泳動によって確認した。
【0127】
図1に示すように、ゴマ検出用PCRプライマー(配列番号1及び2からなるPCRプライマーセット)を使用した場合の検出感度は、1 pg DNA/分析であり、メロン検出用PCRプライマー(配列番号3及び4からなるPCRプライマーセット)を使用した場合の検出感度は、10 pg DNA/分析であり、まぐろ検出用PCRプライマー(配列番号5及び6からなるPCRプライマーセット)を使用した場合の検出感度は、1 pg DNA/分析であり、ブリ検出用PCRプライマー(配列番号7及び8からなるPCRプライマーセット)を使用した場合の検出感度は、1 pg DNA/分析であり、あじ検出用PCRプライマー(配列番号9及び10のPCRプライマーセット)を使用した場合の検出感度は、1 pg DNA/分析であり、たら検出用PCRプライマー(配列番号11及び12からなるPCRプライマーセット)を使用した場合の検出感度は、1 pg DNA/分析であり、たこ検出用PCRプライマー(配列番号11及び12からなるPCRプライマーセット)を使用した場合の検出感度は、10 pg DNA/分析であり、ほたてがい検出用PCRプライマー(配列番号11及び12からなるPCRプライマーセット)を使用した場合の検出感度は、10 pg DNA/分析であった。
【0128】
実施例3
特定動植物用PCRプライマーセットを用いたPCRによる特定動食物含有食品中の特定植物由来DNAの検出
ゴマ、メロン、まぐろ、あじ、たら、たこ、あるいはほたてがいを原料として含有する市販食品等に対する本発明の特定動物用PCRプライマーセットを用いたPCR分析を下記のように行い、本発明の実用性を検討した。
【0129】
ゴマ、メロン、まぐろ、あじ、たら、たこ、あるいはほたてがいをを原料として含有することを明記されている市販食品(表2)を準備し、1〜10 gをマルチビーズショッカーで粉砕した。その混合破砕物の0.1〜1 gから各々のDNAをDneasy Plant mini kitを用いて抽出した。抽出時には、RNA分解酵素によるRNAの除去操作も実施した。抽出した食品試料DNA量を測定後、滅菌水を用いて、食品試料DNAの濃度を10 ng/μLに調製した。なお、ぶりを原料として含有する市販食品の入手が困難であったため、ぶり含有食品の代替試料として、まぐろ薄削り(林久右衛門商店)(10 ng/μL)にぶりDNAを50 pg/μLの濃度で添加したものを使用した。これらの調製DNA液の1 μLを、実施例1で使用した特定動植物用PCRプライマーセットを用い、実施例1に記載したPCR反応条件で、PCRに供した。PCR反応後、実施例1に記載したようにして、PCR増幅産物のTm値を求め、さらに、増幅産物の有無をアガロースゲル電気泳動によって確認した。これらのPCRの結果を表2に記載した。表中の+(プラス)は電気泳動により標的サイズの増幅産物が検出されたことを示し、−(マイナス)は当該増幅産物が検出されなかったことを示し、NDは検査が未実施であることを示す。また、これらのPCRのアガロース電気泳動に関する結果を図2(A、B、C、D、E、F、G及び、H)に示した。さらに、食品試料DNAから増幅されたPCR増幅産物を、BigDye Terminator v3.1 Cycle Sequencing kit(Applied Biosystems社)を用いて、両方向からダイレクトシーケンス後、Applied Biosystems 310 Genetic Analyzer(Applied Biosystems社)によって塩基配列を分析した。分析した塩基配列データをGenBank nucleotide sequence database(BLAST search)もしくは、発明者らが保有するDNAデータベースと比較解析し、その塩基配列の類似性に基づいて、PCR増幅産物由来DNAの生物種を帰属・同定した。
【0130】
その結果、ゴマ検出用PCRプライマー(配列番号1及び2からなるPCRプライマーセット)を使用した場合、ゴマ含有食品である、出前一丁ごまとんこつ(日清食品)及び金のごまだれ(ミツカン)由来DNAにおいてのみ、150bp前後の増幅産物が確認され[表3、図2(A)]、この増幅産物のTm値は、約77.1℃であった。他の食品試料由来DNAを使用した場合には、増幅産物は見られなかった[表3、図2(A)]。なお、PCR増幅産物の塩基配列解析の結果、出前一丁ごまとんこつ(日清食品)及び金のごまだれ(ミツカン)由来DNAから増幅されたPCR増幅産物の塩基配列は、ゴマのクロロプラストのmatK遺伝子配列と一致した。すなわち、当該PCRプライマーを用いたPCRは、複数の市販食品において、ゴマ非含有食品試料からゴマ由来DNAやその他のDNAを検出しないが、ゴマ含有食品試料からゴマ由来DNAを特異的に検出できることを確認した。
【0131】
また、メロン検出用PCRプライマー(配列番号3及び4からなるPCRプライマーセット)を使用した場合、メロン含有食品である、夕張メロンキャラメル(札幌グルメフーズ)及び夕張メロンピュアゼリー(ホリ)由来DNAにおいてのみ、179bp前後の増幅産物が確認され[表3、図2(B)]、この増幅産物のTm値は、約79.2℃であった。他の食品試料由来DNAを使用した場合には、増幅産物は見られなかった[表3、図2(B)]。なお、PCR増幅産物の塩基配列解析の結果、出前一丁ごまとんこつ(日清食品)及び金のごまだれ(ミツカン)由来DNAから増幅されたPCR増幅産物の塩基配列は、メロンのクロロプラストのmatK遺伝子配列と一致した。すなわち、当該PCRプライマーを用いたPCRは、複数の市販食品において、メロン非含有食品試料からメロン由来DNAやその他のDNAを検出しないが、メロン含有食品試料からメロン由来DNAを特異的に検出できることを確認した。
【0132】
また、まぐろ検出用PCRプライマー(配列番号5及び6からなるPCRプライマーセット)を使用した場合、まぐろ含有食品である、Cezar吟撰ビーフまぐろ入り(マスターフーズ)及びまぐろ薄削り(株式会社 林久右衛門商店)由来DNAにおいてのみ、130bp前後の増幅産物が確認され[表3、図2(C)]、この増幅産物のTm値は、約80.6℃であった。他の食品試料由来DNAを使用した場合には、増幅産物は見られなかった[表3、図2(C)]。なお、PCR増幅産物の塩基配列解析の結果、Cezar吟撰ビーフまぐろ入り(マスターフーズ)及びまぐろ薄削り(株式会社 林久右衛門商店)由来DNAから増幅されたPCR増幅産物の塩基配列は、マグロ属(キハダマグロ等)のミトコンドリア由来チトクロームb遺伝子配列と一致した。すなわち、当該PCRプライマーを用いたPCRは、複数の市販食品において、まぐろ非含有食品試料からまぐろ由来DNAやその他のDNAを検出しないが、まぐろ含有食品試料からまぐろ由来DNAを特異的に検出できることを確認した。
【0133】
また、ブリ検出用PCRプライマー(配列番号7及び8からなるPCRプライマーセット)を使用した場合は、ぶり含有食品の代替試料[50pgブリDNAを添加したまぐろ薄削り(株式会社 林久右衛門商店)]由来DNAにおいてのみ、105 bp前後の増幅産物が確認され[表3、図2(D)]、この増幅産物のTm値は、約84.3℃であった。他の食品試料由来DNAを使用した場合には、増幅産物は見られなかった[表2、図2(D)]。なお、PCR増幅産物の塩基配列解析の結果、ぶり含有食品の代替試料由来DNAから増幅されたPCR増幅産物の塩基配列は、当然のことながら、ブリのミトコンドリア由来チトクロームb遺伝子配列と一致した。すなわち、当該PCRプライマーを用いたPCRは、複数の市販食品において、ブリ非含有食品試料からブリ由来DNAやその他のDNAを検出しないが、ブリ非含有食品中に添加された微量のブリ由来DNAを特異的に検出できることを確認した。
【0134】
また、あじ検出用PCRプライマー(配列番号9、10及び11からなるPCRプライマーセット)を使用した場合、あじ含有食品である、鯵揚(長崎・井上蒲鉾工房)及びトップバリュ焼きあじ(イオン)由来DNAにおいてのみ、77bp前後の増幅産物が確認され[表3、図2(E)]、この増幅産物のTm値は、約79.0℃であった。他の食品試料由来DNAを使用した場合には、増幅産物は見られなかった[表3、図2(E)]。なお、PCR増幅産物の塩基配列解析の結果、鯵揚(長崎・井上蒲鉾工房)及びトップバリュ焼きあじ(イオン)由来DNAから増幅されたPCR増幅産物の塩基配列は、いずれもマアジ属に属するあじ(マアジ等)のミトコンドリア由来チトクロームb遺伝子配列と最も高い類似性を示した。すなわち、当該PCRプライマーを用いたPCRは、複数の市販食品において、あじ非含有食品試料からあじ由来DNAやその他のDNAを検出しないが、あじ含有食品試料からあじ由来DNAを特異的に検出できることを確認した。
【0135】
また、たら検出用PCRプライマー(配列番号12及び13からなるPCRプライマーセット)を使用した場合、たら含有食品である、鯵揚(長崎・井上蒲鉾工房)、チーズかまぼこ(株式会社 やおきん)及びマヨたら(株式会社 一栄食品)由来DNAにおいてのみ、144bp前後の増幅産物が確認され[表3、図2(F)]、これらの増幅産物のTm値は、約82.9℃であった。他の食品試料由来DNAを使用した場合には、増幅産物は見られなかった[表3、図2(F)]。なお、PCR増幅産物の塩基配列解析の結果、鯵揚(長崎・井上蒲鉾工房)、チーズかまぼこ(株式会社 やおきん)及びマヨたら(株式会社 一栄食品)由来DNAから増幅されたPCR増幅産物の塩基配列は、いずれもマダラ属、スケトウダラ属に分類されるタラ類のミトコンドリア由来16SrRNA遺伝子配列と一致した。すなわち、当該PCRプライマーを用いたPCRは、複数の市販食品において、たら非含有食品試料からたら由来DNAやその他のDNAを検出しないが、たら含有食品試料からたら由来DNAを特異的に検出できることを確認した。
【0136】
また、たこ検出用PCRプライマー(配列番号14及び15からなるPCRプライマーセット)を使用した場合、たこ含有食品である、冷凍日清のたこ焼き(日清食品冷凍)及びちょうどおてごろたこせんべい(株式会社 かわさ)由来DNAにおいてのみ、204bp前後の増幅産物が確認され[表3、図2(G)]、これらの増幅産物のTm値は、約77.1℃であった。他の食品試料由来DNAを使用した場合には、増幅産物は見られなかった[表3、図2(G)]。なお、PCR増幅産物の塩基配列解析の結果、冷凍日清のたこ焼き(日清食品冷凍)及びちょうどおてごろたこせんべい(株式会社 かわさ)由来DNAから増幅されたPCR増幅産物の塩基配列は、いずれもマダコ属の分類されるタコ(マダコ等)のミトコンドリア由来16SrRNA遺伝子配列と一致した。すなわち、当該PCRプライマーを用いたPCRは、複数の市販食品において、たこ非含有食品試料からたこ由来DNAやその他のDNAを検出しないが、たこ含有食品試料からたこ由来DNAを特異的に検出できることを確認した。
【0137】
さらに、ほたてがい検出用PCRプライマー(配列番号16、17、18及び19からなるPCRプライマーセット)を使用した場合、ほたてがい含有食品である、ちょうどおてごろたこせんべい(株式会社 かわさ)、帆立だし(味の素)、ピアット帆立雑炊(エスビー食品)由来DNAにおいてのみ、180bp前後の増幅産物が確認され[表3、図2(H)]、これらの増幅産物のTm値は、約83.6℃であった。他の食品試料由来DNAを使用した場合には、増幅産物は見られなかった[表3、図2(H)]。なお、PCR増幅産物の塩基配列解析の結果、ちょうどおてごろたこせんべい(株式会社 かわさ)、帆立だし(味の素)、ピアット帆立雑炊(エスビー食品)由来DNAから増幅されたPCR増幅産物の塩基配列は、いずれもホタテガイのミトコンドリア由来16SrRNA遺伝子配列と一致した。すなわち、当該PCRプライマーを用いたPCRは、複数の市販食品において、ほたてがい非含有食品試料からほたてがい由来DNAやその他のDNAを検出しないが、ほたてがい含有食品試料からほたてがい由来DNAを特異的に検出できることを確認した。
【0138】
【表3】

【特許請求の範囲】
【請求項1】
下記の(1)〜(16)のいずれかのプライマーセット。
(1) 配列表の配列番号1における塩基番号13〜27の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号2における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるPCRプライマーセット。
(2) 配列表の配列番号3における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号4における塩基番号11〜25の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット。
(3) 配列表の配列番号5における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号6における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット。
(4) 配列表の配列番号7における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号8における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット。
(5) 配列表の配列番号9における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号10における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号11における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(6) 配列表の配列番号12における塩基番号6〜20の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号13における塩基番号4〜18の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー。
とからなるプライマーセット
(7) 配列表の配列番号14における塩基番号11〜25の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号15における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(8) 配列表の配列番号16における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号17における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号18における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号19における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(9) 配列表の配列番号1の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号2の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(10) 配列表の配列番号3の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号4の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(11) 配列表の配列番号5の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号6の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(12) 配列表の配列番号7の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号8の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(13) 配列表の配列番号9の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号10の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号11の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(14) 配列表の配列番号12の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号13の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(15) 配列表の配列番号14の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号15の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(16) 配列表の配列番号16の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号17の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号18の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号19の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
【請求項2】
請求項1の(1)に記載のプライマーセット。
【請求項3】
請求項1の(2)に記載のプライマーセット。
【請求項4】
請求項1の(3)に記載のプライマーセット。
【請求項5】
請求項1の(4)に記載のプライマーセット。
【請求項6】
請求項1の(5)に記載のプライマーセット。
【請求項7】
請求項1の(6)に記載のプライマーセット。
【請求項8】
請求項1の(7)に記載のプライマーセット。
【請求項9】
請求項1の(8)に記載のプライマーセット。
【請求項10】
請求項1の(9)に記載のプライマーセット。
【請求項11】
請求項1の(10)に記載のプライマーセット。
【請求項12】
請求項1の(11)に記載のプライマーセット。
【請求項13】
請求項1の(12)に記載のプライマーセット。
【請求項14】
請求項1の(13)に記載のプライマーセット。
【請求項15】
請求項1の(14)に記載のプライマーセット。
【請求項16】
請求項1の(15)に記載のプライマーセット。
【請求項17】
請求項1の(16)に記載のプライマーセット。
【請求項18】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項2〜15のいずれかに記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中に特定動物、特定植物が存在しているか否かを検出する工程とを含む特定動物、特定植物の検出方法。
【請求項19】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項2又は10記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にゴマが存在しているか否かを検出する工程とを含む特定植物の検出方法。
【請求項20】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項3又は11記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にメロンが存在しているか否かを検出する工程とを含む特定植物の検出方法。
【請求項21】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項4又は12記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にまぐろが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【請求項22】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項5又は13記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にブリが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【請求項23】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項6又は14記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にあじが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【請求項24】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項7又は15記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にたらが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【請求項25】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項8又は16記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にたこが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【請求項26】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項9又は17記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にほたてがいが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【請求項1】
下記の(1)〜(16)のいずれかのプライマーセット。
(1) 配列表の配列番号1における塩基番号13〜27の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号2における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるPCRプライマーセット。
(2) 配列表の配列番号3における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号4における塩基番号11〜25の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット。
(3) 配列表の配列番号5における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号6における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット。
(4) 配列表の配列番号7における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号8における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット。
(5) 配列表の配列番号9における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号10における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号11における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(6) 配列表の配列番号12における塩基番号6〜20の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号13における塩基番号4〜18の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー。
とからなるプライマーセット
(7) 配列表の配列番号14における塩基番号11〜25の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号15における塩基番号8〜22の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(8) 配列表の配列番号16における塩基番号7〜21の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号17における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号18における塩基番号10〜24の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号19における塩基番号9〜23の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(9) 配列表の配列番号1の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号2の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(10) 配列表の配列番号3の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号4の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(11) 配列表の配列番号5の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号6の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(12) 配列表の配列番号7の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号8の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(13) 配列表の配列番号9の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号10の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号11の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(14) 配列表の配列番号12の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号13の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(15) 配列表の配列番号14の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号15の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
(16) 配列表の配列番号16の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号17の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号18の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマーと、
配列表の配列番号19の塩基配列を3´末端側に含む最大30塩基のDNAからなるPCRプライマー
とからなるプライマーセット
【請求項2】
請求項1の(1)に記載のプライマーセット。
【請求項3】
請求項1の(2)に記載のプライマーセット。
【請求項4】
請求項1の(3)に記載のプライマーセット。
【請求項5】
請求項1の(4)に記載のプライマーセット。
【請求項6】
請求項1の(5)に記載のプライマーセット。
【請求項7】
請求項1の(6)に記載のプライマーセット。
【請求項8】
請求項1の(7)に記載のプライマーセット。
【請求項9】
請求項1の(8)に記載のプライマーセット。
【請求項10】
請求項1の(9)に記載のプライマーセット。
【請求項11】
請求項1の(10)に記載のプライマーセット。
【請求項12】
請求項1の(11)に記載のプライマーセット。
【請求項13】
請求項1の(12)に記載のプライマーセット。
【請求項14】
請求項1の(13)に記載のプライマーセット。
【請求項15】
請求項1の(14)に記載のプライマーセット。
【請求項16】
請求項1の(15)に記載のプライマーセット。
【請求項17】
請求項1の(16)に記載のプライマーセット。
【請求項18】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項2〜15のいずれかに記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中に特定動物、特定植物が存在しているか否かを検出する工程とを含む特定動物、特定植物の検出方法。
【請求項19】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項2又は10記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にゴマが存在しているか否かを検出する工程とを含む特定植物の検出方法。
【請求項20】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項3又は11記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にメロンが存在しているか否かを検出する工程とを含む特定植物の検出方法。
【請求項21】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項4又は12記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にまぐろが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【請求項22】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項5又は13記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にブリが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【請求項23】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項6又は14記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にあじが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【請求項24】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項7又は15記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にたらが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【請求項25】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項8又は16記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にたこが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【請求項26】
試料からDNAを抽出する工程と、このDNAを鋳型として、請求項9又は17記載のプライマーセットを用いてPCRを行う工程と、増幅されたDNAを検出することにより試料中にほたてがいが存在しているか否かを検出する工程とを含む特定動物の検出方法。
【図1】


【図2】




【図2】


【公開番号】特開2011−254730(P2011−254730A)
【公開日】平成23年12月22日(2011.12.22)
【国際特許分類】
【出願番号】特願2010−130420(P2010−130420)
【出願日】平成22年6月7日(2010.6.7)
【出願人】(000226976)日清食品ホールディングス株式会社 (127)
【Fターム(参考)】
【公開日】平成23年12月22日(2011.12.22)
【国際特許分類】
【出願日】平成22年6月7日(2010.6.7)
【出願人】(000226976)日清食品ホールディングス株式会社 (127)
【Fターム(参考)】
[ Back to top ]

