プリン誘導体およびそれらの薬学的使用
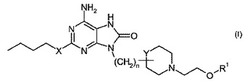
式(I)の化合物またはその薬学上許容される塩:

(式中、R1は水素またはC1−3アルキルを表し、nは1〜5の値を有する整数であり、
XはOまたはNHを表し、YはCまたはNを表す)は、ヒトインターフェロンの誘導物質であることが示され、ヒトインターフェロンの既知の誘導物質に関して改善されたプロファイル(例えば促進された力価)を保持する可能性がある。それゆえ、本発明の化合物は、様々な障害の治療、特に感染症、癌、アレルギー性疾患および他の炎症状態の治療、ならびにワクチンアジュバントとしてのそれらの使用に有用であり得る。

(式中、R1は水素またはC1−3アルキルを表し、nは1〜5の値を有する整数であり、
XはOまたはNHを表し、YはCまたはNを表す)は、ヒトインターフェロンの誘導物質であることが示され、ヒトインターフェロンの既知の誘導物質に関して改善されたプロファイル(例えば促進された力価)を保持する可能性がある。それゆえ、本発明の化合物は、様々な障害の治療、特に感染症、癌、アレルギー性疾患および他の炎症状態の治療、ならびにワクチンアジュバントとしてのそれらの使用に有用であり得る。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、化合物、それらの調製のためのプロセス、それらを含む組成物に関し、様々な障害、特にアレルギー性疾患および他の炎症状態(例えばアレルギー性鼻炎および喘息)、感染症、癌の治療におけるそれらの使用、ならびにワクチンアジュバントとしてのそれらの使用に関する。
【背景技術】
【0002】
脊椎動物は、微生物の侵入によって絶えず脅かされ、伝染性病原体を除去するために免疫防御の機構を発展させてきた。哺乳類において、この免疫系は2つの支流(先天性免疫および後天性免疫)を含む。宿主側防御の最前線は先天性免疫系であり、マクロファージおよび樹状細胞によって媒介される。後天性免疫は、感染の後期段階での病原体の排除に関与しており、免疫記憶の生成も可能にする。後天性免疫は、遺伝子再構成が行われた抗原特異的受容体を持つリンパ球の莫大なレパートリーに起因して、非常に特異的である。
【0003】
先天性免疫応答はもともと非特異的であると考えられていたが、自己と様々な病原体を区別することが現在知られている。先天性免疫系は、複数の重要な特徴を有する、生殖細胞系列にコードされた限られた数のパターン認識受容体(PRR)を介して微生物を認識する。
【0004】
トール様受容体(TLR)はヒトにおいて記載される10のパターン認識受容体のファミリーである。TLRは先天性免疫細胞によって優先的に発現され、そこでのそれらの役割は、感染の兆候について環境を監視し、活性化に際しては侵入病原体の排除を目的とした防御機構を動員することである。TLRが引き起こした早期の先天性免疫応答は感染の伝播を限定し、その一方でそれらが誘導する炎症誘導性のサイトカインおよびケモカインは、抗原提示細胞、B細胞およびT細胞の動員および活性化をもたらす。TLRは適応的免疫応答の性質を修飾して、樹状細胞活性化およびサイトカイン放出を介する適切な保護を提供することができる(Akira S.,et al,Nat.Immunol.,2001:2,675−680)。異なるTLRアゴニストから見られる応答のプロファイルは、活性化された細胞タイプに依存する。
【0005】
TLR7は、非自己核酸の検出に特殊化された細胞のエンドソームコンパートメント中に局在するTLRのサブグループ(TLR3、7、8および9)のメンバーである。TLR7は1本鎖RNAの認識を介して抗ウイルス防御において重要な役割を果たす(Diebold S.S.,et al,Science,2004:303,1529−1531;Lund J.M.,et al,PNAS,2004:101,5598−5603)。TLR7はヒトにおいて限定された発現プロファイルを有しており、B細胞および形質細胞様樹状細胞(pDC)によって優先的に発現され、単球によってより低い程度で発現される。形質細胞様DCは、リンパ系由来の樹状細胞のユニークな集団であり(末梢血単核細胞(PBMC)のうちの0.2〜0.8%)、これはウイルス感染に応答して高レベルインターフェロンα(IFNα)およびインターフェロンβ(IFNβ)を分泌する主要なI型インターフェロン産生細胞である(Liu Y−J,Annu.Rev.Immunol.,2005:23,275−306)。
【0006】
アレルギー性疾患は、Th2に偏ったアレルゲンに対する免疫応答と関連する。Th2応答はIgEレベルの上昇と関連し、それは肥満細胞に対する効果を介して、アレルゲンに対する過敏性を促進して、例えばアレルギー性鼻炎において見られる症状をもたらす。健康な個人において、アレルゲンに対する免疫応答は、Th2/Th1および調節性T細胞の混合された応答により、よりうまく平衡が保たれる。TLR7リガンドは、インビトロでTh2サイトカインを減少させTh1サイトカイン放出を促進すること、およびインビボでアレルギーの肺モデルにおいてTh2タイプ炎症性応答を寛解することが示さている(Fili L.,et al,J.All.Clin.Immunol.,2006:118,511−517;Moisan J.,et al,Am.J.Physiol.Lung Cell Mol.Physiol.,2006:290,L987−995;Tao et al,Chin.Med.J.,2006:119,640−648)。したがって、TLR7リガンドにはアレルギー患者において見られる免疫応答の平衡を再び保ち、疾患緩和をもたらす可能性がある。
【0007】
哺乳類において効果的な先天性免疫応答の生成の中心となるのは、細胞に作用して複数の効果を誘導するインターフェロンおよび他のサイトカインの誘導を引き起こす機構である。これらの効果は、抗感染性遺伝子発現の活性化、強い抗原特異的免疫を推進するための細胞の抗原提示の活性化、および食細胞におけるファゴサイトーシスの促進を含むことができる。
【0008】
インターフェロンは、ウイルス感染から細胞を保護できる物質として最初に記載された(Isaacs & Lindemann,J.Virus Interference.Proc.R.Soc.Lon.Ser.B.Biol.Sci.1957:147,258−267)。ヒトにおいて、I型インターフェロンは、第9染色体上の遺伝子によってコードされ、少なくとも13個のアイソフォームのインターフェロンα(IFNα)、および1個のアイソフォームのインターフェロンβ(IFNβ)をコードする関連タンパク質のファミリーである。組換えIFNαは最初に承認された生物学的治療剤であり、ウイルス感染および癌における重要な治療法となった。細胞に対する直接的抗ウイルス活性に加えて、インターフェロンは免疫系の細胞に対して作用する強力な免疫応答修飾物質であることが知られている。
【0009】
C型肝炎ウイルス(HCV)疾患のための第一選択療法として、インターフェロンの組み合わせは、ウイルス負荷の軽減に、およびある被験体におけるウイルス複製の消去に、非常に効果的であり得る。しかしながら、多くの患者で持続的なウイルス応答を示すことは不成功であり、これらの患者においてウイルス負荷は制御されない。加えて、インターフェロンの注射による治療法は、コンプライアンスに影響を与えることが示される複数の望まれない有害作用と関連する可能性がある(Dudley T.,et al,Gut.,2006:55(9),1362−3)。
【0010】
I型インターフェロンおよび他のサイトカインの活性化を含む先天性免疫応答を刺激することができる低分子化合物の投与は、ウイルス感染を含むヒト疾患の治療または予防のための重要な戦略になり得る。このタイプの免疫修飾戦略には、感染症だけでなく、癌(Krieg.,Curr.Oncol.Rep.,2004:6(2),88−95)、アレルギー性疾患(Moisan J.,et al,Am.J.Physiol.Lung Cell Mol.Physiol.,2006:290,L987−995)、過敏性大腸疾患等の他の炎症状態(Rakoff−Nahoum S.,Cell.,2004,23,118(2):229−41)において、およびワクチンアジュバント(Persing et al.,Trends Microbiol.,2002:10(10 Suppl),S32−7)としても有用かもしれない化合物を同定する可能性がある。
【0011】
動物モデルにおいて、イミキモドの局所的なアジュバント活性(Adams S.,et al,J.Immunol.,2008,181:776−84;Johnston D.,et al,Vaccine,2006,24:1958−65)、または全身的なアジュバント活性(Fransen F.et al,Infect.Immun.,2007,75:5939−46)が実証された。レジキモドおよび他の関連するTLR7/8アゴニストもアジュバント活性を提示することが示された(Ma R.et al,Biochem.Biophys.Res.Commun.,2007,361:537−42;Wille−Reece U.,et al,Proc.Natl.Acad.Sci.USA,2005,102:15190−4;Wille−Reece U.,et al,米国特許出願公開第2006045885号(A1)明細書)。
【0012】
I型インターフェロンの誘導をもたらす機構は部分的にしか理解されていない。多くの細胞タイプにおいてインターフェロンの誘導をもたらすことができる1つの機構は、RNAヘリカーゼRIG−IおよびMDA5による二本鎖ウイルスRNAの認識である。この機構は、センダイウイルスの細胞感染によってインターフェロンが誘導される一次機構であると考えられる。
【0013】
インターフェロンの誘導のためのさらなる機構はTLR依存性シグナル伝達事象を介するものある。ヒトにおいて、形質細胞様樹状細胞(pDC)は専門のインターフェロン産生細胞であり、例えばウイルス感染に応答して多量のインターフェロンを生じることができる。これらのpDCはTLR7およびTLR9を優先的に発現し、ウイルスのRNAまたはDNAによるこれらの受容体の刺激はそれぞれインターフェロンαの発現を誘導できることが示される。
【0014】
動物およびヒトにおいて、これらの細胞タイプからのインターフェロンαを誘導することができる、TLR7およびTLR9のオリゴヌクレオチドアゴニスト、ならびにTLR7の低分子のプリンベースのアゴニストが記載されている(Takeda K.et al,Annu.Rev.Immunol.,2003:21,335−76)。TLR7アゴニストは、イミキモドおよびレジキモド等のイミダゾキノリン化合物、オキソアデニンアナログ、ならびにさらにインターフェロンαを誘導することが長年知られているロキソリビンおよび7−チア−8−オキソグアノシン等のヌクレオシドアナログを含む。国際公開第2008/114008号(AstraZeneca AB/Dainippon Sumitomo Pharma Co.Ltd.)は、TLR7修飾物質として9−置換−8−オキソアデニン化合物を開示する。米国仮出願第61/232132号は実施例1の合成における中間体として6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンを開示する。
【0015】
公知の誘導物質の分子標的が同定されていないので、低分子プリン様化合物がI型インターフェロンおよび他のサイトカインをどのように誘導できるのかは不明瞭なままである。しかしながら、化合物による初代ヒトドナー細胞の刺激に基づいてヒトインターフェロンIFNαの低分子誘導物質を(機構に関係なく)特徴づけるアッセイ戦略が開発されており、本明細書において開示される。
【先行技術文献】
【特許文献】
【0016】
【特許文献1】米国特許出願公開第2006045885号(A1)明細書
【特許文献2】国際公開第2008/114008号
【特許文献3】米国仮出願第61/232132号
【非特許文献】
【0017】
【非特許文献1】Akira S.,et al,Nat.Immunol.,2001:2,675−680
【非特許文献2】Diebold S.S.,et al,Science,2004:303,1529−1531
【非特許文献3】Lund J.M.,et al,PNAS,2004:101,5598−5603
【非特許文献4】Liu Y−J,Annu.Rev.Immunol.,2005:23,275−306
【非特許文献5】Fili L.,et al,J.All.Clin.Immunol.,2006:118,511−517
【非特許文献6】Moisan J.,et al,Am.J.Physiol.Lung Cell Mol.Physiol.,2006:290,L987−995
【非特許文献7】Tao et al,Chin.Med.J.,2006:119,640−648
【非特許文献8】Isaacs & Lindemann,J.Virus Interference.Proc.R.Soc.Lon.Ser.B.Biol.Sci.1957:147,258−267
【非特許文献9】Dudley T.,et al,Gut.,2006:55(9),1362−3
【非特許文献10】Krieg.,Curr.Oncol.Rep.,2004:6(2),88−95
【非特許文献11】Moisan J.,et al,Am.J.Physiol.Lung Cell Mol.Physiol.,2006:290,L987−995
【非特許文献12】Rakoff−Nahoum S.,Cell.,2004,23,118(2):229−41
【非特許文献13】Persing et al.,Trends Microbiol.,2002:10(10 Suppl),S32−7
【非特許文献14】Adams S.,et al,J.Immunol.,2008,181:776−84
【非特許文献15】Johnston D.,et al,Vaccine,2006,24:1958−65
【非特許文献16】Fransen F.et al,Infect.Immun.,2007,75:5939−46
【非特許文献17】Ma R.et al,Biochem.Biophys.Res.Commun.,2007,361:537−42
【非特許文献18】Wille−Reece U.,et al,Proc.Natl.Acad.Sci.USA,2005,102:15190−4
【非特許文献19】Takeda K.et al,Annu.Rev.Immunol.,2003:21,335−76
【発明の概要】
【課題を解決するための手段】
【0018】
発明の簡単な説明
本発明の特定の化合物は、ヒトインターフェロンの誘導物質であることが示され、ヒトインターフェロンの既知の誘導物質に関して改善されたプロファイル(例えば促進された力価)を保持する可能性があり、およびTNFαに関してIFNαの選択性の促進を示し得る。例えば、本発明の特定の化合物はTNFα誘導に関するIFNα誘導について1000倍を超える選択性を示す。ヒトインターフェロンを誘導する化合物は、様々な障害の治療、例えばアレルギー性疾患および他の炎症状態(例えばアレルギー性鼻炎および喘息)の治療、感染症および癌の治療において有用であり得、ワクチンアジュバントとしても有用であり得る。
【0019】
本発明の特定の化合物は、強力な免疫修飾物質であるので、それらの取り扱いにおいて注意しなくてはならない。
【0020】
発明の要旨
第1の態様において、活性治療剤としての式(I)の化合物またはその薬学上許容される塩:
【化1】

【0021】
(式中、R1は水素またはC1−3アルキルを表し、
nは1〜5の値を有する整数であり、
XはOまたはNHを表し、
YはCまたはNを表す)
の使用が提供される。
【0022】
別の実施形態において、感染症、癌、アレルギー性疾患および他の炎症状態の治療のために式(I)の化合物またはその薬学上許容される塩の使用が提供される。
【0023】
別の実施形態において、ワクチンアジュバントとしての使用のために式(I)の化合物またはその薬学上許容される塩が提供される。
【0024】
別の実施形態において、感染症、癌、アレルギー性疾患および他の炎症状態の治療のための薬剤の製造において、式(I)の化合物またはその薬学上許容される塩の使用が提供される。
【0025】
別の実施形態において、感染症、癌、アレルギー性疾患および他の炎症状態の治療のための方法であって、有効量の式(I)の化合物またはその薬学上許容される塩を投与することを含んでなる方法が提供される。
【0026】
別の実施形態において、式(I)の化合物またはその薬学上許容される塩、および任意で1つまたは複数の薬学上許容される希釈剤または担体を含んでなる医薬組成物が提供される。
【0027】
別の実施形態において、式(I)の化合物またはその塩であるが、6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンではない化合物が提供される。
【0028】
さらなる実施形態において、R1がC1−3アルキルである式(I)の化合物またはその塩(または式(I)の化合物もしくはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物)が提供される。
【0029】
さらなる実施形態において、R1が水素である式(I)の化合物もしくはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物が提供される。
【0030】
さらなる実施形態において、R1が水素である式(I)の化合物またはその塩であるが、6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンではない化合物が提供される。
【0031】
さらなる実施形態において、nが1〜4である式(I)の化合物もしくはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物が提供される。
【0032】
さらなる実施形態において、nが1〜4である式(I)の化合物またはその塩であるが、6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンではない化合物が提供される。
【0033】
さらなる実施形態において、XがOを表す式(I)の化合物またはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物が提供される。
【0034】
さらなる実施形態において、XがOを表す式(I)の化合物またはその塩であるが、6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンではない化合物が提供される。
【0035】
さらなる実施形態において、XがNHを表す式(I)の化合物またはその塩(または式(I)の化合物もしくはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物)が提供される。
【0036】
さらなる実施形態において、YがCを表す式(I)の化合物またはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物が提供される。
【0037】
さらなる実施形態において、YがCを表す式(I)の化合物またはその塩であるが、6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンではない化合物が提供される。
【0038】
さらなる実施形態において、YがNを表す式(I)の化合物またはその塩(または式(I)の化合物もしくはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物)が提供される。
【0039】
さらなる実施形態において、YがNを表し、(CH2)nが、Yである窒素原子を介して6員環に結合される、式(I)の化合物またはその塩(または式(I)の化合物もしくはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物)が提供される。
【0040】
さらなる実施形態において、YがCを表し、(CH2)nが炭素原子を介して6員環に結合される、式(I)の化合物またはその塩であるが、6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンではない化合物が提供される。
【0041】
さらなる実施形態において、Yが炭素原子であり、(CH2)nが炭素原子を介して6員環に結合され、6員環の窒素が(CH2)n基に対してオルトである、式(I)の化合物またはその塩(または式(I)の化合物もしくはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物)が提供される。
【0042】
さらなる実施形態において、Yが炭素原子であり、(CH2)nが炭素原子を介して6員環に結合され、6員環の窒素が(CH2)n基に対してメタである、式(I)の化合物またはその塩(または式(I)の化合物もしくはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物)が提供される。
【0043】
さらなる実施形態において、Yが炭素原子であり、(CH2)nは炭素原子を介して6員環に結合され、6員環の窒素が(CH2)n基に対してパラである、式(I)の化合物またはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物が提供される。
【0044】
さらなる実施形態において、Yが炭素原子であり、(CH2)nが炭素原子を介して6員環に結合され、6員環の窒素が(CH2)n基に対してパラである、式(I)の化合物またはその塩であるが、6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンではない化合物が提供される。さらなる実施形態において、以下のものからなる記載から選択された化合物またはその塩が提供される:
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−2−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{[1−(2−ヒドロキシエチル)−3−ピペリジニル]メチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{2−[1−(2−ヒドロキシエチル)−3−ピペリジニル]エチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−3−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[1−(2−ヒドロキシエチル)−3−ピペリジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{2−[1−(2−ヒドロキシエチル)−4−ピペリジニル]エチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−4−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[1−(2−ヒドロキシエチル)−4−ピペリジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{5−[1−(2−ヒドロキシエチル)−4−ピペリジニル]ペンチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルアミノ)−9−{3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルアミノ)−9−{4−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{5−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ペンチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−(5−{4−[2−(メチルオキシ)エチル]−1−ピペラジニル}ペンチル)−7,9−ジヒドロ−8H−プリン−8−オン、および
6−アミノ−2−(ブチルオキシ)−9−(5−{4−[2−(エチルオキシ)エチル]−1−ピペラジニル}ペンチル)−7,9−ジヒドロ−8H−プリン−8−オン。
【0045】
さらなる実施形態において、以下のものからなる記載から選択された化合物またはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物が提供される:
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−2−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{[1−(2−ヒドロキシエチル)−3−ピペリジニル]メチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{2−[1−(2−ヒドロキシエチル)−3−ピペリジニル]エチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−3−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[1−(2−ヒドロキシエチル)−3−ピペリジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{[1−(2−ヒドロキシエチル)−4−ピペリジニル]メチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{2−[1−(2−ヒドロキシエチル)−4−ピペリジニル]エチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−4−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[1−(2−ヒドロキシエチル)−4−ピペリジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{5−[1−(2−ヒドロキシエチル)−4−ピペリジニル]ペンチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルアミノ)−9−{3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルアミノ)−9−{4−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{5−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ペンチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−(5−{4−[2−(メチルオキシ)エチル]−1−ピペラジニル}ペンチル)−7,9−ジヒドロ−8H−プリン−8−オン、および
6−アミノ−2−(ブチルオキシ)−9−(5−{4−[2−(エチルオキシ)エチル]−1−ピペラジニル}ペンチル)−7,9−ジヒドロ−8H−プリン−8−オン。
【0046】
本発明は、本明細書において記述された実施形態および置換基のすべての組合わせを含むことを理解すべきである。
【発明を実施するための形態】
【0047】
「アルキル」に対する参照は、好適には3個までの炭素原子を含む、直鎖および対応するアルキルの分岐鎖脂肪族異性体の両方に対する参照を含む。
【0048】
式(I)の化合物の塩は、薬学上許容される塩ならびに薬学的に許容可能されないかもしれないが式(I)の化合物およびその薬学上許容される塩の調製に有用であり得る塩を含む。塩は、特定の無機酸もしくは有機酸または特定の無機塩基もしくは有機塩基に由来し得る。
【0049】
本発明は、その範囲内に式(I)の化合物の塩のすべての化学量論的形態および非化学量論的形態を含む。
【0050】
本発明の化合物に対する本明細書における参照は、遊離塩基としての、または塩(例えば薬学上許容される塩)としての式(I)の化合物を意味することを理解すべきである。
【0051】
式(I)の化合物の塩は、薬学上許容される塩ならびに薬学的に許容可能されないかもしれないが式(I)の化合物およびその薬学上許容される塩の調製に有用であり得る塩を含む。塩は、特定の無機酸もしくは有機酸または特定の無機塩基もしくは有機塩基に由来し得る。
【0052】
本発明は、その範囲内に式(I)の化合物の塩のすべての化学量論的形態および非化学量論的形態を含む。
【0053】
塩の例は、薬学上許容される塩である。薬学上許容される塩は酸付加塩および塩基付加塩を含む。好適な塩に関する総説については「Berge et al.,J.Pharm.Sci.,66:1−19(1977)」を参照されたい。
【0054】
式(I)の化合物の薬学上許容される酸付加塩の例は、臭化水素酸塩、塩酸塩、マレイン酸塩、硫酸塩、p−トルエンスルホン酸塩、メタンスルホン酸塩、ナフタレンスルホン酸塩、フェニルスルホン酸塩を含む。
【0055】
塩は、当該技術分野における周知の技法を使用して、例えば溶液からの沈殿または結晶に続いて濾過によって、または溶媒の蒸発によって形成することができる。
【0056】
典型的には、薬学上許容される酸付加塩は、有機溶媒等の好適な溶媒中の好適な強酸(臭化水素酸、塩酸、マレイン酸、硫酸、p−トルエンスルホン酸、メタンスルホン酸またはナフタリンスルホン酸等)と、式(I)の化合物の反応によって任意で形成され、例えば結晶および濾過によって通常単離される塩を生ずることができる。
【0057】
多くの有機化合物は溶媒と複合体を形成し、溶媒中で有機化合物が反応するか、または溶媒から有機化合物が沈殿または結晶することが認識されるだろう。これらの複合体は「溶媒和物」として公知である。例えば、水との複合体は「水和物」として公知である。水、エタノール、イソプロピルアルコールおよびN−メチルピロリジノン等の、高沸点を持つ溶媒および/または水素結合を形成する高い傾向を持つ溶媒を使用して、溶媒和物を形成することができる。溶媒和物の同定のための方法はNMRおよび微量分析を含むが、これらに限定されない。式(I)の化合物の溶媒和物は本発明の範囲内である。本明細書において使用される時、溶媒和物という用語は、遊離塩基化合物に加えてその任意の塩の両者の溶媒和物を包含する。
【0058】
本発明の特定の化合物は、キラル原子および/または多重結合を含み、したがって1つまたは複数の立体異性形態で存在することができる。本発明は、個々の立体異性体として、またはそのラセミ体を含む混合物としても、光学異性体を含む本発明の化合物の立体異性体をすべて包含する。任意の立体異性体は、重量で10%未満、例えば重量で5%未満、または重量で0.5%未満の他の立体異性体含むことができる。例えば、任意の光学異性体は、重量で10%未満、例えば重量で5%未満、または重量で0.5%未満のその鏡像異性体を含むことができる。
【0059】
本発明の特定化合物は、互変異性形態で存在することができる。本発明は、本発明の化合物の互変異性体を、個々の互変異性体またはその混合物としても、すべて包含することが理解されるだろう。
【0060】
本発明の化合物は結晶形態または非晶形態であり得る。さらに、本発明の化合物の結晶形態のいくつかは、多形体として存在することができ、そのすべては本発明の範囲内に含まれる。本発明の化合物の最も熱力学的に安定した多形形態(複数可)は特に興味深い。
【0061】
本発明の化合物の多形形態は、X線粉末回折(XRPD)、赤外分光法(IR)、ラマン分光法、示差走査熱量測定法(DSC)、熱重量分析(TGA)および固体核磁気共鳴(ssNMR)を含むが、これらに限定されない複数の従来の分析技術を使用して、特徴づけおよび識別が行われる。
【0062】
本発明の範囲内に含まれるものは、式(I)の化合物の溶媒和物、水和物、異性体および多形形態ならびにその塩および溶媒和物であることが、前述したことから認識されるだろう。
【0063】
式(I)の化合物およびその薬学上許容される塩が、有益な効果を有する可能性のある疾患状態の例は、アレルギー性疾患および他の炎症状態(例えばアレルギー性鼻炎および喘息)、感染症ならびに癌を含む。式(I)の化合物およびその薬学上許容される塩は、ワクチンアジュバントとしても役に立つ可能性がある。
【0064】
免疫応答の修飾物質として、式(I)の化合物およびその薬学上許容される塩は、独立したものとして、またはアジュバントとして組合わせて、喘息、アレルギー性鼻炎および鼻炎結膜炎、食物アレルギー、過敏性肺疾患、レフレル症候群、遅延型過敏性障害、アテローム性動脈硬化症、膵臓炎、胃炎、大腸炎、骨関節炎、乾癬、サルコイド症、肺線維症、呼吸窮迫症候群、毛細気管支炎、慢性閉塞性肺疾患、副鼻腔炎、嚢胞性繊維症、紫外線角化症、皮膚異形成症、慢性蕁麻疹、湿疹、ならびにすべてのタイプの皮膚炎等の炎症性疾患またはアレルギー性疾患を含むが、これらに限定されない免疫介在性障害の治療および/または予防にも有用であり得る。
【0065】
式(I)の化合物およびその薬学上許容される塩は、気道のウイルス性増悪および扁桃腺炎を含むが、これらに限定されない呼吸器感染に対する反応の治療および/または予防にも有用であり得る。化合物は、関節リウマチ、乾癬性関節炎、全身性エリテマトーデス、シェーグレン病、強直性脊椎炎、硬皮症、皮膚筋炎、糖尿病を含むが、これらに限定されない自己免疫性疾患移植片対宿主病を含む移植片拒絶、クローン病および潰瘍性大腸炎を含むが、これらに限定されない炎症性腸疾患の治療および/または予防にも有用であり得る。
【0066】
式(I)の化合物およびその薬学上許容される塩は、肝炎ウイルス(例えばB型肝炎ウイルス、C型肝炎ウイルス)、ヒト免疫不全ウイルス、パピロマウイルス、ヘルペスウイルス、呼吸系ウイルス(例えばインフルエンザウイルス、呼吸器合胞体ウイルス、ライノウイルス、メタ肺炎ウイルス、パラインフルエンザウイルス、SARS)、および西ナイルウイルスによって引き起こされたものを含むが、これらに限定されない感染症の治療にも有用であり得る。式(I)の化合物およびその薬学上許容される塩は、例えば細菌、真菌または原虫類によって引き起こされる微生物感染の治療にも有用であり得る。これらは、結核、細菌性肺炎、アスペルギルス症、ヒストプラスマ症、カンジダ症、ニューモシスチス症、レプラ、クラミジア、クリプトコックス疾患、クリプトスポリジウム症、トキソプラズマ症、リーシュマニア、マラリアおよびトリパノソーマ症を含むが、これらに限定されない。
【0067】
式(I)の化合物およびその薬学上許容される塩は、様々な癌の治療、特に免疫療法に対して応答性である癌であり、腎細胞癌、肺癌、乳癌、結腸直腸癌、膀胱癌、黒色腫、白血病、リンパ腫および卵巣癌を含むが、これらに限定されない既知の癌の治療にも有用であり得る。
【0068】
治療または治療法に対する本明細書の参照は、既存の状態の治療に加えて、状態に依存して予防処置にも拡張できることが、当業者によって認識されるだろう。
【0069】
本明細書において言及されるように、式(I)の化合物およびその薬学上許容される塩は活性治療剤として有用であり得る。
【0070】
式(I)の化合物およびその薬学上許容される塩は、任意の都合のよい方法において投与のために製剤化することができる。
【0071】
式(I)の化合物およびその薬学上許容される塩は、例えば経口投与、局所投与、吸入投与、鼻腔内投与、頬腔投与、非経口投与(例えば静脈内投与、皮下投与、皮内投与または筋肉内投与)または直腸投与のために製剤化することができる。一態様において、式(I)の化合物およびその薬学上許容される塩は経口投与のために製剤化される。さらなる態様において、式(I)の化合物およびその薬学上許容される塩は、局所投与(例えば鼻腔内投与または吸入投与)のために製剤化される。
【0072】
経口投与のための錠剤およびカプセルは、結合剤(例えばシロップ、アラビアゴム、ゼラチン、ソルビトール、トラガント、デンプン漿剤、セルロースまたはポリビニルピロリドン);充填剤(例えばラクトース、微結晶性セルロース、糖、トウモロコシデンプン、リン酸カルシウムまたはソルビトール);潤滑剤(例えばステアリン酸マグネシウム、ステアリン酸、タルク、ポリエチレングリコールまたはシリカ);崩壊剤(例えばジャガイモデンプン、クロスカルメロースナトリウムまたはデンプングリコール酸ナトリウム);またはラウリル硫酸ナトリウム等の湿潤剤等の従来の賦形剤を含むことができる。錠剤は当該技術分野において周知の方法に従ってコートすることができる。
【0073】
経口液体調製は、例えば水性懸濁もしくは油性懸濁物、溶液、乳化物、シロップまたはエリキシルの形態であってもよいし、または使用前の構成のための乾燥製品として水もしくは他の好適な媒質と共に提供されてもよい。かかる液体調製物は、懸濁化剤(例えばソルビトールシロップ、メチルセルロース、グルコース/糖シロップ、ゼラチン、ヒドロキシメチルセルロース、カルボキシメチルセルロース、ステアリン酸アルミニウムゲルまたは水素添加食用脂);乳化剤(例えばレシチン、モノオレイン酸ソルビタンまたはアラビアゴム);非水性媒質(食用油を含み得る)(例えばアーモンドオイル、分留ヤシ油、油状エステル、プロピレングリコールまたはエチルアルコール);または防腐剤(例えばメチル、p−オキシ安息香酸プロピルまたはソルビン酸)等の従来の添加物を含むことができる。調製物は、緩衝塩、着香剤、着色剤および/または甘味剤)(例えばマンニトール)も必要に応じて含むことができる。
【0074】
鼻腔内投与のための組成物は、小滴によってまたは加圧されたポンプによって鼻に投与する水性組成物を含む。好適な組成物はこの目的のための希釈剤または担体として水を含む。肺または鼻に対する投与のための組成物は、1つまたは複数の賦形剤(例えば1つまたは複数の懸濁化剤、1つまたは複数の防腐剤、1つまたは複数の界面活性剤、1つまたは複数の等張性調整剤、1つまたは複数の共溶媒)を含み、組成物(例えば緩衝系)のpHを制御する成分を含むことができる。さらに、組成物は、抗酸化剤(例えばメタ重亜硫酸ナトリウム)および矯味剤等の他の賦形剤を含むことができる。組成物は噴霧化によって鼻または呼吸器管の他の領域にも投与することができる。
【0075】
鼻腔内組成物は、式(I)の化合物(複数可)またはその薬学上許容される塩(複数可)が鼻腔(標的組織)のすべての領域に送達されることを可能にし、さらに式(I)の化合物(複数可)またはその薬学上許容される塩(複数可)をより長い期間の間に標的組織に接触させておくことを可能にできる。鼻腔内組成物のための好適な投薬レジームは、鼻腔を清浄にした後に鼻を介して徐々に吸入する患者のためのものである。吸入の間に、組成物は1つの鼻孔に投与されるが、他の鼻孔は手で圧迫される。次いでこの手順を他の鼻孔について反復する。典型的には、1つの鼻孔あたり1または2スプレーを、上記の手順によって、毎日1、2または3回、理想的には毎日1回投与される。特に興味深いのは毎日1回の投与に好適な鼻腔内組成物である。
【0076】
懸濁化剤(複数可)は、含まれていれば、組成物の全重量に基づいて、0.1〜5%(w/w)(1.5%〜2.4%(w/w)等)の量で典型的には存在する。薬学上許容される懸濁化剤の例は、Avicel(登録商標)(微結晶性セルロースおよびカルボキシメチルセルロースナトリウム)、カルボキシメチルセルロースナトリウム、ビーガム、トラガント、ベントナイト、メチルセルロース、キサンタンガム、カーボポールおよびポリエチレングリコールを含むが、これらに限定されない。
【0077】
肺または鼻に対する投与のための組成物は1つまたは複数の賦形剤を含み、1つまたは複数の防腐剤の含有によって微生物または真菌の汚染および増殖から保護することができる。薬学上許容される抗微生物剤または防腐剤の例は、第四アンモニウム化合物(例えば塩化ベンザルコニウム、塩化ベンゼトニウム、セトリミド、塩化セチルピリジウム、塩化ラウラルコニウムおよびミリスチル塩化ピコリニウム)、水銀剤(例えば硝酸フェニル水銀、酢酸フェニル水銀およびチメロサール)、アルコール剤(例えばクロロブタノール、フェニルエチルアルコールおよびベンジルアルコール)、抗菌性エステル(例えばp−ヒドロキシ安息香酸のエステル)、エデト酸2ナトリウム(EDTA)等のキレート剤、ならびにクロルヘキシジン、クロロクレゾール、ソルビン酸およびその塩(ソルビン酸カリウム等)およびポリミキシン等の他の抗微生物剤を含むが、これらに限定されない。薬学上許容される抗真菌剤または防腐剤の例は、安息香酸ナトリウム、ソルビン酸、プロピオン酸ナトリウム、メチルパラベン、エチルパラベン、プロピルパラベンおよびブチルパラベンを含むが、これらに限定されない。防腐剤(複数可)は、含まれていれば、組成物の全重量に基づいて、0.001〜1%(w/w)(0.015%〜0.5%(w/w)等)の量で存在することができる。
【0078】
組成物(例えば少なくとも1つの化合物が懸濁されている場合)は、組成物の水相中で薬剤粒子の溶解を促進するように機能する1つまたは複数の界面活性剤を含むことができる。例えば、使用される界面活性剤の量は混合の間に発泡を引き起こさない量である。薬学上許容される界面活性剤の例は、ポリオキシエチレン(20)モノオレイン酸ソルビタン(ポリソルベート80)、マクロゴールエーテルおよびポロキサマー等の脂肪族アルコール、エステルおよびエーテルを含む。界面活性剤は、組成物の全重量に基づいて、約0.01〜10%(w/w)(0.01〜0.75%(w/w)等)の間で、例えば約0.5%(w/w)の量で存在することができる。
【0079】
体液(例えば鼻腔液)との等張性を達成して刺激レベルの低下をもたらす、1つまたは複数の等張性調整剤(複数可)が含まれ得る。薬学上許容される等張性調整剤の例は、塩化ナトリウム、デキストロース、キシリトール、塩化カルシウム、グルコース、グリセリンおよびソルビトールを含むが、これらに限定されない。等張性調整剤は、存在するならば、組成物の全重量に基づいて、0.1〜10%(w/w)(4.5〜5.5%(w/w)等)、例えば約5.0%(w/w)の量で含まれ得る。
【0080】
本発明の組成物は、クエン酸ナトリウム、クエン酸、トロメタモール、リン酸水素2ナトリウム(例えば十二水和物、七水和物、二水和物および無水形態)またはリン酸ナトリウム等のリン酸塩およびその混合物等の好適な緩衝剤の添加によって緩衝することができる。
【0081】
緩衝剤は、存在するならば、組成物の全重量に基づいて、0.1〜5%(w/w)、例えば1〜3%(w/w)の量で含まれ得る。
【0082】
矯味剤の例は、スクラロース、スクロース、サッカリンまたはその塩、フルクトース、デキストロース、グリセロール、コーンシロップ、アスパルテーム、アセスルファム・ケィ、キシリトール、ソルビトール、エリトリトール、グリチルリチン酸アンモニウム、タウマチン、ネオテーム、マンニトール、メントール、ユーカリ油、ショウノウ、天然着香剤、人工着香剤およびその組合わせを含む。
【0083】
1つまたは複数の共溶媒(複数可)は、医薬化合物(複数可)および/または他の賦形剤の可溶性を支援するために含まれ得る。薬学上許容される共溶媒の例は、プロピレングリコール、ジプロピレングリコール、エチレングリコール、グリセロール、エタノール、ポリエチレングリコール(例えばPEG300またはPEG400)およびメタノールを含むが、これらに限定されない。一実施形態において、共溶媒はプロピレングリコールである。
【0084】
共溶媒(複数可)は、存在するならば、組成物の全重量に基づいて、0.05〜30%(w/w)(1〜25%(w/w)等)、例えば1〜10%(w/w)の量で含まれ得る。
【0085】
吸入投与のための組成物は、加圧されたポンプまたは吸入器(例えばリザーバー乾燥粉末吸入器、単位用量乾燥粉末吸入器、前定量された多重用量の乾燥粉末吸入器、鼻吸入器または加圧されたエアロゾル吸入器)、噴霧器または通気器によって、呼吸器管へ投与される、水性混合物、有機混合物または水性/有機混合物、乾燥粉末または結晶性組成物を含む。好適な組成物はこの目的のための希釈剤または担体として水を含み、緩衝剤、等張性修飾剤および同種のもの等の従来の賦形剤と共に提供され得る。水性組成物は噴霧化によって鼻および呼吸器管の他の領域へも投与され得る。かかる組成物は、好適な液化された噴射剤の使用により、加圧されたパック(定量された用量の吸入器等)から送達された水性の溶液もしくは懸濁物またはエアロゾルであり得る。
【0086】
鼻(例えば鼻炎の治療のため)または肺への局所的な投与のための組成物は、加圧されたエアロゾル組成物、および加圧されたポンプによって鼻腔に送達される水性組成物を含む。加圧されていない鼻腔への局所的な投与のために好適な組成物は、特に興味深い。好適な組成物はこの目的のための希釈剤または担体として水を含む。肺または鼻への投与のための水性組成物は、緩衝剤等の従来の賦形剤、等張性修飾剤および同種のものと共に提供され得る。水性組成物は噴霧化によっても鼻へ投与することができる。
【0087】
液体分注器は、典型的には鼻腔への液体組成物の送達に使用することができる。液体組成物は水性または非水性であり得るが、典型的には水性であり得る。かかる液体分注器は、液体分注器のポンプ機構に対してユーザーが適用する力の適用に際して、定量された用量の液体組成物が分注される分注ノズルまたは分注オリフィスを有することができる。かかる液体分注器は、概して液体組成物の定量された多重用量(連続的ポンプ作動に際して分注できる用量)のリザーバーを備えて提供される。分注ノズルまたは分注オリフィスは、鼻腔の中への液体組成物のスプレー分注のために、ユーザーの鼻孔の中への挿入用として構成することができる。前記のタイプの液体分注器は国際公開第WO2005/044354号(Glaxo Group Limited)中に記載および図示される。分注器は、液体組成物を含有するための容器上に据え付けられた圧搾ポンプを有する液体発射装置を格納する筺体を有する。筺体は指で操作可能な少なくとも1つのサイドレバーを有し、サイドレバーは、カムによって筺体中で容器を上方へ移動させるように筺体に対して内に向かって移動可能でありポンプを圧縮させ、筺体の鼻腔ノズルを介してポンプステムから定量された用量の組成物をポンプで送り込む。一実施形態において、液体分注器はWO2005/044354の図30〜40中に図示される一般的なタイプである。
【0088】
式(I)の化合物またはその薬学上許容される塩を含む水性組成物は、国際公開第WO2007/138084号(Glaxo Group Limited)中で開示されたような、例えばその図22〜46に関して開示されるような、または英国特許出願第GB0723418.0号(Glaxo Group Limited)中で開示されたような、例えばその図7〜32に関して開示されるようなポンプによっても送達することができる。GB0723418.0の図1〜6中で開示されたような作動器はポンプを作動させることができる。
【0089】
吸入による肺への局所送達のための乾燥粉末組成物は、吸入器または通気器における使用のために、例えばゼラチンのカプセルおよびカートリッジ、または例えば薄くのばされたアルミホイルのブリスター中で例えば提供することができる。粉末ブレンド組成物は、概して式(I)の化合物またはその薬学上許容される塩、および単糖、二糖または多糖(例えばラクトースまたはデンプン)等の好適な粉末基剤(担体/希釈剤/賦形剤の物質)の吸入のための粉末混合物を含む。乾燥粉末組成物は、薬物および担体に加えて、さらなる賦形剤(例えば糖エステル(例えばセロビオースオクタアセタート)、ステアリン酸カルシウム、ステアリン酸マグネシウム等の三成分剤)も含むことができる。
【0090】
一実施形態において、吸入投与のための好適な組成物は、好適な吸入装置の内側に据え付けた薬剤パック(複数可)で提供される複数の密封用量容器の中へ組み込むことができる。容器はひとつずつ破裂、剥離、または他の方法で開口することができ、当該技術分野において公知であるように、乾燥粉末組成物の用量は吸入装置の口金に対する吸入によって投与される。薬剤パックは複数の異なる形態(例えばディスク形状または細長いストリップ)であり得る。代表的な吸入装置はGlaxoSmithKlineによって販売されるDISKHALER(商標)およびDISKUSTM装置である。
【0091】
乾燥粉末の吸入可能な組成物は吸入装置中でバルクリザーバーとしても提供され、そして装置はリザーバーから吸入チャンネルへの組成物の用量の定量のための定量機構を備えて提供され、定量された用量は装置の口金で患者が吸入することによって吸入され得る。このタイプの例示的な販売された装置は、TURBUHALER(商標)(AstraZeneca)、TWISTHALER(商標)(Schering)およびCLICKHALER(商標)(Innovata)である。
【0092】
乾燥粉末の吸入可能な組成物のためのさらなる送達方法は、典型的には患者によって吸入装置の中へ需要に応じて充填されるカプセル(1個のカプセルあたり1用量)において提供される、組成物の定量された用量のためのものである。装置はカプセルを破裂、貫通または他の方法で開口する手段を有し、その結果、用量が装置の口金で吸入されるときに、患者の肺の中へ流入することができる。かかる装置の販売例としては、ROTAHALER(商標)(GlaxoSmithKline)およびHANDIHALER(商標)(Boehringer Ingelheim)がある。
【0093】
吸入のために好適な加圧されたエアロゾル組成物は懸濁物または溶液のいずれかであり得、式(I)の化合物またはその薬学上許容される塩、およびフルオロカーボンもしくは水素含有クロロフルオロカーボンまたはその混合物、特にヒドロフルオロアルカン、さらに特に1,1,1,2−テトラフルオロエタン、1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンまたはその混合物等の好適な噴射剤を含み得る。エアロゾル組成物は、例えばWO94/21229およびWO98/34596(Minnesota Mining and Manufacturing)中で記載されているような、界面活性剤(例えばオレイン酸、レシチン、オリゴ乳酸またはその誘導体)等の当該技術分野において周知のさらなる組成物賦形剤および共溶媒(例えばエタノール)を任意で含むことができる。加圧された組成物は、概してキャニスター(例えばアルミニウムキャニスター)中に保持され、弁(例えば定量弁)により閉鎖され、口金を備えて提供される作動器の中へ取り付けられる。
【0094】
軟膏、クリームおよびゲルは、例えば好適な増粘剤および/またはゲル化剤および/または溶媒の添加により水性基剤または油性基剤を用いて製剤化することができる。したがってかかる基剤は、例えば水および/または油(液体パラフィン、または落花生油もしくはヒマシ油等の植物油等)または溶媒(ポリエチレングリコール等)を含み得る。基剤の性質に応じて使用できる増粘剤およびゲル化剤は、軟パラフィン、ステアリン酸アルミニウム、セトステアリルアルコール、ポリエチレングリコール、羊毛脂、ミツロウ、カルボキシポリメチレンおよびセルロース誘導体、および/またはモノステアリン酸グリセリンおよび/または非イオン性乳化剤を含む。
【0095】
ローションは水性基剤または油性基剤により製剤化され、1つまたは複数の乳化剤、安定化剤、分散剤、懸濁化剤または増粘剤も含む。
【0096】
外部適用のための粉末は、任意の好適な粉末基剤(例えばタルク、ラクトースまたはデンプン)の補助により形成することができる。小滴は、1つまたは複数の分散剤、可溶化剤、懸濁化剤または防腐剤も含む、水性基剤または非水性基剤により製剤化することができる。
【0097】
式(I)の化合物およびその薬学上許容される塩は、例えば、皮膚の中へ活性成分を送達する貼付剤または他の装置(例えば加圧気体装置)用の組成物による経皮送達のために製剤化することができる。
【0098】
頬腔投与のために、組成物は、従来の様式で製剤化された錠剤またはロゼンジの形態をとることができる。
【0099】
式(I)の化合物およびその薬学上許容される塩は、例えばカカオバターまたは他のグリセリド等の従来の坐剤基剤を含む坐剤としても製剤化することができる。
【0100】
式(I)の化合物およびその薬学上許容される塩はボーラス注入または持続点滴による非経口投与のためにも製剤化され、例えばアンプル、バイアル、小体積の点滴または充填済みシリンジとして単位用量形態で、または防腐剤を添加して複数用量容器で提供され得る。組成物は、水性媒質または非水性媒質中の溶液、懸濁物または乳化物としてかかる形態をとり、抗酸化剤、緩衝液、抗菌剤および/または等張性調整剤等の製剤化剤を含むことができる。あるいは、活性成分は、使用前に好適な媒質(例えば滅菌されたパイロジェン不含有水)による構成のための粉末形態であり得る。乾燥固体状態は、個々の滅菌容器の中へ滅菌粉末を無菌的に充填することによって、または各々の容器の中へ滅菌溶液を無菌的に充填し凍結乾燥することによって調製できる。
【0101】
式(I)の化合物およびその薬学上許容される塩は、ワクチンの活性を修飾するアジュバントとしてもワクチンと共に製剤化できる。かかる組成物は、アルミニウム塩、油と水の乳化物、熱ショックタンパク質、リピドA調製物および誘導体、糖脂質、CpG DNAもしくは類似薬剤等の他のTLRアゴニスト、GM−CSFもしくはIL−12等のサイトカインまたは類似薬剤を含むが、これらに限定されないアジュバント活性を持つ1つまたは複数の成分と共に、タンパク質、DNA、生細菌もしくは死細菌および/またはウイルスもしくはウイルス様粒子を含むが、これらに限定されない抗体(複数可)もしくは抗体断片(複数可)または抗原成分を含むことができる。
【0102】
式(I)の化合物およびその薬学上許容される塩は、単独でまたは他の治療剤と組み合わせて用いることができる。式(I)の化合物およびその薬学上許容される塩ならびに他の薬学的に活性のある薬剤(複数可)は、ともにまたは個別に投与することができ、個別に投与した場合、投与は任意の順序で同時にまたは連続して起こり得る。式(I)の化合物(複数可)またはその薬学上許容される塩(複数可)および他の薬学的に活性のある薬剤(複数可)の量および投与の相対的なタイミングは、所望される組合せ療法効果を達成するために選択される。式(I)の化合物またはその薬学上許容される塩の他の治療剤との組合わせ投与は、両方の化合物を含む一体型の医薬組成物での投与、または化合物の1つを各々に含む分離した医薬組成物での投与を併用することによってもよい。あるいは、組合わせは、1つの治療剤を第一におよび他のものを第二に投与するか、またはその逆に投与する連続型様式で個別に投与することができる。かかる連続投与は時間が接近または時間が隔たっていてもよい。
【0103】
式(I)の化合物およびその薬学上許容される塩は、ウイルス感染の予防または治療において有用な1つまたは複数の薬剤と組み合わせて使用することができる。かかる薬剤の例は以下を含むが、これらに限定されない。ポリメラーゼ阻害剤(WO2004/037818−A1中で開示されたものに加えて、WO2004/037818およびWO2006/045613中で開示されたもの等);JTK−003、JTK−019、NM−283、HCV−796、R−803、R1728、R1626に加えて、WO2006/018725、WO2004/074270、WO2003/095441、US2005/0176701、WO2006/020082、WO2005/080388、WO2004/064925、WO2004/065367、WO2003/007945、WO02/04425、WO2005/014543、WO2003/000254、EP1065213、WO01/47883、WO2002/057287、WO2002/057245中で開示されたものおよび類似薬剤;複製阻害剤(アシクロビル、ファムシクロビル、ガンシクロビル、シドフォビル、ラミブジンおよび類似薬剤等);プロテアーゼ阻害剤(HIVプロテアーゼ阻害剤サキナビル、リトナビル、インジナビル、ネルフィナビル、アンプレナビル、ホスアンプレナビル、ブレカナビル、アタザナビル、チプラナビル、パリナビル、ラシナビル、およびHCVプロテアーゼ阻害剤BILN2061、VX−950、SCH503034等);および類似薬剤;ヌクレオシドおよびヌクレオチド系逆転写酵素阻害剤(ジドブジン、ジダノシン、ラミブジン、ザルシタビン、アバカビル、スタビジン(stavidine)、アデフォビル、アデフォビル・ジピボキシル、フォジブジン、トドキシル(todoxil)、エムトリシタビン、アロブジン、アムドキソビル、エルブシタビンおよび類似薬剤等);非ヌクレオシド系逆転写酵素阻害剤(ネビラピン、デラビルジン、エファビレンツ、ロビリド、イムノカル、オルチプラズ、カプラビリン、TMC−278、TMC−125、エトラビリンおよび類似薬剤等)(イムノカル、オルチプラズなどの耐酸化活性を有する薬剤を含む);侵入阻害剤(エンフビルチド(T−20)、T−1249、PRO−542、PRO−140、TNX−355、BMS−806、5−ヘリックスおよび類似薬剤等);インテグラーゼ阻害剤(L−870、180および類似薬剤等);出芽阻害剤(PA−344およびPA−457、および類似薬剤等);ケモカイン受容体阻害剤(ビクリビロク(SchC)、Sch−D、TAK779、マラビロク(UK−427,857)、TAK449に加えて、WO02/74769、WO2004/054974、WO2004/055012、WO2004/055010、WO2004/055016、WO2004/055011およびWO2004/054581中で開示されたもの、ならびに類似薬剤等);ノイラミニダーゼ阻害剤(CS−8958、ザナミビル、オセルタミビル、ペラミビルおよび類似薬剤等);イオンチャネルブロッカー(アマンタジンまたはリマンタジンおよび類似薬剤等);および干渉RNAおよびアンチセンスオリゴヌクレオチド(ISIS−14803および類似薬剤等);決定されてない作用機序の抗ウイルス剤(例えばWO2005/105761、WO2003/085375、WO2006/122011中で開示されたもの、リバビリンおよび類似薬剤)。
【0104】
式(I)の化合物およびその薬学上許容される塩は、ウイルス感染の予防または治療、例えば免疫療法において有用であり得る1つまたは複数の他の薬剤(例えばインターフェロンまたは他のサイトカイン/ケモカイン、サイトカイン/ケモカイン受容体修飾物質、サイトカインアゴニストまたはアンタゴニストおよび類似薬剤);ならびに治療ワクチン、抗線維化剤、コルチコステロイドまたはNSAID(非ステロイド性抗炎症剤)等の抗炎症剤および類似薬剤と組み合わせても使用することができる。式(I)の化合物およびその薬学上許容される塩は、アレルギー性疾患、炎症性疾患、自己免疫性疾患の予防または治療、例えば;抗原免疫療法(抗ヒスタミン、ステロイド、NSAID、気管支拡張剤(例えばβ2アゴニスト、アドレナリン作動性アゴニスト、抗コリン作動剤、テオフィリン)、メトトレキサート、ロイコトリエン修飾物質および類似薬剤);モノクローナル抗体療法(抗IgE、抗TNF、抗IL−5、抗IL−6、抗IL−12、抗IL−1および類似薬剤等);受容体療法(例えばエンタネルセプトおよび類似薬剤);抗原非特異的免疫療法(例えばインターフェロン、他のサイトカイン/ケモカイン、サイトカイン/ケモカイン受容体修飾物質、サイトカインアゴニストまたはアンタゴニスト、TLRアゴニストおよび類似薬剤)において有用であり得る1つまたは複数の他の薬剤と組み合わせて使用することができる。
【0105】
式(I)の化合物およびその薬学上許容される塩は、癌の予防または治療、例えば化学療法(アルキル化剤、トポイソメラーゼ阻害剤、抗代謝剤、抗分裂剤、キナーゼ阻害剤および類似薬剤等);モノクローナル抗体療法(トラスツズマブ、ゲムツズマブおよび他の類似薬剤等);およびホルモン療法(タモキシフェン、ゴセレリンおよび類似薬剤等)において有用であり得る1つまたは複数の他の薬剤と組み合わせて使用することができる。
【0106】
本発明に記載の医薬組成物は、単独でも、または他の治療法上の分野(例えば胃腸疾患)における少なくとも1つの他の治療剤と組み合わせて使用することもできる。本発明に記載の組成物は遺伝子組み換え療法と組み合わせて使用することもできる。
【0107】
本発明は、さらなる態様において、少なくとも1つの他の治療法上活性のある薬剤と共に、式(I)の化合物またはその薬学上許容される塩を含む組合わせを含む。
【0108】
上で参照された組合わせは医薬組成物の形態での使用に便利なように提供することができ、したがって、少なくとも1つの薬学上許容されるその希釈剤または担体と共に上で定義されるような組合わせを含む医薬組成物は本発明のさらなる態様を示す。
【0109】
式(I)の化合物またはその薬学上許容される塩の治療上有効量は複数の因子に依存するだろう。例えば、レシピエントの種、年齢および体重、治療を必要とする正確な状態およびその重症度、組成物の性質、ならびに投与経路は、すべて検討すべき因子である。治療上有効量は、最終的に付き添いの医師の裁量によるべきである。それとは関係なく、衰弱しているヒトの治療のための本発明の化合物の有効量は、一般的には1日あたり0.0001〜100mg/kgレシピエントの体重の範囲であるべきだ。通常は、有効量は、1日あたり0.001〜10mg/kg体重の範囲であるべきだ。したがって、70kgの成人にとって、1日あたりの実際の量の1つの例は通常は7〜700mgであろう。鼻腔内投与経路および吸入投与経路については、70kgの成人のための典型的な用量は1日あたり1mgから1mgの範囲であるべきだ。この量は、1日あたり単一用量、または1日あたり幾つかのサブ用量(2、3、4、5、またはそれ以上等)で全体の用量が同じであるように与えることができる。式(I)の化合物の薬学上許容される塩の有効量は、式(I)の化合物またはその薬学上許容される塩それ自体の有効量の割合として決定することができる。類似の投薬量は本明細書において参照される他の状態の治療に適切であるべきだ。
【0110】
式(I)の化合物およびその薬学上許容される塩は任意の適切な頻度(例えば1週間あたり1〜7回)でも投与することができる。正確な投薬レジメンは、治療指標、患者の年齢および状態、ならびに選ばれた特定の投与経路等の因子にもちろん依存するだろう。
【0111】
医薬組成物は、単位用量あたりの所定の量の活性成分を含む単位用量形態で提供することができる。かかる単位は、非限定的例として、治療されている状態、投与経路ならびに患者の年齢、体重および状態に依存して、0.5mg〜1gの式(I)の化合物またはその薬学上許容される塩を含むことができる。好ましい単位投与量組成物は、活性成分の、用量またはサブ用量(本明細書において上で列挙されたように)、またはその適切な一部を含むものである。かかる医薬組成物は、製薬技術における任意の周知の方法によって調製することができる。
【0112】
式(I)の化合物またはその薬学上許容される塩、および1つまたは複数の薬学上許容される希釈剤または担体を含む医薬組成物がしたがってさらに提供される。
【0113】
1つまたは複数の薬学上許容される希釈剤または担体と共に、式(I)の化合物またはその薬学上許容される塩を混合することを含む、かかる医薬組成物を調製するプロセスがさらに提供される。
【0114】
式(I)の化合物およびその塩は以下に記述される方法論によって調製することができ、本発明のさらなる態様を構成する。
【0115】
したがって、Yが炭素である式(I)の化合物の調製のためのプロセス(プロセスA)が提供され、該プロセスは、式(IIA)の化合物
【化2】

【0116】
を、式(IIIA)の化合物
【化3】

【0117】
(式中、R1、n、XおよびYは、式(I)の化合物について上文で定義された通りである)と反応させ、その後は、メチル保護基(OMe)を除去し、その後は、必要ならば、
(i).式(I)の化合物をさらなる式(I)の化合物に転換するステップ、
(ii).任意の必要なさらなる保護基を除去するステップ、
(iii).そのように形成された化合物の塩または溶媒和物を調製するステップ
のオプションステップのうちの1つまたは複数の実行を含む。
【0118】
例えば、式(IIA)の化合物はN,N’−ジメチルホルムアミド(DMF)等の好適な溶媒中で溶解され、式(IIIA)の化合物(ジ−イソプロピルエチルアミン(DIPEA)等の好適な塩基の存在下において、純粋な形で、またはアセトニトリル等の好適な溶媒中に溶解して導入される)の溶液に添加される。反応が完了するまで、反応混合物を、好適な時間(一晩等)で、45〜55℃等の好適な上昇させた温度まで任意で加熱することができる。
【0119】
メチル保護基(式(IIA)の化合物中のOMe)の除去は、もたらされた化合物を、好適な溶媒(例えば1,4−ジオキサン)中の好適な強度(例えば4Nまたは2N)の塩化水素の溶液により、典型的には室温で4時間〜24時間等の適切な時間で処理することによって達成することができる。
【0120】
式(IIA)の化合物は以下のスキーム1に従って調製することができる。
【0121】
式(IIIA)の化合物は商業的に入手可能であり、2−ブロモエタノールを含む。
【0122】
スキーム1:Yが炭素である式(IIA)の化合物の調製
【化4】

【0123】
ここで、R1、nおよびXは式(I)の化合物について上文で定義され、Protは好適な保護基、通常CBZ(カルボベンジルオキシ)である。
【0124】
試薬および条件:(i)DMF等の好適な溶媒、炭酸カリウム等の好適な塩基、通常50〜60℃等の上昇させた温度で、18〜24時間等の好適な時間;(ii)脱保護。Prot=CBZの場合、CBZ基は、エタノール等の好適な溶媒中の10%のパラジウム炭素の存在下における還元によって除去することができる。
【0125】
式(IV)の化合物は以下のスキーム2およびスキーム3に従って調製することができる。
【0126】
式(V)の化合物は以下のスキーム4に従って調製することができる。
【0127】
スキーム2:Xが酸素である式(IV)の化合物(IVA)の調製
【化5】

【0128】
ここで、TFAはトリフルオロ酢酸である。
【0129】
試薬および条件:(i)p−トルエンスルホン酸等の好適な酸の存在下において酢酸エチル等の好適な溶媒、通常45〜55℃等の上昇させた温度で約1時間等の好適な期間;(ii)イソプロピルアルコール等の好適な溶媒、アンモニア、通常45〜55℃等の上昇させた温度で5〜24時間等の好適な期間;(iii)ナトリウムtert−ブトキシド等の好適な塩基、n−ブタノール(例えばAldrichから商業的に入手可能)、通常約100℃等の上昇させた温度で18〜24時間等の好適な期間;(iv)クロロホルム等の好適な溶媒、N−ブロモスクシンイミド(例えばAldrichから商業的に入手可能)、0℃(アイスバス中の)等の好適な低下させた温度で、次いで周囲温度まで5〜7時間等の好適な期間で上昇;(v)好適な塩基および溶媒の組合わせとしてナトリウムメトキシド/メタノール、通常4〜6時間等の好適な期間の還流;(vi)メタノール等の好適な溶媒、トリフルオロ酢酸等の好適な酸、36〜60時間等の好適な期間。
【0130】
式(VII)および(VIII)の化合物は商業的に入手可能である。
【0131】
式(IX)、(X)、(XIA)、(XII)、(XIII)および(IV)の化合物は、国際公開第WO2008/101867号中で開示される方法に従っても調製することができる。
【0132】
式(X)の化合物は、式(IX)の中間体を単離せずに、式(VII)および(VIII)の化合物からも直接製造することができる。
【0133】
スキーム3:Xが窒素である式(IV)の化合物(IVB)の調製
【化6】

【0134】
ここで、TFAはトリフルオロ酢酸である。
【0135】
試薬および条件:(i)エチレングリコール等の好適な溶媒通常110〜130℃等の上昇させた温度で、12〜24時間等の好適な期間;(ii)クロロホルム等の好適な溶媒、N−ブロモスクシンイミド(例えばAldrichから商業的に入手可能)、周囲温度で15〜35分等の好適な期間、次いで好適な塩基および溶媒の組合わせとしてナトリウムメトキシド/メタノール、通常60〜70℃等の上昇させた温度で、12〜24時間等の好適な期間、続いてメタノール等の好適な溶媒、トリフルオロ酢酸等の好適な酸、36〜60時間等の好適な期間。
【0136】
式(XIV)の化合物は商業的に入手可能である。
【0137】
上のスキーム2におけるように、式(X)の化合物を調製する。
【0138】
スキーム4:Yが炭素である式(V)の化合物の調製
【化7】

【0139】
ここで、nは式(I)の化合物について上文で定義され、Protは好適な保護基、通常CBZである。
【0140】
式(XV)の化合物において、(CH2)n基が6員環の窒素に結合されなくてもよいことが認識される。
【0141】
試薬および条件:(i)以下のいずれか、クロロギ酸ベンジル(例えばAldrichから商業的に入手可能)、トリエチルアミン等の好適な塩基の存在下において、アセトニトリル等の好適な溶媒中で、通常0℃(アイスバス中の)等の好適な低下させた温度で、次いで周囲温度まで12〜24時間等の好適な期間で上昇;またはジクロロメタン等の好適な溶媒中のトリエチルアミン等の好適な塩基の存在下において、1−({[(フェニルメチル)オキシ]カルボニル}オキシ)−2,5−ピロリジンジオン(Aldrichから、例えば商業的に入手可能)を使用して、周囲温度で12〜24時間等の好適な期間。
【0142】
式(XV)の化合物は、以下の対応する酸(アルコールの代わりに)
【化8】

【0143】
からも、ボラン−テトラヒドロフラン錯体の存在下において、テトラヒドロフラン等の好適な溶媒を使用する還元によって、通常0℃(アイスバス中の)等の低下させた温度で、製造することができる。反応物はメタノール等の好適な溶媒を使用して、次いでさらにメタノール中の2N塩化水素等の好適な酸により通常クエンチされる。
【0144】
Yが窒素であり、(CH2)nがYを介して結合される式(I)の化合物の調製のためのプロセス(プロセスB)がさらに提供され、該プロセスは、式(IIB)の化合物
【化9】

【0145】
(式中、R1、nおよびXは、式(I)の化合物について上文で定義された通りである)を脱保護し、その後は、必要ならば、
(i)式(I)の化合物を式(I)のさらなる化合物に転換するステップ、
(ii)そのように形成された化合物の塩または溶媒和物を調製するステップ
のオプションのステップのうちの1つまたは複数の実行を含む。
【0146】
例えば、式(IIB)の化合物は好適な溶媒(例えばメタノール)中で溶解され、好適な溶媒(例えば1,4−ジオキサン)中の4Nの塩化水素溶液により処理される。反応物は、周囲温度等の適切な温度で4〜24時間等の好適な期間撹拌される。
【0147】
式(IIB)の化合物は以下のスキーム5に従って調製することができる。
【0148】
スキーム5:Yが窒素であり、(CH2)nがYを介して結合される式(IIB)の化合物の調製
【化10】

【0149】
ここで、n、XおよびR1は式(I)の化合物について上文で定義される。
【0150】
試薬および条件:(i)化合物(IV)を炭酸カリウム等の好適な塩基の存在下においてDMF等の好適な溶媒中で溶解し、通常40〜60℃への等の上昇させた温度で、0.5〜2時間への等の好適な期間、次いで0℃〜周囲温度等の低下させた温度まで冷却し、式(XVIII)の化合物を添加し、5〜20時間への等の好適な期間で反応させる、(ii)式(IIIC)、アセトニトリル等の好適な溶媒またはDMFの化合物、DIPEA等の好適な塩基、通常60〜80℃等の上昇させた温度で、18〜36時間等の好適な期間。
【0151】
式(IIC)の化合物の式(I)の化合物への転換は、式(IIB)の化合物の単離なしに実行できることが認識される。
【0152】
本明細書において記述された合成経路において用いることができる他の保護基およびそれらの除去のための手段の例は、T.W.Greene「Protective Groups in Organic Synthesis」、第3版、J.Wiley and Sons、1999年(かかる手順に関連して参照として本明細書に援用される)中で見出すことができる。
【0153】
上文に記述された反応またはプロセスのいずれかのための、加熱および冷却の従来の方法、例えば、温度調節オイルバスまたは温度調節ホットブロック、および氷/塩バスまたはドライアイス/アセトンバスをそれぞれ、用いることができる。単離の従来の方法、例えば水性溶媒または非水性溶媒からの、またはそれらの中への抽出を使用することができる。硫酸マグネシウムもしくは硫酸ナトリウムと共に振盪すること、または疎水性フリットを通過させること等の、有機溶媒、溶液または抽出物を乾燥する従来の方法を用いることができる。精製の従来の方法、例えば結晶およびクロマトグラフィー(例えばシリカクロマトグラフィーまたは逆相クロマトグラフィー)を、必要に応じて使用することができる。反応モニタリング技法、例えば薄層クロマトグラフィーおよびLC−MSによって具体的な反応時間、温度が典型的には決定できることが認識される。
【0154】
必要に応じて、式(I)の化合物の個々の異性体は、偏左右異性誘導体の分別結晶またはキラル高速液体クロマトグラフィー(キラルHPLC)等の従来の手順を使用して、個々の異性体として調製することができる。本発明は以下の実施例を限定的な方法ではなく参照して説明される。
【実施例】
【0155】
実験の詳細
本明細書において参照されるLCMSシステムA〜Dの実験の詳細は、以下の通りである。
【0156】
システムA
カラム: 50mm×2.1mm、ID、1.7μm Acquity UPLC BEH C18
流速: 1mL/分
温度: 40℃
UV検出範囲: 210〜350nm
質量スペクトル:交互スキャンの正および負のモードのエレクトロスプレーイオン化を使用して、質量分析計で記録した
溶媒: A:水中の0.1%v/vのギ酸
B:0.1%v/vのギ酸アセトニトリル
勾配:時間(分) A% B%
0 97 3
1.5 0 100
1.9 0 100
2.0 97 3
システムB
カラム: 30mm×4.6mm、ID、3.5μm Sunfire C18カラム
流速: 3mL/分
温度: 30℃
UV検出範囲: 210〜350nm
質量スペクトル:交互スキャンの正および負のモードのエレクトロスプレーイオン化を使用して、質量分析計で記録した
溶媒: A:水中の0.1%v/vのギ酸溶液
B:アセトニトリル中の0.1%v/vのギ酸溶液
勾配:時間(分) A% B%
0 97 3
0.1 97 3
4.2 0 100
4.8 0 100
4.9 97 3
5.0 97 3
システムC
カラム: 50mm×2.1mm、ID、1.7μm Acquity UPLC BEH C18
流速: 1mL/分
温度: 40℃
UV検出範囲: 210〜350nm
質量スペクトル:交互スキャンの正および負のモードのエレクトロスプレーイオン化を使用して、質量分析計で記録した
溶媒: A:アンモニア溶液によりpH10に調節した水中の10mM重炭酸アンモニウム
B:アセトニトリル
勾配:時間(分) A% B%
0 99 1
1.5 3 97
1.9 3 97
2.0 0 100
システムD
カラム: 50mm×4.6mm、ID、3.5μm XBridge C18カラム
流速: 3mL/分
温度: 30℃
UV検出範囲: 210〜350nm
質量スペクトル:交互スキャンの正および負のモードのエレクトロスプレーイオン化を使用して、質量分析計で記録した。
【0157】
溶媒: A:アンモニア溶液によりpH10に調節した水中の10mM重炭酸アンモニウム
B:アセトニトリル
勾配:時間(分) A% B%
0 99 1
0.1 99 1
4.0 3 97
5.0 3 97
システムE
カラム: 30mm×4.6mm、ID、3.5μm Sunfire C18カラム
流速: 3mL/分
温度: 30℃
UV検出範囲: 210〜350nm
質量スペクトル:交互スキャンの正および負のモードのエレクトロスプレーイオン化を使用して、質量分析計で記録した
溶媒: A:水中の0.1%v/vのトリフルオロ酢酸溶液
B:アセトニトリル中の0.1%v/vのトリフルオロ酢酸溶液
勾配:時間(分) A% B%
0 97 3
0.1 97 3
4.2 0 100
4.8 0 100
4.9 97 3
5.0 97 3
クロマトグラフィー精製は、典型的にはプレパックシリカゲルカートリッジを使用して行った。Flashmaster IIは、Argonaut Technologiesから入手可能な自動化マルチユーザーフラッシュクロマトグラフィーシステムであり、使い捨ての順相固相抽出(SPE)カートリッジ(2g〜100g)を利用する。これには、勾配法の実行を可能にする四元オンライン溶媒混合が提供されている。サンプルを、多機能オープンアクセスソフトウェア(溶媒、流速、勾配プロファイルおよび採取条件を管理する)を使用して待機させる。システムは、Knauer波長変更可能UV検出器、ならびに自動化ピークカッティング、採取およびトラッキングを可能にする2個のGilsonFC204フラクションコレクターを装備する。
【0158】
窒素気流を使用する溶媒除去を、Radleys Discovery Technologies(Saffron Walden、Essex、CB11 3AZ、UK)から入手可能なGreenHouse Blowdownシステムで30〜40℃で行った。
【0159】
1H NMRスペクトルは、すべて400MHzで作動する、Bruker DPX 400またはBruker Avance DRXまたはVarian Unity 400分光計のいずれかで、CDCl3またはDMSO−d6のいずれかにおいて記録した。使用される内部標準は、CDCl3について7.25ppmまたはDMSO−d6について2.50ppmで、テトラメチルシランまたは残存するプロトン化された溶媒のいずれかであった。
【0160】
質量分析による自動分取(MPAP)HPLCは、以下で与えられた条件下で行った。UV検出は210nm〜350nmの波長からの平均化されたシグナルであり、質量スペクトルは交互スキャンの正および負のモードのエレクトロスプレーイオン化を使用して質量分析計で記録した。
【0161】
方法A
方法Aは、XBridge C18カラム(典型的には150mm×19mm、内径5μmのパッキングした直径)で周囲温度で行った。用いられた溶媒は以下の通りであった。
【0162】
A=アンモニア溶液によりpH10に調整した10mM重炭酸アンモニウム水溶液。
【0163】
B=アセトニトリル。
【0164】
方法B
方法Bは、Atlantis C18カラム(典型的には100mm×30mm、内径5μmのパッキングした直径)で周囲温度で行った。用いられた溶媒は以下の通りであった。
【0165】
A=水中の0.1%v/vのギ酸溶液
B=アセトニトリル中の0.1%v/vのギ酸溶液。
【0166】
中間体
中間体1:2,6−ジクロロ−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン
【化11】

【0167】
2,6−ジクロロプリン(例えばAldrichから商業的に入手可能)(25.0g)に、酢酸エチル(260mL)、続いてp−トルエンスルホン酸(0.253g)を添加した。混合物を50℃に加熱し、次いで、3,4−ジヒドロ−2H−ピラン(例えばAldrichから商業的に入手可能)(16.8g)を添加した。次いで反応混合物を50℃で4時間加熱した。反応混合物を真空下で蒸発させて黄色固体として表題化合物を得た(36.9g)。
【0168】
1H NMR(CDCl3):8.35(1H,s),5.77(1H,dd),4.20(1H,m),3.79(1H,m),2.20−1.65(6H,m).
中間体2:2−クロロ−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミン
【化12】

【0169】
調製1
2,6−ジクロロ−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン(例えば中間体1のために調製された)(36.9g)を、イソプロパノール(250mL)中の2Mアンモニアと共に50℃で5時間加熱した。周囲温度で一晩放置した後、イソプロパノール(100mL)中の2Mアンモニアをさらに添加して、生じたケーキを破壊し、反応が完了するまで反応混合物をさらに9時間加熱した。反応混合物に水(70mL)を添加し、黄色固体が濾過されて残った。固体をイソプロピルアルコール:水(5:1(v/v)、60mL)で洗浄し、次いで吸引下で空気乾燥して第1の産物を得た。一晩放置して沈殿を単離した後に、濾液を再濾過し、両固体を真空下で乾燥した。第1の産物は純粋であり、第2の産物物質は非常にマイナーな不純物(第1の産物において見られない分離した広範囲のシグナル3.5ppm)を示したが、他の点では同一であった。固体第1の産物(28.4g)、固体第2の産物(3.42g)。
【0170】
1H NMR(CDCl3):8.01(1H,s),5.98(2H,broads),5.70(1H,dd),4.16(1H,m),3.78(1H,m),2.15−1.60(6H,overlapping m).
調製2
無水酢酸エチル(200mL)中の2,6−ジクロロプリン(例えばAldrichから商業的に入手可能)(25g)の溶液に、p−トルエンスルホン酸一水和物(235mg)を添加した。反応物を50℃に加熱し、3,4−ジヒドロ−2H−ピラン(例えばAldrichから商業的に入手可能)(18.1mL)を一気に添加した。反応物を50℃で1時間撹拌したままにし、溶媒を減圧下で除去した。これにより黄色固体を得た。イソプロパノール(460 mL)中の2.0Mアンモニア中のこの固体(〜36g)の懸濁物を窒素下で付属のコンデンサーにより60℃で4時間加熱した。反応物を水(50mL)の中に注ぎ、一晩放置して冷却した。沈殿を濾過し、回転蒸発装置(60℃)で30分間乾燥して、灰白色固体として表題化合物を31g得た(93%、2ステップ)。
【0171】
MS (C10H12ClN5O)+についての計算値(C10H12ClN5O)+=254,256
MS 実測値(電気スプレー):(M)+=254,256(3:1)
1H NMR((CD3)2SO):δ8.43(1H,s),7.82(2H,s),5.55(1H,dd),4.00(1H,m),3.69(1H,m),2.21(1H,m),1.95(2H,m),1.74(1H,m),1.56(2H,m).
中間体3:2−ブトキシ−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミン
【化13】

【0172】
ブタン−1−オール(例えばAldrichから商業的に入手可能)(76mL)に、ナトリウムtert−ブトキシド(15.2g)を小分けで添加した(注:反応混合物は暖かくなる)。均質になるまで上記のものを撹拌してから(〜15分)、次いで2−クロロ−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミンを、生じた淡黄色溶液に添加した。次いで反応混合物を100℃に一晩加熱した。反応混合物をストリップして可能なかぎりブタン−1−オールを除去してから、ジエチルエーテルと水との間で分配した。ジエチルエーテル相を分離し、水相をジエチルエーテルでさらに再抽出した。合わせた有機層を硫酸マグネシウム(無水)の上で乾燥した。硫酸マグネシウムを濾過により除き、濾液をストリップし、茶色の粘稠な油を得て、トルエンと共に共沸し(3回)、高真空下に一晩置き、ジクロロメタンと共に新しいフラスコに移し、ストリップし、高真空下に置いて、茶色ガラスとして表題化合物を得た(9.45g)。
【0173】
1H NMR(CDCl3):7.85(1H,s),5.92(2H,broads),5.64(1H,d),4.32(2H,t),4.14(1H,m),3.75(1H,m),2.10−1.95(3H,overlapping m),1.81−1.58(5H,overlapping m),1.50(2H,m),0.97(3H,t).
中間体4:8−ブロモ−2−ブトキシ−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミン
【化14】

【0174】
2−(ブトキシ)−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミン(例えば中間体4のために調製された)(9.45g)をクロロホルム(50mL)中に溶解し、0℃に冷却した(アイスバス)。この溶液にN−ブロモスクシンイミド(例えばAldrichから商業的に入手可能)(6.07g)を小分けで添加し、3℃未満の温度を維持した。これにより暗緑色溶液が生じ、2.5℃で30分間撹拌してから、室温まで暖め、次いで6時間撹拌した。次いで反応混合物を水(100mL、2回)で洗浄した。有機相を疎水性フリットを使用して乾燥/分離し、蒸発させ、暗褐色ゴムを得て、0〜50%酢酸エチル:シクロヘキサンの勾配溶出を使用して、シリカクロマトグラフィー(120g)(ISCO)によって精製して、淡黄色固体として表題化合物を得た(8.37g)。
【0175】
1H NMR(CDCl3):5.61(1H,dd),5.49(2H,broads),4.32(2H,m),4.17(1H,m),3.71(1H,m),3.04(1H,m),2.11(1H,broadd),1.89−1.45(6H,overlapping m),1.50(2H,m),0.97(3H,t).
中間体5:2−ブトキシ−8−メトキシ−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミン
【化15】

【0176】
8−ブロモ−2−(ブトキシ)−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミン(例えば中間体4のために調製された)(8.37g)を、メタノール(例えばAldrichから商業的に入手可能)(14.4mL)およびメタノール(65mL)中の25%のナトリウムメトキシドと共に4.5時間加熱還流した。反応混合物を減圧下で濃縮し、酢酸エチルと飽和塩化アンモニウム溶液との間で分配した。有機相を分離し、酢酸エチルの中への抽出を反復した。有機相を合わせ、ブライン(2回)で洗浄した。水相の分離後に、有機相は疎水性フリットを通過させ、蒸発させて、薄茶色ゴムを得て、高真空下に置き、泡(7.52g)を得たが、それは周囲圧力でゴム(7.34g)へ潰れ、一晩凝固させ、黄色非晶性固体として表題化合物を得た。
【0177】
MS (C15H23N5O3)+についての計算値=321
MS 実測値(電気スプレー):(M+H)+=322
1H NMR(CDCl3):5.50(1H,dd),5.17(2H,broads),4.29(2H,t),4.12(3H,sおよび1H,m),3.70(1H,m),2.77(1H,m),2.05(1H,m),1.82−1.63(6H,overlapping m),1.50(2H,m),0.97(3H,t).
中間体6:2−ブトキシ−8−メトキシ−9H−プリン−6−アミントリフルオロ酢酸塩
【化16】

【0178】
メタノール(100mL)中の2−(ブトキシ)−8−(メトキシ)−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミン(例えば中間体5のために調製された)(7.34g)の溶液に、トリフルオロ酢酸(10mL)を添加した。混合物を周囲温度で週末の間撹拌して、懸濁物を得た。反応混合物を小体積(濃厚なスラリー)へ濃縮してから、酢酸エチル(50mL)により希釈した。生じたスラリーを濾過し、濾液が無色になるまで小体積の酢酸エチルで洗浄した。残りの固体を空気によって次いで真空下で乾燥して、白色固体として表題化合物を得た(6.20g)。以前に得た濾液を濃縮してスラリーを得て、小体積の酢酸エチル(10mL)で希釈し、次いで濾過し、上記のように乾燥した。この第2の産物を白色固体として単離した(0.276g)。両方の産物はNMRによって同一であった。
【0179】
MS (C10H15N5O2)+についての計算値=237
MS 実測値(電気スプレー):(M+H)+=238
1H NMR(CD3OD):4.47(2H,t),4.15(3H,s),1.80(2H,m),1.50(2H,m),0.99(3H,t)(置換性NH2,NHおよびCOOHプロトンは観察されていない).
中間体7:N2−ブチル−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−2,6−ジアミン
【化17】

【0180】
無水エチレングリコール(例えばAldrichから商業的に入手可能)(50mL)中の2−クロロ−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミン(例えば中間体2のために調製された)(10g)の溶液に、n‐ブチルアミン(例えばAldrichから商業的に入手可能)(16mL)を室温の窒素下で一気に添加した。反応物を120℃で一晩加熱した。反応物を室温まで冷却し、酢酸エチル(150mL)で希釈し、水(2×50mL)で洗浄した。有機層をMgSO4の上で乾燥し、濾過し、真空下で濃縮した。これにより粘稠な緑色油として表題化合物を得て(10.2g)、これをさらに精製せずに次のステップで使用した。
【0181】
MS (C14H22N6O)+についての計算値=290
MS 実測値(電気スプレー):(M+H)+=291
1H NMR((CD3)2SO):δ7.8(1H,s),6.6(2H,s),6.2(1H,t),5.4(1H,dd),4.0(1H,m),3.6(1H,m),3.2(2H,m),2.2(1H,m),1.9(1H,m),1.8(1H,m),1.7(1H,m),1.5(2H,m),1.4(2H,m),1.3(2H,m),0.9(3H,t).
中間体8:N2−ブチル−8−メトキシ−9H−プリン−2,6−ジアミン、トリフルオロ酢酸塩
【化18】

【0182】
無水クロロホルム(100mL)中の未精製N2−ブチル−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−2,6−ジアミン(例えば中間体7のために調製された)(〜10.2g)の溶液に、N−ブロモスクシンイミド(例えばAldrichから商業的に入手可能)(6.3g)を、室温で5分にわたり小分けで添加した。黒っぽい溶液を室温で30分間撹拌したままにした。反応混合物を水(20mL)で洗浄した。有機相は疎水性フリットを通過させ、真空下で濃縮した。これによりベージュ色固体を得て、無水メタノール(100mL)中に溶解し、ナトリウムメトキシド溶液(メタノール中で25重量%、例えばAldrichから商業的に入手可能)(24mL)に、室温の窒素下で一気に添加した。反応物を付属のコンデンサーにより65℃で一晩加熱した。反応物を冷却し、真空下で濃縮した。生じたオレンジ色残留物を酢酸エチル(150mL)中に取り上げ、飽和塩化アンモニウム水溶液(50mL)の中へ注いだ。有機層を分離し、水(50mL)でさらに洗浄した。有機層をMgSO4の上で乾燥し、濾過し、真空下で濃縮した。無水メタノール(70mL)中のこの物質に、トリフルオロ酢酸(7mL)を室温で一気に添加した。反応物を30時間撹拌し、真空下で濃縮して、暗褐色固体を得た。これをジエチルエーテル(20mL)中に取り上げ、粉砕した。固体を濾過して、ベージュ色固体として表題化合物を得た(3.3g、35%、4ステップ)。
【0183】
MS (C10H16N6O)+についての計算値=236
MS 実測値(電気スプレー):(M+H)+=237
1H NMR((CD3)2SO):δ13.3−12.3(1H,br.m),8.6−7.3(2H,m),4.05(3H,s),3.28(2H,m),1.52(2H,m),1.33(2H,m),0.89(3H,t)(残存している置換性プロトンはなくならない).
中間体9:フェニルメチル2−(3−ヒドロキシプロピル)−1−ピペリジンカルボキシラート
【化19】

【0184】
3−(2−ピペリジニル)−1−プロパノール(例えばChemBridgeから商業的に入手可能)(8.69g、60.7mmol)を、トリエチルアミン(10.40mL、74.6mmol)と共にアセトニトリル(90mL)中で窒素下で撹拌し、アイスバス中で冷却した。クロロギ酸ベンジル(例えばAldrichから商業的に入手可能)(9.53mL、66.7mmol)を1滴ずつ添加した。添加の完了後に、反応物を周囲温度まで温まるように放置し、撹拌し、次いで一晩継続した。懸濁物を濾過し、濾液を蒸発乾固した。残留物を酢酸エチルと水との間で分配した。有機相を飽和ブラインで洗浄し、疎水性フリットを通過させ、蒸発乾固した。残留物を、ISCO Companionでの酢酸エチルの50〜100%フラッシュにより、40分にわたるシクロヘキサン中の0〜50%酢酸エチル勾配を使用するシリカクロマトグラフィー(330gシリカRediSepカラム、DCM中でロードした)によって精製した。ピークは検出されなかった(254nm、280nm)。したがって廃液を真空下で蒸発して物質を回収した。以前と同一の条件を使用して物質を再びカラムにかけたが、220nmで検出し溶出液をすべて回収した。主な産物ピークを回収し、真空下で蒸発させて、黄色油として表題化合物を得た(6.15g)。
【0185】
LCMS(System B):tRET=2.46min;MH+278
中間体10:フェニルメチル2−(3−ブロモプロピル)−1−ピペリジンカルボキシラート
【化20】

【0186】
無水ジクロロメタン(34mL)中のフェニルメチル2−(3−ヒドロキシプロピル)−1−ピペリジンカルボキシラート(例えば中間体9のために調製された)(2.14g、7.72mmol)の溶液に、四臭化炭素(例えばAldrichから商業的に入手可能)(5.12g、15.43mmol)を添加した。生じた溶液を氷/水中で冷却した。無水DCM(10mL)中のトリフェニルフォスフィン(4.05g、15.43mmol)の溶液を30分にわたり1滴ずつ添加し、濃琥珀色/茶色溶液が産生された。添加の完了後に、反応物を周囲温度まで徐々に暖まるように放置し、一晩継続して撹拌した。反応混合物を濾過して沈殿を取り出し、エーテルで洗浄し、濾液を〜10mLまで蒸発させた。次いでこれを100gのシリカカートリッジ上にロードし、Flashmasterでの40分にわたるシクロヘキサン中の0〜25%の酢酸エチルのFlashmaster勾配を使用してクロマトグラフィーによって精製し、すべての溶出液を回収した。産物ピークをTLCによって同定し、画分を合わせ、真空下で蒸発させて、透明な油として表題化合物を得た(2.13g)。
【0187】
LCMS(System B):tRET=3.44min;MH+340/342
中間体11:フェニルメチル2−{3−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペリジンカルボキシラート
【化21】

【0188】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミン、トリフルオロ酢酸塩(例えば中間体6のために調製された)(1.834g、5.22mmol)を、DMF(23mL)中の炭酸カリウム(2.89g、20.88mmol)と共に60℃で1時間加熱した。フェニルメチル2−(3−ブロモプロピル)−1−ピペリジンカルボキシラート(例えば中間体10のために調製された)(2.131g、6.26mmol)を添加し、50℃で一晩(20時間)継続して加熱した。反応混合物を水(250mL)と酢酸エチル(150mL)との間で分配した。水相を酢酸エチル(100mL)でさらに抽出した。合わせた有機層をブライン(100mL)で洗浄し、疎水性フリットを通過させて乾燥し、次いでストリップにより乾燥(回転蒸発装置)して、オレンジ色液体を得た。物質を2×70gのアミノプロピルカートリッジ上にロードし、40分にわたるシクロヘキサン中の0〜100%の酢酸エチルの勾配においてFlashmasterシステムで溶出した。適切な産物画分を合わせ、真空下で蒸発させて、透明な油として表題化合物を得た(1.16g)。
【0189】
LCMS(System B):tRET=2.92min;MH+ 497
中間体12:2−(ブチルオキシ)−8−(メチルオキシ)−9−[3−(2−ピペリジニル)プロピル]−9H−プリン−6−アミン
【化22】

【0190】
エタノール(130mL)中のフェニルメチル2−{3−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペリジンカルボキシラート(例えば中間体11のために調製された)(1.16g、2.336mmol)を、10%のパラジウム炭素(0.497g、0.467mmol)の上で周囲温度で一晩水素添加を行った。混合物を窒素下でセライトカートリッジを介して濾過し、エタノールで洗浄し、真空下で蒸発させて、クリーム色固体として表題化合物を得た(0.66g)。
【0191】
LCMS(System B):tRET=1.29min;MH+363
中間体13:フェニルメチル3−{[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]メチル}−1−ピペリジンカルボキシラート
【化23】

【0192】
DMF(60ml)中の2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)(2.56g、7.29mmol)の溶液に炭酸カリウム(4.03g、29.1mmol)を添加し、混合物を窒素の雰囲気下で60℃で1時間撹拌して放置した。次いで反応混合物を室温まで冷却し、これに、フェニルメチル3−(ブロモメチル)−1−ピペリジンカルボキシラート(例えばAniChemから商業的に入手可能、または調製については国際公開WO1999/45006を参照されたい)(2.275g、7.29mmol)を添加した。反応物を50℃まで戻し、一晩撹拌して放置した。反応混合物を水(〜40mL)で希釈し、1:1酢酸エチル:DCM(40mL)の溶媒混合物により分配した。有機層を疎水性フリットを使用して分離し、真空下で濃縮して、淡黄色濃厚油を得た。粗製物質を1:1 DMSO:MeOH(5mL)中で溶解し、この溶液の2分の1を、最初は330gのC18シリカカラムで高pHシステムを使用する逆相クロマトグラフィーで精製した。使用した勾配は以下の通りだった。
【0193】
1CV=A中の40%の溶媒B
2CV=A中の60%の溶媒B
6CV=A中の80%の溶媒B
1CV=A中の95%の溶媒B
0.2CV=A中の95%の溶媒B
1.8CV=100%の溶媒B
溶媒A=10mmol重炭酸アンモニウムおよびNH3を含む水(pH10)、溶媒B=0.1%のNH3を含むアセトニトリル
(CV=カラム体積)
必要な異性体を含むことがLCMS分析によって示された画分を合わせて真空下で濃縮し、残りの混合画分を別に合わせて真空下で濃縮した。
【0194】
精製が必要な粗製物質の残りの2分の1を含むフラスコ中で、何かが沈殿したことが見出された。これを濾過し、冷DMSOで洗浄して白色結晶質を得た。クロマトグラフィーからの混合画分をDMSOから再結晶させた。クロマトグラフィーからの物質および再結晶した物質を合わせて、白色固体として表題化合物を得た(1.38g)。
【0195】
LCMS(System C):tRET=3.13min;MH+469
中間体14:2−(ブチルオキシ)−8−(メチルオキシ)−9−(3−ピペリジニルメチル)−9H−プリン−6−アミン
【化24】

【0196】
フェニルメチル3−{[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]メチル}−1−ピペリジンカルボキシラート(例えば中間体13のために調製された)から、中間体12と同様に調製した。
【0197】
LCMS(System C):tRET=2.25min;MH+335
中間体15:フェニルメチル3−(2−ヒドロキシエチル)−1−ピペリジンカルボキシラート
【化25】

【0198】
2−(3−ピペリジニル)エタノール(例えばTygerから商業的に入手可能)から、中間体9と同様に調製した。
【0199】
LCMS(System B):tRET=2.32min;MH+264
中間体16:フェニルメチル3−(2−ブロモエチル)−1−ピペリジンカルボキシラート
【化26】

【0200】
フェニルメチル3−(2−ヒドロキシエチル)−1−ピペリジンカルボキシラート(例えば中間体15のために調製された)から、中間体10と同様に調製した。
【0201】
LCMS(System D):tRET=3.37min;MH+326/328
中間体17:フェニルメチル3−{2−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]エチル}−1−ピペリジンカルボキシラート
【化27】

【0202】
フェニルメチル3−(2−ブロモエチル)−1−ピペリジンカルボキシラート例えば中間体16のために調製された)および2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)から、中間体11と同様に調製した。
【0203】
LCMS(System D):tRET=3.38min;MH+483
中間体18:2−(ブチルオキシ)−8−(メチルオキシ)−9−[2−(3−ピペリジニル)エチル]−9H−プリン−6−アミン
【化28】

【0204】
フェニルメチル3−{2−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]エチル}−1−ピペリジンカルボキシラート(例えば中間体17のために調製された)から、中間体12と同様に調製した。
【0205】
LCMS(System B):tRET=2.42min;MH+349
中間体19:フェニルメチル3−(3−ヒドロキシプロピル)−1−ピペリジンカルボキシラート
【化29】

【0206】
1−({[(フェニルメチル)オキシ]カルボニル}オキシ)−2,5−ピロリジンジオン(例えばAldrichから商業的に入手可能)(8.70g、34.9mmol)を、ジクロロメタン(100mL)中の3−(3−ピペリジニル)−1−プロパノール(例えばAstatechから商業的に入手可能)(5.02g、35mmol)およびトリエチルアミン(5mL、3.63g、35.9mmol)の撹拌混合物に、小分けで室温で添加した。生じた混合物を室温で18時間放置した。反応混合物を飽和炭酸水素ナトリウム溶液(100mL)で洗浄した。有機相を乾燥し(MgSO4)、濾過し、蒸発させた。サンプルを、40分にわたる0−100%の酢酸エチル−シクロヘキサンの勾配を使用するシリカクロマトグラフィー(ジクロロメタン中でロードした100gのカートリッジ)によって精製した。適切な画分を合わせ、真空下で蒸発させて、無色液体として表題化合物を得た(8.45g)。
【0207】
LCMS(System B):tRET=2.45min;MH+278
中間体20:フェニルメチル3−(3−ブロモプロピル)−1−ピペリジンカルボキシラート
【化30】

【0208】
フェニルメチル3−(3−ヒドロキシプロピル)−1−ピペリジンカルボキシラート(例えば中間体19のために調製された)から、中間体10と同様に調製した。
【0209】
LCMS(System B):tRET=3.44min;MH+340/342
中間体21:フェニルメチル3−{3−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペリジンカルボキシラート
【化31】

【0210】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)およびフェニルメチル3−(3−ブロモプロピル)−1−ピペリジンカルボキシラート(例えば中間体20のために調製された)から、中間体11と同様に調製した。
【0211】
LCMS(System D):tRE=3.39min;MH+497
中間体22:2−(ブチルオキシ)−8−(メチルオキシ)−9−[3−(3−ピペリジニル)プロピル]−9H−プリン−6−アミン
【化32】

【0212】
フェニルメチル3−{3−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペリジンカルボキシラート(例えば中間体21のために調製された)から、中間体12と同様に調製した。
【0213】
LCMS(System D):tRET=2.43min;MH+363
中間体23:フェニルメチル3−(4−ヒドロキシブチル)−1−ピペリジンカルボキシラート
【化33】

【0214】
無水THF(40mL)中の4−(1−{[(フェニルメチル)オキシ]カルボニル}−3−ピペリジニル)ブタン酸(例えばAstatechから商業的に入手可能)(5.01g、16.41mmol)の溶液に、ボラン−THF錯体の溶液(THF中の1M溶液)(49.2mL、49.2mmol)を窒素下で0℃で1時間にわたり1滴ずつ添加した。混合物を0℃で撹拌したままにし、20時間にわたり徐々に室温まで暖まるように放置した。混合物をアイスバス中で冷却し、MeOH(20mL)の滴下による添加で慎重にクエンチし、2時間コールドバス中で撹拌し、次いで10%の2N HCl/MeOH(20mL)でさらにクエンチし、室温で1時間撹拌し、減圧下で蒸発させた。残留物をメタノールにより数回共蒸発させた。サンプルを、30分にわたる0〜100%の酢酸エチル−シクロヘキサンの勾配を使用するシリカクロマトグラフィー(ジクロロメタン/EtOAc中でロードした100g)によって精製し、Flashmaster IIでの45mL画分すべてを回収した。適切な画分を合わせ、真空下で蒸発させて、無色油として表題化合物を得た(4.55g)。
【0215】
LCMS(System B):tRET=2.64min;MH+292
中間体24:フェニルメチル3−(4−ブロモブチル)−1−ピペリジンカルボキシラート
【化34】

【0216】
フェニルメチル3−(4−ヒドロキシブチル)−1−ピペリジンカルボキシラート(例えば中間体23のために調製された)から、中間体10と同様に調製した。
【0217】
LCMS(System B):tRET=3.62min;MH+354/356
中間体25:フェニルメチル3−{4−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]ブチル}−1−ピペリジンカルボキシラート
【化35】

【0218】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)およびフェニルメチル3−(4−ブロモブチル)−1−ピペリジンカルボキシラート(例えば中間体24のために調製された)から、中間体11と同様に調製した。
【0219】
LCMS(System B):tRET=3.08min;MH+511
中間体26:2−(ブチルオキシ)−8−(メチルオキシ)−9−[4−(3−ピペリジニル)ブチル]−9H−プリン−6−アミン
【化36】

【0220】
フェニルメチル3−{4−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]ブチル}−1−ピペリジンカルボキシラートから、中間体12と同様に調製した。
【0221】
LCMS(System B):tRET=1.43min;MH+377
中間体27:フェニルメチル4−{[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]メチル}−1−ピペリジンカルボキシラート
【化37】

【0222】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)およびフェニルメチル4−(ブロモメチル)−1−ピペリジンカルボキシラート(例えばAcros Organicsから商業的に入手可能)から、中間体11と同様に調製した。
【0223】
LCMS(System B):tRET=2.70min;MH+469
中間体28:2−(ブチルオキシ)−8−(メチルオキシ)−9−(4−ピペリジニルメチル)−9H−プリン−6−アミン
【化38】

【0224】
フェニルメチル4−{[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]メチル}−1−ピペリジンカルボキシラートから、中間体12と同様に調製した。
【0225】
LCMS(System B):tRET=1.13min;MH+335
中間体29:フェニルメチル4−{2−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]エチル}−1−ピペリジンカルボキシラート
【化39】

【0226】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)およびフェニルメチル4−(2−ブロモエチル)−1−ピペリジンカルボキシラート(調製に関してはJ.Med.Chem.,2003,46(13),2606を参照されたい)から、中間体11と同様に調製されした。
【0227】
LCMS(System B):tRET=2.90min;MH+483
中間体30:2−(ブチルオキシ)−8−(メチルオキシ)−9−[2−(4−ピペリジニル)エチル]−9H−プリン−6−アミン
【化40】

【0228】
フェニルメチル4−{2−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]エチル}−1−ピペリジンカルボキシラート(例えば中間体29のために調製された)から、中間体12と同様に調製した。
【0229】
LCMS(System D):tRET=2.23min;MH+349
中間体31:フェニルメチル4−{3−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペリジンカルボキシラート
【化41】

【0230】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)およびフェニルメチル4−(3−ブロモプロピル)−1−ピペリジンカルボキシラート(調製に関してはJ.Med.Chem.,2003,46(13),2606を参照されたい)から、中間体11と同様に調製した。
【0231】
LCMS(System D):tRET=3.39min;MH+497
中間体32:2−(ブチルオキシ)−8−(メチルオキシ)−9−[3−(4−ピペリジニル)プロピル]−9H−プリン−6−アミン
【化42】

【0232】
フェニルメチル4−{3−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペリジンカルボキシラート(例えば中間体31のために調製された)から、中間体12と同様に調製した。
【0233】
LCMS(System D):tRET=2.39min;MH+363
中間体33:フェニルメチル4−{4−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]ブチル}−1−ピペリジンカルボキシラート
【化43】

【0234】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)およびフェニルメチル4−(4−ブロモブチル)−1−ピペリジンカルボキシラート(調製に関してはJ.Med.Chem.,2003,46(13),2606を参照されたい)から、中間体11と同様に調製した。
【0235】
LCMS(System B):tRET=3.23min;MH+511
中間体34:2−(ブチルオキシ)−8−(メチルオキシ)−9−[4−(4−ピペリジニル)ブチル]−9H−プリン−6−アミン
【化44】

【0236】
フェニルメチル4−{4−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]ブチル}−1−ピペリジンカルボキシラート(例えば中間体33のために調製された)から、中間体12と同様に調製した。
【0237】
LCMS(System B):tRET=1.47min;MH+377
中間体35:フェニルメチル4−(5−ブロモペンチル)−1−ピペリジンカルボキシラート
【化45】

【0238】
フェニルメチル4−(5−ヒドロキシペンチル)−1−ピペリジンカルボキシラート(調製についてはChem.Pharm.Bull.,1986,34(9),3747−3761を参照されたい)から、中間体10と同様に調製した。
【0239】
LCMS(System B):tRET=3.82min;MH+368/370
中間体36:フェニルメチル4−{5−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]ペンチル}−1−ピペリジンカルボキシラート
【化46】

【0240】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)およびフェニルメチル4−(5−ブロモペンチル)−1−ピペリジンカルボキシラート例えば中間体35のために調製された)から、中間体11と同様に調製した。
【0241】
LCMS(System B):tRET=3.31min;MH+525
中間体37:2−(ブチルオキシ)−8−(メチルオキシ)−9−[5−(4−ピペリジニル)ペンチル]−9H−プリン−6−アミン
【化47】

【0242】
フェニルメチル4−{5−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]ペンチル}−1−ピペリジンカルボキシラート(例えば中間体36のために調製された)から、中間体12と同様に調製した。
【0243】
LCMS(System B):tRET=1.55min;MH+391
中間体38:2−(ブチルオキシ)−9−(3−クロロプロピル)−8−(メチルオキシ)−9H−プリン−6−アミン
【化48】

【0244】
無水DMF(50mL)中の2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)(4.7g、13.38mmol)および炭酸カリウム(4.62g、33.4mmol)を、窒素下で50℃で75分間撹拌および加熱した。混合物を室温まで冷えるように放置し、次いで0℃まで冷却し、1−ブロモ−3−クロロプロパン(例えばAldrichから商業的に入手可能)(2.106g、13.38mmol)を添加した。混合物を0〜10℃で約5時間撹拌し、次いで室温まで暖まるように放置し、さらに約40時間撹拌し、このときLCMSにより所望の産物が約70%であることが示された。混合物を沈降させ、上清をピペットで除去し、溶媒を高真空ポンプを使用する回転蒸発装置で約23℃で蒸発させた。クロロホルムおよび水を合わせた残留物に添加し、撹拌し、相を疎水性フリットを使用して分離した。水層をクロロホルムのさらなる小分けで再抽出し、合わせたクロロホルム抽出物を23℃で高真空下で蒸発させて、黄色固体を得た(2.798g)。この粗製物質を2回の類似調製から得られた類似物質(0.56gおよび0.995g)と共に合わせ、溶出剤として2:1酢酸エチル/クロロホルムを使用するシリカフラッシュカラムクロマトグラフィーによって精製して、灰白色固体として表題化合物を得た(3.011g)。
【0245】
LCMS(System D):tRET=2.79min;MH+314/316
中間体39:2−(4−{3−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペラジニル)エタノール
【化49】

【0246】
2−(ブチルオキシ)−9−(3−クロロプロピル)−8−(メチルオキシ)−9H−プリン−6−アミン(例えば中間体39のために調製された)(80mg、0.255mmol)、DIPEA(0.134mL、0.765mmol)および2−(1−ピペラジニル)エタノール(例えばAldrichから商業的に入手可能)(133mg、1.020mmol)を、Radleyグリーンハウスにおいて試験管中のアセトニトリル(2 mL)中で加熱した。反応物を70℃で28時間加熱し、次いで冷えるように放置し、真空下で蒸発させた。炭酸水素ナトリウム水溶液を添加し、混合物をクロロホルムで数回抽出し、このクロロホルムを疎水性フリットセパレーターを濾過させた。溶媒を除去し、茶色のゴムを得て(171mg)、MDAPで精製した(方法A)。画分を真空下で蒸発させ、残留物の炭酸水素ナトリウム溶液/クロロホルム抽出を以前のように行い、溶媒を除去して、無色油として表題化合物を得た(80mg)。
【0247】
LCMS(System D):tRET=2.06min;MH+408
中間体40:N2−ブチル−9−(3−クロロプロピル)−8−(メチルオキシ)−9H−プリン−2,6−ジアミン
【化50】

【0248】
N2−ブチル−8−(メチルオキシ)−9H−プリン−2,6−ジアミントリフルオロ酢酸塩(例えば中間体8のために調製された)(701mg、2.001mmol)および炭酸カリウム(690mg、4.99mmol)をDMF(10mL)中で懸濁し、混合物を窒素下で50℃で2時間加熱した。混合物を冷えるように放置し、次いで1−ブロモ−3−クロロプロパン(198μL、2.002mmol)を添加し、反応混合物を周囲温度で一晩撹拌した。16時間後に、反応混合物を水とDCM(各々25mL)との間で分配した。水相をさらなるDCM(2×20mL)で抽出した。合わせたDCM抽出物を硫酸マグネシウムの上で乾燥し、真空下で濃縮して、若干の固体が存在する淡黄色油として純粋でない表題化合物を得て(0.76g)、さらなる精製なしに使用した。
【0249】
LCMS(System D):tRET=2.75min;MH+=313/315
中間体41:2−(4−{3−[6−アミノ−2−(ブチルアミノ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペラジニル)エタノール
【化51】

【0250】
N2−ブチル−9−(3−クロロプロピル)−8−(メチルオキシ)−9H−プリン−2,6−ジアミン(例えば中間体40のために調製された)(100mg、0.320mmol)(0.8当量のDMFを含んでいるので実際には120mgを使用した)を、洗浄して中に入れるためにDMF(2mL)を使用して、小試験管の中へ計量した。この溶液に、DIPEA(167μL、0.959mmol)、続いて2−(1−ピペラジニル)エタノール(例えばAldrichから商業的に入手可能)(78μL、0.636mmol)を添加した。生じた淡黄色溶液を窒素下で70℃で18時間撹拌しながら加熱した。反応混合物を水とDCM(各々約10mL)との間で分配した。層を疎水性フリットを使用して分離し、水層をさらなるDCM(2×10mL)で抽出した。合わせたDCM抽出物を真空下で、次いで窒素フロー下で濃縮した。残留物(まだDMFを含む)をMeOHで2mLの全体積に希釈し、MDAPによって精製した(方法A)。産物画分を合わせ、真空下で、次いで窒素フロー下で濃縮して、無色ガラスとして表題化合物を得た(45.9mg)。
【0251】
LCMS(System D):tRET=1.95min;MH+407
中間体42:2−(ブチルオキシ)−9−(4−クロロブチル)−8−(メチルオキシ)−9H−プリン−6−アミン
【化52】

【0252】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)(2g、5.69mmol)および炭酸カリウム(1.967g、14.23mmol)をDMF(20mL)中で懸濁し、窒素下で50℃まで30分間加熱した。混合物を室温まで冷却し、1−ブロモ−4−クロロブタン(例えばAldrichから商業的に入手可能)(0.656mL、5.69mmol)を添加し、室温で20時間継続して撹拌した。溶媒を減圧下で蒸発させ、残留物をDCM(40mL)と水(40mL)との間で分配した。層を疎水性フリットを使用して分離し、水層をDCM(10mL)で洗浄した。合わせた有機抽出物を真空下で濃縮し、粗製物質を得て、これを、30分にわたるシクロヘキサン:酢酸エチルの0〜100%の勾配によるFlashmaster(70gカートリッジ)の溶出を使用するシリカクロマトグラフィーによって精製した。産物を含む画分を合わせ、蒸発させて、白色固体として表題化合物を得た(1.4g)。
【0253】
LCMS(System D):tRET=2.92min;MH+=328/330
中間体43:N2−ブチル−9−(4−クロロブチル)−8−(メチルオキシ)−9H−プリン−2,6−ジアミン
【化53】

【0254】
N2−ブチル−8−(メチルオキシ)−9H−プリン−2,6−ジアミントリフルオロ酢酸塩(例えば中間体8のために調製された)(5g、14.27mmol)および炭酸カリウム(4.93g、35.7mmol)をDMF(40mL)中で懸濁し、窒素下で50℃まで30分間加熱した。混合物を室温まで冷却し、1−ブロモ−4−クロロブタン(例えばAldrichから商業的に入手可能)(1.645mL、14.27mmol)を添加し、室温で20時間継続して撹拌した。溶媒を真空下で濃縮し、残留物をDCM(100mL)と水(100mL)との間で分配した。層を疎水性フリットを使用して分離し、水相をDCM(100mL)で再抽出した。合わせた有機物抽出物を真空下で濃縮し、残留物をFlashmaster装置(100gシリカカートリッジ)を使用し、40分にわたるDCM:メタノールの0〜25%の勾配を使用するクロマトグラフィーによって精製した。所望の画分を合わせ、真空下で濃縮して、黄色油として純粋でない表題化合物を得た(5.1g)。
【0255】
LCMS(System D):tRET=2.88min;MH+=327/329
中間体44:2−(ブチルオキシ)−9−(5−クロロペンチル)−8−(メチルオキシ)−9H−プリン−6−アミン
【化54】

【0256】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)(2g、5.69mmol)および炭酸カリウム(1.967g、14.23mmol)をDMF(20mL)中で懸濁し、窒素下で50℃まで1時間加熱した。混合物を室温まで冷却し、1−ブロモ−5−クロロペンタン(例えばAldrichから商業的に入手可能)(0.75mL、5.69mmol)を添加し、室温で18時間継続して撹拌した。反応混合物をDCM(40mL)と水(40mL)との間で分配し、層を疎水性フリットを使用して分離した。水層をDCM(10mL)で再び抽出し、合わせた有機層を飽和塩化リチウム溶液で洗浄し、分離し(疎水性フリット)、真空下で濃縮して、黄色油として表題化合物を得た(1.946g)。
【0257】
LCMS(System B):tRET=2.58min;MH+=342/344
実施例1:6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−2−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン
【化55】

【0258】
DMF(0.5mL)中の2−(ブチルオキシ)−8−(メチルオキシ)−9−[3−(2−ピペリジニル)プロピル]−9H−プリン−6−アミン(例えば中間体12のために調製された)(0.036g、0.10mmol)を、2−ブロモエタノール(例えばAldrichから商業的に入手可能)(0.0085mL、0.12mmol)(アセトニトリル(1mL)中の1mmolのストック溶液を0.12mLで分注した)に添加した。DIPEA(0.040mL、0.23mmol)を添加し、反応混合物を50℃で18時間加熱した。2−ブロモエタノール溶液(0.080mL、0.08mmol)およびDIPEA(0.040mL、0.23mmol)の追加の小分けを添加し、さらに18時間継続して加熱した。反応混合物をDMSO:MeOH(0.2mL)で希釈し、生じた溶液をMDAPによって精製した(方法A)。適切な画分を合わせ、真空下で蒸発させた。残留物をジオキサン(0.2mL)中の4M HCl中で溶解し、室温で4時間放置した。溶媒をRadleysブローダウン装置において窒素気流下で乾燥した。残留物をメタノール(0.5mL)中で再溶解し、0.1gのアミノプロピルSPE(メタノールでプレコンディショニング、1.5mL)の上部にアプライした。カートリッジをメタノール(1.5mL)で洗浄した。溶媒をRadleysブローダウン装置において窒素気流下で乾燥して、表題化合物を得た(0.0053g)。
【0259】
LCMS(System A):tRET=0.64min;MH+393
実施例2:6−アミノ−2−(ブチルオキシ)−9−{[1−(2−ヒドロキシエチル)−3−ピペリジニル]メチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化56】

【0260】
2−(ブチルオキシ)−8−(メチルオキシ)−9−(−ピペリジニルメチル)−9H−プリン−6−アミン(例えば中間体14のために調製された)(33.4mg、0.1mmol)をDMF(0.3mL)中で懸濁し、2−ブロモエタノール(例えばAldrichから商業的に入手可能)(0.0071mL、0.100mmol)に添加した。DIPEA(0.040mL、0.23mmol)を添加した。反応物を、栓を付けたバイアル中で周囲温度で一晩振盪した。反応混合物をDMSO(0.4mL)で希釈し、生じた溶液をMDAPによって精製した(方法A)。適切な画分を合わせ真空下で蒸発させた。残留物をジオキサン(0.4mL)中の4M HCl中で溶解し、室温で一晩放置した。溶媒をRadleysブローダウン装置中の窒素気流下で乾燥した。残留物をメタノール(0.5mL)中で再溶解し、0.5gのアミノプロピルSPE(メタノールでプレコンディショニング、2CV)の上部にアプライした。カートリッジをメタノール(2mL)で洗浄した。溶媒をRadleysブローダウン装置において窒素気流下で乾燥して、表題化合物を得た(0.022g)。
【0261】
LCMS(System A):tRET=0.57min;MH+365
実施例3:6−アミノ−2−(ブチルオキシ)−9−{2−[1−(2−ヒドロキシエチル)−3−ピペリジニル]エチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化57】

【0262】
2−(ブチルオキシ)−8−(メチルオキシ)−9−[2−(3−ピペリジニル)エチル]−9H−プリン−6−アミン(例えば中間体18のために調製された)および2−ブロモエタノール(例えばAldrichから商業的に入手可能)から、実施例1と同様に調製した。
【0263】
LCMS(System A):tRET=0.62min;MH+379
実施例4:6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−3−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン
【化58】

【0264】
2−(ブチルオキシ)−8−(メチルオキシ)−9−[3−(3−ピペリジニル)プロピル]−9H−プリン−6−アミン(例えば中間体22のために調製された)および2−ブロモエタノール(例えばAldrichから商業的に入手可能)から、実施例1と同様に調製した。
【0265】
LCMS(System A):tRET=0.61min;MH+393
実施例5:6−アミノ−2−(ブチルオキシ)−9−{4−[1−(2−ヒドロキシエチル)−3−ピペリジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化59】

【0266】
2−(ブチルオキシ)−8−(メチルオキシ)−9−[4−(3−ピペリジニル)ブチル]−9H−プリン−6−アミン(例えば中間体26のために調製された)および2−ブロモエタノール(例えばAldrichから商業的に入手可能)から、実施例1と同様に調製した。
【0267】
LCMS(System A):tRET=0.66min;MH+407
実施例6:6−アミノ−2−(ブチルオキシ)−9−{[1−(2−ヒドロキシエチル)−4−ピペリジニル]メチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化60】

【0268】
DMF(0.4mL)中の2−(ブチルオキシ)−8−(メチルオキシ)−9−(4−ピペリジニルメチル)−9H−プリン−6−アミン(例えば中間体28のために調製された)(0.0335g、0.10mmol)を、2−ブロモエタノール(例えばAldrichから商業的に入手可能)(0.0085mL、0.12mmol)に添加した。DIPEA(0.040mL、0.23mmol)を添加し、反応混合物を50℃で18時間加熱した。追加のDIPEA(0.040mL、0.23mmol)を添加し、さらに18時間継続して加熱した。反応混合物をDMSO:MeOH(0.25mL)で希釈し、生じた溶液をMDAPによって精製した(方法A)。適切な画分を合わせ、真空下で蒸発させた。残留物をジオキサン(0.2mL)中の4M HCl中で溶解し、4時間室温で放置した。溶媒をRadleysブローダウン装置において窒素気流下で乾燥した。残留物をメタノール(0.5mL)中で再溶解し、0.1gのアミノプロピルSPE(メタノールでプレコンディショニング、1.5mL)の上部にアプライした。カートリッジをメタノール(1.5mL)で洗浄した。溶媒をRadleysブローダウン装置において窒素気流下で乾燥して、表題化合物を得た(0.0053g)。
【0269】
LCMS(System B):tRET=1.21min;MH+365
実施例7:6−アミノ−2−(ブチルオキシ)−9−{2−[1−(2−ヒドロキシエチル)−4−ピペリジニル]エチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化61】

【0270】
2−(ブチルオキシ)−8−(メチルオキシ)−9−[2−(4−ピペリジニル)エチル]−9H−プリン−6−アミン(例えば中間体30のために調製された)および2−ブロモエタノール(例えばAldrichから商業的に入手可能)から、実施例1と同様に調製した。
【0271】
LCMS(System B):tRET=1.26min;MH+379
実施例8:6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−4−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン
【化62】

【0272】
2−(ブチルオキシ)−8−(メチルオキシ)−9−[3−(4−ピペリジニル)プロピル]−9H−プリン−6−アミンおよび2−ブロモエタノール(例えばAldrichから商業的に入手可能)から、実施例1と同様に調製した。
【0273】
LCMS(System A):tRET=0.62min;MH+393
実施例9:6−アミノ−2−(ブチルオキシ)−9−{4−[1−(2−ヒドロキシエチル)−4−ピペリジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化63】

【0274】
DMF(0.4mL)中の2−(ブチルオキシ)−8−(メチルオキシ)−9−[4−(4−ピペリジニル)ブチル]−9H−プリン−6−アミン(例えば中間体34のために調製された)(0.038g、0.10mmol)を、2−ブロモエタノール(0.0085mL、0.12mmol)に添加した。DIPEA(0.040mL、0.23mmol)を添加し、反応混合物を50℃で18時間加熱した。2−ブロモエタノール(例えばAldrichから商業的に入手可能)(0.015mL)およびDIPEA(0.040mL、0.23mmol)の追加の小分けを添加し、さらに7時間継続して加熱した。反応混合物を室温で72時間撹拌し、次いでDMSO:MeOH(0.2mL)で希釈し、生じた溶液をMDAPによって精製した(方法A)。適切な画分を合わせ、真空下で蒸発させた。残留物をジオキサン(0.2mL)中の4M HCl中で溶解し、室温で18時間放置した。溶媒をRadleysブローダウン装置において窒素気流下で乾燥した。サンプルを1:1 MeOH:DMSO(0.6mL)中で溶解し、TFAモディファイアーと共にアセトニトリル水を使用するSunfire C18カラムで質量分析によるAutoPrepによって精製した。溶媒を真空下で蒸発させた。残留物をメタノール(0.5mL)中で再溶解し、0.1gのアミノプロピルSPE(メタノールでプレコンディショニング、1.5mL)の上部にアプライした。カートリッジをメタノール(1.5mL)で洗浄した。溶媒をRadleysブローダウン装置において窒素気流下で乾燥して、表題化合物を得た(0.0133g)。
【0275】
LCMS(System B):tRET=1.46min;MH+407
実施例10:6−アミノ−2−(ブチルオキシ)−9−{5−[1−(2−ヒドロキシエチル)−4−ピペリジニル]ペンチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化64】

【0276】
2−(ブチルオキシ)−8−(メチルオキシ)−9−[5−(4−ピペリジニル)ペンチル]−9H−プリン−6−アミン(例えば中間体37のために調製された)および2−ブロモエタノール(例えばAldrichから商業的に入手可能)から、実施例1と同様に調製した。
【0277】
LCMS(System B):tRET=1.57min;MH−419
実施例11:6−アミノ−2−(ブチルオキシ)−9−{3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン
【化65】

【0278】
2−(4−{3−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペラジニル)エタノール(例えば中間体39のために調製された)(80mg、0.196mmol)をメタノール(5.5mL)中で溶解し、1,4−ジオキサン(1.2mL)中の4M HClを添加した。溶液を室温で一晩撹拌し、次いで真空下で蒸発させた。固形残留物を最小量のメタノール中に取り上げ、50mLメタノールでプレコンディショニングした2gのアミノプロピルSPE上に置いた。適切な画分を真空下で蒸発させて、白色固体として表題化合物を得た(68mg)。
【0279】
LCMS(System D):tRET=1.80min;MH+394
実施例12:6−アミノ−2−(ブチルアミノ)−9−{3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン
【化66】

【0280】
2−(4−{3−[6−アミノ−2−(ブチルアミノ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペラジニル)エタノールから、実施例11と同様に調製した。
【0281】
LCMS(System D):tRET=1.78min;MH+393
実施例13:6−アミノ−2−(ブチルオキシ)−9−{4−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化67】

【0282】
2−(ブチルオキシ)−9−(4−クロロブチル)−8−(メチルオキシ)−9H−プリン−6−アミン(例えば中間体42のために調製された)(100mg、0.305mmol)、DIPEA(0.160mL、0.915mmol)および2−(1−ピペラジニル)エタノール(例えばAldrichから商業的に入手可能)(0.075mL、0.61mmol)を、DMF(2.2mL)中で溶解した。反応混合物を撹拌し、窒素下で50℃で一晩加熱した。追加の2−(1−ピペラジニル)エタノール(0.075 mL、0.61mmol)を添加し、混合物を80℃で20時間加熱した。反応混合物を室温まで冷却し、水(5mL)とDCM(6mL)との間で分配した。層を疎水性フリットを使用して分離し、水層をDCM(5mL)で洗浄した。合わせた有機層を真空下で濃縮した。残留物をDMSO(1mL)中で溶解し、炭酸アンモニウムモディファイアーと共にアセトニトリル水を使用するXbridgeカラムでMDAPによって精製した。所望の画分を合わせ、窒素ブローダウン下で濃縮した。残留物をメタノール(2mL)中で溶解し、ジオキサン(3mL)中の4M HClを添加した。反応混合物を30分間撹拌し、次いで溶液を室温で1時間放置した。反応混合物を窒素ブローダウン下で濃縮し、次いでMeOH中で溶解し、NH2(1g)を介して溶出した。カラムをMeOH(3CV)で洗浄した。溶媒を窒素ブローダウン下で除去し、茶色固体を得た。サンプルをDMSO(1mL)中で溶解し、炭酸アンモニウムモディファイアーと共にアセトニトリル水を使用するXbridgeカラムでMDAPによって精製した。所望の画分を合わせ、窒素ブローダウン下で濃縮して、白色固体(0.0262g)として表題化合物を得た。
【0283】
LCMS(System D):tRET=1.89min;MH+408
実施例14:6−アミノ−2−(ブチルアミノ)−9−{4−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化68】

【0284】
N2−ブチル−9−(4−クロロブチル)−8−(メチルオキシ)−9H−プリン−2,6−ジアミンから、実施例13と同様に調製した。
【0285】
LCMS(System D):tRET=1.85min;MH+407
実施例15:6−アミノ−2−(ブチルオキシ)−9−{5−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ペンチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化69】

【0286】
MeCN中の2−(ブチルオキシ)−9−(5−クロロペンチル)−8−(メチルオキシ)−9H−プリン−6−アミン(例えば中間体44のために調製された)の溶液(410mgの溶解によって調製した、MeCN(2.4mL)中の1.2mmol)の小分け(0.2mL、0.1mmol)を、2−(1−ピペラジニル)エタノール(例えばAldrichから商業的に入手可能)(0.1mmol)に、試験管中で添加した。DIPEA(50μl、3当量)およびヨウ化ナトリウム(5mg)を添加した。反応混合物をRadleysグリーンハウスにおいて60℃まで18時間加熱した。サンプルを濾過し、次いでDMSO(0.3mL)を添加し、溶液を炭酸アンモニウムモディファイアーと共にアセトニトリル水を使用するXbridgeカラムでMDAPによって精製した。溶媒をGenevacを使用して真空下で蒸発させて、中間体を得た。各々のバイアルに2N HCl/MeOH(200μL)を添加し、キャップをし、室温で4時間放置した。溶媒をRadleysブローダウン装置において窒素気流下で乾燥した。残留物をメタノール(0.5mL)中で再溶解し、アミノプロピルSPE(0.1g、3mL、メタノール(1.5mL)中でプレコンディショニング)の上部にアプライした。カートリッジをメタノール(2×1.5mL)で洗浄した。溶媒を除去し、表題化合物を得た(0.0175g)。
【0287】
LCMS(System B):tRET=1.11min;MH+422
実施例16:6−アミノ−2−(ブチルオキシ)−9−(5−{4−[2−(メチルオキシ)エチル]−1−ピペラジニル}ペンチル)−7,9−ジヒドロ−8H−プリン−8−オン
【化70】

【0288】
2−(ブチルオキシ)−9−(5−クロロペンチル)−8−(メチルオキシ)−9H−プリン−6−アミン(例えば中間体44のために調製された)および1−[2−(メチルオキシ)エチル]ピペラジン(例えばAldrichから商業的に入手可能)から、実施例15と同様に調製した。
【0289】
LCMS(System B):tRET=1.21min;MH+436
実施例17:6−アミノ−2−(ブチルオキシ)−9−(5−{4−[2−(エチルオキシ)エチル]−1−ピペラジニル}ペンチル)−7,9−ジヒドロ−8H−プリン−8−オン
【化71】

【0290】
2−(ブチルオキシ)−9−(5−クロロペンチル)−8−(メチルオキシ)−9H−プリン−6−アミン(例えば中間体44のために調製された)および1−[2−(エチルオキシ)エチル]ピペラジン(例えばAldrichから商業的に入手可能)から、実施例15と同様に調製した。
【0291】
LCMS(System B):tRET=1.28min;MH+450
生物学的データ
本発明の化合物を、以下のアッセイまたは類似のアッセイに従って、インビトロ生物学的活性について試験した。
【0292】
凍結保存されたヒト末梢血単核細胞(PBMC)を使用する、インターフェロン−αの誘導のためのアッセイ
化合物調製
化合物をDMSO中に溶解した。DMSOにより連続的な2倍希釈を調製し、0.25μLを384ウェルの透明なGreinerポリプロピレンプレートの中へ分注した。
【0293】
PBMCの調製
最大200mLの血液サンプルを健康なヒトドナーから得た。25mL体積の全血をLeucosepチューブ中の15mLフィコール勾配上に重層し、1000gで20分間遠心分離した。血漿/histopaque界面のバンドの細胞を慎重に取り出し、PBSで2回洗浄した(400gで5分間遠心分離して採取した)。最終的なペレットを、凍結培地(90%非動化血清、10%DMSO)中で4×107細胞/mLの細胞濃度に再懸濁した。次いで再懸濁した細胞を速度制御フリーザーを使用して凍結保存(凍結)し、最大4か月間−140℃で保存した。
【0294】
インキュベーションおよびインターフェロン−αについてのアッセイ
アッセイの直前に、凍結保存(凍結)したPBMCのバイアルを37℃のウォーターバス中で迅速に解凍した。1:10で希釈したトリパンブルー中の細胞を調製しカウントした。次いでPBMCを、増殖培地[10%ウシ胎仔血清(invitrogen)、ペニシリン+ストレプトアビジン(Gibcoカタログ番号25030−024、1:50)、L−グルタミン2mM、および1000単位/mL組換えヒトIFN−γ(Preprotechカタログ番号300−02)を含むRPMI 1640]中で、1×106細胞/mLの密度に希釈し、0.25μLのDMSO、または0.25μLのDMSO中の試験化合物を含む384ウェルの透明なGreinerポリプロピレンプレートに50μL/ウェルで分注した。化合物の最終的な最高濃度は、典型的には50μMまたは5μMであった(高活性化合物に適する曲線を得るために)。プレートを5% CO2中で37℃で24時間インキュベーションした。
【0295】
マルチアイソフォームイムノアッセイを使用してPBMC上清中のIFN−αを定量した。ヒトIFN−αに対するウサギポリクローナル抗体(カタログ番号31101、Stratech Scientific)を、アッセイ緩衝液(10%のウシ胎仔血清(Invitrogen)を含むRPMI 1640)中で1:10000希釈し、20μLを、MSD(Meso−Scale Discovery)single small−spot 384ウェルGAR(ヤギ抗ウサギ抗体がコートされた)プレートの各ウェルに添加した。プレートを激しく振盪しながら室温で1時間インキュベーションした。PBSによる3回の洗浄に続いて、20μLの細胞上清をプレートの各ウェルに添加した。次いでプレートを激しく振盪しながら室温で1時間インキュベーションした。IFN−αに対する1対のモノクローナル抗体(カタログ番号21100および21112、Stratech Scientific)をsulfo−TAG(MSD)で標識し、アッセイ緩衝液中で1:1000に希釈し、20μLをプレートの各ウェルに添加した。プレートを激しく振盪しながら室温で1時間さらにインキュベーションした。PBSによる3回の洗浄に続いて、30μLの2倍T緩衝液(MSD)を各ウェルに添加し、プレートをMSD Sector 6000プレートリーダーで読み取った。
【0296】
データを、1μMレジキモド(n=16)およびDMSO(n=16)の内部プレート対照に対して正規化した。pEC50値は、ActivityBaseにおけるIRLSによる4−パラメータの曲線フィットによって、11点の試験化合物の2倍連続希釈から導き出した。
【0297】
結果
実施例1〜17は、>5.8の平均pEC50であった。
【0298】
新鮮ヒト末梢血単核細胞(PBMC)を使用するインターフェロン−αおよびTNF−αの誘導についてのアッセイ
化合物調製
化合物をDMSO中で溶解し連続希釈し、Biomek 2000を使用して必要とされる100倍の濃度範囲を提供した。1μLの試験化合物をBiomek FXを使用して96ウェル組織培養プレートの中へ移した。各化合物は、各ドナーについて二重でアッセイした。各プレートはスタンダードとしてTLR7/8アゴニストレジキモドの希釈系列を含み、11カラムは1μLの200μMレジキモド(2μMの最終濃度を提供し、レジキモドに対するおよその最大反応を定義するのに使用した)を含んでいた。
【0299】
PBMCの調製
2名のヒトドナーからの血液サンプルをヘパリンナトリウム(10U/mL)の中へ回収した。25mL体積の全血をLeucosepチューブ中の15mL Histopaque上に重層し、800gで20分間遠心分離し、血漿/histopaque界面のバンドを慎重に取り出した。回収した細胞を2500rpmで10分間遠心分離し、ペレットを10mLの培地(10%v/vウシ胎仔血清(FCS、低エンドトキシン)、100U/mLペニシリンG、100μg/mLストレプトマイシン、10mM L−グルタミンおよび1×非必須アミノ酸を補足したRPMI 1640(低エンドトキシン))中で再懸濁した。1:20希釈の細胞をトリパンブルーを使用して調製し、細胞を血球計数器を使用してカウントした。PBMCを希釈して2×106/mLの最終濃度にし、100μLのこの細胞懸濁物を1μLの希釈した試験化合物を含むウェルへ添加した。
【0300】
インキュベーションならびにインターフェロン−αおよびTNF−αについてのアッセイ
細胞調製物を24時間インキュベーションし(37℃、95%空気、5% CO2)、その後上清のサンプルをBiomek FXを使用して取り出し、MSD(Mesoscale Discovery)電気化学ルミネセンスアッセイプラットフォームを使用してIFN−αおよびTNF−αの両方についてアッセイした。IFN−αアッセイは上記のものと同様に行った。TNF−αアッセイはキット説明書(カタログ番号K111BHB)の通り行った。
【0301】
放出されたサイトカインを、2μMレジキモドの対照(11カラム)のパーセンテージとして表現した。このパーセンテージを化合物濃度に対してプロットし、応答に対するpEC50を非線形最小二乗曲線のフィッティングによって決定した。IFN−α応答について、一般的には4−パラメータロジスティックモデルを選択した。明らかに最大の応答が得られた(すなわち、応答において明確なプラトーが観察された)TNF応答については、一般的には4−パラメータモデルを使用した。曲線の上部漸近線が明確でなかったならば、曲線のフィッティングは、一般的には100%の最大反応に対して(すなわち2μMレジキモドへの応答に対して)または試験した最高濃度の応答がレジキモド応答を超えたならばこの濃度の応答に対して制約された。いくつかの曲線は1つのまたは両方のサイトカインについてベル型であり、ベル型応答の下に向かう斜面(すなわち最大反応を与える濃度より上の濃度)でのサイトカインデータは、一般的にはフィットから除外したが、通常ピーク応答のすぐ上の濃度は例外とした。したがって曲線のフィッティングは用量応答曲線の上に向かう斜面に集中した。
【0302】
結果
実施例2は、IFN−αおよびTNF−αの誘導についてのpEC50が、それぞれ7.2および4.8であることを示した。
【0303】
実施例10は、IFN−αおよびTNF−αの誘導についてのpEC50が、それぞれ9.3および5.5であることを示した。
【0304】
実施例17は、IFN−αおよびTNF−αの誘導についてのpEC50が、それぞれ7.8および5.3であることを示した。
【技術分野】
【0001】
本発明は、化合物、それらの調製のためのプロセス、それらを含む組成物に関し、様々な障害、特にアレルギー性疾患および他の炎症状態(例えばアレルギー性鼻炎および喘息)、感染症、癌の治療におけるそれらの使用、ならびにワクチンアジュバントとしてのそれらの使用に関する。
【背景技術】
【0002】
脊椎動物は、微生物の侵入によって絶えず脅かされ、伝染性病原体を除去するために免疫防御の機構を発展させてきた。哺乳類において、この免疫系は2つの支流(先天性免疫および後天性免疫)を含む。宿主側防御の最前線は先天性免疫系であり、マクロファージおよび樹状細胞によって媒介される。後天性免疫は、感染の後期段階での病原体の排除に関与しており、免疫記憶の生成も可能にする。後天性免疫は、遺伝子再構成が行われた抗原特異的受容体を持つリンパ球の莫大なレパートリーに起因して、非常に特異的である。
【0003】
先天性免疫応答はもともと非特異的であると考えられていたが、自己と様々な病原体を区別することが現在知られている。先天性免疫系は、複数の重要な特徴を有する、生殖細胞系列にコードされた限られた数のパターン認識受容体(PRR)を介して微生物を認識する。
【0004】
トール様受容体(TLR)はヒトにおいて記載される10のパターン認識受容体のファミリーである。TLRは先天性免疫細胞によって優先的に発現され、そこでのそれらの役割は、感染の兆候について環境を監視し、活性化に際しては侵入病原体の排除を目的とした防御機構を動員することである。TLRが引き起こした早期の先天性免疫応答は感染の伝播を限定し、その一方でそれらが誘導する炎症誘導性のサイトカインおよびケモカインは、抗原提示細胞、B細胞およびT細胞の動員および活性化をもたらす。TLRは適応的免疫応答の性質を修飾して、樹状細胞活性化およびサイトカイン放出を介する適切な保護を提供することができる(Akira S.,et al,Nat.Immunol.,2001:2,675−680)。異なるTLRアゴニストから見られる応答のプロファイルは、活性化された細胞タイプに依存する。
【0005】
TLR7は、非自己核酸の検出に特殊化された細胞のエンドソームコンパートメント中に局在するTLRのサブグループ(TLR3、7、8および9)のメンバーである。TLR7は1本鎖RNAの認識を介して抗ウイルス防御において重要な役割を果たす(Diebold S.S.,et al,Science,2004:303,1529−1531;Lund J.M.,et al,PNAS,2004:101,5598−5603)。TLR7はヒトにおいて限定された発現プロファイルを有しており、B細胞および形質細胞様樹状細胞(pDC)によって優先的に発現され、単球によってより低い程度で発現される。形質細胞様DCは、リンパ系由来の樹状細胞のユニークな集団であり(末梢血単核細胞(PBMC)のうちの0.2〜0.8%)、これはウイルス感染に応答して高レベルインターフェロンα(IFNα)およびインターフェロンβ(IFNβ)を分泌する主要なI型インターフェロン産生細胞である(Liu Y−J,Annu.Rev.Immunol.,2005:23,275−306)。
【0006】
アレルギー性疾患は、Th2に偏ったアレルゲンに対する免疫応答と関連する。Th2応答はIgEレベルの上昇と関連し、それは肥満細胞に対する効果を介して、アレルゲンに対する過敏性を促進して、例えばアレルギー性鼻炎において見られる症状をもたらす。健康な個人において、アレルゲンに対する免疫応答は、Th2/Th1および調節性T細胞の混合された応答により、よりうまく平衡が保たれる。TLR7リガンドは、インビトロでTh2サイトカインを減少させTh1サイトカイン放出を促進すること、およびインビボでアレルギーの肺モデルにおいてTh2タイプ炎症性応答を寛解することが示さている(Fili L.,et al,J.All.Clin.Immunol.,2006:118,511−517;Moisan J.,et al,Am.J.Physiol.Lung Cell Mol.Physiol.,2006:290,L987−995;Tao et al,Chin.Med.J.,2006:119,640−648)。したがって、TLR7リガンドにはアレルギー患者において見られる免疫応答の平衡を再び保ち、疾患緩和をもたらす可能性がある。
【0007】
哺乳類において効果的な先天性免疫応答の生成の中心となるのは、細胞に作用して複数の効果を誘導するインターフェロンおよび他のサイトカインの誘導を引き起こす機構である。これらの効果は、抗感染性遺伝子発現の活性化、強い抗原特異的免疫を推進するための細胞の抗原提示の活性化、および食細胞におけるファゴサイトーシスの促進を含むことができる。
【0008】
インターフェロンは、ウイルス感染から細胞を保護できる物質として最初に記載された(Isaacs & Lindemann,J.Virus Interference.Proc.R.Soc.Lon.Ser.B.Biol.Sci.1957:147,258−267)。ヒトにおいて、I型インターフェロンは、第9染色体上の遺伝子によってコードされ、少なくとも13個のアイソフォームのインターフェロンα(IFNα)、および1個のアイソフォームのインターフェロンβ(IFNβ)をコードする関連タンパク質のファミリーである。組換えIFNαは最初に承認された生物学的治療剤であり、ウイルス感染および癌における重要な治療法となった。細胞に対する直接的抗ウイルス活性に加えて、インターフェロンは免疫系の細胞に対して作用する強力な免疫応答修飾物質であることが知られている。
【0009】
C型肝炎ウイルス(HCV)疾患のための第一選択療法として、インターフェロンの組み合わせは、ウイルス負荷の軽減に、およびある被験体におけるウイルス複製の消去に、非常に効果的であり得る。しかしながら、多くの患者で持続的なウイルス応答を示すことは不成功であり、これらの患者においてウイルス負荷は制御されない。加えて、インターフェロンの注射による治療法は、コンプライアンスに影響を与えることが示される複数の望まれない有害作用と関連する可能性がある(Dudley T.,et al,Gut.,2006:55(9),1362−3)。
【0010】
I型インターフェロンおよび他のサイトカインの活性化を含む先天性免疫応答を刺激することができる低分子化合物の投与は、ウイルス感染を含むヒト疾患の治療または予防のための重要な戦略になり得る。このタイプの免疫修飾戦略には、感染症だけでなく、癌(Krieg.,Curr.Oncol.Rep.,2004:6(2),88−95)、アレルギー性疾患(Moisan J.,et al,Am.J.Physiol.Lung Cell Mol.Physiol.,2006:290,L987−995)、過敏性大腸疾患等の他の炎症状態(Rakoff−Nahoum S.,Cell.,2004,23,118(2):229−41)において、およびワクチンアジュバント(Persing et al.,Trends Microbiol.,2002:10(10 Suppl),S32−7)としても有用かもしれない化合物を同定する可能性がある。
【0011】
動物モデルにおいて、イミキモドの局所的なアジュバント活性(Adams S.,et al,J.Immunol.,2008,181:776−84;Johnston D.,et al,Vaccine,2006,24:1958−65)、または全身的なアジュバント活性(Fransen F.et al,Infect.Immun.,2007,75:5939−46)が実証された。レジキモドおよび他の関連するTLR7/8アゴニストもアジュバント活性を提示することが示された(Ma R.et al,Biochem.Biophys.Res.Commun.,2007,361:537−42;Wille−Reece U.,et al,Proc.Natl.Acad.Sci.USA,2005,102:15190−4;Wille−Reece U.,et al,米国特許出願公開第2006045885号(A1)明細書)。
【0012】
I型インターフェロンの誘導をもたらす機構は部分的にしか理解されていない。多くの細胞タイプにおいてインターフェロンの誘導をもたらすことができる1つの機構は、RNAヘリカーゼRIG−IおよびMDA5による二本鎖ウイルスRNAの認識である。この機構は、センダイウイルスの細胞感染によってインターフェロンが誘導される一次機構であると考えられる。
【0013】
インターフェロンの誘導のためのさらなる機構はTLR依存性シグナル伝達事象を介するものある。ヒトにおいて、形質細胞様樹状細胞(pDC)は専門のインターフェロン産生細胞であり、例えばウイルス感染に応答して多量のインターフェロンを生じることができる。これらのpDCはTLR7およびTLR9を優先的に発現し、ウイルスのRNAまたはDNAによるこれらの受容体の刺激はそれぞれインターフェロンαの発現を誘導できることが示される。
【0014】
動物およびヒトにおいて、これらの細胞タイプからのインターフェロンαを誘導することができる、TLR7およびTLR9のオリゴヌクレオチドアゴニスト、ならびにTLR7の低分子のプリンベースのアゴニストが記載されている(Takeda K.et al,Annu.Rev.Immunol.,2003:21,335−76)。TLR7アゴニストは、イミキモドおよびレジキモド等のイミダゾキノリン化合物、オキソアデニンアナログ、ならびにさらにインターフェロンαを誘導することが長年知られているロキソリビンおよび7−チア−8−オキソグアノシン等のヌクレオシドアナログを含む。国際公開第2008/114008号(AstraZeneca AB/Dainippon Sumitomo Pharma Co.Ltd.)は、TLR7修飾物質として9−置換−8−オキソアデニン化合物を開示する。米国仮出願第61/232132号は実施例1の合成における中間体として6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンを開示する。
【0015】
公知の誘導物質の分子標的が同定されていないので、低分子プリン様化合物がI型インターフェロンおよび他のサイトカインをどのように誘導できるのかは不明瞭なままである。しかしながら、化合物による初代ヒトドナー細胞の刺激に基づいてヒトインターフェロンIFNαの低分子誘導物質を(機構に関係なく)特徴づけるアッセイ戦略が開発されており、本明細書において開示される。
【先行技術文献】
【特許文献】
【0016】
【特許文献1】米国特許出願公開第2006045885号(A1)明細書
【特許文献2】国際公開第2008/114008号
【特許文献3】米国仮出願第61/232132号
【非特許文献】
【0017】
【非特許文献1】Akira S.,et al,Nat.Immunol.,2001:2,675−680
【非特許文献2】Diebold S.S.,et al,Science,2004:303,1529−1531
【非特許文献3】Lund J.M.,et al,PNAS,2004:101,5598−5603
【非特許文献4】Liu Y−J,Annu.Rev.Immunol.,2005:23,275−306
【非特許文献5】Fili L.,et al,J.All.Clin.Immunol.,2006:118,511−517
【非特許文献6】Moisan J.,et al,Am.J.Physiol.Lung Cell Mol.Physiol.,2006:290,L987−995
【非特許文献7】Tao et al,Chin.Med.J.,2006:119,640−648
【非特許文献8】Isaacs & Lindemann,J.Virus Interference.Proc.R.Soc.Lon.Ser.B.Biol.Sci.1957:147,258−267
【非特許文献9】Dudley T.,et al,Gut.,2006:55(9),1362−3
【非特許文献10】Krieg.,Curr.Oncol.Rep.,2004:6(2),88−95
【非特許文献11】Moisan J.,et al,Am.J.Physiol.Lung Cell Mol.Physiol.,2006:290,L987−995
【非特許文献12】Rakoff−Nahoum S.,Cell.,2004,23,118(2):229−41
【非特許文献13】Persing et al.,Trends Microbiol.,2002:10(10 Suppl),S32−7
【非特許文献14】Adams S.,et al,J.Immunol.,2008,181:776−84
【非特許文献15】Johnston D.,et al,Vaccine,2006,24:1958−65
【非特許文献16】Fransen F.et al,Infect.Immun.,2007,75:5939−46
【非特許文献17】Ma R.et al,Biochem.Biophys.Res.Commun.,2007,361:537−42
【非特許文献18】Wille−Reece U.,et al,Proc.Natl.Acad.Sci.USA,2005,102:15190−4
【非特許文献19】Takeda K.et al,Annu.Rev.Immunol.,2003:21,335−76
【発明の概要】
【課題を解決するための手段】
【0018】
発明の簡単な説明
本発明の特定の化合物は、ヒトインターフェロンの誘導物質であることが示され、ヒトインターフェロンの既知の誘導物質に関して改善されたプロファイル(例えば促進された力価)を保持する可能性があり、およびTNFαに関してIFNαの選択性の促進を示し得る。例えば、本発明の特定の化合物はTNFα誘導に関するIFNα誘導について1000倍を超える選択性を示す。ヒトインターフェロンを誘導する化合物は、様々な障害の治療、例えばアレルギー性疾患および他の炎症状態(例えばアレルギー性鼻炎および喘息)の治療、感染症および癌の治療において有用であり得、ワクチンアジュバントとしても有用であり得る。
【0019】
本発明の特定の化合物は、強力な免疫修飾物質であるので、それらの取り扱いにおいて注意しなくてはならない。
【0020】
発明の要旨
第1の態様において、活性治療剤としての式(I)の化合物またはその薬学上許容される塩:
【化1】

【0021】
(式中、R1は水素またはC1−3アルキルを表し、
nは1〜5の値を有する整数であり、
XはOまたはNHを表し、
YはCまたはNを表す)
の使用が提供される。
【0022】
別の実施形態において、感染症、癌、アレルギー性疾患および他の炎症状態の治療のために式(I)の化合物またはその薬学上許容される塩の使用が提供される。
【0023】
別の実施形態において、ワクチンアジュバントとしての使用のために式(I)の化合物またはその薬学上許容される塩が提供される。
【0024】
別の実施形態において、感染症、癌、アレルギー性疾患および他の炎症状態の治療のための薬剤の製造において、式(I)の化合物またはその薬学上許容される塩の使用が提供される。
【0025】
別の実施形態において、感染症、癌、アレルギー性疾患および他の炎症状態の治療のための方法であって、有効量の式(I)の化合物またはその薬学上許容される塩を投与することを含んでなる方法が提供される。
【0026】
別の実施形態において、式(I)の化合物またはその薬学上許容される塩、および任意で1つまたは複数の薬学上許容される希釈剤または担体を含んでなる医薬組成物が提供される。
【0027】
別の実施形態において、式(I)の化合物またはその塩であるが、6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンではない化合物が提供される。
【0028】
さらなる実施形態において、R1がC1−3アルキルである式(I)の化合物またはその塩(または式(I)の化合物もしくはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物)が提供される。
【0029】
さらなる実施形態において、R1が水素である式(I)の化合物もしくはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物が提供される。
【0030】
さらなる実施形態において、R1が水素である式(I)の化合物またはその塩であるが、6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンではない化合物が提供される。
【0031】
さらなる実施形態において、nが1〜4である式(I)の化合物もしくはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物が提供される。
【0032】
さらなる実施形態において、nが1〜4である式(I)の化合物またはその塩であるが、6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンではない化合物が提供される。
【0033】
さらなる実施形態において、XがOを表す式(I)の化合物またはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物が提供される。
【0034】
さらなる実施形態において、XがOを表す式(I)の化合物またはその塩であるが、6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンではない化合物が提供される。
【0035】
さらなる実施形態において、XがNHを表す式(I)の化合物またはその塩(または式(I)の化合物もしくはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物)が提供される。
【0036】
さらなる実施形態において、YがCを表す式(I)の化合物またはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物が提供される。
【0037】
さらなる実施形態において、YがCを表す式(I)の化合物またはその塩であるが、6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンではない化合物が提供される。
【0038】
さらなる実施形態において、YがNを表す式(I)の化合物またはその塩(または式(I)の化合物もしくはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物)が提供される。
【0039】
さらなる実施形態において、YがNを表し、(CH2)nが、Yである窒素原子を介して6員環に結合される、式(I)の化合物またはその塩(または式(I)の化合物もしくはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物)が提供される。
【0040】
さらなる実施形態において、YがCを表し、(CH2)nが炭素原子を介して6員環に結合される、式(I)の化合物またはその塩であるが、6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンではない化合物が提供される。
【0041】
さらなる実施形態において、Yが炭素原子であり、(CH2)nが炭素原子を介して6員環に結合され、6員環の窒素が(CH2)n基に対してオルトである、式(I)の化合物またはその塩(または式(I)の化合物もしくはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物)が提供される。
【0042】
さらなる実施形態において、Yが炭素原子であり、(CH2)nが炭素原子を介して6員環に結合され、6員環の窒素が(CH2)n基に対してメタである、式(I)の化合物またはその塩(または式(I)の化合物もしくはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物)が提供される。
【0043】
さらなる実施形態において、Yが炭素原子であり、(CH2)nは炭素原子を介して6員環に結合され、6員環の窒素が(CH2)n基に対してパラである、式(I)の化合物またはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物が提供される。
【0044】
さらなる実施形態において、Yが炭素原子であり、(CH2)nが炭素原子を介して6員環に結合され、6員環の窒素が(CH2)n基に対してパラである、式(I)の化合物またはその塩であるが、6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンではない化合物が提供される。さらなる実施形態において、以下のものからなる記載から選択された化合物またはその塩が提供される:
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−2−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{[1−(2−ヒドロキシエチル)−3−ピペリジニル]メチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{2−[1−(2−ヒドロキシエチル)−3−ピペリジニル]エチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−3−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[1−(2−ヒドロキシエチル)−3−ピペリジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{2−[1−(2−ヒドロキシエチル)−4−ピペリジニル]エチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−4−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[1−(2−ヒドロキシエチル)−4−ピペリジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{5−[1−(2−ヒドロキシエチル)−4−ピペリジニル]ペンチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルアミノ)−9−{3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルアミノ)−9−{4−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{5−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ペンチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−(5−{4−[2−(メチルオキシ)エチル]−1−ピペラジニル}ペンチル)−7,9−ジヒドロ−8H−プリン−8−オン、および
6−アミノ−2−(ブチルオキシ)−9−(5−{4−[2−(エチルオキシ)エチル]−1−ピペラジニル}ペンチル)−7,9−ジヒドロ−8H−プリン−8−オン。
【0045】
さらなる実施形態において、以下のものからなる記載から選択された化合物またはその薬学上許容される塩を含んでなる、使用、治療方法または上述されるような組成物が提供される:
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−2−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{[1−(2−ヒドロキシエチル)−3−ピペリジニル]メチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{2−[1−(2−ヒドロキシエチル)−3−ピペリジニル]エチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−3−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[1−(2−ヒドロキシエチル)−3−ピペリジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{[1−(2−ヒドロキシエチル)−4−ピペリジニル]メチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{2−[1−(2−ヒドロキシエチル)−4−ピペリジニル]エチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−4−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[1−(2−ヒドロキシエチル)−4−ピペリジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{5−[1−(2−ヒドロキシエチル)−4−ピペリジニル]ペンチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルアミノ)−9−{3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルアミノ)−9−{4−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{5−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ペンチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−(5−{4−[2−(メチルオキシ)エチル]−1−ピペラジニル}ペンチル)−7,9−ジヒドロ−8H−プリン−8−オン、および
6−アミノ−2−(ブチルオキシ)−9−(5−{4−[2−(エチルオキシ)エチル]−1−ピペラジニル}ペンチル)−7,9−ジヒドロ−8H−プリン−8−オン。
【0046】
本発明は、本明細書において記述された実施形態および置換基のすべての組合わせを含むことを理解すべきである。
【発明を実施するための形態】
【0047】
「アルキル」に対する参照は、好適には3個までの炭素原子を含む、直鎖および対応するアルキルの分岐鎖脂肪族異性体の両方に対する参照を含む。
【0048】
式(I)の化合物の塩は、薬学上許容される塩ならびに薬学的に許容可能されないかもしれないが式(I)の化合物およびその薬学上許容される塩の調製に有用であり得る塩を含む。塩は、特定の無機酸もしくは有機酸または特定の無機塩基もしくは有機塩基に由来し得る。
【0049】
本発明は、その範囲内に式(I)の化合物の塩のすべての化学量論的形態および非化学量論的形態を含む。
【0050】
本発明の化合物に対する本明細書における参照は、遊離塩基としての、または塩(例えば薬学上許容される塩)としての式(I)の化合物を意味することを理解すべきである。
【0051】
式(I)の化合物の塩は、薬学上許容される塩ならびに薬学的に許容可能されないかもしれないが式(I)の化合物およびその薬学上許容される塩の調製に有用であり得る塩を含む。塩は、特定の無機酸もしくは有機酸または特定の無機塩基もしくは有機塩基に由来し得る。
【0052】
本発明は、その範囲内に式(I)の化合物の塩のすべての化学量論的形態および非化学量論的形態を含む。
【0053】
塩の例は、薬学上許容される塩である。薬学上許容される塩は酸付加塩および塩基付加塩を含む。好適な塩に関する総説については「Berge et al.,J.Pharm.Sci.,66:1−19(1977)」を参照されたい。
【0054】
式(I)の化合物の薬学上許容される酸付加塩の例は、臭化水素酸塩、塩酸塩、マレイン酸塩、硫酸塩、p−トルエンスルホン酸塩、メタンスルホン酸塩、ナフタレンスルホン酸塩、フェニルスルホン酸塩を含む。
【0055】
塩は、当該技術分野における周知の技法を使用して、例えば溶液からの沈殿または結晶に続いて濾過によって、または溶媒の蒸発によって形成することができる。
【0056】
典型的には、薬学上許容される酸付加塩は、有機溶媒等の好適な溶媒中の好適な強酸(臭化水素酸、塩酸、マレイン酸、硫酸、p−トルエンスルホン酸、メタンスルホン酸またはナフタリンスルホン酸等)と、式(I)の化合物の反応によって任意で形成され、例えば結晶および濾過によって通常単離される塩を生ずることができる。
【0057】
多くの有機化合物は溶媒と複合体を形成し、溶媒中で有機化合物が反応するか、または溶媒から有機化合物が沈殿または結晶することが認識されるだろう。これらの複合体は「溶媒和物」として公知である。例えば、水との複合体は「水和物」として公知である。水、エタノール、イソプロピルアルコールおよびN−メチルピロリジノン等の、高沸点を持つ溶媒および/または水素結合を形成する高い傾向を持つ溶媒を使用して、溶媒和物を形成することができる。溶媒和物の同定のための方法はNMRおよび微量分析を含むが、これらに限定されない。式(I)の化合物の溶媒和物は本発明の範囲内である。本明細書において使用される時、溶媒和物という用語は、遊離塩基化合物に加えてその任意の塩の両者の溶媒和物を包含する。
【0058】
本発明の特定の化合物は、キラル原子および/または多重結合を含み、したがって1つまたは複数の立体異性形態で存在することができる。本発明は、個々の立体異性体として、またはそのラセミ体を含む混合物としても、光学異性体を含む本発明の化合物の立体異性体をすべて包含する。任意の立体異性体は、重量で10%未満、例えば重量で5%未満、または重量で0.5%未満の他の立体異性体含むことができる。例えば、任意の光学異性体は、重量で10%未満、例えば重量で5%未満、または重量で0.5%未満のその鏡像異性体を含むことができる。
【0059】
本発明の特定化合物は、互変異性形態で存在することができる。本発明は、本発明の化合物の互変異性体を、個々の互変異性体またはその混合物としても、すべて包含することが理解されるだろう。
【0060】
本発明の化合物は結晶形態または非晶形態であり得る。さらに、本発明の化合物の結晶形態のいくつかは、多形体として存在することができ、そのすべては本発明の範囲内に含まれる。本発明の化合物の最も熱力学的に安定した多形形態(複数可)は特に興味深い。
【0061】
本発明の化合物の多形形態は、X線粉末回折(XRPD)、赤外分光法(IR)、ラマン分光法、示差走査熱量測定法(DSC)、熱重量分析(TGA)および固体核磁気共鳴(ssNMR)を含むが、これらに限定されない複数の従来の分析技術を使用して、特徴づけおよび識別が行われる。
【0062】
本発明の範囲内に含まれるものは、式(I)の化合物の溶媒和物、水和物、異性体および多形形態ならびにその塩および溶媒和物であることが、前述したことから認識されるだろう。
【0063】
式(I)の化合物およびその薬学上許容される塩が、有益な効果を有する可能性のある疾患状態の例は、アレルギー性疾患および他の炎症状態(例えばアレルギー性鼻炎および喘息)、感染症ならびに癌を含む。式(I)の化合物およびその薬学上許容される塩は、ワクチンアジュバントとしても役に立つ可能性がある。
【0064】
免疫応答の修飾物質として、式(I)の化合物およびその薬学上許容される塩は、独立したものとして、またはアジュバントとして組合わせて、喘息、アレルギー性鼻炎および鼻炎結膜炎、食物アレルギー、過敏性肺疾患、レフレル症候群、遅延型過敏性障害、アテローム性動脈硬化症、膵臓炎、胃炎、大腸炎、骨関節炎、乾癬、サルコイド症、肺線維症、呼吸窮迫症候群、毛細気管支炎、慢性閉塞性肺疾患、副鼻腔炎、嚢胞性繊維症、紫外線角化症、皮膚異形成症、慢性蕁麻疹、湿疹、ならびにすべてのタイプの皮膚炎等の炎症性疾患またはアレルギー性疾患を含むが、これらに限定されない免疫介在性障害の治療および/または予防にも有用であり得る。
【0065】
式(I)の化合物およびその薬学上許容される塩は、気道のウイルス性増悪および扁桃腺炎を含むが、これらに限定されない呼吸器感染に対する反応の治療および/または予防にも有用であり得る。化合物は、関節リウマチ、乾癬性関節炎、全身性エリテマトーデス、シェーグレン病、強直性脊椎炎、硬皮症、皮膚筋炎、糖尿病を含むが、これらに限定されない自己免疫性疾患移植片対宿主病を含む移植片拒絶、クローン病および潰瘍性大腸炎を含むが、これらに限定されない炎症性腸疾患の治療および/または予防にも有用であり得る。
【0066】
式(I)の化合物およびその薬学上許容される塩は、肝炎ウイルス(例えばB型肝炎ウイルス、C型肝炎ウイルス)、ヒト免疫不全ウイルス、パピロマウイルス、ヘルペスウイルス、呼吸系ウイルス(例えばインフルエンザウイルス、呼吸器合胞体ウイルス、ライノウイルス、メタ肺炎ウイルス、パラインフルエンザウイルス、SARS)、および西ナイルウイルスによって引き起こされたものを含むが、これらに限定されない感染症の治療にも有用であり得る。式(I)の化合物およびその薬学上許容される塩は、例えば細菌、真菌または原虫類によって引き起こされる微生物感染の治療にも有用であり得る。これらは、結核、細菌性肺炎、アスペルギルス症、ヒストプラスマ症、カンジダ症、ニューモシスチス症、レプラ、クラミジア、クリプトコックス疾患、クリプトスポリジウム症、トキソプラズマ症、リーシュマニア、マラリアおよびトリパノソーマ症を含むが、これらに限定されない。
【0067】
式(I)の化合物およびその薬学上許容される塩は、様々な癌の治療、特に免疫療法に対して応答性である癌であり、腎細胞癌、肺癌、乳癌、結腸直腸癌、膀胱癌、黒色腫、白血病、リンパ腫および卵巣癌を含むが、これらに限定されない既知の癌の治療にも有用であり得る。
【0068】
治療または治療法に対する本明細書の参照は、既存の状態の治療に加えて、状態に依存して予防処置にも拡張できることが、当業者によって認識されるだろう。
【0069】
本明細書において言及されるように、式(I)の化合物およびその薬学上許容される塩は活性治療剤として有用であり得る。
【0070】
式(I)の化合物およびその薬学上許容される塩は、任意の都合のよい方法において投与のために製剤化することができる。
【0071】
式(I)の化合物およびその薬学上許容される塩は、例えば経口投与、局所投与、吸入投与、鼻腔内投与、頬腔投与、非経口投与(例えば静脈内投与、皮下投与、皮内投与または筋肉内投与)または直腸投与のために製剤化することができる。一態様において、式(I)の化合物およびその薬学上許容される塩は経口投与のために製剤化される。さらなる態様において、式(I)の化合物およびその薬学上許容される塩は、局所投与(例えば鼻腔内投与または吸入投与)のために製剤化される。
【0072】
経口投与のための錠剤およびカプセルは、結合剤(例えばシロップ、アラビアゴム、ゼラチン、ソルビトール、トラガント、デンプン漿剤、セルロースまたはポリビニルピロリドン);充填剤(例えばラクトース、微結晶性セルロース、糖、トウモロコシデンプン、リン酸カルシウムまたはソルビトール);潤滑剤(例えばステアリン酸マグネシウム、ステアリン酸、タルク、ポリエチレングリコールまたはシリカ);崩壊剤(例えばジャガイモデンプン、クロスカルメロースナトリウムまたはデンプングリコール酸ナトリウム);またはラウリル硫酸ナトリウム等の湿潤剤等の従来の賦形剤を含むことができる。錠剤は当該技術分野において周知の方法に従ってコートすることができる。
【0073】
経口液体調製は、例えば水性懸濁もしくは油性懸濁物、溶液、乳化物、シロップまたはエリキシルの形態であってもよいし、または使用前の構成のための乾燥製品として水もしくは他の好適な媒質と共に提供されてもよい。かかる液体調製物は、懸濁化剤(例えばソルビトールシロップ、メチルセルロース、グルコース/糖シロップ、ゼラチン、ヒドロキシメチルセルロース、カルボキシメチルセルロース、ステアリン酸アルミニウムゲルまたは水素添加食用脂);乳化剤(例えばレシチン、モノオレイン酸ソルビタンまたはアラビアゴム);非水性媒質(食用油を含み得る)(例えばアーモンドオイル、分留ヤシ油、油状エステル、プロピレングリコールまたはエチルアルコール);または防腐剤(例えばメチル、p−オキシ安息香酸プロピルまたはソルビン酸)等の従来の添加物を含むことができる。調製物は、緩衝塩、着香剤、着色剤および/または甘味剤)(例えばマンニトール)も必要に応じて含むことができる。
【0074】
鼻腔内投与のための組成物は、小滴によってまたは加圧されたポンプによって鼻に投与する水性組成物を含む。好適な組成物はこの目的のための希釈剤または担体として水を含む。肺または鼻に対する投与のための組成物は、1つまたは複数の賦形剤(例えば1つまたは複数の懸濁化剤、1つまたは複数の防腐剤、1つまたは複数の界面活性剤、1つまたは複数の等張性調整剤、1つまたは複数の共溶媒)を含み、組成物(例えば緩衝系)のpHを制御する成分を含むことができる。さらに、組成物は、抗酸化剤(例えばメタ重亜硫酸ナトリウム)および矯味剤等の他の賦形剤を含むことができる。組成物は噴霧化によって鼻または呼吸器管の他の領域にも投与することができる。
【0075】
鼻腔内組成物は、式(I)の化合物(複数可)またはその薬学上許容される塩(複数可)が鼻腔(標的組織)のすべての領域に送達されることを可能にし、さらに式(I)の化合物(複数可)またはその薬学上許容される塩(複数可)をより長い期間の間に標的組織に接触させておくことを可能にできる。鼻腔内組成物のための好適な投薬レジームは、鼻腔を清浄にした後に鼻を介して徐々に吸入する患者のためのものである。吸入の間に、組成物は1つの鼻孔に投与されるが、他の鼻孔は手で圧迫される。次いでこの手順を他の鼻孔について反復する。典型的には、1つの鼻孔あたり1または2スプレーを、上記の手順によって、毎日1、2または3回、理想的には毎日1回投与される。特に興味深いのは毎日1回の投与に好適な鼻腔内組成物である。
【0076】
懸濁化剤(複数可)は、含まれていれば、組成物の全重量に基づいて、0.1〜5%(w/w)(1.5%〜2.4%(w/w)等)の量で典型的には存在する。薬学上許容される懸濁化剤の例は、Avicel(登録商標)(微結晶性セルロースおよびカルボキシメチルセルロースナトリウム)、カルボキシメチルセルロースナトリウム、ビーガム、トラガント、ベントナイト、メチルセルロース、キサンタンガム、カーボポールおよびポリエチレングリコールを含むが、これらに限定されない。
【0077】
肺または鼻に対する投与のための組成物は1つまたは複数の賦形剤を含み、1つまたは複数の防腐剤の含有によって微生物または真菌の汚染および増殖から保護することができる。薬学上許容される抗微生物剤または防腐剤の例は、第四アンモニウム化合物(例えば塩化ベンザルコニウム、塩化ベンゼトニウム、セトリミド、塩化セチルピリジウム、塩化ラウラルコニウムおよびミリスチル塩化ピコリニウム)、水銀剤(例えば硝酸フェニル水銀、酢酸フェニル水銀およびチメロサール)、アルコール剤(例えばクロロブタノール、フェニルエチルアルコールおよびベンジルアルコール)、抗菌性エステル(例えばp−ヒドロキシ安息香酸のエステル)、エデト酸2ナトリウム(EDTA)等のキレート剤、ならびにクロルヘキシジン、クロロクレゾール、ソルビン酸およびその塩(ソルビン酸カリウム等)およびポリミキシン等の他の抗微生物剤を含むが、これらに限定されない。薬学上許容される抗真菌剤または防腐剤の例は、安息香酸ナトリウム、ソルビン酸、プロピオン酸ナトリウム、メチルパラベン、エチルパラベン、プロピルパラベンおよびブチルパラベンを含むが、これらに限定されない。防腐剤(複数可)は、含まれていれば、組成物の全重量に基づいて、0.001〜1%(w/w)(0.015%〜0.5%(w/w)等)の量で存在することができる。
【0078】
組成物(例えば少なくとも1つの化合物が懸濁されている場合)は、組成物の水相中で薬剤粒子の溶解を促進するように機能する1つまたは複数の界面活性剤を含むことができる。例えば、使用される界面活性剤の量は混合の間に発泡を引き起こさない量である。薬学上許容される界面活性剤の例は、ポリオキシエチレン(20)モノオレイン酸ソルビタン(ポリソルベート80)、マクロゴールエーテルおよびポロキサマー等の脂肪族アルコール、エステルおよびエーテルを含む。界面活性剤は、組成物の全重量に基づいて、約0.01〜10%(w/w)(0.01〜0.75%(w/w)等)の間で、例えば約0.5%(w/w)の量で存在することができる。
【0079】
体液(例えば鼻腔液)との等張性を達成して刺激レベルの低下をもたらす、1つまたは複数の等張性調整剤(複数可)が含まれ得る。薬学上許容される等張性調整剤の例は、塩化ナトリウム、デキストロース、キシリトール、塩化カルシウム、グルコース、グリセリンおよびソルビトールを含むが、これらに限定されない。等張性調整剤は、存在するならば、組成物の全重量に基づいて、0.1〜10%(w/w)(4.5〜5.5%(w/w)等)、例えば約5.0%(w/w)の量で含まれ得る。
【0080】
本発明の組成物は、クエン酸ナトリウム、クエン酸、トロメタモール、リン酸水素2ナトリウム(例えば十二水和物、七水和物、二水和物および無水形態)またはリン酸ナトリウム等のリン酸塩およびその混合物等の好適な緩衝剤の添加によって緩衝することができる。
【0081】
緩衝剤は、存在するならば、組成物の全重量に基づいて、0.1〜5%(w/w)、例えば1〜3%(w/w)の量で含まれ得る。
【0082】
矯味剤の例は、スクラロース、スクロース、サッカリンまたはその塩、フルクトース、デキストロース、グリセロール、コーンシロップ、アスパルテーム、アセスルファム・ケィ、キシリトール、ソルビトール、エリトリトール、グリチルリチン酸アンモニウム、タウマチン、ネオテーム、マンニトール、メントール、ユーカリ油、ショウノウ、天然着香剤、人工着香剤およびその組合わせを含む。
【0083】
1つまたは複数の共溶媒(複数可)は、医薬化合物(複数可)および/または他の賦形剤の可溶性を支援するために含まれ得る。薬学上許容される共溶媒の例は、プロピレングリコール、ジプロピレングリコール、エチレングリコール、グリセロール、エタノール、ポリエチレングリコール(例えばPEG300またはPEG400)およびメタノールを含むが、これらに限定されない。一実施形態において、共溶媒はプロピレングリコールである。
【0084】
共溶媒(複数可)は、存在するならば、組成物の全重量に基づいて、0.05〜30%(w/w)(1〜25%(w/w)等)、例えば1〜10%(w/w)の量で含まれ得る。
【0085】
吸入投与のための組成物は、加圧されたポンプまたは吸入器(例えばリザーバー乾燥粉末吸入器、単位用量乾燥粉末吸入器、前定量された多重用量の乾燥粉末吸入器、鼻吸入器または加圧されたエアロゾル吸入器)、噴霧器または通気器によって、呼吸器管へ投与される、水性混合物、有機混合物または水性/有機混合物、乾燥粉末または結晶性組成物を含む。好適な組成物はこの目的のための希釈剤または担体として水を含み、緩衝剤、等張性修飾剤および同種のもの等の従来の賦形剤と共に提供され得る。水性組成物は噴霧化によって鼻および呼吸器管の他の領域へも投与され得る。かかる組成物は、好適な液化された噴射剤の使用により、加圧されたパック(定量された用量の吸入器等)から送達された水性の溶液もしくは懸濁物またはエアロゾルであり得る。
【0086】
鼻(例えば鼻炎の治療のため)または肺への局所的な投与のための組成物は、加圧されたエアロゾル組成物、および加圧されたポンプによって鼻腔に送達される水性組成物を含む。加圧されていない鼻腔への局所的な投与のために好適な組成物は、特に興味深い。好適な組成物はこの目的のための希釈剤または担体として水を含む。肺または鼻への投与のための水性組成物は、緩衝剤等の従来の賦形剤、等張性修飾剤および同種のものと共に提供され得る。水性組成物は噴霧化によっても鼻へ投与することができる。
【0087】
液体分注器は、典型的には鼻腔への液体組成物の送達に使用することができる。液体組成物は水性または非水性であり得るが、典型的には水性であり得る。かかる液体分注器は、液体分注器のポンプ機構に対してユーザーが適用する力の適用に際して、定量された用量の液体組成物が分注される分注ノズルまたは分注オリフィスを有することができる。かかる液体分注器は、概して液体組成物の定量された多重用量(連続的ポンプ作動に際して分注できる用量)のリザーバーを備えて提供される。分注ノズルまたは分注オリフィスは、鼻腔の中への液体組成物のスプレー分注のために、ユーザーの鼻孔の中への挿入用として構成することができる。前記のタイプの液体分注器は国際公開第WO2005/044354号(Glaxo Group Limited)中に記載および図示される。分注器は、液体組成物を含有するための容器上に据え付けられた圧搾ポンプを有する液体発射装置を格納する筺体を有する。筺体は指で操作可能な少なくとも1つのサイドレバーを有し、サイドレバーは、カムによって筺体中で容器を上方へ移動させるように筺体に対して内に向かって移動可能でありポンプを圧縮させ、筺体の鼻腔ノズルを介してポンプステムから定量された用量の組成物をポンプで送り込む。一実施形態において、液体分注器はWO2005/044354の図30〜40中に図示される一般的なタイプである。
【0088】
式(I)の化合物またはその薬学上許容される塩を含む水性組成物は、国際公開第WO2007/138084号(Glaxo Group Limited)中で開示されたような、例えばその図22〜46に関して開示されるような、または英国特許出願第GB0723418.0号(Glaxo Group Limited)中で開示されたような、例えばその図7〜32に関して開示されるようなポンプによっても送達することができる。GB0723418.0の図1〜6中で開示されたような作動器はポンプを作動させることができる。
【0089】
吸入による肺への局所送達のための乾燥粉末組成物は、吸入器または通気器における使用のために、例えばゼラチンのカプセルおよびカートリッジ、または例えば薄くのばされたアルミホイルのブリスター中で例えば提供することができる。粉末ブレンド組成物は、概して式(I)の化合物またはその薬学上許容される塩、および単糖、二糖または多糖(例えばラクトースまたはデンプン)等の好適な粉末基剤(担体/希釈剤/賦形剤の物質)の吸入のための粉末混合物を含む。乾燥粉末組成物は、薬物および担体に加えて、さらなる賦形剤(例えば糖エステル(例えばセロビオースオクタアセタート)、ステアリン酸カルシウム、ステアリン酸マグネシウム等の三成分剤)も含むことができる。
【0090】
一実施形態において、吸入投与のための好適な組成物は、好適な吸入装置の内側に据え付けた薬剤パック(複数可)で提供される複数の密封用量容器の中へ組み込むことができる。容器はひとつずつ破裂、剥離、または他の方法で開口することができ、当該技術分野において公知であるように、乾燥粉末組成物の用量は吸入装置の口金に対する吸入によって投与される。薬剤パックは複数の異なる形態(例えばディスク形状または細長いストリップ)であり得る。代表的な吸入装置はGlaxoSmithKlineによって販売されるDISKHALER(商標)およびDISKUSTM装置である。
【0091】
乾燥粉末の吸入可能な組成物は吸入装置中でバルクリザーバーとしても提供され、そして装置はリザーバーから吸入チャンネルへの組成物の用量の定量のための定量機構を備えて提供され、定量された用量は装置の口金で患者が吸入することによって吸入され得る。このタイプの例示的な販売された装置は、TURBUHALER(商標)(AstraZeneca)、TWISTHALER(商標)(Schering)およびCLICKHALER(商標)(Innovata)である。
【0092】
乾燥粉末の吸入可能な組成物のためのさらなる送達方法は、典型的には患者によって吸入装置の中へ需要に応じて充填されるカプセル(1個のカプセルあたり1用量)において提供される、組成物の定量された用量のためのものである。装置はカプセルを破裂、貫通または他の方法で開口する手段を有し、その結果、用量が装置の口金で吸入されるときに、患者の肺の中へ流入することができる。かかる装置の販売例としては、ROTAHALER(商標)(GlaxoSmithKline)およびHANDIHALER(商標)(Boehringer Ingelheim)がある。
【0093】
吸入のために好適な加圧されたエアロゾル組成物は懸濁物または溶液のいずれかであり得、式(I)の化合物またはその薬学上許容される塩、およびフルオロカーボンもしくは水素含有クロロフルオロカーボンまたはその混合物、特にヒドロフルオロアルカン、さらに特に1,1,1,2−テトラフルオロエタン、1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンまたはその混合物等の好適な噴射剤を含み得る。エアロゾル組成物は、例えばWO94/21229およびWO98/34596(Minnesota Mining and Manufacturing)中で記載されているような、界面活性剤(例えばオレイン酸、レシチン、オリゴ乳酸またはその誘導体)等の当該技術分野において周知のさらなる組成物賦形剤および共溶媒(例えばエタノール)を任意で含むことができる。加圧された組成物は、概してキャニスター(例えばアルミニウムキャニスター)中に保持され、弁(例えば定量弁)により閉鎖され、口金を備えて提供される作動器の中へ取り付けられる。
【0094】
軟膏、クリームおよびゲルは、例えば好適な増粘剤および/またはゲル化剤および/または溶媒の添加により水性基剤または油性基剤を用いて製剤化することができる。したがってかかる基剤は、例えば水および/または油(液体パラフィン、または落花生油もしくはヒマシ油等の植物油等)または溶媒(ポリエチレングリコール等)を含み得る。基剤の性質に応じて使用できる増粘剤およびゲル化剤は、軟パラフィン、ステアリン酸アルミニウム、セトステアリルアルコール、ポリエチレングリコール、羊毛脂、ミツロウ、カルボキシポリメチレンおよびセルロース誘導体、および/またはモノステアリン酸グリセリンおよび/または非イオン性乳化剤を含む。
【0095】
ローションは水性基剤または油性基剤により製剤化され、1つまたは複数の乳化剤、安定化剤、分散剤、懸濁化剤または増粘剤も含む。
【0096】
外部適用のための粉末は、任意の好適な粉末基剤(例えばタルク、ラクトースまたはデンプン)の補助により形成することができる。小滴は、1つまたは複数の分散剤、可溶化剤、懸濁化剤または防腐剤も含む、水性基剤または非水性基剤により製剤化することができる。
【0097】
式(I)の化合物およびその薬学上許容される塩は、例えば、皮膚の中へ活性成分を送達する貼付剤または他の装置(例えば加圧気体装置)用の組成物による経皮送達のために製剤化することができる。
【0098】
頬腔投与のために、組成物は、従来の様式で製剤化された錠剤またはロゼンジの形態をとることができる。
【0099】
式(I)の化合物およびその薬学上許容される塩は、例えばカカオバターまたは他のグリセリド等の従来の坐剤基剤を含む坐剤としても製剤化することができる。
【0100】
式(I)の化合物およびその薬学上許容される塩はボーラス注入または持続点滴による非経口投与のためにも製剤化され、例えばアンプル、バイアル、小体積の点滴または充填済みシリンジとして単位用量形態で、または防腐剤を添加して複数用量容器で提供され得る。組成物は、水性媒質または非水性媒質中の溶液、懸濁物または乳化物としてかかる形態をとり、抗酸化剤、緩衝液、抗菌剤および/または等張性調整剤等の製剤化剤を含むことができる。あるいは、活性成分は、使用前に好適な媒質(例えば滅菌されたパイロジェン不含有水)による構成のための粉末形態であり得る。乾燥固体状態は、個々の滅菌容器の中へ滅菌粉末を無菌的に充填することによって、または各々の容器の中へ滅菌溶液を無菌的に充填し凍結乾燥することによって調製できる。
【0101】
式(I)の化合物およびその薬学上許容される塩は、ワクチンの活性を修飾するアジュバントとしてもワクチンと共に製剤化できる。かかる組成物は、アルミニウム塩、油と水の乳化物、熱ショックタンパク質、リピドA調製物および誘導体、糖脂質、CpG DNAもしくは類似薬剤等の他のTLRアゴニスト、GM−CSFもしくはIL−12等のサイトカインまたは類似薬剤を含むが、これらに限定されないアジュバント活性を持つ1つまたは複数の成分と共に、タンパク質、DNA、生細菌もしくは死細菌および/またはウイルスもしくはウイルス様粒子を含むが、これらに限定されない抗体(複数可)もしくは抗体断片(複数可)または抗原成分を含むことができる。
【0102】
式(I)の化合物およびその薬学上許容される塩は、単独でまたは他の治療剤と組み合わせて用いることができる。式(I)の化合物およびその薬学上許容される塩ならびに他の薬学的に活性のある薬剤(複数可)は、ともにまたは個別に投与することができ、個別に投与した場合、投与は任意の順序で同時にまたは連続して起こり得る。式(I)の化合物(複数可)またはその薬学上許容される塩(複数可)および他の薬学的に活性のある薬剤(複数可)の量および投与の相対的なタイミングは、所望される組合せ療法効果を達成するために選択される。式(I)の化合物またはその薬学上許容される塩の他の治療剤との組合わせ投与は、両方の化合物を含む一体型の医薬組成物での投与、または化合物の1つを各々に含む分離した医薬組成物での投与を併用することによってもよい。あるいは、組合わせは、1つの治療剤を第一におよび他のものを第二に投与するか、またはその逆に投与する連続型様式で個別に投与することができる。かかる連続投与は時間が接近または時間が隔たっていてもよい。
【0103】
式(I)の化合物およびその薬学上許容される塩は、ウイルス感染の予防または治療において有用な1つまたは複数の薬剤と組み合わせて使用することができる。かかる薬剤の例は以下を含むが、これらに限定されない。ポリメラーゼ阻害剤(WO2004/037818−A1中で開示されたものに加えて、WO2004/037818およびWO2006/045613中で開示されたもの等);JTK−003、JTK−019、NM−283、HCV−796、R−803、R1728、R1626に加えて、WO2006/018725、WO2004/074270、WO2003/095441、US2005/0176701、WO2006/020082、WO2005/080388、WO2004/064925、WO2004/065367、WO2003/007945、WO02/04425、WO2005/014543、WO2003/000254、EP1065213、WO01/47883、WO2002/057287、WO2002/057245中で開示されたものおよび類似薬剤;複製阻害剤(アシクロビル、ファムシクロビル、ガンシクロビル、シドフォビル、ラミブジンおよび類似薬剤等);プロテアーゼ阻害剤(HIVプロテアーゼ阻害剤サキナビル、リトナビル、インジナビル、ネルフィナビル、アンプレナビル、ホスアンプレナビル、ブレカナビル、アタザナビル、チプラナビル、パリナビル、ラシナビル、およびHCVプロテアーゼ阻害剤BILN2061、VX−950、SCH503034等);および類似薬剤;ヌクレオシドおよびヌクレオチド系逆転写酵素阻害剤(ジドブジン、ジダノシン、ラミブジン、ザルシタビン、アバカビル、スタビジン(stavidine)、アデフォビル、アデフォビル・ジピボキシル、フォジブジン、トドキシル(todoxil)、エムトリシタビン、アロブジン、アムドキソビル、エルブシタビンおよび類似薬剤等);非ヌクレオシド系逆転写酵素阻害剤(ネビラピン、デラビルジン、エファビレンツ、ロビリド、イムノカル、オルチプラズ、カプラビリン、TMC−278、TMC−125、エトラビリンおよび類似薬剤等)(イムノカル、オルチプラズなどの耐酸化活性を有する薬剤を含む);侵入阻害剤(エンフビルチド(T−20)、T−1249、PRO−542、PRO−140、TNX−355、BMS−806、5−ヘリックスおよび類似薬剤等);インテグラーゼ阻害剤(L−870、180および類似薬剤等);出芽阻害剤(PA−344およびPA−457、および類似薬剤等);ケモカイン受容体阻害剤(ビクリビロク(SchC)、Sch−D、TAK779、マラビロク(UK−427,857)、TAK449に加えて、WO02/74769、WO2004/054974、WO2004/055012、WO2004/055010、WO2004/055016、WO2004/055011およびWO2004/054581中で開示されたもの、ならびに類似薬剤等);ノイラミニダーゼ阻害剤(CS−8958、ザナミビル、オセルタミビル、ペラミビルおよび類似薬剤等);イオンチャネルブロッカー(アマンタジンまたはリマンタジンおよび類似薬剤等);および干渉RNAおよびアンチセンスオリゴヌクレオチド(ISIS−14803および類似薬剤等);決定されてない作用機序の抗ウイルス剤(例えばWO2005/105761、WO2003/085375、WO2006/122011中で開示されたもの、リバビリンおよび類似薬剤)。
【0104】
式(I)の化合物およびその薬学上許容される塩は、ウイルス感染の予防または治療、例えば免疫療法において有用であり得る1つまたは複数の他の薬剤(例えばインターフェロンまたは他のサイトカイン/ケモカイン、サイトカイン/ケモカイン受容体修飾物質、サイトカインアゴニストまたはアンタゴニストおよび類似薬剤);ならびに治療ワクチン、抗線維化剤、コルチコステロイドまたはNSAID(非ステロイド性抗炎症剤)等の抗炎症剤および類似薬剤と組み合わせても使用することができる。式(I)の化合物およびその薬学上許容される塩は、アレルギー性疾患、炎症性疾患、自己免疫性疾患の予防または治療、例えば;抗原免疫療法(抗ヒスタミン、ステロイド、NSAID、気管支拡張剤(例えばβ2アゴニスト、アドレナリン作動性アゴニスト、抗コリン作動剤、テオフィリン)、メトトレキサート、ロイコトリエン修飾物質および類似薬剤);モノクローナル抗体療法(抗IgE、抗TNF、抗IL−5、抗IL−6、抗IL−12、抗IL−1および類似薬剤等);受容体療法(例えばエンタネルセプトおよび類似薬剤);抗原非特異的免疫療法(例えばインターフェロン、他のサイトカイン/ケモカイン、サイトカイン/ケモカイン受容体修飾物質、サイトカインアゴニストまたはアンタゴニスト、TLRアゴニストおよび類似薬剤)において有用であり得る1つまたは複数の他の薬剤と組み合わせて使用することができる。
【0105】
式(I)の化合物およびその薬学上許容される塩は、癌の予防または治療、例えば化学療法(アルキル化剤、トポイソメラーゼ阻害剤、抗代謝剤、抗分裂剤、キナーゼ阻害剤および類似薬剤等);モノクローナル抗体療法(トラスツズマブ、ゲムツズマブおよび他の類似薬剤等);およびホルモン療法(タモキシフェン、ゴセレリンおよび類似薬剤等)において有用であり得る1つまたは複数の他の薬剤と組み合わせて使用することができる。
【0106】
本発明に記載の医薬組成物は、単独でも、または他の治療法上の分野(例えば胃腸疾患)における少なくとも1つの他の治療剤と組み合わせて使用することもできる。本発明に記載の組成物は遺伝子組み換え療法と組み合わせて使用することもできる。
【0107】
本発明は、さらなる態様において、少なくとも1つの他の治療法上活性のある薬剤と共に、式(I)の化合物またはその薬学上許容される塩を含む組合わせを含む。
【0108】
上で参照された組合わせは医薬組成物の形態での使用に便利なように提供することができ、したがって、少なくとも1つの薬学上許容されるその希釈剤または担体と共に上で定義されるような組合わせを含む医薬組成物は本発明のさらなる態様を示す。
【0109】
式(I)の化合物またはその薬学上許容される塩の治療上有効量は複数の因子に依存するだろう。例えば、レシピエントの種、年齢および体重、治療を必要とする正確な状態およびその重症度、組成物の性質、ならびに投与経路は、すべて検討すべき因子である。治療上有効量は、最終的に付き添いの医師の裁量によるべきである。それとは関係なく、衰弱しているヒトの治療のための本発明の化合物の有効量は、一般的には1日あたり0.0001〜100mg/kgレシピエントの体重の範囲であるべきだ。通常は、有効量は、1日あたり0.001〜10mg/kg体重の範囲であるべきだ。したがって、70kgの成人にとって、1日あたりの実際の量の1つの例は通常は7〜700mgであろう。鼻腔内投与経路および吸入投与経路については、70kgの成人のための典型的な用量は1日あたり1mgから1mgの範囲であるべきだ。この量は、1日あたり単一用量、または1日あたり幾つかのサブ用量(2、3、4、5、またはそれ以上等)で全体の用量が同じであるように与えることができる。式(I)の化合物の薬学上許容される塩の有効量は、式(I)の化合物またはその薬学上許容される塩それ自体の有効量の割合として決定することができる。類似の投薬量は本明細書において参照される他の状態の治療に適切であるべきだ。
【0110】
式(I)の化合物およびその薬学上許容される塩は任意の適切な頻度(例えば1週間あたり1〜7回)でも投与することができる。正確な投薬レジメンは、治療指標、患者の年齢および状態、ならびに選ばれた特定の投与経路等の因子にもちろん依存するだろう。
【0111】
医薬組成物は、単位用量あたりの所定の量の活性成分を含む単位用量形態で提供することができる。かかる単位は、非限定的例として、治療されている状態、投与経路ならびに患者の年齢、体重および状態に依存して、0.5mg〜1gの式(I)の化合物またはその薬学上許容される塩を含むことができる。好ましい単位投与量組成物は、活性成分の、用量またはサブ用量(本明細書において上で列挙されたように)、またはその適切な一部を含むものである。かかる医薬組成物は、製薬技術における任意の周知の方法によって調製することができる。
【0112】
式(I)の化合物またはその薬学上許容される塩、および1つまたは複数の薬学上許容される希釈剤または担体を含む医薬組成物がしたがってさらに提供される。
【0113】
1つまたは複数の薬学上許容される希釈剤または担体と共に、式(I)の化合物またはその薬学上許容される塩を混合することを含む、かかる医薬組成物を調製するプロセスがさらに提供される。
【0114】
式(I)の化合物およびその塩は以下に記述される方法論によって調製することができ、本発明のさらなる態様を構成する。
【0115】
したがって、Yが炭素である式(I)の化合物の調製のためのプロセス(プロセスA)が提供され、該プロセスは、式(IIA)の化合物
【化2】

【0116】
を、式(IIIA)の化合物
【化3】

【0117】
(式中、R1、n、XおよびYは、式(I)の化合物について上文で定義された通りである)と反応させ、その後は、メチル保護基(OMe)を除去し、その後は、必要ならば、
(i).式(I)の化合物をさらなる式(I)の化合物に転換するステップ、
(ii).任意の必要なさらなる保護基を除去するステップ、
(iii).そのように形成された化合物の塩または溶媒和物を調製するステップ
のオプションステップのうちの1つまたは複数の実行を含む。
【0118】
例えば、式(IIA)の化合物はN,N’−ジメチルホルムアミド(DMF)等の好適な溶媒中で溶解され、式(IIIA)の化合物(ジ−イソプロピルエチルアミン(DIPEA)等の好適な塩基の存在下において、純粋な形で、またはアセトニトリル等の好適な溶媒中に溶解して導入される)の溶液に添加される。反応が完了するまで、反応混合物を、好適な時間(一晩等)で、45〜55℃等の好適な上昇させた温度まで任意で加熱することができる。
【0119】
メチル保護基(式(IIA)の化合物中のOMe)の除去は、もたらされた化合物を、好適な溶媒(例えば1,4−ジオキサン)中の好適な強度(例えば4Nまたは2N)の塩化水素の溶液により、典型的には室温で4時間〜24時間等の適切な時間で処理することによって達成することができる。
【0120】
式(IIA)の化合物は以下のスキーム1に従って調製することができる。
【0121】
式(IIIA)の化合物は商業的に入手可能であり、2−ブロモエタノールを含む。
【0122】
スキーム1:Yが炭素である式(IIA)の化合物の調製
【化4】

【0123】
ここで、R1、nおよびXは式(I)の化合物について上文で定義され、Protは好適な保護基、通常CBZ(カルボベンジルオキシ)である。
【0124】
試薬および条件:(i)DMF等の好適な溶媒、炭酸カリウム等の好適な塩基、通常50〜60℃等の上昇させた温度で、18〜24時間等の好適な時間;(ii)脱保護。Prot=CBZの場合、CBZ基は、エタノール等の好適な溶媒中の10%のパラジウム炭素の存在下における還元によって除去することができる。
【0125】
式(IV)の化合物は以下のスキーム2およびスキーム3に従って調製することができる。
【0126】
式(V)の化合物は以下のスキーム4に従って調製することができる。
【0127】
スキーム2:Xが酸素である式(IV)の化合物(IVA)の調製
【化5】

【0128】
ここで、TFAはトリフルオロ酢酸である。
【0129】
試薬および条件:(i)p−トルエンスルホン酸等の好適な酸の存在下において酢酸エチル等の好適な溶媒、通常45〜55℃等の上昇させた温度で約1時間等の好適な期間;(ii)イソプロピルアルコール等の好適な溶媒、アンモニア、通常45〜55℃等の上昇させた温度で5〜24時間等の好適な期間;(iii)ナトリウムtert−ブトキシド等の好適な塩基、n−ブタノール(例えばAldrichから商業的に入手可能)、通常約100℃等の上昇させた温度で18〜24時間等の好適な期間;(iv)クロロホルム等の好適な溶媒、N−ブロモスクシンイミド(例えばAldrichから商業的に入手可能)、0℃(アイスバス中の)等の好適な低下させた温度で、次いで周囲温度まで5〜7時間等の好適な期間で上昇;(v)好適な塩基および溶媒の組合わせとしてナトリウムメトキシド/メタノール、通常4〜6時間等の好適な期間の還流;(vi)メタノール等の好適な溶媒、トリフルオロ酢酸等の好適な酸、36〜60時間等の好適な期間。
【0130】
式(VII)および(VIII)の化合物は商業的に入手可能である。
【0131】
式(IX)、(X)、(XIA)、(XII)、(XIII)および(IV)の化合物は、国際公開第WO2008/101867号中で開示される方法に従っても調製することができる。
【0132】
式(X)の化合物は、式(IX)の中間体を単離せずに、式(VII)および(VIII)の化合物からも直接製造することができる。
【0133】
スキーム3:Xが窒素である式(IV)の化合物(IVB)の調製
【化6】

【0134】
ここで、TFAはトリフルオロ酢酸である。
【0135】
試薬および条件:(i)エチレングリコール等の好適な溶媒通常110〜130℃等の上昇させた温度で、12〜24時間等の好適な期間;(ii)クロロホルム等の好適な溶媒、N−ブロモスクシンイミド(例えばAldrichから商業的に入手可能)、周囲温度で15〜35分等の好適な期間、次いで好適な塩基および溶媒の組合わせとしてナトリウムメトキシド/メタノール、通常60〜70℃等の上昇させた温度で、12〜24時間等の好適な期間、続いてメタノール等の好適な溶媒、トリフルオロ酢酸等の好適な酸、36〜60時間等の好適な期間。
【0136】
式(XIV)の化合物は商業的に入手可能である。
【0137】
上のスキーム2におけるように、式(X)の化合物を調製する。
【0138】
スキーム4:Yが炭素である式(V)の化合物の調製
【化7】

【0139】
ここで、nは式(I)の化合物について上文で定義され、Protは好適な保護基、通常CBZである。
【0140】
式(XV)の化合物において、(CH2)n基が6員環の窒素に結合されなくてもよいことが認識される。
【0141】
試薬および条件:(i)以下のいずれか、クロロギ酸ベンジル(例えばAldrichから商業的に入手可能)、トリエチルアミン等の好適な塩基の存在下において、アセトニトリル等の好適な溶媒中で、通常0℃(アイスバス中の)等の好適な低下させた温度で、次いで周囲温度まで12〜24時間等の好適な期間で上昇;またはジクロロメタン等の好適な溶媒中のトリエチルアミン等の好適な塩基の存在下において、1−({[(フェニルメチル)オキシ]カルボニル}オキシ)−2,5−ピロリジンジオン(Aldrichから、例えば商業的に入手可能)を使用して、周囲温度で12〜24時間等の好適な期間。
【0142】
式(XV)の化合物は、以下の対応する酸(アルコールの代わりに)
【化8】

【0143】
からも、ボラン−テトラヒドロフラン錯体の存在下において、テトラヒドロフラン等の好適な溶媒を使用する還元によって、通常0℃(アイスバス中の)等の低下させた温度で、製造することができる。反応物はメタノール等の好適な溶媒を使用して、次いでさらにメタノール中の2N塩化水素等の好適な酸により通常クエンチされる。
【0144】
Yが窒素であり、(CH2)nがYを介して結合される式(I)の化合物の調製のためのプロセス(プロセスB)がさらに提供され、該プロセスは、式(IIB)の化合物
【化9】

【0145】
(式中、R1、nおよびXは、式(I)の化合物について上文で定義された通りである)を脱保護し、その後は、必要ならば、
(i)式(I)の化合物を式(I)のさらなる化合物に転換するステップ、
(ii)そのように形成された化合物の塩または溶媒和物を調製するステップ
のオプションのステップのうちの1つまたは複数の実行を含む。
【0146】
例えば、式(IIB)の化合物は好適な溶媒(例えばメタノール)中で溶解され、好適な溶媒(例えば1,4−ジオキサン)中の4Nの塩化水素溶液により処理される。反応物は、周囲温度等の適切な温度で4〜24時間等の好適な期間撹拌される。
【0147】
式(IIB)の化合物は以下のスキーム5に従って調製することができる。
【0148】
スキーム5:Yが窒素であり、(CH2)nがYを介して結合される式(IIB)の化合物の調製
【化10】

【0149】
ここで、n、XおよびR1は式(I)の化合物について上文で定義される。
【0150】
試薬および条件:(i)化合物(IV)を炭酸カリウム等の好適な塩基の存在下においてDMF等の好適な溶媒中で溶解し、通常40〜60℃への等の上昇させた温度で、0.5〜2時間への等の好適な期間、次いで0℃〜周囲温度等の低下させた温度まで冷却し、式(XVIII)の化合物を添加し、5〜20時間への等の好適な期間で反応させる、(ii)式(IIIC)、アセトニトリル等の好適な溶媒またはDMFの化合物、DIPEA等の好適な塩基、通常60〜80℃等の上昇させた温度で、18〜36時間等の好適な期間。
【0151】
式(IIC)の化合物の式(I)の化合物への転換は、式(IIB)の化合物の単離なしに実行できることが認識される。
【0152】
本明細書において記述された合成経路において用いることができる他の保護基およびそれらの除去のための手段の例は、T.W.Greene「Protective Groups in Organic Synthesis」、第3版、J.Wiley and Sons、1999年(かかる手順に関連して参照として本明細書に援用される)中で見出すことができる。
【0153】
上文に記述された反応またはプロセスのいずれかのための、加熱および冷却の従来の方法、例えば、温度調節オイルバスまたは温度調節ホットブロック、および氷/塩バスまたはドライアイス/アセトンバスをそれぞれ、用いることができる。単離の従来の方法、例えば水性溶媒または非水性溶媒からの、またはそれらの中への抽出を使用することができる。硫酸マグネシウムもしくは硫酸ナトリウムと共に振盪すること、または疎水性フリットを通過させること等の、有機溶媒、溶液または抽出物を乾燥する従来の方法を用いることができる。精製の従来の方法、例えば結晶およびクロマトグラフィー(例えばシリカクロマトグラフィーまたは逆相クロマトグラフィー)を、必要に応じて使用することができる。反応モニタリング技法、例えば薄層クロマトグラフィーおよびLC−MSによって具体的な反応時間、温度が典型的には決定できることが認識される。
【0154】
必要に応じて、式(I)の化合物の個々の異性体は、偏左右異性誘導体の分別結晶またはキラル高速液体クロマトグラフィー(キラルHPLC)等の従来の手順を使用して、個々の異性体として調製することができる。本発明は以下の実施例を限定的な方法ではなく参照して説明される。
【実施例】
【0155】
実験の詳細
本明細書において参照されるLCMSシステムA〜Dの実験の詳細は、以下の通りである。
【0156】
システムA
カラム: 50mm×2.1mm、ID、1.7μm Acquity UPLC BEH C18
流速: 1mL/分
温度: 40℃
UV検出範囲: 210〜350nm
質量スペクトル:交互スキャンの正および負のモードのエレクトロスプレーイオン化を使用して、質量分析計で記録した
溶媒: A:水中の0.1%v/vのギ酸
B:0.1%v/vのギ酸アセトニトリル
勾配:時間(分) A% B%
0 97 3
1.5 0 100
1.9 0 100
2.0 97 3
システムB
カラム: 30mm×4.6mm、ID、3.5μm Sunfire C18カラム
流速: 3mL/分
温度: 30℃
UV検出範囲: 210〜350nm
質量スペクトル:交互スキャンの正および負のモードのエレクトロスプレーイオン化を使用して、質量分析計で記録した
溶媒: A:水中の0.1%v/vのギ酸溶液
B:アセトニトリル中の0.1%v/vのギ酸溶液
勾配:時間(分) A% B%
0 97 3
0.1 97 3
4.2 0 100
4.8 0 100
4.9 97 3
5.0 97 3
システムC
カラム: 50mm×2.1mm、ID、1.7μm Acquity UPLC BEH C18
流速: 1mL/分
温度: 40℃
UV検出範囲: 210〜350nm
質量スペクトル:交互スキャンの正および負のモードのエレクトロスプレーイオン化を使用して、質量分析計で記録した
溶媒: A:アンモニア溶液によりpH10に調節した水中の10mM重炭酸アンモニウム
B:アセトニトリル
勾配:時間(分) A% B%
0 99 1
1.5 3 97
1.9 3 97
2.0 0 100
システムD
カラム: 50mm×4.6mm、ID、3.5μm XBridge C18カラム
流速: 3mL/分
温度: 30℃
UV検出範囲: 210〜350nm
質量スペクトル:交互スキャンの正および負のモードのエレクトロスプレーイオン化を使用して、質量分析計で記録した。
【0157】
溶媒: A:アンモニア溶液によりpH10に調節した水中の10mM重炭酸アンモニウム
B:アセトニトリル
勾配:時間(分) A% B%
0 99 1
0.1 99 1
4.0 3 97
5.0 3 97
システムE
カラム: 30mm×4.6mm、ID、3.5μm Sunfire C18カラム
流速: 3mL/分
温度: 30℃
UV検出範囲: 210〜350nm
質量スペクトル:交互スキャンの正および負のモードのエレクトロスプレーイオン化を使用して、質量分析計で記録した
溶媒: A:水中の0.1%v/vのトリフルオロ酢酸溶液
B:アセトニトリル中の0.1%v/vのトリフルオロ酢酸溶液
勾配:時間(分) A% B%
0 97 3
0.1 97 3
4.2 0 100
4.8 0 100
4.9 97 3
5.0 97 3
クロマトグラフィー精製は、典型的にはプレパックシリカゲルカートリッジを使用して行った。Flashmaster IIは、Argonaut Technologiesから入手可能な自動化マルチユーザーフラッシュクロマトグラフィーシステムであり、使い捨ての順相固相抽出(SPE)カートリッジ(2g〜100g)を利用する。これには、勾配法の実行を可能にする四元オンライン溶媒混合が提供されている。サンプルを、多機能オープンアクセスソフトウェア(溶媒、流速、勾配プロファイルおよび採取条件を管理する)を使用して待機させる。システムは、Knauer波長変更可能UV検出器、ならびに自動化ピークカッティング、採取およびトラッキングを可能にする2個のGilsonFC204フラクションコレクターを装備する。
【0158】
窒素気流を使用する溶媒除去を、Radleys Discovery Technologies(Saffron Walden、Essex、CB11 3AZ、UK)から入手可能なGreenHouse Blowdownシステムで30〜40℃で行った。
【0159】
1H NMRスペクトルは、すべて400MHzで作動する、Bruker DPX 400またはBruker Avance DRXまたはVarian Unity 400分光計のいずれかで、CDCl3またはDMSO−d6のいずれかにおいて記録した。使用される内部標準は、CDCl3について7.25ppmまたはDMSO−d6について2.50ppmで、テトラメチルシランまたは残存するプロトン化された溶媒のいずれかであった。
【0160】
質量分析による自動分取(MPAP)HPLCは、以下で与えられた条件下で行った。UV検出は210nm〜350nmの波長からの平均化されたシグナルであり、質量スペクトルは交互スキャンの正および負のモードのエレクトロスプレーイオン化を使用して質量分析計で記録した。
【0161】
方法A
方法Aは、XBridge C18カラム(典型的には150mm×19mm、内径5μmのパッキングした直径)で周囲温度で行った。用いられた溶媒は以下の通りであった。
【0162】
A=アンモニア溶液によりpH10に調整した10mM重炭酸アンモニウム水溶液。
【0163】
B=アセトニトリル。
【0164】
方法B
方法Bは、Atlantis C18カラム(典型的には100mm×30mm、内径5μmのパッキングした直径)で周囲温度で行った。用いられた溶媒は以下の通りであった。
【0165】
A=水中の0.1%v/vのギ酸溶液
B=アセトニトリル中の0.1%v/vのギ酸溶液。
【0166】
中間体
中間体1:2,6−ジクロロ−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン
【化11】

【0167】
2,6−ジクロロプリン(例えばAldrichから商業的に入手可能)(25.0g)に、酢酸エチル(260mL)、続いてp−トルエンスルホン酸(0.253g)を添加した。混合物を50℃に加熱し、次いで、3,4−ジヒドロ−2H−ピラン(例えばAldrichから商業的に入手可能)(16.8g)を添加した。次いで反応混合物を50℃で4時間加熱した。反応混合物を真空下で蒸発させて黄色固体として表題化合物を得た(36.9g)。
【0168】
1H NMR(CDCl3):8.35(1H,s),5.77(1H,dd),4.20(1H,m),3.79(1H,m),2.20−1.65(6H,m).
中間体2:2−クロロ−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミン
【化12】

【0169】
調製1
2,6−ジクロロ−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン(例えば中間体1のために調製された)(36.9g)を、イソプロパノール(250mL)中の2Mアンモニアと共に50℃で5時間加熱した。周囲温度で一晩放置した後、イソプロパノール(100mL)中の2Mアンモニアをさらに添加して、生じたケーキを破壊し、反応が完了するまで反応混合物をさらに9時間加熱した。反応混合物に水(70mL)を添加し、黄色固体が濾過されて残った。固体をイソプロピルアルコール:水(5:1(v/v)、60mL)で洗浄し、次いで吸引下で空気乾燥して第1の産物を得た。一晩放置して沈殿を単離した後に、濾液を再濾過し、両固体を真空下で乾燥した。第1の産物は純粋であり、第2の産物物質は非常にマイナーな不純物(第1の産物において見られない分離した広範囲のシグナル3.5ppm)を示したが、他の点では同一であった。固体第1の産物(28.4g)、固体第2の産物(3.42g)。
【0170】
1H NMR(CDCl3):8.01(1H,s),5.98(2H,broads),5.70(1H,dd),4.16(1H,m),3.78(1H,m),2.15−1.60(6H,overlapping m).
調製2
無水酢酸エチル(200mL)中の2,6−ジクロロプリン(例えばAldrichから商業的に入手可能)(25g)の溶液に、p−トルエンスルホン酸一水和物(235mg)を添加した。反応物を50℃に加熱し、3,4−ジヒドロ−2H−ピラン(例えばAldrichから商業的に入手可能)(18.1mL)を一気に添加した。反応物を50℃で1時間撹拌したままにし、溶媒を減圧下で除去した。これにより黄色固体を得た。イソプロパノール(460 mL)中の2.0Mアンモニア中のこの固体(〜36g)の懸濁物を窒素下で付属のコンデンサーにより60℃で4時間加熱した。反応物を水(50mL)の中に注ぎ、一晩放置して冷却した。沈殿を濾過し、回転蒸発装置(60℃)で30分間乾燥して、灰白色固体として表題化合物を31g得た(93%、2ステップ)。
【0171】
MS (C10H12ClN5O)+についての計算値(C10H12ClN5O)+=254,256
MS 実測値(電気スプレー):(M)+=254,256(3:1)
1H NMR((CD3)2SO):δ8.43(1H,s),7.82(2H,s),5.55(1H,dd),4.00(1H,m),3.69(1H,m),2.21(1H,m),1.95(2H,m),1.74(1H,m),1.56(2H,m).
中間体3:2−ブトキシ−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミン
【化13】

【0172】
ブタン−1−オール(例えばAldrichから商業的に入手可能)(76mL)に、ナトリウムtert−ブトキシド(15.2g)を小分けで添加した(注:反応混合物は暖かくなる)。均質になるまで上記のものを撹拌してから(〜15分)、次いで2−クロロ−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミンを、生じた淡黄色溶液に添加した。次いで反応混合物を100℃に一晩加熱した。反応混合物をストリップして可能なかぎりブタン−1−オールを除去してから、ジエチルエーテルと水との間で分配した。ジエチルエーテル相を分離し、水相をジエチルエーテルでさらに再抽出した。合わせた有機層を硫酸マグネシウム(無水)の上で乾燥した。硫酸マグネシウムを濾過により除き、濾液をストリップし、茶色の粘稠な油を得て、トルエンと共に共沸し(3回)、高真空下に一晩置き、ジクロロメタンと共に新しいフラスコに移し、ストリップし、高真空下に置いて、茶色ガラスとして表題化合物を得た(9.45g)。
【0173】
1H NMR(CDCl3):7.85(1H,s),5.92(2H,broads),5.64(1H,d),4.32(2H,t),4.14(1H,m),3.75(1H,m),2.10−1.95(3H,overlapping m),1.81−1.58(5H,overlapping m),1.50(2H,m),0.97(3H,t).
中間体4:8−ブロモ−2−ブトキシ−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミン
【化14】

【0174】
2−(ブトキシ)−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミン(例えば中間体4のために調製された)(9.45g)をクロロホルム(50mL)中に溶解し、0℃に冷却した(アイスバス)。この溶液にN−ブロモスクシンイミド(例えばAldrichから商業的に入手可能)(6.07g)を小分けで添加し、3℃未満の温度を維持した。これにより暗緑色溶液が生じ、2.5℃で30分間撹拌してから、室温まで暖め、次いで6時間撹拌した。次いで反応混合物を水(100mL、2回)で洗浄した。有機相を疎水性フリットを使用して乾燥/分離し、蒸発させ、暗褐色ゴムを得て、0〜50%酢酸エチル:シクロヘキサンの勾配溶出を使用して、シリカクロマトグラフィー(120g)(ISCO)によって精製して、淡黄色固体として表題化合物を得た(8.37g)。
【0175】
1H NMR(CDCl3):5.61(1H,dd),5.49(2H,broads),4.32(2H,m),4.17(1H,m),3.71(1H,m),3.04(1H,m),2.11(1H,broadd),1.89−1.45(6H,overlapping m),1.50(2H,m),0.97(3H,t).
中間体5:2−ブトキシ−8−メトキシ−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミン
【化15】

【0176】
8−ブロモ−2−(ブトキシ)−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミン(例えば中間体4のために調製された)(8.37g)を、メタノール(例えばAldrichから商業的に入手可能)(14.4mL)およびメタノール(65mL)中の25%のナトリウムメトキシドと共に4.5時間加熱還流した。反応混合物を減圧下で濃縮し、酢酸エチルと飽和塩化アンモニウム溶液との間で分配した。有機相を分離し、酢酸エチルの中への抽出を反復した。有機相を合わせ、ブライン(2回)で洗浄した。水相の分離後に、有機相は疎水性フリットを通過させ、蒸発させて、薄茶色ゴムを得て、高真空下に置き、泡(7.52g)を得たが、それは周囲圧力でゴム(7.34g)へ潰れ、一晩凝固させ、黄色非晶性固体として表題化合物を得た。
【0177】
MS (C15H23N5O3)+についての計算値=321
MS 実測値(電気スプレー):(M+H)+=322
1H NMR(CDCl3):5.50(1H,dd),5.17(2H,broads),4.29(2H,t),4.12(3H,sおよび1H,m),3.70(1H,m),2.77(1H,m),2.05(1H,m),1.82−1.63(6H,overlapping m),1.50(2H,m),0.97(3H,t).
中間体6:2−ブトキシ−8−メトキシ−9H−プリン−6−アミントリフルオロ酢酸塩
【化16】

【0178】
メタノール(100mL)中の2−(ブトキシ)−8−(メトキシ)−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミン(例えば中間体5のために調製された)(7.34g)の溶液に、トリフルオロ酢酸(10mL)を添加した。混合物を周囲温度で週末の間撹拌して、懸濁物を得た。反応混合物を小体積(濃厚なスラリー)へ濃縮してから、酢酸エチル(50mL)により希釈した。生じたスラリーを濾過し、濾液が無色になるまで小体積の酢酸エチルで洗浄した。残りの固体を空気によって次いで真空下で乾燥して、白色固体として表題化合物を得た(6.20g)。以前に得た濾液を濃縮してスラリーを得て、小体積の酢酸エチル(10mL)で希釈し、次いで濾過し、上記のように乾燥した。この第2の産物を白色固体として単離した(0.276g)。両方の産物はNMRによって同一であった。
【0179】
MS (C10H15N5O2)+についての計算値=237
MS 実測値(電気スプレー):(M+H)+=238
1H NMR(CD3OD):4.47(2H,t),4.15(3H,s),1.80(2H,m),1.50(2H,m),0.99(3H,t)(置換性NH2,NHおよびCOOHプロトンは観察されていない).
中間体7:N2−ブチル−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−2,6−ジアミン
【化17】

【0180】
無水エチレングリコール(例えばAldrichから商業的に入手可能)(50mL)中の2−クロロ−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−6−アミン(例えば中間体2のために調製された)(10g)の溶液に、n‐ブチルアミン(例えばAldrichから商業的に入手可能)(16mL)を室温の窒素下で一気に添加した。反応物を120℃で一晩加熱した。反応物を室温まで冷却し、酢酸エチル(150mL)で希釈し、水(2×50mL)で洗浄した。有機層をMgSO4の上で乾燥し、濾過し、真空下で濃縮した。これにより粘稠な緑色油として表題化合物を得て(10.2g)、これをさらに精製せずに次のステップで使用した。
【0181】
MS (C14H22N6O)+についての計算値=290
MS 実測値(電気スプレー):(M+H)+=291
1H NMR((CD3)2SO):δ7.8(1H,s),6.6(2H,s),6.2(1H,t),5.4(1H,dd),4.0(1H,m),3.6(1H,m),3.2(2H,m),2.2(1H,m),1.9(1H,m),1.8(1H,m),1.7(1H,m),1.5(2H,m),1.4(2H,m),1.3(2H,m),0.9(3H,t).
中間体8:N2−ブチル−8−メトキシ−9H−プリン−2,6−ジアミン、トリフルオロ酢酸塩
【化18】

【0182】
無水クロロホルム(100mL)中の未精製N2−ブチル−9−(テトラヒドロ−2H−ピラン−2−イル)−9H−プリン−2,6−ジアミン(例えば中間体7のために調製された)(〜10.2g)の溶液に、N−ブロモスクシンイミド(例えばAldrichから商業的に入手可能)(6.3g)を、室温で5分にわたり小分けで添加した。黒っぽい溶液を室温で30分間撹拌したままにした。反応混合物を水(20mL)で洗浄した。有機相は疎水性フリットを通過させ、真空下で濃縮した。これによりベージュ色固体を得て、無水メタノール(100mL)中に溶解し、ナトリウムメトキシド溶液(メタノール中で25重量%、例えばAldrichから商業的に入手可能)(24mL)に、室温の窒素下で一気に添加した。反応物を付属のコンデンサーにより65℃で一晩加熱した。反応物を冷却し、真空下で濃縮した。生じたオレンジ色残留物を酢酸エチル(150mL)中に取り上げ、飽和塩化アンモニウム水溶液(50mL)の中へ注いだ。有機層を分離し、水(50mL)でさらに洗浄した。有機層をMgSO4の上で乾燥し、濾過し、真空下で濃縮した。無水メタノール(70mL)中のこの物質に、トリフルオロ酢酸(7mL)を室温で一気に添加した。反応物を30時間撹拌し、真空下で濃縮して、暗褐色固体を得た。これをジエチルエーテル(20mL)中に取り上げ、粉砕した。固体を濾過して、ベージュ色固体として表題化合物を得た(3.3g、35%、4ステップ)。
【0183】
MS (C10H16N6O)+についての計算値=236
MS 実測値(電気スプレー):(M+H)+=237
1H NMR((CD3)2SO):δ13.3−12.3(1H,br.m),8.6−7.3(2H,m),4.05(3H,s),3.28(2H,m),1.52(2H,m),1.33(2H,m),0.89(3H,t)(残存している置換性プロトンはなくならない).
中間体9:フェニルメチル2−(3−ヒドロキシプロピル)−1−ピペリジンカルボキシラート
【化19】

【0184】
3−(2−ピペリジニル)−1−プロパノール(例えばChemBridgeから商業的に入手可能)(8.69g、60.7mmol)を、トリエチルアミン(10.40mL、74.6mmol)と共にアセトニトリル(90mL)中で窒素下で撹拌し、アイスバス中で冷却した。クロロギ酸ベンジル(例えばAldrichから商業的に入手可能)(9.53mL、66.7mmol)を1滴ずつ添加した。添加の完了後に、反応物を周囲温度まで温まるように放置し、撹拌し、次いで一晩継続した。懸濁物を濾過し、濾液を蒸発乾固した。残留物を酢酸エチルと水との間で分配した。有機相を飽和ブラインで洗浄し、疎水性フリットを通過させ、蒸発乾固した。残留物を、ISCO Companionでの酢酸エチルの50〜100%フラッシュにより、40分にわたるシクロヘキサン中の0〜50%酢酸エチル勾配を使用するシリカクロマトグラフィー(330gシリカRediSepカラム、DCM中でロードした)によって精製した。ピークは検出されなかった(254nm、280nm)。したがって廃液を真空下で蒸発して物質を回収した。以前と同一の条件を使用して物質を再びカラムにかけたが、220nmで検出し溶出液をすべて回収した。主な産物ピークを回収し、真空下で蒸発させて、黄色油として表題化合物を得た(6.15g)。
【0185】
LCMS(System B):tRET=2.46min;MH+278
中間体10:フェニルメチル2−(3−ブロモプロピル)−1−ピペリジンカルボキシラート
【化20】

【0186】
無水ジクロロメタン(34mL)中のフェニルメチル2−(3−ヒドロキシプロピル)−1−ピペリジンカルボキシラート(例えば中間体9のために調製された)(2.14g、7.72mmol)の溶液に、四臭化炭素(例えばAldrichから商業的に入手可能)(5.12g、15.43mmol)を添加した。生じた溶液を氷/水中で冷却した。無水DCM(10mL)中のトリフェニルフォスフィン(4.05g、15.43mmol)の溶液を30分にわたり1滴ずつ添加し、濃琥珀色/茶色溶液が産生された。添加の完了後に、反応物を周囲温度まで徐々に暖まるように放置し、一晩継続して撹拌した。反応混合物を濾過して沈殿を取り出し、エーテルで洗浄し、濾液を〜10mLまで蒸発させた。次いでこれを100gのシリカカートリッジ上にロードし、Flashmasterでの40分にわたるシクロヘキサン中の0〜25%の酢酸エチルのFlashmaster勾配を使用してクロマトグラフィーによって精製し、すべての溶出液を回収した。産物ピークをTLCによって同定し、画分を合わせ、真空下で蒸発させて、透明な油として表題化合物を得た(2.13g)。
【0187】
LCMS(System B):tRET=3.44min;MH+340/342
中間体11:フェニルメチル2−{3−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペリジンカルボキシラート
【化21】

【0188】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミン、トリフルオロ酢酸塩(例えば中間体6のために調製された)(1.834g、5.22mmol)を、DMF(23mL)中の炭酸カリウム(2.89g、20.88mmol)と共に60℃で1時間加熱した。フェニルメチル2−(3−ブロモプロピル)−1−ピペリジンカルボキシラート(例えば中間体10のために調製された)(2.131g、6.26mmol)を添加し、50℃で一晩(20時間)継続して加熱した。反応混合物を水(250mL)と酢酸エチル(150mL)との間で分配した。水相を酢酸エチル(100mL)でさらに抽出した。合わせた有機層をブライン(100mL)で洗浄し、疎水性フリットを通過させて乾燥し、次いでストリップにより乾燥(回転蒸発装置)して、オレンジ色液体を得た。物質を2×70gのアミノプロピルカートリッジ上にロードし、40分にわたるシクロヘキサン中の0〜100%の酢酸エチルの勾配においてFlashmasterシステムで溶出した。適切な産物画分を合わせ、真空下で蒸発させて、透明な油として表題化合物を得た(1.16g)。
【0189】
LCMS(System B):tRET=2.92min;MH+ 497
中間体12:2−(ブチルオキシ)−8−(メチルオキシ)−9−[3−(2−ピペリジニル)プロピル]−9H−プリン−6−アミン
【化22】

【0190】
エタノール(130mL)中のフェニルメチル2−{3−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペリジンカルボキシラート(例えば中間体11のために調製された)(1.16g、2.336mmol)を、10%のパラジウム炭素(0.497g、0.467mmol)の上で周囲温度で一晩水素添加を行った。混合物を窒素下でセライトカートリッジを介して濾過し、エタノールで洗浄し、真空下で蒸発させて、クリーム色固体として表題化合物を得た(0.66g)。
【0191】
LCMS(System B):tRET=1.29min;MH+363
中間体13:フェニルメチル3−{[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]メチル}−1−ピペリジンカルボキシラート
【化23】

【0192】
DMF(60ml)中の2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)(2.56g、7.29mmol)の溶液に炭酸カリウム(4.03g、29.1mmol)を添加し、混合物を窒素の雰囲気下で60℃で1時間撹拌して放置した。次いで反応混合物を室温まで冷却し、これに、フェニルメチル3−(ブロモメチル)−1−ピペリジンカルボキシラート(例えばAniChemから商業的に入手可能、または調製については国際公開WO1999/45006を参照されたい)(2.275g、7.29mmol)を添加した。反応物を50℃まで戻し、一晩撹拌して放置した。反応混合物を水(〜40mL)で希釈し、1:1酢酸エチル:DCM(40mL)の溶媒混合物により分配した。有機層を疎水性フリットを使用して分離し、真空下で濃縮して、淡黄色濃厚油を得た。粗製物質を1:1 DMSO:MeOH(5mL)中で溶解し、この溶液の2分の1を、最初は330gのC18シリカカラムで高pHシステムを使用する逆相クロマトグラフィーで精製した。使用した勾配は以下の通りだった。
【0193】
1CV=A中の40%の溶媒B
2CV=A中の60%の溶媒B
6CV=A中の80%の溶媒B
1CV=A中の95%の溶媒B
0.2CV=A中の95%の溶媒B
1.8CV=100%の溶媒B
溶媒A=10mmol重炭酸アンモニウムおよびNH3を含む水(pH10)、溶媒B=0.1%のNH3を含むアセトニトリル
(CV=カラム体積)
必要な異性体を含むことがLCMS分析によって示された画分を合わせて真空下で濃縮し、残りの混合画分を別に合わせて真空下で濃縮した。
【0194】
精製が必要な粗製物質の残りの2分の1を含むフラスコ中で、何かが沈殿したことが見出された。これを濾過し、冷DMSOで洗浄して白色結晶質を得た。クロマトグラフィーからの混合画分をDMSOから再結晶させた。クロマトグラフィーからの物質および再結晶した物質を合わせて、白色固体として表題化合物を得た(1.38g)。
【0195】
LCMS(System C):tRET=3.13min;MH+469
中間体14:2−(ブチルオキシ)−8−(メチルオキシ)−9−(3−ピペリジニルメチル)−9H−プリン−6−アミン
【化24】

【0196】
フェニルメチル3−{[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]メチル}−1−ピペリジンカルボキシラート(例えば中間体13のために調製された)から、中間体12と同様に調製した。
【0197】
LCMS(System C):tRET=2.25min;MH+335
中間体15:フェニルメチル3−(2−ヒドロキシエチル)−1−ピペリジンカルボキシラート
【化25】

【0198】
2−(3−ピペリジニル)エタノール(例えばTygerから商業的に入手可能)から、中間体9と同様に調製した。
【0199】
LCMS(System B):tRET=2.32min;MH+264
中間体16:フェニルメチル3−(2−ブロモエチル)−1−ピペリジンカルボキシラート
【化26】

【0200】
フェニルメチル3−(2−ヒドロキシエチル)−1−ピペリジンカルボキシラート(例えば中間体15のために調製された)から、中間体10と同様に調製した。
【0201】
LCMS(System D):tRET=3.37min;MH+326/328
中間体17:フェニルメチル3−{2−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]エチル}−1−ピペリジンカルボキシラート
【化27】

【0202】
フェニルメチル3−(2−ブロモエチル)−1−ピペリジンカルボキシラート例えば中間体16のために調製された)および2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)から、中間体11と同様に調製した。
【0203】
LCMS(System D):tRET=3.38min;MH+483
中間体18:2−(ブチルオキシ)−8−(メチルオキシ)−9−[2−(3−ピペリジニル)エチル]−9H−プリン−6−アミン
【化28】

【0204】
フェニルメチル3−{2−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]エチル}−1−ピペリジンカルボキシラート(例えば中間体17のために調製された)から、中間体12と同様に調製した。
【0205】
LCMS(System B):tRET=2.42min;MH+349
中間体19:フェニルメチル3−(3−ヒドロキシプロピル)−1−ピペリジンカルボキシラート
【化29】

【0206】
1−({[(フェニルメチル)オキシ]カルボニル}オキシ)−2,5−ピロリジンジオン(例えばAldrichから商業的に入手可能)(8.70g、34.9mmol)を、ジクロロメタン(100mL)中の3−(3−ピペリジニル)−1−プロパノール(例えばAstatechから商業的に入手可能)(5.02g、35mmol)およびトリエチルアミン(5mL、3.63g、35.9mmol)の撹拌混合物に、小分けで室温で添加した。生じた混合物を室温で18時間放置した。反応混合物を飽和炭酸水素ナトリウム溶液(100mL)で洗浄した。有機相を乾燥し(MgSO4)、濾過し、蒸発させた。サンプルを、40分にわたる0−100%の酢酸エチル−シクロヘキサンの勾配を使用するシリカクロマトグラフィー(ジクロロメタン中でロードした100gのカートリッジ)によって精製した。適切な画分を合わせ、真空下で蒸発させて、無色液体として表題化合物を得た(8.45g)。
【0207】
LCMS(System B):tRET=2.45min;MH+278
中間体20:フェニルメチル3−(3−ブロモプロピル)−1−ピペリジンカルボキシラート
【化30】

【0208】
フェニルメチル3−(3−ヒドロキシプロピル)−1−ピペリジンカルボキシラート(例えば中間体19のために調製された)から、中間体10と同様に調製した。
【0209】
LCMS(System B):tRET=3.44min;MH+340/342
中間体21:フェニルメチル3−{3−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペリジンカルボキシラート
【化31】

【0210】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)およびフェニルメチル3−(3−ブロモプロピル)−1−ピペリジンカルボキシラート(例えば中間体20のために調製された)から、中間体11と同様に調製した。
【0211】
LCMS(System D):tRE=3.39min;MH+497
中間体22:2−(ブチルオキシ)−8−(メチルオキシ)−9−[3−(3−ピペリジニル)プロピル]−9H−プリン−6−アミン
【化32】

【0212】
フェニルメチル3−{3−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペリジンカルボキシラート(例えば中間体21のために調製された)から、中間体12と同様に調製した。
【0213】
LCMS(System D):tRET=2.43min;MH+363
中間体23:フェニルメチル3−(4−ヒドロキシブチル)−1−ピペリジンカルボキシラート
【化33】

【0214】
無水THF(40mL)中の4−(1−{[(フェニルメチル)オキシ]カルボニル}−3−ピペリジニル)ブタン酸(例えばAstatechから商業的に入手可能)(5.01g、16.41mmol)の溶液に、ボラン−THF錯体の溶液(THF中の1M溶液)(49.2mL、49.2mmol)を窒素下で0℃で1時間にわたり1滴ずつ添加した。混合物を0℃で撹拌したままにし、20時間にわたり徐々に室温まで暖まるように放置した。混合物をアイスバス中で冷却し、MeOH(20mL)の滴下による添加で慎重にクエンチし、2時間コールドバス中で撹拌し、次いで10%の2N HCl/MeOH(20mL)でさらにクエンチし、室温で1時間撹拌し、減圧下で蒸発させた。残留物をメタノールにより数回共蒸発させた。サンプルを、30分にわたる0〜100%の酢酸エチル−シクロヘキサンの勾配を使用するシリカクロマトグラフィー(ジクロロメタン/EtOAc中でロードした100g)によって精製し、Flashmaster IIでの45mL画分すべてを回収した。適切な画分を合わせ、真空下で蒸発させて、無色油として表題化合物を得た(4.55g)。
【0215】
LCMS(System B):tRET=2.64min;MH+292
中間体24:フェニルメチル3−(4−ブロモブチル)−1−ピペリジンカルボキシラート
【化34】

【0216】
フェニルメチル3−(4−ヒドロキシブチル)−1−ピペリジンカルボキシラート(例えば中間体23のために調製された)から、中間体10と同様に調製した。
【0217】
LCMS(System B):tRET=3.62min;MH+354/356
中間体25:フェニルメチル3−{4−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]ブチル}−1−ピペリジンカルボキシラート
【化35】

【0218】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)およびフェニルメチル3−(4−ブロモブチル)−1−ピペリジンカルボキシラート(例えば中間体24のために調製された)から、中間体11と同様に調製した。
【0219】
LCMS(System B):tRET=3.08min;MH+511
中間体26:2−(ブチルオキシ)−8−(メチルオキシ)−9−[4−(3−ピペリジニル)ブチル]−9H−プリン−6−アミン
【化36】

【0220】
フェニルメチル3−{4−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]ブチル}−1−ピペリジンカルボキシラートから、中間体12と同様に調製した。
【0221】
LCMS(System B):tRET=1.43min;MH+377
中間体27:フェニルメチル4−{[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]メチル}−1−ピペリジンカルボキシラート
【化37】

【0222】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)およびフェニルメチル4−(ブロモメチル)−1−ピペリジンカルボキシラート(例えばAcros Organicsから商業的に入手可能)から、中間体11と同様に調製した。
【0223】
LCMS(System B):tRET=2.70min;MH+469
中間体28:2−(ブチルオキシ)−8−(メチルオキシ)−9−(4−ピペリジニルメチル)−9H−プリン−6−アミン
【化38】

【0224】
フェニルメチル4−{[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]メチル}−1−ピペリジンカルボキシラートから、中間体12と同様に調製した。
【0225】
LCMS(System B):tRET=1.13min;MH+335
中間体29:フェニルメチル4−{2−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]エチル}−1−ピペリジンカルボキシラート
【化39】

【0226】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)およびフェニルメチル4−(2−ブロモエチル)−1−ピペリジンカルボキシラート(調製に関してはJ.Med.Chem.,2003,46(13),2606を参照されたい)から、中間体11と同様に調製されした。
【0227】
LCMS(System B):tRET=2.90min;MH+483
中間体30:2−(ブチルオキシ)−8−(メチルオキシ)−9−[2−(4−ピペリジニル)エチル]−9H−プリン−6−アミン
【化40】

【0228】
フェニルメチル4−{2−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]エチル}−1−ピペリジンカルボキシラート(例えば中間体29のために調製された)から、中間体12と同様に調製した。
【0229】
LCMS(System D):tRET=2.23min;MH+349
中間体31:フェニルメチル4−{3−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペリジンカルボキシラート
【化41】

【0230】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)およびフェニルメチル4−(3−ブロモプロピル)−1−ピペリジンカルボキシラート(調製に関してはJ.Med.Chem.,2003,46(13),2606を参照されたい)から、中間体11と同様に調製した。
【0231】
LCMS(System D):tRET=3.39min;MH+497
中間体32:2−(ブチルオキシ)−8−(メチルオキシ)−9−[3−(4−ピペリジニル)プロピル]−9H−プリン−6−アミン
【化42】

【0232】
フェニルメチル4−{3−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペリジンカルボキシラート(例えば中間体31のために調製された)から、中間体12と同様に調製した。
【0233】
LCMS(System D):tRET=2.39min;MH+363
中間体33:フェニルメチル4−{4−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]ブチル}−1−ピペリジンカルボキシラート
【化43】

【0234】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)およびフェニルメチル4−(4−ブロモブチル)−1−ピペリジンカルボキシラート(調製に関してはJ.Med.Chem.,2003,46(13),2606を参照されたい)から、中間体11と同様に調製した。
【0235】
LCMS(System B):tRET=3.23min;MH+511
中間体34:2−(ブチルオキシ)−8−(メチルオキシ)−9−[4−(4−ピペリジニル)ブチル]−9H−プリン−6−アミン
【化44】

【0236】
フェニルメチル4−{4−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]ブチル}−1−ピペリジンカルボキシラート(例えば中間体33のために調製された)から、中間体12と同様に調製した。
【0237】
LCMS(System B):tRET=1.47min;MH+377
中間体35:フェニルメチル4−(5−ブロモペンチル)−1−ピペリジンカルボキシラート
【化45】

【0238】
フェニルメチル4−(5−ヒドロキシペンチル)−1−ピペリジンカルボキシラート(調製についてはChem.Pharm.Bull.,1986,34(9),3747−3761を参照されたい)から、中間体10と同様に調製した。
【0239】
LCMS(System B):tRET=3.82min;MH+368/370
中間体36:フェニルメチル4−{5−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]ペンチル}−1−ピペリジンカルボキシラート
【化46】

【0240】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)およびフェニルメチル4−(5−ブロモペンチル)−1−ピペリジンカルボキシラート例えば中間体35のために調製された)から、中間体11と同様に調製した。
【0241】
LCMS(System B):tRET=3.31min;MH+525
中間体37:2−(ブチルオキシ)−8−(メチルオキシ)−9−[5−(4−ピペリジニル)ペンチル]−9H−プリン−6−アミン
【化47】

【0242】
フェニルメチル4−{5−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]ペンチル}−1−ピペリジンカルボキシラート(例えば中間体36のために調製された)から、中間体12と同様に調製した。
【0243】
LCMS(System B):tRET=1.55min;MH+391
中間体38:2−(ブチルオキシ)−9−(3−クロロプロピル)−8−(メチルオキシ)−9H−プリン−6−アミン
【化48】

【0244】
無水DMF(50mL)中の2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)(4.7g、13.38mmol)および炭酸カリウム(4.62g、33.4mmol)を、窒素下で50℃で75分間撹拌および加熱した。混合物を室温まで冷えるように放置し、次いで0℃まで冷却し、1−ブロモ−3−クロロプロパン(例えばAldrichから商業的に入手可能)(2.106g、13.38mmol)を添加した。混合物を0〜10℃で約5時間撹拌し、次いで室温まで暖まるように放置し、さらに約40時間撹拌し、このときLCMSにより所望の産物が約70%であることが示された。混合物を沈降させ、上清をピペットで除去し、溶媒を高真空ポンプを使用する回転蒸発装置で約23℃で蒸発させた。クロロホルムおよび水を合わせた残留物に添加し、撹拌し、相を疎水性フリットを使用して分離した。水層をクロロホルムのさらなる小分けで再抽出し、合わせたクロロホルム抽出物を23℃で高真空下で蒸発させて、黄色固体を得た(2.798g)。この粗製物質を2回の類似調製から得られた類似物質(0.56gおよび0.995g)と共に合わせ、溶出剤として2:1酢酸エチル/クロロホルムを使用するシリカフラッシュカラムクロマトグラフィーによって精製して、灰白色固体として表題化合物を得た(3.011g)。
【0245】
LCMS(System D):tRET=2.79min;MH+314/316
中間体39:2−(4−{3−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペラジニル)エタノール
【化49】

【0246】
2−(ブチルオキシ)−9−(3−クロロプロピル)−8−(メチルオキシ)−9H−プリン−6−アミン(例えば中間体39のために調製された)(80mg、0.255mmol)、DIPEA(0.134mL、0.765mmol)および2−(1−ピペラジニル)エタノール(例えばAldrichから商業的に入手可能)(133mg、1.020mmol)を、Radleyグリーンハウスにおいて試験管中のアセトニトリル(2 mL)中で加熱した。反応物を70℃で28時間加熱し、次いで冷えるように放置し、真空下で蒸発させた。炭酸水素ナトリウム水溶液を添加し、混合物をクロロホルムで数回抽出し、このクロロホルムを疎水性フリットセパレーターを濾過させた。溶媒を除去し、茶色のゴムを得て(171mg)、MDAPで精製した(方法A)。画分を真空下で蒸発させ、残留物の炭酸水素ナトリウム溶液/クロロホルム抽出を以前のように行い、溶媒を除去して、無色油として表題化合物を得た(80mg)。
【0247】
LCMS(System D):tRET=2.06min;MH+408
中間体40:N2−ブチル−9−(3−クロロプロピル)−8−(メチルオキシ)−9H−プリン−2,6−ジアミン
【化50】

【0248】
N2−ブチル−8−(メチルオキシ)−9H−プリン−2,6−ジアミントリフルオロ酢酸塩(例えば中間体8のために調製された)(701mg、2.001mmol)および炭酸カリウム(690mg、4.99mmol)をDMF(10mL)中で懸濁し、混合物を窒素下で50℃で2時間加熱した。混合物を冷えるように放置し、次いで1−ブロモ−3−クロロプロパン(198μL、2.002mmol)を添加し、反応混合物を周囲温度で一晩撹拌した。16時間後に、反応混合物を水とDCM(各々25mL)との間で分配した。水相をさらなるDCM(2×20mL)で抽出した。合わせたDCM抽出物を硫酸マグネシウムの上で乾燥し、真空下で濃縮して、若干の固体が存在する淡黄色油として純粋でない表題化合物を得て(0.76g)、さらなる精製なしに使用した。
【0249】
LCMS(System D):tRET=2.75min;MH+=313/315
中間体41:2−(4−{3−[6−アミノ−2−(ブチルアミノ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペラジニル)エタノール
【化51】

【0250】
N2−ブチル−9−(3−クロロプロピル)−8−(メチルオキシ)−9H−プリン−2,6−ジアミン(例えば中間体40のために調製された)(100mg、0.320mmol)(0.8当量のDMFを含んでいるので実際には120mgを使用した)を、洗浄して中に入れるためにDMF(2mL)を使用して、小試験管の中へ計量した。この溶液に、DIPEA(167μL、0.959mmol)、続いて2−(1−ピペラジニル)エタノール(例えばAldrichから商業的に入手可能)(78μL、0.636mmol)を添加した。生じた淡黄色溶液を窒素下で70℃で18時間撹拌しながら加熱した。反応混合物を水とDCM(各々約10mL)との間で分配した。層を疎水性フリットを使用して分離し、水層をさらなるDCM(2×10mL)で抽出した。合わせたDCM抽出物を真空下で、次いで窒素フロー下で濃縮した。残留物(まだDMFを含む)をMeOHで2mLの全体積に希釈し、MDAPによって精製した(方法A)。産物画分を合わせ、真空下で、次いで窒素フロー下で濃縮して、無色ガラスとして表題化合物を得た(45.9mg)。
【0251】
LCMS(System D):tRET=1.95min;MH+407
中間体42:2−(ブチルオキシ)−9−(4−クロロブチル)−8−(メチルオキシ)−9H−プリン−6−アミン
【化52】

【0252】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)(2g、5.69mmol)および炭酸カリウム(1.967g、14.23mmol)をDMF(20mL)中で懸濁し、窒素下で50℃まで30分間加熱した。混合物を室温まで冷却し、1−ブロモ−4−クロロブタン(例えばAldrichから商業的に入手可能)(0.656mL、5.69mmol)を添加し、室温で20時間継続して撹拌した。溶媒を減圧下で蒸発させ、残留物をDCM(40mL)と水(40mL)との間で分配した。層を疎水性フリットを使用して分離し、水層をDCM(10mL)で洗浄した。合わせた有機抽出物を真空下で濃縮し、粗製物質を得て、これを、30分にわたるシクロヘキサン:酢酸エチルの0〜100%の勾配によるFlashmaster(70gカートリッジ)の溶出を使用するシリカクロマトグラフィーによって精製した。産物を含む画分を合わせ、蒸発させて、白色固体として表題化合物を得た(1.4g)。
【0253】
LCMS(System D):tRET=2.92min;MH+=328/330
中間体43:N2−ブチル−9−(4−クロロブチル)−8−(メチルオキシ)−9H−プリン−2,6−ジアミン
【化53】

【0254】
N2−ブチル−8−(メチルオキシ)−9H−プリン−2,6−ジアミントリフルオロ酢酸塩(例えば中間体8のために調製された)(5g、14.27mmol)および炭酸カリウム(4.93g、35.7mmol)をDMF(40mL)中で懸濁し、窒素下で50℃まで30分間加熱した。混合物を室温まで冷却し、1−ブロモ−4−クロロブタン(例えばAldrichから商業的に入手可能)(1.645mL、14.27mmol)を添加し、室温で20時間継続して撹拌した。溶媒を真空下で濃縮し、残留物をDCM(100mL)と水(100mL)との間で分配した。層を疎水性フリットを使用して分離し、水相をDCM(100mL)で再抽出した。合わせた有機物抽出物を真空下で濃縮し、残留物をFlashmaster装置(100gシリカカートリッジ)を使用し、40分にわたるDCM:メタノールの0〜25%の勾配を使用するクロマトグラフィーによって精製した。所望の画分を合わせ、真空下で濃縮して、黄色油として純粋でない表題化合物を得た(5.1g)。
【0255】
LCMS(System D):tRET=2.88min;MH+=327/329
中間体44:2−(ブチルオキシ)−9−(5−クロロペンチル)−8−(メチルオキシ)−9H−プリン−6−アミン
【化54】

【0256】
2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−6−アミントリフルオロ酢酸塩(例えば中間体6のために調製された)(2g、5.69mmol)および炭酸カリウム(1.967g、14.23mmol)をDMF(20mL)中で懸濁し、窒素下で50℃まで1時間加熱した。混合物を室温まで冷却し、1−ブロモ−5−クロロペンタン(例えばAldrichから商業的に入手可能)(0.75mL、5.69mmol)を添加し、室温で18時間継続して撹拌した。反応混合物をDCM(40mL)と水(40mL)との間で分配し、層を疎水性フリットを使用して分離した。水層をDCM(10mL)で再び抽出し、合わせた有機層を飽和塩化リチウム溶液で洗浄し、分離し(疎水性フリット)、真空下で濃縮して、黄色油として表題化合物を得た(1.946g)。
【0257】
LCMS(System B):tRET=2.58min;MH+=342/344
実施例1:6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−2−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン
【化55】

【0258】
DMF(0.5mL)中の2−(ブチルオキシ)−8−(メチルオキシ)−9−[3−(2−ピペリジニル)プロピル]−9H−プリン−6−アミン(例えば中間体12のために調製された)(0.036g、0.10mmol)を、2−ブロモエタノール(例えばAldrichから商業的に入手可能)(0.0085mL、0.12mmol)(アセトニトリル(1mL)中の1mmolのストック溶液を0.12mLで分注した)に添加した。DIPEA(0.040mL、0.23mmol)を添加し、反応混合物を50℃で18時間加熱した。2−ブロモエタノール溶液(0.080mL、0.08mmol)およびDIPEA(0.040mL、0.23mmol)の追加の小分けを添加し、さらに18時間継続して加熱した。反応混合物をDMSO:MeOH(0.2mL)で希釈し、生じた溶液をMDAPによって精製した(方法A)。適切な画分を合わせ、真空下で蒸発させた。残留物をジオキサン(0.2mL)中の4M HCl中で溶解し、室温で4時間放置した。溶媒をRadleysブローダウン装置において窒素気流下で乾燥した。残留物をメタノール(0.5mL)中で再溶解し、0.1gのアミノプロピルSPE(メタノールでプレコンディショニング、1.5mL)の上部にアプライした。カートリッジをメタノール(1.5mL)で洗浄した。溶媒をRadleysブローダウン装置において窒素気流下で乾燥して、表題化合物を得た(0.0053g)。
【0259】
LCMS(System A):tRET=0.64min;MH+393
実施例2:6−アミノ−2−(ブチルオキシ)−9−{[1−(2−ヒドロキシエチル)−3−ピペリジニル]メチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化56】

【0260】
2−(ブチルオキシ)−8−(メチルオキシ)−9−(−ピペリジニルメチル)−9H−プリン−6−アミン(例えば中間体14のために調製された)(33.4mg、0.1mmol)をDMF(0.3mL)中で懸濁し、2−ブロモエタノール(例えばAldrichから商業的に入手可能)(0.0071mL、0.100mmol)に添加した。DIPEA(0.040mL、0.23mmol)を添加した。反応物を、栓を付けたバイアル中で周囲温度で一晩振盪した。反応混合物をDMSO(0.4mL)で希釈し、生じた溶液をMDAPによって精製した(方法A)。適切な画分を合わせ真空下で蒸発させた。残留物をジオキサン(0.4mL)中の4M HCl中で溶解し、室温で一晩放置した。溶媒をRadleysブローダウン装置中の窒素気流下で乾燥した。残留物をメタノール(0.5mL)中で再溶解し、0.5gのアミノプロピルSPE(メタノールでプレコンディショニング、2CV)の上部にアプライした。カートリッジをメタノール(2mL)で洗浄した。溶媒をRadleysブローダウン装置において窒素気流下で乾燥して、表題化合物を得た(0.022g)。
【0261】
LCMS(System A):tRET=0.57min;MH+365
実施例3:6−アミノ−2−(ブチルオキシ)−9−{2−[1−(2−ヒドロキシエチル)−3−ピペリジニル]エチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化57】

【0262】
2−(ブチルオキシ)−8−(メチルオキシ)−9−[2−(3−ピペリジニル)エチル]−9H−プリン−6−アミン(例えば中間体18のために調製された)および2−ブロモエタノール(例えばAldrichから商業的に入手可能)から、実施例1と同様に調製した。
【0263】
LCMS(System A):tRET=0.62min;MH+379
実施例4:6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−3−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン
【化58】

【0264】
2−(ブチルオキシ)−8−(メチルオキシ)−9−[3−(3−ピペリジニル)プロピル]−9H−プリン−6−アミン(例えば中間体22のために調製された)および2−ブロモエタノール(例えばAldrichから商業的に入手可能)から、実施例1と同様に調製した。
【0265】
LCMS(System A):tRET=0.61min;MH+393
実施例5:6−アミノ−2−(ブチルオキシ)−9−{4−[1−(2−ヒドロキシエチル)−3−ピペリジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化59】

【0266】
2−(ブチルオキシ)−8−(メチルオキシ)−9−[4−(3−ピペリジニル)ブチル]−9H−プリン−6−アミン(例えば中間体26のために調製された)および2−ブロモエタノール(例えばAldrichから商業的に入手可能)から、実施例1と同様に調製した。
【0267】
LCMS(System A):tRET=0.66min;MH+407
実施例6:6−アミノ−2−(ブチルオキシ)−9−{[1−(2−ヒドロキシエチル)−4−ピペリジニル]メチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化60】

【0268】
DMF(0.4mL)中の2−(ブチルオキシ)−8−(メチルオキシ)−9−(4−ピペリジニルメチル)−9H−プリン−6−アミン(例えば中間体28のために調製された)(0.0335g、0.10mmol)を、2−ブロモエタノール(例えばAldrichから商業的に入手可能)(0.0085mL、0.12mmol)に添加した。DIPEA(0.040mL、0.23mmol)を添加し、反応混合物を50℃で18時間加熱した。追加のDIPEA(0.040mL、0.23mmol)を添加し、さらに18時間継続して加熱した。反応混合物をDMSO:MeOH(0.25mL)で希釈し、生じた溶液をMDAPによって精製した(方法A)。適切な画分を合わせ、真空下で蒸発させた。残留物をジオキサン(0.2mL)中の4M HCl中で溶解し、4時間室温で放置した。溶媒をRadleysブローダウン装置において窒素気流下で乾燥した。残留物をメタノール(0.5mL)中で再溶解し、0.1gのアミノプロピルSPE(メタノールでプレコンディショニング、1.5mL)の上部にアプライした。カートリッジをメタノール(1.5mL)で洗浄した。溶媒をRadleysブローダウン装置において窒素気流下で乾燥して、表題化合物を得た(0.0053g)。
【0269】
LCMS(System B):tRET=1.21min;MH+365
実施例7:6−アミノ−2−(ブチルオキシ)−9−{2−[1−(2−ヒドロキシエチル)−4−ピペリジニル]エチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化61】

【0270】
2−(ブチルオキシ)−8−(メチルオキシ)−9−[2−(4−ピペリジニル)エチル]−9H−プリン−6−アミン(例えば中間体30のために調製された)および2−ブロモエタノール(例えばAldrichから商業的に入手可能)から、実施例1と同様に調製した。
【0271】
LCMS(System B):tRET=1.26min;MH+379
実施例8:6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−4−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン
【化62】

【0272】
2−(ブチルオキシ)−8−(メチルオキシ)−9−[3−(4−ピペリジニル)プロピル]−9H−プリン−6−アミンおよび2−ブロモエタノール(例えばAldrichから商業的に入手可能)から、実施例1と同様に調製した。
【0273】
LCMS(System A):tRET=0.62min;MH+393
実施例9:6−アミノ−2−(ブチルオキシ)−9−{4−[1−(2−ヒドロキシエチル)−4−ピペリジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化63】

【0274】
DMF(0.4mL)中の2−(ブチルオキシ)−8−(メチルオキシ)−9−[4−(4−ピペリジニル)ブチル]−9H−プリン−6−アミン(例えば中間体34のために調製された)(0.038g、0.10mmol)を、2−ブロモエタノール(0.0085mL、0.12mmol)に添加した。DIPEA(0.040mL、0.23mmol)を添加し、反応混合物を50℃で18時間加熱した。2−ブロモエタノール(例えばAldrichから商業的に入手可能)(0.015mL)およびDIPEA(0.040mL、0.23mmol)の追加の小分けを添加し、さらに7時間継続して加熱した。反応混合物を室温で72時間撹拌し、次いでDMSO:MeOH(0.2mL)で希釈し、生じた溶液をMDAPによって精製した(方法A)。適切な画分を合わせ、真空下で蒸発させた。残留物をジオキサン(0.2mL)中の4M HCl中で溶解し、室温で18時間放置した。溶媒をRadleysブローダウン装置において窒素気流下で乾燥した。サンプルを1:1 MeOH:DMSO(0.6mL)中で溶解し、TFAモディファイアーと共にアセトニトリル水を使用するSunfire C18カラムで質量分析によるAutoPrepによって精製した。溶媒を真空下で蒸発させた。残留物をメタノール(0.5mL)中で再溶解し、0.1gのアミノプロピルSPE(メタノールでプレコンディショニング、1.5mL)の上部にアプライした。カートリッジをメタノール(1.5mL)で洗浄した。溶媒をRadleysブローダウン装置において窒素気流下で乾燥して、表題化合物を得た(0.0133g)。
【0275】
LCMS(System B):tRET=1.46min;MH+407
実施例10:6−アミノ−2−(ブチルオキシ)−9−{5−[1−(2−ヒドロキシエチル)−4−ピペリジニル]ペンチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化64】

【0276】
2−(ブチルオキシ)−8−(メチルオキシ)−9−[5−(4−ピペリジニル)ペンチル]−9H−プリン−6−アミン(例えば中間体37のために調製された)および2−ブロモエタノール(例えばAldrichから商業的に入手可能)から、実施例1と同様に調製した。
【0277】
LCMS(System B):tRET=1.57min;MH−419
実施例11:6−アミノ−2−(ブチルオキシ)−9−{3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン
【化65】

【0278】
2−(4−{3−[6−アミノ−2−(ブチルオキシ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペラジニル)エタノール(例えば中間体39のために調製された)(80mg、0.196mmol)をメタノール(5.5mL)中で溶解し、1,4−ジオキサン(1.2mL)中の4M HClを添加した。溶液を室温で一晩撹拌し、次いで真空下で蒸発させた。固形残留物を最小量のメタノール中に取り上げ、50mLメタノールでプレコンディショニングした2gのアミノプロピルSPE上に置いた。適切な画分を真空下で蒸発させて、白色固体として表題化合物を得た(68mg)。
【0279】
LCMS(System D):tRET=1.80min;MH+394
実施例12:6−アミノ−2−(ブチルアミノ)−9−{3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン
【化66】

【0280】
2−(4−{3−[6−アミノ−2−(ブチルアミノ)−8−(メチルオキシ)−9H−プリン−9−イル]プロピル}−1−ピペラジニル)エタノールから、実施例11と同様に調製した。
【0281】
LCMS(System D):tRET=1.78min;MH+393
実施例13:6−アミノ−2−(ブチルオキシ)−9−{4−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化67】

【0282】
2−(ブチルオキシ)−9−(4−クロロブチル)−8−(メチルオキシ)−9H−プリン−6−アミン(例えば中間体42のために調製された)(100mg、0.305mmol)、DIPEA(0.160mL、0.915mmol)および2−(1−ピペラジニル)エタノール(例えばAldrichから商業的に入手可能)(0.075mL、0.61mmol)を、DMF(2.2mL)中で溶解した。反応混合物を撹拌し、窒素下で50℃で一晩加熱した。追加の2−(1−ピペラジニル)エタノール(0.075 mL、0.61mmol)を添加し、混合物を80℃で20時間加熱した。反応混合物を室温まで冷却し、水(5mL)とDCM(6mL)との間で分配した。層を疎水性フリットを使用して分離し、水層をDCM(5mL)で洗浄した。合わせた有機層を真空下で濃縮した。残留物をDMSO(1mL)中で溶解し、炭酸アンモニウムモディファイアーと共にアセトニトリル水を使用するXbridgeカラムでMDAPによって精製した。所望の画分を合わせ、窒素ブローダウン下で濃縮した。残留物をメタノール(2mL)中で溶解し、ジオキサン(3mL)中の4M HClを添加した。反応混合物を30分間撹拌し、次いで溶液を室温で1時間放置した。反応混合物を窒素ブローダウン下で濃縮し、次いでMeOH中で溶解し、NH2(1g)を介して溶出した。カラムをMeOH(3CV)で洗浄した。溶媒を窒素ブローダウン下で除去し、茶色固体を得た。サンプルをDMSO(1mL)中で溶解し、炭酸アンモニウムモディファイアーと共にアセトニトリル水を使用するXbridgeカラムでMDAPによって精製した。所望の画分を合わせ、窒素ブローダウン下で濃縮して、白色固体(0.0262g)として表題化合物を得た。
【0283】
LCMS(System D):tRET=1.89min;MH+408
実施例14:6−アミノ−2−(ブチルアミノ)−9−{4−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化68】

【0284】
N2−ブチル−9−(4−クロロブチル)−8−(メチルオキシ)−9H−プリン−2,6−ジアミンから、実施例13と同様に調製した。
【0285】
LCMS(System D):tRET=1.85min;MH+407
実施例15:6−アミノ−2−(ブチルオキシ)−9−{5−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ペンチル}−7,9−ジヒドロ−8H−プリン−8−オン
【化69】

【0286】
MeCN中の2−(ブチルオキシ)−9−(5−クロロペンチル)−8−(メチルオキシ)−9H−プリン−6−アミン(例えば中間体44のために調製された)の溶液(410mgの溶解によって調製した、MeCN(2.4mL)中の1.2mmol)の小分け(0.2mL、0.1mmol)を、2−(1−ピペラジニル)エタノール(例えばAldrichから商業的に入手可能)(0.1mmol)に、試験管中で添加した。DIPEA(50μl、3当量)およびヨウ化ナトリウム(5mg)を添加した。反応混合物をRadleysグリーンハウスにおいて60℃まで18時間加熱した。サンプルを濾過し、次いでDMSO(0.3mL)を添加し、溶液を炭酸アンモニウムモディファイアーと共にアセトニトリル水を使用するXbridgeカラムでMDAPによって精製した。溶媒をGenevacを使用して真空下で蒸発させて、中間体を得た。各々のバイアルに2N HCl/MeOH(200μL)を添加し、キャップをし、室温で4時間放置した。溶媒をRadleysブローダウン装置において窒素気流下で乾燥した。残留物をメタノール(0.5mL)中で再溶解し、アミノプロピルSPE(0.1g、3mL、メタノール(1.5mL)中でプレコンディショニング)の上部にアプライした。カートリッジをメタノール(2×1.5mL)で洗浄した。溶媒を除去し、表題化合物を得た(0.0175g)。
【0287】
LCMS(System B):tRET=1.11min;MH+422
実施例16:6−アミノ−2−(ブチルオキシ)−9−(5−{4−[2−(メチルオキシ)エチル]−1−ピペラジニル}ペンチル)−7,9−ジヒドロ−8H−プリン−8−オン
【化70】

【0288】
2−(ブチルオキシ)−9−(5−クロロペンチル)−8−(メチルオキシ)−9H−プリン−6−アミン(例えば中間体44のために調製された)および1−[2−(メチルオキシ)エチル]ピペラジン(例えばAldrichから商業的に入手可能)から、実施例15と同様に調製した。
【0289】
LCMS(System B):tRET=1.21min;MH+436
実施例17:6−アミノ−2−(ブチルオキシ)−9−(5−{4−[2−(エチルオキシ)エチル]−1−ピペラジニル}ペンチル)−7,9−ジヒドロ−8H−プリン−8−オン
【化71】

【0290】
2−(ブチルオキシ)−9−(5−クロロペンチル)−8−(メチルオキシ)−9H−プリン−6−アミン(例えば中間体44のために調製された)および1−[2−(エチルオキシ)エチル]ピペラジン(例えばAldrichから商業的に入手可能)から、実施例15と同様に調製した。
【0291】
LCMS(System B):tRET=1.28min;MH+450
生物学的データ
本発明の化合物を、以下のアッセイまたは類似のアッセイに従って、インビトロ生物学的活性について試験した。
【0292】
凍結保存されたヒト末梢血単核細胞(PBMC)を使用する、インターフェロン−αの誘導のためのアッセイ
化合物調製
化合物をDMSO中に溶解した。DMSOにより連続的な2倍希釈を調製し、0.25μLを384ウェルの透明なGreinerポリプロピレンプレートの中へ分注した。
【0293】
PBMCの調製
最大200mLの血液サンプルを健康なヒトドナーから得た。25mL体積の全血をLeucosepチューブ中の15mLフィコール勾配上に重層し、1000gで20分間遠心分離した。血漿/histopaque界面のバンドの細胞を慎重に取り出し、PBSで2回洗浄した(400gで5分間遠心分離して採取した)。最終的なペレットを、凍結培地(90%非動化血清、10%DMSO)中で4×107細胞/mLの細胞濃度に再懸濁した。次いで再懸濁した細胞を速度制御フリーザーを使用して凍結保存(凍結)し、最大4か月間−140℃で保存した。
【0294】
インキュベーションおよびインターフェロン−αについてのアッセイ
アッセイの直前に、凍結保存(凍結)したPBMCのバイアルを37℃のウォーターバス中で迅速に解凍した。1:10で希釈したトリパンブルー中の細胞を調製しカウントした。次いでPBMCを、増殖培地[10%ウシ胎仔血清(invitrogen)、ペニシリン+ストレプトアビジン(Gibcoカタログ番号25030−024、1:50)、L−グルタミン2mM、および1000単位/mL組換えヒトIFN−γ(Preprotechカタログ番号300−02)を含むRPMI 1640]中で、1×106細胞/mLの密度に希釈し、0.25μLのDMSO、または0.25μLのDMSO中の試験化合物を含む384ウェルの透明なGreinerポリプロピレンプレートに50μL/ウェルで分注した。化合物の最終的な最高濃度は、典型的には50μMまたは5μMであった(高活性化合物に適する曲線を得るために)。プレートを5% CO2中で37℃で24時間インキュベーションした。
【0295】
マルチアイソフォームイムノアッセイを使用してPBMC上清中のIFN−αを定量した。ヒトIFN−αに対するウサギポリクローナル抗体(カタログ番号31101、Stratech Scientific)を、アッセイ緩衝液(10%のウシ胎仔血清(Invitrogen)を含むRPMI 1640)中で1:10000希釈し、20μLを、MSD(Meso−Scale Discovery)single small−spot 384ウェルGAR(ヤギ抗ウサギ抗体がコートされた)プレートの各ウェルに添加した。プレートを激しく振盪しながら室温で1時間インキュベーションした。PBSによる3回の洗浄に続いて、20μLの細胞上清をプレートの各ウェルに添加した。次いでプレートを激しく振盪しながら室温で1時間インキュベーションした。IFN−αに対する1対のモノクローナル抗体(カタログ番号21100および21112、Stratech Scientific)をsulfo−TAG(MSD)で標識し、アッセイ緩衝液中で1:1000に希釈し、20μLをプレートの各ウェルに添加した。プレートを激しく振盪しながら室温で1時間さらにインキュベーションした。PBSによる3回の洗浄に続いて、30μLの2倍T緩衝液(MSD)を各ウェルに添加し、プレートをMSD Sector 6000プレートリーダーで読み取った。
【0296】
データを、1μMレジキモド(n=16)およびDMSO(n=16)の内部プレート対照に対して正規化した。pEC50値は、ActivityBaseにおけるIRLSによる4−パラメータの曲線フィットによって、11点の試験化合物の2倍連続希釈から導き出した。
【0297】
結果
実施例1〜17は、>5.8の平均pEC50であった。
【0298】
新鮮ヒト末梢血単核細胞(PBMC)を使用するインターフェロン−αおよびTNF−αの誘導についてのアッセイ
化合物調製
化合物をDMSO中で溶解し連続希釈し、Biomek 2000を使用して必要とされる100倍の濃度範囲を提供した。1μLの試験化合物をBiomek FXを使用して96ウェル組織培養プレートの中へ移した。各化合物は、各ドナーについて二重でアッセイした。各プレートはスタンダードとしてTLR7/8アゴニストレジキモドの希釈系列を含み、11カラムは1μLの200μMレジキモド(2μMの最終濃度を提供し、レジキモドに対するおよその最大反応を定義するのに使用した)を含んでいた。
【0299】
PBMCの調製
2名のヒトドナーからの血液サンプルをヘパリンナトリウム(10U/mL)の中へ回収した。25mL体積の全血をLeucosepチューブ中の15mL Histopaque上に重層し、800gで20分間遠心分離し、血漿/histopaque界面のバンドを慎重に取り出した。回収した細胞を2500rpmで10分間遠心分離し、ペレットを10mLの培地(10%v/vウシ胎仔血清(FCS、低エンドトキシン)、100U/mLペニシリンG、100μg/mLストレプトマイシン、10mM L−グルタミンおよび1×非必須アミノ酸を補足したRPMI 1640(低エンドトキシン))中で再懸濁した。1:20希釈の細胞をトリパンブルーを使用して調製し、細胞を血球計数器を使用してカウントした。PBMCを希釈して2×106/mLの最終濃度にし、100μLのこの細胞懸濁物を1μLの希釈した試験化合物を含むウェルへ添加した。
【0300】
インキュベーションならびにインターフェロン−αおよびTNF−αについてのアッセイ
細胞調製物を24時間インキュベーションし(37℃、95%空気、5% CO2)、その後上清のサンプルをBiomek FXを使用して取り出し、MSD(Mesoscale Discovery)電気化学ルミネセンスアッセイプラットフォームを使用してIFN−αおよびTNF−αの両方についてアッセイした。IFN−αアッセイは上記のものと同様に行った。TNF−αアッセイはキット説明書(カタログ番号K111BHB)の通り行った。
【0301】
放出されたサイトカインを、2μMレジキモドの対照(11カラム)のパーセンテージとして表現した。このパーセンテージを化合物濃度に対してプロットし、応答に対するpEC50を非線形最小二乗曲線のフィッティングによって決定した。IFN−α応答について、一般的には4−パラメータロジスティックモデルを選択した。明らかに最大の応答が得られた(すなわち、応答において明確なプラトーが観察された)TNF応答については、一般的には4−パラメータモデルを使用した。曲線の上部漸近線が明確でなかったならば、曲線のフィッティングは、一般的には100%の最大反応に対して(すなわち2μMレジキモドへの応答に対して)または試験した最高濃度の応答がレジキモド応答を超えたならばこの濃度の応答に対して制約された。いくつかの曲線は1つのまたは両方のサイトカインについてベル型であり、ベル型応答の下に向かう斜面(すなわち最大反応を与える濃度より上の濃度)でのサイトカインデータは、一般的にはフィットから除外したが、通常ピーク応答のすぐ上の濃度は例外とした。したがって曲線のフィッティングは用量応答曲線の上に向かう斜面に集中した。
【0302】
結果
実施例2は、IFN−αおよびTNF−αの誘導についてのpEC50が、それぞれ7.2および4.8であることを示した。
【0303】
実施例10は、IFN−αおよびTNF−αの誘導についてのpEC50が、それぞれ9.3および5.5であることを示した。
【0304】
実施例17は、IFN−αおよびTNF−αの誘導についてのpEC50が、それぞれ7.8および5.3であることを示した。
【特許請求の範囲】
【請求項1】
式(I)の化合物またはその塩:
【化1】

(式中、
R1は水素またはC1−3アルキルを表し、
nは1〜5の値を有する整数であり、
XはOまたはNHを表し、
YはCまたはNを表すが、
但し、前記化合物は、6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンではない)。
【請求項2】
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−2−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{[1−(2−ヒドロキシエチル)−3−ピペリジニル]メチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{2−[1−(2−ヒドロキシエチル)−3−ピペリジニル]エチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−3−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[1−(2−ヒドロキシエチル)−3−ピペリジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{2−[1−(2−ヒドロキシエチル)−4−ピペリジニル]エチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−4−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[1−(2−ヒドロキシエチル)−4−ピペリジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{5−[1−(2−ヒドロキシエチル)−4−ピペリジニル]ペンチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルアミノ)−9−{3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルアミノ)−9−{4−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{5−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ペンチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−(5−{4−[2−(メチルオキシ)エチル]−1−ピペラジニル}ペンチル)−7,9−ジヒドロ−8H−プリン−8−オン、および、
6−アミノ−2−(ブチルオキシ)−9−(5−{4−[2−(エチルオキシ)エチル]−1−ピペラジニル}ペンチル)−7,9−ジヒドロ−8H−プリン−8−オン、
ならびにそれらの塩
からなる記載から選択される請求項1に記載の化合物。
【請求項3】
請求項1もしくは請求項2に記載の化合物、またはその薬学上許容される塩。
【請求項4】
活性治療剤として使用するための式(I)の化合物またはその薬学上許容される塩:
【化2】

(式中、R1は水素またはC1−3アルキルを表し、
nは1〜5の値を有する整数であり、
XはOまたはNHを表し、
YはCまたはNを表す)。
【請求項5】
感染症、癌、アレルギー性疾患および他の炎症状態の治療において使用するための請求項4において定義される式(I)の化合物またはその薬学上許容される塩。
【請求項6】
アレルギー性鼻炎の治療において使用するための請求項4において定義される式(I)の化合物またはその薬学上許容される塩。
【請求項7】
喘息の治療において使用するための請求項4において定義される式(I)の化合物またはその薬学上許容される塩。
【請求項8】
ワクチンアジュバントとして使用するための請求項4において定義される式(I)の化合物またはその薬学上許容される塩。
【請求項9】
感染症、癌、アレルギー性疾患および他の炎症状態を治療するための薬剤の製造における、請求項4において定義される式(I)の化合物またはその薬学上許容される塩の使用。
【請求項10】
アレルギー性鼻炎を治療するための請求項9に記載の使用。
【請求項11】
喘息を治療するための請求項9に記載の使用。
【請求項12】
感染症、癌、アレルギー性疾患および他の炎症状態を治療するための方法であって、有効量の請求項4において定義される式(I)の化合物またはその薬学上許容される塩を投与することを含んでなる、方法。
【請求項13】
疾患を患っているか、または疾患に感受性のあるヒト被験体に対する、抗原または抗原組成物および請求項4において定義される式(I)の化合物またはその薬学上許容される塩を含んでなるワクチン組成物を投与することを含んでなる、疾患を治療または予防する方法。
【請求項14】
アレルギー性鼻炎を治療するための請求項12に記載の方法。
【請求項15】
喘息を治療するための請求項12に記載の方法。
【請求項16】
請求項4において定義される式(I)の化合物またはその薬学上許容される塩と、任意で1つまたは複数の薬学上許容される希釈剤または担体とを含んでなる、医薬組成物。
【請求項1】
式(I)の化合物またはその塩:
【化1】

(式中、
R1は水素またはC1−3アルキルを表し、
nは1〜5の値を有する整数であり、
XはOまたはNHを表し、
YはCまたはNを表すが、
但し、前記化合物は、6−アミノ−2−ブトキシ−9−(N−(2−ヒドロキシエチル)−4−ピペリジニルメチル)−8−ヒドロキシプリンではない)。
【請求項2】
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−2−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{[1−(2−ヒドロキシエチル)−3−ピペリジニル]メチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{2−[1−(2−ヒドロキシエチル)−3−ピペリジニル]エチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−3−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[1−(2−ヒドロキシエチル)−3−ピペリジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{2−[1−(2−ヒドロキシエチル)−4−ピペリジニル]エチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[1−(2−ヒドロキシエチル)−4−ピペリジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[1−(2−ヒドロキシエチル)−4−ピペリジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{5−[1−(2−ヒドロキシエチル)−4−ピペリジニル]ペンチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルアミノ)−9−{3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロピル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{4−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルアミノ)−9−{4−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ブチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−{5−[4−(2−ヒドロキシエチル)−1−ピペラジニル]ペンチル}−7,9−ジヒドロ−8H−プリン−8−オン、
6−アミノ−2−(ブチルオキシ)−9−(5−{4−[2−(メチルオキシ)エチル]−1−ピペラジニル}ペンチル)−7,9−ジヒドロ−8H−プリン−8−オン、および、
6−アミノ−2−(ブチルオキシ)−9−(5−{4−[2−(エチルオキシ)エチル]−1−ピペラジニル}ペンチル)−7,9−ジヒドロ−8H−プリン−8−オン、
ならびにそれらの塩
からなる記載から選択される請求項1に記載の化合物。
【請求項3】
請求項1もしくは請求項2に記載の化合物、またはその薬学上許容される塩。
【請求項4】
活性治療剤として使用するための式(I)の化合物またはその薬学上許容される塩:
【化2】

(式中、R1は水素またはC1−3アルキルを表し、
nは1〜5の値を有する整数であり、
XはOまたはNHを表し、
YはCまたはNを表す)。
【請求項5】
感染症、癌、アレルギー性疾患および他の炎症状態の治療において使用するための請求項4において定義される式(I)の化合物またはその薬学上許容される塩。
【請求項6】
アレルギー性鼻炎の治療において使用するための請求項4において定義される式(I)の化合物またはその薬学上許容される塩。
【請求項7】
喘息の治療において使用するための請求項4において定義される式(I)の化合物またはその薬学上許容される塩。
【請求項8】
ワクチンアジュバントとして使用するための請求項4において定義される式(I)の化合物またはその薬学上許容される塩。
【請求項9】
感染症、癌、アレルギー性疾患および他の炎症状態を治療するための薬剤の製造における、請求項4において定義される式(I)の化合物またはその薬学上許容される塩の使用。
【請求項10】
アレルギー性鼻炎を治療するための請求項9に記載の使用。
【請求項11】
喘息を治療するための請求項9に記載の使用。
【請求項12】
感染症、癌、アレルギー性疾患および他の炎症状態を治療するための方法であって、有効量の請求項4において定義される式(I)の化合物またはその薬学上許容される塩を投与することを含んでなる、方法。
【請求項13】
疾患を患っているか、または疾患に感受性のあるヒト被験体に対する、抗原または抗原組成物および請求項4において定義される式(I)の化合物またはその薬学上許容される塩を含んでなるワクチン組成物を投与することを含んでなる、疾患を治療または予防する方法。
【請求項14】
アレルギー性鼻炎を治療するための請求項12に記載の方法。
【請求項15】
喘息を治療するための請求項12に記載の方法。
【請求項16】
請求項4において定義される式(I)の化合物またはその薬学上許容される塩と、任意で1つまたは複数の薬学上許容される希釈剤または担体とを含んでなる、医薬組成物。
【公表番号】特表2013−519644(P2013−519644A)
【公表日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願番号】特願2012−552368(P2012−552368)
【出願日】平成23年2月8日(2011.2.8)
【国際出願番号】PCT/EP2011/051828
【国際公開番号】WO2011/098451
【国際公開日】平成23年8月18日(2011.8.18)
【出願人】(509329523)グラクソスミスクライン エルエルシー (38)
【Fターム(参考)】
【公表日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願日】平成23年2月8日(2011.2.8)
【国際出願番号】PCT/EP2011/051828
【国際公開番号】WO2011/098451
【国際公開日】平成23年8月18日(2011.8.18)
【出願人】(509329523)グラクソスミスクライン エルエルシー (38)
【Fターム(参考)】
[ Back to top ]

