プレガバリン及び関連化合物の製造
【課題】商業的に実行可能なプレガバリンの製造方法の提供。
【解決手段】酵素的速度論的分割を経た(2)−(+)−3−アミノメチル−5−メチル−ヘキサン酸及び構造的に関連した化合物の製造法。
【解決手段】酵素的速度論的分割を経た(2)−(+)−3−アミノメチル−5−メチル−ヘキサン酸及び構造的に関連した化合物の製造法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、酵素的速度論的分割を経て鏡像体的に富化されたγ−アミノ酸を製造するための方法及び材料に関し、プレガバリン及び関連化合物を含むヒトα2δカルシウムチャネルサブユニットに結合親和性を示すγ−アミノ酸を製造するために特に有用である。
【背景技術】
【0002】
プレガバリン、つまり(S)−(+)−3−アミノメチル−5−メチル−ヘキサン酸は、脳神経細胞の活性の調節に関与する内在性抑制性神経伝達物質γ−アミノ酪酸(GABA)に関係している。プレガバリンは、R. B. Silverman et al. による米国特許第5,563,175 号に記載されているように、抗てんかん活性を示し、他の状態の中でも、疼痛、精
神運動興奮に付随する生理学的状態、炎症、消化管傷害、アルコール中毒、不眠症、及び躁病及び双極性障害を含む多様な精神障害を治療するために有用であると考えられている。それぞれ、L. Bueno et al. による米国特許第6,242,488 号、L. Magnus & C. A. egal
による米国特許第6,326,374 号、及びL. Singh による米国特許第6,001,876 号;H. C. Akunne et al. による米国特許第6,194,459 号;D. Schrier et al. による米国特許第6,329,429 号;L. Bueno et al. による米国特許第6,127,418 号;L. Bueno et al. による米国特許第6,426,368 号;L. Magnus & C. A. Segal による米国特許第6,306,910 号;及びA. C. Pande による米国特許第6,359,005 号(これらはその全体が、及び全ての目的について、参照により本明細書に取り込まれる)を参照されたい。
【0003】
プレガバリンは、多様な方法で製造されてきた。典型的には、3−(アミノメチル)−5−メチル−ヘキサン酸のラセミ混合物を合成し、引き続いて、そのR−及びS−鏡像体へ分割する。こうした方法は、アジド中間体、マロネート中間体、又はホフマン合成を用いることができる。それぞれ、R. B. Silverman et al. による米国特許第5,563,175 号
;T. M. Grote et alによる米国特許第6,046,353 、5,840,956 及び5,637,767 号;及びB. K. Huckabee & D. M. Sobieray による米国特許第5,629,447 及び5,616,793 号(これ
らはその全体が、及び全ての目的について、参照により本明細書に取り込まれる)を参照されたい。これらの各方法においては、ラセミ化合物をキラル酸(分割剤)と反応させてジアステレオ異性体塩の対を形成させ、それを分別結晶及びクロマトグラフィーのような既知の技術により分離する。それ故、これらの方法は、ラセミ化合物の製造を超えたかなりの処理を含み、それは分割剤とともに、生産コストを高くする。さらに、望まれないR−鏡像体が効率よくリサイクルされ得ないのでしばしば廃棄され、それによりプロセスの有効な処理量を50%減少させる。
【0004】
プレガバリンはまた、キラル助剤、つまり(4R,5S)−4−メチル−5−フェニル−2−オキサゾリジノンを使用して、直接合成されている。例えば、すべてR.B.Silverman et al、による、米国特許第6,359,169 、6,028,214 、5,847,151 、5,710,304 、5,684,189 、5,608,090 及び5,599,973 号(これらはその全体及び、全ての目的について、参
照により本明細書に取り込まれる)を参照されたい。これらの方法は、高い鏡像体純度でプレガバリンを提供するが、取り扱うのが難しい比較的高価な試薬(例えば、キラル助剤)、ならびに、−78℃ほどの低さであり得る、必要とされる処理温度に到達するための特別な極低温の装置を用いるので、大規模合成にはあまり望ましくない。
【0005】
最近公開された米国特許出願は、シアノ置換オレフィンの不斉水素添加を経て、(S)−3−(アミノメチル)−5−メチルヘキサン酸のキラルシアノ前駆体を生成させるプレガバリンの製造法を議論している。共通して譲渡され、2003年11月13日に公開された、Burk et alによる 米国特許出願番号2003/0212290 (その全体が、及び全ての目的
について、参照により本明細書に取り込まれる)を参照されたい。シアノ前駆体は引き続いて還元されてプレガバリンを生成する。この不斉水素添加は、(R,R)−Me−DUPHOSのような、ビスホスフィンリガンドへ結合された遷移金属から構成されるキラル触媒を用いる。この方法は(R)−3−(アミノメチル)−5−メチルヘキサン酸に対するプレバガリンの実質的な富化を生じる。
【0006】
米国特許出願第2003/0212290 A1 号に開示されている方法は、プレガバリンを製造するための商業的に実行可能な方法を代表しているが、さらなる改良が種々の理由で望まれるであろう。例えば、専売権のあるリガンド(R,R)−Me−DUPHOSを含むビスホスフィンリガンドは、二つのキラル中心を有するので製造するのがしばしば困難であるためコストが高くなる。さらに、不斉水素添加は、H2を取り扱うことが可能な特別の装置の使用を必要とし、それは投下コストを追加させる。
【発明の開示】
【0007】
【発明の要旨】
【0008】
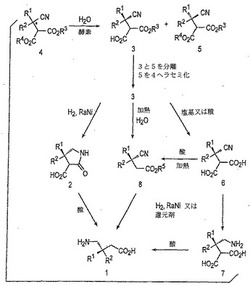
本発明は、プレガバリン(式9)のような、鏡像体的に富化されたγ−アミノ酸(式1)を製造するための材料及び方法を提供する。本発明の方法は、中間体のエステル部分を鏡像体選択的に加水分解するように適合させた酵素を使用するラセミ体シアノジエステル中間体(式4又は式12)の速度論的分割を含む。実質的に鏡像体純粋である生じたジカルボン酸モノエステル(式3又は式11)は、さらに反応を起こし、所望の鏡像体的に富化されたγ−アミノ酸(式1又は式9)を生成する。速度論的分割からの未反応の鏡像体(式5又は式13)は、ラセミ化後の酵素的分割で再使用することが可能であり、それにより全体の収率を改良する。
【0009】
特許請求された方法は、鏡像体的に富化されたγ−アミノ酸(式1及び式9)を製造するための現存するプロセスを超える著しい利点を与える。例えば、光学活性γ−アミノ酸をキラル助剤又は専売権のある水素添加触媒を使用することなく製造することが可能であるのでより低い単位コストをもたらすであろう。酵素的プロセスは、室温及び大気圧で行うことが可能であり、特許請求された方法は、高圧及び低温を取り扱うことが可能な特別の装置の使用から生じる段取り上の衝突を最少化するのを助けるであろう。実施例で示すように、本発明は、ラセミ体シアノジエステル中間体(式12)から出発して、未反応鏡像体(式13)の一回バッチリサイクル後に高収率で(26%〜31%)プレガバリンを製造するのに使用可能である。このことは、上記のマロネート法に対して約50%の節約の利益と言い換えられる。
【0010】
本発明の一つの側面は、式1:
【0011】
【化1】

【0012】
(式中、R1及びR2は異なっていて、各々独立して、水素原子、C1〜12アルキル、C3〜12シクロアルキル、及び置換C3〜12シクロアルキルから選択される)
の化合物又はその薬学的に許容できる複合体、塩、溶媒和物又は水和物を製造する方法を提供し、その方法は:
(a)式2:
【0013】
【化2】

【0014】
の化合物又はその塩と、酸及び水を反応させて、式1の化合物又はその塩を生成させ;そして
(b)場合により、式1の化合物又はその塩を薬学的に許容できる複合体、塩、溶媒和物又は水和物へ変換する
ことを含んでなり、その際、式2のR1及びR2は式1で定義した通りである。
【0015】
本発明の別の側面は、上記式1の化合物を製造する方法を提供し、その方法は:
(a)式6:
【0016】
【化3】

【0017】
の化合物又はその塩のシアノ部分を還元して、式7:
【0018】
【化4】

【0019】
の化合物又はその塩を生成させ;
(b)式7の化合物又はその塩を脱炭酸して、式1の化合物又はその塩を生成させ;そして
(c)場合により、式1の化合物又はその塩を薬学的に許容できる複合体、塩、溶媒和物又は水和物へ変換する
ことを含んでなり、その際、式6及び式7のR1及びR2は式1で定義した通りである。
【0020】
上記の式6の化合物は、式3:
【0021】
【化5】

【0022】
の化合物又はその塩を加水分解することにより製造することができる。その際、式3のR1及びR2は式1で定義した通りであり、そして、R3は、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルである。
【0023】
本発明の追加の側面は、上記式1の化合物を製造する方法を提供し、その方法は:
(a)式8:
【0024】
【化6】

【0025】
の化合物又はその塩のシアノ部分を還元して、式1又はその塩を生成させ;そして
(b)場合により、式1の化合物又はその塩を、薬学的に許容できる複合体、塩、溶媒和物又は水和物へ変換する
ことを含んでなり、その際、式8のR1及びR2は式1で定義した通りであり、そして、式8のR5は、水素原子、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルである。
【0026】
式8の化合物は、上記式3の化合物又はその塩を脱炭酸することにより、又は上記式3の化合物又はその塩を加水分解する及び脱炭酸することにより、製造することができる。
【0027】
本発明のさらなる側面は、上記式3の化合物又はその塩を製造する方法を提供し、その方法は:
(a)式4:
【0028】
【化7】

【0029】
の化合物を、酵素と接触させて式3の化合物及び式5:
【0030】
【化8】

【0031】
の化合物を生成させ、その際、該酵素は、式4の化合物を式3の化合物又はその塩に鏡像体選択的に加水分解するように適合されており;
(b)式3の化合物又はその塩を単離し;そして
(c)場合により、式5の化合物をラセミ化して、式4の化合物を生成させる
ことを含んでなり、その際、式4及び式5のR1、R2、及びR3は、式1及び式3で上に定義した通りであり、そして、式4及び式5のR4は、R3と同一であるか又は異なっていて、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルである。
【0032】
いかなる数の酵素も、式4の化合物を式3の化合物又はその塩に鏡像体選択的に加水分解するために使用することができる。有用な酵素には、サーモミセス・ラヌギノースス(Thermomyces lanuginosus )由来のもののようなリパーゼが含まれる。
【0033】
本発明の別の側面は、上記式2により表される化合物であって、その複合体、塩、溶媒和物又は水和物を含む化合物を提供する。但し、式2中のR1又はR2により表される置換基の一つのが水素である場合、他の置換基はC1〜3アルキルでもC5アルキルでもない。
【0034】
本発明の追加の側面は、式27:
【0035】
【化9】

【0036】
の化合物であって、その複合体、塩、溶媒和物又は水和物を含む化合物を提供し、式中、
R1及びR2は異なっていて、各々独立して、水素原子、C1〜12アルキル、C3〜12シクロアルキル、及び置換C3〜12シクロアルキルから選択され、但し、式2中のR1又はR2により表される置換基の一つのが水素原子である場合、他の置換基はメチルではなく;そして
R5及びR6は、水素原子、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルから独立して選択され、但し、R5及びR6は水素原子でないなら異なっている。
【0037】
化合物27は、上記式3、式4、式5、式6、及び式7により表される化合物を含み、それらの複合体、塩、溶媒和物又は水和物をも含む。式2〜7及び27の有用な化合物には、R1が水素原子であり、R2がイソブチルであるものが含まれる。
【0038】
本発明のさらなる側面は、式9:
【0039】
【化10】

【0040】
の化合物、又はその薬学的に許容できる複合体、塩、溶媒和物又は水和物を製造する方法を提供し、その方法は:
(a)式10:
【0041】
【化11】

【0042】
の化合物又はその塩を、酸及び水と反応させて、式9又はその塩を生成させ;そして
(b)場合により、式9の化合物又はその塩を、薬学的に許容できる複合体、塩、溶媒
和物又は水和物へ変換する
ことを含んでなる。
【0043】
本発明の別の側面は、上記式9の化合物又はその薬学的に許容できる複合体、塩、溶媒和物又は水和物を製造する方法を提供し、その方法は:
(a)式14:
【0044】
【化12】

【0045】
の化合物又はその塩のシアノ部分を還元して、式15:
【0046】
【化13】

【0047】
の化合物又はその塩を生成させ;
(b)式15の化合物又はその塩を脱炭酸して、式9の化合物又はその塩を生成させ;そして
(c)場合により、式9の化合物又はその塩を、薬学的に許容できる複合体、塩、溶媒和物又は水和物へ変換する
ことを含んでなる。
【0048】
上記式14の化合物は、式11:
【0049】
【化14】

【0050】
の化合物又はその塩を加水分解することにより製造することができ、その際、式11のR3は、式3で上に定義した通りである。
【0051】
本発明の追加の側面は、上記式9の化合物又はその薬学的に許容できる複合体、塩、溶媒和物又は水和物を製造する方法を提供し、その方法は:
(a)式16:
【0052】
【化15】

【0053】
の化合物又はその塩のシアノ部分を還元して、式9の化合物又はその塩を生成させ;そして
(b)場合により、式9の化合物又はその塩を、薬学的に許容できる複合体、塩、溶媒和物又は水和物へ変換する
ことを含んでなり、その際、式16のR5は、式8で上に定義した通りである。
【0054】
式16の化合物は、上記式11の化合物又はその塩を脱炭酸すること(例えば、加熱により)により、又は式11の化合物又はその塩を加水分解して脱炭酸することにより、製造することができる。
【0055】
本発明のさらなる側面は、上記式11の化合物又はその塩を製造する方法を提供し、その方法は:
(a)式12:
【0056】
【化16】

【0057】
の化合物を、酵素と接触させて、式11及び式13:
【0058】
【化17】

【0059】
の化合物を生成させ、その際、該酵素は、式12の化合物を式11の化合物又はその塩に鏡像体選択的に加水分解するように適合されており;
(b)式11の化合物又はその塩を単離し;そして
(c)場合により、式13の化合物をラセミ化して、式12の化合物を生成させる
ことを含んでなり、その際、式12及び式13中のR3は、上記式3で定義した通りであり、そして、式12及び式13中のR4は、R3と同一であるか又は異なっていて、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルである。
【0060】
式11の化合物を製造する方法において、式11の化合物の対応する塩には、カリウム塩のようなアルカリ金属塩、t−ブチルアミン塩のような第一アミン塩、及び第二アミン塩から選択される塩が含まれる。さらに、有用な酵素には、サーモミセス・ラヌギノースス由来のもののようなリパーゼが含まれる。
【0061】
本発明の別の側面は:
3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸、
(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸、
(2S,3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸、
(2R,3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸、
3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル、
(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル、
4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸、
(S)−4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸、
3−シアノ−2−カルボキシ−5−メチル−ヘキサン酸、
(S)−3−シアノ−2−カルボキシ−5−メチル−ヘキサン酸、
3−アミノメチル−2−カルボキシ−5−メチル−ヘキサン酸及び
(S)−3−アミノメチル−2−カルボキシ−5−メチル−ヘキサン酸
から選択される化合物であって、その複合体、塩、溶媒和物又は水和物及び反対の鏡像体を含む化合物を提供する。
【0062】
本発明は、ここに開示された化合物の、すべての複合体及び塩、薬学的に許容できるかできないに関わらず、溶媒和物、水和物及び多形形態を含む。特定の化合物は、アルケニル又は環状基を含むことができ、その結果、シス/トランス(又はZ/E)立体異性体が可能であり、又はケト又はオキシム基を含むことができ、その結果、互変異性が生じてもよい。こうした場合において、本発明は、それらが純粋であるか、実質的に純粋であるか、混合物であるかに関わらず、概して、すべてのZ/E異性体及び互変異性形態を含む。
【発明の詳細な説明】
【0063】
定義及び略語
特に示さない限り、本開示は以下に提供される定義を使用する。いくつかの定義及び式は、原子間の結合、及び名称を付けた又は付けていない原子又は原子団への連結点を示すための線分(−)を含むことができる。他の定義及び式は、二重結合又は三重結合を示すために、それぞれ、等号(「=」)又は同一性記号(「≡」)を含むことができる。特定の式はまた、不斉(非対称又はキラル)中心を示すための、一つまたはそれより多くのアステリスク(「*」)も含むことができるが、アステリスクが存在しないことは、化合物が一つまたはそれより多くの立体中心を欠くことを示しているわけではない。こうした式は、ラセミ化合物又は個々の鏡像体又はジアステレオマーを指すことができ、それらは純粋又は実質的に純粋であっても、又はなくてもよい。
【0064】
「置換された」基とは、原子価要求性を満たし、そして置換により化学的に安定な化合物を生じるとの条件で、一つまたはそれより多くの水素原子が、一つまたはそれより多くの非水素原子又は基により置き換えられたものである。
【0065】
「約」又は「およそ」とは、測定可能な数変数に関連して使用される場合、変数の示された値及び示された値の実験誤差範囲にある全ての値(例えば、平均についての95%信頼区間内の)、又は大きいにしても示された値の±10パーセント以内を指す。
【0066】
「アルキル」とは、直鎖及び分枝鎖飽和炭化水素基を指し、一般に、特定された数の炭素原子を有する(即ち、C1〜6アルキルとは、1、2、3、4、5又は6炭素原子を有するアルキル基を指し、そしてC1−12アルキルとは、1、2、3、4、5、6、7、8、9、10、11又は12炭素原子を有するアルキル基を指す)。アルキル基の例には、限定ではなく、メチル、エチル、n−プロピル、i−プロピル、n−ブチル、s−ブチル、i−ブチル、t−ブチル、ペンタ−1−イル、ペンタ−2−イル、ペンタ−3−イル、3−メチルブタ−1−イル、3−メチルブタ−2−イル、2−メチルブタ−2−イル、2,2,2−トリメチルエタ−1−イル、n−ヘキシルなどが含まれる。
【0067】
「アルケニル」とは、一つまたはそれより多くの不飽和炭素−炭素結合を有する直鎖及び分枝鎖炭化水素基を指し、一般に、特定された数の炭素原子を有している。アルケニル基の例には、限定ではなく、エテニル、1−プロペン−1−イル、1−プロペン−2−イル、2−プロペン−1−イル、1−ブテン−1−イル、1−ブテン−2−イル、3−ブテン−1−イル、3−ブテン−2−イル、2−ブテン−1−イル、2−ブテン−2−イル、2−メチル−1−プロペン−1−イル、2−メチル−2−プロペン−1−イル、1,3−ブタジエン−1−イル、1,3−ブタジエン−2−イルなどが含まれる。
【0068】
「アルキニル」とは、一つまたはそれより多くの三重炭素−炭素結合を有する、直鎖及び分枝鎖炭化水素基を指し、一般に、特定された数の炭素原子を有している。アルキニル基の例には、限定ではなく、エチニル、1−プロピン−1−イル、2−プロピン−1−イル、1−ブチン−1−イル、3−ブチン−1−イル、3−ブチン−2−イル、2−ブチン−1−イルなどが含まれる。
【0069】
「アルカノイル」及び「アルカノイルアミノ」とは、各々、アルキル−C(O)−及びアルキル−C(O)−NH−を指し(式中、アルキルは上で定義した通りである)、そして一般に、カルボニル炭素を含んだ特定された数の炭素原子を含む。アルカノイルの例には、限定ではなく、ホルミル、アセチル、プロピオニル、ブチリル、ペンタノイル、ヘキサノイルなどが含まれる。
【0070】
「アルケノイル」及び「アルキノイル」とは、各々、アルケニル−C(O)−及びアルキニル−C(O)−を指し、アルケニル及びアルキニルは上で定義した通りである。アルケノイル及びアルキノイルが表すものは、一般に、カルボニル炭素を除外した特定された
数の炭素原子を含む。アルケノイル基の例には、限定ではなく、プロペノイル、2−メチルプロペノイル、2−ブテノイル、3−ブテノイル、2−メチル−2−ブテノイル、2−メチル−3−ブテノイル、3−メチル−3−ブテノイル、2−ペンテノイル、3−ペンテノイル、4−ペンテノイルなどが含まれる。アルキノイル基の例には、限定ではなく、プロピノイル、2−ブチノイル、3−ブチノイル、2−ペンチノイル、3−ペンチノイル、4−ペンチノイルなどが含まれる。
【0071】
「アルコキシ」、「アルコキシカルボニル」及び「アルコキシカルボニルアミノ」とは、それぞれ、アルキル−O−、アルケニル−O及びアルキニル−O;アルキル−O−C(O)−、アルケニル−O−C(O)−、アルキニル−O−C(O)−;及びアルキル−O−C(O)−NH−、アルケニル−O−C(O)−NH−及びアルキニル−O−C(O)−NH−を指し、アルキル、アルケニル及びアルキニルは上で定義した通りである。アルコキシ基の例には、限定ではなく、メトキシ、エトキシ、n−プロポキシ、i−プロポキシ、n−ブトキシ、s−ブトキシ、t−ブトキシ、n−ペントキシ、s−ペントキシなどが含まれる。アルコキシカルボニル基の例には、限定ではなく、メトキシカルボニル、エトキシカルボニル、n−プロポキシカルボニル、i−プロポキシカルボニル、n−ブトキシカルボニル、s−ブトキシカルボニル、t−ブトキシカルボニル、n−ペントキシカルボニル、s−ペントキシカルボニルなどが含まれる。
【0072】
「アルキルアミノ」、「アルキルアミノカルボニル」、「ジアルキルアミノカルボニル」、「アルキルスルホニル」、「スルホニルアミノアルキル」及び「アルキルスルホニルアミノカルボニル」とは、それぞれ、アルキル−NH−、アルキル−NH−C(O)−、アルキル2−N−C(O)−、アルキル−S(O2)−、HS(O2)−NH−アルキル−、及びアルキル−S(O)−NH−C(O)−(式中、アルキルは上で定義した通りである)を指す。
【0073】
「アミノアルキル」及び「シアノアルキル」とは、それぞれ、NH2−アルキル及びN≡C−アルキルを指し、アルキルは上で定義した通りである。
【0074】
「ハロ」、「ハロゲン」及び「ハロゲノ」は、相互交換的に使用することができ、フルオロ、クロロ、ブロモ及びヨードを指す。
【0075】
「ハロアルキル」、「ハロアルケニル」、「ハロアルキニル」、「ハロアルカノイル」、「ハロアルケノイル」、「ハロアルキノイル」、「ハロアルコキシ」及び「ハロアルコキシカルボニル」とは、それぞれ、一つまたはそれより多くのハロゲン原子で置換されたアルキル、アルケニル、アルキニル、アルカノイル、アルケノイル、アルキノイル、アルコキシ及びアルコキシカルボニル基を指し、アルキル、アルケニル、アルキニル、アルカノイル、アルケノイル、アルキノイル、アルコキシ及びアルコキシカルボニルは上で定義した通りである。ハロアルキル基の例には、限定ではなく、トリフルオロメチル、トリクロロメチル、ペンタフルオロメチル、ペンタクロロエチルなどが含まれる。
【0076】
「ヒドロキシアルキル」及び「オキソアルキル」とは、それぞれ、HO−アルキル及びO=アルキルを指し、アルキルは上で定義した通りである。ヒドロキシアルキル及びオキソアルキル基の例には、限定ではなく、ヒドロキシメチル、ヒドロキシエチル、3−ヒドロキシプロピル、オキソメチル、オキソエチル、3−オキソプロピルなどが含まれる。
【0077】
「シクロアルキル」とは、飽和単環式及び二環式炭化水素環を指し、環を含んでなる特定された数の炭素原子を有している(即ち、C3〜7シクロアルキルとは、環メンバーとして3、4、5、6又は7炭素原子を有しているシクロアルキル基を指す)。シクロアルキルは、その結合が原子価要求性を犯さないであろう限り、いずれの環原子でも、親基又
は基質へ結合することができる。同様に、シクロアルキル基は、その置換が原子価要求性を犯さないであろう限り、一つまたはそれより多くの非水素置換基を含むことができる。有用な置換基には、限定ではなく、上で定義したアルキル、アルケニル、アルキニル、ハロアルキル、ハロアルケニル、ハロアルキニル、アルコキシ、アルコキシカルボニル、アルカノイル及びハロ、及びヒドロキシ、メルカプト、ニトロ及びアミノが含まれる。
【0078】
単環式シクロアルキル基の例には、限定ではなく、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシルなどが含まれる。二環式シクロアルキル基の例には、限定ではなく、ビシクロ[1.1.0]ブチル、ビシクロ[1.1.1]ペンチル、ビシクロ[2.1.0]ペンチル、ビシクロ[2.1.1]ヘキシル、ビシクロ[3.1.0]ヘキシル、ビシクロ[2.2.1]ヘプチル、ビシクロ[3.2.0]ヘプチル、ビシクロ[3.1.1]ヘプチル、ビシクロ[4.1.0]ヘプチル、ビシクロ[2.2.2]オクチル、ビシクロ[3.2.1]オクチル、ビシクロ[4.1.1]オクチル、ビシクロ[3.3.0]オクチル、ビシクロ[4.2.0]オクチル、ビシクロ[3.3.1]ノニル、ビシクロ[4.2.1]ノニル、ビシクロ[4.3.0]ノニル、ビシクロ[3.3.2]デシル、ビシクロ[4.2.2]デシル、ビシクロ[4.3.1]デシル、ビシクロ[4.4.0]デシル、ビシクロ[3.3.3]ウンデシル、ビシクロ[4.3.2]ウンデシル、ビシクロ[4.3.3]ドデシルなどが含まれ、それらは、そうした結合が原子価要求性を犯さないであろう限り、いずれの環原子でも、親基又は基質へ結合されることができる。
【0079】
「シクロアルケニル」とは、一つまたはそれより多くの不飽和炭素−炭素結合を有する単環式及び二環式炭化水素環を指し、そして環を含んでなる、特定された数の炭素原子を有している(即ち、C3〜7シクロアルケニルとは、環メンバーとして3、4、5、6又は7炭素原子を有しているシクロアルケニル基を指す)。シクロアルケニルは、その結合が原子価要求性を犯さないであろう限り、いずれの環原子でも、親基又は基質へ結合することができる。同様に、シクロアルケニル基は、その置換が原子価要求性を犯さないであろう限り、一つまたはそれより多くの非水素置換基を含むことができる。有用な置換基には、限定ではなく、上で定義したアルキル、アルケニル、アルキニル、ハロアルキル、ハロアルケニル、ハロアルキニル、アルコキシ、アルコキシカルボニル、アルカノイル及びハロ、及びヒドロキシ、メルカプト、ニトロ及びアミノが含まれる。
【0080】
「シクロアルカノイル」及び「シクロアルケノイル」とは、それぞれ、シクロアルキル−C(O)−及びシクロアルケニル−C(O)−を指し、シクロアルキル及びシクロアルケニルは上で定義した通りである。シクロアルカノイル及びシクロアルケノイルが表すものは、一般に、カルボニル炭素を除外した特定された数の炭素原子を含む。シクロアルカノイルの例には、限定ではなく、シクロプロパノイル、シクロブタノイル、シクロペンタノイル、シクロヘキサノイル、シクロヘプタノイル、1−シクロブテノイル、2−シクロブテノイル、1−シクロペンテノイル、2−シクロペンテノイル、3−シクロペンテノイル、1−シクロヘキサノイル、2−シクロヘキサノイル、3−シクロヘキサノイルなどが含まれる。
【0081】
「シクロアルコキシ」及び「シクロアルコキシカルボニル」とは、それぞれ、シクロアルキル−O−及びシクロアルケニル−O、及びシクロアルキル−O−C(O)−及びシクロアルケニル−O−C(O)−を指し、シクロアルキル及びシクロアルケニルは上で定義した通りである。シクロアルコキシ及びシクロアルコキシカルボニルが表すものは、一般に、カルボニル炭素を除外した特定された数の炭素原子を含む。シクロアルコキシ基の例には、限定ではなく、シクロプロポキシ、シクロブトキシ、シクロペントキシ、シクロヘキソキシ、1−シクロブテノキシ、2−シクロブテノキシ、1−シクロペンテノキシ、2−シクロペンテノキシ、3−シクロペンテノキシ、1−シクロヘキセノキシ、2−シクロ
ヘキセノキシ、3−シクロヘキセノキシなどが含まれる。シクロアルコキシカルボニル基の例には、限定ではなく、シクロプロポキシカルボニル、シクロブトキシカルボニル、シクロペントキシカルボニル、シクロヘキソキシカルボニル、1−シクロブテノキシカルボニル、2−シクロブテノキシカルボニル、1−シクロペンテノキシカルボニル、2−シクロペンテノキシカルボニル、3−シクロペンテノキシカルボニル、1−シクロヘキセノキシカルボニル、2−シクロヘキセノキシカルボニル、3−シクロヘキセノキシカルボニルなどが含まれる。
【0082】
「アリール」及び「アリーレン」とは、それぞれ、窒素、酸素及び硫黄から独立して選択される、0〜4ヘテロ原子を含む5−及び6−員の単環式芳香族基を含んでいる、一価及び二価の芳香族基を指す。単環式アリール基の例には、限定ではなく、フェニル、ピロリル、フラニル、チオフェニル、チアゾリル、イソチアゾリル、イミダゾリル、トリアゾリル、テトラゾリル、ピラゾリル、オキサゾリル、イソオキサゾリル、ピリジニル、ピラジニル、ピリダジニル、ピリミジニルなどが含まれる。アリール及びアリーレン基はまた、上記の縮合5−及び6−員環を含む、二環式基、三環式基、その他を含む。多環式アリール基の例には、限定ではなく、ナフチル、ビフェニル、アントラセニル、ピレニル、カルバゾリル、ベンゾオキサゾリル、ベンゾジオキサゾリル、ベンゾチアゾリル、ベンゾイミダゾリル、ベンゾチオフェニル、キノリニル、イソキノリニル、インドリル、ベンゾフラニル、プリニル、インドリジニルなどが含まれる。アリール及びアリーレン基は、その結合が原子価要求性を犯さないであろう限り、いずれの環原子でも、親基又は基質へ結合することができる。同様に、アリール及びアリーレン基は、その置換が原子価要求性を犯さないであろう限り、一つまたはそれより多くの非水素置換基を含むことができる。有用な置換基には、限定ではなく、上で定義したアルキル、アルケニル、アルキニル、ハロアルキル、ハロアルケニル、ハロアルキニル、シクロアルキル、シクロアルケニル、アルコキシ、シクロアルコキシ、アルカノイル、シクロアルカノイル、シクロアルケノイル、アルコキシカルボニル、シクロアルコキシカルボニル及びハロ、及びヒドロキシ、メルカプト、ニトロ、アミノ及びアルキルアミノが含まれる。
【0083】
「ヘテロ環」及び「ヘテロシクリル」とは、それぞれ、5〜7又は7〜11の環メンバーを有する、飽和、部分的不飽和又は不飽和、単環式又は二環式環を指す。これらの基は、炭素原子及び、独立して窒素、酸素又は硫黄である、1〜4のヘテロ原子から作り上げられた環メンバーを有し、そして上記の単環式ヘテロ環がベンゼン環に縮合した、いずれかの二環式基を含むことができる。窒素及び硫黄ヘテロ原子は、場合により、酸化されていてもよい。ヘテロ環式環は、結合が原子価要求性を犯さないであろう限り、いずれのヘテロ原子又は炭素原子でも、親基又は基質へ結合されることができる。同様に、いずれの炭素又は窒素環メンバーも、その置換が原子価要求性を犯さないであろう限り、非水素置換基を含むことができる。有用な置換基には、限定ではなく、上で定義したアルキル、アルケニル、アルキニル、ハロアルキル、ハロアルケニル、ハロアルキニル、シクロアルキル、シクロアルケニル、アルコキシ、シクロアルコキシ、アルカノイル、シクロアルカノイル、シクロアルケノイル、アルコキシカルボニル、シクロアルコキシカルボニル及びハロ、及びヒドロキシ、メルカプト、ニトロ、アミノ、及びアルキルアミノが含まれる。
【0084】
ヘテロ環の例には、限定ではなく、アクリジニル、アゾシニル、ベンゾイミダゾリル、ベンゾフラニル、ベンゾチオフラニル、ベンゾチオフェニル、ベンゾオキサゾリル、ベンゾチアゾリル、ベンゾトリアゾリル、ベンゾテトラゾリル、ベンゾイソオキサゾリル、ベンゾイソチアゾリル、ベンゾイミダゾリニル、カルバゾリル、4aH−カルバゾリル、カルボリニル、クロマニル、クロメニル、シンノリニル、デカヒドロキノリニル、2H,6H−1,5,2−ジチアジニル、ジヒドロフロ[2,3−b]テトラヒドロフラン、フラニル、フラザニル、イミダゾリジニル、イミダゾリニル、イミダゾリル、1H−インダゾリル、インドレニル、インドリニル、インドリジニル、インドリル、3H−インドリル、
イソベンゾフラニル、イソクロマニル、イソインダゾリル、イソインドリニル、イソインドリル、イソキノリニル、イソチアゾリル、イソオキサゾリル、モルホリニル、ナフチリジニル、オクタヒドロイソキノリニル、オキサジアゾリル、1,2,3−オキサジアゾリル、1,2,4−オキサジアゾリル、1,2,5−オキサジアゾリル、1,3,4−オキサジアゾリル、オキサゾリジニル、オキサゾリル、オキサゾリジニル、ピリミジニル、フェナントリジニル、フェナントロリニル、フェナジニル、フェノチアジニル、フェノキサチイニル、フェノキサジニル、フタラジニル、ピペラジニル、ピペリジニル、プテリジニル、プリニル、ピラニル、ピラジニル、ピラゾリジニル、ピラゾリニル、ピラゾリル、ピリダジニル、ピロドオキサゾール、ピリドイミダゾール、ピリドチアゾール、ピリジニル、ピリジル、ピリミジニル、ピロリジニル、ピロリニル、2H−ピロリル、ピロリル、キナゾリニル、キノリニル、4H−キノリジニル、キノキサリニル、キヌクリジニル、テトラヒドロフラニル、テトラヒドロイソキノリニル、テトラヒドロキノリニル、6H−1,2,5−チアジアジニル、1,2,3−チアジアゾリル、1,2,4−チアジアゾリル、1,2,5−チアジアゾリル、1,3,4−チアジアゾリル、チアアントレニル、チアゾリル、チエニル、チエノチアゾリル、チエノオキサゾリル、チエノイミダゾリル、チオフェニル、トリアジニル、1,2,3−トリアゾリル、1,2,4−トリアゾリル、1,2,5−トリアゾリル、1,3,4−トリアゾリル及びキサンテニルが含まれる。
【0085】
「ヘテロアリール」及び「ヘテロアリーレン」とは、それぞれ、芳香族である、上で定義した一価及び二価ヘテロ環又はヘテロシクリル基を指す。ヘテロアリール及びヘテロアリーレン基は、それぞれ、アリール及びアリーレン基の下位集団を意味する。
【0086】
「アリールアルキル」及び「ヘテロアリールアルキル」とは、それぞれ、アリール−アルキル及びヘテロアリール−アルキルを指し、アリール、ヘテロアリール及びアルキルは上で定義した通りである。例には、限定ではなく、ベンジル、フルオレニルメチル、イミダゾール−2−イル−メチルなどが含まれる。
【0087】
「アリールアルカノイル」、「ヘテロアリールアルカノイル」、「アリールアルケノイル」、「ヘテロアリールアルケノイル」、「アリールアルキノイル」及び「ヘテロアリールアルキノイル」とは、それぞれ、アリール−アルカノイル、ヘテロアリール−アルカノイル、アリール−アルケノイル、ヘテロアリール−アルケノイル、アリール−アルキノイル、及びヘテロアリール−アルキノイルを指し、アリール、ヘテロアリール、アルカノイル、アルケノイル及びアルキノイルは上で定義した通りである。例には、限定ではなく、ベンゾイル、ベンジルカルボニル、フルオレノイル、フルオレニルメチルカルボニル、イミダゾール−2−オイル、イミダゾール−2−イル−メチルカルボニル、フェニルエテンカルボニル、1−フェニルエテンカルボニル、1−フェニル−プロペンカルボニル、2−フェニル−プロペンカルボニル、3−フェニル−プロペンカルボニル、イミダゾール−2−イル−エテンカルボニル、1−(イミダゾール−2−イル)−エテンカルボニル、1−(イミダゾール−2−イル)−プロペンカルボニル、2−(イミダゾール−2−イル)−プロペンカルボニル、3−(イミダゾール−2−イル)−プロペンカルボニル、フェニルエチンカルボニル、フェニルプロピンカルボニル、(イミダゾール−2−イル)−エチンカルボニル、(イミダゾール−2−イル)−プロピンカルボニルなどが含まれる。
【0088】
「アリールアルコキシ」及び「ヘテロアリールアルコキシ」とは、それぞれ、アリール−アルコキシ及びヘテロアリール−アルコキシを指し、アリール、ヘテロアリール及びアルコキシは上で定義した通りである。例には、限定ではなく、ベンジルオキシ、フルオレニルメチルオキシ、イミダゾール−2−イル−メチルオキシなどが含まれる。
【0089】
「アリールオキシ」及び「ヘテロアリールオキシ」とは、それぞれ、アリール−O−及びヘテロアリール−O−を指し、アリール及びヘテロアリールは上で定義した通りである
。例には、限定ではなく、フェノキシ、イミダゾール−2−イルオキシなどが含まれる。
【0090】
「アリールオキシカルボニル」、「ヘテロアリールオキシカルボニル」、「アリールアルコキシカルボニル」及び「ヘテロアリールアルコキシカルボニル」とは、それぞれ、アリールオキシ−C(O)−、ヘテロアリールオキシ−C(O)−、アリ−ルアルコキシ−C(O)−及びヘテロアリールアルコキシ−C(O)−を指し、アリールオキシ、ヘテロアリールオキシ、アリールアルコキシ及びヘテロアリールアルコキシは上で定義した通りである。例には、限定ではなく、フェノキシカルボニル、イミダゾール−2−イルオキシカルボニル、ベンジルオキシカルボニル、フルオレニルメチルオキシカルボニル、イミダゾール−2−イル−メチルオキシカルボニルなどが含まれる。
【0091】
「脱離基」とは、置換反応、脱離反応及び付加−脱離反応を含む、フラグメンテーションプロセス間に、分子を離れるいずれかの基を指す。脱離基は、脱離基と分子間の結合として以前は働いていた電子対とともに基が離れる、離核性であってもよく、又は電子対なしで基が離れる、離電子性であってもよい。離れるための離核性脱離基の能力は、その塩基強度に依存し、最も強い塩基が最も不十分な脱離基である。通常の離核性脱離基には、窒素(例えば、ジアゾニウム塩からの);アルキルスルホナート(例えば、メシラート)フルオロアルキルスルホナート(例えば、トリフラート、ヘキサフラート、ノナフラート及びトレシラート)及びアリールスルホナート(例えば、トシラート、ブロシラート、クロシラート及びノシラート)を含むスルホナートが含まれる。他には、カルボナート、ハライドイオン、カルボキシラートアニオン、フェノラートイオン及びアルコキシドが含まれる。スルホナート、NH2−及びOH−のような、いくつかのより強い塩基は、酸による処理により、より良好な脱離基とすることが可能である。通常の離電子性脱離基には、プロトン、CO2及び金属が含まれる。
【0092】
「鏡像体過剰率」又は「ee」とは、所与の試料について、一つの鏡像体の、キラル化合物のラセミ体試料に対する過剰率の指標であり、パーセンテージとして表現される。鏡像体過剰率は、100x(er−1)/(er+1)(式中、「er」は、より豊富な鏡像体のより少ない鏡像体に対する比である)として定義される。
【0093】
「ジアステレオマー過剰率」又は「de」とは、所与の試料について、一つのジアステレオマーの、等量のジアステレオマーを有する試料に対する過剰率の指標であり、パーセンテージとして表現される。ジアステレオマー過剰率は、100x(dr−1)/(dr+1)(式中、「dr」は、より豊富なジアステレオマーのより少ないジアステレオマーに対する比である)として定義される。
【0094】
「立体選択的」、「鏡像体選択的」、「ジアステレオ選択的」及びその変異形は、それぞれ、別のものよりも多い一つの立体異性体、鏡像体又はジアステレオマーを生成する規定のプロセス(例えば、エステル加水分解、水素添加、ヒドロホルミル化、π−アリルパラジウムカップリング、ヒドロシリル化、ヒドロシアノ化、オレフィンメタセシス、ヒドロアシル化、アリルアミン異性化その他)を指す。
【0095】
「高レベルの立体選択性」、「高レベルの鏡像体選択性」、「高レベルのジアステレオ選択性」及びその変異形は、生成物の少なくとも約90%を含んでなる、一つの立体異性体、鏡像体又はジアステレオマーを過剰に有する生成物を生成する、規定のプロセスを指す。鏡像体及びジアステレオマーの組については、高レベルの鏡像体選択性又はジアステレオ選択性は、少なくとも約80%のee又はdeに相当するであろう。
【0096】
「立体異性体的に富化された」、「鏡像体的に富化された」、「ジアステレオマー的に富化された」及びその変異形は、それぞれ、一つの立体異性体、鏡像体又はジアステレオ
マーを別のものよりもより多く含む、化合物の試料を指す。富化の程度は、全生成物の%により、鏡像体及びジアステレオマーの組については、ee又はdeにより、測定することができる。
【0097】
「実質的に純粋な立体異性体」、「実質的に純粋な鏡像体」、「実質的に純粋なジアステレオマー」及びその変異形は、それぞれ、試料の少なくとも約95%を含んでなる、立体異性体、鏡像体又はジアステレオマーを含有する試料を指す。鏡像体及びジアステレオマーの組については、実質的に純粋な鏡像体又はジアステレオマーは、約95%又はそれ以上のee又はdeを有する試料に相当するであろう。
【0098】
「純粋な立体異性体」、「純粋な鏡像体」、「純粋なジアステレオマー」及びその変異形は、それぞれ、試料の少なくとも約99.5%を含んでなる、立体異性体、鏡像体又はジアステレオマーを含んでいる試料を指す。鏡像体及びジアステレオマーの組については、純粋な鏡像体又はジアステレオマーは、約99%又はそれ以上のee又はdeを有する試料に相当するであろう。
【0099】
「反対の鏡像体」とは、重ね合わすことが出来ない、参照分子の鏡像である分子を指し、それは、参照分子の立体中心の全てを反転することにより得ることが出来る。例えば、もし参照分子がS絶対立体化学配置を有していたら、反対の鏡像体はR絶対立体化学配置を有する。同様に、もし参照分子がS,S絶対立体化学配置を有していたら、反対の鏡像体はR,R絶対立体化学配置を有するなどである。
【0100】
特定の化合物の「立体異性体」は、化合物の反対の鏡像体、及び化合物のいずれかのジアステレオ異性体又は幾何異性体(Z/E)を指す。例えば、もし特定の化合物がS,R,Z立体化学的コンフィグレーションを有していたら、その立体異性体には、R,S,Zコンフィグレーションを有するその反対の鏡像体、S,S,Zコンフィグレーション及びR,R,Zコンフィグレーションを有するそのジアステレオマー、及びS,R,Eコンフィグレーション、R,S,Eコンフィグレーション、S,S,Eコンフィグレーション及びR,R,Eコンフィグレーションを有するその幾何異性体を含むであろう。
【0101】
「鏡像体選択性値」又は「E」とは、化学的反応及び変換を受けている化合物の各鏡像体についての特異性定数の比を指し、式:
【0102】
【数1】

【0103】
(式中、KS及びKRは、それぞれ、S−及びR−鏡像体の変換についての1次速度定数であり;KSM及びKRMは、それぞれ、S−及びR−鏡像体についてのミカエリス定数であり;χは、基質の転化率であり;eep及びeesは、それぞれ、生成物及び基質(反応体)の鏡像体過剰率である)から計算する(S−鏡像体について)ことができる。
【0104】
「リパーゼ単位」又は「LU」とは、30℃及びpH7で、トリブチリン及び乳化剤(アラビアガム)と接触させた場合、1μmolの滴定可能酪酸/分を遊離する、酵素の量(gで)を指す。
【0105】
「溶媒和物」とは、開示された又は特許請求された化合物及び化学量論又は非化学量論量の一つまたはそれより多くの薬学的に許容できる溶媒分子(例えば、EtOH)を含ん
でなる、分子複合体を指す。
【0106】
「水和物」とは、開示された又は特許請求された化合物及び化学量論又は非化学量論量の水を含んでなる、溶媒和物を指す。
【0107】
「薬学的に許容できる複合体、塩、溶媒和物又は水和物」とは、健全な医学的判断の範囲内で、過度の毒性、刺激作用、アレルギー応答などがなく、患者の組織との接触における使用に適し、合理的利益対危険比が釣り合っており、及びそれらの意図される使用に有益である、開示された又は特許請求された化合物の複合体、酸又は塩基付加塩、溶媒和物又は水和物を指す。
【0108】
「プレ触媒」又は「触媒前駆体」とは、使用に先だって、触媒へ変換される化合物又は化合物の組を指す。
【0109】
「治療する」とは、こうした用語が適用される障害又は状態を、逆行させる、緩和する、進行を抑制する、又は予防すること、又はこうした障害又は状態の一つまたはそれより多くの症状を予防することを指す。
【0110】
「治療」とは、直前に定義した「治療する」ことの行為を指す。
【0111】
表1は、本明細書を通して使用される略語を列挙するものである。
【0112】
【表1】

【0113】
【表2】

【0114】
【表3】

【0115】
以下のいくつかの反応スキーム及び実施例において、特定の化合物を、反応部位以外での望まれない化学反応を防止する、保護基を使用して製造することが可能である。保護基はまた、溶解度を増強するため、さもなければ化合物の物理的性質を修飾するためにも使用することが出来る。保護基戦略、保護基を取り付けるまたは除去するための材料及び方法の記述、及びアミン、カルボン酸、アルコール、ケトン、アルデヒドなどを含む通常の官能基に有用な保護基のコンピレーション(compilation )、についての議論については、全ての目的について、その全体が参照により本明細書に取り込まれる、T. W. Greene and P.G. Wuts, Protecting Groups in Organic Chemistry (1999) and P. Kocienski, Protective Groups (2000) を参照されたい。
【0116】
加えて、以下のいくつかのスキーム及び実施例では、有機化学の当業者には周知である、酸化、還元などを含む、ありふれた反応の詳細は省略されている。こうした反応の詳細は、Richard Larock, Comprehensive Organic Transformations (1999) 及びMichael B. Smith 他により監修された、複数巻より成るCompendium of Organic Synthetic Methods (1974-2003) を含む、多数の学術論文に見ることが可能である。一般に、出発材料及び試薬は、商業的供給元から得ることができるか、又は文献により製造することができる。
【0117】
一般に、本明細書を通して記述されている化学変換は、実質的に化学量論量の反応体を使用して実行できるが、特定の反応は、過剰の一つまたはそれより多くの反応体を使用することにより利益を得ることができる。追加として、以下に詳細に記載されているラセミ体ジエステル(式4)の鏡像体選択的加水分解を含む、本明細書を通して開示されている反応の多くは、RT近辺で実施することができるが、反応速度論、収率などに依存して、特定の反応は、より高い又はより低い温度の使用を必要としてもよい。さらに、多くの化学変換は、反応速度及び収率に影響することができる、一つまたはそれより多くの適合した溶媒を用いることができる。反応の性質に依存して、一つまたはそれより多くの溶媒は、極性プロトン性溶媒、極性非プロトン性溶媒、非極性溶媒、又はいくつかの組み合わせであることができる。濃度範囲、温度範囲、pH範囲、触媒添加範囲などに関する本開示中のいずれの参照も、用語「範囲」が明白に使用されている又はいないとしても、示された終了点を含んでいる。
【0118】
本発明は、薬学的に許容できる塩、エステル、アミドまたはプロドラッグを含む、光学活性γ−アミノ酸(式1)を製造するための材料及び方法を提供する。式1の化合物は、上に定義されている、置換基R1及びR2を含む。式1の有用な化合物には、それ故、R1が水素原子であり、そしてR2がC1〜12アルキル、C3〜12シクロアルキル、又は置換C3〜12シクロアルキルである化合物、又はR2が水素原子であり、そしてR1がC1〜12アルキル、C3〜12シクロアルキル、又は置換C3〜12シクロアルキルである化合物が含まれる。式1の特に有用な化合物には、R1が水素原子であり、そしてR2がC1〜6アルキル又はC3〜7シクロアルキルである化合物、又はR2が水素原子であり、そしてR1がC1〜6アルキル又はC3〜7シクロアルキルである化合物が含まれる。式1の特別に有用な化合物には、プレバガリン(式9)のような、R1が水素原子であり、そしてR2がC1〜4アルキルである化合物が含まれる。
【0119】
図1は、光学活性γ−アミノ酸(式1)を製造するプロセスを示している。本プロセスは、シアノ−置換ジエステル(式4)及び水を含んでなる反応混合物と、酵素を接触させ又は混合して、光学活性ジカルボン酸モノエステル(式3)及び光学活性ジエステル(式5)を含む、生成物混合物を生成させる工程を含んでいる。シアノ−置換ジエステル(式4)は、アステリスク(「*」)で示されている不斉中心を有し、以下に記載するように、図2に示した反応スキームに従って製造することができる。酵素と接触させることに先だっては、シアノ−置換ジエステル(式4)は、典型的には、式5のジエステル及びその反対の鏡像体のラセミ体(等モル)を含んでなる。式3、式4及び式5における置換基R1、R2、及びR3、そして式4及び式5における置換基R4は、式1に関連して定義した通りである。一般に、異なって述べられていない限り、特定の置換基識別名(R1、R2、R3その他)は、式に関連して最初に定義され、続いての式で使用される同一の置換基識別名は、より早い式のものと同一の意味を有するであろう。
【0120】
酵素(又は生物触媒)は、式5の化合物にはほとんどあるいは全く影響しないが、その反対の鏡像体の加水分解を触媒して、ジカルボン酸モノエステル(式3)を生成するであろう、いずれかのタンパク質であることができる。式4から式3の化合物へ鏡像体選択的に加水分解するための有用な酵素は、それ故、リパーゼを含むヒドロラーゼ、特定のプロテアーゼ及び他の鏡像体選択的エステラーゼを含むことができる。こうした酵素は、動物器官及び微生物を含む多様な天然源から得ることができる。例えば、商業的に入手可能なヒドロラーゼの非制限的リストについての表2を参照されたい。
【0121】
【表4】

【0122】
【表5】

【0123】
【表6】

【0124】
実施例の節に示したように、シアノ−置換ジエステル(式4及び式12)の、所望の光学活性ジカルボン酸モノエステル(式3及び式11)への鏡像体選択的変換に有用な酵素には、リパーゼが含まれる。特に有用なリパーゼには、LIPOLASE(登録商標)(CAS番号9001−62−1)の商標でNovo-Nordisk A/S から入手可能なもののよう
な、微生物サーモマイセス・ラヌギノスス(Thermomyces lanuginosus )由来の酵素が含まれる。LIPOLASE(登録商標)酵素は、リパーゼのアミノ酸配列をコードする、サーモマイセス・ラヌギノススDSM4109からのDNAで遺伝子修飾した、アスペルギルス・オリゼ(Aspergillus oryzae )微生物の液内発酵により得られる。LIPOL
ASE(登録商標)100L及びLIPOLASE(登録商標)100Tは、それぞれ、液体溶液及び顆粒固形物として入手可能であり、それぞれは、100kLU/gの公称活性を有している。LIPOLASE(登録商標)の他の形態には、LIPOLASE(登録商標)100Lの半分の活性を有するLIPOLASE(登録商標)50L、及びLIPOLASE(登録商標)100Lと同一の活性を有しているが食品用である、LIPOZYME(登録商標)100L、が含まれる。
【0125】
適した酵素を同定するため、多様なスクリーニング技術を使用することができる。例えば、多数の商業的に入手可能な酵素を、以下の実施例の節に記載されている高処理量スクリーニング技術を使用してスクリーニングすることができる。他の酵素(又は酵素の微生物源)を、富化単離技術を使用してスクリーニングできる。こうした技術には、典型的には、ラセミ体基質(式4)又は構造的に類似した化合物であってもよい、富化基質を補給した炭素−制限又は窒素制限培地の使用が含まれる。潜在的に有用な微生物は、富化基質を含有する培地中で増殖する能力に基づいた、さらなる検討で選択される。これらの微生物は続いて、微生物細胞の懸濁液とラセミ体基質を接触させ、そしてキラルHPLC、ガス−液体クロマトグラフィー、LC/MSなどのような分析法を使用し、所望の光学活性
ジカルボン酸モノエステル(式3)の存在を試験することにより、その鏡像体選択的にエステル加水分解を触媒する能力を評価する。
【0126】
要求される加水分解活性を有する微生物が単離されたら、それを産生する酵素の特性を改良するために、酵素工学を用いることができる。例えば、限定ではなく、エステル加水分解の収率及び鏡像体選択性を増加させるため、酵素の温度及びpH操作範囲を広げるため、及び有機溶媒に対する酵素の耐性を改良するために、酵素工学を使用することができる。有用な酵素工学技術には、部位特異的突然変異発生のような合理的設計法、及び所望の特性を最適化するための無作為突然変異発生、遺伝子発現及び高処理量スクリーニングの連続的ラウンドを利用するインビトロ−方向付け進化技術が含まれる。例えば、その全開示が、参照により本明細書に取り込まれる、K. M. Koeller & C.-H. Wong, 「Enzymes for chemical synthesis」 Nature 409:232-240 (11 Jan. 2001) 、及びそれに引用され
ている参照文献を参照されたい。
【0127】
酵素は、全微生物細胞、透過処理された微生物細胞、微生物細胞の抽出物、部分的に精製された酵素、精製された酵素などの形態であることができる。酵素は、体積に基づいて、約0.1mm未満の(微細分散液)、又は約0.1mm又はより大きな(粗分散液)の平均粒子サイズを有する粒子の分散液を含んでなることができる。粗酵素分散液は、微細分散液よりも、有望なプロセシング利点を与える。例えば、粗酵素粒子は、バッチプロセス、又は半連続的又は連続的プロセスにおいて繰り返し使用することができ、そして通常、酵素の微細分散液よりも、生体変換の他の成分から、より容易に分離することができる(例えば、濾過により)。
【0128】
有用な粗酵素分散液には、主として酵素を含んでなる、架橋酵素結晶(CLEC)及び架橋酵素凝集物(CLEA)が含まれる。他の粗分散液は、不溶性支持体上又は内に固定化された酵素を含むことができる。有用な固体支持体には、アルギン酸カルシウム、ポリアクリルアミド、EUPERGIT(登録商標)及び他のポリマー材料を含んでなるポリマーマトリックス、ならびに、CELITE(登録商標)のような無機材料が含まれる。CLEC及び他の酵素固定化技術の一般的記述については、M. A. Navia & N. L. St. Clair による米国特許第5,618,710 号を参照されたい。製造及び使用を含んだ、CLEAの一般的記述については、L. Cao & J. Elzinga et al による米国特許出願第2003/0149172
号を参照されたい。リパーゼに対するCLEC及びCLEA技術の応用の議論について
は、A. M. Anderson, Biocat. Biotransform, 16:181(1998) 及びP.Lopez-Serrano et al., Biotechnol. Lett. 24:1379-83(2002) も参照されたい。前述の参照文献の全開示は、すべての目的について、参照により本明細書に取り込まれる。
【0129】
反応混合物は、単一相を含んでなることができ、又は多相(例えば、2又は3相システム)を含んでなることができる。それ故、例えば、図1に示した鏡像体選択的加水分解は、酵素、最初の内はラセミ体基質(式4)、望まれない光学活性ジエステル(式5)、及び所望の光学活性ジカルボン酸モノエステル(式3)を含有する、単一水性相で起こすことができる。もしくは、反応混合物は、固体相(例えば、酵素又は生成物)と接触する水性相、有機層と接触する水性相、有機層及び固体相と接触する水性相を含む、多相システムを含んでなることができる。例えば、鏡像体選択的加水分解は、酵素を含有する固体相、最初の内はラセミ体基質、望まれない光学活性ジエステル、及び所望の光学活性ジカルボン酸モノエステルを含有する水性相、を含んでなる2相システム中で実施することができる。
【0130】
また、鏡像体選択的加水分解は、酵素を含有する固体相、最初の内はラセミ体基質(式4)を含有する有機層、及び最初の内は少しのラセミ体基質を含有する水性相、を含んでなる3相システム中で実施することができる。所望の光学活性ジカルボン酸モノエステル
(式3)は、未反応光学活性ジエステル(式5)よりも低いpKaを有しており、そしてそれ故により大きな水性溶解度を示すので、反応が進行するにつれて、有機相は未反応ジエステルで富化されるようになり、一方、水性相は所望のジカルボン酸モノエステルで富化されるようになる。
【0131】
鏡像体選択的加水分解で使用される、ラセミ体基質(式4)及び生物触媒の量は、中でも、特定のシアノ−置換ジエステル及び酵素の特性に依存するであろう。しかしながら一般に、反応は、約0.1M〜約3.0Mの初期濃度を有する、及び多くの場合、約1.5M〜約3.0Mの初期濃度を有する基質を用いることができる。追加として、反応は一般に、約1%〜約10%の酵素添加を用いることができ、そして多くの場合、約3%〜約4%(v/v)の酵素添加を用いることができる。
【0132】
鏡像体選択的加水分解は、広範囲の温度及びpHに渡って実行することができる。例えば、反応は、約10℃の温度から約50℃の温度で実行することができるが、典型的には、RT近辺で実行される。こうした温度は、一般に、酵素を不活性化させることなく、妥当な時間で(約2h〜約24h)ラセミ化合物(式4)の実質的に完全な変換を可能にする。その上、鏡像体選択的加水分解は、約5のpHから約10のpH、より典型的には、約6のpHから約9のpH、そしてしばしば約6.5のpHから約7.5のpHで実行することができる。
【0133】
pH調節を行わないと、反応混合物pHは、ジカルボン酸モノエステル(式3)の形成のため、基質(式4)の加水分解につれて低下するであろう。この変化を相殺するため、加水分解反応は、内部pH調節で(即ち、適した緩衝液存在下で)行うことができ、又は塩基の添加を通した外部pH調節で行うこともできる。適した緩衝液には、リン酸カリウム、リン酸ナトリウム、酢酸ナトリウム、酢酸アンモニウム、酢酸カルシウム、BES、BICINE、HEPES、MES、MOPS、PIPES、TAPS、TES、TRICINE、Tris、TRIZMA(登録商標)、又は約6のpKa〜約9のpKaを有する他の緩衝液が含まれる。緩衝液濃度は、一般に約5mM〜約1mMの範囲であり、そして典型的には約50mM〜約200mMの範囲である。適した塩基には、約0.5M〜約15Mの範囲にわたる、又はより典型的には、約5M〜約10Mの範囲にわたる濃度を有する、KOH、NaOH、NH4OHその他を含んでなる水性溶液が含まれる。酢酸カルシウムのような他の無機添加物もまた使用することができる。
【0134】
ラセミ化合物(式4)の酵素的変換後に又は間に、所望の光学活性ジカルボン酸モノエステル(式3)を、標準技術を使用して生成物混合物から単離する。例えば、単一(水性)相バッチ反応の場合、生成物混合物をヘキサン又はヘプタンのような非極性有機溶媒で一回またはそれより多くの回数抽出することができ、それは所望のジカルボンモノエステル(式2)及び未反応ジエステル(式5)を、それぞれ、水性及び有機相に分離する。もしくは、水性及び有機相を用いる多相反応の場合、それぞれ、所望のモノエステル(式3)及び未反応ジエステル(式5)が富化され、モノエステル及びジエステルを、反応後にバッチ様式で分離することができ、又は鏡像体選択的加水分解の間に、半連続的又は連続的に分離することができる。
【0135】
図1に示したように、未反応ジエステル(式5)を有機相から単離することができ、そしてラセミ化させてラセミ体基質(式4)が生成される。生じたラセミ化合物(式4)は、リサイクルする又は未変換ラセミ体基質と混合することができ、それは続いて上記のような、式3への酵素的変換を受ける。未反応ジエステル(式5)のリサイクリングは、鏡像体選択的加水分解の全収率を50%より大きく増加させ、それにより本方法のアトムエコノミーを増加させ、望まれない鏡像体の廃棄に付随するコストを低下させる。
【0136】
ジエステル(式5)を、マロネート部分の酸性α−プロトンを引き抜くのに十分強い塩基で処理すると、不斉中心の反転、及びラセミ体基質(式4)の発生を生じる。有用な塩基には、アルコキシド(例えば、ナトリウムエトキシド)のような有機塩基、直鎖脂肪族アミン、及び環状アミン、及びKOH、NaOH、NH4OHなどのような無機塩基が含まれる。反応は、EtOHのような極性プロトン性溶媒又はMTBEのような非プロトン性極性溶媒を含む、適合性溶媒中で実施する。RTより上の反応温度が、典型的にはラセミ化プロセスの収率を改良する。
【0137】
図1に示したように、実質的に鏡像体純粋ジカルボン酸モノエステル(式3)を、少なくとも三つの異なった方法を使用して、光学活性γ−アミノ酸(式1)へ変換することができる。一つの方法において、モノエステル(式3)を、酸触媒又は塩基触媒の存在下で加水分解して、光学活性シアノ−置換ジカルボン酸(式6)又は対応する塩を生成させる。生じたジカルボン酸(又はその塩)のシアノ部分を還元して、光学活性γ−アミノジカルボン酸(式7)又は対応する塩を生成させ、それを次ぎに酸による処理により、加熱により、又は両方により脱炭酸して、所望の光学活性γ−アミノ酸(式1)を生成させる。シアノ部分は、触媒量のラネーニッケル、パラジウム、白金などの存在下でH2と反応させることにより、又はLiAlH4、BH4−Me2Sなどのような還元剤との反応により還元することができる。加水分解及び脱炭酸反応に有用な酸には、HClO4、HI、H2SO4、HBr、HClなどのような鉱酸が含まれる。加水分解反応に有用な塩基には、LiOH、NaOH、KOHなどを含む、多様なアルカリ及びアルカリ土類金属水酸化物及び酸化物が含まれる。
【0138】
別の方法において、ジカルボン酸モノエステル(式3)は還元的環化をうけて、光学活性環状3−カルボキシ−ピロリジン−2−オン(式2)を形成し、それを引き続いて酸で処理すると、所望の鏡像体で富化されたγ−アミノ酸(式1)を生成する。還元的環化は、モノエステル(式3)を、触媒量のラネーニッケル、パラジウム、白金などの存在下でH2と反応させることにより実施することができる。HClO4、HI、H2SO4、HBr及びHClのような鉱酸、及びHOAc、TFA、p−TSAなどのような有機酸を含む、一つまたはそれより多くの酸を、生じたラクタム酸(式2)を加水分解及び脱炭酸するために使用できる。酸の濃度は、約1N〜約12Nの範囲であることができ、そして酸の量は、約1当量〜約7当量の範囲であることができる。加水分解及び脱炭酸反応は、RT近辺又はより高い温度で、又は約60℃又はより高い温度で、又は約60℃〜約130℃の範囲の温度で実施することができる。
【0139】
第三の方法においては、上記のように、ジカルボン酸モノエステル(式3)のエステル部分を最初に加水分解してシアノ−置換ジカルボン酸(式6又はその塩)を得る。生じたジカルボン酸(又はその塩)は次ぎに、脱炭酸して光学活性シアノ−置換カルボン酸又はその塩(式8においてR5は水素原子であるが、後で示すようにR5は、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルであってもよい)を得る。ラクタム酸(式2)又はγ−アミノジカルボン酸(式7)を脱炭酸するために使用されたものと同一条件を使用することができる。最初にエステル部分を加水分解する代わりに、ジカルボン酸モノエステル(式3)を、ジカルボン酸モノエステル(塩として)の水性溶液を、約50℃から還流温度へ加熱することにより、シアノ−置換モノエステル(式8)へ直接最初に脱炭酸することができる。クラプチョ(Krapcho )条件(DMSO/NaCl/水)もまた使用することができる。いずれの場合も、式8の化合物のシアノ部分を次ぎに還元して光学活性γ−アミノ酸(式1)を得る。ラネーニッケルに加え、式3、6及び8の化合物のシアノ部分を還元するため、多数の他の触媒を使用することができる。これらには、限定ではなく、Al2O3、C、CaCO3、SrCO3、BaSO4、MgO、SiO2、TiO2、ZrO2などを含む、多様な材料上に典型的には支持されている、酸化物を含むNi、Pd、Pt、Rh、Re、Ru及びIrのような遷移金属
及びそれらの組み合わせを、重量で約0.1%〜約20%、そしてより典型的には、約1%〜約5%含有する、不均一な触媒が含まれる。Pdを含んで、これらの金属の多くは、アミン、スルフィド、又はPb、Cu又はZnのような第二の金属にドープすることができる。それ故、有用な触媒には、重量に基づいて、約1%〜約5%のPdを含有する、Pd/C、Pd/SrCO3、Pd/Al2O3、Pd/MgO、Pd/CaCO3、Pd/BaSO4、PdO、Pd黒、PdCl2のようなパラジウム触媒が含まれる。他の有用な触媒には、Rh/C、Ru/C、Re/C、PtO2、Rh/C、RuO2などが含まれる。
【0140】
シアノ部分の触媒還元は、典型的には、限定ではなく、MeOH、EtOH、IPA、THF、EtOAc及びHOAcのような、水、アルコール、エーテル、エステル及び酸を含む、一つまたはそれより多くの極性溶媒の存在下で実施する。反応は、約5℃〜約100℃の範囲の温度で実施することができるが、RTでの反応が普通である。一般に、基質−触媒比は、重量に基づいて、約1:1〜約1000:1の範囲であることができ、そしてH2圧は、ほぼ大気圧、0psig〜約1500psigの範囲であることができる。より典型的には、基質−触媒比は、約4:1〜約20:1の範囲であり、そしてH2圧は、約25psig〜約150psigの範囲である。
【0141】
すべての前記の方法を、実質的に鏡像体純粋なモノエステル(式3)を光学活性γ−アミノ酸(式1)へ変換するために使用することができるが、それぞれは、他に対して特定の利点を有している。例えば、還元的環化を用いているプロセスの酸後処理に続いて、ラクタム酸(式2)を、有機溶媒中に抽出することにより単離する及び精製することができるが、一方、シアノ−置換ジカルボン酸(式6)は、その比較的により高い水性溶解度のため、単離するのがより困難である。ラクタム酸(式2)の単離は、最終生成物混合物内への水溶性不純物の持ち越しを減少させ、加水分解及び脱炭酸の間のより高い反応体濃度を可能にし(例えば、約1M〜約2M)、それによりプロセス処理量を増加させる。その上、ジカルボン酸モノエステル(式3)の水性溶液の加熱による直接脱炭酸は、シアノモノエステル(式8)を高い鏡像体純度で与える。この化合物は、有機溶媒中への抽出により又は直接相分離により、反応媒質から分離することが可能であり、水相による無機不純物の効果的な除去を確実にしている。高反応処理量及び強酸性条件の回避は、このアプローチの二つの利点である。
【0142】
図2は、図1に示された酵素的鏡像体選択的加水分解の基質として働くことができる、シアノ−置換ジエステル(式4)を製造するためのプロセスを例示している。プロセスは、触媒量の塩基存在下、非対称ケトン又はアルデヒド(式17)とマロン酸ジエステル(式18)を反応させて、α,β−不飽和マロン酸ジエステル(式19)(式中、R1、R2、R3及びR4は、式1に関連して上で定義した通りである)を生成させることを含んでなる、交差アルドール縮合を含む。この型の交差アルドール反応は、クネーベナーゲル縮合として知られており、それは多数の文献総説に記載されている。例えば、その全開示が、すべての目的について、参照により本明細書に取り込まれる、B. K. Wilk, Tetrahedron 53:7097-7100 (1997) 及びそこで引用されている参照文献を参照されたい。
【0143】
一般に、ジ−n−プロピルアミン、ジ−i−プロピルアミノ、ピロリジンその他、及びその塩のような第二アミンを含む、マロン酸ジエステル(式18)からエノラートイオンを発生させることが可能ないずれの塩基も使用することができる。反応は、生成物を中和するため、及び非対称ケトン又はアルデヒド(式17)のエノール化を最少にするため、HOAcのようなカルボン酸を含むことができる。非対称ケトンを含んでいる反応はまた、反応を容易にするため、四塩化チタン、塩化亜鉛、酢酸亜鉛などのようなルイス酸を用いることができる。反応は典型的には、還流条件下、炭化水素溶媒中で実行する。有用な溶媒には、水の共沸的除去を伴う、ヘキサン、ヘプタン、シクロヘキサン、トルエン、メ
チルt−ブチルエーテルなどが含まれる。
【0144】
続いての反応において、HCN、アセトンシアノヒドリン、アルカリ金属シアン化物(NaCN、KCN、その他)、又はアルカリ土類金属シアン化物(マグネシウムシアニド、その他)のようなシアン化物源は、α,β−不飽和マロン酸ジエステル(式19)のβ−炭素への共役付加をうける。反応は典型的には、一つまたはそれより多くの、EtOH、MeOH、n−プロパノール、イソプロパノールを含む極性プロトン性溶媒、又はDMSOなどのような極性非プロトン性溶媒中で実施する。続いての酸後処理で、シアノ−置換ジエステル(式4)を得る。プレガバリン前駆体(式12)を製造するために、図2に示した方法の応用については、その全体が、及びすべての目的について、参照により本明細書に取り込まれる、Grote et al による米国特許第5,637,767 号を参照されたい。
【0145】
本明細書に開示されたいずれの化合物の望まれる(S)−又は(R)−鏡像体も、古典的分割、キラルクロマトグラフィー又は再結晶によりさらに富化することができる。例えば、光学活性γ−アミノ酸(式1又は式9)を、鏡像体で純粋な化合物(例えば、酸又は塩基)と反応させることができて、それぞれが単一の鏡像体から構成される、対のジアステレオ異性体を生成し、それを、例えば、分別再結晶又はクロマトグラフィーにより分離する。続いて所望の鏡像体を適切なジアステレオ異性体から再生させる。追加として、所望の鏡像体はしばしば、十分な量(例えば、典型的には約85%eeよりそれほど少なくない、いくつかの場合には、約90%eeよりそれほど少なくない)で入手可能な場合、適した溶媒での再結晶により、さらに富化することができる。
【0146】
本明細書を通して記述されているように、開示された化合物の多くは、立体異性体を有する。これらの化合物のいくつかは、単一の鏡像体(鏡像体純粋化合物)又は鏡像体の混合物(富化された又はラセミ体試料)として存在することができ、それは、試料中の別の鏡像体に対する一つの鏡像体の相対的過剰に依存して、光学活性を示すことができる。重ねることができない鏡像であるこうした立体異性体は、不斉軸又は一つまたはそれより多くの不斉中心(即ち、キラリティー)を所有する。他の開示された化合物は、鏡像ではない立体異性体であることができる。ジアステレオ異性体として知られているこうした立体異性体は、キラル又はアキラルであることができる(不斉中心を含有していない)。これらには、シス/トランス(又はZ/E)立体異性体が可能である、アルケニル又は環状基を含有する分子、又は一つの不斉中心の反転が対応するジアステレオ異性体を発生する、二つ又はそれより多い不斉中心を含有する分子、が含まれる。記述され又はさもなくば明白でないかぎり(例えば、立体結合の使用、立体中心記述その他により)、本発明の範囲は、基準化合物、及びそれらがそれぞれ純粋であるにせよ(例えば、鏡像体純粋)又は混合物(鏡像体的に富化された又はラセミ体の)であるにせよ、その立体異性体を一般に含む。
【0147】
いくつかの化合物は、また、ケト又はオキシム基も含有し、そのため互変異性を生じることができる。このような場合、本発明は、それらがそれぞれ純粋であるにせよ又は混合物であるにせよ、互変異性形態を一般に含む。
【0148】
式1及び式9で表された化合物を含む本開示に記載されている多くの化合物は、薬学的に許容できる塩を形成できる。これらの塩には、限定ではなく、塩酸、硝酸、リン酸、硫酸、臭化水素酸、ヨウ化水素酸、フッ化水素酸、亜リン酸などのような無機酸から誘導された無毒性塩、ならびに、脂肪族モノ−及びジカルボン酸、フェニル置換アルカン酸、ヒドロキシアルカン酸、アルカン二酸、芳香族酸、脂肪族及び芳香族スルホン酸その他のような有機酸から誘導された無毒性塩が含まれる。それ故、こうした塩には、硫酸塩、ピロ硫酸塩、重硫酸塩、亜硫酸塩、亜硫酸水素塩、硝酸塩、リン酸塩、リン酸一水素塩、リン酸二水素塩、メタ燐酸塩、ピロ燐酸塩、塩化物、臭化物、ヨウ化物、酢酸塩、トリフルオ
ロ酢酸塩、プロピオン酸塩、カプリル酸塩、イソ酪酸塩、シュウ酸塩、マロン酸塩、コハク酸塩、スベリン酸塩、セバシン酸塩、フマル酸塩、マレイン酸塩、マンデル酸塩、安息香酸塩、クロロ安息香酸塩、メチル安息香酸塩、ジニトロ安息香酸塩、フタル酸塩、ベンゼンスルホン酸塩、トルエンスルホン酸塩、フェニル酢酸塩、クエン酸塩、乳酸塩、リンゴ酸塩、酒石酸塩、メタンスルホン酸塩などが含まれる。
【0149】
薬学的に許容できる塩基塩には、アルカリ又はアルカリ土類金属カチオンのような金属カチオン、ならびにアミンを含む塩基から誘導された無毒性塩が含まれる。適した金属カチオンの例には、限定ではなく、ナトリウムカチオン(Na+)、カリウムカチオン(K+)、マグネシウムカチオン(Mg2+)、カルシウムカチオン(Ca2+)などが含まれる。適したアミンの例には、限定ではなく、N,N’−ジベンジルエチレンジアミン、クロロプロカイン、コリン、ジエタノールアミン、ジシクロヘキシルアミン、エチレンジアミン、N−メチルグルカミン、プロカイン及びt−ブチルアミンが含まれる。有用な酸付加及び塩基塩の議論については、S. M. Berge et al., "Pharmaceutical Salts," 66 J. of Pharm. Sci., 1-19 (1977); see also Stahl and Wermuth, Handbook of Pharmaceutical Salts: Properties, Selection, and Use (2002) を参照されたい。
【0150】
化合物の遊離塩基(又は遊離酸)又は双性イオンと十分な量の所望の酸(又は塩基)を接触させて、無毒性塩を生成させることにより、薬学的に許容できる酸付加塩(又は塩基塩)を製造することができる。もし塩が溶液から沈殿するならば、それを濾過により単離することができ;もしくは、溶媒を蒸発させることにより、塩を回収することができる。また、酸付加塩と塩基(又は塩基塩と酸)を接触させることにより、遊離塩基(又は遊離酸)を再生することもできる。遊離塩基(又は遊離酸)及びそのそれぞれの酸付加塩(又は塩基塩)の特定の物理的性質は異なっていてもよいが(例えば、溶解度、結晶構造、吸湿性その他)、化合物の遊離塩基及び酸付加塩(又はその遊離酸及び塩基塩)は、他の点では本開示の目的について同一である。
【0151】
開示され特許請求された化合物は、未溶媒和及び溶媒和形の両方、そして塩以外の他の型の複合体として、存在することができる。有用な複合体には、クラスレート、又は化合物及びホストが化学量論的又は非化学量論的量で存在する場合の化合物−ホスト複合体が含まれる。有用な複合体はまた、化学量論的又は非化学量論的量で、二つ又はそれより多くの有機、無機又は有機及び無機構成要素を含むことができる。生じた複合体は、イオン化、部分イオン化、又は非イオン化することができる。こうした複合体の総説については、J. K. Haleblian, J. Pharm. Sci. 64(8):1269-88 (1975) を参照されたい。薬学的に
許容できる溶媒和物はまた、結晶化溶媒を同位元素で置換することができる(例えば、D2O、d6−アセトン、d6−DMSOその他)、水和物及び溶媒和物を含む。一般に、本開示の目的についても、化合物の未溶媒和形態に関する言及はまた、化合物の対応する溶媒和又は水和形態も含む。
【0152】
開示された化合物はまた、少なくとも一つの原子が、同一の原子番号を有しているが、原子質量が天然に通常観察される原子質量とは異なっている、全ての薬学的に許容できる同位元素変異体も含む。開示された化合物での包含に適した同位元素の例には、限定ではなく、2H及び3Hのような水素の同位元素;13C及び14Cのような炭素の同位元素;15Nのような窒素の同位元素;17O及び18Oのような酸素の同位元素;31P及び32Pのようなリンの同位元素;35Sのような硫黄の同位元素;18Fのようなフッ素の同位元素;36Clのような塩素の同位元素が含まれる。同位元素変異体(例えば、重水素、2H)の使用は、より大きな代謝的安定性から生じる特定の療法的利点、例えば、増加したインビボ半減期又は減少した用量要求性、を与えることができる。追加として、開示された化合物の特定の同位元素変異体は放射性同位元素(例えば、トリチウム、3H、又は14C)を取り込むことができ、それは薬剤及び/又は基質分布研究で有用であ
ることができる。
【実施例】
【0153】
以下の実施例は、例示及び非制限的であることが意図されており、本発明の具体的態様を表している。
【0154】
一般的な方法及び材料
その全開示が参照により本明細書に取り込まれる、D. Yazbeck et al Synth. Catal. 345:524−32 (2003) に記載されている酵素スクリーニングを、96−ウェルプレートを使用して実施した。スクリーニングプレートで使用されたすべての酵素(表2を参照されたい)は、Amano(Nagoya, Japan), Roche(Basel, Switzerland), Novo Nordisk (Bagsvaerd, Denmark), Altus Biologics Inc. (Cambridge, MA), Biocatalytics (Pasadena, CA), Toyobo (Osaka, Japan), Sigma−Aldrich (St. Louis, MO)及びFluka (Buchs, Switzerland) を含む、商業的酵素供給元から得た。スクリーニング反応は、Eppendorf Thermomixer−R (VWR) 中で実行した。続いての大規模酵素分割は、Novo−Nordisk A/S (CAS no. 9001-62-1) から入手可能な、LIPOLASE(登録商標) 100L及びLIPOLASE(登録商標)100T を用
いた。
【0155】
核磁気共鳴
300MHz1H NMR及び75MHz13C NMRスペクトルは、5mmオートスィッチャブルPHQNPプローブを備えた、BRUKER 300 UltraShieldTM で得た。スペ
クトルは、一般にほぼRTで収集し、標準オートロック、オートシム及びオートゲインの日常の操作手順を用いた。1D実験については、試料を通常20Hzで回転させた。1H
NMRスペクトルは、30度励起アングルパルス、1.0秒リサイクル遅延、及び0.25Hz/ポイントの分解能で16スキャン、を使用して収集した。収集幅は、典型的には、+18〜−2ppm(基準TMSを0ppm)の8000Hzであり、プロセシングは0.3Hzラインブロードニングであった。典型的な収集時間は5〜10秒であった。通常の13C NMRスペクトルは、30度励起アングルパルス、2.0秒リサイクル遅延、及び1Hz/ポイントの分解能で2048スキャン、を使用して収集した。収集幅は、典型的には、+235〜−15ppm(基準TMSを0ppm)の25kHzであった。プロトンデカップリングを連続的に適用し、プロセシングの間、1Hzラインブロードニングを適用した。典型的な収集時間は102分であった。
【0156】
質量分析法
質量分析は、HP Chemstation Plus ソフトウェアーを使用し、HEWLETT PACKARD 1100MSDで実施した。LCは、Agilent 1100 クォータナリーLCシステム及びオートサンプラーとしてAgilent リキッドハンドラーを備えていた。データは、溶媒としてACN/水(0.1%ギ酸含有)(10%ACNから90%へ、7分)を用いる、エレクトロンスプレーイオン化で収集した。温度:プローブは350℃であり、イオン源は150℃であった。コロナ放電は陽イオンについて3000Vそして陰イオンについて3000Vであった。
【0157】
高速液体クロマトグラフィー
高速液体クロマトグラフィー(HPLC)は、Agilent 220 HPLC オートサンプラー、
クォータナリーポンプ及びUV検出器を備えた、シリーズ1100 AGILENT TECHNOLOGIES 装置で実施した。LCは、HP Chemstation Plus ソフトウェアーを使用してPC制御されていた。順相キラルHPLC分離は、Chiral Technologies (Exton, PA) 及びPhenomenex (Torrance, CA) により得たChiral HPLC カラムを使用して実施した。
【0158】
ガスクロマトグラフィー
ガスクロマトグラフィー(GC)は、電位計を有するFID検出器、7683 Series スプ
リット/スプリットレスキャピラリーインジェクター、4外部事象をモニターするリレーボード、及びインボードプリンター/プロッターを備えた、110ボルトAgilent 6890N ネットワークGCシステムで実施した。ジエステル(式13,R3=R4=Et)及びモノエステル(式11,R3=Et)の鏡像体過剰率は、ヘリウムキャリアガスを用い、135℃で、CHIRALDEX G−TA カラム (30m x 0.25mm) を使用して実施した。こうした条件下、モノエステルは分解して(S)−3−シアノ−5−メチル−ヘキサン酸エチルエステルを与え、そしてeeを、分解生成物に基づいて決定した。分析に使用されたキラルGCカラムは、Astec, Inc (Whippany, NJ) から得た。
【0159】
実施例1.(R/S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式20)の酵素的加水分解を経て(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸(式21)を生成する酵素スクリーニング
【0160】
【化18】

【0161】
酵素スクリーニングは、前もってD. Yazbeck et al Synth. Catal. 345:524−32(2003)
に記載されている方法に従って調製され、96−ウェルプレート中に加えられた個々の
酵素を含んでなる、スクリーニングキットを使用して実施した。各ウェルは0.3mlの空容量を有していた(浅いウェルプレート)。96−ウェルプレートの一つのウェルはリン酸緩衝液(10μL、0.1M、pH7.2)のみを含んでおり、別のウェルはACN(10μL)のみを含んでおり、そして残りのウェルの各々は、表2に列挙した94の酵素の一つを含んでいる(10μL、100mg/mL)。使用に先だって、スクリーニングキットを−80℃での貯蔵庫から取りだし、酵素をRTで5分融解させた。リン酸カリウム緩衝液(85μL、0.1M、pH7.2)を、多チャンネルピペットを使用してウェル内へ分配した。次ぎに濃縮基質(式20、5μL)を、多チャンネルピペットにより各ウェルへ加え、96の反応混合物を、30℃及び750rpmでインキュベートした。反応混合物の各々を第二の96−ウェルプレートの別のウェル内へ移すことにより、24時間後に反応をクエンチし、そして試料採取した。ウェルのそれぞれは、2mLの空容量を有しており(深いウェルプレート)、そしてEtOAc(1mL)及びHCl(1N、100μL)を含有していた。各ウェルの成分を、ピペットでウェル内容物を吸引することにより混合した。第二のプレートを遠心分離し、100μLの有機上清を各ウェルから第三の96−ウェルプレート(浅いプレート)へ移した。次ぎに、第三のプレートのウェルを、貫通可能マットカバーを使用して封じた。ウェルを封じたら、第三のプレートを、光学純度(ee)決定のために、GCシステムへ移した。
【0162】
表3は、スクリーニングされたいくつかの酵素の、酵素名、商標、供給元及びE値を列挙している。与えられた酵素について、E値は、対の鏡像体(基質)の相対反応性として解釈することができる。表3に列挙したE値は、University of Graz から入手された、
Ee2と称されるコンピュータープログラムを使用して、HPLCデータ(転化率、χ及びee)から計算した。一般に、S−選択性及び約35又はそれより大きなE値を示している酵素が、スケールアップに適している。
【0163】
【表7】

【0164】
実施例2.(R/S)−3−シアノ−2−エトキシカルボニル5−メチル−ヘキサン酸エチルエステル(式20)の、(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸カリウム塩(式23)及び(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式22)を生成する酵素的分割
【0165】
【化19】

【0166】
オーバーヘッド攪拌機を備えた反応器(392L)に、リン酸カリウム緩衝液(292.2L、10mM、pH8.0)及びLIPOLASE(登録商標)100L、タイプEX(3.9L)を加えた。混合物を800RPMで1分攪拌し、KOH(2M)を加えてpHを8.0に調整した。(R/S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式20、100kg)を加え、生じた混合物は、加水分解の間、8.0のpHを維持するためにNaOH水溶液(50%)で滴定した。反応の程度は、HPLC(C18カラム、4.6mmx150mm、200nmで検出)でモニターした。約40〜45%の変換に達した後(例えば、約24時間後)、反応混合物を分液ロートへ移した。水性混合物をヘプタン(205L)で抽出した。形成した淡い乳濁液を透明にするためEtOH(無水)を加え(約5%v/vまで)、水性及び有機層を分離した。抽出工程を2回繰り返し、(3S)−3−シアノ−2−エトキシカルボニル−5−メ
チル−ヘキサン酸カリウム塩(式23)を含有する水性層はさらに真空下で濃縮することができる(例えば、その本来の容量の25〜50%)。(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式22)を含有する有機層を合わせ、乾燥させ、濃縮した。得られたジエチルエステルは、引き続いて実施例6に従ってラセミ化した。MS m/z [M+H]+227. 1H NMR (300 MHz, D2O): δ 2.35(dd, 6H), 2.70 (t, 3H), 2.85 (m, 1H), 2.99 (m, 1H), 3.25 (m, 1H), 4.75 (m, 1H), 5.60 (q, 2H). 13C
NMR (75 ppm, D2O) δ 172.19, 171.48, 122.85, 62.70, 59.49, 40.59, 31.83, 27.91,
23.94, 21.74, 14.77 。
【0167】
実施例3.(R/S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式20)の、(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸カリウム塩(式23)及び(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式22)を生成する酵素的分割
オーバーヘッド攪拌機を備えた反応器(3.92L)に、酢酸カルシウム緩衝液(1.47L、100mM、pH7.0)及び(R/S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式20、1kg)を加えた。混合物を1100RPMで5分攪拌し、KOH(5M)を加えてpHを7.0に調整した。LIPOLASE(登録商標)100L、タイプEX(75mL)を加え、生じた混合物は、加水分解の間、7.0のpHを維持するためにKOH(5M)で滴定した。反応の程度は、HPLC(C18カラム、4.6mmx150mm、200nmで検出)でモニターした。約42〜45%の変換に達した後(例えば、約20〜25時間後)、反応混合物を分液ロートへ移した。水性混合物をヘキサン(100%v/v)で抽出した。形成した淡い乳濁液を透明にするためEtOH(無水)を加え(約5%v/vまで)、水性及び有機層を分離した。(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸カリウム塩(式23)を含有する水性層を得るため、抽出工程を2回繰り返し、それはさらに精製することなく続いての転換で使用した。(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式22)を含有する有機層を合わせ、乾燥させ、濃縮した。得られたジエチルエステルは、引き続いて実施例6に従ってラセミ化した。
【0168】
実施例4.(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸カリウム塩(式23)からの(S)−4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸(式10)の製造
【0169】
【化20】

【0170】
(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸カリウム塩(式23、411L、実施例2から)を含有する水性溶液を、容器に加えた。混合物にラネーニッケル(50%水溶液、Sigma-Aldrich )を加え、反応を通して容器頭隙を50psigの圧力に維持するため、20時間にわたって、容器内へ水素ガスを導入した。水素添加反応は、H2取り込み及び容器内容物のHPLC分析(C18カラム、4.6mmx150mm、200nmで検出)によりモニターした。反応後、ラネーNi触媒を除去す
るために水性混合物を濾過した。濃縮溶液のpHを、37%HCl(約14L)を使用して3.0に調整した。生じた溶液を、EtOAc(50%v/v)で3回抽出した。合わせた有機層を真空下で濃縮すると、(S)−4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸(式10)を得た。MS m/z [M+H]+186.1130. 13C NMR (75 ppm, CDCl3)
δ175.67, 172.23, 54.09, 47.62, 43.69, 37.22, 26.31, 23.34, 22.54 。収率40〜42%;97%ee。
【0171】
実施例5.(S)−4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸(式10)からのプレガバリン(式9)の製造
【0172】
【化21】

【0173】
反応容器(60L)に、(S)−4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸(式10)、HCl(36〜38%、30L)及び水(29L)を加えた。HOAc(1L)を溶液に加え、生じたスラリーを、80℃に36〜38時間、そしてさらに110℃に6時間加熱した。反応の程度は、HPLC(C18カラム、4.6mmx150mm、200nmで検出)でモニターした。水及び過剰のHClを蒸発させると油状物を得、MTBE(2x15L)で洗浄した。油状物に水を加え、溶液が透明になるまで混合物を攪拌した。KOH(約6kg)を使用して、溶液のpHを5.2〜5.5に調整すると、プレガバリンの沈殿を生じた。混合物を80℃まで加熱し、続いて4℃まで冷却した。10時間後、結晶性プレガバリンを濾過し、IPA(12L)で洗浄した。濾液を真空下で濃縮すると、油状物残渣を得た。油状物残渣に水(7.5L)及びEtOH(5.0L)を加え、生じた混合物を80℃まで加熱し、続いて4℃まで冷却した。10時間後、第二のプレガバリン結晶を濾過し、IPA(1L)で洗浄した。合わせたプレガバリン結晶を真空オーブン中、45℃で24時間乾燥した。MS m/z [M+H]+160.1340. 1H NMR (300 MHz, D2O): δ 2.97(dd, J = 5.4, 12.9 Hz, 1H), 2.89 (dd, J = 6.6, 12.9 Hz, 1H),
2.05-2.34 (m, 2H), 1.50-1.70 (sept, J = 6.9 Hz, 1H), 1.17 (t, J = 7.0 Hz, 2H), 0.85 (dd, J = 2.2, 6.6 Hz, 6H). 13C NMR (75 ppm, D2O) δ181.54, 44.32, 41.28, 32.20, 24.94, 22.55, 22.09 。収率80〜85%;ee>99.5%。
【0174】
実施例6.(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式22)のラセミ化を経た(R/S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式20)の製造
【0175】
【化22】

【0176】
反応器に、(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式22、49.5kg)及びEtOH(250L)を加えた。ナトリウムエトキシド(21%w/w EtOH溶液、79.0L、1.1当量)を混合物に加え、80℃に20時間加熱した。反応完了後、混合物をRTまで冷却し、HOAc(12.2L)を加えることにより中和した。EtOHの蒸発後、MTBE(150L)を混合物に加え、得られた溶液を濾過し、蒸発させると、(R/S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式20)を定量的収率で得た。
【0177】
実施例7.(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸(式21)からの(S)−3−シアノ−5−メチル−ヘキサン酸エチルエステル(式24)の製造
【0178】
【化23】

【0179】
50mL丸底フラスコに、(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸(式21、3.138g、13.79mmol)、NaCl(927mg、1.15当量)、脱イオン水(477μL、1.92当量)及びDMSO(9.5mL)を加えた。生じる混合物を88℃に加熱し、その温度に17時間維持した。LC及びLC/MS分析のために試料をとると、それは出発物質(式21)及び生成物(式24及び式25)の存在を示した。混合物の温度をその後135℃に上げ、さらに3.5時間反応させた。LC及びLC/MS分析のために2回目の試料をとると、それは出発物質(式21)の存在は示さず、そして所望の生成物(式24及び式25)に加えて、未同定の副産物の存在を示した。(S)−3−シアノ−5−メチル−ヘキサン酸エチルエステル(式24):88℃の後、97.4%ee、135℃の後、97.5%ee。
【0180】
実施例8.(S)−4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸(式10)の光学純度(ee)の測定
(S)−4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸(式10)の光学純度(ee)は、誘導体化法により決定した。(S)−4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸を、70℃のジオキサン中、触媒量の乾燥HClの存在下、EtOHでエステル化した。生じたラクタムエステルを、ヘキサン及びEtOH(95:5
)の移動相、1.0mL/分の流速、10μLの注入量、35℃のカラム温度、及び200nmでの検出を使用するHPLC(CHIRALPAK AD-H 、4.6mmx250mm)によ
り分析した。
【0181】
実施例9.プレガバリン(式9)の光学純度(ee)の測定
プレガバリンの光学純度は、誘導体化法により決定した。プレガバリン試料を、Marfey試薬(1−フルオロ−2−4−ジニトロフェニル−5−L−アラニンアミド)で誘導体化し、NaPO4水溶液(20nM、pH2.0)及びACN(90:10で10分、10:90で3分、90:10で5分)の移動相、1.2mL/分の流速、10μLの注入量、35℃のカラム温度、及び200nmでの検出を使用するHPLC(LUNA C18(2)カラム、0.46mmx150mm、3μm)により分析した。
【0182】
実施例10.(R/S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式20)の、(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸ナトリウム塩(式23)及び(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式22)を生成する酵素的分割
【0183】
【化24】

【0184】
オーバーヘッド攪拌機を備えた反応器(16000L)に、酢酸カルシウム(254kg)、脱イオン水(1892.7kg)及びLIPOZYME(登録商標)TL100L(食品用LIPOLASE(登録商標)、983.7kg)を加えた。完全に混合後、(R/S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式20,9000kg、85%純度アッセイ)を加え、混合物を24時間攪拌した。pHを7.0に維持するため、反応の経過中、NaOH(2068kgの30%溶液)を加えた。反応の程度は、HPLC(C18カラム、4.6mmx150mm、200nmで検出)でモニターした。約42〜45%の変換に達した後(例えば、約20〜25時間後)、滴定及び攪拌を停止した。有機層を直ちに分離し、水層をトルエン(780kg)で2回洗浄した。(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸ナトリウム塩(式23)を含有する水層は、単離することなく続いての転換(実施例11)で使用した。(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式22)を含有する有機層を合わせて、濃縮した。生じたジエチルエステルは、実施例6に従って、続いてラセミ化した。
【0185】
実施例11.(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸ナトリウム塩(式23)からの(S)−3−シアノ−5−メチル−ヘキサン酸エチルエステル(式24)の製造
【0186】
【化25】

【0187】
オーバーヘッド攪拌機を備えた反応器(16000L)に、実施例10からの最終水性溶液(9698.6L、(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸ナトリウム塩、式23を含有する)、NaCl(630kg)及びトルエン(900L)を加えた。還流条件下(75〜85℃)、混合物を2時間攪拌した。攪拌を停止し;有機層を直ちに分離し、水層をトルエン(900L)で2回洗浄した。(S)−3−シアノ−5−メチル−ヘキサン酸エチルエステル(式24)を含有する有機層を合わせ、濃縮した。エチルエステル(式24)は続いて、実施例12に従って加水分解した。
【0188】
実施例12.(S)−3−シアノ−5−メチル−ヘキサン酸エチルエステル(式24)からの(S)−3−シアノ−5−メチル−ヘキサン酸カリウム塩(式26)の製造
【0189】
【化26】

【0190】
オーバーヘッド攪拌機を備えた反応器(12000L)に、(S)−3−シアノ−5−メチル−ヘキサン酸エチルエステル(式24、2196L、実施例11から)を加えた。KOH(1795.2kg、45%溶液、w/w)及びH2O(693.9kg)を、激しく攪拌しながら反応混合物に加えた。温度を25℃に維持した。4時間後、さらに後処理せずに、反応混合物を水素添加容器(実施例13)に加えた。
【0191】
実施例13.(S)−3−シアノ−5−メチル−ヘキサン酸カリウム塩(式26)からのプレガバリン(式9)の製造
【0192】
【化27】

【0193】
水素添加装置(12000L)に、水(942.1L)及び(S)−3−シアノ−5−メチル−ヘキサン酸カリウム塩を含有する、実施例12からの反応混合物(式26、41
22.9L)を加えた。ラネーニッケル懸濁液(219.6kg、50%w/w H2O溶液)を加えた。水素添加は、50psig圧、35℃で実施した。6時間後、ラネーニッケルを濾過し、そして生じた濾液を、結晶化のために反応器(16000L)に移した。H2O(1098L)添加後、溶液のpHを、HOAc(864.7kg)を使用して7.0〜7.5に調整した。生じた沈殿を濾過し、H2O(549L)で1回及びIPAで2回(各2,586L)洗浄した。固形物を、IPA(12296L)及びH2O(6148L)から再結晶した。混合物を70℃に加熱し、そして4℃まで冷却した。5〜10時間後、結晶性固形物を濾過し、IPA(5724L)で洗浄し、真空オーブン中、45℃で24時間乾燥させると、プレガバリンを結晶性固形物として得た(1431kg、30.0%総収率、99.5%の純度及び99.75%ee)。
【0194】
本明細書及び付随する特許請求の範囲で使用される、「a」、「an」及び「the」のような単数形の冠詞は、文脈が明瞭に示さなければ、一つの目的語又は複数の目的語を指すことに注意すべきである。それ故、例えば、「a compound」を含んでいる文章の指示は、単一の化合物、又は二つ又はそれより多くの化合物を含むことができる。上記の記述は、例示でありそして限定するものではないことが意図されていることを理解すべきである。上記の記述を読むと、多くの態様が当業者には明らかになるであろう。それ故、本発明の範囲は、上記の記述に関して決定されているのではなく、代わりとして、付随する特許請求の範囲に関して決定されるべきであり、こうした特許請求の範囲が資格を与えた均等物の最大限の範囲を含む。特許、特許出願及び出版物を含む、全ての論文及び参照文献の開示は、その全体が、及び全ての目的について、参照により本明細書に組み入れられる。
【図面の簡単な説明】
【0195】
【図1】図1は、鏡像体的に富化されたγ−アミノ酸(式1)を製造するためのスキームを描いている。
【図2】図2は、シアノ置換ジエステル(式4)を製造するためのスキームを描いている。
【技術分野】
【0001】
本発明は、酵素的速度論的分割を経て鏡像体的に富化されたγ−アミノ酸を製造するための方法及び材料に関し、プレガバリン及び関連化合物を含むヒトα2δカルシウムチャネルサブユニットに結合親和性を示すγ−アミノ酸を製造するために特に有用である。
【背景技術】
【0002】
プレガバリン、つまり(S)−(+)−3−アミノメチル−5−メチル−ヘキサン酸は、脳神経細胞の活性の調節に関与する内在性抑制性神経伝達物質γ−アミノ酪酸(GABA)に関係している。プレガバリンは、R. B. Silverman et al. による米国特許第5,563,175 号に記載されているように、抗てんかん活性を示し、他の状態の中でも、疼痛、精
神運動興奮に付随する生理学的状態、炎症、消化管傷害、アルコール中毒、不眠症、及び躁病及び双極性障害を含む多様な精神障害を治療するために有用であると考えられている。それぞれ、L. Bueno et al. による米国特許第6,242,488 号、L. Magnus & C. A. egal
による米国特許第6,326,374 号、及びL. Singh による米国特許第6,001,876 号;H. C. Akunne et al. による米国特許第6,194,459 号;D. Schrier et al. による米国特許第6,329,429 号;L. Bueno et al. による米国特許第6,127,418 号;L. Bueno et al. による米国特許第6,426,368 号;L. Magnus & C. A. Segal による米国特許第6,306,910 号;及びA. C. Pande による米国特許第6,359,005 号(これらはその全体が、及び全ての目的について、参照により本明細書に取り込まれる)を参照されたい。
【0003】
プレガバリンは、多様な方法で製造されてきた。典型的には、3−(アミノメチル)−5−メチル−ヘキサン酸のラセミ混合物を合成し、引き続いて、そのR−及びS−鏡像体へ分割する。こうした方法は、アジド中間体、マロネート中間体、又はホフマン合成を用いることができる。それぞれ、R. B. Silverman et al. による米国特許第5,563,175 号
;T. M. Grote et alによる米国特許第6,046,353 、5,840,956 及び5,637,767 号;及びB. K. Huckabee & D. M. Sobieray による米国特許第5,629,447 及び5,616,793 号(これ
らはその全体が、及び全ての目的について、参照により本明細書に取り込まれる)を参照されたい。これらの各方法においては、ラセミ化合物をキラル酸(分割剤)と反応させてジアステレオ異性体塩の対を形成させ、それを分別結晶及びクロマトグラフィーのような既知の技術により分離する。それ故、これらの方法は、ラセミ化合物の製造を超えたかなりの処理を含み、それは分割剤とともに、生産コストを高くする。さらに、望まれないR−鏡像体が効率よくリサイクルされ得ないのでしばしば廃棄され、それによりプロセスの有効な処理量を50%減少させる。
【0004】
プレガバリンはまた、キラル助剤、つまり(4R,5S)−4−メチル−5−フェニル−2−オキサゾリジノンを使用して、直接合成されている。例えば、すべてR.B.Silverman et al、による、米国特許第6,359,169 、6,028,214 、5,847,151 、5,710,304 、5,684,189 、5,608,090 及び5,599,973 号(これらはその全体及び、全ての目的について、参
照により本明細書に取り込まれる)を参照されたい。これらの方法は、高い鏡像体純度でプレガバリンを提供するが、取り扱うのが難しい比較的高価な試薬(例えば、キラル助剤)、ならびに、−78℃ほどの低さであり得る、必要とされる処理温度に到達するための特別な極低温の装置を用いるので、大規模合成にはあまり望ましくない。
【0005】
最近公開された米国特許出願は、シアノ置換オレフィンの不斉水素添加を経て、(S)−3−(アミノメチル)−5−メチルヘキサン酸のキラルシアノ前駆体を生成させるプレガバリンの製造法を議論している。共通して譲渡され、2003年11月13日に公開された、Burk et alによる 米国特許出願番号2003/0212290 (その全体が、及び全ての目的
について、参照により本明細書に取り込まれる)を参照されたい。シアノ前駆体は引き続いて還元されてプレガバリンを生成する。この不斉水素添加は、(R,R)−Me−DUPHOSのような、ビスホスフィンリガンドへ結合された遷移金属から構成されるキラル触媒を用いる。この方法は(R)−3−(アミノメチル)−5−メチルヘキサン酸に対するプレバガリンの実質的な富化を生じる。
【0006】
米国特許出願第2003/0212290 A1 号に開示されている方法は、プレガバリンを製造するための商業的に実行可能な方法を代表しているが、さらなる改良が種々の理由で望まれるであろう。例えば、専売権のあるリガンド(R,R)−Me−DUPHOSを含むビスホスフィンリガンドは、二つのキラル中心を有するので製造するのがしばしば困難であるためコストが高くなる。さらに、不斉水素添加は、H2を取り扱うことが可能な特別の装置の使用を必要とし、それは投下コストを追加させる。
【発明の開示】
【0007】
【発明の要旨】
【0008】
本発明は、プレガバリン(式9)のような、鏡像体的に富化されたγ−アミノ酸(式1)を製造するための材料及び方法を提供する。本発明の方法は、中間体のエステル部分を鏡像体選択的に加水分解するように適合させた酵素を使用するラセミ体シアノジエステル中間体(式4又は式12)の速度論的分割を含む。実質的に鏡像体純粋である生じたジカルボン酸モノエステル(式3又は式11)は、さらに反応を起こし、所望の鏡像体的に富化されたγ−アミノ酸(式1又は式9)を生成する。速度論的分割からの未反応の鏡像体(式5又は式13)は、ラセミ化後の酵素的分割で再使用することが可能であり、それにより全体の収率を改良する。
【0009】
特許請求された方法は、鏡像体的に富化されたγ−アミノ酸(式1及び式9)を製造するための現存するプロセスを超える著しい利点を与える。例えば、光学活性γ−アミノ酸をキラル助剤又は専売権のある水素添加触媒を使用することなく製造することが可能であるのでより低い単位コストをもたらすであろう。酵素的プロセスは、室温及び大気圧で行うことが可能であり、特許請求された方法は、高圧及び低温を取り扱うことが可能な特別の装置の使用から生じる段取り上の衝突を最少化するのを助けるであろう。実施例で示すように、本発明は、ラセミ体シアノジエステル中間体(式12)から出発して、未反応鏡像体(式13)の一回バッチリサイクル後に高収率で(26%〜31%)プレガバリンを製造するのに使用可能である。このことは、上記のマロネート法に対して約50%の節約の利益と言い換えられる。
【0010】
本発明の一つの側面は、式1:
【0011】
【化1】

【0012】
(式中、R1及びR2は異なっていて、各々独立して、水素原子、C1〜12アルキル、C3〜12シクロアルキル、及び置換C3〜12シクロアルキルから選択される)
の化合物又はその薬学的に許容できる複合体、塩、溶媒和物又は水和物を製造する方法を提供し、その方法は:
(a)式2:
【0013】
【化2】

【0014】
の化合物又はその塩と、酸及び水を反応させて、式1の化合物又はその塩を生成させ;そして
(b)場合により、式1の化合物又はその塩を薬学的に許容できる複合体、塩、溶媒和物又は水和物へ変換する
ことを含んでなり、その際、式2のR1及びR2は式1で定義した通りである。
【0015】
本発明の別の側面は、上記式1の化合物を製造する方法を提供し、その方法は:
(a)式6:
【0016】
【化3】

【0017】
の化合物又はその塩のシアノ部分を還元して、式7:
【0018】
【化4】

【0019】
の化合物又はその塩を生成させ;
(b)式7の化合物又はその塩を脱炭酸して、式1の化合物又はその塩を生成させ;そして
(c)場合により、式1の化合物又はその塩を薬学的に許容できる複合体、塩、溶媒和物又は水和物へ変換する
ことを含んでなり、その際、式6及び式7のR1及びR2は式1で定義した通りである。
【0020】
上記の式6の化合物は、式3:
【0021】
【化5】

【0022】
の化合物又はその塩を加水分解することにより製造することができる。その際、式3のR1及びR2は式1で定義した通りであり、そして、R3は、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルである。
【0023】
本発明の追加の側面は、上記式1の化合物を製造する方法を提供し、その方法は:
(a)式8:
【0024】
【化6】

【0025】
の化合物又はその塩のシアノ部分を還元して、式1又はその塩を生成させ;そして
(b)場合により、式1の化合物又はその塩を、薬学的に許容できる複合体、塩、溶媒和物又は水和物へ変換する
ことを含んでなり、その際、式8のR1及びR2は式1で定義した通りであり、そして、式8のR5は、水素原子、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルである。
【0026】
式8の化合物は、上記式3の化合物又はその塩を脱炭酸することにより、又は上記式3の化合物又はその塩を加水分解する及び脱炭酸することにより、製造することができる。
【0027】
本発明のさらなる側面は、上記式3の化合物又はその塩を製造する方法を提供し、その方法は:
(a)式4:
【0028】
【化7】

【0029】
の化合物を、酵素と接触させて式3の化合物及び式5:
【0030】
【化8】

【0031】
の化合物を生成させ、その際、該酵素は、式4の化合物を式3の化合物又はその塩に鏡像体選択的に加水分解するように適合されており;
(b)式3の化合物又はその塩を単離し;そして
(c)場合により、式5の化合物をラセミ化して、式4の化合物を生成させる
ことを含んでなり、その際、式4及び式5のR1、R2、及びR3は、式1及び式3で上に定義した通りであり、そして、式4及び式5のR4は、R3と同一であるか又は異なっていて、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルである。
【0032】
いかなる数の酵素も、式4の化合物を式3の化合物又はその塩に鏡像体選択的に加水分解するために使用することができる。有用な酵素には、サーモミセス・ラヌギノースス(Thermomyces lanuginosus )由来のもののようなリパーゼが含まれる。
【0033】
本発明の別の側面は、上記式2により表される化合物であって、その複合体、塩、溶媒和物又は水和物を含む化合物を提供する。但し、式2中のR1又はR2により表される置換基の一つのが水素である場合、他の置換基はC1〜3アルキルでもC5アルキルでもない。
【0034】
本発明の追加の側面は、式27:
【0035】
【化9】

【0036】
の化合物であって、その複合体、塩、溶媒和物又は水和物を含む化合物を提供し、式中、
R1及びR2は異なっていて、各々独立して、水素原子、C1〜12アルキル、C3〜12シクロアルキル、及び置換C3〜12シクロアルキルから選択され、但し、式2中のR1又はR2により表される置換基の一つのが水素原子である場合、他の置換基はメチルではなく;そして
R5及びR6は、水素原子、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルから独立して選択され、但し、R5及びR6は水素原子でないなら異なっている。
【0037】
化合物27は、上記式3、式4、式5、式6、及び式7により表される化合物を含み、それらの複合体、塩、溶媒和物又は水和物をも含む。式2〜7及び27の有用な化合物には、R1が水素原子であり、R2がイソブチルであるものが含まれる。
【0038】
本発明のさらなる側面は、式9:
【0039】
【化10】

【0040】
の化合物、又はその薬学的に許容できる複合体、塩、溶媒和物又は水和物を製造する方法を提供し、その方法は:
(a)式10:
【0041】
【化11】

【0042】
の化合物又はその塩を、酸及び水と反応させて、式9又はその塩を生成させ;そして
(b)場合により、式9の化合物又はその塩を、薬学的に許容できる複合体、塩、溶媒
和物又は水和物へ変換する
ことを含んでなる。
【0043】
本発明の別の側面は、上記式9の化合物又はその薬学的に許容できる複合体、塩、溶媒和物又は水和物を製造する方法を提供し、その方法は:
(a)式14:
【0044】
【化12】

【0045】
の化合物又はその塩のシアノ部分を還元して、式15:
【0046】
【化13】

【0047】
の化合物又はその塩を生成させ;
(b)式15の化合物又はその塩を脱炭酸して、式9の化合物又はその塩を生成させ;そして
(c)場合により、式9の化合物又はその塩を、薬学的に許容できる複合体、塩、溶媒和物又は水和物へ変換する
ことを含んでなる。
【0048】
上記式14の化合物は、式11:
【0049】
【化14】

【0050】
の化合物又はその塩を加水分解することにより製造することができ、その際、式11のR3は、式3で上に定義した通りである。
【0051】
本発明の追加の側面は、上記式9の化合物又はその薬学的に許容できる複合体、塩、溶媒和物又は水和物を製造する方法を提供し、その方法は:
(a)式16:
【0052】
【化15】

【0053】
の化合物又はその塩のシアノ部分を還元して、式9の化合物又はその塩を生成させ;そして
(b)場合により、式9の化合物又はその塩を、薬学的に許容できる複合体、塩、溶媒和物又は水和物へ変換する
ことを含んでなり、その際、式16のR5は、式8で上に定義した通りである。
【0054】
式16の化合物は、上記式11の化合物又はその塩を脱炭酸すること(例えば、加熱により)により、又は式11の化合物又はその塩を加水分解して脱炭酸することにより、製造することができる。
【0055】
本発明のさらなる側面は、上記式11の化合物又はその塩を製造する方法を提供し、その方法は:
(a)式12:
【0056】
【化16】

【0057】
の化合物を、酵素と接触させて、式11及び式13:
【0058】
【化17】

【0059】
の化合物を生成させ、その際、該酵素は、式12の化合物を式11の化合物又はその塩に鏡像体選択的に加水分解するように適合されており;
(b)式11の化合物又はその塩を単離し;そして
(c)場合により、式13の化合物をラセミ化して、式12の化合物を生成させる
ことを含んでなり、その際、式12及び式13中のR3は、上記式3で定義した通りであり、そして、式12及び式13中のR4は、R3と同一であるか又は異なっていて、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルである。
【0060】
式11の化合物を製造する方法において、式11の化合物の対応する塩には、カリウム塩のようなアルカリ金属塩、t−ブチルアミン塩のような第一アミン塩、及び第二アミン塩から選択される塩が含まれる。さらに、有用な酵素には、サーモミセス・ラヌギノースス由来のもののようなリパーゼが含まれる。
【0061】
本発明の別の側面は:
3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸、
(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸、
(2S,3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸、
(2R,3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸、
3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル、
(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル、
4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸、
(S)−4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸、
3−シアノ−2−カルボキシ−5−メチル−ヘキサン酸、
(S)−3−シアノ−2−カルボキシ−5−メチル−ヘキサン酸、
3−アミノメチル−2−カルボキシ−5−メチル−ヘキサン酸及び
(S)−3−アミノメチル−2−カルボキシ−5−メチル−ヘキサン酸
から選択される化合物であって、その複合体、塩、溶媒和物又は水和物及び反対の鏡像体を含む化合物を提供する。
【0062】
本発明は、ここに開示された化合物の、すべての複合体及び塩、薬学的に許容できるかできないに関わらず、溶媒和物、水和物及び多形形態を含む。特定の化合物は、アルケニル又は環状基を含むことができ、その結果、シス/トランス(又はZ/E)立体異性体が可能であり、又はケト又はオキシム基を含むことができ、その結果、互変異性が生じてもよい。こうした場合において、本発明は、それらが純粋であるか、実質的に純粋であるか、混合物であるかに関わらず、概して、すべてのZ/E異性体及び互変異性形態を含む。
【発明の詳細な説明】
【0063】
定義及び略語
特に示さない限り、本開示は以下に提供される定義を使用する。いくつかの定義及び式は、原子間の結合、及び名称を付けた又は付けていない原子又は原子団への連結点を示すための線分(−)を含むことができる。他の定義及び式は、二重結合又は三重結合を示すために、それぞれ、等号(「=」)又は同一性記号(「≡」)を含むことができる。特定の式はまた、不斉(非対称又はキラル)中心を示すための、一つまたはそれより多くのアステリスク(「*」)も含むことができるが、アステリスクが存在しないことは、化合物が一つまたはそれより多くの立体中心を欠くことを示しているわけではない。こうした式は、ラセミ化合物又は個々の鏡像体又はジアステレオマーを指すことができ、それらは純粋又は実質的に純粋であっても、又はなくてもよい。
【0064】
「置換された」基とは、原子価要求性を満たし、そして置換により化学的に安定な化合物を生じるとの条件で、一つまたはそれより多くの水素原子が、一つまたはそれより多くの非水素原子又は基により置き換えられたものである。
【0065】
「約」又は「およそ」とは、測定可能な数変数に関連して使用される場合、変数の示された値及び示された値の実験誤差範囲にある全ての値(例えば、平均についての95%信頼区間内の)、又は大きいにしても示された値の±10パーセント以内を指す。
【0066】
「アルキル」とは、直鎖及び分枝鎖飽和炭化水素基を指し、一般に、特定された数の炭素原子を有する(即ち、C1〜6アルキルとは、1、2、3、4、5又は6炭素原子を有するアルキル基を指し、そしてC1−12アルキルとは、1、2、3、4、5、6、7、8、9、10、11又は12炭素原子を有するアルキル基を指す)。アルキル基の例には、限定ではなく、メチル、エチル、n−プロピル、i−プロピル、n−ブチル、s−ブチル、i−ブチル、t−ブチル、ペンタ−1−イル、ペンタ−2−イル、ペンタ−3−イル、3−メチルブタ−1−イル、3−メチルブタ−2−イル、2−メチルブタ−2−イル、2,2,2−トリメチルエタ−1−イル、n−ヘキシルなどが含まれる。
【0067】
「アルケニル」とは、一つまたはそれより多くの不飽和炭素−炭素結合を有する直鎖及び分枝鎖炭化水素基を指し、一般に、特定された数の炭素原子を有している。アルケニル基の例には、限定ではなく、エテニル、1−プロペン−1−イル、1−プロペン−2−イル、2−プロペン−1−イル、1−ブテン−1−イル、1−ブテン−2−イル、3−ブテン−1−イル、3−ブテン−2−イル、2−ブテン−1−イル、2−ブテン−2−イル、2−メチル−1−プロペン−1−イル、2−メチル−2−プロペン−1−イル、1,3−ブタジエン−1−イル、1,3−ブタジエン−2−イルなどが含まれる。
【0068】
「アルキニル」とは、一つまたはそれより多くの三重炭素−炭素結合を有する、直鎖及び分枝鎖炭化水素基を指し、一般に、特定された数の炭素原子を有している。アルキニル基の例には、限定ではなく、エチニル、1−プロピン−1−イル、2−プロピン−1−イル、1−ブチン−1−イル、3−ブチン−1−イル、3−ブチン−2−イル、2−ブチン−1−イルなどが含まれる。
【0069】
「アルカノイル」及び「アルカノイルアミノ」とは、各々、アルキル−C(O)−及びアルキル−C(O)−NH−を指し(式中、アルキルは上で定義した通りである)、そして一般に、カルボニル炭素を含んだ特定された数の炭素原子を含む。アルカノイルの例には、限定ではなく、ホルミル、アセチル、プロピオニル、ブチリル、ペンタノイル、ヘキサノイルなどが含まれる。
【0070】
「アルケノイル」及び「アルキノイル」とは、各々、アルケニル−C(O)−及びアルキニル−C(O)−を指し、アルケニル及びアルキニルは上で定義した通りである。アルケノイル及びアルキノイルが表すものは、一般に、カルボニル炭素を除外した特定された
数の炭素原子を含む。アルケノイル基の例には、限定ではなく、プロペノイル、2−メチルプロペノイル、2−ブテノイル、3−ブテノイル、2−メチル−2−ブテノイル、2−メチル−3−ブテノイル、3−メチル−3−ブテノイル、2−ペンテノイル、3−ペンテノイル、4−ペンテノイルなどが含まれる。アルキノイル基の例には、限定ではなく、プロピノイル、2−ブチノイル、3−ブチノイル、2−ペンチノイル、3−ペンチノイル、4−ペンチノイルなどが含まれる。
【0071】
「アルコキシ」、「アルコキシカルボニル」及び「アルコキシカルボニルアミノ」とは、それぞれ、アルキル−O−、アルケニル−O及びアルキニル−O;アルキル−O−C(O)−、アルケニル−O−C(O)−、アルキニル−O−C(O)−;及びアルキル−O−C(O)−NH−、アルケニル−O−C(O)−NH−及びアルキニル−O−C(O)−NH−を指し、アルキル、アルケニル及びアルキニルは上で定義した通りである。アルコキシ基の例には、限定ではなく、メトキシ、エトキシ、n−プロポキシ、i−プロポキシ、n−ブトキシ、s−ブトキシ、t−ブトキシ、n−ペントキシ、s−ペントキシなどが含まれる。アルコキシカルボニル基の例には、限定ではなく、メトキシカルボニル、エトキシカルボニル、n−プロポキシカルボニル、i−プロポキシカルボニル、n−ブトキシカルボニル、s−ブトキシカルボニル、t−ブトキシカルボニル、n−ペントキシカルボニル、s−ペントキシカルボニルなどが含まれる。
【0072】
「アルキルアミノ」、「アルキルアミノカルボニル」、「ジアルキルアミノカルボニル」、「アルキルスルホニル」、「スルホニルアミノアルキル」及び「アルキルスルホニルアミノカルボニル」とは、それぞれ、アルキル−NH−、アルキル−NH−C(O)−、アルキル2−N−C(O)−、アルキル−S(O2)−、HS(O2)−NH−アルキル−、及びアルキル−S(O)−NH−C(O)−(式中、アルキルは上で定義した通りである)を指す。
【0073】
「アミノアルキル」及び「シアノアルキル」とは、それぞれ、NH2−アルキル及びN≡C−アルキルを指し、アルキルは上で定義した通りである。
【0074】
「ハロ」、「ハロゲン」及び「ハロゲノ」は、相互交換的に使用することができ、フルオロ、クロロ、ブロモ及びヨードを指す。
【0075】
「ハロアルキル」、「ハロアルケニル」、「ハロアルキニル」、「ハロアルカノイル」、「ハロアルケノイル」、「ハロアルキノイル」、「ハロアルコキシ」及び「ハロアルコキシカルボニル」とは、それぞれ、一つまたはそれより多くのハロゲン原子で置換されたアルキル、アルケニル、アルキニル、アルカノイル、アルケノイル、アルキノイル、アルコキシ及びアルコキシカルボニル基を指し、アルキル、アルケニル、アルキニル、アルカノイル、アルケノイル、アルキノイル、アルコキシ及びアルコキシカルボニルは上で定義した通りである。ハロアルキル基の例には、限定ではなく、トリフルオロメチル、トリクロロメチル、ペンタフルオロメチル、ペンタクロロエチルなどが含まれる。
【0076】
「ヒドロキシアルキル」及び「オキソアルキル」とは、それぞれ、HO−アルキル及びO=アルキルを指し、アルキルは上で定義した通りである。ヒドロキシアルキル及びオキソアルキル基の例には、限定ではなく、ヒドロキシメチル、ヒドロキシエチル、3−ヒドロキシプロピル、オキソメチル、オキソエチル、3−オキソプロピルなどが含まれる。
【0077】
「シクロアルキル」とは、飽和単環式及び二環式炭化水素環を指し、環を含んでなる特定された数の炭素原子を有している(即ち、C3〜7シクロアルキルとは、環メンバーとして3、4、5、6又は7炭素原子を有しているシクロアルキル基を指す)。シクロアルキルは、その結合が原子価要求性を犯さないであろう限り、いずれの環原子でも、親基又
は基質へ結合することができる。同様に、シクロアルキル基は、その置換が原子価要求性を犯さないであろう限り、一つまたはそれより多くの非水素置換基を含むことができる。有用な置換基には、限定ではなく、上で定義したアルキル、アルケニル、アルキニル、ハロアルキル、ハロアルケニル、ハロアルキニル、アルコキシ、アルコキシカルボニル、アルカノイル及びハロ、及びヒドロキシ、メルカプト、ニトロ及びアミノが含まれる。
【0078】
単環式シクロアルキル基の例には、限定ではなく、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシルなどが含まれる。二環式シクロアルキル基の例には、限定ではなく、ビシクロ[1.1.0]ブチル、ビシクロ[1.1.1]ペンチル、ビシクロ[2.1.0]ペンチル、ビシクロ[2.1.1]ヘキシル、ビシクロ[3.1.0]ヘキシル、ビシクロ[2.2.1]ヘプチル、ビシクロ[3.2.0]ヘプチル、ビシクロ[3.1.1]ヘプチル、ビシクロ[4.1.0]ヘプチル、ビシクロ[2.2.2]オクチル、ビシクロ[3.2.1]オクチル、ビシクロ[4.1.1]オクチル、ビシクロ[3.3.0]オクチル、ビシクロ[4.2.0]オクチル、ビシクロ[3.3.1]ノニル、ビシクロ[4.2.1]ノニル、ビシクロ[4.3.0]ノニル、ビシクロ[3.3.2]デシル、ビシクロ[4.2.2]デシル、ビシクロ[4.3.1]デシル、ビシクロ[4.4.0]デシル、ビシクロ[3.3.3]ウンデシル、ビシクロ[4.3.2]ウンデシル、ビシクロ[4.3.3]ドデシルなどが含まれ、それらは、そうした結合が原子価要求性を犯さないであろう限り、いずれの環原子でも、親基又は基質へ結合されることができる。
【0079】
「シクロアルケニル」とは、一つまたはそれより多くの不飽和炭素−炭素結合を有する単環式及び二環式炭化水素環を指し、そして環を含んでなる、特定された数の炭素原子を有している(即ち、C3〜7シクロアルケニルとは、環メンバーとして3、4、5、6又は7炭素原子を有しているシクロアルケニル基を指す)。シクロアルケニルは、その結合が原子価要求性を犯さないであろう限り、いずれの環原子でも、親基又は基質へ結合することができる。同様に、シクロアルケニル基は、その置換が原子価要求性を犯さないであろう限り、一つまたはそれより多くの非水素置換基を含むことができる。有用な置換基には、限定ではなく、上で定義したアルキル、アルケニル、アルキニル、ハロアルキル、ハロアルケニル、ハロアルキニル、アルコキシ、アルコキシカルボニル、アルカノイル及びハロ、及びヒドロキシ、メルカプト、ニトロ及びアミノが含まれる。
【0080】
「シクロアルカノイル」及び「シクロアルケノイル」とは、それぞれ、シクロアルキル−C(O)−及びシクロアルケニル−C(O)−を指し、シクロアルキル及びシクロアルケニルは上で定義した通りである。シクロアルカノイル及びシクロアルケノイルが表すものは、一般に、カルボニル炭素を除外した特定された数の炭素原子を含む。シクロアルカノイルの例には、限定ではなく、シクロプロパノイル、シクロブタノイル、シクロペンタノイル、シクロヘキサノイル、シクロヘプタノイル、1−シクロブテノイル、2−シクロブテノイル、1−シクロペンテノイル、2−シクロペンテノイル、3−シクロペンテノイル、1−シクロヘキサノイル、2−シクロヘキサノイル、3−シクロヘキサノイルなどが含まれる。
【0081】
「シクロアルコキシ」及び「シクロアルコキシカルボニル」とは、それぞれ、シクロアルキル−O−及びシクロアルケニル−O、及びシクロアルキル−O−C(O)−及びシクロアルケニル−O−C(O)−を指し、シクロアルキル及びシクロアルケニルは上で定義した通りである。シクロアルコキシ及びシクロアルコキシカルボニルが表すものは、一般に、カルボニル炭素を除外した特定された数の炭素原子を含む。シクロアルコキシ基の例には、限定ではなく、シクロプロポキシ、シクロブトキシ、シクロペントキシ、シクロヘキソキシ、1−シクロブテノキシ、2−シクロブテノキシ、1−シクロペンテノキシ、2−シクロペンテノキシ、3−シクロペンテノキシ、1−シクロヘキセノキシ、2−シクロ
ヘキセノキシ、3−シクロヘキセノキシなどが含まれる。シクロアルコキシカルボニル基の例には、限定ではなく、シクロプロポキシカルボニル、シクロブトキシカルボニル、シクロペントキシカルボニル、シクロヘキソキシカルボニル、1−シクロブテノキシカルボニル、2−シクロブテノキシカルボニル、1−シクロペンテノキシカルボニル、2−シクロペンテノキシカルボニル、3−シクロペンテノキシカルボニル、1−シクロヘキセノキシカルボニル、2−シクロヘキセノキシカルボニル、3−シクロヘキセノキシカルボニルなどが含まれる。
【0082】
「アリール」及び「アリーレン」とは、それぞれ、窒素、酸素及び硫黄から独立して選択される、0〜4ヘテロ原子を含む5−及び6−員の単環式芳香族基を含んでいる、一価及び二価の芳香族基を指す。単環式アリール基の例には、限定ではなく、フェニル、ピロリル、フラニル、チオフェニル、チアゾリル、イソチアゾリル、イミダゾリル、トリアゾリル、テトラゾリル、ピラゾリル、オキサゾリル、イソオキサゾリル、ピリジニル、ピラジニル、ピリダジニル、ピリミジニルなどが含まれる。アリール及びアリーレン基はまた、上記の縮合5−及び6−員環を含む、二環式基、三環式基、その他を含む。多環式アリール基の例には、限定ではなく、ナフチル、ビフェニル、アントラセニル、ピレニル、カルバゾリル、ベンゾオキサゾリル、ベンゾジオキサゾリル、ベンゾチアゾリル、ベンゾイミダゾリル、ベンゾチオフェニル、キノリニル、イソキノリニル、インドリル、ベンゾフラニル、プリニル、インドリジニルなどが含まれる。アリール及びアリーレン基は、その結合が原子価要求性を犯さないであろう限り、いずれの環原子でも、親基又は基質へ結合することができる。同様に、アリール及びアリーレン基は、その置換が原子価要求性を犯さないであろう限り、一つまたはそれより多くの非水素置換基を含むことができる。有用な置換基には、限定ではなく、上で定義したアルキル、アルケニル、アルキニル、ハロアルキル、ハロアルケニル、ハロアルキニル、シクロアルキル、シクロアルケニル、アルコキシ、シクロアルコキシ、アルカノイル、シクロアルカノイル、シクロアルケノイル、アルコキシカルボニル、シクロアルコキシカルボニル及びハロ、及びヒドロキシ、メルカプト、ニトロ、アミノ及びアルキルアミノが含まれる。
【0083】
「ヘテロ環」及び「ヘテロシクリル」とは、それぞれ、5〜7又は7〜11の環メンバーを有する、飽和、部分的不飽和又は不飽和、単環式又は二環式環を指す。これらの基は、炭素原子及び、独立して窒素、酸素又は硫黄である、1〜4のヘテロ原子から作り上げられた環メンバーを有し、そして上記の単環式ヘテロ環がベンゼン環に縮合した、いずれかの二環式基を含むことができる。窒素及び硫黄ヘテロ原子は、場合により、酸化されていてもよい。ヘテロ環式環は、結合が原子価要求性を犯さないであろう限り、いずれのヘテロ原子又は炭素原子でも、親基又は基質へ結合されることができる。同様に、いずれの炭素又は窒素環メンバーも、その置換が原子価要求性を犯さないであろう限り、非水素置換基を含むことができる。有用な置換基には、限定ではなく、上で定義したアルキル、アルケニル、アルキニル、ハロアルキル、ハロアルケニル、ハロアルキニル、シクロアルキル、シクロアルケニル、アルコキシ、シクロアルコキシ、アルカノイル、シクロアルカノイル、シクロアルケノイル、アルコキシカルボニル、シクロアルコキシカルボニル及びハロ、及びヒドロキシ、メルカプト、ニトロ、アミノ、及びアルキルアミノが含まれる。
【0084】
ヘテロ環の例には、限定ではなく、アクリジニル、アゾシニル、ベンゾイミダゾリル、ベンゾフラニル、ベンゾチオフラニル、ベンゾチオフェニル、ベンゾオキサゾリル、ベンゾチアゾリル、ベンゾトリアゾリル、ベンゾテトラゾリル、ベンゾイソオキサゾリル、ベンゾイソチアゾリル、ベンゾイミダゾリニル、カルバゾリル、4aH−カルバゾリル、カルボリニル、クロマニル、クロメニル、シンノリニル、デカヒドロキノリニル、2H,6H−1,5,2−ジチアジニル、ジヒドロフロ[2,3−b]テトラヒドロフラン、フラニル、フラザニル、イミダゾリジニル、イミダゾリニル、イミダゾリル、1H−インダゾリル、インドレニル、インドリニル、インドリジニル、インドリル、3H−インドリル、
イソベンゾフラニル、イソクロマニル、イソインダゾリル、イソインドリニル、イソインドリル、イソキノリニル、イソチアゾリル、イソオキサゾリル、モルホリニル、ナフチリジニル、オクタヒドロイソキノリニル、オキサジアゾリル、1,2,3−オキサジアゾリル、1,2,4−オキサジアゾリル、1,2,5−オキサジアゾリル、1,3,4−オキサジアゾリル、オキサゾリジニル、オキサゾリル、オキサゾリジニル、ピリミジニル、フェナントリジニル、フェナントロリニル、フェナジニル、フェノチアジニル、フェノキサチイニル、フェノキサジニル、フタラジニル、ピペラジニル、ピペリジニル、プテリジニル、プリニル、ピラニル、ピラジニル、ピラゾリジニル、ピラゾリニル、ピラゾリル、ピリダジニル、ピロドオキサゾール、ピリドイミダゾール、ピリドチアゾール、ピリジニル、ピリジル、ピリミジニル、ピロリジニル、ピロリニル、2H−ピロリル、ピロリル、キナゾリニル、キノリニル、4H−キノリジニル、キノキサリニル、キヌクリジニル、テトラヒドロフラニル、テトラヒドロイソキノリニル、テトラヒドロキノリニル、6H−1,2,5−チアジアジニル、1,2,3−チアジアゾリル、1,2,4−チアジアゾリル、1,2,5−チアジアゾリル、1,3,4−チアジアゾリル、チアアントレニル、チアゾリル、チエニル、チエノチアゾリル、チエノオキサゾリル、チエノイミダゾリル、チオフェニル、トリアジニル、1,2,3−トリアゾリル、1,2,4−トリアゾリル、1,2,5−トリアゾリル、1,3,4−トリアゾリル及びキサンテニルが含まれる。
【0085】
「ヘテロアリール」及び「ヘテロアリーレン」とは、それぞれ、芳香族である、上で定義した一価及び二価ヘテロ環又はヘテロシクリル基を指す。ヘテロアリール及びヘテロアリーレン基は、それぞれ、アリール及びアリーレン基の下位集団を意味する。
【0086】
「アリールアルキル」及び「ヘテロアリールアルキル」とは、それぞれ、アリール−アルキル及びヘテロアリール−アルキルを指し、アリール、ヘテロアリール及びアルキルは上で定義した通りである。例には、限定ではなく、ベンジル、フルオレニルメチル、イミダゾール−2−イル−メチルなどが含まれる。
【0087】
「アリールアルカノイル」、「ヘテロアリールアルカノイル」、「アリールアルケノイル」、「ヘテロアリールアルケノイル」、「アリールアルキノイル」及び「ヘテロアリールアルキノイル」とは、それぞれ、アリール−アルカノイル、ヘテロアリール−アルカノイル、アリール−アルケノイル、ヘテロアリール−アルケノイル、アリール−アルキノイル、及びヘテロアリール−アルキノイルを指し、アリール、ヘテロアリール、アルカノイル、アルケノイル及びアルキノイルは上で定義した通りである。例には、限定ではなく、ベンゾイル、ベンジルカルボニル、フルオレノイル、フルオレニルメチルカルボニル、イミダゾール−2−オイル、イミダゾール−2−イル−メチルカルボニル、フェニルエテンカルボニル、1−フェニルエテンカルボニル、1−フェニル−プロペンカルボニル、2−フェニル−プロペンカルボニル、3−フェニル−プロペンカルボニル、イミダゾール−2−イル−エテンカルボニル、1−(イミダゾール−2−イル)−エテンカルボニル、1−(イミダゾール−2−イル)−プロペンカルボニル、2−(イミダゾール−2−イル)−プロペンカルボニル、3−(イミダゾール−2−イル)−プロペンカルボニル、フェニルエチンカルボニル、フェニルプロピンカルボニル、(イミダゾール−2−イル)−エチンカルボニル、(イミダゾール−2−イル)−プロピンカルボニルなどが含まれる。
【0088】
「アリールアルコキシ」及び「ヘテロアリールアルコキシ」とは、それぞれ、アリール−アルコキシ及びヘテロアリール−アルコキシを指し、アリール、ヘテロアリール及びアルコキシは上で定義した通りである。例には、限定ではなく、ベンジルオキシ、フルオレニルメチルオキシ、イミダゾール−2−イル−メチルオキシなどが含まれる。
【0089】
「アリールオキシ」及び「ヘテロアリールオキシ」とは、それぞれ、アリール−O−及びヘテロアリール−O−を指し、アリール及びヘテロアリールは上で定義した通りである
。例には、限定ではなく、フェノキシ、イミダゾール−2−イルオキシなどが含まれる。
【0090】
「アリールオキシカルボニル」、「ヘテロアリールオキシカルボニル」、「アリールアルコキシカルボニル」及び「ヘテロアリールアルコキシカルボニル」とは、それぞれ、アリールオキシ−C(O)−、ヘテロアリールオキシ−C(O)−、アリ−ルアルコキシ−C(O)−及びヘテロアリールアルコキシ−C(O)−を指し、アリールオキシ、ヘテロアリールオキシ、アリールアルコキシ及びヘテロアリールアルコキシは上で定義した通りである。例には、限定ではなく、フェノキシカルボニル、イミダゾール−2−イルオキシカルボニル、ベンジルオキシカルボニル、フルオレニルメチルオキシカルボニル、イミダゾール−2−イル−メチルオキシカルボニルなどが含まれる。
【0091】
「脱離基」とは、置換反応、脱離反応及び付加−脱離反応を含む、フラグメンテーションプロセス間に、分子を離れるいずれかの基を指す。脱離基は、脱離基と分子間の結合として以前は働いていた電子対とともに基が離れる、離核性であってもよく、又は電子対なしで基が離れる、離電子性であってもよい。離れるための離核性脱離基の能力は、その塩基強度に依存し、最も強い塩基が最も不十分な脱離基である。通常の離核性脱離基には、窒素(例えば、ジアゾニウム塩からの);アルキルスルホナート(例えば、メシラート)フルオロアルキルスルホナート(例えば、トリフラート、ヘキサフラート、ノナフラート及びトレシラート)及びアリールスルホナート(例えば、トシラート、ブロシラート、クロシラート及びノシラート)を含むスルホナートが含まれる。他には、カルボナート、ハライドイオン、カルボキシラートアニオン、フェノラートイオン及びアルコキシドが含まれる。スルホナート、NH2−及びOH−のような、いくつかのより強い塩基は、酸による処理により、より良好な脱離基とすることが可能である。通常の離電子性脱離基には、プロトン、CO2及び金属が含まれる。
【0092】
「鏡像体過剰率」又は「ee」とは、所与の試料について、一つの鏡像体の、キラル化合物のラセミ体試料に対する過剰率の指標であり、パーセンテージとして表現される。鏡像体過剰率は、100x(er−1)/(er+1)(式中、「er」は、より豊富な鏡像体のより少ない鏡像体に対する比である)として定義される。
【0093】
「ジアステレオマー過剰率」又は「de」とは、所与の試料について、一つのジアステレオマーの、等量のジアステレオマーを有する試料に対する過剰率の指標であり、パーセンテージとして表現される。ジアステレオマー過剰率は、100x(dr−1)/(dr+1)(式中、「dr」は、より豊富なジアステレオマーのより少ないジアステレオマーに対する比である)として定義される。
【0094】
「立体選択的」、「鏡像体選択的」、「ジアステレオ選択的」及びその変異形は、それぞれ、別のものよりも多い一つの立体異性体、鏡像体又はジアステレオマーを生成する規定のプロセス(例えば、エステル加水分解、水素添加、ヒドロホルミル化、π−アリルパラジウムカップリング、ヒドロシリル化、ヒドロシアノ化、オレフィンメタセシス、ヒドロアシル化、アリルアミン異性化その他)を指す。
【0095】
「高レベルの立体選択性」、「高レベルの鏡像体選択性」、「高レベルのジアステレオ選択性」及びその変異形は、生成物の少なくとも約90%を含んでなる、一つの立体異性体、鏡像体又はジアステレオマーを過剰に有する生成物を生成する、規定のプロセスを指す。鏡像体及びジアステレオマーの組については、高レベルの鏡像体選択性又はジアステレオ選択性は、少なくとも約80%のee又はdeに相当するであろう。
【0096】
「立体異性体的に富化された」、「鏡像体的に富化された」、「ジアステレオマー的に富化された」及びその変異形は、それぞれ、一つの立体異性体、鏡像体又はジアステレオ
マーを別のものよりもより多く含む、化合物の試料を指す。富化の程度は、全生成物の%により、鏡像体及びジアステレオマーの組については、ee又はdeにより、測定することができる。
【0097】
「実質的に純粋な立体異性体」、「実質的に純粋な鏡像体」、「実質的に純粋なジアステレオマー」及びその変異形は、それぞれ、試料の少なくとも約95%を含んでなる、立体異性体、鏡像体又はジアステレオマーを含有する試料を指す。鏡像体及びジアステレオマーの組については、実質的に純粋な鏡像体又はジアステレオマーは、約95%又はそれ以上のee又はdeを有する試料に相当するであろう。
【0098】
「純粋な立体異性体」、「純粋な鏡像体」、「純粋なジアステレオマー」及びその変異形は、それぞれ、試料の少なくとも約99.5%を含んでなる、立体異性体、鏡像体又はジアステレオマーを含んでいる試料を指す。鏡像体及びジアステレオマーの組については、純粋な鏡像体又はジアステレオマーは、約99%又はそれ以上のee又はdeを有する試料に相当するであろう。
【0099】
「反対の鏡像体」とは、重ね合わすことが出来ない、参照分子の鏡像である分子を指し、それは、参照分子の立体中心の全てを反転することにより得ることが出来る。例えば、もし参照分子がS絶対立体化学配置を有していたら、反対の鏡像体はR絶対立体化学配置を有する。同様に、もし参照分子がS,S絶対立体化学配置を有していたら、反対の鏡像体はR,R絶対立体化学配置を有するなどである。
【0100】
特定の化合物の「立体異性体」は、化合物の反対の鏡像体、及び化合物のいずれかのジアステレオ異性体又は幾何異性体(Z/E)を指す。例えば、もし特定の化合物がS,R,Z立体化学的コンフィグレーションを有していたら、その立体異性体には、R,S,Zコンフィグレーションを有するその反対の鏡像体、S,S,Zコンフィグレーション及びR,R,Zコンフィグレーションを有するそのジアステレオマー、及びS,R,Eコンフィグレーション、R,S,Eコンフィグレーション、S,S,Eコンフィグレーション及びR,R,Eコンフィグレーションを有するその幾何異性体を含むであろう。
【0101】
「鏡像体選択性値」又は「E」とは、化学的反応及び変換を受けている化合物の各鏡像体についての特異性定数の比を指し、式:
【0102】
【数1】

【0103】
(式中、KS及びKRは、それぞれ、S−及びR−鏡像体の変換についての1次速度定数であり;KSM及びKRMは、それぞれ、S−及びR−鏡像体についてのミカエリス定数であり;χは、基質の転化率であり;eep及びeesは、それぞれ、生成物及び基質(反応体)の鏡像体過剰率である)から計算する(S−鏡像体について)ことができる。
【0104】
「リパーゼ単位」又は「LU」とは、30℃及びpH7で、トリブチリン及び乳化剤(アラビアガム)と接触させた場合、1μmolの滴定可能酪酸/分を遊離する、酵素の量(gで)を指す。
【0105】
「溶媒和物」とは、開示された又は特許請求された化合物及び化学量論又は非化学量論量の一つまたはそれより多くの薬学的に許容できる溶媒分子(例えば、EtOH)を含ん
でなる、分子複合体を指す。
【0106】
「水和物」とは、開示された又は特許請求された化合物及び化学量論又は非化学量論量の水を含んでなる、溶媒和物を指す。
【0107】
「薬学的に許容できる複合体、塩、溶媒和物又は水和物」とは、健全な医学的判断の範囲内で、過度の毒性、刺激作用、アレルギー応答などがなく、患者の組織との接触における使用に適し、合理的利益対危険比が釣り合っており、及びそれらの意図される使用に有益である、開示された又は特許請求された化合物の複合体、酸又は塩基付加塩、溶媒和物又は水和物を指す。
【0108】
「プレ触媒」又は「触媒前駆体」とは、使用に先だって、触媒へ変換される化合物又は化合物の組を指す。
【0109】
「治療する」とは、こうした用語が適用される障害又は状態を、逆行させる、緩和する、進行を抑制する、又は予防すること、又はこうした障害又は状態の一つまたはそれより多くの症状を予防することを指す。
【0110】
「治療」とは、直前に定義した「治療する」ことの行為を指す。
【0111】
表1は、本明細書を通して使用される略語を列挙するものである。
【0112】
【表1】

【0113】
【表2】

【0114】
【表3】

【0115】
以下のいくつかの反応スキーム及び実施例において、特定の化合物を、反応部位以外での望まれない化学反応を防止する、保護基を使用して製造することが可能である。保護基はまた、溶解度を増強するため、さもなければ化合物の物理的性質を修飾するためにも使用することが出来る。保護基戦略、保護基を取り付けるまたは除去するための材料及び方法の記述、及びアミン、カルボン酸、アルコール、ケトン、アルデヒドなどを含む通常の官能基に有用な保護基のコンピレーション(compilation )、についての議論については、全ての目的について、その全体が参照により本明細書に取り込まれる、T. W. Greene and P.G. Wuts, Protecting Groups in Organic Chemistry (1999) and P. Kocienski, Protective Groups (2000) を参照されたい。
【0116】
加えて、以下のいくつかのスキーム及び実施例では、有機化学の当業者には周知である、酸化、還元などを含む、ありふれた反応の詳細は省略されている。こうした反応の詳細は、Richard Larock, Comprehensive Organic Transformations (1999) 及びMichael B. Smith 他により監修された、複数巻より成るCompendium of Organic Synthetic Methods (1974-2003) を含む、多数の学術論文に見ることが可能である。一般に、出発材料及び試薬は、商業的供給元から得ることができるか、又は文献により製造することができる。
【0117】
一般に、本明細書を通して記述されている化学変換は、実質的に化学量論量の反応体を使用して実行できるが、特定の反応は、過剰の一つまたはそれより多くの反応体を使用することにより利益を得ることができる。追加として、以下に詳細に記載されているラセミ体ジエステル(式4)の鏡像体選択的加水分解を含む、本明細書を通して開示されている反応の多くは、RT近辺で実施することができるが、反応速度論、収率などに依存して、特定の反応は、より高い又はより低い温度の使用を必要としてもよい。さらに、多くの化学変換は、反応速度及び収率に影響することができる、一つまたはそれより多くの適合した溶媒を用いることができる。反応の性質に依存して、一つまたはそれより多くの溶媒は、極性プロトン性溶媒、極性非プロトン性溶媒、非極性溶媒、又はいくつかの組み合わせであることができる。濃度範囲、温度範囲、pH範囲、触媒添加範囲などに関する本開示中のいずれの参照も、用語「範囲」が明白に使用されている又はいないとしても、示された終了点を含んでいる。
【0118】
本発明は、薬学的に許容できる塩、エステル、アミドまたはプロドラッグを含む、光学活性γ−アミノ酸(式1)を製造するための材料及び方法を提供する。式1の化合物は、上に定義されている、置換基R1及びR2を含む。式1の有用な化合物には、それ故、R1が水素原子であり、そしてR2がC1〜12アルキル、C3〜12シクロアルキル、又は置換C3〜12シクロアルキルである化合物、又はR2が水素原子であり、そしてR1がC1〜12アルキル、C3〜12シクロアルキル、又は置換C3〜12シクロアルキルである化合物が含まれる。式1の特に有用な化合物には、R1が水素原子であり、そしてR2がC1〜6アルキル又はC3〜7シクロアルキルである化合物、又はR2が水素原子であり、そしてR1がC1〜6アルキル又はC3〜7シクロアルキルである化合物が含まれる。式1の特別に有用な化合物には、プレバガリン(式9)のような、R1が水素原子であり、そしてR2がC1〜4アルキルである化合物が含まれる。
【0119】
図1は、光学活性γ−アミノ酸(式1)を製造するプロセスを示している。本プロセスは、シアノ−置換ジエステル(式4)及び水を含んでなる反応混合物と、酵素を接触させ又は混合して、光学活性ジカルボン酸モノエステル(式3)及び光学活性ジエステル(式5)を含む、生成物混合物を生成させる工程を含んでいる。シアノ−置換ジエステル(式4)は、アステリスク(「*」)で示されている不斉中心を有し、以下に記載するように、図2に示した反応スキームに従って製造することができる。酵素と接触させることに先だっては、シアノ−置換ジエステル(式4)は、典型的には、式5のジエステル及びその反対の鏡像体のラセミ体(等モル)を含んでなる。式3、式4及び式5における置換基R1、R2、及びR3、そして式4及び式5における置換基R4は、式1に関連して定義した通りである。一般に、異なって述べられていない限り、特定の置換基識別名(R1、R2、R3その他)は、式に関連して最初に定義され、続いての式で使用される同一の置換基識別名は、より早い式のものと同一の意味を有するであろう。
【0120】
酵素(又は生物触媒)は、式5の化合物にはほとんどあるいは全く影響しないが、その反対の鏡像体の加水分解を触媒して、ジカルボン酸モノエステル(式3)を生成するであろう、いずれかのタンパク質であることができる。式4から式3の化合物へ鏡像体選択的に加水分解するための有用な酵素は、それ故、リパーゼを含むヒドロラーゼ、特定のプロテアーゼ及び他の鏡像体選択的エステラーゼを含むことができる。こうした酵素は、動物器官及び微生物を含む多様な天然源から得ることができる。例えば、商業的に入手可能なヒドロラーゼの非制限的リストについての表2を参照されたい。
【0121】
【表4】

【0122】
【表5】

【0123】
【表6】

【0124】
実施例の節に示したように、シアノ−置換ジエステル(式4及び式12)の、所望の光学活性ジカルボン酸モノエステル(式3及び式11)への鏡像体選択的変換に有用な酵素には、リパーゼが含まれる。特に有用なリパーゼには、LIPOLASE(登録商標)(CAS番号9001−62−1)の商標でNovo-Nordisk A/S から入手可能なもののよう
な、微生物サーモマイセス・ラヌギノスス(Thermomyces lanuginosus )由来の酵素が含まれる。LIPOLASE(登録商標)酵素は、リパーゼのアミノ酸配列をコードする、サーモマイセス・ラヌギノススDSM4109からのDNAで遺伝子修飾した、アスペルギルス・オリゼ(Aspergillus oryzae )微生物の液内発酵により得られる。LIPOL
ASE(登録商標)100L及びLIPOLASE(登録商標)100Tは、それぞれ、液体溶液及び顆粒固形物として入手可能であり、それぞれは、100kLU/gの公称活性を有している。LIPOLASE(登録商標)の他の形態には、LIPOLASE(登録商標)100Lの半分の活性を有するLIPOLASE(登録商標)50L、及びLIPOLASE(登録商標)100Lと同一の活性を有しているが食品用である、LIPOZYME(登録商標)100L、が含まれる。
【0125】
適した酵素を同定するため、多様なスクリーニング技術を使用することができる。例えば、多数の商業的に入手可能な酵素を、以下の実施例の節に記載されている高処理量スクリーニング技術を使用してスクリーニングすることができる。他の酵素(又は酵素の微生物源)を、富化単離技術を使用してスクリーニングできる。こうした技術には、典型的には、ラセミ体基質(式4)又は構造的に類似した化合物であってもよい、富化基質を補給した炭素−制限又は窒素制限培地の使用が含まれる。潜在的に有用な微生物は、富化基質を含有する培地中で増殖する能力に基づいた、さらなる検討で選択される。これらの微生物は続いて、微生物細胞の懸濁液とラセミ体基質を接触させ、そしてキラルHPLC、ガス−液体クロマトグラフィー、LC/MSなどのような分析法を使用し、所望の光学活性
ジカルボン酸モノエステル(式3)の存在を試験することにより、その鏡像体選択的にエステル加水分解を触媒する能力を評価する。
【0126】
要求される加水分解活性を有する微生物が単離されたら、それを産生する酵素の特性を改良するために、酵素工学を用いることができる。例えば、限定ではなく、エステル加水分解の収率及び鏡像体選択性を増加させるため、酵素の温度及びpH操作範囲を広げるため、及び有機溶媒に対する酵素の耐性を改良するために、酵素工学を使用することができる。有用な酵素工学技術には、部位特異的突然変異発生のような合理的設計法、及び所望の特性を最適化するための無作為突然変異発生、遺伝子発現及び高処理量スクリーニングの連続的ラウンドを利用するインビトロ−方向付け進化技術が含まれる。例えば、その全開示が、参照により本明細書に取り込まれる、K. M. Koeller & C.-H. Wong, 「Enzymes for chemical synthesis」 Nature 409:232-240 (11 Jan. 2001) 、及びそれに引用され
ている参照文献を参照されたい。
【0127】
酵素は、全微生物細胞、透過処理された微生物細胞、微生物細胞の抽出物、部分的に精製された酵素、精製された酵素などの形態であることができる。酵素は、体積に基づいて、約0.1mm未満の(微細分散液)、又は約0.1mm又はより大きな(粗分散液)の平均粒子サイズを有する粒子の分散液を含んでなることができる。粗酵素分散液は、微細分散液よりも、有望なプロセシング利点を与える。例えば、粗酵素粒子は、バッチプロセス、又は半連続的又は連続的プロセスにおいて繰り返し使用することができ、そして通常、酵素の微細分散液よりも、生体変換の他の成分から、より容易に分離することができる(例えば、濾過により)。
【0128】
有用な粗酵素分散液には、主として酵素を含んでなる、架橋酵素結晶(CLEC)及び架橋酵素凝集物(CLEA)が含まれる。他の粗分散液は、不溶性支持体上又は内に固定化された酵素を含むことができる。有用な固体支持体には、アルギン酸カルシウム、ポリアクリルアミド、EUPERGIT(登録商標)及び他のポリマー材料を含んでなるポリマーマトリックス、ならびに、CELITE(登録商標)のような無機材料が含まれる。CLEC及び他の酵素固定化技術の一般的記述については、M. A. Navia & N. L. St. Clair による米国特許第5,618,710 号を参照されたい。製造及び使用を含んだ、CLEAの一般的記述については、L. Cao & J. Elzinga et al による米国特許出願第2003/0149172
号を参照されたい。リパーゼに対するCLEC及びCLEA技術の応用の議論について
は、A. M. Anderson, Biocat. Biotransform, 16:181(1998) 及びP.Lopez-Serrano et al., Biotechnol. Lett. 24:1379-83(2002) も参照されたい。前述の参照文献の全開示は、すべての目的について、参照により本明細書に取り込まれる。
【0129】
反応混合物は、単一相を含んでなることができ、又は多相(例えば、2又は3相システム)を含んでなることができる。それ故、例えば、図1に示した鏡像体選択的加水分解は、酵素、最初の内はラセミ体基質(式4)、望まれない光学活性ジエステル(式5)、及び所望の光学活性ジカルボン酸モノエステル(式3)を含有する、単一水性相で起こすことができる。もしくは、反応混合物は、固体相(例えば、酵素又は生成物)と接触する水性相、有機層と接触する水性相、有機層及び固体相と接触する水性相を含む、多相システムを含んでなることができる。例えば、鏡像体選択的加水分解は、酵素を含有する固体相、最初の内はラセミ体基質、望まれない光学活性ジエステル、及び所望の光学活性ジカルボン酸モノエステルを含有する水性相、を含んでなる2相システム中で実施することができる。
【0130】
また、鏡像体選択的加水分解は、酵素を含有する固体相、最初の内はラセミ体基質(式4)を含有する有機層、及び最初の内は少しのラセミ体基質を含有する水性相、を含んでなる3相システム中で実施することができる。所望の光学活性ジカルボン酸モノエステル
(式3)は、未反応光学活性ジエステル(式5)よりも低いpKaを有しており、そしてそれ故により大きな水性溶解度を示すので、反応が進行するにつれて、有機相は未反応ジエステルで富化されるようになり、一方、水性相は所望のジカルボン酸モノエステルで富化されるようになる。
【0131】
鏡像体選択的加水分解で使用される、ラセミ体基質(式4)及び生物触媒の量は、中でも、特定のシアノ−置換ジエステル及び酵素の特性に依存するであろう。しかしながら一般に、反応は、約0.1M〜約3.0Mの初期濃度を有する、及び多くの場合、約1.5M〜約3.0Mの初期濃度を有する基質を用いることができる。追加として、反応は一般に、約1%〜約10%の酵素添加を用いることができ、そして多くの場合、約3%〜約4%(v/v)の酵素添加を用いることができる。
【0132】
鏡像体選択的加水分解は、広範囲の温度及びpHに渡って実行することができる。例えば、反応は、約10℃の温度から約50℃の温度で実行することができるが、典型的には、RT近辺で実行される。こうした温度は、一般に、酵素を不活性化させることなく、妥当な時間で(約2h〜約24h)ラセミ化合物(式4)の実質的に完全な変換を可能にする。その上、鏡像体選択的加水分解は、約5のpHから約10のpH、より典型的には、約6のpHから約9のpH、そしてしばしば約6.5のpHから約7.5のpHで実行することができる。
【0133】
pH調節を行わないと、反応混合物pHは、ジカルボン酸モノエステル(式3)の形成のため、基質(式4)の加水分解につれて低下するであろう。この変化を相殺するため、加水分解反応は、内部pH調節で(即ち、適した緩衝液存在下で)行うことができ、又は塩基の添加を通した外部pH調節で行うこともできる。適した緩衝液には、リン酸カリウム、リン酸ナトリウム、酢酸ナトリウム、酢酸アンモニウム、酢酸カルシウム、BES、BICINE、HEPES、MES、MOPS、PIPES、TAPS、TES、TRICINE、Tris、TRIZMA(登録商標)、又は約6のpKa〜約9のpKaを有する他の緩衝液が含まれる。緩衝液濃度は、一般に約5mM〜約1mMの範囲であり、そして典型的には約50mM〜約200mMの範囲である。適した塩基には、約0.5M〜約15Mの範囲にわたる、又はより典型的には、約5M〜約10Mの範囲にわたる濃度を有する、KOH、NaOH、NH4OHその他を含んでなる水性溶液が含まれる。酢酸カルシウムのような他の無機添加物もまた使用することができる。
【0134】
ラセミ化合物(式4)の酵素的変換後に又は間に、所望の光学活性ジカルボン酸モノエステル(式3)を、標準技術を使用して生成物混合物から単離する。例えば、単一(水性)相バッチ反応の場合、生成物混合物をヘキサン又はヘプタンのような非極性有機溶媒で一回またはそれより多くの回数抽出することができ、それは所望のジカルボンモノエステル(式2)及び未反応ジエステル(式5)を、それぞれ、水性及び有機相に分離する。もしくは、水性及び有機相を用いる多相反応の場合、それぞれ、所望のモノエステル(式3)及び未反応ジエステル(式5)が富化され、モノエステル及びジエステルを、反応後にバッチ様式で分離することができ、又は鏡像体選択的加水分解の間に、半連続的又は連続的に分離することができる。
【0135】
図1に示したように、未反応ジエステル(式5)を有機相から単離することができ、そしてラセミ化させてラセミ体基質(式4)が生成される。生じたラセミ化合物(式4)は、リサイクルする又は未変換ラセミ体基質と混合することができ、それは続いて上記のような、式3への酵素的変換を受ける。未反応ジエステル(式5)のリサイクリングは、鏡像体選択的加水分解の全収率を50%より大きく増加させ、それにより本方法のアトムエコノミーを増加させ、望まれない鏡像体の廃棄に付随するコストを低下させる。
【0136】
ジエステル(式5)を、マロネート部分の酸性α−プロトンを引き抜くのに十分強い塩基で処理すると、不斉中心の反転、及びラセミ体基質(式4)の発生を生じる。有用な塩基には、アルコキシド(例えば、ナトリウムエトキシド)のような有機塩基、直鎖脂肪族アミン、及び環状アミン、及びKOH、NaOH、NH4OHなどのような無機塩基が含まれる。反応は、EtOHのような極性プロトン性溶媒又はMTBEのような非プロトン性極性溶媒を含む、適合性溶媒中で実施する。RTより上の反応温度が、典型的にはラセミ化プロセスの収率を改良する。
【0137】
図1に示したように、実質的に鏡像体純粋ジカルボン酸モノエステル(式3)を、少なくとも三つの異なった方法を使用して、光学活性γ−アミノ酸(式1)へ変換することができる。一つの方法において、モノエステル(式3)を、酸触媒又は塩基触媒の存在下で加水分解して、光学活性シアノ−置換ジカルボン酸(式6)又は対応する塩を生成させる。生じたジカルボン酸(又はその塩)のシアノ部分を還元して、光学活性γ−アミノジカルボン酸(式7)又は対応する塩を生成させ、それを次ぎに酸による処理により、加熱により、又は両方により脱炭酸して、所望の光学活性γ−アミノ酸(式1)を生成させる。シアノ部分は、触媒量のラネーニッケル、パラジウム、白金などの存在下でH2と反応させることにより、又はLiAlH4、BH4−Me2Sなどのような還元剤との反応により還元することができる。加水分解及び脱炭酸反応に有用な酸には、HClO4、HI、H2SO4、HBr、HClなどのような鉱酸が含まれる。加水分解反応に有用な塩基には、LiOH、NaOH、KOHなどを含む、多様なアルカリ及びアルカリ土類金属水酸化物及び酸化物が含まれる。
【0138】
別の方法において、ジカルボン酸モノエステル(式3)は還元的環化をうけて、光学活性環状3−カルボキシ−ピロリジン−2−オン(式2)を形成し、それを引き続いて酸で処理すると、所望の鏡像体で富化されたγ−アミノ酸(式1)を生成する。還元的環化は、モノエステル(式3)を、触媒量のラネーニッケル、パラジウム、白金などの存在下でH2と反応させることにより実施することができる。HClO4、HI、H2SO4、HBr及びHClのような鉱酸、及びHOAc、TFA、p−TSAなどのような有機酸を含む、一つまたはそれより多くの酸を、生じたラクタム酸(式2)を加水分解及び脱炭酸するために使用できる。酸の濃度は、約1N〜約12Nの範囲であることができ、そして酸の量は、約1当量〜約7当量の範囲であることができる。加水分解及び脱炭酸反応は、RT近辺又はより高い温度で、又は約60℃又はより高い温度で、又は約60℃〜約130℃の範囲の温度で実施することができる。
【0139】
第三の方法においては、上記のように、ジカルボン酸モノエステル(式3)のエステル部分を最初に加水分解してシアノ−置換ジカルボン酸(式6又はその塩)を得る。生じたジカルボン酸(又はその塩)は次ぎに、脱炭酸して光学活性シアノ−置換カルボン酸又はその塩(式8においてR5は水素原子であるが、後で示すようにR5は、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルであってもよい)を得る。ラクタム酸(式2)又はγ−アミノジカルボン酸(式7)を脱炭酸するために使用されたものと同一条件を使用することができる。最初にエステル部分を加水分解する代わりに、ジカルボン酸モノエステル(式3)を、ジカルボン酸モノエステル(塩として)の水性溶液を、約50℃から還流温度へ加熱することにより、シアノ−置換モノエステル(式8)へ直接最初に脱炭酸することができる。クラプチョ(Krapcho )条件(DMSO/NaCl/水)もまた使用することができる。いずれの場合も、式8の化合物のシアノ部分を次ぎに還元して光学活性γ−アミノ酸(式1)を得る。ラネーニッケルに加え、式3、6及び8の化合物のシアノ部分を還元するため、多数の他の触媒を使用することができる。これらには、限定ではなく、Al2O3、C、CaCO3、SrCO3、BaSO4、MgO、SiO2、TiO2、ZrO2などを含む、多様な材料上に典型的には支持されている、酸化物を含むNi、Pd、Pt、Rh、Re、Ru及びIrのような遷移金属
及びそれらの組み合わせを、重量で約0.1%〜約20%、そしてより典型的には、約1%〜約5%含有する、不均一な触媒が含まれる。Pdを含んで、これらの金属の多くは、アミン、スルフィド、又はPb、Cu又はZnのような第二の金属にドープすることができる。それ故、有用な触媒には、重量に基づいて、約1%〜約5%のPdを含有する、Pd/C、Pd/SrCO3、Pd/Al2O3、Pd/MgO、Pd/CaCO3、Pd/BaSO4、PdO、Pd黒、PdCl2のようなパラジウム触媒が含まれる。他の有用な触媒には、Rh/C、Ru/C、Re/C、PtO2、Rh/C、RuO2などが含まれる。
【0140】
シアノ部分の触媒還元は、典型的には、限定ではなく、MeOH、EtOH、IPA、THF、EtOAc及びHOAcのような、水、アルコール、エーテル、エステル及び酸を含む、一つまたはそれより多くの極性溶媒の存在下で実施する。反応は、約5℃〜約100℃の範囲の温度で実施することができるが、RTでの反応が普通である。一般に、基質−触媒比は、重量に基づいて、約1:1〜約1000:1の範囲であることができ、そしてH2圧は、ほぼ大気圧、0psig〜約1500psigの範囲であることができる。より典型的には、基質−触媒比は、約4:1〜約20:1の範囲であり、そしてH2圧は、約25psig〜約150psigの範囲である。
【0141】
すべての前記の方法を、実質的に鏡像体純粋なモノエステル(式3)を光学活性γ−アミノ酸(式1)へ変換するために使用することができるが、それぞれは、他に対して特定の利点を有している。例えば、還元的環化を用いているプロセスの酸後処理に続いて、ラクタム酸(式2)を、有機溶媒中に抽出することにより単離する及び精製することができるが、一方、シアノ−置換ジカルボン酸(式6)は、その比較的により高い水性溶解度のため、単離するのがより困難である。ラクタム酸(式2)の単離は、最終生成物混合物内への水溶性不純物の持ち越しを減少させ、加水分解及び脱炭酸の間のより高い反応体濃度を可能にし(例えば、約1M〜約2M)、それによりプロセス処理量を増加させる。その上、ジカルボン酸モノエステル(式3)の水性溶液の加熱による直接脱炭酸は、シアノモノエステル(式8)を高い鏡像体純度で与える。この化合物は、有機溶媒中への抽出により又は直接相分離により、反応媒質から分離することが可能であり、水相による無機不純物の効果的な除去を確実にしている。高反応処理量及び強酸性条件の回避は、このアプローチの二つの利点である。
【0142】
図2は、図1に示された酵素的鏡像体選択的加水分解の基質として働くことができる、シアノ−置換ジエステル(式4)を製造するためのプロセスを例示している。プロセスは、触媒量の塩基存在下、非対称ケトン又はアルデヒド(式17)とマロン酸ジエステル(式18)を反応させて、α,β−不飽和マロン酸ジエステル(式19)(式中、R1、R2、R3及びR4は、式1に関連して上で定義した通りである)を生成させることを含んでなる、交差アルドール縮合を含む。この型の交差アルドール反応は、クネーベナーゲル縮合として知られており、それは多数の文献総説に記載されている。例えば、その全開示が、すべての目的について、参照により本明細書に取り込まれる、B. K. Wilk, Tetrahedron 53:7097-7100 (1997) 及びそこで引用されている参照文献を参照されたい。
【0143】
一般に、ジ−n−プロピルアミン、ジ−i−プロピルアミノ、ピロリジンその他、及びその塩のような第二アミンを含む、マロン酸ジエステル(式18)からエノラートイオンを発生させることが可能ないずれの塩基も使用することができる。反応は、生成物を中和するため、及び非対称ケトン又はアルデヒド(式17)のエノール化を最少にするため、HOAcのようなカルボン酸を含むことができる。非対称ケトンを含んでいる反応はまた、反応を容易にするため、四塩化チタン、塩化亜鉛、酢酸亜鉛などのようなルイス酸を用いることができる。反応は典型的には、還流条件下、炭化水素溶媒中で実行する。有用な溶媒には、水の共沸的除去を伴う、ヘキサン、ヘプタン、シクロヘキサン、トルエン、メ
チルt−ブチルエーテルなどが含まれる。
【0144】
続いての反応において、HCN、アセトンシアノヒドリン、アルカリ金属シアン化物(NaCN、KCN、その他)、又はアルカリ土類金属シアン化物(マグネシウムシアニド、その他)のようなシアン化物源は、α,β−不飽和マロン酸ジエステル(式19)のβ−炭素への共役付加をうける。反応は典型的には、一つまたはそれより多くの、EtOH、MeOH、n−プロパノール、イソプロパノールを含む極性プロトン性溶媒、又はDMSOなどのような極性非プロトン性溶媒中で実施する。続いての酸後処理で、シアノ−置換ジエステル(式4)を得る。プレガバリン前駆体(式12)を製造するために、図2に示した方法の応用については、その全体が、及びすべての目的について、参照により本明細書に取り込まれる、Grote et al による米国特許第5,637,767 号を参照されたい。
【0145】
本明細書に開示されたいずれの化合物の望まれる(S)−又は(R)−鏡像体も、古典的分割、キラルクロマトグラフィー又は再結晶によりさらに富化することができる。例えば、光学活性γ−アミノ酸(式1又は式9)を、鏡像体で純粋な化合物(例えば、酸又は塩基)と反応させることができて、それぞれが単一の鏡像体から構成される、対のジアステレオ異性体を生成し、それを、例えば、分別再結晶又はクロマトグラフィーにより分離する。続いて所望の鏡像体を適切なジアステレオ異性体から再生させる。追加として、所望の鏡像体はしばしば、十分な量(例えば、典型的には約85%eeよりそれほど少なくない、いくつかの場合には、約90%eeよりそれほど少なくない)で入手可能な場合、適した溶媒での再結晶により、さらに富化することができる。
【0146】
本明細書を通して記述されているように、開示された化合物の多くは、立体異性体を有する。これらの化合物のいくつかは、単一の鏡像体(鏡像体純粋化合物)又は鏡像体の混合物(富化された又はラセミ体試料)として存在することができ、それは、試料中の別の鏡像体に対する一つの鏡像体の相対的過剰に依存して、光学活性を示すことができる。重ねることができない鏡像であるこうした立体異性体は、不斉軸又は一つまたはそれより多くの不斉中心(即ち、キラリティー)を所有する。他の開示された化合物は、鏡像ではない立体異性体であることができる。ジアステレオ異性体として知られているこうした立体異性体は、キラル又はアキラルであることができる(不斉中心を含有していない)。これらには、シス/トランス(又はZ/E)立体異性体が可能である、アルケニル又は環状基を含有する分子、又は一つの不斉中心の反転が対応するジアステレオ異性体を発生する、二つ又はそれより多い不斉中心を含有する分子、が含まれる。記述され又はさもなくば明白でないかぎり(例えば、立体結合の使用、立体中心記述その他により)、本発明の範囲は、基準化合物、及びそれらがそれぞれ純粋であるにせよ(例えば、鏡像体純粋)又は混合物(鏡像体的に富化された又はラセミ体の)であるにせよ、その立体異性体を一般に含む。
【0147】
いくつかの化合物は、また、ケト又はオキシム基も含有し、そのため互変異性を生じることができる。このような場合、本発明は、それらがそれぞれ純粋であるにせよ又は混合物であるにせよ、互変異性形態を一般に含む。
【0148】
式1及び式9で表された化合物を含む本開示に記載されている多くの化合物は、薬学的に許容できる塩を形成できる。これらの塩には、限定ではなく、塩酸、硝酸、リン酸、硫酸、臭化水素酸、ヨウ化水素酸、フッ化水素酸、亜リン酸などのような無機酸から誘導された無毒性塩、ならびに、脂肪族モノ−及びジカルボン酸、フェニル置換アルカン酸、ヒドロキシアルカン酸、アルカン二酸、芳香族酸、脂肪族及び芳香族スルホン酸その他のような有機酸から誘導された無毒性塩が含まれる。それ故、こうした塩には、硫酸塩、ピロ硫酸塩、重硫酸塩、亜硫酸塩、亜硫酸水素塩、硝酸塩、リン酸塩、リン酸一水素塩、リン酸二水素塩、メタ燐酸塩、ピロ燐酸塩、塩化物、臭化物、ヨウ化物、酢酸塩、トリフルオ
ロ酢酸塩、プロピオン酸塩、カプリル酸塩、イソ酪酸塩、シュウ酸塩、マロン酸塩、コハク酸塩、スベリン酸塩、セバシン酸塩、フマル酸塩、マレイン酸塩、マンデル酸塩、安息香酸塩、クロロ安息香酸塩、メチル安息香酸塩、ジニトロ安息香酸塩、フタル酸塩、ベンゼンスルホン酸塩、トルエンスルホン酸塩、フェニル酢酸塩、クエン酸塩、乳酸塩、リンゴ酸塩、酒石酸塩、メタンスルホン酸塩などが含まれる。
【0149】
薬学的に許容できる塩基塩には、アルカリ又はアルカリ土類金属カチオンのような金属カチオン、ならびにアミンを含む塩基から誘導された無毒性塩が含まれる。適した金属カチオンの例には、限定ではなく、ナトリウムカチオン(Na+)、カリウムカチオン(K+)、マグネシウムカチオン(Mg2+)、カルシウムカチオン(Ca2+)などが含まれる。適したアミンの例には、限定ではなく、N,N’−ジベンジルエチレンジアミン、クロロプロカイン、コリン、ジエタノールアミン、ジシクロヘキシルアミン、エチレンジアミン、N−メチルグルカミン、プロカイン及びt−ブチルアミンが含まれる。有用な酸付加及び塩基塩の議論については、S. M. Berge et al., "Pharmaceutical Salts," 66 J. of Pharm. Sci., 1-19 (1977); see also Stahl and Wermuth, Handbook of Pharmaceutical Salts: Properties, Selection, and Use (2002) を参照されたい。
【0150】
化合物の遊離塩基(又は遊離酸)又は双性イオンと十分な量の所望の酸(又は塩基)を接触させて、無毒性塩を生成させることにより、薬学的に許容できる酸付加塩(又は塩基塩)を製造することができる。もし塩が溶液から沈殿するならば、それを濾過により単離することができ;もしくは、溶媒を蒸発させることにより、塩を回収することができる。また、酸付加塩と塩基(又は塩基塩と酸)を接触させることにより、遊離塩基(又は遊離酸)を再生することもできる。遊離塩基(又は遊離酸)及びそのそれぞれの酸付加塩(又は塩基塩)の特定の物理的性質は異なっていてもよいが(例えば、溶解度、結晶構造、吸湿性その他)、化合物の遊離塩基及び酸付加塩(又はその遊離酸及び塩基塩)は、他の点では本開示の目的について同一である。
【0151】
開示され特許請求された化合物は、未溶媒和及び溶媒和形の両方、そして塩以外の他の型の複合体として、存在することができる。有用な複合体には、クラスレート、又は化合物及びホストが化学量論的又は非化学量論的量で存在する場合の化合物−ホスト複合体が含まれる。有用な複合体はまた、化学量論的又は非化学量論的量で、二つ又はそれより多くの有機、無機又は有機及び無機構成要素を含むことができる。生じた複合体は、イオン化、部分イオン化、又は非イオン化することができる。こうした複合体の総説については、J. K. Haleblian, J. Pharm. Sci. 64(8):1269-88 (1975) を参照されたい。薬学的に
許容できる溶媒和物はまた、結晶化溶媒を同位元素で置換することができる(例えば、D2O、d6−アセトン、d6−DMSOその他)、水和物及び溶媒和物を含む。一般に、本開示の目的についても、化合物の未溶媒和形態に関する言及はまた、化合物の対応する溶媒和又は水和形態も含む。
【0152】
開示された化合物はまた、少なくとも一つの原子が、同一の原子番号を有しているが、原子質量が天然に通常観察される原子質量とは異なっている、全ての薬学的に許容できる同位元素変異体も含む。開示された化合物での包含に適した同位元素の例には、限定ではなく、2H及び3Hのような水素の同位元素;13C及び14Cのような炭素の同位元素;15Nのような窒素の同位元素;17O及び18Oのような酸素の同位元素;31P及び32Pのようなリンの同位元素;35Sのような硫黄の同位元素;18Fのようなフッ素の同位元素;36Clのような塩素の同位元素が含まれる。同位元素変異体(例えば、重水素、2H)の使用は、より大きな代謝的安定性から生じる特定の療法的利点、例えば、増加したインビボ半減期又は減少した用量要求性、を与えることができる。追加として、開示された化合物の特定の同位元素変異体は放射性同位元素(例えば、トリチウム、3H、又は14C)を取り込むことができ、それは薬剤及び/又は基質分布研究で有用であ
ることができる。
【実施例】
【0153】
以下の実施例は、例示及び非制限的であることが意図されており、本発明の具体的態様を表している。
【0154】
一般的な方法及び材料
その全開示が参照により本明細書に取り込まれる、D. Yazbeck et al Synth. Catal. 345:524−32 (2003) に記載されている酵素スクリーニングを、96−ウェルプレートを使用して実施した。スクリーニングプレートで使用されたすべての酵素(表2を参照されたい)は、Amano(Nagoya, Japan), Roche(Basel, Switzerland), Novo Nordisk (Bagsvaerd, Denmark), Altus Biologics Inc. (Cambridge, MA), Biocatalytics (Pasadena, CA), Toyobo (Osaka, Japan), Sigma−Aldrich (St. Louis, MO)及びFluka (Buchs, Switzerland) を含む、商業的酵素供給元から得た。スクリーニング反応は、Eppendorf Thermomixer−R (VWR) 中で実行した。続いての大規模酵素分割は、Novo−Nordisk A/S (CAS no. 9001-62-1) から入手可能な、LIPOLASE(登録商標) 100L及びLIPOLASE(登録商標)100T を用
いた。
【0155】
核磁気共鳴
300MHz1H NMR及び75MHz13C NMRスペクトルは、5mmオートスィッチャブルPHQNPプローブを備えた、BRUKER 300 UltraShieldTM で得た。スペ
クトルは、一般にほぼRTで収集し、標準オートロック、オートシム及びオートゲインの日常の操作手順を用いた。1D実験については、試料を通常20Hzで回転させた。1H
NMRスペクトルは、30度励起アングルパルス、1.0秒リサイクル遅延、及び0.25Hz/ポイントの分解能で16スキャン、を使用して収集した。収集幅は、典型的には、+18〜−2ppm(基準TMSを0ppm)の8000Hzであり、プロセシングは0.3Hzラインブロードニングであった。典型的な収集時間は5〜10秒であった。通常の13C NMRスペクトルは、30度励起アングルパルス、2.0秒リサイクル遅延、及び1Hz/ポイントの分解能で2048スキャン、を使用して収集した。収集幅は、典型的には、+235〜−15ppm(基準TMSを0ppm)の25kHzであった。プロトンデカップリングを連続的に適用し、プロセシングの間、1Hzラインブロードニングを適用した。典型的な収集時間は102分であった。
【0156】
質量分析法
質量分析は、HP Chemstation Plus ソフトウェアーを使用し、HEWLETT PACKARD 1100MSDで実施した。LCは、Agilent 1100 クォータナリーLCシステム及びオートサンプラーとしてAgilent リキッドハンドラーを備えていた。データは、溶媒としてACN/水(0.1%ギ酸含有)(10%ACNから90%へ、7分)を用いる、エレクトロンスプレーイオン化で収集した。温度:プローブは350℃であり、イオン源は150℃であった。コロナ放電は陽イオンについて3000Vそして陰イオンについて3000Vであった。
【0157】
高速液体クロマトグラフィー
高速液体クロマトグラフィー(HPLC)は、Agilent 220 HPLC オートサンプラー、
クォータナリーポンプ及びUV検出器を備えた、シリーズ1100 AGILENT TECHNOLOGIES 装置で実施した。LCは、HP Chemstation Plus ソフトウェアーを使用してPC制御されていた。順相キラルHPLC分離は、Chiral Technologies (Exton, PA) 及びPhenomenex (Torrance, CA) により得たChiral HPLC カラムを使用して実施した。
【0158】
ガスクロマトグラフィー
ガスクロマトグラフィー(GC)は、電位計を有するFID検出器、7683 Series スプ
リット/スプリットレスキャピラリーインジェクター、4外部事象をモニターするリレーボード、及びインボードプリンター/プロッターを備えた、110ボルトAgilent 6890N ネットワークGCシステムで実施した。ジエステル(式13,R3=R4=Et)及びモノエステル(式11,R3=Et)の鏡像体過剰率は、ヘリウムキャリアガスを用い、135℃で、CHIRALDEX G−TA カラム (30m x 0.25mm) を使用して実施した。こうした条件下、モノエステルは分解して(S)−3−シアノ−5−メチル−ヘキサン酸エチルエステルを与え、そしてeeを、分解生成物に基づいて決定した。分析に使用されたキラルGCカラムは、Astec, Inc (Whippany, NJ) から得た。
【0159】
実施例1.(R/S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式20)の酵素的加水分解を経て(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸(式21)を生成する酵素スクリーニング
【0160】
【化18】

【0161】
酵素スクリーニングは、前もってD. Yazbeck et al Synth. Catal. 345:524−32(2003)
に記載されている方法に従って調製され、96−ウェルプレート中に加えられた個々の
酵素を含んでなる、スクリーニングキットを使用して実施した。各ウェルは0.3mlの空容量を有していた(浅いウェルプレート)。96−ウェルプレートの一つのウェルはリン酸緩衝液(10μL、0.1M、pH7.2)のみを含んでおり、別のウェルはACN(10μL)のみを含んでおり、そして残りのウェルの各々は、表2に列挙した94の酵素の一つを含んでいる(10μL、100mg/mL)。使用に先だって、スクリーニングキットを−80℃での貯蔵庫から取りだし、酵素をRTで5分融解させた。リン酸カリウム緩衝液(85μL、0.1M、pH7.2)を、多チャンネルピペットを使用してウェル内へ分配した。次ぎに濃縮基質(式20、5μL)を、多チャンネルピペットにより各ウェルへ加え、96の反応混合物を、30℃及び750rpmでインキュベートした。反応混合物の各々を第二の96−ウェルプレートの別のウェル内へ移すことにより、24時間後に反応をクエンチし、そして試料採取した。ウェルのそれぞれは、2mLの空容量を有しており(深いウェルプレート)、そしてEtOAc(1mL)及びHCl(1N、100μL)を含有していた。各ウェルの成分を、ピペットでウェル内容物を吸引することにより混合した。第二のプレートを遠心分離し、100μLの有機上清を各ウェルから第三の96−ウェルプレート(浅いプレート)へ移した。次ぎに、第三のプレートのウェルを、貫通可能マットカバーを使用して封じた。ウェルを封じたら、第三のプレートを、光学純度(ee)決定のために、GCシステムへ移した。
【0162】
表3は、スクリーニングされたいくつかの酵素の、酵素名、商標、供給元及びE値を列挙している。与えられた酵素について、E値は、対の鏡像体(基質)の相対反応性として解釈することができる。表3に列挙したE値は、University of Graz から入手された、
Ee2と称されるコンピュータープログラムを使用して、HPLCデータ(転化率、χ及びee)から計算した。一般に、S−選択性及び約35又はそれより大きなE値を示している酵素が、スケールアップに適している。
【0163】
【表7】

【0164】
実施例2.(R/S)−3−シアノ−2−エトキシカルボニル5−メチル−ヘキサン酸エチルエステル(式20)の、(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸カリウム塩(式23)及び(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式22)を生成する酵素的分割
【0165】
【化19】

【0166】
オーバーヘッド攪拌機を備えた反応器(392L)に、リン酸カリウム緩衝液(292.2L、10mM、pH8.0)及びLIPOLASE(登録商標)100L、タイプEX(3.9L)を加えた。混合物を800RPMで1分攪拌し、KOH(2M)を加えてpHを8.0に調整した。(R/S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式20、100kg)を加え、生じた混合物は、加水分解の間、8.0のpHを維持するためにNaOH水溶液(50%)で滴定した。反応の程度は、HPLC(C18カラム、4.6mmx150mm、200nmで検出)でモニターした。約40〜45%の変換に達した後(例えば、約24時間後)、反応混合物を分液ロートへ移した。水性混合物をヘプタン(205L)で抽出した。形成した淡い乳濁液を透明にするためEtOH(無水)を加え(約5%v/vまで)、水性及び有機層を分離した。抽出工程を2回繰り返し、(3S)−3−シアノ−2−エトキシカルボニル−5−メ
チル−ヘキサン酸カリウム塩(式23)を含有する水性層はさらに真空下で濃縮することができる(例えば、その本来の容量の25〜50%)。(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式22)を含有する有機層を合わせ、乾燥させ、濃縮した。得られたジエチルエステルは、引き続いて実施例6に従ってラセミ化した。MS m/z [M+H]+227. 1H NMR (300 MHz, D2O): δ 2.35(dd, 6H), 2.70 (t, 3H), 2.85 (m, 1H), 2.99 (m, 1H), 3.25 (m, 1H), 4.75 (m, 1H), 5.60 (q, 2H). 13C
NMR (75 ppm, D2O) δ 172.19, 171.48, 122.85, 62.70, 59.49, 40.59, 31.83, 27.91,
23.94, 21.74, 14.77 。
【0167】
実施例3.(R/S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式20)の、(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸カリウム塩(式23)及び(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式22)を生成する酵素的分割
オーバーヘッド攪拌機を備えた反応器(3.92L)に、酢酸カルシウム緩衝液(1.47L、100mM、pH7.0)及び(R/S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式20、1kg)を加えた。混合物を1100RPMで5分攪拌し、KOH(5M)を加えてpHを7.0に調整した。LIPOLASE(登録商標)100L、タイプEX(75mL)を加え、生じた混合物は、加水分解の間、7.0のpHを維持するためにKOH(5M)で滴定した。反応の程度は、HPLC(C18カラム、4.6mmx150mm、200nmで検出)でモニターした。約42〜45%の変換に達した後(例えば、約20〜25時間後)、反応混合物を分液ロートへ移した。水性混合物をヘキサン(100%v/v)で抽出した。形成した淡い乳濁液を透明にするためEtOH(無水)を加え(約5%v/vまで)、水性及び有機層を分離した。(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸カリウム塩(式23)を含有する水性層を得るため、抽出工程を2回繰り返し、それはさらに精製することなく続いての転換で使用した。(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式22)を含有する有機層を合わせ、乾燥させ、濃縮した。得られたジエチルエステルは、引き続いて実施例6に従ってラセミ化した。
【0168】
実施例4.(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸カリウム塩(式23)からの(S)−4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸(式10)の製造
【0169】
【化20】

【0170】
(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸カリウム塩(式23、411L、実施例2から)を含有する水性溶液を、容器に加えた。混合物にラネーニッケル(50%水溶液、Sigma-Aldrich )を加え、反応を通して容器頭隙を50psigの圧力に維持するため、20時間にわたって、容器内へ水素ガスを導入した。水素添加反応は、H2取り込み及び容器内容物のHPLC分析(C18カラム、4.6mmx150mm、200nmで検出)によりモニターした。反応後、ラネーNi触媒を除去す
るために水性混合物を濾過した。濃縮溶液のpHを、37%HCl(約14L)を使用して3.0に調整した。生じた溶液を、EtOAc(50%v/v)で3回抽出した。合わせた有機層を真空下で濃縮すると、(S)−4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸(式10)を得た。MS m/z [M+H]+186.1130. 13C NMR (75 ppm, CDCl3)
δ175.67, 172.23, 54.09, 47.62, 43.69, 37.22, 26.31, 23.34, 22.54 。収率40〜42%;97%ee。
【0171】
実施例5.(S)−4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸(式10)からのプレガバリン(式9)の製造
【0172】
【化21】

【0173】
反応容器(60L)に、(S)−4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸(式10)、HCl(36〜38%、30L)及び水(29L)を加えた。HOAc(1L)を溶液に加え、生じたスラリーを、80℃に36〜38時間、そしてさらに110℃に6時間加熱した。反応の程度は、HPLC(C18カラム、4.6mmx150mm、200nmで検出)でモニターした。水及び過剰のHClを蒸発させると油状物を得、MTBE(2x15L)で洗浄した。油状物に水を加え、溶液が透明になるまで混合物を攪拌した。KOH(約6kg)を使用して、溶液のpHを5.2〜5.5に調整すると、プレガバリンの沈殿を生じた。混合物を80℃まで加熱し、続いて4℃まで冷却した。10時間後、結晶性プレガバリンを濾過し、IPA(12L)で洗浄した。濾液を真空下で濃縮すると、油状物残渣を得た。油状物残渣に水(7.5L)及びEtOH(5.0L)を加え、生じた混合物を80℃まで加熱し、続いて4℃まで冷却した。10時間後、第二のプレガバリン結晶を濾過し、IPA(1L)で洗浄した。合わせたプレガバリン結晶を真空オーブン中、45℃で24時間乾燥した。MS m/z [M+H]+160.1340. 1H NMR (300 MHz, D2O): δ 2.97(dd, J = 5.4, 12.9 Hz, 1H), 2.89 (dd, J = 6.6, 12.9 Hz, 1H),
2.05-2.34 (m, 2H), 1.50-1.70 (sept, J = 6.9 Hz, 1H), 1.17 (t, J = 7.0 Hz, 2H), 0.85 (dd, J = 2.2, 6.6 Hz, 6H). 13C NMR (75 ppm, D2O) δ181.54, 44.32, 41.28, 32.20, 24.94, 22.55, 22.09 。収率80〜85%;ee>99.5%。
【0174】
実施例6.(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式22)のラセミ化を経た(R/S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式20)の製造
【0175】
【化22】

【0176】
反応器に、(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式22、49.5kg)及びEtOH(250L)を加えた。ナトリウムエトキシド(21%w/w EtOH溶液、79.0L、1.1当量)を混合物に加え、80℃に20時間加熱した。反応完了後、混合物をRTまで冷却し、HOAc(12.2L)を加えることにより中和した。EtOHの蒸発後、MTBE(150L)を混合物に加え、得られた溶液を濾過し、蒸発させると、(R/S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式20)を定量的収率で得た。
【0177】
実施例7.(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸(式21)からの(S)−3−シアノ−5−メチル−ヘキサン酸エチルエステル(式24)の製造
【0178】
【化23】

【0179】
50mL丸底フラスコに、(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸(式21、3.138g、13.79mmol)、NaCl(927mg、1.15当量)、脱イオン水(477μL、1.92当量)及びDMSO(9.5mL)を加えた。生じる混合物を88℃に加熱し、その温度に17時間維持した。LC及びLC/MS分析のために試料をとると、それは出発物質(式21)及び生成物(式24及び式25)の存在を示した。混合物の温度をその後135℃に上げ、さらに3.5時間反応させた。LC及びLC/MS分析のために2回目の試料をとると、それは出発物質(式21)の存在は示さず、そして所望の生成物(式24及び式25)に加えて、未同定の副産物の存在を示した。(S)−3−シアノ−5−メチル−ヘキサン酸エチルエステル(式24):88℃の後、97.4%ee、135℃の後、97.5%ee。
【0180】
実施例8.(S)−4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸(式10)の光学純度(ee)の測定
(S)−4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸(式10)の光学純度(ee)は、誘導体化法により決定した。(S)−4−イソブチル−2−オキソ−ピロリジン−3−カルボン酸を、70℃のジオキサン中、触媒量の乾燥HClの存在下、EtOHでエステル化した。生じたラクタムエステルを、ヘキサン及びEtOH(95:5
)の移動相、1.0mL/分の流速、10μLの注入量、35℃のカラム温度、及び200nmでの検出を使用するHPLC(CHIRALPAK AD-H 、4.6mmx250mm)によ
り分析した。
【0181】
実施例9.プレガバリン(式9)の光学純度(ee)の測定
プレガバリンの光学純度は、誘導体化法により決定した。プレガバリン試料を、Marfey試薬(1−フルオロ−2−4−ジニトロフェニル−5−L−アラニンアミド)で誘導体化し、NaPO4水溶液(20nM、pH2.0)及びACN(90:10で10分、10:90で3分、90:10で5分)の移動相、1.2mL/分の流速、10μLの注入量、35℃のカラム温度、及び200nmでの検出を使用するHPLC(LUNA C18(2)カラム、0.46mmx150mm、3μm)により分析した。
【0182】
実施例10.(R/S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式20)の、(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸ナトリウム塩(式23)及び(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式22)を生成する酵素的分割
【0183】
【化24】

【0184】
オーバーヘッド攪拌機を備えた反応器(16000L)に、酢酸カルシウム(254kg)、脱イオン水(1892.7kg)及びLIPOZYME(登録商標)TL100L(食品用LIPOLASE(登録商標)、983.7kg)を加えた。完全に混合後、(R/S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式20,9000kg、85%純度アッセイ)を加え、混合物を24時間攪拌した。pHを7.0に維持するため、反応の経過中、NaOH(2068kgの30%溶液)を加えた。反応の程度は、HPLC(C18カラム、4.6mmx150mm、200nmで検出)でモニターした。約42〜45%の変換に達した後(例えば、約20〜25時間後)、滴定及び攪拌を停止した。有機層を直ちに分離し、水層をトルエン(780kg)で2回洗浄した。(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸ナトリウム塩(式23)を含有する水層は、単離することなく続いての転換(実施例11)で使用した。(R)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸エチルエステル(式22)を含有する有機層を合わせて、濃縮した。生じたジエチルエステルは、実施例6に従って、続いてラセミ化した。
【0185】
実施例11.(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸ナトリウム塩(式23)からの(S)−3−シアノ−5−メチル−ヘキサン酸エチルエステル(式24)の製造
【0186】
【化25】

【0187】
オーバーヘッド攪拌機を備えた反応器(16000L)に、実施例10からの最終水性溶液(9698.6L、(3S)−3−シアノ−2−エトキシカルボニル−5−メチル−ヘキサン酸ナトリウム塩、式23を含有する)、NaCl(630kg)及びトルエン(900L)を加えた。還流条件下(75〜85℃)、混合物を2時間攪拌した。攪拌を停止し;有機層を直ちに分離し、水層をトルエン(900L)で2回洗浄した。(S)−3−シアノ−5−メチル−ヘキサン酸エチルエステル(式24)を含有する有機層を合わせ、濃縮した。エチルエステル(式24)は続いて、実施例12に従って加水分解した。
【0188】
実施例12.(S)−3−シアノ−5−メチル−ヘキサン酸エチルエステル(式24)からの(S)−3−シアノ−5−メチル−ヘキサン酸カリウム塩(式26)の製造
【0189】
【化26】

【0190】
オーバーヘッド攪拌機を備えた反応器(12000L)に、(S)−3−シアノ−5−メチル−ヘキサン酸エチルエステル(式24、2196L、実施例11から)を加えた。KOH(1795.2kg、45%溶液、w/w)及びH2O(693.9kg)を、激しく攪拌しながら反応混合物に加えた。温度を25℃に維持した。4時間後、さらに後処理せずに、反応混合物を水素添加容器(実施例13)に加えた。
【0191】
実施例13.(S)−3−シアノ−5−メチル−ヘキサン酸カリウム塩(式26)からのプレガバリン(式9)の製造
【0192】
【化27】

【0193】
水素添加装置(12000L)に、水(942.1L)及び(S)−3−シアノ−5−メチル−ヘキサン酸カリウム塩を含有する、実施例12からの反応混合物(式26、41
22.9L)を加えた。ラネーニッケル懸濁液(219.6kg、50%w/w H2O溶液)を加えた。水素添加は、50psig圧、35℃で実施した。6時間後、ラネーニッケルを濾過し、そして生じた濾液を、結晶化のために反応器(16000L)に移した。H2O(1098L)添加後、溶液のpHを、HOAc(864.7kg)を使用して7.0〜7.5に調整した。生じた沈殿を濾過し、H2O(549L)で1回及びIPAで2回(各2,586L)洗浄した。固形物を、IPA(12296L)及びH2O(6148L)から再結晶した。混合物を70℃に加熱し、そして4℃まで冷却した。5〜10時間後、結晶性固形物を濾過し、IPA(5724L)で洗浄し、真空オーブン中、45℃で24時間乾燥させると、プレガバリンを結晶性固形物として得た(1431kg、30.0%総収率、99.5%の純度及び99.75%ee)。
【0194】
本明細書及び付随する特許請求の範囲で使用される、「a」、「an」及び「the」のような単数形の冠詞は、文脈が明瞭に示さなければ、一つの目的語又は複数の目的語を指すことに注意すべきである。それ故、例えば、「a compound」を含んでいる文章の指示は、単一の化合物、又は二つ又はそれより多くの化合物を含むことができる。上記の記述は、例示でありそして限定するものではないことが意図されていることを理解すべきである。上記の記述を読むと、多くの態様が当業者には明らかになるであろう。それ故、本発明の範囲は、上記の記述に関して決定されているのではなく、代わりとして、付随する特許請求の範囲に関して決定されるべきであり、こうした特許請求の範囲が資格を与えた均等物の最大限の範囲を含む。特許、特許出願及び出版物を含む、全ての論文及び参照文献の開示は、その全体が、及び全ての目的について、参照により本明細書に組み入れられる。
【図面の簡単な説明】
【0195】
【図1】図1は、鏡像体的に富化されたγ−アミノ酸(式1)を製造するためのスキームを描いている。
【図2】図2は、シアノ置換ジエステル(式4)を製造するためのスキームを描いている。
【特許請求の範囲】
【請求項1】
式3:
【化1】

(式中、R1及びR2は異なっていて、各々独立して、水素原子、C1〜12アルキル、C3〜12シクロアルキル、及び置換C3〜12シクロアルキルから選択され、そして、R3は、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルである)
の化合物又はその塩を製造する方法であって:
(a)式4:
【化2】

の化合物を、酵素と接触させて、式3の化合物及び式5:
【化3】

の化合物を生成させ、この際、該酵素は、式4の化合物を、式3の化合物又はその塩に鏡像体選択的に加水分解するように適合されており;
(b)式3の化合物又はその塩を単離し;そして
(c)場合により、式5の化合物をラセミ化して、式4の化合物を生成させる
ことを含んでなり、この際、式4及び式5のR1、R2、及びR3は、式3で上に定義した通りであり、そして、式4及び式5のR4は、R3と同一であるか又は異なっていて、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルである方法。
【請求項2】
式27:
【化4】

(式中、R1及びR2は異なっていて、各々独立して、水素原子、C1〜12アルキル、C3〜12シクロアルキル、及び置換C3〜12シクロアルキルから選択され、但し、R1又はR2により表される置換基の一つのが水素原子である場合、他の置換基はメチルではなく、そして、R5及びR6は、水素原子、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルから独立して選択され、但し、R5及びR6は、いずれも水素原子でないなら異なっている)
の化合物であって、その塩を含む化合物。
【請求項3】
式11:
【化5】

(式中、R3は、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルである)
の化合物又はその塩を製造する方法であって、
(a)式12:
【化6】

の化合物を、酵素と接触させて式11の化合物及び式13:
【化7】

の化合物を生成させ、この際、該酵素は、式12の化合物を式11の化合物又はその塩に鏡像体選択的に加水分解するように適合されており;
(b)式11の化合物又はその塩を単離し;そして
(c)場合により、式13の化合物をラセミ化して、式12の化合物を生成させる
ことを含んでなり、この際、式12及び式13のR3は、式11で定義した通りであり、そして、式12及び式13のR4は、R3と同一であるか又は異なっていて、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルである方法。
【請求項1】
式3:
【化1】

(式中、R1及びR2は異なっていて、各々独立して、水素原子、C1〜12アルキル、C3〜12シクロアルキル、及び置換C3〜12シクロアルキルから選択され、そして、R3は、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルである)
の化合物又はその塩を製造する方法であって:
(a)式4:
【化2】

の化合物を、酵素と接触させて、式3の化合物及び式5:
【化3】

の化合物を生成させ、この際、該酵素は、式4の化合物を、式3の化合物又はその塩に鏡像体選択的に加水分解するように適合されており;
(b)式3の化合物又はその塩を単離し;そして
(c)場合により、式5の化合物をラセミ化して、式4の化合物を生成させる
ことを含んでなり、この際、式4及び式5のR1、R2、及びR3は、式3で上に定義した通りであり、そして、式4及び式5のR4は、R3と同一であるか又は異なっていて、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルである方法。
【請求項2】
式27:
【化4】

(式中、R1及びR2は異なっていて、各々独立して、水素原子、C1〜12アルキル、C3〜12シクロアルキル、及び置換C3〜12シクロアルキルから選択され、但し、R1又はR2により表される置換基の一つのが水素原子である場合、他の置換基はメチルではなく、そして、R5及びR6は、水素原子、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルから独立して選択され、但し、R5及びR6は、いずれも水素原子でないなら異なっている)
の化合物であって、その塩を含む化合物。
【請求項3】
式11:
【化5】

(式中、R3は、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルである)
の化合物又はその塩を製造する方法であって、
(a)式12:
【化6】

の化合物を、酵素と接触させて式11の化合物及び式13:
【化7】

の化合物を生成させ、この際、該酵素は、式12の化合物を式11の化合物又はその塩に鏡像体選択的に加水分解するように適合されており;
(b)式11の化合物又はその塩を単離し;そして
(c)場合により、式13の化合物をラセミ化して、式12の化合物を生成させる
ことを含んでなり、この際、式12及び式13のR3は、式11で定義した通りであり、そして、式12及び式13のR4は、R3と同一であるか又は異なっていて、C1〜12アルキル、C3〜12シクロアルキル、又はアリール−C1〜6アルキルである方法。
【図1】


【図2】




【図2】


【公開番号】特開2008−110985(P2008−110985A)
【公開日】平成20年5月15日(2008.5.15)
【国際特許分類】
【出願番号】特願2007−335543(P2007−335543)
【出願日】平成19年12月27日(2007.12.27)
【分割の表示】特願2007−517522(P2007−517522)の分割
【原出願日】平成17年6月9日(2005.6.9)
【出願人】(503181266)ワーナー−ランバート カンパニー リミテッド ライアビリティー カンパニー (167)
【Fターム(参考)】
【公開日】平成20年5月15日(2008.5.15)
【国際特許分類】
【出願日】平成19年12月27日(2007.12.27)
【分割の表示】特願2007−517522(P2007−517522)の分割
【原出願日】平成17年6月9日(2005.6.9)
【出願人】(503181266)ワーナー−ランバート カンパニー リミテッド ライアビリティー カンパニー (167)
【Fターム(参考)】
[ Back to top ]

