プロアポトーシスBAX及びBCL−2ポリペプチドの化学モジュレータ
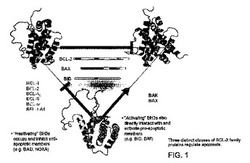
本発明は、BCL−2ファミリーポリペプチドの活性を調節する化合物を同定する方法を提供し、その方法は:a)当該BCL−2ファミリーポリペプチドを、当該BCL−2ファミリーポリペプチドの活性を調節するのに適している条件下で、化合物と接触させること;及びb)化合物による当該BCL−2ファミリーポリペプチドの活性の調節を検出することを含有してなり、ここで化合物は、当該BCL−2ファミリーポリペプチド中のα1螺旋、α2螺旋、α1〜α2間のループ、α6螺旋、並びにα4、α5、及びα8螺旋の選択残基の内の1つ又はそれ以上を含有してなる結合部位と相互作用し;ここで化合物の結合部位との相互作用が、荷電した親水性残基の周辺を有しているか、又は有していない水平な疎水性の溝、上部近傍ループ、下部近傍ループ、或いはこれらの組み合わせの場所で起こる。
Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
方法が:
a)BCL−2ファミリーポリペプチドを、当該BCL−2ファミリーポリペプチドの活性を調節するのに適している条件下で、化合物と接触させること;及び
b)化合物による当該BCL−2ファミリーポリペプチドの活性の調節を検出すること:
を含有してなり、
ここで、化合物は、当該BCL−2ファミリーポリペプチドのα1螺旋、α2螺旋、α1−α2の間のループ、α6螺旋、並びにα4、α5、及びα8螺旋の選択残基の内の1つ又はそれ以上を含有している結合部位と相互作用し;
ここで、化合物の結合部位との相互作用は、荷電した親水性残基の周辺を有しているか、又は有していない水平な疎水性の溝、上部近傍ループ、下部近傍ループ、或いはこれらの組み合わせの場所で起こる、
BCL−2ファミリーポリペプチドの活性を調節する有機分子を同定する方法。
【請求項2】
方法が:
a)当該BAXポリペプチドの結合部位(ここで、結合部位は、α1螺旋、α2螺旋、α1−α2の間のループ、α6螺旋、並びにα4、α5、及びα8螺旋の選択残基の内の1つ又はそれ以上を含有している)を、当該BAXポリペプチドのプロアポトーシス活性を活性化するのに適している条件下で、化合物と接触させること;及び
b)当該化合物による当該BAXポリペプチドの活性化を検出すること:
を含有してなり、
ここで、当該化合物は、配列番号1に記載の配列のGlu17、Gln18、Met20、Lys21、Thr22、Ala24、Leu25、Leu27、Gln28、Gly29、Ile31、Gln32、Asp33、Arg34、Ala35、Gly36、Arg37、Met38、Gly39、Gly40、Glu41、Ala42、Leu47、Asp48、Pro49、Val50、Pro51、Gln52、Asp53、Ala54、Ser55、Thr56、Lys57、Lys58、Leu59、Ser60、Glu61、Lys64、Arg89、Phe92、Phe93、Leu122、Leu125、Thr127、Lys128、Val129、Pro130、Glu131、Leu132、Ile133、Arg134、Thr135、Met137、Gly138、Trp139、Leu141、Asp142、Phe143、Arg145、Glu146、Arg147、Leu149、Gly150、Gly156、Gly157、Trp158、Asp159、Leu161、Leu162に対応する1つ又はそれ以上のアミノ酸残基と結合していて;そして
ここで、化合物の結合部位との相互作用は、荷電した親水性残基の周辺を有しているか、又は有していない水平な疎水性の溝、上部近傍ループ、下部近傍ループ、或いはこれらの組み合わせの場所で起こる、
BAXポリペプチドのプロアポトーシス活性を活性化する有機分子化合物を同定する方法。
【請求項3】
a)当該BCL−2ファミリーポリペプチドの結合部位の三次元構造を用いて(ここで、当該結合部位は、α1螺旋、α2螺旋、α1−α2の間のループ、α6螺旋並びにα4、α5、及びα8螺旋の選択残基の内の1つ又はそれ以上を含有している)、BCL−2ファミリーポリペプチド相互作用テンプレートを形成すること;及び
b.当該BCL−2ファミリーポリペプチド相互作用テンプレートを用いて当該BCL−2ファミリーポリペプチド候補モジュレータを選択すること(ここで、当該候補モジュレータは当該結合部位に結合する):
を含有してなる、
(ここで、候補モジュレータの結合部位との相互作用は、荷電した親水性残基の周辺を有しているか、又は有していない水平な疎水性の溝、上部近傍ループ、下部近傍ループ、或いはこれらの組み合わせの場所で起こる)
BCL−2ファミリーポリペプチドの候補有機分子モジュレータを同定する方法。
【請求項4】
方法が:
c.BAXポリペプチドの結合部位の三次元構造を提供すること(ここで、当該結合部位は、α1螺旋、α2螺旋、α1−α2の間のループ、α6螺旋、並びにα4、α5、及びα8螺旋の選択残基の内の1つ又はそれ以上を含有している);
d.当該結合部位と化合物の間の結合相互作用をシミュレートすること(ここで、化合物の結合部位との相互作用は、荷電した親水性残基の周辺を有しているか、又は有していない水平な疎水性の溝、上部近傍ループ、下部近傍ループ、或いはこれらの組み合わせの場所で起こる);及び
c.当該化合物が、当該結合部位の内の配列番号1に記載の配列のGlu17、Gln18、Met20、Lys21、Thr22、Ala24、Leu25、Leu27、Gln28、Gly29、Ile31、Gln32、Asp33、Arg34、Ala35、Gly36、Arg37、Met38、Gly39、Gly40、Glu41、Ala42、Leu47、Asp48、Pro49、Val50、Pro51、Gln52、Asp53、Ala54、Ser55、Thr56、Lys57、Lys58、Leu59、Ser60、Glu61、Lys64、Arg89、Phe92、Phe93、Leu122、Leu125、Thr127、Lys128、Val129、Pro130、Glu131、Leu132、Ile133、Arg134、Thr135、Met137、Gly138、Trp139、Leu141、Asp142、Phe143、Arg145、Glu146、Arg147、Leu149、Gly150、Gly156、Gly157、Trp158、Asp159、Leu161、Leu162よりなる群から選ばれるアミノ酸残基と結合するか否かを確認すること(ここで、結合部位の当該アミノ酸残基と結合する当該化合物は当該候補化合物である):
を含有してなる、
BAXポリペプチドのプロアポトーシス活性を活性化する候補有機分子化合物を同定する方法。
【請求項5】
当該化合物が有機化合物である、請求項1〜4の何れか一項に記載の方法。
【請求項6】
化合物が表1から選ばれて、更に表1の化合物の誘導体を含有していてもよい(ここで、当該誘導体は結合親和性、活性、溶解性、又はその他の薬理学的特性を改善する)、請求項5に記載の方法。
【請求項7】
当該BCL−2ファミリーポリペプチドがプロアポトーシスポリペプチドである、請求項1又は請求項3に記載の方法。
【請求項8】
当該プロアポトーシスポリペプチドがBAXである、請求項7に記載の方法。
【請求項9】
当該プロアポトーシスポリペプチドがBOK又はBAKである、請求項7に記載の方法。
【請求項10】
当該BCL−2ファミリーポリペプチドがアンチアポトーシスポリペプチドである、請求項1又は請求項3に記載の方法。
【請求項11】
当該アンチアポトーシスポリペプチドが、BCL−2、Bcl−X1、Bcl−w、Mcl−1、BCL−B、A1/Bf1−1、Boo/Diva、Nr−13、Ced−9、ウィルス性同族体、M11L、及びE1B−19Kよりなる群から選ばれる、請求項10に記載の方法。
【請求項12】
当該活性が、プロアポトーシス活性である、請求項1〜4の何れか一項に記載の方法。
【請求項13】
当該活性が、アンチアポトーシス活性である、請求項1〜4の何れか一項に記載の方法。
【請求項14】
当該調節が、当該プロアポトーシス活性の活性化である、請求項1に記載の方法。
【請求項15】
当該調節が、当該プロアポトーシス活性の阻害である、請求項1に記載の方法。
【請求項16】
当該調節が、当該アンチアポトーシス活性の活性化である、請求項1に記載の方法。
【請求項17】
当該調節が、当該アンチアポトーシス活性の阻害である、請求項1に記載の方法。
【請求項18】
工程(b)の検出が、
(A)BCL−2ポリペプチドのオリゴマー化、抗体によるBCL−2ポリペプチド配座異性体の検出、ミトコンドリアチトクロムc放出、リポソーム放出、細胞死、ミトコンドリア又は細胞の形態、ミトコンドリアのカルシウム流出、ミトコンドリアの膜貫通の定量、及びカスパーゼ3活性又はアネキシンV結合の定量よりなる群から選ばれるアッセイ、及び
(B)最適化されたタンパク質発現及び精製条件を通して収率及び安定性を、及びモノマー、ダイマー又はオリゴマーの配座異性体及び種を安定化するポリペプチド突然変異体の作出を最大化するように特別に調製されたBCL−2ポリペプチドタンパク質を使用すること、
を含有してなる、請求項1又は請求項2に記載の方法。
【請求項19】
当該化合物が、結合部位における配列番号1に記載の配列のLys21に対応するアミノ酸残基と結合する、請求項1〜4の何れか一項に記載の方法。
【請求項20】
当該化合物が、結合部位における配列番号1に記載の配列のMet20、Lys21、Ala24、Gln28、Gln32、Glu131、Arg134、Met137、Leu141、Asp142に対応する1つ又はそれ以上のアミノ酸残基と結合する、請求項1〜4の何れか一項に記載の方法。
【請求項21】
当該化合物が、結合部位における配列番号1に記載の配列のGlu17、Met20、Lys21、Thr22、Ala24、Leu25、Leu27、Gln28、Gly29、Ile31、Gln32、Asp33、Leu47、Asp48、Pro49、Val50、Pro51、Gln52、Asp53、Thr56、Arg89、Phe92、Phe93、Pro130、Glu131、Ile133、Arg134、Thr135、Met137、Gly138、Trp139、Leu141、Asp142、Phe143、Arg145、Glu146に対応する1つ又はそれ以上のアミノ酸残基と結合する、請求項1〜4の何れか一項に記載の方法。
【請求項22】
当該化合物が、結合部位における配列番号1に記載の配列のGlu17、Gln18、Met20、Lys21、Thr22、Ala24、Leu25、Leu27、Gln28、Gly29、Ile31、Gln32、Asp33、Arg34、Ala35、Gly36、Arg37、Met38、Gly39、Gly40、Glu41、Ala42、Leu47、Asp48、Pro49、Val50、Pro51、Gln52、Asp53、Ala54、Ser55、Thr56、Lys57、Lys58、Leu59、Ser60、Glu61、Lys64、Arg89、Phe92、Phe93、Leu122、Leu125、Thr127、Lys128、Val129、Pro130、Glu131、Leu132、Ile133、Arg134、Thr135、Met137、Gly138、Trp139、Leu141、Asp142、Phe143、Arg145、Glu146、Arg147、Leu149、Gly150、Gly156、Gly157、Trp158、Asp159、Leu161、Leu162に対応する1つ又はそれ以上のアミノ酸残基と結合する、請求項1〜4の何れか一項に記載の方法。
【請求項23】
当該化合物が更に有機化合物、ポリペプチド、核酸又はこれらの組み合わせを含有してなる、請求項1〜4の何れか一項に記載の方法。
【請求項24】
当該化合物が、表1の第2化合物と関連している表1の化合物を含有してなるか、又は表1に挙げられている化合物又はそれらの化学サブコンポーネントの組み合わせ、及びそれらの誘導体を含有してなる、請求項23に記載の方法。
【請求項25】
当該第2化合物が、荷電した親水性残基の周辺を有しているか、又は有していない水平な疎水性の溝、上部近傍ループ、下部近傍ループ、或いはこれらの組み合わせの場所で結合部位と相互作用する、請求項23に記載の方法。
【請求項26】
当該化合物が更に、BIMポリペプチドを含有してなる、請求項23に記載の方法。
【請求項27】
当該化合物が更に、BIM BH3ペプチド(配列番号3)又はそれらのSAHB誘導体を含有してなる、請求項23に記載の方法。
【請求項28】
当該化合物が更に、配列番号3に記載の配列と30%又はそれ以上同一であるアミノ酸配列を含有してなり、そして配列番号2に記載の配列のIle148、L152、Arg153、Arg154、Gly156、Asp157、Glu158、又はAsn160に対応するアミノ酸残基、又はそれらの同類の天然又は非天然のアミノ酸置換を含有してなる、請求項23に記載の方法。
【請求項29】
当該化合物が更に、配列番号2に記載の配列のIle148、Ala149、L152、Arg153、Arg154、Ile155、Gly156、Asp157、Glu158、Asn160、Ala161、又はTyr163に対応するアミノ酸残基又は同類の天然又は非天然のアミノ酸置換を含有してなる、請求項23に記載の方法。
【請求項30】
当該化合物が更に、BIDポリペプチドを含有してなる、請求項23に記載の方法。
【請求項31】
当該化合物が更に、BID BH3ペプチド(配列番号5)又はそれらのSAHB誘導体を含有してなる、請求項23に記載の方法。
【請求項32】
当該化合物が更に、PUMAポリペプチドを含有してなる、請求項23に記載の方法。
【請求項33】
当該化合物が更に、PUMA BH3ペプチド(配列番号7)又はそれらのSAHB誘導体を含有してなる、請求項32に記載の方法。
【請求項34】
当該化合物が更に、BAXポリペプチドを含有してなる、請求項23に記載の方法。
【請求項35】
当該化合物が更に、BAX BH3ペプチド(配列番号8)又はそれらのSAHB誘導体を含有してなる、請求項32に記載の方法。
【請求項36】
当該化合物が更に、これに限定されないが、BID、BAD、BIK/NBK、BLK、HRK、BIM/BOD、BNIP3、NIX、NOXA、PUMA、BMF及びEGL−1又はこれらのBH3領域を包含している、BH3オンリータンパク質の群から選ばれるポリペプチドを含有してなる、請求項23に記載の方法。
【請求項37】
当該化合物が更に、BCL−2、BCL−XL、BCL−w、Bcl−B、MCL−1、A1/BFL−1、BOO/DIVA、NR−13、CED−9、ウィルス性同族体、M11L、及びE1B−19Kよりなる群から選ばれるポリペプチドを含有してなる、請求項23に記載の方法。
【請求項38】
当該化合物が更に、BAX、BAK及びBOKよりなる群から選ばれるポリペプチドを含有してなる、請求項23に記載の方法。
【請求項39】
当該化合物が更に、配列番号3に記載の配列と30%同一であるBH3領域ポリペプチドを含有してなり、そして配列番号2に記載の配列のLeu152、Gly156、及びAsp157に対応するアミノ酸残基又はそれらの同類置換を含有してなる、請求項23に記載の方法。
【請求項40】
当該化合物が更に、配列番号5に記載の配列と30%同一であるBH3領域ポリペプチドを含有してなり、そして配列番号4に記載の配列のLeu90、Gly94及びAsp95に対応するアミノ酸残基又はそれらの同類置換を含有してなる、請求項23に記載の方法。
【請求項41】
当該化合物が更に、配列番号7に記載の配列と30%同一であるBH3領域ポリペプチドを含有してなり、そして配列番号6に記載の配列のLeu141、Ala145及びAsp146に対応するアミノ酸残基又はそれらの同類置換を含有してなる、請求項23に記載の方法。
【請求項42】
当該化合物が更に、配列番号8に記載の配列と30%同一であるBH3領域ポリペプチドを含有してなり、そして配列番号1に記載の配列のLeu63、Gly67及びAsp68に対応するアミノ酸残基又はそれらの同類置換を含有してなる、請求項23に記載の方法。
【請求項43】
当該化合物が更に、配列番号9に記載の配列に同定されるBAX活性部位と結合するBH3に対するコンセンサス配列及びそれらの同類置換と30%同一であるポリペプチドを含有してなる、請求項23に記載の方法。
【請求項44】
当該化合物が、<1mMの親和性で当該結合部位と結合する、請求項1〜4の何れか一項に記載の方法。
【請求項45】
請求項1〜4の何れか一項に記載の方法で同定された化合物の有効量を、対象が疾患を治療されるように、それを必要としている当該対象に投与することを含有してなる、対象における疾患を治療する方法。
【請求項46】
対象における疾患を治療する方法であって、ここで当該対象は当該疾患の治療を必要としていると確認されていて、
請求項1〜4の何れか一項に記載の方法で同定されたBCL−2ファミリーポリペプチドの結合部位に結合する化合物の有効量を、当該対象が当該疾患を治療されるように、当該対象に投与することを含有してなり、
ここで当該結合部位は、α1螺旋、α2螺旋、α1〜α2間のループ、α6螺旋、並びにα4、α5、及びα8螺旋の選択残基の内の1つ又はそれ以上を含有してなり、
ここで当該化合物は、BCL−2ファミリーポリペプチド又はBAXを調節する、方法。
【請求項47】
当該疾患が細胞増殖又はアポトーシス遮断の障害である、請求項45又は請求項46に記載の方法。
【請求項48】
当該細胞増殖又はアポトーシス遮断の障害が癌又は自己免疫疾患である、請求項47に記載の方法。
【請求項49】
当該癌が、固形癌、白血病、及びリンパ腫よりなる群から選ばれる、請求項48に記載の方法。
【請求項50】
当該癌が、化学療法耐性の癌である、請求項48に記載の方法。
【請求項51】
当該化学療法耐性の癌が、ABT−737、ABT−263、オバトクラックス、又はその他のBCL−2生存タンパク質阻害剤に耐性である、請求項50に記載の方法。
【請求項52】
当該障害が細胞損失の障害である、請求項45又は請求項46に記載の方法。
【請求項53】
当該化合物がBAXの活性化を阻害する、請求項52に記載の方法。
【請求項54】
当該細胞損失障害が、神経変性、心臓発作、又は脳卒中である、請求項52に記載の方法。
【請求項55】
対象における癌又は腫瘍を治療する方法であって、
ここで当該対象は、当該疾患の治療が必要であると確認されていて、
BCL−2ファミリーポリペプチドの結合部位に結合する化合物の有効量を当該対象に投与することを含有してなり、
ここで当該結合部位は、α1螺旋、α2螺旋、α1〜α2間のループ、α6螺旋、並びにα4、α5、及びα8螺旋の選択残基の内の1つ又はそれ以上を含有してなり、
ここで当該化合物は、BAXポリペプチドのプロアポトーシス活性を活性化して、
ここで当該化合物は、配列番号1に記載の配列のGlu17、Gln18、Met20、Lys21、Thr22、Ala24、Leu25、Leu27、Gln28、Gly29、Ile31、Gln32、Asp33、Arg34、Ala35、Gly36、Arg37、Met38、Gly39、Gly40、Glu41、Ala42、Leu47、Asp48、Pro49、Val50、Pro51、Gln52、Asp53、Ala54、Ser55、Thr56、Lys57、Lys58、Leu59、Ser60、Glu61、Lys64、Arg89、Phe92、Phe93、Leu122、Leu125、Thr127、Lys128、Val129、Pro130、Glu131、Leu132、Ile133、Arg134、Thr135、Met137、Gly138、Trp139、Leu141、Asp142、Phe143、Arg145、Glu146、Arg147、Leu149、Gly150、Gly156、Gly157、Trp158、Asp159、Leu161、Leu162の一つ又はそれ以上のアミノ酸残基と結合して、
ここで当該結合部位は、荷電した親水性残基の周辺を有しているか、又は有していない水平な疎水性の溝、上部近傍ループ、下部近傍ループ、或いはこれらの組み合わせの場所で起こる、方法。
【請求項56】
BCL−2関連疾患を治療するための組成物であって、
当該組成物が、BCL−2ファミリーポリペプチドの結合部位に結合する化合物(ここで、当該結合部位は、α1螺旋、α2螺旋、α1〜α2間のループ、α6螺旋、並びにα4、α5、及びα8螺旋の選択残基の内の1つ又はそれ以上を含有してなり、
ここで当該化合物は、BCL−2ファミリーポリペプチドの活性を調節し、
ここで当該化合物は、荷電した親水性残基の周辺を有しているか、又は有していない水平な疎水性の溝、上部近傍ループ、下部近傍ループ、或いはこれらの組み合わせの場所で結合部位と相互作用する);及び
有機化合物、ポリペプチド及び核酸又はこれらの組み合わせから選ばれる第2化合物を含有してなる(ここで、組成物は当該BCL−2ファミリーポリペプチドの結合部位に結合する)、組成物。
【請求項57】
当該化合物が有機化合物である、請求項56に記載の組成物。
【請求項58】
当該化合物が表1の化合物から選ばれる、請求項56に記載の組成物。
【請求項59】
当該化合物が、表1の化合物から選ばれる化合物の組み合わせに由来している、請求項56に記載の組成物。
【請求項60】
当該第2化合物が有機化合物である、請求項56に記載の組成物。
【請求項61】
当該第2化合物がポリペプチドである、請求項56に記載の組成物。
【請求項62】
当該第2化合物が、BIM、BID、BAX、PUMA、BAK及びBOKよりなる群から選ばれる、請求項56に記載の組成物。
【請求項63】
当該BCL−2ファミリーポリペプチドが、プロアポトーシスポリペプチドである、請求項56に記載の組成物。
【請求項64】
当該プロアポトーシスポリペプチドがBAXである、請求項63に記載の組成物。
【請求項65】
当該プロアポトーシスポリペプチドがBOK又はBAKである、請求項63に記載の組成物。
【請求項66】
当該BCL−2ファミリーポリペプチドが、アンチアポトーシスポリペプチドである、請求項56に記載の組成物。
【請求項67】
当該アンチアポトーシスポリペプチドが、BCl−2、BCL−XL、BCL−w、BCL−B、MCL−1、Bfl−1/A1、BOO/DIVA、NR−13、CED−9、ウィルス性同族体(例えば、M11L、E1B−19K等)よりなる群から選ばれる、請求項66に記載の組成物。
【請求項68】
当該調節が、プロアポトーシス活性の活性化である、請求項63に記載の組成物。
【請求項69】
当該調節が、プロアポトーシス活性の阻害である、請求項62に記載の組成物。
【請求項70】
当該調節が、アンチアポトーシス活性の活性化である、請求項66に記載の組成物。
【請求項71】
当該調節が、アンチアポトーシス活性の阻害である、請求項66に記載の組成物。
【請求項72】
当該組成物が、結合部位において配列番号1に記載の配列のLys21に対応するアミノ酸残基と結合する、請求項56に記載の組成物。
【請求項73】
当該組成物が、結合部位において配列番号1に記載の配列のMet20、Lys21、Ala24、Gln28、Gln32、Glu131、Arg134、Met137、Leu141、Asp142から選ばれる1つ又はそれ以上のアミノ酸残基と結合する、請求項56に記載の組成物。
【請求項74】
当該組成物が、結合部位において配列番号1に記載の配列のGlu17、Met20、Lys21、Thr22、Ala24、Leu25、Leu27、Gln28、Gly29、Ile31、Gln32、Asp33、Leu47、Asp48、Pro49、Val50、Pro51、Gln52、Asp53、Thr56、Arg89、Phe92、Phe93、Pro130、Glu131、Ile133、Arg134、Thr135、Met137、Gly138、Trp139、Leu141、Asp142、Phe143、Arg145、Glu146から選ばれる1つ又はそれ以上のアミノ酸残基と結合する、請求項56に記載の組成物。
【請求項75】
当該組成物が、結合部位において配列番号1に記載の配列のGlu17、Gln18、Met20、Lys21、Thr22、Ala24、Leu25、Leu27、Gln28、Gly29、Ile31、Gln32、Asp33、Arg34、Ala35、Gly36、Arg37、Met38、Gly39、Gly40、Glu41、Ala42、Leu47、Asp48、Pro49、Val50、Pro51、Gln52、Asp53、Ala54、Ser55、Thr56、Lys57、Lys58、Leu59、Ser60、Glu61、Lys64、Arg89、Phe92、Phe93、Leu122、Leu125、Thr127、Lys128、Val129、Pro130、Glu131、Leu132、Ile133、Arg134、Thr135、Met137、Gly138、Trp139、Leu141、Asp142、Phe143、Arg145、Glu146、Arg147、Leu149、Gly150、Gly156、Gly157、Trp158、Asp159、Leu161、Leu162から選ばれる1つ又はそれ以上のアミノ酸残基と結合する、請求項56に記載の組成物。
【請求項76】
当該第2化合物がBIMポリペプチドである、請求項56に記載の組成物。
【請求項77】
当該第2化合物が、BIM BH3ポリペプチド又はそれらのSAHB誘導体である、請求項56に記載の組成物。
【請求項78】
当該第2化合物が、配列番号3に記載の配列と30%又はそれ以上同一であるアミノ酸配列を含有してなり、そして配列番号2に記載の配列のIle148、L152、Arg153、Arg154、Gly156、Asp157、Glu158、又はAsn160に対応するアミノ酸残基、又は同類の天然又は非天然のアミノ酸置換を含有してなる、アミノ酸である、請求項56に記載の組成物。
【請求項79】
当該第2化合物が、配列番号2に記載の配列のIle148、Ala149、L152、Arg153、Arg154、Ile155、Gly156、Asp157、Glu158、Asn160、Ala161、又はTyr163のアミノ酸残基を含有してなるアミノ酸である、請求項56に記載の組成物。
【請求項80】
当該第2化合物が、BIDポリペプチドである、請求項56に記載の組成物。
【請求項81】
当該第2化合物が、BID BH3ペプチド又はそれらのSHAB誘導体である、請求項56に記載の組成物。
【請求項82】
当該第2化合物が、PUMAポリペプチドである、請求項56に記載の組成物。
【請求項83】
当該第2化合物が、PUMA BH3ペプチド又はそれらのSAHB誘導体である、請求項82に記載の組成物。
【請求項84】
当該第2化合物が、BAXポリペプチドである、請求項56に記載の組成物。
【請求項85】
当該第2化合物が、BAX BH3ペプチド又それらのSAHB誘導体である、請求項84に記載の組成物。
【請求項86】
当該第2化合物が、これに限定されないが、BID、BAD、BIK/NBK、BLK、HRK、BIM/BOD、BNIP3、NIX、NOXA、PUMA、BMF及びEGL−1又はこれらのBH3領域を包含している、BH3オンリータンパク質の群から選ばれる、請求項56に記載の組成物。
【請求項87】
当該第2化合物が、BCL−2、BCL−XL、BCL−w、BcL−B、MCL−1、Bfl−1/A1、BOO/DIVA、NR−13、CED−9、ウィルス性同族体、M11L、及びE1B−19Kよりなる群から選ばれるポリペプチドを含有してなる、請求項56に記載の組成物。
【請求項88】
当該第2化合物が、BAX、BAK及びBOKよりなる群から選ばれるポリペプチドを含有してなる、請求項56に記載の組成物。
【請求項89】
請求項56に記載の組成物及び使用説明書を含有してなる、キット。
【請求項1】
方法が:
a)BCL−2ファミリーポリペプチドを、当該BCL−2ファミリーポリペプチドの活性を調節するのに適している条件下で、化合物と接触させること;及び
b)化合物による当該BCL−2ファミリーポリペプチドの活性の調節を検出すること:
を含有してなり、
ここで、化合物は、当該BCL−2ファミリーポリペプチドのα1螺旋、α2螺旋、α1−α2の間のループ、α6螺旋、並びにα4、α5、及びα8螺旋の選択残基の内の1つ又はそれ以上を含有している結合部位と相互作用し;
ここで、化合物の結合部位との相互作用は、荷電した親水性残基の周辺を有しているか、又は有していない水平な疎水性の溝、上部近傍ループ、下部近傍ループ、或いはこれらの組み合わせの場所で起こる、
BCL−2ファミリーポリペプチドの活性を調節する有機分子を同定する方法。
【請求項2】
方法が:
a)当該BAXポリペプチドの結合部位(ここで、結合部位は、α1螺旋、α2螺旋、α1−α2の間のループ、α6螺旋、並びにα4、α5、及びα8螺旋の選択残基の内の1つ又はそれ以上を含有している)を、当該BAXポリペプチドのプロアポトーシス活性を活性化するのに適している条件下で、化合物と接触させること;及び
b)当該化合物による当該BAXポリペプチドの活性化を検出すること:
を含有してなり、
ここで、当該化合物は、配列番号1に記載の配列のGlu17、Gln18、Met20、Lys21、Thr22、Ala24、Leu25、Leu27、Gln28、Gly29、Ile31、Gln32、Asp33、Arg34、Ala35、Gly36、Arg37、Met38、Gly39、Gly40、Glu41、Ala42、Leu47、Asp48、Pro49、Val50、Pro51、Gln52、Asp53、Ala54、Ser55、Thr56、Lys57、Lys58、Leu59、Ser60、Glu61、Lys64、Arg89、Phe92、Phe93、Leu122、Leu125、Thr127、Lys128、Val129、Pro130、Glu131、Leu132、Ile133、Arg134、Thr135、Met137、Gly138、Trp139、Leu141、Asp142、Phe143、Arg145、Glu146、Arg147、Leu149、Gly150、Gly156、Gly157、Trp158、Asp159、Leu161、Leu162に対応する1つ又はそれ以上のアミノ酸残基と結合していて;そして
ここで、化合物の結合部位との相互作用は、荷電した親水性残基の周辺を有しているか、又は有していない水平な疎水性の溝、上部近傍ループ、下部近傍ループ、或いはこれらの組み合わせの場所で起こる、
BAXポリペプチドのプロアポトーシス活性を活性化する有機分子化合物を同定する方法。
【請求項3】
a)当該BCL−2ファミリーポリペプチドの結合部位の三次元構造を用いて(ここで、当該結合部位は、α1螺旋、α2螺旋、α1−α2の間のループ、α6螺旋並びにα4、α5、及びα8螺旋の選択残基の内の1つ又はそれ以上を含有している)、BCL−2ファミリーポリペプチド相互作用テンプレートを形成すること;及び
b.当該BCL−2ファミリーポリペプチド相互作用テンプレートを用いて当該BCL−2ファミリーポリペプチド候補モジュレータを選択すること(ここで、当該候補モジュレータは当該結合部位に結合する):
を含有してなる、
(ここで、候補モジュレータの結合部位との相互作用は、荷電した親水性残基の周辺を有しているか、又は有していない水平な疎水性の溝、上部近傍ループ、下部近傍ループ、或いはこれらの組み合わせの場所で起こる)
BCL−2ファミリーポリペプチドの候補有機分子モジュレータを同定する方法。
【請求項4】
方法が:
c.BAXポリペプチドの結合部位の三次元構造を提供すること(ここで、当該結合部位は、α1螺旋、α2螺旋、α1−α2の間のループ、α6螺旋、並びにα4、α5、及びα8螺旋の選択残基の内の1つ又はそれ以上を含有している);
d.当該結合部位と化合物の間の結合相互作用をシミュレートすること(ここで、化合物の結合部位との相互作用は、荷電した親水性残基の周辺を有しているか、又は有していない水平な疎水性の溝、上部近傍ループ、下部近傍ループ、或いはこれらの組み合わせの場所で起こる);及び
c.当該化合物が、当該結合部位の内の配列番号1に記載の配列のGlu17、Gln18、Met20、Lys21、Thr22、Ala24、Leu25、Leu27、Gln28、Gly29、Ile31、Gln32、Asp33、Arg34、Ala35、Gly36、Arg37、Met38、Gly39、Gly40、Glu41、Ala42、Leu47、Asp48、Pro49、Val50、Pro51、Gln52、Asp53、Ala54、Ser55、Thr56、Lys57、Lys58、Leu59、Ser60、Glu61、Lys64、Arg89、Phe92、Phe93、Leu122、Leu125、Thr127、Lys128、Val129、Pro130、Glu131、Leu132、Ile133、Arg134、Thr135、Met137、Gly138、Trp139、Leu141、Asp142、Phe143、Arg145、Glu146、Arg147、Leu149、Gly150、Gly156、Gly157、Trp158、Asp159、Leu161、Leu162よりなる群から選ばれるアミノ酸残基と結合するか否かを確認すること(ここで、結合部位の当該アミノ酸残基と結合する当該化合物は当該候補化合物である):
を含有してなる、
BAXポリペプチドのプロアポトーシス活性を活性化する候補有機分子化合物を同定する方法。
【請求項5】
当該化合物が有機化合物である、請求項1〜4の何れか一項に記載の方法。
【請求項6】
化合物が表1から選ばれて、更に表1の化合物の誘導体を含有していてもよい(ここで、当該誘導体は結合親和性、活性、溶解性、又はその他の薬理学的特性を改善する)、請求項5に記載の方法。
【請求項7】
当該BCL−2ファミリーポリペプチドがプロアポトーシスポリペプチドである、請求項1又は請求項3に記載の方法。
【請求項8】
当該プロアポトーシスポリペプチドがBAXである、請求項7に記載の方法。
【請求項9】
当該プロアポトーシスポリペプチドがBOK又はBAKである、請求項7に記載の方法。
【請求項10】
当該BCL−2ファミリーポリペプチドがアンチアポトーシスポリペプチドである、請求項1又は請求項3に記載の方法。
【請求項11】
当該アンチアポトーシスポリペプチドが、BCL−2、Bcl−X1、Bcl−w、Mcl−1、BCL−B、A1/Bf1−1、Boo/Diva、Nr−13、Ced−9、ウィルス性同族体、M11L、及びE1B−19Kよりなる群から選ばれる、請求項10に記載の方法。
【請求項12】
当該活性が、プロアポトーシス活性である、請求項1〜4の何れか一項に記載の方法。
【請求項13】
当該活性が、アンチアポトーシス活性である、請求項1〜4の何れか一項に記載の方法。
【請求項14】
当該調節が、当該プロアポトーシス活性の活性化である、請求項1に記載の方法。
【請求項15】
当該調節が、当該プロアポトーシス活性の阻害である、請求項1に記載の方法。
【請求項16】
当該調節が、当該アンチアポトーシス活性の活性化である、請求項1に記載の方法。
【請求項17】
当該調節が、当該アンチアポトーシス活性の阻害である、請求項1に記載の方法。
【請求項18】
工程(b)の検出が、
(A)BCL−2ポリペプチドのオリゴマー化、抗体によるBCL−2ポリペプチド配座異性体の検出、ミトコンドリアチトクロムc放出、リポソーム放出、細胞死、ミトコンドリア又は細胞の形態、ミトコンドリアのカルシウム流出、ミトコンドリアの膜貫通の定量、及びカスパーゼ3活性又はアネキシンV結合の定量よりなる群から選ばれるアッセイ、及び
(B)最適化されたタンパク質発現及び精製条件を通して収率及び安定性を、及びモノマー、ダイマー又はオリゴマーの配座異性体及び種を安定化するポリペプチド突然変異体の作出を最大化するように特別に調製されたBCL−2ポリペプチドタンパク質を使用すること、
を含有してなる、請求項1又は請求項2に記載の方法。
【請求項19】
当該化合物が、結合部位における配列番号1に記載の配列のLys21に対応するアミノ酸残基と結合する、請求項1〜4の何れか一項に記載の方法。
【請求項20】
当該化合物が、結合部位における配列番号1に記載の配列のMet20、Lys21、Ala24、Gln28、Gln32、Glu131、Arg134、Met137、Leu141、Asp142に対応する1つ又はそれ以上のアミノ酸残基と結合する、請求項1〜4の何れか一項に記載の方法。
【請求項21】
当該化合物が、結合部位における配列番号1に記載の配列のGlu17、Met20、Lys21、Thr22、Ala24、Leu25、Leu27、Gln28、Gly29、Ile31、Gln32、Asp33、Leu47、Asp48、Pro49、Val50、Pro51、Gln52、Asp53、Thr56、Arg89、Phe92、Phe93、Pro130、Glu131、Ile133、Arg134、Thr135、Met137、Gly138、Trp139、Leu141、Asp142、Phe143、Arg145、Glu146に対応する1つ又はそれ以上のアミノ酸残基と結合する、請求項1〜4の何れか一項に記載の方法。
【請求項22】
当該化合物が、結合部位における配列番号1に記載の配列のGlu17、Gln18、Met20、Lys21、Thr22、Ala24、Leu25、Leu27、Gln28、Gly29、Ile31、Gln32、Asp33、Arg34、Ala35、Gly36、Arg37、Met38、Gly39、Gly40、Glu41、Ala42、Leu47、Asp48、Pro49、Val50、Pro51、Gln52、Asp53、Ala54、Ser55、Thr56、Lys57、Lys58、Leu59、Ser60、Glu61、Lys64、Arg89、Phe92、Phe93、Leu122、Leu125、Thr127、Lys128、Val129、Pro130、Glu131、Leu132、Ile133、Arg134、Thr135、Met137、Gly138、Trp139、Leu141、Asp142、Phe143、Arg145、Glu146、Arg147、Leu149、Gly150、Gly156、Gly157、Trp158、Asp159、Leu161、Leu162に対応する1つ又はそれ以上のアミノ酸残基と結合する、請求項1〜4の何れか一項に記載の方法。
【請求項23】
当該化合物が更に有機化合物、ポリペプチド、核酸又はこれらの組み合わせを含有してなる、請求項1〜4の何れか一項に記載の方法。
【請求項24】
当該化合物が、表1の第2化合物と関連している表1の化合物を含有してなるか、又は表1に挙げられている化合物又はそれらの化学サブコンポーネントの組み合わせ、及びそれらの誘導体を含有してなる、請求項23に記載の方法。
【請求項25】
当該第2化合物が、荷電した親水性残基の周辺を有しているか、又は有していない水平な疎水性の溝、上部近傍ループ、下部近傍ループ、或いはこれらの組み合わせの場所で結合部位と相互作用する、請求項23に記載の方法。
【請求項26】
当該化合物が更に、BIMポリペプチドを含有してなる、請求項23に記載の方法。
【請求項27】
当該化合物が更に、BIM BH3ペプチド(配列番号3)又はそれらのSAHB誘導体を含有してなる、請求項23に記載の方法。
【請求項28】
当該化合物が更に、配列番号3に記載の配列と30%又はそれ以上同一であるアミノ酸配列を含有してなり、そして配列番号2に記載の配列のIle148、L152、Arg153、Arg154、Gly156、Asp157、Glu158、又はAsn160に対応するアミノ酸残基、又はそれらの同類の天然又は非天然のアミノ酸置換を含有してなる、請求項23に記載の方法。
【請求項29】
当該化合物が更に、配列番号2に記載の配列のIle148、Ala149、L152、Arg153、Arg154、Ile155、Gly156、Asp157、Glu158、Asn160、Ala161、又はTyr163に対応するアミノ酸残基又は同類の天然又は非天然のアミノ酸置換を含有してなる、請求項23に記載の方法。
【請求項30】
当該化合物が更に、BIDポリペプチドを含有してなる、請求項23に記載の方法。
【請求項31】
当該化合物が更に、BID BH3ペプチド(配列番号5)又はそれらのSAHB誘導体を含有してなる、請求項23に記載の方法。
【請求項32】
当該化合物が更に、PUMAポリペプチドを含有してなる、請求項23に記載の方法。
【請求項33】
当該化合物が更に、PUMA BH3ペプチド(配列番号7)又はそれらのSAHB誘導体を含有してなる、請求項32に記載の方法。
【請求項34】
当該化合物が更に、BAXポリペプチドを含有してなる、請求項23に記載の方法。
【請求項35】
当該化合物が更に、BAX BH3ペプチド(配列番号8)又はそれらのSAHB誘導体を含有してなる、請求項32に記載の方法。
【請求項36】
当該化合物が更に、これに限定されないが、BID、BAD、BIK/NBK、BLK、HRK、BIM/BOD、BNIP3、NIX、NOXA、PUMA、BMF及びEGL−1又はこれらのBH3領域を包含している、BH3オンリータンパク質の群から選ばれるポリペプチドを含有してなる、請求項23に記載の方法。
【請求項37】
当該化合物が更に、BCL−2、BCL−XL、BCL−w、Bcl−B、MCL−1、A1/BFL−1、BOO/DIVA、NR−13、CED−9、ウィルス性同族体、M11L、及びE1B−19Kよりなる群から選ばれるポリペプチドを含有してなる、請求項23に記載の方法。
【請求項38】
当該化合物が更に、BAX、BAK及びBOKよりなる群から選ばれるポリペプチドを含有してなる、請求項23に記載の方法。
【請求項39】
当該化合物が更に、配列番号3に記載の配列と30%同一であるBH3領域ポリペプチドを含有してなり、そして配列番号2に記載の配列のLeu152、Gly156、及びAsp157に対応するアミノ酸残基又はそれらの同類置換を含有してなる、請求項23に記載の方法。
【請求項40】
当該化合物が更に、配列番号5に記載の配列と30%同一であるBH3領域ポリペプチドを含有してなり、そして配列番号4に記載の配列のLeu90、Gly94及びAsp95に対応するアミノ酸残基又はそれらの同類置換を含有してなる、請求項23に記載の方法。
【請求項41】
当該化合物が更に、配列番号7に記載の配列と30%同一であるBH3領域ポリペプチドを含有してなり、そして配列番号6に記載の配列のLeu141、Ala145及びAsp146に対応するアミノ酸残基又はそれらの同類置換を含有してなる、請求項23に記載の方法。
【請求項42】
当該化合物が更に、配列番号8に記載の配列と30%同一であるBH3領域ポリペプチドを含有してなり、そして配列番号1に記載の配列のLeu63、Gly67及びAsp68に対応するアミノ酸残基又はそれらの同類置換を含有してなる、請求項23に記載の方法。
【請求項43】
当該化合物が更に、配列番号9に記載の配列に同定されるBAX活性部位と結合するBH3に対するコンセンサス配列及びそれらの同類置換と30%同一であるポリペプチドを含有してなる、請求項23に記載の方法。
【請求項44】
当該化合物が、<1mMの親和性で当該結合部位と結合する、請求項1〜4の何れか一項に記載の方法。
【請求項45】
請求項1〜4の何れか一項に記載の方法で同定された化合物の有効量を、対象が疾患を治療されるように、それを必要としている当該対象に投与することを含有してなる、対象における疾患を治療する方法。
【請求項46】
対象における疾患を治療する方法であって、ここで当該対象は当該疾患の治療を必要としていると確認されていて、
請求項1〜4の何れか一項に記載の方法で同定されたBCL−2ファミリーポリペプチドの結合部位に結合する化合物の有効量を、当該対象が当該疾患を治療されるように、当該対象に投与することを含有してなり、
ここで当該結合部位は、α1螺旋、α2螺旋、α1〜α2間のループ、α6螺旋、並びにα4、α5、及びα8螺旋の選択残基の内の1つ又はそれ以上を含有してなり、
ここで当該化合物は、BCL−2ファミリーポリペプチド又はBAXを調節する、方法。
【請求項47】
当該疾患が細胞増殖又はアポトーシス遮断の障害である、請求項45又は請求項46に記載の方法。
【請求項48】
当該細胞増殖又はアポトーシス遮断の障害が癌又は自己免疫疾患である、請求項47に記載の方法。
【請求項49】
当該癌が、固形癌、白血病、及びリンパ腫よりなる群から選ばれる、請求項48に記載の方法。
【請求項50】
当該癌が、化学療法耐性の癌である、請求項48に記載の方法。
【請求項51】
当該化学療法耐性の癌が、ABT−737、ABT−263、オバトクラックス、又はその他のBCL−2生存タンパク質阻害剤に耐性である、請求項50に記載の方法。
【請求項52】
当該障害が細胞損失の障害である、請求項45又は請求項46に記載の方法。
【請求項53】
当該化合物がBAXの活性化を阻害する、請求項52に記載の方法。
【請求項54】
当該細胞損失障害が、神経変性、心臓発作、又は脳卒中である、請求項52に記載の方法。
【請求項55】
対象における癌又は腫瘍を治療する方法であって、
ここで当該対象は、当該疾患の治療が必要であると確認されていて、
BCL−2ファミリーポリペプチドの結合部位に結合する化合物の有効量を当該対象に投与することを含有してなり、
ここで当該結合部位は、α1螺旋、α2螺旋、α1〜α2間のループ、α6螺旋、並びにα4、α5、及びα8螺旋の選択残基の内の1つ又はそれ以上を含有してなり、
ここで当該化合物は、BAXポリペプチドのプロアポトーシス活性を活性化して、
ここで当該化合物は、配列番号1に記載の配列のGlu17、Gln18、Met20、Lys21、Thr22、Ala24、Leu25、Leu27、Gln28、Gly29、Ile31、Gln32、Asp33、Arg34、Ala35、Gly36、Arg37、Met38、Gly39、Gly40、Glu41、Ala42、Leu47、Asp48、Pro49、Val50、Pro51、Gln52、Asp53、Ala54、Ser55、Thr56、Lys57、Lys58、Leu59、Ser60、Glu61、Lys64、Arg89、Phe92、Phe93、Leu122、Leu125、Thr127、Lys128、Val129、Pro130、Glu131、Leu132、Ile133、Arg134、Thr135、Met137、Gly138、Trp139、Leu141、Asp142、Phe143、Arg145、Glu146、Arg147、Leu149、Gly150、Gly156、Gly157、Trp158、Asp159、Leu161、Leu162の一つ又はそれ以上のアミノ酸残基と結合して、
ここで当該結合部位は、荷電した親水性残基の周辺を有しているか、又は有していない水平な疎水性の溝、上部近傍ループ、下部近傍ループ、或いはこれらの組み合わせの場所で起こる、方法。
【請求項56】
BCL−2関連疾患を治療するための組成物であって、
当該組成物が、BCL−2ファミリーポリペプチドの結合部位に結合する化合物(ここで、当該結合部位は、α1螺旋、α2螺旋、α1〜α2間のループ、α6螺旋、並びにα4、α5、及びα8螺旋の選択残基の内の1つ又はそれ以上を含有してなり、
ここで当該化合物は、BCL−2ファミリーポリペプチドの活性を調節し、
ここで当該化合物は、荷電した親水性残基の周辺を有しているか、又は有していない水平な疎水性の溝、上部近傍ループ、下部近傍ループ、或いはこれらの組み合わせの場所で結合部位と相互作用する);及び
有機化合物、ポリペプチド及び核酸又はこれらの組み合わせから選ばれる第2化合物を含有してなる(ここで、組成物は当該BCL−2ファミリーポリペプチドの結合部位に結合する)、組成物。
【請求項57】
当該化合物が有機化合物である、請求項56に記載の組成物。
【請求項58】
当該化合物が表1の化合物から選ばれる、請求項56に記載の組成物。
【請求項59】
当該化合物が、表1の化合物から選ばれる化合物の組み合わせに由来している、請求項56に記載の組成物。
【請求項60】
当該第2化合物が有機化合物である、請求項56に記載の組成物。
【請求項61】
当該第2化合物がポリペプチドである、請求項56に記載の組成物。
【請求項62】
当該第2化合物が、BIM、BID、BAX、PUMA、BAK及びBOKよりなる群から選ばれる、請求項56に記載の組成物。
【請求項63】
当該BCL−2ファミリーポリペプチドが、プロアポトーシスポリペプチドである、請求項56に記載の組成物。
【請求項64】
当該プロアポトーシスポリペプチドがBAXである、請求項63に記載の組成物。
【請求項65】
当該プロアポトーシスポリペプチドがBOK又はBAKである、請求項63に記載の組成物。
【請求項66】
当該BCL−2ファミリーポリペプチドが、アンチアポトーシスポリペプチドである、請求項56に記載の組成物。
【請求項67】
当該アンチアポトーシスポリペプチドが、BCl−2、BCL−XL、BCL−w、BCL−B、MCL−1、Bfl−1/A1、BOO/DIVA、NR−13、CED−9、ウィルス性同族体(例えば、M11L、E1B−19K等)よりなる群から選ばれる、請求項66に記載の組成物。
【請求項68】
当該調節が、プロアポトーシス活性の活性化である、請求項63に記載の組成物。
【請求項69】
当該調節が、プロアポトーシス活性の阻害である、請求項62に記載の組成物。
【請求項70】
当該調節が、アンチアポトーシス活性の活性化である、請求項66に記載の組成物。
【請求項71】
当該調節が、アンチアポトーシス活性の阻害である、請求項66に記載の組成物。
【請求項72】
当該組成物が、結合部位において配列番号1に記載の配列のLys21に対応するアミノ酸残基と結合する、請求項56に記載の組成物。
【請求項73】
当該組成物が、結合部位において配列番号1に記載の配列のMet20、Lys21、Ala24、Gln28、Gln32、Glu131、Arg134、Met137、Leu141、Asp142から選ばれる1つ又はそれ以上のアミノ酸残基と結合する、請求項56に記載の組成物。
【請求項74】
当該組成物が、結合部位において配列番号1に記載の配列のGlu17、Met20、Lys21、Thr22、Ala24、Leu25、Leu27、Gln28、Gly29、Ile31、Gln32、Asp33、Leu47、Asp48、Pro49、Val50、Pro51、Gln52、Asp53、Thr56、Arg89、Phe92、Phe93、Pro130、Glu131、Ile133、Arg134、Thr135、Met137、Gly138、Trp139、Leu141、Asp142、Phe143、Arg145、Glu146から選ばれる1つ又はそれ以上のアミノ酸残基と結合する、請求項56に記載の組成物。
【請求項75】
当該組成物が、結合部位において配列番号1に記載の配列のGlu17、Gln18、Met20、Lys21、Thr22、Ala24、Leu25、Leu27、Gln28、Gly29、Ile31、Gln32、Asp33、Arg34、Ala35、Gly36、Arg37、Met38、Gly39、Gly40、Glu41、Ala42、Leu47、Asp48、Pro49、Val50、Pro51、Gln52、Asp53、Ala54、Ser55、Thr56、Lys57、Lys58、Leu59、Ser60、Glu61、Lys64、Arg89、Phe92、Phe93、Leu122、Leu125、Thr127、Lys128、Val129、Pro130、Glu131、Leu132、Ile133、Arg134、Thr135、Met137、Gly138、Trp139、Leu141、Asp142、Phe143、Arg145、Glu146、Arg147、Leu149、Gly150、Gly156、Gly157、Trp158、Asp159、Leu161、Leu162から選ばれる1つ又はそれ以上のアミノ酸残基と結合する、請求項56に記載の組成物。
【請求項76】
当該第2化合物がBIMポリペプチドである、請求項56に記載の組成物。
【請求項77】
当該第2化合物が、BIM BH3ポリペプチド又はそれらのSAHB誘導体である、請求項56に記載の組成物。
【請求項78】
当該第2化合物が、配列番号3に記載の配列と30%又はそれ以上同一であるアミノ酸配列を含有してなり、そして配列番号2に記載の配列のIle148、L152、Arg153、Arg154、Gly156、Asp157、Glu158、又はAsn160に対応するアミノ酸残基、又は同類の天然又は非天然のアミノ酸置換を含有してなる、アミノ酸である、請求項56に記載の組成物。
【請求項79】
当該第2化合物が、配列番号2に記載の配列のIle148、Ala149、L152、Arg153、Arg154、Ile155、Gly156、Asp157、Glu158、Asn160、Ala161、又はTyr163のアミノ酸残基を含有してなるアミノ酸である、請求項56に記載の組成物。
【請求項80】
当該第2化合物が、BIDポリペプチドである、請求項56に記載の組成物。
【請求項81】
当該第2化合物が、BID BH3ペプチド又はそれらのSHAB誘導体である、請求項56に記載の組成物。
【請求項82】
当該第2化合物が、PUMAポリペプチドである、請求項56に記載の組成物。
【請求項83】
当該第2化合物が、PUMA BH3ペプチド又はそれらのSAHB誘導体である、請求項82に記載の組成物。
【請求項84】
当該第2化合物が、BAXポリペプチドである、請求項56に記載の組成物。
【請求項85】
当該第2化合物が、BAX BH3ペプチド又それらのSAHB誘導体である、請求項84に記載の組成物。
【請求項86】
当該第2化合物が、これに限定されないが、BID、BAD、BIK/NBK、BLK、HRK、BIM/BOD、BNIP3、NIX、NOXA、PUMA、BMF及びEGL−1又はこれらのBH3領域を包含している、BH3オンリータンパク質の群から選ばれる、請求項56に記載の組成物。
【請求項87】
当該第2化合物が、BCL−2、BCL−XL、BCL−w、BcL−B、MCL−1、Bfl−1/A1、BOO/DIVA、NR−13、CED−9、ウィルス性同族体、M11L、及びE1B−19Kよりなる群から選ばれるポリペプチドを含有してなる、請求項56に記載の組成物。
【請求項88】
当該第2化合物が、BAX、BAK及びBOKよりなる群から選ばれるポリペプチドを含有してなる、請求項56に記載の組成物。
【請求項89】
請求項56に記載の組成物及び使用説明書を含有してなる、キット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6A】


【図6B】


【図7A】


【図7BC】


【図8−1】


【図8−2】


【図8−3】


【図8−4】


【図9AB】


【図9C】


【図10A】


【図10BC】


【図11】


【図12A】


【図12B】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4】


【図5】


【図6A】


【図6B】


【図7A】


【図7BC】


【図8−1】


【図8−2】


【図8−3】


【図8−4】


【図9AB】


【図9C】


【図10A】


【図10BC】


【図11】


【図12A】


【図12B】


【図13】


【図14】


【図15】


【公表番号】特表2012−505403(P2012−505403A)
【公表日】平成24年3月1日(2012.3.1)
【国際特許分類】
【出願番号】特願2011−531031(P2011−531031)
【出願日】平成21年10月9日(2009.10.9)
【国際出願番号】PCT/US2009/005568
【国際公開番号】WO2010/042225
【国際公開日】平成22年4月15日(2010.4.15)
【出願人】(510084149)ダナ ファーバー キャンサー インスティテュート インコーポレイテッド (7)
【Fターム(参考)】
【公表日】平成24年3月1日(2012.3.1)
【国際特許分類】
【出願日】平成21年10月9日(2009.10.9)
【国際出願番号】PCT/US2009/005568
【国際公開番号】WO2010/042225
【国際公開日】平成22年4月15日(2010.4.15)
【出願人】(510084149)ダナ ファーバー キャンサー インスティテュート インコーポレイテッド (7)
【Fターム(参考)】
[ Back to top ]

