プログラム細胞死1(PD−1)経路を阻害することによる持続感染および癌の処置のための方法および組成物
【課題】持続感染(例えば、慢性感染、潜在性感染、および遅発性感染)および癌の処置、予防、または減少のための方法および組成物を提供する。
【解決手段】方法および組成物はまた、このような感染および癌に関連する1種以上の症状の軽減に有用である。特定の実施形態では、持続感染または癌の症状を軽減または予防する方法であって、その必要がある被験体に、該被験体におけるプログラム細胞死−1(PD−1)ポリペプチドの活性または発現を減少させる化合物を投与する工程を包含する。
【解決手段】方法および組成物はまた、このような感染および癌に関連する1種以上の症状の軽減に有用である。特定の実施形態では、持続感染または癌の症状を軽減または予防する方法であって、その必要がある被験体に、該被験体におけるプログラム細胞死−1(PD−1)ポリペプチドの活性または発現を減少させる化合物を投与する工程を包含する。
【発明の詳細な説明】
【技術分野】
【0001】
(連邦支援研究についての宣言)
本発明は、NIH助成金AI39671およびNIH助成金CA84500の下での米国政府支援によってなされた。米国政府は、本発明において特定の権利を有する。
【0002】
(発明の分野)
一般に、本発明は、持続感染および癌の処置のための方法および組成物に関する。
【背景技術】
【0003】
(発明の背景)
予防ワクチンの開発はウイルス感染の死亡率を顕著に減少させたが、持続感染を引き起こすウイルス(例えば、C型肝炎ウイルス)に対するこのようなワクチンの使用は、限られた成果しか上げていない。急性感染および自己限定型の感染を引き起こすウイルスとは対照的に、持続感染を引き起こす微生物に対して惹起される免疫応答は、しばしば、一過性であり、そしてその感染を除去するには不十分である。結果として、その感染性微生物は、必ずしも宿主に一定の損傷を引き起こすことなく、感染した被験体内に長期間にわたって残存する。
【0004】
持続感染を引き起こす微生物の根絶における主要な障害は、宿主生物体の免疫系を回避するこのような微生物の能力である。例えば、特定のウイルスおよび寄生虫は、感染した細胞の効率的なT細胞認識に必要な宿主分子の発現をダウンレギュレートする。持続感染はまた、ウイルス感染の制御および根絶に不可欠である抗原特異的CD8+ T細胞の機能的欠陥を引き起こす。治療用ワクチンとサイトカインアジュバントとの組み合わせが、奨励されてきたが、得られた免疫応答は、病原体を首尾よく根絶させなかった。
【発明の概要】
【発明が解決しようとする課題】
【0005】
したがって、より良い方法が、持続感染を処置、予防または軽減するための必要とされている。
【課題を解決するための手段】
【0006】
(発明の要旨)
本発明は、持続感染または癌の処置、予防、または減少のための方法および組成物、あるいは持続感染または癌の1種以上の症状の軽減のための方法および組成物を提供する。本発明は、抗原特異的CD8+ T細胞が、プログラム細胞死(Programmed Death)−1ポリペプチド(PD−1)の誘導後に感染因子に対して機能的に寛容性になる(「疲弊する(exhausted)」)という知見に基づく。したがって、PD−1、PD−L1またはPDL2の発現または活性を減少させることによって、機能的に寛容性のCD8+ T細胞の増殖、サイトカインの産生、および感染因子(例えば、ウイルス、細菌、真菌、寄生虫、マイコプラズマまたは癌)クリアランスの速度は、増大され、その結果、その感染因子に特異的な免疫応答が、増強される。
【0007】
したがって、本発明は、持続感染(例えば、ウイルス感染、細菌感染、真菌感染、マイコプラズマ感染および寄生虫感染)または癌の症状を軽減または予防する必要がある被験体(例えば、ヒト)に、CD28様ファミリーのメンバー(例えば、PD−1、CTLA−4、BTLAおよびそれらの機能性フラグメントまたは改変体)またはCD28様ファミリーリガンドのメンバー(例えば、PD−L1またはPD−L2)の活性または発現を減少させる化合物を投与することによって持続感染または癌の症状を軽減または予防する方法を提供する。あるいは、上記被験体は、抗原特異的T細胞または抗原特異的B細胞におけるPD−1ポリペプチドの発現または活性を減少させる化合物と接触させた抗原特異的T細胞または抗原特異的B細胞を投与される。例えば、上記抗原特異的T細胞または抗原特異的B細胞は、ウイルス抗原に特異的である。上記T細胞またはB細胞は、自系供給源(autologous source)、あるいは処置される被験体と同じかまたは異なる種である別の被験体に由来する。
【0008】
さらに、本発明は、T細胞(例えば、アネルギー性T細胞または抗原に対する増大した免疫寛容を有するT細胞)の細胞傷害活性を、そのT細胞と、PD−1ポリペプチドの活性または発現を減少させる化合物とを接触させることによって増大させる方法を特徴とする。
【0009】
本発明の全ての上記局面において、持続性ウイルス感染は、肝炎ウイルス、ヒト免疫不全ウイルス(HIV)、ヒトTリンパ球向性ウイルス(HTLV)、ヘルペスウイルス、エプスタイン−バーウイルス、またはヒトパピローマウイルスなどの感染によって生じる。持続性ウイルス感染はまた、潜伏ウイルスによって引き起こされる感染を含み得る。癌としては、血管免疫芽球性リンパ腫および結節性リンパ球優勢型ホジキンリンパ腫(nodular lymphocyte Hodhkin lymphoma)などのリンパ増殖性障害が挙げられる。望ましくは、本発明の化合物は、処置される被験体における細胞傷害性T細胞の活性を増大させること(例えば、細胞傷害性サイトカイン(例えば、IFNγ、TNFα、またはIL−2)の産生の増大、T細胞増殖の増大、またはウイルスクリアランスの増大)によって抗原特異的免疫応答を増大させる。例えば、上記化合物は、PDリガンド1(PD−L1)またはPDリガンド2(PD−L2)の発現または活性を減少させるか、あるいはPD−1とPD−L1との間の相互作用またはPD−1とPD−L2との間の相互作用を減少させる。例示の化合物としては、抗体(例えば、抗PD−1抗体、抗PD−L1抗体、および抗PD−L2抗体)、RNAi分子(例えば、抗PD−1 RNAi分子、抗PD−L1 RNAi、および抗PD−L2 RNAi)、アンチセンス分子(例えば、抗PD−1アンチセンスRNA、抗PD−L1アンチセンスRNA、および抗PD−L2アンチセンスRNA)、ドミナントネガティブタンパク質(例えば、ドミナントネガティブPD−1タンパク質、ドミナントネガティブPD−L1タンパク質、およびドミナントネガティブPD−L2タンパク質)、および低分子インヒビターが挙げられる。抗体としては、モノクローナル抗体、ヒト化抗体、脱免疫抗体(deimmunized antibody)、およびIg融合タンパク質が挙げられる。例示の抗PD−L1抗体としては、クローンEH12が挙げられる。
【0010】
PD−1発現またはPD−1活性を減少させる化合物に加えて、処置される被験体はまた、アジュバントまたはプライムブースト注射(prime booster shot)を含んでも含まなくてもよいワクチンを投与され得る。必要に応じて、上記被験体は、第2の化合物(例えば、抗ウイルス化合物(例えば、ビダラビン、アシクロビル、ガンシクロビル、バルガンシクロビル)、ヌクレオシドアナログ逆転写酵素インヒビター(NRTI)(例えば、AZT(ジドブジン)、ddI(ジダノシン)、ddC(ザルシタビン)、d4T(スタブジン)、または3TC(ラミブジン))、非ヌクレオシド逆転写酵素インヒビター(NNRTI)(例えば、ネビラピンまたはデラビルジン)、プロテアーゼインヒビター(例えば、サキナビル、リトナビル、インジナビル、またはネルフィナビル)、リバビリン、およびインターフェロン)、抗細菌化合物、抗真菌化合物、抗寄生虫化合物、抗炎症性化合物、抗腫瘍性化合物または鎮痛剤)を投与される。上記第2の化合物はまた、細胞傷害性Tリンパ球抗原4(CTLA−4)またはBリンパ球およびTリンパ球のアテニュエーター(B and T lymphocyte attenuator)(BTLA)の発現または活性を減少させる化合物であり得る。上記被験体に投与され得る他の例示の化合物は、抗CTLA−4抗体、抗BTLA抗体、抗CD28抗体、抗ICOS抗体、抗ICOS−L抗体、抗B7−1抗体、抗B7−2抗体、抗B7−H3抗体、および抗B7−H4抗体である。
【0011】
本発明は、PD−1ポリペプチドの活性または発現を調節する候補化合物を同定するための方法をさらに提供し、その方法は、以下の工程を含む:(a)PD−1遺伝子(例えば、PD−1融合遺伝子)を発現する細胞と候補化合物とを接触させる工程;(b)上記細胞におけるPD−1の発現または活性を測定する工程(例えば、PD−1 mRNAまたはPD−1タンパク質の発現を測定することによって);および(c)上記化合物と接触させていないコントロール細胞におけるこのような発現または活性と比較して、上記細胞におけるPD−1の発現または活性を比較する工程。PD−1の発現または活性の増大または減少は、上記候補化合物がPD−1ポリペプチドの活性または発現を調節するのに有用であることを示す。
【0012】
あるいは、上記スクリーニング方法は、以下の工程を包含し得る:(a)PD−1遺伝子を過剰発現するT細胞と候補化合物とを接触させる工程;および(b)上記T細胞の細胞傷害活性を決定する工程;(c)上記T細胞の細胞傷害活性を、上記化合物と接触させていないコントロール細胞におけるこのような活性に対して比較する工程。このような活性の増大または減少により、上記候補化合物がPD−1ポリペプチドの活性または発現を調節するのに有用であると同定される。細胞傷害活性は、サイトカイン産生、T細胞増殖、およびウイルスクリアランスを含む。
【0013】
本発明は、以下の工程を包含するスクリーニング方法をさらに提供する:(a)PD−1ポリペプチドと候補化合物とを接触させる工程;(b)上記候補化合物が上記PD−1ポリペプチドと相互作用するか否かを決定する工程;および(c)候補化合物を、PD−1の発現または活性を調節するのに有用であると同定する工程。望ましくは、同定された候補化合物は、PD−1ポリペプチドと相互作用し、そしてその候補化合物は、PD−1の活性を減少させる。
【0014】
本明細書中に記載されるスクリーニング方法によって同定された候補化合物は、PD−1とPD−L1との間の相互作用またはPD−1とPD−L2との間の相互作用を減少させ得る。本明細書中に記載されるあらゆるスクリーニング方法において使用される細胞としては、哺乳動物細胞(例えば、げっ歯類細胞またはヒト細胞)が挙げられる。上記細胞は、T細胞などの免疫細胞である。望ましくは、このようなスクリーニング方法において使用されるPD−1ポリペプチドは、ヒトPD−1ポリペプチドである。
【0015】
被験体を、持続感染または癌を有するか、あるいは持続感染または癌を有する危険性があると診断する方法がまた、本明細書中で提供され、その方法は、以下の工程を包含する:(a)被験体由来の免疫細胞(例えば、T細胞またはB細胞)を含むサンプルを提供する工程、および(b)サンプル中のPD−1の発現または活性を測定する工程。コントロールサンプルにおけるPD−1の発現または活性と比較したPD−1の発現または活性の増大により、上記被験体が、持続感染または癌を有するか、持続感染または癌を有する危険性があると同定される。望ましくは、工程(b)は、抗原(例えば、ウイルス抗原、細菌抗原、寄生虫抗原、または真菌抗原)特異的免疫細胞を同定することを包含する。
【0016】
持続感染または癌を有するか、あるいは持続感染または癌を有する危険性がある被験体に対する処置を選択する方法もまた、記載される。この方法は、以下の工程を包含する:(a)被験体由来の免疫細胞(例えば、T細胞またはB細胞)を含むサンプルを提供する工程;ならびに(b)上記免疫細胞におけるPD−1の発現または活性を測定する工程であって、コントロールサンプルにおけるPD−1の発現または活性と比較したPD−1の発現または活性の増大により、持続感染または癌を有するか、あるいは持続感染または癌を有する危険性がある被験体が同定される、工程;および(c)持続感染または癌を有するか、あるいは持続感染または癌を有する危険性があると診断された被験体に対する処置を選択する工程であって、その処置が、PD−1の発現または活性を減少させる化合物を含む、工程。望ましくは、工程(b)は、抗原(例えば、ウイルス抗原、細菌抗原、寄生虫抗原、または真菌抗原)特異的免疫細胞を同定することを包含する。
【0017】
被験体に由来するサンプルとしては、血液サンプル、組織生検、および骨髄サンプルが挙げられる。さらに、コントロール細胞は、持続感染を有さないか、または持続感染を有する危険性がない被験体に由来し得る。
【0018】
本発明は、以下を含む組成物をさらに提供する:(a)PD−1のレベルまたは活性を減少させる化合物;および(b)第2の化合物(例えば、抗ウイルス化合物、抗細菌化合物、抗真菌化合物、抗寄生虫化合物、抗炎症性化合物、鎮痛剤、抗CTLA−4抗体、抗BTLA抗体、抗CD28抗体、抗ICOS抗体、抗ICOS−L抗体、抗B7−1抗体、抗B7−2抗体、抗B7−H3抗体、または抗B7−H4抗体)。
【0019】
本発明はまた、以下を備えるキットを提供する:(a)PD−1のレベルまたは活性を減少させる化合物;および(b)被験体に対する上記化合物の送達についての説明書。あるいは、上記キットは、以下を備える:(a)PD−1のレベルまたは活性を減少させる第1の化合物;(b)第2の化合物(例えば、抗ウイルス化合物、抗細菌化合物、抗真菌化合物、抗寄生虫化合物、抗炎症性化合物、鎮痛剤、抗CTLA−4抗体、抗BTLA抗体、抗CD28抗体、抗ICOS抗体、抗ICOS−L抗体、抗B7−1抗体、抗B7−2抗体、抗B7−H3抗体、または抗B7−H4抗体);ならびに(c)被験体に対する上記第1の化合物および上記第2の化合物の送達についての説明書。
【0020】
本発明は、持続感染の処置、予防、および減少、あるいは、持続感染の1種以上の症状の軽減に関して、標準的な治療を上回る顕著な利益を提供する。PD−1のレベルまたは活性を減少させる治療剤の投与は、CD8+ T細胞の細胞傷害性を増大させ、次に、持続感染を確立する能力を有する感染因子に対する免疫応答を増大させる。さらに、本発明によって提供される候補化合物スクリーニング方法は、単に症状を緩和するよりもむしろ損傷プロセスを改変する新規治療の同定を可能にする。
【0021】
他に定義されない限り、本明細書中で使用される全ての技術用語および科学用語は、本発明が属する分野の当業者によって一般的に認識される意味と同じ意味を有する。本明細書中に記載されるものと同様かまたは等価である方法および材料が、本発明の実施または試験において使用され得るが、適切な方法および材料は、下に記載される。本明細書中で言及される全ての刊行物、特許出願、特許、および他の参考文献は、その全体が参考として援用される。矛盾する場合において、定義を含む本明細書が、支配する。さらに、材料、方法、および実施例は、単なる例示であり、そしてそれらは、限定することを意図しない。
【0022】
本発明の他の特徴および利点は、添付の詳細な説明および特許請求の範囲から明らかである。
【図面の簡単な説明】
【0023】
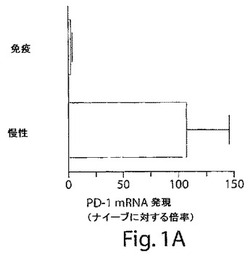
【図1A】図1Aは、遺伝子アレイ分析によって測定した場合の、ナイーブのトランスジェニックマウス、リンパ球脈絡髄膜炎ウイルス(LCMV)Armstrong免疫(感染の約30日後)感染マウス、またはCD4枯渇LCMV−Cl−13感染マウス(感染の約30日後)に由来するDbGP33−41特異的T細胞および/またはDbGP276−286特異的T細胞のPD−1 mRNAのレベルを示す棒グラフである。
【図1B】図1Bは、LCMV Armstrong免疫感染マウスおよびCD4枯渇LCMV−Cl−13感染マウスにおける感染の約60日後のCD8+ テトラマー+ T細胞上のPD−1表面発現を示すフローサイトメトリー実験の一連の画像である。アネルギー性CD8+ T細胞は、LCMV−Cl−13ウイルスによる慢性感染の約60日後(「慢性」と標識される)において細胞表面上に高レベルのPD−1ポリペプチドを発現するが、ウイルス特異的CD8+ T細胞は、急性LCMV Armstrong感染のクリアランス後(「免疫」と標識される)に、PD−1ポリペプチドを発現しない。
【図1C】図1Cは、慢性感染しているマウスおよび慢性感染していないマウスに由来する脾臓細胞上のPD−L1の存在を示すフローサイトメトリー実験の一連の画像である。それは、PD−L1発現が上記ウイルスに感染した脾臓細胞上において最も高いことを示す。
【図2A】図2Aは、Cl−13感染マウスが感染の23〜37日後に処置される場合に、未処置のコントロールと比較して、DbNP396−404特異的CD8T細胞およびDbGP33−41特異的CD8T細胞の数が約3倍増加したことを示す一連の散布図である。機能における任意の変化を決定するために、IFN−γ産生およびTNF−α産生は、8種の異なるLCMVエピトープに対する応答において測定された。
【図2B】図2Bは、全ての公知のCD8 T細胞特異性が測定される場合に、LCMV特異的CD8 T細胞の総数が2.3倍増加することを示す散布図である。
【図2C】図2Cは、8種の異なるLCMVエピトープに対する応答におけるIFN−γ産生およびTNF−α産生を示す一連のフローサイトメトリーのグラフである。
【図2D】図2Dは、処置マウス中のより多くのウイルス特異的なCD8 T細胞がTNF−αを産生する能力を有することを示す散布図である。
【図2E】図2Eは、PD−L1遮断がまた脾臓、肝臓、肺および血清における増大したウイルス制御をもたらしたことを示す一連の棒グラフである。
【図3A】図3Aは、感染の46〜60日後に抗PD−L1によって処置されたCD4枯渇Cl−13感染マウス(「αPD−L1」と標識される)対コントロール(「untx」と標識される)における、DbGP33−41特異的CD8+ T細胞およびDbGP276−286特異的CD8+ T細胞(「GP33」および「GP276」と標識される)の増加を示すグラフであり、これは、抗PD−L1によって処置されたマウスが、処置していないマウスよりも、DbGP276−286特異的な脾性CD8+ T細胞を約7倍多く含み、そしてDbGP33−41特異的な脾性CD8+ T細胞を約4倍多く含んだことを示す。
【図3B】図3Bは、感染の46〜60日後に抗PD−L1によって処置されたCD4枯渇Cl−13感染マウス(「αPD−L1 Tx」と標識される)の脾臓 対 コントロール(「untx」と標識される)の脾臓における、DbGP33−41特異的CD8+ T細胞およびDbGP276−286特異的CD8+ T細胞の増加した頻度を示す一連の画像である。
【図3C】図3Cは、BrdU取り込みおよびKi67発現によって測定した場合の、抗PD−L1処置マウスにおけるDbGP276−286特異的CD8+ T細胞の増大した増殖を示す一連の画像である。
【図3D】図3Dは、脾臓におけるDbGP276−286特異的CD8+ T細胞と比較して末梢血単核細胞(PBMC)におけるDbGP276−286特異的CD8+ T細胞を比較することによって示されるように、高レベルのCD8+ T細胞増殖を有するマウスがPBMCにおける評価可能な応答を実証することを示すチャートである。
【図4A】図4Aは、コントロールと比較して、抗PD−L1処置マウス中のIFN−γを産生するDbGP276−286特異的CD8+ T細胞およびDbGP33−41特異的CD8+ T細胞の増加を示す一連のチャートである。DbNP396−404特異的CD8+ T細胞、KbNP205−212特異的CD8+ T細胞、DbNP166−175特異的CD8+ T細胞、およびDbGP92−101特異的CD8+ T細胞のより高い頻度は、抗PD−L1処置マウスにおいて検出された。
【図4B】図4Bは、コントロールマウス中では20%のDbGP276−286特異的CD8+ T細胞がIFN−γを産生することと比較して、抗PD−L1処置マウスにおいては50%のDbGP276−286特異的CD8+ T細胞がIFN−γを産生することを示すチャートである。
【図4C】図4Cは、抗PD−L1処置慢性感染マウスが未処置の慢性感染マウスよりも高いレベルのTNF−αを産生するが、LCMV Armstrongウイルスに感染した免疫マウスよりも依然として低いレベルのTNF−αを産生することを示す一連の画像である。
【図4D】図4Dは、51Cr放出アッセイを使用して測定したところ、抗PD−L1によるLCMV−Cl−13感染マウスの処置が、未処置の感染マウスと比較してウイルス特異的T細胞のエキソビボ細胞溶解活性を回復させることを示すチャートである。
【図4E】図4Eは、α−PD−L1によって処置されたLCMV−Cl−13感染マウスの処置後の種々の器官におけるウイルス力価の減少を示す一連のチャートである。ウイルス力価は、抗PD−L1処置の2週間後に、未処置マウスと比較して、脾臓において約3倍、肝臓において約4倍、肺において約2倍、そして血清において約2倍減少した。
【図5A】図5Aは、慢性のクレードC型HIV感染において標的化された優性のエピトープに特異的な10のHIVテトラマーを使用したPD−1表面発現を示すフローサイトメトリー実験の一連の画像である。%は、PD−1+であるテトラマー+細胞の%を示す。
【図5B】図5Bは、PD−1の%およびMFIが、抗レトロウイルス治療ナイーブの個体における全CD8 T細胞集団と比較して、HIV特異的CD8 T細胞において有意にアップレギュレートされ(p<0.0001)、そしてPD−1がHIV感染 対 HIV血清反応陰性コントロールにおける全CD8 T細胞集団において増加した(それぞれ、p=0.0033およびp<0.0001)ことを示す一連のチャートである。65のHIV感染個体および11のHIV血清反応陰性コントロールに由来する120のHIVテトラマー染色が、この分析に含められた。
【図5C】図5Cは、テトラマー+細胞上のPD−1発現の中央値%およびMFIをエピトープ特異性によって示す一連のチャートである。
【図5D】図5Dは、複数の検出可能な応答を有する個体内の異なるエピトープ特異的集団におけるPD−1+細胞の%のバリエーションを示すチャートである。水平のバーは、各個体におけるPD−1+ HIVテトラマー+細胞の中央値%を示す。
【図6A】図6Aは、(テトラマー染色によって測定した)HIV特異的CD8 T細胞の数と血漿ウイルス量との間には相関がないのに対し、テトラマー+細胞上のPD−1の%およびMFIの両方と血漿ウイルス量との間に正の相関があること(それぞれ、p=0.0013およびp<0.0001)を示す一連のチャートである。
【図6B】図6Bは、HIVテトラマー+細胞の数とCD4数との間には相関がないのに対し、HIVテトラマー+細胞上のPD−1の%およびMFIとCD4数との間に逆の相関があること(それぞれ、p=0.0046およびp=0.0150)を示す一連のチャートである。
【図6C】図6Cは、全CD8 T細胞集団上のPD−1の%およびMFIが血漿ウイルス量と正に相関すること(それぞれ、p=0.0021およびp<0.0001)を示す一連のチャートである。
【図6D】図6Dは、全CD8 T細胞集団上のPD−1発現の%およびMFIがCD4数と逆に相関すること(それぞれ、p=0.0049およびp=0.0006)を示す一連のチャートである。
【図7A】図7Aは、B*4201 TL9特異的CD8 T細胞の98%がPD−1+である被験体SK222由来のB*4201 TL9特異的CD8 T細胞の代表的な表現型の染色を示すフローサイトメトリー実験の一連の画像である。
【図7B】図7Bは、HIV特異的CD8 T細胞の>95%がPD−1+である者由来の表現型データのまとめを示すチャートである。7〜19人のサンプルが、示された表現型マーカーの各々について分析された。水平のバーは、示されたマーカーに対して陽性であったテトラマー+ PD−1+細胞の中央値%を示す。
【図8A】図8Aは、B*4201陽性被験体からの代表的な増殖アッセイデータを示すフローサイトメトリー実験の一連の画像である。ペプチドによる6日間の刺激の後、B*4201 TL9特異的CD8 T細胞の%は、抗PD−L1遮断抗体の存在下で5.7%から12.4%まで増加した。
【図8B】図8Bは、抗PD−L1遮断抗体の存在下におけるHIV特異的CD8 T細胞の増殖の有意な増大を示すまとめの増殖アッセイデータを示す線グラフである(n=28、p=0.0006、対t検定)。
【図8C】図8Cは、個々の患者に基づくHIV特異的CD8 T細胞の増殖に対するPD−1/PD−L1遮断の示差的効果を示す棒グラフである。白色のバーは、ペプチド単独の存在下におけるテトラマー+細胞の増加倍率を示し、黒色のバーは、ペプチドに加えて抗PD−L1遮断抗体の存在下におけるテトラマー+細胞の増加倍率を示す。CFSEアッセイが1種以上のエピトープについて行なわれた個体は、アスタリスク、四角、または三角の記号によって示される。
【発明を実施するための形態】
【0024】
(詳細な説明)
最近数十年間における抗生物質およびワクチンの使用は、微生物感染に起因する死亡率を顕著に減少させている。しかし、抗微生物治療様式の成功は、宿主生物体の免疫系を回避し、次に持続感染を確立する特定の感染因子の能力によって制限されている。例えば、肝炎およびHIVなどのウイルスに対して惹起される免疫応答は、感染因子を除去するのに十分ではなく、その感染因子は、感染した被験体に残存する。このような感染において、抗原特異的CD8+ T細胞は、感染因子に対して機能的に寛容性(「アネルギー」または「疲弊(exhaustion)」として公知である)になる。アネルギー性T細胞は、それらの細胞傷害活性(すなわち、それらのサイトカインを産生する能力、増殖する能力、および感染因子を除去する能力)を失う。
【0025】
本発明は、T細胞アネルギーが、PD−1発現の誘導と同時に生じること、およびPD−1発現が特定の型のリンパ増殖性障害と相関するという驚くべき知見に基づく。したがって、本発明は、T細胞と、PD−1、PD−1リガンド(PD−L1)またはPD−1リガンド2(PD−L2)の発現または活性を減少させる薬剤とを接触させることによってT細胞の細胞傷害性を増大させる方法を提供する。より具体的には、本発明は、被験体に、PD−1の発現または活性を減少させる薬剤を投与することによって持続感染またはリンパ増殖性障害(例えば、血管免疫芽球性リンパ腫および結節性リンパ球優勢型ホジキンリンパ腫などの癌)を処置または予防する方法を提供する。PD−1、PD−L1またはPD−L2の発現または活性の減少は、細胞傷害性T細胞の活性の増大をもたらし、感染因子に対する特異的な免疫応答を増大させる。本明細書中で提供される結果は、抗プログラム細胞死リガンド−1(PD−L1)遮断抗体を持続的に感染したマウスへと投与することがアネルギー性T細胞の細胞傷害活性を増大させたことを示す。具体的には、PD−1シグナリングの途絶は、アネルギー性CD8+ T細胞の増殖、増強されたサイトカイン産生、および増大したウイルスクリアランスを誘導する:さらに、CD4枯渇マウスの持続感染の間に産生されたCD8+ T細胞は、抗PD−L1処置の際に、増殖しかつそれらのかなりの機能を取り戻していた。
【0026】
T細胞が外来タンパク質に対して応答するためには、2つのシグナルが、抗原提示細胞(APC)によって休止Tリンパ球に与えられる必要がある。免疫応答についての特異性を与える第1のシグナルは、主要組織適合遺伝子複合体(MHC)の構成(context)において提示される外来抗原ペプチドの認識後に、T細胞レセプター(TCR)を介して伝達される。補助刺激と称される第2のシグナルは、増殖しかつ機能性になるT細胞を誘導する。補助刺激は、抗原特異的でも、MHCにも拘束されず、そして補助刺激は、APCによって発現される1種以上の異なる細胞表面ポリペプチドによって提供される。T細胞が、さらなる補助刺激シグナルを受容することなくT細胞レセプターによってのみ刺激される場合、それらは、応答しなくなるか、アネルギー性になるか、または死に、免疫応答の下方調節(downmodulation)をもたらす。
【0027】
APC上に発現されるCD80(B7−1)タンパク質およびCD86(B7−2)タンパク質は、重要な補助刺激ポリペプチドである。B7−2が、一次免疫応答の間に優勢な役割を果たす一方で、B7−1は、免疫応答の過程の後期にアップレギュレートされて一次T細胞応答を延長するかまたは二次的T細胞応答を補助刺激する。B7ポリペプチドは、免疫細胞に対して補助刺激シグナルまたは阻害性シグナルを提供して免疫細胞応答を促進または阻害し得る。例えば、補助刺激レセプターに結合した場合、PD−L1(B7−4)は、免疫細胞の補助刺激を誘導するか、または可溶性形態で存在する場合に免疫細胞補助刺激を阻害する。阻害性レセプターに結合した場合、B7−4分子は、阻害性シグナルを免疫細胞に対して伝達し得る。例示のB7ファミリーメンバーとしては、B7−1、B7−2、B7−3(抗体BB−1によって認識される)、B7h(PD−L1)、およびB7−4ならびにそれらの可溶性フラグメントまたは誘導体が挙げられる。B7ファミリーメンバーは、免疫細胞上の1種以上のレセプター(例えば、CTLA4、CD28、ICOS、PD−1および/または他のレセプター)に結合し、そしてB7ファミリーメンバーは、そのレセプターに依存して、阻害性シグナルまたは補助刺激シグナルを免疫細胞に対して伝達する能力を有する。
【0028】
CD28は、休止T細胞上に構成的に発現されるレセプターである。T細胞レセプターを介したシグナリングの後、CD28の連結および補助刺激シグナルの伝達は、IL−2を増殖および分泌するT細胞を誘導する。CTLA4(CD152)(CD28と相同なレセプター)は、休止T細胞上に存在しないが、CTLA4(CD152)の発現は、T細胞の活性化後に誘導される。CTLA4は、T細胞応答のネガティブな調節において役割を果たす。ICOS(CD28およびCTLA4に関連するポリペプチド)は、IL−10産生に関与する。PD−1(PD−L1およびPD−L2が結合するレセプター)はまた、T細胞の表面上に迅速に誘導される。PD−1はまた、B細胞の表面上(抗IgMに対する応答において)、ならびに胸腺細胞および骨髄性細胞のサブセットにおいて発現される。
【0029】
PD−1の結合(engagement)(例えば、架橋または凝集による)は、免疫細胞において阻害性シグナルの伝達をもたらし、免疫細胞アネルギーの増大と同時に生じる免疫応答の減少を生じる。PD−1ファミリーメンバーは、抗原提示細胞上の1種以上のレセプター(例えば、PD−L1およびPD−L2)に結合する。
【0030】
PD−L1およびPD−L2(これらの両方は、ヒトPD−1リガンドポリペプチドである)は、上記B7ファミリーのポリペプチドのメンバーである。各PD−1リガンドは、シグナル配列、IgVドメイン、IgCドメイン、膜貫通ドメイン、および短い細胞質テール(cytoplasmic tail)を含む。これらのリガンドは、胎盤、脾臓、リンパ節、胸腺、および心臓において発現される。PD−L2はまた、膵臓、肺、および肝臓において発現されるが、PD−L1は、胎児肝臓、活性化T細胞および内皮細胞において発現される。両方のPD−1リガンドは、活性化単球および樹状細胞においてアップレギュレートされる。
【0031】
(定義)
本明細書中で使用される場合、「持続感染」によって、感染因子(例えば、ウイルス、細菌、寄生虫、マイコプラズマ、または真菌)が免疫応答の誘導後でさえも、感染した宿主から除去または排除されていない感染が意味される。持続感染は、慢性感染、潜在性感染、または遅発性感染であり得る。急性感染は、比較的短期間(数日間〜数週間持続する)であり、そして免疫系によって身体から消散され、一方で、持続感染は、数ヶ月間、数年間、または一生にわたってでさえ持続し得る。これらの感染はまた、長期間の間に頻繁に再発し得、細胞の殺傷または宿主細胞に対する過剰な損傷さえも伴わない無症候性かつ増殖性の感染の段階を含む。原因である感染因子はまた、免疫応答が解消した後でさえ、標準的な技術を使用して宿主(例えば、感染した個体の内部の特定の細胞)において検出され得る。哺乳動物は、当該分野において公知である任意の標準的な方法および例えば、米国特許第6,368,832号、同第6,579,854号、および同第6,808,710号ならびに米国特許出願第20040137577号、同第20030232323号、同第20030166531号、同第20030064380号、同第20030044768号、同第20030039653号、同第20020164600号、同第20020160000号、同第20020110836号、同第20020107363号、および同第20020106730号(これらの全ては、本明細書によって参考として援用される)に記載される任意の標準的な方法に従って、持続感染を有すると診断される。例えば、被験体は、PCR分析を使用したこの個体からの生物学的サンプルにおけるクラミジア種の検出後に、持続性クラミジア感染を有すると診断され得る。哺乳動物は、本発明によって処置されるべき持続感染と診断されていない必要がない。持続感染を確立し得る微生物因子としては、ウイルス(例えば、パピローマウイルス、肝炎ウイルス、ヒト免疫不全ウイルス、およびヘルペスウイルス)、細菌(例えば、Escherichia coliおよびクラミジア属の種)、寄生虫(例えば、プラスモディウム属、リーシュマニア属の種、住血吸虫属の種、トリパノソーマ属の種、トキソプラスマ属の種)および真菌が挙げられる。
【0032】
「持続感染の症状を軽減すること」によって、持続感染が生じる前後における持続感染に関連した任意の状態または症状を改善することが意味される。あるいは、持続感染の症状を軽減することは、被験体中の感染性微生物(例えば、ウイルス、細菌、真菌、マイコプラズマ、または寄生虫)量を、未処置のコントロールにおけるこのような量に比較して減少させることを含み得る。対応する未処置のコントロールと比較して、このような減少または予防の程度は、任意の標準的な技術によって測定される場合、少なくとも5%、10%、20%、40%、50%、60%、80%、90%、95%、または100%である。望ましくは、上記持続感染は、当該分野において公知である任意の標準的な方法によって検出される場合、完全に除去され、この場合、持続感染が、処置されたと見なされる。持続感染について処置されるべきである患者は、医師がこのような状態を有すると診断した患者である。診断は、任意の適切な手段によるものであり得る。診断およびモニタリングは、例えば、生物学的サンプル(例えば、組織生検、血液検査、または尿検査)における微生物量のレベルを検出すること、生物学的サンプルにおける微生物感染の代用マーカーのレベルを検出すること、持続感染と関連した症状を検出すること、または持続感染の代表的な免疫応答に関与する免疫細胞を検出すること(例えば、アネルギー性である抗原特異的T細胞の検出)を含み得る。持続感染の発症が予防されている患者は、このような診断を受けていても受けていなくてもよい。当業者は、これらの患者が、上に記載されるものと同じ標準的な試験に供された可能性があるか、または1種以上の危険因子(例えば、家族歴または感染因子に対する曝露)の存在に起因する高い危険性があると検査なしで同定されている可能性があることを、理解する。
【0033】
本明細書中で使用される場合、「PD−1」によって、PD−L1タンパク質またはPD−L2タンパク質との複合体を形成し、したがって免疫応答(例えば、T細胞の補助刺激)に関与するポリペプチドが、意味される。本発明のPD−1タンパク質は、天然に存在するPD−1(例えば、Ishidaら、EMBO J.11:3887−3895、1992、Shinoharaら、Genomics 23:704−706、1994;および米国特許第5,698,520号(本明細書中に参考として援用される)を参照のこと)と実質的に同一である。PD−1シグナリングは、T細胞増殖、サイトカイン産生、またはウイルスクリアランスを減少させることによって、例えば、CD8+ T細胞の細胞傷害性を減少させ得る。本発明に従って、上記PD−1ポリペプチドは、任意の標準的な方法によって測定される場合、CD8+ T細胞の細胞傷害活性を、コントロールレベルの少なくとも5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、または100%超低くに減少させる。
【0034】
「PD−1遺伝子」によって、PD−1タンパク質をコードする核酸が意味される。
【0035】
「PD−1融合遺伝子」によって、第2の異種核酸配列に作動可能に連結されたPD−1プロモーターおよび/またはPD−1コード領域全体もしくはその一部が意味される。好ましい実施形態において、上記第2の異種核酸配列は、レポーター遺伝子(すなわち、その遺伝子の発現がアッセイされ得る遺伝子)である;レポーター遺伝子としては、グルクロニダーゼ(GUS)をコードする遺伝子、ルシフェラーゼをコードする遺伝子、クロラムフェニコールトランスアセチラーゼ(CAT)をコードする遺伝子、緑色蛍光タンパク質(GFP)をコードする遺伝子、アルカリホスファターゼをコードする遺伝子、およびβ−ガラクトシダーゼをコードする遺伝子が挙げられるが、これらに限定されない。
【0036】
「PD−1の発現または活性を減少させる」によって、未処置のコントロールにおけるPD−1のレベルまたは生物学的活性と比較してPD−1のレベルまたは生物学的活性を減少させることが意味する。本発明にしたがって、このような活性またはレベルは、未処置のコントロールと比較して少なくとも10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、または100%よりもさらに大きく減少する。例えば、PD−L1、PD−L2、またはその両方に対するPD−1の結合が減少する場合、PD−1の生物学的活性は減少し、それによってPD−1シグナリングの減少が生じ、したがってCD8+ T細胞の細胞傷害性の増大を生じる。本明細書中で使用される場合、PD−1ポリペプチドに関する用語「活性」は、天然に存在するPD−1タンパク質に固有である任意の活性(例えば、天然のリガンドを抗原提示細胞に結合することによって活性化免疫細胞において阻害性シグナルを調節する能力)を含む。免疫細胞における阻害性シグナルのこのような調節は、増殖の調節および/または免疫細胞によるサイトカイン分泌を生じる。PD−1はまた、B7分子の結合について補助刺激レセプターと競合することによって補助刺激シグナルを調節し得る。したがって、用語「PD−1活性」は、PD−1ポリペプチドの天然のリガンドを結合するPD−1ポリペプチドの能力、免疫細胞補助刺激シグナルまたは免疫細胞阻害性シグナルを調節する能力、および免疫応答を調節する能力を含む。したがって、PD−1活性を減少させることは、PD−L1またはPD−L2に対するPD−1の相互作用を減少させることを含む。これは、例えば、PD−L1またはPD−L2を遮断することによって達成され得る。
【0037】
「免疫細胞」によって、造血起源の細胞であって、免疫応答において役割を果たす細胞が、意味される。免疫細胞としては、リンパ球(例えば、B細胞およびT細胞)、ナチュラルキラー細胞、および骨髄性細胞(例えば、単球、マクロファージ、好酸球、肥満細胞、好塩基球、および顆粒球)が挙げられる。
【0038】
「T細胞」によって、CD4+ T細胞またはCD8+ T細胞が意味される。用語「T細胞」は、TH1細胞およびTH2細胞の両方を含む。用語「T細胞の細胞傷害」は、CD8+ T細胞の活性化によって媒介される任意の免疫応答を含む。例示の免疫応答としては、サイトカイン産生、CD8+ T細胞増殖、グランザイムまたはパーフォリンの産生、および感染因子のクリアランスが挙げられる。
【0039】
「無応答性」によって、刺激(例えば、活性化レセプターおよびサイトカインを介する刺激)に対する免疫細胞の不応性(refractivity)が含まれる。無応答性は、例えば、免疫抑制剤に対する曝露または高用量の抗原に対する曝露に起因して起こり得る。本明細書中で使用される場合、用語「アネルギー」または「免疫寛容」は、活性化レセプター媒介性の刺激に対する不応性を含む。このような不応性は、一般に、抗原特異的であり、そして寛容化する抗原に対する曝露が途絶えた後に持続する。例えば、T細胞におけるアネルギー(無応答性とは対照的である)は、サイトカイン産生(例えば、IL−2)の欠如によって特徴付けられる。T細胞アネルギーは、T細胞が、抗原に曝され、そして第1のシグナル(T細胞レセプターまたはCD−3媒介性のシグナル)を第2のシグナル(補助刺激シグナル)の非存在下で受容する場合に生じる。これらの条件下で、同じ抗原に対するその細胞の再曝露(再曝露が、補助刺激分子の存在下で起きる場合でさえも)は、サイトカインが産生されないことをもたらし、したがって増殖のないことをもたらす。しかし、アネルギー性T細胞は、無関係の抗原に対する応答を惹起し得、そしてサイトカイン(例えば、IL−2)と一緒に培養した場合に、増殖し得る。例えば、T細胞アネルギーはまた、ELISAによってか、または指標の細胞株を使用する増殖アッセイによって測定される場合、Tリンパ球によるIL−2産生の欠如によって観察され得る。あるいは、レポーター遺伝子構築物が、使用され得る。例えば、アネルギー性T細胞は、5’IL−2遺伝子エンハンサーの制御下での異種プロモーターによって、またはそのエンハンサー内に見出され得るAP1配列のマルチマーによって誘導されるIL−2遺伝子転写を、開始し損なう(Kangら、Science 257:1134、1992)。アネルギー性の抗原特異的T細胞は、対応するコントロールの抗原特異的T細胞と比較して、細胞傷害活性において少なくとも10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、または100%でさえありうる減少を有し得る。
【0040】
「精製された抗体」によって、その抗体が天然に付随するタンパク質および天然に存在する有機分子のうちの少なくとも60重量%を含まない抗体が、意味される。好ましくは、その調製物は、少なくとも75重量%、より好ましくは90重量%、および最も好ましくは少なくとも99重量%の抗体(例えば、PD−1特異的抗体、PD−L1特異的抗体、またはPD−L2特異的抗体)である。精製された抗体は、例えば、組換えで産生されたタンパク質または保存されたモチーフペプチドを使用したアフィニティークロマトグラフィーおよび標準的な技術によって得られ得る。
【0041】
「特異的に結合する」によって、抗原(例えば、PD−1ポリペプチド、PD−L1ポリペプチド、またはPD−L2ポリペプチド)を認識および結合するが、タンパク質を天然に含むサンプル(例えば、生物学的サンプル)中の他の非抗原分子を実質的に認識および結合しない抗体が、意味される。好ましい抗体は、米国特許第6,808,710号ならびに米国特許出願第20040137577号、同第20030232323号、同第20030166531号、同第20030064380号、同第20030044768号、同第20030039653号、同第20020164600号、同第20020160000号、同第20020110836号、同第20020107363号、および同第20020106730号(これらの全ては、本明細書によって参考として援用される)において開示されるPD−1ポリペプチド、PD−L1ポリペプチド、またはPD−L2ポリペプチドに結合する。
【0042】
「中和抗体」によって、PD−1ポリペプチドの任意の生物学的活性(特に、PD−1ポリペプチドの、免疫応答(例えば、T細胞の細胞傷害)を減少させる能力)を妨げる抗体が、意味される。中和抗体は、PD−1ポリペプチドの、免疫応答を減少させる能力を、好ましくは50%、より好ましくは70%、および最も好ましくは90%以上減少させ得る。免疫応答を測定するための任意の標準的なアッセイ(本明細書中に記載されるものを含む)は、潜在的中和抗体を評価するために使用され得る。
【0043】
タンパク質またはポリペプチドについて言及する場合、「実質的に同一である」によって、参照アミノ酸配列に対して少なくとも75%の同一性を示すが、好ましくは85%の同一性、より好ましくは90%の同一性、最も好ましくは95%、または99%でさえありうる同一性を示すタンパク質またはポリペプチドが、意味される。タンパク質またはポリペプチドに関して、比較配列の長さは、一般に、少なくとも20アミノ酸、好ましくは少なくとも30アミノ酸、より好ましくは少なくとも40アミノ酸、そして最も好ましくは50アミノ酸であるか、または完全長タンパク質もしくは完全長ポリペプチドである。それぞれの「実質的に同一である」タンパク質またはポリペプチドをコードする核酸は、「実質的に同一である」核酸の例を構成する;その核酸はそれらのタンパク質またはポリペプチドをコードするあらゆる配列(遺伝暗号の縮重に起因する)を含むことが、認識される。さらに、「実質的に同一である」核酸配列はまた、高ストリンジェンシー条件下で参照核酸分子にハイブリダイズするポリヌクレオチドを含む。
【0044】
「高ストリンジェンシー条件」によって、高温および低イオン強度によって特徴付けられ、そして65℃の温度で0.5M NaHPO4(pH7.2)と、7% SDSと、1mM EDTAと、1% BSA(Fraction V)とを含む緩衝液、または42℃の温度で、48%ホルムアミドと、4.8×SSCと、0.2M Tris−Cl(pH7.6)と、1×Denhardt溶液と、10%硫酸デキストランと、0.1% SDSとを含む緩衝液における、少なくとも40ヌクレオチド長のDNAプローブの使用によって生じるハイブリダイゼーションに匹敵するハイブリダイゼーションを可能にするあらゆるセットの条件が、意味される。高ストリンジェンシーハイブリダイゼーション(例えば、PCR、ノーザンハイブリダイゼーション、サザンハイブリダイゼーション、またはインサイチュハイブリダイゼーション、DNA配列決定など)についての他の条件は、分子生物学の分野の当業者に周知である。例えば、F.Ausubelら、Current Protocols in Molecular Biology、John Wiley & Sons、New York、N.Y.、1998(本明細書によって参考として援用される)を参照のこと。
【0045】
「実質的に純粋」によって、核酸、ポリペプチド、または他の分子と天然で付随している成分から分離されている、核酸、ポリペプチド、または他の分子が、意味される。代表的に、ポリペプチドは、そのポリペプチドが、それが天然に付随するタンパク質および天然に存在する有機分子のうちの少なくとも60重量%、70重量%、80重量%、90重量%、95重量%、または99重量%を含まない場合に、実質的に純粋である。例えば、実質的に純粋なポリペプチドは、天然の供給源からの抽出、通常はそのタンパク質を発現しない細胞における組換え核酸の発現、または化学合成によって得られ得る。
【0046】
用語「単離されたDNA」は、所与のDNAが得られる生物体の天然に存在するゲノムにおいてそのDNAに隣接(flank)している遺伝子を含まないDNAを意味する。したがって、用語「単離されたDNA」は、例えば、cDNA、クローニングされたゲノムDNA、および合成DNAを包含する。
【0047】
「有効量」によって、単独または組み合わせで哺乳動物において高血圧を低下させるかもしくは予防するか、または慢性感染を処置するかもしくは予防するのに必要とされる化合物の量が、意味される。活性化合物の有効量は、投与経路、被験体の年齢、体重、および一般的健康に依存して変動する。最終的に、担当する医師または獣医師が、適切な量および投薬レジメンを決定する。
【0048】
「候補化合物」によって、天然に存在するかまたは人工的に得られる化学物質が意味される。候補化合物としては、例えば、ペプチド、ポリペプチド、合成有機分子、天然に存在する有機分子、核酸分子、ペプチド核酸分子、および成分ならびにそれらの誘導体が挙げられ得る。例えば、本発明に従って有用な候補化合物は、PD−L1、PD−L2、またはその両方に対するPD−1の結合を減少させる。
【0049】
用語「薬学的組成物」は、少なくとも1つの治療的または生物学的に活性な因子を含み、そして患者に対する投与に適している、任意の組成物を意味する。任意のこれらの処方物は、当該分野の周知であって認められた方法によって調製され得る。例えば、Remington:The Science and Practice of Pharmacy、20.sup.th edition、(A R Gennaro編)、Mack
Publishing Co.、Easton、Pa.、2000を参照のこと。
【0050】
(処置する方法)
T細胞の細胞傷害は、T細胞とPD−1の発現または活性を減少させる化合物とを接触させることによって増大する。上記T細胞は、ナイーブT細胞、記憶T細胞または活性化T細胞である。あるいは、上記T細胞は、抗原特異的T細胞である。上記抗原特異的T細胞は、感染因子に対してアネルギー性または寛容性である。T細胞の細胞傷害は、細胞増殖およびサイトカイン放出の増加によって特徴付けられる。
【0051】
本方法は、種々の感染および癌の症状を軽減するのに有用である。被験体にPD−1インヒビターを投与することによって、感染または癌が、処置されるか、予防されるか、または症状が、軽減される。上記被験体は、哺乳動物(例えば、ヒト、霊長類、マウス、ラット、イヌ、ネコ、ウシ、ウマ、およびブタ)である。上記被験体は、感染に罹患しているか、または感染を発症する危険性がある。感染に罹患しているか、または感染を発症する危険性がある被験体は、特定の感染に適した標準的な方法に基づくものである。
【0052】
上記感染(例えば、細菌感染、ウイルス感染、真菌感染、マイコプラズマ感染、または寄生虫感染)は、持続感染である。持続感染は、急性感染とは対照的に、宿主免疫応答の誘導によって有効に除去されない。上記感染因子と上記免疫応答とは、感染した被験体が必ずしも症状を発現することなく長期間にわたって感染性のままであるように平衡に達する。持続感染としては、例えば、潜在性感染、慢性感染および遅発性感染が挙げられる。
【0053】
慢性感染において、上記感染因子は、身体においていつでも検出され得る。しかし、上記疾患の徴候および症状は、長期間にわたって、存在しても、存在しなくてもよい。慢性感染の例としては、B型肝炎(HBVによって引き起こされる)およびC型肝炎(HCVによって引き起こされる)、アデノウイルス、サイトメガロウイルス、エプスタイン−バーウイルス、単純ヘルペスウイルス1型、単純ヘルペスウイルス2型、ヒトヘルペスウイルス6型、水痘−帯状疱疹ウイルス、B型肝炎ウイルス、D型肝炎ウイルス、パピローマウイルス、パルボウイルスB19、ポリオーマウイルスBK、ポリオーマウイルスJC、麻疹ウイルス、風疹ウイルス、ヒト免疫不全ウイルス(HIV)、ヒトT細胞白血病ウイルスI型、およびヒトT細胞白血病ウイルスII型が挙げられる。寄生虫による持続感染は、リーシュマニア属、トキソプラスマ、トリパノソーマ属、プラスモディウム属、住血吸虫属、およびエンセファリトゾーン属による感染の結果として生じ得る。
【0054】
潜在性感染において、上記感染因子(例えば、ウイルス)は、外見的に、不活性であり、そして休止しており、その結果、上記被験体は、必ずしも徴候または症状を示さない。潜在性ウイルス感染において、上記ウイルスは、平衡状態で、症状が再び出現する前に長期間にわたって存続する;しかし、疾患の再活性化が起きるまで、実際のウイルスを検出できない。潜在性感染の例としては、HSV−1(熱性疱疹)によって引き起こされる感染、HSV−2(陰部ヘルペス)によって引き起こされる感染、およびVZV(水痘−帯状疱疹)によって引き起こされる感染が挙げられる。
【0055】
遅発性感染において、上記感染因子は、顕著な徴候または症状が観察されない非常に長い期間にわたって、次第にその数が増加する。遅発性感染の例としては、AIDS(HIV−1およびHIV−2によって引き起こされる)、動物において腫瘍を引き起こすレンチウイルス、およびプリオンが挙げられる。
【0056】
さらに、持続感染は、しばしば、急性感染の後期合併症(late complication)として生じる。例えば、亜急性硬化性汎脳炎(SSPE)は、急性麻疹感染の後に起こり得るか、または退行性の脳炎(regressive encephalitis)は、風疹感染の結果として起こり得る。
【0057】
癌としては、例えば、血管免疫芽球性リンパ腫または結節性リンパ球優勢型ホジキンリンパ腫が挙げられる。
【0058】
血管免疫芽球性リンパ腫(AIL)は、肥大したリンパ節および高ガンマグロブリン血症(血中の抗体の増加)を特徴とする攻撃的な(迅速に進行する)型のT細胞性非ホジキンリンパ腫である。他の症状は、皮疹、発熱、体重減少、陽性のクームズ試験または寝汗を含み得る。この悪性疾患は、通常、成人に起きる。患者は、通常、40〜90歳(中央値は約65歳)であり、そしてその患者は、より多くの場合、男性である。AILが進行する場合、肝脾腫大、溶血性貧血、および多クローン性高ガンマグロブリン血症が、発症し得る。皮膚は、約40〜50%の患者にかかわる。
【0059】
結節性リンパ球優勢型ホジキンリンパ腫は、変異した非機能的な免疫グロブリン遺伝子を有する胚中心B細胞に由来するようであるB細胞性新生物である。血管免疫芽球性リンパ腫と同様に、腫瘍性細胞は、濾胞性樹状細胞の網目構造に関連する。PD−1発現は、CD57+ T細胞について見られるものと同様のパターンで、結節性リンパ球優勢型ホジキンリンパ腫における腫瘍性CD20+細胞と密接に関連するT細胞において見られる。CD57は、CXCR5と一緒に、胚中心関連性T細胞の別のマーカーとして同定された(結節性リンパ球優勢型ホジキンリンパ腫における腫瘍性細胞が胚中心関連性T細胞と密接な関連を有するという結論を支持する知見である)。
【0060】
PD−1のインヒビターは、細胞におけるPD−1、PD−L1またはPD−2の発現または活性を減少させる能力を有する任意の因子である。PD−1の発現または活性は、コントロール細胞におけるこのような発現または活性と比較して、少なくとも10%、20%、30%、40%、50%、60%、70%、80%、90%、または100%減少する。上記コントロール細胞は、上記PD−1インヒビターによって処理されていない細胞である。PD−1の発現または活性は、当該分野における任意の標準的な方法(本明細書中に記載されるものを含む)によって決定される。必要に応じて、上記PD−1インヒビターは、PD−L1、PD−L2、またはその両方に対するPD−1の結合を阻害するか、または減少させる。PD−1インヒビターは、ポリペプチド、ポリヌクレオチド、低分子アンタゴニスト、またはsiRNAを含む。
【0061】
PD−1インヒビターポリペプチドとしては、例えば、PD−1の発現またはシグナリングを減少させる抗体またはそのフラグメントが挙げられる。例示の抗体としては、抗PD−1抗体、抗PD−L1抗体、抗PD−L2抗体、抗CTLA−4抗体、抗BTLA抗体、抗CD28抗体、抗ICOS抗体、抗ICOS−L抗体、抗B7−1抗体、抗B7−2抗体、抗B7−H3抗体、または抗B7−H4抗体が挙げられる。
【0062】
あるいは、上記PD−1インヒビターは、PD−1の生物学的活性(すなわち、PD−L1、PD−L2、またはその両方に対するPD−1の結合)を妨げるドミナントネガティブタンパク質またはドミナントネガティブタンパク質をコードする核酸である。ドミナントネガティブタンパク質は、そのドミナントネガティブタンパク質が対応する野生型タンパク質のうちの少なくとも10アミノ酸、20アミノ酸、35アミノ酸、50アミノ酸、100アミノ酸、または150より多くのアミノ酸に対して少なくとも50%、70%、80%、90%、95%、または99%でさえありうる配列同一性を有する配列を有する任意のアミノ酸分子である。例えば、ドミナントネガティブPD−1は、それがもはやPD−L1に結合できないような変異を有する。
【0063】
上記ドミナントネガティブタンパク質は、発現ベクターとして投与され得る。上記発現ベクターは、非ウイルスベクターまたはウイルスベクター(例えば、レトロウイルス、組換えアデノ随伴ウイルス、または組換えアデノウイルスベクター)であり得る。あるいは、上記ドミナントネガティブタンパク質は、全身的か、または例えば、マイクロインジェクション技術を使用して感染領域に対して、組換えタンパク質として直接投与され得る。
【0064】
低分子としては、ペプチド、ペプチド模倣体(peptidomimetic)(例えば、ペプトイド)、アミノ酸、アミノ酸アナログ、ポリヌクレオチド、ポリヌクレオチドアナログ、ヌクレオチド、ヌクレオチドアナログ、1モルあたり約5,000グラム未満の分子量を有する有機化合物および無機化合物(ヘテロ有機化合物および有機金属化合物を含む)、1モルあたり約2,000グラム未満の分子量を有する有機化合物および無機化合物、1モルあたり約1,000グラム未満の分子量を有する有機化合物および無機化合物、1モルあたり約500グラム未満の分子量を有する有機化合物および無機化合物、ならびにこのような化合物の塩、エステル、および他の薬学的に受容可能な形態が挙げられるが、これらに限定されない。
【0065】
上記PD−1インヒビターは、PD−1の発現または活性を標的とする、アンチセンス分子、RNA干渉(siRNA)分子、または低分子アンタゴニストである。用語「siRNA」によって、標的mRNAの翻訳を妨害する二本鎖RNA分子が意味される。siRNAを細胞に導入する標準的な技術が、使用され、その技術としては、DNAが鋳型であり、siRNAのRNAがその鋳型から転写されるものが挙げられる。上記siRNAは、センスのPD−1核酸配列、PD−L1核酸配列またはPD−L2核酸配列、アンチセンスのPD−1核酸配列、PD−L1核酸配列またはPD−L2核酸配列あるいはその両方を含む。必要に応じて、上記siRNAは、単一の転写物が標的遺伝子(例えば、ヘアピン)由来のセンス配列および相補アンチセンス配列の両方を有するように構築される。標的細胞中のPD−1転写物、PD−L1転写物またはPD−L2転写物に対する上記siRNAの結合は、細胞によるPD−1、PD−L1またはPD−L2の産生における減少を生じる。上記オリゴヌクレオチドの長さは、少なくとも10ヌクレオチドであり、そして天然に存在するPD−1転写物、PD−L1転写物またはPD−L2転写物と同程度の長さであり得る。好ましくは、上記オリゴヌクレオチドは、19〜25ヌクレオチド長である。最も好ましくは、上記オリゴヌクレオチドは、75ヌクレオチド長未満、50ヌクレオチド長未満、25ヌクレオチド長未満である。
【0066】
他の適切なPD−1インヒビターは、例えば、米国特許第6,808,710号ならびに米国特許出願第20040137577号、同第20030232323号、同第20030166531号、同第20030064380号、同第20030044768号、同第20030039653号、同第20020164600号、同第20020160000号、同第20020110836号、同第20020107363号、および同第20020106730号(これらの全ては、本明細書によって参考として援用される)に記載される。
【0067】
上記PD−1インヒビターの好ましい用量は、生物学的に活性な用量である。生物学的に活性な用量は、CD8+ T細胞の細胞傷害活性の増大(上記感染因子に特異的な免疫応答の増大)を誘導する用量である。望ましくは、上記PD−1インヒビターは、抗原特異的免疫細胞(例えば、CD8+ T細胞などのT細胞)におけるPD−1の発現または活性を、未処置のコントロールレベルと比較して少なくとも5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、または100%超低くに減少させる能力を有する。免疫細胞におけるPD−1のレベルまたは活性は、当該分野において公知である任意の方法によって測定され、その方法としては、例えば、ウェスタンブロット分析、免疫組織化学、ELISA、およびノーザンブロット分析が挙げられる。あるいは、PD−1の生物学的活性は、PD−L1、PD−L2、またはその両方に対するPD−1の結合を評価することによって測定される。PD−1の生物学的活性は、CD8+ T細胞の細胞傷害(例えば、サイトカイン産生、感染因子のクリアランス、および抗原特異的CD8+ T細胞の増殖が挙げられる)を増大させるその能力によって決定される。好ましくは、PD−1の発現または活性を減少させる因子は、上記感染因子に特異的な免疫応答を、未処置のコントロールレベルと比較して少なくとも5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、または100%超高くに増大させ得る。したがって、本発明の因子は、これらの活性のうちの任意の1つ以上を有する任意の因子である。本発明の薬剤は、好ましくは、CD8+ T細胞において発現されるが、持続感染に対する免疫応答に影響し得る任意の細胞がまた、本発明の方法に従うこと、およびその細胞が、例えば、B細胞を含むことが、理解される。
【0068】
必要に応じて、上記被験体は、1種以上のさらなる治療剤を投与される。さらなる治療剤としては、例えば、抗ウイルス化合物(例えば、ビダラビン、アシクロビル、ガンシクロビル、バルガンシクロビル、ヌクレオシドアナログ逆転写酵素インヒビター(NRTI)(例えば、AZT(ジドブジン)、ddI(ジダノシン)、ddC(ザルシタビン)、d4T(スタブジン)、または3TC(ラミブジン))、非ヌクレオシド逆転写酵素インヒビター(NNRTI)(例えば、ネビラピンまたはデラビルジン)、プロテアーゼインヒビター(サキナビル、リトナビル、インジナビル、またはネルフィナビル)、リバビリン、またはインターフェロン)、抗細菌化合物、抗真菌化合物、抗寄生虫化合物、抗炎症性化合物、抗腫瘍性薬剤または鎮痛剤が挙げられる。
【0069】
上記さらなる治療剤は、上記PD−1インヒビターの投与の前か、その投与と同時か、またはその投与の後に投与される。例えば、上記PD−1インヒビターと上記さらなる薬剤は、少なくとも1時間以内、2時間以内、4時間以内、6時間以内、10時間以内、12時間以内、18時間以内、または24時間より長く以内の間隔を空けて、別個の処方物において投与される。必要に応じて、上記さらなる薬剤は、上記PD−1インヒビターと一緒に処方される。上記さらなる薬剤が、異なる組成物中に存在する場合、異なる投与経路が、使用され得る。上記薬剤は、感染を処置するか、減少させるか、または予防するために有効であることがこのような薬剤について公知である用量で投与される。
【0070】
上記PD−1インヒビターの濃度および上記さらなる薬剤の濃度は、異なる因子に依存し、その因子としては、投与手段、標的部位、哺乳動物の生理学的状態、および投与される他の薬物が挙げられる。したがって、処置投薬量は、安全性および効力を最適化するために滴定され得、そしてその処置投薬量は、当業者の技術範囲内である。特定の状況のための適切な投薬量および投薬レジメンの決定は、当該分野の技術範囲内である。
【0071】
必要に応じて、上記被験体は、持続感染を引き起こす感染因子に対する防御免疫応答を誘発するワクチンをさらに投与される。例えば、上記被験体は、ヒト免疫不全ウイルス(HIV)、結核、インフルエンザ、またはC型肝炎に対する免疫応答を誘発するワクチンを受容する。例示のワクチンは、例えば、Berzofskyら(J.Clin.Invest. 114:456−462、2004)において記載される。所望される場合、上記ワクチンは、プライムブースト注射またはアジュバントと一緒に投与される。
【0072】
PD−1インヒビターは、T細胞(例えば、CD8+ T細胞)の細胞傷害を増大させるのに十分な量で投与される。T細胞の細胞傷害における増大は、増大した免疫応答および上記持続感染の減少を生じる。増大した免疫応答は、例えば、免疫細胞増殖(例えば、T細胞またはB細胞)の増大、サイトカイン産生の増大、および感染因子のクリアランスの増大によって測定される。このような減少は、上記持続感染と関連した1種以上の症状の軽減を誘導する。上記PD−1インヒビターの投与は、上記持続感染を減少させるか、またはその持続感染に関連した1種以上の症状を、未処置の被験体と比較して少なくとも10%、20%、30%、40%、50%、60%、70%、80%、90%、もしくは100%軽減する。
【0073】
処置は、その処置が臨床上の利益(例えば、被験体における感染因子量の減少)をもたらす場合に、効果的である。処置が予防的に適用される場合、「効果的」は、その処置が感染の形成を遅延させるかまたは予防することを意味する。効力は、特定の感染を診断または処置する任意の公知である方法を使用して決定され得る。
【0074】
(治療投与)
本発明は、被験体に、PD−1の発現または活性を減少させる化合物(本明細書中で「PD−1インヒビター」または「治療用化合物」と称される)を含む組成物を投与することを包含する。
【0075】
治療用化合物の有効量は、好ましくは、約0.1mg/kg〜約150mg/kgである。有効用量は、当業者によって認識されるように、投与経路、賦形剤の使用、および特定の感染または癌の症状を処置、予防または軽減するための他の抗感染剤または治療剤の使用を含む他の治療処置との組み合せに依存して変動する。治療用レジメンは、標準的な方法を使用して哺乳動物(例えば、感染または癌に罹患しているヒト患者(感染または癌を発症する危険性があるヒト患者))を同定することによって行われる。
【0076】
薬学的化合物は、当該分野において公知である方法を使用してこのような個体に投与される。好ましくは、上記化合物は、経口的、直腸的、経鼻的、局所または非経口的(例えば、皮下、腹腔内、筋肉内、および静脈内)に投与される。上記化合物は、予防的に投与されるか、または感染の検出後に投与される。上記化合物は、必要に応じて、感染を処置する治療用薬物のカクテルの成分として処方される。非経口投与に適した処方物の例としては、等張食塩溶液、5%グルコース溶液、または別の標準的な薬学的に受容可能な賦形剤における活性薬剤の水溶液が挙げられる。標準的な可溶化剤(例えば、PVPまたはシクロデキストリン)もまた、上記治療用化合物の送達のために、薬学的賦形剤として利用される。
【0077】
本明細書中に記載される治療用化合物は、従来の方法を利用する他の投与経路のための組成物中に処方される。例えば、PD−1インヒビターは、経口投与のために、カプセルまたは錠剤中に処方される。カプセルは、任意の標準的な薬学的に受容可能な材料(例えば、ゼラチンまたはセルロース)を含み得る。錠剤は、治療用化合物と固体キャリアおよび滑沢剤との混合物を圧縮することによる従来の手順に従って処方され得る。固体キャリアの例としては、デンプンおよび糖ベントナイト(sugar bentonite)が挙げられる。上記化合物は、結合剤(例えば、ラクトースまたはマンニトール)、充填剤、および錠剤形成剤(tableting agent)を含むハードシェルの錠剤(hard shell tablet)またはカプセルの形態で投与される。他の処方物は、軟膏、坐剤、パスタ、スプレー、パッチ、クリーム、ゲル、吸収性スポンジ、またはフォームを含む。このような処方物は、当該分野において周知である方法を使用して生産される。
【0078】
上記治療用化合物がタンパク質をコードする核酸である場合、その治療用核酸は、そのコードされたタンパク質の発現を促進するために、その核酸を適切な核酸発現ベクターの一部分として構築し、そしてそのベクターをそれが細胞内に入るように投与すること(例えば、レトロウイルスベクターの使用、直接注射、微粒子ボンバードメントの使用、脂質または細胞表面レセプターまたはトランスフェクション剤(transfecting agent)によってコーティングすること、または核に進入することが公知であるホメオボックス様ペプチド(例えば、Joliotら、1991.Proc Natl Acad Sci USA 88:1864−1868を参照のこと)に連結して投与することなど)によって、インビボで投与される。あるいは、核酸治療薬は、細胞内に導入され、そして相同組換えによって発現のために宿主細胞DNA内に組み込まれるか、またはエピソームのままである。
【0079】
DNAの局所投与のために、標準的な遺伝子治療ベクターが、使用される。このようなベクターは、ウイルスベクターを含み、そのウイルスベクターとしては、複製欠損の肝炎ウイルス(例えば、HBVおよびHCV)、レトロウイルス(例えば、WO 89/07136;Rosenbergら、1990、N.Eng.J.Med.323(9):570−578を参照のこと)、アデノウイルス(例えば、Morseyら、1993、J.Cell.Biochem.、補遺17E5を参照のこと)、アデノ随伴ウイルス(Kotinら、1990、Proc.Natl.Acad.Sci.USA 87:2211−2215)、複製欠損の単純ヘルペスウイルス(HSV;Luら、1992、Abstract、66ページ、Abstracts of the Meeting on Gene Therapy、Sept.22−26、Cold Spring Harbor Laboratory、Cold Spring Harbor、New York)、およびこれらのベクターの任意の改変バージョンに由来するものが挙げられる。本発明は、真核生物細胞への核酸のインビボ伝達を達成する任意の他の送達系を利用し得る。例えば、上記核酸は、リポソーム(例えば、カチオン性リポソーム(Lipofectin))、レセプター媒介性送達系、非ウイルス核酸ベースのベクター、赤血球ゴースト、またはマイクロスフェア(例えば、微粒子;例えば、米国特許第4,789,734号;米国特許第4,925,673号;米国特許第3,625,214号;Gregoriadis、1979、Drug Carriers in Biology and Medicine、pp.287−341(Academic Press))に封入され得る。むき出し(naked)のDNAもまた、投与され得る。
【0080】
遺伝子治療のためのDNAは、非経口的(例えば、静脈内、皮下、筋肉内、および腹腔内)に患者に投与され得る。DNAまたは誘導剤(inducing agent)は、薬学的に受容可能なキャリア(すなわち、動物に対する投与に適した生物学的に適合性のビヒクル(例えば、生理食塩水))中で投与される。治療有効量は、医学的に望ましい結果(例えば、処置された動物におけるPD−1遺伝子産物の減少)をもたらし得る量である。このような量は、当業者によって決定され得る。医学分野において周知であるように、任意の所与の患者に対する投薬量は、多くの因子に依存し、その因子としては、患者のサイズ、体表面積、年齢、投与されるべき特定の化合物、性別、投与の時間および経路、一般的健康、ならびに同時に投与される他の薬物が挙げられる。投薬量は、変動し得るが、DNAの静脈内投与のための好ましい投薬量は、約106〜1022コピーのDNA分子である。代表的に、プラスミドは、約1ナノグラム〜約5000マイクログラムの量のDNAで哺乳動物に投与される。望ましくは、組成物は、約5ナノグラム〜1000マイクログラムのDNA、10ナノグラム〜800マイクログラムのDNA、0.1マイクログラム〜500マイクログラムのDNA、1マイクログラム〜350マイクログラムのDNA、25マイクログラム〜250マイクログラムのDNA、または100マイクログラム〜200マイクログラムのDNAを含む。あるいは、上記PD−1インヒビターをコードする組換えアデノウイルスベクターの哺乳動物への投与は、少なくとも105、106、107、108、109、1010、または1011プラーク形成単位(pfu)の濃度にて適用され得る。
【0081】
PD−1遺伝子産物は、薬学的に受容可能なキャリア(例えば、生理食塩水)中で患者に静脈内投与される。ペプチドの細胞内送達のための標準的な方法が、使用され得る(例えば、リポソーム中に封入される)。このような方法は、当業者にとって周知である。1日につき体重1kgあたりで約1〜100モルの静脈内投薬量の本発明のポリペプチドが投与されることが、期待される。本発明の組成物は、非経口投与(例えば、静脈内投与、皮下投与、筋肉内投与、および腹腔内投与)に有用である。
【0082】
PD−1インヒビターは、その化合物と患部組織とが直接的に接触すると有効である。したがって、上記化合物は、局所に投与され得る。あるいは、PD−1インヒビターは、全身的に投与され得る。さらに、化合物は、その化合物を被験体の隣接組織および周辺組織にゆっくりと放出する固体マトリックスまたは吸収性マトリックスを(器官(例えば、腸または肝臓)に直接かまたは皮下のいずれかに)移植することによって投与され得る。例えば、胃腸感染の処置に関して、上記化合物は、全身的(例えば、静脈内、直腸または経口的)または局所(例えば、胃の組織に直接的)に投与され得る。あるいは、PD−1インヒビターを含漬させたカシェ剤または吸収性スポンジが、胃の組織と直接接触して配置される。上記PD−1インヒビターは、カシェ剤からの薬物の拡散およびポリマーマトリックスの浸食によってインビボでゆっくりと放出される。別の例として、肝臓の感染(すなわち、肝炎)は、上記PD−1インヒビターを含む溶液を肝臓脈管構造に注入することによって処置される。
【0083】
神経学的な感染の処置のために、上記PD−1インヒビターは、静脈内または髄腔内(すなわち、脳脊髄液への直接注入によって)に投与され得る。局所投与に関して、化合物を含漬させたカシェ剤または吸収性スポンジは、CNS組織と直接接触して配置される。上記化合物または化合物の混合物は、カシェ剤からの薬物の拡散およびポリマーマトリックスの浸食によってインビボでゆっくりと放出される。あるいは、上記化合物は、標準的な方法を使用して脳または脳脊髄液に注入される。例えば、注射ポートとして使用するためのカテーテルを有する穿頭孔リング(burr hole ring)が、頭蓋骨に穿孔した穿頭孔にてその頭蓋骨と係合するように配置される。上記カテーテルに連結された流体レザバは、穿頭孔リングの上部に配置された隔壁を通して挿入された針またはスタイレットによってアクセスされる。カテーテルアセンブリ(例えば、米国特許第5,954,687号に記載される)は、期間にわたる薬物の投与を可能にするために、脳の近傍または脳内における選択された位置に対してか、またはその位置からの流体の輸送に適した流体流路を提供する。
【0084】
心臓の感染に関して、上記化合物は、例えば、胸壁を通した直接の冠内注射またはX線透視検査による案内下での標準的な経皮カテーテルベースの方法の使用によって心臓組織(すなわち、心筋層、心膜、または心内膜)に送達され得る。したがって、上記インヒビターは、組織に注射されても、体腔に挿入されるステントまたはカテーテルから注入されてもよい。任意の種々の心臓カテーテルまたは灌流カテーテルが、上記化合物を投与するために使用され得る。あるいは、上記化合物は、冠血管に配置されるステントにコーティングまたは含漬される。
【0085】
肺の感染は、例えば、吸入によって上記化合物を投与することによって処置され得る。上記化合物は、加圧式容器または適切なプロペラント(例えば、二酸化炭素などの気体)を含むディスペンサーまたは噴霧器からエアゾールの形態で送達される。
【0086】
当業者は、本発明によって処置される患者が、持続的に感染した被験体を診断するための同一の試験に供された可能性があるか、または1種以上の危険因子(例えば、感染因子に対する曝露、感染した被験体に対する曝露、遺伝的素因、または二次感染に罹患し易い病理学的状態を有すること)の存在に起因する高い危険性があると検査なしで同定されている可能性があることを理解する。持続感染の症状または損傷の減少としてはまた、症状の軽減、疾患の程度の減少、疾患の安定した(すなわち、悪化していない)状態、疾患の進行の遅延または緩徐化、および疾患状態の改善または緩和が挙げられ得るが、これらに限定されない。処置は、保健医療提供者による厳重な管理を伴って自宅で行なわれても、保健施設において行なわれてもよい。
【0087】
(免疫応答を測定するための方法)
本発明による処置後に免疫応答を測定するための方法は、当該分野において周知である。T細胞の活性は、例えば、サイトカイン産生を検出するアッセイ、T細胞増殖を測定するアッセイ、微生物因子のクリアランスを測定するアッセイ、およびCD8+ T細胞の細胞傷害を測定するアッセイによって評価され得る。これらのアッセイは、例えば、米国特許第6,808,710号ならびに米国特許出願第20040137577号、同第20030232323号、同第20030166531号、同第20030064380号、同第20030044768号、同第20030039653号、同第20020164600号、同第20020160000号、同第20020110836号、同第20020107363号、および同第20020106730号(これらの全ては、本明細書によって参考として援用される)に記載される。
【0088】
必要に応じて、CD8+ T細胞の細胞傷害を増大させるPD−1インヒビターの能力は、例えば、Dongら(Nature 5:1365−1369、1999)によって記載される、CD8+ T細胞の増殖を測定するアッセイ(例えば、チミジン取り込み、BrdUアッセイ、および細胞周期マーカー(例えば、Ki67およびCFSE)による染色)によって評価される。1つの例において、T細胞増殖は、PD−1を発現する精製されたT細胞を、PD−1インヒビター、上に記載されるような一次活性化シグナル、および3H−チミジンと一緒に培養することによってモニタリングされる。T細胞増殖のレベルは、チミジン取り込みを測定することによって決定される。
【0089】
CD8+ T細胞の細胞傷害はまた、細胞溶解アッセイ(例えば、51Cr放出アッセイあるいはパーフォリンまたはグランザイムの放出を検出するアッセイ)、カスパーゼ活性化を検出するアッセイ、または感染した被験体からの微生物因子のクリアランスを測定するアッセイによって評価される。例えば、感染した被験体由来の生物学的サンプル(例えば、血清、脾臓、肝臓、肺、またはウイルスが向性を有する組織)におけるウイルス量は、処置の前後に測定され得る。
【0090】
サイトカイン(例えば、IFNγ、TNF−α、およびIL−2)の産生もまた、測定され得る。例えば、精製されたT細胞は、PD−1インヒビタータンパク質および一次活性化シグナルの存在下で培養される。上清中の種々のサイトカインのレベルは、例えば、Dongら(Nature 5:1365−1369、1999)に記載されるサンドイッチ型酵素結合イムノソルベントアッセイまたは他の従来のアッセイによって決定され得る。
【0091】
所望される場合、上記PD−1インヒビターの効力は、T細胞の補助刺激を誘導するその能力によって評価される。例えば、インビトロT細胞補助刺激についての方法は、PD−1を発現する精製されたT細胞に、抗CD3モノクローナル抗体もしくはホルボールエステル、またはクラスII MHCと一緒の抗原によって第1活性化シグナルまたは一次活性化シグナルを提供することを包含する。PD−1の発現または活性を減少させ、したがって免疫機能を調節するのに必要な二次シグナルまたは補助刺激シグナルをこれらのT細胞に対して提供する候補化合物薬剤の能力が、次いで、当該分野において周知である数種の従来のアッセイのいずれか1つによってアッセイされ得る。
【0092】
B細胞応答は、抗原特異的ELISA(例えば、LCMV、HIV、結核、またはマラリア)、形質細胞ELISPOT、記憶B細胞アッセイ、B細胞の表現型分類、および免疫組織化学による胚中心の分析によって評価される。
【0093】
(スクリーニングアッセイ)
本発明は、PD−1の発現または活性を阻害し得る化合物を同定するためのスクリーニング方法を提供する。有用な化合物は、PD−1の生物学的活性を阻害するか、またはPD−1の細胞レベルを低下させる任意の薬剤を含む。例えば、候補化合物は、PD−L1、PD−L2、またはその両方に対するPD−1の結合を減少させ得る。リード化合物としてこのような薬剤を使用することにより、例えば、本発明のスクリーニング方法はまた、持続感染を処置するか、減少させるか、または予防するように機能するか、あるいはこのような感染に関連した1種以上の症状を軽減するPD−1のさらなる新規であり特異的なインヒビターの同定を、可能にする。上記スクリーニングの方法は、ハイスループット技術を含み得る。
【0094】
「候補化合物」によって、天然に存在するか、または人工的に得られる化学物質が、意味される。候補化合物としては、例えば、ペプチド、ポリペプチド、合成有機分子、天然に存在する有機分子、核酸分子、ペプチド核酸分子、ならびにその成分および誘導体が挙げられ得る。例えば、本発明に従って有用な候補化合物は、PD−L1、PD−L2、またはその両方に対するPD−1の結合を減少させる。
【0095】
多くの方法が、このようなスクリーニングアッセイを実施するために利用可能である。1つのアプローチに従って、候補化合物は、PD−1を発現する細胞の培養培地に種々の濃度で添加される。「PD−1遺伝子」によって、PD−1タンパク質をコードする核酸が意味される。「PD−1融合遺伝子」によって、第2の異種核酸配列に作動可能に連結されたPD−1プロモーターおよび/またはPD−1コード領域全体もしくはその一部が意味される。好ましい実施形態において、上記第2の異種核酸配列は、レポーター遺伝子(すなわち、その遺伝子の発現がアッセイされ得る遺伝子)である;レポーター遺伝子としては、グルクロニダーゼ(GUS)をコードする遺伝子、ルシフェラーゼをコードする遺伝子、クロラムフェニコールトランスアセチラーゼ(CAT)をコードする遺伝子、緑色蛍光タンパク質(GFP)をコードする遺伝子、アルカリホスファターゼをコードする遺伝子、およびβ−ガラクトシダーゼをコードする遺伝子が挙げられるが、これらに限定されない。
【0096】
次いで、PD−1の遺伝子発現が、例えば、ハイブリダイゼーションプローブとしてPD−1の核酸分子から調製された任意の適切なフラグメントを使用する標準的なノーザンブロット分析(Ausubelら、前出)によってか、または適切なプライマーを用いたリアルタイムPCRによって測定される。上記候補化合物の存在下での遺伝子発現のレベルは、その候補分子を欠くコントロール培養培地において測定されたレベルと比較される。所望される場合、候補化合物の効果は、上記に代えて、同一の一般的アプローチおよび例えば、PD−1に特異的な抗体を用いたウェスタンブロッティングまたは免疫沈降などの標準的な免疫学的技術を使用して、PD−1ポリペプチドのレベルで測定され得る。例えば、免疫アッセイは、PD−1のレベルを検出またはモニタリングするために使用され得る。PD−1に結合し得るポリクローナル抗体またはモノクローナル抗体が、PD−1のレベルを測定するために、任意の標準的な免疫アッセイ形式(例えば、ELISAまたはRIAアッセイ)において使用され得る。PD−1はまた、質量分析、高速液体クロマトグラフィー、分光測光技術もしくは蛍光定量技術、またはそれらの組み合わせを使用して測定され得る。
【0097】
あるいは、本発明のスクリーニング方法は、PD−L1、PD−L2、またはその両方に対するPD−1の結合を減少させることによってPD−1の生物学的活性を、未処置のコントロールと比較して少なくとも10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、または100%低下させる候補化合物を同定するために使用され得る。例えば、候補化合物は、下で記載されるように、PD−1についてのcDNAを用いたトランスフェクション後か、またはPD−1を含む無細胞溶液において、PD−1を天然に発現する細胞におけるPD−1活性を低下させるその能力について試験され得る。PD−1の結合または活性化に対する候補化合物の効果は、放射結合アッセイおよび非放射結合アッセイ、競合アッセイ、ならびにレセプターシグナリングアッセイによって試験され得る。
【0098】
特定の例として、PD−1をコードする核酸を発現する哺乳動物細胞(例えば、げっ歯類細胞)は、候補化合物(例えば、ペプチド、ポリペプチド、合成有機分子、天然に存在する有機分子、核酸分子、またはそれらの成分)の存在下で培養される。細胞は、PD−1を内因性に発現し得るか、または代替的に、PD−1を過剰発現するように当該分野において公知である任意の標準的な技術(例えば、トランスフェクションおよびウイルス感染)によって遺伝的に操作され得るかのいずれである。PD−1の発現レベルは、ウェスタンブロット分析によってこれらの細胞において測定され、次いでその発現レベルは、候補化合物に接触されていないコントロール細胞における同じタンパク質の発現レベルと比較される。PD−1の合成または生物学的活性を減少させることの結果としてPD−1活性のレベルの低下を促す化合物は、本発明において有用であると見なされる。
【0099】
1つの特定の例において、PD−L1、PD−L2、またはその両方に対するPD−1結合を妨げ(それによってPD−1の生物学的活性を減少させる)、免疫応答の増大をもたらす化合物は、本発明に従って有用である。PD−1の生物学的活性を低下させるその能力を前提として、このような分子、例えば、持続感染を処置するか、減少させるか、または予防するためか、あるいはこのような感染に関連した1種以上の症状を軽減するための治療剤として使用され得る。特定の例として、候補化合物は、2つのタンパク質(PD−1と実質的に同一のポリペプチドである第1のタンパク質およびPD−L1またはPD−L2のいずれかである第2のタンパク質(すなわち、結合を可能にし、そして減少した免疫応答をもたらす条件下でPD−1ポリペプチドを結合するタンパク質))と接触され得る。この特定のスクリーニング方法に従って、これら2つのタンパク質の間の相互作用は、候補化合物の添加後に測定される。候補化合物の添加後における上記第2のポリペプチドに対するPD−1の結合の減少(その化合物の非存在下でのこのような結合と比較した場合)により、その候補化合物は上記2つのタンパク質の間の相互作用を阻害する能力を有すると同定される。最終的に、本発明のスクリーニングアッセイは、例えば、無細胞系においてか、または酵母ツーハイブリッド系を使用して行なわれ得る。所望される場合、それらのタンパク質の一方またはその候補化合物は、上に記載されるような支持体に固定化されても、検出可能な基を有してもよい。
【0100】
代替的かまたは追加的に、候補化合物は、PD−1に特異的に結合し、それによってPD−1を阻害するものについてスクリーニングされ得る。このような候補化合物の効力は、PD−1と相互作用するその能力に依存する。このような相互作用は、多くの標準的な結合技術および機能的アッセイ(例えば、Ausubelら、前出に記載されるもの)を使用して容易にアッセイされ得る。例えば、候補化合物は、PD−1との相互作用および結合についてインビトロで試験され得、そして免疫応答を調節するその能力は、任意の標準的なアッセイ(例えば、本明細書中に記載されるもの)によってアッセイされ得る。
【0101】
例えば、PD−1に結合する候補化合物は、クロマトグラフィーベースの技術を使用して同定され得る。例えば、組換えPD−1は、PD−1を発現するように操作された細胞(例えば、上に記載されるもの)から標準的な技術によって精製され得、そしてその組換えPD−1は、カラムに固定化され得る。あるいは、天然に存在するPD−1が、カラムに固定化され得る。次いで、候補化合物の溶液は、上記カラムに通され、そしてPD−1に特異的な化合物は、PD−1に結合しかつそのカラムに固定化されるその能力に基づいて同定される。上記化合物を同定するために、上記カラムは、非特異的に結合した分子を除去するために洗浄され、次いで目的の化合物は、そのカラムから放出され、そして回収される。この方法(または任意の他の適切な方法)によって単離された化合物は、所望される場合、さらに精製され得る(例えば、高速液体クロマトグラフィーによって)。
【0102】
新規インヒビターについてのスクリーニングおよびリード化合物の最適化は、例えば、標準的な技術を使用して細胞傷害性T細胞の活性または免疫応答を調節するそれらの能力を評価することによって評価され得る。さらに、これらの候補化合物は、抗微生物剤(例えば、本明細書中に記載されるようなもの)として機能するそれらの能力について試験される。このアプローチによって単離された化合物はまた、例えば、持続感染を処置するか、減少させるか、または予防するためか、あるいはこのような感染に関連した1種以上の症状を軽減するための治療薬として使用され得る。PD−1に10mM以下の親和性定数で結合すると同定される化合物は、本発明において特に有用であると見なされる。
【0103】
潜在的な治療剤としては、有機分子、ペプチド、ペプチド模倣体(mimetic)、ポリペプチド、およびPD−1をコードする核酸配列またはポリペプチドに結合し、それによってそれらの活性を阻害するか、または減少させる抗体が挙げられる。潜在的な抗微生物剤としてはまた、正常な生物学的活性が妨害されるように、このようなポリペプチドの結合部位に結合しかつその結合部位を占有し、それによって細胞の結合分子に対する結合を妨害する低分子が挙げられる。他の潜在的な抗微生物剤としては、アンチセンス分子が挙げられる。
【0104】
(診断方法および予後判定方法)
癌(例えば、血管免疫芽球性T細胞リンパ腫または結節性リンパ球優勢型ホジキンリンパ腫)は、試験サンプル(すなわち、患者由来サンプル)中のPD−1ポリペプチドの量を調べることによって検出される。上記PD−1ポリペプチドをコントロールサンプル比較した場合、そのレベルの変化は、被験体における癌を示す。上記変化は、コントロールサンプルに対する上記PD−1ポリペプチドの増加または減少であり得る。上記コントロールサンプルは、試験サンプルと同様の様式で調製(すなわち、分画)される。
【0105】
サンプルは、例えば、血液、血清、腹水(acsites fluid)、尿、または他の体液である。好ましくは、上記サンプルは、T細胞またはB細胞である。
【0106】
上記PD−1の量は、上記試験サンプルにおいて決定され、そして正常のコントロールレベルの発現と比較される。正常のコントロールレベルによって、癌に罹患していない被験体において代表的に見出されるPD−1ポリペプチドの発現レベルが意味される。患者由来サンプル中のPD−1のレベルの上昇は、被験体が、癌に罹患しているかまたは癌を発症する危険性があることを示す。対照的に、本方法が予防的に適用される場合、患者由来サンプルのPD−1ポリペプチドの同様のレベルまたはレベルの低下は、被験体が、癌に罹患していないかまたは癌を発症する危険性がないことを示す。患者由来サンプル中のPD−1ポリペプチドのレベルの上昇は、被験体が、癌に罹患しているかまたは癌を発症する危険性があることを示す。
【0107】
上記PD−1ポリペプチドの量の変化は、統計的に有意である。統計的に有意によって、その変化が、単独の変化によって起きることが予期されるものよりも大きいことが、意味される。統計的有意性は、当該分野において公知である方法によって決定される。例えば、統計的有意性は、p値によって決定される。p値は、実験の間における群間の差が偶然と起こる確率の尺度である。(P(z≧zobserved))。例えば、0.01というp値は、この結果が偶然おこるのが100回中1回であることを意味する。p値が低いほど、群間の差が処置によって引き起こされたという可能性がより高くなる。変化は、p値が少なくとも0.05である場合、統計的に有意である。好ましくは、p値は、0.04、0.03、0.02、0.01、0.005、0.001またはそれ未満である。
【0108】
試験、アッセイ、または方法の「診断精度」は、その試験、アッセイ、または方法が癌を有する患者または癌の危険性がある患者の間を区別する能力に関係し、それは、患者がPD−1ポリペプチドの「臨床的に有意な存在」を有するか否かに基づく。「臨床的に有意な存在」によって、患者(代表的に、その患者由来のサンプル)における上記PD−1ポリペプチドの存在が、そのPD−1ポリペプチドについての所定のカットオフポイント(または閾値)よりも、高いかまたは低いことが意味され、したがってそれは、その患者がそのタンパク質の十分に高い存在がマーカーである癌を有することを示す。
【0109】
用語「高い程度の診断精度」および「非常に高い程度の診断精度」とは、癌の存在または非存在を正しく(正確に)示す所定のカットオフポイントを用いたそのPD−1ポリペプチドについての試験またはアッセイをいう。完全な試験は、完全な精度を有する。したがって、糖尿病を有する個体に関して、上記試験は、陽性の試験結果だけを示し、そしてそれらの個体のいずれについても「陰性」であるとは報告しない(「偽陰性」は存在しない)。換言すれば、上記試験の「感度」(真の陽性率)は、100%である。一方では、糖尿病を有さなかった個体に関して、上記試験は、陰性の試験結果だけを示し、そしてそれらの個体のいずれについても「陽性」であるとは報告しない(「偽陽性」は存在しない)。換言すれば、「特異性」(真の陰性率)は、100%である。例えば、試験(例えば、臨床診断試験)の特異性、感度、ならびに陽性および陰性の的中度を考察するO’Marcaigh AS、Jacobson RM、「Estimating The Predictive Value OfA Diagnostic Test,How To Prevent Misleading Or Confusing Results」、Clin.Ped.1993、32(8):485−491を参照のこと。
【0110】
試験(またはアッセイ)のカットポイントまたは閾値を変えることは、通常、感度および特異性を変化させるが、質的に逆相関にある。例えば、カットポイントを低くする場合、試験された集団のより多くの個体は、代表的に、カットポイントまたは閾値を超える試験結果を有する。カットポイントを上回る試験結果を有する個体は、その試験が行われている疾患、状態、または症候群を有すると報告されるので、そのカットポイントを低くすることは、より多くの個体が陽性の結果を有する(すなわち、それらが癌を有する)と報告されることを生じる。したがって、より高い比率の癌を有する個体が、そのカットポイントを有する試験によって示される。したがって、上記試験の感度(真の陽性率)は、上昇する。しかし、同時に、疾患、状態、または症候群のいずれをも有さないより多くの者(すなわち、真に「陰性」である者)が、この試験によってカットポイントを上回るPD−1ポリペプチド値を有すると示され、したがってその試験によって陰性であることが正しく示されるよりもむしろ、陽性(すなわち、疾患、状態、または症候群を有する)であると報告されるで、より多くの偽陽性が、存在する。したがって、上記試験の特異性(真の陰性率)は、減少する。同様に、カットポイントを上げることは、感度を低下させ、そして特異性を上昇させる傾向にある。したがって、患者の状態を評価するための提案された医学的試験、アッセイ、または方法の精度および有用性の評価において、常に感度および特異性の両方を考慮し、そして感度および特異性はカットポイントの範囲にわたって著しく変動し得るので感度および特異性が報告されているカットポイントがなにであるのかに留意すべきである。
【0111】
しかし、カットポイントの全範囲にわたって試験、アッセイ、または方法の感度および特異性をただ1つの値によって表示することを可能にする指標が、存在する。その指標は、問題の試験、アッセイ、または方法についての受容者動作特性(「ROC」)曲線から得られる。例えば、Shultz、「Clinical Interpretation
Of Laboratory Procedures」、第14章、Teitz、Fundamentals of Clinical Chemistry、Burtis and Ashwood(編)、第4版、1996、W.B.Saunders Company、192〜199ページ;およびZweigら、「ROC Curve Analysis:An Example Showing The Relationships Among Serum Lipid And Apolipoprotein Concentrations In Identifying Patients With Coronory Artery Disease」、Clin.Chem.、1992、38(8):1425−1428を参照のこと。
【0112】
ROC曲線は、0〜1(すなわち、100%)の目盛りのx軸における1−特異性に等しい値に対する0〜1(すなわち、100%)の目盛りのy軸における感度のx−yプロットである。換言すれば、それは、その試験、アッセイ、または方法についての偽陽性率に対する真の陽性率のプロットである。問題の試験、アッセイ、または方法についてのROC曲線を構築するために、患者は、その患者が疾患、状態、または症候群について真に陽性または陰性であるか否かを決定するために、問題の試験、アッセイ、または方法とは無関係の完全に正確かまたは「極上の基準(gold standard)」方法を使用して評価される(例えば、冠動脈造影は、冠状動脈硬化症の存在についての極上の基準試験である)。上記患者はまた、問題の試験、アッセイ、または方法を使用して、変化するカットポイントに対して試験され、その患者は、その試験、アッセイ、または方法に従って陽性または陰性であると報告される。上記感度(真の陽性率)および1−上記特異性と等しい値(その値は、偽陽性率に対応する)は、各カットポイントに対して決定され、そしてx−y値の各対は、x−yダイアグラム上に単一の点としてプロットされる。それらの点を連結する「曲線」が、ROC曲線である。
【0113】
曲線下面積(「AUC」)は、カットポイントの全範囲にわたって試験、アッセイ、または方法の感度および特異性のただ1つの値による表示を可能にする指標である。最大AUCは、1(完全な試験)であり、そして最小面積は、2分の1である。AUCが1に近いほど、その試験の精度は良好である。
【0114】
「高い程度の診断精度」によって、AUC(試験またはアッセイについてのROC曲線下面積)が少なくとも0.70、望ましくは少なくとも0.75、より望ましくは少なくとも0.80、好ましくは少なくとも0.85、より好ましくは少なくとも0.90、そして最も好ましくは少なくとも0.95である試験またはアッセイ(例えば、PD−1ポリペプチドの臨床的に有意な存在を決定し、それによって糖尿病の存在を示すための本発明の試験)が、意味される。
【0115】
「非常に高い程度の診断精度」によって、AUC(試験またはアッセイについてのROC曲線下面積)が少なくとも0.875、望ましくは少なくとも0.90、より望ましくは少なくとも0.925、好ましくは少なくとも0.95、より好ましくは少なくとも0.975、そして最も好ましくは少なくとも0.98である試験またはアッセイが、意味される。
【0116】
必要に応じて、特定の癌に対する他の公知のバイオマーカーの発現はまた、被験体が癌を有しているか否かをさらに示すものとして測定される。例えば、CD10、bcl−6、CD20、CD57またはCXCR5が、検出される。
【0117】
上記PD−1ポリペプチドおよび上記さらなるバイオマーカーは、任意の適切な様式で検出されるが、代表的に、患者由来のサンプルと、PD−1またはバイオマーカーを結合し、次いで反応生成物の存在または非存在を検出する抗体とを接触させることによって検出される。上記抗体は、モノクローナル性、ポリクローナル性、キメラ、または上で詳細に考察されるような上記のフラグメントであり得、そして上記反応生成物を検出する工程は、任意の適切な免疫アッセイを用いて行われ得る。被験体由来のサンプルは、代表的に、上に記載されるような生物学的流体であり、そして上に記載される方法を行うために使用される生物学的流体の同一のサンプルであり得る。
【0118】
PD−1ポリペプチドの発現はまた、癌の処置の過程がモニタリングされることを可能にする。この方法において、生物学的サンプルは、癌に対する処置(例えば、外科手術、化学療法またはホルモンによる処置)を受けている被験体から提供される。所望される場合、生物学的サンプルは、処置の前、処置の間、または処置の後の種々の時点において被験体から得られる。次いで、PD−1の発現が、決定され、そしてその発現は、参照(例えば、その癌の病期が既知であるコントロール)と比較される。上記参照サンプルは、処置に曝されている。あるいは、上記参照サンプルは、処置に曝されていない。必要に応じて、このようなモニタリングは、セカンドルック外科的監視手順、およびその後の外科的監視手順に対して予備的に行われる。例えば、サンプルは、処置の進行をモニタリングするために、最初に癌に対する外科的処置を受け、次いでその癌に対する抗腫瘍性薬剤による処置を受けた被験体から回収され得る。
【0119】
上記参照サンプルが癌を有さない被験体由来である場合、上記試験サンプルおよび参照サンプルにおけるPD−1ポリペプチドの量の類似性または減少は、処置が効力があることを示す。しかし、上記試験サンプルおよび参照サンプルにおけるPD−1ポリペプチドの量の増加は、あまり望ましくない臨床的な帰結または予後を示す。
【0120】
「効力がある」によって、処置が被験体におけるPD−1ポリペプチドの量の減少、あるいは腫瘍のサイズ、有病率、または転移能の減少をもたらすことが、意味される。癌の評価は、標準的な臨床プロトコルを使用して行われる。効力は、特定の腫瘍を診断または処置するための任意の公知の方法に関連して決定される。PD−1ポリペプチドの発現はまた、全身的治療(例えば、化学療法、ホルモン療法または放射線治療)に応答性である患者の同定を可能にする。本方法において、生物学的サンプルは、癌に対する外科的処置を受ける前に被験体から提供される。次いで、PD−1ポリペプチドの発現が、決定され、そしてその発現は、癌の外科的除去後に被験体から得られた生物学的サンプルと比較される。患者は、PD−1ポリペプチドの量が癌の外科的除去後に減少する場合、全身的処置に応答性であるようである。対照的に、患者は、上記ポリペプチドの量が癌の外科的除去後に変わらないままであるかまたは増加する場合、全身的処置に応答性ではないようである。
【0121】
PD−1ポリペプチドまたは他の癌バイオマーカーの発現は、当該分野において公知である任意の方法を使用して、タンパク質レベルまたは核酸レベルにて決定される。例えば、これらの配列の1種以上を特異的に認識するプローブを使用するノーザンハイブリダイゼーション分析は、遺伝子発現を決定するために使用され得る。あるいは、発現は、逆転写ベースのPCRアッセイ(例えば、遺伝子の示差的に発現された配列に特異的なプライマーを使用する)を使用して測定される。発現はまた、タンパク質レベルにて決定される(すなわち、本明細書中に記載される遺伝子産物によってコードされるペプチドのレベルまたはその活性を測定することによる)。このような方法は、当該分野において周知であり、そしてその方法としては、例えば、上記遺伝子によってコードされるタンパク質に対する抗体に基づく免疫アッセイが挙げられる。任意の生物学的材料は、上記タンパク質またはその活性の検出/定量のために使用され得る。あるいは、適切な方法が、分析される各タンパク質の活性に従って、マーカー遺伝子によってコードされるタンパク質の活性を決定するために選択され得る。
【0122】
被験体は、好ましくは、哺乳動物である。上記哺乳動物は、例えば、ヒト、非ヒト霊長類、マウス、ラット、イヌ、ネコ、ウマ、またはウシである。被験体は、代表的に、ヒトの女性またはヒトの男性である。上記被験体は、癌を有すると以前に診断されており、そしておそらく、その癌に対する処置を既に受けている。あるいは、上記被験体は、癌を有すると以前に診断されていない。本発明は、癌についての危険性がある患者に関して有用である。各タイプの癌は、それら特有の危険因子のセットを有し、癌を発症する危険性は、加齢、性別、人種ならびに個人および家族の病歴に関連して増大する。他の危険因子は、生活様式の選択に大きく関連するが、特定の感染、職業上の曝露およびいくつかの環境因子もまた、癌の発症に関連し得る。
【0123】
癌の診断は、代表的に、検査におけるサイズの同定によって行われるが、それは、他の手段(例えば、放射線学的診断、および超音波)によるものであり得る。処置は、代表的に、腫瘍縮小手術、その後の抗腫瘍性薬剤による処置(ドセタキセル、ビノレルビン、ゲムシタビン、カペシタビンまたはシクロホスファミドとメトトレキセートとフルオロウラシルとの組み合せ;シクロホスファミドとドキソルビシンとフルオロウラシルとの組み合せ;ドキソルビシンとシクロホスファミドとの組み合せ;パクリタキセルを伴うドキソルビシンとシクロホスファミドとの組み合せ;ドキソルビシンに続くCMF;またはシクロホスファミドとエピルビシンとフルオロウラシルとの組み合せ)によって行われる。さらに、多くの患者は、放射線治療を必要とする。
【0124】
本発明に従って行われる免疫アッセイは、均一アッセイまたは不均一アッセイであり得る。均一アッセイにおいて、免疫学的反応は、通常、特異的抗体(例えば、PD−1ポリペプチド)、標識された分析物、および目的のサンプルを含む。標識から生じるシグナルは、上記標識された分析物に対する抗体の結合の際に、直接的かまたは間接的に改変される。免疫学的反応およびその程度の検出の両方は、均一溶液において行われる。使用され得る免疫化学的標識は、フリーラジカル、放射性同位体、蛍光色素、酵素、バクテリオファージ、または補酵素を含む。
【0125】
不均一アッセイアプローチにおいて、試薬は、通常、サンプル、抗体、および検出可能なシグナルを生じるための手段を含む。上に記載されるようなサンプルが、使用され得る。上記抗体は、一般に、支持体(例えば、ビーズ、プレートまたはスライド)に固定化され、そして液相中に抗原を含む疑いのある検体と接触される。次いで、上記支持体は、上記液相から分離され、その支持体相またはその液相のいずれかが、検出可能なシグナルについて、このようなシグナルをもたらすための手段を使用して調べられる。上記シグナルは、上記サンプル中の分析物の存在に関連する。検出可能なシグナルを生じるための手段は、放射性標識、蛍光標識、または酵素標識の使用を含む。例えば、検出される抗原が、第2の結合部位を含む場合、その結合部位に結合する抗体は、検出可能な基に結合体化され得、そして分離工程の前に液相反応溶液に添加され得る。上記固体支持体における検出可能な基の存在は、試験サンプル中の上記抗原の存在を示す。適切な免疫アッセイの例は、放射免疫アッセイ、免疫蛍光法、または酵素結合免疫アッセイである。
【0126】
当業者は、本明細書中に開示される方法を行うのに有用であり得る多くの特定の免疫アッセイ形式およびそのバリエーションに精通している。一般に、E.Maggio、Enzyme−Immunoassay、(1980)(CRC Press,Inc.、Boca Raton、Fla.)を参照のこと;また、Skoldらに対する米国特許第4,727,022号(発明の名称「Methods for Modulating Ligand−Receptor Interactions and their Application」)、Forrestらに対する米国特許第4,659,678号(発明の名称「Immunoassay of Antigens」)、Davidらに対する米国特許第4,376,110号(発明の名称「Immunometric Assays Using Monoclonal Antibodies」)、Litmanらに対する米国特許第4,275,149号(発明の名称「Macromolecular Environment Control in Specific Receptor Assays」)、Maggioらに対する米国特許第4,233,402号(発明の名称「Reagents and Method Employing Channeling」)およびBoguslaskiらに対する米国特許第4,230,767号(発明の名称「Heterogeneous Specific Binding Assay Employing a Coenzyme as Label」)を参照のこと。抗体は、公知の技術(例えば、沈降)に従って、診断アッセイに適した固体支持体(例えば、ラテックスまたはポリスチレンなどの材料から形成されるビーズ、プレート、スライドまたはウェル)に結合体化される。本明細書中に記載されるような抗体は、同様に、公知の技術に従って、検出可能な基(例えば、放射標識(例えば、35 S、125
I、131 I)、酵素標識(例えば、西洋ワサビペルオキシダーゼ、アルカリホスファターゼ)、および蛍光標識(例えば、フルオレセイン))に結合体化され得る。
【0127】
本明細書中に記載される方法を実施するための診断キットは、多くの様式で生産される。1つの実施形態において、上記診断キットは、(a)固体支持体に結合体化された抗体(例えば、PD−1ポリペプチド)および(b)検出可能な基に結合体化される本発明の第2の抗体を備える。試薬はまた、補助的な薬剤(例えば、緩衝剤およびタンパク質安定化剤(例えば、多糖類など))を含み得る。上記診断キットは、必要な場合、シグナル生成系(検出可能な基がメンバー(例えば、酵素基質)である系)の他のメンバー、試験におけるバックグラウンド干渉を減少させるための薬剤、コントロール試薬、試験を行うための装置などをさらに備え得る。あるいは、試験キットは、(a)抗体、および(b)検出可能な基に結合体化される抗体に対する特異的結合パートナーを備える。同様に、上に記載される補助的な薬剤を備えることができる。試験キットは、代表的に、上記試験を行うための指示が印刷されたシートとともに全ての構成要素を単一の容器中に入れて、任意の適切な様式で梱包され得る。
【0128】
本発明は、部分的に、以下の実施例に記載される実験に基づく。これらの実施例は、本発明を例示するために提供され、そして限定として解釈されるべきではない。
【実施例】
【0129】
(実施例1:慢性的に感染したマウスにおける、抗PD−L1抗体を使用したPD−1経路の阻害)
種々の株のリンパ球脈絡髄膜炎ウイルス(LCMV)に感染したマウスを、CD8+ T細胞機能に対する慢性ウイルス感染の影響を研究するために使用した。LCMV Armstrong株は、8日以内に除去される急性感染を引き起こし、非常に機能的な休止記憶(resting memory)CD8+ T細胞の長寿命の集団を残す。LCMV Cl−13株は、対照的に、宿主において持続感染を確立し、最長で3ヶ月間まで持続するウイルス血症によって特徴付けられる。上記ウイルスは、いくつかの組織においていつまでも残存し、そして抗原特異的CD8+ T細胞は、機能的に損なわれるようになる。DbNP396−404 CD8+ T細胞が、身体から消失する一方で、DbGP33−41 CD8+ T細胞およびDbGP276−286 CD8+ T細胞は、存続するが、抗ウイルスサイトカイン(例えば、IFN−γおよびTNF−α)を増殖または分泌する能力を失う。
【0130】
C57BL/6マウスを、National Cancer Institute(Frederick、MD)から購入した。マウスに対して、2×106pfuのLCMV−Cl−13をi.v.感染させた。CD4枯渇を、PBS中の500μgのGK1.5を感染の日および感染の翌日に注射することによって行なった。LCMV免疫マウスを、マウスに対して2×105pfuのLCMV Armstrongをi.p.感染させることによって産生する。
【0131】
遺伝子アレイ分析を、FACS精製したナイーブのDbGP33−41特異的P14トランスジェニックCD8+ T細胞、LCMV Armstrong免疫マウスに由来するDbGP33−41特異的記憶CD8+ T細胞、およびCD4+枯渇LCMV Cl−13感染マウスに由来するDbGP33−41特異的CD8+ T細胞またはDbGP276−286特異的CD8+ T細胞に対して行なった。RNA単離および遺伝子アレイ分析を、Kaechら(Cell 111:837−51、2002)に記載される通りに行った。PD−1 mRNAは、記憶CD8+ T細胞と比較して、疲弊したCD8+ T細胞において高度に発現された(図1A):さらに、PD−1は、LCMV Cl−13感染マウスにおけるCD8+ T細胞の表面に発現されたが、LCMV Armstrongのクリアランス後のCD8+ T細胞の表面上に存在しなかった(図1B)。慢性的に感染したマウスはまた、未感染のマウスと比較して、ほとんどのリンパ球およびAPC上に、より高いレベルのPD−1のリガンドのうちの1つ(PD−L1)を発現した。したがって、ウイルス抗原の存続およびCD8+ T細胞の疲弊は、PD−1発現の誘導と同時に生じる。
【0132】
PD−1/PD−L1経路の遮断が、T細胞機能を回復し得、そして慢性LCMV感染の間のウイルス制御を増強するという仮説を試験するために、PD−1/PD−L1同時阻害性経路を、αPD−L1遮断抗体を使用して、慢性LCMV感染の間に途絶させた。PD−L1に対する遮断モノクローナル抗体を、LCMV Cl−13に感染したマウス対して、感染後の23日目〜37日目において3日毎にi.p.投与した(200μgのラット抗マウスPD−L1 IgG2bモノクローナル抗体(クローン10F.5C5またはクローン10F.9G2))。37日目にて、未処置のコントロールと比較して、処置マウス中に約2.5倍のDbNP396−404特異的CD8+ T細胞および3倍のDbGP33−41特異的CD8+ T細胞が、存在した(図2A)。増殖の誘導は、CD8+ T細胞に対して特異的であった。なぜならば、脾臓におけるCD4+ T細胞の数が、処置マウスおよび未処置マウスの両方においてほぼ同じ(脾臓あたり約6×104
IAbGP61−80のCD4+ T細胞)であったからである。
【0133】
CD8+ T細胞増殖の増大に加えて、PD−1シグナリングの阻害はまた、ウイルス特異的CD8+ T細胞における抗ウイルスサイトカインの増大した産生をもたらした。CD8+ T細胞による、8種の異なるCTLエピトープに対するIFN−γおよびTNF−αの産生を、決定した。組み合せられた応答は、未処置マウスと比較して、処置マウスにおいて2.3倍高かった(図2Bおよび2C)。TNF−α産生細胞の頻度の2.3倍の増加がまた、処置後に観察された(図2D)。ウイルスクリアランスはまた、ウイルスが処置マウスの血清、脾臓、および肝臓から除去されるにつれて増進された。減少したウイルス力価が、感染の37日目(処置を開始した14日後)に処置マウスの肺および腎臓において観察された(約10倍)。しかし、未処置マウスは、これら全て組織においてウイルスの顕著なレベルを示した(図2E)。血清および組織ホモジネートにおけるウイルス力価を、Ahmedら(J.Virol.51:34−41、1984)に記載される通りにVero細胞を使用して決定した。この結果は、PD−1インヒビターがCD8+ T細胞増殖およびウイルスクリアランスを増大させ、したがってPD−1シグナリングの阻害がCD8+ T細胞機能を回復させることを示す。さらに、PD−1シグナリングの阻害はまた、B細胞応答を増強した。なぜならば脾臓におけるLCMV特異的抗体分泌細胞の数もまた、処置後に増加(>10倍)したからである。
【0134】
CD4+ T細胞は、CD8+ T細胞応答の発生および維持において重要な役割を果たす。このことに関して、CD4+ T細胞(いわゆる「無力(helpless)」のCD8+ T細胞)の非存在下でプライムされたCD8+ T細胞は、正常の免疫応答を惹起できない。さらに、慢性LCMV感染は、CD4+ T細胞の存在下においてより重篤である。したがって、LCMV−Cl−13感染の間に産生された無力のT細胞は、CD4+ T細胞の存在下で産生されたT細胞よりもさらに大きい顕著な機能的障害を示す。DbNP396−404特異的CD8+ T細胞は、検出不可能なレベルまで消失し、そしてDbGP33−41 CD8+ T細胞およびDbGP276−286 CD8+
T細胞は、IFN−γおよびTNF−αを分泌する能力を完全に失う。
【0135】
CD4+ T細胞は、LCMV−Cl−13感染時に枯渇させ、そしてマウスを、感染の46日目〜60日目に抗PD−L1抗体処置によって処置した。LCMV特異的CD4+ T細胞は、処置の前後に細胞内IFN−γ染色によって検出できなかった。処置の後に、処置マウスは、未処置のコントロールマウスよりも、処置マウスの脾臓において約7倍のDbGP276−286 CD8+ T細胞および4倍多いDbGP33−41 CD8+ T細胞を有した(図3A)。上記脾臓におけるウイルス特異的CD8+ T細胞の数もまた、増加した(図3B)。処置マウスにおけるウイルス特異的CD8+ T細胞の増加は、BrdU取り込みによって検出されるような増殖の増大に起因した。未処置マウスにおいて、43%のDbGP276−286 CD8+ T細胞は、中程度のレベルのBrdUを取り込み、そして2%のDbGP276−286 CD8+ T細胞は、高レベルのBrdUを取り込み、一方で、処置マウスにおいて、50%のDbGP276−286 CD8+ T細胞は、中程度のレベルのBrdUを取り込み、そして37%のDbGP276−286 CD8+ T細胞は、高レベルのBrdUを取り込んだ。BrdU分析を、処置中の飲料水に1mg/mlのBrdUを導入することによって行い、そして染色は、製造業者のプロトコル(BD Biosciences、San Diego、CA)に従って行った。さらに、処置マウスは、細胞周期関連タンパク質Ki67を発現する、より高い%のCD8+ T細胞を含んだ(未処置マウスにおいて19%であるのに対して60%、図3C)。PBMCにおけるCD8+ T細胞の処置に対する応答は、高レベルのCD8+ T細胞増殖を有するマウスに限定された。
【0136】
PD−1阻害はまた、無力の疲弊したウイルス特異的CD8+ T細胞における抗ウイルスサイトカイン産生を増大させた。処置の後に、IFN−γを産生するDbGP33−41 CD8+ T細胞およびDbGP276−286 CD8+ T細胞の数は、著しく増加した(図4A)が、より多い数のDbNP396−404特異的CD8+ T細胞、KbNP205−212特異的CD8+ T細胞、DbNP166−175特異的CD8+ T細胞、およびDbGP92−101特異的CD8+ T細胞がまた、処置マウスにおいて検出された(図4A)。コントロールの未処置マウスにおけるDbGP276−286特異的CD8+ T細胞の20%と比較して、処置マウス由来のDbGP276−286特異的CD8+ T細胞の50%が、IFN−γを産生し得る(図4B)。しかし、処置マウス由来のDbGP276−286特異的CD8+ T細胞によって産生されたIFN−γおよびTNF−αのレベルは、完全に機能的なDbGP276−286特異的記憶細胞よりも低かった(図4C)。
【0137】
PD−1阻害はまた、無力の細胞溶解活性を増大させ、ウイルス特異的CD8+ T細胞を疲弊させた。ウイルス特異的CD8+ T細胞のエキソビボ細胞溶解活性を、51Cr放出アッセイ(Wherryら、2003.J.Virol.77:4911−27)を使用して処置後に検出した。ウイルス力価は、処置の2週間後に、未処置マウスと比較して脾臓において約3倍、肝臓において4倍、肺において2倍、そして血清において2倍減少した(図4E)。
【0138】
したがって、これらの結果は、PD−1経路の遮断が慢性ウイルス感染に対するCTL末梢性寛容を破壊すること、およびCD4+ T細胞のヘルプが欠乏した疲弊したCD8+ T細胞が不可逆的に活性化されないことを示す。
【0139】
(実施例2:抗ウイルスワクチンおよびPD−1インヒビターの投与)
持続感染中にT細胞応答をブーストするための1つのアプローチは、治療用ワクチン接種である。このアプローチについての理論的根拠は、内因性抗原が慢性ウイルス感染中に最適かまたは免疫原性の様式で与えられる可能性がないこと、およびワクチンの形態で抗原を提供することがウイルス特異的T細胞およびウイルス特異的B細胞に対するより有効な刺激を提供し得ることである。上記慢性LCMVモデルを使用して、マウスに、治療用ワクチン(VVGP33)としてLCMV GP33エピトープを発現する組換えワクシニアウイルスを投与した。その治療用ワクチンは、いくつかの慢性的に感染したマウスにおいてCD8+ T細胞応答の適切な増強をもたらした。上記治療用ワクチンを受容した9匹の慢性的に感染したマウスのうちの4匹は、陽性の応答を示したが、コントロールマウスは、GP33に対する免疫応答の有意な増大を有さなかった。この治療用ワクチン接種をPD−L1インヒビターと組み合せた場合、LCMV特異的T細胞応答は、単独のどの処置と比較してもより大きいレベルまでブーストされ、そして組み合せた処置の効果は、相加的なものよりも大きかった。
【0140】
(実施例3:PD−1 RNAiを使用した慢性的に感染したマウスにおけるPD−1経路の阻害)
RNA干渉(RNAi)は、哺乳動物細胞において遺伝子発現をサイレンシングし得る。長い二本鎖RNA(dsRNA)が、細胞に導入され、そして次に、特異的mRNA分子または小さい群のmRNAを標的とするより小さいサイレンシングRNA(siRNA)へとプロセシングされる。この技術は、抗体が機能的ではない状況において特に有用である。例えば、RNAiは、特有のスプライス改変体がPD−1およびCTLA−4の可溶性形態を産生する状況において使用され得る。
【0141】
PD−1サイレンサーRNAを、市販のsiRNA発現ベクター(例えば、pSilencerTM発現ベクターまたはpSilencerTMアデノウイルスベクター(Ambion、Austin、TX)に挿入する。次いでこれらのベクターを、インビボまたはエキソビボで標的である疲弊したT細胞と接触させる(実施例4を参照のこと)。
【0142】
(実施例4:疲弊したT細胞のエキソビボでの若返り(rejuvenation))
ウイルス特異的な疲弊したCD8+ T細胞を、磁性ビーズまたは密度勾配遠心分離(density centrifugation)を使用してLCMV−Cl−13に慢性的に感染したマウスから単離する。トランスフェクトしたCD8 T細胞を、PD−L1、PD−L2またはPD−1を標的とするモノクローナル抗体と接触させる。実施例1に記載する通り、PD−1経路の阻害は、CD8 T細胞の若返りを生じる。したがって、例えば、CD8+ T細胞増殖およびサイトカイン産生の増大が、存在する。これらの若返ったCD8+ T細胞を、上記感染したマウスに再度導入し、そしてウイルス量を、実施例1において記載するように測定する。
【0143】
(実施例5:新規のCD8+ T細胞若返り剤(rejuvenator)化合物のインビトロスクリーニング)
PD−1経路を調節する化合物は、慢性ウイルス感染によるCD8+ T細胞の疲弊を逆転するそれらの能力に基づくインビボスクリーニングアッセイおよびエキソビボスクリーニングアッセイにおいて同定され得る。
【0144】
疲弊したCD8+ T細胞を、LCMV−Cl−13に慢性的に感染したマウスから得て、次に試験化合物と接触させる。上記接触したT細胞から放出された抗ウイルスサイトカイン(例えば、IFN−γまたはTNF−α)の量を、例えば、ELISAまたは他の定量方法によって測定し、そして存在する場合、上記試験化合物と接触していない疲弊したT細胞から放出された抗ウイルスサイトカインの量を比較する。未処置の細胞における量と比較した処置細胞によって放出された抗ウイルスサイトカインの量の増加により、その化合物はT細胞活性を調節するのに有用なPD−1インヒビターと同定される。
【0145】
(実施例6:新規のCD8+ T細胞若返り剤化合物のインビボスクリーニング)
疲弊したCD8+ T細胞を、LCMV−Cl−13に慢性的に感染したマウスから得る。試験化合物を、上記感染したマウスに対して静脈内に投与する。処置マウスおよび未処置マウスの血清中に放出される抗ウイルスサイトカイン(例えば、IFN−γまたはTNF−α)の量を、例えば、ELISAまたは他の定量方法によって測定し、そしてその量を、比較する。未処置マウスにおける量と比較した処置マウスの血清において見出される抗ウイルスサイトカインの量の増加により、上記試験化合物はPD−1インヒビターと同定される。あるいは、ウイルス力価(例えば、血清ウイルス力価)が、上記試験化合物による処置の前後に決定され得る。
【0146】
(実施例7:持続HCV感染の免疫療法についてのモデルとしてのチンパンジー)
チンパンジーは、ヒトにおけるHCV持続のモデルを提供する。長寿命のウイルス持続を生じるT細胞免疫の欠損は、HCV特異的CD4+ Tヘルパー細胞および損なわれたかまたは変化したCD8+ Tエフェクター細胞活性の欠損の両方を誘導する。持続的に感染したチンパンジーを、CTLA−4、PD−1、またはその2つの組み合せに対する抗体によって処置する。組換え構造的HCVタンパク質および組換え非構造的HCVタンパク質を使用してワクチン接種と組み合わせた上記阻害性経路の遮断の効力、ならびにこのようなストラテジーがウイルス特異的記憶T細胞の頻度および寿命を向上させ得るか否かを、決定する。T細胞免疫の欠損は、持続的に感染したヒトおよびチンパンジーにおいて専らHCV特異的である。感染したチンパンジーの血液および肝臓を、CTLA−4、PD−1、BTLAおよびそれらのリガンドの発現ならびにTreg細胞の存在について調べる。次いで、抗ウイルス活性は、これらの分子によってシグナリングを遮断するヒト化モノクローナル抗体をチンパンジーに送達することによって回復され得る。
【0147】
持続的に感染したチンパンジーを、ヒト化αCTLA−4抗体(MDX−010、Medarex)またはαPD−1抗体によって処置する。MDX−010の最初の用量は、0.3mg/kgであり、その用量は、次いで2週間後に1.0mg/kgであり、次いで3週間の間隔で3mg/kg、10mg/kg、30mg/kgである。同時阻害性分子に対する抗体による処置後に、体液性免疫応答および細胞性免疫応答ならびにHCV RNA量を、測定する。サンプルを、1週目、2週目、3週目、5週目、および8週目に回収し、次いで1ヶ月間隔で回収する。サンプルは、以下を含む:1)トランスアミナーゼ、自己抗体、HCVに対する中和抗体、およびサイトカイン応答の分析のための血清、2)ウイルス量およびゲノム進化のための血清、3)免疫、補助刺激/阻害性レセプターの発現および機能のインビトロ測定のためのPBMC、4)肝臓内のリンパ球およびRNAの単離のための新鮮な(固定されていない)肝臓、ならびに5)組織学および免疫組織化学的分析のための固定された(ホルマリン/パラフィン包埋された)肝臓。局所のリンパ節はまた、免疫組織化学技術および分子的技術によって同時阻害性分子およびスプライス改変体の発現を評価するために2つまたは3つの時点にて回収する。これらの治療の安全性の効力および安全性を評価するためのアッセイを、本明細書中で記載するように行う。
【0148】
HCV抗原によるワクチン接種がPD−1の対する抗体の治療効果を強化するか否かを決定するために、チンパンジーを、以下の通りに処置する:1)0週間、4週間、および24週間での組換えエンベロープ糖タンパク質E1およびE2(MF59アジュバントにおける)ならびに他のタンパク質(ISCOMSと一緒に処方されたコア+NS 3、NS 4、およびNS 5)による筋肉内免疫化;2)1)において使用したワクチンを用いるが、αCTLA−4抗体との同時投与による筋肉内免疫化(ワクチンが与えられる場合、それぞれ体重1kgあたり30mg、静脈内に0週目、4週目、および24週目);3)αPD−1(またはBTLA)抗体でCTLA−4抗体を置換することを除いて2)と同一;4)CTLA−4抗体とPD−1(またはBTLA)抗体との組み合せをそのワクチンに加えて使用することを除いて群2および群3と同一。HCV特異的T細胞応答およびHCV特異的B細胞応答を、免疫化後に1年間にわたって1ヶ月間隔でモニタリングする。
【0149】
この分析においてHCV−テトラマー+および全T細胞に対して調べたマーカーは、分化のマーカー(例えばCD45RA/RO、CD62L、CCR7、およびCD27)、活性化のマーカー(例えばCD25、CD69、CD38、およびHLA−DR)、生存/増殖のマーカー(例えばbcl−2およびKi67)、細胞傷害の可能性のマーカー(例えば、グランザイムおよびパーフォリン)、およびサイトカインレセプターのマーカー(CD122およびCD127)を含む。興味深い相互関係が、ケモカインIP−10の治療前のレベルとPEG IFN−γ/リバビリンに対する応答との間に存在する。IP−10レベルを、ネガティブな調節経路またはHCV特異的T細胞応答とIP−10レベルとの間の潜在的な相関関係を調査するために測定する。PBMCにおける阻害性レセプターおよびリガンドの発現を、フローサイトメトリーによって行う。
【0150】
(実施例8:反応性リンパ組織におけるPD−1免疫染色)
(材料)
症例の材料を、施設の方針に従ってBrigham & Women’s Hospital、Boston、MAから得た。全ての診断は、World Health Organization Lymphoma Classificationシステム(Jaffe ESら、2001)に記載される組織学的特徴および免疫表現型の特徴に基づき、そして全ての場合において、診断材料は、血液病理学者によって再評価された。
【0151】
(免疫染色)
PD−1の免疫染色を、ホルマリン固定したパラフィン包埋組織切片に対して、マイクロ波抗原賦活後に先に記載される(Jones Dら、1999;Dorfman DMら、2003)ような標準的な間接アビジン−ビオチン西洋ワサビペルオキシダーゼ法およびジアミノベンジジン発色を使用し、10mMクエン酸緩衝液(pH6.0)において先に記載した抗ヒトPD−1モノクローナル抗体(2H7;5)を用いて行った。症例を、少なくとも25%の腫瘍性細胞が陽性の染色を示した場合、PD−1に対して免疫反応性と見なした。PD−1染色を、研究した全ての症例について同一のタンパク質濃度まで希釈したマウスIgGアイソタイプコントロール抗体の染色と比較して、染色の特異性を確かめた。
【0152】
PD−1に対するモノクローナル抗体2H7を、反応性リンパ組織(胸腺)のホルマリン固定したパラフィン包埋検体ならびにさまざまなB細胞リンパ増殖性障害およびT細胞リンパ増殖性障害の症例を染色するために使用した。反応性の変化(濾胞性過形成を含む)を示す扁桃腺の検体において、胚中心における優性に小さいリンパ球のサブセットは、濾胞間T細胞領域において見られる稀なPD−1陽性細胞を伴って、PD−1についての細胞質染色を示した。胚中心におけるPD−1染色パターンは、CD3(pan−T細胞マーカー)に対する抗体によって見られるものと実質的に同一であったのに対し、CD20(pan−B細胞マーカー)に対する抗体は、大多数の胚中心B細胞を染色した。同様の結果が、反応性のリンパ節および脾臓の組織切片において見られた。PD−1染色は、成人の胸腺において観察されなかった。
【0153】
(実施例9:B細胞リンパ増殖性障害およびT細胞リンパ増殖性障害のパラフィン包埋組織切片におけるPD−1免疫染色)
PD−1発現についてさまざまなB細胞リンパ増殖性障害およびT細胞リンパ増殖性障害を、研究した;その結果を、表1にまとめる。前駆Bリンパ芽球性白血病/リンパ芽球性リンパ腫の代表的な症例、ならびに多くの濾胞起源のB細胞非ホジキンリンパ腫(6症例の濾胞性リンパ腫および7症例のバーキットリンパ腫を含む)を含むさまざまな成熟B細胞のリンパ増殖性障害を含む42症例のB細胞リンパ増殖性障害を、PD−1発現について調べた。B細胞リンパ増殖性障害は、PD−1についての染色を示さなかった。いくつかの症例において、非腫瘍性の反応性リンパ組織が、存在し、そして扁桃腺および上に記載した他の反応性リンパ組織において見られるようなPD−1染色パターンを示した。
【0154】
同様に、25症例のホジキンリンパ腫(11症例の古典的なホジキンリンパ腫および14症例のリンパ球優勢型ホジキンリンパ腫を含む)において、腫瘍性細胞は、PD−1についての染色を示さなかった。興味深いことに、14症例全てのリンパ球優勢型ホジキンリンパ腫において、腫瘍性CD20陽性L&H細胞を囲むT細胞は、リンパ球優勢型ホジキンリンパ腫においてCD57+ T細胞について記載した染色パターンと同様に、PD−1に対して免疫反応性であった。これらのPD−1陽性細胞は、存在する全CD3+ T細胞集団のサブセットであった。
【0155】
さまざまなT細胞リンパ増殖性障害を、PD−1の発現について研究した;その結果を、表1にまとめる。前駆T細胞リンパ芽球性白血病/リンパ芽球性リンパ腫(未熟なT細胞の未熟なT細胞の新生物)の症例は、末梢の胸腺後(post−thymic)T細胞の新生物(T細胞前リンパ球性白血病、末梢性T細胞リンパ腫、不特定の未分化大細胞型リンパ腫、および成人T細胞白血病/リンパ腫の症例を含む)であったので、PD−1について陰性であった。対照的に、19症例全ての血管免疫芽球性リンパ腫は、汎T細胞マーカー(例えば、CD3)に対して免疫反応性でもあるPD−1陽性細胞の病巣を含んだ。PD−1陽性細胞は、拡大したCD21+濾胞性樹状細胞(FDC)ネットワークの病巣(血管免疫芽球性リンパ腫の特性)において一貫して見出される。
【0156】
【表1】

略語:B−LL/LL−前駆B細胞リンパ芽球性リンパ腫/リンパ芽球性白血病;CLL−慢性リンパ性白血病;MCL−マントル細胞リンパ腫;FL−濾胞性リンパ腫;MZL−辺縁帯リンパ腫;HCL−へアリー細胞白血病;DLBCL−びまん性大細胞型B細胞リンパ腫;BL−バーキットリンパ腫;LPL−リンパ形質細胞性リンパ腫;MM−多発性骨髄腫;T−LL/L−前駆Tリンパ芽球性白血病/リンパ芽球性リンパ腫;T−PLL−T細胞前リンパ球性白血病;AIL−血管免疫芽球性リンパ腫;PTCL−末梢性T細胞リンパ腫、不特定;ALCL−未分化大細胞リンパ腫;ATLL−成人T細胞白血病/リンパ腫。
*免疫反応性の症例の数/症例の総数
**PD−1陽性細胞は、14/14症例において腫瘍性L&H細胞の周りにロゼットを形成する。
【0157】
(実施例10:HIV特異的ヒトCD8 T細胞上のPD−1発現を研究するための一般的方法)
以下の方法を、実施例11〜14で詳述する実験を行うために使用した。
【0158】
(研究被験体)
慢性のクレード(clade)C HIV−I感染を有する研究参加者を、McCord Hospital、Durban、South Africa、およびSt.Mary’s Hospital、Mariannhill、South Africaにおける外来診療所から募った。末梢血を、このコホートの65人の被験体の全員が分析時に抗レトロウイルス治療ナイーブであったから得た。被験体を、構築された10種のクラスIテトラマーに適合するそれらの発現したHLA対立遺伝子に基づいて加入に関して選択した(下を参照のこと)。上記コホートのウイルス量の中央値は、血漿1mlあたり42,800のHIV−I RNAコピー(163〜750,000の範囲)であり、そして絶対的CD4数の中央値は、362(129〜1179の範囲)であった。感染の持続期間に関する情報は、入手可能ではなかった。全ての被験体は、その施設の施設内審査委員会によって承認された上記研究についてのインフォームドコンセントに署名した。
【0159】
(PD−1抗体およびPD−L1抗体の構築)
ヒトPD−L1に対するモノクローナル抗体(29E.2A3、マウスIgG2b)およびPD−1に対する抗体(EH12、マウスIgG1)を、先に記載したように調製し、そしてそれらの抗体は、PD−1:PD−L1相互作用を遮断することが示された。
【0160】
(MHCクラスIテトラマー)
先に記載される(Airman JDら、1996)ように合成した10種のHIV MHCクラスIテトラマーを、この研究のために使用した:A*0205 GL9(p24、GAFDLSFFL;配列番号1)、A*3002 KIY9(インテグラーゼ、KIQNFRVYY;配列番号2)、B*0801 DI8(p24、DIYKRWII;配列番号3)、B*0801 FL8(Nef、FLKEKGGL;配列番号4)、B*4201 RM9(Nef、RPQVPLRPM;配列番号5)、B*4201 TL9(p24、TPQDLNTML;配列番号6)、B*4201 TL10(Nef、TPGPGVRYPL;配列番号7)、B*4201 YL9(RT、YPGIKVKQL;配列番号8)、B*8101 TL9(p24、TPQDLNTML;配列番号9)、およびCw0304 YL9(p24、YVDRFFKTL;配列番号10)。A*0205を発現するプラスミド構築物、A*3002を発現するプラスミド構築物、およびCw*0304を発現するプラスミド構築物は、寛大にもDr.Eugene RavkovおよびDr.John Airman、NIH Tetramer Core Facility、Atlanta、Georgiaによって提供された。
【0161】
(HLAクラスIテトラマー染色および表現型分析)
新鮮に単離した末梢血単核細胞(PBMC、50万個)を、テトラマーによって37℃にて20分間染色した。次いで、その細胞を、リン酸緩衝化生理食塩水(PBS)によって1回洗浄し、ペレットにし、そしてフルオレセインイソチオシアネート(FITC)結合体化抗CD8(Becton Dickinson)、フィコエリトリン結合体化抗PD−1(クローンEH12)、およびViaProbe(Becton Dickinson)によって直接染色した。細胞を、室温にて20分間インキュベートし、PBSにおいて1回洗浄し、そして1%パラホルムアルデヒドを含む200μl PBSに懸濁し、そして蛍光活性化セルソーター(FACSCalibur、Becton Dickinson)において取得した。最低で100,000イベントを、FACSCaliburにおいて獲得した。
【0162】
(CFSE増殖アッセイ)
100万個の新鮮に単離したPBMCを、PBSにおいて2回洗浄し、ペレットにし、そして1mlの0.5μMカルボキシ−フルオレセインジアセテート,スクシンイミジルエステル(CFSE、Molecular Probes)に37℃にて7分間懸濁した。その細胞を、PBSにおいて2回洗浄し、1ml R10培地(グルタチオン、ペニシリン、ストレプトマイシン、および10%ウシ胎仔血清[FCS]を補充したRPMI 1640)に懸濁し、そして24ウェルプレートのうちの1つのウェルに蒔いた。最初の研究は、0.2μg/mlの最終濃度のペプチドが最適な増殖性応答をもたらしたことを示し、したがってこれは、各アッセイに使用したウェルにおける最終ペプチド濃度であった。ネガティブコントロールウェルは、培地単独中のPBMC、または精製した抗PD−L1(10μg/ml)を含む培地中のPBMCからなり、そしてポジティブコントロールウェルを、10μg/mlのフィトヘマグルチニン(phytohemagluttinin)(PHA)によって刺激した。37℃のインキュベーターにおいて6日間インキュベートした後、その細胞を、2ml PBSによって洗浄し、そしてPE結合体化MHCクラスIテトラマー、ViaProbe(Becton Dickinson)、および抗CD8−APC抗体によって染色した。細胞を、FACSCaliburにおいて獲得し、そしてCellQuest(登録商標)ソフトウェア(Becton Dickinson)によって分析した。細胞を、ViaProbe− CD8+リンパ球についてゲート選別(gate)した。テトラマー+細胞の増加倍率(fold increase)を、ペプチドの存在下におけるCD8+テトラマー+細胞の%をペプチド刺激の非存在下におけるCD8テトラマー細胞の%で除算することによって算出した。
【0163】
(統計分析)
スピアマン相関、マン−ホイットニー検定、および対t検定(paired t−test)分析を、GraphPad Prism Version 4.0aを使用して行った。全ての検定は、両側であり、そしてp<0.05のp値を、有意であると見なした。
【0164】
(実施例11:HIV特異的CD8 T細胞上のPD−1発現)
優性のHIV−1クレードCウイルスCD8 T細胞エピトープに特異的な10のMHCクラスIテトラマーのパネルを、一般的なHLA対立遺伝子、ならびに、Gag、Nef、インテグラーゼ、およびRTにおける頻繁に標的される、エピトープ(Kiepiela Pら、2004)に基づいて合成、これらの細胞上の表面PD−1発現の直接的な可視化を可能にした。高分解能HLA分類を、コホート全体に対して行い、そして65人の抗レトロウイルス治療ナイーブの者のサブセットを、関連するHLA対立遺伝子の発現に基づいて研究のために選択した。合計で120の個々のエピトープを調べた。HIVテトラマー+細胞上のPD−1の代表的なエキソビボ染色を、図5Aに示す。PD−1発現は、これらのテトラマー+細胞上に迅速に出現し、そして同じ個体由来の全CD8 T細胞集団におけるPD−1発現よりも有意に高い(p<0.0001);次に、テトラマー+ CD8 T細胞および全CD8 T細胞集団の両方におけるPD−1発現は、HIV血清反応陰性コントロールにおけるPD−1発現よりも有意に高かった(図5B)。試験した10個のテトラマーのうちの8個に関して、抗原特異的CD8細胞上の発現のレベルが100%である少なくとも1人の者を、同定した(図5C)。3〜25人の個体由来のPBMCを各HIVテトラマー応答について染色し、PD−1発現レベルの中央値は、テトラマー+細胞の68%〜94%の範囲であった。(図5C)。これらの知見を、テトラマー+細胞および全CD8 T細胞集団の両方におけるPD−1の平均蛍光強度(MFI)の分析によってさらに確かめた(図5B、図5C)。
【0165】
次に、複数の検出可能な応答を有する人におけるPD−1発現レベルに関してエピトープ特異的な差についての証拠が存在するか否かを、決定した。調べた65人のうち、16人は、それぞれ、3個と5個との間のテトラマー陽性応答を有した。PD−1発現は、16人の被験体のうちの3人について分析した各応答に関して、ほぼ同一であり、そして100%に近かった;しかし、その他の13人の個体は、上記エピトープに依存してPD−1発現の異なるパターンを示した(図5D)。これらのデータは、PD−1発現が単一の者由来の同時発生的なエピトープ特異的CD8 T細胞上に差次的に発現され得、抗ウイルス効力におけるエピトープ特異的な差を示す最近のデータ(Tsomides TJら、1994;Yang Oら、1996;Loffredo JTら、2005)とおそらく一致することを示した。
【0166】
(実施例12:PD−1発現とHIV疾患の進行との間の相関)
相関を、HIV特異的CD8 T細胞上のPD−1発現と、血漿ウイルス量およびCD4数(その両方は、HIV疾患の進行の指標である)との間において決定した。先の研究と一致して、テトラマー陽性細胞の数とウイルス量またはCD4数との間の相関は、何の有意な相関をも示さなかった(図6A、図6B)。対照的に、ウイルス量と、HIVテトラマー陽性細胞上のPD−1発現の%およびMFIの両方との有意にポジティブな相関(それぞれ、p=0.0013およびp<0.0001;図6A)が存在した。CD4数と、HIVテトラマー陽性細胞上のPD−1の%およびMFIとの間に、逆相関(それぞれ、p=0.0046およびp=0.0150;図6B)がまた存在する。試験したテトラマーは、これらの被験体におけるHIV特異的CD8 T細胞集団の画分のみを示すようであるので、全てのCD8細胞上のPD−1発現とこれらのパラメータとの間の相関をまた、調べた。ウイルス量と、全CD8 T細胞集団上のPD−1発現の%およびMFIとの間の有意にポジティブな相関(それぞれ、p=0.0021およびp<0.0001;図6C)が存在し、そして逆相関がまた、CD4数と、全CD8 T細胞集団上のPD−1発現の%およびMFIとの間において観察された(それぞれ、p=0.0049およびp=0.0006;図6D)。この同じ群において、CMV特異的CD8 T細胞上のPD−1発現を、5人の被験体において試験し、そして有意に少ないPD−1が、HIV特異的CD8 T細胞と比較してこれらの細胞上に発現され(CMVテトラマー+ PD−1+の23%という中央値、p=0.0036、データ示さず)、そしてその発現は、それらの同一の個体における大部分のCD8 T細胞とは異ならなかった。このことは、高いPD−1発現が全てのウイルス特異的CD8 T細胞の一様な特徴ではないことを示す。これらのデータは、慢性HIV感染における抗原の量の増加がCD8 T細胞上のPD−1の増大した発現を生じることを示唆し、そしてそのデータは、PD−1発現がCD8
T細胞の機能的な疲弊に関連する慢性LCMV感染におけるマウスのデータ(Barber DLら、2005)と一致する。さらに、それらは、複数のエピトープの分析を含む大規模研究における、HIV特異的CD8 T細胞とウイルス量またはCD4数のいずれかとの間の最初の明確な関連を提供する。
【0167】
(実施例13:PD−1発現とCD8 T細胞の記憶状態および機能との間の相関)
次に、PD−1発現を、CD8 T細胞の記憶状態および機能に関連する多くのさらなる表現型マーカー(CD27、CD28、CD45RA、CD57、CD62L、CD127、CCR7、パーフォリン、グランザイムB、およびKi67を含む)の構成において分析した(図7)。1人の個体由来のB*4201 TL9テトラマー+細胞におけるこれらのマーカーに対する代表的な染色を、図7Aに示し、そして13人の被験体について集められたデータを、図7Bに示す。4色よりも多いマルチパラメータフローサイトメトリーはKwaZulu Natalにおいて利用可能ではなかったので、これらの研究は、95%よりも大きいPD−1陽性であったテトラマー応答に限られた。上記HIVテトラマー+ PD−1+細胞は、高レベルのCD27およびグランザイムB、非常に低レベルのCD28、CCR7、および細胞内Ki67、低レベルのCD45RAおよびパーフォリン、ならびに中程度のレベルのCD57およびCD62Lを発現する(図7B)。これらのデータは、HIV特異的PD−1+ T細胞がエフェクター/エフェクター記憶表現型を提示することを示し、そしてそれは、先の報告のHIV特異的CD8 T細胞の歪んだ成熟(Champagne Pら、2001;Appay Vら、2002;Hess Cら、2004)と一致する。さらに、ウイルスの配列決定を、これらの細胞が免疫回避(Brown JAら、2003)を駆動していたか否かを決定するために行った。45個の評価したこれらのテトラマー陽性応答のうち、5個のみにおけるウイルスエピトープが、South AfricanクレードC共通配列と異なっており(データ示さず)、これは、これらの細胞が、インビボでほとんど選択圧を発揮しなかったこと示す。
【0168】
LCMVモデルを使用したマウスにおける先の実験は、抗PD−L1遮断抗体の注入によるPD−1/PD−L1相互作用のインビボ遮断がサイトカイン産生、殺傷能力、増殖能力、および、非常に著しいウイルス量の減少によって測定されるようなLCMV特異的CD8 T細胞の増強した機能性を生じることを示した(Barber DLら、2005)。
【0169】
(実施例14:HIV特異的CD8 T細胞の増殖に対するPD−1/PD−L1経路の遮断の効果)
HIV特異的CD8 T細胞はまた、損なわれた増殖能力を示す(Migueles SAら、2002;Lichterfeld Mら、2004)ので、PD−1/PD−L1の遮断がインビトロでこの機能を増強し得るか否かを、決定した。B*4201陽性個体からの代表的なデータを、図8Aに示す。培地単独、または抗PD−L1抗体を含む培地を伴う新鮮に単離したCFSE標識PBMCのインキュベーションは、培養の6日後にCFSEhiを保持したB*4201−TL9特異的CD8 T細胞の集団(1.2%のCD8 T細胞)の維持をもたらした。TL9ペプチド単独による6日間にわたるCFSE標識PBMCの刺激が、CFSElo B*4201 TL9テトラマー+細胞の4.8倍の拡大をもたらしたのに対し、抗PD−L1遮断抗体の存在下でのTL9ペプチドによるCFSE標識PBMCの刺激は、10.3倍のテトラマー+細胞の増加を生じる、TL9特異的細胞の増殖をさらに増強した。CFSE増殖アッセイを、精製した抗ヒトPD−L1遮断抗体の存在下および非存在下で28個のサンプルに対して行った。HIV特異的CD8+ T細胞の増殖の有意な増大が、ペプチド単独による刺激後における増殖の量と比較して、抗PD−L1遮断抗体を加えたペプチドの存在下で観察された(図8B;p=0.0006、対t検定)。抗PD−L1遮断抗体の存在下におけるテトラマー+細胞の増加倍率は、個体および所定の個体内のエピトープによって変化し(図8C)、それはまた、これらの応答の機能的疲弊の程度におけるエピトープ特異的な差を示唆する。
【0170】
(他の実施形態)
本発明は、その詳細な説明と組み合せて記載されているが、上記の説明は、例示することを意図し、そして添付の特許請求の範囲によって規定される本発明の範囲を限定しない。他の局面、利点、および改変は、添付の特許請求の範囲の範囲内である。
【技術分野】
【0001】
(連邦支援研究についての宣言)
本発明は、NIH助成金AI39671およびNIH助成金CA84500の下での米国政府支援によってなされた。米国政府は、本発明において特定の権利を有する。
【0002】
(発明の分野)
一般に、本発明は、持続感染および癌の処置のための方法および組成物に関する。
【背景技術】
【0003】
(発明の背景)
予防ワクチンの開発はウイルス感染の死亡率を顕著に減少させたが、持続感染を引き起こすウイルス(例えば、C型肝炎ウイルス)に対するこのようなワクチンの使用は、限られた成果しか上げていない。急性感染および自己限定型の感染を引き起こすウイルスとは対照的に、持続感染を引き起こす微生物に対して惹起される免疫応答は、しばしば、一過性であり、そしてその感染を除去するには不十分である。結果として、その感染性微生物は、必ずしも宿主に一定の損傷を引き起こすことなく、感染した被験体内に長期間にわたって残存する。
【0004】
持続感染を引き起こす微生物の根絶における主要な障害は、宿主生物体の免疫系を回避するこのような微生物の能力である。例えば、特定のウイルスおよび寄生虫は、感染した細胞の効率的なT細胞認識に必要な宿主分子の発現をダウンレギュレートする。持続感染はまた、ウイルス感染の制御および根絶に不可欠である抗原特異的CD8+ T細胞の機能的欠陥を引き起こす。治療用ワクチンとサイトカインアジュバントとの組み合わせが、奨励されてきたが、得られた免疫応答は、病原体を首尾よく根絶させなかった。
【発明の概要】
【発明が解決しようとする課題】
【0005】
したがって、より良い方法が、持続感染を処置、予防または軽減するための必要とされている。
【課題を解決するための手段】
【0006】
(発明の要旨)
本発明は、持続感染または癌の処置、予防、または減少のための方法および組成物、あるいは持続感染または癌の1種以上の症状の軽減のための方法および組成物を提供する。本発明は、抗原特異的CD8+ T細胞が、プログラム細胞死(Programmed Death)−1ポリペプチド(PD−1)の誘導後に感染因子に対して機能的に寛容性になる(「疲弊する(exhausted)」)という知見に基づく。したがって、PD−1、PD−L1またはPDL2の発現または活性を減少させることによって、機能的に寛容性のCD8+ T細胞の増殖、サイトカインの産生、および感染因子(例えば、ウイルス、細菌、真菌、寄生虫、マイコプラズマまたは癌)クリアランスの速度は、増大され、その結果、その感染因子に特異的な免疫応答が、増強される。
【0007】
したがって、本発明は、持続感染(例えば、ウイルス感染、細菌感染、真菌感染、マイコプラズマ感染および寄生虫感染)または癌の症状を軽減または予防する必要がある被験体(例えば、ヒト)に、CD28様ファミリーのメンバー(例えば、PD−1、CTLA−4、BTLAおよびそれらの機能性フラグメントまたは改変体)またはCD28様ファミリーリガンドのメンバー(例えば、PD−L1またはPD−L2)の活性または発現を減少させる化合物を投与することによって持続感染または癌の症状を軽減または予防する方法を提供する。あるいは、上記被験体は、抗原特異的T細胞または抗原特異的B細胞におけるPD−1ポリペプチドの発現または活性を減少させる化合物と接触させた抗原特異的T細胞または抗原特異的B細胞を投与される。例えば、上記抗原特異的T細胞または抗原特異的B細胞は、ウイルス抗原に特異的である。上記T細胞またはB細胞は、自系供給源(autologous source)、あるいは処置される被験体と同じかまたは異なる種である別の被験体に由来する。
【0008】
さらに、本発明は、T細胞(例えば、アネルギー性T細胞または抗原に対する増大した免疫寛容を有するT細胞)の細胞傷害活性を、そのT細胞と、PD−1ポリペプチドの活性または発現を減少させる化合物とを接触させることによって増大させる方法を特徴とする。
【0009】
本発明の全ての上記局面において、持続性ウイルス感染は、肝炎ウイルス、ヒト免疫不全ウイルス(HIV)、ヒトTリンパ球向性ウイルス(HTLV)、ヘルペスウイルス、エプスタイン−バーウイルス、またはヒトパピローマウイルスなどの感染によって生じる。持続性ウイルス感染はまた、潜伏ウイルスによって引き起こされる感染を含み得る。癌としては、血管免疫芽球性リンパ腫および結節性リンパ球優勢型ホジキンリンパ腫(nodular lymphocyte Hodhkin lymphoma)などのリンパ増殖性障害が挙げられる。望ましくは、本発明の化合物は、処置される被験体における細胞傷害性T細胞の活性を増大させること(例えば、細胞傷害性サイトカイン(例えば、IFNγ、TNFα、またはIL−2)の産生の増大、T細胞増殖の増大、またはウイルスクリアランスの増大)によって抗原特異的免疫応答を増大させる。例えば、上記化合物は、PDリガンド1(PD−L1)またはPDリガンド2(PD−L2)の発現または活性を減少させるか、あるいはPD−1とPD−L1との間の相互作用またはPD−1とPD−L2との間の相互作用を減少させる。例示の化合物としては、抗体(例えば、抗PD−1抗体、抗PD−L1抗体、および抗PD−L2抗体)、RNAi分子(例えば、抗PD−1 RNAi分子、抗PD−L1 RNAi、および抗PD−L2 RNAi)、アンチセンス分子(例えば、抗PD−1アンチセンスRNA、抗PD−L1アンチセンスRNA、および抗PD−L2アンチセンスRNA)、ドミナントネガティブタンパク質(例えば、ドミナントネガティブPD−1タンパク質、ドミナントネガティブPD−L1タンパク質、およびドミナントネガティブPD−L2タンパク質)、および低分子インヒビターが挙げられる。抗体としては、モノクローナル抗体、ヒト化抗体、脱免疫抗体(deimmunized antibody)、およびIg融合タンパク質が挙げられる。例示の抗PD−L1抗体としては、クローンEH12が挙げられる。
【0010】
PD−1発現またはPD−1活性を減少させる化合物に加えて、処置される被験体はまた、アジュバントまたはプライムブースト注射(prime booster shot)を含んでも含まなくてもよいワクチンを投与され得る。必要に応じて、上記被験体は、第2の化合物(例えば、抗ウイルス化合物(例えば、ビダラビン、アシクロビル、ガンシクロビル、バルガンシクロビル)、ヌクレオシドアナログ逆転写酵素インヒビター(NRTI)(例えば、AZT(ジドブジン)、ddI(ジダノシン)、ddC(ザルシタビン)、d4T(スタブジン)、または3TC(ラミブジン))、非ヌクレオシド逆転写酵素インヒビター(NNRTI)(例えば、ネビラピンまたはデラビルジン)、プロテアーゼインヒビター(例えば、サキナビル、リトナビル、インジナビル、またはネルフィナビル)、リバビリン、およびインターフェロン)、抗細菌化合物、抗真菌化合物、抗寄生虫化合物、抗炎症性化合物、抗腫瘍性化合物または鎮痛剤)を投与される。上記第2の化合物はまた、細胞傷害性Tリンパ球抗原4(CTLA−4)またはBリンパ球およびTリンパ球のアテニュエーター(B and T lymphocyte attenuator)(BTLA)の発現または活性を減少させる化合物であり得る。上記被験体に投与され得る他の例示の化合物は、抗CTLA−4抗体、抗BTLA抗体、抗CD28抗体、抗ICOS抗体、抗ICOS−L抗体、抗B7−1抗体、抗B7−2抗体、抗B7−H3抗体、および抗B7−H4抗体である。
【0011】
本発明は、PD−1ポリペプチドの活性または発現を調節する候補化合物を同定するための方法をさらに提供し、その方法は、以下の工程を含む:(a)PD−1遺伝子(例えば、PD−1融合遺伝子)を発現する細胞と候補化合物とを接触させる工程;(b)上記細胞におけるPD−1の発現または活性を測定する工程(例えば、PD−1 mRNAまたはPD−1タンパク質の発現を測定することによって);および(c)上記化合物と接触させていないコントロール細胞におけるこのような発現または活性と比較して、上記細胞におけるPD−1の発現または活性を比較する工程。PD−1の発現または活性の増大または減少は、上記候補化合物がPD−1ポリペプチドの活性または発現を調節するのに有用であることを示す。
【0012】
あるいは、上記スクリーニング方法は、以下の工程を包含し得る:(a)PD−1遺伝子を過剰発現するT細胞と候補化合物とを接触させる工程;および(b)上記T細胞の細胞傷害活性を決定する工程;(c)上記T細胞の細胞傷害活性を、上記化合物と接触させていないコントロール細胞におけるこのような活性に対して比較する工程。このような活性の増大または減少により、上記候補化合物がPD−1ポリペプチドの活性または発現を調節するのに有用であると同定される。細胞傷害活性は、サイトカイン産生、T細胞増殖、およびウイルスクリアランスを含む。
【0013】
本発明は、以下の工程を包含するスクリーニング方法をさらに提供する:(a)PD−1ポリペプチドと候補化合物とを接触させる工程;(b)上記候補化合物が上記PD−1ポリペプチドと相互作用するか否かを決定する工程;および(c)候補化合物を、PD−1の発現または活性を調節するのに有用であると同定する工程。望ましくは、同定された候補化合物は、PD−1ポリペプチドと相互作用し、そしてその候補化合物は、PD−1の活性を減少させる。
【0014】
本明細書中に記載されるスクリーニング方法によって同定された候補化合物は、PD−1とPD−L1との間の相互作用またはPD−1とPD−L2との間の相互作用を減少させ得る。本明細書中に記載されるあらゆるスクリーニング方法において使用される細胞としては、哺乳動物細胞(例えば、げっ歯類細胞またはヒト細胞)が挙げられる。上記細胞は、T細胞などの免疫細胞である。望ましくは、このようなスクリーニング方法において使用されるPD−1ポリペプチドは、ヒトPD−1ポリペプチドである。
【0015】
被験体を、持続感染または癌を有するか、あるいは持続感染または癌を有する危険性があると診断する方法がまた、本明細書中で提供され、その方法は、以下の工程を包含する:(a)被験体由来の免疫細胞(例えば、T細胞またはB細胞)を含むサンプルを提供する工程、および(b)サンプル中のPD−1の発現または活性を測定する工程。コントロールサンプルにおけるPD−1の発現または活性と比較したPD−1の発現または活性の増大により、上記被験体が、持続感染または癌を有するか、持続感染または癌を有する危険性があると同定される。望ましくは、工程(b)は、抗原(例えば、ウイルス抗原、細菌抗原、寄生虫抗原、または真菌抗原)特異的免疫細胞を同定することを包含する。
【0016】
持続感染または癌を有するか、あるいは持続感染または癌を有する危険性がある被験体に対する処置を選択する方法もまた、記載される。この方法は、以下の工程を包含する:(a)被験体由来の免疫細胞(例えば、T細胞またはB細胞)を含むサンプルを提供する工程;ならびに(b)上記免疫細胞におけるPD−1の発現または活性を測定する工程であって、コントロールサンプルにおけるPD−1の発現または活性と比較したPD−1の発現または活性の増大により、持続感染または癌を有するか、あるいは持続感染または癌を有する危険性がある被験体が同定される、工程;および(c)持続感染または癌を有するか、あるいは持続感染または癌を有する危険性があると診断された被験体に対する処置を選択する工程であって、その処置が、PD−1の発現または活性を減少させる化合物を含む、工程。望ましくは、工程(b)は、抗原(例えば、ウイルス抗原、細菌抗原、寄生虫抗原、または真菌抗原)特異的免疫細胞を同定することを包含する。
【0017】
被験体に由来するサンプルとしては、血液サンプル、組織生検、および骨髄サンプルが挙げられる。さらに、コントロール細胞は、持続感染を有さないか、または持続感染を有する危険性がない被験体に由来し得る。
【0018】
本発明は、以下を含む組成物をさらに提供する:(a)PD−1のレベルまたは活性を減少させる化合物;および(b)第2の化合物(例えば、抗ウイルス化合物、抗細菌化合物、抗真菌化合物、抗寄生虫化合物、抗炎症性化合物、鎮痛剤、抗CTLA−4抗体、抗BTLA抗体、抗CD28抗体、抗ICOS抗体、抗ICOS−L抗体、抗B7−1抗体、抗B7−2抗体、抗B7−H3抗体、または抗B7−H4抗体)。
【0019】
本発明はまた、以下を備えるキットを提供する:(a)PD−1のレベルまたは活性を減少させる化合物;および(b)被験体に対する上記化合物の送達についての説明書。あるいは、上記キットは、以下を備える:(a)PD−1のレベルまたは活性を減少させる第1の化合物;(b)第2の化合物(例えば、抗ウイルス化合物、抗細菌化合物、抗真菌化合物、抗寄生虫化合物、抗炎症性化合物、鎮痛剤、抗CTLA−4抗体、抗BTLA抗体、抗CD28抗体、抗ICOS抗体、抗ICOS−L抗体、抗B7−1抗体、抗B7−2抗体、抗B7−H3抗体、または抗B7−H4抗体);ならびに(c)被験体に対する上記第1の化合物および上記第2の化合物の送達についての説明書。
【0020】
本発明は、持続感染の処置、予防、および減少、あるいは、持続感染の1種以上の症状の軽減に関して、標準的な治療を上回る顕著な利益を提供する。PD−1のレベルまたは活性を減少させる治療剤の投与は、CD8+ T細胞の細胞傷害性を増大させ、次に、持続感染を確立する能力を有する感染因子に対する免疫応答を増大させる。さらに、本発明によって提供される候補化合物スクリーニング方法は、単に症状を緩和するよりもむしろ損傷プロセスを改変する新規治療の同定を可能にする。
【0021】
他に定義されない限り、本明細書中で使用される全ての技術用語および科学用語は、本発明が属する分野の当業者によって一般的に認識される意味と同じ意味を有する。本明細書中に記載されるものと同様かまたは等価である方法および材料が、本発明の実施または試験において使用され得るが、適切な方法および材料は、下に記載される。本明細書中で言及される全ての刊行物、特許出願、特許、および他の参考文献は、その全体が参考として援用される。矛盾する場合において、定義を含む本明細書が、支配する。さらに、材料、方法、および実施例は、単なる例示であり、そしてそれらは、限定することを意図しない。
【0022】
本発明の他の特徴および利点は、添付の詳細な説明および特許請求の範囲から明らかである。
【図面の簡単な説明】
【0023】
【図1A】図1Aは、遺伝子アレイ分析によって測定した場合の、ナイーブのトランスジェニックマウス、リンパ球脈絡髄膜炎ウイルス(LCMV)Armstrong免疫(感染の約30日後)感染マウス、またはCD4枯渇LCMV−Cl−13感染マウス(感染の約30日後)に由来するDbGP33−41特異的T細胞および/またはDbGP276−286特異的T細胞のPD−1 mRNAのレベルを示す棒グラフである。
【図1B】図1Bは、LCMV Armstrong免疫感染マウスおよびCD4枯渇LCMV−Cl−13感染マウスにおける感染の約60日後のCD8+ テトラマー+ T細胞上のPD−1表面発現を示すフローサイトメトリー実験の一連の画像である。アネルギー性CD8+ T細胞は、LCMV−Cl−13ウイルスによる慢性感染の約60日後(「慢性」と標識される)において細胞表面上に高レベルのPD−1ポリペプチドを発現するが、ウイルス特異的CD8+ T細胞は、急性LCMV Armstrong感染のクリアランス後(「免疫」と標識される)に、PD−1ポリペプチドを発現しない。
【図1C】図1Cは、慢性感染しているマウスおよび慢性感染していないマウスに由来する脾臓細胞上のPD−L1の存在を示すフローサイトメトリー実験の一連の画像である。それは、PD−L1発現が上記ウイルスに感染した脾臓細胞上において最も高いことを示す。
【図2A】図2Aは、Cl−13感染マウスが感染の23〜37日後に処置される場合に、未処置のコントロールと比較して、DbNP396−404特異的CD8T細胞およびDbGP33−41特異的CD8T細胞の数が約3倍増加したことを示す一連の散布図である。機能における任意の変化を決定するために、IFN−γ産生およびTNF−α産生は、8種の異なるLCMVエピトープに対する応答において測定された。
【図2B】図2Bは、全ての公知のCD8 T細胞特異性が測定される場合に、LCMV特異的CD8 T細胞の総数が2.3倍増加することを示す散布図である。
【図2C】図2Cは、8種の異なるLCMVエピトープに対する応答におけるIFN−γ産生およびTNF−α産生を示す一連のフローサイトメトリーのグラフである。
【図2D】図2Dは、処置マウス中のより多くのウイルス特異的なCD8 T細胞がTNF−αを産生する能力を有することを示す散布図である。
【図2E】図2Eは、PD−L1遮断がまた脾臓、肝臓、肺および血清における増大したウイルス制御をもたらしたことを示す一連の棒グラフである。
【図3A】図3Aは、感染の46〜60日後に抗PD−L1によって処置されたCD4枯渇Cl−13感染マウス(「αPD−L1」と標識される)対コントロール(「untx」と標識される)における、DbGP33−41特異的CD8+ T細胞およびDbGP276−286特異的CD8+ T細胞(「GP33」および「GP276」と標識される)の増加を示すグラフであり、これは、抗PD−L1によって処置されたマウスが、処置していないマウスよりも、DbGP276−286特異的な脾性CD8+ T細胞を約7倍多く含み、そしてDbGP33−41特異的な脾性CD8+ T細胞を約4倍多く含んだことを示す。
【図3B】図3Bは、感染の46〜60日後に抗PD−L1によって処置されたCD4枯渇Cl−13感染マウス(「αPD−L1 Tx」と標識される)の脾臓 対 コントロール(「untx」と標識される)の脾臓における、DbGP33−41特異的CD8+ T細胞およびDbGP276−286特異的CD8+ T細胞の増加した頻度を示す一連の画像である。
【図3C】図3Cは、BrdU取り込みおよびKi67発現によって測定した場合の、抗PD−L1処置マウスにおけるDbGP276−286特異的CD8+ T細胞の増大した増殖を示す一連の画像である。
【図3D】図3Dは、脾臓におけるDbGP276−286特異的CD8+ T細胞と比較して末梢血単核細胞(PBMC)におけるDbGP276−286特異的CD8+ T細胞を比較することによって示されるように、高レベルのCD8+ T細胞増殖を有するマウスがPBMCにおける評価可能な応答を実証することを示すチャートである。
【図4A】図4Aは、コントロールと比較して、抗PD−L1処置マウス中のIFN−γを産生するDbGP276−286特異的CD8+ T細胞およびDbGP33−41特異的CD8+ T細胞の増加を示す一連のチャートである。DbNP396−404特異的CD8+ T細胞、KbNP205−212特異的CD8+ T細胞、DbNP166−175特異的CD8+ T細胞、およびDbGP92−101特異的CD8+ T細胞のより高い頻度は、抗PD−L1処置マウスにおいて検出された。
【図4B】図4Bは、コントロールマウス中では20%のDbGP276−286特異的CD8+ T細胞がIFN−γを産生することと比較して、抗PD−L1処置マウスにおいては50%のDbGP276−286特異的CD8+ T細胞がIFN−γを産生することを示すチャートである。
【図4C】図4Cは、抗PD−L1処置慢性感染マウスが未処置の慢性感染マウスよりも高いレベルのTNF−αを産生するが、LCMV Armstrongウイルスに感染した免疫マウスよりも依然として低いレベルのTNF−αを産生することを示す一連の画像である。
【図4D】図4Dは、51Cr放出アッセイを使用して測定したところ、抗PD−L1によるLCMV−Cl−13感染マウスの処置が、未処置の感染マウスと比較してウイルス特異的T細胞のエキソビボ細胞溶解活性を回復させることを示すチャートである。
【図4E】図4Eは、α−PD−L1によって処置されたLCMV−Cl−13感染マウスの処置後の種々の器官におけるウイルス力価の減少を示す一連のチャートである。ウイルス力価は、抗PD−L1処置の2週間後に、未処置マウスと比較して、脾臓において約3倍、肝臓において約4倍、肺において約2倍、そして血清において約2倍減少した。
【図5A】図5Aは、慢性のクレードC型HIV感染において標的化された優性のエピトープに特異的な10のHIVテトラマーを使用したPD−1表面発現を示すフローサイトメトリー実験の一連の画像である。%は、PD−1+であるテトラマー+細胞の%を示す。
【図5B】図5Bは、PD−1の%およびMFIが、抗レトロウイルス治療ナイーブの個体における全CD8 T細胞集団と比較して、HIV特異的CD8 T細胞において有意にアップレギュレートされ(p<0.0001)、そしてPD−1がHIV感染 対 HIV血清反応陰性コントロールにおける全CD8 T細胞集団において増加した(それぞれ、p=0.0033およびp<0.0001)ことを示す一連のチャートである。65のHIV感染個体および11のHIV血清反応陰性コントロールに由来する120のHIVテトラマー染色が、この分析に含められた。
【図5C】図5Cは、テトラマー+細胞上のPD−1発現の中央値%およびMFIをエピトープ特異性によって示す一連のチャートである。
【図5D】図5Dは、複数の検出可能な応答を有する個体内の異なるエピトープ特異的集団におけるPD−1+細胞の%のバリエーションを示すチャートである。水平のバーは、各個体におけるPD−1+ HIVテトラマー+細胞の中央値%を示す。
【図6A】図6Aは、(テトラマー染色によって測定した)HIV特異的CD8 T細胞の数と血漿ウイルス量との間には相関がないのに対し、テトラマー+細胞上のPD−1の%およびMFIの両方と血漿ウイルス量との間に正の相関があること(それぞれ、p=0.0013およびp<0.0001)を示す一連のチャートである。
【図6B】図6Bは、HIVテトラマー+細胞の数とCD4数との間には相関がないのに対し、HIVテトラマー+細胞上のPD−1の%およびMFIとCD4数との間に逆の相関があること(それぞれ、p=0.0046およびp=0.0150)を示す一連のチャートである。
【図6C】図6Cは、全CD8 T細胞集団上のPD−1の%およびMFIが血漿ウイルス量と正に相関すること(それぞれ、p=0.0021およびp<0.0001)を示す一連のチャートである。
【図6D】図6Dは、全CD8 T細胞集団上のPD−1発現の%およびMFIがCD4数と逆に相関すること(それぞれ、p=0.0049およびp=0.0006)を示す一連のチャートである。
【図7A】図7Aは、B*4201 TL9特異的CD8 T細胞の98%がPD−1+である被験体SK222由来のB*4201 TL9特異的CD8 T細胞の代表的な表現型の染色を示すフローサイトメトリー実験の一連の画像である。
【図7B】図7Bは、HIV特異的CD8 T細胞の>95%がPD−1+である者由来の表現型データのまとめを示すチャートである。7〜19人のサンプルが、示された表現型マーカーの各々について分析された。水平のバーは、示されたマーカーに対して陽性であったテトラマー+ PD−1+細胞の中央値%を示す。
【図8A】図8Aは、B*4201陽性被験体からの代表的な増殖アッセイデータを示すフローサイトメトリー実験の一連の画像である。ペプチドによる6日間の刺激の後、B*4201 TL9特異的CD8 T細胞の%は、抗PD−L1遮断抗体の存在下で5.7%から12.4%まで増加した。
【図8B】図8Bは、抗PD−L1遮断抗体の存在下におけるHIV特異的CD8 T細胞の増殖の有意な増大を示すまとめの増殖アッセイデータを示す線グラフである(n=28、p=0.0006、対t検定)。
【図8C】図8Cは、個々の患者に基づくHIV特異的CD8 T細胞の増殖に対するPD−1/PD−L1遮断の示差的効果を示す棒グラフである。白色のバーは、ペプチド単独の存在下におけるテトラマー+細胞の増加倍率を示し、黒色のバーは、ペプチドに加えて抗PD−L1遮断抗体の存在下におけるテトラマー+細胞の増加倍率を示す。CFSEアッセイが1種以上のエピトープについて行なわれた個体は、アスタリスク、四角、または三角の記号によって示される。
【発明を実施するための形態】
【0024】
(詳細な説明)
最近数十年間における抗生物質およびワクチンの使用は、微生物感染に起因する死亡率を顕著に減少させている。しかし、抗微生物治療様式の成功は、宿主生物体の免疫系を回避し、次に持続感染を確立する特定の感染因子の能力によって制限されている。例えば、肝炎およびHIVなどのウイルスに対して惹起される免疫応答は、感染因子を除去するのに十分ではなく、その感染因子は、感染した被験体に残存する。このような感染において、抗原特異的CD8+ T細胞は、感染因子に対して機能的に寛容性(「アネルギー」または「疲弊(exhaustion)」として公知である)になる。アネルギー性T細胞は、それらの細胞傷害活性(すなわち、それらのサイトカインを産生する能力、増殖する能力、および感染因子を除去する能力)を失う。
【0025】
本発明は、T細胞アネルギーが、PD−1発現の誘導と同時に生じること、およびPD−1発現が特定の型のリンパ増殖性障害と相関するという驚くべき知見に基づく。したがって、本発明は、T細胞と、PD−1、PD−1リガンド(PD−L1)またはPD−1リガンド2(PD−L2)の発現または活性を減少させる薬剤とを接触させることによってT細胞の細胞傷害性を増大させる方法を提供する。より具体的には、本発明は、被験体に、PD−1の発現または活性を減少させる薬剤を投与することによって持続感染またはリンパ増殖性障害(例えば、血管免疫芽球性リンパ腫および結節性リンパ球優勢型ホジキンリンパ腫などの癌)を処置または予防する方法を提供する。PD−1、PD−L1またはPD−L2の発現または活性の減少は、細胞傷害性T細胞の活性の増大をもたらし、感染因子に対する特異的な免疫応答を増大させる。本明細書中で提供される結果は、抗プログラム細胞死リガンド−1(PD−L1)遮断抗体を持続的に感染したマウスへと投与することがアネルギー性T細胞の細胞傷害活性を増大させたことを示す。具体的には、PD−1シグナリングの途絶は、アネルギー性CD8+ T細胞の増殖、増強されたサイトカイン産生、および増大したウイルスクリアランスを誘導する:さらに、CD4枯渇マウスの持続感染の間に産生されたCD8+ T細胞は、抗PD−L1処置の際に、増殖しかつそれらのかなりの機能を取り戻していた。
【0026】
T細胞が外来タンパク質に対して応答するためには、2つのシグナルが、抗原提示細胞(APC)によって休止Tリンパ球に与えられる必要がある。免疫応答についての特異性を与える第1のシグナルは、主要組織適合遺伝子複合体(MHC)の構成(context)において提示される外来抗原ペプチドの認識後に、T細胞レセプター(TCR)を介して伝達される。補助刺激と称される第2のシグナルは、増殖しかつ機能性になるT細胞を誘導する。補助刺激は、抗原特異的でも、MHCにも拘束されず、そして補助刺激は、APCによって発現される1種以上の異なる細胞表面ポリペプチドによって提供される。T細胞が、さらなる補助刺激シグナルを受容することなくT細胞レセプターによってのみ刺激される場合、それらは、応答しなくなるか、アネルギー性になるか、または死に、免疫応答の下方調節(downmodulation)をもたらす。
【0027】
APC上に発現されるCD80(B7−1)タンパク質およびCD86(B7−2)タンパク質は、重要な補助刺激ポリペプチドである。B7−2が、一次免疫応答の間に優勢な役割を果たす一方で、B7−1は、免疫応答の過程の後期にアップレギュレートされて一次T細胞応答を延長するかまたは二次的T細胞応答を補助刺激する。B7ポリペプチドは、免疫細胞に対して補助刺激シグナルまたは阻害性シグナルを提供して免疫細胞応答を促進または阻害し得る。例えば、補助刺激レセプターに結合した場合、PD−L1(B7−4)は、免疫細胞の補助刺激を誘導するか、または可溶性形態で存在する場合に免疫細胞補助刺激を阻害する。阻害性レセプターに結合した場合、B7−4分子は、阻害性シグナルを免疫細胞に対して伝達し得る。例示のB7ファミリーメンバーとしては、B7−1、B7−2、B7−3(抗体BB−1によって認識される)、B7h(PD−L1)、およびB7−4ならびにそれらの可溶性フラグメントまたは誘導体が挙げられる。B7ファミリーメンバーは、免疫細胞上の1種以上のレセプター(例えば、CTLA4、CD28、ICOS、PD−1および/または他のレセプター)に結合し、そしてB7ファミリーメンバーは、そのレセプターに依存して、阻害性シグナルまたは補助刺激シグナルを免疫細胞に対して伝達する能力を有する。
【0028】
CD28は、休止T細胞上に構成的に発現されるレセプターである。T細胞レセプターを介したシグナリングの後、CD28の連結および補助刺激シグナルの伝達は、IL−2を増殖および分泌するT細胞を誘導する。CTLA4(CD152)(CD28と相同なレセプター)は、休止T細胞上に存在しないが、CTLA4(CD152)の発現は、T細胞の活性化後に誘導される。CTLA4は、T細胞応答のネガティブな調節において役割を果たす。ICOS(CD28およびCTLA4に関連するポリペプチド)は、IL−10産生に関与する。PD−1(PD−L1およびPD−L2が結合するレセプター)はまた、T細胞の表面上に迅速に誘導される。PD−1はまた、B細胞の表面上(抗IgMに対する応答において)、ならびに胸腺細胞および骨髄性細胞のサブセットにおいて発現される。
【0029】
PD−1の結合(engagement)(例えば、架橋または凝集による)は、免疫細胞において阻害性シグナルの伝達をもたらし、免疫細胞アネルギーの増大と同時に生じる免疫応答の減少を生じる。PD−1ファミリーメンバーは、抗原提示細胞上の1種以上のレセプター(例えば、PD−L1およびPD−L2)に結合する。
【0030】
PD−L1およびPD−L2(これらの両方は、ヒトPD−1リガンドポリペプチドである)は、上記B7ファミリーのポリペプチドのメンバーである。各PD−1リガンドは、シグナル配列、IgVドメイン、IgCドメイン、膜貫通ドメイン、および短い細胞質テール(cytoplasmic tail)を含む。これらのリガンドは、胎盤、脾臓、リンパ節、胸腺、および心臓において発現される。PD−L2はまた、膵臓、肺、および肝臓において発現されるが、PD−L1は、胎児肝臓、活性化T細胞および内皮細胞において発現される。両方のPD−1リガンドは、活性化単球および樹状細胞においてアップレギュレートされる。
【0031】
(定義)
本明細書中で使用される場合、「持続感染」によって、感染因子(例えば、ウイルス、細菌、寄生虫、マイコプラズマ、または真菌)が免疫応答の誘導後でさえも、感染した宿主から除去または排除されていない感染が意味される。持続感染は、慢性感染、潜在性感染、または遅発性感染であり得る。急性感染は、比較的短期間(数日間〜数週間持続する)であり、そして免疫系によって身体から消散され、一方で、持続感染は、数ヶ月間、数年間、または一生にわたってでさえ持続し得る。これらの感染はまた、長期間の間に頻繁に再発し得、細胞の殺傷または宿主細胞に対する過剰な損傷さえも伴わない無症候性かつ増殖性の感染の段階を含む。原因である感染因子はまた、免疫応答が解消した後でさえ、標準的な技術を使用して宿主(例えば、感染した個体の内部の特定の細胞)において検出され得る。哺乳動物は、当該分野において公知である任意の標準的な方法および例えば、米国特許第6,368,832号、同第6,579,854号、および同第6,808,710号ならびに米国特許出願第20040137577号、同第20030232323号、同第20030166531号、同第20030064380号、同第20030044768号、同第20030039653号、同第20020164600号、同第20020160000号、同第20020110836号、同第20020107363号、および同第20020106730号(これらの全ては、本明細書によって参考として援用される)に記載される任意の標準的な方法に従って、持続感染を有すると診断される。例えば、被験体は、PCR分析を使用したこの個体からの生物学的サンプルにおけるクラミジア種の検出後に、持続性クラミジア感染を有すると診断され得る。哺乳動物は、本発明によって処置されるべき持続感染と診断されていない必要がない。持続感染を確立し得る微生物因子としては、ウイルス(例えば、パピローマウイルス、肝炎ウイルス、ヒト免疫不全ウイルス、およびヘルペスウイルス)、細菌(例えば、Escherichia coliおよびクラミジア属の種)、寄生虫(例えば、プラスモディウム属、リーシュマニア属の種、住血吸虫属の種、トリパノソーマ属の種、トキソプラスマ属の種)および真菌が挙げられる。
【0032】
「持続感染の症状を軽減すること」によって、持続感染が生じる前後における持続感染に関連した任意の状態または症状を改善することが意味される。あるいは、持続感染の症状を軽減することは、被験体中の感染性微生物(例えば、ウイルス、細菌、真菌、マイコプラズマ、または寄生虫)量を、未処置のコントロールにおけるこのような量に比較して減少させることを含み得る。対応する未処置のコントロールと比較して、このような減少または予防の程度は、任意の標準的な技術によって測定される場合、少なくとも5%、10%、20%、40%、50%、60%、80%、90%、95%、または100%である。望ましくは、上記持続感染は、当該分野において公知である任意の標準的な方法によって検出される場合、完全に除去され、この場合、持続感染が、処置されたと見なされる。持続感染について処置されるべきである患者は、医師がこのような状態を有すると診断した患者である。診断は、任意の適切な手段によるものであり得る。診断およびモニタリングは、例えば、生物学的サンプル(例えば、組織生検、血液検査、または尿検査)における微生物量のレベルを検出すること、生物学的サンプルにおける微生物感染の代用マーカーのレベルを検出すること、持続感染と関連した症状を検出すること、または持続感染の代表的な免疫応答に関与する免疫細胞を検出すること(例えば、アネルギー性である抗原特異的T細胞の検出)を含み得る。持続感染の発症が予防されている患者は、このような診断を受けていても受けていなくてもよい。当業者は、これらの患者が、上に記載されるものと同じ標準的な試験に供された可能性があるか、または1種以上の危険因子(例えば、家族歴または感染因子に対する曝露)の存在に起因する高い危険性があると検査なしで同定されている可能性があることを、理解する。
【0033】
本明細書中で使用される場合、「PD−1」によって、PD−L1タンパク質またはPD−L2タンパク質との複合体を形成し、したがって免疫応答(例えば、T細胞の補助刺激)に関与するポリペプチドが、意味される。本発明のPD−1タンパク質は、天然に存在するPD−1(例えば、Ishidaら、EMBO J.11:3887−3895、1992、Shinoharaら、Genomics 23:704−706、1994;および米国特許第5,698,520号(本明細書中に参考として援用される)を参照のこと)と実質的に同一である。PD−1シグナリングは、T細胞増殖、サイトカイン産生、またはウイルスクリアランスを減少させることによって、例えば、CD8+ T細胞の細胞傷害性を減少させ得る。本発明に従って、上記PD−1ポリペプチドは、任意の標準的な方法によって測定される場合、CD8+ T細胞の細胞傷害活性を、コントロールレベルの少なくとも5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、または100%超低くに減少させる。
【0034】
「PD−1遺伝子」によって、PD−1タンパク質をコードする核酸が意味される。
【0035】
「PD−1融合遺伝子」によって、第2の異種核酸配列に作動可能に連結されたPD−1プロモーターおよび/またはPD−1コード領域全体もしくはその一部が意味される。好ましい実施形態において、上記第2の異種核酸配列は、レポーター遺伝子(すなわち、その遺伝子の発現がアッセイされ得る遺伝子)である;レポーター遺伝子としては、グルクロニダーゼ(GUS)をコードする遺伝子、ルシフェラーゼをコードする遺伝子、クロラムフェニコールトランスアセチラーゼ(CAT)をコードする遺伝子、緑色蛍光タンパク質(GFP)をコードする遺伝子、アルカリホスファターゼをコードする遺伝子、およびβ−ガラクトシダーゼをコードする遺伝子が挙げられるが、これらに限定されない。
【0036】
「PD−1の発現または活性を減少させる」によって、未処置のコントロールにおけるPD−1のレベルまたは生物学的活性と比較してPD−1のレベルまたは生物学的活性を減少させることが意味する。本発明にしたがって、このような活性またはレベルは、未処置のコントロールと比較して少なくとも10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、または100%よりもさらに大きく減少する。例えば、PD−L1、PD−L2、またはその両方に対するPD−1の結合が減少する場合、PD−1の生物学的活性は減少し、それによってPD−1シグナリングの減少が生じ、したがってCD8+ T細胞の細胞傷害性の増大を生じる。本明細書中で使用される場合、PD−1ポリペプチドに関する用語「活性」は、天然に存在するPD−1タンパク質に固有である任意の活性(例えば、天然のリガンドを抗原提示細胞に結合することによって活性化免疫細胞において阻害性シグナルを調節する能力)を含む。免疫細胞における阻害性シグナルのこのような調節は、増殖の調節および/または免疫細胞によるサイトカイン分泌を生じる。PD−1はまた、B7分子の結合について補助刺激レセプターと競合することによって補助刺激シグナルを調節し得る。したがって、用語「PD−1活性」は、PD−1ポリペプチドの天然のリガンドを結合するPD−1ポリペプチドの能力、免疫細胞補助刺激シグナルまたは免疫細胞阻害性シグナルを調節する能力、および免疫応答を調節する能力を含む。したがって、PD−1活性を減少させることは、PD−L1またはPD−L2に対するPD−1の相互作用を減少させることを含む。これは、例えば、PD−L1またはPD−L2を遮断することによって達成され得る。
【0037】
「免疫細胞」によって、造血起源の細胞であって、免疫応答において役割を果たす細胞が、意味される。免疫細胞としては、リンパ球(例えば、B細胞およびT細胞)、ナチュラルキラー細胞、および骨髄性細胞(例えば、単球、マクロファージ、好酸球、肥満細胞、好塩基球、および顆粒球)が挙げられる。
【0038】
「T細胞」によって、CD4+ T細胞またはCD8+ T細胞が意味される。用語「T細胞」は、TH1細胞およびTH2細胞の両方を含む。用語「T細胞の細胞傷害」は、CD8+ T細胞の活性化によって媒介される任意の免疫応答を含む。例示の免疫応答としては、サイトカイン産生、CD8+ T細胞増殖、グランザイムまたはパーフォリンの産生、および感染因子のクリアランスが挙げられる。
【0039】
「無応答性」によって、刺激(例えば、活性化レセプターおよびサイトカインを介する刺激)に対する免疫細胞の不応性(refractivity)が含まれる。無応答性は、例えば、免疫抑制剤に対する曝露または高用量の抗原に対する曝露に起因して起こり得る。本明細書中で使用される場合、用語「アネルギー」または「免疫寛容」は、活性化レセプター媒介性の刺激に対する不応性を含む。このような不応性は、一般に、抗原特異的であり、そして寛容化する抗原に対する曝露が途絶えた後に持続する。例えば、T細胞におけるアネルギー(無応答性とは対照的である)は、サイトカイン産生(例えば、IL−2)の欠如によって特徴付けられる。T細胞アネルギーは、T細胞が、抗原に曝され、そして第1のシグナル(T細胞レセプターまたはCD−3媒介性のシグナル)を第2のシグナル(補助刺激シグナル)の非存在下で受容する場合に生じる。これらの条件下で、同じ抗原に対するその細胞の再曝露(再曝露が、補助刺激分子の存在下で起きる場合でさえも)は、サイトカインが産生されないことをもたらし、したがって増殖のないことをもたらす。しかし、アネルギー性T細胞は、無関係の抗原に対する応答を惹起し得、そしてサイトカイン(例えば、IL−2)と一緒に培養した場合に、増殖し得る。例えば、T細胞アネルギーはまた、ELISAによってか、または指標の細胞株を使用する増殖アッセイによって測定される場合、Tリンパ球によるIL−2産生の欠如によって観察され得る。あるいは、レポーター遺伝子構築物が、使用され得る。例えば、アネルギー性T細胞は、5’IL−2遺伝子エンハンサーの制御下での異種プロモーターによって、またはそのエンハンサー内に見出され得るAP1配列のマルチマーによって誘導されるIL−2遺伝子転写を、開始し損なう(Kangら、Science 257:1134、1992)。アネルギー性の抗原特異的T細胞は、対応するコントロールの抗原特異的T細胞と比較して、細胞傷害活性において少なくとも10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、または100%でさえありうる減少を有し得る。
【0040】
「精製された抗体」によって、その抗体が天然に付随するタンパク質および天然に存在する有機分子のうちの少なくとも60重量%を含まない抗体が、意味される。好ましくは、その調製物は、少なくとも75重量%、より好ましくは90重量%、および最も好ましくは少なくとも99重量%の抗体(例えば、PD−1特異的抗体、PD−L1特異的抗体、またはPD−L2特異的抗体)である。精製された抗体は、例えば、組換えで産生されたタンパク質または保存されたモチーフペプチドを使用したアフィニティークロマトグラフィーおよび標準的な技術によって得られ得る。
【0041】
「特異的に結合する」によって、抗原(例えば、PD−1ポリペプチド、PD−L1ポリペプチド、またはPD−L2ポリペプチド)を認識および結合するが、タンパク質を天然に含むサンプル(例えば、生物学的サンプル)中の他の非抗原分子を実質的に認識および結合しない抗体が、意味される。好ましい抗体は、米国特許第6,808,710号ならびに米国特許出願第20040137577号、同第20030232323号、同第20030166531号、同第20030064380号、同第20030044768号、同第20030039653号、同第20020164600号、同第20020160000号、同第20020110836号、同第20020107363号、および同第20020106730号(これらの全ては、本明細書によって参考として援用される)において開示されるPD−1ポリペプチド、PD−L1ポリペプチド、またはPD−L2ポリペプチドに結合する。
【0042】
「中和抗体」によって、PD−1ポリペプチドの任意の生物学的活性(特に、PD−1ポリペプチドの、免疫応答(例えば、T細胞の細胞傷害)を減少させる能力)を妨げる抗体が、意味される。中和抗体は、PD−1ポリペプチドの、免疫応答を減少させる能力を、好ましくは50%、より好ましくは70%、および最も好ましくは90%以上減少させ得る。免疫応答を測定するための任意の標準的なアッセイ(本明細書中に記載されるものを含む)は、潜在的中和抗体を評価するために使用され得る。
【0043】
タンパク質またはポリペプチドについて言及する場合、「実質的に同一である」によって、参照アミノ酸配列に対して少なくとも75%の同一性を示すが、好ましくは85%の同一性、より好ましくは90%の同一性、最も好ましくは95%、または99%でさえありうる同一性を示すタンパク質またはポリペプチドが、意味される。タンパク質またはポリペプチドに関して、比較配列の長さは、一般に、少なくとも20アミノ酸、好ましくは少なくとも30アミノ酸、より好ましくは少なくとも40アミノ酸、そして最も好ましくは50アミノ酸であるか、または完全長タンパク質もしくは完全長ポリペプチドである。それぞれの「実質的に同一である」タンパク質またはポリペプチドをコードする核酸は、「実質的に同一である」核酸の例を構成する;その核酸はそれらのタンパク質またはポリペプチドをコードするあらゆる配列(遺伝暗号の縮重に起因する)を含むことが、認識される。さらに、「実質的に同一である」核酸配列はまた、高ストリンジェンシー条件下で参照核酸分子にハイブリダイズするポリヌクレオチドを含む。
【0044】
「高ストリンジェンシー条件」によって、高温および低イオン強度によって特徴付けられ、そして65℃の温度で0.5M NaHPO4(pH7.2)と、7% SDSと、1mM EDTAと、1% BSA(Fraction V)とを含む緩衝液、または42℃の温度で、48%ホルムアミドと、4.8×SSCと、0.2M Tris−Cl(pH7.6)と、1×Denhardt溶液と、10%硫酸デキストランと、0.1% SDSとを含む緩衝液における、少なくとも40ヌクレオチド長のDNAプローブの使用によって生じるハイブリダイゼーションに匹敵するハイブリダイゼーションを可能にするあらゆるセットの条件が、意味される。高ストリンジェンシーハイブリダイゼーション(例えば、PCR、ノーザンハイブリダイゼーション、サザンハイブリダイゼーション、またはインサイチュハイブリダイゼーション、DNA配列決定など)についての他の条件は、分子生物学の分野の当業者に周知である。例えば、F.Ausubelら、Current Protocols in Molecular Biology、John Wiley & Sons、New York、N.Y.、1998(本明細書によって参考として援用される)を参照のこと。
【0045】
「実質的に純粋」によって、核酸、ポリペプチド、または他の分子と天然で付随している成分から分離されている、核酸、ポリペプチド、または他の分子が、意味される。代表的に、ポリペプチドは、そのポリペプチドが、それが天然に付随するタンパク質および天然に存在する有機分子のうちの少なくとも60重量%、70重量%、80重量%、90重量%、95重量%、または99重量%を含まない場合に、実質的に純粋である。例えば、実質的に純粋なポリペプチドは、天然の供給源からの抽出、通常はそのタンパク質を発現しない細胞における組換え核酸の発現、または化学合成によって得られ得る。
【0046】
用語「単離されたDNA」は、所与のDNAが得られる生物体の天然に存在するゲノムにおいてそのDNAに隣接(flank)している遺伝子を含まないDNAを意味する。したがって、用語「単離されたDNA」は、例えば、cDNA、クローニングされたゲノムDNA、および合成DNAを包含する。
【0047】
「有効量」によって、単独または組み合わせで哺乳動物において高血圧を低下させるかもしくは予防するか、または慢性感染を処置するかもしくは予防するのに必要とされる化合物の量が、意味される。活性化合物の有効量は、投与経路、被験体の年齢、体重、および一般的健康に依存して変動する。最終的に、担当する医師または獣医師が、適切な量および投薬レジメンを決定する。
【0048】
「候補化合物」によって、天然に存在するかまたは人工的に得られる化学物質が意味される。候補化合物としては、例えば、ペプチド、ポリペプチド、合成有機分子、天然に存在する有機分子、核酸分子、ペプチド核酸分子、および成分ならびにそれらの誘導体が挙げられ得る。例えば、本発明に従って有用な候補化合物は、PD−L1、PD−L2、またはその両方に対するPD−1の結合を減少させる。
【0049】
用語「薬学的組成物」は、少なくとも1つの治療的または生物学的に活性な因子を含み、そして患者に対する投与に適している、任意の組成物を意味する。任意のこれらの処方物は、当該分野の周知であって認められた方法によって調製され得る。例えば、Remington:The Science and Practice of Pharmacy、20.sup.th edition、(A R Gennaro編)、Mack
Publishing Co.、Easton、Pa.、2000を参照のこと。
【0050】
(処置する方法)
T細胞の細胞傷害は、T細胞とPD−1の発現または活性を減少させる化合物とを接触させることによって増大する。上記T細胞は、ナイーブT細胞、記憶T細胞または活性化T細胞である。あるいは、上記T細胞は、抗原特異的T細胞である。上記抗原特異的T細胞は、感染因子に対してアネルギー性または寛容性である。T細胞の細胞傷害は、細胞増殖およびサイトカイン放出の増加によって特徴付けられる。
【0051】
本方法は、種々の感染および癌の症状を軽減するのに有用である。被験体にPD−1インヒビターを投与することによって、感染または癌が、処置されるか、予防されるか、または症状が、軽減される。上記被験体は、哺乳動物(例えば、ヒト、霊長類、マウス、ラット、イヌ、ネコ、ウシ、ウマ、およびブタ)である。上記被験体は、感染に罹患しているか、または感染を発症する危険性がある。感染に罹患しているか、または感染を発症する危険性がある被験体は、特定の感染に適した標準的な方法に基づくものである。
【0052】
上記感染(例えば、細菌感染、ウイルス感染、真菌感染、マイコプラズマ感染、または寄生虫感染)は、持続感染である。持続感染は、急性感染とは対照的に、宿主免疫応答の誘導によって有効に除去されない。上記感染因子と上記免疫応答とは、感染した被験体が必ずしも症状を発現することなく長期間にわたって感染性のままであるように平衡に達する。持続感染としては、例えば、潜在性感染、慢性感染および遅発性感染が挙げられる。
【0053】
慢性感染において、上記感染因子は、身体においていつでも検出され得る。しかし、上記疾患の徴候および症状は、長期間にわたって、存在しても、存在しなくてもよい。慢性感染の例としては、B型肝炎(HBVによって引き起こされる)およびC型肝炎(HCVによって引き起こされる)、アデノウイルス、サイトメガロウイルス、エプスタイン−バーウイルス、単純ヘルペスウイルス1型、単純ヘルペスウイルス2型、ヒトヘルペスウイルス6型、水痘−帯状疱疹ウイルス、B型肝炎ウイルス、D型肝炎ウイルス、パピローマウイルス、パルボウイルスB19、ポリオーマウイルスBK、ポリオーマウイルスJC、麻疹ウイルス、風疹ウイルス、ヒト免疫不全ウイルス(HIV)、ヒトT細胞白血病ウイルスI型、およびヒトT細胞白血病ウイルスII型が挙げられる。寄生虫による持続感染は、リーシュマニア属、トキソプラスマ、トリパノソーマ属、プラスモディウム属、住血吸虫属、およびエンセファリトゾーン属による感染の結果として生じ得る。
【0054】
潜在性感染において、上記感染因子(例えば、ウイルス)は、外見的に、不活性であり、そして休止しており、その結果、上記被験体は、必ずしも徴候または症状を示さない。潜在性ウイルス感染において、上記ウイルスは、平衡状態で、症状が再び出現する前に長期間にわたって存続する;しかし、疾患の再活性化が起きるまで、実際のウイルスを検出できない。潜在性感染の例としては、HSV−1(熱性疱疹)によって引き起こされる感染、HSV−2(陰部ヘルペス)によって引き起こされる感染、およびVZV(水痘−帯状疱疹)によって引き起こされる感染が挙げられる。
【0055】
遅発性感染において、上記感染因子は、顕著な徴候または症状が観察されない非常に長い期間にわたって、次第にその数が増加する。遅発性感染の例としては、AIDS(HIV−1およびHIV−2によって引き起こされる)、動物において腫瘍を引き起こすレンチウイルス、およびプリオンが挙げられる。
【0056】
さらに、持続感染は、しばしば、急性感染の後期合併症(late complication)として生じる。例えば、亜急性硬化性汎脳炎(SSPE)は、急性麻疹感染の後に起こり得るか、または退行性の脳炎(regressive encephalitis)は、風疹感染の結果として起こり得る。
【0057】
癌としては、例えば、血管免疫芽球性リンパ腫または結節性リンパ球優勢型ホジキンリンパ腫が挙げられる。
【0058】
血管免疫芽球性リンパ腫(AIL)は、肥大したリンパ節および高ガンマグロブリン血症(血中の抗体の増加)を特徴とする攻撃的な(迅速に進行する)型のT細胞性非ホジキンリンパ腫である。他の症状は、皮疹、発熱、体重減少、陽性のクームズ試験または寝汗を含み得る。この悪性疾患は、通常、成人に起きる。患者は、通常、40〜90歳(中央値は約65歳)であり、そしてその患者は、より多くの場合、男性である。AILが進行する場合、肝脾腫大、溶血性貧血、および多クローン性高ガンマグロブリン血症が、発症し得る。皮膚は、約40〜50%の患者にかかわる。
【0059】
結節性リンパ球優勢型ホジキンリンパ腫は、変異した非機能的な免疫グロブリン遺伝子を有する胚中心B細胞に由来するようであるB細胞性新生物である。血管免疫芽球性リンパ腫と同様に、腫瘍性細胞は、濾胞性樹状細胞の網目構造に関連する。PD−1発現は、CD57+ T細胞について見られるものと同様のパターンで、結節性リンパ球優勢型ホジキンリンパ腫における腫瘍性CD20+細胞と密接に関連するT細胞において見られる。CD57は、CXCR5と一緒に、胚中心関連性T細胞の別のマーカーとして同定された(結節性リンパ球優勢型ホジキンリンパ腫における腫瘍性細胞が胚中心関連性T細胞と密接な関連を有するという結論を支持する知見である)。
【0060】
PD−1のインヒビターは、細胞におけるPD−1、PD−L1またはPD−2の発現または活性を減少させる能力を有する任意の因子である。PD−1の発現または活性は、コントロール細胞におけるこのような発現または活性と比較して、少なくとも10%、20%、30%、40%、50%、60%、70%、80%、90%、または100%減少する。上記コントロール細胞は、上記PD−1インヒビターによって処理されていない細胞である。PD−1の発現または活性は、当該分野における任意の標準的な方法(本明細書中に記載されるものを含む)によって決定される。必要に応じて、上記PD−1インヒビターは、PD−L1、PD−L2、またはその両方に対するPD−1の結合を阻害するか、または減少させる。PD−1インヒビターは、ポリペプチド、ポリヌクレオチド、低分子アンタゴニスト、またはsiRNAを含む。
【0061】
PD−1インヒビターポリペプチドとしては、例えば、PD−1の発現またはシグナリングを減少させる抗体またはそのフラグメントが挙げられる。例示の抗体としては、抗PD−1抗体、抗PD−L1抗体、抗PD−L2抗体、抗CTLA−4抗体、抗BTLA抗体、抗CD28抗体、抗ICOS抗体、抗ICOS−L抗体、抗B7−1抗体、抗B7−2抗体、抗B7−H3抗体、または抗B7−H4抗体が挙げられる。
【0062】
あるいは、上記PD−1インヒビターは、PD−1の生物学的活性(すなわち、PD−L1、PD−L2、またはその両方に対するPD−1の結合)を妨げるドミナントネガティブタンパク質またはドミナントネガティブタンパク質をコードする核酸である。ドミナントネガティブタンパク質は、そのドミナントネガティブタンパク質が対応する野生型タンパク質のうちの少なくとも10アミノ酸、20アミノ酸、35アミノ酸、50アミノ酸、100アミノ酸、または150より多くのアミノ酸に対して少なくとも50%、70%、80%、90%、95%、または99%でさえありうる配列同一性を有する配列を有する任意のアミノ酸分子である。例えば、ドミナントネガティブPD−1は、それがもはやPD−L1に結合できないような変異を有する。
【0063】
上記ドミナントネガティブタンパク質は、発現ベクターとして投与され得る。上記発現ベクターは、非ウイルスベクターまたはウイルスベクター(例えば、レトロウイルス、組換えアデノ随伴ウイルス、または組換えアデノウイルスベクター)であり得る。あるいは、上記ドミナントネガティブタンパク質は、全身的か、または例えば、マイクロインジェクション技術を使用して感染領域に対して、組換えタンパク質として直接投与され得る。
【0064】
低分子としては、ペプチド、ペプチド模倣体(peptidomimetic)(例えば、ペプトイド)、アミノ酸、アミノ酸アナログ、ポリヌクレオチド、ポリヌクレオチドアナログ、ヌクレオチド、ヌクレオチドアナログ、1モルあたり約5,000グラム未満の分子量を有する有機化合物および無機化合物(ヘテロ有機化合物および有機金属化合物を含む)、1モルあたり約2,000グラム未満の分子量を有する有機化合物および無機化合物、1モルあたり約1,000グラム未満の分子量を有する有機化合物および無機化合物、1モルあたり約500グラム未満の分子量を有する有機化合物および無機化合物、ならびにこのような化合物の塩、エステル、および他の薬学的に受容可能な形態が挙げられるが、これらに限定されない。
【0065】
上記PD−1インヒビターは、PD−1の発現または活性を標的とする、アンチセンス分子、RNA干渉(siRNA)分子、または低分子アンタゴニストである。用語「siRNA」によって、標的mRNAの翻訳を妨害する二本鎖RNA分子が意味される。siRNAを細胞に導入する標準的な技術が、使用され、その技術としては、DNAが鋳型であり、siRNAのRNAがその鋳型から転写されるものが挙げられる。上記siRNAは、センスのPD−1核酸配列、PD−L1核酸配列またはPD−L2核酸配列、アンチセンスのPD−1核酸配列、PD−L1核酸配列またはPD−L2核酸配列あるいはその両方を含む。必要に応じて、上記siRNAは、単一の転写物が標的遺伝子(例えば、ヘアピン)由来のセンス配列および相補アンチセンス配列の両方を有するように構築される。標的細胞中のPD−1転写物、PD−L1転写物またはPD−L2転写物に対する上記siRNAの結合は、細胞によるPD−1、PD−L1またはPD−L2の産生における減少を生じる。上記オリゴヌクレオチドの長さは、少なくとも10ヌクレオチドであり、そして天然に存在するPD−1転写物、PD−L1転写物またはPD−L2転写物と同程度の長さであり得る。好ましくは、上記オリゴヌクレオチドは、19〜25ヌクレオチド長である。最も好ましくは、上記オリゴヌクレオチドは、75ヌクレオチド長未満、50ヌクレオチド長未満、25ヌクレオチド長未満である。
【0066】
他の適切なPD−1インヒビターは、例えば、米国特許第6,808,710号ならびに米国特許出願第20040137577号、同第20030232323号、同第20030166531号、同第20030064380号、同第20030044768号、同第20030039653号、同第20020164600号、同第20020160000号、同第20020110836号、同第20020107363号、および同第20020106730号(これらの全ては、本明細書によって参考として援用される)に記載される。
【0067】
上記PD−1インヒビターの好ましい用量は、生物学的に活性な用量である。生物学的に活性な用量は、CD8+ T細胞の細胞傷害活性の増大(上記感染因子に特異的な免疫応答の増大)を誘導する用量である。望ましくは、上記PD−1インヒビターは、抗原特異的免疫細胞(例えば、CD8+ T細胞などのT細胞)におけるPD−1の発現または活性を、未処置のコントロールレベルと比較して少なくとも5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、または100%超低くに減少させる能力を有する。免疫細胞におけるPD−1のレベルまたは活性は、当該分野において公知である任意の方法によって測定され、その方法としては、例えば、ウェスタンブロット分析、免疫組織化学、ELISA、およびノーザンブロット分析が挙げられる。あるいは、PD−1の生物学的活性は、PD−L1、PD−L2、またはその両方に対するPD−1の結合を評価することによって測定される。PD−1の生物学的活性は、CD8+ T細胞の細胞傷害(例えば、サイトカイン産生、感染因子のクリアランス、および抗原特異的CD8+ T細胞の増殖が挙げられる)を増大させるその能力によって決定される。好ましくは、PD−1の発現または活性を減少させる因子は、上記感染因子に特異的な免疫応答を、未処置のコントロールレベルと比較して少なくとも5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、または100%超高くに増大させ得る。したがって、本発明の因子は、これらの活性のうちの任意の1つ以上を有する任意の因子である。本発明の薬剤は、好ましくは、CD8+ T細胞において発現されるが、持続感染に対する免疫応答に影響し得る任意の細胞がまた、本発明の方法に従うこと、およびその細胞が、例えば、B細胞を含むことが、理解される。
【0068】
必要に応じて、上記被験体は、1種以上のさらなる治療剤を投与される。さらなる治療剤としては、例えば、抗ウイルス化合物(例えば、ビダラビン、アシクロビル、ガンシクロビル、バルガンシクロビル、ヌクレオシドアナログ逆転写酵素インヒビター(NRTI)(例えば、AZT(ジドブジン)、ddI(ジダノシン)、ddC(ザルシタビン)、d4T(スタブジン)、または3TC(ラミブジン))、非ヌクレオシド逆転写酵素インヒビター(NNRTI)(例えば、ネビラピンまたはデラビルジン)、プロテアーゼインヒビター(サキナビル、リトナビル、インジナビル、またはネルフィナビル)、リバビリン、またはインターフェロン)、抗細菌化合物、抗真菌化合物、抗寄生虫化合物、抗炎症性化合物、抗腫瘍性薬剤または鎮痛剤が挙げられる。
【0069】
上記さらなる治療剤は、上記PD−1インヒビターの投与の前か、その投与と同時か、またはその投与の後に投与される。例えば、上記PD−1インヒビターと上記さらなる薬剤は、少なくとも1時間以内、2時間以内、4時間以内、6時間以内、10時間以内、12時間以内、18時間以内、または24時間より長く以内の間隔を空けて、別個の処方物において投与される。必要に応じて、上記さらなる薬剤は、上記PD−1インヒビターと一緒に処方される。上記さらなる薬剤が、異なる組成物中に存在する場合、異なる投与経路が、使用され得る。上記薬剤は、感染を処置するか、減少させるか、または予防するために有効であることがこのような薬剤について公知である用量で投与される。
【0070】
上記PD−1インヒビターの濃度および上記さらなる薬剤の濃度は、異なる因子に依存し、その因子としては、投与手段、標的部位、哺乳動物の生理学的状態、および投与される他の薬物が挙げられる。したがって、処置投薬量は、安全性および効力を最適化するために滴定され得、そしてその処置投薬量は、当業者の技術範囲内である。特定の状況のための適切な投薬量および投薬レジメンの決定は、当該分野の技術範囲内である。
【0071】
必要に応じて、上記被験体は、持続感染を引き起こす感染因子に対する防御免疫応答を誘発するワクチンをさらに投与される。例えば、上記被験体は、ヒト免疫不全ウイルス(HIV)、結核、インフルエンザ、またはC型肝炎に対する免疫応答を誘発するワクチンを受容する。例示のワクチンは、例えば、Berzofskyら(J.Clin.Invest. 114:456−462、2004)において記載される。所望される場合、上記ワクチンは、プライムブースト注射またはアジュバントと一緒に投与される。
【0072】
PD−1インヒビターは、T細胞(例えば、CD8+ T細胞)の細胞傷害を増大させるのに十分な量で投与される。T細胞の細胞傷害における増大は、増大した免疫応答および上記持続感染の減少を生じる。増大した免疫応答は、例えば、免疫細胞増殖(例えば、T細胞またはB細胞)の増大、サイトカイン産生の増大、および感染因子のクリアランスの増大によって測定される。このような減少は、上記持続感染と関連した1種以上の症状の軽減を誘導する。上記PD−1インヒビターの投与は、上記持続感染を減少させるか、またはその持続感染に関連した1種以上の症状を、未処置の被験体と比較して少なくとも10%、20%、30%、40%、50%、60%、70%、80%、90%、もしくは100%軽減する。
【0073】
処置は、その処置が臨床上の利益(例えば、被験体における感染因子量の減少)をもたらす場合に、効果的である。処置が予防的に適用される場合、「効果的」は、その処置が感染の形成を遅延させるかまたは予防することを意味する。効力は、特定の感染を診断または処置する任意の公知である方法を使用して決定され得る。
【0074】
(治療投与)
本発明は、被験体に、PD−1の発現または活性を減少させる化合物(本明細書中で「PD−1インヒビター」または「治療用化合物」と称される)を含む組成物を投与することを包含する。
【0075】
治療用化合物の有効量は、好ましくは、約0.1mg/kg〜約150mg/kgである。有効用量は、当業者によって認識されるように、投与経路、賦形剤の使用、および特定の感染または癌の症状を処置、予防または軽減するための他の抗感染剤または治療剤の使用を含む他の治療処置との組み合せに依存して変動する。治療用レジメンは、標準的な方法を使用して哺乳動物(例えば、感染または癌に罹患しているヒト患者(感染または癌を発症する危険性があるヒト患者))を同定することによって行われる。
【0076】
薬学的化合物は、当該分野において公知である方法を使用してこのような個体に投与される。好ましくは、上記化合物は、経口的、直腸的、経鼻的、局所または非経口的(例えば、皮下、腹腔内、筋肉内、および静脈内)に投与される。上記化合物は、予防的に投与されるか、または感染の検出後に投与される。上記化合物は、必要に応じて、感染を処置する治療用薬物のカクテルの成分として処方される。非経口投与に適した処方物の例としては、等張食塩溶液、5%グルコース溶液、または別の標準的な薬学的に受容可能な賦形剤における活性薬剤の水溶液が挙げられる。標準的な可溶化剤(例えば、PVPまたはシクロデキストリン)もまた、上記治療用化合物の送達のために、薬学的賦形剤として利用される。
【0077】
本明細書中に記載される治療用化合物は、従来の方法を利用する他の投与経路のための組成物中に処方される。例えば、PD−1インヒビターは、経口投与のために、カプセルまたは錠剤中に処方される。カプセルは、任意の標準的な薬学的に受容可能な材料(例えば、ゼラチンまたはセルロース)を含み得る。錠剤は、治療用化合物と固体キャリアおよび滑沢剤との混合物を圧縮することによる従来の手順に従って処方され得る。固体キャリアの例としては、デンプンおよび糖ベントナイト(sugar bentonite)が挙げられる。上記化合物は、結合剤(例えば、ラクトースまたはマンニトール)、充填剤、および錠剤形成剤(tableting agent)を含むハードシェルの錠剤(hard shell tablet)またはカプセルの形態で投与される。他の処方物は、軟膏、坐剤、パスタ、スプレー、パッチ、クリーム、ゲル、吸収性スポンジ、またはフォームを含む。このような処方物は、当該分野において周知である方法を使用して生産される。
【0078】
上記治療用化合物がタンパク質をコードする核酸である場合、その治療用核酸は、そのコードされたタンパク質の発現を促進するために、その核酸を適切な核酸発現ベクターの一部分として構築し、そしてそのベクターをそれが細胞内に入るように投与すること(例えば、レトロウイルスベクターの使用、直接注射、微粒子ボンバードメントの使用、脂質または細胞表面レセプターまたはトランスフェクション剤(transfecting agent)によってコーティングすること、または核に進入することが公知であるホメオボックス様ペプチド(例えば、Joliotら、1991.Proc Natl Acad Sci USA 88:1864−1868を参照のこと)に連結して投与することなど)によって、インビボで投与される。あるいは、核酸治療薬は、細胞内に導入され、そして相同組換えによって発現のために宿主細胞DNA内に組み込まれるか、またはエピソームのままである。
【0079】
DNAの局所投与のために、標準的な遺伝子治療ベクターが、使用される。このようなベクターは、ウイルスベクターを含み、そのウイルスベクターとしては、複製欠損の肝炎ウイルス(例えば、HBVおよびHCV)、レトロウイルス(例えば、WO 89/07136;Rosenbergら、1990、N.Eng.J.Med.323(9):570−578を参照のこと)、アデノウイルス(例えば、Morseyら、1993、J.Cell.Biochem.、補遺17E5を参照のこと)、アデノ随伴ウイルス(Kotinら、1990、Proc.Natl.Acad.Sci.USA 87:2211−2215)、複製欠損の単純ヘルペスウイルス(HSV;Luら、1992、Abstract、66ページ、Abstracts of the Meeting on Gene Therapy、Sept.22−26、Cold Spring Harbor Laboratory、Cold Spring Harbor、New York)、およびこれらのベクターの任意の改変バージョンに由来するものが挙げられる。本発明は、真核生物細胞への核酸のインビボ伝達を達成する任意の他の送達系を利用し得る。例えば、上記核酸は、リポソーム(例えば、カチオン性リポソーム(Lipofectin))、レセプター媒介性送達系、非ウイルス核酸ベースのベクター、赤血球ゴースト、またはマイクロスフェア(例えば、微粒子;例えば、米国特許第4,789,734号;米国特許第4,925,673号;米国特許第3,625,214号;Gregoriadis、1979、Drug Carriers in Biology and Medicine、pp.287−341(Academic Press))に封入され得る。むき出し(naked)のDNAもまた、投与され得る。
【0080】
遺伝子治療のためのDNAは、非経口的(例えば、静脈内、皮下、筋肉内、および腹腔内)に患者に投与され得る。DNAまたは誘導剤(inducing agent)は、薬学的に受容可能なキャリア(すなわち、動物に対する投与に適した生物学的に適合性のビヒクル(例えば、生理食塩水))中で投与される。治療有効量は、医学的に望ましい結果(例えば、処置された動物におけるPD−1遺伝子産物の減少)をもたらし得る量である。このような量は、当業者によって決定され得る。医学分野において周知であるように、任意の所与の患者に対する投薬量は、多くの因子に依存し、その因子としては、患者のサイズ、体表面積、年齢、投与されるべき特定の化合物、性別、投与の時間および経路、一般的健康、ならびに同時に投与される他の薬物が挙げられる。投薬量は、変動し得るが、DNAの静脈内投与のための好ましい投薬量は、約106〜1022コピーのDNA分子である。代表的に、プラスミドは、約1ナノグラム〜約5000マイクログラムの量のDNAで哺乳動物に投与される。望ましくは、組成物は、約5ナノグラム〜1000マイクログラムのDNA、10ナノグラム〜800マイクログラムのDNA、0.1マイクログラム〜500マイクログラムのDNA、1マイクログラム〜350マイクログラムのDNA、25マイクログラム〜250マイクログラムのDNA、または100マイクログラム〜200マイクログラムのDNAを含む。あるいは、上記PD−1インヒビターをコードする組換えアデノウイルスベクターの哺乳動物への投与は、少なくとも105、106、107、108、109、1010、または1011プラーク形成単位(pfu)の濃度にて適用され得る。
【0081】
PD−1遺伝子産物は、薬学的に受容可能なキャリア(例えば、生理食塩水)中で患者に静脈内投与される。ペプチドの細胞内送達のための標準的な方法が、使用され得る(例えば、リポソーム中に封入される)。このような方法は、当業者にとって周知である。1日につき体重1kgあたりで約1〜100モルの静脈内投薬量の本発明のポリペプチドが投与されることが、期待される。本発明の組成物は、非経口投与(例えば、静脈内投与、皮下投与、筋肉内投与、および腹腔内投与)に有用である。
【0082】
PD−1インヒビターは、その化合物と患部組織とが直接的に接触すると有効である。したがって、上記化合物は、局所に投与され得る。あるいは、PD−1インヒビターは、全身的に投与され得る。さらに、化合物は、その化合物を被験体の隣接組織および周辺組織にゆっくりと放出する固体マトリックスまたは吸収性マトリックスを(器官(例えば、腸または肝臓)に直接かまたは皮下のいずれかに)移植することによって投与され得る。例えば、胃腸感染の処置に関して、上記化合物は、全身的(例えば、静脈内、直腸または経口的)または局所(例えば、胃の組織に直接的)に投与され得る。あるいは、PD−1インヒビターを含漬させたカシェ剤または吸収性スポンジが、胃の組織と直接接触して配置される。上記PD−1インヒビターは、カシェ剤からの薬物の拡散およびポリマーマトリックスの浸食によってインビボでゆっくりと放出される。別の例として、肝臓の感染(すなわち、肝炎)は、上記PD−1インヒビターを含む溶液を肝臓脈管構造に注入することによって処置される。
【0083】
神経学的な感染の処置のために、上記PD−1インヒビターは、静脈内または髄腔内(すなわち、脳脊髄液への直接注入によって)に投与され得る。局所投与に関して、化合物を含漬させたカシェ剤または吸収性スポンジは、CNS組織と直接接触して配置される。上記化合物または化合物の混合物は、カシェ剤からの薬物の拡散およびポリマーマトリックスの浸食によってインビボでゆっくりと放出される。あるいは、上記化合物は、標準的な方法を使用して脳または脳脊髄液に注入される。例えば、注射ポートとして使用するためのカテーテルを有する穿頭孔リング(burr hole ring)が、頭蓋骨に穿孔した穿頭孔にてその頭蓋骨と係合するように配置される。上記カテーテルに連結された流体レザバは、穿頭孔リングの上部に配置された隔壁を通して挿入された針またはスタイレットによってアクセスされる。カテーテルアセンブリ(例えば、米国特許第5,954,687号に記載される)は、期間にわたる薬物の投与を可能にするために、脳の近傍または脳内における選択された位置に対してか、またはその位置からの流体の輸送に適した流体流路を提供する。
【0084】
心臓の感染に関して、上記化合物は、例えば、胸壁を通した直接の冠内注射またはX線透視検査による案内下での標準的な経皮カテーテルベースの方法の使用によって心臓組織(すなわち、心筋層、心膜、または心内膜)に送達され得る。したがって、上記インヒビターは、組織に注射されても、体腔に挿入されるステントまたはカテーテルから注入されてもよい。任意の種々の心臓カテーテルまたは灌流カテーテルが、上記化合物を投与するために使用され得る。あるいは、上記化合物は、冠血管に配置されるステントにコーティングまたは含漬される。
【0085】
肺の感染は、例えば、吸入によって上記化合物を投与することによって処置され得る。上記化合物は、加圧式容器または適切なプロペラント(例えば、二酸化炭素などの気体)を含むディスペンサーまたは噴霧器からエアゾールの形態で送達される。
【0086】
当業者は、本発明によって処置される患者が、持続的に感染した被験体を診断するための同一の試験に供された可能性があるか、または1種以上の危険因子(例えば、感染因子に対する曝露、感染した被験体に対する曝露、遺伝的素因、または二次感染に罹患し易い病理学的状態を有すること)の存在に起因する高い危険性があると検査なしで同定されている可能性があることを理解する。持続感染の症状または損傷の減少としてはまた、症状の軽減、疾患の程度の減少、疾患の安定した(すなわち、悪化していない)状態、疾患の進行の遅延または緩徐化、および疾患状態の改善または緩和が挙げられ得るが、これらに限定されない。処置は、保健医療提供者による厳重な管理を伴って自宅で行なわれても、保健施設において行なわれてもよい。
【0087】
(免疫応答を測定するための方法)
本発明による処置後に免疫応答を測定するための方法は、当該分野において周知である。T細胞の活性は、例えば、サイトカイン産生を検出するアッセイ、T細胞増殖を測定するアッセイ、微生物因子のクリアランスを測定するアッセイ、およびCD8+ T細胞の細胞傷害を測定するアッセイによって評価され得る。これらのアッセイは、例えば、米国特許第6,808,710号ならびに米国特許出願第20040137577号、同第20030232323号、同第20030166531号、同第20030064380号、同第20030044768号、同第20030039653号、同第20020164600号、同第20020160000号、同第20020110836号、同第20020107363号、および同第20020106730号(これらの全ては、本明細書によって参考として援用される)に記載される。
【0088】
必要に応じて、CD8+ T細胞の細胞傷害を増大させるPD−1インヒビターの能力は、例えば、Dongら(Nature 5:1365−1369、1999)によって記載される、CD8+ T細胞の増殖を測定するアッセイ(例えば、チミジン取り込み、BrdUアッセイ、および細胞周期マーカー(例えば、Ki67およびCFSE)による染色)によって評価される。1つの例において、T細胞増殖は、PD−1を発現する精製されたT細胞を、PD−1インヒビター、上に記載されるような一次活性化シグナル、および3H−チミジンと一緒に培養することによってモニタリングされる。T細胞増殖のレベルは、チミジン取り込みを測定することによって決定される。
【0089】
CD8+ T細胞の細胞傷害はまた、細胞溶解アッセイ(例えば、51Cr放出アッセイあるいはパーフォリンまたはグランザイムの放出を検出するアッセイ)、カスパーゼ活性化を検出するアッセイ、または感染した被験体からの微生物因子のクリアランスを測定するアッセイによって評価される。例えば、感染した被験体由来の生物学的サンプル(例えば、血清、脾臓、肝臓、肺、またはウイルスが向性を有する組織)におけるウイルス量は、処置の前後に測定され得る。
【0090】
サイトカイン(例えば、IFNγ、TNF−α、およびIL−2)の産生もまた、測定され得る。例えば、精製されたT細胞は、PD−1インヒビタータンパク質および一次活性化シグナルの存在下で培養される。上清中の種々のサイトカインのレベルは、例えば、Dongら(Nature 5:1365−1369、1999)に記載されるサンドイッチ型酵素結合イムノソルベントアッセイまたは他の従来のアッセイによって決定され得る。
【0091】
所望される場合、上記PD−1インヒビターの効力は、T細胞の補助刺激を誘導するその能力によって評価される。例えば、インビトロT細胞補助刺激についての方法は、PD−1を発現する精製されたT細胞に、抗CD3モノクローナル抗体もしくはホルボールエステル、またはクラスII MHCと一緒の抗原によって第1活性化シグナルまたは一次活性化シグナルを提供することを包含する。PD−1の発現または活性を減少させ、したがって免疫機能を調節するのに必要な二次シグナルまたは補助刺激シグナルをこれらのT細胞に対して提供する候補化合物薬剤の能力が、次いで、当該分野において周知である数種の従来のアッセイのいずれか1つによってアッセイされ得る。
【0092】
B細胞応答は、抗原特異的ELISA(例えば、LCMV、HIV、結核、またはマラリア)、形質細胞ELISPOT、記憶B細胞アッセイ、B細胞の表現型分類、および免疫組織化学による胚中心の分析によって評価される。
【0093】
(スクリーニングアッセイ)
本発明は、PD−1の発現または活性を阻害し得る化合物を同定するためのスクリーニング方法を提供する。有用な化合物は、PD−1の生物学的活性を阻害するか、またはPD−1の細胞レベルを低下させる任意の薬剤を含む。例えば、候補化合物は、PD−L1、PD−L2、またはその両方に対するPD−1の結合を減少させ得る。リード化合物としてこのような薬剤を使用することにより、例えば、本発明のスクリーニング方法はまた、持続感染を処置するか、減少させるか、または予防するように機能するか、あるいはこのような感染に関連した1種以上の症状を軽減するPD−1のさらなる新規であり特異的なインヒビターの同定を、可能にする。上記スクリーニングの方法は、ハイスループット技術を含み得る。
【0094】
「候補化合物」によって、天然に存在するか、または人工的に得られる化学物質が、意味される。候補化合物としては、例えば、ペプチド、ポリペプチド、合成有機分子、天然に存在する有機分子、核酸分子、ペプチド核酸分子、ならびにその成分および誘導体が挙げられ得る。例えば、本発明に従って有用な候補化合物は、PD−L1、PD−L2、またはその両方に対するPD−1の結合を減少させる。
【0095】
多くの方法が、このようなスクリーニングアッセイを実施するために利用可能である。1つのアプローチに従って、候補化合物は、PD−1を発現する細胞の培養培地に種々の濃度で添加される。「PD−1遺伝子」によって、PD−1タンパク質をコードする核酸が意味される。「PD−1融合遺伝子」によって、第2の異種核酸配列に作動可能に連結されたPD−1プロモーターおよび/またはPD−1コード領域全体もしくはその一部が意味される。好ましい実施形態において、上記第2の異種核酸配列は、レポーター遺伝子(すなわち、その遺伝子の発現がアッセイされ得る遺伝子)である;レポーター遺伝子としては、グルクロニダーゼ(GUS)をコードする遺伝子、ルシフェラーゼをコードする遺伝子、クロラムフェニコールトランスアセチラーゼ(CAT)をコードする遺伝子、緑色蛍光タンパク質(GFP)をコードする遺伝子、アルカリホスファターゼをコードする遺伝子、およびβ−ガラクトシダーゼをコードする遺伝子が挙げられるが、これらに限定されない。
【0096】
次いで、PD−1の遺伝子発現が、例えば、ハイブリダイゼーションプローブとしてPD−1の核酸分子から調製された任意の適切なフラグメントを使用する標準的なノーザンブロット分析(Ausubelら、前出)によってか、または適切なプライマーを用いたリアルタイムPCRによって測定される。上記候補化合物の存在下での遺伝子発現のレベルは、その候補分子を欠くコントロール培養培地において測定されたレベルと比較される。所望される場合、候補化合物の効果は、上記に代えて、同一の一般的アプローチおよび例えば、PD−1に特異的な抗体を用いたウェスタンブロッティングまたは免疫沈降などの標準的な免疫学的技術を使用して、PD−1ポリペプチドのレベルで測定され得る。例えば、免疫アッセイは、PD−1のレベルを検出またはモニタリングするために使用され得る。PD−1に結合し得るポリクローナル抗体またはモノクローナル抗体が、PD−1のレベルを測定するために、任意の標準的な免疫アッセイ形式(例えば、ELISAまたはRIAアッセイ)において使用され得る。PD−1はまた、質量分析、高速液体クロマトグラフィー、分光測光技術もしくは蛍光定量技術、またはそれらの組み合わせを使用して測定され得る。
【0097】
あるいは、本発明のスクリーニング方法は、PD−L1、PD−L2、またはその両方に対するPD−1の結合を減少させることによってPD−1の生物学的活性を、未処置のコントロールと比較して少なくとも10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、または100%低下させる候補化合物を同定するために使用され得る。例えば、候補化合物は、下で記載されるように、PD−1についてのcDNAを用いたトランスフェクション後か、またはPD−1を含む無細胞溶液において、PD−1を天然に発現する細胞におけるPD−1活性を低下させるその能力について試験され得る。PD−1の結合または活性化に対する候補化合物の効果は、放射結合アッセイおよび非放射結合アッセイ、競合アッセイ、ならびにレセプターシグナリングアッセイによって試験され得る。
【0098】
特定の例として、PD−1をコードする核酸を発現する哺乳動物細胞(例えば、げっ歯類細胞)は、候補化合物(例えば、ペプチド、ポリペプチド、合成有機分子、天然に存在する有機分子、核酸分子、またはそれらの成分)の存在下で培養される。細胞は、PD−1を内因性に発現し得るか、または代替的に、PD−1を過剰発現するように当該分野において公知である任意の標準的な技術(例えば、トランスフェクションおよびウイルス感染)によって遺伝的に操作され得るかのいずれである。PD−1の発現レベルは、ウェスタンブロット分析によってこれらの細胞において測定され、次いでその発現レベルは、候補化合物に接触されていないコントロール細胞における同じタンパク質の発現レベルと比較される。PD−1の合成または生物学的活性を減少させることの結果としてPD−1活性のレベルの低下を促す化合物は、本発明において有用であると見なされる。
【0099】
1つの特定の例において、PD−L1、PD−L2、またはその両方に対するPD−1結合を妨げ(それによってPD−1の生物学的活性を減少させる)、免疫応答の増大をもたらす化合物は、本発明に従って有用である。PD−1の生物学的活性を低下させるその能力を前提として、このような分子、例えば、持続感染を処置するか、減少させるか、または予防するためか、あるいはこのような感染に関連した1種以上の症状を軽減するための治療剤として使用され得る。特定の例として、候補化合物は、2つのタンパク質(PD−1と実質的に同一のポリペプチドである第1のタンパク質およびPD−L1またはPD−L2のいずれかである第2のタンパク質(すなわち、結合を可能にし、そして減少した免疫応答をもたらす条件下でPD−1ポリペプチドを結合するタンパク質))と接触され得る。この特定のスクリーニング方法に従って、これら2つのタンパク質の間の相互作用は、候補化合物の添加後に測定される。候補化合物の添加後における上記第2のポリペプチドに対するPD−1の結合の減少(その化合物の非存在下でのこのような結合と比較した場合)により、その候補化合物は上記2つのタンパク質の間の相互作用を阻害する能力を有すると同定される。最終的に、本発明のスクリーニングアッセイは、例えば、無細胞系においてか、または酵母ツーハイブリッド系を使用して行なわれ得る。所望される場合、それらのタンパク質の一方またはその候補化合物は、上に記載されるような支持体に固定化されても、検出可能な基を有してもよい。
【0100】
代替的かまたは追加的に、候補化合物は、PD−1に特異的に結合し、それによってPD−1を阻害するものについてスクリーニングされ得る。このような候補化合物の効力は、PD−1と相互作用するその能力に依存する。このような相互作用は、多くの標準的な結合技術および機能的アッセイ(例えば、Ausubelら、前出に記載されるもの)を使用して容易にアッセイされ得る。例えば、候補化合物は、PD−1との相互作用および結合についてインビトロで試験され得、そして免疫応答を調節するその能力は、任意の標準的なアッセイ(例えば、本明細書中に記載されるもの)によってアッセイされ得る。
【0101】
例えば、PD−1に結合する候補化合物は、クロマトグラフィーベースの技術を使用して同定され得る。例えば、組換えPD−1は、PD−1を発現するように操作された細胞(例えば、上に記載されるもの)から標準的な技術によって精製され得、そしてその組換えPD−1は、カラムに固定化され得る。あるいは、天然に存在するPD−1が、カラムに固定化され得る。次いで、候補化合物の溶液は、上記カラムに通され、そしてPD−1に特異的な化合物は、PD−1に結合しかつそのカラムに固定化されるその能力に基づいて同定される。上記化合物を同定するために、上記カラムは、非特異的に結合した分子を除去するために洗浄され、次いで目的の化合物は、そのカラムから放出され、そして回収される。この方法(または任意の他の適切な方法)によって単離された化合物は、所望される場合、さらに精製され得る(例えば、高速液体クロマトグラフィーによって)。
【0102】
新規インヒビターについてのスクリーニングおよびリード化合物の最適化は、例えば、標準的な技術を使用して細胞傷害性T細胞の活性または免疫応答を調節するそれらの能力を評価することによって評価され得る。さらに、これらの候補化合物は、抗微生物剤(例えば、本明細書中に記載されるようなもの)として機能するそれらの能力について試験される。このアプローチによって単離された化合物はまた、例えば、持続感染を処置するか、減少させるか、または予防するためか、あるいはこのような感染に関連した1種以上の症状を軽減するための治療薬として使用され得る。PD−1に10mM以下の親和性定数で結合すると同定される化合物は、本発明において特に有用であると見なされる。
【0103】
潜在的な治療剤としては、有機分子、ペプチド、ペプチド模倣体(mimetic)、ポリペプチド、およびPD−1をコードする核酸配列またはポリペプチドに結合し、それによってそれらの活性を阻害するか、または減少させる抗体が挙げられる。潜在的な抗微生物剤としてはまた、正常な生物学的活性が妨害されるように、このようなポリペプチドの結合部位に結合しかつその結合部位を占有し、それによって細胞の結合分子に対する結合を妨害する低分子が挙げられる。他の潜在的な抗微生物剤としては、アンチセンス分子が挙げられる。
【0104】
(診断方法および予後判定方法)
癌(例えば、血管免疫芽球性T細胞リンパ腫または結節性リンパ球優勢型ホジキンリンパ腫)は、試験サンプル(すなわち、患者由来サンプル)中のPD−1ポリペプチドの量を調べることによって検出される。上記PD−1ポリペプチドをコントロールサンプル比較した場合、そのレベルの変化は、被験体における癌を示す。上記変化は、コントロールサンプルに対する上記PD−1ポリペプチドの増加または減少であり得る。上記コントロールサンプルは、試験サンプルと同様の様式で調製(すなわち、分画)される。
【0105】
サンプルは、例えば、血液、血清、腹水(acsites fluid)、尿、または他の体液である。好ましくは、上記サンプルは、T細胞またはB細胞である。
【0106】
上記PD−1の量は、上記試験サンプルにおいて決定され、そして正常のコントロールレベルの発現と比較される。正常のコントロールレベルによって、癌に罹患していない被験体において代表的に見出されるPD−1ポリペプチドの発現レベルが意味される。患者由来サンプル中のPD−1のレベルの上昇は、被験体が、癌に罹患しているかまたは癌を発症する危険性があることを示す。対照的に、本方法が予防的に適用される場合、患者由来サンプルのPD−1ポリペプチドの同様のレベルまたはレベルの低下は、被験体が、癌に罹患していないかまたは癌を発症する危険性がないことを示す。患者由来サンプル中のPD−1ポリペプチドのレベルの上昇は、被験体が、癌に罹患しているかまたは癌を発症する危険性があることを示す。
【0107】
上記PD−1ポリペプチドの量の変化は、統計的に有意である。統計的に有意によって、その変化が、単独の変化によって起きることが予期されるものよりも大きいことが、意味される。統計的有意性は、当該分野において公知である方法によって決定される。例えば、統計的有意性は、p値によって決定される。p値は、実験の間における群間の差が偶然と起こる確率の尺度である。(P(z≧zobserved))。例えば、0.01というp値は、この結果が偶然おこるのが100回中1回であることを意味する。p値が低いほど、群間の差が処置によって引き起こされたという可能性がより高くなる。変化は、p値が少なくとも0.05である場合、統計的に有意である。好ましくは、p値は、0.04、0.03、0.02、0.01、0.005、0.001またはそれ未満である。
【0108】
試験、アッセイ、または方法の「診断精度」は、その試験、アッセイ、または方法が癌を有する患者または癌の危険性がある患者の間を区別する能力に関係し、それは、患者がPD−1ポリペプチドの「臨床的に有意な存在」を有するか否かに基づく。「臨床的に有意な存在」によって、患者(代表的に、その患者由来のサンプル)における上記PD−1ポリペプチドの存在が、そのPD−1ポリペプチドについての所定のカットオフポイント(または閾値)よりも、高いかまたは低いことが意味され、したがってそれは、その患者がそのタンパク質の十分に高い存在がマーカーである癌を有することを示す。
【0109】
用語「高い程度の診断精度」および「非常に高い程度の診断精度」とは、癌の存在または非存在を正しく(正確に)示す所定のカットオフポイントを用いたそのPD−1ポリペプチドについての試験またはアッセイをいう。完全な試験は、完全な精度を有する。したがって、糖尿病を有する個体に関して、上記試験は、陽性の試験結果だけを示し、そしてそれらの個体のいずれについても「陰性」であるとは報告しない(「偽陰性」は存在しない)。換言すれば、上記試験の「感度」(真の陽性率)は、100%である。一方では、糖尿病を有さなかった個体に関して、上記試験は、陰性の試験結果だけを示し、そしてそれらの個体のいずれについても「陽性」であるとは報告しない(「偽陽性」は存在しない)。換言すれば、「特異性」(真の陰性率)は、100%である。例えば、試験(例えば、臨床診断試験)の特異性、感度、ならびに陽性および陰性の的中度を考察するO’Marcaigh AS、Jacobson RM、「Estimating The Predictive Value OfA Diagnostic Test,How To Prevent Misleading Or Confusing Results」、Clin.Ped.1993、32(8):485−491を参照のこと。
【0110】
試験(またはアッセイ)のカットポイントまたは閾値を変えることは、通常、感度および特異性を変化させるが、質的に逆相関にある。例えば、カットポイントを低くする場合、試験された集団のより多くの個体は、代表的に、カットポイントまたは閾値を超える試験結果を有する。カットポイントを上回る試験結果を有する個体は、その試験が行われている疾患、状態、または症候群を有すると報告されるので、そのカットポイントを低くすることは、より多くの個体が陽性の結果を有する(すなわち、それらが癌を有する)と報告されることを生じる。したがって、より高い比率の癌を有する個体が、そのカットポイントを有する試験によって示される。したがって、上記試験の感度(真の陽性率)は、上昇する。しかし、同時に、疾患、状態、または症候群のいずれをも有さないより多くの者(すなわち、真に「陰性」である者)が、この試験によってカットポイントを上回るPD−1ポリペプチド値を有すると示され、したがってその試験によって陰性であることが正しく示されるよりもむしろ、陽性(すなわち、疾患、状態、または症候群を有する)であると報告されるで、より多くの偽陽性が、存在する。したがって、上記試験の特異性(真の陰性率)は、減少する。同様に、カットポイントを上げることは、感度を低下させ、そして特異性を上昇させる傾向にある。したがって、患者の状態を評価するための提案された医学的試験、アッセイ、または方法の精度および有用性の評価において、常に感度および特異性の両方を考慮し、そして感度および特異性はカットポイントの範囲にわたって著しく変動し得るので感度および特異性が報告されているカットポイントがなにであるのかに留意すべきである。
【0111】
しかし、カットポイントの全範囲にわたって試験、アッセイ、または方法の感度および特異性をただ1つの値によって表示することを可能にする指標が、存在する。その指標は、問題の試験、アッセイ、または方法についての受容者動作特性(「ROC」)曲線から得られる。例えば、Shultz、「Clinical Interpretation
Of Laboratory Procedures」、第14章、Teitz、Fundamentals of Clinical Chemistry、Burtis and Ashwood(編)、第4版、1996、W.B.Saunders Company、192〜199ページ;およびZweigら、「ROC Curve Analysis:An Example Showing The Relationships Among Serum Lipid And Apolipoprotein Concentrations In Identifying Patients With Coronory Artery Disease」、Clin.Chem.、1992、38(8):1425−1428を参照のこと。
【0112】
ROC曲線は、0〜1(すなわち、100%)の目盛りのx軸における1−特異性に等しい値に対する0〜1(すなわち、100%)の目盛りのy軸における感度のx−yプロットである。換言すれば、それは、その試験、アッセイ、または方法についての偽陽性率に対する真の陽性率のプロットである。問題の試験、アッセイ、または方法についてのROC曲線を構築するために、患者は、その患者が疾患、状態、または症候群について真に陽性または陰性であるか否かを決定するために、問題の試験、アッセイ、または方法とは無関係の完全に正確かまたは「極上の基準(gold standard)」方法を使用して評価される(例えば、冠動脈造影は、冠状動脈硬化症の存在についての極上の基準試験である)。上記患者はまた、問題の試験、アッセイ、または方法を使用して、変化するカットポイントに対して試験され、その患者は、その試験、アッセイ、または方法に従って陽性または陰性であると報告される。上記感度(真の陽性率)および1−上記特異性と等しい値(その値は、偽陽性率に対応する)は、各カットポイントに対して決定され、そしてx−y値の各対は、x−yダイアグラム上に単一の点としてプロットされる。それらの点を連結する「曲線」が、ROC曲線である。
【0113】
曲線下面積(「AUC」)は、カットポイントの全範囲にわたって試験、アッセイ、または方法の感度および特異性のただ1つの値による表示を可能にする指標である。最大AUCは、1(完全な試験)であり、そして最小面積は、2分の1である。AUCが1に近いほど、その試験の精度は良好である。
【0114】
「高い程度の診断精度」によって、AUC(試験またはアッセイについてのROC曲線下面積)が少なくとも0.70、望ましくは少なくとも0.75、より望ましくは少なくとも0.80、好ましくは少なくとも0.85、より好ましくは少なくとも0.90、そして最も好ましくは少なくとも0.95である試験またはアッセイ(例えば、PD−1ポリペプチドの臨床的に有意な存在を決定し、それによって糖尿病の存在を示すための本発明の試験)が、意味される。
【0115】
「非常に高い程度の診断精度」によって、AUC(試験またはアッセイについてのROC曲線下面積)が少なくとも0.875、望ましくは少なくとも0.90、より望ましくは少なくとも0.925、好ましくは少なくとも0.95、より好ましくは少なくとも0.975、そして最も好ましくは少なくとも0.98である試験またはアッセイが、意味される。
【0116】
必要に応じて、特定の癌に対する他の公知のバイオマーカーの発現はまた、被験体が癌を有しているか否かをさらに示すものとして測定される。例えば、CD10、bcl−6、CD20、CD57またはCXCR5が、検出される。
【0117】
上記PD−1ポリペプチドおよび上記さらなるバイオマーカーは、任意の適切な様式で検出されるが、代表的に、患者由来のサンプルと、PD−1またはバイオマーカーを結合し、次いで反応生成物の存在または非存在を検出する抗体とを接触させることによって検出される。上記抗体は、モノクローナル性、ポリクローナル性、キメラ、または上で詳細に考察されるような上記のフラグメントであり得、そして上記反応生成物を検出する工程は、任意の適切な免疫アッセイを用いて行われ得る。被験体由来のサンプルは、代表的に、上に記載されるような生物学的流体であり、そして上に記載される方法を行うために使用される生物学的流体の同一のサンプルであり得る。
【0118】
PD−1ポリペプチドの発現はまた、癌の処置の過程がモニタリングされることを可能にする。この方法において、生物学的サンプルは、癌に対する処置(例えば、外科手術、化学療法またはホルモンによる処置)を受けている被験体から提供される。所望される場合、生物学的サンプルは、処置の前、処置の間、または処置の後の種々の時点において被験体から得られる。次いで、PD−1の発現が、決定され、そしてその発現は、参照(例えば、その癌の病期が既知であるコントロール)と比較される。上記参照サンプルは、処置に曝されている。あるいは、上記参照サンプルは、処置に曝されていない。必要に応じて、このようなモニタリングは、セカンドルック外科的監視手順、およびその後の外科的監視手順に対して予備的に行われる。例えば、サンプルは、処置の進行をモニタリングするために、最初に癌に対する外科的処置を受け、次いでその癌に対する抗腫瘍性薬剤による処置を受けた被験体から回収され得る。
【0119】
上記参照サンプルが癌を有さない被験体由来である場合、上記試験サンプルおよび参照サンプルにおけるPD−1ポリペプチドの量の類似性または減少は、処置が効力があることを示す。しかし、上記試験サンプルおよび参照サンプルにおけるPD−1ポリペプチドの量の増加は、あまり望ましくない臨床的な帰結または予後を示す。
【0120】
「効力がある」によって、処置が被験体におけるPD−1ポリペプチドの量の減少、あるいは腫瘍のサイズ、有病率、または転移能の減少をもたらすことが、意味される。癌の評価は、標準的な臨床プロトコルを使用して行われる。効力は、特定の腫瘍を診断または処置するための任意の公知の方法に関連して決定される。PD−1ポリペプチドの発現はまた、全身的治療(例えば、化学療法、ホルモン療法または放射線治療)に応答性である患者の同定を可能にする。本方法において、生物学的サンプルは、癌に対する外科的処置を受ける前に被験体から提供される。次いで、PD−1ポリペプチドの発現が、決定され、そしてその発現は、癌の外科的除去後に被験体から得られた生物学的サンプルと比較される。患者は、PD−1ポリペプチドの量が癌の外科的除去後に減少する場合、全身的処置に応答性であるようである。対照的に、患者は、上記ポリペプチドの量が癌の外科的除去後に変わらないままであるかまたは増加する場合、全身的処置に応答性ではないようである。
【0121】
PD−1ポリペプチドまたは他の癌バイオマーカーの発現は、当該分野において公知である任意の方法を使用して、タンパク質レベルまたは核酸レベルにて決定される。例えば、これらの配列の1種以上を特異的に認識するプローブを使用するノーザンハイブリダイゼーション分析は、遺伝子発現を決定するために使用され得る。あるいは、発現は、逆転写ベースのPCRアッセイ(例えば、遺伝子の示差的に発現された配列に特異的なプライマーを使用する)を使用して測定される。発現はまた、タンパク質レベルにて決定される(すなわち、本明細書中に記載される遺伝子産物によってコードされるペプチドのレベルまたはその活性を測定することによる)。このような方法は、当該分野において周知であり、そしてその方法としては、例えば、上記遺伝子によってコードされるタンパク質に対する抗体に基づく免疫アッセイが挙げられる。任意の生物学的材料は、上記タンパク質またはその活性の検出/定量のために使用され得る。あるいは、適切な方法が、分析される各タンパク質の活性に従って、マーカー遺伝子によってコードされるタンパク質の活性を決定するために選択され得る。
【0122】
被験体は、好ましくは、哺乳動物である。上記哺乳動物は、例えば、ヒト、非ヒト霊長類、マウス、ラット、イヌ、ネコ、ウマ、またはウシである。被験体は、代表的に、ヒトの女性またはヒトの男性である。上記被験体は、癌を有すると以前に診断されており、そしておそらく、その癌に対する処置を既に受けている。あるいは、上記被験体は、癌を有すると以前に診断されていない。本発明は、癌についての危険性がある患者に関して有用である。各タイプの癌は、それら特有の危険因子のセットを有し、癌を発症する危険性は、加齢、性別、人種ならびに個人および家族の病歴に関連して増大する。他の危険因子は、生活様式の選択に大きく関連するが、特定の感染、職業上の曝露およびいくつかの環境因子もまた、癌の発症に関連し得る。
【0123】
癌の診断は、代表的に、検査におけるサイズの同定によって行われるが、それは、他の手段(例えば、放射線学的診断、および超音波)によるものであり得る。処置は、代表的に、腫瘍縮小手術、その後の抗腫瘍性薬剤による処置(ドセタキセル、ビノレルビン、ゲムシタビン、カペシタビンまたはシクロホスファミドとメトトレキセートとフルオロウラシルとの組み合せ;シクロホスファミドとドキソルビシンとフルオロウラシルとの組み合せ;ドキソルビシンとシクロホスファミドとの組み合せ;パクリタキセルを伴うドキソルビシンとシクロホスファミドとの組み合せ;ドキソルビシンに続くCMF;またはシクロホスファミドとエピルビシンとフルオロウラシルとの組み合せ)によって行われる。さらに、多くの患者は、放射線治療を必要とする。
【0124】
本発明に従って行われる免疫アッセイは、均一アッセイまたは不均一アッセイであり得る。均一アッセイにおいて、免疫学的反応は、通常、特異的抗体(例えば、PD−1ポリペプチド)、標識された分析物、および目的のサンプルを含む。標識から生じるシグナルは、上記標識された分析物に対する抗体の結合の際に、直接的かまたは間接的に改変される。免疫学的反応およびその程度の検出の両方は、均一溶液において行われる。使用され得る免疫化学的標識は、フリーラジカル、放射性同位体、蛍光色素、酵素、バクテリオファージ、または補酵素を含む。
【0125】
不均一アッセイアプローチにおいて、試薬は、通常、サンプル、抗体、および検出可能なシグナルを生じるための手段を含む。上に記載されるようなサンプルが、使用され得る。上記抗体は、一般に、支持体(例えば、ビーズ、プレートまたはスライド)に固定化され、そして液相中に抗原を含む疑いのある検体と接触される。次いで、上記支持体は、上記液相から分離され、その支持体相またはその液相のいずれかが、検出可能なシグナルについて、このようなシグナルをもたらすための手段を使用して調べられる。上記シグナルは、上記サンプル中の分析物の存在に関連する。検出可能なシグナルを生じるための手段は、放射性標識、蛍光標識、または酵素標識の使用を含む。例えば、検出される抗原が、第2の結合部位を含む場合、その結合部位に結合する抗体は、検出可能な基に結合体化され得、そして分離工程の前に液相反応溶液に添加され得る。上記固体支持体における検出可能な基の存在は、試験サンプル中の上記抗原の存在を示す。適切な免疫アッセイの例は、放射免疫アッセイ、免疫蛍光法、または酵素結合免疫アッセイである。
【0126】
当業者は、本明細書中に開示される方法を行うのに有用であり得る多くの特定の免疫アッセイ形式およびそのバリエーションに精通している。一般に、E.Maggio、Enzyme−Immunoassay、(1980)(CRC Press,Inc.、Boca Raton、Fla.)を参照のこと;また、Skoldらに対する米国特許第4,727,022号(発明の名称「Methods for Modulating Ligand−Receptor Interactions and their Application」)、Forrestらに対する米国特許第4,659,678号(発明の名称「Immunoassay of Antigens」)、Davidらに対する米国特許第4,376,110号(発明の名称「Immunometric Assays Using Monoclonal Antibodies」)、Litmanらに対する米国特許第4,275,149号(発明の名称「Macromolecular Environment Control in Specific Receptor Assays」)、Maggioらに対する米国特許第4,233,402号(発明の名称「Reagents and Method Employing Channeling」)およびBoguslaskiらに対する米国特許第4,230,767号(発明の名称「Heterogeneous Specific Binding Assay Employing a Coenzyme as Label」)を参照のこと。抗体は、公知の技術(例えば、沈降)に従って、診断アッセイに適した固体支持体(例えば、ラテックスまたはポリスチレンなどの材料から形成されるビーズ、プレート、スライドまたはウェル)に結合体化される。本明細書中に記載されるような抗体は、同様に、公知の技術に従って、検出可能な基(例えば、放射標識(例えば、35 S、125
I、131 I)、酵素標識(例えば、西洋ワサビペルオキシダーゼ、アルカリホスファターゼ)、および蛍光標識(例えば、フルオレセイン))に結合体化され得る。
【0127】
本明細書中に記載される方法を実施するための診断キットは、多くの様式で生産される。1つの実施形態において、上記診断キットは、(a)固体支持体に結合体化された抗体(例えば、PD−1ポリペプチド)および(b)検出可能な基に結合体化される本発明の第2の抗体を備える。試薬はまた、補助的な薬剤(例えば、緩衝剤およびタンパク質安定化剤(例えば、多糖類など))を含み得る。上記診断キットは、必要な場合、シグナル生成系(検出可能な基がメンバー(例えば、酵素基質)である系)の他のメンバー、試験におけるバックグラウンド干渉を減少させるための薬剤、コントロール試薬、試験を行うための装置などをさらに備え得る。あるいは、試験キットは、(a)抗体、および(b)検出可能な基に結合体化される抗体に対する特異的結合パートナーを備える。同様に、上に記載される補助的な薬剤を備えることができる。試験キットは、代表的に、上記試験を行うための指示が印刷されたシートとともに全ての構成要素を単一の容器中に入れて、任意の適切な様式で梱包され得る。
【0128】
本発明は、部分的に、以下の実施例に記載される実験に基づく。これらの実施例は、本発明を例示するために提供され、そして限定として解釈されるべきではない。
【実施例】
【0129】
(実施例1:慢性的に感染したマウスにおける、抗PD−L1抗体を使用したPD−1経路の阻害)
種々の株のリンパ球脈絡髄膜炎ウイルス(LCMV)に感染したマウスを、CD8+ T細胞機能に対する慢性ウイルス感染の影響を研究するために使用した。LCMV Armstrong株は、8日以内に除去される急性感染を引き起こし、非常に機能的な休止記憶(resting memory)CD8+ T細胞の長寿命の集団を残す。LCMV Cl−13株は、対照的に、宿主において持続感染を確立し、最長で3ヶ月間まで持続するウイルス血症によって特徴付けられる。上記ウイルスは、いくつかの組織においていつまでも残存し、そして抗原特異的CD8+ T細胞は、機能的に損なわれるようになる。DbNP396−404 CD8+ T細胞が、身体から消失する一方で、DbGP33−41 CD8+ T細胞およびDbGP276−286 CD8+ T細胞は、存続するが、抗ウイルスサイトカイン(例えば、IFN−γおよびTNF−α)を増殖または分泌する能力を失う。
【0130】
C57BL/6マウスを、National Cancer Institute(Frederick、MD)から購入した。マウスに対して、2×106pfuのLCMV−Cl−13をi.v.感染させた。CD4枯渇を、PBS中の500μgのGK1.5を感染の日および感染の翌日に注射することによって行なった。LCMV免疫マウスを、マウスに対して2×105pfuのLCMV Armstrongをi.p.感染させることによって産生する。
【0131】
遺伝子アレイ分析を、FACS精製したナイーブのDbGP33−41特異的P14トランスジェニックCD8+ T細胞、LCMV Armstrong免疫マウスに由来するDbGP33−41特異的記憶CD8+ T細胞、およびCD4+枯渇LCMV Cl−13感染マウスに由来するDbGP33−41特異的CD8+ T細胞またはDbGP276−286特異的CD8+ T細胞に対して行なった。RNA単離および遺伝子アレイ分析を、Kaechら(Cell 111:837−51、2002)に記載される通りに行った。PD−1 mRNAは、記憶CD8+ T細胞と比較して、疲弊したCD8+ T細胞において高度に発現された(図1A):さらに、PD−1は、LCMV Cl−13感染マウスにおけるCD8+ T細胞の表面に発現されたが、LCMV Armstrongのクリアランス後のCD8+ T細胞の表面上に存在しなかった(図1B)。慢性的に感染したマウスはまた、未感染のマウスと比較して、ほとんどのリンパ球およびAPC上に、より高いレベルのPD−1のリガンドのうちの1つ(PD−L1)を発現した。したがって、ウイルス抗原の存続およびCD8+ T細胞の疲弊は、PD−1発現の誘導と同時に生じる。
【0132】
PD−1/PD−L1経路の遮断が、T細胞機能を回復し得、そして慢性LCMV感染の間のウイルス制御を増強するという仮説を試験するために、PD−1/PD−L1同時阻害性経路を、αPD−L1遮断抗体を使用して、慢性LCMV感染の間に途絶させた。PD−L1に対する遮断モノクローナル抗体を、LCMV Cl−13に感染したマウス対して、感染後の23日目〜37日目において3日毎にi.p.投与した(200μgのラット抗マウスPD−L1 IgG2bモノクローナル抗体(クローン10F.5C5またはクローン10F.9G2))。37日目にて、未処置のコントロールと比較して、処置マウス中に約2.5倍のDbNP396−404特異的CD8+ T細胞および3倍のDbGP33−41特異的CD8+ T細胞が、存在した(図2A)。増殖の誘導は、CD8+ T細胞に対して特異的であった。なぜならば、脾臓におけるCD4+ T細胞の数が、処置マウスおよび未処置マウスの両方においてほぼ同じ(脾臓あたり約6×104
IAbGP61−80のCD4+ T細胞)であったからである。
【0133】
CD8+ T細胞増殖の増大に加えて、PD−1シグナリングの阻害はまた、ウイルス特異的CD8+ T細胞における抗ウイルスサイトカインの増大した産生をもたらした。CD8+ T細胞による、8種の異なるCTLエピトープに対するIFN−γおよびTNF−αの産生を、決定した。組み合せられた応答は、未処置マウスと比較して、処置マウスにおいて2.3倍高かった(図2Bおよび2C)。TNF−α産生細胞の頻度の2.3倍の増加がまた、処置後に観察された(図2D)。ウイルスクリアランスはまた、ウイルスが処置マウスの血清、脾臓、および肝臓から除去されるにつれて増進された。減少したウイルス力価が、感染の37日目(処置を開始した14日後)に処置マウスの肺および腎臓において観察された(約10倍)。しかし、未処置マウスは、これら全て組織においてウイルスの顕著なレベルを示した(図2E)。血清および組織ホモジネートにおけるウイルス力価を、Ahmedら(J.Virol.51:34−41、1984)に記載される通りにVero細胞を使用して決定した。この結果は、PD−1インヒビターがCD8+ T細胞増殖およびウイルスクリアランスを増大させ、したがってPD−1シグナリングの阻害がCD8+ T細胞機能を回復させることを示す。さらに、PD−1シグナリングの阻害はまた、B細胞応答を増強した。なぜならば脾臓におけるLCMV特異的抗体分泌細胞の数もまた、処置後に増加(>10倍)したからである。
【0134】
CD4+ T細胞は、CD8+ T細胞応答の発生および維持において重要な役割を果たす。このことに関して、CD4+ T細胞(いわゆる「無力(helpless)」のCD8+ T細胞)の非存在下でプライムされたCD8+ T細胞は、正常の免疫応答を惹起できない。さらに、慢性LCMV感染は、CD4+ T細胞の存在下においてより重篤である。したがって、LCMV−Cl−13感染の間に産生された無力のT細胞は、CD4+ T細胞の存在下で産生されたT細胞よりもさらに大きい顕著な機能的障害を示す。DbNP396−404特異的CD8+ T細胞は、検出不可能なレベルまで消失し、そしてDbGP33−41 CD8+ T細胞およびDbGP276−286 CD8+
T細胞は、IFN−γおよびTNF−αを分泌する能力を完全に失う。
【0135】
CD4+ T細胞は、LCMV−Cl−13感染時に枯渇させ、そしてマウスを、感染の46日目〜60日目に抗PD−L1抗体処置によって処置した。LCMV特異的CD4+ T細胞は、処置の前後に細胞内IFN−γ染色によって検出できなかった。処置の後に、処置マウスは、未処置のコントロールマウスよりも、処置マウスの脾臓において約7倍のDbGP276−286 CD8+ T細胞および4倍多いDbGP33−41 CD8+ T細胞を有した(図3A)。上記脾臓におけるウイルス特異的CD8+ T細胞の数もまた、増加した(図3B)。処置マウスにおけるウイルス特異的CD8+ T細胞の増加は、BrdU取り込みによって検出されるような増殖の増大に起因した。未処置マウスにおいて、43%のDbGP276−286 CD8+ T細胞は、中程度のレベルのBrdUを取り込み、そして2%のDbGP276−286 CD8+ T細胞は、高レベルのBrdUを取り込み、一方で、処置マウスにおいて、50%のDbGP276−286 CD8+ T細胞は、中程度のレベルのBrdUを取り込み、そして37%のDbGP276−286 CD8+ T細胞は、高レベルのBrdUを取り込んだ。BrdU分析を、処置中の飲料水に1mg/mlのBrdUを導入することによって行い、そして染色は、製造業者のプロトコル(BD Biosciences、San Diego、CA)に従って行った。さらに、処置マウスは、細胞周期関連タンパク質Ki67を発現する、より高い%のCD8+ T細胞を含んだ(未処置マウスにおいて19%であるのに対して60%、図3C)。PBMCにおけるCD8+ T細胞の処置に対する応答は、高レベルのCD8+ T細胞増殖を有するマウスに限定された。
【0136】
PD−1阻害はまた、無力の疲弊したウイルス特異的CD8+ T細胞における抗ウイルスサイトカイン産生を増大させた。処置の後に、IFN−γを産生するDbGP33−41 CD8+ T細胞およびDbGP276−286 CD8+ T細胞の数は、著しく増加した(図4A)が、より多い数のDbNP396−404特異的CD8+ T細胞、KbNP205−212特異的CD8+ T細胞、DbNP166−175特異的CD8+ T細胞、およびDbGP92−101特異的CD8+ T細胞がまた、処置マウスにおいて検出された(図4A)。コントロールの未処置マウスにおけるDbGP276−286特異的CD8+ T細胞の20%と比較して、処置マウス由来のDbGP276−286特異的CD8+ T細胞の50%が、IFN−γを産生し得る(図4B)。しかし、処置マウス由来のDbGP276−286特異的CD8+ T細胞によって産生されたIFN−γおよびTNF−αのレベルは、完全に機能的なDbGP276−286特異的記憶細胞よりも低かった(図4C)。
【0137】
PD−1阻害はまた、無力の細胞溶解活性を増大させ、ウイルス特異的CD8+ T細胞を疲弊させた。ウイルス特異的CD8+ T細胞のエキソビボ細胞溶解活性を、51Cr放出アッセイ(Wherryら、2003.J.Virol.77:4911−27)を使用して処置後に検出した。ウイルス力価は、処置の2週間後に、未処置マウスと比較して脾臓において約3倍、肝臓において4倍、肺において2倍、そして血清において2倍減少した(図4E)。
【0138】
したがって、これらの結果は、PD−1経路の遮断が慢性ウイルス感染に対するCTL末梢性寛容を破壊すること、およびCD4+ T細胞のヘルプが欠乏した疲弊したCD8+ T細胞が不可逆的に活性化されないことを示す。
【0139】
(実施例2:抗ウイルスワクチンおよびPD−1インヒビターの投与)
持続感染中にT細胞応答をブーストするための1つのアプローチは、治療用ワクチン接種である。このアプローチについての理論的根拠は、内因性抗原が慢性ウイルス感染中に最適かまたは免疫原性の様式で与えられる可能性がないこと、およびワクチンの形態で抗原を提供することがウイルス特異的T細胞およびウイルス特異的B細胞に対するより有効な刺激を提供し得ることである。上記慢性LCMVモデルを使用して、マウスに、治療用ワクチン(VVGP33)としてLCMV GP33エピトープを発現する組換えワクシニアウイルスを投与した。その治療用ワクチンは、いくつかの慢性的に感染したマウスにおいてCD8+ T細胞応答の適切な増強をもたらした。上記治療用ワクチンを受容した9匹の慢性的に感染したマウスのうちの4匹は、陽性の応答を示したが、コントロールマウスは、GP33に対する免疫応答の有意な増大を有さなかった。この治療用ワクチン接種をPD−L1インヒビターと組み合せた場合、LCMV特異的T細胞応答は、単独のどの処置と比較してもより大きいレベルまでブーストされ、そして組み合せた処置の効果は、相加的なものよりも大きかった。
【0140】
(実施例3:PD−1 RNAiを使用した慢性的に感染したマウスにおけるPD−1経路の阻害)
RNA干渉(RNAi)は、哺乳動物細胞において遺伝子発現をサイレンシングし得る。長い二本鎖RNA(dsRNA)が、細胞に導入され、そして次に、特異的mRNA分子または小さい群のmRNAを標的とするより小さいサイレンシングRNA(siRNA)へとプロセシングされる。この技術は、抗体が機能的ではない状況において特に有用である。例えば、RNAiは、特有のスプライス改変体がPD−1およびCTLA−4の可溶性形態を産生する状況において使用され得る。
【0141】
PD−1サイレンサーRNAを、市販のsiRNA発現ベクター(例えば、pSilencerTM発現ベクターまたはpSilencerTMアデノウイルスベクター(Ambion、Austin、TX)に挿入する。次いでこれらのベクターを、インビボまたはエキソビボで標的である疲弊したT細胞と接触させる(実施例4を参照のこと)。
【0142】
(実施例4:疲弊したT細胞のエキソビボでの若返り(rejuvenation))
ウイルス特異的な疲弊したCD8+ T細胞を、磁性ビーズまたは密度勾配遠心分離(density centrifugation)を使用してLCMV−Cl−13に慢性的に感染したマウスから単離する。トランスフェクトしたCD8 T細胞を、PD−L1、PD−L2またはPD−1を標的とするモノクローナル抗体と接触させる。実施例1に記載する通り、PD−1経路の阻害は、CD8 T細胞の若返りを生じる。したがって、例えば、CD8+ T細胞増殖およびサイトカイン産生の増大が、存在する。これらの若返ったCD8+ T細胞を、上記感染したマウスに再度導入し、そしてウイルス量を、実施例1において記載するように測定する。
【0143】
(実施例5:新規のCD8+ T細胞若返り剤(rejuvenator)化合物のインビトロスクリーニング)
PD−1経路を調節する化合物は、慢性ウイルス感染によるCD8+ T細胞の疲弊を逆転するそれらの能力に基づくインビボスクリーニングアッセイおよびエキソビボスクリーニングアッセイにおいて同定され得る。
【0144】
疲弊したCD8+ T細胞を、LCMV−Cl−13に慢性的に感染したマウスから得て、次に試験化合物と接触させる。上記接触したT細胞から放出された抗ウイルスサイトカイン(例えば、IFN−γまたはTNF−α)の量を、例えば、ELISAまたは他の定量方法によって測定し、そして存在する場合、上記試験化合物と接触していない疲弊したT細胞から放出された抗ウイルスサイトカインの量を比較する。未処置の細胞における量と比較した処置細胞によって放出された抗ウイルスサイトカインの量の増加により、その化合物はT細胞活性を調節するのに有用なPD−1インヒビターと同定される。
【0145】
(実施例6:新規のCD8+ T細胞若返り剤化合物のインビボスクリーニング)
疲弊したCD8+ T細胞を、LCMV−Cl−13に慢性的に感染したマウスから得る。試験化合物を、上記感染したマウスに対して静脈内に投与する。処置マウスおよび未処置マウスの血清中に放出される抗ウイルスサイトカイン(例えば、IFN−γまたはTNF−α)の量を、例えば、ELISAまたは他の定量方法によって測定し、そしてその量を、比較する。未処置マウスにおける量と比較した処置マウスの血清において見出される抗ウイルスサイトカインの量の増加により、上記試験化合物はPD−1インヒビターと同定される。あるいは、ウイルス力価(例えば、血清ウイルス力価)が、上記試験化合物による処置の前後に決定され得る。
【0146】
(実施例7:持続HCV感染の免疫療法についてのモデルとしてのチンパンジー)
チンパンジーは、ヒトにおけるHCV持続のモデルを提供する。長寿命のウイルス持続を生じるT細胞免疫の欠損は、HCV特異的CD4+ Tヘルパー細胞および損なわれたかまたは変化したCD8+ Tエフェクター細胞活性の欠損の両方を誘導する。持続的に感染したチンパンジーを、CTLA−4、PD−1、またはその2つの組み合せに対する抗体によって処置する。組換え構造的HCVタンパク質および組換え非構造的HCVタンパク質を使用してワクチン接種と組み合わせた上記阻害性経路の遮断の効力、ならびにこのようなストラテジーがウイルス特異的記憶T細胞の頻度および寿命を向上させ得るか否かを、決定する。T細胞免疫の欠損は、持続的に感染したヒトおよびチンパンジーにおいて専らHCV特異的である。感染したチンパンジーの血液および肝臓を、CTLA−4、PD−1、BTLAおよびそれらのリガンドの発現ならびにTreg細胞の存在について調べる。次いで、抗ウイルス活性は、これらの分子によってシグナリングを遮断するヒト化モノクローナル抗体をチンパンジーに送達することによって回復され得る。
【0147】
持続的に感染したチンパンジーを、ヒト化αCTLA−4抗体(MDX−010、Medarex)またはαPD−1抗体によって処置する。MDX−010の最初の用量は、0.3mg/kgであり、その用量は、次いで2週間後に1.0mg/kgであり、次いで3週間の間隔で3mg/kg、10mg/kg、30mg/kgである。同時阻害性分子に対する抗体による処置後に、体液性免疫応答および細胞性免疫応答ならびにHCV RNA量を、測定する。サンプルを、1週目、2週目、3週目、5週目、および8週目に回収し、次いで1ヶ月間隔で回収する。サンプルは、以下を含む:1)トランスアミナーゼ、自己抗体、HCVに対する中和抗体、およびサイトカイン応答の分析のための血清、2)ウイルス量およびゲノム進化のための血清、3)免疫、補助刺激/阻害性レセプターの発現および機能のインビトロ測定のためのPBMC、4)肝臓内のリンパ球およびRNAの単離のための新鮮な(固定されていない)肝臓、ならびに5)組織学および免疫組織化学的分析のための固定された(ホルマリン/パラフィン包埋された)肝臓。局所のリンパ節はまた、免疫組織化学技術および分子的技術によって同時阻害性分子およびスプライス改変体の発現を評価するために2つまたは3つの時点にて回収する。これらの治療の安全性の効力および安全性を評価するためのアッセイを、本明細書中で記載するように行う。
【0148】
HCV抗原によるワクチン接種がPD−1の対する抗体の治療効果を強化するか否かを決定するために、チンパンジーを、以下の通りに処置する:1)0週間、4週間、および24週間での組換えエンベロープ糖タンパク質E1およびE2(MF59アジュバントにおける)ならびに他のタンパク質(ISCOMSと一緒に処方されたコア+NS 3、NS 4、およびNS 5)による筋肉内免疫化;2)1)において使用したワクチンを用いるが、αCTLA−4抗体との同時投与による筋肉内免疫化(ワクチンが与えられる場合、それぞれ体重1kgあたり30mg、静脈内に0週目、4週目、および24週目);3)αPD−1(またはBTLA)抗体でCTLA−4抗体を置換することを除いて2)と同一;4)CTLA−4抗体とPD−1(またはBTLA)抗体との組み合せをそのワクチンに加えて使用することを除いて群2および群3と同一。HCV特異的T細胞応答およびHCV特異的B細胞応答を、免疫化後に1年間にわたって1ヶ月間隔でモニタリングする。
【0149】
この分析においてHCV−テトラマー+および全T細胞に対して調べたマーカーは、分化のマーカー(例えばCD45RA/RO、CD62L、CCR7、およびCD27)、活性化のマーカー(例えばCD25、CD69、CD38、およびHLA−DR)、生存/増殖のマーカー(例えばbcl−2およびKi67)、細胞傷害の可能性のマーカー(例えば、グランザイムおよびパーフォリン)、およびサイトカインレセプターのマーカー(CD122およびCD127)を含む。興味深い相互関係が、ケモカインIP−10の治療前のレベルとPEG IFN−γ/リバビリンに対する応答との間に存在する。IP−10レベルを、ネガティブな調節経路またはHCV特異的T細胞応答とIP−10レベルとの間の潜在的な相関関係を調査するために測定する。PBMCにおける阻害性レセプターおよびリガンドの発現を、フローサイトメトリーによって行う。
【0150】
(実施例8:反応性リンパ組織におけるPD−1免疫染色)
(材料)
症例の材料を、施設の方針に従ってBrigham & Women’s Hospital、Boston、MAから得た。全ての診断は、World Health Organization Lymphoma Classificationシステム(Jaffe ESら、2001)に記載される組織学的特徴および免疫表現型の特徴に基づき、そして全ての場合において、診断材料は、血液病理学者によって再評価された。
【0151】
(免疫染色)
PD−1の免疫染色を、ホルマリン固定したパラフィン包埋組織切片に対して、マイクロ波抗原賦活後に先に記載される(Jones Dら、1999;Dorfman DMら、2003)ような標準的な間接アビジン−ビオチン西洋ワサビペルオキシダーゼ法およびジアミノベンジジン発色を使用し、10mMクエン酸緩衝液(pH6.0)において先に記載した抗ヒトPD−1モノクローナル抗体(2H7;5)を用いて行った。症例を、少なくとも25%の腫瘍性細胞が陽性の染色を示した場合、PD−1に対して免疫反応性と見なした。PD−1染色を、研究した全ての症例について同一のタンパク質濃度まで希釈したマウスIgGアイソタイプコントロール抗体の染色と比較して、染色の特異性を確かめた。
【0152】
PD−1に対するモノクローナル抗体2H7を、反応性リンパ組織(胸腺)のホルマリン固定したパラフィン包埋検体ならびにさまざまなB細胞リンパ増殖性障害およびT細胞リンパ増殖性障害の症例を染色するために使用した。反応性の変化(濾胞性過形成を含む)を示す扁桃腺の検体において、胚中心における優性に小さいリンパ球のサブセットは、濾胞間T細胞領域において見られる稀なPD−1陽性細胞を伴って、PD−1についての細胞質染色を示した。胚中心におけるPD−1染色パターンは、CD3(pan−T細胞マーカー)に対する抗体によって見られるものと実質的に同一であったのに対し、CD20(pan−B細胞マーカー)に対する抗体は、大多数の胚中心B細胞を染色した。同様の結果が、反応性のリンパ節および脾臓の組織切片において見られた。PD−1染色は、成人の胸腺において観察されなかった。
【0153】
(実施例9:B細胞リンパ増殖性障害およびT細胞リンパ増殖性障害のパラフィン包埋組織切片におけるPD−1免疫染色)
PD−1発現についてさまざまなB細胞リンパ増殖性障害およびT細胞リンパ増殖性障害を、研究した;その結果を、表1にまとめる。前駆Bリンパ芽球性白血病/リンパ芽球性リンパ腫の代表的な症例、ならびに多くの濾胞起源のB細胞非ホジキンリンパ腫(6症例の濾胞性リンパ腫および7症例のバーキットリンパ腫を含む)を含むさまざまな成熟B細胞のリンパ増殖性障害を含む42症例のB細胞リンパ増殖性障害を、PD−1発現について調べた。B細胞リンパ増殖性障害は、PD−1についての染色を示さなかった。いくつかの症例において、非腫瘍性の反応性リンパ組織が、存在し、そして扁桃腺および上に記載した他の反応性リンパ組織において見られるようなPD−1染色パターンを示した。
【0154】
同様に、25症例のホジキンリンパ腫(11症例の古典的なホジキンリンパ腫および14症例のリンパ球優勢型ホジキンリンパ腫を含む)において、腫瘍性細胞は、PD−1についての染色を示さなかった。興味深いことに、14症例全てのリンパ球優勢型ホジキンリンパ腫において、腫瘍性CD20陽性L&H細胞を囲むT細胞は、リンパ球優勢型ホジキンリンパ腫においてCD57+ T細胞について記載した染色パターンと同様に、PD−1に対して免疫反応性であった。これらのPD−1陽性細胞は、存在する全CD3+ T細胞集団のサブセットであった。
【0155】
さまざまなT細胞リンパ増殖性障害を、PD−1の発現について研究した;その結果を、表1にまとめる。前駆T細胞リンパ芽球性白血病/リンパ芽球性リンパ腫(未熟なT細胞の未熟なT細胞の新生物)の症例は、末梢の胸腺後(post−thymic)T細胞の新生物(T細胞前リンパ球性白血病、末梢性T細胞リンパ腫、不特定の未分化大細胞型リンパ腫、および成人T細胞白血病/リンパ腫の症例を含む)であったので、PD−1について陰性であった。対照的に、19症例全ての血管免疫芽球性リンパ腫は、汎T細胞マーカー(例えば、CD3)に対して免疫反応性でもあるPD−1陽性細胞の病巣を含んだ。PD−1陽性細胞は、拡大したCD21+濾胞性樹状細胞(FDC)ネットワークの病巣(血管免疫芽球性リンパ腫の特性)において一貫して見出される。
【0156】
【表1】

略語:B−LL/LL−前駆B細胞リンパ芽球性リンパ腫/リンパ芽球性白血病;CLL−慢性リンパ性白血病;MCL−マントル細胞リンパ腫;FL−濾胞性リンパ腫;MZL−辺縁帯リンパ腫;HCL−へアリー細胞白血病;DLBCL−びまん性大細胞型B細胞リンパ腫;BL−バーキットリンパ腫;LPL−リンパ形質細胞性リンパ腫;MM−多発性骨髄腫;T−LL/L−前駆Tリンパ芽球性白血病/リンパ芽球性リンパ腫;T−PLL−T細胞前リンパ球性白血病;AIL−血管免疫芽球性リンパ腫;PTCL−末梢性T細胞リンパ腫、不特定;ALCL−未分化大細胞リンパ腫;ATLL−成人T細胞白血病/リンパ腫。
*免疫反応性の症例の数/症例の総数
**PD−1陽性細胞は、14/14症例において腫瘍性L&H細胞の周りにロゼットを形成する。
【0157】
(実施例10:HIV特異的ヒトCD8 T細胞上のPD−1発現を研究するための一般的方法)
以下の方法を、実施例11〜14で詳述する実験を行うために使用した。
【0158】
(研究被験体)
慢性のクレード(clade)C HIV−I感染を有する研究参加者を、McCord Hospital、Durban、South Africa、およびSt.Mary’s Hospital、Mariannhill、South Africaにおける外来診療所から募った。末梢血を、このコホートの65人の被験体の全員が分析時に抗レトロウイルス治療ナイーブであったから得た。被験体を、構築された10種のクラスIテトラマーに適合するそれらの発現したHLA対立遺伝子に基づいて加入に関して選択した(下を参照のこと)。上記コホートのウイルス量の中央値は、血漿1mlあたり42,800のHIV−I RNAコピー(163〜750,000の範囲)であり、そして絶対的CD4数の中央値は、362(129〜1179の範囲)であった。感染の持続期間に関する情報は、入手可能ではなかった。全ての被験体は、その施設の施設内審査委員会によって承認された上記研究についてのインフォームドコンセントに署名した。
【0159】
(PD−1抗体およびPD−L1抗体の構築)
ヒトPD−L1に対するモノクローナル抗体(29E.2A3、マウスIgG2b)およびPD−1に対する抗体(EH12、マウスIgG1)を、先に記載したように調製し、そしてそれらの抗体は、PD−1:PD−L1相互作用を遮断することが示された。
【0160】
(MHCクラスIテトラマー)
先に記載される(Airman JDら、1996)ように合成した10種のHIV MHCクラスIテトラマーを、この研究のために使用した:A*0205 GL9(p24、GAFDLSFFL;配列番号1)、A*3002 KIY9(インテグラーゼ、KIQNFRVYY;配列番号2)、B*0801 DI8(p24、DIYKRWII;配列番号3)、B*0801 FL8(Nef、FLKEKGGL;配列番号4)、B*4201 RM9(Nef、RPQVPLRPM;配列番号5)、B*4201 TL9(p24、TPQDLNTML;配列番号6)、B*4201 TL10(Nef、TPGPGVRYPL;配列番号7)、B*4201 YL9(RT、YPGIKVKQL;配列番号8)、B*8101 TL9(p24、TPQDLNTML;配列番号9)、およびCw0304 YL9(p24、YVDRFFKTL;配列番号10)。A*0205を発現するプラスミド構築物、A*3002を発現するプラスミド構築物、およびCw*0304を発現するプラスミド構築物は、寛大にもDr.Eugene RavkovおよびDr.John Airman、NIH Tetramer Core Facility、Atlanta、Georgiaによって提供された。
【0161】
(HLAクラスIテトラマー染色および表現型分析)
新鮮に単離した末梢血単核細胞(PBMC、50万個)を、テトラマーによって37℃にて20分間染色した。次いで、その細胞を、リン酸緩衝化生理食塩水(PBS)によって1回洗浄し、ペレットにし、そしてフルオレセインイソチオシアネート(FITC)結合体化抗CD8(Becton Dickinson)、フィコエリトリン結合体化抗PD−1(クローンEH12)、およびViaProbe(Becton Dickinson)によって直接染色した。細胞を、室温にて20分間インキュベートし、PBSにおいて1回洗浄し、そして1%パラホルムアルデヒドを含む200μl PBSに懸濁し、そして蛍光活性化セルソーター(FACSCalibur、Becton Dickinson)において取得した。最低で100,000イベントを、FACSCaliburにおいて獲得した。
【0162】
(CFSE増殖アッセイ)
100万個の新鮮に単離したPBMCを、PBSにおいて2回洗浄し、ペレットにし、そして1mlの0.5μMカルボキシ−フルオレセインジアセテート,スクシンイミジルエステル(CFSE、Molecular Probes)に37℃にて7分間懸濁した。その細胞を、PBSにおいて2回洗浄し、1ml R10培地(グルタチオン、ペニシリン、ストレプトマイシン、および10%ウシ胎仔血清[FCS]を補充したRPMI 1640)に懸濁し、そして24ウェルプレートのうちの1つのウェルに蒔いた。最初の研究は、0.2μg/mlの最終濃度のペプチドが最適な増殖性応答をもたらしたことを示し、したがってこれは、各アッセイに使用したウェルにおける最終ペプチド濃度であった。ネガティブコントロールウェルは、培地単独中のPBMC、または精製した抗PD−L1(10μg/ml)を含む培地中のPBMCからなり、そしてポジティブコントロールウェルを、10μg/mlのフィトヘマグルチニン(phytohemagluttinin)(PHA)によって刺激した。37℃のインキュベーターにおいて6日間インキュベートした後、その細胞を、2ml PBSによって洗浄し、そしてPE結合体化MHCクラスIテトラマー、ViaProbe(Becton Dickinson)、および抗CD8−APC抗体によって染色した。細胞を、FACSCaliburにおいて獲得し、そしてCellQuest(登録商標)ソフトウェア(Becton Dickinson)によって分析した。細胞を、ViaProbe− CD8+リンパ球についてゲート選別(gate)した。テトラマー+細胞の増加倍率(fold increase)を、ペプチドの存在下におけるCD8+テトラマー+細胞の%をペプチド刺激の非存在下におけるCD8テトラマー細胞の%で除算することによって算出した。
【0163】
(統計分析)
スピアマン相関、マン−ホイットニー検定、および対t検定(paired t−test)分析を、GraphPad Prism Version 4.0aを使用して行った。全ての検定は、両側であり、そしてp<0.05のp値を、有意であると見なした。
【0164】
(実施例11:HIV特異的CD8 T細胞上のPD−1発現)
優性のHIV−1クレードCウイルスCD8 T細胞エピトープに特異的な10のMHCクラスIテトラマーのパネルを、一般的なHLA対立遺伝子、ならびに、Gag、Nef、インテグラーゼ、およびRTにおける頻繁に標的される、エピトープ(Kiepiela Pら、2004)に基づいて合成、これらの細胞上の表面PD−1発現の直接的な可視化を可能にした。高分解能HLA分類を、コホート全体に対して行い、そして65人の抗レトロウイルス治療ナイーブの者のサブセットを、関連するHLA対立遺伝子の発現に基づいて研究のために選択した。合計で120の個々のエピトープを調べた。HIVテトラマー+細胞上のPD−1の代表的なエキソビボ染色を、図5Aに示す。PD−1発現は、これらのテトラマー+細胞上に迅速に出現し、そして同じ個体由来の全CD8 T細胞集団におけるPD−1発現よりも有意に高い(p<0.0001);次に、テトラマー+ CD8 T細胞および全CD8 T細胞集団の両方におけるPD−1発現は、HIV血清反応陰性コントロールにおけるPD−1発現よりも有意に高かった(図5B)。試験した10個のテトラマーのうちの8個に関して、抗原特異的CD8細胞上の発現のレベルが100%である少なくとも1人の者を、同定した(図5C)。3〜25人の個体由来のPBMCを各HIVテトラマー応答について染色し、PD−1発現レベルの中央値は、テトラマー+細胞の68%〜94%の範囲であった。(図5C)。これらの知見を、テトラマー+細胞および全CD8 T細胞集団の両方におけるPD−1の平均蛍光強度(MFI)の分析によってさらに確かめた(図5B、図5C)。
【0165】
次に、複数の検出可能な応答を有する人におけるPD−1発現レベルに関してエピトープ特異的な差についての証拠が存在するか否かを、決定した。調べた65人のうち、16人は、それぞれ、3個と5個との間のテトラマー陽性応答を有した。PD−1発現は、16人の被験体のうちの3人について分析した各応答に関して、ほぼ同一であり、そして100%に近かった;しかし、その他の13人の個体は、上記エピトープに依存してPD−1発現の異なるパターンを示した(図5D)。これらのデータは、PD−1発現が単一の者由来の同時発生的なエピトープ特異的CD8 T細胞上に差次的に発現され得、抗ウイルス効力におけるエピトープ特異的な差を示す最近のデータ(Tsomides TJら、1994;Yang Oら、1996;Loffredo JTら、2005)とおそらく一致することを示した。
【0166】
(実施例12:PD−1発現とHIV疾患の進行との間の相関)
相関を、HIV特異的CD8 T細胞上のPD−1発現と、血漿ウイルス量およびCD4数(その両方は、HIV疾患の進行の指標である)との間において決定した。先の研究と一致して、テトラマー陽性細胞の数とウイルス量またはCD4数との間の相関は、何の有意な相関をも示さなかった(図6A、図6B)。対照的に、ウイルス量と、HIVテトラマー陽性細胞上のPD−1発現の%およびMFIの両方との有意にポジティブな相関(それぞれ、p=0.0013およびp<0.0001;図6A)が存在した。CD4数と、HIVテトラマー陽性細胞上のPD−1の%およびMFIとの間に、逆相関(それぞれ、p=0.0046およびp=0.0150;図6B)がまた存在する。試験したテトラマーは、これらの被験体におけるHIV特異的CD8 T細胞集団の画分のみを示すようであるので、全てのCD8細胞上のPD−1発現とこれらのパラメータとの間の相関をまた、調べた。ウイルス量と、全CD8 T細胞集団上のPD−1発現の%およびMFIとの間の有意にポジティブな相関(それぞれ、p=0.0021およびp<0.0001;図6C)が存在し、そして逆相関がまた、CD4数と、全CD8 T細胞集団上のPD−1発現の%およびMFIとの間において観察された(それぞれ、p=0.0049およびp=0.0006;図6D)。この同じ群において、CMV特異的CD8 T細胞上のPD−1発現を、5人の被験体において試験し、そして有意に少ないPD−1が、HIV特異的CD8 T細胞と比較してこれらの細胞上に発現され(CMVテトラマー+ PD−1+の23%という中央値、p=0.0036、データ示さず)、そしてその発現は、それらの同一の個体における大部分のCD8 T細胞とは異ならなかった。このことは、高いPD−1発現が全てのウイルス特異的CD8 T細胞の一様な特徴ではないことを示す。これらのデータは、慢性HIV感染における抗原の量の増加がCD8 T細胞上のPD−1の増大した発現を生じることを示唆し、そしてそのデータは、PD−1発現がCD8
T細胞の機能的な疲弊に関連する慢性LCMV感染におけるマウスのデータ(Barber DLら、2005)と一致する。さらに、それらは、複数のエピトープの分析を含む大規模研究における、HIV特異的CD8 T細胞とウイルス量またはCD4数のいずれかとの間の最初の明確な関連を提供する。
【0167】
(実施例13:PD−1発現とCD8 T細胞の記憶状態および機能との間の相関)
次に、PD−1発現を、CD8 T細胞の記憶状態および機能に関連する多くのさらなる表現型マーカー(CD27、CD28、CD45RA、CD57、CD62L、CD127、CCR7、パーフォリン、グランザイムB、およびKi67を含む)の構成において分析した(図7)。1人の個体由来のB*4201 TL9テトラマー+細胞におけるこれらのマーカーに対する代表的な染色を、図7Aに示し、そして13人の被験体について集められたデータを、図7Bに示す。4色よりも多いマルチパラメータフローサイトメトリーはKwaZulu Natalにおいて利用可能ではなかったので、これらの研究は、95%よりも大きいPD−1陽性であったテトラマー応答に限られた。上記HIVテトラマー+ PD−1+細胞は、高レベルのCD27およびグランザイムB、非常に低レベルのCD28、CCR7、および細胞内Ki67、低レベルのCD45RAおよびパーフォリン、ならびに中程度のレベルのCD57およびCD62Lを発現する(図7B)。これらのデータは、HIV特異的PD−1+ T細胞がエフェクター/エフェクター記憶表現型を提示することを示し、そしてそれは、先の報告のHIV特異的CD8 T細胞の歪んだ成熟(Champagne Pら、2001;Appay Vら、2002;Hess Cら、2004)と一致する。さらに、ウイルスの配列決定を、これらの細胞が免疫回避(Brown JAら、2003)を駆動していたか否かを決定するために行った。45個の評価したこれらのテトラマー陽性応答のうち、5個のみにおけるウイルスエピトープが、South AfricanクレードC共通配列と異なっており(データ示さず)、これは、これらの細胞が、インビボでほとんど選択圧を発揮しなかったこと示す。
【0168】
LCMVモデルを使用したマウスにおける先の実験は、抗PD−L1遮断抗体の注入によるPD−1/PD−L1相互作用のインビボ遮断がサイトカイン産生、殺傷能力、増殖能力、および、非常に著しいウイルス量の減少によって測定されるようなLCMV特異的CD8 T細胞の増強した機能性を生じることを示した(Barber DLら、2005)。
【0169】
(実施例14:HIV特異的CD8 T細胞の増殖に対するPD−1/PD−L1経路の遮断の効果)
HIV特異的CD8 T細胞はまた、損なわれた増殖能力を示す(Migueles SAら、2002;Lichterfeld Mら、2004)ので、PD−1/PD−L1の遮断がインビトロでこの機能を増強し得るか否かを、決定した。B*4201陽性個体からの代表的なデータを、図8Aに示す。培地単独、または抗PD−L1抗体を含む培地を伴う新鮮に単離したCFSE標識PBMCのインキュベーションは、培養の6日後にCFSEhiを保持したB*4201−TL9特異的CD8 T細胞の集団(1.2%のCD8 T細胞)の維持をもたらした。TL9ペプチド単独による6日間にわたるCFSE標識PBMCの刺激が、CFSElo B*4201 TL9テトラマー+細胞の4.8倍の拡大をもたらしたのに対し、抗PD−L1遮断抗体の存在下でのTL9ペプチドによるCFSE標識PBMCの刺激は、10.3倍のテトラマー+細胞の増加を生じる、TL9特異的細胞の増殖をさらに増強した。CFSE増殖アッセイを、精製した抗ヒトPD−L1遮断抗体の存在下および非存在下で28個のサンプルに対して行った。HIV特異的CD8+ T細胞の増殖の有意な増大が、ペプチド単独による刺激後における増殖の量と比較して、抗PD−L1遮断抗体を加えたペプチドの存在下で観察された(図8B;p=0.0006、対t検定)。抗PD−L1遮断抗体の存在下におけるテトラマー+細胞の増加倍率は、個体および所定の個体内のエピトープによって変化し(図8C)、それはまた、これらの応答の機能的疲弊の程度におけるエピトープ特異的な差を示唆する。
【0170】
(他の実施形態)
本発明は、その詳細な説明と組み合せて記載されているが、上記の説明は、例示することを意図し、そして添付の特許請求の範囲によって規定される本発明の範囲を限定しない。他の局面、利点、および改変は、添付の特許請求の範囲の範囲内である。
【特許請求の範囲】
【請求項1】
持続感染または癌の症状を軽減または予防する方法であって、その必要がある被験体に、該被験体におけるプログラム細胞死−1(PD−1)ポリペプチドの活性または発現を減少させる化合物を投与する工程を包含する、方法。
【請求項2】
前記持続感染は、ウイルス感染、細菌感染、真菌感染、マイコプラズマ感染、または寄生虫感染である、請求項1に記載の方法。
【請求項3】
前記ウイルス感染は、肝炎ウイルス、ヒト免疫不全ウイルス(HIV)、ヒトTリンパ球向性ウイルス(HTLV)、ヘルペスウイルス、エプスタイン−バーウイルス、またはヒトパピローマウイルスによる感染である、請求項2に記載の方法。
【請求項4】
前記寄生虫感染は、マラリアである、請求項2に記載の方法。
【請求項5】
前記細菌感染は、結核である、請求項2に記載の方法。
【請求項6】
前記癌は、血管免疫芽球性リンパ腫または結節性リンパ球優勢型ホジキンリンパ腫である、請求項1に記載の方法。
【請求項7】
前記化合物は、PD−1リガンド(PD−L1)またはPD−1リガンド2(PD−L2)の発現または活性を減少させる、請求項1に記載の方法。
【請求項8】
前記化合物は、PD−1とPD−L1との間の相互作用またはPD−1とPD−L2との間の相互作用を減少させる、請求項1に記載の方法。
【請求項9】
前記化合物は、前記被験体における細胞傷害性T細胞の活性を増大させる、請求項1に記載の方法。
【請求項10】
前記細胞傷害性T細胞活性は、サイトカイン産生、T細胞増殖、または感染因子クリアランスである、請求項9に記載の方法。
【請求項11】
前記感染因子は、ウイルス、細菌、真菌、マイコプラズマ、または寄生虫である、請求項10に記載の方法。
【請求項12】
前記T細胞は、癌特異的T細胞である、請求項9に記載の方法。
【請求項13】
前記サイトカインは、IFNγ、TNFα、またはIL−2である、請求項10に記載の方法。
【請求項14】
前記化合物は、抗PD−1抗体、抗PD−L1抗体、抗PD−L2抗体、抗PD−1 RNAi、抗PD−L1 RNAi、抗PD−L2 RNAi、抗PD−1アンチセンスRNA、抗PD−L1アンチセンスRNA、抗PD−L2アンチセンスRNA、ドミナントネガティブPD−1タンパク質、ドミナントネガティブPD−L1タンパク質、またはドミナントネガティブPD−L2タンパク質である、請求項1に記載の方法。
【請求項15】
前記抗体は、モノクローナル抗体、ヒト化抗体、脱免疫抗体、またはIg融合タンパク質である、請求項12に記載の方法。
【請求項16】
前記化合物は、低分子である、請求項1に記載の方法。
【請求項17】
前記被験体にワクチンを投与する工程をさらに包含する、請求項1に記載の方法。
【請求項18】
前記ワクチンは、アジュバントまたはプライムブースト注射を含む、請求項17に記載の方法。
【請求項19】
前記被験体に第2の化合物を投与する工程をさらに包含する、請求項1に記載の方法。
【請求項20】
前記第2の化合物は、抗ウイルス化合物、抗細菌化合物、抗真菌化合物、抗寄生虫化合物、抗炎症性化合物、抗腫瘍性化合物または鎮痛剤である、請求項19に記載の方法。
【請求項21】
前記第2の化合物は、細胞傷害性Tリンパ球抗原4(CTLA−4)またはBリンパ球およびTリンパ球のアテニュエーター(BTLA)の発現または活性を減少させる、請求項19に記載の方法。
【請求項22】
前記第2の化合物は、癌細胞量を減少させる、請求項19に記載の方法。
【請求項23】
前記第2の化合物は、抗CTLA−4抗体、抗BTLA抗体、抗CD28抗体、抗ICOS抗体、抗ICOS−L抗体、抗B7−1抗体、抗B7−2抗体、抗B7−H3抗体、または抗B7−H4抗体である、請求項19に記載の方法。
【請求項24】
前記被験体は、ヒトである、請求項1に記載の方法。
【請求項25】
持続感染または癌の症状を軽減または予防する方法であって、その必要がある被験体にCD28様ファミリーのメンバーの活性または発現を減少させる化合物を投与する工程を包含し、該CD28ファミリーメンバーが、PD−1、CTLA−4、BTLA、およびそれらの機能性フラグメントまたは改変体からなる群より選択される、方法。
【請求項26】
前記持続感染は、ウイルス感染である、請求項25に記載の方法。
【請求項27】
前記ウイルス感染は、肝炎ウイルス、ヒト免疫不全ウイルス(HIV)、ヒトTリンパ球向性ウイルス(HTLV)、ヘルペスウイルス、エプスタイン−バーウイルス、またはヒトパピローマウイルスのよる感染である、請求項26に記載の方法。
【請求項28】
前記化合物は、前記被験体における細胞傷害性T細胞活性を増大させる、請求項25に記載の方法。
【請求項29】
前記細胞傷害性T細胞活性は、サイトカイン産生、T細胞増殖、または感染因子クリアランスである、請求項28に記載の方法。
【請求項30】
前記化合物は、抗PD−1抗体、抗PD−L1抗体、抗PD−L2抗体、抗CTLA−4抗体、抗BTLA抗体、抗CD28抗体、抗ICOS抗体、抗ICOS−L抗体、抗B7−1抗体、抗B7−2抗体、抗B7−H3抗体、または抗B7−H4抗体である、請求項25に記載の方法。
【請求項31】
前記被験体にワクチンを投与する工程をさらに包含する、請求項25に記載の方法。
【請求項32】
前記被験体に第2の化合物を投与する工程をさらに包含する、請求項25に記載の方法。
【請求項33】
被験体において持続感染または癌の症状を軽減または予防する方法であって、該被験体に、抗原特異的T細胞におけるPD−1ポリペプチドの発現または活性を減少させる化合物と接触させた抗原特異的T細胞を投与する工程を包含する、方法。
【請求項34】
前記被験体は、抗原特異的B細胞におけるPD−1ポリペプチドの発現または活性を減少させる化合物と接触させた抗原特異的B細胞をさらに投与される、請求項33に記載の方法。
【請求項35】
前記T細胞は、自系供給源に由来する、請求項33に記載の方法。
【請求項36】
前記T細胞は、前記被験体と同じ種の被験体に由来する、請求項33に記載の方法。
【請求項37】
前記T細胞は、前記処置される被験体とは異なる種の被験体に由来する、請求項33に記載の方法。
【請求項38】
前記抗原特異的T細胞は、ウイルス抗原、細菌抗原、真菌抗原または寄生虫抗原または癌抗原に特異的である、請求項33に記載の方法。
【請求項39】
前記ウイルス抗原は、肝炎ウイルス、ヒト免疫不全ウイルス(HIV)、ヒトTリンパ球向性ウイルス(HTLV)、ヘルペスウイルス、エプスタイン−バーウイルス、またはヒトパピローマウイルスの抗原である、請求項38に記載の方法。
【請求項40】
T細胞の細胞傷害活性を増大させる方法であって、該T細胞と、PD−1ポリペプチドの活性または発現を減少させる化合物とを接触させる工程を包含する、方法。
【請求項41】
前記生物学的活性は、PD−1リガンド(PD−L1)またはPD−1リガンド2(PD−2L)の発現または活性を減少させることによって減少する、請求項40に記載の方法。
【請求項42】
前記化合物は、PD−1とPD−L1との間の相互作用またはPD−1とPD−L2との間の相互作用を減少させる、請求項40に記載の方法。
【請求項43】
前記細胞傷害活性は、サイトカイン産生、T細胞増殖、または感染因子クリアランスである、請求項40に記載の方法。
【請求項44】
前記化合物は、抗PD−1抗体、抗PD−L1抗体、抗PD−L2抗体、抗PD−1 RNAi、抗PD−L1 RNAi、抗PD−L2 RNAi、抗PD−1アンチセンスRNA、抗PD−L1アンチセンスRNA、抗PD−L2アンチセンスRNA、ドミナントネガティブPD−1タンパク質、ドミナントネガティブPD−L1タンパク質、またはドミナントネガティブPD−L2タンパク質である、請求項40に記載の方法。
【請求項45】
前記細胞と、抗PD−1抗体、抗PD−L1抗体、抗PD−L2抗体、抗CTLA−4抗体、抗BTLA抗体、抗CD28抗体、抗ICOS抗体、抗ICOS−L抗体、抗B7−1抗体、抗B7−2抗体、抗B7−H3抗体、または抗B7−H4抗体とを接触させる工程をさらに包含する、請求項40に記載の方法。
【請求項46】
持続感染または癌を有するか、あるいは持続感染または癌を有する危険性があると被験体を診断する方法であって、
(a)該被験体由来のサンプルを提供する工程であって、該サンプルが、免疫細胞を含む、工程;および
(b)該被験体由来の該サンプルにおけるPD−1の発現または活性を測定する工程であって、コントロールサンプルにおけるPD−1の発現または活性と比較したPD−1の発現または活性の増大により、持続感染または癌を有するか、あるいは持続感染または癌を有する危険性があると該被験体が同定される、工程;
を包含する、方法。
【請求項47】
持続感染または癌を有するか、あるいは持続感染または癌を有する危険性がある被験体の処置を選択する方法であって、
(a)免疫細胞を含む該被験体由来のサンプルを提供する工程;
(b)該免疫細胞におけるPD−1の発現または活性を測定する工程であって、コントロールサンプルにおけるPD−1の発現または活性と比較したPD−1の発現または活性における増大により、持続感染または癌を有するか、あるいは持続感染または癌を有する危険性があると該被験体が同定される、工程;
(c)持続感染または癌を有するか、あるいは持続感染または癌を有する危険性があると診断された該被験体に対する処置を選択する工程であって、該処置が、PD−1の発現または活性を減少させる化合物を含む、工程;
を包含する、方法。
【請求項48】
前記工程(b)は、抗原特異的免疫細胞を同定する工程をさらに包含し、該抗原は、ウイルス抗原、細菌抗原、寄生虫抗原、または真菌抗原である、請求項46または47に記載の方法。
【請求項49】
前記サンプルは、血液サンプル、組織生検、または骨髄サンプルである、請求項46または47に記載の方法。
【請求項50】
前記コントロール細胞は、持続感染または癌のいずれかを有することも、あるいは持続感染または癌のいずれかを有する危険性もない被験体に由来する、請求項46または47に記載の方法。
【請求項1】
持続感染または癌の症状を軽減または予防する方法であって、その必要がある被験体に、該被験体におけるプログラム細胞死−1(PD−1)ポリペプチドの活性または発現を減少させる化合物を投与する工程を包含する、方法。
【請求項2】
前記持続感染は、ウイルス感染、細菌感染、真菌感染、マイコプラズマ感染、または寄生虫感染である、請求項1に記載の方法。
【請求項3】
前記ウイルス感染は、肝炎ウイルス、ヒト免疫不全ウイルス(HIV)、ヒトTリンパ球向性ウイルス(HTLV)、ヘルペスウイルス、エプスタイン−バーウイルス、またはヒトパピローマウイルスによる感染である、請求項2に記載の方法。
【請求項4】
前記寄生虫感染は、マラリアである、請求項2に記載の方法。
【請求項5】
前記細菌感染は、結核である、請求項2に記載の方法。
【請求項6】
前記癌は、血管免疫芽球性リンパ腫または結節性リンパ球優勢型ホジキンリンパ腫である、請求項1に記載の方法。
【請求項7】
前記化合物は、PD−1リガンド(PD−L1)またはPD−1リガンド2(PD−L2)の発現または活性を減少させる、請求項1に記載の方法。
【請求項8】
前記化合物は、PD−1とPD−L1との間の相互作用またはPD−1とPD−L2との間の相互作用を減少させる、請求項1に記載の方法。
【請求項9】
前記化合物は、前記被験体における細胞傷害性T細胞の活性を増大させる、請求項1に記載の方法。
【請求項10】
前記細胞傷害性T細胞活性は、サイトカイン産生、T細胞増殖、または感染因子クリアランスである、請求項9に記載の方法。
【請求項11】
前記感染因子は、ウイルス、細菌、真菌、マイコプラズマ、または寄生虫である、請求項10に記載の方法。
【請求項12】
前記T細胞は、癌特異的T細胞である、請求項9に記載の方法。
【請求項13】
前記サイトカインは、IFNγ、TNFα、またはIL−2である、請求項10に記載の方法。
【請求項14】
前記化合物は、抗PD−1抗体、抗PD−L1抗体、抗PD−L2抗体、抗PD−1 RNAi、抗PD−L1 RNAi、抗PD−L2 RNAi、抗PD−1アンチセンスRNA、抗PD−L1アンチセンスRNA、抗PD−L2アンチセンスRNA、ドミナントネガティブPD−1タンパク質、ドミナントネガティブPD−L1タンパク質、またはドミナントネガティブPD−L2タンパク質である、請求項1に記載の方法。
【請求項15】
前記抗体は、モノクローナル抗体、ヒト化抗体、脱免疫抗体、またはIg融合タンパク質である、請求項12に記載の方法。
【請求項16】
前記化合物は、低分子である、請求項1に記載の方法。
【請求項17】
前記被験体にワクチンを投与する工程をさらに包含する、請求項1に記載の方法。
【請求項18】
前記ワクチンは、アジュバントまたはプライムブースト注射を含む、請求項17に記載の方法。
【請求項19】
前記被験体に第2の化合物を投与する工程をさらに包含する、請求項1に記載の方法。
【請求項20】
前記第2の化合物は、抗ウイルス化合物、抗細菌化合物、抗真菌化合物、抗寄生虫化合物、抗炎症性化合物、抗腫瘍性化合物または鎮痛剤である、請求項19に記載の方法。
【請求項21】
前記第2の化合物は、細胞傷害性Tリンパ球抗原4(CTLA−4)またはBリンパ球およびTリンパ球のアテニュエーター(BTLA)の発現または活性を減少させる、請求項19に記載の方法。
【請求項22】
前記第2の化合物は、癌細胞量を減少させる、請求項19に記載の方法。
【請求項23】
前記第2の化合物は、抗CTLA−4抗体、抗BTLA抗体、抗CD28抗体、抗ICOS抗体、抗ICOS−L抗体、抗B7−1抗体、抗B7−2抗体、抗B7−H3抗体、または抗B7−H4抗体である、請求項19に記載の方法。
【請求項24】
前記被験体は、ヒトである、請求項1に記載の方法。
【請求項25】
持続感染または癌の症状を軽減または予防する方法であって、その必要がある被験体にCD28様ファミリーのメンバーの活性または発現を減少させる化合物を投与する工程を包含し、該CD28ファミリーメンバーが、PD−1、CTLA−4、BTLA、およびそれらの機能性フラグメントまたは改変体からなる群より選択される、方法。
【請求項26】
前記持続感染は、ウイルス感染である、請求項25に記載の方法。
【請求項27】
前記ウイルス感染は、肝炎ウイルス、ヒト免疫不全ウイルス(HIV)、ヒトTリンパ球向性ウイルス(HTLV)、ヘルペスウイルス、エプスタイン−バーウイルス、またはヒトパピローマウイルスのよる感染である、請求項26に記載の方法。
【請求項28】
前記化合物は、前記被験体における細胞傷害性T細胞活性を増大させる、請求項25に記載の方法。
【請求項29】
前記細胞傷害性T細胞活性は、サイトカイン産生、T細胞増殖、または感染因子クリアランスである、請求項28に記載の方法。
【請求項30】
前記化合物は、抗PD−1抗体、抗PD−L1抗体、抗PD−L2抗体、抗CTLA−4抗体、抗BTLA抗体、抗CD28抗体、抗ICOS抗体、抗ICOS−L抗体、抗B7−1抗体、抗B7−2抗体、抗B7−H3抗体、または抗B7−H4抗体である、請求項25に記載の方法。
【請求項31】
前記被験体にワクチンを投与する工程をさらに包含する、請求項25に記載の方法。
【請求項32】
前記被験体に第2の化合物を投与する工程をさらに包含する、請求項25に記載の方法。
【請求項33】
被験体において持続感染または癌の症状を軽減または予防する方法であって、該被験体に、抗原特異的T細胞におけるPD−1ポリペプチドの発現または活性を減少させる化合物と接触させた抗原特異的T細胞を投与する工程を包含する、方法。
【請求項34】
前記被験体は、抗原特異的B細胞におけるPD−1ポリペプチドの発現または活性を減少させる化合物と接触させた抗原特異的B細胞をさらに投与される、請求項33に記載の方法。
【請求項35】
前記T細胞は、自系供給源に由来する、請求項33に記載の方法。
【請求項36】
前記T細胞は、前記被験体と同じ種の被験体に由来する、請求項33に記載の方法。
【請求項37】
前記T細胞は、前記処置される被験体とは異なる種の被験体に由来する、請求項33に記載の方法。
【請求項38】
前記抗原特異的T細胞は、ウイルス抗原、細菌抗原、真菌抗原または寄生虫抗原または癌抗原に特異的である、請求項33に記載の方法。
【請求項39】
前記ウイルス抗原は、肝炎ウイルス、ヒト免疫不全ウイルス(HIV)、ヒトTリンパ球向性ウイルス(HTLV)、ヘルペスウイルス、エプスタイン−バーウイルス、またはヒトパピローマウイルスの抗原である、請求項38に記載の方法。
【請求項40】
T細胞の細胞傷害活性を増大させる方法であって、該T細胞と、PD−1ポリペプチドの活性または発現を減少させる化合物とを接触させる工程を包含する、方法。
【請求項41】
前記生物学的活性は、PD−1リガンド(PD−L1)またはPD−1リガンド2(PD−2L)の発現または活性を減少させることによって減少する、請求項40に記載の方法。
【請求項42】
前記化合物は、PD−1とPD−L1との間の相互作用またはPD−1とPD−L2との間の相互作用を減少させる、請求項40に記載の方法。
【請求項43】
前記細胞傷害活性は、サイトカイン産生、T細胞増殖、または感染因子クリアランスである、請求項40に記載の方法。
【請求項44】
前記化合物は、抗PD−1抗体、抗PD−L1抗体、抗PD−L2抗体、抗PD−1 RNAi、抗PD−L1 RNAi、抗PD−L2 RNAi、抗PD−1アンチセンスRNA、抗PD−L1アンチセンスRNA、抗PD−L2アンチセンスRNA、ドミナントネガティブPD−1タンパク質、ドミナントネガティブPD−L1タンパク質、またはドミナントネガティブPD−L2タンパク質である、請求項40に記載の方法。
【請求項45】
前記細胞と、抗PD−1抗体、抗PD−L1抗体、抗PD−L2抗体、抗CTLA−4抗体、抗BTLA抗体、抗CD28抗体、抗ICOS抗体、抗ICOS−L抗体、抗B7−1抗体、抗B7−2抗体、抗B7−H3抗体、または抗B7−H4抗体とを接触させる工程をさらに包含する、請求項40に記載の方法。
【請求項46】
持続感染または癌を有するか、あるいは持続感染または癌を有する危険性があると被験体を診断する方法であって、
(a)該被験体由来のサンプルを提供する工程であって、該サンプルが、免疫細胞を含む、工程;および
(b)該被験体由来の該サンプルにおけるPD−1の発現または活性を測定する工程であって、コントロールサンプルにおけるPD−1の発現または活性と比較したPD−1の発現または活性の増大により、持続感染または癌を有するか、あるいは持続感染または癌を有する危険性があると該被験体が同定される、工程;
を包含する、方法。
【請求項47】
持続感染または癌を有するか、あるいは持続感染または癌を有する危険性がある被験体の処置を選択する方法であって、
(a)免疫細胞を含む該被験体由来のサンプルを提供する工程;
(b)該免疫細胞におけるPD−1の発現または活性を測定する工程であって、コントロールサンプルにおけるPD−1の発現または活性と比較したPD−1の発現または活性における増大により、持続感染または癌を有するか、あるいは持続感染または癌を有する危険性があると該被験体が同定される、工程;
(c)持続感染または癌を有するか、あるいは持続感染または癌を有する危険性があると診断された該被験体に対する処置を選択する工程であって、該処置が、PD−1の発現または活性を減少させる化合物を含む、工程;
を包含する、方法。
【請求項48】
前記工程(b)は、抗原特異的免疫細胞を同定する工程をさらに包含し、該抗原は、ウイルス抗原、細菌抗原、寄生虫抗原、または真菌抗原である、請求項46または47に記載の方法。
【請求項49】
前記サンプルは、血液サンプル、組織生検、または骨髄サンプルである、請求項46または47に記載の方法。
【請求項50】
前記コントロール細胞は、持続感染または癌のいずれかを有することも、あるいは持続感染または癌のいずれかを有する危険性もない被験体に由来する、請求項46または47に記載の方法。
【図1A】


【図1B】


【図1C】


【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図3A】


【図3B】


【図3C】


【図3D】


【図4A】


【図4B】


【図4C】


【図4D】


【図4E】


【図5A】


【図5B】


【図5C】


【図5D】


【図6A】


【図6B】


【図6C】


【図6D】


【図7A】


【図7B】


【図8A】


【図8B】


【図8C】




【図1B】


【図1C】


【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図3A】


【図3B】


【図3C】


【図3D】


【図4A】


【図4B】


【図4C】


【図4D】


【図4E】


【図5A】


【図5B】


【図5C】


【図5D】


【図6A】


【図6B】


【図6C】


【図6D】


【図7A】


【図7B】


【図8A】


【図8B】


【図8C】


【公開番号】特開2012−229213(P2012−229213A)
【公開日】平成24年11月22日(2012.11.22)
【国際特許分類】
【出願番号】特願2012−121491(P2012−121491)
【出願日】平成24年5月29日(2012.5.29)
【分割の表示】特願2008−515956(P2008−515956)の分割
【原出願日】平成18年6月8日(2006.6.8)
【出願人】(399052796)デイナ ファーバー キャンサー インスティチュート,インコーポレイテッド (36)
【出願人】(503146324)ザ ブリガム アンド ウィメンズ ホスピタル インコーポレイテッド (24)
【氏名又は名称原語表記】The Brigham and Women’s Hospital, Inc.
【出願人】(507403698)エモリー ユニバーシティ (2)
【出願人】(507403735)プレジデント アンド フェローズ オブ ハーバード カレッジ (15)
【Fターム(参考)】
【公開日】平成24年11月22日(2012.11.22)
【国際特許分類】
【出願日】平成24年5月29日(2012.5.29)
【分割の表示】特願2008−515956(P2008−515956)の分割
【原出願日】平成18年6月8日(2006.6.8)
【出願人】(399052796)デイナ ファーバー キャンサー インスティチュート,インコーポレイテッド (36)
【出願人】(503146324)ザ ブリガム アンド ウィメンズ ホスピタル インコーポレイテッド (24)
【氏名又は名称原語表記】The Brigham and Women’s Hospital, Inc.
【出願人】(507403698)エモリー ユニバーシティ (2)
【出願人】(507403735)プレジデント アンド フェローズ オブ ハーバード カレッジ (15)
【Fターム(参考)】
[ Back to top ]

