プロテアソーム活性化剤
【課題】プロテアソーム活性化剤を提供する。
【解決手段】リンゴ抽出物を有効成分とするプロテアソーム活性化剤、リンゴ抽出物を有
効成分とする酸化カルボニルタンパク抑制剤。
【解決手段】リンゴ抽出物を有効成分とするプロテアソーム活性化剤、リンゴ抽出物を有
効成分とする酸化カルボニルタンパク抑制剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、プロテアソーム活性化技術に関する。
【背景技術】
【0002】
近年、活性酸素による生体内の細胞や組織で見られる様々な酸化傷害が問題になっている。活性酸素は非常に反応性が高く、生体の様々な成分を破壊し、脳卒中、心筋梗塞、白内障、リウマチ、癌、胃潰瘍、皮膚におけるしわやしみなどの様々な疾患に関与することが明らかになっている(非特許文献1)。活性酸素を増加させる要因として、加齢、過度の運動、紫外線暴露、精神的ストレスなどが知られている。活性酸素が増加すると、生体内に酸化タンパク質、いわゆる異常タンパク質が蓄積し、前述したような様々な疾患を引き起こす(非特許文献2)。皮膚においては、特に紫外線暴露による酸化障害の影響が大きく、紫外線暴露により、表皮角化細胞や皮膚線維芽細胞のDNA損傷、皮膚の弾性成分であるエラスチンやコラーゲンの分解などが起こり、しわやしみの形成を促進することが知られている(非特許文献3)。
【0003】
これまで、活性酸素による酸化障害を防ぐために、抗酸化物質の摂取、適用により生体内の活性酸素を消去し、タンパク質の酸化を抑制するという試みがなされてきた。代表的な抗酸化物質として、トコフェロール類、カロテノイド類及びフラボノイド類などが知られており、これらのいくつかは食品や化粧品に配合されて利用されている。
しかしながら、抗酸化物質の摂取、適用は、生体内で発生する活性酸素の消去には関与するが、既に蓄積している異常タンパク質の除去には全く関与しない。したがって、生体内に蓄積した異常タンパク質が関与する種々の疾病の改善をするには蓄積している異常タンパク質の除去が必須となる。
【0004】
生体内の異常タンパク質を除去する酵素として、プロテアソームが知られている。プロテアソームは複雑な分子構成をした巨大な多成分複合体であり、近年その生体内における生理機能の研究が注目されている。プロテアソームは、タンパク質が立体構造を形成する過程で正常な折り畳みや分子集合に支障をきたした異常タンパク質の除去を行い、タンパク質の品質管理の役割を担うとともに、紫外線や酸化ストレスなどにより、変性や傷害を受けたタンパク質を除去することにより、ストレス応答にも密接に関係している(非特許文献4)。このように、プロテアソームは異常タンパク質を除去することにより、細胞の
恒常性を維持、監視する中心的役割を担う物質である。
【0005】
以上のようなことから、生体内のプロテアソーム活性を促進し、種々の疾病を予防及び改善する組成物が開発されている。例えば、マンネンタケの抽出物を含むプロテアソーム活性促進剤(特許文献1)、特定のペプチド化合物を含むプロテアソーム作用増強剤(特許文献2)、プロテアソーム活性促進作用をもつ大豆由来サポニンを含む異常タンパク質除去用組成物(特許文献3)、及びケール及び/又はその抽出物を含むプロテアソーム活性促進用組成物(特許文献4)が開発されている。
【0006】
さらに、本発明者は、大豆由来サポニンやケール及び/又はその抽出物のプロテアソーム活性促進成分が、生体内の異常タンパク質を除去するのみではなく、紫外線傷害を予防又は改善する作用をもつことを見出し、大豆由来のサポニンを含むことを特徴とする紫外線傷害予防又は改善用組成物(特許文献5)の開発を行っている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2002−29996号公報
【特許文献2】国際公開00/04042号パンフレット
【特許文献3】特開2002−179592号公報
【特許文献4】特開2004−91398号公報
【特許文献5】特開2004−131431号公報
【非特許文献】
【0008】
【非特許文献1】老化のメカニズムと制御、藤本大三郎編著、株式会社アイピーシー、平成5年6月30日
【非特許文献2】BIO Clinica、11巻、第5号、1996年
【非特許文献3】化粧品の有用性・評価技術の進歩と将来展望、日本化粧品技術者会編、薬事日報社、2001年3月31日
【非特許文献4】蛋白質 核酸 酵素、第44巻、第6号、766〜775頁、1999年、共立出版社
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、異常タンパクを除去するプロテアソームを活性化するプロテアソーム活性化剤を提供することを目的とする。
【課題を解決するための手段】
【0010】
リンゴ抽出物に着目して試験した結果、リンゴポリフェノールにプロテアソーム活性化作用及び酸化カルボニルタンパク抑制作用があることを知見したことに基づき、本発明を提案する。
【0011】
すなわち、本発明は、
(1)リンゴ抽出物を有効成分とするプロテアソーム活性化剤。
(2)リンゴ抽出物が、リンゴ由来のポリフェノールを含む、(1)に記載のプロテアソーム活性化剤。
(3)リンゴ抽出物が、リンゴ幼果の抽出物である(1)または(2)に記載のプロテアソーム活性化剤。
(4)リンゴ抽出物を有効成分とする酸化カルボニルタンパク抑制剤。
(5)リンゴ抽出物が、リンゴ由来のポリフェノールを含む、(4)に記載の酸化カルボニルタンパク抑制剤。
(6)リンゴ抽出物が、リンゴ幼果の抽出物である(4)または(5)に記載の酸化カルボニルタンパク抑制剤。
【発明の効果】
【0012】
本発明は、プロテアソーム活性を増強し、さらに、酸化カルボニルタンパクの生成を抑制する剤である。本発明のリンゴ抽出物は、紫外線に暴露されるとプロテアソームを活性化し、また、酸化カルボニルタンパク質の生成を抑制することから、紫外線暴露により生じた異常タンパク質が蓄積することにより生じる白内障、皮膚がん、皮膚におけるしわやしみなどの予防又は改善することができる。
【図面の簡単な説明】
【0013】
【図1】紫外線B波照射時のトリプシン様プロテアソーム活性を示すグラフ
【図2】紫外線B波照射時のキモトリプシン様プロテアソーム活性を示すグラフ
【図3】紫外線A波照射時のトリプシン様プロテアソーム活性を示すグラフ
【図4】紫外線A波照射時のキモトリプシン様プロテアソーム活性を示すグラフ
【図5】紫外線A波照射時のリンゴ抽出物(Appl’in)添加による酸化カルボニルタンパク抑制を示すグラフ
【図6】紫外線B波照射時のリンゴ抽出物(Appl’in)添加による酸化カルボニルタンパク抑制を示すグラフ
【図7】紫外線A波照射時のリンゴ抽出物(ポマクティブHFV)添加による酸化カルボニルタンパク抑制を示すグラフ
【図8】紫外線B波照射時のリンゴ抽出物(ポマクティブHFV)添加による酸化カルボニルタンパク抑制を示すグラフ
【図9】リンゴポリフェノール(ポマクティブHFV)を投与したヘアレスマウスに紫外線A・B波を照射した時の肝臓におけるトリプシン様プロテオソーム活性の変動を示すグラフ
【図10】リンゴポリフェノール(ポマクティブHFV)を投与したヘアレスマウスに紫外線A・B波を照射した時の肝臓におけるキモトリプシン様プロテオソーム活性の変動を示すグラフ
【図11】リンゴポリフェノール(ポマクティブHFV)を投与したヘアレスマウスに紫外線A・B波を照射した時の皮膚におけるトリプシン様プロテオソーム活性の変動を示すグラフ
【図12】リンゴポリフェノール(ポマクティブHFV)を投与したヘアレスマウスに紫外線A・B波を照射した時の皮膚におけるキモトリプシン様プロテオソーム活性の変動を示すグラフ
【図13】リンゴポリフェノール(ポマクティブHFV)を投与したヘアレスマウスに紫外線A・B波を照射した時の皮膚の酸化カルボニルタンパクの変動を示すグラフ
【図14】リンゴポリフェノール(ポマクティブHFV)を投与したヘアレスマウスに紫外線A・B波を照射した時の皮膚の酸化カルボニルタンパクの変動を観察した免疫染色病理組織標本の写真。
【発明を実施するための形態】
【0014】
本発明のプロテアソーム活性化剤及び酸化カルボニルタンパク抑制剤は、リンゴ抽出物を有効成分とし、前記リンゴ抽出物が、リンゴ果実の抽出物であることが好ましい。特に、リンゴ幼果抽出物に含まれるポリフェノールを、主成分とすることが好ましい。
【0015】
リンゴ抽出物には、ポリフェノール、有機酸、アミノ酸などが含まれることが知られている。
リンゴ抽出物は、血管機能改善作用を高めることが可能なBNP調節剤として該抽出物を有効成分として含有してなるBNP調節剤、血行促進剤(特開2007−008837号公報、特開2006−265220号公報)や飲料(特開2004−305087号公報)、化粧料配合剤(特開2001−187724号公報)、消臭剤成分(特開平11−319051号公報)、香料成分(特開平08−023939号公報)などに用いられることが知られている。
しかしながら、リンゴ抽出物およびリンゴ由来のポリフェノールについて、プロテアソーム活性化機能があることは知られていない。
【0016】
以下に、本発明のプロテアソーム活性化剤について、詳細に説明する。
本発明のプロテアソーム活性化剤は、ポリユビキチン化異常タンパク質を分解する酵素であるプロテアソームの活性化剤であって、リンゴ抽出物を有効成分とすることを特徴とする。
【0017】
リンゴ抽出物において、リンゴ(Malus pumila)の品種は、例えば、ふじ、国光、王林、紅玉、ジョナゴールド、デリシャス、さんさ、千秋などが挙げられ、特に制限されない。リンゴの抽出部位は、特に制限されず、例えば、果実、葉、幹、花などが挙げられ、好ましくは、果実である。前記果実は、例えば、未熟果(幼果)でも良く、完熟果でも良く、特に制限されない。抽出に用いる前記果実の部位は、特に制限されず、例えば、全果、果肉、果皮、種などが挙げられる。リンゴ抽出物は、これらの部位を、単独で、または2種以上組み合わせて抽出しても良い。
【0018】
リンゴ抽出物を抽出する方法は、特に制限されず、従来公知の方法を採用できる。抽出方法の具体例としては、例えば、以下のようであっても良い。まず、リンゴの全果を、水洗後、グラインダーなどにより粉砕する。この粉砕物を、ペクチナーゼ処理に供し、遠心分離後、抽出溶媒により分配ろ過して、リンゴ抽出物を調製しても良い。前記ペクチナーゼ処理としては、特に制限されないが、例えば、20〜60℃の温度条件化で、ペクチナーゼを10〜50ppm添加して行っても良い。抽出溶媒としては、特に制限されないが、例えば、ヘキサン、クロロホルムなどの有機溶媒が挙げられる。
【0019】
本発明において、リンゴ抽出物は、例えば、市販のリンゴ抽出物を用いても良く、リンゴ果実から抽出して調製しても良く、特に制限されない。
本発明のプロテアソーム活性化剤及び酸化カルボニルタンパク抑制剤は、リンゴ由来のポリフェノールを含むリンゴ抽出物が好ましい。
【0020】
ポリフェノールの分画方法は、特に制限されず、従来公知の方法を採用できる。ポリフェノールは、例えば、リンゴ抽出物をカラムに通液後、カラムの吸着物を溶出し、この溶出画分を減圧留去濃縮して分画しても良い。また、さらに、この濃縮液に粉末助剤を添加し、凍結乾燥または噴霧乾燥して、ポリフェノール粉末を調製しても良い。
【0021】
本発明において、ポリフェノールは、例えば、市販のリンゴ由来のポリフェノール含有物を用いても良く、リンゴ果実から抽出および分画して調製しても良く、特に制限されない。
【0022】
本発明のプロテアソーム活性化剤は、紫外線暴露により発生した活性酸素により産生された細胞内の変性タンパク質(異常タンパク質)を分解するプロテアーゼを活性化し、紫外線暴露による細胞傷害を抑制することにより、白内障、皮膚癌、皮膚におけるしわやしみなどの様々な疾患を予防及び改善することができる。また、酸化カルボニルタンパク抑制剤は、紫外線照射による酸化カルボニルタンパク質の生成を抑制することができる。
【実施例】
【0023】
(1)試料及び正常ヒト皮膚線維芽細胞の培養
[リンゴ抽出物試料]
リンゴ抽出物としては、
・アップルフェノンSH(アサヒフード アンド ヘルスケア、総ポリフェノール(UV 法)98%以上)
・Appl’in(清田産業、総ポリフェノール(UV法)80%以上)
・ポマクティブHFV(ユニテックフーズ、総ポリフェノール(UV法)90%以上)
をサンプルとし、5%ウシ胎児血清(FBS)及び1%ジメチルスルホキシド(DMSO)含有ダルベッコ改変イーグル培地(DMEM、GIBCO社製)に添加し、評価検体であるリンゴ抽出物含有液を作製した。
【0024】
[正常ヒト皮膚線維芽細胞の培養]
新生児由来正常ヒト皮膚線維芽細胞(NHFB、三光純薬)を線維芽細胞用培地(FBM、三光純薬)で37℃−5%CO2インキュベーターにて培養した。
FBMにヒト線維芽細胞増殖因子(1μg/ml)、インシュリン(5mg/ml)、ゲンタマイシン(50μg/ml)、アンフォテリシンB(50μg/ml)を添加して継代培養に用いた。本実験には集団倍加数(population doubling level:PDL)がPDL20〜40の若い細胞を紫外線B波照射の試験に使用し、PDL40〜60の老化した細胞を紫外線A波照射の試験に使用した。トリプシン処理で剥がした線維芽細胞の細胞数をコールターカウンターで計測し、200000cells/mlの細胞密度になるように調整した。
【0025】
(2)細胞培養と紫外線照射
[リンゴ抽出物含有液の紫外線B波傷害]
PDL20〜40の若い細胞を6ウェル平底プレートに105個/ウェルの細胞密度で播種し、24時間培養した。
紫外線照射前に、前記リンゴ抽出物含有液の最終濃度が10μg/mlとなるように添加し、24h培養した。培養液を廃棄し、細胞をHank’s(−)液(ハンクス緩衝塩類溶液、Ca2+、Mg2+非含有)で洗浄後、再度Hank’s(−)液を添加し、プレートに蓋をしない状態でUVBを2.5W/m2で3分間照射した(50mJ/cm2)。対照として、UVBを照射しない群の細胞も作製した。照射終了後、直ちにHank’s(−)液を評価検体であるリンゴ抽出物を10μg/ml含有する5%FBS及び1%DMSO含有DMEMに置換し、24h培養した。
【0026】
[リンゴ抽出物含有液の紫外線A波傷害]
PDL40〜60の老化した細胞を6ウェル平底プレートに105個/ウェルの細胞密度で播種し、24時間培養した。紫外線照射前に、前記リンゴ抽出物含有液の最終濃度が10μg/mlとなるように添加し、24h培養した。培養液を廃棄し、細胞をHank’s(−)液で洗浄後、再度Hank’s(−)液を添加し、プレートに蓋をしない状態でUVAを30W/m2で1.5時間照射した(15J/cm2)。対照として、UVAを照射しない群の細胞も作製した。照射終了後、直ちにHank’s液を評価検体であるリンゴ抽出物を10μg/ml含有する5%FBS及び1%DMSO含有DMEMに置換し、24h培養した。
【0027】
以後のプロテアソーム活性測定操作は紫外線B波および紫外線A波を照射した試験で共通している。
(3)細胞懸濁液回収、プロテアソーム活性溶液調整、タンパク濃度の測定
培養液を除去しPBS(−)で各ウェルを洗浄後、各ウェルにトリプシン-EDTA(Sigma)を800μl添加し、37℃で5分間処理して線維芽細胞をディッシュ底面から剥離させ、10%FBS含有DMEM1.5mlでトリプシン反応を終止した。溶液と一部底着したままの細胞についてはスクレーパー処理で細胞を15ml容遠沈管に回収した。1,500rpm 5minの条件で遠沈して培養液を除去、PBS(−)で洗浄し再び1,500rpm 5minの条件で遠沈してDMEM中の色素(フェノールレッド)を完全に除去した。
この細胞塊をホモジナイズBuffer(50mMトリス塩酸、1mM DTT、5mMMgCl2、5%(v/v)グリセリン、pH=7.5)300μlに懸濁させた。その後、氷冷中でホモジナイズ処理(UD−201超音波破砕装置、TOMY製を使用、条件は「OUT PUT 1、DUTY40、15secを2set」)した。ホモジナイズ溶液を1.5ml容エッペンチューブに全量移し、15,000rpmで10min遠心分離して上清をプロテアソーム活性溶液として回収した。
このプロテアソーム活性溶液について、Bradford法に準拠してBSA(ウシ血清アルブミン、SIGMA社製)換算で全タンパク量を求めた。
発色試薬はBio−Rad protein assay(脱イオン水で5倍希釈)を用いた。
平板96ウェルプレートに、
プロテアソーム活性溶液/BSA 溶媒:ホモジナイズBuffer 10μl
Bio−Rad protein assay(脱イオン水で5倍希釈) 200μl
を加えて10min室温にてプレートごとに撹拌反応した。吸光度590nmをプレートリーダーで計測し、BSA溶液で作成した検量線について全タンパク濃度を求めた。
【0028】
(4)プロテアソーム活性の測定
トリプシン様プロテアソーム活性測定用基質Boc−Leu−Arg−Arg−MCA
(t−ブチルオキシカルボニル−L−ロイシル−L−アルギニル−L−アルギニル−4−メチル−クマリル−7−アミド)(ペプチド研究所)、
キモトリプシン様プロテアソーム活性測定用基質Suc−Leu−Leu−Val−Tyr−MCA(キモトリプシン様プロテアソーム活性を測定するための基質として、サクシニル−L−ロイシル−L−ロイシル−L−バリル−L−チロシル−4−メチル−クマリル−7−アミド(ペプチド研究所))(ペプチド研究所)、をそれぞれ10mM(溶媒、DMSO)で調整し、30μlずつを分注して−20℃冷凍保存した。使用時に解凍し600μlの反応液で希釈して使用した。
蛍光分析用平板96ウェルプレートに以下の溶液をそれぞれ加えた。
1. 基質ペプチド(トリプシン様/キモトリプシン様) 10.5μl (蛍光分 析時の基質ペプチド濃度23.8μM)
2. 反応液(100mMトリス塩酸、1mM DTT、5mM MgCl2、pH=8.0) 25μl
3. 10mM ATP含有ホモジナイズBuffer 19.5μl(蛍光分析時のAT P濃度は0.975mM)
4. プロテアソーム活性サンプル(cell lysate) 20μl
37℃で1h撹拌反応した。反応終了後に、
5. 10%(w/v) SDS(反応停止液) 25μl
6. 100mMトリス塩酸(pH=9.0) 100μl (全量200μl/well)
として、プロテアソームによって基質ペプチドから遊離した7−アミノ−4−メチルクマリン(MCA)由来の蛍光強度(励起波長Ex380nm、蛍光波長Em440nm)を測定した。
【0029】
(5)データ処理
(蛍光強度/タンパク濃度)で算出されるプロテアソーム活性について、UV(−)のコントロール群を基準(1.00)とし、平均値で他の各群と比較した。
遊離した7−アミノ−4−メチルクマリンの蛍光強度を励起波長(Ex)380nm、吸収波長(Em)440nmで測定した。結果はリンゴ抽出物含有液を各濃度で処理した3試料の測定値から、平均±標準偏差を計算し、グラフ化した。
統計解析は多重比較検討としてDunnett test(vs UV A or UV B+ コントロール群**:p<0.01, *p<0.05)を行った。また、p値が0.05<p<0.1を有意傾向として表記した。
【実施例1】
【0030】
[紫外線B波照射時のプロテアソーム活性]
PDL26の若い状態の線維芽細胞を用いて、リンゴ抽出物のプロテアソーム活性化評価を行った。
試験群1 紫外線B波 非照射 コントロール群
試験群2 紫外線B波 照射 コントロール群
試験群3 紫外線B波 照射 10μg/mlアップルフェノンSH 添加
試験群4 紫外線B波 照射 10μg/mlAppl’in添加
試験群5 紫外線B波 照射 10μg/mlポマクティブHFV添加
【0031】
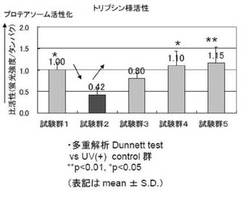
図1に紫外線B波照射時のトリプシン様プロテアソーム活性を、表1にDunnett testの結果を示す。
紫外線B波照射条件時のトリプシン様活性では、試験群2の紫外線B波照射群が試験群1の紫外線B波未照射群(p値0.0465)に対してプロテアソーム活性が低下していた。また、試験群4(p値0.0256)および試験群5(p値0.0169)が、試験群2に対して有意にプロテアソームが活性化したことから、リンゴ抽出物である「Appl’in」及び「ポマクティブHFV」は、若い状態の線維芽細胞のトリプシン様プロテアソームを活性化することが分かった。
【0032】
【表1】

【実施例2】
【0033】
図2に紫外線B照射時のキモトリプシン様プロテアソーム活性を、表2にDunnett testの結果を示す。
紫外線B照射時のキモトリプシン様活性では、試験群2の紫外線B波照射群が試験群1の紫外線B波未照射群(p値0.000734)に対してプロテアソーム活性が低下していた。また、試験群3(p値0.000739)、試験群4(p値0.0000255)および試験群5(p値0.0000511)のいずれもが試験群2の紫外線B波照射群に対して有意にプロテアソームが活性化したことから、リンゴ抽出物である「アップルフェノンSH」、「Appl’in」及び「ポマクティブHFV」は、若い状態の線維芽細胞のキモトリプシン様プロテアソームを活性化することが分かった。
【0034】
【表2】

【実施例3】
【0035】
[紫外線A波照射時のプロテアソーム活性]
PDL50の老化した状態の線維芽細胞を用いて、リンゴ抽出物のプロテアソーム活性化評価を行った。
試験群1 紫外線A波 非照射 コントロール群
試験群2 紫外線A波 照射 コントロール群
試験群3 紫外線A波 照射 10μg/mlアップルフェノンSH 添加
試験群4 紫外線A波 照射 10μg/mlAppl’in添加
試験群5 紫外線A波 照射 10μg/mlポマクティブHFV添加
【0036】
図3に紫外線A照射時のトリプシン様プロテアソーム活性を、表3にDunnett testの結果を示す。
紫外線A波照射条件時のトリプシン様活性では、試験群2の紫外線A波照射群が試験群1の紫外線A波未照射群(p値0.0137)に対してプロテアソーム活性が低下していた。また、試験群3は試験群2の紫外線A波照射群に対して有意(p値0.0347)にプロテアソ−ム活性が上がった。また、試験群4は有意傾向(p=0.0937)でプロテアソームが活性化した。このことから、リンゴ抽出物である「アップルフェノンSH」、「Appl’in」は、老化した状態の線維芽細胞のトリプシン様プロテアソームを活性化することが分かった。
【0037】
【表3】

【実施例4】
【0038】
図4に紫外線A照射時のキモトリプシン様プロテアソーム活性を、表4にDunnett testの結果を示す。
紫外線A照射時のキモトリプシン様活性では、試験群2の紫外線A波照射群が試験群1の紫外線A波未照射群(p値0.0681、有意傾向)に対してプロテアソーム活性が低下していた。また、試験群3は試験群2の紫外線A波照射群に対して有意(p値0.00370)にプロテアソ−ム活性が上がった。また、試験群4も有意(p=0.0120)でプロテアソームが活性化した。このことから、リンゴ抽出物である「アップルフェノンSH」、「Appl’in」は、老化した状態の線維芽細胞のキモトリプシン様プロテアソームを活性化することが分かった。
【0039】
【表4】

【0040】
以上の結果から、リンゴ抽出物には線維芽細胞の状態(若い或いは老化)を問わず、細胞内のプロテアソームを活性化させるという顕著な機能を有することが分かった。
【0041】
[酸化カルボニルタンパクの測定]
(1)タンパク濃度0.1〜0.4μg/μlの範囲で凍結保存していた線維芽細胞由来のサンプルを自然解凍後にトリクロロ酢酸(TCA)処理してタンパク沈殿し、20μgタンパク重量に相当するサンプルを用意した。そのサンプルについて、カルボニル化蛋白質測定キット(日研ザイル製)で酸化カルボニルタンパク量を定量した。具体的には、前処理したサンプル、スタンダード、コントロール、各200μlをウェルに分注し、プレートをシールして、4℃一晩反応させた。EIAバッファー 300μl/ウェルにて5回洗浄後に、全てのウェルに「希釈済みブロッキング試薬」を250μl/ウェル分注し、室温にて30分 インキュベート後にEIAバッファー 300μl/ウェルにて5回洗浄、そして、ビオチン標識-抗DNP抗体を200μl分注し、37℃にて1時間インキュベートした。EIAバッファー 300μl/ウェルにて5回洗浄、「希釈済み HRP標識-ストレプトアビジン」を200μl分注し、室温にて1時間インキュベートした。EIAバッファー 300μl/ウェルにて5回洗浄、「発色液」を200μl/ウェル分注し、室温にて各ウェルでの反応時間が5分になるよう調整し、「反応停止液」を100μl/ウェル分注し、反応を停止させた。マイクロプレートリーダーで450nmの吸光度を測定した。
【0042】
(2)データ処理
反応生成物であるp−ニトロアニリン由来の吸光度450nmを測定し、カルボニル化蛋白質測定キットに付属している標準カルボニルタンパクで作成した検量線に対する各サンプルのカルボニル化タンパクを測定した。
【実施例5】
【0043】
[紫外線A波照射時のAppl’in添加による酸化カルボニル抑制]
PDL50の老化した状態の線維芽細胞を用いて評価した。
試験群1 紫外線A波 非照射 コントロール群
試験群2 紫外線A波 照射 コントロール群
試験群3 紫外線A波 照射 10μg/mlAppl’in添加
【0044】
図5に紫外線A照射時の酸化カルボニル量を、表5にDunnett testの結果を示す。
紫外線A照射時の酸化カルボニル量は、試験群2の紫外線A波照射群が試験群1の紫外線A波未照射群(p値0.000645)に対して増加していた。また、試験群3の10μg/mlAppl’in添加群が試験群2の紫外線A波照射群に対して有意(p値0.00720)に酸化カルボニルを抑制していた。
【0045】
【表5】

【実施例6】
【0046】
[紫外線B波照射時のAppl’in添加による酸化カルボニル抑制]
PDL26の若い状態の線維芽細胞を用いて評価した。
試験群1 紫外線B波 非照射 コントロール群
試験群2 紫外線B波 照射 コントロール群
試験群3 紫外線B波 照射 10μg/mlAppl’in添加
【0047】
図6に紫外線B照射時の酸化カルボニル量を、表6にDunnett testの結果を示す。
紫外線B照射時の酸化カルボニル量は、試験群2の紫外線B波照射群が試験群1の紫外線B波未照射群(p値0.000214)に対して増加していた。また、試験群3の10μg/mlAppl’in添加群が試験群2の紫外線B波照射群に対して有意(p値0.00192)に酸化カルボニルを抑制していた。
【0048】
【表6】

【実施例7】
【0049】
[紫外線A照射時におけるポマクティブHFVの酸化カルボニルタンパク抑制]
PDL54の老化した線維芽細胞を用いて評価した。
試験群1 紫外線A波 非照射 コントロール群
試験群2 紫外線A波 照射 コントロール群
試験群3 紫外線A波 照射 10μg/mlポマクティブHFV添加
【0050】
図7に紫外線A波照射時の酸化カルボニル量を、表7にDunnett testの結果を示す。
紫外線A照射時の酸化カルボニル量は、試験群2の紫外線A波照射群が試験群1の紫外線A波未照射群(p値0.00230)に対して増加していた。また、試験群3の10μg/mlポマクティブHFV添加群が試験群2の紫外線A波照射群に対して有意(p値0.00151)に酸化カルボニルを抑制していた。
【0051】
【表7】

【実施例8】
【0052】
[紫外線B照射時におけるポマクティブHFVの酸化カルボニルタンパク抑制]
PDL27の若い線維芽細胞を用いて評価した。
試験群1 紫外線B波 非照射 コントロール群
試験群2 紫外線B波 照射 コントロール群
試験群3 紫外線B波 照射 10μg/mlポマクティブHFV添加
【0053】
図8に紫外線B波照射時の酸化カルボニル量を、表8にDunnett testの結果を示す。
紫外線B照射時の酸化カルボニル量は、試験群2の紫外線B波照射群が試験群1の紫外線B波未照射群(p値0.000139)に対して増加していた。また、試験群3の10μg/mlポマクティブHFV添加群が試験群2の紫外線B波照射群に対して有意(p値0.00193)に酸化カルボニルを抑制していた。
【0054】
【表8】

【0055】
以上の結果から、リンゴ抽出物であるAppl’inやポマクティブHFVは、線維芽細胞の状態(若い或いは老化)を問わず、いずれも紫外線惹起性の酸化カルボニルタンパクを抑制除去する効果に優れていることが分かった。
【実施例9】
【0056】
[光老化動物による試験]
紫外線A(UVA)波および紫外線B(UVB)波をヘアレスマウスに照射させてシワを形成させる試験系によりポマクティブHFVのシワの抑制および皮膚老化抑制効果について確認試験を行った。
導入時6週齢のヘアレスマウス(Hos:HR−1雌)を用いて試験を行った。
【0057】
(1)試験対象物の調製および投与
ヘアレスマウスの群分けは投与開始日に、一般状態が良好な動物を体重により、群間での差が無いように1群6匹に振り分けた。なお、各々の個体は1ゲージ/群で飼育とした。
マウス用飼料MF(オリエンタルバイオサービス製)に、それぞれポマクティブHFVを均一に混合処理し、自由摂取させた。投与群と配合成分の一覧を表9に示す。
【0058】
【表9】

【0059】
混餌飼料の投与は動物搬入直後から解剖18時間前までとした。
【0060】
(2)UV照射
UV照射は、動物を専用のケージに移し、1群ずつUVB20mJ/cm2およびUVA10J/cm2を照射した。照射は週三回とし、このサイクルを10週間繰り返した。
【0061】
(3)解剖
各群、本飼育期間終了翌日より18時間絶食させた後、氷冷したAvertin(2,2,2−トリブロモエタノール)0.5mg/kgBWを腹腔内投与して麻酔した。その後、皮膚背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位範囲で反射型レプリカ((有)アサヒバイオメッド製)を採取した。次いで開腹し解剖を行った。皮膚組織はメタカン固定液(メタノール:クロロホルム:酢酸=6:3:1(v/v/v))で浸潤、パラフィン包埋処理し、組織染色実験時に5μmの厚さでスライドガラスに貼付した。
【0062】
(4)皮膚形態観察シワ体積率計測
皮膚表面部の写真撮影と採取したレプリカの判定を行った。シワ形成度合を指標としてASA−03RXD((有)アサヒバイオメッド製)を用いてシワ体積率%(μm3/mm2/100) を算出した。
紫外線照射第4週目頃よりUV照射動物において、頭部の皮膚の軽度褐色化や頸部のしわの深さならびに後肢背部のしわがUV非照射動物に比較して目立つようになった。
解剖時の外観観察では、UV照射動物で顔、頸部および後肢背部のしわが明瞭に確認されたが、UV照射においても高濃度(0.06%)、中濃度(0.012%)および低濃度(0.006%)ポマクティブHFVを摂取したマウスではその症状は軽度であり、特に高濃度摂取動物のしわの深度が浅く、肉眼的にはしわの程度が皆無であった。また、ポマクティブHFV摂取動物は、コントロール群に比較して皮膚にしっとり感があり、特に高濃度摂取群でその症状は顕著に感じられた。
【0063】
表10に結果を示すが、紫外線照射により明確なシワの形成が認められた。特に、同一線量の紫外線照射条件下で 混餌群ではポマクティブHFVの濃度依存的にシワ抑制効果が有意に認められた。特に0.06%および0.012%混餌で有意にシワ体積率を抑制した。
【0064】
【表10】

【0065】
(5)マウス肝臓のプロテアソーム活性
測定試料の調整
上記の解剖で得たマウス肝臓を100mgから200mgの範囲で湿重量を秤量し、以下の条件でホモジナイズした。
【0066】
ホモジナイズ条件
肝臓:50mM Tris塩酸緩衝液(pH7.5,グリセロール、DTT、MgCl2含有)=1:3(w/v)
ホモジナイザー(UD−201超音波破砕装置、TOMY製を使用、条件は「OUT PUT 2、DUTY40、30secを2set」)。
【0067】
試験溶液の調整
このホモジネートを遠心分離(10,000g、30分間、4℃)して上澄み画分を採取し、これを再度遠心分離(20,000g、30分間、4℃)し、得られた上澄み画分をプロテアソーム活性測定試験溶液とした。
【0068】
タンパク質量の測定
Bradford法に準拠してBSA換算で全タンパク量を求めた。
発色試薬はBio−Radprotein assay(バイオラッド社)を用いた。平板96ウェルプレートに、プロテアソーム活性測定溶液1μl、ホモジナイズ緩衝液 9μl、Bio−Rad protein assay(脱イオン水で5倍希釈) 200μlを加えて10min室温にて撹拌して反応させた。次いで590nmの吸光度を、プレートリーダーを用いて測定した。次いで得られた吸光度からBSA溶液で作成した検量線を用いて全タンパク質濃度(0.7〜1.5μg/μlの範囲)を求めた。
【0069】
プロテアソーム活性の測定
トリプシン様プロテアソーム活性測定用基質Boc−Leu−Arg−Arg−MCA(ペプチド研究所)キモトリプシン様プロテアソーム活性測定用基質Suc−Leu−Leu−Val−Tyr−MCA(ペプチド研究所)をそれぞれ10mM(溶媒;DMSO)に調整し、30μlずつを分注して−20℃冷凍保存し、使用時に解凍し600μlの反応液で希釈して使用した。
蛍光分析用平板96ウェルプレートに以下の溶液をそれぞれ加えた。
1. 基質ペプチド(トリプシン様/キモトリプシン様) 10.5μl (蛍光分析 時の基質ペプチド濃度23.8μM)
2. 反応液(100mMトリス塩酸、1mM DTT、5mM MgCl2、pH=8.0) 25μl
3. 10mM ATP含有ホモジナイズBuffer 19.5μl(蛍光分析時のATP濃 度は0.975mM)
4. ホモジナイズBuffer 15μl
5. マウス肝臓プロテアソーム活性サンプル 5μl
37℃30分間撹拌反応。反応終了後に、
6. 10%(w/v) SDS(反応停止液) 25μl
7. 100mMトリス塩酸(pH=9.0) 100μl
1ウエル当たり全量200μlとして37℃30分間インキュベートし、基質ペプチドから遊離したMCA由来の蛍光強度(Ex380nm、Em440nm)を測定し、プロテアソーム活性を求めた。
【0070】
データ処理
蛍光強度/タンパク濃度 で算出されるプロテアソーム活性値を、紫外線非照射動物(UV(−))を対照(1.00)として活性値をもとめ、各動物個体の活性値を平均して、試験群の値として表した。
【0071】
測定結果
測定結果を表11、表12及び図9、図10、に示す。
【0072】
【表11】

【0073】
【表12】

【0074】
以上の試験結果から以下のことが明らかになった。
すなわち、
A.コントロール食群では、紫外線照射の有無でマウス肝臓のプロテアソーム活性に 有意な差は無かった。
B.トリプシン様活性は、ポマクティブHFV0.06%(p=0.0108)混餌 群で有意な活性上昇が確認された。
C.キモトリプシン様活性は、ポマクティブHFV0.012%(p= 0.0132)および0.06%(p=0.00000160)混餌群で有意な 活性上昇が確認された。
D.従ってポマクティブHFV投与によりマウス肝臓におけるプロテアソーム活性化 効果が確認できた。
すなわち、本発明により肝臓のプロテアソームが活性化され、異常タンパク質を除去する機能が高まり、種々の疾病予防に寄与する事が可能となった。
【0075】
(6)マウス皮膚のプロテアソーム活性の測定
測定試料の調整
次のホモジナイズ条件で背部ヒフ試料をホモジナイズ処理した。
【0076】
ホモジナイズ条件
背部皮膚(前足周縁):50mM Tris塩酸緩衝液(pH7.5、グリセロール、DTT、MgCl2 含有)=1:3(w/v)
ホモジナイザーを使用して試料調製した(UD−201超音波破砕装置、TOMY製を使用、条件は「OUT PUT 5(皮膚は肝臓よりも硬組織なので、激しいホジナイズを実施した、DUTY40、30secを2set」)。
【0077】
試験溶液の調整
得られたホモジネートを遠心分離(10,000g、30分間、4℃)し、上澄み画分を引き続き遠心分離(20,000g、30分間、4℃)した。得られた上澄み画分をプロテアソーム活性測定試験溶液とした。
【0078】
タンパク質量の測定
上記と同様に、Bradford法に準拠してBSA換算で全タンパク量を求めた。
発色試薬はBio−Radprotein assayを用いた。平板96ウェルプレートに、プロテアソーム活性測定溶液1μl、ホモジナイズ緩衝液 9μl、Bio−Rad protein assay(脱イオン水で5倍希釈) 200μlを加えて10min室温にて撹拌して反応させた。次いで590nmの吸光度をプレートリーダーを用いて測定した。次いで得られた吸光度からBSA溶液で作成した検量線を用いて全タンパク質濃度(0.7〜1.5μg/μlの範囲)を求めた。
【0079】
プロテアソーム活性の測定
トリプシン様プロテアソーム活性測定用基質Boc−Leu−Arg−Arg−MCA(ペプチド研究所)キモトリプシン様プロテアソーム活性測定用基質Suc−Leu−Leu−Val−Tyr−MCA(ペプチド研究所)をそれぞれ10mM(溶媒;DMSO)に調整し、30μlずつを分注して−20℃冷凍保存し、使用時に解凍し600μlの反応液で希釈して使用した。
蛍光分析用平板96ウェルプレートに以下の溶液をそれぞれ加えた。
1. 基質ペプチド(トリプシン様/キモトリプシン様) 10.5μl (蛍光分析時 の基質ペプチド濃度23.8μM)
2. 反応液(100mMトリス塩酸、1mM DTT、5mM MgCl2、pH=8.0) 25μl
3. 10mM ATP含有ホモジナイズBuffer 19.5μl(蛍光分析時のATP濃度 は0.975mM)
4. マウス皮膚プロテアソーム活性サンプル 20μl
37℃30分間撹拌反応。反応終了後に、
5. 10%(w/v) SDS(反応停止液) 25μl
6. 100mMトリス塩酸(pH=9.0) 100μl
1ウエル当たり全量200μlとして37℃30分間インキュベートし、基質ペプチドから遊離したMCA由来の蛍光強度(Ex380nm、Em440nm)を測定し、プロテアソーム活性を求めた。
【0080】
データ処理
蛍光強度/タンパク濃度 で算出されるプロテアソーム活性を、紫外線非照射動物(UV(−))を対照(1.00)としてもとめ、各動物個体の活性値の平均値を試験群の値として表した。
【0081】
測定結果
測定結果を表13、表14 及び図11、図12に示す。
【0082】
【表13】

【0083】
【表14】

【0084】
以上の試験結果から次の点が明らかとなった。
A.コントロール食群において、紫外線照射の有無でマウス皮膚のプロテアソーム活 性に有意な差は無かったが紫外線照射群の皮膚でプロテアソーム活性が低下する 傾向が認められた。
B.トリプシン様活性はポマクティブHFV0.06%混餌群(p=0.0153) で有意な活性上昇が確認された。
C.キモトリプシン様活性において、ポマクティブHFV0.06%混餌群(p= 0.0103)で有意な活性上昇が確認された。
D.以上の結果からポマクティブHFV投与によるマウス皮膚におけるプロテアソー ム活性化作用が証明された。
【0085】
従って、本発明により皮膚の異常タンパク質を除去する機能が高まり、種々の疾病予防に寄与する事が期待できる。
【0086】
(7)マウス皮膚の酸化カルボニルタンパクの抑制効果の確認
プロテアソーム活性化によって酸化タンパク質の一種であるカルボニル化タンパク質の抑制を確認した。
上記(3)で得たメタカン固定液浸潤してパラフィン包埋した5μmマウス皮膚切片を、免疫組織染色の手法を用いて評価した。抗体等の試薬はカルボニル化タンパク質免疫組織染色キット(株式会社シマ研究所)を用いた。
脱パラフィン処理、親水化は公知の方法に基づいて実施した。それぞれの皮膚切片サンプルに対し本キットに付属のDNPH溶液を室温で30分間反応させた。DNPHは2,4−ジニトロフェニルヒドラジンの略語である。DNPH反応終了後、2%塩酸を5分間、80%エタノールを5分間、100%エタノールを5分間、50%エタノール/50%酢酸を5分間、80%エタノールを1分間、蒸留水で1分間順次洗浄した。常温下0.3%過酸化水素含有メタノールで30分反応させて内因性ペルオキシダーゼを阻害した。水洗、10mMPBS(-)洗浄後、ブロッキング液2%BSA/PBS‐2%ヤギ血清を30分間ブロッキング反応、ブロッキング終了後にPBS(−)で5分間3回洗浄し、1次抗体(本キット付属のウサギ抗DNPポリクローナル抗体の100倍希釈、希釈液はブロッキング溶液)を1時間室温で反応させた。PBS(−)で2回洗浄し、ビオチン化二次抗体(ビオチン化抗ウサギ免疫グロブリンG;DAKO製)を200倍希釈したものを30分間室温で反応させた。PBS(−)で2回洗浄し、ABC試薬(アビジン−ビオチン複合体ABC-HRP;Dako製)を30分間室温にて反応させた。PBS(−)で2回洗浄し、発色試薬としてDAB(3,3-ジアミノベンジジンテトラヒドロクロライド:DAKO製)を用いて4分常温下で反応させた。水洗後、脱水、封入処理を行い、酸化カルボニル化タンパク質の病理組織標本を得た。
【0087】
得られた病理組織標本を顕微鏡で染色状況を観察し、DAB発色の程度をスコア評価(スコア0→酸化カルボニル無し、スコア1→酸化カルボニル僅かに形成、スコア2→酸化カルボニル形成、スコア3→酸化カルボニルが非常に多い)し、各群の平均値から酸化カルボニルタンパクの形成および抑制を評価した。上記組織標本は、酸化カルボニル化タンパク質の存在量に応じて、着色度合いが高まる。着色度合いに基づく評価結果を表15、図13に示す。また、各試験群の動物の評価スコアの病理組織を図14に示す。酸化カルボニル化タンパク質が多いものほど病理組織が濃く着色されていることが明らかである。
【0088】
【表15】

【0089】
染色標本の評価に基づく多重検定により、紫外線照射群では明確に酸化カルボニルタンパクが増加しており、試験群3から試験群5におけるポマクティブHFV摂取群では濃度依存的にマウス皮膚の酸化カルボニルタンパクの抑制が確認された。
【技術分野】
【0001】
本発明は、プロテアソーム活性化技術に関する。
【背景技術】
【0002】
近年、活性酸素による生体内の細胞や組織で見られる様々な酸化傷害が問題になっている。活性酸素は非常に反応性が高く、生体の様々な成分を破壊し、脳卒中、心筋梗塞、白内障、リウマチ、癌、胃潰瘍、皮膚におけるしわやしみなどの様々な疾患に関与することが明らかになっている(非特許文献1)。活性酸素を増加させる要因として、加齢、過度の運動、紫外線暴露、精神的ストレスなどが知られている。活性酸素が増加すると、生体内に酸化タンパク質、いわゆる異常タンパク質が蓄積し、前述したような様々な疾患を引き起こす(非特許文献2)。皮膚においては、特に紫外線暴露による酸化障害の影響が大きく、紫外線暴露により、表皮角化細胞や皮膚線維芽細胞のDNA損傷、皮膚の弾性成分であるエラスチンやコラーゲンの分解などが起こり、しわやしみの形成を促進することが知られている(非特許文献3)。
【0003】
これまで、活性酸素による酸化障害を防ぐために、抗酸化物質の摂取、適用により生体内の活性酸素を消去し、タンパク質の酸化を抑制するという試みがなされてきた。代表的な抗酸化物質として、トコフェロール類、カロテノイド類及びフラボノイド類などが知られており、これらのいくつかは食品や化粧品に配合されて利用されている。
しかしながら、抗酸化物質の摂取、適用は、生体内で発生する活性酸素の消去には関与するが、既に蓄積している異常タンパク質の除去には全く関与しない。したがって、生体内に蓄積した異常タンパク質が関与する種々の疾病の改善をするには蓄積している異常タンパク質の除去が必須となる。
【0004】
生体内の異常タンパク質を除去する酵素として、プロテアソームが知られている。プロテアソームは複雑な分子構成をした巨大な多成分複合体であり、近年その生体内における生理機能の研究が注目されている。プロテアソームは、タンパク質が立体構造を形成する過程で正常な折り畳みや分子集合に支障をきたした異常タンパク質の除去を行い、タンパク質の品質管理の役割を担うとともに、紫外線や酸化ストレスなどにより、変性や傷害を受けたタンパク質を除去することにより、ストレス応答にも密接に関係している(非特許文献4)。このように、プロテアソームは異常タンパク質を除去することにより、細胞の
恒常性を維持、監視する中心的役割を担う物質である。
【0005】
以上のようなことから、生体内のプロテアソーム活性を促進し、種々の疾病を予防及び改善する組成物が開発されている。例えば、マンネンタケの抽出物を含むプロテアソーム活性促進剤(特許文献1)、特定のペプチド化合物を含むプロテアソーム作用増強剤(特許文献2)、プロテアソーム活性促進作用をもつ大豆由来サポニンを含む異常タンパク質除去用組成物(特許文献3)、及びケール及び/又はその抽出物を含むプロテアソーム活性促進用組成物(特許文献4)が開発されている。
【0006】
さらに、本発明者は、大豆由来サポニンやケール及び/又はその抽出物のプロテアソーム活性促進成分が、生体内の異常タンパク質を除去するのみではなく、紫外線傷害を予防又は改善する作用をもつことを見出し、大豆由来のサポニンを含むことを特徴とする紫外線傷害予防又は改善用組成物(特許文献5)の開発を行っている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2002−29996号公報
【特許文献2】国際公開00/04042号パンフレット
【特許文献3】特開2002−179592号公報
【特許文献4】特開2004−91398号公報
【特許文献5】特開2004−131431号公報
【非特許文献】
【0008】
【非特許文献1】老化のメカニズムと制御、藤本大三郎編著、株式会社アイピーシー、平成5年6月30日
【非特許文献2】BIO Clinica、11巻、第5号、1996年
【非特許文献3】化粧品の有用性・評価技術の進歩と将来展望、日本化粧品技術者会編、薬事日報社、2001年3月31日
【非特許文献4】蛋白質 核酸 酵素、第44巻、第6号、766〜775頁、1999年、共立出版社
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、異常タンパクを除去するプロテアソームを活性化するプロテアソーム活性化剤を提供することを目的とする。
【課題を解決するための手段】
【0010】
リンゴ抽出物に着目して試験した結果、リンゴポリフェノールにプロテアソーム活性化作用及び酸化カルボニルタンパク抑制作用があることを知見したことに基づき、本発明を提案する。
【0011】
すなわち、本発明は、
(1)リンゴ抽出物を有効成分とするプロテアソーム活性化剤。
(2)リンゴ抽出物が、リンゴ由来のポリフェノールを含む、(1)に記載のプロテアソーム活性化剤。
(3)リンゴ抽出物が、リンゴ幼果の抽出物である(1)または(2)に記載のプロテアソーム活性化剤。
(4)リンゴ抽出物を有効成分とする酸化カルボニルタンパク抑制剤。
(5)リンゴ抽出物が、リンゴ由来のポリフェノールを含む、(4)に記載の酸化カルボニルタンパク抑制剤。
(6)リンゴ抽出物が、リンゴ幼果の抽出物である(4)または(5)に記載の酸化カルボニルタンパク抑制剤。
【発明の効果】
【0012】
本発明は、プロテアソーム活性を増強し、さらに、酸化カルボニルタンパクの生成を抑制する剤である。本発明のリンゴ抽出物は、紫外線に暴露されるとプロテアソームを活性化し、また、酸化カルボニルタンパク質の生成を抑制することから、紫外線暴露により生じた異常タンパク質が蓄積することにより生じる白内障、皮膚がん、皮膚におけるしわやしみなどの予防又は改善することができる。
【図面の簡単な説明】
【0013】
【図1】紫外線B波照射時のトリプシン様プロテアソーム活性を示すグラフ
【図2】紫外線B波照射時のキモトリプシン様プロテアソーム活性を示すグラフ
【図3】紫外線A波照射時のトリプシン様プロテアソーム活性を示すグラフ
【図4】紫外線A波照射時のキモトリプシン様プロテアソーム活性を示すグラフ
【図5】紫外線A波照射時のリンゴ抽出物(Appl’in)添加による酸化カルボニルタンパク抑制を示すグラフ
【図6】紫外線B波照射時のリンゴ抽出物(Appl’in)添加による酸化カルボニルタンパク抑制を示すグラフ
【図7】紫外線A波照射時のリンゴ抽出物(ポマクティブHFV)添加による酸化カルボニルタンパク抑制を示すグラフ
【図8】紫外線B波照射時のリンゴ抽出物(ポマクティブHFV)添加による酸化カルボニルタンパク抑制を示すグラフ
【図9】リンゴポリフェノール(ポマクティブHFV)を投与したヘアレスマウスに紫外線A・B波を照射した時の肝臓におけるトリプシン様プロテオソーム活性の変動を示すグラフ
【図10】リンゴポリフェノール(ポマクティブHFV)を投与したヘアレスマウスに紫外線A・B波を照射した時の肝臓におけるキモトリプシン様プロテオソーム活性の変動を示すグラフ
【図11】リンゴポリフェノール(ポマクティブHFV)を投与したヘアレスマウスに紫外線A・B波を照射した時の皮膚におけるトリプシン様プロテオソーム活性の変動を示すグラフ
【図12】リンゴポリフェノール(ポマクティブHFV)を投与したヘアレスマウスに紫外線A・B波を照射した時の皮膚におけるキモトリプシン様プロテオソーム活性の変動を示すグラフ
【図13】リンゴポリフェノール(ポマクティブHFV)を投与したヘアレスマウスに紫外線A・B波を照射した時の皮膚の酸化カルボニルタンパクの変動を示すグラフ
【図14】リンゴポリフェノール(ポマクティブHFV)を投与したヘアレスマウスに紫外線A・B波を照射した時の皮膚の酸化カルボニルタンパクの変動を観察した免疫染色病理組織標本の写真。
【発明を実施するための形態】
【0014】
本発明のプロテアソーム活性化剤及び酸化カルボニルタンパク抑制剤は、リンゴ抽出物を有効成分とし、前記リンゴ抽出物が、リンゴ果実の抽出物であることが好ましい。特に、リンゴ幼果抽出物に含まれるポリフェノールを、主成分とすることが好ましい。
【0015】
リンゴ抽出物には、ポリフェノール、有機酸、アミノ酸などが含まれることが知られている。
リンゴ抽出物は、血管機能改善作用を高めることが可能なBNP調節剤として該抽出物を有効成分として含有してなるBNP調節剤、血行促進剤(特開2007−008837号公報、特開2006−265220号公報)や飲料(特開2004−305087号公報)、化粧料配合剤(特開2001−187724号公報)、消臭剤成分(特開平11−319051号公報)、香料成分(特開平08−023939号公報)などに用いられることが知られている。
しかしながら、リンゴ抽出物およびリンゴ由来のポリフェノールについて、プロテアソーム活性化機能があることは知られていない。
【0016】
以下に、本発明のプロテアソーム活性化剤について、詳細に説明する。
本発明のプロテアソーム活性化剤は、ポリユビキチン化異常タンパク質を分解する酵素であるプロテアソームの活性化剤であって、リンゴ抽出物を有効成分とすることを特徴とする。
【0017】
リンゴ抽出物において、リンゴ(Malus pumila)の品種は、例えば、ふじ、国光、王林、紅玉、ジョナゴールド、デリシャス、さんさ、千秋などが挙げられ、特に制限されない。リンゴの抽出部位は、特に制限されず、例えば、果実、葉、幹、花などが挙げられ、好ましくは、果実である。前記果実は、例えば、未熟果(幼果)でも良く、完熟果でも良く、特に制限されない。抽出に用いる前記果実の部位は、特に制限されず、例えば、全果、果肉、果皮、種などが挙げられる。リンゴ抽出物は、これらの部位を、単独で、または2種以上組み合わせて抽出しても良い。
【0018】
リンゴ抽出物を抽出する方法は、特に制限されず、従来公知の方法を採用できる。抽出方法の具体例としては、例えば、以下のようであっても良い。まず、リンゴの全果を、水洗後、グラインダーなどにより粉砕する。この粉砕物を、ペクチナーゼ処理に供し、遠心分離後、抽出溶媒により分配ろ過して、リンゴ抽出物を調製しても良い。前記ペクチナーゼ処理としては、特に制限されないが、例えば、20〜60℃の温度条件化で、ペクチナーゼを10〜50ppm添加して行っても良い。抽出溶媒としては、特に制限されないが、例えば、ヘキサン、クロロホルムなどの有機溶媒が挙げられる。
【0019】
本発明において、リンゴ抽出物は、例えば、市販のリンゴ抽出物を用いても良く、リンゴ果実から抽出して調製しても良く、特に制限されない。
本発明のプロテアソーム活性化剤及び酸化カルボニルタンパク抑制剤は、リンゴ由来のポリフェノールを含むリンゴ抽出物が好ましい。
【0020】
ポリフェノールの分画方法は、特に制限されず、従来公知の方法を採用できる。ポリフェノールは、例えば、リンゴ抽出物をカラムに通液後、カラムの吸着物を溶出し、この溶出画分を減圧留去濃縮して分画しても良い。また、さらに、この濃縮液に粉末助剤を添加し、凍結乾燥または噴霧乾燥して、ポリフェノール粉末を調製しても良い。
【0021】
本発明において、ポリフェノールは、例えば、市販のリンゴ由来のポリフェノール含有物を用いても良く、リンゴ果実から抽出および分画して調製しても良く、特に制限されない。
【0022】
本発明のプロテアソーム活性化剤は、紫外線暴露により発生した活性酸素により産生された細胞内の変性タンパク質(異常タンパク質)を分解するプロテアーゼを活性化し、紫外線暴露による細胞傷害を抑制することにより、白内障、皮膚癌、皮膚におけるしわやしみなどの様々な疾患を予防及び改善することができる。また、酸化カルボニルタンパク抑制剤は、紫外線照射による酸化カルボニルタンパク質の生成を抑制することができる。
【実施例】
【0023】
(1)試料及び正常ヒト皮膚線維芽細胞の培養
[リンゴ抽出物試料]
リンゴ抽出物としては、
・アップルフェノンSH(アサヒフード アンド ヘルスケア、総ポリフェノール(UV 法)98%以上)
・Appl’in(清田産業、総ポリフェノール(UV法)80%以上)
・ポマクティブHFV(ユニテックフーズ、総ポリフェノール(UV法)90%以上)
をサンプルとし、5%ウシ胎児血清(FBS)及び1%ジメチルスルホキシド(DMSO)含有ダルベッコ改変イーグル培地(DMEM、GIBCO社製)に添加し、評価検体であるリンゴ抽出物含有液を作製した。
【0024】
[正常ヒト皮膚線維芽細胞の培養]
新生児由来正常ヒト皮膚線維芽細胞(NHFB、三光純薬)を線維芽細胞用培地(FBM、三光純薬)で37℃−5%CO2インキュベーターにて培養した。
FBMにヒト線維芽細胞増殖因子(1μg/ml)、インシュリン(5mg/ml)、ゲンタマイシン(50μg/ml)、アンフォテリシンB(50μg/ml)を添加して継代培養に用いた。本実験には集団倍加数(population doubling level:PDL)がPDL20〜40の若い細胞を紫外線B波照射の試験に使用し、PDL40〜60の老化した細胞を紫外線A波照射の試験に使用した。トリプシン処理で剥がした線維芽細胞の細胞数をコールターカウンターで計測し、200000cells/mlの細胞密度になるように調整した。
【0025】
(2)細胞培養と紫外線照射
[リンゴ抽出物含有液の紫外線B波傷害]
PDL20〜40の若い細胞を6ウェル平底プレートに105個/ウェルの細胞密度で播種し、24時間培養した。
紫外線照射前に、前記リンゴ抽出物含有液の最終濃度が10μg/mlとなるように添加し、24h培養した。培養液を廃棄し、細胞をHank’s(−)液(ハンクス緩衝塩類溶液、Ca2+、Mg2+非含有)で洗浄後、再度Hank’s(−)液を添加し、プレートに蓋をしない状態でUVBを2.5W/m2で3分間照射した(50mJ/cm2)。対照として、UVBを照射しない群の細胞も作製した。照射終了後、直ちにHank’s(−)液を評価検体であるリンゴ抽出物を10μg/ml含有する5%FBS及び1%DMSO含有DMEMに置換し、24h培養した。
【0026】
[リンゴ抽出物含有液の紫外線A波傷害]
PDL40〜60の老化した細胞を6ウェル平底プレートに105個/ウェルの細胞密度で播種し、24時間培養した。紫外線照射前に、前記リンゴ抽出物含有液の最終濃度が10μg/mlとなるように添加し、24h培養した。培養液を廃棄し、細胞をHank’s(−)液で洗浄後、再度Hank’s(−)液を添加し、プレートに蓋をしない状態でUVAを30W/m2で1.5時間照射した(15J/cm2)。対照として、UVAを照射しない群の細胞も作製した。照射終了後、直ちにHank’s液を評価検体であるリンゴ抽出物を10μg/ml含有する5%FBS及び1%DMSO含有DMEMに置換し、24h培養した。
【0027】
以後のプロテアソーム活性測定操作は紫外線B波および紫外線A波を照射した試験で共通している。
(3)細胞懸濁液回収、プロテアソーム活性溶液調整、タンパク濃度の測定
培養液を除去しPBS(−)で各ウェルを洗浄後、各ウェルにトリプシン-EDTA(Sigma)を800μl添加し、37℃で5分間処理して線維芽細胞をディッシュ底面から剥離させ、10%FBS含有DMEM1.5mlでトリプシン反応を終止した。溶液と一部底着したままの細胞についてはスクレーパー処理で細胞を15ml容遠沈管に回収した。1,500rpm 5minの条件で遠沈して培養液を除去、PBS(−)で洗浄し再び1,500rpm 5minの条件で遠沈してDMEM中の色素(フェノールレッド)を完全に除去した。
この細胞塊をホモジナイズBuffer(50mMトリス塩酸、1mM DTT、5mMMgCl2、5%(v/v)グリセリン、pH=7.5)300μlに懸濁させた。その後、氷冷中でホモジナイズ処理(UD−201超音波破砕装置、TOMY製を使用、条件は「OUT PUT 1、DUTY40、15secを2set」)した。ホモジナイズ溶液を1.5ml容エッペンチューブに全量移し、15,000rpmで10min遠心分離して上清をプロテアソーム活性溶液として回収した。
このプロテアソーム活性溶液について、Bradford法に準拠してBSA(ウシ血清アルブミン、SIGMA社製)換算で全タンパク量を求めた。
発色試薬はBio−Rad protein assay(脱イオン水で5倍希釈)を用いた。
平板96ウェルプレートに、
プロテアソーム活性溶液/BSA 溶媒:ホモジナイズBuffer 10μl
Bio−Rad protein assay(脱イオン水で5倍希釈) 200μl
を加えて10min室温にてプレートごとに撹拌反応した。吸光度590nmをプレートリーダーで計測し、BSA溶液で作成した検量線について全タンパク濃度を求めた。
【0028】
(4)プロテアソーム活性の測定
トリプシン様プロテアソーム活性測定用基質Boc−Leu−Arg−Arg−MCA
(t−ブチルオキシカルボニル−L−ロイシル−L−アルギニル−L−アルギニル−4−メチル−クマリル−7−アミド)(ペプチド研究所)、
キモトリプシン様プロテアソーム活性測定用基質Suc−Leu−Leu−Val−Tyr−MCA(キモトリプシン様プロテアソーム活性を測定するための基質として、サクシニル−L−ロイシル−L−ロイシル−L−バリル−L−チロシル−4−メチル−クマリル−7−アミド(ペプチド研究所))(ペプチド研究所)、をそれぞれ10mM(溶媒、DMSO)で調整し、30μlずつを分注して−20℃冷凍保存した。使用時に解凍し600μlの反応液で希釈して使用した。
蛍光分析用平板96ウェルプレートに以下の溶液をそれぞれ加えた。
1. 基質ペプチド(トリプシン様/キモトリプシン様) 10.5μl (蛍光分 析時の基質ペプチド濃度23.8μM)
2. 反応液(100mMトリス塩酸、1mM DTT、5mM MgCl2、pH=8.0) 25μl
3. 10mM ATP含有ホモジナイズBuffer 19.5μl(蛍光分析時のAT P濃度は0.975mM)
4. プロテアソーム活性サンプル(cell lysate) 20μl
37℃で1h撹拌反応した。反応終了後に、
5. 10%(w/v) SDS(反応停止液) 25μl
6. 100mMトリス塩酸(pH=9.0) 100μl (全量200μl/well)
として、プロテアソームによって基質ペプチドから遊離した7−アミノ−4−メチルクマリン(MCA)由来の蛍光強度(励起波長Ex380nm、蛍光波長Em440nm)を測定した。
【0029】
(5)データ処理
(蛍光強度/タンパク濃度)で算出されるプロテアソーム活性について、UV(−)のコントロール群を基準(1.00)とし、平均値で他の各群と比較した。
遊離した7−アミノ−4−メチルクマリンの蛍光強度を励起波長(Ex)380nm、吸収波長(Em)440nmで測定した。結果はリンゴ抽出物含有液を各濃度で処理した3試料の測定値から、平均±標準偏差を計算し、グラフ化した。
統計解析は多重比較検討としてDunnett test(vs UV A or UV B+ コントロール群**:p<0.01, *p<0.05)を行った。また、p値が0.05<p<0.1を有意傾向として表記した。
【実施例1】
【0030】
[紫外線B波照射時のプロテアソーム活性]
PDL26の若い状態の線維芽細胞を用いて、リンゴ抽出物のプロテアソーム活性化評価を行った。
試験群1 紫外線B波 非照射 コントロール群
試験群2 紫外線B波 照射 コントロール群
試験群3 紫外線B波 照射 10μg/mlアップルフェノンSH 添加
試験群4 紫外線B波 照射 10μg/mlAppl’in添加
試験群5 紫外線B波 照射 10μg/mlポマクティブHFV添加
【0031】
図1に紫外線B波照射時のトリプシン様プロテアソーム活性を、表1にDunnett testの結果を示す。
紫外線B波照射条件時のトリプシン様活性では、試験群2の紫外線B波照射群が試験群1の紫外線B波未照射群(p値0.0465)に対してプロテアソーム活性が低下していた。また、試験群4(p値0.0256)および試験群5(p値0.0169)が、試験群2に対して有意にプロテアソームが活性化したことから、リンゴ抽出物である「Appl’in」及び「ポマクティブHFV」は、若い状態の線維芽細胞のトリプシン様プロテアソームを活性化することが分かった。
【0032】
【表1】

【実施例2】
【0033】
図2に紫外線B照射時のキモトリプシン様プロテアソーム活性を、表2にDunnett testの結果を示す。
紫外線B照射時のキモトリプシン様活性では、試験群2の紫外線B波照射群が試験群1の紫外線B波未照射群(p値0.000734)に対してプロテアソーム活性が低下していた。また、試験群3(p値0.000739)、試験群4(p値0.0000255)および試験群5(p値0.0000511)のいずれもが試験群2の紫外線B波照射群に対して有意にプロテアソームが活性化したことから、リンゴ抽出物である「アップルフェノンSH」、「Appl’in」及び「ポマクティブHFV」は、若い状態の線維芽細胞のキモトリプシン様プロテアソームを活性化することが分かった。
【0034】
【表2】

【実施例3】
【0035】
[紫外線A波照射時のプロテアソーム活性]
PDL50の老化した状態の線維芽細胞を用いて、リンゴ抽出物のプロテアソーム活性化評価を行った。
試験群1 紫外線A波 非照射 コントロール群
試験群2 紫外線A波 照射 コントロール群
試験群3 紫外線A波 照射 10μg/mlアップルフェノンSH 添加
試験群4 紫外線A波 照射 10μg/mlAppl’in添加
試験群5 紫外線A波 照射 10μg/mlポマクティブHFV添加
【0036】
図3に紫外線A照射時のトリプシン様プロテアソーム活性を、表3にDunnett testの結果を示す。
紫外線A波照射条件時のトリプシン様活性では、試験群2の紫外線A波照射群が試験群1の紫外線A波未照射群(p値0.0137)に対してプロテアソーム活性が低下していた。また、試験群3は試験群2の紫外線A波照射群に対して有意(p値0.0347)にプロテアソ−ム活性が上がった。また、試験群4は有意傾向(p=0.0937)でプロテアソームが活性化した。このことから、リンゴ抽出物である「アップルフェノンSH」、「Appl’in」は、老化した状態の線維芽細胞のトリプシン様プロテアソームを活性化することが分かった。
【0037】
【表3】

【実施例4】
【0038】
図4に紫外線A照射時のキモトリプシン様プロテアソーム活性を、表4にDunnett testの結果を示す。
紫外線A照射時のキモトリプシン様活性では、試験群2の紫外線A波照射群が試験群1の紫外線A波未照射群(p値0.0681、有意傾向)に対してプロテアソーム活性が低下していた。また、試験群3は試験群2の紫外線A波照射群に対して有意(p値0.00370)にプロテアソ−ム活性が上がった。また、試験群4も有意(p=0.0120)でプロテアソームが活性化した。このことから、リンゴ抽出物である「アップルフェノンSH」、「Appl’in」は、老化した状態の線維芽細胞のキモトリプシン様プロテアソームを活性化することが分かった。
【0039】
【表4】

【0040】
以上の結果から、リンゴ抽出物には線維芽細胞の状態(若い或いは老化)を問わず、細胞内のプロテアソームを活性化させるという顕著な機能を有することが分かった。
【0041】
[酸化カルボニルタンパクの測定]
(1)タンパク濃度0.1〜0.4μg/μlの範囲で凍結保存していた線維芽細胞由来のサンプルを自然解凍後にトリクロロ酢酸(TCA)処理してタンパク沈殿し、20μgタンパク重量に相当するサンプルを用意した。そのサンプルについて、カルボニル化蛋白質測定キット(日研ザイル製)で酸化カルボニルタンパク量を定量した。具体的には、前処理したサンプル、スタンダード、コントロール、各200μlをウェルに分注し、プレートをシールして、4℃一晩反応させた。EIAバッファー 300μl/ウェルにて5回洗浄後に、全てのウェルに「希釈済みブロッキング試薬」を250μl/ウェル分注し、室温にて30分 インキュベート後にEIAバッファー 300μl/ウェルにて5回洗浄、そして、ビオチン標識-抗DNP抗体を200μl分注し、37℃にて1時間インキュベートした。EIAバッファー 300μl/ウェルにて5回洗浄、「希釈済み HRP標識-ストレプトアビジン」を200μl分注し、室温にて1時間インキュベートした。EIAバッファー 300μl/ウェルにて5回洗浄、「発色液」を200μl/ウェル分注し、室温にて各ウェルでの反応時間が5分になるよう調整し、「反応停止液」を100μl/ウェル分注し、反応を停止させた。マイクロプレートリーダーで450nmの吸光度を測定した。
【0042】
(2)データ処理
反応生成物であるp−ニトロアニリン由来の吸光度450nmを測定し、カルボニル化蛋白質測定キットに付属している標準カルボニルタンパクで作成した検量線に対する各サンプルのカルボニル化タンパクを測定した。
【実施例5】
【0043】
[紫外線A波照射時のAppl’in添加による酸化カルボニル抑制]
PDL50の老化した状態の線維芽細胞を用いて評価した。
試験群1 紫外線A波 非照射 コントロール群
試験群2 紫外線A波 照射 コントロール群
試験群3 紫外線A波 照射 10μg/mlAppl’in添加
【0044】
図5に紫外線A照射時の酸化カルボニル量を、表5にDunnett testの結果を示す。
紫外線A照射時の酸化カルボニル量は、試験群2の紫外線A波照射群が試験群1の紫外線A波未照射群(p値0.000645)に対して増加していた。また、試験群3の10μg/mlAppl’in添加群が試験群2の紫外線A波照射群に対して有意(p値0.00720)に酸化カルボニルを抑制していた。
【0045】
【表5】

【実施例6】
【0046】
[紫外線B波照射時のAppl’in添加による酸化カルボニル抑制]
PDL26の若い状態の線維芽細胞を用いて評価した。
試験群1 紫外線B波 非照射 コントロール群
試験群2 紫外線B波 照射 コントロール群
試験群3 紫外線B波 照射 10μg/mlAppl’in添加
【0047】
図6に紫外線B照射時の酸化カルボニル量を、表6にDunnett testの結果を示す。
紫外線B照射時の酸化カルボニル量は、試験群2の紫外線B波照射群が試験群1の紫外線B波未照射群(p値0.000214)に対して増加していた。また、試験群3の10μg/mlAppl’in添加群が試験群2の紫外線B波照射群に対して有意(p値0.00192)に酸化カルボニルを抑制していた。
【0048】
【表6】

【実施例7】
【0049】
[紫外線A照射時におけるポマクティブHFVの酸化カルボニルタンパク抑制]
PDL54の老化した線維芽細胞を用いて評価した。
試験群1 紫外線A波 非照射 コントロール群
試験群2 紫外線A波 照射 コントロール群
試験群3 紫外線A波 照射 10μg/mlポマクティブHFV添加
【0050】
図7に紫外線A波照射時の酸化カルボニル量を、表7にDunnett testの結果を示す。
紫外線A照射時の酸化カルボニル量は、試験群2の紫外線A波照射群が試験群1の紫外線A波未照射群(p値0.00230)に対して増加していた。また、試験群3の10μg/mlポマクティブHFV添加群が試験群2の紫外線A波照射群に対して有意(p値0.00151)に酸化カルボニルを抑制していた。
【0051】
【表7】

【実施例8】
【0052】
[紫外線B照射時におけるポマクティブHFVの酸化カルボニルタンパク抑制]
PDL27の若い線維芽細胞を用いて評価した。
試験群1 紫外線B波 非照射 コントロール群
試験群2 紫外線B波 照射 コントロール群
試験群3 紫外線B波 照射 10μg/mlポマクティブHFV添加
【0053】
図8に紫外線B波照射時の酸化カルボニル量を、表8にDunnett testの結果を示す。
紫外線B照射時の酸化カルボニル量は、試験群2の紫外線B波照射群が試験群1の紫外線B波未照射群(p値0.000139)に対して増加していた。また、試験群3の10μg/mlポマクティブHFV添加群が試験群2の紫外線B波照射群に対して有意(p値0.00193)に酸化カルボニルを抑制していた。
【0054】
【表8】

【0055】
以上の結果から、リンゴ抽出物であるAppl’inやポマクティブHFVは、線維芽細胞の状態(若い或いは老化)を問わず、いずれも紫外線惹起性の酸化カルボニルタンパクを抑制除去する効果に優れていることが分かった。
【実施例9】
【0056】
[光老化動物による試験]
紫外線A(UVA)波および紫外線B(UVB)波をヘアレスマウスに照射させてシワを形成させる試験系によりポマクティブHFVのシワの抑制および皮膚老化抑制効果について確認試験を行った。
導入時6週齢のヘアレスマウス(Hos:HR−1雌)を用いて試験を行った。
【0057】
(1)試験対象物の調製および投与
ヘアレスマウスの群分けは投与開始日に、一般状態が良好な動物を体重により、群間での差が無いように1群6匹に振り分けた。なお、各々の個体は1ゲージ/群で飼育とした。
マウス用飼料MF(オリエンタルバイオサービス製)に、それぞれポマクティブHFVを均一に混合処理し、自由摂取させた。投与群と配合成分の一覧を表9に示す。
【0058】
【表9】

【0059】
混餌飼料の投与は動物搬入直後から解剖18時間前までとした。
【0060】
(2)UV照射
UV照射は、動物を専用のケージに移し、1群ずつUVB20mJ/cm2およびUVA10J/cm2を照射した。照射は週三回とし、このサイクルを10週間繰り返した。
【0061】
(3)解剖
各群、本飼育期間終了翌日より18時間絶食させた後、氷冷したAvertin(2,2,2−トリブロモエタノール)0.5mg/kgBWを腹腔内投与して麻酔した。その後、皮膚背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位範囲で反射型レプリカ((有)アサヒバイオメッド製)を採取した。次いで開腹し解剖を行った。皮膚組織はメタカン固定液(メタノール:クロロホルム:酢酸=6:3:1(v/v/v))で浸潤、パラフィン包埋処理し、組織染色実験時に5μmの厚さでスライドガラスに貼付した。
【0062】
(4)皮膚形態観察シワ体積率計測
皮膚表面部の写真撮影と採取したレプリカの判定を行った。シワ形成度合を指標としてASA−03RXD((有)アサヒバイオメッド製)を用いてシワ体積率%(μm3/mm2/100) を算出した。
紫外線照射第4週目頃よりUV照射動物において、頭部の皮膚の軽度褐色化や頸部のしわの深さならびに後肢背部のしわがUV非照射動物に比較して目立つようになった。
解剖時の外観観察では、UV照射動物で顔、頸部および後肢背部のしわが明瞭に確認されたが、UV照射においても高濃度(0.06%)、中濃度(0.012%)および低濃度(0.006%)ポマクティブHFVを摂取したマウスではその症状は軽度であり、特に高濃度摂取動物のしわの深度が浅く、肉眼的にはしわの程度が皆無であった。また、ポマクティブHFV摂取動物は、コントロール群に比較して皮膚にしっとり感があり、特に高濃度摂取群でその症状は顕著に感じられた。
【0063】
表10に結果を示すが、紫外線照射により明確なシワの形成が認められた。特に、同一線量の紫外線照射条件下で 混餌群ではポマクティブHFVの濃度依存的にシワ抑制効果が有意に認められた。特に0.06%および0.012%混餌で有意にシワ体積率を抑制した。
【0064】
【表10】

【0065】
(5)マウス肝臓のプロテアソーム活性
測定試料の調整
上記の解剖で得たマウス肝臓を100mgから200mgの範囲で湿重量を秤量し、以下の条件でホモジナイズした。
【0066】
ホモジナイズ条件
肝臓:50mM Tris塩酸緩衝液(pH7.5,グリセロール、DTT、MgCl2含有)=1:3(w/v)
ホモジナイザー(UD−201超音波破砕装置、TOMY製を使用、条件は「OUT PUT 2、DUTY40、30secを2set」)。
【0067】
試験溶液の調整
このホモジネートを遠心分離(10,000g、30分間、4℃)して上澄み画分を採取し、これを再度遠心分離(20,000g、30分間、4℃)し、得られた上澄み画分をプロテアソーム活性測定試験溶液とした。
【0068】
タンパク質量の測定
Bradford法に準拠してBSA換算で全タンパク量を求めた。
発色試薬はBio−Radprotein assay(バイオラッド社)を用いた。平板96ウェルプレートに、プロテアソーム活性測定溶液1μl、ホモジナイズ緩衝液 9μl、Bio−Rad protein assay(脱イオン水で5倍希釈) 200μlを加えて10min室温にて撹拌して反応させた。次いで590nmの吸光度を、プレートリーダーを用いて測定した。次いで得られた吸光度からBSA溶液で作成した検量線を用いて全タンパク質濃度(0.7〜1.5μg/μlの範囲)を求めた。
【0069】
プロテアソーム活性の測定
トリプシン様プロテアソーム活性測定用基質Boc−Leu−Arg−Arg−MCA(ペプチド研究所)キモトリプシン様プロテアソーム活性測定用基質Suc−Leu−Leu−Val−Tyr−MCA(ペプチド研究所)をそれぞれ10mM(溶媒;DMSO)に調整し、30μlずつを分注して−20℃冷凍保存し、使用時に解凍し600μlの反応液で希釈して使用した。
蛍光分析用平板96ウェルプレートに以下の溶液をそれぞれ加えた。
1. 基質ペプチド(トリプシン様/キモトリプシン様) 10.5μl (蛍光分析 時の基質ペプチド濃度23.8μM)
2. 反応液(100mMトリス塩酸、1mM DTT、5mM MgCl2、pH=8.0) 25μl
3. 10mM ATP含有ホモジナイズBuffer 19.5μl(蛍光分析時のATP濃 度は0.975mM)
4. ホモジナイズBuffer 15μl
5. マウス肝臓プロテアソーム活性サンプル 5μl
37℃30分間撹拌反応。反応終了後に、
6. 10%(w/v) SDS(反応停止液) 25μl
7. 100mMトリス塩酸(pH=9.0) 100μl
1ウエル当たり全量200μlとして37℃30分間インキュベートし、基質ペプチドから遊離したMCA由来の蛍光強度(Ex380nm、Em440nm)を測定し、プロテアソーム活性を求めた。
【0070】
データ処理
蛍光強度/タンパク濃度 で算出されるプロテアソーム活性値を、紫外線非照射動物(UV(−))を対照(1.00)として活性値をもとめ、各動物個体の活性値を平均して、試験群の値として表した。
【0071】
測定結果
測定結果を表11、表12及び図9、図10、に示す。
【0072】
【表11】

【0073】
【表12】

【0074】
以上の試験結果から以下のことが明らかになった。
すなわち、
A.コントロール食群では、紫外線照射の有無でマウス肝臓のプロテアソーム活性に 有意な差は無かった。
B.トリプシン様活性は、ポマクティブHFV0.06%(p=0.0108)混餌 群で有意な活性上昇が確認された。
C.キモトリプシン様活性は、ポマクティブHFV0.012%(p= 0.0132)および0.06%(p=0.00000160)混餌群で有意な 活性上昇が確認された。
D.従ってポマクティブHFV投与によりマウス肝臓におけるプロテアソーム活性化 効果が確認できた。
すなわち、本発明により肝臓のプロテアソームが活性化され、異常タンパク質を除去する機能が高まり、種々の疾病予防に寄与する事が可能となった。
【0075】
(6)マウス皮膚のプロテアソーム活性の測定
測定試料の調整
次のホモジナイズ条件で背部ヒフ試料をホモジナイズ処理した。
【0076】
ホモジナイズ条件
背部皮膚(前足周縁):50mM Tris塩酸緩衝液(pH7.5、グリセロール、DTT、MgCl2 含有)=1:3(w/v)
ホモジナイザーを使用して試料調製した(UD−201超音波破砕装置、TOMY製を使用、条件は「OUT PUT 5(皮膚は肝臓よりも硬組織なので、激しいホジナイズを実施した、DUTY40、30secを2set」)。
【0077】
試験溶液の調整
得られたホモジネートを遠心分離(10,000g、30分間、4℃)し、上澄み画分を引き続き遠心分離(20,000g、30分間、4℃)した。得られた上澄み画分をプロテアソーム活性測定試験溶液とした。
【0078】
タンパク質量の測定
上記と同様に、Bradford法に準拠してBSA換算で全タンパク量を求めた。
発色試薬はBio−Radprotein assayを用いた。平板96ウェルプレートに、プロテアソーム活性測定溶液1μl、ホモジナイズ緩衝液 9μl、Bio−Rad protein assay(脱イオン水で5倍希釈) 200μlを加えて10min室温にて撹拌して反応させた。次いで590nmの吸光度をプレートリーダーを用いて測定した。次いで得られた吸光度からBSA溶液で作成した検量線を用いて全タンパク質濃度(0.7〜1.5μg/μlの範囲)を求めた。
【0079】
プロテアソーム活性の測定
トリプシン様プロテアソーム活性測定用基質Boc−Leu−Arg−Arg−MCA(ペプチド研究所)キモトリプシン様プロテアソーム活性測定用基質Suc−Leu−Leu−Val−Tyr−MCA(ペプチド研究所)をそれぞれ10mM(溶媒;DMSO)に調整し、30μlずつを分注して−20℃冷凍保存し、使用時に解凍し600μlの反応液で希釈して使用した。
蛍光分析用平板96ウェルプレートに以下の溶液をそれぞれ加えた。
1. 基質ペプチド(トリプシン様/キモトリプシン様) 10.5μl (蛍光分析時 の基質ペプチド濃度23.8μM)
2. 反応液(100mMトリス塩酸、1mM DTT、5mM MgCl2、pH=8.0) 25μl
3. 10mM ATP含有ホモジナイズBuffer 19.5μl(蛍光分析時のATP濃度 は0.975mM)
4. マウス皮膚プロテアソーム活性サンプル 20μl
37℃30分間撹拌反応。反応終了後に、
5. 10%(w/v) SDS(反応停止液) 25μl
6. 100mMトリス塩酸(pH=9.0) 100μl
1ウエル当たり全量200μlとして37℃30分間インキュベートし、基質ペプチドから遊離したMCA由来の蛍光強度(Ex380nm、Em440nm)を測定し、プロテアソーム活性を求めた。
【0080】
データ処理
蛍光強度/タンパク濃度 で算出されるプロテアソーム活性を、紫外線非照射動物(UV(−))を対照(1.00)としてもとめ、各動物個体の活性値の平均値を試験群の値として表した。
【0081】
測定結果
測定結果を表13、表14 及び図11、図12に示す。
【0082】
【表13】

【0083】
【表14】

【0084】
以上の試験結果から次の点が明らかとなった。
A.コントロール食群において、紫外線照射の有無でマウス皮膚のプロテアソーム活 性に有意な差は無かったが紫外線照射群の皮膚でプロテアソーム活性が低下する 傾向が認められた。
B.トリプシン様活性はポマクティブHFV0.06%混餌群(p=0.0153) で有意な活性上昇が確認された。
C.キモトリプシン様活性において、ポマクティブHFV0.06%混餌群(p= 0.0103)で有意な活性上昇が確認された。
D.以上の結果からポマクティブHFV投与によるマウス皮膚におけるプロテアソー ム活性化作用が証明された。
【0085】
従って、本発明により皮膚の異常タンパク質を除去する機能が高まり、種々の疾病予防に寄与する事が期待できる。
【0086】
(7)マウス皮膚の酸化カルボニルタンパクの抑制効果の確認
プロテアソーム活性化によって酸化タンパク質の一種であるカルボニル化タンパク質の抑制を確認した。
上記(3)で得たメタカン固定液浸潤してパラフィン包埋した5μmマウス皮膚切片を、免疫組織染色の手法を用いて評価した。抗体等の試薬はカルボニル化タンパク質免疫組織染色キット(株式会社シマ研究所)を用いた。
脱パラフィン処理、親水化は公知の方法に基づいて実施した。それぞれの皮膚切片サンプルに対し本キットに付属のDNPH溶液を室温で30分間反応させた。DNPHは2,4−ジニトロフェニルヒドラジンの略語である。DNPH反応終了後、2%塩酸を5分間、80%エタノールを5分間、100%エタノールを5分間、50%エタノール/50%酢酸を5分間、80%エタノールを1分間、蒸留水で1分間順次洗浄した。常温下0.3%過酸化水素含有メタノールで30分反応させて内因性ペルオキシダーゼを阻害した。水洗、10mMPBS(-)洗浄後、ブロッキング液2%BSA/PBS‐2%ヤギ血清を30分間ブロッキング反応、ブロッキング終了後にPBS(−)で5分間3回洗浄し、1次抗体(本キット付属のウサギ抗DNPポリクローナル抗体の100倍希釈、希釈液はブロッキング溶液)を1時間室温で反応させた。PBS(−)で2回洗浄し、ビオチン化二次抗体(ビオチン化抗ウサギ免疫グロブリンG;DAKO製)を200倍希釈したものを30分間室温で反応させた。PBS(−)で2回洗浄し、ABC試薬(アビジン−ビオチン複合体ABC-HRP;Dako製)を30分間室温にて反応させた。PBS(−)で2回洗浄し、発色試薬としてDAB(3,3-ジアミノベンジジンテトラヒドロクロライド:DAKO製)を用いて4分常温下で反応させた。水洗後、脱水、封入処理を行い、酸化カルボニル化タンパク質の病理組織標本を得た。
【0087】
得られた病理組織標本を顕微鏡で染色状況を観察し、DAB発色の程度をスコア評価(スコア0→酸化カルボニル無し、スコア1→酸化カルボニル僅かに形成、スコア2→酸化カルボニル形成、スコア3→酸化カルボニルが非常に多い)し、各群の平均値から酸化カルボニルタンパクの形成および抑制を評価した。上記組織標本は、酸化カルボニル化タンパク質の存在量に応じて、着色度合いが高まる。着色度合いに基づく評価結果を表15、図13に示す。また、各試験群の動物の評価スコアの病理組織を図14に示す。酸化カルボニル化タンパク質が多いものほど病理組織が濃く着色されていることが明らかである。
【0088】
【表15】

【0089】
染色標本の評価に基づく多重検定により、紫外線照射群では明確に酸化カルボニルタンパクが増加しており、試験群3から試験群5におけるポマクティブHFV摂取群では濃度依存的にマウス皮膚の酸化カルボニルタンパクの抑制が確認された。
【特許請求の範囲】
【請求項1】
リンゴ抽出物を有効成分とするプロテアソーム活性化剤。
【請求項2】
リンゴ抽出物が、リンゴ由来のポリフェノールを含む、請求項1に記載のプロテアソーム活性化剤。
【請求項3】
リンゴ抽出物が、リンゴ幼果の抽出物である請求項1または2記載のプロテアソーム活性化剤。
【請求項4】
リンゴ抽出物を有効成分とする酸化カルボニルタンパク抑制剤。
【請求項5】
リンゴ抽出物が、リンゴ由来のポリフェノールを含む、請求項4に記載の酸化カルボニルタンパク抑制剤。
【請求項6】
リンゴ抽出物が、リンゴ幼果の抽出物である請求項4または5記載の酸化カルボニルタンパク抑制剤。
【請求項1】
リンゴ抽出物を有効成分とするプロテアソーム活性化剤。
【請求項2】
リンゴ抽出物が、リンゴ由来のポリフェノールを含む、請求項1に記載のプロテアソーム活性化剤。
【請求項3】
リンゴ抽出物が、リンゴ幼果の抽出物である請求項1または2記載のプロテアソーム活性化剤。
【請求項4】
リンゴ抽出物を有効成分とする酸化カルボニルタンパク抑制剤。
【請求項5】
リンゴ抽出物が、リンゴ由来のポリフェノールを含む、請求項4に記載の酸化カルボニルタンパク抑制剤。
【請求項6】
リンゴ抽出物が、リンゴ幼果の抽出物である請求項4または5記載の酸化カルボニルタンパク抑制剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公開番号】特開2012−31133(P2012−31133A)
【公開日】平成24年2月16日(2012.2.16)
【国際特許分類】
【出願番号】特願2011−39499(P2011−39499)
【出願日】平成23年2月25日(2011.2.25)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
【公開日】平成24年2月16日(2012.2.16)
【国際特許分類】
【出願日】平成23年2月25日(2011.2.25)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
[ Back to top ]

