プロテアーゼ阻害剤及びそれを含む医薬
【課題】新規なプロテアーゼ阻害剤を提供する。
【解決手段】配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列、または同アミノ酸配列において1もしくは数個のアミノ酸が置換、欠失、挿入もしくは付加されたアミノ酸配列を含むタンパク質からなるプロテアーゼ阻害剤。
【解決手段】配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列、または同アミノ酸配列において1もしくは数個のアミノ酸が置換、欠失、挿入もしくは付加されたアミノ酸配列を含むタンパク質からなるプロテアーゼ阻害剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、プロテアーゼ阻害剤に関するものであり、筋ジストロフィー、筋萎縮症、癌、ウイルス感染症、アルツハイマー病等を予防または治療するための医薬等に利用することが可能なプロテアーゼ阻害剤に関する。
【背景技術】
【0002】
活性中心にチオール基を有するタンパク質分解酵素はシステインプロテアーゼと総称されている。カテプシンL、カテプシンB、カテプシンK、カルシウム依存性中性プロテアーゼ、パパイン、フィシン、ブロメライン等が代表的なシステインプロテアーゼとして知られている。そして、これらシステインプロテアーゼに対して阻害作用を有する物質は、システインプロテアーゼが関与するとされる疾患、例えば筋ジストロフィー、筋萎縮症、骨粗鬆症、心筋梗塞、関節炎、癌などへの治療効果が期待できる(例えば、特許文献1)。
【0003】
また、アスパラギン酸プロテアーゼとしては、ペプシン、カテプシンD、β-セクレターゼやHIVプロテアーゼ等が知られており、ヒト疾患との関連も知られている。例えば、β-セクレターゼはアルツハイマー病の特徴であるアミロイドβ(Aβ)タンパク質の脳内生産を誘発する(例えば、特許文献2)。カテプシンDとアルツハイマー病の関係も報告されている(例えば、特許文献3)。また、HIVプロテアーゼはHIVゲノムに存在するウイルス酵素であり、HIVの複製に必要である(例えば、非特許文献1)。
【0004】
これまでにプロテアーゼ阻害物質がいくつか見いだされており、医薬への応用も試みられている。しかしながら、複数の種類のプロテアーゼに対して阻害活性を示す物質はあまり知られておらず、ギンナン抽出物の中にそのようなプロテアーゼ阻害活性を有する物質が存在することは知られていなかった。
【特許文献1】特開2004-511549号公報
【特許文献2】特表2007-530696号公報
【特許文献3】特開2008-063341号公報
【非特許文献1】Kohlら,Proc. Nat'l Acad. Sci. 1988, 85:4686
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、様々な種類のプロテアーゼに対して阻害活性を有するプロテアーゼ阻害剤であって、医薬などに利用することが可能な新規なプロテアーゼ阻害剤を提供することを目的としている。
【課題を解決するための手段】
【0006】
本発明者は、上記課題を解決するために鋭意検討を行った。その結果、ギンナン(イチョウの種)由来の約10kDaの分子量のタンパク質がシステインプロテアーゼ、アスパラギン酸プロテアーゼ、及びセリンプロテアーゼに対して阻害活性を有することを見出し、本発明を完成するに至った。
【0007】
本発明の要旨は以下のとおりである。
(1)配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列、または同アミノ酸配列において1もしくは数個のアミノ酸が置換、欠失、挿入もしくは付加されたアミノ酸配列を含むタンパク質からなるプロテアーゼ阻害剤。
(2)プロテアーゼが、システインプロテアーゼ、アスパラギン酸プロテアーゼ、またはセリンプロテアーゼである、(1)のプロテアーゼ阻害剤。
(3)(1)または(2)のプロテアーゼ阻害剤を有効成分とする医薬。
(4)配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列、または同アミノ酸配列において1もしくは数個のアミノ酸が置換、欠失、挿入もしくは付加されたアミノ酸配列を含むタンパク質をコードするDNAで形質転換された宿主生物体を培養して該タンパク質を生産させ、該タンパク質を回収することを特徴とする、プロテアーゼ阻害剤の製造方法。
【発明を実施するための最良の形態】
【0008】
次に、本発明の好ましい実施態様について詳細に説明する。ただし、本発明は以下の好ましい実施態様に限定されず、本発明の範囲内で自由に変更することができるものである。
【0009】
本発明は、ギンナン由来の約10kDaの分子量のタンパク質(Gb-nsLTP1)を有効成分として含有するプロテアーゼ阻害剤である。
【0010】
本発明に使用するGb-nsLTP1の好ましい形態としては、配列番号2のアミノ酸配列のうちの、アミノ酸番号28〜119のアミノ酸配列を有するタンパク質を挙げることができる。なお、配列番号2に記載のアミノ酸配列のうち、アミノ酸番号1〜27はシグナル配列である。
【0011】
また、通常の遺伝子においては、種、属、個体等の違いによって、1又は数個の位置での1又は数個の塩基の置換、欠失、挿入、もしくは付加などの変異が存在し、このような変異を有する遺伝子がコードするタンパク質のアミノ酸においても変異が生じている場合がある。本発明に用いることができるGb-nsLTP1には、プロテアーゼ阻害活性が損なわれない範囲において、このような変異を含むものも含有される。
【0012】
すなわち、本発明に用いることができるGb-nsLTP1としては、配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列において、1又は数個のアミノ酸の置換、欠失、挿入、もしくは付加を含み、プロテアーゼ阻害活性を有するタンパク質も例示される。なお、「1又は数個のアミノ酸の置換、欠失、挿入、もしくは付加」として可能なものは、少なくとも前記アミノ酸配列を有するタンパク質とプロテアーゼとの間の立体的な相互作用に影響を及ぼさず、プロテアーゼ阻害活性を損なわない範囲で任意に設定できるものである。例えば、「1又は数個のアミノ酸の置換、欠失、挿入、もしくは付加」とは、配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列において、例えば、1から5個、好ましくは1から3個、より好ましくは1から2個のアミノ酸の置換、欠失、挿入、もしくは付加である。
【0013】
なお、配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列における、1又は数個のアミノ酸の置換、欠失、挿入、もしくは付加の結果、システインプロテアーゼ、アスパラギン酸プロテアーゼ、およびセリンプロテアーゼのうちの、少なくとも1種のプロテアーゼに対する阻害活性を有していれば、本発明に用いることができる。
【0014】
さらに、本発明に用いることができるGb-nsLTP1としては、配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列の全長と、80%以上、好ましくは90%以上、より好ましくは95%以上の相同性を有し、プロテアーゼ阻害活性を有するタンパク質も例示される。
上記のようなGb-nsLTP1と実質的に同一のタンパク質をコードする塩基配列は、例えば部位特異的変異法によって、特定の部位のアミノ酸残基が置換、欠失、挿入、もしくは付加を含むように塩基配列を改変することによって得られる。また、上記のような改変された塩基配列は、従来知られている変異処理によっても取得されうる。
【0015】
上記のような変異を有する塩基配列を適当な細胞で発現させ、本発明の実施例に記載のプロテアーゼ阻害活性の測定法によってプロテアーゼ阻害活性を調べることにより、Gb-nsLTP1と実質的に同一のタンパク質をコードする塩基配列が得られる。
具体的な変異体としては、後述の実施例に示すようなP79A(配列番号2の106番目のProをAlaに置換したもの)、F80A(配列番号2の107番目のPheをAlaに置換したもの)などが例示される。
【0016】
Gb-nsLTP1は遺伝子組換え技術等により得ることもできる。例えば、該アミノ酸配列をコードする塩基配列を基に適当なプライマーを作製し、該プライマーを用いて、目的の塩基配列(例えば、配列番号1の128〜403)を含むcDNAを鋳型としてPCR等によって塩基配列を増幅し、得られた塩基配列を適当な大腸菌、植物、哺乳動物細胞などの発現系を用いて発現させることにより得ることができる。
また、本発明に使用するGb-nsLTP1は、ギンナンから実施例に記載されたような方法で精製して得られるGb-nsLTP1を用いることもできる。
【0017】
上記Gb-nsLTP1はプロテアーゼ阻害活性を有するため、本発明のプロテアーゼ阻害剤に使用することが可能である。ここで、プロテアーゼとしては、システインプロテアーゼ、アスパラギン酸プロテアーゼ、セリンプロテアーゼなどが挙げられ、具体的には、システインプロテアーゼとしては、カテプシンL、カテプシンB、カテプシンK、カルシウム依存性中性プロテアーゼ(CAMP)、パパイン、フィシン、ブロメライン、カスパーゼが、アスパラギン酸プロテアーゼとしては、ペプシン、カテプシンD、βセクレターゼ、HIVプロテアーゼが、セリンプロテアーゼとしては、トリプシン、血液凝固因子、C型肝炎ウイルスNS3プロテアーゼが、それぞれ挙げられる。
【0018】
本発明のシステインプロテアーゼ阻害剤は上記Gb-nsLTP1を公知の薬学的に許容される担体と組み合わせることにより、製造することができる。本発明の製剤の投与単位形態は特に限定されず、治療目的に応じて適宜選択でき、具体的には、錠剤、丸剤、散剤、液剤、懸濁剤、乳剤、顆粒剤、カプセル剤、シロップ剤、坐剤、注射剤、軟膏剤、貼付剤、点眼剤、点鼻剤等を例示できる。製剤化にあたっては製剤担体として通常の薬剤に汎用される賦形剤、結合剤、崩壊剤、滑沢剤、安定剤、矯味矯臭剤、希釈剤、界面活性剤、注射剤用溶剤等の添加剤を使用できる。
【0019】
本発明の製剤中に含まれるGb-nsLTP1の量は特に限定されず適宜選択すればよいが、例えばいずれも通常製剤中に0.005〜50質量%、好ましくは0.05〜10質量%とするのがよい。
【0020】
本発明のGb-nsLTP1を有効成分とするプロテアーゼ阻害剤を経口的、又は非経口的に患者に投与することにより、プロテアーゼが関与する疾患を治療することができる。ここで、患者とは、ヒトであってもよいが、ヒト以外の哺乳動物であってもよい。
本発明の製剤の投与方法は特に限定されず、疾患の種類、各種製剤形態、患者の年齢、性別、その他の条件、患者の症状の程度等に応じて決定される。本発明の製剤の有効成分の投与量は、用法、患者の年齢、性別、疾患の程度、その他の条件等により適宜選択される。通常有効成分としてのGb-nsLTP1の量は、0.1〜1000mg/kg/日、好ましくは10〜500mg/kg/日の範囲となる量を目安とするのが良く、1日1回又は複数回に分けて投与することができる。
【0021】
本発明のプロテアーゼ阻害剤は、プロテアーゼが関与する疾患に対する予防又は治療のための医薬として使用することができる。
システインプロテアーゼが関与する疾患としては、例えば、筋ジストロフィー、筋萎縮症、骨粗鬆症、心筋梗塞、関節炎、癌などが挙げられる。
アスパラギン酸プロテアーゼが関与する疾患としては、例えば、アルツハイマー病、AIDSなどが挙げられる。
セリンプロテアーゼが関与する疾患としては、例えば、C型肝炎、血栓症などが挙げられる。
【0022】
本発明のプロテアーゼ阻害剤は、単独で使用しても良いが、公知の前記疾患の予防・治療剤と併用して使用することも可能である。併用することによって、前記疾患の予防・治療効果を高めることができる。併用する公知の前記疾患の予防・治療剤は、本発明の阻害剤中に有効成分として含有させても良いし、本発明の阻害剤中には含有させずに別個の薬剤として組み合わせて商品化し使用時に組み合わせても良い。
【実施例】
【0023】
以下、実施例を挙げて、本発明を具体的に説明する。
<プロテアーゼ阻害物質の精製>
775gのギンナンの抽出物をSephadex G-50(GE Healthcare Life Sciences, Piscataway, NJ)で分画してパパイン阻害活性を有する画分を得た。
具体的手順は以下のとおりである。
まず、成熟したギンナン(殻を剥いだもの)を2〜3倍容量の抽出バッファー(50 mM Tris-HCl バッファー(pH 7.5), 10 mM KCl, 1 mM EDTA, 1 mM PMSF, 5 mM ヨード酢酸)でホモジナイズした。一晩撹拌した後、ホモジネートを33570 g、4°Cで10分遠心し、上清を得た。これを凍結乾燥し、再度、滅菌水に懸濁し、抽出バッファーに対して分子量1000のカットオフ膜を用いて透析した。透析して得られた液を、0.1 M NaCl を含む50 mM Tris-HCl バッファー(pH 7.5)で平衡化したSephadex G-50 ゲル濾過カラム(2.2 × 96 cm)
に負荷した。その結果、図1Aの横線に示される画分にパパイン阻害活性が検出された。
【0024】
得られた阻害画分 (0.52 g)をさらに、10 mM酢酸アンモニウムバッファー(pH 4.3)で平衡化したイオン交換クロマトグラフィー(SP-Sepharose high-performance column: GE Healthcare Life Sciences)を用い、NaCl リニアグラジエント (0−1.0 M)で溶出させて精製した。その結果、SDS-PAGEで分子量約 10 kDaのタンパク質のバンドが得られた (図1B)。アミノ酸配列分析(Applied Biosystems model 491 sequencer)の結果、アミノ末端の28アミノ酸残基の配列はAPGCDTVDTD LAPCISYLQT GTGNPTVQ (配列番号2の28〜55番目に相当)であった。
【0025】
さらに、同タンパク質をトリプシンで分解し、分解産物のいくつかについてアミノ酸分析を行った結果、同タンパク質の部分アミノ酸配列として、SLPGLCSVTLPFPISIATDCN(配列番号2の96〜116番目に相当)が得られた。
【0026】
<遺伝子の取得>
上記で得られた配列より縮重プライマー(5'-GCICCIGGITGYGAYACIGT-3'(GBf1:配列番号3) および5'-RTTRCARTCIGTIGCDAT-3'(GBr2:配列番号4) (R=A/G, Y=C/T, D=G/A/T, I=inosine))を作成し、RT-PCR(RTにはオリゴdTプライマーを用いた)を行って、267 bpのcDNAを得た。
得られたcDNA配列をもとにして、3' RACE(3'-rapid amplification of cDNA ends:Proc Natl Acad Sci USA 85: 8998-9002)用にプライマー GBs1 とGBs2を、5' RACE(5'-rapid amplification of cDNA ends:Proc Nat'l Acad Sci USA 85: 8998-9002)用にプライマー GBa3, GBa4, GBa5, GBa6, GBa7, およびGBa8を作成し、これらのプライマーを使用したRACE法により、357 bpのopen reading frame(配列番号1の47〜406)を含む700 bpの配列(配列番号1)を得た。
【0027】
具体的方法を以下に示す。
3'RACEには、まず、配列番号5(5'- CTGTGAATGCTGCGACTACGA(T)17V-3'(V=A/C/G))のプライマーを用いてRTを行い、プライマーGBs1(配列番号6:5'-TGGCACCTTGCATTTCCTATCTTCAGACC-3')とアダプタープライマー(配列番号7:5'-CTGTGAATGCTGCGACTACGA-3')を用いてPCRを行った。次に、プライマーGBs2(配列番号8:5'-CCGGCAACCCAACTGTACAATGCTG-3')と前記アダプタープライマーを用いてnested PCRを行って、3'側フラグメントを得た。
【0028】
5'RACEには、まず、プライマーGBa3(配列番号9:5'-GAAAGGCAGAGTAACGCTACACAGTCCCG-3')を用いてRTを行い、得られたcDNAの3’にポリAを付加した後、前記アダプタープライマーとプライマーGba4(配列番号10:5'-AGGCTTTTGACGGCGTTCGCAACC-3')を用いてPCRを行った。次に、プライマーGBa5(配列番号11:5'-ACTCGAATAGCGGCCGTCTTTATACATTCAC-3')と前記アダプタープライマーを用いてnested PCRを行って、5'側フラグメントを得た。
【0029】
さらに5'側のフラグメントを得るために、プライマーGBa6(配列番号12:5'-GCAGTTCCGGCCAGCGTTTTGACACC-3')を用いてRTを行い、得られたcDNAの3’にポリAを付加した後、前記アダプタープライマーとプライマーGBa7(配列番号13:5'-AGCATTGTACAGTTGGGTTGCCGGTTCC-3') を用いてPCRを行った。次に、プライマーGBa8(配列番号14:5'-GTGTCTACAGTGTCACATCCGGGTGCTGC-3')と前記アダプタープライマーを用いてnested PCRを行って、より長い5'側フラグメントを得た。
これにより、700 bpの配列(配列番号1)を得た。
【0030】
open reading frameによってコードされる全長119アミノ酸には、8つのシステイン残基が含まれていた (配列番号2の28番目のAlaを1として数えて4, 14, 29, 30, 50, 52, 74, 及び88番目)。また、上記アミノ酸分析で得られたアミノ末端配列は配列番号2の28〜119番目に相当したため、配列番号2の1〜27番目のアミノ酸配列(MMKISWQLWL LVAFAVMVCV WTPLSTA)はシグナル配列であると考えられ、パパイン阻害活性タンパク質は分泌タンパク質であると考えられた。Genetyx-Win プログラム (Genetyx, Tokyo, Japan)
によれば、等電点 (pI)は7.45であり、成熟タンパク質の分子量は9.44 kDaと計算された。
【0031】
そして、National Center for Biotechnology Information (NCBI) のデータベースからBlastP2.2.13を用いて検索をおこなった結果、ギンナンから精製されたパパイン阻害タンパク質は、多くの植物由来脂質輸送タンパク質(LTP1)に高い配列相同性(約40%)を示した(図2)。このことにちなんで、得られたタンパク質をGb-nsLTP1と名づけた。実際に、Gb-nsLTP1についてLTP活性と脂質結合能を測定した結果、Gb-nsLTP1はLTP活性を有しており、cis-不飽和脂肪酸に結合することがわかった(データは示さず)。
しかしながら、これまでにLTP1がプロテアーゼ阻害活性を有するという報告はなかったため、ギンナンから精製されたLTP1がプロテアーゼ阻害活性を有することは予想外の発見であった。
【0032】
<プロテアーゼ阻害活性>
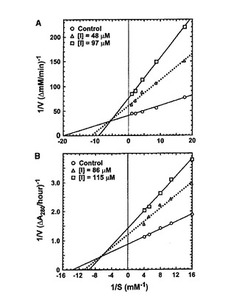
Gb-nsLTP1のプロテアーゼ阻害活性についてさらに詳細な解析を行った。アスパラギン酸プロテアーゼ、セリンプロテアーゼ、システインプロテアーゼ及びメタロプロテアーゼに対する阻害効果について調べた結果、システインプロテアーゼであるパパインを74%、アスパラギン酸プロテアーゼであるペプシンを43%、そしてセリンプロテアーゼであるトリプシンを25%阻害することがわかった。一方、メタロプロテアーゼであるサーモライシンについては阻害しなかった。パパインとペプシンに対するLineweaver-Burk プロットを図3のAおよびBにそれぞれ示す。それによると、Gb-nsLTP1 はパパイン及びペプシンを部分非競争的に阻害することがわかった。パパインとペプシンに対するKi 値はそれぞれ2.40 × 10-5 と8.50 × 10-5 Mであった。パパインに対する好ましい阻害pHは約5で
あった(図4)。
【0033】
なお、各種プロテアーゼに対する阻害活性測定の手順は以下のとおりである。
ペプシン阻害活性はAnson の方法(J Gen Physiol 22: 79-89,1938)の改変法で調べた。50
mM リン酸ナトリウムバッファー(pH 4.0)中、72μLのサンプル(Gb-nsLTP1)溶液(終濃度172 μM) を286 μL の2.5% 酸変性ヘモグロビンと混合し、37°Cで2分、プレインキュベートした。そこへ約1.0 mg ml-1 の酵素溶液(72 μL) を加え、37℃で60分、インキュベートした。インキュベート終了後、570 μL の5% (w/v) トリクロロ酢酸を加え、4℃で10分インキュベートした後、5800 g で10分遠心した。得られた上清の280 nm (A280) を測定した。ブランクとコントロールは、それぞれ、5% トリクロロ酢酸を酵素溶液添加前に加えて測定したもの、サンプル溶液を水に置換して測定したもの、とした。
%阻害は次の式で計算した。
Inhibition (%) = [A280(control) − A280(sample) + A280(blank)]/A280(control) ×
100
【0034】
パパイン阻害活性測定においては、16 μL の約0.1 mg mL-1 の酵素溶液, 16 μL のサンプル溶液 (終濃度147 μM), および652 μL の50 mM 酢酸ナトリウムバッファー(2 mM EDTA と 1 mM DTT を含有: pH 5.0) をキュベット内で混合した。
トリプシン阻害活性測定においては、16 μL の約0.01 mg mL-1 の酵素溶液, 16 μL のサンプル溶液 (終濃度147 μM), および652 μL の20 mM リン酸ナトリウムバッファー(0.6 mM CaCl2を含有:pH 6.3) をキュベット内で混合した。
キュベットをBeckman DU-640 spectrophotometer (Palo Alto, CA)内の25℃に保たれた区画に設置し、2分プレインキュベートした後、16 μL の基質(p-nitrophenyl benzyloxycarbonyl-L-lysinate (CLN) (1.1 mg mL-1) )を加えて、10秒撹拌した。
反応速度 (v0) をp-nitrophenolに対応する340 nm の吸収の増加により測定した。
%阻害を次の式で計算した。
Inhibition (%) = [1 − (v0 with sample)/(v0 without sample)] × 100
ペプシンとパパインに関する阻害定数(Ki) をDixon plot analysis (Dixon, Biochem J 55: 170-171,1953)によって求めた。
【0035】
サーモライシンについては、10 mM CaCl2 と 100 mM NaCl を含む50 mM Tris-HCl バッファー(pH 7.5) を用い、N-(3-[2-furyl]acryloyl)-Gly-Leu amide (1.0 mg mL-1) を酵素の基質として用いた。50μLの約0.01 mg mL-1 の酵素溶液と、16 μL のサンプル溶液 (終濃度49 μM)と、584 μL のバッファーをキュベット内で混合した。37℃で少なくとも2分プレインキュベートした後, 50 μL の基質を加えて10秒撹拌した。サーモライシンによる基質の加水分解を345 nmの吸収の減少によって測定した。
【0036】
パパイン阻害活性のpH依存性については、50 mM バッファー(2 mM EDTA, 1 mM DTTを含む)を用い、pH2.0 〜 7.5の範囲で調べた。バッファーは、glycine-HCl (pH 2.0−3.0),
クエン酸ナトリウム(pH 3.0−5.5), またはリン酸ナトリウム(pH 5.5−7.5)を用いた。サンプル溶液(終濃度145 μM) および約0.1 mg mL-1 の酵素溶液を各バッファーに混合してパパイン活性を測定した。
なお、各酵素、および基質はSigma-Aldrich (St. Louis, MO, USA)より購入した。
【0037】
<発現解析>
各組織におけるGb-nsLTP1の発現パターンをRT-PCRによって調べた。
各組織から単離したトータルRNAを用い、プライマーには 配列番号15(5'-ATGATGAAGATATCGTGGCAGCTC-3')のオリゴヌクレオチドと配列番号16(5'-TTAAACGATCTTGTTACAGTC-GGTGG-3')のオリゴヌクレオチドを用いてRT-PCRを行った。コントロールの18S rRNA 遺伝子増幅用には、 配列番号17(5'-ATGATAACTCGACGGATCGC-3')のオリゴヌクレオチドと
配列番号18(5'-CTTGGATGTGGTAGCCGTTT-3')のオリゴヌクレオチドを用いた。検出はSYBR Safe DNA gel stain (Invitrogen)を用いた。
その結果、図5に示すとおり、Gb-nsLTP1は未成熟種子および成熟種子において高発現していたが、茎、葉および根では発現が検出されなかった。
【0038】
<組換え体発現>
組換えGb-nsLTP1 をチオレドキシン融合タンパク質(Trx0-Gb-nsLTP1; Mr = 25400)として発現させた。
まず、配列番号19(5'-GCACCCGGATGTGACACTGTAGAC-3')と配列番号20(5'-CGGGGATCCTTATTAAACGATCTTGTTACAGTCGG-3')のオリゴヌクレオチドを用いてGb-nsLTP1 を増幅した。得られたPCR産物をT4 polynucleotide kinase (TaKaRa)でリン酸化し、BamHIで消化した後にSmaI/BamHIで消化された発現ベクターpET48 (Novagen, La Jolla, CA) に挿入した。得られたベクターpET48−Gb-nsLTP1 は アミノ末端側から、チオレドキシン tag (Trx tag), (His)6 tag, HRV3Cプロテアーゼ認識配列および Gb-nsLTP1 遺伝子をこの順で含んでいる。
【0039】
E. coli Origami2(DE3) (Novagen) をpET48−Gb-nsLTP1で形質転換し、形質転換細胞をカナマイシン (30 μg mL-1) とテトラサイクリン(10 μg mL-1)を含むLB培地で37℃で培養した。600nmの光学濃度が0.5になったときに終濃度0.5mMのIPTGを加えて組換えタンパク質の発現を誘導した。25℃で16時間培養した後、菌体を回収し、0.5% (w/v) NaClで洗浄した後、−80℃で凍結した。これを結合バッファー(0.1 mM 4-(2-aminoethyl)-benzenesulfonyl fluoride hydrochloride, 80 nM aprotinin, 2 μM leupeptin, 4 μM bestatin,
1.5 μM pepstatin A, 1.4 μM E-64を含む50 mM 燐酸ナトリウムバッファー(pH 8.0), 300 mM NaCl, 10 mM イミダゾール) に再懸濁した後、超音波処理にて細胞破砕した。遠心分離(40000 g、4°C、30分)にて得られた上清を結合バッファーで平衡化されたNi-NTA-agarose カラム (Qiagen)に負荷し、洗浄後、300 mM NaCl 及び300 mM imidazole を含む50 mM リン酸ナトリウムバッファー (pH 8.0) で溶出を行って組換えタンパク質を含む溶出液を得た。溶出液は20 mM Tris-HCl バッファー(pH 7.5)に対して透析を行った。HRV3C プロテアーゼ(Novagen) で消化することにより、Trx tag と(His)6 tagを含む部分を除いた。得られた組換えGb-nsLTP1を含むサンプルは20 mM MES バッファー(pH 5.5)で平衡化したMono-S 10/10 カラム(GE Healthcare Life Sciences)に負荷し、0 〜 0.2 M
NaClリニアグラジエントで溶出させることによってさらに精製した。得られたサンプルを10 mM MES バッファー(pH 6.0)に対して透析を行い、3,000-分子量カットオフVivaspin (Sartorius, Goettingen, Germany)を用いて濃縮して、精製組換えGb-nsLTP1とした。
【0040】
結果を図6に示す。チオレドキシン融合タンパク質は細胞破砕後の上清画分(図6:レーン2)から、Ni-NTAクロマトグラフィーによって精製した (図6:レーン3)。融合タンパク質をHRV3Cプロテアーゼで切断して、組換えGb-nsLTP1 (Mr = 9600) (図6:レーン4の下のバンド)を得た。そして、この組換えGb-nsLTP1 をMono-S クロマトグラフィーによって精製し、SDS-PAGEで単一バンドを得た (図6:レーン5)。
【0041】
<変異体の取得と評価>
R46A(配列番号2の73番目のArgをAlaに置換したもの)、P79A(配列番号2の106番目のProをAlaに置換したもの)、F80A(配列番号2の107番目のPheをAlaに置換したもの)およびI82A(配列番号2の109番目のIleをAlaに置換したもの)の変異体を含む発現ベクターを、部位特異的変異導入法により作成し、上記組換えGb-nsLTP1と同様に発現、精製した。得られた46A, P79A, F80A, およびI82Aについて、パパイン阻害活性を調べたところ、46AとI82Aは野生型とほぼ変わらなかったが、P79A とF80Aのパパイン阻害活性は野生型の約2倍を示した(表1)。
【0042】
【表1】

a 野生型の組み換え体の活性を100%としたが、天然型のタンパク質はそれぞれ116%そして115%であった。
【図面の簡単な説明】
【0043】
【図1】ギンナンからのパパイン阻害タンパク質精製のためのSephadex G-50カラムクロマトグラフィーにおける各フラクションの280nmの吸収を示す図(A)と各フラクションのSDS-PAGEの結果を示す図(B:写真)。
【図2】Gb-nsLTP1と他の植物由来LTPとの配列アラインメントを示す図。
【図3】パパイン(A)とペプシン(B)に対するLineweaver-Burk プロットを示す図。
【図4】パパイン阻害活性のpH依存性を示す図。
【図5】各組織におけるGb-nsLTP1の発現をRT-PCRで調べた結果を示す図(写真)。RT-PCRのコントロールとして18SrRNA遺伝子を用いた。
【図6】組換えGb-nsLTP1のSDS-PAGEの結果を示す図(写真)。レーン1はIPTGなし、レーン2はIPTG有り、レーン3はチオレドキシン-Gb-nsLTP1融合タンパク質、レーン4は融合タンパク質をプロテアーゼで切断した後の切断産物、レーン5は組換えGb-nsLTP1をさらに精製したもの。矢印は、上がチオレドキシン-Gb-nsLTP1融合タンパク質、下がGb-nsLTP1を示す。
【技術分野】
【0001】
本発明は、プロテアーゼ阻害剤に関するものであり、筋ジストロフィー、筋萎縮症、癌、ウイルス感染症、アルツハイマー病等を予防または治療するための医薬等に利用することが可能なプロテアーゼ阻害剤に関する。
【背景技術】
【0002】
活性中心にチオール基を有するタンパク質分解酵素はシステインプロテアーゼと総称されている。カテプシンL、カテプシンB、カテプシンK、カルシウム依存性中性プロテアーゼ、パパイン、フィシン、ブロメライン等が代表的なシステインプロテアーゼとして知られている。そして、これらシステインプロテアーゼに対して阻害作用を有する物質は、システインプロテアーゼが関与するとされる疾患、例えば筋ジストロフィー、筋萎縮症、骨粗鬆症、心筋梗塞、関節炎、癌などへの治療効果が期待できる(例えば、特許文献1)。
【0003】
また、アスパラギン酸プロテアーゼとしては、ペプシン、カテプシンD、β-セクレターゼやHIVプロテアーゼ等が知られており、ヒト疾患との関連も知られている。例えば、β-セクレターゼはアルツハイマー病の特徴であるアミロイドβ(Aβ)タンパク質の脳内生産を誘発する(例えば、特許文献2)。カテプシンDとアルツハイマー病の関係も報告されている(例えば、特許文献3)。また、HIVプロテアーゼはHIVゲノムに存在するウイルス酵素であり、HIVの複製に必要である(例えば、非特許文献1)。
【0004】
これまでにプロテアーゼ阻害物質がいくつか見いだされており、医薬への応用も試みられている。しかしながら、複数の種類のプロテアーゼに対して阻害活性を示す物質はあまり知られておらず、ギンナン抽出物の中にそのようなプロテアーゼ阻害活性を有する物質が存在することは知られていなかった。
【特許文献1】特開2004-511549号公報
【特許文献2】特表2007-530696号公報
【特許文献3】特開2008-063341号公報
【非特許文献1】Kohlら,Proc. Nat'l Acad. Sci. 1988, 85:4686
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、様々な種類のプロテアーゼに対して阻害活性を有するプロテアーゼ阻害剤であって、医薬などに利用することが可能な新規なプロテアーゼ阻害剤を提供することを目的としている。
【課題を解決するための手段】
【0006】
本発明者は、上記課題を解決するために鋭意検討を行った。その結果、ギンナン(イチョウの種)由来の約10kDaの分子量のタンパク質がシステインプロテアーゼ、アスパラギン酸プロテアーゼ、及びセリンプロテアーゼに対して阻害活性を有することを見出し、本発明を完成するに至った。
【0007】
本発明の要旨は以下のとおりである。
(1)配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列、または同アミノ酸配列において1もしくは数個のアミノ酸が置換、欠失、挿入もしくは付加されたアミノ酸配列を含むタンパク質からなるプロテアーゼ阻害剤。
(2)プロテアーゼが、システインプロテアーゼ、アスパラギン酸プロテアーゼ、またはセリンプロテアーゼである、(1)のプロテアーゼ阻害剤。
(3)(1)または(2)のプロテアーゼ阻害剤を有効成分とする医薬。
(4)配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列、または同アミノ酸配列において1もしくは数個のアミノ酸が置換、欠失、挿入もしくは付加されたアミノ酸配列を含むタンパク質をコードするDNAで形質転換された宿主生物体を培養して該タンパク質を生産させ、該タンパク質を回収することを特徴とする、プロテアーゼ阻害剤の製造方法。
【発明を実施するための最良の形態】
【0008】
次に、本発明の好ましい実施態様について詳細に説明する。ただし、本発明は以下の好ましい実施態様に限定されず、本発明の範囲内で自由に変更することができるものである。
【0009】
本発明は、ギンナン由来の約10kDaの分子量のタンパク質(Gb-nsLTP1)を有効成分として含有するプロテアーゼ阻害剤である。
【0010】
本発明に使用するGb-nsLTP1の好ましい形態としては、配列番号2のアミノ酸配列のうちの、アミノ酸番号28〜119のアミノ酸配列を有するタンパク質を挙げることができる。なお、配列番号2に記載のアミノ酸配列のうち、アミノ酸番号1〜27はシグナル配列である。
【0011】
また、通常の遺伝子においては、種、属、個体等の違いによって、1又は数個の位置での1又は数個の塩基の置換、欠失、挿入、もしくは付加などの変異が存在し、このような変異を有する遺伝子がコードするタンパク質のアミノ酸においても変異が生じている場合がある。本発明に用いることができるGb-nsLTP1には、プロテアーゼ阻害活性が損なわれない範囲において、このような変異を含むものも含有される。
【0012】
すなわち、本発明に用いることができるGb-nsLTP1としては、配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列において、1又は数個のアミノ酸の置換、欠失、挿入、もしくは付加を含み、プロテアーゼ阻害活性を有するタンパク質も例示される。なお、「1又は数個のアミノ酸の置換、欠失、挿入、もしくは付加」として可能なものは、少なくとも前記アミノ酸配列を有するタンパク質とプロテアーゼとの間の立体的な相互作用に影響を及ぼさず、プロテアーゼ阻害活性を損なわない範囲で任意に設定できるものである。例えば、「1又は数個のアミノ酸の置換、欠失、挿入、もしくは付加」とは、配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列において、例えば、1から5個、好ましくは1から3個、より好ましくは1から2個のアミノ酸の置換、欠失、挿入、もしくは付加である。
【0013】
なお、配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列における、1又は数個のアミノ酸の置換、欠失、挿入、もしくは付加の結果、システインプロテアーゼ、アスパラギン酸プロテアーゼ、およびセリンプロテアーゼのうちの、少なくとも1種のプロテアーゼに対する阻害活性を有していれば、本発明に用いることができる。
【0014】
さらに、本発明に用いることができるGb-nsLTP1としては、配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列の全長と、80%以上、好ましくは90%以上、より好ましくは95%以上の相同性を有し、プロテアーゼ阻害活性を有するタンパク質も例示される。
上記のようなGb-nsLTP1と実質的に同一のタンパク質をコードする塩基配列は、例えば部位特異的変異法によって、特定の部位のアミノ酸残基が置換、欠失、挿入、もしくは付加を含むように塩基配列を改変することによって得られる。また、上記のような改変された塩基配列は、従来知られている変異処理によっても取得されうる。
【0015】
上記のような変異を有する塩基配列を適当な細胞で発現させ、本発明の実施例に記載のプロテアーゼ阻害活性の測定法によってプロテアーゼ阻害活性を調べることにより、Gb-nsLTP1と実質的に同一のタンパク質をコードする塩基配列が得られる。
具体的な変異体としては、後述の実施例に示すようなP79A(配列番号2の106番目のProをAlaに置換したもの)、F80A(配列番号2の107番目のPheをAlaに置換したもの)などが例示される。
【0016】
Gb-nsLTP1は遺伝子組換え技術等により得ることもできる。例えば、該アミノ酸配列をコードする塩基配列を基に適当なプライマーを作製し、該プライマーを用いて、目的の塩基配列(例えば、配列番号1の128〜403)を含むcDNAを鋳型としてPCR等によって塩基配列を増幅し、得られた塩基配列を適当な大腸菌、植物、哺乳動物細胞などの発現系を用いて発現させることにより得ることができる。
また、本発明に使用するGb-nsLTP1は、ギンナンから実施例に記載されたような方法で精製して得られるGb-nsLTP1を用いることもできる。
【0017】
上記Gb-nsLTP1はプロテアーゼ阻害活性を有するため、本発明のプロテアーゼ阻害剤に使用することが可能である。ここで、プロテアーゼとしては、システインプロテアーゼ、アスパラギン酸プロテアーゼ、セリンプロテアーゼなどが挙げられ、具体的には、システインプロテアーゼとしては、カテプシンL、カテプシンB、カテプシンK、カルシウム依存性中性プロテアーゼ(CAMP)、パパイン、フィシン、ブロメライン、カスパーゼが、アスパラギン酸プロテアーゼとしては、ペプシン、カテプシンD、βセクレターゼ、HIVプロテアーゼが、セリンプロテアーゼとしては、トリプシン、血液凝固因子、C型肝炎ウイルスNS3プロテアーゼが、それぞれ挙げられる。
【0018】
本発明のシステインプロテアーゼ阻害剤は上記Gb-nsLTP1を公知の薬学的に許容される担体と組み合わせることにより、製造することができる。本発明の製剤の投与単位形態は特に限定されず、治療目的に応じて適宜選択でき、具体的には、錠剤、丸剤、散剤、液剤、懸濁剤、乳剤、顆粒剤、カプセル剤、シロップ剤、坐剤、注射剤、軟膏剤、貼付剤、点眼剤、点鼻剤等を例示できる。製剤化にあたっては製剤担体として通常の薬剤に汎用される賦形剤、結合剤、崩壊剤、滑沢剤、安定剤、矯味矯臭剤、希釈剤、界面活性剤、注射剤用溶剤等の添加剤を使用できる。
【0019】
本発明の製剤中に含まれるGb-nsLTP1の量は特に限定されず適宜選択すればよいが、例えばいずれも通常製剤中に0.005〜50質量%、好ましくは0.05〜10質量%とするのがよい。
【0020】
本発明のGb-nsLTP1を有効成分とするプロテアーゼ阻害剤を経口的、又は非経口的に患者に投与することにより、プロテアーゼが関与する疾患を治療することができる。ここで、患者とは、ヒトであってもよいが、ヒト以外の哺乳動物であってもよい。
本発明の製剤の投与方法は特に限定されず、疾患の種類、各種製剤形態、患者の年齢、性別、その他の条件、患者の症状の程度等に応じて決定される。本発明の製剤の有効成分の投与量は、用法、患者の年齢、性別、疾患の程度、その他の条件等により適宜選択される。通常有効成分としてのGb-nsLTP1の量は、0.1〜1000mg/kg/日、好ましくは10〜500mg/kg/日の範囲となる量を目安とするのが良く、1日1回又は複数回に分けて投与することができる。
【0021】
本発明のプロテアーゼ阻害剤は、プロテアーゼが関与する疾患に対する予防又は治療のための医薬として使用することができる。
システインプロテアーゼが関与する疾患としては、例えば、筋ジストロフィー、筋萎縮症、骨粗鬆症、心筋梗塞、関節炎、癌などが挙げられる。
アスパラギン酸プロテアーゼが関与する疾患としては、例えば、アルツハイマー病、AIDSなどが挙げられる。
セリンプロテアーゼが関与する疾患としては、例えば、C型肝炎、血栓症などが挙げられる。
【0022】
本発明のプロテアーゼ阻害剤は、単独で使用しても良いが、公知の前記疾患の予防・治療剤と併用して使用することも可能である。併用することによって、前記疾患の予防・治療効果を高めることができる。併用する公知の前記疾患の予防・治療剤は、本発明の阻害剤中に有効成分として含有させても良いし、本発明の阻害剤中には含有させずに別個の薬剤として組み合わせて商品化し使用時に組み合わせても良い。
【実施例】
【0023】
以下、実施例を挙げて、本発明を具体的に説明する。
<プロテアーゼ阻害物質の精製>
775gのギンナンの抽出物をSephadex G-50(GE Healthcare Life Sciences, Piscataway, NJ)で分画してパパイン阻害活性を有する画分を得た。
具体的手順は以下のとおりである。
まず、成熟したギンナン(殻を剥いだもの)を2〜3倍容量の抽出バッファー(50 mM Tris-HCl バッファー(pH 7.5), 10 mM KCl, 1 mM EDTA, 1 mM PMSF, 5 mM ヨード酢酸)でホモジナイズした。一晩撹拌した後、ホモジネートを33570 g、4°Cで10分遠心し、上清を得た。これを凍結乾燥し、再度、滅菌水に懸濁し、抽出バッファーに対して分子量1000のカットオフ膜を用いて透析した。透析して得られた液を、0.1 M NaCl を含む50 mM Tris-HCl バッファー(pH 7.5)で平衡化したSephadex G-50 ゲル濾過カラム(2.2 × 96 cm)
に負荷した。その結果、図1Aの横線に示される画分にパパイン阻害活性が検出された。
【0024】
得られた阻害画分 (0.52 g)をさらに、10 mM酢酸アンモニウムバッファー(pH 4.3)で平衡化したイオン交換クロマトグラフィー(SP-Sepharose high-performance column: GE Healthcare Life Sciences)を用い、NaCl リニアグラジエント (0−1.0 M)で溶出させて精製した。その結果、SDS-PAGEで分子量約 10 kDaのタンパク質のバンドが得られた (図1B)。アミノ酸配列分析(Applied Biosystems model 491 sequencer)の結果、アミノ末端の28アミノ酸残基の配列はAPGCDTVDTD LAPCISYLQT GTGNPTVQ (配列番号2の28〜55番目に相当)であった。
【0025】
さらに、同タンパク質をトリプシンで分解し、分解産物のいくつかについてアミノ酸分析を行った結果、同タンパク質の部分アミノ酸配列として、SLPGLCSVTLPFPISIATDCN(配列番号2の96〜116番目に相当)が得られた。
【0026】
<遺伝子の取得>
上記で得られた配列より縮重プライマー(5'-GCICCIGGITGYGAYACIGT-3'(GBf1:配列番号3) および5'-RTTRCARTCIGTIGCDAT-3'(GBr2:配列番号4) (R=A/G, Y=C/T, D=G/A/T, I=inosine))を作成し、RT-PCR(RTにはオリゴdTプライマーを用いた)を行って、267 bpのcDNAを得た。
得られたcDNA配列をもとにして、3' RACE(3'-rapid amplification of cDNA ends:Proc Natl Acad Sci USA 85: 8998-9002)用にプライマー GBs1 とGBs2を、5' RACE(5'-rapid amplification of cDNA ends:Proc Nat'l Acad Sci USA 85: 8998-9002)用にプライマー GBa3, GBa4, GBa5, GBa6, GBa7, およびGBa8を作成し、これらのプライマーを使用したRACE法により、357 bpのopen reading frame(配列番号1の47〜406)を含む700 bpの配列(配列番号1)を得た。
【0027】
具体的方法を以下に示す。
3'RACEには、まず、配列番号5(5'- CTGTGAATGCTGCGACTACGA(T)17V-3'(V=A/C/G))のプライマーを用いてRTを行い、プライマーGBs1(配列番号6:5'-TGGCACCTTGCATTTCCTATCTTCAGACC-3')とアダプタープライマー(配列番号7:5'-CTGTGAATGCTGCGACTACGA-3')を用いてPCRを行った。次に、プライマーGBs2(配列番号8:5'-CCGGCAACCCAACTGTACAATGCTG-3')と前記アダプタープライマーを用いてnested PCRを行って、3'側フラグメントを得た。
【0028】
5'RACEには、まず、プライマーGBa3(配列番号9:5'-GAAAGGCAGAGTAACGCTACACAGTCCCG-3')を用いてRTを行い、得られたcDNAの3’にポリAを付加した後、前記アダプタープライマーとプライマーGba4(配列番号10:5'-AGGCTTTTGACGGCGTTCGCAACC-3')を用いてPCRを行った。次に、プライマーGBa5(配列番号11:5'-ACTCGAATAGCGGCCGTCTTTATACATTCAC-3')と前記アダプタープライマーを用いてnested PCRを行って、5'側フラグメントを得た。
【0029】
さらに5'側のフラグメントを得るために、プライマーGBa6(配列番号12:5'-GCAGTTCCGGCCAGCGTTTTGACACC-3')を用いてRTを行い、得られたcDNAの3’にポリAを付加した後、前記アダプタープライマーとプライマーGBa7(配列番号13:5'-AGCATTGTACAGTTGGGTTGCCGGTTCC-3') を用いてPCRを行った。次に、プライマーGBa8(配列番号14:5'-GTGTCTACAGTGTCACATCCGGGTGCTGC-3')と前記アダプタープライマーを用いてnested PCRを行って、より長い5'側フラグメントを得た。
これにより、700 bpの配列(配列番号1)を得た。
【0030】
open reading frameによってコードされる全長119アミノ酸には、8つのシステイン残基が含まれていた (配列番号2の28番目のAlaを1として数えて4, 14, 29, 30, 50, 52, 74, 及び88番目)。また、上記アミノ酸分析で得られたアミノ末端配列は配列番号2の28〜119番目に相当したため、配列番号2の1〜27番目のアミノ酸配列(MMKISWQLWL LVAFAVMVCV WTPLSTA)はシグナル配列であると考えられ、パパイン阻害活性タンパク質は分泌タンパク質であると考えられた。Genetyx-Win プログラム (Genetyx, Tokyo, Japan)
によれば、等電点 (pI)は7.45であり、成熟タンパク質の分子量は9.44 kDaと計算された。
【0031】
そして、National Center for Biotechnology Information (NCBI) のデータベースからBlastP2.2.13を用いて検索をおこなった結果、ギンナンから精製されたパパイン阻害タンパク質は、多くの植物由来脂質輸送タンパク質(LTP1)に高い配列相同性(約40%)を示した(図2)。このことにちなんで、得られたタンパク質をGb-nsLTP1と名づけた。実際に、Gb-nsLTP1についてLTP活性と脂質結合能を測定した結果、Gb-nsLTP1はLTP活性を有しており、cis-不飽和脂肪酸に結合することがわかった(データは示さず)。
しかしながら、これまでにLTP1がプロテアーゼ阻害活性を有するという報告はなかったため、ギンナンから精製されたLTP1がプロテアーゼ阻害活性を有することは予想外の発見であった。
【0032】
<プロテアーゼ阻害活性>
Gb-nsLTP1のプロテアーゼ阻害活性についてさらに詳細な解析を行った。アスパラギン酸プロテアーゼ、セリンプロテアーゼ、システインプロテアーゼ及びメタロプロテアーゼに対する阻害効果について調べた結果、システインプロテアーゼであるパパインを74%、アスパラギン酸プロテアーゼであるペプシンを43%、そしてセリンプロテアーゼであるトリプシンを25%阻害することがわかった。一方、メタロプロテアーゼであるサーモライシンについては阻害しなかった。パパインとペプシンに対するLineweaver-Burk プロットを図3のAおよびBにそれぞれ示す。それによると、Gb-nsLTP1 はパパイン及びペプシンを部分非競争的に阻害することがわかった。パパインとペプシンに対するKi 値はそれぞれ2.40 × 10-5 と8.50 × 10-5 Mであった。パパインに対する好ましい阻害pHは約5で
あった(図4)。
【0033】
なお、各種プロテアーゼに対する阻害活性測定の手順は以下のとおりである。
ペプシン阻害活性はAnson の方法(J Gen Physiol 22: 79-89,1938)の改変法で調べた。50
mM リン酸ナトリウムバッファー(pH 4.0)中、72μLのサンプル(Gb-nsLTP1)溶液(終濃度172 μM) を286 μL の2.5% 酸変性ヘモグロビンと混合し、37°Cで2分、プレインキュベートした。そこへ約1.0 mg ml-1 の酵素溶液(72 μL) を加え、37℃で60分、インキュベートした。インキュベート終了後、570 μL の5% (w/v) トリクロロ酢酸を加え、4℃で10分インキュベートした後、5800 g で10分遠心した。得られた上清の280 nm (A280) を測定した。ブランクとコントロールは、それぞれ、5% トリクロロ酢酸を酵素溶液添加前に加えて測定したもの、サンプル溶液を水に置換して測定したもの、とした。
%阻害は次の式で計算した。
Inhibition (%) = [A280(control) − A280(sample) + A280(blank)]/A280(control) ×
100
【0034】
パパイン阻害活性測定においては、16 μL の約0.1 mg mL-1 の酵素溶液, 16 μL のサンプル溶液 (終濃度147 μM), および652 μL の50 mM 酢酸ナトリウムバッファー(2 mM EDTA と 1 mM DTT を含有: pH 5.0) をキュベット内で混合した。
トリプシン阻害活性測定においては、16 μL の約0.01 mg mL-1 の酵素溶液, 16 μL のサンプル溶液 (終濃度147 μM), および652 μL の20 mM リン酸ナトリウムバッファー(0.6 mM CaCl2を含有:pH 6.3) をキュベット内で混合した。
キュベットをBeckman DU-640 spectrophotometer (Palo Alto, CA)内の25℃に保たれた区画に設置し、2分プレインキュベートした後、16 μL の基質(p-nitrophenyl benzyloxycarbonyl-L-lysinate (CLN) (1.1 mg mL-1) )を加えて、10秒撹拌した。
反応速度 (v0) をp-nitrophenolに対応する340 nm の吸収の増加により測定した。
%阻害を次の式で計算した。
Inhibition (%) = [1 − (v0 with sample)/(v0 without sample)] × 100
ペプシンとパパインに関する阻害定数(Ki) をDixon plot analysis (Dixon, Biochem J 55: 170-171,1953)によって求めた。
【0035】
サーモライシンについては、10 mM CaCl2 と 100 mM NaCl を含む50 mM Tris-HCl バッファー(pH 7.5) を用い、N-(3-[2-furyl]acryloyl)-Gly-Leu amide (1.0 mg mL-1) を酵素の基質として用いた。50μLの約0.01 mg mL-1 の酵素溶液と、16 μL のサンプル溶液 (終濃度49 μM)と、584 μL のバッファーをキュベット内で混合した。37℃で少なくとも2分プレインキュベートした後, 50 μL の基質を加えて10秒撹拌した。サーモライシンによる基質の加水分解を345 nmの吸収の減少によって測定した。
【0036】
パパイン阻害活性のpH依存性については、50 mM バッファー(2 mM EDTA, 1 mM DTTを含む)を用い、pH2.0 〜 7.5の範囲で調べた。バッファーは、glycine-HCl (pH 2.0−3.0),
クエン酸ナトリウム(pH 3.0−5.5), またはリン酸ナトリウム(pH 5.5−7.5)を用いた。サンプル溶液(終濃度145 μM) および約0.1 mg mL-1 の酵素溶液を各バッファーに混合してパパイン活性を測定した。
なお、各酵素、および基質はSigma-Aldrich (St. Louis, MO, USA)より購入した。
【0037】
<発現解析>
各組織におけるGb-nsLTP1の発現パターンをRT-PCRによって調べた。
各組織から単離したトータルRNAを用い、プライマーには 配列番号15(5'-ATGATGAAGATATCGTGGCAGCTC-3')のオリゴヌクレオチドと配列番号16(5'-TTAAACGATCTTGTTACAGTC-GGTGG-3')のオリゴヌクレオチドを用いてRT-PCRを行った。コントロールの18S rRNA 遺伝子増幅用には、 配列番号17(5'-ATGATAACTCGACGGATCGC-3')のオリゴヌクレオチドと
配列番号18(5'-CTTGGATGTGGTAGCCGTTT-3')のオリゴヌクレオチドを用いた。検出はSYBR Safe DNA gel stain (Invitrogen)を用いた。
その結果、図5に示すとおり、Gb-nsLTP1は未成熟種子および成熟種子において高発現していたが、茎、葉および根では発現が検出されなかった。
【0038】
<組換え体発現>
組換えGb-nsLTP1 をチオレドキシン融合タンパク質(Trx0-Gb-nsLTP1; Mr = 25400)として発現させた。
まず、配列番号19(5'-GCACCCGGATGTGACACTGTAGAC-3')と配列番号20(5'-CGGGGATCCTTATTAAACGATCTTGTTACAGTCGG-3')のオリゴヌクレオチドを用いてGb-nsLTP1 を増幅した。得られたPCR産物をT4 polynucleotide kinase (TaKaRa)でリン酸化し、BamHIで消化した後にSmaI/BamHIで消化された発現ベクターpET48 (Novagen, La Jolla, CA) に挿入した。得られたベクターpET48−Gb-nsLTP1 は アミノ末端側から、チオレドキシン tag (Trx tag), (His)6 tag, HRV3Cプロテアーゼ認識配列および Gb-nsLTP1 遺伝子をこの順で含んでいる。
【0039】
E. coli Origami2(DE3) (Novagen) をpET48−Gb-nsLTP1で形質転換し、形質転換細胞をカナマイシン (30 μg mL-1) とテトラサイクリン(10 μg mL-1)を含むLB培地で37℃で培養した。600nmの光学濃度が0.5になったときに終濃度0.5mMのIPTGを加えて組換えタンパク質の発現を誘導した。25℃で16時間培養した後、菌体を回収し、0.5% (w/v) NaClで洗浄した後、−80℃で凍結した。これを結合バッファー(0.1 mM 4-(2-aminoethyl)-benzenesulfonyl fluoride hydrochloride, 80 nM aprotinin, 2 μM leupeptin, 4 μM bestatin,
1.5 μM pepstatin A, 1.4 μM E-64を含む50 mM 燐酸ナトリウムバッファー(pH 8.0), 300 mM NaCl, 10 mM イミダゾール) に再懸濁した後、超音波処理にて細胞破砕した。遠心分離(40000 g、4°C、30分)にて得られた上清を結合バッファーで平衡化されたNi-NTA-agarose カラム (Qiagen)に負荷し、洗浄後、300 mM NaCl 及び300 mM imidazole を含む50 mM リン酸ナトリウムバッファー (pH 8.0) で溶出を行って組換えタンパク質を含む溶出液を得た。溶出液は20 mM Tris-HCl バッファー(pH 7.5)に対して透析を行った。HRV3C プロテアーゼ(Novagen) で消化することにより、Trx tag と(His)6 tagを含む部分を除いた。得られた組換えGb-nsLTP1を含むサンプルは20 mM MES バッファー(pH 5.5)で平衡化したMono-S 10/10 カラム(GE Healthcare Life Sciences)に負荷し、0 〜 0.2 M
NaClリニアグラジエントで溶出させることによってさらに精製した。得られたサンプルを10 mM MES バッファー(pH 6.0)に対して透析を行い、3,000-分子量カットオフVivaspin (Sartorius, Goettingen, Germany)を用いて濃縮して、精製組換えGb-nsLTP1とした。
【0040】
結果を図6に示す。チオレドキシン融合タンパク質は細胞破砕後の上清画分(図6:レーン2)から、Ni-NTAクロマトグラフィーによって精製した (図6:レーン3)。融合タンパク質をHRV3Cプロテアーゼで切断して、組換えGb-nsLTP1 (Mr = 9600) (図6:レーン4の下のバンド)を得た。そして、この組換えGb-nsLTP1 をMono-S クロマトグラフィーによって精製し、SDS-PAGEで単一バンドを得た (図6:レーン5)。
【0041】
<変異体の取得と評価>
R46A(配列番号2の73番目のArgをAlaに置換したもの)、P79A(配列番号2の106番目のProをAlaに置換したもの)、F80A(配列番号2の107番目のPheをAlaに置換したもの)およびI82A(配列番号2の109番目のIleをAlaに置換したもの)の変異体を含む発現ベクターを、部位特異的変異導入法により作成し、上記組換えGb-nsLTP1と同様に発現、精製した。得られた46A, P79A, F80A, およびI82Aについて、パパイン阻害活性を調べたところ、46AとI82Aは野生型とほぼ変わらなかったが、P79A とF80Aのパパイン阻害活性は野生型の約2倍を示した(表1)。
【0042】
【表1】

a 野生型の組み換え体の活性を100%としたが、天然型のタンパク質はそれぞれ116%そして115%であった。
【図面の簡単な説明】
【0043】
【図1】ギンナンからのパパイン阻害タンパク質精製のためのSephadex G-50カラムクロマトグラフィーにおける各フラクションの280nmの吸収を示す図(A)と各フラクションのSDS-PAGEの結果を示す図(B:写真)。
【図2】Gb-nsLTP1と他の植物由来LTPとの配列アラインメントを示す図。
【図3】パパイン(A)とペプシン(B)に対するLineweaver-Burk プロットを示す図。
【図4】パパイン阻害活性のpH依存性を示す図。
【図5】各組織におけるGb-nsLTP1の発現をRT-PCRで調べた結果を示す図(写真)。RT-PCRのコントロールとして18SrRNA遺伝子を用いた。
【図6】組換えGb-nsLTP1のSDS-PAGEの結果を示す図(写真)。レーン1はIPTGなし、レーン2はIPTG有り、レーン3はチオレドキシン-Gb-nsLTP1融合タンパク質、レーン4は融合タンパク質をプロテアーゼで切断した後の切断産物、レーン5は組換えGb-nsLTP1をさらに精製したもの。矢印は、上がチオレドキシン-Gb-nsLTP1融合タンパク質、下がGb-nsLTP1を示す。
【特許請求の範囲】
【請求項1】
配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列、または同アミノ酸配列において1もしくは数個のアミノ酸が置換、欠失、挿入もしくは付加されたアミノ酸配列を含むタンパク質からなるプロテアーゼ阻害剤。
【請求項2】
プロテアーゼが、システインプロテアーゼ、アスパラギン酸プロテアーゼ、またはセリンプロテアーゼである、請求項1に記載のプロテアーゼ阻害剤。
【請求項3】
請求項1または2に記載のプロテアーゼ阻害剤を有効成分とする医薬。
【請求項4】
配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列、または同アミノ酸配列において1もしくは数個のアミノ酸が置換、欠失、挿入もしくは付加されたアミノ酸配列を含むタンパク質をコードするDNAで形質転換された宿主生物体を培養して該タンパク質を生産させ、該タンパク質を回収することを特徴とする、プロテアーゼ阻害剤の製造方法。
【請求項1】
配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列、または同アミノ酸配列において1もしくは数個のアミノ酸が置換、欠失、挿入もしくは付加されたアミノ酸配列を含むタンパク質からなるプロテアーゼ阻害剤。
【請求項2】
プロテアーゼが、システインプロテアーゼ、アスパラギン酸プロテアーゼ、またはセリンプロテアーゼである、請求項1に記載のプロテアーゼ阻害剤。
【請求項3】
請求項1または2に記載のプロテアーゼ阻害剤を有効成分とする医薬。
【請求項4】
配列番号2のうちのアミノ酸番号28〜119のアミノ酸配列、または同アミノ酸配列において1もしくは数個のアミノ酸が置換、欠失、挿入もしくは付加されたアミノ酸配列を含むタンパク質をコードするDNAで形質転換された宿主生物体を培養して該タンパク質を生産させ、該タンパク質を回収することを特徴とする、プロテアーゼ阻害剤の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2010−47508(P2010−47508A)
【公開日】平成22年3月4日(2010.3.4)
【国際特許分類】
【出願番号】特願2008−212561(P2008−212561)
【出願日】平成20年8月21日(2008.8.21)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 掲載年月日 平成20年2月27日 掲載アドレス http://www.plantphysiol.org/cgi/content/abstract/146/4/1909
【出願人】(504145364)国立大学法人群馬大学 (352)
【Fターム(参考)】
【公開日】平成22年3月4日(2010.3.4)
【国際特許分類】
【出願日】平成20年8月21日(2008.8.21)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 掲載年月日 平成20年2月27日 掲載アドレス http://www.plantphysiol.org/cgi/content/abstract/146/4/1909
【出願人】(504145364)国立大学法人群馬大学 (352)
【Fターム(参考)】
[ Back to top ]

