プローブ及び該プローブを用いた結合検出方法
【課題】コスト面に優れ、かつ、高い検出感度を得ることができる新規なプローブ、及びこれを用いた結合検出方法の提供。
【解決手段】所定の物質Tに結合可能な分子鎖Pに、他の化学種を包接し得る化学種であって、かつ、光学活性を有する第一の化学種Hが結合されていることを特徴とするプローブを提供する。このプローブは、さらに、分子鎖Pに、第一の化学種Hに包接され得る第二の化学種Aが結合されていてもよく、この場合において、第一の化学種Hと第二の化学種Aは、物質Tとの非結合時において包接状態を維持し、かつ、物質Tとの結合により包接状態が解除されるように構成されている。
【解決手段】所定の物質Tに結合可能な分子鎖Pに、他の化学種を包接し得る化学種であって、かつ、光学活性を有する第一の化学種Hが結合されていることを特徴とするプローブを提供する。このプローブは、さらに、分子鎖Pに、第一の化学種Hに包接され得る第二の化学種Aが結合されていてもよく、この場合において、第一の化学種Hと第二の化学種Aは、物質Tとの非結合時において包接状態を維持し、かつ、物質Tとの結合により包接状態が解除されるように構成されている。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、所定の物質に結合可能なプローブに関する。より詳しくは、光学活性を有する包接化学種が結合されたプローブ、及びこれを用いた結合検出方法に関する。
【背景技術】
【0002】
現在、各種疾患の分子メカニズムの解明や診断方法の確立、さらには創薬ターゲットの探索等を目的として、細胞や組織内に発現する遺伝子(核酸)や遺伝子産物(タンパク)を検出するための技術が種々開発されてきている。
【0003】
なかでも、蛍光色素を用いた検出方法は、一般に高い感度が得られること、またフォトダイオードや光電子倍増管などの小型で集積し易く、安価な部品を用いて検出装置を構成できること、などから、現在最も広く用いられている。
【0004】
一例として、二本鎖核酸の塩基対間に結合または挿入された状態で、励起光を照射されることにより蛍光を発するインターカレーター性の蛍光色素を用いた方法がある。
【0005】
インターカレーター性蛍光色素の存在下で、検出対象核酸鎖と、これに相補的な塩基配列を有するオリゴヌクレオチド(プローブ)とのハイブリダイズ(二本鎖形成)反応を行うと、生成した二本鎖核酸鎖の塩基対間にインターカレーター性蛍光色素が結合する。この際、励起光の照射によってインターカレーター性蛍光色素から発せられる蛍光を検出することで、検出対象核酸鎖を検出することができる。
【0006】
また別の例として、オリゴヌクレオチドの5′末端を蛍光色素で、3′末端をクエンチャー物質で修飾したTaqManプローブ(登録商標、以下同じ)を用いる方法がある。この方法は、特にリアルタイムPCR法に用いられている。
【0007】
TaqManプローブは、PCR反応のアニーリングステップで、検出対象DNAに特異的にハイブリダイズする。このとき、プローブ上にはクエンチャーが存在しているため、励起光を照射しても蛍光色素からの蛍光の発生は抑制されている。しかし、エクステンションステップにおいて、Taq DNA ポリメラーゼのもつ5′→ 3′エキソヌクレアーゼ活性によって検出対象DNAにハイブリダイズしたプローブが分解されると、蛍光色素がプローブから遊離し、クエンチャーによる抑制が解除され蛍光が発せられる。この蛍光を検出することで、PCR増幅産物の生成量、さらには検出対象DNA量をリアルタイムに測定することができる。
【0008】
特許文献1には、インターカレーター性蛍光色素を用いたハイブリダイゼーション検出方法が開示されている。また、特許文献2には、TaqManプローブを用いたリアルタイムPCR法により、ヒトβディフェンシン2mRNAを定量的に検出する方法が記載されている。
【0009】
以下、本発明に関連する技術用語について説明する。
【0010】
「シクロデキストリン」はデンプンにある種の酵素を作用させて得られる環状オリゴ糖であり、グルコースがα‐1,4結合で環状に連なった化合物である。グルコースが6、7、8個環状に結合したものは、それぞれα‐、β‐、γ‐シクロデキストリンと呼ばれており、天然には、さらにたくさんのグルコースが環状に結合した大環状のシクロデキストリンも存在している。現在では独ワッカーケミー社がα‐、β‐、γ‐3種類のシクロデキストリンを選択的に生成する酵素を発見し、工業生産を行っている(非特許文献1参照)。
【0011】
シクロデキストリンは、底のないバケツ型をしており環の広い側に二級水酸基が、狭い側に一級水酸基がそれぞれ外側に向いて位置しており、このため環の外側は親水性を帯び、内側が疎水性の空洞の場となっている。この空洞に分子、特に水溶液中では疎水性の分子を取り込む、すなわち「包接」する。包接能は環のサイズと包接される分子のサイズの調和、および分子の疎水性などに応じて異なる。
【0012】
シクロデキストリンはオリゴ糖であるから水溶性であり、脂溶性物質の可溶化にも用いられる。また構成単位である光学活性なオリゴ糖に由来して、シクロデキストリンも光学活性である。
【0013】
シクロデキストリンの包接現象は、食品、化粧品、医薬品の工業分野で、わさびなどの揮発性香料の徐放、ビタミン類など、光、熱に不安定な物質の安定化、経口抗真菌剤であるスポラノックス(登録商標)では水溶性改善に利用されている。分析化学の分野ではアフィニティークロマトグラフィーやキャピラリー電気泳動法に応用されている(非特許文献2参照)。また、最近ではドラッグデリバリーへの応用が有望視されている(非特許文献3参照)。
【0014】
シクロデキストリンの包接能、すなわち分子認識能を利用して、特定の物質に対するセンサーとする研究も盛んである。センサープローブとしての蛍光色素部、シクロデキストリン、クエンチャーなどの機能性部をつなぐ支持台としてポリペプチドを採用し、蛍光強度、蛍光寿命などによってゲスト化合物の検出を行う試みがなされている(非特許文献4及び非特許文献5参照)。なお、上記のポリペプチドは単に支持台として用いられ、他の物質に結合し得るものではなく、これらの技術はシクロデキストリンに包接するゲスト化合物そのものを検出するためのものである。
【0015】
「円二色性(Circular Dichroism:CD)」とは、右円偏光と左円偏光に対する吸光度の差が生じる現象で、この結果生じた偏光は楕円偏光となる。楕円率は左右偏光の放射強度の関数となり、さらにランバートベールの式を代入することで、モル円二色性とモル楕円率の間に [θ] = 18000/4πlog10e・Δε ≒ 3298Δεの関係を導き出すことができる。すなわち、円二色性はモル円二色性とモル楕円率のどちらかで表すことができる。物質固有のモル円二色性またはモル楕円率が既知であれば、物質濃度を算出することが可能である。
【0016】
シクロデキストリンは光学活性であるから、本来の吸収遷移に応じて紫外域で円二色性を示す。本来は光学活性でない分子Gが光学活性分子Hと包接体や付加体を形成すると、励起子カップリングにより、Gの吸収遷移に応じて円二色性を示すことがある。これを「誘起円二色性」と呼ぶ。Gが色素であれば、吸収遷移は可視部に現れ、他の構成種と区別して検出することが容易となる。
【0017】
次に、「円二色性測定装置」について説明する。一般的な円二色性測定装置は、さまざまな振動ベクトルを持った光の混ざった非偏光を励起光とし、偏光プリズムにて直線偏光とした後に、λ/4波長板などの円偏光変調器にて左右の円偏光に変換する。この左右円偏光に同期して、サンプルを通過した光の吸光度データを交互に光電子倍増管などの検出器で採取し、計算処理する。もし左右円偏光に同期して、サンプルの蛍光を測定すれば、すなわち蛍光検出円二色性を観測したことになる(特許文献3参照)。
【0018】
【特許文献1】特開2006−296279号公報
【特許文献2】特開2004−248676号公報
【特許文献3】特許第3745881号公報
【非特許文献1】「古くて新しい食品素材−天然シクロデキストリンの利用技術」, Foods Food Ingredients Journal. Japan, 2005, Vol.210, No.3, p.222-243
【非特許文献2】“Cyclodextrinsand Their Applications in Analytical Chemistry.”, Chemical Reviews, 1992, Vol.92, No.6, p.1457-1470
【非特許文献3】「ナノマテリアルシクロデキストリン」、シクロデキストリン学会編、産業図書,2005
【非特許文献4】“Guest-Induced Diminishment in Fluorescence Quenching and Molecule Sensing Ability of A novel Cyclodextrin-Peptide Conjugate.” Journal of American Chemistry Society, 2001, Vol.123, No.30, p.7435-7436
【非特許文献5】“Fluorescent Cyclodextrin/Peptide Hybrids with a Novel Guest-Responsive Chemosensor in the Peptide Side Chain.” Macromolecular Raped Communication, 2002, Vol.23, No.15, p.905-908
【発明の開示】
【発明が解決しようとする課題】
【0019】
上述したインターカレーター性の蛍光色素を用いた方法は、安価なインターカレーター性蛍光色素を用いることができ、コスト面で優れている。しかし、二本鎖に結合していない遊離色素からのバックグランド蛍光や、ヘアピン構造をとる一本鎖やミスマッチ鎖に結合した色素からのノイズ蛍光によって、検出感度が低下するという問題があった。特に、微量の核酸鎖の検出を行う場合には、十分な感度を得ることが難しかった。
【0020】
TaqManプローブを用いた方法では、インターカレーター性蛍光色素で生じていたバックグランド蛍光やノイズ蛍光の問題を解決し、より感度の高い検出を行うことが可能である。しかし、TaqManプローブは非常に高価であるため、コスト面での問題があった。また、TaqManプローブを用いた方法では、蛍光色素を直接プローブに標識していることから、反応系に過剰量の蛍光色素を投入して蛍光検出を行うインターカレーター性蛍光色素を用いる方法に比べて、蛍光検出時の蛍光色素劣化の影響を受け易いという問題もある。
【0021】
そこで、本発明は、コスト面に優れ、かつ、高い検出感度を得ることができる新規なプローブ、及びこれを用いた結合検出方法を提供することを主な目的とする。
【課題を解決するための手段】
【0022】
上記課題解決のため、本発明は、所定の物質に結合可能な分子鎖に、他の化学種を包接し得る化学種であって、かつ、光学活性を有する第一の化学種が結合されていることを特徴とするプローブを提供する。
本発明に係るこのプローブは、さらに、分子鎖に、第一の化学種に包接され得る第二の化学種が結合されていてもよい。
この場合において、第一の化学種と第二の化学種は、物質との非結合時において包接状態を維持し、かつ、物質との結合により包接状態が解除されるように構成される。この包接状態は、例えば、分子鎖が形成するステムループ構造によって安定化されるよう構成することができる。
このプローブと物質との結合反応を、第一の化学種に包接され得る色素の存在下において行い、プローブと物質との非結合時において維持される第一の化学種と第二の化学種の包接状態が、プローブと物質との結合によって解除されることにより、色素が第一の化学種に包接されて獲得する誘起円二色性を検知することで、物質とプローブとの結合を検出することができる。
この際、第一の化学種に対する色素の包接能は、第一の化学種に対する第二の化学種の包接能よりも低いことが望ましい。
【0023】
また、本発明に係るプローブの第二の化学種を、色素としてもよい。
このプローブと物質との結合反応を行い、プローブと物質との非結合時において維持される第一の化学種と色素の包接状態が、プローブと物質との結合によって解除されることにより、色素の誘起円二色性が消失することを検知することで、物質とプローブとの結合を検出することができる。
【0024】
さらに、本発明は、所定の物質に結合可能な分子鎖に、他の化学種を包接し得る化学種であって、かつ、光学活性を有する第一の化学種が結合された上記の第一のプローブに加え、分子鎖に、第一の化学種に包接され得る第二の化学種が結合された第二のプローブと、からなるプローブペアを提供する。
このプローブペアにおいて、第一の化学種と第二の化学種は、物質との非結合時において包接状態を維持し、かつ、物質との結合により包接状態が解除されるように構成される。
第二の化学種は、色素としてもよく、このプローブペアと物質との結合反応を行い、プローブペアと物質との非結合時において維持される第一の化学種と色素の包接状態が、プローブと物質との結合によって解除されることにより、色素の誘起円二色性が消失することを検知することで、物質とプローブとの結合を検出することができる。
本発明に係る結合検出方法は、特に、リアルタイムPCR法に好適に用いることができるものである。
【0025】
ここで、本発明において「所定の物質」には、核酸やペプチド、タンパクが少なくとも含まれる。従って、「所定の物質」及び「所定の物質に結合可能な分子鎖」の組み合わせとしては、例えば、特定の一本鎖核酸とこれにハイブリダイズする核酸鎖又は核酸類似構造鎖、特定のタンパクとこれに結合するタンパク又はペプチド等の組み合わせがある。他に、特定の核酸やペプチド、タンパクとこれに相互作用する化合物、特定の物質とこれにパイ電子相互作用や水素結合、静電的な効果等により相互作用する物質、などの組合せが可能である。
【0026】
「誘起円二色性」とは、キラルな物質が円偏光を吸収する際に左円偏光と右円偏光に対して吸光度に差が生じる現象のことをいう。誘起円二色性はその物質が吸収する波長でのみ生じる。誘起円二色性は、非偏光の励起光を偏光プリズム及びλ/4波長板などの円偏光変調器を用いて左右の円偏光に変換して物質を照射し、その透過光における左右円偏光に対する吸光度差を検出することにより検知することができる。
【0027】
また、「ステムループ構造」とは、一般的には、一本鎖DNAや一本鎖RNAにおいて、分子内で離れた2箇所の領域に相補的な配列がある場合、核酸の塩基対間の相互作用によって二重鎖を形成するとともに、その2領域ではさまれたランダムな配列部がループ構造をなすものをいう。ヘアピンループとも称される。タンパクやペプチドの立体(3次元)構造は、分子内における親水性部分及び疎水性部分の存在によって、また分子間での水素結合やパイ電子による相互作用によって、決定される。本発明における「ステムループ構造」には、上記の核酸鎖におけるヘアピンループの他、タンパクやペプチドの立体構造において、分子内の離れた2箇所の領域間での相互作用の結果、その2領域ではさまれた配列部がループ状の構造をとっているものも含まれるものとし、この他、所定の分子鎖が、その分子内の2領域間における水素結合や静電的な効果、パイ電子等による相互作用の結果形成するループ状の構造を広く包含し得るものとする。
【発明の効果】
【0028】
本発明により、コスト面に優れ、かつ、高い検出感度を得ることができる新規なプローブ、及びこれを用いた結合検出方法が提供される。
【発明を実施するための最良の形態】
【0029】
以下、本発明を実施するための好適な形態について図面を参照しながら説明する。なお、以下に説明する実施形態は、本発明の代表的な実施形態の一例を示したものであり、これにより本発明の範囲が狭く解釈されることはない。
【0030】
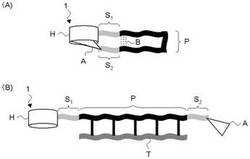
図1は、本発明に係るプローブの第一の実施形態を示す模式図である。図中、プローブを符号1で示す。
【0031】
図1中、符号Pは所定の物質に結合可能な分子鎖を示す。分子鎖Pは、自己組織化や吸着、光照射、加熱などによって、物質の特定の構造を認識して結合する結合領域である。分子鎖Pは、物質に応じて、オリゴヌクレオチドやオリゴペプチド、ポリペプチドなどの化学的に活性な基を有する高分子鎖によって構成することができる。
【0032】
図1中、符号Hは、他の化学種を包接し得る化学種(包接化学種)であって、かつ、光学活性を有する第一の化学種(以下、「ホストH」という)を示す。ホストHは、その光吸収スペクトル(以下、単に「吸収スペクトル」という)と、後述する色素Dとの吸収スペクトルと、の重なりが小さいものを用いることが望ましい。これは、色素Dの誘起円二色性検出のためである(この点、後述する)。
【0033】
ホストHは、図1中、符号S1で示すスペーサーによって、分子鎖Pの一端に結合されている。スペーサーS1は、通常、オリゴヌクレオチドプローブ等の化学修飾に用いられる二官能性スペーサーであってよく、例えば、アルキレンやオリゴペプチド、オリゴヌクレオチド、ポリエーテル、ポリビニレンなどの高分子構造からなる。スペーサーS1には、エーテル結合やスルフィド結合、ペプチド結合、エステル結合、ウレタン結合、リン酸結合、スルホン酸、アリーレンなどを含んでもよく、また分岐構造をとってもよい。さらに、アリーレンはヘテロ原子を含んでいてもよい。
【0034】
図1中、符号Aは、ホストに包接され得る第二の化学種(以下、「アンカーA」という)。アンカーAは、ホストHに包接されて、後述する色素DがホストHに包接されるのを阻害する。このアンカーAの色素Dに対する包接阻害作用を確実ならしめるため、アンカーAのホストHに対する包接能は、色素DのホストHに対する包接能と同程度以上であることが望ましい。
【0035】
アンカーAは、図1中、符号S2で示すスペーサーによって、分子鎖PのホストHと反対端に結合されている。スペーサーS2の構成は、スペーサーS1と同様とすることができるが、必ずしも同一である必要はなく、スペーサーS1で説明したもののなかから任意に選択することができる。
【0036】
図2は、ホストHとして好適に採用可能な化学種の一例を示す図である。
【0037】
図2中、(A)はα−シクロデキストリン置換基、(B)はβ−シクロデキストリン置換基、(C)はγ−シクロデキストリン置換基、(D)はヘプタキス(o−メチル)−γ−シクロデキストリン置換基を示す。図中、「-X-」は「-O-」, 「-S-」, 「-NH-」, 「-OC(=O)-」,「-OS(=O) 2-」, 「OP(=O)2O-」,「- NHC(=O)-」から選択される基である。
【0038】
各化学種中、水酸基の全て又は一部は、メルカプト基やオキシ基、チオ基、アミノ基、カルバモイル基、オキシカルボニル基、カルボキシ基、スルホ基、リン酸基、トリアルキルシロキシ基などに変換されていてもよい。
【0039】
図3は、アンカーAとして好適に採用可能な化学種の一例を示す図である。
【0040】
図3中、(A)はコレステロール置換基、(B)はリトコール置換基、(C)はアダマンタン置換基、(D)はビタミンA置換基、(E)はユビキノン置換基、(F)はナフタレン置換基、(G)はピレン置換基、(H)はベンゾ[c]フェナントレン置換基、(I)はビナフチル置換基、(J)はルテニウム(II)トリス(フェナントロリン)置換基を示す。図中、「-X2-」は、「-O-」, 「-S-」, 「-NH-」, 「-OC(=O)-」,「-OS(=O) 2-」, 「OP(=O)2O-」,「- NHC(=O)-」から選択される基である。
【0041】
各化学種は、分子内にキラル構造を有してもよい。この他、アンカーAとしては、ステロイド構造を有する化学種を広く採用することが可能である。
【0042】
図4は、プローブ1の具体的な構成例を示す模式図である。
【0043】
図4中、符号11で示すプローブは、所定の物質が核酸である場合に、分子鎖Pを該核酸に相補的な塩基配列を有するオリゴヌクレオチド(塩基数n)として、またホストHをβ−シクロデキストリン、アンカーAをリトコール酸とした場合を示した。
【0044】
図5は、プローブ1の挙動を示す模式図である。(A)は、所定の物質との非結合時、(B)は結合時の状態を示す。
【0045】
まず、図5(A)に示す所定の物質(図5(B)符号T参照)との非結合時におけるプローブ1では、アンカーAがホストHに包接されることにより、分子鎖Pは折れ曲がって図のようなループ構造をとる。
【0046】
プローブ1では、分子鎖Pのうち、スペーサーS1側及びスペーサーS2側の両末端に位置する2つの領域(後述する「ステム部St1及びSt2」)が、水素結合(図5(A)中、符号B参照)を形成し、分子鎖Pのループ構造の形成が促進、安定化されるよう構成されている。すなわち、アンカーAがホストHに包接され、分子鎖Pが折れ曲がると、スペーサーS1側及びスペーサーS2側の両末端に位置する2つの領域が相互に水素結合Bを形成することによって、分子鎖Pのステムループ構造が安定化するよう構成されている。
【0047】
一方、図5(B)に示す物質Tとの結合時におけるプローブ1では、分子鎖Pは、物質Tとの結合のためにループ構造をとることができない。従って、アンカーAは、ホストHに対し包接状態を形成し得る距離にまで容易に近接することができず、ホストHとの包接状態を形成する確率が極端に減少する。
【0048】
このように、プローブ1は、物質Tとの非結合時には、ホストHとアンカーAとが包接状態を維持し、物質Tとの結合によってこの包接状態が解除されることを特徴としている。
【0049】
図6は、分子鎖Pが形成するステムループ構造を示す模式図である。(A)は、ステムループ構造非形成時のスペーサーS1及びS2と分子鎖Pを、(B)は形成時のスペーサーS1及びS2と分子鎖Pを拡大して示している。なお、図では、分子鎖Pをオリゴヌクレオチとした上記プローブ11を例示した。
【0050】
図6(A)に示す分子鎖Pは、スペーサーS1側及びスペーサーS2側の両末端に位置する2つの領域に、ステム部St1及びSt2が設けられている。ステム部St1の塩基配列は、スペーサーS1に続いて5´末端側から「GATCGAA」であり、ステム部St2の塩基配列は5´末端側からスペーサーS2に向かって「TTCGATC」とされている。
【0051】
先に説明したように、アンカーAがホストHに包接されると、分子鎖Pが折れ曲がってループ構造となる。このとき、図6(B)に示すように、ステム部St2は、ステム部St1に対して逆向きに配置される。そして、ステム部St2の塩基配列「TTCGATC」は、この配置状態において、ステム部St1の塩基配列「GATCGAA」に対して相補的となるようにされている。これにより、ステム部St1及びSt2の対向する各塩基間に水素結合Bを形成させることができる。
【0052】
この水素結合Bの形成によって、分子鎖Pはステムループ構造を形成することとなり、アンカーAのホストHへの包接による分子鎖Pのループ構造の形成が、さらに促進、安定化されることとなる。
【0053】
このステムループ構造による分子鎖Pのループ構造の形成の促進、安定化作用は、分子鎖Pに用いる分子種及び分子数によって、ステム部St1及びSt2間の水素結合の強度及び数を任意に設定することによって、任意に調整することができる。
【0054】
分子鎖Pをオリゴヌクレオチドとして構成する場合には、ループ部(分子鎖Pのうち、ステム部St1とステム部St2の間の領域)の塩基配列数は、4〜8塩基程度が好適である(”A Semiflexible Polymer Model Applied to Loop Formation in DNA Hairpins.” Biophysical Journal 2001, Vol.81, p2864-2875
参照)
【0055】
なお、このステムループ構造は、物質Tとの非結合時におけるホストHとアンカーAの包接状態の維持を確実ならしめるためのものであり、ホストHへのアンカーAの包接のための必須の構成となるものではない。上述のように、分子鎖Pのループ構造は、アンカーAのホストHへの包接の結果生じるものであり、水素結合Bはこのステムループ構造の形成促進、安定化に機能するものである。
【0056】
図7は、プローブ1と物質Tとの結合を検出する方法を説明する模式図である。(A)は、プローブ1と物質Tとの結合反応前、(B)は結合反応後、の反応系を示す。
【0057】
まず、図7(A)に示すように、物質Tとプローブ1との結合反応を、ホストHに包接され得る色素(図中、符号D参照)の存在下において行う。
【0058】
図7中、符号Nは、物質Tと共存する他の物質を表している。プローブ1の分子鎖Pは他の物質Nと結合しないため、プローブ1と他の物質Nとが結合することはない。なお、図では、プローブ1及び物質T、他の物質N、色素Dを便宜上一分子ずつ示したが、これらは反応系に複数存在するものである。
【0059】
図に示すように、結合反応前においては、ホストHはアンカーAとの包接状態を維持している。このため、色素DはホストHに対する包接能を有するものの、アンカーAが色素DのホストHへの包接を阻害するため、色素DがホストHに包接される確率は無視しうる。以下、ホストHに包接されていない状態の色素Dを「遊離色素D」というものとする。
【0060】
遊離色素Dに対し、非偏光を偏光プリズムによって直線偏光に変換し、さらにλ/4波長板などにより円偏光に変換した測定光(図中、符号L1参照)を照射すると、遊離色素Dによって特定波長が吸収された透過光が測定対象光(図中、符号L2参照)として生じる。
【0061】
この際、遊離色素Dは光学活性(以下、「キラリティ」ともいう)を有さないため、色素Dが吸収する左円偏光と右円偏光の吸光度に差は生じない。従って、色素Dに対する測定光L1の照射により誘起円二色性が生じることはなく、測定対象光L2の検出によって誘起円二色性が検知されることはない。
【0062】
これに対して、図7(B)に示す結合反応後においては、分子鎖Pと物質Tとの結合により、ホストHとアンカーAとの包接状態が解除され、アンカーAに代わって色素DがホストHに包接される。そして、色素DはホストHへの包接により、ホストHの供するキラルな場によって誘起されてキラリティを獲得する。
【0063】
従って、図に示すように、ホストHに包接された色素Dに対し測定光L1を照射すると、色素Dの吸収波長において、キラリティによる左円偏光と右円偏光に対する吸光度差が生じ、誘起円二色性を呈する測定対象光L3が検出されることとなる。
【0064】
このように、プローブ1では、物質Tとの非結合時においては透過光(測定対象光L2)が誘起円二色性を呈することはないが、物質Tと結合すると透過光(測定対象光L3)が誘起円二色性を呈するようになる。従って、物質Tとプローブ1との結合反応を色素Dの存在下において行い、測定光L1の照射によって色素Dから発生する透過光(測定対象光L2又は測定対象光L3)の誘起円二色性を検知することによって、物質Tとプローブ1との結合を検出することが可能となる。
【0065】
色素Dは、ホストHに包接され得る色素であれば特に限定されないが、より好適には色素DのホストHに対する包接能が、アンカーAのホストHに対する包接能と同程度以下であるものが望ましい。これにより、結合反応前(図7(A)参照)において、アンカーAが、色素DのホストHへの包接を確実に阻害するようにできる。また、色素Dは、測定対象光L2及び測定対象光L3の検出のため、その吸収スペクトルと、ホストHとの吸収スペクトルと、の重なりが小さいものを用いることが望ましく、さらに物質Tが核酸鎖であって、プローブ1の分子鎖Pがオリゴヌクレオチドである場合には、インターカレーター性のない色素を用いることが好ましい。
【0066】
図8は、色素Dとして好適に採用可能な化学種の一例を示す図である。
【0067】
図8中、(A)はトリメチンシアニン色素(Cy3骨格)、(B)はペンタメチンシアニン色素(Cy5骨格)、(C)はチアゾールオレンジ(TO)、(D)はアクリジンオレンジ(AO)、(E)はアクリジンレッド(AR)、(F)はニュートラルレッド(NR)、(G)はダンシル酸(DA)、(H)はローダミンB(RhB)、(I)はフルオレセイン(FL)、(J)はエチルブロミド(EB)、(K)はピレン、(L)はクマリン102(C102)、(M)はエチルレッド(ER)を示す。また、これらの色素は置換基を有していてもよい。
【0068】
測定対象光L2及び測定対象光L3における誘起円二色性の検知は、先に説明した一般的な円二色性測定装置により行うことが可能である。具体的には、さまざまな振動ベクトルを持った光の混ざった非偏光を励起光とし、偏光プリズムにて直線偏光とした後に、λ/4波長板などの円偏光変調器にて左右の円偏光に変換する。この左右円偏光に同期して、サンプルを通過した透過光の吸光度データを交互に光電子倍増管などの検出器で採取し、左右偏光の吸光度差を算出することにより、誘起円二色性の検知を行う。
【0069】
この際、測定装置の小型化、高感度化のために、光磁気記録用のピックアップを改造すれば検出器として利用可能である。光磁気記録での読み取り(すなわち、検出)は、本来、磁化されたメディアに直線偏光を入射し、反射光の偏光面が、入射光に対してわずかに回転して楕円偏光となる現象(磁気カー効果と呼ぶ)を利用したものである。ここで、磁気メディアの替わりに円二色性を示すサンプルを配置すれば、同様に入射光に対する楕円率を測定することが可能である。
【0070】
光磁気記録用のピックアップは、一般的には半導体レーザー、複数個の光検出器、偏光ビームスプリッタまたは偏光ホログラム素子、および対物レンズから構成される。半導体レーザーから出射された光は対物レンズによってメディアに集光され、反射光または透過光を偏光ビームスプリッタまたは偏光ホログラム素子によって左右偏光にそれぞれ分離して各光検出器に到達する。左右偏光の強度から、楕円率を算出することが出来る。
【0071】
また、ここまでは、測定光L1の照射によって色素Dが呈する透過光(測定対象光L2又は測定対象光L3)の誘起円二色性を検知する場合を説明したが、別法として、円偏光変調器により分離された左右の円偏光によってそれぞれ励起された色素Dの蛍光量を円偏光変調器に同期して採取し、処理したデータをもって)誘起円二色性(「蛍光円二色性」ということもできる)を検知することもできる。
【0072】
この場合、キラルな場に置かれた色素Dの吸収する左右円偏光には差があるため、それぞれで励起される蛍光量にも差が生じる。一方、遊離色素Dは左右円偏光を等分吸収するため蛍光量も同じとなる。よってこの差を検出すれば、キラルな場に置かれた色素Dを遊離色素Dと区別することが可能となる。
【0073】
次に、図7に基づいて、プローブ1と物質Tとの結合検出方法についてさらに具体的に説明する。
【0074】
ここでは、分子鎖Pをオリゴヌクレオチド(塩基数n)として構成した上述のプローブ11を用いて、物質Tとして核酸(以下、「検出対象核酸T」という)を検出する場合を例として説明する。
【0075】
まず、図7(A)に示すように、検出対象核酸鎖Tを含む試料とプローブ11とのハイブリダイゼーション反応を、色素Dの存在下において行う。このハイブリダイゼーション反応は、例えば、PCRやDNAマイクロアレイ(DNAチップ)において行うことが考えられる。PCRでは、従来のTaqmanプローブの替わりにプローブ11を用いて、アニーリングステップの際に、増幅された検出対象核酸鎖Tとプローブ11とのハイブリダイゼーション反応を行う。また、DNAマイクロアレイの場合、プローブ11をスライドガラス等の基板上に固相化し、試料中に含まれる検出対象核酸鎖Tとのハイブリダイゼーション反応を行う。なお、プローブ11の固相化については、図11において後述する。
【0076】
これらハイブリダイゼーション反応において、プローブ11と検出対象核酸鎖Tが二本鎖形成をしていない段階では、ホストHはアンカーAとの包接状態を維持するため、色素DはホストHに包接されず、測定対象光L2の検出によって誘起円二色性が検知される確率は極めて小さくなる(図7(A)参照)。
【0077】
これに対して、プローブ11と検出対象核酸鎖Tが二本鎖を形成すると、ホストHとアンカーAとの包接状態が解除され、色素DがホストHに包接される。これにより、色素Dがキラリティを獲得し、測定対象光L3の検出によって誘起円二色性が検知されるようになる(図7(B)参照)。
【0078】
従って、プローブ11によれば、PCRのアニーリングステップにおいて測定対象光L3の誘起円二色性を検知することにより、PCR溶液中のプローブ11と検出対象核酸鎖Tとのハイブリダイズを検出することができる。さらに、ホストHに包接された色素Dが呈する測定対象光L3(誘起円二色性あり)の左右円偏光に対する吸光度差に基づいて、検出対象核酸鎖Tの増幅量をリアルタイムに定量検出することができる。
【0079】
PCRにおけるホストHと色素Dの包接状態の形成は、従来のTaqmanプローブで行われているようなポリメラーゼの5′→ 3′エキソヌクレアーゼ活性を利用し、プローブを分解させることによって行うことも可能である。具体的には、アニーリングステップにおいて検出対象核酸鎖Tにハイブリダイズしたプローブ11を、エクステンション(伸長反応)ステップにおいてポリメラーゼのエキソヌクレアーゼ活性により分解し、ホストHをプローブ11本体から遊離させる。これにより、エクステンションステップ後に、遊離したホストHと反応溶液中に含まれる遊離色素Dとが包摂状態を形成することとなり、色素Dの左右円偏光に対する吸光度差に基づいて誘起円二色性を検知できる。
【0080】
DNAマイクロアレイにおいても、測定対象光L3における誘起円二色性に基づいて、基板上に固相化したプローブ11と検出対象核酸鎖Tとのハイブリダイズを検出することができる。そして、遊離色素Dから発生する測定対象光L2(誘起円二色性なし)と、ホストHに包接された色素Dから発生する測定対象光L3(誘起円二色性あり、楕円偏光)との比率に基づいて、試料中の検出対象核酸鎖Tを定量的に検出することが可能となる。
【0081】
以上のように、プローブ1によれば、測定対象光L3の誘起円二色性に基づいて、物質Tとプローブ1との結合を検出することが可能であるため、従来のインターカレーター性の蛍光色素を用いた検出方法で生じていたバックグランド蛍光やノイズ蛍光が生じることがなく、高い検出感度を得ることが可能となる。
【0082】
また、廉価な色素Dを用いることで、TaqManプローブにおけるコスト上の問題を解決することができる。さらに、廉価な色素Dを反応系に大過剰量投入することで、TaqManプローブを用いた方法で生じていた蛍光検出時の蛍光色素劣化の問題を解決することが可能となる。
【0083】
次に、図9及び図10に基づいて、プローブ1と物質Tとの結合検出方法について他の具体例を説明する。
【0084】
図9中、符号12で示すプローブは、物質Tがタンパク質である場合に、分子鎖Pを該タンパク質に結合可能なペプチド(アミノ酸数14)とした場合を示した。
【0085】
図9下方に、分子鎖Pのペプチド配列を拡大して示す。分子鎖Pは、「Leu-Lys-Lys-Leu-Leu-Lys-Leu-Leu-Lys-Lys-Leu-Leu-Lys-Leu」で示されるペプチド配列であって、α−へリックス構造を形成する配列を有している。以下、このプローブ12を用いて、α−へリックス構造を認識して結合するタンパク質であるカルモジュリン(以下、「カルモジュリンT」という)とプローブ12との結合を検出する方法について説明する。
【0086】
まず、カルモジュリンTとプローブ12との結合反応を、色素Dの存在下において行う。なお、このようなカルモジュリンTとプローブ12との結合反応は、タンパク質間の相互作用としてみることができ、タンパク質の機能解析のため用いることができる。
【0087】
図10(A)に示すように、プローブ12とカルモジュリンTが結合していない段階では、同一分子内にホストHとアンカーAが存在することで分子内錯形成による自由エネルギーの利得、特にはエントロピーの利得によってホストHはアンカーAとの包接状態を維持するため、色素DはホストHに包接されにくく、測定対象光L2の検出によって誘起円二色性が検知される確率は極めて低い。
【0088】
これに対して、図10(B)に示すように、カルモジュリンTがプローブ12の分子鎖Pによって形成されるα−へリックス構造を認識してプローブ12に結合すると、ホストHとアンカーAとの包接状態が解除され、色素DがホストHに包接される。これにより、色素Dがキラリティを獲得し、測定対象光L3の検出によって誘起円二色性が検知されるようになる。
【0089】
従って、プローブ12によれば、結合反応において測定対象光L3の誘起円二色性を検知することにより、プローブ12とカルモジュリンTとの結合を検出することができる。さらに、ホストHに包接された色素Dが呈する測定対象光L3(誘起円二色性あり)の左右円偏光に対する吸光度差に基づけば、カルモジュリンTに結合したプローブ12の量を定量的に検出することができる。
【0090】
このカルモジュリンTとプローブ12との結合検出方法は、分子鎖Pのペプチド配列を任意に設計することにより、カルモジュリンに替えて種々のタンパク質とプローブ12との結合検出に応用することができる。これにより、合成ペプチドライブラリー中から目的とするタンパク質に認識され得るペプチド配列(抗原)をスクリーニングしたり、タンパク質ライブラリー中から所定のペプチド配列に結合し得るタンパク質をスクリーニングするといったタンパク質の機能解析を行うことが可能となる。
【0091】
図11は、本発明に係るプローブの第二の実施形態を示す模式図である。図中、プローブを符号2で示す。
【0092】
図11中、符号Pは所定の物質に結合可能な分子鎖、符号Hは他の化学種を包接し得る化学種(包接化学種)であって、かつ、光学活性を有する第一の化学種(ホスト)、符号S1及びS2はスペーサーを示す。分子鎖P、ホストH、スペーサーS1及びS2については、図1で示したプローブ1と同様の構成とすることができる。
【0093】
ここで、プローブ1では、分子鎖Pの一端に、ホストHに包接され得る第二の化学種としてアンカーAを結合しているのに対して(図1参照)、図に示すプローブ2では、上記第二の化学種として色素Dを結合している点で異なっている。この色素Dは、図7で説明したものと同一のものであり、ホストHに包接され得る色素である(図8参照)。
【0094】
また、プローブ2では、分子鎖PのスペーサーS1の反対側にスペーサーS3を結合して、プローブ2を他の物質に結合できるように構成した。スペーサーS3は、例えば、先に挙げたDNAマイクロアレイにプローブ2を用いる場合、基板表面上へプローブ2を固相化するために必要となる。
【0095】
スペーサーS3は、通常、オリゴヌクレオチドプローブ等を基板表面に固相化するために用いられる二官能性スペーサーであってよい。基板には、シリコンやガラスを成形したもの、若しくはこれらに金や高分子、ダイヤモンドライクカーボンを表面処理したものが用いられる。または、高分子フィルムそのものを基板とすることもできる。スペーサーS3は、これら基板表面の結合対象物質に応じて、適切な活性基を有するものが用いられる。
【0096】
表1に、スペーサーS3末端の活性基と、基板表面の結合対象物質の活性基との組み合わせ、及び、その際の結合方法を例示した。
【0097】
【表1】

【0098】
図12は、プローブ2の具体的な構成例を示す模式図である。
【0099】
図中、符号21で示すプローブは、所定の物質が核酸である場合に、分子鎖Pを該核酸に相補的な塩基配列を有するオリゴヌクレオチド(塩基数n)として、また、ホストHをβ−シクロデキストリン、色素DをローダミンBとした場合を示した。
【0100】
図13は、プローブ2の挙動を示す模式図である。(A)は、所定の物質との非結合時、(B)は結合時の状態を示す。
【0101】
図13(A)に示す所定の物質(図13(B)符号T参照)との非結合時におけるプローブ2では、色素DがホストHに包接されることにより、分子鎖Pは折れ曲がって図のようなループ構造をとる。
【0102】
プローブ2においても、プローブ1と同様に、スペーサーS1及びS2が水素結合(図13(A)中、符号B参照)を形成することで、分子鎖Pのループ構造の形成が促進、安定化されるよう構成されている。
【0103】
図13(B)に示す物質Tとの結合時におけるプローブ2では、分子鎖Pは、物質Tとの結合のためにループ構造をとることができない。従って、色素Dは、ホストHに対し包接状態を形成し得る距離にまで近接することができず、ホストHとの包接状態を形成しない。
【0104】
このように、プローブ2は、物質Tとの非結合時にはホストHと色素Dとが包接状態を維持し、物質Tとの結合によってこの包接状態が解除されることを特徴としている。
【0105】
図14は、プローブ2と物質Tとの結合を検出する方法を説明する模式図である。(A)は、プローブ1と物質Tとの結合反応前、(B)は結合反応後、の反応系を示す。
【0106】
まず、物質Tとプローブ2との結合反応を行なう。ここで、図7で説明したプローブ1を用いる結合検出方法とは異なり、プローブ2においては、色素Dがプローブそのものに結合されているため、反応系に新たに色素Dを加える必要はない。
【0107】
図14中、符号Nは、物質Tと共存する他の物質を表している。プローブ2の分子鎖Pは他の物質Nと結合することはできないため、他の物質Nとプローブ1が結合することはない。なお、図では、プローブ2及び物質T、他の物質Nを便宜上一分子ずつ示したが、これらは反応系に複数存在するものである。また、図中、符号Kは、プローブ2が固相化された基板表面を表している(この点については後述する)。
【0108】
図14(A)に示すように、物質Tとの結合反応前においては、ホストHは色素Dとの包接状態を維持している。この状態において、色素Dは、ホストHの有するキラリティに誘起されてキラリティを有している。
【0109】
従って、図に示すように、ホストHに包接された色素Dに対し測定光L1を照射すると、色素Dの吸収波長において、キラリティによる左円偏光と右円偏光に対する吸光度差が生じ、誘起円二色性を呈する測定対象光L3が検出される。なお、測定光L1については、図7において説明した通りである。
【0110】
これに対して、図14(B)に示す、物質Tとの結合反応後においては、分子鎖Pと物質Tとの結合により、ホストHと色素Dとの包接状態が解除される。この包接状態解除により、色素Dは、ホストHに誘起されるキラリティを喪失する。
【0111】
従って、色素Dに対し測定光L1を照射しても、色素Dが吸収する左円偏光と右円偏光の吸光度に差は生じず、測定対象光L2の検出によって誘起円二色性は検知されなくなる。
【0112】
このように、プローブ2では、物質Tとの非結合時においては反射光(測定対象光L3)が誘起円二色性を呈するのに対して、物質Tと結合すると反射光(測定対象光L2)の誘起円二色性が失われる。従って、物質Tとプローブ2との結合反応を行い、測定光L1の照射によって色素Dから発生する反射光(測定対象光L2及び測定対象光L3)の誘起円二色性を検知することによって、物質Tとプローブ2との結合を検出することが可能となる。
【0113】
次に、図14に基づいて、プローブ2と物質Tとの結合検出方法についてさらに具体的に説明する。
【0114】
ここでは、分子鎖Pをオリゴヌクレオチド(塩基数n)として構成した上述のプローブ21(図12参照)を用いて、物質Tとして核酸(以下、「検出対象核酸T」という)を検出する場合を例として説明する。
【0115】
まず、検出対象核酸鎖Tを含む試料とプローブ21とのハイブリダイゼーション反応を行う。図では、符号Kで示す基板表面にプローブ21を固相化したDNAマイクロアレイにおけるハイブリダイゼーション反応を例示した。
【0116】
ハイブリダイゼーション反応において、プローブ21と検出対象核酸鎖Tが二本鎖形成をしていない段階では、ホストHは色素Dとの包接状態を維持するため、測定対象光L3の検出によって誘起円二色性が検知される(図14(A)参照)。
【0117】
これに対して、プローブ21と検出対象核酸鎖Tが二本鎖を形成すると、ホストHと色素Dとの包接状態が解除され、色素Dがキラリティを喪失するため、測定対象光L2の検出によって誘起円二色性が検知されなくなる(図14(B)参照)。
【0118】
従って、プローブ21によれば、測定対象光L3における誘起円二色性に基づいて、基板表面K上に固相化したプローブ21と検出対象核酸鎖Tとのハイブリダイズを検出することができる。さらに、ホストHに包接された色素Dが呈する測定対象光L3(誘起円二色性あり)の左右円偏光に対する吸光度差に基づけば試料中の検出対象核酸鎖Tを定量的に検出することが可能となる。
【0119】
また、従来のTaqmanプローブの替わりにプローブ21を用いてPCRを行い、アニーリングステップにおいて測定対象光L3の誘起円二色性を検知すれば、増幅された検出対象核酸鎖Tとプローブ21とのハイブリダイズを検出することができる。そして、ホストHに包接された色素Dが呈する測定対象光L3(誘起円二色性あり)の左右円偏光に対する吸光度差に基づいて、検出対象核酸鎖Tの増幅量をリアルタイムに定量検出することができる。さらに、先に説明したように、ポリメラーゼの5′→ 3′エキソヌクレアーゼ活性を利用して、プローブを分解させ、ホストHと色素Dとの包接状態を解除することも可能である。
【0120】
以上のように、プローブ2によれば、測定対象光L3の誘起円二色性に基づいて、物質Tとプローブ2との結合を検出することが可能であるため、従来のインターカレーター性の蛍光色素を用いた検出方法で生じていたバックグランド蛍光やノイズ蛍光が生じることがなく、高い検出感度を得ることができる。
【0121】
また、廉価な色素Dを用いることで、TaqManプローブにおけるコスト上の問題を解決することができる。
【0122】
図15は、本発明に係るプローブペアの実施形態を示す模式図である。図(A)はプローブペア3を構成する第一のプローブ31、(B)は第二のプローブ32を示す。
【0123】
図15(A)に示すように、第一のプローブ31は、所定の物質に結合可能な分子鎖P1に、スペーサーS1を介して、他の化学種を包接し得る化学種であって、かつ、光学活性を有する第一の化学種(ホストH)が結合されている。
【0124】
また、図15(B)に示すように、第二のプローブ32は、第一のプローブ31と同一の物質に結合可能な分子鎖P2に、スペーサーS2を介して、ホストHに包接され得る色素Dが結合されている。
【0125】
分子鎖P1及びP2、ホストH、スペーサーS1及びS2については、図1で示したプローブ1と同様の構成とすることができる。ただし、分子鎖P1及びP2が所定の物質中において結合する部位は、同一もしくは近傍にないことが望ましい。なお、色素Dは、図7及びプローブ2で説明したものと同一のものであってよい(図8参照)。
【0126】
図16は、プローブペア3の挙動を示す模式図である。(A)は、所定の物質との非結合時、(B)は結合時の状態を示す。
【0127】
プローブペア3は、所定の物質(図16(B)符号T参照)との非結合時においては、図16(A)に示すように、プローブ31に結合されたホストHに、プローブ32に結合された色素Dが包接された状態となる。
【0128】
これに対して、図16(B)に示す物質Tとの結合時には、プローブ31及びプローブ32がそれぞれ物質Tに結合することによって、プローブ31のホストHとプローブ32の色素Dが包接し得る距離に近接することができなくなるため、ホストHと色素Dとの包接状態が解除される。この際、プローブ31及びプローブ32の分子鎖P1及びP2が物質Tの同一部位もしくは近傍部位に結合すると、物質Tとの結合時においてもホストHと色素Dとの包接状態が維持されてしまう可能性があるため、分子鎖P1及びP2が所定の物質中において結合する部位は、同一もしくは近傍にないことが望ましい。
【0129】
このように、プローブペア3は、物質Tとの非結合時にはホストHと色素Dとが包接状態を維持し、物質Tとの結合によってこの包接状態が解除されることを特徴としている。
【0130】
図17は、プローブペア3と物質Tとの結合を検出する方法を説明する模式図である。(A)は、プローブペア3と物質Tとの結合反応前、(B)は結合反応後、の反応系を示す。
【0131】
ここでは、分子鎖P1及びP2をオリゴヌクレオチド(塩基数n)として構成したプローブペア3をプライマーとして用いて、物質Tとして核酸をPCRにより増幅して検出する場合を説明する。以下、検出対象とする核酸のセンス鎖を「センス鎖Ts」、アンチセンス鎖を「アンチセンス鎖Ta」というものとする。
【0132】
分子鎖P1及びP2は、通常のPCRに用いられるプライマーと同様、それぞれ「センス鎖Ts」及び「アンチセンス鎖Ta」に相補的な塩基配列を有するオリゴペプチドとして設計され、核酸鎖の増幅対象領域の両末端にハイブリダイズするように設計される。
【0133】
PCR反応前において、プローブ31及びプローブ32は、図17(A)に示すように、ホストHと色素Dとの包接状態を維持している。この状態において、色素Dは、ホストH誘起されたキラリティを有する。
【0134】
従って、図に示すように、ホストHに包接された色素Dに対し測定光L1を照射すると、色素Dの吸収波長において、キラリティによる左円偏光と右円偏光に対する吸光度差が生じ、誘起円二色性を呈する測定対象光L3が検出される。
【0135】
図17(B)に示すPCR反応中においては、プローブ31がセンス鎖Tsに、プローブ32がアンチセンス鎖Taに結合し、図中矢印E方向に伸長反応が起こる。この際、プローブ31及びプローブ32は、増幅対象領域の両末端にハイブリダイズされるよう設計されるため、色素DはホストHに包接され得る距離にまで近接することができず、ホストHと色素Dとの包接状態は解除される。この包接状態解除により、色素Dは、ホストHに誘起されたキラリティを喪失することとなる。
【0136】
従って、色素Dに対し測定光L1を照射しても、色素Dが吸収する左円偏光と右円偏光の吸光度に差は生じず、測定対象光L2の検出によって誘起円二色性が検知されることはない。
【0137】
このように、本発明に係るプローブペア3によれば、測定対象光L3における誘起円二色性に基づいて、PCRによって増幅される核酸鎖とプローブペア3とのハイブリダイズを検出することができる。
【0138】
また、PCRの過程においてセンス鎖Ts及びアンチセンス鎖Taが増幅されると、ホストHと色素Dとの包接状態を維持するプローブペア3(図17(A)参照)の量が減少し、かわってセンス鎖Ts及びアンチセンス鎖Taに結合するプローブペア3の量が増加することとなる。従って、ホストHに包接された色素Dが呈する測定対象光L3(誘起円二色性あり)の左右円偏光に対する吸光度差に基づいて、PCRにおける核酸鎖(センス鎖Ts及びアンチセンス鎖Ta)の増幅過程をリアルタイムに定量解析することが可能となる。
【0139】
以上のように、プローブペア3によれば、測定対象光L3の誘起円二色性に基づいて、物質Tとプローブペア3との結合を検出することが可能であるため、従来のインターカレーター性の蛍光色素を用いた検出方法で生じていたバックグランド蛍光やノイズ蛍光が生じることがなく、高い検出感度を得ることができる。
【0140】
また、廉価な色素Dを用いることで、TaqManプローブにおけるコスト上の問題を解決することができる。
【0141】
以上に説明した本発明に係るプローブ(プローブ1及びプローブ2、プローブペア3)及びこれらを用いた結合検出方法は、検出対象物質に応じて、各プローブの分子鎖P(P1及びP2)をオリゴヌクレオチドやオリゴペプチド、ポリペプチドなどの化学的に活性な基を有する高分子鎖によって任意に設計することにより、種々の物質を検出するために用いることができる。また、同様に各プローブの分子鎖Pを任意に設計することにより、所定の物質に結合し得る分子鎖Pをスクリーニングするためにも用いることができる。
【0142】
このうち、本発明に係るプローブ及び結合検出方法は、図7及び図14、図17において説明したように、PCRにおける増幅核酸鎖のリアルタイム定量検出に特に好適に用いることができ、従来のインターカレーター性蛍光色素やTaqManプローブを用いた方法に比べ、優れた検出感度及びコストパフォーマンスを実現することができるものである。
【実施例】
【0143】
本発明に係るプローブを用いて、オリゴヌクレオチドT(塩基配列:「5´−GATCGAAGGCGCTACGTTTCGATC−3´」)とプローブとの結合検出を以下の条件で行った。
【0144】
プローブには、図1に示したプローブ1において、ホストHをヘプタス(o−メチル)−γ−シクロデキストリン置換基又はβ−シクロデキストリン、アンカーAをリトコール酸とし、スペーサーS1及びS2と分子鎖Pを、図6に示した通りに構成したプローブを用いた。分子鎖Pの塩基配列は「5´−GATCGAAACGTAGCGCCTTCGATC−3´」であり、上記オリゴヌクレオチドTと相補的な塩基配列を有する。
【0145】
このプローブとオリゴヌクレオチドTとのハイブリダイゼーション反応を、トリメチンシアニン色素(Cy3)、ニュートラルレッド(NR)、ローダミンB(RhB)のいずれかの色素の存在下において行い、波長450nm〜650nmの測定光を色素に照射して、透過光における円二色性を測定した。プローブ、色素、オリゴヌクレオチド Tの最終濃度がそれぞれ以下の濃度となるよう調整した5xSSCバッファー溶液を、まず95℃で1分アニーリングし、室温で攪拌しつつ3時間ハイブリダイゼーションを行った。反応後、同温度において円二色性の測定を行った。
【0146】
図18に、ホストHをヘプタキス(o−メチル)−γ−シクロデキストリン置換基としたプローブを用い、トリメチンシアニン色素の存在下にて、円二色性の測定を行った結果を示す。
【0147】
プローブの濃度は1.0×10-4Mとし、トリメチンシアニン色素の濃度は5.0×10-3Mとした。オリゴヌクレオチドTの濃度は0M、3.7×10-5M、6.0×10-5M、8.1×10-5Mと段階的に変化させた。
【0148】
図18(A)に、遊離トリメチンシアニン色素の吸収スペクトルを、(B)に円二色性スペクトルの測定結果を示す。(B)中、横軸は透過光の波長、縦軸は円二色性(millidegree)を示す。また、符号(1)〜(4)は、それぞれオリゴヌクレオチドTの濃度0M、3.7×10-5M、6.0×10-5M、8.1×10-5M)において得られた測定結果を示す。
【0149】
トリメチンシアニン色素の吸収ピーク((A)中符号*参照)に一致して、(B)中、円二色性の最大値が観察されている。(C)は、オリゴヌクレオチドTの各濃度において得られた円二色性の最大値をプロットしたものである。図中、横軸はオリゴヌクレオチドT濃度、縦軸は円二色性の最大値(絶対値)を示す。オリゴヌクレオチドTの濃度に依存して円二色性の増大が認められる。
【0150】
これらの結果は、プローブとオリゴヌクレオチドTとのハイブリダイズによって、ヘプタキス(o−メチル)−γ−シクロデキストリン置換基とリトコール酸との包接状態が解除され、リトコール酸に代わってトリメチンシアニン色素がヘプタキス(o−メチル)−γ−シクロデキストリン置換基に包接されたことを示している。そして、このトリメチンシアニン色素のヘプタキス(o−メチル)−γ−シクロデキストリン置換基への包接による誘起円二色性の絶対値は、オリゴヌクレオチドTの濃度に依存して増強されたことから、本発明に係る結合検出方法によれば、円二色性の変化幅に基づいてオリゴヌクレオチドTを定量的に検出し得ることが示された。
【0151】
図19には、ホストHをβ−シクロデキストリン置換基としたプローブを用い、ニュートラルレッドの存在下にて、円二色性の測定を行った結果を示す。
【0152】
プローブの濃度は8.0×10-4Mとし、ニュートラルレッドの濃度は4.0×10-3Mとした。オリゴヌクレオチドTの濃度は、0M、4.7×10-5M、5.7×10-5M、6.7×10-5M)と段階的に変化させた。その他の条件は、図18に同様である。
【0153】
図19(A)に、遊離ニュートラルレッドの吸収スペクトルを、(B)に円二色性スペクトルの測定結果を示す。(B)中、符号(1)〜(4)は、それぞれオリゴヌクレオチドTの濃度0M、4.7×10-5M、5.7×10-5M、6.7×10-5Mにおいて得られた測定結果を示す。
【0154】
図20には、ホストHをβ−シクロデキストリン置換基としたプローブを用い、ローダミンBの存在下にて、円二色性の測定を行った結果を示す。
【0155】
プローブの濃度は1.2×10-4Mとし、ローダミンBの濃度は6.0×10-3Mとした。オリゴヌクレオチドTの濃度は、0M、5.5×10-5M、8.0×10-5M、10×10-5Mと段階的に変化させた。その他の条件は、図18に同様である。
【0156】
図20(A)に、遊離ローダミンBの吸収スペクトルを、(B)に円二色性スペクトルの測定結果を示す。(B)中、符号(1)〜(4)は、それぞれオリゴヌクレオチドTの濃度0M、5.5×10-5M、8.0×10-5M、10×10-5Mにおいて得られた測定結果を示す。
【0157】
図19及び図20においても、色素の吸収ピーク(図(A)中符号*参照)に一致して円二色性の最大値が観察され、オリゴヌクレオチドTの濃度に依存して円二色性の増大が認められている(図(C)参照)。
【産業上の利用可能性】
【0158】
本発明に係るプローブ及びプローブペア、並びにこれらを用いた結合検出方法は、核酸やタンパク、ペプチド等の検出や、これらに結合し得る高分子鎖のスクリーニングのために用いることができ、各種疾患の分子メカニズムの解明や創薬ターゲットの探索等のため使用することが可能である。
【図面の簡単な説明】
【0159】
【図1】本発明に係るプローブの第一の実施形態を示す模式図である。
【図2】ホストHとして好適に採用可能な化学種の一例を示す図である。
【図3】アンカーAとして好適に採用可能な化学種の一例を示す図である。
【図4】プローブ1の具体的な構成例を示す模式図である。
【図5】プローブ1の挙動を示す模式図である。
【図6】分子鎖Pが形成するステムループ構造を示す模式図である。
【図7】プローブ1と物質Tとの結合を検出する方法を説明する模式図である。(A)は、プローブ1と物質Tとの結合反応前、(B)は結合反応後、の反応系を示す。
【図8】色素Dとして好適に採用可能な化学種の一例を示す図である。
【図9】プローブ1の具体的な構成例を示す模式図である。
【図10】プローブ1と物質Tとの結合を検出する他の方法を説明する模式図である。(A)は、プローブ1と物質Tとの結合反応前、(B)は結合反応後、の反応系を示す。
【図11】本発明に係るプローブの第二の実施形態を示す模式図である。
【図12】プローブ2の具体的な構成例を示す模式図である。
【図13】プローブ2の挙動を示す模式図である。
【図14】プローブ2と物質Tとの結合を検出する方法を説明する模式図である。(A)は、プローブ1と物質Tとの結合反応前、(B)は結合反応後、の反応系を示す。
【図15】本発明に係るプローブペアの実施形態を示す模式図である。
【図16】プローブペア3の挙動を示す模式図である。
【図17】プローブペア3と物質Tとの結合を検出する方法を説明する模式図である。(A)は、プローブペア3と物質Tとの結合反応前、(B)は結合反応後、の反応系を示す。
【図18】ホストHをヘプタキス(o−メチル)−γ−シクロデキストリン置換基としたプローブを用い、トリメチンシアニン色素の存在下にて、円二色性の測定を行った結果を示す図である。
【図19】ホストHをβ−シクロデキストリン置換基としたプローブを用い、ニュートラルレッドの存在下にて、円二色性の測定を行った結果を示す図である。
【図20】ホストHをβ−シクロデキストリン置換基としたプローブを用い、ローダミンBの存在下にて、円二色性の測定を行った結果を示す図である。
【符号の説明】
【0160】
1、11、12、2、21、31、32 プローブ
A アンカー
B 水素結合
D 色素
H ホスト
K 基板表面
L1 測定光
L2、L3 測定対象光
P、P1、P2 分子鎖
S1、S2、S3 スペーサー
St1、St2 ステム部
T 物質
【技術分野】
【0001】
本発明は、所定の物質に結合可能なプローブに関する。より詳しくは、光学活性を有する包接化学種が結合されたプローブ、及びこれを用いた結合検出方法に関する。
【背景技術】
【0002】
現在、各種疾患の分子メカニズムの解明や診断方法の確立、さらには創薬ターゲットの探索等を目的として、細胞や組織内に発現する遺伝子(核酸)や遺伝子産物(タンパク)を検出するための技術が種々開発されてきている。
【0003】
なかでも、蛍光色素を用いた検出方法は、一般に高い感度が得られること、またフォトダイオードや光電子倍増管などの小型で集積し易く、安価な部品を用いて検出装置を構成できること、などから、現在最も広く用いられている。
【0004】
一例として、二本鎖核酸の塩基対間に結合または挿入された状態で、励起光を照射されることにより蛍光を発するインターカレーター性の蛍光色素を用いた方法がある。
【0005】
インターカレーター性蛍光色素の存在下で、検出対象核酸鎖と、これに相補的な塩基配列を有するオリゴヌクレオチド(プローブ)とのハイブリダイズ(二本鎖形成)反応を行うと、生成した二本鎖核酸鎖の塩基対間にインターカレーター性蛍光色素が結合する。この際、励起光の照射によってインターカレーター性蛍光色素から発せられる蛍光を検出することで、検出対象核酸鎖を検出することができる。
【0006】
また別の例として、オリゴヌクレオチドの5′末端を蛍光色素で、3′末端をクエンチャー物質で修飾したTaqManプローブ(登録商標、以下同じ)を用いる方法がある。この方法は、特にリアルタイムPCR法に用いられている。
【0007】
TaqManプローブは、PCR反応のアニーリングステップで、検出対象DNAに特異的にハイブリダイズする。このとき、プローブ上にはクエンチャーが存在しているため、励起光を照射しても蛍光色素からの蛍光の発生は抑制されている。しかし、エクステンションステップにおいて、Taq DNA ポリメラーゼのもつ5′→ 3′エキソヌクレアーゼ活性によって検出対象DNAにハイブリダイズしたプローブが分解されると、蛍光色素がプローブから遊離し、クエンチャーによる抑制が解除され蛍光が発せられる。この蛍光を検出することで、PCR増幅産物の生成量、さらには検出対象DNA量をリアルタイムに測定することができる。
【0008】
特許文献1には、インターカレーター性蛍光色素を用いたハイブリダイゼーション検出方法が開示されている。また、特許文献2には、TaqManプローブを用いたリアルタイムPCR法により、ヒトβディフェンシン2mRNAを定量的に検出する方法が記載されている。
【0009】
以下、本発明に関連する技術用語について説明する。
【0010】
「シクロデキストリン」はデンプンにある種の酵素を作用させて得られる環状オリゴ糖であり、グルコースがα‐1,4結合で環状に連なった化合物である。グルコースが6、7、8個環状に結合したものは、それぞれα‐、β‐、γ‐シクロデキストリンと呼ばれており、天然には、さらにたくさんのグルコースが環状に結合した大環状のシクロデキストリンも存在している。現在では独ワッカーケミー社がα‐、β‐、γ‐3種類のシクロデキストリンを選択的に生成する酵素を発見し、工業生産を行っている(非特許文献1参照)。
【0011】
シクロデキストリンは、底のないバケツ型をしており環の広い側に二級水酸基が、狭い側に一級水酸基がそれぞれ外側に向いて位置しており、このため環の外側は親水性を帯び、内側が疎水性の空洞の場となっている。この空洞に分子、特に水溶液中では疎水性の分子を取り込む、すなわち「包接」する。包接能は環のサイズと包接される分子のサイズの調和、および分子の疎水性などに応じて異なる。
【0012】
シクロデキストリンはオリゴ糖であるから水溶性であり、脂溶性物質の可溶化にも用いられる。また構成単位である光学活性なオリゴ糖に由来して、シクロデキストリンも光学活性である。
【0013】
シクロデキストリンの包接現象は、食品、化粧品、医薬品の工業分野で、わさびなどの揮発性香料の徐放、ビタミン類など、光、熱に不安定な物質の安定化、経口抗真菌剤であるスポラノックス(登録商標)では水溶性改善に利用されている。分析化学の分野ではアフィニティークロマトグラフィーやキャピラリー電気泳動法に応用されている(非特許文献2参照)。また、最近ではドラッグデリバリーへの応用が有望視されている(非特許文献3参照)。
【0014】
シクロデキストリンの包接能、すなわち分子認識能を利用して、特定の物質に対するセンサーとする研究も盛んである。センサープローブとしての蛍光色素部、シクロデキストリン、クエンチャーなどの機能性部をつなぐ支持台としてポリペプチドを採用し、蛍光強度、蛍光寿命などによってゲスト化合物の検出を行う試みがなされている(非特許文献4及び非特許文献5参照)。なお、上記のポリペプチドは単に支持台として用いられ、他の物質に結合し得るものではなく、これらの技術はシクロデキストリンに包接するゲスト化合物そのものを検出するためのものである。
【0015】
「円二色性(Circular Dichroism:CD)」とは、右円偏光と左円偏光に対する吸光度の差が生じる現象で、この結果生じた偏光は楕円偏光となる。楕円率は左右偏光の放射強度の関数となり、さらにランバートベールの式を代入することで、モル円二色性とモル楕円率の間に [θ] = 18000/4πlog10e・Δε ≒ 3298Δεの関係を導き出すことができる。すなわち、円二色性はモル円二色性とモル楕円率のどちらかで表すことができる。物質固有のモル円二色性またはモル楕円率が既知であれば、物質濃度を算出することが可能である。
【0016】
シクロデキストリンは光学活性であるから、本来の吸収遷移に応じて紫外域で円二色性を示す。本来は光学活性でない分子Gが光学活性分子Hと包接体や付加体を形成すると、励起子カップリングにより、Gの吸収遷移に応じて円二色性を示すことがある。これを「誘起円二色性」と呼ぶ。Gが色素であれば、吸収遷移は可視部に現れ、他の構成種と区別して検出することが容易となる。
【0017】
次に、「円二色性測定装置」について説明する。一般的な円二色性測定装置は、さまざまな振動ベクトルを持った光の混ざった非偏光を励起光とし、偏光プリズムにて直線偏光とした後に、λ/4波長板などの円偏光変調器にて左右の円偏光に変換する。この左右円偏光に同期して、サンプルを通過した光の吸光度データを交互に光電子倍増管などの検出器で採取し、計算処理する。もし左右円偏光に同期して、サンプルの蛍光を測定すれば、すなわち蛍光検出円二色性を観測したことになる(特許文献3参照)。
【0018】
【特許文献1】特開2006−296279号公報
【特許文献2】特開2004−248676号公報
【特許文献3】特許第3745881号公報
【非特許文献1】「古くて新しい食品素材−天然シクロデキストリンの利用技術」, Foods Food Ingredients Journal. Japan, 2005, Vol.210, No.3, p.222-243
【非特許文献2】“Cyclodextrinsand Their Applications in Analytical Chemistry.”, Chemical Reviews, 1992, Vol.92, No.6, p.1457-1470
【非特許文献3】「ナノマテリアルシクロデキストリン」、シクロデキストリン学会編、産業図書,2005
【非特許文献4】“Guest-Induced Diminishment in Fluorescence Quenching and Molecule Sensing Ability of A novel Cyclodextrin-Peptide Conjugate.” Journal of American Chemistry Society, 2001, Vol.123, No.30, p.7435-7436
【非特許文献5】“Fluorescent Cyclodextrin/Peptide Hybrids with a Novel Guest-Responsive Chemosensor in the Peptide Side Chain.” Macromolecular Raped Communication, 2002, Vol.23, No.15, p.905-908
【発明の開示】
【発明が解決しようとする課題】
【0019】
上述したインターカレーター性の蛍光色素を用いた方法は、安価なインターカレーター性蛍光色素を用いることができ、コスト面で優れている。しかし、二本鎖に結合していない遊離色素からのバックグランド蛍光や、ヘアピン構造をとる一本鎖やミスマッチ鎖に結合した色素からのノイズ蛍光によって、検出感度が低下するという問題があった。特に、微量の核酸鎖の検出を行う場合には、十分な感度を得ることが難しかった。
【0020】
TaqManプローブを用いた方法では、インターカレーター性蛍光色素で生じていたバックグランド蛍光やノイズ蛍光の問題を解決し、より感度の高い検出を行うことが可能である。しかし、TaqManプローブは非常に高価であるため、コスト面での問題があった。また、TaqManプローブを用いた方法では、蛍光色素を直接プローブに標識していることから、反応系に過剰量の蛍光色素を投入して蛍光検出を行うインターカレーター性蛍光色素を用いる方法に比べて、蛍光検出時の蛍光色素劣化の影響を受け易いという問題もある。
【0021】
そこで、本発明は、コスト面に優れ、かつ、高い検出感度を得ることができる新規なプローブ、及びこれを用いた結合検出方法を提供することを主な目的とする。
【課題を解決するための手段】
【0022】
上記課題解決のため、本発明は、所定の物質に結合可能な分子鎖に、他の化学種を包接し得る化学種であって、かつ、光学活性を有する第一の化学種が結合されていることを特徴とするプローブを提供する。
本発明に係るこのプローブは、さらに、分子鎖に、第一の化学種に包接され得る第二の化学種が結合されていてもよい。
この場合において、第一の化学種と第二の化学種は、物質との非結合時において包接状態を維持し、かつ、物質との結合により包接状態が解除されるように構成される。この包接状態は、例えば、分子鎖が形成するステムループ構造によって安定化されるよう構成することができる。
このプローブと物質との結合反応を、第一の化学種に包接され得る色素の存在下において行い、プローブと物質との非結合時において維持される第一の化学種と第二の化学種の包接状態が、プローブと物質との結合によって解除されることにより、色素が第一の化学種に包接されて獲得する誘起円二色性を検知することで、物質とプローブとの結合を検出することができる。
この際、第一の化学種に対する色素の包接能は、第一の化学種に対する第二の化学種の包接能よりも低いことが望ましい。
【0023】
また、本発明に係るプローブの第二の化学種を、色素としてもよい。
このプローブと物質との結合反応を行い、プローブと物質との非結合時において維持される第一の化学種と色素の包接状態が、プローブと物質との結合によって解除されることにより、色素の誘起円二色性が消失することを検知することで、物質とプローブとの結合を検出することができる。
【0024】
さらに、本発明は、所定の物質に結合可能な分子鎖に、他の化学種を包接し得る化学種であって、かつ、光学活性を有する第一の化学種が結合された上記の第一のプローブに加え、分子鎖に、第一の化学種に包接され得る第二の化学種が結合された第二のプローブと、からなるプローブペアを提供する。
このプローブペアにおいて、第一の化学種と第二の化学種は、物質との非結合時において包接状態を維持し、かつ、物質との結合により包接状態が解除されるように構成される。
第二の化学種は、色素としてもよく、このプローブペアと物質との結合反応を行い、プローブペアと物質との非結合時において維持される第一の化学種と色素の包接状態が、プローブと物質との結合によって解除されることにより、色素の誘起円二色性が消失することを検知することで、物質とプローブとの結合を検出することができる。
本発明に係る結合検出方法は、特に、リアルタイムPCR法に好適に用いることができるものである。
【0025】
ここで、本発明において「所定の物質」には、核酸やペプチド、タンパクが少なくとも含まれる。従って、「所定の物質」及び「所定の物質に結合可能な分子鎖」の組み合わせとしては、例えば、特定の一本鎖核酸とこれにハイブリダイズする核酸鎖又は核酸類似構造鎖、特定のタンパクとこれに結合するタンパク又はペプチド等の組み合わせがある。他に、特定の核酸やペプチド、タンパクとこれに相互作用する化合物、特定の物質とこれにパイ電子相互作用や水素結合、静電的な効果等により相互作用する物質、などの組合せが可能である。
【0026】
「誘起円二色性」とは、キラルな物質が円偏光を吸収する際に左円偏光と右円偏光に対して吸光度に差が生じる現象のことをいう。誘起円二色性はその物質が吸収する波長でのみ生じる。誘起円二色性は、非偏光の励起光を偏光プリズム及びλ/4波長板などの円偏光変調器を用いて左右の円偏光に変換して物質を照射し、その透過光における左右円偏光に対する吸光度差を検出することにより検知することができる。
【0027】
また、「ステムループ構造」とは、一般的には、一本鎖DNAや一本鎖RNAにおいて、分子内で離れた2箇所の領域に相補的な配列がある場合、核酸の塩基対間の相互作用によって二重鎖を形成するとともに、その2領域ではさまれたランダムな配列部がループ構造をなすものをいう。ヘアピンループとも称される。タンパクやペプチドの立体(3次元)構造は、分子内における親水性部分及び疎水性部分の存在によって、また分子間での水素結合やパイ電子による相互作用によって、決定される。本発明における「ステムループ構造」には、上記の核酸鎖におけるヘアピンループの他、タンパクやペプチドの立体構造において、分子内の離れた2箇所の領域間での相互作用の結果、その2領域ではさまれた配列部がループ状の構造をとっているものも含まれるものとし、この他、所定の分子鎖が、その分子内の2領域間における水素結合や静電的な効果、パイ電子等による相互作用の結果形成するループ状の構造を広く包含し得るものとする。
【発明の効果】
【0028】
本発明により、コスト面に優れ、かつ、高い検出感度を得ることができる新規なプローブ、及びこれを用いた結合検出方法が提供される。
【発明を実施するための最良の形態】
【0029】
以下、本発明を実施するための好適な形態について図面を参照しながら説明する。なお、以下に説明する実施形態は、本発明の代表的な実施形態の一例を示したものであり、これにより本発明の範囲が狭く解釈されることはない。
【0030】
図1は、本発明に係るプローブの第一の実施形態を示す模式図である。図中、プローブを符号1で示す。
【0031】
図1中、符号Pは所定の物質に結合可能な分子鎖を示す。分子鎖Pは、自己組織化や吸着、光照射、加熱などによって、物質の特定の構造を認識して結合する結合領域である。分子鎖Pは、物質に応じて、オリゴヌクレオチドやオリゴペプチド、ポリペプチドなどの化学的に活性な基を有する高分子鎖によって構成することができる。
【0032】
図1中、符号Hは、他の化学種を包接し得る化学種(包接化学種)であって、かつ、光学活性を有する第一の化学種(以下、「ホストH」という)を示す。ホストHは、その光吸収スペクトル(以下、単に「吸収スペクトル」という)と、後述する色素Dとの吸収スペクトルと、の重なりが小さいものを用いることが望ましい。これは、色素Dの誘起円二色性検出のためである(この点、後述する)。
【0033】
ホストHは、図1中、符号S1で示すスペーサーによって、分子鎖Pの一端に結合されている。スペーサーS1は、通常、オリゴヌクレオチドプローブ等の化学修飾に用いられる二官能性スペーサーであってよく、例えば、アルキレンやオリゴペプチド、オリゴヌクレオチド、ポリエーテル、ポリビニレンなどの高分子構造からなる。スペーサーS1には、エーテル結合やスルフィド結合、ペプチド結合、エステル結合、ウレタン結合、リン酸結合、スルホン酸、アリーレンなどを含んでもよく、また分岐構造をとってもよい。さらに、アリーレンはヘテロ原子を含んでいてもよい。
【0034】
図1中、符号Aは、ホストに包接され得る第二の化学種(以下、「アンカーA」という)。アンカーAは、ホストHに包接されて、後述する色素DがホストHに包接されるのを阻害する。このアンカーAの色素Dに対する包接阻害作用を確実ならしめるため、アンカーAのホストHに対する包接能は、色素DのホストHに対する包接能と同程度以上であることが望ましい。
【0035】
アンカーAは、図1中、符号S2で示すスペーサーによって、分子鎖PのホストHと反対端に結合されている。スペーサーS2の構成は、スペーサーS1と同様とすることができるが、必ずしも同一である必要はなく、スペーサーS1で説明したもののなかから任意に選択することができる。
【0036】
図2は、ホストHとして好適に採用可能な化学種の一例を示す図である。
【0037】
図2中、(A)はα−シクロデキストリン置換基、(B)はβ−シクロデキストリン置換基、(C)はγ−シクロデキストリン置換基、(D)はヘプタキス(o−メチル)−γ−シクロデキストリン置換基を示す。図中、「-X-」は「-O-」, 「-S-」, 「-NH-」, 「-OC(=O)-」,「-OS(=O) 2-」, 「OP(=O)2O-」,「- NHC(=O)-」から選択される基である。
【0038】
各化学種中、水酸基の全て又は一部は、メルカプト基やオキシ基、チオ基、アミノ基、カルバモイル基、オキシカルボニル基、カルボキシ基、スルホ基、リン酸基、トリアルキルシロキシ基などに変換されていてもよい。
【0039】
図3は、アンカーAとして好適に採用可能な化学種の一例を示す図である。
【0040】
図3中、(A)はコレステロール置換基、(B)はリトコール置換基、(C)はアダマンタン置換基、(D)はビタミンA置換基、(E)はユビキノン置換基、(F)はナフタレン置換基、(G)はピレン置換基、(H)はベンゾ[c]フェナントレン置換基、(I)はビナフチル置換基、(J)はルテニウム(II)トリス(フェナントロリン)置換基を示す。図中、「-X2-」は、「-O-」, 「-S-」, 「-NH-」, 「-OC(=O)-」,「-OS(=O) 2-」, 「OP(=O)2O-」,「- NHC(=O)-」から選択される基である。
【0041】
各化学種は、分子内にキラル構造を有してもよい。この他、アンカーAとしては、ステロイド構造を有する化学種を広く採用することが可能である。
【0042】
図4は、プローブ1の具体的な構成例を示す模式図である。
【0043】
図4中、符号11で示すプローブは、所定の物質が核酸である場合に、分子鎖Pを該核酸に相補的な塩基配列を有するオリゴヌクレオチド(塩基数n)として、またホストHをβ−シクロデキストリン、アンカーAをリトコール酸とした場合を示した。
【0044】
図5は、プローブ1の挙動を示す模式図である。(A)は、所定の物質との非結合時、(B)は結合時の状態を示す。
【0045】
まず、図5(A)に示す所定の物質(図5(B)符号T参照)との非結合時におけるプローブ1では、アンカーAがホストHに包接されることにより、分子鎖Pは折れ曲がって図のようなループ構造をとる。
【0046】
プローブ1では、分子鎖Pのうち、スペーサーS1側及びスペーサーS2側の両末端に位置する2つの領域(後述する「ステム部St1及びSt2」)が、水素結合(図5(A)中、符号B参照)を形成し、分子鎖Pのループ構造の形成が促進、安定化されるよう構成されている。すなわち、アンカーAがホストHに包接され、分子鎖Pが折れ曲がると、スペーサーS1側及びスペーサーS2側の両末端に位置する2つの領域が相互に水素結合Bを形成することによって、分子鎖Pのステムループ構造が安定化するよう構成されている。
【0047】
一方、図5(B)に示す物質Tとの結合時におけるプローブ1では、分子鎖Pは、物質Tとの結合のためにループ構造をとることができない。従って、アンカーAは、ホストHに対し包接状態を形成し得る距離にまで容易に近接することができず、ホストHとの包接状態を形成する確率が極端に減少する。
【0048】
このように、プローブ1は、物質Tとの非結合時には、ホストHとアンカーAとが包接状態を維持し、物質Tとの結合によってこの包接状態が解除されることを特徴としている。
【0049】
図6は、分子鎖Pが形成するステムループ構造を示す模式図である。(A)は、ステムループ構造非形成時のスペーサーS1及びS2と分子鎖Pを、(B)は形成時のスペーサーS1及びS2と分子鎖Pを拡大して示している。なお、図では、分子鎖Pをオリゴヌクレオチとした上記プローブ11を例示した。
【0050】
図6(A)に示す分子鎖Pは、スペーサーS1側及びスペーサーS2側の両末端に位置する2つの領域に、ステム部St1及びSt2が設けられている。ステム部St1の塩基配列は、スペーサーS1に続いて5´末端側から「GATCGAA」であり、ステム部St2の塩基配列は5´末端側からスペーサーS2に向かって「TTCGATC」とされている。
【0051】
先に説明したように、アンカーAがホストHに包接されると、分子鎖Pが折れ曲がってループ構造となる。このとき、図6(B)に示すように、ステム部St2は、ステム部St1に対して逆向きに配置される。そして、ステム部St2の塩基配列「TTCGATC」は、この配置状態において、ステム部St1の塩基配列「GATCGAA」に対して相補的となるようにされている。これにより、ステム部St1及びSt2の対向する各塩基間に水素結合Bを形成させることができる。
【0052】
この水素結合Bの形成によって、分子鎖Pはステムループ構造を形成することとなり、アンカーAのホストHへの包接による分子鎖Pのループ構造の形成が、さらに促進、安定化されることとなる。
【0053】
このステムループ構造による分子鎖Pのループ構造の形成の促進、安定化作用は、分子鎖Pに用いる分子種及び分子数によって、ステム部St1及びSt2間の水素結合の強度及び数を任意に設定することによって、任意に調整することができる。
【0054】
分子鎖Pをオリゴヌクレオチドとして構成する場合には、ループ部(分子鎖Pのうち、ステム部St1とステム部St2の間の領域)の塩基配列数は、4〜8塩基程度が好適である(”A Semiflexible Polymer Model Applied to Loop Formation in DNA Hairpins.” Biophysical Journal 2001, Vol.81, p2864-2875
参照)
【0055】
なお、このステムループ構造は、物質Tとの非結合時におけるホストHとアンカーAの包接状態の維持を確実ならしめるためのものであり、ホストHへのアンカーAの包接のための必須の構成となるものではない。上述のように、分子鎖Pのループ構造は、アンカーAのホストHへの包接の結果生じるものであり、水素結合Bはこのステムループ構造の形成促進、安定化に機能するものである。
【0056】
図7は、プローブ1と物質Tとの結合を検出する方法を説明する模式図である。(A)は、プローブ1と物質Tとの結合反応前、(B)は結合反応後、の反応系を示す。
【0057】
まず、図7(A)に示すように、物質Tとプローブ1との結合反応を、ホストHに包接され得る色素(図中、符号D参照)の存在下において行う。
【0058】
図7中、符号Nは、物質Tと共存する他の物質を表している。プローブ1の分子鎖Pは他の物質Nと結合しないため、プローブ1と他の物質Nとが結合することはない。なお、図では、プローブ1及び物質T、他の物質N、色素Dを便宜上一分子ずつ示したが、これらは反応系に複数存在するものである。
【0059】
図に示すように、結合反応前においては、ホストHはアンカーAとの包接状態を維持している。このため、色素DはホストHに対する包接能を有するものの、アンカーAが色素DのホストHへの包接を阻害するため、色素DがホストHに包接される確率は無視しうる。以下、ホストHに包接されていない状態の色素Dを「遊離色素D」というものとする。
【0060】
遊離色素Dに対し、非偏光を偏光プリズムによって直線偏光に変換し、さらにλ/4波長板などにより円偏光に変換した測定光(図中、符号L1参照)を照射すると、遊離色素Dによって特定波長が吸収された透過光が測定対象光(図中、符号L2参照)として生じる。
【0061】
この際、遊離色素Dは光学活性(以下、「キラリティ」ともいう)を有さないため、色素Dが吸収する左円偏光と右円偏光の吸光度に差は生じない。従って、色素Dに対する測定光L1の照射により誘起円二色性が生じることはなく、測定対象光L2の検出によって誘起円二色性が検知されることはない。
【0062】
これに対して、図7(B)に示す結合反応後においては、分子鎖Pと物質Tとの結合により、ホストHとアンカーAとの包接状態が解除され、アンカーAに代わって色素DがホストHに包接される。そして、色素DはホストHへの包接により、ホストHの供するキラルな場によって誘起されてキラリティを獲得する。
【0063】
従って、図に示すように、ホストHに包接された色素Dに対し測定光L1を照射すると、色素Dの吸収波長において、キラリティによる左円偏光と右円偏光に対する吸光度差が生じ、誘起円二色性を呈する測定対象光L3が検出されることとなる。
【0064】
このように、プローブ1では、物質Tとの非結合時においては透過光(測定対象光L2)が誘起円二色性を呈することはないが、物質Tと結合すると透過光(測定対象光L3)が誘起円二色性を呈するようになる。従って、物質Tとプローブ1との結合反応を色素Dの存在下において行い、測定光L1の照射によって色素Dから発生する透過光(測定対象光L2又は測定対象光L3)の誘起円二色性を検知することによって、物質Tとプローブ1との結合を検出することが可能となる。
【0065】
色素Dは、ホストHに包接され得る色素であれば特に限定されないが、より好適には色素DのホストHに対する包接能が、アンカーAのホストHに対する包接能と同程度以下であるものが望ましい。これにより、結合反応前(図7(A)参照)において、アンカーAが、色素DのホストHへの包接を確実に阻害するようにできる。また、色素Dは、測定対象光L2及び測定対象光L3の検出のため、その吸収スペクトルと、ホストHとの吸収スペクトルと、の重なりが小さいものを用いることが望ましく、さらに物質Tが核酸鎖であって、プローブ1の分子鎖Pがオリゴヌクレオチドである場合には、インターカレーター性のない色素を用いることが好ましい。
【0066】
図8は、色素Dとして好適に採用可能な化学種の一例を示す図である。
【0067】
図8中、(A)はトリメチンシアニン色素(Cy3骨格)、(B)はペンタメチンシアニン色素(Cy5骨格)、(C)はチアゾールオレンジ(TO)、(D)はアクリジンオレンジ(AO)、(E)はアクリジンレッド(AR)、(F)はニュートラルレッド(NR)、(G)はダンシル酸(DA)、(H)はローダミンB(RhB)、(I)はフルオレセイン(FL)、(J)はエチルブロミド(EB)、(K)はピレン、(L)はクマリン102(C102)、(M)はエチルレッド(ER)を示す。また、これらの色素は置換基を有していてもよい。
【0068】
測定対象光L2及び測定対象光L3における誘起円二色性の検知は、先に説明した一般的な円二色性測定装置により行うことが可能である。具体的には、さまざまな振動ベクトルを持った光の混ざった非偏光を励起光とし、偏光プリズムにて直線偏光とした後に、λ/4波長板などの円偏光変調器にて左右の円偏光に変換する。この左右円偏光に同期して、サンプルを通過した透過光の吸光度データを交互に光電子倍増管などの検出器で採取し、左右偏光の吸光度差を算出することにより、誘起円二色性の検知を行う。
【0069】
この際、測定装置の小型化、高感度化のために、光磁気記録用のピックアップを改造すれば検出器として利用可能である。光磁気記録での読み取り(すなわち、検出)は、本来、磁化されたメディアに直線偏光を入射し、反射光の偏光面が、入射光に対してわずかに回転して楕円偏光となる現象(磁気カー効果と呼ぶ)を利用したものである。ここで、磁気メディアの替わりに円二色性を示すサンプルを配置すれば、同様に入射光に対する楕円率を測定することが可能である。
【0070】
光磁気記録用のピックアップは、一般的には半導体レーザー、複数個の光検出器、偏光ビームスプリッタまたは偏光ホログラム素子、および対物レンズから構成される。半導体レーザーから出射された光は対物レンズによってメディアに集光され、反射光または透過光を偏光ビームスプリッタまたは偏光ホログラム素子によって左右偏光にそれぞれ分離して各光検出器に到達する。左右偏光の強度から、楕円率を算出することが出来る。
【0071】
また、ここまでは、測定光L1の照射によって色素Dが呈する透過光(測定対象光L2又は測定対象光L3)の誘起円二色性を検知する場合を説明したが、別法として、円偏光変調器により分離された左右の円偏光によってそれぞれ励起された色素Dの蛍光量を円偏光変調器に同期して採取し、処理したデータをもって)誘起円二色性(「蛍光円二色性」ということもできる)を検知することもできる。
【0072】
この場合、キラルな場に置かれた色素Dの吸収する左右円偏光には差があるため、それぞれで励起される蛍光量にも差が生じる。一方、遊離色素Dは左右円偏光を等分吸収するため蛍光量も同じとなる。よってこの差を検出すれば、キラルな場に置かれた色素Dを遊離色素Dと区別することが可能となる。
【0073】
次に、図7に基づいて、プローブ1と物質Tとの結合検出方法についてさらに具体的に説明する。
【0074】
ここでは、分子鎖Pをオリゴヌクレオチド(塩基数n)として構成した上述のプローブ11を用いて、物質Tとして核酸(以下、「検出対象核酸T」という)を検出する場合を例として説明する。
【0075】
まず、図7(A)に示すように、検出対象核酸鎖Tを含む試料とプローブ11とのハイブリダイゼーション反応を、色素Dの存在下において行う。このハイブリダイゼーション反応は、例えば、PCRやDNAマイクロアレイ(DNAチップ)において行うことが考えられる。PCRでは、従来のTaqmanプローブの替わりにプローブ11を用いて、アニーリングステップの際に、増幅された検出対象核酸鎖Tとプローブ11とのハイブリダイゼーション反応を行う。また、DNAマイクロアレイの場合、プローブ11をスライドガラス等の基板上に固相化し、試料中に含まれる検出対象核酸鎖Tとのハイブリダイゼーション反応を行う。なお、プローブ11の固相化については、図11において後述する。
【0076】
これらハイブリダイゼーション反応において、プローブ11と検出対象核酸鎖Tが二本鎖形成をしていない段階では、ホストHはアンカーAとの包接状態を維持するため、色素DはホストHに包接されず、測定対象光L2の検出によって誘起円二色性が検知される確率は極めて小さくなる(図7(A)参照)。
【0077】
これに対して、プローブ11と検出対象核酸鎖Tが二本鎖を形成すると、ホストHとアンカーAとの包接状態が解除され、色素DがホストHに包接される。これにより、色素Dがキラリティを獲得し、測定対象光L3の検出によって誘起円二色性が検知されるようになる(図7(B)参照)。
【0078】
従って、プローブ11によれば、PCRのアニーリングステップにおいて測定対象光L3の誘起円二色性を検知することにより、PCR溶液中のプローブ11と検出対象核酸鎖Tとのハイブリダイズを検出することができる。さらに、ホストHに包接された色素Dが呈する測定対象光L3(誘起円二色性あり)の左右円偏光に対する吸光度差に基づいて、検出対象核酸鎖Tの増幅量をリアルタイムに定量検出することができる。
【0079】
PCRにおけるホストHと色素Dの包接状態の形成は、従来のTaqmanプローブで行われているようなポリメラーゼの5′→ 3′エキソヌクレアーゼ活性を利用し、プローブを分解させることによって行うことも可能である。具体的には、アニーリングステップにおいて検出対象核酸鎖Tにハイブリダイズしたプローブ11を、エクステンション(伸長反応)ステップにおいてポリメラーゼのエキソヌクレアーゼ活性により分解し、ホストHをプローブ11本体から遊離させる。これにより、エクステンションステップ後に、遊離したホストHと反応溶液中に含まれる遊離色素Dとが包摂状態を形成することとなり、色素Dの左右円偏光に対する吸光度差に基づいて誘起円二色性を検知できる。
【0080】
DNAマイクロアレイにおいても、測定対象光L3における誘起円二色性に基づいて、基板上に固相化したプローブ11と検出対象核酸鎖Tとのハイブリダイズを検出することができる。そして、遊離色素Dから発生する測定対象光L2(誘起円二色性なし)と、ホストHに包接された色素Dから発生する測定対象光L3(誘起円二色性あり、楕円偏光)との比率に基づいて、試料中の検出対象核酸鎖Tを定量的に検出することが可能となる。
【0081】
以上のように、プローブ1によれば、測定対象光L3の誘起円二色性に基づいて、物質Tとプローブ1との結合を検出することが可能であるため、従来のインターカレーター性の蛍光色素を用いた検出方法で生じていたバックグランド蛍光やノイズ蛍光が生じることがなく、高い検出感度を得ることが可能となる。
【0082】
また、廉価な色素Dを用いることで、TaqManプローブにおけるコスト上の問題を解決することができる。さらに、廉価な色素Dを反応系に大過剰量投入することで、TaqManプローブを用いた方法で生じていた蛍光検出時の蛍光色素劣化の問題を解決することが可能となる。
【0083】
次に、図9及び図10に基づいて、プローブ1と物質Tとの結合検出方法について他の具体例を説明する。
【0084】
図9中、符号12で示すプローブは、物質Tがタンパク質である場合に、分子鎖Pを該タンパク質に結合可能なペプチド(アミノ酸数14)とした場合を示した。
【0085】
図9下方に、分子鎖Pのペプチド配列を拡大して示す。分子鎖Pは、「Leu-Lys-Lys-Leu-Leu-Lys-Leu-Leu-Lys-Lys-Leu-Leu-Lys-Leu」で示されるペプチド配列であって、α−へリックス構造を形成する配列を有している。以下、このプローブ12を用いて、α−へリックス構造を認識して結合するタンパク質であるカルモジュリン(以下、「カルモジュリンT」という)とプローブ12との結合を検出する方法について説明する。
【0086】
まず、カルモジュリンTとプローブ12との結合反応を、色素Dの存在下において行う。なお、このようなカルモジュリンTとプローブ12との結合反応は、タンパク質間の相互作用としてみることができ、タンパク質の機能解析のため用いることができる。
【0087】
図10(A)に示すように、プローブ12とカルモジュリンTが結合していない段階では、同一分子内にホストHとアンカーAが存在することで分子内錯形成による自由エネルギーの利得、特にはエントロピーの利得によってホストHはアンカーAとの包接状態を維持するため、色素DはホストHに包接されにくく、測定対象光L2の検出によって誘起円二色性が検知される確率は極めて低い。
【0088】
これに対して、図10(B)に示すように、カルモジュリンTがプローブ12の分子鎖Pによって形成されるα−へリックス構造を認識してプローブ12に結合すると、ホストHとアンカーAとの包接状態が解除され、色素DがホストHに包接される。これにより、色素Dがキラリティを獲得し、測定対象光L3の検出によって誘起円二色性が検知されるようになる。
【0089】
従って、プローブ12によれば、結合反応において測定対象光L3の誘起円二色性を検知することにより、プローブ12とカルモジュリンTとの結合を検出することができる。さらに、ホストHに包接された色素Dが呈する測定対象光L3(誘起円二色性あり)の左右円偏光に対する吸光度差に基づけば、カルモジュリンTに結合したプローブ12の量を定量的に検出することができる。
【0090】
このカルモジュリンTとプローブ12との結合検出方法は、分子鎖Pのペプチド配列を任意に設計することにより、カルモジュリンに替えて種々のタンパク質とプローブ12との結合検出に応用することができる。これにより、合成ペプチドライブラリー中から目的とするタンパク質に認識され得るペプチド配列(抗原)をスクリーニングしたり、タンパク質ライブラリー中から所定のペプチド配列に結合し得るタンパク質をスクリーニングするといったタンパク質の機能解析を行うことが可能となる。
【0091】
図11は、本発明に係るプローブの第二の実施形態を示す模式図である。図中、プローブを符号2で示す。
【0092】
図11中、符号Pは所定の物質に結合可能な分子鎖、符号Hは他の化学種を包接し得る化学種(包接化学種)であって、かつ、光学活性を有する第一の化学種(ホスト)、符号S1及びS2はスペーサーを示す。分子鎖P、ホストH、スペーサーS1及びS2については、図1で示したプローブ1と同様の構成とすることができる。
【0093】
ここで、プローブ1では、分子鎖Pの一端に、ホストHに包接され得る第二の化学種としてアンカーAを結合しているのに対して(図1参照)、図に示すプローブ2では、上記第二の化学種として色素Dを結合している点で異なっている。この色素Dは、図7で説明したものと同一のものであり、ホストHに包接され得る色素である(図8参照)。
【0094】
また、プローブ2では、分子鎖PのスペーサーS1の反対側にスペーサーS3を結合して、プローブ2を他の物質に結合できるように構成した。スペーサーS3は、例えば、先に挙げたDNAマイクロアレイにプローブ2を用いる場合、基板表面上へプローブ2を固相化するために必要となる。
【0095】
スペーサーS3は、通常、オリゴヌクレオチドプローブ等を基板表面に固相化するために用いられる二官能性スペーサーであってよい。基板には、シリコンやガラスを成形したもの、若しくはこれらに金や高分子、ダイヤモンドライクカーボンを表面処理したものが用いられる。または、高分子フィルムそのものを基板とすることもできる。スペーサーS3は、これら基板表面の結合対象物質に応じて、適切な活性基を有するものが用いられる。
【0096】
表1に、スペーサーS3末端の活性基と、基板表面の結合対象物質の活性基との組み合わせ、及び、その際の結合方法を例示した。
【0097】
【表1】

【0098】
図12は、プローブ2の具体的な構成例を示す模式図である。
【0099】
図中、符号21で示すプローブは、所定の物質が核酸である場合に、分子鎖Pを該核酸に相補的な塩基配列を有するオリゴヌクレオチド(塩基数n)として、また、ホストHをβ−シクロデキストリン、色素DをローダミンBとした場合を示した。
【0100】
図13は、プローブ2の挙動を示す模式図である。(A)は、所定の物質との非結合時、(B)は結合時の状態を示す。
【0101】
図13(A)に示す所定の物質(図13(B)符号T参照)との非結合時におけるプローブ2では、色素DがホストHに包接されることにより、分子鎖Pは折れ曲がって図のようなループ構造をとる。
【0102】
プローブ2においても、プローブ1と同様に、スペーサーS1及びS2が水素結合(図13(A)中、符号B参照)を形成することで、分子鎖Pのループ構造の形成が促進、安定化されるよう構成されている。
【0103】
図13(B)に示す物質Tとの結合時におけるプローブ2では、分子鎖Pは、物質Tとの結合のためにループ構造をとることができない。従って、色素Dは、ホストHに対し包接状態を形成し得る距離にまで近接することができず、ホストHとの包接状態を形成しない。
【0104】
このように、プローブ2は、物質Tとの非結合時にはホストHと色素Dとが包接状態を維持し、物質Tとの結合によってこの包接状態が解除されることを特徴としている。
【0105】
図14は、プローブ2と物質Tとの結合を検出する方法を説明する模式図である。(A)は、プローブ1と物質Tとの結合反応前、(B)は結合反応後、の反応系を示す。
【0106】
まず、物質Tとプローブ2との結合反応を行なう。ここで、図7で説明したプローブ1を用いる結合検出方法とは異なり、プローブ2においては、色素Dがプローブそのものに結合されているため、反応系に新たに色素Dを加える必要はない。
【0107】
図14中、符号Nは、物質Tと共存する他の物質を表している。プローブ2の分子鎖Pは他の物質Nと結合することはできないため、他の物質Nとプローブ1が結合することはない。なお、図では、プローブ2及び物質T、他の物質Nを便宜上一分子ずつ示したが、これらは反応系に複数存在するものである。また、図中、符号Kは、プローブ2が固相化された基板表面を表している(この点については後述する)。
【0108】
図14(A)に示すように、物質Tとの結合反応前においては、ホストHは色素Dとの包接状態を維持している。この状態において、色素Dは、ホストHの有するキラリティに誘起されてキラリティを有している。
【0109】
従って、図に示すように、ホストHに包接された色素Dに対し測定光L1を照射すると、色素Dの吸収波長において、キラリティによる左円偏光と右円偏光に対する吸光度差が生じ、誘起円二色性を呈する測定対象光L3が検出される。なお、測定光L1については、図7において説明した通りである。
【0110】
これに対して、図14(B)に示す、物質Tとの結合反応後においては、分子鎖Pと物質Tとの結合により、ホストHと色素Dとの包接状態が解除される。この包接状態解除により、色素Dは、ホストHに誘起されるキラリティを喪失する。
【0111】
従って、色素Dに対し測定光L1を照射しても、色素Dが吸収する左円偏光と右円偏光の吸光度に差は生じず、測定対象光L2の検出によって誘起円二色性は検知されなくなる。
【0112】
このように、プローブ2では、物質Tとの非結合時においては反射光(測定対象光L3)が誘起円二色性を呈するのに対して、物質Tと結合すると反射光(測定対象光L2)の誘起円二色性が失われる。従って、物質Tとプローブ2との結合反応を行い、測定光L1の照射によって色素Dから発生する反射光(測定対象光L2及び測定対象光L3)の誘起円二色性を検知することによって、物質Tとプローブ2との結合を検出することが可能となる。
【0113】
次に、図14に基づいて、プローブ2と物質Tとの結合検出方法についてさらに具体的に説明する。
【0114】
ここでは、分子鎖Pをオリゴヌクレオチド(塩基数n)として構成した上述のプローブ21(図12参照)を用いて、物質Tとして核酸(以下、「検出対象核酸T」という)を検出する場合を例として説明する。
【0115】
まず、検出対象核酸鎖Tを含む試料とプローブ21とのハイブリダイゼーション反応を行う。図では、符号Kで示す基板表面にプローブ21を固相化したDNAマイクロアレイにおけるハイブリダイゼーション反応を例示した。
【0116】
ハイブリダイゼーション反応において、プローブ21と検出対象核酸鎖Tが二本鎖形成をしていない段階では、ホストHは色素Dとの包接状態を維持するため、測定対象光L3の検出によって誘起円二色性が検知される(図14(A)参照)。
【0117】
これに対して、プローブ21と検出対象核酸鎖Tが二本鎖を形成すると、ホストHと色素Dとの包接状態が解除され、色素Dがキラリティを喪失するため、測定対象光L2の検出によって誘起円二色性が検知されなくなる(図14(B)参照)。
【0118】
従って、プローブ21によれば、測定対象光L3における誘起円二色性に基づいて、基板表面K上に固相化したプローブ21と検出対象核酸鎖Tとのハイブリダイズを検出することができる。さらに、ホストHに包接された色素Dが呈する測定対象光L3(誘起円二色性あり)の左右円偏光に対する吸光度差に基づけば試料中の検出対象核酸鎖Tを定量的に検出することが可能となる。
【0119】
また、従来のTaqmanプローブの替わりにプローブ21を用いてPCRを行い、アニーリングステップにおいて測定対象光L3の誘起円二色性を検知すれば、増幅された検出対象核酸鎖Tとプローブ21とのハイブリダイズを検出することができる。そして、ホストHに包接された色素Dが呈する測定対象光L3(誘起円二色性あり)の左右円偏光に対する吸光度差に基づいて、検出対象核酸鎖Tの増幅量をリアルタイムに定量検出することができる。さらに、先に説明したように、ポリメラーゼの5′→ 3′エキソヌクレアーゼ活性を利用して、プローブを分解させ、ホストHと色素Dとの包接状態を解除することも可能である。
【0120】
以上のように、プローブ2によれば、測定対象光L3の誘起円二色性に基づいて、物質Tとプローブ2との結合を検出することが可能であるため、従来のインターカレーター性の蛍光色素を用いた検出方法で生じていたバックグランド蛍光やノイズ蛍光が生じることがなく、高い検出感度を得ることができる。
【0121】
また、廉価な色素Dを用いることで、TaqManプローブにおけるコスト上の問題を解決することができる。
【0122】
図15は、本発明に係るプローブペアの実施形態を示す模式図である。図(A)はプローブペア3を構成する第一のプローブ31、(B)は第二のプローブ32を示す。
【0123】
図15(A)に示すように、第一のプローブ31は、所定の物質に結合可能な分子鎖P1に、スペーサーS1を介して、他の化学種を包接し得る化学種であって、かつ、光学活性を有する第一の化学種(ホストH)が結合されている。
【0124】
また、図15(B)に示すように、第二のプローブ32は、第一のプローブ31と同一の物質に結合可能な分子鎖P2に、スペーサーS2を介して、ホストHに包接され得る色素Dが結合されている。
【0125】
分子鎖P1及びP2、ホストH、スペーサーS1及びS2については、図1で示したプローブ1と同様の構成とすることができる。ただし、分子鎖P1及びP2が所定の物質中において結合する部位は、同一もしくは近傍にないことが望ましい。なお、色素Dは、図7及びプローブ2で説明したものと同一のものであってよい(図8参照)。
【0126】
図16は、プローブペア3の挙動を示す模式図である。(A)は、所定の物質との非結合時、(B)は結合時の状態を示す。
【0127】
プローブペア3は、所定の物質(図16(B)符号T参照)との非結合時においては、図16(A)に示すように、プローブ31に結合されたホストHに、プローブ32に結合された色素Dが包接された状態となる。
【0128】
これに対して、図16(B)に示す物質Tとの結合時には、プローブ31及びプローブ32がそれぞれ物質Tに結合することによって、プローブ31のホストHとプローブ32の色素Dが包接し得る距離に近接することができなくなるため、ホストHと色素Dとの包接状態が解除される。この際、プローブ31及びプローブ32の分子鎖P1及びP2が物質Tの同一部位もしくは近傍部位に結合すると、物質Tとの結合時においてもホストHと色素Dとの包接状態が維持されてしまう可能性があるため、分子鎖P1及びP2が所定の物質中において結合する部位は、同一もしくは近傍にないことが望ましい。
【0129】
このように、プローブペア3は、物質Tとの非結合時にはホストHと色素Dとが包接状態を維持し、物質Tとの結合によってこの包接状態が解除されることを特徴としている。
【0130】
図17は、プローブペア3と物質Tとの結合を検出する方法を説明する模式図である。(A)は、プローブペア3と物質Tとの結合反応前、(B)は結合反応後、の反応系を示す。
【0131】
ここでは、分子鎖P1及びP2をオリゴヌクレオチド(塩基数n)として構成したプローブペア3をプライマーとして用いて、物質Tとして核酸をPCRにより増幅して検出する場合を説明する。以下、検出対象とする核酸のセンス鎖を「センス鎖Ts」、アンチセンス鎖を「アンチセンス鎖Ta」というものとする。
【0132】
分子鎖P1及びP2は、通常のPCRに用いられるプライマーと同様、それぞれ「センス鎖Ts」及び「アンチセンス鎖Ta」に相補的な塩基配列を有するオリゴペプチドとして設計され、核酸鎖の増幅対象領域の両末端にハイブリダイズするように設計される。
【0133】
PCR反応前において、プローブ31及びプローブ32は、図17(A)に示すように、ホストHと色素Dとの包接状態を維持している。この状態において、色素Dは、ホストH誘起されたキラリティを有する。
【0134】
従って、図に示すように、ホストHに包接された色素Dに対し測定光L1を照射すると、色素Dの吸収波長において、キラリティによる左円偏光と右円偏光に対する吸光度差が生じ、誘起円二色性を呈する測定対象光L3が検出される。
【0135】
図17(B)に示すPCR反応中においては、プローブ31がセンス鎖Tsに、プローブ32がアンチセンス鎖Taに結合し、図中矢印E方向に伸長反応が起こる。この際、プローブ31及びプローブ32は、増幅対象領域の両末端にハイブリダイズされるよう設計されるため、色素DはホストHに包接され得る距離にまで近接することができず、ホストHと色素Dとの包接状態は解除される。この包接状態解除により、色素Dは、ホストHに誘起されたキラリティを喪失することとなる。
【0136】
従って、色素Dに対し測定光L1を照射しても、色素Dが吸収する左円偏光と右円偏光の吸光度に差は生じず、測定対象光L2の検出によって誘起円二色性が検知されることはない。
【0137】
このように、本発明に係るプローブペア3によれば、測定対象光L3における誘起円二色性に基づいて、PCRによって増幅される核酸鎖とプローブペア3とのハイブリダイズを検出することができる。
【0138】
また、PCRの過程においてセンス鎖Ts及びアンチセンス鎖Taが増幅されると、ホストHと色素Dとの包接状態を維持するプローブペア3(図17(A)参照)の量が減少し、かわってセンス鎖Ts及びアンチセンス鎖Taに結合するプローブペア3の量が増加することとなる。従って、ホストHに包接された色素Dが呈する測定対象光L3(誘起円二色性あり)の左右円偏光に対する吸光度差に基づいて、PCRにおける核酸鎖(センス鎖Ts及びアンチセンス鎖Ta)の増幅過程をリアルタイムに定量解析することが可能となる。
【0139】
以上のように、プローブペア3によれば、測定対象光L3の誘起円二色性に基づいて、物質Tとプローブペア3との結合を検出することが可能であるため、従来のインターカレーター性の蛍光色素を用いた検出方法で生じていたバックグランド蛍光やノイズ蛍光が生じることがなく、高い検出感度を得ることができる。
【0140】
また、廉価な色素Dを用いることで、TaqManプローブにおけるコスト上の問題を解決することができる。
【0141】
以上に説明した本発明に係るプローブ(プローブ1及びプローブ2、プローブペア3)及びこれらを用いた結合検出方法は、検出対象物質に応じて、各プローブの分子鎖P(P1及びP2)をオリゴヌクレオチドやオリゴペプチド、ポリペプチドなどの化学的に活性な基を有する高分子鎖によって任意に設計することにより、種々の物質を検出するために用いることができる。また、同様に各プローブの分子鎖Pを任意に設計することにより、所定の物質に結合し得る分子鎖Pをスクリーニングするためにも用いることができる。
【0142】
このうち、本発明に係るプローブ及び結合検出方法は、図7及び図14、図17において説明したように、PCRにおける増幅核酸鎖のリアルタイム定量検出に特に好適に用いることができ、従来のインターカレーター性蛍光色素やTaqManプローブを用いた方法に比べ、優れた検出感度及びコストパフォーマンスを実現することができるものである。
【実施例】
【0143】
本発明に係るプローブを用いて、オリゴヌクレオチドT(塩基配列:「5´−GATCGAAGGCGCTACGTTTCGATC−3´」)とプローブとの結合検出を以下の条件で行った。
【0144】
プローブには、図1に示したプローブ1において、ホストHをヘプタス(o−メチル)−γ−シクロデキストリン置換基又はβ−シクロデキストリン、アンカーAをリトコール酸とし、スペーサーS1及びS2と分子鎖Pを、図6に示した通りに構成したプローブを用いた。分子鎖Pの塩基配列は「5´−GATCGAAACGTAGCGCCTTCGATC−3´」であり、上記オリゴヌクレオチドTと相補的な塩基配列を有する。
【0145】
このプローブとオリゴヌクレオチドTとのハイブリダイゼーション反応を、トリメチンシアニン色素(Cy3)、ニュートラルレッド(NR)、ローダミンB(RhB)のいずれかの色素の存在下において行い、波長450nm〜650nmの測定光を色素に照射して、透過光における円二色性を測定した。プローブ、色素、オリゴヌクレオチド Tの最終濃度がそれぞれ以下の濃度となるよう調整した5xSSCバッファー溶液を、まず95℃で1分アニーリングし、室温で攪拌しつつ3時間ハイブリダイゼーションを行った。反応後、同温度において円二色性の測定を行った。
【0146】
図18に、ホストHをヘプタキス(o−メチル)−γ−シクロデキストリン置換基としたプローブを用い、トリメチンシアニン色素の存在下にて、円二色性の測定を行った結果を示す。
【0147】
プローブの濃度は1.0×10-4Mとし、トリメチンシアニン色素の濃度は5.0×10-3Mとした。オリゴヌクレオチドTの濃度は0M、3.7×10-5M、6.0×10-5M、8.1×10-5Mと段階的に変化させた。
【0148】
図18(A)に、遊離トリメチンシアニン色素の吸収スペクトルを、(B)に円二色性スペクトルの測定結果を示す。(B)中、横軸は透過光の波長、縦軸は円二色性(millidegree)を示す。また、符号(1)〜(4)は、それぞれオリゴヌクレオチドTの濃度0M、3.7×10-5M、6.0×10-5M、8.1×10-5M)において得られた測定結果を示す。
【0149】
トリメチンシアニン色素の吸収ピーク((A)中符号*参照)に一致して、(B)中、円二色性の最大値が観察されている。(C)は、オリゴヌクレオチドTの各濃度において得られた円二色性の最大値をプロットしたものである。図中、横軸はオリゴヌクレオチドT濃度、縦軸は円二色性の最大値(絶対値)を示す。オリゴヌクレオチドTの濃度に依存して円二色性の増大が認められる。
【0150】
これらの結果は、プローブとオリゴヌクレオチドTとのハイブリダイズによって、ヘプタキス(o−メチル)−γ−シクロデキストリン置換基とリトコール酸との包接状態が解除され、リトコール酸に代わってトリメチンシアニン色素がヘプタキス(o−メチル)−γ−シクロデキストリン置換基に包接されたことを示している。そして、このトリメチンシアニン色素のヘプタキス(o−メチル)−γ−シクロデキストリン置換基への包接による誘起円二色性の絶対値は、オリゴヌクレオチドTの濃度に依存して増強されたことから、本発明に係る結合検出方法によれば、円二色性の変化幅に基づいてオリゴヌクレオチドTを定量的に検出し得ることが示された。
【0151】
図19には、ホストHをβ−シクロデキストリン置換基としたプローブを用い、ニュートラルレッドの存在下にて、円二色性の測定を行った結果を示す。
【0152】
プローブの濃度は8.0×10-4Mとし、ニュートラルレッドの濃度は4.0×10-3Mとした。オリゴヌクレオチドTの濃度は、0M、4.7×10-5M、5.7×10-5M、6.7×10-5M)と段階的に変化させた。その他の条件は、図18に同様である。
【0153】
図19(A)に、遊離ニュートラルレッドの吸収スペクトルを、(B)に円二色性スペクトルの測定結果を示す。(B)中、符号(1)〜(4)は、それぞれオリゴヌクレオチドTの濃度0M、4.7×10-5M、5.7×10-5M、6.7×10-5Mにおいて得られた測定結果を示す。
【0154】
図20には、ホストHをβ−シクロデキストリン置換基としたプローブを用い、ローダミンBの存在下にて、円二色性の測定を行った結果を示す。
【0155】
プローブの濃度は1.2×10-4Mとし、ローダミンBの濃度は6.0×10-3Mとした。オリゴヌクレオチドTの濃度は、0M、5.5×10-5M、8.0×10-5M、10×10-5Mと段階的に変化させた。その他の条件は、図18に同様である。
【0156】
図20(A)に、遊離ローダミンBの吸収スペクトルを、(B)に円二色性スペクトルの測定結果を示す。(B)中、符号(1)〜(4)は、それぞれオリゴヌクレオチドTの濃度0M、5.5×10-5M、8.0×10-5M、10×10-5Mにおいて得られた測定結果を示す。
【0157】
図19及び図20においても、色素の吸収ピーク(図(A)中符号*参照)に一致して円二色性の最大値が観察され、オリゴヌクレオチドTの濃度に依存して円二色性の増大が認められている(図(C)参照)。
【産業上の利用可能性】
【0158】
本発明に係るプローブ及びプローブペア、並びにこれらを用いた結合検出方法は、核酸やタンパク、ペプチド等の検出や、これらに結合し得る高分子鎖のスクリーニングのために用いることができ、各種疾患の分子メカニズムの解明や創薬ターゲットの探索等のため使用することが可能である。
【図面の簡単な説明】
【0159】
【図1】本発明に係るプローブの第一の実施形態を示す模式図である。
【図2】ホストHとして好適に採用可能な化学種の一例を示す図である。
【図3】アンカーAとして好適に採用可能な化学種の一例を示す図である。
【図4】プローブ1の具体的な構成例を示す模式図である。
【図5】プローブ1の挙動を示す模式図である。
【図6】分子鎖Pが形成するステムループ構造を示す模式図である。
【図7】プローブ1と物質Tとの結合を検出する方法を説明する模式図である。(A)は、プローブ1と物質Tとの結合反応前、(B)は結合反応後、の反応系を示す。
【図8】色素Dとして好適に採用可能な化学種の一例を示す図である。
【図9】プローブ1の具体的な構成例を示す模式図である。
【図10】プローブ1と物質Tとの結合を検出する他の方法を説明する模式図である。(A)は、プローブ1と物質Tとの結合反応前、(B)は結合反応後、の反応系を示す。
【図11】本発明に係るプローブの第二の実施形態を示す模式図である。
【図12】プローブ2の具体的な構成例を示す模式図である。
【図13】プローブ2の挙動を示す模式図である。
【図14】プローブ2と物質Tとの結合を検出する方法を説明する模式図である。(A)は、プローブ1と物質Tとの結合反応前、(B)は結合反応後、の反応系を示す。
【図15】本発明に係るプローブペアの実施形態を示す模式図である。
【図16】プローブペア3の挙動を示す模式図である。
【図17】プローブペア3と物質Tとの結合を検出する方法を説明する模式図である。(A)は、プローブペア3と物質Tとの結合反応前、(B)は結合反応後、の反応系を示す。
【図18】ホストHをヘプタキス(o−メチル)−γ−シクロデキストリン置換基としたプローブを用い、トリメチンシアニン色素の存在下にて、円二色性の測定を行った結果を示す図である。
【図19】ホストHをβ−シクロデキストリン置換基としたプローブを用い、ニュートラルレッドの存在下にて、円二色性の測定を行った結果を示す図である。
【図20】ホストHをβ−シクロデキストリン置換基としたプローブを用い、ローダミンBの存在下にて、円二色性の測定を行った結果を示す図である。
【符号の説明】
【0160】
1、11、12、2、21、31、32 プローブ
A アンカー
B 水素結合
D 色素
H ホスト
K 基板表面
L1 測定光
L2、L3 測定対象光
P、P1、P2 分子鎖
S1、S2、S3 スペーサー
St1、St2 ステム部
T 物質
【特許請求の範囲】
【請求項1】
所定の物質に結合可能な分子鎖を有するプローブにおいて、
前記分子鎖に、他の化学種を包接し得る化学種であって、かつ、光学活性を有する第一の化学種が結合されていることを特徴とするプローブ。
【請求項2】
さらに、前記分子鎖に、前記第一の化学種に包接され得る第二の化学種が結合されていることを特徴とする請求項1記載のプローブ。
【請求項3】
前記物質との非結合時において、前記第一の化学種と前記第二の化学種は包接状態を維持し、かつ、
前記物質との結合により、前記包接状態が解除されることを特徴とする請求項2記載のプローブ。
【請求項4】
所定の物質と、
該物質に結合可能な分子鎖に、他の化学種を包接し得る化学種であって、かつ、光学活性を有する、第一の化学種と、前記第一の化学種に包接され得る第二の化学種と、が結合されたプローブと、
の結合反応を、前記第一の化学種に包接され得る色素の存在下において行い、
前記プローブと前記物質との非結合時において維持される前記第一の化学種と前記第二の化学種の包接状態が、前記プローブと前記物質との結合によって解除されることにより、前記色素が前記第一の化学種に包接されて獲得する誘起円二色性を検知することで、前記物質と前記プローブとの結合を検出する方法。
【請求項5】
前記第一の化学種に対する前記色素の包接能が、
前記第一の化学種に対する前記第二の化学種の包接能よりも低いことを特徴とする請求項4記載の検出方法。
【請求項6】
前記第二の化学種は、色素であることを特徴とする請求項2又は3記載のプローブ。
【請求項7】
所定の物質と、
該物質に結合可能な分子鎖に、他の化学種を包接し得る化学種であって、かつ、光学活性を有する、第一の化学種と、前記第一の化学種に包接され得る色素と、が結合されたプローブと、
の結合反応を行い、
前記プローブと前記物質との非結合時において維持される前記第一の化学種と前記色素の包接状態が、前記プローブと前記物質との結合によって解除されることにより、前記色素の誘起円二色性が消失することを検知することで、前記物質と前記プローブとの結合を検出する方法。
【請求項8】
前記包接状態は、前記分子鎖が形成するステムループ構造によって安定化されていることを特徴とする請求項3記載のプローブ。
【請求項9】
所定の物質に結合可能な分子鎖を有するプローブにおいて、
前記分子鎖に、他の化学種を包接し得る化学種であって、かつ、光学活性を有する、第一の化学種が結合された第一のプローブと、
前記分子鎖に、前記第一の化学種に包接され得る第二の化学種が結合された第二のプローブと、からなるプローブペア。
【請求項10】
前記物質との非結合時において、前記第一の化学種と前記第二の化学種は包接状態を維持し、かつ、
前記物質との結合により、前記包接状態が解除されることを特徴とする請求項9記載のプローブペア。
【請求項11】
前記第二の化学種は、色素であることを特徴とする請求項10記載のプローブペア。
【請求項12】
所定の物質と、
該物質に結合可能な分子鎖に、他の化学種を包接し得る化学種であって、かつ、光学活性を有する、第一の化学種が結合された第一のプローブと、前記分子鎖に、前記第一の化学種に包接され得る色素が結合された第二のプローブと、からなるプローブペアと、
の結合反応を行い、
前記プローブペアと前記物質との非結合時において維持される前記第一の化学種と前記色素の包接状態が、前記プローブと前記物質との結合によって解除されることにより、前記色素の誘起円二色性が消失することを検知することで、前記物質と前記プローブとの結合を検出する方法。
【請求項13】
リアルタイムPCR法であることを特徴とする請求項4、7又は12のいずれか一項記載の検出方法。
【請求項1】
所定の物質に結合可能な分子鎖を有するプローブにおいて、
前記分子鎖に、他の化学種を包接し得る化学種であって、かつ、光学活性を有する第一の化学種が結合されていることを特徴とするプローブ。
【請求項2】
さらに、前記分子鎖に、前記第一の化学種に包接され得る第二の化学種が結合されていることを特徴とする請求項1記載のプローブ。
【請求項3】
前記物質との非結合時において、前記第一の化学種と前記第二の化学種は包接状態を維持し、かつ、
前記物質との結合により、前記包接状態が解除されることを特徴とする請求項2記載のプローブ。
【請求項4】
所定の物質と、
該物質に結合可能な分子鎖に、他の化学種を包接し得る化学種であって、かつ、光学活性を有する、第一の化学種と、前記第一の化学種に包接され得る第二の化学種と、が結合されたプローブと、
の結合反応を、前記第一の化学種に包接され得る色素の存在下において行い、
前記プローブと前記物質との非結合時において維持される前記第一の化学種と前記第二の化学種の包接状態が、前記プローブと前記物質との結合によって解除されることにより、前記色素が前記第一の化学種に包接されて獲得する誘起円二色性を検知することで、前記物質と前記プローブとの結合を検出する方法。
【請求項5】
前記第一の化学種に対する前記色素の包接能が、
前記第一の化学種に対する前記第二の化学種の包接能よりも低いことを特徴とする請求項4記載の検出方法。
【請求項6】
前記第二の化学種は、色素であることを特徴とする請求項2又は3記載のプローブ。
【請求項7】
所定の物質と、
該物質に結合可能な分子鎖に、他の化学種を包接し得る化学種であって、かつ、光学活性を有する、第一の化学種と、前記第一の化学種に包接され得る色素と、が結合されたプローブと、
の結合反応を行い、
前記プローブと前記物質との非結合時において維持される前記第一の化学種と前記色素の包接状態が、前記プローブと前記物質との結合によって解除されることにより、前記色素の誘起円二色性が消失することを検知することで、前記物質と前記プローブとの結合を検出する方法。
【請求項8】
前記包接状態は、前記分子鎖が形成するステムループ構造によって安定化されていることを特徴とする請求項3記載のプローブ。
【請求項9】
所定の物質に結合可能な分子鎖を有するプローブにおいて、
前記分子鎖に、他の化学種を包接し得る化学種であって、かつ、光学活性を有する、第一の化学種が結合された第一のプローブと、
前記分子鎖に、前記第一の化学種に包接され得る第二の化学種が結合された第二のプローブと、からなるプローブペア。
【請求項10】
前記物質との非結合時において、前記第一の化学種と前記第二の化学種は包接状態を維持し、かつ、
前記物質との結合により、前記包接状態が解除されることを特徴とする請求項9記載のプローブペア。
【請求項11】
前記第二の化学種は、色素であることを特徴とする請求項10記載のプローブペア。
【請求項12】
所定の物質と、
該物質に結合可能な分子鎖に、他の化学種を包接し得る化学種であって、かつ、光学活性を有する、第一の化学種が結合された第一のプローブと、前記分子鎖に、前記第一の化学種に包接され得る色素が結合された第二のプローブと、からなるプローブペアと、
の結合反応を行い、
前記プローブペアと前記物質との非結合時において維持される前記第一の化学種と前記色素の包接状態が、前記プローブと前記物質との結合によって解除されることにより、前記色素の誘起円二色性が消失することを検知することで、前記物質と前記プローブとの結合を検出する方法。
【請求項13】
リアルタイムPCR法であることを特徴とする請求項4、7又は12のいずれか一項記載の検出方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【公開番号】特開2009−133711(P2009−133711A)
【公開日】平成21年6月18日(2009.6.18)
【国際特許分類】
【出願番号】特願2007−309870(P2007−309870)
【出願日】平成19年11月30日(2007.11.30)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
【公開日】平成21年6月18日(2009.6.18)
【国際特許分類】
【出願日】平成19年11月30日(2007.11.30)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
[ Back to top ]

