ヘキサヒドロ−シクロオクチルピラゾール系カンナビノイドモジュレーター
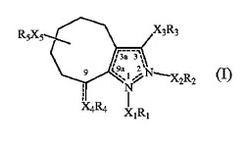
本発明は、式(I):
【化1】

で表されるヘキサヒドロ−シクロオクチルピラゾール系カンナビノイドモジュレーター化合物、そしてそれをカンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防で用いる方法に向けたものである。
【化1】

で表されるヘキサヒドロ−シクロオクチルピラゾール系カンナビノイドモジュレーター化合物、そしてそれをカンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防で用いる方法に向けたものである。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願に対する相互参照
本出願は2005年9月23日付けで出願した米国仮特許出願連続番号60/719,884および2006年9月22日付けで出願した米国特許出願連続番号11/525,573(これらは引用することによって全体があらゆる目的で本明細書に組み入れられる)の利点を請求する一部継続出願である。
【0002】
本発明は、ヘキサヒドロ−シクロオクチルピラゾール系カンナビノイド(CB)モジュレーター化合物およびそれをカンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防で用いる方法に向けたものである。
【背景技術】
【0003】
カンナビノイドCB1およびCB2受容体が発見されるまでは、大麻の生物学的に有効な成分を記述する目的で用語カンナビノイドが用いられていて、それらの中で最も豊富に存在する物質はデルタ−9−テトラヒドロカンナビノール(THC)およびカンナビジオールである。
【0004】
【化1】

【0005】
THCは、CB1およびCB2受容体の中程度の効力を示す部分作動薬であり、“古典的なカンナビノイド”であると見なされているが、これは、三環式ジベンゾピランTHC中心部と構造的に関連している他の類似物および誘導体を指す目的で現在用いられている用語である。用語“非古典的カンナビノイド”は、カンナビジオールと構造的に関連したカンナビノイド作動薬を指す。
【0006】
薬理学的調査はピラゾール構造の種類の選択的CB受容体モジュレーターに集中しており、それらにはSR 141716A(SR 141716の一塩酸塩)およびSR 144528が含まれる。
【0007】
【化2】

【0008】
ピラゾール系カンナビノイドモジュレーターは多種多様な構造種の中の1つであり、それらはCB薬理学の進展を促し、カンナビノイド受容体が媒介する生物学的効果の測定に役立ち、現在の化合物のさらなる改良をもたらしかつ将来的には新規な化学種の源になるであろう。
【0009】
元々は選択的拮抗薬であるとして分類分けされていた特定の化合物(SR 141716、SR 144528などを包含)は、現在では、純粋な拮抗薬ではなくむしろ“逆作動薬”として働くと考えられている。逆作動薬は、作動薬が受容体の所に結合することによって誘発される活性化を単に妨害するのではなく、作動薬が存在しない時に受容体の活性化の構成的レベルを低下させる能力を有する。CB受容体が示す構成的活性は重要な暗示である、と言うのは、CB1およびCB2は両方ともが作動薬が存在しない時でもあるレベルで連続的にシグナルを伝達するからである。例えば、SR 141716AはCB1蛋白質の濃度を増加させかつ細胞が作動薬の作用に対して示す感受性を高め、従って、このことは、逆作動薬はエンドカンナビノイド系およびCB受容体によって活性化される下流のシグナル伝達経路をモジュレートする目的で使用可能な別の種類のリガンドであり得ることを示している。
【0010】
ピラゾール誘導体がCB1またはCB2受容体作動薬として特許文献1に記述されている。
【0011】
CBおよびカンナビ模擬リガンドの合成が進展したことで受容体の薬理学が更に進展しかつ追加的カンナビノイド受容体サブタイプが存在する証拠がもたらされた。しかしながら、CB受容体がモジュレートするいろいろな症候群、障害および病気を治療する目的でCB1またはCB2受容体カンナビノイドモジュレーターを同定および開発する必要性は継続して存在したままである。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】PCT出願WO2006/030124
【発明の概要】
【0013】
発明の詳細な説明
本発明は式(I):
【0014】
【化3】

【0015】
[式中、
式(I)中の位置2−3の間の破線および位置3a−9aの間の破線は、X1R1が存在する時に存在する2個の二重結合の各々の位置を表し、
式(I)中の位置3−3aの間の破線および位置9a−1の間の破線は、X2R2が存在する時に存在する2個の二重結合の各々の位置を表し、
式(I)中の位置9とX4R4の間の破線は、二重結合の位置を表し、
X1は、存在しないか或は低級アルキレンであり、
X2は、存在しないか或は低級アルキレンであり、かつ
X1R1およびX2R2の中の一方のみが存在し、
X3は、存在しないか、低級アルキレン、低級アルキリデンまたは−NH−であり、
位置9とX4R4の間の破線が存在しない時には、X4が存在しないか或は低級アルキレンであり、
位置9とX4R4の間の破線が存在する時には、X4が存在せず、
X5は、存在しないか或は低級アルキレンであり、
R1は、水素、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、低級アルキル−スルホニル、アリール、C3−C12シクロアルキルまたはヘテロシクリルから選択され、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1つ以上の位置がハロゲン、アミノスルホニル、低級アルキル−アミノスルホニル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、ヒドロキシまたはアルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)で置換されていてもよく、
R2は、水素、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、低級アルキル−スルホニル、アリール、C3−C12シクロアルキルまたはヘテロシクリルから選択され、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1つ以上の位置がハロゲン、アミノスルホニル、低級アルキル−アミノスルホニル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、ヒドロキシまたはアルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)で置換されていてもよく、
R3は、−C(O)−Z1(R6)、−SO2−NR7−Z2(R8)または−C(O)−NR9−Z3(R10)であり、
位置9とX4R4の間の破線が存在しない時には、X4が存在しないか或は低級アルキレンでありそしてR4が水素、ヒドロキシ、低級アルキル、低級アルコキシ、ハロゲン、アリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1つ以上の位置がヒドロキシ、オキソ、低級アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、低級アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)またはハロゲンで置換されていてもよく、
位置9とX4R4の間の破線が存在する時には、X4が存在せずそしてR4がCH−アリールまたはCH−ヘテロシクリルであり、かつアリールまたはヘテロシクリルは各々場合により1つ以上の位置がヒドロキシ、オキソ、低級アルキル、低級アルコキシまたはハロゲンで置換されていてもよく、
R5は、存在しないか、ヒドロキシ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルであり、R6は、アリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよく、R7は、水素または低級アルキルであり、
R8は、アリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよく、R9は、水素または低級アルキルであり、
R10は、アリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アミノスルホニル、低級アルキル−アミノスルホニル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよく、
Z1およびZ2は、各々、存在しないか或はアルキルであり、そして
Z3は、存在しないか、−NH−、−SO2−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)である]
で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体に向けたものである。
【発明を実施するための形態】
【0016】
本発明の一例は、X1が存在しないか或は低級アルキレンでありそしてR1が水素、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アリール、C3−C12シクロアルキルまたはヘテロシクリルか選択されかつアリール、C3−C12シクロアルキルまたはヘテロシクリルが各々場合により1つ以上の位置がハロゲン、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、ヒドロキシまたはアルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)で置換されていてもよい式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0017】
本発明の一例は、X1が存在せずそしてR1がアリールまたはC3−C12シクロアルキルから選択されかつアリールが場合により1つ以上の位置がハロゲンで置換されていてもよい式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0018】
本発明の一例は、X1が存在せずそしてR1が水素である式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0019】
本発明の一例は、R3が−C(O)−Z1(R6)、−SO2−NH−Z2(R8)または−C(O)−NH−Z3(R10)である式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0020】
本発明の一例は、R3が−C(O)−Z1(R6)であり、X3が存在しないか、低級アルキレン、低級アルキリデンまたは−NH−であり、Z1が存在しないか或はアルキルでありそしてR6がアリール、C3−C12シクロアルキルまたはヘテロシクリルでありかつアリール、C3−C12シクロアルキルまたはヘテロシクリルが各々場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよい式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0021】
本発明の一例は、R3が−C(O)−Z1(R6)であり、X3が存在せず、Z1が存在せずそしてR6がヘテロシクリルである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0022】
本発明の一例は、R3が−SO2−NR7−Z2(R8)であり、X3が存在しないか或は低級アルキリデンであり、R7が水素または低級アルキルであり、Z2が存在しないか或はアルキルでありそしてR8が場合により1つ以上の位置がアルコキシで置換されていてもよいアリールである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0023】
本発明の一例は、R3が−SO2−NH−Z2(R8)であり、X3が存在しないか或は低級アルキリデンであり、Z2が存在しないか或はアルキルでありそしてR8が場合により1つ以上の位置がアルコキシで置換されていてもよいアリールである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0024】
本発明の一例は、R3が−C(O)−NR9−Z3(R10)であり、X3が存在しないか、低級アルキレン、低級アルキリデンまたは−NH−であり、R9が水素または低級アルキルであり、Z3が存在しないか、−NH−、−SO2−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)でありそしてR10が各々が場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アミノスルホニル、低級アルキル−アミノスルホニル、ア
リール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよいアリール、C3−C12シクロアルキルまたはヘテロシクリルである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0025】
本発明の一例は、R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか、−NH−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)でありそしてR10が各々が場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ、カルボキシ、カルボニルアルコキシ、アリールまたはヘテロシクリルで置換されていてもよいアリール、C3−C12シクロアルキルまたはヘテロシクリルである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0026】
本発明の一例は、R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか或はアルキルでありそしてR10が場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ、カルボキシ、カルボニルアルコキシ、アリールまたはヘテロシクリルで置換されていてもよいC3−C12シクロアルキルである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0027】
本発明の一例は、R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか或はアルキルでありそしてR10が場合により1個以上のアルキルまたはカルボニルアルコキシで置換されていてもよいC3−C12シクロアルキルである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0028】
本発明の一例は、R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか、−NH−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)でありそしてR10が場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ、カルボキシ、カルボニルアルコキシ、アリールまたはヘテロシクリルで置換されていてもよいアリールである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0029】
本発明の一例は、R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか、−NH−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)でありそしてR10が場合により1個以上のハロゲンで置換されていてもよいアリールである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0030】
本発明の一例は、R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか或はアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)でありそしてR10が場合により1個以上のアルキルで置
換されていてもよいヘテロシクリルである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0031】
本発明の一例は、位置9とX4R4の間の破線が存在せず、X4が存在しないか或は低級アルキレンでありそしてR4が水素または場合により1つ以上の位置がハロゲンで置換されていてもよいアリールである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0032】
本発明の一例は、位置9とX4R4の間の破線が存在し、X4が存在せずそしてR4が場合によりアリール上の1つ以上の位置がハロゲンで置換されていてもよいCH−アリールである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0033】
本発明の一例は、X5が存在せずそしてR5が存在しない式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0034】
本発明の一例は、式(Ia):
【0035】
【化4】

【0036】
[式中、
X1は存在せず、X3は存在しないか或は低級アルキリデンであり、位置9とX4R4の間の破線が存在しない時にはX4が存在しないか或は低級アルキレンでありそしてR4が水素または場合により1つ以上の位置がハロゲンで置換されていてもよいアリールであり、位置9とX4R4の間の破線が存在する時にはX4が存在せずそしてR4がCH−アリールでありかつアリールが場合により1つ以上の位置がハロゲンで置換されていてもよく、R1は水素、アリールまたはC3−C12シクロアルキルから選択され、かつアリールは場合により1つ以上の位置がハロゲンで置換されていてもよく、R3は−C(O)−Z1(R6)、−SO2−NH−Z2(R8)または−C(O)−NH−Z3(R10)であり、R6はヘテロシクリルであり、R8は場合により1つ以上の位置がアルコキシで置換されていてもよいアリールであり、R10はアリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリールまたはC3−C12シクロアルキルは各々場合により1個以上のハロゲン、アルキルまたはカルボニルアルコキシで置換されていてもよく、Z1は存在せず、Z2はアルキルであり、そしてZ3は存在しないか、−NH−またはアルキル(ここで、アルキルは場合により1個以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)である]
で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0037】
本発明の一例は、X1が存在せず、X3が存在しないか或は低級アルキリデンであり、位置9とX4R4の間の破線が存在しない時にはX4が存在しないか或は低級アルキレンでありそしてR4が水素または場合により1つ以上の位置がハロゲンで置換されていても
よいアリールであり、位置9とX4R4の間の破線が存在する時にはX4が存在せずそしてR4がCH−アリールでありかつアリールが場合により1つ以上の位置がハロゲンで置換されていてもよく、R1が水素またはアリールから選択され、かつアリールが場合により1つ以上の位置がハロゲンで置換されていてもよく、R3が−SO2−NH−Z2(R8)または−C(O)−NH−Z3(R10)であり、R8が場合により1つ以上の位置がアルコキシで置換されていてもよいアリールであり、R10が場合により1個以上のハロゲン、アルキルまたはカルボニルアルコキシで置換されていてもよいアリールであり、Z2がアルキルでありそしてZ3が存在しないか或はアルキル(ここで、アルキルは場合により1個以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)である式(Ia)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0038】
本発明の一例は、X1R1、X3R3およびX4R4が依存して下記:
【0039】
【表1】

【0040】
から選択される式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0041】
式(I)で表される化合物およびこれらの製薬学的に許容される形態物には下記から選択したそれらが含まれる:
【0042】
【化5】

【0043】
【化6】

【0044】
【化7】

【0045】
【化8】

【0046】
定義
下記の用語を本明細書で用いる場合、これらに以下の意味を持たせる:
用語“アルキル”は、炭素原子数が10以下の飽和分枝または直鎖の一価炭化水素基を意味する。アルキルには、典型的に、これらに限定するものでないが、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、ペンチル、ヘキシル、ヘプチルなどが含まれる。
【0047】
用語“低級アルキル”は、炭素原子数が4以下のアルキル基を意味する。結合点はアルキルまたは低級アルキルのいずれかの炭素原子上であり得、そしてさらなる置換基が存在する場合、置換基変項の場所はいずれかの炭素原子上であり得る。
【0048】
用語“アルキレン”は、炭素原子数が10以下の飽和分枝または直鎖の一価炭化水素連結基を意味し、ここで、この連結基は、2個の炭素原子の各々から水素原子が1個ずつ取り除かれることで生じる。アルキレンには、典型的に、これらに限定するものでないが、メチレン、エチレン、プロピレン、イソプロピレン、n−ブチレン、t−ブチレン、ペンチレン、ヘキシレン、ヘプチレンなどが含まれる。用語“低級アルキレン”は炭素原子数が4以下のアルキレン連結基を意味する。結合点はアルキレンまたは低級アルキレンの炭素原子のいずれか上であり得、そしてさらなる置換基が存在する場合、置換基変項の場所はいずれかの炭素原子上であり得る。
【0049】
用語“アルキリデン”は、隣接して位置する2個の炭素原子の間に形成された二重結合を少なくとも1個有する炭素原子数が1から10のアルキレン連結基を意味し、ここで、前記二重結合は2個の炭素原子各々から水素原子が1個ずつ取り除かれることで生じる。原子は前記二重結合の回りでシス(E)またはトランス(Z)配置のいずれかで配向している可能性がある。アルキリデンには、典型的に、これらに限定するものでないが、メチリデン、ビニリデン、プロピリデン、イソ−プロピリデン、メタリレン、アリリデン(2−プロペニリデン)、クロチレン(2−ブテニレン)、プレニレン(3−メチル−2−ブテニレン)などが含まれる。用語“低級アルキリデン”は炭素原子数が1から4の基または連結基を意味する。結合点はアルキリデンまたは低級アルキリデンの炭素原子のいずれか上であり得、そしてさらなる置換基が存在する場合、置換基変項の場所はいずれかの炭素原子上であり得る。
【0050】
用語“アルコキシ”は、酸素原子を通して結合している炭素原子数が10以下のアルキル、アルキレンまたはアルキリデン基を意味し、結合点は、親基上のヒドロキサイド置換基から水素原子が取り除かれることで形成される。用語“低級アルコキシ”は、炭素原子数が4以下のアルキル、アルキレンまたはアルキリデン基を意味する。低級アルコキシには、典型的に、これらに限定するものでないが、メトキシ、エトキシ、プロポキシ、ブトキシなどが含まれる。さらなる置換基が存在する場合、置換基変項の場所はアルコキシのいずれかの炭素原子上であり得る。
【0051】
用語“シクロアルキル”は、飽和または部分不飽和の単環式、多環式または橋状炭化水素環系基または連結基を意味する。炭素原子数が3から20の環はC3−20シクロアルキルで表示可能であり、炭素原子数が3から12の環はC3−12シクロアルキルで表示可能であり、炭素原子数が3から8の環はC3−8シクロアルキルで表示可能である、等々。
【0052】
シクロアルキルには、典型的に、これらに限定するものでないが、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘキセニル、シクロヘプチル、シクロオクチル、インダニル、インデニル、1,2,3,4−テトラヒドロ−ナフタレニル、5,6,7,8−テトラヒドロ−ナフタレニル、6,7,8,9−テトラヒドロ−5H−ベンゾシクロヘプテニル、5,6,7,8,9,10−ヘキサヒドロ−ベンゾシクロオ
クテニル、フルオレニル、ビシクロ[2.2.1]ヘプチル、ビシクロ[2.2.1]ヘプテニル、ビシクロ[2.2.2]オクチル、ビシクロ[3.1.1]ヘプチル、ビシクロ[3.2.1]オクチル、ビシクロ[2.2.2]オクテニル、ビシクロ[3.2.1]オクテニル、アダマンタニル、オクタヒドロ−4,7−メタノ−1H−インデニル、オクタヒドロ−2,5−メタノ−ペンタレニル(またヘキサヒドロ−2,5−メタノ−ペンタレニルとも呼ばれる)などが含まれる。さらなる置換基が存在する場合、置換基変項の場所は環のいずれかの炭素原子上であり得る。
【0053】
用語“ヘテロシクリル”は、少なくとも1個の環炭素原子がN、OまたはSから独立して選択される1個以上のヘテロ原子に置き換わっている飽和、部分不飽和または不飽和の単環式、多環式または橋状炭化水素環系基または連結基を意味する。ヘテロシクリル環系には、更に、窒素原子である環員を4個以下の数で有する環系または窒素原子である環員の数が0から3で酸素または硫黄原子である環員の数が1の環系も含まれる。有効原子価が許容する場合、隣接して位置する環員がヘテロ原子であってもよい数は2以下であり、この場合、一方のヘテロ原子が窒素でありそしてもう一方がN、OまたはSから選択される。ヘテロシクリル基は、1個の炭素もしくは窒素環原子から水素原子が1個取り除かれることで生じる。ヘテロシクリル連結基は、炭素または窒素環原子のいずれかの各々から水素原子が2個取り除かれることで生じる。
【0054】
ヘテロシクリルには、典型的に、これらに限定するものでないが、フリル、チエニル、2H−ピロール、2−ピロリニル、3−ピロリニル、ピロリジニル、ピロリル、1,3−ジオキソラニル、オキサゾリル、チアゾリル、イミダゾリル、2−イミダゾリニル(また4,5−ジヒドロ−1H−イミダゾリルとも呼ばれる)、イミダゾリジニル、2−ピラゾリニル、ピラゾリジニル、ピラゾリル、イソオキサゾリル、イソチアゾリル、オキサジアゾリル、トリアゾリル、チアジアゾリル、テトラゾリル、2H−ピラン、4H−ピラン、ピリジニル、ピペリジニル、1,4−ジオキサニル、モルホリニル、1,4−ジチアニル、チオモルホリニル、ピリダジニル、ピリミジニル、ピラジニル、ピペラジニル、アゼパニル、インドリジニル、インドリル、イソインドリル、3H−インドリル、インドリニル、ベンゾ[b]フリル、ベンゾ[b]チエニル、1H−インダゾリル、ベンゾイミダゾリル、ベンゾチアゾリル、プリニル、4H−キノリジニル、キノリニル、イソキノリニル、シンノリニル、フタルジニル、キナゾリニル、キノキサリニル、1,8−ナフチリジニル、プテリジニル、キヌクリジニル、ヘキサヒドロ−1,4−ジアゼピニル、1,3−ベンゾジオキソリル(また1,3−メチレンジオキシフェニルとしても知られる)、2,3−ジヒドロ−1,4−ベンゾジオキシニル(また1,4−エチレンジオキシフェニルとしても知られる)、ベンゾ−ジヒドロ−フリル、ベンゾ−テトラヒドロ−ピラニル、ベンゾ−ジヒドロ−チエニル、5,6,7,8−テトラヒドロ−4H−シクロヘプタ(b)チエニル、5,6,7−トリヒドロ−4H−シクロヘキダ(b)チエニル、5,6−ジヒドロ−4H−シクロペンタ(b)チエニル、2−アザ−ビシクロ[2.2.1]ヘプチル、1−アザ−ビシクロ[2.2.2]オクチル、8−アザ−ビシクロ[3.2.1]オクチル、7−オキサ−ビシクロ[2.2.1]ヘプチルなどが含まれる。
【0055】
用語“アリール”は、炭素原子数が6、9、10または14の不飽和共役π電子単環式または多環式炭化水素環系基または連結基を意味する。アリール基は1個の炭素環原子から1個の水素原子が取り除かれることで生じる。アリーレン連結基は2個の炭素環原子の各々から2個の水素原子が取り除かれることで生じる。アリールには、典型的に、これらに限定するものでないが、フェニル、ナフタレニル、アズレニル、アントラセニルなどが含まれる。
【0056】
用語“アミノ”は式−NH2で表される基を意味する。
【0057】
用語“アミノアルキル”は式−NH−アルキルまたは−N(アルキル)2で表される基を意味する。
【0058】
用語“アミノスルホニル”は式−SO2NH2で表される基を意味する。
【0059】
用語“アリールアルコキシ”は式−O−アルキル−アリールで表される基を意味する。
【0060】
用語“アリールオキシ”は式−O−アリールで表される基を意味する。
【0061】
用語“カルバモイル”は式−C(O)NH2で表される基を意味する。
【0062】
用語“カルバモイルアルキル”は式−C(O)NH−アルキルまたは−C(O)N(アルキル)2で表される基を意味する。
【0063】
用語“カルボニルアルコキシ”は式−C(O)O−アルキルで表される基を意味する。
【0064】
用語“カルボキシ”は式−COOHまたは−CO2Hで表される基を意味する。
【0065】
用語“ハロ”または“ハロゲン”は、フルオロ、クロロ、ブロモまたはヨードを意味する。
【0066】
用語“低級アルキル−アミノ”は、式−NH−アルキルまたは−N(アルキル)2で表される基を意味する。
【0067】
用語“低級アルキル−アミノスルホニル”は、式−SO2NH−アルキルまたは−SO2N(アルキル)2で表される基を意味する。
【0068】
用語“低級アルキル−スルホニル”は、式−SO2−アルキルまたは−C(O)N(アルキル)2で表される基を意味する。
【0069】
用語“置換”は、中心分子上の1個以上の水素原子が1個以上の基または連結基に置き換わっていることを意味し、ここで、定義として、連結基もまた更に置換される。当業者は、化学的に安定な中心分子がもたらされるように個々の基または連結基が水素原子に置き換わり得ることを最適に予測するであろう。
【0070】
用語“依存して選択”は、1個以上の置換基変項が指定組み合わせで存在することを意味する(例えば表のリストに通常示す置換基の群)。
【0071】
本発明の開示で用いる置換基の命名法は、当業者に良く知られている命名規則を用いることに由来する命名法である(例えば、IUPAC)。
【0072】
製薬学的形態物
本発明の化合物は製薬学的に許容される塩の形態で存在し得る。本発明の化合物の“製薬学的に許容される塩”を薬剤として用いる場合、これは無毒の酸/アニオンまたは塩基/カチオン塩形態物を指す。
【0073】
本発明の化合物の適切な製薬学的に許容される塩には、例えば本発明に従う化合物の溶液を製薬学的に許容される酸、例えば塩酸、硫酸、フマル酸、マレイン酸、こはく酸、酢酸、安息香酸、クエン酸、酒石酸、炭酸または燐酸などの溶液と一緒に混合することなどで生じ得る酸付加塩が含まれる。
【0074】
更に、本発明の化合物が酸性部分を持つ場合、それらの適切な製薬学的に許容される塩には、アルカリ金属塩、例えばナトリウムまたはカリウム塩など、アルカリ土類金属塩、例えばカルシウムまたはマグネシウム塩など、および適切な有機配位子と一緒に生じる塩、例えば第四級アンモニウム塩などが含まれ得る。このように、代表的な製薬学的に許容される塩には下記が含まれる:酢酸塩、ベンゼンスルホン酸塩、安息香酸塩、重炭酸塩、重硫酸塩、重酒石酸塩、ホウ酸塩、臭化物、カルシウム、カンシル酸塩(または樟脳スルホン酸塩)、炭酸塩、塩化物、クラブラン酸塩、クエン酸塩、二塩酸塩、エデト酸塩、フマル酸塩、グルコン酸塩、グルタミン酸塩、ヒドラバミン、臭化水素酸塩、塩酸塩、ヨウ化物、イセチオン酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マンデル酸塩、メシル酸塩、硝酸塩、オレイン酸塩、パモ酸塩、パルミチン酸塩、燐酸塩/二燐酸塩、サリチル酸塩、ステアリン酸塩、硫酸塩、こはく酸塩、酒石酸塩、トシル酸塩。
【0075】
本発明は本発明の化合物のプロドラッグおよび代謝産物を本発明の範囲内に包含する。そのようなプロドラッグおよび代謝産物は一般に生体内で容易に活性化合物に変化し得る本化合物の機能的誘導体である。
【0076】
従って、本発明の治療方法における用語“投与する”は、具体的に開示した化合物または特定の本化合物として具体的には開示しなかったが明らかに本発明の範囲内に含まれるであろう化合物またはこれのプロドラッグまたは代謝産物を用いて本明細書に記述する症候群、障害または病気を治療、改善または予防する手段を包含する。
【0077】
用語“プロドラッグ”は、本発明の化合物(またはこれの塩)の機能的誘導体の製薬学的に許容される形態を意味し、このプロドラッグは、1)生体内で活性プロドラッグ成分に変化する比較的活性のある前駆体、2)生体内で活性プロドラッグ成分に変化する比較的不活性な前駆体、または3)生体内で利用可能になった後に治療的生物学的活性に貢献(即ち代謝産物として)する本化合物の活性が比較的低い成分であり得る。適切なプロドラッグ誘導体を選択および調製する通常の手順は、例えばH.Bundgaard編集の“Design of Produrgs”、Elsevier、1985などに記述されている。
【0078】
用語“代謝産物”は、本発明の化合物(またはこれの塩)の代謝誘導体の製薬学的に許容される形態を意味し、この誘導体は、生体内で利用可能になった後に治療的生物学的活性に貢献する本化合物の活性が比較的低い成分である。
【0079】
本発明は、化合物のいろいろな異性体およびこれらの混合物を包含する。用語“異性体”は、組成および分子量は同じであるが物理的および/または化学的特性が異なる化合物を指す。そのような物質が有する原子の数および種類は同じであるが、構造は異なる。その構造の差は構成の差(幾何異性体)または偏光面回転性の差(立体異性体)であり得る。
【0080】
用語“立体異性体”は、構成は同じであるが原子の空間配置が異なる異性体を指す。鏡像異性体およびジアステレオマーは、不斉置換されている炭素原子がキラル中心として働く立体異性体である。用語“キラル”は、分子が鏡像に重なり合わないことを指し、これは、対称軸および面または中心が存在しないことを意味する。用語“鏡像異性体”は、互いに鏡像であるが重なり合わない1対の分子種の中の一方を指す。用語“ジアステレオマー”は、鏡像に関係しない立体異性体を指す。記号“R”および“S”は、不斉炭素原子1個または2個以上の回りの置換基の配置を表す。記号“R*”および“S*”は、不斉炭素原子1個または2個以上の回りの置換基の相対的配置を表す。
【0081】
用語“ラセミ化合物”または“ラセミ混合物”は、2種類の鏡像異性体種が等モル量で存在する化合物を指し、この化合物は光学活性を示さない。用語“光学活性”は、キラル分子またはキラル分子の非ラセミ混合物が偏光面を回転させる度合を指す。
【0082】
用語“幾何異性体”は、炭素−炭素二重結合、シクロアルキル環または橋状二環式系に関して置換基の原子の配向が異なる異性体を指す。炭素−炭素二重結合の各側に位置する置換基の原子(H以外)はEまたはZ配置であり得る。“E”(相対する側)または“椅子形”配置の場合の置換基は炭素−炭素二重結合に関して相対する側に位置し、“Z”(同じ側)または“舟形”配置の場合の置換基は炭素−炭素二重結合に関して同じ側に配向している。炭素環式環と結合している置換基の原子(H以外)はシスまたはトランス配置であり得る。“シス”配置の場合の置換基は環の面に関して同じ側に位置し、“トランス”配置の場合の置換基は環の面に関して相対する側に位置する。“シス”と“トランス”種の混合物を有する化合物を“シス/トランス”と表示する。橋状二環式系と結合している置換基の原子(H以外)は“エンド”または“エキソ”配置であり得る。“エンド”配置の場合の置換基は残りの2個のブリッジの中の大きい方に向かうブリッジ(ブリッジヘッドではない)地点に結合しており、“エキソ”配置の場合の置換基は残りの2個のブリッジの中の小さい方に向かうブリッジ地点に結合している。
【0083】
本発明の化合物を調製する時に用いるいろいろな置換立体異性体、幾何異性体およびこれらの混合物は商業的に入手可能であるか、商業的に入手可能な出発材料を用いて合成的に調製可能であるか、或は異性体混合物として調製した後に通常の当業者に良く知られている技術を用いて分割した異性体として得ることができると理解されるべきである。
【0084】
異性体記述子“R”、“S”、“S*”、“R*”、“E”、“Z”、“シス”、“トランス”、“エキソ”および“エンド”を本明細書に記述する場合、これらは、中心分子に関する原子配置を指しそしてそれらを文献(IUPAC Recommendations for Fundamental Stereochemistry(Section E)、Pure Appl.Chem.、1976、45:13−30)に定義されている如く用いることを意図する。
【0085】
本発明の化合物は異性体に特異的な合成を用いて個々の異性体として調製可能であるか或は異性体混合物から分割可能である。通常の分割技術には、光学的活性塩を用いて異性体対の各異性体の遊離塩基を生じさせ(続いて分別結晶化そして遊離塩基の再生を行い)、異性体対の各異性体のエステルまたはアミドを生じさせる(続いてクロマトグラフィーによる分離そしてキラル補助剤の除去を行う)か或は良く知られている調製用TLC(薄層クロマトグラフィー)またはキラルHPLCカラムを用いて出発材料または最終的化合物のいずれかの異性体混合物に分割を受けさせることが含まれる。
【0086】
その上、本発明の化合物は1種以上の多形体または非晶質結晶形態も取り得、このように、それらも本発明の範囲内に包含させることを意図する。加うるに、本化合物の数種は水と一緒に溶媒和物(即ち水化物)または通常の有機溶媒と一緒に溶媒和物を形成する可能性があり、それらもまた本発明の範囲内に包含させることを意図する。
【0087】
本発明の化合物を生じさせる過程のいずれかを行っている間に、関係する分子のいずれかが有する敏感または反応性基を保護する必要がありそして/またはその方が望ましい可能性がある。これは通常の保護基、例えばJ.F.W.McOmie編集、Protective Groups in Organic Chemistry、Plenum Press、1973およびT.W.Greene & P.G.M.Wuts、Protective Groups in Organic Synthesis、John
Wiley & Sons、1991に記述されている如き保護基を用いて達成可能で
ある。このような保護基は当該技術分野で公知の方法を用いて後の便利な段階で除去可能である。
【0088】
治療的使用
CB1およびCB2カンナビノイド受容体はG蛋白質共役受容体(GCPR)ファミリー、即ち7回膜貫通ドメインのパターンが独特である受容体スーパーファミリーに属し、これはN型カルシウムチャンネルを阻害しそして/またはアデニレートシクラーゼを阻害することでQ型カルシウムチャンネルを阻害する。CB1受容体はCNS内に存在し、主に記憶および運動に関連した脳領域、例えば海馬(記憶の貯蔵)、小脳(運動機能、姿勢および均衡の調整)、基底核(運動調節)、視床下部(体温調節、神経内分泌物放出、食欲)、脊髄(痛覚)、大脳皮質(嘔吐)および末梢領域、例えばリンパ器官(細胞媒介および先天性免疫)、血管平滑筋細胞(血圧)、消化管(食道および胃腸の運動を調節する管および食道、十二指腸、空腸、回腸および大腸における先天性抗炎症)、肺平滑筋細胞(気管支拡張)、眼毛様体(眼圧)などの中に発現する。
【0089】
CB2受容体は主にリンパ組織(細胞媒介および先天性免疫)、末梢神経末端部(末梢神経系)、脾臓免疫細胞(免疫系の調節)および網膜(眼圧)内の末端に発現すると思われる。CB2 mRNAはCNS内の小脳顆粒細胞(運動機能の調整)内に存在する。薬理学的および生理学的証拠はまた他のカンナビノイド受容体サブタイプが存在することも示唆しているが、それらはまだクローン化も特徴付けも成されていない。
【0090】
CB受容体を活性化または阻害することによっていろいろな症候群、障害または病気を調節することができると思われるが、臨床的用途の可能な領域には、これらに限定するものでないが、食欲の調節、代謝の調節、糖尿病、緑内障関連眼圧の低下、社会的および気分障害の治療、発作関連障害の治療、薬物乱用障害の治療、学習、認識および記憶の向上、器官収縮および筋けいれんの制御、腸障害の治療、呼吸器障害の治療、自発運動または運動障害の治療、免疫および炎症障害の治療、細胞増殖の調節、疼痛管理における使用、神経保護薬としての使用などが含まれる。
【0091】
従って、本発明の式(I)または(Ia)で表される化合物を包含するカンナビノイド受容体モジュレーターは、カンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防で用いるに有用であり、それらには、これらに限定するものでないが、食欲の調節、代謝の調節、糖尿病、緑内障関連眼圧、痛み、社会的および気分障害、発作関連障害、薬物乱用障害、学習、認識および/または記憶障害、腸障害、呼吸器障害、自発運動障害、運動障害、免疫障害または炎症障害、器官収縮および筋けいれんの制御、学習、認識および/または記憶の向上、細胞増殖の調節、神経保護作用の供与などが含まれる。
【0092】
本発明は、カンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法に向けたものであり、これは、前記被験体に式(I)で表される化合物を有効な量で投与する段階を含んで成る。
【0093】
本発明は、カンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法に向けたものであり、これは、前記被験体に式(Ia)で表される化合物またはこれのプロドラッグ、代謝産物または組成物を有効な量で投与する段階を含んで成る。
【0094】
本発明は、カンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法に向けたものであり、これは、前記被験体に式(I)で表される化合物および治療薬を有効な量で含有して
成る組み合わせ製品および/または治療薬を投与する段階を含んで成る。
【0095】
本発明は、カンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法に向けたものであり、これは、前記被験体に式(Ia)で表される化合物および治療薬を有効な量で含有して成る組み合わせ製品および/または治療薬を投与する段階を含んで成る。
【0096】
本発明の組み合わせ製品および/または治療薬で用いることを意図する治療薬には、抗けいれん薬または避妊薬が含まれる。そのような抗けいれん薬には、これらに限定するものでないが、トピラメート、トピラメートの類似物、カルバマゼピン、バルプロ酸、ラモトリジン、ガバペンチン、フェニトインなどおよびこれらの混合物または製薬学的に許容される塩が含まれる。避妊薬には、これらに限定するものでないが、例えばプロゲスチンのみの避妊薬およびプロゲスチン成分とエストロゲン成分の両方を含有する避妊薬などが含まれる。本発明は、更に、前記避妊薬が経口避妊薬でありそして前記避妊薬が場合により葉酸成分を含有していてもよい製薬学的組成物も包含する。
【0097】
本発明は、また、被験体に避妊を施す方法も包含し、これは、前記被験体に避妊薬および式(I)または(Ia)で表されるCB1受容体逆作動薬もしくは拮抗薬化合物を含有して成っていて当該被験体における喫煙衝動を低下させそして/または当該被験体の減量に役立つ組成物を投与する段階を含んで成る。
【0098】
本発明は、CB受容体媒介症候群、障害または病気の治療、改善または予防に有用なカンナビノイド受容体モジュレーターを包含する。本発明の化合物またはこれの組成物がCBモジュレーターとして有用であることは本明細書に開示する方法に従って決定可能である。そのような使用の範囲には、複数のCB受容体媒介症候群、障害または病気の治療、改善または予防が含まれる。
【0099】
本発明は、また、CB受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法にも向けたものであり、ここで、前記症候群、障害または病気は、食欲、代謝、糖尿病、緑内障関連眼圧、社会的および気分障害、発作、薬物乱用、学習、認識または記憶、器官収縮または筋けいれん、腸障害、呼吸器障害、自発運動または運動障害、免疫および炎症障害、無秩序な細胞増殖、疼痛管理、神経保護作用などに関連している。
【0100】
CB受容体モジュレーターとして用いるに適した式(I)または(Ia)で表される化合物には、CB受容体結合活性に関する平均阻害定数(IC50)が約50μMから約0.01nMの範囲、約25μMから約0.01nMの範囲、約15μMから約0.01nMの範囲、約10μMから約0.01nMの範囲、約1μMから約0.01nMの範囲、約800nMから約0.01nMの範囲、約200nMから約0.01nMの範囲、約100nMから約0.01nMの範囲、約80nMから約0.01nMの範囲、約20nMから約0.01nMの範囲、約10nMから約0.1nMの範囲、または約0.1nMの化合物が含まれる。
【0101】
本発明のCB受容体モジュレーターとして用いるに適した式(I)または(Ia)で表される化合物には、CB1作動薬結合活性に関するCB1作動薬IC50が約50μMから約0.01nMの範囲、約25μMから約0.01nMの範囲、約15μMから約0.01nMの範囲、約10μMから約0.01nMの範囲、約1μMから約0.01nMの範囲、約800nMから約0.01nMの範囲、約200nMから約0.01nMの範囲、約100nMから約0.01nMの範囲、約80nMから約0.01nMの範囲、約20nMから約0.01nMの範囲、約10nMから約0.1nMの範囲、または約0.1
nMの化合物が含まれる。
【0102】
本発明のCB受容体モジュレーターとして用いるに適した式(I)または(Ia)で表される化合物には、CB1拮抗薬結合活性に関するCB1拮抗薬IC50が約50μMから約0.01nMの範囲、約25μMから約0.01nMの範囲、約15μMから約0.01nMの範囲、約10μMから約0.01nMの範囲、約1μMから約0.01nMの範囲、約800nMから約0.01nMの範囲、約200nMから約0.01nMの範囲、約100nMから約0.01nMの範囲、約80nMから約0.01nMの範囲、約20nMから約0.01nMの範囲、約10nMから約0.1nMの範囲、または約0.1nMの化合物が含まれる。
【0103】
本発明のCB受容体モジュレーターとして用いるに適した式(I)または(Ia)で表される化合物には、CB1逆作動薬結合活性に関するCB1逆作動薬IC50が約50μMから約0.01nMの範囲、約25μMから約0.01nMの範囲、約15μMから約0.01nMの範囲、約10μMから約0.01nMの範囲、約1μMから約0.01nMの範囲、約800nMから約0.01nMの範囲、約200nMから約0.01nMの範囲、約100nMから約0.01nMの範囲、約80nMから約0.01nMの範囲、約20nMから約0.01nMの範囲、約10nMから約0.1nMの範囲、または約0.1nMの化合物が含まれる。
【0104】
本発明のCB受容体モジュレーターとして用いるに適した式(I)または(Ia)で表される化合物には、CB2作動薬結合活性に関するCB2作動薬IC50が約50μMから約0.01nMの範囲、約25μMから約0.01nMの範囲、約15μMから約0.01nMの範囲、約10μMから約0.01nMの範囲、約1μMから約0.01nMの範囲、約800nMから約0.01nMの範囲、約200nMから約0.01nMの範囲、約100nMから約0.01nMの範囲、約80nMから約0.01nMの範囲、約20nMから約0.01nMの範囲、約10nMから約0.1nMの範囲、または約0.1nMの化合物が含まれる。
【0105】
本発明のCB受容体モジュレーターとして用いるに適した式(I)または(Ia)で表される化合物には、CB2拮抗薬結合活性に関するCB2拮抗薬IC50が約50μMから約0.01nMの範囲、約25μMから約0.01nMの範囲、約15μMから約0.01nMの範囲、約10μMから約0.01nMの範囲、約1μMから約0.01nMの範囲、約800nMから約0.01nMの範囲、約200nMから約0.01nMの範囲、約100nMから約0.01nMの範囲、約80nMから約0.01nMの範囲、約20nMから約0.01nMの範囲、約10nMから約0.1nMの範囲、または約0.1nMの化合物が含まれる。
【0106】
本発明のCB受容体モジュレーターとして用いるに適した式(I)または(Ia)で表される化合物には、CB2逆作動薬結合活性に関するCB2逆作動薬IC50が約50μMから約0.01nMの範囲、約25μMから約0.01nMの範囲、約15μMから約0.01nMの範囲、約10μMから約0.01nMの範囲、約1μMから約0.01nMの範囲、約800nMから約0.01nMの範囲、約200nMから約0.01nMの範囲、約100nMから約0.01nMの範囲、約80nMから約0.01nMの範囲、約20nMから約0.01nMの範囲、約10nMから約0.1nMの範囲、または約0.1nMの化合物が含まれる。
【0107】
用語“カンナビノイド受容体”は、本発明のカンナビノイドモジュレーター化合物が結合し得る種類のカンナビノイド受容体の公知または今までに知られていないサブタイプのいずれか1つ、特にCB1受容体およびCB2受容体から成る群から選択されるカンナビ
ノイド受容体を指す。用語“モジュレーター“は、更に、本発明の化合物をCB受容体作動薬、拮抗薬または逆作動薬として用いることを指す。
【0108】
本発明は、CB受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明の化合物またはこれの組成物を有効な量で投与する段階を含んで成り、ここで、カンナビノイド受容体はCB1またはCB2受容体であり、そして本化合物は前記受容体の作動薬、拮抗薬または逆作動薬である。
【0109】
本発明は、CB受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明の化合物またはこれの組成物を治療薬、例えば抗けいれん約または避妊薬などと一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成り、ここで、カンナビノイド受容体はCB1またはCB2受容体であり、そして本化合物は前記受容体の作動薬、拮抗薬または逆作動薬である。
【0110】
組み合わせ製品および/または治療薬で用いるに適した避妊薬を経口避妊薬に限定するものでなく、それにまた他の通常利用可能な避妊薬、例えば経皮、注射または移植などで投与されるそれらも包含させると理解されるべきである。
【0111】
更に明記する場合を除き、“組み合わせ製品および/または治療薬”は式(I)または(Ia)で表される化合物と1種以上の治療薬を含有して成る製薬学的組成物を意味する。式(I)または(Ia)で表される化合物と1種以上の治療薬の投薬量をそれらが組み合わせた時に有効な量を達成するように調整する。
【0112】
本明細書で用いる如き用語“被験体”は、治療、観察または実験の対象でありかつCB受容体媒介症候群、障害または病気を発症する危険性のある(または発症し易い)患者を指し、これは動物、好適には哺乳動物、最も好適にはヒトであり得る。
【0113】
用語“投与”は、本発明の方法に応じて解釈されるべきである。そのような方法には、本発明の組成物または薬剤を治療過程中のいろいろな時または組み合わせ形態の時には製品として同時に有効な量で治療的または予防的に投与することを包含する。
【0114】
予防的投与を実施する時期はCB受容体媒介症候群、障害または病気に特徴的な症状が現れる前であってもよく、その結果として、その症候群、障害または病気を治療するか、改善するか、予防するかまたは他の様式で進行を遅らせる。更に、本発明の方法は当業者が用いる治療的もしくは予防的な処置療法の全部を包含すると理解されるべきである。
【0115】
用語“有効な量”は、研究者、獣医、医者または他の臨床医が探求している活性化合物または薬剤が組織、系、動物またはヒトに生物学的または医薬的反応(治療すべき症候群、障害または病気の症状の軽減を包含)を引き出す量を指す。本発明の化合物の有効な量は約0.001mg/kg/日から約300mg/kg/日である。
【0116】
本発明が式(I)で表される化合物と抗けいれん薬または避妊薬の組み合わせを投与することを意図する場合の用語“有効な量”は、薬剤を一緒にした時の組み合わせ効果が所望の生物学的または医薬的反応を引き出す組み合わせた量を意味する。
【0117】
当業者が理解するであろうように、その組み合わせ製品を構成する成分の有効な量を個別に最適に組み合わせることができかつそれらを組み合わせることで当該組み合わせ製品の成分を単独で用いた時にもたらされるであろう病状軽減よりも高い病状軽減をもたらす
相乗的結果を達成することができる。
【0118】
例えば、式(I)で表される化合物とトピラメートを投与することを包含する組み合わせ製品および/または治療薬の有効な量は、式(I)で表される化合物およびトピラメートを一緒にまたは逐次的に用いた時に有効な組み合わせ効果をもたらすそれらの量であろう。その上、当業者は、組み合わせ製品および/または治療薬を有効な量で用いる場合の式(I)で表される化合物の量および/または抗けいれん薬(例えばトピラメート)の量はこの上に示した例の場合と同様に個別に有効な量であってもよいか或は有効な量でなくてもよいことも認識するであろう。
【0119】
本発明が組み合わせ製品および/または治療薬の投与に向けたものである場合、本化合物と抗けいれん薬または避妊薬を適切な任意手段で同時、逐次的または単一の製薬学的組成物として共投与してもよい。本化合物1種または2種以上と抗けいれん薬または避妊薬成分を個別に投与する場合、1日に投与する各化合物1種または2種以上の投薬回数は必ずしも同じでなくてもよく、例えば一方の化合物が示す作用期間の方が長い場合などでは同じでなくてもよく、従って、投与頻度を少なくする。
【0120】
式(I)で表される化合物1種または2種以上と抗けいれん薬1種または2種以上または避妊薬1種または2種以上を同じまたは異なる投薬経路で投与してもよい。式(I)で表される化合物1種または2種以上と抗けいれん薬1種または2種以上または避妊薬1種または2種以上を同じまたは異なる投与経路で投与してもよい。
【0121】
投与方法の適切な例は経口、静脈内(iv)、吸入内(im)および皮下(sc)である。また、化合物を神経系に直接投与することも可能であり、それには、これらに限定するものでないが、脳内、心室内、脳室内、髄腔内、嚢内、脊髄内および/または頭蓋内または脊髄内針および/またはカテーテル(ポンプ装置の使用有り無し)を用いた送達による脊髄周囲投与経路が含まれる。
【0122】
式(I)で表される化合物1種または2種以上と抗けいれん薬1種または2種以上または避妊薬1種または2種以上を同時または交互療法に従って治療過程中の同じまたは異なる時間にか、分割してか或は単一形態で同時に投与してもよい。
【0123】
当業者は最適な投与量を容易に決定することができ、これは使用する個々の化合物、投与様式、および製剤の濃度および病気状態の進行度合に伴って変わるであろう。加うるに、治療すべき個々の患者に関連した要因によって結果として投薬量を調節する必要もあり、そのような要因には、患者の性、年齢、体重、食事、投与時間および付随する病気が含まれる。
【0124】
用語“CB受容体媒介症候群、障害または病気”は、不快または有機体に期待される寿命の低下をもたらすようにCB受容体が媒介する生物学的反応に関連した症候群、障害または病気を指す。
【0125】
CB受容体媒介症候群、障害または病気は動物およびヒトの両方に起こり得、それらには食欲、代謝、糖尿病、肥満、緑内障関連眼圧、社会的、気分、発作、薬物乱用、学習、認識、記憶、器官収縮、筋けいれん、腸、呼吸器、自発運動、運動、免疫、炎症、細胞増殖、痛みまたは神経変性に関連した症候群、障害または病気が含まれる。
【0126】
食欲関連症候群、障害または病気には、肥満、体重過剰状態、拒食症、過食症、悪液質、食欲無調節などが含まれる。
【0127】
肥満関連症候群、障害または病気には、遺伝、食事、食物摂取量、代謝関性症候群、障害または病気、視床下部性障害または病気、加齢、活動低下、異常脂肪質量分布、異常脂肪画分分布などの結果として生じる肥満が含まれる。
【0128】
代謝関連症候群、障害または病気には、代謝症候群、脂質異常症、高血圧、糖尿病、インスリン感受性もしくは耐性、高インスリン血症、高コレステロール血症、高脂血症、高トリグリセリド血症、アテローム性動脈硬化症、肝腫大、脂肪症、異常アラニンアミノトランスフェラーゼレベル、炎症、アテローム性動脈硬化症などが含まれる。
【0129】
糖尿病関連症候群、障害または病気には、糖調節異常、インスリン耐性、耐糖能異常、高インスリン血症、脂質異常症、高血圧、肥満などが含まれる。
【0130】
2型糖尿病(インスリン非依存性糖尿病)は、糖調節異常およびインスリン耐性の結果として慢性の長期医学的合併症を青年および成年の両方にもたらすことで眼、腎臓、神経および血管に影響を与えかつ盲目、最終段階の腎疾患、心筋梗塞または手足切断をもたらす可能性のある代謝障害(即ち代謝関連症候群、障害または病気)である。糖調節異常には、インスリンを充分な量で産生することができないこと(異常インスリン分泌)およびインスリンを有効に用いることができないこと(標的器官および組織におけるインスリン作用に対する抵抗)が含まれる。2型糖尿病に苦しんでいる人は関連したインスリン欠乏を示す。即ち、そのような人では、血漿中インスリン濃度が絶対的意味で正常から高いが、存在する血漿中糖濃度で予測される濃度よりも低い。
【0131】
2型糖尿病は下記の臨床的兆候および症状で特徴づけられる:持続的に高い血漿中糖濃度または高血糖、多尿症、多渇症および/または多食症、慢性的微小血管合併症、例えば網膜症、腎症および神経障害など、および大血管合併症、例えば高脂血症および高血圧など。そのような微小および大血管合併症によって盲目、最終段階の腎疾患、手足切断および心筋梗塞がもたらされる可能性がある。
【0132】
インスリン抵抗症候群(IRS)(またX症候群、代謝症候群またはX代謝症候群とも呼ばれる)は、2型糖尿病および心疾患を発症する危険因子を示す障害であり、それには、耐糖能異常、高インスリン血症、インスリン耐性、脂質異常(例えば高トリグリセリド、低HDL−コレステロールなど)、高血圧および肥満が含まれる。
【0133】
社会的または気分関連症候群、障害または病気には、鬱病、不安、精神病、社会的感情障害または認識障害などが含まれる。
【0134】
薬物乱用関連症候群、障害または病気には、薬物乱用、薬物離脱、アルコール中毒、アルコール離脱、ニコチン離脱、コカイン中毒、コカイン離脱、ヘロイン中毒、ヘロイン離脱などが含まれる。
【0135】
学習、認識または記憶関連症候群、障害または病気には、記憶喪失または加齢、病気、薬剤の副作用(有害事象)の結果として起こる障害が含まれる。
【0136】
筋けいれん症候群、障害または病気には、多発性硬化症、脳性麻痺などが含まれる。
【0137】
自発運動および運動症候群、障害または病気には、脳卒中、パーキンソン病、多発性硬化症、てんかんなどが含まれる。
【0138】
腸関連症候群、障害または病気には、腸運動不全関連障害(痛み、下痢または便秘に付随するか或は付随しない)、過敏性腸症候群(および他の形態の腸運動不全など)、炎症
性腸疾患(例えば潰瘍性大腸炎、クローン病など)およびセリアック病が含まれる。
【0139】
本発明の一例には、痛みを伴うか或は伴わない炎症に関連した腸関連症候群、障害または病気、例えば炎症性腸疾患、手術、外傷または外傷の結果としてもたらされる後遺症、腹腔内炎症、基底肺炎(basal pneumonia)、心筋梗塞、代謝障害またはこれらの任意組み合わせのいずれかから生じる炎症に関連した腸運動障害などが含まれる。
【0140】
痛みを伴うか或は伴わない炎症に関連した本発明の腸関連症候群、障害または病気の例には、炎症性腸疾患、例えば潰瘍性大腸炎、クローン病またはセリアック病などが含まれる。手術によって生じる炎症に関連した腸運動障害には、腹部手術、移植手術、腸切除、整形手術、心臓血管手術または婦人科手術が含まれる。外傷には転倒、車の事故または人的暴力が含まれる。外傷の結果としてもたらされる後遺症には手足骨折、肋骨骨折、脊椎骨折、胸部傷害、虚血または後腹膜犠牲(retroperitoneal hecatomb)が含まれる。腹腔内炎症には腹腔内敗血症、急性虫垂炎、胆嚢炎、膵炎または尿管疝痛が含まれる。
【0141】
呼吸関連症候群、障害または病気には、慢性閉塞性肺疾患、気腫、喘息、気管支炎などが含まれる。
【0142】
免疫または炎症関連症候群、障害または病気には、アレルギー、関節リウマチ、皮膚炎、自己免疫病、免疫不全、慢性神経障害性痛などが含まれる。
【0143】
細胞増殖関連症候群、障害または病気には、哺乳動物細胞増殖異常調節、乳癌細胞増殖、前立腺癌細胞増殖などが含まれる。
【0144】
痛み関連症候群、障害または病気には、中枢および末梢路媒介痛、骨および関節の痛み、片頭痛関連痛、癌痛、生理痛、陣痛などが含まれる。
【0145】
神経変性関連症候群、障害または病気には、パーキンソン病、多発性硬化症、てんかん、虚血または外傷による頭または脳傷害に付随する二次的な生化学的傷害、脳炎症、眼傷害または脳卒中などが含まれる。
【0146】
本発明は、カンナビノイド受容体作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のカンナビノイド作動薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0147】
本発明は、カンナビノイド受容体作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のカンナビノイド作動薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0148】
本発明は、カンナビノイド受容体逆作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のカンナビノイド逆作動薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0149】
本発明は、カンナビノイド受容体逆作動薬によって調節される症候群、障害または病気
の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のカンナビノイド逆作動薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0150】
本発明は、カンナビノイド受容体逆作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のカンナビノイド逆作動薬化合物またはこれの組成物を1種以上の避妊薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0151】
本発明は、カンナビノイド受容体拮抗薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のカンナビノイド拮抗薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0152】
本発明は、カンナビノイド受容体拮抗薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のカンナビノイド拮抗薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0153】
本発明は、カンナビノイド受容体拮抗薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のカンナビノイド拮抗薬化合物またはこれの組成物を1種以上の避妊薬と一緒に組み合わせ製品および/または治療薬として治療的または予防的に有効な量で投与する段階を含んで成る。
【0154】
本発明は、CB1受容体作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1作動薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0155】
本発明は、CB1受容体作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1作動薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0156】
本発明は、CB1受容体逆作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1逆作動薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0157】
本発明は、CB1受容体逆作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1逆作動薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0158】
本発明は、CB1受容体逆作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1逆作動薬化合物またはこれの組成物を1種以上の避妊薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0159】
本発明は、CB1受容体逆作動薬によって調節される食欲関連肥満または代謝関連症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1逆作動薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0160】
本発明は、CB1受容体逆作動薬によって調節される食欲関連肥満または代謝関連症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1逆作動薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0161】
本発明は、CB1受容体逆作動薬によって調節される食欲関連肥満または代謝関連症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1逆作動薬化合物またはこれの組成物を1種以上の避妊薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0162】
食欲関連症候群、障害または病気には、肥満、体重過剰状態、拒食症、過食症、悪液質、食欲無調節などが含まれる。
【0163】
肥満関連症候群、障害または病気には、遺伝、食事、食物摂取量、代謝関性症候群、障害または病気、視床下部性障害または病気、加齢、活動低下、異常脂肪質量分布、異常脂肪画分分布などの結果として生じる肥満が含まれる。
【0164】
代謝関連症候群、障害または病気には、代謝症候群、脂質異常症、高血圧、糖尿病、インスリン感受性もしくは抵抗性、高インスリン血症、高コレステロール血症、高脂血症、高トリグリセリド血症、アテローム性動脈硬化症、肝腫大、脂肪症、異常アラニンアミノトランスフェラーゼレベル、炎症、アテローム性動脈硬化症などが含まれる。
【0165】
本発明は、CB1受容体拮抗薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1拮抗薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0166】
本発明は、CB1受容体拮抗薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1拮抗薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0167】
本発明は、CB1受容体拮抗薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1拮抗薬化合物またはこれの組成物を1種以上の避妊薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段
階を含んで成る。
【0168】
本発明は、CB2受容体作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB2作動薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0169】
本発明は、CB2受容体作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB2作動薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0170】
本発明は、CB2受容体逆作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB2逆作動薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0171】
本発明は、CB2受容体逆作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB2逆作動薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0172】
本発明は、CB2受容体拮抗薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB2拮抗薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0173】
本発明は、CB2受容体拮抗薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB2拮抗薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0174】
本発明は、代謝関連症候群、障害または病気、食欲関連症候群、障害または病気、糖尿病関連症候群、障害または病気、肥満関連症候群、障害または病気または学習、認識または記憶関連症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明の化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0175】
本発明は、代謝関連症候群、障害または病気、食欲関連症候群、障害または病気、糖尿病関連症候群、障害または病気、肥満関連症候群、障害または病気または学習、認識または記憶関連症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明の化合物またはこれの組成物を抗けいれん薬との組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0176】
本発明は、本発明の化合物と任意の製薬学的に許容される担体の混合物を含有して成る製薬学的組成物もしくは製剤を包含する。
【0177】
本発明は、本発明の2種以上の化合物と任意の製薬学的に許容される担体の混合物を含有して成る製薬学的組成物もしくは製剤を包含する。
【0178】
本発明は、また、式(I)で表される化合物と抗けいれん薬と任意の製薬学的に許容される担体の混合物を含有して成る製薬学的組成物もしくは製剤も包含する。
【0179】
そのような製薬学的組成物は、特に、代謝関連症候群、障害または病気、食欲関連症候群、障害または病気、糖尿病関連症候群、障害または病気、肥満関連症候群、障害または病気または学習、認識または記憶関連症候群、障害または病気に苦しんでいる被験体を治療する目的で用いるに有用である。
【0180】
式(I)または(Ia)で表される化合物と組み合わせて本発明の方法および組成物で用いるに有用な抗けいれん薬には、これらに限定するものでないが、トピラメート、トピラメート類似物、カルバマゼピン、バルプロ酸、ラモトリジン、ガバペンチン、フェニトインなどおよびこれらの混合物または製薬学的に許容される塩が含まれる。
【0181】
トピラメート、即ち2,3:4,5−ビス−O−(1−メチルエチリデン)−s−D−フラクトピラノーススルファメートは、単純および複雑部分てんかんにかかっている患者における発作および原発性または続発性全身発作にかかっている患者における発作を治療する目的で米国、ヨーロッパおよび世界中の他の大部分の市場で現在市販されている。トピラメートは経口投与用の活性薬剤含有量が25mg、100mgまたは200mgの円形錠剤として現在入手可能でありかつ経口投与用の15mgおよび25mgのスプリンクルカプセル(sprinkle capsules)としてホールカプセル(whole
capsules)または開放型(opened)としておよびスプリンクルドオンツーソフトフード(sprinkled onto soft food)の状態で現在入手可能である。米国特許第4,513,006号(引用することによって本明細書に組み入れられる)に、トピラメートおよびトピラメート類似物、それらの製造およびそれらをてんかんの治療で用いることが開示されている。加うるに、トピラメートの製造をまた米国特許第5,242,942号および5,384,327号(これらは引用することによって本明細書に組み入れら)に開示されている方法を用いて実施することも可能である。本明細書で用いる如き用語“トピラメート類似物”は、式(I)で表されるスルファメート化合物を指し、これらは米国特許第4,513,006号に開示されている(例えば米国特許第4,513,006号のコラム1の36−65行を参照)。
【0182】
本発明の方法でトピラメート(またはトピラメート類似物)を式(I)または(Ia)で表される化合物と組み合わせて用いる場合、それを1日当たり約10から約1000mgの範囲、好適には1日当たり約10から約650mgの範囲、より好適には約15から約325mgの範囲の量で日に1または2回投与してもよい。
【0183】
カルバマゼピン、即ち5H−ジベンゾ[b,f]アゼピン−5−カルボキサミドは抗けいれん薬および三叉神経痛用の特定の鎮痛薬であり、これは経口投与用の100mgのチュアブル錠、200mgの錠剤、100、200および400mgのXR(徐放)錠剤および100mg/5mL(茶サジ一杯)の懸濁液として入手可能であり、米国特許第2,948,718号(これは引用することによって全体が本明細書に組み入れられる)にカルバマゼピンおよびこれの使用方法が開示されている。
【0184】
本発明の方法で式(I)または(Ia)で表される化合物と組み合わせてカルバマゼピンを用いる場合、これを約200から約1200mg/日の範囲、好適には約400mg/日の量で投与してもよい。
【0185】
バルプロ酸、即ち2−プロピルペンタン酸またはジプロピル酢酸は抗てんかん薬であり、これはバルプロ酸含有量が250mgの軟質弾性カプセルおよびバルプロ酸がナトリウム塩として5mL当たり250mgに相当する量で入っているシロップとして商業的に入手可能である。バルプロ酸およびいろいろな製薬学的に許容される塩が米国特許第4,699,927号(これは引用することによって全体が本明細書に組み入れられる)に開示されている。
【0186】
本発明の方法で式(I)または(Ia)で表される化合物と組み合わせてバルプロ酸を用いる場合、これを約250から約2500mg/日の範囲、好適には約1000mg/日の量で投与してもよい。
【0187】
ラモトリジン、即ち3,5−ジアミノ−6−(2,3−ジクロロフェニル)−1,2,4−トリアジンは抗てんかん薬であり、これは経口投与用のラモトリジン含有量が25mg、100mg、150mgおよび200mgの錠剤およびラモトリジン含有量が2mg、5mgまたは25mgの分散性チュアブル錠として商業的に入手可能である。ラモトリジンおよびこれの使用が米国特許第4,486,354号(これは引用することによって全体が本明細書に組み入れられる)に開示されている。
【0188】
本発明の方法で式(I)または(Ia)で表される化合物と組み合わせてラモトリジンを用いる場合、これを1から2回の投与で約50から約600mg/日の範囲、好適には約200から約400mg/日、最も好適には約200mg/日の量で投与してもよい。
【0189】
ガバペンチン、即ち1−(アミノメチル)シクロヘキサン酢酸は、てんかんおよび成人におけるヘルペス後神経痛の補助療法の目的でガバペンチン含有量が100mg、300mgおよび400mgのカプセル、ガバペンチン含有量が600mgおよび800mgの膜被覆錠剤およびガバペンチン含有量が250mg/5mLの経口用溶液として商業的に入手可能である。ガバペンチンおよびこれの使用方法が米国特許第4,024,175号および4,087,544号(これらは引用することによって全体が本明細書に組み入れられる)に開示されている。
【0190】
本発明の方法で式(I)または(Ia)で表される化合物と組み合わせてガバペンチンを用いる場合、これを2から3回に分割した投薬で約300から約3600mg/日の範囲、好適には約300から約1800mg/日、最も好適には約900mg/日の量で投与してもよい。
【0191】
フェニトインナトリウム、即ち5,5−ジフェニルヒダントインのナトリウム塩は抗けいれん薬であり、これは経口投与の目的でフェニトインナトリウム含有量が100mg、200mgまたは300mgのカプセルとして商業的に入手可能である。
【0192】
本発明の方法で式(I)または(Ia)で表される化合物と組み合わせてフェニトインナトリウムを用いる場合、これを約100から約500mg/日の範囲、好適には約300から約400mg/日、最も好適には約300mg/日の量で投与してもよい。
【0193】
本発明は、また、式(I)または(Ia)で表される化合物と1種以上の避妊薬と任意の製薬学的に許容される担体の混合物を含有して成る製薬学的組成物または製剤も包含する。
【0194】
組み合わせ製品および/または治療薬として用いるに適した避妊薬には、例えばORTHO CYCLEN(商標)、ORTHO TRI−CYCLEN(商標)、ORTHO
TRI−CYCLEN LO(商標)およびORTHO EVRA(商標)が含まれ、これらは全部Ortho−McNeil Pharmaceutical,Inc.、Raritan、NJから入手可能である。また、本発明で用いるに適した避妊薬には葉酸成分を含有する避妊薬も含まれることも理解すべきである。
【0195】
喫煙および/または肥満は、経口避妊薬を服用している女性における危険因子であると識別されている。CB1受容体拮抗薬および逆作動薬は、喫煙衝動を低下させかつ摂食障害を有する患者の減量に役立つ有用な治療薬であることを見いだした。
【0196】
従って、本発明は、更に、避妊薬を服用している女性の喫煙および/または肥満に関連した危険因子を低下させる方法も包含し、ここでは、避妊薬を式(I)または(Ia)で表される少なくとも1種のCB1受容体拮抗薬および/またはCB1受容体逆作動薬化合物と一緒に共投与する。
【0197】
そのような化合物またはこれの製薬学的組成物または製剤を用いて、避妊薬を服用している患者の喫煙要望を低下させそして/または減量に役立たせる。
【0198】
製薬学的組成物
用語“組成物”は、指定材料を指定量で含有して成る製品ばかりでなく指定材料を指定量で組み合わせる結果として直接または間接的にもたらされる如何なる生成物も指す。本発明は、更に、本発明の1種以上の化合物と製薬学的担体を混合することも包含し、かつそのような方法の結果としてもたらされた組成物も包含する。意図する方法は伝統的および最新両方の製薬学的技術を包含する。
【0199】
別法としてか或は式(I)または(Ia)で表される化合物に加えて、本発明の製薬学的組成物に、式(I)または(Ia)で表される化合物の製薬学的に許容される塩または前記化合物または塩のプロドラッグまたは製薬学的に有効な代謝産物を製薬学的に許容される担体との混合物として含有させる。
【0200】
用語“製剤”は、カンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防で用いるに適した製品を指す。
【0201】
“製薬学的に許容される担体”は、本発明の組成物の調製で用いるに充分な純度および品質を有しかつ動物またはヒトに適切に投与された時に副作用もアレルギー反応も他の有害な反応ももたらすことのない分子的実体および組成物を意味する。
【0202】
臨床および獣医両方の使用を本発明の範囲内に等しく包含させることから、製薬学的に許容される製剤には臨床または獣医用途のいずれの組成物も薬製剤も含まれるであろう。
【0203】
本発明は、本化合物のいずれかと製薬学的に許容される担体を混合することを含んで成る組成物または製剤製造方法を包含し、かつそのような方法の結果としてもたらされた組成物または製剤も包含する。意図する方法は通常および通常ではない製薬学的技術の両方を包含する。他の例には、少なくとも2種類の本化合物を製薬学的に許容される担体と一緒に含有する混合物を含んで成る組成物または製剤が含まれる。
【0204】
そのような組成物または製剤は、投与方法に応じて幅広く多様な投薬単位形態物として投与可能であり、そのような方法には、これらに限定するものでないが、製薬学的投与分野の通常の技術者に良く知られている適切な投薬形態物を用いた経口、舌下、鼻(吸入または吹送)、経皮、直腸、膣、局所(閉鎖の有り無し)、静脈内(ボーラスまたは輸液)または注射(腹腔内、皮下、筋肉内、腫瘍内または非経口)が含まれる。従って、用語“
投薬単位“または“投薬形態物“をこれらに限定するものでないが錠剤、ピル、カプセル、溶液、シロップ、エリキシル、乳液、懸濁液、座薬、粉末、顆粒または無菌の溶液、乳液または懸濁液(アンプルを用いるか或は自己注入装置の如き装置を用いた注射、またはエーロゾル、スプレーまたは滴としての使用)を指す目的で互換的に用いる。その上、本組成物を週に1回または月に1回[例えば、筋肉内注射用持続製剤をもたらすに適した活性化合物の不溶塩(例えばデカン酸塩)などとして]投与するに適した形態で提供することも可能である。
【0205】
投薬形態物の調製では、主要な有効成分(例えば本発明の化合物またはこれの製薬学的に許容される塩、ラセミ体、鏡像異性体またはジアステレオマーなど)を場合により1種以上の製薬学的担体(例えば澱粉、糖、希釈剤、顆粒剤、滑剤、流動促進剤、結合剤、崩壊剤など)、1種以上の不活性な製薬学的賦形剤(例えば水、グリコール、油、アルコール、風味剤、防腐剤、着色剤、シロップなど)、1種以上の通常の製錠用材料(例えばコーンスターチ、ラクトース、スクロース、ソルビトール、タルク、ステアリン酸、ステアリン酸マグネシウム、燐酸ジカルシウム、いろいろなゴムのいずれかなど)および希釈剤(例えば水など)と一緒に混合することで均一な組成物(有効成分が混合物全体に渡ってむらなく分散または懸濁している)を生じさせてもよく、これは容易に本発明の化合物を等しい量で含有する投薬単位に細分可能である。
【0206】
結合剤には、これらに限定するものでないが、澱粉、ゼラチン、天然糖(例えばグルコース、ベータ−ラクトースなど)、コーン甘味料および天然および合成ゴム(例えばアカシア、トラガカント、オレイン酸ナトリウム、ステアリン酸ナトリウム、ステアリン酸マグネシウム、安息香酸ナトリウム、酢酸ナトリウム、塩化ナトリウムなど)が含まれる。崩壊剤には、これらに限定するものでないが、澱粉、メチルセルロース、寒天、ベントナイト、キサンタンゴムなどが含まれる。
【0207】
投与が容易なことから錠剤およびカプセルが有利な経口投薬単位形態物に相当し、この場合には、固体状の製薬学的担体を用いる。必要ならば、錠剤に糖または膜被覆または腸溶性膜被覆を標準的技術で受けさせることも可能である。また、錠剤に被覆を受けさせるか或は他の様式の複合化を受けさせることで治療効果を長引かせることも可能である。例えば、投薬形態物に内側投薬成分と外側投薬成分を含有させて外側成分を内側成分を覆う膜の形態にする。更に、前記2成分を胃の中で起こる崩壊に抵抗し(例えば腸溶性層)かつ内側成分が無傷のまま十二指腸の中に入り込むことを可能にする層または放出を遅らせるか或は持続させる層で分離することも可能である。いろいろな腸溶性および非腸溶性層または被覆材料(例えば高分子酸、シェラック、アセチルアルコール、酢酸セルロースなど)またはこれらの組み合わせを用いてもよい。
【0208】
本発明の化合物を経口投与の目的で混合することが可能な液状形態物には、これらに限定するものでないが、水溶液、適切な風味のシロップ、水性もしくは油性懸濁液(適切な合成もしくは天然ゴムである分散もしくは懸濁剤、例えばトラガカント、アカシア、アルギン酸塩、デキストラン、ナトリウムカルボキシメチルセルロース、メチルセルロース、ポリビニルピロリドン、ゼラチンなどを用いた)、風味を付けた乳液(例えば適切な食用油、例えば綿実油、胡麻油、ヤシ油、落花生油などを用いた)、エリキシルおよびいろいろな製薬学的に許容される媒体を用いた同様な他の液状形態物が含まれる。
【0209】
また、当該技術分野で公知のように、別法として、本化合物を注射で非経口投与することも可能である。非経口投与の場合、無菌の溶液または注射可能懸濁液が非経口媒体であり得、この場合には適切な液状担体、懸濁剤などを用いる。無菌の溶液が好適な非経口媒体である。静脈内投与が望まれる場合には、一般に適切な防腐剤を入れておいた等張性製剤を用いる。有効成分を適切な不活性液状担体に溶解または混合することで非経口製剤を
構成させてもよい。許容される液状担体は水性溶媒などおよび溶解性または防腐性を補助する他の任意の材料を含有して成る。そのような水性溶媒には、無菌水、リンゲル液または等張性食塩水溶液が含まれる。別法として、無菌の非揮発性油を溶媒作用剤として用いることも可能である。他の任意の材料には、植物油(例えば落花生油、綿実油、胡麻油など)、有機溶媒(例えばソルケタール、グリセロール、ホルミルなど)、防腐剤、等張剤、可溶化剤、安定剤、鎮痛剤などが含まれる。最終的投薬単位の有効成分含有量が0.005から10重量%になるように有効成分を液状担体に溶解または懸濁させることで非経口製剤の調製を実施する。
【0210】
本発明の化合物を適切な鼻内媒体を用いて鼻内投与することも可能である。本発明の化合物を適切な局所経皮媒体または経皮パッチを用いて局所的に投与することも可能である。経皮送達系による投与では断続的投与療法ではなく連続的投与が要求される。
【0211】
また、本発明の化合物を急速溶解もしくは徐放組成物によって投与することも可能であり、この場合、その組成物に急速に溶解するか或は徐放性の生分解性担体(例えば重合体担体など)および本発明の化合物を含有させる。急速に溶解するか或は徐放性の担体は当該技術分野で良く知られていて、活性化合物1種または2種以上を中に捕捉しそして適切な環境(例えば水溶液、酸性、塩基性など)下で急速またはゆっくりと分解/溶解する複合体を生じさせる目的で用いられる。そのような粒子は体液中で分解/溶解することでそれに入っている活性化合物1種または2種以上を放出することから有用である。そのような組成物で用いる本発明の化合物、担体または任意の賦形剤の粒径を通常の当業者に公知の技術を用いて最適に調整してもよい。
【0212】
本発明は、本化合物またはこれのプロドラッグが症状の軽減を必要としている被験体に必要な予防的または治療的に有効な量で存在する組成物を包含する。本化合物またはこれのプロドラッグの予防的または治療的に有効な量は約0.01ngから約1gの範囲であり得、それを当該被験体に適するように選択した投与方法および療法に適したいずれかの形態に構築してもよい。
【0213】
そのような予防的または治療的に有効な量は、治療すべき被験体および病気に応じて、約70kgの平均的体重の人の場合、1日当たり約0.01ng/kgから約300mg/kg、約0.1ng/kgから約200mg/kg、約0.5ng/kgから約100mg/kgまたは約0.1ng/kgから約50mg/kgの範囲であり得る。
【0214】
当業者は予防的または治療的に有効な最適な量および投与方法および療法を容易に決定することができ、これは治療すべき個々の患者に関連した要因(年齢、体重、食事および投与時間)、治療すべき状態のひどさ、用いる化合物および投薬単位、投与様式および製剤の濃度に応じて変わるであろう。
【0215】
1日当たり約1回から1日当たり約5回の計画で治療的または予防的に有効な量が達成されるように投薬単位1個または2個以上を投与してもよい。経口投与に好適な投薬単位は有効成分含有量が0.01、0.05、0.1、0.5、1.0、2.5、5.0、10.0、15.0、25.0、50.0、100、150、200、250または500mgの錠剤である。
【0216】
本明細書に記述する代表的化合物には下記から選択した化合物が含まれる:
【0217】
【表2】

【0218】
【表3】

【0219】
本明細書に記述する代表的化合物には更に下記から選択した化合物も含まれる:
【0220】
【表4】

【0221】
【表5】

【0222】
合成方法
本発明の代表的化合物の合成は以下に記述する一般的合成スキームに従って実施可能であり、それらを以下に示す特定の合成実施例の中により詳細に例示する。そのような一般的スキームおよび具体的実施例は例として示すものであり、本発明をその示す化学的反応および条件で限定するとして解釈されるべきでない。本スキームおよび実施例で用いるいろいろな出発材料の製造方法は当業者の技術の充分に範囲内である。本実施例の反応のいずれで得る収率も最適にする試みは全く行わなかった。当業者は、反応時間、温度、溶媒および/または反応体を常規通り変えることでそのような収率を高くする方法を知っているであろう。
【0223】
本発明の記述で用いる用語は一般的に用いられている用語であり、当業者に公知である。以下の省略形および式を本明細書で用いる場合、これらにその示す意味を持たせる:
【0224】
【表6】

【0225】
【化9】

【0226】
シクロオクタノン化合物A1の溶液(溶媒、例えばTHFなど中)と化合物A2(溶媒、例えば無水THFなどに入っており、ここで、Q−Xyは適切な反応基を表し、そしてQ−Xyの特定部分が反応生成物としてX4R4の中に取り込まれる)を塩基性条件下で反応させることで化合物A3を生じさせる。
【0227】
【化10】

【0228】
化合物A3の溶液(溶媒、例えばEt2O、THFなどまたはこれらの混合物中)を反応体溶液(例えば溶媒、例えばEt2OまたはTHFなどまたはこれらの混合物中のLHMDSなど)に不活性雰囲気下−78℃で滴下した後、約−78℃で約40分間撹拌する。化合物A4の溶液(溶媒、例えばEt2Oなど中)を滴下し、その混合物を約−78℃
で約1時間撹拌した後、室温に約2時間かけて温めることで化合物A5を粗生成物として得て、それをさらなる精製なしに次の段階で用いる。
【0229】
【化11】

【0230】
反応体(例えばK2CO3など)および置換ヒドラジンの一塩酸または二塩酸化合物A6を化合物A5の溶液(溶媒、例えばMeOH、EtOH、CH2Cl2などの中の1種以上に入っている)に不活性雰囲気下約0℃の温度で加える。その混合物を一晩撹拌しながら室温に温めることで処理後に化合物A7を得る。
【0231】
化合物A6のXaRa置換基部分は、異性体を分離した後に置換アミン基がN1位置にX1R1として存在するか或はN2位置にX2R2として存在し得る可能性を示している。化合物A7は異性体の混合物に相当し、それにはX1R1とX2R2異性体の混合物が存在する。
【0232】
ヒドラジンの塩酸塩または二塩酸塩化合物A6を当業者に公知の方法で遊離塩基に変化させることができる。本発明の実施例では、そのような遊離塩基をK2CO3との反応でインシトゥ(本スキームに例示の目的で示すように)または個別に生じさせる(次に反応混合物に添加する)。
【0233】
このスキームに例示するように、また、化合物A6にいろいろなXaRa置換基(本明細書の上で定義した如き)によるさらなる置換を受けさせることも可能である。多くの場合、そのような置換ヒドラジン化合物A6は商業的に入手可能である。商業的に入手可能でない場合、特別に置換されている化合物A6の調製を当業者に公知の方法を用いて実施してもよい。
【0234】
より具体的には、ハロゲン置換XaRa置換基部分と水加ヒドラジン溶液を還流下で反応させた後、さらなる精製無しに化合物A6の代わりに用いる。
【0235】
【化12】

【0236】
化合物A7の異性体混合物の分離をフラッシュクロマトグラフィー(適切な溶媒混合物、例えばヘキサンなど中約20%から約30%のEtOAcなどを用いて溶離させる)で実施することで精製された主異性体である化合物A8と主要でない異性体である化合物A9を得る。
【0237】
その主要な異性体である化合物A8はN1位がX1R1で置換されている(X2R2は必ずしも存在するとは限らない)。主要でない異性体である化合物A9はN2位がX2R2で置換されている(X1R1は存在しない)。
【0238】
【化13】

【0239】
その分離した主異性体化合物A8を反応体溶液(例えば溶媒、例えば水、MeOH、THFなどまたはこれらの混合物に入っているNaOHまたはLiOHの混合物)で処理した後、一晩撹拌することで、処理後に化合物A10を得る。
【0240】
【化14】

【0241】
反応体溶液(例えば溶媒、例えばCH2Cl2などに入っているSOCl2など)を化合物A10に不活性な窒素雰囲気下周囲温度で加える。その反応混合物を還流温度で約15分間撹拌することで、処理後に化合物A11を得る。
【0242】
【化15】

【0243】
化合物A11の溶液(場合によりTEAなどと混合しておいてもよい)を置換アミン化合物A12の溶液(溶媒、例えばCH2Cl2など中)に不活性な窒素雰囲気下周囲温度で加える。その混合物を室温である時間撹拌することで、処理後に化合物A13を得る。
【0244】
本スキームの目的で、化合物A12のXb部分は場合により置換されていてもよいアミノ部分であり、それによって、化合物A13のX3R3置換基部分が化合物A11のC3置換基のC(O)部分および化合物A12のXbRbに由来するXb部分を取り込む。
【0245】
一般に、化合物A12は商業的に入手可能な置換アミンである。商業的に入手可能でない場合、特別に置換されている化合物A12の調製は、適切に調製した化合物A11との反応に従い、当業者に公知の方法を用いて実施可能である。
【0246】
例えば、当業者に公知の官能基変換を用いて、XbRbがアルキルスルホニルアミノ部分またはアルキルカルバモイル部分(これらは各々更にアミノ部分が置換されていてもよい)である特別に置換されている化合物A12との反応で化合物A10を調製してもよい。
【0247】
本明細書の以下に示す合成実施例に本発明の範囲内に包含させる個々の化合物の調製をより完全に記述する。
【0248】
実施例1
1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1,3,3−トリメチル−ビシクロ[2.2.1]ヘプト−2−イル)−アミド(化合物1)
【0249】
【化16】

【0250】
段階1. LHMDS(0.33L、0.20モル)を無水Et2O(200mL)に入れることで生じさせた−78℃の溶液にN2雰囲気下でシクロオクタノン化合物1a(25.0g、0.20モル)をEt2O(100mL)に入れることで生じさせた溶液を滴下した。その混合物を−78℃に維持しながら60分間撹拌した。化合物1b(29.2g、0.20モル)を無水Et2O(100mL)に入れて滴下し、その混合物を−78℃で1時間撹拌した後、3時間かけて室温に温めて1時間撹拌した。その反応混合物の反応を水(100mL)で消滅させ、EtOAc(300mL)で希釈した後、有機層を分離して食塩水で洗浄し、無水硫酸ナトリウムで乾燥させた後、濾過しそして真空下で濃縮した。その結果として得た粗生成物をフラッシュクロマトグラフィー(ヘキサン中20%のEtOAcで溶離)で精製することで化合物1c(36g、80%)を得た。
【0251】
【化17】

【0252】
段階2. 化合物1c(3.7g、16.7ミリモル)をEtOH(50mL)に入れることで生じさせた周囲温度の溶液にN2雰囲気下でシクロヘキシル−ヒドラジンの塩酸塩化合物1d(2.5g、16.7ミリモル)およびK2CO3(2.31g、16.7ミリモル)を加えた。その反応混合物を一晩撹拌した後、水(25mL)で反応を消滅させそしてEtOAc(500mL)を用いた抽出を実施した。その有機層を分離し、食塩水で洗浄し、無水硫酸ナトリウムで乾燥させた後、濾過しそして真空下で濃縮することで化
合物1e(5g)を得て、これをさらなる精製なしに次の段階で用いた。
【0253】
【化18】

【0254】
段階3. 化合物1e(5g、16.4ミリモル)をTHF(25mL)に入れて、これに1NのNaOH(50mL)を加えた。その混合物を30時間撹拌し、1NのHClで酸性にしてpHを2にした後、EtOAc(100mL)を用いた抽出を実施した。その有機層を食塩水で洗浄し、硫酸ナトリウムで乾燥させた後、濾過しそして真空下で濃縮することで化合物1fを白色の固体として得た。化合物1fをCH2Cl2(50mL)に入れることで生じさせた周囲温度の溶液にN2雰囲気下で塩化チオニル(5.87g、49.3ミリモル)を加えた。その反応物を3時間撹拌した後、真空下で濃縮することで化合物1g(4.5g、91%)を明褐色の固体として得た。
【0255】
【化19】

【0256】
段階4. 1,3,3−トリメチル−ビシクロ[2.2.1]ヘプト−2−イルアミン化合物1h(0.87g、0.46ミリモル)とEt3N(0.10g、0.98ミリモル)をCH2Cl2(10mL)に入れることで生じさせた周囲温度の溶液にN2雰囲気下で化合物1g(0.130g、0.46ミリモル)をDCM(5mL)に入れることで生じさせた溶液を滴下した。その反応混合物を室温で3時間撹拌した後、水(10mL)およびCH2Cl2(50mL)で希釈した。その有機層を分離し、無水硫酸ナトリウムで乾燥させた後、濾過しそして真空下で濃縮した。その結果として得た粗油をフラッシュクロマトグラフィーにかけてヘキサン中20%のEtOAcを用いて精製することで化合物1(0.115g、63%)を白色の固体として得た。 MS m/z 412(M+)。
【0257】
実施例1の手順に従い、適切な出発材料、反応体および溶媒を代わりに用いることで下記の化合物を調製した:
【0258】
【表7】

【0259】
実施例2
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−1−フェニル−エチル]−アミド(化合物15)
【0260】
【化20】

【0261】
段階1. KOH(0.25g、4.46ミリモル)を水(4.4mL)に入れることで生じさせた溶液を4−フルオロ−ベンズアルデヒド化合物2a(1.07mL、10ミリモル)に加えた後、その混合物を65°Cに加熱した。シクロオクタノン化合物1a(1.26g、10ミリモル)を15分かけて滴下した。その混合物を5時間還流させた後、室温で一晩撹拌した。その反応混合物を1NのHCl(26mL)で酸性にした後、EtOAc(100mL)で抽出した。その有機層を食塩水で洗浄し、Na2SO4で乾燥させた後、濾過しそして濃縮した。その結果として得た黄色の残留物をシリカゲルカラムにかけて3%のEtOAc/ヘキサンを用いて精製することで(2E)−2−(4−フルオロ−ベンジリデン)−シクロオクタノン化合物2b(1.04g、44.8%)を得た。
【0262】
【化21】

【0263】
段階2. 化合物2b(1.04g、4.48ミリモル)をTHF(5mL)に入れることで生じさせた溶液をLHMDSの溶液(5.4mL、THF中1Mの溶液)に−78℃で滴下した。その結果として得た混合物を−78℃で1時間撹拌した後、しゅう酸ジエチルエステル化合物1b(0.61ml、4.48ミリモル)を滴下した。その混合物を−78°Cで1時間撹拌した後、室温になるまで徐々に温めて室温で一晩撹拌した。その反応混合物を1NのHClで酸性にした後、EtOAc(150mL)を用いた抽出を実施した。その有機層を1NのHCl(1×)そして水(2×)で洗浄し、Na2SO4で乾燥させた後、濾過しそして濃縮することで(3E)−[3−(4−フルオロ−ベンジリデン)−2−オキソ−シクロオクチル]−オキソ−酢酸エチルエステル化合物2cを黄色の油として得て、これをさらなる精製なしに次の段階で用いた。
【0264】
【化22】

【0265】
段階3. 化合物2c(4.48ミリモル)をエタノール(30mL)に入れることで生じさせた溶液にK2CO3(0.62g、4.48ミリモル)および(2,4−ジクロロ−フェニル)−ヒドラジン塩酸塩化合物2d(0.96g、4.50ミリモル)を加えた後、その混合物を室温で一晩撹拌した。その反応混合物を濾過した後、エタノール(20mL)で洗浄した。その濾液に濃縮を受けさせた後、それをシリカゲルカラムにかけて15%のEtOAc/ヘキサンを用いて精製することで(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸エチルエステル化合物2e(0.37g、最後の2段階で17.5%)を得た。
【0266】
【化23】

【0267】
段階4. 化合物2e(0.17g、0.36ミリモル)をTHF(6mL)とエタノール(1mL)の混合物に入れることで生じさせた溶液にLiOH(43mg、1.8ミリモル)を水(2mL)に入れることで生じさせた溶液を加えた。その混合物を室温で一晩撹拌した後、濃縮しそして1NのHCl(10mL)で酸性にした。その水溶液にEtOAc(100mL)を用いた抽出を受けさせた。その有機層を食塩水で洗浄し、Na2SO4で乾燥させた後、濾過しそして濃縮することで(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸化合物2f(0.15g、93.6%)を黄色の固体として得た。
【0268】
【化24】

【0269】
段階5. 化合物2f(0.15g、0.34ミリモル)をDCM(2mL)に入れることで生じさせた溶液にSOCl2(0.3mL、4.1ミリモル)を加えた。その混合物を3時間還流させた後、高真空下で濃縮することで(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボニルクロライド化合物2g(0.15g、95.3%)を黄色の固体として得た。
【0270】
【化25】

【0271】
段階6. 化合物2g(30mg、0.065ミリモル)をDCM(2ml)に入れることで生じさせた溶液に(1S)−1−フェニル−エチルアミン(0.013g、0.11ミリモル)とTEA(0.03ml、0.22ミリモル)の溶液を加えた。その反応混合物を室温で1時間撹拌し、DCMで希釈した後、1NのHClで洗浄した。その有機層を水で洗浄し、Na2SO4で乾燥させた後、濾過しそして濃縮した。その結果として得た黄色の残留物を調製用シリカゲルプレートにかけて20% EtOAc/ヘキサンを用いて精製することで化合物15(30mg、84.2%)を淡黄色の粉末として得た。 MS m/z 548(M+)。
【0272】
実施例2の手順に従い、適切な出発材料、反応体および溶媒を代わりに用いることで、下記の化合物を調製した:
【0273】
【表8】

【0274】
【表9】

【0275】
実施例3
(2E)−[9−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−イル]−エテンスルホン酸[(1S)−1−フェニル−エチル]−アミド(化合物21)
【0276】
【化26】

【0277】
段階1. LiHMDS(23.8mL、23.8ミリモル)を無水THF(50mL)に入れることで生じさせた−78℃の溶液にN2雰囲気下でシクロオクタノン化合物1a(2.5g、19.8ミリモル)をTHF(5mL)に入れて滴下した。その混合物を−78°Cで60分間撹拌した後、1−ブロモメチル−3−クロロ−ベンゼン化合物3a(4.1g、19.9ミリモル)を無水THF(10mL)に入れて滴下した。その混合物を5時間撹拌しながら室温になるまで温めた。水(5mL)で反応を消滅させ、その有機層をEtOAc(100mL)で希釈した後、水そして食塩水で洗浄した。その有機層を分離し、無水硫酸ナトリウムで乾燥させた後、濾過し、そして真空下で濃縮することで粗油を得て、それをフラッシュクロマトグラフィーにかけてヘキサン中3%のEtOAcを用いて精製することで2−(3−クロロ−ベンジル)−シクロオクタノン化合物3b(4.12g、82.6%)を得た。
【0278】
【化27】

【0279】
段階2. LiHMDS(39.5mL、39.5ミリモル)を無水THF(25mL)に入れることで生じさせた1Mの溶液にN2雰囲気下−78℃で化合物3b(4.12g
、16.5ミリモル)をTHF(5mL)に入れることで生じさせた溶液を滴下した。その混合物を−78°Cで60分間撹拌した後、ジメトキシ−酢酸メチルエステル化合物3c(2.2g、16.4ミリモル)を無水THF(5mL)に入れることで生じさせた溶液を滴下した。その混合物を15時間撹拌しながら室温になるまで温めた。水(5mL)で反応を消滅させた後、EtOAc(100mL)を用いた希釈を実施した。その有機層を分離し、水そして食塩水で洗浄し、無水硫酸ナトリウムで乾燥させた後、濾過し、そして真空下で濃縮することで粗油を得て、それをフラッシュクロマトグラフィーにかけてヘキサン中10%のEtOAcを用いて精製することで2−(2,2−ジメトキシ−アセチル)−8−(3−クロロ−ベンジル)−シクロオクタノン化合物3d(3.48g、60%)を得た。
【0280】
【化28】

【0281】
段階3. 化合物3d(3.48g、9.9ミリモル)をMeOH(50mL)に入れることで生じさせた0℃の溶液にヒドラジン化合物3e(0.32g、10ミリモル)を加えた。その混合物を一晩撹拌しながら室温になるまで温めた。水(20mL)で反応を消滅させ、その有機層をEtOAc(200mL)で希釈した後、水そして食塩水で洗浄した。その有機層を分離し、無水硫酸ナトリウムで乾燥させた後、濾過し、そして真空下で濃縮することで粗油を得て、それをフラッシュクロマトグラフィーにかけてヘキサン中40%のEtOAcを用いて精製することで9−(3−クロロ−ベンジル)−3−ジメトキシメチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール化合物3f(2.24g、65%)を無色の油として得た。
【0282】
【化29】

【0283】
段階4. 化合物3f(2.24g、6.4ミリモル)をアセトン(50mL)に入れることで生じさせた0℃の溶液に3NのHCl(8mL)を加えた。その混合物を4時間撹拌しながら室温になるまで温めた。水(20mL)で反応を消滅させ、K2CO3で中和してpHを7にした後、DCM(100mL)で希釈した。その有機層を水そして食塩水で洗浄し、分離し、無水硫酸ナトリウムで乾燥させた後、濾過し、そして真空下で濃縮することで9−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボアルデヒド化合物3g(1.84g、95%)を
白色の固体として得た。
【0284】
【化30】

【0285】
段階5. (S)−1−フェニル−エチルアミン化合物3h1(2.13g、17.46ミリモル)の溶液にN2雰囲気下0℃でTEA(2.90mL、20.9ミリモル)およびメタンスルホニルクロライド(2.0g、17.46ミリモル)を加えた。その混合物を3時間撹拌しながら室温になるまで温めた。水(20mL)で反応を消滅させ、有機層をCH2Cl2(100mL)で希釈し、水そして食塩水で洗浄し、分離し、無水硫酸ナトリウムで乾燥させた後、濾過し、そして真空下で濃縮することでN−(1−フェニル−エチル)−メタンスルホンアミド化合物3h2を油として得た。
【0286】
【化31】

【0287】
段階6. 化合物3h2をCH2Cl2(10mL)に入れることで生じさせた溶液にN2雰囲気下0℃で炭酸ジ−t−ブチルエステル化合物3h3(4.57g、20.95ミリモル)およびDMAP(8mg)を加えた。その混合物を一晩撹拌しながら室温になるまで温めた。飽和NaHCO3溶液(10mL)で反応を消滅させた。その有機層を分離し、無水硫酸ナトリウムで乾燥させ、濾過した後、真空下で濃縮することで粗生成物を得て、それをフラッシュクロマトグラフィーにかけてヘキサン中10%のEtOAcを用いて精製することでN−Boc−N−(1−フェニル−エチル)−メタンスルホンアミド化合物3h(4.31g、82%)を無色の油として得た。
【0288】
【化32】

【0289】
段階7. 化合物3h(0.075g、0.250ミリモル)を無水THF(5mL)に入れることで生じさせた溶液にN2雰囲気下−78℃でカリウムt−ブトキサドをTHFに入れることで生じさせた1Mの溶液(0.75mL、0.75ミリモル)を滴下した。45分後に化合物3g(0.076g、0.250ミリモル)をTHF(3mL)に入れることで生じさせた溶液を滴下した。その混合物を15時間反応させながら室温になるまで温めた。水(5mL)で反応を消滅させた後、EtOAc(100mL)を用いた希釈を実施した。その有機層を分離し、水そして食塩水で洗浄し、無水硫酸ナトリウムで乾燥させた後、濾過し、そして真空下で濃縮することで粗油を得て、それをフラッシュクロマトグラフィーにかけてヘキサン中40%のEtOAcを用いて精製することで化合物21(0.082g、70%)を白色固体として得た。1H NMR(CD2Cl2,300MHz)δ 7.42−7.02(m,11H),6.40(dd,1H),5.10−4.90(m,1H),4.52−4.44(m,1H),3.26−3.12(m,2H),3.04−2.90(m,1H),2.68−2.30(m,2H),1.86−1.70(m,2H),1.52−1.08(m,8H).MS m/z 484(M+H+)。
【0290】
実施例3の手順に従い、適切な出発材料、反応体および溶媒を代わりに用いることで、下記の化合物を調製した:
【0291】
【表10】

【0292】
実施例4
実施例2の段階2から6の手順に従い、適切な出発材料、反応体および溶媒を用いることで、化合物3bから下記の化合物を調製した:
【0293】
【表11】

【0294】
当業者は、本方法で用いた可能な出発材料、反応体および条件のみを異ならせることで追加的化合物を本発明の合成方法に従って製造することができるであろう。
【0295】
生物学的実施例
以下の実施例では、本発明の化合物がカンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防するに有用なCB受容体モジュレーターであることを例示する。
【0296】
実施例1
CB1またはCB2作動薬または逆作動薬の結合検定
pcDNA3 CB−1(ヒト)またはpcDNA3 CB−2(ヒト)によるトランスフェクションを受けさせておいたSK−N−MC細胞内でヒトCB1およびCB2受容体を安定に発現させた。前記細胞をT−180細胞培養フラスコ内で37℃の標準的細胞培養条件下5%のCO2雰囲気下で増殖させた。前記細胞をトリプシン処理で収穫し、ホモジナイゼーション(homogenization)緩衝液(10mMのTris、0.2mMのMgCl2、5mMのKClに加えてプロテアーゼ阻害剤であるアプロチニン、ロイペプチン、ペプスタチンAおよびバシトラシン)中で均一にした後、遠心分離(2000g)にかけた。次に、その上澄み液を2Mのスクロース(31,300g)に入れて遠心分離にかけることで半精製膜沈澱物を生じさせた。その沈澱物をホモジナイゼーションに入れて再懸濁させた後、−80℃で貯蔵した。
【0297】
検定日に前記沈澱物を氷上で解凍させた後、検定用緩衝液(50mMのTris−HCl、5mMのMgCl2、2.5mMのEDTA、0.5mg/mLのウシ血清アルブミン(脂肪酸が入っていない)、pH7.5)で希釈した。その希釈した膜沈澱物を96穴ポリプロピレン製プレートの穴に緩衝液、試験化合物または媒体標準のいずれかおよび放射性リガンド[H]3+−CP−55,940(0.2nM)と一緒に加えた。非特異的結合を測定する穴にはWIN55,212(10uM)を入れた。前記プレートにカバーを付けた後、30℃で90分間インキュベートした。次に、その内容物を吸引して0.5%のポリエチレンイミンで前以て湿らせておいたPackard Unifilter GF/Cフィルターボトムプレート上に置いた。前記ポリプロピレン製プレートの穴を濯いだ後、0.9%の食塩水−0.5%のTween 20溶液を用いた吸引を数回実施した。前記Unifilterプレートを乾燥させ、シンチレーションカクテルを各穴に加えた後、結合に相当するカウント数をTopCountシンチレーションカウンターで量化した。
【0298】
CB1およびCB2受容体結合の結果
試験を受けさせた化合物毎にIC50結合値をいろいろな試験濃度を用いた阻害パーセント検定で得た。その結合値を線形回帰で計算した。
【0299】
IC50結合値を示さなかった化合物の場合、阻害パーセント(%)を(1)10μM、(2)1μM、(3)0.2μM、(4)0.003μMの試験濃度で得、(5)示す値は平均値である。
【0300】
【表12】

【0301】
【表13】

【0302】
実施例2
CB1またはCB2作動薬および逆作動薬が細胞内アデニレートシクラーゼ活性に対して示す効果に関する細胞を基にした機能的検定
CB1およびCB2受容体はG蛋白質共役受容体(GPCR)であり、これはGi蛋白質を通して細胞の機能に影響を与える。そのような受容体は細胞内アデニレートシクラーゼの活性をモジュレートし、それによって細胞内シグナルメッセンジャー環状AMP(cAMP)を生じさせる。
【0303】
ベースライン、即ちリガンドが結合していない状態では、そのような受容体は構成的に活性がありかつ強力にアデニレートシクラーゼ活性を抑制する。作動薬が結合すると更に受容体が活性化されることでアデニレートシクラーゼ活性の追加的抑制がもたらされる。逆作動薬が結合すると前記受容体の構成的活性が抑制される結果としてアデニレートシクラーゼ活性が高くなる。
【0304】
細胞内アデニレートシクラーゼ活性を監視することで、化合物が作動薬または逆作動薬として働く能力を測定することができる。
【0305】
検定
試験化合物にSK−N−MC細胞を用いた評価を受けさせたが、この評価では、標準的なトランスフェクション手順を用いて、前記細胞にpcDNA3−CRE β−galおよびpcDNA3 CB1受容体(ヒト)またはpcDNA3 CB2受容体(ヒト)のヒトcDNAによる安定なトランスフェクションを受けさせた。その細胞は、CRE β−galを発現することで、cAMPによるCRE プロモーターの活性化に反応してβ−ガラクトシダーゼを産生した。CRE β−galおよびヒトCB1またはCB2受容体のいずれかを発現する細胞にCB1/CB2作動薬による処理を受けさせるとβ−ガラクトシダーゼの産生量が少なくなり、CB1/CB2逆作動薬による処理を受けさせるとβ−ガラクトシダーゼ産生量が多くなる。
【0306】
細胞増殖
細胞を96穴プレートに入れて37℃の標準的細胞培養条件下5%のCO2雰囲気下で増殖させた。3日後に培地を除去した後、試験化合物を培地[この培地に2mMのL−グルタミン、1Mのピルビン酸ナトリウム,0.1%の低脂肪FBS(ウシ胎仔血清)および抗生物質を補充しておいた]に入れて前記細胞に加えた。前記プレートを37℃で30分間インキュベートし、次に、前記プレートの細胞をホルスコリンで4−6時間処理した後、洗浄しそして溶解させた。β−ガラクトシダーゼの活性を市販キットの試薬(Promega Corp.Madison、WI)およびVmax Plate Reader(Molecular Devices、Inc)を用いて量化した。
【0307】
CB1受容体が媒介するCRE β−gal発現変化
CRE β−galおよびCB1受容体を発現する細胞では、CB1作動薬によってβ−ガラクトシダーゼの活性が用量依存様式で低下し、そしてCB1逆作動薬によってβ−ガラクトシダーゼの活性が用量依存様式で高くなった。
【0308】
β−ガラクトシダーゼ活性の変化を媒体で処置した細胞が示す活性値を100%に設定することで測定し、そして相当する化合物で処置した細胞で測定したβ−ガラクトシダーゼ活性を媒体処置細胞活性のパーセントとして表した。
【0309】
CB1受容体の結果
試験を受けさせた化合物が示した機能的活性のEC50値を線形回帰で計算し、そしていろいろな化合物濃度を用いた検定で得た。特定の化合物に関しては、データを下記の単一試験濃度における機能的活性の変化パーセント(%)で示す:(1)10μMおよび(
2)1μM
【0310】
【表14】

【0311】
【表15】

【0312】
CB2受容体が媒介するCRE β−gal発現変化
CRE β−galおよびCB2受容体を発現する細胞では、CB2作動薬によってβ−ガラクトシダーゼの活性が用量依存様式で低下し、そしてCB2逆作動薬によってβ−ガラクトシダーゼの活性が用量依存様式で高くなる。
【0313】
β−ガラクトシダーゼ活性の変化を媒体で処置した細胞が示す活性値を100%に設定することで測定し、そして相当する化合物で処置した細胞で測定したβ−ガラクトシダーゼ活性を媒体処置細胞活性のパーセントとして表した。
【0314】
CB2受容体結合の結果
試験を受けさせた化合物が示す機能的活性のEC50値を線形回帰で計算し、それをいろいろな化合物濃度を用いた検定で得た。
【0315】
化合物5が示した値が29%であることは機能的活性が変化することに相当し、それを1つの化合物濃度を用いた検定で得た。
【0316】
【表16】

【0317】
【表17】

【0318】
CB1またはCB2作動薬が細胞内アデニレートシクラーゼ活性に対して示す効果に関する細胞を基にした修飾機能的検定
若干修飾して追加的機能的活性検定を実施した。ベータガラクトシダーゼ活性の量化を発光Beta−Glo Assay System(Promega Corp.、Madison、WI)およびOrion Microplate Luminometer(Berthold Detection Systems、Oak Ridge、TN)を用いて実施した。EC50値の計算をGraphPad Prismおよび4パラメーターロジスティック方程式を用いて実施した。
【0319】
CB1/CB2受容体の結果
使用する化合物濃度を変えて検定を行うことで化合物31が示すCB2作動薬機能的活性EC50値は18nMであることを得た。
【0320】
実施例4
からし油誘発大腸炎モデル
からし油大腸炎モデルでは、遠位大腸が粘膜上皮障害、粘膜下浮腫、粘膜および粘膜下への炎症細胞(マクロファージ、好中球およびリンパ球を包含)の侵入、湿った状態の大腸重量の増加、大腸の長さの収縮、下痢および明らかな炎症の断続的パターンを示すことを特徴とする(Kimball E.S.、Palmer J.M.、D’Andrea
M.R.、Hornby P.J.およびWade P.R.、Acute colitis induction by oil of mustard results in later development of an IBS−like accelerated upper GI transit in mice、Am.J.Physiol.Gastrointest.Liver Physiol.、2005、288:G1266−1273を参照)。
【0321】
大腸炎誘発
オスCD−1マウス(Charles River Laboratories、Kingston、NC)(9−11週齢)および新鮮なからし油(OM)(イソチオシアン酸アリル、98%の純度、Sigma−Aldrich St.Louis、MO)を用いた。
【0322】
マウス(1処置グループ当たり9匹)にケタミン/キシラシン(Sigma、St.Louis、MO)を用いた麻酔を短時間かけて、30%エタノール中0.5%のOM溶液(50μL)をシリンジ(先端がボールの22G針が備わっている)で大腸内投与した(4cmの深さに)。
【0323】
試験化合物を大腸炎誘発1日前に経口投与することで予防的療法を評価するか、或は誘発1日後に経口投与することで治療的療法を評価した。その後、試験化合物を毎日経口投与した。OMを投与してから2日後に最後の1回分の試験化合物を投与した。
【0324】
OMを投与してから3日後の動物を屠殺した。大腸を切除し、炎症の兆候を検査し、糞便内容物を取り出した後に重量を測定し、盲腸の尾方端から肛門までの長さを測定した。糞便内容物を下痢兆候に関して検査した。1センチメートル目から4センチメートル目の間の遠位大腸を取り出した後、10%の中性緩衝ホルマリンに入れて組織学的分析を実施した。
【0325】
巨視的観察および判断基準
大腸炎症の巨視的観察(大腸損傷の尺度)、大腸の重量および長さおよび排泄物の粘ちょう度および外観にスコアを付けて、それらを用いて大腸炎のひどさを評価した。
【0326】
各大腸毎に4つの観察スコアを組み合わせ、組み合わせたスコアが0であることは大腸が正常であることに相当し、組み合わせたスコアが15であることは大腸が最大限の影響を受けたことに相当する。統計学的分析をANOVAを用いたGraphpad Prism 4.0で実施した。
【0327】
【表18】

【0328】
顕微鏡(組織学的)検査
組織の組織学的分析をパラフィン埋め込み組織断片をヘマトキシリン−エオシン色素で染色することで構成させた。サンプルグループを伏せておいた検査者が光顕微鏡で組織を検査した。
【0329】
組織学的観察および判断基準
上皮損傷の顕微鏡観察、細胞侵入および平滑筋構造の損傷または変化(筋肉損傷の尺度)にスコアを付けて、それらを用いて大腸炎のひどさを評価した。
【0330】
各大腸毎にスコアを組み合わせ、組み合わせたスコアが0であることは大腸が正常であることに相当し、組み合わせたスコアが9であることは大腸が最大限の影響を受けたことに相当する。統計学的分析をANOVAを用いたGraphpad Prism 4.0
で実施した。
【0331】
判断基準および観察
【0332】
【表19】

【0333】
予防的および治療的大腸炎処置療法の結果
予防および治療療法における各処置グループに関する巨視的スコアおよび顕微鏡的スコアの結果の各々を組み合わせて平均スコアにして、大腸炎の抑制%(%Inh)として表した。試験(#)は、各投薬レベルにおける実験数を表す。
【0334】
【表20】

【0335】
【表21】

【0336】
実施例5
デキストラン硫酸ナトリウム(DSS)誘発大腸炎モデル
DSS大腸炎モデルでは、遠位大腸が粘膜上皮損傷、粘膜および粘膜下への炎症細胞(
マクロファージ、好中球およびリンパ球を包含)の侵入、湿った状態の大腸重量の低下、大腸の長さの収縮および下痢の断続的パターンを示すことを特徴とする(Blumberg R.S.、Saubermann L.J.およびStrober W.、Animal models of mucosal inflammation and their relation to human inflammatory bowel
disease、Current Opinion in Immunology、1999、11巻:648−656;Egger B.、Bajaj−Elliott M.、MacDonald T.T.、Inglin R.、Eysselein、V.E.およびBuchler M.W.、Characterization of acute murine dextran sodium sulphate colitis:Cytokine profile and dose dependency、Digestion、2000、62巻:240−248;Stevceva L.、Pavli P.、Husband A.J.およびDoe、W.F.、The inflammatory infiltrate in the acute stage of
the dextran sulphate sodium induced colitis:B cell response differs depending on the percentage of DSS used to induce it、BMC Clinical Pathology、2001、1巻:3−13;およびDiaz−Granados、Howe K.、Lu J.およびMcKay D.M.、Dextran sulfate sodium−induced colonic
histopathology、but not altered epithelial ion transport、is reduced by inhibition of phosphodiesterase activity、Amer.J.Pathology、2000、156巻:2169−2177を参照)。
【0337】
大腸炎誘発
メスBalb/cマウス(Taconic Farms、Germantown、NY)(10−13週齢)に水道水中5%のDSS(分子量45kD、ICN chemicals、Newport、CA)溶液を7日間に渡って随意与えた。DSS溶液を毎日補充しそして消費量を測定した。
【0338】
マウス(1処置グループ当たり10匹)に試験化合物を大腸炎誘発日に経口投与した後、毎日投与した。
【0339】
最初にDSSを投与してから6日後に最後の1回分の試験化合物を投与した。
【0340】
最初のDSSを投与してから7日後の動物を屠殺した。大腸を切除し、炎症の兆候を検査し、糞便内容物を取り出した後に重量を測定し、盲腸の尾方端から肛門までの長さを測定した。糞便内容物を下痢兆候に関して検査した。1センチメートル目から4センチメートル目の間の遠位大腸を取り出した後、10%の中性緩衝ホルマリンに入れて組織学的分析を実施した。
【0341】
巨視的観察および判断基準
大腸炎症の巨視的観察(大腸損傷の尺度)、大腸の長さおよび排泄物の粘ちょう度および外観にスコアを付けて、それらを用いて大腸炎のひどさを評価した。
【0342】
各大腸毎に3つの観察スコアを組み合わせ、組み合わせたスコアが0であることは大腸が正常であることに相当し、組み合わせたスコアが11であることは大腸が最大限の影響を受けたことに相当する。統計学的分析をANOVAを用いたGraphpad Prism 4.0で実施した。
【0343】
【表22】

【0344】
顕微鏡(組織学的)検査
組織の組織学的分析をパラフィン埋め込み組織断片をヘマトキシリン−エオシン色素で染色することで構成させた。サンプルグループを伏せておいた検査者が光顕微鏡で組織を検査した。
【0345】
組織学的観察および判断基準
上皮損傷の顕微鏡観察、細胞侵入および平滑筋構造の損傷または変化(筋肉損傷の尺度)にスコアを付けて、それらを用いて大腸炎のひどさを評価した。
【0346】
各大腸毎にスコアを組み合わせ、組み合わせたスコアが0であることは大腸が正常であることに相当し、組み合わせたスコアが9であることは大腸が最大限の影響を受けたことに相当する。統計学的分析をANOVAを用いたGraphpad Prism 4.0で実施した。
【0347】
判断基準および観察
【0348】
【表23】

【0349】
大腸炎処置療法の結果
各処置グループ毎の巨視的スコアおよび顕微鏡的スコアの結果の各々を組み合わせて平均スコアにして、大腸炎の抑制%(抑制%)として表した。試験(#)は、各投薬レベルにおける実験数を表す。NDは測定せずを表す。
【0350】
【表24】

【0351】
実施例6
術後炎症性腸閉塞
急性胃腸炎症は、手術中の直接的腸障害またはひどい肉体的外傷によって生じ得る。炎症によって典型的には腸鬱滞、即ち腸閉塞の発症がもたらされ、これは調整の取れた胃腸運動の一時的障害として定義される。腸閉塞は消化管のいずれかの部分、例えば胃、小腸および/または大腸などに起こり得る。腸閉塞は腸閉塞をもたらし得る要因のいずれか、例えば手術、即ち腹部手術、例えば移植手術または移植手術以外の腹部手術、整形手術など、外傷、例えば転倒、車の事故、人的暴力など、または外傷の結果としてもたらされる後遺症のいずれか、例えば手足骨折、肋骨骨折、脊椎骨折、胸部傷害、虚血、後腹膜犠牲など、腹腔内炎症、例えば腹腔内敗血症、急性虫垂炎、胆嚢炎、膵炎、尿管疝痛、基底肺炎など、心筋梗塞、代謝障害またはこれらの任意組み合わせなどのいずれかの結果として生じ得る。
【0352】
急性胃腸炎症、従って腸閉塞の最も一般的な原因の1つは、腹部手術中の腸障害である。腸接触および操作によって腸壁内に炎症イベントが始まり、それによって神経筋組織の抑制および調整された胃腸運動の損失がもたらされる。その結果としてもたらされた”術後腸閉塞”は、胃内容排出遅延、小腸および大腸の膨張、腹部膨満、正常な推進収縮様式の損失およびガスもしくは排泄物の排泄不可によって特徴づけられる。Holte,K.およびH.Kehlet(2000).“Postoperative ileus:a
preventable event.”Br J Surg 87(11):1480−93。臨床症状では、術後腸閉塞によって患者の不快さの増大(腹部膨満、吐き気、嘔吐)がもたらされかつ長期入院の一因となる主要な要因である。
【0353】
腸閉塞発症の一因になる機構は複雑であり、それには、交感神経反射の活性化、視床下部−下垂体軸からの中枢阻害性体液性因子放出、腸壁からのノルエピネフリン放出ばかりでなく麻酔薬および鎮痛薬が含まれる(Livingston,E.H.およびE.P.Passaro(1990)“Postoperative ileus.”Degestive Disease and Sciences 35(1):121−132およびBauer,A.J.、N.T.Schwarz他(2002)“Ileus in
critical illness:mechanisms and management.”Curr Opin Crit Care 8(2):152−7)。
【0354】
そのようなプロセスの基礎になる中心的イベントは、急性炎症反応がGI管壁内に始まることにある。術後腸閉塞の齧歯類モデルを用いた研究によって、外筋層が免疫学的に高い活性を示す部分であることが示された。通常は外筋層内に多量の在住マクロファージが存在していて、それらは食道から大腸に及ぶ広範な細胞ネットワークを形成しており(Mikkelsen,H.B.(1995)“Macrophages in the external muscle layers of mammalian intestines.”Histology and Histopathology 10:719−736およびKalff,J.C.、W.H.Schraut他(1998)“Surgical manipulation of the gut elicits an intestinal muscularis inflammatory response resulting in paralytic ileus.”Annals of Surgery 228:652−663)かつそれらは消化管を損傷から防護するように平衡状態にある。腹部手術中に腸が障害を受けるとそのようなマクロファージネットワークが活性化されることで局所的な分子炎症反応が始まる。マクロファージが活性化されると炎症性のサイトカインおよびケモカインが放出され、それによって神経筋組織が抑制されかつ血管内皮上に接着分子の発現が誘発される(Kalff、Schraut他(1998);Kalff,J.C.、N.T.Schwarz他(1998)“Leukocytes of the intestinal muscularis:their phenotype and isolation.”J Leukoc Biol 63(6):683−91;Josephs,M.D.、G.Cheng他(1999)“Products of cycloxygenase−2 catalysis regulate postoperative bowel motility.”J Surg Res 86(1):50−4;Kalff,J.C.、T.M.Carlos他(1999)“Surgically induced leukocytic infiltrates within the rat intestinal muscularis mediate postoperative ileus.”Gastroenterology 117:378−387;Kalff,J.C.、W.H.Schraut他(2000)“Role of inducible
nitric oxide synthase in postoperative intestinal smooth muscle dysfunction in
rodents.”Gastroenterology 118(2):316−27およびWehner,S.、N.T.Schwarz他(2005)“Induction
of IL−6 within the rodent intestinal muscularis after intestinal surgical stress.”Surgery 137(4):436−46)。
【0355】
それによって、白血球(単球、好中球、t細胞、マスト細胞)が全身循環から動員されることで特徴づけられる細胞炎症反応がもたらされる(Kalff,J.C.、N.T.Schwarz他(1997)“Phagocyte activation and infiltration of the intestinal muscularis with impairment of small bowel motility after surgicla manipulation.”Langenbecks Archiv fur Chirurgie Suppl.:425−428およびKalff,J.C.、B.M.Buchholz他(1999)“Biphasic
response to gut manipulation and temporal correlation of cellular infiltrates and muscle dysfunction in rat.”Surgery 126(3):498−509)。浸潤白血球が追加的サイトカインばかりでなくプロスタグランジン、酸化窒素、プロテアーゼおよび反応性酸素種を放出し、それらが神経筋機能障害のさらなる原因になる(von Ritter,C.、R.Be他(1989)“Neutrophilic proteases:mediators of formyl−methionyl−leucyl−phenylalanine−induced ileitis in rats.”Gastroenterology 97(3):605−9およびBielefeldt,KおよびJ.L.Conklin(1997)“Intestinal motility during hypoxia and reoxygenation in vitro.”Dig Dis Sci 42(5):878−84)。
【0356】
本発明の化合物は、免疫学的に活性化された循環白血球が消化管の筋壁の中に入り込まないようにするか或はそれらの活動を抑制することで腸閉塞を予防または治療すると期待する。本発明の化合物は、また、胃腸収縮機能障害をもたらす炎症性後遺症を防止することでも腸閉塞を予防または治療すると期待する。
【0357】
術後腸閉塞の誘発
オスCD−1マウスにイソフルランを吸入させて麻酔をかけることで手術の準備をする。腹部の毛を剃った後、それを消毒液で処置する。次に、その動物を手術用ドレープで腹部が露出したままになるように覆う。中心線開腹を実施した後、小腸全体を体外に出して無菌ドレープの上に置く。次に、湿った無菌の綿が先端に付いているアプリケーターを2個用いて前記小腸をトライツ靭帯から回盲部まで長さ方向に沿って穏やかに圧縮する。次に、その小腸を腹腔に戻した後、2層の縫合糸で切開部を閉じる。
【0358】
化合物の投与
年齢適合マウスを無作為にグループ(1グループ当たり6匹の動物)に割り当て、開腹術を行う1時間前に、試験化合物をいろいろな用量で入れておいた”媒体”(エタノールが5%/Tween 80が5%/水中5%(重量/体積)のデキストランが90%の混合物)を腹腔内(i.p.)注入する。2番目のグループに媒体を腹腔内注入する。3番目のグループにデキサメタゾンを水中20%のヒドロキシプロピルメチルデキストランに入れることで生じさせた混合物(1mg/mL)を手術前2日間に渡って日に1回そして開腹術から5時間後に胃内投与(1mg/kg)投与する。前記4グループに治療介入を受けさせないで、それらを投薬を受けさせない対照として用いる。
【0359】
胃腸運動性測定方法−上部消化管通過−フルオレセイン−イソチオシアネート(FITC)−デキストラン技術:
上部消化管通過の測定を開腹術から24時間後に実施する。マウスに150μLのFITC−デキストラン溶液(フルオレセイン−イソチオシアネートと接合させた分子量が70,000のデキストランを0.5%のヒドロキシプロピルメチルセルロース/脱イオン水に5mg/mL入れた)で構成させた試験餌を18ゲージの栄養チューブで胃内投与することで与える。FITC−デキストラン試験餌を経口投与した後の動物をホームゲージに戻す。45分間の試験時間後、マウスにイソフルランの過剰投与および放血を受けさせることでマウスを安楽死させる。下部食道括約筋から大腸末端部までの消化管全体を取り出す。腸部分を腸間膜側縁に沿って開ける。胃の組織および管腔の内容物、小腸を等しく10分割した部分、盲腸および大腸を等しく3分割した部分をPBSを1mL入れておいた個々のエッペンドルフ管に入れる。前記組織を卓上渦巻き装置で激しく混合した後、遠心分離にかけることで固体状材料を沈澱させる。透明な上澄み液の一定分量を96穴蛍光プレートリーダーで重複して読み取ることで腸の各部分が示す蛍光シグナルの大きさを量化する。
【0360】
それらの値を用いて幾何学的中心(Geometric Center)(REF)を計算するが、これは消化管に沿った蛍光シグナルの加重平均分布:
GC=Σ(一部分当たりの総蛍光シグナルの%x部分の数)/100
であるとして定義する。
【0361】
GC値が高ければ高いほど通過速度が速いことに相当し、それを1から15のスケールで表す。通常のマウスが45分間の試験時間後に示すGCは8である。
【0362】
ミエロペルオキシダーゼの組織学的顕微鏡検査
開腹術から24時間後に収穫した組織に対して組織学的顕微鏡検査を実施する。活性免疫細胞、例えば好中球および単球などはミエロペルオキシダーゼ活性を示す。Hanker−Yates試薬(Polysciences Inc.)は過酸化水素およびペルオキシダーゼ酵素活性の存在下で青−黒色の不溶重合体を形成する。小腸中心部の断片をこの上の章に記述した遠心分離管から集める。腸管を腸間膜側縁に沿って開けた後に組織をSylgard(商標)で覆っておいたペトリ皿の中に粘膜表面が上に向くように平らに固定することで筋層全載標本の調製を実施する。前記組織を長さ方向に1.5倍および幅方向に2.5倍に引き伸ばした後、微細切開で粘膜を除去する。次に、残存する筋層全載標本を100%のエタノールで45分間かけて固定し、PBSで3回洗浄した後、過酸化水素を0.1%とHanker−Yates試薬(Polysciences Inc.)を1mg/ml入れておいたPBSに入れて20分間インキュベートする。前記試薬は過酸化水素およびペルオキシダーゼ活性の存在下で重合して青−黒色の沈着物を形成する。PBSを用いて2回目の洗浄を行った後の全載標本をガラススライドの上に置き、カバーを滑らかに滑らせた後、光学顕微鏡で見る。6から8個の隣接して位置する200Xの光場の中に存在するミエロペルオキシダーゼ含有白血球の数を数え、平均細胞数を計算して記録する。
【0363】
術後腸閉塞の結果
通常の動物ではミエロペルオキシダーゼ(MPO)陽性免疫細胞が腸筋層内に存在するのは稀である。小腸を外科的処置すると浸潤白血球の数が顕著に増加する。デキサメタゾンで処置するか或は本発明の試験化合物で処置するとそのような侵入度合の大きさが有意に低下する。
【0364】
術後炎症性腸閉塞に関連した消化管の運動性
小腸を外科的に処置すると有意な消化管通過遅延がもたらされ、通常のマウスが示す幾何学的中心である8.4から媒体で処置した動物が示す3.3になる。デキサメタゾンで処置するとある程度の回復がもたらされる。本発明の試験化合物は消化管通過の向上を示すと期待する。
【0365】
この上で行った本発明の説明およびいろいろな実施例は特定面を強調するものであると理解されるべきである。それにも拘らず、具体的な説明も考察も行わなかった他のいろいろな相当物も本発明または本請求項の精神および範囲内に入る可能性があり、それらを包含させることを意図する。
【技術分野】
【0001】
関連出願に対する相互参照
本出願は2005年9月23日付けで出願した米国仮特許出願連続番号60/719,884および2006年9月22日付けで出願した米国特許出願連続番号11/525,573(これらは引用することによって全体があらゆる目的で本明細書に組み入れられる)の利点を請求する一部継続出願である。
【0002】
本発明は、ヘキサヒドロ−シクロオクチルピラゾール系カンナビノイド(CB)モジュレーター化合物およびそれをカンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防で用いる方法に向けたものである。
【背景技術】
【0003】
カンナビノイドCB1およびCB2受容体が発見されるまでは、大麻の生物学的に有効な成分を記述する目的で用語カンナビノイドが用いられていて、それらの中で最も豊富に存在する物質はデルタ−9−テトラヒドロカンナビノール(THC)およびカンナビジオールである。
【0004】
【化1】

【0005】
THCは、CB1およびCB2受容体の中程度の効力を示す部分作動薬であり、“古典的なカンナビノイド”であると見なされているが、これは、三環式ジベンゾピランTHC中心部と構造的に関連している他の類似物および誘導体を指す目的で現在用いられている用語である。用語“非古典的カンナビノイド”は、カンナビジオールと構造的に関連したカンナビノイド作動薬を指す。
【0006】
薬理学的調査はピラゾール構造の種類の選択的CB受容体モジュレーターに集中しており、それらにはSR 141716A(SR 141716の一塩酸塩)およびSR 144528が含まれる。
【0007】
【化2】

【0008】
ピラゾール系カンナビノイドモジュレーターは多種多様な構造種の中の1つであり、それらはCB薬理学の進展を促し、カンナビノイド受容体が媒介する生物学的効果の測定に役立ち、現在の化合物のさらなる改良をもたらしかつ将来的には新規な化学種の源になるであろう。
【0009】
元々は選択的拮抗薬であるとして分類分けされていた特定の化合物(SR 141716、SR 144528などを包含)は、現在では、純粋な拮抗薬ではなくむしろ“逆作動薬”として働くと考えられている。逆作動薬は、作動薬が受容体の所に結合することによって誘発される活性化を単に妨害するのではなく、作動薬が存在しない時に受容体の活性化の構成的レベルを低下させる能力を有する。CB受容体が示す構成的活性は重要な暗示である、と言うのは、CB1およびCB2は両方ともが作動薬が存在しない時でもあるレベルで連続的にシグナルを伝達するからである。例えば、SR 141716AはCB1蛋白質の濃度を増加させかつ細胞が作動薬の作用に対して示す感受性を高め、従って、このことは、逆作動薬はエンドカンナビノイド系およびCB受容体によって活性化される下流のシグナル伝達経路をモジュレートする目的で使用可能な別の種類のリガンドであり得ることを示している。
【0010】
ピラゾール誘導体がCB1またはCB2受容体作動薬として特許文献1に記述されている。
【0011】
CBおよびカンナビ模擬リガンドの合成が進展したことで受容体の薬理学が更に進展しかつ追加的カンナビノイド受容体サブタイプが存在する証拠がもたらされた。しかしながら、CB受容体がモジュレートするいろいろな症候群、障害および病気を治療する目的でCB1またはCB2受容体カンナビノイドモジュレーターを同定および開発する必要性は継続して存在したままである。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】PCT出願WO2006/030124
【発明の概要】
【0013】
発明の詳細な説明
本発明は式(I):
【0014】
【化3】

【0015】
[式中、
式(I)中の位置2−3の間の破線および位置3a−9aの間の破線は、X1R1が存在する時に存在する2個の二重結合の各々の位置を表し、
式(I)中の位置3−3aの間の破線および位置9a−1の間の破線は、X2R2が存在する時に存在する2個の二重結合の各々の位置を表し、
式(I)中の位置9とX4R4の間の破線は、二重結合の位置を表し、
X1は、存在しないか或は低級アルキレンであり、
X2は、存在しないか或は低級アルキレンであり、かつ
X1R1およびX2R2の中の一方のみが存在し、
X3は、存在しないか、低級アルキレン、低級アルキリデンまたは−NH−であり、
位置9とX4R4の間の破線が存在しない時には、X4が存在しないか或は低級アルキレンであり、
位置9とX4R4の間の破線が存在する時には、X4が存在せず、
X5は、存在しないか或は低級アルキレンであり、
R1は、水素、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、低級アルキル−スルホニル、アリール、C3−C12シクロアルキルまたはヘテロシクリルから選択され、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1つ以上の位置がハロゲン、アミノスルホニル、低級アルキル−アミノスルホニル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、ヒドロキシまたはアルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)で置換されていてもよく、
R2は、水素、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、低級アルキル−スルホニル、アリール、C3−C12シクロアルキルまたはヘテロシクリルから選択され、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1つ以上の位置がハロゲン、アミノスルホニル、低級アルキル−アミノスルホニル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、ヒドロキシまたはアルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)で置換されていてもよく、
R3は、−C(O)−Z1(R6)、−SO2−NR7−Z2(R8)または−C(O)−NR9−Z3(R10)であり、
位置9とX4R4の間の破線が存在しない時には、X4が存在しないか或は低級アルキレンでありそしてR4が水素、ヒドロキシ、低級アルキル、低級アルコキシ、ハロゲン、アリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1つ以上の位置がヒドロキシ、オキソ、低級アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、低級アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)またはハロゲンで置換されていてもよく、
位置9とX4R4の間の破線が存在する時には、X4が存在せずそしてR4がCH−アリールまたはCH−ヘテロシクリルであり、かつアリールまたはヘテロシクリルは各々場合により1つ以上の位置がヒドロキシ、オキソ、低級アルキル、低級アルコキシまたはハロゲンで置換されていてもよく、
R5は、存在しないか、ヒドロキシ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルであり、R6は、アリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよく、R7は、水素または低級アルキルであり、
R8は、アリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよく、R9は、水素または低級アルキルであり、
R10は、アリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アミノスルホニル、低級アルキル−アミノスルホニル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよく、
Z1およびZ2は、各々、存在しないか或はアルキルであり、そして
Z3は、存在しないか、−NH−、−SO2−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)である]
で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体に向けたものである。
【発明を実施するための形態】
【0016】
本発明の一例は、X1が存在しないか或は低級アルキレンでありそしてR1が水素、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アリール、C3−C12シクロアルキルまたはヘテロシクリルか選択されかつアリール、C3−C12シクロアルキルまたはヘテロシクリルが各々場合により1つ以上の位置がハロゲン、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、ヒドロキシまたはアルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)で置換されていてもよい式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0017】
本発明の一例は、X1が存在せずそしてR1がアリールまたはC3−C12シクロアルキルから選択されかつアリールが場合により1つ以上の位置がハロゲンで置換されていてもよい式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0018】
本発明の一例は、X1が存在せずそしてR1が水素である式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0019】
本発明の一例は、R3が−C(O)−Z1(R6)、−SO2−NH−Z2(R8)または−C(O)−NH−Z3(R10)である式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0020】
本発明の一例は、R3が−C(O)−Z1(R6)であり、X3が存在しないか、低級アルキレン、低級アルキリデンまたは−NH−であり、Z1が存在しないか或はアルキルでありそしてR6がアリール、C3−C12シクロアルキルまたはヘテロシクリルでありかつアリール、C3−C12シクロアルキルまたはヘテロシクリルが各々場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよい式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0021】
本発明の一例は、R3が−C(O)−Z1(R6)であり、X3が存在せず、Z1が存在せずそしてR6がヘテロシクリルである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0022】
本発明の一例は、R3が−SO2−NR7−Z2(R8)であり、X3が存在しないか或は低級アルキリデンであり、R7が水素または低級アルキルであり、Z2が存在しないか或はアルキルでありそしてR8が場合により1つ以上の位置がアルコキシで置換されていてもよいアリールである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0023】
本発明の一例は、R3が−SO2−NH−Z2(R8)であり、X3が存在しないか或は低級アルキリデンであり、Z2が存在しないか或はアルキルでありそしてR8が場合により1つ以上の位置がアルコキシで置換されていてもよいアリールである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0024】
本発明の一例は、R3が−C(O)−NR9−Z3(R10)であり、X3が存在しないか、低級アルキレン、低級アルキリデンまたは−NH−であり、R9が水素または低級アルキルであり、Z3が存在しないか、−NH−、−SO2−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)でありそしてR10が各々が場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アミノスルホニル、低級アルキル−アミノスルホニル、ア
リール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよいアリール、C3−C12シクロアルキルまたはヘテロシクリルである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0025】
本発明の一例は、R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか、−NH−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)でありそしてR10が各々が場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ、カルボキシ、カルボニルアルコキシ、アリールまたはヘテロシクリルで置換されていてもよいアリール、C3−C12シクロアルキルまたはヘテロシクリルである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0026】
本発明の一例は、R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか或はアルキルでありそしてR10が場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ、カルボキシ、カルボニルアルコキシ、アリールまたはヘテロシクリルで置換されていてもよいC3−C12シクロアルキルである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0027】
本発明の一例は、R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか或はアルキルでありそしてR10が場合により1個以上のアルキルまたはカルボニルアルコキシで置換されていてもよいC3−C12シクロアルキルである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0028】
本発明の一例は、R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか、−NH−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)でありそしてR10が場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ、カルボキシ、カルボニルアルコキシ、アリールまたはヘテロシクリルで置換されていてもよいアリールである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0029】
本発明の一例は、R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか、−NH−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)でありそしてR10が場合により1個以上のハロゲンで置換されていてもよいアリールである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0030】
本発明の一例は、R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか或はアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)でありそしてR10が場合により1個以上のアルキルで置
換されていてもよいヘテロシクリルである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0031】
本発明の一例は、位置9とX4R4の間の破線が存在せず、X4が存在しないか或は低級アルキレンでありそしてR4が水素または場合により1つ以上の位置がハロゲンで置換されていてもよいアリールである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0032】
本発明の一例は、位置9とX4R4の間の破線が存在し、X4が存在せずそしてR4が場合によりアリール上の1つ以上の位置がハロゲンで置換されていてもよいCH−アリールである式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0033】
本発明の一例は、X5が存在せずそしてR5が存在しない式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0034】
本発明の一例は、式(Ia):
【0035】
【化4】

【0036】
[式中、
X1は存在せず、X3は存在しないか或は低級アルキリデンであり、位置9とX4R4の間の破線が存在しない時にはX4が存在しないか或は低級アルキレンでありそしてR4が水素または場合により1つ以上の位置がハロゲンで置換されていてもよいアリールであり、位置9とX4R4の間の破線が存在する時にはX4が存在せずそしてR4がCH−アリールでありかつアリールが場合により1つ以上の位置がハロゲンで置換されていてもよく、R1は水素、アリールまたはC3−C12シクロアルキルから選択され、かつアリールは場合により1つ以上の位置がハロゲンで置換されていてもよく、R3は−C(O)−Z1(R6)、−SO2−NH−Z2(R8)または−C(O)−NH−Z3(R10)であり、R6はヘテロシクリルであり、R8は場合により1つ以上の位置がアルコキシで置換されていてもよいアリールであり、R10はアリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリールまたはC3−C12シクロアルキルは各々場合により1個以上のハロゲン、アルキルまたはカルボニルアルコキシで置換されていてもよく、Z1は存在せず、Z2はアルキルであり、そしてZ3は存在しないか、−NH−またはアルキル(ここで、アルキルは場合により1個以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)である]
で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0037】
本発明の一例は、X1が存在せず、X3が存在しないか或は低級アルキリデンであり、位置9とX4R4の間の破線が存在しない時にはX4が存在しないか或は低級アルキレンでありそしてR4が水素または場合により1つ以上の位置がハロゲンで置換されていても
よいアリールであり、位置9とX4R4の間の破線が存在する時にはX4が存在せずそしてR4がCH−アリールでありかつアリールが場合により1つ以上の位置がハロゲンで置換されていてもよく、R1が水素またはアリールから選択され、かつアリールが場合により1つ以上の位置がハロゲンで置換されていてもよく、R3が−SO2−NH−Z2(R8)または−C(O)−NH−Z3(R10)であり、R8が場合により1つ以上の位置がアルコキシで置換されていてもよいアリールであり、R10が場合により1個以上のハロゲン、アルキルまたはカルボニルアルコキシで置換されていてもよいアリールであり、Z2がアルキルでありそしてZ3が存在しないか或はアルキル(ここで、アルキルは場合により1個以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)である式(Ia)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0038】
本発明の一例は、X1R1、X3R3およびX4R4が依存して下記:
【0039】
【表1】

【0040】
から選択される式(I)で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体である。
【0041】
式(I)で表される化合物およびこれらの製薬学的に許容される形態物には下記から選択したそれらが含まれる:
【0042】
【化5】

【0043】
【化6】

【0044】
【化7】

【0045】
【化8】

【0046】
定義
下記の用語を本明細書で用いる場合、これらに以下の意味を持たせる:
用語“アルキル”は、炭素原子数が10以下の飽和分枝または直鎖の一価炭化水素基を意味する。アルキルには、典型的に、これらに限定するものでないが、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、ペンチル、ヘキシル、ヘプチルなどが含まれる。
【0047】
用語“低級アルキル”は、炭素原子数が4以下のアルキル基を意味する。結合点はアルキルまたは低級アルキルのいずれかの炭素原子上であり得、そしてさらなる置換基が存在する場合、置換基変項の場所はいずれかの炭素原子上であり得る。
【0048】
用語“アルキレン”は、炭素原子数が10以下の飽和分枝または直鎖の一価炭化水素連結基を意味し、ここで、この連結基は、2個の炭素原子の各々から水素原子が1個ずつ取り除かれることで生じる。アルキレンには、典型的に、これらに限定するものでないが、メチレン、エチレン、プロピレン、イソプロピレン、n−ブチレン、t−ブチレン、ペンチレン、ヘキシレン、ヘプチレンなどが含まれる。用語“低級アルキレン”は炭素原子数が4以下のアルキレン連結基を意味する。結合点はアルキレンまたは低級アルキレンの炭素原子のいずれか上であり得、そしてさらなる置換基が存在する場合、置換基変項の場所はいずれかの炭素原子上であり得る。
【0049】
用語“アルキリデン”は、隣接して位置する2個の炭素原子の間に形成された二重結合を少なくとも1個有する炭素原子数が1から10のアルキレン連結基を意味し、ここで、前記二重結合は2個の炭素原子各々から水素原子が1個ずつ取り除かれることで生じる。原子は前記二重結合の回りでシス(E)またはトランス(Z)配置のいずれかで配向している可能性がある。アルキリデンには、典型的に、これらに限定するものでないが、メチリデン、ビニリデン、プロピリデン、イソ−プロピリデン、メタリレン、アリリデン(2−プロペニリデン)、クロチレン(2−ブテニレン)、プレニレン(3−メチル−2−ブテニレン)などが含まれる。用語“低級アルキリデン”は炭素原子数が1から4の基または連結基を意味する。結合点はアルキリデンまたは低級アルキリデンの炭素原子のいずれか上であり得、そしてさらなる置換基が存在する場合、置換基変項の場所はいずれかの炭素原子上であり得る。
【0050】
用語“アルコキシ”は、酸素原子を通して結合している炭素原子数が10以下のアルキル、アルキレンまたはアルキリデン基を意味し、結合点は、親基上のヒドロキサイド置換基から水素原子が取り除かれることで形成される。用語“低級アルコキシ”は、炭素原子数が4以下のアルキル、アルキレンまたはアルキリデン基を意味する。低級アルコキシには、典型的に、これらに限定するものでないが、メトキシ、エトキシ、プロポキシ、ブトキシなどが含まれる。さらなる置換基が存在する場合、置換基変項の場所はアルコキシのいずれかの炭素原子上であり得る。
【0051】
用語“シクロアルキル”は、飽和または部分不飽和の単環式、多環式または橋状炭化水素環系基または連結基を意味する。炭素原子数が3から20の環はC3−20シクロアルキルで表示可能であり、炭素原子数が3から12の環はC3−12シクロアルキルで表示可能であり、炭素原子数が3から8の環はC3−8シクロアルキルで表示可能である、等々。
【0052】
シクロアルキルには、典型的に、これらに限定するものでないが、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘキセニル、シクロヘプチル、シクロオクチル、インダニル、インデニル、1,2,3,4−テトラヒドロ−ナフタレニル、5,6,7,8−テトラヒドロ−ナフタレニル、6,7,8,9−テトラヒドロ−5H−ベンゾシクロヘプテニル、5,6,7,8,9,10−ヘキサヒドロ−ベンゾシクロオ
クテニル、フルオレニル、ビシクロ[2.2.1]ヘプチル、ビシクロ[2.2.1]ヘプテニル、ビシクロ[2.2.2]オクチル、ビシクロ[3.1.1]ヘプチル、ビシクロ[3.2.1]オクチル、ビシクロ[2.2.2]オクテニル、ビシクロ[3.2.1]オクテニル、アダマンタニル、オクタヒドロ−4,7−メタノ−1H−インデニル、オクタヒドロ−2,5−メタノ−ペンタレニル(またヘキサヒドロ−2,5−メタノ−ペンタレニルとも呼ばれる)などが含まれる。さらなる置換基が存在する場合、置換基変項の場所は環のいずれかの炭素原子上であり得る。
【0053】
用語“ヘテロシクリル”は、少なくとも1個の環炭素原子がN、OまたはSから独立して選択される1個以上のヘテロ原子に置き換わっている飽和、部分不飽和または不飽和の単環式、多環式または橋状炭化水素環系基または連結基を意味する。ヘテロシクリル環系には、更に、窒素原子である環員を4個以下の数で有する環系または窒素原子である環員の数が0から3で酸素または硫黄原子である環員の数が1の環系も含まれる。有効原子価が許容する場合、隣接して位置する環員がヘテロ原子であってもよい数は2以下であり、この場合、一方のヘテロ原子が窒素でありそしてもう一方がN、OまたはSから選択される。ヘテロシクリル基は、1個の炭素もしくは窒素環原子から水素原子が1個取り除かれることで生じる。ヘテロシクリル連結基は、炭素または窒素環原子のいずれかの各々から水素原子が2個取り除かれることで生じる。
【0054】
ヘテロシクリルには、典型的に、これらに限定するものでないが、フリル、チエニル、2H−ピロール、2−ピロリニル、3−ピロリニル、ピロリジニル、ピロリル、1,3−ジオキソラニル、オキサゾリル、チアゾリル、イミダゾリル、2−イミダゾリニル(また4,5−ジヒドロ−1H−イミダゾリルとも呼ばれる)、イミダゾリジニル、2−ピラゾリニル、ピラゾリジニル、ピラゾリル、イソオキサゾリル、イソチアゾリル、オキサジアゾリル、トリアゾリル、チアジアゾリル、テトラゾリル、2H−ピラン、4H−ピラン、ピリジニル、ピペリジニル、1,4−ジオキサニル、モルホリニル、1,4−ジチアニル、チオモルホリニル、ピリダジニル、ピリミジニル、ピラジニル、ピペラジニル、アゼパニル、インドリジニル、インドリル、イソインドリル、3H−インドリル、インドリニル、ベンゾ[b]フリル、ベンゾ[b]チエニル、1H−インダゾリル、ベンゾイミダゾリル、ベンゾチアゾリル、プリニル、4H−キノリジニル、キノリニル、イソキノリニル、シンノリニル、フタルジニル、キナゾリニル、キノキサリニル、1,8−ナフチリジニル、プテリジニル、キヌクリジニル、ヘキサヒドロ−1,4−ジアゼピニル、1,3−ベンゾジオキソリル(また1,3−メチレンジオキシフェニルとしても知られる)、2,3−ジヒドロ−1,4−ベンゾジオキシニル(また1,4−エチレンジオキシフェニルとしても知られる)、ベンゾ−ジヒドロ−フリル、ベンゾ−テトラヒドロ−ピラニル、ベンゾ−ジヒドロ−チエニル、5,6,7,8−テトラヒドロ−4H−シクロヘプタ(b)チエニル、5,6,7−トリヒドロ−4H−シクロヘキダ(b)チエニル、5,6−ジヒドロ−4H−シクロペンタ(b)チエニル、2−アザ−ビシクロ[2.2.1]ヘプチル、1−アザ−ビシクロ[2.2.2]オクチル、8−アザ−ビシクロ[3.2.1]オクチル、7−オキサ−ビシクロ[2.2.1]ヘプチルなどが含まれる。
【0055】
用語“アリール”は、炭素原子数が6、9、10または14の不飽和共役π電子単環式または多環式炭化水素環系基または連結基を意味する。アリール基は1個の炭素環原子から1個の水素原子が取り除かれることで生じる。アリーレン連結基は2個の炭素環原子の各々から2個の水素原子が取り除かれることで生じる。アリールには、典型的に、これらに限定するものでないが、フェニル、ナフタレニル、アズレニル、アントラセニルなどが含まれる。
【0056】
用語“アミノ”は式−NH2で表される基を意味する。
【0057】
用語“アミノアルキル”は式−NH−アルキルまたは−N(アルキル)2で表される基を意味する。
【0058】
用語“アミノスルホニル”は式−SO2NH2で表される基を意味する。
【0059】
用語“アリールアルコキシ”は式−O−アルキル−アリールで表される基を意味する。
【0060】
用語“アリールオキシ”は式−O−アリールで表される基を意味する。
【0061】
用語“カルバモイル”は式−C(O)NH2で表される基を意味する。
【0062】
用語“カルバモイルアルキル”は式−C(O)NH−アルキルまたは−C(O)N(アルキル)2で表される基を意味する。
【0063】
用語“カルボニルアルコキシ”は式−C(O)O−アルキルで表される基を意味する。
【0064】
用語“カルボキシ”は式−COOHまたは−CO2Hで表される基を意味する。
【0065】
用語“ハロ”または“ハロゲン”は、フルオロ、クロロ、ブロモまたはヨードを意味する。
【0066】
用語“低級アルキル−アミノ”は、式−NH−アルキルまたは−N(アルキル)2で表される基を意味する。
【0067】
用語“低級アルキル−アミノスルホニル”は、式−SO2NH−アルキルまたは−SO2N(アルキル)2で表される基を意味する。
【0068】
用語“低級アルキル−スルホニル”は、式−SO2−アルキルまたは−C(O)N(アルキル)2で表される基を意味する。
【0069】
用語“置換”は、中心分子上の1個以上の水素原子が1個以上の基または連結基に置き換わっていることを意味し、ここで、定義として、連結基もまた更に置換される。当業者は、化学的に安定な中心分子がもたらされるように個々の基または連結基が水素原子に置き換わり得ることを最適に予測するであろう。
【0070】
用語“依存して選択”は、1個以上の置換基変項が指定組み合わせで存在することを意味する(例えば表のリストに通常示す置換基の群)。
【0071】
本発明の開示で用いる置換基の命名法は、当業者に良く知られている命名規則を用いることに由来する命名法である(例えば、IUPAC)。
【0072】
製薬学的形態物
本発明の化合物は製薬学的に許容される塩の形態で存在し得る。本発明の化合物の“製薬学的に許容される塩”を薬剤として用いる場合、これは無毒の酸/アニオンまたは塩基/カチオン塩形態物を指す。
【0073】
本発明の化合物の適切な製薬学的に許容される塩には、例えば本発明に従う化合物の溶液を製薬学的に許容される酸、例えば塩酸、硫酸、フマル酸、マレイン酸、こはく酸、酢酸、安息香酸、クエン酸、酒石酸、炭酸または燐酸などの溶液と一緒に混合することなどで生じ得る酸付加塩が含まれる。
【0074】
更に、本発明の化合物が酸性部分を持つ場合、それらの適切な製薬学的に許容される塩には、アルカリ金属塩、例えばナトリウムまたはカリウム塩など、アルカリ土類金属塩、例えばカルシウムまたはマグネシウム塩など、および適切な有機配位子と一緒に生じる塩、例えば第四級アンモニウム塩などが含まれ得る。このように、代表的な製薬学的に許容される塩には下記が含まれる:酢酸塩、ベンゼンスルホン酸塩、安息香酸塩、重炭酸塩、重硫酸塩、重酒石酸塩、ホウ酸塩、臭化物、カルシウム、カンシル酸塩(または樟脳スルホン酸塩)、炭酸塩、塩化物、クラブラン酸塩、クエン酸塩、二塩酸塩、エデト酸塩、フマル酸塩、グルコン酸塩、グルタミン酸塩、ヒドラバミン、臭化水素酸塩、塩酸塩、ヨウ化物、イセチオン酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マンデル酸塩、メシル酸塩、硝酸塩、オレイン酸塩、パモ酸塩、パルミチン酸塩、燐酸塩/二燐酸塩、サリチル酸塩、ステアリン酸塩、硫酸塩、こはく酸塩、酒石酸塩、トシル酸塩。
【0075】
本発明は本発明の化合物のプロドラッグおよび代謝産物を本発明の範囲内に包含する。そのようなプロドラッグおよび代謝産物は一般に生体内で容易に活性化合物に変化し得る本化合物の機能的誘導体である。
【0076】
従って、本発明の治療方法における用語“投与する”は、具体的に開示した化合物または特定の本化合物として具体的には開示しなかったが明らかに本発明の範囲内に含まれるであろう化合物またはこれのプロドラッグまたは代謝産物を用いて本明細書に記述する症候群、障害または病気を治療、改善または予防する手段を包含する。
【0077】
用語“プロドラッグ”は、本発明の化合物(またはこれの塩)の機能的誘導体の製薬学的に許容される形態を意味し、このプロドラッグは、1)生体内で活性プロドラッグ成分に変化する比較的活性のある前駆体、2)生体内で活性プロドラッグ成分に変化する比較的不活性な前駆体、または3)生体内で利用可能になった後に治療的生物学的活性に貢献(即ち代謝産物として)する本化合物の活性が比較的低い成分であり得る。適切なプロドラッグ誘導体を選択および調製する通常の手順は、例えばH.Bundgaard編集の“Design of Produrgs”、Elsevier、1985などに記述されている。
【0078】
用語“代謝産物”は、本発明の化合物(またはこれの塩)の代謝誘導体の製薬学的に許容される形態を意味し、この誘導体は、生体内で利用可能になった後に治療的生物学的活性に貢献する本化合物の活性が比較的低い成分である。
【0079】
本発明は、化合物のいろいろな異性体およびこれらの混合物を包含する。用語“異性体”は、組成および分子量は同じであるが物理的および/または化学的特性が異なる化合物を指す。そのような物質が有する原子の数および種類は同じであるが、構造は異なる。その構造の差は構成の差(幾何異性体)または偏光面回転性の差(立体異性体)であり得る。
【0080】
用語“立体異性体”は、構成は同じであるが原子の空間配置が異なる異性体を指す。鏡像異性体およびジアステレオマーは、不斉置換されている炭素原子がキラル中心として働く立体異性体である。用語“キラル”は、分子が鏡像に重なり合わないことを指し、これは、対称軸および面または中心が存在しないことを意味する。用語“鏡像異性体”は、互いに鏡像であるが重なり合わない1対の分子種の中の一方を指す。用語“ジアステレオマー”は、鏡像に関係しない立体異性体を指す。記号“R”および“S”は、不斉炭素原子1個または2個以上の回りの置換基の配置を表す。記号“R*”および“S*”は、不斉炭素原子1個または2個以上の回りの置換基の相対的配置を表す。
【0081】
用語“ラセミ化合物”または“ラセミ混合物”は、2種類の鏡像異性体種が等モル量で存在する化合物を指し、この化合物は光学活性を示さない。用語“光学活性”は、キラル分子またはキラル分子の非ラセミ混合物が偏光面を回転させる度合を指す。
【0082】
用語“幾何異性体”は、炭素−炭素二重結合、シクロアルキル環または橋状二環式系に関して置換基の原子の配向が異なる異性体を指す。炭素−炭素二重結合の各側に位置する置換基の原子(H以外)はEまたはZ配置であり得る。“E”(相対する側)または“椅子形”配置の場合の置換基は炭素−炭素二重結合に関して相対する側に位置し、“Z”(同じ側)または“舟形”配置の場合の置換基は炭素−炭素二重結合に関して同じ側に配向している。炭素環式環と結合している置換基の原子(H以外)はシスまたはトランス配置であり得る。“シス”配置の場合の置換基は環の面に関して同じ側に位置し、“トランス”配置の場合の置換基は環の面に関して相対する側に位置する。“シス”と“トランス”種の混合物を有する化合物を“シス/トランス”と表示する。橋状二環式系と結合している置換基の原子(H以外)は“エンド”または“エキソ”配置であり得る。“エンド”配置の場合の置換基は残りの2個のブリッジの中の大きい方に向かうブリッジ(ブリッジヘッドではない)地点に結合しており、“エキソ”配置の場合の置換基は残りの2個のブリッジの中の小さい方に向かうブリッジ地点に結合している。
【0083】
本発明の化合物を調製する時に用いるいろいろな置換立体異性体、幾何異性体およびこれらの混合物は商業的に入手可能であるか、商業的に入手可能な出発材料を用いて合成的に調製可能であるか、或は異性体混合物として調製した後に通常の当業者に良く知られている技術を用いて分割した異性体として得ることができると理解されるべきである。
【0084】
異性体記述子“R”、“S”、“S*”、“R*”、“E”、“Z”、“シス”、“トランス”、“エキソ”および“エンド”を本明細書に記述する場合、これらは、中心分子に関する原子配置を指しそしてそれらを文献(IUPAC Recommendations for Fundamental Stereochemistry(Section E)、Pure Appl.Chem.、1976、45:13−30)に定義されている如く用いることを意図する。
【0085】
本発明の化合物は異性体に特異的な合成を用いて個々の異性体として調製可能であるか或は異性体混合物から分割可能である。通常の分割技術には、光学的活性塩を用いて異性体対の各異性体の遊離塩基を生じさせ(続いて分別結晶化そして遊離塩基の再生を行い)、異性体対の各異性体のエステルまたはアミドを生じさせる(続いてクロマトグラフィーによる分離そしてキラル補助剤の除去を行う)か或は良く知られている調製用TLC(薄層クロマトグラフィー)またはキラルHPLCカラムを用いて出発材料または最終的化合物のいずれかの異性体混合物に分割を受けさせることが含まれる。
【0086】
その上、本発明の化合物は1種以上の多形体または非晶質結晶形態も取り得、このように、それらも本発明の範囲内に包含させることを意図する。加うるに、本化合物の数種は水と一緒に溶媒和物(即ち水化物)または通常の有機溶媒と一緒に溶媒和物を形成する可能性があり、それらもまた本発明の範囲内に包含させることを意図する。
【0087】
本発明の化合物を生じさせる過程のいずれかを行っている間に、関係する分子のいずれかが有する敏感または反応性基を保護する必要がありそして/またはその方が望ましい可能性がある。これは通常の保護基、例えばJ.F.W.McOmie編集、Protective Groups in Organic Chemistry、Plenum Press、1973およびT.W.Greene & P.G.M.Wuts、Protective Groups in Organic Synthesis、John
Wiley & Sons、1991に記述されている如き保護基を用いて達成可能で
ある。このような保護基は当該技術分野で公知の方法を用いて後の便利な段階で除去可能である。
【0088】
治療的使用
CB1およびCB2カンナビノイド受容体はG蛋白質共役受容体(GCPR)ファミリー、即ち7回膜貫通ドメインのパターンが独特である受容体スーパーファミリーに属し、これはN型カルシウムチャンネルを阻害しそして/またはアデニレートシクラーゼを阻害することでQ型カルシウムチャンネルを阻害する。CB1受容体はCNS内に存在し、主に記憶および運動に関連した脳領域、例えば海馬(記憶の貯蔵)、小脳(運動機能、姿勢および均衡の調整)、基底核(運動調節)、視床下部(体温調節、神経内分泌物放出、食欲)、脊髄(痛覚)、大脳皮質(嘔吐)および末梢領域、例えばリンパ器官(細胞媒介および先天性免疫)、血管平滑筋細胞(血圧)、消化管(食道および胃腸の運動を調節する管および食道、十二指腸、空腸、回腸および大腸における先天性抗炎症)、肺平滑筋細胞(気管支拡張)、眼毛様体(眼圧)などの中に発現する。
【0089】
CB2受容体は主にリンパ組織(細胞媒介および先天性免疫)、末梢神経末端部(末梢神経系)、脾臓免疫細胞(免疫系の調節)および網膜(眼圧)内の末端に発現すると思われる。CB2 mRNAはCNS内の小脳顆粒細胞(運動機能の調整)内に存在する。薬理学的および生理学的証拠はまた他のカンナビノイド受容体サブタイプが存在することも示唆しているが、それらはまだクローン化も特徴付けも成されていない。
【0090】
CB受容体を活性化または阻害することによっていろいろな症候群、障害または病気を調節することができると思われるが、臨床的用途の可能な領域には、これらに限定するものでないが、食欲の調節、代謝の調節、糖尿病、緑内障関連眼圧の低下、社会的および気分障害の治療、発作関連障害の治療、薬物乱用障害の治療、学習、認識および記憶の向上、器官収縮および筋けいれんの制御、腸障害の治療、呼吸器障害の治療、自発運動または運動障害の治療、免疫および炎症障害の治療、細胞増殖の調節、疼痛管理における使用、神経保護薬としての使用などが含まれる。
【0091】
従って、本発明の式(I)または(Ia)で表される化合物を包含するカンナビノイド受容体モジュレーターは、カンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防で用いるに有用であり、それらには、これらに限定するものでないが、食欲の調節、代謝の調節、糖尿病、緑内障関連眼圧、痛み、社会的および気分障害、発作関連障害、薬物乱用障害、学習、認識および/または記憶障害、腸障害、呼吸器障害、自発運動障害、運動障害、免疫障害または炎症障害、器官収縮および筋けいれんの制御、学習、認識および/または記憶の向上、細胞増殖の調節、神経保護作用の供与などが含まれる。
【0092】
本発明は、カンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法に向けたものであり、これは、前記被験体に式(I)で表される化合物を有効な量で投与する段階を含んで成る。
【0093】
本発明は、カンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法に向けたものであり、これは、前記被験体に式(Ia)で表される化合物またはこれのプロドラッグ、代謝産物または組成物を有効な量で投与する段階を含んで成る。
【0094】
本発明は、カンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法に向けたものであり、これは、前記被験体に式(I)で表される化合物および治療薬を有効な量で含有して
成る組み合わせ製品および/または治療薬を投与する段階を含んで成る。
【0095】
本発明は、カンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法に向けたものであり、これは、前記被験体に式(Ia)で表される化合物および治療薬を有効な量で含有して成る組み合わせ製品および/または治療薬を投与する段階を含んで成る。
【0096】
本発明の組み合わせ製品および/または治療薬で用いることを意図する治療薬には、抗けいれん薬または避妊薬が含まれる。そのような抗けいれん薬には、これらに限定するものでないが、トピラメート、トピラメートの類似物、カルバマゼピン、バルプロ酸、ラモトリジン、ガバペンチン、フェニトインなどおよびこれらの混合物または製薬学的に許容される塩が含まれる。避妊薬には、これらに限定するものでないが、例えばプロゲスチンのみの避妊薬およびプロゲスチン成分とエストロゲン成分の両方を含有する避妊薬などが含まれる。本発明は、更に、前記避妊薬が経口避妊薬でありそして前記避妊薬が場合により葉酸成分を含有していてもよい製薬学的組成物も包含する。
【0097】
本発明は、また、被験体に避妊を施す方法も包含し、これは、前記被験体に避妊薬および式(I)または(Ia)で表されるCB1受容体逆作動薬もしくは拮抗薬化合物を含有して成っていて当該被験体における喫煙衝動を低下させそして/または当該被験体の減量に役立つ組成物を投与する段階を含んで成る。
【0098】
本発明は、CB受容体媒介症候群、障害または病気の治療、改善または予防に有用なカンナビノイド受容体モジュレーターを包含する。本発明の化合物またはこれの組成物がCBモジュレーターとして有用であることは本明細書に開示する方法に従って決定可能である。そのような使用の範囲には、複数のCB受容体媒介症候群、障害または病気の治療、改善または予防が含まれる。
【0099】
本発明は、また、CB受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法にも向けたものであり、ここで、前記症候群、障害または病気は、食欲、代謝、糖尿病、緑内障関連眼圧、社会的および気分障害、発作、薬物乱用、学習、認識または記憶、器官収縮または筋けいれん、腸障害、呼吸器障害、自発運動または運動障害、免疫および炎症障害、無秩序な細胞増殖、疼痛管理、神経保護作用などに関連している。
【0100】
CB受容体モジュレーターとして用いるに適した式(I)または(Ia)で表される化合物には、CB受容体結合活性に関する平均阻害定数(IC50)が約50μMから約0.01nMの範囲、約25μMから約0.01nMの範囲、約15μMから約0.01nMの範囲、約10μMから約0.01nMの範囲、約1μMから約0.01nMの範囲、約800nMから約0.01nMの範囲、約200nMから約0.01nMの範囲、約100nMから約0.01nMの範囲、約80nMから約0.01nMの範囲、約20nMから約0.01nMの範囲、約10nMから約0.1nMの範囲、または約0.1nMの化合物が含まれる。
【0101】
本発明のCB受容体モジュレーターとして用いるに適した式(I)または(Ia)で表される化合物には、CB1作動薬結合活性に関するCB1作動薬IC50が約50μMから約0.01nMの範囲、約25μMから約0.01nMの範囲、約15μMから約0.01nMの範囲、約10μMから約0.01nMの範囲、約1μMから約0.01nMの範囲、約800nMから約0.01nMの範囲、約200nMから約0.01nMの範囲、約100nMから約0.01nMの範囲、約80nMから約0.01nMの範囲、約20nMから約0.01nMの範囲、約10nMから約0.1nMの範囲、または約0.1
nMの化合物が含まれる。
【0102】
本発明のCB受容体モジュレーターとして用いるに適した式(I)または(Ia)で表される化合物には、CB1拮抗薬結合活性に関するCB1拮抗薬IC50が約50μMから約0.01nMの範囲、約25μMから約0.01nMの範囲、約15μMから約0.01nMの範囲、約10μMから約0.01nMの範囲、約1μMから約0.01nMの範囲、約800nMから約0.01nMの範囲、約200nMから約0.01nMの範囲、約100nMから約0.01nMの範囲、約80nMから約0.01nMの範囲、約20nMから約0.01nMの範囲、約10nMから約0.1nMの範囲、または約0.1nMの化合物が含まれる。
【0103】
本発明のCB受容体モジュレーターとして用いるに適した式(I)または(Ia)で表される化合物には、CB1逆作動薬結合活性に関するCB1逆作動薬IC50が約50μMから約0.01nMの範囲、約25μMから約0.01nMの範囲、約15μMから約0.01nMの範囲、約10μMから約0.01nMの範囲、約1μMから約0.01nMの範囲、約800nMから約0.01nMの範囲、約200nMから約0.01nMの範囲、約100nMから約0.01nMの範囲、約80nMから約0.01nMの範囲、約20nMから約0.01nMの範囲、約10nMから約0.1nMの範囲、または約0.1nMの化合物が含まれる。
【0104】
本発明のCB受容体モジュレーターとして用いるに適した式(I)または(Ia)で表される化合物には、CB2作動薬結合活性に関するCB2作動薬IC50が約50μMから約0.01nMの範囲、約25μMから約0.01nMの範囲、約15μMから約0.01nMの範囲、約10μMから約0.01nMの範囲、約1μMから約0.01nMの範囲、約800nMから約0.01nMの範囲、約200nMから約0.01nMの範囲、約100nMから約0.01nMの範囲、約80nMから約0.01nMの範囲、約20nMから約0.01nMの範囲、約10nMから約0.1nMの範囲、または約0.1nMの化合物が含まれる。
【0105】
本発明のCB受容体モジュレーターとして用いるに適した式(I)または(Ia)で表される化合物には、CB2拮抗薬結合活性に関するCB2拮抗薬IC50が約50μMから約0.01nMの範囲、約25μMから約0.01nMの範囲、約15μMから約0.01nMの範囲、約10μMから約0.01nMの範囲、約1μMから約0.01nMの範囲、約800nMから約0.01nMの範囲、約200nMから約0.01nMの範囲、約100nMから約0.01nMの範囲、約80nMから約0.01nMの範囲、約20nMから約0.01nMの範囲、約10nMから約0.1nMの範囲、または約0.1nMの化合物が含まれる。
【0106】
本発明のCB受容体モジュレーターとして用いるに適した式(I)または(Ia)で表される化合物には、CB2逆作動薬結合活性に関するCB2逆作動薬IC50が約50μMから約0.01nMの範囲、約25μMから約0.01nMの範囲、約15μMから約0.01nMの範囲、約10μMから約0.01nMの範囲、約1μMから約0.01nMの範囲、約800nMから約0.01nMの範囲、約200nMから約0.01nMの範囲、約100nMから約0.01nMの範囲、約80nMから約0.01nMの範囲、約20nMから約0.01nMの範囲、約10nMから約0.1nMの範囲、または約0.1nMの化合物が含まれる。
【0107】
用語“カンナビノイド受容体”は、本発明のカンナビノイドモジュレーター化合物が結合し得る種類のカンナビノイド受容体の公知または今までに知られていないサブタイプのいずれか1つ、特にCB1受容体およびCB2受容体から成る群から選択されるカンナビ
ノイド受容体を指す。用語“モジュレーター“は、更に、本発明の化合物をCB受容体作動薬、拮抗薬または逆作動薬として用いることを指す。
【0108】
本発明は、CB受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明の化合物またはこれの組成物を有効な量で投与する段階を含んで成り、ここで、カンナビノイド受容体はCB1またはCB2受容体であり、そして本化合物は前記受容体の作動薬、拮抗薬または逆作動薬である。
【0109】
本発明は、CB受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明の化合物またはこれの組成物を治療薬、例えば抗けいれん約または避妊薬などと一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成り、ここで、カンナビノイド受容体はCB1またはCB2受容体であり、そして本化合物は前記受容体の作動薬、拮抗薬または逆作動薬である。
【0110】
組み合わせ製品および/または治療薬で用いるに適した避妊薬を経口避妊薬に限定するものでなく、それにまた他の通常利用可能な避妊薬、例えば経皮、注射または移植などで投与されるそれらも包含させると理解されるべきである。
【0111】
更に明記する場合を除き、“組み合わせ製品および/または治療薬”は式(I)または(Ia)で表される化合物と1種以上の治療薬を含有して成る製薬学的組成物を意味する。式(I)または(Ia)で表される化合物と1種以上の治療薬の投薬量をそれらが組み合わせた時に有効な量を達成するように調整する。
【0112】
本明細書で用いる如き用語“被験体”は、治療、観察または実験の対象でありかつCB受容体媒介症候群、障害または病気を発症する危険性のある(または発症し易い)患者を指し、これは動物、好適には哺乳動物、最も好適にはヒトであり得る。
【0113】
用語“投与”は、本発明の方法に応じて解釈されるべきである。そのような方法には、本発明の組成物または薬剤を治療過程中のいろいろな時または組み合わせ形態の時には製品として同時に有効な量で治療的または予防的に投与することを包含する。
【0114】
予防的投与を実施する時期はCB受容体媒介症候群、障害または病気に特徴的な症状が現れる前であってもよく、その結果として、その症候群、障害または病気を治療するか、改善するか、予防するかまたは他の様式で進行を遅らせる。更に、本発明の方法は当業者が用いる治療的もしくは予防的な処置療法の全部を包含すると理解されるべきである。
【0115】
用語“有効な量”は、研究者、獣医、医者または他の臨床医が探求している活性化合物または薬剤が組織、系、動物またはヒトに生物学的または医薬的反応(治療すべき症候群、障害または病気の症状の軽減を包含)を引き出す量を指す。本発明の化合物の有効な量は約0.001mg/kg/日から約300mg/kg/日である。
【0116】
本発明が式(I)で表される化合物と抗けいれん薬または避妊薬の組み合わせを投与することを意図する場合の用語“有効な量”は、薬剤を一緒にした時の組み合わせ効果が所望の生物学的または医薬的反応を引き出す組み合わせた量を意味する。
【0117】
当業者が理解するであろうように、その組み合わせ製品を構成する成分の有効な量を個別に最適に組み合わせることができかつそれらを組み合わせることで当該組み合わせ製品の成分を単独で用いた時にもたらされるであろう病状軽減よりも高い病状軽減をもたらす
相乗的結果を達成することができる。
【0118】
例えば、式(I)で表される化合物とトピラメートを投与することを包含する組み合わせ製品および/または治療薬の有効な量は、式(I)で表される化合物およびトピラメートを一緒にまたは逐次的に用いた時に有効な組み合わせ効果をもたらすそれらの量であろう。その上、当業者は、組み合わせ製品および/または治療薬を有効な量で用いる場合の式(I)で表される化合物の量および/または抗けいれん薬(例えばトピラメート)の量はこの上に示した例の場合と同様に個別に有効な量であってもよいか或は有効な量でなくてもよいことも認識するであろう。
【0119】
本発明が組み合わせ製品および/または治療薬の投与に向けたものである場合、本化合物と抗けいれん薬または避妊薬を適切な任意手段で同時、逐次的または単一の製薬学的組成物として共投与してもよい。本化合物1種または2種以上と抗けいれん薬または避妊薬成分を個別に投与する場合、1日に投与する各化合物1種または2種以上の投薬回数は必ずしも同じでなくてもよく、例えば一方の化合物が示す作用期間の方が長い場合などでは同じでなくてもよく、従って、投与頻度を少なくする。
【0120】
式(I)で表される化合物1種または2種以上と抗けいれん薬1種または2種以上または避妊薬1種または2種以上を同じまたは異なる投薬経路で投与してもよい。式(I)で表される化合物1種または2種以上と抗けいれん薬1種または2種以上または避妊薬1種または2種以上を同じまたは異なる投与経路で投与してもよい。
【0121】
投与方法の適切な例は経口、静脈内(iv)、吸入内(im)および皮下(sc)である。また、化合物を神経系に直接投与することも可能であり、それには、これらに限定するものでないが、脳内、心室内、脳室内、髄腔内、嚢内、脊髄内および/または頭蓋内または脊髄内針および/またはカテーテル(ポンプ装置の使用有り無し)を用いた送達による脊髄周囲投与経路が含まれる。
【0122】
式(I)で表される化合物1種または2種以上と抗けいれん薬1種または2種以上または避妊薬1種または2種以上を同時または交互療法に従って治療過程中の同じまたは異なる時間にか、分割してか或は単一形態で同時に投与してもよい。
【0123】
当業者は最適な投与量を容易に決定することができ、これは使用する個々の化合物、投与様式、および製剤の濃度および病気状態の進行度合に伴って変わるであろう。加うるに、治療すべき個々の患者に関連した要因によって結果として投薬量を調節する必要もあり、そのような要因には、患者の性、年齢、体重、食事、投与時間および付随する病気が含まれる。
【0124】
用語“CB受容体媒介症候群、障害または病気”は、不快または有機体に期待される寿命の低下をもたらすようにCB受容体が媒介する生物学的反応に関連した症候群、障害または病気を指す。
【0125】
CB受容体媒介症候群、障害または病気は動物およびヒトの両方に起こり得、それらには食欲、代謝、糖尿病、肥満、緑内障関連眼圧、社会的、気分、発作、薬物乱用、学習、認識、記憶、器官収縮、筋けいれん、腸、呼吸器、自発運動、運動、免疫、炎症、細胞増殖、痛みまたは神経変性に関連した症候群、障害または病気が含まれる。
【0126】
食欲関連症候群、障害または病気には、肥満、体重過剰状態、拒食症、過食症、悪液質、食欲無調節などが含まれる。
【0127】
肥満関連症候群、障害または病気には、遺伝、食事、食物摂取量、代謝関性症候群、障害または病気、視床下部性障害または病気、加齢、活動低下、異常脂肪質量分布、異常脂肪画分分布などの結果として生じる肥満が含まれる。
【0128】
代謝関連症候群、障害または病気には、代謝症候群、脂質異常症、高血圧、糖尿病、インスリン感受性もしくは耐性、高インスリン血症、高コレステロール血症、高脂血症、高トリグリセリド血症、アテローム性動脈硬化症、肝腫大、脂肪症、異常アラニンアミノトランスフェラーゼレベル、炎症、アテローム性動脈硬化症などが含まれる。
【0129】
糖尿病関連症候群、障害または病気には、糖調節異常、インスリン耐性、耐糖能異常、高インスリン血症、脂質異常症、高血圧、肥満などが含まれる。
【0130】
2型糖尿病(インスリン非依存性糖尿病)は、糖調節異常およびインスリン耐性の結果として慢性の長期医学的合併症を青年および成年の両方にもたらすことで眼、腎臓、神経および血管に影響を与えかつ盲目、最終段階の腎疾患、心筋梗塞または手足切断をもたらす可能性のある代謝障害(即ち代謝関連症候群、障害または病気)である。糖調節異常には、インスリンを充分な量で産生することができないこと(異常インスリン分泌)およびインスリンを有効に用いることができないこと(標的器官および組織におけるインスリン作用に対する抵抗)が含まれる。2型糖尿病に苦しんでいる人は関連したインスリン欠乏を示す。即ち、そのような人では、血漿中インスリン濃度が絶対的意味で正常から高いが、存在する血漿中糖濃度で予測される濃度よりも低い。
【0131】
2型糖尿病は下記の臨床的兆候および症状で特徴づけられる:持続的に高い血漿中糖濃度または高血糖、多尿症、多渇症および/または多食症、慢性的微小血管合併症、例えば網膜症、腎症および神経障害など、および大血管合併症、例えば高脂血症および高血圧など。そのような微小および大血管合併症によって盲目、最終段階の腎疾患、手足切断および心筋梗塞がもたらされる可能性がある。
【0132】
インスリン抵抗症候群(IRS)(またX症候群、代謝症候群またはX代謝症候群とも呼ばれる)は、2型糖尿病および心疾患を発症する危険因子を示す障害であり、それには、耐糖能異常、高インスリン血症、インスリン耐性、脂質異常(例えば高トリグリセリド、低HDL−コレステロールなど)、高血圧および肥満が含まれる。
【0133】
社会的または気分関連症候群、障害または病気には、鬱病、不安、精神病、社会的感情障害または認識障害などが含まれる。
【0134】
薬物乱用関連症候群、障害または病気には、薬物乱用、薬物離脱、アルコール中毒、アルコール離脱、ニコチン離脱、コカイン中毒、コカイン離脱、ヘロイン中毒、ヘロイン離脱などが含まれる。
【0135】
学習、認識または記憶関連症候群、障害または病気には、記憶喪失または加齢、病気、薬剤の副作用(有害事象)の結果として起こる障害が含まれる。
【0136】
筋けいれん症候群、障害または病気には、多発性硬化症、脳性麻痺などが含まれる。
【0137】
自発運動および運動症候群、障害または病気には、脳卒中、パーキンソン病、多発性硬化症、てんかんなどが含まれる。
【0138】
腸関連症候群、障害または病気には、腸運動不全関連障害(痛み、下痢または便秘に付随するか或は付随しない)、過敏性腸症候群(および他の形態の腸運動不全など)、炎症
性腸疾患(例えば潰瘍性大腸炎、クローン病など)およびセリアック病が含まれる。
【0139】
本発明の一例には、痛みを伴うか或は伴わない炎症に関連した腸関連症候群、障害または病気、例えば炎症性腸疾患、手術、外傷または外傷の結果としてもたらされる後遺症、腹腔内炎症、基底肺炎(basal pneumonia)、心筋梗塞、代謝障害またはこれらの任意組み合わせのいずれかから生じる炎症に関連した腸運動障害などが含まれる。
【0140】
痛みを伴うか或は伴わない炎症に関連した本発明の腸関連症候群、障害または病気の例には、炎症性腸疾患、例えば潰瘍性大腸炎、クローン病またはセリアック病などが含まれる。手術によって生じる炎症に関連した腸運動障害には、腹部手術、移植手術、腸切除、整形手術、心臓血管手術または婦人科手術が含まれる。外傷には転倒、車の事故または人的暴力が含まれる。外傷の結果としてもたらされる後遺症には手足骨折、肋骨骨折、脊椎骨折、胸部傷害、虚血または後腹膜犠牲(retroperitoneal hecatomb)が含まれる。腹腔内炎症には腹腔内敗血症、急性虫垂炎、胆嚢炎、膵炎または尿管疝痛が含まれる。
【0141】
呼吸関連症候群、障害または病気には、慢性閉塞性肺疾患、気腫、喘息、気管支炎などが含まれる。
【0142】
免疫または炎症関連症候群、障害または病気には、アレルギー、関節リウマチ、皮膚炎、自己免疫病、免疫不全、慢性神経障害性痛などが含まれる。
【0143】
細胞増殖関連症候群、障害または病気には、哺乳動物細胞増殖異常調節、乳癌細胞増殖、前立腺癌細胞増殖などが含まれる。
【0144】
痛み関連症候群、障害または病気には、中枢および末梢路媒介痛、骨および関節の痛み、片頭痛関連痛、癌痛、生理痛、陣痛などが含まれる。
【0145】
神経変性関連症候群、障害または病気には、パーキンソン病、多発性硬化症、てんかん、虚血または外傷による頭または脳傷害に付随する二次的な生化学的傷害、脳炎症、眼傷害または脳卒中などが含まれる。
【0146】
本発明は、カンナビノイド受容体作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のカンナビノイド作動薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0147】
本発明は、カンナビノイド受容体作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のカンナビノイド作動薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0148】
本発明は、カンナビノイド受容体逆作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のカンナビノイド逆作動薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0149】
本発明は、カンナビノイド受容体逆作動薬によって調節される症候群、障害または病気
の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のカンナビノイド逆作動薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0150】
本発明は、カンナビノイド受容体逆作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のカンナビノイド逆作動薬化合物またはこれの組成物を1種以上の避妊薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0151】
本発明は、カンナビノイド受容体拮抗薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のカンナビノイド拮抗薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0152】
本発明は、カンナビノイド受容体拮抗薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のカンナビノイド拮抗薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0153】
本発明は、カンナビノイド受容体拮抗薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のカンナビノイド拮抗薬化合物またはこれの組成物を1種以上の避妊薬と一緒に組み合わせ製品および/または治療薬として治療的または予防的に有効な量で投与する段階を含んで成る。
【0154】
本発明は、CB1受容体作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1作動薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0155】
本発明は、CB1受容体作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1作動薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0156】
本発明は、CB1受容体逆作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1逆作動薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0157】
本発明は、CB1受容体逆作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1逆作動薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0158】
本発明は、CB1受容体逆作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1逆作動薬化合物またはこれの組成物を1種以上の避妊薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0159】
本発明は、CB1受容体逆作動薬によって調節される食欲関連肥満または代謝関連症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1逆作動薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0160】
本発明は、CB1受容体逆作動薬によって調節される食欲関連肥満または代謝関連症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1逆作動薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0161】
本発明は、CB1受容体逆作動薬によって調節される食欲関連肥満または代謝関連症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1逆作動薬化合物またはこれの組成物を1種以上の避妊薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0162】
食欲関連症候群、障害または病気には、肥満、体重過剰状態、拒食症、過食症、悪液質、食欲無調節などが含まれる。
【0163】
肥満関連症候群、障害または病気には、遺伝、食事、食物摂取量、代謝関性症候群、障害または病気、視床下部性障害または病気、加齢、活動低下、異常脂肪質量分布、異常脂肪画分分布などの結果として生じる肥満が含まれる。
【0164】
代謝関連症候群、障害または病気には、代謝症候群、脂質異常症、高血圧、糖尿病、インスリン感受性もしくは抵抗性、高インスリン血症、高コレステロール血症、高脂血症、高トリグリセリド血症、アテローム性動脈硬化症、肝腫大、脂肪症、異常アラニンアミノトランスフェラーゼレベル、炎症、アテローム性動脈硬化症などが含まれる。
【0165】
本発明は、CB1受容体拮抗薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1拮抗薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0166】
本発明は、CB1受容体拮抗薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1拮抗薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0167】
本発明は、CB1受容体拮抗薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB1拮抗薬化合物またはこれの組成物を1種以上の避妊薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段
階を含んで成る。
【0168】
本発明は、CB2受容体作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB2作動薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0169】
本発明は、CB2受容体作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB2作動薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0170】
本発明は、CB2受容体逆作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB2逆作動薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0171】
本発明は、CB2受容体逆作動薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB2逆作動薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0172】
本発明は、CB2受容体拮抗薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB2拮抗薬化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0173】
本発明は、CB2受容体拮抗薬によって調節される症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明のCB2拮抗薬化合物またはこれの組成物を抗けいれん薬と一緒に組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0174】
本発明は、代謝関連症候群、障害または病気、食欲関連症候群、障害または病気、糖尿病関連症候群、障害または病気、肥満関連症候群、障害または病気または学習、認識または記憶関連症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明の化合物またはこれの組成物を有効な量で投与する段階を含んで成る。
【0175】
本発明は、代謝関連症候群、障害または病気、食欲関連症候群、障害または病気、糖尿病関連症候群、障害または病気、肥満関連症候群、障害または病気または学習、認識または記憶関連症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法を包含し、この方法は、前記被験体に本発明の化合物またはこれの組成物を抗けいれん薬との組み合わせ製品および/または治療薬として有効な量で投与する段階を含んで成る。
【0176】
本発明は、本発明の化合物と任意の製薬学的に許容される担体の混合物を含有して成る製薬学的組成物もしくは製剤を包含する。
【0177】
本発明は、本発明の2種以上の化合物と任意の製薬学的に許容される担体の混合物を含有して成る製薬学的組成物もしくは製剤を包含する。
【0178】
本発明は、また、式(I)で表される化合物と抗けいれん薬と任意の製薬学的に許容される担体の混合物を含有して成る製薬学的組成物もしくは製剤も包含する。
【0179】
そのような製薬学的組成物は、特に、代謝関連症候群、障害または病気、食欲関連症候群、障害または病気、糖尿病関連症候群、障害または病気、肥満関連症候群、障害または病気または学習、認識または記憶関連症候群、障害または病気に苦しんでいる被験体を治療する目的で用いるに有用である。
【0180】
式(I)または(Ia)で表される化合物と組み合わせて本発明の方法および組成物で用いるに有用な抗けいれん薬には、これらに限定するものでないが、トピラメート、トピラメート類似物、カルバマゼピン、バルプロ酸、ラモトリジン、ガバペンチン、フェニトインなどおよびこれらの混合物または製薬学的に許容される塩が含まれる。
【0181】
トピラメート、即ち2,3:4,5−ビス−O−(1−メチルエチリデン)−s−D−フラクトピラノーススルファメートは、単純および複雑部分てんかんにかかっている患者における発作および原発性または続発性全身発作にかかっている患者における発作を治療する目的で米国、ヨーロッパおよび世界中の他の大部分の市場で現在市販されている。トピラメートは経口投与用の活性薬剤含有量が25mg、100mgまたは200mgの円形錠剤として現在入手可能でありかつ経口投与用の15mgおよび25mgのスプリンクルカプセル(sprinkle capsules)としてホールカプセル(whole
capsules)または開放型(opened)としておよびスプリンクルドオンツーソフトフード(sprinkled onto soft food)の状態で現在入手可能である。米国特許第4,513,006号(引用することによって本明細書に組み入れられる)に、トピラメートおよびトピラメート類似物、それらの製造およびそれらをてんかんの治療で用いることが開示されている。加うるに、トピラメートの製造をまた米国特許第5,242,942号および5,384,327号(これらは引用することによって本明細書に組み入れら)に開示されている方法を用いて実施することも可能である。本明細書で用いる如き用語“トピラメート類似物”は、式(I)で表されるスルファメート化合物を指し、これらは米国特許第4,513,006号に開示されている(例えば米国特許第4,513,006号のコラム1の36−65行を参照)。
【0182】
本発明の方法でトピラメート(またはトピラメート類似物)を式(I)または(Ia)で表される化合物と組み合わせて用いる場合、それを1日当たり約10から約1000mgの範囲、好適には1日当たり約10から約650mgの範囲、より好適には約15から約325mgの範囲の量で日に1または2回投与してもよい。
【0183】
カルバマゼピン、即ち5H−ジベンゾ[b,f]アゼピン−5−カルボキサミドは抗けいれん薬および三叉神経痛用の特定の鎮痛薬であり、これは経口投与用の100mgのチュアブル錠、200mgの錠剤、100、200および400mgのXR(徐放)錠剤および100mg/5mL(茶サジ一杯)の懸濁液として入手可能であり、米国特許第2,948,718号(これは引用することによって全体が本明細書に組み入れられる)にカルバマゼピンおよびこれの使用方法が開示されている。
【0184】
本発明の方法で式(I)または(Ia)で表される化合物と組み合わせてカルバマゼピンを用いる場合、これを約200から約1200mg/日の範囲、好適には約400mg/日の量で投与してもよい。
【0185】
バルプロ酸、即ち2−プロピルペンタン酸またはジプロピル酢酸は抗てんかん薬であり、これはバルプロ酸含有量が250mgの軟質弾性カプセルおよびバルプロ酸がナトリウム塩として5mL当たり250mgに相当する量で入っているシロップとして商業的に入手可能である。バルプロ酸およびいろいろな製薬学的に許容される塩が米国特許第4,699,927号(これは引用することによって全体が本明細書に組み入れられる)に開示されている。
【0186】
本発明の方法で式(I)または(Ia)で表される化合物と組み合わせてバルプロ酸を用いる場合、これを約250から約2500mg/日の範囲、好適には約1000mg/日の量で投与してもよい。
【0187】
ラモトリジン、即ち3,5−ジアミノ−6−(2,3−ジクロロフェニル)−1,2,4−トリアジンは抗てんかん薬であり、これは経口投与用のラモトリジン含有量が25mg、100mg、150mgおよび200mgの錠剤およびラモトリジン含有量が2mg、5mgまたは25mgの分散性チュアブル錠として商業的に入手可能である。ラモトリジンおよびこれの使用が米国特許第4,486,354号(これは引用することによって全体が本明細書に組み入れられる)に開示されている。
【0188】
本発明の方法で式(I)または(Ia)で表される化合物と組み合わせてラモトリジンを用いる場合、これを1から2回の投与で約50から約600mg/日の範囲、好適には約200から約400mg/日、最も好適には約200mg/日の量で投与してもよい。
【0189】
ガバペンチン、即ち1−(アミノメチル)シクロヘキサン酢酸は、てんかんおよび成人におけるヘルペス後神経痛の補助療法の目的でガバペンチン含有量が100mg、300mgおよび400mgのカプセル、ガバペンチン含有量が600mgおよび800mgの膜被覆錠剤およびガバペンチン含有量が250mg/5mLの経口用溶液として商業的に入手可能である。ガバペンチンおよびこれの使用方法が米国特許第4,024,175号および4,087,544号(これらは引用することによって全体が本明細書に組み入れられる)に開示されている。
【0190】
本発明の方法で式(I)または(Ia)で表される化合物と組み合わせてガバペンチンを用いる場合、これを2から3回に分割した投薬で約300から約3600mg/日の範囲、好適には約300から約1800mg/日、最も好適には約900mg/日の量で投与してもよい。
【0191】
フェニトインナトリウム、即ち5,5−ジフェニルヒダントインのナトリウム塩は抗けいれん薬であり、これは経口投与の目的でフェニトインナトリウム含有量が100mg、200mgまたは300mgのカプセルとして商業的に入手可能である。
【0192】
本発明の方法で式(I)または(Ia)で表される化合物と組み合わせてフェニトインナトリウムを用いる場合、これを約100から約500mg/日の範囲、好適には約300から約400mg/日、最も好適には約300mg/日の量で投与してもよい。
【0193】
本発明は、また、式(I)または(Ia)で表される化合物と1種以上の避妊薬と任意の製薬学的に許容される担体の混合物を含有して成る製薬学的組成物または製剤も包含する。
【0194】
組み合わせ製品および/または治療薬として用いるに適した避妊薬には、例えばORTHO CYCLEN(商標)、ORTHO TRI−CYCLEN(商標)、ORTHO
TRI−CYCLEN LO(商標)およびORTHO EVRA(商標)が含まれ、これらは全部Ortho−McNeil Pharmaceutical,Inc.、Raritan、NJから入手可能である。また、本発明で用いるに適した避妊薬には葉酸成分を含有する避妊薬も含まれることも理解すべきである。
【0195】
喫煙および/または肥満は、経口避妊薬を服用している女性における危険因子であると識別されている。CB1受容体拮抗薬および逆作動薬は、喫煙衝動を低下させかつ摂食障害を有する患者の減量に役立つ有用な治療薬であることを見いだした。
【0196】
従って、本発明は、更に、避妊薬を服用している女性の喫煙および/または肥満に関連した危険因子を低下させる方法も包含し、ここでは、避妊薬を式(I)または(Ia)で表される少なくとも1種のCB1受容体拮抗薬および/またはCB1受容体逆作動薬化合物と一緒に共投与する。
【0197】
そのような化合物またはこれの製薬学的組成物または製剤を用いて、避妊薬を服用している患者の喫煙要望を低下させそして/または減量に役立たせる。
【0198】
製薬学的組成物
用語“組成物”は、指定材料を指定量で含有して成る製品ばかりでなく指定材料を指定量で組み合わせる結果として直接または間接的にもたらされる如何なる生成物も指す。本発明は、更に、本発明の1種以上の化合物と製薬学的担体を混合することも包含し、かつそのような方法の結果としてもたらされた組成物も包含する。意図する方法は伝統的および最新両方の製薬学的技術を包含する。
【0199】
別法としてか或は式(I)または(Ia)で表される化合物に加えて、本発明の製薬学的組成物に、式(I)または(Ia)で表される化合物の製薬学的に許容される塩または前記化合物または塩のプロドラッグまたは製薬学的に有効な代謝産物を製薬学的に許容される担体との混合物として含有させる。
【0200】
用語“製剤”は、カンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防で用いるに適した製品を指す。
【0201】
“製薬学的に許容される担体”は、本発明の組成物の調製で用いるに充分な純度および品質を有しかつ動物またはヒトに適切に投与された時に副作用もアレルギー反応も他の有害な反応ももたらすことのない分子的実体および組成物を意味する。
【0202】
臨床および獣医両方の使用を本発明の範囲内に等しく包含させることから、製薬学的に許容される製剤には臨床または獣医用途のいずれの組成物も薬製剤も含まれるであろう。
【0203】
本発明は、本化合物のいずれかと製薬学的に許容される担体を混合することを含んで成る組成物または製剤製造方法を包含し、かつそのような方法の結果としてもたらされた組成物または製剤も包含する。意図する方法は通常および通常ではない製薬学的技術の両方を包含する。他の例には、少なくとも2種類の本化合物を製薬学的に許容される担体と一緒に含有する混合物を含んで成る組成物または製剤が含まれる。
【0204】
そのような組成物または製剤は、投与方法に応じて幅広く多様な投薬単位形態物として投与可能であり、そのような方法には、これらに限定するものでないが、製薬学的投与分野の通常の技術者に良く知られている適切な投薬形態物を用いた経口、舌下、鼻(吸入または吹送)、経皮、直腸、膣、局所(閉鎖の有り無し)、静脈内(ボーラスまたは輸液)または注射(腹腔内、皮下、筋肉内、腫瘍内または非経口)が含まれる。従って、用語“
投薬単位“または“投薬形態物“をこれらに限定するものでないが錠剤、ピル、カプセル、溶液、シロップ、エリキシル、乳液、懸濁液、座薬、粉末、顆粒または無菌の溶液、乳液または懸濁液(アンプルを用いるか或は自己注入装置の如き装置を用いた注射、またはエーロゾル、スプレーまたは滴としての使用)を指す目的で互換的に用いる。その上、本組成物を週に1回または月に1回[例えば、筋肉内注射用持続製剤をもたらすに適した活性化合物の不溶塩(例えばデカン酸塩)などとして]投与するに適した形態で提供することも可能である。
【0205】
投薬形態物の調製では、主要な有効成分(例えば本発明の化合物またはこれの製薬学的に許容される塩、ラセミ体、鏡像異性体またはジアステレオマーなど)を場合により1種以上の製薬学的担体(例えば澱粉、糖、希釈剤、顆粒剤、滑剤、流動促進剤、結合剤、崩壊剤など)、1種以上の不活性な製薬学的賦形剤(例えば水、グリコール、油、アルコール、風味剤、防腐剤、着色剤、シロップなど)、1種以上の通常の製錠用材料(例えばコーンスターチ、ラクトース、スクロース、ソルビトール、タルク、ステアリン酸、ステアリン酸マグネシウム、燐酸ジカルシウム、いろいろなゴムのいずれかなど)および希釈剤(例えば水など)と一緒に混合することで均一な組成物(有効成分が混合物全体に渡ってむらなく分散または懸濁している)を生じさせてもよく、これは容易に本発明の化合物を等しい量で含有する投薬単位に細分可能である。
【0206】
結合剤には、これらに限定するものでないが、澱粉、ゼラチン、天然糖(例えばグルコース、ベータ−ラクトースなど)、コーン甘味料および天然および合成ゴム(例えばアカシア、トラガカント、オレイン酸ナトリウム、ステアリン酸ナトリウム、ステアリン酸マグネシウム、安息香酸ナトリウム、酢酸ナトリウム、塩化ナトリウムなど)が含まれる。崩壊剤には、これらに限定するものでないが、澱粉、メチルセルロース、寒天、ベントナイト、キサンタンゴムなどが含まれる。
【0207】
投与が容易なことから錠剤およびカプセルが有利な経口投薬単位形態物に相当し、この場合には、固体状の製薬学的担体を用いる。必要ならば、錠剤に糖または膜被覆または腸溶性膜被覆を標準的技術で受けさせることも可能である。また、錠剤に被覆を受けさせるか或は他の様式の複合化を受けさせることで治療効果を長引かせることも可能である。例えば、投薬形態物に内側投薬成分と外側投薬成分を含有させて外側成分を内側成分を覆う膜の形態にする。更に、前記2成分を胃の中で起こる崩壊に抵抗し(例えば腸溶性層)かつ内側成分が無傷のまま十二指腸の中に入り込むことを可能にする層または放出を遅らせるか或は持続させる層で分離することも可能である。いろいろな腸溶性および非腸溶性層または被覆材料(例えば高分子酸、シェラック、アセチルアルコール、酢酸セルロースなど)またはこれらの組み合わせを用いてもよい。
【0208】
本発明の化合物を経口投与の目的で混合することが可能な液状形態物には、これらに限定するものでないが、水溶液、適切な風味のシロップ、水性もしくは油性懸濁液(適切な合成もしくは天然ゴムである分散もしくは懸濁剤、例えばトラガカント、アカシア、アルギン酸塩、デキストラン、ナトリウムカルボキシメチルセルロース、メチルセルロース、ポリビニルピロリドン、ゼラチンなどを用いた)、風味を付けた乳液(例えば適切な食用油、例えば綿実油、胡麻油、ヤシ油、落花生油などを用いた)、エリキシルおよびいろいろな製薬学的に許容される媒体を用いた同様な他の液状形態物が含まれる。
【0209】
また、当該技術分野で公知のように、別法として、本化合物を注射で非経口投与することも可能である。非経口投与の場合、無菌の溶液または注射可能懸濁液が非経口媒体であり得、この場合には適切な液状担体、懸濁剤などを用いる。無菌の溶液が好適な非経口媒体である。静脈内投与が望まれる場合には、一般に適切な防腐剤を入れておいた等張性製剤を用いる。有効成分を適切な不活性液状担体に溶解または混合することで非経口製剤を
構成させてもよい。許容される液状担体は水性溶媒などおよび溶解性または防腐性を補助する他の任意の材料を含有して成る。そのような水性溶媒には、無菌水、リンゲル液または等張性食塩水溶液が含まれる。別法として、無菌の非揮発性油を溶媒作用剤として用いることも可能である。他の任意の材料には、植物油(例えば落花生油、綿実油、胡麻油など)、有機溶媒(例えばソルケタール、グリセロール、ホルミルなど)、防腐剤、等張剤、可溶化剤、安定剤、鎮痛剤などが含まれる。最終的投薬単位の有効成分含有量が0.005から10重量%になるように有効成分を液状担体に溶解または懸濁させることで非経口製剤の調製を実施する。
【0210】
本発明の化合物を適切な鼻内媒体を用いて鼻内投与することも可能である。本発明の化合物を適切な局所経皮媒体または経皮パッチを用いて局所的に投与することも可能である。経皮送達系による投与では断続的投与療法ではなく連続的投与が要求される。
【0211】
また、本発明の化合物を急速溶解もしくは徐放組成物によって投与することも可能であり、この場合、その組成物に急速に溶解するか或は徐放性の生分解性担体(例えば重合体担体など)および本発明の化合物を含有させる。急速に溶解するか或は徐放性の担体は当該技術分野で良く知られていて、活性化合物1種または2種以上を中に捕捉しそして適切な環境(例えば水溶液、酸性、塩基性など)下で急速またはゆっくりと分解/溶解する複合体を生じさせる目的で用いられる。そのような粒子は体液中で分解/溶解することでそれに入っている活性化合物1種または2種以上を放出することから有用である。そのような組成物で用いる本発明の化合物、担体または任意の賦形剤の粒径を通常の当業者に公知の技術を用いて最適に調整してもよい。
【0212】
本発明は、本化合物またはこれのプロドラッグが症状の軽減を必要としている被験体に必要な予防的または治療的に有効な量で存在する組成物を包含する。本化合物またはこれのプロドラッグの予防的または治療的に有効な量は約0.01ngから約1gの範囲であり得、それを当該被験体に適するように選択した投与方法および療法に適したいずれかの形態に構築してもよい。
【0213】
そのような予防的または治療的に有効な量は、治療すべき被験体および病気に応じて、約70kgの平均的体重の人の場合、1日当たり約0.01ng/kgから約300mg/kg、約0.1ng/kgから約200mg/kg、約0.5ng/kgから約100mg/kgまたは約0.1ng/kgから約50mg/kgの範囲であり得る。
【0214】
当業者は予防的または治療的に有効な最適な量および投与方法および療法を容易に決定することができ、これは治療すべき個々の患者に関連した要因(年齢、体重、食事および投与時間)、治療すべき状態のひどさ、用いる化合物および投薬単位、投与様式および製剤の濃度に応じて変わるであろう。
【0215】
1日当たり約1回から1日当たり約5回の計画で治療的または予防的に有効な量が達成されるように投薬単位1個または2個以上を投与してもよい。経口投与に好適な投薬単位は有効成分含有量が0.01、0.05、0.1、0.5、1.0、2.5、5.0、10.0、15.0、25.0、50.0、100、150、200、250または500mgの錠剤である。
【0216】
本明細書に記述する代表的化合物には下記から選択した化合物が含まれる:
【0217】
【表2】

【0218】
【表3】

【0219】
本明細書に記述する代表的化合物には更に下記から選択した化合物も含まれる:
【0220】
【表4】

【0221】
【表5】

【0222】
合成方法
本発明の代表的化合物の合成は以下に記述する一般的合成スキームに従って実施可能であり、それらを以下に示す特定の合成実施例の中により詳細に例示する。そのような一般的スキームおよび具体的実施例は例として示すものであり、本発明をその示す化学的反応および条件で限定するとして解釈されるべきでない。本スキームおよび実施例で用いるいろいろな出発材料の製造方法は当業者の技術の充分に範囲内である。本実施例の反応のいずれで得る収率も最適にする試みは全く行わなかった。当業者は、反応時間、温度、溶媒および/または反応体を常規通り変えることでそのような収率を高くする方法を知っているであろう。
【0223】
本発明の記述で用いる用語は一般的に用いられている用語であり、当業者に公知である。以下の省略形および式を本明細書で用いる場合、これらにその示す意味を持たせる:
【0224】
【表6】

【0225】
【化9】

【0226】
シクロオクタノン化合物A1の溶液(溶媒、例えばTHFなど中)と化合物A2(溶媒、例えば無水THFなどに入っており、ここで、Q−Xyは適切な反応基を表し、そしてQ−Xyの特定部分が反応生成物としてX4R4の中に取り込まれる)を塩基性条件下で反応させることで化合物A3を生じさせる。
【0227】
【化10】

【0228】
化合物A3の溶液(溶媒、例えばEt2O、THFなどまたはこれらの混合物中)を反応体溶液(例えば溶媒、例えばEt2OまたはTHFなどまたはこれらの混合物中のLHMDSなど)に不活性雰囲気下−78℃で滴下した後、約−78℃で約40分間撹拌する。化合物A4の溶液(溶媒、例えばEt2Oなど中)を滴下し、その混合物を約−78℃
で約1時間撹拌した後、室温に約2時間かけて温めることで化合物A5を粗生成物として得て、それをさらなる精製なしに次の段階で用いる。
【0229】
【化11】

【0230】
反応体(例えばK2CO3など)および置換ヒドラジンの一塩酸または二塩酸化合物A6を化合物A5の溶液(溶媒、例えばMeOH、EtOH、CH2Cl2などの中の1種以上に入っている)に不活性雰囲気下約0℃の温度で加える。その混合物を一晩撹拌しながら室温に温めることで処理後に化合物A7を得る。
【0231】
化合物A6のXaRa置換基部分は、異性体を分離した後に置換アミン基がN1位置にX1R1として存在するか或はN2位置にX2R2として存在し得る可能性を示している。化合物A7は異性体の混合物に相当し、それにはX1R1とX2R2異性体の混合物が存在する。
【0232】
ヒドラジンの塩酸塩または二塩酸塩化合物A6を当業者に公知の方法で遊離塩基に変化させることができる。本発明の実施例では、そのような遊離塩基をK2CO3との反応でインシトゥ(本スキームに例示の目的で示すように)または個別に生じさせる(次に反応混合物に添加する)。
【0233】
このスキームに例示するように、また、化合物A6にいろいろなXaRa置換基(本明細書の上で定義した如き)によるさらなる置換を受けさせることも可能である。多くの場合、そのような置換ヒドラジン化合物A6は商業的に入手可能である。商業的に入手可能でない場合、特別に置換されている化合物A6の調製を当業者に公知の方法を用いて実施してもよい。
【0234】
より具体的には、ハロゲン置換XaRa置換基部分と水加ヒドラジン溶液を還流下で反応させた後、さらなる精製無しに化合物A6の代わりに用いる。
【0235】
【化12】

【0236】
化合物A7の異性体混合物の分離をフラッシュクロマトグラフィー(適切な溶媒混合物、例えばヘキサンなど中約20%から約30%のEtOAcなどを用いて溶離させる)で実施することで精製された主異性体である化合物A8と主要でない異性体である化合物A9を得る。
【0237】
その主要な異性体である化合物A8はN1位がX1R1で置換されている(X2R2は必ずしも存在するとは限らない)。主要でない異性体である化合物A9はN2位がX2R2で置換されている(X1R1は存在しない)。
【0238】
【化13】

【0239】
その分離した主異性体化合物A8を反応体溶液(例えば溶媒、例えば水、MeOH、THFなどまたはこれらの混合物に入っているNaOHまたはLiOHの混合物)で処理した後、一晩撹拌することで、処理後に化合物A10を得る。
【0240】
【化14】

【0241】
反応体溶液(例えば溶媒、例えばCH2Cl2などに入っているSOCl2など)を化合物A10に不活性な窒素雰囲気下周囲温度で加える。その反応混合物を還流温度で約15分間撹拌することで、処理後に化合物A11を得る。
【0242】
【化15】

【0243】
化合物A11の溶液(場合によりTEAなどと混合しておいてもよい)を置換アミン化合物A12の溶液(溶媒、例えばCH2Cl2など中)に不活性な窒素雰囲気下周囲温度で加える。その混合物を室温である時間撹拌することで、処理後に化合物A13を得る。
【0244】
本スキームの目的で、化合物A12のXb部分は場合により置換されていてもよいアミノ部分であり、それによって、化合物A13のX3R3置換基部分が化合物A11のC3置換基のC(O)部分および化合物A12のXbRbに由来するXb部分を取り込む。
【0245】
一般に、化合物A12は商業的に入手可能な置換アミンである。商業的に入手可能でない場合、特別に置換されている化合物A12の調製は、適切に調製した化合物A11との反応に従い、当業者に公知の方法を用いて実施可能である。
【0246】
例えば、当業者に公知の官能基変換を用いて、XbRbがアルキルスルホニルアミノ部分またはアルキルカルバモイル部分(これらは各々更にアミノ部分が置換されていてもよい)である特別に置換されている化合物A12との反応で化合物A10を調製してもよい。
【0247】
本明細書の以下に示す合成実施例に本発明の範囲内に包含させる個々の化合物の調製をより完全に記述する。
【0248】
実施例1
1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1,3,3−トリメチル−ビシクロ[2.2.1]ヘプト−2−イル)−アミド(化合物1)
【0249】
【化16】

【0250】
段階1. LHMDS(0.33L、0.20モル)を無水Et2O(200mL)に入れることで生じさせた−78℃の溶液にN2雰囲気下でシクロオクタノン化合物1a(25.0g、0.20モル)をEt2O(100mL)に入れることで生じさせた溶液を滴下した。その混合物を−78℃に維持しながら60分間撹拌した。化合物1b(29.2g、0.20モル)を無水Et2O(100mL)に入れて滴下し、その混合物を−78℃で1時間撹拌した後、3時間かけて室温に温めて1時間撹拌した。その反応混合物の反応を水(100mL)で消滅させ、EtOAc(300mL)で希釈した後、有機層を分離して食塩水で洗浄し、無水硫酸ナトリウムで乾燥させた後、濾過しそして真空下で濃縮した。その結果として得た粗生成物をフラッシュクロマトグラフィー(ヘキサン中20%のEtOAcで溶離)で精製することで化合物1c(36g、80%)を得た。
【0251】
【化17】

【0252】
段階2. 化合物1c(3.7g、16.7ミリモル)をEtOH(50mL)に入れることで生じさせた周囲温度の溶液にN2雰囲気下でシクロヘキシル−ヒドラジンの塩酸塩化合物1d(2.5g、16.7ミリモル)およびK2CO3(2.31g、16.7ミリモル)を加えた。その反応混合物を一晩撹拌した後、水(25mL)で反応を消滅させそしてEtOAc(500mL)を用いた抽出を実施した。その有機層を分離し、食塩水で洗浄し、無水硫酸ナトリウムで乾燥させた後、濾過しそして真空下で濃縮することで化
合物1e(5g)を得て、これをさらなる精製なしに次の段階で用いた。
【0253】
【化18】

【0254】
段階3. 化合物1e(5g、16.4ミリモル)をTHF(25mL)に入れて、これに1NのNaOH(50mL)を加えた。その混合物を30時間撹拌し、1NのHClで酸性にしてpHを2にした後、EtOAc(100mL)を用いた抽出を実施した。その有機層を食塩水で洗浄し、硫酸ナトリウムで乾燥させた後、濾過しそして真空下で濃縮することで化合物1fを白色の固体として得た。化合物1fをCH2Cl2(50mL)に入れることで生じさせた周囲温度の溶液にN2雰囲気下で塩化チオニル(5.87g、49.3ミリモル)を加えた。その反応物を3時間撹拌した後、真空下で濃縮することで化合物1g(4.5g、91%)を明褐色の固体として得た。
【0255】
【化19】

【0256】
段階4. 1,3,3−トリメチル−ビシクロ[2.2.1]ヘプト−2−イルアミン化合物1h(0.87g、0.46ミリモル)とEt3N(0.10g、0.98ミリモル)をCH2Cl2(10mL)に入れることで生じさせた周囲温度の溶液にN2雰囲気下で化合物1g(0.130g、0.46ミリモル)をDCM(5mL)に入れることで生じさせた溶液を滴下した。その反応混合物を室温で3時間撹拌した後、水(10mL)およびCH2Cl2(50mL)で希釈した。その有機層を分離し、無水硫酸ナトリウムで乾燥させた後、濾過しそして真空下で濃縮した。その結果として得た粗油をフラッシュクロマトグラフィーにかけてヘキサン中20%のEtOAcを用いて精製することで化合物1(0.115g、63%)を白色の固体として得た。 MS m/z 412(M+)。
【0257】
実施例1の手順に従い、適切な出発材料、反応体および溶媒を代わりに用いることで下記の化合物を調製した:
【0258】
【表7】

【0259】
実施例2
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−1−フェニル−エチル]−アミド(化合物15)
【0260】
【化20】

【0261】
段階1. KOH(0.25g、4.46ミリモル)を水(4.4mL)に入れることで生じさせた溶液を4−フルオロ−ベンズアルデヒド化合物2a(1.07mL、10ミリモル)に加えた後、その混合物を65°Cに加熱した。シクロオクタノン化合物1a(1.26g、10ミリモル)を15分かけて滴下した。その混合物を5時間還流させた後、室温で一晩撹拌した。その反応混合物を1NのHCl(26mL)で酸性にした後、EtOAc(100mL)で抽出した。その有機層を食塩水で洗浄し、Na2SO4で乾燥させた後、濾過しそして濃縮した。その結果として得た黄色の残留物をシリカゲルカラムにかけて3%のEtOAc/ヘキサンを用いて精製することで(2E)−2−(4−フルオロ−ベンジリデン)−シクロオクタノン化合物2b(1.04g、44.8%)を得た。
【0262】
【化21】

【0263】
段階2. 化合物2b(1.04g、4.48ミリモル)をTHF(5mL)に入れることで生じさせた溶液をLHMDSの溶液(5.4mL、THF中1Mの溶液)に−78℃で滴下した。その結果として得た混合物を−78℃で1時間撹拌した後、しゅう酸ジエチルエステル化合物1b(0.61ml、4.48ミリモル)を滴下した。その混合物を−78°Cで1時間撹拌した後、室温になるまで徐々に温めて室温で一晩撹拌した。その反応混合物を1NのHClで酸性にした後、EtOAc(150mL)を用いた抽出を実施した。その有機層を1NのHCl(1×)そして水(2×)で洗浄し、Na2SO4で乾燥させた後、濾過しそして濃縮することで(3E)−[3−(4−フルオロ−ベンジリデン)−2−オキソ−シクロオクチル]−オキソ−酢酸エチルエステル化合物2cを黄色の油として得て、これをさらなる精製なしに次の段階で用いた。
【0264】
【化22】

【0265】
段階3. 化合物2c(4.48ミリモル)をエタノール(30mL)に入れることで生じさせた溶液にK2CO3(0.62g、4.48ミリモル)および(2,4−ジクロロ−フェニル)−ヒドラジン塩酸塩化合物2d(0.96g、4.50ミリモル)を加えた後、その混合物を室温で一晩撹拌した。その反応混合物を濾過した後、エタノール(20mL)で洗浄した。その濾液に濃縮を受けさせた後、それをシリカゲルカラムにかけて15%のEtOAc/ヘキサンを用いて精製することで(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸エチルエステル化合物2e(0.37g、最後の2段階で17.5%)を得た。
【0266】
【化23】

【0267】
段階4. 化合物2e(0.17g、0.36ミリモル)をTHF(6mL)とエタノール(1mL)の混合物に入れることで生じさせた溶液にLiOH(43mg、1.8ミリモル)を水(2mL)に入れることで生じさせた溶液を加えた。その混合物を室温で一晩撹拌した後、濃縮しそして1NのHCl(10mL)で酸性にした。その水溶液にEtOAc(100mL)を用いた抽出を受けさせた。その有機層を食塩水で洗浄し、Na2SO4で乾燥させた後、濾過しそして濃縮することで(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸化合物2f(0.15g、93.6%)を黄色の固体として得た。
【0268】
【化24】

【0269】
段階5. 化合物2f(0.15g、0.34ミリモル)をDCM(2mL)に入れることで生じさせた溶液にSOCl2(0.3mL、4.1ミリモル)を加えた。その混合物を3時間還流させた後、高真空下で濃縮することで(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボニルクロライド化合物2g(0.15g、95.3%)を黄色の固体として得た。
【0270】
【化25】

【0271】
段階6. 化合物2g(30mg、0.065ミリモル)をDCM(2ml)に入れることで生じさせた溶液に(1S)−1−フェニル−エチルアミン(0.013g、0.11ミリモル)とTEA(0.03ml、0.22ミリモル)の溶液を加えた。その反応混合物を室温で1時間撹拌し、DCMで希釈した後、1NのHClで洗浄した。その有機層を水で洗浄し、Na2SO4で乾燥させた後、濾過しそして濃縮した。その結果として得た黄色の残留物を調製用シリカゲルプレートにかけて20% EtOAc/ヘキサンを用いて精製することで化合物15(30mg、84.2%)を淡黄色の粉末として得た。 MS m/z 548(M+)。
【0272】
実施例2の手順に従い、適切な出発材料、反応体および溶媒を代わりに用いることで、下記の化合物を調製した:
【0273】
【表8】

【0274】
【表9】

【0275】
実施例3
(2E)−[9−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−イル]−エテンスルホン酸[(1S)−1−フェニル−エチル]−アミド(化合物21)
【0276】
【化26】

【0277】
段階1. LiHMDS(23.8mL、23.8ミリモル)を無水THF(50mL)に入れることで生じさせた−78℃の溶液にN2雰囲気下でシクロオクタノン化合物1a(2.5g、19.8ミリモル)をTHF(5mL)に入れて滴下した。その混合物を−78°Cで60分間撹拌した後、1−ブロモメチル−3−クロロ−ベンゼン化合物3a(4.1g、19.9ミリモル)を無水THF(10mL)に入れて滴下した。その混合物を5時間撹拌しながら室温になるまで温めた。水(5mL)で反応を消滅させ、その有機層をEtOAc(100mL)で希釈した後、水そして食塩水で洗浄した。その有機層を分離し、無水硫酸ナトリウムで乾燥させた後、濾過し、そして真空下で濃縮することで粗油を得て、それをフラッシュクロマトグラフィーにかけてヘキサン中3%のEtOAcを用いて精製することで2−(3−クロロ−ベンジル)−シクロオクタノン化合物3b(4.12g、82.6%)を得た。
【0278】
【化27】

【0279】
段階2. LiHMDS(39.5mL、39.5ミリモル)を無水THF(25mL)に入れることで生じさせた1Mの溶液にN2雰囲気下−78℃で化合物3b(4.12g
、16.5ミリモル)をTHF(5mL)に入れることで生じさせた溶液を滴下した。その混合物を−78°Cで60分間撹拌した後、ジメトキシ−酢酸メチルエステル化合物3c(2.2g、16.4ミリモル)を無水THF(5mL)に入れることで生じさせた溶液を滴下した。その混合物を15時間撹拌しながら室温になるまで温めた。水(5mL)で反応を消滅させた後、EtOAc(100mL)を用いた希釈を実施した。その有機層を分離し、水そして食塩水で洗浄し、無水硫酸ナトリウムで乾燥させた後、濾過し、そして真空下で濃縮することで粗油を得て、それをフラッシュクロマトグラフィーにかけてヘキサン中10%のEtOAcを用いて精製することで2−(2,2−ジメトキシ−アセチル)−8−(3−クロロ−ベンジル)−シクロオクタノン化合物3d(3.48g、60%)を得た。
【0280】
【化28】

【0281】
段階3. 化合物3d(3.48g、9.9ミリモル)をMeOH(50mL)に入れることで生じさせた0℃の溶液にヒドラジン化合物3e(0.32g、10ミリモル)を加えた。その混合物を一晩撹拌しながら室温になるまで温めた。水(20mL)で反応を消滅させ、その有機層をEtOAc(200mL)で希釈した後、水そして食塩水で洗浄した。その有機層を分離し、無水硫酸ナトリウムで乾燥させた後、濾過し、そして真空下で濃縮することで粗油を得て、それをフラッシュクロマトグラフィーにかけてヘキサン中40%のEtOAcを用いて精製することで9−(3−クロロ−ベンジル)−3−ジメトキシメチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール化合物3f(2.24g、65%)を無色の油として得た。
【0282】
【化29】

【0283】
段階4. 化合物3f(2.24g、6.4ミリモル)をアセトン(50mL)に入れることで生じさせた0℃の溶液に3NのHCl(8mL)を加えた。その混合物を4時間撹拌しながら室温になるまで温めた。水(20mL)で反応を消滅させ、K2CO3で中和してpHを7にした後、DCM(100mL)で希釈した。その有機層を水そして食塩水で洗浄し、分離し、無水硫酸ナトリウムで乾燥させた後、濾過し、そして真空下で濃縮することで9−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボアルデヒド化合物3g(1.84g、95%)を
白色の固体として得た。
【0284】
【化30】

【0285】
段階5. (S)−1−フェニル−エチルアミン化合物3h1(2.13g、17.46ミリモル)の溶液にN2雰囲気下0℃でTEA(2.90mL、20.9ミリモル)およびメタンスルホニルクロライド(2.0g、17.46ミリモル)を加えた。その混合物を3時間撹拌しながら室温になるまで温めた。水(20mL)で反応を消滅させ、有機層をCH2Cl2(100mL)で希釈し、水そして食塩水で洗浄し、分離し、無水硫酸ナトリウムで乾燥させた後、濾過し、そして真空下で濃縮することでN−(1−フェニル−エチル)−メタンスルホンアミド化合物3h2を油として得た。
【0286】
【化31】

【0287】
段階6. 化合物3h2をCH2Cl2(10mL)に入れることで生じさせた溶液にN2雰囲気下0℃で炭酸ジ−t−ブチルエステル化合物3h3(4.57g、20.95ミリモル)およびDMAP(8mg)を加えた。その混合物を一晩撹拌しながら室温になるまで温めた。飽和NaHCO3溶液(10mL)で反応を消滅させた。その有機層を分離し、無水硫酸ナトリウムで乾燥させ、濾過した後、真空下で濃縮することで粗生成物を得て、それをフラッシュクロマトグラフィーにかけてヘキサン中10%のEtOAcを用いて精製することでN−Boc−N−(1−フェニル−エチル)−メタンスルホンアミド化合物3h(4.31g、82%)を無色の油として得た。
【0288】
【化32】

【0289】
段階7. 化合物3h(0.075g、0.250ミリモル)を無水THF(5mL)に入れることで生じさせた溶液にN2雰囲気下−78℃でカリウムt−ブトキサドをTHFに入れることで生じさせた1Mの溶液(0.75mL、0.75ミリモル)を滴下した。45分後に化合物3g(0.076g、0.250ミリモル)をTHF(3mL)に入れることで生じさせた溶液を滴下した。その混合物を15時間反応させながら室温になるまで温めた。水(5mL)で反応を消滅させた後、EtOAc(100mL)を用いた希釈を実施した。その有機層を分離し、水そして食塩水で洗浄し、無水硫酸ナトリウムで乾燥させた後、濾過し、そして真空下で濃縮することで粗油を得て、それをフラッシュクロマトグラフィーにかけてヘキサン中40%のEtOAcを用いて精製することで化合物21(0.082g、70%)を白色固体として得た。1H NMR(CD2Cl2,300MHz)δ 7.42−7.02(m,11H),6.40(dd,1H),5.10−4.90(m,1H),4.52−4.44(m,1H),3.26−3.12(m,2H),3.04−2.90(m,1H),2.68−2.30(m,2H),1.86−1.70(m,2H),1.52−1.08(m,8H).MS m/z 484(M+H+)。
【0290】
実施例3の手順に従い、適切な出発材料、反応体および溶媒を代わりに用いることで、下記の化合物を調製した:
【0291】
【表10】

【0292】
実施例4
実施例2の段階2から6の手順に従い、適切な出発材料、反応体および溶媒を用いることで、化合物3bから下記の化合物を調製した:
【0293】
【表11】

【0294】
当業者は、本方法で用いた可能な出発材料、反応体および条件のみを異ならせることで追加的化合物を本発明の合成方法に従って製造することができるであろう。
【0295】
生物学的実施例
以下の実施例では、本発明の化合物がカンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防するに有用なCB受容体モジュレーターであることを例示する。
【0296】
実施例1
CB1またはCB2作動薬または逆作動薬の結合検定
pcDNA3 CB−1(ヒト)またはpcDNA3 CB−2(ヒト)によるトランスフェクションを受けさせておいたSK−N−MC細胞内でヒトCB1およびCB2受容体を安定に発現させた。前記細胞をT−180細胞培養フラスコ内で37℃の標準的細胞培養条件下5%のCO2雰囲気下で増殖させた。前記細胞をトリプシン処理で収穫し、ホモジナイゼーション(homogenization)緩衝液(10mMのTris、0.2mMのMgCl2、5mMのKClに加えてプロテアーゼ阻害剤であるアプロチニン、ロイペプチン、ペプスタチンAおよびバシトラシン)中で均一にした後、遠心分離(2000g)にかけた。次に、その上澄み液を2Mのスクロース(31,300g)に入れて遠心分離にかけることで半精製膜沈澱物を生じさせた。その沈澱物をホモジナイゼーションに入れて再懸濁させた後、−80℃で貯蔵した。
【0297】
検定日に前記沈澱物を氷上で解凍させた後、検定用緩衝液(50mMのTris−HCl、5mMのMgCl2、2.5mMのEDTA、0.5mg/mLのウシ血清アルブミン(脂肪酸が入っていない)、pH7.5)で希釈した。その希釈した膜沈澱物を96穴ポリプロピレン製プレートの穴に緩衝液、試験化合物または媒体標準のいずれかおよび放射性リガンド[H]3+−CP−55,940(0.2nM)と一緒に加えた。非特異的結合を測定する穴にはWIN55,212(10uM)を入れた。前記プレートにカバーを付けた後、30℃で90分間インキュベートした。次に、その内容物を吸引して0.5%のポリエチレンイミンで前以て湿らせておいたPackard Unifilter GF/Cフィルターボトムプレート上に置いた。前記ポリプロピレン製プレートの穴を濯いだ後、0.9%の食塩水−0.5%のTween 20溶液を用いた吸引を数回実施した。前記Unifilterプレートを乾燥させ、シンチレーションカクテルを各穴に加えた後、結合に相当するカウント数をTopCountシンチレーションカウンターで量化した。
【0298】
CB1およびCB2受容体結合の結果
試験を受けさせた化合物毎にIC50結合値をいろいろな試験濃度を用いた阻害パーセント検定で得た。その結合値を線形回帰で計算した。
【0299】
IC50結合値を示さなかった化合物の場合、阻害パーセント(%)を(1)10μM、(2)1μM、(3)0.2μM、(4)0.003μMの試験濃度で得、(5)示す値は平均値である。
【0300】
【表12】

【0301】
【表13】

【0302】
実施例2
CB1またはCB2作動薬および逆作動薬が細胞内アデニレートシクラーゼ活性に対して示す効果に関する細胞を基にした機能的検定
CB1およびCB2受容体はG蛋白質共役受容体(GPCR)であり、これはGi蛋白質を通して細胞の機能に影響を与える。そのような受容体は細胞内アデニレートシクラーゼの活性をモジュレートし、それによって細胞内シグナルメッセンジャー環状AMP(cAMP)を生じさせる。
【0303】
ベースライン、即ちリガンドが結合していない状態では、そのような受容体は構成的に活性がありかつ強力にアデニレートシクラーゼ活性を抑制する。作動薬が結合すると更に受容体が活性化されることでアデニレートシクラーゼ活性の追加的抑制がもたらされる。逆作動薬が結合すると前記受容体の構成的活性が抑制される結果としてアデニレートシクラーゼ活性が高くなる。
【0304】
細胞内アデニレートシクラーゼ活性を監視することで、化合物が作動薬または逆作動薬として働く能力を測定することができる。
【0305】
検定
試験化合物にSK−N−MC細胞を用いた評価を受けさせたが、この評価では、標準的なトランスフェクション手順を用いて、前記細胞にpcDNA3−CRE β−galおよびpcDNA3 CB1受容体(ヒト)またはpcDNA3 CB2受容体(ヒト)のヒトcDNAによる安定なトランスフェクションを受けさせた。その細胞は、CRE β−galを発現することで、cAMPによるCRE プロモーターの活性化に反応してβ−ガラクトシダーゼを産生した。CRE β−galおよびヒトCB1またはCB2受容体のいずれかを発現する細胞にCB1/CB2作動薬による処理を受けさせるとβ−ガラクトシダーゼの産生量が少なくなり、CB1/CB2逆作動薬による処理を受けさせるとβ−ガラクトシダーゼ産生量が多くなる。
【0306】
細胞増殖
細胞を96穴プレートに入れて37℃の標準的細胞培養条件下5%のCO2雰囲気下で増殖させた。3日後に培地を除去した後、試験化合物を培地[この培地に2mMのL−グルタミン、1Mのピルビン酸ナトリウム,0.1%の低脂肪FBS(ウシ胎仔血清)および抗生物質を補充しておいた]に入れて前記細胞に加えた。前記プレートを37℃で30分間インキュベートし、次に、前記プレートの細胞をホルスコリンで4−6時間処理した後、洗浄しそして溶解させた。β−ガラクトシダーゼの活性を市販キットの試薬(Promega Corp.Madison、WI)およびVmax Plate Reader(Molecular Devices、Inc)を用いて量化した。
【0307】
CB1受容体が媒介するCRE β−gal発現変化
CRE β−galおよびCB1受容体を発現する細胞では、CB1作動薬によってβ−ガラクトシダーゼの活性が用量依存様式で低下し、そしてCB1逆作動薬によってβ−ガラクトシダーゼの活性が用量依存様式で高くなった。
【0308】
β−ガラクトシダーゼ活性の変化を媒体で処置した細胞が示す活性値を100%に設定することで測定し、そして相当する化合物で処置した細胞で測定したβ−ガラクトシダーゼ活性を媒体処置細胞活性のパーセントとして表した。
【0309】
CB1受容体の結果
試験を受けさせた化合物が示した機能的活性のEC50値を線形回帰で計算し、そしていろいろな化合物濃度を用いた検定で得た。特定の化合物に関しては、データを下記の単一試験濃度における機能的活性の変化パーセント(%)で示す:(1)10μMおよび(
2)1μM
【0310】
【表14】

【0311】
【表15】

【0312】
CB2受容体が媒介するCRE β−gal発現変化
CRE β−galおよびCB2受容体を発現する細胞では、CB2作動薬によってβ−ガラクトシダーゼの活性が用量依存様式で低下し、そしてCB2逆作動薬によってβ−ガラクトシダーゼの活性が用量依存様式で高くなる。
【0313】
β−ガラクトシダーゼ活性の変化を媒体で処置した細胞が示す活性値を100%に設定することで測定し、そして相当する化合物で処置した細胞で測定したβ−ガラクトシダーゼ活性を媒体処置細胞活性のパーセントとして表した。
【0314】
CB2受容体結合の結果
試験を受けさせた化合物が示す機能的活性のEC50値を線形回帰で計算し、それをいろいろな化合物濃度を用いた検定で得た。
【0315】
化合物5が示した値が29%であることは機能的活性が変化することに相当し、それを1つの化合物濃度を用いた検定で得た。
【0316】
【表16】

【0317】
【表17】

【0318】
CB1またはCB2作動薬が細胞内アデニレートシクラーゼ活性に対して示す効果に関する細胞を基にした修飾機能的検定
若干修飾して追加的機能的活性検定を実施した。ベータガラクトシダーゼ活性の量化を発光Beta−Glo Assay System(Promega Corp.、Madison、WI)およびOrion Microplate Luminometer(Berthold Detection Systems、Oak Ridge、TN)を用いて実施した。EC50値の計算をGraphPad Prismおよび4パラメーターロジスティック方程式を用いて実施した。
【0319】
CB1/CB2受容体の結果
使用する化合物濃度を変えて検定を行うことで化合物31が示すCB2作動薬機能的活性EC50値は18nMであることを得た。
【0320】
実施例4
からし油誘発大腸炎モデル
からし油大腸炎モデルでは、遠位大腸が粘膜上皮障害、粘膜下浮腫、粘膜および粘膜下への炎症細胞(マクロファージ、好中球およびリンパ球を包含)の侵入、湿った状態の大腸重量の増加、大腸の長さの収縮、下痢および明らかな炎症の断続的パターンを示すことを特徴とする(Kimball E.S.、Palmer J.M.、D’Andrea
M.R.、Hornby P.J.およびWade P.R.、Acute colitis induction by oil of mustard results in later development of an IBS−like accelerated upper GI transit in mice、Am.J.Physiol.Gastrointest.Liver Physiol.、2005、288:G1266−1273を参照)。
【0321】
大腸炎誘発
オスCD−1マウス(Charles River Laboratories、Kingston、NC)(9−11週齢)および新鮮なからし油(OM)(イソチオシアン酸アリル、98%の純度、Sigma−Aldrich St.Louis、MO)を用いた。
【0322】
マウス(1処置グループ当たり9匹)にケタミン/キシラシン(Sigma、St.Louis、MO)を用いた麻酔を短時間かけて、30%エタノール中0.5%のOM溶液(50μL)をシリンジ(先端がボールの22G針が備わっている)で大腸内投与した(4cmの深さに)。
【0323】
試験化合物を大腸炎誘発1日前に経口投与することで予防的療法を評価するか、或は誘発1日後に経口投与することで治療的療法を評価した。その後、試験化合物を毎日経口投与した。OMを投与してから2日後に最後の1回分の試験化合物を投与した。
【0324】
OMを投与してから3日後の動物を屠殺した。大腸を切除し、炎症の兆候を検査し、糞便内容物を取り出した後に重量を測定し、盲腸の尾方端から肛門までの長さを測定した。糞便内容物を下痢兆候に関して検査した。1センチメートル目から4センチメートル目の間の遠位大腸を取り出した後、10%の中性緩衝ホルマリンに入れて組織学的分析を実施した。
【0325】
巨視的観察および判断基準
大腸炎症の巨視的観察(大腸損傷の尺度)、大腸の重量および長さおよび排泄物の粘ちょう度および外観にスコアを付けて、それらを用いて大腸炎のひどさを評価した。
【0326】
各大腸毎に4つの観察スコアを組み合わせ、組み合わせたスコアが0であることは大腸が正常であることに相当し、組み合わせたスコアが15であることは大腸が最大限の影響を受けたことに相当する。統計学的分析をANOVAを用いたGraphpad Prism 4.0で実施した。
【0327】
【表18】

【0328】
顕微鏡(組織学的)検査
組織の組織学的分析をパラフィン埋め込み組織断片をヘマトキシリン−エオシン色素で染色することで構成させた。サンプルグループを伏せておいた検査者が光顕微鏡で組織を検査した。
【0329】
組織学的観察および判断基準
上皮損傷の顕微鏡観察、細胞侵入および平滑筋構造の損傷または変化(筋肉損傷の尺度)にスコアを付けて、それらを用いて大腸炎のひどさを評価した。
【0330】
各大腸毎にスコアを組み合わせ、組み合わせたスコアが0であることは大腸が正常であることに相当し、組み合わせたスコアが9であることは大腸が最大限の影響を受けたことに相当する。統計学的分析をANOVAを用いたGraphpad Prism 4.0
で実施した。
【0331】
判断基準および観察
【0332】
【表19】

【0333】
予防的および治療的大腸炎処置療法の結果
予防および治療療法における各処置グループに関する巨視的スコアおよび顕微鏡的スコアの結果の各々を組み合わせて平均スコアにして、大腸炎の抑制%(%Inh)として表した。試験(#)は、各投薬レベルにおける実験数を表す。
【0334】
【表20】

【0335】
【表21】

【0336】
実施例5
デキストラン硫酸ナトリウム(DSS)誘発大腸炎モデル
DSS大腸炎モデルでは、遠位大腸が粘膜上皮損傷、粘膜および粘膜下への炎症細胞(
マクロファージ、好中球およびリンパ球を包含)の侵入、湿った状態の大腸重量の低下、大腸の長さの収縮および下痢の断続的パターンを示すことを特徴とする(Blumberg R.S.、Saubermann L.J.およびStrober W.、Animal models of mucosal inflammation and their relation to human inflammatory bowel
disease、Current Opinion in Immunology、1999、11巻:648−656;Egger B.、Bajaj−Elliott M.、MacDonald T.T.、Inglin R.、Eysselein、V.E.およびBuchler M.W.、Characterization of acute murine dextran sodium sulphate colitis:Cytokine profile and dose dependency、Digestion、2000、62巻:240−248;Stevceva L.、Pavli P.、Husband A.J.およびDoe、W.F.、The inflammatory infiltrate in the acute stage of
the dextran sulphate sodium induced colitis:B cell response differs depending on the percentage of DSS used to induce it、BMC Clinical Pathology、2001、1巻:3−13;およびDiaz−Granados、Howe K.、Lu J.およびMcKay D.M.、Dextran sulfate sodium−induced colonic
histopathology、but not altered epithelial ion transport、is reduced by inhibition of phosphodiesterase activity、Amer.J.Pathology、2000、156巻:2169−2177を参照)。
【0337】
大腸炎誘発
メスBalb/cマウス(Taconic Farms、Germantown、NY)(10−13週齢)に水道水中5%のDSS(分子量45kD、ICN chemicals、Newport、CA)溶液を7日間に渡って随意与えた。DSS溶液を毎日補充しそして消費量を測定した。
【0338】
マウス(1処置グループ当たり10匹)に試験化合物を大腸炎誘発日に経口投与した後、毎日投与した。
【0339】
最初にDSSを投与してから6日後に最後の1回分の試験化合物を投与した。
【0340】
最初のDSSを投与してから7日後の動物を屠殺した。大腸を切除し、炎症の兆候を検査し、糞便内容物を取り出した後に重量を測定し、盲腸の尾方端から肛門までの長さを測定した。糞便内容物を下痢兆候に関して検査した。1センチメートル目から4センチメートル目の間の遠位大腸を取り出した後、10%の中性緩衝ホルマリンに入れて組織学的分析を実施した。
【0341】
巨視的観察および判断基準
大腸炎症の巨視的観察(大腸損傷の尺度)、大腸の長さおよび排泄物の粘ちょう度および外観にスコアを付けて、それらを用いて大腸炎のひどさを評価した。
【0342】
各大腸毎に3つの観察スコアを組み合わせ、組み合わせたスコアが0であることは大腸が正常であることに相当し、組み合わせたスコアが11であることは大腸が最大限の影響を受けたことに相当する。統計学的分析をANOVAを用いたGraphpad Prism 4.0で実施した。
【0343】
【表22】

【0344】
顕微鏡(組織学的)検査
組織の組織学的分析をパラフィン埋め込み組織断片をヘマトキシリン−エオシン色素で染色することで構成させた。サンプルグループを伏せておいた検査者が光顕微鏡で組織を検査した。
【0345】
組織学的観察および判断基準
上皮損傷の顕微鏡観察、細胞侵入および平滑筋構造の損傷または変化(筋肉損傷の尺度)にスコアを付けて、それらを用いて大腸炎のひどさを評価した。
【0346】
各大腸毎にスコアを組み合わせ、組み合わせたスコアが0であることは大腸が正常であることに相当し、組み合わせたスコアが9であることは大腸が最大限の影響を受けたことに相当する。統計学的分析をANOVAを用いたGraphpad Prism 4.0で実施した。
【0347】
判断基準および観察
【0348】
【表23】

【0349】
大腸炎処置療法の結果
各処置グループ毎の巨視的スコアおよび顕微鏡的スコアの結果の各々を組み合わせて平均スコアにして、大腸炎の抑制%(抑制%)として表した。試験(#)は、各投薬レベルにおける実験数を表す。NDは測定せずを表す。
【0350】
【表24】

【0351】
実施例6
術後炎症性腸閉塞
急性胃腸炎症は、手術中の直接的腸障害またはひどい肉体的外傷によって生じ得る。炎症によって典型的には腸鬱滞、即ち腸閉塞の発症がもたらされ、これは調整の取れた胃腸運動の一時的障害として定義される。腸閉塞は消化管のいずれかの部分、例えば胃、小腸および/または大腸などに起こり得る。腸閉塞は腸閉塞をもたらし得る要因のいずれか、例えば手術、即ち腹部手術、例えば移植手術または移植手術以外の腹部手術、整形手術など、外傷、例えば転倒、車の事故、人的暴力など、または外傷の結果としてもたらされる後遺症のいずれか、例えば手足骨折、肋骨骨折、脊椎骨折、胸部傷害、虚血、後腹膜犠牲など、腹腔内炎症、例えば腹腔内敗血症、急性虫垂炎、胆嚢炎、膵炎、尿管疝痛、基底肺炎など、心筋梗塞、代謝障害またはこれらの任意組み合わせなどのいずれかの結果として生じ得る。
【0352】
急性胃腸炎症、従って腸閉塞の最も一般的な原因の1つは、腹部手術中の腸障害である。腸接触および操作によって腸壁内に炎症イベントが始まり、それによって神経筋組織の抑制および調整された胃腸運動の損失がもたらされる。その結果としてもたらされた”術後腸閉塞”は、胃内容排出遅延、小腸および大腸の膨張、腹部膨満、正常な推進収縮様式の損失およびガスもしくは排泄物の排泄不可によって特徴づけられる。Holte,K.およびH.Kehlet(2000).“Postoperative ileus:a
preventable event.”Br J Surg 87(11):1480−93。臨床症状では、術後腸閉塞によって患者の不快さの増大(腹部膨満、吐き気、嘔吐)がもたらされかつ長期入院の一因となる主要な要因である。
【0353】
腸閉塞発症の一因になる機構は複雑であり、それには、交感神経反射の活性化、視床下部−下垂体軸からの中枢阻害性体液性因子放出、腸壁からのノルエピネフリン放出ばかりでなく麻酔薬および鎮痛薬が含まれる(Livingston,E.H.およびE.P.Passaro(1990)“Postoperative ileus.”Degestive Disease and Sciences 35(1):121−132およびBauer,A.J.、N.T.Schwarz他(2002)“Ileus in
critical illness:mechanisms and management.”Curr Opin Crit Care 8(2):152−7)。
【0354】
そのようなプロセスの基礎になる中心的イベントは、急性炎症反応がGI管壁内に始まることにある。術後腸閉塞の齧歯類モデルを用いた研究によって、外筋層が免疫学的に高い活性を示す部分であることが示された。通常は外筋層内に多量の在住マクロファージが存在していて、それらは食道から大腸に及ぶ広範な細胞ネットワークを形成しており(Mikkelsen,H.B.(1995)“Macrophages in the external muscle layers of mammalian intestines.”Histology and Histopathology 10:719−736およびKalff,J.C.、W.H.Schraut他(1998)“Surgical manipulation of the gut elicits an intestinal muscularis inflammatory response resulting in paralytic ileus.”Annals of Surgery 228:652−663)かつそれらは消化管を損傷から防護するように平衡状態にある。腹部手術中に腸が障害を受けるとそのようなマクロファージネットワークが活性化されることで局所的な分子炎症反応が始まる。マクロファージが活性化されると炎症性のサイトカインおよびケモカインが放出され、それによって神経筋組織が抑制されかつ血管内皮上に接着分子の発現が誘発される(Kalff、Schraut他(1998);Kalff,J.C.、N.T.Schwarz他(1998)“Leukocytes of the intestinal muscularis:their phenotype and isolation.”J Leukoc Biol 63(6):683−91;Josephs,M.D.、G.Cheng他(1999)“Products of cycloxygenase−2 catalysis regulate postoperative bowel motility.”J Surg Res 86(1):50−4;Kalff,J.C.、T.M.Carlos他(1999)“Surgically induced leukocytic infiltrates within the rat intestinal muscularis mediate postoperative ileus.”Gastroenterology 117:378−387;Kalff,J.C.、W.H.Schraut他(2000)“Role of inducible
nitric oxide synthase in postoperative intestinal smooth muscle dysfunction in
rodents.”Gastroenterology 118(2):316−27およびWehner,S.、N.T.Schwarz他(2005)“Induction
of IL−6 within the rodent intestinal muscularis after intestinal surgical stress.”Surgery 137(4):436−46)。
【0355】
それによって、白血球(単球、好中球、t細胞、マスト細胞)が全身循環から動員されることで特徴づけられる細胞炎症反応がもたらされる(Kalff,J.C.、N.T.Schwarz他(1997)“Phagocyte activation and infiltration of the intestinal muscularis with impairment of small bowel motility after surgicla manipulation.”Langenbecks Archiv fur Chirurgie Suppl.:425−428およびKalff,J.C.、B.M.Buchholz他(1999)“Biphasic
response to gut manipulation and temporal correlation of cellular infiltrates and muscle dysfunction in rat.”Surgery 126(3):498−509)。浸潤白血球が追加的サイトカインばかりでなくプロスタグランジン、酸化窒素、プロテアーゼおよび反応性酸素種を放出し、それらが神経筋機能障害のさらなる原因になる(von Ritter,C.、R.Be他(1989)“Neutrophilic proteases:mediators of formyl−methionyl−leucyl−phenylalanine−induced ileitis in rats.”Gastroenterology 97(3):605−9およびBielefeldt,KおよびJ.L.Conklin(1997)“Intestinal motility during hypoxia and reoxygenation in vitro.”Dig Dis Sci 42(5):878−84)。
【0356】
本発明の化合物は、免疫学的に活性化された循環白血球が消化管の筋壁の中に入り込まないようにするか或はそれらの活動を抑制することで腸閉塞を予防または治療すると期待する。本発明の化合物は、また、胃腸収縮機能障害をもたらす炎症性後遺症を防止することでも腸閉塞を予防または治療すると期待する。
【0357】
術後腸閉塞の誘発
オスCD−1マウスにイソフルランを吸入させて麻酔をかけることで手術の準備をする。腹部の毛を剃った後、それを消毒液で処置する。次に、その動物を手術用ドレープで腹部が露出したままになるように覆う。中心線開腹を実施した後、小腸全体を体外に出して無菌ドレープの上に置く。次に、湿った無菌の綿が先端に付いているアプリケーターを2個用いて前記小腸をトライツ靭帯から回盲部まで長さ方向に沿って穏やかに圧縮する。次に、その小腸を腹腔に戻した後、2層の縫合糸で切開部を閉じる。
【0358】
化合物の投与
年齢適合マウスを無作為にグループ(1グループ当たり6匹の動物)に割り当て、開腹術を行う1時間前に、試験化合物をいろいろな用量で入れておいた”媒体”(エタノールが5%/Tween 80が5%/水中5%(重量/体積)のデキストランが90%の混合物)を腹腔内(i.p.)注入する。2番目のグループに媒体を腹腔内注入する。3番目のグループにデキサメタゾンを水中20%のヒドロキシプロピルメチルデキストランに入れることで生じさせた混合物(1mg/mL)を手術前2日間に渡って日に1回そして開腹術から5時間後に胃内投与(1mg/kg)投与する。前記4グループに治療介入を受けさせないで、それらを投薬を受けさせない対照として用いる。
【0359】
胃腸運動性測定方法−上部消化管通過−フルオレセイン−イソチオシアネート(FITC)−デキストラン技術:
上部消化管通過の測定を開腹術から24時間後に実施する。マウスに150μLのFITC−デキストラン溶液(フルオレセイン−イソチオシアネートと接合させた分子量が70,000のデキストランを0.5%のヒドロキシプロピルメチルセルロース/脱イオン水に5mg/mL入れた)で構成させた試験餌を18ゲージの栄養チューブで胃内投与することで与える。FITC−デキストラン試験餌を経口投与した後の動物をホームゲージに戻す。45分間の試験時間後、マウスにイソフルランの過剰投与および放血を受けさせることでマウスを安楽死させる。下部食道括約筋から大腸末端部までの消化管全体を取り出す。腸部分を腸間膜側縁に沿って開ける。胃の組織および管腔の内容物、小腸を等しく10分割した部分、盲腸および大腸を等しく3分割した部分をPBSを1mL入れておいた個々のエッペンドルフ管に入れる。前記組織を卓上渦巻き装置で激しく混合した後、遠心分離にかけることで固体状材料を沈澱させる。透明な上澄み液の一定分量を96穴蛍光プレートリーダーで重複して読み取ることで腸の各部分が示す蛍光シグナルの大きさを量化する。
【0360】
それらの値を用いて幾何学的中心(Geometric Center)(REF)を計算するが、これは消化管に沿った蛍光シグナルの加重平均分布:
GC=Σ(一部分当たりの総蛍光シグナルの%x部分の数)/100
であるとして定義する。
【0361】
GC値が高ければ高いほど通過速度が速いことに相当し、それを1から15のスケールで表す。通常のマウスが45分間の試験時間後に示すGCは8である。
【0362】
ミエロペルオキシダーゼの組織学的顕微鏡検査
開腹術から24時間後に収穫した組織に対して組織学的顕微鏡検査を実施する。活性免疫細胞、例えば好中球および単球などはミエロペルオキシダーゼ活性を示す。Hanker−Yates試薬(Polysciences Inc.)は過酸化水素およびペルオキシダーゼ酵素活性の存在下で青−黒色の不溶重合体を形成する。小腸中心部の断片をこの上の章に記述した遠心分離管から集める。腸管を腸間膜側縁に沿って開けた後に組織をSylgard(商標)で覆っておいたペトリ皿の中に粘膜表面が上に向くように平らに固定することで筋層全載標本の調製を実施する。前記組織を長さ方向に1.5倍および幅方向に2.5倍に引き伸ばした後、微細切開で粘膜を除去する。次に、残存する筋層全載標本を100%のエタノールで45分間かけて固定し、PBSで3回洗浄した後、過酸化水素を0.1%とHanker−Yates試薬(Polysciences Inc.)を1mg/ml入れておいたPBSに入れて20分間インキュベートする。前記試薬は過酸化水素およびペルオキシダーゼ活性の存在下で重合して青−黒色の沈着物を形成する。PBSを用いて2回目の洗浄を行った後の全載標本をガラススライドの上に置き、カバーを滑らかに滑らせた後、光学顕微鏡で見る。6から8個の隣接して位置する200Xの光場の中に存在するミエロペルオキシダーゼ含有白血球の数を数え、平均細胞数を計算して記録する。
【0363】
術後腸閉塞の結果
通常の動物ではミエロペルオキシダーゼ(MPO)陽性免疫細胞が腸筋層内に存在するのは稀である。小腸を外科的処置すると浸潤白血球の数が顕著に増加する。デキサメタゾンで処置するか或は本発明の試験化合物で処置するとそのような侵入度合の大きさが有意に低下する。
【0364】
術後炎症性腸閉塞に関連した消化管の運動性
小腸を外科的に処置すると有意な消化管通過遅延がもたらされ、通常のマウスが示す幾何学的中心である8.4から媒体で処置した動物が示す3.3になる。デキサメタゾンで処置するとある程度の回復がもたらされる。本発明の試験化合物は消化管通過の向上を示すと期待する。
【0365】
この上で行った本発明の説明およびいろいろな実施例は特定面を強調するものであると理解されるべきである。それにも拘らず、具体的な説明も考察も行わなかった他のいろいろな相当物も本発明または本請求項の精神および範囲内に入る可能性があり、それらを包含させることを意図する。
【特許請求の範囲】
【請求項1】
式(I):
【化1】

[式中、
式(I)中の位置2−3の間の破線および位置3a−9aの間の破線は、X1R1が存在する時に存在する2個の二重結合の各々の位置を表し、
式(I)中の位置3−3aの間の破線および位置9a−1の間の破線は、X2R2が存在する時に存在する2個の二重結合の各々の位置を表し、
式(I)中の位置9とX4R4の間の破線は、二重結合の位置を表し、
X1は、存在しないか或は低級アルキレンであり、
X2は、存在しないか或は低級アルキレンであり、かつ
X1R1およびX2R2の中の一方のみが存在し、
X3は、存在しないか、低級アルキレン、低級アルキリデンまたは−NH−であり、
位置9とX4R4の間の破線が存在しない時には、X4が存在しないか或は低級アルキレンであり、
位置9とX4R4の間の破線が存在する時には、X4が存在せず、
X5は、存在しないか或は低級アルキレンであり、
R1は、水素、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、低級アルキル−スルホニル、アリール、C3−C12シクロアルキルまたはヘテロシクリルから選択され、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1つ以上の位置がハロゲン、アミノスルホニル、低級アルキル−アミノスルホニル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、ヒドロキシまたはアルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)で置換されていてもよく、
R2は、水素、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、低級アルキル−スルホニル、アリール、C3−C12シクロアルキルまたはヘテロシクリルから選択され、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1つ以上の位置がハロゲン、アミノスルホニル、低級アルキル−アミノスルホニル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、ヒドロキシまたはアルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)で置換されていてもよく、
R3は、−C(O)−Z1(R6)、−SO2−NR7−Z2(R8)または−C(O)−NR9−Z3(R10)であり、
位置9とX4R4の間の破線が存在しない時には、X4が存在しないか或は低級アルキレンでありそしてR4が水素、ヒドロキシ、低級アルキル、低級アルコキシ、ハロゲン、アリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1つ以上の位置がヒドロキシ、オキソ、低級アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは
低級アルコキシで置換されていてもよい)、低級アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)またはハロゲンで置換されていてもよく、
位置9とX4R4の間の破線が存在する時には、X4が存在せずそしてR4がCH−アリールまたはCH−ヘテロシクリルであり、かつアリールまたはヘテロシクリルは各々場合により1つ以上の位置がヒドロキシ、オキソ、低級アルキル、低級アルコキシまたはハロゲンで置換されていてもよく、
R5は、存在しないか、ヒドロキシ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルであり、R6は、アリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよく、R7は、水素または低級アルキルであり、
R8は、アリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよく、R9は、水素または低級アルキルであり、
R10は、アリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アミノスルホニル、低級アルキル−アミノスルホニル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよく、
Z1およびZ2は、各々、存在しないか或はアルキルであり、そして
Z3は、存在しないか、−NH−、−SO2−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)である]
に従う構造を有する化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項2】
X1が存在しないか或は低級アルキレンであり、そしてR1が水素、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アリール、C3−C12シクロアルキルまたはヘテロシクリルか選択され、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルが各々場合により1つ以上の位置がハロゲン、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、ヒドロキシまたはアルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)で置換されていてもよ
い請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項3】
X1が存在せず、そしてR1がアリールまたはC3−C12シクロアルキルから選択され、かつアリールが場合により1つ以上の位置がハロゲンで置換されていてもよい請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項4】
R3が−C(O)−Z1(R6)、−SO2−NH−Z2(R8)または−C(O)−NH−Z3(R10)である請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項5】
R3が−C(O)−Z1(R6)であり、X3が存在しないか、低級アルキレン、低級アルキリデンまたは−NH−であり、Z1が存在しないか或はアルキルであり、そしてR6がアリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルが各々場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよい請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項6】
R3が−C(O)−Z1(R6)であり、X3が存在せず、Z1が存在せず、そしてR6がヘテロシクリルである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項7】
R3が−C(O)−NR9−Z3(R10)であり、X3が存在しないか、低級アルキレン、低級アルキリデンまたは−NH−であり、R9が水素または低級アルキルであり、Z3が存在しないか、−NH−、−SO2−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)であり、そしてR10が各々が場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アミノスルホニル、低級アルキル−アミノスルホニル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよいアリール、C3−C12シクロアルキルまたはヘテロシクリルである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項8】
R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか、−NH−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)であり、そしてR10が各々が場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ、カルボキシ、カルボニルアルコキシ、アリールまたはヘテロシクリルで置換されていてもよいアリール、C3−C12シクロアルキルまたはヘテロシクリルである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項9】
R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか或はアルキルであり、そしてR10が場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ、カルボキシ、カルボニルアルコキシ、アリールまたはヘテロシクリルで置換されていてもよいC3−C12シクロアルキルである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項10】
R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか或はアルキルであり、そしてR10が場合により1個以上のアルキルまたはカルボニルアルコキシで置換されていてもよいC3−C12シクロアルキルである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項11】
R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか、−NH−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)であり、そしてR10が場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ、カルボキシ、カルボニルアルコキシ、アリールまたはヘテロシクリルで置換されていてもよいアリールである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項12】
R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか、−NH−またはアルキルであり、そしてR10が場合により1個以上のハロゲンで置換されていてもよいアリールである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項13】
R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか或はアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)であり、そしてR10が場合により1個以上のアルキルで置換されていてもよいヘテロシクリルである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項14】
位置9とX4R4の間の破線が存在せず、X4が存在せず、そしてR4が水素である請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項15】
位置9とX4R4の間の破線が存在し、X4が存在せずそしてR4が場合によりアリール上の1つ以上の位置がハロゲンで置換されていてもよいCH−アリールである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項16】
X5が存在せずそしてR5が存在しない請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項17】
式(Ia):
【化2】

[式中、
X1は存在せず、X3は存在せず、位置9とX4R4の間の破線が存在しない時にはX4が存在せずそしてR4が水素であり、位置9とX4R4の間の破線が存在する時にはX4が存在せずそしてR4がCH−アリール(ここで、アリールは場合により1つ以上の位置がハロゲンで置換されていてもよい)であり、R1はアリールまたはC3−C12シクロアルキル(ここで、アリールは場合により1つ以上の位置がハロゲンで置換されていてもよい)から選択され、R3は−C(O)−Z1(R6)または−C(O)−NH−Z3(R10)であり、R6はヘテロシクリルであり、R10はアリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリールまたはC3−C12シクロアルキルは各々場合により1個以上のハロゲン、アルキルまたはカルボニルアルコキシで置換されていてもよく、Z1は存在せず、そしてZ3は存在しないか、−NH−またはアルキルである]
で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項18】
下記:
1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1,3,3−トリメチル−ビシクロ[2.2.1]ヘプト−2−イル)−アミド,
1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(アダマンタン−1−イルメチル)−アミド,
1−シクロペンチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(アダマンタン−1−イルメチル)−アミド,
2−[(1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボニル)−アミノ]−ビシクロ[2.2.1]ヘプタン−2−カルボン酸エチルエステル、
1−シクロペンチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1−アダマンタン−1−イル−エチル)−アミド,
1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1−アダマンタン−1−イル−エチル)−アミド,
1−シクロペンチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1,3,3−トリメチル−ビシクロ[2.2.1]ヘプト−2−イル)−アミド,
1−シクロブチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1,3,3−トリメチル−ビシクロ[2.2.1]ヘプト−2−イル)−アミド,
1−シクロブチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(アダマンタン−1−イルメチル)−アミド,
1−シクロブチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1−アダマンタン−1−イル−エチル)−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボ
ン酸N’−(2,4−ジクロロ−フェニル)−ヒドラジド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−1−フェニル−エチル]−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−1−ピリジン−2−イル−エチル]−アミド,
(9E)−[1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−イル]−ピペリジン−1−イル−メタノン、
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−1−フェニル−エチル]−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−1−シクロヘキシル−エチル]−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−1−シクロヘキシル−エチル]−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(ヘキサヒドロ−シクロペンタ[c]ピロール−2−イル)−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸ピペリジン−1−イルアミド,
(2E)−[9−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−イル]−エテンスルホン酸[(1S)−1−(4−メトキシ−フェニル)−エチル]−アミド,
(2E)−[9−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−イル]−エテンスルホン酸[(1S)−1−フェニル−エチル]−アミド,
(9S*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−ヒドロキシ−1−フェニル−エチル]−アミド,
(9R*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−ヒドロキシ−1−フェニル−エチル]−アミド,
(9R*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−2−ヒドロキシ−1−フェニル−エチル]−アミド,
(9S*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−2−ヒドロキシ−1−フェニル−エチル]−アミド,
(9S*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−メトキシ−1−フェニル−エチル]−アミド,
(9R*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−メトキシ−1−フェニル−エチル]−アミド,
(9E)−(3−クロロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1
H−シクロオクタピラゾール−3−カルボン酸[(1R)−1−フェニル−エチル]−アミド,
(9E)−(3−クロロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−1−フェニル−エチル]−アミド,
(9E)−(3−クロロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−2−ヒドロキシ−1−フェニル−エチル]−アミドまたは
(9E)−(3−クロロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−ヒドロキシ−1−フェニル−エチル]−アミド
から選択される請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項19】
下記:
1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1,3,3−トリメチル−ビシクロ[2.2.1]ヘプト−2−イル)−アミド,
1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(アダマンタン−1−イルメチル)−アミド,
1−シクロペンチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(アダマンタン−1−イルメチル)−アミド,
2−[(1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボニル)−アミノ]−ビシクロ[2.2.1]ヘプタン−2−カルボン酸エチルエステル、
1−シクロペンチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1−アダマンタン−1−イル−エチル)−アミド,
1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1−アダマンタン−1−イル−エチル)−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸N’−(2,4−ジクロロ−フェニル)−ヒドラジド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−1−フェニル−エチル]−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−1−ピリジン−2−イル−エチル]−アミド,
(9E)−[1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−イル]−ピペリジン−1−イル−メタノン、
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−1−フェニル−エチル]−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−1−シクロヘキシル−エチル]−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−1−シクロヘキシル−エチル]−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(ヘキサヒドロ−シクロペンタ[c]ピロール−2−イル)−アミドまたは
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸ピペリジン−1−イルアミド,
(2E)−[9−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−イル]−エテンスルホン酸[(1S)−1−(4−メトキシ−フェニル)−エチル]−アミド,
(2E)−[9−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−イル]−エテンスルホン酸[(1S)−1−フェニル−エチル]−アミド,
(9S*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−ヒドロキシ−1−フェニル−エチル]−アミド,
(9R*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−ヒドロキシ−1−フェニル−エチル]−アミド,
(9R*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−2−ヒドロキシ−1−フェニル−エチル]−アミド,
(9S*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−2−ヒドロキシ−1−フェニル−エチル]−アミド,
(9S*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−メトキシ−1−フェニル−エチル]−アミド,
(9R*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−メトキシ−1−フェニル−エチル]−アミド,
(9E)−(3−クロロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−1−フェニル−エチル]−アミド,
(9E)−(3−クロロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−1−フェニル−エチル]−アミド,
(9E)−(3−クロロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−2−ヒドロキシ−1−フェニル−エチル]−アミドまたは
(9E)−(3−クロロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−ヒドロキシ−1−フェニル−エチル]−アミド
から選択される請求項18記載の化合物。
【請求項20】
カンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法であって、前記被験体に請求項1記載の化合物を有効な量で投与する段階を含んで成る方法。
【請求項21】
前記カンナビノイド受容体がCB1またはCB2受容体でありそして請求項1記載の化合物が前記受容体の作動薬、拮抗薬または逆作動薬である請求項20記載の方法。
【請求項22】
前記化合物がCB1受容体逆作動薬である請求項20記載の方法。
【請求項23】
前記化合物がCB2受容体作動薬である請求項20記載の方法。
【請求項24】
前記症候群、障害または病気が食欲、代謝、糖尿病、緑内障関連眼圧、社会的および気分障害、発作、薬物乱用、学習、認識または記憶、器官収縮または筋けいれん、腸障害、呼吸器障害、自発運動または運動障害、免疫および炎症障害、無秩序な細胞増殖、疼痛管理または神経保護作用に関係している請求項20記載の方法。
【請求項25】
痛みを伴うか或は伴わない炎症に関連した腸関連症候群、障害または病気が炎症性腸疾患、手術、外傷または外傷の結果としてもたらされる後遺症、腹腔内炎症、基底肺炎、心筋梗塞、代謝障害またはこれらの任意組み合わせのいずれかから生じる炎症に関連した腸運動障害から選択される請求項24記載の方法。
【請求項26】
炎症性腸疾患が潰瘍性大腸炎、クローン病またはセリアック病から選択される請求項25記載の方法。
【請求項27】
手術が腹部手術、移植手術、腸切除、整形手術、心臓血管手術または婦人科手術から選択される請求項25記載の方法。
【請求項28】
外傷が転倒、車の事故または人的暴力から選択される請求項25記載の方法。
【請求項29】
外傷の結果としてもたらされる後遺症が手足骨折、肋骨骨折、脊椎骨折、胸部傷害、虚血または後腹膜犠牲から選択される請求項25記載の方法。
【請求項30】
腹腔内炎症が腹腔内敗血症、急性虫垂炎、胆嚢炎、膵炎または尿管疝痛から選択される請求項25記載の方法。
【請求項31】
請求項1記載化合物の有効な量が約0.001mg/kg/日から約300mg/kg/日である請求項20記載の方法。
【請求項32】
前記症候群、障害または病気がCB1受容体逆作動薬によって調節される食欲関連、肥満関連または代謝関連症候群、障害または病気である請求項20記載の方法。
【請求項33】
前記症候群、障害または病気が痛みを伴うか或は伴わない炎症に関連したCB2受容体作動薬によって調節される腸関連症候群、障害または病気でありかつそれが炎症性腸疾患、手術、外傷または外傷の結果としてもたらされる後遺症、腹腔内炎症、基底肺炎、心筋梗塞、代謝障害またはこれらの任意組み合わせのいずれかから生じる炎症に関連した腸運動障害から選択される請求項20記載の方法。
【請求項34】
更に前記被験体に有効な量の請求項1記載化合物および治療薬を含有して成る組み合わせ製品および/または治療薬を投与する段階も含んで成る請求項20記載の方法。
【請求項35】
前記治療薬が抗けいれん薬または避妊薬である請求項34記載の方法。
【請求項36】
前記抗けいれん薬がトピラメート、トピラメート類似物、カルバマゼピン、バルプロ酸、ラモトリジン、ガバペンチン、フェニトインなどおよびこれらの混合物または製薬学的に許容される塩である請求項35記載の方法。
【請求項37】
前記避妊薬がプロゲスチンのみの避妊薬、プロゲスチン成分とエストロゲン成分を有する避妊薬または場合により葉酸成分を有していてもよい経口避妊薬である請求項35記載の方法。
【請求項38】
被験体に避妊を施す方法であって、前記被験体に避妊薬および請求項1記載のCB1受容体逆作動薬もしくは拮抗薬化合物を含有して成っていて当該被験体における喫煙衝動を低下させそして/または当該被験体の減量に役立つ組成物を投与する段階を含んで成る方法。
【請求項39】
カンナビノイド受容体媒介症候群、障害または病気を治療、改善または予防するための薬剤の製造における請求項1記載化合物の使用。
【請求項40】
前記症候群、障害または病気がCB1受容体逆作動薬によって調節される食欲関連、肥満関連または代謝関連症候群、障害または病気である請求項39記載の使用。
【請求項41】
前記症候群、障害または病気が痛みを伴うか或は伴わない炎症に関連したCB2受容体作動薬によって調節される腸関連症候群、障害または病気でありかつそれが炎症性腸疾患、手術、外傷または外傷の結果としてもたらされる後遺症、腹腔内炎症、基底肺炎、心筋梗塞、代謝障害またはこれらの任意組み合わせのいずれかから生じる炎症に関連した腸運動障害から選択される請求項39記載の使用。
【請求項1】
式(I):
【化1】

[式中、
式(I)中の位置2−3の間の破線および位置3a−9aの間の破線は、X1R1が存在する時に存在する2個の二重結合の各々の位置を表し、
式(I)中の位置3−3aの間の破線および位置9a−1の間の破線は、X2R2が存在する時に存在する2個の二重結合の各々の位置を表し、
式(I)中の位置9とX4R4の間の破線は、二重結合の位置を表し、
X1は、存在しないか或は低級アルキレンであり、
X2は、存在しないか或は低級アルキレンであり、かつ
X1R1およびX2R2の中の一方のみが存在し、
X3は、存在しないか、低級アルキレン、低級アルキリデンまたは−NH−であり、
位置9とX4R4の間の破線が存在しない時には、X4が存在しないか或は低級アルキレンであり、
位置9とX4R4の間の破線が存在する時には、X4が存在せず、
X5は、存在しないか或は低級アルキレンであり、
R1は、水素、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、低級アルキル−スルホニル、アリール、C3−C12シクロアルキルまたはヘテロシクリルから選択され、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1つ以上の位置がハロゲン、アミノスルホニル、低級アルキル−アミノスルホニル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、ヒドロキシまたはアルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)で置換されていてもよく、
R2は、水素、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、低級アルキル−スルホニル、アリール、C3−C12シクロアルキルまたはヘテロシクリルから選択され、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1つ以上の位置がハロゲン、アミノスルホニル、低級アルキル−アミノスルホニル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、ヒドロキシまたはアルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)で置換されていてもよく、
R3は、−C(O)−Z1(R6)、−SO2−NR7−Z2(R8)または−C(O)−NR9−Z3(R10)であり、
位置9とX4R4の間の破線が存在しない時には、X4が存在しないか或は低級アルキレンでありそしてR4が水素、ヒドロキシ、低級アルキル、低級アルコキシ、ハロゲン、アリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1つ以上の位置がヒドロキシ、オキソ、低級アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは
低級アルコキシで置換されていてもよい)、低級アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)またはハロゲンで置換されていてもよく、
位置9とX4R4の間の破線が存在する時には、X4が存在せずそしてR4がCH−アリールまたはCH−ヘテロシクリルであり、かつアリールまたはヘテロシクリルは各々場合により1つ以上の位置がヒドロキシ、オキソ、低級アルキル、低級アルコキシまたはハロゲンで置換されていてもよく、
R5は、存在しないか、ヒドロキシ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルであり、R6は、アリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよく、R7は、水素または低級アルキルであり、
R8は、アリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよく、R9は、水素または低級アルキルであり、
R10は、アリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルは各々場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アミノスルホニル、低級アルキル−アミノスルホニル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよく、
Z1およびZ2は、各々、存在しないか或はアルキルであり、そして
Z3は、存在しないか、−NH−、−SO2−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)である]
に従う構造を有する化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項2】
X1が存在しないか或は低級アルキレンであり、そしてR1が水素、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アリール、C3−C12シクロアルキルまたはヘテロシクリルか選択され、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルが各々場合により1つ以上の位置がハロゲン、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、ヒドロキシまたはアルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)で置換されていてもよ
い請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項3】
X1が存在せず、そしてR1がアリールまたはC3−C12シクロアルキルから選択され、かつアリールが場合により1つ以上の位置がハロゲンで置換されていてもよい請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項4】
R3が−C(O)−Z1(R6)、−SO2−NH−Z2(R8)または−C(O)−NH−Z3(R10)である請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項5】
R3が−C(O)−Z1(R6)であり、X3が存在しないか、低級アルキレン、低級アルキリデンまたは−NH−であり、Z1が存在しないか或はアルキルであり、そしてR6がアリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリール、C3−C12シクロアルキルまたはヘテロシクリルが各々場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよい請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項6】
R3が−C(O)−Z1(R6)であり、X3が存在せず、Z1が存在せず、そしてR6がヘテロシクリルである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項7】
R3が−C(O)−NR9−Z3(R10)であり、X3が存在しないか、低級アルキレン、低級アルキリデンまたは−NH−であり、R9が水素または低級アルキルであり、Z3が存在しないか、−NH−、−SO2−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)であり、そしてR10が各々が場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ(場合により1つ以上の位置がハロゲンまたはヒドロキシで置換されていてもよい)、カルボキシ、カルボニルアルコキシ、カルバモイル、カルバモイルアルキル、アミノスルホニル、低級アルキル−アミノスルホニル、アリール、アリールオキシ、アリールアルコキシまたはヘテロシクリルで置換されていてもよいアリール、C3−C12シクロアルキルまたはヘテロシクリルである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項8】
R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか、−NH−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)であり、そしてR10が各々が場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ、カルボキシ、カルボニルアルコキシ、アリールまたはヘテロシクリルで置換されていてもよいアリール、C3−C12シクロアルキルまたはヘテロシクリルである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項9】
R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか或はアルキルであり、そしてR10が場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ、カルボキシ、カルボニルアルコキシ、アリールまたはヘテロシクリルで置換されていてもよいC3−C12シクロアルキルである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項10】
R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか或はアルキルであり、そしてR10が場合により1個以上のアルキルまたはカルボニルアルコキシで置換されていてもよいC3−C12シクロアルキルである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項11】
R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか、−NH−またはアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)であり、そしてR10が場合により1個以上のヒドロキシ、オキソ、ハロゲン、アミノ、アミノアルキル、アルキル(場合により1つ以上の位置がハロゲン、ヒドロキシまたは低級アルコキシで置換されていてもよい)、アルコキシ、カルボキシ、カルボニルアルコキシ、アリールまたはヘテロシクリルで置換されていてもよいアリールである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項12】
R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか、−NH−またはアルキルであり、そしてR10が場合により1個以上のハロゲンで置換されていてもよいアリールである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項13】
R3が−C(O)−NH−Z3(R10)であり、X3が存在せず、Z3が存在しないか或はアルキル(ここで、アルキルは場合により1つ以上の位置がハロゲン、ヒドロキシ、低級アルキル、低級アルコキシ、カルボキシまたはカルボニルアルコキシで置換されていてもよい)であり、そしてR10が場合により1個以上のアルキルで置換されていてもよいヘテロシクリルである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項14】
位置9とX4R4の間の破線が存在せず、X4が存在せず、そしてR4が水素である請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項15】
位置9とX4R4の間の破線が存在し、X4が存在せずそしてR4が場合によりアリール上の1つ以上の位置がハロゲンで置換されていてもよいCH−アリールである請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項16】
X5が存在せずそしてR5が存在しない請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項17】
式(Ia):
【化2】

[式中、
X1は存在せず、X3は存在せず、位置9とX4R4の間の破線が存在しない時にはX4が存在せずそしてR4が水素であり、位置9とX4R4の間の破線が存在する時にはX4が存在せずそしてR4がCH−アリール(ここで、アリールは場合により1つ以上の位置がハロゲンで置換されていてもよい)であり、R1はアリールまたはC3−C12シクロアルキル(ここで、アリールは場合により1つ以上の位置がハロゲンで置換されていてもよい)から選択され、R3は−C(O)−Z1(R6)または−C(O)−NH−Z3(R10)であり、R6はヘテロシクリルであり、R10はアリール、C3−C12シクロアルキルまたはヘテロシクリルであり、かつアリールまたはC3−C12シクロアルキルは各々場合により1個以上のハロゲン、アルキルまたはカルボニルアルコキシで置換されていてもよく、Z1は存在せず、そしてZ3は存在しないか、−NH−またはアルキルである]
で表される化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項18】
下記:
1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1,3,3−トリメチル−ビシクロ[2.2.1]ヘプト−2−イル)−アミド,
1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(アダマンタン−1−イルメチル)−アミド,
1−シクロペンチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(アダマンタン−1−イルメチル)−アミド,
2−[(1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボニル)−アミノ]−ビシクロ[2.2.1]ヘプタン−2−カルボン酸エチルエステル、
1−シクロペンチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1−アダマンタン−1−イル−エチル)−アミド,
1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1−アダマンタン−1−イル−エチル)−アミド,
1−シクロペンチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1,3,3−トリメチル−ビシクロ[2.2.1]ヘプト−2−イル)−アミド,
1−シクロブチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1,3,3−トリメチル−ビシクロ[2.2.1]ヘプト−2−イル)−アミド,
1−シクロブチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(アダマンタン−1−イルメチル)−アミド,
1−シクロブチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1−アダマンタン−1−イル−エチル)−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボ
ン酸N’−(2,4−ジクロロ−フェニル)−ヒドラジド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−1−フェニル−エチル]−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−1−ピリジン−2−イル−エチル]−アミド,
(9E)−[1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−イル]−ピペリジン−1−イル−メタノン、
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−1−フェニル−エチル]−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−1−シクロヘキシル−エチル]−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−1−シクロヘキシル−エチル]−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(ヘキサヒドロ−シクロペンタ[c]ピロール−2−イル)−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸ピペリジン−1−イルアミド,
(2E)−[9−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−イル]−エテンスルホン酸[(1S)−1−(4−メトキシ−フェニル)−エチル]−アミド,
(2E)−[9−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−イル]−エテンスルホン酸[(1S)−1−フェニル−エチル]−アミド,
(9S*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−ヒドロキシ−1−フェニル−エチル]−アミド,
(9R*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−ヒドロキシ−1−フェニル−エチル]−アミド,
(9R*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−2−ヒドロキシ−1−フェニル−エチル]−アミド,
(9S*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−2−ヒドロキシ−1−フェニル−エチル]−アミド,
(9S*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−メトキシ−1−フェニル−エチル]−アミド,
(9R*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−メトキシ−1−フェニル−エチル]−アミド,
(9E)−(3−クロロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1
H−シクロオクタピラゾール−3−カルボン酸[(1R)−1−フェニル−エチル]−アミド,
(9E)−(3−クロロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−1−フェニル−エチル]−アミド,
(9E)−(3−クロロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−2−ヒドロキシ−1−フェニル−エチル]−アミドまたは
(9E)−(3−クロロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−ヒドロキシ−1−フェニル−エチル]−アミド
から選択される請求項1記載の化合物またはこれの塩、異性体、プロドラッグ、代謝産物または多形体。
【請求項19】
下記:
1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1,3,3−トリメチル−ビシクロ[2.2.1]ヘプト−2−イル)−アミド,
1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(アダマンタン−1−イルメチル)−アミド,
1−シクロペンチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(アダマンタン−1−イルメチル)−アミド,
2−[(1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボニル)−アミノ]−ビシクロ[2.2.1]ヘプタン−2−カルボン酸エチルエステル、
1−シクロペンチル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1−アダマンタン−1−イル−エチル)−アミド,
1−シクロヘキシル−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(1−アダマンタン−1−イル−エチル)−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸N’−(2,4−ジクロロ−フェニル)−ヒドラジド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−1−フェニル−エチル]−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−1−ピリジン−2−イル−エチル]−アミド,
(9E)−[1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−イル]−ピペリジン−1−イル−メタノン、
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−1−フェニル−エチル]−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−1−シクロヘキシル−エチル]−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−1−シクロヘキシル−エチル]−アミド,
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸(ヘキサヒドロ−シクロペンタ[c]ピロール−2−イル)−アミドまたは
(9E)−1−(2,4−ジクロロ−フェニル)−9−(4−フルオロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸ピペリジン−1−イルアミド,
(2E)−[9−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−イル]−エテンスルホン酸[(1S)−1−(4−メトキシ−フェニル)−エチル]−アミド,
(2E)−[9−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−イル]−エテンスルホン酸[(1S)−1−フェニル−エチル]−アミド,
(9S*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−ヒドロキシ−1−フェニル−エチル]−アミド,
(9R*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−ヒドロキシ−1−フェニル−エチル]−アミド,
(9R*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−2−ヒドロキシ−1−フェニル−エチル]−アミド,
(9S*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−2−ヒドロキシ−1−フェニル−エチル]−アミド,
(9S*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−メトキシ−1−フェニル−エチル]−アミド,
(9R*)−(3−クロロ−ベンジル)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−メトキシ−1−フェニル−エチル]−アミド,
(9E)−(3−クロロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−1−フェニル−エチル]−アミド,
(9E)−(3−クロロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−1−フェニル−エチル]−アミド,
(9E)−(3−クロロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1S)−2−ヒドロキシ−1−フェニル−エチル]−アミドまたは
(9E)−(3−クロロ−ベンジリデン)−4,5,6,7,8,9−ヘキサヒドロ−1H−シクロオクタピラゾール−3−カルボン酸[(1R)−2−ヒドロキシ−1−フェニル−エチル]−アミド
から選択される請求項18記載の化合物。
【請求項20】
カンナビノイド受容体媒介症候群、障害または病気の治療、改善または予防を必要としている被験体におけるそれを治療、改善または予防する方法であって、前記被験体に請求項1記載の化合物を有効な量で投与する段階を含んで成る方法。
【請求項21】
前記カンナビノイド受容体がCB1またはCB2受容体でありそして請求項1記載の化合物が前記受容体の作動薬、拮抗薬または逆作動薬である請求項20記載の方法。
【請求項22】
前記化合物がCB1受容体逆作動薬である請求項20記載の方法。
【請求項23】
前記化合物がCB2受容体作動薬である請求項20記載の方法。
【請求項24】
前記症候群、障害または病気が食欲、代謝、糖尿病、緑内障関連眼圧、社会的および気分障害、発作、薬物乱用、学習、認識または記憶、器官収縮または筋けいれん、腸障害、呼吸器障害、自発運動または運動障害、免疫および炎症障害、無秩序な細胞増殖、疼痛管理または神経保護作用に関係している請求項20記載の方法。
【請求項25】
痛みを伴うか或は伴わない炎症に関連した腸関連症候群、障害または病気が炎症性腸疾患、手術、外傷または外傷の結果としてもたらされる後遺症、腹腔内炎症、基底肺炎、心筋梗塞、代謝障害またはこれらの任意組み合わせのいずれかから生じる炎症に関連した腸運動障害から選択される請求項24記載の方法。
【請求項26】
炎症性腸疾患が潰瘍性大腸炎、クローン病またはセリアック病から選択される請求項25記載の方法。
【請求項27】
手術が腹部手術、移植手術、腸切除、整形手術、心臓血管手術または婦人科手術から選択される請求項25記載の方法。
【請求項28】
外傷が転倒、車の事故または人的暴力から選択される請求項25記載の方法。
【請求項29】
外傷の結果としてもたらされる後遺症が手足骨折、肋骨骨折、脊椎骨折、胸部傷害、虚血または後腹膜犠牲から選択される請求項25記載の方法。
【請求項30】
腹腔内炎症が腹腔内敗血症、急性虫垂炎、胆嚢炎、膵炎または尿管疝痛から選択される請求項25記載の方法。
【請求項31】
請求項1記載化合物の有効な量が約0.001mg/kg/日から約300mg/kg/日である請求項20記載の方法。
【請求項32】
前記症候群、障害または病気がCB1受容体逆作動薬によって調節される食欲関連、肥満関連または代謝関連症候群、障害または病気である請求項20記載の方法。
【請求項33】
前記症候群、障害または病気が痛みを伴うか或は伴わない炎症に関連したCB2受容体作動薬によって調節される腸関連症候群、障害または病気でありかつそれが炎症性腸疾患、手術、外傷または外傷の結果としてもたらされる後遺症、腹腔内炎症、基底肺炎、心筋梗塞、代謝障害またはこれらの任意組み合わせのいずれかから生じる炎症に関連した腸運動障害から選択される請求項20記載の方法。
【請求項34】
更に前記被験体に有効な量の請求項1記載化合物および治療薬を含有して成る組み合わせ製品および/または治療薬を投与する段階も含んで成る請求項20記載の方法。
【請求項35】
前記治療薬が抗けいれん薬または避妊薬である請求項34記載の方法。
【請求項36】
前記抗けいれん薬がトピラメート、トピラメート類似物、カルバマゼピン、バルプロ酸、ラモトリジン、ガバペンチン、フェニトインなどおよびこれらの混合物または製薬学的に許容される塩である請求項35記載の方法。
【請求項37】
前記避妊薬がプロゲスチンのみの避妊薬、プロゲスチン成分とエストロゲン成分を有する避妊薬または場合により葉酸成分を有していてもよい経口避妊薬である請求項35記載の方法。
【請求項38】
被験体に避妊を施す方法であって、前記被験体に避妊薬および請求項1記載のCB1受容体逆作動薬もしくは拮抗薬化合物を含有して成っていて当該被験体における喫煙衝動を低下させそして/または当該被験体の減量に役立つ組成物を投与する段階を含んで成る方法。
【請求項39】
カンナビノイド受容体媒介症候群、障害または病気を治療、改善または予防するための薬剤の製造における請求項1記載化合物の使用。
【請求項40】
前記症候群、障害または病気がCB1受容体逆作動薬によって調節される食欲関連、肥満関連または代謝関連症候群、障害または病気である請求項39記載の使用。
【請求項41】
前記症候群、障害または病気が痛みを伴うか或は伴わない炎症に関連したCB2受容体作動薬によって調節される腸関連症候群、障害または病気でありかつそれが炎症性腸疾患、手術、外傷または外傷の結果としてもたらされる後遺症、腹腔内炎症、基底肺炎、心筋梗塞、代謝障害またはこれらの任意組み合わせのいずれかから生じる炎症に関連した腸運動障害から選択される請求項39記載の使用。
【公表番号】特表2010−522183(P2010−522183A)
【公表日】平成22年7月1日(2010.7.1)
【国際特許分類】
【出願番号】特願2009−554631(P2009−554631)
【出願日】平成20年3月6日(2008.3.6)
【国際出願番号】PCT/US2008/056016
【国際公開番号】WO2009/023292
【国際公開日】平成21年2月19日(2009.2.19)
【出願人】(390033008)ジヤンセン・フアーマシユーチカ・ナームローゼ・フエンノートシヤツプ (616)
【氏名又は名称原語表記】JANSSEN PHARMACEUTICA NAAMLOZE VENNOOTSCHAP
【Fターム(参考)】
【公表日】平成22年7月1日(2010.7.1)
【国際特許分類】
【出願日】平成20年3月6日(2008.3.6)
【国際出願番号】PCT/US2008/056016
【国際公開番号】WO2009/023292
【国際公開日】平成21年2月19日(2009.2.19)
【出願人】(390033008)ジヤンセン・フアーマシユーチカ・ナームローゼ・フエンノートシヤツプ (616)
【氏名又は名称原語表記】JANSSEN PHARMACEUTICA NAAMLOZE VENNOOTSCHAP
【Fターム(参考)】
[ Back to top ]

