ヘテロ二官能性重合体生物複合体
【課題】本発明の方法および方法を実施するための装置が提供される。本発明の方法は、生物または化学標的を同定し所定の化合物をスクリーニングするために、マイクロアレイ上で間接的な競合結合アッセイを行う工程を含む。
【解決手段】本発明のマイクロアレイは、膜−、脂質−またはタンパク質−結合活性結合部位に位置する共通のリガンドを有する。本発明の方法は、マイクロスポットの限られた境界内での異なる結合部位に対する所定の生物または化学標的と普遍的読み取りユニットとの間の既知のまたはよく特徴付けられた結合運動学、および立体障害を利用する。生物標的、化学物質または有機体は、標的結合部位に特異的に結合することができ、普遍的な読み取りユニットはマイクロスポット中のリガンドに結合する。
【解決手段】本発明のマイクロアレイは、膜−、脂質−またはタンパク質−結合活性結合部位に位置する共通のリガンドを有する。本発明の方法は、マイクロスポットの限られた境界内での異なる結合部位に対する所定の生物または化学標的と普遍的読み取りユニットとの間の既知のまたはよく特徴付けられた結合運動学、および立体障害を利用する。生物標的、化学物質または有機体は、標的結合部位に特異的に結合することができ、普遍的な読み取りユニットはマイクロスポット中のリガンドに結合する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、治療剤のターゲティングおよび供給において有用な高分子量へテロ二官能性ポリマー複合体の合成に関する。この複合体を生成および使用する方法もまた開示される。
【背景技術】
【0002】
治療剤のターゲティングおよびドラッグデリバリーは、特に癌の治療における細胞毒の使用と共にますます重要になっている。治療剤で腫瘍を選択的に標的にし、ヒトおよび他の動物中の癌を治療するために、多くの方法が使用されている。モノクローナル抗体(mAb)またはその断片のようなターゲティング成分は、側鎖官能基により直線状のポリマーに接合される。しかしながら、この方法では通常、抗体の化学的特性の変化またはターゲティング成分をランダムコイル構造に組み込むポリマーの折りたたみ構造により、レセプター結合親和性が減少する。理想的には、新しい複合体は、ターゲティング機能性並びに治療上の価値を有する。
【0003】
近年、一端でターゲティング官能基を有し他端で治療成分(例えば化学療法薬)有するヘテロ二官能性ポリマー複合体が、開示されている。特許文献1参照。使用されるポリマー複合体は、一端に複数の薬分子(例えばポリ(1−グルタミン酸))を結合する複数の側鎖官能基を含有するポリマーキャリアに結合したポリマースペーサーを有し、ポリマースペーサーの他端はターゲティング成分に結合される。しかしながら、ポリマースペーサー部分の分子量は、著しく低い。
【0004】
より高い分子量のヘテロ二官能性ポリマー構造物を調製する方法が、開示される。特許文献2参照。しかしながら、これらの方法は、所望でないポリマー分散性のためにそれ自体は理想的でないモノマーの重合を含む。他の従来の方法は、陰イオンエトキシル化および困難な精製工程を有する。上記の技術を使用して高分子量ポリマー複合体を達成しようとした結果、所望の産物の質が悪くなり低収率となった。
【特許文献1】米国特許出願公開第2002/0197261A1号明細書
【特許文献2】米国特許出願公開第2002/0072573A1号明細書
【非特許文献3】Wilson, D.S., et al., Curr. Opinion in Chemical Biology 2001, 6, 81-85
【発明の開示】
【発明が解決しようとする課題】
【0005】
現在の方法の不十分さのために、高収率および高純度の基質を生成し、同時に低ポリマー分散性を保持する、高分子量へテロ二官能性ポリマー基質を生成する改良された方法が必要とされる。治療的活性化合物をターゲティングおよび供給する手段としてヘテロ二官能性ポリマー複合体を含む化合物を提供することもまた所望である。
【課題を解決するための手段】
【0006】
発明の概要
本発明のある態様において、構造式(I)の化合物が提供される。
【化1】

【0007】
X1-X6は独立してO、SまたはNR1であり;
R44およびR44’は独立して選択されるポリアルキレンオキシドであり;
R1は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、アラルキル、およびC3-8置換シクロアルキルからなる群より選択され;
R40-43は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、C3-8置換シクロアルキル、アリール、置換アリール、アラルキル、C1-6ヘテロアルキル、置換C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
y、およびy’は、独立して、0または自然数であり;
pおよびp’は、独立して、0または自然数であり;
nおよびn’は、独立して、0または自然数であり;
aおよびbは、独立して、0または自然数であって、a+bは2以上であり;
zは1または自然数であり;
D1およびD2は、独立して、B、脱離基、活性化基、OH、および末端基からなる群より選択され;
Bは、生物活性成分、診断用薬およびOHからなる群より選択される。
【0008】
好ましい実施の形態において、X1-X6は独立してOまたはNR1であり、R1は水素であり、aおよびbは独立して選択される1から約20までの整数であり、yおよびy’は独立して0、1または2であり、pおよびp’はそれぞれ1であり、D1およびD2は脱離基および末端基およびBから独立して選択され、ここでBは、薬、アミノまたはヒドロキシル含有残基、色素のような診断用薬、キレート剤または同位体標識化合物、脱離基または活性化基のような生物活性成分である。
【0009】
本発明の目的のために、「残基」という用語は、プロドラッグキャリアが結合される置換反応を受けた後に残る生物活性化合物の一部を意味すると解されるべきである。
【0010】
本発明の目的のために、「アルキル」という用語は、直鎖、分枝、置換C1-12アルキル、C3-8シクロアルキルまたは置換シクロアルキル等を含むと解されるべきである。
【0011】
本発明の主な利点のいくつかは、循環半減期および天然または未修飾の分子の可溶性を高めることのできる新しい高分子量へテロに機能性ポリマー複合体、並びに高純度を維持しながらクロマトグラフィー工程を必要としないでそのような複合体を形成する方法を含む。本発明の方法の別の利点は、ポリマー複合体の分子量を増加させながら低いポリマー分散を保持することである。本発明のさらなる利点は、当業者が、ポリマー部分のどちらの側にも同じまたは異なる基を有することができる薬複合体を設計できるということである。この利点により、当業者は、供給またはターゲティング機能性および特定の必要性に依存して同じ複合体内で治療機能性を含有する化合物を調整することができる。
【0012】
ここに記載される化合物および複合体を生成および使用する方法もまた提供される。
【図面の簡単な説明】
【0013】
【図1】図1は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【図2】図2は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【図3】図3は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【図4】図4は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【図5】図5は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【図6】図6は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【図7】図7は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【図8】図8は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【図9】図9は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【発明を実施するための最良の形態】
【0014】
発明の詳細な説明
A. 式(I)
本発明のある態様において、構造式(I)の化合物が提供される。
【化2】

【0015】
ここで、
X1-X6は独立してO、SまたはNR1であり;
R44およびR44’は独立して選択されるポリアルキレンオキシドであり;
R1は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、アラルキル、およびC3-8置換シクロアルキルからなる群より選択され;
R40-43は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、C3-8置換シクロアルキル、アリール、置換アリール、アラルキル、C1-6ヘテロアルキル、置換C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
y、およびy’は、独立して、0または自然数であり;
pおよびp’は、独立して、0または自然数であり;
nおよびn’は、独立して、0または自然数であり;
aおよびbは、独立して、0または自然数であって、a+bは2以上であり;
zは1または自然数であり;
D1およびD2は、独立して、B、脱離基、活性化基、OH、および末端基からなる群より選択され;
Bは、生物活性成分、診断用薬およびOHからなる群より選択される。
【0016】
構造式(I)の化合物の好ましい実施の形態において、
X1-X6は独立してOまたはNR1であり、
R1は水素、C1-6アルキル、C1-6ヘテロアルキル、アラルキル、およびC1-6置換アルキルから選択され、
yおよびy’は独立して0または1から18までの整数であり、
pおよびp’は独立して0または1であり、
nおよびn’は独立して選択される0から100までの整数であり、
aおよびbは独立して選択される1から20までの整数であり、
zは自然数である。
【0017】
より好ましくは、
X1-X4は、独立してNR1であり;
X5-X6は、それぞれOであり;
R44およびR44’は、それぞれ-(CH2-CH2-O)-であり;
R1は、水素またはメチルであり;
yおよびy’は、それぞれ0、1または2であり;
pおよびp’は、それぞれ1であり;
nおよびn’は、独立して、70から80までの間の整数から選択され;
aおよびbは、独立して、5から10までの間の整数から選択され;
zは自然数であり;
D1およびD2は、独立して、OH、ハロゲン、ターゲティング物質、薬、酵素、タンパク質、治療的活性化合物、色素、キレート剤および同位体標識化合物からなる群より選択される。
【0018】
構造式(I)の化合物のさらに別の好ましい実施の形態において、D1およびD2は、独立して選択される下記のような末端基である。
【化3】

【0019】
ここで、
Y1-6は、独立して、OまたはNR1’であり;
R1’は、水素またはメチルであり;
R2-8は、独立して、水素およびC1-6アルキルから選択され;
Arは、多置換の芳香族炭化水素または多置換の複素環式基を形成する成分であり;
L1-2は、独立して選択される二官能性リンカーであり;
eおよびf’は、それぞれ1であり;
c、c’およびe’は、独立して、0または1であり;
d、fおよびd’は、独立して0または1であり;
B’は、脱離基、活性化基、OH、生物活性成分および診断用薬からなる群より選択される。
【0020】
本発明の別の好ましい態様において、構造式(Ia)のポリマー複合体が提供される。
【化4】

【0021】
ここで、
Y7-9は、独立してOまたはNR1”であり;
R1”は、水素またはメチルであり;
R9-18は、独立して、水素またはC1-6アルキルであり;
L3-4は、独立して選択される二官能性リンカーであり;
Qは、標的細胞中に能動輸送される成分、疎水性成分、二官能性リンカー成分およびそれらの組合せから選択され;
l、k、mおよびoは、独立して自然数であり;
jおよびhは、独立して0または1であり;
gおよびiは、それぞれ1であり;
qは、0または1であり;
B’は、脱離基、活性化基、OH、生物活性成分および診断用薬から選択され;
D10およびD11は、D1を定める同じ群から選択されるか、または一緒になって下記の構造式の末端基を形成する。
【化5】

【0022】
本発明の別の好ましい態様において、D1およびD2は、独立して選択される下記のような末端基である。
【化6】

【0023】
ここで、D’は、下記の構造式の化合物の一つであり、
【化7】

【0024】
B’は、脱離基、活性化基、OH、生物活性成分および診断用薬から選択される。
【0025】
B. リンカー成分L1-4
上記に示すように、本発明は、二官能性リンカー成分L1-L4を含んでもよい。好ましくは、L1-L4は、下記の限定されないリストから独立して選択される。
【化8】

【0026】
ここで、
R34-38は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、C3-8置換シクロアルキル、アリール、置換アリール、アラルキル、C1-6ヘテロアルキル、置換C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシから選択され;
R39は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、C3-8置換シクロアルキル、アリール、置換アリール、アラルキル、C1-6ヘテロアルキル、置換C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシ、NO2、ハロアルキルおよびハロゲンから選択され;
a’およびb’は、独立して選択される自然数である。
【0027】
C. Ar成分の説明
本発明のある態様において、Ar成分は、構造式(I)に含まれる場合に多置換の芳香族炭化水素または多置換の複素環式基を形成する成分であることが分かる。重要な特徴は、Ar成分は、天然で芳香性であるということである。通常、-n電子は、環式分子の平面の上および下の両方で「雲(cloud)」内で共有されなければならない。さらに、π電子の数は、ヒュッケル則(Huckel rule)(4n+2)を満たさなければならない。当業者は、無数の成分が、構造式(I)についての成分の芳香性の必要性を満たし、したがって、ここで用いるのに適切であるということを理解するであろう。
【0028】
いくつかの特定の好ましい芳香族基は、以下のものを含む。
【化9】

【0029】
ここで、R62-67は、独立して、R2を定めるのと同じ群から選択される。
【0030】
他の好ましい芳香族炭化水素成分は、以下を含んでもよいがこれに限定されない。
【化10】

【0031】
ここで、ZおよびEは、独立してCR68またはNR69であり;JはO、SまたはNR70であって、R68-70はR2を定めるのと同じ群、またはシアノ、ニトロ、カルボキシル、アシル、置換アシルまたはカルボキシアルキルからなる群より選択される。5および6員環の異性体も考えられ、ベンゾ−およびジベンゾ−系およびそれらの関連する同属種も検討される。芳香族環は、必要に応じて、ヒュッケル則に従う限りO、S、NR1等のようなヘテロ原子で置換できるということも、当業者によって明らかとなるであろう。さらに、芳香族または複素環式の構造は、必要に応じて、ハロゲンおよび/または当該技術において通常理解される用語としての側鎖で置換されてもよい。
【0032】
D. ポリアルキレンオキシド
構造式(I)を参照すると、R44はポリアルキレンオキシドのようなポリマー成分であることが分かるであろう。そのようなポリマーの適切な例には、実質的に非抗原性であるポリエチレングリコールが含まれる。同一出願人による米国特許第5,643,575号に記載されるようなポリプロピレングリコールもまた有用である。本発明の方法において有用な他のPEGは、Shearwater Polymers, Inc. catalog “Polyethylene Glycol and Derivatives 2001”に記載される。それぞれの開示は、ここに言及することにより引用される。
【0033】
PAOおよびPEGは、両平均分子量において実質的に変化できるが、好ましくは、R44は、本発明の多くの態様において約2000から約136000Daまでの重量平均分子量を有する。より好ましくは、R44は、約3400から約65000Daまでの重量平均分子量を有し、最も好ましくは約3400から約20000Daまでの重量平均分子量を有する。
【0034】
ここに含まれるポリマー物質は、好ましくは室温で水溶性である。そのようなポリマーの限定されないリストには、ポリエチレングリコール(PEG)またはポリプロピレングリコールのようなポリアルキレンオキシドホモポリマー、ポリオキシエチレン化ポリオール、それらのコポリマーおよびブロックコポリマーの水溶性が維持される場合にはそれらのブロックコポリマーが含まれる。
【0035】
E. 構造式(I)D1、D2BおよびB’基
1.脱離基
D1、D2が、独立して選択される脱離基である構造式(I)の態様において、適切な成分は、ハロゲン、ヒドロキシスクシニミジルカーボネートのような活性化カーボネート、カルボニルイミダゾール、環式イミドチオン、イソシアネート、N-パラ-ニトロフェノール、N-ヒドロキシフタルイミド、N-ヒドロキシベンゾトリアゾリル、イミダゾール、およびトシレート、下記の化合物のような基を含むがこれに限定されない。
【化11】

【0036】
他の適切な脱離基は当業者に明らかであろう。
【0037】
本発明の目的のために、脱離基は、所望の標的、すなわち生物活性成分、二官能性スペーサー、中間体等上に見られる求核剤と反応できる基であると理解されるべきである。したがって、標的は、タンパク質、ペプチド、酵素、天然のまたはドキソルビシンのような化学合成された治療分子上に見られるNH2のような、置換のための基を含む。
【0038】
2.活性化基
D1、D2、BおよびB’が、独立して活性化基である構造式(I)の態様において、そのような官能基の限定されない例には、マレイミジル、ビニル、ビニルスルホンの残基、ヒドロキシ、アミノ、カルボキシ、メルカプト、ヒドラジド、カルバゼート(carbazate)等が含まれる。ポリマー複合体に結合されると、官能基(例えばマレイミド)を使用して、ポリペプチド、アミノ酸またはペプチドスペーサー等のシステイン残基のような標的にポリマー複合体を結合できる。
【0039】
3.生物活性成分
D1、D2、BまたはB’が、アミンまたはヒドロキシル含有化合物の残基である構造式(I)の態様において、そのような適切な化合物の限定されない例には、有機化合物、酵素、タンパク質、ポリペプチド等の残基が含まれる。有機化合物は、ダウノルビシン、ドキソルビシンを含むアントラサイクリン化合物のような成分;p-アミノアニリンマスタード、メルファラン、Ara-C(シトシンアラビノシド)および関連する代謝拮抗化合物、例えばゲムシタビンを含むがこれに限定されない。あるいは、この成分は、アミンまたはヒドロキシルを含有する心血管作動薬、カンプトテシンおよびパクリタキセルのような抗悪性腫瘍薬、抗感染薬、ニスタチン、フルコナゾールおよびアンホテリシンBのような抗真菌薬、抗不安薬、胃腸薬、中枢神経系活性化剤、鎮痛薬、不妊薬(fertility agent)、避妊薬、抗炎症薬、ステロイド剤、作用薬等の残基でもよい。
【0040】
上記のものに加えて、生物活性成分は、酵素、タンパク質、ポリペプチド、一本鎖抗原結合タンパク質、CC49のような(SCAの)モノクローナル抗体、その断片等の残基でもよい。SCAのモノクローナル抗体もまた考慮される。適切なタンパク質は、ポリマー結合のため少なくとも一つの利用可能な基、例えばε-アミノ、シスチニルチオ、N-末端アミノ、を有するポリペプチド、酵素、ペプチド等を含むがこれに限定されず、生理的または薬理的活性を有する物質並びに有機溶媒中で反応を触媒できる物質を含む。
【0041】
所定のタンパク質、ポリペプチドおよびペプチドは、ヘモグロビン、因子VII、VIII、およびIXを含む血液因子のような血清タンパク質;免疫グロブリン、インターロイキン、すなわちIL-1からIL-13までのようなサイトカイン等、α、βおよびγインターフェロン、顆粒球コロニー刺激因子を含むコロニー刺激因子、血小板由来成長因子およびホスホリパーゼ活性化タンパク質(PLAP)を含むがこれに限定されない。一般的な生物学的または治療上興味のある他のタンパク質は、インスリン、レクチンおよびリシンのような植物タンパク質、腫瘍壊死因子および関連タンパク質、例えばTGFαまたはTGFβの形質転換増殖因子および上皮成長因子のような成長因子、ホルモン、ソマトメジン、エリスロポイエチン、色素性ホルモン、視床下部放出因子、抗利尿ホルモン、プロラクチン、絨毛性ゴナドトロピン、卵胞刺激ホルモン、甲状腺刺激ホルモン、組織プラスミノゲンアクチベーター等を含む。所定の免疫グロブリンは、IgG、IgE、IgM、IgA、IgDおよびそれらの断片を含む。
【0042】
インターロイキン、インターフェロンおよびコロニー刺激因子のようないくつかのタンパク質は、通常は組換え技術を使用する結果として、非グリコシル化形態でも存在する。非グリコシル化形態も本発明のタンパク質に含まれる。
【0043】
所定の酵素は、炭水化物特異的酵素、タンパク質分解酵素、酸化還元酵素、転移酵素、加水分解酵素、脱離酵素、イソメラーゼおよびリガーゼを含む。特定の酵素に限定されずに、所定の酵素の例は、アスパラギナーゼ、アルギナーゼ、アルギニンデアミナーゼ、アデノシンデアミナーゼ、スーパーオキシドジスムターゼ、エンドトキシナーゼ、カタラーゼ、キモトリプシン、リパーゼ、ウリカーゼ、アデノシンジホスファターゼ、チロシナーゼおよびビリルビンオキシダーゼを含む。所定の炭水化物特異的酵素は、グルコースオキシダーゼ、グルコダーゼ(glucodase)、ガラクトシダーゼ、グルコセレブロシダーゼ、グルクロニダーゼ(guludouronidase)等を含む。
【0044】
生体内生物活性を示す生物ポリマーの任意の部分もここに含まれる。これには、アミノ酸配列、核酸(DNA、RNA)、ペプチド核酸(PNA)、抗体断片、一本鎖結合タンパク質、例えばここに言及することにより引用される米国特許第4,946,778号参照、抗体または断片、ポリクローナル抗体、モノクローナル抗体および触媒抗体の融合を含む結合分子が含まれる。
【0045】
タンパク質またはそれらの一部は、組織培養のような当業者に知られる技術、動物供給源からの抽出、または組換えDNA技術を使用することにより調製または単離できる。タンパク質、ポリペプチド、アミノ酸配列等の形質転換供給源も考慮される。そのような物質は、形質転換動物、すなわちマウス、ブタ、ウシ等から得られ、タンパク質は、ミルク、血液または組織中で発現される。形質転換昆虫およびバキュロウィルス発現系もまた、供給源として考慮される。さらに、突然変異インターフェロンのような、タンパク質の突然変異バージョンもまた、本発明の範囲内である。
【0046】
所定の他のタンパク質は、ブタクサ(ragweed)、抗原E、ミツバチ毒、ダニアレルゲン等のようなアレルゲンタンパク質である。上記のものは本発明に適切なタンパク質の例示である。ここで定められるように、特別に説明されていないが利用可能なアミノ基を有するこれらのタンパク質もまた考慮され、本発明の範囲内であることを理解すべきである。
【0047】
本発明の好ましい態様において、アミノまたはヒドロキシル含有化合物は、そのような治療が所望である条件について、動物、例えばヒトを含む哺乳類の治療における医薬または診断用途に適切な生物活性化合物である。上記のリストは、例示であり修飾可能な化合物について制限するものではない。当業者は、他のそのような化合物/組成物を過度の実験をしないで同様に修飾できることが分かるであろう。特別に説明されていないが適切な結合基を有するそれらの生物活性物質もまた考慮され、本発明の範囲内であることを理解すべきである。
【0048】
ここに含めるのに適切なアミノまたはヒドロキシル含有分子の種類についての唯一の限定は、ポリマー複合体と反応し結合できる利用可能な少なくとも一つの(一次または二次)アミンまたはヒドロキシルが存在すること、およびプロドラッグシステム放出および親化合物の再生後に生物活性の実質的損失がないことである。
【0049】
4.診断用薬
D1、D2、BおよびB’が診断用薬である構造式(I)の態様において、適切な薬の限定されないリストには、色素、キレート剤、および同位体標識化合物および緑色蛍光タンパク質(GFP)のような他の標識化合物が含まれる。
【0050】
F. Q成分およびその機能
本発明のある態様において、QはL5-C(=Y10)であり、L5は、L1、L2、L3、およびL4を定める群より選択される二官能性リンカーであり、Y10は、Y1-9を定めるのと同じ群から選択される。本発明のこの態様において、Q基は、B’基とポリマー複合体の残りとの間のつながりとして作用する。
【0051】
本発明の他の態様において、Qは、標的細胞中に能動輸送される成分、疎水性成分、およびそれらの組合せである。Qは好ましくは一価であるが、Qは必要に応じて、ポリマー複合体へ1つ以上のB’基を結合させるために二価または多価でもよい。能動輸送を達成するために、Qは、アミノ酸またはペプチド残基、糖残基、脂肪酸残基、C6-18アルキル、置換アリール、ヘテロアリール、-C(=O)、-C(=S)または-C(NR28)を含んでもよく、ここでR28はH、低アルキル等である。
【0052】
本発明のこの態様は、ポリマー複合体中への組み込みに適切な生物活性物質はそれ自体、ポリマー基質からの加水分解放出後は活性でないがさらに化学的工程/反応を受けた後に活性となる物質/化合物でもよいという原理に広く基づく。この実施の形態と共に、ポリマー系により血流中に供給される治療剤または診断用薬、ペプチド、ポリペプチド等は、所定の標的細胞中に入るまたは能動輸送されるまで不活性のままであり、細胞内化学により、例えば組織または細胞中に存在する酵素または酵素系により、すぐに活性化される。
【0053】
本発明のこの態様の化合物を調製して、Q成分に結合したまま、細胞外液中に活性生物物質(ここでB’と指定される)を放出するように、ポリマーに基づく複合体の生体内の加水分解により複合体を切断する。本発明のこの態様における生物活性物質は好ましくは、小分子の治療剤および/または診断用薬であるが、これに限定されない。例えば、一つの可能なQ-B’の組合せは、ロイシン−ドキサルバシン(doxarubacin)であり、別の組合せは、アミノ酸−結合カンプトセシンまたはパクリタキセルであり、治療される組織は腫瘍組織である。本発明がどのように作用するかに関して任意の理論または仮説により拘束されることを意図せず、輸送エンハンサーとして選択される追加の成分に依存して、腫瘍細胞中への生物活性物質の輸送の速度は、保護されたおよび/または輸送が増強された形態で、例えばEPR効果を示す組織の、細胞外組織スペース中に生物活性物質を供給することによると考えられる。
【0054】
さらに必要に応じて、輸送エンハンサー(Q)は、細胞膜輸送系についての既知の基質から選択される。単に実施例として、細胞は特定の栄養分および内分泌因子等を能動輸送することが知られており、そのような栄養分、またはその類似物は、標的細胞中への生物学的に有効な物質の能動輸送を増強するために容易に利用される。これらの栄養分の例には、アミノ酸残基、ペプチド、例えば約2から10残基かそれ以上のサイズの短いペプチド、単糖および脂肪酸、内分泌因子等が含まれる。
【0055】
短いペプチドは、上記のように、例えば、2から約10までかそれ以上のアミノ酸残基のペプチドである。本発明のこの実施の形態において、そのようなペプチド輸送エンハンサーは、疎水性である必要はないが、他の経路により取り込みを増強するおよび/または通常の血流中の成熟前加水分解から結合した小分子物質を保護する作用をすると考えられる。例えば、ペプチド輸送エンハンサー、および同様の分子量範囲の他の輸送エンハンサーは、血漿に基づく加水分解酵素による生物活性物質からの切断を立体的に障害するが、その後、カプテシン(capthesin)のような様々のペプチドおよび/またはプロテアーゼにより標的細胞内で切断されると考えられる。
【0056】
ある好ましい態様において、Qは疎水性成分である。疎水性が効果にどのように寄与するかに関して任意の理論または仮説に拘束されることを意図せず、疎水性成分は、細胞外組織スペース中、例えば血漿中に存在する疎水性酵素等の攻撃を抑制することにより、活性生物物質からの輸送エンハンサーの細胞外切断を抑制すると考えられる。したがって、いくつかの好ましい輸送エンハンサーには、上記のように、例えば、アラニン、バリン、ロイシン、イソロイシン、メチオニン、プロリン、フェニルアラニン、チロシン、およびトリプトファンのような疎水性アミノ酸、並びに非天然発生誘導体およびそれらの類似物が含まれる。
【0057】
さらに必要に応じて、輸送エンハンサーは、疎水性有機成分である。単に例として、有機成分は、C6-18、またはより大きいアルキル、アリールまたはヘテロアリールの置換または非置換である。有機成分輸送エンハンサーは、例えば-C(=S)および/または-C(=O)を含む有機官能基を含むことが考えられる。
【0058】
G. 二官能性ポリマー複合体の合成
特定のヘテロ二官能性ポリマー化合物の合成は、実施例に示される。説明のために図1を参照すると、ある好ましい方法は、以下の工程を含む:
1)基本的なカップリング条件下で、アミン保護され、活性化されたヘテロ二官能性PEGポリマーを、ヘテロ二官能性PEGポリマーと反応させ、第一の中間体を得る工程、
2)第一の中間体を、NHS活性化エステルのような適切な活性化基と反応させる工程、
3)工程1)の反応を反復して第二の中間体を得る工程、
4)第二の中間体を脱保護する工程、および
5)カップリング条件下で、活性化された第一の中間体を、脱保護された第二の中間体と反応させ、高分子量のヘテロ二官能性PEG複合体を完成する工程。
【0059】
本発明によるポリマー複合体を生成するさらなる方法は、適切な条件下で、
構造式(i)の化合物を、
【化12】

【0060】
A1は、活性化基であり;
Tは、保護基であり;
X1、X3およびX5は、独立して、O、SまたはNR1であり;
R44は、ポリアルキレンオキシドであり;
R1は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、アラルキル、およびC3-8置換シクロアルキルから選択され;
R40-41は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、C3-8置換シクロアルキル、アリール、置換アリール、アラルキル、C1-6ヘテロアルキル、置換C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
nは1または自然数であり;
yは0または自然数であり;
tは自然数であり、
pは0または1である;
構造式(ii)の化合物と反応させ、
【化13】

【0061】
X2、X4およびX6は、独立して、O、S、NR1であり;
R44’は、ポリアルキレンオキシドであり;
R1は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、アラルキル、およびC3-8置換シクロアルキルから選択され;
R42-43は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、C3-8置換シクロアルキル、アリール、置換アリール、アラルキル、C1-6ヘテロアルキル、置換C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
n’は自然数であり;
y’は0または自然数であり;
t’は自然数であり;
p’は0または1である;
構造式(iii)の化合物を形成する工程を含む。
【化14】

【0062】
この方法はまた、必要に応じてさらに、構造式(iii)の化合物を脱保護して、さらなる合成、活性化および/または薬への接合等において使用できる有用な中間体を提供する工程を含んでもよい。あるいは、この方法はさらに、適切な条件下で、構造式(iii)の化合物を活性化剤と反応させて、構造式(iv)の化合物を生成する工程を含んでもよい。
【化15】

【0063】
ここでA2は活性化基であり、全ての他の変数は上記のように定められる。
【0064】
さらなる態様において、本発明の方法は、適切な条件下で構造式(iv)のアミノ保護基(T)を活性化基に転換して、構造式(v)の化合物を生成する工程を含んでもよい。
【化16】

【0065】
ここでA3は活性化基である。
【0066】
構造式(v)の化合物が生成されると、適切な条件下で、生物活性成分、診断用薬または末端基と反応させ、構造式(vi)の化合物を生成してもよい。
【化17】

【0067】
ここでD2は生物活性成分、診断用薬または末端基であり、全ての他の変数は上記のように定められる。
【0068】
適切なカップリング剤の限定されないリストには、1,3-ジイソプロピル-カルボジイミド(DIPC)、任意の適切なジアルキルカルボジイミド、2-ハロ-1-アルキル-ピリジニウムハライド(Mukaiyama試薬)、1-(3-ジメチルアミノプロピル)-3-エチルカルボジイミド(EDC)、プロパンホスホン酸環式無水物(PPACA)およびフェニルジクロロホスフェート等が含まれ、これらは、Sigma-Aldrich Chemicalのような商業供給源から入手され、または既知の技術を使用して合成される。
【0069】
好ましくは、置換基は、テトラヒドロフラン(THF)、アセトニトリル(CH3CN)、塩化メチレン(DCM)、クロロホルム(CH3Cl)、ジメチルホルムアミド(DMF)またはそれらの混合物のような不活性溶媒中で反応させる。適切な塩基には、ジメチルアミノピリジン(DMAP)、ジイソプロピルエチルアミン、ピリジン、トリエチルアミン、KOH、カリウムt-ブトキシドおよびNaOH等が含まれる。反応は通常、約0℃から約22℃までの温度(室温)で行われる。
【0070】
より具体的には、高分子量ポリマー複合体を生成する一つの方法は、以下の工程を含む:
1)下記の構造式のアミン保護活性化ポリマー残基を、
【化18】

【0071】
ここで、nは自然数である、
下記の構造式のヘテロ二官能性ポリマー残基と反応させ、
【化19】

【0072】
ここで、nは自然数である、
下記の構造式の化合物を生成する工程:
【化20】

【0073】
2)工程1)からの中間体を、活性化基、生物活性成分、診断用薬または末端基と反応させて、下記の構造式の化合物を生成する工程:
【化21】

【0074】
ここで、D2は、活性化基、生物活性成分、診断用薬または末端基であり、例えば下記のala-カンプトテシンである、
【化22】

【0075】
3)アミン部分を脱保護し、マレイミドのような成分と共に活性化し、下記の構造式の化合物を生成する工程:
【化23】

【0076】
4)その後、マレイミド中間体を、モノクローナル抗体CC49(TAG-72に結合する)の一本鎖抗原結合タンパク質または上記のいずれか、以下便宜上全て「SCA」と示す、の他の断片のような生物活性成分と反応させ、以下の構造式のSCA免疫複合体を産出する工程:
【化24】

【0077】
ここで、nは自然数である。
【0078】
上記は、カルバメート結合を有するヘテロ二官能性を産出する活性化カーボネートを示す。当業者によって理解されるように、活性化エステルを工程の初めに使用して、アミド結合を生成できる。
【0079】
当業者は、本発明の方法により調製される複合体は、単一または複数のポリマーユニット中で増加し、それにより所望の複合体を達成するために選択される方法に依存して同じまたは無作為のポリマーサブユニットを反復することができるということを理解するであろう。
【0080】
選択される経路に関係なく、ここに記載される合成技術から生じる好ましい化合物のいくつかは、以下のものを含む:
【化25】

【0081】
ここで、BおよびB’は、脱離基、活性化剤、生物活性物質、診断用薬等であり、SCAは一本鎖抗体である。いくつかの他の化合物は、以下のものを含む:
【化26】

【0082】
H. 治療の方法
本発明の別の態様は、哺乳類中で様々の病状を治療する方法を提供する。この方法は、そのような治療を必要とする哺乳類に、ここに記載されるようにして調製された本発明のヘテロ二官能性ポリマー組成物の有効な量を投与する工程を含む。この組成物は、特に、腫瘍性疾患の治療、全身腫瘍組織量の減少、腫瘍の転移の防止および哺乳類における腫瘍/新生物の成長の再発の防止に有用である。
【0083】
投与される化合物の量は、そこに含まれる親分子(parent molecule)、例えばペプチド、ポリペプチド、タンパク質、酵素、小分子の薬等に依存する。通常、治療方法に使用される化合物の量は、哺乳類中で所望の治療結果を有効に達成する量である。もちろん、様々の化合物の投薬量は、親化合物、生体内加水分解の速度、ポリマーの分子量等にいくらか依存して変化する。当業者は、臨床的経験および治療指示に基づいて選択された化合物の最適な投薬量を特定するであろう。実際の投薬量は、過度の実験をせずに当業者に明らかであろう。
【0084】
本発明の化合物は、哺乳類への投与のための一つ以上の適切な薬剤組成物中に含まれてもよい。薬剤組成物は、当該技術においてよく知られる方法により調製される、溶液、懸濁液、錠剤、カプセル等の形態でもよい。そのような組成物の投与は、医師の必要性に依存して経口および/または非経口の経路によってもよい。組成物の溶液および/または懸濁液は、例えば、任意の既知の方法により、例えば静脈、筋肉、皮下注射等による、組成物の注射または浸潤のための運搬媒介物として利用してもよい。
【0085】
そのような投与は、体の空間または腔への注入、並びに吸入および/または鼻腔内経路によってもよい。しかしながら、本発明の好ましい態様において、化合物は、それを必要とする哺乳類に非経口で投与される。
【実施例】
【0086】
以下の実施例は、本発明のさらなる認識を提供するために役立つものであり、決して本発明の有効な範囲を制限することを意味するものではない。実施例に記載される数は、図1から9に示されるものと対応する。
【0087】
基本手順
全ての反応は、乾燥した窒素またはアルゴン雰囲気下で行った。市販の試薬をさらに精製せずに使用した。全てのPEG化合物を、使用前に、真空下でトルエンからの共沸蒸留により乾燥させた。Varian Mercury 300NMRスペクトロメーターおよび特に定めがない限り溶媒として重水素化クロロホルムを使用して、NMRスペクトルを得た。テトラメチルシラン(TMS)からダウンフィールド(downfield)の100万(ppm)ごとに分けて化学シフト(δ)を報告した。
【0088】
HPLC方法。1mL/分の流速で0.5%トリフルオロ酢酸中30-90%のアセトニトリルの勾配を使用して、多波長UV検出器と共にZOBAX 300 SB C-8逆相カラム(150×4.6mm)またはPhenomenex Jupiter 300A C18逆相カラム(150×4.6mm)を使用するBeckman Coulter System Gold HPLC器具により、中間体および最終産物の反応混合物および純度を観察した。
【0089】
化合物3.ジクロロメタン(DCM、20mL)中の1(0.623g、0.180mmol)、2(0.623g、0.180mmol)、およびN,N-ジメチルアミノピリジン(DMAP、0.110g、0.90mmol)の溶液を、12時間室温で攪拌した。溶液を0.1N HCl(2×20mL)で洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去し、イソプロピルアルコール(IPA,25mL)から結晶化して3(0.910g,0.134mmol,74.3%)を得た。13C NMR(67.8MHz、CDCL3)δ171.91、155.79、155.30、66.15、63.32、40.34、39.91、34.26、28.02。
【0090】
化合物4.DCM/トリフルオロ酢酸(TFA)(8mL:4mL)中の3(0.707g,0.104mmol)の溶液を、室温で3.5時間攪拌した。溶媒を減圧下で除去し、生じた固体をエーテルで洗浄して4(0.707g,0.104mmol,〜100%)を産出した。13C NMR(67.8MHz、CDCL3)δ172.18、155.94、66.62、66.32、63.49、40.49、39.71、34.46。
【0091】
化合物5.DCM(15mL)中の3(0.910g,0.134mmol)、2-メカプトチアゾリン(mecaptothiazoline)(2-MT,0.0319g,0.268mmol)、およびDMAP(0.0327g,0.268mmol)を、15分間0℃で冷却し、1-[3-(ジメチルアミノ)-プロピル]-3-エチルカルボジイミドハイドロクロライド(EDC,0.0513g,0.268mmol)を加え、反応溶液を室温まで徐々に温め、12時間攪拌した。PEG誘導体をエチルエーテルで沈殿させ、濾過により採集し、IPA(19mL)から結晶化し5(0.820g,0.121mmol,90.0%)を得た。13C NMR(67.8MHz、CDCL3)δ200.94、171.73、155.85、155.36、65.75、63.37、55.54、40.37、39.94、38.73、28.08。
【0092】
化合物6.DCM(15mL)中の4(0.668g,0.098mmol)の溶液にDMAPを加え、pHを7.0に調整した。化合物5(0.677g,0.098mmol)を加え、反応混合物を12時間室温で攪拌した。溶液を0.1N HCl(2×20mL)で洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去し、イソプロピルアルコール(IPA,25mL)から結晶化して6(1.053g,0.077mmol,79.0%)を得た。13C NMR(67.8MHz、CDCL3)δ171.97、170.72、155.87、155.36、66.83、66.24、63.39、40.40、39.99、38.74、36.50、34.34、28.08。
【0093】
化合物8.DCM(10mL)中の6(0.616g,0.045mmol)、20-(S)-カンプトテシンアラニネート(alaninate)トリフルオロ酢酸塩(0.0706g,0.136mmol)、およびDMAP(0.111g,0.906mmol)の溶液を、15分間0℃で冷却し、EDC(0.026g,0.136mmol)を加え、反応用液を室温まで温めた。12時間攪拌した後、溶液を0.1N HCl(2×20mL)で洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去し、イソプロピルアルコール(IPA,13mL)から結晶化して8(0.536g,0.038mmol,85.0%)を得た。13C NMR(67.8MHz、CDCL3)δ171.09、170.83、170.63、166.48、156.82、155.99、151.82、148.46、146.01、144.98、130.77、130.12、129.40、128.06、127.77、127.58、119.72、95.58、66.97、66.77、63.57、49.74、47.56、40.55、40.14、38.90、36.70、36.41、31.48、28.22、17.58、7.40。
【0094】
化合物9.DCM/TFA(8mL:4mL)中の8(0.536g,0.038mmol)の溶液を、室温で2時間攪拌した。溶媒を減圧下で除去し、残留物をエチルエーテルで洗浄して9(0.536g,0.038mmol,〜100%)を得た。13C NMR(67.8MHz、CDCL3)δ170.99、170.81、170.60、166.25、156.58、155.79、151.56、148.19、145.79、144.79、130.71、129.92、129.12、127.91、127.63、127.37、119.46、95.44、66.71、66.54、63.34、49.59、47.45、40.34、39.59、38.78、36.34、36.08、31.24、17.24、7.20。
【0095】
化合物11.DCM(15mL)中の9(0.818g,0.059mmol)の溶液にDMAPを加え、pHを7.0に調整し、10を加え、溶液を0℃に冷却した。1.3-ジイソプロピルカルボジイミド(DIPC,0.0554μL,0.354mmol)を反応に加え、混合物を12時間攪拌しながら室温に温めた。溶液を0.1N HCl(2×20mL)で洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去し、イソプロピルアルコール(IPA,16mL)から結晶化して11(0.65g,0.046mmol,78%)を得た。13C NMR(67.8MHz、CDCL3)δ172.22、171.10、170.84、170.60、170.32、166.48、156.83、155.99、151.82、148.48、146.04、144.98、133.70、130.76、130.13、129.43、128.06、127.78、127.60、119.75、95.56、66.99、66.77、63.58、49.74、47.56、40.57、38.92、37.39、36.72、36.43、36.05、31.48、28.08、26.17、25.18、24.86、17.30、7.40。
【0096】
化合物12.A.タンパク質CC49の減少:100mMのリン酸ナトリウム中のCC49の28mg(2.79mg/ml)の溶液に、pH7.8、37℃で、2mM DTTと共に2mM EDTAを加え、2時間反応を進行させた。100mMのリン酸ナトリウム、pH6.5、および2mM EDTAの溶液で平衡化した脱塩カラムによりDTTを除去した。減少したタンパク質の最終濃度は、0.39mg/ml(〜23mg、〜60ml、83%)。
【0097】
B.ペグ化:CC49および11を、100mMのリン酸ナトリウムの溶液、pH6.5、2mM EDTA中1:10のモル比で混合し、25℃で2時間反応させた。
【0098】
C.CC49-PEG-CPTの精製:反応溶液のpH値を、HOAcで5に調整し、水(〜200mL)を加えて溶液の導電率を2mS未満に減少し、混合物を5mL/分でPoros HSカラム上に充填した。10mMリン酸ナトリウム溶液中1M NaClにより産物を溶出し、タンパク質の画分のピークを組み合わせ、30k Centriplus遠心分離管を使用して濃縮した。濃縮されたサンプルを生理食塩水に対して透析し、活性成分について分析した。ヨード染色によって、産物中に非タンパク質接合PEG種は発見されなかった。
【0099】
化合物13.DCM/TFA(30mL:15mL)中の6(4.50g,0.335mmol)の溶液を、室温で3.5時間攪拌した。溶媒を減圧下で除去し、生じた固体をエーテルで洗浄して13(4.30g,0.320mmol,95.6%)を産出した。13C NMR(67.8MHz、CDCL3)δ171.59、155.58、66.36、65.89、63.02、40.05、39.36、38.61、35.85、33.96。
【0100】
化合物14.DCM(50mL)中の13(4.30g,0.320mmol)の溶液にDMAPを加え、pHを7.0に調整した。次に、化合物5(2.20g,0.320mmol)を加え、反応混合物を12時間室温で攪拌した。溶液を0.1N HCl(2×30mL)で洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去し、残留物をイソプロピルアルコール(IPA,25mL)から結晶化して14(5.30g,0.260mmol,81.2%)を得た。13C NMR(67.8MHz、CDCL3)δ171.77、170.60、155.75、66.73、66.12、63.28、40.29、39.86、38.66、36.41、34.19、27.99。
【0101】
化合物15.DCM/TFA(30mL:15mL)中の14(5.30g,0.260mmol)の溶液を、室温で3.5時間攪拌した。溶媒を減圧下で除去し、生じた固体をエーテルで洗浄して15(5.30g,0.260mmol,〜100%)を産出した。13C NMR(67.8MHz、CDCL3)δ171.77、170.60、155.75、66.73、66.12、63.28、40.29、39.86、38.66、36.41、34.19。
【0102】
化合物18.DCM(30mL)中のローダミンB塩基(1.00g,2.09mmol)、グリシンt-ブチルエステルハイドロクロライド塩(0.670g,4.0mmol)およびDMAP(0.767g,8.0mmol)の溶液を15分間0℃に冷却し、EDC(0.767g,4.0mmol)を加えた。反応混合物を室温に温め、12時間攪拌した。溶液を0.1N HCl(2×30mL)で洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去し、溶出溶媒としてヘキサンおよび酢酸エチル(3:2,v/v)を使用してシリカゲルカラムクロマトグラフィーにより残留物を精製し、18(0.937g,1.58mmol,76%)を得た。13C NMR(67.8MHz、CDCL3)δ167.30、166.73、153.06、153.01、148.36、132.05、130.60、129.31、127.63、123.46、122.67、107.64、104.69、97.21、80.80、64.74、44.10、42.03、27.63、12.41。
【0103】
化合物19.DCM/TFA(16mL:8mL)中の18(0.937g,1.58mmol)の溶液を、室温で2時間攪拌した。溶媒を減圧下で除去し、残留物をエチルエーテルで洗浄して19(0.930g,1.57mmol,〜100%)を産出した。13C NMR(67.8MHz、CDCL3)δ169.30、167.83、152.72、152.15、144.14、133.09、130.28、128.83、123.64、123.41、112.32、103.89、64.69、48.47、41.49、11.44。
【0104】
化合物20.DCM(15mL)中の19(0.421g,0.785mmol)、2-MT(0.140g,1.18mmol)およびDMAP(0.287g,2.30mmol)の溶液を15分間0℃に冷却し、EDC(0.226g,1.18mmol)を加え、反応溶液を室温まで徐々に温め、12時間攪拌した。溶液を0.1N HCl(2×20mL)で洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去し、20(0.450g,0.706mmol,90%)を得た。13C NMR(67.8MHz、CDCL3)δ200.68、168.90、167.73、153.27、152.07、148.10、139.66、132.47、130.20、129.39、127.94、123.63、122.85、108.19、98.14、65.11、55.77、51.31、45.68、44.68、33.67、29.09、12.53。
【0105】
化合物21.DCM中の15(2.7g,0.134mmol)の溶液にDMAPを加え、pHを7に調整した。化合物20(171mg,0.268mmol)を加え、反応溶液を12時間室温で攪拌した。反応混合物を0.1N HClで洗浄し、溶媒を減圧下で蒸発させ、固体をIPAから結晶化させて21(2.3g,0.112mmol,84%)を産出した。13C NMR(67.8MHz、CDCL3)δ201.00、170.78、167.73、155.88、152.86、148.80、132.51、129.86、128.06、127.87、123.59、122.53、108.14、98.09、66.86、63.45、55.57、44.37、43.99、40.43、38.80、38.54、36.57、34.32、28.10、12.18。
【0106】
化合物22.DCM(15mL)中の21(2.3g,0.112mmol)、2-MT(0.027g,0.224mmol)およびDMAP(0.027g,0.224mmol)の溶液を0℃に冷却し、EDC(0.043g,0.224mmol)を加えた。反応溶液を室温まで徐々に温め、12時間攪拌した。PEG誘導体をエチルエーテルで沈殿させ、濾過し、IPAから結晶化させて22(2.0g,0.097mmol,86%)を得た。13C NMR(67.8MHz、CDCL3)δ200.00、171.70、170.64、167.96、167.68、155.79、152.86、148.24、132.38、129.86、127.84、127.72、123.55、122.38、104.12、97.47、66.80、63.37、55.51、44.91、40.37、38.72、38.44、36.50、28.08、12.26。
【0107】
化合物23.DCM(10mL)中の22(2.0g,0.097mmol)、3,5-ジメチル-4-ヒドロキシベンジルアルコール(0.059g,0.388mmol)およびDMAP(0.048g,0.388mmol)の溶液を12時間還流させた。PEG誘導体をエチルエーテルで沈殿させ、濾過紙、IPAから結晶化させて23(1.9g,0.096mmol,99%)を得た。13C NMR(67.8MHz、CDCL3)δ170.40、168.40、167.64、167.38、155.59、152.65、148.01、132.13、129.66、129.11、127.66、126.16、123.31、122.14、107.48、103.99、97.26、66.88、63.34、43.70、40.15、38.52、38.25、36.26、34.37、15.76、12.07。
【0108】
化合物24.DCM(20mL)中の23(1.9g,0.097mmol)およびN,N’-ジスクシニミジルカーボネート(0.199g,0.775mmol)およびDMF(2mL)を0℃に冷却し、ピリジン(0.063μL、0.775mmol)を加えた。反応溶液を徐々に室温まで温め、12時間攪拌した。PEG誘導体をエチルエーテルで沈殿させ、濾過し、IPAから結晶化させて24(1.58g,0.075mmol,77%)を得た。13C NMR(67.8MHz、CDCL3)δ171.22、170.49、168.35、168.05、167.73、167.47、155.65、152.71、148.07、132.24、129.69、128.09、127.72、123.39、122.23、107.53、104.02、97.30、66.65、63.19、43.77、40.22、38.57、38.31、36.22、34.43、24.89、15.79、12.13。
【0109】
化合物25.活性化PEGリンカー24を、0.05M HEPES中、pH7.8、モル比30:1(PEG:GFP)のGFP(2mg/ml)の溶液に加えた。溶液を、N2下で45分間25℃で攪拌し、pH6.4のリン酸ナトリウム緩衝液を加えることにより溶液のpHを低くし、最終濃度を50mMにした。Biocad Perfusion Chromatography Workstationを使用して、Superdex 200 Hiload 16/60カラム(Amersham Pharmacia Biotech, Piscataway, NJ)上で遊離PEGを除去した。溶出緩衝液は、10mMリン酸ナトリウム、pH6.8および150mM NaClから成った。280nmにおける吸光度および蛍光を示した画分を集め、30k NMWL膜(Millipore Corp.,Bedford,MA)と共にウルトラフリー-15遠心濾過装置を使用して濃縮した。55000cm-1M-1の減衰係数を使用して、489nmにおけるUVによりPEG-GFP(25)を特定した。
【0110】
化合物27.DCM中の6、26、およびDMAPの溶液にEDCを加え、溶液を12時間室温で攪拌した。溶媒を減圧下で除去し、固体をIPAから結晶化して27を得た。27の構造を13C NMRにより確かめた。
【0111】
化合物28.DCM/TFA中の27の溶液を、12時間室温で攪拌した。溶媒を減圧下で除去し、固体をIPAから結晶化して28を得た。28の構造を13C NMRにより確かめた。
【0112】
化合物29.DCM中の10、2-MT、およびDMAPの溶液を0℃で15分間冷却し、EDCを加え、反応溶液を徐々に室温まで温めて2時間攪拌した。次に溶液を0.1N HClで洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去して29を得た。29の構造を13C NMRにより確かめた。
【0113】
化合物30.DCM中の28、29およびDMAPの溶液を、室温で12時間攪拌した。溶媒を減圧下で除去し、固体をIPAから結晶化させて30を得た。30の構造を13C NMRにより確かめた。
【0114】
化合物31.DCM中の30、7、およびDMAPの溶液を15分間0℃で冷却し、EDCを加え、反応溶液を室温に温めた。12時間の攪拌後、溶液を0.1N HClで洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去し、残留物をIPAから結晶化して31を得た。31の構造を13C NMRにより確かめた。
【技術分野】
【0001】
本発明は、治療剤のターゲティングおよび供給において有用な高分子量へテロ二官能性ポリマー複合体の合成に関する。この複合体を生成および使用する方法もまた開示される。
【背景技術】
【0002】
治療剤のターゲティングおよびドラッグデリバリーは、特に癌の治療における細胞毒の使用と共にますます重要になっている。治療剤で腫瘍を選択的に標的にし、ヒトおよび他の動物中の癌を治療するために、多くの方法が使用されている。モノクローナル抗体(mAb)またはその断片のようなターゲティング成分は、側鎖官能基により直線状のポリマーに接合される。しかしながら、この方法では通常、抗体の化学的特性の変化またはターゲティング成分をランダムコイル構造に組み込むポリマーの折りたたみ構造により、レセプター結合親和性が減少する。理想的には、新しい複合体は、ターゲティング機能性並びに治療上の価値を有する。
【0003】
近年、一端でターゲティング官能基を有し他端で治療成分(例えば化学療法薬)有するヘテロ二官能性ポリマー複合体が、開示されている。特許文献1参照。使用されるポリマー複合体は、一端に複数の薬分子(例えばポリ(1−グルタミン酸))を結合する複数の側鎖官能基を含有するポリマーキャリアに結合したポリマースペーサーを有し、ポリマースペーサーの他端はターゲティング成分に結合される。しかしながら、ポリマースペーサー部分の分子量は、著しく低い。
【0004】
より高い分子量のヘテロ二官能性ポリマー構造物を調製する方法が、開示される。特許文献2参照。しかしながら、これらの方法は、所望でないポリマー分散性のためにそれ自体は理想的でないモノマーの重合を含む。他の従来の方法は、陰イオンエトキシル化および困難な精製工程を有する。上記の技術を使用して高分子量ポリマー複合体を達成しようとした結果、所望の産物の質が悪くなり低収率となった。
【特許文献1】米国特許出願公開第2002/0197261A1号明細書
【特許文献2】米国特許出願公開第2002/0072573A1号明細書
【非特許文献3】Wilson, D.S., et al., Curr. Opinion in Chemical Biology 2001, 6, 81-85
【発明の開示】
【発明が解決しようとする課題】
【0005】
現在の方法の不十分さのために、高収率および高純度の基質を生成し、同時に低ポリマー分散性を保持する、高分子量へテロ二官能性ポリマー基質を生成する改良された方法が必要とされる。治療的活性化合物をターゲティングおよび供給する手段としてヘテロ二官能性ポリマー複合体を含む化合物を提供することもまた所望である。
【課題を解決するための手段】
【0006】
発明の概要
本発明のある態様において、構造式(I)の化合物が提供される。
【化1】

【0007】
X1-X6は独立してO、SまたはNR1であり;
R44およびR44’は独立して選択されるポリアルキレンオキシドであり;
R1は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、アラルキル、およびC3-8置換シクロアルキルからなる群より選択され;
R40-43は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、C3-8置換シクロアルキル、アリール、置換アリール、アラルキル、C1-6ヘテロアルキル、置換C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
y、およびy’は、独立して、0または自然数であり;
pおよびp’は、独立して、0または自然数であり;
nおよびn’は、独立して、0または自然数であり;
aおよびbは、独立して、0または自然数であって、a+bは2以上であり;
zは1または自然数であり;
D1およびD2は、独立して、B、脱離基、活性化基、OH、および末端基からなる群より選択され;
Bは、生物活性成分、診断用薬およびOHからなる群より選択される。
【0008】
好ましい実施の形態において、X1-X6は独立してOまたはNR1であり、R1は水素であり、aおよびbは独立して選択される1から約20までの整数であり、yおよびy’は独立して0、1または2であり、pおよびp’はそれぞれ1であり、D1およびD2は脱離基および末端基およびBから独立して選択され、ここでBは、薬、アミノまたはヒドロキシル含有残基、色素のような診断用薬、キレート剤または同位体標識化合物、脱離基または活性化基のような生物活性成分である。
【0009】
本発明の目的のために、「残基」という用語は、プロドラッグキャリアが結合される置換反応を受けた後に残る生物活性化合物の一部を意味すると解されるべきである。
【0010】
本発明の目的のために、「アルキル」という用語は、直鎖、分枝、置換C1-12アルキル、C3-8シクロアルキルまたは置換シクロアルキル等を含むと解されるべきである。
【0011】
本発明の主な利点のいくつかは、循環半減期および天然または未修飾の分子の可溶性を高めることのできる新しい高分子量へテロに機能性ポリマー複合体、並びに高純度を維持しながらクロマトグラフィー工程を必要としないでそのような複合体を形成する方法を含む。本発明の方法の別の利点は、ポリマー複合体の分子量を増加させながら低いポリマー分散を保持することである。本発明のさらなる利点は、当業者が、ポリマー部分のどちらの側にも同じまたは異なる基を有することができる薬複合体を設計できるということである。この利点により、当業者は、供給またはターゲティング機能性および特定の必要性に依存して同じ複合体内で治療機能性を含有する化合物を調整することができる。
【0012】
ここに記載される化合物および複合体を生成および使用する方法もまた提供される。
【図面の簡単な説明】
【0013】
【図1】図1は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【図2】図2は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【図3】図3は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【図4】図4は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【図5】図5は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【図6】図6は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【図7】図7は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【図8】図8は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【図9】図9は、実施例に説明される本発明の化合物を形成する方法を概略的に図示する。
【発明を実施するための最良の形態】
【0014】
発明の詳細な説明
A. 式(I)
本発明のある態様において、構造式(I)の化合物が提供される。
【化2】

【0015】
ここで、
X1-X6は独立してO、SまたはNR1であり;
R44およびR44’は独立して選択されるポリアルキレンオキシドであり;
R1は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、アラルキル、およびC3-8置換シクロアルキルからなる群より選択され;
R40-43は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、C3-8置換シクロアルキル、アリール、置換アリール、アラルキル、C1-6ヘテロアルキル、置換C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
y、およびy’は、独立して、0または自然数であり;
pおよびp’は、独立して、0または自然数であり;
nおよびn’は、独立して、0または自然数であり;
aおよびbは、独立して、0または自然数であって、a+bは2以上であり;
zは1または自然数であり;
D1およびD2は、独立して、B、脱離基、活性化基、OH、および末端基からなる群より選択され;
Bは、生物活性成分、診断用薬およびOHからなる群より選択される。
【0016】
構造式(I)の化合物の好ましい実施の形態において、
X1-X6は独立してOまたはNR1であり、
R1は水素、C1-6アルキル、C1-6ヘテロアルキル、アラルキル、およびC1-6置換アルキルから選択され、
yおよびy’は独立して0または1から18までの整数であり、
pおよびp’は独立して0または1であり、
nおよびn’は独立して選択される0から100までの整数であり、
aおよびbは独立して選択される1から20までの整数であり、
zは自然数である。
【0017】
より好ましくは、
X1-X4は、独立してNR1であり;
X5-X6は、それぞれOであり;
R44およびR44’は、それぞれ-(CH2-CH2-O)-であり;
R1は、水素またはメチルであり;
yおよびy’は、それぞれ0、1または2であり;
pおよびp’は、それぞれ1であり;
nおよびn’は、独立して、70から80までの間の整数から選択され;
aおよびbは、独立して、5から10までの間の整数から選択され;
zは自然数であり;
D1およびD2は、独立して、OH、ハロゲン、ターゲティング物質、薬、酵素、タンパク質、治療的活性化合物、色素、キレート剤および同位体標識化合物からなる群より選択される。
【0018】
構造式(I)の化合物のさらに別の好ましい実施の形態において、D1およびD2は、独立して選択される下記のような末端基である。
【化3】

【0019】
ここで、
Y1-6は、独立して、OまたはNR1’であり;
R1’は、水素またはメチルであり;
R2-8は、独立して、水素およびC1-6アルキルから選択され;
Arは、多置換の芳香族炭化水素または多置換の複素環式基を形成する成分であり;
L1-2は、独立して選択される二官能性リンカーであり;
eおよびf’は、それぞれ1であり;
c、c’およびe’は、独立して、0または1であり;
d、fおよびd’は、独立して0または1であり;
B’は、脱離基、活性化基、OH、生物活性成分および診断用薬からなる群より選択される。
【0020】
本発明の別の好ましい態様において、構造式(Ia)のポリマー複合体が提供される。
【化4】

【0021】
ここで、
Y7-9は、独立してOまたはNR1”であり;
R1”は、水素またはメチルであり;
R9-18は、独立して、水素またはC1-6アルキルであり;
L3-4は、独立して選択される二官能性リンカーであり;
Qは、標的細胞中に能動輸送される成分、疎水性成分、二官能性リンカー成分およびそれらの組合せから選択され;
l、k、mおよびoは、独立して自然数であり;
jおよびhは、独立して0または1であり;
gおよびiは、それぞれ1であり;
qは、0または1であり;
B’は、脱離基、活性化基、OH、生物活性成分および診断用薬から選択され;
D10およびD11は、D1を定める同じ群から選択されるか、または一緒になって下記の構造式の末端基を形成する。
【化5】

【0022】
本発明の別の好ましい態様において、D1およびD2は、独立して選択される下記のような末端基である。
【化6】

【0023】
ここで、D’は、下記の構造式の化合物の一つであり、
【化7】

【0024】
B’は、脱離基、活性化基、OH、生物活性成分および診断用薬から選択される。
【0025】
B. リンカー成分L1-4
上記に示すように、本発明は、二官能性リンカー成分L1-L4を含んでもよい。好ましくは、L1-L4は、下記の限定されないリストから独立して選択される。
【化8】

【0026】
ここで、
R34-38は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、C3-8置換シクロアルキル、アリール、置換アリール、アラルキル、C1-6ヘテロアルキル、置換C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシから選択され;
R39は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、C3-8置換シクロアルキル、アリール、置換アリール、アラルキル、C1-6ヘテロアルキル、置換C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシ、NO2、ハロアルキルおよびハロゲンから選択され;
a’およびb’は、独立して選択される自然数である。
【0027】
C. Ar成分の説明
本発明のある態様において、Ar成分は、構造式(I)に含まれる場合に多置換の芳香族炭化水素または多置換の複素環式基を形成する成分であることが分かる。重要な特徴は、Ar成分は、天然で芳香性であるということである。通常、-n電子は、環式分子の平面の上および下の両方で「雲(cloud)」内で共有されなければならない。さらに、π電子の数は、ヒュッケル則(Huckel rule)(4n+2)を満たさなければならない。当業者は、無数の成分が、構造式(I)についての成分の芳香性の必要性を満たし、したがって、ここで用いるのに適切であるということを理解するであろう。
【0028】
いくつかの特定の好ましい芳香族基は、以下のものを含む。
【化9】

【0029】
ここで、R62-67は、独立して、R2を定めるのと同じ群から選択される。
【0030】
他の好ましい芳香族炭化水素成分は、以下を含んでもよいがこれに限定されない。
【化10】

【0031】
ここで、ZおよびEは、独立してCR68またはNR69であり;JはO、SまたはNR70であって、R68-70はR2を定めるのと同じ群、またはシアノ、ニトロ、カルボキシル、アシル、置換アシルまたはカルボキシアルキルからなる群より選択される。5および6員環の異性体も考えられ、ベンゾ−およびジベンゾ−系およびそれらの関連する同属種も検討される。芳香族環は、必要に応じて、ヒュッケル則に従う限りO、S、NR1等のようなヘテロ原子で置換できるということも、当業者によって明らかとなるであろう。さらに、芳香族または複素環式の構造は、必要に応じて、ハロゲンおよび/または当該技術において通常理解される用語としての側鎖で置換されてもよい。
【0032】
D. ポリアルキレンオキシド
構造式(I)を参照すると、R44はポリアルキレンオキシドのようなポリマー成分であることが分かるであろう。そのようなポリマーの適切な例には、実質的に非抗原性であるポリエチレングリコールが含まれる。同一出願人による米国特許第5,643,575号に記載されるようなポリプロピレングリコールもまた有用である。本発明の方法において有用な他のPEGは、Shearwater Polymers, Inc. catalog “Polyethylene Glycol and Derivatives 2001”に記載される。それぞれの開示は、ここに言及することにより引用される。
【0033】
PAOおよびPEGは、両平均分子量において実質的に変化できるが、好ましくは、R44は、本発明の多くの態様において約2000から約136000Daまでの重量平均分子量を有する。より好ましくは、R44は、約3400から約65000Daまでの重量平均分子量を有し、最も好ましくは約3400から約20000Daまでの重量平均分子量を有する。
【0034】
ここに含まれるポリマー物質は、好ましくは室温で水溶性である。そのようなポリマーの限定されないリストには、ポリエチレングリコール(PEG)またはポリプロピレングリコールのようなポリアルキレンオキシドホモポリマー、ポリオキシエチレン化ポリオール、それらのコポリマーおよびブロックコポリマーの水溶性が維持される場合にはそれらのブロックコポリマーが含まれる。
【0035】
E. 構造式(I)D1、D2BおよびB’基
1.脱離基
D1、D2が、独立して選択される脱離基である構造式(I)の態様において、適切な成分は、ハロゲン、ヒドロキシスクシニミジルカーボネートのような活性化カーボネート、カルボニルイミダゾール、環式イミドチオン、イソシアネート、N-パラ-ニトロフェノール、N-ヒドロキシフタルイミド、N-ヒドロキシベンゾトリアゾリル、イミダゾール、およびトシレート、下記の化合物のような基を含むがこれに限定されない。
【化11】

【0036】
他の適切な脱離基は当業者に明らかであろう。
【0037】
本発明の目的のために、脱離基は、所望の標的、すなわち生物活性成分、二官能性スペーサー、中間体等上に見られる求核剤と反応できる基であると理解されるべきである。したがって、標的は、タンパク質、ペプチド、酵素、天然のまたはドキソルビシンのような化学合成された治療分子上に見られるNH2のような、置換のための基を含む。
【0038】
2.活性化基
D1、D2、BおよびB’が、独立して活性化基である構造式(I)の態様において、そのような官能基の限定されない例には、マレイミジル、ビニル、ビニルスルホンの残基、ヒドロキシ、アミノ、カルボキシ、メルカプト、ヒドラジド、カルバゼート(carbazate)等が含まれる。ポリマー複合体に結合されると、官能基(例えばマレイミド)を使用して、ポリペプチド、アミノ酸またはペプチドスペーサー等のシステイン残基のような標的にポリマー複合体を結合できる。
【0039】
3.生物活性成分
D1、D2、BまたはB’が、アミンまたはヒドロキシル含有化合物の残基である構造式(I)の態様において、そのような適切な化合物の限定されない例には、有機化合物、酵素、タンパク質、ポリペプチド等の残基が含まれる。有機化合物は、ダウノルビシン、ドキソルビシンを含むアントラサイクリン化合物のような成分;p-アミノアニリンマスタード、メルファラン、Ara-C(シトシンアラビノシド)および関連する代謝拮抗化合物、例えばゲムシタビンを含むがこれに限定されない。あるいは、この成分は、アミンまたはヒドロキシルを含有する心血管作動薬、カンプトテシンおよびパクリタキセルのような抗悪性腫瘍薬、抗感染薬、ニスタチン、フルコナゾールおよびアンホテリシンBのような抗真菌薬、抗不安薬、胃腸薬、中枢神経系活性化剤、鎮痛薬、不妊薬(fertility agent)、避妊薬、抗炎症薬、ステロイド剤、作用薬等の残基でもよい。
【0040】
上記のものに加えて、生物活性成分は、酵素、タンパク質、ポリペプチド、一本鎖抗原結合タンパク質、CC49のような(SCAの)モノクローナル抗体、その断片等の残基でもよい。SCAのモノクローナル抗体もまた考慮される。適切なタンパク質は、ポリマー結合のため少なくとも一つの利用可能な基、例えばε-アミノ、シスチニルチオ、N-末端アミノ、を有するポリペプチド、酵素、ペプチド等を含むがこれに限定されず、生理的または薬理的活性を有する物質並びに有機溶媒中で反応を触媒できる物質を含む。
【0041】
所定のタンパク質、ポリペプチドおよびペプチドは、ヘモグロビン、因子VII、VIII、およびIXを含む血液因子のような血清タンパク質;免疫グロブリン、インターロイキン、すなわちIL-1からIL-13までのようなサイトカイン等、α、βおよびγインターフェロン、顆粒球コロニー刺激因子を含むコロニー刺激因子、血小板由来成長因子およびホスホリパーゼ活性化タンパク質(PLAP)を含むがこれに限定されない。一般的な生物学的または治療上興味のある他のタンパク質は、インスリン、レクチンおよびリシンのような植物タンパク質、腫瘍壊死因子および関連タンパク質、例えばTGFαまたはTGFβの形質転換増殖因子および上皮成長因子のような成長因子、ホルモン、ソマトメジン、エリスロポイエチン、色素性ホルモン、視床下部放出因子、抗利尿ホルモン、プロラクチン、絨毛性ゴナドトロピン、卵胞刺激ホルモン、甲状腺刺激ホルモン、組織プラスミノゲンアクチベーター等を含む。所定の免疫グロブリンは、IgG、IgE、IgM、IgA、IgDおよびそれらの断片を含む。
【0042】
インターロイキン、インターフェロンおよびコロニー刺激因子のようないくつかのタンパク質は、通常は組換え技術を使用する結果として、非グリコシル化形態でも存在する。非グリコシル化形態も本発明のタンパク質に含まれる。
【0043】
所定の酵素は、炭水化物特異的酵素、タンパク質分解酵素、酸化還元酵素、転移酵素、加水分解酵素、脱離酵素、イソメラーゼおよびリガーゼを含む。特定の酵素に限定されずに、所定の酵素の例は、アスパラギナーゼ、アルギナーゼ、アルギニンデアミナーゼ、アデノシンデアミナーゼ、スーパーオキシドジスムターゼ、エンドトキシナーゼ、カタラーゼ、キモトリプシン、リパーゼ、ウリカーゼ、アデノシンジホスファターゼ、チロシナーゼおよびビリルビンオキシダーゼを含む。所定の炭水化物特異的酵素は、グルコースオキシダーゼ、グルコダーゼ(glucodase)、ガラクトシダーゼ、グルコセレブロシダーゼ、グルクロニダーゼ(guludouronidase)等を含む。
【0044】
生体内生物活性を示す生物ポリマーの任意の部分もここに含まれる。これには、アミノ酸配列、核酸(DNA、RNA)、ペプチド核酸(PNA)、抗体断片、一本鎖結合タンパク質、例えばここに言及することにより引用される米国特許第4,946,778号参照、抗体または断片、ポリクローナル抗体、モノクローナル抗体および触媒抗体の融合を含む結合分子が含まれる。
【0045】
タンパク質またはそれらの一部は、組織培養のような当業者に知られる技術、動物供給源からの抽出、または組換えDNA技術を使用することにより調製または単離できる。タンパク質、ポリペプチド、アミノ酸配列等の形質転換供給源も考慮される。そのような物質は、形質転換動物、すなわちマウス、ブタ、ウシ等から得られ、タンパク質は、ミルク、血液または組織中で発現される。形質転換昆虫およびバキュロウィルス発現系もまた、供給源として考慮される。さらに、突然変異インターフェロンのような、タンパク質の突然変異バージョンもまた、本発明の範囲内である。
【0046】
所定の他のタンパク質は、ブタクサ(ragweed)、抗原E、ミツバチ毒、ダニアレルゲン等のようなアレルゲンタンパク質である。上記のものは本発明に適切なタンパク質の例示である。ここで定められるように、特別に説明されていないが利用可能なアミノ基を有するこれらのタンパク質もまた考慮され、本発明の範囲内であることを理解すべきである。
【0047】
本発明の好ましい態様において、アミノまたはヒドロキシル含有化合物は、そのような治療が所望である条件について、動物、例えばヒトを含む哺乳類の治療における医薬または診断用途に適切な生物活性化合物である。上記のリストは、例示であり修飾可能な化合物について制限するものではない。当業者は、他のそのような化合物/組成物を過度の実験をしないで同様に修飾できることが分かるであろう。特別に説明されていないが適切な結合基を有するそれらの生物活性物質もまた考慮され、本発明の範囲内であることを理解すべきである。
【0048】
ここに含めるのに適切なアミノまたはヒドロキシル含有分子の種類についての唯一の限定は、ポリマー複合体と反応し結合できる利用可能な少なくとも一つの(一次または二次)アミンまたはヒドロキシルが存在すること、およびプロドラッグシステム放出および親化合物の再生後に生物活性の実質的損失がないことである。
【0049】
4.診断用薬
D1、D2、BおよびB’が診断用薬である構造式(I)の態様において、適切な薬の限定されないリストには、色素、キレート剤、および同位体標識化合物および緑色蛍光タンパク質(GFP)のような他の標識化合物が含まれる。
【0050】
F. Q成分およびその機能
本発明のある態様において、QはL5-C(=Y10)であり、L5は、L1、L2、L3、およびL4を定める群より選択される二官能性リンカーであり、Y10は、Y1-9を定めるのと同じ群から選択される。本発明のこの態様において、Q基は、B’基とポリマー複合体の残りとの間のつながりとして作用する。
【0051】
本発明の他の態様において、Qは、標的細胞中に能動輸送される成分、疎水性成分、およびそれらの組合せである。Qは好ましくは一価であるが、Qは必要に応じて、ポリマー複合体へ1つ以上のB’基を結合させるために二価または多価でもよい。能動輸送を達成するために、Qは、アミノ酸またはペプチド残基、糖残基、脂肪酸残基、C6-18アルキル、置換アリール、ヘテロアリール、-C(=O)、-C(=S)または-C(NR28)を含んでもよく、ここでR28はH、低アルキル等である。
【0052】
本発明のこの態様は、ポリマー複合体中への組み込みに適切な生物活性物質はそれ自体、ポリマー基質からの加水分解放出後は活性でないがさらに化学的工程/反応を受けた後に活性となる物質/化合物でもよいという原理に広く基づく。この実施の形態と共に、ポリマー系により血流中に供給される治療剤または診断用薬、ペプチド、ポリペプチド等は、所定の標的細胞中に入るまたは能動輸送されるまで不活性のままであり、細胞内化学により、例えば組織または細胞中に存在する酵素または酵素系により、すぐに活性化される。
【0053】
本発明のこの態様の化合物を調製して、Q成分に結合したまま、細胞外液中に活性生物物質(ここでB’と指定される)を放出するように、ポリマーに基づく複合体の生体内の加水分解により複合体を切断する。本発明のこの態様における生物活性物質は好ましくは、小分子の治療剤および/または診断用薬であるが、これに限定されない。例えば、一つの可能なQ-B’の組合せは、ロイシン−ドキサルバシン(doxarubacin)であり、別の組合せは、アミノ酸−結合カンプトセシンまたはパクリタキセルであり、治療される組織は腫瘍組織である。本発明がどのように作用するかに関して任意の理論または仮説により拘束されることを意図せず、輸送エンハンサーとして選択される追加の成分に依存して、腫瘍細胞中への生物活性物質の輸送の速度は、保護されたおよび/または輸送が増強された形態で、例えばEPR効果を示す組織の、細胞外組織スペース中に生物活性物質を供給することによると考えられる。
【0054】
さらに必要に応じて、輸送エンハンサー(Q)は、細胞膜輸送系についての既知の基質から選択される。単に実施例として、細胞は特定の栄養分および内分泌因子等を能動輸送することが知られており、そのような栄養分、またはその類似物は、標的細胞中への生物学的に有効な物質の能動輸送を増強するために容易に利用される。これらの栄養分の例には、アミノ酸残基、ペプチド、例えば約2から10残基かそれ以上のサイズの短いペプチド、単糖および脂肪酸、内分泌因子等が含まれる。
【0055】
短いペプチドは、上記のように、例えば、2から約10までかそれ以上のアミノ酸残基のペプチドである。本発明のこの実施の形態において、そのようなペプチド輸送エンハンサーは、疎水性である必要はないが、他の経路により取り込みを増強するおよび/または通常の血流中の成熟前加水分解から結合した小分子物質を保護する作用をすると考えられる。例えば、ペプチド輸送エンハンサー、および同様の分子量範囲の他の輸送エンハンサーは、血漿に基づく加水分解酵素による生物活性物質からの切断を立体的に障害するが、その後、カプテシン(capthesin)のような様々のペプチドおよび/またはプロテアーゼにより標的細胞内で切断されると考えられる。
【0056】
ある好ましい態様において、Qは疎水性成分である。疎水性が効果にどのように寄与するかに関して任意の理論または仮説に拘束されることを意図せず、疎水性成分は、細胞外組織スペース中、例えば血漿中に存在する疎水性酵素等の攻撃を抑制することにより、活性生物物質からの輸送エンハンサーの細胞外切断を抑制すると考えられる。したがって、いくつかの好ましい輸送エンハンサーには、上記のように、例えば、アラニン、バリン、ロイシン、イソロイシン、メチオニン、プロリン、フェニルアラニン、チロシン、およびトリプトファンのような疎水性アミノ酸、並びに非天然発生誘導体およびそれらの類似物が含まれる。
【0057】
さらに必要に応じて、輸送エンハンサーは、疎水性有機成分である。単に例として、有機成分は、C6-18、またはより大きいアルキル、アリールまたはヘテロアリールの置換または非置換である。有機成分輸送エンハンサーは、例えば-C(=S)および/または-C(=O)を含む有機官能基を含むことが考えられる。
【0058】
G. 二官能性ポリマー複合体の合成
特定のヘテロ二官能性ポリマー化合物の合成は、実施例に示される。説明のために図1を参照すると、ある好ましい方法は、以下の工程を含む:
1)基本的なカップリング条件下で、アミン保護され、活性化されたヘテロ二官能性PEGポリマーを、ヘテロ二官能性PEGポリマーと反応させ、第一の中間体を得る工程、
2)第一の中間体を、NHS活性化エステルのような適切な活性化基と反応させる工程、
3)工程1)の反応を反復して第二の中間体を得る工程、
4)第二の中間体を脱保護する工程、および
5)カップリング条件下で、活性化された第一の中間体を、脱保護された第二の中間体と反応させ、高分子量のヘテロ二官能性PEG複合体を完成する工程。
【0059】
本発明によるポリマー複合体を生成するさらなる方法は、適切な条件下で、
構造式(i)の化合物を、
【化12】

【0060】
A1は、活性化基であり;
Tは、保護基であり;
X1、X3およびX5は、独立して、O、SまたはNR1であり;
R44は、ポリアルキレンオキシドであり;
R1は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、アラルキル、およびC3-8置換シクロアルキルから選択され;
R40-41は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、C3-8置換シクロアルキル、アリール、置換アリール、アラルキル、C1-6ヘテロアルキル、置換C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
nは1または自然数であり;
yは0または自然数であり;
tは自然数であり、
pは0または1である;
構造式(ii)の化合物と反応させ、
【化13】

【0061】
X2、X4およびX6は、独立して、O、S、NR1であり;
R44’は、ポリアルキレンオキシドであり;
R1は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、アラルキル、およびC3-8置換シクロアルキルから選択され;
R42-43は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、C1-6置換アルキル、C3-8置換シクロアルキル、アリール、置換アリール、アラルキル、C1-6ヘテロアルキル、置換C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
n’は自然数であり;
y’は0または自然数であり;
t’は自然数であり;
p’は0または1である;
構造式(iii)の化合物を形成する工程を含む。
【化14】

【0062】
この方法はまた、必要に応じてさらに、構造式(iii)の化合物を脱保護して、さらなる合成、活性化および/または薬への接合等において使用できる有用な中間体を提供する工程を含んでもよい。あるいは、この方法はさらに、適切な条件下で、構造式(iii)の化合物を活性化剤と反応させて、構造式(iv)の化合物を生成する工程を含んでもよい。
【化15】

【0063】
ここでA2は活性化基であり、全ての他の変数は上記のように定められる。
【0064】
さらなる態様において、本発明の方法は、適切な条件下で構造式(iv)のアミノ保護基(T)を活性化基に転換して、構造式(v)の化合物を生成する工程を含んでもよい。
【化16】

【0065】
ここでA3は活性化基である。
【0066】
構造式(v)の化合物が生成されると、適切な条件下で、生物活性成分、診断用薬または末端基と反応させ、構造式(vi)の化合物を生成してもよい。
【化17】

【0067】
ここでD2は生物活性成分、診断用薬または末端基であり、全ての他の変数は上記のように定められる。
【0068】
適切なカップリング剤の限定されないリストには、1,3-ジイソプロピル-カルボジイミド(DIPC)、任意の適切なジアルキルカルボジイミド、2-ハロ-1-アルキル-ピリジニウムハライド(Mukaiyama試薬)、1-(3-ジメチルアミノプロピル)-3-エチルカルボジイミド(EDC)、プロパンホスホン酸環式無水物(PPACA)およびフェニルジクロロホスフェート等が含まれ、これらは、Sigma-Aldrich Chemicalのような商業供給源から入手され、または既知の技術を使用して合成される。
【0069】
好ましくは、置換基は、テトラヒドロフラン(THF)、アセトニトリル(CH3CN)、塩化メチレン(DCM)、クロロホルム(CH3Cl)、ジメチルホルムアミド(DMF)またはそれらの混合物のような不活性溶媒中で反応させる。適切な塩基には、ジメチルアミノピリジン(DMAP)、ジイソプロピルエチルアミン、ピリジン、トリエチルアミン、KOH、カリウムt-ブトキシドおよびNaOH等が含まれる。反応は通常、約0℃から約22℃までの温度(室温)で行われる。
【0070】
より具体的には、高分子量ポリマー複合体を生成する一つの方法は、以下の工程を含む:
1)下記の構造式のアミン保護活性化ポリマー残基を、
【化18】

【0071】
ここで、nは自然数である、
下記の構造式のヘテロ二官能性ポリマー残基と反応させ、
【化19】

【0072】
ここで、nは自然数である、
下記の構造式の化合物を生成する工程:
【化20】

【0073】
2)工程1)からの中間体を、活性化基、生物活性成分、診断用薬または末端基と反応させて、下記の構造式の化合物を生成する工程:
【化21】

【0074】
ここで、D2は、活性化基、生物活性成分、診断用薬または末端基であり、例えば下記のala-カンプトテシンである、
【化22】

【0075】
3)アミン部分を脱保護し、マレイミドのような成分と共に活性化し、下記の構造式の化合物を生成する工程:
【化23】

【0076】
4)その後、マレイミド中間体を、モノクローナル抗体CC49(TAG-72に結合する)の一本鎖抗原結合タンパク質または上記のいずれか、以下便宜上全て「SCA」と示す、の他の断片のような生物活性成分と反応させ、以下の構造式のSCA免疫複合体を産出する工程:
【化24】

【0077】
ここで、nは自然数である。
【0078】
上記は、カルバメート結合を有するヘテロ二官能性を産出する活性化カーボネートを示す。当業者によって理解されるように、活性化エステルを工程の初めに使用して、アミド結合を生成できる。
【0079】
当業者は、本発明の方法により調製される複合体は、単一または複数のポリマーユニット中で増加し、それにより所望の複合体を達成するために選択される方法に依存して同じまたは無作為のポリマーサブユニットを反復することができるということを理解するであろう。
【0080】
選択される経路に関係なく、ここに記載される合成技術から生じる好ましい化合物のいくつかは、以下のものを含む:
【化25】

【0081】
ここで、BおよびB’は、脱離基、活性化剤、生物活性物質、診断用薬等であり、SCAは一本鎖抗体である。いくつかの他の化合物は、以下のものを含む:
【化26】

【0082】
H. 治療の方法
本発明の別の態様は、哺乳類中で様々の病状を治療する方法を提供する。この方法は、そのような治療を必要とする哺乳類に、ここに記載されるようにして調製された本発明のヘテロ二官能性ポリマー組成物の有効な量を投与する工程を含む。この組成物は、特に、腫瘍性疾患の治療、全身腫瘍組織量の減少、腫瘍の転移の防止および哺乳類における腫瘍/新生物の成長の再発の防止に有用である。
【0083】
投与される化合物の量は、そこに含まれる親分子(parent molecule)、例えばペプチド、ポリペプチド、タンパク質、酵素、小分子の薬等に依存する。通常、治療方法に使用される化合物の量は、哺乳類中で所望の治療結果を有効に達成する量である。もちろん、様々の化合物の投薬量は、親化合物、生体内加水分解の速度、ポリマーの分子量等にいくらか依存して変化する。当業者は、臨床的経験および治療指示に基づいて選択された化合物の最適な投薬量を特定するであろう。実際の投薬量は、過度の実験をせずに当業者に明らかであろう。
【0084】
本発明の化合物は、哺乳類への投与のための一つ以上の適切な薬剤組成物中に含まれてもよい。薬剤組成物は、当該技術においてよく知られる方法により調製される、溶液、懸濁液、錠剤、カプセル等の形態でもよい。そのような組成物の投与は、医師の必要性に依存して経口および/または非経口の経路によってもよい。組成物の溶液および/または懸濁液は、例えば、任意の既知の方法により、例えば静脈、筋肉、皮下注射等による、組成物の注射または浸潤のための運搬媒介物として利用してもよい。
【0085】
そのような投与は、体の空間または腔への注入、並びに吸入および/または鼻腔内経路によってもよい。しかしながら、本発明の好ましい態様において、化合物は、それを必要とする哺乳類に非経口で投与される。
【実施例】
【0086】
以下の実施例は、本発明のさらなる認識を提供するために役立つものであり、決して本発明の有効な範囲を制限することを意味するものではない。実施例に記載される数は、図1から9に示されるものと対応する。
【0087】
基本手順
全ての反応は、乾燥した窒素またはアルゴン雰囲気下で行った。市販の試薬をさらに精製せずに使用した。全てのPEG化合物を、使用前に、真空下でトルエンからの共沸蒸留により乾燥させた。Varian Mercury 300NMRスペクトロメーターおよび特に定めがない限り溶媒として重水素化クロロホルムを使用して、NMRスペクトルを得た。テトラメチルシラン(TMS)からダウンフィールド(downfield)の100万(ppm)ごとに分けて化学シフト(δ)を報告した。
【0088】
HPLC方法。1mL/分の流速で0.5%トリフルオロ酢酸中30-90%のアセトニトリルの勾配を使用して、多波長UV検出器と共にZOBAX 300 SB C-8逆相カラム(150×4.6mm)またはPhenomenex Jupiter 300A C18逆相カラム(150×4.6mm)を使用するBeckman Coulter System Gold HPLC器具により、中間体および最終産物の反応混合物および純度を観察した。
【0089】
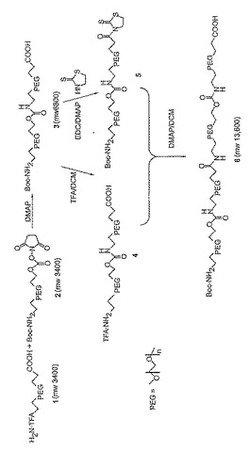
化合物3.ジクロロメタン(DCM、20mL)中の1(0.623g、0.180mmol)、2(0.623g、0.180mmol)、およびN,N-ジメチルアミノピリジン(DMAP、0.110g、0.90mmol)の溶液を、12時間室温で攪拌した。溶液を0.1N HCl(2×20mL)で洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去し、イソプロピルアルコール(IPA,25mL)から結晶化して3(0.910g,0.134mmol,74.3%)を得た。13C NMR(67.8MHz、CDCL3)δ171.91、155.79、155.30、66.15、63.32、40.34、39.91、34.26、28.02。
【0090】
化合物4.DCM/トリフルオロ酢酸(TFA)(8mL:4mL)中の3(0.707g,0.104mmol)の溶液を、室温で3.5時間攪拌した。溶媒を減圧下で除去し、生じた固体をエーテルで洗浄して4(0.707g,0.104mmol,〜100%)を産出した。13C NMR(67.8MHz、CDCL3)δ172.18、155.94、66.62、66.32、63.49、40.49、39.71、34.46。
【0091】
化合物5.DCM(15mL)中の3(0.910g,0.134mmol)、2-メカプトチアゾリン(mecaptothiazoline)(2-MT,0.0319g,0.268mmol)、およびDMAP(0.0327g,0.268mmol)を、15分間0℃で冷却し、1-[3-(ジメチルアミノ)-プロピル]-3-エチルカルボジイミドハイドロクロライド(EDC,0.0513g,0.268mmol)を加え、反応溶液を室温まで徐々に温め、12時間攪拌した。PEG誘導体をエチルエーテルで沈殿させ、濾過により採集し、IPA(19mL)から結晶化し5(0.820g,0.121mmol,90.0%)を得た。13C NMR(67.8MHz、CDCL3)δ200.94、171.73、155.85、155.36、65.75、63.37、55.54、40.37、39.94、38.73、28.08。
【0092】
化合物6.DCM(15mL)中の4(0.668g,0.098mmol)の溶液にDMAPを加え、pHを7.0に調整した。化合物5(0.677g,0.098mmol)を加え、反応混合物を12時間室温で攪拌した。溶液を0.1N HCl(2×20mL)で洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去し、イソプロピルアルコール(IPA,25mL)から結晶化して6(1.053g,0.077mmol,79.0%)を得た。13C NMR(67.8MHz、CDCL3)δ171.97、170.72、155.87、155.36、66.83、66.24、63.39、40.40、39.99、38.74、36.50、34.34、28.08。
【0093】
化合物8.DCM(10mL)中の6(0.616g,0.045mmol)、20-(S)-カンプトテシンアラニネート(alaninate)トリフルオロ酢酸塩(0.0706g,0.136mmol)、およびDMAP(0.111g,0.906mmol)の溶液を、15分間0℃で冷却し、EDC(0.026g,0.136mmol)を加え、反応用液を室温まで温めた。12時間攪拌した後、溶液を0.1N HCl(2×20mL)で洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去し、イソプロピルアルコール(IPA,13mL)から結晶化して8(0.536g,0.038mmol,85.0%)を得た。13C NMR(67.8MHz、CDCL3)δ171.09、170.83、170.63、166.48、156.82、155.99、151.82、148.46、146.01、144.98、130.77、130.12、129.40、128.06、127.77、127.58、119.72、95.58、66.97、66.77、63.57、49.74、47.56、40.55、40.14、38.90、36.70、36.41、31.48、28.22、17.58、7.40。
【0094】
化合物9.DCM/TFA(8mL:4mL)中の8(0.536g,0.038mmol)の溶液を、室温で2時間攪拌した。溶媒を減圧下で除去し、残留物をエチルエーテルで洗浄して9(0.536g,0.038mmol,〜100%)を得た。13C NMR(67.8MHz、CDCL3)δ170.99、170.81、170.60、166.25、156.58、155.79、151.56、148.19、145.79、144.79、130.71、129.92、129.12、127.91、127.63、127.37、119.46、95.44、66.71、66.54、63.34、49.59、47.45、40.34、39.59、38.78、36.34、36.08、31.24、17.24、7.20。
【0095】
化合物11.DCM(15mL)中の9(0.818g,0.059mmol)の溶液にDMAPを加え、pHを7.0に調整し、10を加え、溶液を0℃に冷却した。1.3-ジイソプロピルカルボジイミド(DIPC,0.0554μL,0.354mmol)を反応に加え、混合物を12時間攪拌しながら室温に温めた。溶液を0.1N HCl(2×20mL)で洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去し、イソプロピルアルコール(IPA,16mL)から結晶化して11(0.65g,0.046mmol,78%)を得た。13C NMR(67.8MHz、CDCL3)δ172.22、171.10、170.84、170.60、170.32、166.48、156.83、155.99、151.82、148.48、146.04、144.98、133.70、130.76、130.13、129.43、128.06、127.78、127.60、119.75、95.56、66.99、66.77、63.58、49.74、47.56、40.57、38.92、37.39、36.72、36.43、36.05、31.48、28.08、26.17、25.18、24.86、17.30、7.40。
【0096】
化合物12.A.タンパク質CC49の減少:100mMのリン酸ナトリウム中のCC49の28mg(2.79mg/ml)の溶液に、pH7.8、37℃で、2mM DTTと共に2mM EDTAを加え、2時間反応を進行させた。100mMのリン酸ナトリウム、pH6.5、および2mM EDTAの溶液で平衡化した脱塩カラムによりDTTを除去した。減少したタンパク質の最終濃度は、0.39mg/ml(〜23mg、〜60ml、83%)。
【0097】
B.ペグ化:CC49および11を、100mMのリン酸ナトリウムの溶液、pH6.5、2mM EDTA中1:10のモル比で混合し、25℃で2時間反応させた。
【0098】
C.CC49-PEG-CPTの精製:反応溶液のpH値を、HOAcで5に調整し、水(〜200mL)を加えて溶液の導電率を2mS未満に減少し、混合物を5mL/分でPoros HSカラム上に充填した。10mMリン酸ナトリウム溶液中1M NaClにより産物を溶出し、タンパク質の画分のピークを組み合わせ、30k Centriplus遠心分離管を使用して濃縮した。濃縮されたサンプルを生理食塩水に対して透析し、活性成分について分析した。ヨード染色によって、産物中に非タンパク質接合PEG種は発見されなかった。
【0099】
化合物13.DCM/TFA(30mL:15mL)中の6(4.50g,0.335mmol)の溶液を、室温で3.5時間攪拌した。溶媒を減圧下で除去し、生じた固体をエーテルで洗浄して13(4.30g,0.320mmol,95.6%)を産出した。13C NMR(67.8MHz、CDCL3)δ171.59、155.58、66.36、65.89、63.02、40.05、39.36、38.61、35.85、33.96。
【0100】
化合物14.DCM(50mL)中の13(4.30g,0.320mmol)の溶液にDMAPを加え、pHを7.0に調整した。次に、化合物5(2.20g,0.320mmol)を加え、反応混合物を12時間室温で攪拌した。溶液を0.1N HCl(2×30mL)で洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去し、残留物をイソプロピルアルコール(IPA,25mL)から結晶化して14(5.30g,0.260mmol,81.2%)を得た。13C NMR(67.8MHz、CDCL3)δ171.77、170.60、155.75、66.73、66.12、63.28、40.29、39.86、38.66、36.41、34.19、27.99。
【0101】
化合物15.DCM/TFA(30mL:15mL)中の14(5.30g,0.260mmol)の溶液を、室温で3.5時間攪拌した。溶媒を減圧下で除去し、生じた固体をエーテルで洗浄して15(5.30g,0.260mmol,〜100%)を産出した。13C NMR(67.8MHz、CDCL3)δ171.77、170.60、155.75、66.73、66.12、63.28、40.29、39.86、38.66、36.41、34.19。
【0102】
化合物18.DCM(30mL)中のローダミンB塩基(1.00g,2.09mmol)、グリシンt-ブチルエステルハイドロクロライド塩(0.670g,4.0mmol)およびDMAP(0.767g,8.0mmol)の溶液を15分間0℃に冷却し、EDC(0.767g,4.0mmol)を加えた。反応混合物を室温に温め、12時間攪拌した。溶液を0.1N HCl(2×30mL)で洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去し、溶出溶媒としてヘキサンおよび酢酸エチル(3:2,v/v)を使用してシリカゲルカラムクロマトグラフィーにより残留物を精製し、18(0.937g,1.58mmol,76%)を得た。13C NMR(67.8MHz、CDCL3)δ167.30、166.73、153.06、153.01、148.36、132.05、130.60、129.31、127.63、123.46、122.67、107.64、104.69、97.21、80.80、64.74、44.10、42.03、27.63、12.41。
【0103】
化合物19.DCM/TFA(16mL:8mL)中の18(0.937g,1.58mmol)の溶液を、室温で2時間攪拌した。溶媒を減圧下で除去し、残留物をエチルエーテルで洗浄して19(0.930g,1.57mmol,〜100%)を産出した。13C NMR(67.8MHz、CDCL3)δ169.30、167.83、152.72、152.15、144.14、133.09、130.28、128.83、123.64、123.41、112.32、103.89、64.69、48.47、41.49、11.44。
【0104】
化合物20.DCM(15mL)中の19(0.421g,0.785mmol)、2-MT(0.140g,1.18mmol)およびDMAP(0.287g,2.30mmol)の溶液を15分間0℃に冷却し、EDC(0.226g,1.18mmol)を加え、反応溶液を室温まで徐々に温め、12時間攪拌した。溶液を0.1N HCl(2×20mL)で洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去し、20(0.450g,0.706mmol,90%)を得た。13C NMR(67.8MHz、CDCL3)δ200.68、168.90、167.73、153.27、152.07、148.10、139.66、132.47、130.20、129.39、127.94、123.63、122.85、108.19、98.14、65.11、55.77、51.31、45.68、44.68、33.67、29.09、12.53。
【0105】
化合物21.DCM中の15(2.7g,0.134mmol)の溶液にDMAPを加え、pHを7に調整した。化合物20(171mg,0.268mmol)を加え、反応溶液を12時間室温で攪拌した。反応混合物を0.1N HClで洗浄し、溶媒を減圧下で蒸発させ、固体をIPAから結晶化させて21(2.3g,0.112mmol,84%)を産出した。13C NMR(67.8MHz、CDCL3)δ201.00、170.78、167.73、155.88、152.86、148.80、132.51、129.86、128.06、127.87、123.59、122.53、108.14、98.09、66.86、63.45、55.57、44.37、43.99、40.43、38.80、38.54、36.57、34.32、28.10、12.18。
【0106】
化合物22.DCM(15mL)中の21(2.3g,0.112mmol)、2-MT(0.027g,0.224mmol)およびDMAP(0.027g,0.224mmol)の溶液を0℃に冷却し、EDC(0.043g,0.224mmol)を加えた。反応溶液を室温まで徐々に温め、12時間攪拌した。PEG誘導体をエチルエーテルで沈殿させ、濾過し、IPAから結晶化させて22(2.0g,0.097mmol,86%)を得た。13C NMR(67.8MHz、CDCL3)δ200.00、171.70、170.64、167.96、167.68、155.79、152.86、148.24、132.38、129.86、127.84、127.72、123.55、122.38、104.12、97.47、66.80、63.37、55.51、44.91、40.37、38.72、38.44、36.50、28.08、12.26。
【0107】
化合物23.DCM(10mL)中の22(2.0g,0.097mmol)、3,5-ジメチル-4-ヒドロキシベンジルアルコール(0.059g,0.388mmol)およびDMAP(0.048g,0.388mmol)の溶液を12時間還流させた。PEG誘導体をエチルエーテルで沈殿させ、濾過紙、IPAから結晶化させて23(1.9g,0.096mmol,99%)を得た。13C NMR(67.8MHz、CDCL3)δ170.40、168.40、167.64、167.38、155.59、152.65、148.01、132.13、129.66、129.11、127.66、126.16、123.31、122.14、107.48、103.99、97.26、66.88、63.34、43.70、40.15、38.52、38.25、36.26、34.37、15.76、12.07。
【0108】
化合物24.DCM(20mL)中の23(1.9g,0.097mmol)およびN,N’-ジスクシニミジルカーボネート(0.199g,0.775mmol)およびDMF(2mL)を0℃に冷却し、ピリジン(0.063μL、0.775mmol)を加えた。反応溶液を徐々に室温まで温め、12時間攪拌した。PEG誘導体をエチルエーテルで沈殿させ、濾過し、IPAから結晶化させて24(1.58g,0.075mmol,77%)を得た。13C NMR(67.8MHz、CDCL3)δ171.22、170.49、168.35、168.05、167.73、167.47、155.65、152.71、148.07、132.24、129.69、128.09、127.72、123.39、122.23、107.53、104.02、97.30、66.65、63.19、43.77、40.22、38.57、38.31、36.22、34.43、24.89、15.79、12.13。
【0109】
化合物25.活性化PEGリンカー24を、0.05M HEPES中、pH7.8、モル比30:1(PEG:GFP)のGFP(2mg/ml)の溶液に加えた。溶液を、N2下で45分間25℃で攪拌し、pH6.4のリン酸ナトリウム緩衝液を加えることにより溶液のpHを低くし、最終濃度を50mMにした。Biocad Perfusion Chromatography Workstationを使用して、Superdex 200 Hiload 16/60カラム(Amersham Pharmacia Biotech, Piscataway, NJ)上で遊離PEGを除去した。溶出緩衝液は、10mMリン酸ナトリウム、pH6.8および150mM NaClから成った。280nmにおける吸光度および蛍光を示した画分を集め、30k NMWL膜(Millipore Corp.,Bedford,MA)と共にウルトラフリー-15遠心濾過装置を使用して濃縮した。55000cm-1M-1の減衰係数を使用して、489nmにおけるUVによりPEG-GFP(25)を特定した。
【0110】
化合物27.DCM中の6、26、およびDMAPの溶液にEDCを加え、溶液を12時間室温で攪拌した。溶媒を減圧下で除去し、固体をIPAから結晶化して27を得た。27の構造を13C NMRにより確かめた。
【0111】
化合物28.DCM/TFA中の27の溶液を、12時間室温で攪拌した。溶媒を減圧下で除去し、固体をIPAから結晶化して28を得た。28の構造を13C NMRにより確かめた。
【0112】
化合物29.DCM中の10、2-MT、およびDMAPの溶液を0℃で15分間冷却し、EDCを加え、反応溶液を徐々に室温まで温めて2時間攪拌した。次に溶液を0.1N HClで洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去して29を得た。29の構造を13C NMRにより確かめた。
【0113】
化合物30.DCM中の28、29およびDMAPの溶液を、室温で12時間攪拌した。溶媒を減圧下で除去し、固体をIPAから結晶化させて30を得た。30の構造を13C NMRにより確かめた。
【0114】
化合物31.DCM中の30、7、およびDMAPの溶液を15分間0℃で冷却し、EDCを加え、反応溶液を室温に温めた。12時間の攪拌後、溶液を0.1N HClで洗浄し、乾燥し(MgSO4)、濾過し、溶媒を減圧下で除去し、残留物をIPAから結晶化して31を得た。31の構造を13C NMRにより確かめた。
【特許請求の範囲】
【請求項1】
下記の構造式のヘテロ二官能性ポリマー化合物であって、
【化1】

X1-X6は独立してO、SまたはNR1であり;
R44およびR44’は独立して選択されるポリアルキレンオキシドであり;
R1は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、およびアラルキルからなる群より選択され;
R40-43は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、アリール、アラルキル、C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
yおよびy’は、独立して、0または自然数であり;
pおよびp’は、独立して、0または1であり;’
nおよびn’は、独立して選択される70から80までの間の整数であり;
aおよびbは、独立して、0または自然数であって、a+bは2以上であり;
zは自然数であり;
D1およびD2は、独立して、B、OH、脱離基、活性化基、および末端基からなる群より選択され;
Bは、生物活性成分およびOHからなる群より選択され、
前記末端基が、下記の構造式からなる群より選択され、
【化2】

Y1-6は、独立して、O、SまたはNR1からなる群より選択され;
R1’は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、およびアラルキルからなる群より選択され;
R2-8は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、アリール、アラルキル、C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
Arは、多置換の芳香族炭化水素または多置換の複素環式基を形成する成分であり、
L1-2は、独立して二官能性リンカーから選択され;
eおよびf’は、独立して選択される自然数であり;
c、c’およびe’は、独立して、0または自然数であり;
d、fおよびd’は、独立して0または1であり;
nおよびn’は、独立して選択される70から80までの間の整数であり;
B’は、脱離基、活性化基、OH、および生物活性成分からなる群より選択され;
前記活性化基は、マレイミジル、ビニル、ビニルスルホンの残基、ヒドロキシ、アミノ、カルボキシ、メルカプト、ヒドラジド、およびカルバゼートからなる群より選択され、
D1およびD2の少なくとも一つは生物活性成分を含む、
ことを特徴とする化合物。
【請求項2】
前記末端基が、下記の構造式からなる群より選択され、
【化3】

D’は、下記の構造式の化合物の一つであり、
【化4−1】

【化4−2】

B’は、脱離基、活性化基、OH、および生物活性成分からなる群より選択される、
ことを特徴とする請求項1記載の化合物。
【請求項3】
X1-X4は、独立してOまたはNR1であり;
X5-X6は、いずれもOであり;
R1は、水素、およびC1-6アルキルからなる群より選択され;
yおよびy’は、独立して、0または1から18までの間の整数であり;
pおよびp’は、独立して、0または1であり;
aおよびbは、独立して選択される1から20までの間の整数である、
ことを特徴とする請求項1記載の化合物。
【請求項4】
X1-X4は、独立してNR1であり;
X5-X6は、いずれもOであり;
R44およびR44’は、それぞれ-(CH2-CH2-O)-であり;
R1は、水素またはメチルであり;
yおよびy’は、それぞれ0、1または2であり;
pおよびp’は、それぞれ1であり;
aおよびbは、独立して選択される5から10までの間の整数であり;
前記生物活性成分は、独立して、酵素、タンパク質、および治療的活性有機化合物からなる群より選択される、
ことを特徴とする請求項1記載の化合物。
【請求項5】
前記末端基が、下記の構造式の化合物からなる群より選択され、
【化5】

B’は、OH、ハロゲン、ペプチド、タンパク質、酵素、オリゴヌクレオチド、ステロイド、治療的活性有機化合物、および脂質からなる群より選択される、
ことを特徴とする請求項1記載の化合物。
【請求項6】
前記脱離基が、ハロゲン、およびN-ヒドロキシスクシニミジルからなる群より選択され;前記生物活性成分が、ペプチド、タンパク質、酵素、オリゴヌクレオチド、ステロイド、治療的活性有機化合物、および脂質からなる群より選択されることを特徴とする請求項1記載の化合物。
【請求項7】
nおよびn’は、独立して選択される自然数であり、重量平均分子量が、4000から270000Daまでであることを特徴とする請求項1記載の化合物。
【請求項8】
nおよびn’は、独立して選択される自然数であり、重量平均分子量が、6800から130000Daまでであることを特徴とする請求項1記載の化合物。
【請求項9】
nおよびn’は、独立して選択される自然数であり、重量平均分子量が、6800から38000Daまでであることを特徴とする請求項1記載の化合物。
【請求項10】
前記脱離基が、ハロゲン、活性化カルボネート、カルボニルイミダゾール、環式イミドチオン(thione)、イソシアネート、N-ヒドロキシスクシニミジル、パラ−ニトロフェノール、N-ヒドロキシフタルイミド(hydroxyphtalimide)、N-ヒドロキシベンゾトリアゾリル(hydroxybenzotriazolyl)、イミダゾール、およびトシレート(tosylate)から成る群より選択されることを特徴とする請求項1記載の化合物。
【請求項11】
B’が、マレイミドおよびヒドロキシル含有またはアミン含有化合物の残基からなる群より選択されることを特徴とする請求項1記載の化合物。
【請求項12】
B’が、アントラサイクリン、ダウノルビシン、ドキソルビシン、p-ヒドロキシアニリンマスタード、シトシン、ara-C、ゲムシタビン(gemcitibine)、カンプトテシン、バンコマイシン、パウロン(paullone)、パクリタキセル、シスプラチン、ビンクリスチン、ビンブラスチンからなる群より選択されることを特徴とする請求項11記載の化合物。
【請求項13】
下記の構造式の化合物からなる群より選択される請求項1記載の化合物であって、
【化6−1】

【化6−2】

BおよびB’は、脱離基、活性化剤、OH、および生物活性物質からなる群より選択され;
SCAは、一本鎖結合抗原、モノクローナル抗体またはそれらの断片であり;
nおよびzは自然数である、
ことを特徴とする化合物。
【請求項14】
下記の構造式の化合物からなる群より選択される請求項1記載の化合物であって、
【化7】

SCAは、一本鎖結合抗原、モノクローナル抗体またはそれらの断片であり;nおよびzは自然数である、
ことを特徴とする化合物。
【請求項15】
下記の構造式の化合物からなる群より選択されることを特徴とする請求項1記載の化合物。
【化8】

【請求項16】
下記の構造式を有する請求項1記載の化合物であって、
【化9】

D10およびD11は、独立して、OH、ハロゲン、酵素、タンパク質、および治療的活性有機化合物からなる群より選択されるか、または一緒になって下記の構造式の末端基を形成し、
【化10】

Y7-9は、独立して、O、SまたはNR1”からなる群より選択され;
R1”は、水素またはメチルであり;
R9-18は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、アリール、アラルキル、C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
L3-4は、独立して選択される二官能性リンカーであり;
Qは、二官能性リンカー成分およびそれらの組合せから選択され;
l、k、mおよびoは、独立して自然数であり;
jおよびhは、独立して0または自然数であり;
g、iおよびqは、独立して0または1であり;
B’は、脱離基、活性化基、OH、および生物活性成分からなる群より選択され、
D10、D11およびB’の少なくとも一つは生物活性成分を含む、
ことを特徴とする化合物。
【請求項17】
下記の構造式を有することを特徴とする請求項16記載の化合物。
【化11】

【請求項18】
下記の構造式の化合物からなる群より選択される請求項17記載の化合物であって、
【化12】

B’は、脱離基、活性化剤、OH、および生物活性物質からなる群より選択されることを特徴とする化合物。
【請求項19】
B’が、マレイミドおよびヒドロキシル含有またはアミン含有化合物の残基からなる群より選択されることを特徴とする請求項18記載の化合物。
【請求項20】
B’が、アントラサイクリン、ダウノルビシン、ドキソルビシン、p-ヒドロキシアニリンマスタード、シトシン、ara-C、ゲムシタビン、カンプトテシン、バンコマイシン、パウロン、パクリタキセル、シスプラチン、ビンクリスチン、ビンブラスチンからなる群より選択されることを特徴とする請求項18記載の化合物。
【請求項21】
ポリマー複合体を生成する方法であって、
構造式(i)の化合物であって、
【化13】

A1は活性化基であり;
Tは保護基であり;
X1、X3およびX5は、独立して、O、SまたはNR1であり;
R44はポリアルキレンオキシドであり;
R1は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、およびアラルキルからなる群より選択され;
R40-41は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、アリール、アラルキル、C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
nは独立して選択される70から80までの間の整数であり;
yは0または自然数であり;
tは自然数であり、
pは0または1である;
ことを特徴とする化合物を、
構造式(ii)の化合物であって、
【化14】

X2、X4およびX6は、独立して、O、S、NR1であり;
R44’は、ポリアルキレンオキシドであり;
R1は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、およびアラルキルからなる群より選択され;
R42-43は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、アリール、アラルキル、C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
n’は独立して選択される70から80までの間の整数であり;
y’は0または自然数であり;
t’は自然数であり;
p’は0または1であり;
前記活性化基は、マレイミジル、ビニル、ビニルスルホンの残基、ヒドロキシ、アミノ、カルボキシ、メルカプト、ヒドラジド、およびカルバゼートからなる群より選択され;
ことを特徴とする化合物と反応させ、
適切な条件下で、構造式(iii)の化合物を形成する工程を含むことを特徴とする方法。
【化15】

【請求項22】
構造式(iii)の化合物を脱保護(deprotecting)する工程をさらに含むことを特徴とする請求項21記載の方法。
【請求項23】
構造式(iii)の化合物を、適切な条件下で活性化剤と反応させ、構造式(iv)の化合物であって、
【化16】

A2は、マレイミジル、ビニル、ビニルスルホンの残基、ヒドロキシ、アミノ、カルボキシ、メルカプト、ヒドラジド、およびカルバゼートからなる群より選択される活性化基であり、全ての他の変数は上記のように定められる化合物を形成する工程をさらに含むことを特徴とする請求項21記載の方法。
【請求項24】
tおよびt’は、独立して選択される1から30までの整数であることを特徴とする請求項21記載の方法。
【請求項25】
構造式(iv)の保護基(T)を、適切な条件下で活性化基に転換させ、構造式(v)の化合物であって、
【化17】

A3は、マレイミジル、ビニル、ビニルスルホンの残基、ヒドロキシ、アミノ、カルボキシ、メルカプト、ヒドラジド、およびカルバゼートからなる群より選択される活性化基である化合物を形成する工程をさらに含むことを特徴とする請求項23記載の方法。
【請求項26】
構造式(v)の化合物を、適切な条件下で生物活性成分、または末端基と反応させ、構造式(vi)の化合物であって、
【化18】

D2は、生物活性成分、または末端基であり、該末端基は下記の構造式からなる群より選択され、
【化19】

Y1-6は、独立して、O、SまたはNR1からなる群より選択され;
R1’は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、およびアラルキルからなる群より選択され;
R2-8は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、アリール、アラルキル、C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
Arは、多置換の芳香族炭化水素または多置換の複素環式基を形成する成分であり、
L1-2は、独立して二官能性リンカーから選択され;
eおよびf’は、独立して選択される自然数であり;
c、c’およびe’は、独立して、0または自然数であり;
d、fおよびd’は、独立して0または1であり;
B’は、脱離基、活性化基、OH、および生物活性成分からなる群より選択され;
前記活性化基は、マレイミジル、ビニル、ビニルスルホンの残基、ヒドロキシ、アミノ、カルボキシ、メルカプト、ヒドラジド、およびカルバゼートからなる群より選択され、
全ての他の変数は上記のように定められる化合物を形成する工程をさらに含むことを特徴とする請求項25記載の方法。
【請求項27】
D2が末端基であり、該末端基をさらに活性化し、生物活性成分と反応させることを特徴とする請求項26記載の方法。
【請求項28】
前記活性化基A3を、生物活性成分、または末端基とさらに反応させることを特徴とする請求項26記載の方法。
【請求項29】
前記生物活性成分が、ペプチド、タンパク質、ポリペプチド、オリゴヌクレオチド、ステロイド、脂質、治療的活性有機化合物、および酵素からなる群より選択されることを特徴とする請求項27記載の方法。
【請求項30】
前記生物活性成分が、ペプチド、タンパク質、ポリペプチド、オリゴヌクレオチド、ステロイド、脂質、治療的活性有機化合物、および酵素からなる群より選択されることを特徴とする請求項28記載の方法。
【請求項31】
薬剤の調製における請求項1の化合物の使用方法。
【請求項32】
X3およびX4はいずれもNHであり;
X5およびX6はいずれも0であり;
R44およびR44’はそれぞれポリエチレングリコールであり;
p、p’、yおよびy’は全て0である、
ことを特徴とする請求項1記載の化合物。
【請求項33】
X3およびX4はいずれもNHであり;
X1、X2、X5およびX6はそれぞれ0であり;
R44およびR44’はそれぞれポリエチレングリコールであり;
R40−R43はHであり;
yおよびy’はそれぞれ2であり;
pおよびp’は独立して0または1である、
ことを特徴とする請求項1記載の化合物。
【請求項1】
下記の構造式のヘテロ二官能性ポリマー化合物であって、
【化1】

X1-X6は独立してO、SまたはNR1であり;
R44およびR44’は独立して選択されるポリアルキレンオキシドであり;
R1は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、およびアラルキルからなる群より選択され;
R40-43は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、アリール、アラルキル、C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
yおよびy’は、独立して、0または自然数であり;
pおよびp’は、独立して、0または1であり;’
nおよびn’は、独立して選択される70から80までの間の整数であり;
aおよびbは、独立して、0または自然数であって、a+bは2以上であり;
zは自然数であり;
D1およびD2は、独立して、B、OH、脱離基、活性化基、および末端基からなる群より選択され;
Bは、生物活性成分およびOHからなる群より選択され、
前記末端基が、下記の構造式からなる群より選択され、
【化2】

Y1-6は、独立して、O、SまたはNR1からなる群より選択され;
R1’は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、およびアラルキルからなる群より選択され;
R2-8は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、アリール、アラルキル、C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
Arは、多置換の芳香族炭化水素または多置換の複素環式基を形成する成分であり、
L1-2は、独立して二官能性リンカーから選択され;
eおよびf’は、独立して選択される自然数であり;
c、c’およびe’は、独立して、0または自然数であり;
d、fおよびd’は、独立して0または1であり;
nおよびn’は、独立して選択される70から80までの間の整数であり;
B’は、脱離基、活性化基、OH、および生物活性成分からなる群より選択され;
前記活性化基は、マレイミジル、ビニル、ビニルスルホンの残基、ヒドロキシ、アミノ、カルボキシ、メルカプト、ヒドラジド、およびカルバゼートからなる群より選択され、
D1およびD2の少なくとも一つは生物活性成分を含む、
ことを特徴とする化合物。
【請求項2】
前記末端基が、下記の構造式からなる群より選択され、
【化3】

D’は、下記の構造式の化合物の一つであり、
【化4−1】

【化4−2】

B’は、脱離基、活性化基、OH、および生物活性成分からなる群より選択される、
ことを特徴とする請求項1記載の化合物。
【請求項3】
X1-X4は、独立してOまたはNR1であり;
X5-X6は、いずれもOであり;
R1は、水素、およびC1-6アルキルからなる群より選択され;
yおよびy’は、独立して、0または1から18までの間の整数であり;
pおよびp’は、独立して、0または1であり;
aおよびbは、独立して選択される1から20までの間の整数である、
ことを特徴とする請求項1記載の化合物。
【請求項4】
X1-X4は、独立してNR1であり;
X5-X6は、いずれもOであり;
R44およびR44’は、それぞれ-(CH2-CH2-O)-であり;
R1は、水素またはメチルであり;
yおよびy’は、それぞれ0、1または2であり;
pおよびp’は、それぞれ1であり;
aおよびbは、独立して選択される5から10までの間の整数であり;
前記生物活性成分は、独立して、酵素、タンパク質、および治療的活性有機化合物からなる群より選択される、
ことを特徴とする請求項1記載の化合物。
【請求項5】
前記末端基が、下記の構造式の化合物からなる群より選択され、
【化5】

B’は、OH、ハロゲン、ペプチド、タンパク質、酵素、オリゴヌクレオチド、ステロイド、治療的活性有機化合物、および脂質からなる群より選択される、
ことを特徴とする請求項1記載の化合物。
【請求項6】
前記脱離基が、ハロゲン、およびN-ヒドロキシスクシニミジルからなる群より選択され;前記生物活性成分が、ペプチド、タンパク質、酵素、オリゴヌクレオチド、ステロイド、治療的活性有機化合物、および脂質からなる群より選択されることを特徴とする請求項1記載の化合物。
【請求項7】
nおよびn’は、独立して選択される自然数であり、重量平均分子量が、4000から270000Daまでであることを特徴とする請求項1記載の化合物。
【請求項8】
nおよびn’は、独立して選択される自然数であり、重量平均分子量が、6800から130000Daまでであることを特徴とする請求項1記載の化合物。
【請求項9】
nおよびn’は、独立して選択される自然数であり、重量平均分子量が、6800から38000Daまでであることを特徴とする請求項1記載の化合物。
【請求項10】
前記脱離基が、ハロゲン、活性化カルボネート、カルボニルイミダゾール、環式イミドチオン(thione)、イソシアネート、N-ヒドロキシスクシニミジル、パラ−ニトロフェノール、N-ヒドロキシフタルイミド(hydroxyphtalimide)、N-ヒドロキシベンゾトリアゾリル(hydroxybenzotriazolyl)、イミダゾール、およびトシレート(tosylate)から成る群より選択されることを特徴とする請求項1記載の化合物。
【請求項11】
B’が、マレイミドおよびヒドロキシル含有またはアミン含有化合物の残基からなる群より選択されることを特徴とする請求項1記載の化合物。
【請求項12】
B’が、アントラサイクリン、ダウノルビシン、ドキソルビシン、p-ヒドロキシアニリンマスタード、シトシン、ara-C、ゲムシタビン(gemcitibine)、カンプトテシン、バンコマイシン、パウロン(paullone)、パクリタキセル、シスプラチン、ビンクリスチン、ビンブラスチンからなる群より選択されることを特徴とする請求項11記載の化合物。
【請求項13】
下記の構造式の化合物からなる群より選択される請求項1記載の化合物であって、
【化6−1】

【化6−2】

BおよびB’は、脱離基、活性化剤、OH、および生物活性物質からなる群より選択され;
SCAは、一本鎖結合抗原、モノクローナル抗体またはそれらの断片であり;
nおよびzは自然数である、
ことを特徴とする化合物。
【請求項14】
下記の構造式の化合物からなる群より選択される請求項1記載の化合物であって、
【化7】

SCAは、一本鎖結合抗原、モノクローナル抗体またはそれらの断片であり;nおよびzは自然数である、
ことを特徴とする化合物。
【請求項15】
下記の構造式の化合物からなる群より選択されることを特徴とする請求項1記載の化合物。
【化8】

【請求項16】
下記の構造式を有する請求項1記載の化合物であって、
【化9】

D10およびD11は、独立して、OH、ハロゲン、酵素、タンパク質、および治療的活性有機化合物からなる群より選択されるか、または一緒になって下記の構造式の末端基を形成し、
【化10】

Y7-9は、独立して、O、SまたはNR1”からなる群より選択され;
R1”は、水素またはメチルであり;
R9-18は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、アリール、アラルキル、C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
L3-4は、独立して選択される二官能性リンカーであり;
Qは、二官能性リンカー成分およびそれらの組合せから選択され;
l、k、mおよびoは、独立して自然数であり;
jおよびhは、独立して0または自然数であり;
g、iおよびqは、独立して0または1であり;
B’は、脱離基、活性化基、OH、および生物活性成分からなる群より選択され、
D10、D11およびB’の少なくとも一つは生物活性成分を含む、
ことを特徴とする化合物。
【請求項17】
下記の構造式を有することを特徴とする請求項16記載の化合物。
【化11】

【請求項18】
下記の構造式の化合物からなる群より選択される請求項17記載の化合物であって、
【化12】

B’は、脱離基、活性化剤、OH、および生物活性物質からなる群より選択されることを特徴とする化合物。
【請求項19】
B’が、マレイミドおよびヒドロキシル含有またはアミン含有化合物の残基からなる群より選択されることを特徴とする請求項18記載の化合物。
【請求項20】
B’が、アントラサイクリン、ダウノルビシン、ドキソルビシン、p-ヒドロキシアニリンマスタード、シトシン、ara-C、ゲムシタビン、カンプトテシン、バンコマイシン、パウロン、パクリタキセル、シスプラチン、ビンクリスチン、ビンブラスチンからなる群より選択されることを特徴とする請求項18記載の化合物。
【請求項21】
ポリマー複合体を生成する方法であって、
構造式(i)の化合物であって、
【化13】

A1は活性化基であり;
Tは保護基であり;
X1、X3およびX5は、独立して、O、SまたはNR1であり;
R44はポリアルキレンオキシドであり;
R1は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、およびアラルキルからなる群より選択され;
R40-41は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、アリール、アラルキル、C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
nは独立して選択される70から80までの間の整数であり;
yは0または自然数であり;
tは自然数であり、
pは0または1である;
ことを特徴とする化合物を、
構造式(ii)の化合物であって、
【化14】

X2、X4およびX6は、独立して、O、S、NR1であり;
R44’は、ポリアルキレンオキシドであり;
R1は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、およびアラルキルからなる群より選択され;
R42-43は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、アリール、アラルキル、C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
n’は独立して選択される70から80までの間の整数であり;
y’は0または自然数であり;
t’は自然数であり;
p’は0または1であり;
前記活性化基は、マレイミジル、ビニル、ビニルスルホンの残基、ヒドロキシ、アミノ、カルボキシ、メルカプト、ヒドラジド、およびカルバゼートからなる群より選択され;
ことを特徴とする化合物と反応させ、
適切な条件下で、構造式(iii)の化合物を形成する工程を含むことを特徴とする方法。
【化15】

【請求項22】
構造式(iii)の化合物を脱保護(deprotecting)する工程をさらに含むことを特徴とする請求項21記載の方法。
【請求項23】
構造式(iii)の化合物を、適切な条件下で活性化剤と反応させ、構造式(iv)の化合物であって、
【化16】

A2は、マレイミジル、ビニル、ビニルスルホンの残基、ヒドロキシ、アミノ、カルボキシ、メルカプト、ヒドラジド、およびカルバゼートからなる群より選択される活性化基であり、全ての他の変数は上記のように定められる化合物を形成する工程をさらに含むことを特徴とする請求項21記載の方法。
【請求項24】
tおよびt’は、独立して選択される1から30までの整数であることを特徴とする請求項21記載の方法。
【請求項25】
構造式(iv)の保護基(T)を、適切な条件下で活性化基に転換させ、構造式(v)の化合物であって、
【化17】

A3は、マレイミジル、ビニル、ビニルスルホンの残基、ヒドロキシ、アミノ、カルボキシ、メルカプト、ヒドラジド、およびカルバゼートからなる群より選択される活性化基である化合物を形成する工程をさらに含むことを特徴とする請求項23記載の方法。
【請求項26】
構造式(v)の化合物を、適切な条件下で生物活性成分、または末端基と反応させ、構造式(vi)の化合物であって、
【化18】

D2は、生物活性成分、または末端基であり、該末端基は下記の構造式からなる群より選択され、
【化19】

Y1-6は、独立して、O、SまたはNR1からなる群より選択され;
R1’は、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、およびアラルキルからなる群より選択され;
R2-8は、独立して、水素、C1-6アルキル、C3-12分枝アルキル、C3-8シクロアルキル、アリール、アラルキル、C1-6ヘテロアルキル、C1-6アルコキシ、フェノキシおよびC1-6ヘテロアルコキシからなる群より選択され;
Arは、多置換の芳香族炭化水素または多置換の複素環式基を形成する成分であり、
L1-2は、独立して二官能性リンカーから選択され;
eおよびf’は、独立して選択される自然数であり;
c、c’およびe’は、独立して、0または自然数であり;
d、fおよびd’は、独立して0または1であり;
B’は、脱離基、活性化基、OH、および生物活性成分からなる群より選択され;
前記活性化基は、マレイミジル、ビニル、ビニルスルホンの残基、ヒドロキシ、アミノ、カルボキシ、メルカプト、ヒドラジド、およびカルバゼートからなる群より選択され、
全ての他の変数は上記のように定められる化合物を形成する工程をさらに含むことを特徴とする請求項25記載の方法。
【請求項27】
D2が末端基であり、該末端基をさらに活性化し、生物活性成分と反応させることを特徴とする請求項26記載の方法。
【請求項28】
前記活性化基A3を、生物活性成分、または末端基とさらに反応させることを特徴とする請求項26記載の方法。
【請求項29】
前記生物活性成分が、ペプチド、タンパク質、ポリペプチド、オリゴヌクレオチド、ステロイド、脂質、治療的活性有機化合物、および酵素からなる群より選択されることを特徴とする請求項27記載の方法。
【請求項30】
前記生物活性成分が、ペプチド、タンパク質、ポリペプチド、オリゴヌクレオチド、ステロイド、脂質、治療的活性有機化合物、および酵素からなる群より選択されることを特徴とする請求項28記載の方法。
【請求項31】
薬剤の調製における請求項1の化合物の使用方法。
【請求項32】
X3およびX4はいずれもNHであり;
X5およびX6はいずれも0であり;
R44およびR44’はそれぞれポリエチレングリコールであり;
p、p’、yおよびy’は全て0である、
ことを特徴とする請求項1記載の化合物。
【請求項33】
X3およびX4はいずれもNHであり;
X1、X2、X5およびX6はそれぞれ0であり;
R44およびR44’はそれぞれポリエチレングリコールであり;
R40−R43はHであり;
yおよびy’はそれぞれ2であり;
pおよびp’は独立して0または1である、
ことを特徴とする請求項1記載の化合物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2011−102329(P2011−102329A)
【公開日】平成23年5月26日(2011.5.26)
【国際特許分類】
【出願番号】特願2011−32083(P2011−32083)
【出願日】平成23年2月17日(2011.2.17)
【分割の表示】特願2006−507123(P2006−507123)の分割
【原出願日】平成16年3月12日(2004.3.12)
【出願人】(505354899)エンゾン ファーマスーティカルズ インコーポレイテッド (28)
【氏名又は名称原語表記】ENZON PHARMACEUTICALS, INC.
【Fターム(参考)】
【公開日】平成23年5月26日(2011.5.26)
【国際特許分類】
【出願日】平成23年2月17日(2011.2.17)
【分割の表示】特願2006−507123(P2006−507123)の分割
【原出願日】平成16年3月12日(2004.3.12)
【出願人】(505354899)エンゾン ファーマスーティカルズ インコーポレイテッド (28)
【氏名又は名称原語表記】ENZON PHARMACEUTICALS, INC.
【Fターム(参考)】
[ Back to top ]

