ヘテロ環化合物及びこれを含む有機発光素子
【課題】ヘテロ環化合物及びこれを含む有機発光素子の提供。
【解決手段】下記化学式1で表示されるヘテロ環化合物。

(式中、Rは、アルキル基、アリール基またはヘテロアリール基を表す。)
【解決手段】下記化学式1で表示されるヘテロ環化合物。

(式中、Rは、アルキル基、アリール基またはヘテロアリール基を表す。)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヘテロ環化合物及びこれを含む有機発光素子に関する。
【背景技術】
【0002】
有機発光素子(organic light emitting device)は、自発光型、表示素子であって、視野角が広く、かつコントラストにすぐれるだけではなく、応答時間が速いという長所を有しており、大きな注目を集めている。
【0003】
有機発光素子は、一般的に、アノード/有機発光層/カソードの積層構造を有し、前記アノードと発光層との間に正孔注入層及び/または正孔輸送層、また発光層とカソードとの間に電子注入層をさらに積層し、アノード/正孔輸送層/有機発光層/カソード、アノード/正孔輸送層/有機発光層/電子輸送層/カソードなどの構造を有する。
【0004】
このうち、有機発光層材料としてアントラセン誘導体などが使われうるが、これまで公知の有機発光材料を含んだ有機発光素子は、寿命、効率及び消費電力特性において、満足すべきレベルに至っておらず、改善の余地が多い。
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明の一側面は、改善された電気的特性、電荷輸送能及び発光能を有するヘテロ環化合物を提供することである。
【0006】
本発明の他の側面は、前記ヘテロ環化合物を含む有機発光素子を提供することである。
【課題を解決するための手段】
【0007】
本発明の一側面によって、下記化学式1で表示されるヘテロ環化合物が提供される。
【化1】

【0008】
前記化学式1で、R1ないしR14は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、カルボキシル基、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、R1ないしR14のうち隣接する2個以上は、互いに結合して飽和環または不飽和環を形成することもでき、Ar1ないしAr4は互いに独立して、置換または非置換のC1−C50アルキレン基、置換または非置換のC2−C50アルケニレン基、置換または非置換のC5−C60アリーレン基、及び置換または非置換のC4−C60ヘテロアリーレン基からなる群から選択され、Ar11,Ar12及びAr13は互いに独立して、置換または非置換のC5−C60アリール基、置換または非置換のC5−C50アリールオキシ基、置換または非置換のC5−C50アリールチオ基、及び置換または非置換のC4−C60ヘテロアリール基からなる群から選択され、a,b,c及びdは互いに独立して、0ないし10の整数であり、−(Ar1)a−(Ar11)で表示される基において、a個のAr1は、互いに同一であるか異なり、−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基において、b個のAr2は、互いに同一であるか異なり、c個のAr3は、互いに同一であるか異なり、d個のAr4は、互いに同一であるか異なりうる。
【0009】
前記ヘテロ環化合物は、下記化学式2で表示されうる。
【化2】

【0010】
前記化学式2で、R1,R2,R3,R8,R9及びR10は互いに独立して、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、R1,R2,R3,R8,R9及びR10のうち隣接する2個以上は、互いに結合して飽和環または不飽和環を形成することもでき、Ar1,Ar2,Ar3,Ar4,Ar11,Ar12,Ar13,a,b,c及びdは、上述により定義したとおりである。
【0011】
本発明の他の側面によって、第1電極と、前記第1電極に対向した第2電極と、前記第1電極と前記第2電極との間に介在した有機層と、を具備し、前記有機層が前記ヘテロ環化合物を含む有機発光素子が提供される。
【0012】
本発明の一側面による新規のヘテロ環化合物は、発光特性及び電荷輸送能にすぐれ、赤色、緑色、青色、白色などのほぼあらゆるカラーの蛍光素子およびリン光素子に適した電子注入/輸送材料または緑色、青色、白色の発光材料として有用であり、これを利用して、高効率、低電圧、高輝度、長寿命の有機発光素子を製作できる。
【図面の簡単な説明】
【0013】
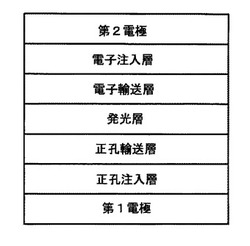
【図1】本発明の一具現例による有機発光素子の構造を示した図面である。
【発明を実施するための形態】
【0014】
本発明の一側面によるヘテロ環化合物は、下記化学式1で表示されうる。
【化3】

【0015】
前記化学式1で、R1ないしR14は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、カルボキシル基、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、R1ないしR14のうち隣接する2個以上は、互いに結合して飽和環または不飽和環を形成することもできる。
【0016】
前記Ar1ないしAr4は互いに独立して、置換または非置換のC1−C50アルキレン基、置換または非置換のC2−C50アルケニレン基、置換または非置換のC5−C60アリーレン基、及び置換または非置換のC4−C60ヘテロアリーレン基からなる群から選択されうる。
【0017】
置換または非置換のC5−C20アリーレン基、及び置換または非置換のC4−C20ヘテロアリーレン基の例としては、フェニレン基、C1−C10アルキルフェニレン基、C1−C10アルコキシフェニレン基、ハロフェニレン基、シアノフェニレン基、ジシアノフェニレン基、トリフルオロメトキシフェニレン基、o−,m−またはp−トリレン基、o−,m−またはp−クメニレン基、メシチレン基、フェノキシフェニレン基、(α,α−ジメチルベンゼン)フェニレン基、(C1−C10アルキルシクロヘキシル)フェニレン基、(アントラセニル)フェニレン基、ビフェニレン基、C1−C10アルキルビフェニレン基、C1−C10アルコキシビフェニレン基、ペンタレニル基、インデニレン基、ナフチレン基、C1−C10アルキルナフチレン基、C1−C10アルコキシナフチレン基、ハロナフチレン基、シアノナフチレン基、ビフェニレニレン基、C1−C10アルキルビフェニレニレン基、C1−C10アルコキシビフェニレニレン基、ビフェニルアントラセニレン基、アントラセニレン基、アズレニレン基、ヘプタレニレン基、アセナフチレニレン基、フェナレニレン基、フルオレニレン基、アントラキノリレン基、メチルアントリレン基、フェナントレニレン基、トリフェニレニレン基、ピレニレン基、クリセニレン基、エチル−クリセニレン基、ピセニレン基、ペリレニレン基、クロロペリレニレン基、ペンタフェニレン基、ペンタセニレン基、テトラフェニレニレン基、ヘキサフェニレン基、ヘキサセニレン基、ルビセニレン基、コロネニレン基、トリナフチレニレン基、ヘプタフェニレン基、ヘプタセニレン基、ピラントレニレン基、オバレニレン基、カルバゾリレン基、C1−C10アルキルカルバゾリレン基、チオフェニレン基、インドリレン基、プリニレン基、ベンズイミダゾリレン基、キノリニレン基、ベンゾチオフェニレン基、パラチアジニレン基、ピロリレン基、ピラゾリレン基、イミダゾリレン基、イミダゾリニレン基、オキサゾリレン基、チアゾリレン基、トリアゾリレン基、テトラゾリレン基、オキサジアゾリレン基、ピリジニレン基、ピリダジニレン基、ピリミジニレン基、ピラジニレン基及びチアントレニレン基(thianthrenylene)、ピロリジニレン基、ピラゾリジニレン基、イミダゾリジニレン基、ピペリジニレン基、ピペラジニレン基またはモルホリニレン基などを挙げることができる。
【0018】
具体的には、Ar1ないしAr4は互いに独立して、フェニレン基、C1−C10アルキルフェニレン基、ジ(C1−C10アルキル)フェニレン基、ナフチレン基、C1−C10アルキルナフチレン基、ジ(C1−C10アルキル)ナフチレン基、アントリレン基、C1−C10アルキルアントリレン基、ジ(C1−C10アルキル)アントリレン基、フルオレニレン基(fluorenylene)、C1−C10アルキルフルオレニレン基、ジ(C1−C10アルキル)フルオレニレン基、C6−C14アリールフルオレニレン基、ジ(C6−C14アリール)フルオレニレン基、ピリジレン基(pyridylene)、C1−C10アルキルピリジレン基、ジ(C1−C10アルキル)ピリジレン基、カルバゾリレン基(carbazolylene)、C1−C10アルキルカルバゾリレン基、ジ(C1−C10アルキル)カルバゾリレン基からなる群から選択されうる。
【0019】
例えば、Ar1ないしAr4は互いに独立して、下記化学式2Aないし2Gからなる群から選択されうるが、これらに限定されるものではない。
【化4】

【0020】
ただし、前記化学式で、Z1,Z2,Z11及びZ12は互いに独立して、水素原子、重水素原子、C1−C10アルキル基(例えば、メチル、エチル、プロピル、イソブチル、sec−ブチルなど)、C1−C10アルコキシ基(例えば、メトキシ、エトキシ、プロポキシ、イソプロピルオキシ、ブトキシなど)、及びC6−C14アリール基(例えば、フェニル、ナフチルなど)からなる群から選択され、pは、1ないし8の整数であり、*は、Ar11,Ar12もしくはAr13または窒素原子との結合サイトであり、*’は、化学式1のバックボーン(backbone)をなす原子または窒素原子との結合サイトである。
【0021】
前記Ar11,Ar12及びAr13は互いに独立して、置換または非置換のC5−C60アリール基、置換または非置換のC5−C50アリールオキシ基、置換または非置換のC5−C50アリールチオ基、及び置換または非置換のC4−C60ヘテロアリール基からなる群から選択されうる。
【0022】
Ar11,Ar12及びAr13は互いに独立して、置換または非置換のC5−C20アリール基、及び置換または非置換のC4−C20ヘテロアリール基からなる群から選択されうる。
【0023】
置換または非置換のC5−C20アリーレン基、及び置換または非置換のC4−C20ヘテロアリーレン基の例としては、フェニレン基、C1−C10アルキルフェニレン基、C1−C10アルコキシフェニレン基、ハロフェニレン基、シアノフェニレン基、ジシアノフェニレン基、トリフルオロメトキシフェニレン基、o−,m−またはp−トリレン基、o−,m−またはp−クメニレン基、メシチレン基、フェノキシフェニレン基、(α,α−ジメチルベンゼン)フェニレン基、(C1−C10アルキルシクロヘキシル)フェニレン基、(アントラセニル)フェニレン基、ビフェニレン基、C1−C10アルキルビフェニレン基、C1−C10アルコキシビフェニレン基、ペンタレニル基、インデニレン基、ナフチレン基、C1−C10アルキルナフチレン基、C1−C10アルコキシナフチレン基、ハロナフチレン基、シアノナフチレン基、ビフェニレニレン基、C1−C10アルキルビフェニレニレン基、C1−C10アルコキシビフェニレニレン基、ビフェニルアントラセニレン基、アントラセニレン基、アズレニレン基、ヘプタレニレン基、アセナフチレニレン基、フェナレニレン基、フルオレニレン基、アントラキノリレン基、メチルアントリレン基、フェナントレニレン基、トリフェニレニレン基、ピレニレン基、クリセニレン基、エチル−クリセニレン基、ピセニレン基、ペリレニレン基、クロロペリレニレン基、ペンタフェニレン基、ペンタセニレン基、テトラフェニレニレン基、ヘキサフェニレン基、ヘキサセニレン基、ルビセニレン基、コロネニレン基、トリナフチレニレン基、ヘプタフェニレン基、ヘプタセニレン基、ピラントレニレン基、オバレニレン基、カルバゾリレン基、C1−C10アルキルカルバゾリレン基、チオフェニレン基、インドリレン基、プリニレン基、ベンズイミダゾリレン基、キノリニレン基、ベンゾチオフェニレン基、パラチアジニレン基、ピロリレン基、ピラゾリレン基、イミダゾリレン基、イミダゾリニレン基、オキサゾリレン基、チアゾリレン基、トリアゾリレン基、テトラゾリレン基、オキサジアゾリレン基、ピリジニレン基、ピリダジニレン基、ピリミジニレン基、ピラジニレン基、チアントレニレン基、ピロリジニレン基、ピラゾリジニレン基、イミダゾリジニレン基、ピペリジニレン基、ピペラジニレン基またはモルホリニレン基などを挙げることができる。
【0024】
具体的には、前記Ar11,Ar12及びAr13は互いに独立して、フェニル基、C1−C10アルキルフェニル基、ジ(C1−C10アルキル)フェニル基、C6−C14アリールフェニル基、ジ(C6−C14アリール)フェニル基、ナフチル基、C1−C10アルキルナフチル基、ジ(C1−C10アルキル)ナフチル基、C6−C14アリールナフチル基、ジ(C6−C14アリール)ナフチル基、アントリル基、C1−C10アルキルアントリル基、ジ(C1−C10アルキル)アントリル基、C6−C14アリールアントリル基、ジ(C6−C14アリール)アントリル基、フェナントリル基、C1−C10アルキルフェナントリル基、ジ(C1−C10アルキル)フェナントリル基、C6−C14アリールフェナントリル基、ジ(C6−C14アリール)フェナントリル基、フルオレニル基、C1−C10アルキルフルオレニル基、ジ(C1−C10アルキル)フルオレニル基、C6−C14アリールフルオレニル基、ジ(C6−C14アリール)フルオレニル基、ピリジル基、C1−C10アルキルピリジル基、ジ(C1−C10アルキル)ピリジル基、ピレニル基、C1−C10アルキルピレニル基、ジ(C1−C10アルキル)ピレニル基、C6−C14アリールピレニル基、ジ(C6−C14アリール)ピレニル基、フェナントロリニル基、C1−C10アルキルフェナントロリニル基、ジ(C1−C10アルキル)フェナントロリニル基、C6−C14アリールフェナントロリニル基、ジ(C6−C14アリール)フェナントロリニル基、キノリニル基、C1−C10アルキルキノリニル基、ジ(C1−C10アルキル)キノリニル基、C6−C14アリールキノリニル基、ジ(C6−C14アリール)キノリニル基、ベンゾオキサゾリル基、C1−C10アルキルベンゾオキサゾリル基、ジ(C1−C10アルキル)ベンゾオキサゾリル基、C6−C14アリールベンゾオキサゾリル基、ジ(C6−C14アリール)ベンゾオキサゾリル基、ベンゾチアゾリル基、C1−C10アルキルベンゾチアゾリル基、ジ(C1−C10アルキル)ベンゾチアゾリル基、C6−C14アリールベンゾチアゾリル基、ジ(C6−C14アリール)ベンゾチアゾリル基、ベンゾイミダゾリル基、C1−C10アルキルベンゾイミダゾリル基、ジ(C1−C10アルキル)ベンゾイミダゾリル基、C6−C14アリールベンゾイミダゾリル基、ジ(C6−C14アリール)ベンゾイミダゾリル基、イミダゾールピリジニル基、C1−C10アルキルイミダゾールピリジニル基、ジ(C1−C10アルキル)イミダゾールピリジニル基、C6−C14アリールイミダゾールピリジニル基、ジ(C6−C14アリール)イミダゾールピリジニル基、イミダゾールピリミジニル基、C1−C10アルキルイミダゾールピリミジニル基、ジ(C1−C10アルキル)イミダゾールピリミジニル基、C6−C14アリールイミダゾールピリミジニル基、ジ(C6−C14アリール)イミダゾールピリミジニル基、カルバゾリル基、C1−C10アルキルカルバゾリル基、ジ(C1−C10アルキル)カルバゾリル基、C6−C14アリールカルバゾリル基、ジ(C6−C14アリール)カルバゾリル基からなる群から選択されうる。
【0025】
例えば、前記Ar11,Ar12及びAr13は互いに独立して、下記化学式3Aないし3Pからなる群から選択されうるが、これらに限定されるものではない。
【化5】

【0026】
ただし、前記化学式で、Z1,Z2,Z3,Z11及びZ12は互いに独立して、水素原子、重水素原子、C1−C10アルキル基(例えば、メチル、エチル、プロピル、イソブチル、sec−ブチルなど)、C1−C10アルコキシ基(例えば、メトキシ、エトキシ、プロポキシ、イソプロピルオキシ、ブトキシなど)、及びC6−C14アリール基(例えば、フェニル、ナフチルなど)からなる群から選択され、pは、1ないし8の整数であり、*は、Ar1、もしくはAr4または窒素原子との結合サイトである。
【0027】
前記a,b,c及びdは互いに独立して、0ないし10の整数でありうる。
【0028】
例えば、a,b,c及びdは互いに独立して、0,1,2または3でありうる。
【0029】
−(Ar1)a−(Ar11)で表示される基において、a個のAr1は、互いに同一であるか異なり、−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基において、b個のAr2は、互いに同一であるか異なり、c個のAr3は、互いに同一であるか異なり、d個のAr4は、互いに同一であるか異なりうる。
【0030】
R1ないしR14のうちいずれか一つが、−(Ar1)a−(Ar11)で表示される基から選択され、同時にa=0である場合、該置換基は、−(Ar11)で表示され、R1ないしR14のうちいずれか一つが、−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基から選択され、同時にb≠0及びc=d=0である場合、該置換基は、−(Ar2)b−N[−(Ar12)][−(Ar13)]で表示されうる。ここで、Ar1,Ar2,Ar3,Ar4,Ar11,Ar12,Ar13,a,b,c及びdは、上述により定義したとおりである。
【0031】
化学式1のヘテロ環化合物のR1ないしR14は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、置換または非置換のC1−C10アルキル基、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、前記Ar1ないしAr4は互いに独立して、置換または非置換のC5−C20アリーレン基、及び置換または非置換のC4−C20ヘテロアリーレン基からなる群から選択され、前記Ar11,Ar12及びAr13は互いに独立して、フェニル基、C1−C10アルキルフェニル基、ジ(C1−C10アルキル)フェニル基、C6−C14アリールフェニル基、ジ(C6−C14アリール)フェニル基、ナフチル基、C1−C10アルキルナフチル基、ジ(C1−C10アルキル)ナフチル基、C6−C14アリールナフチル基、ジ(C6−C14アリール)ナフチル基、アントリル基、C1−C10アルキルアントリル基、ジ(C1−C10アルキル)アントリル基、C6−C14アリールアントリル基、ジ(C6−C14アリール)アントリル基、フェナントリル基、C1−C10アルキルフェナントリル基、ジ(C1−C10アルキル)フェナントリル基、C6−C14アリールフェナントリル基、ジ(C6−C14アリール)フェナントリル基、フルオレニル基、C1−C10アルキルフルオレニル基、ジ(C1−C10アルキル)フルオレニル基、C6−C14アリールフルオレニル基、ジ(C6−C14アリール)フルオレニル基、ピリジル基、C1−C10アルキルピリジル基、ジ(C1−C10アルキル)ピリジル基、ピレニル基、C1−C10アルキルピレニル基、ジ(C1−C10アルキル)ピレニル基、C6−C14アリールピレニル基、ジ(C6−C14アリール)ピレニル基、フェナントロリニル基、C1−C10アルキルフェナントロリニル基、ジ(C1−C10アルキル)フェナントロリニル基、C6−C14アリールフェナントロリニル基、ジ(C6−C14アリール)フェナントロリニル基、キノリニル基、C1−C10アルキルキノリニル基、ジ(C1−C10アルキル)キノリニル基、C6−C14アリールキノリニル基、ジ(C6−C14アリール)キノリニル基、ベンゾオキサゾリル基、C1−C10アルキルベンゾオキサゾリル基、ジ(C1−C10アルキル)ベンゾオキサゾリル基、C6−C14アリールベンゾオキサゾリル基、ジ(C6−C14アリール)ベンゾオキサゾリル基、ベンゾチアゾリル基、C1−C10アルキルベンゾチアゾリル基、ジ(C1−C10アルキル)ベンゾチアゾリル基、C6−C14アリールベンゾチアゾリル基、ジ(C6−C14アリール)ベンゾチアゾリル基、ベンゾイミダゾリル基、C1−C10アルキルベンゾイミダゾリル基、ジ(C1−C10アルキル)ベンゾイミダゾリル基、C6−C14アリールベンゾイミダゾリル基、ジ(C6−C14アリール)ベンゾイミダゾリル基、イミダゾールピリジニル基、C1−C10アルキルイミダゾールピリジニル基、ジ(C1−C10アルキル)イミダゾールピリジニル基、C6−C14アリールイミダゾールピリジニル基、ジ(C6−C14アリール)イミダゾールピリジニル基、イミダゾールピリミジニル基、C1−C10アルキルイミダゾールピリミジニル基、ジ(C1−C10アルキル)イミダゾールピリミジニル基、C6−C14アリールイミダゾールピリミジニル基、ジ(C6−C14アリール)イミダゾールピリミジニル基、カルバゾリル基、C1−C10アルキルカルバゾリル基、ジ(C1−C10アルキル)カルバゾリル基、C6−C14アリールカルバゾリル基、ジ(C6−C14アリール)カルバゾリル基からなる群から選択され、前記a,b,c及びdは互いに独立して、0,1,2または3でありうる。
【0032】
前記ヘテロ環化合物は、下記化学式2で表示されうる(すなわち、化学式1で、R4,R5,R6,R7,R11,R12,R13及びR14が水素である)。
【化6】

【0033】
前記化学式2で、R1,R2,R3,R8,R9及びR10は互いに独立して、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、R1ないしR3のうち隣接する2個以上は、互いに結合して飽和環または不飽和環を形成することもできる。
【0034】
Ar1,Ar2,Ar3,Ar4,Ar11,Ar12,Ar13,a,b,c及びdについての説明は、本明細書の化学式1について上述したとおりである。
【0035】
R1,R2,R3,R8,R9及びR10のうちいずれか一つが、−(Ar1)a−(Ar11)で表示される基から選択され、同時にa=0である場合、該置換基は、−(Ar11)で表示され、R1,R2,R3,R8,R9及びR10のうちいずれか一つが、−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基から選択され、同時にb≠0及びc=d=0である場合、該置換基は、−(Ar2)b−N[−(Ar12)][−(Ar13)]で表示されうる。
【0036】
例えば、化学式2のヘテロ環化合物のR1及びR8は互いに独立して、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、前記R2,R3,R9及びR10は互いに独立して、メチル基、フェニル基からなる群から選択され、前記Ar1ないしAr4は互いに独立して、置換または非置換のC5−C20アリーレン基、及び置換または非置換のC4−C20ヘテロアリーレン基からなる群から選択され、前記Ar11,Ar12及びAr13は互いに独立して、フェニル基、C1−C10アルキルフェニル基、ジ(C1−C10アルキル)フェニル基、C6−C14アリールフェニル基、ジ(C6−C14アリール)フェニル基、ナフチル基、C1−C10アルキルナフチル基、ジ(C1−C10アルキル)ナフチル基、C6−C14アリールナフチル基、ジ(C6−C14アリール)ナフチル基、アントリル基、C1−C10アルキルアントリル基、ジ(C1−C10アルキル)アントリル基、C6−C14アリールアントリル基、ジ(C6−C14アリール)アントリル基、フェナントリル基、C1−C10アルキルフェナントリル基、ジ(C1−C10アルキル)フェナントリル基、C6−C14アリールフェナントリル基、ジ(C6−C14アリール)フェナントリル基、フルオレニル基、C1−C10アルキルフルオレニル基、ジ(C1−C10アルキル)フルオレニル基、C6−C14アリールフルオレニル基、ジ(C6−C14アリール)フルオレニル基、ピリジル基、C1−C10アルキルピリジル基、ジ(C1−C10アルキル)ピリジル基、ピレニル基、C1−C10アルキルピレニル基、ジ(C1−C10アルキル)ピレニル基、C6−C14アリールピレニル基、ジ(C6−C14アリール)ピレニル基、フェナントロリニル基、C1−C10アルキルフェナントロリニル基、ジ(C1−C10アルキル)フェナントロリニル基、C6−C14アリールフェナントロリニル基、ジ(C6−C14アリール)フェナントロリニル基、キノリニル基、C1−C10アルキルキノリニル基、ジ(C1−C10アルキル)キノリニル基、C6−C14アリールキノリニル基、ジ(C6−C14アリール)キノリニル基、ベンゾオキサゾリル基、C1−C10アルキルベンゾオキサゾリル基、ジ(C1−C10アルキル)ベンゾオキサゾリル基、C6−C14アリールベンゾオキサゾリル基、ジ(C6−C14アリール)ベンゾオキサゾリル基、ベンゾチアゾリル基、C1−C10アルキルベンゾチアゾリル基、ジ(C1−C10アルキル)ベンゾチアゾリル基、C6−C14アリールベンゾチアゾリル基、ジ(C6−C14アリール)ベンゾチアゾリル基、ベンゾイミダゾリル基、C1−C10アルキルベンゾイミダゾリル基、ジ(C1−C10アルキル)ベンゾイミダゾリル基、C6−C14アリールベンゾイミダゾリル基、ジ(C6−C14アリール)ベンゾイミダゾリル基、イミダゾールピリジニル基、C1−C10アルキルイミダゾールピリジニル基、ジ(C1−C10アルキル)イミダゾールピリジニル基、C6−C14アリールイミダゾールピリジニル基、ジ(C6−C14アリール)イミダゾールピリジニル基、イミダゾールピリミジニル基、C1−C10アルキルイミダゾールピリミジニル基、ジ(C1−C10アルキル)イミダゾールピリミジニル基、C6−C14アリールイミダゾールピリミジニル基、ジ(C6−C14アリール)イミダゾールピリミジニル基、カルバゾリル基、C1−C10アルキルカルバゾリル基、ジ(C1−C10アルキル)カルバゾリル基、C6−C14アリールカルバゾリル基、ジ(C6−C14アリール)カルバゾリル基からなる群から選択され、前記a,b,c及びdは互いに独立して、0,1,2または3でありうる。
【0037】
以下、化学式1で表現される化合物の詳細な例として、下記化合物1ないし36を挙げることができる。しかし、化学式1で表現される化合物が、それら化合物に限定されるものではない。
【化7A】

【化7B】

【化7C】

【0038】
本明細書において、非置換のC1−C50アルキル基は、直鎖状または分枝状であって、その非制限的な例としては、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、ペンチル基、iso−アミル基、ヘキシル基、ヘプチル基、オクチル基、ノナニル基、ドデシル基などを挙げることができる。前記C1−C50アルキル基のうち一つ以上の水素原子は、重水素原子、ハロゲン原子、シアノ基、アミノ基、アミジノ基、ニトロ基、ヒドロキシル基、ヒドラジニル基、ヒドラゾニル基、カルボキシル基やその塩、スルホン酸基やその塩、リン酸やその塩、C1−C30アルキル基、C1−C30アルコキシ基、C2−C30アルケニル基、C2−C30アルキニル基、C6−C20アリール基、C4−C20ヘテロアリール基、−N(Q1)(Q2)、または−Si(Q3)(Q4)(Q5)で置換可能である。ここで、Q1ないしQ5は、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、アミジノ基、ニトロ基、ヒドロキシル基、ヒドラジニル基、ヒドラゾニル基、カルボキシル基やその塩、スルホン酸基やその塩、リン酸やその塩、C1−C30アルキル基、C1−C30アルコキシ基、C2−C30アルケニル基、C2−C30アルキニル基、C6−C20アリール基、またはC4−C20ヘテロアリール基でありうる。
【0039】
本明細書において、非置換のC2−C50アルケニル基は、前記非置換のC2−C50アルキル基の中間や最末端に一つ以上の炭素二重結合を含有しているものを意味する。その非制限的な例としては、エテニル基、プロペニル基、ブテニル基などがある。それら非置換のC2−C50アルケニル基のうち少なくとも一つ以上の水素原子は、前述の置換されたC1−C50アルキル基の場合と同じ置換基で置換可能である。
【0040】
本明細書において、非置換のC2−C50アルキニル基は、前記定義されたようなC2−C50アルキル基の中間や最末端に一つ以上の炭素三重結合を含有しているものを意味する。その非制限的な例としては、アセチレン、プロピレン、フェニルアセチレン、ナフチルアセチレン、イソプロピルアセチレン、t−ブチルアセチレン、ジフェニルアセチレンなどがある。それらアルキニル基のうち少なくとも一つ以上の水素原子は、前述の置換されたC1−C50アルキル基の場合と同じ置換基で置換可能である。
【0041】
本明細書において、非置換のC3−C50シクロアルキル基は、C3−C50環状のアルキル基を意味し、前記シクロアルキル基のうち一つ以上の水素原子は、前述のC1−C50アルキル基の置換基と同じ置換基で置換可能である。
【0042】
本明細書において、非置換のC1−C50アルコキシ基は、−OA(ここで、Aは、前述のような非置換のC1−C50アルキル基である)の構造を有する基を意味し、その非制限的な例としては、メトキシ基、エトキシ基、プロポキシ基、イソプロピルオキシ基、ブトキシ基、ペントキシ基などを挙げることができる。それらアルコキシ基のうち少なくとも一つ以上の水素原子は、前述のC1−C50アルキル基の場合と同様の置換基で置換可能である。
【0043】
本明細書において、非置換のC5−C60アリール基は、一つ以上の環を含む炭素環式芳香族システムを意味し、2個以上の環を有する場合、互いに融合されたり、単一結合などを介して連結されうる。アリール基という用語は、フェニル、ナフチル、アントラセニルのような芳香族系を含む。また、前記アリール基のうち一つ以上の水素原子は、前述のC1−C50アルキル基の置換基と同じ置換基で置換可能である。置換または非置換のC6−C30アリール基の例としては、フェニル基、C1−C10アルキルフェニル基(例えば、エチルフェニル基)、ハロフェニル基(例えば、o−,m−及びp−フルオロフェニル基、ジクロロフェニル基)、シアノフェニル基、ジシアノフェニル基、トリフルオロメトキシフェニル基、ビフェニル基、ハロビフェニル基、シアノビフェニル基、C1−C10アルキルビフェニル基、C1−C10アルコキシビフェニル基、o−,m−及びp−トリル基、o−,m−及びp−クメニル基、メシチル基、フェノキシフェニル基、(α,α−ジメチルベンゼン)フェニル基、(N,N”−ジメチル)アミノフェニル基、(N,N’−ジフェニル)アミノフェニル基、ペンタレニル基、インデニル基、ナフチル基、ハロナフチル基(例えば、フルオロナフチル基)、C1−C10アルキルナフチル基(例えば、メチルナフチル基)、C1−C10アルコキシナフチル基(例えば、メトキシナフチル基)、シアノナフチル基、アントラセニル基、アズレニル基、ヘプタレニル基、アセナフチレニル基、フェナレニル基、フルオレニル基、アントラキノリル基、メチルアントリル基、フェナントリル基、トリフェニレン基、ピレニル基、クリセニル基、エチル−クリセニル基、ピセニル基、ペリレニル基、クロロペリレニル基、ペンタフェニル基、ペンタセニル基、テトラフェニレニル基、ヘキサフェニル基、ヘキサセニル基、ルビセニル基、コロネリル基、トリナフチレニル基、ヘプタフェニル基、ヘプタセニル基、ピラントレニル基及びオバレニル基などを挙げることができる。
【0044】
本明細書において、非置換のC5−C50アリールオキシ基は、−OA1で表示される基であって、このとき、A1が、前記C5−C60アリール基であることを意味する。前記アリールオキシ基の例としては、フェノキシ基などを挙げることができる。前記アリールオキシ基のうち一つ以上の水素原子は、前述のC1−C50アルキル基の置換基と同じ置換基で置換可能である。
【0045】
本明細書において、非置換のC5−C50アリールチオ基は、−SA1で表示される基であって、このとき、A1が、前記C5−C60アリール基であることを意味する。前記アリールチオ基の例としては、フェニルチオ基、ナフチルチオ基あるいはフルオレニルチオ基などを挙げることができる。前記アリールチオ基のうち一つ以上の水素原子は、前述のC1−C50アルキル基の置換基と同じ置換基で置換可能である。
【0046】
本明細書において、非置換のC4−C60ヘテロアリール基は、N,O,PまたはSのうちから選択された1個,2個または3個のヘテロ原子を含み、2個以上の環を有する場合、それらは互いに融合されたり、単一結合などを介して連結されうる。非置換のC4−C60ヘテロアリール基の例としては、ピラゾリル基、イミダゾリル基、オキサゾリル基、チアゾリル基、トリアゾリル基、テトラゾリル基、オキサジアゾリル基、ピリジニル基、ピリダジニル基、ピリミジニル基、トリアジニル基、カルバゾリル基、インドリル基、キノリニル基、イソキノリニル基などを挙げることができる。また、前記ヘテロアリール基のうち一つ以上の水素原子は、前述のC1−C50アルキル基の置換基と同じ置換基で置換可能である。
【0047】
本明細書において、隣接する2個以上の置換基が、互いに結合して形成した飽和環または不飽和環は、一つ以上の芳香族環及び/または一つ以上の非芳香族環が互いに融合された2個以上の環を含んだ置換基を指すものであり、アリール基またはヘテロアリール基の例の一部がこれに該当しうる。
【0048】
本発明の他の側面による有機発光素子は、第1電極と、前記第1電極に対向した第2電極と、前記第1電極と前記第2電極との間に介在した有機層と、を具備し、前記有機層が、前述のような化学式1のヘテロ環化合物を含む。
【0049】
前記化学式1の化合物は、有機発光素子用発光材料、及び/または電子輸送材料または電子注入材料としての機能を有する。前記化学式1の化合物は、分子内へのヘテロ環の導入により、ガラス転移温度(Tg)や融点が高く、結晶化を防止できる。特に、化学式1の化合物は、クリセン基及びインドール基が融合された対称構造を有し、このような化合物を含んで製造された有機発光素子は、保存時及び駆動時の耐久性が高い。ここに、フルオレン基などの置換基を導入すれば、ガラス転移温度(Tg)と熱分解温度(Td)とが高まり、高温駆動下で有機発光素子の特性をさらに向上させることができる。従って、このような化合物を有機発光材料として使用する場合、発光時に、有機層内、有機層間、あるいは有機層と金属電極との間で発生するジュール熱に対する耐熱性及び高温環境下での耐性が上昇しうる。
【0050】
具体的には、前記化学式1で表示されるヘテロ環化合物を含んだ有機層は、電子注入層であっても、電子輸送層であっても、あるいは、発光層であって電子注入機能及び電子輸送機能を同時に有する単一層であってもよい。
【0051】
前記化学式1で表示されるヘテロ環化合物を含んだ有機層は、発光層であってよく、前記有機層が発光層である場合には、前記ヘテロ環化合物は、蛍光またはリン光のホストとして使われてもよく、あるいは蛍光ドーパントとして使われてもよい。
【0052】
本発明の一具現例による前記有機発光素子の発光層、電子注入層または電子輸送層が、前記化合物を含む場合、前記発光層は、公知のアントラセン化合物、アリールアミン化合物またはスチリル化合物を含むことができ、前記アントラセン化合物、アリールアミン化合物またはスチリル化合物は、非置換であってよく、または前述のC1−C50アルキル基の置換基と同じ置換基で置換されていてもよい。
【0053】
本発明の一具現例による有機発光素子の電子注入層または電子輸送層が、前記化合物を含む場合、赤色発光層、緑色発光層、青色発光層または白色発光層が、公知のリン光化合物を含むことができる。
【0054】
ここで、前記第1電極はアノードであり、前記第2電極はカソードであるが、これと反対の場合も、もちろん可能である。
【0055】
前述のような有機発光素子は、必要によって、前記有機層は、正孔注入層、正孔輸送層、電子阻止層、発光層、正孔阻止層、電子輸送層及び電子注入層のうち1層以上の層をさらに具備でき、必要によっては、前記有機層の各層を2層に形成することも可能である。
【0056】
例えば、本発明の一具現例による有機発光素子は、第1電極/正孔注入層/発光層/第2電極、第1電極/正孔注入層/正孔輸送層/発光層/電子輸送層/第2電極、または第1電極/正孔注入層/正孔輸送層/発光層/電子輸送層/電子注入層/第2電極の構造を有することができる。または、前記有機発光素子は、第1電極/正孔注入機能及び正孔輸送機能を同時に有する単一層/発光層/電子輸送層/第2電極、または第1電極/正孔注入機能及び正孔輸送機能を同時に有する単一層/発光層/電子輸送層/電子注入層/第2電極の構造を有することができる。
【0057】
本発明の一具現例による有機発光素子は前面発光型、背面発光型などの多様な構造に適用可能である。
【0058】
以下、本発明の一具現例による有機発光素子の製造方法について、図1に図示された有機発光素子を参照しつつ説明する。図1の有機発光素子は、基板、第1電極(アノード)、正孔注入層、正孔輸送層、発光層、電子輸送層、電子注入層及び第2電極(カソード)を具備している。
【0059】
まず、基板上に、大きい仕事関数を有する第1電極用物質を、蒸着法またはスパッタリング法などによって形成し、第1電極を形成する。前記第1電極はアノードまたはカソードでありうる。ここで、基板としては、一般的な有機発光素子で使われる基板を使用するが、機械的強度、熱的安定性、透明性、表面平滑性、取扱容易性及び防水性にすぐれるガラス基板または透明プラスチック基板でありうる。第1電極用物質としては、伝導性にすぐれる酸化インジウムスズ(ITO)、酸化インジウム亜鉛(IZO)、酸化スズ(SnO2)、酸化亜鉛(ZnO)、Al、Ag、Mgなどを利用でき、透明電極または反射電極として形成できる。
【0060】
次に、前記第1電極上に、真空蒸着法、スピンコーティング法、キャスト法、LB(Langmuir-Blodgett)法のような多様な方法を利用し、正孔注入層(HIL)を形成できる。
【0061】
真空蒸着法によって正孔注入層を形成する場合、その蒸着条件は、正孔注入層の材料として使用する化合物、目的とする正孔注入層の構造及び熱的特性などによって異なるが、一般的に、蒸着温度100ないし500℃、真空度10−8ないし10−3torr、蒸着速度0.01ないし100Å/secの範囲で適切に選択できる。
【0062】
スピンコーティング法によって正孔注入層を形成する場合、そのコーティング条件は、正孔注入層の材料として使用する化合物、目的とする正孔注入層の構造及び熱的特性によって異なるが、約2,000rpmないし5,000rpmのコーティング速度、コーティング後の溶媒除去のための熱処理温度は、約80℃ないし200℃の温度範囲で適切に選択できる。
【0063】
前記正孔注入層の物質としては、公知の正孔注入材料を使用できる。例えば、銅フタロシアニンなどのフタロシアニン化合物、4,4’,4”−トリス(3−メチルフェニルフェニルアミノ)トリフェニルアミン(m−MTDATA)、N,N’−ジ(1−ナフチル)−N,N’−ジフェニルベンジジン(NPB)、4,4’,4”−トリス{N,Nジフェニルアミノ}トリフェニルアミン(TDATA)、4,4’−ビス[N−(ナフチル)−N−フェニル−アミノ]ビフェニル(2−TNATA)、ポリアニリン/ドデシルベンゼンスルホン酸(Pani/DBSA)、ポリ(3,4−エチレンジオキシチオフェン)/ポリ(4−スチレンスルホネート)(PEDOT/PSS)、ポリアニリン/カンファースルホン酸(Pani/CSA)またはポリアニリン/ポリ(4−スチレンスルホネート)(PANI/PSS)などを使用できるが、これらに制限されるものではない。
【0064】
【化8】

【0065】
前記正孔注入層の厚みは、約100Åないし10,000Å、例えば100Åないし1,000Åでありうる。前記正孔注入層の厚みが前記範囲を満足する場合、駆動電圧の上昇なしに、優秀な正孔注入特性を得ることができる。
【0066】
次に、前記正孔注入層の上に、真空蒸着法、スピンコーティング法、キャスト法、LB法のような多様な方法を利用し、正孔輸送層(HTL)を形成できる。真空蒸着法及びスピンコーティング法によって正孔輸送層を形成する場合、その蒸着条件及びコーティング条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択される。
【0067】
前記正孔輸送層の物質は、公知の正孔輸送層の物質を利用できる。例えば、N−フェニルカルバゾール、ポリビニルカルバゾールなどのカルバゾール誘導体;N,N’−ジ(1−ナフチル)−N,N’−ジフェニルベンジジン(NPB)、N,N’−ビス(3−メチルフェニル)−N,N’−ジフェニル−[1,1−ビフェニル]−4,4’−ジアミン(TPD)などの芳香族縮合環を有するアミン誘導体などを使用できる。例えば、(4,4’,4’’−トリ(N−カルバゾリル)トリフェニルアミン)(TCTA)の場合、正孔輸送の役割以外にも、発光層から励起子が拡散することを防止する役割も行うことができる。
【0068】
【化9】

【0069】
前記正孔輸送層の厚みは、約50Åないし1,000Å、例えば100Åないし600Åでありうる。前記正孔輸送層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な正孔輸送特性を得ることができる。
【0070】
次に、前記正孔輸送層の上に、真空蒸着法、スピンコーティング法、キャスト法、LB法のような方法を利用し、発光層(EML)を形成できる。真空蒸着法及びスピンコーティング法によって発光層を形成する場合、その蒸着条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択される。
【0071】
前記発光層は、前述のような化学式1で表示されるヘテロ環化合物を含むこともできる。例えば、化学式1で表示されるヘテロ環化合物は、ホストまたはドーパントとして使われうる。前記ヘテロ環化合物以外に、発光層は、公知の多様な発光物質、例えば公知のホスト及びドーパントなどを利用して形成することもできる。前記ドーパントの場合、公知の蛍光ドーパント及び公知のリン光ドーパントをいずれも使用できる。
【0072】
例えば、ホストとしては、トリス(8−キノリノラト)アルミニウム(Alq3)、4,4’−N,N’−ジカルバゾール−ビフェニル(CBP)、9,10−ジ(ナフタレン−2−イル)アントラセン(ADN)またはジスチリルアリーレン(DSA)などを使用できるが、これらに限定されるものではない。
【0073】
一方、公知のドーパントの例として、PtOEP、Ir(piq)3、Btp2Ir(acac)、Ir(ppy)3(ppy=フェニルピリジン)、Ir(ppy)2(acac)、Ir(mpyp)3、10−(2−ベンゾチアゾリル)−2,3,6,7−テトラヒドロ−1,1,7,7−テトラメチル−1H,5H,11H−(1)ベンゾピロピラノ(6,7−8−i,j)キノリジン−11−オン(C545T)、F2Irpic、(F2ppy)2Ir(tmd)、Ir(dfppz)3、ter−フルオレン、4,4’−ビス(4−ジフェニルアミノスチリル)ビフェニル(DPAVBi)及び2,5,8,11−テトラ−t−ブチルペリレン(TBP)などがあるが、これらに限定されるものではない。
【0074】
【化10A】

【化10B】

【0075】
前記ドーパントの含有量は、発光層の形成材料100重量部(すなわち、ホストとドーパントとの総重量を100重量部とする)を基準として、0.1ないし20重量部、例えば、0.5ないし12重量部でありうる。ドーパントの含有量が前記範囲を満足するらば、濃度消光現象が実質的に防止されうる。
【0076】
前記発光層の厚みは、約100Åないし1,000Å、例えば200Åないし600Åでありうる。前記発光層の厚みが前記範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な発光特性を得ることができる。
【0077】
発光層がリン光ドーパントを含む場合、三重項 励起子または正孔が電子輸送層に拡散する現象を防止するために、正孔阻止層(HBL)を発光層の上に形成できる(図1には図示せず)。このとき、使用できる正孔阻止層の物質は特別に制限されず、公知の正孔阻止層の物質のうちから任意に選択して利用できる。例えば、オキサジアゾール誘導体、トリアゾール誘導体、2,9−ジメチル−4,7−ジフェニル−1,10−フェナントロリン(BCP)のようなフェナントロリン誘導体、ビス(2−メチル−8−キノリノラト)−(p−フェニルフェノラート)−アルミニウム(BAlq)などを利用できる。
【0078】
前記正孔阻止層の厚みは、約50Åないし1,000Å、例えば100Åないし400Åでありうる。前記正孔阻止層の厚みが50Å未満である場合、正孔阻止特性が低下し、前記正孔阻止層の厚みが1,000Åを超える場合、駆動電圧が上昇しうるからである。
【0079】
次に、電子輸送層(ETL)を、真空蒸着法、またはスピンコーティング法、キャスト法などの多様な方法を利用して、正孔阻止層または発光層上に形成する。真空蒸着法及びスピンコーティング法によって電子輸送層を形成する場合、その条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択される。
【0080】
前記電子輸送層の物質は、前述のような化学式1で表示されるヘテロ環化合物を含むことができる。前記ヘテロ環化合物以外に、公知の電子輸送層の形成材料を任意に選択して使用することもできる。例えば、その例としては、Alq3, BAlqのようなキノリン誘導体、1,2,4−トリアゾール誘導体(TAZ)などの公知の材料を使用することができるが、これらに限定されるものではない。
【0081】
【化11】

【0082】
前記電子輸送層の厚みは、約100Åないし1,000Å、例えば100Åないし500Åでありうる。前記電子輸送層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な電子輸送特性を得ることができる。
【0083】
また、電子輸送層の上に、カソードから電子の注入を容易にする機能を有する物質である電子注入層(EIL)が積層されうる。
【0084】
該電子注入層は、前述のような化学式1で表示されるヘテロ環化合物を含むことができる。前記ヘテロ環化合物以外に、LiF、NaCl、CsF、Li2O、BaOのような電子注入層の形成材料として公知の任意の物質を使用することもできる。前記電子注入層の蒸着条件及びコーティング条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択される。
【0085】
前記電子注入層の厚みは、約1Åないし100Å、例えば5Åないし90Åでありうる。前記電子注入層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な電子注入特性を得ることができる。
【0086】
最後に、電子注入層の上に、真空蒸着法やスパッタリング法のような方法を利用し、第2電極を形成できる。前記第2電極は、カソードまたはアノードとして使われうる。前記第2電極形成用の物質としては、小さい仕事関数を有する金属、合金、電気伝導性化合物及びそれらの混合物を使用できる。具体的な例としては、リチウム(Li)、マグネシウム(Mg)、アルミニウム(Al)、アルミニウム−リチウム(Al−Li)、カルシウム(Ca)、マグネシウム−インジウム(Mg−In)、マグネシウム−銀(Mg−Ag)などを挙げることができる。また、前面発光素子を得るために、ITO、IZOを使用した透明カソードを使用することもできる。
【0087】
本発明の一具現例による有機発光素子は、多様な形態の平板表示装置、例えば、受動マトリックス有機発光表示装置及び能動マトリックス有機発光表示装置に備わりうる。特に、能動マトリックス有機発光表示装置に備わる場合、基板側に備わった第1電極は、画素電極であって、薄膜トランジスタのソース電極またはドレイン電極きて電気的に連結されうる。また、前記有機発光素子は、両面に画面を表示できる平板表示装置に備わりうる。
また、本発明の一具現例による有機発光素子の1層以上の層は、前記化学式1の化合物を使用して蒸着方法で形成することができ、または溶液で製造された化学式1の化合物をコーティングする湿式方法でも形成することができる。
【0088】
以下、前記化合物4、20、21、27及び28の合成例及び実施例について、具体的に例示するが、下記の実施例に限定されるということを意味するものではない。
【実施例】
【0089】
合成例:化合物4の合成
【化12】

【0090】
中間体1の合成
6,12−ジブロモクリセン3.84g(10mmol)、ベンゾフェノンヒドラゾン2.16g(11mmol)、t−BuONa 1.44g(15mmol)、Pd(OAc)2 45mg(0.2mmol)、および2−ジシクロヘキシルホスフィノ−2’,4’,6’−トリイソプロピルフェニル82mg(0.2mmol)を、トルエン50mLに溶かした後、90℃で3時間撹拌した。常温に冷やした反応物に蒸溜水を加え、ジエチルエーテル80mLで2回、ジクロロメタン80mLで1回抽出した。集めた有機層を硫酸マグネシウムで乾燥させて濾過した後で溶媒を蒸発させ、得られた残留物をシリカゲル・カラムクロマトグラフィで分離精製し、中間体1を5.7g(収率92%)得た。生成された化合物は、HR−MS(high resolution mass spectrometry)によって確認した(calc:616.2627,found:616.2618)。
【0091】
中間体2の合成
中間体1 6.2g(10mmol)、p−トルエンスルホン酸一水和物3.8g(20mmol)及びメチルエチルケトン50mLを加えた後、110℃で24時間撹拌した。常温に冷やした反応物に蒸溜水を加え、ジエチルエーテル80mLで2回、ジクロロメタン80mLで2回抽出した。集めた有機層を硫酸マグネシウムで乾燥させて濾過した後で溶媒を蒸発させ、得られた残留物をシリカゲル・カラムクロマトグラフィで分離精製し、中間体2を2.5g(収率69%)得た。生成された化合物は、HR−MSによって確認した(calc:360.1626,found:360.1513)。
【0092】
化合物4の合成
窒素下で、中間体2 2.5g(70mmol)、9−ブロモフルオレン3.8g(14mmol)、t−BuONa 2.0g(21mmol)、Pd2(dba)3 260mg(0.28mmol)及びP(t−Bu)3 56mg(0.28mmol)を、トルエン50mLに溶かした後、90℃で3時間撹拌した。前記反応が完結した後、常温に冷やし、これを、蒸溜水とジエチルエーテル50mLとで3回抽出した。集められた有機層を硫酸マグネシウムで乾燥させて溶媒を蒸発させ、得られた残留物をシリカゲル・カラムクロマトグラフィで分離精製し、化合物4を3.5g(収率67%)得た。生成した化合物は、HR−MSによって確認した(calc:746.3661,found:746.3761)。
【0093】
合成例:化合物20の合成
【化13】

前記の化合物5の合成と同じ方法で、9−ブロモフルオレンの代わりに、2−(4−ブロモフェニル)−イミダゾールピリミジンと反応させ、化合物20を71%の収率で合成した。生成した化合物は、HR−MSによって確認した(calc:748.3063,found:748.3321)。
【0094】
合成例:化合物21の合成
【化14】

前記の化合物5の合成と同じ方法で、9−ブロモフルオレンの代わりに、3−ブロモ−(1,10)フェナントロリンと反応させ、化合物21を65%の収率で合成した。生成した化合物は、HR−MSによって確認した(calc:718.2845,found:718.2547)。
【0095】
合成例:化合物27の合成
中間体3の合成
【化15】

中間体1 6.2g(10mmol)、p−トルエンスルホン酸一水和物1.90g(10.0mmol)及びベンジルフェニルケトン2.0g(10.0mmol)の混合物に、エタノール80mLとトルエン20mLとを加えた後、110℃で24時間撹拌した。常温に冷やした反応物に蒸溜水を加え、ジエチルエーテル50mLで2回、ジクロロメタン50mLで2回抽出した。集めた有機層を硫酸マグネシウムで乾燥させて濾過した後で溶媒を蒸発させ、得られた残留物をシリカゲル・カラムクロマトグラフィで分離精製し、中間体3を4.8g(収率79%)得た。生成した化合物は、HR−MSによって確認した(calc:608.2252,found:608.2623)。
【0096】
化合物27の合成
【化16】

前記の化合物5の合成と同じ方法で、中間体2の代わりに中間体3を使用し、9−ブロモフルオレンの代わりに、2−(4−ブロモフェニル)−1−フェニル−1−ベンゾイミダゾールを使用して反応させ、化合物27を68%の収率で合成した。生成した化合物は、HR−MSによって確認した(calc:1146.4410,found:1146.4352)。
【0097】
合成例:化合物28の合成
中間体4の合成
【化17】

2,5−ジブロモピリジン3.08g(13mmol)、4−ピリジルボロン酸1.23g(10mmol)、Pd(PPh3)4 0.58g(0.5mmol)及びK2CO3 5.53g(40mmol)を、50mLのテトラヒドロフラン(THF)/H2O(2:1)混合溶液に溶かし、80℃で5時間間撹拌した。反応液をジエチルエーテル60mlで3回抽出した。集めた有機層を硫酸マグネシウムで乾燥させて溶媒を蒸発させ、得られた残留物をジクロロメタンとノルマルヘキサンとで再結晶させて、中間体4を1.74g(収率74%)合成した。生成した化合物は、HR−MSによって確認した(calc:233.9793,found:234.9349)。
【0098】
化合物28の合成
【化18】

前記の化合物5の合成と同じ方法で、中間体2の代わりに中間体3を使用し、9−ブロモフルオレンの代わりに中間体4を使用して反応させて、化合物28を70%の収率で合成した。生成した化合物は、HR−MSによって確認した(calc:918.3471,found:918.3645)。
【0099】
実施例1
アノードとして、コーニング(Corning)15Ω/cm2(1,200Å)ITOガラス基板を、50mm×50mm×0.7mmサイズに切りイソプロピルアルコールと純水とを利用し、それぞれ5分間超音波洗浄した後、30分間紫外線を照射してオゾンに露出させて洗浄し、真空蒸着装置にこのガラス基板を備え付けた。
【0100】
前記基板上に、まず正孔注入層として、公知の物質である2−TNATAを真空蒸着し、600Å厚に形成した後、次に、正孔輸送性化合物として公知の物質である4,4’−ビス[N−(1−ナフチル)−N−フェニルアミノ]ビフェニル(NPB)を、300Å厚に真空蒸着して正孔輸送層を形成した。
【0101】
【化19】

【0102】
前記正孔輸送層の上に、公知の緑色蛍光ホストであるAlq3と、公知の緑色蛍光ドーパントであるC545Tとを、重量比98:2で同時蒸着して、300Å厚に発光層を形成した。
【0103】
次に、前記発光層の上に、電子輸送層として、前記化合物4を300Å厚に蒸着した後、この電子輸送層の上に、ハロゲン化アルカリ金属であるLiFを電子注入層として10Å厚に蒸着し、Alを3,000Å(カソード電極)厚に真空蒸着し、LiF/Al電極を形成することによって、有機発光素子を製造した。
【0104】
この素子は、電流密度50mA/cm2での駆動電圧6.36V、発光輝度7.235cd/m2の高輝度を示し、色座標は(0.313,0.641)であり、発光効率は、14.47cd/Aであった。
【0105】
実施例2
電子輸送層の形成時に、前記化合物4の代わりに化合物20を利用したことを除いては、実施例1と同一にし、有機発光素子を製作した。
【0106】
実施例3
電子輸送層の形成時に、前記化合物4の代わりに化合物21を利用したことを除いては、実施例1と同一にし、有機発光素子を製作した。
【0107】
実施例4
電子輸送層の形成時に、前記化合物4の代わりに化合物27を利用したことを除いては、実施例1と同一にし、有機発光素子を製作した。
【0108】
実施例5
電子輸送層の形成時に、前記化合物4の代わりに化合物28を利用したことを除いては、実施例1と同一にし、有機発光素子を製作した。
【0109】
比較例1
電子輸送層の形成時に、前記化合物4の代わりに公知の物質であるAlq3を利用したことを除いては、実施例1と同一にし、有機発光素子を製作した。
【化20】

【0110】
化学式1の構造を有するヘテロ環化合物を電子輸送層として有機発光素子に使用した結果、いずれも公知の物質であるAlq3と比較して、駆動電圧が1V以上低くなり、効率が向上し、優秀なI−V−L特性を示した(実施例1ないし5)。特に、寿命改善効果にすぐれ、実施例1ないし4の場合、比較例1に比べて、寿命が大幅に向上するという結果を示した。代表的な寿命結果を要約して、下記表1に示す。
【0111】
【表1】

【0112】
本発明の一側面による新規のヘテロ環化合物は、発光特性及び電荷輸送能にすぐれ、赤色、緑色、青色、白色などのほぼあらゆるカラーの蛍光素子およびリン光素子に適した電子注入/輸送材料または緑色、青色、白色の発光材料として有用であり、これを利用して、高効率、低電圧、高輝度、長寿命の有機発光素子を製作できる。
【0113】
本発明について、前記合成例及び実施例を参考にして説明したが、それらは例示的なものに過ぎず、本発明に属する技術分野の当業者であるならば、それらからから多様な変形及び均等な他実施例が可能であるという点を理解することが可能であろう。よって、本発明の真の技術的保護範囲は、特許請求の範囲の技術的思想によって決まるものである。
【技術分野】
【0001】
本発明は、ヘテロ環化合物及びこれを含む有機発光素子に関する。
【背景技術】
【0002】
有機発光素子(organic light emitting device)は、自発光型、表示素子であって、視野角が広く、かつコントラストにすぐれるだけではなく、応答時間が速いという長所を有しており、大きな注目を集めている。
【0003】
有機発光素子は、一般的に、アノード/有機発光層/カソードの積層構造を有し、前記アノードと発光層との間に正孔注入層及び/または正孔輸送層、また発光層とカソードとの間に電子注入層をさらに積層し、アノード/正孔輸送層/有機発光層/カソード、アノード/正孔輸送層/有機発光層/電子輸送層/カソードなどの構造を有する。
【0004】
このうち、有機発光層材料としてアントラセン誘導体などが使われうるが、これまで公知の有機発光材料を含んだ有機発光素子は、寿命、効率及び消費電力特性において、満足すべきレベルに至っておらず、改善の余地が多い。
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明の一側面は、改善された電気的特性、電荷輸送能及び発光能を有するヘテロ環化合物を提供することである。
【0006】
本発明の他の側面は、前記ヘテロ環化合物を含む有機発光素子を提供することである。
【課題を解決するための手段】
【0007】
本発明の一側面によって、下記化学式1で表示されるヘテロ環化合物が提供される。
【化1】

【0008】
前記化学式1で、R1ないしR14は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、カルボキシル基、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、R1ないしR14のうち隣接する2個以上は、互いに結合して飽和環または不飽和環を形成することもでき、Ar1ないしAr4は互いに独立して、置換または非置換のC1−C50アルキレン基、置換または非置換のC2−C50アルケニレン基、置換または非置換のC5−C60アリーレン基、及び置換または非置換のC4−C60ヘテロアリーレン基からなる群から選択され、Ar11,Ar12及びAr13は互いに独立して、置換または非置換のC5−C60アリール基、置換または非置換のC5−C50アリールオキシ基、置換または非置換のC5−C50アリールチオ基、及び置換または非置換のC4−C60ヘテロアリール基からなる群から選択され、a,b,c及びdは互いに独立して、0ないし10の整数であり、−(Ar1)a−(Ar11)で表示される基において、a個のAr1は、互いに同一であるか異なり、−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基において、b個のAr2は、互いに同一であるか異なり、c個のAr3は、互いに同一であるか異なり、d個のAr4は、互いに同一であるか異なりうる。
【0009】
前記ヘテロ環化合物は、下記化学式2で表示されうる。
【化2】

【0010】
前記化学式2で、R1,R2,R3,R8,R9及びR10は互いに独立して、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、R1,R2,R3,R8,R9及びR10のうち隣接する2個以上は、互いに結合して飽和環または不飽和環を形成することもでき、Ar1,Ar2,Ar3,Ar4,Ar11,Ar12,Ar13,a,b,c及びdは、上述により定義したとおりである。
【0011】
本発明の他の側面によって、第1電極と、前記第1電極に対向した第2電極と、前記第1電極と前記第2電極との間に介在した有機層と、を具備し、前記有機層が前記ヘテロ環化合物を含む有機発光素子が提供される。
【0012】
本発明の一側面による新規のヘテロ環化合物は、発光特性及び電荷輸送能にすぐれ、赤色、緑色、青色、白色などのほぼあらゆるカラーの蛍光素子およびリン光素子に適した電子注入/輸送材料または緑色、青色、白色の発光材料として有用であり、これを利用して、高効率、低電圧、高輝度、長寿命の有機発光素子を製作できる。
【図面の簡単な説明】
【0013】
【図1】本発明の一具現例による有機発光素子の構造を示した図面である。
【発明を実施するための形態】
【0014】
本発明の一側面によるヘテロ環化合物は、下記化学式1で表示されうる。
【化3】

【0015】
前記化学式1で、R1ないしR14は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、カルボキシル基、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、R1ないしR14のうち隣接する2個以上は、互いに結合して飽和環または不飽和環を形成することもできる。
【0016】
前記Ar1ないしAr4は互いに独立して、置換または非置換のC1−C50アルキレン基、置換または非置換のC2−C50アルケニレン基、置換または非置換のC5−C60アリーレン基、及び置換または非置換のC4−C60ヘテロアリーレン基からなる群から選択されうる。
【0017】
置換または非置換のC5−C20アリーレン基、及び置換または非置換のC4−C20ヘテロアリーレン基の例としては、フェニレン基、C1−C10アルキルフェニレン基、C1−C10アルコキシフェニレン基、ハロフェニレン基、シアノフェニレン基、ジシアノフェニレン基、トリフルオロメトキシフェニレン基、o−,m−またはp−トリレン基、o−,m−またはp−クメニレン基、メシチレン基、フェノキシフェニレン基、(α,α−ジメチルベンゼン)フェニレン基、(C1−C10アルキルシクロヘキシル)フェニレン基、(アントラセニル)フェニレン基、ビフェニレン基、C1−C10アルキルビフェニレン基、C1−C10アルコキシビフェニレン基、ペンタレニル基、インデニレン基、ナフチレン基、C1−C10アルキルナフチレン基、C1−C10アルコキシナフチレン基、ハロナフチレン基、シアノナフチレン基、ビフェニレニレン基、C1−C10アルキルビフェニレニレン基、C1−C10アルコキシビフェニレニレン基、ビフェニルアントラセニレン基、アントラセニレン基、アズレニレン基、ヘプタレニレン基、アセナフチレニレン基、フェナレニレン基、フルオレニレン基、アントラキノリレン基、メチルアントリレン基、フェナントレニレン基、トリフェニレニレン基、ピレニレン基、クリセニレン基、エチル−クリセニレン基、ピセニレン基、ペリレニレン基、クロロペリレニレン基、ペンタフェニレン基、ペンタセニレン基、テトラフェニレニレン基、ヘキサフェニレン基、ヘキサセニレン基、ルビセニレン基、コロネニレン基、トリナフチレニレン基、ヘプタフェニレン基、ヘプタセニレン基、ピラントレニレン基、オバレニレン基、カルバゾリレン基、C1−C10アルキルカルバゾリレン基、チオフェニレン基、インドリレン基、プリニレン基、ベンズイミダゾリレン基、キノリニレン基、ベンゾチオフェニレン基、パラチアジニレン基、ピロリレン基、ピラゾリレン基、イミダゾリレン基、イミダゾリニレン基、オキサゾリレン基、チアゾリレン基、トリアゾリレン基、テトラゾリレン基、オキサジアゾリレン基、ピリジニレン基、ピリダジニレン基、ピリミジニレン基、ピラジニレン基及びチアントレニレン基(thianthrenylene)、ピロリジニレン基、ピラゾリジニレン基、イミダゾリジニレン基、ピペリジニレン基、ピペラジニレン基またはモルホリニレン基などを挙げることができる。
【0018】
具体的には、Ar1ないしAr4は互いに独立して、フェニレン基、C1−C10アルキルフェニレン基、ジ(C1−C10アルキル)フェニレン基、ナフチレン基、C1−C10アルキルナフチレン基、ジ(C1−C10アルキル)ナフチレン基、アントリレン基、C1−C10アルキルアントリレン基、ジ(C1−C10アルキル)アントリレン基、フルオレニレン基(fluorenylene)、C1−C10アルキルフルオレニレン基、ジ(C1−C10アルキル)フルオレニレン基、C6−C14アリールフルオレニレン基、ジ(C6−C14アリール)フルオレニレン基、ピリジレン基(pyridylene)、C1−C10アルキルピリジレン基、ジ(C1−C10アルキル)ピリジレン基、カルバゾリレン基(carbazolylene)、C1−C10アルキルカルバゾリレン基、ジ(C1−C10アルキル)カルバゾリレン基からなる群から選択されうる。
【0019】
例えば、Ar1ないしAr4は互いに独立して、下記化学式2Aないし2Gからなる群から選択されうるが、これらに限定されるものではない。
【化4】

【0020】
ただし、前記化学式で、Z1,Z2,Z11及びZ12は互いに独立して、水素原子、重水素原子、C1−C10アルキル基(例えば、メチル、エチル、プロピル、イソブチル、sec−ブチルなど)、C1−C10アルコキシ基(例えば、メトキシ、エトキシ、プロポキシ、イソプロピルオキシ、ブトキシなど)、及びC6−C14アリール基(例えば、フェニル、ナフチルなど)からなる群から選択され、pは、1ないし8の整数であり、*は、Ar11,Ar12もしくはAr13または窒素原子との結合サイトであり、*’は、化学式1のバックボーン(backbone)をなす原子または窒素原子との結合サイトである。
【0021】
前記Ar11,Ar12及びAr13は互いに独立して、置換または非置換のC5−C60アリール基、置換または非置換のC5−C50アリールオキシ基、置換または非置換のC5−C50アリールチオ基、及び置換または非置換のC4−C60ヘテロアリール基からなる群から選択されうる。
【0022】
Ar11,Ar12及びAr13は互いに独立して、置換または非置換のC5−C20アリール基、及び置換または非置換のC4−C20ヘテロアリール基からなる群から選択されうる。
【0023】
置換または非置換のC5−C20アリーレン基、及び置換または非置換のC4−C20ヘテロアリーレン基の例としては、フェニレン基、C1−C10アルキルフェニレン基、C1−C10アルコキシフェニレン基、ハロフェニレン基、シアノフェニレン基、ジシアノフェニレン基、トリフルオロメトキシフェニレン基、o−,m−またはp−トリレン基、o−,m−またはp−クメニレン基、メシチレン基、フェノキシフェニレン基、(α,α−ジメチルベンゼン)フェニレン基、(C1−C10アルキルシクロヘキシル)フェニレン基、(アントラセニル)フェニレン基、ビフェニレン基、C1−C10アルキルビフェニレン基、C1−C10アルコキシビフェニレン基、ペンタレニル基、インデニレン基、ナフチレン基、C1−C10アルキルナフチレン基、C1−C10アルコキシナフチレン基、ハロナフチレン基、シアノナフチレン基、ビフェニレニレン基、C1−C10アルキルビフェニレニレン基、C1−C10アルコキシビフェニレニレン基、ビフェニルアントラセニレン基、アントラセニレン基、アズレニレン基、ヘプタレニレン基、アセナフチレニレン基、フェナレニレン基、フルオレニレン基、アントラキノリレン基、メチルアントリレン基、フェナントレニレン基、トリフェニレニレン基、ピレニレン基、クリセニレン基、エチル−クリセニレン基、ピセニレン基、ペリレニレン基、クロロペリレニレン基、ペンタフェニレン基、ペンタセニレン基、テトラフェニレニレン基、ヘキサフェニレン基、ヘキサセニレン基、ルビセニレン基、コロネニレン基、トリナフチレニレン基、ヘプタフェニレン基、ヘプタセニレン基、ピラントレニレン基、オバレニレン基、カルバゾリレン基、C1−C10アルキルカルバゾリレン基、チオフェニレン基、インドリレン基、プリニレン基、ベンズイミダゾリレン基、キノリニレン基、ベンゾチオフェニレン基、パラチアジニレン基、ピロリレン基、ピラゾリレン基、イミダゾリレン基、イミダゾリニレン基、オキサゾリレン基、チアゾリレン基、トリアゾリレン基、テトラゾリレン基、オキサジアゾリレン基、ピリジニレン基、ピリダジニレン基、ピリミジニレン基、ピラジニレン基、チアントレニレン基、ピロリジニレン基、ピラゾリジニレン基、イミダゾリジニレン基、ピペリジニレン基、ピペラジニレン基またはモルホリニレン基などを挙げることができる。
【0024】
具体的には、前記Ar11,Ar12及びAr13は互いに独立して、フェニル基、C1−C10アルキルフェニル基、ジ(C1−C10アルキル)フェニル基、C6−C14アリールフェニル基、ジ(C6−C14アリール)フェニル基、ナフチル基、C1−C10アルキルナフチル基、ジ(C1−C10アルキル)ナフチル基、C6−C14アリールナフチル基、ジ(C6−C14アリール)ナフチル基、アントリル基、C1−C10アルキルアントリル基、ジ(C1−C10アルキル)アントリル基、C6−C14アリールアントリル基、ジ(C6−C14アリール)アントリル基、フェナントリル基、C1−C10アルキルフェナントリル基、ジ(C1−C10アルキル)フェナントリル基、C6−C14アリールフェナントリル基、ジ(C6−C14アリール)フェナントリル基、フルオレニル基、C1−C10アルキルフルオレニル基、ジ(C1−C10アルキル)フルオレニル基、C6−C14アリールフルオレニル基、ジ(C6−C14アリール)フルオレニル基、ピリジル基、C1−C10アルキルピリジル基、ジ(C1−C10アルキル)ピリジル基、ピレニル基、C1−C10アルキルピレニル基、ジ(C1−C10アルキル)ピレニル基、C6−C14アリールピレニル基、ジ(C6−C14アリール)ピレニル基、フェナントロリニル基、C1−C10アルキルフェナントロリニル基、ジ(C1−C10アルキル)フェナントロリニル基、C6−C14アリールフェナントロリニル基、ジ(C6−C14アリール)フェナントロリニル基、キノリニル基、C1−C10アルキルキノリニル基、ジ(C1−C10アルキル)キノリニル基、C6−C14アリールキノリニル基、ジ(C6−C14アリール)キノリニル基、ベンゾオキサゾリル基、C1−C10アルキルベンゾオキサゾリル基、ジ(C1−C10アルキル)ベンゾオキサゾリル基、C6−C14アリールベンゾオキサゾリル基、ジ(C6−C14アリール)ベンゾオキサゾリル基、ベンゾチアゾリル基、C1−C10アルキルベンゾチアゾリル基、ジ(C1−C10アルキル)ベンゾチアゾリル基、C6−C14アリールベンゾチアゾリル基、ジ(C6−C14アリール)ベンゾチアゾリル基、ベンゾイミダゾリル基、C1−C10アルキルベンゾイミダゾリル基、ジ(C1−C10アルキル)ベンゾイミダゾリル基、C6−C14アリールベンゾイミダゾリル基、ジ(C6−C14アリール)ベンゾイミダゾリル基、イミダゾールピリジニル基、C1−C10アルキルイミダゾールピリジニル基、ジ(C1−C10アルキル)イミダゾールピリジニル基、C6−C14アリールイミダゾールピリジニル基、ジ(C6−C14アリール)イミダゾールピリジニル基、イミダゾールピリミジニル基、C1−C10アルキルイミダゾールピリミジニル基、ジ(C1−C10アルキル)イミダゾールピリミジニル基、C6−C14アリールイミダゾールピリミジニル基、ジ(C6−C14アリール)イミダゾールピリミジニル基、カルバゾリル基、C1−C10アルキルカルバゾリル基、ジ(C1−C10アルキル)カルバゾリル基、C6−C14アリールカルバゾリル基、ジ(C6−C14アリール)カルバゾリル基からなる群から選択されうる。
【0025】
例えば、前記Ar11,Ar12及びAr13は互いに独立して、下記化学式3Aないし3Pからなる群から選択されうるが、これらに限定されるものではない。
【化5】

【0026】
ただし、前記化学式で、Z1,Z2,Z3,Z11及びZ12は互いに独立して、水素原子、重水素原子、C1−C10アルキル基(例えば、メチル、エチル、プロピル、イソブチル、sec−ブチルなど)、C1−C10アルコキシ基(例えば、メトキシ、エトキシ、プロポキシ、イソプロピルオキシ、ブトキシなど)、及びC6−C14アリール基(例えば、フェニル、ナフチルなど)からなる群から選択され、pは、1ないし8の整数であり、*は、Ar1、もしくはAr4または窒素原子との結合サイトである。
【0027】
前記a,b,c及びdは互いに独立して、0ないし10の整数でありうる。
【0028】
例えば、a,b,c及びdは互いに独立して、0,1,2または3でありうる。
【0029】
−(Ar1)a−(Ar11)で表示される基において、a個のAr1は、互いに同一であるか異なり、−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基において、b個のAr2は、互いに同一であるか異なり、c個のAr3は、互いに同一であるか異なり、d個のAr4は、互いに同一であるか異なりうる。
【0030】
R1ないしR14のうちいずれか一つが、−(Ar1)a−(Ar11)で表示される基から選択され、同時にa=0である場合、該置換基は、−(Ar11)で表示され、R1ないしR14のうちいずれか一つが、−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基から選択され、同時にb≠0及びc=d=0である場合、該置換基は、−(Ar2)b−N[−(Ar12)][−(Ar13)]で表示されうる。ここで、Ar1,Ar2,Ar3,Ar4,Ar11,Ar12,Ar13,a,b,c及びdは、上述により定義したとおりである。
【0031】
化学式1のヘテロ環化合物のR1ないしR14は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、置換または非置換のC1−C10アルキル基、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、前記Ar1ないしAr4は互いに独立して、置換または非置換のC5−C20アリーレン基、及び置換または非置換のC4−C20ヘテロアリーレン基からなる群から選択され、前記Ar11,Ar12及びAr13は互いに独立して、フェニル基、C1−C10アルキルフェニル基、ジ(C1−C10アルキル)フェニル基、C6−C14アリールフェニル基、ジ(C6−C14アリール)フェニル基、ナフチル基、C1−C10アルキルナフチル基、ジ(C1−C10アルキル)ナフチル基、C6−C14アリールナフチル基、ジ(C6−C14アリール)ナフチル基、アントリル基、C1−C10アルキルアントリル基、ジ(C1−C10アルキル)アントリル基、C6−C14アリールアントリル基、ジ(C6−C14アリール)アントリル基、フェナントリル基、C1−C10アルキルフェナントリル基、ジ(C1−C10アルキル)フェナントリル基、C6−C14アリールフェナントリル基、ジ(C6−C14アリール)フェナントリル基、フルオレニル基、C1−C10アルキルフルオレニル基、ジ(C1−C10アルキル)フルオレニル基、C6−C14アリールフルオレニル基、ジ(C6−C14アリール)フルオレニル基、ピリジル基、C1−C10アルキルピリジル基、ジ(C1−C10アルキル)ピリジル基、ピレニル基、C1−C10アルキルピレニル基、ジ(C1−C10アルキル)ピレニル基、C6−C14アリールピレニル基、ジ(C6−C14アリール)ピレニル基、フェナントロリニル基、C1−C10アルキルフェナントロリニル基、ジ(C1−C10アルキル)フェナントロリニル基、C6−C14アリールフェナントロリニル基、ジ(C6−C14アリール)フェナントロリニル基、キノリニル基、C1−C10アルキルキノリニル基、ジ(C1−C10アルキル)キノリニル基、C6−C14アリールキノリニル基、ジ(C6−C14アリール)キノリニル基、ベンゾオキサゾリル基、C1−C10アルキルベンゾオキサゾリル基、ジ(C1−C10アルキル)ベンゾオキサゾリル基、C6−C14アリールベンゾオキサゾリル基、ジ(C6−C14アリール)ベンゾオキサゾリル基、ベンゾチアゾリル基、C1−C10アルキルベンゾチアゾリル基、ジ(C1−C10アルキル)ベンゾチアゾリル基、C6−C14アリールベンゾチアゾリル基、ジ(C6−C14アリール)ベンゾチアゾリル基、ベンゾイミダゾリル基、C1−C10アルキルベンゾイミダゾリル基、ジ(C1−C10アルキル)ベンゾイミダゾリル基、C6−C14アリールベンゾイミダゾリル基、ジ(C6−C14アリール)ベンゾイミダゾリル基、イミダゾールピリジニル基、C1−C10アルキルイミダゾールピリジニル基、ジ(C1−C10アルキル)イミダゾールピリジニル基、C6−C14アリールイミダゾールピリジニル基、ジ(C6−C14アリール)イミダゾールピリジニル基、イミダゾールピリミジニル基、C1−C10アルキルイミダゾールピリミジニル基、ジ(C1−C10アルキル)イミダゾールピリミジニル基、C6−C14アリールイミダゾールピリミジニル基、ジ(C6−C14アリール)イミダゾールピリミジニル基、カルバゾリル基、C1−C10アルキルカルバゾリル基、ジ(C1−C10アルキル)カルバゾリル基、C6−C14アリールカルバゾリル基、ジ(C6−C14アリール)カルバゾリル基からなる群から選択され、前記a,b,c及びdは互いに独立して、0,1,2または3でありうる。
【0032】
前記ヘテロ環化合物は、下記化学式2で表示されうる(すなわち、化学式1で、R4,R5,R6,R7,R11,R12,R13及びR14が水素である)。
【化6】

【0033】
前記化学式2で、R1,R2,R3,R8,R9及びR10は互いに独立して、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、R1ないしR3のうち隣接する2個以上は、互いに結合して飽和環または不飽和環を形成することもできる。
【0034】
Ar1,Ar2,Ar3,Ar4,Ar11,Ar12,Ar13,a,b,c及びdについての説明は、本明細書の化学式1について上述したとおりである。
【0035】
R1,R2,R3,R8,R9及びR10のうちいずれか一つが、−(Ar1)a−(Ar11)で表示される基から選択され、同時にa=0である場合、該置換基は、−(Ar11)で表示され、R1,R2,R3,R8,R9及びR10のうちいずれか一つが、−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基から選択され、同時にb≠0及びc=d=0である場合、該置換基は、−(Ar2)b−N[−(Ar12)][−(Ar13)]で表示されうる。
【0036】
例えば、化学式2のヘテロ環化合物のR1及びR8は互いに独立して、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、前記R2,R3,R9及びR10は互いに独立して、メチル基、フェニル基からなる群から選択され、前記Ar1ないしAr4は互いに独立して、置換または非置換のC5−C20アリーレン基、及び置換または非置換のC4−C20ヘテロアリーレン基からなる群から選択され、前記Ar11,Ar12及びAr13は互いに独立して、フェニル基、C1−C10アルキルフェニル基、ジ(C1−C10アルキル)フェニル基、C6−C14アリールフェニル基、ジ(C6−C14アリール)フェニル基、ナフチル基、C1−C10アルキルナフチル基、ジ(C1−C10アルキル)ナフチル基、C6−C14アリールナフチル基、ジ(C6−C14アリール)ナフチル基、アントリル基、C1−C10アルキルアントリル基、ジ(C1−C10アルキル)アントリル基、C6−C14アリールアントリル基、ジ(C6−C14アリール)アントリル基、フェナントリル基、C1−C10アルキルフェナントリル基、ジ(C1−C10アルキル)フェナントリル基、C6−C14アリールフェナントリル基、ジ(C6−C14アリール)フェナントリル基、フルオレニル基、C1−C10アルキルフルオレニル基、ジ(C1−C10アルキル)フルオレニル基、C6−C14アリールフルオレニル基、ジ(C6−C14アリール)フルオレニル基、ピリジル基、C1−C10アルキルピリジル基、ジ(C1−C10アルキル)ピリジル基、ピレニル基、C1−C10アルキルピレニル基、ジ(C1−C10アルキル)ピレニル基、C6−C14アリールピレニル基、ジ(C6−C14アリール)ピレニル基、フェナントロリニル基、C1−C10アルキルフェナントロリニル基、ジ(C1−C10アルキル)フェナントロリニル基、C6−C14アリールフェナントロリニル基、ジ(C6−C14アリール)フェナントロリニル基、キノリニル基、C1−C10アルキルキノリニル基、ジ(C1−C10アルキル)キノリニル基、C6−C14アリールキノリニル基、ジ(C6−C14アリール)キノリニル基、ベンゾオキサゾリル基、C1−C10アルキルベンゾオキサゾリル基、ジ(C1−C10アルキル)ベンゾオキサゾリル基、C6−C14アリールベンゾオキサゾリル基、ジ(C6−C14アリール)ベンゾオキサゾリル基、ベンゾチアゾリル基、C1−C10アルキルベンゾチアゾリル基、ジ(C1−C10アルキル)ベンゾチアゾリル基、C6−C14アリールベンゾチアゾリル基、ジ(C6−C14アリール)ベンゾチアゾリル基、ベンゾイミダゾリル基、C1−C10アルキルベンゾイミダゾリル基、ジ(C1−C10アルキル)ベンゾイミダゾリル基、C6−C14アリールベンゾイミダゾリル基、ジ(C6−C14アリール)ベンゾイミダゾリル基、イミダゾールピリジニル基、C1−C10アルキルイミダゾールピリジニル基、ジ(C1−C10アルキル)イミダゾールピリジニル基、C6−C14アリールイミダゾールピリジニル基、ジ(C6−C14アリール)イミダゾールピリジニル基、イミダゾールピリミジニル基、C1−C10アルキルイミダゾールピリミジニル基、ジ(C1−C10アルキル)イミダゾールピリミジニル基、C6−C14アリールイミダゾールピリミジニル基、ジ(C6−C14アリール)イミダゾールピリミジニル基、カルバゾリル基、C1−C10アルキルカルバゾリル基、ジ(C1−C10アルキル)カルバゾリル基、C6−C14アリールカルバゾリル基、ジ(C6−C14アリール)カルバゾリル基からなる群から選択され、前記a,b,c及びdは互いに独立して、0,1,2または3でありうる。
【0037】
以下、化学式1で表現される化合物の詳細な例として、下記化合物1ないし36を挙げることができる。しかし、化学式1で表現される化合物が、それら化合物に限定されるものではない。
【化7A】

【化7B】

【化7C】

【0038】
本明細書において、非置換のC1−C50アルキル基は、直鎖状または分枝状であって、その非制限的な例としては、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、ペンチル基、iso−アミル基、ヘキシル基、ヘプチル基、オクチル基、ノナニル基、ドデシル基などを挙げることができる。前記C1−C50アルキル基のうち一つ以上の水素原子は、重水素原子、ハロゲン原子、シアノ基、アミノ基、アミジノ基、ニトロ基、ヒドロキシル基、ヒドラジニル基、ヒドラゾニル基、カルボキシル基やその塩、スルホン酸基やその塩、リン酸やその塩、C1−C30アルキル基、C1−C30アルコキシ基、C2−C30アルケニル基、C2−C30アルキニル基、C6−C20アリール基、C4−C20ヘテロアリール基、−N(Q1)(Q2)、または−Si(Q3)(Q4)(Q5)で置換可能である。ここで、Q1ないしQ5は、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、アミジノ基、ニトロ基、ヒドロキシル基、ヒドラジニル基、ヒドラゾニル基、カルボキシル基やその塩、スルホン酸基やその塩、リン酸やその塩、C1−C30アルキル基、C1−C30アルコキシ基、C2−C30アルケニル基、C2−C30アルキニル基、C6−C20アリール基、またはC4−C20ヘテロアリール基でありうる。
【0039】
本明細書において、非置換のC2−C50アルケニル基は、前記非置換のC2−C50アルキル基の中間や最末端に一つ以上の炭素二重結合を含有しているものを意味する。その非制限的な例としては、エテニル基、プロペニル基、ブテニル基などがある。それら非置換のC2−C50アルケニル基のうち少なくとも一つ以上の水素原子は、前述の置換されたC1−C50アルキル基の場合と同じ置換基で置換可能である。
【0040】
本明細書において、非置換のC2−C50アルキニル基は、前記定義されたようなC2−C50アルキル基の中間や最末端に一つ以上の炭素三重結合を含有しているものを意味する。その非制限的な例としては、アセチレン、プロピレン、フェニルアセチレン、ナフチルアセチレン、イソプロピルアセチレン、t−ブチルアセチレン、ジフェニルアセチレンなどがある。それらアルキニル基のうち少なくとも一つ以上の水素原子は、前述の置換されたC1−C50アルキル基の場合と同じ置換基で置換可能である。
【0041】
本明細書において、非置換のC3−C50シクロアルキル基は、C3−C50環状のアルキル基を意味し、前記シクロアルキル基のうち一つ以上の水素原子は、前述のC1−C50アルキル基の置換基と同じ置換基で置換可能である。
【0042】
本明細書において、非置換のC1−C50アルコキシ基は、−OA(ここで、Aは、前述のような非置換のC1−C50アルキル基である)の構造を有する基を意味し、その非制限的な例としては、メトキシ基、エトキシ基、プロポキシ基、イソプロピルオキシ基、ブトキシ基、ペントキシ基などを挙げることができる。それらアルコキシ基のうち少なくとも一つ以上の水素原子は、前述のC1−C50アルキル基の場合と同様の置換基で置換可能である。
【0043】
本明細書において、非置換のC5−C60アリール基は、一つ以上の環を含む炭素環式芳香族システムを意味し、2個以上の環を有する場合、互いに融合されたり、単一結合などを介して連結されうる。アリール基という用語は、フェニル、ナフチル、アントラセニルのような芳香族系を含む。また、前記アリール基のうち一つ以上の水素原子は、前述のC1−C50アルキル基の置換基と同じ置換基で置換可能である。置換または非置換のC6−C30アリール基の例としては、フェニル基、C1−C10アルキルフェニル基(例えば、エチルフェニル基)、ハロフェニル基(例えば、o−,m−及びp−フルオロフェニル基、ジクロロフェニル基)、シアノフェニル基、ジシアノフェニル基、トリフルオロメトキシフェニル基、ビフェニル基、ハロビフェニル基、シアノビフェニル基、C1−C10アルキルビフェニル基、C1−C10アルコキシビフェニル基、o−,m−及びp−トリル基、o−,m−及びp−クメニル基、メシチル基、フェノキシフェニル基、(α,α−ジメチルベンゼン)フェニル基、(N,N”−ジメチル)アミノフェニル基、(N,N’−ジフェニル)アミノフェニル基、ペンタレニル基、インデニル基、ナフチル基、ハロナフチル基(例えば、フルオロナフチル基)、C1−C10アルキルナフチル基(例えば、メチルナフチル基)、C1−C10アルコキシナフチル基(例えば、メトキシナフチル基)、シアノナフチル基、アントラセニル基、アズレニル基、ヘプタレニル基、アセナフチレニル基、フェナレニル基、フルオレニル基、アントラキノリル基、メチルアントリル基、フェナントリル基、トリフェニレン基、ピレニル基、クリセニル基、エチル−クリセニル基、ピセニル基、ペリレニル基、クロロペリレニル基、ペンタフェニル基、ペンタセニル基、テトラフェニレニル基、ヘキサフェニル基、ヘキサセニル基、ルビセニル基、コロネリル基、トリナフチレニル基、ヘプタフェニル基、ヘプタセニル基、ピラントレニル基及びオバレニル基などを挙げることができる。
【0044】
本明細書において、非置換のC5−C50アリールオキシ基は、−OA1で表示される基であって、このとき、A1が、前記C5−C60アリール基であることを意味する。前記アリールオキシ基の例としては、フェノキシ基などを挙げることができる。前記アリールオキシ基のうち一つ以上の水素原子は、前述のC1−C50アルキル基の置換基と同じ置換基で置換可能である。
【0045】
本明細書において、非置換のC5−C50アリールチオ基は、−SA1で表示される基であって、このとき、A1が、前記C5−C60アリール基であることを意味する。前記アリールチオ基の例としては、フェニルチオ基、ナフチルチオ基あるいはフルオレニルチオ基などを挙げることができる。前記アリールチオ基のうち一つ以上の水素原子は、前述のC1−C50アルキル基の置換基と同じ置換基で置換可能である。
【0046】
本明細書において、非置換のC4−C60ヘテロアリール基は、N,O,PまたはSのうちから選択された1個,2個または3個のヘテロ原子を含み、2個以上の環を有する場合、それらは互いに融合されたり、単一結合などを介して連結されうる。非置換のC4−C60ヘテロアリール基の例としては、ピラゾリル基、イミダゾリル基、オキサゾリル基、チアゾリル基、トリアゾリル基、テトラゾリル基、オキサジアゾリル基、ピリジニル基、ピリダジニル基、ピリミジニル基、トリアジニル基、カルバゾリル基、インドリル基、キノリニル基、イソキノリニル基などを挙げることができる。また、前記ヘテロアリール基のうち一つ以上の水素原子は、前述のC1−C50アルキル基の置換基と同じ置換基で置換可能である。
【0047】
本明細書において、隣接する2個以上の置換基が、互いに結合して形成した飽和環または不飽和環は、一つ以上の芳香族環及び/または一つ以上の非芳香族環が互いに融合された2個以上の環を含んだ置換基を指すものであり、アリール基またはヘテロアリール基の例の一部がこれに該当しうる。
【0048】
本発明の他の側面による有機発光素子は、第1電極と、前記第1電極に対向した第2電極と、前記第1電極と前記第2電極との間に介在した有機層と、を具備し、前記有機層が、前述のような化学式1のヘテロ環化合物を含む。
【0049】
前記化学式1の化合物は、有機発光素子用発光材料、及び/または電子輸送材料または電子注入材料としての機能を有する。前記化学式1の化合物は、分子内へのヘテロ環の導入により、ガラス転移温度(Tg)や融点が高く、結晶化を防止できる。特に、化学式1の化合物は、クリセン基及びインドール基が融合された対称構造を有し、このような化合物を含んで製造された有機発光素子は、保存時及び駆動時の耐久性が高い。ここに、フルオレン基などの置換基を導入すれば、ガラス転移温度(Tg)と熱分解温度(Td)とが高まり、高温駆動下で有機発光素子の特性をさらに向上させることができる。従って、このような化合物を有機発光材料として使用する場合、発光時に、有機層内、有機層間、あるいは有機層と金属電極との間で発生するジュール熱に対する耐熱性及び高温環境下での耐性が上昇しうる。
【0050】
具体的には、前記化学式1で表示されるヘテロ環化合物を含んだ有機層は、電子注入層であっても、電子輸送層であっても、あるいは、発光層であって電子注入機能及び電子輸送機能を同時に有する単一層であってもよい。
【0051】
前記化学式1で表示されるヘテロ環化合物を含んだ有機層は、発光層であってよく、前記有機層が発光層である場合には、前記ヘテロ環化合物は、蛍光またはリン光のホストとして使われてもよく、あるいは蛍光ドーパントとして使われてもよい。
【0052】
本発明の一具現例による前記有機発光素子の発光層、電子注入層または電子輸送層が、前記化合物を含む場合、前記発光層は、公知のアントラセン化合物、アリールアミン化合物またはスチリル化合物を含むことができ、前記アントラセン化合物、アリールアミン化合物またはスチリル化合物は、非置換であってよく、または前述のC1−C50アルキル基の置換基と同じ置換基で置換されていてもよい。
【0053】
本発明の一具現例による有機発光素子の電子注入層または電子輸送層が、前記化合物を含む場合、赤色発光層、緑色発光層、青色発光層または白色発光層が、公知のリン光化合物を含むことができる。
【0054】
ここで、前記第1電極はアノードであり、前記第2電極はカソードであるが、これと反対の場合も、もちろん可能である。
【0055】
前述のような有機発光素子は、必要によって、前記有機層は、正孔注入層、正孔輸送層、電子阻止層、発光層、正孔阻止層、電子輸送層及び電子注入層のうち1層以上の層をさらに具備でき、必要によっては、前記有機層の各層を2層に形成することも可能である。
【0056】
例えば、本発明の一具現例による有機発光素子は、第1電極/正孔注入層/発光層/第2電極、第1電極/正孔注入層/正孔輸送層/発光層/電子輸送層/第2電極、または第1電極/正孔注入層/正孔輸送層/発光層/電子輸送層/電子注入層/第2電極の構造を有することができる。または、前記有機発光素子は、第1電極/正孔注入機能及び正孔輸送機能を同時に有する単一層/発光層/電子輸送層/第2電極、または第1電極/正孔注入機能及び正孔輸送機能を同時に有する単一層/発光層/電子輸送層/電子注入層/第2電極の構造を有することができる。
【0057】
本発明の一具現例による有機発光素子は前面発光型、背面発光型などの多様な構造に適用可能である。
【0058】
以下、本発明の一具現例による有機発光素子の製造方法について、図1に図示された有機発光素子を参照しつつ説明する。図1の有機発光素子は、基板、第1電極(アノード)、正孔注入層、正孔輸送層、発光層、電子輸送層、電子注入層及び第2電極(カソード)を具備している。
【0059】
まず、基板上に、大きい仕事関数を有する第1電極用物質を、蒸着法またはスパッタリング法などによって形成し、第1電極を形成する。前記第1電極はアノードまたはカソードでありうる。ここで、基板としては、一般的な有機発光素子で使われる基板を使用するが、機械的強度、熱的安定性、透明性、表面平滑性、取扱容易性及び防水性にすぐれるガラス基板または透明プラスチック基板でありうる。第1電極用物質としては、伝導性にすぐれる酸化インジウムスズ(ITO)、酸化インジウム亜鉛(IZO)、酸化スズ(SnO2)、酸化亜鉛(ZnO)、Al、Ag、Mgなどを利用でき、透明電極または反射電極として形成できる。
【0060】
次に、前記第1電極上に、真空蒸着法、スピンコーティング法、キャスト法、LB(Langmuir-Blodgett)法のような多様な方法を利用し、正孔注入層(HIL)を形成できる。
【0061】
真空蒸着法によって正孔注入層を形成する場合、その蒸着条件は、正孔注入層の材料として使用する化合物、目的とする正孔注入層の構造及び熱的特性などによって異なるが、一般的に、蒸着温度100ないし500℃、真空度10−8ないし10−3torr、蒸着速度0.01ないし100Å/secの範囲で適切に選択できる。
【0062】
スピンコーティング法によって正孔注入層を形成する場合、そのコーティング条件は、正孔注入層の材料として使用する化合物、目的とする正孔注入層の構造及び熱的特性によって異なるが、約2,000rpmないし5,000rpmのコーティング速度、コーティング後の溶媒除去のための熱処理温度は、約80℃ないし200℃の温度範囲で適切に選択できる。
【0063】
前記正孔注入層の物質としては、公知の正孔注入材料を使用できる。例えば、銅フタロシアニンなどのフタロシアニン化合物、4,4’,4”−トリス(3−メチルフェニルフェニルアミノ)トリフェニルアミン(m−MTDATA)、N,N’−ジ(1−ナフチル)−N,N’−ジフェニルベンジジン(NPB)、4,4’,4”−トリス{N,Nジフェニルアミノ}トリフェニルアミン(TDATA)、4,4’−ビス[N−(ナフチル)−N−フェニル−アミノ]ビフェニル(2−TNATA)、ポリアニリン/ドデシルベンゼンスルホン酸(Pani/DBSA)、ポリ(3,4−エチレンジオキシチオフェン)/ポリ(4−スチレンスルホネート)(PEDOT/PSS)、ポリアニリン/カンファースルホン酸(Pani/CSA)またはポリアニリン/ポリ(4−スチレンスルホネート)(PANI/PSS)などを使用できるが、これらに制限されるものではない。
【0064】
【化8】

【0065】
前記正孔注入層の厚みは、約100Åないし10,000Å、例えば100Åないし1,000Åでありうる。前記正孔注入層の厚みが前記範囲を満足する場合、駆動電圧の上昇なしに、優秀な正孔注入特性を得ることができる。
【0066】
次に、前記正孔注入層の上に、真空蒸着法、スピンコーティング法、キャスト法、LB法のような多様な方法を利用し、正孔輸送層(HTL)を形成できる。真空蒸着法及びスピンコーティング法によって正孔輸送層を形成する場合、その蒸着条件及びコーティング条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択される。
【0067】
前記正孔輸送層の物質は、公知の正孔輸送層の物質を利用できる。例えば、N−フェニルカルバゾール、ポリビニルカルバゾールなどのカルバゾール誘導体;N,N’−ジ(1−ナフチル)−N,N’−ジフェニルベンジジン(NPB)、N,N’−ビス(3−メチルフェニル)−N,N’−ジフェニル−[1,1−ビフェニル]−4,4’−ジアミン(TPD)などの芳香族縮合環を有するアミン誘導体などを使用できる。例えば、(4,4’,4’’−トリ(N−カルバゾリル)トリフェニルアミン)(TCTA)の場合、正孔輸送の役割以外にも、発光層から励起子が拡散することを防止する役割も行うことができる。
【0068】
【化9】

【0069】
前記正孔輸送層の厚みは、約50Åないし1,000Å、例えば100Åないし600Åでありうる。前記正孔輸送層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な正孔輸送特性を得ることができる。
【0070】
次に、前記正孔輸送層の上に、真空蒸着法、スピンコーティング法、キャスト法、LB法のような方法を利用し、発光層(EML)を形成できる。真空蒸着法及びスピンコーティング法によって発光層を形成する場合、その蒸着条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択される。
【0071】
前記発光層は、前述のような化学式1で表示されるヘテロ環化合物を含むこともできる。例えば、化学式1で表示されるヘテロ環化合物は、ホストまたはドーパントとして使われうる。前記ヘテロ環化合物以外に、発光層は、公知の多様な発光物質、例えば公知のホスト及びドーパントなどを利用して形成することもできる。前記ドーパントの場合、公知の蛍光ドーパント及び公知のリン光ドーパントをいずれも使用できる。
【0072】
例えば、ホストとしては、トリス(8−キノリノラト)アルミニウム(Alq3)、4,4’−N,N’−ジカルバゾール−ビフェニル(CBP)、9,10−ジ(ナフタレン−2−イル)アントラセン(ADN)またはジスチリルアリーレン(DSA)などを使用できるが、これらに限定されるものではない。
【0073】
一方、公知のドーパントの例として、PtOEP、Ir(piq)3、Btp2Ir(acac)、Ir(ppy)3(ppy=フェニルピリジン)、Ir(ppy)2(acac)、Ir(mpyp)3、10−(2−ベンゾチアゾリル)−2,3,6,7−テトラヒドロ−1,1,7,7−テトラメチル−1H,5H,11H−(1)ベンゾピロピラノ(6,7−8−i,j)キノリジン−11−オン(C545T)、F2Irpic、(F2ppy)2Ir(tmd)、Ir(dfppz)3、ter−フルオレン、4,4’−ビス(4−ジフェニルアミノスチリル)ビフェニル(DPAVBi)及び2,5,8,11−テトラ−t−ブチルペリレン(TBP)などがあるが、これらに限定されるものではない。
【0074】
【化10A】

【化10B】

【0075】
前記ドーパントの含有量は、発光層の形成材料100重量部(すなわち、ホストとドーパントとの総重量を100重量部とする)を基準として、0.1ないし20重量部、例えば、0.5ないし12重量部でありうる。ドーパントの含有量が前記範囲を満足するらば、濃度消光現象が実質的に防止されうる。
【0076】
前記発光層の厚みは、約100Åないし1,000Å、例えば200Åないし600Åでありうる。前記発光層の厚みが前記範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な発光特性を得ることができる。
【0077】
発光層がリン光ドーパントを含む場合、三重項 励起子または正孔が電子輸送層に拡散する現象を防止するために、正孔阻止層(HBL)を発光層の上に形成できる(図1には図示せず)。このとき、使用できる正孔阻止層の物質は特別に制限されず、公知の正孔阻止層の物質のうちから任意に選択して利用できる。例えば、オキサジアゾール誘導体、トリアゾール誘導体、2,9−ジメチル−4,7−ジフェニル−1,10−フェナントロリン(BCP)のようなフェナントロリン誘導体、ビス(2−メチル−8−キノリノラト)−(p−フェニルフェノラート)−アルミニウム(BAlq)などを利用できる。
【0078】
前記正孔阻止層の厚みは、約50Åないし1,000Å、例えば100Åないし400Åでありうる。前記正孔阻止層の厚みが50Å未満である場合、正孔阻止特性が低下し、前記正孔阻止層の厚みが1,000Åを超える場合、駆動電圧が上昇しうるからである。
【0079】
次に、電子輸送層(ETL)を、真空蒸着法、またはスピンコーティング法、キャスト法などの多様な方法を利用して、正孔阻止層または発光層上に形成する。真空蒸着法及びスピンコーティング法によって電子輸送層を形成する場合、その条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択される。
【0080】
前記電子輸送層の物質は、前述のような化学式1で表示されるヘテロ環化合物を含むことができる。前記ヘテロ環化合物以外に、公知の電子輸送層の形成材料を任意に選択して使用することもできる。例えば、その例としては、Alq3, BAlqのようなキノリン誘導体、1,2,4−トリアゾール誘導体(TAZ)などの公知の材料を使用することができるが、これらに限定されるものではない。
【0081】
【化11】

【0082】
前記電子輸送層の厚みは、約100Åないし1,000Å、例えば100Åないし500Åでありうる。前記電子輸送層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な電子輸送特性を得ることができる。
【0083】
また、電子輸送層の上に、カソードから電子の注入を容易にする機能を有する物質である電子注入層(EIL)が積層されうる。
【0084】
該電子注入層は、前述のような化学式1で表示されるヘテロ環化合物を含むことができる。前記ヘテロ環化合物以外に、LiF、NaCl、CsF、Li2O、BaOのような電子注入層の形成材料として公知の任意の物質を使用することもできる。前記電子注入層の蒸着条件及びコーティング条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択される。
【0085】
前記電子注入層の厚みは、約1Åないし100Å、例えば5Åないし90Åでありうる。前記電子注入層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な電子注入特性を得ることができる。
【0086】
最後に、電子注入層の上に、真空蒸着法やスパッタリング法のような方法を利用し、第2電極を形成できる。前記第2電極は、カソードまたはアノードとして使われうる。前記第2電極形成用の物質としては、小さい仕事関数を有する金属、合金、電気伝導性化合物及びそれらの混合物を使用できる。具体的な例としては、リチウム(Li)、マグネシウム(Mg)、アルミニウム(Al)、アルミニウム−リチウム(Al−Li)、カルシウム(Ca)、マグネシウム−インジウム(Mg−In)、マグネシウム−銀(Mg−Ag)などを挙げることができる。また、前面発光素子を得るために、ITO、IZOを使用した透明カソードを使用することもできる。
【0087】
本発明の一具現例による有機発光素子は、多様な形態の平板表示装置、例えば、受動マトリックス有機発光表示装置及び能動マトリックス有機発光表示装置に備わりうる。特に、能動マトリックス有機発光表示装置に備わる場合、基板側に備わった第1電極は、画素電極であって、薄膜トランジスタのソース電極またはドレイン電極きて電気的に連結されうる。また、前記有機発光素子は、両面に画面を表示できる平板表示装置に備わりうる。
また、本発明の一具現例による有機発光素子の1層以上の層は、前記化学式1の化合物を使用して蒸着方法で形成することができ、または溶液で製造された化学式1の化合物をコーティングする湿式方法でも形成することができる。
【0088】
以下、前記化合物4、20、21、27及び28の合成例及び実施例について、具体的に例示するが、下記の実施例に限定されるということを意味するものではない。
【実施例】
【0089】
合成例:化合物4の合成
【化12】

【0090】
中間体1の合成
6,12−ジブロモクリセン3.84g(10mmol)、ベンゾフェノンヒドラゾン2.16g(11mmol)、t−BuONa 1.44g(15mmol)、Pd(OAc)2 45mg(0.2mmol)、および2−ジシクロヘキシルホスフィノ−2’,4’,6’−トリイソプロピルフェニル82mg(0.2mmol)を、トルエン50mLに溶かした後、90℃で3時間撹拌した。常温に冷やした反応物に蒸溜水を加え、ジエチルエーテル80mLで2回、ジクロロメタン80mLで1回抽出した。集めた有機層を硫酸マグネシウムで乾燥させて濾過した後で溶媒を蒸発させ、得られた残留物をシリカゲル・カラムクロマトグラフィで分離精製し、中間体1を5.7g(収率92%)得た。生成された化合物は、HR−MS(high resolution mass spectrometry)によって確認した(calc:616.2627,found:616.2618)。
【0091】
中間体2の合成
中間体1 6.2g(10mmol)、p−トルエンスルホン酸一水和物3.8g(20mmol)及びメチルエチルケトン50mLを加えた後、110℃で24時間撹拌した。常温に冷やした反応物に蒸溜水を加え、ジエチルエーテル80mLで2回、ジクロロメタン80mLで2回抽出した。集めた有機層を硫酸マグネシウムで乾燥させて濾過した後で溶媒を蒸発させ、得られた残留物をシリカゲル・カラムクロマトグラフィで分離精製し、中間体2を2.5g(収率69%)得た。生成された化合物は、HR−MSによって確認した(calc:360.1626,found:360.1513)。
【0092】
化合物4の合成
窒素下で、中間体2 2.5g(70mmol)、9−ブロモフルオレン3.8g(14mmol)、t−BuONa 2.0g(21mmol)、Pd2(dba)3 260mg(0.28mmol)及びP(t−Bu)3 56mg(0.28mmol)を、トルエン50mLに溶かした後、90℃で3時間撹拌した。前記反応が完結した後、常温に冷やし、これを、蒸溜水とジエチルエーテル50mLとで3回抽出した。集められた有機層を硫酸マグネシウムで乾燥させて溶媒を蒸発させ、得られた残留物をシリカゲル・カラムクロマトグラフィで分離精製し、化合物4を3.5g(収率67%)得た。生成した化合物は、HR−MSによって確認した(calc:746.3661,found:746.3761)。
【0093】
合成例:化合物20の合成
【化13】

前記の化合物5の合成と同じ方法で、9−ブロモフルオレンの代わりに、2−(4−ブロモフェニル)−イミダゾールピリミジンと反応させ、化合物20を71%の収率で合成した。生成した化合物は、HR−MSによって確認した(calc:748.3063,found:748.3321)。
【0094】
合成例:化合物21の合成
【化14】

前記の化合物5の合成と同じ方法で、9−ブロモフルオレンの代わりに、3−ブロモ−(1,10)フェナントロリンと反応させ、化合物21を65%の収率で合成した。生成した化合物は、HR−MSによって確認した(calc:718.2845,found:718.2547)。
【0095】
合成例:化合物27の合成
中間体3の合成
【化15】

中間体1 6.2g(10mmol)、p−トルエンスルホン酸一水和物1.90g(10.0mmol)及びベンジルフェニルケトン2.0g(10.0mmol)の混合物に、エタノール80mLとトルエン20mLとを加えた後、110℃で24時間撹拌した。常温に冷やした反応物に蒸溜水を加え、ジエチルエーテル50mLで2回、ジクロロメタン50mLで2回抽出した。集めた有機層を硫酸マグネシウムで乾燥させて濾過した後で溶媒を蒸発させ、得られた残留物をシリカゲル・カラムクロマトグラフィで分離精製し、中間体3を4.8g(収率79%)得た。生成した化合物は、HR−MSによって確認した(calc:608.2252,found:608.2623)。
【0096】
化合物27の合成
【化16】

前記の化合物5の合成と同じ方法で、中間体2の代わりに中間体3を使用し、9−ブロモフルオレンの代わりに、2−(4−ブロモフェニル)−1−フェニル−1−ベンゾイミダゾールを使用して反応させ、化合物27を68%の収率で合成した。生成した化合物は、HR−MSによって確認した(calc:1146.4410,found:1146.4352)。
【0097】
合成例:化合物28の合成
中間体4の合成
【化17】

2,5−ジブロモピリジン3.08g(13mmol)、4−ピリジルボロン酸1.23g(10mmol)、Pd(PPh3)4 0.58g(0.5mmol)及びK2CO3 5.53g(40mmol)を、50mLのテトラヒドロフラン(THF)/H2O(2:1)混合溶液に溶かし、80℃で5時間間撹拌した。反応液をジエチルエーテル60mlで3回抽出した。集めた有機層を硫酸マグネシウムで乾燥させて溶媒を蒸発させ、得られた残留物をジクロロメタンとノルマルヘキサンとで再結晶させて、中間体4を1.74g(収率74%)合成した。生成した化合物は、HR−MSによって確認した(calc:233.9793,found:234.9349)。
【0098】
化合物28の合成
【化18】

前記の化合物5の合成と同じ方法で、中間体2の代わりに中間体3を使用し、9−ブロモフルオレンの代わりに中間体4を使用して反応させて、化合物28を70%の収率で合成した。生成した化合物は、HR−MSによって確認した(calc:918.3471,found:918.3645)。
【0099】
実施例1
アノードとして、コーニング(Corning)15Ω/cm2(1,200Å)ITOガラス基板を、50mm×50mm×0.7mmサイズに切りイソプロピルアルコールと純水とを利用し、それぞれ5分間超音波洗浄した後、30分間紫外線を照射してオゾンに露出させて洗浄し、真空蒸着装置にこのガラス基板を備え付けた。
【0100】
前記基板上に、まず正孔注入層として、公知の物質である2−TNATAを真空蒸着し、600Å厚に形成した後、次に、正孔輸送性化合物として公知の物質である4,4’−ビス[N−(1−ナフチル)−N−フェニルアミノ]ビフェニル(NPB)を、300Å厚に真空蒸着して正孔輸送層を形成した。
【0101】
【化19】

【0102】
前記正孔輸送層の上に、公知の緑色蛍光ホストであるAlq3と、公知の緑色蛍光ドーパントであるC545Tとを、重量比98:2で同時蒸着して、300Å厚に発光層を形成した。
【0103】
次に、前記発光層の上に、電子輸送層として、前記化合物4を300Å厚に蒸着した後、この電子輸送層の上に、ハロゲン化アルカリ金属であるLiFを電子注入層として10Å厚に蒸着し、Alを3,000Å(カソード電極)厚に真空蒸着し、LiF/Al電極を形成することによって、有機発光素子を製造した。
【0104】
この素子は、電流密度50mA/cm2での駆動電圧6.36V、発光輝度7.235cd/m2の高輝度を示し、色座標は(0.313,0.641)であり、発光効率は、14.47cd/Aであった。
【0105】
実施例2
電子輸送層の形成時に、前記化合物4の代わりに化合物20を利用したことを除いては、実施例1と同一にし、有機発光素子を製作した。
【0106】
実施例3
電子輸送層の形成時に、前記化合物4の代わりに化合物21を利用したことを除いては、実施例1と同一にし、有機発光素子を製作した。
【0107】
実施例4
電子輸送層の形成時に、前記化合物4の代わりに化合物27を利用したことを除いては、実施例1と同一にし、有機発光素子を製作した。
【0108】
実施例5
電子輸送層の形成時に、前記化合物4の代わりに化合物28を利用したことを除いては、実施例1と同一にし、有機発光素子を製作した。
【0109】
比較例1
電子輸送層の形成時に、前記化合物4の代わりに公知の物質であるAlq3を利用したことを除いては、実施例1と同一にし、有機発光素子を製作した。
【化20】

【0110】
化学式1の構造を有するヘテロ環化合物を電子輸送層として有機発光素子に使用した結果、いずれも公知の物質であるAlq3と比較して、駆動電圧が1V以上低くなり、効率が向上し、優秀なI−V−L特性を示した(実施例1ないし5)。特に、寿命改善効果にすぐれ、実施例1ないし4の場合、比較例1に比べて、寿命が大幅に向上するという結果を示した。代表的な寿命結果を要約して、下記表1に示す。
【0111】
【表1】

【0112】
本発明の一側面による新規のヘテロ環化合物は、発光特性及び電荷輸送能にすぐれ、赤色、緑色、青色、白色などのほぼあらゆるカラーの蛍光素子およびリン光素子に適した電子注入/輸送材料または緑色、青色、白色の発光材料として有用であり、これを利用して、高効率、低電圧、高輝度、長寿命の有機発光素子を製作できる。
【0113】
本発明について、前記合成例及び実施例を参考にして説明したが、それらは例示的なものに過ぎず、本発明に属する技術分野の当業者であるならば、それらからから多様な変形及び均等な他実施例が可能であるという点を理解することが可能であろう。よって、本発明の真の技術的保護範囲は、特許請求の範囲の技術的思想によって決まるものである。
【特許請求の範囲】
【請求項1】
下記化学式1で表示されるヘテロ環化合物:
【化1】

前記化学式1で、
R1ないしR14は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、カルボキシル基、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、R1ないしR14のうち隣接する2個以上は、互いに結合して飽和環または不飽和環を形成することもでき、
Ar1ないしAr4は互いに独立して、置換または非置換のC1−C50アルキレン基、置換または非置換のC2−C50アルケニレン基、置換または非置換のC5−C60アリーレン基、及び置換または非置換のC4−C60ヘテロアリーレン基からなる群から選択され、
Ar11,Ar12及びAr13は互いに独立して、置換または非置換のC5−C60アリール基、置換または非置換のC5−C50アリールオキシ基、置換または非置換のC5−C50アリールチオ基、及び置換または非置換のC4−C60ヘテロアリール基からなる群から選択され、
a,b,c及びdは互いに独立して、0ないし10の整数であり、
−(Ar1)a−(Ar11)で表示される基において、a個のAr1は、互いに同一であるか異なり、−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基において、b個のAr2は、互いに同一であるか異なり、c個のAr3は、互いに同一であるか異なり、d個のAr4は、互いに同一であるか異なりうる。
【請求項2】
前記Ar1ないしAr4は互いに独立して、置換または非置換のC5−C20アリーレン基、及び置換または非置換のC4−C20ヘテロアリーレン基からなる群から選択されることを特徴とする請求項1に記載のヘテロ環化合物。
【請求項3】
前記Ar1ないしAr4は互いに独立して、フェニレン基、C1−C10アルキルフェニレン基、ジ(C1−C10アルキル)フェニレン基、ナフチレン基、C1−C10アルキルナフチレン基、ジ(C1−C10アルキル)ナフチレン基、アントリレン基、C1−C10アルキルアントリレン基、ジ(C1−C10アルキル)アントリレン基、フルオレニレン基、C1−C10アルキルフルオレニレン基、ジ(C1−C10アルキル)フルオレニレン基、C6−C14アリールフルオレニレン基、ジ(C6−C14アリール)フルオレニレン基、ピリジレン基、C1−C10アルキルピリジレン基、ジ(C1−C10アルキル)ピリジレン基、カルバゾリレン基、C1−C10アルキルカルバゾリレン基、ジ(C1−C10アルキル)カルバゾリレン基からなる群から選択されることを特徴とする請求項1に記載のヘテロ環化合物。
【請求項4】
前記Ar1ないしAr4は互いに独立して、下記化学式2Aないし2Gからなる群から選択されることを特徴とする請求項1に記載のヘテロ環化合物:
【化2】

前記化学式で、Z1,Z2,Z11及びZ12は互いに独立して、水素原子、重水素原子、C1−C10アルキル基、C1−C10アルコキシ基及びC6−C14アリール基からなる群から選択され、pは、1ないし8の整数であり、*は、Ar11,Ar12もしくはAr13または窒素原子との結合サイトであり、*’は、化学式1のバックボーン(backbone)をなす原子または窒素原子との結合サイトである。
【請求項5】
前記Ar11,Ar12及びAr13は互いに独立して、置換または非置換のC5−C20アリール基、及び置換または非置換のC4−C20ヘテロアリール基からなる群から選択されることを特徴とする請求項1に記載のヘテロ環化合物。
【請求項6】
前記Ar11,Ar12及びAr13は互いに独立して、フェニル基、C1−C10アルキルフェニル基、ジ(C1−C10アルキル)フェニル基、C6−C14アリールフェニル基、ジ(C6−C14アリール)フェニル基、ナフチル基、C1−C10アルキルナフチル基、ジ(C1−C10アルキル)ナフチル基、C6−C14アリールナフチル基、ジ(C6−C14アリール)ナフチル基、アントリル基、C1−C10アルキルアントリル基、ジ(C1−C10アルキル)アントリル基、C6−C14アリールアントリル基、ジ(C6−C14アリール)アントリル基、フェナントリル基、C1−C10アルキルフェナントリル基、ジ(C1−C10アルキル)フェナントリル基、C6−C14アリールフェナントリル基、ジ(C6−C14アリール)フェナントリル基、フルオレニル基、C1−C10アルキルフルオレニル基、ジ(C1−C10アルキル)フルオレニル基、C6−C14アリールフルオレニル基、ジ(C6−C14アリール)フルオレニル基、ピリジル基、C1−C10アルキルピリジル基、ジ(C1−C10アルキル)ピリジル基、ピレニル基、C1−C10アルキルピレニル基、ジ(C1−C10アルキル)ピレニル基、C6−C14アリールピレニル基、ジ(C6−C14アリール)ピレニル基、フェナントロリニル基、C1−C10アルキルフェナントロリニル基、ジ(C1−C10アルキル)フェナントロリニル基、C6−C14アリールフェナントロリニル基、ジ(C6−C14アリール)フェナントロリニル基、キノリニル基、C1−C10アルキルキノリニル基、ジ(C1−C10アルキル)キノリニル基、C6−C14アリールキノリニル基、ジ(C6−C14アリール)キノリニル基、ベンゾオキサゾリル基、C1−C10アルキルベンゾオキサゾリル基、ジ(C1−C10アルキル)ベンゾオキサゾリル基、C6−C14アリールベンゾオキサゾリル基、ジ(C6−C14アリール)ベンゾオキサゾリル基、ベンゾチアゾリル基、C1−C10アルキルベンゾチアゾリル基、ジ(C1−C10アルキル)ベンゾチアゾリル基、C6−C14アリールベンゾチアゾリル基、ジ(C6−C14アリール)ベンゾチアゾリル基、ベンゾイミダゾリル基、C1−C10アルキルベンゾイミダゾリル基、ジ(C1−C10アルキル)ベンゾイミダゾリル基、C6−C14アリールベンゾイミダゾリル基、ジ(C6−C14アリール)ベンゾイミダゾリル基、イミダゾールピリジニル基、C1−C10アルキルイミダゾールピリジニル基、ジ(C1−C10アルキル)イミダゾールピリジニル基、C6−C14アリールイミダゾールピリジニル基、ジ(C6−C14アリール)イミダゾールピリジニル基、イミダゾールピリミジニル基、C1−C10アルキルイミダゾールピリミジニル基、ジ(C1−C10アルキル)イミダゾールピリミジニル基、C6−C14アリールイミダゾールピリミジニル基、ジ(C6−C14アリール)イミダゾールピリミジニル基、カルバゾリル基、C1−C10アルキルカルバゾリル基、ジ(C1−C10アルキル)カルバゾリル基、C6−C14アリールカルバゾリル基、ジ(C6−C14アリール)カルバゾリル基からなる群から選択されることを特徴とする請求項1に記載のヘテロ環化合物。
【請求項7】
前記Ar11,Ar12及びAr13は互いに独立して、下記化学式3Aないし3Pからなる群から選択されることを特徴とする請求項1に記載のヘテロ環化合物:
【化3】

前記化学式で、Z1,Z2,Z3,Z11及びZ12は互いに独立して、水素原子、重水素原子、C1−C10アルキル基、C1−C10アルコキシ基及びC6−C14アリール基からなる群から選択され、pは、1ないし8の整数であり、*は、Ar1,Ar2、Ar3もしくはAr4または窒素原子との結合サイトである。
【請求項8】
前記a,b,c及びdは互いに独立して、0,1,2または3であることを特徴とする請求項1に記載のヘテロ環化合物。
【請求項9】
前記R1ないしR14は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、置換または非置換のC1−C10アルキル基、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、
前記Ar1ないしAr4は互いに独立して、置換または非置換のC5−C20アリーレン基、及び置換または非置換のC4−C20ヘテロアリーレン基からなる群から選択され、
前記Ar11,Ar12及びAr13は互いに独立して、フェニル基、C1−C10アルキルフェニル基、ジ(C1−C10アルキル)フェニル基、C6−C14アリールフェニル基、ジ(C6−C14アリール)フェニル基、ナフチル基、C1−C10アルキルナフチル基、ジ(C1−C10アルキル)ナフチル基、C6−C14アリールナフチル基、ジ(C6−C14アリール)ナフチル基、アントリル基、C1−C10アルキルアントリル基、ジ(C1−C10アルキル)アントリル基、C6−C14アリールアントリル基、ジ(C6−C14アリール)アントリル基、フェナントリル基、C1−C10アルキルフェナントリル基、ジ(C1−C10アルキル)フェナントリル基、C6−C14アリールフェナントリル基、ジ(C6−C14アリール)フェナントリル基、フルオレニル基、C1−C10アルキルフルオレニル基、ジ(C1−C10アルキル)フルオレニル基、C6−C14アリールフルオレニル基、ジ(C6−C14アリール)フルオレニル基、ピリジル基、C1−C10アルキルピリジル基、ジ(C1−C10アルキル)ピリジル基、ピレニル基、C1−C10アルキルピレニル基、ジ(C1−C10アルキル)ピレニル基、C6−C14アリールピレニル基、ジ(C6−C14アリール)ピレニル基、フェナントロリニル基、C1−C10アルキルフェナントロリニル基、ジ(C1−C10アルキル)フェナントロリニル基、C6−C14アリールフェナントロリニル基、ジ(C6−C14アリール)フェナントロリニル基、キノリニル基、C1−C10アルキルキノリニル基、ジ(C1−C10アルキル)キノリニル基、C6−C14アリールキノリニル基、ジ(C6−C14アリール)キノリニル基、ベンゾオキサゾリル基、C1−C10アルキルベンゾオキサゾリル基、ジ(C1−C10アルキル)ベンゾオキサゾリル基、C6−C14アリールベンゾオキサゾリル基、ジ(C6−C14アリール)ベンゾオキサゾリル基、ベンゾチアゾリル基、C1−C10アルキルベンゾチアゾリル基、ジ(C1−C10アルキル)ベンゾチアゾリル基、C6−C14アリールベンゾチアゾリル基、ジ(C6−C14アリール)ベンゾチアゾリル基、ベンゾイミダゾリル基、C1−C10アルキルベンゾイミダゾリル基、ジ(C1−C10アルキル)ベンゾイミダゾリル基、C6−C14アリールベンゾイミダゾリル基、ジ(C6−C14アリール)ベンゾイミダゾリル基、イミダゾールピリジニル基、C1−C10アルキルイミダゾールピリジニル基、ジ(C1−C10アルキル)イミダゾールピリジニル基、C6−C14アリールイミダゾールピリジニル基、ジ(C6−C14アリール)イミダゾールピリジニル基、イミダゾールピリミジニル基、C1−C10アルキルイミダゾールピリミジニル基、ジ(C1−C10アルキル)イミダゾールピリミジニル基、C6−C14アリールイミダゾールピリミジニル基、ジ(C6−C14アリール)イミダゾールピリミジニル基、カルバゾリル基、C1−C10アルキルカルバゾリル基、ジ(C1−C10アルキル)カルバゾリル基、C6−C14アリールカルバゾリル基、ジ(C6−C14アリール)カルバゾリル基からなる群から選択され、
前記a,b,c及びdは互いに独立して、0,1,2または3であることを特徴とする請求項1に記載のヘテロ環化合物。
【請求項10】
下記化学式2で表示されることを特徴とする請求項1に記載のヘテロ環化合物:
【化4】

前記化学式2で、
R1,R2,R3,R8,R9及びR10は互いに独立して、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、R1,R2,R3,R8,R9及びR10のうち隣接する2個以上は、互いに結合して飽和環または不飽和環を形成することもでき、
Ar1ないしAr4は互いに独立して、置換または非置換のC1−C50アルキレン基、置換または非置換のC2−C50アルケニレン基、置換または非置換のC5−C60アリーレン基、及び置換または非置換のC4−C60ヘテロアリーレン基からなる群から選択され、
Ar11,Ar12及びAr13は互いに独立して、置換または非置換のC5−C60アリール基、置換または非置換のC5−C50アリールオキシ基、置換または非置換のC5−C50アリールチオ基、及び置換または非置換のC4−C60ヘテロアリール基からなる群から選択され、
a,b,c及びdは互いに独立して、0ないし10の整数であり、
−(Ar1)a−(Ar11)で表示される基において、a個のAr1は、互いに同一であるか異なり、−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基において、b個のAr2は、互いに同一であるか異なり、c個のAr3は、互いに同一であるか異なり、d個のAr4は、互いに同一であるか異なりうる。
【請求項11】
前記Ar1ないしAr4は互いに独立して、置換または非置換のC5−C20アリーレン基、及び置換または非置換のC4−C20ヘテロアリーレン基からなる群から選択されることを特徴とする請求項10に記載のヘテロ環化合物。
【請求項12】
前記Ar1ないしAr4は互いに独立して、フェニレン基、C1−C10アルキルフェニレン基、ジ(C1−C10アルキル)フェニレン基、ナフチレン基、C1−C10アルキルナフチレン基、ジ(C1−C10アルキル)ナフチレン基、アントリレン基、C1−C10アルキルアントリレン基、ジ(C1−C10アルキル)アントリレン基、フルオレニレン基、C1−C10アルキルフルオレニレン基、ジ(C1−C10アルキル)フルオレニレン基、C6−C14アリールフルオレニレン基、ジ(C6−C14アリール)フルオレニレン基、ピリジレン基、C1−C10アルキルピリジレン基、ジ(C1−C10アルキル)ピリジレン基、カルバゾリレン基、C1−C10アルキルカルバゾリレン基、ジ(C1−C10アルキル)カルバゾリレン基からなる群から選択されることを特徴とする請求項10に記載のヘテロ環化合物。
【請求項13】
前記Ar1ないしAr4は互いに独立して、下記化学式2Aないし2Gからなる群から選択されることを特徴とする請求項10に記載のヘテロ環化合物:
【化5】

前記化学式で、Z1,Z2,Z11及びZ12は互いに独立して、水素原子、重水素原子、C1−C10アルキル基、C1−C10アルコキシ基及びC6−C14アリール基からなる群から選択され、pは、1ないし8の整数であり、*は、Ar11,Ar12もしくはAr13または窒素原子との結合サイトであり、*’は、化学式1のバックボーン(backbone)をなす原子または窒素原子との結合サイトである。
【請求項14】
前記Ar11,Ar12及びAr13は互いに独立して、置換または非置換のC5−C20アリール基、及び置換または非置換のC4−C20ヘテロアリール基からなる群から選択されることを特徴とする請求項10に記載のヘテロ環化合物。
【請求項15】
前記Ar11,Ar12及びAr13は互いに独立して、フェニル基、C1−C10アルキルフェニル基、ジ(C1−C10アルキル)フェニル基、C6−C14アリールフェニル基、ジ(C6−C14アリール)フェニル基、ナフチル基、C1−C10アルキルナフチル基、ジ(C1−C10アルキル)ナフチル基、C6−C14アリールナフチル基、ジ(C6−C14アリール)ナフチル基、アントリル基、C1−C10アルキルアントリル基、ジ(C1−C10アルキル)アントリル基、C6−C14アリールアントリル基、ジ(C6−C14アリール)アントリル基、フェナントリル基、C1−C10アルキルフェナントリル基、ジ(C1−C10アルキル)フェナントリル基、C6−C14アリールフェナントリル基、ジ(C6−C14アリール)フェナントリル基、フルオレニル基、C1−C10アルキルフルオレニル基、ジ(C1−C10アルキル)フルオレニル基、C6−C14アリールフルオレニル基、ジ(C6−C14アリール)フルオレニル基、ピリジル基、C1−C10アルキルピリジル基、ジ(C1−C10アルキル)ピリジル基、ピレニル基、C1−C10アルキルピレニル基、ジ(C1−C10アルキル)ピレニル基、C6−C14アリールピレニル基、ジ(C6−C14アリール)ピレニル基、フェナントロリニル基、C1−C10アルキルフェナントロリニル基、ジ(C1−C10アルキル)フェナントロリニル基、C6−C14アリールフェナントロリニル基、ジ(C6−C14アリール)フェナントロリニル基、キノリニル基、C1−C10アルキルキノリニル基、ジ(C1−C10アルキル)キノリニル基、C6−C14アリールキノリニル基、ジ(C6−C14アリール)キノリニル基、ベンゾオキサゾリル基、C1−C10アルキルベンゾオキサゾリル基、ジ(C1−C10アルキル)ベンゾオキサゾリル基、C6−C14アリールベンゾオキサゾリル基、ジ(C6−C14アリール)ベンゾオキサゾリル基、ベンゾチアゾリル基、C1−C10アルキルベンゾチアゾリル基、ジ(C1−C10アルキル)ベンゾチアゾリル基、C6−C14アリールベンゾチアゾリル基、ジ(C6−C14アリール)ベンゾチアゾリル基、ベンゾイミダゾリル基、C1−C10アルキルベンゾイミダゾリル基、ジ(C1−C10アルキル)ベンゾイミダゾリル基、C6−C14アリールベンゾイミダゾリル基、ジ(C6−C14アリール)ベンゾイミダゾリル基、イミダゾールピリジニル基、C1−C10アルキルイミダゾールピリジニル基、ジ(C1−C10アルキル)イミダゾールピリジニル基、C6−C14アリールイミダゾールピリジニル基、ジ(C6−C14アリール)イミダゾールピリジニル基、イミダゾールピリミジニル基、C1−C10アルキルイミダゾールピリミジニル基、ジ(C1−C10アルキル)イミダゾールピリミジニル基、C6−C14アリールイミダゾールピリミジニル基、ジ(C6−C14アリール)イミダゾールピリミジニル基、カルバゾリル基、C1−C10アルキルカルバゾリル基、ジ(C1−C10アルキル)カルバゾリル基、C6−C14アリールカルバゾリル基、ジ(C6−C14アリール)カルバゾリル基からなる群から選択されることを特徴とする請求項10に記載のヘテロ環化合物。
【請求項16】
前記Ar11,Ar12及びAr13は互いに独立して、下記化学式3Aないし3Pからなる群から選択されることを特徴とする請求項10に記載のヘテロ環化合物:
【化6】

前記化学式で、Z1,Z2,Z3,Z11及びZ12は互いに独立して、水素原子、重水素原子、C1−C10アルキル基、C1−C10アルコキシ基及びC6−C14アリール基からなる群から選択され、pは、1ないし8の整数であり、*は、Ar1,Ar2、A3もしくはAr4または窒素原子との結合サイトである。
【請求項17】
前記a,b,c及びdは互いに独立して、0,1,2または3であることを特徴とする請求項10に記載のヘテロ環化合物。
【請求項18】
前記R1及びR8は互いに独立して、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、前記R2,R3,R9及びR10は互いに独立して、メチル基、フェニル基からなる群から選択され、
前記Ar1ないしAr4は互いに独立して、置換または非置換のC5−C20アリーレン基、及び置換または非置換のC4−C20ヘテロアリーレン基からなる群から選択され、
前記Ar11,Ar12及びAr13は互いに独立して、フェニル基、C1−C10アルキルフェニル基、ジ(C1−C10アルキル)フェニル基、C6−C14アリールフェニル基、ジ(C6−C14アリール)フェニル基、ナフチル基、C1−C10アルキルナフチル基、ジ(C1−C10アルキル)ナフチル基、C6−C14アリールナフチル基、ジ(C6−C14アリール)ナフチル基、アントリル基、C1−C10アルキルアントリル基、ジ(C1−C10アルキル)アントリル基、C6−C14アリールアントリル基、ジ(C6−C14アリール)アントリル基、フェナントリル基、C1−C10アルキルフェナントリル基、ジ(C1−C10アルキル)フェナントリル基、C6−C14アリールフェナントリル基、ジ(C6−C14アリール)フェナントリル基、フルオレニル基、C1−C10アルキルフルオレニル基、ジ(C1−C10アルキル)フルオレニル基、C6−C14アリールフルオレニル基、ジ(C6−C14アリール)フルオレニル基、ピリジル基、C1−C10アルキルピリジル基、ジ(C1−C10アルキル)ピリジル基、ピレニル基、C1−C10アルキルピレニル基、ジ(C1−C10アルキル)ピレニル基、C6−C14アリールピレニル基、ジ(C6−C14アリール)ピレニル基、フェナントロリニル基、C1−C10アルキルフェナントロリニル基、ジ(C1−C10アルキル)フェナントロリニル基、C6−C14アリールフェナントロリニル基、ジ(C6−C14アリール)フェナントロリニル基、キノリニル基、C1−C10アルキルキノリニル基、ジ(C1−C10アルキル)キノリニル基、C6−C14アリールキノリニル基、ジ(C6−C14アリール)キノリニル基、ベンゾオキサゾリル基、C1−C10アルキルベンゾオキサゾリル基、ジ(C1−C10アルキル)ベンゾオキサゾリル基、C6−C14アリールベンゾオキサゾリル基、ジ(C6−C14アリール)ベンゾオキサゾリル基、ベンゾチアゾリル基、C1−C10アルキルベンゾチアゾリル基、ジ(C1−C10アルキル)ベンゾチアゾリル基、C6−C14アリールベンゾチアゾリル基、ジ(C6−C14アリール)ベンゾチアゾリル基、ベンゾイミダゾリル基、C1−C10アルキルベンゾイミダゾリル基、ジ(C1−C10アルキル)ベンゾイミダゾリル基、C6−C14アリールベンゾイミダゾリル基、ジ(C6−C14アリール)ベンゾイミダゾリル基、イミダゾールピリジニル基、C1−C10アルキルイミダゾールピリジニル基、ジ(C1−C10アルキル)イミダゾールピリジニル基、C6−C14アリールイミダゾールピリジニル基、ジ(C6−C14アリール)イミダゾールピリジニル基、イミダゾールピリミジニル基、C1−C10アルキルイミダゾールピリミジニル基、ジ(C1−C10アルキル)イミダゾールピリミジニル基、C6−C14アリールイミダゾールピリミジニル基、ジ(C6−C14アリール)イミダゾールピリミジニル基、カルバゾリル基、C1−C10アルキルカルバゾリル基、ジ(C1−C10アルキル)カルバゾリル基、C6−C14アリールカルバゾリル基、ジ(C6−C14アリール)カルバゾリル基からなる群から選択され、
前記a,b,c及びdは互いに独立して、0,1,2または3であることを特徴とする請求項10に記載のヘテロ環化合物。
【請求項19】
第1電極と、前記第1電極に対向した第2電極と、前記第1電極と前記第2電極との間に介在した有機層と、を具備し、前記有機層が請求項1ないし請求項18のうち、いずれか1項に記載のヘテロ環化合物を含む有機発光素子。
【請求項20】
前記有機層が、電子注入層、電子輸送層または発光層であることを特徴とする請求項19に記載の有機発光素子。
【請求項1】
下記化学式1で表示されるヘテロ環化合物:
【化1】

前記化学式1で、
R1ないしR14は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、カルボキシル基、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、R1ないしR14のうち隣接する2個以上は、互いに結合して飽和環または不飽和環を形成することもでき、
Ar1ないしAr4は互いに独立して、置換または非置換のC1−C50アルキレン基、置換または非置換のC2−C50アルケニレン基、置換または非置換のC5−C60アリーレン基、及び置換または非置換のC4−C60ヘテロアリーレン基からなる群から選択され、
Ar11,Ar12及びAr13は互いに独立して、置換または非置換のC5−C60アリール基、置換または非置換のC5−C50アリールオキシ基、置換または非置換のC5−C50アリールチオ基、及び置換または非置換のC4−C60ヘテロアリール基からなる群から選択され、
a,b,c及びdは互いに独立して、0ないし10の整数であり、
−(Ar1)a−(Ar11)で表示される基において、a個のAr1は、互いに同一であるか異なり、−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基において、b個のAr2は、互いに同一であるか異なり、c個のAr3は、互いに同一であるか異なり、d個のAr4は、互いに同一であるか異なりうる。
【請求項2】
前記Ar1ないしAr4は互いに独立して、置換または非置換のC5−C20アリーレン基、及び置換または非置換のC4−C20ヘテロアリーレン基からなる群から選択されることを特徴とする請求項1に記載のヘテロ環化合物。
【請求項3】
前記Ar1ないしAr4は互いに独立して、フェニレン基、C1−C10アルキルフェニレン基、ジ(C1−C10アルキル)フェニレン基、ナフチレン基、C1−C10アルキルナフチレン基、ジ(C1−C10アルキル)ナフチレン基、アントリレン基、C1−C10アルキルアントリレン基、ジ(C1−C10アルキル)アントリレン基、フルオレニレン基、C1−C10アルキルフルオレニレン基、ジ(C1−C10アルキル)フルオレニレン基、C6−C14アリールフルオレニレン基、ジ(C6−C14アリール)フルオレニレン基、ピリジレン基、C1−C10アルキルピリジレン基、ジ(C1−C10アルキル)ピリジレン基、カルバゾリレン基、C1−C10アルキルカルバゾリレン基、ジ(C1−C10アルキル)カルバゾリレン基からなる群から選択されることを特徴とする請求項1に記載のヘテロ環化合物。
【請求項4】
前記Ar1ないしAr4は互いに独立して、下記化学式2Aないし2Gからなる群から選択されることを特徴とする請求項1に記載のヘテロ環化合物:
【化2】

前記化学式で、Z1,Z2,Z11及びZ12は互いに独立して、水素原子、重水素原子、C1−C10アルキル基、C1−C10アルコキシ基及びC6−C14アリール基からなる群から選択され、pは、1ないし8の整数であり、*は、Ar11,Ar12もしくはAr13または窒素原子との結合サイトであり、*’は、化学式1のバックボーン(backbone)をなす原子または窒素原子との結合サイトである。
【請求項5】
前記Ar11,Ar12及びAr13は互いに独立して、置換または非置換のC5−C20アリール基、及び置換または非置換のC4−C20ヘテロアリール基からなる群から選択されることを特徴とする請求項1に記載のヘテロ環化合物。
【請求項6】
前記Ar11,Ar12及びAr13は互いに独立して、フェニル基、C1−C10アルキルフェニル基、ジ(C1−C10アルキル)フェニル基、C6−C14アリールフェニル基、ジ(C6−C14アリール)フェニル基、ナフチル基、C1−C10アルキルナフチル基、ジ(C1−C10アルキル)ナフチル基、C6−C14アリールナフチル基、ジ(C6−C14アリール)ナフチル基、アントリル基、C1−C10アルキルアントリル基、ジ(C1−C10アルキル)アントリル基、C6−C14アリールアントリル基、ジ(C6−C14アリール)アントリル基、フェナントリル基、C1−C10アルキルフェナントリル基、ジ(C1−C10アルキル)フェナントリル基、C6−C14アリールフェナントリル基、ジ(C6−C14アリール)フェナントリル基、フルオレニル基、C1−C10アルキルフルオレニル基、ジ(C1−C10アルキル)フルオレニル基、C6−C14アリールフルオレニル基、ジ(C6−C14アリール)フルオレニル基、ピリジル基、C1−C10アルキルピリジル基、ジ(C1−C10アルキル)ピリジル基、ピレニル基、C1−C10アルキルピレニル基、ジ(C1−C10アルキル)ピレニル基、C6−C14アリールピレニル基、ジ(C6−C14アリール)ピレニル基、フェナントロリニル基、C1−C10アルキルフェナントロリニル基、ジ(C1−C10アルキル)フェナントロリニル基、C6−C14アリールフェナントロリニル基、ジ(C6−C14アリール)フェナントロリニル基、キノリニル基、C1−C10アルキルキノリニル基、ジ(C1−C10アルキル)キノリニル基、C6−C14アリールキノリニル基、ジ(C6−C14アリール)キノリニル基、ベンゾオキサゾリル基、C1−C10アルキルベンゾオキサゾリル基、ジ(C1−C10アルキル)ベンゾオキサゾリル基、C6−C14アリールベンゾオキサゾリル基、ジ(C6−C14アリール)ベンゾオキサゾリル基、ベンゾチアゾリル基、C1−C10アルキルベンゾチアゾリル基、ジ(C1−C10アルキル)ベンゾチアゾリル基、C6−C14アリールベンゾチアゾリル基、ジ(C6−C14アリール)ベンゾチアゾリル基、ベンゾイミダゾリル基、C1−C10アルキルベンゾイミダゾリル基、ジ(C1−C10アルキル)ベンゾイミダゾリル基、C6−C14アリールベンゾイミダゾリル基、ジ(C6−C14アリール)ベンゾイミダゾリル基、イミダゾールピリジニル基、C1−C10アルキルイミダゾールピリジニル基、ジ(C1−C10アルキル)イミダゾールピリジニル基、C6−C14アリールイミダゾールピリジニル基、ジ(C6−C14アリール)イミダゾールピリジニル基、イミダゾールピリミジニル基、C1−C10アルキルイミダゾールピリミジニル基、ジ(C1−C10アルキル)イミダゾールピリミジニル基、C6−C14アリールイミダゾールピリミジニル基、ジ(C6−C14アリール)イミダゾールピリミジニル基、カルバゾリル基、C1−C10アルキルカルバゾリル基、ジ(C1−C10アルキル)カルバゾリル基、C6−C14アリールカルバゾリル基、ジ(C6−C14アリール)カルバゾリル基からなる群から選択されることを特徴とする請求項1に記載のヘテロ環化合物。
【請求項7】
前記Ar11,Ar12及びAr13は互いに独立して、下記化学式3Aないし3Pからなる群から選択されることを特徴とする請求項1に記載のヘテロ環化合物:
【化3】

前記化学式で、Z1,Z2,Z3,Z11及びZ12は互いに独立して、水素原子、重水素原子、C1−C10アルキル基、C1−C10アルコキシ基及びC6−C14アリール基からなる群から選択され、pは、1ないし8の整数であり、*は、Ar1,Ar2、Ar3もしくはAr4または窒素原子との結合サイトである。
【請求項8】
前記a,b,c及びdは互いに独立して、0,1,2または3であることを特徴とする請求項1に記載のヘテロ環化合物。
【請求項9】
前記R1ないしR14は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、置換または非置換のC1−C10アルキル基、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、
前記Ar1ないしAr4は互いに独立して、置換または非置換のC5−C20アリーレン基、及び置換または非置換のC4−C20ヘテロアリーレン基からなる群から選択され、
前記Ar11,Ar12及びAr13は互いに独立して、フェニル基、C1−C10アルキルフェニル基、ジ(C1−C10アルキル)フェニル基、C6−C14アリールフェニル基、ジ(C6−C14アリール)フェニル基、ナフチル基、C1−C10アルキルナフチル基、ジ(C1−C10アルキル)ナフチル基、C6−C14アリールナフチル基、ジ(C6−C14アリール)ナフチル基、アントリル基、C1−C10アルキルアントリル基、ジ(C1−C10アルキル)アントリル基、C6−C14アリールアントリル基、ジ(C6−C14アリール)アントリル基、フェナントリル基、C1−C10アルキルフェナントリル基、ジ(C1−C10アルキル)フェナントリル基、C6−C14アリールフェナントリル基、ジ(C6−C14アリール)フェナントリル基、フルオレニル基、C1−C10アルキルフルオレニル基、ジ(C1−C10アルキル)フルオレニル基、C6−C14アリールフルオレニル基、ジ(C6−C14アリール)フルオレニル基、ピリジル基、C1−C10アルキルピリジル基、ジ(C1−C10アルキル)ピリジル基、ピレニル基、C1−C10アルキルピレニル基、ジ(C1−C10アルキル)ピレニル基、C6−C14アリールピレニル基、ジ(C6−C14アリール)ピレニル基、フェナントロリニル基、C1−C10アルキルフェナントロリニル基、ジ(C1−C10アルキル)フェナントロリニル基、C6−C14アリールフェナントロリニル基、ジ(C6−C14アリール)フェナントロリニル基、キノリニル基、C1−C10アルキルキノリニル基、ジ(C1−C10アルキル)キノリニル基、C6−C14アリールキノリニル基、ジ(C6−C14アリール)キノリニル基、ベンゾオキサゾリル基、C1−C10アルキルベンゾオキサゾリル基、ジ(C1−C10アルキル)ベンゾオキサゾリル基、C6−C14アリールベンゾオキサゾリル基、ジ(C6−C14アリール)ベンゾオキサゾリル基、ベンゾチアゾリル基、C1−C10アルキルベンゾチアゾリル基、ジ(C1−C10アルキル)ベンゾチアゾリル基、C6−C14アリールベンゾチアゾリル基、ジ(C6−C14アリール)ベンゾチアゾリル基、ベンゾイミダゾリル基、C1−C10アルキルベンゾイミダゾリル基、ジ(C1−C10アルキル)ベンゾイミダゾリル基、C6−C14アリールベンゾイミダゾリル基、ジ(C6−C14アリール)ベンゾイミダゾリル基、イミダゾールピリジニル基、C1−C10アルキルイミダゾールピリジニル基、ジ(C1−C10アルキル)イミダゾールピリジニル基、C6−C14アリールイミダゾールピリジニル基、ジ(C6−C14アリール)イミダゾールピリジニル基、イミダゾールピリミジニル基、C1−C10アルキルイミダゾールピリミジニル基、ジ(C1−C10アルキル)イミダゾールピリミジニル基、C6−C14アリールイミダゾールピリミジニル基、ジ(C6−C14アリール)イミダゾールピリミジニル基、カルバゾリル基、C1−C10アルキルカルバゾリル基、ジ(C1−C10アルキル)カルバゾリル基、C6−C14アリールカルバゾリル基、ジ(C6−C14アリール)カルバゾリル基からなる群から選択され、
前記a,b,c及びdは互いに独立して、0,1,2または3であることを特徴とする請求項1に記載のヘテロ環化合物。
【請求項10】
下記化学式2で表示されることを特徴とする請求項1に記載のヘテロ環化合物:
【化4】

前記化学式2で、
R1,R2,R3,R8,R9及びR10は互いに独立して、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、R1,R2,R3,R8,R9及びR10のうち隣接する2個以上は、互いに結合して飽和環または不飽和環を形成することもでき、
Ar1ないしAr4は互いに独立して、置換または非置換のC1−C50アルキレン基、置換または非置換のC2−C50アルケニレン基、置換または非置換のC5−C60アリーレン基、及び置換または非置換のC4−C60ヘテロアリーレン基からなる群から選択され、
Ar11,Ar12及びAr13は互いに独立して、置換または非置換のC5−C60アリール基、置換または非置換のC5−C50アリールオキシ基、置換または非置換のC5−C50アリールチオ基、及び置換または非置換のC4−C60ヘテロアリール基からなる群から選択され、
a,b,c及びdは互いに独立して、0ないし10の整数であり、
−(Ar1)a−(Ar11)で表示される基において、a個のAr1は、互いに同一であるか異なり、−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基において、b個のAr2は、互いに同一であるか異なり、c個のAr3は、互いに同一であるか異なり、d個のAr4は、互いに同一であるか異なりうる。
【請求項11】
前記Ar1ないしAr4は互いに独立して、置換または非置換のC5−C20アリーレン基、及び置換または非置換のC4−C20ヘテロアリーレン基からなる群から選択されることを特徴とする請求項10に記載のヘテロ環化合物。
【請求項12】
前記Ar1ないしAr4は互いに独立して、フェニレン基、C1−C10アルキルフェニレン基、ジ(C1−C10アルキル)フェニレン基、ナフチレン基、C1−C10アルキルナフチレン基、ジ(C1−C10アルキル)ナフチレン基、アントリレン基、C1−C10アルキルアントリレン基、ジ(C1−C10アルキル)アントリレン基、フルオレニレン基、C1−C10アルキルフルオレニレン基、ジ(C1−C10アルキル)フルオレニレン基、C6−C14アリールフルオレニレン基、ジ(C6−C14アリール)フルオレニレン基、ピリジレン基、C1−C10アルキルピリジレン基、ジ(C1−C10アルキル)ピリジレン基、カルバゾリレン基、C1−C10アルキルカルバゾリレン基、ジ(C1−C10アルキル)カルバゾリレン基からなる群から選択されることを特徴とする請求項10に記載のヘテロ環化合物。
【請求項13】
前記Ar1ないしAr4は互いに独立して、下記化学式2Aないし2Gからなる群から選択されることを特徴とする請求項10に記載のヘテロ環化合物:
【化5】

前記化学式で、Z1,Z2,Z11及びZ12は互いに独立して、水素原子、重水素原子、C1−C10アルキル基、C1−C10アルコキシ基及びC6−C14アリール基からなる群から選択され、pは、1ないし8の整数であり、*は、Ar11,Ar12もしくはAr13または窒素原子との結合サイトであり、*’は、化学式1のバックボーン(backbone)をなす原子または窒素原子との結合サイトである。
【請求項14】
前記Ar11,Ar12及びAr13は互いに独立して、置換または非置換のC5−C20アリール基、及び置換または非置換のC4−C20ヘテロアリール基からなる群から選択されることを特徴とする請求項10に記載のヘテロ環化合物。
【請求項15】
前記Ar11,Ar12及びAr13は互いに独立して、フェニル基、C1−C10アルキルフェニル基、ジ(C1−C10アルキル)フェニル基、C6−C14アリールフェニル基、ジ(C6−C14アリール)フェニル基、ナフチル基、C1−C10アルキルナフチル基、ジ(C1−C10アルキル)ナフチル基、C6−C14アリールナフチル基、ジ(C6−C14アリール)ナフチル基、アントリル基、C1−C10アルキルアントリル基、ジ(C1−C10アルキル)アントリル基、C6−C14アリールアントリル基、ジ(C6−C14アリール)アントリル基、フェナントリル基、C1−C10アルキルフェナントリル基、ジ(C1−C10アルキル)フェナントリル基、C6−C14アリールフェナントリル基、ジ(C6−C14アリール)フェナントリル基、フルオレニル基、C1−C10アルキルフルオレニル基、ジ(C1−C10アルキル)フルオレニル基、C6−C14アリールフルオレニル基、ジ(C6−C14アリール)フルオレニル基、ピリジル基、C1−C10アルキルピリジル基、ジ(C1−C10アルキル)ピリジル基、ピレニル基、C1−C10アルキルピレニル基、ジ(C1−C10アルキル)ピレニル基、C6−C14アリールピレニル基、ジ(C6−C14アリール)ピレニル基、フェナントロリニル基、C1−C10アルキルフェナントロリニル基、ジ(C1−C10アルキル)フェナントロリニル基、C6−C14アリールフェナントロリニル基、ジ(C6−C14アリール)フェナントロリニル基、キノリニル基、C1−C10アルキルキノリニル基、ジ(C1−C10アルキル)キノリニル基、C6−C14アリールキノリニル基、ジ(C6−C14アリール)キノリニル基、ベンゾオキサゾリル基、C1−C10アルキルベンゾオキサゾリル基、ジ(C1−C10アルキル)ベンゾオキサゾリル基、C6−C14アリールベンゾオキサゾリル基、ジ(C6−C14アリール)ベンゾオキサゾリル基、ベンゾチアゾリル基、C1−C10アルキルベンゾチアゾリル基、ジ(C1−C10アルキル)ベンゾチアゾリル基、C6−C14アリールベンゾチアゾリル基、ジ(C6−C14アリール)ベンゾチアゾリル基、ベンゾイミダゾリル基、C1−C10アルキルベンゾイミダゾリル基、ジ(C1−C10アルキル)ベンゾイミダゾリル基、C6−C14アリールベンゾイミダゾリル基、ジ(C6−C14アリール)ベンゾイミダゾリル基、イミダゾールピリジニル基、C1−C10アルキルイミダゾールピリジニル基、ジ(C1−C10アルキル)イミダゾールピリジニル基、C6−C14アリールイミダゾールピリジニル基、ジ(C6−C14アリール)イミダゾールピリジニル基、イミダゾールピリミジニル基、C1−C10アルキルイミダゾールピリミジニル基、ジ(C1−C10アルキル)イミダゾールピリミジニル基、C6−C14アリールイミダゾールピリミジニル基、ジ(C6−C14アリール)イミダゾールピリミジニル基、カルバゾリル基、C1−C10アルキルカルバゾリル基、ジ(C1−C10アルキル)カルバゾリル基、C6−C14アリールカルバゾリル基、ジ(C6−C14アリール)カルバゾリル基からなる群から選択されることを特徴とする請求項10に記載のヘテロ環化合物。
【請求項16】
前記Ar11,Ar12及びAr13は互いに独立して、下記化学式3Aないし3Pからなる群から選択されることを特徴とする請求項10に記載のヘテロ環化合物:
【化6】

前記化学式で、Z1,Z2,Z3,Z11及びZ12は互いに独立して、水素原子、重水素原子、C1−C10アルキル基、C1−C10アルコキシ基及びC6−C14アリール基からなる群から選択され、pは、1ないし8の整数であり、*は、Ar1,Ar2、A3もしくはAr4または窒素原子との結合サイトである。
【請求項17】
前記a,b,c及びdは互いに独立して、0,1,2または3であることを特徴とする請求項10に記載のヘテロ環化合物。
【請求項18】
前記R1及びR8は互いに独立して、−(Ar1)a−(Ar11)で表示される基及び−(Ar2)b−N[−(Ar3)c−(Ar12)][−(Ar4)d−(Ar13)]で表示される基からなる群から選択され、前記R2,R3,R9及びR10は互いに独立して、メチル基、フェニル基からなる群から選択され、
前記Ar1ないしAr4は互いに独立して、置換または非置換のC5−C20アリーレン基、及び置換または非置換のC4−C20ヘテロアリーレン基からなる群から選択され、
前記Ar11,Ar12及びAr13は互いに独立して、フェニル基、C1−C10アルキルフェニル基、ジ(C1−C10アルキル)フェニル基、C6−C14アリールフェニル基、ジ(C6−C14アリール)フェニル基、ナフチル基、C1−C10アルキルナフチル基、ジ(C1−C10アルキル)ナフチル基、C6−C14アリールナフチル基、ジ(C6−C14アリール)ナフチル基、アントリル基、C1−C10アルキルアントリル基、ジ(C1−C10アルキル)アントリル基、C6−C14アリールアントリル基、ジ(C6−C14アリール)アントリル基、フェナントリル基、C1−C10アルキルフェナントリル基、ジ(C1−C10アルキル)フェナントリル基、C6−C14アリールフェナントリル基、ジ(C6−C14アリール)フェナントリル基、フルオレニル基、C1−C10アルキルフルオレニル基、ジ(C1−C10アルキル)フルオレニル基、C6−C14アリールフルオレニル基、ジ(C6−C14アリール)フルオレニル基、ピリジル基、C1−C10アルキルピリジル基、ジ(C1−C10アルキル)ピリジル基、ピレニル基、C1−C10アルキルピレニル基、ジ(C1−C10アルキル)ピレニル基、C6−C14アリールピレニル基、ジ(C6−C14アリール)ピレニル基、フェナントロリニル基、C1−C10アルキルフェナントロリニル基、ジ(C1−C10アルキル)フェナントロリニル基、C6−C14アリールフェナントロリニル基、ジ(C6−C14アリール)フェナントロリニル基、キノリニル基、C1−C10アルキルキノリニル基、ジ(C1−C10アルキル)キノリニル基、C6−C14アリールキノリニル基、ジ(C6−C14アリール)キノリニル基、ベンゾオキサゾリル基、C1−C10アルキルベンゾオキサゾリル基、ジ(C1−C10アルキル)ベンゾオキサゾリル基、C6−C14アリールベンゾオキサゾリル基、ジ(C6−C14アリール)ベンゾオキサゾリル基、ベンゾチアゾリル基、C1−C10アルキルベンゾチアゾリル基、ジ(C1−C10アルキル)ベンゾチアゾリル基、C6−C14アリールベンゾチアゾリル基、ジ(C6−C14アリール)ベンゾチアゾリル基、ベンゾイミダゾリル基、C1−C10アルキルベンゾイミダゾリル基、ジ(C1−C10アルキル)ベンゾイミダゾリル基、C6−C14アリールベンゾイミダゾリル基、ジ(C6−C14アリール)ベンゾイミダゾリル基、イミダゾールピリジニル基、C1−C10アルキルイミダゾールピリジニル基、ジ(C1−C10アルキル)イミダゾールピリジニル基、C6−C14アリールイミダゾールピリジニル基、ジ(C6−C14アリール)イミダゾールピリジニル基、イミダゾールピリミジニル基、C1−C10アルキルイミダゾールピリミジニル基、ジ(C1−C10アルキル)イミダゾールピリミジニル基、C6−C14アリールイミダゾールピリミジニル基、ジ(C6−C14アリール)イミダゾールピリミジニル基、カルバゾリル基、C1−C10アルキルカルバゾリル基、ジ(C1−C10アルキル)カルバゾリル基、C6−C14アリールカルバゾリル基、ジ(C6−C14アリール)カルバゾリル基からなる群から選択され、
前記a,b,c及びdは互いに独立して、0,1,2または3であることを特徴とする請求項10に記載のヘテロ環化合物。
【請求項19】
第1電極と、前記第1電極に対向した第2電極と、前記第1電極と前記第2電極との間に介在した有機層と、を具備し、前記有機層が請求項1ないし請求項18のうち、いずれか1項に記載のヘテロ環化合物を含む有機発光素子。
【請求項20】
前記有機層が、電子注入層、電子輸送層または発光層であることを特徴とする請求項19に記載の有機発光素子。
【図1】




【公開番号】特開2011−219472(P2011−219472A)
【公開日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願番号】特願2011−67598(P2011−67598)
【出願日】平成23年3月25日(2011.3.25)
【出願人】(308040351)三星モバイルディスプレイ株式會社 (764)
【氏名又は名称原語表記】Samsung Mobile Display Co., Ltd.
【住所又は居所原語表記】San #24 Nongseo−Dong,Giheung−Gu,Yongin−City,Gyeonggi−Do 446−711 Republic of KOREA
【Fターム(参考)】
【公開日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願日】平成23年3月25日(2011.3.25)
【出願人】(308040351)三星モバイルディスプレイ株式會社 (764)
【氏名又は名称原語表記】Samsung Mobile Display Co., Ltd.
【住所又は居所原語表記】San #24 Nongseo−Dong,Giheung−Gu,Yongin−City,Gyeonggi−Do 446−711 Republic of KOREA
【Fターム(参考)】
[ Back to top ]

