ヘリピロンAを有効成分とするアディポネクチン産生促進剤
【課題】循環器系疾患、糖尿病、肥満などの生活習慣病と密接に関連することが知られているサイトカインであるアディポネクチンの産生・分泌促進剤の提供。
【解決手段】下式で示されるヘリピロンAを有効成分とするアディポネクチンの産生・分泌促進剤。該促進剤は、経口剤であることが好ましい。該促進剤は、食後血糖改善剤、糖尿病治療剤として有効である。

【解決手段】下式で示されるヘリピロンAを有効成分とするアディポネクチンの産生・分泌促進剤。該促進剤は、経口剤であることが好ましい。該促進剤は、食後血糖改善剤、糖尿病治療剤として有効である。

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アディポネクチン産生促進剤に関する。
【背景技術】
【0002】
アディポネクチンは、脂肪細胞から特異的に産生および分泌される善玉アディポサイトカインであり、循環器系疾患、糖尿病、肥満などの生活習慣病と密接に関連することが知られている。血中でのアディポネクチンの産生を促進する成分の研究・開発が進められている。
【0003】
アディポネクチンは分子量約30KDaの、脂肪細胞で最も豊富に発現している善玉アディポサイトカインである。補体のC1qと構造上の相同性があり、N末端よりシグナルペプチド、コラーゲン様ドメイン、球状ドメインよりなる。血中では12-18量体の高分子量アディポネクチン、6量体の中分子量アディポネクチン、3量体の低分子量アディポネクチンの3種類の多量体を形成している。
肥満や内臓脂肪蓄積に伴って、アディポネクチンの血中レベルが低下する。アディポネクチンは遺伝子の多型など遺伝的要因によっても低下する。アディポネクチン遺伝子欠損マウスは、インスリン抵抗性、耐糖能異常、脂質異常、高血圧などのメタボリックシンドロームの諸徴候を呈する。アディポネクチンの補充は、インスリン抵抗性やメタボリックシンドロームを改善する。
【0004】
アディポネクチン産生促進に関し、多数の提案が成されている。
特許文献1(特開2009−209080号公報)には、大豆蛋白加水分解物を有効成分とし、特に大豆蛋白加水分解物がジペプチド又は/及びトリペプチドを主成分とするオリゴペプチド混合物であるような組成物が、アディポネクチン分泌促進作用があり、血中アディポネクチン濃度を強く亢進することが開示されている。
特許文献2(特開2009−249341号公報)には、紅麹抽出物およびプロアントシアニジンを有効成分とする、アディポネクチン産生促進剤が開示されている。
特許文献3(特開2008−255040号公報)には、レスベラトロールを有効成分とするアディポネクチン産生促進剤が開示されている。
【0005】
一方、ヘリピロンAは種々の植物に含有されている化合物であり、下記の化学式(I)で表される構造を持つ公知物質である。
【0006】
【化1】

一般式(I)
【0007】
ヘリピロンAの研究は殆どなされていない。本発明者らはこのヘリピロンAについて研究を行い、一重項酸素消去剤、皮膚老化改善剤、しわ改善剤、たるみ改善剤、皮膚水分量改善剤、美白剤、メラニン抑制剤、一酸化窒素消去剤あるいは酸化防止剤などの用途を見出している(特許文献4:WO2007/125832号国際公開公報)。
また化学合成技術が公開されている(非特許文献1:Esahak Ali, et al., Phytochemistry,1982,21,243-244)。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2009−209080号公報
【特許文献2】特開2009−249341号公報
【特許文献3】特開2008−255040号公報
【特許文献4】WO2007/125832号国際公開公報
【非特許文献】
【0009】
【非特許文献1】Esahak Ali, et al., Phytochemistry,1982,21,243-244
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明の目的は、新規なアディポネクチンの産生・分泌促進剤を提案することである。
【課題を解決するための手段】
【0011】
本発明者は、ヘリピロンAの新たな用途を調査研究した結果、アディポネクチンの産生・分泌促進作用を知見したので提案する。
すなわち、本発明の主な構成は、次のとおりである。
(1)ヘリピロンAを有効成分とするアディポネクチン産生促進剤
(2)経口剤である(1)に記載のアディポネクチン産生促進剤
(3)(1)又は(2)に記載のアディポネクチン産生促進剤を有効成分とする食後血糖改善剤
(4)(1)又は(2)に記載のアディポネクチン産生促進剤を有効成分とする糖尿病治療剤。
(5)ヘリピロンAを有効成分とするPPARγ活性化剤。
【発明の効果】
【0012】
本発明の有効成分であるヘリピロンAは、アディポネクチン産生促進作用を有するため、アディポネクチン産生が低下した状態を改善する。これによりアディポネクチンが関与する種々のインスリン抵抗性を改善し、メタボリックシンドロームに基づく種々の病態の治療・予防に役立つことが期待される。特にアディポネクチン産生促進によって食後血糖の上昇を抑制するため、糖尿病などの血糖コントロールを必要とする患者にとって有効な治療剤となる。またヘリピロンAは核内レセプターであるPPARγを活性化させる作用を有しておりPPARγが関わる疾患の治療や改善に有用である。
【図面の簡単な説明】
【0013】
【図1】前駆脂肪細胞の分化の相対割合を示すグラフ。
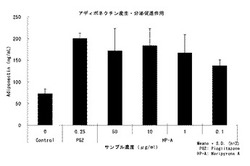
【図2】前駆脂肪細胞のadiponectin産生量を示すグラフ。
【図3】核内因子PPARγに対してヘリピロンAが濃度依存性リガンドすることを示すグラフ。
【図4】in vivo試験でモデル動物の食餌量を示すグラフ。
【図5】in vivo試験でモデル動物の体重変化を示すグラフ。
【図6】糖負荷試験での血中グルコース濃度の変化を示すグラフ。
【図7】糖負荷試験での血中グルコースAUCを示すグラフ。
【図8】in vivo試験の血中アディポネクチン産生促進効果を示すグラフ。
【図9】in vivo試験のモデル動物の尿糖測定結果を示すグラフ。
【発明を実施するための形態】
【0014】
以下、本発明を詳細に説明する。
本発明で用いるヘリピロンAは化学的に合成される。あるいは植物から抽出することができる。合成方法は公知であるが、以下に概要を示す。
[ヘリピロンA(Helipyrone A)の化学合成]
ヘリピロンA(Helipyrone A)の化学合成については、上述したように非特許文献1(Esahak Ali, et al., Phytochemistry,1982,21,243-244)、に開示されている。
例えば、本発明では、次のように合成した。
400mLのヘキサン溶媒を用いて、四塩化チタンの存在下で化合物1 ジエチルケトン(3-pentanone)172gと化合物2 テトラヒドロ−1,4−オキサジン(terahydro-1,4-oxazine (morpholine) )1,000gを4℃で3時間で反応させ、蒸留処理で精製し、化合物3(N−イソプロペニル)−テトラヒドロ−1,4−オキサジン((N-isopropenyl)- terahydro-1,4-oxazine)503.57g(収率81.1%)を得た。
200mLのトルエン溶媒を用いて、化合物3(N−イソプロペニル)−テトラヒドロ−1,4−オキサジン((N-isopropenyl)- terahydro-1,4-oxazine)167gを化合物4 エチルマロニルクロライド(ethyl malonyl chloride)81gとメタノール−氷冷(-17℃〜-11℃)条件で反応させ、一般式2で表される化合物5を合成した。
【0015】
【化2】

一般式(2)
【0016】
化合物3と化合物4との反応は2N塩酸添加で終了させ、クロロホルム抽出後に硫酸マグネシウム乾燥処理を行った。その次に反応溶液にトルエン200mLと25%塩酸400mLを順次加えて液−液分配でトルエン層を回収した。トルエン層を0.1N塩酸400mLで洗浄し、硫酸マグネシウム乾燥処理後にトルエンを真空エバポレーターで除去して橙色油状溶液を得た。 この溶液にPPA(ポリリン酸)1kgを加え、110℃〜118℃で環化して化合物5を合成した。化合物5は室温に冷却し、クロロホルム抽出で回収し、硫酸マグネシウム乾燥処理後に真空エバポレータ−でクロロホルムを除去した。固形物をシリカゲルクロマトグラフィー(クロロホルム:メタノール=50:1(v/v))で橙色固形の化合物5を45.7g得た。本反応の収率は18.3%であった。
【0017】
この化合物5について1N塩酸の存在下でホルムアルデヒドを重合反応することで化合物6 ヘリピロンA(Helipyrone A)を化学合成した。化合物5の45.7gをエタノール460mLに溶解し、濃塩酸2.5mLの存在下でホルムアルデヒド(37%)247.81gを79℃で還流反応させ、結晶が析出した。この結晶をエタノール300mLで洗浄し、白色結晶としてヘリピロンA(Helipyrone A)を34.01g得た。本反応の収率は71.6%であった。
【0018】
得られたヘリピロンA(Helipyrone A)の物性値を以下に示す。
外観:白色結晶
NMRスペクトル(400 MHz, 溶媒;CDCl3)
1H-NMR
δ=a 1.231、b 1.969、c 2.554、d 3.616、e 11.199
13C NMR(400 MHz、溶媒;CDCl3)
δ=I→169.335(t) H→168.499(m), G→160.160(m), F→108.709(m), E→101.592(t), D→24.368(qt), C→19.176(t), B→11.689(qt), A→9.476(q)
【0019】
【化3】

(一般式3)
【化4】

(一般式4)
分子量:320.341g/mol(質量分析)
分子式:C17H20O6 (質量分析)
融点:218−220℃
【0020】
本発明のヘリピロンA(Helipyrone A)を含有するアディポネクチン産生促進剤としては、経口投与、経皮投与、直腸内投与、注射などの投与方法に適した固体又は液体の医薬用無毒性担体と混合して、慣用の医薬製剤の形態で投与することができる。
このような製剤としては、例えば、錠剤、顆粒剤、散剤、カプセル剤などの固形剤、溶液剤、懸濁剤、乳剤などの液剤、凍結乾燥製剤などが挙げられ、これらの製剤は製剤上の常套手段により調製することができる。
上記の医薬用無毒性担体としては、例えば、グルコース、乳糖、ショ糖、澱粉、マンニトール、デキストリン、脂肪酸グリセリド、ポリエチレングルコール、ヒドロキシエチルデンプン、エチレングリコール、ポリオキシエチレンソルビタン脂肪酸エステル、アミノ酸、ゼラチン、アルブミン、水、生理食塩水などが挙げられる。また、必要に応じて、安定化剤、湿潤剤、乳化剤、結合剤、等張化剤などの慣用の添加剤を適宜添加することもできる。
【0021】
ヘリピロンAは血中アディポネクチン量の増加作用をもたらす。従って上記作用を有することにより、アディポネクチンの欠乏や不足に伴う各種疾患、特に肥満や糖尿病の改善剤として使用できる。
【実施例】
【0022】
ヘリピロンAのアディポネクチン産生促進効果試験
アディポネクチン産生促進試験の陽性対照としてピオグリタゾン(以下PGZ、シグマ)を用い以下の試験を行った。
【0023】
[in vitro試験]
前駆脂肪細胞の分化促進作用、およびアディポネクチン産生促進作用
1.試験方法
マウス由来前駆脂肪細胞(3T3-L1、DSファーマバイオメディカル)を10%FBS、1%Penicilin-Streptmycinを含有したDulbecco's変法Eagle培地(DMEM)にて継代・培養した。これを試験細胞とする。
試験は、ラット尾コラーゲンIをコートしたマルチウェルプレート(48ウェル、BD BioCoat、BD Bioscience)に1ウェル当り5×104個の3T3-L1細胞を播種し、コンフルエントになるまで培養した(6〜8日)。その後、1mMデキサメタゾン(シグマ)5.55mLと3-イソブチルメチルキサンチン(シグマ)61.05mg、10mg/mLインスリン(ウシ膵臓由来、シグマ)(氷酢酸を添加してpH調製した酸性水(pH 2.0))555μLを含む誘導培地500mLにて3〜4日間培養して前駆脂肪細胞から未熟脂肪細胞へ分化誘導した。次いで、10mg/mLインスリン555μLとDMSOに溶解させた被験サンプルを含む維持培地にて1週間培養した。1週間の培養の後、成熟脂肪細胞中の脂肪滴の量をOil Red O染色法にて測定した。測定方法は、培養上清に存在する産生・分泌されたアディポネクチンの量をELISAキット(マウス/ラットアディポネクチンELISAキット、大塚製薬)を用いて測定した。
すなわち、未熟脂肪細胞に被験サンプルを添加し、維持培地にて培養したのち、各ウェルを0.1Mリン酸緩衝液(PBS)200μLで2回洗浄した。洗浄後、各ウェルに100μLの10%中性ホルマリンを加えて1時間室温にて放置し、細胞を固定させた。その後ホルマリンを除去し、イソプロパノールで溶解した5.0 g/L Oil Red O染色液(予め半日撹拌し、使用直前に濾紙にて濾過した)を各ウェルに100μL加えて、15分間室温で放置した。その後各ウェルを蒸留水200μLで3回洗浄し、洗浄後各ウェルに150μLのイソプロパノールを加えて15分間室温で放置し、細胞内の脂肪滴の色素を脱色した。15分後、脱色されたイソプロパノールを96ウェルプレート(IWAKI)に移し、490nmの吸光度を測定した。コントロールには、DMSOのみ添加し、前駆脂肪細胞からの分化促進作用の相対的な活性を求めた。
【0024】
アディポネクチン濃度の測定は、1週間の維持培地での培養後、培養上清(500μL)を1.5mLのチューブに移し、-80℃で凍結後、凍結乾燥させた。その後、蒸留水100μLを加えて再溶解させ、ELISAキット(マウス/ラットアディポネクチンELISAキット、大塚製薬)のマニュアルに従い測定した。
【0025】
2.試験結果
前駆脂肪細胞の分化促進作用、およびアディポネクチン産生・分泌促進作用に対する各サンプルの結果を図1、図2に示した。ヘリピロンAは濃度依存性で、前駆脂肪細胞を脂肪細胞へ分化させることが確認できた。また同様にアディポネクチン産生を促進させることが確認できた。
【0026】
Peroxisome proliferator-activated receptor(PPAR)γに対するリガンド活性の測定
核内転写因子であるPPARγは主に脂肪組織に分布して脂肪細胞分化などに関与する他、マクロファージや血管内皮細胞などにも発現が見られる。インスリン抵抗性改善薬の標的分子でもある。このリガンド活性を測定することでアディポネクチンが脂肪組織に有効に作用し、脂肪組織においてインスリン抵抗性が改善し、グルコースが細胞内に取り込まれ、抗糖尿病作用を示すことを確認できる。
【0027】
1.試験方法
被験サンプルのPPARγに対するリガンド活性の測定は被験サンプルをDMSOに溶解して、市販のキット(EnBio RCAS for PPARγ、藤倉化成)のマニュアルに従い測定した。なおこの測定はコアクチベータの関与を確認できる測定方法である。
【0028】
2.試験結果
前駆脂肪細胞のインシュリン抵抗性の指標となるPPARγに対するリガンド活性をヘリピロンAは有していた。図3に示すとおり、ヘリピロンAは濃度依存的に、PPARγに対するリガンド活性を有しており、この核内レセプターを介してアディポネクチンの産生を促進していることが裏付けられた。またこの反応はコアクチベータが関わっていることが確認できた。
【0029】
[in vivo試験]
マウス血中アディポネクチン分泌促進と血糖改善作用
1.試験方法
試験動物には4週齢の雄性のKKAy-TaJclマウス(日本クレア)19匹を用いた。マウス搬入後、7日間は馴化期間とし、食餌はCRF-1(オリエンタル酵母)、給水は水道水の自由摂取とした。5週齢より本飼育を開始した。試験食として、高脂肪高ショ糖食(オリエンタル酵母、F2HFHSD粉末飼料、以下HFとする)、HFにヘリピロンA(以下HP-Aとする)を0.1%となるように添加した。また、HFの対照となる試験飼料はAIN-93G(オリエンタル酵母、以下LFとする)を用いた。
【0030】
試験動物の馴化終了後、上記の各試験食を4週間摂取させた。試験期間中、食餌摂取量、および体重を週2回測定した。4週間の食餌摂取後に約16時間の絶食処置をし、経口グルコース負荷試験(OGTT)を実施した。OGTTでは絶食時に尾切断により採血したのち、D-グルコース(2g/10ml/kg)溶液を強制経口投与して投与開始30分、60分、120分後に尾切断により採血した。血液は6,200g、5分間遠心分離して血漿を得た。得られた血漿を用いて血漿中のグルコース濃度を富士ドライケム3500(富士フィルム)(測定キットは富士ドライケムスライド GLU-PIIIを使用)にて測定した。
OGTT後、各群に1週間各試験群の試験飼料を再摂食させ、1週間後に16時間以上の絶食下にて解剖を実施した。また、解剖までの約16時間に排泄された尿を全量採取した。
解剖は絶食下にて断頭屠殺にて実施し、血液を採取し、6,200g、15分間遠心分離して得られる血漿を採取し、分析まで-80℃で保存した。尿を用いて尿糖のレベルをプレテスト3aII(和光純薬)にて測定した。
【0031】
2.統計解析
in vivo試験における尿糖の分析以外のすべての結果を平均値±標準誤差(Means±SE)で示した。HF群との有意差の検定には、Dunnett法を用いて統計学的な解析を行った。尿糖の分布の分析にはクラスカルウォルス検定を行い、HF群との有意差の検定にはSteel法を用いた。
いずれの検定も統計学的な有意差をp<0.05とした。
【0032】
3.試験結果
<食餌摂取量、および体重推移>
試験期間中の食餌摂取量、および体重推移を図4、図5に示した。
試験期間を通じての総食餌摂取量については、HF群と比較して有意な差は確認されなかった。体重推移については、試験期間を通じてLF群においてHF群と比較して有意に低値であった(試験期間3日目〜35日目)。
【0033】
<グルコース付加試験(耐糖能試験)>
OGTTでの血漿グルコース濃度の推移を図6に示した。糖負荷後の血中グルコース濃度はLF群、HP-AはHF群と比較して低値に推移した。この結果はヘリピロンAが食後血糖を低下させる効果を有することを意味している。
また血中グルコース濃度の曲線下面積(AUC)を図7に示す。HP-A群はHF群に比して低い傾向が認められた。すなわち、食後血中に出現するグルコース総量を引き下げる作用を有することがわかった。
【0034】
<血中アディポネクチン産生量>
血中アディポネクチン産生量を図8に示す。ヘリピロンAを投与したHP-A群は、LF群、HF群の約2倍量のアディポネクチンが血中に産生されることがわかった。ヘリピロンAは強いアディポネクチン産生促進作用を示すことが確認された。
【0035】
<尿糖の測定結果>
高脂肪食摂取することで肥満に伴う血中グルコースが尿糖に漏出すると糖尿病と呼ばれる。図9に示すとおりヘリピロンAは肥満に伴って発生した尿糖を低下させた。
【0036】
以上のin vitro、in vivo試験から、ヘリピロンAは血中のアディポネクチン産生を促進し、さらに食後血中グルコース濃度を低下させ、糖尿病治療に有用であることが明らかとなった。
【技術分野】
【0001】
本発明は、アディポネクチン産生促進剤に関する。
【背景技術】
【0002】
アディポネクチンは、脂肪細胞から特異的に産生および分泌される善玉アディポサイトカインであり、循環器系疾患、糖尿病、肥満などの生活習慣病と密接に関連することが知られている。血中でのアディポネクチンの産生を促進する成分の研究・開発が進められている。
【0003】
アディポネクチンは分子量約30KDaの、脂肪細胞で最も豊富に発現している善玉アディポサイトカインである。補体のC1qと構造上の相同性があり、N末端よりシグナルペプチド、コラーゲン様ドメイン、球状ドメインよりなる。血中では12-18量体の高分子量アディポネクチン、6量体の中分子量アディポネクチン、3量体の低分子量アディポネクチンの3種類の多量体を形成している。
肥満や内臓脂肪蓄積に伴って、アディポネクチンの血中レベルが低下する。アディポネクチンは遺伝子の多型など遺伝的要因によっても低下する。アディポネクチン遺伝子欠損マウスは、インスリン抵抗性、耐糖能異常、脂質異常、高血圧などのメタボリックシンドロームの諸徴候を呈する。アディポネクチンの補充は、インスリン抵抗性やメタボリックシンドロームを改善する。
【0004】
アディポネクチン産生促進に関し、多数の提案が成されている。
特許文献1(特開2009−209080号公報)には、大豆蛋白加水分解物を有効成分とし、特に大豆蛋白加水分解物がジペプチド又は/及びトリペプチドを主成分とするオリゴペプチド混合物であるような組成物が、アディポネクチン分泌促進作用があり、血中アディポネクチン濃度を強く亢進することが開示されている。
特許文献2(特開2009−249341号公報)には、紅麹抽出物およびプロアントシアニジンを有効成分とする、アディポネクチン産生促進剤が開示されている。
特許文献3(特開2008−255040号公報)には、レスベラトロールを有効成分とするアディポネクチン産生促進剤が開示されている。
【0005】
一方、ヘリピロンAは種々の植物に含有されている化合物であり、下記の化学式(I)で表される構造を持つ公知物質である。
【0006】
【化1】

一般式(I)
【0007】
ヘリピロンAの研究は殆どなされていない。本発明者らはこのヘリピロンAについて研究を行い、一重項酸素消去剤、皮膚老化改善剤、しわ改善剤、たるみ改善剤、皮膚水分量改善剤、美白剤、メラニン抑制剤、一酸化窒素消去剤あるいは酸化防止剤などの用途を見出している(特許文献4:WO2007/125832号国際公開公報)。
また化学合成技術が公開されている(非特許文献1:Esahak Ali, et al., Phytochemistry,1982,21,243-244)。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2009−209080号公報
【特許文献2】特開2009−249341号公報
【特許文献3】特開2008−255040号公報
【特許文献4】WO2007/125832号国際公開公報
【非特許文献】
【0009】
【非特許文献1】Esahak Ali, et al., Phytochemistry,1982,21,243-244
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明の目的は、新規なアディポネクチンの産生・分泌促進剤を提案することである。
【課題を解決するための手段】
【0011】
本発明者は、ヘリピロンAの新たな用途を調査研究した結果、アディポネクチンの産生・分泌促進作用を知見したので提案する。
すなわち、本発明の主な構成は、次のとおりである。
(1)ヘリピロンAを有効成分とするアディポネクチン産生促進剤
(2)経口剤である(1)に記載のアディポネクチン産生促進剤
(3)(1)又は(2)に記載のアディポネクチン産生促進剤を有効成分とする食後血糖改善剤
(4)(1)又は(2)に記載のアディポネクチン産生促進剤を有効成分とする糖尿病治療剤。
(5)ヘリピロンAを有効成分とするPPARγ活性化剤。
【発明の効果】
【0012】
本発明の有効成分であるヘリピロンAは、アディポネクチン産生促進作用を有するため、アディポネクチン産生が低下した状態を改善する。これによりアディポネクチンが関与する種々のインスリン抵抗性を改善し、メタボリックシンドロームに基づく種々の病態の治療・予防に役立つことが期待される。特にアディポネクチン産生促進によって食後血糖の上昇を抑制するため、糖尿病などの血糖コントロールを必要とする患者にとって有効な治療剤となる。またヘリピロンAは核内レセプターであるPPARγを活性化させる作用を有しておりPPARγが関わる疾患の治療や改善に有用である。
【図面の簡単な説明】
【0013】
【図1】前駆脂肪細胞の分化の相対割合を示すグラフ。
【図2】前駆脂肪細胞のadiponectin産生量を示すグラフ。
【図3】核内因子PPARγに対してヘリピロンAが濃度依存性リガンドすることを示すグラフ。
【図4】in vivo試験でモデル動物の食餌量を示すグラフ。
【図5】in vivo試験でモデル動物の体重変化を示すグラフ。
【図6】糖負荷試験での血中グルコース濃度の変化を示すグラフ。
【図7】糖負荷試験での血中グルコースAUCを示すグラフ。
【図8】in vivo試験の血中アディポネクチン産生促進効果を示すグラフ。
【図9】in vivo試験のモデル動物の尿糖測定結果を示すグラフ。
【発明を実施するための形態】
【0014】
以下、本発明を詳細に説明する。
本発明で用いるヘリピロンAは化学的に合成される。あるいは植物から抽出することができる。合成方法は公知であるが、以下に概要を示す。
[ヘリピロンA(Helipyrone A)の化学合成]
ヘリピロンA(Helipyrone A)の化学合成については、上述したように非特許文献1(Esahak Ali, et al., Phytochemistry,1982,21,243-244)、に開示されている。
例えば、本発明では、次のように合成した。
400mLのヘキサン溶媒を用いて、四塩化チタンの存在下で化合物1 ジエチルケトン(3-pentanone)172gと化合物2 テトラヒドロ−1,4−オキサジン(terahydro-1,4-oxazine (morpholine) )1,000gを4℃で3時間で反応させ、蒸留処理で精製し、化合物3(N−イソプロペニル)−テトラヒドロ−1,4−オキサジン((N-isopropenyl)- terahydro-1,4-oxazine)503.57g(収率81.1%)を得た。
200mLのトルエン溶媒を用いて、化合物3(N−イソプロペニル)−テトラヒドロ−1,4−オキサジン((N-isopropenyl)- terahydro-1,4-oxazine)167gを化合物4 エチルマロニルクロライド(ethyl malonyl chloride)81gとメタノール−氷冷(-17℃〜-11℃)条件で反応させ、一般式2で表される化合物5を合成した。
【0015】
【化2】

一般式(2)
【0016】
化合物3と化合物4との反応は2N塩酸添加で終了させ、クロロホルム抽出後に硫酸マグネシウム乾燥処理を行った。その次に反応溶液にトルエン200mLと25%塩酸400mLを順次加えて液−液分配でトルエン層を回収した。トルエン層を0.1N塩酸400mLで洗浄し、硫酸マグネシウム乾燥処理後にトルエンを真空エバポレーターで除去して橙色油状溶液を得た。 この溶液にPPA(ポリリン酸)1kgを加え、110℃〜118℃で環化して化合物5を合成した。化合物5は室温に冷却し、クロロホルム抽出で回収し、硫酸マグネシウム乾燥処理後に真空エバポレータ−でクロロホルムを除去した。固形物をシリカゲルクロマトグラフィー(クロロホルム:メタノール=50:1(v/v))で橙色固形の化合物5を45.7g得た。本反応の収率は18.3%であった。
【0017】
この化合物5について1N塩酸の存在下でホルムアルデヒドを重合反応することで化合物6 ヘリピロンA(Helipyrone A)を化学合成した。化合物5の45.7gをエタノール460mLに溶解し、濃塩酸2.5mLの存在下でホルムアルデヒド(37%)247.81gを79℃で還流反応させ、結晶が析出した。この結晶をエタノール300mLで洗浄し、白色結晶としてヘリピロンA(Helipyrone A)を34.01g得た。本反応の収率は71.6%であった。
【0018】
得られたヘリピロンA(Helipyrone A)の物性値を以下に示す。
外観:白色結晶
NMRスペクトル(400 MHz, 溶媒;CDCl3)
1H-NMR
δ=a 1.231、b 1.969、c 2.554、d 3.616、e 11.199
13C NMR(400 MHz、溶媒;CDCl3)
δ=I→169.335(t) H→168.499(m), G→160.160(m), F→108.709(m), E→101.592(t), D→24.368(qt), C→19.176(t), B→11.689(qt), A→9.476(q)
【0019】
【化3】

(一般式3)
【化4】

(一般式4)
分子量:320.341g/mol(質量分析)
分子式:C17H20O6 (質量分析)
融点:218−220℃
【0020】
本発明のヘリピロンA(Helipyrone A)を含有するアディポネクチン産生促進剤としては、経口投与、経皮投与、直腸内投与、注射などの投与方法に適した固体又は液体の医薬用無毒性担体と混合して、慣用の医薬製剤の形態で投与することができる。
このような製剤としては、例えば、錠剤、顆粒剤、散剤、カプセル剤などの固形剤、溶液剤、懸濁剤、乳剤などの液剤、凍結乾燥製剤などが挙げられ、これらの製剤は製剤上の常套手段により調製することができる。
上記の医薬用無毒性担体としては、例えば、グルコース、乳糖、ショ糖、澱粉、マンニトール、デキストリン、脂肪酸グリセリド、ポリエチレングルコール、ヒドロキシエチルデンプン、エチレングリコール、ポリオキシエチレンソルビタン脂肪酸エステル、アミノ酸、ゼラチン、アルブミン、水、生理食塩水などが挙げられる。また、必要に応じて、安定化剤、湿潤剤、乳化剤、結合剤、等張化剤などの慣用の添加剤を適宜添加することもできる。
【0021】
ヘリピロンAは血中アディポネクチン量の増加作用をもたらす。従って上記作用を有することにより、アディポネクチンの欠乏や不足に伴う各種疾患、特に肥満や糖尿病の改善剤として使用できる。
【実施例】
【0022】
ヘリピロンAのアディポネクチン産生促進効果試験
アディポネクチン産生促進試験の陽性対照としてピオグリタゾン(以下PGZ、シグマ)を用い以下の試験を行った。
【0023】
[in vitro試験]
前駆脂肪細胞の分化促進作用、およびアディポネクチン産生促進作用
1.試験方法
マウス由来前駆脂肪細胞(3T3-L1、DSファーマバイオメディカル)を10%FBS、1%Penicilin-Streptmycinを含有したDulbecco's変法Eagle培地(DMEM)にて継代・培養した。これを試験細胞とする。
試験は、ラット尾コラーゲンIをコートしたマルチウェルプレート(48ウェル、BD BioCoat、BD Bioscience)に1ウェル当り5×104個の3T3-L1細胞を播種し、コンフルエントになるまで培養した(6〜8日)。その後、1mMデキサメタゾン(シグマ)5.55mLと3-イソブチルメチルキサンチン(シグマ)61.05mg、10mg/mLインスリン(ウシ膵臓由来、シグマ)(氷酢酸を添加してpH調製した酸性水(pH 2.0))555μLを含む誘導培地500mLにて3〜4日間培養して前駆脂肪細胞から未熟脂肪細胞へ分化誘導した。次いで、10mg/mLインスリン555μLとDMSOに溶解させた被験サンプルを含む維持培地にて1週間培養した。1週間の培養の後、成熟脂肪細胞中の脂肪滴の量をOil Red O染色法にて測定した。測定方法は、培養上清に存在する産生・分泌されたアディポネクチンの量をELISAキット(マウス/ラットアディポネクチンELISAキット、大塚製薬)を用いて測定した。
すなわち、未熟脂肪細胞に被験サンプルを添加し、維持培地にて培養したのち、各ウェルを0.1Mリン酸緩衝液(PBS)200μLで2回洗浄した。洗浄後、各ウェルに100μLの10%中性ホルマリンを加えて1時間室温にて放置し、細胞を固定させた。その後ホルマリンを除去し、イソプロパノールで溶解した5.0 g/L Oil Red O染色液(予め半日撹拌し、使用直前に濾紙にて濾過した)を各ウェルに100μL加えて、15分間室温で放置した。その後各ウェルを蒸留水200μLで3回洗浄し、洗浄後各ウェルに150μLのイソプロパノールを加えて15分間室温で放置し、細胞内の脂肪滴の色素を脱色した。15分後、脱色されたイソプロパノールを96ウェルプレート(IWAKI)に移し、490nmの吸光度を測定した。コントロールには、DMSOのみ添加し、前駆脂肪細胞からの分化促進作用の相対的な活性を求めた。
【0024】
アディポネクチン濃度の測定は、1週間の維持培地での培養後、培養上清(500μL)を1.5mLのチューブに移し、-80℃で凍結後、凍結乾燥させた。その後、蒸留水100μLを加えて再溶解させ、ELISAキット(マウス/ラットアディポネクチンELISAキット、大塚製薬)のマニュアルに従い測定した。
【0025】
2.試験結果
前駆脂肪細胞の分化促進作用、およびアディポネクチン産生・分泌促進作用に対する各サンプルの結果を図1、図2に示した。ヘリピロンAは濃度依存性で、前駆脂肪細胞を脂肪細胞へ分化させることが確認できた。また同様にアディポネクチン産生を促進させることが確認できた。
【0026】
Peroxisome proliferator-activated receptor(PPAR)γに対するリガンド活性の測定
核内転写因子であるPPARγは主に脂肪組織に分布して脂肪細胞分化などに関与する他、マクロファージや血管内皮細胞などにも発現が見られる。インスリン抵抗性改善薬の標的分子でもある。このリガンド活性を測定することでアディポネクチンが脂肪組織に有効に作用し、脂肪組織においてインスリン抵抗性が改善し、グルコースが細胞内に取り込まれ、抗糖尿病作用を示すことを確認できる。
【0027】
1.試験方法
被験サンプルのPPARγに対するリガンド活性の測定は被験サンプルをDMSOに溶解して、市販のキット(EnBio RCAS for PPARγ、藤倉化成)のマニュアルに従い測定した。なおこの測定はコアクチベータの関与を確認できる測定方法である。
【0028】
2.試験結果
前駆脂肪細胞のインシュリン抵抗性の指標となるPPARγに対するリガンド活性をヘリピロンAは有していた。図3に示すとおり、ヘリピロンAは濃度依存的に、PPARγに対するリガンド活性を有しており、この核内レセプターを介してアディポネクチンの産生を促進していることが裏付けられた。またこの反応はコアクチベータが関わっていることが確認できた。
【0029】
[in vivo試験]
マウス血中アディポネクチン分泌促進と血糖改善作用
1.試験方法
試験動物には4週齢の雄性のKKAy-TaJclマウス(日本クレア)19匹を用いた。マウス搬入後、7日間は馴化期間とし、食餌はCRF-1(オリエンタル酵母)、給水は水道水の自由摂取とした。5週齢より本飼育を開始した。試験食として、高脂肪高ショ糖食(オリエンタル酵母、F2HFHSD粉末飼料、以下HFとする)、HFにヘリピロンA(以下HP-Aとする)を0.1%となるように添加した。また、HFの対照となる試験飼料はAIN-93G(オリエンタル酵母、以下LFとする)を用いた。
【0030】
試験動物の馴化終了後、上記の各試験食を4週間摂取させた。試験期間中、食餌摂取量、および体重を週2回測定した。4週間の食餌摂取後に約16時間の絶食処置をし、経口グルコース負荷試験(OGTT)を実施した。OGTTでは絶食時に尾切断により採血したのち、D-グルコース(2g/10ml/kg)溶液を強制経口投与して投与開始30分、60分、120分後に尾切断により採血した。血液は6,200g、5分間遠心分離して血漿を得た。得られた血漿を用いて血漿中のグルコース濃度を富士ドライケム3500(富士フィルム)(測定キットは富士ドライケムスライド GLU-PIIIを使用)にて測定した。
OGTT後、各群に1週間各試験群の試験飼料を再摂食させ、1週間後に16時間以上の絶食下にて解剖を実施した。また、解剖までの約16時間に排泄された尿を全量採取した。
解剖は絶食下にて断頭屠殺にて実施し、血液を採取し、6,200g、15分間遠心分離して得られる血漿を採取し、分析まで-80℃で保存した。尿を用いて尿糖のレベルをプレテスト3aII(和光純薬)にて測定した。
【0031】
2.統計解析
in vivo試験における尿糖の分析以外のすべての結果を平均値±標準誤差(Means±SE)で示した。HF群との有意差の検定には、Dunnett法を用いて統計学的な解析を行った。尿糖の分布の分析にはクラスカルウォルス検定を行い、HF群との有意差の検定にはSteel法を用いた。
いずれの検定も統計学的な有意差をp<0.05とした。
【0032】
3.試験結果
<食餌摂取量、および体重推移>
試験期間中の食餌摂取量、および体重推移を図4、図5に示した。
試験期間を通じての総食餌摂取量については、HF群と比較して有意な差は確認されなかった。体重推移については、試験期間を通じてLF群においてHF群と比較して有意に低値であった(試験期間3日目〜35日目)。
【0033】
<グルコース付加試験(耐糖能試験)>
OGTTでの血漿グルコース濃度の推移を図6に示した。糖負荷後の血中グルコース濃度はLF群、HP-AはHF群と比較して低値に推移した。この結果はヘリピロンAが食後血糖を低下させる効果を有することを意味している。
また血中グルコース濃度の曲線下面積(AUC)を図7に示す。HP-A群はHF群に比して低い傾向が認められた。すなわち、食後血中に出現するグルコース総量を引き下げる作用を有することがわかった。
【0034】
<血中アディポネクチン産生量>
血中アディポネクチン産生量を図8に示す。ヘリピロンAを投与したHP-A群は、LF群、HF群の約2倍量のアディポネクチンが血中に産生されることがわかった。ヘリピロンAは強いアディポネクチン産生促進作用を示すことが確認された。
【0035】
<尿糖の測定結果>
高脂肪食摂取することで肥満に伴う血中グルコースが尿糖に漏出すると糖尿病と呼ばれる。図9に示すとおりヘリピロンAは肥満に伴って発生した尿糖を低下させた。
【0036】
以上のin vitro、in vivo試験から、ヘリピロンAは血中のアディポネクチン産生を促進し、さらに食後血中グルコース濃度を低下させ、糖尿病治療に有用であることが明らかとなった。
【特許請求の範囲】
【請求項1】
ヘリピロンAを有効成分とするアディポネクチン産生促進剤。
【請求項2】
経口剤である請求項1記載のアディポネクチン産生促進剤。
【請求項3】
請求項1又は請求項2に記載のアディポネクチン産生促進剤を有効成分とする食後血糖改善剤。
【請求項4】
請求項1又は2に記載のアディポネクチン産生促進剤を有効成分とする糖尿病治療剤。
【請求項5】
ヘリピロンAを有効成分とするPPARγ活性化剤。
【請求項1】
ヘリピロンAを有効成分とするアディポネクチン産生促進剤。
【請求項2】
経口剤である請求項1記載のアディポネクチン産生促進剤。
【請求項3】
請求項1又は請求項2に記載のアディポネクチン産生促進剤を有効成分とする食後血糖改善剤。
【請求項4】
請求項1又は2に記載のアディポネクチン産生促進剤を有効成分とする糖尿病治療剤。
【請求項5】
ヘリピロンAを有効成分とするPPARγ活性化剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2013−60383(P2013−60383A)
【公開日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願番号】特願2011−199078(P2011−199078)
【出願日】平成23年9月13日(2011.9.13)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
【公開日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願日】平成23年9月13日(2011.9.13)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
[ Back to top ]

