ベニクスノキタケ子実体の抽出物およびその用途、antrocamphinAの用途、および炎症誘発性分子生成の抑制方法
【課題】ベニクスノキタケ子実体の派生物による抗炎症用途を提供する。
【解決手段】エタノール抽出物、無水プロピオン酸抽出物とAntrocamphin Aを含む該子実体派生物を特徴とするものであり、該エタノール抽出物、無水プロピオン酸抽出物とAntrocamphin Aは、一酸化窒素合成酵素またはシクロオキシゲナーゼ2の生成を低減させて、炎症誘発性分子の生成を抑制する効果がある。
【解決手段】エタノール抽出物、無水プロピオン酸抽出物とAntrocamphin Aを含む該子実体派生物を特徴とするものであり、該エタノール抽出物、無水プロピオン酸抽出物とAntrocamphin Aは、一酸化窒素合成酵素またはシクロオキシゲナーゼ2の生成を低減させて、炎症誘発性分子の生成を抑制する効果がある。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ベニクスノキタケ子実体の派生物に関わり、特にベニクスノキタケ子実体の派生物による抗炎症用途(The anti−inflammatory usage of Antrodia cinnamomea fruit body derivatives)に関する。
【背景技術】
【0002】
炎症反応は多くの病理学的状態で、主要特徴の一つになるが、細菌感染を例として、細菌表面にあるリポ多糖(lipopolysaccharide,LPS,別称:内毒素)は、宿主体内のマクロファージを活性化させるが、正常の状態で、当該活性化過程において、宿主の免疫システム全体を活性化して、病原菌を消滅する目的が達成される。しかし、一部の異常な生理的反応(疾患の発生で生じられた、または疾患発生の主因になるもの)で、活性化されたマクロファージは、過量の一酸化窒素(NO)の生成を引き起こし、宿主細胞の死亡を加速化することになるため、多くの病理学的状態で、炎症反応への制御は疾患治療の重要な一環であろう。
【0003】
炎症的刺激として知られる腫瘍壊死因子−α(TNF−α)、一酸化窒素(NO)と前立腺素E2(prostaglandin−E2, PGE2は、アラキドン酸がシクロオキシゲナーゼ(COX)ルートの代謝)で生成されたもので、それは免疫反応の重要な部分であり、例えば、敗血症または敗血症ショック(septic and hemorrhagic shock)、関節リウマチ(rheumatoid arthritis)や粥状動脈硬化(arthrosclerosis)の発症は、上述の媒介物が大量に検出された。従って、新薬の開発は、一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の遺伝子を抑制し、リポ多糖(LPS)が誘導する情報伝達の主なレセプターまたは酵素活性を阻害して、一酸化窒素(NO)と前立腺素E2の生成を低減させることに重点が置かれている。
【0004】
ベニクスノキタケ(Antrodia cinnamomea)は真菌の一種で、非常に珍貴な漢方生薬として見られており、多くの科学的研究結果により、ベニクスノキタケ菌糸体からのメチルアルコール抽出物と熱水抽出物、その子実体のメチルアルコール抽出物、エタノール抽出物と無水プロピオン酸抽出物は、優れた抗ガン活性があることが分かった。そして、一部の研究によると、ベニクスノキタケの菌糸体と子実体は、幾らかのトリテルぺノイド化合物が含まれている、抗炎症の潜在力を持つ化合物であると指摘された。しかし、ベニクスノキタケ及びその含まれたトリテルぺノイド化合物が、炎症反応を制御する作用メカリズムと生理的活性を更に解明する必要がある。
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、ベニクスノキタケ子実体の派生物及びその用途を提供することを目的とし、それにより、炎症誘発性分子の生成を抑制し、優れた抗炎症機能がある。
【課題を解決するための手段】
【0006】
上述の目的を達成させるために、本発明は、乾燥ベニクスノキタケの子実体が提供され、該乾燥ベニクスノキタケの子実体を一定の温度で、エタノールで抽出するという手順で得られたことを特徴とするベニクスノキタケの子実体の抽出物を提供する。
【0007】
本発明は、また、乾燥ベニクスノキタケの子実体が提供されており、該乾燥ベニクスノキタケの子実体を一定の温度でエタノールを抽出して、エタノール抽出物が得られるが、該エタノール抽出物を濃縮して、濃縮産物が得られ、該濃縮産物を無水プロピオン酸と水でパーティション(partition)するという手順で得られた該無水プロピオン酸抽出物というベニクスノキタケ子実体の抽出物を提供することを特徴とする。
【0008】
該乾燥の方法は、冷凍乾燥で行われていることを特徴とする。
該温度は、42〜45℃で行われていることを特徴とする。
該エタノールは、体積百分率95%のエタノールで行われていることを特徴とする。
【0009】
該濃縮の方法は、真空濃縮で行われていることを特徴とする。
該無水プロピオン酸は、体積百分率50%の無水プロピオン酸で行われていることを特徴とする。
【0010】
本発明は更に、炎症誘発性分子の生成を抑制することを特徴とする該抽出物の用途を提供する。
該抽出物は、一酸化窒素(NO)または前立腺素E2(PGE2)という該炎症誘発性分子を抑制することを特徴とする。
該抽出物は、一酸化窒素合成酵素とシクロオキシゲナーゼ2を減少させて、それぞれ該一酸化窒素(NO)と該前立腺素E2(PGE2)の生成を抑制することを特徴とする。
【0011】
本発明は、また更に、一酸化窒素(NO)の生成を抑制することを特徴とするantrocamphin Aの用途を提供する。
該antrocamphin Aは、一酸化窒素合成酵素を減少させて、該一酸化窒素(NO)の生成を抑制することを特徴とする。
本発明は、そのうえ、前立腺素E2(PGE2)の生成を抑制することを特徴とするantrocamphin Aの用途を提供する。
該antrocamphin Aは、シクロオキシゲナーゼ2を減少させて、該前立腺素E2(PGE2)の生成を抑制することを特徴とする。
【0012】
本発明は、また、被験者を請求項17に記載のいずれかの一つの抽出物またはantrocamphin Aと接触させることを含むことを特徴とする炎症誘発性分子生成の抑制方法を提供する。
該炎症誘発性分子は、一酸化窒素(NO)または前立腺素E2(PGE2)であることを特徴とする。
【0013】
上述の内容をまとめると、本発明において、ベニクスノキタケ子実体の派生物による抗炎症の効果は、本発明に掲示したベニクスノキタケ子実体の派生物による抗炎症の生理的活性及び作用メカリズムが更に明確になった。
【図面の簡単な説明】
【0014】
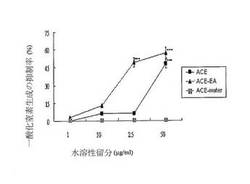
【図1】本発明のエタノール抽出物、無水プロピオン酸抽出物と水溶性留分が有する、一酸化窒素生成の抑制率を示すグラフ。
【図2A】本発明のエタノール抽出物が影響した一酸化窒素合成酵素(iNOS)の生成量を示すグラフ。
【図2B】本発明のエタノール抽出物が影響したシクロオキシゲナーゼ2(COX−2)の生成量を示すグラフ。
【図3】本発明の無水プロピオン酸抽出物の17留分が有する、一酸化窒素生成の抑制率を示すグラフ。
【図4A】antrocamphin Aが影響した一酸化窒素合成酵素(iNOS)の伝令リボ核酸(mRNA)の生成量を示すグラフ。
【図4B】antrocamphin Aが影響したシクロオキシゲナーゼ2(COX−2)の伝令リボ核酸(mRNA)の生成量を示すグラフ。
【図5A】antrocamphin Aが影響した一酸化窒素合成酵素(iNOS)の生成量を示すグラフ。
【図5B】antrocamphin Aが影響したシクロオキシゲナーゼ2(COX−2)の生成量を示すグラフ。
【発明を実施するための形態】
【0015】
本発明は、ベニクスノキタケ子実体の派生物及びその用途に関わり、それにより、炎症誘発性分子の生成を抑制して、優れた抗炎症機能がある。該“派生物”とは、ベニクスノキタケ子実体の抽出物及びその成分化合物のことを意味し、もっとはっきりと言えば、本発明でいう“派生物”は、ベニクスノキタケ子実体のエタノール抽出物、無水プロピオン酸抽出物またはantrocamphin Aのことをいう。
【0016】
リポ多糖(lipopolysaccharide,LPS)は、脂質と多糖を共同結合して構成され、グラム陰性菌の細胞表面の主要分子で、内毒素とも言われる。リポ多糖は宿主の体内で激しい炎症反応を引き起こすが、この激しい炎症反応は通常、マクロファージで活性化された免疫反応であり、それゆえ、本発明は、リポ多糖で誘発したマウス体内またはマクロファージ株による炎症反応を実験することを、本発明におけるベニクスノキタケ子実体が抗炎症反応に関わる役割を検討するモデルとする。
【0017】
以下に掲示した実施例は、本発明を詳しく説明するために挙げられた例であり、それらを以って、本発明の特許請求の範囲を制限してはならない。
【実施例1】
【0018】
実験設計
[材料]
本発明に使用するベニクスノキタケの子実体は、台湾高雄六亀で採集した野生株であり、牛胎児血清(FBS)はGibco BRL(Invitrogen, Grand Island, NY)から購入、ジメチルスルホキシド(DMSO), ペニシリン(penicillin)、リポ多糖(lipopolysaccharide, Escherichia coli 0127:138/LPS)MTT(3−(4,5−dimethylthiazol−2−yl)−2,5−diphenyltetrazolium bromide)とグリース試薬(Griess reagent)は、いずれもSigma−Aldrich(St Louis,MO)から購入した。本発明に使用するあらゆる化学薬品及び溶剤はいずれも試薬またはHPLCクラスである。
【0019】
[実験マウス]
実験マウスは、BioLasco(台北、台湾)から購入した生後四週間のオスICR系マウス(約25〜28g)で、実験前、実験マウスを環境に慣らさせるために、温度25±2℃、相対湿度55±5%、明暗周期は12時間(より明確に言えば、毎日午前六時から午後六時を明期とする)、自由に摂食と飲水を行わせる条件下で、少なくとも一週間飼育しておいた。すべての動物実験処理は、実験動物飼育管理(Guide for the Care and Use of Laboratory Animals)、使用ガイド及び台湾の動物保護法に関する規定に従い、また現地の道徳委員から承認を得てから行われた。
【0020】
[細胞培養]
本発明は、マウスマクロファージ株RAW 267.4で、一酸化窒素と前立腺素E2(PGE2)の生成量を検討した。RAW267.4細胞の培養では、まず、培養培地に培養されていた(75cm2)RAW 267.4細胞を接種密度2×105cells/wellで、96孔培養プレートに接種し、それを培養箱(37℃,5%CO2)に入れて培養し、培養液はATCC(American TypeCulture Collection)の意見を受けて、培養液DMEMを使用し、それに牛胎児血清(fetal bovine serum,FBS)10%を加えて、ペニシリン(penicillin,100units/ml)とストレプトマイシン(streptomycin,100g/ml)を培養する。
【0021】
[ウェスタンブロット法分析]
細胞の全蛋白質(total protein)を得てから、それと同様な量の蛋白質を5〜7%勾配電気泳動ゲル孔内(SDS−PAGE)に加えて、300mAで90分間分離(resolve)し、大きさにより分離した蛋白質ブロッティング(100V,1時間)をフッ化ポリビニリデン膜(polyvinylidene difluoride,PVDF,Immobilon, Millipore,Bedford,MA)に転写したあと、フッ化ポリビニリデン膜を、ブロッキング緩衝液で(blocking buffer, 10%w/v脱脂乳粉末をTBST 緩衝液の中に入れて)1時間作用する。
【0022】
それから、フッ化ポリビニリデン膜を抗一酸化窒素合成酵素の抗体溶液(anti−iNOS,1:1000,Cayman Chemicals)または抗シクロオキシゲナーゼ2の抗体溶液(anti−COX−2,1:1000,Cayman Chemicals)に浸かり、それから、TBST 緩衝液0.1%(Tween20 0.1%含有のTBS緩衝液)で二回洗浄して、非特異的(non−specific)結合の抗体抗原を洗い落とす。
その後、フッ化ポリビニリデン膜を西洋わさびペルオキシダーゼ(horseradish peroxidase)の抗ウサギ二級抗体溶液(anti−rabbit secondary antibodies)に浸かったあと、化学発光試薬(enhanced chemiluminescene regents,ECL,Pierce)を加えて、各組の蛍光強度を検出し、そしてβ−アクチン(β−actin)の生成量を蛋白の制御対照にする。
【0023】
[逆転写ポリメラーゼ連鎖反応]
Trizol試薬(Invitrogen Life Technologies,Carlsbad,CA,USA)で、抽取細胞の全リボ核酸(total RNA)を抽出し、逆転写ポリメラーゼ連鎖反応でiNOS,COX−2和G3PDHの伝令リボ核酸(mRNA)をcDNAに逆転写し、それから、定量的リアルタイムポリメラーゼ連鎖反応(real time−PCR,Applied Biosystems)で、iNOS、COX−2とG3PDHの生成漁を測定する。
【0024】
該定量的リアルタイムポリメラーゼ連鎖反応は、DNA結合蛍光剤グリーン核酸ゲル染色液(SYBR Green)でPCR産物を検出するが、温度サイクル(thermal cycle)は、95℃で5分間を1サイクルの後、95℃で1分間、55℃で45秒、及び72℃で30秒を40サイクルにするが、プライマー配列は Inos順向き5’−TCC TAC ACC ACA CCA AAC−3’;iNOS逆向き5’−CTC CAA TCT CTG CCT ATC C−3’;COX−2順向き5’−CCT CTG CGA TGC TCT TCC−3’;COX−2逆向き5’−TCA CAC TTA TAC TGG TCA AAT CC−3’;G3PDH順向き5’−TCA ACG GCA CAG TCA AGG−3’;G3PDH逆向き5’−ACT CCA CGA CAT ACT CAG C−3’であり、G3PDHはハウスキーピング遺伝子(housekeeping gene)で、細胞内に安定し大量な遺伝子があり、実験中でiNOSとCOX−2の量を標準化する。
【実施例2】
【0025】
本発明のベニクスノキタケ子実体のエタノール抽出物と無水プロピオン酸抽出の製造
まず、ベニクスノキタケの子実体を冷凍乾燥法で乾燥し、それから、42〜45℃下で、冷凍乾燥したベニクスノキタケの子実体580gをエタノール95%で抽出して、本発明のエタノール抽出物(ACE)を得る。この乾燥法は、制限することがなく、所属分野で知られている何れかの乾燥法で行ってもよい。
【0026】
それから、該エタノール抽出物を真空(rotary evaporator)で濃縮して、濃縮産物183.9gを得た。得られた濃縮産物を無水プロピオン酸と水で無水プロピオン酸層と水溶性層に分離し(partition)し、該水溶性層は水溶性留分(ACE−water)と表示され、該無水プロピオン酸層はすなわち、本発明の無水プロピオン酸抽出物(ACE−EA)である。
【実施例3】
【0027】
実施例2のエタノール抽出物(ACE)、無水プロピオン酸抽出物(ACE−EA)と水溶性留分(ACE−water)による一酸化窒素の活性抑制試験: マクロファージ株RAW 267.4
本実施例では、マクロファージ株RAW 267.4により、実施例二で得られたベニクスノキタケの子実体エタノール抽出物(ACE)、無水プロピオン酸抽出物(ACE−EA)と水溶性留分(ACE−water)による一酸化窒素の活性抑制試験を行う。
【0028】
まず、RAW 267.4細胞は、実施例1に述べた細胞培養法で培養したあと、実験組一(エタノール抽出物、ACE)、実験組二(無水プロピオン酸抽出物、ACE−EA)と実験組三(水溶性留分、ACE−water)の三組に分ける。各組の細胞を濃度(1,10,25,50g/ml)により、該エタノール抽出物、該無水プロピオン酸抽出物と該水溶性留分をそれぞれ培養液に入れ、それから、リポ多糖(LPS)を培養液に加えて、RAW 267.4細胞に一酸化窒素の生成を誘導させるが、24時間後、グリース反応法(Griess reaction)で亜硝酸塩の含有量を測定し、一酸化窒素の生成量を間接的に測定するが、その実験設計は次の表1に示す。
【0029】
【表1】

“+” は添加あり、“−” は無添加を表す。
図に示すのは、グリース反応法で測定した一酸化窒素の生成量、及び一酸化窒素生成の抑制率の統計結果を表す。図を見て分かるように、実施例2から得たベニクスノキタケエタノール抽出物と無水プロピオン酸抽出物はいずれも、一酸化窒素への活性抑制効果があり、特に濃度50g/mlのときその効果がより顕著になる。
【実施例4】
【0030】
実施例2のエタノール抽出物(ACE)による一酸化窒素の活性抑制試験: マウス生体実験
本実施例はマウス生体で、実施例二で得られたエタノール抽出物(ACE)による一酸化窒素の活性抑制試験を行う。マウスは実施例1に述べた条件下での実験マウスを使用する。
【0031】
[実験設計]
まず、六匹のマウスを一組にし、計六組あり、下表2の配置により、リポ多糖(5g/kg)の注射前、各組マウスにそれぞれ腹腔内注射法(intraperitoneal injection)で、濃度の異なった実施例2で得たベニクスノキタケエタノール抽出物(ACE,100,300,500mg/kg)、クルクミン(curcumin)を注射し、または注射しないが、その中、制御組にはジメチルスルホキシド(DMSO)だけを注射し、また、抗炎症薬剤として知られるクルクミン(curcumin)は、本実施例における陽性対照組に使用される。マウスにリポ多糖を注射したあと、更にエーテルで麻酔し、12時間後、断頭法(decapitation)で犠死させた。
【0032】
【表2】

“+” は添加あり、“−” は無添加を表す。
制御組にリポ多糖を投与せず、その代わりにジメチルスルホキシド(DMSO)を投与した。
【0033】
[実験結果]
眼窩採血法または心臓採血法で採血したあと、その血液をエチレンジアミン四酢酸(EDTA)含有の試験管に注ぎ、温度4℃で、500gで10分間の遠心により血清を集め、それから、グリース反応法で血清中の一酸化窒素濃度を測定するが、その結果は次の表3に示す。
【0034】
【表3】

表3の結果により、実施例2のエタノール抽出物は、生体実験にも、一酸化窒素の生成量への抑制は効果が顕著であり、それがクルクミンの效果に類似している。
そして、犠死させた実験マウスの肝臓を摘出し、よく知られている実験方法で全蛋白質を抽出し、蛋白質濃度の定量はBradford法で595nm的吸光度値で測定するが、得られた全蛋白質は、ウェスタンブロット法(Western blot analysis、実施例1におけるウェスタンブロット法の分析説明を参照)の一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の生成量の測定に用いられる。図2Aと図2Bの表示結果から分かるように、実施例2のエタノール抽出物は、生体実験において、一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の生成量が顕著に低下したが、実施例2のエタノール抽出物が一酸化窒素の生成を抑制したからだと考えられる。
【実施例5】
【0035】
Antrocamphin Aの分離
実施例2で得られた無水プロピオン酸抽出物(ACE−EA)を、クロマトグラフ法(chromatography)で、流動相の濃度勾配で17つの留分に分けるが、該クロマトグラフ法に用いれる固体相はシリコン(60−80mesh)は、流動相為n−へキサン/無水プロピオン酸混合液。該濃度勾配はn−へキサンと無水プロピオン酸の体積百分率が95:5,90:10,85:15,80:20,70:30,60:40,50:50,40:60,0:100という順であるn−へキサン/無水プロピオン酸混合液を流動相として、該クロマトグラフ法で行う。
【0036】
得られた17つの留分について、それぞれRAW267.4細胞(実施例1における細胞培養の内容を参照)で一酸化窒素への活性抑制試験を行う。まず、RAW267.4細胞を17組に分け、該17つの留分(50g/ml)をそれぞれ培養培地に加え、それから、それぞれリポ多糖(LPS,1g/ml)を加えて、一酸化窒素の生成を誘発させるが、24時間後、グリース反応法(Griess reaction)で亜硝酸塩の含有量を測定し、一酸化窒素の生成量を間接的に測定して、一酸化窒素生成の抑制率を計算する。実験結果は図3に示すように、第1,7,10留分はそれぞれ、一酸化窒素生成の抑制率が87%, 48%と64%となる。
【0037】
次は、該第1留分を高速液体クロマトグラフィー(HPLC)で更に分離純化し、その構成成分(固体相:シリコン管柱、流動相:体積比85:15のn−へキサン/無水プロピオン酸混合液、流速:3mm/分、UV波長:254nm)を得て、そして、含有量の最も高い成分を分光測定で分析し分子量247.14を得たが、それは分子式C15H19O3と推定。当該成分を更にプロトン核磁気共鳴分光法で解析すると、その分子構造は次のようになり、
【0038】
【化1】

当該化合物はAntrocamphin A.であることを明らかにした。
【0039】
実施例6:Antrocamphin Aによる炎症誘発性分子生成の活性抑制試験:マクロファージ株RAW 267.4
本実施例では、マクロファージ株RAW 267.4により、実施例5で得られたAntrocamphin Aによる炎症誘発性分子生成の活性抑制試験を行う。
【0040】
一酸化窒素の生成量の実験は、まず、RAW267.4細胞を実施例1に述べた細胞培養法で培養したあと、異なる濃度のantrocamphin A(1, 5,10,20g/ml)またはcurcumin(10g/ml)を加えて1時間放置し、それから、リポ多糖(1g/ml)を加えて24時間放置したあと、グリース反応法(Griess reaction)で亜硝酸塩の含有量を測定し、一酸化窒素の生成量を間接的に測定する。
【0041】
前立腺素E2(PGE2)の生成量の実験は、まず、RAW267.4細胞を実施例一で述べた細胞培養法で培養したあと、培養液にアスピリン500mを加えて3時間放置して、内生的シクロオキシゲナーゼ1(COX−1)の活性を喪失させる。それから、異なる濃度のantrocamphin A(1,5,10,20g/ml)またはcurcumin(10g/ml)を加えて1時間放置し、更に、リポ多糖(1g/ml)を加えて16時間放置したあと、最後に、酵素免疫吸着分析法(ELISA kit,Cayman Chemicals)で、細胞培養中の上清液から、内生的アラキドン酸(arachidonic acid)から生じられた前立腺素E2(PGE2)の生成量を測定する。
本実施例で実験した組別は表4に示す。
【0042】
【表4】

“+” は添加あり、“−” は無添加を表す。
制御組にはリポ多糖を投与せず、その代わりにジメチルスルホキシド(DMSO)を投与した。
【0043】
なお、よく知られているMTT法で、Antrocamphin Aの細胞毒性を測定する。該MTT法は生物学でよく用いられる、細胞生存率またはその増殖を測定する方法であり、その原理として、生きている細胞内のミトコンドリアにある琥珀酸脱水素酵素の働きにより、MTTのtetrazolium代謝が青色の産物に変換されるが、そこへジメチルスルホキシド(DMSO)を加えて、細胞に堆積した青色の代謝物を溶かしたあと、分光器で青色の代謝産物の量を測定して、生きている細胞数が間接的に推定できる。
その実験結果を次の表5にまとめる。
【0044】
【表5】

この結果から分かるように、antrocamphin Aは炎症誘発性分子の生成を低下させられるが、顕著な効果が出る濃度は20g/mlであり、この濃度下で、antrocamphin Aは細胞毒性の発生がないと言える。
【0045】
また、各組の細胞から抽出した全リボ核酸(total RNA)と全蛋白質(total protein)を、実施例1に述べた逆転写ポリメラーゼ連鎖反応、及びウェスタンブロット法で、遺伝物質(mRNA)と蛋白質の視点から、一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の生成量をそれぞれ評価する。
【0046】
図4Aと図4Bに示すのは、それぞれ一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の伝令リボ核酸(mRNA)の生成量。 その結果から分かるように、一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の伝令リボ核酸(mRNA)の生成量及びantrocamphin Aの間は、薬剤用量に関わり、薬剤用量の高いantrocamphin Aは、一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の伝令リボ核酸(mRNA)の量を有効に低下させることができる。
【0047】
図5A と図5Bに示すのは、それぞれ一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の生成量であり、その図を見て分かるように、一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の生成量とantrocamphin Aの間は、薬剤用量に関わり、薬剤用量の高いantrocamphin Aは、一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の生成量を有効に低下させられるが、特に濃度20g/mlのときにその効果が顕著に見られる。
【0048】
その結果数値をまとめると、antrocamphin Aは、遺伝物質の転写または蛋白質の視点から見ても、一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の生成量を低下させ、更に炎症誘発性分子、例えば一酸化窒素と前立腺素E2(PGE2)の生成を抑制する効果がある。
【技術分野】
【0001】
本発明は、ベニクスノキタケ子実体の派生物に関わり、特にベニクスノキタケ子実体の派生物による抗炎症用途(The anti−inflammatory usage of Antrodia cinnamomea fruit body derivatives)に関する。
【背景技術】
【0002】
炎症反応は多くの病理学的状態で、主要特徴の一つになるが、細菌感染を例として、細菌表面にあるリポ多糖(lipopolysaccharide,LPS,別称:内毒素)は、宿主体内のマクロファージを活性化させるが、正常の状態で、当該活性化過程において、宿主の免疫システム全体を活性化して、病原菌を消滅する目的が達成される。しかし、一部の異常な生理的反応(疾患の発生で生じられた、または疾患発生の主因になるもの)で、活性化されたマクロファージは、過量の一酸化窒素(NO)の生成を引き起こし、宿主細胞の死亡を加速化することになるため、多くの病理学的状態で、炎症反応への制御は疾患治療の重要な一環であろう。
【0003】
炎症的刺激として知られる腫瘍壊死因子−α(TNF−α)、一酸化窒素(NO)と前立腺素E2(prostaglandin−E2, PGE2は、アラキドン酸がシクロオキシゲナーゼ(COX)ルートの代謝)で生成されたもので、それは免疫反応の重要な部分であり、例えば、敗血症または敗血症ショック(septic and hemorrhagic shock)、関節リウマチ(rheumatoid arthritis)や粥状動脈硬化(arthrosclerosis)の発症は、上述の媒介物が大量に検出された。従って、新薬の開発は、一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の遺伝子を抑制し、リポ多糖(LPS)が誘導する情報伝達の主なレセプターまたは酵素活性を阻害して、一酸化窒素(NO)と前立腺素E2の生成を低減させることに重点が置かれている。
【0004】
ベニクスノキタケ(Antrodia cinnamomea)は真菌の一種で、非常に珍貴な漢方生薬として見られており、多くの科学的研究結果により、ベニクスノキタケ菌糸体からのメチルアルコール抽出物と熱水抽出物、その子実体のメチルアルコール抽出物、エタノール抽出物と無水プロピオン酸抽出物は、優れた抗ガン活性があることが分かった。そして、一部の研究によると、ベニクスノキタケの菌糸体と子実体は、幾らかのトリテルぺノイド化合物が含まれている、抗炎症の潜在力を持つ化合物であると指摘された。しかし、ベニクスノキタケ及びその含まれたトリテルぺノイド化合物が、炎症反応を制御する作用メカリズムと生理的活性を更に解明する必要がある。
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、ベニクスノキタケ子実体の派生物及びその用途を提供することを目的とし、それにより、炎症誘発性分子の生成を抑制し、優れた抗炎症機能がある。
【課題を解決するための手段】
【0006】
上述の目的を達成させるために、本発明は、乾燥ベニクスノキタケの子実体が提供され、該乾燥ベニクスノキタケの子実体を一定の温度で、エタノールで抽出するという手順で得られたことを特徴とするベニクスノキタケの子実体の抽出物を提供する。
【0007】
本発明は、また、乾燥ベニクスノキタケの子実体が提供されており、該乾燥ベニクスノキタケの子実体を一定の温度でエタノールを抽出して、エタノール抽出物が得られるが、該エタノール抽出物を濃縮して、濃縮産物が得られ、該濃縮産物を無水プロピオン酸と水でパーティション(partition)するという手順で得られた該無水プロピオン酸抽出物というベニクスノキタケ子実体の抽出物を提供することを特徴とする。
【0008】
該乾燥の方法は、冷凍乾燥で行われていることを特徴とする。
該温度は、42〜45℃で行われていることを特徴とする。
該エタノールは、体積百分率95%のエタノールで行われていることを特徴とする。
【0009】
該濃縮の方法は、真空濃縮で行われていることを特徴とする。
該無水プロピオン酸は、体積百分率50%の無水プロピオン酸で行われていることを特徴とする。
【0010】
本発明は更に、炎症誘発性分子の生成を抑制することを特徴とする該抽出物の用途を提供する。
該抽出物は、一酸化窒素(NO)または前立腺素E2(PGE2)という該炎症誘発性分子を抑制することを特徴とする。
該抽出物は、一酸化窒素合成酵素とシクロオキシゲナーゼ2を減少させて、それぞれ該一酸化窒素(NO)と該前立腺素E2(PGE2)の生成を抑制することを特徴とする。
【0011】
本発明は、また更に、一酸化窒素(NO)の生成を抑制することを特徴とするantrocamphin Aの用途を提供する。
該antrocamphin Aは、一酸化窒素合成酵素を減少させて、該一酸化窒素(NO)の生成を抑制することを特徴とする。
本発明は、そのうえ、前立腺素E2(PGE2)の生成を抑制することを特徴とするantrocamphin Aの用途を提供する。
該antrocamphin Aは、シクロオキシゲナーゼ2を減少させて、該前立腺素E2(PGE2)の生成を抑制することを特徴とする。
【0012】
本発明は、また、被験者を請求項17に記載のいずれかの一つの抽出物またはantrocamphin Aと接触させることを含むことを特徴とする炎症誘発性分子生成の抑制方法を提供する。
該炎症誘発性分子は、一酸化窒素(NO)または前立腺素E2(PGE2)であることを特徴とする。
【0013】
上述の内容をまとめると、本発明において、ベニクスノキタケ子実体の派生物による抗炎症の効果は、本発明に掲示したベニクスノキタケ子実体の派生物による抗炎症の生理的活性及び作用メカリズムが更に明確になった。
【図面の簡単な説明】
【0014】
【図1】本発明のエタノール抽出物、無水プロピオン酸抽出物と水溶性留分が有する、一酸化窒素生成の抑制率を示すグラフ。
【図2A】本発明のエタノール抽出物が影響した一酸化窒素合成酵素(iNOS)の生成量を示すグラフ。
【図2B】本発明のエタノール抽出物が影響したシクロオキシゲナーゼ2(COX−2)の生成量を示すグラフ。
【図3】本発明の無水プロピオン酸抽出物の17留分が有する、一酸化窒素生成の抑制率を示すグラフ。
【図4A】antrocamphin Aが影響した一酸化窒素合成酵素(iNOS)の伝令リボ核酸(mRNA)の生成量を示すグラフ。
【図4B】antrocamphin Aが影響したシクロオキシゲナーゼ2(COX−2)の伝令リボ核酸(mRNA)の生成量を示すグラフ。
【図5A】antrocamphin Aが影響した一酸化窒素合成酵素(iNOS)の生成量を示すグラフ。
【図5B】antrocamphin Aが影響したシクロオキシゲナーゼ2(COX−2)の生成量を示すグラフ。
【発明を実施するための形態】
【0015】
本発明は、ベニクスノキタケ子実体の派生物及びその用途に関わり、それにより、炎症誘発性分子の生成を抑制して、優れた抗炎症機能がある。該“派生物”とは、ベニクスノキタケ子実体の抽出物及びその成分化合物のことを意味し、もっとはっきりと言えば、本発明でいう“派生物”は、ベニクスノキタケ子実体のエタノール抽出物、無水プロピオン酸抽出物またはantrocamphin Aのことをいう。
【0016】
リポ多糖(lipopolysaccharide,LPS)は、脂質と多糖を共同結合して構成され、グラム陰性菌の細胞表面の主要分子で、内毒素とも言われる。リポ多糖は宿主の体内で激しい炎症反応を引き起こすが、この激しい炎症反応は通常、マクロファージで活性化された免疫反応であり、それゆえ、本発明は、リポ多糖で誘発したマウス体内またはマクロファージ株による炎症反応を実験することを、本発明におけるベニクスノキタケ子実体が抗炎症反応に関わる役割を検討するモデルとする。
【0017】
以下に掲示した実施例は、本発明を詳しく説明するために挙げられた例であり、それらを以って、本発明の特許請求の範囲を制限してはならない。
【実施例1】
【0018】
実験設計
[材料]
本発明に使用するベニクスノキタケの子実体は、台湾高雄六亀で採集した野生株であり、牛胎児血清(FBS)はGibco BRL(Invitrogen, Grand Island, NY)から購入、ジメチルスルホキシド(DMSO), ペニシリン(penicillin)、リポ多糖(lipopolysaccharide, Escherichia coli 0127:138/LPS)MTT(3−(4,5−dimethylthiazol−2−yl)−2,5−diphenyltetrazolium bromide)とグリース試薬(Griess reagent)は、いずれもSigma−Aldrich(St Louis,MO)から購入した。本発明に使用するあらゆる化学薬品及び溶剤はいずれも試薬またはHPLCクラスである。
【0019】
[実験マウス]
実験マウスは、BioLasco(台北、台湾)から購入した生後四週間のオスICR系マウス(約25〜28g)で、実験前、実験マウスを環境に慣らさせるために、温度25±2℃、相対湿度55±5%、明暗周期は12時間(より明確に言えば、毎日午前六時から午後六時を明期とする)、自由に摂食と飲水を行わせる条件下で、少なくとも一週間飼育しておいた。すべての動物実験処理は、実験動物飼育管理(Guide for the Care and Use of Laboratory Animals)、使用ガイド及び台湾の動物保護法に関する規定に従い、また現地の道徳委員から承認を得てから行われた。
【0020】
[細胞培養]
本発明は、マウスマクロファージ株RAW 267.4で、一酸化窒素と前立腺素E2(PGE2)の生成量を検討した。RAW267.4細胞の培養では、まず、培養培地に培養されていた(75cm2)RAW 267.4細胞を接種密度2×105cells/wellで、96孔培養プレートに接種し、それを培養箱(37℃,5%CO2)に入れて培養し、培養液はATCC(American TypeCulture Collection)の意見を受けて、培養液DMEMを使用し、それに牛胎児血清(fetal bovine serum,FBS)10%を加えて、ペニシリン(penicillin,100units/ml)とストレプトマイシン(streptomycin,100g/ml)を培養する。
【0021】
[ウェスタンブロット法分析]
細胞の全蛋白質(total protein)を得てから、それと同様な量の蛋白質を5〜7%勾配電気泳動ゲル孔内(SDS−PAGE)に加えて、300mAで90分間分離(resolve)し、大きさにより分離した蛋白質ブロッティング(100V,1時間)をフッ化ポリビニリデン膜(polyvinylidene difluoride,PVDF,Immobilon, Millipore,Bedford,MA)に転写したあと、フッ化ポリビニリデン膜を、ブロッキング緩衝液で(blocking buffer, 10%w/v脱脂乳粉末をTBST 緩衝液の中に入れて)1時間作用する。
【0022】
それから、フッ化ポリビニリデン膜を抗一酸化窒素合成酵素の抗体溶液(anti−iNOS,1:1000,Cayman Chemicals)または抗シクロオキシゲナーゼ2の抗体溶液(anti−COX−2,1:1000,Cayman Chemicals)に浸かり、それから、TBST 緩衝液0.1%(Tween20 0.1%含有のTBS緩衝液)で二回洗浄して、非特異的(non−specific)結合の抗体抗原を洗い落とす。
その後、フッ化ポリビニリデン膜を西洋わさびペルオキシダーゼ(horseradish peroxidase)の抗ウサギ二級抗体溶液(anti−rabbit secondary antibodies)に浸かったあと、化学発光試薬(enhanced chemiluminescene regents,ECL,Pierce)を加えて、各組の蛍光強度を検出し、そしてβ−アクチン(β−actin)の生成量を蛋白の制御対照にする。
【0023】
[逆転写ポリメラーゼ連鎖反応]
Trizol試薬(Invitrogen Life Technologies,Carlsbad,CA,USA)で、抽取細胞の全リボ核酸(total RNA)を抽出し、逆転写ポリメラーゼ連鎖反応でiNOS,COX−2和G3PDHの伝令リボ核酸(mRNA)をcDNAに逆転写し、それから、定量的リアルタイムポリメラーゼ連鎖反応(real time−PCR,Applied Biosystems)で、iNOS、COX−2とG3PDHの生成漁を測定する。
【0024】
該定量的リアルタイムポリメラーゼ連鎖反応は、DNA結合蛍光剤グリーン核酸ゲル染色液(SYBR Green)でPCR産物を検出するが、温度サイクル(thermal cycle)は、95℃で5分間を1サイクルの後、95℃で1分間、55℃で45秒、及び72℃で30秒を40サイクルにするが、プライマー配列は Inos順向き5’−TCC TAC ACC ACA CCA AAC−3’;iNOS逆向き5’−CTC CAA TCT CTG CCT ATC C−3’;COX−2順向き5’−CCT CTG CGA TGC TCT TCC−3’;COX−2逆向き5’−TCA CAC TTA TAC TGG TCA AAT CC−3’;G3PDH順向き5’−TCA ACG GCA CAG TCA AGG−3’;G3PDH逆向き5’−ACT CCA CGA CAT ACT CAG C−3’であり、G3PDHはハウスキーピング遺伝子(housekeeping gene)で、細胞内に安定し大量な遺伝子があり、実験中でiNOSとCOX−2の量を標準化する。
【実施例2】
【0025】
本発明のベニクスノキタケ子実体のエタノール抽出物と無水プロピオン酸抽出の製造
まず、ベニクスノキタケの子実体を冷凍乾燥法で乾燥し、それから、42〜45℃下で、冷凍乾燥したベニクスノキタケの子実体580gをエタノール95%で抽出して、本発明のエタノール抽出物(ACE)を得る。この乾燥法は、制限することがなく、所属分野で知られている何れかの乾燥法で行ってもよい。
【0026】
それから、該エタノール抽出物を真空(rotary evaporator)で濃縮して、濃縮産物183.9gを得た。得られた濃縮産物を無水プロピオン酸と水で無水プロピオン酸層と水溶性層に分離し(partition)し、該水溶性層は水溶性留分(ACE−water)と表示され、該無水プロピオン酸層はすなわち、本発明の無水プロピオン酸抽出物(ACE−EA)である。
【実施例3】
【0027】
実施例2のエタノール抽出物(ACE)、無水プロピオン酸抽出物(ACE−EA)と水溶性留分(ACE−water)による一酸化窒素の活性抑制試験: マクロファージ株RAW 267.4
本実施例では、マクロファージ株RAW 267.4により、実施例二で得られたベニクスノキタケの子実体エタノール抽出物(ACE)、無水プロピオン酸抽出物(ACE−EA)と水溶性留分(ACE−water)による一酸化窒素の活性抑制試験を行う。
【0028】
まず、RAW 267.4細胞は、実施例1に述べた細胞培養法で培養したあと、実験組一(エタノール抽出物、ACE)、実験組二(無水プロピオン酸抽出物、ACE−EA)と実験組三(水溶性留分、ACE−water)の三組に分ける。各組の細胞を濃度(1,10,25,50g/ml)により、該エタノール抽出物、該無水プロピオン酸抽出物と該水溶性留分をそれぞれ培養液に入れ、それから、リポ多糖(LPS)を培養液に加えて、RAW 267.4細胞に一酸化窒素の生成を誘導させるが、24時間後、グリース反応法(Griess reaction)で亜硝酸塩の含有量を測定し、一酸化窒素の生成量を間接的に測定するが、その実験設計は次の表1に示す。
【0029】
【表1】

“+” は添加あり、“−” は無添加を表す。
図に示すのは、グリース反応法で測定した一酸化窒素の生成量、及び一酸化窒素生成の抑制率の統計結果を表す。図を見て分かるように、実施例2から得たベニクスノキタケエタノール抽出物と無水プロピオン酸抽出物はいずれも、一酸化窒素への活性抑制効果があり、特に濃度50g/mlのときその効果がより顕著になる。
【実施例4】
【0030】
実施例2のエタノール抽出物(ACE)による一酸化窒素の活性抑制試験: マウス生体実験
本実施例はマウス生体で、実施例二で得られたエタノール抽出物(ACE)による一酸化窒素の活性抑制試験を行う。マウスは実施例1に述べた条件下での実験マウスを使用する。
【0031】
[実験設計]
まず、六匹のマウスを一組にし、計六組あり、下表2の配置により、リポ多糖(5g/kg)の注射前、各組マウスにそれぞれ腹腔内注射法(intraperitoneal injection)で、濃度の異なった実施例2で得たベニクスノキタケエタノール抽出物(ACE,100,300,500mg/kg)、クルクミン(curcumin)を注射し、または注射しないが、その中、制御組にはジメチルスルホキシド(DMSO)だけを注射し、また、抗炎症薬剤として知られるクルクミン(curcumin)は、本実施例における陽性対照組に使用される。マウスにリポ多糖を注射したあと、更にエーテルで麻酔し、12時間後、断頭法(decapitation)で犠死させた。
【0032】
【表2】

“+” は添加あり、“−” は無添加を表す。
制御組にリポ多糖を投与せず、その代わりにジメチルスルホキシド(DMSO)を投与した。
【0033】
[実験結果]
眼窩採血法または心臓採血法で採血したあと、その血液をエチレンジアミン四酢酸(EDTA)含有の試験管に注ぎ、温度4℃で、500gで10分間の遠心により血清を集め、それから、グリース反応法で血清中の一酸化窒素濃度を測定するが、その結果は次の表3に示す。
【0034】
【表3】

表3の結果により、実施例2のエタノール抽出物は、生体実験にも、一酸化窒素の生成量への抑制は効果が顕著であり、それがクルクミンの效果に類似している。
そして、犠死させた実験マウスの肝臓を摘出し、よく知られている実験方法で全蛋白質を抽出し、蛋白質濃度の定量はBradford法で595nm的吸光度値で測定するが、得られた全蛋白質は、ウェスタンブロット法(Western blot analysis、実施例1におけるウェスタンブロット法の分析説明を参照)の一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の生成量の測定に用いられる。図2Aと図2Bの表示結果から分かるように、実施例2のエタノール抽出物は、生体実験において、一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の生成量が顕著に低下したが、実施例2のエタノール抽出物が一酸化窒素の生成を抑制したからだと考えられる。
【実施例5】
【0035】
Antrocamphin Aの分離
実施例2で得られた無水プロピオン酸抽出物(ACE−EA)を、クロマトグラフ法(chromatography)で、流動相の濃度勾配で17つの留分に分けるが、該クロマトグラフ法に用いれる固体相はシリコン(60−80mesh)は、流動相為n−へキサン/無水プロピオン酸混合液。該濃度勾配はn−へキサンと無水プロピオン酸の体積百分率が95:5,90:10,85:15,80:20,70:30,60:40,50:50,40:60,0:100という順であるn−へキサン/無水プロピオン酸混合液を流動相として、該クロマトグラフ法で行う。
【0036】
得られた17つの留分について、それぞれRAW267.4細胞(実施例1における細胞培養の内容を参照)で一酸化窒素への活性抑制試験を行う。まず、RAW267.4細胞を17組に分け、該17つの留分(50g/ml)をそれぞれ培養培地に加え、それから、それぞれリポ多糖(LPS,1g/ml)を加えて、一酸化窒素の生成を誘発させるが、24時間後、グリース反応法(Griess reaction)で亜硝酸塩の含有量を測定し、一酸化窒素の生成量を間接的に測定して、一酸化窒素生成の抑制率を計算する。実験結果は図3に示すように、第1,7,10留分はそれぞれ、一酸化窒素生成の抑制率が87%, 48%と64%となる。
【0037】
次は、該第1留分を高速液体クロマトグラフィー(HPLC)で更に分離純化し、その構成成分(固体相:シリコン管柱、流動相:体積比85:15のn−へキサン/無水プロピオン酸混合液、流速:3mm/分、UV波長:254nm)を得て、そして、含有量の最も高い成分を分光測定で分析し分子量247.14を得たが、それは分子式C15H19O3と推定。当該成分を更にプロトン核磁気共鳴分光法で解析すると、その分子構造は次のようになり、
【0038】
【化1】

当該化合物はAntrocamphin A.であることを明らかにした。
【0039】
実施例6:Antrocamphin Aによる炎症誘発性分子生成の活性抑制試験:マクロファージ株RAW 267.4
本実施例では、マクロファージ株RAW 267.4により、実施例5で得られたAntrocamphin Aによる炎症誘発性分子生成の活性抑制試験を行う。
【0040】
一酸化窒素の生成量の実験は、まず、RAW267.4細胞を実施例1に述べた細胞培養法で培養したあと、異なる濃度のantrocamphin A(1, 5,10,20g/ml)またはcurcumin(10g/ml)を加えて1時間放置し、それから、リポ多糖(1g/ml)を加えて24時間放置したあと、グリース反応法(Griess reaction)で亜硝酸塩の含有量を測定し、一酸化窒素の生成量を間接的に測定する。
【0041】
前立腺素E2(PGE2)の生成量の実験は、まず、RAW267.4細胞を実施例一で述べた細胞培養法で培養したあと、培養液にアスピリン500mを加えて3時間放置して、内生的シクロオキシゲナーゼ1(COX−1)の活性を喪失させる。それから、異なる濃度のantrocamphin A(1,5,10,20g/ml)またはcurcumin(10g/ml)を加えて1時間放置し、更に、リポ多糖(1g/ml)を加えて16時間放置したあと、最後に、酵素免疫吸着分析法(ELISA kit,Cayman Chemicals)で、細胞培養中の上清液から、内生的アラキドン酸(arachidonic acid)から生じられた前立腺素E2(PGE2)の生成量を測定する。
本実施例で実験した組別は表4に示す。
【0042】
【表4】

“+” は添加あり、“−” は無添加を表す。
制御組にはリポ多糖を投与せず、その代わりにジメチルスルホキシド(DMSO)を投与した。
【0043】
なお、よく知られているMTT法で、Antrocamphin Aの細胞毒性を測定する。該MTT法は生物学でよく用いられる、細胞生存率またはその増殖を測定する方法であり、その原理として、生きている細胞内のミトコンドリアにある琥珀酸脱水素酵素の働きにより、MTTのtetrazolium代謝が青色の産物に変換されるが、そこへジメチルスルホキシド(DMSO)を加えて、細胞に堆積した青色の代謝物を溶かしたあと、分光器で青色の代謝産物の量を測定して、生きている細胞数が間接的に推定できる。
その実験結果を次の表5にまとめる。
【0044】
【表5】

この結果から分かるように、antrocamphin Aは炎症誘発性分子の生成を低下させられるが、顕著な効果が出る濃度は20g/mlであり、この濃度下で、antrocamphin Aは細胞毒性の発生がないと言える。
【0045】
また、各組の細胞から抽出した全リボ核酸(total RNA)と全蛋白質(total protein)を、実施例1に述べた逆転写ポリメラーゼ連鎖反応、及びウェスタンブロット法で、遺伝物質(mRNA)と蛋白質の視点から、一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の生成量をそれぞれ評価する。
【0046】
図4Aと図4Bに示すのは、それぞれ一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の伝令リボ核酸(mRNA)の生成量。 その結果から分かるように、一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の伝令リボ核酸(mRNA)の生成量及びantrocamphin Aの間は、薬剤用量に関わり、薬剤用量の高いantrocamphin Aは、一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の伝令リボ核酸(mRNA)の量を有効に低下させることができる。
【0047】
図5A と図5Bに示すのは、それぞれ一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の生成量であり、その図を見て分かるように、一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の生成量とantrocamphin Aの間は、薬剤用量に関わり、薬剤用量の高いantrocamphin Aは、一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の生成量を有効に低下させられるが、特に濃度20g/mlのときにその効果が顕著に見られる。
【0048】
その結果数値をまとめると、antrocamphin Aは、遺伝物質の転写または蛋白質の視点から見ても、一酸化窒素合成酵素(iNOS)とシクロオキシゲナーゼ2(COX−2)の生成量を低下させ、更に炎症誘発性分子、例えば一酸化窒素と前立腺素E2(PGE2)の生成を抑制する効果がある。
【特許請求の範囲】
【請求項1】
乾燥ベニクスノキタケの子実体が提供され、該乾燥ベニクスノキタケの子実体を一定の温度で、エタノールで抽出するという手順で得られたことを特徴とするベニクスノキタケ子実体の抽出物。
【請求項2】
該乾燥の方法は、冷凍乾燥であることを特徴とする請求項1に記載のベニクスノキタケ子実体の抽出物。
【請求項3】
該温度は、42〜45℃であることを特徴とする請求項1に記載のベニクスノキタケ子実体の抽出物。
【請求項4】
該エタノールは、体積百分率95%のエタノールであることを特徴とする請求項1に記載のベニクスノキタケ子実体の抽出物。
【請求項5】
乾燥ベニクスノキタケの子実体が提供されており、該乾燥ベニクスノキタケの子実体を一定の温度でエタノールを抽出して、エタノール抽出物が得られるが、該エタノール抽出物を濃縮して、濃縮産物が得られ、該濃縮産物を無水プロピオン酸と水でパーティション(partition)するという手順で得られた該無水プロピオン酸の抽出物であることを特徴とするベニクスノキタケ子実体の抽出物。
【請求項6】
該乾燥の方法は冷凍乾燥で行われていることを特徴とする請求項5に記載のベニクスノキタケ子実体の抽出物。
【請求項7】
該濃縮の方法は真空濃縮で行われていることを特徴とする請求項5に記載のベニクスノキタケ子実体の抽出物。
【請求項8】
該温度は、42〜45℃で行われていることを特徴とする請求項5に記載のベニクスノキタケ子実体の抽出物。
【請求項9】
該エタノールは、体積百分率95%のエタノールで行われていることを特徴とする請求項5に記載のベニクスノキタケ子実体の抽出物。
【請求項10】
該無水プロピオン酸は、体積百分率50%の無水プロピオン酸で行われていることを特徴とする請求項5に記載のベニクスノキタケ子実体の抽出物。
【請求項11】
炎症誘発性分子の生成を抑制することを特徴とする請求項1〜請求項10の何れかの一つに記載のベニクスノキタケ子実体の抽出物の用途。
【請求項12】
該抽出物は、一酸化窒素(NO)または前立腺素E2(PGE2)という炎症誘発性分子を抑制することを特徴とする請求項11に記載のベニクスノキタケ子実体の抽出物の用途。
【請求項13】
該抽出物は、一酸化窒素合成酵素とシクロオキシゲナーゼ2を減少させて、それぞれ該一酸化窒素(NO)と該前立腺素E2(PGE2)の生成を抑制することを特徴とする請求項12に記載のベニクスノキタケ子実体の抽出物の用途。
【請求項14】
一酸化窒素(NO)の生成を抑制することを特徴とするantrocamphin Aの用途。
【請求項15】
該antrocamphin Aで、一酸化窒素合成酵素を減少させて、該一酸化窒素(NO)の生成を抑制することを特徴とする請求項14に記載のantrocamphin Aの用途。
【請求項16】
前立腺素E2(PGE2)の生成を抑制することを特徴とするantrocamphin Aの用途。
【請求項17】
該antrocamphin Aは、シクロオキシゲナーゼ2を減少させて、該前立腺素E2(PGE2)の生成を抑制することを特徴とする請求項16に記載の用途。
【請求項18】
被験者を請求項17に記載のいずれかの一つの抽出物またはantrocamphin Aと接触させることを含むことを特徴とする炎症誘発性分子生成の抑制方法。
【請求項19】
該炎症誘発性分子は、一酸化窒素(NO)または前立腺素E2(PGE2)であることを特徴とする請求項18に記載の方法。
【請求項1】
乾燥ベニクスノキタケの子実体が提供され、該乾燥ベニクスノキタケの子実体を一定の温度で、エタノールで抽出するという手順で得られたことを特徴とするベニクスノキタケ子実体の抽出物。
【請求項2】
該乾燥の方法は、冷凍乾燥であることを特徴とする請求項1に記載のベニクスノキタケ子実体の抽出物。
【請求項3】
該温度は、42〜45℃であることを特徴とする請求項1に記載のベニクスノキタケ子実体の抽出物。
【請求項4】
該エタノールは、体積百分率95%のエタノールであることを特徴とする請求項1に記載のベニクスノキタケ子実体の抽出物。
【請求項5】
乾燥ベニクスノキタケの子実体が提供されており、該乾燥ベニクスノキタケの子実体を一定の温度でエタノールを抽出して、エタノール抽出物が得られるが、該エタノール抽出物を濃縮して、濃縮産物が得られ、該濃縮産物を無水プロピオン酸と水でパーティション(partition)するという手順で得られた該無水プロピオン酸の抽出物であることを特徴とするベニクスノキタケ子実体の抽出物。
【請求項6】
該乾燥の方法は冷凍乾燥で行われていることを特徴とする請求項5に記載のベニクスノキタケ子実体の抽出物。
【請求項7】
該濃縮の方法は真空濃縮で行われていることを特徴とする請求項5に記載のベニクスノキタケ子実体の抽出物。
【請求項8】
該温度は、42〜45℃で行われていることを特徴とする請求項5に記載のベニクスノキタケ子実体の抽出物。
【請求項9】
該エタノールは、体積百分率95%のエタノールで行われていることを特徴とする請求項5に記載のベニクスノキタケ子実体の抽出物。
【請求項10】
該無水プロピオン酸は、体積百分率50%の無水プロピオン酸で行われていることを特徴とする請求項5に記載のベニクスノキタケ子実体の抽出物。
【請求項11】
炎症誘発性分子の生成を抑制することを特徴とする請求項1〜請求項10の何れかの一つに記載のベニクスノキタケ子実体の抽出物の用途。
【請求項12】
該抽出物は、一酸化窒素(NO)または前立腺素E2(PGE2)という炎症誘発性分子を抑制することを特徴とする請求項11に記載のベニクスノキタケ子実体の抽出物の用途。
【請求項13】
該抽出物は、一酸化窒素合成酵素とシクロオキシゲナーゼ2を減少させて、それぞれ該一酸化窒素(NO)と該前立腺素E2(PGE2)の生成を抑制することを特徴とする請求項12に記載のベニクスノキタケ子実体の抽出物の用途。
【請求項14】
一酸化窒素(NO)の生成を抑制することを特徴とするantrocamphin Aの用途。
【請求項15】
該antrocamphin Aで、一酸化窒素合成酵素を減少させて、該一酸化窒素(NO)の生成を抑制することを特徴とする請求項14に記載のantrocamphin Aの用途。
【請求項16】
前立腺素E2(PGE2)の生成を抑制することを特徴とするantrocamphin Aの用途。
【請求項17】
該antrocamphin Aは、シクロオキシゲナーゼ2を減少させて、該前立腺素E2(PGE2)の生成を抑制することを特徴とする請求項16に記載の用途。
【請求項18】
被験者を請求項17に記載のいずれかの一つの抽出物またはantrocamphin Aと接触させることを含むことを特徴とする炎症誘発性分子生成の抑制方法。
【請求項19】
該炎症誘発性分子は、一酸化窒素(NO)または前立腺素E2(PGE2)であることを特徴とする請求項18に記載の方法。
【図1】


【図2A】


【図2B】


【図3】


【図4A】


【図4B】


【図5A】


【図5B】




【図2A】


【図2B】


【図3】


【図4A】


【図4B】


【図5A】


【図5B】


【公開番号】特開2011−162462(P2011−162462A)
【公開日】平成23年8月25日(2011.8.25)
【国際特許分類】
【出願番号】特願2010−24980(P2010−24980)
【出願日】平成22年2月8日(2010.2.8)
【出願人】(506187511)國立中興大學 (12)
【Fターム(参考)】
【公開日】平成23年8月25日(2011.8.25)
【国際特許分類】
【出願日】平成22年2月8日(2010.2.8)
【出願人】(506187511)國立中興大學 (12)
【Fターム(参考)】
[ Back to top ]

