ベンダムスチン製薬学的組成物
【課題】ナイトロジェンマスタードベンダムスチンを含んでなる製薬学的調剤の提供。
【解決手段】ベンダムスチン又はベンダムスチン塩酸塩、マンニトール、第三級ブタノールおよび水を有する製薬学的組成物であり、前記ベンダムスチン又はベンダムスチン塩酸塩は約12〜17mg/mlの濃度で存在し、前記マンニトールは約20〜30mg/mlの濃度で存在し、および、前記第三級ブタノールは約10〜50%(v/v)の濃度で存在するものである、製薬学的組成物。
【解決手段】ベンダムスチン又はベンダムスチン塩酸塩、マンニトール、第三級ブタノールおよび水を有する製薬学的組成物であり、前記ベンダムスチン又はベンダムスチン塩酸塩は約12〜17mg/mlの濃度で存在し、前記マンニトールは約20〜30mg/mlの濃度で存在し、および、前記第三級ブタノールは約10〜50%(v/v)の濃度で存在するものである、製薬学的組成物。
【発明の詳細な説明】
【技術分野】
【0001】
発明の分野
本発明は、種々の疾病状態、特に新生物疾病および自己免疫疾病の処置のための製薬学的組成物の分野に関する。特に、それはナイトロジェンマスタード類(nitrogen mustards)、特にナイトロジェンマスタードベンダムスチン、例えば、ベンダムスチンHClを含んでなる製薬学的調剤に関する。
【背景技術】
【0002】
発明の背景
本発明は、引用することにより本発明の内容となる2005年1月14日に出願された「ベンダムスチン製薬学的組成物(Bendamustine Pharmaceutical Compositions)」の名称の米国特許出願番号第60/644,354号の権利および優先権を、図面および特許請求の範囲を含めて主張する。
【0003】
以下の記述は本発明を理解する際に有用でありうる情報を包含する。いずれかのそのような情報がここで特許請求される発明の先行技術であるかもしくは関連があること、または具体的にもしくは含蓄的に照合されるいずれかの文献が先行技術であることは認められない。
【0004】
水溶液中のそれらの高い反応性の理由のために、ナイトロジェンマスタード類は薬剤として調合することが困難でありそしてしばしば凍結乾燥形態での投与のために供給され、それは投与前に一般的には水中での熟練病院専門家による再構成を必要とする。水溶液中になると、ナイトロジェンマスタード類は加水分解による分解を受け、その結果として、再構成された製品はその再構成後にできるだけ速やかに患者に投与しなければならない。
【0005】
ベンダムスチンである(4−{5−[ビス(2−クロロエチル)アミノ]−1−メチル−2−ベンズイミダゾリル}酪酸はベンズイミダゾール環を有する非定型構造であり、その構造は活性ナイトロジェンマスタードを包含する(ベンダムスチン塩酸塩を示す式I参照)。
【0006】
【化1】

【0007】
ベンダムスチンは1963年にドイツ共和国(GDR)で最初に合成されそして1971年から1992年までその地域で名称ストスタサン(Cytostasan)(R)として入手可能であった。その時点以降は、それはドイツで商品名リボムスチン(Ribomustin)(R)として販売されてきた。それはドイツにおいて慢性リンパ性白血病、ホジキン病、非−ホジキンリンパ腫、多発性骨髄腫、および乳癌を処置するために広く使用されてきた。
【0008】
(他のナイトロジェンマスタード類のような)水溶液中でのその分解のために、ベンダムスチンは凍結乾燥製品として供給される。ベンダムスチンの最近の凍結乾燥調剤(リボムスチン(R))はベンダムスチン塩酸塩およびマンニトールを殺菌性凍結乾燥形態で再構成後の静脈内使用のための白色粉末として含有する。仕上げられた凍結乾燥物は光への露呈時に不安定である。従って、製品は褐色または琥珀色のガラスバイアルの中に貯蔵される。ベンダムスチンの最近の凍結乾燥調剤は薬品物質の製造中および/または仕上げ薬品製品を製造するための凍結乾燥工程中に生じうる分解生成物を含有する。
【0009】
最近では、ベンダムスチンは50mLバイアル当たり100mgの薬品または20mLバイアル当たり25mgの薬品を有する注射用の凍結乾燥粉末として調合される。バイアルが開けられそしてできるだけ患者投与時間近くで再構成される。製品は40mL(100mg表示に関して)または10mL(25mg表示に関して)の注射用殺菌水で再構成される。再構成された製品はさらに500mLにするのに充分な0.9%注射用塩化ナトリウムで希釈される。投与経路は30〜60分間にわたる静脈注入による。
【0010】
40mLの注射用殺菌水による再構成後に、ベンダムスチンのバイアルは室温貯蔵下で7時間の期間にわたりまたは2〜8℃における貯蔵時に6日間にわたり安定である。(混合物の室温貯蔵と仮定して)500mL混合溶液は患者にバイアル再構成から7時間以内に投与しなければならない。
【0011】
このベンダムスチン凍結乾燥粉末の再構成は困難である。臨床報告は、再構成は少なくとも15分間を必要としそして30分間程度の長さを必要としうることを示している。面倒であり且つ製品を再構成するための責任のある健康管理専門家による時間消費の他に、再構成工程中の水に対するベンダムスチンの長期露呈が水による製品の加水分解による有効性損失の可能性および不純物生成を増加させる。
【0012】
それ故、より容易に再構成され且つベンダムスチンの最近の凍結乾燥物(凍結乾燥粉末)調剤より良好な不純物特性を有するベンダムスチンの凍結乾燥調剤に関する要望が存在する。
【0013】
特許文献1は、1−位置で置換されたω−[5−ビス−(β−クロロエチル)−アミノ−ベンズイミダゾリル−(2)]−アルカンカルボン酸類の製造方法を開示している。
【0014】
特許文献2は、γ−[1−メチル−5−ビス−(β−クロロエチル)−アミノ−ベンズイミダゾリル−(2)]−酪酸塩酸塩の注射調合物を開示している。
【0015】
特許文献3は、4−[1−メチル−5−ビス(2−クロロエチル)アミノ−ベンズイミダゾリル−2)−酪酸の製造方法を開示している。
【0016】
特許文献4は、ベンダムスチンの注射溶液を開示している。
【0017】
非特許文献1は、製品記述を包含するリボムスチン(R)に関する情報を提供している。
【0018】
Ni他は、ニトロソウレアであるサルCNU(SarCNU)は純粋な第三級ブタノールの中では純粋な酢酸、ジメチルスルホキシド、メチルヒドロキシ、水またはTBA/水混合物の中でより安定性が大きいことを報告している(非特許文献2)。
【0019】
凍結乾燥されたシクロホスファミドは当該技術で既知であり、例えば米国特許である特許文献5、特許文献6、特許文献7、特許文献8、特許文献9、特許文献10、特許文献11、および特許文献12を参照のこと。
【0020】
凍結乾燥されたナイトロジェンマスタードであるイフォスファミド(Ifosfamide)は国際公開である特許文献13、米国特許である特許文献14、特許文献15、特許文献16、特許文献17、および特許文献18に開示されている。
【0021】
Teagarden他はPGE−1をラクトースおよび第三級ブチルアルコールの溶液の中に溶解させることにより製造されるプロスタグランジンE−1の凍結乾燥調剤を開示している(特許文献19)。
【特許文献1】独国特許発明(GDR)第34727号明細書
【特許文献2】独国特許発明(GDR)第80967号明細書
【特許文献3】独国特許発明(GDR)第159877号明細書
【特許文献4】独国特許発明(GDR)第159289号明細書
【特許文献5】米国特許第5,418,223号明細書
【特許文献6】米国特許第5,413,995号明細書
【特許文献7】米国特許第5,268,368号明細書
【特許文献8】米国特許第5,227,374号明細書
【特許文献9】米国特許第5,130,305号明細書
【特許文献10】米国特許第4,659,699号明細書
【特許文献11】米国特許第4,537,883号明細書
【特許文献12】米国特許第5,066,647号明細書
【特許文献13】国際公開第2003/066027号パンフレット
【特許文献14】米国特許第6,613,927号明細書
【特許文献15】米国特許第5,750,131号明細書
【特許文献16】米国特許第5,972,912号明細書
【特許文献17】米国特許第5,227,373号明細書
【特許文献18】米国特許第5,204,335号明細書
【特許文献19】米国特許第5,770,230号明細書
【非特許文献1】Ribomustin(R) bendamustine Product monograph (updated 1/2002) http://www.ribosepharm.de/pdf/ribomustin bendamustin/productmonograph.pdf
【非特許文献2】Ni et al.(2001) Intl.J.Pharmaceutics 226:39−46
【発明の概要】
【発明が解決しようとする課題】
【0022】
発明の要旨
本発明は、ナイトロジェンマスタード類、特に凍結乾燥されたベンダムスチンの安定な製薬学的組成物、並びに種々の疾病状態、特に新生物疾病および自己免疫疾病の処置におけるその使用に関する。
【0023】
本発明の態様は、放出時またはHP1がベンダムスチンの凍結乾燥調合物の再構成後の時間ゼロに存在するHP1の量である時に、約0.5〜0.9%(ベンダムスチンの面積百分率)より多くない式II
【0024】
【化2】

【0025】
で示されるHP1を含有するベンダムスチンの製薬学的組成物である。好ましい態様は、約0.5%(ベンダムスチンの面積百分率)より多くない、好ましくは約0.45%より多くない、より好ましくは約0.40%より多くない、より好ましくは約0.35%より多くない、さらにより好ましくは0.30%より多くないHP1を含有するベンダムスチンの製薬学的組成物である。
【0026】
本発明の別の態様は、放出時または再構成後の時間ゼロにおいて約0.1%〜約0.3%より多くない式III
【0027】
【化3】

【0028】
で示されるベンダムスチン二量体を含有するベンダムスチンの凍結乾燥調合物である。
【0029】
本発明のさらに別の態様は、放出時または再構成後の時間ゼロにおいて約0.5%より多くない、好ましくは約0.15%〜約0.5%の式IV
【0030】
【化4】

【0031】
で示されるベンダムスチンエチルエステルを含有するベンダムスチンの凍結乾燥調合物で
ある。
【0032】
本発明のさらに別の態様は、ベンダムスチンエチルエステル(式IV)の濃度が凍結乾燥調合物を製造するために使用される薬品物質中で見出されるベンダムスチンエチルエステルの濃度より0.2%、好ましくは0.1%、より多くないベンダムスチンの凍結乾燥調合物である。
【0033】
本発明の別の態様は、薬品製品の放出時に約0.5%〜約0.9%(ベンダムスチンの面積百分率)より多くないHP1を含有するベンダムスチンの凍結乾燥調合物である。好ましい態様は、約0.50%(ベンダムスチンの面積百分率)より多くない、好ましくは約0.45%より多くない、より好ましくは約0.40%より多くない、より好ましくは約0.35%より多くない、さらにより好ましくは約0.30%より多くないHP1を含有するベンダムスチンの凍結乾燥調合物である。この態様の一面は、凍結乾燥調合物がバイアルまたは他の製薬学的に許容可能な容器内に包装されている約0.5%〜約0.9%、好ましくは0.5%(ベンダムスチンの面積百分率)より多くないHP1を含有するベンダムスチンの凍結乾燥調合物である。
【0034】
本発明のさらに別の態様では、ベンダムスチンの凍結乾燥調合物は、約2°〜約30°で貯蔵される時に、HP1の量に関して、少なくとも約6ヶ月間、好ましくは12ヶ月間、好ましくは24ヶ月間、ないし約36ヶ月間もしくはそれ以上にわたり安定である。好ましい貯蔵温度は5℃およびほぼ室温である。
【0035】
本発明の別の態様は、約0.5%〜約0.9%より多くない、好ましくは約0.50%より多くない、好ましくは約0.45%より多くない、より好ましくは約0.40%より多くない、より好ましくは約0.35%より多くない、さらにより好ましくは約0.30%より多くないHP1を含有するベンダムスチンの製薬学的組成物を包含し、ここでHP1が本発明のベンダムスチンの凍結乾燥調合物の放出時または再構成後の時間ゼロにおいて存在するHP1の量である。本発明の好ましい面では、薬用量形態は約5mg〜約500mgのベンダムスチン、約10〜約300mgのベンダムスチン、約25mgのベンダムスチン、約100mgのベンダムスチン、および約200mgのベンダムスチンでありうる。
【0036】
本発明のさらに別の態様は、約0.5%〜約0.9%、好ましくは0.5%、より多くないHP1を含有するベンダムスチンの凍結乾燥調合物を包含する製薬学的薬用量形態である。好ましい薬用量形態は約5〜約500mgのベンダムスチン、約10mg〜約300mgのベンダムスチン、約25mgのベンダムスチン、約100mgのベンダムスチン、および約200mgのベンダムスチンでありうる。
【0037】
さらに別の態様では、本発明は約0.5%〜約0.9%(ベンダムスチンの面積百分率)より多くない、好ましくは約0.50%より多くない、好ましくは約0.45%より多くない、より好ましくは約0.40%より多くない、より好ましくは約0.35%より多くない、さらにより好ましくは約0.30%より多くないHP1を含有するベンダムスチン、および痕跡量の1種もしくはそれ以上の有機溶媒を包含するベンダムスチンの製薬学的組成物を包含し、ここで該HP1がここに開示されたベンダムスチンの凍結乾燥製薬学的組成物の放出時または再構成後の時間ゼロにおいて存在するHP1の量である。この態様の別の面では、有機溶媒は第三級ブタノール、n−プロパノール、n−ブタノール、イソプロパノール、エタノール、メタノール、アセトン、酢酸エチル、炭酸ジメチル、アセトニトリル、ジクロロメタン、メチルエチルケトン、メチルイソブチルケトン、1−ペンタノール、酢酸メチル、四塩化炭素、ジメチルスルホキシド、ヘキサフルオロアセトン、クロロブタノール、ジメチルスルホン、酢酸、およびシクロヘキサンの1種もしくはそれ以上から選択される。好ましい有機溶媒はエタノール、メタノール、プロパノール、ブタノール、イソプロパノール、および第三級ブタノールの1種もしくはそれ以上を包含する。より好ましい有機溶媒は、TBA、t−ブタノール、tert−ブチルアルコールまたは第三級ブチルアルコールとしても知られる第三級ブタノールである。
【0038】
本発明は、ベンダムスチン製品に関する官庁認可(agency approval)を得るための方法であって、ここに記載されている製薬学的組成物を得るためのベンダムスチン分解物(bendamustine degradant)に関する放出仕様を少なくとも約4.0%、好ましくは約2.0%〜約4.0%、(ベンダムスチンの面積百分率)に設定することを包含する改良を包括する。この態様の一面は、HP1に関する放出仕様を1.5%(ベンダムスチンの面積百分率)より少ないかもしくはそれと同等に設定することを包含するベンダムスチン製品に関する官庁認可を得るための方法である。このベンダムスチン製品は放出時に約0.5%(ベンダムスチンの面積百分率)より多くないHP1を含有する。
【0039】
別の態様は、ベンダムスチン製品に関する官庁認可を得るための方法であって、製品が約2℃〜約30℃において貯蔵される場合にベンダムスチン分解物に関する貯蔵寿命仕様を少なくとも約7.0%、好ましくは約5.0〜7.0%(ベンダムスチンの面積百分率)に設定する改良である。好ましい貯蔵温度は約5℃およびほぼ室温である。このベンダムスチン製品は放出時に約0.5%(ベンダムスチンの面積百分率)より多くないHP1を含有する。
【0040】
本発明の別の態様は、最終製品中のベンダムスチン分解物の濃度を、放出時に、ベンダムスチン分解物の濃度が約4.0%より少なく、好ましくは約2.0%〜約4.0%(ベンダムスチンの面積百分率)より少なくなるように、或いはそうでない方法でここに記載された製薬学的組成物を得るように調節することを包含するベンダムスチンの凍結乾燥調合物の製造方法である。このベンダムスチン製品は放出時に約0.5%〜約0.9%、好ましくは約0.5%、(ベンダムスチンの面積百分率)より多くないHP1を含有する。
【0041】
本発明は、約2℃〜約30℃において貯蔵される場合に最終製品中のベンダムスチン分解物の濃度を、放出時に、HP1の濃度が0.9%、好ましくは0.5%、(ベンダムスチンの面積百分率)より少なく、且つ製品有効期限時にベンダムスチン分解物の濃度が7.0%より少なく、好ましくは約5.0%〜約7.0%より多くなくなるように調節することを含んでなるベンダムスチンの凍結乾燥調合物の製造方法を開示する。
【0042】
本発明の別の態様は、溶液または分散液が凍結乾燥中に製造されるHP1の量が約0〜24時間にわたり0.9%(ベンダムスチンの面積百分率)、好ましくは0.50%、好ましくは0.45%、より好ましくは0.40%、より好ましくは0.35%、さらにより好ましくは0.30%を越えないようにベンダムスチンの分解水準を減ずる少なくとも1種の安定化濃度の有機溶媒を含んでなる、1種もしくはそれ以上の有機溶媒を含んでなるベンダムスチン凍結乾燥前溶液または分散液である。この態様の一面は、凍結乾燥前溶液または分散液から製造される凍結乾燥粉末である。
【0043】
本発明のさらに別の面は、溶液または分散液が凍結乾燥中に製造されるベンダムスチンエチルエステルの量が約0〜24時間にわたり約0.5%(ベンダムスチンの面積百分率)を越えないようにベンダムスチンの分解水準を減ずる少なくとも1種の安定化濃度の有機溶媒を含んでなる、1種もしくはそれ以上の有機溶媒を含んでなるベンダムスチン凍結乾燥前溶液または分散液である。この態様の一面は、凍結乾燥前溶液または分散液から製造される凍結乾燥粉末である。
【0044】
本発明のさらに別の態様は、溶液または分散液が凍結乾燥中に製造されるベンダムスチ
ンエチルエステル(式IVで示される)の量が約0〜24時間にわたり凍結乾燥溶液を製
造するために使用される薬品物質の中で見出されるベンダムスチンエチルエステルの濃度
より0.2%、好ましくは0.1%、より多くないようにベンダムスチンの分解水準を減
ずる少なくとも1種の安定化濃度の有機溶媒を含んでなる、1種もしくはそれ以上の有機
溶媒を含んでなるベンダムスチン凍結乾燥前溶液または分散液である。好ましい有機溶媒
は第三級ブタノールである。
【0045】
本発明はまた、溶液または分散液がベンダムスチンを安定化濃度の約5%〜約100%(v/v)の間のアルコールのアルコール溶媒の中に溶解させて凍結乾燥前溶液を生成し、そして凍結乾燥前溶液を凍結乾燥することを含んでなるベンダムスチン凍結乾燥調合物を製造する方法も開示し、ここで該方法から製造される該ベンダムスチン凍結乾燥調合物が約0.5%〜約0.9%、好ましくは0.5%、(ベンダムスチンの面積百分率)より多くない式IIで示されるHP1を含有し、ここで該HP1が放出時にまたはベンダムスチンの凍結乾燥製薬学的組成物の再構成後の時間ゼロにおいて存在するHP1の量である。別のアルコール濃度は約5%〜約99.9%、約5%〜約70%、約5%〜約60%、約5%〜約50%、約5%〜約40%、約20%〜約35%を包含する。アルコールの好ましい濃度は約20%〜約30%である。好ましいアルコールはメタノール、エタノール、プロパノール、イソ−プロパノール、ブタノール、および第三級−ブタノールの1種もしくはそれ以上を包含する。より好ましいアルコールは第三級−ブタノールである。第三級−ブタノールの好ましい濃度は約20%〜約30%、好ましくは約30%である。本発明の一面は、凍結乾燥前の賦形剤の添加である。好ましい賦形剤はマンニトールである。ベンダムスチンの好ましい凍結乾燥前濃度は約2mg/mL〜50mg/mLである。
【0046】
ベンダムスチン凍結乾燥調合物の好ましい製造方法では、凍結乾燥前溶液の凍結乾燥はi)凍結乾燥前溶液を約−40℃、好ましくは−50℃より低い温度で凍結して凍結溶液を生成せしめ、ii)凍結溶液を−40℃もしくはそれ以下、好ましくは−50℃に少なくとも2時間にわたり保ち、iii)凍結溶液を約−40℃〜約−10℃の間の第一乾燥温度に徐々に上げて乾燥溶液を生成せしめ、iv)約10〜約70時間にわたり保ち、v)乾燥溶液を約25℃〜約40℃の間の第二乾燥温度に徐々に上げ、そしてvii)約5〜約40時間にわたり保ってベンダムスチン凍結乾燥調合物を生成せしめることを含んでなる。さらに好ましい方法では、凍結乾燥前溶液の凍結乾燥はi)凍結乾燥前溶液を約−50℃より低い温度で凍結して凍結溶液を生成し、ii)凍結溶液を約−50℃に少なくとも2時間〜約4時間にわたり保ち、iii)約−20℃〜約−12℃の間の第一乾燥温度に徐々に上げて乾燥溶液を生成せしめ、iv)第一乾燥温度を約10〜約48時間にわたり保ち、v)乾燥溶液を約25℃〜約40℃の間の第二乾燥温度に徐々に上げ、そしてvi)第二乾燥温度を少なくとも約5時間から約20時間までにわたり保つことを含んでなる。好ましいアルコールは第三級−ブタノールである。第三級ブタノールの好ましい濃度は約20%〜30%、好ましくは約30%、である。この態様の一面は、凍結乾燥前の賦形剤の添加である。好ましい賦形剤はマンニトールである。ベンダムスチンの好ましい凍結乾燥濃度は約2mg/mL〜50mg/mLである。
【0047】
本発明の別の態様は、ここに開示されたベンダムスチン凍結乾燥調合物の製造方法から得られる凍結乾燥粉末または調合物である。
【0048】
本発明は、また、賦形剤および安定化濃度の有機溶媒を包含する凍結乾燥用のベンダムスチン調剤も包括する。好ましい調剤は約15mg/mLの濃度のベンダムスチン、約25.5mg/mLの濃度のマンニトール、約30%(v/v)の濃度の第三級−ブチルアルコールおよび水を包含する。本発明のこの態様にはそのようなベンダムスチン調剤から製造される凍結乾燥調合物が包含される。
【0049】
本発明には、治療的に有効な量の本発明の製薬学的組成物を投与することを含む患者における該調合物を用いる処置を受容可能な医学的症状を処置する方法が包含される。本発明の組成物を用いる処置を受容可能な医学的症状は慢性リンパ性白血病(CLL)、ホジキン病、非−ホジキンリンパ腫(NHL)、多発性骨髄腫(MM)、乳癌、小細胞肺癌、高増殖性疾病および自己免疫疾病を包含する。好ましい症状はNHL、CLL、乳癌、およびMMを包含する。好ましい自己免疫疾病は慢性関節リウマチ、多発性硬化症または狼瘡である。
【0050】
本発明には、治療的に有効な量の本発明の製薬学的組成物を投与することを包括する患者における該調合物を用いる処置を受容可能なここで規定されたような医学的症状の処置のための薬品の製造における本発明の製薬学的組成物または製薬学的調合物の使用が包含される。
【0051】
本発明には、本発明の製薬学的組成物を1種もしくはそれ以上の抗−新生物剤と組み合わせ、ここで該抗新生物剤が本発明の製薬学的組成物の投与の前に、同時に、または後に与えられるような処置方法も包含される。好ましい抗新生物剤はCD20に特異的な抗体である。本発明の別の態様は、本発明の凍結乾燥ベンダムスチン調合物を製造するための凍結乾燥サイクルである。好ましい凍結乾燥サイクルは、a)約−50℃に約8時間にわたり凍結し、b)−50℃に約4時間にわたり保ち、c)約−25℃に約3時間にわたり徐々に上げ、d)約−10℃に30時間にわたり保ち、e)約25℃〜約40℃の間もしくはそれより高く約3時間にわたり徐々に上げ、f)約25℃〜約40℃の間に約25時間にわたり保ち、g)約20℃に1時間にわたり徐々に上げ、h)密封される製薬学的に許容可能な容器中に約5℃で約13.5psiの圧力において入れることを含んでなり、ここで圧力は第一回乾燥中の約150ミクロンおよび第二回乾燥中の50ミクロンである。本発明の一面は、約30−35℃に約3時間にわたり勾配がつけられそして40℃に約5時間にわたり勾配がつけられる段階(e)を包括する。この態様の別の面は、そのような凍結乾燥サイクルから製造される凍結乾燥粉末である。より好ましい凍結乾燥サイクルは、i)充填のための約5℃の貯蔵温度で開始し、ii)約−50℃に約8時間にわたり凍結し、iii)−50℃に約4時間にわたり保ち、iv)約−20℃に約3時間にわたり徐々に上げ、v)約−20℃に6時間にわたり保ち、約−15℃に約1時間にわたり徐々に上げ、vi)−15℃に約20時間にわたり保ち、vii)約−15℃に約1時間にわたり徐々に上げ、viii)約−15℃に約20時間にわたり保ち、ix)約−12℃に約0.5時間にわたり徐々に上げ、x)約−12℃に約15.5時間にわたり保ち、xi)約25℃〜約40℃の間にもしくはそれより高く約15時間にわたり徐々に上げ、xii)約25℃〜約40℃の間に約10時間にわたり保ち、xiii)約40℃に約1時間にわたり徐々に上げ、そしてxiv)約40℃に約5時間にわたり保つことを含んでなり、密封される製薬学的に許容可能な容器中に約5℃で約13.5psiの圧力において入れ、ここで圧力は第一回乾燥中の約150ミクロンおよび第二回乾燥中の50ミクロンである。好ましい態様では、段階(xi)は約30−35℃に約15時間にわたり勾配が
つけられる。
【0052】
本発明は、また、約0.5%〜約0.9%、好ましくは0.5%、(ベンダムスチンの面積百分率)より多くないHP1を含有するベンダムスチン製薬学的薬用量形態であって、ここで該薬用量形態がバイアルまたは他の製薬学的に許容可能な容器を含んでなり、ここで該HP1が再構成前または該薬用量形態の再構成後の時間ゼロにおいて存在するHP1の量である製薬学的薬用量形態も包括する。ベンダムスチンの好ましい濃度は約10〜約500mg/容器、約100mg/容器、約5mg〜約2g/容器および約170mg/容器を包含する。
【0053】
本発明はまたベンダムスチンの凍結乾燥前製薬学的組成物も包含する。好ましい凍結乾燥前組成物は約15mg/mLのベンダムスチンHCl、約25.5mg/mLのマンニトール、約30%(v/v)の第三級−ブチルアルコールおよび水を包含する。
【0054】
本発明のこれらのおよび他の態様は以下に記載されているかまたは以下の開示に基づき当業者には明らかである。
【図面の簡単な説明】
【0055】
【図1】図1は、2種のベンダムスチンの第三級ブタノール中溶液に関する種々の温度におけるベンダムスチンの溶解度を示す。
【図2】図2は、ベンダムスチンを種々のアルコール類の中で24時間にわたり5℃において培養した後のHPLC分析の純度結果を示す。結果はベンダムスチンピークの面積百分率として表示される。
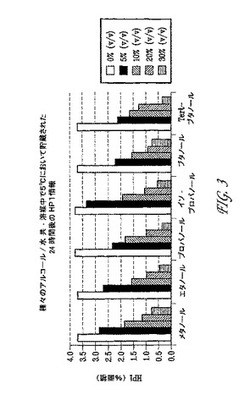
【図3】図3は、種々のアルコール/水の共−溶媒の中での5℃における24時間後のHP1(式II)生成を示す。
【図4】図4は、種々のアルコール/水の共−溶媒の中での5℃における24時間後の二量体(式III)生成を示す。
【図5】図5は、TBA/水の共−溶媒を用いるベンダムスチンに関する凍結乾燥サイクルを示す。
【図6】図6はHPLC方法番号1を用いるリボムスチン(R)に関するクロマトグラムを示す。
【発明を実施するための形態】
【0056】
ここで使用される用語「調剤」は哺乳動物患者、好ましくは人間、に対する投与に適する形態の薬品、例えば、ベンダムスチン、の調合物をさす。それ故、「調剤」は製薬学的に許容可能な賦形剤、希釈剤、または担体の添加を包含しうる。
【0057】
ここで使用される用語「凍結乾燥粉末」または「凍結乾燥調合物」は水溶液の凍結乾燥、すなわち、凍結−乾燥、により得られるいずれかの固体物質をさす。水溶液は非−水性溶媒を含有することができ、すなわち水性および1種もしくはそれ以上の非−水性溶媒より構成されうる。好ましくは、凍結乾燥調合物は固体物質が水性および1種もしくはそれ以上の非−水性溶媒より構成される溶液を凍結−乾燥することにより得られるものであり、より好ましくは非−水性溶媒はアルコールである。
【0058】
「安定な製薬学的組成物」によると、製薬学的製品としての有用性を有するのに充分な安定性を有するいずれかの製薬学的組成物が意味される。好ましくは、安定な製薬学的組成物は好ましくは−20℃〜40℃、より好ましくは約2℃〜約30℃の間の便利な温度における妥当な期間、例えば、1ヶ月ほどの短さでありうるが典型的には6ヶ月もしくはそれ以上、より好ましくは24ヶ月もしくはそれ以上、そしてより好ましくは36ヶ月もしくはそれ以上である製品の貯蔵−寿命、にわたる貯蔵を可能にするのに充分な安定性を有する。貯蔵−寿命または有効期限は、活性成分が90%純度より低い点まで分解する時間量でありうる。本発明の目的のためには、安定な製薬学的組成物はここに記載された具体的な範囲の不純物を有する製薬学的組成物への言及を包含する。好ましくは、安定な製薬学的組成物は活性成分の最少の分解があるものであり、例えばそれは2〜30℃における2〜3年間の期間にわたる貯蔵後に少なくとも約85%、好ましくは少なくとも90%、そしてより好ましくは少なくとも約95%の分解されない活性成分を保有する。
「安定な凍結乾燥調合物」によると、製薬学的製品としての有用性を有するための充分な安定性、例えば安定な製薬学的組成物に関してここで同様に定義されたような特性、を有するいずれかの凍結乾燥調合物が意味される。
【0059】
「分解された」によると、活性成分が化学構造における変化を受けたことを意味する。
【0060】
ここで使用される用語「治療的に有効な量」は、処置される疾患の1種もしくはそれ以上の徴候をある程度緩和するであろう化合物の投与量をさす。新生物の処置に言及すると、治療的に有効な量は(1)腫瘍の寸法を減ずる、(2)腫瘍転移を抑制する(すなわち、ある程度遅らせ、好ましくは停止させる)、(3)腫瘍成長をある程度抑制する(すなわち、ある程度遅らせ、好ましくは停止させる)、および/または、(4)癌に伴う1種もしくはそれ以上の徴候をある程度緩和する(もしくは、好ましくは、排除する)効果を有する量をさす。治療的に有効な量は、疾病に罹り易いが疾病の徴候をまだ体験または示さない動物における疾病発生の防止も意味する(予防処置)。さらに、治療的に有効な量は末期疾患に罹っている患者の余命を延ばす量でもありうる。非−ホジキンリンパ腫の処置のためのベンダムスチンに関する典型的な治療的に有効な服用量は2連続日にわたる単一服用量としての約60〜120mg/m2でありうる。サイクルを3〜4週間毎に繰り返すことができる。慢性リンパ性白血病(CLL)の処置のためには、ベンダムスチンは1および2日目に約80〜100mg/m2で与えることができ、サイクルを4週間後毎に繰り返すことができる。ホジキン病(段階II〜IV)の処置のためには、ベンダムスチンは1および15日目における25mg/m2のダウロルビシン、1および15日目における10mg/m2のブレオマイシン、1および15日目における1.4mg/m2のビンクリスチン、並びに1〜5日目における50mg/m2のベンダムスチンで「DBVBe処方」において与えられ、約4週間毎のサイクルを繰り返す。乳癌に関すると、1および8日目におけるベンダムスチン(120mg/m2)を1および8日目における40mg/m2のメトトレキセートおよび1および8日目における600mg/m2のフルオロウラシルと組み合わせて与えることができ、サイクルを約4週間毎に繰り返す。乳癌に関する別系統の療法として、ベンダムスチンを1および2日目に約100〜150mg/m2で与えることができ、サイクルを約4週間毎に繰り返す。
【0061】
ここで使用される「新生物」は、成長の通常の制限を受けない細胞の増殖のために起きる成長の如き異常成長である新生物生成をさす。ここで使用される「抗−新生物剤」は細胞の新生物表現型を抑制し、除去し、遅らせ、または逆転するいずれかの化合物、組成物、混合物、共同混合物、または配合物である。
【0062】
ここで使用される「高増殖」は特定の成長因子に応答する細胞の過剰生成である。「高増殖性疾患」は特定の成長因子に応答して細胞が過剰生成する疾病である。そのような「高増殖性疾患」の例は糖尿病性網膜症、乾癬、子宮内膜症、癌、斑変性疾患および良性成長疾患、例えば前立腺肥大を包含する。
【0063】
ここで使用される用語「バイアル」は、硬質または軟質のどちらかの、いずれかの壁のある容器をさす。
【0064】
ここで使用される「調節する」は調節される事象の達成を促進させるためにその場で調節を行うことを意味する。例えば、特定の場合には、「調節する」は各ロットまたは多くのロットの試料を規則的にまたは無作為に試験し;分解物の濃度を放出仕様として設定し;工程条件、例えば凍結乾燥前溶液または分散液中でのアルコールおよび/または他の有機溶媒の使用を選択して、活性成分の分解物の濃度が許容不能なほど高くなくするなどを意味しうる。分解物の量に関する放出仕様を設定することによる分解物に関する調節を使用して規制官庁、例えば米国食品医薬品局および他の国々または地域における同様な官庁(「官庁」)、による製薬学的製品の規制認可を早めることができる。
【0065】
ここで使用される用語「製薬学的に許容可能な」は、成分が薬理学的活性の許容不能な損失または許容不能な悪質な副作用を引き起こさないようなもの、例えば、製薬学的組成物の容器を包含する成分を意味する。製薬学的に許容可能な成分の例は、米国薬局方(USP)、1990年にメリーランド州ロックビルで開催された米国薬局方会議において採択された米国国民医薬品集(NF)、および米国食品医薬品局により発行されたEDA不活性成分指針1990、1996(両方とも図面を包含して引用することにより本発明の内容となる)に示されている。USP/NF以外の必然的な制限および/または仕様に合う他の等級の溶液または成分を使用することもできる。
【0066】
ここで使用される用語「製薬学的組成物」は、それが人間への投与に適する、例えば、それがGMP条件下で製造されるような、例えばそれが製薬学的に許容可能な賦形剤、例えば限定するものではないが安定剤、バルキング剤、緩衝剤、担体、希釈剤、賦形剤、溶解剤、および結合剤を含有するような条件下で製造されるような組成物を意味する。ここで使用される製薬学的組成物は凍結乾燥前溶液または分散液並びに凍結乾燥調合物の再構
成後の注射または注入の準備がなされている液体形態を包含するが、それらに限定されない。
【0067】
ここで使用される「製薬学的薬用量形態」は、容器内にありそして1回もしくはそれ以上の服用量、典型的には約1〜2、1〜3、1〜4、1〜5、1〜6、1〜10、もしく約1〜20回の服用量、の再構成および投与に適する量のここに開示されている製薬学的組成物を意味する。好ましくは、ここで使用される「製薬学的薬用量形態」は、容器内にありそして1回もしくはそれ以上の服用量、典型的には約1〜2、1〜3、1〜4、1〜5、1〜6、1〜10、もしくは約1〜20回の服用量の再構成および分配に適する量のここに開示されている製薬学的組成物を意味する。製薬学的薬用量形態はバイアルもしくは注射器または他の適当な製薬学的に許容可能な容器を含んでなりうる。注射または注入使用に適する製薬学的薬用量形態は、殺菌性の注射可能もしくは注入可能な溶液または分散液の処方箋調合物用に適合させた活性成分を含んでなる殺菌性の水性溶液もしくは分散液または殺菌性粉末を包含しうる。全ての場合に、最終的な薬用量形態は製造および貯蔵の条件下で殺菌性であり、流動性であり且つ安定性でなければならない。液体の担体または賦形剤は、例えば、水、エタノール、ポリオール、例えばグリセロール、プロピレングリコールもしくは液体ポリエチレングリコール類など、植物油、無毒のグリセリルエステル類、およびそれらの適当な混合物を含んでなる溶媒または液体分散媒体でありうる。微生物の成長の防止は、種々の抗細菌および抗カビ・菌剤、例えば、パラベン類、クロロブタノール、フェノール、ソルビン酸、チオメロサルなどにより行うことができる。
【0068】
ここで使用される用語「賦形剤」は製薬学的調剤中で活性な製薬学的成分(API)を調合するために使用される物質を意味し、好ましい態様では、賦形剤はAPIの主要な治療効果を低下もしくは妨害しない。好ましくは、賦形剤は治療的に不活性である。用語「賦形剤」は担体、希釈剤、ビヒクル、溶解剤、安定剤、バルキング剤、および結合剤を包括する。賦形剤はまた、製造工程の間接的なまたは意図せぬ結果として製薬学的調剤中に存在する物質でもありうる。好ましくは、賦形剤は人間および動物投与に関して安全であると認可されまたはみなされており、すなわち、(一般的に安全性に関する)GRAS物質である。GRAS物質は、引用することにより本発明の内容となる連邦規制法(CFR)食品および医薬品投与21CFR§182および21CFR§184により挙げられている。好ましい賦形剤はマンニトール類などを包含するヘキシトール類を包含するが、それらに限定されない。
【0069】
ここで使用される「有機溶媒の安定化濃度」または「アルコールの安定化濃度」は、最終薬品製品の中で特定水準の分解物を得るためにベンダムスチンの分解水準を減ずる有機溶媒またはアルコールの量を意味する。例えば、分解物HP1に関すると、有機溶媒の安定化濃度は約0.5%より低い、好ましくは約0.45%より低い、好ましくは約0.40%より低い、より好ましくは約0.35%より低い、より好ましくは約0.30%より低い、そしてさらにより好ましくは約0.25%より低いHP1濃度(ベンダムスチンの面積百分率)をもたらす量である。最終薬品製品の全体的なすなわち合計の分解物濃度に関すると、有機溶媒の安定化濃度は約7%(ベンダムスチンの面積百分率)より低い、好ましくは約6%より低い、より好ましくは約5%より低い、そしてさらにより好ましくは約4.0%より低い、(薬品製品放出時における)合計の分解物濃度をもたらす量である。「ベンダムスチンの面積百分率」によると、例えば、HPLCにより測定されるベンダムスチンの量に関する特定の分解物、例えば、HP1の量が意味される。
【0070】
用語「有機溶媒」は、他の物質を溶解しうる有機物質、一般的には液体を意味する。
【0071】
ここで使用される用語「有機溶媒の痕跡量」は、例えば、ICH指針(International Conferences on Harmonization,Impu
rities-Guidelines for Residual Solvents.Q3C.Federal Register.1997;62(247):67377)により推奨されるような製薬学的製品に関する推奨水準と同等またはそれより少ない溶媒の量を意味する。下限は検出されうる最低量である。
【0072】
用語「放出」または「放出時」は、薬品製品が放出仕様に合致しておりそしてその意図する製薬学的目的のために使用できることを意味する。
【0073】
A.一般論
本発明はベンダムスチンから製造される安定な製薬学的に許容可能な組成物を提供する。特に、本発明はベンダムスチンHClの凍結乾燥用の調剤を提供する。そのような調剤から得られる凍結乾燥粉末はベンダムスチンの現在入手可能な凍結乾燥粉末より容易に再構成される。さらに、本発明の凍結乾燥製品は、再構成前に、凍結乾燥物の貯蔵時に、または再構成および混合後に、ある種の不純物、特にHP1、ベンダムスチン二量体、およびベンダムスチンエチルエステル、に関してリボムスチン(R)より良好な不純物特徴を有する。
【0074】
本発明はさらに、新生物疾病を処置するために有用なベンダムスチンの調剤も提供する。ここに記載された調剤は単独でまたは少なくとも1種の他の抗−新生物剤および/または放射活性療法と組み合わせて投与することができる。
【0075】
本発明の一面は、凍結乾燥工程の前もしくは最中に、貯蔵時にまたは再構成時にベンダムスチンの安定性を高めるための条件および手段である。
【0076】
本発明の調剤と組み合わされて使用できる抗−新生物剤は、the Merck Index 11,pp 16−17,Merck & Co.,Inc.(1989)およびThe Chemotherapy Source Book(1997)に示されているものを包含する。両方の文献は広く認識されておりそして当業者には容易に入手可能である。
【0077】
商業的使用において、臨床評価において、そして非−臨床開発において利用可能な組み合わせ薬品化学療法による新生物の処置のために選択できる多くの抗新生物剤がある。そのような抗新生物剤は数種の主要な種類、すなわち、抗生物質−タイプ剤、共有DNA−結合薬品、抗代謝剤、例えばプレドニソン(prednisone)およびデキサメタソン(dexamethasone)の如きグルココルチコイド類を包含するホルモン剤、免疫剤、インターフェロン−タイプ剤、例えばレチノイド類の如き分化剤、プロ−アポプトシス剤、並びに例えばアンチセンス(antisense)、小さい妨害RNAの如き化合物を包含するある種の混成剤に入る。或いは、他の抗−新生物剤、例えばメタロマトリックス・プロテアーゼ(MMP)阻害剤、SOD模造物質またはアルファvベータ3阻害剤を使用することができる。
【0078】
本発明の化合物と組み合わせて使用できる抗新生物の一群は抗代謝−タイプの抗新生物剤よりなる。適する抗代謝抗新生物剤は、アラノシン(alanosine)、AG2037(フィッツァー(Pfizer))、5−FU−フィブリノーゲン(5−FU−fibrinogen)、アカンチフォリック・アシド(acanthifolic acid)、アミノチアジアゾール(aminothiadiazole)、ブレキナー・ナトリウム(brequinar sodium)、カルモフル(carmofur)、チバ−ガイギーCGP−30694(Ciba−Geigy CGP−30694)、シクロペンチル・シトシン(cyclopentyl cytosine)、ステアリン酸燐酸シタラビン(cytarabine phosphate stearate)、シタラビン・コンジュゲート類(cytarabine conjugates)、リリー・DATHF(Lilly DATHF)、メレル・ダウ・DDFC(Merrel Dow DDFC)、デザグアニン(dezaguanine)、ジデオキシシチジン(dideoxycytidine)、ジデオキシグアノシン(dideoxyguanosine)、ジドックス(didox)、ヨシトミ・DMDC(Yoshitomi DMDC)、ドキシフルリジン(doxifluridine)、ウェルカム・EHNA(Wellcome EHNA)、メルク・アンド・カンパニー・EX−015(Merck & Co.EX−015)、ファザラビン(fazarabine)、フロクスリジン(floxuridine)、燐酸フルダラビン(fludarabine phosphate)、5−フルオロウラシル(5−fluorouracil)、N−(2’−フラニジル)−5−フルオロウラシル(N−(2’−furanidyl)−5−fluorouracil)、ダイイチ・セイヤク・FO−152(Daiichi Seiyaku FO−152)、イソプロピル・ピロリジン(isopropyl pyrrolizine)、リリー・LY−188011(Lilly LY−188011)、リリー・LY−264618(Lilly LY−264618)、メトベンザプリム(methobenzaprim)、メトトレキセート(methotrexate)、ウェルカム・MZPES(Wellcome MZPES)、ノルスペルミジン(norspermidine)、NCI NSC−127716、NCI NSC−264880、NCI NSC−39661、NCI NSC−612567、ワーナー−ランバート・PALA(Warner−Lambert PALA)、ペントスタチン(pentostatin)、ピリトレキシム(piritrexim)、プリカマイシン(plicamycin)、アサヒ・ケミカル・PL−AC(Asahi Chemical PL−AC)、タケダ・TAC−788(Takeda TAC−788)、チオグアニン(thioguanine)、チアゾフリン(tiazofurin)、エルバモント・TIF(Erbamont TIF)、トリメトレキセート(trimetrexate)、チロシン・キナーゼ(tyrosine kinase)阻害剤、チロシン・プレテイン・キナーゼ(tyrosine pretein kinase)阻害剤、タイホウ・UFT(Taiho UFT)およびウリシチン(uricytin)よりなる群から選択されうる。
【0079】
本発明の化合物と組み合わせて使用できる抗新生物剤の第二群は共有DNA−結合剤よりなる。適するアルキル化−タイプの抗新生物剤はシオノギ・254−S(Shionogi 254−S)、アルド−ホスファミド(aldo−phosphamide)同族体、アルトレタミン(altretamine)、アナキシロン(anaxirone)、ベーリンゲル・マンハイム・BBR−2207(Boehringer Mannheim BBR−2207)、ベストラブシル(bestrabucil)、ブドチタン(budotitane)、ワクナガ・CA−102(Wakunaga CA−102)、カルボプラチン(carboplatin)、カルムスチン(carmustine)、チノイン−139(Chinoin−139)、チノイン−153(Chinoin−153)、クロランブシル(chlorambucil)、シスプラチン(cysplatin)、シクロホスファミド(cyclophosphamide)、アメリカン・シアナミド・CL−286558(American Cyanamid CL−286558)、サノフィ・CY−233(Sanofi CY−233)、シプラテート(cyplatate)、デグッサ・D−19−384(Degussa D−19−384)、スミモト・DACHP(Myr)2(Sumimoto DACHP(Myr)2)、ジフェニルスピロムスチン(diphenylspiromustine)、ジプラチナム・シトスタティック(diplatinum cytostatic)、エルバ・ジスタマイシン(Erba distamycin)誘導体、チュウガイ・DWA−2114R(Chugai DWA−2114R)、ITI E09、エルムスチン(elmustine)、エルバモント・FCE−24517(Erbamont FCE−24517)、エストラムスチン・フォスフェート・ナトリウム(estramustine phosphate sodium)、フォテムスチン(fotemustine)、ユニメド・G−6−M(Umimed G−6−M)、チノイン・GYKI−17230(Chinoin GYKI−17230)、ヘプスル−ファム(hepsul−fam)、イフォスファミド(ifosfamide)、イプロプラチン(iproplatin)、ロムスチン(lomustine)、マフォスファミド(mafosfamide)、メルファラン(melphalan)、ミトラクトール(mitolactol)、ニッポン・カガク・NK−121(Nippon Kayaku NK−121)、NCI NSC−264395、NCI NSC−342215、オキサリプラチン(oxaliplatin)、アップジョン・PCNU(Upjohn PCNU)、プレドニムスチン(prednimustine)、プロター・PTT−119(Proter PTT−119)、ラニムスチン(ranimustine)、セムスチン(semustine)、スミスクライン・SK&F−101772(SmithKline SK&F−101772)、ヤクルト・ホンシャ・SN−22(Yakult Honsha SN−22)、スピロムスチン(spiromustine)、タナベ・セイヤク・TA−077(Tanabe Seiyaku TA−077)、タウロムスチン(tauromustine)、テモゾロミド(temozolomide)、テロキシロン(teroxirone)、テトラプラチン(tetraplatin)およびトリメラモル(trimelamol)よりなる群から選択されうる。
【0080】
ここに開示された化合物と組み合わせて使用できる抗新生物剤の別の群は抗生物質−タイプ抗新生物剤よりなる。適する抗生物質−タイプ抗新生物剤はタイホウ・4181−A(Taiho 4181−A)、アクラルビシン(aclarubicin)、アクチノマイシン・D(actinomycin D)、アンチノプラノン(actinoplanone)、アラノシン(alanosine)、エルバモント・ADR−456(Erbamont ADR−456)、アエロプリシニン(aeroplysinin)誘導体、アジノモト・AN−201−II(Ajinomoto AN−201−II)、アジノモト・AN−3(Ajinomoto AN−3)、ニッポン・ソーダ・アニソマイシン類(Nippon Soda anisomycins)、アンスラシクリン(anthracycline)、アジノ−マイシン−A(azino−mycin−A)、ビスカベリン(bisucaberin)、ブリストール−マイヤーズ・BL−6859(Bristol−Myers BMY−6859)、ブリストール−マイヤーズ・BMY−25067(Bristol−Myers BMY−25067)、ブリストール−マイヤーズ・BMY−25551(Bristol−Myers BMY−25551)、ブリストール−マイヤーズ・BMY−26605(Bristol−Myers BMY−26605)、ブリストール−マイヤーズ・BMY−27557(Bristol−Myers BMY−27557)、ブリストール−マイヤーズ・BMY−28438(Bristol−Myers BMY−28438)、硫酸ブレオマイシン(bleomycin sulfate)、ブリオスタチン−1(bryostatin−1)、タイホウ・C−1027(Taiho C−1027)、カリケマイシン(calichemycin)、クロモキシマイシン(chromoximycin)、ダクチノマイシン(dactinomycin)、ダウノルビシン(daunorubicin)、キョウワ・ハッコウ・DC−102(Kyowa Hakko DC−102)、キョウワ・ハッコウ・DC−79(Kyowa Hakko DC−79)、キョウワ・ハッコウ・DC88−A(Kyowa Hakko DC88−A)、キョウワ・ハッコウ・DC89−A1(Kyowa Hakko DC89−A1)、キョウワ・ハッコウ・DC92−B(Kyowa Hakko DC92−B)、ジトリサルビシン・B(ditrisarubicin B)、シオノギ・DOB−41(Shionogi DOB−41)、ドキソルビシン(doxorubicin)、ドキソルビシン−フィブリノーゲン(doxorubicin−fibrinogen)、エルサミシン−A(elsamicin−A)、エピルビシン(epirubicin)、エルブスタチン(erbstatin)、エソルビシン(esorubicin)、エスペラミシン−A1(esperamicin−A1)、エスペラミシン−A1b(esperamicin−A1b)、エルバモント・FCE−21954(Erbamont FCE−21954)、フジサワ・FK−973(Fujisawa FK−973)、フォストリエシン(fostriecin)、フジサワ・FR−900482(Fujisawa FR−900482)、グリドバクチン(glidobactin)、グレガチン−A(gregatin−A)、グリンカマイシン(grincamycin)、ヘルビマイシン(herbimycin)、イダルビシン(idarubicin)、イルジン類(illudins)、カズサマイシン(kazusamycin)、ケサリロージン類(kesarirhodins)、キョウワ・ハッコウ・KM−5539(Kyowa Hakko KM−5539)、キリン・ブレヴェリー・KRN−8602(Kirin Brewery KRN−8602)、キョウワ・ハッコウ・KT−5432(Kyowa Hakko KT−5432)、キョウワ・ハッコウ・KT−5594(Kyowa Hakko KT−5594)、キョウワ・ハッコウ・KT−6149(Kyowa Hakko KT−6149)、アメリカン・シアナミド・LL−D49194(American Cyanamid LL−D49194)、メイジ・セイカ・ME2303(Meiji Seika ME 2303)、メノガリル(menogaril)、ミトマイシン(mitomycin)、ミトキサントロン(mitoxantrone)、スミスクライン・M−TAG(SmithKline M−TAG)、ネオエナクチン(neoenactin)、ニッポン・カガク・NK−313(Nippon Kayaku NK−313)、ニッポン・カガク・NKT−01(Nippon Kayaku NKT−01)、SRI・インターナショナル・NSC−357704(SRI International NSC−357704)、オキサリシン(oxalysine)、オキサウノマイシン(oxaunomycin)、ペプロマイシン(peplomycin)、ピラチン(pilatin)、ピラルビシン(pirarubicin)、ポロスラマイシン(porothramycin)、ピリンダマイシン・A(pyrindamycin A)、トビシ・RA−I(Tobishi RA−I)、ラパマイシン(rapamycin)、リゾキシン(rhizoxin)、ロドルビシン(rodorubicin)、シバノミシン(sibanomicin)、シウェンマイシン(siwenmycin)、スミトモ・SM−5887(Sumitomo SM−5887)、スノウ・ブランド・SN−706(Snow Brand SN−706)、スノウ・ブランド・SN−07(Snow Brand SN−07)、ソランギシン−A(sorangicin−A)、スパルソマイシン(sparsomycin)、SS・ファーマシューティカル・SS−21020(SS Pharmaceutical SS−21020)、SS・ファーマシューティカル・SS−7313B(SS Pharmaceutical SS−7313B)、SS・ファーマシューティカル・SS−9816B(SS Pharmaceutical SS−9816B)、ステフィマイシン・B(steffimycin B)、タイホウ・4181−2(Taiho 4181−2)、タリソマイシン(talisomycin)、タケダ・TAN−868A(Takeda TAN−868A)、テルペンテシン(terpentecin)、スラジン(thrazine)、トリクロザリン・A(tricrozarin A)、アップジョン・U−73975(Upjohn U−73975)、キョウワ・ハッコウ・UCN−10028A(Kyowa Hakko UCN−10028A)、フジサワ・WF−3405(Fujisawa WF−3405)、ヨシトミ・Y−25024(Yoshitomi Y−25024)およびゾルビシン(zorubicin)よりなる群から選択されうる。
【0081】
本発明の化合物と組み合わせて使用できる抗新生物剤の第四群はアルファ−カロテン(alpha−carotene)、アルファ−ジフルオロメチル−アルギニン(alpha−difluoromethyl−arginine)、アシトレチン(acitretin)、三酸化砒素、アバスチン(Avastin)(R)(ベバシズマブ(bevacizumab))、バイオテク・AD−5(Biotec AD−5)、キョウリン・AHC−52(Kyorin AHC−52)、アルストニン(alstonine)、アモナフィド(amonafide)、アンフェチニル(amphethinile)、アンサクリン(amsacrine)、アンギオスタット(Angiostat)、アンキノマイシン(ankinomycin)、アンチ−ネオプラストン・A10(anti−neoplaston A10)、アンチネオプラストン・A2(antineoplaston A2)、アンチネオプラストン・A3(antineoplaston A3)、アンチネオプラストン・A5(antineoplaston A5)、アンチネオプラストン・AS2−1(antineoplaston AS2−1)、ヘンケル・APD(Henkel APD)、アフィジコリン・グリシネート(aphidicolin glycinate)、アスパラギナーゼ(asparaginase)、アバロール(Avarol)、バッカリン(baccharin)、バトラシリン(batracylin)、ベンフルロン(benfluron)、ベンゾトリプト(benzotript)、イプセン−ビューフォア・BIM−23015(Ipsen−Beaufour BIM−23015)、ビサントレン(bisantrene)、ブリスト−マイヤーズ・BMY−40481(Bristo−Myers BMY−40481)、ベスター・ボロン−10(Vestar boron−10)、ブロモフスファミド(bromofosfamide)、ウェルカム・BW−502(Wellcome BW−502)、ウェルカム・BW−773(Wellcome BW−773)、カラセミド(caracemide)、カルメチゾール塩酸塩(carmethizole hydrochloride)、アジノモト・CDAF(Ajinomoto CDAF)、クロルスルファキノキサロン(chlorsulfaquinoxalone)、ケメス・CHX−2053(Chemes CHX−2053)、ケメックス・CHX−100(Chemex CHX−100)、ワーナー−ランバート・CI−921(Warner−Lambert CI−921)、ワーナー−ランバート・CI−937(Warner−Lambert CI−937)、ワーナー−ランバート・CI−941(Warner−Lambert CI−941)、ワーナー−ランバート・CI−958(Warner−Lambert CI−958)、クランフェヌル(clanfenur)、クラビリデノン(claviridenone)、ICN化合物1259、ICN化合物4711、コントラカン(Contracan)、ヤクルト・ホンシャ・CPT−11 (Yakult Honsha CPT−11)、クリスナトール(crisnatol)、クラデルム(curaderm)、シトチャラシン・B(cytochalasin B)、シタラビン(cytarabine)、シトシチン(cytocytin)、メルズ・D−609(Merz D−609)、DABIS・マレエート(DABIS maleate)、ダカルバジン(dacarbazine)、ダテリプチニウム(datelliptinium)、ジデムニン−B(didemnin−B)、ジヘマトポルフィリン・エーテル(dihaematoporphyrin ether)、ジヒドロレンペロン(dihydrolenperone)、ジナリン(dinaline)、ジスタマイシン(distamycin)、トウヨウ・ファーマー・DM−341(Toyo Pharmar DM−341)、トウヨウ・ファーマー・DM−75(Toyo Pharmar DM−75)、ダイイチ・セイヤク・DN−9693(Daiichi Seiyaku DN−9693)、エリプラビン(elliprabin)、エリプチニウム・アセテート(elliptinium acetate)、エポチオネス・ツムラ・EPMTC(epothiones Tsumura EPMTC)、エルビツックス(erbitux)、エルゴタミン(ergotamine)、エルロトニブ(erlotnib)、エトポシド(etoposide)、エトレチネート(etretinate)、フェンレチニド(fenretinide)、フジサワ・FR−57704(Fujisawa FR−57704)、ガリウム・ナイトレート(gallium nitrate)、ゲンクワダフニン(genkwadaphnin)、グリベック(Gleevec)(R)(イマトニブ(imatnib))、チュウガイ・GLA−43(Chugai GLA−43)、グラクソ・GR−63178(Glaxo GR−6318)、ゲフィチニブ(gefitinib)、グリフォラン・NMF−5N(grifolan NMF−5N)、ヘキサデシルホスホコリン(hexadecylphosphocholine)、グリーン・クロス・HO−221(Green Cross HO−221)、ホモハリントニン(homoharringtonine)、ヒドロキシウレア(hydroxyurea)、BTG IGRF−187、インダノシン(indanocine)、イルモフォシン(ilmofosine)、イソグルタミン(isoglutamine)、イソトレチノイン(isotretinoin)、オウツカ・JI−36(Otsuka JI−36)、ラモット・K−477(Ramot K−477)、オツアク・K−76COONa(Otsuak K−76COONa)、クレハ・ケミカル・K−AM(Kureha Chemical K−AM)、メクト・コープ・KI−8110(MECT Corp KI−8110)、アメリカン・シアナミド・L−623(American Cyanamid L−623)、リューコレグリン(leukoregulin)、ロニダミン(lonidamine)、ルンドベック・LU−23−112(Lundbeck LU−23−112)、リリー・LY−186641(Lilly LY−186641)、NCI(US)MAP、マリシン(marycin)、メフロクイン(mefloquine)、メレル・ダウ・MDL−27048(Merrel Dow MDL−27048)、メドコ・MEDR−340(Medco MEDR−340)、メルバロン(merbarone)、メロシアニン(merocyanine)誘導体、メチルアニリノアクリジン(methylanilinoacridine)、モレキュラー・ゲネティックス・MGI−136(Molecular Genetics MGI−136)、ミナクチビン(minactivin)、ミトナフィド(mitonafide)、ミトキドン(mitoquidone)、モピダモル(mopidamol)、モトレチニド(motretinide)、ゼンヤク・コウギョウ・MST−16(Zenyaku Kogyo MST−16)、N−(レチノイル)アミノ酸類、ニッシン・フラウー・ミリング・N−021(Nisshin Flour Milling N−021)、N−アシル化されたデヒドロアラニン類、ナファザトロム(nafazatrom)、タイショウ・NCU−190(Taisho NCU−190)、ノコダゾール(nocodazole)誘導体、ノルモサング(Normosang)、NCI NSC−145813、NCI NSC−361456、NCI NSC−604782、NCI NSC−95580、オクトレオチド(octreotide)、オノ・ONO−112(Ono ONO−112)、オキザノシン(oquizanocine)、アクゾ・Org−10172(Akzo Org−10172)、パクリタキセル(paclitaxel)、パンクラチスタチン(pancratistatin)、パゼリプチン(pazelliptine)、ワーナー−ランバート・PD−111707(Warner−Lambert PD−111707)、ワーナー−ランバート・PD−115934(Warner−Lambert PD−115934)、ワーナー−ランバート・PD−131141(Warner−Lambert PD−131141)、ピエール・ファブレ・PE−1001(Pierre Fabre PE−1001)、ICRT・ペプチド・D(ICRT peptide D)、ピロキサントロン(piroxantrone)、ポリヘマトポルフィリン(polyhaematoporphyrin)、ポリプレイック・アシド(polypreic acid)、エファモル・ポルフィリン(Efamol porphyrin)、プロビマン(probimane)、プロカルバジン(procarbazine)、プログルミド(proglumide)、インビトロン・プロテアーゼ・ネキシン・I(Invitron protease nexin I)、トビシ・RA−700(Tobishi RA−700)、ラゾキサン(razoxane)、サッポロ・ブレヴェリーズ・RBS(Sapporo Breweries RBS)、レストリクチン−P(restrictin−P)、レテリプチン(retelliptine)、レチノイン酸、ローン−プーラン・RP−49532(Rhone−Poulenc RP−49532)、ローン−プーラン・RP−56976(Rhone−Poulenc RP−56976)、リツキサン(Rituxan)(R)(および他の抗CD20抗体、例えばベックサー(Bexxar)(R)、ゼバリン(Zevalin)(R))、スミスクライン・SK&F−104864(SmithKline SK&F−104864)、スタチン類(statins)(リピトル(Lipitor)(R)など)、スミトモ・SM−108(Sumitomo SM−108)、クラレイ・SMANCS(Kuraray SMANCS)、シーファーム・SP−10094(SeaPharm SP−10094)、スパトール(spatol)、スピロシクロプロパン(spirocyclopropane)誘導体、スピロゲルマニウム(spirogermanium)、ユニミド(Unimed)、SS・ファーマシューティカル・SS−554(SS Pharmaceutical SS−554)、ストリポルジノン(strypoldinone)、スチポルジオン(Stypoldione)、サントリー・SUN0237(Suntory SUN 0237)、サントリーSUN2071(Suntory SUN 2071)、スーパーオキシド・ジスムターゼ(superoxide dismutase)、タリドミド(Thalidomide)、タリドミド(Thalidomide)同族体、トヤマ・T−506(Toyama T−506)、トヤマ・T−680(Toyama T−680)、タキソール(taxol)、テイジン・TEI−0303(Teijin TEI−0303)、テニポシド(teniposide)、タリブラスチン(thaliblastine)、イーストマン・コダック・TJB−29(Eastman Kodak TJB−29)、トコトリエノール(tocotrienol)、トポスチン(Topostin)、テイジン・TT−82(Teijin TT−82)、キョウワ・ハッコウ・UCN−01(Kyowa Hakko UCN−01)、キョウワ・ハッコウ・UCN−1028(Kyowa Hakko UCN−1028)、ウクレイン(ukrain)、イーストマン・コダック・USB−006(Eastman Kodak USB−006)、ビンブラスチン・サルフェート(vin
blastine sulfate)、ビンクリスチン(vincristine)、ビンデシン(vindesine)、ビネストラミド(vinestramide)、ビノレルビン(vinorelbine)、ビントリプトール(vintriptol)、ビンゾリジン(vinzolidine)、ウィタノリド類(withanolides)およびヤマノウチ・YM−534(Yamanouchi YM−534)、ゾメタ(Zometa)(R)よりなる群から選択される抗新生物剤の混成群を包含する。
【0082】
本発明の組み合わせ化学療法で使用できる放射保護剤の例はAD−5、アドクノン(adchnon)、アミフォスチン(amifostine)同族体、デトックス(detox)、ジメスナ(dimesna)、1−102、MM−159、N−アシル化された−デヒドロアラニン類、TGF−ゲネンテク(TGF−Genentech)、チプロチモッド(tiprotimod)、アミフォスチン(amifostine)、WR−151327、FUT−187、ケトプロフェン・トランスデルマル(ketoprofen transdermal)、ナブメトン(nabumetone)、スーパーオキシド・ジスムターゼ(superoxide dismutase)(キロン・アンド・エンゾン(Chiron and Enzon))である。
【0083】
上記の抗新生物剤の製造方法は文献に見られる。ドキソルビシンの製造方法は、例えば、米国特許第3,590,028号明細書および第4,012,448号明細書に記載されている。メタロマトリックス・プロテアーゼ阻害剤の製造方法は欧州特許第780386号明細書に記載されている。アルファvベータ3阻害剤の製造方法は国際公開第97/08174号パンフレットに記載されている。
【0084】
好ましい非−新生物剤はダウノルビシン(daunorubicin)、ブレオマイシン(bleomycin)、ビンクリスチン(vincristine)、ドキソルビシン(doxorubicin)、ダカルバジン(dacarbazine)、プレドニソロン(prednisolone)、ミトキサントロン(mitoxantrone)、プレドニソン(prednisone)、メトトレキセート(methotrexate)、5−フルオロウラシル(5−fluorouracil)、デキサメタソン(dexamethasone)、タリドミド(thalidomide)、タリドミド(thalidomide)誘導体、2ME2、ネオバスタット(Neovastat)、R115777、三酸化砒素、ボルテゾミブ(bortezomib)、タモキシフェン(tamoxifen)、G3139(アンチセンス(antisense))、およびSU5416、ミトマイシン(mitomycin)、抗−CD20抗体、例えばリツキサン(Rituxan)(R)およびR−エトドラック(R−etodolac)の1種もしくはそれ以上を包含するが、それらに限定されない。
【0085】
本調剤を1種もしくはそれ以上の成分と共にまたはそれの代替として使用できる好ましい薬品処方はABVD(ドキソルビシン(doxorubicin)、ブレオマイシン(bleomycin)、ビンクリスチン(vincristine)、ダカルバジン(dacarbazine))、DBV(ダウノルビシン(daunorubicin)、ベロマイシン(belomycin)、ビンクリスチン(vincristine))、CVPP(シクロホスファミド、ビンブラスチン(vinblastine)、プロカルバジン(procarbazine)、プレドニソロン(prednisolone))、COP(シクロホスファミド、ビンクリスチン(vincristine)、プレドニソロン(prednisolone))、CHOP(シクロホスファミド、ドキソルビシン(doxorubicin)、ビンクリスチン(vincristine)およびプレドニソン(prednisolone))並びにCMF(シクロホスファミド、メトトレキセート(methotrexate)、5−フルオロウラシル(5−fluorouracil))を包含するが、それらに限定されない。別の処方は以下の表Aに示される。
【0086】
【表1】

【0087】
【表2】

【0088】
【表3】

【0089】
【表4】

【0090】
ここに記載されているように、水中の有機溶媒の除去後にベンダムスチンの凍結乾燥調剤が得られる。この調剤を製造するために使用される溶媒の最も典型的な例は第三級ブタノール(TBA)である。エタノール、n−プロパノール、n−ブタノール、イソプロパノール、酢酸エチル、炭酸ジメチル、アセトニトリル、ジクロロメタン、メチルエチルケトン、メチルイソブチルケトン、アセトン、1−ペンタノール、酢酸メチル、メタノール、四塩化炭素、ジメチルスルホキシド、ヘキサフルオロアセトン、クロロブタノール、ジメチルスルホン、酢酸、シクロヘキサンを包含する他の有機溶媒を使用することができる。これらの前記溶媒は個別にまたは組み合わせて使用することができる。有用な溶媒はベンダムスチンと共に安定な溶液を生成しなければならず且つ認識できる程度にAPIを分解または不活性化してはならない。選択される溶媒中のベンダムスチンの溶解度は溶媒中の薬品の商業的に有用な濃度を生ずるのに充分なほど高くなければならない。さらに、溶媒は薬品製品の水性分散液または溶液から、例えば、凍結乾燥または真空乾燥により、容易に除去できなければならない。好ましくは、約2−80mg/mL、好ましくは約5−40mg/mL、より好ましくは5−20mg/mLそしてさらにより好ましくは12−17mg/mL、のベンダムスチンの濃度を有する溶液が使用される。
【0091】
製薬学的に許容可能な凍結乾燥賦形剤を水相の中に溶解させることができる。本発明に有用な賦形剤の例は燐酸ナトリウムもしくはカリウム、クエン酸、酒石酸、ゼラチン、グリシン、並びに炭水化物、例えばラクトース、スクロース、マルトース、グリシン、デキストロース、デキストラン、トレハロースおよびヘタスターチ、を包含するが、それらに限定されない。マンニトールが好ましい賦形剤である。所望により使用することができる他の賦形剤は酸化防止剤、例えば、限定するものではないがアスコルビン酸、アセチルシステイン、システイン、亜硫酸水素ナトリウム、ブチル−ヒドロキシアニソール、ブチル
−ヒドロキシトルエンもしくはアルファ−酢酸トコフェロール、またはキレート化剤を包含する。
【0092】
本発明に従う有用な代表的な調剤および凍結乾燥サイクルを以下に示す。凍結乾燥は凍結乾燥または真空乾燥用に使用される標準的装置を用いて行うことができる。サイクルは充填/仕上げ用に使用される装置および施設に依存して変動しうる。
【0093】
本発明の代表的な態様によると、水性凍結乾燥前溶液または分散液を最初に製薬学的に許容可能な混和容器の中で調合する。溶液を殺菌容器内に無菌的に濾過し、適当な寸法のバイアルの中に充填し、部分的に栓をしそして凍結乾燥器の中に充填する。ここに記載されている凍結乾燥技術を用いて、約0.1〜約8.0%の範囲内の水分含有量が得られるまで溶液を凍結乾燥する。生じた凍結乾燥粉末は約6ヶ月間〜約2年間もしくはそれ以上、好ましくは約3年間もしくはそれ以上、にわたり約5℃〜約25℃において安定であり且つ注射用殺菌水または他の適当な担体を用いて容易に再構成されて例えば非経口的注射による内部投与に適するベンダムスチンの液体調剤を与えることができる。静脈内投与のためには、再構成された液体調剤、すなわち、製薬学的組成物、は好ましくは溶液である。
【0094】
凍結乾燥前溶液または分散液は通常は最初に製薬学的に許容可能な容器の中で、1)水(合計容量の約65%)に周囲温度において混合しながら賦形剤、例えばマンニトール、(約0〜約50mg/mL)を加え、2)約20°−35℃において混合しながら有機溶媒(0.5−99.9%v/v)、例えばTBA、を水溶液に加え、4)混合しながらベンダムスチンHClを所望する濃度となるまで加え、5)水を加えて最終容量を得、そして6)溶液を約1℃〜約30℃、好ましくは約5℃、に冷却することにより、調合される。前記の段階は特定の順序で示されているが、当業者が段階の順序および量を必要に応じて変動させうることは理解されよう。量は重量基準で準備することもできる。
【0095】
凍結乾燥前溶液または分散液を凍結乾燥前に殺菌することができ、殺菌は一般的には例えば0.22ミクロンもしくはそれ以下のフィルターによる無菌濾過により行われる。複数の殺菌フィルターを使用することができる。溶液または分散液の殺菌は当該技術で既知の他の手段、例えば照射、により行うことができる。
【0096】
この場合、殺菌後に、溶液または分散液は凍結乾燥の準備がなされる。一般的に、濾過された溶液が殺菌性受容容器に導入され、そして次にいずれかの適当な1個もしくは複数の容器に移され、そこで調剤が効果的に凍結乾燥される。普通は、ここに記載されたようにそして当該技術で既知であるように、製品が市販用容器、例えば、限定するものではないがバイアル、の中で調剤が効果的に且つ効率的に凍結乾燥される。
【0097】
凍結乾燥前溶液または分散液を凍結乾燥する際の使用のための代表的な工程を以下に示す。しかしながら、当業者は例えば限定されるものではないが凍結乾燥前溶液または分散液および凍結乾燥装置の如き事柄によって工程または方法に対する修飾を行えることを理解するであろう。
【0098】
最初に、製品を凍結乾燥室の中にある範囲の温度において入れそして次に一般的には数時間にわたり製品の凍結点よりかなり下の温度にする。好ましくは、温度は少なくとも2時間にわたる約−40℃もしくはそれ以下であろう。凍結が完了した後に、室およびコンデンサーを真空ポンプにより真空にし、コンデンサー表面は循環する冷蔵剤によりすでに冷却されていた。好ましくは、コンデンサーは溶液の凍結点より約−40°、より好ましくは約−50℃もしくはそれ以下、さらにより好ましくは約−60℃もしくはそれ以下、冷却されているであろう。さらに、室の真空化は約10〜約600ミクロン、好ましくは
約50〜約150ミクロン、の圧力が得られるまで続けるべきである。
【0099】
製品組成物を次に真空下で室およびコンデンサーの中で暖める。これは普通は、製品が凍結乾燥工程中に約10〜約600ミクロンの範囲の圧力において製品が載せられている凍結乾燥器内の棚を暖めることにより、行われるであろう。暖める工程は最適には非常に徐々に、数時間にわたり、行われるであろう。例えば、製品温度を最初に約−30℃から約−10℃に高めそして約10−70時間にわたり保つべきである。さらに、製品温度を凍結温度から約25℃−40℃に30−192時間の期間にわたり高めることもできる。バイアルからの凍結乾燥物の射出を防止するために、有機溶媒および水の完全な除去を第一回乾燥段階中に行わなければならない。完全な乾燥は真空、コンデンサー温度および製品貯蔵温度の安定化により確認できる。第一回乾燥後に、製品温度は約25℃−40℃に高められそして約5−40時間にわたり保たれなければならない。
【0100】
乾燥サイクルが完了したら、室内の圧力を殺菌性乾燥−窒素ガス(または同様な気体)を用いて大気圧(またはそれよりわずかに下)にゆっくり下げることができる。製品組成物が例えばバイアルの如き容器の中で凍結乾燥された場合には、バイアルに栓をし、取り出しそして密封することができる。製品の品質を分析するための種々の物理的、化学的、および微生物学的試験を行う目的のために、数個の代表試料を取り出すことができる。
【0101】
凍結乾燥ベンダムスチン調剤は典型的には製薬学的薬用量形態で販売される。本発明の製薬学的薬用量形態は、典型的にはバイアルの形態であるが、殺菌環境を維持可能な適当な容器、例えばアンプル、注射器、共通バイアル、でありうる。そのような容器は、材料がベンダムスチン調剤と相互作用しない限り、ガラスまたはプラスチックでありうる。閉鎖具は典型的には栓、最も典型的には殺菌性ゴム栓、好ましくはブルモブチルゴム栓、であり、それが密封を与える。
【0102】
凍結乾燥後に、ベンダムスチン凍結乾燥粉末を例えばバイアルの如き容器の中に充填することができ、或いは凍結乾燥前溶液をそのようなバイアルの中に充填しそしてその中で凍結乾燥して凍結乾燥ベンダムスチン調剤を直接含有するバイアルを生ずることもできる。そのようなバイアルは、溶液のその中への充填または凍結乾燥後に、栓を用いるようにして密封して、密封された殺菌性の製薬学的薬用量形態を与える。典型的には、バイアルは約10−500mg/バイアル、好ましくは約100mg/バイアル、のベンダムスチンおよび約5mg−2g/バイアル、好ましくは約170mg/バイアル、のマンニトールを含む凍結乾燥粉末を含有するであろう。
【0103】
本発明の凍結乾燥調剤を水、好ましくは注射用殺菌水、または他の殺菌性流体、例えば共−溶媒、を用いて再構成して、例えば通常の食塩水による適当な静脈内混合容器中でのさらなる希釈後の非経口的注射によるような投与に適するベンダムスチンの溶液を与えることができる。
【0104】
B.溶解度
水(単独)並びに種々の量の凍結乾燥で一般的に使用されるアルコール類、例えば、メタノール、エタノール、プロパノール、イソプロパノール、ブタノールおよび第三級−ブチルアルコール(TBA)、を含むものの中のベンダムスチンHCl(ベンダムスチン)の溶解度を視覚的検査により測定した。25.5mg/mLのマンニトールと組み合わされた15mg/mLのベンダムスチンの量を10mLの指定されたアルコール溶液中で室温において製造した(表1参照)。試料を次に5℃において冷蔵しそして0、3、6および24時間後に粒子および/または沈殿に関して検査した。
【0105】
表1に示される結果は、ベンダムスチン溶解度が温度および水溶液中のアルコールの量
に依存することを示す。試験したアルコール類に関しては、ベンダムスチンの溶解度はアルコールの濃度の増加につれて増加した。沈殿の生成も温度および時間に依存していた。ベンダムスチンはいずれのアルコールとも即時に沈殿しなかったが、5℃における貯蔵後に結晶化した。アルコール類は溶解度に対するそれらの影響において変動した。いずれかの特定理論に拘束しようとは望まないが、比較的高級のアルコール類(第三級−ブタノールおよびn−ブタノール)と比べて比較的低級のアルコール類、例えばメタノールおよびエタノール、は溶解度に対してより少ない影響を有する。しかしながら、アルコールの形状も重要である。例えば、この系における沈殿を防止する際にはn−プロパノールはイソ−プロパノールより良好でないことが見出された。溶解度に対する最大の影響を有する2種のアルコール類はn−ブタノールおよび第三級−ブタノールであった。
【0106】
【表5】

【0107】
3種の異なる溶液に関して種々の温度においてベンダムスチンの溶解度を定量的に評価するための実験は図1および表2にまとめられている。実験で使用された20%(v/v)、30%(v/v)TBAの量は安定性試験に基づいている(結果は以下に記載される)。試験した両方の溶液に関して、ベンダムスチンの溶解度は25℃から0℃への温度につれて線状に減少した。この実験は表1に示されたデータを確認しそして20%および30%TBA溶液に関するベンダムスチン溶解度における差異を際立たせる。
【0108】
【表6】

【0109】
C.安定性
水を用いる加水分解による水溶液中のその不安定性のために、製薬学的使用に適する製品を製造するためにはベンダムスチンは凍結乾燥を必要とする。しかしながら、凍結乾燥薬品製品の製造中に、凍結乾燥前の充填には水溶液が一般的に必要である。それ故、ベンダムスチンおよび他のナイトロジェンマスタード類に関する混和および充填工程中の水溶液の使用は薬品製品の分解をもたらしうる。従って、ベンダムスチンの分解に対する種々のアルコール類の影響を評価してその調剤が比較的長い充填−仕上げが可能であると考えられるかどうかを決め、最近のリボムスチン(R)調剤より急速に再構成できる凍結乾燥粉末を与え、および/または、ある種の不純物、例えば、HP1、およびBM1二量体、に関してリボムスチン(R)より良好な不純物特徴を有するベンダムスチンの凍結乾燥調合物を与えた。
【0110】
好ましくは、本発明の凍結乾燥調合物はHP1に関して安定であり、すなわち、約2℃〜約30℃、好ましくは約5℃、において貯蔵される時にHP1の量は6ヶ月間にわたり、より好ましくは12ヶ月間より長く、そしてさらにより好ましくは24ヶ月間より長く、例えば36ヶ月間にわたり、認識できるほど増加しない(貯蔵−寿命仕様を越えない)。
【0111】
表3は、24時間の期間にわたる5℃におけるアルコールを添加しない水中でのベンダムスチンの安定性結果を示す。ベンダムスチンは水だけの中では急速に分解しそして主として加水分解生成物であるHP1(モノヒドロキシベンダムスチン)を生成する。
【0112】
【化5】

【0113】
【表7】

【0114】
この試験および他の長期安定性試験中に観察された他の主な分解物はベンダムスチンの二量体であった。
【0115】
【化6】

【0116】
ベンダムスチン凍結乾燥製品中に含有される他の分解物はベンダムスチンエチルエステル(BM1EE)(式IV)およびBM1DCE(式V)である。ベンダムスチンがエチルアルコールと反応する時にBM1EEが生成する。
【0117】
【化7】

【0118】
【化8】

【0119】
図2は、ベンダムスチンを種々のアルコール類の中で24時間にわたり5℃において培養した後のHPLC分析の純度結果をまとめている。結果は合計ピーク面積の面積百分率として表示される。図2に関する数値は表3−9に与えられている。純度は比較的高い濃度のアルコールを含有する溶液の中で、アルコールとは関係なく、最高であった。評価したアルコール類の中では、ベンダムスチンは約30%(v/v)のTBAを含有する溶液の中で最も少なく分解した。約10%〜約20%アルコール溶液の中では、ベンダムスチンの分解を予防する際にはn−ブタノールが優れていた。20%および30%(v/v)では、水中n−ブタノールはこれらの濃度における水中n−ブタノールの不溶性のために二相系を生じた。
【0120】
図3および4は、(ここで記載された通りの)HPLCにより定量化されたHP1および二量体生成により測定されるベンダムスチン類の分解量を示す。アルコール濃度の量が減少するにつれてHP1および二量体生成が増加した。不純物におけるこの増加は予測された時間依存性を伴って生じた(表3−9)。ベンダムスチンの分解の予防においてはtert−ブタノールおよびn−ブタノールが他のアルコール類より優れているようであった。表10に見られるように、マンニトールはTBAを用いるベンダムスチンの安定化に影響しなかった。
【0121】
【表8】

【0122】
【表9】

【0123】
【表10】

【0124】
【表11】

【0125】
【表12】

【0126】
【表13】

【0127】
表1−9における結果は、HP1および二量体に関するベンダムスチンHClの安定性がアルコール濃度の増加につれて改良することを示す。
【0128】
【表14】

【0129】
D.凍結乾燥サイクル開発
種々の凍結乾燥前調剤をベンダムスチン、マンニトール、およびアルコール類の種々の水中濃度において製造した。ここに記載されているような凍結(急速対遅延)、第一回乾燥(温度および圧力の両方)、並びに第二回乾燥に関して各段階においてサイクル開発を変化させそして最適化した。
【0130】
溶解度、安定性、および凍結乾燥の容易さに関する以上で詳述した情報の全てに基づき、好ましい調剤は下記のものを包含する:
【0131】
成分 濃度
ベンダムスチン 約2−40mg/mL
マンニトール 約0−50mg/mL
アルコール 約0.5%−40%(v/v)
水 所望する容量にするのに充分な量
ここでアルコールはメタノール、n−プロパノール、またはイソプロパノールから選択される。
【0132】
成分 濃度
ベンダムスチン 約5−20mg/mL
マンニトール 0−20mg/mL
アルコール 1−20%(v/v)
水 所望する容量にするのに充分な量
ここでアルコールはメタノール、n−プロパノール、またはイソプロパノールから選択される。
【0133】
成分 濃度
ベンダムスチン 約5−20mg/mL
マンニトール 10−30mg/mL
アルコール 5−40%(v/v)
水 所望する容量にするのに充分な量
【0134】
成分 濃度
ベンダムスチンHCl 約12−17mg/mL
マンニトール 約20−30mg/mL
アルコール 約5−15%(v/v)
水 所望する容量にするのに充分な量
【0135】
成分 濃度
ベンダムスチンHCl 約15mg/mL
マンニトール 約25.5mg/mL
アルコール 約10%(v/v)
水 所望する容量にするのに充分な量
【0136】
成分 濃度
ベンダムスチンHCl 約2−40mg/mL
マンニトール 約0−50mg/mL
ブタノール 約0.5−20%(v/v)
水 所望する容量にするのに充分な量
【0137】
成分 濃度
ベンダムスチンHCl 約5−20mg/mL
マンニトール 約10−30mg/mL
ブタノール 約1−10%(v/v)
水 所望する容量にするのに充分な量
【0138】
成分 濃度
ベンダムスチンHCl 約12−17mg/mL
マンニトール 約20−30mg/mL
ブタノール 約1−10%(v/v)
水 所望する容量にするのに充分な量
【0139】
成分 濃度
ベンダムスチンHCl 約15mg/mL
マンニトール 約25.5mg/mL
ブタノール 約10%(v/v)
水 所望する容量にするのに充分な量
【0140】
成分 濃度
ベンダムスチンHCl 約2−50mg/mL
マンニトール 約0−50mg/mL
第三級ブタノール 約0.5−100%(v/v)
水 所望する容量にするのに充分な量
【0141】
成分 濃度
ベンダムスチンHCl 約2−50mg/mL
マンニトール 約0−50mg/mL
第三級ブタノール 約0.5−99.9%(v/v)
水 所望する容量にするのに充分な量
【0142】
成分 濃度
ベンダムスチンHCl 約2−50mg/mL
マンニトール 約0−50mg/mL
第三級ブタノール 約0.5−99%(v/v)
水 所望する容量にするのに充分な量
【0143】
成分 濃度
ベンダムスチンHCl 約2−50mg/mL
マンニトール 約0−50mg/mL
第三級ブタノール 約90−99%(v/v)
水 所望する容量にするのに充分な量
【0144】
成分 濃度
ベンダムスチンHCl 約5−20mg/mL
マンニトール 約10−30mg/mL
第三級ブタノール 約5−80%(v/v)
水 所望する容量にするのに充分な量
【0145】
成分 濃度
ベンダムスチンHCl 約12−17mg/mL
マンニトール 約20−30mg/mL
第三級ブタノール 約10−50%(v/v)
水 所望する容量にするのに充分な量
【0146】
成分 濃度
ベンダムスチンHCl 約12.5−15mg/mL
マンニトール 約0−30mg/mL
エタノール 約20−30%(v/v)
水 所望する容量にするのに充分な量
【0147】
成分 濃度
ベンダムスチンHCl 約15mg/mL
マンニトール 約25.5mg/mL
第三級ブタノール 約30%(v/v)
水 所望する容量にするのに充分な量
【実施例】
【0148】
以下の実施例は本発明のある面を説明するためおよび本発明を実施する際に当業者を助けるために与えられる。これらの実施例は本発明の範囲をいずれかの方法で限定すると何ら考えるべきでない。
【0149】
物質:
ベンダムスチンHCl、(デグッサ(Degussa)、ロット番号0206005および0206007)
マンニトール、NFまたは同等物(マリンクロット(Mallinckrodt))
脱水されたエチルアルコール(200保証)、USPまたは同等物(スペクトルム(Spectrum))
第三級−ブチルアルコール、ACS(EMサイエンス(EM Science))
メタノール(スペクトルムおよびEMD)
プロパノール(スペクトルム)
イソ−プロパノール(スペクトルム)
ブタノール(スペクトルム)
水、HPLC等級または同等物(EMD)
アセトニトリル、HPLC等級または同等物(EMD)
トリフルオロ酢酸、J.T.ベーカー(J.T. Baker))
メタノール、HPLC等級または同等物(EMサイエンス、カタログ番号MX0488P−1)
トリフルオロ酢酸、HPLC等級または同等物(J.T.ベーカー、カタログ番号JT9470−01)
【0150】
装置:
光ダイオード列検出器付きのウォーターズ(Waters)2695アライアンス(Alliance)HPLCシステム
二重波長検出器付きのウォーターズ2795アライアンスHPLCシステム
分析秤(メトラー(Mettler)AG285、ID番号1028)および(メトラーXS205)
ヴィルチス・リオフィライザー・アドバンテージ(VirTis Lyophilizer AdVantage))
アジレント・ゾルバックス(Agilent Zorbax)SB−C18 5μm 80Å 4.6×250mmカラム、カタログ番号880975−902
【0151】
実施例1−HPLC工程
方法1
移動相A:0.1%TFA;H2O
移動相B:0.1%TFA;50%ACN:50%H2O
UV:230nm
流速:1.0mL/分
カラム温度:30℃
カラム:ゾルバックスSB−C18 5μm 80Å 4.6×250mm
試料温度:5℃
注入容量:10μL
試料濃度:MeOH中0.25mg/mL
勾配:1分間にわたる20%B
23分間にわたる20−90%B
6分間にわたる90%B
1分間にわたる20%Bへの戻り
4分間にわたり20%Bにおける保持
操作時間:30分間
後操作時間:5分間
【0152】
方法2
移動相A:0.1%TFA;H2O:ACN(9:1)
移動相B:0.1%TFA;H2O:ACN(5:5)
UV:230nm
流速:1.0mL/分
カラム:ゾルバックスSB−C18 5μm 80Å 4.6×250mm
カラム温度:30℃
試料温度:5℃
注入容量:10μL
試料濃度:MeOH中0.25mg/mL
勾配:3分間にわたる0%B
13分間にわたる0−50%
17分間にわたる50−70%
2分間にわたる70−90%
5分間にわたる90%
1分間にわたる0%Bへの戻り
4分間にわたり0%における保持
操作時間:40分間
後操作時間:5分間
【0153】
方法3
相A:0.1%TFA(v/v)を含むHPLC等級
相B:0.1%TFA(v/v)を含むHPLC等級ACN/水(1:1v/v)
UV:254nm
流速:1.0mL/分
カラム:ゾルバックスSB−C18 5μm 80Å 4.6×250mm
カラム温度:30℃
試料温度:5℃
注入容量:5μL
捕捉時間:30分間
後時間:9分間
希釈剤:メタノール
【0154】
【表15】

【0155】
試料調合物−薬品製品を200mLのMeOHと共に溶解させる。6分間にわたり超音波処理する。溶液をHPLCの中に直接注入することができる(約0.5mg/mL)。
【0156】
方法4
相A:0.1%TFA(v/v)を含むHPLC等級
相B:0.1%TFA(v/v)を含むHPLC等級ACN
UV:254nm
流速:1.0mL/分
カラム:ゾルバックスRP−C14 5μm 80Å 4.6×150mm
カラム温度:30℃
試料温度:5℃
注入容量:2μL
捕捉時間:31分間
後時間:9分間
希釈剤:NMP/水中0.1%TFA(50:50v/v)
【0157】
【表16】

【0158】
方法4に関する試料調合物−薬品製品を既知量の希釈剤と共に溶解させてHPLC中への直接的注入用の4.2mg/mLの濃度を生ずる。4.2mg/mLの試料濃度を得るためには第二回希釈(100mg/バイアル薬用量形態)を行うことが必要でありうる。
【0159】
結果
上記のHPLC方法1を用いるある種のベンダムスチン不純物に関する保持時間は表11に示されている。ここに記載されたHPLC工程を用いるリボムスチン(R)に関するHPLCクロマトグラフは図6に示されている。
【0160】
【表17】

【0161】
HPLC方法1はベンダムスチン中で見出される不純物を分解可能であったが、分析中に生成する潜在的不純物であるベンダムスチンのメチルエステル(BM1ME)を分離することはできなかった。BM1MEおよびBM1二量体の間の保持時間差は0.3分間だけであった。BM1二量体を分解するために、別のHPLC方法(番号2)を開発した。HPLC方法番号2は全ての不純物を分離できたが、45分間という比較的長い操作時間を必要とした(表12)。
【0162】
【表18】

【0163】
HPLC方法3を用いるリボムスチンの種々のロットの不純物特徴を表13に示す。
【0164】
【表19】

【0165】
実施例2−溶解度
水(単独)並びに種々の量のメタノール、エタノール、プロパノール、イソプロパノール、ブタノールおよび第三級−ブチルアルコール(TBA)中のベンダムスチンHCl(ベンダムスチン)の溶解度を視覚的検査により測定した。15mg/mLのベンダムスチン、25.5mg/mLのマンニトールの量を10mLの指定されたアルコール溶液(表1)の中で室温において製造した。試料を次に5℃において冷蔵しそして0、3、6および24時間後に粒子および/または沈殿に関して検査した。
【0166】
表1にまとめられている結果は、ベンダムスチン溶解度は温度および水溶液中のアルコ
ールの量に依存することを示している。全てのアルコール類に関して、アルコールの濃度が増加するにつれてベンダムスチンの溶解度が増加した。沈殿の生成も温度および時間に依存性であった。
【0167】
ベンダムスチンの溶解度は、25.5mg/mLの水中マンニトールを含有する20%(v/v)TBAおよび25.5mg/mLの水中マンニトールを含有する30%(v/v)TBAの中でも測定された(図1)。ベンダムスチンを4mLの各溶液に、それがもはや溶解しなくなるまで混合しながら、加えた。飽和溶液をそのまま1時間にわたり−8℃、0℃、5℃、または25℃において混合した。試料を遠心しそして元の温度に最低30分間にわたり戻した。−8℃の試料を塩化ナトリウムを含有する氷浴の中に入れ、それが氷浴の温度を低下させ、そして試料を分析用に除去する時に温度を測定した。各試料のアリコートを採取しそしてHPLC分析用に準備した。
【0168】
これらの実験の結果は図1および表2に示されている。実験(図1)で使用されたTBA、20%(v/v)および30%(v/v)の量はここに記載された安定性試験に基づいていた。
【0169】
図1に示されているように、ベンダムスチンの溶解度は温度(25℃から0℃まで)につれて線状に減少した。ベンダムスチンの溶解度は、それが水単独の中にまたはアルコールを含む水の中に溶解されたかどうかにかかわらず、温度依存性であった。20%(v/v)TBAも同様にベンダムスチンの安定性および溶解度に関して有効であり且つ耐久性のある製薬学的製造に関して要求される下方限度でありうる。15mg/mLのベンダムスチンの充填溶液は17.2mg/mLのベンダムスチンの5℃における飽和限度に近いが0℃における限度より高い。30%(v/v)TBAが最終的調剤に関するTBAの推奨濃度でありそして温度にかかわらず溶解度限度内である。
【0170】
実施例3−安定性
A.水中の安定性
ベンダムスチン(15mg/mL)およびマンニトール(25.5mg/mL)の水中溶液を室温において製造しそして10分間にわたり氷浴の中に入れて(温度を約5℃に急速に低下させ)そして次に5℃において冷蔵した。各調剤の試料をHPLCによりここに記載された方法を用いて0、3、6および24時間後に5℃において貯蔵される時に分析した。
【0171】
B.アルコール中の安定性
15mg/mLベのンダムスチン、25.5mg/mLのマンニトール、および1.9%、5%、10%、20%もしくは30%(v/v)のエチルアルコールの水中溶液または5%、10%、20%もしくは30%(v/v)のTBA、メタノール、プロパノール、イソ−プロパノール、もしくはブタノールの水中溶液を室温において製造し、10分間にわたり氷浴の中に入れそして次に5℃において冷蔵した。各調剤の試料をHPLCによりここに記載された方法を用いて0、3、6および24時間後に5℃において貯蔵される時に分析した。
【0172】
C.安定性結果
表3は、24時間の期間にわたる5℃におけるアルコールを添加しない水の中のベンダムスチンの安定性結果を示す。ベンダムスチンは水中で急速に分解するが、ベンダムスチンの安定性はアルコール濃度の増加につれて増加する(図2、3および4)。アルコール類はしばしば溶解問題を助けるために凍結乾燥において使用されるが、ベンダムスチンの安定性を保ちながら水溶液を使用することができるため、ベンダムスチン安定性に対するアルコール類の影響は比較的わずかな不純物を含むベンダムスチンの製造においては独特
なものであり、予期されておらずしかも有用である。試験した6種のアルコール類の中でTBAが最良の安定剤であることが見出された(図2、3、および4)。30%(v/v)における全てのアルコール類は、不純物であるHPIおよび二量体の生成を5℃において24時間までにわたり減じた。TBAに関すると、HPIは5℃における24時間までにわたる貯蔵時には約0.4%にだけ達する。15mg/mLのベンダムスチンで調合されそして5℃で貯蔵される時には、ベンダムスチン沈殿および不純物生成のために比較的低濃度のアルコールは有効でなくなりうる。
【0173】
実施例4−調剤最適化
ベンダムスチンの溶解度および安定性が測定された後に、調剤を凍結乾燥に関して最適化した。ベンダムスチンの濃度は30%TBA/水飽和溶液の中では他のアルコール溶液の中と比べて高いため、100mgのベンダムスチンを充填するのに必要なバイアル寸法を最近のリボムスチン(R)表示から減少させうることが予測される。ベンダムスチンの飽和溶液は0℃において18mg/mLを含有するが、バッチ差の結果としてのバルクAPI純度における差によるAPI溶解度におけるわずかな差を相殺するために15mg/mLの濃度が調剤に関して選択された。15mg/mLの濃度のベンダムスチンは1個のバイアル当たり100mgのベンダムスチンHClを充填するために6.67mLを必要とする。
【0174】
急速に凍結乾燥する良好な外観を有する凍結乾燥製品を製造するためには、表面積(昇華)対容量比が重要である。一般的に、凍結乾燥製品がバイアル容量の30%〜50%の間を占める。6.67mLを有する20mLバイアルはその容積の約30%を含有しておりそして0.796cm2/mL表面積比を有する。
【0175】
リボムスチン(R)と同様な調剤を維持するためにマンニトールがバルキング剤として選択された。ベンダムスチン溶解度および製品の外観に対するマンニトールの影響を評価するために試験を行った。マンニトールはエタノールおよびTBA水溶液の両方の中のベンダムスチン(15mg/mLにおける)の溶解度を減じる。例えば、5%および10%のエタノール並びにTBAを含有するマンニトールを含まない溶液は24時間にわたり沈殿しなかった。しかしながら、マンニトールを含む試料(表1)に関すると沈殿が24時間以内に観察された。30%(v/v)のTBA、15mg/mLのベンダムスチン、および25.5mg/mLのマンニトールを含有する水溶液に関しては沈殿がなかった。取り扱い中の破壊に対して耐性がある良く形成されたケーキを保つためには最低134mg/バイアルのマンニトールが必要であり、200mg/バイアルまでのマンニトールではバイアルの中で差異はなかった。
【0176】
試験した全てのアルコール類はベンダムスチンの安定性および溶解度を増加した。しかしながら、充填溶液の安定性および製造の容易さに影響を与えるためには有意なモル分率が必要であった。比較的少量のアルコール類はバルク溶液の凍結点を下げる望ましくない影響を有しておりそしてその結果として比較的低い温度では長い凍結乾燥サイクルを必要とする。高濃度のメタノールおよびエタノールは再構成することが困難な興味のないケーキを製造した。ベンダムスチン(15mg/mL)、マンニトール(25.5mg/mL)を含有する10%エタノール、20%エタノール、10%イソ−プロパノール、20%イソ−プロパノール、または30%TBA水溶液を製造しそして凍結乾燥した。0%エタノール、20%エタノール、10%イソ−プロパノール、20%イソ−プロパノールの溶液から充填された凍結乾燥バイアルはいずれも破壊したケーキまたはフィルム残渣を生じた。許容可能なケーキを生ずる唯一の溶媒系は30%TBAであった。さらに、0%エタノール、20%エタノール、10%イソ−プロパノール、20%イソ−プロパノール凍結乾燥バイアルの再構成は困難でありそして>45分間まで充分に溶解しなかった。
【0177】
小さいバイアルの使用可能性は水/有機溶液中のベンダムスチンの濃度または溶解度により限定される。許容可能なケーキ外観を生じた比較的低濃度のエタノール、メタノール、イソプロパノールおよびn−プロパノールでは、溶解度限度のためにベンダムスチンのさらなる希釈溶液が必要である。1個のバイアル当たり100mgのベンダムスチンを含む表示を保つためには、50mLより大きいバイアルが必要でなるであろう。また、ここでの安定性試験は比較的低いアルコール濃度では化学的安定性が許容可能な充填時間を可能にするには充分でなかったことを示した。
【0178】
再構成の容易さに影響する因子の1つは凍結乾燥物の多孔性である。一般的に、わずかな表面積を有する非晶質的に沈殿した固体は溶解するのがより困難である。マンニトールを含有するほとんどの凍結乾燥物は、しばしば液体の蒸発(溶融戻り)により引き起こされる凍結乾燥中に生成した沈殿がない限り、3−5分間以内に再構成されるであろう。数種の凍結乾燥溶媒系を用いる我々の経験に基づくといずれかの特定の理論に拘束されることは望まないが、リボムスチン(R)再構成に関連する問題は凍結乾燥中に溶融戻りを引き起こす沈殿に関連する。ほとんどの有機溶媒は効率的に凍結乾燥せずそしてそれらの低い融点のために溶融戻りを引き起こす。TBA(第三級ブチルアルコール)は水と比べて高い融点および同様な蒸気圧を有する。30−45分間を要することがある市販のリボムスチンと比べて、本発明に従う30%(v/v)TBAを含む製造された凍結乾燥物は3−10分以内に再構成される。
【0179】
溶解度、安定性、再構成の容易さおよび製造上の考察点に基づくと、下記のものが好ましい本発明の凍結乾燥前調剤である:約15mg/mLのベンダムスチンHCl、約25.5mg/mLのマンニトール、約30%(v/v)の第三級−ブチルアルコール、および充分量の注射用水。調剤を次に5℃において6.67mLを用いて琥珀色の20mLの20mmバイアルの中に充填しそしてブロモブチル栓で部分的に栓をし、そして予備−冷却された凍結乾燥器の中に充填した。
【0180】
実施例5−不純物評価
HPLC分析(図6)により測定される、製造、混和、充填、および凍結乾燥工程中に導入される主な不純物は、加水分解生成物であるHPI、二量体、およびベンダムスチンのエチルエステル、BM1EEである。BM1EEは薬品物質製造中、例えば再構成および/または精製中、に生成されうる。BM1EEはベンダムスチンより有効な細胞毒性薬品であることが知られている。30%TBA水性充填溶液の使用がベンダムスチンt−ブチルエステルの生成をもたらすかどうかを測定する実験が行われた。
【0181】
実験はベンダムスチンのt−ブチルエステルの生成に関して必要な伝統的なフィッシャーエステル化反応条件を用いて行われた。ベンダムスチンを60℃TBAの中でHClと共に20時間にわたり加熱した。何らかの反応も観察されなかった。この結果は、充填/仕上げ工程中にベンダムスチンのt−ブチルエステルを生成することが非常に困難であることを示した。TBAから製造された薬品製品中の新たな不純物は現在まで安定性試験では観察されなかった。
【0182】
薬品製品の試験を助けるために、t−ブチル部分のさらに反応性が大きい原料を用いる合成経路を開発した。tert−ブチルエステルを製造するための他の試みはベンダムスチンの塩化アシルの生成により行われた。ベンダムスチンの塩化メチレン中懸濁液を塩化オキサリルおよびN,N−ジメチルホルムアミドで処理した。塩化アシルが生成した後に、溶媒を濃縮した。残渣を塩化メチレン、tert−ブタノール、トリエチルアミン、および4−ジメチルホルムアミドに加えそして混合物を室温において一晩にわたり撹拌した。全ての溶媒の添加および精製後に、未知の化合物が得られた。LC−MSはベンダムスチンtert−ブチルエステルの分子量と合致せずそしてプロトンNMRはtert−ブチルに関するピークを示さなかった。従って、この試みはベンダムスチンtert−ブチルエステルを製造することにも失敗した。それ故、共−溶媒としてのTBAの使用はアルコールからエステルを生成しないという別の利点を有する。
【0183】
実施例6−凍結乾燥サイクル開発
凍結乾燥の重要な段階を評価しそして最も有効な乾燥サイクルを得るために多くの凍結乾燥サイクルを行った。製品に対する凍結速度、第一回乾燥温度、時間および圧力の影響を評価するために実験を行った。
【0184】
A.凍結速度
文献は、TBAが凍結速度によって異なる結晶形態をとることを報告している。ある種のTBA溶液の中では、製品がゆっくり凍結すればするほど、それは急速に乾燥する。より大きい孔を生ずるゆっくりした凍結中に生成する比較的大きい結晶はより効率的な昇華を可能にする。しかしながら、ベンダムスチンを用いる試験中には、2および8時間における評価時に凍結速度が臨界的な処理パラメーターであることは見出されなかった。
【0185】
B.第一回および第二回乾燥
30%TBA溶液から凍結乾燥するための最初の試みの間に、凍結乾燥ケーキは破壊しそして粉末がバイアルから射出された。これらのケーキは、溶融戻りを示す非晶質粒子を凍結乾燥物の中に含有するようであった。この現象は再現性がありそして暖める速度に関係なく製品が約−10℃に達した時に起きた(図5参照)。粉末射出の原因および解決法を決めるために数種の可変因子を試験した。圧力を第一回乾燥中に50μmから150μmに上昇させたが、粉末射出は比較的少ない程度であるが依然として観察された。凍結速度を2時間から8時間に延ばしたこと以外は、この実験を次に繰り返した。この変化は影響を与えなかった。
【0186】
第一回乾燥の長さを次に評価した。例えば、以下の非常にゆっくりした乾燥サイクルを評価した:150μmの室圧力を乾燥中に保ちながら、8時間にわたり+25℃から−50℃に凍結し;5時間にわたり−50℃に保ち、7時間にわたり−50℃から−25℃に暖めそして乾燥し;20時間にわたり−25℃に保ち、2時間にわたり−25℃から−15℃に暖めそして乾燥し且つ20時間にわたり−15℃に保ち、6時間にわたり−15℃から40℃に暖めそして乾燥し且つ20時間にわたり40℃に保つ。粉末射出は観察されなかった(図5)。このサイクルは、破壊のない容易に再構成される良好に製造されたケーキをもたらした。特定の理論に拘束しようとは望まないが、粉末射出に関連する問題および再構成に関連する困難はケーキからの強い蒸気流出並びに溶融戻りを生ずるあまりにも急速な凍結乾燥物の乾燥の結果でありうる。比較的激しくない乾燥サイクルの使用で、美的な、安定な、そして再構成が容易なケーキが再現可能に製造される。それ故、第二回乾燥前の全ての結合されていない水および第三級−ブチルアルコールの除去がこれらの穏やかな条件下ではさらに最適であった(図5)。40℃における20時間までの乾燥の結果として即時の分解生成物はなかった。
【0187】
実施例7−凍結乾燥サイクル
【0188】
【表20】

【0189】
ここに開示された全ての組成物および方法はこの開示に照らして過度の実験なしに製造および実施することができる。本発明の組成物および方法は好ましい態様に関して記載されてきたが、組成物および方法並びにここに記載された段階または段階の工程において本発明の精神および範囲から逸脱せずに当業者が変更を行えることは明らかである。より具体的には、ここに開示されている溶媒と化学的および生理学的の両方で関連するある種の溶媒がここに記載された溶媒を代替しても同一または同様な結果が得られるであろうことは明らかである。当業者に明らかな全てのそのような同様な代替および変更は添付された特許請求の範囲により規定される本発明の精神および範囲内であるとみなされる。
【0190】
明細書に挙げられた全ての特許、特許出願、および文献は、本発明が関与する技術の通常の専門家の水準を示す。全ての特許、特許出願、および文献は、各個別文献が具体的にそして個別に引用することにより本発明の内容となるように指示されている場合には同じ程度に引用することにより本発明の内容となる。
【0191】
ここで説明のために適切であると記載されている本発明はここに具体的に開示されていない1種もしくは複数の要素の不存在下で実施することができる。それ故、例えば、ここでの各場合において、用語「含んでなる」、「本質的になる」、および「よりなる」のいずれも他の2つの用語のいずれかで代替されうる。使用されてきた用語および表示は記述用語として使用されておりそして限定用ではなく、且つ示されそして記載された特徴またはその一部の同等物を排除するそのような用語および表示の使用を意図しないが、特許請求される発明の範囲内で種々の修飾が可能であることは認識される。それ故、本発明は好ましい態様および選択自由な特徴により具体的に開示されてきたがここに開示されている概念の修飾および変更が当業者により行われうること、並びにそのような修飾および変更が添付された特許請求の範囲により規定される本発明の範囲内であると考えられることは理解すべきである。
【技術分野】
【0001】
発明の分野
本発明は、種々の疾病状態、特に新生物疾病および自己免疫疾病の処置のための製薬学的組成物の分野に関する。特に、それはナイトロジェンマスタード類(nitrogen mustards)、特にナイトロジェンマスタードベンダムスチン、例えば、ベンダムスチンHClを含んでなる製薬学的調剤に関する。
【背景技術】
【0002】
発明の背景
本発明は、引用することにより本発明の内容となる2005年1月14日に出願された「ベンダムスチン製薬学的組成物(Bendamustine Pharmaceutical Compositions)」の名称の米国特許出願番号第60/644,354号の権利および優先権を、図面および特許請求の範囲を含めて主張する。
【0003】
以下の記述は本発明を理解する際に有用でありうる情報を包含する。いずれかのそのような情報がここで特許請求される発明の先行技術であるかもしくは関連があること、または具体的にもしくは含蓄的に照合されるいずれかの文献が先行技術であることは認められない。
【0004】
水溶液中のそれらの高い反応性の理由のために、ナイトロジェンマスタード類は薬剤として調合することが困難でありそしてしばしば凍結乾燥形態での投与のために供給され、それは投与前に一般的には水中での熟練病院専門家による再構成を必要とする。水溶液中になると、ナイトロジェンマスタード類は加水分解による分解を受け、その結果として、再構成された製品はその再構成後にできるだけ速やかに患者に投与しなければならない。
【0005】
ベンダムスチンである(4−{5−[ビス(2−クロロエチル)アミノ]−1−メチル−2−ベンズイミダゾリル}酪酸はベンズイミダゾール環を有する非定型構造であり、その構造は活性ナイトロジェンマスタードを包含する(ベンダムスチン塩酸塩を示す式I参照)。
【0006】
【化1】

【0007】
ベンダムスチンは1963年にドイツ共和国(GDR)で最初に合成されそして1971年から1992年までその地域で名称ストスタサン(Cytostasan)(R)として入手可能であった。その時点以降は、それはドイツで商品名リボムスチン(Ribomustin)(R)として販売されてきた。それはドイツにおいて慢性リンパ性白血病、ホジキン病、非−ホジキンリンパ腫、多発性骨髄腫、および乳癌を処置するために広く使用されてきた。
【0008】
(他のナイトロジェンマスタード類のような)水溶液中でのその分解のために、ベンダムスチンは凍結乾燥製品として供給される。ベンダムスチンの最近の凍結乾燥調剤(リボムスチン(R))はベンダムスチン塩酸塩およびマンニトールを殺菌性凍結乾燥形態で再構成後の静脈内使用のための白色粉末として含有する。仕上げられた凍結乾燥物は光への露呈時に不安定である。従って、製品は褐色または琥珀色のガラスバイアルの中に貯蔵される。ベンダムスチンの最近の凍結乾燥調剤は薬品物質の製造中および/または仕上げ薬品製品を製造するための凍結乾燥工程中に生じうる分解生成物を含有する。
【0009】
最近では、ベンダムスチンは50mLバイアル当たり100mgの薬品または20mLバイアル当たり25mgの薬品を有する注射用の凍結乾燥粉末として調合される。バイアルが開けられそしてできるだけ患者投与時間近くで再構成される。製品は40mL(100mg表示に関して)または10mL(25mg表示に関して)の注射用殺菌水で再構成される。再構成された製品はさらに500mLにするのに充分な0.9%注射用塩化ナトリウムで希釈される。投与経路は30〜60分間にわたる静脈注入による。
【0010】
40mLの注射用殺菌水による再構成後に、ベンダムスチンのバイアルは室温貯蔵下で7時間の期間にわたりまたは2〜8℃における貯蔵時に6日間にわたり安定である。(混合物の室温貯蔵と仮定して)500mL混合溶液は患者にバイアル再構成から7時間以内に投与しなければならない。
【0011】
このベンダムスチン凍結乾燥粉末の再構成は困難である。臨床報告は、再構成は少なくとも15分間を必要としそして30分間程度の長さを必要としうることを示している。面倒であり且つ製品を再構成するための責任のある健康管理専門家による時間消費の他に、再構成工程中の水に対するベンダムスチンの長期露呈が水による製品の加水分解による有効性損失の可能性および不純物生成を増加させる。
【0012】
それ故、より容易に再構成され且つベンダムスチンの最近の凍結乾燥物(凍結乾燥粉末)調剤より良好な不純物特性を有するベンダムスチンの凍結乾燥調剤に関する要望が存在する。
【0013】
特許文献1は、1−位置で置換されたω−[5−ビス−(β−クロロエチル)−アミノ−ベンズイミダゾリル−(2)]−アルカンカルボン酸類の製造方法を開示している。
【0014】
特許文献2は、γ−[1−メチル−5−ビス−(β−クロロエチル)−アミノ−ベンズイミダゾリル−(2)]−酪酸塩酸塩の注射調合物を開示している。
【0015】
特許文献3は、4−[1−メチル−5−ビス(2−クロロエチル)アミノ−ベンズイミダゾリル−2)−酪酸の製造方法を開示している。
【0016】
特許文献4は、ベンダムスチンの注射溶液を開示している。
【0017】
非特許文献1は、製品記述を包含するリボムスチン(R)に関する情報を提供している。
【0018】
Ni他は、ニトロソウレアであるサルCNU(SarCNU)は純粋な第三級ブタノールの中では純粋な酢酸、ジメチルスルホキシド、メチルヒドロキシ、水またはTBA/水混合物の中でより安定性が大きいことを報告している(非特許文献2)。
【0019】
凍結乾燥されたシクロホスファミドは当該技術で既知であり、例えば米国特許である特許文献5、特許文献6、特許文献7、特許文献8、特許文献9、特許文献10、特許文献11、および特許文献12を参照のこと。
【0020】
凍結乾燥されたナイトロジェンマスタードであるイフォスファミド(Ifosfamide)は国際公開である特許文献13、米国特許である特許文献14、特許文献15、特許文献16、特許文献17、および特許文献18に開示されている。
【0021】
Teagarden他はPGE−1をラクトースおよび第三級ブチルアルコールの溶液の中に溶解させることにより製造されるプロスタグランジンE−1の凍結乾燥調剤を開示している(特許文献19)。
【特許文献1】独国特許発明(GDR)第34727号明細書
【特許文献2】独国特許発明(GDR)第80967号明細書
【特許文献3】独国特許発明(GDR)第159877号明細書
【特許文献4】独国特許発明(GDR)第159289号明細書
【特許文献5】米国特許第5,418,223号明細書
【特許文献6】米国特許第5,413,995号明細書
【特許文献7】米国特許第5,268,368号明細書
【特許文献8】米国特許第5,227,374号明細書
【特許文献9】米国特許第5,130,305号明細書
【特許文献10】米国特許第4,659,699号明細書
【特許文献11】米国特許第4,537,883号明細書
【特許文献12】米国特許第5,066,647号明細書
【特許文献13】国際公開第2003/066027号パンフレット
【特許文献14】米国特許第6,613,927号明細書
【特許文献15】米国特許第5,750,131号明細書
【特許文献16】米国特許第5,972,912号明細書
【特許文献17】米国特許第5,227,373号明細書
【特許文献18】米国特許第5,204,335号明細書
【特許文献19】米国特許第5,770,230号明細書
【非特許文献1】Ribomustin(R) bendamustine Product monograph (updated 1/2002) http://www.ribosepharm.de/pdf/ribomustin bendamustin/productmonograph.pdf
【非特許文献2】Ni et al.(2001) Intl.J.Pharmaceutics 226:39−46
【発明の概要】
【発明が解決しようとする課題】
【0022】
発明の要旨
本発明は、ナイトロジェンマスタード類、特に凍結乾燥されたベンダムスチンの安定な製薬学的組成物、並びに種々の疾病状態、特に新生物疾病および自己免疫疾病の処置におけるその使用に関する。
【0023】
本発明の態様は、放出時またはHP1がベンダムスチンの凍結乾燥調合物の再構成後の時間ゼロに存在するHP1の量である時に、約0.5〜0.9%(ベンダムスチンの面積百分率)より多くない式II
【0024】
【化2】

【0025】
で示されるHP1を含有するベンダムスチンの製薬学的組成物である。好ましい態様は、約0.5%(ベンダムスチンの面積百分率)より多くない、好ましくは約0.45%より多くない、より好ましくは約0.40%より多くない、より好ましくは約0.35%より多くない、さらにより好ましくは0.30%より多くないHP1を含有するベンダムスチンの製薬学的組成物である。
【0026】
本発明の別の態様は、放出時または再構成後の時間ゼロにおいて約0.1%〜約0.3%より多くない式III
【0027】
【化3】

【0028】
で示されるベンダムスチン二量体を含有するベンダムスチンの凍結乾燥調合物である。
【0029】
本発明のさらに別の態様は、放出時または再構成後の時間ゼロにおいて約0.5%より多くない、好ましくは約0.15%〜約0.5%の式IV
【0030】
【化4】

【0031】
で示されるベンダムスチンエチルエステルを含有するベンダムスチンの凍結乾燥調合物で
ある。
【0032】
本発明のさらに別の態様は、ベンダムスチンエチルエステル(式IV)の濃度が凍結乾燥調合物を製造するために使用される薬品物質中で見出されるベンダムスチンエチルエステルの濃度より0.2%、好ましくは0.1%、より多くないベンダムスチンの凍結乾燥調合物である。
【0033】
本発明の別の態様は、薬品製品の放出時に約0.5%〜約0.9%(ベンダムスチンの面積百分率)より多くないHP1を含有するベンダムスチンの凍結乾燥調合物である。好ましい態様は、約0.50%(ベンダムスチンの面積百分率)より多くない、好ましくは約0.45%より多くない、より好ましくは約0.40%より多くない、より好ましくは約0.35%より多くない、さらにより好ましくは約0.30%より多くないHP1を含有するベンダムスチンの凍結乾燥調合物である。この態様の一面は、凍結乾燥調合物がバイアルまたは他の製薬学的に許容可能な容器内に包装されている約0.5%〜約0.9%、好ましくは0.5%(ベンダムスチンの面積百分率)より多くないHP1を含有するベンダムスチンの凍結乾燥調合物である。
【0034】
本発明のさらに別の態様では、ベンダムスチンの凍結乾燥調合物は、約2°〜約30°で貯蔵される時に、HP1の量に関して、少なくとも約6ヶ月間、好ましくは12ヶ月間、好ましくは24ヶ月間、ないし約36ヶ月間もしくはそれ以上にわたり安定である。好ましい貯蔵温度は5℃およびほぼ室温である。
【0035】
本発明の別の態様は、約0.5%〜約0.9%より多くない、好ましくは約0.50%より多くない、好ましくは約0.45%より多くない、より好ましくは約0.40%より多くない、より好ましくは約0.35%より多くない、さらにより好ましくは約0.30%より多くないHP1を含有するベンダムスチンの製薬学的組成物を包含し、ここでHP1が本発明のベンダムスチンの凍結乾燥調合物の放出時または再構成後の時間ゼロにおいて存在するHP1の量である。本発明の好ましい面では、薬用量形態は約5mg〜約500mgのベンダムスチン、約10〜約300mgのベンダムスチン、約25mgのベンダムスチン、約100mgのベンダムスチン、および約200mgのベンダムスチンでありうる。
【0036】
本発明のさらに別の態様は、約0.5%〜約0.9%、好ましくは0.5%、より多くないHP1を含有するベンダムスチンの凍結乾燥調合物を包含する製薬学的薬用量形態である。好ましい薬用量形態は約5〜約500mgのベンダムスチン、約10mg〜約300mgのベンダムスチン、約25mgのベンダムスチン、約100mgのベンダムスチン、および約200mgのベンダムスチンでありうる。
【0037】
さらに別の態様では、本発明は約0.5%〜約0.9%(ベンダムスチンの面積百分率)より多くない、好ましくは約0.50%より多くない、好ましくは約0.45%より多くない、より好ましくは約0.40%より多くない、より好ましくは約0.35%より多くない、さらにより好ましくは約0.30%より多くないHP1を含有するベンダムスチン、および痕跡量の1種もしくはそれ以上の有機溶媒を包含するベンダムスチンの製薬学的組成物を包含し、ここで該HP1がここに開示されたベンダムスチンの凍結乾燥製薬学的組成物の放出時または再構成後の時間ゼロにおいて存在するHP1の量である。この態様の別の面では、有機溶媒は第三級ブタノール、n−プロパノール、n−ブタノール、イソプロパノール、エタノール、メタノール、アセトン、酢酸エチル、炭酸ジメチル、アセトニトリル、ジクロロメタン、メチルエチルケトン、メチルイソブチルケトン、1−ペンタノール、酢酸メチル、四塩化炭素、ジメチルスルホキシド、ヘキサフルオロアセトン、クロロブタノール、ジメチルスルホン、酢酸、およびシクロヘキサンの1種もしくはそれ以上から選択される。好ましい有機溶媒はエタノール、メタノール、プロパノール、ブタノール、イソプロパノール、および第三級ブタノールの1種もしくはそれ以上を包含する。より好ましい有機溶媒は、TBA、t−ブタノール、tert−ブチルアルコールまたは第三級ブチルアルコールとしても知られる第三級ブタノールである。
【0038】
本発明は、ベンダムスチン製品に関する官庁認可(agency approval)を得るための方法であって、ここに記載されている製薬学的組成物を得るためのベンダムスチン分解物(bendamustine degradant)に関する放出仕様を少なくとも約4.0%、好ましくは約2.0%〜約4.0%、(ベンダムスチンの面積百分率)に設定することを包含する改良を包括する。この態様の一面は、HP1に関する放出仕様を1.5%(ベンダムスチンの面積百分率)より少ないかもしくはそれと同等に設定することを包含するベンダムスチン製品に関する官庁認可を得るための方法である。このベンダムスチン製品は放出時に約0.5%(ベンダムスチンの面積百分率)より多くないHP1を含有する。
【0039】
別の態様は、ベンダムスチン製品に関する官庁認可を得るための方法であって、製品が約2℃〜約30℃において貯蔵される場合にベンダムスチン分解物に関する貯蔵寿命仕様を少なくとも約7.0%、好ましくは約5.0〜7.0%(ベンダムスチンの面積百分率)に設定する改良である。好ましい貯蔵温度は約5℃およびほぼ室温である。このベンダムスチン製品は放出時に約0.5%(ベンダムスチンの面積百分率)より多くないHP1を含有する。
【0040】
本発明の別の態様は、最終製品中のベンダムスチン分解物の濃度を、放出時に、ベンダムスチン分解物の濃度が約4.0%より少なく、好ましくは約2.0%〜約4.0%(ベンダムスチンの面積百分率)より少なくなるように、或いはそうでない方法でここに記載された製薬学的組成物を得るように調節することを包含するベンダムスチンの凍結乾燥調合物の製造方法である。このベンダムスチン製品は放出時に約0.5%〜約0.9%、好ましくは約0.5%、(ベンダムスチンの面積百分率)より多くないHP1を含有する。
【0041】
本発明は、約2℃〜約30℃において貯蔵される場合に最終製品中のベンダムスチン分解物の濃度を、放出時に、HP1の濃度が0.9%、好ましくは0.5%、(ベンダムスチンの面積百分率)より少なく、且つ製品有効期限時にベンダムスチン分解物の濃度が7.0%より少なく、好ましくは約5.0%〜約7.0%より多くなくなるように調節することを含んでなるベンダムスチンの凍結乾燥調合物の製造方法を開示する。
【0042】
本発明の別の態様は、溶液または分散液が凍結乾燥中に製造されるHP1の量が約0〜24時間にわたり0.9%(ベンダムスチンの面積百分率)、好ましくは0.50%、好ましくは0.45%、より好ましくは0.40%、より好ましくは0.35%、さらにより好ましくは0.30%を越えないようにベンダムスチンの分解水準を減ずる少なくとも1種の安定化濃度の有機溶媒を含んでなる、1種もしくはそれ以上の有機溶媒を含んでなるベンダムスチン凍結乾燥前溶液または分散液である。この態様の一面は、凍結乾燥前溶液または分散液から製造される凍結乾燥粉末である。
【0043】
本発明のさらに別の面は、溶液または分散液が凍結乾燥中に製造されるベンダムスチンエチルエステルの量が約0〜24時間にわたり約0.5%(ベンダムスチンの面積百分率)を越えないようにベンダムスチンの分解水準を減ずる少なくとも1種の安定化濃度の有機溶媒を含んでなる、1種もしくはそれ以上の有機溶媒を含んでなるベンダムスチン凍結乾燥前溶液または分散液である。この態様の一面は、凍結乾燥前溶液または分散液から製造される凍結乾燥粉末である。
【0044】
本発明のさらに別の態様は、溶液または分散液が凍結乾燥中に製造されるベンダムスチ
ンエチルエステル(式IVで示される)の量が約0〜24時間にわたり凍結乾燥溶液を製
造するために使用される薬品物質の中で見出されるベンダムスチンエチルエステルの濃度
より0.2%、好ましくは0.1%、より多くないようにベンダムスチンの分解水準を減
ずる少なくとも1種の安定化濃度の有機溶媒を含んでなる、1種もしくはそれ以上の有機
溶媒を含んでなるベンダムスチン凍結乾燥前溶液または分散液である。好ましい有機溶媒
は第三級ブタノールである。
【0045】
本発明はまた、溶液または分散液がベンダムスチンを安定化濃度の約5%〜約100%(v/v)の間のアルコールのアルコール溶媒の中に溶解させて凍結乾燥前溶液を生成し、そして凍結乾燥前溶液を凍結乾燥することを含んでなるベンダムスチン凍結乾燥調合物を製造する方法も開示し、ここで該方法から製造される該ベンダムスチン凍結乾燥調合物が約0.5%〜約0.9%、好ましくは0.5%、(ベンダムスチンの面積百分率)より多くない式IIで示されるHP1を含有し、ここで該HP1が放出時にまたはベンダムスチンの凍結乾燥製薬学的組成物の再構成後の時間ゼロにおいて存在するHP1の量である。別のアルコール濃度は約5%〜約99.9%、約5%〜約70%、約5%〜約60%、約5%〜約50%、約5%〜約40%、約20%〜約35%を包含する。アルコールの好ましい濃度は約20%〜約30%である。好ましいアルコールはメタノール、エタノール、プロパノール、イソ−プロパノール、ブタノール、および第三級−ブタノールの1種もしくはそれ以上を包含する。より好ましいアルコールは第三級−ブタノールである。第三級−ブタノールの好ましい濃度は約20%〜約30%、好ましくは約30%である。本発明の一面は、凍結乾燥前の賦形剤の添加である。好ましい賦形剤はマンニトールである。ベンダムスチンの好ましい凍結乾燥前濃度は約2mg/mL〜50mg/mLである。
【0046】
ベンダムスチン凍結乾燥調合物の好ましい製造方法では、凍結乾燥前溶液の凍結乾燥はi)凍結乾燥前溶液を約−40℃、好ましくは−50℃より低い温度で凍結して凍結溶液を生成せしめ、ii)凍結溶液を−40℃もしくはそれ以下、好ましくは−50℃に少なくとも2時間にわたり保ち、iii)凍結溶液を約−40℃〜約−10℃の間の第一乾燥温度に徐々に上げて乾燥溶液を生成せしめ、iv)約10〜約70時間にわたり保ち、v)乾燥溶液を約25℃〜約40℃の間の第二乾燥温度に徐々に上げ、そしてvii)約5〜約40時間にわたり保ってベンダムスチン凍結乾燥調合物を生成せしめることを含んでなる。さらに好ましい方法では、凍結乾燥前溶液の凍結乾燥はi)凍結乾燥前溶液を約−50℃より低い温度で凍結して凍結溶液を生成し、ii)凍結溶液を約−50℃に少なくとも2時間〜約4時間にわたり保ち、iii)約−20℃〜約−12℃の間の第一乾燥温度に徐々に上げて乾燥溶液を生成せしめ、iv)第一乾燥温度を約10〜約48時間にわたり保ち、v)乾燥溶液を約25℃〜約40℃の間の第二乾燥温度に徐々に上げ、そしてvi)第二乾燥温度を少なくとも約5時間から約20時間までにわたり保つことを含んでなる。好ましいアルコールは第三級−ブタノールである。第三級ブタノールの好ましい濃度は約20%〜30%、好ましくは約30%、である。この態様の一面は、凍結乾燥前の賦形剤の添加である。好ましい賦形剤はマンニトールである。ベンダムスチンの好ましい凍結乾燥濃度は約2mg/mL〜50mg/mLである。
【0047】
本発明の別の態様は、ここに開示されたベンダムスチン凍結乾燥調合物の製造方法から得られる凍結乾燥粉末または調合物である。
【0048】
本発明は、また、賦形剤および安定化濃度の有機溶媒を包含する凍結乾燥用のベンダムスチン調剤も包括する。好ましい調剤は約15mg/mLの濃度のベンダムスチン、約25.5mg/mLの濃度のマンニトール、約30%(v/v)の濃度の第三級−ブチルアルコールおよび水を包含する。本発明のこの態様にはそのようなベンダムスチン調剤から製造される凍結乾燥調合物が包含される。
【0049】
本発明には、治療的に有効な量の本発明の製薬学的組成物を投与することを含む患者における該調合物を用いる処置を受容可能な医学的症状を処置する方法が包含される。本発明の組成物を用いる処置を受容可能な医学的症状は慢性リンパ性白血病(CLL)、ホジキン病、非−ホジキンリンパ腫(NHL)、多発性骨髄腫(MM)、乳癌、小細胞肺癌、高増殖性疾病および自己免疫疾病を包含する。好ましい症状はNHL、CLL、乳癌、およびMMを包含する。好ましい自己免疫疾病は慢性関節リウマチ、多発性硬化症または狼瘡である。
【0050】
本発明には、治療的に有効な量の本発明の製薬学的組成物を投与することを包括する患者における該調合物を用いる処置を受容可能なここで規定されたような医学的症状の処置のための薬品の製造における本発明の製薬学的組成物または製薬学的調合物の使用が包含される。
【0051】
本発明には、本発明の製薬学的組成物を1種もしくはそれ以上の抗−新生物剤と組み合わせ、ここで該抗新生物剤が本発明の製薬学的組成物の投与の前に、同時に、または後に与えられるような処置方法も包含される。好ましい抗新生物剤はCD20に特異的な抗体である。本発明の別の態様は、本発明の凍結乾燥ベンダムスチン調合物を製造するための凍結乾燥サイクルである。好ましい凍結乾燥サイクルは、a)約−50℃に約8時間にわたり凍結し、b)−50℃に約4時間にわたり保ち、c)約−25℃に約3時間にわたり徐々に上げ、d)約−10℃に30時間にわたり保ち、e)約25℃〜約40℃の間もしくはそれより高く約3時間にわたり徐々に上げ、f)約25℃〜約40℃の間に約25時間にわたり保ち、g)約20℃に1時間にわたり徐々に上げ、h)密封される製薬学的に許容可能な容器中に約5℃で約13.5psiの圧力において入れることを含んでなり、ここで圧力は第一回乾燥中の約150ミクロンおよび第二回乾燥中の50ミクロンである。本発明の一面は、約30−35℃に約3時間にわたり勾配がつけられそして40℃に約5時間にわたり勾配がつけられる段階(e)を包括する。この態様の別の面は、そのような凍結乾燥サイクルから製造される凍結乾燥粉末である。より好ましい凍結乾燥サイクルは、i)充填のための約5℃の貯蔵温度で開始し、ii)約−50℃に約8時間にわたり凍結し、iii)−50℃に約4時間にわたり保ち、iv)約−20℃に約3時間にわたり徐々に上げ、v)約−20℃に6時間にわたり保ち、約−15℃に約1時間にわたり徐々に上げ、vi)−15℃に約20時間にわたり保ち、vii)約−15℃に約1時間にわたり徐々に上げ、viii)約−15℃に約20時間にわたり保ち、ix)約−12℃に約0.5時間にわたり徐々に上げ、x)約−12℃に約15.5時間にわたり保ち、xi)約25℃〜約40℃の間にもしくはそれより高く約15時間にわたり徐々に上げ、xii)約25℃〜約40℃の間に約10時間にわたり保ち、xiii)約40℃に約1時間にわたり徐々に上げ、そしてxiv)約40℃に約5時間にわたり保つことを含んでなり、密封される製薬学的に許容可能な容器中に約5℃で約13.5psiの圧力において入れ、ここで圧力は第一回乾燥中の約150ミクロンおよび第二回乾燥中の50ミクロンである。好ましい態様では、段階(xi)は約30−35℃に約15時間にわたり勾配が
つけられる。
【0052】
本発明は、また、約0.5%〜約0.9%、好ましくは0.5%、(ベンダムスチンの面積百分率)より多くないHP1を含有するベンダムスチン製薬学的薬用量形態であって、ここで該薬用量形態がバイアルまたは他の製薬学的に許容可能な容器を含んでなり、ここで該HP1が再構成前または該薬用量形態の再構成後の時間ゼロにおいて存在するHP1の量である製薬学的薬用量形態も包括する。ベンダムスチンの好ましい濃度は約10〜約500mg/容器、約100mg/容器、約5mg〜約2g/容器および約170mg/容器を包含する。
【0053】
本発明はまたベンダムスチンの凍結乾燥前製薬学的組成物も包含する。好ましい凍結乾燥前組成物は約15mg/mLのベンダムスチンHCl、約25.5mg/mLのマンニトール、約30%(v/v)の第三級−ブチルアルコールおよび水を包含する。
【0054】
本発明のこれらのおよび他の態様は以下に記載されているかまたは以下の開示に基づき当業者には明らかである。
【図面の簡単な説明】
【0055】
【図1】図1は、2種のベンダムスチンの第三級ブタノール中溶液に関する種々の温度におけるベンダムスチンの溶解度を示す。
【図2】図2は、ベンダムスチンを種々のアルコール類の中で24時間にわたり5℃において培養した後のHPLC分析の純度結果を示す。結果はベンダムスチンピークの面積百分率として表示される。
【図3】図3は、種々のアルコール/水の共−溶媒の中での5℃における24時間後のHP1(式II)生成を示す。
【図4】図4は、種々のアルコール/水の共−溶媒の中での5℃における24時間後の二量体(式III)生成を示す。
【図5】図5は、TBA/水の共−溶媒を用いるベンダムスチンに関する凍結乾燥サイクルを示す。
【図6】図6はHPLC方法番号1を用いるリボムスチン(R)に関するクロマトグラムを示す。
【発明を実施するための形態】
【0056】
ここで使用される用語「調剤」は哺乳動物患者、好ましくは人間、に対する投与に適する形態の薬品、例えば、ベンダムスチン、の調合物をさす。それ故、「調剤」は製薬学的に許容可能な賦形剤、希釈剤、または担体の添加を包含しうる。
【0057】
ここで使用される用語「凍結乾燥粉末」または「凍結乾燥調合物」は水溶液の凍結乾燥、すなわち、凍結−乾燥、により得られるいずれかの固体物質をさす。水溶液は非−水性溶媒を含有することができ、すなわち水性および1種もしくはそれ以上の非−水性溶媒より構成されうる。好ましくは、凍結乾燥調合物は固体物質が水性および1種もしくはそれ以上の非−水性溶媒より構成される溶液を凍結−乾燥することにより得られるものであり、より好ましくは非−水性溶媒はアルコールである。
【0058】
「安定な製薬学的組成物」によると、製薬学的製品としての有用性を有するのに充分な安定性を有するいずれかの製薬学的組成物が意味される。好ましくは、安定な製薬学的組成物は好ましくは−20℃〜40℃、より好ましくは約2℃〜約30℃の間の便利な温度における妥当な期間、例えば、1ヶ月ほどの短さでありうるが典型的には6ヶ月もしくはそれ以上、より好ましくは24ヶ月もしくはそれ以上、そしてより好ましくは36ヶ月もしくはそれ以上である製品の貯蔵−寿命、にわたる貯蔵を可能にするのに充分な安定性を有する。貯蔵−寿命または有効期限は、活性成分が90%純度より低い点まで分解する時間量でありうる。本発明の目的のためには、安定な製薬学的組成物はここに記載された具体的な範囲の不純物を有する製薬学的組成物への言及を包含する。好ましくは、安定な製薬学的組成物は活性成分の最少の分解があるものであり、例えばそれは2〜30℃における2〜3年間の期間にわたる貯蔵後に少なくとも約85%、好ましくは少なくとも90%、そしてより好ましくは少なくとも約95%の分解されない活性成分を保有する。
「安定な凍結乾燥調合物」によると、製薬学的製品としての有用性を有するための充分な安定性、例えば安定な製薬学的組成物に関してここで同様に定義されたような特性、を有するいずれかの凍結乾燥調合物が意味される。
【0059】
「分解された」によると、活性成分が化学構造における変化を受けたことを意味する。
【0060】
ここで使用される用語「治療的に有効な量」は、処置される疾患の1種もしくはそれ以上の徴候をある程度緩和するであろう化合物の投与量をさす。新生物の処置に言及すると、治療的に有効な量は(1)腫瘍の寸法を減ずる、(2)腫瘍転移を抑制する(すなわち、ある程度遅らせ、好ましくは停止させる)、(3)腫瘍成長をある程度抑制する(すなわち、ある程度遅らせ、好ましくは停止させる)、および/または、(4)癌に伴う1種もしくはそれ以上の徴候をある程度緩和する(もしくは、好ましくは、排除する)効果を有する量をさす。治療的に有効な量は、疾病に罹り易いが疾病の徴候をまだ体験または示さない動物における疾病発生の防止も意味する(予防処置)。さらに、治療的に有効な量は末期疾患に罹っている患者の余命を延ばす量でもありうる。非−ホジキンリンパ腫の処置のためのベンダムスチンに関する典型的な治療的に有効な服用量は2連続日にわたる単一服用量としての約60〜120mg/m2でありうる。サイクルを3〜4週間毎に繰り返すことができる。慢性リンパ性白血病(CLL)の処置のためには、ベンダムスチンは1および2日目に約80〜100mg/m2で与えることができ、サイクルを4週間後毎に繰り返すことができる。ホジキン病(段階II〜IV)の処置のためには、ベンダムスチンは1および15日目における25mg/m2のダウロルビシン、1および15日目における10mg/m2のブレオマイシン、1および15日目における1.4mg/m2のビンクリスチン、並びに1〜5日目における50mg/m2のベンダムスチンで「DBVBe処方」において与えられ、約4週間毎のサイクルを繰り返す。乳癌に関すると、1および8日目におけるベンダムスチン(120mg/m2)を1および8日目における40mg/m2のメトトレキセートおよび1および8日目における600mg/m2のフルオロウラシルと組み合わせて与えることができ、サイクルを約4週間毎に繰り返す。乳癌に関する別系統の療法として、ベンダムスチンを1および2日目に約100〜150mg/m2で与えることができ、サイクルを約4週間毎に繰り返す。
【0061】
ここで使用される「新生物」は、成長の通常の制限を受けない細胞の増殖のために起きる成長の如き異常成長である新生物生成をさす。ここで使用される「抗−新生物剤」は細胞の新生物表現型を抑制し、除去し、遅らせ、または逆転するいずれかの化合物、組成物、混合物、共同混合物、または配合物である。
【0062】
ここで使用される「高増殖」は特定の成長因子に応答する細胞の過剰生成である。「高増殖性疾患」は特定の成長因子に応答して細胞が過剰生成する疾病である。そのような「高増殖性疾患」の例は糖尿病性網膜症、乾癬、子宮内膜症、癌、斑変性疾患および良性成長疾患、例えば前立腺肥大を包含する。
【0063】
ここで使用される用語「バイアル」は、硬質または軟質のどちらかの、いずれかの壁のある容器をさす。
【0064】
ここで使用される「調節する」は調節される事象の達成を促進させるためにその場で調節を行うことを意味する。例えば、特定の場合には、「調節する」は各ロットまたは多くのロットの試料を規則的にまたは無作為に試験し;分解物の濃度を放出仕様として設定し;工程条件、例えば凍結乾燥前溶液または分散液中でのアルコールおよび/または他の有機溶媒の使用を選択して、活性成分の分解物の濃度が許容不能なほど高くなくするなどを意味しうる。分解物の量に関する放出仕様を設定することによる分解物に関する調節を使用して規制官庁、例えば米国食品医薬品局および他の国々または地域における同様な官庁(「官庁」)、による製薬学的製品の規制認可を早めることができる。
【0065】
ここで使用される用語「製薬学的に許容可能な」は、成分が薬理学的活性の許容不能な損失または許容不能な悪質な副作用を引き起こさないようなもの、例えば、製薬学的組成物の容器を包含する成分を意味する。製薬学的に許容可能な成分の例は、米国薬局方(USP)、1990年にメリーランド州ロックビルで開催された米国薬局方会議において採択された米国国民医薬品集(NF)、および米国食品医薬品局により発行されたEDA不活性成分指針1990、1996(両方とも図面を包含して引用することにより本発明の内容となる)に示されている。USP/NF以外の必然的な制限および/または仕様に合う他の等級の溶液または成分を使用することもできる。
【0066】
ここで使用される用語「製薬学的組成物」は、それが人間への投与に適する、例えば、それがGMP条件下で製造されるような、例えばそれが製薬学的に許容可能な賦形剤、例えば限定するものではないが安定剤、バルキング剤、緩衝剤、担体、希釈剤、賦形剤、溶解剤、および結合剤を含有するような条件下で製造されるような組成物を意味する。ここで使用される製薬学的組成物は凍結乾燥前溶液または分散液並びに凍結乾燥調合物の再構
成後の注射または注入の準備がなされている液体形態を包含するが、それらに限定されない。
【0067】
ここで使用される「製薬学的薬用量形態」は、容器内にありそして1回もしくはそれ以上の服用量、典型的には約1〜2、1〜3、1〜4、1〜5、1〜6、1〜10、もしく約1〜20回の服用量、の再構成および投与に適する量のここに開示されている製薬学的組成物を意味する。好ましくは、ここで使用される「製薬学的薬用量形態」は、容器内にありそして1回もしくはそれ以上の服用量、典型的には約1〜2、1〜3、1〜4、1〜5、1〜6、1〜10、もしくは約1〜20回の服用量の再構成および分配に適する量のここに開示されている製薬学的組成物を意味する。製薬学的薬用量形態はバイアルもしくは注射器または他の適当な製薬学的に許容可能な容器を含んでなりうる。注射または注入使用に適する製薬学的薬用量形態は、殺菌性の注射可能もしくは注入可能な溶液または分散液の処方箋調合物用に適合させた活性成分を含んでなる殺菌性の水性溶液もしくは分散液または殺菌性粉末を包含しうる。全ての場合に、最終的な薬用量形態は製造および貯蔵の条件下で殺菌性であり、流動性であり且つ安定性でなければならない。液体の担体または賦形剤は、例えば、水、エタノール、ポリオール、例えばグリセロール、プロピレングリコールもしくは液体ポリエチレングリコール類など、植物油、無毒のグリセリルエステル類、およびそれらの適当な混合物を含んでなる溶媒または液体分散媒体でありうる。微生物の成長の防止は、種々の抗細菌および抗カビ・菌剤、例えば、パラベン類、クロロブタノール、フェノール、ソルビン酸、チオメロサルなどにより行うことができる。
【0068】
ここで使用される用語「賦形剤」は製薬学的調剤中で活性な製薬学的成分(API)を調合するために使用される物質を意味し、好ましい態様では、賦形剤はAPIの主要な治療効果を低下もしくは妨害しない。好ましくは、賦形剤は治療的に不活性である。用語「賦形剤」は担体、希釈剤、ビヒクル、溶解剤、安定剤、バルキング剤、および結合剤を包括する。賦形剤はまた、製造工程の間接的なまたは意図せぬ結果として製薬学的調剤中に存在する物質でもありうる。好ましくは、賦形剤は人間および動物投与に関して安全であると認可されまたはみなされており、すなわち、(一般的に安全性に関する)GRAS物質である。GRAS物質は、引用することにより本発明の内容となる連邦規制法(CFR)食品および医薬品投与21CFR§182および21CFR§184により挙げられている。好ましい賦形剤はマンニトール類などを包含するヘキシトール類を包含するが、それらに限定されない。
【0069】
ここで使用される「有機溶媒の安定化濃度」または「アルコールの安定化濃度」は、最終薬品製品の中で特定水準の分解物を得るためにベンダムスチンの分解水準を減ずる有機溶媒またはアルコールの量を意味する。例えば、分解物HP1に関すると、有機溶媒の安定化濃度は約0.5%より低い、好ましくは約0.45%より低い、好ましくは約0.40%より低い、より好ましくは約0.35%より低い、より好ましくは約0.30%より低い、そしてさらにより好ましくは約0.25%より低いHP1濃度(ベンダムスチンの面積百分率)をもたらす量である。最終薬品製品の全体的なすなわち合計の分解物濃度に関すると、有機溶媒の安定化濃度は約7%(ベンダムスチンの面積百分率)より低い、好ましくは約6%より低い、より好ましくは約5%より低い、そしてさらにより好ましくは約4.0%より低い、(薬品製品放出時における)合計の分解物濃度をもたらす量である。「ベンダムスチンの面積百分率」によると、例えば、HPLCにより測定されるベンダムスチンの量に関する特定の分解物、例えば、HP1の量が意味される。
【0070】
用語「有機溶媒」は、他の物質を溶解しうる有機物質、一般的には液体を意味する。
【0071】
ここで使用される用語「有機溶媒の痕跡量」は、例えば、ICH指針(International Conferences on Harmonization,Impu
rities-Guidelines for Residual Solvents.Q3C.Federal Register.1997;62(247):67377)により推奨されるような製薬学的製品に関する推奨水準と同等またはそれより少ない溶媒の量を意味する。下限は検出されうる最低量である。
【0072】
用語「放出」または「放出時」は、薬品製品が放出仕様に合致しておりそしてその意図する製薬学的目的のために使用できることを意味する。
【0073】
A.一般論
本発明はベンダムスチンから製造される安定な製薬学的に許容可能な組成物を提供する。特に、本発明はベンダムスチンHClの凍結乾燥用の調剤を提供する。そのような調剤から得られる凍結乾燥粉末はベンダムスチンの現在入手可能な凍結乾燥粉末より容易に再構成される。さらに、本発明の凍結乾燥製品は、再構成前に、凍結乾燥物の貯蔵時に、または再構成および混合後に、ある種の不純物、特にHP1、ベンダムスチン二量体、およびベンダムスチンエチルエステル、に関してリボムスチン(R)より良好な不純物特徴を有する。
【0074】
本発明はさらに、新生物疾病を処置するために有用なベンダムスチンの調剤も提供する。ここに記載された調剤は単独でまたは少なくとも1種の他の抗−新生物剤および/または放射活性療法と組み合わせて投与することができる。
【0075】
本発明の一面は、凍結乾燥工程の前もしくは最中に、貯蔵時にまたは再構成時にベンダムスチンの安定性を高めるための条件および手段である。
【0076】
本発明の調剤と組み合わされて使用できる抗−新生物剤は、the Merck Index 11,pp 16−17,Merck & Co.,Inc.(1989)およびThe Chemotherapy Source Book(1997)に示されているものを包含する。両方の文献は広く認識されておりそして当業者には容易に入手可能である。
【0077】
商業的使用において、臨床評価において、そして非−臨床開発において利用可能な組み合わせ薬品化学療法による新生物の処置のために選択できる多くの抗新生物剤がある。そのような抗新生物剤は数種の主要な種類、すなわち、抗生物質−タイプ剤、共有DNA−結合薬品、抗代謝剤、例えばプレドニソン(prednisone)およびデキサメタソン(dexamethasone)の如きグルココルチコイド類を包含するホルモン剤、免疫剤、インターフェロン−タイプ剤、例えばレチノイド類の如き分化剤、プロ−アポプトシス剤、並びに例えばアンチセンス(antisense)、小さい妨害RNAの如き化合物を包含するある種の混成剤に入る。或いは、他の抗−新生物剤、例えばメタロマトリックス・プロテアーゼ(MMP)阻害剤、SOD模造物質またはアルファvベータ3阻害剤を使用することができる。
【0078】
本発明の化合物と組み合わせて使用できる抗新生物の一群は抗代謝−タイプの抗新生物剤よりなる。適する抗代謝抗新生物剤は、アラノシン(alanosine)、AG2037(フィッツァー(Pfizer))、5−FU−フィブリノーゲン(5−FU−fibrinogen)、アカンチフォリック・アシド(acanthifolic acid)、アミノチアジアゾール(aminothiadiazole)、ブレキナー・ナトリウム(brequinar sodium)、カルモフル(carmofur)、チバ−ガイギーCGP−30694(Ciba−Geigy CGP−30694)、シクロペンチル・シトシン(cyclopentyl cytosine)、ステアリン酸燐酸シタラビン(cytarabine phosphate stearate)、シタラビン・コンジュゲート類(cytarabine conjugates)、リリー・DATHF(Lilly DATHF)、メレル・ダウ・DDFC(Merrel Dow DDFC)、デザグアニン(dezaguanine)、ジデオキシシチジン(dideoxycytidine)、ジデオキシグアノシン(dideoxyguanosine)、ジドックス(didox)、ヨシトミ・DMDC(Yoshitomi DMDC)、ドキシフルリジン(doxifluridine)、ウェルカム・EHNA(Wellcome EHNA)、メルク・アンド・カンパニー・EX−015(Merck & Co.EX−015)、ファザラビン(fazarabine)、フロクスリジン(floxuridine)、燐酸フルダラビン(fludarabine phosphate)、5−フルオロウラシル(5−fluorouracil)、N−(2’−フラニジル)−5−フルオロウラシル(N−(2’−furanidyl)−5−fluorouracil)、ダイイチ・セイヤク・FO−152(Daiichi Seiyaku FO−152)、イソプロピル・ピロリジン(isopropyl pyrrolizine)、リリー・LY−188011(Lilly LY−188011)、リリー・LY−264618(Lilly LY−264618)、メトベンザプリム(methobenzaprim)、メトトレキセート(methotrexate)、ウェルカム・MZPES(Wellcome MZPES)、ノルスペルミジン(norspermidine)、NCI NSC−127716、NCI NSC−264880、NCI NSC−39661、NCI NSC−612567、ワーナー−ランバート・PALA(Warner−Lambert PALA)、ペントスタチン(pentostatin)、ピリトレキシム(piritrexim)、プリカマイシン(plicamycin)、アサヒ・ケミカル・PL−AC(Asahi Chemical PL−AC)、タケダ・TAC−788(Takeda TAC−788)、チオグアニン(thioguanine)、チアゾフリン(tiazofurin)、エルバモント・TIF(Erbamont TIF)、トリメトレキセート(trimetrexate)、チロシン・キナーゼ(tyrosine kinase)阻害剤、チロシン・プレテイン・キナーゼ(tyrosine pretein kinase)阻害剤、タイホウ・UFT(Taiho UFT)およびウリシチン(uricytin)よりなる群から選択されうる。
【0079】
本発明の化合物と組み合わせて使用できる抗新生物剤の第二群は共有DNA−結合剤よりなる。適するアルキル化−タイプの抗新生物剤はシオノギ・254−S(Shionogi 254−S)、アルド−ホスファミド(aldo−phosphamide)同族体、アルトレタミン(altretamine)、アナキシロン(anaxirone)、ベーリンゲル・マンハイム・BBR−2207(Boehringer Mannheim BBR−2207)、ベストラブシル(bestrabucil)、ブドチタン(budotitane)、ワクナガ・CA−102(Wakunaga CA−102)、カルボプラチン(carboplatin)、カルムスチン(carmustine)、チノイン−139(Chinoin−139)、チノイン−153(Chinoin−153)、クロランブシル(chlorambucil)、シスプラチン(cysplatin)、シクロホスファミド(cyclophosphamide)、アメリカン・シアナミド・CL−286558(American Cyanamid CL−286558)、サノフィ・CY−233(Sanofi CY−233)、シプラテート(cyplatate)、デグッサ・D−19−384(Degussa D−19−384)、スミモト・DACHP(Myr)2(Sumimoto DACHP(Myr)2)、ジフェニルスピロムスチン(diphenylspiromustine)、ジプラチナム・シトスタティック(diplatinum cytostatic)、エルバ・ジスタマイシン(Erba distamycin)誘導体、チュウガイ・DWA−2114R(Chugai DWA−2114R)、ITI E09、エルムスチン(elmustine)、エルバモント・FCE−24517(Erbamont FCE−24517)、エストラムスチン・フォスフェート・ナトリウム(estramustine phosphate sodium)、フォテムスチン(fotemustine)、ユニメド・G−6−M(Umimed G−6−M)、チノイン・GYKI−17230(Chinoin GYKI−17230)、ヘプスル−ファム(hepsul−fam)、イフォスファミド(ifosfamide)、イプロプラチン(iproplatin)、ロムスチン(lomustine)、マフォスファミド(mafosfamide)、メルファラン(melphalan)、ミトラクトール(mitolactol)、ニッポン・カガク・NK−121(Nippon Kayaku NK−121)、NCI NSC−264395、NCI NSC−342215、オキサリプラチン(oxaliplatin)、アップジョン・PCNU(Upjohn PCNU)、プレドニムスチン(prednimustine)、プロター・PTT−119(Proter PTT−119)、ラニムスチン(ranimustine)、セムスチン(semustine)、スミスクライン・SK&F−101772(SmithKline SK&F−101772)、ヤクルト・ホンシャ・SN−22(Yakult Honsha SN−22)、スピロムスチン(spiromustine)、タナベ・セイヤク・TA−077(Tanabe Seiyaku TA−077)、タウロムスチン(tauromustine)、テモゾロミド(temozolomide)、テロキシロン(teroxirone)、テトラプラチン(tetraplatin)およびトリメラモル(trimelamol)よりなる群から選択されうる。
【0080】
ここに開示された化合物と組み合わせて使用できる抗新生物剤の別の群は抗生物質−タイプ抗新生物剤よりなる。適する抗生物質−タイプ抗新生物剤はタイホウ・4181−A(Taiho 4181−A)、アクラルビシン(aclarubicin)、アクチノマイシン・D(actinomycin D)、アンチノプラノン(actinoplanone)、アラノシン(alanosine)、エルバモント・ADR−456(Erbamont ADR−456)、アエロプリシニン(aeroplysinin)誘導体、アジノモト・AN−201−II(Ajinomoto AN−201−II)、アジノモト・AN−3(Ajinomoto AN−3)、ニッポン・ソーダ・アニソマイシン類(Nippon Soda anisomycins)、アンスラシクリン(anthracycline)、アジノ−マイシン−A(azino−mycin−A)、ビスカベリン(bisucaberin)、ブリストール−マイヤーズ・BL−6859(Bristol−Myers BMY−6859)、ブリストール−マイヤーズ・BMY−25067(Bristol−Myers BMY−25067)、ブリストール−マイヤーズ・BMY−25551(Bristol−Myers BMY−25551)、ブリストール−マイヤーズ・BMY−26605(Bristol−Myers BMY−26605)、ブリストール−マイヤーズ・BMY−27557(Bristol−Myers BMY−27557)、ブリストール−マイヤーズ・BMY−28438(Bristol−Myers BMY−28438)、硫酸ブレオマイシン(bleomycin sulfate)、ブリオスタチン−1(bryostatin−1)、タイホウ・C−1027(Taiho C−1027)、カリケマイシン(calichemycin)、クロモキシマイシン(chromoximycin)、ダクチノマイシン(dactinomycin)、ダウノルビシン(daunorubicin)、キョウワ・ハッコウ・DC−102(Kyowa Hakko DC−102)、キョウワ・ハッコウ・DC−79(Kyowa Hakko DC−79)、キョウワ・ハッコウ・DC88−A(Kyowa Hakko DC88−A)、キョウワ・ハッコウ・DC89−A1(Kyowa Hakko DC89−A1)、キョウワ・ハッコウ・DC92−B(Kyowa Hakko DC92−B)、ジトリサルビシン・B(ditrisarubicin B)、シオノギ・DOB−41(Shionogi DOB−41)、ドキソルビシン(doxorubicin)、ドキソルビシン−フィブリノーゲン(doxorubicin−fibrinogen)、エルサミシン−A(elsamicin−A)、エピルビシン(epirubicin)、エルブスタチン(erbstatin)、エソルビシン(esorubicin)、エスペラミシン−A1(esperamicin−A1)、エスペラミシン−A1b(esperamicin−A1b)、エルバモント・FCE−21954(Erbamont FCE−21954)、フジサワ・FK−973(Fujisawa FK−973)、フォストリエシン(fostriecin)、フジサワ・FR−900482(Fujisawa FR−900482)、グリドバクチン(glidobactin)、グレガチン−A(gregatin−A)、グリンカマイシン(grincamycin)、ヘルビマイシン(herbimycin)、イダルビシン(idarubicin)、イルジン類(illudins)、カズサマイシン(kazusamycin)、ケサリロージン類(kesarirhodins)、キョウワ・ハッコウ・KM−5539(Kyowa Hakko KM−5539)、キリン・ブレヴェリー・KRN−8602(Kirin Brewery KRN−8602)、キョウワ・ハッコウ・KT−5432(Kyowa Hakko KT−5432)、キョウワ・ハッコウ・KT−5594(Kyowa Hakko KT−5594)、キョウワ・ハッコウ・KT−6149(Kyowa Hakko KT−6149)、アメリカン・シアナミド・LL−D49194(American Cyanamid LL−D49194)、メイジ・セイカ・ME2303(Meiji Seika ME 2303)、メノガリル(menogaril)、ミトマイシン(mitomycin)、ミトキサントロン(mitoxantrone)、スミスクライン・M−TAG(SmithKline M−TAG)、ネオエナクチン(neoenactin)、ニッポン・カガク・NK−313(Nippon Kayaku NK−313)、ニッポン・カガク・NKT−01(Nippon Kayaku NKT−01)、SRI・インターナショナル・NSC−357704(SRI International NSC−357704)、オキサリシン(oxalysine)、オキサウノマイシン(oxaunomycin)、ペプロマイシン(peplomycin)、ピラチン(pilatin)、ピラルビシン(pirarubicin)、ポロスラマイシン(porothramycin)、ピリンダマイシン・A(pyrindamycin A)、トビシ・RA−I(Tobishi RA−I)、ラパマイシン(rapamycin)、リゾキシン(rhizoxin)、ロドルビシン(rodorubicin)、シバノミシン(sibanomicin)、シウェンマイシン(siwenmycin)、スミトモ・SM−5887(Sumitomo SM−5887)、スノウ・ブランド・SN−706(Snow Brand SN−706)、スノウ・ブランド・SN−07(Snow Brand SN−07)、ソランギシン−A(sorangicin−A)、スパルソマイシン(sparsomycin)、SS・ファーマシューティカル・SS−21020(SS Pharmaceutical SS−21020)、SS・ファーマシューティカル・SS−7313B(SS Pharmaceutical SS−7313B)、SS・ファーマシューティカル・SS−9816B(SS Pharmaceutical SS−9816B)、ステフィマイシン・B(steffimycin B)、タイホウ・4181−2(Taiho 4181−2)、タリソマイシン(talisomycin)、タケダ・TAN−868A(Takeda TAN−868A)、テルペンテシン(terpentecin)、スラジン(thrazine)、トリクロザリン・A(tricrozarin A)、アップジョン・U−73975(Upjohn U−73975)、キョウワ・ハッコウ・UCN−10028A(Kyowa Hakko UCN−10028A)、フジサワ・WF−3405(Fujisawa WF−3405)、ヨシトミ・Y−25024(Yoshitomi Y−25024)およびゾルビシン(zorubicin)よりなる群から選択されうる。
【0081】
本発明の化合物と組み合わせて使用できる抗新生物剤の第四群はアルファ−カロテン(alpha−carotene)、アルファ−ジフルオロメチル−アルギニン(alpha−difluoromethyl−arginine)、アシトレチン(acitretin)、三酸化砒素、アバスチン(Avastin)(R)(ベバシズマブ(bevacizumab))、バイオテク・AD−5(Biotec AD−5)、キョウリン・AHC−52(Kyorin AHC−52)、アルストニン(alstonine)、アモナフィド(amonafide)、アンフェチニル(amphethinile)、アンサクリン(amsacrine)、アンギオスタット(Angiostat)、アンキノマイシン(ankinomycin)、アンチ−ネオプラストン・A10(anti−neoplaston A10)、アンチネオプラストン・A2(antineoplaston A2)、アンチネオプラストン・A3(antineoplaston A3)、アンチネオプラストン・A5(antineoplaston A5)、アンチネオプラストン・AS2−1(antineoplaston AS2−1)、ヘンケル・APD(Henkel APD)、アフィジコリン・グリシネート(aphidicolin glycinate)、アスパラギナーゼ(asparaginase)、アバロール(Avarol)、バッカリン(baccharin)、バトラシリン(batracylin)、ベンフルロン(benfluron)、ベンゾトリプト(benzotript)、イプセン−ビューフォア・BIM−23015(Ipsen−Beaufour BIM−23015)、ビサントレン(bisantrene)、ブリスト−マイヤーズ・BMY−40481(Bristo−Myers BMY−40481)、ベスター・ボロン−10(Vestar boron−10)、ブロモフスファミド(bromofosfamide)、ウェルカム・BW−502(Wellcome BW−502)、ウェルカム・BW−773(Wellcome BW−773)、カラセミド(caracemide)、カルメチゾール塩酸塩(carmethizole hydrochloride)、アジノモト・CDAF(Ajinomoto CDAF)、クロルスルファキノキサロン(chlorsulfaquinoxalone)、ケメス・CHX−2053(Chemes CHX−2053)、ケメックス・CHX−100(Chemex CHX−100)、ワーナー−ランバート・CI−921(Warner−Lambert CI−921)、ワーナー−ランバート・CI−937(Warner−Lambert CI−937)、ワーナー−ランバート・CI−941(Warner−Lambert CI−941)、ワーナー−ランバート・CI−958(Warner−Lambert CI−958)、クランフェヌル(clanfenur)、クラビリデノン(claviridenone)、ICN化合物1259、ICN化合物4711、コントラカン(Contracan)、ヤクルト・ホンシャ・CPT−11 (Yakult Honsha CPT−11)、クリスナトール(crisnatol)、クラデルム(curaderm)、シトチャラシン・B(cytochalasin B)、シタラビン(cytarabine)、シトシチン(cytocytin)、メルズ・D−609(Merz D−609)、DABIS・マレエート(DABIS maleate)、ダカルバジン(dacarbazine)、ダテリプチニウム(datelliptinium)、ジデムニン−B(didemnin−B)、ジヘマトポルフィリン・エーテル(dihaematoporphyrin ether)、ジヒドロレンペロン(dihydrolenperone)、ジナリン(dinaline)、ジスタマイシン(distamycin)、トウヨウ・ファーマー・DM−341(Toyo Pharmar DM−341)、トウヨウ・ファーマー・DM−75(Toyo Pharmar DM−75)、ダイイチ・セイヤク・DN−9693(Daiichi Seiyaku DN−9693)、エリプラビン(elliprabin)、エリプチニウム・アセテート(elliptinium acetate)、エポチオネス・ツムラ・EPMTC(epothiones Tsumura EPMTC)、エルビツックス(erbitux)、エルゴタミン(ergotamine)、エルロトニブ(erlotnib)、エトポシド(etoposide)、エトレチネート(etretinate)、フェンレチニド(fenretinide)、フジサワ・FR−57704(Fujisawa FR−57704)、ガリウム・ナイトレート(gallium nitrate)、ゲンクワダフニン(genkwadaphnin)、グリベック(Gleevec)(R)(イマトニブ(imatnib))、チュウガイ・GLA−43(Chugai GLA−43)、グラクソ・GR−63178(Glaxo GR−6318)、ゲフィチニブ(gefitinib)、グリフォラン・NMF−5N(grifolan NMF−5N)、ヘキサデシルホスホコリン(hexadecylphosphocholine)、グリーン・クロス・HO−221(Green Cross HO−221)、ホモハリントニン(homoharringtonine)、ヒドロキシウレア(hydroxyurea)、BTG IGRF−187、インダノシン(indanocine)、イルモフォシン(ilmofosine)、イソグルタミン(isoglutamine)、イソトレチノイン(isotretinoin)、オウツカ・JI−36(Otsuka JI−36)、ラモット・K−477(Ramot K−477)、オツアク・K−76COONa(Otsuak K−76COONa)、クレハ・ケミカル・K−AM(Kureha Chemical K−AM)、メクト・コープ・KI−8110(MECT Corp KI−8110)、アメリカン・シアナミド・L−623(American Cyanamid L−623)、リューコレグリン(leukoregulin)、ロニダミン(lonidamine)、ルンドベック・LU−23−112(Lundbeck LU−23−112)、リリー・LY−186641(Lilly LY−186641)、NCI(US)MAP、マリシン(marycin)、メフロクイン(mefloquine)、メレル・ダウ・MDL−27048(Merrel Dow MDL−27048)、メドコ・MEDR−340(Medco MEDR−340)、メルバロン(merbarone)、メロシアニン(merocyanine)誘導体、メチルアニリノアクリジン(methylanilinoacridine)、モレキュラー・ゲネティックス・MGI−136(Molecular Genetics MGI−136)、ミナクチビン(minactivin)、ミトナフィド(mitonafide)、ミトキドン(mitoquidone)、モピダモル(mopidamol)、モトレチニド(motretinide)、ゼンヤク・コウギョウ・MST−16(Zenyaku Kogyo MST−16)、N−(レチノイル)アミノ酸類、ニッシン・フラウー・ミリング・N−021(Nisshin Flour Milling N−021)、N−アシル化されたデヒドロアラニン類、ナファザトロム(nafazatrom)、タイショウ・NCU−190(Taisho NCU−190)、ノコダゾール(nocodazole)誘導体、ノルモサング(Normosang)、NCI NSC−145813、NCI NSC−361456、NCI NSC−604782、NCI NSC−95580、オクトレオチド(octreotide)、オノ・ONO−112(Ono ONO−112)、オキザノシン(oquizanocine)、アクゾ・Org−10172(Akzo Org−10172)、パクリタキセル(paclitaxel)、パンクラチスタチン(pancratistatin)、パゼリプチン(pazelliptine)、ワーナー−ランバート・PD−111707(Warner−Lambert PD−111707)、ワーナー−ランバート・PD−115934(Warner−Lambert PD−115934)、ワーナー−ランバート・PD−131141(Warner−Lambert PD−131141)、ピエール・ファブレ・PE−1001(Pierre Fabre PE−1001)、ICRT・ペプチド・D(ICRT peptide D)、ピロキサントロン(piroxantrone)、ポリヘマトポルフィリン(polyhaematoporphyrin)、ポリプレイック・アシド(polypreic acid)、エファモル・ポルフィリン(Efamol porphyrin)、プロビマン(probimane)、プロカルバジン(procarbazine)、プログルミド(proglumide)、インビトロン・プロテアーゼ・ネキシン・I(Invitron protease nexin I)、トビシ・RA−700(Tobishi RA−700)、ラゾキサン(razoxane)、サッポロ・ブレヴェリーズ・RBS(Sapporo Breweries RBS)、レストリクチン−P(restrictin−P)、レテリプチン(retelliptine)、レチノイン酸、ローン−プーラン・RP−49532(Rhone−Poulenc RP−49532)、ローン−プーラン・RP−56976(Rhone−Poulenc RP−56976)、リツキサン(Rituxan)(R)(および他の抗CD20抗体、例えばベックサー(Bexxar)(R)、ゼバリン(Zevalin)(R))、スミスクライン・SK&F−104864(SmithKline SK&F−104864)、スタチン類(statins)(リピトル(Lipitor)(R)など)、スミトモ・SM−108(Sumitomo SM−108)、クラレイ・SMANCS(Kuraray SMANCS)、シーファーム・SP−10094(SeaPharm SP−10094)、スパトール(spatol)、スピロシクロプロパン(spirocyclopropane)誘導体、スピロゲルマニウム(spirogermanium)、ユニミド(Unimed)、SS・ファーマシューティカル・SS−554(SS Pharmaceutical SS−554)、ストリポルジノン(strypoldinone)、スチポルジオン(Stypoldione)、サントリー・SUN0237(Suntory SUN 0237)、サントリーSUN2071(Suntory SUN 2071)、スーパーオキシド・ジスムターゼ(superoxide dismutase)、タリドミド(Thalidomide)、タリドミド(Thalidomide)同族体、トヤマ・T−506(Toyama T−506)、トヤマ・T−680(Toyama T−680)、タキソール(taxol)、テイジン・TEI−0303(Teijin TEI−0303)、テニポシド(teniposide)、タリブラスチン(thaliblastine)、イーストマン・コダック・TJB−29(Eastman Kodak TJB−29)、トコトリエノール(tocotrienol)、トポスチン(Topostin)、テイジン・TT−82(Teijin TT−82)、キョウワ・ハッコウ・UCN−01(Kyowa Hakko UCN−01)、キョウワ・ハッコウ・UCN−1028(Kyowa Hakko UCN−1028)、ウクレイン(ukrain)、イーストマン・コダック・USB−006(Eastman Kodak USB−006)、ビンブラスチン・サルフェート(vin
blastine sulfate)、ビンクリスチン(vincristine)、ビンデシン(vindesine)、ビネストラミド(vinestramide)、ビノレルビン(vinorelbine)、ビントリプトール(vintriptol)、ビンゾリジン(vinzolidine)、ウィタノリド類(withanolides)およびヤマノウチ・YM−534(Yamanouchi YM−534)、ゾメタ(Zometa)(R)よりなる群から選択される抗新生物剤の混成群を包含する。
【0082】
本発明の組み合わせ化学療法で使用できる放射保護剤の例はAD−5、アドクノン(adchnon)、アミフォスチン(amifostine)同族体、デトックス(detox)、ジメスナ(dimesna)、1−102、MM−159、N−アシル化された−デヒドロアラニン類、TGF−ゲネンテク(TGF−Genentech)、チプロチモッド(tiprotimod)、アミフォスチン(amifostine)、WR−151327、FUT−187、ケトプロフェン・トランスデルマル(ketoprofen transdermal)、ナブメトン(nabumetone)、スーパーオキシド・ジスムターゼ(superoxide dismutase)(キロン・アンド・エンゾン(Chiron and Enzon))である。
【0083】
上記の抗新生物剤の製造方法は文献に見られる。ドキソルビシンの製造方法は、例えば、米国特許第3,590,028号明細書および第4,012,448号明細書に記載されている。メタロマトリックス・プロテアーゼ阻害剤の製造方法は欧州特許第780386号明細書に記載されている。アルファvベータ3阻害剤の製造方法は国際公開第97/08174号パンフレットに記載されている。
【0084】
好ましい非−新生物剤はダウノルビシン(daunorubicin)、ブレオマイシン(bleomycin)、ビンクリスチン(vincristine)、ドキソルビシン(doxorubicin)、ダカルバジン(dacarbazine)、プレドニソロン(prednisolone)、ミトキサントロン(mitoxantrone)、プレドニソン(prednisone)、メトトレキセート(methotrexate)、5−フルオロウラシル(5−fluorouracil)、デキサメタソン(dexamethasone)、タリドミド(thalidomide)、タリドミド(thalidomide)誘導体、2ME2、ネオバスタット(Neovastat)、R115777、三酸化砒素、ボルテゾミブ(bortezomib)、タモキシフェン(tamoxifen)、G3139(アンチセンス(antisense))、およびSU5416、ミトマイシン(mitomycin)、抗−CD20抗体、例えばリツキサン(Rituxan)(R)およびR−エトドラック(R−etodolac)の1種もしくはそれ以上を包含するが、それらに限定されない。
【0085】
本調剤を1種もしくはそれ以上の成分と共にまたはそれの代替として使用できる好ましい薬品処方はABVD(ドキソルビシン(doxorubicin)、ブレオマイシン(bleomycin)、ビンクリスチン(vincristine)、ダカルバジン(dacarbazine))、DBV(ダウノルビシン(daunorubicin)、ベロマイシン(belomycin)、ビンクリスチン(vincristine))、CVPP(シクロホスファミド、ビンブラスチン(vinblastine)、プロカルバジン(procarbazine)、プレドニソロン(prednisolone))、COP(シクロホスファミド、ビンクリスチン(vincristine)、プレドニソロン(prednisolone))、CHOP(シクロホスファミド、ドキソルビシン(doxorubicin)、ビンクリスチン(vincristine)およびプレドニソン(prednisolone))並びにCMF(シクロホスファミド、メトトレキセート(methotrexate)、5−フルオロウラシル(5−fluorouracil))を包含するが、それらに限定されない。別の処方は以下の表Aに示される。
【0086】
【表1】

【0087】
【表2】

【0088】
【表3】

【0089】
【表4】

【0090】
ここに記載されているように、水中の有機溶媒の除去後にベンダムスチンの凍結乾燥調剤が得られる。この調剤を製造するために使用される溶媒の最も典型的な例は第三級ブタノール(TBA)である。エタノール、n−プロパノール、n−ブタノール、イソプロパノール、酢酸エチル、炭酸ジメチル、アセトニトリル、ジクロロメタン、メチルエチルケトン、メチルイソブチルケトン、アセトン、1−ペンタノール、酢酸メチル、メタノール、四塩化炭素、ジメチルスルホキシド、ヘキサフルオロアセトン、クロロブタノール、ジメチルスルホン、酢酸、シクロヘキサンを包含する他の有機溶媒を使用することができる。これらの前記溶媒は個別にまたは組み合わせて使用することができる。有用な溶媒はベンダムスチンと共に安定な溶液を生成しなければならず且つ認識できる程度にAPIを分解または不活性化してはならない。選択される溶媒中のベンダムスチンの溶解度は溶媒中の薬品の商業的に有用な濃度を生ずるのに充分なほど高くなければならない。さらに、溶媒は薬品製品の水性分散液または溶液から、例えば、凍結乾燥または真空乾燥により、容易に除去できなければならない。好ましくは、約2−80mg/mL、好ましくは約5−40mg/mL、より好ましくは5−20mg/mLそしてさらにより好ましくは12−17mg/mL、のベンダムスチンの濃度を有する溶液が使用される。
【0091】
製薬学的に許容可能な凍結乾燥賦形剤を水相の中に溶解させることができる。本発明に有用な賦形剤の例は燐酸ナトリウムもしくはカリウム、クエン酸、酒石酸、ゼラチン、グリシン、並びに炭水化物、例えばラクトース、スクロース、マルトース、グリシン、デキストロース、デキストラン、トレハロースおよびヘタスターチ、を包含するが、それらに限定されない。マンニトールが好ましい賦形剤である。所望により使用することができる他の賦形剤は酸化防止剤、例えば、限定するものではないがアスコルビン酸、アセチルシステイン、システイン、亜硫酸水素ナトリウム、ブチル−ヒドロキシアニソール、ブチル
−ヒドロキシトルエンもしくはアルファ−酢酸トコフェロール、またはキレート化剤を包含する。
【0092】
本発明に従う有用な代表的な調剤および凍結乾燥サイクルを以下に示す。凍結乾燥は凍結乾燥または真空乾燥用に使用される標準的装置を用いて行うことができる。サイクルは充填/仕上げ用に使用される装置および施設に依存して変動しうる。
【0093】
本発明の代表的な態様によると、水性凍結乾燥前溶液または分散液を最初に製薬学的に許容可能な混和容器の中で調合する。溶液を殺菌容器内に無菌的に濾過し、適当な寸法のバイアルの中に充填し、部分的に栓をしそして凍結乾燥器の中に充填する。ここに記載されている凍結乾燥技術を用いて、約0.1〜約8.0%の範囲内の水分含有量が得られるまで溶液を凍結乾燥する。生じた凍結乾燥粉末は約6ヶ月間〜約2年間もしくはそれ以上、好ましくは約3年間もしくはそれ以上、にわたり約5℃〜約25℃において安定であり且つ注射用殺菌水または他の適当な担体を用いて容易に再構成されて例えば非経口的注射による内部投与に適するベンダムスチンの液体調剤を与えることができる。静脈内投与のためには、再構成された液体調剤、すなわち、製薬学的組成物、は好ましくは溶液である。
【0094】
凍結乾燥前溶液または分散液は通常は最初に製薬学的に許容可能な容器の中で、1)水(合計容量の約65%)に周囲温度において混合しながら賦形剤、例えばマンニトール、(約0〜約50mg/mL)を加え、2)約20°−35℃において混合しながら有機溶媒(0.5−99.9%v/v)、例えばTBA、を水溶液に加え、4)混合しながらベンダムスチンHClを所望する濃度となるまで加え、5)水を加えて最終容量を得、そして6)溶液を約1℃〜約30℃、好ましくは約5℃、に冷却することにより、調合される。前記の段階は特定の順序で示されているが、当業者が段階の順序および量を必要に応じて変動させうることは理解されよう。量は重量基準で準備することもできる。
【0095】
凍結乾燥前溶液または分散液を凍結乾燥前に殺菌することができ、殺菌は一般的には例えば0.22ミクロンもしくはそれ以下のフィルターによる無菌濾過により行われる。複数の殺菌フィルターを使用することができる。溶液または分散液の殺菌は当該技術で既知の他の手段、例えば照射、により行うことができる。
【0096】
この場合、殺菌後に、溶液または分散液は凍結乾燥の準備がなされる。一般的に、濾過された溶液が殺菌性受容容器に導入され、そして次にいずれかの適当な1個もしくは複数の容器に移され、そこで調剤が効果的に凍結乾燥される。普通は、ここに記載されたようにそして当該技術で既知であるように、製品が市販用容器、例えば、限定するものではないがバイアル、の中で調剤が効果的に且つ効率的に凍結乾燥される。
【0097】
凍結乾燥前溶液または分散液を凍結乾燥する際の使用のための代表的な工程を以下に示す。しかしながら、当業者は例えば限定されるものではないが凍結乾燥前溶液または分散液および凍結乾燥装置の如き事柄によって工程または方法に対する修飾を行えることを理解するであろう。
【0098】
最初に、製品を凍結乾燥室の中にある範囲の温度において入れそして次に一般的には数時間にわたり製品の凍結点よりかなり下の温度にする。好ましくは、温度は少なくとも2時間にわたる約−40℃もしくはそれ以下であろう。凍結が完了した後に、室およびコンデンサーを真空ポンプにより真空にし、コンデンサー表面は循環する冷蔵剤によりすでに冷却されていた。好ましくは、コンデンサーは溶液の凍結点より約−40°、より好ましくは約−50℃もしくはそれ以下、さらにより好ましくは約−60℃もしくはそれ以下、冷却されているであろう。さらに、室の真空化は約10〜約600ミクロン、好ましくは
約50〜約150ミクロン、の圧力が得られるまで続けるべきである。
【0099】
製品組成物を次に真空下で室およびコンデンサーの中で暖める。これは普通は、製品が凍結乾燥工程中に約10〜約600ミクロンの範囲の圧力において製品が載せられている凍結乾燥器内の棚を暖めることにより、行われるであろう。暖める工程は最適には非常に徐々に、数時間にわたり、行われるであろう。例えば、製品温度を最初に約−30℃から約−10℃に高めそして約10−70時間にわたり保つべきである。さらに、製品温度を凍結温度から約25℃−40℃に30−192時間の期間にわたり高めることもできる。バイアルからの凍結乾燥物の射出を防止するために、有機溶媒および水の完全な除去を第一回乾燥段階中に行わなければならない。完全な乾燥は真空、コンデンサー温度および製品貯蔵温度の安定化により確認できる。第一回乾燥後に、製品温度は約25℃−40℃に高められそして約5−40時間にわたり保たれなければならない。
【0100】
乾燥サイクルが完了したら、室内の圧力を殺菌性乾燥−窒素ガス(または同様な気体)を用いて大気圧(またはそれよりわずかに下)にゆっくり下げることができる。製品組成物が例えばバイアルの如き容器の中で凍結乾燥された場合には、バイアルに栓をし、取り出しそして密封することができる。製品の品質を分析するための種々の物理的、化学的、および微生物学的試験を行う目的のために、数個の代表試料を取り出すことができる。
【0101】
凍結乾燥ベンダムスチン調剤は典型的には製薬学的薬用量形態で販売される。本発明の製薬学的薬用量形態は、典型的にはバイアルの形態であるが、殺菌環境を維持可能な適当な容器、例えばアンプル、注射器、共通バイアル、でありうる。そのような容器は、材料がベンダムスチン調剤と相互作用しない限り、ガラスまたはプラスチックでありうる。閉鎖具は典型的には栓、最も典型的には殺菌性ゴム栓、好ましくはブルモブチルゴム栓、であり、それが密封を与える。
【0102】
凍結乾燥後に、ベンダムスチン凍結乾燥粉末を例えばバイアルの如き容器の中に充填することができ、或いは凍結乾燥前溶液をそのようなバイアルの中に充填しそしてその中で凍結乾燥して凍結乾燥ベンダムスチン調剤を直接含有するバイアルを生ずることもできる。そのようなバイアルは、溶液のその中への充填または凍結乾燥後に、栓を用いるようにして密封して、密封された殺菌性の製薬学的薬用量形態を与える。典型的には、バイアルは約10−500mg/バイアル、好ましくは約100mg/バイアル、のベンダムスチンおよび約5mg−2g/バイアル、好ましくは約170mg/バイアル、のマンニトールを含む凍結乾燥粉末を含有するであろう。
【0103】
本発明の凍結乾燥調剤を水、好ましくは注射用殺菌水、または他の殺菌性流体、例えば共−溶媒、を用いて再構成して、例えば通常の食塩水による適当な静脈内混合容器中でのさらなる希釈後の非経口的注射によるような投与に適するベンダムスチンの溶液を与えることができる。
【0104】
B.溶解度
水(単独)並びに種々の量の凍結乾燥で一般的に使用されるアルコール類、例えば、メタノール、エタノール、プロパノール、イソプロパノール、ブタノールおよび第三級−ブチルアルコール(TBA)、を含むものの中のベンダムスチンHCl(ベンダムスチン)の溶解度を視覚的検査により測定した。25.5mg/mLのマンニトールと組み合わされた15mg/mLのベンダムスチンの量を10mLの指定されたアルコール溶液中で室温において製造した(表1参照)。試料を次に5℃において冷蔵しそして0、3、6および24時間後に粒子および/または沈殿に関して検査した。
【0105】
表1に示される結果は、ベンダムスチン溶解度が温度および水溶液中のアルコールの量
に依存することを示す。試験したアルコール類に関しては、ベンダムスチンの溶解度はアルコールの濃度の増加につれて増加した。沈殿の生成も温度および時間に依存していた。ベンダムスチンはいずれのアルコールとも即時に沈殿しなかったが、5℃における貯蔵後に結晶化した。アルコール類は溶解度に対するそれらの影響において変動した。いずれかの特定理論に拘束しようとは望まないが、比較的高級のアルコール類(第三級−ブタノールおよびn−ブタノール)と比べて比較的低級のアルコール類、例えばメタノールおよびエタノール、は溶解度に対してより少ない影響を有する。しかしながら、アルコールの形状も重要である。例えば、この系における沈殿を防止する際にはn−プロパノールはイソ−プロパノールより良好でないことが見出された。溶解度に対する最大の影響を有する2種のアルコール類はn−ブタノールおよび第三級−ブタノールであった。
【0106】
【表5】

【0107】
3種の異なる溶液に関して種々の温度においてベンダムスチンの溶解度を定量的に評価するための実験は図1および表2にまとめられている。実験で使用された20%(v/v)、30%(v/v)TBAの量は安定性試験に基づいている(結果は以下に記載される)。試験した両方の溶液に関して、ベンダムスチンの溶解度は25℃から0℃への温度につれて線状に減少した。この実験は表1に示されたデータを確認しそして20%および30%TBA溶液に関するベンダムスチン溶解度における差異を際立たせる。
【0108】
【表6】

【0109】
C.安定性
水を用いる加水分解による水溶液中のその不安定性のために、製薬学的使用に適する製品を製造するためにはベンダムスチンは凍結乾燥を必要とする。しかしながら、凍結乾燥薬品製品の製造中に、凍結乾燥前の充填には水溶液が一般的に必要である。それ故、ベンダムスチンおよび他のナイトロジェンマスタード類に関する混和および充填工程中の水溶液の使用は薬品製品の分解をもたらしうる。従って、ベンダムスチンの分解に対する種々のアルコール類の影響を評価してその調剤が比較的長い充填−仕上げが可能であると考えられるかどうかを決め、最近のリボムスチン(R)調剤より急速に再構成できる凍結乾燥粉末を与え、および/または、ある種の不純物、例えば、HP1、およびBM1二量体、に関してリボムスチン(R)より良好な不純物特徴を有するベンダムスチンの凍結乾燥調合物を与えた。
【0110】
好ましくは、本発明の凍結乾燥調合物はHP1に関して安定であり、すなわち、約2℃〜約30℃、好ましくは約5℃、において貯蔵される時にHP1の量は6ヶ月間にわたり、より好ましくは12ヶ月間より長く、そしてさらにより好ましくは24ヶ月間より長く、例えば36ヶ月間にわたり、認識できるほど増加しない(貯蔵−寿命仕様を越えない)。
【0111】
表3は、24時間の期間にわたる5℃におけるアルコールを添加しない水中でのベンダムスチンの安定性結果を示す。ベンダムスチンは水だけの中では急速に分解しそして主として加水分解生成物であるHP1(モノヒドロキシベンダムスチン)を生成する。
【0112】
【化5】

【0113】
【表7】

【0114】
この試験および他の長期安定性試験中に観察された他の主な分解物はベンダムスチンの二量体であった。
【0115】
【化6】

【0116】
ベンダムスチン凍結乾燥製品中に含有される他の分解物はベンダムスチンエチルエステル(BM1EE)(式IV)およびBM1DCE(式V)である。ベンダムスチンがエチルアルコールと反応する時にBM1EEが生成する。
【0117】
【化7】

【0118】
【化8】

【0119】
図2は、ベンダムスチンを種々のアルコール類の中で24時間にわたり5℃において培養した後のHPLC分析の純度結果をまとめている。結果は合計ピーク面積の面積百分率として表示される。図2に関する数値は表3−9に与えられている。純度は比較的高い濃度のアルコールを含有する溶液の中で、アルコールとは関係なく、最高であった。評価したアルコール類の中では、ベンダムスチンは約30%(v/v)のTBAを含有する溶液の中で最も少なく分解した。約10%〜約20%アルコール溶液の中では、ベンダムスチンの分解を予防する際にはn−ブタノールが優れていた。20%および30%(v/v)では、水中n−ブタノールはこれらの濃度における水中n−ブタノールの不溶性のために二相系を生じた。
【0120】
図3および4は、(ここで記載された通りの)HPLCにより定量化されたHP1および二量体生成により測定されるベンダムスチン類の分解量を示す。アルコール濃度の量が減少するにつれてHP1および二量体生成が増加した。不純物におけるこの増加は予測された時間依存性を伴って生じた(表3−9)。ベンダムスチンの分解の予防においてはtert−ブタノールおよびn−ブタノールが他のアルコール類より優れているようであった。表10に見られるように、マンニトールはTBAを用いるベンダムスチンの安定化に影響しなかった。
【0121】
【表8】

【0122】
【表9】

【0123】
【表10】

【0124】
【表11】

【0125】
【表12】

【0126】
【表13】

【0127】
表1−9における結果は、HP1および二量体に関するベンダムスチンHClの安定性がアルコール濃度の増加につれて改良することを示す。
【0128】
【表14】

【0129】
D.凍結乾燥サイクル開発
種々の凍結乾燥前調剤をベンダムスチン、マンニトール、およびアルコール類の種々の水中濃度において製造した。ここに記載されているような凍結(急速対遅延)、第一回乾燥(温度および圧力の両方)、並びに第二回乾燥に関して各段階においてサイクル開発を変化させそして最適化した。
【0130】
溶解度、安定性、および凍結乾燥の容易さに関する以上で詳述した情報の全てに基づき、好ましい調剤は下記のものを包含する:
【0131】
成分 濃度
ベンダムスチン 約2−40mg/mL
マンニトール 約0−50mg/mL
アルコール 約0.5%−40%(v/v)
水 所望する容量にするのに充分な量
ここでアルコールはメタノール、n−プロパノール、またはイソプロパノールから選択される。
【0132】
成分 濃度
ベンダムスチン 約5−20mg/mL
マンニトール 0−20mg/mL
アルコール 1−20%(v/v)
水 所望する容量にするのに充分な量
ここでアルコールはメタノール、n−プロパノール、またはイソプロパノールから選択される。
【0133】
成分 濃度
ベンダムスチン 約5−20mg/mL
マンニトール 10−30mg/mL
アルコール 5−40%(v/v)
水 所望する容量にするのに充分な量
【0134】
成分 濃度
ベンダムスチンHCl 約12−17mg/mL
マンニトール 約20−30mg/mL
アルコール 約5−15%(v/v)
水 所望する容量にするのに充分な量
【0135】
成分 濃度
ベンダムスチンHCl 約15mg/mL
マンニトール 約25.5mg/mL
アルコール 約10%(v/v)
水 所望する容量にするのに充分な量
【0136】
成分 濃度
ベンダムスチンHCl 約2−40mg/mL
マンニトール 約0−50mg/mL
ブタノール 約0.5−20%(v/v)
水 所望する容量にするのに充分な量
【0137】
成分 濃度
ベンダムスチンHCl 約5−20mg/mL
マンニトール 約10−30mg/mL
ブタノール 約1−10%(v/v)
水 所望する容量にするのに充分な量
【0138】
成分 濃度
ベンダムスチンHCl 約12−17mg/mL
マンニトール 約20−30mg/mL
ブタノール 約1−10%(v/v)
水 所望する容量にするのに充分な量
【0139】
成分 濃度
ベンダムスチンHCl 約15mg/mL
マンニトール 約25.5mg/mL
ブタノール 約10%(v/v)
水 所望する容量にするのに充分な量
【0140】
成分 濃度
ベンダムスチンHCl 約2−50mg/mL
マンニトール 約0−50mg/mL
第三級ブタノール 約0.5−100%(v/v)
水 所望する容量にするのに充分な量
【0141】
成分 濃度
ベンダムスチンHCl 約2−50mg/mL
マンニトール 約0−50mg/mL
第三級ブタノール 約0.5−99.9%(v/v)
水 所望する容量にするのに充分な量
【0142】
成分 濃度
ベンダムスチンHCl 約2−50mg/mL
マンニトール 約0−50mg/mL
第三級ブタノール 約0.5−99%(v/v)
水 所望する容量にするのに充分な量
【0143】
成分 濃度
ベンダムスチンHCl 約2−50mg/mL
マンニトール 約0−50mg/mL
第三級ブタノール 約90−99%(v/v)
水 所望する容量にするのに充分な量
【0144】
成分 濃度
ベンダムスチンHCl 約5−20mg/mL
マンニトール 約10−30mg/mL
第三級ブタノール 約5−80%(v/v)
水 所望する容量にするのに充分な量
【0145】
成分 濃度
ベンダムスチンHCl 約12−17mg/mL
マンニトール 約20−30mg/mL
第三級ブタノール 約10−50%(v/v)
水 所望する容量にするのに充分な量
【0146】
成分 濃度
ベンダムスチンHCl 約12.5−15mg/mL
マンニトール 約0−30mg/mL
エタノール 約20−30%(v/v)
水 所望する容量にするのに充分な量
【0147】
成分 濃度
ベンダムスチンHCl 約15mg/mL
マンニトール 約25.5mg/mL
第三級ブタノール 約30%(v/v)
水 所望する容量にするのに充分な量
【実施例】
【0148】
以下の実施例は本発明のある面を説明するためおよび本発明を実施する際に当業者を助けるために与えられる。これらの実施例は本発明の範囲をいずれかの方法で限定すると何ら考えるべきでない。
【0149】
物質:
ベンダムスチンHCl、(デグッサ(Degussa)、ロット番号0206005および0206007)
マンニトール、NFまたは同等物(マリンクロット(Mallinckrodt))
脱水されたエチルアルコール(200保証)、USPまたは同等物(スペクトルム(Spectrum))
第三級−ブチルアルコール、ACS(EMサイエンス(EM Science))
メタノール(スペクトルムおよびEMD)
プロパノール(スペクトルム)
イソ−プロパノール(スペクトルム)
ブタノール(スペクトルム)
水、HPLC等級または同等物(EMD)
アセトニトリル、HPLC等級または同等物(EMD)
トリフルオロ酢酸、J.T.ベーカー(J.T. Baker))
メタノール、HPLC等級または同等物(EMサイエンス、カタログ番号MX0488P−1)
トリフルオロ酢酸、HPLC等級または同等物(J.T.ベーカー、カタログ番号JT9470−01)
【0150】
装置:
光ダイオード列検出器付きのウォーターズ(Waters)2695アライアンス(Alliance)HPLCシステム
二重波長検出器付きのウォーターズ2795アライアンスHPLCシステム
分析秤(メトラー(Mettler)AG285、ID番号1028)および(メトラーXS205)
ヴィルチス・リオフィライザー・アドバンテージ(VirTis Lyophilizer AdVantage))
アジレント・ゾルバックス(Agilent Zorbax)SB−C18 5μm 80Å 4.6×250mmカラム、カタログ番号880975−902
【0151】
実施例1−HPLC工程
方法1
移動相A:0.1%TFA;H2O
移動相B:0.1%TFA;50%ACN:50%H2O
UV:230nm
流速:1.0mL/分
カラム温度:30℃
カラム:ゾルバックスSB−C18 5μm 80Å 4.6×250mm
試料温度:5℃
注入容量:10μL
試料濃度:MeOH中0.25mg/mL
勾配:1分間にわたる20%B
23分間にわたる20−90%B
6分間にわたる90%B
1分間にわたる20%Bへの戻り
4分間にわたり20%Bにおける保持
操作時間:30分間
後操作時間:5分間
【0152】
方法2
移動相A:0.1%TFA;H2O:ACN(9:1)
移動相B:0.1%TFA;H2O:ACN(5:5)
UV:230nm
流速:1.0mL/分
カラム:ゾルバックスSB−C18 5μm 80Å 4.6×250mm
カラム温度:30℃
試料温度:5℃
注入容量:10μL
試料濃度:MeOH中0.25mg/mL
勾配:3分間にわたる0%B
13分間にわたる0−50%
17分間にわたる50−70%
2分間にわたる70−90%
5分間にわたる90%
1分間にわたる0%Bへの戻り
4分間にわたり0%における保持
操作時間:40分間
後操作時間:5分間
【0153】
方法3
相A:0.1%TFA(v/v)を含むHPLC等級
相B:0.1%TFA(v/v)を含むHPLC等級ACN/水(1:1v/v)
UV:254nm
流速:1.0mL/分
カラム:ゾルバックスSB−C18 5μm 80Å 4.6×250mm
カラム温度:30℃
試料温度:5℃
注入容量:5μL
捕捉時間:30分間
後時間:9分間
希釈剤:メタノール
【0154】
【表15】

【0155】
試料調合物−薬品製品を200mLのMeOHと共に溶解させる。6分間にわたり超音波処理する。溶液をHPLCの中に直接注入することができる(約0.5mg/mL)。
【0156】
方法4
相A:0.1%TFA(v/v)を含むHPLC等級
相B:0.1%TFA(v/v)を含むHPLC等級ACN
UV:254nm
流速:1.0mL/分
カラム:ゾルバックスRP−C14 5μm 80Å 4.6×150mm
カラム温度:30℃
試料温度:5℃
注入容量:2μL
捕捉時間:31分間
後時間:9分間
希釈剤:NMP/水中0.1%TFA(50:50v/v)
【0157】
【表16】

【0158】
方法4に関する試料調合物−薬品製品を既知量の希釈剤と共に溶解させてHPLC中への直接的注入用の4.2mg/mLの濃度を生ずる。4.2mg/mLの試料濃度を得るためには第二回希釈(100mg/バイアル薬用量形態)を行うことが必要でありうる。
【0159】
結果
上記のHPLC方法1を用いるある種のベンダムスチン不純物に関する保持時間は表11に示されている。ここに記載されたHPLC工程を用いるリボムスチン(R)に関するHPLCクロマトグラフは図6に示されている。
【0160】
【表17】

【0161】
HPLC方法1はベンダムスチン中で見出される不純物を分解可能であったが、分析中に生成する潜在的不純物であるベンダムスチンのメチルエステル(BM1ME)を分離することはできなかった。BM1MEおよびBM1二量体の間の保持時間差は0.3分間だけであった。BM1二量体を分解するために、別のHPLC方法(番号2)を開発した。HPLC方法番号2は全ての不純物を分離できたが、45分間という比較的長い操作時間を必要とした(表12)。
【0162】
【表18】

【0163】
HPLC方法3を用いるリボムスチンの種々のロットの不純物特徴を表13に示す。
【0164】
【表19】

【0165】
実施例2−溶解度
水(単独)並びに種々の量のメタノール、エタノール、プロパノール、イソプロパノール、ブタノールおよび第三級−ブチルアルコール(TBA)中のベンダムスチンHCl(ベンダムスチン)の溶解度を視覚的検査により測定した。15mg/mLのベンダムスチン、25.5mg/mLのマンニトールの量を10mLの指定されたアルコール溶液(表1)の中で室温において製造した。試料を次に5℃において冷蔵しそして0、3、6および24時間後に粒子および/または沈殿に関して検査した。
【0166】
表1にまとめられている結果は、ベンダムスチン溶解度は温度および水溶液中のアルコ
ールの量に依存することを示している。全てのアルコール類に関して、アルコールの濃度が増加するにつれてベンダムスチンの溶解度が増加した。沈殿の生成も温度および時間に依存性であった。
【0167】
ベンダムスチンの溶解度は、25.5mg/mLの水中マンニトールを含有する20%(v/v)TBAおよび25.5mg/mLの水中マンニトールを含有する30%(v/v)TBAの中でも測定された(図1)。ベンダムスチンを4mLの各溶液に、それがもはや溶解しなくなるまで混合しながら、加えた。飽和溶液をそのまま1時間にわたり−8℃、0℃、5℃、または25℃において混合した。試料を遠心しそして元の温度に最低30分間にわたり戻した。−8℃の試料を塩化ナトリウムを含有する氷浴の中に入れ、それが氷浴の温度を低下させ、そして試料を分析用に除去する時に温度を測定した。各試料のアリコートを採取しそしてHPLC分析用に準備した。
【0168】
これらの実験の結果は図1および表2に示されている。実験(図1)で使用されたTBA、20%(v/v)および30%(v/v)の量はここに記載された安定性試験に基づいていた。
【0169】
図1に示されているように、ベンダムスチンの溶解度は温度(25℃から0℃まで)につれて線状に減少した。ベンダムスチンの溶解度は、それが水単独の中にまたはアルコールを含む水の中に溶解されたかどうかにかかわらず、温度依存性であった。20%(v/v)TBAも同様にベンダムスチンの安定性および溶解度に関して有効であり且つ耐久性のある製薬学的製造に関して要求される下方限度でありうる。15mg/mLのベンダムスチンの充填溶液は17.2mg/mLのベンダムスチンの5℃における飽和限度に近いが0℃における限度より高い。30%(v/v)TBAが最終的調剤に関するTBAの推奨濃度でありそして温度にかかわらず溶解度限度内である。
【0170】
実施例3−安定性
A.水中の安定性
ベンダムスチン(15mg/mL)およびマンニトール(25.5mg/mL)の水中溶液を室温において製造しそして10分間にわたり氷浴の中に入れて(温度を約5℃に急速に低下させ)そして次に5℃において冷蔵した。各調剤の試料をHPLCによりここに記載された方法を用いて0、3、6および24時間後に5℃において貯蔵される時に分析した。
【0171】
B.アルコール中の安定性
15mg/mLベのンダムスチン、25.5mg/mLのマンニトール、および1.9%、5%、10%、20%もしくは30%(v/v)のエチルアルコールの水中溶液または5%、10%、20%もしくは30%(v/v)のTBA、メタノール、プロパノール、イソ−プロパノール、もしくはブタノールの水中溶液を室温において製造し、10分間にわたり氷浴の中に入れそして次に5℃において冷蔵した。各調剤の試料をHPLCによりここに記載された方法を用いて0、3、6および24時間後に5℃において貯蔵される時に分析した。
【0172】
C.安定性結果
表3は、24時間の期間にわたる5℃におけるアルコールを添加しない水の中のベンダムスチンの安定性結果を示す。ベンダムスチンは水中で急速に分解するが、ベンダムスチンの安定性はアルコール濃度の増加につれて増加する(図2、3および4)。アルコール類はしばしば溶解問題を助けるために凍結乾燥において使用されるが、ベンダムスチンの安定性を保ちながら水溶液を使用することができるため、ベンダムスチン安定性に対するアルコール類の影響は比較的わずかな不純物を含むベンダムスチンの製造においては独特
なものであり、予期されておらずしかも有用である。試験した6種のアルコール類の中でTBAが最良の安定剤であることが見出された(図2、3、および4)。30%(v/v)における全てのアルコール類は、不純物であるHPIおよび二量体の生成を5℃において24時間までにわたり減じた。TBAに関すると、HPIは5℃における24時間までにわたる貯蔵時には約0.4%にだけ達する。15mg/mLのベンダムスチンで調合されそして5℃で貯蔵される時には、ベンダムスチン沈殿および不純物生成のために比較的低濃度のアルコールは有効でなくなりうる。
【0173】
実施例4−調剤最適化
ベンダムスチンの溶解度および安定性が測定された後に、調剤を凍結乾燥に関して最適化した。ベンダムスチンの濃度は30%TBA/水飽和溶液の中では他のアルコール溶液の中と比べて高いため、100mgのベンダムスチンを充填するのに必要なバイアル寸法を最近のリボムスチン(R)表示から減少させうることが予測される。ベンダムスチンの飽和溶液は0℃において18mg/mLを含有するが、バッチ差の結果としてのバルクAPI純度における差によるAPI溶解度におけるわずかな差を相殺するために15mg/mLの濃度が調剤に関して選択された。15mg/mLの濃度のベンダムスチンは1個のバイアル当たり100mgのベンダムスチンHClを充填するために6.67mLを必要とする。
【0174】
急速に凍結乾燥する良好な外観を有する凍結乾燥製品を製造するためには、表面積(昇華)対容量比が重要である。一般的に、凍結乾燥製品がバイアル容量の30%〜50%の間を占める。6.67mLを有する20mLバイアルはその容積の約30%を含有しておりそして0.796cm2/mL表面積比を有する。
【0175】
リボムスチン(R)と同様な調剤を維持するためにマンニトールがバルキング剤として選択された。ベンダムスチン溶解度および製品の外観に対するマンニトールの影響を評価するために試験を行った。マンニトールはエタノールおよびTBA水溶液の両方の中のベンダムスチン(15mg/mLにおける)の溶解度を減じる。例えば、5%および10%のエタノール並びにTBAを含有するマンニトールを含まない溶液は24時間にわたり沈殿しなかった。しかしながら、マンニトールを含む試料(表1)に関すると沈殿が24時間以内に観察された。30%(v/v)のTBA、15mg/mLのベンダムスチン、および25.5mg/mLのマンニトールを含有する水溶液に関しては沈殿がなかった。取り扱い中の破壊に対して耐性がある良く形成されたケーキを保つためには最低134mg/バイアルのマンニトールが必要であり、200mg/バイアルまでのマンニトールではバイアルの中で差異はなかった。
【0176】
試験した全てのアルコール類はベンダムスチンの安定性および溶解度を増加した。しかしながら、充填溶液の安定性および製造の容易さに影響を与えるためには有意なモル分率が必要であった。比較的少量のアルコール類はバルク溶液の凍結点を下げる望ましくない影響を有しておりそしてその結果として比較的低い温度では長い凍結乾燥サイクルを必要とする。高濃度のメタノールおよびエタノールは再構成することが困難な興味のないケーキを製造した。ベンダムスチン(15mg/mL)、マンニトール(25.5mg/mL)を含有する10%エタノール、20%エタノール、10%イソ−プロパノール、20%イソ−プロパノール、または30%TBA水溶液を製造しそして凍結乾燥した。0%エタノール、20%エタノール、10%イソ−プロパノール、20%イソ−プロパノールの溶液から充填された凍結乾燥バイアルはいずれも破壊したケーキまたはフィルム残渣を生じた。許容可能なケーキを生ずる唯一の溶媒系は30%TBAであった。さらに、0%エタノール、20%エタノール、10%イソ−プロパノール、20%イソ−プロパノール凍結乾燥バイアルの再構成は困難でありそして>45分間まで充分に溶解しなかった。
【0177】
小さいバイアルの使用可能性は水/有機溶液中のベンダムスチンの濃度または溶解度により限定される。許容可能なケーキ外観を生じた比較的低濃度のエタノール、メタノール、イソプロパノールおよびn−プロパノールでは、溶解度限度のためにベンダムスチンのさらなる希釈溶液が必要である。1個のバイアル当たり100mgのベンダムスチンを含む表示を保つためには、50mLより大きいバイアルが必要でなるであろう。また、ここでの安定性試験は比較的低いアルコール濃度では化学的安定性が許容可能な充填時間を可能にするには充分でなかったことを示した。
【0178】
再構成の容易さに影響する因子の1つは凍結乾燥物の多孔性である。一般的に、わずかな表面積を有する非晶質的に沈殿した固体は溶解するのがより困難である。マンニトールを含有するほとんどの凍結乾燥物は、しばしば液体の蒸発(溶融戻り)により引き起こされる凍結乾燥中に生成した沈殿がない限り、3−5分間以内に再構成されるであろう。数種の凍結乾燥溶媒系を用いる我々の経験に基づくといずれかの特定の理論に拘束されることは望まないが、リボムスチン(R)再構成に関連する問題は凍結乾燥中に溶融戻りを引き起こす沈殿に関連する。ほとんどの有機溶媒は効率的に凍結乾燥せずそしてそれらの低い融点のために溶融戻りを引き起こす。TBA(第三級ブチルアルコール)は水と比べて高い融点および同様な蒸気圧を有する。30−45分間を要することがある市販のリボムスチンと比べて、本発明に従う30%(v/v)TBAを含む製造された凍結乾燥物は3−10分以内に再構成される。
【0179】
溶解度、安定性、再構成の容易さおよび製造上の考察点に基づくと、下記のものが好ましい本発明の凍結乾燥前調剤である:約15mg/mLのベンダムスチンHCl、約25.5mg/mLのマンニトール、約30%(v/v)の第三級−ブチルアルコール、および充分量の注射用水。調剤を次に5℃において6.67mLを用いて琥珀色の20mLの20mmバイアルの中に充填しそしてブロモブチル栓で部分的に栓をし、そして予備−冷却された凍結乾燥器の中に充填した。
【0180】
実施例5−不純物評価
HPLC分析(図6)により測定される、製造、混和、充填、および凍結乾燥工程中に導入される主な不純物は、加水分解生成物であるHPI、二量体、およびベンダムスチンのエチルエステル、BM1EEである。BM1EEは薬品物質製造中、例えば再構成および/または精製中、に生成されうる。BM1EEはベンダムスチンより有効な細胞毒性薬品であることが知られている。30%TBA水性充填溶液の使用がベンダムスチンt−ブチルエステルの生成をもたらすかどうかを測定する実験が行われた。
【0181】
実験はベンダムスチンのt−ブチルエステルの生成に関して必要な伝統的なフィッシャーエステル化反応条件を用いて行われた。ベンダムスチンを60℃TBAの中でHClと共に20時間にわたり加熱した。何らかの反応も観察されなかった。この結果は、充填/仕上げ工程中にベンダムスチンのt−ブチルエステルを生成することが非常に困難であることを示した。TBAから製造された薬品製品中の新たな不純物は現在まで安定性試験では観察されなかった。
【0182】
薬品製品の試験を助けるために、t−ブチル部分のさらに反応性が大きい原料を用いる合成経路を開発した。tert−ブチルエステルを製造するための他の試みはベンダムスチンの塩化アシルの生成により行われた。ベンダムスチンの塩化メチレン中懸濁液を塩化オキサリルおよびN,N−ジメチルホルムアミドで処理した。塩化アシルが生成した後に、溶媒を濃縮した。残渣を塩化メチレン、tert−ブタノール、トリエチルアミン、および4−ジメチルホルムアミドに加えそして混合物を室温において一晩にわたり撹拌した。全ての溶媒の添加および精製後に、未知の化合物が得られた。LC−MSはベンダムスチンtert−ブチルエステルの分子量と合致せずそしてプロトンNMRはtert−ブチルに関するピークを示さなかった。従って、この試みはベンダムスチンtert−ブチルエステルを製造することにも失敗した。それ故、共−溶媒としてのTBAの使用はアルコールからエステルを生成しないという別の利点を有する。
【0183】
実施例6−凍結乾燥サイクル開発
凍結乾燥の重要な段階を評価しそして最も有効な乾燥サイクルを得るために多くの凍結乾燥サイクルを行った。製品に対する凍結速度、第一回乾燥温度、時間および圧力の影響を評価するために実験を行った。
【0184】
A.凍結速度
文献は、TBAが凍結速度によって異なる結晶形態をとることを報告している。ある種のTBA溶液の中では、製品がゆっくり凍結すればするほど、それは急速に乾燥する。より大きい孔を生ずるゆっくりした凍結中に生成する比較的大きい結晶はより効率的な昇華を可能にする。しかしながら、ベンダムスチンを用いる試験中には、2および8時間における評価時に凍結速度が臨界的な処理パラメーターであることは見出されなかった。
【0185】
B.第一回および第二回乾燥
30%TBA溶液から凍結乾燥するための最初の試みの間に、凍結乾燥ケーキは破壊しそして粉末がバイアルから射出された。これらのケーキは、溶融戻りを示す非晶質粒子を凍結乾燥物の中に含有するようであった。この現象は再現性がありそして暖める速度に関係なく製品が約−10℃に達した時に起きた(図5参照)。粉末射出の原因および解決法を決めるために数種の可変因子を試験した。圧力を第一回乾燥中に50μmから150μmに上昇させたが、粉末射出は比較的少ない程度であるが依然として観察された。凍結速度を2時間から8時間に延ばしたこと以外は、この実験を次に繰り返した。この変化は影響を与えなかった。
【0186】
第一回乾燥の長さを次に評価した。例えば、以下の非常にゆっくりした乾燥サイクルを評価した:150μmの室圧力を乾燥中に保ちながら、8時間にわたり+25℃から−50℃に凍結し;5時間にわたり−50℃に保ち、7時間にわたり−50℃から−25℃に暖めそして乾燥し;20時間にわたり−25℃に保ち、2時間にわたり−25℃から−15℃に暖めそして乾燥し且つ20時間にわたり−15℃に保ち、6時間にわたり−15℃から40℃に暖めそして乾燥し且つ20時間にわたり40℃に保つ。粉末射出は観察されなかった(図5)。このサイクルは、破壊のない容易に再構成される良好に製造されたケーキをもたらした。特定の理論に拘束しようとは望まないが、粉末射出に関連する問題および再構成に関連する困難はケーキからの強い蒸気流出並びに溶融戻りを生ずるあまりにも急速な凍結乾燥物の乾燥の結果でありうる。比較的激しくない乾燥サイクルの使用で、美的な、安定な、そして再構成が容易なケーキが再現可能に製造される。それ故、第二回乾燥前の全ての結合されていない水および第三級−ブチルアルコールの除去がこれらの穏やかな条件下ではさらに最適であった(図5)。40℃における20時間までの乾燥の結果として即時の分解生成物はなかった。
【0187】
実施例7−凍結乾燥サイクル
【0188】
【表20】

【0189】
ここに開示された全ての組成物および方法はこの開示に照らして過度の実験なしに製造および実施することができる。本発明の組成物および方法は好ましい態様に関して記載されてきたが、組成物および方法並びにここに記載された段階または段階の工程において本発明の精神および範囲から逸脱せずに当業者が変更を行えることは明らかである。より具体的には、ここに開示されている溶媒と化学的および生理学的の両方で関連するある種の溶媒がここに記載された溶媒を代替しても同一または同様な結果が得られるであろうことは明らかである。当業者に明らかな全てのそのような同様な代替および変更は添付された特許請求の範囲により規定される本発明の精神および範囲内であるとみなされる。
【0190】
明細書に挙げられた全ての特許、特許出願、および文献は、本発明が関与する技術の通常の専門家の水準を示す。全ての特許、特許出願、および文献は、各個別文献が具体的にそして個別に引用することにより本発明の内容となるように指示されている場合には同じ程度に引用することにより本発明の内容となる。
【0191】
ここで説明のために適切であると記載されている本発明はここに具体的に開示されていない1種もしくは複数の要素の不存在下で実施することができる。それ故、例えば、ここでの各場合において、用語「含んでなる」、「本質的になる」、および「よりなる」のいずれも他の2つの用語のいずれかで代替されうる。使用されてきた用語および表示は記述用語として使用されておりそして限定用ではなく、且つ示されそして記載された特徴またはその一部の同等物を排除するそのような用語および表示の使用を意図しないが、特許請求される発明の範囲内で種々の修飾が可能であることは認識される。それ故、本発明は好ましい態様および選択自由な特徴により具体的に開示されてきたがここに開示されている概念の修飾および変更が当業者により行われうること、並びにそのような修飾および変更が添付された特許請求の範囲により規定される本発明の範囲内であると考えられることは理解すべきである。
【特許請求の範囲】
【請求項1】
ベンダムスチン又はベンダムスチン塩酸塩、マンニトール、第三級ブタノールおよび水を有する製薬学的組成物。
【請求項2】
請求項1記載の製薬学的組成物において、前記ベンダムスチン又はベンダムスチン塩酸塩は約12〜17mg/mlの濃度で存在し、前記マンニトールは約20〜30mg/mlの濃度で存在し、および、前記第三級ブタノールは約10〜50%(v/v)の濃度で存在するものである、製薬学的組成物。
【請求項3】
請求項2記載の製薬学的組成物において、前記ベンダムスチン又はベンダムスチン塩酸塩は約15mg/mlの濃度で存在し、前記マンニトールは約25.5mg/mlの濃度で存在し、および、前記第三級ブタノールは約30%(v/v)の濃度で存在するものである、製薬学的組成物。
【請求項4】
請求項1記載の製薬学的組成物から製造される凍結乾燥製薬学的組成物。
【請求項5】
請求項4記載の凍結乾燥製薬学的組成物において、前記ベンダムスチン又はベンダムスチン塩酸塩は前記製薬学的組成物中に約12〜17mg/mlの濃度で存在し、前記マンニトールは前記製薬学的組成物中に約20〜30mg/mlの濃度で存在し、および、前記第三級ブタノールは前記製薬学的組成物中に約10〜50%(v/v)の濃度で存在するものである、凍結乾燥製薬学的組成物。
【請求項6】
請求項4記載の凍結乾燥製薬学的組成物において、前記ベンダムスチン又はベンダムスチン塩酸塩は前記製薬学的組成物中に約15mg/mlの濃度で存在し、前記マンニトールは前記製薬学的組成物中に約25.5mg/mlの濃度で存在し、および、前記第三級ブタノールは前記製薬学的組成物中に約30%(v/v)の濃度で存在するものである、凍結乾燥製薬学的組成物。
【請求項7】
約0.5%を超えない量のベンダムスチンエチルエステルを含む請求項4記載の凍結乾燥製薬学的組成物。
【請求項8】
約0.5%を超えない量のベンダムスチンエチルエステルを含む請求項5記載の凍結乾燥製薬学的組成物。
【請求項9】
約0.5%を超えない量のベンダムスチンエチルエステルを含む請求項6記載の凍結乾燥製薬学的組成物。
【請求項1】
ベンダムスチン又はベンダムスチン塩酸塩、マンニトール、第三級ブタノールおよび水を有する製薬学的組成物。
【請求項2】
請求項1記載の製薬学的組成物において、前記ベンダムスチン又はベンダムスチン塩酸塩は約12〜17mg/mlの濃度で存在し、前記マンニトールは約20〜30mg/mlの濃度で存在し、および、前記第三級ブタノールは約10〜50%(v/v)の濃度で存在するものである、製薬学的組成物。
【請求項3】
請求項2記載の製薬学的組成物において、前記ベンダムスチン又はベンダムスチン塩酸塩は約15mg/mlの濃度で存在し、前記マンニトールは約25.5mg/mlの濃度で存在し、および、前記第三級ブタノールは約30%(v/v)の濃度で存在するものである、製薬学的組成物。
【請求項4】
請求項1記載の製薬学的組成物から製造される凍結乾燥製薬学的組成物。
【請求項5】
請求項4記載の凍結乾燥製薬学的組成物において、前記ベンダムスチン又はベンダムスチン塩酸塩は前記製薬学的組成物中に約12〜17mg/mlの濃度で存在し、前記マンニトールは前記製薬学的組成物中に約20〜30mg/mlの濃度で存在し、および、前記第三級ブタノールは前記製薬学的組成物中に約10〜50%(v/v)の濃度で存在するものである、凍結乾燥製薬学的組成物。
【請求項6】
請求項4記載の凍結乾燥製薬学的組成物において、前記ベンダムスチン又はベンダムスチン塩酸塩は前記製薬学的組成物中に約15mg/mlの濃度で存在し、前記マンニトールは前記製薬学的組成物中に約25.5mg/mlの濃度で存在し、および、前記第三級ブタノールは前記製薬学的組成物中に約30%(v/v)の濃度で存在するものである、凍結乾燥製薬学的組成物。
【請求項7】
約0.5%を超えない量のベンダムスチンエチルエステルを含む請求項4記載の凍結乾燥製薬学的組成物。
【請求項8】
約0.5%を超えない量のベンダムスチンエチルエステルを含む請求項5記載の凍結乾燥製薬学的組成物。
【請求項9】
約0.5%を超えない量のベンダムスチンエチルエステルを含む請求項6記載の凍結乾燥製薬学的組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2013−56902(P2013−56902A)
【公開日】平成25年3月28日(2013.3.28)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−231760(P2012−231760)
【出願日】平成24年10月19日(2012.10.19)
【分割の表示】特願2007−551416(P2007−551416)の分割
【原出願日】平成18年1月13日(2006.1.13)
【出願人】(599133646)セフアロン・インコーポレーテツド (10)
【Fターム(参考)】
【公開日】平成25年3月28日(2013.3.28)
【国際特許分類】
【出願番号】特願2012−231760(P2012−231760)
【出願日】平成24年10月19日(2012.10.19)
【分割の表示】特願2007−551416(P2007−551416)の分割
【原出願日】平成18年1月13日(2006.1.13)
【出願人】(599133646)セフアロン・インコーポレーテツド (10)
【Fターム(参考)】
[ Back to top ]

