ペプチドが結合したビタミンC誘導体、その製造方法およびそれを含む組成物
【課題】安全性および安定性が改善されかつ皮膚浸透力に優れたビタミンC誘導体を提供することにある。
【解決手段】本発明は、ペプチドが結合したビタミンC誘導体またはその薬学的に許容される塩、その製造方法およびそれを含む組成物を開示する。
【解決手段】本発明は、ペプチドが結合したビタミンC誘導体またはその薬学的に許容される塩、その製造方法およびそれを含む組成物を開示する。
【発明の詳細な説明】
【発明の詳細な説明】
【0001】
〔技術分野〕
本発明は、ペプチドが結合したビタミンC誘導体またはその薬学的に許容される塩、その製造方法およびそれを含む組成物に関する。
【0002】
〔背景技術〕
皮膚は、保護機能、障壁機能、温度調節機能、排泄機能、呼吸機能などをする器官であって、表皮、真皮および皮下組織からなる。表皮は、最も薄い層であって、角質細胞とメラニン細胞との有機的な結合からなっている。真皮は、皮膚の約95%を担当し、皮膚の保湿および保護を担当する層であって、皮膚弾力(皺)に重要な役割をする代表的な蛋白質であるコラーゲンとエラスチンが網の如く絡み合っており、血管、神経が存在し、アレルギー反応に関与する肥満細胞、およびNa−PCAやヒアルロン酸などの天然保湿因子も含有している。皮下組織は、表皮および真皮への栄養供給、体型決定、体温維持、外部的な衝撃吸収、および皮下組織下の細胞保護などの役割をする。
【0003】
ところが、歳を取るにつれて、内因性および外因性原因によって皮膚機能が急激に低下する老化を感じるようになる。老化が進みながら、皮膚の構成成分である表皮、真皮および皮下組織の厚みが薄くなり、コラーゲンとエラスチンが細くかつ緩くなって弾力が低下し、皺などが生ずる。また、皮膚障壁の機能を担当している脂質障壁(Lipid barrier)の脂質の組成と含量が変わるにつれて皮膚の水分含量が低下し肌が乾いてしまうといった生理的変化を経験する。また、染み、雀斑、色素沈着およびその他様々な皮膚病変が誘発される。
【0004】
このような皮膚老化による問題点を解決するために、皮膚改善効果を持つ各種有効成分とそれを含む組成物が研究されている。
【0005】
皮膚老化を抑制させる効果のある成分としては、ビタミンC、ビタミンE、βカロチンといった抗酸化ビタミンなどが多く用いられている。この中でも、ビタミンCは、紫外線(UV)カット効果、抗酸化効果、コラーゲン形成促進による皮膚皺改善効果、染み/雀斑/黒斑などの色素沈着の改善効果、免疫体系強化効果などを持つ。このようなビタミンCの作用をまとめると、次のとおりである。
【0006】
ビタミンCは、紫外線、特にUVAに対する遮断機能が強い(Darr, D. et al., 1996, Acta Derm. Venereol. (Strckh). 76: 264-268; Black, H. S. et al., 1975, J. Invest. Dermatol. 65: 412-414)。また、ビタミンCは、UVBにより発生する皮膚損傷から保護する役割をするが、UVB照射の前に、ビタミンCを豚と人間のUVB照射皮膚部位につけると、赤み(紅斑)および日焼け現象が防止される(Darr, D. et al., 1992, Brit. J. Dermatil. 127: 247-253; Murry, J. et al., 1991, J. Invest. Dermatol. 96: 587)。
【0007】
皮膚、血液およびその他の組織における、化学的汚染、吸煙、特に紫外線(UV)によって誘発されるROS(Reactive Oxygen Species)を中和させる強力な生体抗酸化剤としてのビタミンCの作用は、ビタミンCが2つの電子を受け入れて脱水素−L−アスコルビン酸(Dehydro-L-ascorbic acid)の形で容易に酸化できる構造を持つためである。ビタミンCは、皮膚の非酵素的抗酸化剤防御システムの重要な要素であって、ビタミンCが高濃度で存在するとき、一重項酸素(single oxygen)、スーパーオキシドアニオン(superoxide anion)、ヒドロキシラジカル(hydroxyl radical)といったROSなどが蛋白質、核酸、細胞膜脂質などの生体成分を酸化または変性させる前に、これらを中和させる役割をする(Buettner, G. R. et al. 1996. Cadenas, E., Packer, L., eds. Handbook of antioxidants. pp. 91-115)。
【0008】
角質層に経皮的に供給されることにより皮膚光沢、皮膚色および弾力の改善、および皺の減少などを示すビタミンCの効果(米国特許第4,983,382号)は、ビタミンCによってコラーゲンの合成が促進されるためである。コラーゲンポリペプチドの10%程度を占めるヒドロキシプロリンは、プロリンヒドロキシラーゼ(praline hydroxylase)によって生合成されるが、この酵素の補因子(cofactor)としてビタミンCが作用する(Tomita, Y. et al., 1980, J. Invest. Dermatol. 75(5): 379-382)。すなわち、ビタミンCは、プロリンヒドロキシラーゼの活性を促進してヒドロキシルプロリンの合成を促進し、これにより三重螺旋構造のコラーゲンの生合成を測定して皮膚皺形成抑制などの皮膚改善効果を持つのである。
【0009】
ビタミンCの美白効果は、ビタミンCがメラニンの形成に重要なチロシナーゼ(tyrosinase)の活性とメラニンの形成を抑えるからである(Tomita, Y. et al., 1980, J. Invset. Dermatol. 75(5); 379-382)。
【0010】
上述したように、ビタミンCは免疫体系を強化させる。具体的には、ビタミンCは、細胞膜からのヒスタミンの放出を抑えることにより、敏感性皮膚におけるアレルギー反応を抑制し、抗原との接触の際に紫外線による免疫抑制と耐性からマウスを保護する(Nakamura, T. et al., 1997, J. Invest. Dermatol. 109: 20-24)。また、白血球の食菌作用を助け、ウィルス感染の間に白血球の移動を促進させて感染を抑制し、ウィルス増殖抑制物質であるインターフェロンの生合成を増加させる作用をして、様々な感染性疾患に対する生体抵抗性を上昇させる役割もする。その他、ビタミンCは生体内の葉酸代謝およびアミノ酸代謝過程にも関与するなど様々な機能を行う。
【0011】
上述した様々な役割を担当するビタミンCは、C6H8O6の化学式を有する水溶性の物質である。ビタミンCは、分子の2、3、5、6番炭素に位置する水酸基のため、親水性(hydrophilicity)を持つ。水のような中性のpHではこれらの水酸基、特に2番と3番炭素における水酸基が陰の電荷を持つが、これにより水溶液に速くかつ完全に溶けるが、水溶液ではなく皮膚のような有機的な環境では溶解度の制限がある。また、ビタミンCは、外用剤に公式的に使用される有機溶媒、例えばグリセリン、プロピレングリコール、様々な脂肪などによく溶解されないため、ビタミンCを皮膚に運搬するのに限界を持つ。すなわち、ビタミンCがイオン化されていないとき、皮膚障壁を容易に通過して吸収されるが、非イオン状態を保つためにはpHが4.2以下でなければならないという制限点がある。
【0012】
ビタミンCの皮膚蓄積量は、経口投与より外用剤として使用したとき、20倍〜40倍程度高いものと知られている。UVカット効果、抗酸化効果、コラーゲン形成促進による皮膚皺改善効果、染み/雀斑/黒斑などの色素沈着の改善効果、面積体系強化などを図るための目的で使用する皮膚外用剤の場合には、効能物質が皮膚の角質層を通過して表皮の細胞まで到達しなければ作用しないため、効能物質の経皮吸収率が高くなければならない。一般に、ある物質の皮膚浸透率はその物質の親油性(lipophilicity)と関係がある。皮膚の親油性と類似の物質であれば皮膚への分配係数が大きくなって経皮吸収が容易になると知られているが、ビタミンCの場合は、親水性が高くて皮膚への分配が低いため、経皮吸収が難しい。
【0013】
上述したようにビタミンCは様々な効果を示すが、安定性および経皮吸収性が低いため、これを改善するための研究が盛んに行われてきた。
【0014】
後述するように、ビタミンC誘導体は3つの類型に区分される。その一つの類型は、リン酸化アスコルビン酸またはリン酸化アスコルビン酸の金属塩を含む。アルコルビン酸の2番炭素と3番炭素のヒドロキシル基をリン酸化基とエステル結合によって連結してそれぞれアスコルビル−2−ホスフェートまたはアスコルビル−3−ホスフェート(ascorbyl-3-phosphate)を形成したが、この種の誘導体は、他の誘導体に比較して、人体が使用可能な形態であるL−アスコルビン酸への転換は容易になされるが、陰の電荷を持つため、皮膚吸収が難しいという欠点がある。
【0015】
ビタミンC誘導体の他の類型は、脂肪酸が結合した形態のアスコルビン酸を含む。例えば、米国特許第5409693号は、アスコルビン酸の親油性脂肪酸エステル(fat soluble fatty acid ester)形態、例えばパルミチン酸アスコルビル、ラウリン酸アスコルビル、ミリスチン酸アスコルビル、ステアリン酸アスコルビルなどのビタミンC誘導体を開示している。この中でも、アルコルビル−6−パルミテートが最も広く使用される。ところが、アスコルビル−6−パルミテートは、皮膚に吸収され易いが、L−アスコルビン酸への転換が難しいという欠点がある。アスコルビル−6−パルミテートは、マウスの肌を光酸化から保護するのに失敗したという結果が発表された(Bissett, D. et al., 1990, Photodermatol Photoimmunol Photomed 7: 56-62)。また、10wt%のアスコルビル−6−パルミテートを含んだ血清を処理したとき、皮膚からアスコルビン酸の顕著な増加が観察されなかったという結果も発表された(Pinnell, S. R. et al., 2001. Dermatologic Surgery. 27(2): 137-142)。
【0016】
第3の類型は、アスコルビン酸が単糖類に誘導体化された形態、例えばグリコシル化、マンノシル化、フルクトシル化、フコシル化、ガラクトシル化、N−アセチルグルコースアミン化、N−アセチルムラミン化された誘導体を含む。ところが、生体内の生理活性に対する具体的かつ正確な究明は未だ行われていない実情である。
【0017】
コラーゲンは、皮膚、血管、内臓、骨などから非常に多く発見される。皮膚を構成する真皮の70%はコラーゲンから構成されており、筋肉を取り囲んでいる筋膜もコラーゲンから構成されている。生体蛋白質の総重量の30%を占めるコラーゲンは、皮膚の機械的堅固性、結合組織の抵抗力、組織の結合力、細胞接着の保持、有機体の成長、または傷治癒時の細胞分割と分化を誘導する機能をする。コラーゲンは、線維芽細胞で生合成されるが、自然老化および光老化によって量が減少し、20歳から80歳に達する間に65%の減少が起こると知られている(Shuster S., 1975, British Journal of Dermatology, 93(6): 639-643)。生体内コラーゲンの合成が活発になると、真皮基質成分が増加して傷治癒、弾力増加、皺改善などの効果が期待できるという事実が確認されることにより、化粧品、食品、医薬品などに使用されている。このようなコラーゲンを形成する最小活性単位である10個以下のオリゴーペプチドは、メッセンジャー、刺激剤、神経伝達剤としての役割と成長調節、授乳、免疫、消化、血圧、治癒などの生理代謝作用とも関連がある。特に、皮膚再生効果を示すことが明らかになったペプチドは、フランス特許第2,668,265号、米国特許4,665,054号、国際特許公開第WO091/3488号および第WO91/7431号などに公知になっている。ところが、このようなペプチドの場合、沈澱物が形成されて製品の安定度が大幅低下するという欠点がある。
【0018】
〔発明の要約〕
前記従来のビタミンC誘導体の問題点を克服するために、本発明の目的は、ビタミンCをコラーゲンペプチドと結び付けることにより、安全性および安定性が改善されかつ皮膚浸透力に優れたビタミンC誘導体を提供することにある。
【0019】
〔図面の簡単な説明〕
この発明の前記及び他の目的、特徴及びその他の利点は、添付図面を参照する次の説明によって明確に理解されるであろう。
【0020】
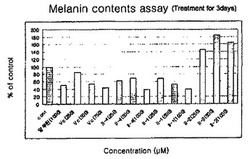
図1は本発明の化合物、ビタミンCおよびアルブチンを用いてメラニン細胞B16によるメラニン生産量を検定したグラフである。
【0021】
図2は本発明の化合物およびビタミンCを用いてエラスターゼ活性を検定したグラフである。
【0022】
図3は本発明の化合物およびビタミンCを用いてコラーゲン生合成能を検定したグラフである。
【0023】
図4は本発明の化合物およびビタミンCを用いてラジカル除去能を検定したグラフである。
【0024】
〔発明を実施するための最良の様態〕
一つの様態において、本発明は、下記化学式1で表わされるビタミンC誘導体またはその薬学的に許容される塩に関する。
【0025】
【化1】

【0026】
式中、R1およびR2はそれぞれ同じでも異なってもよく、−OHまたは
【化2】

であり、R1とR2が同時に−OHではなく、Xは−OC(O)(CH2)mC(O)−であり、
【化3】

は天然または非天然アミノ酸の中から選択される同一または異なるアミノ酸残基がアミド結合したペプチドであり、Rは天然または非天然アミノ酸残基残基の中から選択されるアミノ酸残基の側鎖であり、nは3〜10の整数であり、mは2〜5の整数である。
【0027】
具体的に、化学式1の化合物は、下記化学式1a、1bおよび1cを含む。
【0028】
【化4】

【0029】
【化5】

【0030】
【化6】

【0031】
好適な様態において、
【化7】

は、グリシン、リジン、ヒスチジン、セリン、プロリン、ヒドロキシプロリンおよびトレオニンの中から選択される同一または異なるアミノ酸残基がアミド結合したペプチドであり、Rは前記アミノ酸残基の側鎖であり、nは3〜7、より好ましくは3〜5の整数であって、好ましくはトリ−、テトラ−またはペンタ−ペプチドであり、特に好ましくはグリシル−リシル−ヒスチジン、グリシル−ヒスチジル−リジン、グリシル−プロリル−ヒドロキシプロリンまたはリシル−トレオニル−トレオニル−リシル−セリンである。また、mは2〜4、より好ましくは2または3の整数、特に好ましくは2の整数であり、Xはスクシニル基である。
【0032】
他の様態において、本発明は、化学式2で表わされるビタミンC誘導体またはその薬学的に許容される塩に関する。
【0033】
【化8】

【0034】
式中、Xは−(CH2)p−O−であり、
【化9】

は天然または非天然アミノ酸の中から選択される同一または異なるアミノ酸残基がアミド結合したペプチドであり、Rは天然または非天然アミノ酸残基の中から選択されるアミノ酸残基の側鎖であり、nは3〜10の整数であり、pは2〜5の整数である。
【0035】
好適な様態において、
【化10】

は、グリシン、リジン、ヒスチジン、セリン、プロリン、ヒドロキシプロリンおよびトレオニンの中から選択される同一または異なるアミノ酸残基がアミド結合したペプチドであり、Rは前記アミノ酸残基の側鎖であり、nは3〜7、より好ましくは3〜5の整数であって、好ましくはトリ−、テトラ−またはペンタ−ペプチドであり、特に好ましくはグリシル−リシル−ヒスチジン、グリシル−ヒスチジル−リジン、グリシル−プロリル−ヒドロキシプロリン、またはリシル−トレオニル−トレオニル−リシル−セリンである。また、pは2〜4、より好ましくは3または4、特に好ましくは3の整数であり、Xはプロパノールである。
【0036】
好適な様態において、本発明の化合物は、6−(スクシニル−リシル−トレオニル−トレオニル−リシル−セリン)アスコルビン酸、5−(スクシニル−リシル−トレオニル−トレオニル−リシル−セリン)アスコルビン酸、5,6−ジ(スクシニル−リシル−トレオニル−トレオニル−リシル−セリン)アスコルビン酸、6−(スクシニル−グリシル−リシル−ヒスチジン)アスコルビン酸、5−(スクシニル−グリシル−リシル−ヒスチジン)アスコルビン酸、5,6−ジ(スクシニル−グリシル−リシル−ヒスチジン)アスコルビン酸、6−(スクシニル−グリシル−ヒスチジン−リジン)アスコルビン酸、5−(スクシニル−グリシル−ヒスチジン−リジン)アスコルビン酸、5,6−ジ(スクシニル−グリシル−ヒスチジン−リジン)アスコルビン酸、6−(スクシニル−グリシル−プロリル−ヒドロキシプロリン)アスコルビン酸、5−(スクシニル−グリシル−プロリル−ヒドロキシプロリン)アスコルビン酸、5,6−ジ(スクシニル−グリシル−プロリル−ヒドロキシプロリン)アスコルビン酸、2−(プロピル−リシル−トレオニル−トレオニル−リシル−セリン)アスコルビン酸、2−(プロピル−グリシル−リシル−ヒスチジン)アスコルビン酸、2−(プロピル−グリシル−ヒスチジン−リジン)アスコルビン酸、2−(プロピル−グリシル−プロリル−ヒドロキシプロリン)アスコルビン酸、およびこれらの薬学的に許容される塩よりなる群から選択される。
【0037】
最も好適な様態において、本発明の化合物は、6−(スクシニル−リシル−トレオニル−トレオニル−リシル−セリン)アスコルビン酸、6−(スクニシル−グリシル−リシル−ヒスチジン)アスコルビン酸、6−(スクシニル−グリシル−ヒスチジン−リシル)アスコルビン酸、およびこれらの薬学的に許容される塩よりなる群から選択される。
【0038】
本願で使用された用語「天然アミノ酸」とは、アラニン、バリン、ロイシン、イソロイシン、プロリン、フェニルアラニン、トリプトファン、メチオニン、グリシン、セリン、トレオニン、システイン、チロシン、アスパラギン、グルタミン、リジン、アルギニン、ヒスチジン、アスパラギン酸およびグルタミン酸よりなる群から選択されたα−アミノ酸を意味する。また、「非天然アミノ酸」は、核酸コドンによって暗号化されないアミノ酸であって、その例には前記の天然α−アミノ酸のD異性体;アミノ酪酸(Aib)、3−アミノイソ酪酸(bAib)、ノルバリン(Nva)、β−Ala、2−アミノアジピン酸(Aad)、3−アミノアジピン酸(bAad)、2−アミノ酪酸(Abu)、γ−アミノ酪酸(Gaba)、6−アミノカプロン酸(Acp)、2,4−ジアミノ酪酸(Dbu)、α−アミノピメリン酸、トリメチルシリル−Ala(TMSA)、アロ−イソロイシン(alle)、ノルロイシン(Nle)、3級−Leu、シトルリン(Cit)、オルニチン(Orn)、2,2’−ジアミノピメリン酸(Dpm)、2,3−ジアミノプロピオン酸(Dpr)、α−またはβ−Nal、シクロヘキシル−Ala(Cha)、ヒドロキシプロリン、サルコシン(Sar)など;環状アミノ酸;Nα−アルキル化アミノ酸、例えばNα−メチルグリシン(MeGly)、Nα−エチルグリシン(EtGly)およびNα−エチルアスパラギン(EtAsn);およびα−炭素が2つの側鎖置換体を持つアミノ酸が含まれる。
【0039】
本願で使用された用語「ペプチド」とは、アミド結合(またはペプチド結合)で連結された3〜10個のアミノ酸残基からなるポリマーを意味する。ペプチドは、生体内の蛋白質を抽出して蛋白質分解酵素を処理して低分子量化させるか、あるいは遺伝子組み換えと蛋白質発現システムを利用することもでき、好ましくはペプチド合成器などを用いて試験管内で合成する方法などで製造される。目的によっては、ペプチドは特定の原子または原子団がヒドロキシル基などで置換された誘導体である。ペプチドにおいて、COOHをC−末端といい、NH2をN−末端という。
【0040】
本願において、ペプチドは特にコラーゲンペプチドを含み、「コラーゲンペプチド」は、コラーゲン蛋白質の断片であって、コラーゲンの合成を促進し或いはコラーゲン蛋白質の構成要素として使用できる。例えば、本発明の具体例で使用されたトリないしペンタペプチドは、真皮の内部に多量存在するコラーゲンと、グリコスアミノグリカンの合成を促進させて水分保有効率を高め、真皮の弾力を増進させることにより、保湿効果と皺改善効果を与える機能を持っている。特に、ペンタペプチドであるリシル−トレオニル−トレオニル−リシル−セリン(Lysyl-Threonyl-Threonyl-Lysyl-Serine)は、皮膚結合組織、皺形成および保湿と関連して重要なコラーゲンタイプIのカルボキシル基の末端断片(fragment)であって、コラーゲンを生合成する細胞である線維芽細胞の細胞培養においてコラーゲンタイプIおよびIII、細胞と細胞間の接着に関連して細胞間の情報伝達が円滑に行われるように助けるフィブロネクチン(fibronectin)、および成長因子β−TGFの合成を促進し(Kou Katayama et al., 1991, Biochemistry 30: 7097-7104)、コラーゲン遺伝子のプロモータに結合してその転写を促進させるものと報告された(Kou Katayama et al., 1993, The Journal of Biological Chemistry 268(14): 9941-9944)。
【0041】
韓国特許出願第10−2001−0060244号は、HIV蛋白質の一種であるTatペプチドが結合したビタミンC誘導体を開示している。前記特許において、Tatペプチドは、ビタミンCの2番炭素位置のヒドロキシル基または3番炭素位置のヒドロキシル基に直接(リンカーの連結なしに)エステル結合し、炭素数6以上の反復的なアルコール、例えば−(CH2CH2O)3−リンカーを介してエーテル結合している。これは、コラーゲンペプチドが炭素数5以下のアルコール−(CH2)2−5−O−リンカーを介してエーテル結合し、リンカーとペプチドとがエステル結合した本発明のビタミンC誘導体とは異なる構造を持つ化合物である。エステル結合で連結されたビタミンC誘導体の場合は、エーテル結合で連結されたビタミンC誘導体の場合と比較するとき、生体内でビタミンCからコラーゲンペプチドを分離することが容易である。
【0042】
本願で使用された用語「薬学的に許容される塩」は、薬学的に許容される無機および有機酸および塩基から誘導されたものを含む。適宜な酸の例としては、塩酸、臭素酸、硫酸、硝酸、過塩素酸、フマル酸、マレイン酸、リン酸、グリコール酸、乳酸、サリチル酸、琥珀酸、トルエン−p−スルホン酸、酒石酸、酢酸、クエン酸、メタンスルホン酸、蟻酸、ベンゾ酸、マロン酸、ナフタレン−2−スルホン酸、ベンゼンスルホン酸などを含むことができる。適宜な塩基から誘導された塩は、ナトリウムなどのアルカリ金属と、マグネシウム、アンモニウムなどのアルカリ土金属を含むことができる。
【0043】
別の様態において、本発明は、ヒドロキシル基の保護のためにビタミンCの2、3番炭素位置のヒドロキシル基にベンジル基を導入し、ビタミンCの5番、6番または5番と6番炭素位置のヒドロキシル基と炭素数2〜5のジカルボン酸をエステル結合させた後、ペプチドとアミド結合させることを特徴とする、化学式1のビタミンC誘導体又はその薬学的に許容される塩の製造方法に関する。
【0044】
好適な様態において、本発明は、化学式3の5,6−イソプロピリジエン−アスコルビン酸を化学式4のハロゲン化ベンジルと反応させて2番および3番炭素位置のヒドロキシル基にベンジル基を導入する段階と、化学式5のベンジル基が導入された5,6−イソプロピリジエン−アスコルビン酸を開環させた後、化学式6のジカルボン酸と反応させる段階と、化学式7の化合物を化学式8のペプチドとアミド結合させる段階と、保護基を除去する段階とを含むことを特徴とする、化学式1のビタミンC誘導体またはその薬学的に許容される塩を製造する方法を提供する。
【0045】
【化11】

【0046】
【化12】

【0047】
【化13】

【0048】
[化学式6]
HOOC(CH2)mCOOH
【0049】
【化14】

【0050】
【化15】

【0051】
式中、mは2〜5の整数であり、Bnはベンジルであり、Yは塩素、臭素、フッ素またはヨウ素であり、R1’とR2’はそれぞれ同じでも異なってもよく、−OHまたは−OC(O)(CH2)mC(O)OHであり、R1’とR2’が同時に−OHではなく、Rは保護されておりあるいは保護されていない天然または非天然アミノ酸残基の側鎖であり、nは3〜10の整数である。
【0052】
より好適な様態において、化学式3の5,6−イソプロピリジエン−アスコルビン酸は、化学式4のハロゲン化ベンジル、好ましくは塩化ベンジルと40〜60℃、好ましくは50℃の温度で3〜5時間、好ましくは4時間反応させる。具体的に、アスコルビン酸の2番および3番炭素位置のヒドロキシル基にベンジル基が導入された化学式5の生成物に酸、好ましくはトリフルオロ酢酸を添加して3〜5時間、好ましくは4時間反応させて5,6−イソプロピリジエン環を開環させ、化学式6のジカルボン酸、好ましくは琥珀酸を添加して15〜17時間、好ましくは16時間室温でアスコルビン酸とエステル結合させて化学式7の化合物を合成し、樹脂上で典型的な固相合成法によって保護されたペプチドN末端のNH2とアミド結合させた後、保護基を除去する。
【0053】
前記反応は、無水条件の下、例えば無水有機溶媒を用いて行う。無水有機溶媒は、例えばジメチルホルムアミド、ジメチルスルホキシド、N−メチルピロリジノン、ジクロロメタンなど、好ましくはジメチルホルムアミドを含む。前記反応の縮合剤は、DCC(N,N¢-dicycllohexylcarbodiimide)、HOBT(N-hydroxybenzotriazole)、PyBOP(benzotriazole-1-yl-oxy-tris-pyrrolidinophosphonium hexafluorphosphate)、HBTU(2-(1H-benzotriazole-1-yl)-1,3,3-tetramethyluronium hexafluorophosphate)などを含む。
【0054】
別の様態において、本発明は、ヒドロキシル基の保護のためにビタミンCの3番炭素位置のヒドロキシル基にベンジル基を導入し、2番位置のヒドロキシル基と炭素数2〜5のアルコールをエーテル結合させた後、ペプチドとエステル反応させることを特徴とする化学式2のビタミンC誘導体またはその薬学的に許容される塩の製造方法に関する。
【0055】
好適な様態において、本発明は、化学式3の5,6−イソプロピリジエン−アスコルビン酸を化学式4のハロゲン化ベンジルと反応させて3番炭素位置のヒドロキシル基にベンジル基を導入させる段階と、化学式9の化合物の2番炭素位置のヒドロキシル基を化学式10のハライドアルコールと反応させる段階と、アルコール基が導入された5,6−イソプロピリジエン−アスコルビン酸をアミノ酸残基のC末端とエステル結合させる段階と、ペプチド延長反応させる段階と、保護基を除去する段階とを含むことを特徴とする、化学式2のビタミンCの誘導体またはその薬学的に許容される塩を製造する方法を提供する。
【0056】
【化16】

【0057】
【化17】

【0058】
【化18】

【0059】
[化学式10]
Y(CH2)pOH
式中、pは2〜5の整数であり、Bnはベンジルであり、Yは塩素、臭素、フッ素またはヨウ素である。
【0060】
より好適な様態において、化学式3の5,6−イソプロピリジエン−アスコルビン酸は、化学式4のハロゲン化ベンジル、好ましくは塩化ベンジルと40〜60℃、好ましくは50℃の温度で14〜18時間、好ましくは16時間反応させる。3番炭素位置のヒドロキシル基にベンジル基が導入された化学式9の化合物を化学式10のハライドアルコール、好ましくはブロモプロパノールと40〜60℃、好ましくは50℃で3〜5時間、好ましくは4時間反応させてエーテル結合させた後、アルコール基の導入された5,6−イソプロピリジエン−アスコルビン酸を保護されたアミノ酸残基のC末端とエステル結合させ、次いでペプチド延長反応させた後、保護基を除去する。
【0061】
前記反応は、無水条件の下、例えば無水有機溶媒を用いて行う。無水有機溶媒は、例えばジメチルホルムアミド、ジメチルスルホキシド、N−メチルピロリジノン、ジクロロメタンなどを含む。また、前記反応の縮合剤は、DCC(N,N¢-dicyclohexylcarbodiimide)、HOBT(N-hydroxybenzotriazole)、PyBOP(benzotriazole-1-yl-oxy-tris-pyrrolidino-phosphonium hexafluorphosphate)、HBTU(2-(1H-benzotriazole-1-yl)-1,3,3-tetramethyluronium hexafluorophosphate)などを含む。
【0062】
本発明で使用できる縮合剤、触媒および溶媒は、反応に悪影響を及ぼさない範囲内で、当業界に通常公知されているいずれのものでも使用できる。
【0063】
前記のような方法で製造された本発明の化学式1および2のビタミンC誘導体は、通常の分離、精製方法、例えば再結晶またはカラムクロマトグラフィ法を用いて精製することができる。
【0064】
化学式1の化合物を製造するための前述した本発明の製造方法において、ヒドロキシル基がベンジル基で保護されたアスコルビン酸と結合するペプチドは、固相合成法で製造できる。例えば、それぞれのアスコルビン酸のヒドロキシル基を保護した後、保護されていないヒドロキシル基に選択的にスクシニル基を導入し、樹脂上で典型的な固相合成法によって合成されたペプチドのN末端とスクシニル基の導入されたアスコルビン酸とを反応させた後、アスコルビン酸とペプチドの保護基を除去する。
【0065】
化学式2の化合物を製造するための前述した本発明の製造方法において、ヒドロキシル基がベンジル基で保護されたアスコルビン酸と結合するアミノ酸残基の延長反応は、固相合成法で行われる。例えば、アスコルビン酸のヒドロキシル基を保護した後、保護されていないヒドロキシル基にプロパノール基を導入し、溶液相でアミノ酸残基のC末端と結合させた後、樹脂上で典型的な固相合成法によってペプチドを延長反応させ、その後アスコルビン酸とペプチドの保護基を除去する。
【0066】
本発明の化学式1および2の化合物を固相または溶液相合成法を用いて製造する方法を図式化して下記反応式1および2に示した。反応式1は特に化学式1bの化合物の製造過程を示し、反応式2は化学式2の化合物の製造過程を示す。
【0067】
【化19】

a.Bncl、K2CO3、DMF、50℃、4hr
b.TFA、DCM、室温、4hr
c.琥珀酸無水物、TEA、DMF、室温、16hr
d.固相合成
e.TFA/フェノール/チオアニソール/H2O/TIS(85/5/5/3/2)v/v、室温、3hr
f.10%Pd/C、MeOH、H2、室温、1hr
(BnCl:塩化ベンジル;DMF:ジメチルホルムアミド;TFA:トリフルオロ酢酸)
DCM:ジクロロメタン;TEA:トリエチルアミン;MeOH:メタノール
【0068】
【化20】

a.BnCl、K2CO3、DMF,50℃、16hr
b.3−ブロモプロパノール、CsCO3、DMF、50℃、4hr
c.Fmoc−アミノ酸、DCC、HOBT、DMF、室温
d、e.固相合成
f.TFA/フェノール/チオアニソール/H2O/TIS(85/5/5/3/2)v/v、室温、3hr
g.10%Pd/C、MeOH、H2、室温、1hr
(BnCl:塩化ベンジル;DMF:ジメチルホルムアミド;Fmoc:フルオレニルメチルカルボニル;DCC:N,N’−ジシクロヘキシルカルボジイミド;HOBT:N−ヒドロキシベンゾトリアゾール;TEA:トリエチルアミン;MeOH:メタノール)
【0069】
前記製造された本発明のビタミンC誘導体は、優れた抗酸化効果、皮膚皺の改善効果、美白効果を示すうえ、皮膚刺激、感作性および光毒性などを示さない。
【0070】
したがって、別の様態において、本発明は、化学式1および2の化合物の中から選択された1種以上を含む皮膚外用のための組成物に関する。好適な様態において、本発明の組成物は化粧料、特に美白、皮膚皺改善などに有用である。
【0071】
本願で使用された用語「皮膚外用」とは、皮膚の保湿効果、皺抑制効果、皮膚粗さ改善効果、経皮吸収促進効果などの様々な効果を示し、皮膚状態を改善しあるいは皮膚状態の悪化を抑制するために使用するということを意味する。本発明の皮膚外用剤は、化粧料、医薬品、医薬部外品などに使用できる。その中でも、化粧料の形で使用することが好ましく、このような化粧料の形態は特に限定されない。
【0072】
本発明に係る組成物は、化学式1および2で表わされる化合物の中から選択された1種以上の物質を0.001〜5%(w/w)、好ましくは0.01〜3%(w/w)含有する。これは、0.001%未満の濃度では実質的な美白効果を期待し難いためである。
【0073】
本発明の皮膚美白用組成物を製造する場合、溶媒としてエタノール、グリセリン、ブチレングリコール、プロピレングリコール、グリセレス−26、メチルグルセス−20、ミリスチン酸イソセチル、オクタン酸イソセチル、ミリスチン酸オクチルドデシル、オクチルドデカノール、イソステアリン酸イソステアリル、オクタン酸セチルおよびネオペンチルグリコールジカプレートの中から選択された1種以上を使用する。このような溶媒を用いて本発明の組成物を製造する場合、化合物の種類および溶媒と化合物との比によって溶媒に対する化合物の溶解度が少しずつ異なるが、本発明の属する技術分野の当業者であれば、製品の特性に応じて溶媒の種類および使用量を適切に選択して適用することができる。
【0074】
本発明に係る組成物は、皮膚外用のための軟膏、柔軟化粧水、栄養化粧水、栄養クリーム、マッサージクリーム、エッセンス、パックなどの化粧料の形で製造できる。ここで、皮膚外用軟膏は、化学式1または2の化合物の有効成分以外にワセリン50.0〜97.0重量%およびポリオキシエチレンオレイル−エーテルホスフェート0.1〜5.0重量%を含有するように製造され、柔軟化粧水はプロピレングリコール、グリセリンなどの多価アルコール類1.0〜10.0重量%およびポリエチレンオレイルエーテル、ポリオキシエチレン硬化ヒマシ油などの界面活性剤0.05〜2.0重量%を含有するように製造される。栄養化粧水および栄養クリームは、化学式1または2の有効成分以外にスクアレン、ワセリン、オクチルドデカノールなどのオイル類5.0〜20.0重量%、およびエタノール、ステアリルアルコール、蜜蝋などのワックス成分3.0〜15.0重量%を含有し、エッセンスはグリセリン、プロピレングリコールなどの多価アルコール類5.0〜30.0重量%を含有する。マッサージクリームは化学式1または2の有効成分以外に流動パラフィン、ワセリン、イソノニルイソノナノエートなどのオイルを30.0〜70.0重量%含有して製造され、パックは、ポリビニルアルコールを5.0〜20.0重量%含有するピールオフパック、または一般乳化型化粧料にカオリン、タルク、酸化亜鉛、二酸化チタンなどの顔料が5.0〜30.0重量%含有されたウォッシュオフパックの形で製造される。
【0075】
また、本発明の前記化学式1または2で表わされる化合物を含有する化粧料組成物は、一般皮膚化粧料に配合される通常の成分、例えば油分、水、界面活性剤、保湿剤、低級アルコール、増粘剤、キレート剤、色素、防腐剤、香料などを必要な分だけ適用配合することが可能である
以下、本発明について下記の実施例を挙げてより詳細に説明する。ところが、これらの実施例は本発明の範囲を限定するものではない。
【0076】
〔実施例1:2,3−O−ジベンジル−6−O−スクシニル−アスコルビン酸の合成〕
【0077】
【化21】

【0078】
(a)5,6−イソプロピリジエン−L−アスコルビン酸(5g、23.1mmol)をジメチルホルムアミド50mLに溶解させた後、固体炭酸水素セシウム(15g、46mmol)を添加した。この混合物に塩化ベンジル(7.3g、58mmol)を加えた後、50℃で4時間攪拌した。この反応物から減圧の下でジメチルホルムアミドを除去した後、濃縮された溶液をジクロロメタンで希釈し、生成された固体を濾過した後、濾液を減圧の下で濃縮した。
【0079】
(b)前記生成された化合物をジクロロメタンに溶かした後、20%(v/v)TFAを添加した後、4時間攪拌させた。この反応物から減圧の下で溶媒とTFAを除去した後、再結晶化して薄黄色の半固体の形で得た。
【0080】
(c)前記得られた化合物をジメチルホルムアミドに溶解させ、琥珀酸(1.2eq.)を加えた後、トリエチルアミン(1.2eq.)を徐々に滴加した。16時間室温で攪拌した後、減圧の下でジメチルホルムアミドを除去し、その後濃縮された溶液をシリカゲルカラムクロマトグラフィを用いて薄黄色の半固体状の化合物(3.9g)を得た。
【0081】
前記2,3−O−ジベンジル−6−O−スクシニル−アスコルビン酸の1HNMR (CDCl3):2.67 (s, 4H, CH2CH2COOH) 4.06 (t, 1H, C-5-H), 4.32 (d, 2H, C-6-H2), 4.67 (d, 1H, C-4-H), 5.17 (m, 4H, O-CH2-Ph), 7.36 (m, 10H, Ar-H)
【0082】
〔実施例2:2−O−(3−ヒドロキシプロピル)−3−O−ベンジル−5,6−イソプロピリジエン−アスコルビン酸の合成〕
【0083】
【化22】

【0084】
(a)5,6−イソプロピリジエン−L−アスコルビン酸(5g、23.1mmol)をジメチルホルムアミド50mLに溶解させた後、固体炭酸水素セシウム(3.8g、11.5mmol)を加えた後、50℃で16時間攪拌した。この反応物から減圧の下でジメチルホルムアミドを除去した後、濃縮された溶液をジクロロメタンで希釈し、精製された固体を濾過した後、濾液を減圧の下で濃縮した。
【0085】
(b)前記生成された化合物をジメチルホルムアミドに溶かした後、3−ブロモプロパノール1当量と固体炭酸水素セシウム1当量を添加し、その後50℃で4時間攪拌した。この反応物から減圧の下でジメチルホルムアミドを除去した後、濃縮された溶液をシリカゲルカラムクロマトグラフィを用いて白色の固体化合物(2.9g)を得た。
【0086】
前記2−O−(3−ヒドロキシプロピル)−3−O−ベンジル−5,6−イソプロピリジエン−アスコルビン酸の1HNMR (CDCl3):1.35 (s, 3H, C-CH3), 1.39 (s, 3H, C-CH3), 1.85 (m, 2H, O-CH2CH2CH2-OH), 3.58 (t, 2H, O-CH2CH2CH2-OH), 3.9(t, 2H, O-CH2CH2CH2-OH), 3.98-4.24 (m, 3H, C-5-H, C-6-H2), 4.51 (d, 1H, C-4-H), 5.17 (s, 2H, O-CH2-Ph), 7.37 (m, 5H, Ar-H)
【0087】
〔実施例3:ペプチドの合成〕
本発明に使用される様々な種類のペプチドの合成は、Fmoc(9-fluorenylmethoxycarbonyl)をNα−アミノ酸の保護基として使用する固相法によって合成し、HOBt−DCC(N-hydroxybenzotriazole-dicyclohexylcarbodiimide)方法によってペプチドを延長した(Wang C. Chan, Perter D. white, “Fmoc solid phase peptide synthesis" Oxford)。グリシル−ヒスチジル−リジン、グリシル−リシル−ヒスチジン、グリシル−プロリル−ヒドロキシプロリン、リシル−トレオニル−トレオニル−リシル−セリンペプチドを合成した。
【0088】
〔実施例4:ビタミンC誘導体の合成〕
〈4−1:化合式1の化合物の合成〉
N末端のアミノ酸までカップリングされた、実施例3で合成されたペプチドに20%ピペリジン/N−メチルピロリドン(Piperidine/N-methylpyrrolidone)溶液を加えてFmoc基を除去し、N−メチルピロリドンとジクロロメタン(dichloromethane)で洗浄した後、実施例1で合成されたビタミンC誘導体をカップリングさせた。カップリング完了の後、N−メチルピロリドンとジクロロメタンで複数回洗浄した後、窒素ガスで乾燥させた。ここにトリフルオロ酢酸:フェノール:チオアニソール:水:トリイソプロピルシラン(trifluoroacetic acid: phenol: thioanisole: water: triisopropylsilane)の85:5:5:3:2(v/v)溶液で2〜3時間反応させてペプチド保護基を除去し、ペプチドが結合したビタミンC誘導体を樹脂から分離させた後、ジエチルエーテルでペプチドを沈澱させた。ビタミンCの2番および3番炭素に結合したアルコール基を保護しているベンジル基を除去するために、10%Pd/Cをメタノールに添加し、水素雰囲気の下に約1時間室温で攪拌した後、セライトを用いてPd/Cを除去して得た濾液を減圧濃縮した。こうして得たビタミンC誘導体は、0.1%トリフルオロ酢酸含有のアセトニトリルを勾配として精製逆相高性能液体クロマトグラフィカラム(purified reverse phase high performance liquid chromatography column,Zobax, C8 300Å, 21.1mm ´ 25cm)を用いて精製することにより、化学式1のペプチドが結合したビタミンC誘導体を合成した。
【0089】
〈4−2:化学式2の化合物の合成〉
実施例2で合成されたビタミンC誘導体と側鎖をトリフェニルメタン基で保護したC末端のペプチドをジメチルホルムアミドに溶解させた後、N−ヒドロキシベンゾトリアゾールを添加した。この混合物にN,N’−ジシクロヘキシルカボジイミドを加えた後、常温で2時間攪拌して、実施例2で合成されたビタミンC誘導体とC末端のペプチドとをカップリングさせた。この反応物から減圧の下でジメチルホルムアミドを除去した後、濃縮された溶液をジクロロメタンで希釈し、トリフルオロ酢酸を1%添加した。この混合物を常温で10分間攪拌してC末端のペプチド側鎖の保護基であるトリフェニルメチル基を除去した。この反応物にトリエチルアミンを添加した後、クロロトリフェニルメチル樹脂とカップリングして実施例3のペプチド合成に応じてペプチドを延長反応した。N末端のアミノ酸までカップリングされた前記ペプチドが結合したビタミンC誘導体に20%ピペリジン/N−メチルピロリドン(Piperidine/N-methylpyrrolithane)溶液を加えてFmoc基を除去し、N−メチルピロリドンとジクロロメタンで洗浄した後、窒素ガスで乾燥させた。ここにトリフルオロ酢酸:フェノール:チオアニソール:水:トリイソプロピルシラン(trifluoroacetic acid: phenol: thioanisole: water: triisopropylsilane)の85:5:5:3:2(v/v)溶液で2〜3時間反応させてペプチド保護基を除去し、ペプチドの結合したビタミンC誘導体を樹脂から分離させた後、ジエチルエーテルでペプチドを沈澱させた。ビタミンCの3番炭素に結合したアルコール基を保護しているベンジル基を除去するために、10%Pd/Cをメタノールに添加し、水素雰囲気の下に約1時間室温で攪拌した後、セライトを用いてPd/Cを除去して得た濾液を減圧濃縮した。こうして得たビタミンC誘導体は、0.1%トリフルオロ酢酸含有のアセトニトリルを勾配として精製逆相高性能液体クロマトグラフィカラム(purified reverse phase high performance liquid chromatography column,Zobax, C8 300Å, 21.1mm ´ 25cm)を用いて精製することにより、化学式2のペプチドが結合したビタミンC誘導体を合成した。
【0090】
このような方法で合成された、それぞれのペプチドが結合したビタミンC誘導体を質量分光光度計(mass spectrophotometer)で分子量を測定し、ペプチドと琥珀酸基またはプロピル基が導入されたビタミンCの結合を確認した。表1は実施例4で説明した方法で合成されたビタミンC誘導体の測定分子量をまとめたものである。
【0091】
【表1】

【0092】
表1において、化合物番号I、II、IIIおよびIVはそれぞれ化学式1a、1b、1cおよび2の化合物を示す。
【0093】
化合物II−1に対する1H NMR (CD3OD):8.78(dd, 1H), 7.38(s, 1H), 4.73(m, 3H), 4.42(m, 1H), 4.27(m, 2H), 4.14(m, 1H), 3.84(m, 2H), 3.19(m, 1H), 2.96(td, 2H), 2.76(m, 2H), 2.59(m, 2H), 1.81(m, 4H), 1.50(m, 2H)
- 化合物II−2に対する1H NMR (CD3OD):8.78(m, 1H), 7.36(s, 1H), 4.74(m, 3H), 4.24(m, 3H), 3.86(d, 2H), 3.29(m, 2H), 2.95(t, 2H), 2.66(m, 4H), 1.80(m, 4H), 1.51(m, 2H)
化合物II−4に対する1H NMR (CD3OD):4.78(m, 3H), 4.31(m, 10H), 3.90(m, 2H), 2.96(q, 4H), 2.65(m, 4H), 1.92(m, 2H), 1.74(m, 6H), 1.52(m, 4H), 1.23(q, 6H)
【0094】
〔試験例1:着色実験〕
実施例4で合成された化合物I〜IVとビタミンC(Aldrich)をそれぞれpH7の50mMリン酸カリウム緩衝溶液に50mMの濃度で溶かし、40℃の恒温槽で3週間保管した後、着色有無の経時変化を前記評価基準に基づいて観察し、その結果を表2に示した。
【0095】
【表2】

【0096】
表2から分かるように、本発明の化合物I〜IVは、ビタミンCに比べて比較的安定であり、変色が起こらず、沈澱物が生成されていない。
【0097】
〔試験例2:チロシナーゼ阻害活性の評価〕
実施例4で合成された化合物II−1、II−2およびII−4を用いてチロシナーゼ活性阻害効果を測定した。チロシナーゼは、茸から分離されて精製されたもので、Sigma社から購入して使用した。基質であるチロシンは、0.05Mリン酸カリウム緩衝溶液(pH6.8)に溶かして0.3mg/mL溶液に作って使用した。化合物およびビタミンCは、蒸留水に10mMの濃度で溶解させ、さらに適切な濃度で蒸留水に希釈して使用した。
【0098】
試料チロシン溶液と緩衝溶液をそれぞれ0.5mLずつ試験管に仕込み、ここに前記化合物またはビタミンC溶液0.5mLを加えて37℃の恒温器で10分間放置した後、2,000U/mLチロシナーゼ0.05mLを仕込んで37℃で10分間反応させた。この際、対照群は各化合物の代わりに蒸留水0.5mLを仕込んだものである。反応液入りの試験管を氷で急冷させて反応を中止させ、分光光度計によって波長475nmで吸光度を測定してチロシナーゼ活性阻害率を求めた。IC50値は、酵素活性阻害率が50%に達する阻害剤の濃度で決定した。阻害率は数式1によって求め、その結果は表3に示した。
【0099】
[数式1]
阻害率(%)=(A−B)/A×100
【0100】
式中、Aは阻害剤が添加されていないものの475nmにおける吸光度であり、Bは阻害剤が添加されたものの475nmにおける吸光度である。
【0101】
【表3】

【0102】
〔試験例3:メラニン形成抑制能の評価〕
試験管内でメラニン細胞のB6黒色腫細胞(韓国細胞株銀行)を培養し、その後培地を除去し、試料が適切な濃度で希釈された培地で取り替えた後、5%CO2、37℃の下で各濃度別試験物質(ビタミンC、アルブチン、化合物II−1、II−2、II−4)を添加して一定の時間培養した。培地を除去した細胞をPBS(phosphated buffer saline)で洗浄し、これをトリプシンで処理して細胞を回収した。回収された細胞は、血球計算盤(hematocytometer)を用いて細胞数を測定し、5,000〜10,000rpmにて10分間遠心分離した後、上澄み液を除去してペレットを得た。この細胞ペレットを60℃で乾燥させた後、10%DMSO含有の1M水酸化ナトリウム液100μLまたは適量の細胞分解緩衝液を入れて60℃の恒温槽で細胞内メラニンを得た。この液をもってマイクロプレートリーダーによって490nmで吸光度を測定して一定の細胞数当たりのメラニン量または一定の蛋白質当たりのメラニン量を求めて図1に示した。
【0103】
図1に示すように、化合物II−4は1mM濃度でアルブチン(albutin)より約24%高いメラニン生成抑制能を示し、ビタミンCよりは約10〜20%高い抑制能を示した。化合物II−1の場合、化合物II−4と類似の抑制能を示した。
【0104】
〔試験例4:エラスターゼ抑制能の評価〕
エラスターゼ(Sigma)の基質としてMeO−Suc−(Ala)2−Pro−Val−pNAを用いて、エラスターゼによる分解産物p−ニトロアニリンの色を測定してエラスターゼの活性を評価し、その結果を図2に示した。
【0105】
図2に示すように、1mM濃度以下ではビタミンCとエラスターゼの抑制能において大きい差を示していないが、1mM以上の濃度では2〜20%程度高い抑制能を示した。
【0106】
〔試験例5:細胞毒性の評価〕
化粧品に使用される原料としての1次安全性を検証するために化合物II−1、II−2およびII−4に対してヒト正常線維芽細胞、B16黒色腫、HaCaT細胞を培養してそれぞれ濃度別に試験物質を処理してMTT試験(Mossman T., 1983, Journal of Immunological Methods 65, 55-63)を行って細胞毒性を評価した結果、化合物II−4の場合は、ビタミンCと比較するとき、5mM濃度でも細胞毒性が見られず、化合物II−1、II−2の場合は、10mM以下で類似の効果を示して安全性に優れた。
【0107】
〔試験例6:皮膚刺激性試験〕
前記化合物II−4の皮膚刺激性試験のために、ウサギを用いた貼布試験を行った(Draize J.H. et al., 1944, J. Pharmacol. Exp. Ther., 82: 377-390; Gfeller W et al., 1985, Fd. Chem. Toxic., 23: 165-168; Bosshard, E et al., 1985, Fd. Chem. Toxic., 12:149-154)。
【0108】
化合物II−4を0.01M PBSに1%となるように調製した後、除毛した背中部位(2.5cm×2.5cm)に1区画当たり0.5mLずつ使用して1回24時間塗布し、適用部位から試験化合物の漏洩を防止するためにガーゼ(10cm×10cm)一枚を被せた後、試験化合物の蒸発を防ぐために不浸透性および非反応性の固体薄膜を覆い、弾力包帯でウサギの行動に支障を来たさないように取り巻いた後、紙テープで包帯を固定した。試験化合物の塗布24時間後、72時間後の刺激の度合いを判定した。その結果、化学式II−4の化合物は皮膚に非常に安全であった。
【0109】
〔試験例7:眼粘膜刺激性試験〕
局所的に現われる眼粘膜刺激性の有無およびその度合いを評価するために、ウサギ(New Zealand White Rabbit;NZW)の眼粘膜に化合物II−4を適用した。
【0110】
試験化合物II−4を0.01M PBSに1%となるように調製して適用部位に0.1mLずつ適用した。すなわち、9匹のウサギの片目(右眼)に「医薬品などの毒性試験基準(韓国食品医薬品安全庁告示第1999−61号、1999.12.22)」によって試験化合物を0.1mL/headずつ適用した後、約1秒間目を瞑った状態に維持させて試験化合物の損失を防止し、これを利用して角膜、虹彩および結膜の損傷の度合いを観察した。1日目から7日目まで試験物質による結膜発赤および結膜浮腫は観察されなかった。眼粘膜刺激性試験結果、急性眼刺激指数(Acute Ocular Irritation;I.A.O.I)は洗浄群および非洗浄群の両者ともにおいて「0」であって、化合物II−4は「無刺激物」と判明された。
【0111】
〔試験例8:皮膚感作性試験〕
化合物II−4の皮膚感作性をHartley系雄モルモット((株)セムタコバイオコリア)を用いてGPMT(Guinea Pig Maximization Test)法によって検討した。この試験は、化粧品およびその他ヒトとの接触可能性のある物質の場合に対して皮膚接触刺激を起こるアレルギー誘発可能性の検討が必要であるため使用される。
【0112】
試験化合物投与群は、頚背部感作部位に1%試験化合物調製液を0.1mL/部位で皮内投与して1次感作し、1%試験化合物調製液1mL/動物および0.2mL/動物を含むパッチを貼って48時間閉塞貼布して2次感作をした。2次感作2週後、左側腹部誘起部位に1%試験化合物調製液を24時間閉塞貼布して誘起した。その結果が表4(チャレンジ反応に対する感作等級)に示されている。
【0113】
【表4】

【0114】
表4に示すように、いずれの10匹の試験物質投与群の誘起部位においても皮膚反応は確認されていない。また、皮膚感作率はそれぞれ0%であって、皮膚感作性評価基準等級は「1」(非常に弱い、Very weak)と評価された。この結果より、モルモットを用いた皮膚感作性試験において化合物II−4は皮膚感作性を誘発しない物質と判断された。
【0115】
〔試験例9:光毒性試験〕
Hartely系モルモット雄20匹を各群当たり5匹ずつ賦形剤対照群(0.01M PBS)、試験化合物II−4投与群、陽性対照群1(Chlorpromazine、CP:クロロプロマジン)および陽性対照群2(8-methoxypsoralen、8−MOP:8−メトキシプソラレン)の4群を設定してモルモットの皮膚に適用した後、UVAを照射するときに現われる光毒性誘発可能性を検査した。これは化学物質によって非免疫学的に起こる皮膚の紫外線および可視光線などの光刺激に対する異常反応であって、アレルギーとは異なり十分な光量と薬物で反応強度の予測が可能である。
【0116】
化合物II−4は、賦形剤の0.01MPBSを用いて0.1%、0.5%および1%に調製して使用した。CPおよび8−MOPをDMSOに最終10%となるように均一に調製して1%の濃度でさらに希釈して陽性対照物質を作った。動物を固定器に固定した後、50μLずつ均等に塗布し、その後動物の右側部位を光遮断対照部位とし、左側部位を光照射部位としてUVA(320〜380nm)で約10cmの距離から約2時間最終エネルギーが15J/cm2となるように照射した後、24、48および72時間の後に陽性対照群と皮膚反応を比較して光毒性の有無を評価した結果、表5に示すように「光毒性が殆どない」と評価された。
【0117】
【表5】

【0118】
〔試験例10:単回投与毒性試験〕
化合物II−4に対する単回経口投与時の安全性を検討するために、雌、雄マウス((株)セムタコバイオコリア)を用いて化合物II−4を単回経口投与するときに現われる毒性を評価するために、試験化合物II−4投与群は単一用量として0および2,000mg/10mL/kg、対照群は0.1M PBS(リン酸塩緩衝溶液)10mL/kgを雌、雄それぞれ5匹ずつ単回経口投与し、投与後14日間、投与に起因した死亡例、一般症状、体重変化は観察されておらず、単回経口投与時の概略の致死量は雌、雄それぞれ2,000mg/kg以上と判断された。
【0119】
〔試験例11:光感作性試験〕
化合物II−4の光感作性試験をHartley系雄モルモットを用いてAdjuvant & Strip法によって行った。
【0120】
モルモットの頚背部皮膚に感作部位を定め、4区画に、注射用水とFCAを混合して乳化した乳化液をそれぞれ皮内投与した。感作部位の皮膚は、少し紅斑が生ずる程度にストリッピング(stripping)を行い、賦形剤対照群には0.01M PBS(リン酸塩緩衝溶液)、試験物質投与群には化合物II−4、陽性対照群にはCP(chlorpromazine:クロロプロマジン)をそれぞれ開放塗布した。塗布2時間後に約10J/cm2で長波長紫外線を照射した。紫外線照射24、48および72時間後、誘起部位を観察し、光感作性の有無を判定した。
【0121】
賦形剤対照群および試験物質投与群のUVA非照射部位と照射部位の皮膚刺激指数(irritation index)はそれぞれ「0」と評価され、光感作性指数(Photosensitivity index)はそれぞれ「0」であって「刺激が殆どない(Practically non-irritating)」と評価された。陽性対照群のUVA非照射部位における皮膚刺激指数は「0」であり、UVA照射部位皮膚刺激指数は「5.8」であって「激しい刺激がある(Extremely irritating)」と評価された。したがって、本試験に使用されたモルモットは、既に知られている光感作性物質CP(Chlorpromazine)で正常的な反応を示すことが確認された。観察期間中、試験物質による特異な一般症状および死亡動物は観察されておらず、全ての群において有意性のある体重変化も確認されていない。その結果を表6(Group summary)に示した。
【0122】
【表6】

【0123】
表6に示すように、以上の試験結果より、モルモットを用いた光感作性試験において化合物II−4は光感作性を誘発しない物質と判断される。
【0124】
〔試験例12:コラーゲン生合成能〕
ヒトの正常線維芽細胞に本発明の有効活性成分を添加して細胞水準でコラーゲン合成促進効果を試験した。
【0125】
生合成されたコラーゲンの測定は、文献(Martens, Gut, 1992, 33, 1664-1670)の方法を応用してコラーゲン生合成促進効果を測定し、試料を添加していないものを100%とした。詳細な試験方法は次のとおりである。
【0126】
ヒトの正常線維芽細胞を細胞培養用6ウェルプレートに分注し、一定数の細胞をシーディングし、0.05%含有FBS(Fetal Bovine Serum)条件下で48時間培養した後、PBSで2回洗浄した。培養終了の後、前記の細胞および培養液をそれぞれ1/2ずつ分けて一方の分画にのみコラゲナーゼを処理した後、TCA(trichloroacetic acid)で蛋白質を沈澱させて2分画の放射活性の差異からコラーゲン生合成促進効果を測定し、試料を添加していないものを100%とした。
【0127】
図3に示すように、化合物II−4は、ビタミンCと類似のコラーゲン生合成能を示し、このような結果は、試験例1の着色試験から分かる安定性の改善効果と共に優れたコラーゲン生合成能を持つことを立証する。
【0128】
〔試験例13:抗酸化効果〕
実施例4で合成された化合物II−1、II−2およびII−4を選別してフリーラジカル除去能を行った。使用されたDPPH(1,1-diphenyl-2-picrylhydrazyl)は、酸化/還元環境に応じて変色するラジカルを用いて試料のラジカル除去能力をO.D.値の測定によって確認することができる。
【0129】
前記選別された化合物を蒸留水または溶媒に溶かした後、液相状態の100μL試料に200μM DPPH100μLを混ぜた。よく混ぜた後、常温で10分間放置した後、517nmにおける吸光度を測定する。この際、使用された対照群は、化合物を除いた蒸留水または溶媒を入れたものである。
【0130】
図4に示すように、選別された化合物II−4の場合、ビタミンCと同様に、100μMで70%以上フリーラジカル消去能を示し、化合物II−1および化合物II−2の場合も、100μMで70%台のフリーラジカル消去能を示した。その結果、選別された化合物II−4は、優れた抗酸化効果を持つ物質であるビタミンCと類似の抗酸化効果を持つ。
【0131】
〔産業上の利用可能性〕
以上述べたように、本発明のビタミンC誘導体は、皮膚刺激などの副作用なしに、安定性、安全性および皮膚浸透力が向上した。よって、本発明のビタミンC誘導体は、皮膚状態を改善しあるいは皮膚状態の悪化を抑制するために使用できる。
【0132】
以上、本発明の好適な実施例について説明したが、当業者であれば、特許請求の範囲に記載された本発明の範囲および精神から逸脱することなく、各種の変形、追加および置換が可能であることを理解するであろう。
【図面の簡単な説明】
【0133】
【図1】本発明の化合物、ビタミンCおよびアルブチンを用いてメラニン細胞B16によるメラニン生産量を検定したグラフである。
【図2】本発明の化合物およびビタミンCを用いてエラスターゼ活性を検定したグラフである。
【図3】本発明の化合物およびビタミンCを用いてコラーゲン生合成能を検定したグラフである。
【図4】本発明の化合物およびビタミンCを用いてラジカル除去能を検定したグラフである。
【発明の詳細な説明】
【0001】
〔技術分野〕
本発明は、ペプチドが結合したビタミンC誘導体またはその薬学的に許容される塩、その製造方法およびそれを含む組成物に関する。
【0002】
〔背景技術〕
皮膚は、保護機能、障壁機能、温度調節機能、排泄機能、呼吸機能などをする器官であって、表皮、真皮および皮下組織からなる。表皮は、最も薄い層であって、角質細胞とメラニン細胞との有機的な結合からなっている。真皮は、皮膚の約95%を担当し、皮膚の保湿および保護を担当する層であって、皮膚弾力(皺)に重要な役割をする代表的な蛋白質であるコラーゲンとエラスチンが網の如く絡み合っており、血管、神経が存在し、アレルギー反応に関与する肥満細胞、およびNa−PCAやヒアルロン酸などの天然保湿因子も含有している。皮下組織は、表皮および真皮への栄養供給、体型決定、体温維持、外部的な衝撃吸収、および皮下組織下の細胞保護などの役割をする。
【0003】
ところが、歳を取るにつれて、内因性および外因性原因によって皮膚機能が急激に低下する老化を感じるようになる。老化が進みながら、皮膚の構成成分である表皮、真皮および皮下組織の厚みが薄くなり、コラーゲンとエラスチンが細くかつ緩くなって弾力が低下し、皺などが生ずる。また、皮膚障壁の機能を担当している脂質障壁(Lipid barrier)の脂質の組成と含量が変わるにつれて皮膚の水分含量が低下し肌が乾いてしまうといった生理的変化を経験する。また、染み、雀斑、色素沈着およびその他様々な皮膚病変が誘発される。
【0004】
このような皮膚老化による問題点を解決するために、皮膚改善効果を持つ各種有効成分とそれを含む組成物が研究されている。
【0005】
皮膚老化を抑制させる効果のある成分としては、ビタミンC、ビタミンE、βカロチンといった抗酸化ビタミンなどが多く用いられている。この中でも、ビタミンCは、紫外線(UV)カット効果、抗酸化効果、コラーゲン形成促進による皮膚皺改善効果、染み/雀斑/黒斑などの色素沈着の改善効果、免疫体系強化効果などを持つ。このようなビタミンCの作用をまとめると、次のとおりである。
【0006】
ビタミンCは、紫外線、特にUVAに対する遮断機能が強い(Darr, D. et al., 1996, Acta Derm. Venereol. (Strckh). 76: 264-268; Black, H. S. et al., 1975, J. Invest. Dermatol. 65: 412-414)。また、ビタミンCは、UVBにより発生する皮膚損傷から保護する役割をするが、UVB照射の前に、ビタミンCを豚と人間のUVB照射皮膚部位につけると、赤み(紅斑)および日焼け現象が防止される(Darr, D. et al., 1992, Brit. J. Dermatil. 127: 247-253; Murry, J. et al., 1991, J. Invest. Dermatol. 96: 587)。
【0007】
皮膚、血液およびその他の組織における、化学的汚染、吸煙、特に紫外線(UV)によって誘発されるROS(Reactive Oxygen Species)を中和させる強力な生体抗酸化剤としてのビタミンCの作用は、ビタミンCが2つの電子を受け入れて脱水素−L−アスコルビン酸(Dehydro-L-ascorbic acid)の形で容易に酸化できる構造を持つためである。ビタミンCは、皮膚の非酵素的抗酸化剤防御システムの重要な要素であって、ビタミンCが高濃度で存在するとき、一重項酸素(single oxygen)、スーパーオキシドアニオン(superoxide anion)、ヒドロキシラジカル(hydroxyl radical)といったROSなどが蛋白質、核酸、細胞膜脂質などの生体成分を酸化または変性させる前に、これらを中和させる役割をする(Buettner, G. R. et al. 1996. Cadenas, E., Packer, L., eds. Handbook of antioxidants. pp. 91-115)。
【0008】
角質層に経皮的に供給されることにより皮膚光沢、皮膚色および弾力の改善、および皺の減少などを示すビタミンCの効果(米国特許第4,983,382号)は、ビタミンCによってコラーゲンの合成が促進されるためである。コラーゲンポリペプチドの10%程度を占めるヒドロキシプロリンは、プロリンヒドロキシラーゼ(praline hydroxylase)によって生合成されるが、この酵素の補因子(cofactor)としてビタミンCが作用する(Tomita, Y. et al., 1980, J. Invest. Dermatol. 75(5): 379-382)。すなわち、ビタミンCは、プロリンヒドロキシラーゼの活性を促進してヒドロキシルプロリンの合成を促進し、これにより三重螺旋構造のコラーゲンの生合成を測定して皮膚皺形成抑制などの皮膚改善効果を持つのである。
【0009】
ビタミンCの美白効果は、ビタミンCがメラニンの形成に重要なチロシナーゼ(tyrosinase)の活性とメラニンの形成を抑えるからである(Tomita, Y. et al., 1980, J. Invset. Dermatol. 75(5); 379-382)。
【0010】
上述したように、ビタミンCは免疫体系を強化させる。具体的には、ビタミンCは、細胞膜からのヒスタミンの放出を抑えることにより、敏感性皮膚におけるアレルギー反応を抑制し、抗原との接触の際に紫外線による免疫抑制と耐性からマウスを保護する(Nakamura, T. et al., 1997, J. Invest. Dermatol. 109: 20-24)。また、白血球の食菌作用を助け、ウィルス感染の間に白血球の移動を促進させて感染を抑制し、ウィルス増殖抑制物質であるインターフェロンの生合成を増加させる作用をして、様々な感染性疾患に対する生体抵抗性を上昇させる役割もする。その他、ビタミンCは生体内の葉酸代謝およびアミノ酸代謝過程にも関与するなど様々な機能を行う。
【0011】
上述した様々な役割を担当するビタミンCは、C6H8O6の化学式を有する水溶性の物質である。ビタミンCは、分子の2、3、5、6番炭素に位置する水酸基のため、親水性(hydrophilicity)を持つ。水のような中性のpHではこれらの水酸基、特に2番と3番炭素における水酸基が陰の電荷を持つが、これにより水溶液に速くかつ完全に溶けるが、水溶液ではなく皮膚のような有機的な環境では溶解度の制限がある。また、ビタミンCは、外用剤に公式的に使用される有機溶媒、例えばグリセリン、プロピレングリコール、様々な脂肪などによく溶解されないため、ビタミンCを皮膚に運搬するのに限界を持つ。すなわち、ビタミンCがイオン化されていないとき、皮膚障壁を容易に通過して吸収されるが、非イオン状態を保つためにはpHが4.2以下でなければならないという制限点がある。
【0012】
ビタミンCの皮膚蓄積量は、経口投与より外用剤として使用したとき、20倍〜40倍程度高いものと知られている。UVカット効果、抗酸化効果、コラーゲン形成促進による皮膚皺改善効果、染み/雀斑/黒斑などの色素沈着の改善効果、面積体系強化などを図るための目的で使用する皮膚外用剤の場合には、効能物質が皮膚の角質層を通過して表皮の細胞まで到達しなければ作用しないため、効能物質の経皮吸収率が高くなければならない。一般に、ある物質の皮膚浸透率はその物質の親油性(lipophilicity)と関係がある。皮膚の親油性と類似の物質であれば皮膚への分配係数が大きくなって経皮吸収が容易になると知られているが、ビタミンCの場合は、親水性が高くて皮膚への分配が低いため、経皮吸収が難しい。
【0013】
上述したようにビタミンCは様々な効果を示すが、安定性および経皮吸収性が低いため、これを改善するための研究が盛んに行われてきた。
【0014】
後述するように、ビタミンC誘導体は3つの類型に区分される。その一つの類型は、リン酸化アスコルビン酸またはリン酸化アスコルビン酸の金属塩を含む。アルコルビン酸の2番炭素と3番炭素のヒドロキシル基をリン酸化基とエステル結合によって連結してそれぞれアスコルビル−2−ホスフェートまたはアスコルビル−3−ホスフェート(ascorbyl-3-phosphate)を形成したが、この種の誘導体は、他の誘導体に比較して、人体が使用可能な形態であるL−アスコルビン酸への転換は容易になされるが、陰の電荷を持つため、皮膚吸収が難しいという欠点がある。
【0015】
ビタミンC誘導体の他の類型は、脂肪酸が結合した形態のアスコルビン酸を含む。例えば、米国特許第5409693号は、アスコルビン酸の親油性脂肪酸エステル(fat soluble fatty acid ester)形態、例えばパルミチン酸アスコルビル、ラウリン酸アスコルビル、ミリスチン酸アスコルビル、ステアリン酸アスコルビルなどのビタミンC誘導体を開示している。この中でも、アルコルビル−6−パルミテートが最も広く使用される。ところが、アスコルビル−6−パルミテートは、皮膚に吸収され易いが、L−アスコルビン酸への転換が難しいという欠点がある。アスコルビル−6−パルミテートは、マウスの肌を光酸化から保護するのに失敗したという結果が発表された(Bissett, D. et al., 1990, Photodermatol Photoimmunol Photomed 7: 56-62)。また、10wt%のアスコルビル−6−パルミテートを含んだ血清を処理したとき、皮膚からアスコルビン酸の顕著な増加が観察されなかったという結果も発表された(Pinnell, S. R. et al., 2001. Dermatologic Surgery. 27(2): 137-142)。
【0016】
第3の類型は、アスコルビン酸が単糖類に誘導体化された形態、例えばグリコシル化、マンノシル化、フルクトシル化、フコシル化、ガラクトシル化、N−アセチルグルコースアミン化、N−アセチルムラミン化された誘導体を含む。ところが、生体内の生理活性に対する具体的かつ正確な究明は未だ行われていない実情である。
【0017】
コラーゲンは、皮膚、血管、内臓、骨などから非常に多く発見される。皮膚を構成する真皮の70%はコラーゲンから構成されており、筋肉を取り囲んでいる筋膜もコラーゲンから構成されている。生体蛋白質の総重量の30%を占めるコラーゲンは、皮膚の機械的堅固性、結合組織の抵抗力、組織の結合力、細胞接着の保持、有機体の成長、または傷治癒時の細胞分割と分化を誘導する機能をする。コラーゲンは、線維芽細胞で生合成されるが、自然老化および光老化によって量が減少し、20歳から80歳に達する間に65%の減少が起こると知られている(Shuster S., 1975, British Journal of Dermatology, 93(6): 639-643)。生体内コラーゲンの合成が活発になると、真皮基質成分が増加して傷治癒、弾力増加、皺改善などの効果が期待できるという事実が確認されることにより、化粧品、食品、医薬品などに使用されている。このようなコラーゲンを形成する最小活性単位である10個以下のオリゴーペプチドは、メッセンジャー、刺激剤、神経伝達剤としての役割と成長調節、授乳、免疫、消化、血圧、治癒などの生理代謝作用とも関連がある。特に、皮膚再生効果を示すことが明らかになったペプチドは、フランス特許第2,668,265号、米国特許4,665,054号、国際特許公開第WO091/3488号および第WO91/7431号などに公知になっている。ところが、このようなペプチドの場合、沈澱物が形成されて製品の安定度が大幅低下するという欠点がある。
【0018】
〔発明の要約〕
前記従来のビタミンC誘導体の問題点を克服するために、本発明の目的は、ビタミンCをコラーゲンペプチドと結び付けることにより、安全性および安定性が改善されかつ皮膚浸透力に優れたビタミンC誘導体を提供することにある。
【0019】
〔図面の簡単な説明〕
この発明の前記及び他の目的、特徴及びその他の利点は、添付図面を参照する次の説明によって明確に理解されるであろう。
【0020】
図1は本発明の化合物、ビタミンCおよびアルブチンを用いてメラニン細胞B16によるメラニン生産量を検定したグラフである。
【0021】
図2は本発明の化合物およびビタミンCを用いてエラスターゼ活性を検定したグラフである。
【0022】
図3は本発明の化合物およびビタミンCを用いてコラーゲン生合成能を検定したグラフである。
【0023】
図4は本発明の化合物およびビタミンCを用いてラジカル除去能を検定したグラフである。
【0024】
〔発明を実施するための最良の様態〕
一つの様態において、本発明は、下記化学式1で表わされるビタミンC誘導体またはその薬学的に許容される塩に関する。
【0025】
【化1】

【0026】
式中、R1およびR2はそれぞれ同じでも異なってもよく、−OHまたは
【化2】

であり、R1とR2が同時に−OHではなく、Xは−OC(O)(CH2)mC(O)−であり、
【化3】

は天然または非天然アミノ酸の中から選択される同一または異なるアミノ酸残基がアミド結合したペプチドであり、Rは天然または非天然アミノ酸残基残基の中から選択されるアミノ酸残基の側鎖であり、nは3〜10の整数であり、mは2〜5の整数である。
【0027】
具体的に、化学式1の化合物は、下記化学式1a、1bおよび1cを含む。
【0028】
【化4】

【0029】
【化5】

【0030】
【化6】

【0031】
好適な様態において、
【化7】

は、グリシン、リジン、ヒスチジン、セリン、プロリン、ヒドロキシプロリンおよびトレオニンの中から選択される同一または異なるアミノ酸残基がアミド結合したペプチドであり、Rは前記アミノ酸残基の側鎖であり、nは3〜7、より好ましくは3〜5の整数であって、好ましくはトリ−、テトラ−またはペンタ−ペプチドであり、特に好ましくはグリシル−リシル−ヒスチジン、グリシル−ヒスチジル−リジン、グリシル−プロリル−ヒドロキシプロリンまたはリシル−トレオニル−トレオニル−リシル−セリンである。また、mは2〜4、より好ましくは2または3の整数、特に好ましくは2の整数であり、Xはスクシニル基である。
【0032】
他の様態において、本発明は、化学式2で表わされるビタミンC誘導体またはその薬学的に許容される塩に関する。
【0033】
【化8】

【0034】
式中、Xは−(CH2)p−O−であり、
【化9】

は天然または非天然アミノ酸の中から選択される同一または異なるアミノ酸残基がアミド結合したペプチドであり、Rは天然または非天然アミノ酸残基の中から選択されるアミノ酸残基の側鎖であり、nは3〜10の整数であり、pは2〜5の整数である。
【0035】
好適な様態において、
【化10】

は、グリシン、リジン、ヒスチジン、セリン、プロリン、ヒドロキシプロリンおよびトレオニンの中から選択される同一または異なるアミノ酸残基がアミド結合したペプチドであり、Rは前記アミノ酸残基の側鎖であり、nは3〜7、より好ましくは3〜5の整数であって、好ましくはトリ−、テトラ−またはペンタ−ペプチドであり、特に好ましくはグリシル−リシル−ヒスチジン、グリシル−ヒスチジル−リジン、グリシル−プロリル−ヒドロキシプロリン、またはリシル−トレオニル−トレオニル−リシル−セリンである。また、pは2〜4、より好ましくは3または4、特に好ましくは3の整数であり、Xはプロパノールである。
【0036】
好適な様態において、本発明の化合物は、6−(スクシニル−リシル−トレオニル−トレオニル−リシル−セリン)アスコルビン酸、5−(スクシニル−リシル−トレオニル−トレオニル−リシル−セリン)アスコルビン酸、5,6−ジ(スクシニル−リシル−トレオニル−トレオニル−リシル−セリン)アスコルビン酸、6−(スクシニル−グリシル−リシル−ヒスチジン)アスコルビン酸、5−(スクシニル−グリシル−リシル−ヒスチジン)アスコルビン酸、5,6−ジ(スクシニル−グリシル−リシル−ヒスチジン)アスコルビン酸、6−(スクシニル−グリシル−ヒスチジン−リジン)アスコルビン酸、5−(スクシニル−グリシル−ヒスチジン−リジン)アスコルビン酸、5,6−ジ(スクシニル−グリシル−ヒスチジン−リジン)アスコルビン酸、6−(スクシニル−グリシル−プロリル−ヒドロキシプロリン)アスコルビン酸、5−(スクシニル−グリシル−プロリル−ヒドロキシプロリン)アスコルビン酸、5,6−ジ(スクシニル−グリシル−プロリル−ヒドロキシプロリン)アスコルビン酸、2−(プロピル−リシル−トレオニル−トレオニル−リシル−セリン)アスコルビン酸、2−(プロピル−グリシル−リシル−ヒスチジン)アスコルビン酸、2−(プロピル−グリシル−ヒスチジン−リジン)アスコルビン酸、2−(プロピル−グリシル−プロリル−ヒドロキシプロリン)アスコルビン酸、およびこれらの薬学的に許容される塩よりなる群から選択される。
【0037】
最も好適な様態において、本発明の化合物は、6−(スクシニル−リシル−トレオニル−トレオニル−リシル−セリン)アスコルビン酸、6−(スクニシル−グリシル−リシル−ヒスチジン)アスコルビン酸、6−(スクシニル−グリシル−ヒスチジン−リシル)アスコルビン酸、およびこれらの薬学的に許容される塩よりなる群から選択される。
【0038】
本願で使用された用語「天然アミノ酸」とは、アラニン、バリン、ロイシン、イソロイシン、プロリン、フェニルアラニン、トリプトファン、メチオニン、グリシン、セリン、トレオニン、システイン、チロシン、アスパラギン、グルタミン、リジン、アルギニン、ヒスチジン、アスパラギン酸およびグルタミン酸よりなる群から選択されたα−アミノ酸を意味する。また、「非天然アミノ酸」は、核酸コドンによって暗号化されないアミノ酸であって、その例には前記の天然α−アミノ酸のD異性体;アミノ酪酸(Aib)、3−アミノイソ酪酸(bAib)、ノルバリン(Nva)、β−Ala、2−アミノアジピン酸(Aad)、3−アミノアジピン酸(bAad)、2−アミノ酪酸(Abu)、γ−アミノ酪酸(Gaba)、6−アミノカプロン酸(Acp)、2,4−ジアミノ酪酸(Dbu)、α−アミノピメリン酸、トリメチルシリル−Ala(TMSA)、アロ−イソロイシン(alle)、ノルロイシン(Nle)、3級−Leu、シトルリン(Cit)、オルニチン(Orn)、2,2’−ジアミノピメリン酸(Dpm)、2,3−ジアミノプロピオン酸(Dpr)、α−またはβ−Nal、シクロヘキシル−Ala(Cha)、ヒドロキシプロリン、サルコシン(Sar)など;環状アミノ酸;Nα−アルキル化アミノ酸、例えばNα−メチルグリシン(MeGly)、Nα−エチルグリシン(EtGly)およびNα−エチルアスパラギン(EtAsn);およびα−炭素が2つの側鎖置換体を持つアミノ酸が含まれる。
【0039】
本願で使用された用語「ペプチド」とは、アミド結合(またはペプチド結合)で連結された3〜10個のアミノ酸残基からなるポリマーを意味する。ペプチドは、生体内の蛋白質を抽出して蛋白質分解酵素を処理して低分子量化させるか、あるいは遺伝子組み換えと蛋白質発現システムを利用することもでき、好ましくはペプチド合成器などを用いて試験管内で合成する方法などで製造される。目的によっては、ペプチドは特定の原子または原子団がヒドロキシル基などで置換された誘導体である。ペプチドにおいて、COOHをC−末端といい、NH2をN−末端という。
【0040】
本願において、ペプチドは特にコラーゲンペプチドを含み、「コラーゲンペプチド」は、コラーゲン蛋白質の断片であって、コラーゲンの合成を促進し或いはコラーゲン蛋白質の構成要素として使用できる。例えば、本発明の具体例で使用されたトリないしペンタペプチドは、真皮の内部に多量存在するコラーゲンと、グリコスアミノグリカンの合成を促進させて水分保有効率を高め、真皮の弾力を増進させることにより、保湿効果と皺改善効果を与える機能を持っている。特に、ペンタペプチドであるリシル−トレオニル−トレオニル−リシル−セリン(Lysyl-Threonyl-Threonyl-Lysyl-Serine)は、皮膚結合組織、皺形成および保湿と関連して重要なコラーゲンタイプIのカルボキシル基の末端断片(fragment)であって、コラーゲンを生合成する細胞である線維芽細胞の細胞培養においてコラーゲンタイプIおよびIII、細胞と細胞間の接着に関連して細胞間の情報伝達が円滑に行われるように助けるフィブロネクチン(fibronectin)、および成長因子β−TGFの合成を促進し(Kou Katayama et al., 1991, Biochemistry 30: 7097-7104)、コラーゲン遺伝子のプロモータに結合してその転写を促進させるものと報告された(Kou Katayama et al., 1993, The Journal of Biological Chemistry 268(14): 9941-9944)。
【0041】
韓国特許出願第10−2001−0060244号は、HIV蛋白質の一種であるTatペプチドが結合したビタミンC誘導体を開示している。前記特許において、Tatペプチドは、ビタミンCの2番炭素位置のヒドロキシル基または3番炭素位置のヒドロキシル基に直接(リンカーの連結なしに)エステル結合し、炭素数6以上の反復的なアルコール、例えば−(CH2CH2O)3−リンカーを介してエーテル結合している。これは、コラーゲンペプチドが炭素数5以下のアルコール−(CH2)2−5−O−リンカーを介してエーテル結合し、リンカーとペプチドとがエステル結合した本発明のビタミンC誘導体とは異なる構造を持つ化合物である。エステル結合で連結されたビタミンC誘導体の場合は、エーテル結合で連結されたビタミンC誘導体の場合と比較するとき、生体内でビタミンCからコラーゲンペプチドを分離することが容易である。
【0042】
本願で使用された用語「薬学的に許容される塩」は、薬学的に許容される無機および有機酸および塩基から誘導されたものを含む。適宜な酸の例としては、塩酸、臭素酸、硫酸、硝酸、過塩素酸、フマル酸、マレイン酸、リン酸、グリコール酸、乳酸、サリチル酸、琥珀酸、トルエン−p−スルホン酸、酒石酸、酢酸、クエン酸、メタンスルホン酸、蟻酸、ベンゾ酸、マロン酸、ナフタレン−2−スルホン酸、ベンゼンスルホン酸などを含むことができる。適宜な塩基から誘導された塩は、ナトリウムなどのアルカリ金属と、マグネシウム、アンモニウムなどのアルカリ土金属を含むことができる。
【0043】
別の様態において、本発明は、ヒドロキシル基の保護のためにビタミンCの2、3番炭素位置のヒドロキシル基にベンジル基を導入し、ビタミンCの5番、6番または5番と6番炭素位置のヒドロキシル基と炭素数2〜5のジカルボン酸をエステル結合させた後、ペプチドとアミド結合させることを特徴とする、化学式1のビタミンC誘導体又はその薬学的に許容される塩の製造方法に関する。
【0044】
好適な様態において、本発明は、化学式3の5,6−イソプロピリジエン−アスコルビン酸を化学式4のハロゲン化ベンジルと反応させて2番および3番炭素位置のヒドロキシル基にベンジル基を導入する段階と、化学式5のベンジル基が導入された5,6−イソプロピリジエン−アスコルビン酸を開環させた後、化学式6のジカルボン酸と反応させる段階と、化学式7の化合物を化学式8のペプチドとアミド結合させる段階と、保護基を除去する段階とを含むことを特徴とする、化学式1のビタミンC誘導体またはその薬学的に許容される塩を製造する方法を提供する。
【0045】
【化11】

【0046】
【化12】

【0047】
【化13】

【0048】
[化学式6]
HOOC(CH2)mCOOH
【0049】
【化14】

【0050】
【化15】

【0051】
式中、mは2〜5の整数であり、Bnはベンジルであり、Yは塩素、臭素、フッ素またはヨウ素であり、R1’とR2’はそれぞれ同じでも異なってもよく、−OHまたは−OC(O)(CH2)mC(O)OHであり、R1’とR2’が同時に−OHではなく、Rは保護されておりあるいは保護されていない天然または非天然アミノ酸残基の側鎖であり、nは3〜10の整数である。
【0052】
より好適な様態において、化学式3の5,6−イソプロピリジエン−アスコルビン酸は、化学式4のハロゲン化ベンジル、好ましくは塩化ベンジルと40〜60℃、好ましくは50℃の温度で3〜5時間、好ましくは4時間反応させる。具体的に、アスコルビン酸の2番および3番炭素位置のヒドロキシル基にベンジル基が導入された化学式5の生成物に酸、好ましくはトリフルオロ酢酸を添加して3〜5時間、好ましくは4時間反応させて5,6−イソプロピリジエン環を開環させ、化学式6のジカルボン酸、好ましくは琥珀酸を添加して15〜17時間、好ましくは16時間室温でアスコルビン酸とエステル結合させて化学式7の化合物を合成し、樹脂上で典型的な固相合成法によって保護されたペプチドN末端のNH2とアミド結合させた後、保護基を除去する。
【0053】
前記反応は、無水条件の下、例えば無水有機溶媒を用いて行う。無水有機溶媒は、例えばジメチルホルムアミド、ジメチルスルホキシド、N−メチルピロリジノン、ジクロロメタンなど、好ましくはジメチルホルムアミドを含む。前記反応の縮合剤は、DCC(N,N¢-dicycllohexylcarbodiimide)、HOBT(N-hydroxybenzotriazole)、PyBOP(benzotriazole-1-yl-oxy-tris-pyrrolidinophosphonium hexafluorphosphate)、HBTU(2-(1H-benzotriazole-1-yl)-1,3,3-tetramethyluronium hexafluorophosphate)などを含む。
【0054】
別の様態において、本発明は、ヒドロキシル基の保護のためにビタミンCの3番炭素位置のヒドロキシル基にベンジル基を導入し、2番位置のヒドロキシル基と炭素数2〜5のアルコールをエーテル結合させた後、ペプチドとエステル反応させることを特徴とする化学式2のビタミンC誘導体またはその薬学的に許容される塩の製造方法に関する。
【0055】
好適な様態において、本発明は、化学式3の5,6−イソプロピリジエン−アスコルビン酸を化学式4のハロゲン化ベンジルと反応させて3番炭素位置のヒドロキシル基にベンジル基を導入させる段階と、化学式9の化合物の2番炭素位置のヒドロキシル基を化学式10のハライドアルコールと反応させる段階と、アルコール基が導入された5,6−イソプロピリジエン−アスコルビン酸をアミノ酸残基のC末端とエステル結合させる段階と、ペプチド延長反応させる段階と、保護基を除去する段階とを含むことを特徴とする、化学式2のビタミンCの誘導体またはその薬学的に許容される塩を製造する方法を提供する。
【0056】
【化16】

【0057】
【化17】

【0058】
【化18】

【0059】
[化学式10]
Y(CH2)pOH
式中、pは2〜5の整数であり、Bnはベンジルであり、Yは塩素、臭素、フッ素またはヨウ素である。
【0060】
より好適な様態において、化学式3の5,6−イソプロピリジエン−アスコルビン酸は、化学式4のハロゲン化ベンジル、好ましくは塩化ベンジルと40〜60℃、好ましくは50℃の温度で14〜18時間、好ましくは16時間反応させる。3番炭素位置のヒドロキシル基にベンジル基が導入された化学式9の化合物を化学式10のハライドアルコール、好ましくはブロモプロパノールと40〜60℃、好ましくは50℃で3〜5時間、好ましくは4時間反応させてエーテル結合させた後、アルコール基の導入された5,6−イソプロピリジエン−アスコルビン酸を保護されたアミノ酸残基のC末端とエステル結合させ、次いでペプチド延長反応させた後、保護基を除去する。
【0061】
前記反応は、無水条件の下、例えば無水有機溶媒を用いて行う。無水有機溶媒は、例えばジメチルホルムアミド、ジメチルスルホキシド、N−メチルピロリジノン、ジクロロメタンなどを含む。また、前記反応の縮合剤は、DCC(N,N¢-dicyclohexylcarbodiimide)、HOBT(N-hydroxybenzotriazole)、PyBOP(benzotriazole-1-yl-oxy-tris-pyrrolidino-phosphonium hexafluorphosphate)、HBTU(2-(1H-benzotriazole-1-yl)-1,3,3-tetramethyluronium hexafluorophosphate)などを含む。
【0062】
本発明で使用できる縮合剤、触媒および溶媒は、反応に悪影響を及ぼさない範囲内で、当業界に通常公知されているいずれのものでも使用できる。
【0063】
前記のような方法で製造された本発明の化学式1および2のビタミンC誘導体は、通常の分離、精製方法、例えば再結晶またはカラムクロマトグラフィ法を用いて精製することができる。
【0064】
化学式1の化合物を製造するための前述した本発明の製造方法において、ヒドロキシル基がベンジル基で保護されたアスコルビン酸と結合するペプチドは、固相合成法で製造できる。例えば、それぞれのアスコルビン酸のヒドロキシル基を保護した後、保護されていないヒドロキシル基に選択的にスクシニル基を導入し、樹脂上で典型的な固相合成法によって合成されたペプチドのN末端とスクシニル基の導入されたアスコルビン酸とを反応させた後、アスコルビン酸とペプチドの保護基を除去する。
【0065】
化学式2の化合物を製造するための前述した本発明の製造方法において、ヒドロキシル基がベンジル基で保護されたアスコルビン酸と結合するアミノ酸残基の延長反応は、固相合成法で行われる。例えば、アスコルビン酸のヒドロキシル基を保護した後、保護されていないヒドロキシル基にプロパノール基を導入し、溶液相でアミノ酸残基のC末端と結合させた後、樹脂上で典型的な固相合成法によってペプチドを延長反応させ、その後アスコルビン酸とペプチドの保護基を除去する。
【0066】
本発明の化学式1および2の化合物を固相または溶液相合成法を用いて製造する方法を図式化して下記反応式1および2に示した。反応式1は特に化学式1bの化合物の製造過程を示し、反応式2は化学式2の化合物の製造過程を示す。
【0067】
【化19】

a.Bncl、K2CO3、DMF、50℃、4hr
b.TFA、DCM、室温、4hr
c.琥珀酸無水物、TEA、DMF、室温、16hr
d.固相合成
e.TFA/フェノール/チオアニソール/H2O/TIS(85/5/5/3/2)v/v、室温、3hr
f.10%Pd/C、MeOH、H2、室温、1hr
(BnCl:塩化ベンジル;DMF:ジメチルホルムアミド;TFA:トリフルオロ酢酸)
DCM:ジクロロメタン;TEA:トリエチルアミン;MeOH:メタノール
【0068】
【化20】

a.BnCl、K2CO3、DMF,50℃、16hr
b.3−ブロモプロパノール、CsCO3、DMF、50℃、4hr
c.Fmoc−アミノ酸、DCC、HOBT、DMF、室温
d、e.固相合成
f.TFA/フェノール/チオアニソール/H2O/TIS(85/5/5/3/2)v/v、室温、3hr
g.10%Pd/C、MeOH、H2、室温、1hr
(BnCl:塩化ベンジル;DMF:ジメチルホルムアミド;Fmoc:フルオレニルメチルカルボニル;DCC:N,N’−ジシクロヘキシルカルボジイミド;HOBT:N−ヒドロキシベンゾトリアゾール;TEA:トリエチルアミン;MeOH:メタノール)
【0069】
前記製造された本発明のビタミンC誘導体は、優れた抗酸化効果、皮膚皺の改善効果、美白効果を示すうえ、皮膚刺激、感作性および光毒性などを示さない。
【0070】
したがって、別の様態において、本発明は、化学式1および2の化合物の中から選択された1種以上を含む皮膚外用のための組成物に関する。好適な様態において、本発明の組成物は化粧料、特に美白、皮膚皺改善などに有用である。
【0071】
本願で使用された用語「皮膚外用」とは、皮膚の保湿効果、皺抑制効果、皮膚粗さ改善効果、経皮吸収促進効果などの様々な効果を示し、皮膚状態を改善しあるいは皮膚状態の悪化を抑制するために使用するということを意味する。本発明の皮膚外用剤は、化粧料、医薬品、医薬部外品などに使用できる。その中でも、化粧料の形で使用することが好ましく、このような化粧料の形態は特に限定されない。
【0072】
本発明に係る組成物は、化学式1および2で表わされる化合物の中から選択された1種以上の物質を0.001〜5%(w/w)、好ましくは0.01〜3%(w/w)含有する。これは、0.001%未満の濃度では実質的な美白効果を期待し難いためである。
【0073】
本発明の皮膚美白用組成物を製造する場合、溶媒としてエタノール、グリセリン、ブチレングリコール、プロピレングリコール、グリセレス−26、メチルグルセス−20、ミリスチン酸イソセチル、オクタン酸イソセチル、ミリスチン酸オクチルドデシル、オクチルドデカノール、イソステアリン酸イソステアリル、オクタン酸セチルおよびネオペンチルグリコールジカプレートの中から選択された1種以上を使用する。このような溶媒を用いて本発明の組成物を製造する場合、化合物の種類および溶媒と化合物との比によって溶媒に対する化合物の溶解度が少しずつ異なるが、本発明の属する技術分野の当業者であれば、製品の特性に応じて溶媒の種類および使用量を適切に選択して適用することができる。
【0074】
本発明に係る組成物は、皮膚外用のための軟膏、柔軟化粧水、栄養化粧水、栄養クリーム、マッサージクリーム、エッセンス、パックなどの化粧料の形で製造できる。ここで、皮膚外用軟膏は、化学式1または2の化合物の有効成分以外にワセリン50.0〜97.0重量%およびポリオキシエチレンオレイル−エーテルホスフェート0.1〜5.0重量%を含有するように製造され、柔軟化粧水はプロピレングリコール、グリセリンなどの多価アルコール類1.0〜10.0重量%およびポリエチレンオレイルエーテル、ポリオキシエチレン硬化ヒマシ油などの界面活性剤0.05〜2.0重量%を含有するように製造される。栄養化粧水および栄養クリームは、化学式1または2の有効成分以外にスクアレン、ワセリン、オクチルドデカノールなどのオイル類5.0〜20.0重量%、およびエタノール、ステアリルアルコール、蜜蝋などのワックス成分3.0〜15.0重量%を含有し、エッセンスはグリセリン、プロピレングリコールなどの多価アルコール類5.0〜30.0重量%を含有する。マッサージクリームは化学式1または2の有効成分以外に流動パラフィン、ワセリン、イソノニルイソノナノエートなどのオイルを30.0〜70.0重量%含有して製造され、パックは、ポリビニルアルコールを5.0〜20.0重量%含有するピールオフパック、または一般乳化型化粧料にカオリン、タルク、酸化亜鉛、二酸化チタンなどの顔料が5.0〜30.0重量%含有されたウォッシュオフパックの形で製造される。
【0075】
また、本発明の前記化学式1または2で表わされる化合物を含有する化粧料組成物は、一般皮膚化粧料に配合される通常の成分、例えば油分、水、界面活性剤、保湿剤、低級アルコール、増粘剤、キレート剤、色素、防腐剤、香料などを必要な分だけ適用配合することが可能である
以下、本発明について下記の実施例を挙げてより詳細に説明する。ところが、これらの実施例は本発明の範囲を限定するものではない。
【0076】
〔実施例1:2,3−O−ジベンジル−6−O−スクシニル−アスコルビン酸の合成〕
【0077】
【化21】

【0078】
(a)5,6−イソプロピリジエン−L−アスコルビン酸(5g、23.1mmol)をジメチルホルムアミド50mLに溶解させた後、固体炭酸水素セシウム(15g、46mmol)を添加した。この混合物に塩化ベンジル(7.3g、58mmol)を加えた後、50℃で4時間攪拌した。この反応物から減圧の下でジメチルホルムアミドを除去した後、濃縮された溶液をジクロロメタンで希釈し、生成された固体を濾過した後、濾液を減圧の下で濃縮した。
【0079】
(b)前記生成された化合物をジクロロメタンに溶かした後、20%(v/v)TFAを添加した後、4時間攪拌させた。この反応物から減圧の下で溶媒とTFAを除去した後、再結晶化して薄黄色の半固体の形で得た。
【0080】
(c)前記得られた化合物をジメチルホルムアミドに溶解させ、琥珀酸(1.2eq.)を加えた後、トリエチルアミン(1.2eq.)を徐々に滴加した。16時間室温で攪拌した後、減圧の下でジメチルホルムアミドを除去し、その後濃縮された溶液をシリカゲルカラムクロマトグラフィを用いて薄黄色の半固体状の化合物(3.9g)を得た。
【0081】
前記2,3−O−ジベンジル−6−O−スクシニル−アスコルビン酸の1HNMR (CDCl3):2.67 (s, 4H, CH2CH2COOH) 4.06 (t, 1H, C-5-H), 4.32 (d, 2H, C-6-H2), 4.67 (d, 1H, C-4-H), 5.17 (m, 4H, O-CH2-Ph), 7.36 (m, 10H, Ar-H)
【0082】
〔実施例2:2−O−(3−ヒドロキシプロピル)−3−O−ベンジル−5,6−イソプロピリジエン−アスコルビン酸の合成〕
【0083】
【化22】

【0084】
(a)5,6−イソプロピリジエン−L−アスコルビン酸(5g、23.1mmol)をジメチルホルムアミド50mLに溶解させた後、固体炭酸水素セシウム(3.8g、11.5mmol)を加えた後、50℃で16時間攪拌した。この反応物から減圧の下でジメチルホルムアミドを除去した後、濃縮された溶液をジクロロメタンで希釈し、精製された固体を濾過した後、濾液を減圧の下で濃縮した。
【0085】
(b)前記生成された化合物をジメチルホルムアミドに溶かした後、3−ブロモプロパノール1当量と固体炭酸水素セシウム1当量を添加し、その後50℃で4時間攪拌した。この反応物から減圧の下でジメチルホルムアミドを除去した後、濃縮された溶液をシリカゲルカラムクロマトグラフィを用いて白色の固体化合物(2.9g)を得た。
【0086】
前記2−O−(3−ヒドロキシプロピル)−3−O−ベンジル−5,6−イソプロピリジエン−アスコルビン酸の1HNMR (CDCl3):1.35 (s, 3H, C-CH3), 1.39 (s, 3H, C-CH3), 1.85 (m, 2H, O-CH2CH2CH2-OH), 3.58 (t, 2H, O-CH2CH2CH2-OH), 3.9(t, 2H, O-CH2CH2CH2-OH), 3.98-4.24 (m, 3H, C-5-H, C-6-H2), 4.51 (d, 1H, C-4-H), 5.17 (s, 2H, O-CH2-Ph), 7.37 (m, 5H, Ar-H)
【0087】
〔実施例3:ペプチドの合成〕
本発明に使用される様々な種類のペプチドの合成は、Fmoc(9-fluorenylmethoxycarbonyl)をNα−アミノ酸の保護基として使用する固相法によって合成し、HOBt−DCC(N-hydroxybenzotriazole-dicyclohexylcarbodiimide)方法によってペプチドを延長した(Wang C. Chan, Perter D. white, “Fmoc solid phase peptide synthesis" Oxford)。グリシル−ヒスチジル−リジン、グリシル−リシル−ヒスチジン、グリシル−プロリル−ヒドロキシプロリン、リシル−トレオニル−トレオニル−リシル−セリンペプチドを合成した。
【0088】
〔実施例4:ビタミンC誘導体の合成〕
〈4−1:化合式1の化合物の合成〉
N末端のアミノ酸までカップリングされた、実施例3で合成されたペプチドに20%ピペリジン/N−メチルピロリドン(Piperidine/N-methylpyrrolidone)溶液を加えてFmoc基を除去し、N−メチルピロリドンとジクロロメタン(dichloromethane)で洗浄した後、実施例1で合成されたビタミンC誘導体をカップリングさせた。カップリング完了の後、N−メチルピロリドンとジクロロメタンで複数回洗浄した後、窒素ガスで乾燥させた。ここにトリフルオロ酢酸:フェノール:チオアニソール:水:トリイソプロピルシラン(trifluoroacetic acid: phenol: thioanisole: water: triisopropylsilane)の85:5:5:3:2(v/v)溶液で2〜3時間反応させてペプチド保護基を除去し、ペプチドが結合したビタミンC誘導体を樹脂から分離させた後、ジエチルエーテルでペプチドを沈澱させた。ビタミンCの2番および3番炭素に結合したアルコール基を保護しているベンジル基を除去するために、10%Pd/Cをメタノールに添加し、水素雰囲気の下に約1時間室温で攪拌した後、セライトを用いてPd/Cを除去して得た濾液を減圧濃縮した。こうして得たビタミンC誘導体は、0.1%トリフルオロ酢酸含有のアセトニトリルを勾配として精製逆相高性能液体クロマトグラフィカラム(purified reverse phase high performance liquid chromatography column,Zobax, C8 300Å, 21.1mm ´ 25cm)を用いて精製することにより、化学式1のペプチドが結合したビタミンC誘導体を合成した。
【0089】
〈4−2:化学式2の化合物の合成〉
実施例2で合成されたビタミンC誘導体と側鎖をトリフェニルメタン基で保護したC末端のペプチドをジメチルホルムアミドに溶解させた後、N−ヒドロキシベンゾトリアゾールを添加した。この混合物にN,N’−ジシクロヘキシルカボジイミドを加えた後、常温で2時間攪拌して、実施例2で合成されたビタミンC誘導体とC末端のペプチドとをカップリングさせた。この反応物から減圧の下でジメチルホルムアミドを除去した後、濃縮された溶液をジクロロメタンで希釈し、トリフルオロ酢酸を1%添加した。この混合物を常温で10分間攪拌してC末端のペプチド側鎖の保護基であるトリフェニルメチル基を除去した。この反応物にトリエチルアミンを添加した後、クロロトリフェニルメチル樹脂とカップリングして実施例3のペプチド合成に応じてペプチドを延長反応した。N末端のアミノ酸までカップリングされた前記ペプチドが結合したビタミンC誘導体に20%ピペリジン/N−メチルピロリドン(Piperidine/N-methylpyrrolithane)溶液を加えてFmoc基を除去し、N−メチルピロリドンとジクロロメタンで洗浄した後、窒素ガスで乾燥させた。ここにトリフルオロ酢酸:フェノール:チオアニソール:水:トリイソプロピルシラン(trifluoroacetic acid: phenol: thioanisole: water: triisopropylsilane)の85:5:5:3:2(v/v)溶液で2〜3時間反応させてペプチド保護基を除去し、ペプチドの結合したビタミンC誘導体を樹脂から分離させた後、ジエチルエーテルでペプチドを沈澱させた。ビタミンCの3番炭素に結合したアルコール基を保護しているベンジル基を除去するために、10%Pd/Cをメタノールに添加し、水素雰囲気の下に約1時間室温で攪拌した後、セライトを用いてPd/Cを除去して得た濾液を減圧濃縮した。こうして得たビタミンC誘導体は、0.1%トリフルオロ酢酸含有のアセトニトリルを勾配として精製逆相高性能液体クロマトグラフィカラム(purified reverse phase high performance liquid chromatography column,Zobax, C8 300Å, 21.1mm ´ 25cm)を用いて精製することにより、化学式2のペプチドが結合したビタミンC誘導体を合成した。
【0090】
このような方法で合成された、それぞれのペプチドが結合したビタミンC誘導体を質量分光光度計(mass spectrophotometer)で分子量を測定し、ペプチドと琥珀酸基またはプロピル基が導入されたビタミンCの結合を確認した。表1は実施例4で説明した方法で合成されたビタミンC誘導体の測定分子量をまとめたものである。
【0091】
【表1】

【0092】
表1において、化合物番号I、II、IIIおよびIVはそれぞれ化学式1a、1b、1cおよび2の化合物を示す。
【0093】
化合物II−1に対する1H NMR (CD3OD):8.78(dd, 1H), 7.38(s, 1H), 4.73(m, 3H), 4.42(m, 1H), 4.27(m, 2H), 4.14(m, 1H), 3.84(m, 2H), 3.19(m, 1H), 2.96(td, 2H), 2.76(m, 2H), 2.59(m, 2H), 1.81(m, 4H), 1.50(m, 2H)
- 化合物II−2に対する1H NMR (CD3OD):8.78(m, 1H), 7.36(s, 1H), 4.74(m, 3H), 4.24(m, 3H), 3.86(d, 2H), 3.29(m, 2H), 2.95(t, 2H), 2.66(m, 4H), 1.80(m, 4H), 1.51(m, 2H)
化合物II−4に対する1H NMR (CD3OD):4.78(m, 3H), 4.31(m, 10H), 3.90(m, 2H), 2.96(q, 4H), 2.65(m, 4H), 1.92(m, 2H), 1.74(m, 6H), 1.52(m, 4H), 1.23(q, 6H)
【0094】
〔試験例1:着色実験〕
実施例4で合成された化合物I〜IVとビタミンC(Aldrich)をそれぞれpH7の50mMリン酸カリウム緩衝溶液に50mMの濃度で溶かし、40℃の恒温槽で3週間保管した後、着色有無の経時変化を前記評価基準に基づいて観察し、その結果を表2に示した。
【0095】
【表2】

【0096】
表2から分かるように、本発明の化合物I〜IVは、ビタミンCに比べて比較的安定であり、変色が起こらず、沈澱物が生成されていない。
【0097】
〔試験例2:チロシナーゼ阻害活性の評価〕
実施例4で合成された化合物II−1、II−2およびII−4を用いてチロシナーゼ活性阻害効果を測定した。チロシナーゼは、茸から分離されて精製されたもので、Sigma社から購入して使用した。基質であるチロシンは、0.05Mリン酸カリウム緩衝溶液(pH6.8)に溶かして0.3mg/mL溶液に作って使用した。化合物およびビタミンCは、蒸留水に10mMの濃度で溶解させ、さらに適切な濃度で蒸留水に希釈して使用した。
【0098】
試料チロシン溶液と緩衝溶液をそれぞれ0.5mLずつ試験管に仕込み、ここに前記化合物またはビタミンC溶液0.5mLを加えて37℃の恒温器で10分間放置した後、2,000U/mLチロシナーゼ0.05mLを仕込んで37℃で10分間反応させた。この際、対照群は各化合物の代わりに蒸留水0.5mLを仕込んだものである。反応液入りの試験管を氷で急冷させて反応を中止させ、分光光度計によって波長475nmで吸光度を測定してチロシナーゼ活性阻害率を求めた。IC50値は、酵素活性阻害率が50%に達する阻害剤の濃度で決定した。阻害率は数式1によって求め、その結果は表3に示した。
【0099】
[数式1]
阻害率(%)=(A−B)/A×100
【0100】
式中、Aは阻害剤が添加されていないものの475nmにおける吸光度であり、Bは阻害剤が添加されたものの475nmにおける吸光度である。
【0101】
【表3】

【0102】
〔試験例3:メラニン形成抑制能の評価〕
試験管内でメラニン細胞のB6黒色腫細胞(韓国細胞株銀行)を培養し、その後培地を除去し、試料が適切な濃度で希釈された培地で取り替えた後、5%CO2、37℃の下で各濃度別試験物質(ビタミンC、アルブチン、化合物II−1、II−2、II−4)を添加して一定の時間培養した。培地を除去した細胞をPBS(phosphated buffer saline)で洗浄し、これをトリプシンで処理して細胞を回収した。回収された細胞は、血球計算盤(hematocytometer)を用いて細胞数を測定し、5,000〜10,000rpmにて10分間遠心分離した後、上澄み液を除去してペレットを得た。この細胞ペレットを60℃で乾燥させた後、10%DMSO含有の1M水酸化ナトリウム液100μLまたは適量の細胞分解緩衝液を入れて60℃の恒温槽で細胞内メラニンを得た。この液をもってマイクロプレートリーダーによって490nmで吸光度を測定して一定の細胞数当たりのメラニン量または一定の蛋白質当たりのメラニン量を求めて図1に示した。
【0103】
図1に示すように、化合物II−4は1mM濃度でアルブチン(albutin)より約24%高いメラニン生成抑制能を示し、ビタミンCよりは約10〜20%高い抑制能を示した。化合物II−1の場合、化合物II−4と類似の抑制能を示した。
【0104】
〔試験例4:エラスターゼ抑制能の評価〕
エラスターゼ(Sigma)の基質としてMeO−Suc−(Ala)2−Pro−Val−pNAを用いて、エラスターゼによる分解産物p−ニトロアニリンの色を測定してエラスターゼの活性を評価し、その結果を図2に示した。
【0105】
図2に示すように、1mM濃度以下ではビタミンCとエラスターゼの抑制能において大きい差を示していないが、1mM以上の濃度では2〜20%程度高い抑制能を示した。
【0106】
〔試験例5:細胞毒性の評価〕
化粧品に使用される原料としての1次安全性を検証するために化合物II−1、II−2およびII−4に対してヒト正常線維芽細胞、B16黒色腫、HaCaT細胞を培養してそれぞれ濃度別に試験物質を処理してMTT試験(Mossman T., 1983, Journal of Immunological Methods 65, 55-63)を行って細胞毒性を評価した結果、化合物II−4の場合は、ビタミンCと比較するとき、5mM濃度でも細胞毒性が見られず、化合物II−1、II−2の場合は、10mM以下で類似の効果を示して安全性に優れた。
【0107】
〔試験例6:皮膚刺激性試験〕
前記化合物II−4の皮膚刺激性試験のために、ウサギを用いた貼布試験を行った(Draize J.H. et al., 1944, J. Pharmacol. Exp. Ther., 82: 377-390; Gfeller W et al., 1985, Fd. Chem. Toxic., 23: 165-168; Bosshard, E et al., 1985, Fd. Chem. Toxic., 12:149-154)。
【0108】
化合物II−4を0.01M PBSに1%となるように調製した後、除毛した背中部位(2.5cm×2.5cm)に1区画当たり0.5mLずつ使用して1回24時間塗布し、適用部位から試験化合物の漏洩を防止するためにガーゼ(10cm×10cm)一枚を被せた後、試験化合物の蒸発を防ぐために不浸透性および非反応性の固体薄膜を覆い、弾力包帯でウサギの行動に支障を来たさないように取り巻いた後、紙テープで包帯を固定した。試験化合物の塗布24時間後、72時間後の刺激の度合いを判定した。その結果、化学式II−4の化合物は皮膚に非常に安全であった。
【0109】
〔試験例7:眼粘膜刺激性試験〕
局所的に現われる眼粘膜刺激性の有無およびその度合いを評価するために、ウサギ(New Zealand White Rabbit;NZW)の眼粘膜に化合物II−4を適用した。
【0110】
試験化合物II−4を0.01M PBSに1%となるように調製して適用部位に0.1mLずつ適用した。すなわち、9匹のウサギの片目(右眼)に「医薬品などの毒性試験基準(韓国食品医薬品安全庁告示第1999−61号、1999.12.22)」によって試験化合物を0.1mL/headずつ適用した後、約1秒間目を瞑った状態に維持させて試験化合物の損失を防止し、これを利用して角膜、虹彩および結膜の損傷の度合いを観察した。1日目から7日目まで試験物質による結膜発赤および結膜浮腫は観察されなかった。眼粘膜刺激性試験結果、急性眼刺激指数(Acute Ocular Irritation;I.A.O.I)は洗浄群および非洗浄群の両者ともにおいて「0」であって、化合物II−4は「無刺激物」と判明された。
【0111】
〔試験例8:皮膚感作性試験〕
化合物II−4の皮膚感作性をHartley系雄モルモット((株)セムタコバイオコリア)を用いてGPMT(Guinea Pig Maximization Test)法によって検討した。この試験は、化粧品およびその他ヒトとの接触可能性のある物質の場合に対して皮膚接触刺激を起こるアレルギー誘発可能性の検討が必要であるため使用される。
【0112】
試験化合物投与群は、頚背部感作部位に1%試験化合物調製液を0.1mL/部位で皮内投与して1次感作し、1%試験化合物調製液1mL/動物および0.2mL/動物を含むパッチを貼って48時間閉塞貼布して2次感作をした。2次感作2週後、左側腹部誘起部位に1%試験化合物調製液を24時間閉塞貼布して誘起した。その結果が表4(チャレンジ反応に対する感作等級)に示されている。
【0113】
【表4】

【0114】
表4に示すように、いずれの10匹の試験物質投与群の誘起部位においても皮膚反応は確認されていない。また、皮膚感作率はそれぞれ0%であって、皮膚感作性評価基準等級は「1」(非常に弱い、Very weak)と評価された。この結果より、モルモットを用いた皮膚感作性試験において化合物II−4は皮膚感作性を誘発しない物質と判断された。
【0115】
〔試験例9:光毒性試験〕
Hartely系モルモット雄20匹を各群当たり5匹ずつ賦形剤対照群(0.01M PBS)、試験化合物II−4投与群、陽性対照群1(Chlorpromazine、CP:クロロプロマジン)および陽性対照群2(8-methoxypsoralen、8−MOP:8−メトキシプソラレン)の4群を設定してモルモットの皮膚に適用した後、UVAを照射するときに現われる光毒性誘発可能性を検査した。これは化学物質によって非免疫学的に起こる皮膚の紫外線および可視光線などの光刺激に対する異常反応であって、アレルギーとは異なり十分な光量と薬物で反応強度の予測が可能である。
【0116】
化合物II−4は、賦形剤の0.01MPBSを用いて0.1%、0.5%および1%に調製して使用した。CPおよび8−MOPをDMSOに最終10%となるように均一に調製して1%の濃度でさらに希釈して陽性対照物質を作った。動物を固定器に固定した後、50μLずつ均等に塗布し、その後動物の右側部位を光遮断対照部位とし、左側部位を光照射部位としてUVA(320〜380nm)で約10cmの距離から約2時間最終エネルギーが15J/cm2となるように照射した後、24、48および72時間の後に陽性対照群と皮膚反応を比較して光毒性の有無を評価した結果、表5に示すように「光毒性が殆どない」と評価された。
【0117】
【表5】

【0118】
〔試験例10:単回投与毒性試験〕
化合物II−4に対する単回経口投与時の安全性を検討するために、雌、雄マウス((株)セムタコバイオコリア)を用いて化合物II−4を単回経口投与するときに現われる毒性を評価するために、試験化合物II−4投与群は単一用量として0および2,000mg/10mL/kg、対照群は0.1M PBS(リン酸塩緩衝溶液)10mL/kgを雌、雄それぞれ5匹ずつ単回経口投与し、投与後14日間、投与に起因した死亡例、一般症状、体重変化は観察されておらず、単回経口投与時の概略の致死量は雌、雄それぞれ2,000mg/kg以上と判断された。
【0119】
〔試験例11:光感作性試験〕
化合物II−4の光感作性試験をHartley系雄モルモットを用いてAdjuvant & Strip法によって行った。
【0120】
モルモットの頚背部皮膚に感作部位を定め、4区画に、注射用水とFCAを混合して乳化した乳化液をそれぞれ皮内投与した。感作部位の皮膚は、少し紅斑が生ずる程度にストリッピング(stripping)を行い、賦形剤対照群には0.01M PBS(リン酸塩緩衝溶液)、試験物質投与群には化合物II−4、陽性対照群にはCP(chlorpromazine:クロロプロマジン)をそれぞれ開放塗布した。塗布2時間後に約10J/cm2で長波長紫外線を照射した。紫外線照射24、48および72時間後、誘起部位を観察し、光感作性の有無を判定した。
【0121】
賦形剤対照群および試験物質投与群のUVA非照射部位と照射部位の皮膚刺激指数(irritation index)はそれぞれ「0」と評価され、光感作性指数(Photosensitivity index)はそれぞれ「0」であって「刺激が殆どない(Practically non-irritating)」と評価された。陽性対照群のUVA非照射部位における皮膚刺激指数は「0」であり、UVA照射部位皮膚刺激指数は「5.8」であって「激しい刺激がある(Extremely irritating)」と評価された。したがって、本試験に使用されたモルモットは、既に知られている光感作性物質CP(Chlorpromazine)で正常的な反応を示すことが確認された。観察期間中、試験物質による特異な一般症状および死亡動物は観察されておらず、全ての群において有意性のある体重変化も確認されていない。その結果を表6(Group summary)に示した。
【0122】
【表6】

【0123】
表6に示すように、以上の試験結果より、モルモットを用いた光感作性試験において化合物II−4は光感作性を誘発しない物質と判断される。
【0124】
〔試験例12:コラーゲン生合成能〕
ヒトの正常線維芽細胞に本発明の有効活性成分を添加して細胞水準でコラーゲン合成促進効果を試験した。
【0125】
生合成されたコラーゲンの測定は、文献(Martens, Gut, 1992, 33, 1664-1670)の方法を応用してコラーゲン生合成促進効果を測定し、試料を添加していないものを100%とした。詳細な試験方法は次のとおりである。
【0126】
ヒトの正常線維芽細胞を細胞培養用6ウェルプレートに分注し、一定数の細胞をシーディングし、0.05%含有FBS(Fetal Bovine Serum)条件下で48時間培養した後、PBSで2回洗浄した。培養終了の後、前記の細胞および培養液をそれぞれ1/2ずつ分けて一方の分画にのみコラゲナーゼを処理した後、TCA(trichloroacetic acid)で蛋白質を沈澱させて2分画の放射活性の差異からコラーゲン生合成促進効果を測定し、試料を添加していないものを100%とした。
【0127】
図3に示すように、化合物II−4は、ビタミンCと類似のコラーゲン生合成能を示し、このような結果は、試験例1の着色試験から分かる安定性の改善効果と共に優れたコラーゲン生合成能を持つことを立証する。
【0128】
〔試験例13:抗酸化効果〕
実施例4で合成された化合物II−1、II−2およびII−4を選別してフリーラジカル除去能を行った。使用されたDPPH(1,1-diphenyl-2-picrylhydrazyl)は、酸化/還元環境に応じて変色するラジカルを用いて試料のラジカル除去能力をO.D.値の測定によって確認することができる。
【0129】
前記選別された化合物を蒸留水または溶媒に溶かした後、液相状態の100μL試料に200μM DPPH100μLを混ぜた。よく混ぜた後、常温で10分間放置した後、517nmにおける吸光度を測定する。この際、使用された対照群は、化合物を除いた蒸留水または溶媒を入れたものである。
【0130】
図4に示すように、選別された化合物II−4の場合、ビタミンCと同様に、100μMで70%以上フリーラジカル消去能を示し、化合物II−1および化合物II−2の場合も、100μMで70%台のフリーラジカル消去能を示した。その結果、選別された化合物II−4は、優れた抗酸化効果を持つ物質であるビタミンCと類似の抗酸化効果を持つ。
【0131】
〔産業上の利用可能性〕
以上述べたように、本発明のビタミンC誘導体は、皮膚刺激などの副作用なしに、安定性、安全性および皮膚浸透力が向上した。よって、本発明のビタミンC誘導体は、皮膚状態を改善しあるいは皮膚状態の悪化を抑制するために使用できる。
【0132】
以上、本発明の好適な実施例について説明したが、当業者であれば、特許請求の範囲に記載された本発明の範囲および精神から逸脱することなく、各種の変形、追加および置換が可能であることを理解するであろう。
【図面の簡単な説明】
【0133】
【図1】本発明の化合物、ビタミンCおよびアルブチンを用いてメラニン細胞B16によるメラニン生産量を検定したグラフである。
【図2】本発明の化合物およびビタミンCを用いてエラスターゼ活性を検定したグラフである。
【図3】本発明の化合物およびビタミンCを用いてコラーゲン生合成能を検定したグラフである。
【図4】本発明の化合物およびビタミンCを用いてラジカル除去能を検定したグラフである。
【特許請求の範囲】
【請求項1】
下記化学式1で表わされるビタミンC誘導体またはその薬学的に許容される塩。
【化1】

(式中、R1およびR2はそれぞれ同じでも異なってもよく、−OHまたは
【化2】

であり、R1とR2が同時に−OHではなく、
Xは−OC(O)(CH2)mC(O)−であり、
【化3】

はグリシン、リシン、ヒスチジン、セリン、プロリン、ヒドロキプロリンおよびトレオニンの中から選択される同一または異なるアミノ酸残基がアミド結合したペプチドであり、
Rはグリシン、リシン、ヒスチジン、セリン、プロリン、ヒドロキプロリンおよびトレオニンの中から選択されるアミノ酸残基の側鎖であり、
nは3〜10の整数であり、
mは2〜5の整数である。)
【請求項2】
nが3〜5の整数であり、mが2の整数であることを特徴とする、請求項1に記載のビタミンC誘導体またはその薬学的に許容される塩。
【請求項3】
【化4】

がグリシル−ヒスチジル−リジン、グリシル−リシル−ヒスチジン、グリシル−プロリル−ヒドロキシプロリンおよびリシル−トレオニル−トレオニル−リシル−セリンの中から選択されることを特徴とする、請求項2に記載のビタミンC誘導体またはその薬学的に許容される塩。
【請求項4】
6−(スクシニル−リシル−トレオニル−トレオニル−リシル−セリン)アスコルビン酸、6−(スクニシル−グリシル−リシル−ヒスチジン)アスコルビン酸および6−(スクシニル−グリシル−ヒスチジン−リシル)アスコルビン酸の中から選択されることを特徴とする、請求項3に記載のビタミンC誘導体またはその薬学的に許容される塩。
【請求項5】
下記化学式2で表わされるビタミンC誘導体またはその薬学的に許容される塩。
【化5】

(式中、Xは−(CH2)p−O−であり、
【化6】

はグリシン、リシン、ヒスチジン、セリン、プロリン、ヒドロキプロリンおよびトレオニンの中から選択される同一または異なるアミノ酸残基がアミド結合したペプチドであり、
Rはグリシン、リシン、ヒスチジン、セリン、プロリン、ヒドロキプロリンおよびトレオニンアミノの中から選択されるアミノ酸残基の側鎖であり、
nは3〜10の整数であり、
pは2〜5の整数である。)
【請求項6】
nが3〜5の整数であり、pが3の整数であることを特徴とする、請求項5に記載のビタミンC誘導体またはその薬学的に許容される塩。
【請求項7】
【化7】

がグリシル−ヒスチジル−リジン、グリシル−リシル−ヒスチジン、グリシル−プロリル−ヒドロキシプロリンおよびリシル−トレオニル−トレオニル−リシル−セリンよりなる群から選択されることを特徴とする、請求項6に記載のビタミンC誘導体またはその薬学的に許容される塩。
【請求項8】
化学式3の5,6−イソプロピリジエン−アスコルビン酸を40〜60℃で3〜5時間化学式4のハロゲン化ベンジルと反応させて2番および3番炭素位置のヒドロキシル基にベンジル基を導入させる段階と、
化学式5のベンジル基が導入された5,6−イソプロピリジエン−アスコルビン酸を開環させた後、化学式6のジカルボン酸と反応させる段階と、
生成された化学式7の化合物を化学式8のペプチドとアミド結合させる段階と、
保護基を除去する段階とを含むことを特徴とする、請求項1による化学式1のビタミンC誘導体またはその薬学的に許容される塩を製造する方法。
【化8】

【化9】

【化10】

【化11】

[化学式6]
HOOC(CH2)mCOOH
【化12】

【化13】

(式中、Bnはベンジルであり、
R1’とR2’はそれぞれ同じでも異なってもよく、−OHまたは−OC(O)(CH2)mC(O)OHであり、R1’とR2’が同時に−OHではなく、
R1およびR2はそれぞれ同じでも異なってもよく、−OHまたは
【化14】

であり、R1とR2が同時に−OHではなく、
Xは−OC(O)(CH2)mC(O)−であり、
【化15】

はグリシン、リジン、ヒスチジン、セリン、プロリン、ヒドロキシプロリンおよびトレオニンの中から選択される同一または異なるアミノ酸残基がアミド結合したペプチドであり、
Rはグリシン、リジン、ヒスチジン、セリン、プロリン、ヒドロキシプロリンおよびトレオニンの中から選択されるアミノ酸残基の側鎖であり、
nは3〜10の整数である。
mは2〜5の整数であり、
Yは塩素、臭素、フッ素またはヨウ素である。)
【請求項9】
nが3〜5の整数であり、mが2の整数であり、Yが塩素であることを特徴とする、請求項8に記載の方法。
【請求項10】
化学式3の5,6−イソプロピリジエン−アスコルビン酸を40〜60℃で14〜18時間化学式4のハロゲン化ベンジルと反応させて3番炭素位置のヒドロキシル基にベンジル基を導入させる段階と、
化学式9の化合物の2番炭素位置のヒドロキシル基を化学式10のハライドアルコールと反応させる段階と、
アルコール基が導入された5,6−イソプロピリジエン−アスコルビン酸をアミノ酸残基のC末端とエステル結合させる段階と、
ペプチド延長反応させる段階と、
保護基を除去する段階とを含むことを特徴とする、請求項5による化学式2のビタミンC誘導体およびその薬学的に許容される塩を製造する方法。
【化16】

【化17】

【化18】

【化19】

[化学式10]
Y(CH2)pOH
(式中、Bnはベンジルであり、
Xは−(CH2)p−O−であり、
【化20】

はグリシン、リジン、ヒスチジン、セリン、プロリン、ヒドロキシプロリンおよびトレオニンの中から選択される同一または異なるアミノ酸残基がアミド結合したペプチドであり、
Rはグリシン、リジン、ヒスチジン、セリン、プロリン、ヒドロキシプロリンおよびトレオニンの中から選択されるアミノ酸残基の側鎖であり、
nは3〜10の整数である。
pは2〜5の整数であり、
Yは塩素、臭素、フッ素またはヨウ素である。)
【請求項11】
nが3〜5の整数であり、pが3の整数であり、Yが塩素であることを特徴とする、請求項10に記載の方法。
【請求項12】
請求項1または5に記載のビタミンC誘導体またはその薬学的に許容される塩を含む、皮膚外用組成物。
【請求項13】
前記組成物は化粧料用組成物であることを特徴とする、請求項12に記載の組成物。
【請求項1】
下記化学式1で表わされるビタミンC誘導体またはその薬学的に許容される塩。
【化1】

(式中、R1およびR2はそれぞれ同じでも異なってもよく、−OHまたは
【化2】

であり、R1とR2が同時に−OHではなく、
Xは−OC(O)(CH2)mC(O)−であり、
【化3】

はグリシン、リシン、ヒスチジン、セリン、プロリン、ヒドロキプロリンおよびトレオニンの中から選択される同一または異なるアミノ酸残基がアミド結合したペプチドであり、
Rはグリシン、リシン、ヒスチジン、セリン、プロリン、ヒドロキプロリンおよびトレオニンの中から選択されるアミノ酸残基の側鎖であり、
nは3〜10の整数であり、
mは2〜5の整数である。)
【請求項2】
nが3〜5の整数であり、mが2の整数であることを特徴とする、請求項1に記載のビタミンC誘導体またはその薬学的に許容される塩。
【請求項3】
【化4】

がグリシル−ヒスチジル−リジン、グリシル−リシル−ヒスチジン、グリシル−プロリル−ヒドロキシプロリンおよびリシル−トレオニル−トレオニル−リシル−セリンの中から選択されることを特徴とする、請求項2に記載のビタミンC誘導体またはその薬学的に許容される塩。
【請求項4】
6−(スクシニル−リシル−トレオニル−トレオニル−リシル−セリン)アスコルビン酸、6−(スクニシル−グリシル−リシル−ヒスチジン)アスコルビン酸および6−(スクシニル−グリシル−ヒスチジン−リシル)アスコルビン酸の中から選択されることを特徴とする、請求項3に記載のビタミンC誘導体またはその薬学的に許容される塩。
【請求項5】
下記化学式2で表わされるビタミンC誘導体またはその薬学的に許容される塩。
【化5】

(式中、Xは−(CH2)p−O−であり、
【化6】

はグリシン、リシン、ヒスチジン、セリン、プロリン、ヒドロキプロリンおよびトレオニンの中から選択される同一または異なるアミノ酸残基がアミド結合したペプチドであり、
Rはグリシン、リシン、ヒスチジン、セリン、プロリン、ヒドロキプロリンおよびトレオニンアミノの中から選択されるアミノ酸残基の側鎖であり、
nは3〜10の整数であり、
pは2〜5の整数である。)
【請求項6】
nが3〜5の整数であり、pが3の整数であることを特徴とする、請求項5に記載のビタミンC誘導体またはその薬学的に許容される塩。
【請求項7】
【化7】

がグリシル−ヒスチジル−リジン、グリシル−リシル−ヒスチジン、グリシル−プロリル−ヒドロキシプロリンおよびリシル−トレオニル−トレオニル−リシル−セリンよりなる群から選択されることを特徴とする、請求項6に記載のビタミンC誘導体またはその薬学的に許容される塩。
【請求項8】
化学式3の5,6−イソプロピリジエン−アスコルビン酸を40〜60℃で3〜5時間化学式4のハロゲン化ベンジルと反応させて2番および3番炭素位置のヒドロキシル基にベンジル基を導入させる段階と、
化学式5のベンジル基が導入された5,6−イソプロピリジエン−アスコルビン酸を開環させた後、化学式6のジカルボン酸と反応させる段階と、
生成された化学式7の化合物を化学式8のペプチドとアミド結合させる段階と、
保護基を除去する段階とを含むことを特徴とする、請求項1による化学式1のビタミンC誘導体またはその薬学的に許容される塩を製造する方法。
【化8】

【化9】

【化10】

【化11】

[化学式6]
HOOC(CH2)mCOOH
【化12】

【化13】

(式中、Bnはベンジルであり、
R1’とR2’はそれぞれ同じでも異なってもよく、−OHまたは−OC(O)(CH2)mC(O)OHであり、R1’とR2’が同時に−OHではなく、
R1およびR2はそれぞれ同じでも異なってもよく、−OHまたは
【化14】

であり、R1とR2が同時に−OHではなく、
Xは−OC(O)(CH2)mC(O)−であり、
【化15】

はグリシン、リジン、ヒスチジン、セリン、プロリン、ヒドロキシプロリンおよびトレオニンの中から選択される同一または異なるアミノ酸残基がアミド結合したペプチドであり、
Rはグリシン、リジン、ヒスチジン、セリン、プロリン、ヒドロキシプロリンおよびトレオニンの中から選択されるアミノ酸残基の側鎖であり、
nは3〜10の整数である。
mは2〜5の整数であり、
Yは塩素、臭素、フッ素またはヨウ素である。)
【請求項9】
nが3〜5の整数であり、mが2の整数であり、Yが塩素であることを特徴とする、請求項8に記載の方法。
【請求項10】
化学式3の5,6−イソプロピリジエン−アスコルビン酸を40〜60℃で14〜18時間化学式4のハロゲン化ベンジルと反応させて3番炭素位置のヒドロキシル基にベンジル基を導入させる段階と、
化学式9の化合物の2番炭素位置のヒドロキシル基を化学式10のハライドアルコールと反応させる段階と、
アルコール基が導入された5,6−イソプロピリジエン−アスコルビン酸をアミノ酸残基のC末端とエステル結合させる段階と、
ペプチド延長反応させる段階と、
保護基を除去する段階とを含むことを特徴とする、請求項5による化学式2のビタミンC誘導体およびその薬学的に許容される塩を製造する方法。
【化16】

【化17】

【化18】

【化19】

[化学式10]
Y(CH2)pOH
(式中、Bnはベンジルであり、
Xは−(CH2)p−O−であり、
【化20】

はグリシン、リジン、ヒスチジン、セリン、プロリン、ヒドロキシプロリンおよびトレオニンの中から選択される同一または異なるアミノ酸残基がアミド結合したペプチドであり、
Rはグリシン、リジン、ヒスチジン、セリン、プロリン、ヒドロキシプロリンおよびトレオニンの中から選択されるアミノ酸残基の側鎖であり、
nは3〜10の整数である。
pは2〜5の整数であり、
Yは塩素、臭素、フッ素またはヨウ素である。)
【請求項11】
nが3〜5の整数であり、pが3の整数であり、Yが塩素であることを特徴とする、請求項10に記載の方法。
【請求項12】
請求項1または5に記載のビタミンC誘導体またはその薬学的に許容される塩を含む、皮膚外用組成物。
【請求項13】
前記組成物は化粧料用組成物であることを特徴とする、請求項12に記載の組成物。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公表番号】特表2007−528356(P2007−528356A)
【公表日】平成19年10月11日(2007.10.11)
【国際特許分類】
【出願番号】特願2006−507799(P2006−507799)
【出願日】平成16年4月7日(2004.4.7)
【国際出願番号】PCT/KR2004/000804
【国際公開番号】WO2004/096837
【国際公開日】平成16年11月11日(2004.11.11)
【出願人】(505404220)ペプトロン カンパニー リミテッド (6)
【Fターム(参考)】
【公表日】平成19年10月11日(2007.10.11)
【国際特許分類】
【出願日】平成16年4月7日(2004.4.7)
【国際出願番号】PCT/KR2004/000804
【国際公開番号】WO2004/096837
【国際公開日】平成16年11月11日(2004.11.11)
【出願人】(505404220)ペプトロン カンパニー リミテッド (6)
【Fターム(参考)】
[ Back to top ]

