ペプチドの遊離方法および回収方法
【課題】本発明は、ペプチドとアルブミンとの複合体からペプチドを遊離させることができる新規な方法およびその方法を利用してペプチドを回収する方法を提供することを課題とする。
【解決手段】ペプチドとアルブミンとの複合体を含む液体試料を加熱処理してアルブミンの自己会合体を形成させることにより、該ペプチドをアルブミンから遊離させる方法によって上記の課題を解決する。
【解決手段】ペプチドとアルブミンとの複合体を含む液体試料を加熱処理してアルブミンの自己会合体を形成させることにより、該ペプチドをアルブミンから遊離させる方法によって上記の課題を解決する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ペプチドとアルブミンとの複合体から該ペプチドを遊離させる方法に関する。また、本発明はその遊離方法を利用したペプチドの回収方法にも関する。
【背景技術】
【0002】
血液中には様々なペプチドが含まれているが、その中には、特定の病態にある生体において健常時とは異なる血中濃度を示すペプチドも存在する。そのようなペプチドは、臨床検査の分野において疾患のマーカーとして有用視されている。例えば、重症の心不全やカヘキシーの強い症例の胃癌の患者においてはグレリンの血漿中濃度が低下することが知られている。また、脳性ナトリウム利尿ペプチド(BNP)の血中濃度は心不全の臨床的指標として重要であり、BNPは検査マーカーとして用いられている。
【0003】
一方、血液中にはアルブミンと呼ばれるタンパク質が多量に存在している。このアルブミンは血中のペプチドの検出の障害となることが知られている。従来は、血液試料からアルブミンを除去するために、アルブミンと特異的に結合するカラムに該血液試料を通し、アルブミンをカラムに吸着させて、血液中に遊離しているペプチドを得るという手法が採られていた(非特許文献1および2)。
【0004】
しかしながら、血液中のペプチドのほとんどはアルブミンと結合して複合体となっていることが、現在知られている。例えば、Lowenthalらは、血清中では98%ものペプチドがアルブミンと結合することを報じている(非特許文献1)。すなわち、上記のアルブミンを吸着除去してペプチドを取得する方法では、アルブミンと共にペプチドも捨ててしまうため、極めて微量のペプチドしか取得することができなかった。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Lowenthal MSら,“Anaysis of albumin-associated peptides and proteins from ovarian cancer patients”,Clin. Chem.,vol. 51,1933-1945 (2005)
【非特許文献2】Zhou Mら,“An investigation into the human serum interactome”,Electrophoresis.,vol. 25,1289-1298 (2004)
【発明の概要】
【発明が解決しようとする課題】
【0006】
このような事情に鑑みて、本発明は、ペプチドとアルブミンとの複合体からペプチドを遊離させることができる新規な方法を提供することを目的とする。また、本発明は、その方法を利用してペプチドを回収する方法を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは、驚くべきことに、ペプチドとアルブミンとの複合体を含む液体試料を加熱処理すると、アルブミンが自己会合体を形成して沈殿し、これに伴ってペプチドがアルブミンから遊離されることを見出して、本発明を完成した。
【0008】
すなわち、本発明は、ペプチドとアルブミンとの複合体を含む液体試料を加熱処理してアルブミンの自己会合体を形成させることにより、該ペプチドを遊離させることを特徴とするペプチドの遊離方法を提供する。
【0009】
また、本発明は、ペプチドとアルブミンとの複合体を含む液体試料を加熱処理してアルブミンの自己会合体を形成させることにより、前記ペプチドを遊離させる工程と、加熱処理後の液体試料から前記自己会合体を除去して、遊離したペプチドを回収する工程とを含むペプチドの回収方法を提供する。
【発明の効果】
【0010】
本発明によれば、ペプチドとアルブミンとの複合体からペプチドを遊離させることができる。また、本発明によれば、該複合体から遊離させたペプチドを効率よく回収することができる。
【図面の簡単な説明】
【0011】
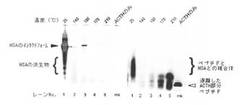
【図1】ACTH部分ペプチドとヒト血清アルブミンとの複合体を含む液体試料を加熱処理し、得られた試料の上清を電気泳動したときの写真である。
【図2】ACTH部分ペプチドとウシ血清アルブミン(BSA)との複合体を含む液体試料を、種々の温度で5分間加熱処理し、得られた試料の上清を電気泳動したときの写真である。
【図3】ACTH部分ペプチドとBSAとの複合体を含む液体試料を、種々の温度で60分間加熱処理し、得られた試料の上清を電気泳動したときの写真である。
【図4】ACTH部分ペプチドとBSAとの複合体を含む液体試料を、種々の温度で1110分間加熱処理し、得られた試料の上清を電気泳動したときの写真である。
【図5】SA21(酸性ペプチド)とBSAとの複合体を含む液体試料を加熱処理し、得られた試料の上清を電気泳動したときの写真である。
【図6】ACTH部分ペプチドとBSAとの複合体を含む液体試料を加熱処理し、生じたBSAの自己会合体に物理的処理を行って上清をさらに取得し、得られた上清を電気泳動したときの写真である。
【発明を実施するための形態】
【0012】
本発明のペプチドの遊離方法(以下、単に「遊離方法」ともいう)は、ペプチドとアルブミンとの複合体を含む液体試料を加熱処理して該タンパク質の自己会合体を形成させることにより、該ペプチドを遊離させることを特徴とする。
【0013】
本発明のペプチドの遊離方法および回収方法は、液体試料中に含まれるペプチドを検出する際における、試料の前処理に用いることができる。本発明の方法を用いて液体試料の前処理を行うことにより、ペプチド検出の障害となるアルブミンとペプチドとの複合体から、ペプチドのみを取得することができ、ペプチドを検出するための測定試料を調製することができる。
【0014】
本明細書において、「アルブミン」とは、生物学の分野において一般に知られている用語と同じ意味を有し、動物および植物の細胞や体液中に含まれる、一群の可溶性タンパク質の総称である。
【0015】
本発明の実施形態において、アルブミンは、未変性のアルブミンであれば特に限定されない。そのようなアルブミンとしては、例えば動物起源のアルブミンとして、血清に含まれる血清アルブミン、卵白に含まれるオボアルブミン、乳汁に含まれるラクトアルブミンなど、また植物起源のアルブミンとして、コムギやオオムギなどに含まれるロイコシン、エンドウやダイズなどの種子に含まれるレグメリン、ヒマ種子に含まれるリシンなどが挙げられる。
【0016】
本発明の実施形態において、液体試料は、ペプチドとアルブミンとの複合体を含む限り、特に限定されない。なお、未変性のアルブミンは元来、ペプチドと結合して複合体を形成する傾向にあることが当該技術において知られている(非特許文献1)。したがって、液体試料中にいずれかのペプチドと未変性のアルブミンとが存在する場合、該液体試料は本発明の対象となり得る。
【0017】
本発明の好ましい実施形態において、液体試料は生体試料である。生体試料としては、例えば、生体から採取した血液および体液などが挙げられる。また、血液から取得した血漿および血清も生体試料に含まれる。
本発明の実施形態において、液体試料の量は特に限定されないが、微量の場合は後述する加熱処理により液体試料中の水分が完全に失われないように留意すべきである。
【0018】
本発明の実施形態において、ペプチドは特に限定されず、天然起源のペプチドであってもよいし、合成ペプチドであってもよい。ペプチドの長さとしては、好ましくは10〜100アミノ酸、より好ましくは10〜60アミノ酸、さらに好ましくは10〜40アミノ酸である。
また、本発明の実施形態において、ペプチドの等電点は特に限定されず、ペプチドは塩基性ペプチド、酸性ペプチドおよび中性ペプチドのいずれであってもよい。
【0019】
本発明の実施形態において、液体試料が生体試料である場合、ペプチドは生体試料中に存在するペプチドである。そのようなペプチドとしては、例えば血液、血漿、血清および体液に含まれる生体由来のペプチドが挙げられる。本発明の実施形態において、ペプチドは、血液中に存在するバイオマーカーが好ましい。
そのようなバイオマーカーであるペプチドとしては、例えばグレリン、脳性ナトリウム利尿ペプチド(BNP)、副腎皮質刺激ホルモン(ACTH)、心房性ナトリウム利尿ペプチド(ANP)、ブラジキニン、α−エンドルフィン、Cペプチド、C3fフラグメント、ITIH4フラグメント、Aβペプチドなどが挙げられるが、これらに限定されない。すなわち、本発明において、遊離されるペプチドには、これまでに同定されていない新規なアミノ酸配列を有するペプチドも含み得る。
【0020】
本発明の実施形態において、液体試料の加熱処理における温度と時間は、液体試料中のペプチドが熱によって完全には分解されない範囲であればよい。ここで「ペプチドが完全に分解される」とは、ペプチドが検出不可能なほどに断片化されたり、完全に失われたりすることを意図する。すなわち、本発明の遊離方法においては、アルブミンから遊離したペプチドのほとんどは熱分解されることなく無傷の状態で存在する。また、本発明の実施形態においては、加熱処理後の液体試料中の一部のペプチドが、熱の影響により1〜数アミノ酸残基がその末端から欠けている場合がある。しかし、本発明の遊離方法においては、上記の加熱処理が適切に行われる限り、液体試料中のペプチドは熱分解によって検出不可能なほどに断片化されたり、完全に失われたりすることはない。
【0021】
本発明の実施形態において、加熱処理は、より具体的には140〜260℃の温度で5分〜19時間加熱する処理である。本発明の好ましい実施形態においては、加熱温度が140℃以上155℃未満である場合、加熱時間は少なくとも90分以上、特に120分以上である。また、加熱温度が155℃以上170℃未満である場合、加熱時間は少なくとも20分以上であることが好ましく、加熱温度が170℃以上である場合、加熱時間は少なくとも5分以上であることが好ましい。
【0022】
本発明の実施形態において、液体試料を入れて加熱処理するための容器は、加熱処理に耐える材質の容器であれば特に限定されず、例えば耐熱ガラスや耐熱性樹脂などの材質の容器が挙げられる。また、液体試料が少量の場合は、ペプチドの吸着性が低い材質の容器を用いることが好ましい。なお、これらの容器は一般に入手可能である。
【0023】
本発明の実施形態において、加熱処理の方法は、液体試料を上記の温度で加熱できる方法であれば特に限定されず、当該技術において公知の方法から選択される。そのような方法としては、例えば外部からの熱伝導による加熱、マイクロ波による加熱などが挙げられる。
また、本発明の実施形態において、加熱処理に用いる装置は、液体試料の温度を調節しながら加熱できる装置であれば特に限定されないが、例えば水熱反応器、マイクロ波照射装置などが挙げられる。
【0024】
本発明の遊離方法においては、上記の加熱処理により液体試料中のペプチドとアルブミンの複合体から、アルブミンの自己会合体を形成させることができる。ここで、このアルブミンの自己会合体は、熱変性により高次構造が変化し、ペプチドと結合する能力をほとんど失っていると考えられる。したがって、本発明の遊離方法においては、このアルブミンの自己会合体が形成される際に、ペプチドがアルブミンから遊離される。
また、上記のアルブミンの自己会合体は、液体試料に含まれる溶媒に不溶であり、加熱処理後の液体試料中に沈殿する。すなわち、加熱処理後の液体試料は、アルブミンの自己会合体である沈殿物とペプチドを含む上清画分とに分離される。
【0025】
本発明の実施形態においては、上記の上清画分をサンプルとして用い、当該技術において公知の方法で解析することにより、ペプチドがアルブミンから遊離してフリーな状態で液体試料中に存在していることを確認できる。そのような方法としては、例えば電気泳動法、質量分析法などが挙げられる。
【0026】
本発明のペプチドの回収方法(以下、単に「回収方法」ともいう)は、次の2つの工程を含むことを特徴とする:
(1)ペプチドとアルブミンとの複合体を含む液体試料を加熱処理してアルブミンの自己会合体を形成させることにより、該ペプチドをアルブミンから遊離させる工程(以下、遊離工程という);および
(2)加熱処理後の液体試料から該自己会合体を除去して、遊離したペプチドを回収する工程(以下、回収工程という)。
【0027】
本発明の回収方法において、上記の遊離工程は、上記の本発明の遊離方法について述べたことと同様である。
【0028】
上記の回収工程においては、加熱処理後の液体試料からアルブミンの自己会合体を除去する方法は特に限定されない。例えば、薬さじなどでアルブミンの自己会合体を直接取り出してもよいし、市販のセパレータまたは濾紙などを用いて該自己会合体を除去してもよい。このように、本発明の回収方法は、加熱処理後の液体試料からアルブミンの自己会合体を除去して、遊離したペプチドを含む上清画分を取得することによりペプチドを回収することができる。
【0029】
上述したようにアルブミンの自己会合体はペプチドと結合することはない。しかしながら、アルブミンの自己会合体はスポンジのように吸水性を有するので、該自己会合体にはペプチドを含む上清画分が取り込まれている。
したがって、本発明の回収方法においては、除去したアルブミンの自己会合体からペプチドを含む上清を取得する工程をさらに含んでもよい。アルブミンの自己会合体からペプチドを含む上清を取得する方法としては、例えば該自己会合体を限外ろ過チューブに入れて遠心することにより上清を搾り取ってもよいし、該自己会合体をホモジナイザーで撹拌することにより上清を取得してもよい。なお、このアルブミンの自己会合体からペプチドを含む上清を取得する方法においては、加熱処理を行う必要はない。
【0030】
以下に、本発明を実施例により詳細に説明するが、本発明はこれらの実施例に限定されるものではない。
【実施例】
【0031】
実施例1
(1)ペプチドとアルブミンの複合体を含む液体試料の調製
ペプチドとして、ACTHの1位〜24位のアミノ酸からなるACTH部分ペプチド(株式会社ペプチド研究所)および該ペプチドを赤色蛍光色素であるテトラメチルローダミン(TMR)で標識したTMR-ACTH部分ペプチド(株式会社バイオロジカ)を用いた。なお、ACTHは塩基性ペプチドである。また、アルブミンとして、ヒト血清アルブミン(HSA、シグマアルドリッチジャパン株式会社)を用いた。上記のペプチドとHSAを超純水に溶解して、ペプチドとアルブミンの複合体を含む液体試料(ACTH部分ペプチド濃度:34μM、TMR-ACTH部分ペプチド濃度:6μM、HSA濃度:600μM)を調製した。なお、HSAと、ACTH部分ペプチドおよびTMR-ACTH部分ペプチドとの間の平衡の解離定数(Kd)を蛍光滴定法により計測したところ、Kd値は6μMであった。すなわち、前記の調製された溶液中では、98.9%のACTH部分ペプチドおよびTMR-ACTH部分ペプチドが、HSAと複合体を形成している。
【0032】
(2)液体試料の加熱処理
上記の液体試料(3mL)を10 mL容のガラス試験管に移し、次にテフロン製の試験管用耐圧密封ホルダー(マイルストーンゼネラル株式会社)にて封じてから、マイクロ波照射装置(MultiSYNTH型、マイルストーンゼネラル株式会社)を用いて140、155、170および210℃で120分間加熱処理した。本発明を実施した実験室内の温度(25℃一定調温)から、それら4つの温度に達するまでの時間、すなわち昇温速度はいずれの場合も、毎分35℃とした。加熱後の冷却は、前記のマイクロ波照射装置に接続されたエアコンプレッサー(YC-3R型、株式会社八重崎空圧)から圧縮空気を前記の耐圧密封ホルダーに対して吹き付けることで行った。冷却速度は、毎分20℃とした。対照として、上記の液体試料(3mL)を同様に封じてから、25℃で120分間保温した。
なお、前記のマイクロ波照射による加熱方法以外にも、密封式溶解るつぼ(MR-28型、オーエムラボテック株式会社)の中に前記の液体試料(3mL)を封じてから、オーブン(FC-410型、アドバンテック東洋株式会社)内部に静置し、オーブンからの熱伝導によって加熱する方法も試したが、マイクロ波照の場合とまったく同様の結果が得られた。
上記の各温度での加熱処理後の液体試料中には、いずれも沈殿物が見られた。しかし、25℃で保温した液体試料には沈殿物は認められなかった。
【0033】
(3)ペプチドおよびアルブミンの検出
加熱処理後の各液体試料の上清画分をサンプルとしてSDS-PAGEを行った。ニューページLDSサンプルバッファーおよびニューページサンプル還元試薬(共にライフテクノロジーズジャパン株式会社)を用いて上記サンプルを70℃で10分間加熱処理し、ニューページ4-12%ビス-トリスゲルおよびニューページMES SDSランニングバッファー(共にライフテクノロジーズジャパン株式会社)を用いて200V(定電圧)で30分間、電気泳動を行った。泳動槽はエクセルシュアロックミニセル(ライフテクノロジーズジャパン株式会社)、電源装置はパワーステーション1000XP(アトー株式会社)を用いた。電気泳動後のゲルについて、TMR-ACTH部分ペプチドを蛍光イメージャー(Pharos FX Molecular Imager型、バイオラッドラボラトリーズ株式会社)を用いて検出し、HSAを銀染色により検出した。銀染色には銀染色キット「イージーステインシルバー」(アトー株式会社)を用いた。染色の各工程は以下の通りである。固定;固定液 100 mL(超純水40 mL+メタノール 50 mL+酢酸 10 mL+キット瓶S-1 1 mL)で10分間振とう、洗浄;超純水100 mLで10分間振とう×3回、染色;染色液(超純水100 mL+キット瓶S-2 1 mL)で10分間振とう、洗浄;超純水100 mLで30秒間振とう、発色液100 mL(超純水200 mL+キット瓶S-3 1 mL+キット瓶S-4 1 mL)で30秒間振とう、発色;発色液 100 mLで5〜10分間振とう、停止;停止液 100 mL(超純水100 mL+酢酸 1 mL)で10分間振とう、洗浄;超純水100 mLで5分間振とう×2回。振とう機はインビトロシェーカーWave-SI(タイテック株式会社)を用いた。結果を図1に示す。なお、図1において「mk」とは、サイズマーカーとしてTMR-ACTH部分ペプチドのみを電気泳動したレーンを示す。
【0034】
図1の左パネルより、25℃で保温した液体試料については、HSAのインタクトな形態およびそれよりも低分子量の派生物のバンドが見られた。すなわち、25℃で保温した液体試料にはアルブミンが溶解して存在していることがわかる。また、図1の右パネルより、25℃で保温した液体試料については、HSAの派生物とほぼ同じ位置に蛍光シグナルが検出された。ここで、TMR-ACTH部分ペプチドについては「mk」のレーンからわかるように、このような位置にシグナルは出現しない。したがって、25℃で保温した液体試料において、TMR-ACTH部分ペプチドはHSAと複合体を形成して存在していることがわかる。
【0035】
これに対し、図1の左パネルにおいて、上記の各温度で加熱処理した液体試料については、HSAのバンドがほとんど見られなかった。また、図1の右パネルより、加熱処理した液体試料については、TMR-ACTH部分ペプチドのみを電気泳動した「mk」のレーンと同じ位置にバンドが認められた。これらの結果より、加熱処理した液体試料においては、HSAは自己会合して沈殿し、その際にACTH部分ペプチドがHSAから遊離したことが示唆される。
【0036】
実施例2
(1)液体試料の調製
アルブミンとしてウシ血清アルブミン(BSA、シグマアルドリッチジャパン株式会社)を用いたこと以外は、実施例1と同様にして、ペプチドとアルブミンの複合体を含む液体試料(ACTH部分ペプチド濃度:34μM、TMR-ACTH部分ペプチド濃度:6μM、BSA濃度:600μM)を調製した。
【0037】
(2)液体試料の加熱処理
実施例1と同様にして上記の液体試料(3mL)を加熱処理した。なお、加熱温度および時間は次のとおりである。(i)130、140、155および170℃で5分間の加熱処理、(ii)50、105、120、140および150℃で60分間の加熱処理および(iii)25、130および140℃で1110分間の加熱処理。
【0038】
(3)ペプチドおよびアルブミンの検出
加熱処理後の各液体試料について、実施例1と同様にしてアルブミンとペプチドを検出した。結果を図2〜4に示す。なお、図3において「Ag」とは銀染色を意味し、「FL」とは蛍光イメージングを意味する。また、図2および4は蛍光イメージングの結果のみ示す。
【0039】
図2の上のパネルより、加熱処理の時間が5分の場合、加熱温度が130、140および155℃のレーン(No.1〜3)ではBSAと複合体を形成しているTMR-ACTH部分ペプチドが認められた。これに対して、加熱温度が170℃のレーン(No.4)において遊離したTMR-ACTH部分ペプチドのバンドがはっきりと見られた。これらの結果より、加熱処理の時間が短い場合は、加熱処理を比較的高温で行う必要があることがわかる。
【0040】
図3より、加熱処理の時間が60分の場合、加熱温度が50、105および120℃のレーン(No.1〜6)ではBSAが銀染色されており、またBSAと複合体を形成しているTMR-ACTH部分ペプチドが認められた。これに対して、加熱温度が140および150℃のレーン(No.7〜10)ではBSAのバンドはかなり減少し、またBSAとTMR-ACTH部分ペプチドとの複合体は認められなかった。これらの結果より、アルブミンの除去には少なくとも140℃以上の加熱温度が必要であることが示唆される。
【0041】
図4より、加熱処理の時間が1110分(18.5時間)の場合、加熱温度が25℃のレーン(No.1)では依然としてBSAとTMR-ACTH部分ペプチドとの複合体は認められた。また、加熱温度が130℃のレーン(No.2)では遊離したTMR-ACTH部分ペプチドのバンドは十分に検出されなかった。これに対して、加熱温度が140℃のレーン(No.3)では遊離したTMR-ACTH部分ペプチドのバンドが明確に検出された。これらの結果より、ペプチドとアルブミンとの複合体からペプチドを遊離させるためには少なくとも140℃以上の加熱温度が必要であることが示唆される。
【0042】
実施例3
(1)液体試料の調製
ペプチドとして、18アミノ酸からなるSA21を緑色蛍光色素であるフルオレセインイソチオシアネート(FITC)で標識したFITC- SA21(株式会社バイオロジカ)を用いた。なお、SA21は酸性ペプチドである。また、アルブミンとしてBSA(シグマアルドリッチジャパン株式会社)を用いた。上記のペプチドとBSAを超純水に溶解して、ペプチドとアルブミンの複合体を含む液体試料(FITC- SA21濃度:43μM、BSA濃度:100μM)を調製した。なお、BSAと、FITC-SA21との間のKd値を蛍光滴定法により計測したところ、その値は1μM以下と、HSAとACTH部分ペプチドとの間の結合の親和性よりも6倍以上強いことが判明した。すなわち、前記の調製された溶液中では、98.3%のFITC-SA21が、HSAと複合体を形成している。
【0043】
(2)液体試料の加熱処理
実施例1と同様にして上記の液体試料(1mL)を加熱処理した。なお、加熱温度および時間は次のとおりである。(i)140℃で120分間の加熱処理、(ii)170℃で5、30および120分間の加熱処理および(iii)200℃で5分間の加熱処理。
【0044】
(3)ペプチドおよびアルブミンの検出
加熱処理後の各液体試料について、実施例1と同様にしてアルブミンとペプチドを検出した。結果を図5に示す。なお、図5において「mk」とは、サイズマーカーとしてFITC- SA21のみを電気泳動したレーンを示す。
【0045】
図5より、液体試料を加熱処理することにより、酸性ペプチドをアルブミンから遊離できることが示された。したがって、本発明のペプチドの遊離方法は、ペプチドの等電点に影響されないことがわかる。
【0046】
実施例4
(1)液体試料の調製
アルブミンとしてウシ血清アルブミン(BSA、シグマアルドリッチジャパン株式会社)を用いたこと以外は、実施例1と同様にして、ペプチドとアルブミンの複合体を含む液体試料(ACTH部分ペプチド濃度:91μM、TMR-ACTH部分ペプチド濃度:9μM、BSA濃度:100μM)を調製した。
【0047】
(2)液体試料の加熱処理
実施例1と同様にして上記の液体試料(1mL)を加熱処理した。なお、加熱温度および時間は次のとおりである。(i)170℃で30分間の加熱処理および(ii)200℃で5分間の加熱処理。
【0048】
(3)アルブミンの自己会合体からの上清画分の回収
液体試料の加熱処理によって生じたアルブミンの自己会合体に、限外ろ過チューブ(アミコンウルトラ分子量カットオフ10,000型、日本ミリポア株式会社)を用いる遠心ろ過またはマイクロホモジナイザーによる撹拌を行い、該自己会合体含まれる液体試料の上清画分を回収した。なお、遠心ろ過および撹拌はそれぞれ2回ずつ行った。
【0049】
(4)ペプチドおよびアルブミンの検出
加熱処理後の各液体試料および自己会合体から回収した上清画分について、実施例1と同様にしてアルブミンとペプチドを検出した。結果を図6に示す。なお、図6において「mk」とは、サイズマーカーとしてTMR-ACTH部分ペプチドのみを電気泳動したレーンを示す。また、レーンNo.1〜10において電気泳動したサンプルは、以下の表1に示す。
【0050】
【表1】

【0051】
図6より、本発明の遊離方法によってACTH部分ペプチドとBSAとの複合体からACTH部分ペプチドを遊離できたことがわかる。また、図6のレーンNo.2〜10より、BSAの自己会合体から回収した上清画分にACTH部分ペプチドが含まれていることがわかる。したがって、本発明においては、アルブミンの自己会合体から上清画分をさらに回収することができる。
【技術分野】
【0001】
本発明は、ペプチドとアルブミンとの複合体から該ペプチドを遊離させる方法に関する。また、本発明はその遊離方法を利用したペプチドの回収方法にも関する。
【背景技術】
【0002】
血液中には様々なペプチドが含まれているが、その中には、特定の病態にある生体において健常時とは異なる血中濃度を示すペプチドも存在する。そのようなペプチドは、臨床検査の分野において疾患のマーカーとして有用視されている。例えば、重症の心不全やカヘキシーの強い症例の胃癌の患者においてはグレリンの血漿中濃度が低下することが知られている。また、脳性ナトリウム利尿ペプチド(BNP)の血中濃度は心不全の臨床的指標として重要であり、BNPは検査マーカーとして用いられている。
【0003】
一方、血液中にはアルブミンと呼ばれるタンパク質が多量に存在している。このアルブミンは血中のペプチドの検出の障害となることが知られている。従来は、血液試料からアルブミンを除去するために、アルブミンと特異的に結合するカラムに該血液試料を通し、アルブミンをカラムに吸着させて、血液中に遊離しているペプチドを得るという手法が採られていた(非特許文献1および2)。
【0004】
しかしながら、血液中のペプチドのほとんどはアルブミンと結合して複合体となっていることが、現在知られている。例えば、Lowenthalらは、血清中では98%ものペプチドがアルブミンと結合することを報じている(非特許文献1)。すなわち、上記のアルブミンを吸着除去してペプチドを取得する方法では、アルブミンと共にペプチドも捨ててしまうため、極めて微量のペプチドしか取得することができなかった。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Lowenthal MSら,“Anaysis of albumin-associated peptides and proteins from ovarian cancer patients”,Clin. Chem.,vol. 51,1933-1945 (2005)
【非特許文献2】Zhou Mら,“An investigation into the human serum interactome”,Electrophoresis.,vol. 25,1289-1298 (2004)
【発明の概要】
【発明が解決しようとする課題】
【0006】
このような事情に鑑みて、本発明は、ペプチドとアルブミンとの複合体からペプチドを遊離させることができる新規な方法を提供することを目的とする。また、本発明は、その方法を利用してペプチドを回収する方法を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは、驚くべきことに、ペプチドとアルブミンとの複合体を含む液体試料を加熱処理すると、アルブミンが自己会合体を形成して沈殿し、これに伴ってペプチドがアルブミンから遊離されることを見出して、本発明を完成した。
【0008】
すなわち、本発明は、ペプチドとアルブミンとの複合体を含む液体試料を加熱処理してアルブミンの自己会合体を形成させることにより、該ペプチドを遊離させることを特徴とするペプチドの遊離方法を提供する。
【0009】
また、本発明は、ペプチドとアルブミンとの複合体を含む液体試料を加熱処理してアルブミンの自己会合体を形成させることにより、前記ペプチドを遊離させる工程と、加熱処理後の液体試料から前記自己会合体を除去して、遊離したペプチドを回収する工程とを含むペプチドの回収方法を提供する。
【発明の効果】
【0010】
本発明によれば、ペプチドとアルブミンとの複合体からペプチドを遊離させることができる。また、本発明によれば、該複合体から遊離させたペプチドを効率よく回収することができる。
【図面の簡単な説明】
【0011】
【図1】ACTH部分ペプチドとヒト血清アルブミンとの複合体を含む液体試料を加熱処理し、得られた試料の上清を電気泳動したときの写真である。
【図2】ACTH部分ペプチドとウシ血清アルブミン(BSA)との複合体を含む液体試料を、種々の温度で5分間加熱処理し、得られた試料の上清を電気泳動したときの写真である。
【図3】ACTH部分ペプチドとBSAとの複合体を含む液体試料を、種々の温度で60分間加熱処理し、得られた試料の上清を電気泳動したときの写真である。
【図4】ACTH部分ペプチドとBSAとの複合体を含む液体試料を、種々の温度で1110分間加熱処理し、得られた試料の上清を電気泳動したときの写真である。
【図5】SA21(酸性ペプチド)とBSAとの複合体を含む液体試料を加熱処理し、得られた試料の上清を電気泳動したときの写真である。
【図6】ACTH部分ペプチドとBSAとの複合体を含む液体試料を加熱処理し、生じたBSAの自己会合体に物理的処理を行って上清をさらに取得し、得られた上清を電気泳動したときの写真である。
【発明を実施するための形態】
【0012】
本発明のペプチドの遊離方法(以下、単に「遊離方法」ともいう)は、ペプチドとアルブミンとの複合体を含む液体試料を加熱処理して該タンパク質の自己会合体を形成させることにより、該ペプチドを遊離させることを特徴とする。
【0013】
本発明のペプチドの遊離方法および回収方法は、液体試料中に含まれるペプチドを検出する際における、試料の前処理に用いることができる。本発明の方法を用いて液体試料の前処理を行うことにより、ペプチド検出の障害となるアルブミンとペプチドとの複合体から、ペプチドのみを取得することができ、ペプチドを検出するための測定試料を調製することができる。
【0014】
本明細書において、「アルブミン」とは、生物学の分野において一般に知られている用語と同じ意味を有し、動物および植物の細胞や体液中に含まれる、一群の可溶性タンパク質の総称である。
【0015】
本発明の実施形態において、アルブミンは、未変性のアルブミンであれば特に限定されない。そのようなアルブミンとしては、例えば動物起源のアルブミンとして、血清に含まれる血清アルブミン、卵白に含まれるオボアルブミン、乳汁に含まれるラクトアルブミンなど、また植物起源のアルブミンとして、コムギやオオムギなどに含まれるロイコシン、エンドウやダイズなどの種子に含まれるレグメリン、ヒマ種子に含まれるリシンなどが挙げられる。
【0016】
本発明の実施形態において、液体試料は、ペプチドとアルブミンとの複合体を含む限り、特に限定されない。なお、未変性のアルブミンは元来、ペプチドと結合して複合体を形成する傾向にあることが当該技術において知られている(非特許文献1)。したがって、液体試料中にいずれかのペプチドと未変性のアルブミンとが存在する場合、該液体試料は本発明の対象となり得る。
【0017】
本発明の好ましい実施形態において、液体試料は生体試料である。生体試料としては、例えば、生体から採取した血液および体液などが挙げられる。また、血液から取得した血漿および血清も生体試料に含まれる。
本発明の実施形態において、液体試料の量は特に限定されないが、微量の場合は後述する加熱処理により液体試料中の水分が完全に失われないように留意すべきである。
【0018】
本発明の実施形態において、ペプチドは特に限定されず、天然起源のペプチドであってもよいし、合成ペプチドであってもよい。ペプチドの長さとしては、好ましくは10〜100アミノ酸、より好ましくは10〜60アミノ酸、さらに好ましくは10〜40アミノ酸である。
また、本発明の実施形態において、ペプチドの等電点は特に限定されず、ペプチドは塩基性ペプチド、酸性ペプチドおよび中性ペプチドのいずれであってもよい。
【0019】
本発明の実施形態において、液体試料が生体試料である場合、ペプチドは生体試料中に存在するペプチドである。そのようなペプチドとしては、例えば血液、血漿、血清および体液に含まれる生体由来のペプチドが挙げられる。本発明の実施形態において、ペプチドは、血液中に存在するバイオマーカーが好ましい。
そのようなバイオマーカーであるペプチドとしては、例えばグレリン、脳性ナトリウム利尿ペプチド(BNP)、副腎皮質刺激ホルモン(ACTH)、心房性ナトリウム利尿ペプチド(ANP)、ブラジキニン、α−エンドルフィン、Cペプチド、C3fフラグメント、ITIH4フラグメント、Aβペプチドなどが挙げられるが、これらに限定されない。すなわち、本発明において、遊離されるペプチドには、これまでに同定されていない新規なアミノ酸配列を有するペプチドも含み得る。
【0020】
本発明の実施形態において、液体試料の加熱処理における温度と時間は、液体試料中のペプチドが熱によって完全には分解されない範囲であればよい。ここで「ペプチドが完全に分解される」とは、ペプチドが検出不可能なほどに断片化されたり、完全に失われたりすることを意図する。すなわち、本発明の遊離方法においては、アルブミンから遊離したペプチドのほとんどは熱分解されることなく無傷の状態で存在する。また、本発明の実施形態においては、加熱処理後の液体試料中の一部のペプチドが、熱の影響により1〜数アミノ酸残基がその末端から欠けている場合がある。しかし、本発明の遊離方法においては、上記の加熱処理が適切に行われる限り、液体試料中のペプチドは熱分解によって検出不可能なほどに断片化されたり、完全に失われたりすることはない。
【0021】
本発明の実施形態において、加熱処理は、より具体的には140〜260℃の温度で5分〜19時間加熱する処理である。本発明の好ましい実施形態においては、加熱温度が140℃以上155℃未満である場合、加熱時間は少なくとも90分以上、特に120分以上である。また、加熱温度が155℃以上170℃未満である場合、加熱時間は少なくとも20分以上であることが好ましく、加熱温度が170℃以上である場合、加熱時間は少なくとも5分以上であることが好ましい。
【0022】
本発明の実施形態において、液体試料を入れて加熱処理するための容器は、加熱処理に耐える材質の容器であれば特に限定されず、例えば耐熱ガラスや耐熱性樹脂などの材質の容器が挙げられる。また、液体試料が少量の場合は、ペプチドの吸着性が低い材質の容器を用いることが好ましい。なお、これらの容器は一般に入手可能である。
【0023】
本発明の実施形態において、加熱処理の方法は、液体試料を上記の温度で加熱できる方法であれば特に限定されず、当該技術において公知の方法から選択される。そのような方法としては、例えば外部からの熱伝導による加熱、マイクロ波による加熱などが挙げられる。
また、本発明の実施形態において、加熱処理に用いる装置は、液体試料の温度を調節しながら加熱できる装置であれば特に限定されないが、例えば水熱反応器、マイクロ波照射装置などが挙げられる。
【0024】
本発明の遊離方法においては、上記の加熱処理により液体試料中のペプチドとアルブミンの複合体から、アルブミンの自己会合体を形成させることができる。ここで、このアルブミンの自己会合体は、熱変性により高次構造が変化し、ペプチドと結合する能力をほとんど失っていると考えられる。したがって、本発明の遊離方法においては、このアルブミンの自己会合体が形成される際に、ペプチドがアルブミンから遊離される。
また、上記のアルブミンの自己会合体は、液体試料に含まれる溶媒に不溶であり、加熱処理後の液体試料中に沈殿する。すなわち、加熱処理後の液体試料は、アルブミンの自己会合体である沈殿物とペプチドを含む上清画分とに分離される。
【0025】
本発明の実施形態においては、上記の上清画分をサンプルとして用い、当該技術において公知の方法で解析することにより、ペプチドがアルブミンから遊離してフリーな状態で液体試料中に存在していることを確認できる。そのような方法としては、例えば電気泳動法、質量分析法などが挙げられる。
【0026】
本発明のペプチドの回収方法(以下、単に「回収方法」ともいう)は、次の2つの工程を含むことを特徴とする:
(1)ペプチドとアルブミンとの複合体を含む液体試料を加熱処理してアルブミンの自己会合体を形成させることにより、該ペプチドをアルブミンから遊離させる工程(以下、遊離工程という);および
(2)加熱処理後の液体試料から該自己会合体を除去して、遊離したペプチドを回収する工程(以下、回収工程という)。
【0027】
本発明の回収方法において、上記の遊離工程は、上記の本発明の遊離方法について述べたことと同様である。
【0028】
上記の回収工程においては、加熱処理後の液体試料からアルブミンの自己会合体を除去する方法は特に限定されない。例えば、薬さじなどでアルブミンの自己会合体を直接取り出してもよいし、市販のセパレータまたは濾紙などを用いて該自己会合体を除去してもよい。このように、本発明の回収方法は、加熱処理後の液体試料からアルブミンの自己会合体を除去して、遊離したペプチドを含む上清画分を取得することによりペプチドを回収することができる。
【0029】
上述したようにアルブミンの自己会合体はペプチドと結合することはない。しかしながら、アルブミンの自己会合体はスポンジのように吸水性を有するので、該自己会合体にはペプチドを含む上清画分が取り込まれている。
したがって、本発明の回収方法においては、除去したアルブミンの自己会合体からペプチドを含む上清を取得する工程をさらに含んでもよい。アルブミンの自己会合体からペプチドを含む上清を取得する方法としては、例えば該自己会合体を限外ろ過チューブに入れて遠心することにより上清を搾り取ってもよいし、該自己会合体をホモジナイザーで撹拌することにより上清を取得してもよい。なお、このアルブミンの自己会合体からペプチドを含む上清を取得する方法においては、加熱処理を行う必要はない。
【0030】
以下に、本発明を実施例により詳細に説明するが、本発明はこれらの実施例に限定されるものではない。
【実施例】
【0031】
実施例1
(1)ペプチドとアルブミンの複合体を含む液体試料の調製
ペプチドとして、ACTHの1位〜24位のアミノ酸からなるACTH部分ペプチド(株式会社ペプチド研究所)および該ペプチドを赤色蛍光色素であるテトラメチルローダミン(TMR)で標識したTMR-ACTH部分ペプチド(株式会社バイオロジカ)を用いた。なお、ACTHは塩基性ペプチドである。また、アルブミンとして、ヒト血清アルブミン(HSA、シグマアルドリッチジャパン株式会社)を用いた。上記のペプチドとHSAを超純水に溶解して、ペプチドとアルブミンの複合体を含む液体試料(ACTH部分ペプチド濃度:34μM、TMR-ACTH部分ペプチド濃度:6μM、HSA濃度:600μM)を調製した。なお、HSAと、ACTH部分ペプチドおよびTMR-ACTH部分ペプチドとの間の平衡の解離定数(Kd)を蛍光滴定法により計測したところ、Kd値は6μMであった。すなわち、前記の調製された溶液中では、98.9%のACTH部分ペプチドおよびTMR-ACTH部分ペプチドが、HSAと複合体を形成している。
【0032】
(2)液体試料の加熱処理
上記の液体試料(3mL)を10 mL容のガラス試験管に移し、次にテフロン製の試験管用耐圧密封ホルダー(マイルストーンゼネラル株式会社)にて封じてから、マイクロ波照射装置(MultiSYNTH型、マイルストーンゼネラル株式会社)を用いて140、155、170および210℃で120分間加熱処理した。本発明を実施した実験室内の温度(25℃一定調温)から、それら4つの温度に達するまでの時間、すなわち昇温速度はいずれの場合も、毎分35℃とした。加熱後の冷却は、前記のマイクロ波照射装置に接続されたエアコンプレッサー(YC-3R型、株式会社八重崎空圧)から圧縮空気を前記の耐圧密封ホルダーに対して吹き付けることで行った。冷却速度は、毎分20℃とした。対照として、上記の液体試料(3mL)を同様に封じてから、25℃で120分間保温した。
なお、前記のマイクロ波照射による加熱方法以外にも、密封式溶解るつぼ(MR-28型、オーエムラボテック株式会社)の中に前記の液体試料(3mL)を封じてから、オーブン(FC-410型、アドバンテック東洋株式会社)内部に静置し、オーブンからの熱伝導によって加熱する方法も試したが、マイクロ波照の場合とまったく同様の結果が得られた。
上記の各温度での加熱処理後の液体試料中には、いずれも沈殿物が見られた。しかし、25℃で保温した液体試料には沈殿物は認められなかった。
【0033】
(3)ペプチドおよびアルブミンの検出
加熱処理後の各液体試料の上清画分をサンプルとしてSDS-PAGEを行った。ニューページLDSサンプルバッファーおよびニューページサンプル還元試薬(共にライフテクノロジーズジャパン株式会社)を用いて上記サンプルを70℃で10分間加熱処理し、ニューページ4-12%ビス-トリスゲルおよびニューページMES SDSランニングバッファー(共にライフテクノロジーズジャパン株式会社)を用いて200V(定電圧)で30分間、電気泳動を行った。泳動槽はエクセルシュアロックミニセル(ライフテクノロジーズジャパン株式会社)、電源装置はパワーステーション1000XP(アトー株式会社)を用いた。電気泳動後のゲルについて、TMR-ACTH部分ペプチドを蛍光イメージャー(Pharos FX Molecular Imager型、バイオラッドラボラトリーズ株式会社)を用いて検出し、HSAを銀染色により検出した。銀染色には銀染色キット「イージーステインシルバー」(アトー株式会社)を用いた。染色の各工程は以下の通りである。固定;固定液 100 mL(超純水40 mL+メタノール 50 mL+酢酸 10 mL+キット瓶S-1 1 mL)で10分間振とう、洗浄;超純水100 mLで10分間振とう×3回、染色;染色液(超純水100 mL+キット瓶S-2 1 mL)で10分間振とう、洗浄;超純水100 mLで30秒間振とう、発色液100 mL(超純水200 mL+キット瓶S-3 1 mL+キット瓶S-4 1 mL)で30秒間振とう、発色;発色液 100 mLで5〜10分間振とう、停止;停止液 100 mL(超純水100 mL+酢酸 1 mL)で10分間振とう、洗浄;超純水100 mLで5分間振とう×2回。振とう機はインビトロシェーカーWave-SI(タイテック株式会社)を用いた。結果を図1に示す。なお、図1において「mk」とは、サイズマーカーとしてTMR-ACTH部分ペプチドのみを電気泳動したレーンを示す。
【0034】
図1の左パネルより、25℃で保温した液体試料については、HSAのインタクトな形態およびそれよりも低分子量の派生物のバンドが見られた。すなわち、25℃で保温した液体試料にはアルブミンが溶解して存在していることがわかる。また、図1の右パネルより、25℃で保温した液体試料については、HSAの派生物とほぼ同じ位置に蛍光シグナルが検出された。ここで、TMR-ACTH部分ペプチドについては「mk」のレーンからわかるように、このような位置にシグナルは出現しない。したがって、25℃で保温した液体試料において、TMR-ACTH部分ペプチドはHSAと複合体を形成して存在していることがわかる。
【0035】
これに対し、図1の左パネルにおいて、上記の各温度で加熱処理した液体試料については、HSAのバンドがほとんど見られなかった。また、図1の右パネルより、加熱処理した液体試料については、TMR-ACTH部分ペプチドのみを電気泳動した「mk」のレーンと同じ位置にバンドが認められた。これらの結果より、加熱処理した液体試料においては、HSAは自己会合して沈殿し、その際にACTH部分ペプチドがHSAから遊離したことが示唆される。
【0036】
実施例2
(1)液体試料の調製
アルブミンとしてウシ血清アルブミン(BSA、シグマアルドリッチジャパン株式会社)を用いたこと以外は、実施例1と同様にして、ペプチドとアルブミンの複合体を含む液体試料(ACTH部分ペプチド濃度:34μM、TMR-ACTH部分ペプチド濃度:6μM、BSA濃度:600μM)を調製した。
【0037】
(2)液体試料の加熱処理
実施例1と同様にして上記の液体試料(3mL)を加熱処理した。なお、加熱温度および時間は次のとおりである。(i)130、140、155および170℃で5分間の加熱処理、(ii)50、105、120、140および150℃で60分間の加熱処理および(iii)25、130および140℃で1110分間の加熱処理。
【0038】
(3)ペプチドおよびアルブミンの検出
加熱処理後の各液体試料について、実施例1と同様にしてアルブミンとペプチドを検出した。結果を図2〜4に示す。なお、図3において「Ag」とは銀染色を意味し、「FL」とは蛍光イメージングを意味する。また、図2および4は蛍光イメージングの結果のみ示す。
【0039】
図2の上のパネルより、加熱処理の時間が5分の場合、加熱温度が130、140および155℃のレーン(No.1〜3)ではBSAと複合体を形成しているTMR-ACTH部分ペプチドが認められた。これに対して、加熱温度が170℃のレーン(No.4)において遊離したTMR-ACTH部分ペプチドのバンドがはっきりと見られた。これらの結果より、加熱処理の時間が短い場合は、加熱処理を比較的高温で行う必要があることがわかる。
【0040】
図3より、加熱処理の時間が60分の場合、加熱温度が50、105および120℃のレーン(No.1〜6)ではBSAが銀染色されており、またBSAと複合体を形成しているTMR-ACTH部分ペプチドが認められた。これに対して、加熱温度が140および150℃のレーン(No.7〜10)ではBSAのバンドはかなり減少し、またBSAとTMR-ACTH部分ペプチドとの複合体は認められなかった。これらの結果より、アルブミンの除去には少なくとも140℃以上の加熱温度が必要であることが示唆される。
【0041】
図4より、加熱処理の時間が1110分(18.5時間)の場合、加熱温度が25℃のレーン(No.1)では依然としてBSAとTMR-ACTH部分ペプチドとの複合体は認められた。また、加熱温度が130℃のレーン(No.2)では遊離したTMR-ACTH部分ペプチドのバンドは十分に検出されなかった。これに対して、加熱温度が140℃のレーン(No.3)では遊離したTMR-ACTH部分ペプチドのバンドが明確に検出された。これらの結果より、ペプチドとアルブミンとの複合体からペプチドを遊離させるためには少なくとも140℃以上の加熱温度が必要であることが示唆される。
【0042】
実施例3
(1)液体試料の調製
ペプチドとして、18アミノ酸からなるSA21を緑色蛍光色素であるフルオレセインイソチオシアネート(FITC)で標識したFITC- SA21(株式会社バイオロジカ)を用いた。なお、SA21は酸性ペプチドである。また、アルブミンとしてBSA(シグマアルドリッチジャパン株式会社)を用いた。上記のペプチドとBSAを超純水に溶解して、ペプチドとアルブミンの複合体を含む液体試料(FITC- SA21濃度:43μM、BSA濃度:100μM)を調製した。なお、BSAと、FITC-SA21との間のKd値を蛍光滴定法により計測したところ、その値は1μM以下と、HSAとACTH部分ペプチドとの間の結合の親和性よりも6倍以上強いことが判明した。すなわち、前記の調製された溶液中では、98.3%のFITC-SA21が、HSAと複合体を形成している。
【0043】
(2)液体試料の加熱処理
実施例1と同様にして上記の液体試料(1mL)を加熱処理した。なお、加熱温度および時間は次のとおりである。(i)140℃で120分間の加熱処理、(ii)170℃で5、30および120分間の加熱処理および(iii)200℃で5分間の加熱処理。
【0044】
(3)ペプチドおよびアルブミンの検出
加熱処理後の各液体試料について、実施例1と同様にしてアルブミンとペプチドを検出した。結果を図5に示す。なお、図5において「mk」とは、サイズマーカーとしてFITC- SA21のみを電気泳動したレーンを示す。
【0045】
図5より、液体試料を加熱処理することにより、酸性ペプチドをアルブミンから遊離できることが示された。したがって、本発明のペプチドの遊離方法は、ペプチドの等電点に影響されないことがわかる。
【0046】
実施例4
(1)液体試料の調製
アルブミンとしてウシ血清アルブミン(BSA、シグマアルドリッチジャパン株式会社)を用いたこと以外は、実施例1と同様にして、ペプチドとアルブミンの複合体を含む液体試料(ACTH部分ペプチド濃度:91μM、TMR-ACTH部分ペプチド濃度:9μM、BSA濃度:100μM)を調製した。
【0047】
(2)液体試料の加熱処理
実施例1と同様にして上記の液体試料(1mL)を加熱処理した。なお、加熱温度および時間は次のとおりである。(i)170℃で30分間の加熱処理および(ii)200℃で5分間の加熱処理。
【0048】
(3)アルブミンの自己会合体からの上清画分の回収
液体試料の加熱処理によって生じたアルブミンの自己会合体に、限外ろ過チューブ(アミコンウルトラ分子量カットオフ10,000型、日本ミリポア株式会社)を用いる遠心ろ過またはマイクロホモジナイザーによる撹拌を行い、該自己会合体含まれる液体試料の上清画分を回収した。なお、遠心ろ過および撹拌はそれぞれ2回ずつ行った。
【0049】
(4)ペプチドおよびアルブミンの検出
加熱処理後の各液体試料および自己会合体から回収した上清画分について、実施例1と同様にしてアルブミンとペプチドを検出した。結果を図6に示す。なお、図6において「mk」とは、サイズマーカーとしてTMR-ACTH部分ペプチドのみを電気泳動したレーンを示す。また、レーンNo.1〜10において電気泳動したサンプルは、以下の表1に示す。
【0050】
【表1】

【0051】
図6より、本発明の遊離方法によってACTH部分ペプチドとBSAとの複合体からACTH部分ペプチドを遊離できたことがわかる。また、図6のレーンNo.2〜10より、BSAの自己会合体から回収した上清画分にACTH部分ペプチドが含まれていることがわかる。したがって、本発明においては、アルブミンの自己会合体から上清画分をさらに回収することができる。
【特許請求の範囲】
【請求項1】
ペプチドとアルブミンとの複合体を含む液体試料を加熱処理してアルブミンの自己会合体を形成させることにより、前記ペプチドをアルブミンから遊離させることを特徴とするペプチドの遊離方法。
【請求項2】
ペプチドとアルブミンとの複合体を含む液体試料を加熱処理してアルブミンの自己会合体を形成させることにより、前記ペプチドをアルブミンから遊離させる工程と、
加熱処理後の液体試料から前記自己会合体を除去して、遊離したペプチドを回収する工程と
を含むペプチドの回収方法。
【請求項3】
前記加熱処理が、液体試料中のペプチドが熱によって完全には分解されない条件で行われる請求項1または2に記載の方法。
【請求項4】
前記加熱処理が140〜260℃の温度で5分〜19時間加熱する処理である請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記液体試料が生体試料であり、前記ペプチドが該生体試料中に存在するペプチドである請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記生体試料が血液、血漿、血清または体液である請求項5に記載の方法。
【請求項7】
前記ペプチドが血液中に存在するバイオマーカーである請求項1〜6のいずれか1項に記載の方法。
【請求項1】
ペプチドとアルブミンとの複合体を含む液体試料を加熱処理してアルブミンの自己会合体を形成させることにより、前記ペプチドをアルブミンから遊離させることを特徴とするペプチドの遊離方法。
【請求項2】
ペプチドとアルブミンとの複合体を含む液体試料を加熱処理してアルブミンの自己会合体を形成させることにより、前記ペプチドをアルブミンから遊離させる工程と、
加熱処理後の液体試料から前記自己会合体を除去して、遊離したペプチドを回収する工程と
を含むペプチドの回収方法。
【請求項3】
前記加熱処理が、液体試料中のペプチドが熱によって完全には分解されない条件で行われる請求項1または2に記載の方法。
【請求項4】
前記加熱処理が140〜260℃の温度で5分〜19時間加熱する処理である請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記液体試料が生体試料であり、前記ペプチドが該生体試料中に存在するペプチドである請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記生体試料が血液、血漿、血清または体液である請求項5に記載の方法。
【請求項7】
前記ペプチドが血液中に存在するバイオマーカーである請求項1〜6のいずれか1項に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2012−233753(P2012−233753A)
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願番号】特願2011−101588(P2011−101588)
【出願日】平成23年4月28日(2011.4.28)
【国等の委託研究の成果に係る記載事項】(出願人による申告)独立行政法人科学技術振興機構による独創的シーズ展開事業の委託開発「ペプチドマーカーを用いた早期がん検査法」、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願日】平成23年4月28日(2011.4.28)
【国等の委託研究の成果に係る記載事項】(出願人による申告)独立行政法人科学技術振興機構による独創的シーズ展開事業の委託開発「ペプチドマーカーを用いた早期がん検査法」、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
[ Back to top ]

