ペプチド付加生体分子の溶解度計算方法、及びそれを用いたペプチドタグの設計方法と封入体形成防止方法
【課題】ペプチド及びタンパク質の溶解度を、事前(合成や発現前)に、かつ従来手法より飛躍的に高い計算精度で、熱力学法則に従って物理化学的に正しい手法でアミノ酸配列から定量的に求める方法を提供する。
【解決手段】生体分子の末端に任意のアミノ酸配列からなるペプチド付加生体分子の溶解度Sを熱力学的理論に基づき計算する方法であって、上記ペプチドの会合のギブス自由エネルギーΔGAggrを下式(1)で表される上記生体分子に付加されるアミノ酸Xの残基数Nの二次関数により定義し、該ペプチドの会合のギブス自由エネルギーΔGAggrを用いて、下式(2)により上記ペプチド付加生体分子の溶解度Sを計算する。ΔGXAggr=ΔGAggr0+ΔGXAggr1N+ΔGXAggr2N2式(1)S=exp(ΔGAggr/RT)式(2)
【解決手段】生体分子の末端に任意のアミノ酸配列からなるペプチド付加生体分子の溶解度Sを熱力学的理論に基づき計算する方法であって、上記ペプチドの会合のギブス自由エネルギーΔGAggrを下式(1)で表される上記生体分子に付加されるアミノ酸Xの残基数Nの二次関数により定義し、該ペプチドの会合のギブス自由エネルギーΔGAggrを用いて、下式(2)により上記ペプチド付加生体分子の溶解度Sを計算する。ΔGXAggr=ΔGAggr0+ΔGXAggr1N+ΔGXAggr2N2式(1)S=exp(ΔGAggr/RT)式(2)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体分子の凝集の熱力学モデルに基づいて、それら生体分子の溶解度をアミノ酸配列から計算する方法に関する。
さらに、本発明は、上記の計算方法を用いて所望の溶解度とするペプチドタグを設計する方法及び封入体(細胞内に蓄積する不活性型凝集)形成を防止する方法に関する。
【背景技術】
【0002】
ポストゲノム時代においては、生命現象の仕組みや疾患の原因の解明に向けて、遺伝子情報に基づくタンパク質の構造と機能の解明研究が注目されている。生体内におけるタンパク質は熱力学的に安定なフォールド状態をもち、その天然構造をとったときに特定の機能を発現する。従って、生体内以外でも目的タンパク質を本来の立体構造(天然構造)を保持したまま合成することは、プロテオーム研究のみならず、工業的利用や医薬応用の分野においても非常に重要な課題である。
タンパク質は、熱やpH、塩濃度、還元剤の存在などの環境変化により変性し、活性が低下・失活するだけでなく、溶解度が大幅に低下する。これは、分子内の高次構造を支えている結合が切断され、フォールド状態が壊れるためであり、変性を起こしたタンパク質では、分子の内側にあった疎水性の高い部分が外側に露出し、溶媒(水)と接触するようになるために、タンパク質同士が凝集して沈澱する傾向がある。また、天然状態であっても、分子表面に疎水性残基が多い場合や等電点付近では、タンパク質同士が凝集して沈澱する傾向がある。
【0003】
かかる凝集現象は、分子の濃度がある溶解限界濃度(溶解度)以上になると起きる。タンパク質の凝集を抑制する方法として、pHや温度、塩濃度などの溶媒条件を操作することにより溶解度を向上させる手法が一般に用いられる。例えば、高濃度の解析サンプルが必要とされるNMRによるタンパク質の構造解析においては、CHAPSなどの界面活性剤を低濃度添加することにより、タンパク質の溶解度を向上させることが行なわれる。
しかし、この手法は、タンパク質の溶解度が分子の疎水性・親水性で決定されるという定説に基づくもので、研究者の勘や経験に依存するところが大きく、溶媒条件の最適化には労力と時間が必要とされる。また、制御した溶媒条件下ではタンパク質の機能的立体構造が保持されないなどの問題がある
【0004】
また、特許文献1には、タンパク質溶液中の沈殿剤濃度を上昇させたときの結晶周囲のタンパク質溶液の干渉縞の観察に基づき、溶解度曲線からタンパク質の溶解度を測定する方法が記載されている。
しかし、この方法も半経験的に溶解度を「予測」するものであり、精度が低い上、温度やpH、各種添加剤の濃度をパラメータとして膨大なスクリーニングから最適溶媒条件を求める必要があり、非効率的である。
この他、非特許文献1には、タンパク質のアミノ酸配列の凝集傾向性を理論計算から予測する方法が記載されている。しかし、計算式に用いるパラメータにはペプチドの溶解度の実測値を文献及び実験から求めており、精度が低く、工業的に利用するには汎用性が低い。
【0005】
これに対し、本発明者らは、短い親水性アミノ酸からなるタグを目的タンパク質に付与することにより、該タグが付加された目的タンパク質の溶解度を飛躍的に向上させる方法を開発した(特許文献2参照)。この方法によれば、目的タンパク質の機能発現や立体構造に影響を及ぼすことなく、溶解度の向上を図ることができる。
この方法は、広い溶媒条件下で使用することができ、汎用性に優れた画期的な手法ではあるものの、原理的には経験則を数式化したものにとどまるものである。このため、タンパク質の溶解現象を厳密に定義する方法論の確立が望まれている。
【0006】
遺伝子工学が発展した現在において、大量合成法から得られたさまざまな組換えタンパク質が医薬品や食品、診断等の幅広い分野で利用されている。中でも、大腸菌は増殖が速く培養が容易であるため、大量合成用の宿主として汎用されている。
しかし、大腸菌を用いた組換えタンパク質の発現系では、産生される目的タンパク質の多くが不溶性となり、不活性な封入体(インクルージョンボディ)を形成する。このため、得られたタンパク質は、変性剤などで立体構造を完全に壊した状態にした後、さらにリフォールディング (巻き戻し)することが必要である。
従来、目的タンパク質を可溶化状態で得るために、MBP(マルトースバインディングプロテイン)などの溶解度の高いタンパク質(溶解度向上タグ)を目的タンパク質との融合タンパク質として発現させる方法やタンパク質濃度や添加物の種類を最適化する方法、透析法、希釈法などの様々な方法が適宜組み合わせて使用されている。
しかしながら、これらの方法は、いずれも目的とするタンパク質毎に個々的に対処されるものであり、収率も低い場合がある。また、上記溶解度向上タグを用いる方法では、タグとして用いるタンパク質の分子量が10kD以上と嵩高であり、そのためタグの付加により目的タンパク質の機能や構造に影響が生じるなどの問題があるため、タグ部分の除去が必要であり、コストや手間がかかる。
【特許文献1】WO2004/90515号公報
【特許文献2】特開2006−188507号公報
【非特許文献1】"Prediction of sequence-dependent and mutational effects on the aggregation of peptides and proteins", Serrano et al., Nat Biotechnol., vol.22, p1302-1306, 2004
【非特許文献2】"A theory of linear and helical aggregation of macromolecules.", Oosawa, F., and M. Kasai., J. Mol. Biol., vol.4, p10-21, 1962
【発明の開示】
【発明が解決しようとする課題】
【0007】
以上のように、現在ペプチドやタンパク質(一般的には生体分子)の凝集を理論的に「正しく」表現した熱力学モデルは存在しておらず、精度良くシステマティックに溶解度を調節する方法はない。従って、目的タンパク質毎に実験データを積み重ねる経験的な手法により、定性的な溶解度予測を行っているのが実情である。このため、プロテオーム研究やペプチド合成などの膨大な母集団の網羅的解析においては、より効率良く定量的な溶解度予測ができ、汎用性の高い可溶化技術の開発が期待されている。
そこで、本発明は、任意の溶液条件下における目的タンパク質の溶解度を、実際に合成する前にアミノ酸配列情報に基づく理論計算から予測する方法を確立するとともに、この理論計算により溶解度向上ペプチドタグを設計して、機能や立体構造、熱安定性などを変えることなく、該タグの付与によるタンパク質の溶解度を向上させる方法を提供する。また、該タグを用いて大腸菌を宿主とする発現系における封入体の形成を防止する方法を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明者らは、ペプチドやタンパク質の「溶解度」を新しい視点から解決するために鋭意研究を行った結果、
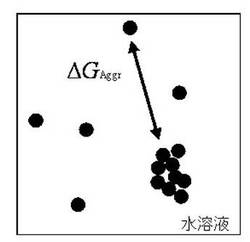
(1)溶解度(溶解限界濃度)以上になると生体分子同士の凝集が起こる現象に着目し、この凝集の起こりやすさ(即ち「溶解(限界濃)度」)は、Oosawa&Kasaiの分子会合モデル(非特許文献2参照)に基づき、生体分子の会合体にさらに1分子が会合する(図1)のに伴うギブス自由エネルギー(以下、会合自由エネルギーと略す。)ΔGAggrによって表すことができること、
(2)任意のアミノ酸配列からなるペプチドの会合自由エネルギーΔGAggrは、該ペプチドを構成する全種類のアミノ酸(全アミノ酸種)における各アミノ酸種Xの会合自由エネルギーΔGxAggrの総和により計算されるとともに、ΔGxAggrは該ペプチドに含まれるアミノ酸種の個数(残基数)の2次関数で近似的に表されること、
(3)熱力学的理論に基づきアミノ酸配列から計算したペプチドが付加された生体分子の溶解度の理論値は実測値とほぼ同じであり、且つ該ペプチドを構成するアミノ酸の種類と個数の組み合わせが同じであるときは、アミノ酸の配列パターンに関係なく、その溶解度がほぼ同じ値になるため、計算により所望の溶解度が得られるアミノ酸配列を設計(同定)できること、
(4)(3)にて設計した高い溶解度をもたらすアミノ酸配列からなるペプチドタグを目的タンパク質に付加することで、封入体をはじめとした凝集体の形成を防止できること、
を見出し、本発明を完成するに至った。
【0009】
即ち、本発明において、
第1の発明は、生体分子(アミノ酸、ペプチド、蛋白質など)の末端に任意のアミノ酸配列からなるペプチドが付加されたペプチド付加生体分子の溶解度Sを熱力学的理論に基づき計算する方法であって、上記ペプチドの会合のギブス自由エネルギーΔGAggrは、下式(1)で表される上記アミノ酸配列を構成するアミノ酸種Xの残基数Nの二次関数により定義されたΔGXAggrの総和として算出し、該ペプチドの会合のギブス自由エネルギーΔGAggrを用いて、下式(2)により上記ペプチド付加生体分子の溶解度Sを計算する方法を要旨とする。
ΔGXAggr=ΔGAggr0+ΔGXAggr1N+ΔGXAggr2N2 式(1)
(上式(1)中、Xは上記生体分子に付加されるアミノ酸種、ΔGXAggrは該アミノ酸種Xの上記生体分子への付加に伴う会合のギブス自由エネルギー(すなわち、該アミノ酸種Xの会合自由エネルギー)(J/mol)、ΔGAggr0は上記生体分子の会合のギブス自由エネルギー(J/mol)、ΔGXAggr1は該アミノ酸種Xの会合のギブス自由エネルギーの1次の項(J/mol)、ΔGXAggr2は該アミノ酸種Xの会合のギブス自由エネルギーの2次の項(J/mol)、Nは付加したペプチドに含まれる上記アミノ酸種Xの残基数をそれぞれ表す。)
S=exp(ΔGAggr/RT) 式(2)
(上式(2)中、Sは上記ペプチド付加生体分子の溶解度、Rは気体定数、Tは絶対温度、ΔGAggrは上記ペプチドに含まれる全てのアミノ酸種Xに対する各アミノ酸種Xの会合自由エネルギーΔGXAggrの総和(ΣΔGXAggr(J/mol))をそれぞれ表す。)
ここで、標準とする生体分子(標準生体分子)の末端に上記アミノ酸種Xのうちの1種類のアミノ酸種xが付加された変異体を作成し、該変異体を任意の溶媒に対して溶解限界濃度以上に添加した時の可溶性画分の溶液濃度を測定し、上記アミノ酸種xの残基数nを変化させたときの溶解度の変化から、回帰分析法により上記アミノ酸種xの会合のギブス自由エネルギーΔGxAggr1,ΔGxAggr2を下式(3)により算出することができる。
s=exp((ΔGxAggr1n+ΔGxAggr2n2)/RT) 式(3)
(上式(3)中、sは上記変異体の溶解度と上記標準生体分子の溶解度との比、Rは気体定数、Tは絶対温度、xは上記標準生体分子に付加された特定の種類のアミノ酸種、nは該アミノ酸種xの残基数、ΔGxAggr1は該アミノ酸種xの会合のギブス自由エネルギーの1次の項(J/mol)、ΔGxAggr2は該アミノ酸種xの会合のギブス自由エネルギーの2次の項(J/mol)をそれぞれ表す。)
第2の発明は、上記アミノ酸種Xの種類とその残基数Nの組合せパターンの中から、上記ペプチドのアミノ酸配列を選択する際に、上述の溶解度計算方法により各組合せパターンにおけるペプチド付加生体分子の溶解度Sを計算し、該溶解度Sが所望の値となる組合せパターンを選択して、上記ペプチドのアミノ酸配列を設計する方法を要旨とする。
第3の発明は、菌体内又は試験管内で目的タンパク質を、上述の方法により設計したペプチドタグとの融合タンパク質として発現させることにより、上記目的タンパク質の封入体形成を防止する方法を要旨とする。
【0010】
天然構造を有するタンパク質では、一部のアミノ酸はタンパク質の内部に埋もれており、溶媒(水)と接触していないので、タンパク質の溶解性を決定する要因として、内側にあるアミノ酸の影響は小さい。そこで、本発明においては、タンパク質の溶解度をOosawa&Kasaiの分子会合モデルに基づいて理論的に求めるに際し、該タンパク質を構成する全アミノ酸の特性を考慮するのではなく、該タンパク質表面に露出した、末端側のアミノ酸数残基の会合自由エネルギーを用いる。このとき、該末端側にあるアミノ酸数残基を、タンパク質に付加されたペプチドとみなし、このペプチドの溶解度を理論計算により求める方法を提供する。このように、末端側のアミノ酸のみに着目し、該末端側のアミノ酸の会合の起こりやすさを示すミクロな値と、タンパク質間の会合の起こりやすさを示すマクロな値から溶解度を決定することにより、対象とするタンパク質や溶媒条件に制限されず、ペプチドの溶解度を理論計算により精度良く求めることができる。
ここで、該ペプチドタグが付与される対象は、タンパク質に限らずペプチド(本発明では、1アミノ酸も「ペプチド」に拡張して定義する。)を含む生体分子とすることができ、その状態(変性状態または天然状態)、構成するアミノ酸の種類や個数、及びその組み合わせ等について特に限定されない。
かかる生体分子に付加される上記ペプチドとしては、低分子量で立体構造を形成しないものであれば良く、アミノ酸残基数が30残基以下が好ましく、20残基以下がより好ましい。特に3〜15残基の場合には、顕著な溶解度の向上と目的生体分子に対する影響が小さい点で優れた効果が得られる。また、その分子量は、約30,000までが好ましい。アミノ酸残基数や分子量が上記範囲内である場合には、上式(1)で表される近似式において補正パラメータが必要とならず、また上記生体分子を解析研究や医療応用などに利用する場合に、該ペプチドを除去することなく、付加されたままの状態で利用が可能となる点で優れている。
【0011】
モノマー分子同士が結合し凝集していく際にエネルギー(会合自由エネルギー、ΔGAggr)を要する。その値は分子を構成するアミノ酸種によって異なるが、各アミノ酸に対して2つのパラメータ(会合自由エネルギーΔGXAggr1とΔGXAggr2)を用いることにより、構成アミノ酸の会合自由エネルギーΔGXAggrの総和を計算することで、溶解度を求めることができる。
【0012】
上記ΔGXAggr1及びΔGXAggr2は、任意の溶液条件下で実験的に決定することができる。
この決定方法としては、標準とする生体分子(標準サンプル)に付加されるアミノ酸の残基数を変化させたときの溶解度曲線を通常の方法により求め、この結果から回帰分析法により求めることができる。具体的には、以下の手順により決定できる。
先ず標準サンプルの末端に所定のアミノ酸種xを1〜数個付加してアミノ酸残基数の異なる該生体分子の変異体を作成する(Kato.A. et al.,Biopolymers.,vol.85,no.1,p12−18,2006参照)。
該変異体としては、例えば上記アミノ酸残基数が1,3,5,7となるように付加されたものが挙げられる。
次に、得られた変異体を溶媒に任意の条件下で、見かけ上溶解が限界をやや超えた状態(溶液が少し白濁する状態)になるまで添加し、得られた溶液を平衡状態に至るまで遠心分離して上清と沈殿に分ける。続いて、沈殿を除き、上清(可溶性画分)を得る。
ここで使用する溶媒としては、水溶液系であれば特に限定されず、通常使用されるものがいずれも使用可能である。また、緩衝液は使用する溶媒のpHにあわせて、適宜選択されればよく、例えばグリシン緩衝液、アセテート緩衝液、フォスフェート緩衝液、Tris緩衝液等が挙げられる。濃度は、適宜選択すれば良いが、溶解度への影響を最小限に抑えるために50mM程度であることが好ましい。
また、温度やpH、塩濃度など、その他の溶媒条件は、適宜選択すれば良く、例えば温度4℃、pH7.0等が挙げられる。
上記遠心条件としては、生化学分野において通常使用される条件であれば特に限定されず、例えば20,000×gで4℃にて1時間等が使用可能である。この時、平衡状態に至っていることを確認することが必要である。例えば、得られた可溶性画分を測定条件下で保管した後、例えば6,12,24時間経過毎に再度濃度を測定し、濃度が変わらないことを確認すればよい。また、凝集の可逆性を確認する必要がある。例えば、測定に用いた緩衝液を不溶性画分に加え、該不溶性画分が可溶性画分に移行することで可逆性が確認できる。
そして、この可溶性画分の溶液濃度を分光光度計により測定し、これを溶解度と規定して、上記アミノ酸の残基数を変数とする溶解度曲線を求める。
そして、上記アミノ酸の残基数を変化させたときの溶解度の変化から、回帰分析法により上記アミノ酸の会合自由エネルギーΔGxAggr1,ΔGxAggr2を上式(3)により決定する。
上記標準サンプルとしては、特に制限されないが、発現・精製が容易で、分光学的にサンプル濃度を測定することが可能なトリプトファン又はチロシンを含み、且つ測定条件下で完全に天然状態又は完全に変性状態であるものであればよい。また、溶解度が数100μM〜1mMであることが好ましい。更に、分子量は2,000以上でることが好ましく、1万程度であることがより好ましい。具体的に例示すれば、ウシ膵臓トリプシン阻害物質BPTI(Bovine Pancreatic Trypsin Inhibitor)の変異体であるBPTI−21やBPTI−22(BPTIの第21位、第22位がそれぞれ置換されたもの)、或いはBPTI−22の第40〜58位のアミノ酸配列からなるペプチド断片をSS結合により管状化したもの、Cys(GlyAlaAlaSerAlaAla)4CysGlyGly配列を基本として人工設計したペプチド断片等が挙げられる。
【0013】
以上のようにして、全20種類のアミノ酸について、任意の溶媒条件下における2つのパラメータΔGXAggr1とΔGXAggr2を求めることで、該パラメータは各アミノ酸固有の値であるので、任意のアミノ酸配列を有する種々のペプチドの会合自由エネルギー(ΔGAggr)を自在に求めることができ、更にこのペプチドの会合自由エネルギーΔGAggr(該ペプチドに含まれる上記アミノ酸種Xの会合自由エネルギーΔGXAggrの総和ΣΔGXAggr)から熱力学的理論に基づく上式(2)により該ペプチドが付加された生体分子の溶解度を求めることができる。
かかるパラメータは、pH依存性が低く、比較的広いpH範囲で補正を加えずに、上式(2)に用いることができるが、温度と塩濃度の溶媒条件に対しては変化が大きく、適宜補正が必要になる。
また、物理化学的性質が比較的似ているアミノ酸同士(ロイシンとイソロイシン、アスパラギンとグルタミン酸など)のパラメータは、比較的同じ値を示す傾向にある。従って、開発コストを抑えるために、代表的なアミノ酸のパラメータを決定し、それらを他のアミノ酸のパラメータとして代用することで、求めたいサンプルのおおよその溶解度を見積もることも有効である。
このようにペプチド付加生体分子の溶解度をアミノ酸配列から計算する方法は、汎用性が高く、タンパク質が関係する先端研究開発分野や医療応用分野等において溶解度に起因する問題を解決するための手法として有効である
【0014】
第2の発明は、上式(1)〜(3)を用いることで、所望の溶解度を有するペプチドタグを設計(同定)する方法である。
例えば、後述のように、2つのパラメータΔGXAggr1,ΔGXAggr2の値が高いアルギニンやリジンの組み合わせによるアミノ酸配列からなるペプチドタグにおいては、高い溶解度が得られる。
図3に、高い溶解度を導くタグを付加したことによるNMRスペクトルの改善状態を示す。図3(A)は、“BPTI−22(3.8mM)”のHSQCスペクトルであり、該濃度(3.8mM)では写真のサンプルは白濁していて沈殿が多いため、クロスピークの形が不均一でブロードになっていることから解析不能であることがわかる。これ対し、図3(B)は、BPTI−22のC末端に5個のアルギニン(R)を付加した変異体(“BPTI−22―C5R(3.8mM)”)の同一測定時間(20分)におけるHSQCスペクトルであり、同じ分子量であるにもかかわらず写真のサンプルでは沈殿が減少しており溶解度が向上したため、良好なスペクトルの質が得られることがわかる。
【0015】
かかるペプチドタグのアミノ酸の残基数としては、タグ自体の分子量が大きすぎると、目的タンパク質の機能発現や精製、構造解析などに影響を及ぼす虞があるため、好ましくは1〜20残基、さらに好ましくは3〜15残基である。
【0016】
第3の発明は、第1または第2の発明による方法で設計したペプチドタグを、目的タンパク質に付与することにより、封入体の形成を防止するタンパク質の合成方法である。
上記目的タンパク質については、状態(変性または天然)や、構成するアミノ酸の種類、個数、組合せについて特に限定されない。
【0017】
第3の発明におけるペプチドタグのアミノ酸残基数は1〜20残基であり、好ましくは、3〜15残基、より好ましくは、5〜10残基である。アミノ酸残基数が上記範囲内である場合には、溶解度が向上し、封入体としての発現を抑えることができる。アミノ酸残基数が上記範囲を超えると、ペプチドタグ自体の分子量が大きすぎるために、目的タンパク質の機能発現や精製、構造解析などに影響を及ぼす虞が生じる。
菌体内での封入体形成抑制能は、目的タンパク質の末端にペプチドタグを融合させた融合タンパク質を発現・精製し、菌体破砕後、遠心を行い、可溶性画分と不溶性画分におけるそれぞれの濃度をSDS−PAGEにより定量化して求める。また、試験管内での凝集体形成抑制能は、目的タンパク質の末端にペプチドタグを融合させた融合タンパク質を発現・精製し、遠心分離後、可溶性画分の濃度を分光学的に定量化して求める。
封入体形成抑制能は付加するペプチドタグの長さと関係があり、使用するペプチドタグのアミノ酸残基数に依存して、封入体の発現量が減少する。
実際に、Caspase-Activated DNase (CAD)タンパク質の第1〜86位のアミノ酸配列からなるペプチド断片のC末端にアミノ酸残基数の異なる3種類のペプチドタグを融合させた変異体をそれぞれ作成し、封入体への影響を解析したところ、溶解度の向上を可能にするペプチドタグを付加することで封入体が抑制されることが明らかになった。
例えば、9残基のアミノ酸からなるペプチドタグを付加したとき、封入体形成が9割以上防止できるようになった。このことは、封入体の形成が、タンパク質の溶解度と相関関係にあることを示唆している。従って、本発明により設計される溶解度向上ペプチドタグを用いることにより、汎用性の高い封入体の形成抑制技術を提供することができる。
【0018】
このようなペプチドタグは、目的タンパク質のN末端、C末端のいずれかに付与しても良いし、N末端、及びC末端の両末端に付与しても構わないが、目的タンパク質の立体構造によってはN末端、及びC末端の両末端にペプチドタグを付与することにより、これらに相互作用を生じ、目的タンパク質の機能発現や立体構造に影響を及ぼす場合もあり得る。そのような場合には、N末端かC末端のいずれかにペプチドタグを付与すると良い。
また、該ペプチドタグには必要に応じてリンカーを付与しても良い。リンカーとしては、グリシン、及び/またはプロリンを挙げることができ、1〜5残基程度、好ましくは2〜5残基程度とする。該ペプチドタグにリンカーを付与するのは、タグ自体に柔軟性を持たせること、及び目的タンパク質と設計されるペプチドタグとの間に距離を置くことにより、それらの間における相互作用を防止することを目的とするためである。
【0019】
上記ペプチドタグを目的タンパク質に付与して融合タンパク質を得る方法としては、特に制限されるものではないが、例えば該融合タンパク質を発現する遺伝子を用いた遺伝子組み換えにより、セルフリー(インビトロ)合成や大腸菌や酵母などの宿主を形質転換し、得られた宿主を培養することによりこれを得る方法、シンセサイザーなどを用いた化学的合成による方法などを挙げることができる。
【発明の効果】
【0020】
本願第1の発明は、従来の疎水性・親水性モデルに基づく溶解度計算法とは異なり、生体分子の凝集の熱力学モデルを用い、1分子の会合自由エネルギーの値と生体分子の溶解度の関係から溶解度を熱力学法則に従った物理化学的に理論計算するものであり、タンパク質発現やペプチド合成を行う前に、高い精度で定量的に溶解度を予測することを可能にする。
従って、
1.溶解度が低いペプチドやタンパク質を取り扱う場合や高濃度でタンパク質を溶解する必要がある場合(高濃度での機能解析やNMRによる構造解析)など、或いはプロテインチップやマイクロバイオリアクターの作成、精製の高率化など、溶解度が問題となる種々の場合において、膨大な母集団のペプチドやタンパク質を対象とする網羅的解析を行う際に、予め効率良くターゲットを選定することができる。
2.対象ペプチドや目的タンパク質の溶解度計算において、任意のpH、温度、塩濃度などの溶媒条件下で使用可能であり、汎用性に優れた溶解度予測を行うことができる。これにより、例えば図2に示すような、アミノ酸配列、溶媒条件、タンパク質の立体構造を入力データとする溶解度計算システムの開発への応用が期待できる。
【0021】
また、第2の発明によれば、上記溶解度を求める方法を用いることで、所望の溶解度とするペプチドタグを設計することができる。
従って、
3.溶解度が低いペプチドやタンパク質を解析対象とする場合に、解析対象の機能や構造、安定性などを変えずに、その溶解度を飛躍的に向上させることが可能なペプチドタグを付与すること等で、効率的な解析を可能にし、解析コストの削減を図ることが可能になる。
4.ペプチド合成に際し、予め対象とするペプチドの溶解度を設計することができる。
【0022】
さらに、第3の発明は、タンパク質の凝集性の傾向と大腸菌内の封入体形成の強い相関関係に着目した知見に基づくものであり、上述のようにして設計したタグを目的タンパク質に付加することにより、大腸菌内において封入体の形成を防止できる。
従って、
5.可溶化したタンパク質を産生することができ、収量の向上が図られる。
6.数種類のペプチドタグで大抵のタンパク質の溶解度向上が可能となり、汎用性の高い封入体防止発現ベクターの開発への応用が期待できる。
【発明を実施するための最良の形態】
【0023】
実施例1
〔融合タンパク質の合成〕
本実施例1では、目的タンパク質として難溶性タンパク質ウシ膵臓トリプシン阻害タンパク質(Bovine Pancreatic Trypsin Inhibitor;BPTI)において22個のAlaを有する変異体BPTI−22(58aa、分子量5,880)を使用した。
タンパク質の発現には、pMMHaBPTI−22発現ベクター(J.Mol.Biol.,Vol.298,p493−501,2000参照)を用いた。この発現ベクターは、Stratagene社製の試薬キット(商品名:QuikChangeIIXLSite−Directed Mutagenesis Kit)を用いてtrpΔLEリーダー配列のN末端にHisタグ配列が付加してある。
この発現ベクターで大腸菌JM109(DE3)pLysSをトランスフォーメーションし、得られたコロニーを50μg/mlのアンピシリンと34μg/mlのクロラムフェニコールを含む100mlのLB培地に直接植菌し、37℃で6時間振盪培養した。その後、2LのLB培地に植菌し、 37℃で一晩振盪培養した。得られた培養液を500mlの遠心管に移し、5,000×g、4℃にて20分間遠心分離を行い、集菌した。集菌後の菌体を100mMTris−HCl緩衝液(pH8.7)に懸濁し、7,000×g、4℃にて20分間再び遠心して洗浄した。
洗浄後の菌体は、培養液2L分の菌体を50mlの遠沈管にて集菌し、菌体重量に対して約10倍量の緩衝液A(50mMTris−HCl(pH8.7)、150mMNaCl)に懸濁した。懸濁液を氷冷しながら、懸濁液が半透明になるまで超音波破砕を行った。
破砕後、7,000×g、4℃にて20分間遠心分離を行って上清を除き、不溶性画分を得た。
再び不溶性画分を緩衝液B(50mMTris−HCl(pH8.7)、1容積%NP−40、1重量%Deoxycholic acid、1mMEDTA)で懸濁し、超音波破砕を行なった。液が白色になるまでこの操作を3回繰り返した。
目的タンパク質は大腸菌内で封入体を形成するため、遠心後は不溶性画分を得た。
続いて、不溶性画分(封入体を形成をしたタンパク質)を6MGuHCl(pH8.7)で可溶させ、BPTI変異体分子内のCys5とCys55においてS−S結合をさせるために、10時間攪拌させ空気酸化させた。その後、50mMTris−HCl緩衝液(pH8.7)で透析を行い、6MGuHClを除くと沈殿が現れた。これは、目的タンパク質に付加しているtrpΔLEリーダー配列を持つタグタンパク質がpH8.7において沈殿するために、目的タンパク質も沈殿するためである。
この沈殿を7,000×g、4℃にて20分間遠心分離で回収し、沈殿重量に対して10倍量の70%formic acidを加え、室温にて6時間CNBr反応(10mg/ml CNBr/70% formic acid)を行い、目的タンパク質からタグタンパク質を切断した。
更に、約2時間Speed vacした後、mill-Qで一晩透析した。そして、10mMリン酸塩緩衝液(pH6.0)で透析を一晩行った。透析後、7,000×g、4℃にて20分間遠心分離を行い、沈殿(タグタンパク質)を除き、可溶性画分から融合タンパク質(上記BPTI−22のN末端又はC末端にGGnR配列(nはアルギニン(R)の残基数であり、n=1,3,5)を有するペプチドタグが付加された融合タンパク質)を得た。
この溶液に酢酸を加え、HPLCにより精製した。精製に用いた逆相カラム(YMC−Pack PROTEIN−RP S,5μm)は25%アセトニトリルで平衡化させ、タンパク質をカラムに吸着させた。吸着後、リニアグラジエント(25〜60%,アセトニトリルの増加率:1%/分)をかけ、カラムに吸着させたタンパク質を溶出させた。
そして、溶出液の220nmにおける吸光度をオンラインで測定した。この時、流速は8.0ml/分とした。
吸光度にピークが現れたフラクションをESI−TOFMS“JMS−T100X”(日本電子社製)を用いて分子量を同定し、精製標品を凍結乾燥し、−80℃で保存した。
〔パラメータΔGXAggr1、ΔGXAggr2の決定〕
このようにして得られた融合タンパク質(C末端にGGnR配列を有するペプチドタグが付加された融合タンパク質)を100mM酢酸緩衝液(pH4.7)に溶解し、生じた沈殿を20,000×g、4℃で1時間の遠心分離により除去した。尚、タンパク質は基本的にすべての実験操作において氷上で取り扱った。
分光光度計により280nmの吸光度を測定して、20℃、pH7.0における溶解限界濃度を求め、これを溶解度とした。そして、“付加したアミノ酸残基数”と“溶解度”との関係を実験的に求めた。その結果を図4に示す。
図4中、横軸は付加したアミノ酸残基数、縦軸は溶解度をそれぞれ示し、標準ペプチド(何も付加していない)の溶解度を“1”とした。
続いて、この溶解度曲線から(即ち、実験的に求めた“溶解度”から)付加したアミノ酸の個数Nに対する回帰分析法によって2つのパラメータΔGXAggr1、ΔGXAggr2(J/mol)を求めた。
この結果、アルギニン(R)のΔGRAggr1は4.72J/mol、ΔGRAggr2は143.65J/molと決定した。
また、アルギニンと同様にして、リジン(K)についても2つのパラメータΔGXAggr1、ΔGXAggr2(J/mol)を求めたところ、ΔGKAggr1は4.72J/mol、ΔGKAggr2は130.47J/molとなった。
【0024】
〔ペプチドタグ融合タンパク質の溶解度計算〕
実験では、ペプチドタグを付与していないBPTI−22タンパク質と、アルギニンタグ(RRRGG、RRRRRGG(「GG」はリンカー残基として付与))をBPTI−22のN末端に付加した融合タンパク質との溶解度を測定した。
即ち、各タンパク質に100mM酢酸緩衝液(pH4.7)を白濁(凝集)するまで加え(約100μl)、これらタンパク質溶液20,000×gを4℃、1時間の条件下で遠心分離した。そして、該タンパク質溶液の可溶性画分について、分光光度計にて280nmにおける吸光度を計測し、タンパク質濃度を求め、この測定値を溶解度とした。
この結果、上記ペプチドタグを付与した融合タンパク質の溶解度は、BPTI−22タンパク質の溶解度(1.70mM)と比較して、アミノ酸配列がRRRGGであるペプチドタグを付加した場合(溶解度は2.70mM)で1.59倍、アミノ酸配列がRRRRRGGであるペプチドタグを付加した場合(溶解度は6.20mM)で3.65倍それぞれ実験的に向上することを確認した。
一方、上述のようにして求めたアルギニンのΔGRAggr1(4.72J/mol)及びΔGRAggr2(143.65J/mol)を上式(1)に代入し、上記ペプチドタグのΔGRAggrを求めた。
ここで、該ペプチドタグはいずれもアルギニンのみから構成されているので、ΔGRAggr=ΔGAggrとなり、該ペプチドタグの溶解度は上式(2)から導かれる。
アルギニンを3個付加したタンパク質の溶解度は以下のとおり;
ΔGAggr=4.72×3+143.65×32=1307.01J/mol
となり、277.15K(4°C)における両タンパク質の溶解度の比は
S=exp(1307.01/(8.314×277.15))=1.76
よって、4°Cの温度では、アルギニンを3個付加したタンパク質の溶解度は付加していないものより溶解度が1.76倍向上すると計算され、上記の実験で測定した1.59倍とよく一致した。
同じようにアルギニンを5個付加したタンパク質の溶解度は以下のとおり;
ΔGAggr=4.72×5(=23.6)+143.65×52(3591.25)=3614.85J/mol
となり、277.15K(4°C)での両タンパク質の溶解度の比は
S=exp(3614.85/(8.314×277.15))=4.80
よって、4°Cの温度では、アルギニンを5個付加したタンパク質の溶解度は付加していないものより溶解度が4.80倍向上すると計算され、上記の実験で測定した3.65倍と24%の誤差で理論値と実測値が一致した。
以上のようにして求めた計算による溶解度の値と実測値を比較したところ、両者は近似しており、本発明の計算方法により、精度良く溶解度の計算を行うことができることが検証された。
また、ペプチドタグの溶解度は、タグを構成するアミノ酸の種類と個数を変数に依存しており、それらアミノ酸の配列順序には大きく左右されないことが確認できた。
【0025】
次に、このペプチドタグが付与された融合タンパク質溶液3.8mMと、該ペプチドタグ付与がないBPTI−22溶液を解析サンプルとして用い、NMR法により15N−HSQCスペクトルをそれぞれ測定した。
この結果を図3に示す。ここでは、BPTI−22のC末端に5個のアルギニン(R)を付加した変異体(“BPTI−22―C5R(3.8mM)”)と、BPTI−22との同一測定時間(20分)におけるHSQCスペクトルを比較した。図3から明らかなよう、上記融合タンパク質においては、S/N比、クロスピークの線幅及び形態でスペクトル質の評価から、測定時間がタグなしの試料の約1/8で得られる上、上質なNMRスペクトルが得られた。従って、上記ペプチドタグの付加により、タンパク質の機能、構造及び安定性を変えずに、その溶解度を大きく向上させることが可能となることが明らかとなった。
【0026】
実施例2
本実施例2では、目的タンパク質として難溶性タンパク質ウシ膵臓トリプシン阻害タンパク質(Bovine Pancreatic Trypsin Inhibitor;BPTI)において22個のAlaを有する変異体BPTI−22のN末端にリジン残基を3,5個付加し、計算結果と比較した。
実験では、ペプチドタグを付与していないBPTI−22タンパク質と、リジンタグ(KKKGG、KKKKKGG)をBPTI−22のN末端に付加した融合タンパク質との溶解度を実例1と同様の方法で測定した。
即ち、各タンパク質に100mM酢酸緩衝液(pH4.7)を白濁(凝集)するまで加え(約100μl)、これらタンパク質溶液20,000×gを4℃、1時間の条件下で遠心分離した。そして、該タンパク質溶液の可溶性画分について、分光光度計にて280nmにおける吸光度を計測し、タンパク質濃度を求め、この測定値を溶解度とした。
この結果、上記ペプチドタグを付与した融合タンパク質の溶解度は、BPTI−22タンパク質の溶解度(1.70mM)と比較して、アミノ酸配列がKKKGGであるペプチドタグを付加した場合(溶解度は2.66mM)で1.56倍、アミノ酸配列がKKKKKGGであるペプチドタグを付加した場合(溶解度は5.37mM)で3.16倍それぞれ実験的に向上することを確認した。
一方、上述のようにして求めたリジンのΔGKAggr1(4.72J/mol)及びΔGKAggr2(130.47J/mol)を上式(1)に代入し、上記ペプチドタグのΔGKAggrを求めた。
ここで、該ペプチドタグはいずれもリジンのみから構成されているので、ΔGKAggr=ΔGAggrとなり、該ペプチドタグの溶解度は上式(2)から導かれる。
リジンを3個付加したタンパク質の溶解度は以下のとおり;
ΔGAggr=4.72×3+130.47×32=1188.39J/mol
となり、277.15K(4°C)における両タンパク質の溶解度の比は
S=exp(1188.39/(8.314×277.15))=1.67
よって、4°Cの温度では、リジンを3個付加したタンパク質の溶解度は付加していないものより溶解度が1.67倍向上すると計算され、上記の実験で測定した1.56倍とよく一致した。
同じようにリジンを5個付加したタンパク質の溶解度は以下のとおり;
ΔGAggr=4.72×5(=23.6)+130.47×52(3261.75)=3285.35J/mol
となり、277.15K(4°C)での両タンパク質の溶解度の比は
S=exp(3285.35/(8.314×277.15))=4.16
よって、4°Cの温度では、リジンを5個付加したタンパク質の溶解度は付加していないものより溶解度が4.16倍向上すると計算され、上記の実験で測定した3.16倍と24%の誤差の範囲で一致した。
以上のようにして求めた計算による溶解度の値と実測値を比較したところ、両者は近似しており、本発明の計算方法により、精度良く溶解度の計算を行うことができることが検証された。
【0027】
実施例3
〔アミノ酸Xの種類とその残基数Nの組合せパターン〕
先ず、pAEDベクター を用いて<1>目的タンパク質、<2>目的タンパク質の末端にペプチドタグが付与された融合タンパク質、<3>該融合タンパク質にHisタグを さらに付与したサンプル、<4>上記目的タンパク質の末端にHisタグが付与されたサンプル、の四つのコンストラクトを大腸菌内 で発現させた。
ここで、上記目的タンパク質には、分子量6kD〜30kDのBPTを用いた。また、上記ペプチドタグとしては、GGRn配列(nはアルギニン(R)の残基数であり、n=1,3,5)からなるものを用いた。
そして、各コンストラクトが目的タンパク質に対して溶解度向上が最大になるように配列を再設計した。
アルギニンを1個付加したタンパク質の溶解度は以下のとおり;
ΔGXAggr=4.72×1+143.65×12=2317.28J/mol
よって、300Kの温度では、アルギニンを1個付加したタンパク質の溶解度は付加していないものより溶解度が1.06倍向上すると計算される。
また、アルギニンを3個付加したタンパク質の溶解度は以下のとおり;
ΔGXAggr=4.72×3+143.65×32=1307.01J/mol
よって、300Kの温度では、アルギニンを3個付加したタンパク質の溶解度は付加していないものより溶解度が1.71倍向上すると計算される。
同じようにアルギニンを5個付加したタンパク質の溶解度は以下のとおり;
ΔGXAggr=4.72×5+143.65×52=3614.85J/mol
よって、300Kの温度では、アルギニンを5個付加したタンパク質の溶解度は付加していないものより溶解度が4.26倍向上すると計算される。
以上の計算結果から、アミノ酸5残基が付与された場合に溶解度が最大となった。
この結果より、各コンストラクトが目的タンパク質に対して溶解度向上が最大になるペプチドタグのアミノ酸配列は、GG5Rであることがわかった。
〔溶解度向上タグによる封入体形成防止〕
実施例4
本実施例4では、目的タンパク質として塩基性タンパク質CAD(Caspase−Activated Dnase)の第34位のCysをSerに置換した変異体の第1〜86位のアミノ酸配列を有するペプチド断片CAD1-86C34S変異体を使用した。
先ず、CAD1-86C34S変異体のC末端側に3,6,9個のアルギニン残基をペプチドタグとして付加した融合タンパク質を作成し、それぞれC0R(付加数0)、C3R(付加数3)、C6R(付加数6)、C9R(付加数9)とした。
【0028】
即ち、大腸菌BL21(DE3)pLysSを宿主として用い、培養温度を25℃とした場合と37℃とした場合についてそれぞれ調べた。OD590nm=0.6〜0.7の範囲でIPTGを添加し、発現誘導を行った。その後、4時間培養し、ODを測定後、200μlにおけるOD値が8.0になるように各サンプルを調整した。
これらのサンプルを精製し、菌体破砕後、15,000×gで15分間遠心を行い、上清(可溶性画分)と沈殿(不溶性画分)をそれぞれ回収し、沈殿には10mMトリス緩衝液(pH8.0)200μlを加え、SDG−PAGEにより定量解析し、封入体形成への影響を調べた。この結果を図5に示す。
図5より、25℃の培養条件では、アルギニン残基の付加数が増える(タグの長さが長くなる)ほど、不溶性画分(ppt)中のタンパク質量が減少し(即ち、可溶性画分(sup)中のタンパク質量が増加し)ており、付加するアミノ酸が長くなるにつれて溶解度が向上し、封入体形成防止に効果があることがわかった。なお、アルギニン系タグ付加が37℃で溶解効果を発揮せず25℃で効果を持つのは、CAD1-86C34S変異体は高温では構造を形成できず、凝集しやすい状態になるが、25℃では構造を形成し、タグを付加することで封入体形成を防止できると考えられ、他にも不安定なタンパク質に於いては、タグを付加すると同時に培養温度を下げることでタグの効果が最大限に利用できると思われる。
このように、塩基性タンパク質が形成する封入体の防止には、アルギニンを基本とした溶解度向上ペプチドタグが効果的なことが明らかになった。
【0029】
実施例5
本実施例5では、目的タンパク質として酸性タンパク質N−intein(127aa、分子量14388.2)を使用した。
実施例4と同様にして、N−inteinタンパク質のC末端に3,6,9個のアスパラギン酸をペプチドタグとして付加した融合タンパク質を作成し、それぞれC0R(付加数0)、C3R(付加数3)、C6R(付加数6)、C9R(付加数9)とした。
発現宿主にはBL21(DE3)pLysSを使用し、培養温度を37℃とした。OD590nm=0.6〜0.7の範囲でIPTGを添加して発現誘導した。その後、4時間培養し、実施例4と同様にして封入体形成への影響を調べた。この結果を図6に示す。
図6に示すように、全菌体 (all) についてはサンプル間で発現量に殆ど差異は見られないものの、可溶性画分(sup)では大きく異なり、アスパラギン酸残基数が多くなるとともに可溶性画分での発現量が増え、C9Dでは殆どすべてのタンパク質が可溶性画分として発現した。即ち、アスパラギン酸残基を9残基付加することにより、N−inteinが形成する封入体を防止できることがわかった。
このことから、酸性タンパク質が形成する封入体の防止には、アスパラギン酸系タグの付加が有効であることが明らかになった。
また、実施例4及び実施例5より、溶解度向上ペプチドタグの封入体形成防止効果は、塩基性・酸性のいずれのタンパク質でも得られることが明らかになった。
更に、CAD1-86C34S変異体の等電点(pI)及びアルギニンのpKaはそれぞれ9.77及び12.5であり、一方N−inteinの等電点(pI)及びアスパラギン酸のpKaはそれぞれ4.36及び3.9〜4.0であることから、封入体形成を防止するための溶解度向上ペプチドタグは、目的タンパク質の等電点を基にして設計することが効果的であると予想された。
【産業上の利用可能性】
【0030】
本発明は、例えば、以下のようなケースに応用が示唆される。
・バイオリアクター、プロテインチップなどで高濃度の酵素・タンパク質を使用したいとき。
・インクジェットプリンターなどにおいて、インク使用中に溶解度が低くなった際に、有機物が沈殿することを防ぎたいとき。
・ペプチド(タンパク質)の封入体の形成の傾向性を予測したいとき。
・ペプチド、ホルモン、酵素、変性タンパク質等、溶解度が低い球状タンパク質、膜タンパク質等を可溶化したいとき。
【図面の簡単な説明】
【0031】
【図1】生体分子の凝集を表す熱力学モデルの模式図である。
【図2】溶解度計算システムの入力画面の例を示す図である。
【図3】溶解度向上ペプチドタグの付加による「溶液状態(写真)」及び「NMRスペクトル」の比較を示し、(A)はBPTI−22の状態であり、(B)はBPTI−22−C5Rの状態である。
【図4】アルギニンについて実験的に求めた溶解度曲線である。
【図5】アルギニン系タグ付加がCAD1-86C34S変異体の封入体形成に与える影響及び培養温度依存性を示すSDG−PAGEの写真であり、(A)は培養温度を37℃とした場合、及び(B)は25℃とした場合である。
【図6】アスパラギン酸系タグ付加がN−inteinタンパク質の封入体形成に与える影響を示すSDG−PAGEの写真である。
【符号の説明】
【0032】
ΔGAggr 会合自由エネルギー
【技術分野】
【0001】
本発明は、生体分子の凝集の熱力学モデルに基づいて、それら生体分子の溶解度をアミノ酸配列から計算する方法に関する。
さらに、本発明は、上記の計算方法を用いて所望の溶解度とするペプチドタグを設計する方法及び封入体(細胞内に蓄積する不活性型凝集)形成を防止する方法に関する。
【背景技術】
【0002】
ポストゲノム時代においては、生命現象の仕組みや疾患の原因の解明に向けて、遺伝子情報に基づくタンパク質の構造と機能の解明研究が注目されている。生体内におけるタンパク質は熱力学的に安定なフォールド状態をもち、その天然構造をとったときに特定の機能を発現する。従って、生体内以外でも目的タンパク質を本来の立体構造(天然構造)を保持したまま合成することは、プロテオーム研究のみならず、工業的利用や医薬応用の分野においても非常に重要な課題である。
タンパク質は、熱やpH、塩濃度、還元剤の存在などの環境変化により変性し、活性が低下・失活するだけでなく、溶解度が大幅に低下する。これは、分子内の高次構造を支えている結合が切断され、フォールド状態が壊れるためであり、変性を起こしたタンパク質では、分子の内側にあった疎水性の高い部分が外側に露出し、溶媒(水)と接触するようになるために、タンパク質同士が凝集して沈澱する傾向がある。また、天然状態であっても、分子表面に疎水性残基が多い場合や等電点付近では、タンパク質同士が凝集して沈澱する傾向がある。
【0003】
かかる凝集現象は、分子の濃度がある溶解限界濃度(溶解度)以上になると起きる。タンパク質の凝集を抑制する方法として、pHや温度、塩濃度などの溶媒条件を操作することにより溶解度を向上させる手法が一般に用いられる。例えば、高濃度の解析サンプルが必要とされるNMRによるタンパク質の構造解析においては、CHAPSなどの界面活性剤を低濃度添加することにより、タンパク質の溶解度を向上させることが行なわれる。
しかし、この手法は、タンパク質の溶解度が分子の疎水性・親水性で決定されるという定説に基づくもので、研究者の勘や経験に依存するところが大きく、溶媒条件の最適化には労力と時間が必要とされる。また、制御した溶媒条件下ではタンパク質の機能的立体構造が保持されないなどの問題がある
【0004】
また、特許文献1には、タンパク質溶液中の沈殿剤濃度を上昇させたときの結晶周囲のタンパク質溶液の干渉縞の観察に基づき、溶解度曲線からタンパク質の溶解度を測定する方法が記載されている。
しかし、この方法も半経験的に溶解度を「予測」するものであり、精度が低い上、温度やpH、各種添加剤の濃度をパラメータとして膨大なスクリーニングから最適溶媒条件を求める必要があり、非効率的である。
この他、非特許文献1には、タンパク質のアミノ酸配列の凝集傾向性を理論計算から予測する方法が記載されている。しかし、計算式に用いるパラメータにはペプチドの溶解度の実測値を文献及び実験から求めており、精度が低く、工業的に利用するには汎用性が低い。
【0005】
これに対し、本発明者らは、短い親水性アミノ酸からなるタグを目的タンパク質に付与することにより、該タグが付加された目的タンパク質の溶解度を飛躍的に向上させる方法を開発した(特許文献2参照)。この方法によれば、目的タンパク質の機能発現や立体構造に影響を及ぼすことなく、溶解度の向上を図ることができる。
この方法は、広い溶媒条件下で使用することができ、汎用性に優れた画期的な手法ではあるものの、原理的には経験則を数式化したものにとどまるものである。このため、タンパク質の溶解現象を厳密に定義する方法論の確立が望まれている。
【0006】
遺伝子工学が発展した現在において、大量合成法から得られたさまざまな組換えタンパク質が医薬品や食品、診断等の幅広い分野で利用されている。中でも、大腸菌は増殖が速く培養が容易であるため、大量合成用の宿主として汎用されている。
しかし、大腸菌を用いた組換えタンパク質の発現系では、産生される目的タンパク質の多くが不溶性となり、不活性な封入体(インクルージョンボディ)を形成する。このため、得られたタンパク質は、変性剤などで立体構造を完全に壊した状態にした後、さらにリフォールディング (巻き戻し)することが必要である。
従来、目的タンパク質を可溶化状態で得るために、MBP(マルトースバインディングプロテイン)などの溶解度の高いタンパク質(溶解度向上タグ)を目的タンパク質との融合タンパク質として発現させる方法やタンパク質濃度や添加物の種類を最適化する方法、透析法、希釈法などの様々な方法が適宜組み合わせて使用されている。
しかしながら、これらの方法は、いずれも目的とするタンパク質毎に個々的に対処されるものであり、収率も低い場合がある。また、上記溶解度向上タグを用いる方法では、タグとして用いるタンパク質の分子量が10kD以上と嵩高であり、そのためタグの付加により目的タンパク質の機能や構造に影響が生じるなどの問題があるため、タグ部分の除去が必要であり、コストや手間がかかる。
【特許文献1】WO2004/90515号公報
【特許文献2】特開2006−188507号公報
【非特許文献1】"Prediction of sequence-dependent and mutational effects on the aggregation of peptides and proteins", Serrano et al., Nat Biotechnol., vol.22, p1302-1306, 2004
【非特許文献2】"A theory of linear and helical aggregation of macromolecules.", Oosawa, F., and M. Kasai., J. Mol. Biol., vol.4, p10-21, 1962
【発明の開示】
【発明が解決しようとする課題】
【0007】
以上のように、現在ペプチドやタンパク質(一般的には生体分子)の凝集を理論的に「正しく」表現した熱力学モデルは存在しておらず、精度良くシステマティックに溶解度を調節する方法はない。従って、目的タンパク質毎に実験データを積み重ねる経験的な手法により、定性的な溶解度予測を行っているのが実情である。このため、プロテオーム研究やペプチド合成などの膨大な母集団の網羅的解析においては、より効率良く定量的な溶解度予測ができ、汎用性の高い可溶化技術の開発が期待されている。
そこで、本発明は、任意の溶液条件下における目的タンパク質の溶解度を、実際に合成する前にアミノ酸配列情報に基づく理論計算から予測する方法を確立するとともに、この理論計算により溶解度向上ペプチドタグを設計して、機能や立体構造、熱安定性などを変えることなく、該タグの付与によるタンパク質の溶解度を向上させる方法を提供する。また、該タグを用いて大腸菌を宿主とする発現系における封入体の形成を防止する方法を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明者らは、ペプチドやタンパク質の「溶解度」を新しい視点から解決するために鋭意研究を行った結果、
(1)溶解度(溶解限界濃度)以上になると生体分子同士の凝集が起こる現象に着目し、この凝集の起こりやすさ(即ち「溶解(限界濃)度」)は、Oosawa&Kasaiの分子会合モデル(非特許文献2参照)に基づき、生体分子の会合体にさらに1分子が会合する(図1)のに伴うギブス自由エネルギー(以下、会合自由エネルギーと略す。)ΔGAggrによって表すことができること、
(2)任意のアミノ酸配列からなるペプチドの会合自由エネルギーΔGAggrは、該ペプチドを構成する全種類のアミノ酸(全アミノ酸種)における各アミノ酸種Xの会合自由エネルギーΔGxAggrの総和により計算されるとともに、ΔGxAggrは該ペプチドに含まれるアミノ酸種の個数(残基数)の2次関数で近似的に表されること、
(3)熱力学的理論に基づきアミノ酸配列から計算したペプチドが付加された生体分子の溶解度の理論値は実測値とほぼ同じであり、且つ該ペプチドを構成するアミノ酸の種類と個数の組み合わせが同じであるときは、アミノ酸の配列パターンに関係なく、その溶解度がほぼ同じ値になるため、計算により所望の溶解度が得られるアミノ酸配列を設計(同定)できること、
(4)(3)にて設計した高い溶解度をもたらすアミノ酸配列からなるペプチドタグを目的タンパク質に付加することで、封入体をはじめとした凝集体の形成を防止できること、
を見出し、本発明を完成するに至った。
【0009】
即ち、本発明において、
第1の発明は、生体分子(アミノ酸、ペプチド、蛋白質など)の末端に任意のアミノ酸配列からなるペプチドが付加されたペプチド付加生体分子の溶解度Sを熱力学的理論に基づき計算する方法であって、上記ペプチドの会合のギブス自由エネルギーΔGAggrは、下式(1)で表される上記アミノ酸配列を構成するアミノ酸種Xの残基数Nの二次関数により定義されたΔGXAggrの総和として算出し、該ペプチドの会合のギブス自由エネルギーΔGAggrを用いて、下式(2)により上記ペプチド付加生体分子の溶解度Sを計算する方法を要旨とする。
ΔGXAggr=ΔGAggr0+ΔGXAggr1N+ΔGXAggr2N2 式(1)
(上式(1)中、Xは上記生体分子に付加されるアミノ酸種、ΔGXAggrは該アミノ酸種Xの上記生体分子への付加に伴う会合のギブス自由エネルギー(すなわち、該アミノ酸種Xの会合自由エネルギー)(J/mol)、ΔGAggr0は上記生体分子の会合のギブス自由エネルギー(J/mol)、ΔGXAggr1は該アミノ酸種Xの会合のギブス自由エネルギーの1次の項(J/mol)、ΔGXAggr2は該アミノ酸種Xの会合のギブス自由エネルギーの2次の項(J/mol)、Nは付加したペプチドに含まれる上記アミノ酸種Xの残基数をそれぞれ表す。)
S=exp(ΔGAggr/RT) 式(2)
(上式(2)中、Sは上記ペプチド付加生体分子の溶解度、Rは気体定数、Tは絶対温度、ΔGAggrは上記ペプチドに含まれる全てのアミノ酸種Xに対する各アミノ酸種Xの会合自由エネルギーΔGXAggrの総和(ΣΔGXAggr(J/mol))をそれぞれ表す。)
ここで、標準とする生体分子(標準生体分子)の末端に上記アミノ酸種Xのうちの1種類のアミノ酸種xが付加された変異体を作成し、該変異体を任意の溶媒に対して溶解限界濃度以上に添加した時の可溶性画分の溶液濃度を測定し、上記アミノ酸種xの残基数nを変化させたときの溶解度の変化から、回帰分析法により上記アミノ酸種xの会合のギブス自由エネルギーΔGxAggr1,ΔGxAggr2を下式(3)により算出することができる。
s=exp((ΔGxAggr1n+ΔGxAggr2n2)/RT) 式(3)
(上式(3)中、sは上記変異体の溶解度と上記標準生体分子の溶解度との比、Rは気体定数、Tは絶対温度、xは上記標準生体分子に付加された特定の種類のアミノ酸種、nは該アミノ酸種xの残基数、ΔGxAggr1は該アミノ酸種xの会合のギブス自由エネルギーの1次の項(J/mol)、ΔGxAggr2は該アミノ酸種xの会合のギブス自由エネルギーの2次の項(J/mol)をそれぞれ表す。)
第2の発明は、上記アミノ酸種Xの種類とその残基数Nの組合せパターンの中から、上記ペプチドのアミノ酸配列を選択する際に、上述の溶解度計算方法により各組合せパターンにおけるペプチド付加生体分子の溶解度Sを計算し、該溶解度Sが所望の値となる組合せパターンを選択して、上記ペプチドのアミノ酸配列を設計する方法を要旨とする。
第3の発明は、菌体内又は試験管内で目的タンパク質を、上述の方法により設計したペプチドタグとの融合タンパク質として発現させることにより、上記目的タンパク質の封入体形成を防止する方法を要旨とする。
【0010】
天然構造を有するタンパク質では、一部のアミノ酸はタンパク質の内部に埋もれており、溶媒(水)と接触していないので、タンパク質の溶解性を決定する要因として、内側にあるアミノ酸の影響は小さい。そこで、本発明においては、タンパク質の溶解度をOosawa&Kasaiの分子会合モデルに基づいて理論的に求めるに際し、該タンパク質を構成する全アミノ酸の特性を考慮するのではなく、該タンパク質表面に露出した、末端側のアミノ酸数残基の会合自由エネルギーを用いる。このとき、該末端側にあるアミノ酸数残基を、タンパク質に付加されたペプチドとみなし、このペプチドの溶解度を理論計算により求める方法を提供する。このように、末端側のアミノ酸のみに着目し、該末端側のアミノ酸の会合の起こりやすさを示すミクロな値と、タンパク質間の会合の起こりやすさを示すマクロな値から溶解度を決定することにより、対象とするタンパク質や溶媒条件に制限されず、ペプチドの溶解度を理論計算により精度良く求めることができる。
ここで、該ペプチドタグが付与される対象は、タンパク質に限らずペプチド(本発明では、1アミノ酸も「ペプチド」に拡張して定義する。)を含む生体分子とすることができ、その状態(変性状態または天然状態)、構成するアミノ酸の種類や個数、及びその組み合わせ等について特に限定されない。
かかる生体分子に付加される上記ペプチドとしては、低分子量で立体構造を形成しないものであれば良く、アミノ酸残基数が30残基以下が好ましく、20残基以下がより好ましい。特に3〜15残基の場合には、顕著な溶解度の向上と目的生体分子に対する影響が小さい点で優れた効果が得られる。また、その分子量は、約30,000までが好ましい。アミノ酸残基数や分子量が上記範囲内である場合には、上式(1)で表される近似式において補正パラメータが必要とならず、また上記生体分子を解析研究や医療応用などに利用する場合に、該ペプチドを除去することなく、付加されたままの状態で利用が可能となる点で優れている。
【0011】
モノマー分子同士が結合し凝集していく際にエネルギー(会合自由エネルギー、ΔGAggr)を要する。その値は分子を構成するアミノ酸種によって異なるが、各アミノ酸に対して2つのパラメータ(会合自由エネルギーΔGXAggr1とΔGXAggr2)を用いることにより、構成アミノ酸の会合自由エネルギーΔGXAggrの総和を計算することで、溶解度を求めることができる。
【0012】
上記ΔGXAggr1及びΔGXAggr2は、任意の溶液条件下で実験的に決定することができる。
この決定方法としては、標準とする生体分子(標準サンプル)に付加されるアミノ酸の残基数を変化させたときの溶解度曲線を通常の方法により求め、この結果から回帰分析法により求めることができる。具体的には、以下の手順により決定できる。
先ず標準サンプルの末端に所定のアミノ酸種xを1〜数個付加してアミノ酸残基数の異なる該生体分子の変異体を作成する(Kato.A. et al.,Biopolymers.,vol.85,no.1,p12−18,2006参照)。
該変異体としては、例えば上記アミノ酸残基数が1,3,5,7となるように付加されたものが挙げられる。
次に、得られた変異体を溶媒に任意の条件下で、見かけ上溶解が限界をやや超えた状態(溶液が少し白濁する状態)になるまで添加し、得られた溶液を平衡状態に至るまで遠心分離して上清と沈殿に分ける。続いて、沈殿を除き、上清(可溶性画分)を得る。
ここで使用する溶媒としては、水溶液系であれば特に限定されず、通常使用されるものがいずれも使用可能である。また、緩衝液は使用する溶媒のpHにあわせて、適宜選択されればよく、例えばグリシン緩衝液、アセテート緩衝液、フォスフェート緩衝液、Tris緩衝液等が挙げられる。濃度は、適宜選択すれば良いが、溶解度への影響を最小限に抑えるために50mM程度であることが好ましい。
また、温度やpH、塩濃度など、その他の溶媒条件は、適宜選択すれば良く、例えば温度4℃、pH7.0等が挙げられる。
上記遠心条件としては、生化学分野において通常使用される条件であれば特に限定されず、例えば20,000×gで4℃にて1時間等が使用可能である。この時、平衡状態に至っていることを確認することが必要である。例えば、得られた可溶性画分を測定条件下で保管した後、例えば6,12,24時間経過毎に再度濃度を測定し、濃度が変わらないことを確認すればよい。また、凝集の可逆性を確認する必要がある。例えば、測定に用いた緩衝液を不溶性画分に加え、該不溶性画分が可溶性画分に移行することで可逆性が確認できる。
そして、この可溶性画分の溶液濃度を分光光度計により測定し、これを溶解度と規定して、上記アミノ酸の残基数を変数とする溶解度曲線を求める。
そして、上記アミノ酸の残基数を変化させたときの溶解度の変化から、回帰分析法により上記アミノ酸の会合自由エネルギーΔGxAggr1,ΔGxAggr2を上式(3)により決定する。
上記標準サンプルとしては、特に制限されないが、発現・精製が容易で、分光学的にサンプル濃度を測定することが可能なトリプトファン又はチロシンを含み、且つ測定条件下で完全に天然状態又は完全に変性状態であるものであればよい。また、溶解度が数100μM〜1mMであることが好ましい。更に、分子量は2,000以上でることが好ましく、1万程度であることがより好ましい。具体的に例示すれば、ウシ膵臓トリプシン阻害物質BPTI(Bovine Pancreatic Trypsin Inhibitor)の変異体であるBPTI−21やBPTI−22(BPTIの第21位、第22位がそれぞれ置換されたもの)、或いはBPTI−22の第40〜58位のアミノ酸配列からなるペプチド断片をSS結合により管状化したもの、Cys(GlyAlaAlaSerAlaAla)4CysGlyGly配列を基本として人工設計したペプチド断片等が挙げられる。
【0013】
以上のようにして、全20種類のアミノ酸について、任意の溶媒条件下における2つのパラメータΔGXAggr1とΔGXAggr2を求めることで、該パラメータは各アミノ酸固有の値であるので、任意のアミノ酸配列を有する種々のペプチドの会合自由エネルギー(ΔGAggr)を自在に求めることができ、更にこのペプチドの会合自由エネルギーΔGAggr(該ペプチドに含まれる上記アミノ酸種Xの会合自由エネルギーΔGXAggrの総和ΣΔGXAggr)から熱力学的理論に基づく上式(2)により該ペプチドが付加された生体分子の溶解度を求めることができる。
かかるパラメータは、pH依存性が低く、比較的広いpH範囲で補正を加えずに、上式(2)に用いることができるが、温度と塩濃度の溶媒条件に対しては変化が大きく、適宜補正が必要になる。
また、物理化学的性質が比較的似ているアミノ酸同士(ロイシンとイソロイシン、アスパラギンとグルタミン酸など)のパラメータは、比較的同じ値を示す傾向にある。従って、開発コストを抑えるために、代表的なアミノ酸のパラメータを決定し、それらを他のアミノ酸のパラメータとして代用することで、求めたいサンプルのおおよその溶解度を見積もることも有効である。
このようにペプチド付加生体分子の溶解度をアミノ酸配列から計算する方法は、汎用性が高く、タンパク質が関係する先端研究開発分野や医療応用分野等において溶解度に起因する問題を解決するための手法として有効である
【0014】
第2の発明は、上式(1)〜(3)を用いることで、所望の溶解度を有するペプチドタグを設計(同定)する方法である。
例えば、後述のように、2つのパラメータΔGXAggr1,ΔGXAggr2の値が高いアルギニンやリジンの組み合わせによるアミノ酸配列からなるペプチドタグにおいては、高い溶解度が得られる。
図3に、高い溶解度を導くタグを付加したことによるNMRスペクトルの改善状態を示す。図3(A)は、“BPTI−22(3.8mM)”のHSQCスペクトルであり、該濃度(3.8mM)では写真のサンプルは白濁していて沈殿が多いため、クロスピークの形が不均一でブロードになっていることから解析不能であることがわかる。これ対し、図3(B)は、BPTI−22のC末端に5個のアルギニン(R)を付加した変異体(“BPTI−22―C5R(3.8mM)”)の同一測定時間(20分)におけるHSQCスペクトルであり、同じ分子量であるにもかかわらず写真のサンプルでは沈殿が減少しており溶解度が向上したため、良好なスペクトルの質が得られることがわかる。
【0015】
かかるペプチドタグのアミノ酸の残基数としては、タグ自体の分子量が大きすぎると、目的タンパク質の機能発現や精製、構造解析などに影響を及ぼす虞があるため、好ましくは1〜20残基、さらに好ましくは3〜15残基である。
【0016】
第3の発明は、第1または第2の発明による方法で設計したペプチドタグを、目的タンパク質に付与することにより、封入体の形成を防止するタンパク質の合成方法である。
上記目的タンパク質については、状態(変性または天然)や、構成するアミノ酸の種類、個数、組合せについて特に限定されない。
【0017】
第3の発明におけるペプチドタグのアミノ酸残基数は1〜20残基であり、好ましくは、3〜15残基、より好ましくは、5〜10残基である。アミノ酸残基数が上記範囲内である場合には、溶解度が向上し、封入体としての発現を抑えることができる。アミノ酸残基数が上記範囲を超えると、ペプチドタグ自体の分子量が大きすぎるために、目的タンパク質の機能発現や精製、構造解析などに影響を及ぼす虞が生じる。
菌体内での封入体形成抑制能は、目的タンパク質の末端にペプチドタグを融合させた融合タンパク質を発現・精製し、菌体破砕後、遠心を行い、可溶性画分と不溶性画分におけるそれぞれの濃度をSDS−PAGEにより定量化して求める。また、試験管内での凝集体形成抑制能は、目的タンパク質の末端にペプチドタグを融合させた融合タンパク質を発現・精製し、遠心分離後、可溶性画分の濃度を分光学的に定量化して求める。
封入体形成抑制能は付加するペプチドタグの長さと関係があり、使用するペプチドタグのアミノ酸残基数に依存して、封入体の発現量が減少する。
実際に、Caspase-Activated DNase (CAD)タンパク質の第1〜86位のアミノ酸配列からなるペプチド断片のC末端にアミノ酸残基数の異なる3種類のペプチドタグを融合させた変異体をそれぞれ作成し、封入体への影響を解析したところ、溶解度の向上を可能にするペプチドタグを付加することで封入体が抑制されることが明らかになった。
例えば、9残基のアミノ酸からなるペプチドタグを付加したとき、封入体形成が9割以上防止できるようになった。このことは、封入体の形成が、タンパク質の溶解度と相関関係にあることを示唆している。従って、本発明により設計される溶解度向上ペプチドタグを用いることにより、汎用性の高い封入体の形成抑制技術を提供することができる。
【0018】
このようなペプチドタグは、目的タンパク質のN末端、C末端のいずれかに付与しても良いし、N末端、及びC末端の両末端に付与しても構わないが、目的タンパク質の立体構造によってはN末端、及びC末端の両末端にペプチドタグを付与することにより、これらに相互作用を生じ、目的タンパク質の機能発現や立体構造に影響を及ぼす場合もあり得る。そのような場合には、N末端かC末端のいずれかにペプチドタグを付与すると良い。
また、該ペプチドタグには必要に応じてリンカーを付与しても良い。リンカーとしては、グリシン、及び/またはプロリンを挙げることができ、1〜5残基程度、好ましくは2〜5残基程度とする。該ペプチドタグにリンカーを付与するのは、タグ自体に柔軟性を持たせること、及び目的タンパク質と設計されるペプチドタグとの間に距離を置くことにより、それらの間における相互作用を防止することを目的とするためである。
【0019】
上記ペプチドタグを目的タンパク質に付与して融合タンパク質を得る方法としては、特に制限されるものではないが、例えば該融合タンパク質を発現する遺伝子を用いた遺伝子組み換えにより、セルフリー(インビトロ)合成や大腸菌や酵母などの宿主を形質転換し、得られた宿主を培養することによりこれを得る方法、シンセサイザーなどを用いた化学的合成による方法などを挙げることができる。
【発明の効果】
【0020】
本願第1の発明は、従来の疎水性・親水性モデルに基づく溶解度計算法とは異なり、生体分子の凝集の熱力学モデルを用い、1分子の会合自由エネルギーの値と生体分子の溶解度の関係から溶解度を熱力学法則に従った物理化学的に理論計算するものであり、タンパク質発現やペプチド合成を行う前に、高い精度で定量的に溶解度を予測することを可能にする。
従って、
1.溶解度が低いペプチドやタンパク質を取り扱う場合や高濃度でタンパク質を溶解する必要がある場合(高濃度での機能解析やNMRによる構造解析)など、或いはプロテインチップやマイクロバイオリアクターの作成、精製の高率化など、溶解度が問題となる種々の場合において、膨大な母集団のペプチドやタンパク質を対象とする網羅的解析を行う際に、予め効率良くターゲットを選定することができる。
2.対象ペプチドや目的タンパク質の溶解度計算において、任意のpH、温度、塩濃度などの溶媒条件下で使用可能であり、汎用性に優れた溶解度予測を行うことができる。これにより、例えば図2に示すような、アミノ酸配列、溶媒条件、タンパク質の立体構造を入力データとする溶解度計算システムの開発への応用が期待できる。
【0021】
また、第2の発明によれば、上記溶解度を求める方法を用いることで、所望の溶解度とするペプチドタグを設計することができる。
従って、
3.溶解度が低いペプチドやタンパク質を解析対象とする場合に、解析対象の機能や構造、安定性などを変えずに、その溶解度を飛躍的に向上させることが可能なペプチドタグを付与すること等で、効率的な解析を可能にし、解析コストの削減を図ることが可能になる。
4.ペプチド合成に際し、予め対象とするペプチドの溶解度を設計することができる。
【0022】
さらに、第3の発明は、タンパク質の凝集性の傾向と大腸菌内の封入体形成の強い相関関係に着目した知見に基づくものであり、上述のようにして設計したタグを目的タンパク質に付加することにより、大腸菌内において封入体の形成を防止できる。
従って、
5.可溶化したタンパク質を産生することができ、収量の向上が図られる。
6.数種類のペプチドタグで大抵のタンパク質の溶解度向上が可能となり、汎用性の高い封入体防止発現ベクターの開発への応用が期待できる。
【発明を実施するための最良の形態】
【0023】
実施例1
〔融合タンパク質の合成〕
本実施例1では、目的タンパク質として難溶性タンパク質ウシ膵臓トリプシン阻害タンパク質(Bovine Pancreatic Trypsin Inhibitor;BPTI)において22個のAlaを有する変異体BPTI−22(58aa、分子量5,880)を使用した。
タンパク質の発現には、pMMHaBPTI−22発現ベクター(J.Mol.Biol.,Vol.298,p493−501,2000参照)を用いた。この発現ベクターは、Stratagene社製の試薬キット(商品名:QuikChangeIIXLSite−Directed Mutagenesis Kit)を用いてtrpΔLEリーダー配列のN末端にHisタグ配列が付加してある。
この発現ベクターで大腸菌JM109(DE3)pLysSをトランスフォーメーションし、得られたコロニーを50μg/mlのアンピシリンと34μg/mlのクロラムフェニコールを含む100mlのLB培地に直接植菌し、37℃で6時間振盪培養した。その後、2LのLB培地に植菌し、 37℃で一晩振盪培養した。得られた培養液を500mlの遠心管に移し、5,000×g、4℃にて20分間遠心分離を行い、集菌した。集菌後の菌体を100mMTris−HCl緩衝液(pH8.7)に懸濁し、7,000×g、4℃にて20分間再び遠心して洗浄した。
洗浄後の菌体は、培養液2L分の菌体を50mlの遠沈管にて集菌し、菌体重量に対して約10倍量の緩衝液A(50mMTris−HCl(pH8.7)、150mMNaCl)に懸濁した。懸濁液を氷冷しながら、懸濁液が半透明になるまで超音波破砕を行った。
破砕後、7,000×g、4℃にて20分間遠心分離を行って上清を除き、不溶性画分を得た。
再び不溶性画分を緩衝液B(50mMTris−HCl(pH8.7)、1容積%NP−40、1重量%Deoxycholic acid、1mMEDTA)で懸濁し、超音波破砕を行なった。液が白色になるまでこの操作を3回繰り返した。
目的タンパク質は大腸菌内で封入体を形成するため、遠心後は不溶性画分を得た。
続いて、不溶性画分(封入体を形成をしたタンパク質)を6MGuHCl(pH8.7)で可溶させ、BPTI変異体分子内のCys5とCys55においてS−S結合をさせるために、10時間攪拌させ空気酸化させた。その後、50mMTris−HCl緩衝液(pH8.7)で透析を行い、6MGuHClを除くと沈殿が現れた。これは、目的タンパク質に付加しているtrpΔLEリーダー配列を持つタグタンパク質がpH8.7において沈殿するために、目的タンパク質も沈殿するためである。
この沈殿を7,000×g、4℃にて20分間遠心分離で回収し、沈殿重量に対して10倍量の70%formic acidを加え、室温にて6時間CNBr反応(10mg/ml CNBr/70% formic acid)を行い、目的タンパク質からタグタンパク質を切断した。
更に、約2時間Speed vacした後、mill-Qで一晩透析した。そして、10mMリン酸塩緩衝液(pH6.0)で透析を一晩行った。透析後、7,000×g、4℃にて20分間遠心分離を行い、沈殿(タグタンパク質)を除き、可溶性画分から融合タンパク質(上記BPTI−22のN末端又はC末端にGGnR配列(nはアルギニン(R)の残基数であり、n=1,3,5)を有するペプチドタグが付加された融合タンパク質)を得た。
この溶液に酢酸を加え、HPLCにより精製した。精製に用いた逆相カラム(YMC−Pack PROTEIN−RP S,5μm)は25%アセトニトリルで平衡化させ、タンパク質をカラムに吸着させた。吸着後、リニアグラジエント(25〜60%,アセトニトリルの増加率:1%/分)をかけ、カラムに吸着させたタンパク質を溶出させた。
そして、溶出液の220nmにおける吸光度をオンラインで測定した。この時、流速は8.0ml/分とした。
吸光度にピークが現れたフラクションをESI−TOFMS“JMS−T100X”(日本電子社製)を用いて分子量を同定し、精製標品を凍結乾燥し、−80℃で保存した。
〔パラメータΔGXAggr1、ΔGXAggr2の決定〕
このようにして得られた融合タンパク質(C末端にGGnR配列を有するペプチドタグが付加された融合タンパク質)を100mM酢酸緩衝液(pH4.7)に溶解し、生じた沈殿を20,000×g、4℃で1時間の遠心分離により除去した。尚、タンパク質は基本的にすべての実験操作において氷上で取り扱った。
分光光度計により280nmの吸光度を測定して、20℃、pH7.0における溶解限界濃度を求め、これを溶解度とした。そして、“付加したアミノ酸残基数”と“溶解度”との関係を実験的に求めた。その結果を図4に示す。
図4中、横軸は付加したアミノ酸残基数、縦軸は溶解度をそれぞれ示し、標準ペプチド(何も付加していない)の溶解度を“1”とした。
続いて、この溶解度曲線から(即ち、実験的に求めた“溶解度”から)付加したアミノ酸の個数Nに対する回帰分析法によって2つのパラメータΔGXAggr1、ΔGXAggr2(J/mol)を求めた。
この結果、アルギニン(R)のΔGRAggr1は4.72J/mol、ΔGRAggr2は143.65J/molと決定した。
また、アルギニンと同様にして、リジン(K)についても2つのパラメータΔGXAggr1、ΔGXAggr2(J/mol)を求めたところ、ΔGKAggr1は4.72J/mol、ΔGKAggr2は130.47J/molとなった。
【0024】
〔ペプチドタグ融合タンパク質の溶解度計算〕
実験では、ペプチドタグを付与していないBPTI−22タンパク質と、アルギニンタグ(RRRGG、RRRRRGG(「GG」はリンカー残基として付与))をBPTI−22のN末端に付加した融合タンパク質との溶解度を測定した。
即ち、各タンパク質に100mM酢酸緩衝液(pH4.7)を白濁(凝集)するまで加え(約100μl)、これらタンパク質溶液20,000×gを4℃、1時間の条件下で遠心分離した。そして、該タンパク質溶液の可溶性画分について、分光光度計にて280nmにおける吸光度を計測し、タンパク質濃度を求め、この測定値を溶解度とした。
この結果、上記ペプチドタグを付与した融合タンパク質の溶解度は、BPTI−22タンパク質の溶解度(1.70mM)と比較して、アミノ酸配列がRRRGGであるペプチドタグを付加した場合(溶解度は2.70mM)で1.59倍、アミノ酸配列がRRRRRGGであるペプチドタグを付加した場合(溶解度は6.20mM)で3.65倍それぞれ実験的に向上することを確認した。
一方、上述のようにして求めたアルギニンのΔGRAggr1(4.72J/mol)及びΔGRAggr2(143.65J/mol)を上式(1)に代入し、上記ペプチドタグのΔGRAggrを求めた。
ここで、該ペプチドタグはいずれもアルギニンのみから構成されているので、ΔGRAggr=ΔGAggrとなり、該ペプチドタグの溶解度は上式(2)から導かれる。
アルギニンを3個付加したタンパク質の溶解度は以下のとおり;
ΔGAggr=4.72×3+143.65×32=1307.01J/mol
となり、277.15K(4°C)における両タンパク質の溶解度の比は
S=exp(1307.01/(8.314×277.15))=1.76
よって、4°Cの温度では、アルギニンを3個付加したタンパク質の溶解度は付加していないものより溶解度が1.76倍向上すると計算され、上記の実験で測定した1.59倍とよく一致した。
同じようにアルギニンを5個付加したタンパク質の溶解度は以下のとおり;
ΔGAggr=4.72×5(=23.6)+143.65×52(3591.25)=3614.85J/mol
となり、277.15K(4°C)での両タンパク質の溶解度の比は
S=exp(3614.85/(8.314×277.15))=4.80
よって、4°Cの温度では、アルギニンを5個付加したタンパク質の溶解度は付加していないものより溶解度が4.80倍向上すると計算され、上記の実験で測定した3.65倍と24%の誤差で理論値と実測値が一致した。
以上のようにして求めた計算による溶解度の値と実測値を比較したところ、両者は近似しており、本発明の計算方法により、精度良く溶解度の計算を行うことができることが検証された。
また、ペプチドタグの溶解度は、タグを構成するアミノ酸の種類と個数を変数に依存しており、それらアミノ酸の配列順序には大きく左右されないことが確認できた。
【0025】
次に、このペプチドタグが付与された融合タンパク質溶液3.8mMと、該ペプチドタグ付与がないBPTI−22溶液を解析サンプルとして用い、NMR法により15N−HSQCスペクトルをそれぞれ測定した。
この結果を図3に示す。ここでは、BPTI−22のC末端に5個のアルギニン(R)を付加した変異体(“BPTI−22―C5R(3.8mM)”)と、BPTI−22との同一測定時間(20分)におけるHSQCスペクトルを比較した。図3から明らかなよう、上記融合タンパク質においては、S/N比、クロスピークの線幅及び形態でスペクトル質の評価から、測定時間がタグなしの試料の約1/8で得られる上、上質なNMRスペクトルが得られた。従って、上記ペプチドタグの付加により、タンパク質の機能、構造及び安定性を変えずに、その溶解度を大きく向上させることが可能となることが明らかとなった。
【0026】
実施例2
本実施例2では、目的タンパク質として難溶性タンパク質ウシ膵臓トリプシン阻害タンパク質(Bovine Pancreatic Trypsin Inhibitor;BPTI)において22個のAlaを有する変異体BPTI−22のN末端にリジン残基を3,5個付加し、計算結果と比較した。
実験では、ペプチドタグを付与していないBPTI−22タンパク質と、リジンタグ(KKKGG、KKKKKGG)をBPTI−22のN末端に付加した融合タンパク質との溶解度を実例1と同様の方法で測定した。
即ち、各タンパク質に100mM酢酸緩衝液(pH4.7)を白濁(凝集)するまで加え(約100μl)、これらタンパク質溶液20,000×gを4℃、1時間の条件下で遠心分離した。そして、該タンパク質溶液の可溶性画分について、分光光度計にて280nmにおける吸光度を計測し、タンパク質濃度を求め、この測定値を溶解度とした。
この結果、上記ペプチドタグを付与した融合タンパク質の溶解度は、BPTI−22タンパク質の溶解度(1.70mM)と比較して、アミノ酸配列がKKKGGであるペプチドタグを付加した場合(溶解度は2.66mM)で1.56倍、アミノ酸配列がKKKKKGGであるペプチドタグを付加した場合(溶解度は5.37mM)で3.16倍それぞれ実験的に向上することを確認した。
一方、上述のようにして求めたリジンのΔGKAggr1(4.72J/mol)及びΔGKAggr2(130.47J/mol)を上式(1)に代入し、上記ペプチドタグのΔGKAggrを求めた。
ここで、該ペプチドタグはいずれもリジンのみから構成されているので、ΔGKAggr=ΔGAggrとなり、該ペプチドタグの溶解度は上式(2)から導かれる。
リジンを3個付加したタンパク質の溶解度は以下のとおり;
ΔGAggr=4.72×3+130.47×32=1188.39J/mol
となり、277.15K(4°C)における両タンパク質の溶解度の比は
S=exp(1188.39/(8.314×277.15))=1.67
よって、4°Cの温度では、リジンを3個付加したタンパク質の溶解度は付加していないものより溶解度が1.67倍向上すると計算され、上記の実験で測定した1.56倍とよく一致した。
同じようにリジンを5個付加したタンパク質の溶解度は以下のとおり;
ΔGAggr=4.72×5(=23.6)+130.47×52(3261.75)=3285.35J/mol
となり、277.15K(4°C)での両タンパク質の溶解度の比は
S=exp(3285.35/(8.314×277.15))=4.16
よって、4°Cの温度では、リジンを5個付加したタンパク質の溶解度は付加していないものより溶解度が4.16倍向上すると計算され、上記の実験で測定した3.16倍と24%の誤差の範囲で一致した。
以上のようにして求めた計算による溶解度の値と実測値を比較したところ、両者は近似しており、本発明の計算方法により、精度良く溶解度の計算を行うことができることが検証された。
【0027】
実施例3
〔アミノ酸Xの種類とその残基数Nの組合せパターン〕
先ず、pAEDベクター を用いて<1>目的タンパク質、<2>目的タンパク質の末端にペプチドタグが付与された融合タンパク質、<3>該融合タンパク質にHisタグを さらに付与したサンプル、<4>上記目的タンパク質の末端にHisタグが付与されたサンプル、の四つのコンストラクトを大腸菌内 で発現させた。
ここで、上記目的タンパク質には、分子量6kD〜30kDのBPTを用いた。また、上記ペプチドタグとしては、GGRn配列(nはアルギニン(R)の残基数であり、n=1,3,5)からなるものを用いた。
そして、各コンストラクトが目的タンパク質に対して溶解度向上が最大になるように配列を再設計した。
アルギニンを1個付加したタンパク質の溶解度は以下のとおり;
ΔGXAggr=4.72×1+143.65×12=2317.28J/mol
よって、300Kの温度では、アルギニンを1個付加したタンパク質の溶解度は付加していないものより溶解度が1.06倍向上すると計算される。
また、アルギニンを3個付加したタンパク質の溶解度は以下のとおり;
ΔGXAggr=4.72×3+143.65×32=1307.01J/mol
よって、300Kの温度では、アルギニンを3個付加したタンパク質の溶解度は付加していないものより溶解度が1.71倍向上すると計算される。
同じようにアルギニンを5個付加したタンパク質の溶解度は以下のとおり;
ΔGXAggr=4.72×5+143.65×52=3614.85J/mol
よって、300Kの温度では、アルギニンを5個付加したタンパク質の溶解度は付加していないものより溶解度が4.26倍向上すると計算される。
以上の計算結果から、アミノ酸5残基が付与された場合に溶解度が最大となった。
この結果より、各コンストラクトが目的タンパク質に対して溶解度向上が最大になるペプチドタグのアミノ酸配列は、GG5Rであることがわかった。
〔溶解度向上タグによる封入体形成防止〕
実施例4
本実施例4では、目的タンパク質として塩基性タンパク質CAD(Caspase−Activated Dnase)の第34位のCysをSerに置換した変異体の第1〜86位のアミノ酸配列を有するペプチド断片CAD1-86C34S変異体を使用した。
先ず、CAD1-86C34S変異体のC末端側に3,6,9個のアルギニン残基をペプチドタグとして付加した融合タンパク質を作成し、それぞれC0R(付加数0)、C3R(付加数3)、C6R(付加数6)、C9R(付加数9)とした。
【0028】
即ち、大腸菌BL21(DE3)pLysSを宿主として用い、培養温度を25℃とした場合と37℃とした場合についてそれぞれ調べた。OD590nm=0.6〜0.7の範囲でIPTGを添加し、発現誘導を行った。その後、4時間培養し、ODを測定後、200μlにおけるOD値が8.0になるように各サンプルを調整した。
これらのサンプルを精製し、菌体破砕後、15,000×gで15分間遠心を行い、上清(可溶性画分)と沈殿(不溶性画分)をそれぞれ回収し、沈殿には10mMトリス緩衝液(pH8.0)200μlを加え、SDG−PAGEにより定量解析し、封入体形成への影響を調べた。この結果を図5に示す。
図5より、25℃の培養条件では、アルギニン残基の付加数が増える(タグの長さが長くなる)ほど、不溶性画分(ppt)中のタンパク質量が減少し(即ち、可溶性画分(sup)中のタンパク質量が増加し)ており、付加するアミノ酸が長くなるにつれて溶解度が向上し、封入体形成防止に効果があることがわかった。なお、アルギニン系タグ付加が37℃で溶解効果を発揮せず25℃で効果を持つのは、CAD1-86C34S変異体は高温では構造を形成できず、凝集しやすい状態になるが、25℃では構造を形成し、タグを付加することで封入体形成を防止できると考えられ、他にも不安定なタンパク質に於いては、タグを付加すると同時に培養温度を下げることでタグの効果が最大限に利用できると思われる。
このように、塩基性タンパク質が形成する封入体の防止には、アルギニンを基本とした溶解度向上ペプチドタグが効果的なことが明らかになった。
【0029】
実施例5
本実施例5では、目的タンパク質として酸性タンパク質N−intein(127aa、分子量14388.2)を使用した。
実施例4と同様にして、N−inteinタンパク質のC末端に3,6,9個のアスパラギン酸をペプチドタグとして付加した融合タンパク質を作成し、それぞれC0R(付加数0)、C3R(付加数3)、C6R(付加数6)、C9R(付加数9)とした。
発現宿主にはBL21(DE3)pLysSを使用し、培養温度を37℃とした。OD590nm=0.6〜0.7の範囲でIPTGを添加して発現誘導した。その後、4時間培養し、実施例4と同様にして封入体形成への影響を調べた。この結果を図6に示す。
図6に示すように、全菌体 (all) についてはサンプル間で発現量に殆ど差異は見られないものの、可溶性画分(sup)では大きく異なり、アスパラギン酸残基数が多くなるとともに可溶性画分での発現量が増え、C9Dでは殆どすべてのタンパク質が可溶性画分として発現した。即ち、アスパラギン酸残基を9残基付加することにより、N−inteinが形成する封入体を防止できることがわかった。
このことから、酸性タンパク質が形成する封入体の防止には、アスパラギン酸系タグの付加が有効であることが明らかになった。
また、実施例4及び実施例5より、溶解度向上ペプチドタグの封入体形成防止効果は、塩基性・酸性のいずれのタンパク質でも得られることが明らかになった。
更に、CAD1-86C34S変異体の等電点(pI)及びアルギニンのpKaはそれぞれ9.77及び12.5であり、一方N−inteinの等電点(pI)及びアスパラギン酸のpKaはそれぞれ4.36及び3.9〜4.0であることから、封入体形成を防止するための溶解度向上ペプチドタグは、目的タンパク質の等電点を基にして設計することが効果的であると予想された。
【産業上の利用可能性】
【0030】
本発明は、例えば、以下のようなケースに応用が示唆される。
・バイオリアクター、プロテインチップなどで高濃度の酵素・タンパク質を使用したいとき。
・インクジェットプリンターなどにおいて、インク使用中に溶解度が低くなった際に、有機物が沈殿することを防ぎたいとき。
・ペプチド(タンパク質)の封入体の形成の傾向性を予測したいとき。
・ペプチド、ホルモン、酵素、変性タンパク質等、溶解度が低い球状タンパク質、膜タンパク質等を可溶化したいとき。
【図面の簡単な説明】
【0031】
【図1】生体分子の凝集を表す熱力学モデルの模式図である。
【図2】溶解度計算システムの入力画面の例を示す図である。
【図3】溶解度向上ペプチドタグの付加による「溶液状態(写真)」及び「NMRスペクトル」の比較を示し、(A)はBPTI−22の状態であり、(B)はBPTI−22−C5Rの状態である。
【図4】アルギニンについて実験的に求めた溶解度曲線である。
【図5】アルギニン系タグ付加がCAD1-86C34S変異体の封入体形成に与える影響及び培養温度依存性を示すSDG−PAGEの写真であり、(A)は培養温度を37℃とした場合、及び(B)は25℃とした場合である。
【図6】アスパラギン酸系タグ付加がN−inteinタンパク質の封入体形成に与える影響を示すSDG−PAGEの写真である。
【符号の説明】
【0032】
ΔGAggr 会合自由エネルギー
【特許請求の範囲】
【請求項1】
生体分子の末端に任意のアミノ酸配列からなるペプチドが付加されたペプチド付加生体分子の溶解度Sを熱力学的理論に基づき計算する方法であって、上記ペプチドの会合のギブス自由エネルギーΔGAggrは、下式(1)で表される上記アミノ酸配列を構成するアミノ酸種Xの残基数Nの二次関数により定義されたΔGXAggrの総和として算出し、該ペプチドの会合のギブス自由エネルギーΔGAggrを用いて、下式(2)により上記ペプチド付加生体分子の溶解度Sを計算することを特徴とする溶解度計算方法。
ΔGXAggr=ΔGAggr0+ΔGXAggr1N+ΔGXAggr2N2 式(1)
(上式(1)中、Xは上記生体分子に付加されるアミノ酸種、ΔGXAggrは該アミノ酸種Xの上記生体分子への付加に伴う会合のギブス自由エネルギー(J/mol)、ΔGAggr0は上記生体分子の会合のギブス自由エネルギー(J/mol)、ΔGXAggr1は該アミノ酸種Xの会合のギブス自由エネルギーの1次の項(J/mol)、ΔGXAggr2は該アミノ酸種Xの会合のギブス自由エネルギーの2次の項(J/mol)、Nは付加したペプチドに含まれる上記アミノ酸種Xの残基数をそれぞれ表す。)
S=exp(ΔGAggr/RT) 式(2)
(上式(2)中、Sは上記ペプチド付加生体分子の溶解度、Rは気体定数、Tは絶対温度、ΔGAggrは上記ペプチドに含まれる全てのアミノ酸種Xに対する各アミノ酸種Xの会合自由エネルギーΔGXAggrの総和(ΣΔGXAggr(J/mol))をそれぞれ表す。)
【請求項2】
標準とする生体分子の末端に上記アミノ酸種Xのうちの1種類のアミノ酸種xが付加された変異体を作成し、該変異体を任意の溶媒に対して溶解限界濃度以上に添加した時の可溶性画分の溶液濃度を測定し、上記アミノ酸種xの残基数nを変化させたときの溶解度の変化から、回帰分析法により上記アミノ酸種xの会合のギブス自由エネルギーΔGxAggr1,ΔGxAggr2を下式(3)により算出することを特徴とする請求項1記載の溶解度計算方法。
s=exp((ΔGxAggr1n+ΔGxAggr2n2)/RT) 式(3)
(上式(3)中、sは上記変異体の溶解度と上記標準生体分子の溶解度との比、Rは気体定数、Tは絶対温度、xは上記標準生体分子に付加された特定の種類のアミノ酸種、nは該アミノ酸種xの残基数、ΔGxAggr1は該アミノ酸種xの会合のギブス自由エネルギーの1次の項(J/mol)、ΔGxAggr2は該アミノ酸種xの会合のギブス自由エネルギーの2次の項(J/mol)をそれぞれ表す。)
【請求項3】
上記アミノ酸種Xの種類とその残基数Nの組合せパターンの中から、上記ペプチドのアミノ酸配列を選択する際に、請求項1又は請求項2記載の溶解度計算方法により各組合せパターンにおけるペプチド生体付加分子の溶解度Sを計算し、該溶解度Sが所望の値となる組合せパターンを選択して、上記ペプチドのアミノ酸配列を設計するペプチドタグの設計方法。
【請求項4】
菌体内又は試験管内で目的タンパク質を、請求項3記載の方法により設計したペプチドタグとの融合タンパク質として発現させることにより、上記目的タンパク質の封入体形成を防止する方法。
【請求項5】
上記ペプチドタグが1〜20残基のアミノ酸であることを特徴とする請求項4記載の封入体形成を防止する方法。
【請求項1】
生体分子の末端に任意のアミノ酸配列からなるペプチドが付加されたペプチド付加生体分子の溶解度Sを熱力学的理論に基づき計算する方法であって、上記ペプチドの会合のギブス自由エネルギーΔGAggrは、下式(1)で表される上記アミノ酸配列を構成するアミノ酸種Xの残基数Nの二次関数により定義されたΔGXAggrの総和として算出し、該ペプチドの会合のギブス自由エネルギーΔGAggrを用いて、下式(2)により上記ペプチド付加生体分子の溶解度Sを計算することを特徴とする溶解度計算方法。
ΔGXAggr=ΔGAggr0+ΔGXAggr1N+ΔGXAggr2N2 式(1)
(上式(1)中、Xは上記生体分子に付加されるアミノ酸種、ΔGXAggrは該アミノ酸種Xの上記生体分子への付加に伴う会合のギブス自由エネルギー(J/mol)、ΔGAggr0は上記生体分子の会合のギブス自由エネルギー(J/mol)、ΔGXAggr1は該アミノ酸種Xの会合のギブス自由エネルギーの1次の項(J/mol)、ΔGXAggr2は該アミノ酸種Xの会合のギブス自由エネルギーの2次の項(J/mol)、Nは付加したペプチドに含まれる上記アミノ酸種Xの残基数をそれぞれ表す。)
S=exp(ΔGAggr/RT) 式(2)
(上式(2)中、Sは上記ペプチド付加生体分子の溶解度、Rは気体定数、Tは絶対温度、ΔGAggrは上記ペプチドに含まれる全てのアミノ酸種Xに対する各アミノ酸種Xの会合自由エネルギーΔGXAggrの総和(ΣΔGXAggr(J/mol))をそれぞれ表す。)
【請求項2】
標準とする生体分子の末端に上記アミノ酸種Xのうちの1種類のアミノ酸種xが付加された変異体を作成し、該変異体を任意の溶媒に対して溶解限界濃度以上に添加した時の可溶性画分の溶液濃度を測定し、上記アミノ酸種xの残基数nを変化させたときの溶解度の変化から、回帰分析法により上記アミノ酸種xの会合のギブス自由エネルギーΔGxAggr1,ΔGxAggr2を下式(3)により算出することを特徴とする請求項1記載の溶解度計算方法。
s=exp((ΔGxAggr1n+ΔGxAggr2n2)/RT) 式(3)
(上式(3)中、sは上記変異体の溶解度と上記標準生体分子の溶解度との比、Rは気体定数、Tは絶対温度、xは上記標準生体分子に付加された特定の種類のアミノ酸種、nは該アミノ酸種xの残基数、ΔGxAggr1は該アミノ酸種xの会合のギブス自由エネルギーの1次の項(J/mol)、ΔGxAggr2は該アミノ酸種xの会合のギブス自由エネルギーの2次の項(J/mol)をそれぞれ表す。)
【請求項3】
上記アミノ酸種Xの種類とその残基数Nの組合せパターンの中から、上記ペプチドのアミノ酸配列を選択する際に、請求項1又は請求項2記載の溶解度計算方法により各組合せパターンにおけるペプチド生体付加分子の溶解度Sを計算し、該溶解度Sが所望の値となる組合せパターンを選択して、上記ペプチドのアミノ酸配列を設計するペプチドタグの設計方法。
【請求項4】
菌体内又は試験管内で目的タンパク質を、請求項3記載の方法により設計したペプチドタグとの融合タンパク質として発現させることにより、上記目的タンパク質の封入体形成を防止する方法。
【請求項5】
上記ペプチドタグが1〜20残基のアミノ酸であることを特徴とする請求項4記載の封入体形成を防止する方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2009−145313(P2009−145313A)
【公開日】平成21年7月2日(2009.7.2)
【国際特許分類】
【出願番号】特願2008−3983(P2008−3983)
【出願日】平成20年1月11日(2008.1.11)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 〔研究集会名〕第30回日本分子生物学会年会 〔主催者名〕特定非営利活動法人日本分子生物学会 〔開催日〕平成19年12月14日
【出願人】(504132881)国立大学法人東京農工大学 (595)
【Fターム(参考)】
【公開日】平成21年7月2日(2009.7.2)
【国際特許分類】
【出願日】平成20年1月11日(2008.1.11)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 〔研究集会名〕第30回日本分子生物学会年会 〔主催者名〕特定非営利活動法人日本分子生物学会 〔開催日〕平成19年12月14日
【出願人】(504132881)国立大学法人東京農工大学 (595)
【Fターム(参考)】
[ Back to top ]

