ホルマリンおよびUV光での処理によるサンプル中の病原体の不活化
【課題】ホルマリンおよびUV光での処理によるサンプル中の病原体の不活化方法の提供。
【解決手段】本発明は、ウイルス含有サンプルを有効濃度のホルマリンで処理すること、およびそのサンプルをフロースルー装置において有効線量のUV光で処理することによって、ウイルスを不活化するための方法に関する。本出願は、具体的には、サンプル中に含まれるウイルスを不活化するための方法を提供する。この方法は、(i)そのサンプルを有効濃度のホルマリンで処理する工程;および(ii)そのサンプルをフロースルー装置中で有効線量のUV光に供す工程;を包含し、工程(i)は、工程(ii)の前に実施されるかまたはその逆であり、その装置を通るサンプルの流量は、約50L/時間〜約1000L/時間である。
【解決手段】本発明は、ウイルス含有サンプルを有効濃度のホルマリンで処理すること、およびそのサンプルをフロースルー装置において有効線量のUV光で処理することによって、ウイルスを不活化するための方法に関する。本出願は、具体的には、サンプル中に含まれるウイルスを不活化するための方法を提供する。この方法は、(i)そのサンプルを有効濃度のホルマリンで処理する工程;および(ii)そのサンプルをフロースルー装置中で有効線量のUV光に供す工程;を包含し、工程(i)は、工程(ii)の前に実施されるかまたはその逆であり、その装置を通るサンプルの流量は、約50L/時間〜約1000L/時間である。
【発明の詳細な説明】
【技術分野】
【0001】
(発明の分野)
本発明は、ウイルス含有サンプルを有効濃度のホルマリンで処理することによって、およびそのサンプルをフロースルー装置中で有効照射量のUV光で処理することによって、ウイルスを不活化するための方法に関する。
【背景技術】
【0002】
(発明の背景)
医学的製品中の病原体の有効な不活化は、公共に健康に関する問題である。なぜなら、以前には未知であった疾患が、治療の投与を介して急速に伝播し得ることが発見されたからである。従って、バイオテクノロジー製品が、それを使用することによって病原因子を伝達するリスクを低下することを意図する、ますます厳しくなる基準の下で出現している。潜在的な混入物質が、血液製品の製造における問題であるのみならず、安全なワクチンの製造における問題でもある。
【0003】
病原体に対するワクチン(特に、ウイルスワクチン)の製造における最も重要な工程のうちの1つは、ウイルス不活化である。ウイルス不活化の場合、ホルマリンが、ワクチン製造において最も頻繁に使用される不活化剤である。このホルマリン不活化工程は、確立された分析手順を用いて確認されている。しかし、非常に厳密な品質管理試験(例えば、哺乳動物細胞培養試験(例えば、VERO安全性試験))の導入は、いくつかの場合において、残留感染性の証拠を示した。この残留感染性を除去するための努力において、凝集物および/または濾過の機械的破壊が、成功しないことがわかった。
【0004】
ホルマリン処理に対する代替法として、UV不活化が、上記製造プロセス中に組み込むために考えられた。ヒトワクチンのUV照射不活化の使用が、以前に実証されている。非特許文献1および非特許文献2は、ヒトにおける研究からの免疫原性の結果に関して報告しており、この研究において、その著者らは、UV不活化したポリオワクチンを使用した。ポリオウイルスは、非エンベロープピコルナウイルスであり、1つのセグメント中に+鎖の一本鎖RNAゲノムを有する。このウイルスゲノムは、ウイルス表面抗原よりもUV損傷に対して感受性が高いので、ポリオウイルスキャプシドタンパク質の場合、UV不活化は、製品の生化学的特徴にも免疫原性にも、ほとんど負の影響を有さないことが示された。UV不活化のための標的は、ホルマリンにより標的とされるタンパク質とは対照的に、主に核酸である。ホルマリンとUV不活化とを組合わせることによって、科学者達は、特に活発なポリオウイルスを不活化する場合に、単独のUV不活化またはホルマリン不活化それぞれの限界を克服しようとした。例えば、非特許文献3を参照のこと。
【0005】
UV照射技術は、食物、薬剤、化粧品、および飲料の産業、ならびに飲料水において広範な適用範囲を有する。UV殺菌は、物理化学的プロセスであり、このプロセスにおいて、プリン塩基およびピリミジン塩基の環状分子の共有結合が、UV波長照射の励起エネルギーによって破壊され、核酸とその核酸がコードする遺伝情報とを損傷させる。有効なUVC(100nm〜280nm)に対して曝露された微生物(例えば、細菌および酵母など、ならびにウイルス)は、数秒以内に不活化される。結果として、成功する殺菌は、低下等価(reduction−equivalent)照射線量に依存する。平均殺菌照射線量(J/m2で表わす)が、バイオ線量計を使用して照射ゾーンにおいて測定される。しかし、UV不活化単独では、安全かつ有効なワクチンを生成するためには適切ではない。
【0006】
非特許文献4は、ホルマリンと紫外線との組み合わせを用いるポリオウイルスの不活化を記載する。非特許文献5は、紫外線−ホルマリンで不活化したポリオワクチンでワクチン接種された被験体の血液における、測定可能なレベルの循環抗体の形成を記載する。非特許文献6は、ホルマリン、UV光、およびβ−プロピオラクトンからなる3段階不活化プロセスによる、ハムスターにおけるアデノウイルスおよびシミアンウイルス40の腫瘍原性の不活化に関して報告する。非特許文献7は、紫外線とホルマリンとでの処理による、センダイウイルスの免疫原の調製を記載する。上記の構想のうちのいずれも、ワクチン製造における一般的使用のためにこれまで採用されていないが、産業規模で安全かつ有効なワクチンの製造について、絶えず存在する必要性があった。さらに、引用した研究のいずれも、本研究において使用されるVERO安全性試験と同程度に感度が高い、「不活化ウイルス」の残留感染性を決定するための安全性試験を使用していない。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Milzerら、Am.J.Pub.Health(1954)44:26〜33
【非特許文献2】Wolfら、JAMA(1956)161:775〜81
【非特許文献3】McLeanら、Experiences in the Production of Poliovirus Vaccines、Prog.Med.Virol.(1958),vol 1,pp.122〜164
【非特許文献4】Taylorら、J.Immunol.(1957)79:265〜75
【非特許文献5】Molnerら、Am.J.Pub.Health(1958)48:590〜8
【非特許文献6】Truffelliら、Appl.Microbiol.(1967)15:516〜27
【非特許文献7】Miyamae、Microbiol.Immunol.(1986)30:213〜23
【発明の概要】
【課題を解決するための手段】
【0008】
驚くべきことに、本発明者らは、ホルマリン不活化工程とUV不活化工程との組み合わせが、産業規模でのワクチン調製のために不活化ウイルスの製造のための高体積スループット系においてバルクウイルス中のウイルスを完全に不活化するために利用され得る。このことはまた、実施例において使用されるような高力価濃縮ウイルス調製物に関して示されており、実施例において、残留ウイルス活性が、非常に感度の高いVERO細胞培養物試験を使用して検出されなかった。本発明者らはまた、驚くべきことには、この方法は、非エンベロープウイルス(例えば、ポリオピコルナウイルス)と比較して、エンベロープウイルス(例えば、オルトミクソウイルス)について特によく機能することを実証した。この発見は、新生の急速に変化するウイルス疾患(例えば、大流行間性(interpandemic)インフルエンザ株および汎発性(pandemic)インフルエンザ株)のための、安全な非常に免疫原性のワクチンの迅速な製造のための重要な暗示を有する。
【0009】
(発明の要旨)
サンプル中に含まれるワクチンの非常に効率的かつ安全な不活化を可能にし、同時に、その不活化ワクチンの高い抗原性および免疫原性を保持する方法を提供することが、本発明の目的である。具体的には、本発明の方法は、高体積スループット系において、ホルマリン不活化工程をUV不活化工程と合わせて利用して、ワクチン製造において使用するための高抗原含量の安全なバルクウイルス調製物を製造する。
例えば、本願発明は以下の項目を提供する。
(項目1)
サンプル中に含まれるウイルスを不活化するための方法であって、該方法は、
(i)該サンプルを有効濃度のホルマリンで処理する工程;および
(ii)該サンプルをフロースルー装置中で有効線量のUV光に供す工程;
を包含し、工程(i)は、工程(ii)の前に実施されるかまたはその逆であり、該装置を通る該サンプルの流量は、約50L/時間〜約1000L/時間である、方法。
(項目2)
サンプル中に含まれるエンベロープウイルスを不活化するための方法であって、該方法は、
(i)該サンプルを有効濃度のホルマリンで処理する工程;および
(ii)該サンプルをフロースルー装置中で有効線量のUV光に供す工程;
を包含し、工程(i)は工程(ii)の前に実施されるかまたはその逆であり、該エンベロープウイルスは、完全に不活化される、方法。
(項目3)
サンプル中に含まれるエンベロープRNAウイルスを不活化するための方法であって、該方法は、
(i)該サンプルを有効濃度のホルマリンで処理する工程;および
(ii)該サンプルをフロースルー装置中で有効線量のUV光に供す工程;
を包含し、工程(i)は工程(ii)の前に実施されるかまたはその逆であり、該エンベロープウイルスは、完全に不活化される、方法。
(項目4)
サンプル中に含まれるウイルスを不活化するための方法であって、該方法は、
(i)該サンプルを有効濃度のホルマリンで処理する工程;および
(ii)該サンプルをフロースルー装置中で有効線量のUV光に供す工程であって、該装置は、該装置中にUVランプと該UVランプの直径に対して実質的に垂直な薄層チャンバとを備える、工程;
を包含し、工程(i)は、工程(ii)の前に実施されるかまたはその逆であり、該サンプルは、工程(ii)において該装置の薄層チャンバを通される、方法。
(項目5)
項目1〜項目4のうちのいずれか1項に記載の方法であって、前記サンプル中の前記ウイルスの不活化に起因するウイルス力価の低下は、少なくとも約1×105または少なくとも約1×107または少なくとも約1×1010または少なくとも約1×1014である、方法。
(項目6)
項目1〜項目5のうちのいずれか1項に記載の方法であって、前記サンプルを有効濃度のホルマリンで処理する工程は、約12時間〜約96時間かけて実行される、方法。
(項目7)
項目1〜項目6のうちのいずれか1項に記載の方法であって、前記ホルマリンの有効濃度は、約0.01%〜約0.1%である、方法。
方法。
(項目8)
項目1〜項目7のうちのいずれか1項に記載の方法であって、前記UV光は、約100nm〜約280nmの波長を有するUVCである、方法。
(項目9)
項目1〜項目8のうちのいずれか1項に記載の方法であって、前記UV光の線量は、約5mJ/cm2〜約200mJ/cm2である、方法。
(項目10)
項目1〜項目9のうちのいずれか1項に記載の方法であって、前記サンプルと前記UV光との接触時間は、約1秒間〜約20秒間である、方法。
(項目11)
項目1〜項目10のうちのいずれか1項に記載の方法であって、前記フロースルー装置における流量は、約50L/時間〜約100L/時間である、方法。
(項目12)
項目1〜項目11のうちのいずれか1項に記載の方法であって、前記フロースルー装置は、薄層チャンバを備える、方法。
(項目13)
項目1〜項目12のうちのいずれか1項に記載の方法であって、前記薄層チャンバを通る前記サンプルのフローは、濁っている、方法。
(項目14)
項目12または項目13に記載の方法であって、前記薄層チャンバの薄層は、約1mmの厚さを有する、方法。
(項目15)
項目1〜項目14のうちのいずれか1項に記載の方法であって、前記サンプルをフロースルー装置中で有効線量のUV光に供す工程は、約2回〜約10回反復される、方法。
(項目16)
項目1〜項目15のうちのいずれか1項に記載の方法であって、前記サンプルは、生物学的製品、医学的製品、または薬学的製品を調製するための細胞培養プロセスに由来する、生物学的流体または溶液からなる群より選択される、方法。
(項目17)
項目1〜項目16のうちのいずれか1項に記載の方法であって、該方法は、
前記サンプルを精製工程に供して該サンプル中の残留ホルマリンを除去する工程;
をさらに包含する、方法。
(項目18)
項目1〜項目17のうちのいずれか1項に記載の方法であって、該方法は、
前記サンプル中の不活化ウイルスを薬学的純度まで精製する工程;および
該精製された不活化ウイルスを、ワクチンとして使用するための薬学的組成物へと処方する工程;
をさらに包含する、方法。
【図面の簡単な説明】
【0010】
【図1】図1は、本発明のUV不活化工程のために使用され得るUV薄層チャンバを示す。
【図2】図2は、UVセンサーを備えたUV不活化システムを示す。上記のUVセンサーおよびフローメーターは、必要に応じた特徴である。本願のさらなる実施形態において、上記ポンプおよび/またはフローメーターは、出口チューブに備えられ得る。
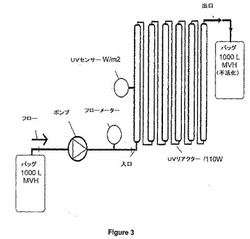
【図3】図3は、フロースルー装置における有効線量にサンプルを反復して供するために、互いに接続されたいくつかのUV薄層チャンバ(UVリアクター)を使用するUV不活化システムを示す。UV薄層チャンバの数は、約2個〜約10個の間で変化し得る。上記UVセンサーおよびフローメーターは、必要に応じた特徴である。本願のさらなる実施形態において、上記ポンプおよび/またはフローメーターは、出口チューブに設置され得る。連続的に接続された不活化チャンバを備える連続UV生成器が、大規模製造プロセスにおいて使用され得、それによって、サンプルのハイスループットが可能になる。
【発明を実施するための形態】
【0011】
(発明の詳細な説明)
本発明の一局面に従って、上記目的は、サンプル中に含まれるウイルスを不活化するための方法を提供することによって解決される。この方法は、
(i)上記サンプルを有効濃度のホルマリンで処理する工程;および
(ii)上記サンプルをフロースルー装置中で有効線量のUV光に供す工程;
を包含し、工程(i)は、工程(ii)の前に実施されるかまたはその逆である。好ましくは、上記装置を通る上記サンプルの流量は、約50L/時間〜約1000L/時間である。
【0012】
不活化するための方法の別の好ましい局面において、不活化されるべきウイルスは、それぞれ、エンベロープウイルスまたはエンベロープRNAであり、上記エンベロープウイルスまたはエンベロープRNAウイルスは、それぞれ、完全に不活化される。
【0013】
別の局面に従って、サンプル中に含まれるウイルスを不活化するための方法が提供される。この方法は、
(i)上記サンプルを有効濃度のホルマリンで処理する工程;および
(ii)上記サンプルをフロースルー装置中で有効線量のUV光に供す工程;
を包含し、上記装置は、上記装置中にUVランプと上記UVランプの直径に対して実質的に垂直な薄層チャンバとを備え、工程(i)は工程(ii)の前に実施されるかまたはその逆であり、上記サンプルは、工程(ii)において上記装置の薄層チャンバを通される。
【0014】
本発明の好ましい実施形態において、上記サンプルは、有効濃度のホルマリンで処理された後に、フロースルー装置中で有効線量のUV光で処理される。本発明者らは、いかなる理論によっても拘束されないが、ビリオンの表面分子上でのホルマリンの架橋効果が、UV不活化フロースルー装置の高体積流体力学の厳密さ(rigor)のためにウイルスを安定化すると、考えられる。
【0015】
本発明に従う不活化する方法は、実施例2および実施例4(A)において実証されるように、有効かつ安全である。さらに、不活化する方法は、実施例4(B)において示されるように防御免疫応答を惹起する、高い抗原性および免疫原性を有するワクチンの製造を可能にする。
【0016】
用語「サンプル」とは、本明細書中で使用される場合、病原体もしくはその一部を含有する任意のサンプル(例えば、(生物学的製品、医学的製品、または薬学的製品(例えば、血液製品もしくはワクチン)を調製するための細胞培養プロセスに由来する任意の流体(例えば、生物学的流体もしくは溶液))を包含する。そのサンプルは、生物学的流体(例えば、血液または血漿)を含むサンプルであり得る。そのサンプルはまた、細胞培養物の収集された成分(例えば、その培養物の細胞もしくは培養培地画分)を含む流体であり得る。好ましい実施形態において、そのサンプルは、例えば、ワクチンの製造における治療剤の製造において使用される流体であり、その不活化ワクチンまたはその部分が、治療剤である。特に好ましい実施形態において、細胞成分は、例えば、濾過または遠心分離によって、不活化方法の前の上記サンプルから分離される。
【0017】
本出願の好ましい実施形態において、上記ウイルスは、細胞培養物の収集物(その上清および細胞からなる)から生成され、これは、医療製品(例えば、ワクチン)の調製のためにさらに使用される。本発明のさらなる実施形態において、上記細胞培養物の細胞は、病原体に感染している。上記細胞は、上記ウイルスを生成するために適切な一次細胞または任意の培養細胞であり得る。使用され得る細胞の例としては、哺乳動物細胞(例えば、CHO細胞、BHK細胞、VERO細胞、HELA細胞)、鳥類細胞(例えば、ニワトリ胚線維芽細胞、または鳥類由来の連続細胞株)、および昆虫細胞(例えば、Sf9細胞)が挙げられる。本発明の好ましい実施形態において、ウイルスバルクの細胞培養生成に由来する細胞および細胞破片は、化学的(ホルマリン)不活化工程および/またはUV照射不活化工程の前に、そのウイルスバルクから分離される。
【0018】
本発明において、不活化されるべきウイルスは、エンベロープまたは非エンベロープのDNAウイルスもしくはRNAウイルスであり、一本鎖ゲノムもしくは二本鎖(DNA)ゲノムを有し、センスもしくはアンチセンスであり、連続的であるかもしくは分節している(segmented)。上記ウイルスは、バキュロウイルス、ポックスウイルス、アデノウイルス、パポバウイルス、パルボウイルス、ヘパドナウイルス、コロナウイルス、フラビウイルス、トガウイルス、アストロウイルス、ピコルナウイルス、レトロウイルス、オルトミクソウイルス、フィロウイルス、パラミクソウイルス、ラブドウイルス、アレナウイルス、およびブンヤウイルスからなる群より選択され得る。本発明の好ましい実施形態において、上記ウイルスは、エンベロープウイルス(フラビウイルス、トガウイルス、レトロウイルス、コロナウイルス、フィロウイルス、ラブドウイルス、ブンヤウイルス、オルトミクソウイルス、パラミクソウイルス、アレナウイルス、ヘパドナウイルス、ヘルペスウイルス、およびポックスウイルスが挙げられる)の群から選択される。実施例および実施例7において示されるように、本発明の不活化方法は、非エンベロープポリオおよび非エンベロープアデノウイルスと比較して、エンベロープウイルス(例えば、インフルエンザウイルスおよびロス川ウイルス)に対して特に有効である。本発明の他の好ましい実施形態において、上記ウイルスは、エンベロープRNAウイルス(フラビウイルス、トガウイルス、レトロウイルス、コロナウイルス、フィロウイルス、ラブドウイルス、ブンヤウイルス、オルトミクソウイルス、パラミクソウイルス、およびアレナウイルスが挙げられる)の群から選択される。特に好ましい一実施形態において、上記ウイルスは、オルトミクソウイルス(例えば、インフルエンザウイルス株)から選択される。インフルエンザウイルス株は、赤血球凝集素タンパク質およびノイラミニダーゼ表面タンパク質の種々の組み合わせを有し得る。別の特に好ましい実施形態において、上記ウイルスは、トガウイルス(例えば、アルファウイルス(例えば、ロス川ウイルス(RRV)))から選択される。バルクウイルス溶液として使用するための別の好ましいウイルス群は、コロナウイルス(重症急性呼吸器症候群(SARS)に関連するウイルスが挙げられる)である。別の好ましいウイルス群は、フラビウイルス(日本脳炎ウイルス、ダニ媒介脳炎(TBE)ウイルス、デング熱ウイルス、黄熱病ウイルス、および出血熱ウイルスが挙げられる)およびトリポックスウイルスである。
【0019】
不活化ウイルス病原体の部分もまた、本発明によって包含される。本発明の好ましい実施形態において、上記部分は、免疫原においてエピトープとして役立ち得る。このエピトープは、上記病原体に対する免疫応答を惹起するために使用され得る。本願の好ましい実施形態において、病原体の部分は、上記病原体に対するワクチンとして使用される。特に好ましい実施形態において、上記病原体の部分は、分割されたビリオン(split virion)であり、これは、分割される前または分割された後に、不活化され得る。
【0020】
本発明の意味においては、本発明に従う不活化する方法は、その方法を使用して生成された不活化されたウイルスが哺乳動物細胞培養試験(例えば、実施例2において詳述される安全性試験)を合格した場合に、安全である、または完全に不活化されている、と考えられる。示されるように、これらの試験は、使用される他の試験(例えば、卵試験)よりも感度が高い。その安全性試験の好ましい合格/不合格の基準は、実施例1および実施例2において詳述される。
【0021】
本願の好ましい実施形態において、上記サンプルにおけるウイルスの不活化に起因するウイルス力価の低下は、少なくとも約1×105、より好ましい実施形態において少なくとも1×107、より好ましい実施形態において少なくとも約1×1010、最も好ましい実施形態約1×1014である。
【0022】
本発明の好ましい実施形態において、上記サンプルは、有効濃度のホルマリンで約12時間〜約96時間処理される。より好ましい実施形態において、上記サンプルは、有効濃度のホルマリンで約24時間〜約48時間、より好ましくは約24時間〜約30時間、処理される。
【0023】
本発明の特に好ましい実施形態において、上記サンプルは、有効濃度のホルマリンで24時間〜約24.5時間される。
【0024】
さらなる実施形態において、上記サンプルを有効濃度のホルマリンで処理する工程は、約10℃〜約40℃にて実行される。本出願の特に好ましい実施形態において、上記サンプルを有効濃度のホルマリンで処理する工程は、約32℃で実行される。
【0025】
本発明の特に好ましい実施形態は、有効濃度のホルマリンによる上記サンプルの処理を包含し、そのホルマリンの有効濃度は、好ましくは約0.01%(w/w)〜約1%(w/w)、好ましくは約0.01%〜約0.1%、より好ましくは約0.025%(これは、この有効濃度を調節するために37%ホルマリン溶液を使用する場合、約92mg/lホルマリンに対応する)〜約0.1%(これは、この有効濃度を調節するために37%ホルマリン溶液を使用する場合、それぞれ、約368mg/lホルマリンに対応する)の範囲である。
【0026】
本出願において、用語「UV光」とは、100nm〜400nmの波長を有する紫外線を意味する。上記UV光は、UVC(100nm〜280nm)、UVB(280nm〜320nm)、およびUVA(320nm〜400nm)からなる群より選択され得る。光感作剤(DNA中にインターカレートしかつUV光によって不活化されるもの(例えば、ソラレン)など)が、UV照射の不活化効果を増強するために使用され得る。本発明の好ましい実施形態において、上記UV光は、約100nm〜〜約280nmの波長を有するUVCである。本発明のより好ましい実施形態において、上記UV光は、約240nm〜〜約290nmの波長を有する。本発明の特に好ましい実施形態において、上記UV光のうちの約85%以上は、約254nmの波長を有する。
【0027】
UV光放射は、連続形態のUV光放射(例えば水銀ランプ技術)であっても、パルス型UV光(単色レーザー技術)であってもよい。望ましいUV強度は、2つ以上のランプを組合わせることによって、生成され得る。好ましい実施形態において、上記光は、約110Wのランプによって連続的に放射される。実施例において示される好ましい実施形態において、上記UVランプは、実施例において使用されるランプ(950nm)と同様に、少なくとも1mの長さを有する。
【0028】
本発明の主題は、有効線量のUV光(すなわち、上記のようなホルマリン処理と組み合わせた場合に所定のウイルスを安全に不活化する、任意の線量のUV光)を包含する。その有効線量は、当該分野で一般的に公知である種々の要因(例えば、UV不活化の物理的パラメーター(例えば、ランプおよびチャンバの大きさおよび直径;ウイルス含有培地とUV光源との間の距離;チャンバ材料の光吸収特性および光反射特性))に依存し得る。同じ理由によって、UV光の波長および強度、ならびにウイルスがUV光に曝露される接触時間もまた、上記有効線量のために重要である。さらに、有効線量はまた、ウイルス自体、ウイルスを含む培地、およびそれらの光吸収特性によって影響を受ける。好ましくは、上記有効線量は、サンプル中に含まれるウイルスのうちの少なくとも99.99%を死滅させるために十分であり、より好ましくは、活性なウイルスが哺乳動物細胞培養試験(好ましくは実施例2に従う試験)において検出されないレベルまで上記ウイルスを不活化する(すなわち、完全に不活化する)ために、十分である。好ましい実施形態において、UVC光を使用して、上記ウイルスを含むサンプルが、約5mJ/cm2〜約200mJ/cm2の範囲の有効線量に曝露される。好ましい実施形態において、上記有効線量は、約20mJ/cm2〜約100mJ/cm2の範囲にある。他の好ましい実施形態において、上記有効線量は、約40mJ/cm2〜約90mJ/cm2の範囲にある。比較として、飲料水中に存在する病原体のうちの99.99%を死滅させるための有効線量は、約>40mJ/cm2である。好ましい実施形態において、上記有効線量は、初期ウイルス力価を1×105低下させる。バルクワクチン不活化において、上記有効線量は、初期化学的(ホルマリン)不活化工程の後に存在し得るあらゆる残留ウイルスを除去するために十分であるべきである。実施例において示されるように、これは、非常に感度の高い哺乳動物細胞培養感染試験(例えば、記載されるVero細胞培養試験)によって決定され得る。
【0029】
本発明(特に、UV光チャンバ)のさらなる好ましい実施形態が、実施例に提供される。
【0030】
本発明のさらなる好ましい実施形態において、上記サンプルとUV光との接触時間は、約1秒間〜約20秒間、好ましくは約1.4秒間〜約14秒間の範囲にある。上記接触時間は、上記光源に対する接線に沿って約1mm厚であるサンプルおよび上記UVランプのワット量約110Wに基づいて好ましくは計算される。当業者は、サンプルの奥行きが厚く光源のエネルギー(ワット量)が少ない程、上記曝露時間が増大し、その逆もまた真であることを、認識する。本出願のより好ましい実施形態において、上記サンプルとUV光との接触時間は、約1.4秒間〜約7秒間である。本願の特に好ましい実施形態において、上記サンプルと上記UV光との接触時間は、約2.8秒間〜約4.2秒間である。
【0031】
所定のUV光線量を使用する本発明に従う所定の設定が本発明に従って病原体を有効に不活化するか否かを試験するために、その不活化されたウイルスを、残留ウイルス活性について試験すべきである。これは、哺乳動物細胞培養試験(例えば、Vero安全性試験)を使用することによって、好ましくは実施例1および実施例2に詳述される基準を適用して、達成され得る。
【0032】
本発明に従って、有効線量のUV光による上記サンプルの処理は、好ましくは表1および図1において特定されるように、フロースルー装置において実行される。
【0033】
本発明の好ましい実施形態において、上記フロースルー装置は、薄層チャンバを含む。そのチャンバの最小厚は、妥当な迅速な処理を可能にしかつ完全不活化ウイルスワクチンのためにウイルス破壊を防止するために、上記バルクウイルス溶液の十分なフローを可能にすべきである。また、上記バルクウイルス溶液によるUV照射の吸収と、上記溶液中のすべてのウイルスの十分な照射を確実にする必要性とに起因して、その最大の厚みは、すべてのビリオンが十分に照射されることなく上記装置を通過することを許容すべきではない。従って、上記薄層は、約1cm厚よりも厚いものであるべきではない。上記薄層は、好ましくは0.5mm厚〜約3mm厚であり、より好ましくは約1mmであり、その結果、上記UVランプと不活化されるべき病原体との間の最大距離は、約1mm未満である。あるいは、上記サンプルは、上記ランプの長さに対して平行に上記ランプウを通され得、その結果、上記サンプルは、上記サンプルチャンバの内径ではなく外径から照射される。同様に、ランプ(またはランプの円)中のサンプルチャンバ内のランプは、内径および外径の両方から上記サンプルチャンバを照射する構成として、使用され得る。さらに、上記チャンバは、好ましくは、上記チャンバを通るサンプルのフローが厳密には層流ではなく乱流であるように、設計される。このことは、上記ウイルスをサンプル培地と混合することを補助し、UV照射に対する均一な曝露を確実にする。
【0034】
本出願の別の好ましい実施形態において、上記フロースルー装置は、UV不活化チャンバを含み、UVランプは、直径約30mmを有し、上記サンプルが流れるUVランプを取り囲むチャンバは、約32mmの直径を有する。本願の好ましい実施形態において、上記チャンバは、総体積約92mlを有する。
【0035】
照射されるべきサンプルは、上記装置を通され得る。好ましい実施形態において、上記サンプルは、上記UV照射チャンバを通りながら冷却される。本発明のさらなる好ましい実施形態において、上記UVチャンバを通るサンプルは、約2℃〜約32℃、より好ましくは約2℃〜約8℃の温度を有する。
【0036】
好ましくは、上記フロースルー装置中のサンプルの流量は、約50L/時間〜約1000L/時間、より好ましくは約230L/時間〜約480L/時間の範囲にある。特に好ましい実施形態において、上記フロー装置中のサンプルの流量は、約230L/時間〜約250L/時間の範囲にあり、より好ましくは約240L/時間である。実施例において例証されるこれらの好ましい流量は、上記バルクウイルス溶液の経済的大規模UV処理を可能にする。
【0037】
好ましい実施形態において、上記接触時間は、上記サンプルがUV照射に曝露されるサンプルチャンバの長さ、およびそのチャンバを通る上記サンプルの流量に依存する。従って、上記フロースルー装置において配置されたUVランプの数を増加することによって簡単に調整され得る有効線量は、UV照射に対して曝露されるサンプルチャンバの有効長さを増加する。あるいは、同じ数の、より長いランプ−チャンバを使用すると、上記有効線量を増加し、同様に、より多くの数の、より短いランプ−チャンバを使用すると、同じ有効線量と等価であり得る。
【0038】
本発明のさらなる好ましい実施形態において、上記サンプルをフロースルー装置において有効線量のUV光に供する工程は、周期的様式または連続的様式で反復される。この工程は、約2回〜約10回反復され得る。本願の好ましい実施形態において、上記サンプルをフロースルー装置において有効線量のUV光に供する工程は、約2回〜約5回反復され、本願のより好ましい実施形態において、この工程は、約2回〜約3回反復される。複数のランプチャンバを連続して使用することまたは同じランプを通す再循環フローを使用することに対するさらなる利点は、上記サンプルが、チャンバ間またはサイクル間で、より徹底的に混合され得て、UV照射に対する上記ウイルスの均一な曝露を確実にし得ることである。
【0039】
上記サンプル中のウイルスが不活化された後に、不活化されたウイルスは、種々の適用(ワクチンおよび他の薬学的組成物が挙げられる)における使用のために精製され得る。本発明の別の好ましい実施形態によると、不活化する方法は、上記サンプル中の不活化ウイルスを薬学純度に精製し、精製されたウイルスを、ワクチンとして使用するための薬学的組成物へと処方する工程をさらに包含する。精製は、当該分野において公知の手段(濾過、またはダイアフィルトレーション、クロマトグラフィー(例えば、サイズ排除クロマトグラフィー、イオン交換クロマトグラフィー、免疫親和性クロマトグラフィーなど)、または遠心分離が挙げられるが、これらに限定はされない)によって達成され得る。あるいは、上記ウイルスは、本発明の方法による不活化の前に、精製され得る。
【0040】
本発明の別の好ましい実施形態によると、不活化する方法は、精製工程をさらに包含する。すなわち、上記サンプルは、そのサンプル中の残留ホルマリンを除去するための精製工程に供される。そのような精製は、薬学的に受容可能なレベルよりも高いホルマリンレベルが残る場合に、有用である。不活化されたウイルスは、必要に応じた精製工程の後に、薬学的組成物へと処方され得る。処方物は、必要に応じて、キャリア(例えば、生理食塩水もしくは緩衝液)、賦形剤、安定剤(例えば、アルブミン、糖、および/もしくはアミノ酸)、塩および/またはアジュバント(例えば、ミョウバン)を含み得る。あるいは、不活化されたウイルスは、薬学的使用のために、例えば、リポソーム中への封入によって、さらに改変され得る。
【0041】
本発明は、以下の実施例においてさらに例証され、以下の実施例は決して限定されない。本発明が詳細に記載されているが、改変および変化が、添付の特許請求の範囲において定義される発明の範囲から逸脱することなく可能であることが、明らかである。
【実施例】
【0042】
(実施例1:標準的卵安全性試験の原理)
標準的卵安全性試験を使用して、不活化されたインフルエンザウイルスの残留感染性について試験した。一価バルク製品(すなわち、ショ糖勾配遠心分離および超ダイアフィルトレーションの後の精製ウイルス抗原)を、10個の卵(0.2ml/卵)に注入する。32℃にて3日間インキュベートした後、それらの卵を収集し、プールし、再度、10個の卵(0.2ml/卵)に注入する。32℃にて3日間さらにインキュベートした後、それらの卵を収集し、プールし、赤血球凝集素(HA)について試験する。
【0043】
このHA試験は、インフルエンザウイルスが、その表面タンパク質である赤血球凝集素を使用して赤血球に結合し得ることに基づく。この試験は、滅菌環境において実行する。所定のHA力価を有するインフルエンザ懸濁物が、ポジティブコントロールとして役立ち、0.9% NaCl溶液が、ネガティブコントロールとして役立つ。0.9% NaCl中における試験すべきサンプルの1:2希釈物50μlを、96ウェルプレートのうちの1つのウェルに提供する。各ウェルに、ニワトリ赤血球を含む溶液50μlを添加する。その後、そのプレートを、室温で30分間〜45分間インキュベートする。そのgお、赤血球凝集素を視覚的に決定する。この場合、同じサンプルを含む5つのサンプルが赤血球凝集素を全く示さない場合、そのサンプルは、このHA試験を合格した。
【0044】
(実施例2:標準的Vero安全性試験の原理)
標準的Vero安全性試験は、不活化インフルエンザ株の残留感染性についての非常に厳密な品質試験である。この試験はまた、他のウイルスにも適用可能である。一価バルク製品(すなわち、ショ糖勾配遠心分離および超ダイアフィルトレーションの後の精製ウイルス抗原)を、5個のルー瓶(4ml/瓶)に注入する。Vero培地中で32℃にて7日間インキュベートした後、それらの細胞培養物を収集し、プールし、5個のルー瓶(10ml/瓶)に注入する。32℃にて7日間さらにインキュベートした後、それらの細胞培養物を収集し、プールし、実施例1において記載されるように赤血球凝集素(HA)について試験する。
【0045】
(実施例3:ホルマリン不活化)
ホルマリンによる最初の不活化工程は、無細胞の感染性一価ウイルス収集物(すなわち、遠心分離を介して清澄化した後のバイオリアクター収集物)で実行する。30℃〜34℃で収集した後、その一価ウイルス収集物を、約0.9U/ml〜約1.1U/mlのベンゾナーゼを用いて30℃〜34℃にて4時間〜8時間処理する。その後、それを、≦92mg/lのホルマリンを用いて32±2℃にて24時間〜24.5時間処理する。
【0046】
(実施例4:65ワットUVランプを用いる不活化実験)
ホルマリン不活化ウイルスを用いる多数の不活化実験を、65WのUVランプと薄層チャンバとを備える不活化チャンバを使用して実行する。一価ウイルス収集物の完全な不活化が、100L/時間の流量で3サイクルを使用した場合に実証され得るが、この設定は、UVシグナルのオンライン測定を可能にはしなかった。インフルエンザ生成のために使用されるVero細胞培地は、UVシグナルの吸収を担う種々の有機化合物を含む。従って、上記のシステムは、110Wのランプを備え、これによって、一価ウイルス収集物の処理の間のUVシグナルの連続的モニタリングを可能にする。
【0047】
(実施例5:110ワットUVランプを用いる不活化実験)
ホルマリン処理した一価インフルエンザパナマ(Panama)収集物を、この不活化研究のためのモデル基質として使用する。薄層UV技術を用いる連続的不活化のために、VISAランプ(110W/4V)を備えるWEDECO VISAシステム(Germany)を使用する。UV薄層チャンバは、30mm直径石英チューブを備えるステンレス鋼製1.4435デバイスである(表1を参照のこと)。較正済みUVセンサーは、UVシグナルのオンライン制御を可能にする。UV薄層チャンバを、周囲温度において240±10L/時間の流量で操作する。この流量条件を、較正済みフローメーターによって制御する(表2を参照のこと)。
【0048】
(表1)
(UV不活化チャンバの特徴)
【0049】
【表1】

上記一価収集物を、10回のUVサイクルに曝露する。各サイクルの後、UV処理済み一価収集物のうちの20Lを取り出す。これを、20mM Tris緩衝液中での長期42%ショ糖勾配を用いる連続的超遠心分離条件を使用するショ糖勾配精製によってさらに精製し、所定の精製一価収集物(PMVH)を、プレ清澄器(preclarifier)を備えないSorvall CC40遠心機(Hitachi Koki Co,LTD,Tokyo,Japan)を使用して、48%から36%へのショ糖を使用して精製する。
【0050】
(表2)
(ホルマリンとUVとで処理したインフルエンザパナマ(Panama)の超遠心分離実行の概要)
【0051】
【表2】

((A)抗原の収率および純度)
インフルエンザ抗原の収率および純度を、赤血球凝集素(HA)含量、総タンパク質、およびVeroタンパク質(宿主細胞タンパク質)に基づいて比較する。精製ウイルスを、HA/タンパク質比、宿主細胞タンパク質/HA比、およびウイルス安全性に基づいて比較する(表3を参照のこと)。UV処理したすべての収集物について、何のウイルス増殖も検出され得ない。対照的に、標準的ホルマリン不活化プロセス(UV照射を適用しない)に由来する精製ウイルスは、Vero細胞培養物において増殖され得る。HA/タンパク質比の有意な低下がサイクル7およびサイクル10の後に観察され得るが、ホルマリン不活化製品と二重不活化製品との有意な差異は、HA/タンパク質比および宿主細胞タンパク質/HA比として測定した抗原純度に関して検出されない。
【0052】
(表3)
(ホルマリンとUVとでの処理の後のショ糖勾配精製したパナマ(Panama)ウイルス。0回〜10回のUVサイクル後の、HA/タンパク質比、宿主細胞タンパク質/HA比、および安全性)
【0053】
【表3】

さらなる研究を実行して、赤血球凝集素阻害(HAI)分析によってモルモットおよびマウスにおける抗原性と免疫原性とに対するUV不活化の効果を特徴付ける。
【0054】
((B)抗原性)
抗原性を、パナマ(Panama)特異的抗血清に対するHAIアッセイによって分析する。UV接触時間の増加は、HAのわずかな喪失をもたらすが、HAI力価については何の負の影響も示されない(表4を参照のこと)。
【0055】
(表4)
(ホルマリンとUVとでの処理の後のショ糖勾配精製したパナマ(Panama)ウイルス。0回〜10回のUVサイクル後の、パナマ(Panama)特異的抗血清を用いたHA力価およびHAI力価に基づく抗原性の比較)
【0056】
【表4】

((C)免疫原性)
免疫原性を、モルモットおよびマウスを、種々のアリコートの精製一価ウイルス収集物で免疫して、最初の免疫の3週間後にブースターで免疫することによって、分析する。免疫した動物の血清を、3週間後および6週間後に収集してプールし、卵由来抗原に対するHAIアッセイおよびVero由来抗原に対するHAIアッセイによって分析する。3週間後および6週間後にモルモットおよびマウスにおいて試験した免疫原性は、非常に有望な結果を与える。二重不活化ウイルスについて、標準的ホルマリン処理ウイルスに対する有意な差異は、観察され得ない(表5を参照のこと)。
【0057】
(表5)
(ホルマリンとUVとでの処理(0回〜10回のサイクル)の後のショ糖勾配精製パナマ(Panama)ウイルス。モルモットおよびマウスにおいて試験した免疫原性の比較。A)3種間後、B)6週間後。卵由来インフルエンザ抗原を用いるHAIおよびVero由来インフルエンザ抗原を用いるHAI)
【0058】
【表5】

表4および表5において要約される結果は、UV処理が、HAI力価の有意な差異を生じないことを示し、このことは、その製品の抗原性(従って、免疫原性)が、影響を受けないことを示す。
【0059】
すべての二重不活化実験において、1サイクルのUV処理の後でさえ、完全な安全性が実証され得る。実験室および最終規模における詳細な研究は、ホルマリン処理と組合わせた場合に、UV照射工程の有効性を実証した。UV処理の後の精製ウイルス抗原の免疫学的特徴づけは、非UV未処理製品で得られる結果に匹敵する結果を生じる。そのウイルス製品の生化学的特徴に対しても免疫原性に対しても、何の負の影響も検出され得ない。
【0060】
(実施例6:ホルマリンおよび/またはUVでの不活化によるウイルス力価の低下)
有効濃度のホルマリンとフロースルー装置における有効濃度のUV光とを組合わせたサンプル処理によるウイルス力価低下を、種々のウイルスを用いて試験する。ホルマリン不活化を、最終ホルマリン濃度0.025%(w/v)を用いて32℃で24時間実行した。フロースルー装置におけるUV不活化を、流量240l/時間にて3サイクル事項する。1サイクル当たりのサンプルとUV光との接触時間は、1.4秒間である。
【0061】
(表6)
(ホルマリンおよび/またはUV不活化によるウイルス力価低下)
【0062】
【表6】


この結果は、ホルマリンとUVとを合わせたウイルス処理によって、それぞれのウイルス力価の劇的な低下が得られることを示す。
【0063】
(実施例7:ロス川ウイルス(RRV)候補ワクチンのUV不活化)
ロス川ウイルス(RRV)は、流行性多発性関節炎(EPA)として公知であるヒトの疾患を引き起こす、蚊媒介性アルファウイルスである。症状としては、関節炎(特に、膝ならびに手および脚の小関節における関節炎)が挙げられ、しばしば、発熱、発疹、および他の非特異的全身変化を伴う)が挙げられる。関節炎の症状は、一般的には、30週間〜40週間継続し、患者のうちの25%は、発症1年後に残留する症状を依然として有する。これは、オーストラリア(毎年8000件よりも多い症例がある)および太平洋領域全体にわって流行する。1989/80年において、ロス川ウイルス感染の流行がまた、フィジー、サモア、クック諸島、およびニューカレドニアにおいて生じた。現在、何のワクチンも存在しない。
【0064】
((A)無血清マイクロキャリアベースの1200L Vero細胞発酵槽培養物のRRV接種、およびホルマリン不活化)
マイクロキャリアベースの無血清Vero細胞の1200L発酵槽培養物に、ロス川産生ウイルスを接種した。その培養物を、37℃にて3日間インキュベートした。サンプルを、力価決定用に毎日取り出した。3日目に、その細胞のうちの100%がCPR(細胞障害効果)によって破壊された場合に、ウイルスを収集した。感染性ウイルス収集物からの細胞破片およびマイクロキャリアの分離と最初の力価決定工程(1.2μm/0.2μm)の後、ベンゾナーゼを、核酸(DNA/RNA)分解のために添加した。ホルマリン不活化を、0.1%(w/v)ホルマリン最終濃度を用いて8日間実行した。第二の濾過工程および第三の濾過工程を、それぞれ、2時間後および24時間後に実行した。ベンゾナーゼを、残留核酸の除去のために、24時間目に2回目に添加した。サンプルを、ウイルス力価決定(Vero細胞における組織培養感染量(tissue culture infectious dose)50(TCID50/ml)のため、および表7に従
うC6−36細胞およびVero細胞における安全性試験のために、取り出した。
【0065】
RRVを1200L発酵槽に接種した1日後に、logTCID50/ml=5.8であるウイルス力価が、実証され得、これは、7.8(2日目)、8.1(収集前3日目)、および8.0(ウイルス収集後)に増加した。分離、第一濾過、およびベンゾナーゼ添加の後、ウイルス力価は、それぞれ、7.5、7.2、および7.4へと低下した。ホルマリン添加後、ウイルスペレットの遠心分離および再懸濁(表7、カラム:TCID50/ml TL100)によって細胞傷害性ホルマリン懸濁物を除去した後に、力価を決定した。ホルマリンをウイルス収集物に添加した15分間後に、力価は、1.6へと隙敵に添加した。ホルマリン不活化の12時間後、もはやウイルス力価は実証され得なかった。
【0066】
ホルマリン不活化開始の24時間後に、サンプルを、C6−36細胞およびVero細胞における安全性試験に供した。不活化の24時間後および26時間後に、1つの陽性サンプル(CPE)および4つの陰性サンプルが、Vero細胞において実証され得、4つの陽性サンプルおよび1つの陰性サンプルが、さらに感度が高いC6−36細胞株を用いて得られた。2日目よりも後には、すべてのサンプルがVero細胞において院生であった。このC6−36細胞は、2日目および3日目に1つのサンプルでCPE、および4つの陰性サンプルをそれぞれ依然として示した。4日目および5日目に、すべてのサンプルは、C6−36細胞において陰性であると試験されたが、6日目および7日目に、1つのサンプルが、再びCPEを示した。8日目に、Vero細胞においてもC6−36細胞においても、もはや陽性サンプルは示され得なかった。
【0067】
【表7】

((B)RRV RNAを用いるトランスフェクション実験および感染実験)
上記の安全性試験の結果は、ゲノムRRV RNAが上記不活化手順の間に放出され得るという疑いを増加させた。これは、次に、それぞれの細胞中へのゲノムRRV RNAの組み込みをもたらし得る。ベンゾナーゼ処理は、RNAの完全な分解をもたらすはずであるが、リポソーム形成または他の機構(タンパク質破片によるゲノムRRV RNAのマスキングなど)が、インタクトなRNAの逃避ストラテジーを説明し得る。
【0068】
RRVゲノムRNAを、勾配精製したビリオンから単離した。RT−PCRを介して、粒子等価物の数を決定し得た。第一の実験(表8、番号1)において、粒子等価物(ゲノムRNA)は、トランスフェクション培地(すなわち、トランスフェクション)および通常培地(すなわち、感染)の両方において10倍段階で希釈した。両方の混合物を用いて、C6−36細胞およびVero細胞に接種した。培地交換の後、細胞培養物を、数時間インキュベートした。個々の上清のサンプルを、ウイルス力価決定およびHA決定のために使用した。ゲノムRNAを用いる感染実験を、数回実行した(表8、番号1〜5)。
【0069】
上記トランスフェクション実験は、C6−36細胞およびVero細胞の両方において、TCID50を生じる。Vero細胞上清はまた、HA力価を示した。多数の粒子等価物(108)によるVero細胞の感染は、ウイルス力価6.8log TCID50/mlを示し、HA力価128を有したが、C6−36細胞には感染しなかった。ゲノムRRV RNAを用いる別の感染実験(番号4)は、C6−36細胞およびVero細胞の両方の感染(それぞれ、力価8.4log TCID50/mlおよび6.6log TCID50/ml)を生じた。感染試行2、3、および5は、Vero細胞において陽性の結果を生じなかった。感染事項番号3は、C6−36細胞において、低い力価1.6log TCID50/mlを生じた。
【0070】
純粋なゲノムRRV RNAを用いて細胞を感染させるすべての試行が陽性の結果を示したわけではないが、高濃度のゲノムRNAが、細胞にランダムに感染可能であるようである。リポソームトランスフェクション試薬を使用したすべての実験が、陽性の結果を示した。従って、RNAのタンパク質マスキングまたはリポソーム形成機構が、表7におけるホルマリン不活化および遊離DNA/RNAのベンゾナーゼ分解の後の陽性の安全性試験を説明する。
【0071】
【表8】

((C)感染性RRVのUV不活化)
上記の考慮事項について、小規模実験を実行して、UV照射によりRRVを不活化した。RRV PV上清を、2つのUV強度(2.1mW/cm2(サンプル1〜10)および3.3mW/cm2(サンプル11〜20))を用いて、種々の時間の間UV照射した。その後、これらのサンプルをウイルス力価決定に供し、抗原力価(EIA)および赤血球凝集素力価を決定した。3分間よりも長く照射したサンプル(番号6〜10および14〜19)もまた、C6−36細胞において安全性試験に供した(表9)。
【0072】
ウイルス力価は、両方のUV強度を用いた10分間のUV照射の後に、7.4log TCID50/ml(コントロール、サンプル番号1)から1.5log TCID50/mlへと低下した。赤血球凝集反応は、UV強度2.1mW/cm2にて15分間の間安定なままでありHA力価が9であったが、UV強度3.3mW/cm2では8まで低下した。抗原力価(EIA)はまた、15分間の照射の間、640〜1280の範囲内で安定なままであった。安全性試験は、UV強度2.1mW/cm2にて3分間および5分間照射したサンプル(サンプル番号6および7)を用いて実行したところ、依然として、細胞培養物においてCPEを示し、それぞれ、ウイルス力価8.2log TCID50/mlおよび8.6log TCID50/mlを生じた。安全性試験は、UV強度3.3mW/cm2にて2分間、3分間、および5分間照射したサンプル(サンプル番号14〜16)を用いて実行したところ、依然として、細胞培養物においてCPEを示し、それぞれ、ウイルス力価8.2log TCID50/ml、8.6log TCID50/ml、および8.7log TCID50/mlを生じた。10分間の照射の後、すべての安全性試験は陰性であった。
【0073】
2.1mW/cm2および3.3mW/cm2の両方の強度で10分間よりも長くUV照射すると、RRV調製物を完全に不活化した。HA試験およびEIA試験において示されるように、抗原性は、両方の照射強度で15分間の間で損なわれないままであった。30分間後、抗原性は影響を受けた。
【0074】
【表9】

((D)ホルマリンで不活化した1200L発酵槽収集物のUV不活化)
ホルマリンで処理した1200L発酵槽のウイルス収集物のアリコートを、流量300l/時間で3サイクル、150l/時間で3サイクル、75l/時間で3サイクルにてUV照射した。ホルマリンで処理した1200L発酵槽のウイルス収集物の第二アリコートを、流量300l/時間にて10サイクルでUV照射したが、今度は、ダイアフィルトレーションの後に、高濃度の残留する小タンパク質を除去した。HA力価、抗原−EIA力価、ウイルス力価、および安全性(CPE)を、各試行の後に決定した(表10)。
【0075】
第一の実験(ダイアフィルトレーションなし)におけるウイルス力価は、流速150l/時間にて1サイクルのUV照射の後に、6.13log TCID50/mlから検出限界未満までに低下した。安全性試験もまた、CPEを示さなかった。しかし、流量150l/時間にて3サイクルのUV照射の後、細胞培養物における安全性試験は、陽性の結果を示し、そしてまた、ウイルス力価決定においても陽性であった(6.7log TCID50/ml)。流量75l/時間にて3サイクルのUV照射は、ウイルス力価決定および安全性試験の両方において陰性のままであった。第二実験において、安全性試験およびウイルス力価決定は、5回以上の照射サイクルの後で陰性のままであった。第一の実験において、すべての照射線量は、HA力価およびEIA力価に影響を与えず、それぞれ、11および1:320であった。第二の実験において、すべてのHA力価およびEIA力価は、それぞれ、10および1:320であり、例外として、6回の照射サイクルが、EIA力価1:640を生じた。
【0076】
ホルマリンと、流量300l/時間にて5サイクル以上のUV照射とで、RRVの発酵槽収集物を二重不活化することが、抗原性を損なうことなく感染性を完全に破壊するためには十分である。
【0077】
【表10】

【0078】
((E)二重不活化したRRV候補ワクチン調製物の効力)
(免疫したマウスにおける有効用量(ED50)、防御用量(PD50)、およびELISA力価)
ホルマリンで不活化したRRV候補ワクチンおよび二重不活化(ホルマリン+UV照射)したRRV候補ワクチンを、10μg/用量に調整し、その後、4倍段階で希釈した。各希釈物を、10匹のマウスからなる群に注射した。3週間後に、そのマウスに、対応する量の上記ワクチンをブースター投与した。血液サンプルを、3週間後、ブースター前、6週間目、ブースターの3週間後に取り出した。その血清を、RRV抗体ELISAによって分析した。有効用量50(ED50)(これは、免疫したマウスのうちの50%におけるセロコンバーションを誘導するために十分である抗原用量である)を、その後算出した。
【0079】
3週間目に、ブースターの前に、ホルマリンで不活化した群のED50は、635ngであった。ホルマリン・UV二重不活化した群のED50は、202ngであった。ブースターの後に、そのED50値は、それぞれ、33ngおよび10ngであった。しかし、ELISA力価の分析は、二重不活化した群が、さらに高い抗体力価を有した(例えば、3週間目に、ELISA力価1000であるマウスが二重不活化群において16匹であったのに対してホルマリン群では9匹であり、ELISA力価10,000であるマウスが二重不活化群において4匹であるのに対してホルマリン群ではなかった)ことを、実証した。ブースターの後もまた、二重不活化群の力価は、より高かった(ELISA力価100,000であるマウスが二重不活化群において11匹であったのに対してホルマリン群では8匹であり、ELISA力価が1,000,000であるマウスが二重不活化群においてはさらに4匹いた(表11))。
【0080】
6週間目(ブースターの3週間後)に、マウスに、106 TCID50/ml(組織培養感染用量50)のロス川ウイルス(T48株)を静脈内感染させた。感染後1日目、2日目、3日目、および4日目に、血液サンプルを採取し、その血清のTCID50をその後決定した。防御用量50(PD50)(これは、感染したマウスのうちの50%がウイルス血症を示されない抗原用量である)を算出した。PD50=78ngが、両方の抗原調製物(ホルマリン不活化抗原、および二重不活化(ホルマリン+UV照射)抗原)について同じであった。
【0081】
(表11)
(免疫したマウスにおける有効用量(ED50)、防御用量(PD50)、およびELISA力価)
【0082】
【表11】

ホルマリン処理単独の後に非常に感受性であるC6−36細胞株において主に見出される残留感染性は、ほぼおそらくは、感染性RRV RNAによって引き起こされる。第二のさらなるウイルス不活化工程(UV照射)(これは、ホルマリン処理後のウイルスゲノムに影響を及ぼす)は、マウスモデルにおいて免疫原性および効力に影響を及ぼすことなく、完全に不活化されかつ安全なRRV候補ワクチン調製物を生じた。
【技術分野】
【0001】
(発明の分野)
本発明は、ウイルス含有サンプルを有効濃度のホルマリンで処理することによって、およびそのサンプルをフロースルー装置中で有効照射量のUV光で処理することによって、ウイルスを不活化するための方法に関する。
【背景技術】
【0002】
(発明の背景)
医学的製品中の病原体の有効な不活化は、公共に健康に関する問題である。なぜなら、以前には未知であった疾患が、治療の投与を介して急速に伝播し得ることが発見されたからである。従って、バイオテクノロジー製品が、それを使用することによって病原因子を伝達するリスクを低下することを意図する、ますます厳しくなる基準の下で出現している。潜在的な混入物質が、血液製品の製造における問題であるのみならず、安全なワクチンの製造における問題でもある。
【0003】
病原体に対するワクチン(特に、ウイルスワクチン)の製造における最も重要な工程のうちの1つは、ウイルス不活化である。ウイルス不活化の場合、ホルマリンが、ワクチン製造において最も頻繁に使用される不活化剤である。このホルマリン不活化工程は、確立された分析手順を用いて確認されている。しかし、非常に厳密な品質管理試験(例えば、哺乳動物細胞培養試験(例えば、VERO安全性試験))の導入は、いくつかの場合において、残留感染性の証拠を示した。この残留感染性を除去するための努力において、凝集物および/または濾過の機械的破壊が、成功しないことがわかった。
【0004】
ホルマリン処理に対する代替法として、UV不活化が、上記製造プロセス中に組み込むために考えられた。ヒトワクチンのUV照射不活化の使用が、以前に実証されている。非特許文献1および非特許文献2は、ヒトにおける研究からの免疫原性の結果に関して報告しており、この研究において、その著者らは、UV不活化したポリオワクチンを使用した。ポリオウイルスは、非エンベロープピコルナウイルスであり、1つのセグメント中に+鎖の一本鎖RNAゲノムを有する。このウイルスゲノムは、ウイルス表面抗原よりもUV損傷に対して感受性が高いので、ポリオウイルスキャプシドタンパク質の場合、UV不活化は、製品の生化学的特徴にも免疫原性にも、ほとんど負の影響を有さないことが示された。UV不活化のための標的は、ホルマリンにより標的とされるタンパク質とは対照的に、主に核酸である。ホルマリンとUV不活化とを組合わせることによって、科学者達は、特に活発なポリオウイルスを不活化する場合に、単独のUV不活化またはホルマリン不活化それぞれの限界を克服しようとした。例えば、非特許文献3を参照のこと。
【0005】
UV照射技術は、食物、薬剤、化粧品、および飲料の産業、ならびに飲料水において広範な適用範囲を有する。UV殺菌は、物理化学的プロセスであり、このプロセスにおいて、プリン塩基およびピリミジン塩基の環状分子の共有結合が、UV波長照射の励起エネルギーによって破壊され、核酸とその核酸がコードする遺伝情報とを損傷させる。有効なUVC(100nm〜280nm)に対して曝露された微生物(例えば、細菌および酵母など、ならびにウイルス)は、数秒以内に不活化される。結果として、成功する殺菌は、低下等価(reduction−equivalent)照射線量に依存する。平均殺菌照射線量(J/m2で表わす)が、バイオ線量計を使用して照射ゾーンにおいて測定される。しかし、UV不活化単独では、安全かつ有効なワクチンを生成するためには適切ではない。
【0006】
非特許文献4は、ホルマリンと紫外線との組み合わせを用いるポリオウイルスの不活化を記載する。非特許文献5は、紫外線−ホルマリンで不活化したポリオワクチンでワクチン接種された被験体の血液における、測定可能なレベルの循環抗体の形成を記載する。非特許文献6は、ホルマリン、UV光、およびβ−プロピオラクトンからなる3段階不活化プロセスによる、ハムスターにおけるアデノウイルスおよびシミアンウイルス40の腫瘍原性の不活化に関して報告する。非特許文献7は、紫外線とホルマリンとでの処理による、センダイウイルスの免疫原の調製を記載する。上記の構想のうちのいずれも、ワクチン製造における一般的使用のためにこれまで採用されていないが、産業規模で安全かつ有効なワクチンの製造について、絶えず存在する必要性があった。さらに、引用した研究のいずれも、本研究において使用されるVERO安全性試験と同程度に感度が高い、「不活化ウイルス」の残留感染性を決定するための安全性試験を使用していない。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Milzerら、Am.J.Pub.Health(1954)44:26〜33
【非特許文献2】Wolfら、JAMA(1956)161:775〜81
【非特許文献3】McLeanら、Experiences in the Production of Poliovirus Vaccines、Prog.Med.Virol.(1958),vol 1,pp.122〜164
【非特許文献4】Taylorら、J.Immunol.(1957)79:265〜75
【非特許文献5】Molnerら、Am.J.Pub.Health(1958)48:590〜8
【非特許文献6】Truffelliら、Appl.Microbiol.(1967)15:516〜27
【非特許文献7】Miyamae、Microbiol.Immunol.(1986)30:213〜23
【発明の概要】
【課題を解決するための手段】
【0008】
驚くべきことに、本発明者らは、ホルマリン不活化工程とUV不活化工程との組み合わせが、産業規模でのワクチン調製のために不活化ウイルスの製造のための高体積スループット系においてバルクウイルス中のウイルスを完全に不活化するために利用され得る。このことはまた、実施例において使用されるような高力価濃縮ウイルス調製物に関して示されており、実施例において、残留ウイルス活性が、非常に感度の高いVERO細胞培養物試験を使用して検出されなかった。本発明者らはまた、驚くべきことには、この方法は、非エンベロープウイルス(例えば、ポリオピコルナウイルス)と比較して、エンベロープウイルス(例えば、オルトミクソウイルス)について特によく機能することを実証した。この発見は、新生の急速に変化するウイルス疾患(例えば、大流行間性(interpandemic)インフルエンザ株および汎発性(pandemic)インフルエンザ株)のための、安全な非常に免疫原性のワクチンの迅速な製造のための重要な暗示を有する。
【0009】
(発明の要旨)
サンプル中に含まれるワクチンの非常に効率的かつ安全な不活化を可能にし、同時に、その不活化ワクチンの高い抗原性および免疫原性を保持する方法を提供することが、本発明の目的である。具体的には、本発明の方法は、高体積スループット系において、ホルマリン不活化工程をUV不活化工程と合わせて利用して、ワクチン製造において使用するための高抗原含量の安全なバルクウイルス調製物を製造する。
例えば、本願発明は以下の項目を提供する。
(項目1)
サンプル中に含まれるウイルスを不活化するための方法であって、該方法は、
(i)該サンプルを有効濃度のホルマリンで処理する工程;および
(ii)該サンプルをフロースルー装置中で有効線量のUV光に供す工程;
を包含し、工程(i)は、工程(ii)の前に実施されるかまたはその逆であり、該装置を通る該サンプルの流量は、約50L/時間〜約1000L/時間である、方法。
(項目2)
サンプル中に含まれるエンベロープウイルスを不活化するための方法であって、該方法は、
(i)該サンプルを有効濃度のホルマリンで処理する工程;および
(ii)該サンプルをフロースルー装置中で有効線量のUV光に供す工程;
を包含し、工程(i)は工程(ii)の前に実施されるかまたはその逆であり、該エンベロープウイルスは、完全に不活化される、方法。
(項目3)
サンプル中に含まれるエンベロープRNAウイルスを不活化するための方法であって、該方法は、
(i)該サンプルを有効濃度のホルマリンで処理する工程;および
(ii)該サンプルをフロースルー装置中で有効線量のUV光に供す工程;
を包含し、工程(i)は工程(ii)の前に実施されるかまたはその逆であり、該エンベロープウイルスは、完全に不活化される、方法。
(項目4)
サンプル中に含まれるウイルスを不活化するための方法であって、該方法は、
(i)該サンプルを有効濃度のホルマリンで処理する工程;および
(ii)該サンプルをフロースルー装置中で有効線量のUV光に供す工程であって、該装置は、該装置中にUVランプと該UVランプの直径に対して実質的に垂直な薄層チャンバとを備える、工程;
を包含し、工程(i)は、工程(ii)の前に実施されるかまたはその逆であり、該サンプルは、工程(ii)において該装置の薄層チャンバを通される、方法。
(項目5)
項目1〜項目4のうちのいずれか1項に記載の方法であって、前記サンプル中の前記ウイルスの不活化に起因するウイルス力価の低下は、少なくとも約1×105または少なくとも約1×107または少なくとも約1×1010または少なくとも約1×1014である、方法。
(項目6)
項目1〜項目5のうちのいずれか1項に記載の方法であって、前記サンプルを有効濃度のホルマリンで処理する工程は、約12時間〜約96時間かけて実行される、方法。
(項目7)
項目1〜項目6のうちのいずれか1項に記載の方法であって、前記ホルマリンの有効濃度は、約0.01%〜約0.1%である、方法。
方法。
(項目8)
項目1〜項目7のうちのいずれか1項に記載の方法であって、前記UV光は、約100nm〜約280nmの波長を有するUVCである、方法。
(項目9)
項目1〜項目8のうちのいずれか1項に記載の方法であって、前記UV光の線量は、約5mJ/cm2〜約200mJ/cm2である、方法。
(項目10)
項目1〜項目9のうちのいずれか1項に記載の方法であって、前記サンプルと前記UV光との接触時間は、約1秒間〜約20秒間である、方法。
(項目11)
項目1〜項目10のうちのいずれか1項に記載の方法であって、前記フロースルー装置における流量は、約50L/時間〜約100L/時間である、方法。
(項目12)
項目1〜項目11のうちのいずれか1項に記載の方法であって、前記フロースルー装置は、薄層チャンバを備える、方法。
(項目13)
項目1〜項目12のうちのいずれか1項に記載の方法であって、前記薄層チャンバを通る前記サンプルのフローは、濁っている、方法。
(項目14)
項目12または項目13に記載の方法であって、前記薄層チャンバの薄層は、約1mmの厚さを有する、方法。
(項目15)
項目1〜項目14のうちのいずれか1項に記載の方法であって、前記サンプルをフロースルー装置中で有効線量のUV光に供す工程は、約2回〜約10回反復される、方法。
(項目16)
項目1〜項目15のうちのいずれか1項に記載の方法であって、前記サンプルは、生物学的製品、医学的製品、または薬学的製品を調製するための細胞培養プロセスに由来する、生物学的流体または溶液からなる群より選択される、方法。
(項目17)
項目1〜項目16のうちのいずれか1項に記載の方法であって、該方法は、
前記サンプルを精製工程に供して該サンプル中の残留ホルマリンを除去する工程;
をさらに包含する、方法。
(項目18)
項目1〜項目17のうちのいずれか1項に記載の方法であって、該方法は、
前記サンプル中の不活化ウイルスを薬学的純度まで精製する工程;および
該精製された不活化ウイルスを、ワクチンとして使用するための薬学的組成物へと処方する工程;
をさらに包含する、方法。
【図面の簡単な説明】
【0010】
【図1】図1は、本発明のUV不活化工程のために使用され得るUV薄層チャンバを示す。
【図2】図2は、UVセンサーを備えたUV不活化システムを示す。上記のUVセンサーおよびフローメーターは、必要に応じた特徴である。本願のさらなる実施形態において、上記ポンプおよび/またはフローメーターは、出口チューブに備えられ得る。
【図3】図3は、フロースルー装置における有効線量にサンプルを反復して供するために、互いに接続されたいくつかのUV薄層チャンバ(UVリアクター)を使用するUV不活化システムを示す。UV薄層チャンバの数は、約2個〜約10個の間で変化し得る。上記UVセンサーおよびフローメーターは、必要に応じた特徴である。本願のさらなる実施形態において、上記ポンプおよび/またはフローメーターは、出口チューブに設置され得る。連続的に接続された不活化チャンバを備える連続UV生成器が、大規模製造プロセスにおいて使用され得、それによって、サンプルのハイスループットが可能になる。
【発明を実施するための形態】
【0011】
(発明の詳細な説明)
本発明の一局面に従って、上記目的は、サンプル中に含まれるウイルスを不活化するための方法を提供することによって解決される。この方法は、
(i)上記サンプルを有効濃度のホルマリンで処理する工程;および
(ii)上記サンプルをフロースルー装置中で有効線量のUV光に供す工程;
を包含し、工程(i)は、工程(ii)の前に実施されるかまたはその逆である。好ましくは、上記装置を通る上記サンプルの流量は、約50L/時間〜約1000L/時間である。
【0012】
不活化するための方法の別の好ましい局面において、不活化されるべきウイルスは、それぞれ、エンベロープウイルスまたはエンベロープRNAであり、上記エンベロープウイルスまたはエンベロープRNAウイルスは、それぞれ、完全に不活化される。
【0013】
別の局面に従って、サンプル中に含まれるウイルスを不活化するための方法が提供される。この方法は、
(i)上記サンプルを有効濃度のホルマリンで処理する工程;および
(ii)上記サンプルをフロースルー装置中で有効線量のUV光に供す工程;
を包含し、上記装置は、上記装置中にUVランプと上記UVランプの直径に対して実質的に垂直な薄層チャンバとを備え、工程(i)は工程(ii)の前に実施されるかまたはその逆であり、上記サンプルは、工程(ii)において上記装置の薄層チャンバを通される。
【0014】
本発明の好ましい実施形態において、上記サンプルは、有効濃度のホルマリンで処理された後に、フロースルー装置中で有効線量のUV光で処理される。本発明者らは、いかなる理論によっても拘束されないが、ビリオンの表面分子上でのホルマリンの架橋効果が、UV不活化フロースルー装置の高体積流体力学の厳密さ(rigor)のためにウイルスを安定化すると、考えられる。
【0015】
本発明に従う不活化する方法は、実施例2および実施例4(A)において実証されるように、有効かつ安全である。さらに、不活化する方法は、実施例4(B)において示されるように防御免疫応答を惹起する、高い抗原性および免疫原性を有するワクチンの製造を可能にする。
【0016】
用語「サンプル」とは、本明細書中で使用される場合、病原体もしくはその一部を含有する任意のサンプル(例えば、(生物学的製品、医学的製品、または薬学的製品(例えば、血液製品もしくはワクチン)を調製するための細胞培養プロセスに由来する任意の流体(例えば、生物学的流体もしくは溶液))を包含する。そのサンプルは、生物学的流体(例えば、血液または血漿)を含むサンプルであり得る。そのサンプルはまた、細胞培養物の収集された成分(例えば、その培養物の細胞もしくは培養培地画分)を含む流体であり得る。好ましい実施形態において、そのサンプルは、例えば、ワクチンの製造における治療剤の製造において使用される流体であり、その不活化ワクチンまたはその部分が、治療剤である。特に好ましい実施形態において、細胞成分は、例えば、濾過または遠心分離によって、不活化方法の前の上記サンプルから分離される。
【0017】
本出願の好ましい実施形態において、上記ウイルスは、細胞培養物の収集物(その上清および細胞からなる)から生成され、これは、医療製品(例えば、ワクチン)の調製のためにさらに使用される。本発明のさらなる実施形態において、上記細胞培養物の細胞は、病原体に感染している。上記細胞は、上記ウイルスを生成するために適切な一次細胞または任意の培養細胞であり得る。使用され得る細胞の例としては、哺乳動物細胞(例えば、CHO細胞、BHK細胞、VERO細胞、HELA細胞)、鳥類細胞(例えば、ニワトリ胚線維芽細胞、または鳥類由来の連続細胞株)、および昆虫細胞(例えば、Sf9細胞)が挙げられる。本発明の好ましい実施形態において、ウイルスバルクの細胞培養生成に由来する細胞および細胞破片は、化学的(ホルマリン)不活化工程および/またはUV照射不活化工程の前に、そのウイルスバルクから分離される。
【0018】
本発明において、不活化されるべきウイルスは、エンベロープまたは非エンベロープのDNAウイルスもしくはRNAウイルスであり、一本鎖ゲノムもしくは二本鎖(DNA)ゲノムを有し、センスもしくはアンチセンスであり、連続的であるかもしくは分節している(segmented)。上記ウイルスは、バキュロウイルス、ポックスウイルス、アデノウイルス、パポバウイルス、パルボウイルス、ヘパドナウイルス、コロナウイルス、フラビウイルス、トガウイルス、アストロウイルス、ピコルナウイルス、レトロウイルス、オルトミクソウイルス、フィロウイルス、パラミクソウイルス、ラブドウイルス、アレナウイルス、およびブンヤウイルスからなる群より選択され得る。本発明の好ましい実施形態において、上記ウイルスは、エンベロープウイルス(フラビウイルス、トガウイルス、レトロウイルス、コロナウイルス、フィロウイルス、ラブドウイルス、ブンヤウイルス、オルトミクソウイルス、パラミクソウイルス、アレナウイルス、ヘパドナウイルス、ヘルペスウイルス、およびポックスウイルスが挙げられる)の群から選択される。実施例および実施例7において示されるように、本発明の不活化方法は、非エンベロープポリオおよび非エンベロープアデノウイルスと比較して、エンベロープウイルス(例えば、インフルエンザウイルスおよびロス川ウイルス)に対して特に有効である。本発明の他の好ましい実施形態において、上記ウイルスは、エンベロープRNAウイルス(フラビウイルス、トガウイルス、レトロウイルス、コロナウイルス、フィロウイルス、ラブドウイルス、ブンヤウイルス、オルトミクソウイルス、パラミクソウイルス、およびアレナウイルスが挙げられる)の群から選択される。特に好ましい一実施形態において、上記ウイルスは、オルトミクソウイルス(例えば、インフルエンザウイルス株)から選択される。インフルエンザウイルス株は、赤血球凝集素タンパク質およびノイラミニダーゼ表面タンパク質の種々の組み合わせを有し得る。別の特に好ましい実施形態において、上記ウイルスは、トガウイルス(例えば、アルファウイルス(例えば、ロス川ウイルス(RRV)))から選択される。バルクウイルス溶液として使用するための別の好ましいウイルス群は、コロナウイルス(重症急性呼吸器症候群(SARS)に関連するウイルスが挙げられる)である。別の好ましいウイルス群は、フラビウイルス(日本脳炎ウイルス、ダニ媒介脳炎(TBE)ウイルス、デング熱ウイルス、黄熱病ウイルス、および出血熱ウイルスが挙げられる)およびトリポックスウイルスである。
【0019】
不活化ウイルス病原体の部分もまた、本発明によって包含される。本発明の好ましい実施形態において、上記部分は、免疫原においてエピトープとして役立ち得る。このエピトープは、上記病原体に対する免疫応答を惹起するために使用され得る。本願の好ましい実施形態において、病原体の部分は、上記病原体に対するワクチンとして使用される。特に好ましい実施形態において、上記病原体の部分は、分割されたビリオン(split virion)であり、これは、分割される前または分割された後に、不活化され得る。
【0020】
本発明の意味においては、本発明に従う不活化する方法は、その方法を使用して生成された不活化されたウイルスが哺乳動物細胞培養試験(例えば、実施例2において詳述される安全性試験)を合格した場合に、安全である、または完全に不活化されている、と考えられる。示されるように、これらの試験は、使用される他の試験(例えば、卵試験)よりも感度が高い。その安全性試験の好ましい合格/不合格の基準は、実施例1および実施例2において詳述される。
【0021】
本願の好ましい実施形態において、上記サンプルにおけるウイルスの不活化に起因するウイルス力価の低下は、少なくとも約1×105、より好ましい実施形態において少なくとも1×107、より好ましい実施形態において少なくとも約1×1010、最も好ましい実施形態約1×1014である。
【0022】
本発明の好ましい実施形態において、上記サンプルは、有効濃度のホルマリンで約12時間〜約96時間処理される。より好ましい実施形態において、上記サンプルは、有効濃度のホルマリンで約24時間〜約48時間、より好ましくは約24時間〜約30時間、処理される。
【0023】
本発明の特に好ましい実施形態において、上記サンプルは、有効濃度のホルマリンで24時間〜約24.5時間される。
【0024】
さらなる実施形態において、上記サンプルを有効濃度のホルマリンで処理する工程は、約10℃〜約40℃にて実行される。本出願の特に好ましい実施形態において、上記サンプルを有効濃度のホルマリンで処理する工程は、約32℃で実行される。
【0025】
本発明の特に好ましい実施形態は、有効濃度のホルマリンによる上記サンプルの処理を包含し、そのホルマリンの有効濃度は、好ましくは約0.01%(w/w)〜約1%(w/w)、好ましくは約0.01%〜約0.1%、より好ましくは約0.025%(これは、この有効濃度を調節するために37%ホルマリン溶液を使用する場合、約92mg/lホルマリンに対応する)〜約0.1%(これは、この有効濃度を調節するために37%ホルマリン溶液を使用する場合、それぞれ、約368mg/lホルマリンに対応する)の範囲である。
【0026】
本出願において、用語「UV光」とは、100nm〜400nmの波長を有する紫外線を意味する。上記UV光は、UVC(100nm〜280nm)、UVB(280nm〜320nm)、およびUVA(320nm〜400nm)からなる群より選択され得る。光感作剤(DNA中にインターカレートしかつUV光によって不活化されるもの(例えば、ソラレン)など)が、UV照射の不活化効果を増強するために使用され得る。本発明の好ましい実施形態において、上記UV光は、約100nm〜〜約280nmの波長を有するUVCである。本発明のより好ましい実施形態において、上記UV光は、約240nm〜〜約290nmの波長を有する。本発明の特に好ましい実施形態において、上記UV光のうちの約85%以上は、約254nmの波長を有する。
【0027】
UV光放射は、連続形態のUV光放射(例えば水銀ランプ技術)であっても、パルス型UV光(単色レーザー技術)であってもよい。望ましいUV強度は、2つ以上のランプを組合わせることによって、生成され得る。好ましい実施形態において、上記光は、約110Wのランプによって連続的に放射される。実施例において示される好ましい実施形態において、上記UVランプは、実施例において使用されるランプ(950nm)と同様に、少なくとも1mの長さを有する。
【0028】
本発明の主題は、有効線量のUV光(すなわち、上記のようなホルマリン処理と組み合わせた場合に所定のウイルスを安全に不活化する、任意の線量のUV光)を包含する。その有効線量は、当該分野で一般的に公知である種々の要因(例えば、UV不活化の物理的パラメーター(例えば、ランプおよびチャンバの大きさおよび直径;ウイルス含有培地とUV光源との間の距離;チャンバ材料の光吸収特性および光反射特性))に依存し得る。同じ理由によって、UV光の波長および強度、ならびにウイルスがUV光に曝露される接触時間もまた、上記有効線量のために重要である。さらに、有効線量はまた、ウイルス自体、ウイルスを含む培地、およびそれらの光吸収特性によって影響を受ける。好ましくは、上記有効線量は、サンプル中に含まれるウイルスのうちの少なくとも99.99%を死滅させるために十分であり、より好ましくは、活性なウイルスが哺乳動物細胞培養試験(好ましくは実施例2に従う試験)において検出されないレベルまで上記ウイルスを不活化する(すなわち、完全に不活化する)ために、十分である。好ましい実施形態において、UVC光を使用して、上記ウイルスを含むサンプルが、約5mJ/cm2〜約200mJ/cm2の範囲の有効線量に曝露される。好ましい実施形態において、上記有効線量は、約20mJ/cm2〜約100mJ/cm2の範囲にある。他の好ましい実施形態において、上記有効線量は、約40mJ/cm2〜約90mJ/cm2の範囲にある。比較として、飲料水中に存在する病原体のうちの99.99%を死滅させるための有効線量は、約>40mJ/cm2である。好ましい実施形態において、上記有効線量は、初期ウイルス力価を1×105低下させる。バルクワクチン不活化において、上記有効線量は、初期化学的(ホルマリン)不活化工程の後に存在し得るあらゆる残留ウイルスを除去するために十分であるべきである。実施例において示されるように、これは、非常に感度の高い哺乳動物細胞培養感染試験(例えば、記載されるVero細胞培養試験)によって決定され得る。
【0029】
本発明(特に、UV光チャンバ)のさらなる好ましい実施形態が、実施例に提供される。
【0030】
本発明のさらなる好ましい実施形態において、上記サンプルとUV光との接触時間は、約1秒間〜約20秒間、好ましくは約1.4秒間〜約14秒間の範囲にある。上記接触時間は、上記光源に対する接線に沿って約1mm厚であるサンプルおよび上記UVランプのワット量約110Wに基づいて好ましくは計算される。当業者は、サンプルの奥行きが厚く光源のエネルギー(ワット量)が少ない程、上記曝露時間が増大し、その逆もまた真であることを、認識する。本出願のより好ましい実施形態において、上記サンプルとUV光との接触時間は、約1.4秒間〜約7秒間である。本願の特に好ましい実施形態において、上記サンプルと上記UV光との接触時間は、約2.8秒間〜約4.2秒間である。
【0031】
所定のUV光線量を使用する本発明に従う所定の設定が本発明に従って病原体を有効に不活化するか否かを試験するために、その不活化されたウイルスを、残留ウイルス活性について試験すべきである。これは、哺乳動物細胞培養試験(例えば、Vero安全性試験)を使用することによって、好ましくは実施例1および実施例2に詳述される基準を適用して、達成され得る。
【0032】
本発明に従って、有効線量のUV光による上記サンプルの処理は、好ましくは表1および図1において特定されるように、フロースルー装置において実行される。
【0033】
本発明の好ましい実施形態において、上記フロースルー装置は、薄層チャンバを含む。そのチャンバの最小厚は、妥当な迅速な処理を可能にしかつ完全不活化ウイルスワクチンのためにウイルス破壊を防止するために、上記バルクウイルス溶液の十分なフローを可能にすべきである。また、上記バルクウイルス溶液によるUV照射の吸収と、上記溶液中のすべてのウイルスの十分な照射を確実にする必要性とに起因して、その最大の厚みは、すべてのビリオンが十分に照射されることなく上記装置を通過することを許容すべきではない。従って、上記薄層は、約1cm厚よりも厚いものであるべきではない。上記薄層は、好ましくは0.5mm厚〜約3mm厚であり、より好ましくは約1mmであり、その結果、上記UVランプと不活化されるべき病原体との間の最大距離は、約1mm未満である。あるいは、上記サンプルは、上記ランプの長さに対して平行に上記ランプウを通され得、その結果、上記サンプルは、上記サンプルチャンバの内径ではなく外径から照射される。同様に、ランプ(またはランプの円)中のサンプルチャンバ内のランプは、内径および外径の両方から上記サンプルチャンバを照射する構成として、使用され得る。さらに、上記チャンバは、好ましくは、上記チャンバを通るサンプルのフローが厳密には層流ではなく乱流であるように、設計される。このことは、上記ウイルスをサンプル培地と混合することを補助し、UV照射に対する均一な曝露を確実にする。
【0034】
本出願の別の好ましい実施形態において、上記フロースルー装置は、UV不活化チャンバを含み、UVランプは、直径約30mmを有し、上記サンプルが流れるUVランプを取り囲むチャンバは、約32mmの直径を有する。本願の好ましい実施形態において、上記チャンバは、総体積約92mlを有する。
【0035】
照射されるべきサンプルは、上記装置を通され得る。好ましい実施形態において、上記サンプルは、上記UV照射チャンバを通りながら冷却される。本発明のさらなる好ましい実施形態において、上記UVチャンバを通るサンプルは、約2℃〜約32℃、より好ましくは約2℃〜約8℃の温度を有する。
【0036】
好ましくは、上記フロースルー装置中のサンプルの流量は、約50L/時間〜約1000L/時間、より好ましくは約230L/時間〜約480L/時間の範囲にある。特に好ましい実施形態において、上記フロー装置中のサンプルの流量は、約230L/時間〜約250L/時間の範囲にあり、より好ましくは約240L/時間である。実施例において例証されるこれらの好ましい流量は、上記バルクウイルス溶液の経済的大規模UV処理を可能にする。
【0037】
好ましい実施形態において、上記接触時間は、上記サンプルがUV照射に曝露されるサンプルチャンバの長さ、およびそのチャンバを通る上記サンプルの流量に依存する。従って、上記フロースルー装置において配置されたUVランプの数を増加することによって簡単に調整され得る有効線量は、UV照射に対して曝露されるサンプルチャンバの有効長さを増加する。あるいは、同じ数の、より長いランプ−チャンバを使用すると、上記有効線量を増加し、同様に、より多くの数の、より短いランプ−チャンバを使用すると、同じ有効線量と等価であり得る。
【0038】
本発明のさらなる好ましい実施形態において、上記サンプルをフロースルー装置において有効線量のUV光に供する工程は、周期的様式または連続的様式で反復される。この工程は、約2回〜約10回反復され得る。本願の好ましい実施形態において、上記サンプルをフロースルー装置において有効線量のUV光に供する工程は、約2回〜約5回反復され、本願のより好ましい実施形態において、この工程は、約2回〜約3回反復される。複数のランプチャンバを連続して使用することまたは同じランプを通す再循環フローを使用することに対するさらなる利点は、上記サンプルが、チャンバ間またはサイクル間で、より徹底的に混合され得て、UV照射に対する上記ウイルスの均一な曝露を確実にし得ることである。
【0039】
上記サンプル中のウイルスが不活化された後に、不活化されたウイルスは、種々の適用(ワクチンおよび他の薬学的組成物が挙げられる)における使用のために精製され得る。本発明の別の好ましい実施形態によると、不活化する方法は、上記サンプル中の不活化ウイルスを薬学純度に精製し、精製されたウイルスを、ワクチンとして使用するための薬学的組成物へと処方する工程をさらに包含する。精製は、当該分野において公知の手段(濾過、またはダイアフィルトレーション、クロマトグラフィー(例えば、サイズ排除クロマトグラフィー、イオン交換クロマトグラフィー、免疫親和性クロマトグラフィーなど)、または遠心分離が挙げられるが、これらに限定はされない)によって達成され得る。あるいは、上記ウイルスは、本発明の方法による不活化の前に、精製され得る。
【0040】
本発明の別の好ましい実施形態によると、不活化する方法は、精製工程をさらに包含する。すなわち、上記サンプルは、そのサンプル中の残留ホルマリンを除去するための精製工程に供される。そのような精製は、薬学的に受容可能なレベルよりも高いホルマリンレベルが残る場合に、有用である。不活化されたウイルスは、必要に応じた精製工程の後に、薬学的組成物へと処方され得る。処方物は、必要に応じて、キャリア(例えば、生理食塩水もしくは緩衝液)、賦形剤、安定剤(例えば、アルブミン、糖、および/もしくはアミノ酸)、塩および/またはアジュバント(例えば、ミョウバン)を含み得る。あるいは、不活化されたウイルスは、薬学的使用のために、例えば、リポソーム中への封入によって、さらに改変され得る。
【0041】
本発明は、以下の実施例においてさらに例証され、以下の実施例は決して限定されない。本発明が詳細に記載されているが、改変および変化が、添付の特許請求の範囲において定義される発明の範囲から逸脱することなく可能であることが、明らかである。
【実施例】
【0042】
(実施例1:標準的卵安全性試験の原理)
標準的卵安全性試験を使用して、不活化されたインフルエンザウイルスの残留感染性について試験した。一価バルク製品(すなわち、ショ糖勾配遠心分離および超ダイアフィルトレーションの後の精製ウイルス抗原)を、10個の卵(0.2ml/卵)に注入する。32℃にて3日間インキュベートした後、それらの卵を収集し、プールし、再度、10個の卵(0.2ml/卵)に注入する。32℃にて3日間さらにインキュベートした後、それらの卵を収集し、プールし、赤血球凝集素(HA)について試験する。
【0043】
このHA試験は、インフルエンザウイルスが、その表面タンパク質である赤血球凝集素を使用して赤血球に結合し得ることに基づく。この試験は、滅菌環境において実行する。所定のHA力価を有するインフルエンザ懸濁物が、ポジティブコントロールとして役立ち、0.9% NaCl溶液が、ネガティブコントロールとして役立つ。0.9% NaCl中における試験すべきサンプルの1:2希釈物50μlを、96ウェルプレートのうちの1つのウェルに提供する。各ウェルに、ニワトリ赤血球を含む溶液50μlを添加する。その後、そのプレートを、室温で30分間〜45分間インキュベートする。そのgお、赤血球凝集素を視覚的に決定する。この場合、同じサンプルを含む5つのサンプルが赤血球凝集素を全く示さない場合、そのサンプルは、このHA試験を合格した。
【0044】
(実施例2:標準的Vero安全性試験の原理)
標準的Vero安全性試験は、不活化インフルエンザ株の残留感染性についての非常に厳密な品質試験である。この試験はまた、他のウイルスにも適用可能である。一価バルク製品(すなわち、ショ糖勾配遠心分離および超ダイアフィルトレーションの後の精製ウイルス抗原)を、5個のルー瓶(4ml/瓶)に注入する。Vero培地中で32℃にて7日間インキュベートした後、それらの細胞培養物を収集し、プールし、5個のルー瓶(10ml/瓶)に注入する。32℃にて7日間さらにインキュベートした後、それらの細胞培養物を収集し、プールし、実施例1において記載されるように赤血球凝集素(HA)について試験する。
【0045】
(実施例3:ホルマリン不活化)
ホルマリンによる最初の不活化工程は、無細胞の感染性一価ウイルス収集物(すなわち、遠心分離を介して清澄化した後のバイオリアクター収集物)で実行する。30℃〜34℃で収集した後、その一価ウイルス収集物を、約0.9U/ml〜約1.1U/mlのベンゾナーゼを用いて30℃〜34℃にて4時間〜8時間処理する。その後、それを、≦92mg/lのホルマリンを用いて32±2℃にて24時間〜24.5時間処理する。
【0046】
(実施例4:65ワットUVランプを用いる不活化実験)
ホルマリン不活化ウイルスを用いる多数の不活化実験を、65WのUVランプと薄層チャンバとを備える不活化チャンバを使用して実行する。一価ウイルス収集物の完全な不活化が、100L/時間の流量で3サイクルを使用した場合に実証され得るが、この設定は、UVシグナルのオンライン測定を可能にはしなかった。インフルエンザ生成のために使用されるVero細胞培地は、UVシグナルの吸収を担う種々の有機化合物を含む。従って、上記のシステムは、110Wのランプを備え、これによって、一価ウイルス収集物の処理の間のUVシグナルの連続的モニタリングを可能にする。
【0047】
(実施例5:110ワットUVランプを用いる不活化実験)
ホルマリン処理した一価インフルエンザパナマ(Panama)収集物を、この不活化研究のためのモデル基質として使用する。薄層UV技術を用いる連続的不活化のために、VISAランプ(110W/4V)を備えるWEDECO VISAシステム(Germany)を使用する。UV薄層チャンバは、30mm直径石英チューブを備えるステンレス鋼製1.4435デバイスである(表1を参照のこと)。較正済みUVセンサーは、UVシグナルのオンライン制御を可能にする。UV薄層チャンバを、周囲温度において240±10L/時間の流量で操作する。この流量条件を、較正済みフローメーターによって制御する(表2を参照のこと)。
【0048】
(表1)
(UV不活化チャンバの特徴)
【0049】
【表1】

上記一価収集物を、10回のUVサイクルに曝露する。各サイクルの後、UV処理済み一価収集物のうちの20Lを取り出す。これを、20mM Tris緩衝液中での長期42%ショ糖勾配を用いる連続的超遠心分離条件を使用するショ糖勾配精製によってさらに精製し、所定の精製一価収集物(PMVH)を、プレ清澄器(preclarifier)を備えないSorvall CC40遠心機(Hitachi Koki Co,LTD,Tokyo,Japan)を使用して、48%から36%へのショ糖を使用して精製する。
【0050】
(表2)
(ホルマリンとUVとで処理したインフルエンザパナマ(Panama)の超遠心分離実行の概要)
【0051】
【表2】

((A)抗原の収率および純度)
インフルエンザ抗原の収率および純度を、赤血球凝集素(HA)含量、総タンパク質、およびVeroタンパク質(宿主細胞タンパク質)に基づいて比較する。精製ウイルスを、HA/タンパク質比、宿主細胞タンパク質/HA比、およびウイルス安全性に基づいて比較する(表3を参照のこと)。UV処理したすべての収集物について、何のウイルス増殖も検出され得ない。対照的に、標準的ホルマリン不活化プロセス(UV照射を適用しない)に由来する精製ウイルスは、Vero細胞培養物において増殖され得る。HA/タンパク質比の有意な低下がサイクル7およびサイクル10の後に観察され得るが、ホルマリン不活化製品と二重不活化製品との有意な差異は、HA/タンパク質比および宿主細胞タンパク質/HA比として測定した抗原純度に関して検出されない。
【0052】
(表3)
(ホルマリンとUVとでの処理の後のショ糖勾配精製したパナマ(Panama)ウイルス。0回〜10回のUVサイクル後の、HA/タンパク質比、宿主細胞タンパク質/HA比、および安全性)
【0053】
【表3】

さらなる研究を実行して、赤血球凝集素阻害(HAI)分析によってモルモットおよびマウスにおける抗原性と免疫原性とに対するUV不活化の効果を特徴付ける。
【0054】
((B)抗原性)
抗原性を、パナマ(Panama)特異的抗血清に対するHAIアッセイによって分析する。UV接触時間の増加は、HAのわずかな喪失をもたらすが、HAI力価については何の負の影響も示されない(表4を参照のこと)。
【0055】
(表4)
(ホルマリンとUVとでの処理の後のショ糖勾配精製したパナマ(Panama)ウイルス。0回〜10回のUVサイクル後の、パナマ(Panama)特異的抗血清を用いたHA力価およびHAI力価に基づく抗原性の比較)
【0056】
【表4】

((C)免疫原性)
免疫原性を、モルモットおよびマウスを、種々のアリコートの精製一価ウイルス収集物で免疫して、最初の免疫の3週間後にブースターで免疫することによって、分析する。免疫した動物の血清を、3週間後および6週間後に収集してプールし、卵由来抗原に対するHAIアッセイおよびVero由来抗原に対するHAIアッセイによって分析する。3週間後および6週間後にモルモットおよびマウスにおいて試験した免疫原性は、非常に有望な結果を与える。二重不活化ウイルスについて、標準的ホルマリン処理ウイルスに対する有意な差異は、観察され得ない(表5を参照のこと)。
【0057】
(表5)
(ホルマリンとUVとでの処理(0回〜10回のサイクル)の後のショ糖勾配精製パナマ(Panama)ウイルス。モルモットおよびマウスにおいて試験した免疫原性の比較。A)3種間後、B)6週間後。卵由来インフルエンザ抗原を用いるHAIおよびVero由来インフルエンザ抗原を用いるHAI)
【0058】
【表5】

表4および表5において要約される結果は、UV処理が、HAI力価の有意な差異を生じないことを示し、このことは、その製品の抗原性(従って、免疫原性)が、影響を受けないことを示す。
【0059】
すべての二重不活化実験において、1サイクルのUV処理の後でさえ、完全な安全性が実証され得る。実験室および最終規模における詳細な研究は、ホルマリン処理と組合わせた場合に、UV照射工程の有効性を実証した。UV処理の後の精製ウイルス抗原の免疫学的特徴づけは、非UV未処理製品で得られる結果に匹敵する結果を生じる。そのウイルス製品の生化学的特徴に対しても免疫原性に対しても、何の負の影響も検出され得ない。
【0060】
(実施例6:ホルマリンおよび/またはUVでの不活化によるウイルス力価の低下)
有効濃度のホルマリンとフロースルー装置における有効濃度のUV光とを組合わせたサンプル処理によるウイルス力価低下を、種々のウイルスを用いて試験する。ホルマリン不活化を、最終ホルマリン濃度0.025%(w/v)を用いて32℃で24時間実行した。フロースルー装置におけるUV不活化を、流量240l/時間にて3サイクル事項する。1サイクル当たりのサンプルとUV光との接触時間は、1.4秒間である。
【0061】
(表6)
(ホルマリンおよび/またはUV不活化によるウイルス力価低下)
【0062】
【表6】


この結果は、ホルマリンとUVとを合わせたウイルス処理によって、それぞれのウイルス力価の劇的な低下が得られることを示す。
【0063】
(実施例7:ロス川ウイルス(RRV)候補ワクチンのUV不活化)
ロス川ウイルス(RRV)は、流行性多発性関節炎(EPA)として公知であるヒトの疾患を引き起こす、蚊媒介性アルファウイルスである。症状としては、関節炎(特に、膝ならびに手および脚の小関節における関節炎)が挙げられ、しばしば、発熱、発疹、および他の非特異的全身変化を伴う)が挙げられる。関節炎の症状は、一般的には、30週間〜40週間継続し、患者のうちの25%は、発症1年後に残留する症状を依然として有する。これは、オーストラリア(毎年8000件よりも多い症例がある)および太平洋領域全体にわって流行する。1989/80年において、ロス川ウイルス感染の流行がまた、フィジー、サモア、クック諸島、およびニューカレドニアにおいて生じた。現在、何のワクチンも存在しない。
【0064】
((A)無血清マイクロキャリアベースの1200L Vero細胞発酵槽培養物のRRV接種、およびホルマリン不活化)
マイクロキャリアベースの無血清Vero細胞の1200L発酵槽培養物に、ロス川産生ウイルスを接種した。その培養物を、37℃にて3日間インキュベートした。サンプルを、力価決定用に毎日取り出した。3日目に、その細胞のうちの100%がCPR(細胞障害効果)によって破壊された場合に、ウイルスを収集した。感染性ウイルス収集物からの細胞破片およびマイクロキャリアの分離と最初の力価決定工程(1.2μm/0.2μm)の後、ベンゾナーゼを、核酸(DNA/RNA)分解のために添加した。ホルマリン不活化を、0.1%(w/v)ホルマリン最終濃度を用いて8日間実行した。第二の濾過工程および第三の濾過工程を、それぞれ、2時間後および24時間後に実行した。ベンゾナーゼを、残留核酸の除去のために、24時間目に2回目に添加した。サンプルを、ウイルス力価決定(Vero細胞における組織培養感染量(tissue culture infectious dose)50(TCID50/ml)のため、および表7に従
うC6−36細胞およびVero細胞における安全性試験のために、取り出した。
【0065】
RRVを1200L発酵槽に接種した1日後に、logTCID50/ml=5.8であるウイルス力価が、実証され得、これは、7.8(2日目)、8.1(収集前3日目)、および8.0(ウイルス収集後)に増加した。分離、第一濾過、およびベンゾナーゼ添加の後、ウイルス力価は、それぞれ、7.5、7.2、および7.4へと低下した。ホルマリン添加後、ウイルスペレットの遠心分離および再懸濁(表7、カラム:TCID50/ml TL100)によって細胞傷害性ホルマリン懸濁物を除去した後に、力価を決定した。ホルマリンをウイルス収集物に添加した15分間後に、力価は、1.6へと隙敵に添加した。ホルマリン不活化の12時間後、もはやウイルス力価は実証され得なかった。
【0066】
ホルマリン不活化開始の24時間後に、サンプルを、C6−36細胞およびVero細胞における安全性試験に供した。不活化の24時間後および26時間後に、1つの陽性サンプル(CPE)および4つの陰性サンプルが、Vero細胞において実証され得、4つの陽性サンプルおよび1つの陰性サンプルが、さらに感度が高いC6−36細胞株を用いて得られた。2日目よりも後には、すべてのサンプルがVero細胞において院生であった。このC6−36細胞は、2日目および3日目に1つのサンプルでCPE、および4つの陰性サンプルをそれぞれ依然として示した。4日目および5日目に、すべてのサンプルは、C6−36細胞において陰性であると試験されたが、6日目および7日目に、1つのサンプルが、再びCPEを示した。8日目に、Vero細胞においてもC6−36細胞においても、もはや陽性サンプルは示され得なかった。
【0067】
【表7】

((B)RRV RNAを用いるトランスフェクション実験および感染実験)
上記の安全性試験の結果は、ゲノムRRV RNAが上記不活化手順の間に放出され得るという疑いを増加させた。これは、次に、それぞれの細胞中へのゲノムRRV RNAの組み込みをもたらし得る。ベンゾナーゼ処理は、RNAの完全な分解をもたらすはずであるが、リポソーム形成または他の機構(タンパク質破片によるゲノムRRV RNAのマスキングなど)が、インタクトなRNAの逃避ストラテジーを説明し得る。
【0068】
RRVゲノムRNAを、勾配精製したビリオンから単離した。RT−PCRを介して、粒子等価物の数を決定し得た。第一の実験(表8、番号1)において、粒子等価物(ゲノムRNA)は、トランスフェクション培地(すなわち、トランスフェクション)および通常培地(すなわち、感染)の両方において10倍段階で希釈した。両方の混合物を用いて、C6−36細胞およびVero細胞に接種した。培地交換の後、細胞培養物を、数時間インキュベートした。個々の上清のサンプルを、ウイルス力価決定およびHA決定のために使用した。ゲノムRNAを用いる感染実験を、数回実行した(表8、番号1〜5)。
【0069】
上記トランスフェクション実験は、C6−36細胞およびVero細胞の両方において、TCID50を生じる。Vero細胞上清はまた、HA力価を示した。多数の粒子等価物(108)によるVero細胞の感染は、ウイルス力価6.8log TCID50/mlを示し、HA力価128を有したが、C6−36細胞には感染しなかった。ゲノムRRV RNAを用いる別の感染実験(番号4)は、C6−36細胞およびVero細胞の両方の感染(それぞれ、力価8.4log TCID50/mlおよび6.6log TCID50/ml)を生じた。感染試行2、3、および5は、Vero細胞において陽性の結果を生じなかった。感染事項番号3は、C6−36細胞において、低い力価1.6log TCID50/mlを生じた。
【0070】
純粋なゲノムRRV RNAを用いて細胞を感染させるすべての試行が陽性の結果を示したわけではないが、高濃度のゲノムRNAが、細胞にランダムに感染可能であるようである。リポソームトランスフェクション試薬を使用したすべての実験が、陽性の結果を示した。従って、RNAのタンパク質マスキングまたはリポソーム形成機構が、表7におけるホルマリン不活化および遊離DNA/RNAのベンゾナーゼ分解の後の陽性の安全性試験を説明する。
【0071】
【表8】

((C)感染性RRVのUV不活化)
上記の考慮事項について、小規模実験を実行して、UV照射によりRRVを不活化した。RRV PV上清を、2つのUV強度(2.1mW/cm2(サンプル1〜10)および3.3mW/cm2(サンプル11〜20))を用いて、種々の時間の間UV照射した。その後、これらのサンプルをウイルス力価決定に供し、抗原力価(EIA)および赤血球凝集素力価を決定した。3分間よりも長く照射したサンプル(番号6〜10および14〜19)もまた、C6−36細胞において安全性試験に供した(表9)。
【0072】
ウイルス力価は、両方のUV強度を用いた10分間のUV照射の後に、7.4log TCID50/ml(コントロール、サンプル番号1)から1.5log TCID50/mlへと低下した。赤血球凝集反応は、UV強度2.1mW/cm2にて15分間の間安定なままでありHA力価が9であったが、UV強度3.3mW/cm2では8まで低下した。抗原力価(EIA)はまた、15分間の照射の間、640〜1280の範囲内で安定なままであった。安全性試験は、UV強度2.1mW/cm2にて3分間および5分間照射したサンプル(サンプル番号6および7)を用いて実行したところ、依然として、細胞培養物においてCPEを示し、それぞれ、ウイルス力価8.2log TCID50/mlおよび8.6log TCID50/mlを生じた。安全性試験は、UV強度3.3mW/cm2にて2分間、3分間、および5分間照射したサンプル(サンプル番号14〜16)を用いて実行したところ、依然として、細胞培養物においてCPEを示し、それぞれ、ウイルス力価8.2log TCID50/ml、8.6log TCID50/ml、および8.7log TCID50/mlを生じた。10分間の照射の後、すべての安全性試験は陰性であった。
【0073】
2.1mW/cm2および3.3mW/cm2の両方の強度で10分間よりも長くUV照射すると、RRV調製物を完全に不活化した。HA試験およびEIA試験において示されるように、抗原性は、両方の照射強度で15分間の間で損なわれないままであった。30分間後、抗原性は影響を受けた。
【0074】
【表9】

((D)ホルマリンで不活化した1200L発酵槽収集物のUV不活化)
ホルマリンで処理した1200L発酵槽のウイルス収集物のアリコートを、流量300l/時間で3サイクル、150l/時間で3サイクル、75l/時間で3サイクルにてUV照射した。ホルマリンで処理した1200L発酵槽のウイルス収集物の第二アリコートを、流量300l/時間にて10サイクルでUV照射したが、今度は、ダイアフィルトレーションの後に、高濃度の残留する小タンパク質を除去した。HA力価、抗原−EIA力価、ウイルス力価、および安全性(CPE)を、各試行の後に決定した(表10)。
【0075】
第一の実験(ダイアフィルトレーションなし)におけるウイルス力価は、流速150l/時間にて1サイクルのUV照射の後に、6.13log TCID50/mlから検出限界未満までに低下した。安全性試験もまた、CPEを示さなかった。しかし、流量150l/時間にて3サイクルのUV照射の後、細胞培養物における安全性試験は、陽性の結果を示し、そしてまた、ウイルス力価決定においても陽性であった(6.7log TCID50/ml)。流量75l/時間にて3サイクルのUV照射は、ウイルス力価決定および安全性試験の両方において陰性のままであった。第二実験において、安全性試験およびウイルス力価決定は、5回以上の照射サイクルの後で陰性のままであった。第一の実験において、すべての照射線量は、HA力価およびEIA力価に影響を与えず、それぞれ、11および1:320であった。第二の実験において、すべてのHA力価およびEIA力価は、それぞれ、10および1:320であり、例外として、6回の照射サイクルが、EIA力価1:640を生じた。
【0076】
ホルマリンと、流量300l/時間にて5サイクル以上のUV照射とで、RRVの発酵槽収集物を二重不活化することが、抗原性を損なうことなく感染性を完全に破壊するためには十分である。
【0077】
【表10】

【0078】
((E)二重不活化したRRV候補ワクチン調製物の効力)
(免疫したマウスにおける有効用量(ED50)、防御用量(PD50)、およびELISA力価)
ホルマリンで不活化したRRV候補ワクチンおよび二重不活化(ホルマリン+UV照射)したRRV候補ワクチンを、10μg/用量に調整し、その後、4倍段階で希釈した。各希釈物を、10匹のマウスからなる群に注射した。3週間後に、そのマウスに、対応する量の上記ワクチンをブースター投与した。血液サンプルを、3週間後、ブースター前、6週間目、ブースターの3週間後に取り出した。その血清を、RRV抗体ELISAによって分析した。有効用量50(ED50)(これは、免疫したマウスのうちの50%におけるセロコンバーションを誘導するために十分である抗原用量である)を、その後算出した。
【0079】
3週間目に、ブースターの前に、ホルマリンで不活化した群のED50は、635ngであった。ホルマリン・UV二重不活化した群のED50は、202ngであった。ブースターの後に、そのED50値は、それぞれ、33ngおよび10ngであった。しかし、ELISA力価の分析は、二重不活化した群が、さらに高い抗体力価を有した(例えば、3週間目に、ELISA力価1000であるマウスが二重不活化群において16匹であったのに対してホルマリン群では9匹であり、ELISA力価10,000であるマウスが二重不活化群において4匹であるのに対してホルマリン群ではなかった)ことを、実証した。ブースターの後もまた、二重不活化群の力価は、より高かった(ELISA力価100,000であるマウスが二重不活化群において11匹であったのに対してホルマリン群では8匹であり、ELISA力価が1,000,000であるマウスが二重不活化群においてはさらに4匹いた(表11))。
【0080】
6週間目(ブースターの3週間後)に、マウスに、106 TCID50/ml(組織培養感染用量50)のロス川ウイルス(T48株)を静脈内感染させた。感染後1日目、2日目、3日目、および4日目に、血液サンプルを採取し、その血清のTCID50をその後決定した。防御用量50(PD50)(これは、感染したマウスのうちの50%がウイルス血症を示されない抗原用量である)を算出した。PD50=78ngが、両方の抗原調製物(ホルマリン不活化抗原、および二重不活化(ホルマリン+UV照射)抗原)について同じであった。
【0081】
(表11)
(免疫したマウスにおける有効用量(ED50)、防御用量(PD50)、およびELISA力価)
【0082】
【表11】

ホルマリン処理単独の後に非常に感受性であるC6−36細胞株において主に見出される残留感染性は、ほぼおそらくは、感染性RRV RNAによって引き起こされる。第二のさらなるウイルス不活化工程(UV照射)(これは、ホルマリン処理後のウイルスゲノムに影響を及ぼす)は、マウスモデルにおいて免疫原性および効力に影響を及ぼすことなく、完全に不活化されかつ安全なRRV候補ワクチン調製物を生じた。
【特許請求の範囲】
【請求項1】
本願明細書に記載された発明。
【請求項1】
本願明細書に記載された発明。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−143249(P2012−143249A)
【公開日】平成24年8月2日(2012.8.2)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−96623(P2012−96623)
【出願日】平成24年4月20日(2012.4.20)
【分割の表示】特願2007−513806(P2007−513806)の分割
【原出願日】平成17年5月26日(2005.5.26)
【出願人】(591013229)バクスター・インターナショナル・インコーポレイテッド (448)
【氏名又は名称原語表記】BAXTER INTERNATIONAL INCORP0RATED
【出願人】(501453189)バクスター・ヘルスケヤー・ソシエテ・アノニム (289)
【氏名又は名称原語表記】BAXTER HEALTHCARE S.A.
【Fターム(参考)】
【公開日】平成24年8月2日(2012.8.2)
【国際特許分類】
【出願番号】特願2012−96623(P2012−96623)
【出願日】平成24年4月20日(2012.4.20)
【分割の表示】特願2007−513806(P2007−513806)の分割
【原出願日】平成17年5月26日(2005.5.26)
【出願人】(591013229)バクスター・インターナショナル・インコーポレイテッド (448)
【氏名又は名称原語表記】BAXTER INTERNATIONAL INCORP0RATED
【出願人】(501453189)バクスター・ヘルスケヤー・ソシエテ・アノニム (289)
【氏名又は名称原語表記】BAXTER HEALTHCARE S.A.
【Fターム(参考)】
[ Back to top ]

