ポックスウイルスゲノムへの異種遺伝子の組込みのためのベクター
【課題】ポックスウイルスのゲノムに異種配列を挿入するのに有用な核酸配列を含むDNAベクターの提供
【解決手段】ポックスウイルスゲノム由来の転写制御因子又は転写制御因子のコンセンサス配列がクローニング部位に導入されているベクター、マーカー遺伝子、治療用遺伝子、ホスト域遺伝子および/または免疫原性抗原決定基のグループから選択される異種コーディング配列、マーカー遺伝子、ホスト域遺伝子を含むベクターにより転移された核酸配列をそのゲノム中に含む、組換え型ポックスウイルス、および、ポックスウイルスゲノムに異種配列を導入する方法。
【解決手段】ポックスウイルスゲノム由来の転写制御因子又は転写制御因子のコンセンサス配列がクローニング部位に導入されているベクター、マーカー遺伝子、治療用遺伝子、ホスト域遺伝子および/または免疫原性抗原決定基のグループから選択される異種コーディング配列、マーカー遺伝子、ホスト域遺伝子を含むベクターにより転移された核酸配列をそのゲノム中に含む、組換え型ポックスウイルス、および、ポックスウイルスゲノムに異種配列を導入する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、相同組換えを利用したポックスウイルスのゲノム中への異種配列の挿入に有用な核酸配列を含む、新規のDNAベクターを供給するものである。本発明はまた、特に本発明によるベクターにより転移される異種のコーディング配列を保持している組換え型のポックスウイルスに関連するものである。
【背景技術】
【0002】
ウエスタンリザーブ、コペンハーゲン、アンカラといったワクシニアウイルス株のような、オルソポックスウイルス生菌でのワクチン注射による天然痘の世界的な根絶の成功は、80年代初期のより厳密で詳細にわたるポックスウイルスの研究を刺激した。その後、天然痘ウイルスは詳細に理解され、扱いやすいウイルスベクターもしくは研究のツールとして開発された(Moss, 1996)。今日では、ポックスウイルスベクターは例えば発現ベクターとして、もしくはワクチン開発や治療物質の開発のために様々な分野で使用されている。ポックスウイルスベクターの高い許容性の大きな理由は、以下に示す有望な特徴からである:第一に、ベクターウイルスは操作が簡単であり、安定性が高く、安価に作成できる。第二に、上述のベクターウイルスは大量の異種遺伝子に適合することができ、そして多用途な発現ベクターであることが証明されている。第三に、容易にin vivoで導入することができ、そして体液性・細胞性免疫応答の刺激を起すことができる。従って、感染症もしくは癌に対する防御的免疫のための組換え型ワクチンとしての使用は、ポックスウイルスベクターを特に魅力的なものとする。特に、オルソポックスウイルス科のよく知られたメンバーであるワクシニアウイルスは、多くの多様な動物モデルでの疾病防御に対する組換え型ワクチンとして首尾よく使用されてきた(Carroll et al., 1997; Sutter et al., 1994a)。
【0003】
組換え型ワクシニアウイルスの開発と樹立のために、いくつかの挿入部位が使用された。ワクシニアゲノムでの最も目だった挿入部位は、ウイルスチミジンキナーゼ(tk)遺伝子の遺伝子座である(Mackett et al., 1982)。しかしながら、ウイルスヘマグルチニン遺伝子およびリボヌクレオチドリダクターゼ遺伝子(Shida et al. 1987, Howley et al. 1996)のような必須ではない他の遺伝子または自然発生した欠如部位IIや欠如部位IIIもまた、ワクシニアウイルスゲノムへの異種遺伝子DNA配列の挿入に使用されたきた(Sutter et al., 1994a)。いくつかの異種遺伝子または免疫原性のある抗原決定部位を保持する組換え型ウイルスベクターの構築は、より一層一般的な興味の対象となっている。それゆえに、ウイルスゲノムにおいて、さらなる異種遺伝子配列の導入に適したさらなる部位を同定することに対する強い要請がある。
【0004】
ポックスウイルスゲノムへの異種なDNA配列の導入は、ポックスウイルスの生活環の完全な理解を欠いていることから、ウイルス繁殖に必須の領域を破壊するリスクを負っている。いくつかのポックスウイルスゲノムの配列情報(Goebel et al. 1990; Antoine et al. 1998)が利用可能であるが、同定されたオープンリーディングフレームによりコードされる大抵の蛋白質の機能は知られていない。それゆえに、ウイルスの複製および増殖に必須な任意の配列を破壊することなしに、異種遺伝子を安定的に取り込ませるのに適したゲノム中の位置の決定はいまだに複雑な試みである。
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明の目的は、ポックスウイルスゲノムにおける新規の挿入部位を同定し、該挿入部位への異種DNA配列の直接的な組込みに適したベクターを提供することである。
【課題を解決するための手段】
【0006】
前述の目的および他の目的を達成するために、本発明は、配列番号1による核酸配列またはそれの相補鎖を含むベクターを提する。配列番号1による核酸配列は、ポックスウイルスゲノムの部分的なゲノム配列と高度に相同性がある。この相同性ゆえに、本発明による核酸配列は、上述の配列とポックスウイルスの相当するゲノム配列の間で相同組換えを起す能力がある。従って本発明は、異なるオルソポックスウイルスゲノム中に、好ましくは改変されたワクシニアウイルスアンカラ(MVA)のゲノム中に、さらにまた、例えばワクシニアウイルス株であるウエスタンリザーブ、コペンハーゲンというのような関連するオルソポックスウイルスなどのゲノム中に、DNA配列を直接的に組込むために有用な手段を提供する。
【図面の簡単な説明】
【0007】
【図1】本発明で言及された配列番号1の構造。
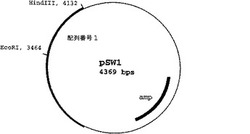
【図2】本発明で作成されたpSW1プラスミドの制限酵素認識部位を示したマップ。
【0008】
好ましい実施例によると、本発明の核酸配列は、改変されたワクシニアウイルスアンカラ(MVA)、特に、単離され且つブダペスト条約に従って1994年1月27日に寄託番号V94012707でEuropean Collection of Animal Cell Cultures(Salisbury, UK)に保管されたMVAに由来するものである。
【0009】
本発明はさらに、厳格な条件下において、配列番号1による配列もしくはそれの相補鎖にハイブリダイズする核酸配列を含むベクターを供給する。本発明との関連において、“ベクター”という用語はプラスミド、コスミドのような環状構造をとるもの、または人工染色体でのDNAの伝達手段と理解される。上述のベクターは目的とする核酸配列に加えて、制御的配列(regulatory sequences)、選択マーカー遺伝子、そしてベクターの自己複製を可能にするレプリコンから構成される。従って、本発明によるベクターは単細胞のホスト生物中で容易に増幅され、分離されうる。さらに“厳格な条件下”という用語は、反応温度、ホルムアミド濃度もしくは塩濃度のような、DNA―DNA配列(相同性が約70%付近以上)のハイブリダイゼーションを許容する標準的なプロトコールによるパラメーターを定義する。上記のように、ポックスウイルスゲノムの相当する配列にハイブリダイズするこれらの配列は、特に、オルソポックスウイルスのゲノムへの異種配列の組込みに有用である。
【0010】
加えて、本発明は上記で言及した核酸配列の断片を含むベクターを提供する。これらの断片は上述の核酸配列の連続的な塩基対を含んでおり、そしてまた相同組換えによるポックスウイルスゲノムへの組込みに有用である。上述の断片の長さは変異に富んでおり、そしてポックスウイルスゲノムの相当する部分と30塩基対でのみ相同である断片でも、組換えを引き起こすのには十分である。しかしながら、ポックスウイルスゲノムと本発明で使用されるような断片の間の相同組換えの効率を増加するために、上述の断片は長さで約200塩基対以上であることが好ましく、約300もしくは約500塩基対以上であればより好ましい。
【0011】
相同組換えを開始するために、本発明によるベクターと野生型のポックスウイルスがホスト細胞に導入された。ポックスウイルスゲノムの複製の間に、ベクターに挿入された核酸配列とポックスウイルスゲノムの相当する配列の間で相同組換えが生じる。相同組換えは統計学的確率上1:103から1:104程度の確率で生じるので、生成したあらゆる組換え型ポックスウイルスも分離される必要がある。このため、例えば機能的に関連する制御因子をもつマーカー遺伝子が、ベクター内にもうけられた核酸配列のクローニングサイトに挿入された。相同組換え後に生成した組換え型ポックスウイルスはそれぞれ、上述のマーカー遺伝子の発現に対するスクリーニング、もしくは優性選択マーカー遺伝子の発現に対する選択により分離された。
【0012】
さらなる実施例によると、本発明のベクターは、特にポックスウイルスゲノムへの目的の異種コーディング配列の挿入に対して特に有用である。本発明との関連において、“異種”という用語は、自然界で密接に関連しているものでは通常は認められない核酸配列の任意の組み合わせに対して使用される。本発明による異種遺伝子は、好ましくはマーカー遺伝子の一群、抗ウイルス遺伝子、抗腫瘍遺伝子、サイトカインもしくはケモカイン遺伝子、自殺遺伝子のような治療用遺伝子から選択されるが、またホスト域遺伝子もしくは免疫原性のある抗原決定基からも選択される。ポックスウイルスゲノムを用いた目的の異種コーディング配列の挿入および/または発現のために、上述の異種コーディング配列が核酸配列内のクローニングサイトに挿入される。
【0013】
一般的には、クローニングサイトは制限酵素認識部位である。本発明によると、異種配列の挿入における好ましいクローニングサイトはEcoRI酵素の制限酵素認識部位である。EcoRI認識部位は本発明の核酸配列中でユニークであり、そして上述の核酸配列に含まれる2つのORFの間に配置されている(図1)。これとは別に、上述の2つのORF間の非コーディング領域に配置されるさらなる任意の制限酵素認識部位が、クローニングサイトとして使用可能である。意外にも、ORFの1つに位置するいかなるクローニングサイトもまた、異種配列の挿入に使用することができる。特に、発明者等はORFへのそのような挿入による上述ORFの破壊は、それぞれウイルスの生活環もしくは複製効率を妨害しないことを見出した。同様に、相同組換えを惹起するためにベクター内に導入された本発明による断片の使用もまた、ウイルスの繁殖および複製効率に影響しないことが発明者等によって見出された。
【0014】
一般的に、相同組換えによってウイルスゲノム内に組込まれる異種配列の両端は、ウイルスゲノムの相当する配列に対して相同である配列に接している。しかしながら、本発明はまた、異種配列の片側のみが上述の核酸配列に接しているベクターを含む。本発明によると、断片および望ましい異種配列を含んでいるベクターは、ポックスウイルスゲノムへ上述の異種配列を挿入するために有用である。
【0015】
挿入された異種コーディング配列の発現を保証するために、少なくとも1つの転写制御因子が付加的にクローニングサイトに挿入される。この転写制御領域は異種のコーディング配列に機能的に関連しており、それにより、発現を制御および/または可能にする。本発明のさらなる好ましい実施例によると、この転写制御因子はポックスウイルスに由来し、および/またはポックスウイルス由来の転写制御因子のコンセンサス配列である。
【0016】
本発明のさらなる実施例によると、このベクターは、特にクローニングサイトに挿入された例えばマーカー遺伝子もしくはホスト域遺伝子、および/または転写制御因子などの1以上の異種のコーディング配列に接する少なくとも2つの組換え型の(recombinogenic)配列を含む。“組換え型配列”という用語は、ゲノム内の相同組換えにより上述の組換え型配列間の任意の配列を(それらの類似性もしくはほぼ同一の構造により)削除する能力のある核酸配列を定義する。従って、上述の組換え型配列に接している配列はウイルスゲノムに一時的にのみ挿入され、そして引き続き完全に削除される。上述の組換え型の(recombinogenic)配列に接する配列の削除は、治療用遺伝子もしくは免疫原性遺伝子をコードする異種のコーディング配列のみを含み、どのようなさらなるマーカーもしくはホスト域遺伝子も含まないはずの組換え型ポックスウイルスを分離するために特に重要である。このために、マーカー遺伝子、ホスト域遺伝子、および/または結局は転写制御因子も(しかし、例えば治療用遺伝子もしくは免疫原性の抗原決定基のような目的とする異種コーディング配列は除く)、そのような組換え型配列に接している。マーカー遺伝子もしくはホスト域遺伝子の選択圧の下で行われる組換え型ウイルスの分離の後に、選択圧が解除されて、マーカー遺伝子もしくはホスト域遺伝子を削除するためのゲノム内での相同組換えが許容される。
【0017】
本発明はさらに、ゲノム内に本発明によるベクターにより転移された核酸配列を含む組換え型ポックスウイルスを提供する。この組換え型ウイルスは組換え型のMVAウイルスであることがもっとも好ましい。
【0018】
本発明のさらなる実施例は、感染症もしくは増殖性の障害の治療および/または予防の方法を提供する。上述の方法は、本発明による組換え型ポックスウイルスで標的細胞の集団を感染させる(in vivoまたはin vitroの何れか)方法を含む。或いは、この方法によると、標的細胞は本発明によるベクターで形質導入(in vivoまたはin vitroの何れか)され、そして本発明の組換え型ポックスウイルスを含む任意のオルソポックスウイルスで同時に、または時間をずらして感染される。この場合、ポックスウイルスは細胞にウイルスの複製と転写機構を供給する。結果的に、ベクターに取り込まれ、ポックスウイルス由来の転写制御因子で制御される目的の異種のコーディング配列は、標的細胞内で発現する。in vitroで形質導入され感染された標的細胞は、本発明の方法により、ヒトを含む動物の生体に適用されうる。
【0019】
本発明は感染症もしくは増殖性の障害の治療および/または予防に有用なベクター、組換え型ポックスウイルス、および/または本発明による標的細胞を提供する。さらに、本発明によるベクター、組換え型ポックスウイルス、および/または標的細胞は上記のようにin vivoおよびin vitroでの遺伝子の運搬に有用な薬学的な構成物(特にワクチン)の生産、および/またはヒトを含む哺乳類でのワクチン接種に使用される。
【0020】
本発明は特に以下に示す要件の単独もしくは組み合わせから構成される。
【0021】
ポックスウイルスゲノムへの異種コーディング配列の挿入に使用するベクターであって、以下の(a)〜(c)からなる群の中から選択された1以上の因子から構成される核酸配列を含む:
(a)配列番号1による核酸配列またはその相補鎖;
(b)厳格な条件下で(a)に定義する配列とハイブリダイズする核酸配列;
(c)(a)または(b)に定義される核酸配列のうち少なくとも連続的な30塩基対を含む断片。
【0022】
前記核酸配列が改変されたワクシニアアンカラウイルス(MVA)に由来する前記のベクター。
【0023】
付加的に少なくとも1つの転写制御因子が当該核酸配列の中の少なくとも1つのクローニングサイトに導入されている前記のベクター。
【0024】
前記転写制御因子がポックスウイルスゲノム由来であるか、またポックスウイルス由来の転写制御因子のコンセンサス配列である前記のベクター。
【0025】
付加的に少なくとも1つの異種コーディング配列を含み、該異種コーディング配列は前記の転写制御因子と機能的に関連するものである前記のベクター。
【0026】
前記異種コーディング配列がマーカー遺伝子、治療用遺伝子、ホスト域遺伝子および/または免疫原性抗原決定基のグループから選択される前記のベクター。
【0027】
マーカー遺伝子、ホスト域遺伝子、および/または前記の転写制御因子をコードする1以上の異種コーディング配列に接している組換え型の配列を含む、前記のベクター。
【0028】
前記ベクターにより転移された核酸配列をそのゲノム中に含む、組換え型ポックスウイルス。
【0029】
ポックスウイルスが改変されたワクシニアアンカラウイルス(MVA)である前記の組換え型ポックスウイルス。
【0030】
ポックスウイルスゲノムに異種配列を導入する方法であって、
(a)前記ベクターを用いて、ホスト細胞を形質導入することと;
(b)上述のホスト細胞をポックスウイルスで感染させることと;
(c)組換え型ポックスウイルスを分離することと
を含む方法。
【0031】
動物生体(ヒトを含む)の感染症もしくは増殖性の障害を治療および/または予防する方法であって、前記動物生体に対して、前記ポックスウイルス、および/または前記ベクターの適用、或いは他の何れかのポックスウイルスによる前記ベクターの適用を含む方法。
【0032】
前記組換え型ポックスウイルスがオルソポックスウイルスに由来する前記の方法。
【0033】
前記の組換え型ポックスウイルス、および/または前記ベクターを含む標的細胞。
【0034】
感染症もしくは増殖性の障害の治療および/または予防のための、前記ベクター、前記組換え型ポックスウイルス、および/または前記標的細胞。
【0035】
前記ベクター、前記組換え型ポックスウイルス、および/または前記標的細胞の使用であって、感染症もしくは増殖性障害の治療および/または予防のための薬物を生産するための使用。
【0036】
前記ベクター、前記組換え型ポックスウイルス、および/または前記標的細胞、並びに薬学的に許容可能な担体および/または希釈剤を含む医薬組成物。
【0037】
前記ベクター、ポックスウイルス(前記の組換え型ポックスウイルスを除く)、並びに薬学的に許容可能な担体および/または希釈剤を含む医薬組成物。
【0038】
下記の実施例はさらに本発明を説明する。当業者は、提出された実施例が、本発明より提供される技術の適用性をこの実施例に制限するようには決して解釈されないことを十分に理解するであろう、それゆえに本発明は付属の請求項の全範囲によってのみ限定される。
【実施例】
【0039】
実施例1
挿入ベクターの構築
ポックスウイルスゲノムへの組換えに適した配列を得るために、改変されたワクシニアアンカラウイルス(寄託番号V94012707でEuropean Collection of Animal Cell Cultures, Salisbury, UKにブタペスト条約により保管された)に由来するDNA断片が、以下のオリゴヌクレオチドプライマーを使用した通常のPCR法により増幅された。
A24R_1;5’−CCGAAGCTTAATGAACGCCAGAGG−3’, 配列番号2
A27L_1c;5’−AGGCTCGAGTAAGAGCGGCTATGAT−3’, 配列番号3
オリゴヌクレオチドプライマーは、クローニングベクターへの生成した増殖断片のサブクローニングのために、5’端の近くに下線で示された制限酵素HindIII(配列番号2)もしくはXhoI(配列番号3)の認識配列を含んでいる。それにより、1.7kbの特異的に増幅された配列(配列番号1)がpUC19クローニングプラスミド(GenBank Accession No.: X02514)にSalI/HindIIIでサブクローニングされた。生成したプラスミドはpSW1(図2)と名づけられた。
【0040】
サブクローニングされたインサートの配列が調べられ、そしてこの配列はワクシニアウイルス株であるコペンハーゲン、WR、MVAからの他の既知の配列と比較された。上述の配列はMVA−ATI領域の部分配列を含むことがわかった。大抵のオルソポックスウイルスのATI遺伝子は、感染した細胞で光学顕微鏡により観察しうる、いわゆる封入体(inclusion bodies)と称する成熟したウイルス体に埋め込まれた密集した細胞質間充質を形成する。推測上のATIの機能は、一般的な環境下での感染性ウイルス粒子の高い安定性と伝播性の延長である。オルソポックスウイルスはエクトロメリアウイルス、牛痘ウイルス、アライグマポックスウイルスを含むいくつかのグループであり、130kDaから160kDaの典型的な封入体蛋白質を産生する。しかしながら、例えばワクシニアウイルスウエスタンリザーブ(WR)、ワクシニアウイルスコペンハーゲンもしくはMVAのようなオルソポックス属の他のメンバーは、そのような封入体を形成しない。これは配列の削除もしくはフレームシフト変異の結果であり、コーディング配列の欠失を導き、またATIホモログの欠如を生じる。例えば、ワクシニアウイルスWRは94kDaのATIホモログを発現するが、一方、MVAとワクシニアウイルスコペンハーゲンはそのようなATIホモログを発現しない。
【0041】
挿入ベクターのさらなる構築のために、自然発生した制限酵素EcoRIの認識部位が、増幅した配列を2つの部分に分離するために使用された。これらの分節はフランキング領域(flank1、flank2)として働き、ポックスウイルスゲノムとの相同組換えを起こさせる。それらのフランキング領域の間に、操作される異種遺伝子の挿入のためのマルチプルクローニングサイトに加え、例えば、7.5プロモーター(7.5)、および/または合成したプロモーターによるワクシニアウイルスのプロモーター配列が挿入された。生成したプラスミドはpSW−7.5−sP, pSW−7.5, pSW−sPと名づけられた。
【0042】
また、EGFPフュージョン遺伝子(pEGFP, Clonetech, GenBank Accession #: U76561から分離された)と融合させたワクシニアウイルスのホスト域遺伝子(K1L)から成る発現カセットと、天然に存在するK1Lプロモーターが上記のフランキング領域の間に挿入された。この発現カセットは組換え型のウイルスの効率的な選択と分離に特に有用である。生成したプラスミドはpSWk1lgfpと名づけられた。
【0043】
組換え型ウイルスの産生
組換え型ウイルスを産生するために、およそ80%コンフルエントの単層培養細胞を有する6ウェルの組織培養プレートが使用された。組換え型MVAを産生するために、ニワトリ胚繊維芽細胞のような許容細胞(permissive cell)が使用された。組換え型WR株ワクシニアウイルスを産生するために、アフリカミドリ猿の細胞(Vero)が使用された。
【0044】
最初に、細胞培養の培地を除去し、MOI(multiplicity of infection)が0.01(例えば、1ウェル5x105細胞1ml培地中に接種物5x103IU(感染単位))の野生型のポックスウイルスを含んだ無血清培地が細胞の上に層状に加えられた。この混合物は、37℃、5% CO2存在下で1時間インキュベーションされた。そして、接種物が除かれ、細胞がウェル毎に2mlのOptiMEMで2回洗浄された。
【0045】
引き続き、単層細胞は、メーカー(GIBCO BRL)記載の方法により調整したリポフェクチン/プラスミドDNA混合物(全量:1ml)およびpSWk1lgfpのプラスミドDNA15μgでカバーされた。この混合物は、5% CO2の存在下において、37℃で5−12時間インキュベーションされた。次いで、リポフェクチン/プラスミドDNA混合物が除かれ、細胞は、1.5mlの10%FCSが添加された新鮮な培地でカバーされた。感染の48時間後に、単層細胞はセルスクレーパーではがされて、細胞および培地は2mlの遠心チューブに移された。トランスフェクション回収物は、‐20〜‐80℃で保存された。ポックスウイルス感染細胞へのpSWk1lgfpプラスミドのトランスフェクションに際して、EGFP遺伝子に融合したホスト域遺伝子K1Lは、ベクタープラスミドのフランキング領域と相同性のあるポックスウイルスゲノムの部位に正確に組換えられる。
【0046】
非組換え型のMVAウイルスから組換え型MVAウイルスを分離するために、ホスト域細胞であるウサギ腎臓(RK)13が、上記のトランスフェクション実験で得られたウイルス成分で感染された。以前の研究において、RK13細胞でのMVA感染は、ウイルスRNAの中間生成物の合成損傷およびウイルスDNAの複製欠如を特徴とするウイルス複製の早期阻害に至ることが示された。しかしながら、このRK13細胞での非生産的MVA感染は、ワクシニアウイルスのホスト域遺伝子であるK1Lの過剰発現によって克服することができた(Sutter et al., 1994b)。従って、RK13培養細胞に対する上記トランスフェクション実験で得られたウイルス成分の接種は、K1L遺伝子を共発現する組換え型のみの高選択的繁殖を生じた。6ウェルもしくは96ウェルの組織培養プレートにおいて培養されたRK13細胞上で連続的に5回継代した後に、MVA−K1LGFPウイルスが分離された。非組換え型のMVAが存在しないことはPCR法により証明された。
【0047】
また、融合されたEGFP遺伝子の発現は、GFPの蛍光によって組換え型ウイルス感染の直接的なモニタリングを可能にした。また、直接的なモニタリングは、K1L選択に対して感受性でない組換え型ワクシニアウイルスのWR株の同定、およびその後の分離に使用される。
【参照文献】
【0048】
Antoine, G. et al., 1998, The complete genomic sequence of the modified vaccinia Ankara strain: comparison with other orthopoxviruses. Virology, May 10; 244(2): 365−96.
Carroll, M.W. et al. 1997: Highly attenuated modified vaccinia virus Ankara(MVA)as an effective recombinant vector: A murine tumor model. Vaccine 15, 387.
Fenner, F. et al. 1998: Smallpox and its eradication. World Health Organisation, Geneva.
Goebel, SJ. et al., 1990, The complete DNA sequence of vaccinia virus. Virology, Nov; 179(1): 247−66, 517−63.
Howley, PM. et al., 1996, A vaccinia virus transfer vector using a GUS reporter gene inserted into the I4L locus. Gene, Jun 26; 172(2): 233−7.
Mackett, M. et al. 1982: Vaccinia virus: a selectable eukaryotic cloning and expression vector. Proc. Natl. Acad. Sci. USA 79, 7415.
Moss, B. 1996: Genetically engineered poxviruses for recombinant gene expression, vaccination, and safety. Proc. Natl. Acad. Sci. USA 93, 11341.
Sambrook, et al., 1989, Molecular Cloning: a laboratory manual, Cold Spring Harbor Laboratory Press publication, New York.
Shida, H. et al., 1987, Effect of the recombinant vaccinia viruses that express HTLV−I envelope gene on HTLV−I infection. EMBO J. Nov; 6(11): 3379−84.
Sutter, G. et al., 1994a: A recombinant vector derived from the host range−restricted and highly attenuated MVA strain of vaccinia virus stimulates protective immunity in mice to influenza virus. Vaccine 12, 1032.
Sutter, G. et al., 1994b: Stable expression of the vaccinia virus K1L gene in rabbit cells complements the host range defect of a vaccinia virus mutant. J. Virol. 68, 4109.
【技術分野】
【0001】
本発明は、相同組換えを利用したポックスウイルスのゲノム中への異種配列の挿入に有用な核酸配列を含む、新規のDNAベクターを供給するものである。本発明はまた、特に本発明によるベクターにより転移される異種のコーディング配列を保持している組換え型のポックスウイルスに関連するものである。
【背景技術】
【0002】
ウエスタンリザーブ、コペンハーゲン、アンカラといったワクシニアウイルス株のような、オルソポックスウイルス生菌でのワクチン注射による天然痘の世界的な根絶の成功は、80年代初期のより厳密で詳細にわたるポックスウイルスの研究を刺激した。その後、天然痘ウイルスは詳細に理解され、扱いやすいウイルスベクターもしくは研究のツールとして開発された(Moss, 1996)。今日では、ポックスウイルスベクターは例えば発現ベクターとして、もしくはワクチン開発や治療物質の開発のために様々な分野で使用されている。ポックスウイルスベクターの高い許容性の大きな理由は、以下に示す有望な特徴からである:第一に、ベクターウイルスは操作が簡単であり、安定性が高く、安価に作成できる。第二に、上述のベクターウイルスは大量の異種遺伝子に適合することができ、そして多用途な発現ベクターであることが証明されている。第三に、容易にin vivoで導入することができ、そして体液性・細胞性免疫応答の刺激を起すことができる。従って、感染症もしくは癌に対する防御的免疫のための組換え型ワクチンとしての使用は、ポックスウイルスベクターを特に魅力的なものとする。特に、オルソポックスウイルス科のよく知られたメンバーであるワクシニアウイルスは、多くの多様な動物モデルでの疾病防御に対する組換え型ワクチンとして首尾よく使用されてきた(Carroll et al., 1997; Sutter et al., 1994a)。
【0003】
組換え型ワクシニアウイルスの開発と樹立のために、いくつかの挿入部位が使用された。ワクシニアゲノムでの最も目だった挿入部位は、ウイルスチミジンキナーゼ(tk)遺伝子の遺伝子座である(Mackett et al., 1982)。しかしながら、ウイルスヘマグルチニン遺伝子およびリボヌクレオチドリダクターゼ遺伝子(Shida et al. 1987, Howley et al. 1996)のような必須ではない他の遺伝子または自然発生した欠如部位IIや欠如部位IIIもまた、ワクシニアウイルスゲノムへの異種遺伝子DNA配列の挿入に使用されたきた(Sutter et al., 1994a)。いくつかの異種遺伝子または免疫原性のある抗原決定部位を保持する組換え型ウイルスベクターの構築は、より一層一般的な興味の対象となっている。それゆえに、ウイルスゲノムにおいて、さらなる異種遺伝子配列の導入に適したさらなる部位を同定することに対する強い要請がある。
【0004】
ポックスウイルスゲノムへの異種なDNA配列の導入は、ポックスウイルスの生活環の完全な理解を欠いていることから、ウイルス繁殖に必須の領域を破壊するリスクを負っている。いくつかのポックスウイルスゲノムの配列情報(Goebel et al. 1990; Antoine et al. 1998)が利用可能であるが、同定されたオープンリーディングフレームによりコードされる大抵の蛋白質の機能は知られていない。それゆえに、ウイルスの複製および増殖に必須な任意の配列を破壊することなしに、異種遺伝子を安定的に取り込ませるのに適したゲノム中の位置の決定はいまだに複雑な試みである。
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明の目的は、ポックスウイルスゲノムにおける新規の挿入部位を同定し、該挿入部位への異種DNA配列の直接的な組込みに適したベクターを提供することである。
【課題を解決するための手段】
【0006】
前述の目的および他の目的を達成するために、本発明は、配列番号1による核酸配列またはそれの相補鎖を含むベクターを提する。配列番号1による核酸配列は、ポックスウイルスゲノムの部分的なゲノム配列と高度に相同性がある。この相同性ゆえに、本発明による核酸配列は、上述の配列とポックスウイルスの相当するゲノム配列の間で相同組換えを起す能力がある。従って本発明は、異なるオルソポックスウイルスゲノム中に、好ましくは改変されたワクシニアウイルスアンカラ(MVA)のゲノム中に、さらにまた、例えばワクシニアウイルス株であるウエスタンリザーブ、コペンハーゲンというのような関連するオルソポックスウイルスなどのゲノム中に、DNA配列を直接的に組込むために有用な手段を提供する。
【図面の簡単な説明】
【0007】
【図1】本発明で言及された配列番号1の構造。
【図2】本発明で作成されたpSW1プラスミドの制限酵素認識部位を示したマップ。
【0008】
好ましい実施例によると、本発明の核酸配列は、改変されたワクシニアウイルスアンカラ(MVA)、特に、単離され且つブダペスト条約に従って1994年1月27日に寄託番号V94012707でEuropean Collection of Animal Cell Cultures(Salisbury, UK)に保管されたMVAに由来するものである。
【0009】
本発明はさらに、厳格な条件下において、配列番号1による配列もしくはそれの相補鎖にハイブリダイズする核酸配列を含むベクターを供給する。本発明との関連において、“ベクター”という用語はプラスミド、コスミドのような環状構造をとるもの、または人工染色体でのDNAの伝達手段と理解される。上述のベクターは目的とする核酸配列に加えて、制御的配列(regulatory sequences)、選択マーカー遺伝子、そしてベクターの自己複製を可能にするレプリコンから構成される。従って、本発明によるベクターは単細胞のホスト生物中で容易に増幅され、分離されうる。さらに“厳格な条件下”という用語は、反応温度、ホルムアミド濃度もしくは塩濃度のような、DNA―DNA配列(相同性が約70%付近以上)のハイブリダイゼーションを許容する標準的なプロトコールによるパラメーターを定義する。上記のように、ポックスウイルスゲノムの相当する配列にハイブリダイズするこれらの配列は、特に、オルソポックスウイルスのゲノムへの異種配列の組込みに有用である。
【0010】
加えて、本発明は上記で言及した核酸配列の断片を含むベクターを提供する。これらの断片は上述の核酸配列の連続的な塩基対を含んでおり、そしてまた相同組換えによるポックスウイルスゲノムへの組込みに有用である。上述の断片の長さは変異に富んでおり、そしてポックスウイルスゲノムの相当する部分と30塩基対でのみ相同である断片でも、組換えを引き起こすのには十分である。しかしながら、ポックスウイルスゲノムと本発明で使用されるような断片の間の相同組換えの効率を増加するために、上述の断片は長さで約200塩基対以上であることが好ましく、約300もしくは約500塩基対以上であればより好ましい。
【0011】
相同組換えを開始するために、本発明によるベクターと野生型のポックスウイルスがホスト細胞に導入された。ポックスウイルスゲノムの複製の間に、ベクターに挿入された核酸配列とポックスウイルスゲノムの相当する配列の間で相同組換えが生じる。相同組換えは統計学的確率上1:103から1:104程度の確率で生じるので、生成したあらゆる組換え型ポックスウイルスも分離される必要がある。このため、例えば機能的に関連する制御因子をもつマーカー遺伝子が、ベクター内にもうけられた核酸配列のクローニングサイトに挿入された。相同組換え後に生成した組換え型ポックスウイルスはそれぞれ、上述のマーカー遺伝子の発現に対するスクリーニング、もしくは優性選択マーカー遺伝子の発現に対する選択により分離された。
【0012】
さらなる実施例によると、本発明のベクターは、特にポックスウイルスゲノムへの目的の異種コーディング配列の挿入に対して特に有用である。本発明との関連において、“異種”という用語は、自然界で密接に関連しているものでは通常は認められない核酸配列の任意の組み合わせに対して使用される。本発明による異種遺伝子は、好ましくはマーカー遺伝子の一群、抗ウイルス遺伝子、抗腫瘍遺伝子、サイトカインもしくはケモカイン遺伝子、自殺遺伝子のような治療用遺伝子から選択されるが、またホスト域遺伝子もしくは免疫原性のある抗原決定基からも選択される。ポックスウイルスゲノムを用いた目的の異種コーディング配列の挿入および/または発現のために、上述の異種コーディング配列が核酸配列内のクローニングサイトに挿入される。
【0013】
一般的には、クローニングサイトは制限酵素認識部位である。本発明によると、異種配列の挿入における好ましいクローニングサイトはEcoRI酵素の制限酵素認識部位である。EcoRI認識部位は本発明の核酸配列中でユニークであり、そして上述の核酸配列に含まれる2つのORFの間に配置されている(図1)。これとは別に、上述の2つのORF間の非コーディング領域に配置されるさらなる任意の制限酵素認識部位が、クローニングサイトとして使用可能である。意外にも、ORFの1つに位置するいかなるクローニングサイトもまた、異種配列の挿入に使用することができる。特に、発明者等はORFへのそのような挿入による上述ORFの破壊は、それぞれウイルスの生活環もしくは複製効率を妨害しないことを見出した。同様に、相同組換えを惹起するためにベクター内に導入された本発明による断片の使用もまた、ウイルスの繁殖および複製効率に影響しないことが発明者等によって見出された。
【0014】
一般的に、相同組換えによってウイルスゲノム内に組込まれる異種配列の両端は、ウイルスゲノムの相当する配列に対して相同である配列に接している。しかしながら、本発明はまた、異種配列の片側のみが上述の核酸配列に接しているベクターを含む。本発明によると、断片および望ましい異種配列を含んでいるベクターは、ポックスウイルスゲノムへ上述の異種配列を挿入するために有用である。
【0015】
挿入された異種コーディング配列の発現を保証するために、少なくとも1つの転写制御因子が付加的にクローニングサイトに挿入される。この転写制御領域は異種のコーディング配列に機能的に関連しており、それにより、発現を制御および/または可能にする。本発明のさらなる好ましい実施例によると、この転写制御因子はポックスウイルスに由来し、および/またはポックスウイルス由来の転写制御因子のコンセンサス配列である。
【0016】
本発明のさらなる実施例によると、このベクターは、特にクローニングサイトに挿入された例えばマーカー遺伝子もしくはホスト域遺伝子、および/または転写制御因子などの1以上の異種のコーディング配列に接する少なくとも2つの組換え型の(recombinogenic)配列を含む。“組換え型配列”という用語は、ゲノム内の相同組換えにより上述の組換え型配列間の任意の配列を(それらの類似性もしくはほぼ同一の構造により)削除する能力のある核酸配列を定義する。従って、上述の組換え型配列に接している配列はウイルスゲノムに一時的にのみ挿入され、そして引き続き完全に削除される。上述の組換え型の(recombinogenic)配列に接する配列の削除は、治療用遺伝子もしくは免疫原性遺伝子をコードする異種のコーディング配列のみを含み、どのようなさらなるマーカーもしくはホスト域遺伝子も含まないはずの組換え型ポックスウイルスを分離するために特に重要である。このために、マーカー遺伝子、ホスト域遺伝子、および/または結局は転写制御因子も(しかし、例えば治療用遺伝子もしくは免疫原性の抗原決定基のような目的とする異種コーディング配列は除く)、そのような組換え型配列に接している。マーカー遺伝子もしくはホスト域遺伝子の選択圧の下で行われる組換え型ウイルスの分離の後に、選択圧が解除されて、マーカー遺伝子もしくはホスト域遺伝子を削除するためのゲノム内での相同組換えが許容される。
【0017】
本発明はさらに、ゲノム内に本発明によるベクターにより転移された核酸配列を含む組換え型ポックスウイルスを提供する。この組換え型ウイルスは組換え型のMVAウイルスであることがもっとも好ましい。
【0018】
本発明のさらなる実施例は、感染症もしくは増殖性の障害の治療および/または予防の方法を提供する。上述の方法は、本発明による組換え型ポックスウイルスで標的細胞の集団を感染させる(in vivoまたはin vitroの何れか)方法を含む。或いは、この方法によると、標的細胞は本発明によるベクターで形質導入(in vivoまたはin vitroの何れか)され、そして本発明の組換え型ポックスウイルスを含む任意のオルソポックスウイルスで同時に、または時間をずらして感染される。この場合、ポックスウイルスは細胞にウイルスの複製と転写機構を供給する。結果的に、ベクターに取り込まれ、ポックスウイルス由来の転写制御因子で制御される目的の異種のコーディング配列は、標的細胞内で発現する。in vitroで形質導入され感染された標的細胞は、本発明の方法により、ヒトを含む動物の生体に適用されうる。
【0019】
本発明は感染症もしくは増殖性の障害の治療および/または予防に有用なベクター、組換え型ポックスウイルス、および/または本発明による標的細胞を提供する。さらに、本発明によるベクター、組換え型ポックスウイルス、および/または標的細胞は上記のようにin vivoおよびin vitroでの遺伝子の運搬に有用な薬学的な構成物(特にワクチン)の生産、および/またはヒトを含む哺乳類でのワクチン接種に使用される。
【0020】
本発明は特に以下に示す要件の単独もしくは組み合わせから構成される。
【0021】
ポックスウイルスゲノムへの異種コーディング配列の挿入に使用するベクターであって、以下の(a)〜(c)からなる群の中から選択された1以上の因子から構成される核酸配列を含む:
(a)配列番号1による核酸配列またはその相補鎖;
(b)厳格な条件下で(a)に定義する配列とハイブリダイズする核酸配列;
(c)(a)または(b)に定義される核酸配列のうち少なくとも連続的な30塩基対を含む断片。
【0022】
前記核酸配列が改変されたワクシニアアンカラウイルス(MVA)に由来する前記のベクター。
【0023】
付加的に少なくとも1つの転写制御因子が当該核酸配列の中の少なくとも1つのクローニングサイトに導入されている前記のベクター。
【0024】
前記転写制御因子がポックスウイルスゲノム由来であるか、またポックスウイルス由来の転写制御因子のコンセンサス配列である前記のベクター。
【0025】
付加的に少なくとも1つの異種コーディング配列を含み、該異種コーディング配列は前記の転写制御因子と機能的に関連するものである前記のベクター。
【0026】
前記異種コーディング配列がマーカー遺伝子、治療用遺伝子、ホスト域遺伝子および/または免疫原性抗原決定基のグループから選択される前記のベクター。
【0027】
マーカー遺伝子、ホスト域遺伝子、および/または前記の転写制御因子をコードする1以上の異種コーディング配列に接している組換え型の配列を含む、前記のベクター。
【0028】
前記ベクターにより転移された核酸配列をそのゲノム中に含む、組換え型ポックスウイルス。
【0029】
ポックスウイルスが改変されたワクシニアアンカラウイルス(MVA)である前記の組換え型ポックスウイルス。
【0030】
ポックスウイルスゲノムに異種配列を導入する方法であって、
(a)前記ベクターを用いて、ホスト細胞を形質導入することと;
(b)上述のホスト細胞をポックスウイルスで感染させることと;
(c)組換え型ポックスウイルスを分離することと
を含む方法。
【0031】
動物生体(ヒトを含む)の感染症もしくは増殖性の障害を治療および/または予防する方法であって、前記動物生体に対して、前記ポックスウイルス、および/または前記ベクターの適用、或いは他の何れかのポックスウイルスによる前記ベクターの適用を含む方法。
【0032】
前記組換え型ポックスウイルスがオルソポックスウイルスに由来する前記の方法。
【0033】
前記の組換え型ポックスウイルス、および/または前記ベクターを含む標的細胞。
【0034】
感染症もしくは増殖性の障害の治療および/または予防のための、前記ベクター、前記組換え型ポックスウイルス、および/または前記標的細胞。
【0035】
前記ベクター、前記組換え型ポックスウイルス、および/または前記標的細胞の使用であって、感染症もしくは増殖性障害の治療および/または予防のための薬物を生産するための使用。
【0036】
前記ベクター、前記組換え型ポックスウイルス、および/または前記標的細胞、並びに薬学的に許容可能な担体および/または希釈剤を含む医薬組成物。
【0037】
前記ベクター、ポックスウイルス(前記の組換え型ポックスウイルスを除く)、並びに薬学的に許容可能な担体および/または希釈剤を含む医薬組成物。
【0038】
下記の実施例はさらに本発明を説明する。当業者は、提出された実施例が、本発明より提供される技術の適用性をこの実施例に制限するようには決して解釈されないことを十分に理解するであろう、それゆえに本発明は付属の請求項の全範囲によってのみ限定される。
【実施例】
【0039】
実施例1
挿入ベクターの構築
ポックスウイルスゲノムへの組換えに適した配列を得るために、改変されたワクシニアアンカラウイルス(寄託番号V94012707でEuropean Collection of Animal Cell Cultures, Salisbury, UKにブタペスト条約により保管された)に由来するDNA断片が、以下のオリゴヌクレオチドプライマーを使用した通常のPCR法により増幅された。
A24R_1;5’−CCGAAGCTTAATGAACGCCAGAGG−3’, 配列番号2
A27L_1c;5’−AGGCTCGAGTAAGAGCGGCTATGAT−3’, 配列番号3
オリゴヌクレオチドプライマーは、クローニングベクターへの生成した増殖断片のサブクローニングのために、5’端の近くに下線で示された制限酵素HindIII(配列番号2)もしくはXhoI(配列番号3)の認識配列を含んでいる。それにより、1.7kbの特異的に増幅された配列(配列番号1)がpUC19クローニングプラスミド(GenBank Accession No.: X02514)にSalI/HindIIIでサブクローニングされた。生成したプラスミドはpSW1(図2)と名づけられた。
【0040】
サブクローニングされたインサートの配列が調べられ、そしてこの配列はワクシニアウイルス株であるコペンハーゲン、WR、MVAからの他の既知の配列と比較された。上述の配列はMVA−ATI領域の部分配列を含むことがわかった。大抵のオルソポックスウイルスのATI遺伝子は、感染した細胞で光学顕微鏡により観察しうる、いわゆる封入体(inclusion bodies)と称する成熟したウイルス体に埋め込まれた密集した細胞質間充質を形成する。推測上のATIの機能は、一般的な環境下での感染性ウイルス粒子の高い安定性と伝播性の延長である。オルソポックスウイルスはエクトロメリアウイルス、牛痘ウイルス、アライグマポックスウイルスを含むいくつかのグループであり、130kDaから160kDaの典型的な封入体蛋白質を産生する。しかしながら、例えばワクシニアウイルスウエスタンリザーブ(WR)、ワクシニアウイルスコペンハーゲンもしくはMVAのようなオルソポックス属の他のメンバーは、そのような封入体を形成しない。これは配列の削除もしくはフレームシフト変異の結果であり、コーディング配列の欠失を導き、またATIホモログの欠如を生じる。例えば、ワクシニアウイルスWRは94kDaのATIホモログを発現するが、一方、MVAとワクシニアウイルスコペンハーゲンはそのようなATIホモログを発現しない。
【0041】
挿入ベクターのさらなる構築のために、自然発生した制限酵素EcoRIの認識部位が、増幅した配列を2つの部分に分離するために使用された。これらの分節はフランキング領域(flank1、flank2)として働き、ポックスウイルスゲノムとの相同組換えを起こさせる。それらのフランキング領域の間に、操作される異種遺伝子の挿入のためのマルチプルクローニングサイトに加え、例えば、7.5プロモーター(7.5)、および/または合成したプロモーターによるワクシニアウイルスのプロモーター配列が挿入された。生成したプラスミドはpSW−7.5−sP, pSW−7.5, pSW−sPと名づけられた。
【0042】
また、EGFPフュージョン遺伝子(pEGFP, Clonetech, GenBank Accession #: U76561から分離された)と融合させたワクシニアウイルスのホスト域遺伝子(K1L)から成る発現カセットと、天然に存在するK1Lプロモーターが上記のフランキング領域の間に挿入された。この発現カセットは組換え型のウイルスの効率的な選択と分離に特に有用である。生成したプラスミドはpSWk1lgfpと名づけられた。
【0043】
組換え型ウイルスの産生
組換え型ウイルスを産生するために、およそ80%コンフルエントの単層培養細胞を有する6ウェルの組織培養プレートが使用された。組換え型MVAを産生するために、ニワトリ胚繊維芽細胞のような許容細胞(permissive cell)が使用された。組換え型WR株ワクシニアウイルスを産生するために、アフリカミドリ猿の細胞(Vero)が使用された。
【0044】
最初に、細胞培養の培地を除去し、MOI(multiplicity of infection)が0.01(例えば、1ウェル5x105細胞1ml培地中に接種物5x103IU(感染単位))の野生型のポックスウイルスを含んだ無血清培地が細胞の上に層状に加えられた。この混合物は、37℃、5% CO2存在下で1時間インキュベーションされた。そして、接種物が除かれ、細胞がウェル毎に2mlのOptiMEMで2回洗浄された。
【0045】
引き続き、単層細胞は、メーカー(GIBCO BRL)記載の方法により調整したリポフェクチン/プラスミドDNA混合物(全量:1ml)およびpSWk1lgfpのプラスミドDNA15μgでカバーされた。この混合物は、5% CO2の存在下において、37℃で5−12時間インキュベーションされた。次いで、リポフェクチン/プラスミドDNA混合物が除かれ、細胞は、1.5mlの10%FCSが添加された新鮮な培地でカバーされた。感染の48時間後に、単層細胞はセルスクレーパーではがされて、細胞および培地は2mlの遠心チューブに移された。トランスフェクション回収物は、‐20〜‐80℃で保存された。ポックスウイルス感染細胞へのpSWk1lgfpプラスミドのトランスフェクションに際して、EGFP遺伝子に融合したホスト域遺伝子K1Lは、ベクタープラスミドのフランキング領域と相同性のあるポックスウイルスゲノムの部位に正確に組換えられる。
【0046】
非組換え型のMVAウイルスから組換え型MVAウイルスを分離するために、ホスト域細胞であるウサギ腎臓(RK)13が、上記のトランスフェクション実験で得られたウイルス成分で感染された。以前の研究において、RK13細胞でのMVA感染は、ウイルスRNAの中間生成物の合成損傷およびウイルスDNAの複製欠如を特徴とするウイルス複製の早期阻害に至ることが示された。しかしながら、このRK13細胞での非生産的MVA感染は、ワクシニアウイルスのホスト域遺伝子であるK1Lの過剰発現によって克服することができた(Sutter et al., 1994b)。従って、RK13培養細胞に対する上記トランスフェクション実験で得られたウイルス成分の接種は、K1L遺伝子を共発現する組換え型のみの高選択的繁殖を生じた。6ウェルもしくは96ウェルの組織培養プレートにおいて培養されたRK13細胞上で連続的に5回継代した後に、MVA−K1LGFPウイルスが分離された。非組換え型のMVAが存在しないことはPCR法により証明された。
【0047】
また、融合されたEGFP遺伝子の発現は、GFPの蛍光によって組換え型ウイルス感染の直接的なモニタリングを可能にした。また、直接的なモニタリングは、K1L選択に対して感受性でない組換え型ワクシニアウイルスのWR株の同定、およびその後の分離に使用される。
【参照文献】
【0048】
Antoine, G. et al., 1998, The complete genomic sequence of the modified vaccinia Ankara strain: comparison with other orthopoxviruses. Virology, May 10; 244(2): 365−96.
Carroll, M.W. et al. 1997: Highly attenuated modified vaccinia virus Ankara(MVA)as an effective recombinant vector: A murine tumor model. Vaccine 15, 387.
Fenner, F. et al. 1998: Smallpox and its eradication. World Health Organisation, Geneva.
Goebel, SJ. et al., 1990, The complete DNA sequence of vaccinia virus. Virology, Nov; 179(1): 247−66, 517−63.
Howley, PM. et al., 1996, A vaccinia virus transfer vector using a GUS reporter gene inserted into the I4L locus. Gene, Jun 26; 172(2): 233−7.
Mackett, M. et al. 1982: Vaccinia virus: a selectable eukaryotic cloning and expression vector. Proc. Natl. Acad. Sci. USA 79, 7415.
Moss, B. 1996: Genetically engineered poxviruses for recombinant gene expression, vaccination, and safety. Proc. Natl. Acad. Sci. USA 93, 11341.
Sambrook, et al., 1989, Molecular Cloning: a laboratory manual, Cold Spring Harbor Laboratory Press publication, New York.
Shida, H. et al., 1987, Effect of the recombinant vaccinia viruses that express HTLV−I envelope gene on HTLV−I infection. EMBO J. Nov; 6(11): 3379−84.
Sutter, G. et al., 1994a: A recombinant vector derived from the host range−restricted and highly attenuated MVA strain of vaccinia virus stimulates protective immunity in mice to influenza virus. Vaccine 12, 1032.
Sutter, G. et al., 1994b: Stable expression of the vaccinia virus K1L gene in rabbit cells complements the host range defect of a vaccinia virus mutant. J. Virol. 68, 4109.
【特許請求の範囲】
【請求項1】
ポックスウイルスゲノムへの異種なコーディング配列の挿入に使用するベクターであって、以下の(a)〜(c)からなる群の中から選択された1以上の因子から構成される核酸配列を含むベクター:
(a)配列番号1による核酸配列またはその相補鎖;
(b)厳格な条件下で(a)に定義する配列とハイブリダイズする1つの核酸配列;
(c)(a)または(b)に定義される核酸配列のうち少なくとも連続的な30塩基対を含む断片。
【請求項2】
前記核酸配列が改変されたワクシニアアンカラウイルス(MVA)に由来する請求項1に記載のベクター。
【請求項3】
付加的に少なくとも1つの転写制御因子が当該核酸配列の中のクローニング部位に導入されている請求項1または2に記載のベクター。
【請求項4】
前記転写制御因子がポックスウイルスゲノム由来であるか、またはポックスウイルス由来の転写制御因子のコンセンサス配列である請求項3に記載されたベクター。
【請求項5】
付加的に少なくとも1つの異種コーディング配列を含み、該異種コーディング配列は請求項3または4に記載された転写制御因子と機能的に関連するものである、請求項1〜4の何れか1項に記載のベクター。
【請求項6】
前記異種コーディング配列がマーカー遺伝子、治療用遺伝子、ホスト域遺伝子および/または免疫原性抗原決定基のグループから選択される請求項5に記載のベクター。
【請求項7】
マーカー遺伝子、ホスト域遺伝子および/または請求項3〜5に記載の転写制御因子をコードする1以上の異種コーディング配列に接している組換え型の配列を含む、請求項3〜6の何れか1項に記載のベクター。
【請求項8】
請求項3〜7の何れか1項に記載のベクターにより転移された核酸配列をそのゲノム中に含む、組換え型ポックスウイルス。
【請求項9】
ポックスウイルスが改変されたワクシニアアンカラウイルス(MVA)である請求項8に記載の組換え型ポックスウイルス。
【請求項10】
ポックスウイルスゲノムに異種配列を導入する方法であって、
(a)請求項3〜7の何れか1項に記載のベクターを用いて、ホスト細胞を形質導入することと;
(b)上述のホスト細胞をポックスウイルスで感染させることと;
(c)組換え型ポックスウイルスを分離することと
を含む方法。
【請求項11】
請求項8または9に記載の組換え型ポックスウイルス、および/または請求項1〜7の何れか1項に記載のベクターを含む標的細胞。
【請求項12】
感染症もしくは増殖性の障害の治療および/または予防のための、前述の請求項1〜7の何れか1項に記載のベクター、請求項8もしくは9記載の組換え型ポックスウイルス、および/または請求項11に記載の標的細胞。
【請求項13】
請求項1〜7の何れか1項に記載のベクター、請求項8もしくは9に記載の組換え型ポックスウイルス、および/または請求項11に記載の標的細胞の使用であって、感染症もしくは増殖性障害の治療および/または予防のための薬物を製造するための使用。
【請求項14】
請求項1〜7の何れか1項に記載のベクター、請求項8または9の何れか1項に記載の組換え型ポックスウイルス、および/または請求項11に記載の標的細胞、並びに薬学的に許容可能な担体および/または希釈剤を含む薬学的組成物。
【請求項15】
前述の請求項1〜7の何れか1項に記載のベクター、何れかのポックスウイルス(請求項8もしくは請求項9に記載された組換え型ポックスウイルスを除く)、並びに薬学的に許容可能な担体および/または希釈剤を含む薬学的組成物。
【請求項16】
動物生体(ヒトを含む)の感染症もしくは増殖性の障害を治療および/または予防する方法であって、前記動物生体に対して、請求項8もしくは9に記載の組換え型ポックスウイルス、および/または請求項1〜7の何れか1項に記載のベクターの適用、或いは他の何れかの組換え型ポックスウイルスに含まれる前記ベクターの適用を含む方法。
【請求項17】
前記組換え型ポックスウイルスがオルソポックスウイルスに由来する請求項16に記載の方法。
【請求項1】
ポックスウイルスゲノムへの異種なコーディング配列の挿入に使用するベクターであって、以下の(a)〜(c)からなる群の中から選択された1以上の因子から構成される核酸配列を含むベクター:
(a)配列番号1による核酸配列またはその相補鎖;
(b)厳格な条件下で(a)に定義する配列とハイブリダイズする1つの核酸配列;
(c)(a)または(b)に定義される核酸配列のうち少なくとも連続的な30塩基対を含む断片。
【請求項2】
前記核酸配列が改変されたワクシニアアンカラウイルス(MVA)に由来する請求項1に記載のベクター。
【請求項3】
付加的に少なくとも1つの転写制御因子が当該核酸配列の中のクローニング部位に導入されている請求項1または2に記載のベクター。
【請求項4】
前記転写制御因子がポックスウイルスゲノム由来であるか、またはポックスウイルス由来の転写制御因子のコンセンサス配列である請求項3に記載されたベクター。
【請求項5】
付加的に少なくとも1つの異種コーディング配列を含み、該異種コーディング配列は請求項3または4に記載された転写制御因子と機能的に関連するものである、請求項1〜4の何れか1項に記載のベクター。
【請求項6】
前記異種コーディング配列がマーカー遺伝子、治療用遺伝子、ホスト域遺伝子および/または免疫原性抗原決定基のグループから選択される請求項5に記載のベクター。
【請求項7】
マーカー遺伝子、ホスト域遺伝子および/または請求項3〜5に記載の転写制御因子をコードする1以上の異種コーディング配列に接している組換え型の配列を含む、請求項3〜6の何れか1項に記載のベクター。
【請求項8】
請求項3〜7の何れか1項に記載のベクターにより転移された核酸配列をそのゲノム中に含む、組換え型ポックスウイルス。
【請求項9】
ポックスウイルスが改変されたワクシニアアンカラウイルス(MVA)である請求項8に記載の組換え型ポックスウイルス。
【請求項10】
ポックスウイルスゲノムに異種配列を導入する方法であって、
(a)請求項3〜7の何れか1項に記載のベクターを用いて、ホスト細胞を形質導入することと;
(b)上述のホスト細胞をポックスウイルスで感染させることと;
(c)組換え型ポックスウイルスを分離することと
を含む方法。
【請求項11】
請求項8または9に記載の組換え型ポックスウイルス、および/または請求項1〜7の何れか1項に記載のベクターを含む標的細胞。
【請求項12】
感染症もしくは増殖性の障害の治療および/または予防のための、前述の請求項1〜7の何れか1項に記載のベクター、請求項8もしくは9記載の組換え型ポックスウイルス、および/または請求項11に記載の標的細胞。
【請求項13】
請求項1〜7の何れか1項に記載のベクター、請求項8もしくは9に記載の組換え型ポックスウイルス、および/または請求項11に記載の標的細胞の使用であって、感染症もしくは増殖性障害の治療および/または予防のための薬物を製造するための使用。
【請求項14】
請求項1〜7の何れか1項に記載のベクター、請求項8または9の何れか1項に記載の組換え型ポックスウイルス、および/または請求項11に記載の標的細胞、並びに薬学的に許容可能な担体および/または希釈剤を含む薬学的組成物。
【請求項15】
前述の請求項1〜7の何れか1項に記載のベクター、何れかのポックスウイルス(請求項8もしくは請求項9に記載された組換え型ポックスウイルスを除く)、並びに薬学的に許容可能な担体および/または希釈剤を含む薬学的組成物。
【請求項16】
動物生体(ヒトを含む)の感染症もしくは増殖性の障害を治療および/または予防する方法であって、前記動物生体に対して、請求項8もしくは9に記載の組換え型ポックスウイルス、および/または請求項1〜7の何れか1項に記載のベクターの適用、或いは他の何れかの組換え型ポックスウイルスに含まれる前記ベクターの適用を含む方法。
【請求項17】
前記組換え型ポックスウイルスがオルソポックスウイルスに由来する請求項16に記載の方法。
【図1】


【図2】




【図2】


【公開番号】特開2011−234731(P2011−234731A)
【公開日】平成23年11月24日(2011.11.24)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−160693(P2011−160693)
【出願日】平成23年7月22日(2011.7.22)
【分割の表示】特願2001−500788(P2001−500788)の分割
【原出願日】平成12年5月25日(2000.5.25)
【出願人】(398061245)ヘルムホルツ・ツェントルム・ミュンヒェン・ドイチェス・フォルシュンクスツェントルム・フューア・ゲズントハイト・ウント・ウムベルト(ゲーエムベーハー) (19)
【氏名又は名称原語表記】Helmholtz Zentrum Muenchen Deutsches Forschungszentrum fuer Gesundheit und Umwelt (GmbH)
【Fターム(参考)】
【公開日】平成23年11月24日(2011.11.24)
【国際特許分類】
【出願番号】特願2011−160693(P2011−160693)
【出願日】平成23年7月22日(2011.7.22)
【分割の表示】特願2001−500788(P2001−500788)の分割
【原出願日】平成12年5月25日(2000.5.25)
【出願人】(398061245)ヘルムホルツ・ツェントルム・ミュンヒェン・ドイチェス・フォルシュンクスツェントルム・フューア・ゲズントハイト・ウント・ウムベルト(ゲーエムベーハー) (19)
【氏名又は名称原語表記】Helmholtz Zentrum Muenchen Deutsches Forschungszentrum fuer Gesundheit und Umwelt (GmbH)
【Fターム(参考)】
[ Back to top ]

