ポリアミド酸およびポリイミドならびに光学材料
【課題】 耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れるポリイミド、およびその原料として有用なポリアミド酸を提供する。
【解決手段】 塩素原子及びフッ素原子を含み、かつ下記式(1):
【化1】

ただし、X及びX’は、それぞれ独立して、2価の有機基を表わし;Y及びY’は、それぞれ独立して、塩素、臭素またはヨウ素原子を表わし;p及びp’は、それぞれ独立して、相当するベンゼン環へのフッ素原子(式(1)中のF)の結合数を表わし、0〜3の整数であり;q及びq’は、それぞれ独立して、0〜3の整数であり;およびp+qは3であり、p’+q’は3である、で示される繰り返し単位からなる、ポリアミド酸。
【解決手段】 塩素原子及びフッ素原子を含み、かつ下記式(1):
【化1】

ただし、X及びX’は、それぞれ独立して、2価の有機基を表わし;Y及びY’は、それぞれ独立して、塩素、臭素またはヨウ素原子を表わし;p及びp’は、それぞれ独立して、相当するベンゼン環へのフッ素原子(式(1)中のF)の結合数を表わし、0〜3の整数であり;q及びq’は、それぞれ独立して、0〜3の整数であり;およびp+qは3であり、p’+q’は3である、で示される繰り返し単位からなる、ポリアミド酸。
【発明の詳細な説明】
【0001】
【発明の属する技術分野】本発明は、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れるポリイミド、その前駆体として有用なポリアミド酸およびこのポリイミドを用いてなる光学材料に関するものである。
【0002】
【従来の技術】情報化社会における基幹産業としてエレクトロニクス産業が現在興隆を極めているが、このエレクトロニクス技術の進展に果たした高分子材料の役割は非常に大きく、絶縁用および微細加工用高分子なくしては、今日のエレクトロニクス時代はないといえるほどである。このように電気を流さないことを主たる特徴として、エレクトロニクス時代の産業・技術の進展を支えてきた高分子材料は、その分子及び集合体構造に適切な条件が整えば、強誘電性、電子やイオンの高導電性、超伝導性、さらに強磁性など、従来金属や半導体、さらには無機材料の特徴とされた諸機能を発現できることが分かり、近年、電子機能材料としての高分子の研究領域が非常に広がった。その結果、近年では、トランジスタ、サイリスタ、IC等の層間絶縁膜やパッシベーション材、シリコーン樹脂に代表されるジャンクションコート材、モールドストレスを緩和するチッピコート用バッファ材、メモリー素子のソフトエラー対策としてのα線シールド材、ダイボンディング材、レジスト材、半導体封止材料、ハイブリッドICの防湿コート材、TAB(TapeAutomated Bonding)用チップキャリヤーテープ、多層回路基板など、様々な用途に使用されている。
【0003】このように様々な用途に使用される高分子材料のうち、その優れた機能や耐熱性などの観点から、ポリイミドに注目が集まり、その研究・開発が現在盛んに行なわれ、現在、上述したような用途への応用が盛んに試みられている。例えば、特開平5−1148号公報には、炭素−水素結合(C−H結合)の代わりに炭素−フッ素結合(C−F結合)のみを含む繰り返し単位から構成される全フッ素化ポリイミドが開示されている。しかしながら、このポリイミドは、光電子集積回路を作製するに十分な耐熱性があり、近赤外域光、特に光通信波長域(1.0〜1.7μm)における光透過損失の極めて少ないものの、上記材料の組合わせでそれぞれ光導波路もしくは、光ファイバーのコア・クラッドを製造した場合、屈折率差Δn=0.2%程度と、実用に耐えうる屈折率差0.5%以上を提供できなかった。
【0004】上述したように、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れるポリイミドに対する要求は高いものの、いまだ存在しなかった。
【0005】
【発明が解決しようとする課題】したがって、本発明は、上記事情を鑑みてなされたものであり、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れ、概存の全フッ素化ポリイミドに対して屈折率差Δnが0.5%を超えるポリイミド、およびその原料として有用なポリアミド酸を提供することを目的とする。
【0006】本発明の他の目的は、上記ポリイミドを用いてなる光学材料を提供することである。
【0007】
【課題を解決するための手段】本発明者らは、上記諸目的を達成すべく鋭意検討を行った結果、炭素−フッ素結合(C−F結合)および/または炭素−塩素結合(C−Cl結合)からなりかつ特定の繰り返し単位からなるるポリイミドが耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れることを見出し、この知見に基づいて、本発明を完成するに至った。
【0008】すなわち、上記諸目的は、下記(1)〜(7)によって達成される。
【0009】(1) 塩素原子及びフッ素原子を含み、かつ下記式(1):
【0010】
【化5】

【0011】ただし、X及びX’は、それぞれ独立して、2価の有機基を表わし;Y及びY’は、それぞれ独立して、塩素、臭素またはヨウ素原子を表わし;p及びp’は、それぞれ独立して、相当するベンゼン環へのフッ素原子(式(1)中のF)の結合数を表わし、0〜3の整数であり;q及びq’は、それぞれ独立して、0〜3の整数であり;およびp+qは3であり、p’+q’は3である、で示される繰り返し単位からなる、ポリアミド酸。
【0012】(2) 下記式(3)および/または(3’):
【0013】
【化6】

【0014】ただし、X及びX’は、それぞれ独立して、2価の有機基を表わす、で示される繰り返し単位を有する、前記(1)に記載のポリアミド酸。
【0015】(3) 塩素原子及びフッ素原子を含み、かつ下記式(2):
【0016】
【化7】

【0017】ただし、X及びX’は、それぞれ独立して、2価の有機基を表わし;Y及びY’は、それぞれ独立して、塩素、臭素またはヨウ素原子を表わし;p及びp’は、それぞれ独立して、相当するベンゼン環へのフッ素原子(式(2)中のF)の結合数を表わし、0〜3の整数であり;q及びq’は、それぞれ独立して、0〜3の整数であり;およびp+qは3であり、p’+q’は3である、で示される繰り返し単位からなる、ポリイミド。
【0018】(4) 下記式(4)および/または(4’):
【0019】
【化8】

【0020】X及びX’は、それぞれ独立して、2価の有機基を表わす、で示される繰り返し単位を有する、前記(3)に記載のポリイミド。
【0021】(5) 有機溶媒中で、下記式(5):
【0022】
【化9】

【0023】ただし、X’は、2価の有機基を表わす、で示されるジアミン化合物を、下記式(7):
【0024】
【化10】

【0025】ただし、Xは、2価の有機基を表わし;Y及びY’は、それぞれ独立して、塩素、臭素またはヨウ素原子を表わし;p及びp’は、それぞれ独立して、相当するベンゼン環へのフッ素原子(式(7)中のF)の結合数を表わし、0〜3の整数であり;q及びq’は、それぞれ独立して、0〜3の整数であり;およびp+qは3であり、p’+q’は3である、で示されるテトラカルボン酸、その酸無水物もしくは酸塩化物、またはそのエステル化物と反応させることからなる、前記(1)に記載のポリアミド酸の製造方法。
【0026】(6) 前記(1)または(2)に記載のポリアミド酸を加熱閉環することからなる、前記(3)に記載のポリイミドの製造方法。
【0027】(7) 前記(3)または(4)に記載のポリイミドを含む光学材料。
【0028】
【発明の実施の形態】以下、本発明を詳細に説明する。
【0029】第一の態様によると、本発明は、塩素原子及びフッ素原子を含み、かつ前記式(1)、好ましくは式(3)および/または(3’)で示される繰り返し単位からなるポリアミド酸に関するものである。このように炭素−フッ素結合(C−F結合)および/または炭素−塩素結合(C−Cl結合)からなりかつ特定の繰り返し単位からなるポリアミド酸は、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れるポリイミドの原料として有用である。
【0030】本発明において、ポリアミド酸は、塩素原子及びフッ素原子を含むことを必須とする。この際、ポリアミド酸中に存在する塩素原子の含量は、特に制限されず、製造のし易さ及び所望の特性(例えば、溶解性、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性)を考慮して適宜選択されるが、ポリアミド酸の全質量に対して、60質量%以下の含量の塩素原子を含むことが好ましい。塩素原子の含量が60質量%を超えると、ポリアミド酸の溶解性が低下し、ポリアミド酸を製造するのが困難になる場合がある。なお、本発明のポリアミド酸は塩素原子を含むことを必須要件とするため、ポリアミド酸の塩素原子の含量の下限は、0質量%となることはない。これから形成されるポリイミドの誘電率、屈折率、耐熱性及び耐吸湿性などを考慮すると、ポリアミド酸中に存在する塩素原子の含量は、ポリアミド酸の全質量に対して、より好ましくは4〜55質量%、特に好ましくは4〜30質量%である。
【0031】また、本発明において、ポリアミド酸は、前記式(1)で示される繰り返し単位を有するものであることを必須要件とする。このような特定の繰り返し単位からなることによって、これから形成されるポリイミドの所望の屈折率(即ち、既存の全フッ素化ポリイミドに対する屈折率差Δn)が達成できるからである。また、本発明のポリアミド酸は、近赤外域光、特に光通信波長域(1.0〜1.7μm)における光透過損失を考慮すると、炭素−水素結合(C−H結合)が存在しないことが好ましい。
【0032】上記式(1)において、X及びX’は、2価の有機基を表わす。この際、X及びX’は、同一であってもまたは異なるものであってもよい。また、2価の有機基としては、環状アルキル、鎖状アルキル、オレフィン、グリコールなど由来の、2価の脂肪族有機基;ベンゼンビフェニル、ビフェニルエーテル、ビスフェニルベンゼン、ビスフェノキシベンゼンなど由来の、2価の芳香族有機基;ならびにこれらの含ハロゲン脂肪族および芳香族有機基などが挙げられる。これらのうち、2価の芳香族有機基、より好ましくは2価の含ハロゲン芳香族有機基、最も好ましくは2価の全ハロゲン化芳香族有機基が、上記(1)における「X」及び「X’」として好ましい。なお、本明細書において、「全ハロゲン化芳香族有機基」とは、その基中に存在するすべての炭素−水素結合(C−H結合)が炭素−ハロゲン結合(例えば、炭素−フッ素結合(C−F結合)や炭素−塩素結合(C−Cl結合))に置換された基を意味する。これにより、これから形成されるポリイミドの所望の屈折率(即ち、既存の全フッ素化ポリイミドに対する屈折率差Δn)及び光通信波長域(1.0〜1.7μm)における光透過損失が達成できる。また、このような2価の全ハロゲン化芳香族有機基の例としては、ベンゼンビフェニル、ビフェニルエーテル、ビスフェニルベンゼン、ビスフェノキシベンゼンなど由来の、2価の全ハロゲン化芳香族有機基などが挙げられる。
【0033】これらのうち、上記(1)における「X」として好ましい2価の有機基の例としては、結合子または下記式:
【0034】
【化11】

【0035】で示される2価の基である。これらのうち、Xは、結合子または下記式:
【0036】
【化12】

【0037】で示される2価の基であることがより好ましい。
【0038】上記「X」を表わす式において、Z及びZ’は、ハロゲン原子、即ち、フッ素、塩素、臭素またはヨウ素原子を表わし、好ましくはフッ素または塩素原子、最も好ましくは塩素原子を表わす。上記「X」を表わす式において、Z及びZ’双方が存在する際には、Z及びZ’は、同一であってもまたは異なるものであってもよく、また、各ベンゼン環中に複数個存在するZ及びZ’は、それぞれ、各ベンゼン環中で同一であってもまたは異なるものであってもよい。
【0039】すなわち、上記(1)における「X」としては、結合子または下記式のいずれかで示される2価の有機基であることがより好ましい。
【0040】
【化13】

【0041】また、上記「X」のうち、下記いずれかの式:
【0042】
【化14】

【0043】で示される2価の有機基、特に、下記式:
【0044】
【化15】

【0045】で示される2価の有機基が好ましい。
【0046】また、上記(1)における「X’」として好ましい2価の有機基の例としては、下記式:
【0047】
【化16】

【0048】で示される基が挙げられる。この際、Z”は、塩素、臭素またはヨウ素原子を表わし、好ましくは塩素または臭素原子、最も好ましくは塩素原子を表わす。また、aは、ベンゼン環へのフッ素原子の結合数を表わし、0〜4の整数であり、好ましくは0、3または4である。bは、ベンゼン環へのZ”の結合数を表わし、0〜4の整数であり、0、1または4である。なお、上記式において、Z”がベンゼン環中で複数個存在する(即ち、bが2〜4の整数である)場合には、Z”は、それぞれ、ベンゼン環中で同一であってもあるいは異なるものであってもよい。なお、上記式において、a及びbの合計は必ず4であり(即ち、a+b=4)。これは、最終産物であるポリイミドの光通信波長域における低光損失を考慮すると、ポリアミド酸中にC−H結合が存在しないことが好ましいからである。よって、上記(1)における「X’」としては、下記式:
【0049】
【化17】

【0050】で示される2価の基であることが最も好ましい。
【0051】上記式(1)において、Y及びY’は、塩素、臭素またはヨウ素原子を表わし、好ましくは塩素または臭素原子、最も好ましくは塩素原子を表わす。この際、Y及びY’は、同一であってもまたは異なるものであってもよい。また、上記式(1)において、p及びp’は、それぞれ、相当するベンゼン環へのフッ素原子の結合数を表わし、0〜3の整数であり、好ましくは0または3である。この際、p及びp’は、同一であってもまたは異なるものであってもよい。さらに、上記式(1)において、q及びq’は、それぞれ、相当するベンゼン環へのY及びY’の結合数を表わし、0〜3の整数であり、好ましくは0または3である。この際、q及びq’は、同一であってもまたは異なるものであってもよい。なお、上記式において、Y及びY’がベンゼン環中で複数個存在する(即ち、q及びq’が2〜3の整数である)場合には、Y及びY’は、それぞれ、ベンゼン環中で同一であってもあるいは異なるものであってもよい。なお、上記式(1)において、p及びqの合計は必ず3であり(即ち、p+q=3)、p’及びq’の合計は必ず3である(即ち、p’+q’=3)。これは、最終産物であるポリイミドの光通信波長域における低光損失を考慮すると、ポリアミド酸中にC−H結合が存在しないことが好ましいからである。
【0052】すなわち、本発明のポリアミド酸の好ましい例としては、前記式(3)および/または(3’)で示される繰り返し単位を有するポリアミド酸、より好ましくは、式(3)および/または(3’)において、X及びX’は上記好ましい2価の有機基を表わすポリアミド酸であり、特に、下記いずれかの式:
【0053】
【化18】

【0054】で示される繰り返し単位を有するポリアミド酸が好ましい。
【0055】なお、本発明のポリアミド酸の製造方法については以下に詳述するが、この記載から、本発明のポリアミド酸の末端は、ジアミン化合物及びテトラカルボン酸誘導体の添加量(モル比)によって異なるが、アミン末端または酸誘導体末端のいずれかであると考えられる。また、本発明のポリアミド酸は、同一の繰り返し単位からなるものであってもまたは異なる繰り返し単位からなるものであってもよく、後者の場合には、その繰り返し単位はブロック状であってもまたはランダム状であってもよい。
【0056】本発明において、ポリアミド酸は、少なくとも一個の塩素原子が存在する限り、全フッ素化型の繰り返し単位[例えば、X及びX’が水素原子(C−H結合)がすべてフッ素原子(C−F結合)に置換された全フッ素化型の2価の有機基を表わし、p及びp’が3である、式(1)の繰り返し単位]を含むものであってもよい。このように、全フッ素化型の繰り返し単位を一部に含む共重合体の形態を有するポリアミド酸は、有機溶剤に対する溶解性、耐熱性及び耐吸湿性の点から、本発明において好ましい。この際、これらの繰り返し単位(全フッ素化型の繰り返し単位及び非全フッ素化型の繰り返し単位)は、ブロック状であってもまたはランダム状であってもよい。
【0057】本発明のポリアミド酸は、公知の技術の組み合わせによって製造でき、その製造方法は、特に制限されるものではない。一般的には、有機溶媒中で、前記式(5)で示されるジアミン化合物を、前記式(7)で示されるテトラカルボン酸、その酸無水物もしくは酸塩化物、またはそのエステル化物等と反応させる方法が好ましく使用される。したがって、第二の態様によると、本発明は、有機溶媒中で、上記式(5)で示されるジアミン化合物(本明細書中では、単に「ジアミン化合物」とも称する)を、上記式(7)で示されるテトラカルボン酸、その酸無水物もしくは酸塩化物、またはそのエステル化物(本明細書中では、一括して、「テトラカルボン酸誘導体」とも称する)と反応させることからなる本発明の第一の態様のポリアミド酸の製造方法を提供するものである。なお、上記式(5)における「X”」、ならびに上記式(7)における「X」、「Y」、「Y’」、「p」、「q」、「p’」及び「q’」は、上記式(1)における定義と同様であるため、ここでの説明を省略する。
【0058】本発明の第二の態様の方法の好ましい一実施態様として、例えば、上記式(1)において、X’が下記式:
【0059】
【化19】

【0060】で示される2価の基である、上記式(1)のポリアミド酸である場合について、以下に説明する。すなわち、有機溶媒中で、下記式(6):
【0061】
【化20】

【0062】で示される1,3−ジアミノベンゼン誘導体(本明細書中では、単に「1,3−ジアミノベンゼン誘導体」とも称する)を、上記式(7)のテトラカルボン酸誘導体と反応させる方法によって、所望のポリアミド酸が製造できる。なお、下記実施態様は本発明の好ましい例である1,3−ジアミノベンゼン誘導体を原料として使用して説明したものであり、本発明の第二の態様の方法は、1,3−ジアミノベンゼン誘導体の代わりに、適切に選択されたジアミン化合物を使用する以外は、下記実施態様と同様にして、適用できる。また、上記式(6)における「Z”」、「a」及び「b」は、「X’」の好ましい例における定義と同様であるため、ここでの説明を省略する。
【0063】本発明において、1,3−ジアミノベンゼン誘導体は、上記式(6)で示されかつハロゲン化テトラカルボン酸誘導体と反応して所望のポリアミド酸が製造できるような構造を有するものであれば、特に制限されるものではない。したがって、本発明の好ましいポリアミド酸の構造から、1,3−ジアミノ−2,4,5,6−テトラフルオロベンゼン、5−クロロ−1,3−ジアミノ−2,4,6−トリフルオロベンゼン、2,4,5,6−テトラクロロ−1,3−ジアミノベンゼン、4,5,6−トリクロロ−1,3−ジアミノ−2―フルオロベンゼン、5−ブロモ−1,3−ジアミノ−2,4,6−トリフルオロベンゼン、2,4,5,6−テトラブロモ−1,3−ジアミノベンゼンが好ましく、1,3−ジアミノ−2,4,5,6−テトラフルオロベンゼン及び5−クロロ−1,3−ジアミノ−2,4,6−トリフルオロベンゼンが特に好ましい。なお、これらの1,3−ジアミノベンゼン誘導体は、単独で使用されてもあるいは2種以上の混合物の形態で使用されてもよい。
【0064】本発明において、1,3−ジアミノベンゼン誘導体の添加量は、ハロゲン化テトラカルボン酸誘導体と効率よく反応できる量であればよく、特に制限されない。具体的には、1,3−ジアミノベンゼン誘導体の添加量は、化学量論的には、ハロゲン化テトラカルボン酸誘導体と等モルであるが、好ましくは、ハロゲン化テトラカルボン酸誘導体の全モル数を1モルとしたのに対して、0.8〜1.2モル、より好ましくは0.9〜1.1モルである。この際、1,3−ジアミノベンゼン誘導体の添加量が0.8モル未満であると、ハロゲン化テトラカルボン酸誘導体が多量に残存してしまい精製工程が複雑になる恐れがあり、また、重合度が大きくならない場合があり、逆に1.2モルを超えると、1,3−ジアミノベンゼン誘導体が多量に残存してしまい精製工程が複雑になる恐れがあり、また、重合度が大きくならない場合がある。
【0065】本発明において、ハロゲン化テトラカルボン酸誘導体は、上記式(7)で示されるハロゲン化テトラカルボン酸、その酸無水物もしくは酸塩化物、またはそのエステル化物である。具体的には、ヘキサフルオロ−3,3’,4,4’−ビフェニルテトラカルボン酸、ヘキサクロロ−3,3’,4,4’−ビフェニルテトラカルボン酸、ビス(3,4−ジカルボキシトリフルオロフェニル)スルフィド、ビス(3,4−ジカルボキシトリクロロフェニル)スルフィド、1,4−ビス(3,4−ジカルボキシトリフルオロフェノキシ)テトラフルオロベンゼン、1,4−ビス(3,4−ジカルボキシトリクロロフェノキシ)テトラフルオロベンゼン、1,4−ビス(3,4−ジカルボキシトリフルオロフェノキシ)テトラクロロベンゼン、1,4−ビス(3,4−ジカルボキシトリクロロフェノキシ)テトラクロロベンゼン、3,6−ジフルオロピロメリット酸、3,6−ジクロロピロメリット酸、3−クロロ−6−フルオロピロメリット酸等の、上記式(7)のハロゲン化テトラカルボン酸;対応する酸二無水物;対応する酸塩化物;メチルエステル、エチルエステル等の対応するエステル化物などが挙げられる。これらのうち、ヘキサフルオロ−3,3’,4,4’−ビフェニルテトラカルボン酸、1,4−ビス(3,4−ジカルボキシトリフルオロフェノキシ)テトラフルオロベンゼン、1,4−ビス(3,4−ジカルボキシトリフルオロフェノキシ)テトラクロロベンゼン、ならびにこれらの対応する酸二無水物及び酸塩化物が好ましく、1,4−ビス(3,4−ジカルボキシトリフルオロフェノキシ)テトラフルオロベンゼン、1,4−ビス(3,4−ジカルボキシトリフルオロフェノキシ)テトラクロロベンゼン、ならびにこれらの酸二無水物及び酸塩化物が特に好ましい。なお、これらのハロゲン化テトラカルボン酸誘導体は、単独で使用されてもあるいは2種以上の混合物の形態で使用されてもよい。
【0066】本発明で使用される上記式(7)で示されるハロゲン化テトラカルボン酸は、特に制限されるものではなく、特開平11−147955号公報に記載の方法など、公知の技術またはその組み合わせによって製造できる。
【0067】本発明で使用される有機溶媒は、1,3−ジアミノベンゼン誘導体及びハロゲン化テトラカルボン酸誘導体との反応が効率よく進行でき、かつこれらの原料に対して不活性であれば、特に制限されるものではない。例えば、N−メチル−2−ピロリジノン、N,N−ジメチルアセトアミド、N,N−ジメチルホルムアミド、ジメチルスルホキシド、スルホラン、メチルイソブチルケトン、アセトニトリル、ベンゾニトリルなどの極性有機溶媒が挙げられる。なお、これらの有機溶媒は、単独で使用されてもあるいは2種以上の混合物の形態で使用されてもよい。また、有機溶媒の量は、1,3−ジアミノベンゼン誘導体及びハロゲン化テトラカルボン酸誘導体との反応が効率よく進行できる量であれば特に制限されないが、有機溶媒中の1,3−ジアミノベンゼン誘導体の濃度が1〜80質量%、より好ましくは5〜50質量%となるような量であることが好ましい。
【0068】本発明において、1,3−ジアミノベンゼン誘導体及びハロゲン化テトラカルボン酸誘導体との反応条件は、これらの反応が十分進行できる条件であれば特に制限されるものではない。例えば、反応温度は、好ましくは0〜100℃、より好ましくは20〜50℃である。また、反応時間は、通常、1〜72時間、好ましくは2〜48時間である。また、反応は、加圧下、常圧下または減圧下のいずれの圧力下で行なってもよいが、好ましくは常圧下で行われる。また、1,3−ジアミノベンゼン誘導体及びハロゲン化テトラカルボン酸誘導体との反応は、反応効率及び重合度などを考慮すると、乾燥した不活性ガス雰囲気下で行なわれることが好ましく、この際の反応雰囲気における相対湿度は、好ましくは10%以下、より好ましくは1%以下であり、不活性ガスとしては、窒素、ヘリウム、アルゴンなどが使用できる。
【0069】本発明においては、本発明のポリアミド酸を加熱閉環することによって、新規なポリイミドが調製できる。したがって、第三の態様によると、本発明は、塩素原子及びフッ素原子を含み、かつ上記式(2)、好ましくは式(4)および/または(4’)で示される繰り返し単位からなる、ポリイミドに関するものである。このような炭素−フッ素結合(C−F結合)および/または炭素−塩素結合(C−Cl結合)からなりかつ特定の繰り返し単位からなるポリイミドは、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れるため、プリント基板、LSI用層間絶縁膜、半導体部品用封止材料、光学部品、光電子集積回路(OEIC)、光電子混載実装配線板における光導波路など、様々な光学材料に有用である。
【0070】本発明において、ポリイミドは、塩素原子及びフッ素原子を含むことを必須とする。この際、ポリイミド中に存在する塩素原子の含量は、特に制限されず、製造のし易さ及び所望の特性(例えば、溶解性、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性)を考慮して適宜選択されるが、ポリイミドの全質量に対して、60質量%以下の含量の塩素原子を含むことが好ましい。塩素原子の含量が60質量%を超えると、誘電率及び屈折率が高くなる恐れがあり、また、フッ素原子の含量が塩素原子の含量の増加に伴って低下するため耐熱性が低下する恐れもある。なお、本発明のポリイミドは塩素原子を含むことを必須要件とするため、ポリイミドの塩素原子の含量の下限は、0質量%となることはない。ポリイミドの誘電率、屈折率、耐熱性及び耐吸湿性などを考慮すると、ポリイミド中に存在する塩素原子の含量は、ポリイミドの全質量に対して、より好ましくは4〜55質量%、特に好ましくは4〜30質量%である。
【0071】また、本発明において、ポリイミドは、前記式(2)で示される繰り返し単位を有するものであることを必須要件とする。このような特定の繰り返し単位からなることによって、所望の屈折率(即ち、既存の全フッ素化ポリイミドに対する屈折率差Δn)が達成できるからである。また、本発明のポリイミドは、近赤外域光、特に光通信波長域(1.0〜1.7μm)における光透過損失を考慮すると、炭素−水素結合(C−H結合)が存在しないことが好ましい。このような構造を有するポリイミドは、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れる。なお、上記式(2)における「X」、「X’」、「Y」、「Y’」、「p」、「p’」、「q」及び「q’」は、上記式(1)における定義と同様であるため、ここでの説明を省略する。
【0072】本発明のポリイミドの好ましい例としては、前記式(4)および/または(4’)で示される繰り返し単位を有するポリイミドが挙げられる。上記式(4)および/または(4’)において、「X」及び「X’」は上記第一の態様(上記式(1))における定義と同様である。すなわち、上記(4)における「X」として好ましい2価の有機基の例としては、結合子または下記式:
【0073】
【化21】

【0074】で示される2価の基である。これらのうち、Xは、結合子または下記式:
【0075】
【化22】

【0076】で示される2価の基であることがより好ましい。上記「X」を表わす式において、Z及びZ’は、上記第一の態様における定義と同様であるため、ここでは説明を省略する。
【0077】上記式(4)における「X」のうち、Xは、結合子または下記式のいずれかで示される2価の有機基であることがより好ましい。
【0078】
【化23】

【0079】また、上記「X」のうち、下記いずれかの式:
【0080】
【化24】

【0081】で示される2価の有機基、特に、下記式:
【0082】
【化25】

【0083】で示される2価の有機基が好ましい。
【0084】また、上記式(4)において、X’もまた、上記第一の態様(上記式(1))における定義と同様であり、下記式:
【0085】
【化26】

【0086】で示される2価の有機基であることが好ましい。上記式において、Z”、a及びbもまた、上記第一の態様における定義と同様であるため、ここでは説明を省略する。したがって、上記(4)における「X’」としては、下記式:
【0087】
【化27】

【0088】で示される2価の基であることが最も好ましい。
【0089】本発明のポリイミドは、特に、下記いずれかの式:
【0090】
【化28】

【0091】で示される繰り返し単位を有するポリイミドであることが好ましい。
【0092】なお、本発明のポリイミドは、下記に詳述するように、ポリアミド酸を加熱閉環することによって製造されるが、これから、本発明のポリイミドの末端は、使用されるポリアミド酸の構造によって異なるが、アミン末端または酸誘導体末端であると考えられる。また、本発明のポリイミドは、同一の繰り返し単位からなるものであってもまたは異なる繰り返し単位からなるものであってもよく、後者の場合には、その繰り返し単位はブロック状であってもまたはランダム状であってもよい。
【0093】本発明において、ポリイミドは、少なくとも一個の塩素原子が存在する限り、全フッ素化型の繰り返し単位[例えば、X及びX’が水素原子(C−H結合)がすべてフッ素原子(C−F結合)に置換された全フッ素化型の2価の有機基を表わし、p及びp’が3である、式(2)の繰り返し単位]を含むものであってもよい。このように、全フッ素化型の繰り返し単位を一部に含む共重合体の形態を有するポリイミドは、有機溶剤に対する溶解性、耐熱性及び耐吸湿性の点から、本発明において好ましい。この際、これらの繰り返し単位(全フッ素化型の繰り返し単位及び非全フッ素化型の繰り返し単位)は、ブロック状であってもまたはランダム状であってもよい。
【0094】本発明のポリイミドは、公知の技術の組み合わせによって製造でき、その製造方法は、特に制限されるものではないが、一般的に、本発明のポリアミド酸を加熱閉環することによって製造される。したがって、第四の態様によると、本発明は、本発明の第一の態様のポリアミド酸を加熱閉環することからなる本発明の第三の態様のポリイミドの製造方法を提供するものである。
【0095】本発明の第四の態様において、ポリアミド酸の加熱処理は、溶剤中で行なわれても、あるいは溶剤の不存在下で行なわれてもよいが、反応効率などを考慮すると、溶剤中で行なわれることが好ましい。この際、ポリアミド酸は、上述したポリアミド酸の製造工程により1,3−ジアミノベンゼン誘導体とハロゲン化テトラカルボン酸誘導体との反応で得られた溶液の形態で加熱処理されても、またはこれからポリアミド酸を固体として分離した後、溶剤に再溶解して加熱処理されてもよい。後者の方法において使用できる他の溶剤としては、例えば、N−メチル−2−ピロリジノン、N,N−ジメチルアセトアミド、アセトニトリル、ベンゾニトリル、ニトロベンゼン、ニトロメタン、ジメチルスルフォキシド、アセトン、メチルエチルケトン、イソブチルケトンおよびメタノール等の極性溶剤やトルエンやキシレン等の非極性溶剤などが挙げられる。これらのうち、好ましくは、N−メチル−2−ピロリジノン及びN,N−ジメチルアセトアミドが使用される。また、これらの溶剤は、単独でまたは2種類以上の混合物の形態で使用されてもよい。
【0096】本発明の第三の態様において、ポリアミド酸の加熱処理条件は、特に制限されるものではなく、本発明のポリアミド酸が効率良く閉環されて、所望のポリイミドが製造できる条件であればよい。具体的には、加熱処理は、通常、空気中、好ましくは、窒素、ヘリウム、アルゴンなどによる不活性ガス雰囲気中で、70〜350℃程度で2〜5時間程度、行なわれ、本発明による加熱処理は、段階的に行なわれてもあるいは連続的に行なわれてもよい。好ましい実施態様によれば、ポリアミド酸は、70℃で2時間、160℃で1時間、250℃で30分、及び350℃で1時間、段階的に加熱処理が行なわれる。
【0097】本発明のポリイミドは、耐薬品性、撥水性、誘電特性、電気特性及び光学特性にも優れるものである。また、本発明のポリイミドは、特に分子鎖内に炭素−水素結合(C−H結合)を持たない場合には、近赤外域の吸収スペクトルにおいてC−H結合の伸縮振動の高調波あるいはC−H結合の伸縮信号の高調波と変角振動の結合振動に由来するピークが存在せず、ゆえに光通信波長域(1.0〜1.7μm)の全域にわたって低い光損失が達成できるため、プリント基板、LSI用層間絶縁膜、半導体部品用封止材料、光学部品、光電子集積回路(OEIC)、光電子混載実装配線板における光導波路など、様々な光学材料に有用である。
【0098】したがって、第五の態様によると、本発明は、本発明のポリイミドを含む光学材料を提供するものである。
【0099】第五の態様において、本発明の光学材料は、本発明のポリイミドを含むことを必須とするが、これに加えて、所望の特性、例えば、光透過性、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性などの特性をさらに向上することを目的として、他の成分を含んでいてもよい。この際、他の成分としては、例えば、ポリアミド、ポリアミドイミド、エポキシ樹脂、フェノール樹脂、メラミン樹脂、尿素樹脂、ジアリルフタレート樹脂、不飽和ポリエステル樹脂、ウレタン樹脂、付加型ポリイミド樹脂、シリコーン樹脂、ポリパラビニルフェノール樹脂、ポリフェニレンスルフィド、ポリエーテル、ポリエーテルエーテルケトン、ポリプロピレン及びポリアゾメチン;ポリテトラフルオロエチレン(PTFE)、テトラフルオロエチレン−ヘキサフルオロプロピレン共重合体(FEP)、エチレン−テトラフルオロエチレン共重合体(ETFE)、テトラフルオロエチレン−パーフルオロアルキルビニルエーテル共重合体(PFA)及びポリクロロトリフルオロエチレン(PCTFE)等のフッ素樹脂;炭酸カルシウム、シリカ、アルミナ、チタニア、水酸化アルミニウム、ケイ酸アルミニウム、ケイ酸ジルコニウム、ジルコン、ガラス、タルク、マイカ、黒鉛、アルミニウム、銅及び鉄等の粉末や短繊維状の無機充填材;脂肪酸やワックス類等の離型剤;エポキシシラン、ビニルシラン、ボラン系化合物及びアルキルチタネート系化合物等のカップリング剤;アンチモンやリンの化合物およびハロゲン含有化合物等の難燃剤;ならびに分散剤や溶剤等の各種添加剤が挙げられる。
【0100】本発明の光学材料の適用方法は、本発明のポリイミドを使用する以外は、従来と同様にして使用できる。例えば、本発明の光学材料をプリント基板に使用する場合には、基板上に、ポリアミド酸溶液を、キャスティング(流延法)、スピンコーティング(回転塗布法)、ロールコーティング、スプレイコーティング、バーコーティング、フレキソ印刷、およびディップコーティングなどの公知の方法によって、塗布した後、窒素、ヘリウム、アルゴンなどの、不活性ガス雰囲気中で、70〜350℃で、2〜5時間、加熱することによって、基板上にポリイミドフィルムを形成することができる。上記方法において、ポリアミド酸溶液は、上述したポリアミド酸の製造工程において1,3−ジアミノベンゼン誘導体とハロゲン化テトラカルボン酸誘導体との反応で得られた溶液の形態をそのまま使用しても、あるいはこれからポリアミド酸を分離した後、他の溶媒に溶解して使用してもよい。後者の方法において使用できる他の溶媒としては、例えば、N−メチル−2−ピロリジノン、N,N−ジメチルアセトアミド、アセトニトリル、ベンゾニトリル、ニトロベンゼン、ニトロメタン、ジメチルスルフォキシド、アセトン、メチルエチルケトン、イソブチルケトンおよびメタノール等の極性溶媒やトルエンやキシレン等の非極性溶媒などが挙げられる。これらのうち好ましくは、N−メチル−2−ピロリジノン及びN,N−ジメチルアセトアミドが使用される。また、これらの溶媒は、単独でまたは2種類以上の混合物の形態で使用されてよい。なお、上記方法において、フィルムの厚みなどは、その用途に応じて適宜選択されればよく、公知の値を同様にして使用できる。
【0101】
【実施例】以下、本発明の実施例により具体的に説明する。
【0102】実施例150ml容の三ツ口フラスコに、1,3−ジアミノ−2,4,5,6−テトラフルオロベンゼン 1.88g(10ミリモル)、下記式:
【0103】
【化29】

【0104】で示される4,4’−[(2,3,5,6−テトラフルオロ−1,4−フェニレン)ビス(オキシ)]ビス(3,5,6−トリフルオロフタル酸無水物) 1.21g(2ミリモル)、下記式:
【0105】
【化30】

【0106】で示される4,4’−[(2,3,5,6−テトラクロロ−1,4−フェニレン)ビス(オキシ)]ビス(3,5,6−トリフルオロフタル酸無水物) 5.41g(8ミリモル)、及びN,N−ジメチルアセトアミド、 11.5gを仕込んだ。この混合液を、窒素雰囲気中で、室温で、2日間、攪拌することによって、ポリアミド酸溶液を得た。
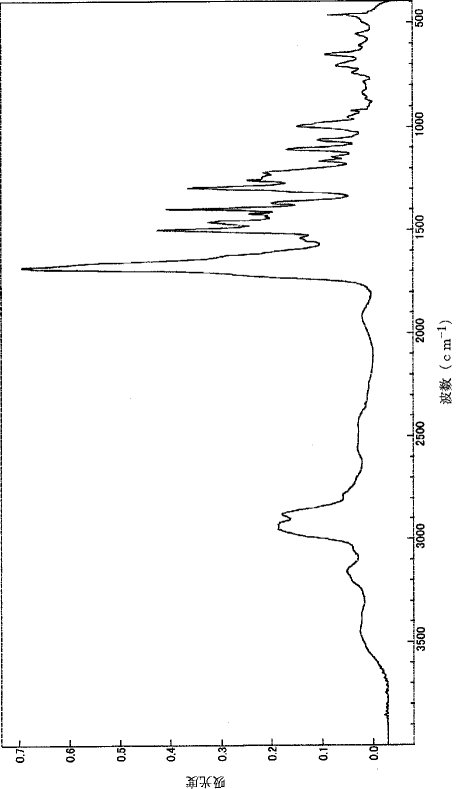
【0107】このようにして得られたポリアミド酸について、IRスペクトルで分析したところ、図1に示される結果が得られた。
【0108】参考例1実施例1において、酸無水物として4,4’−[(2,3,5,6−テトラフルオロ−1,4−フェニレン)ビス(オキシ)]ビス(3,5,6−トリフルオロフタル酸無水物)6.05g(10ミリモル)のみを使用する以外は、実施例1に記載の操作を繰り返すことによって、参考ポリアミド酸溶液を得た。
【0109】実施例2実施例1及び参考例1で得られたポリアミド酸溶液及び参考ポリアミド酸溶液を、それぞれ、直径4インチの大きさのシリコン基板上に、フィルムの膜の厚さが8μmとなるように、スピンコーティングし、窒素雰囲気中で、70℃で2時間、160℃で1時間、250℃で30分、及び350℃で1時間、加熱することによって、シリコン基板上にポリイミドフィルム及び参考ポリイミドフィルムを形成した。
【0110】このようにして得られたポリイミドフィルムについて、IRスペクトルで分析したところ、図2に示される結果が得られた。
【0111】また、このようにして得られたポリイミドフィルムの光通信波長域(0.8〜1.7μm)での光の吸収を測定したところ、当該波長域での光透過損失が極めて少ないことを確認した。
【0112】さらに、このようにして得られたポリイミドフィルム及び参考ポリイミドフィルムについて、633及び1300nmでの屈折率を測定したところ、下記表1に示される結果が得られた。
【0113】
【表1】

【0114】表1から示されるように、本発明のポリイミドフィルムは屈折率差が1.0%を超え、光導波路を始めとする様々な光学材料の実用に十分耐え得ると考察される。
【0115】
【発明の効果】本発明は、塩素原子及びフッ素原子を含み、かつ上記式(1)で示される繰り返し単位からなる、新規なポリアミド酸;塩素原子及びフッ素原子を含み、かつ上記式(2)で示される繰り返し単位からなる、新規なポリイミド;これらの製造方法;およびこのポリイミドからなる光学材料を提供するものである。このポリイミドは、通信波長全域における高い光透過性と耐熱性を同時に満足できるものであり、また、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れるため、プリント基板、LSI用層間絶縁膜、半導体部品用封止材料、光学部品、光電子集積回路(OEIC)、光電子混載実装配線板における光導波路など、様々な光学材料に有用であることが期待される。
【図面の簡単な説明】
【図1】は、実施例1で得られたポリアミド酸のIRスペクトルのチャートを示すグラフである。
【図2】は、実施例2で得られたポリイミドのIRスペクトルのチャートを示すグラフである。
【0001】
【発明の属する技術分野】本発明は、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れるポリイミド、その前駆体として有用なポリアミド酸およびこのポリイミドを用いてなる光学材料に関するものである。
【0002】
【従来の技術】情報化社会における基幹産業としてエレクトロニクス産業が現在興隆を極めているが、このエレクトロニクス技術の進展に果たした高分子材料の役割は非常に大きく、絶縁用および微細加工用高分子なくしては、今日のエレクトロニクス時代はないといえるほどである。このように電気を流さないことを主たる特徴として、エレクトロニクス時代の産業・技術の進展を支えてきた高分子材料は、その分子及び集合体構造に適切な条件が整えば、強誘電性、電子やイオンの高導電性、超伝導性、さらに強磁性など、従来金属や半導体、さらには無機材料の特徴とされた諸機能を発現できることが分かり、近年、電子機能材料としての高分子の研究領域が非常に広がった。その結果、近年では、トランジスタ、サイリスタ、IC等の層間絶縁膜やパッシベーション材、シリコーン樹脂に代表されるジャンクションコート材、モールドストレスを緩和するチッピコート用バッファ材、メモリー素子のソフトエラー対策としてのα線シールド材、ダイボンディング材、レジスト材、半導体封止材料、ハイブリッドICの防湿コート材、TAB(TapeAutomated Bonding)用チップキャリヤーテープ、多層回路基板など、様々な用途に使用されている。
【0003】このように様々な用途に使用される高分子材料のうち、その優れた機能や耐熱性などの観点から、ポリイミドに注目が集まり、その研究・開発が現在盛んに行なわれ、現在、上述したような用途への応用が盛んに試みられている。例えば、特開平5−1148号公報には、炭素−水素結合(C−H結合)の代わりに炭素−フッ素結合(C−F結合)のみを含む繰り返し単位から構成される全フッ素化ポリイミドが開示されている。しかしながら、このポリイミドは、光電子集積回路を作製するに十分な耐熱性があり、近赤外域光、特に光通信波長域(1.0〜1.7μm)における光透過損失の極めて少ないものの、上記材料の組合わせでそれぞれ光導波路もしくは、光ファイバーのコア・クラッドを製造した場合、屈折率差Δn=0.2%程度と、実用に耐えうる屈折率差0.5%以上を提供できなかった。
【0004】上述したように、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れるポリイミドに対する要求は高いものの、いまだ存在しなかった。
【0005】
【発明が解決しようとする課題】したがって、本発明は、上記事情を鑑みてなされたものであり、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れ、概存の全フッ素化ポリイミドに対して屈折率差Δnが0.5%を超えるポリイミド、およびその原料として有用なポリアミド酸を提供することを目的とする。
【0006】本発明の他の目的は、上記ポリイミドを用いてなる光学材料を提供することである。
【0007】
【課題を解決するための手段】本発明者らは、上記諸目的を達成すべく鋭意検討を行った結果、炭素−フッ素結合(C−F結合)および/または炭素−塩素結合(C−Cl結合)からなりかつ特定の繰り返し単位からなるるポリイミドが耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れることを見出し、この知見に基づいて、本発明を完成するに至った。
【0008】すなわち、上記諸目的は、下記(1)〜(7)によって達成される。
【0009】(1) 塩素原子及びフッ素原子を含み、かつ下記式(1):
【0010】
【化5】

【0011】ただし、X及びX’は、それぞれ独立して、2価の有機基を表わし;Y及びY’は、それぞれ独立して、塩素、臭素またはヨウ素原子を表わし;p及びp’は、それぞれ独立して、相当するベンゼン環へのフッ素原子(式(1)中のF)の結合数を表わし、0〜3の整数であり;q及びq’は、それぞれ独立して、0〜3の整数であり;およびp+qは3であり、p’+q’は3である、で示される繰り返し単位からなる、ポリアミド酸。
【0012】(2) 下記式(3)および/または(3’):
【0013】
【化6】

【0014】ただし、X及びX’は、それぞれ独立して、2価の有機基を表わす、で示される繰り返し単位を有する、前記(1)に記載のポリアミド酸。
【0015】(3) 塩素原子及びフッ素原子を含み、かつ下記式(2):
【0016】
【化7】

【0017】ただし、X及びX’は、それぞれ独立して、2価の有機基を表わし;Y及びY’は、それぞれ独立して、塩素、臭素またはヨウ素原子を表わし;p及びp’は、それぞれ独立して、相当するベンゼン環へのフッ素原子(式(2)中のF)の結合数を表わし、0〜3の整数であり;q及びq’は、それぞれ独立して、0〜3の整数であり;およびp+qは3であり、p’+q’は3である、で示される繰り返し単位からなる、ポリイミド。
【0018】(4) 下記式(4)および/または(4’):
【0019】
【化8】

【0020】X及びX’は、それぞれ独立して、2価の有機基を表わす、で示される繰り返し単位を有する、前記(3)に記載のポリイミド。
【0021】(5) 有機溶媒中で、下記式(5):
【0022】
【化9】

【0023】ただし、X’は、2価の有機基を表わす、で示されるジアミン化合物を、下記式(7):
【0024】
【化10】

【0025】ただし、Xは、2価の有機基を表わし;Y及びY’は、それぞれ独立して、塩素、臭素またはヨウ素原子を表わし;p及びp’は、それぞれ独立して、相当するベンゼン環へのフッ素原子(式(7)中のF)の結合数を表わし、0〜3の整数であり;q及びq’は、それぞれ独立して、0〜3の整数であり;およびp+qは3であり、p’+q’は3である、で示されるテトラカルボン酸、その酸無水物もしくは酸塩化物、またはそのエステル化物と反応させることからなる、前記(1)に記載のポリアミド酸の製造方法。
【0026】(6) 前記(1)または(2)に記載のポリアミド酸を加熱閉環することからなる、前記(3)に記載のポリイミドの製造方法。
【0027】(7) 前記(3)または(4)に記載のポリイミドを含む光学材料。
【0028】
【発明の実施の形態】以下、本発明を詳細に説明する。
【0029】第一の態様によると、本発明は、塩素原子及びフッ素原子を含み、かつ前記式(1)、好ましくは式(3)および/または(3’)で示される繰り返し単位からなるポリアミド酸に関するものである。このように炭素−フッ素結合(C−F結合)および/または炭素−塩素結合(C−Cl結合)からなりかつ特定の繰り返し単位からなるポリアミド酸は、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れるポリイミドの原料として有用である。
【0030】本発明において、ポリアミド酸は、塩素原子及びフッ素原子を含むことを必須とする。この際、ポリアミド酸中に存在する塩素原子の含量は、特に制限されず、製造のし易さ及び所望の特性(例えば、溶解性、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性)を考慮して適宜選択されるが、ポリアミド酸の全質量に対して、60質量%以下の含量の塩素原子を含むことが好ましい。塩素原子の含量が60質量%を超えると、ポリアミド酸の溶解性が低下し、ポリアミド酸を製造するのが困難になる場合がある。なお、本発明のポリアミド酸は塩素原子を含むことを必須要件とするため、ポリアミド酸の塩素原子の含量の下限は、0質量%となることはない。これから形成されるポリイミドの誘電率、屈折率、耐熱性及び耐吸湿性などを考慮すると、ポリアミド酸中に存在する塩素原子の含量は、ポリアミド酸の全質量に対して、より好ましくは4〜55質量%、特に好ましくは4〜30質量%である。
【0031】また、本発明において、ポリアミド酸は、前記式(1)で示される繰り返し単位を有するものであることを必須要件とする。このような特定の繰り返し単位からなることによって、これから形成されるポリイミドの所望の屈折率(即ち、既存の全フッ素化ポリイミドに対する屈折率差Δn)が達成できるからである。また、本発明のポリアミド酸は、近赤外域光、特に光通信波長域(1.0〜1.7μm)における光透過損失を考慮すると、炭素−水素結合(C−H結合)が存在しないことが好ましい。
【0032】上記式(1)において、X及びX’は、2価の有機基を表わす。この際、X及びX’は、同一であってもまたは異なるものであってもよい。また、2価の有機基としては、環状アルキル、鎖状アルキル、オレフィン、グリコールなど由来の、2価の脂肪族有機基;ベンゼンビフェニル、ビフェニルエーテル、ビスフェニルベンゼン、ビスフェノキシベンゼンなど由来の、2価の芳香族有機基;ならびにこれらの含ハロゲン脂肪族および芳香族有機基などが挙げられる。これらのうち、2価の芳香族有機基、より好ましくは2価の含ハロゲン芳香族有機基、最も好ましくは2価の全ハロゲン化芳香族有機基が、上記(1)における「X」及び「X’」として好ましい。なお、本明細書において、「全ハロゲン化芳香族有機基」とは、その基中に存在するすべての炭素−水素結合(C−H結合)が炭素−ハロゲン結合(例えば、炭素−フッ素結合(C−F結合)や炭素−塩素結合(C−Cl結合))に置換された基を意味する。これにより、これから形成されるポリイミドの所望の屈折率(即ち、既存の全フッ素化ポリイミドに対する屈折率差Δn)及び光通信波長域(1.0〜1.7μm)における光透過損失が達成できる。また、このような2価の全ハロゲン化芳香族有機基の例としては、ベンゼンビフェニル、ビフェニルエーテル、ビスフェニルベンゼン、ビスフェノキシベンゼンなど由来の、2価の全ハロゲン化芳香族有機基などが挙げられる。
【0033】これらのうち、上記(1)における「X」として好ましい2価の有機基の例としては、結合子または下記式:
【0034】
【化11】

【0035】で示される2価の基である。これらのうち、Xは、結合子または下記式:
【0036】
【化12】

【0037】で示される2価の基であることがより好ましい。
【0038】上記「X」を表わす式において、Z及びZ’は、ハロゲン原子、即ち、フッ素、塩素、臭素またはヨウ素原子を表わし、好ましくはフッ素または塩素原子、最も好ましくは塩素原子を表わす。上記「X」を表わす式において、Z及びZ’双方が存在する際には、Z及びZ’は、同一であってもまたは異なるものであってもよく、また、各ベンゼン環中に複数個存在するZ及びZ’は、それぞれ、各ベンゼン環中で同一であってもまたは異なるものであってもよい。
【0039】すなわち、上記(1)における「X」としては、結合子または下記式のいずれかで示される2価の有機基であることがより好ましい。
【0040】
【化13】

【0041】また、上記「X」のうち、下記いずれかの式:
【0042】
【化14】

【0043】で示される2価の有機基、特に、下記式:
【0044】
【化15】

【0045】で示される2価の有機基が好ましい。
【0046】また、上記(1)における「X’」として好ましい2価の有機基の例としては、下記式:
【0047】
【化16】

【0048】で示される基が挙げられる。この際、Z”は、塩素、臭素またはヨウ素原子を表わし、好ましくは塩素または臭素原子、最も好ましくは塩素原子を表わす。また、aは、ベンゼン環へのフッ素原子の結合数を表わし、0〜4の整数であり、好ましくは0、3または4である。bは、ベンゼン環へのZ”の結合数を表わし、0〜4の整数であり、0、1または4である。なお、上記式において、Z”がベンゼン環中で複数個存在する(即ち、bが2〜4の整数である)場合には、Z”は、それぞれ、ベンゼン環中で同一であってもあるいは異なるものであってもよい。なお、上記式において、a及びbの合計は必ず4であり(即ち、a+b=4)。これは、最終産物であるポリイミドの光通信波長域における低光損失を考慮すると、ポリアミド酸中にC−H結合が存在しないことが好ましいからである。よって、上記(1)における「X’」としては、下記式:
【0049】
【化17】

【0050】で示される2価の基であることが最も好ましい。
【0051】上記式(1)において、Y及びY’は、塩素、臭素またはヨウ素原子を表わし、好ましくは塩素または臭素原子、最も好ましくは塩素原子を表わす。この際、Y及びY’は、同一であってもまたは異なるものであってもよい。また、上記式(1)において、p及びp’は、それぞれ、相当するベンゼン環へのフッ素原子の結合数を表わし、0〜3の整数であり、好ましくは0または3である。この際、p及びp’は、同一であってもまたは異なるものであってもよい。さらに、上記式(1)において、q及びq’は、それぞれ、相当するベンゼン環へのY及びY’の結合数を表わし、0〜3の整数であり、好ましくは0または3である。この際、q及びq’は、同一であってもまたは異なるものであってもよい。なお、上記式において、Y及びY’がベンゼン環中で複数個存在する(即ち、q及びq’が2〜3の整数である)場合には、Y及びY’は、それぞれ、ベンゼン環中で同一であってもあるいは異なるものであってもよい。なお、上記式(1)において、p及びqの合計は必ず3であり(即ち、p+q=3)、p’及びq’の合計は必ず3である(即ち、p’+q’=3)。これは、最終産物であるポリイミドの光通信波長域における低光損失を考慮すると、ポリアミド酸中にC−H結合が存在しないことが好ましいからである。
【0052】すなわち、本発明のポリアミド酸の好ましい例としては、前記式(3)および/または(3’)で示される繰り返し単位を有するポリアミド酸、より好ましくは、式(3)および/または(3’)において、X及びX’は上記好ましい2価の有機基を表わすポリアミド酸であり、特に、下記いずれかの式:
【0053】
【化18】

【0054】で示される繰り返し単位を有するポリアミド酸が好ましい。
【0055】なお、本発明のポリアミド酸の製造方法については以下に詳述するが、この記載から、本発明のポリアミド酸の末端は、ジアミン化合物及びテトラカルボン酸誘導体の添加量(モル比)によって異なるが、アミン末端または酸誘導体末端のいずれかであると考えられる。また、本発明のポリアミド酸は、同一の繰り返し単位からなるものであってもまたは異なる繰り返し単位からなるものであってもよく、後者の場合には、その繰り返し単位はブロック状であってもまたはランダム状であってもよい。
【0056】本発明において、ポリアミド酸は、少なくとも一個の塩素原子が存在する限り、全フッ素化型の繰り返し単位[例えば、X及びX’が水素原子(C−H結合)がすべてフッ素原子(C−F結合)に置換された全フッ素化型の2価の有機基を表わし、p及びp’が3である、式(1)の繰り返し単位]を含むものであってもよい。このように、全フッ素化型の繰り返し単位を一部に含む共重合体の形態を有するポリアミド酸は、有機溶剤に対する溶解性、耐熱性及び耐吸湿性の点から、本発明において好ましい。この際、これらの繰り返し単位(全フッ素化型の繰り返し単位及び非全フッ素化型の繰り返し単位)は、ブロック状であってもまたはランダム状であってもよい。
【0057】本発明のポリアミド酸は、公知の技術の組み合わせによって製造でき、その製造方法は、特に制限されるものではない。一般的には、有機溶媒中で、前記式(5)で示されるジアミン化合物を、前記式(7)で示されるテトラカルボン酸、その酸無水物もしくは酸塩化物、またはそのエステル化物等と反応させる方法が好ましく使用される。したがって、第二の態様によると、本発明は、有機溶媒中で、上記式(5)で示されるジアミン化合物(本明細書中では、単に「ジアミン化合物」とも称する)を、上記式(7)で示されるテトラカルボン酸、その酸無水物もしくは酸塩化物、またはそのエステル化物(本明細書中では、一括して、「テトラカルボン酸誘導体」とも称する)と反応させることからなる本発明の第一の態様のポリアミド酸の製造方法を提供するものである。なお、上記式(5)における「X”」、ならびに上記式(7)における「X」、「Y」、「Y’」、「p」、「q」、「p’」及び「q’」は、上記式(1)における定義と同様であるため、ここでの説明を省略する。
【0058】本発明の第二の態様の方法の好ましい一実施態様として、例えば、上記式(1)において、X’が下記式:
【0059】
【化19】

【0060】で示される2価の基である、上記式(1)のポリアミド酸である場合について、以下に説明する。すなわち、有機溶媒中で、下記式(6):
【0061】
【化20】

【0062】で示される1,3−ジアミノベンゼン誘導体(本明細書中では、単に「1,3−ジアミノベンゼン誘導体」とも称する)を、上記式(7)のテトラカルボン酸誘導体と反応させる方法によって、所望のポリアミド酸が製造できる。なお、下記実施態様は本発明の好ましい例である1,3−ジアミノベンゼン誘導体を原料として使用して説明したものであり、本発明の第二の態様の方法は、1,3−ジアミノベンゼン誘導体の代わりに、適切に選択されたジアミン化合物を使用する以外は、下記実施態様と同様にして、適用できる。また、上記式(6)における「Z”」、「a」及び「b」は、「X’」の好ましい例における定義と同様であるため、ここでの説明を省略する。
【0063】本発明において、1,3−ジアミノベンゼン誘導体は、上記式(6)で示されかつハロゲン化テトラカルボン酸誘導体と反応して所望のポリアミド酸が製造できるような構造を有するものであれば、特に制限されるものではない。したがって、本発明の好ましいポリアミド酸の構造から、1,3−ジアミノ−2,4,5,6−テトラフルオロベンゼン、5−クロロ−1,3−ジアミノ−2,4,6−トリフルオロベンゼン、2,4,5,6−テトラクロロ−1,3−ジアミノベンゼン、4,5,6−トリクロロ−1,3−ジアミノ−2―フルオロベンゼン、5−ブロモ−1,3−ジアミノ−2,4,6−トリフルオロベンゼン、2,4,5,6−テトラブロモ−1,3−ジアミノベンゼンが好ましく、1,3−ジアミノ−2,4,5,6−テトラフルオロベンゼン及び5−クロロ−1,3−ジアミノ−2,4,6−トリフルオロベンゼンが特に好ましい。なお、これらの1,3−ジアミノベンゼン誘導体は、単独で使用されてもあるいは2種以上の混合物の形態で使用されてもよい。
【0064】本発明において、1,3−ジアミノベンゼン誘導体の添加量は、ハロゲン化テトラカルボン酸誘導体と効率よく反応できる量であればよく、特に制限されない。具体的には、1,3−ジアミノベンゼン誘導体の添加量は、化学量論的には、ハロゲン化テトラカルボン酸誘導体と等モルであるが、好ましくは、ハロゲン化テトラカルボン酸誘導体の全モル数を1モルとしたのに対して、0.8〜1.2モル、より好ましくは0.9〜1.1モルである。この際、1,3−ジアミノベンゼン誘導体の添加量が0.8モル未満であると、ハロゲン化テトラカルボン酸誘導体が多量に残存してしまい精製工程が複雑になる恐れがあり、また、重合度が大きくならない場合があり、逆に1.2モルを超えると、1,3−ジアミノベンゼン誘導体が多量に残存してしまい精製工程が複雑になる恐れがあり、また、重合度が大きくならない場合がある。
【0065】本発明において、ハロゲン化テトラカルボン酸誘導体は、上記式(7)で示されるハロゲン化テトラカルボン酸、その酸無水物もしくは酸塩化物、またはそのエステル化物である。具体的には、ヘキサフルオロ−3,3’,4,4’−ビフェニルテトラカルボン酸、ヘキサクロロ−3,3’,4,4’−ビフェニルテトラカルボン酸、ビス(3,4−ジカルボキシトリフルオロフェニル)スルフィド、ビス(3,4−ジカルボキシトリクロロフェニル)スルフィド、1,4−ビス(3,4−ジカルボキシトリフルオロフェノキシ)テトラフルオロベンゼン、1,4−ビス(3,4−ジカルボキシトリクロロフェノキシ)テトラフルオロベンゼン、1,4−ビス(3,4−ジカルボキシトリフルオロフェノキシ)テトラクロロベンゼン、1,4−ビス(3,4−ジカルボキシトリクロロフェノキシ)テトラクロロベンゼン、3,6−ジフルオロピロメリット酸、3,6−ジクロロピロメリット酸、3−クロロ−6−フルオロピロメリット酸等の、上記式(7)のハロゲン化テトラカルボン酸;対応する酸二無水物;対応する酸塩化物;メチルエステル、エチルエステル等の対応するエステル化物などが挙げられる。これらのうち、ヘキサフルオロ−3,3’,4,4’−ビフェニルテトラカルボン酸、1,4−ビス(3,4−ジカルボキシトリフルオロフェノキシ)テトラフルオロベンゼン、1,4−ビス(3,4−ジカルボキシトリフルオロフェノキシ)テトラクロロベンゼン、ならびにこれらの対応する酸二無水物及び酸塩化物が好ましく、1,4−ビス(3,4−ジカルボキシトリフルオロフェノキシ)テトラフルオロベンゼン、1,4−ビス(3,4−ジカルボキシトリフルオロフェノキシ)テトラクロロベンゼン、ならびにこれらの酸二無水物及び酸塩化物が特に好ましい。なお、これらのハロゲン化テトラカルボン酸誘導体は、単独で使用されてもあるいは2種以上の混合物の形態で使用されてもよい。
【0066】本発明で使用される上記式(7)で示されるハロゲン化テトラカルボン酸は、特に制限されるものではなく、特開平11−147955号公報に記載の方法など、公知の技術またはその組み合わせによって製造できる。
【0067】本発明で使用される有機溶媒は、1,3−ジアミノベンゼン誘導体及びハロゲン化テトラカルボン酸誘導体との反応が効率よく進行でき、かつこれらの原料に対して不活性であれば、特に制限されるものではない。例えば、N−メチル−2−ピロリジノン、N,N−ジメチルアセトアミド、N,N−ジメチルホルムアミド、ジメチルスルホキシド、スルホラン、メチルイソブチルケトン、アセトニトリル、ベンゾニトリルなどの極性有機溶媒が挙げられる。なお、これらの有機溶媒は、単独で使用されてもあるいは2種以上の混合物の形態で使用されてもよい。また、有機溶媒の量は、1,3−ジアミノベンゼン誘導体及びハロゲン化テトラカルボン酸誘導体との反応が効率よく進行できる量であれば特に制限されないが、有機溶媒中の1,3−ジアミノベンゼン誘導体の濃度が1〜80質量%、より好ましくは5〜50質量%となるような量であることが好ましい。
【0068】本発明において、1,3−ジアミノベンゼン誘導体及びハロゲン化テトラカルボン酸誘導体との反応条件は、これらの反応が十分進行できる条件であれば特に制限されるものではない。例えば、反応温度は、好ましくは0〜100℃、より好ましくは20〜50℃である。また、反応時間は、通常、1〜72時間、好ましくは2〜48時間である。また、反応は、加圧下、常圧下または減圧下のいずれの圧力下で行なってもよいが、好ましくは常圧下で行われる。また、1,3−ジアミノベンゼン誘導体及びハロゲン化テトラカルボン酸誘導体との反応は、反応効率及び重合度などを考慮すると、乾燥した不活性ガス雰囲気下で行なわれることが好ましく、この際の反応雰囲気における相対湿度は、好ましくは10%以下、より好ましくは1%以下であり、不活性ガスとしては、窒素、ヘリウム、アルゴンなどが使用できる。
【0069】本発明においては、本発明のポリアミド酸を加熱閉環することによって、新規なポリイミドが調製できる。したがって、第三の態様によると、本発明は、塩素原子及びフッ素原子を含み、かつ上記式(2)、好ましくは式(4)および/または(4’)で示される繰り返し単位からなる、ポリイミドに関するものである。このような炭素−フッ素結合(C−F結合)および/または炭素−塩素結合(C−Cl結合)からなりかつ特定の繰り返し単位からなるポリイミドは、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れるため、プリント基板、LSI用層間絶縁膜、半導体部品用封止材料、光学部品、光電子集積回路(OEIC)、光電子混載実装配線板における光導波路など、様々な光学材料に有用である。
【0070】本発明において、ポリイミドは、塩素原子及びフッ素原子を含むことを必須とする。この際、ポリイミド中に存在する塩素原子の含量は、特に制限されず、製造のし易さ及び所望の特性(例えば、溶解性、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性)を考慮して適宜選択されるが、ポリイミドの全質量に対して、60質量%以下の含量の塩素原子を含むことが好ましい。塩素原子の含量が60質量%を超えると、誘電率及び屈折率が高くなる恐れがあり、また、フッ素原子の含量が塩素原子の含量の増加に伴って低下するため耐熱性が低下する恐れもある。なお、本発明のポリイミドは塩素原子を含むことを必須要件とするため、ポリイミドの塩素原子の含量の下限は、0質量%となることはない。ポリイミドの誘電率、屈折率、耐熱性及び耐吸湿性などを考慮すると、ポリイミド中に存在する塩素原子の含量は、ポリイミドの全質量に対して、より好ましくは4〜55質量%、特に好ましくは4〜30質量%である。
【0071】また、本発明において、ポリイミドは、前記式(2)で示される繰り返し単位を有するものであることを必須要件とする。このような特定の繰り返し単位からなることによって、所望の屈折率(即ち、既存の全フッ素化ポリイミドに対する屈折率差Δn)が達成できるからである。また、本発明のポリイミドは、近赤外域光、特に光通信波長域(1.0〜1.7μm)における光透過損失を考慮すると、炭素−水素結合(C−H結合)が存在しないことが好ましい。このような構造を有するポリイミドは、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れる。なお、上記式(2)における「X」、「X’」、「Y」、「Y’」、「p」、「p’」、「q」及び「q’」は、上記式(1)における定義と同様であるため、ここでの説明を省略する。
【0072】本発明のポリイミドの好ましい例としては、前記式(4)および/または(4’)で示される繰り返し単位を有するポリイミドが挙げられる。上記式(4)および/または(4’)において、「X」及び「X’」は上記第一の態様(上記式(1))における定義と同様である。すなわち、上記(4)における「X」として好ましい2価の有機基の例としては、結合子または下記式:
【0073】
【化21】

【0074】で示される2価の基である。これらのうち、Xは、結合子または下記式:
【0075】
【化22】

【0076】で示される2価の基であることがより好ましい。上記「X」を表わす式において、Z及びZ’は、上記第一の態様における定義と同様であるため、ここでは説明を省略する。
【0077】上記式(4)における「X」のうち、Xは、結合子または下記式のいずれかで示される2価の有機基であることがより好ましい。
【0078】
【化23】

【0079】また、上記「X」のうち、下記いずれかの式:
【0080】
【化24】

【0081】で示される2価の有機基、特に、下記式:
【0082】
【化25】

【0083】で示される2価の有機基が好ましい。
【0084】また、上記式(4)において、X’もまた、上記第一の態様(上記式(1))における定義と同様であり、下記式:
【0085】
【化26】

【0086】で示される2価の有機基であることが好ましい。上記式において、Z”、a及びbもまた、上記第一の態様における定義と同様であるため、ここでは説明を省略する。したがって、上記(4)における「X’」としては、下記式:
【0087】
【化27】

【0088】で示される2価の基であることが最も好ましい。
【0089】本発明のポリイミドは、特に、下記いずれかの式:
【0090】
【化28】

【0091】で示される繰り返し単位を有するポリイミドであることが好ましい。
【0092】なお、本発明のポリイミドは、下記に詳述するように、ポリアミド酸を加熱閉環することによって製造されるが、これから、本発明のポリイミドの末端は、使用されるポリアミド酸の構造によって異なるが、アミン末端または酸誘導体末端であると考えられる。また、本発明のポリイミドは、同一の繰り返し単位からなるものであってもまたは異なる繰り返し単位からなるものであってもよく、後者の場合には、その繰り返し単位はブロック状であってもまたはランダム状であってもよい。
【0093】本発明において、ポリイミドは、少なくとも一個の塩素原子が存在する限り、全フッ素化型の繰り返し単位[例えば、X及びX’が水素原子(C−H結合)がすべてフッ素原子(C−F結合)に置換された全フッ素化型の2価の有機基を表わし、p及びp’が3である、式(2)の繰り返し単位]を含むものであってもよい。このように、全フッ素化型の繰り返し単位を一部に含む共重合体の形態を有するポリイミドは、有機溶剤に対する溶解性、耐熱性及び耐吸湿性の点から、本発明において好ましい。この際、これらの繰り返し単位(全フッ素化型の繰り返し単位及び非全フッ素化型の繰り返し単位)は、ブロック状であってもまたはランダム状であってもよい。
【0094】本発明のポリイミドは、公知の技術の組み合わせによって製造でき、その製造方法は、特に制限されるものではないが、一般的に、本発明のポリアミド酸を加熱閉環することによって製造される。したがって、第四の態様によると、本発明は、本発明の第一の態様のポリアミド酸を加熱閉環することからなる本発明の第三の態様のポリイミドの製造方法を提供するものである。
【0095】本発明の第四の態様において、ポリアミド酸の加熱処理は、溶剤中で行なわれても、あるいは溶剤の不存在下で行なわれてもよいが、反応効率などを考慮すると、溶剤中で行なわれることが好ましい。この際、ポリアミド酸は、上述したポリアミド酸の製造工程により1,3−ジアミノベンゼン誘導体とハロゲン化テトラカルボン酸誘導体との反応で得られた溶液の形態で加熱処理されても、またはこれからポリアミド酸を固体として分離した後、溶剤に再溶解して加熱処理されてもよい。後者の方法において使用できる他の溶剤としては、例えば、N−メチル−2−ピロリジノン、N,N−ジメチルアセトアミド、アセトニトリル、ベンゾニトリル、ニトロベンゼン、ニトロメタン、ジメチルスルフォキシド、アセトン、メチルエチルケトン、イソブチルケトンおよびメタノール等の極性溶剤やトルエンやキシレン等の非極性溶剤などが挙げられる。これらのうち、好ましくは、N−メチル−2−ピロリジノン及びN,N−ジメチルアセトアミドが使用される。また、これらの溶剤は、単独でまたは2種類以上の混合物の形態で使用されてもよい。
【0096】本発明の第三の態様において、ポリアミド酸の加熱処理条件は、特に制限されるものではなく、本発明のポリアミド酸が効率良く閉環されて、所望のポリイミドが製造できる条件であればよい。具体的には、加熱処理は、通常、空気中、好ましくは、窒素、ヘリウム、アルゴンなどによる不活性ガス雰囲気中で、70〜350℃程度で2〜5時間程度、行なわれ、本発明による加熱処理は、段階的に行なわれてもあるいは連続的に行なわれてもよい。好ましい実施態様によれば、ポリアミド酸は、70℃で2時間、160℃で1時間、250℃で30分、及び350℃で1時間、段階的に加熱処理が行なわれる。
【0097】本発明のポリイミドは、耐薬品性、撥水性、誘電特性、電気特性及び光学特性にも優れるものである。また、本発明のポリイミドは、特に分子鎖内に炭素−水素結合(C−H結合)を持たない場合には、近赤外域の吸収スペクトルにおいてC−H結合の伸縮振動の高調波あるいはC−H結合の伸縮信号の高調波と変角振動の結合振動に由来するピークが存在せず、ゆえに光通信波長域(1.0〜1.7μm)の全域にわたって低い光損失が達成できるため、プリント基板、LSI用層間絶縁膜、半導体部品用封止材料、光学部品、光電子集積回路(OEIC)、光電子混載実装配線板における光導波路など、様々な光学材料に有用である。
【0098】したがって、第五の態様によると、本発明は、本発明のポリイミドを含む光学材料を提供するものである。
【0099】第五の態様において、本発明の光学材料は、本発明のポリイミドを含むことを必須とするが、これに加えて、所望の特性、例えば、光透過性、耐熱性、耐薬品性、撥水性、誘電特性、電気特性及び光学特性などの特性をさらに向上することを目的として、他の成分を含んでいてもよい。この際、他の成分としては、例えば、ポリアミド、ポリアミドイミド、エポキシ樹脂、フェノール樹脂、メラミン樹脂、尿素樹脂、ジアリルフタレート樹脂、不飽和ポリエステル樹脂、ウレタン樹脂、付加型ポリイミド樹脂、シリコーン樹脂、ポリパラビニルフェノール樹脂、ポリフェニレンスルフィド、ポリエーテル、ポリエーテルエーテルケトン、ポリプロピレン及びポリアゾメチン;ポリテトラフルオロエチレン(PTFE)、テトラフルオロエチレン−ヘキサフルオロプロピレン共重合体(FEP)、エチレン−テトラフルオロエチレン共重合体(ETFE)、テトラフルオロエチレン−パーフルオロアルキルビニルエーテル共重合体(PFA)及びポリクロロトリフルオロエチレン(PCTFE)等のフッ素樹脂;炭酸カルシウム、シリカ、アルミナ、チタニア、水酸化アルミニウム、ケイ酸アルミニウム、ケイ酸ジルコニウム、ジルコン、ガラス、タルク、マイカ、黒鉛、アルミニウム、銅及び鉄等の粉末や短繊維状の無機充填材;脂肪酸やワックス類等の離型剤;エポキシシラン、ビニルシラン、ボラン系化合物及びアルキルチタネート系化合物等のカップリング剤;アンチモンやリンの化合物およびハロゲン含有化合物等の難燃剤;ならびに分散剤や溶剤等の各種添加剤が挙げられる。
【0100】本発明の光学材料の適用方法は、本発明のポリイミドを使用する以外は、従来と同様にして使用できる。例えば、本発明の光学材料をプリント基板に使用する場合には、基板上に、ポリアミド酸溶液を、キャスティング(流延法)、スピンコーティング(回転塗布法)、ロールコーティング、スプレイコーティング、バーコーティング、フレキソ印刷、およびディップコーティングなどの公知の方法によって、塗布した後、窒素、ヘリウム、アルゴンなどの、不活性ガス雰囲気中で、70〜350℃で、2〜5時間、加熱することによって、基板上にポリイミドフィルムを形成することができる。上記方法において、ポリアミド酸溶液は、上述したポリアミド酸の製造工程において1,3−ジアミノベンゼン誘導体とハロゲン化テトラカルボン酸誘導体との反応で得られた溶液の形態をそのまま使用しても、あるいはこれからポリアミド酸を分離した後、他の溶媒に溶解して使用してもよい。後者の方法において使用できる他の溶媒としては、例えば、N−メチル−2−ピロリジノン、N,N−ジメチルアセトアミド、アセトニトリル、ベンゾニトリル、ニトロベンゼン、ニトロメタン、ジメチルスルフォキシド、アセトン、メチルエチルケトン、イソブチルケトンおよびメタノール等の極性溶媒やトルエンやキシレン等の非極性溶媒などが挙げられる。これらのうち好ましくは、N−メチル−2−ピロリジノン及びN,N−ジメチルアセトアミドが使用される。また、これらの溶媒は、単独でまたは2種類以上の混合物の形態で使用されてよい。なお、上記方法において、フィルムの厚みなどは、その用途に応じて適宜選択されればよく、公知の値を同様にして使用できる。
【0101】
【実施例】以下、本発明の実施例により具体的に説明する。
【0102】実施例150ml容の三ツ口フラスコに、1,3−ジアミノ−2,4,5,6−テトラフルオロベンゼン 1.88g(10ミリモル)、下記式:
【0103】
【化29】

【0104】で示される4,4’−[(2,3,5,6−テトラフルオロ−1,4−フェニレン)ビス(オキシ)]ビス(3,5,6−トリフルオロフタル酸無水物) 1.21g(2ミリモル)、下記式:
【0105】
【化30】

【0106】で示される4,4’−[(2,3,5,6−テトラクロロ−1,4−フェニレン)ビス(オキシ)]ビス(3,5,6−トリフルオロフタル酸無水物) 5.41g(8ミリモル)、及びN,N−ジメチルアセトアミド、 11.5gを仕込んだ。この混合液を、窒素雰囲気中で、室温で、2日間、攪拌することによって、ポリアミド酸溶液を得た。
【0107】このようにして得られたポリアミド酸について、IRスペクトルで分析したところ、図1に示される結果が得られた。
【0108】参考例1実施例1において、酸無水物として4,4’−[(2,3,5,6−テトラフルオロ−1,4−フェニレン)ビス(オキシ)]ビス(3,5,6−トリフルオロフタル酸無水物)6.05g(10ミリモル)のみを使用する以外は、実施例1に記載の操作を繰り返すことによって、参考ポリアミド酸溶液を得た。
【0109】実施例2実施例1及び参考例1で得られたポリアミド酸溶液及び参考ポリアミド酸溶液を、それぞれ、直径4インチの大きさのシリコン基板上に、フィルムの膜の厚さが8μmとなるように、スピンコーティングし、窒素雰囲気中で、70℃で2時間、160℃で1時間、250℃で30分、及び350℃で1時間、加熱することによって、シリコン基板上にポリイミドフィルム及び参考ポリイミドフィルムを形成した。
【0110】このようにして得られたポリイミドフィルムについて、IRスペクトルで分析したところ、図2に示される結果が得られた。
【0111】また、このようにして得られたポリイミドフィルムの光通信波長域(0.8〜1.7μm)での光の吸収を測定したところ、当該波長域での光透過損失が極めて少ないことを確認した。
【0112】さらに、このようにして得られたポリイミドフィルム及び参考ポリイミドフィルムについて、633及び1300nmでの屈折率を測定したところ、下記表1に示される結果が得られた。
【0113】
【表1】

【0114】表1から示されるように、本発明のポリイミドフィルムは屈折率差が1.0%を超え、光導波路を始めとする様々な光学材料の実用に十分耐え得ると考察される。
【0115】
【発明の効果】本発明は、塩素原子及びフッ素原子を含み、かつ上記式(1)で示される繰り返し単位からなる、新規なポリアミド酸;塩素原子及びフッ素原子を含み、かつ上記式(2)で示される繰り返し単位からなる、新規なポリイミド;これらの製造方法;およびこのポリイミドからなる光学材料を提供するものである。このポリイミドは、通信波長全域における高い光透過性と耐熱性を同時に満足できるものであり、また、耐薬品性、撥水性、誘電特性、電気特性及び光学特性に優れるため、プリント基板、LSI用層間絶縁膜、半導体部品用封止材料、光学部品、光電子集積回路(OEIC)、光電子混載実装配線板における光導波路など、様々な光学材料に有用であることが期待される。
【図面の簡単な説明】
【図1】は、実施例1で得られたポリアミド酸のIRスペクトルのチャートを示すグラフである。
【図2】は、実施例2で得られたポリイミドのIRスペクトルのチャートを示すグラフである。
【特許請求の範囲】
【請求項1】 塩素原子及びフッ素原子を含み、かつ下記式(1):
【化1】

ただし、X及びX’は、それぞれ独立して、2価の有機基を表わし;Y及びY’は、それぞれ独立して、塩素、臭素またはヨウ素原子を表わし;p及びp’は、それぞれ独立して、相当するベンゼン環へのフッ素原子(式(1)中のF)の結合数を表わし、0〜3の整数であり;q及びq’は、それぞれ独立して、0〜3の整数であり;およびp+qは3であり、p’+q’は3である、で示される繰り返し単位からなる、ポリアミド酸。
【請求項2】 塩素原子及びフッ素原子を含み、かつ下記式(2):
【化2】

ただし、X及びX’は、それぞれ独立して、2価の有機基を表わし;Y及びY’は、それぞれ独立して、塩素、臭素またはヨウ素原子を表わし;p及びp’は、それぞれ独立して、相当するベンゼン環へのフッ素原子(式(2)中のF)の結合数を表わし、0〜3の整数であり;q及びq’は、それぞれ独立して、0〜3の整数であり;およびp+qは3であり、p’+q’は3である、で示される繰り返し単位からなる、ポリイミド。
【請求項3】 有機溶媒中で、下記式(5):
【化3】

ただし、X’は、2価の有機基を表わす、で示されるジアミン化合物を、下記式(7):
【化4】

ただし、Xは、2価の有機基を表わし;Y及びY’は、それぞれ独立して、塩素、臭素またはヨウ素原子を表わし;p及びp’は、それぞれ独立して、相当するベンゼン環へのフッ素原子(式(7)中のF)の結合数を表わし、0〜3の整数であり;q及びq’は、それぞれ独立して、0〜3の整数であり;およびp+qは3であり、p’+q’は3である、で示されるテトラカルボン酸、その酸無水物もしくは酸塩化物、またはそのエステル化物と反応させることからなる、請求項1に記載のポリアミド酸の製造方法。
【請求項4】 請求項1に記載のポリアミド酸を加熱閉環することからなる、請求項2に記載のポリイミドの製造方法。
【請求項5】 請求項2に記載のポリイミドを含む光学材料。
【請求項1】 塩素原子及びフッ素原子を含み、かつ下記式(1):
【化1】

ただし、X及びX’は、それぞれ独立して、2価の有機基を表わし;Y及びY’は、それぞれ独立して、塩素、臭素またはヨウ素原子を表わし;p及びp’は、それぞれ独立して、相当するベンゼン環へのフッ素原子(式(1)中のF)の結合数を表わし、0〜3の整数であり;q及びq’は、それぞれ独立して、0〜3の整数であり;およびp+qは3であり、p’+q’は3である、で示される繰り返し単位からなる、ポリアミド酸。
【請求項2】 塩素原子及びフッ素原子を含み、かつ下記式(2):
【化2】

ただし、X及びX’は、それぞれ独立して、2価の有機基を表わし;Y及びY’は、それぞれ独立して、塩素、臭素またはヨウ素原子を表わし;p及びp’は、それぞれ独立して、相当するベンゼン環へのフッ素原子(式(2)中のF)の結合数を表わし、0〜3の整数であり;q及びq’は、それぞれ独立して、0〜3の整数であり;およびp+qは3であり、p’+q’は3である、で示される繰り返し単位からなる、ポリイミド。
【請求項3】 有機溶媒中で、下記式(5):
【化3】

ただし、X’は、2価の有機基を表わす、で示されるジアミン化合物を、下記式(7):
【化4】

ただし、Xは、2価の有機基を表わし;Y及びY’は、それぞれ独立して、塩素、臭素またはヨウ素原子を表わし;p及びp’は、それぞれ独立して、相当するベンゼン環へのフッ素原子(式(7)中のF)の結合数を表わし、0〜3の整数であり;q及びq’は、それぞれ独立して、0〜3の整数であり;およびp+qは3であり、p’+q’は3である、で示されるテトラカルボン酸、その酸無水物もしくは酸塩化物、またはそのエステル化物と反応させることからなる、請求項1に記載のポリアミド酸の製造方法。
【請求項4】 請求項1に記載のポリアミド酸を加熱閉環することからなる、請求項2に記載のポリイミドの製造方法。
【請求項5】 請求項2に記載のポリイミドを含む光学材料。
【図1】


【図2】




【図2】


【公開番号】特開2003−26800(P2003−26800A)
【公開日】平成15年1月29日(2003.1.29)
【国際特許分類】
【出願番号】特願2001−213744(P2001−213744)
【出願日】平成13年7月13日(2001.7.13)
【出願人】(000102739)エヌ・ティ・ティ・アドバンステクノロジ株式会社 (265)
【出願人】(000004628)株式会社日本触媒 (2,292)
【Fターム(参考)】
【公開日】平成15年1月29日(2003.1.29)
【国際特許分類】
【出願日】平成13年7月13日(2001.7.13)
【出願人】(000102739)エヌ・ティ・ティ・アドバンステクノロジ株式会社 (265)
【出願人】(000004628)株式会社日本触媒 (2,292)
【Fターム(参考)】
[ Back to top ]

