ポリウレア電解質及びその製造方法
【課題】燃料電池用電解質膜として好適な機械的強度と耐酸性に優れたポリウレア電解質を提供することにある。
【解決手段】 本発明のポリウレア電解質は、2以上のイソシアネート基を有する第一化合物と、2以上のアミノ基を有する第二化合物とを重合させることにより形成されるポリウレア樹脂を含有する。そして、第一化合物又は第二化合物が10以上の炭素連鎖を含み、かつ、第一化合物又は第二化合物がスルホン酸基又はカルボン酸基を含むことを特徴とする。さらに、前記ポリウレア電解質の製造方法は、第一化合物又は第二化合物におけるスルホン酸基又はカルボン酸基を中和剤により中和する工程と、中和工程後に、第一化合物及び第二化合物を重合する工程と、重合工程後に、第一化合物及び第二化合物の重合体から前記中和剤を除去する工程と、を有することを特徴とする。
【解決手段】 本発明のポリウレア電解質は、2以上のイソシアネート基を有する第一化合物と、2以上のアミノ基を有する第二化合物とを重合させることにより形成されるポリウレア樹脂を含有する。そして、第一化合物又は第二化合物が10以上の炭素連鎖を含み、かつ、第一化合物又は第二化合物がスルホン酸基又はカルボン酸基を含むことを特徴とする。さらに、前記ポリウレア電解質の製造方法は、第一化合物又は第二化合物におけるスルホン酸基又はカルボン酸基を中和剤により中和する工程と、中和工程後に、第一化合物及び第二化合物を重合する工程と、重合工程後に、第一化合物及び第二化合物の重合体から前記中和剤を除去する工程と、を有することを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、燃料電池用電解質膜として好適な機械的強度や耐酸性等を有するポリウレア電解質及びその製造方法に関する。
【背景技術】
【0002】
最近の地球環境問題の観点から、クリーンエネルギの開発及び普及が世界的に大きな課題となっている。そしてクリーンエネルギの中でも低公害及び高効率という観点から、燃料電池が注目されている。燃料電池とは、水素やメタノール等の燃料を酸素又は空気を用いて電気化学的に酸化することにより、燃料の化学エネルギを電気エネルギに変換して取り出すものである。燃料電池には、電解質の種類によって、アルカリ形、リン酸形、溶融炭酸塩形、固体電解質形及び固体高分子形等、様々なタイプがある。そして、その中でも、低温で稼動でき、取扱いが容易で、かつ出力密度が高い固体高分子形が、自動車や家庭用の電源として期待されている。
【0003】
固体高分子形燃料電池を特に自動車用燃料電池として実用化するためには、更なる小型化及び高出力化が求められている。そのためには、電解質を薄膜化し、燃料電池そのものの容積を小さくすると同時に、燃料電池内の内部抵抗を低減することが必要である。このため、従来のフッ素系電解質膜に加えて、炭化水素系電解質膜の開発が進められている。炭化水素系電解質膜は、上記フッ素系電解質膜と比較すると、原料が安価で製造工程が簡便であり、さらに材料の選択性が高いという利点がある。しかし、これまでに開発されてきた炭化水素系電解質膜は多くが高耐熱性かつ高剛性のスーパーエンジニアリングプラスチックスをベースとするため、剛性は強いが柔軟性に乏しく、靭性が本質的に弱いという問題点がある。さらに、高温条件下でスルホン酸基が脱離する等の問題も知られており、これらの問題点の解決が望まれている。
【0004】
最近では、機械的強度を改善する目的で、側鎖に電離性官能基を備えたポリウレア電解質及びそれを用いた燃料電池が開示されている(例えば、特許文献1及び2参照)。また、ポリウレア樹脂の多孔膜にアクリルアミド系の電解質を充填したプロトン伝導性複合膜も提案されている(例えば、特許文献3参照)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2006−040709号公報
【特許文献2】特開2006−120518号公報
【特許文献3】特開2007−207522号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、上記特許文献1及び2のポリウレア電解質において、側鎖は、ウレア樹脂の合成後にウレア結合部位の活性水素を利用して後から付加されたものである。そのため、活性水素を失うことでウレア結合部位間の凝集力が低下して機械的強度が低下すると共に耐酸性及び耐水性が低下するという問題がある。
【0007】
また、上記特許文献3のプロトン伝導性複合膜では、電解質がポリウレア樹脂の多孔膜の孔部分に偏在する。そのため、膜全体としてはプロトン伝導抵抗が上昇してしまうという問題がある。また、プロトン伝導抵抗を下げるために薄膜化すると、多孔質基材の機械的強度が低下してしまう。加えて、上記プロトン伝導性複合膜では、アクリルアミドが加水分解し、スルホン酸が脱離しやすいという問題もある。
【0008】
本発明は、このような従来技術の有する課題に鑑みてなされたものである。そして、その目的は、機械的強度、耐水性、耐酸性及び耐久性に優れたポリウレア電解質及びその製造方法を提供することにある。
【課題を解決するための手段】
【0009】
本発明のポリウレア電解質は、2以上のイソシアネート基を有する第一化合物と、2以上のアミノ基を有する第二化合物とを重合させることにより形成されるポリウレア樹脂を含有する。そして、第一化合物又は第二化合物が10以上の炭素連鎖を含み、かつ、第一化合物又は第二化合物がスルホン酸基又はカルボン酸基を含む。
【0010】
本発明のポリウレア電解質の製造方法は、第一化合物又は第二化合物におけるスルホン酸基又はカルボン酸基を中和剤により中和する工程と、中和工程後に、第一化合物及び第二化合物を重合する工程と、重合工程後に、第一化合物及び第二化合物の重合体から中和剤を除去する工程と、を有する。
【発明の効果】
【0011】
本発明のポリウレア電解質は、分子内にハードセグメントとなるウレア結合を含んでいるため、機械的強度に優れる。さらに、分子内にソフトセグメントとなる10以上の炭素連鎖からなる構造が含まれるため、柔軟性にも優れる。また、上記ポリウレア電解質における10以上の炭素連鎖が比較的強い疎水性を示し、酸及び水の接近からウレア結合部位を保護することから、耐酸性及び耐水性にも優れる。
【図面の簡単な説明】
【0012】
【図1】図1は、本発明の実施形態に係るポリウレア電解質を電解質膜として使用した固体高分子形燃料電池の単セルを示す概略図である。
【図2】図2は、本発明の実施形態に係る燃料電池を搭載した自動車を示す概略図である。
【発明を実施するための形態】
【0013】
以下、本発明の実施形態に係るポリウレア電解質及びその製造方法について、図面を用いて詳細に説明する。なお、図面の寸法比率は説明の都合上誇張されており、実際の比率とは異なる場合がある。
【0014】
[ポリウレア電解質]
本発明の実施形態に係るポリウレア電解質は、2以上のイソシアネート基(−NCO)を有する第一化合物と、2以上のアミノ基(−NH2)を有する第二化合物とを重合させることにより形成されるポリウレア樹脂を備える。そして、上記第一化合物又は第二化合物が10以上の炭素連鎖を含み、かつ、第一化合物又は第二化合物がスルホン酸基(−SO3H)又はカルボン酸基(−CO2H)を含むことを特徴とする。
【0015】
より詳細に説明すると、化学式1に示すように、2以上のイソシアネート基を有する第一化合物(イソシアネート化合物)と、2以上のアミノ基を有する第二化合物(アミノ化合物)とを重合させることにより、ウレア結合を有するポリウレア樹脂を得ることができる。そして、上記ポリウレア樹脂では、第一化合物における分子鎖R1又は第二化合物における分子鎖R2が10以上の炭素連鎖を含んでいる。さらに、第一化合物における分子鎖R1又は第二化合物における分子鎖R2がスルホン酸基又はカルボン酸基を含んでいる。
【0016】
【化1】

【0017】
上記ポリウレア電解質内の炭素連鎖は主鎖方向に連続する炭素原子を意味し、その数は通常10以上である。本実施形態における炭素原子数は、好ましくは10〜300、より好ましくは10〜130、更により好ましくは12〜100、更により好ましくは12〜80である。炭素連鎖がこの範囲内であることにより、十分な耐水性、耐酸性、柔軟性及びプロトン伝導性を得ることができる。
【0018】
炭素連鎖の構造は特に制限されないが、例えば、高級アルカン、高級アルケン、高級シクロアルカン、高級シクロアルケン及びこれらの二量体や三量体とすることができる。さらに炭素連鎖としては、1,3−ブタジエン、イソプレン、2,3−ジメチル−1,3−ブタジエン及び1,3−ぺンタジエン等の共役ジエン化合物や、エチレン、プロピレン、ブテン等のオレフィン化合物など、ヘテロ元素を含有しない化合物を重合した構造とすることもできる。なお、共役ジエン化合物を用いる場合、必要に応じて不飽和結合への水素添加を行ってもかまわない。
【0019】
炭素連鎖には、本発明の目的を損なわない範囲で側鎖を備えることが可能である。ただ、炭素連鎖による十分な疎水性を確保するため、ヘテロ元素を含有しない側鎖が好ましい。
【0020】
10以上の炭素連鎖を含む第一化合物又は第二化合物の分子量は特に限定されないが、200〜3700、好ましくは200〜1700、より好ましくは200〜1200である。この範囲内であることにより、柔軟性、機械的強度、耐水性、耐酸性、耐久性及びプロトン伝導性に優れた電解質を得ることができる。
【0021】
本実施形態に係る電解質における当量重量は特に限定されないが、2000以下、好ましくは1500以下、より好ましくは1000以下、更に好ましくは800以下、特に好ましくは500以下である。また、上記当量重量は、300以上であることが好ましい。上記当量重量とは、ポリウレア電解質におけるスルホン酸基の当量重量、又はポリウレア電解質におけるカルボン酸基の当量重量を意味する。また、スルホン酸基の当量重量とはスルホン酸基当量当たりの膜重量を意味し、カルボン酸基の当量重量とはカルボン酸基当量当たりのポリウレア電解質の膜重量を意味する。上記当量重量が2000以下であることにより、十分なプロトン伝導性を得ることができる。また300以上であることにより、耐水性、耐酸性、耐久性及び機械的強度が向上し、燃料電池用電解質として好ましく使用することができる。
【0022】
上述のように、本実施形態に係る電解質は、10以上の炭素連鎖と、スルホン酸基又はカルボン酸基とを含んでいることが必要である。そして、第一化合物及び第二化合物の少なくともいずれか一方が10以上の炭素連鎖を含んでいれば良く、両方とも含んでいても良い。つまり、上記化学式1における分子鎖R1及びR2の少なくともいずれか一方が10以上の炭素連鎖を含んでいれば良い。また、第一化合物及び第二化合物の少なくともいずれか一方がスルホン酸基又はカルボン酸基を含んでいれば良く、スルホン酸基及びカルボン酸基の両方を含んでいても良い。つまり、上記化学式1における分子鎖R1及びR2の少なくともいずれか一方がスルホン酸基又はカルボン酸基を含んでいれば良く、スルホン酸基及びカルボン酸基の両方を含んでいても良い。
【0023】
第一化合物又は第二化合物のいずれか一方が10以上の炭素連鎖を有し、かつ、スルホン酸基又はカルボン酸基を含む場合、第一化合物又は第二化合物の他方は10以上の炭素連鎖を有さなくても良く、かつ、スルホン酸基及びカルボン酸基を含まなくても良い。
【0024】
本実施形態の電解質の好ましい例としては、(A)第一化合物が10以上の炭素連鎖を含み、かつ、第二化合物がスルホン酸基又はカルボン酸基を含む場合が挙げられる。また、好ましい例として、(B)第一化合物がスルホン酸基又はカルボン酸基を含み、かつ、第二化合物が10以上の炭素連鎖を含む場合も挙げられる。そして、本実施形態の電解質で最も好ましい例は、上記(A)の場合であり、以下に例を用いて説明する。
【0025】
<第一化合物>
本実施形態における2以上のイソシアネート基を有する第一化合物は、10以上の炭素連鎖を含むイソシアネート化合物であることが好ましい。このような第一化合物としては、特に限定はされないが、(a)共役ジエン系のグリコール及びその水添物の両末端をイソシアネート基に変換した化合物が挙げられる。
【0026】
上記共役ジエン系のグリコール及びその水添物としては、特に限定されないが、1,4−結合や1,2−結合を含有するポリブタジエングリコール及びその水添物や、ポリイソプレングリコール及びその水添物が好ましい。また、より好ましくは、1,4−結合や1,2−結合を含有するポリブタジエングリコール又はポリイソプレングリコールの水添物である。ポリブタジエン系グリコールとしては、化学式2に代表されるような構造が好ましい。
【0027】
【化2】

なお、式中のxは1,2−結合の重合度を表し、yは1,4−結合の重合度を表す。
【0028】
また、ポリイソプレン系グリコールの水添物としては、例えば、化学式3に代表されるような構造が好ましい。
【0029】
【化3】

なお、式中のzは重合度を表す。
【0030】
さらに、第一化合物としては、(b)水酸基、カルボン酸基又はアミン基を含む植物性油の両末端をイソシアネート基に変換した化合物が挙げられる。なお、植物性油としては、例えば乾性油(亜麻仁油、桐油、紫蘇油及び向日葵油等)や半乾性油(菜種油、米糠油、コーン油、綿実油及びゴマ油等)が挙げられる。
【0031】
上記(a)共役ジエン系のグリコール及びその水添物及び(b)水酸基、カルボン酸基又はアミン基を含む植物性油の両末端をイソシアネート基に変換する手法としては、特に限定されることなく、公知の手法を用いることができる。例えば、上記(a)及び(b)の末端水酸基と、低分子量のイソシアネート化合物とを結合させ、ウレタン結合(−NHC(=O)O−)を形成することにより、末端をイソシアネート基とすることができる。
【0032】
上記低分子量のイソシアネート化合物としては、例えば、2,4−又は2,6−トリレンジイソシアネート、4,4’−又は2,4’−ジフェニルメタンジイソシアネート、イソホロンジイソシアネートを用いることができる。なお、以下、2,4−又は2,6−トリレンジイソシアネートをTDIと略記し、4,4’−又は2,4’−ジフェニルメタンジイソシアネートをMDIと略記し、イソホロンジイソシアネートをIPDIと略記する。
【0033】
さらに第一化合物としては、(c)カルボン酸基又はアミン基を含有する植物性油におけるカルボン酸基又はアミン基をイソシアネート基に変換した化合物が挙げられる。(c)カルボン酸基又はアミン基を含有する植物性油におけるカルボン酸基又はアミン基をイソシアネート基に変換する手法としては、特に限定されることなく、公知の手法を用いることができる。
【0034】
上記第一化合物の別の好ましい化合物の一つとして、ダイマー酸ジイソシアネートがある。ダイマー酸イソシアネートとは、2つの脂肪酸を2量化した化合物から誘導されるイソシアネートであり、分子内に長鎖の炭化水素構造をもつことが特徴である。ダイマー酸イソシアネートとは、例えば化学式4に代表されるような構造を有している。
【0035】
【化4】

なお、式中のR3及びR5は直鎖状のアルキル基であり、R4及びR6は直鎖状のアルキレン基である。
【0036】
第一化合物として、ダイマー酸ジイソシアネートを用いた場合、脂肪族ジイソシアネートを用いた場合と比べて、その特徴的な構造から、優れた耐水性、耐酸性及び柔軟性を発現したポリウレア電解質を得ることが出来る。
【0037】
そして、ダイマー酸イソシアネートの中でも、オレイン酸とリノール酸を二量体化した化合物から誘導されるジイソシアネートを用いることが好ましいが、本発明はこれに限定されない。オレイン酸とリノール酸を二量体化したダイマー酸の例として、化学式5に示す非環型や単環型が挙げられる。さらに、化学式5に示すように、ダイマー酸の末端カルボン酸基を公知の方法によりイソシアネート基に置換した化合物を第一化合物として使用することができる。
【0038】
【化5】

【0039】
さらに第一化合物としては、例えば、ノルボルナンジイソシアネート、ジシクロヘキシルジイソシアネート及びテトラメチルキシリレンジイソシアネートを用いることも可能である。
【0040】
本実施形態におけるポリウレア電解質では、上述の第一化合物を使用することが好ましい。しかし、上記第一化合物として、10以上の炭素連鎖と、スルホン酸基又はカルボン酸基とを含まないイソシアネート化合物(A−1)を併用しても良い。併用できるイソシアネート化合物(A−1)としては、特に限定されないが、芳香族ポリイソシアネート、脂肪族ポリイソシアネート、脂環式ポリイソシアネート及びこれらのプレポリマー等が挙げられる。
【0041】
イソシアネート化合物(A−1)のうち、芳香族ポリイソシアネートとしては、例えば、1,3−又は1,4−フェニレンジイソシアネート、TDI、MDI、1,5−ナフタレンジイソシアネート、m−キシリレンジイソシアネート,テトラメチルキシリレンジイソシアネート及びこれらの誘導体が挙げられる。
【0042】
イソシアネート化合物(A−1)のうち、脂肪族ポリイソシアネートとしては、例えば、テトラメチレンジイソシアネート及びヘキサメチレンジイソシアネート、リジントリイソシアネート及びこれらの誘導体が挙げられる。
【0043】
イソシアネート化合物(A−1)のうち、脂環式ポリイソシアネートとしては、例えば、IPDI、ジシクロヘキシル−4,4’−ジイソシアネート、1,3−ビス(イソシアネートメチル)シクロヘキサン、ノルボルネンジイソシアネート、トランス−シクロヘキサンジイソシアネート及びこれらの誘導体が挙げられる。
【0044】
イソシアネート化合物(A−1)のうち、好ましくは、芳香族ポリイソシアネート、より好ましくは、TDI、MDI及びその誘導体である。また、第一化合物へのイソシアネート化合物(A−1)の添加量は、第一化合物全体を100部としたときに、20部以下、好ましくは10部以下である。
【0045】
<第二化合物>
本実施形態における2以上のアミノ基を有する第二化合物は、スルホン酸基又はカルボン酸基を含む化合物であることが好ましい。さらに上記第二化合物は、スルホン酸基を含み、かつ、芳香環を有する化合物であることがより好ましい。
【0046】
上記第二化合物の代表的な化合物として、スルホン酸ジアミンを好適に用いることができる。スルホン酸ジアミンの製造方法は特に限定されず、公知の手法を用いることができるが、例えば、芳香族ジアミンを濃硫酸等のスルホン化剤によりスルホン化することにより得ることができる。
【0047】
スルホン酸ジアミンの例としては、2,2’−ベンジジンジスルホン酸、ジアミノベンゼンスルホン酸、(4,4’−ジアミノジフェニルエーテル)スルホン酸、(4,4’−ジアミノジフェニルスルホン)スルホン酸、2,2’−ビス[4−(4−アミノフェノキシ)フェニル]プロパンスルホン酸、ビス[4−(4−アミノフェノキシ)フェニル]スルホン−スルホン酸、1,3−ビス(4−アミノフェノキシ)ベンゼンスルホン酸、(9,9−ビス(4−アミノフェニル)フルオレンスルホン酸等を挙げることができる。なお、以下、2,2’−ベンジジンジスルホン酸をBDSと略記し、ジアミノベンゼンスルホン酸をDABSと略記し、(4,4’−ジアミノジフェニルエーテル)スルホン酸をS−DPEと略記し、2,2’−ビス[4−(4−アミノフェノキシ)フェニル]プロパンスルホン酸をS−BAPPと略記し、ビス[4−(4−アミノフェノキシ)フェニル]スルホン−スルホン酸をS−BAPSと略記する。
【0048】
さらに、スルホン酸ジアミンは、分子中に芳香環を1個以上有する化合物が好ましく、スルホン酸が芳香環に結合した化合物がより好ましい。これらスルホン酸ジアミンのうち、上記第一化合物との反応性及びプロトン伝導性の観点から、BDS、DABS、S−DPE、S−BAPP及びS−BAPSが特に好ましい。
【0049】
上述のような第一及び第二化合物を用いたポリウレア電解質の一例としては、化学式6に記載したポリウレア樹脂があげられる。化学式6のポリウレア樹脂は、オレイン酸とリノール酸を二量体化した単環型のダイマー酸の末端カルボン酸をイソシアネート基に置換したイソシアネート化合物と、(4,4’−ジアミノジフェニルエーテル)ジスルホン酸とを重合したものである。
【0050】
【化6】

【0051】
上述のように、本実施形態に係るポリウレア電解質は、分子内にウレア結合を含んでいる。そして、このウレア結合部位が凝集エネルギーの高いハードセグメントを形成するため、機械的強度に優れた電解質を得ることができる。さらに、上記ポリウレア電解質は、分子内に10以上の炭素連鎖からなる構造が含まれる。そして、この炭素連鎖がソフトセグメントを形成するため、柔軟性にも優れた電解質を得ることができる。
【0052】
なお、本実施形態に係るポリウレア電解質が優れた耐酸性及び耐水性を持つ理由は明らかではない。ただ、分子内に存在する10以上の炭素連鎖が比較的強い疎水性を示す。そのため、ウレア結合部位の分解原因となり得る酸及び水の接近からウレア結合部位を保護することから、耐酸性及び耐水性に優れると予想することができる。
【0053】
また、上述のように、第一化合物として、(a)共役ジエン系のグリコール及びその水添物の両末端をイソシアネート基に変換した化合物や(b)水酸基、カルボン酸基又はアミン基を含むの両末端をイソシアネート基に変換した化合物を使用する場合には、第一化合物内にウレタン結合(−NHC(=O)O−)が含まれる場合がある。そして、ウレタン結合部位も酸及び水により分解する虞がある。しかし、上述のように、本実施形態のポリウレア電解質では分子内に存在する10以上の炭素連鎖が比較的強い疎水性を示すため、ウレタン結合部位が酸及び水から保護され、分解が抑制される。
【0054】
上述のように、本実施形態に係るポリウレア電解質は、2以上のイソシアネート基を有する第一化合物と、2以上のアミノ基を有する第二化合物とを重合させることにより形成されるポリウレア樹脂を備え、第一化合物又は第二化合物がスルホン酸基(−SO3H)又はカルボン酸基(−CO2H)を含むことを特徴とする。これに対し、特許文献1及び2のポリウレア電解質はポリウレア樹脂のウレア結合部位に、後からスルホン酸基又はカルボン酸基を導入している。つまり、特許文献1及び2では、ウレア結合部位に直接スルホン酸基等が結合している。この場合、ウレア結合部位における凝集力が低下してしまう。これに対し、本実施形態に係るポリウレア電解質は、ウレア結合部位にスルホン酸基やカルボン酸基を結合させているわけではなく、第一化合物及び第二化合物の分子鎖R1及びR2にスルホン酸基やカルボン酸基を結合させている。そのため、ウレア結合部位における凝集力が高いため、機械的強度に優れた電解質を得ることができる。
【0055】
[ポリウレア電解質の製造方法]
本発明の実施形態に係るポリウレア電解質の製造方法は、次の工程を有することを特徴とする。
(a)第一化合物又は第二化合物におけるスルホン酸基又はカルボン酸基を中和剤により中和する工程
(b)中和工程後に、第一化合物及び第二化合物を重合する工程
(c)重合工程後に、第一化合物及び第二化合物の重合体から中和剤を除去する工程
【0056】
上記製造方法は、スルホン酸基又はカルボン酸基に対して、中和剤を用いることを特徴としており、特に第二化合物たるスルホン酸ジアミンに対して特定の中和剤を用いることを特徴とする。上記スルホン酸ジアミンは通常溶媒に難溶であるが、特定の中和剤を用いることにより、中和と同時に溶媒に対する溶解性を改善することが可能となる。なお、従来よりスルホン酸ジアミンに中和剤を用いることで可溶化できることは知られている。しかし、本発明者らは、鋭意検討の結果、スルホン酸ジアミンを特定のアルキルアミンで中和することにより、第一化合物の溶媒に対する溶解性も改善され、スルホン酸ジアミンと第一化合物が好適に反応することを見出した。
【0057】
このような中和剤としては、脂肪族3級アミン及び環状3級アミンを使用することが好ましい。脂肪族3級アミンの例としては、トリアルキルアミンが挙げられる。また、環状3級アミンの例としては、窒素が1個の化合物としてピリジン等が挙げられ、窒素が2個の化合物としてトリエチレンジアミン、1,8−ジアザビシクロ[5.4.0]ウンデセン−7、1,5−ジアザビシクロ[4.3.0]ノネン−7等が挙げられる。なお、以下、トリエチレンジアミンをTEDAと略記し、1,8−ジアザビシクロ[5.4.0]ウンデセン−7をDBUと略記し、1,5−ジアザビシクロ[4.3.0]ノネン−7をDBNと略記する。
【0058】
このような脂肪族3級アミン及び環状3級アミンのうち、長鎖アルキル基を有するトリアルキルアミンが好ましい。長鎖アルキル基を有するトリアルキルアミンのアルキル基の炭素数は6以上、好ましくは8以上、より好ましくは10以上、更により好ましくは12以上である。中でも、炭素数が12のアルキル基を含有するドデシルジメチルアミン等を好適に用いることができる。
【0059】
上記中和剤の添加量は、スルホン酸基又はカルボン酸基1モルに対し、化学量論的に0.9〜1.1モルの範囲で添加すれば良い。また、スルホン酸基又はカルボン酸基1モルに対し、1.0モル添加することがより好ましい。
【0060】
中和剤の除去方法およびプロトン置換方法は、公知の方法を用いることができ、特に限定はされない。例えば、合成物を塩酸水溶液や塩酸−アルコール混合溶液等によりプロトン置換し、水洗、乾燥することにより中和剤を除去することができる。なお、このときの合成物の形状は、ブロック状や膜状等、如何なる形状であってもかまわないが、製膜してから中和及びプロトン置換をする方が好ましい。
【0061】
本実施形態に係るポリウレア電解質における第一化合物と第二化合物の重合方法は特に限定されないが、溶液重合法、界面重合法、懸濁重合法及び乳化重合法などの公知の方法が適用できる。
【0062】
上記溶液重合法の場合は、例えば、溶媒中で、中和剤を用いてスルホン酸基又はカルボン酸基を有する第二化合物を中和して溶解し、その後、第一化合物を添加して重合することが出来る。ここで用いる溶媒としては、ジメチルホルムアミド、ジメチルアセトアミド、ジメチルスルホキシド、N−メチルピロリドン等、ウレタン溶媒として公知のものを使用することができる。また、重合温度は、通常20℃〜150℃、好ましくは40℃〜120℃である。重合温度をこの範囲内とすることにより、重合反応が効率的に進行し、さらに架橋を生じる副反応を抑制することができる。
【0063】
上記界面重合法の場合は、例えば、親水系溶媒に中和済みの第二化合物を溶解し、疎水系溶媒に第一化合物を溶解し、両者の界面で重合することができる。
【0064】
上記製造方法においては、必要により公知のウレタン用触媒を使用して重合反応を促進しても良い。このような重合触媒としては特に限定はされないが、有機錫(ジブチル錫ジラウレート及びオクチル錫等)及び3級アミン(TEDA、DBU、DBN等)を挙げることができる。これらのうち、好ましいものは3級アミンであり、DBU及びDBNがより好ましい。通常、第二化合物としてスルホン酸ジアミンを使用した場合、反応性が低いため、高分子量のポリマーを効率的に調製できない場合があるが、触媒を使用することにより高分子量のポリマーを効率的に調製することができる。
【0065】
上記製造方法において、電解質としての性能を向上させるために、必要により各種添加剤を使用しても良い。添加剤としては、オレフィン系エマルジョン(例えば、ポリエチレンエマルジョン、EPDMエマルジョン、ポリブタジエン、ポリイソプレン及びポリスチレンイソプレン等)等を挙げることができるが、特にこれらに限定されるものではない。上記添加剤は、重合時の溶媒に添加することが好ましい。
【0066】
上記製造方法において、第一化合物と第二化合物を重合させる時に、反応溶液にマイクロ波を照射することにより、重合体の分子量を向上させることができる場合がある。マイクロ波とは、波長が1m(周波数300MHz)〜1mm(周波数300GHz)の電磁波をいう。このようなマイクロ波としては、反応促進効果の観点から周波数300MHz〜3GHzのマイクロ波が好ましく、例えば、一般的に加熱に用いられている周波数2.45GHzのマイクロ波を使用しても良い。
【0067】
[燃料電池及び自動車]
本発明の実施形態に係る燃料電池は、上記ポリウレア電解質を燃料電池用電解質膜として使用することを特徴とする。上述のように、本発明のポリウレア電解質は、柔軟性、機械的強度、耐酸性、耐水性及び耐久性が優れている。さらに、ポリウレア電解質はスルホン酸基又はカルボン酸基が結合されているため、高いプロトン伝導性も示す。そのため、この電解質を燃料電池用電解質膜として使用した場合、耐酸性、耐水性、耐久性及び機械的強度に優れた膜電極接合体(MEA)を得ることができる。また、このような膜電極接合体は薄膜化が可能なため、燃料電池は更なる小型化及び高出力化を可能とする。
【0068】
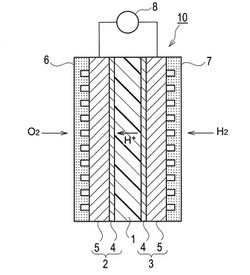
ポリウレア電解質からなる燃料電池用電解質膜は、ダイレクトメタノール形燃料電池(DMFC)や固体高分子形燃料電池(PEFC)に使用することができる。図1では、ポリウレア電解質を電解質膜として使用した固体高分子形燃料電池の単セルの構成を示す。図1に示すように、上記燃料電池(単セル)10は、固体高分子電解質膜1の両側に正極2及び負極3を接合して一体化した膜電極接合体を有する。正極2及び負極3は、触媒層4及びガス拡散層5(GDL)を備えた二層構造であり、触媒層4は固体高分子電解質膜1に接触している。正極2及び負極3の両側には、正極側セパレータ6及び負極側セパレータ7が各々設置されている。そして、正極側セパレータ6及び負極側セパレータ7により、酸素ガス流路、水素ガス流路及び冷却水流路が形成されている。
【0069】
上記燃料電池10では、負極3側に、水素、窒素及び水蒸気の混合ガスを供給し、正極2側に空気及び水蒸気を供給する。燃料の水素は負極3において電気化学的に酸化されて、プロトンと電子を生成する。このプロトンは電解質膜1内を通過し正極2に移動する。一方、負極3で生成した電子は燃料電池10に接続された外部負荷8を通り、正極2に流れ、正極2においてプロトンと酸素と電子が反応して水を生成する。
【0070】
本実施形態に係るポリウレア電解質を使用した上記電解質膜1は、機械的強度、特に引裂強度に代表される靭性(タフネス)に優れてるため、従来の電解質膜よりも膜厚を薄くすることが容易である。つまり、上記電解質膜1は、目的に応じて任意の膜厚にすることができるが、プロトン伝導性の面から薄いことが好ましく、通常1〜200μmである。この範囲内では、プロトン伝導性と機械的強度の両方に優れた電解質膜とすることができる。
【0071】
ダイレクトメタノール形燃料電池用の電解質膜として上記ポリウレア電解質を使用する場合、膜厚は200μm以下、好ましくは100μm以下、より好ましくは50μm以下、更に好ましくは20μm以下、特に好ましくは10μm以下、極めて好ましくは5μm以下、最も好ましくは1μmである。また、固体高分子形燃料電池用の電解質膜として上記ポリウレア電解質を使用する場合、膜厚は30μm以下、好ましくは20μm以下、より好ましくは10μm以下、更に好ましくは5μm以下、特に好ましくは1μmである。
【0072】
燃料電池用電解質膜に本発明のポリウレア電解質を用いる場合には、上記ポリウレア電解質のほかに、他のフッ素系電解質や炭化水素系電解質を混合しても良い。しかし、上記電解質膜においては、本発明のポリウレア電解質を少なくとも50重量%以上含有することが好ましく、80重量%以上含有することがより好ましい。また、上記電解質膜が本発明のポリウレア電解質のみから形成されていても構わない。
【0073】
本発明のポリウレア電解質を、燃料電池で使用する電解質膜に成形する方法としては、様々な公知の方法を使用することができ、特に限定されるものではない。具体的には、上記第一化合物及び第二化合物を重合した後、塩酸水溶液等で中和剤を除去してプロトン置換し、水洗、乾燥することで電解質膜を得ることができる。
【0074】
上記燃料電池における触媒層は導電材、バインダ及び触媒金属を含有していることが好ましい。導電材としては、電気伝導性物質であればいずれのものでも良く、各種金属や炭素材料等を使用することができる。例えばアセチレンブラック等のカーボンブラック、活性炭及び黒鉛等が使用でき、これらを単独あるいは混合して使用することができる。
【0075】
バインダとしては、本発明のポリウレア電解質を使用することが好ましいが、特に限定されるものではない。さらにバインダに他の樹脂を添加しても良い。その場合、添加する樹脂としては撥水性を有するフッ素樹脂等が挙げられる。フッ素樹脂の中でも融点が400℃以下のものが好ましく、例えばポリテトラフルオロエチレン、テトラフルオロエチレン−パーフルオロアルキルビニルエーテル共重合体等が挙げられるが、特に限定されるものではない。
【0076】
触媒金属としては、水素の酸化反応及び酸素の還元反応を促進する金属であれば、特に限定されない。触媒金属としては、例えば鉛、鉄、マンガン、コバルト、クロム、ガリウム、バナジウム、タングステン、ルテニウム、イリジウム、パラジウム、白金、ロジウム又はそれらの合金が挙げられる。
【0077】
本発明の電解質膜を有する燃料電池は、耐久性に優れるため、システムの起動及び停止や出力変動が頻繁に発生する自動車用途において、特に好適に利用できる。図2には、本発明に係る燃料電池10を搭載した自動車20の外観を示す。図2の燃料電池自動車では、車体21のフロント部に燃料電池10を搭載しているが、如何なる場所に燃料電池10を搭載しても構わない。
【実施例】
【0078】
以下、本発明を実施例により更に詳細に説明するが、本発明はこれら実施例に限定されるものではない。
【0079】
(当量重量の測定法)
電解質の当量重量(EW)は、イオン交換容量(IEC)を測定し、換算して算出した。また、IECは次のようにして測定した。まず、プロトン型の電解質をおよそ0.1g計量し、0.1Nの水酸化ナトリウム水溶液20mlに浸漬した。次に、この混合物を室温で攪拌しながら一晩放置した。その後、自動滴定装置(東亜ディーケーケー株式会社製)及びpH複合電極(東亜ディーケーケー株式会社製)を用いて、0.1Nの塩酸水溶液によりpH7.0を終点とした中和滴定を行った。塩酸の滴定量から、電解質のイオン交換により消費された水酸化ナトリウム量を求め、式(1)からイオン交換容量を算出した。
イオン交換容量(meq/g)=0.1×(20×F1−A×F2)/W・・・(1)
ここで、F1は滴定用水酸化ナトリウム水溶液のファクタ、F2は滴定用塩酸水溶液のファクタであり、Aは塩酸水溶液の滴定量(ml)、Wは膜重量(g)である。
【0080】
そして、EWは、上記方法によって得られたIECから、式(2)より算出した。
EW=1000/IEC・・・(2)
【0081】
なお、耐水性、耐酸性及び膜強度の評価は、電解質を電解質膜にした後に実施した。
【0082】
(耐水性の評価法)
電解質膜を50mlの純水に投入し、105℃にて静置した。20時間後、膜を取り出し、80℃にて15時間以上減圧乾燥し、膜の外観を実体顕微鏡にて観察した。なお、耐水性の評価基準は、以下の通りである。
○:膜表面は平滑でクラックがない
×:膜の形態を保持できない、又は膜表面にクラックが認められる
【0083】
(耐酸性の評価法)
電解質膜を80℃にて減圧乾燥し、試験前乾燥重量(w1)を計量した。次に乾燥後の電解質膜を10重量%の塩酸水溶液50mlに投入し、80℃にて静置した。20時間後、電解質膜を回収し、大量の純水で洗浄後、80℃にて減圧乾燥し、試験後乾燥重量(w2)を計量した。そして、試験前後の乾燥重量から、式(3)より重量減少率を算出した。
重量減少率(%)=(w1−w2)/w1×100・・・(3)
【0084】
上記重量減少率が小さい程、耐酸性に優れた電解質膜であることを意味し、重量減少率が大きい程、耐酸性に劣った電解質膜であることを意味する。
【0085】
(膜強度の評価法)
膜強度の評価は、耐水性評価後の電解質膜に対する折り曲げ試験及び引張り試験により実施した。折り曲げ試験は、電解質膜の中央部を二つに折り曲げ、元の状態に戻したときの中央部を観察することにより実施した。また、引張り試験は、電解質膜を引張伸度100%まで引張った後、元の状態に戻したときの膜表面状態を観察することにより実施した。なお、膜強度の評価基準は、以下の通りである。
○:折り曲げ試験の結果、折り目において破断せず、折り目にも痕が残らない。さらに引張り試験においても破断しない。
×:折り曲げ試験の結果、破断する、又は折り目に痕が残る。また、引張り試験において破断が生じる。その他、膜が水溶性である。
【0086】
(実施例1)
まず、ジオキサン2.29gにジイソシアネート誘導体(商品名:DDI−1410、コグニスジャパン社製)1.00gを溶解させることにより溶液(I)を調製した。さらに、N,N−ジメチルホルムアミド2.7gにスルホン酸ジアミン(DABS)0.30g、中和剤(トリエチルアミン)0.114gを加え、溶解させることにより溶液(II)を調製した。次に耐圧容器中で溶液(I)と溶液(II)を混合し、100℃で24時間攪拌しながら重合した。その重合溶液をポリエチレン製のキャップに注入し、80℃で12時間乾燥した。乾燥後、中和剤を除去し、電解質膜を得た。この電解質膜のIECは1.24(EW:806)であり、耐水性及び膜強度は良好であった。なお、以下、N,N−ジメチルホルムアミドをDMFと略記し、トリエチルアミンをTEAと略記する。また、上記コグニスジャパン社のDDI−1410は、オレイン酸とリノール酸を二量体化した単環型のダイマー酸の末端カルボン酸を、イソシアネート基に置換した化合物である。
【0087】
(実施例2)
<(4,4’−ジアミノジフェニルエーテル)−2,2−ジスルホン酸(S−DPE)の合成>
20gの4,4’−オキシジニアニリンを95%硫酸17mlに溶解後、溶液を0℃まで冷却した。次に冷却した溶液に発煙硫酸(三酸化硫黄含有率:60%)35ml滴下した。この溶液を80℃で1時間攪拌後、室温まで冷却し、更に氷水で冷却することにより、固体を析出させ、これを濾別した。さらに濾別した固体を水酸化ナトリウム溶液に溶解した後、塩酸を加え、析出した固体を濾別、水洗、乾燥することにより、生成物を得た。得られた生成物は、プロトン核磁気共鳴分光法により、化学式7の構造を有する(4,4’−ジアミノジフェニルエーテル)−2,2−ジスルホン酸であるであることが確認された。
【0088】
【化7】

【0089】
<電解質膜の調製>
まず、上述のように合成したスルホン酸ジアミン(S−DPE)2.50g、イオン交換水22.50g及び中和剤(TEA)1.55gを溶解した溶液(I)と、ジイソシアネート誘導体(DDI−1410)をトルエンに溶解し、ジイソシアネート誘導体を20重量%とした溶液(II)とを作成した。次に溶液(I)5.31g及び溶液(II)4.39gを耐圧容器中に投入し、100℃で30時間攪拌しながら重合した。そして界面にできた重合液を実施例1と同様に処理して電解質膜を得た。この電解質膜のIECは1.20(EW:833)であり、耐水性及び膜強度は良好であった。耐酸性試験における重量減少率は0.8%と良好であり、極めて耐酸性に優れた電解質膜であった。
【0090】
(実施例3)
両末端に水酸基を有する液状ポリブタジエン(商品名:R−15HT、出光興産株式会社製)にイソシアネート誘導体(TDI−80)を付加し、NCO(イソシアネート基)が5.14%のプレポリマーを作成した。このプレポリマーをジオキサンに溶解し、プレポリマーを50重量%とした溶液(I)を調製した。さらに、ジメチルスルホキシド4.50gに、実施例2で合成したスルホン酸ジアミン(S−DPE)0.50g、中和剤(TEA)0.28gを加え、溶解させることにより溶液(II)を調製した。次に耐圧容器中で溶液(II)に溶液(I)を4.78g加え、80℃で3時間攪拌しながら重合した。その重合液を、実施例1と同様に処理して電解質膜を得た。この電解質膜のIECは1.09(EW:917)であり、耐水性及び膜強度は良好であった。なお、上記TDI−80は、トルエン−2,4−ジイソシアネート80%、トルエン−2,6−ジイソシアネ−ト20%の混合物を示す。
【0091】
(実施例4)
スルホン酸ジアミン(DABS)1.30gをDMF13gに懸濁し、ここに中和剤として、長鎖3級アミン(ジメチルラウリルアミン、日油株式会社製、商品名:ニッサンアミンBB)1.47gを添加し、DABSが完全に溶解した溶液(I)を調製した。さらにジイソシアネート誘導体(DDI−1410)をDMFに溶解し、ジイソシアネート誘導体を50重量%とした溶液(II)を調製した。次に耐圧容器中に、溶液(I)3.25g、溶液(II)1.76g、触媒(DBU)をジイソシアネート誘導体に対して1重量%となるように加え、60℃で24時間攪拌しながら重合した。得られた重合液を、実施例1と同様に処理して電解質膜を得た。この電解質膜のIECは1.23(EW:813)であり、耐水性及び膜強度は良好であった。
【0092】
(実施例5)
放射温度計を備えたマイクロ波照射装置(CEM社製、Discover、シングルモード型)を用いて、2.45GHzのマイクロ波を60℃で10分照射したこと以外は、実施例4と同様の方法にして、電解質膜を得た。この電解質膜のIECは1.20(EW:833)であり、耐水性及び膜強度は良好であった。
【0093】
(実施例6)
<ビス[4−(4−アミノフェノキシ)フェニル]スルホン−3,3’−ジスルホン酸(S−BAPS)の合成>
25gのビス[4−(4−アミノフェノキシ)フェニル]スルホンを95%硫酸17mlに溶解後、溶液を0℃まで冷却した。次に冷却した溶液に発煙硫酸(三酸化硫黄含有率:60%)35ml滴下した。この溶液を80℃で1時間攪拌後、室温まで冷却し、更に氷水で冷却することにより、固体を析出させ、これを濾別した。さらに濾別した固体を水酸化ナトリウム溶液に溶解した後、塩酸を加え、析出した固体を濾別、水洗、乾燥することにより、生成物を得た。得られた生成物を少量のトリエチルアミン(TEA)を加えた重水素化ジメチルスルホキシドに溶解させ、生成物のTEA塩をプロトン核磁気共鳴分光法により分析した。その結果、1.00〜1.18ppmと2.70〜2.82ppmにTEAのアルキル基の水素に基づくシグナルが観測され、さらに6.59〜6.62ppm(d)、6.73〜6.76ppm(d)、7.72〜7.75ppm(d)、8.20ppm(s)にベンゼン間の水素に基づくシグナルが観測された。それぞれのシグナルの帰属と積分強度比から、生成物は、化学式8の構造を有するビス[4−(4−アミノフェノキシ)フェニル]スルホン−3,3’−ジスルホン酸であることが確認された。
【0094】
【化8】

【0095】
<電解質膜の調製>
20mlの密閉容器に、ジメチルホルムアミド2.41gと、上述のように合成したスルホン酸ジアミン(S−BAPS)0.2gと、TEA0.068gとを投入し、これらを溶解することにより、S−BAPS塩溶液を調製した。次に実施例3で使用した、両末端に水酸基を有する液状ポリブタジエンにイソシアネート誘導体を付加したプレポリマー0.58gをジオキサン5.2gに溶解し、プレポリマー溶液を調製した。このプレポリマー溶液をS−BAPS塩溶液に加え、窒素置換して攪拌し、反応液を調製した。その後、反応液をシリコーン容器に流し入れ、80℃で一晩乾燥することにより、電解質膜を得た。この電解質膜のIECは1.06(EW:943)であり、耐水性及び膜強度は良好であった。
【0096】
(実施例7)
実施例1にて作成したプロトン置換前の膜を使用して、プロトン置換法につき検討した。具体的には、まず、実施例1にて調製した重合溶液をポリエチレン製のキャップに注入し、80℃で12時間乾燥した。次に得られた乾燥膜を、濃塩酸をメタノールにて1mol/Lになるように希釈した塩酸メタノール溶液に浸積し、50℃で15時間処理することにより、電解質膜を得た。この電解質膜のIECは1.2(EW:833)であり、耐水性及び膜強度は良好であった。また、この電解質膜の引裂き強度は、500〜1000N/mであった。
【0097】
(比較例1)
耐圧容器に、実施例1で作成した溶液(II)3.46gと、ペンタメチレングリコールの両末端にイソシアネート誘導体(TDI−80)を付加したNCO9.47%のプレポリマー1.49gとを加え、80℃で24時間重合した。得られた重合液を、実施例1と同様に処理して電解質膜を得た。得られた電解質膜の強度は非常に弱く、ひび割れが多く発生した。また、この電解質膜のIECは1.04(EW:962)であったが、耐水性試験後のサンプル膜は形状保持が困難であった。
【0098】
(比較例2)
耐圧容器に、実施例1で作成した溶液(II)3.00gに、ウレタン変性MDI(BASF INOAC ポリウレタン株式会社製、商品名:ルプラネートMP−102)0.53gを加え、80℃で24時間重合した。得られた重合液を、実施例1と同様にして電解質膜を得た。全体的に均一な膜が作製できたが、膜強度が弱く、ひび割れが多く発生した。また、この電解質膜のIECは0.92(EW:1087)であったが、耐水性試験後のサンプル膜の形状保持は困難であった。耐酸性試験における重量減少率は21.3%であった。
【0099】
(比較例3)
イソシアネート(TDI)0.50g及びDMF0.50gを混合し、イソシアネートが50重量%の溶液(I)を作成した。次に耐圧容器に、溶液(I)0.3g及び実施例3で作成した溶液(II)3.17gを投入し、80℃で24時間重合した。得られた重合液を実施例1と同様にして乾燥し、中和剤を除去した。しかしながら、得られた電解質は水溶性であり、電解質膜を得ることができなかった。
【0100】
(比較例4)
耐圧容器に、実施例3で作成した溶液(II)3.17gと、ウレタン変性MDI(BASF INOAC ポリウレタン株式会社製、商品名:ルプラネートMP−102)0.32gとを投入し、80℃で24時間重合した。得られた重合液を実施例1と同様にして乾燥し、中和剤を除去した。しかしながら、得られた電解質は水溶性であり、電解質膜を得ることができなかった。
【0101】
上記実施例1〜5及び比較例1〜4の評価結果を表1に示す。表1より、実施例1〜7は、比較例1〜4と比べると、耐水性、耐酸性及び膜強度が良好な電解質膜が得られた。また比較例1〜4から、第一化合物の炭素連鎖数が10よりも小さい場合、得られる電解質膜は耐水性に乏しく、膜強度が弱いことが分かった。
【0102】
【表1】

【0103】
(実施例8)
実施例1におけるジイソシアネート誘導体の使用量を1.00gから0.95gに減らし、さらに溶液(I)と溶液(II)の反応温度を100℃から60℃にした以外は、実施例1と同様に電解質膜を調製した。なお、実施例8のNCO Indexは1.00とした。ここで、NCO Indexとは、第一化合物中のイソシアネート基のモル数と、第二化合物中のアミノ基のモル数の比([NCO]/[NH2])をいう。
【0104】
ゲル浸透クロマトグラフィを用いて実施例8で得られた電解質膜の分子量を測定した結果、重量平均分子量(Mw)は130000であった。ちなみに、実施例1ではNCO Indexを1.05とし、実施例1で得られた電解質膜の重量平均分子量は80000であった。実施例1及び実施例8より、ポリウレア電解質の分子量を上げるためには、NCO Indexを1.00に近づけたほうが望ましいことが分かった。
【0105】
(実施例9〜15)
第一化合物、第二化合物、溶媒、原料濃度、NCO Index及び反応温度を表2のように変更した以外は実施例1と同じ条件で電解質膜を調製した。また、実施例10及び13では、重合触媒としてジブチル錫ジラウレート(日東化成株式会社製、商品名:ネオスタンU−100)を使用した。得られた電解質膜及び重合溶液の評価結果を表3に示す。
【0106】
ちなみに、表3における粘度は、重合溶液の濃度が20%と40%のときの粘度を示している。また、重合溶液の粘度は、粘度計(ブルックフィールド社製、商品名:レオメーターHBDV−III−CP)を使用して、それぞれの濃度で測定した値である。
【0107】
また、表3におけるNCO反応率とは、反応終点における反応液をフーリエ変換赤外分光光度計(FT−IR)で調べた結果から、以下の式(4)のように定義した値である。
NCO反応率(%)=(1−Xt/X0)×100・・・(4)
A1:2272cm−1における吸光度
A2:2852cm−1における吸光度
X:NCO存在指標(=A1/A2)
X0:反応時間0分におけるNCO存在指標
Xt:反応時間t分におけるNCO存在指標
【0108】
さらに、表3における分岐・架橋量とは、プロトン核磁気共鳴分光法により観察されるウレア結合(−NHCONH−)に由来する6.0ppm付近のシグナルの積分値(A)と、そのNHがさらにNCOと反応して生成する分岐・架橋構造のビュレット結合(−N(CONH−)CONH−)に由来する5.7ppm付近のシグナルの積分値(B)の比(=B/(A+B))である。
【0109】
【表2】

【0110】
【表3】

【0111】
表3より、実施例9〜15の電解質膜のイオン交換容量(IEC)は1.25以下であり、また当量重量(EW)も1000以下であった。さらに、耐水性及び膜強度も良好であった。
【0112】
以上、実施形態及び実施例に沿って本発明の内容を説明したが、本発明はこれらの記載に限定されるものではなく、種々の変形及び改良が可能であることは、当業者には自明である。
【産業上の利用可能性】
【0113】
本発明のポリウレア電解質は、優れた機械的強度、耐水性、耐酸性及び耐久性を有する。そのため、各種燃料電池、例えば自動車用、移動通信体用及び家庭用等の燃料電池の電解質膜や電極触媒用のバインダとして好適に利用できる。
【符号の説明】
【0114】
1 電解質膜
2 正極
3 負極
4 触媒層
5 ガス拡散層
6 正極側セパレータ
7 負極側セパレータ
8 外部負荷
10 燃料電池
【技術分野】
【0001】
本発明は、燃料電池用電解質膜として好適な機械的強度や耐酸性等を有するポリウレア電解質及びその製造方法に関する。
【背景技術】
【0002】
最近の地球環境問題の観点から、クリーンエネルギの開発及び普及が世界的に大きな課題となっている。そしてクリーンエネルギの中でも低公害及び高効率という観点から、燃料電池が注目されている。燃料電池とは、水素やメタノール等の燃料を酸素又は空気を用いて電気化学的に酸化することにより、燃料の化学エネルギを電気エネルギに変換して取り出すものである。燃料電池には、電解質の種類によって、アルカリ形、リン酸形、溶融炭酸塩形、固体電解質形及び固体高分子形等、様々なタイプがある。そして、その中でも、低温で稼動でき、取扱いが容易で、かつ出力密度が高い固体高分子形が、自動車や家庭用の電源として期待されている。
【0003】
固体高分子形燃料電池を特に自動車用燃料電池として実用化するためには、更なる小型化及び高出力化が求められている。そのためには、電解質を薄膜化し、燃料電池そのものの容積を小さくすると同時に、燃料電池内の内部抵抗を低減することが必要である。このため、従来のフッ素系電解質膜に加えて、炭化水素系電解質膜の開発が進められている。炭化水素系電解質膜は、上記フッ素系電解質膜と比較すると、原料が安価で製造工程が簡便であり、さらに材料の選択性が高いという利点がある。しかし、これまでに開発されてきた炭化水素系電解質膜は多くが高耐熱性かつ高剛性のスーパーエンジニアリングプラスチックスをベースとするため、剛性は強いが柔軟性に乏しく、靭性が本質的に弱いという問題点がある。さらに、高温条件下でスルホン酸基が脱離する等の問題も知られており、これらの問題点の解決が望まれている。
【0004】
最近では、機械的強度を改善する目的で、側鎖に電離性官能基を備えたポリウレア電解質及びそれを用いた燃料電池が開示されている(例えば、特許文献1及び2参照)。また、ポリウレア樹脂の多孔膜にアクリルアミド系の電解質を充填したプロトン伝導性複合膜も提案されている(例えば、特許文献3参照)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2006−040709号公報
【特許文献2】特開2006−120518号公報
【特許文献3】特開2007−207522号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、上記特許文献1及び2のポリウレア電解質において、側鎖は、ウレア樹脂の合成後にウレア結合部位の活性水素を利用して後から付加されたものである。そのため、活性水素を失うことでウレア結合部位間の凝集力が低下して機械的強度が低下すると共に耐酸性及び耐水性が低下するという問題がある。
【0007】
また、上記特許文献3のプロトン伝導性複合膜では、電解質がポリウレア樹脂の多孔膜の孔部分に偏在する。そのため、膜全体としてはプロトン伝導抵抗が上昇してしまうという問題がある。また、プロトン伝導抵抗を下げるために薄膜化すると、多孔質基材の機械的強度が低下してしまう。加えて、上記プロトン伝導性複合膜では、アクリルアミドが加水分解し、スルホン酸が脱離しやすいという問題もある。
【0008】
本発明は、このような従来技術の有する課題に鑑みてなされたものである。そして、その目的は、機械的強度、耐水性、耐酸性及び耐久性に優れたポリウレア電解質及びその製造方法を提供することにある。
【課題を解決するための手段】
【0009】
本発明のポリウレア電解質は、2以上のイソシアネート基を有する第一化合物と、2以上のアミノ基を有する第二化合物とを重合させることにより形成されるポリウレア樹脂を含有する。そして、第一化合物又は第二化合物が10以上の炭素連鎖を含み、かつ、第一化合物又は第二化合物がスルホン酸基又はカルボン酸基を含む。
【0010】
本発明のポリウレア電解質の製造方法は、第一化合物又は第二化合物におけるスルホン酸基又はカルボン酸基を中和剤により中和する工程と、中和工程後に、第一化合物及び第二化合物を重合する工程と、重合工程後に、第一化合物及び第二化合物の重合体から中和剤を除去する工程と、を有する。
【発明の効果】
【0011】
本発明のポリウレア電解質は、分子内にハードセグメントとなるウレア結合を含んでいるため、機械的強度に優れる。さらに、分子内にソフトセグメントとなる10以上の炭素連鎖からなる構造が含まれるため、柔軟性にも優れる。また、上記ポリウレア電解質における10以上の炭素連鎖が比較的強い疎水性を示し、酸及び水の接近からウレア結合部位を保護することから、耐酸性及び耐水性にも優れる。
【図面の簡単な説明】
【0012】
【図1】図1は、本発明の実施形態に係るポリウレア電解質を電解質膜として使用した固体高分子形燃料電池の単セルを示す概略図である。
【図2】図2は、本発明の実施形態に係る燃料電池を搭載した自動車を示す概略図である。
【発明を実施するための形態】
【0013】
以下、本発明の実施形態に係るポリウレア電解質及びその製造方法について、図面を用いて詳細に説明する。なお、図面の寸法比率は説明の都合上誇張されており、実際の比率とは異なる場合がある。
【0014】
[ポリウレア電解質]
本発明の実施形態に係るポリウレア電解質は、2以上のイソシアネート基(−NCO)を有する第一化合物と、2以上のアミノ基(−NH2)を有する第二化合物とを重合させることにより形成されるポリウレア樹脂を備える。そして、上記第一化合物又は第二化合物が10以上の炭素連鎖を含み、かつ、第一化合物又は第二化合物がスルホン酸基(−SO3H)又はカルボン酸基(−CO2H)を含むことを特徴とする。
【0015】
より詳細に説明すると、化学式1に示すように、2以上のイソシアネート基を有する第一化合物(イソシアネート化合物)と、2以上のアミノ基を有する第二化合物(アミノ化合物)とを重合させることにより、ウレア結合を有するポリウレア樹脂を得ることができる。そして、上記ポリウレア樹脂では、第一化合物における分子鎖R1又は第二化合物における分子鎖R2が10以上の炭素連鎖を含んでいる。さらに、第一化合物における分子鎖R1又は第二化合物における分子鎖R2がスルホン酸基又はカルボン酸基を含んでいる。
【0016】
【化1】

【0017】
上記ポリウレア電解質内の炭素連鎖は主鎖方向に連続する炭素原子を意味し、その数は通常10以上である。本実施形態における炭素原子数は、好ましくは10〜300、より好ましくは10〜130、更により好ましくは12〜100、更により好ましくは12〜80である。炭素連鎖がこの範囲内であることにより、十分な耐水性、耐酸性、柔軟性及びプロトン伝導性を得ることができる。
【0018】
炭素連鎖の構造は特に制限されないが、例えば、高級アルカン、高級アルケン、高級シクロアルカン、高級シクロアルケン及びこれらの二量体や三量体とすることができる。さらに炭素連鎖としては、1,3−ブタジエン、イソプレン、2,3−ジメチル−1,3−ブタジエン及び1,3−ぺンタジエン等の共役ジエン化合物や、エチレン、プロピレン、ブテン等のオレフィン化合物など、ヘテロ元素を含有しない化合物を重合した構造とすることもできる。なお、共役ジエン化合物を用いる場合、必要に応じて不飽和結合への水素添加を行ってもかまわない。
【0019】
炭素連鎖には、本発明の目的を損なわない範囲で側鎖を備えることが可能である。ただ、炭素連鎖による十分な疎水性を確保するため、ヘテロ元素を含有しない側鎖が好ましい。
【0020】
10以上の炭素連鎖を含む第一化合物又は第二化合物の分子量は特に限定されないが、200〜3700、好ましくは200〜1700、より好ましくは200〜1200である。この範囲内であることにより、柔軟性、機械的強度、耐水性、耐酸性、耐久性及びプロトン伝導性に優れた電解質を得ることができる。
【0021】
本実施形態に係る電解質における当量重量は特に限定されないが、2000以下、好ましくは1500以下、より好ましくは1000以下、更に好ましくは800以下、特に好ましくは500以下である。また、上記当量重量は、300以上であることが好ましい。上記当量重量とは、ポリウレア電解質におけるスルホン酸基の当量重量、又はポリウレア電解質におけるカルボン酸基の当量重量を意味する。また、スルホン酸基の当量重量とはスルホン酸基当量当たりの膜重量を意味し、カルボン酸基の当量重量とはカルボン酸基当量当たりのポリウレア電解質の膜重量を意味する。上記当量重量が2000以下であることにより、十分なプロトン伝導性を得ることができる。また300以上であることにより、耐水性、耐酸性、耐久性及び機械的強度が向上し、燃料電池用電解質として好ましく使用することができる。
【0022】
上述のように、本実施形態に係る電解質は、10以上の炭素連鎖と、スルホン酸基又はカルボン酸基とを含んでいることが必要である。そして、第一化合物及び第二化合物の少なくともいずれか一方が10以上の炭素連鎖を含んでいれば良く、両方とも含んでいても良い。つまり、上記化学式1における分子鎖R1及びR2の少なくともいずれか一方が10以上の炭素連鎖を含んでいれば良い。また、第一化合物及び第二化合物の少なくともいずれか一方がスルホン酸基又はカルボン酸基を含んでいれば良く、スルホン酸基及びカルボン酸基の両方を含んでいても良い。つまり、上記化学式1における分子鎖R1及びR2の少なくともいずれか一方がスルホン酸基又はカルボン酸基を含んでいれば良く、スルホン酸基及びカルボン酸基の両方を含んでいても良い。
【0023】
第一化合物又は第二化合物のいずれか一方が10以上の炭素連鎖を有し、かつ、スルホン酸基又はカルボン酸基を含む場合、第一化合物又は第二化合物の他方は10以上の炭素連鎖を有さなくても良く、かつ、スルホン酸基及びカルボン酸基を含まなくても良い。
【0024】
本実施形態の電解質の好ましい例としては、(A)第一化合物が10以上の炭素連鎖を含み、かつ、第二化合物がスルホン酸基又はカルボン酸基を含む場合が挙げられる。また、好ましい例として、(B)第一化合物がスルホン酸基又はカルボン酸基を含み、かつ、第二化合物が10以上の炭素連鎖を含む場合も挙げられる。そして、本実施形態の電解質で最も好ましい例は、上記(A)の場合であり、以下に例を用いて説明する。
【0025】
<第一化合物>
本実施形態における2以上のイソシアネート基を有する第一化合物は、10以上の炭素連鎖を含むイソシアネート化合物であることが好ましい。このような第一化合物としては、特に限定はされないが、(a)共役ジエン系のグリコール及びその水添物の両末端をイソシアネート基に変換した化合物が挙げられる。
【0026】
上記共役ジエン系のグリコール及びその水添物としては、特に限定されないが、1,4−結合や1,2−結合を含有するポリブタジエングリコール及びその水添物や、ポリイソプレングリコール及びその水添物が好ましい。また、より好ましくは、1,4−結合や1,2−結合を含有するポリブタジエングリコール又はポリイソプレングリコールの水添物である。ポリブタジエン系グリコールとしては、化学式2に代表されるような構造が好ましい。
【0027】
【化2】

なお、式中のxは1,2−結合の重合度を表し、yは1,4−結合の重合度を表す。
【0028】
また、ポリイソプレン系グリコールの水添物としては、例えば、化学式3に代表されるような構造が好ましい。
【0029】
【化3】

なお、式中のzは重合度を表す。
【0030】
さらに、第一化合物としては、(b)水酸基、カルボン酸基又はアミン基を含む植物性油の両末端をイソシアネート基に変換した化合物が挙げられる。なお、植物性油としては、例えば乾性油(亜麻仁油、桐油、紫蘇油及び向日葵油等)や半乾性油(菜種油、米糠油、コーン油、綿実油及びゴマ油等)が挙げられる。
【0031】
上記(a)共役ジエン系のグリコール及びその水添物及び(b)水酸基、カルボン酸基又はアミン基を含む植物性油の両末端をイソシアネート基に変換する手法としては、特に限定されることなく、公知の手法を用いることができる。例えば、上記(a)及び(b)の末端水酸基と、低分子量のイソシアネート化合物とを結合させ、ウレタン結合(−NHC(=O)O−)を形成することにより、末端をイソシアネート基とすることができる。
【0032】
上記低分子量のイソシアネート化合物としては、例えば、2,4−又は2,6−トリレンジイソシアネート、4,4’−又は2,4’−ジフェニルメタンジイソシアネート、イソホロンジイソシアネートを用いることができる。なお、以下、2,4−又は2,6−トリレンジイソシアネートをTDIと略記し、4,4’−又は2,4’−ジフェニルメタンジイソシアネートをMDIと略記し、イソホロンジイソシアネートをIPDIと略記する。
【0033】
さらに第一化合物としては、(c)カルボン酸基又はアミン基を含有する植物性油におけるカルボン酸基又はアミン基をイソシアネート基に変換した化合物が挙げられる。(c)カルボン酸基又はアミン基を含有する植物性油におけるカルボン酸基又はアミン基をイソシアネート基に変換する手法としては、特に限定されることなく、公知の手法を用いることができる。
【0034】
上記第一化合物の別の好ましい化合物の一つとして、ダイマー酸ジイソシアネートがある。ダイマー酸イソシアネートとは、2つの脂肪酸を2量化した化合物から誘導されるイソシアネートであり、分子内に長鎖の炭化水素構造をもつことが特徴である。ダイマー酸イソシアネートとは、例えば化学式4に代表されるような構造を有している。
【0035】
【化4】

なお、式中のR3及びR5は直鎖状のアルキル基であり、R4及びR6は直鎖状のアルキレン基である。
【0036】
第一化合物として、ダイマー酸ジイソシアネートを用いた場合、脂肪族ジイソシアネートを用いた場合と比べて、その特徴的な構造から、優れた耐水性、耐酸性及び柔軟性を発現したポリウレア電解質を得ることが出来る。
【0037】
そして、ダイマー酸イソシアネートの中でも、オレイン酸とリノール酸を二量体化した化合物から誘導されるジイソシアネートを用いることが好ましいが、本発明はこれに限定されない。オレイン酸とリノール酸を二量体化したダイマー酸の例として、化学式5に示す非環型や単環型が挙げられる。さらに、化学式5に示すように、ダイマー酸の末端カルボン酸基を公知の方法によりイソシアネート基に置換した化合物を第一化合物として使用することができる。
【0038】
【化5】

【0039】
さらに第一化合物としては、例えば、ノルボルナンジイソシアネート、ジシクロヘキシルジイソシアネート及びテトラメチルキシリレンジイソシアネートを用いることも可能である。
【0040】
本実施形態におけるポリウレア電解質では、上述の第一化合物を使用することが好ましい。しかし、上記第一化合物として、10以上の炭素連鎖と、スルホン酸基又はカルボン酸基とを含まないイソシアネート化合物(A−1)を併用しても良い。併用できるイソシアネート化合物(A−1)としては、特に限定されないが、芳香族ポリイソシアネート、脂肪族ポリイソシアネート、脂環式ポリイソシアネート及びこれらのプレポリマー等が挙げられる。
【0041】
イソシアネート化合物(A−1)のうち、芳香族ポリイソシアネートとしては、例えば、1,3−又は1,4−フェニレンジイソシアネート、TDI、MDI、1,5−ナフタレンジイソシアネート、m−キシリレンジイソシアネート,テトラメチルキシリレンジイソシアネート及びこれらの誘導体が挙げられる。
【0042】
イソシアネート化合物(A−1)のうち、脂肪族ポリイソシアネートとしては、例えば、テトラメチレンジイソシアネート及びヘキサメチレンジイソシアネート、リジントリイソシアネート及びこれらの誘導体が挙げられる。
【0043】
イソシアネート化合物(A−1)のうち、脂環式ポリイソシアネートとしては、例えば、IPDI、ジシクロヘキシル−4,4’−ジイソシアネート、1,3−ビス(イソシアネートメチル)シクロヘキサン、ノルボルネンジイソシアネート、トランス−シクロヘキサンジイソシアネート及びこれらの誘導体が挙げられる。
【0044】
イソシアネート化合物(A−1)のうち、好ましくは、芳香族ポリイソシアネート、より好ましくは、TDI、MDI及びその誘導体である。また、第一化合物へのイソシアネート化合物(A−1)の添加量は、第一化合物全体を100部としたときに、20部以下、好ましくは10部以下である。
【0045】
<第二化合物>
本実施形態における2以上のアミノ基を有する第二化合物は、スルホン酸基又はカルボン酸基を含む化合物であることが好ましい。さらに上記第二化合物は、スルホン酸基を含み、かつ、芳香環を有する化合物であることがより好ましい。
【0046】
上記第二化合物の代表的な化合物として、スルホン酸ジアミンを好適に用いることができる。スルホン酸ジアミンの製造方法は特に限定されず、公知の手法を用いることができるが、例えば、芳香族ジアミンを濃硫酸等のスルホン化剤によりスルホン化することにより得ることができる。
【0047】
スルホン酸ジアミンの例としては、2,2’−ベンジジンジスルホン酸、ジアミノベンゼンスルホン酸、(4,4’−ジアミノジフェニルエーテル)スルホン酸、(4,4’−ジアミノジフェニルスルホン)スルホン酸、2,2’−ビス[4−(4−アミノフェノキシ)フェニル]プロパンスルホン酸、ビス[4−(4−アミノフェノキシ)フェニル]スルホン−スルホン酸、1,3−ビス(4−アミノフェノキシ)ベンゼンスルホン酸、(9,9−ビス(4−アミノフェニル)フルオレンスルホン酸等を挙げることができる。なお、以下、2,2’−ベンジジンジスルホン酸をBDSと略記し、ジアミノベンゼンスルホン酸をDABSと略記し、(4,4’−ジアミノジフェニルエーテル)スルホン酸をS−DPEと略記し、2,2’−ビス[4−(4−アミノフェノキシ)フェニル]プロパンスルホン酸をS−BAPPと略記し、ビス[4−(4−アミノフェノキシ)フェニル]スルホン−スルホン酸をS−BAPSと略記する。
【0048】
さらに、スルホン酸ジアミンは、分子中に芳香環を1個以上有する化合物が好ましく、スルホン酸が芳香環に結合した化合物がより好ましい。これらスルホン酸ジアミンのうち、上記第一化合物との反応性及びプロトン伝導性の観点から、BDS、DABS、S−DPE、S−BAPP及びS−BAPSが特に好ましい。
【0049】
上述のような第一及び第二化合物を用いたポリウレア電解質の一例としては、化学式6に記載したポリウレア樹脂があげられる。化学式6のポリウレア樹脂は、オレイン酸とリノール酸を二量体化した単環型のダイマー酸の末端カルボン酸をイソシアネート基に置換したイソシアネート化合物と、(4,4’−ジアミノジフェニルエーテル)ジスルホン酸とを重合したものである。
【0050】
【化6】

【0051】
上述のように、本実施形態に係るポリウレア電解質は、分子内にウレア結合を含んでいる。そして、このウレア結合部位が凝集エネルギーの高いハードセグメントを形成するため、機械的強度に優れた電解質を得ることができる。さらに、上記ポリウレア電解質は、分子内に10以上の炭素連鎖からなる構造が含まれる。そして、この炭素連鎖がソフトセグメントを形成するため、柔軟性にも優れた電解質を得ることができる。
【0052】
なお、本実施形態に係るポリウレア電解質が優れた耐酸性及び耐水性を持つ理由は明らかではない。ただ、分子内に存在する10以上の炭素連鎖が比較的強い疎水性を示す。そのため、ウレア結合部位の分解原因となり得る酸及び水の接近からウレア結合部位を保護することから、耐酸性及び耐水性に優れると予想することができる。
【0053】
また、上述のように、第一化合物として、(a)共役ジエン系のグリコール及びその水添物の両末端をイソシアネート基に変換した化合物や(b)水酸基、カルボン酸基又はアミン基を含むの両末端をイソシアネート基に変換した化合物を使用する場合には、第一化合物内にウレタン結合(−NHC(=O)O−)が含まれる場合がある。そして、ウレタン結合部位も酸及び水により分解する虞がある。しかし、上述のように、本実施形態のポリウレア電解質では分子内に存在する10以上の炭素連鎖が比較的強い疎水性を示すため、ウレタン結合部位が酸及び水から保護され、分解が抑制される。
【0054】
上述のように、本実施形態に係るポリウレア電解質は、2以上のイソシアネート基を有する第一化合物と、2以上のアミノ基を有する第二化合物とを重合させることにより形成されるポリウレア樹脂を備え、第一化合物又は第二化合物がスルホン酸基(−SO3H)又はカルボン酸基(−CO2H)を含むことを特徴とする。これに対し、特許文献1及び2のポリウレア電解質はポリウレア樹脂のウレア結合部位に、後からスルホン酸基又はカルボン酸基を導入している。つまり、特許文献1及び2では、ウレア結合部位に直接スルホン酸基等が結合している。この場合、ウレア結合部位における凝集力が低下してしまう。これに対し、本実施形態に係るポリウレア電解質は、ウレア結合部位にスルホン酸基やカルボン酸基を結合させているわけではなく、第一化合物及び第二化合物の分子鎖R1及びR2にスルホン酸基やカルボン酸基を結合させている。そのため、ウレア結合部位における凝集力が高いため、機械的強度に優れた電解質を得ることができる。
【0055】
[ポリウレア電解質の製造方法]
本発明の実施形態に係るポリウレア電解質の製造方法は、次の工程を有することを特徴とする。
(a)第一化合物又は第二化合物におけるスルホン酸基又はカルボン酸基を中和剤により中和する工程
(b)中和工程後に、第一化合物及び第二化合物を重合する工程
(c)重合工程後に、第一化合物及び第二化合物の重合体から中和剤を除去する工程
【0056】
上記製造方法は、スルホン酸基又はカルボン酸基に対して、中和剤を用いることを特徴としており、特に第二化合物たるスルホン酸ジアミンに対して特定の中和剤を用いることを特徴とする。上記スルホン酸ジアミンは通常溶媒に難溶であるが、特定の中和剤を用いることにより、中和と同時に溶媒に対する溶解性を改善することが可能となる。なお、従来よりスルホン酸ジアミンに中和剤を用いることで可溶化できることは知られている。しかし、本発明者らは、鋭意検討の結果、スルホン酸ジアミンを特定のアルキルアミンで中和することにより、第一化合物の溶媒に対する溶解性も改善され、スルホン酸ジアミンと第一化合物が好適に反応することを見出した。
【0057】
このような中和剤としては、脂肪族3級アミン及び環状3級アミンを使用することが好ましい。脂肪族3級アミンの例としては、トリアルキルアミンが挙げられる。また、環状3級アミンの例としては、窒素が1個の化合物としてピリジン等が挙げられ、窒素が2個の化合物としてトリエチレンジアミン、1,8−ジアザビシクロ[5.4.0]ウンデセン−7、1,5−ジアザビシクロ[4.3.0]ノネン−7等が挙げられる。なお、以下、トリエチレンジアミンをTEDAと略記し、1,8−ジアザビシクロ[5.4.0]ウンデセン−7をDBUと略記し、1,5−ジアザビシクロ[4.3.0]ノネン−7をDBNと略記する。
【0058】
このような脂肪族3級アミン及び環状3級アミンのうち、長鎖アルキル基を有するトリアルキルアミンが好ましい。長鎖アルキル基を有するトリアルキルアミンのアルキル基の炭素数は6以上、好ましくは8以上、より好ましくは10以上、更により好ましくは12以上である。中でも、炭素数が12のアルキル基を含有するドデシルジメチルアミン等を好適に用いることができる。
【0059】
上記中和剤の添加量は、スルホン酸基又はカルボン酸基1モルに対し、化学量論的に0.9〜1.1モルの範囲で添加すれば良い。また、スルホン酸基又はカルボン酸基1モルに対し、1.0モル添加することがより好ましい。
【0060】
中和剤の除去方法およびプロトン置換方法は、公知の方法を用いることができ、特に限定はされない。例えば、合成物を塩酸水溶液や塩酸−アルコール混合溶液等によりプロトン置換し、水洗、乾燥することにより中和剤を除去することができる。なお、このときの合成物の形状は、ブロック状や膜状等、如何なる形状であってもかまわないが、製膜してから中和及びプロトン置換をする方が好ましい。
【0061】
本実施形態に係るポリウレア電解質における第一化合物と第二化合物の重合方法は特に限定されないが、溶液重合法、界面重合法、懸濁重合法及び乳化重合法などの公知の方法が適用できる。
【0062】
上記溶液重合法の場合は、例えば、溶媒中で、中和剤を用いてスルホン酸基又はカルボン酸基を有する第二化合物を中和して溶解し、その後、第一化合物を添加して重合することが出来る。ここで用いる溶媒としては、ジメチルホルムアミド、ジメチルアセトアミド、ジメチルスルホキシド、N−メチルピロリドン等、ウレタン溶媒として公知のものを使用することができる。また、重合温度は、通常20℃〜150℃、好ましくは40℃〜120℃である。重合温度をこの範囲内とすることにより、重合反応が効率的に進行し、さらに架橋を生じる副反応を抑制することができる。
【0063】
上記界面重合法の場合は、例えば、親水系溶媒に中和済みの第二化合物を溶解し、疎水系溶媒に第一化合物を溶解し、両者の界面で重合することができる。
【0064】
上記製造方法においては、必要により公知のウレタン用触媒を使用して重合反応を促進しても良い。このような重合触媒としては特に限定はされないが、有機錫(ジブチル錫ジラウレート及びオクチル錫等)及び3級アミン(TEDA、DBU、DBN等)を挙げることができる。これらのうち、好ましいものは3級アミンであり、DBU及びDBNがより好ましい。通常、第二化合物としてスルホン酸ジアミンを使用した場合、反応性が低いため、高分子量のポリマーを効率的に調製できない場合があるが、触媒を使用することにより高分子量のポリマーを効率的に調製することができる。
【0065】
上記製造方法において、電解質としての性能を向上させるために、必要により各種添加剤を使用しても良い。添加剤としては、オレフィン系エマルジョン(例えば、ポリエチレンエマルジョン、EPDMエマルジョン、ポリブタジエン、ポリイソプレン及びポリスチレンイソプレン等)等を挙げることができるが、特にこれらに限定されるものではない。上記添加剤は、重合時の溶媒に添加することが好ましい。
【0066】
上記製造方法において、第一化合物と第二化合物を重合させる時に、反応溶液にマイクロ波を照射することにより、重合体の分子量を向上させることができる場合がある。マイクロ波とは、波長が1m(周波数300MHz)〜1mm(周波数300GHz)の電磁波をいう。このようなマイクロ波としては、反応促進効果の観点から周波数300MHz〜3GHzのマイクロ波が好ましく、例えば、一般的に加熱に用いられている周波数2.45GHzのマイクロ波を使用しても良い。
【0067】
[燃料電池及び自動車]
本発明の実施形態に係る燃料電池は、上記ポリウレア電解質を燃料電池用電解質膜として使用することを特徴とする。上述のように、本発明のポリウレア電解質は、柔軟性、機械的強度、耐酸性、耐水性及び耐久性が優れている。さらに、ポリウレア電解質はスルホン酸基又はカルボン酸基が結合されているため、高いプロトン伝導性も示す。そのため、この電解質を燃料電池用電解質膜として使用した場合、耐酸性、耐水性、耐久性及び機械的強度に優れた膜電極接合体(MEA)を得ることができる。また、このような膜電極接合体は薄膜化が可能なため、燃料電池は更なる小型化及び高出力化を可能とする。
【0068】
ポリウレア電解質からなる燃料電池用電解質膜は、ダイレクトメタノール形燃料電池(DMFC)や固体高分子形燃料電池(PEFC)に使用することができる。図1では、ポリウレア電解質を電解質膜として使用した固体高分子形燃料電池の単セルの構成を示す。図1に示すように、上記燃料電池(単セル)10は、固体高分子電解質膜1の両側に正極2及び負極3を接合して一体化した膜電極接合体を有する。正極2及び負極3は、触媒層4及びガス拡散層5(GDL)を備えた二層構造であり、触媒層4は固体高分子電解質膜1に接触している。正極2及び負極3の両側には、正極側セパレータ6及び負極側セパレータ7が各々設置されている。そして、正極側セパレータ6及び負極側セパレータ7により、酸素ガス流路、水素ガス流路及び冷却水流路が形成されている。
【0069】
上記燃料電池10では、負極3側に、水素、窒素及び水蒸気の混合ガスを供給し、正極2側に空気及び水蒸気を供給する。燃料の水素は負極3において電気化学的に酸化されて、プロトンと電子を生成する。このプロトンは電解質膜1内を通過し正極2に移動する。一方、負極3で生成した電子は燃料電池10に接続された外部負荷8を通り、正極2に流れ、正極2においてプロトンと酸素と電子が反応して水を生成する。
【0070】
本実施形態に係るポリウレア電解質を使用した上記電解質膜1は、機械的強度、特に引裂強度に代表される靭性(タフネス)に優れてるため、従来の電解質膜よりも膜厚を薄くすることが容易である。つまり、上記電解質膜1は、目的に応じて任意の膜厚にすることができるが、プロトン伝導性の面から薄いことが好ましく、通常1〜200μmである。この範囲内では、プロトン伝導性と機械的強度の両方に優れた電解質膜とすることができる。
【0071】
ダイレクトメタノール形燃料電池用の電解質膜として上記ポリウレア電解質を使用する場合、膜厚は200μm以下、好ましくは100μm以下、より好ましくは50μm以下、更に好ましくは20μm以下、特に好ましくは10μm以下、極めて好ましくは5μm以下、最も好ましくは1μmである。また、固体高分子形燃料電池用の電解質膜として上記ポリウレア電解質を使用する場合、膜厚は30μm以下、好ましくは20μm以下、より好ましくは10μm以下、更に好ましくは5μm以下、特に好ましくは1μmである。
【0072】
燃料電池用電解質膜に本発明のポリウレア電解質を用いる場合には、上記ポリウレア電解質のほかに、他のフッ素系電解質や炭化水素系電解質を混合しても良い。しかし、上記電解質膜においては、本発明のポリウレア電解質を少なくとも50重量%以上含有することが好ましく、80重量%以上含有することがより好ましい。また、上記電解質膜が本発明のポリウレア電解質のみから形成されていても構わない。
【0073】
本発明のポリウレア電解質を、燃料電池で使用する電解質膜に成形する方法としては、様々な公知の方法を使用することができ、特に限定されるものではない。具体的には、上記第一化合物及び第二化合物を重合した後、塩酸水溶液等で中和剤を除去してプロトン置換し、水洗、乾燥することで電解質膜を得ることができる。
【0074】
上記燃料電池における触媒層は導電材、バインダ及び触媒金属を含有していることが好ましい。導電材としては、電気伝導性物質であればいずれのものでも良く、各種金属や炭素材料等を使用することができる。例えばアセチレンブラック等のカーボンブラック、活性炭及び黒鉛等が使用でき、これらを単独あるいは混合して使用することができる。
【0075】
バインダとしては、本発明のポリウレア電解質を使用することが好ましいが、特に限定されるものではない。さらにバインダに他の樹脂を添加しても良い。その場合、添加する樹脂としては撥水性を有するフッ素樹脂等が挙げられる。フッ素樹脂の中でも融点が400℃以下のものが好ましく、例えばポリテトラフルオロエチレン、テトラフルオロエチレン−パーフルオロアルキルビニルエーテル共重合体等が挙げられるが、特に限定されるものではない。
【0076】
触媒金属としては、水素の酸化反応及び酸素の還元反応を促進する金属であれば、特に限定されない。触媒金属としては、例えば鉛、鉄、マンガン、コバルト、クロム、ガリウム、バナジウム、タングステン、ルテニウム、イリジウム、パラジウム、白金、ロジウム又はそれらの合金が挙げられる。
【0077】
本発明の電解質膜を有する燃料電池は、耐久性に優れるため、システムの起動及び停止や出力変動が頻繁に発生する自動車用途において、特に好適に利用できる。図2には、本発明に係る燃料電池10を搭載した自動車20の外観を示す。図2の燃料電池自動車では、車体21のフロント部に燃料電池10を搭載しているが、如何なる場所に燃料電池10を搭載しても構わない。
【実施例】
【0078】
以下、本発明を実施例により更に詳細に説明するが、本発明はこれら実施例に限定されるものではない。
【0079】
(当量重量の測定法)
電解質の当量重量(EW)は、イオン交換容量(IEC)を測定し、換算して算出した。また、IECは次のようにして測定した。まず、プロトン型の電解質をおよそ0.1g計量し、0.1Nの水酸化ナトリウム水溶液20mlに浸漬した。次に、この混合物を室温で攪拌しながら一晩放置した。その後、自動滴定装置(東亜ディーケーケー株式会社製)及びpH複合電極(東亜ディーケーケー株式会社製)を用いて、0.1Nの塩酸水溶液によりpH7.0を終点とした中和滴定を行った。塩酸の滴定量から、電解質のイオン交換により消費された水酸化ナトリウム量を求め、式(1)からイオン交換容量を算出した。
イオン交換容量(meq/g)=0.1×(20×F1−A×F2)/W・・・(1)
ここで、F1は滴定用水酸化ナトリウム水溶液のファクタ、F2は滴定用塩酸水溶液のファクタであり、Aは塩酸水溶液の滴定量(ml)、Wは膜重量(g)である。
【0080】
そして、EWは、上記方法によって得られたIECから、式(2)より算出した。
EW=1000/IEC・・・(2)
【0081】
なお、耐水性、耐酸性及び膜強度の評価は、電解質を電解質膜にした後に実施した。
【0082】
(耐水性の評価法)
電解質膜を50mlの純水に投入し、105℃にて静置した。20時間後、膜を取り出し、80℃にて15時間以上減圧乾燥し、膜の外観を実体顕微鏡にて観察した。なお、耐水性の評価基準は、以下の通りである。
○:膜表面は平滑でクラックがない
×:膜の形態を保持できない、又は膜表面にクラックが認められる
【0083】
(耐酸性の評価法)
電解質膜を80℃にて減圧乾燥し、試験前乾燥重量(w1)を計量した。次に乾燥後の電解質膜を10重量%の塩酸水溶液50mlに投入し、80℃にて静置した。20時間後、電解質膜を回収し、大量の純水で洗浄後、80℃にて減圧乾燥し、試験後乾燥重量(w2)を計量した。そして、試験前後の乾燥重量から、式(3)より重量減少率を算出した。
重量減少率(%)=(w1−w2)/w1×100・・・(3)
【0084】
上記重量減少率が小さい程、耐酸性に優れた電解質膜であることを意味し、重量減少率が大きい程、耐酸性に劣った電解質膜であることを意味する。
【0085】
(膜強度の評価法)
膜強度の評価は、耐水性評価後の電解質膜に対する折り曲げ試験及び引張り試験により実施した。折り曲げ試験は、電解質膜の中央部を二つに折り曲げ、元の状態に戻したときの中央部を観察することにより実施した。また、引張り試験は、電解質膜を引張伸度100%まで引張った後、元の状態に戻したときの膜表面状態を観察することにより実施した。なお、膜強度の評価基準は、以下の通りである。
○:折り曲げ試験の結果、折り目において破断せず、折り目にも痕が残らない。さらに引張り試験においても破断しない。
×:折り曲げ試験の結果、破断する、又は折り目に痕が残る。また、引張り試験において破断が生じる。その他、膜が水溶性である。
【0086】
(実施例1)
まず、ジオキサン2.29gにジイソシアネート誘導体(商品名:DDI−1410、コグニスジャパン社製)1.00gを溶解させることにより溶液(I)を調製した。さらに、N,N−ジメチルホルムアミド2.7gにスルホン酸ジアミン(DABS)0.30g、中和剤(トリエチルアミン)0.114gを加え、溶解させることにより溶液(II)を調製した。次に耐圧容器中で溶液(I)と溶液(II)を混合し、100℃で24時間攪拌しながら重合した。その重合溶液をポリエチレン製のキャップに注入し、80℃で12時間乾燥した。乾燥後、中和剤を除去し、電解質膜を得た。この電解質膜のIECは1.24(EW:806)であり、耐水性及び膜強度は良好であった。なお、以下、N,N−ジメチルホルムアミドをDMFと略記し、トリエチルアミンをTEAと略記する。また、上記コグニスジャパン社のDDI−1410は、オレイン酸とリノール酸を二量体化した単環型のダイマー酸の末端カルボン酸を、イソシアネート基に置換した化合物である。
【0087】
(実施例2)
<(4,4’−ジアミノジフェニルエーテル)−2,2−ジスルホン酸(S−DPE)の合成>
20gの4,4’−オキシジニアニリンを95%硫酸17mlに溶解後、溶液を0℃まで冷却した。次に冷却した溶液に発煙硫酸(三酸化硫黄含有率:60%)35ml滴下した。この溶液を80℃で1時間攪拌後、室温まで冷却し、更に氷水で冷却することにより、固体を析出させ、これを濾別した。さらに濾別した固体を水酸化ナトリウム溶液に溶解した後、塩酸を加え、析出した固体を濾別、水洗、乾燥することにより、生成物を得た。得られた生成物は、プロトン核磁気共鳴分光法により、化学式7の構造を有する(4,4’−ジアミノジフェニルエーテル)−2,2−ジスルホン酸であるであることが確認された。
【0088】
【化7】

【0089】
<電解質膜の調製>
まず、上述のように合成したスルホン酸ジアミン(S−DPE)2.50g、イオン交換水22.50g及び中和剤(TEA)1.55gを溶解した溶液(I)と、ジイソシアネート誘導体(DDI−1410)をトルエンに溶解し、ジイソシアネート誘導体を20重量%とした溶液(II)とを作成した。次に溶液(I)5.31g及び溶液(II)4.39gを耐圧容器中に投入し、100℃で30時間攪拌しながら重合した。そして界面にできた重合液を実施例1と同様に処理して電解質膜を得た。この電解質膜のIECは1.20(EW:833)であり、耐水性及び膜強度は良好であった。耐酸性試験における重量減少率は0.8%と良好であり、極めて耐酸性に優れた電解質膜であった。
【0090】
(実施例3)
両末端に水酸基を有する液状ポリブタジエン(商品名:R−15HT、出光興産株式会社製)にイソシアネート誘導体(TDI−80)を付加し、NCO(イソシアネート基)が5.14%のプレポリマーを作成した。このプレポリマーをジオキサンに溶解し、プレポリマーを50重量%とした溶液(I)を調製した。さらに、ジメチルスルホキシド4.50gに、実施例2で合成したスルホン酸ジアミン(S−DPE)0.50g、中和剤(TEA)0.28gを加え、溶解させることにより溶液(II)を調製した。次に耐圧容器中で溶液(II)に溶液(I)を4.78g加え、80℃で3時間攪拌しながら重合した。その重合液を、実施例1と同様に処理して電解質膜を得た。この電解質膜のIECは1.09(EW:917)であり、耐水性及び膜強度は良好であった。なお、上記TDI−80は、トルエン−2,4−ジイソシアネート80%、トルエン−2,6−ジイソシアネ−ト20%の混合物を示す。
【0091】
(実施例4)
スルホン酸ジアミン(DABS)1.30gをDMF13gに懸濁し、ここに中和剤として、長鎖3級アミン(ジメチルラウリルアミン、日油株式会社製、商品名:ニッサンアミンBB)1.47gを添加し、DABSが完全に溶解した溶液(I)を調製した。さらにジイソシアネート誘導体(DDI−1410)をDMFに溶解し、ジイソシアネート誘導体を50重量%とした溶液(II)を調製した。次に耐圧容器中に、溶液(I)3.25g、溶液(II)1.76g、触媒(DBU)をジイソシアネート誘導体に対して1重量%となるように加え、60℃で24時間攪拌しながら重合した。得られた重合液を、実施例1と同様に処理して電解質膜を得た。この電解質膜のIECは1.23(EW:813)であり、耐水性及び膜強度は良好であった。
【0092】
(実施例5)
放射温度計を備えたマイクロ波照射装置(CEM社製、Discover、シングルモード型)を用いて、2.45GHzのマイクロ波を60℃で10分照射したこと以外は、実施例4と同様の方法にして、電解質膜を得た。この電解質膜のIECは1.20(EW:833)であり、耐水性及び膜強度は良好であった。
【0093】
(実施例6)
<ビス[4−(4−アミノフェノキシ)フェニル]スルホン−3,3’−ジスルホン酸(S−BAPS)の合成>
25gのビス[4−(4−アミノフェノキシ)フェニル]スルホンを95%硫酸17mlに溶解後、溶液を0℃まで冷却した。次に冷却した溶液に発煙硫酸(三酸化硫黄含有率:60%)35ml滴下した。この溶液を80℃で1時間攪拌後、室温まで冷却し、更に氷水で冷却することにより、固体を析出させ、これを濾別した。さらに濾別した固体を水酸化ナトリウム溶液に溶解した後、塩酸を加え、析出した固体を濾別、水洗、乾燥することにより、生成物を得た。得られた生成物を少量のトリエチルアミン(TEA)を加えた重水素化ジメチルスルホキシドに溶解させ、生成物のTEA塩をプロトン核磁気共鳴分光法により分析した。その結果、1.00〜1.18ppmと2.70〜2.82ppmにTEAのアルキル基の水素に基づくシグナルが観測され、さらに6.59〜6.62ppm(d)、6.73〜6.76ppm(d)、7.72〜7.75ppm(d)、8.20ppm(s)にベンゼン間の水素に基づくシグナルが観測された。それぞれのシグナルの帰属と積分強度比から、生成物は、化学式8の構造を有するビス[4−(4−アミノフェノキシ)フェニル]スルホン−3,3’−ジスルホン酸であることが確認された。
【0094】
【化8】

【0095】
<電解質膜の調製>
20mlの密閉容器に、ジメチルホルムアミド2.41gと、上述のように合成したスルホン酸ジアミン(S−BAPS)0.2gと、TEA0.068gとを投入し、これらを溶解することにより、S−BAPS塩溶液を調製した。次に実施例3で使用した、両末端に水酸基を有する液状ポリブタジエンにイソシアネート誘導体を付加したプレポリマー0.58gをジオキサン5.2gに溶解し、プレポリマー溶液を調製した。このプレポリマー溶液をS−BAPS塩溶液に加え、窒素置換して攪拌し、反応液を調製した。その後、反応液をシリコーン容器に流し入れ、80℃で一晩乾燥することにより、電解質膜を得た。この電解質膜のIECは1.06(EW:943)であり、耐水性及び膜強度は良好であった。
【0096】
(実施例7)
実施例1にて作成したプロトン置換前の膜を使用して、プロトン置換法につき検討した。具体的には、まず、実施例1にて調製した重合溶液をポリエチレン製のキャップに注入し、80℃で12時間乾燥した。次に得られた乾燥膜を、濃塩酸をメタノールにて1mol/Lになるように希釈した塩酸メタノール溶液に浸積し、50℃で15時間処理することにより、電解質膜を得た。この電解質膜のIECは1.2(EW:833)であり、耐水性及び膜強度は良好であった。また、この電解質膜の引裂き強度は、500〜1000N/mであった。
【0097】
(比較例1)
耐圧容器に、実施例1で作成した溶液(II)3.46gと、ペンタメチレングリコールの両末端にイソシアネート誘導体(TDI−80)を付加したNCO9.47%のプレポリマー1.49gとを加え、80℃で24時間重合した。得られた重合液を、実施例1と同様に処理して電解質膜を得た。得られた電解質膜の強度は非常に弱く、ひび割れが多く発生した。また、この電解質膜のIECは1.04(EW:962)であったが、耐水性試験後のサンプル膜は形状保持が困難であった。
【0098】
(比較例2)
耐圧容器に、実施例1で作成した溶液(II)3.00gに、ウレタン変性MDI(BASF INOAC ポリウレタン株式会社製、商品名:ルプラネートMP−102)0.53gを加え、80℃で24時間重合した。得られた重合液を、実施例1と同様にして電解質膜を得た。全体的に均一な膜が作製できたが、膜強度が弱く、ひび割れが多く発生した。また、この電解質膜のIECは0.92(EW:1087)であったが、耐水性試験後のサンプル膜の形状保持は困難であった。耐酸性試験における重量減少率は21.3%であった。
【0099】
(比較例3)
イソシアネート(TDI)0.50g及びDMF0.50gを混合し、イソシアネートが50重量%の溶液(I)を作成した。次に耐圧容器に、溶液(I)0.3g及び実施例3で作成した溶液(II)3.17gを投入し、80℃で24時間重合した。得られた重合液を実施例1と同様にして乾燥し、中和剤を除去した。しかしながら、得られた電解質は水溶性であり、電解質膜を得ることができなかった。
【0100】
(比較例4)
耐圧容器に、実施例3で作成した溶液(II)3.17gと、ウレタン変性MDI(BASF INOAC ポリウレタン株式会社製、商品名:ルプラネートMP−102)0.32gとを投入し、80℃で24時間重合した。得られた重合液を実施例1と同様にして乾燥し、中和剤を除去した。しかしながら、得られた電解質は水溶性であり、電解質膜を得ることができなかった。
【0101】
上記実施例1〜5及び比較例1〜4の評価結果を表1に示す。表1より、実施例1〜7は、比較例1〜4と比べると、耐水性、耐酸性及び膜強度が良好な電解質膜が得られた。また比較例1〜4から、第一化合物の炭素連鎖数が10よりも小さい場合、得られる電解質膜は耐水性に乏しく、膜強度が弱いことが分かった。
【0102】
【表1】

【0103】
(実施例8)
実施例1におけるジイソシアネート誘導体の使用量を1.00gから0.95gに減らし、さらに溶液(I)と溶液(II)の反応温度を100℃から60℃にした以外は、実施例1と同様に電解質膜を調製した。なお、実施例8のNCO Indexは1.00とした。ここで、NCO Indexとは、第一化合物中のイソシアネート基のモル数と、第二化合物中のアミノ基のモル数の比([NCO]/[NH2])をいう。
【0104】
ゲル浸透クロマトグラフィを用いて実施例8で得られた電解質膜の分子量を測定した結果、重量平均分子量(Mw)は130000であった。ちなみに、実施例1ではNCO Indexを1.05とし、実施例1で得られた電解質膜の重量平均分子量は80000であった。実施例1及び実施例8より、ポリウレア電解質の分子量を上げるためには、NCO Indexを1.00に近づけたほうが望ましいことが分かった。
【0105】
(実施例9〜15)
第一化合物、第二化合物、溶媒、原料濃度、NCO Index及び反応温度を表2のように変更した以外は実施例1と同じ条件で電解質膜を調製した。また、実施例10及び13では、重合触媒としてジブチル錫ジラウレート(日東化成株式会社製、商品名:ネオスタンU−100)を使用した。得られた電解質膜及び重合溶液の評価結果を表3に示す。
【0106】
ちなみに、表3における粘度は、重合溶液の濃度が20%と40%のときの粘度を示している。また、重合溶液の粘度は、粘度計(ブルックフィールド社製、商品名:レオメーターHBDV−III−CP)を使用して、それぞれの濃度で測定した値である。
【0107】
また、表3におけるNCO反応率とは、反応終点における反応液をフーリエ変換赤外分光光度計(FT−IR)で調べた結果から、以下の式(4)のように定義した値である。
NCO反応率(%)=(1−Xt/X0)×100・・・(4)
A1:2272cm−1における吸光度
A2:2852cm−1における吸光度
X:NCO存在指標(=A1/A2)
X0:反応時間0分におけるNCO存在指標
Xt:反応時間t分におけるNCO存在指標
【0108】
さらに、表3における分岐・架橋量とは、プロトン核磁気共鳴分光法により観察されるウレア結合(−NHCONH−)に由来する6.0ppm付近のシグナルの積分値(A)と、そのNHがさらにNCOと反応して生成する分岐・架橋構造のビュレット結合(−N(CONH−)CONH−)に由来する5.7ppm付近のシグナルの積分値(B)の比(=B/(A+B))である。
【0109】
【表2】

【0110】
【表3】

【0111】
表3より、実施例9〜15の電解質膜のイオン交換容量(IEC)は1.25以下であり、また当量重量(EW)も1000以下であった。さらに、耐水性及び膜強度も良好であった。
【0112】
以上、実施形態及び実施例に沿って本発明の内容を説明したが、本発明はこれらの記載に限定されるものではなく、種々の変形及び改良が可能であることは、当業者には自明である。
【産業上の利用可能性】
【0113】
本発明のポリウレア電解質は、優れた機械的強度、耐水性、耐酸性及び耐久性を有する。そのため、各種燃料電池、例えば自動車用、移動通信体用及び家庭用等の燃料電池の電解質膜や電極触媒用のバインダとして好適に利用できる。
【符号の説明】
【0114】
1 電解質膜
2 正極
3 負極
4 触媒層
5 ガス拡散層
6 正極側セパレータ
7 負極側セパレータ
8 外部負荷
10 燃料電池
【特許請求の範囲】
【請求項1】
2以上のイソシアネート基を有する第一化合物と、2以上のアミノ基を有する第二化合物とを重合させることにより形成されるポリウレア樹脂を含有し、
前記第一化合物又は第二化合物が10以上の炭素連鎖を含み、かつ、第一化合物又は第二化合物がスルホン酸基又はカルボン酸基を含むことを特徴とするポリウレア電解質。
【請求項2】
前記第一化合物が10以上の炭素連鎖を含み、前記第二化合物がスルホン酸基又はカルボン酸基を含むことを特徴とする請求項1に記載のポリウレア電解質。
【請求項3】
前記第二化合物がスルホン酸基又はカルボン酸基を含み、かつ、芳香環を有することを特徴とする請求項1又は2に記載のポリウレア電解質。
【請求項4】
当量重量が300〜2000であることを特徴とする請求項1乃至3のいずれか一項に記載のポリウレア電解質。
【請求項5】
請求項1乃至4のいずれか一項に記載のポリウレア電解質からなり、膜厚が200μm以下であることを特徴とするポリウレア電解質膜。
【請求項6】
請求項5記載のポリウレア電解質膜を備えたことを特徴とする燃料電池。
【請求項7】
請求項6記載の燃料電池を備えたことを特徴とする自動車。
【請求項8】
2以上のイソシアネート基を有する第一化合物と、2以上のアミノ基を有する第二化合物とを重合させることにより形成されるポリウレア樹脂を備え、前記第一化合物又は第二化合物が10以上の炭素連鎖を含み、かつ、第一化合物又は第二化合物がスルホン酸基又はカルボン酸基を含むことを特徴とするポリウレア電解質の製造方法であって、
前記第一化合物又は第二化合物におけるスルホン酸基又はカルボン酸基を中和剤により中和する工程と、
前記中和工程後に、前記第一化合物及び第二化合物を重合する工程と、
前記重合工程後に、前記第一化合物及び第二化合物の重合体から前記中和剤を除去する工程と、
を有することを特徴とするポリウレア電解質の製造方法。
【請求項9】
前記中和剤が炭素数6以上のアルキルアミンであることを特徴とする請求項8に記載のポリウレア電解質の製造方法。
【請求項10】
前記重合工程がマイクロ波の照射下にて行われることを特徴とする請求項8又は9に記載のポリウレア電解質の製造方法。
【請求項1】
2以上のイソシアネート基を有する第一化合物と、2以上のアミノ基を有する第二化合物とを重合させることにより形成されるポリウレア樹脂を含有し、
前記第一化合物又は第二化合物が10以上の炭素連鎖を含み、かつ、第一化合物又は第二化合物がスルホン酸基又はカルボン酸基を含むことを特徴とするポリウレア電解質。
【請求項2】
前記第一化合物が10以上の炭素連鎖を含み、前記第二化合物がスルホン酸基又はカルボン酸基を含むことを特徴とする請求項1に記載のポリウレア電解質。
【請求項3】
前記第二化合物がスルホン酸基又はカルボン酸基を含み、かつ、芳香環を有することを特徴とする請求項1又は2に記載のポリウレア電解質。
【請求項4】
当量重量が300〜2000であることを特徴とする請求項1乃至3のいずれか一項に記載のポリウレア電解質。
【請求項5】
請求項1乃至4のいずれか一項に記載のポリウレア電解質からなり、膜厚が200μm以下であることを特徴とするポリウレア電解質膜。
【請求項6】
請求項5記載のポリウレア電解質膜を備えたことを特徴とする燃料電池。
【請求項7】
請求項6記載の燃料電池を備えたことを特徴とする自動車。
【請求項8】
2以上のイソシアネート基を有する第一化合物と、2以上のアミノ基を有する第二化合物とを重合させることにより形成されるポリウレア樹脂を備え、前記第一化合物又は第二化合物が10以上の炭素連鎖を含み、かつ、第一化合物又は第二化合物がスルホン酸基又はカルボン酸基を含むことを特徴とするポリウレア電解質の製造方法であって、
前記第一化合物又は第二化合物におけるスルホン酸基又はカルボン酸基を中和剤により中和する工程と、
前記中和工程後に、前記第一化合物及び第二化合物を重合する工程と、
前記重合工程後に、前記第一化合物及び第二化合物の重合体から前記中和剤を除去する工程と、
を有することを特徴とするポリウレア電解質の製造方法。
【請求項9】
前記中和剤が炭素数6以上のアルキルアミンであることを特徴とする請求項8に記載のポリウレア電解質の製造方法。
【請求項10】
前記重合工程がマイクロ波の照射下にて行われることを特徴とする請求項8又は9に記載のポリウレア電解質の製造方法。
【図1】


【図2】




【図2】


【公開番号】特開2011−21176(P2011−21176A)
【公開日】平成23年2月3日(2011.2.3)
【国際特許分類】
【出願番号】特願2010−126776(P2010−126776)
【出願日】平成22年6月2日(2010.6.2)
【出願人】(591167430)株式会社KRI (211)
【出願人】(000003997)日産自動車株式会社 (16,386)
【出願人】(508229574)KYCソリューションズ有限会社 (5)
【Fターム(参考)】
【公開日】平成23年2月3日(2011.2.3)
【国際特許分類】
【出願日】平成22年6月2日(2010.6.2)
【出願人】(591167430)株式会社KRI (211)
【出願人】(000003997)日産自動車株式会社 (16,386)
【出願人】(508229574)KYCソリューションズ有限会社 (5)
【Fターム(参考)】
[ Back to top ]

