ポリオールの水素化分解物の製造方法
【課題】効率よく、ポリオールを水素化分解して、ポリオールの水素化分解物を得るポリオールの水素化分解物の製造方法を提供する。
【解決手段】本発明のポリオールの水素化分解物の製造方法は、反応器にポリオールを含む原料液及び水素を供給し、前記反応器中において、触媒の存在下で前記ポリオールと水素とを反応させ、ポリオールの水素化分解物を得るポリオールの水素化分解物の製造方法であって、前記触媒としてイリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒を使用し、前記反応器として鉄成分及び/又はニッケル成分の含有量が10重量%未満である材質からなる金属製反応器を使用することを特徴とする。
【解決手段】本発明のポリオールの水素化分解物の製造方法は、反応器にポリオールを含む原料液及び水素を供給し、前記反応器中において、触媒の存在下で前記ポリオールと水素とを反応させ、ポリオールの水素化分解物を得るポリオールの水素化分解物の製造方法であって、前記触媒としてイリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒を使用し、前記反応器として鉄成分及び/又はニッケル成分の含有量が10重量%未満である材質からなる金属製反応器を使用することを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、触媒の存在下、ポリオールを水素化分解してポリオールの水素化分解物を得るポリオールの水素化分解物の製造方法に関する。
【背景技術】
【0002】
現在、化学製品は主に原油が出発原料になっている。化学製品は炭素原子を主な構成成分とする。その炭素の流れを地球規模でみると、原油として地中に眠っていた炭素が、化学製品として地上にもたらされ、様々な用途で使用され、使用が終われば燃焼廃棄処分される。その際、炭素は二酸化炭素となり大気中に蓄積される。ガソリン、軽油等のように、燃焼そのものが使用目的である化学製品も多数存在する。この炭素の流れにより大気中に蓄積される二酸化炭素は、地球温暖化を引き起こし、異常気候や海面上昇等様々な害悪を引き起こすとされ、二酸化炭素排出量の削減が叫ばれている。
【0003】
その解決策の1つとして、植物由来の資源であるバイオマス(例えば、セルロース、グルコース、植物油等)を化学製品の出発原料に用いることが挙げられる。バイオマスの元となる植物は、その成長過程において光合成により二酸化炭素を吸収するため、その二酸化炭素の吸収量により化学製品の燃焼による二酸化炭素の排出量が相殺されるからである。
【0004】
化学製品の原料のうち、エチレンに代表される炭素数2の化合物はバイオエタノールの脱水により製造されることが知られており、プロピレン、1,2−プロパンジオール、1,3−プロパンジオール等の炭素数3の化合物はバイオディーゼル製造の際に副生するグリセリンを水素化分解及び脱水することにより製造できることが知られている(非特許文献1等)。しかし、未だ満足できる収率が得られていない。
【0005】
一方、炭素数4の化合物としては、グルコース等の糖類から発酵技術で誘導されるエリスリトール、コハク酸、1,4−ブタンジオール、及び1−ブタノール等がある。なかでも、エリスリトールは4つの炭素すべてに水酸基を有するため、ブタン−モノ、ジ、及びトリオール(具体的には、エンジニアリングプラスチックや繊維の原料として有用な1,4−ブタンジオールや、優れた燃料である1−ブタノール、火薬の原料として有用な1,2,3−ブタントリオール、1,2,4−ブタントリオール、医薬・化粧品原料、食品添加物、各種溶剤の原料として有用な1,3−ブタンジオール、2,3−ブタンジオール等)へ誘導できる可能性を持つ。しかし、未だ、実用化されていない。その理由としては、エリスリトールが4つの炭素すべてに水酸基を有するため、様々な化合物への変換が可能であり、高度な選択性を有する変換技術を必要とすること、収率の点で不十分であること等が挙げられる。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Yoshinao Nakagawa,et al."Direct hydrogenolysis of glycerol into 1,3-propanediol over rhenium-modified iridium catalyst",Journal of Catalysis,2010,272,p.191-194.
【発明の概要】
【発明が解決しようとする課題】
【0007】
従って、本発明の目的は、ポリオールを水素化分解することにより、効率よく、選択的に水素化分解物を得るポリオールの水素化分解物の製造方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者等は、上記課題を解決するため鋭意検討した結果、イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒は、ポリオールの水素化分解反応を促進し、選択的にポリオールの水素化分解物を生成できることを見いだした。
【0009】
しかし、前記触媒を使用したポリオールの水素化分解反応は、ガラス製反応器(金属製反応器の内部をガラスでコーティングしたものも含む)内では優れた収率で水素化分解物が得られるが、ガラス製反応器は高価であり、急激な温度変化等によりひび割れが生じやすくメンテナンスが欠かせない上、運転操作に細心の注意が必要であるため、実験室レベルでは使用可能であっても、スケールアップが困難であり、工業的にポリオールの水素化分解物を製造する際に反応器として使用することは困難であった。
【0010】
そして、本発明者等は、ガラス製反応器に代えてステンレス鋼製反応器を使用すると、ステンレス鋼に含有する鉄成分及び/又はニッケル成分により触媒活性が著しく阻害されること、反応器として、鉄成分及び/又はニッケル成分の含有量が10重量%未満である材質からなる金属製反応器を使用すると、反応スケールの大規模化(スケールアップ)に対応することができ、且つ、触媒活性の阻害を極めて低く抑制することができ、優れた収率で水素化分解物を得ることができることを見出した。本発明はこれらの知見に基づいて完成させたものである。
【0011】
すなわち、本発明は、反応器にポリオールを含む原料液及び水素を供給し、前記反応器中において、触媒の存在下で前記ポリオールと水素とを反応させ、ポリオールの水素化分解物を得るポリオールの水素化分解物の製造方法であって、前記触媒としてイリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒を使用し、前記反応器として鉄成分及び/又はニッケル成分の含有量が10重量%未満である材質からなる金属製反応器を使用することを特徴とするポリオールの水素化分解物の製造方法を提供する。
【0012】
前記反応器としては、チタン、モリブデン及びクロムから選択される1種以上の金属成分を90重量%以上含有する材質からなることが好ましい。
【0013】
前記触媒としては、イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒と共に、レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分を併用することが好ましく、イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒と、レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分とを、[イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分/レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分](モル比)が、50/1〜1/6となる範囲で併用することが好ましい。
【0014】
レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分は、担体に担持した状態で使用することが好ましい。
【0015】
イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担持する担体としては無機酸化物が好ましく、シリカ、チタニア、ジルコニア、アルミナ、マグネシア、及びゼオライトから選択される少なくとも1種の化合物が好ましい。
【0016】
レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分を担持する担体としては、無機酸化物が好ましく、シリカ、チタニア、ジルコニア、アルミナ、マグネシア、及びゼオライトから選択される少なくとも1種の化合物が好ましい。
【0017】
本発明のポリオールの水素化分解物の製造方法は、酸の共存下で反応させることが好ましく、ポリオールを含む原料液を、反応器に供給する前に、金属除去処理工程に付して、鉄成分及びニッケル成分を除去することが好ましい。
【発明の効果】
【0018】
本発明に係るポリオールの水素化分解物の製造方法によれば、ポリオールの水素化分解物を、優れた収率で、且つ選択的に製造することができ、生産性に優れる。また、反応スケールの大規模化が可能であり、工業的にポリオールの水素化分解物を製造する際に好適である。そして、本発明に係るポリオールの水素化分解物の製造方法によれば、従来は原油を出発原料として合成していたプロパン−モノ、及びジオールやブタン−モノ、ジ、及びトリオール等を、植物由来の資源であるグリセリンやエリスリトール等のポリオールから効率よく製造することができるため、大気中の二酸化炭素総量の増減に影響を与えず、カーボンニュートラルであり、二酸化炭素排出量の削減に大いに貢献することができる。更にまた、工業製品原料を石油由来からバイオマス由来に転換することができ、石油資源枯渇の後の化学産業の存続にも大いに貢献することができる。
【図面の簡単な説明】
【0019】
【図1】図1は、トリクルベッド反応器を使用した場合の、ポリオールの水素化分解物の製造方法の一例を示すフロー図である。
【発明を実施するための形態】
【0020】
本発明に係るポリオールの水素化分解物の製造方法は、反応器にポリオールを含む原料液及び水素を供給し、前記反応器中において、触媒の存在下で前記ポリオールと水素とを反応させ、ポリオールの水素化分解物を得るポリオールの水素化分解物の製造方法であって、前記触媒としてイリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒を使用し、前記反応器として鉄成分及び/又はニッケル成分の含有量が10重量%未満である材質からなる金属製反応器を使用することを特徴とする。
【0021】
[ポリオール]
本発明のポリオールとしては、例えば、エチレングリコール、ジエチレングリコール、プロピレングリコール、1,3−ブタンジオール、1,4−ブタンジオール、1,6−ヘキサンジオール、ネオペンチルグリコール、水添ビスフェノールAなどの2価のポリオール;グリセリン、トリメチロールプロパン、エリスリトール、ヘキサントリオール、ペンタエリスリトール、キシリトール、ソルビトールなどの3価以上のポリオール等を挙げることができる。
【0022】
本発明においては、なかでも、3価以上のポリオールが好ましく、特に、グリセリン、及びエリスリトールが、様々な化学製品の出発原料に変換可能である点で好ましい。
【0023】
グリセリンとしては、精製グリセリンであってもよく、粗製グリセリンであってもよい。また、前記グリセリンはエチレン、プロピレン等から化学合成されたグリセリンであってもよく、バイオディーゼルの製造における植物油等のエステル交換反応で生じるバイオマス由来のグリセリンであってもよい。また、エリスリトールとしては、グルコース等の糖類から発酵技術で誘導されるエリスリトールを使用することができる。
【0024】
ポリオールとしてグリセリンを使用する場合、得られるポリオールの水素化分解物としては、例えば、プロパン−モノ及びジオール(例えば、1,3−プロパンジオール、1,2−プロパンジオール、1−プロパノール、2−プロパノール等)等を挙げることができる。ポリオールとしてエリスリトールを使用する場合、得られるポリオールの水素化分解物としては、例えば、ブタン−モノ、ジ、及びトリオール(例えば、1,2,3−ブタントリオール、1,2,4−ブタントリオール、1,4−ブタンジオール、1,3−ブタンジオール、1,2−ブタンジオール、2,3−ブタンジオール、1−ブタノール、2−ブタノール等)等を挙げることができる。
【0025】
[水素]
本発明のポリオールの水素化分解物の製造方法において使用する水素(水素ガス)としては、実質的に水素のみの状態でもよく、窒素、アルゴン、ヘリウム等の不活性ガス等により希釈された状態でもよい。また、本発明のポリオールの水素化分解物の製造方法により得られた反応混合物から回収した水素を再利用することもできる。
【0026】
[触媒]
本発明の触媒としては、イリジウム(Ir)、白金(Pt)、ロジウム(Rh)、コバルト(Co)、及びパラジウム(Pd)からなる群より選択される少なくとも1種の金属成分(以後、「イリジウム等」と称する場合がある)を担体に担持した触媒を使用する。イリジウム等が担体に担持される状態としては、特に限定されることがなく、例えば、金属単体、金属塩、金属酸化物、金属水酸化物又は金属錯体の状態等を挙げることができる。
【0027】
本発明の触媒としては、なかでも、反応活性に優れる点で、少なくともイリジウムを担体に担持した触媒を使用することが好ましい。
【0028】
イリジウム等を担持する担体としては、例えば、無機酸化物や活性炭等の無機物担体、イオン交換樹脂等の有機物担体等を挙げることができる。本発明におけるイリジウム等を担持する担体としては、なかでも、反応活性に優れる点で、無機酸化物が好ましい。無機酸化物としては、例えば、シリカ(SiO2)、チタニア(TiO2)、ジルコニア(ZrO2)、アルミナ(Al2O3)、マグネシア(MgO)、及びこれらの無機酸化物の2種以上の複合体(例えば、ゼオライト等)等を挙げることができる。本発明においては、特に、反応活性に優れる点で、シリカ(SiO2)、又はゼオライトが好ましい。
【0029】
また、担体の比表面積としては、イリジウム等を高分散に配置でき、イリジウム等の凝集を抑制することができ、単位重量当たりの触媒活性を向上することができる点で、50m2/g以上程度(例えば、50〜1500m2/g程度、好ましくは100〜1000m2/g程度)が好ましい。担体の比表面積が上記範囲を下回ると、単位重量当たりの触媒活性が低下する傾向がある。
【0030】
担体の平均粒径としては、特に限定されないが、過剰な圧力損失を伴わない点で、100〜10000μmが好ましく、より好ましくは1000〜10000μmである。また、担体の形状は、粉末状、粒状、成型(成型体状)等、特に限定されない。
【0031】
イリジウム等の担体への担持量としては、特に限定されないが、イリジウム等と担体の総量(100重量%)に対して、0.01〜20重量%程度が好ましく、特に好ましくは0.5〜15重量%程度、最も好ましくは1.0〜10重量%程度である。イリジウム等の担持量が0.01重量%未満であると、ポリオールの転化率が低下する傾向がある。一方、イリジウム等の担持量が50重量%を超えると、不経済となる場合がある。
【0032】
イリジウム等の担体への担持方法としては、特に限定されず、公知乃至慣用の担持方法により行うことができ、例えば、イリジウム等を含有する溶液(例えば、塩化イリジウム酸水溶液等)を担体に含浸させた後、乾燥させ、次いで焼成する方法により担持させることができる。尚、イリジウム等を含有する溶液の濃度や、担体への含浸、及び乾燥処理の施用回数を調整することにより、イリジウム等の担持量を制御することができる。また、イリジウム等を含有する溶液を含浸させる際の温度、該溶液を含浸させた担体を乾燥させる際の温度は、特に限定されない。
【0033】
イリジウム等を含有する溶液を含浸させ、乾燥させた後の担体を焼成する際の温度としては、例えば、大気中において400〜700℃程度、好ましくは450〜550℃程度である。また、焼成する際の雰囲気は、上述のように大気中に限定されず、例えば、窒素、アルゴン等の不活性ガス雰囲気、水素等の還元性ガス雰囲気等で焼成することもできる。
【0034】
本発明の触媒は、イリジウム等を担体に担持した触媒と共に、レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分(以後、「レニウム等」と称する場合がある)を併用することが好ましい。レニウム等を併用することにより、ポリオールの転化率を向上することができ、ポリオールとして、グリセリンを使用する場合は、1,3−プロパンジオールの選択率を高めることができる。また、ポリオールとしてエリスリトールを使用する場合は、1,4−ブタンジオール、1,3−ブタンジオールの選択率を高めることができる。選択率が高まる理由は明らかではないが、イリジウム等とレニウム等との何らかの相互作用により、レニウム等がポリオールの一つの水酸基と相互作用を持った状態でイリジウム等が隣接する水酸基を還元すると考えられる。また、イリジウム等とレニウム等の相互作用により、イリジウム等の酸化還元状態が変化してそのイリジウム等の還元能力が高まるとも考えられる。
【0035】
触媒として、イリジウム等を担体に担持した触媒と共にレニウム等を併用する場合、レニウム等の使用量が増加するにつれて、ポリオールの転化率を向上することができる。また、レニウム等の使用量が増加するにつれて、トリオールの選択率が減少し、ジオール、及びモノオールの選択率が高くなる傾向がある。イリジウム等(2種類以上含有する場合は合計量)とレニウム等(2種類以上含有する場合は合計量)とのモル比(前者/後者)は、例えば、50/1〜1/6程度(好ましくは4/1〜1/4、特に好ましくは3/1〜1/3)の範囲内であることが好ましい。レニウム等の使用量は、反応温度、反応時間、及び目的とする生成化合物によって、前記範囲内で適宜調整することができる。
【0036】
触媒に含まれるレニウム等の態様としては、特に限定されることがなく、例えば、金属単体、金属塩、金属酸化物、金属水酸化物又は金属錯体の状態で含まれる態様や、金属単体、金属塩、金属酸化物、金属水酸化物又は金属錯体として担体に担持された状態で含まれる態様等を挙げることができる。
【0037】
レニウム等を担持する担体としては、上記イリジウム等を担持する担体と同様の例を挙げることができる。本発明におけるレニウム等を担持する担体としては、なかでも、反応活性に優れる点で、無機酸化物が好ましく、特に好ましくは、シリカ(SiO2)、チタニア(TiO2)、ジルコニア(ZrO2)、アルミナ(Al2O3)、マグネシア(MgO)、及びこれらの無機酸化物の2種以上の複合体(例えば、ゼオライト等)から選択される少なくとも1種の化合物であり、最も好ましくは、シリカ(SiO2)、又はゼオライトである。また、レニウム等を担持する担体はイリジウム等を担持する担体と同一であってもよく異なっていてもよい。本発明においては、なかでも、より優れた触媒作用を発揮することができる点で、レニウム等を担持する担体とイリジウム等を担持する担体が同一であること(すなわち、イリジウム等とレニウム等が同一の担体に担持されていること)が好ましい。
【0038】
レニウム等を担体に担持させる場合、その方法は特に限定されず、公知乃至慣用の担持方法を利用することができる。具体的には、例えば、レニウム等含有溶液を担体に含浸し、乾燥させた後、焼成する方法等を挙げることができる。また、レニウム等を、上記イリジウム等と同じ担体に担持させる場合は、例えば、イリジウム等を含有する溶液を含浸させ、乾燥させた後の担体にレニウム等含有溶液を含浸し、乾燥させた後、焼成する方法等を挙げることができる。尚、上記レニウム等含有溶液を含浸させる際の温度、該溶液を含浸させた担体を乾燥させる際の温度、及び上記担体を焼成する際の温度は特に限定されない。
【0039】
本発明における触媒としては、なかでも、イリジウム等を担体に担持した触媒と共に、レニウム(Re)、モリブデン(Mo)、タングステン(W)、及びマンガン(Mn)からなる群より選択された少なくとも1種以上の金属成分[特に、レニウム(Re)]を、担体に担持した状態(好ましくは、イリジウム等とレニウム等を同一の担体に担持した状態であり、特に好ましくはイリジウムとレニウムを同一の担体に担持した状態)で使用することが、より優れた触媒作用を発揮することができる点、及び反応後の触媒を容易に回収することができる点で好ましい。
【0040】
[反応器]
本発明のポリオールの水素化分解物の製造方法においては、反応器として鉄成分及び/又はニッケル成分の含有量が10重量%未満(好ましくは5重量%以下、特に好ましくは1重量%以下、最も好ましくは実質上含有しない)である材質からなる金属製反応器を使用することを特徴とする。それにより、反応スケールの大規模化が可能となり、工業的に、且つ、優れた収率でポリオールの水素化分解物の製造が可能となる。一方、鉄成分及び/又はニッケル成分含有量が10重量%以上である材質からなる反応器を使用すると、反応スケールの大規模化は可能であるが、反応器中に含有する鉄成分及び/又はニッケル成分が反応系中に溶出して触媒活性を阻害し、水素化分解物の収率を低下させる。また、ガラス製反応器は、高価であり、急激な温度変化等によりひび割れが生じやすくメンテナンスが欠かせない上、運転操作に細心の注意が必要であるため、反応スケールの大規模化が困難である。
【0041】
反応器の材質としては、鉄成分及び/又はニッケル成分の含有量が10重量%未満であればよい。本発明においては、なかでも、不導体となりやすく、酸化被膜の形成により反応系への金属成分の溶出を防止することができる金属成分(例えば、チタン、モリブデン及びクロムから選択される1種以上の金属成分等)を90重量%以上(好ましくは95重量%以上、特に好ましくは99重量%以上)含有することが好ましく、反応器の材質が実質上、前記金属成分のみであることが特に好ましい。
【0042】
チタン、モリブデン及びクロムから選択される2種以上の金属成分を含有する場合は、その総量が90重量%以上(好ましくは95重量%以上、特に好ましくは99重量%以上)であることが好ましく、反応器の材質が実質上、前記金属成分のみであることが特に好ましい。
【0043】
本発明においては、例えば、チタン製、モリブデン製、クロム製、又はチタン、モリブデン若しくはクロムから選択される2種以上の合金製反応器等を使用することが好ましく、なかでも、より触媒活性の阻害を抑制することができる点で、チタン製、モリブデン製、若しくはチタン−モリブデン合金製反応器を使用することが好ましく、特に、工業的に材料入手が容易であり、反応器が成型し易い点で、チタン製反応器を使用することが好ましい。
【0044】
反応器の形式としては、例えば、槽型反応器、管型反応器等を挙げることができる。槽型反応器としては、例えば、オートクレーブ等を使用することができる。また、管型反応器としては、例えば、流動床反応器、固定床反応器等を使用することができる。
【0045】
本発明においては、なかでも、生産性に優れる点で、管型反応器が好ましく、なかでも、反応生成物からの触媒の分離プロセスが不要である点で、固定床反応器が好ましい。前記固定床反応器を使用したポリオールの水素化分解法としては、例えば、(1)固体触媒が充填された触媒充填層を内部に有し、該触媒充填層に対して液体(本発明では、原料液)と気体(本発明では、水素)とを共に、反応器の上方から下向流(気液下向並流)で流通する方法、いわゆるトリクルベッド法、(2)液体(本発明では、原料液)および気体(本発明では、水素)を並流で導入して運転する塔底法等を挙げることができる。本発明においては、なかでも、トリクルベッド法を採用することが、原料であるポリオールを気化することなく、気液固三相で反応を進行させることができ、且つ、ポリオールを含有する原料液が触媒表面に薄膜を形成しながら下方に流通するため、原料液と水素の界面(気液界面)から触媒表面までの距離が短く、原料液に溶解した水素の触媒表面への拡散が容易となり、ポリオールの水素化分解物を効率的に生成することができる点で好ましい。一方、水素化分解を気相反応で行う場合、ポリオールのなかでもエリスリトールの沸点は330℃と非常に高く、反応系を330℃以上の高温に加熱する必要があり、炭素同士の結合開裂による副生物の生成が起こりやすくなり、精製処理のコストが嵩むことが問題である。
【0046】
従って、本発明においては、反応器としてトリクルベッド法を採用した固定床反応器(すなわち、トリクルベッド反応器)を使用することが好ましい。
【0047】
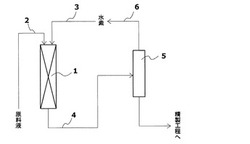
図1は、トリクルベッド反応器を使用した場合の、ポリオールの水素化分解物の製造方法の一例を示すフロー図である。図1において、1はトリクルベッド反応器、2は原料液の供給ライン、3は水素の供給ラインを示す。また、4は反応混合物取り出しライン、5は高圧気液分離器、6は水素リサイクルラインを示す。以下、図1を参照しながら、トリクルベッド反応器を使用したポリオールの水素化分解物の製造方法を簡単に説明する。
【0048】
まず、トリクルベッド反応器1の上方から原料液と水素とを連続的に供給し、その後、反応器の内部で原料液中のポリオールと水素とを、触媒充填層における触媒の存在下で反応させ、ポリオールの水素化分解物(反応生成物)を生成させる。そして、当該ポリオールの水素化分解物を含む反応混合物をトリクルベッド反応器1の下方の反応混合物取り出しライン4から連続的に取り出し、その後、必要に応じて、高圧気液分離器5により該反応混合物から水素を分離した後、精製工程にてポリオールの水素化分解物を精製・単離する。また、高圧気液分離器5により分離した水素は、水素リサイクルライン6を通じて、再度トリクルベッド反応器1に供給して反応に再利用することもできる。
【0049】
トリクルベッド反応器の形状、サイズ(例えば、塔径や塔長等)等は、特に限定されず、公知乃至慣用のトリクルベッド反応器の中から、反応の規模等に応じて適宜選択することができる。また、上記トリクルベッド反応器は、単一の反応管により構成されるものであってもよいし、複数の反応管により構成された多段反応器であってもよい。上記トリクルベッド反応器が多段反応器である場合の反応管の数は、適宜選択でき、特に限定されない。また、上記トリクルベッド反応器が多段反応器である場合には、当該反応器は、複数の反応管が直列に設置されたものであってもよいし、複数の反応管が並列に配置されたものであってもよい。
【0050】
更に、トリクルベッド反応器の内部における触媒充填層は、必要に応じて、例えば、反応熱による過熱を抑制するために触媒充填層を2以上の位置に分割(分離)して配置してもよい。
【0051】
原料液の液基準空間速度(LHSV)としては、特に限定されることがなく、例えば0.05〜100hr-1程度、好ましくは0.1〜50hr-1、特に好ましくは0.5〜20hr-1である。原料液の液基準空間速度が0.05h-1未満であると、ポリオールの水素化分解物の生産性が低下する場合がある。一方、原料液の液基準空間速度が100hr-1を超えると、ポリオールの反応率(転化率)が低下する場合がある。尚、上記液基準空間速度は、反応器への原料液の供給速度(体積流量)の触媒充填体積に対する比[原料液の供給速度(L/hr-1)/触媒充填体積(L)]で表される。
【0052】
[原料液]
本発明に係るポリオールの水素化分解物の製造方法において用いられる原料液は、ポリオールを必須成分として含有する。上記原料液は、ポリオールの他に水や有機溶媒等の溶媒を含有してもよく、溶媒を実質的に含有しなくてもよい。上記有機溶媒としては、特に限定されることがなく、例えば、メタノール、エタノール、イソプロパノール、n−ブタノール等を挙げることができる。本発明の原料液としては、なかでも、反応性に優れる点、及び取り扱いや廃棄が容易である点等で、溶媒として水を使用することが好ましい。
【0053】
上記原料液におけるポリオールの濃度(原料液100重量%に対するポリオールの含有量)は、特に限定されることがなく、例えば20〜98重量%程度、好ましくは20〜90重量%、さらに好ましくは40〜90重量%、特に好ましくは60〜80重量%である。ポリオールの濃度が20重量%を下回ると、ポリオールの反応率(転化率)が低下する場合がある。一方、ポリオールの濃度が98重量%を上回ると、粘度が高くなり、操作が煩雑になる場合がある。
【0054】
上記原料液には、上述のポリオール、溶媒のほか、例えば、酸を添加してもよい。上記酸としては、特に限定されず、公知乃至慣用の酸、例えば、硫酸、リン酸、トリフルオロメタンスルホン酸等を挙げることができる。酸を添加することにより水素化分解反応を促進することができる。
【0055】
酸の使用量としては、触媒に含有するイリジウム等に対して、例えば、0.1〜10モル倍程度、好ましくは0.5〜3モル倍程度である。酸を添加した場合は、反応終了後、中和工程を設けることが好ましい。
【0056】
上記原料液には、本発明の効果を阻害しない範囲でその他の成分(例えば、アルコール類等)を含有させてもよい。
【0057】
上記原料液は、ポリオールと、必要に応じて溶媒、その他の成分を均一に混合することにより得られる。混合には、公知乃至慣用の撹拌機等を使用してもよい。
【0058】
[ポリオールの水素化分解物の製造方法]
本発明のポリオールの水素化分解物の製造方法は、反応器にポリオールを含む原料液及び水素を供給し、前記反応器中において、触媒の存在下で前記ポリオールと水素とを反応させ、ポリオールの水素化分解物を得るポリオールの水素化分解物の製造方法であって、前記触媒としてイリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒を使用し、前記反応器として鉄成分及び/又はニッケル成分の含有量が10重量%未満である材質からなる金属製反応器を使用することを特徴とする。
【0059】
反応に付す水素とポリオールのモル比[水素(mol)/ポリオール(mol)]としては、例えば、1〜100程度、好ましくは1.5〜50程度、特に好ましくは2〜30程度である。上記水素とポリオールのモル比が1を下回ると、ポリオールの反応率(転化率)が低下する場合がある。一方、上記水素とポリオールのモル比が100を上回ると、未反応水素回収のための用役コストが増加する傾向がある。
【0060】
上記反応におけるポリオールと水素の反応温度は、特に限定されることがなく、例えば50〜200℃程度、好ましくは60〜150℃、特に好ましくは70〜130℃である。反応温度が50℃未満であると、ポリオールの反応率(転化率)が低下する場合がある。一方、反応温度が200℃を超えると、ポリオールが完全に水素化分解された炭化水素が副生し易くなり、ポリオールの分解(例えば、炭素−炭素結合の開裂等)が生じ易くなるため、ポリオールの水素化分解物の選択率が低下する場合がある。
【0061】
上記反応におけるポリオールと水素の反応時間は、特に限定されないが、0.1〜100時間が好ましく、より好ましくは0.2〜5時間、さらに好ましくは0.5〜3時間である。反応時間が0.1時間未満であると、ポリオールの反応率(転化率)が低下する場合がある。一方、反応時間が100時間を超えると、ポリオールが完全に水素化分解された炭化水素の生成が急激に増える場合がある。
【0062】
上記反応におけるポリオールと水素の反応圧力(ポリオールと水素の反応における水素圧)としては、1〜50MPa程度の範囲内で適宜調整することができる。本発明においては、なかでも、高圧下で反応を行うことが、水素化分解物の収率をより一層向上させることができる点で好ましく、例えば3〜30.0MPa、好ましくは5.0〜15.0MPaである。反応圧力が1MPa以下であると、ポリオールの反応率(転化率)が低下する場合がある。一方、反応圧力が50MPaを上回ると、反応器が高度な耐圧性を備える必要があるため、製造コストが高くなる傾向がある。
【0063】
本発明のポリオールの水素化分解物の製造方法は、回分形式、半回分形式、連続流通形式等を任意に選択した形式により実施することができる。また、所定量のポリオールから得られるポリオールの水素化分解物の量を増加させたい場合には、水素化分解実施後の未反応ポリオールを分離回収してリサイクルするプロセスを採用してもよい。このリサイクルプロセスを採用すれば、ポリオールを所定量使用したときのポリオールの水素化分解物の生成量を高めることができる。
【0064】
本発明のポリオールの水素化分解物の製造方法は、上記ポリオールを含む原料液と水素の反応工程以外にも、必要に応じて他の工程を含んでいてもよい。他の工程としては、例えば、反応器に供給する前に、ポリオールを含む原料液を調製・精製する工程、反応器から排出(流出)された反応混合物(例えば、ポリオール、水素、及びポリオールの水素化分解物等の混合物)を分離・精製する工程等を挙げることができる。尚、これらの工程は、本発明のポリオールの水素化分解物の製造方法の反応工程とは別ラインで実施してもよく、上記反応工程と一連の工程として実施してもよい。
【0065】
本発明においては、ポリオールを含む原料液を、反応器に供給する前に、金属除去処理工程に付して、鉄成分及びニッケル成分を除去する(たとえば、原料液100g当たり、鉄成分及び/又はニッケル成分含有量(金属換算)が1.5×10-4モル以下程度、好ましくは1.5×10-5モル以下程度まで低減させる)精製工程を設けることが好ましい。それにより、触媒活性を一層向上させることができ、ポリオールの水素化分解物の収率を向上させることができる。
【0066】
前記金属除去処理としては、例えば、キレート樹脂を使用したキレート形成により金属を吸着して捕捉する方法、イオン交換樹脂を使用したイオン交換により金属を捕捉する方法、蒸留、晶析、抽出などの周知慣用の方法により行うことができる。
【0067】
本発明のポリオールの水素化分解物の製造方法は、ポリオールの水素化分解反応を、鉄成分及び/又はニッケル成分の含有量が10重量%未満である材質からなる金属製反応器中にて、上記特定の触媒を使用して行うため、容易に反応スケールを大規模化することができ、作業性に優れた方法で、工業的にポリオールの水素化分解反応を行うことができ、且つ、ガラス製反応器を使用した場合と同等の優れた触媒能を前記触媒に発揮させることができる。そのため、ポリオールの水素化分解物を選択的且つ高収率で得ることができる。また、使用後の触媒は容易に再生できる。以上より、本発明のポリオールの水素化分解物の製造方法は、経済的に有利にポリオールの水素化分解物を選択的且つ優れた収率で製造することができるため、工業化に極めて有利であり、大幅な二酸化炭素排出量の削減に貢献することができると共に、石油資源枯渇の後の化学産業の存続にも大いに貢献することができる。
【実施例】
【0068】
以下、実施例により本発明をより具体的に説明するが、本発明はこれらの実施例により限定されるものではない。
【0069】
調製例1(触媒調製)
二酸化ケイ素(SiO2)(商品名「CARIACT G−6」、富士シリシア化学(株)製、比表面積:400〜500m2/g)を担体とした。上記担体に、Ir濃度が4.47wt%になるように調製した塩化イリジウム酸(H2IrCl6)水溶液を滴下して、担体全体を湿潤させ、110℃で乾燥した。その後、この滴下と乾燥を繰り返して、Irがシリカに対して4wt%になるように担持させた。次ぎに、Re濃度が3wt%になるように調製した過レニウム酸アンモニウム(NH4ReO4)水溶液を、塩化イリジウム酸を担持したシリカに前記と同様に滴下と乾燥を繰り返して、ReがIrに対してRe/Ir=1/1(mol比)になるように担持させた。その後、空気雰囲気下で、500℃、3時間焼成して、触媒(1)(Ir/Re/SiO2、Ir/Re=1/1)を得た。
【0070】
参考例1(水素化分解反応)
ガラス製内缶のあるSUS316製(容量:190mL)オートクレーブとテフロン(登録商標)コーティングをされたマグネチックスターラーチップで構成される反応器を、マグネチックスターラーと電気炉からなる加熱・撹拌する装置と共に用いた。
調製例1で得られた触媒 150mg、及び水 1gを反応器に入れ、1MPaの水素を張り込んで、常圧まで排気する水素置換作業を三回繰り返したのち、反応器内が200℃になった時に、全圧8MPaになるように水素を張り込み、200℃で1時間触媒を還元した。
【0071】
触媒の還元後、オートクレーブを冷却、開圧し、グリセリン 4g、および1%硫酸 150mgを含む原料液を加えて、再度1MPa水素で3回水素置換を行った。120℃で、8MPaになるように水素を張り込み、撹拌回転数250rpmにて24時間反応を行った。
反応後、オートクレーブを室温まで冷却後、開圧し、排気ガスおよび反応液をガスクロマトフィーにて分析したところ、グリセリンの転化率は56.6%、各生成物の選択率は、1,3−プロパンジオールが43.8%、1,2−プロパンジオールが4.9%、1−プロパノールが39.9%、2−プロパノールが9.5%であった。
【0072】
以下金属片、金属粉末を添加する場合、参考例1において反応液が反応器に接した面積と等しくなる量を添加した。尚、SUS316片は円柱、その他の粉末は球形としてその表面積を算出した。
【0073】
参考例2(水素化分解反応へのSUS316の影響)
触媒還元後に、直径1mm、長さ1.2mmのSUS316金属片 0.3488gを反応器内に加えた以外は、参考例1と同様に行った。グリセリンの転化率は10.8%、各生成物の選択率は、1,3−プロパンジオールが66.7%、1,2−プロパンジオールが16.0%、1−プロパノールが12.4%、2−プロパノールが4.6%であった。
【0074】
参考例3(水素化分解反応へのFe粉の影響)
触媒還元後に、粒径45μmの鉄粉末 62.3mgを反応器内に加えた以外は、参考例1と同様に行った。グリセリンは全く転化しなかった。
【0075】
参考例4(水素化分解反応へのNi粉の影響)
触媒還元後に、粒径150μmのニッケル粉末 236mgを反応器内に加えた以外は、参考例1と同様に行った。グリセリンは全く転化しなかった。
【0076】
参考例5(水素化分解反応へのCr粉の影響)
触媒還元後に、粒径45μmのクロム粉末 56.8mgを反応器内に加えた以外は、参考例1と同様に行った。グリセリンの転化率は37.8%、各生成物の選択率は、1,3−プロパンジオールが60.1%、1,2−プロパンジオールが7.5%、1−プロパノールが24.7%、2−プロパノールが7.2%であった。
【0077】
参考例6(水素化分解反応へのMo粉の影響)
触媒還元後に、粒径3μmのモリブデン粉末 5.4mgを反応器内に加えた以外は、参考例1と同様に行った。グリセリンの転化率は49.0%、各生成物の選択率は、1,3−プロパンジオールが48.6%、1,2−プロパンジオールが5.6%、1−プロパノールが36.5%、2−プロパノールが8.7%であった。
【0078】
参考例7(水素化分解反応へのTi粉の影響)
触媒還元後に、粒径45μmのチタン粉末 35.8mgを反応器内に加えた以外は、参考例1と同様に行った。グリセリンの転化率は44.4%、各生成物の選択率は、1,3−プロパンジオールが52.4%、1,2−プロパンジオールが4.8%、1−プロパノールが33.2%、2−プロパノールが8.4%であった。
【0079】
参考例8(水素化分解反応へのFeイオンの影響)
触媒還元後に、0.15Mの硫酸鉄水溶液 0.1mLを反応器内に加えた以外は、参考例1と同様に行った。グリセリンは全く転化しなかった。Fe成分をイオンとして加えても反応を阻害することが確認でき、原料液にFeイオン混入が起こりうる場合には、反応工程の前にFeイオン除去工程が必要であることがわかった。
【0080】
参考例9(水素化分解反応へのNiイオンの影響)
触媒還元後に、0.15Mの硫酸ニッケル水溶液 0.1mLを反応器内に加えた以外は、参考例1と同様に行った。グリセリンは全く転化しなかった。Ni成分をイオンとして加えても反応を阻害することが確認でき、原料液にNiイオン混入が起こりうる場合には、反応工程の前にNiイオン除去工程が必要であることがわかった。
【0081】
実施例1
(チタン(Ti)製のトリクルベッド反応器を使用した水素化分解反応)
グリセリン 7200重量部、水 1800重量部、および硫酸 10重量部を混合して、グリセリンを80重量%含有する原料液を調製した。
内径9mmの反応管を有するチタン(Ti)製のトリクルベッド反応器(固定床連続反応装置、鉄成分の含有量:0重量%、ニッケル成分の含有量:0重量%)を使用し、調製例1で得られた触媒(1)1.2kg(0.8L)を充填した触媒充填部を120℃に加熱した(反応温度:100℃)。この触媒充填部分に前記原料液を900g/時間(LHSV=1.0hr-1)で供給し、水素を2L/分で供給して、反応を開始させた(水素とグリセリンの供給モル比:水素/グリセリン=4/1)。反応中、反応管内の圧力は8MPa(ゲージ圧)に保持した。そして、反応物取り出しラインから連続的に反応混合物(反応液)を排出(流出)させ、原料液及び水素の供給開始から5時間後、反応物取り出しラインから流出する反応混合物を1時間かけて捕集し、その捕集液(反応生成物を含む)の分析を行った。その結果、グリセリンの転化率は37.6%、各生成物の選択率は、1,3−プロパンジオールが47.5%、1,2−プロパンジオールが12.8%、1−プロパノールが20.4%、2−プロパノールが19.1%であった。
【0082】
実施例2
エリスリトール 7200重量部、硫酸 10重量部、及び水 1800重量部を混合して、90℃まで加熱し、エリスリトール 80重量%の原料液を調製した。
内径9mmの反応管を有するチタン(Ti)製のトリクルベッド反応器(固定床連続反応装置、鉄成分の含有量:0重量%、ニッケル成分の含有量:0重量%)に、調製例1で得られた触媒(1)1.2Kg(0.8L)を充填し、触媒充填部を100℃に加熱した(反応温度:100℃)。この触媒充填部分に上記原料液を900g/時間(LHSV=1.0hr-1)で供給し、水素を2L/分で供給して、反応を開始させた(水素とエリスリトールの供給モル比:水素/エリスリトール=4.0)。反応中、反応管内の圧力は12MPa(ゲージ圧)に保持した。そして、反応物取り出しラインから連続的に反応混合物(反応液)を排出(流出)させ、原料液及び水素の供給開始から5時間後、反応物取り出しラインから流出する反応混合物を1時間かけて捕集し、その捕集液(反応生成物を含む)の分析を行った。その結果、エリスリトールの転化率は65.4%で、各生成物の選択率は1,2,3−ブタントリオールが17.3%、1,2,4−ブタントリオールが4.9%、1,4−ブタンジオールが35.4%、1,3−ブタンジオールが13.5%、1,2−ブタンジオールが2.1%、2,3−ブタンジオールが2.1%、1−ブタノールが1.1%、2−ブタノールが1.5%であった。
【0083】
尚、上記グリセリン(又は、エリスリトール)の転化率(%)は、反応生成物中に残存するグリセリン(又は、エリスリトール)量を測定し、単位時間あたりのグリセリン(又は、エリスリトール)減少量を仕込んだグリセリン(又は、エリスリトール)量で割ったものを転化率とした。また、各生成物の選択率(%)は、単位時間あたりの各生成物生成量を、当該単位時間当たりのグリセリン(又は、エリスリトール)減少量で割ったものを選択率とした。
反応生成物中の各成分の含有量は、ガスクロマトグラフィー(ガスクロマトグラフ装置:商品名「GC−2010」、(株)島津製作所製)を使用し、下記条件で測定した。
測定条件
カラム:FFAP(QUADREX製)
検出器:FID
【符号の説明】
【0084】
1:トリクルベッド反応器
2:原料液供給ライン
3:水素供給ライン
4:反応混合物取り出しライン
5:高圧気液分離器
6:水素リサイクルライン
【技術分野】
【0001】
本発明は、触媒の存在下、ポリオールを水素化分解してポリオールの水素化分解物を得るポリオールの水素化分解物の製造方法に関する。
【背景技術】
【0002】
現在、化学製品は主に原油が出発原料になっている。化学製品は炭素原子を主な構成成分とする。その炭素の流れを地球規模でみると、原油として地中に眠っていた炭素が、化学製品として地上にもたらされ、様々な用途で使用され、使用が終われば燃焼廃棄処分される。その際、炭素は二酸化炭素となり大気中に蓄積される。ガソリン、軽油等のように、燃焼そのものが使用目的である化学製品も多数存在する。この炭素の流れにより大気中に蓄積される二酸化炭素は、地球温暖化を引き起こし、異常気候や海面上昇等様々な害悪を引き起こすとされ、二酸化炭素排出量の削減が叫ばれている。
【0003】
その解決策の1つとして、植物由来の資源であるバイオマス(例えば、セルロース、グルコース、植物油等)を化学製品の出発原料に用いることが挙げられる。バイオマスの元となる植物は、その成長過程において光合成により二酸化炭素を吸収するため、その二酸化炭素の吸収量により化学製品の燃焼による二酸化炭素の排出量が相殺されるからである。
【0004】
化学製品の原料のうち、エチレンに代表される炭素数2の化合物はバイオエタノールの脱水により製造されることが知られており、プロピレン、1,2−プロパンジオール、1,3−プロパンジオール等の炭素数3の化合物はバイオディーゼル製造の際に副生するグリセリンを水素化分解及び脱水することにより製造できることが知られている(非特許文献1等)。しかし、未だ満足できる収率が得られていない。
【0005】
一方、炭素数4の化合物としては、グルコース等の糖類から発酵技術で誘導されるエリスリトール、コハク酸、1,4−ブタンジオール、及び1−ブタノール等がある。なかでも、エリスリトールは4つの炭素すべてに水酸基を有するため、ブタン−モノ、ジ、及びトリオール(具体的には、エンジニアリングプラスチックや繊維の原料として有用な1,4−ブタンジオールや、優れた燃料である1−ブタノール、火薬の原料として有用な1,2,3−ブタントリオール、1,2,4−ブタントリオール、医薬・化粧品原料、食品添加物、各種溶剤の原料として有用な1,3−ブタンジオール、2,3−ブタンジオール等)へ誘導できる可能性を持つ。しかし、未だ、実用化されていない。その理由としては、エリスリトールが4つの炭素すべてに水酸基を有するため、様々な化合物への変換が可能であり、高度な選択性を有する変換技術を必要とすること、収率の点で不十分であること等が挙げられる。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Yoshinao Nakagawa,et al."Direct hydrogenolysis of glycerol into 1,3-propanediol over rhenium-modified iridium catalyst",Journal of Catalysis,2010,272,p.191-194.
【発明の概要】
【発明が解決しようとする課題】
【0007】
従って、本発明の目的は、ポリオールを水素化分解することにより、効率よく、選択的に水素化分解物を得るポリオールの水素化分解物の製造方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者等は、上記課題を解決するため鋭意検討した結果、イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒は、ポリオールの水素化分解反応を促進し、選択的にポリオールの水素化分解物を生成できることを見いだした。
【0009】
しかし、前記触媒を使用したポリオールの水素化分解反応は、ガラス製反応器(金属製反応器の内部をガラスでコーティングしたものも含む)内では優れた収率で水素化分解物が得られるが、ガラス製反応器は高価であり、急激な温度変化等によりひび割れが生じやすくメンテナンスが欠かせない上、運転操作に細心の注意が必要であるため、実験室レベルでは使用可能であっても、スケールアップが困難であり、工業的にポリオールの水素化分解物を製造する際に反応器として使用することは困難であった。
【0010】
そして、本発明者等は、ガラス製反応器に代えてステンレス鋼製反応器を使用すると、ステンレス鋼に含有する鉄成分及び/又はニッケル成分により触媒活性が著しく阻害されること、反応器として、鉄成分及び/又はニッケル成分の含有量が10重量%未満である材質からなる金属製反応器を使用すると、反応スケールの大規模化(スケールアップ)に対応することができ、且つ、触媒活性の阻害を極めて低く抑制することができ、優れた収率で水素化分解物を得ることができることを見出した。本発明はこれらの知見に基づいて完成させたものである。
【0011】
すなわち、本発明は、反応器にポリオールを含む原料液及び水素を供給し、前記反応器中において、触媒の存在下で前記ポリオールと水素とを反応させ、ポリオールの水素化分解物を得るポリオールの水素化分解物の製造方法であって、前記触媒としてイリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒を使用し、前記反応器として鉄成分及び/又はニッケル成分の含有量が10重量%未満である材質からなる金属製反応器を使用することを特徴とするポリオールの水素化分解物の製造方法を提供する。
【0012】
前記反応器としては、チタン、モリブデン及びクロムから選択される1種以上の金属成分を90重量%以上含有する材質からなることが好ましい。
【0013】
前記触媒としては、イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒と共に、レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分を併用することが好ましく、イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒と、レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分とを、[イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分/レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分](モル比)が、50/1〜1/6となる範囲で併用することが好ましい。
【0014】
レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分は、担体に担持した状態で使用することが好ましい。
【0015】
イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担持する担体としては無機酸化物が好ましく、シリカ、チタニア、ジルコニア、アルミナ、マグネシア、及びゼオライトから選択される少なくとも1種の化合物が好ましい。
【0016】
レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分を担持する担体としては、無機酸化物が好ましく、シリカ、チタニア、ジルコニア、アルミナ、マグネシア、及びゼオライトから選択される少なくとも1種の化合物が好ましい。
【0017】
本発明のポリオールの水素化分解物の製造方法は、酸の共存下で反応させることが好ましく、ポリオールを含む原料液を、反応器に供給する前に、金属除去処理工程に付して、鉄成分及びニッケル成分を除去することが好ましい。
【発明の効果】
【0018】
本発明に係るポリオールの水素化分解物の製造方法によれば、ポリオールの水素化分解物を、優れた収率で、且つ選択的に製造することができ、生産性に優れる。また、反応スケールの大規模化が可能であり、工業的にポリオールの水素化分解物を製造する際に好適である。そして、本発明に係るポリオールの水素化分解物の製造方法によれば、従来は原油を出発原料として合成していたプロパン−モノ、及びジオールやブタン−モノ、ジ、及びトリオール等を、植物由来の資源であるグリセリンやエリスリトール等のポリオールから効率よく製造することができるため、大気中の二酸化炭素総量の増減に影響を与えず、カーボンニュートラルであり、二酸化炭素排出量の削減に大いに貢献することができる。更にまた、工業製品原料を石油由来からバイオマス由来に転換することができ、石油資源枯渇の後の化学産業の存続にも大いに貢献することができる。
【図面の簡単な説明】
【0019】
【図1】図1は、トリクルベッド反応器を使用した場合の、ポリオールの水素化分解物の製造方法の一例を示すフロー図である。
【発明を実施するための形態】
【0020】
本発明に係るポリオールの水素化分解物の製造方法は、反応器にポリオールを含む原料液及び水素を供給し、前記反応器中において、触媒の存在下で前記ポリオールと水素とを反応させ、ポリオールの水素化分解物を得るポリオールの水素化分解物の製造方法であって、前記触媒としてイリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒を使用し、前記反応器として鉄成分及び/又はニッケル成分の含有量が10重量%未満である材質からなる金属製反応器を使用することを特徴とする。
【0021】
[ポリオール]
本発明のポリオールとしては、例えば、エチレングリコール、ジエチレングリコール、プロピレングリコール、1,3−ブタンジオール、1,4−ブタンジオール、1,6−ヘキサンジオール、ネオペンチルグリコール、水添ビスフェノールAなどの2価のポリオール;グリセリン、トリメチロールプロパン、エリスリトール、ヘキサントリオール、ペンタエリスリトール、キシリトール、ソルビトールなどの3価以上のポリオール等を挙げることができる。
【0022】
本発明においては、なかでも、3価以上のポリオールが好ましく、特に、グリセリン、及びエリスリトールが、様々な化学製品の出発原料に変換可能である点で好ましい。
【0023】
グリセリンとしては、精製グリセリンであってもよく、粗製グリセリンであってもよい。また、前記グリセリンはエチレン、プロピレン等から化学合成されたグリセリンであってもよく、バイオディーゼルの製造における植物油等のエステル交換反応で生じるバイオマス由来のグリセリンであってもよい。また、エリスリトールとしては、グルコース等の糖類から発酵技術で誘導されるエリスリトールを使用することができる。
【0024】
ポリオールとしてグリセリンを使用する場合、得られるポリオールの水素化分解物としては、例えば、プロパン−モノ及びジオール(例えば、1,3−プロパンジオール、1,2−プロパンジオール、1−プロパノール、2−プロパノール等)等を挙げることができる。ポリオールとしてエリスリトールを使用する場合、得られるポリオールの水素化分解物としては、例えば、ブタン−モノ、ジ、及びトリオール(例えば、1,2,3−ブタントリオール、1,2,4−ブタントリオール、1,4−ブタンジオール、1,3−ブタンジオール、1,2−ブタンジオール、2,3−ブタンジオール、1−ブタノール、2−ブタノール等)等を挙げることができる。
【0025】
[水素]
本発明のポリオールの水素化分解物の製造方法において使用する水素(水素ガス)としては、実質的に水素のみの状態でもよく、窒素、アルゴン、ヘリウム等の不活性ガス等により希釈された状態でもよい。また、本発明のポリオールの水素化分解物の製造方法により得られた反応混合物から回収した水素を再利用することもできる。
【0026】
[触媒]
本発明の触媒としては、イリジウム(Ir)、白金(Pt)、ロジウム(Rh)、コバルト(Co)、及びパラジウム(Pd)からなる群より選択される少なくとも1種の金属成分(以後、「イリジウム等」と称する場合がある)を担体に担持した触媒を使用する。イリジウム等が担体に担持される状態としては、特に限定されることがなく、例えば、金属単体、金属塩、金属酸化物、金属水酸化物又は金属錯体の状態等を挙げることができる。
【0027】
本発明の触媒としては、なかでも、反応活性に優れる点で、少なくともイリジウムを担体に担持した触媒を使用することが好ましい。
【0028】
イリジウム等を担持する担体としては、例えば、無機酸化物や活性炭等の無機物担体、イオン交換樹脂等の有機物担体等を挙げることができる。本発明におけるイリジウム等を担持する担体としては、なかでも、反応活性に優れる点で、無機酸化物が好ましい。無機酸化物としては、例えば、シリカ(SiO2)、チタニア(TiO2)、ジルコニア(ZrO2)、アルミナ(Al2O3)、マグネシア(MgO)、及びこれらの無機酸化物の2種以上の複合体(例えば、ゼオライト等)等を挙げることができる。本発明においては、特に、反応活性に優れる点で、シリカ(SiO2)、又はゼオライトが好ましい。
【0029】
また、担体の比表面積としては、イリジウム等を高分散に配置でき、イリジウム等の凝集を抑制することができ、単位重量当たりの触媒活性を向上することができる点で、50m2/g以上程度(例えば、50〜1500m2/g程度、好ましくは100〜1000m2/g程度)が好ましい。担体の比表面積が上記範囲を下回ると、単位重量当たりの触媒活性が低下する傾向がある。
【0030】
担体の平均粒径としては、特に限定されないが、過剰な圧力損失を伴わない点で、100〜10000μmが好ましく、より好ましくは1000〜10000μmである。また、担体の形状は、粉末状、粒状、成型(成型体状)等、特に限定されない。
【0031】
イリジウム等の担体への担持量としては、特に限定されないが、イリジウム等と担体の総量(100重量%)に対して、0.01〜20重量%程度が好ましく、特に好ましくは0.5〜15重量%程度、最も好ましくは1.0〜10重量%程度である。イリジウム等の担持量が0.01重量%未満であると、ポリオールの転化率が低下する傾向がある。一方、イリジウム等の担持量が50重量%を超えると、不経済となる場合がある。
【0032】
イリジウム等の担体への担持方法としては、特に限定されず、公知乃至慣用の担持方法により行うことができ、例えば、イリジウム等を含有する溶液(例えば、塩化イリジウム酸水溶液等)を担体に含浸させた後、乾燥させ、次いで焼成する方法により担持させることができる。尚、イリジウム等を含有する溶液の濃度や、担体への含浸、及び乾燥処理の施用回数を調整することにより、イリジウム等の担持量を制御することができる。また、イリジウム等を含有する溶液を含浸させる際の温度、該溶液を含浸させた担体を乾燥させる際の温度は、特に限定されない。
【0033】
イリジウム等を含有する溶液を含浸させ、乾燥させた後の担体を焼成する際の温度としては、例えば、大気中において400〜700℃程度、好ましくは450〜550℃程度である。また、焼成する際の雰囲気は、上述のように大気中に限定されず、例えば、窒素、アルゴン等の不活性ガス雰囲気、水素等の還元性ガス雰囲気等で焼成することもできる。
【0034】
本発明の触媒は、イリジウム等を担体に担持した触媒と共に、レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分(以後、「レニウム等」と称する場合がある)を併用することが好ましい。レニウム等を併用することにより、ポリオールの転化率を向上することができ、ポリオールとして、グリセリンを使用する場合は、1,3−プロパンジオールの選択率を高めることができる。また、ポリオールとしてエリスリトールを使用する場合は、1,4−ブタンジオール、1,3−ブタンジオールの選択率を高めることができる。選択率が高まる理由は明らかではないが、イリジウム等とレニウム等との何らかの相互作用により、レニウム等がポリオールの一つの水酸基と相互作用を持った状態でイリジウム等が隣接する水酸基を還元すると考えられる。また、イリジウム等とレニウム等の相互作用により、イリジウム等の酸化還元状態が変化してそのイリジウム等の還元能力が高まるとも考えられる。
【0035】
触媒として、イリジウム等を担体に担持した触媒と共にレニウム等を併用する場合、レニウム等の使用量が増加するにつれて、ポリオールの転化率を向上することができる。また、レニウム等の使用量が増加するにつれて、トリオールの選択率が減少し、ジオール、及びモノオールの選択率が高くなる傾向がある。イリジウム等(2種類以上含有する場合は合計量)とレニウム等(2種類以上含有する場合は合計量)とのモル比(前者/後者)は、例えば、50/1〜1/6程度(好ましくは4/1〜1/4、特に好ましくは3/1〜1/3)の範囲内であることが好ましい。レニウム等の使用量は、反応温度、反応時間、及び目的とする生成化合物によって、前記範囲内で適宜調整することができる。
【0036】
触媒に含まれるレニウム等の態様としては、特に限定されることがなく、例えば、金属単体、金属塩、金属酸化物、金属水酸化物又は金属錯体の状態で含まれる態様や、金属単体、金属塩、金属酸化物、金属水酸化物又は金属錯体として担体に担持された状態で含まれる態様等を挙げることができる。
【0037】
レニウム等を担持する担体としては、上記イリジウム等を担持する担体と同様の例を挙げることができる。本発明におけるレニウム等を担持する担体としては、なかでも、反応活性に優れる点で、無機酸化物が好ましく、特に好ましくは、シリカ(SiO2)、チタニア(TiO2)、ジルコニア(ZrO2)、アルミナ(Al2O3)、マグネシア(MgO)、及びこれらの無機酸化物の2種以上の複合体(例えば、ゼオライト等)から選択される少なくとも1種の化合物であり、最も好ましくは、シリカ(SiO2)、又はゼオライトである。また、レニウム等を担持する担体はイリジウム等を担持する担体と同一であってもよく異なっていてもよい。本発明においては、なかでも、より優れた触媒作用を発揮することができる点で、レニウム等を担持する担体とイリジウム等を担持する担体が同一であること(すなわち、イリジウム等とレニウム等が同一の担体に担持されていること)が好ましい。
【0038】
レニウム等を担体に担持させる場合、その方法は特に限定されず、公知乃至慣用の担持方法を利用することができる。具体的には、例えば、レニウム等含有溶液を担体に含浸し、乾燥させた後、焼成する方法等を挙げることができる。また、レニウム等を、上記イリジウム等と同じ担体に担持させる場合は、例えば、イリジウム等を含有する溶液を含浸させ、乾燥させた後の担体にレニウム等含有溶液を含浸し、乾燥させた後、焼成する方法等を挙げることができる。尚、上記レニウム等含有溶液を含浸させる際の温度、該溶液を含浸させた担体を乾燥させる際の温度、及び上記担体を焼成する際の温度は特に限定されない。
【0039】
本発明における触媒としては、なかでも、イリジウム等を担体に担持した触媒と共に、レニウム(Re)、モリブデン(Mo)、タングステン(W)、及びマンガン(Mn)からなる群より選択された少なくとも1種以上の金属成分[特に、レニウム(Re)]を、担体に担持した状態(好ましくは、イリジウム等とレニウム等を同一の担体に担持した状態であり、特に好ましくはイリジウムとレニウムを同一の担体に担持した状態)で使用することが、より優れた触媒作用を発揮することができる点、及び反応後の触媒を容易に回収することができる点で好ましい。
【0040】
[反応器]
本発明のポリオールの水素化分解物の製造方法においては、反応器として鉄成分及び/又はニッケル成分の含有量が10重量%未満(好ましくは5重量%以下、特に好ましくは1重量%以下、最も好ましくは実質上含有しない)である材質からなる金属製反応器を使用することを特徴とする。それにより、反応スケールの大規模化が可能となり、工業的に、且つ、優れた収率でポリオールの水素化分解物の製造が可能となる。一方、鉄成分及び/又はニッケル成分含有量が10重量%以上である材質からなる反応器を使用すると、反応スケールの大規模化は可能であるが、反応器中に含有する鉄成分及び/又はニッケル成分が反応系中に溶出して触媒活性を阻害し、水素化分解物の収率を低下させる。また、ガラス製反応器は、高価であり、急激な温度変化等によりひび割れが生じやすくメンテナンスが欠かせない上、運転操作に細心の注意が必要であるため、反応スケールの大規模化が困難である。
【0041】
反応器の材質としては、鉄成分及び/又はニッケル成分の含有量が10重量%未満であればよい。本発明においては、なかでも、不導体となりやすく、酸化被膜の形成により反応系への金属成分の溶出を防止することができる金属成分(例えば、チタン、モリブデン及びクロムから選択される1種以上の金属成分等)を90重量%以上(好ましくは95重量%以上、特に好ましくは99重量%以上)含有することが好ましく、反応器の材質が実質上、前記金属成分のみであることが特に好ましい。
【0042】
チタン、モリブデン及びクロムから選択される2種以上の金属成分を含有する場合は、その総量が90重量%以上(好ましくは95重量%以上、特に好ましくは99重量%以上)であることが好ましく、反応器の材質が実質上、前記金属成分のみであることが特に好ましい。
【0043】
本発明においては、例えば、チタン製、モリブデン製、クロム製、又はチタン、モリブデン若しくはクロムから選択される2種以上の合金製反応器等を使用することが好ましく、なかでも、より触媒活性の阻害を抑制することができる点で、チタン製、モリブデン製、若しくはチタン−モリブデン合金製反応器を使用することが好ましく、特に、工業的に材料入手が容易であり、反応器が成型し易い点で、チタン製反応器を使用することが好ましい。
【0044】
反応器の形式としては、例えば、槽型反応器、管型反応器等を挙げることができる。槽型反応器としては、例えば、オートクレーブ等を使用することができる。また、管型反応器としては、例えば、流動床反応器、固定床反応器等を使用することができる。
【0045】
本発明においては、なかでも、生産性に優れる点で、管型反応器が好ましく、なかでも、反応生成物からの触媒の分離プロセスが不要である点で、固定床反応器が好ましい。前記固定床反応器を使用したポリオールの水素化分解法としては、例えば、(1)固体触媒が充填された触媒充填層を内部に有し、該触媒充填層に対して液体(本発明では、原料液)と気体(本発明では、水素)とを共に、反応器の上方から下向流(気液下向並流)で流通する方法、いわゆるトリクルベッド法、(2)液体(本発明では、原料液)および気体(本発明では、水素)を並流で導入して運転する塔底法等を挙げることができる。本発明においては、なかでも、トリクルベッド法を採用することが、原料であるポリオールを気化することなく、気液固三相で反応を進行させることができ、且つ、ポリオールを含有する原料液が触媒表面に薄膜を形成しながら下方に流通するため、原料液と水素の界面(気液界面)から触媒表面までの距離が短く、原料液に溶解した水素の触媒表面への拡散が容易となり、ポリオールの水素化分解物を効率的に生成することができる点で好ましい。一方、水素化分解を気相反応で行う場合、ポリオールのなかでもエリスリトールの沸点は330℃と非常に高く、反応系を330℃以上の高温に加熱する必要があり、炭素同士の結合開裂による副生物の生成が起こりやすくなり、精製処理のコストが嵩むことが問題である。
【0046】
従って、本発明においては、反応器としてトリクルベッド法を採用した固定床反応器(すなわち、トリクルベッド反応器)を使用することが好ましい。
【0047】
図1は、トリクルベッド反応器を使用した場合の、ポリオールの水素化分解物の製造方法の一例を示すフロー図である。図1において、1はトリクルベッド反応器、2は原料液の供給ライン、3は水素の供給ラインを示す。また、4は反応混合物取り出しライン、5は高圧気液分離器、6は水素リサイクルラインを示す。以下、図1を参照しながら、トリクルベッド反応器を使用したポリオールの水素化分解物の製造方法を簡単に説明する。
【0048】
まず、トリクルベッド反応器1の上方から原料液と水素とを連続的に供給し、その後、反応器の内部で原料液中のポリオールと水素とを、触媒充填層における触媒の存在下で反応させ、ポリオールの水素化分解物(反応生成物)を生成させる。そして、当該ポリオールの水素化分解物を含む反応混合物をトリクルベッド反応器1の下方の反応混合物取り出しライン4から連続的に取り出し、その後、必要に応じて、高圧気液分離器5により該反応混合物から水素を分離した後、精製工程にてポリオールの水素化分解物を精製・単離する。また、高圧気液分離器5により分離した水素は、水素リサイクルライン6を通じて、再度トリクルベッド反応器1に供給して反応に再利用することもできる。
【0049】
トリクルベッド反応器の形状、サイズ(例えば、塔径や塔長等)等は、特に限定されず、公知乃至慣用のトリクルベッド反応器の中から、反応の規模等に応じて適宜選択することができる。また、上記トリクルベッド反応器は、単一の反応管により構成されるものであってもよいし、複数の反応管により構成された多段反応器であってもよい。上記トリクルベッド反応器が多段反応器である場合の反応管の数は、適宜選択でき、特に限定されない。また、上記トリクルベッド反応器が多段反応器である場合には、当該反応器は、複数の反応管が直列に設置されたものであってもよいし、複数の反応管が並列に配置されたものであってもよい。
【0050】
更に、トリクルベッド反応器の内部における触媒充填層は、必要に応じて、例えば、反応熱による過熱を抑制するために触媒充填層を2以上の位置に分割(分離)して配置してもよい。
【0051】
原料液の液基準空間速度(LHSV)としては、特に限定されることがなく、例えば0.05〜100hr-1程度、好ましくは0.1〜50hr-1、特に好ましくは0.5〜20hr-1である。原料液の液基準空間速度が0.05h-1未満であると、ポリオールの水素化分解物の生産性が低下する場合がある。一方、原料液の液基準空間速度が100hr-1を超えると、ポリオールの反応率(転化率)が低下する場合がある。尚、上記液基準空間速度は、反応器への原料液の供給速度(体積流量)の触媒充填体積に対する比[原料液の供給速度(L/hr-1)/触媒充填体積(L)]で表される。
【0052】
[原料液]
本発明に係るポリオールの水素化分解物の製造方法において用いられる原料液は、ポリオールを必須成分として含有する。上記原料液は、ポリオールの他に水や有機溶媒等の溶媒を含有してもよく、溶媒を実質的に含有しなくてもよい。上記有機溶媒としては、特に限定されることがなく、例えば、メタノール、エタノール、イソプロパノール、n−ブタノール等を挙げることができる。本発明の原料液としては、なかでも、反応性に優れる点、及び取り扱いや廃棄が容易である点等で、溶媒として水を使用することが好ましい。
【0053】
上記原料液におけるポリオールの濃度(原料液100重量%に対するポリオールの含有量)は、特に限定されることがなく、例えば20〜98重量%程度、好ましくは20〜90重量%、さらに好ましくは40〜90重量%、特に好ましくは60〜80重量%である。ポリオールの濃度が20重量%を下回ると、ポリオールの反応率(転化率)が低下する場合がある。一方、ポリオールの濃度が98重量%を上回ると、粘度が高くなり、操作が煩雑になる場合がある。
【0054】
上記原料液には、上述のポリオール、溶媒のほか、例えば、酸を添加してもよい。上記酸としては、特に限定されず、公知乃至慣用の酸、例えば、硫酸、リン酸、トリフルオロメタンスルホン酸等を挙げることができる。酸を添加することにより水素化分解反応を促進することができる。
【0055】
酸の使用量としては、触媒に含有するイリジウム等に対して、例えば、0.1〜10モル倍程度、好ましくは0.5〜3モル倍程度である。酸を添加した場合は、反応終了後、中和工程を設けることが好ましい。
【0056】
上記原料液には、本発明の効果を阻害しない範囲でその他の成分(例えば、アルコール類等)を含有させてもよい。
【0057】
上記原料液は、ポリオールと、必要に応じて溶媒、その他の成分を均一に混合することにより得られる。混合には、公知乃至慣用の撹拌機等を使用してもよい。
【0058】
[ポリオールの水素化分解物の製造方法]
本発明のポリオールの水素化分解物の製造方法は、反応器にポリオールを含む原料液及び水素を供給し、前記反応器中において、触媒の存在下で前記ポリオールと水素とを反応させ、ポリオールの水素化分解物を得るポリオールの水素化分解物の製造方法であって、前記触媒としてイリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒を使用し、前記反応器として鉄成分及び/又はニッケル成分の含有量が10重量%未満である材質からなる金属製反応器を使用することを特徴とする。
【0059】
反応に付す水素とポリオールのモル比[水素(mol)/ポリオール(mol)]としては、例えば、1〜100程度、好ましくは1.5〜50程度、特に好ましくは2〜30程度である。上記水素とポリオールのモル比が1を下回ると、ポリオールの反応率(転化率)が低下する場合がある。一方、上記水素とポリオールのモル比が100を上回ると、未反応水素回収のための用役コストが増加する傾向がある。
【0060】
上記反応におけるポリオールと水素の反応温度は、特に限定されることがなく、例えば50〜200℃程度、好ましくは60〜150℃、特に好ましくは70〜130℃である。反応温度が50℃未満であると、ポリオールの反応率(転化率)が低下する場合がある。一方、反応温度が200℃を超えると、ポリオールが完全に水素化分解された炭化水素が副生し易くなり、ポリオールの分解(例えば、炭素−炭素結合の開裂等)が生じ易くなるため、ポリオールの水素化分解物の選択率が低下する場合がある。
【0061】
上記反応におけるポリオールと水素の反応時間は、特に限定されないが、0.1〜100時間が好ましく、より好ましくは0.2〜5時間、さらに好ましくは0.5〜3時間である。反応時間が0.1時間未満であると、ポリオールの反応率(転化率)が低下する場合がある。一方、反応時間が100時間を超えると、ポリオールが完全に水素化分解された炭化水素の生成が急激に増える場合がある。
【0062】
上記反応におけるポリオールと水素の反応圧力(ポリオールと水素の反応における水素圧)としては、1〜50MPa程度の範囲内で適宜調整することができる。本発明においては、なかでも、高圧下で反応を行うことが、水素化分解物の収率をより一層向上させることができる点で好ましく、例えば3〜30.0MPa、好ましくは5.0〜15.0MPaである。反応圧力が1MPa以下であると、ポリオールの反応率(転化率)が低下する場合がある。一方、反応圧力が50MPaを上回ると、反応器が高度な耐圧性を備える必要があるため、製造コストが高くなる傾向がある。
【0063】
本発明のポリオールの水素化分解物の製造方法は、回分形式、半回分形式、連続流通形式等を任意に選択した形式により実施することができる。また、所定量のポリオールから得られるポリオールの水素化分解物の量を増加させたい場合には、水素化分解実施後の未反応ポリオールを分離回収してリサイクルするプロセスを採用してもよい。このリサイクルプロセスを採用すれば、ポリオールを所定量使用したときのポリオールの水素化分解物の生成量を高めることができる。
【0064】
本発明のポリオールの水素化分解物の製造方法は、上記ポリオールを含む原料液と水素の反応工程以外にも、必要に応じて他の工程を含んでいてもよい。他の工程としては、例えば、反応器に供給する前に、ポリオールを含む原料液を調製・精製する工程、反応器から排出(流出)された反応混合物(例えば、ポリオール、水素、及びポリオールの水素化分解物等の混合物)を分離・精製する工程等を挙げることができる。尚、これらの工程は、本発明のポリオールの水素化分解物の製造方法の反応工程とは別ラインで実施してもよく、上記反応工程と一連の工程として実施してもよい。
【0065】
本発明においては、ポリオールを含む原料液を、反応器に供給する前に、金属除去処理工程に付して、鉄成分及びニッケル成分を除去する(たとえば、原料液100g当たり、鉄成分及び/又はニッケル成分含有量(金属換算)が1.5×10-4モル以下程度、好ましくは1.5×10-5モル以下程度まで低減させる)精製工程を設けることが好ましい。それにより、触媒活性を一層向上させることができ、ポリオールの水素化分解物の収率を向上させることができる。
【0066】
前記金属除去処理としては、例えば、キレート樹脂を使用したキレート形成により金属を吸着して捕捉する方法、イオン交換樹脂を使用したイオン交換により金属を捕捉する方法、蒸留、晶析、抽出などの周知慣用の方法により行うことができる。
【0067】
本発明のポリオールの水素化分解物の製造方法は、ポリオールの水素化分解反応を、鉄成分及び/又はニッケル成分の含有量が10重量%未満である材質からなる金属製反応器中にて、上記特定の触媒を使用して行うため、容易に反応スケールを大規模化することができ、作業性に優れた方法で、工業的にポリオールの水素化分解反応を行うことができ、且つ、ガラス製反応器を使用した場合と同等の優れた触媒能を前記触媒に発揮させることができる。そのため、ポリオールの水素化分解物を選択的且つ高収率で得ることができる。また、使用後の触媒は容易に再生できる。以上より、本発明のポリオールの水素化分解物の製造方法は、経済的に有利にポリオールの水素化分解物を選択的且つ優れた収率で製造することができるため、工業化に極めて有利であり、大幅な二酸化炭素排出量の削減に貢献することができると共に、石油資源枯渇の後の化学産業の存続にも大いに貢献することができる。
【実施例】
【0068】
以下、実施例により本発明をより具体的に説明するが、本発明はこれらの実施例により限定されるものではない。
【0069】
調製例1(触媒調製)
二酸化ケイ素(SiO2)(商品名「CARIACT G−6」、富士シリシア化学(株)製、比表面積:400〜500m2/g)を担体とした。上記担体に、Ir濃度が4.47wt%になるように調製した塩化イリジウム酸(H2IrCl6)水溶液を滴下して、担体全体を湿潤させ、110℃で乾燥した。その後、この滴下と乾燥を繰り返して、Irがシリカに対して4wt%になるように担持させた。次ぎに、Re濃度が3wt%になるように調製した過レニウム酸アンモニウム(NH4ReO4)水溶液を、塩化イリジウム酸を担持したシリカに前記と同様に滴下と乾燥を繰り返して、ReがIrに対してRe/Ir=1/1(mol比)になるように担持させた。その後、空気雰囲気下で、500℃、3時間焼成して、触媒(1)(Ir/Re/SiO2、Ir/Re=1/1)を得た。
【0070】
参考例1(水素化分解反応)
ガラス製内缶のあるSUS316製(容量:190mL)オートクレーブとテフロン(登録商標)コーティングをされたマグネチックスターラーチップで構成される反応器を、マグネチックスターラーと電気炉からなる加熱・撹拌する装置と共に用いた。
調製例1で得られた触媒 150mg、及び水 1gを反応器に入れ、1MPaの水素を張り込んで、常圧まで排気する水素置換作業を三回繰り返したのち、反応器内が200℃になった時に、全圧8MPaになるように水素を張り込み、200℃で1時間触媒を還元した。
【0071】
触媒の還元後、オートクレーブを冷却、開圧し、グリセリン 4g、および1%硫酸 150mgを含む原料液を加えて、再度1MPa水素で3回水素置換を行った。120℃で、8MPaになるように水素を張り込み、撹拌回転数250rpmにて24時間反応を行った。
反応後、オートクレーブを室温まで冷却後、開圧し、排気ガスおよび反応液をガスクロマトフィーにて分析したところ、グリセリンの転化率は56.6%、各生成物の選択率は、1,3−プロパンジオールが43.8%、1,2−プロパンジオールが4.9%、1−プロパノールが39.9%、2−プロパノールが9.5%であった。
【0072】
以下金属片、金属粉末を添加する場合、参考例1において反応液が反応器に接した面積と等しくなる量を添加した。尚、SUS316片は円柱、その他の粉末は球形としてその表面積を算出した。
【0073】
参考例2(水素化分解反応へのSUS316の影響)
触媒還元後に、直径1mm、長さ1.2mmのSUS316金属片 0.3488gを反応器内に加えた以外は、参考例1と同様に行った。グリセリンの転化率は10.8%、各生成物の選択率は、1,3−プロパンジオールが66.7%、1,2−プロパンジオールが16.0%、1−プロパノールが12.4%、2−プロパノールが4.6%であった。
【0074】
参考例3(水素化分解反応へのFe粉の影響)
触媒還元後に、粒径45μmの鉄粉末 62.3mgを反応器内に加えた以外は、参考例1と同様に行った。グリセリンは全く転化しなかった。
【0075】
参考例4(水素化分解反応へのNi粉の影響)
触媒還元後に、粒径150μmのニッケル粉末 236mgを反応器内に加えた以外は、参考例1と同様に行った。グリセリンは全く転化しなかった。
【0076】
参考例5(水素化分解反応へのCr粉の影響)
触媒還元後に、粒径45μmのクロム粉末 56.8mgを反応器内に加えた以外は、参考例1と同様に行った。グリセリンの転化率は37.8%、各生成物の選択率は、1,3−プロパンジオールが60.1%、1,2−プロパンジオールが7.5%、1−プロパノールが24.7%、2−プロパノールが7.2%であった。
【0077】
参考例6(水素化分解反応へのMo粉の影響)
触媒還元後に、粒径3μmのモリブデン粉末 5.4mgを反応器内に加えた以外は、参考例1と同様に行った。グリセリンの転化率は49.0%、各生成物の選択率は、1,3−プロパンジオールが48.6%、1,2−プロパンジオールが5.6%、1−プロパノールが36.5%、2−プロパノールが8.7%であった。
【0078】
参考例7(水素化分解反応へのTi粉の影響)
触媒還元後に、粒径45μmのチタン粉末 35.8mgを反応器内に加えた以外は、参考例1と同様に行った。グリセリンの転化率は44.4%、各生成物の選択率は、1,3−プロパンジオールが52.4%、1,2−プロパンジオールが4.8%、1−プロパノールが33.2%、2−プロパノールが8.4%であった。
【0079】
参考例8(水素化分解反応へのFeイオンの影響)
触媒還元後に、0.15Mの硫酸鉄水溶液 0.1mLを反応器内に加えた以外は、参考例1と同様に行った。グリセリンは全く転化しなかった。Fe成分をイオンとして加えても反応を阻害することが確認でき、原料液にFeイオン混入が起こりうる場合には、反応工程の前にFeイオン除去工程が必要であることがわかった。
【0080】
参考例9(水素化分解反応へのNiイオンの影響)
触媒還元後に、0.15Mの硫酸ニッケル水溶液 0.1mLを反応器内に加えた以外は、参考例1と同様に行った。グリセリンは全く転化しなかった。Ni成分をイオンとして加えても反応を阻害することが確認でき、原料液にNiイオン混入が起こりうる場合には、反応工程の前にNiイオン除去工程が必要であることがわかった。
【0081】
実施例1
(チタン(Ti)製のトリクルベッド反応器を使用した水素化分解反応)
グリセリン 7200重量部、水 1800重量部、および硫酸 10重量部を混合して、グリセリンを80重量%含有する原料液を調製した。
内径9mmの反応管を有するチタン(Ti)製のトリクルベッド反応器(固定床連続反応装置、鉄成分の含有量:0重量%、ニッケル成分の含有量:0重量%)を使用し、調製例1で得られた触媒(1)1.2kg(0.8L)を充填した触媒充填部を120℃に加熱した(反応温度:100℃)。この触媒充填部分に前記原料液を900g/時間(LHSV=1.0hr-1)で供給し、水素を2L/分で供給して、反応を開始させた(水素とグリセリンの供給モル比:水素/グリセリン=4/1)。反応中、反応管内の圧力は8MPa(ゲージ圧)に保持した。そして、反応物取り出しラインから連続的に反応混合物(反応液)を排出(流出)させ、原料液及び水素の供給開始から5時間後、反応物取り出しラインから流出する反応混合物を1時間かけて捕集し、その捕集液(反応生成物を含む)の分析を行った。その結果、グリセリンの転化率は37.6%、各生成物の選択率は、1,3−プロパンジオールが47.5%、1,2−プロパンジオールが12.8%、1−プロパノールが20.4%、2−プロパノールが19.1%であった。
【0082】
実施例2
エリスリトール 7200重量部、硫酸 10重量部、及び水 1800重量部を混合して、90℃まで加熱し、エリスリトール 80重量%の原料液を調製した。
内径9mmの反応管を有するチタン(Ti)製のトリクルベッド反応器(固定床連続反応装置、鉄成分の含有量:0重量%、ニッケル成分の含有量:0重量%)に、調製例1で得られた触媒(1)1.2Kg(0.8L)を充填し、触媒充填部を100℃に加熱した(反応温度:100℃)。この触媒充填部分に上記原料液を900g/時間(LHSV=1.0hr-1)で供給し、水素を2L/分で供給して、反応を開始させた(水素とエリスリトールの供給モル比:水素/エリスリトール=4.0)。反応中、反応管内の圧力は12MPa(ゲージ圧)に保持した。そして、反応物取り出しラインから連続的に反応混合物(反応液)を排出(流出)させ、原料液及び水素の供給開始から5時間後、反応物取り出しラインから流出する反応混合物を1時間かけて捕集し、その捕集液(反応生成物を含む)の分析を行った。その結果、エリスリトールの転化率は65.4%で、各生成物の選択率は1,2,3−ブタントリオールが17.3%、1,2,4−ブタントリオールが4.9%、1,4−ブタンジオールが35.4%、1,3−ブタンジオールが13.5%、1,2−ブタンジオールが2.1%、2,3−ブタンジオールが2.1%、1−ブタノールが1.1%、2−ブタノールが1.5%であった。
【0083】
尚、上記グリセリン(又は、エリスリトール)の転化率(%)は、反応生成物中に残存するグリセリン(又は、エリスリトール)量を測定し、単位時間あたりのグリセリン(又は、エリスリトール)減少量を仕込んだグリセリン(又は、エリスリトール)量で割ったものを転化率とした。また、各生成物の選択率(%)は、単位時間あたりの各生成物生成量を、当該単位時間当たりのグリセリン(又は、エリスリトール)減少量で割ったものを選択率とした。
反応生成物中の各成分の含有量は、ガスクロマトグラフィー(ガスクロマトグラフ装置:商品名「GC−2010」、(株)島津製作所製)を使用し、下記条件で測定した。
測定条件
カラム:FFAP(QUADREX製)
検出器:FID
【符号の説明】
【0084】
1:トリクルベッド反応器
2:原料液供給ライン
3:水素供給ライン
4:反応混合物取り出しライン
5:高圧気液分離器
6:水素リサイクルライン
【特許請求の範囲】
【請求項1】
反応器にポリオールを含む原料液及び水素を供給し、前記反応器中において、触媒の存在下で前記ポリオールと水素とを反応させ、ポリオールの水素化分解物を得るポリオールの水素化分解物の製造方法であって、前記触媒としてイリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒を使用し、前記反応器として鉄成分及び/又はニッケル成分の含有量が10重量%未満である材質からなる金属製反応器を使用することを特徴とするポリオールの水素化分解物の製造方法。
【請求項2】
反応器が、チタン、モリブデン及びクロムから選択される1種以上の金属成分を90重量%以上含有する材質からなる請求項1に記載のポリオールの水素化分解物の製造方法。
【請求項3】
触媒として、イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒と共に、レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分を併用する請求項1又は2に記載のポリオールの水素化分解物の製造方法。
【請求項4】
イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒と、レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分とを、[イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分/レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分](モル比)が、50/1〜1/6となる範囲で併用する請求項3に記載のポリオールの水素化分解物の製造方法。
【請求項5】
レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分を担体に担持した状態で使用する請求項3又は4に記載のポリオールの水素化分解物の製造方法。
【請求項6】
イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担持する担体が無機酸化物である請求項1〜5の何れかの項に記載のポリオールの水素化分解物の製造方法。
【請求項7】
レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分を担持する担体が無機酸化物である請求項5又は6に記載のポリオールの水素化分解物の製造方法。
【請求項8】
無機酸化物が、シリカ、チタニア、ジルコニア、アルミナ、マグネシア、及びゼオライトから選択される少なくとも1種の化合物である請求項6又は7に記載のポリオールの水素化分解物の製造方法。
【請求項9】
酸の共存下で反応させる請求項1〜8の何れかの項に記載のポリオールの水素化分解物の製造方法。
【請求項10】
ポリオールを含む原料液を、反応器に供給する前に、金属除去処理工程に付して、鉄成分及びニッケル成分を除去する請求項1〜9の何れかの項に記載のポリオールの水素化分解物の製造方法。
【請求項1】
反応器にポリオールを含む原料液及び水素を供給し、前記反応器中において、触媒の存在下で前記ポリオールと水素とを反応させ、ポリオールの水素化分解物を得るポリオールの水素化分解物の製造方法であって、前記触媒としてイリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒を使用し、前記反応器として鉄成分及び/又はニッケル成分の含有量が10重量%未満である材質からなる金属製反応器を使用することを特徴とするポリオールの水素化分解物の製造方法。
【請求項2】
反応器が、チタン、モリブデン及びクロムから選択される1種以上の金属成分を90重量%以上含有する材質からなる請求項1に記載のポリオールの水素化分解物の製造方法。
【請求項3】
触媒として、イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒と共に、レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分を併用する請求項1又は2に記載のポリオールの水素化分解物の製造方法。
【請求項4】
イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担体に担持した触媒と、レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分とを、[イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分/レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分](モル比)が、50/1〜1/6となる範囲で併用する請求項3に記載のポリオールの水素化分解物の製造方法。
【請求項5】
レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分を担体に担持した状態で使用する請求項3又は4に記載のポリオールの水素化分解物の製造方法。
【請求項6】
イリジウム、白金、ロジウム、コバルト、及びパラジウムからなる群より選択される少なくとも1種の金属成分を担持する担体が無機酸化物である請求項1〜5の何れかの項に記載のポリオールの水素化分解物の製造方法。
【請求項7】
レニウム、モリブデン、タングステン、及びマンガンからなる群より選択される少なくとも1種の金属成分を担持する担体が無機酸化物である請求項5又は6に記載のポリオールの水素化分解物の製造方法。
【請求項8】
無機酸化物が、シリカ、チタニア、ジルコニア、アルミナ、マグネシア、及びゼオライトから選択される少なくとも1種の化合物である請求項6又は7に記載のポリオールの水素化分解物の製造方法。
【請求項9】
酸の共存下で反応させる請求項1〜8の何れかの項に記載のポリオールの水素化分解物の製造方法。
【請求項10】
ポリオールを含む原料液を、反応器に供給する前に、金属除去処理工程に付して、鉄成分及びニッケル成分を除去する請求項1〜9の何れかの項に記載のポリオールの水素化分解物の製造方法。
【図1】




【公開番号】特開2013−10707(P2013−10707A)
【公開日】平成25年1月17日(2013.1.17)
【国際特許分類】
【出願番号】特願2011−143752(P2011−143752)
【出願日】平成23年6月29日(2011.6.29)
【出願人】(000002901)株式会社ダイセル (1,236)
【Fターム(参考)】
【公開日】平成25年1月17日(2013.1.17)
【国際特許分類】
【出願日】平成23年6月29日(2011.6.29)
【出願人】(000002901)株式会社ダイセル (1,236)
【Fターム(参考)】
[ Back to top ]

